Композиции клеток и способы их применения для лечения сердечной ткани - RU2519762C2
Код документа: RU2519762C2
Чертежи





















Описание
Область техники, к которой относится изобретение
Этот документ относится к способам и материалам, связанным с получением и использованием сердечных клеток. Например, этот документ относится к способам и материалам для обеспечения сердечной ткани млекопитающих клетками (например, дифференцированными клетками-кардиопредшественниками или кардиопоэтическими клетками), которые встраиваются в сердечную ткань как функциональные кардиомиоциты.
Уровень техники
Сердечно-сосудистая болезнь является главной причиной заболеваемости и смертности во всем мире, несмотря на достижения в области медицины. В противоположность тканям с высокой репаративной способностью сердечная ткань подвергается необратимому повреждению. Поэтому в клинической практике развивается регенеративная сердечно-сосудистая терапия на основе клеток.
Недавний прорыв в биологии стволовых клеток расширяет границы современных моделей практического применения по направлению от традиционного временного облегчения (паллеативного лечения) к лечебному восстановлению. Как правило, клинический опыт основывается на взрослых стволовых клетках, набранных из аутологичных источников и доставленных в неизмененном состоянии. Первое поколение биопрепаратов представляет собой ранее не подвергавшиеся воздействиям стволовые клетки человека, установленные как легкодоступные цитотипы. Показано, что отдельные индивидуумы поправляются после доставки ранее не подвергавшихся воздействиям стволовых клеток человека.
Определения
В рамках настоящего документа, если не указано иначе, нижеприведенные в кавычках термины, имеют следующие определения.
Термин 'hMSC' означает мезенхимальные стволовые клетки.
'Кардиогенеративный потенциал' клетки означает способность этой клетки содействовать порождению сердечных клеток, например миокарда, при введении в поврежденное сердце.
'Кардиопоэтические клетки' (СР) представляют собой клетки, вовлеченные на путь дифференцировки из недифференцированной клетки. 'Кардиопоэтическая клетка' показывает сердечную дифференцировку, характеризующуюся ядерной транслокацией раннего сердечного фактора транскрипции Nkx2.5 и позднего сердечного фактора транскрипции MEF2C (Behfar et al. Derivation of a cardiopoietic population from human мезенхимальный stem yields progeny. Nature Clinical Practice, Cardiovascular Medicine, March 2006 vol. 3 supplement 1, pages S78-S82). Может наблюдаться ядерная транслокация сердечного фактора транскрипции GATA4. Кардиопоэтические клетки могут не иметь саркомеры и могут не иметь экспрессии саркомерных протеинов. Кардиопоэтическая клетка сохраняет способность делиться. Кардиопоэтические клетки также называются 'предшественниками кардиомиоцитов' или 'клетками-предшественниками кардиомиоцитов', так как они могут дифференцироваться в кардиомиоциты. В контексте настоящего описания кардиопоэтические клетки можно получить из взрослых мезенхимальных стволовых клеток человека (hMSC). 'CP-hMSC' обозначает такие кардиопоэтические клетки, полученные из взрослых мезенхимальных стволовых клеток человека.
'Смесь (коктейль)' или 'кардиогенная смесь' обозначает композицию, содержащую, по меньшей мере, две кардиогенные субстанции.
'Кардиогенная субстанция' представляет собой субстанцию, которая улучшает кардиогенеративный потенциал клетки.
'Смесь-образующая клетка' или 'клетка, направленная (guided) к кардиопоэзу' представляет собой клетку, которая находится в контакте со смесью и дополнительно вступает в дифференцировку.
'Дифференцировка' - это процесс, посредством которого менее специализированные клетки становятся более специализированными клетками.
'Фракция выброса' означает фракцию крови, «выбрасываемой» во время сокращения сердца. Если не определено иначе, термин фракция выброса относится конкретно к фракции выброса левого желудочка (фракция выброса левого желудочка или LVEF).
'Изменение фракции выброса' означает различие между фракцией выброса сердца у животного, которого лечили клетками, инъецированными в его инфарктное сердце, измеренной после заданного времени, и фракцией выброса, измеренной до инъекции.
Если не определено иначе, все технические и научные термины, использованные здесь, имеют то же самое значение, которое обычно понятно среднему специалисту в области техники, к которой это изобретение относится. Несмотря на то, что при осуществлении на практике изобретения могут быть использованы способы и материалы, сходные или равноценные описанным здесь, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, приведенные в данном описании, полностью включены путем отсылки. В случае конфликта настоящее подробное описание, включая определения, будет служить контролем. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначаются для ограничения.
Раскрытие изобретения
Изобретение относится к композициям, содержащим TGFp-1, BMP4, α-тромбин, соединение, выбранное из группы, состоящей из кардиотрофина и IL-6, и соединение, выбранное из группы, состоящей из кардиогенола С и ретиноевой кислоты. В предпочтительном варианте осуществления композиции изобретения содержат TGFβ-1, BMP4, α-тромбин, кардиотрофин и кардиогенол С. Композиции изобретения могут содержать, по меньшей мере, одно соединение, выбранное из группы состоящей из FGF-2, IGF-1, активина-A, TNF-α, FGF-4, LIF, VEGF-A и их комбинаций. Также они могут содержать FGF-2, IGF-1 и активин-A. Другие предпочтительные композиции изобретения содержат активин-A, FGF-2, IL-6, IGF-1 и ретиноевую кислоту. Согласно альтернативному варианту осуществления композиции изобретения могут не содержать, по меньшей мере, одно соединение, выбранное из группы, состоящей из TNF-α, FGF-4, LIF и VEGF-A.
Когда одно из следующих соединений присутствует в композиции изобретения, оно может присутствовать в количестве между 1 и 5 нг указанного TGFβ-1 на мл, между 1 и 10 нг указанного BMP4 на мл, между 0,5 и 5 нг указанного кардиотрофина на мл, между 0,5 и 5 единиц указанного α-тромбина на мл и между 50 и 500 нМ указанного кардиогенола C, между 1 и 10 нг указанного FGF-2 на мл, между 10 и 100 нг указанного IGF-1 на мл, между 1 и 50 нг указанного активина-А на мл, между 1 и 50 нг указанного TNF-α на мл, между 1 и 20 нг указанного FGF-4 на мл, между 10 и 100 нг указанного IL-6 на мл, между 1 и 10 единиц указанного LIF на мл, между 1 и 50 нг указанного VEGF-A на мл, между 0,1 и 1,0 мкМ указанной ретиноевой кислоты на мл.
Предпочтительные композиции согласно изобретению содержат рекомбинантный TGFβ-1 (2,5 нг/мл), BMP4 (5 нг/мл), кардиотрофин (1 нг/мл), кардиогенол С (100 µМ), применяемые комбинаторным образом. В частности, предпочтительные композиции изобретения содержат такие соединения и дополнительно содержат α-тромбин (1 ед./мл), FGF-2 (10 нг/мл), IGF-1 (50 нг/мл) и активин-A (5 нг/мл).
Другие предпочтительные композиции изобретения содержат рекомбинантный TGFβ-1 (2,5 нг/мл), ВМР4 (5 нг/мл), активин-A (5 нг/мл), FGF-2 (10 нг/мл), IL-6 (100 нг/мл), Фактор-IIa (hα-тромбин, 1 U/мл), IGF-1 (50 нг/мл) и ретиноевую кислоту (1 мкМ), применяемые комбинаторным образом.
Предпочтительно композиции изобретения содержатся в среде, выбранной из группы, состоящей из среды, содержащей эмбриональную телячью сыворотку, сыворотку человека, лизат тромбоцитов и их смеси.
Изобретение также относится к способу получения из исходных клеток дифференцированных клеток, которые экспрессируют повышенный уровень, по меньшей мере, одной из мРНК, выбранной из группы, состоящей из MEF2c мРНК, MESP-1 мРНК, Tbx-5 мРНК, GATA4 мРНК, Flk-1 мРНК, GATA6 мРНК, Fog-1 мРНК и их комбинаций и/или имеют, по меньшей мере, один полипептид, выбранный из группы, состоящей из Nkx2.5 полипептидов, MEF2C полипептидов, Тbх-5 полипептидов, FOG-2 полипептидов, GATA-4 полипептидов, MESP-1 полипептидов и их комбинаций, при котором указанный, по меньшей мере, один полипептид является связанным с ядрами указанных дифференцированных клеток, указанный способ включает культивирование исходных клеток в присутствии композиции согласно изобретению. В таких способах дифференцированные клетки экспрессируют предпочтительно повышенный уровень MEF2c мРНК и MESP-1 мРНК.
В предпочтительном варианте осуществления изобретения исходные клетки представляют собой мезенхимальные стволовые клетки. Такие клетки могут быть стволовыми клетками, полученными из костного мозга. Они могут экспрессировать CD90, CD105, CD133, CD166, CD29 и CD44 на клеточной поверхности и не экспрессировать CD14, CD34, и CD45 на клеточной поверхности.
Наиболее предпочтительно, дифференцированные клетки являются кардиопоэтическими клетками.
Другим аспектом изобретения является способ доставки дифференцированных клеток млекопитающему, когда указанный способ включает:
(a) определение, что образец клеток из популяции дифференцированных клеток содержит клетки, которые экспрессируют повышенный уровень, по меньшей мере, одной из мРНК, выбранной из группы, состоящей из MEF2c мРНК, MESP-1 мРНК, Тbх-5 мРНК, GATA4 мРНК, Flk-1 мРНК, GATA6 мРНК, Fog-1 мРНК и их комбинаций и/или имеет, по меньшей мере, один полипептид, выбранный из группы, состоящей из Nkx2.5 полипептидов, MEF2C полипептидов, Тbх-5 полипептидов, MESP-1 полипептидов, GATA-4 полипептидов, FOG-2 полипептидов и их комбинаций, в котором указанный полипептид связан с ядрами указанных дифференцированных клеток, и
(b) введение клеток из популяции дифференцированных клеток указанному млекопитающему. Популяцию дифференцированных клеток можно получить из исходных клеток, культивированных в присутствии любой из композиций согласно изобретению. В отдельном варианте осуществления указанная стадия (a) может включать использование полимеразной цепной реакции с обратной транскриптазой или использование иммуноцитохимии. Указанная стадия введения может включать введение указанных клеток путем введения, выбранного из группы, состоящей из системного, внутрисердечного и внутрикоронарного введений.
Другим аспектом изобретения является способ обеспечения сердечной ткани кардиомиоцитами, который включает введение в ткань сердца дифференцированных клеток формулы изобретения, полученных при контакте с композицией согласно изобретению.
Детали одного или более вариантов осуществления изобретения изложены в прилагаемых фигурах и описании ниже. Другие признаки, цели и преимущества изобретения станут понятны из описания и пунктов формулы изобретения.
Осуществление изобретения
Эта заявка предоставляет способы и материалы, имеющие отношение к сердечным клеткам (например, дифференцированным клеткам-кардиопредшественникам). Например, предоставляет клетки, обладающие способностью встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов, способы получения таких клеток, композиции для получения таких клеток и способы определения, содержит или нет популяция клеток (например, дифференцированные клетки-кардиопредшественники) клетки, обладающие способностью встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов. Эта заявка также предоставляет способы и материалы для обеспечения сердечной ткани (например, сердечной ткани человека) функциональными кардиомиоцитами.
Дифференцированные клетки-кардиопредшественники, предоставленные здесь, могут происходить из любых видов, включая, без ограничения, человека, обезьян, лошадей, собак, кошек, крыс или мышей. Например, дифференцированные клетки-кардиопредшественники могут быть дифференцированными клетками-кардиопредшественниками млекопитающего (например, человека).
В некоторых случаях дифференцированные клетки-кардиопредшественники, предоставленные здесь, обладают способностью встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов.
Для получения дифференцированных клеток-кардиопредшественников можно использовать любой подходящий метод. Например, дифференцированные клетки-кардиопредшественники можно получить из стволовых клеток, таких как стволовые клетки млекопитающего (например, человека).
В некоторых случаях дифференцированные клетки-кардиопредшественники можно получить из эмбриональных стволовых клеток. В некоторых случаях дифференцированные клетки-кардиопредшественники можно получить из мезенхимальных стволовых клеток. Мезенхимальные стволовые клетки можно получить из любого источника. Например, мезенхимальные стволовые клетки можно получить из ткани млекопитающего (например, человека), такой как костный мозг и губчатая кость. Мезенхимальные стволовые клетки можно культивировать in vitro. Например, мезенхимальные стволовые клетки можно увеличить в количестве in vitro. Мезенхимальные стволовые клетки могут экспрессировать или не экспрессировать полипептидный маркер на клеточной поверхности. Например, мезенхимальные стволовые клетки могут выделять CD133, CD90, CD105, CD166, CD29 и CD44 на клеточной поверхности и не выделять CD14, CD34 и CD45 на клеточной поверхности.
Чтобы получить дифференцированные клетки-кардиопредшественники из стволовых клеток (например, мезенхимальных стволовых клеток) можно использовать любой подходящий способ. Например, дифференцированные клетки-кардиопредшественники можно получить из мезенхимальных стволовых клеток, инкубируя мезенхимальные стволовые клетки с композицией (например, культуральной средой). Композицией может быть подходящая композиция, содержащая один или более факторов. Факторами могут быть любые типы факторов, такие как полипептиды, стероиды, гормоны и небольшие молекулы. Примеры таких факторов включают, без ограничения, TGFβ, BMP, FGF-2, IGF-1, активин-А, кардиотрофин, α-тромбин и кардиогенол С.
В одном варианте осуществления среду, содержащую TGFβ, BMP, кардиотрофин, α-тромбин и кардиогенол С, можно использовать для получения дифференцированных клеток-кардиопредшественников из стволовых клеток (например, мезенхимальных стволовых клеток). В таких случаях FGF-2, IGF-1, активин-A или их комбинацию можно добавить к среде после первоначального периода культивирования (например, одного или двух дней) со средой, содержащей TGFβ, BMP, кардиотрофин, α-тромбин и кардиогенол С.
TGFβ может быть любым полипептидом, обладающим активностью TGFβ, таким как TGFβ человека. Например, TGFβ может быть рекомбинантным TGFβ или синтетическим TGFβ. В одном варианте осуществления TGFβ может быть TGFβ-1. Можно использовать любую подходящую концентрацию TGFβ. Например, можно использовать между 1 и 10 нг TGF-β на мл (например, около 2,5 нг TGFβ1 на мл).
BMP может быть любым полипептидом, обладающим ВМР-активностью, таким как BMP человека. Например, BMP может быть рекомбинантным BMP или синтетическим BMP. В одном варианте осуществления BMP может быть ВМР4. Можно использовать любую концентрацию BMP. Например, можно использовать между 1 и 20 нг BMP на мл (например, около 5 нг ВМР4 на мл).
FGF-2 может быть любым полипептидом, обладающим FGF-активностью, таким как FGF-2 человека. Например, FGF-2 может быть рекомбинантным FGF-2 или синтетическим FGF-2. Можно использовать любую концентрацию FGF-2. Например, можно использовать между 1 и 20 нг FGF-2 на мл (например, около 5 нг FGF-2 на мл).
IGF-1 может быть любым полипептидом, обладающим IGF-1-активностью, таким как IGF-1 человека. Например, IGF-1 может быть рекомбинантным IGF-1 или синтетическим IGF-1. Можно использовать любую концентрацию IGF-1. Например, можно использовать между 10 и 100 нг IGF-1 на мл (например, около 50 нг IGF-1 на мл),
Активин-A может быть любым полипептидом, обладающим активин-A-активностью, таким как активин А человека. Например, активин-A может быть рекомбинантным активином-A или синтетическим активином-A. Можно использовать любую концентрацию активина-A. Например, можно использовать между 1 и 50 нг активин-A на мл (например, около 10 нг активина-A на мл).
α-Тромбин может быть любым полипептидом, обладающим активностью α-тромбина, таким как α-тромбин человека. Например, α-тромбин может быть рекомбинантным α-тромбином или синтетическим α-тромбином. Можно использовать любую концентрацию α-тромбина. Например, можно использовать между 0,5 и 10 единицами α-тромбина на мл (например, около 1 единицы α-тромбин на мл).
Кардиотрофин может быть любым полипептидом, обладающим активностью кардиотрофина, таким как кардиотрофин-1 человека. Например, кардиотрофин может быть рекомбинантным кардиотрофином или синтетическим кардиотрофином. Можно использовать любую концентрацию кардиотрофина. Например, можно использовать между 0,5 и 10 нг кардиотрофина на мл (например, около 1 нг кардиотрофина-1 на мл).
IL-6 может быть любым полипептидом, обладающим IL-6-активностью, таким как IL-6 человека. Например, IL-6 может быть рекомбинантным IL-6 или синтетическим IL-6. Можно использовать любую концентрацию IL-6. Например, можно использовать между 100 и 200 нг IL-6 на мл.
Можно использовать любую концентрацию кардиогенола С или его фармацевтически приемлемой соли (например, гидрохлорид кардиогенола С). Например, можно использовать между 10 и 1000 нМ кардиогенола С (например, около 100 нМ кардиогенола С).
Ретиноевая кислота может быть любой молекулой, обладающей активностью ретиноевой кислоты, такой как синтетическая ретиноевая кислота, природная ретиноевая кислота, метаболит витамина А, природное производное витамина А или синтетическое производное витамина А. Можно использовать любую концентрацию ретиноевой кислоты. Например, можно использовать между 1×10-6 и 2×10-6 мкМ ретиноевой кислоты.
В некоторых случаях можно использовать среду, содержащую сыворотку, или среду без сыворотки с добавлением TGFβ-1 (например, 2,5 нг/мл), ВМР4 (например, 5 нг/мл), FGF-2 (например, 5 нг/мл), IGF-1 (например, 50 нг/мл), активина-A (например, 10 нг/мл), кардиотрофина (например, 1 нг/мл), α-тромбина (например, 1 единиц/мл) и кардиогенола С (например, 100 нМ), чтобы получить дифференцированные клетки-кардиопредшественники из стволовых клеток (например, мезенхимальных стволовых клеток). В некоторых случаях среда (например, среда, содержащая сыворотку, или среда без сыворотки) может содержать лизат тромбоцитов (например, лизат тромбоцитов человека).
В некоторых случаях композиция, используемая для получения дифференцированных клеток-кардиопредшественников из мезенхимальных стволовых клеток, может содержать дополнительно необязательные факторы, такие как TNF-α, LIF и VEGF-A.
TNF-α может быть любым полипептидом, обладающим активностью TNF-α, таким как TNF-α человека. Например, TNF-α может быть рекомбинантным TNF-α или синтетическим TNF-α. Можно использовать любую концентрацию TNF-α. Например, можно использовать между 5 и 50 нг TNF-α на мл.
LIF может быть любым полипептидом, обладающим LIF-активностью, таким как LIF человека. Например, LIF может быть рекомбинантным LIF или синтетическим LIF. Можно использовать любую концентрацию LIF. Например, можно использовать между 2,5 и 100 нг LIF на мл.
VEGF-A может быть любым полипептидом, обладающим VEGF-A-активностью, таким как VEGF-A человека. Например, VEGF-A может быть рекомбинантным VEGF-A или синтетическим VEGF-A. Можно использовать любую концентрацию VEGF-A. Например, можно использовать между 5 и 200 нг VEGF-A на мл.
Композиция, предоставленная здесь, может содержать любую комбинацию факторов. Например, композиция, предоставленная здесь, может содержать TGFβ-1, ВМР4, активин-A, кардиотрофин, α-тромбин и кардиогенол С. В некоторых случаях композиция, предоставленная здесь, может содержать TGFβ-1, ВМР4, FGF-2, IGF-1, кардиотрофин, α-тромбин и кардиогенол С. В некоторых случаях композиция, предоставленная здесь, может содержать TGFβ-1, ВМР4, FGF-2, IGF-1, кардиотрофин, α-тромбин и кардиогенол С. В некоторых случаях композиция, предоставленная здесь, может не содержать TNF-α, IL-6, LIF, VEGF-A, ретиноевой кислоты или любой их комбинации (например, IL-6, LIF, VEGF-A и ретиноевой кислоты; LIF, VEGF-A и ретиноевой кислоты; или TNF-α, IL-6, LIF и VEGF-A).
Композицию, предоставленную здесь, можно приготовить с помощью любого подходящего метода. Например, композицию, предоставленную здесь, можно приготовить с использованием коммерчески доступных факторов. В некоторых случаях композицию, предоставленную здесь, можно приготовить так, чтобы она имела в своем составе лизаты клеток (например, лизат тромбоцитов) или кондиционированную среду из клеток, таких как кардиомиоциты или стимулированные TNF-α эндодермальные клетки. Например, композицию, предоставленную здесь, можно приготовить с использованием лизата тромбоцитов с добавлением коммерчески доступных факторов. В некоторых случаях композицию, предоставленную здесь, можно приготовить с использованием факторов, выделенных из кондиционированной среды. В некоторых случаях факторы можно растворить в среде, например культуральной среде, которая содержит или не содержит сыворотку.
Для инкубации стволовых клеток (например, мезенхимальных стволовых клеток) с композицией, предоставленной здесь, можно использовать любой подходящий способ, чтобы получить дифференцированные клетки-кардиопредшественники, обладающие способностью встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов. Например, мезенхимальные стволовые клетки можно инкубировать с композицией, предоставленной здесь, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45 или 50 дней. В некоторых случаях композицию, предоставленную здесь и используемую для инкубации мезенхимальных стволовых клеток, можно заменять каждый день или каждые 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45 или 50 дней.
В некоторых случаях мезенхимальные стволовые клетки можно инкубировать с композицией, предоставленной здесь, в присутствии или в отсутствие сыворотки. Можно использовать любую подходящую плотность клеток при инкубации стволовых клеток с композицией, предоставленной здесь. Например, между около 1000 и 2000 мезенхимальных стволовых клеток на см2 (например, примерно между 1500-2000 клеток/см2) можно инкубировать с композицией, предоставленной здесь, чтобы получить дифференцированные клетки-кардиопредшественники.
После того как стволовые клетки (например, мезенхимальные стволовые клетки) проинкубированы с композицией, предоставленной здесь, или иначе обработаны факторами дифференцировки, состояние дифференцировки можно проверить, чтобы определить, дифференцировали или нет стволовые клетки в дифференцированные клетки-кардиопредшественники, обладающие способностью встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов. Например, можно отобрать образец клеток и оценить его с помощью таких методов, как вестерн-блоттинг, метод флуоресцентно-активируемой клеточной сортировки (FACS), иммуноокрашивание, лазерная конфокальная микроскопия и методы полимеразной цепной реакции с обратной транскриптазой (RT-PCR) (например, количественный RT-PCR). В некоторых случаях, обнаружено, что клетки экспрессируют повышенный уровень MEF2c, MESP-1, Tbx-5, Nkx2.5, GATA6, Flk-1, Fog 1 и Fog 2 полипептидов, или можно выбрать мРНК для введения млекопитающему с целью лечения сердечной ткани.
Как описано здесь, дифференцированные клетки-кардиопредшественники, полученные из мезенхимальных стволовых клеток, культивированных с лизатом тромбоцитов, содержащим TGFβ-1, BMP4, FGF-2, IGF-1, активин-A, кардиотрофин, α-тромбин и кардиогенол С, показали 2-5-кратное увеличение уровней MEF2c мРНК, MESP-1 мРНК, Tbx-5 мРНК, GATA6 мРНК, Flk-1 или Fog 1 мРНК по сравнению с уровнями, наблюдаемыми в мезенхимальных стволовых клетках до инкубации. Эти дифференцированные клетки-кардиопредшественники также продемонстрировали способность встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов при введении интрамиокардиально, подкожно или интраваскулярно (внутрь сосуда) вместе с улучшением функционирования сердечного насоса, прямо связанного со структурным восстановлением в ишемических и в не-ишемических условиях. Функциональное преимущество было подтверждено с помощью эхокардиографии in vivo и гистологически при аутопсии с помощью окрашивания специфических протеинов человека. Также, как описано здесь, дифференцированные клетки-кардиопредшественники, полученные из мезенхимальных стволовых клеток, культивированных с сывороткой, содержащей TGFβ-1, BMP4, FGF-2, IGF-1, активин-A, кардиотрофин, α-тромбин и кардиогенол С, продемонстрировали 5-10-кратное увеличение уровней MEF2c мРНК, MESP-1 мРНК и Tbx-5 мРНК по сравнению с уровнями, наблюдаемыми в мезенхимальных стволовых клетках перед инкубацией.
Эти дифференцированные клетки-кардиопредшественники также продемонстрировали способность встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов при введении интрамиокардиально (например, с помощью эндокардиального или эпикардиального путей), в коронарные артерии, при инфузии в сердце или системном введении (например, подкожно) вместе с улучшением функционирования сердечного насоса, прямо связанного со структурным восстановлением в ишемических и в не-ишемических условиях. Функциональное преимущество было подтверждено с помощью эхокардиографии in vivo и с помощью микроскопического исследования при аутопсии с помощью окрашивания специфических протеинов человека. Таким образом, критерии высвобождения, например, повышенные уровни полипептида или мРНК MEF2c, MESP-1, Tbx-5, GATA6, Flk-1, Fog 1, FOG 2 или их комбинаций можно использовать для оценки клеток до введения млекопитающему.
Термин "повышенный уровень" при использовании здесь в отношении уровней полипептида или мРНК MEF2c, MESP-1, Tbx-5, GATA6, Flk-1 или Fog (например, FOG 1 для мРНК, FOG 2 для полипептида) в клеточной популяции относится к любому уровню, который больше чем исходный уровень этого полипептида или мРНК.
Термин "исходный уровень" при использовании здесь в отношении уровней полипептида или мРНК MEF2c, MESP-1, Tbx-5, GATA6, Flk-1 или Fog (например, FOG 1 для мРНК, FOG 2 для полипептида) в клеточной популяции относится к уровню, как правило, существующему в клетках перед обработкой (например, предобработанных мезенхимальных стволовых клетках). Например, исходный уровень MEF2c мРНК, исходный уровень MESP-1 мРНК, исходный уровень Tbx-5 мРНК, исходный уровень GATA6 мРНК и исходный уровень FOG 1 мРНК может быть средним уровнем MEF2c, MESP-1, Tbx-5, GATA6, Flk-1 и FOG 1 мРНК, соответственно, который присутствует в случайно выбранных пробах мезенхимальных стволовых клеток, необработанных композицией, предоставленной здесь, или иным образом обработанной факторами дифференцировки. Понятно, что уровни из сравниваемых образцов используются при определении, является или нет конкретный уровень повышенным уровнем.
Повышенные уровни полипептида и/или мРНК MEF2c, MESP-1, Tbx-5, GATA 4, GATA6, Flk-1, Fog 2 или FOG 1 могут быть любыми уровнями, при условии, что уровень больше чем соответствующий исходный уровень. Например, повышенный уровень Tbx-5 мРНК может быть в 1,5; 2; 3; 4; 5; 6; 7; 8; 9; 10 или более раз больше чем исходный уровень Tbx-5 мРНК, наблюдаемый в необработанных мезенхимальных стволовых клетках. Следует отметить, что исходный уровень может быть любым количеством. Например, исходный уровень для Tbx-5 мРНК может быть нулем. В этом случае любой уровень Tbx-5 мРНК больше чем ноль может являться повышенным уровнем.
В некоторых случаях критерий идентификации может включать микроскопическое исследование клеток до введения млекопитающему. Такое микроскопическое исследование может включать оценку клеток в отношении транскрипционного фактора полипептидов, связанного с ядром. Например, клетки, подходящие для введения млекопитающему, можно оценить на присутствие Nkx2.5, MEF2c, GATA4, MESP-1, FOG 2, Tbx-5 или любой их комбинации, соединенной с ядром до введения млекопитающему.
Можно использовать любой подходящий способ для предоставления сердечной ткани дифференцированных клеток-кардиопредшественников, обладающих способностью встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов. Например, дифференцированные клетки-кардиопредшественники можно ввести интрамиокардиально (например, с помощью эндокардиального или эпикардиального путей) в коронарные артерии, вливанием в сердце или системным введением (например, подкожно).
Любая сердечная ткань может быть обеспечена дифференцированными клетками-кардиопредшественниками. Например, сердечная ткань млекопитающего (например, человека) может быть обеспечена дифференцированными клетками-кардиопредшественниками. В некоторых случаях сердечная ткань, которая пострадала от ишемической кардиомиопатии, инфаркта миокарда или сердечной недостаточности, может быть обеспечена дифференцированными клетками-кардиопредшественниками.
Любой тип дифференцированных клеток-кардиопредшественников может быть введен в сердечную ткань. Например, аутологичные или гетерологичные дифференцированные клетки-кардиопредшественники могут быть введены в сердечную ткань. В некоторых случаях стволовые клетки (например, мезенхимальные стволовые клетки), которые были проинкубированы с композицией, предоставленной здесь, могут быть введены в сердечную ткань.
Стволовые клетки можно проинкубировать с композицией, предоставленной здесь, в течение любой продолжительности времени до введения в сердечную ткань. Например, стволовые клетки можно инкубировать с композицией, предоставленной здесь, в течение от 6 до 24 часов (например, 8, 10, 12, 18 или 22 часов) или в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45 или 50 дней до введения в сердечную ткань. В некоторых случаях стволовые клетки, которые были проинкубированы с композицией, предоставленной здесь, можно вводить в сердечную ткань вместе с композицией, предоставленной здесь.
Стволовые клетки могут быть проинкубированы с композицией, предоставленной здесь, в течение любой продолжительности времени до введения в сердечную ткань вместе с композицией, предоставленной здесь. Например, стволовые клетки можно инкубировать с композицией, предоставленной здесь, в течение от 6 до 24 часов (например, 8, 10, 12, 18 или 22 часов) или в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45 или 50 дней до введения в сердечную ткань вместе с композицией, предоставленной здесь.
В некоторых случаях, дифференцированные клетки-кардиопредшественники можно оценить, чтобы определить встречаются они или нет с конкретными критериями высвобождения до введения млекопитающему. Например, дифференцированные клетки-кардиопредшественники можно оценить с помощью RT-PCR, чтобы подтвердить, что дифференцированные клетки-кардиопредшественники экспрессируют повышенный уровень полипептида или мРНК MEF2c, MESP-1, Tbx-5, GATA6, Flk-1, Fog, (FOG 1 для мРНК, FOG 2 для полипептида) или их комбинаций до введения млекопитающему.
Изобретение будет дополнительно описано в следующих примерах, которые не ограничивают рамки изобретения, описанного в пунктах формулы изобретения.
Краткое описание чертежей
Фиг.1 представляет изменение фракции выброса (ΔEF) в %, найденное до и после обработки ранее не подвергавшимися воздействию (наивными) мезенхимальными стволовыми клетками (hMSC), полученными из костного мозга 11 пациентов с болезнью коронарных сосудов.
Фиг.2, полученная с помощью конфокальной микроскопии после иммуноокрашивания красителем DAPI, показывает экспрессию белкового сердечного фактора транкрипции для пациента 2, который не демонстрирует положительного изменения фракции выброса (слева) и для пациента 9 (справа), который демонстрирует положительное изменение фракции выброса после лечения.
Фиг.3 показывает экспрессию мРНК двух важных сердечных факторов транкрипции в hMSC одиннадцати пациентов.
Фиг.4 показывает экспрессию мРНК в произвольных единицах (A.U.) сердечных факторов транкрипции для, соответственно, Nkx2.5 мРНК, GATA-6 мРНК и Fog-1 мРНК, нелеченых, наивных hMSC (слева) и CP-hMSC, обработанных кардиогенной смесью (справа).
Фиг.5 представляет изображения, полученные с помощью конфокальной микроскопии, показывающие ядерную транслокацию Nkx2.5, MEF2C, FOG-2 и GATA4 полипептидов в CP-hMSC, обработанных кардиогенной смесью (справа) по сравнению с наивными hMSC (слева).
Фиг.6 иллюстрирует постепенное превращение (на дни D0, D5, D15 и день D20) из наивных hMSC в 'направляемые смесью (cocktail-guided)' CP-hMSC и в конце концов в кардиомиоциты (СМ).
Фиг.7 показывает (с помощью transition электронной микроскопии) ультраструктуру наивной hMSC и 'направляемого смесью' кардиомиоцита.
Фиг.8 показывает 'направляемый смесью' кардиомиоцит в световом микроскопе.
Фиг.9 представляет на первом графике слева экспрессию Tbx-5 мРНК (в AU) для наивных hMSC и CP-hMSC от каждого пациента фиг.1, результаты для наивных клеток находятся справа и то же самое для СР клеток находится слева гистограммы. Второй график в середине представляет экспрессию MEF2C мРНК, а третий график справа представляет экспрессию MESP-1 мРНК. Средние значения для наивных клеток от всех пациентов и то же самое для СР клеток для всех пациентов даны на заднем плане гистограммы.
Фиг.10 - график, который представляет изменение фракции выброса (∆ фракции выброса) после лечения сердца разными количествами наивных hMSC (правая часть гистограммы для каждого из двенадцати пациентов) против лечения сердца с помощью CP-hMSC, т.е. 'направляемыми смесью' hMSC (CP-hMSC).
Фиг.11 представляет эхокардиографию инфарктных сердец, нелеченых (слева) и леченых с помощью кардиопоэтических клеток (справа), которая показывает гораздо лучшую реанимацию передней стенки после лечения CP-hMSC.
Фиг.12 - график, подобный фиг.5, показывающий изменение фракции выброса (ΔFF) после введения наивных (слева) и кардиопоэтических клеток (справа) в инфарктный миокард. Симуляция - это инъекция без клеток.
Фиг.13 показывает инфарктные сердца мышей, леченые наивными hMSC и CP-hMSC через шесть месяцев после начала лечения. Аневризмы и шрам, который оставался неисправленным в сердцах, которые лечили необработанными hMSC, рассосались при лечении CP-hMSC, что вызвало ремускуляризацию.
Фиг.14 показывает, что конфокальное разрешение обнаружило в обработанном кардиопоэтическими hMSC миокарде мыши широко распространенное присутствие клеток, полученных от человека, с положительным окрашиванием в отношении h-ALU-ДНК последовательностей, специфических к человеческим видам, подтвержденное иммуноокрашиванием человек-специфическим ламином, все из которых отсутствовали в инфарктных контролях.
Фиг.15 показывает, что кардиомиоциты человеческого происхождения были отслежены с помощью со-локализации человеческого сердечного тропонина-1 и α-актинина в сердцах, обработанных кардиопоэтическими hMSC. В сердцах, обработанных наивными hMSC, отсутствовали кардиомиоциты человеческого происхождения. Количественная оценка в инфарктных передних стенках выявила 3±2% и 25±5% миокардиальных ядер в сердцах, обработанных наивными против CP-hMSC-обработанных, что означает увеличенное приживление при лечении кардиопоэтическими hMSC.
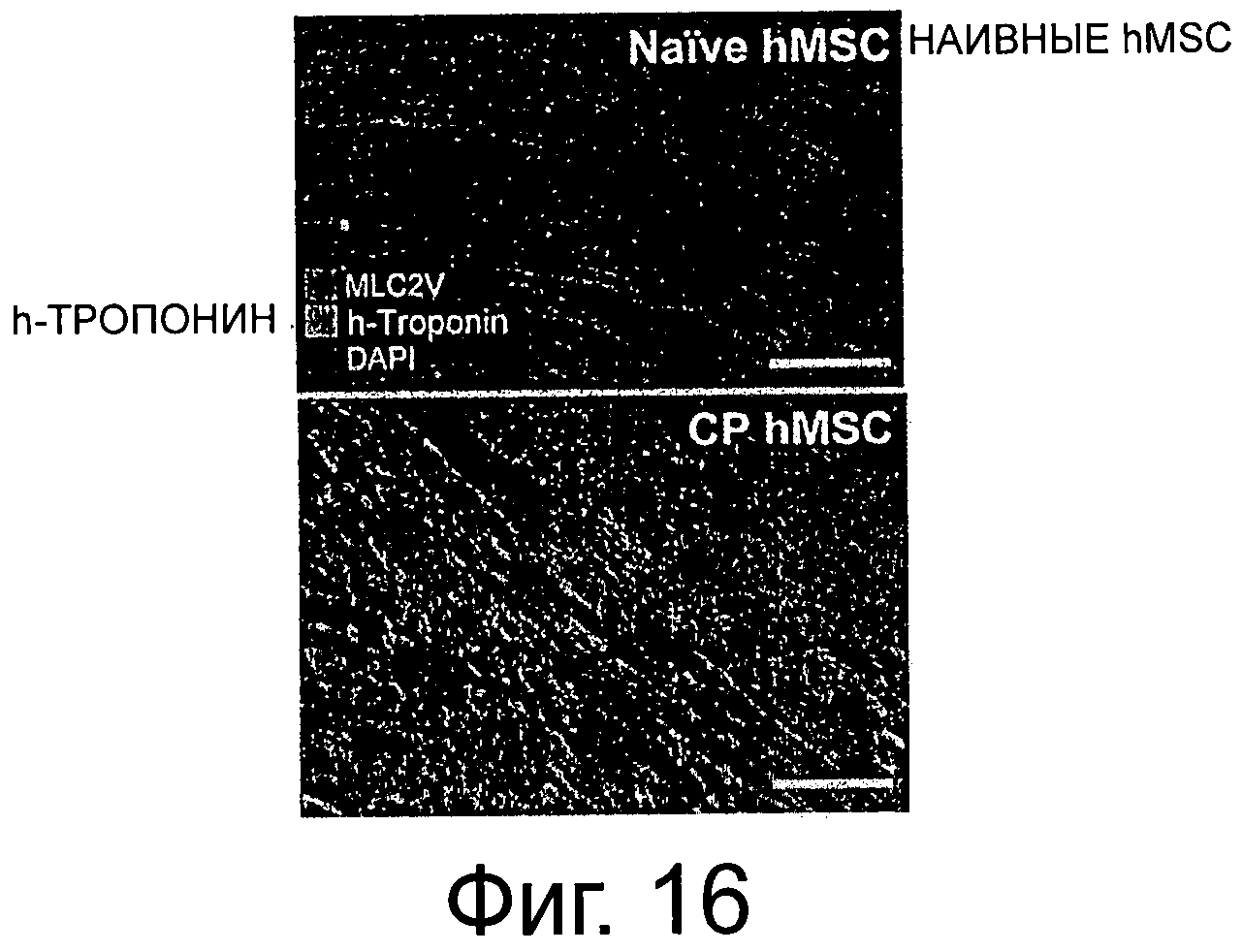
Фиг.16 представляет фотографии наивной и СР hMSC, окрашенных человеческим тропонином, легкой цепью желудочкового миозина mlC2V и DAPI. Фенотип клеток желудочка был подтвержден контрастной окраской положительных к тропонину человека клеток с помощью иммуноокрашивания легкой цепью миозина mlC2V в восстановленной передней стенке, как показано на фиг.15, или рассасывающемся рубце, как показано на фиг.17.
Фиг.17 - фотография остаточного рубца, окрашенного тропонином человека, легкой цепью желудочкового миозина mlC2V и DAPI.
Фиг.18 представляет фотографии регенерирующего миокарда, обработанного CP-hMSC, демонстрирующего ангиогенез дистально к закупоренному коронарному сосуду.
Фиг.19 демонстрирует CP-hMSC вклад в неоваскуляризацию посредством экспрессии человеческого РЕСАМ-1 (CD-31) в миокардиальной сосудистой сети.
Фиг.20 - график Δ фракции выброса относительно симуляции (%) против времени (месяцы) после доставки клеток. Долгосрочное воздействие CP-hMSC-лечения было прослежено в течение более чем одного года 1 или одной трети продолжительности жизни мыши, что следует перевести в 25-лет человеческой жизни. Относительно симуляции, лечение наивными hMSC показало влияние 5% и 2,5% на фракцию выброса на 6 и 12 месяцев, соответственно. Наоборот, инфарктные мыши, леченые кардиопоэтическими hMSC, показали значительное улучшение фракции выброса на 25% на 6 и 12 месяцев относительно симуляции.
Фиг.21 - график Δ фракции выброса (%) против времени (месяцы) после трансплантации клеток. Инфарктная когорта была разделена, чтобы оценить эффективность в подгруппах с точно установленной явной сердечной недостаточностью (фракция выброса <45%) во время воздействия. Несмотря на равноценную фракцию выброса перед обработкой 35%, только обработка кардиопоэтическими hMSC улучшила абсолютную фракцию выброса на 10% на 6 и 12-месяцы, в противоположность уменьшению на 5% во фракции выброса в когорте, которую лечили наивными hMSC.
Фиг.22 - гистограмма выживаемости (%) для указанных подгрупп мышей. В подгруппах с явной сердечной недостаточностью, прослеженных на протяжении 400 дней, не наблюдалось выживших в подгруппе с симуляцией и была отмечена смертность >50% при лечении наивными hMSC. Напротив, при лечении кардиопоэтическими hMSC была достигнута выживаемость >80%.
Фиг.23 иллюстрирует безопасность лечения CP-hMSC, которую установили с помощью анатомо-патологического исследования и электрокардиографии.
Примеры
Для сбора костного мозга случайно отобрали пациентов, подвергавшихся аортокоронарному шунтированию по причине ишемической болезни сердца. Они предоставили информированное согласие, а протоколы исследования были одобрены соответственным институциональным Комитетом по этике и Комитетом по институциональному уходу за животными и их использованию. Следует отметить, что инъекции делали мышам, а не пациентам.
Пример 1
Мезенхимальные стволовые клетки получали из человеческого костного мозга, извлеченного из заднего подвздошного гребня тазовой кости индивидуумов в возрасте от 18 до 45 лет (Cambrex, East Rutherford, New Jersey). Исходя из исследований с помощью проточной цитометрии, мезенхимальные стволовые клетки экспрессировали CD90, CD133, CD105, CD166, CD29 и CD44 и не экспрессировали CD14, CD34 и CD45.
Полученные из костного мозга человека мезенхимальные стволовые клетки культивировали, или в лизате тромбоцитов, или в сыворотке с добавлением TGFβ-1 (2,5 нг/мл), ВМР4 (5 нг/мл), FGF-2 (5 нг/мл), IGF-1 (50 нг/мл), активина-A (10 нг/мл), кардиотрофина (1 нг/мл), α-тромбина (1 единиц/мл) и кардиогенола С (100 нМ). Через 4-10 дней в культуре, содержащей лизат тромбоцитов, при плотности около 1000-2000 клеток на см, было обнаружено, что клетки экспрессируют в 2-5-раз больше MEF2c мРНК, MESP-1 мРНК, Tbx-5 мРНК, GATA6 мРНК, Flk-1 или FOG 1 мРНК, чем необработанные мезенхимальные стволовые клетки.
Через 5-15 дней в культуре, содержащей сыворотку, при плотности около 1000-2000 клеток на см2, было обнаружено, что клетки экспрессируют в 5-10-раз больше MEF2c мРНК, MESP-1 мРНК, Tbx-5 мРНК, GATA 4 мРНК, GATA6 мРНК, Flk-1 или FOG 1 мРНК, чем необработанные мезенхимальные стволовые клетки.
Пары праймеров, использованные для RT-PCR исследований, были стандартными праймерами, полученными коммерческим путем от компании Applied Biosystems.
Результаты показывают, что дифференцированные клетки-кардиопредшественники, обладающие способностью встраиваться в сердечную ткань в качестве функциональных кардиомиоцитов, были получены и in vivo в сокращающемся сердце, и in vitro после аутопсии. In vivo, при анастезии изофлураном, прямая миокардиальная доставка клеток кардиопредшественников в больные сердца улучшала деятельность сердца, что было проконтролировано с помощью эхокардиографии по короткой оси при использовании двумерного M-способа исследования по длинной оси, доплеровского импульсно-волнового исследования и электрокардиографии с 12 отведениями.
Собранную ткань сердца фиксировали в 3% параформальдегиде, делали срезы и проводили иммуноисследование для «отслеживания» клеток человека. Новые, происходящие от человека кардиомиоциты и сосудистая сеть вместе с функциональным улучшением и рассасыванием рубца были подтверждены при исследованиях на мышах, обработанных клетками кардиопредшественниками, удовлетворяющими критериям высвобождения (например, повышенному уровню экспрессии MEF2c мРНК, MESP-1 мРНК, Tbx-5 мРНК, GATA 4 мРНК, GATA6 мРНК, Flk-1 или FOG 1 мРНК), в противоположность отсутствию пользы при использовании клеток, которые не удовлетворяли критерию высвобождения.
Для увеличения выработки кардиопоэтических клеток для аутологичного введения пациентам был рассмотрен альтернативный способ, так как иммунофлуоресценция может быть способом трудоемким, качественным и потенциально зависящим от оператора. Одним из способов выбора является количественная полимеразная цепная реакция с обратной транкриптазой в реальном времени (RT-qPCR). Этот способ дает более быстрые результаты (в течение одного дня), которые не зависят от оператора и являются количественными относительно стандартного образца. Кроме того, тогда как иммуноокрашенные образцы требуют поочередной оценки с помощью флуоресцентной микроскопии, с помощью RT-qPCR, используя 96-луночные планшеты, можно проверить вплоть до 48 разных образцов (или состояний) дважды.
Для установления подходящих маркеров для RT-QPCR кардиопоэтические клетки были извлечены из образцов костного мозга, полученных от пациентов-сердечников (n=7). Клетки оценивали с помощью иммунофлуоресцентного окрашивания к MEF2C и Nkx2.5. Из этих клеток экстрагировали РНК и измеряли экспрессию Nkx2.5 и MEF2C с помощью количественного PCR в реальном времени.
Стандартный образец, состоящий из клеток из той же самой партии, не культивировали в присутствии кардиогенной смеси.
Результаты вычисляли с помощью двойного дельта-Ct-метода, нормализуя данные, полученные от обработанных клеток, к данным от необработанных клеток.
MEF2C был установлен как подходящий маркер кардиопоэтических клеток и при qPCR и при иммунофлуоресценции (ядерная транслокация) по сравнению с наивными клетками. В отличие от этого, качественное изменение в Nkx2.5, обнаруженное при этом уровне белка с помощью иммунофлуоресценции (ядерная транслокация), не было первоначально преобразовано в количественное изменение на уровне РНК относительно необработанных клеток. Затем были изучены гены, расположенные ниже (downstream) Nkx2.5, так как индукция их экспрессии могла зависеть от ядерной транслокации Nxk2.5. Это привело к установлению MESP-1, Flk-1 и Tbx5 как дополнительных подходящих генов для идентификации с помощью QPCR.
Аспираты костного мозга человека (15-20 мл) получали во время хирургической операции аортокоронарного шунтирования после стернотомии. Костный мозг хранили криозамороженным в растворе для заморозки на основе DMSO без сыворотки. Мезенхимальные стволовые клетки набирали посредством platting (плетения) сырого костного мозга на пластиковых чашках с помощью промывки через 12 час селективных адгезивных клеток с идентичностью, подтвержденной методом флуоресцентно-активируемой клеточной сортировки (FACS) с использованием панели маркеров CD34-/CD45-/CD133+. Клетки культивировали при 37°С в среде DMEM с добавлением 5% лизата тромбоцитов человека (Mayo Clinic Blood Bank, Rochester, MN).
Инфаркт миокарда получали у «голых» мышей с иммунной недостаточностью (Harlan, Indianapolis, IN). Вслед за слепым исследованием, через один месяц после инфаркта всего 600000 наивных или «направленных к кардиопоэзу» hMSC, суспензированных в 12,5 мкл среды для выращивания, вводили при визуализации с помощью микроскопа в пять эпикардиальных мест на передней стенке левого желудочка. «Симуляция» - проведение той же самой хирургической процедуры без введения клеток. Миокардиальное введение hMSC костного мозга в эту модель хронического инфаркта показало неоднородность результата трансплантации клеток только от двух из одиннадцати исследованных индивидуумов, улучшая фракцию выброса, исходя из эхокардиографии.
Пациенты 3 и 9 были определены как индивидуумы с высоким кардиогенеративным потенциалом. Как было видно ранее из фиг.1, изменение фракции выброса у мышей (n=3), которых лечили hMSC от каждого пациента 3 и 9, было значимо положительным, тогда как изменение в отношении каждого другого пациента не было таким.
Экспрессия белков сердечных факторов транскрипции была видна в hMSC при помощи конфокальной микроскопии, как показано на фиг.2. Столбик соответствует 20 мкм, относящимся ко всем панелям.
Иммуноокрашивание было выполнено с помощью антител, специфических к MEF2C (1:400, Cell Signaling Technologies, Danvers, MA), Nkx2.5 (1:150, Santa Cruz Biotechnology Inc., Santa Cruz, CA), GATA4 (Santa Cruz Biotechnology Inc.), Phospho-АКТSer473 (1:100, Cell Signaling Technologies), Tbx5 (1:5000, Abeam, Cambridge, MA), Mesp-1 (1:250, Novus Bio, Littleton, CO), Fog-2 (1:100, Santa Cruz Biotechnology), саркомерному белку α-актинину (1:500, Sigma-Aldrich) и человек-специфическому тропонину-I (1:100, Abeam), mlC2v (1:500, Synaptic Systems, Gottigen, Germany), Sca-1 (1:100, R&D Systems, Minneapolis, MN), CD-31/PECAM-1 (1:500, Beckman Coulter, Fullerton, CA), гладкомышечному α-актину (Abeam), человек-специфическому тропонину-I (1:100, Abeam), человеческому ламину А/С (1:50, Novacastra, New Castle, UK), и Ki67 (1:500, Abeam) после фиксации в 3% параформальдегиде и пермеабилизации с помощью 1% Тритона Х-100, и вместе с окрашиванием DAPI, чтобы визуализировать ядра на конфокальной микроскопии, выполненной с помощью лазерного конфокального сканирующего микроскопа LSM 510 (Carl Zeiss Inc., Jena, Германия).
Ранние сердечные факторы транскрипции Nkx2.5, Tbx-5 и MESP1 и поздний сердечный фактор транскрипции MEF2C наблюдали при окрашивании с помощью DAPI. Результаты для пациента 2 представлены слева, а для пациента 9 - справа. Полученные изображения показали, что экспрессия сердечных факторов транскрипции является слабой для hMSC от пациента 2 и высокой для hMSC от пациента 9. Это подтверждает тот факт, что hMSC от пациента 9 дают действенную терапевтическую выгоду, тогда как hMSC от пациента 2 не дают выгоды. DAPI дает синее окрашивание.
На фиг.2 первая серия изображений для Nkx 2.5 показывает ядра клеток, окрашенные DAPI (слева) только синие для hMSC пациента 2 (слева). Также появляется слабое зеленое окрашивание, соответствующее присутствию Nkx 2.5 в цитоплазме. Соответствующее изображение для пациента 9 (справа) показывает более высокую экспрессию Nkx 2.5 (зеленый) в цитоплазме, а также в ядрах клеток.
Вторая серия изображений показывает сердечные факторы транскрипции Tbx-5 (зеленый) и MESP-1 (красный) для пациента 2 и ядра клеток, окрашенные в синий с помощью DAPI, не видно зеленого или красного окрашивания, что соответствует отсутствию экспрессии Tbx-5 и MESP-1. У пациента 2 цитоплазмы клеток окрашены в красный, а ядра - в зеленый, что соответствует сильной экспрессии обоих сердечных факторов транскрипции и перемещению (транслокации) Tbx-5 в ядра клеток.
Третья серия изображений предоставляет результаты для MEF2C, подобно результатам для Nkx 2.5.
Фиг.3 показывает экспрессию мРНК, исследованную с помощью qPCR, показывающую экспрессию сердечных факторов транскрипции (MEF2C и Tbx-5) для hMSC одиннадцати пациентов исследования.
Количественную полимеразную цепную реакцию (qPCR) проводили с использованием набора TaqMan PCR с помощью прибора Applied Biosystems 7,900HT Sequence Detection System (Applied Biosystems, Foster City, CA). Реакции TaqMan Gene Expression инкубировали в 96-луночных планшетах и проводили трижды. Пороговый цикл (Ст) был определен как число дробных циклов, при котором флуоресценция проходит фиксированный порог. Значения TaqMan CT преобразовывали в относительные кратные изменения, определенные с помощью способа, нормализованного к GAPDH (PW 435,2662-0506003) экспрессии.
Были оценены гены, перечисленные в таблице 1, которые являются характерными для сердечной транскрипционной активности.
В клетках оценили уровни мРНК и белка до и после 5-дневной стимуляции кардиогенной смесью, содержащей человеческий рекомбинантный TGFβ-1 (2,5 нг/мл), ВМР4 (5 нг/мл), кардиотрофин (1 нг/мл), α-тромбин (1 U/мл) и кардиогенол С (100 µМ). Экспрессия и MEF2C мРНК и Tbx-5 мРНК (в произвольных единицах AU) намного выше для hMSC пациентов 2 и 9, чем одного из других пациентов.
Функцию левого желудочка и структуру исследовали периодически с последующей трансторакальной эхокардиографией (Sequoia 512; Siemens, Malvem, PA и VisualSonics Inc, Торонто, Канада). Фракцию выброса (%) вычисляли как [(LVVd-LVVs)/LVVd]×100, где LVVd представляет собой левый желудочковый конечно-диастолический объем (мкл), a LVVs представляет собой правый желудочковый конечно-систолический объем (мкл).
Фиг.4 показывает экспрессию мРНК в произвольных единицах (A.U.) сердечных факторов транкрипции соответственно для Nkx2.5 мРНК, GATA-6 мРНК и Fog-1 мРНК, необработанных, наивных hMSC (слева) и CP-hMSC, обработанных кардиогенной смесью (справа). Понятно, в этом случае, что результаты намного лучше, когда используются клетки, обработанные кардиогенной смесью.
Фиг.5 представляет изображения, полученные с помощью конфокальной микроскопии, показывающие ядерную транслокацию Nkx2.5, MEF2c, GATA4 и FOG-2 полипептидов в наивных CP-hMSC, обработанных кардиогенной смесью. Nkx2.5, MEF2c, GATA4 и FOG-2 появляются в зеленом свете, a DAPI - в синем. На изображениях наивных hMSC не появляется факторов транскрипции. Полипептиды перемещаются в ядра CP-hMSC (правая сторона), как видно по концентрированному зеленому окрашиванию.
Фиг.6 иллюстрирует постепенное превращение (на дни D0, D5, D15 и день D20) из наивных hMSC в 'направляемые смесью' CP-hMSC и в конце концов в кардиомиоциты, СМ. На день D0 ядра окрашиваются в синий цвет с помощью DAPI. На D5 MEF2C полипептид перемещается в ядра (зеленое окрашивание). На D15 присутствует саркомерный α-актинин (красное окрашивание), который показывает, что присутствуют саркомеры и, следовательно, что клетки являются окончательно включенными в кардиомиотическую дифференцировку и не являются больше кардиопоэтическими. На D20 в кардиомиоцитах присутствует большое количество тропонина-1 (конечная дифференцировка).
Фиг.7 показывает (с помощью transition элетронной микроскопии) ультраструктуру наивной hMSC (слева) и 'направляемого смесью' кардиомиоцита (справа). С этой целью клетки культивировали в 1% лизате тромбоцитов в течение 15 дней. Кардиомиоциты показывают митохондриальное созревание, саркомерогенез и образование мышечных трубочек.
Фиг.8 показывает 'направляемый смесью' кардиомиоцит в световом микроскопе. Созревание системы возбуждения-сокращения было оценено через индукцию calcium transients (повышений кальция, скачков кальция). С этой целью клетки культивировали в течение 15 дней после 5 дней стимулирования смесью и «нагружали» в течение 30 мин при 37°С (5 мкМ) кальций-селективным зондом фтор-4-ацетоксиметилэфиром (Molecular Probes, Carlsbad, CA) для живого изображения с использованием микроскопа с контролируемой температурой Zeiss LSM510 (Цейс) и изображений линейного сканирования, полученных во время стимуляции 1 Hz.
Фиг.9 показывает 3-, 8- и 8-кратное увеличение Tbx-5, MEF2C и MESP-1 в обработанных по сравнению с необработанными hMSC.
Как показано на фиг.10, CP-hMSC, удовлетворяющие CARPI критериям, были доставлены in vivo через один месяц после инфаркта и значительно улучшали фракцию выброса по сравнению с сопоставимыми пациентами с наивными hMSC.
Фиг.11 представляет эхокардиографию инфарктных сердец нелеченых (слева) и леченых с помощью кардиопоэтических клеток (справа), которая показывает гораздо лучшую реанимацию передней стенки после лечения CP-hMSC. Электрокардиограммы были записаны с помощью электрокардиографии с четырьмя отведениями (МР150; Biopac, Goleta, CA) под легкой анестезией (1,5% изофлуран).
На основании эхокардиографии: сократимость улучшалась на 15% и 20% за один и два месяца, соответственно, после лечения CP-hMSC (n=14), в противоположность незначительному изменению, зарегистрированному с наивными hMSC (n=17) или симуляцией (n=10; фиг.9). Наверху: эхокардиография инфарктных сердец через 4 недели после перевязки коронарной артерии и за 1 день до клеточной трансплантации (4 недели после MI - нет клеточной трансплантации Tx), показанной M-способом на акинетической передней стенке в обеих исследуемых группах. Середина: 4 недели после клеточной трансплантации; сердца, которые лечили наивными hMSC, показали сохранившуюся акинезию в передней стенке, в противоположность реанимации (оживлению) в группе, леченой CP-hMSC. Ниже: 8 недель после клеточной трансплантации, леченые наивными hMSC сердца продолжали показывать ограниченное подтверждение миокардиального восстановления против сильной сократительной активности в инфарктных сердцах, которые лечили СР hMSC. Левые панели представляют парастернальные (PS) проекции по длинной оси с пунктирной линией, показывающей уровень 2-D M-Mode capture (захват). Стрелки на правых панелях показывают реанимацию передней стенки.
Фиг.12 показывает, что в среднем, направленные кардиопоэтические hMSC давали заметное улучшение в течение одного и двух месяцев после инъекции в инфарктный миокард. В противоположность этому, наивные hMSC или контроли-симуляция имели ограниченное влияние на фракцию выброса. Звездочка и двойная звездочка показывает p<0,01 по сравнению с наивными hMSC для двух временных точек.
В сердцах, которые лечили кардиопоэтическими клетками, полученными от hMSC, функциональное улучшение коррелировало с миокардиальной регенерацией при трехмесячной и 18-месячной гистопатологической оценке. Аневризмы и рубец, которые оставались неисправленными в сердцах, которые лечили наивными hMSC, рассасывались при лечении кардиопоэтическими hMSC, что вызывало ремускуляризацию (фиг.13).
Полная патологическая оценка показала рассасывание рубца после перевязки левой передней нисходящей артерии (LAD) (желтый круг на сердце) при наличии, на поперечном сечении, сильной ремускуляризации и незначительного ремоделирования в кардиопоэтических (СР, справа) в противоположность инфарктным сердцам, леченым наивными (слева) hMSC на 6-месяц после начала лечения. Эти результаты являются особенно хорошими.
Взятие пробы для ALU-ДНК было проведено с помощью человеческой ALU-пробы (Biogenex, San Ramon, CA) путем гибридизации при 85°С в течение 5-10 минут и инкубации при 37°С в течение ночи с последующим антифлуоресцеин GFP-меченым вторичным обнаружением.
Конфокальное разрешение показало в миокарде мыши, леченом CP-hMSC, широко распространенное присутствие клеток, происходящих от человека, с положительным окрашиванием ALU ДНК последовательностей, специфических к человеческим видам, подтвержденное иммуноокрашиванием человек-специфическим ламином, причем клетки отсутствуют в неинфарктных контролях (фиг.14).
В противоположность симуляции (слева), сердца, леченые кардиопоэтическими hMSC, при оценке с помощью конфокальной микроскопии обнаружили значительное присутствие человеческих ядер при окрашивании с помощью человеческой h-ALU ДНК пробы (середина), помещенной в инфарктный миокард мыши, дополнительно подкрепленное дополнительным окрашиванием антителом, специфическим к ламину человека (справа вставка, показанная на фиг.14). Замороженные срезы миокарда были сделаны из сердец, зафиксированных сверхокисленным 3% параформальдегидом при PBS перфузии. Столбик показывает 50 мкм.
Фиг.15 показывает, что антитело, специфичное к тропонину-I человека, не показало окрашивания в наивных (слева) против значительного окрашивания в передней стенке сердец, обработанных кардиопоэтическими hMSC (средняя и правая панели).
Кроме того, как показано на фиг.16 окрашивание тропонином-I человека сердец, обработанных наивными (верх), против сердец, обработанных кардиопоэтическими hMSC (низ), контрастно-окрашенных с помощью mlC2v, показало образование миокарда желудочка из привитых человеческих клеток. Столбик показывает 20 мкм (верх) и 50 мкм (низ).
Как показано на фиг.17 в остаточном рубце миокард, происходящий из стволовых клеток, извлеченных из сердец, обработанных кардиопоэтическими hMSC, можно отличить от нативного мышиного миокарда с помощью со-локализации тропонина человека с mlC2V. Столбик показывает 50 мкм.
На фиг.18 микроскопия поверхности обнаружила ангиогенез дистально к перевязанной LAD (черный круг) в сердцах, леченых CP-hMSC, возникающий из правой коронарной артерии (RCA; левый низ) и circumflex (огибающей артерии) (правая нижняя часть).
Фиг.19 показывает конфокальную оценку коллатеральных сосудов из сердец, обработанных кардиопоэтическими hMSC, продемонстрированную человек-специфическим CD-31 (PECAM-1) окрашиванием. Столбик представляет 20 мкм.
Фиг.20 показывает оценку изменения фракции выброса относительно симуляции в %, в течение 12 месяцев, во время лечения и наивными и направленными смесью (СР) hMSC. Относительно симуляции, обработка наивными hMSC показала эффект 5% и 2,5% на фракцию выброса на 6 и 12 месяцев, соответственно.
В противоположность этому, CP-hMSC-обработанные инфарктные мыши показали значимое улучшение фракции выброса 25% на 6 и 12 месяцев относительно симуляции (фиг.20). Кроме того, инфарктная когорта была разделена, чтобы оценить эффективность в подгруппах с подтвержденной явной сердечной недостаточностью (фракция выброса <45%) во время воздействия. Несмотря на равноценную фракцию выброса до обработки 35%, только лечение кардиопоэтическими hMSC улучшало абсолютную фракцию выброса до 10% на 6 и 12-месяцев, в противоположность 5% снижению фракции выброса в когорте, которую лечили наивными hMSC (фиг.23). Как показано на фиг.22, большее преимущество по выживанию в группе, обработанной кардиопоэтическими hMSC, в противоположность когорте, обработанной наивными клетками, и симуляции было определено благодаря применению функции Каплана-Майера с цензурированием.
Эффективность кардиопоэтических (СР) hMSC была показана с помощью эхокардиографии в течение последующего 1-летнего наблюдения (см. фиг.23). Изображение по продольной оси сердец, обработанных наивными стволовыми клетками, показало фиброзную и гипокинетическую переднюю стенку, наиболее очевидную при апикальной оценке М-способом (пациент 11, левые панели). В противоположность этому CP-hMSC-обработанные сердца показали сильный сократительный профиль по всей передней стенке, показывая продолжительную пользу от терапии направленными стволовыми клетками (пациент 11, правые панели).
Пример 2
Подобные результаты наблюдались при обработке стволовых клеток смесью, содержащей рекомбинантный TGFβ-1(2.5 нг/мл), ВМР4 (5 нг/мл), кардиотрофин (1 нг/мл), кардиогенол С (100 µМ) и α-тромбин, (1 U/мл), FGF-2 (10 нг/мл), IGF-1 (50 нг/мл) и активин-A (5 нг/мл), использованные комбинаторным образом.
Пример 3
Подобные результаты наблюдались при обработке стволовых клеток смесью, содержащей рекомбинантный TGF-βl (2.5 нг/мл), BMP-4 (5 нг/мл), активин-A (5 нг/мл), FGF-2 (10 нг/мл), IL-6 (100 нг/мл), фактор IIа (hα-тромбин, 1 U/мл), IGF-1 (50 нг/мл) и ретиноевую кислоту (1 мкМ), использованные комбинаторным образом.
Другие варианты осуществления
Понятно, что тогда как изобретение описано вместе с его подробным описанием, предшествующее описание предназначено для того, чтобы иллюстрировать и не ограничивать рамки изобретения, которое определяется рамками прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в рамках следующих пунктов формулы изобретения.
Реферат
Группа изобретений относится к медицине и касается композиции для лечения сердечной ткани, содержащей TGFβ-1, ВМР4, α-тромбин, кардиотрофин и кардиогенол С; способа получения из стволовых клеток млекопитающих, дифференцированных клеток-кардиопредшественников, включающего культивирование исходных клеток в присутствии указанной композиции; способа обеспечения сердечной ткани кардиомиоцитами, который включает введение в сердечную ткань дифференцированных клеток, полученных указанным выше способом получения. Группа изобретений обеспечивает улучшенную специфичность в регулировании транскрипции генов, необходимых для индукции дифференцирования. 5 н. и 22 з.п. ф-лы, 23 ил., 1 табл., 3 пр.
Формула
13 Композиция по п.1, которая содержится в среде, выбранной из группы, состоящей из среды, содержащей фетальную телячью сыворотку, человеческую сыворотку, лизат тромбоцитов и их смеси.
(а) определение, что образец клеток из популяции дифференцированных клеток содержит клетки, которые экспрессируют повышенный уровень, по меньшей мере, одной из мРНК, выбранной из группы, состоящей из MEF2c мРНК, MESP-1 мРНК, Tbx-5 мРНК, GATA4 мРНК, Flk-1 мРНК, GATA6 мРНК, Fog-1 мРНК и их комбинаций и/или имеет, по меньшей мере, один полипептид, выбранный из группы, состоящей из Nkx2.5 полипептидов, MEF2C полипептидов, Tbx-5 полипептидов, MESP-1 полипептидов, GATA-4 полипептидов, FOG-2 полипептидов и их комбинаций, при этом указанный полипептид связан с ядрами указанных дифференцированных клеток, и
(b) введение клеток из популяции дифференцированных клеток млекопитающему.

Комментарии