Гидроксипуриновые соединения и пути их применения - RU2673458C1
Код документа: RU2673458C1
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[1] Настоящее изобретение относится к группе гидроксипуриновых соединений и к путям их применениям в качестве ингибиторов PDE2 или TNF-α, в частности относится к соединению, характеризующемуся структурой формулы (I), его таутомеру или его фармацевтически приемлемой соли.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[2] Фосфодиэстеразы (PDE) катализируют гидролиз циклических нуклеотидов cGMP и cAMP и регулируют различные физиологические реакции путем контроля внутримолекулярных концентраций этих двух важных вторичных мессенджеров. Атипичная внутримолекулярная регуляция циклических нуклеотидов cGMP и cAMP является причиной многих заболеваний, при этом уже существует ряд лекарственных средств, которые могут улучшать и лечить заболевания путем ингибирования активности PDE, такие как ингибиторы PDE5 для лечения легочной гипертензии и ингибиторы PDE4 для лечения артрита, вызванного псориазом. Существует одиннадцать категорий известных сегодня генов фосфодиэстеразы, причем каждая категория может экспрессироваться в несколько подтипов, в общей сложности более 100 подтипов PDE. Разные подтипы имеют разную структуру и разное распределение в тканях, при этом активность циклических нуклеотидов cGMP и cAMP и физиологическое действие регуляции также очень отличаются.
[3] Фосфодиэстераза PDE2 может катализировать гидролиз циклических нуклеотидов cGMP и cAMP, в то время как активность в отношении cAMP регулируется cGMP, что играет ключевую роль во внутриклеточном балансе действия cGMP и cAMP. PDE2 в значительной степени экспрессируется в тканях человека, при этом распределяется в основном в сердце, центральной нервной системе, печени, надпочечнике, эндотелиальных клетках, тромбоцитах и и т.д. PDE2 участвует в регуляции различной физиологической деятельности, такой как обучение, память и когнитивные процессы центральной нервной системы, поддержание основного ритма сердца, гладкой мышцы и эндотелиальных клеток, поддержание проницаемости эндотелиальных клеток, регуляция воспалительной реакции. Нокаут гена PDE2 приведет к гибели эмбриона мыши. Ингибирование активности PDE2 можно применять для лечения множества заболеваний, связанных с центральной нервной системой, сердечно-сосудистых заболеваний и при борьбе с воспалением.
[4] Активность, заключающаяся в неселективном ингибировании PDE, была обнаружена намного раньше для множества природных и искусственных пуриновых соединений, таких как кофеин, теофилин, пентоксифиллин и т.д. Пентоксифиллин (обладает активностью в отношении PDE2) был одобрен для клинического применения при динамическом нарушении кровообращения нижних конечностей, вызванном закупориванием периферических сосудов, основными функциями которого являются уменьшение вязкости крови, улучшении деформации эритроцитов, ингибирование агрегации тромбоцитов и т.п. Также сообщалось о том, что новые высокоселективные ингибиторы PDE2 контролируют деление эндотелиальных клеток и регенерацию кровеносных сосудов, а также улучшают диагностику центральной нервной системы. Однако разработка и применение новых селективных ингибиторов PDE2 в целом все еще очень ограничены, и открытие и применение новых ингибиторов PDE2 имеют широкие перспективы.
[5] Фактор некроза опухолей альфа (TNF-α) представляет собой цитокин с множественной биологической активностью, который оказывает существенное влияние на возникновение, развитие и прогнозирование множества заболеваний. TNF-α в основном продуцируется моноцитами и макрофагальными клетками, которые участвуют в иммуномодуляции и координации цитокиновой сети. При нормальных условиях TNF-α играет важную роль в иммунной защите и иммунном надзоре, но в некоторых случаях он оказывает отрицательные воздействия. Исследования показывают, что сверхэкспрессия TNF-α может вызвать экспрессию провоспалительных цитокинов, таких как интерлейкин 1 (IL-1) и IL-6, увеличить проницаемость эндотелиальных клеток, повысить уровень регуляции экспрессии адгезивных молекул и активировать нейтрофилы и эозинофилы, а также вызвать секрецию костными синовиальными клетками и хрящевыми клетками веществ острой фазы и ферментов, разрушающих ткани, и подобное, что может спровоцировать возникновение воспаления. Данные патологические реакции играют очень важную роль в возникновении и развитии многих иммуноопосредованных воспалительных заболеваний (IMID), таких как ревматоидный артрит (RA), псориатический артрит (PsA), анкилозирующий спондилоартрит (AS), воспалительное заболевание кишечника (IBD), ювенильный хронический артрит (JCA), васкулит и т.п. Исследования показали, что TNF-α является идеальной мишенью при лечении вышеупомянутого множества IMID, а применение антагонистов TNF-α (ингибиторов TNF-α) для нейтрализации избытка TNF-α является идеальным способом эффективной профилактики хронических воспалительных заболеваний, обусловленных сверхэкспрессией TNF-α. PDE2 регулирует экспрессию TNF-α в соответствии с механизмом, согласно которому уровень TNF-α может контролироваться посредством регулирования активности PDE2, направленной на борьбу с воспалением.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[6] В настоящем изобретении предусматривают соединение, характеризующееся структурой формулы (I), его таутомер или его фармацевтически приемлемую соль,

(I),
[7] где
[8] структурная единица
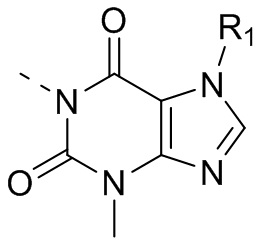

[9] L11 выбран из отсутствия или C(R)(R');
[10] каждый из R, R' независимо выбран из H, галогена, OH, NH2, CN или необязательно замещенного 1-6-членного алкила или гетероалкила;
[11] при этом R, R' необязательно могут образовывать 3-6-членный циклоалкил, гетероциклоалкил путем циклизации;
[12] A отсутствует или выбран из циклоалкила, гетероциклоалкила, арила или гетероарила, каждый из которых является необязательно замещенным;
[13] L12 выбран из необязательно замещенного 1-6-членного алкила или гетероалкила;
[14] R1 выбран из необязательно замещенного 1-6-членного алкила или гетероалкила;
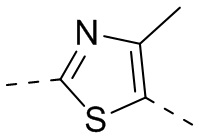
[15] “гетеро” означает N, O, S, C(=O), S(=O) или S(=O)2, при этом число гетероатомов в каждой группе выбрано из 1, 2, 3 или 4.
[16] В некоторых вариантах осуществления настоящего изобретения заместители в R, R', A, L12 и R1 независимо выбраны из галогена, OH, NH2, CN или необязательно замещенного 1-6-членного алкила или гетероалкила, при этом число заместителей при каждой группе независимо выбрано из 1, 2 или 3.
[17] В некоторых вариантах осуществления настоящего изобретения заместители в R, R', A, L12 и R1 независимо выбраны из галогена, CF3, CN, OH, Me, Et, н-пропила, изопропила, циклопропила,


[18] В некоторых вариантах осуществления настоящего изобретения R и R' независимо выбраны из H, Me, CF3 или Et.
[19] В некоторых вариантах осуществления настоящего изобретения L11 выбран из







[20] В некоторых вариантах осуществления настоящего изобретения A выбран из 3-12-членного алкила или циклоалкила или 5-12-членного арила или гетероарила, каждый из которых является необязательно замещенным.
[21] В некоторых вариантах осуществления настоящего изобретения A выбран из циклопропила, циклобутила, циклопентила, циклогексила, эпоксипентила, фенила, пиридила, пиразинила, оксазолила, изоксазолила, тиазолила или бицикло[1.1.1]пентана или бициклической группы, спирогруппы или конденсированной циклической группы, состоящей из любых двух вышеупомянутых групп, каждая из которых является необязательно замещенной.
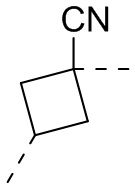
[22] В некоторых вариантах осуществления настоящего изобретения A выбран из








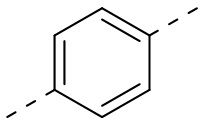






[23] В некоторых вариантах осуществления настоящего изобретения A выбран из



























[24] В некоторых вариантах осуществления настоящего изобретения L12 выбран из метилена,






[25] В некоторых вариантах осуществления настоящего изобретения R1 выбран из Me, CHF2, CF3, Et, CH2CF3, изопропила,


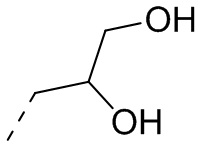


[26] Объект настоящего изобретения выбран из группы, состоящей из:


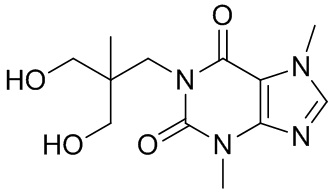

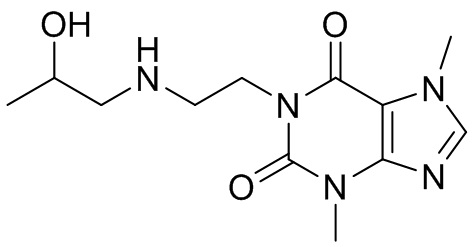


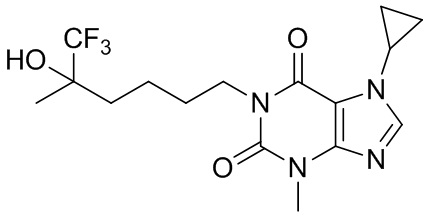





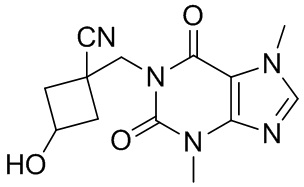









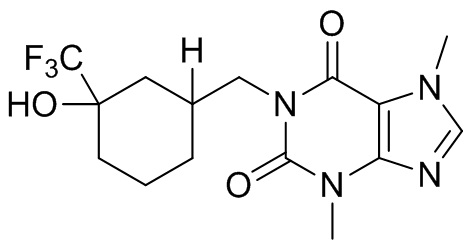



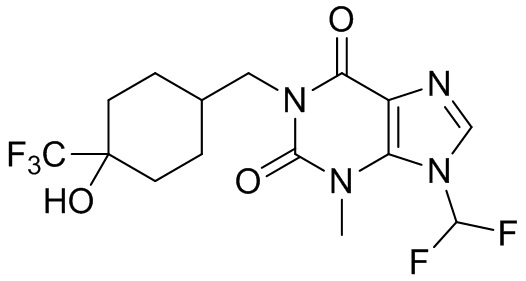















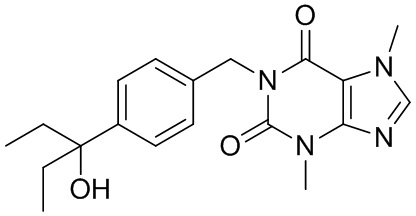

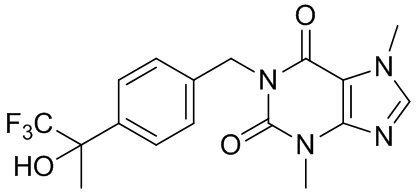












[27] Более того, объект настоящего изобретения выбран из группы, состоящей из:



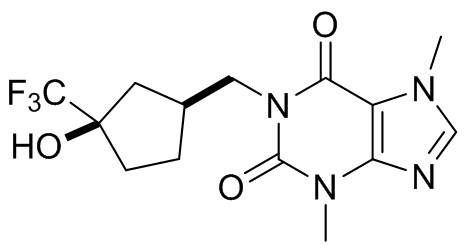














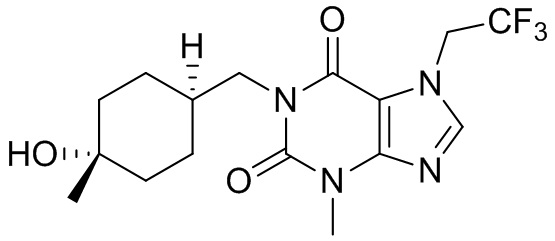






[28] В настоящем изобретении также предусматривают применение соединения, его таутомера или его фармацевтически приемлемой соли в получении ингибитора PDE2 и ингибитора TNF-α.
Соответствующие определения
[29] Если не указано иное, предполагается, что следующие термины и выражения, используемые в данном документе, имеют следующие значения. Конкретные термин или выражение при отсутствии точного определения не стоит считать неопределенным или неясным, а следует понимать в соответствии с обычным значением. Если в данном документе встречается торговое название, то оно относится к соответствующему продукту или к его активному ингредиенту.
[30] В данном документе термин «фармацевтически приемлемый» предназначен для тех соединений, материалов, композиций и/или лекарственных форм, которые в рамках объективного врачебного мнения применимы для использования по отношению к тканям людей и животных, но без чрезмерных токсичности, раздражения, аллергических реакций или других проблем или осложнений, при этом также отвечают приемлемому отношению польза/риск.
[31] Термин «фармацевтически приемлемая соль» относится к соли соединения согласно настоящему изобретению, которую получают с помощью соединения с конкретным заместителем, раскрытым в настоящем изобретении, и относительно нетоксичной кислоты или щелочи. Если соединение согласно настоящему изобретению содержит относительно кислотную функциональную группу, соль присоединения щелочи можно получить путем приведения соединения в нейтральной форме в контакт с достаточным количеством щелочи в чистом растворе или подходящем инертном растворе. Фармацевтически приемлемая соль присоединения щелочи включает соль натрия, калия, кальция, аммония, органического аммония или магния или т.п. Если соединение согласно настоящему изобретению содержит относительно щелочную функциональную группу, соль присоединения кислоты можно получить путем приведения соединения в нейтральной форме в контакт с достаточным количеством кислоты в чистом растворе или подходящем инертном растворителе. Примеры фармацевтически приемлемой соли присоединения кислоты включают соль неорганической кислоты, причем неорганическая кислота включает кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, угольная кислота, бикарбонат, фосфорная кислота, гидрофосфат, дигидрофосфат, серная кислота, гидросульфат, йодистоводородная кислота, фосфористая кислота и т.д.; и соль органической кислоты, причем органическая кислота включает кислоты, такие как уксусная кислота, пропионовая кислота, изомасляная кислота, малеиновая кислота, малоновая кислота, бензойная кислота, янтарная кислота, субериновая кислота, фумаровая кислота, молочная кислота, миндальная кислота, фталевая кислота, фенилсульфоновая кислота, п-толуолсульфоновая кислота, лимонная кислота, винная кислота, метилсульфоновая кислота и т.п.; и также включают соль аминокислоты (например, аргинина и т.д.), и соль органической кислоты, такой как глюкуроновая кислота и т.п. (см. Berge et al., «Pharmaceutical Salts», Journal of Pharmaceutical Science 66: 1-19 (1977)). Некоторые конкретные соединения согласно настоящему изобретению содержат как щелочную, так и кислотную функциональные группы, с возможностью превращения в любую соль присоединения щелочи или присоединения кислоты.
[32] Предпочтительно нейтральную форму соединения регенерируют путем приведения соли в контакт с основанием или кислотой традиционным способом, а затем отделения исходного соединения. Разница между исходной формой соединения и различными солевыми формами заключена в некоторых физических свойствах, как, например, отличающаяся растворимость в полярном растворителе.
[33] «Фармацевтически приемлемая соль» по настоящему изобретению представляет собой производные соединения согласно настоящему изобретению, где исходное соединение модифицировано путем образования соли с помощью кислоты или щелочи. Примеры фармацевтически приемлемой соли включают, но без ограничения, соль неорганической кислоты или органической кислоты и щелочи, такой как амин, щелочной металл, или органическую соль кислотного радикала, такого как карбоновой кислоты и т.п. Фармацевтически приемлемая соль включает традиционные нетоксичные соли или соли четвертичного аммония исходного соединения, такие как соль, образованная с помощью нетоксичной неорганической кислоты или органической кислоты. Традиционная нетоксичная соль включает, но без ограничения, такие соли, которые получены из неорганических кислот и органических кислот, причем неорганические кислоты или органические кислоты выбраны из 2-ацетоксибензойной кислоты, 2-изэтионовой кислоты, уксусной кислоты, аскорбиновой кислоты, фенилсульфоновой кислоты, бензойной кислоты, бикарбоната, угольной кислоты, лимонной кислоты, этилендиаминтетрауксусной кислоты, этандисульфоновой кислоты, этансульфоновой кислоты, фумаровой кислоты, глюкогептозы, глюконовой кислоты, глутаминовой кислоты, гликолевой кислоты, бромистоводородной кислоты, хлористоводородной кислоты, гидройодата, гидроксила, гидроксинафтойной кислоты, изэтионовой кислоты, молочной кислоты, лактозы, додекансульфоновой кислоты, малеиновой кислоты, яблочной кислоты, миндальной кислоты, метансульфоновой кислоты, азотной кислоты, щавелевой кислоты, памоевой кислоты, пантотеновой кислоты, фенилуксусной кислоты, фосфорной кислоты, полигалактуронана, пропионовой кислоты, салициловой кислоты, стеариновой кислоты, фолиновой кислоты, янтарной кислоты, аминосульфоновой кислоты, сульфаниловой кислоты, серной кислоты, дубильной кислоты, винной кислоты и п-толуолсульфоновой кислоты.
[34] Фармацевтически приемлемая соль согласно настоящему изобретению может быть получена посредством традиционного способа с помощью исходного соединения, содержащего кислотную или щелочную группу. В общем, способ получения соли включает получение в воде или органическом растворителе или смеси воды и органического растворителя, приведение данных соединений в форме свободных кислот или щелочей в реакцию со Ошибка! Недопустимый объект гиперссылки. подходящих щелочей или кислот. В общем, предпочтительно выбирать неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил и т.п.
[35] За исключением формы соли в настоящем изобретении представлена форма пролекарства для соединения. Пролекарство соединения, описанного в настоящем изобретении, легко превращают в соединение согласно настоящему изобретению посредством химических изменений в физиологических условиях. Кроме того, пролекарство можно превращать в соединение согласно настоящему изобретению посредством химического или биохимического способа в окружающей среде in vivo.
[36] Некоторые соединения согласно настоящему изобретению могут существовать в виде несольватной или сольватной форм, в том числе гидратных форм. В общем, сольватная форма подобна несольватной форме, обе из которых включены в объем настоящего изобретения.
[37] Некоторые соединения согласно настоящему изобретению могут содержать асимметрические атомы углерода (оптический центр) или двойные связи. Рацемические изомеры, диастереомеры, геометрические изомеры и одинарные изомеры включены в объем настоящего изобретения.
[38] Ошибка! Недопустимый объект гиперссылки. рацемического изомера, амбискалемического и скалемического или энантиомерно чистого соединения согласно настоящему изобретению взято из Maehr, J. Chem. Ed. 1985, 62: 114-120. Если не указано иное, абсолютная конфигурация стереоцентра представлена клиновидными и пунктирными линиями. Если соединение согласно настоящему изобретению содержит виниловую двойную связь или другой геометрический асимметрический центр и если не указано иное, то включены E-, Z-геометрические изомеры. Подобным образом, в объем настоящего изобретения включены все таутомерные формы.
[39] Соединение по настоящему изобретению может существовать в виде конкретного геометрического или стереоизомерного изомера. Настоящее изобретение предусматривает все соединения этого класса, включая цис- и транс-изомеры, (-)- и (+)-антимеры, (R)- и (S)-антимеры, диастереомеры, (D)-изомер, (L)-изомер, а также рацемические смеси и другие смеси, такие как энантиомерно или диастереомерно обогащенные смеси, при этом все такие смеси включены в объем настоящего изобретения. В таких заместителях, как алкил, могут находиться другие асимметричные атомы углерода. Все эти изомеры и их смеси включены в объем настоящего изобретения.
[40] Оптически активные (R)- и (S)-изомеры, (D)- и (L)-изомеры могут быть получены посредством асимметричного синтеза, или хиральных реагентов, или других обычных методик. Если желателен энантиомер соединения согласно настоящему изобретению, то для его получения можно применять асимметричный синтез или получение производных хиральных вспомогательных веществ, при которых выделяют получаемые в результате смеси диастереомеров, а вспомогательные группы расщепляют с получением чистого необходимого энантиомера. Либо же, если молекула содержит щелочную функциональную группу (такую как амино) или кислотные функциональные группы (такие как карбоксильная), то соль диастереомера образуется с помощью соответствующей оптически активной кислоты или щелочи, а затем чистый энантиомер можно повторно использовать после расщепления на соль диастереомера посредством обычных способов, которые известны в данной области. Кроме того, разделение энантиомера и диастереомера, как правило, осуществляют посредством хроматографического способа, при этом в хроматографическом способе используют хиральную стационарную фазу и необязательно в комбинации с химическим способом получения производных (например, из амина образуется карбамат).
[41] Один или несколько атомов, из которых состоит соединение по настоящему изобретению, могут содержать неестественное соотношение атомных изотопов. Например, соединение может быть мечено радиоактивным изотопом, таким как тритий (3H), йод-125(125I) или C-14(14C). Все варианты в изотопной композиции соединения, раскрытого в настоящем изобретении, вне зависимости от радиоактивности, включены в объем настоящего изобретения.
[42] Термин «фармацевтически приемлемый носитель» относится к любому составу или несущей среде, способным доставлять эффективное количество активного вещества, раскрытого в настоящем изобретении, не оказывающим отрицательного воздействия на биологическую активность активного вещества и без каких-либо токсичных побочных эффектов на хозяина или пациента, при этом иллюстративный носитель включает воду, масло, растительного и минерального происхождения, основу для крема, основу для лосьона, основу для мази и т.п. Основа включает суспензию, загуститель, усилитель проникновения через кожу и т.п. Их составы хорошо известны специалисту в области косметических или локальных лекарственных средств. В отношении других данных о носителе можно ссылаться на Remington: The Science and Practice of Pharmacy, 21st Ed., Lippincott, Williams & Wilkins (2005), содержание которого включено в данный раздел в качестве ссылки.
[43] Термин «вспомогательное средство» относится, как правило, к носителю, разбавителю и/или среде, необходимым для получения эффективной фармацевтической композиции.
[44] В отношении лекарственного средства или фармакологического активного средства термин «эффективное количество» или «терапевтически эффективное количество» относится к количеству лекарственного средства или состава, достаточному для достижения необходимых эффектов, но без токсичности. В отношении состава для перорального применения по настоящему изобретению «эффективное количество» одного активного вещества в композиции относится к количеству, необходимому для достижения необходимых эффектов в комбинации с другим активным веществом в композиции. Определение эффективного количества отличается для каждого субъекта, причем зависит от возраста и общего состояния пациента, а также от конкретного активного вещества. В одном из случаев соответствующее эффективное количество может быть определено специалистом в данной области техники согласно традиционным тестам.
[45] Термин «активный ингредиент», «терапевтическое средство», «активное вещество» или «активное средство» относится к химическому структурному элементу, с помощью которого можно эффективно лечить у целевого субъекта нарушение, болезнь или заболевание.
[46] Термин «замещенный» относится к одному или нескольким атомам водорода в конкретном атоме, необязательно замещенном заместителем, в том числе дейтерием и вариантом водорода, при условии, что валентное состояние конкретного атома является нормальным и соединение, полученное после замещения, является стабильным. Если заместитель представляет собой кетонную группу (т. е. =O), это означает, что два атома водорода являются замещенными. Замещение кетонной группы не происходит в ариле. Термин «необязательно замещенный» означает, что названное может быть замещенным или быть незамещенным, если не указано иное, при этом тип и число заместителей может быть произвольным при соблюдении стабильности, доступной в химической структуре.
[47] Если любой параметр (например, R) демонстрирует возникновение более одного раза в композиции или структуре соединения, то определение каждого возникновения является независимым. Следовательно, например, если группа является замещенной 0~2 R, то группа может быть необязательно замещенной не более чем двумя R, при этом R имеет независимый вариант в каждом случае. Кроме того, комбинация заместителей и/или их вариантов возможна, только если такая комбинация приведет к стабильному соединению.
[48] Если число групп соединения равняется 0, как например -(CRR)0-, то это означает, что группа соединения представляет собой одинарную связь.
[49] Если один из параметров выбран из одинарной связи, то это означает, что две группы, к которым он прикреплен, соединены непосредственно, например, если L в A-L-Z представляет одинарную связь, это означает, что структура фактически представляет собой A-Z.
[50] Если связи заместителя могут быть поперечно соединены с двумя атомами кольца, то заместитель может быть связан с произвольными атомами в кольце. Если не указано, посредством какого атома приведенный заместитель соединен с общей структурной формулой, включая соединение, которое конкретно не упомянуто, заместитель может быть связан посредством любого из его атомов. Комбинация заместителей и/или их вариантов возможна, только если такая комбинация приведет к стабильному соединению. Например, структурная единица

[51] Если не указано иное, термин «галогенированный» или «галоген» сам по себе или как часть другого заместителя относятся к атому фтора, хлора, брома или йода. Кроме того, термин «галогенированный алкил» предназначен для включения моногалогенированного алкила и полигалогенированного алкила. Например, термин «галогенированный (C1-C4)алкил» предназначен для включения, но без ограничения, трифторметила, 2,2,2-трифторэтила, 4-хлорбутила и 3-бромпропила и т.д.
[52] Примеры галогенированного алкила включают, но без ограничения, трифторметил, трихлорметил, пентафторэтил и пентахлорэтил. «Алкокси» означает, что алкильная группа с конкретным числом атомов углерода присоединена с помощью кислородного мостика. C1-6алкокси включает C1, C2, C3, C4, C5 и C6алкокси. Примеры алкокси включают, но без ограничения, метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентилокси и S-пентилокси. «Циклоалкил» включает в себя насыщенную циклическую группу, такую как циклопропил, циклобутил или циклопентил. 3-7-членный циклоалкил включает C3, C4, C5, C6 и C7циклоалкил. «Алкенил» включает линейную или разветвленную углеводородную цепь, где любые стабильные участки на цепи характеризуются одной или несколькими C-C двойными связями, такими как винил и пропенил.
[53] Термин «галоген» или «галогенид» относится к фтору, хлору, брому и йоду.
[54] Если не указано иное, термин «гетеро» относится к гетероатому или гетероатомной группе (т. е. группе, содержащей гетероатом), включая атомы за исключением углерода (C) и водорода (H), и к группам, содержащим такие гетероатомы, например, включая кислород (O), азот (N), серу (S), кремний (Si), германий (Ge), алюминий (Al), бор (B), -O-, -S-, =O, =S, -C(=O)O-, -C(=O)-, -C(=S)-, -S(=O), -S(=O)2- и необязательно замещенные -C(=O)N(H)-, -N(H)-, -C(=NH)-, -S(=O)2 N(H)- или -S(=O) N(H)-.
[55] Если не указано иное, «кольцо» относится к замещенному или незамещенному циклоалкилу, гетероциклоалкилу, циклоалкенилу, гетероциклоалкенилу, циклоалкинилу, гетероциклоалкинилу, арилу или гетероарилу. Кольцо включает одинарное кольцо, соединительное кольцо, спирокольцо, конденсированное кольцо или кольцо с внутренним мостиком. Число атомов в кольце обычно определяется как число членов кольца, например, «5-7-членное кольцо» представляет собой кольцо с замкнутой структурой из 5-7 атомов. Если не указано иное, кольцо необязательно содержит 1-3 гетероатома. Следовательно, «5-7-членное кольцо» включает, например, фенилпиридин и пиперидинил; с другой стороны, термин «5-7-членное гетероциклоалкильное кольцо» включает пиридил и пиперидинил, но не включает фенил. Термин «кольцо» также включает кольцевую систему, содержащую по меньшей мере одно кольцо, где каждое кольцо независимо отвечает вышеуказанному определению.
[56] Если не указано иное, термин «гетероцикл» или «гетероциклил» относится к стабильному моноциклическому, бициклическому или трициклическому кольцу, содержащему гетероатом или гетероатомную группу, при этом они могут быть насыщенными, частично ненасыщенными или ненасыщенными (ароматическими), причем они содержат атомы углерода и 1, 2, 3 или 4 гетероатома в кольце, которые независимо выбраны из группы, состоящей из N, O и S, где любой из гетероциклов может быть конденсирован до бензольного кольца с образованием бициклического кольца. Атомы азота и серы необязательно могут быть окислены (т. е. NO и S(O)p, p равняется 1 или 2). Атом азота может быть замещенным или не замещенным (т. е. N или NR, где R представляет собой H или другой заместитель, определенный в данном документе). Гетероцикл может быть присоединен к боковой группе любого гетероатома или атома углерода с образованием стабильной структуры. Если полученное соединение является стабильным, то гетероцикл, описанный в данном документе, может быть замещен при атоме углерода или азота. Атом азота в гетероцикле необязательно является кватернизованным. В качестве предпочтительного варианта осуществления настоящего изобретения, если общее количество атомов S и O, содержащихся в гетероцикле, превышает 1, то эти гетероатомы не присоединены друг к другу. В качестве другого предпочтительного варианта осуществления настоящего изобретения общее число атомов S и O в гетероцикле не превышает 1. Используемый в данном документе термин «ароматическая гетероциклическая группа» или «гетероарил» относится к стабильному 5-, 6-, 7-членному моноциклу или бициклу или 7-, 8-, 9- или 10-членному бициклическому гетероароматическому кольцу, который содержит атомы углерода и 1, 2, 3 или 4 гетероатома в кольце, которые независимо выбраны из группы, состоящей из N, O и S. Атом азота может быть замещенным или незамещенным (т. е. N или NR, где R представляет собой H или другой заместитель, определенный в данном документе). Атомы азота и серы необязательно могут быть окислены (т. е. NO и S(O)p, p равняется 1 или 2). Следует отметить, что общее число атомов S и O в гетероароматическом кольце не превышает 1. Кольца с внутренними мостиками также включены в определение гетероцикла. Если один или несколько атомов (т. е. C, O, N или S) присоединены к двум несмежным атомам углерода или атомам азота, то происходит образование кольца с внутренним мостиком. Предпочтительное кольцо с внутренним мостиком включает в себя, но без ограничения, один атом углерода, два атома углерода, один атом азота, два атома азота и одну группу углерод-азот. Следует отметить, что мостик всегда превращает моноциклическое кольцо в трициклическое кольцо. В кольце с внутренним мостиком заместитель в кольце также может находиться на мостике.
[57] Примеры гетероциклического соединения включают, но без ограничения, акридинил, азоцинил, бензимидазолил, бензофуранил, бензомеркаптофуранил, бензомеркаптофенил, бензоксазолил, бензоксазолинил, бензотиазолил, бензотриазолил, бензотетразолил, бензоизоксазолил, бензоизотиазолил, бензоимидазолинил, карбазолил, 4aH-карбазолил, карболинил, хроманил, хромен, циннолинила декагидрохинолил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуранил, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоалкенил, индолинил, индолизинил, индолил, 3H-индолил, изатиногруппу, изобензофуранил, изоиндолил, изоиндолинил, изохинолил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, гидроксилиндил, пиримидил, фенантридинил, фенантролинил, феназин, фенотиазин, бензопуринил, феноксазинил, фталазинил, пиперазинил, пиперидил, оксопиперидинил, 4-оксопиперидинил, пиперонил, птеридил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, оксазолопиридин, пиридиноимидазол, пиридинотиазол, пиридил, пирролидинил, пирролинил, 3H-пирролил, пирролил, хиназолинил, хинолил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофурил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазил, изотиазолилтиенил, тиенил, тиофеноксазолил, тиофенотиазолил, тиофеноимидазолил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил. Конденсированные кольцевые и спирокольцевые соединения также включены.
[58] Если не указано иное, термин «гидрокарбонил» или его конкретный представитель (такой как алкил, алкенил, алкинил, фенил и т.п.) сам по себе или как часть другого заместителя представляет линейный, разветвленный или циклический гидрокарбонил или их комбинацию, которые могут быть полностью насыщенными, моноциклическими или полициклическими ненасыщенными, могут быть монозамещенными, дизамещенными или полизамещенными, могут быть одновалентными (такими как метил), бивалентными (такими как метилен) или многовалентными (такими как метенил), могут включать бивалентные или многовалентные атомные группы с конкретным числом атомов углерода (как, например, C1-C10 относится к группе, имеющей 1~10 атомов углерода). Термин «алкил» включает, но без ограничения, алифатический гидрокарбонил и ароматический гидрокарбонил, причем алифатический гидрокарбонил включает линейные и циклические структуры, в частности включает, но без ограничения, алкил, алкенил и алкинил, а ароматический гидрокарбонил включает, но без ограничения, 6-12-членный ароматический гидрокарбонил, такой как бензол, нафталин и т.п. В некоторых вариантах осуществления термин «гидрокарбонил» относится к линейной или разветвленной группам или к их комбинации, которые могут быть полностью насыщенными, моноциклическими или полициклическими ненасыщенными, могут включать дивалентные и поливалентные группы. Примеры насыщенного гидрокарбонила включают, но без ограничения, гомологи или изомеры метила, этила, н-пропила, изопропила, н-бутила, трет-бутила, изобутила, втор-бутила, изобутила, циклогексила, (циклогексил)метила, циклопропилметила, н-амила, н-гексила, н-гептила, н-октила и т.п. Ненасыщенный алкил имеет одинарную, или двойную, или тройную связь, примеры которого включают, но без ограничения, винил, 2-пропенил, бутенил, кротил, 2-изопентенил, 2-бутадиенил, 2,4-(пентадиенил), 3-(1,4-пентадиенил), ацетенил, 1- и 3-пропинил, 3-бутинил и более сложные гомологи и изомеры.
[59] Если не указано иное, термин «гетерогидрокарбонил» или его конкретные представители (такие как гетероалкил, гетероалкенил, гетероалкинил, гетероарил и т.д.) сам по себе или в комбинации с другим термином относится к стабильному линейному, разветвленному или циклическому гидрокарбонилу или к их комбинациям, которые состоят из конкретного числа атомов углерода и по меньшей мере одного гетероатома. В некоторых вариантах осуществления термин «гетерогидрокарбонил» сам по себе или в комбинации с другим термином относится к стабильному линейному, разветвленному гидрокарбонилу или к их комбинациям, которые состоят из конкретного числа атомов углерода и по меньшей мере одного гетероатома. В типичном варианте осуществления гетероатом выбран из группы, состоящей из B, O, N и S, в которой атомы азота и серы необязательно окислены, и атом азота необязательно кватернизован. Гетероатомы B, O, N и S могут быть размещены в любом внутреннем положении гетерогидрокарбонила (включая положение, в котором гидрокарбонил присоединен к остальной части молекулы). Примеры включают, но без ограничения, -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -CH2-CH=N-OCH3 и -CH=CH-N(CH3)-CH3. Не более двух гетероатомов являются присоединенными, как, например, -CH2-NH-OCH3.
[60] Термины «алкокси», «алкиламино» и «алкилтио» (или тиоалкокси) являются идиоматическими выражениями, которые относятся к алкильной группе, присоединенной к остальной части молекулы посредством атома кислорода, аминогруппы или атома серы, соответственно.
[61] Если не указано иное, термин «циклогидрокарбонил», «гетероциклогидрокарбонил» или их конкретные представители (такие как арил, гетероарил, циклоалкил, гетероциклоалкил, циклоалкенил, гетероцикловинил, циклоалкинил, гетероциклоалкинил и т.п.) сам по себе или в комбинации с другими терминами относится, соответственно, к циклическому «гидрокарбонилу», «гетерогидрокарбонилу». Кроме того, в отношении гетерогидрокарбонила или гетероциклогидрокарбонила (таких, как гетероалкил, гетероциклоалкил), гетероатомы могут занимать положение, в котором гетероциклическое кольцо присоединено к остальной части молекулы. Примеры циклоалкила включают, но без ограничения, циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.д. Неограниченные примеры гетероциклила включают 1-(1,2,5,6-тетрагидропиридинил), 1-пиперидил, 2-пиперидил, 3-пиперидил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуранилиндол-3-ил, тетрагидротиофен-2-ил, тетрагидротиофен-3-ил, 1-пиперазинил и 2-пиперазинил.
[62] Если не указано иное, термин «арил» относится к полиненасыщенному ароматическому углеводородному заместителю, который может быть монозамещенным, дизамещенным или многозамещенным, может быть одновалентным, бивалентным или многовалентным. Он может быть моноциклическим или полициклическим (предпочтительно с 1~3 кольцами). Они конденсированы вместе или соединены посредством ковалентной связи. Термин “гетероарил” относится к арилу (или кольцу), содержащему 1~4 гетероатома. В иллюстративном варианте осуществления гетероатом выбран из группы, состоящей из B, N, O и S, в которой атомы азота и серы необязательно окислены, и атом азота необязательно кватернизован. Гетероарильная группа может быть присоединена к остальной части молекулы посредством гетероатома. Неограниченные примеры арила или гетероарила включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-бензотиазолил, пуринил, 2-бензоимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалил, 5-хиноксалил, 3-хинолил и 6-хинолил. Любой из заместителей в арильной и гетероарильной кольцевой системе выбран из приемлемых заместителей, описанных ниже.
[63] В целях краткости, при использовании в комбинации с другими терминами (например, арилокси, арилтио, аралкил) арил включает определение арильного и гетероарильного кольца, определенного выше. Следовательно, подразумевается, что термин «аралкил» включает группы, в которых арил присоединен к алкилу (например, бензил, фенилэтил, пиридилметил), в том числе те алкилы, где атомы углерода (как например, метилен) заменены такими атомами, как атомы кислорода, как например, феноксиметил, 2-пиридилоксиметил-3-(1-нафтокси)пропил и т.д.
[64] Термин «уходящая группа» относится к функциональной группе или атому, которые могут быть заменены другими функциональной группой или атомом посредством реакции замещения (например, реакции нуклеофильного замещения). Например, иллюстративные уходящие группы включают трифлат; хлор, бром, йод; сульфонат, как например, мезилат, тозилат, п-бромбензолсульфонат, п-тозилат и т.д.; ацилокси, как например, ацетокси, трифторацетокси и т.п.
[65] Термин «защитная группа» включает, но без ограничения, «амино-защитную группу», «гидрокси-защитную группу» или «меркапто-защитную группу». Термин «амино-защитная группа» относится к защитной группе, которая является подходящей для предупреждения побочных реакций, возникающих при атоме азота аминогруппы. Иллюстративная амино-защитная группа включает, но без ограничения, формил; ацил, такой как алканоил (как например, ацетил, трихлорацетил или трифторацетил); алкоксикарбонил, такой как трет-бутоксикарбонил (Boc); арилметоксикарбонил, такой как бензилоксикарбонил (Cbz) и 9-фторенилметоксикарбонил (Fmoc); арилметил, такой как бензил (Bn), трифенилметил (Tr), 1,1-бис-(4'-метоксифенил)метил; силил, такой как триметилсилил (TMS) и трет-бутилдиметилсилил (TBS), и т.д. Термин “гидрокси-защитная группа” относится к защитной группе, которая является подходящей для предупреждения побочных реакций гидроксигруппы. Иллюстративная гидрокси-защитная группа включает, но без ограничения, алкил, такой как метил, этил и трет-бутил; ацил, такой как алканоил (как например, ацетил); арилметил, такой как бензил (Bn), п-метоксибензил (PMB), 9-фторенилметил (Fm) и дифенилметил (дифенилметил, DPM); силил, такой как триметилсилил (TMS) и трет-бутилдиметилсилил (TBS), и т.д.
[66] Соединение согласно настоящему изобретению можно получить посредством многих способов синтеза, которые хорошо известны специалисту в данной области техники, включая конкретные варианты осуществления, перечисленные далее, и их комбинацию с другими химическими способами синтеза и эквивалентными альтернативными способами, которые известны специалисту в данной области техники, при этом предпочтительные варианты осуществления включают, но без ограничения, варианты осуществления согласно настоящему изобретению
[67] Используемые в настоящем изобретении растворители являются коммерчески доступными и могут применяться без дополнительной очистки. В настоящем изобретении приняты следующие сокращения: водн. означает воду; HATU означает O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат; EDC означает N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид; m-CPBA означает м-хлорпербензойную кислоту; экв. означает эквивалент, равноколичественный; CDI означает карбонилдиимидазол; DCM означает дихлорметан; PE означает петролейный эфир; DIAD означает диизопропилазодикарбоксилат; DMF означает N,N-диметилформамид; DMSO означает диметилсульфоксид; EtOAc означает этилацетат; EtOH означает этанол; MeOH означает метанол; Cbz означает бензилоксикарбонил, амино-защитную группу; Boc означает трет-бутоксикарбонил, амин-защитную группу; HOAc означает уксусную кислоту; NaCNBH3 означает цианоборогидрид натрия; к. т. означает комнатную температуру; O/N означает в течение ночи; THF означает тетрагидрофуран; Boc2O означает ди-трет-бутилдикарбонат; TFA означает трифторуксусную кислоту; DIPEA означает диизопропилэтиламин; SOCl2 означает тионилхлорид; CS2 означает сероуглерод; TsOH означает п-толуолсульфоновую кислоту; NFSI означает N-фторбензолсульфонимид; NCS означает N-хлорсукцинимид; н-Bu4NF означает тетрабутиламмония фторид; iPrOH означает 2-пропанол; т.п.л. означает температуру плавления; LDA означает диизопропиламид лития; TMSCF3 означает трифторметилтриметилсилан; Ti(Oi-Pr)4 означает тетраизопропилтитанат; MsCl означает метансульфохлорид; DMAP означает N,N-диметил-4-аминопиридин; TEA означает триэтиламин; BnBr означает бромистый бензил; DIEA означает диизопропилэтиламин; BH3DMS означает диметилсульфид-боран; DMP означает перйодинан Десс-Мартина; TBAF означает тетрабутиламмония фторид; HOBT означает 1-гидроксибензотриазол; AIBN означает 2,2'-азо-бис-изобутиронитрил; NBS означает N-бромсукцинимид.
[68] Соединения названы самостоятельно или с помощью программного обеспечения ChemDraw®, коммерчески доступные соединения названы в соответствии с каталогом поставщиков.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[69] Нижеследующие примеры дополнительно иллюстрируют настоящее изобретение, однако настоящее изобретение ими не ограничивается.
Вариант осуществления 1
3,7-Диметил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-дион


Этап 1
3,7-Диметил-1-(6,6,6-трифтор-5-метил-5-(триметилсилокси)гексил)-1H-пурин-2,6(3H,7H)-дион
[70] 3,7-Диметил-1-(5-оксогексил)-1H-пурин-2,6(3H,7H)-дион (200 мг, 0,719 ммоль), фторид цезия (10,9 мг, 0,0719 ммоль) растворяли в тетрагидрофуране (2 мл), трифторметилтриметилсилан (153 мг, 1,08 ммоль) добавляли по каплям при 0°C. Реакционный раствор перемешивали при 20°C в течение 2 часов, реакционную смесь гасили посредством добавления насыщенного солевого раствора (50 мл), экстрагировали этилацетатом (100 мл × 3). Органическую фазу промывали насыщенным солевым раствором (100 мл × 3), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, затем сушили в вакууме с получением 3,7-диметил-1-(6,6,6-трифтор-5-метил-5-(триметилсилокси)гексил)-1H-пурин-2,6(3H,7H)-диона (200 мг, твердое вещество белого цвета), выход: 66%. MS-ESI: рассч. для [M+H]+ 421, обнаружено 421.
Этап 2
3,7-Диметил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-дион
[71] 3,7-Диметил-1-(6,6,6-трифтор-5-метил-5-(триметилсилокси)гексил)-1H-пурин-2,6(3H,7H)-дион (200 мг, 0,476 ммоль) растворяли в тетрагидрофуране (2 мл), 1 M соляную кислоту (0,5 мл) добавляли по каплям при 0°C, а затем смесь перемешивали при 20°C в течение 1 часа. Смесь охлаждали до 0°C и реакционную смесь гасили посредством добавления раствора бикарбоната натрия (30 мл). Смесь экстрагировали этилацетатом (100 мл × 3). Органическую фазу промывали насыщенным солевым раствором (100 мл × 3), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток выделяли и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-диона (50,0 мг, твердое вещество белого цвета), выход: 30%.1H ЯМР: (400 МГц, метанол-d4) δ 7,85 (s, 1H), 4,02-3,98 (m, 2H), 3,96 (s, 3H), 3,52 (s, 3H), 1,69-1,64 (m, 4H), 1,52-1,48 (m, 2H), 1,28 (s, 3H). MS-ESI: рассч. для [M+H]+ 349, обнаружено 349.
Вариант осуществления 2
1-(5-Гидрокси-5-метилгептил)-3,7-диметил-1H-пурин-2,6 (3H,7H)-дион


Этап 1
Этил-5-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)пентаноат
[72] 3,7-Диметил-1H-пурин-2,6(3H,7H)-дион (500 мг, 28,0 ммоль), этилбромвалерат (7,51 г, 33,4 ммоль), карбонат калия (7,73 г, 56,0 ммоль) и йодид калия (500 мг, 2,80 ммоль) растворяли в N,N-диметилформамиде (62 мл). Реакционный раствор нагревали до 110°C и перемешивали в течение двух часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали с получением этил-5-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил)пентаноата (5,00 г, твердое вещество желтого цвета), выход: 50%.1H ЯМР: (400 МГц, CDCl3) δ 7,51 (s, 1H), 4,14-4,09 (m, 2H), 4,04-4,01 (m, 2H), 3,97 (s, 3H), 3,57 (s, 3H) 2,37-2,33 (m, 2H), 1,72-1,69 (m, 4H), 1,25 (t, J = 7,2 Гц, 3H).
Этап 2
1-(5-Этил-5-гидроксигептил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[73] Этил-5-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил)пентаноат (0,500 г, 1,62 ммоль) растворяли в безводном тетрагидрофуране (5 мл). В атмосфере газообразного азота медленно добавляли по каплям этилмагния бромид (3 M эфирный раствор, 3,42 мл, 9,72 ммоль) при -78°C. Реакционный раствор перемешивали при -78°C в течение 0,5 часа, медленно подогревали до 0°C, а затем подвергали реакции в течение 0,5 часа. Реакционный раствор выливали в воду и экстрагировали этилацетатом (30 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-(5-этил-5-гидроксигептил-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (0,300 г, бесцветное масло), выход: 57%.1H ЯМР: (400 МГц, CDCl3) δ 7,50 (s, 1H), 4,05-4,01 (m, 2H), 3,99 (s, 3H), 3,57 (s, 3H), 1,70-1,37 (m, 10H) 0,86 (t, J = 7,6 Гц, 6H). MS-ESI: рассч. для [M+H]+ 323, обнаружено 323,
Вариант осуществления 3
1-(4-(1-Гидроксициклопропил)бутил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


[74] В атмосфере газообразного азота добавляли этилмагния бромид (3 M эфирный растворитель, 1,1 мл, 3,24 ммоль) при -35°C к раствору этил-5-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил)пентаноата (500 мг, 1,62 ммоль) и тетраизопропилтитаната (461 мг, 1,62 ммоль) в тетрагидрофуране (10 мл). Реакционный раствор медленно подогревали до 25°C и перемешивали в течение 2 часов. Реакционную смесь гасили посредством добавления воды (10 мл). Нерастворимое вещество удаляли фильтрованием, а фильтрат экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли продукт и очищали посредством высокоэффективной жидкостной хроматографии с получением 1-(4-(1-гидроксициклопропил)бутил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (90,0 мг, твердое вещество белого цвета), выход: 19%.1H ЯМР: (400 МГц, метанол-d4) δ 7,86 (s, 1H), 4,03-3,90 (m, 5H), 3,51 (s, 3H), 1,72-1,53 (m, 6H), 0,68-0,59 (m, 2H), 0,46-0,38 (m, 2H). MS-ESI: рассч. для [M+H]+ 293, обнаружено 293.
Вариант осуществления 4
3,7-Диметил-1-((1-(1,1,1-трифтор-2-гидроксипропан-2-ил)циклопропил)метил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
Этил-1-ацетилциклопропан
[75] Этил-3-оксобутановую кислоту (10,0 г, 76,8 ммоль) и 1,2-дибромэтан (21,7 г, 115 ммоль) растворяли в диметилсульфоксиде (300 мл), в атмосфере газообразного азота порциями добавляли карбонат калия (42,5 г, 307 ммоль). Реакционный раствор перемешивали при 25°C в течение 24 часов. Добавляли воду (500 мл) и реакционный раствор экстрагировали этилацетатом (300 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,4) с получением этил-1-ацетилциклопропана (6,00 г, масло белого цвета), выход: 50%.1H ЯМР: (400 МГц, метанол-d4) δ 4,25-4,20 (m, 2H), 2,44 (s, 3H), 1,47-1,42 (m, 4H), 1,32-1,28 (m, 3H).
Этап 2
1-(1,1,1-Трифтор-2-гидроксипропан-2-ил)циклопропанкарбоновая кислота
[76] Этил-1-ацетилциклопропан (2,00 г, 12,8 ммоль), фторид цезия (195 мг, 1,28 ммоль) растворяли в тетрагидрофуране (30 мл), а затем добавляли трифторметилтриметилсилан (3,64 г, 25,6 ммоль) при 0°C. Реакционный раствор подвергали реакции при 20°C в атмосфере газообразного азота в течение 6 часов. Потом добавляли разбавленную 4 н. соляную кислоту (7 мл). Смесь подвергали реакции при комнатной температуре в атмосфере газообразного азота в течение 6 часов. реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (30 мл) и экстрагировали этилацетатом (100 мл x 3). Органическую фазу сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,4) с получением 1-(1,1,1-трифтор-2-гидроксипропан-2-ил)циклопропанкарбоновой кислоты (1,70 г, масло белого цвета), выход: 59%.1H ЯМР: (400 МГц, метанол-d4) δ 4,14-4,10 (m, 2H), 1,64 (s, 3H), 1,29-1,24 (m, 3H), 1,23-1,22 (m, 2H), 0,92-0,90 (M, 2H).
Этап 3
1,1,1-Трифтор-2-(1-(гидроксиметил)циклопропил)пропан-2-ол
[77] 1-(1,1,1-Трифтор-2-гидроксипропан-2-ил)циклопропанкарбоновую кислоту (400 мг, 1,77 ммоль) растворяли в безводном тетрагидрофуране (10 мл), добавляли алюмогидрид лития (81,0 мг, 2,12 ммоль) при 0°C. Реакционный раствор подогревали до 25°C и перемешивали в течение 1 часа. Реакционную смесь гасили посредством добавления воды (10 мл), экстрагировали этилацетатом (50 мл × 3), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,2) с получением 1,1,1-трифтор-2-(1-(гидроксиметил)циклопропил)пропан-2-ола (200 мг, масло желтого цвета), выход: 61%.1H ЯМР: (400 МГц, DMSO-d6): δ 5,64 (s, 1H), 4,63-4,60 (m, 1H), 3,64-3,60 (m, 1H), 3,23-3,17 (m, 1H), 1,36 (s, 1H), 1,36 (s, 3H), 0,83-0,91 (m, 1H), 0,56-0,55 (m, 1H), 0,39-0,35 (m, 2H).
Этап 4
(1-(1,1,1-Трифтор-2-гидроксипропан-2-ил)циклопропил)метилметансульфонат
[78] 1,1,1-Трифтор-2-(1-(гидроксиметил)циклопропил)пропан-2-ол (100 мг, 0,543 ммоль) растворяли в дихлорметане (5 мл), добавляли триэтиламин (110 мг, 1,08 ммоль) и метансульфохлорид (62,2 мг, 0,543 ммоль) при 0°C. Реакционный раствор подвергали реакции при 0°C в течение 2 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (10 мл), экстрагировали дихлорметаном (10 мл × 3), органические фазы объединяли, промывали насыщенным водным раствором хлорида натрия (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением (1-(1,1,1-трифтор-2-гидроксипропан-2-ил)циклопропил)метилметансульфоната (80,0 мг, масло желтого цвета), выход: 56%.
Этап 5
3,7-Диметил-1-((1-(1,1,1-трифтор-2-гидроксипропан-2-ил)циклопропил)метил)-1H-пурин-2,6-(3H,7H)-дион
[79] (1-(1,1,1-Трифтор-2-гидроксипропан-2-ил)циклопропил)метилметансульфонат (80,0 мг, 0,305 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (54,9 мг, 0,305 ммоль), йодид калия (5,10 мг, 0,0305 ммоль) и карбонат калия (126 мг, 0,915 ммоль) растворяли в безводном N,N-диметилформамиде (5 мл). Реакционный раствор нагревали до 120°C и подвергали реакции в течение 2 часов. Реакционный раствор охлаждали до 20°C, фильтровали и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-((1-(1,1,1-трифтор-2-гидроксипропан-2-ил)циклопропил)метил)-1H-пурин-2,6-(3H,7H)-диона (40,0 мг, твердое вещество белого цвета), выход: 38%.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 4,45 (d, J = 6,8 Гц, 1H), 4,24 (d, J = 6,8 Гц, 1H), 3,97 (s, 3H), 3,53 (s, 3H), 1,53 (s, 3H), 0,92-0,88 (m, 1H), 0,64-0,63(m, 1H), 0,41-0,38 (m, 1H), 0,15-0,12 (m, 1H).
[80] MS-ESI: рассч. для [M+H]+ 347, обнаружено 347.
Вариант осуществления 5
1-(3-Гидрокси-3-(трифторметил)циклобутил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
Метил-3-оксоциклобутанкарбоксилат
[81] 3-Оксоциклобутанкарбоновую кислоту (25 г, 0,220 ммоль), метанол (14 мл) и N,N-диметил-4-аминопиридин (3,00 г, 353 ммоль) растворяли в дихлорметане (500 мл), перемешивали при 25°C, по каплям медленно добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (64,0 г, 340 ммоль) и смесь перемешивали в течение ночи. Реакционный раствор промывали последовательно водным раствором соляной кислоты (1,5 н., 72 мл), водой (150 мл × 2) и насыщенным солевым раствором (75 мл × 2). Органическую фазу сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением продукта метил-3-оксоциклобутанкарбоксилата (25 г, жидкость желтого цвета), выход: 89%.
Этап 2
Метил-5,8-диоксаспиро[3.4]октан-2-карбоксилат
[82] Метил-3-оксоциклобутанкарбоксилат (25,0 г, 195 ммоль), этиленгликоль (35,0 г, 564 ммоль) и п-толуолсульфоновую кислоту (3,50 г, 20,0 ммоль) растворяли в толуоле (250 мл), после чего устанавливали водоотделитель и реакционную смесь нагревали для кипения с обратным холодильником в течение ночи. Реакционный раствор охлаждали до 25°C и промывали последовательно водой (300 мл × 2), насыщенным водным раствором бикарбоната натрия (500 мл × 2). Органическую фазу сушили над безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении с получением метил-5,8-диоксаспиро[3.4]октан-2-карбоксилата (22,5 г, жидкость желтого цвета), выход: 90%.
Этап 3
5,8-Диоксаспиро[3.4]октан-2-илметанол
[83] В атмосфере газообразного азота медленно растворяли алюмогидрид лития (5,20 г, 136 ммоль) в тетрагидрофуране (240 мл) при 0°C, а затем добавляли по каплям метил-5,8-диоксаспиро[3.4]октан-2-карбоксилат (19,5 г, 113 ммоль), растворенный в тетрагидрофуране (60 мл). Реакционную смесь медленно подогревали до 25°C и перемешивали в течение 3,5 часов. Реакционный раствор охлаждали до 0°C и медленно добавляли последовательно воду (5,20 г, 289 ммоль), 15% гидроксид натрия (5,20 г, 19,5 ммоль) и воду (15,6 г, 867 ммоль). Реакционную смесь фильтровали и осадок на фильтре промывали тетрагидрофураном (10 мл × 3), а фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,4) с получением продукта 5,8-диоксаспиро[3.4]октан-2-илметанола (10,0 г, жидкость желтого цвета), выход: 62%.1H-ЯМР: (400 МГц, CDCl3) δ 3,90-3,87 (m, 4H), 3,67 (d, J = 6,4 Гц, 2H), 2,45-2,40 (m, 2H), 2,38-2,26 (m, 1H), 2,13-2,08 (m, 2H).
Этап 4
5,8-Диоксаспиро[3.4]октан-2-илметилметансульфонат
[84] 5,8-Диоксаспиро[3.4]октан-2-илметанол (500 мг, 53,1 ммоль) и триэтиламин (896 мг, 6,90 ммоль) растворяли в дихлорметане (23 мл), медленно добавляли метансульфохлорид (1,40 г, 12,6 ммоль) при 0°C. Реакционный раствор подогревали до 25°C и перемешивали в течение ночи. Реакционную смесь гасили посредством добавления воды (50 мл) и экстрагировали этилацетатом (50 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением продукта 5,8-диоксаспиро[3,4]октан-2-илметилметансульфоната (2,30 г, жидкость желтого цвета).
[85] MS-ESI: рассч. для [M+H]+ 223, обнаружено 223.
Этап 5
1-(5,8-Диоксаспиро[3.4]октан-2-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[86] 5,8-Диоксаспиро[3,4]октан-2-илметилметансульфонат (1,00 г, 4,50 ммоль), 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (810 мг, 4,50 ммоль), карбонат калия (1,20 г, 13,5 ммоль) и йодид калия (75,0 мг, 0,45 ммоль) растворяли в N,N-диметилформамиде (20 мл). Реакционную смесь нагревали до 130°C и перемешивали в течение 3,5 часов. Реакционный раствор фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-(5,8-диоксаспиро[3.4]октан-2-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (1,50 г, коричневая жидкость), выход: 93%. MS-ESI: рассч. для [M+H]+ 307, обнаружено 307.
Этап 6
3,7-Диметил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион
[87] 1-(5,8-Диоксаспиро[3.4]октан-2-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион (1,50 г, 5,00 ммоль) растворяли в ацетоне (18 мл), добавляли водный раствор соляной кислоты (4 н., 3 мл). Реакционную смесь нагревали до 30°C и перемешивали в течение ночи. Реакционную смесь разбавляли водой, доводили pH до нейтрального с помощью насыщенного водного раствора бикарбоната натрия (20 мл) и экстрагировали этилацетатом (150 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, получаемый в результате продукт очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,2) с получением продукта 3,7-диметил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона (180 мг, твердое вещество белого цвета), выход: 14%.1H ЯМР: (400 МГц, CDCl3) δ 7,49 (s, 1 H), 4,25 (d, J = 7,6 Гц, 2 H), 3,95 (s, 3 H), 3,55 (s, 3 H), 3,13-2,96 (m, 4 H), 2,95-2,84 (m, 1 H). MS-ESI: рассч. для [M+H]+ 263, обнаружено 263.
Этап 7
1-((3-Гидрокси-3-(трифторметил)циклопентил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[88] 3,7-Диметил-1-((3-оксоциклопентил)метил)-1H-пурин-2,6(3H,7H)-дион (100 мг, 0,382 ммоль) и фторид цезия (11,5 мг, 0,0763 ммоль) растворяли в безводном тетрагидрофуране (3 мл) и в атмосфере газообразного азота добавляли трифторметилтриметилсилан (95,0 мг, 0,640 ммоль). Реакционный раствор медленно нагревали до 30°C и перемешивали в течение 12 часов. Водный раствор соляной кислоты (1 н., 5 мл) добавляли в реакционную смесь, которую потом перемешивали в течение еще 0,5 часа. Реакционный раствор разбавляли водой (50 мл), показатель рН доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия (10 мл), концентрировали при пониженном давлении и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-((3-гидрокси-3-(трифторметил)циклопентил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (80,0 мг, твердое вещество белого цвета), выход: 64%.1H ЯМР: (400 МГц, метанол-d4) δ 8,54 (s, 1H), 4,13-4,07 (m, 5H), 3,56 (s, 3H), 2,58-2,48 (m, 3H), 2,14-2,10 (m, 2H). MS-ESI: рассч. для [M+H]+333, обнаружено 333.
Вариант осуществления 6
1-((3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)-3-гидроксициклобутанкарбонитрил


Этап 1
(((1,3-Дибромпропан-2-ил)окси)метил)бензол
[89] 2-(Бромметил)оксиран (8,40 г, 61,3 ммоль) добавляли к раствору хлорида меди (6,87 г, 51,1 ммоль) в бромистом бензиле (8,74 г, 51,1 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 150°C в течение 11 часов. Реакционный раствор охлаждали до комнатной температуры, медленно добавляли воду (100 мл) и реакционную смесь экстрагировали этилацетатом (100 мл × 3). Органические фазы объединяли и сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, получаемый в результате продукт очищали посредством колоночной хроматографии на силикагеле (петролейный эфир, Rf = 0,6) с получением продукта (((1,3-дибромпропан-2-ил)окси)метил)бензола (8,60 г, масло желтого цвета), выход: 44%.1H ЯМР: (400 МГц, CDCl3) δ 7,39-7,31 (m, 5H), 4,67 (s, 2H), 3,82-3,78 (m, 1H), 3,58 (d, J = 5,2 Гц, 4H).
Этап 2
Этил 3-(бензилокси)-1-цианоциклобутанкарбоксилат
[90] Этилцианоацетат (2,76 г, 24,3 ммоль) добавляли медленно при комнатной температуре к раствору (((1,3-дибромпропан-2-ил)окси)метил)бензола (7,00 г, 18,2 ммоль) и карбоната калия (10,0 г, 72,7 ммоль) в N,N-диметилформамиде (35 мл). Реакционную смесь перемешивали при 90°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали и твердое вещество промывали этилацетатом (20 мл). Получаемую в результате органическую фазу промывали насыщенным водным раствором хлорида аммония (20 мл × 3). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, получаемый в результате продукт очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 30:1, Rf = 0,4) с получением продукта этил-3-(бензилокси)-1-цианоциклобутанкарбоксилата (3,80 г, бесцветное масло), выход: 81%.1H ЯМР: (400 МГц, метанол-d4) δ 7,40-7,28 (m, 5H), 4,48-4,44 (m, 2H), 4,37-4,31 (m, 1H), 4,30-4,24 (m, 2H), 2,97 -2,80 (m, 2H), 2,73-2,65 (m, 2H), 1,37-1,30 (m, 3H).
Этап 3
3-(Бензилокси)-1-(гидроксиметил)циклобутанкарбонитрил
[91] Борогидрид натрия (1,39 г, 36,6 ммоль) растворяли в тетрагидрофуране и воде (20 мл : 2 мл) и медленно добавляли по каплям раствор этил-3-(бензилокси)-1-цианоциклобутанкарбоксилата (3,80 г, 14,6 ммоль) в тетрагидрофуране (22 мл) при 0°C на протяжении 20 минут. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Смесь разбавляли этилацетатом (50 мл), раздельно промывали водой (30 мл) и насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта 3-(бензилокси)-1-(гидроксиметил)циклобутанкарбонитрила (3,70 г, бесцветное масло).1H ЯМР: (400 МГц, DMSO-d6) δ 7,38-7,25 (m, 5H), 5,57-5,52 (m, 1H), 4,39-4,36 (m, 2H), 4,13-4,04 (m, 1H), 3,57-3,51 (m, 2H), 2,58-2,51 (m, 1H), 2,49-2,45 (m, 1H), 2,31-2,09 (m, 2H).
Этап 4
(3-(Бензилокси)-1-цианоциклобутил)метилметансульфонат
[92] 3-(Бензилокси)-1-(гидроксиметил)циклобутанкарбонитрил (3,70 г, 15,3 ммоль) и триэтиламин (3,10 г, 30,6 ммоль) растворяли в дихлорметане (35 мл), медленно добавляли метансульфохлорид (3,29 г, 28,7 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, добавляли насыщенный водный раствор хлорида аммония (30 мл) и реакционную смесь экстрагировали этилацетатом (50 мл × 2), органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта (3-(бензилокси)-1-цианоциклобутил)метилметансульфоната (4,56 г, темно-коричневое масло).1H ЯМР: (400 МГц, метанол-d4) δ 7,36-7,26 (m, 5H), 4,47-4,45 (m, 2H), 4,44-4,38 (m, 2H), 3,21-3,18 (m, 1H), 3,17 -3,14 (m, 3H), 2,81-2,60 (m, 2H), 2,53-2,26 (m, 2H).
Этап 5
3-(Бензилокси)-1-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)циклобутанкарбонитрил
[93] (3-(Бензилокси)-1-цианоциклобутил)метилметансульфонат (4,50 г, 15,2 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (2,75 г, 15,2 ммоль) и йодид калия (1,26 г, 7,62 ммоль) растворяли в N,N-диметилформамиде (100 мл), добавляли карбонат калия (6,32 г, 45,7 ммоль), реакционную смесь нагревали до 120°C и кипятили с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали, фильтрат концентрировали при пониженном давлении, добавляли воду (50 мл) и реакционную смесь экстрагировали этилацетатом (50 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта 3-(бензилокси)-1-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)циклобутанкарбонитрила (4,60 г, твердое вещество желтого цвета). MS-ESI: рассч. для [M+H]+ 380, обнаружено 380.
Этап 6
1-((3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)-3-гидроксициклобутанкарбонитрил
[94] 3-(Бензилокси)-1-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)циклобутанкарбонитрил (100 мг, 0,263 ммоль) растворяли в дихлорметане (10 мл) и добавляли хлорид железа(III) (128 мг, 0,790 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Добавляли воду (10 мл) и смесь экстрагировали дихлорметаном (40 мл × 3). Органические фазы объединяли и сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, получаемый в результате продукт очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)-3-гидроксициклобутанкарбонитрила (12,0 мг, твердое вещество желтого цвета), выход: 16%.1H ЯМР: (400 МГц, CDCl3) δ 7,56 (s, 1H), 4,66-4,49 (m, 1H), 4,45-4,37 (m, 2H), 4,01 (s, 3H), 3,62 (s, 3H) 2,96-2,85 (m, 2H), 2,60-2,49 (m, 2H). MS-ESI: рассч. для [M+H]+ 290, обнаружено 290.
Вариант осуществления 7


Этап 1
Сложный метиловый эфир метил-3-(гидроксиметил)бицикло[1.1.1]пентан-1-карбоновой кислоты
[95] 3-(Метоксикарбонил)бицикло[1.1.1]пентан-1-карбоновую кислоту (100 мг, 0,587 ммоль) и триэтиламин (71,0 мг, 0,705 ммоль) растворяли в тетрагидрофуране (20 мл), медленно добавляли по каплям метилхлорформиат (56,0 мг, 0,587 ммоль) при -10°C. Реакционный раствор перемешивали при 0°C в течение получаса, а затем добавляли борогидрид натрия (33,0 мг, 0,881 ммоль) и реакционную смесь перемешивали в течение еще 2 часов. Добавляли воду (10 мл) в реакционный раствор, который потом экстрагировали этилацетатом (10 мл × 3), органические фазы объединяли и промывали насыщенным хлоридом натрия (10 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением сложного метилового эфира метил-3-(гидроксиметил)бицикло[1.1.1]пентан-1-карбоновой кислоты (80,0 мг, бесцветное масло), выход: 87%.1H ЯМР: (400 МГц, CDCl3) δ 3,65 (s, 3H), 3,60 (s, 2H), 2,00 (s, 6H).
Этап 2
Сложный метиловый эфир метил-3-(((метилсульфонил)окси)метил)бицикло[1.1.1]пентан-1-карбоновой кислоты
[96] Метил-3-(гидроксиметил)бицикло[1.1.1]пентан-1-карбоксилат (40,0 мг, 0,256 ммоль) и триэтиламин (39,0 мг, 0,384 ммоль) растворяли в дихлорметане (15 мл), медленно добавляли по каплям метансульфохлорид (35,0 мг, 0,307 ммоль) при 0°C. Реакционный раствор перемешивали при 0°C в течение 2 часов, реакционный раствор разбавляли дихлорметаном (10 мл), органическую фазу промывали водой (10 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением сложного метилового эфира метил-3-(((метилсульфонил)окси)метил)бицикло[1.1.1]пентан-1-карбоновой кислоты (50,0 мг, масло желтого цвета), выход: 83%.
Этап 3
Сложный метиловый эфир метил-3-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бицикло[1.1.1]пентан-1-карбоновой кислоты
[97] Сложный метиловый эфир метил-3-(((метилсульфонил)окси)метил)бицикло[1.1.1]пентан-1-карбоновой кислоты (100 мг, 0,426 ммоль) и 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (77,0 мг, 0,427 ммоль) растворяли в N,N-диметилформамиде (20 мл), добавляли карбонат калия (88,0 мг, 0,640 ммоль) и йодид калия (8,00 мг, 0,0430 ммоль) при комнатной температуре. Реакционный раствор перемешивали при 100°C в течение 2 часов, реакционный раствор охлаждали до комнатной температуры и концентрировали, разбавляли этилацетатом (20 мл), органическую фазу промывали водой (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении, выделяли продукт и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,2) с получением сложного метилового эфира метил-3-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бицикло[1.1.1]пентан-1-карбоновой кислоты (100 мг, твердое вещество желтого цвета), выход: 73%.1H ЯМР: (400 МГц, CDCl3) δ 7,50 (s, 3H), 3,65 (s, 3H), 3,52 (s, 3H), 1,95 (s, 6H). MS-ESI: рассч. для [M+H]+ 319, обнаружено 319.
Этап 4
3-((3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бицикло[1.1.1]пентан-1-карбоновая кислота
[98] Сложный метиловый эфир метил-3-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бицикло[1.1.1]пентан-1-карбоновой кислоты (100 мг, 0,314 ммоль) растворяли в тетрагидрофуране (15 мл) и воде (5 мл), добавляли гидроксид лития (26,0 мг, 0,628 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 2 часов в реакционный раствор добавляли 2 н. разбавленную соляную кислоту (10 мл), показатель рН доводили до 4, смесь потом экстрагировали этилацетатом (15 мл × 3), органические фазы объединяли и промывали насыщенным водным раствором хлорида натрия (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 3-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бицикло[1.1.1]пентан-1-карбоновой кислоты (90,0 мг, твердое вещество белого цвета), выход: 94%.
[99] MS-ESI: рассч. для [M+H]+ 305, обнаружено 305.
Этап 5
3-((3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)-N-метокси-N-метилбицикло[1.1.1]пентан-1-карбоксамид
[100] 3-((3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бицикло[1.1.1]пентан-1-карбоновую кислоту (30,0 мг, 0,0986 ммоль) и N,O-диметилгидроксиламин (10,0 мг, 0,0986 ммоль) растворяли в дихлорметане (20 мл), добавляли 2-(7-азобензотриазол)-N,N,N',N'-тетраметилурония гексафторфосфат (75,0 мг, 0,197 ммоль) и диизопропилэтиламин (19,0 мг, 0,148 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 12 часов добавляли воду (20 мл) в реакционный раствор, который потом экстрагировали дихлорметаном (20 мл × 2), органические фазы объединяли и промывали насыщенным водным раствором хлорида аммония (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:2, Rf = 0,2) с получением 3-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)-N-метокси-N-метилбицикло[1.1.1]пентан-1-карбоксамида (30,0 мг, твердое вещество белого цвета), выход: 88%.
[101] MS-ESI: рассч. для [M + H]+ 348, обнаружено 348.
Этап 6
1-((3-Ацетилбицикло[1.1.1]пентан-1-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[102] 3-((3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)-N-метокси-N-метилбицикло[1.1.1]пентан-1-карбоксамид (20,0 мг, 0,0575 ммоль) растворяли в тетрагидрофуране (20 мл), в реакционный раствор добавляли метилмагния бромид (3 M эфирный раствор, 0,040 мл, 0,120 ммоль) при -78°C, после перемешивания в течение еще 30 минут реакционный раствор подогревали до комнатной температуры и подвергали реакции в течение 4 часов. Добавляли насыщенный водный раствор хлорида аммония (10 мл) в реакционный раствор при 0°C, который потом экстрагировали этилацетатом (15 мл × 3), органические фазы объединяли и промывали насыщенным раствором хлорида натрия (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. И выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,5) с получением 1-((3-ацетилбицикло[1.1.1]пентан-1-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (15,0 мг, бесцветное масло), выход: 86%.1H ЯМР: (400 МГц, CDCl3) δ 7,55 (s, 1H), 4,17 (s, 2H), 3,99 (s, 3H), 3,59 (s, 3H), 2,07 (s, 3H), 1,97 6H). MS-ESI: рассч. для [M+H]+ 303, обнаружено 303.
Этап 7
3,7-Диметил-1-((3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бицикло[1.1.1]пентан-1-ил)метил)-1H-пурин-2,6-(3H,7H)-дион
[103] 1-((3-Ацетилбицикло[1.1.1]пентан-1-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (20,0 мг, 0,0660 ммоль) и трифторметилтриметилхлорсилан (19,0 мг, 0,132 ммоль) растворяли в тетрагидрофуране (15 мл), в реакционный раствор добавляли фторид цезия (10,0 мг, 00660 ммоль) при комнатной температуре и реакционную смесь перемешивали в течение еще 12 часов при комнатной температуре. В реакционный раствор добавляли 2 н. разбавленную соляную кислоту (10 мл), который потом перемешивали в течение 30 минут, экстрагировали этилацетатом (20 мл × 2), органические фазы объединяли и промывали насыщенным водным раствором бикарбоната натрия (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-((3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бицикло[1.1.1]пентан-1-ил)метил)-1H-пурин-2,6-(3H,7H)-диона (5,00 мг, бесцветное масло), выход: 20%.1H ЯМР: (400 МГц, CDCl3) δ 7,59 (s, 1H), 4,20 (s, 2H), 4,02 (s, 3H), 3,59 (s, 3H), 1,97 (s, 6H), 1,79 3H). MS-ESI: рассч. для [M+H]+ 373, обнаружено 373.
Вариант осуществления 8


Этап 1
3,7-Диметил-1-[[3-[2,2,2-трифтор-1-гидрокси-1-(трифторметил)этил]циклобутил]метил]пурин-2,6-дион
[104] 3,7-Диметил-1-[[3-(2,2,2-трифтор-1,1-дигидроксиэтил)циклобутил]метил]пурин-2,6-дион (60,0 мг, 0,165 ммоль), фторид цезия (25,2 мг, 0,165 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли трифторметилтриметилхлорсилан (70,6 мг, 0,496 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл). Полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1 (8,00 мг, твердое вещество желтого цвета) (изомер 1, первый пик), выход: 12%.1H ЯМР: (400 МГц, метанол-d4) δ 8,01 (s, IH), 4,22-4,17 (m, 2H), 4,01 (s, 3H), 3,54 (s, 3H), 3,55-3,19 (m, 1H), 2,63-2,56 (m, 1H), 2,50-2,42 (m, 2H), 1,82-1,78 (m, 2H). MS-ESI: рассч. для [M+H]+ 415, обнаружено 415.
[105] И получали продукт 2 (изомер 2, второй пик), выход: 6%.1H ЯМР: (400 МГц, метанол-d4) δ 8,20 (s, 1H), 4,04-4,00 (m, 5H), 3,55 (s, 3H), 2,70-2,65 (m, 1H), 2,55-2,53 (m, 1H), 2,17-2,12 (m, 2H), 2,02-1,98 (m, 2H). MS-ESI: рассч. для [M+H]+ 415, обнаружено 415.
Вариант осуществления 9


Этап 1
3-Метиленциклобутанкарбоновая кислота
[106] 3-Метиленциклобутиронитрил (10,0 г, 107 ммоль) и гидроксид калия (18,1 г, 322 ммоль) растворяли в этаноле (100 мл) и воде (50 мл), затем подвергали реакции при 100°C в течение 2 часов, добавляли 1 н. соляную кислоту (120 мл). Полученную в результате смесь экстрагировали дихлорметаном (30 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 3-метиленциклобутанкарбоновой кислоты (11,0 г, масло желтого цвета), выход: 91%.1H ЯМР: (400 МГц, метанол-d4) δ 4,83-4,76 (m, 2H), 3,15-2,96 (m, 1H), 2,95-2,92 (m, 4H).
Этап 2
Метил-3-метиленциклобутанкарбоксилат
[107] 3-Метиленциклобутанкарбоновую кислоту (11,0 г, 98,1 ммоль) и карбонат калия (27,1 г, 196 ммоль) растворяли в ацетоне (100 мл), добавляли диметилсульфат (14,8 г, 117 ммоль) при 25°C. После проведения реакции при 70°C в течение 12 часов реакционную смесь гасили посредством добавления воды (20 мл), экстрагировали дихлорметаном (30 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением метил-3-метиленциклобутанкарбоксилата (12,0 г, масло желтого цвета), выход: 97%.1H ЯМР: (400 МГц, метанол-d4) δ 4,83-4,79 (m, 2H), 3,96 (s, 2H), 3,68 (s, 3H), 3,17-3,15 (m, 1H), 2,95-2,92 (m, 2H).
Этап 3
Метил-3-(гидроксиметил)циклогептанкарбоксилат
[108] Метил-3-метиленциклобутанкарбоксилат (2,00 г, 15,8 ммоль) растворяли в тетрагидрофуране (30 мл), добавляли по каплям диметилсульфид-боран (3,61 г, 47,5 ммоль) при -10°C, а затем подвергали реакции при -10°C в течение 3 часов, добавляли 3 н. водный раствор гидроксида натрия (10 мл) и перекись водорода (5 мл) и реакцию продолжали в течение 1 часа, реакционный раствор гасили посредством добавления насыщенного водного раствора тиосульфата натрия (30 мл), экстрагировали дихлорметаном (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением метил-3-(гидроксиметил)циклобутанкарбоксилата (2,00 г, масло желтого цвета), выход: 87%.1H ЯМР: (400 МГц, метанол-d4) δ 3,70 (s, 3H), 3,58 (d, J = 6,8 Гц, 1H), 3,49 (d, J = 6,8 Гц, 1H), 3,10-3,05 (m, 1H), 2,32-2,26 (m, 3H), 2,03-1,98 (m, 2H).
Этап 4
Метил-3-(((метилсульфонил)окси)метил)циклобутанкарбоксилат
[109] Метил-3-(гидроксиметил)циклобутанкарбоксилат (1,00 г, 6,94 ммоль) и триэтиламин (2,11 г, 20,8 ммоль) растворяли в дихлорметане (20 мл), добавляли метансульфохлорид (1,59 г, 13,9 ммоль) при 0°C. Реакционный раствор медленно подогревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь гасили посредством добавления водного раствора бикарбоната натрия (50 мл). Полученную в результате смесь экстрагировали дихлорметаном (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением метил-3-(((метилсульфонил)окси)метил)циклобутанкарбоксилата (1,40 г, масло желтого цвета), выход: 91%.1H ЯМР: (400 МГц, метанол-d4) δ 4,28 (d, J = 6,8 Гц, 1H), 4,19 (d, J = 6,8 Гц, 1H), 3,70 (s, 3H), 3,20-3,08 (m, 4H), 2,40-2,34 (m, 3H), 2,13-2,09 (m, 2H). MS-ESI: рассч. для [M+H]+ 223, обнаружено 223.
Этап 5
Метил-3-[(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил]циклобутанкарбоксилат
[110] Этил-3-(((метилсульфонил)окси)метил)циклобутанкарбоксилат (1,40 г, 6,30 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (1,13 г, 6,30 ммоль), йодид калия (209 мг, 1,26 ммоль) и карбонат калия (2,61 г, 18,90 ммоль) растворяли в N,N-диметилформамиде (100 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Потом реакционную смесь охлаждали до комнатной температуры, фильтровали, при этом туда добавляли воду (100 мл), экстрагировали дихлорметаном (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением метил-3-[(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил]циклобутанкарбоксилата (1,50 г, твердое вещество желтого цвета), выход: 78%.1H ЯМР: (400 МГц, метанол-d4) δ 7,51 (s, 1H), 4,18-4,10 (m, 2H), 3,99 (s, 3H), 3,67 (s, 3H), 3,55 (s, 3H) 3,26-2,65 (m, 2H), 2,29-2,13 (m, 4H). MS-ESI: рассч. для [M+H]+ 307, обнаружено 307.
Этап 6
3-[(3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил]циклобутанкарбоновая кислота
[111] Метил-3-[(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил]циклобутанкарбоксилат (1,00 г, 3,26 ммоль) и гидроксид калия (548 мг, 9,78 ммоль) растворяли в метаноле (10 мл) и воде (5 мл). Реакционный раствор нагревали до 90°C и перемешивали в течение 3 часов. Полученную в результате смесь охлаждали до комнатной температуры, нейтрализовали посредством добавления 1 н. соляной кислоты (20 мл) и фильтровали, экстрагировали дихлорметаном (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 3-[(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил]циклобутанкарбоновой кислоты (800,00 мг, твердое вещество желтого цвета), выход: 84%. MS-ESI: рассч. для [M+H]+ 293, обнаружено 293.
Этап 7
3-[(3,7-Диметил-2,6-диоксо-пурин-1-ил)метил]-N-метокси-N-метилциклобутанкарбоксамид
[112] 3-[(3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил]циклобутанкарбоновую кислоту (300 мг, 1,03 ммоль), N,O-диметилгидроксиламина гидрохлорид (200 мг, 2,05 ммоль), 1-этил-(3-диметиламинопропил)карбодиимида гидрохлорид (394 мг, 2,06 ммоль), 1-гидроксибензотриазол (27,8 мг, 0,206 ммоль) и триэтиламин (312 мг, 3,09 ммоль) растворяли в дихлорметане (10 мл). Реакционную смесь перемешивали при 25°C в течение 12 часов. Реакционную смесь концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC (этилацетат, величина Rf = 0,3) с получением 3-[(3,7-диметил-2,6-диоксопурин-1-ил)метил]-N-метокси-N-метилциклобутанкарбоксамида (200 мг, твердое вещество желтого цвета), выход: 58%. MS-ESI: рассч. для [M+H]+ 336, обнаружено 336.
Этап 8
1-[(3-Ацетилциклобутил)метил]-3,7-диметилпурин-2,6-дион
[113] 3-[(3,7-Диметил-2,6-диоксопурин-1-ил)метил]-N-метокси-N-метилциклобутанкарбоксамид (300 мг, 0,894 ммоль) растворяли в тетрагидрофуране (10 мл). Добавляли по каплям метилмагния бромид (3 M эфирный раствор, 1,49 мл, 4,47 ммоль) при 0°C и перемешивали в течение 3 часов. Реакционный раствор гасили посредством добавления насыщенного водного раствора хлорида аммония (20 мл) и экстрагировали дихлорметаном (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC (этилацетат, величина Rf = 0,5) с получением 1-[(3-ацетилциклобутил)метил]-3,7-диметилпурин-2,6-диона (200 мг, твердое вещество желтого цвета), выход: 77%.
[114] MS-ESI: рассч. для [M+H]+ 291, обнаружено 291.
Этап 9
[115] 1-[(3-Ацетилциклобутил)метил]-3,7-диметилпурин-2,6-дион (250 мг, 0,861 ммоль), фторид цезия (130 мг, 0,861 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (244 мг, 1,72 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл). Полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1 (65,0 мг, твердое вещество желтого цвета) (изомер 1, первый пик), выход: 20%.1H ЯМР: (400 МГц, метанол-d4) δ 8,21 (s, 1H), 4,23 (d, J = 7,6 Гц, 2H), 4,03 (s, 3H), 3,55 (s, 3H), 3,26-3,19 (m, 2H), 2,63-2,56 (m, 2H), 2,55-2,42 (m, 2H), 1,82-1,78 (m, 3H). MS-ESI: рассч. для [M+H]+ 361, обнаружено 361.
[116] Продукт 2 (изомер 2, второй пик), выход: 22%.1H ЯМР: (400 МГц, метанол-d4) δ 8,05 (s, 1H), 4,01-3,99 (m, 5H), 4,03 (s, 3H), 3,54 (s, 3H), 2,71-2,66 (m, 1H), 2,55-2,54 (m, 1H), 2,17-2,12 (m, 2H), 2,02-1,98 (m, 2H). MS-ESI: рассч. для [M+H]+ 361, обнаружено 361.
Вариант осуществления 10


Этап 1
Метил-1,4-диоксаспиро[4.4]нонан-7-карбоксилат
[117] Метил-3-оксоциклопентанкарбоксилат (16,0 г, 110 ммоль), п-толуолсульфоновую кислоту (14,0 г, 220 ммоль) и этиленгликоль (969 мг, 5,60 ммоль) растворяли в безводном толуоле (160 мл), после чего устанавливали водоотделитель и реакционную смесь нагревали для кипения с обратным холодильником в течение 4 часов. Реакционную смесь гасили посредством добавления воды (200 мл), экстрагировали этилацетатом и органические фазы объединяли. Объединенную органическую фазу последовательно промывали водой (200 мл × 2), насыщенным водным раствором хлорида натрия (200 мл × 2), сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 5:1, Rf = 0,3) с получением метил-1,4-диоксаспиро[4.4]нонан-7-карбоксилата (6,20 г, масло желтого цвета), выход: 29%.1H ЯМР: (400 МГц, CDCl3) δ 3,93-3,89 (m, 4H), 3,69 (s, 3H), 2,91-2,89 (m, 1H), 2,11-1,82 (m, 6H). MS-ESI: рассч. для [M+H]+ 187, обнаружено 187.
Этап 2
(1,4-Диоксаспиро[4.4]нонан-7-ил)метанол
[118] Метил-1,4-диоксаспиро[4.4]нонан-7-карбоксилат (1,00 г, 10,7 ммоль) растворяли в безводном тетрагидрофуране (30 мл), в атмосфере газообразного азота медленно добавляли алюмогидрид лития (531 мг, 13,9 ммоль) при -10°C. Реакционный раствор медленно подогревали до 25°C и перемешивали в течение 3 часов. В реакционный раствор добавляли последовательно воду (0,5 мл), 15% раствор гидроксида натрия (0,5 мл) и воду (1,5 мл). Нерастворимое вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением (1,4-диоксаспиро[4.4]нонан-7-ил)-метанола (1,5 мг, масло желтого цвета), выход: 88%.1H ЯМР: (400 МГц, CDCl3) δ 3,94-3,89 (m, 4H), 3,58-3,57 (m, 2H), 2,31-1,48 (m, 7H). MS-ESI: рассч. для [M+H]+ 159, обнаружено 159.
Этап 3
1,4-Диоксаспиро[4.4]нонан-7-илметилметансульфонат
[119] (1,4-Диоксаспиро[4.4]нонан-7-ил)-метанол (500 мг, 53,1 ммоль) и триэтиламин (800 мг, 7,92 ммоль) растворяли в безводном дихлорметане (5 мл), в атмосфере газообразного азота медленно добавляли метансульфохлорид (433 мг, 3,80 ммоль) при 0°C. Реакционный раствор подогревали до 25°C и перемешивали в течение 2 часов. Реакционную смесь гасили посредством добавления воды (40 мл) и экстрагировали этилацетатом. Органические фазы объединяли, промывали последовательно водой (20 мл × 2), насыщенным водным раствором хлорида натрия (50 мл × 2), сушили над безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1,4-диоксаспиро[4.4]нонан-7-илметилметансульфоната (800 мг, масло желтого цвета). MS-ESI: рассч. для [M+H]+ 237, обнаружено 237.
Этап 4
(1,4-Диоксаспиро[4.4]нонан-7-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[120] 1,4-Диоксаспиро[4.4]нонан-7-илметилметансульфонат (300 мг, 1,27 ммоль) растворяли в безводном N,N-диметилформамиде (10 мл), в атмосфере газообразного азота добавляли карбонат калия (350 мг, 2,54 ммоль), йодид калия (21,0 мг, 0,130 ммоль), 2,6-гидрокси-3,7-диметилпурин (275 мг, 1,52 ммоль) при 25°C. Реакционный раствор нагревали до 130°C и перемешивали в течение 3 часов. Реакционный раствор охлаждали до 25°C, гасили посредством добавления воды (40 мл) и экстрагировали этилацетатом (30 мл × 2). Органические фазы объединяли, промывали насыщенным водным раствором хлорида натрия (100 мл × 2), сушили над безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении с получением (1,4-диоксаспиро[4.4]нонан-7-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (200 мг, твердое вещество белого цвета), выход: 45%. MS-ESI: рассч. для [M+H]+ 321, обнаружено 321.
Этап 5
3,7-Диметил-1-(3-оксоциклопентилметил)-1H-пурин-2,6(3H,7H)-дион
[121] (1,4-Диоксаспиро[4.4]нонан-7-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион (200 мг, 0,620 ммоль) растворяли в безводном тетрагидрофуране (5 мл), в атмосфере газообразного азота добавляли конц. соляную кислоту (3 мл) при 25°C. Реакционный раствор перемешивали при 25°C в течение 1 часа. Смесь разбавляли водой (60 мл) и реакционную смесь экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, промывали насыщенным водным раствором хлорида натрия (100 мл × 2), сушили над безводным сульфатом магния, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением 3,7-диметил-1-(3-оксоциклопентилметил)-1H-пурин-2,6(3H,7H)-дион (100 мг, масло желтого цвета), выход: 57%. MS-ESI: рассч. для [M+H]+ 277, обнаружено 277.
Этап 6
1,3-Транс-1-((3-гидрокси-3-(трифторметил)циклопентил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
1,3-Цис-1-((3-гидрокси-3-(трифторметил)циклопентил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[122] 3,7-Диметил-1-((3-оксоциклопентил)метил)-1H-пурин-2,6(3H,7H)-дион (100 мг, 0,362 ммоль) и фторид цезия (11,0 мг, 0,0725 ммоль) растворяли в безводном тетрагидрофуране (3 мл), в атмосфере газообразного азота добавляли трифторметилтриметилсилан (95,0 мг, 0,640 ммоль). Реакционный раствор медленно нагревали до 30°C и перемешивали в течение 12 часов. В реакционный раствор добавляли водный раствор соляной кислоты (1 н., 5 мл) и реакционную смесь перемешивали в течение еще 0,5 часа при 30°C. Реакционный раствор разбавляли водой (50 мл), показатель рН доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия (10 мл) и экстрагировали этилацетатом (30 мл × 2). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением двух изомерных продуктов.
[123] Продукт 1 (изомер 1, первый пик) (40,0 мг, твердое вещество белого цвета), выход: 32%.1H ЯМР: (400 МГц, метанол-d4) δ 7,68 (s, 1H), 4,13-4,08 (m, 2H), 4,05 (s, 3H), 3,61 (s, 3H), 2,80-2,78 (m, 1H), 2,40-2,24 (m, 1H), 2,04-2,03 (m, 1H), 2,01-1,87 (m, 2H), 1,84-1,76 (m, 1H), 1,62-1,60 (m, 1H). MS-ESI: рассч. для [M+H]+ 347, обнаружено 347.
[124] Продукт 2 (изомер 2, второй пик) (20,0 мг, твердое вещество белого цвета), выход: 16%.1H ЯМР: (400 МГц, метанол-d4) δ 7,62 (s, 1H), 4,22-4,18 (m, 1H), 4,05-4,04 (m, 1H), 4,00 (s, 3H), 3,63 (s, 3H), 2,65-2,63 (m, 1H), 2,09-2,01 (m, 4H), 1,70-1,68 (m, 1H), 1,67-1,65 (m, 1H). MS-ESI: рассч. для [M+H]+ 347, обнаружено 347.
Вариант осуществления 11
1-((4-Гидрокси-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
Этил-1,4-диоксаспиро[4.5]декан-8-карбоксилат
[125] Этил-4-оксоциклогексанкарбоксилат (30,0 г, 176 ммоль), этиленгликоль (22,0 г, 353 ммоль) и п-толуолсульфоновую кислоту (304 мг, 1,70 ммоль) растворяли в толуоле (315 мл), после чего устанавливали водоотделитель и реакционную смесь нагревали для кипения с обратным холодильником в течение ночи. Реакционную смесь охлаждали до 25°C и промывали последовательно водой (300 мл × 2), насыщенным водным раствором бикарбоната натрия (500 мл × 2), органическую фазу сушили над безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении, очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением продукта этил-1,4-диоксаспиро[4.5]декан-8-карбоксилата (37,2 г, жидкость желтого цвета), выход: 99%. MS-ESI: рассч. для [M+H]+ 215, обнаружено 215.
Этап 2
1,4-Диоксаспиро[4.5]декан-8-илметанол
[126] В атмосфере газообразного азота алюмогидрид лития (2,30 г, 61,0 ммоль) медленно добавляли в тетрагидрофуран (60 мл) при 0°C, добавляли по каплям раствор этил-1,4-диоксаспиро[4.5]декан-8-карбоксилата (10,0 г, 42,0 ммоль) в тетрагидрофуране (40 мл). Реакционную смесь медленно подогревали до 25°C и перемешивали в течение 3,5 часов. Реакционный раствор охлаждали до 0°C и медленно добавляли последовательно воду (2,3 г, 127 ммоль), 15% гидроксид натрия (2,3 г, 8,60 ммоль) и воду (6,9 г, 383 ммоль). Полученную в результате смесь фильтровали и осадок на фильтре промывали тетрагидрофураном (50 мл × 3), органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением продукта 1,4-диоксаспиро[4.5]декан-8-илметанола (6,22 г, жидкость желтого цвета), выход: 89%. MS-ESI: рассч. для [M+H]+ 173, обнаружено 173.
Этап 3
1,4-Диоксаспиро[4.5]декан-8-илметилметансульфонат
[127] 1,4-Диоксаспиро[4.5]декан-8-илметанол (2,00 г, 12,0 ммоль) и диизопропилэтиламин (3,10 г, 24,0 ммоль) растворяли в дихлорметане (40 мл), медленно добавляли метансульфохлорид (3,90 г, 30,0 ммоль) при 0°C. Реакционный раствор подогревали до 25°C и перемешивали в течение ночи. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония (100 мл) и экстрагировали этилацетатом (200 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом магния и фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 3:1, Rf = 0,4) с получением продукта 1,4-диоксаспиро[4.5]декан-8-илметилметансульфоната (1,80 г, жидкость желтого цвета), выход: 60%. MS-ESI: рассч. для [M+H]+ 251, обнаружено 251.
Этап 4
1-(1,4-диоксаспиро[4.5]декан-8-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[128] 1,4-Диоксаспиро[4.5]декан-8-илметилметансульфонат (1,50 г, 6,00 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (1,00 г, 6,00 ммоль), карбонат калия (2,50 г, 18,0 ммоль), йодид калия (100 мг, 0,600 ммоль) растворяли в N,N-диметилформамиде (20 мл), реакционный раствор нагревали до 130°C и перемешивали в течение 3 часов. Реакционный раствор охлаждали до 25°C, гасили насыщенным солевым раствором (100 мл) и экстрагировали этилацетатом (500 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом магния, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением продукта 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (1,75 г, твердое вещество белого цвета), выход: 63%. MS-ESI: рассч. для [M+H]+ 335, обнаружено 335.
Этап 5
3,7-Диметил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион
[129] 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион (1,50 г, 4,50 ммоль) растворяли в ацетоне (15 мл) и добавляли водный раствор соляной кислоты (2 н., 2,5 мл). Реакционную смесь перемешивали в течение ночи при 25°C, гасили посредством добавления воды (50 мл) и экстрагировали этилацетатом (50 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:3, Rf = 0,4) с получением продукта 3,7-диметил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона (1,02 г, твердое вещество белого цвета), выход: 78%. MS-ESI: рассч. для [M+H]+ 291, обнаружено 291.
Этап 6
1-((4-Гидрокси-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[130] 3,7-Диметил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион (100 мг, 0,330 ммоль) и фторид цезия (60,0 мг, 0,350 ммоль) растворяли в тетрагидрофуране (5 мл), в атмосфере газообразного азота медленно добавляли трифторметилтриметилсилан (75,0 мг, 0,500 ммоль). Реакционный раствор перемешивали при 30°C в течение 3 часов. Реакционный раствор охлаждали до 25°C, в который добавляли водный раствор соляной кислоты (4 н., 3 мл), затем перемешивали при 25°C в течение получаса, показатель рН полученной в результате смеси доводили до 7, разбавляли водой и экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении и остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (24,0 мг, твердое вещество белого цвета), выход: 39%.
[131]1H ЯМР: (400 МГц, метанол-d4) δ 7,86 (s, 1H), 4,04 (d, J = 7,2 Гц, IH), 3,97 (s, 3H), 3,89 (d, J = 7,6 Гц, 1H), 3,53 (s, 3H), 2,06-1,97 (m, 2H), 1,88-1,77 (m, 3H), 1,62-1,43 (m, 4H). MS-ESI: рассч. для [M+H]+ 361, обнаружено 361.
Вариант осуществления 12


Этап 1
Этил-4-гидрокси-4-(трифторметил)циклогексанкарбоксилат
[132] Этил-4-оксоциклогексанкарбоксилат (10,0 г, 58,7 ммоль) растворяли в тетрагидрофуране (100 мл), добавляли трифторметилтриметилсилан (12,5 г, 88,1 ммоль) и фторид цезия (8,92 г, 58,7 ммоль) при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре в течение 12 часов, добавляли тетрабутиламмония фторид (9,27 г, 29,4 ммоль), после перемешивания при комнатной температуре в течение 30 минут добавляли этилацетат (80 мл) для разбавления реакционного раствора, органическую фазу промывали насыщенным водным раствором бикарбоната натрия (50 мл × 2), сушили над безводным сульфатом натрия, фильтровали и концентрировали, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,5) с получением этил-4-гидрокси-4-(трифторметил)циклогексанкарбоксилата (12,0 г, бесцветное масло), выход: 85%.1H ЯМР: (400 МГц, метанол-d4) δ 4,20-4,12 (m, 2H), 2,03-1,86 (m, 9H), 1,29-1,25 (m, 3H).
[133] MS-ESI: рассч. для [M+H]+ 241, обнаружено 241.
Этап 2
4-(Гидроксиметил)-1-(трифторметил)циклогексанол
[134] Этил-4-гидрокси-4-(трифторметил)циклогексанкарбоксилат (12,00 г, 49,9 ммоль) растворяли в тетрагидрофуране (20 мл), добавляли алюмогидрид лития (3,79 г, 100 ммоль) при 0°C и подвергали реакции в течение 2 часов. Реакционную смесь гасили посредством добавления воды (30 мл). Полученную в результате смесь экстрагировали (50 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,2) с получением 4-(гидроксиметил)-1-(трифторметил)циклогексанола (9,00 г, бесцветное масло), выход: 91%.1H ЯМР: (400 МГц, метанол-d4) δ 3,58-3,40 (m, 2H), 1,90-1,40 (m, 9H).
Этап 3
(4-Гидрокси-4-(трифторметил)циклогексил)метилметансульфонат
[135] 4-(Гидроксиметил)-1-(трифторметил)циклогексанол (11,0 г, 55,5 ммоль) и триэтиламин (1,18 г, 11,6 ммоль) растворяли в дихлорметане (80 мл) и добавляли метансульфохлорид (14,4 г, 125 ммоль) при 0°C. Реакционный раствор перемешивали при комнатной температуре в течение 2 часов, разбавляли дихлорметаном (60 мл), промывали насыщенным водным раствором бикарбоната натрия (50 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 4:1, Rf = 0,5) с получением (4-гидрокси-4-(трифторметил)циклогексил)метилметансульфоната (13,00 г, бесцветное масло), выход: 85%.1H ЯМР: (400 МГц, метанол-d4) δ 4,25-4,01 (m, 2H), 3,10-3,07 (m, 3H), 2,03-1,24 (m, 9H).
Этап 4
1-(((1S,4S)-4-Гидрокси-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[136] (4-Гидрокси-4-(трифторметил)циклогексил)метилметансульфонат (10,0 г, 36,2 ммоль) растворяли в N,N-диметилформамиде (100 мл) и добавляли в реакционный раствор 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (6,52 г, 36,2 ммоль), карбонат калия (7,50 г, 54,3 ммоль) и йодид калия (184 мг, 1,11 ммоль) при комнатной температуре. Реакционный раствор нагревали до 100°C и подвергали реакции в течение 5 часов, реакционный раствор концентрировали и разбавляли этилацетатом (100 мл), органическую фазу промывали насыщенным водным раствором бикарбоната натрия (50 мл × 2), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и разделяли посредством препаративной SFC с получением продукта 1 (2,5 г, твердое вещество белого цвета) (изомер 1, первый пик), выход: 19%. Условия разделения: колонка: Chiralpak AD-3 150 × 4,6 мм, I.D: 3 мкм, подвижная фаза: этанол (0,05% диэтиламин) в CO2 от 5% до 40% при 2,5 мл/мин., длина волны: 220 нм.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 4,02 (d, J = 7,6 Гц, 2H), 3,98 (s, 3H), 3,53 (s, 3H), 2,16-2,02 (m, 1H), 1,99-1,98 (m, 2H), 1,87-1,80 (m, 2H), 1,60-1,49 (m, 2H), 1,48-1,46 (m, 2H). MS-ESI: рассч. для [M+H]+ 361, обнаружено 361.
[137] Продукт 2 (2,40 г, твердое вещество белого цвета) (изомер 2, второй пик), выход: 19%.1H ЯМР: (400 МГц, CDCl3) δ 7,88 (s, 1H), 3,99 (s, 3H), 3,90 (d, J = 7,6 Гц, 2H), 3,54 (s, 3H), 1,84-1,81 (m, 3H), 1,58-1,46 (m, 6H). MS-ESI: рассч. для [M+H]+ 361, обнаружено 361.
Вариант осуществления 13
1-((4-Гидрокси-4-метилциклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


[138] 3,7-Диметил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион (50,0 мг, 0,170 ммоль) растворяли в тетрагидрофуране (2 мл). В атмосфере газообразного азота медленно добавляли метиловый реактив Гриньяра (3 M эфирный растворитель, 0,4 мл, 1,20 ммоль) при -78°C. Реакционный раствор перемешивали при -78°C в течение 0,5 часа, медленно подогревали до 0°C и перемешивали в течение еще 0,5 часа. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония, показатель рН которого доводили до 7. Полученную в результате смесь экстрагировали этилацетатом, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1-((4-гидрокси-4-метилциклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (8,0 мг, твердое вещество белого цвета), выход: 16%.1H ЯМР: (400 МГц, метанол-d4) δ 7,86 (s, 1H), 3,97 (s, 3H), 3,88 (d, J = 7,6 Гц, 2H), 3,52 (s, 3H), 1,85-1,78 (m, 1H), 1,73-1,57 (m, 3H), 1,46-1,33 (m, 2H), 1,32-1,15 (m, 6H). MS-ESI: рассч. для [M+H-H2O]+ 289, обнаружено 289.
Вариант осуществления 14
1-((4-Этил-4-гидроксициклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


[139] 3,7-Диметил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион (50,0 мг, 0,170 ммоль) растворяли в тетрагидрофуране (2 мл). В атмосфере газообразного азота медленно добавляли этиловый реактив Гриньяра (3 M эфирный растворитель, 0,4 мл, 1,20 ммоль) при -78°C. Реакционный раствор перемешивали при -78°C в течение 0,5 часа, медленно подогревали до 0°C и перемешивали в течение еще 0,5 часа. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония, показатель рН которого доводили до 7. Потом полученную в результате смесь экстрагировали этилацетатом, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1-((4-этил-4-гидроксициклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (42,0 мг, твердое вещество белого цвета), выход: 77%.1H ЯМР: (400 МГц, метанол-d4) δ 7,86 (s, 1H), 3,97 (s, 3H), 3,88 (d, J = 7,6 Гц, 2H), 3,54-3,50 (m, 3H), 1,93-1,80 (m, 1H), 1,76-1,72 (m, 2H), 1,66-1,51 (m, 3H), 1,38-1,28 (m, 3H), 1,27-1,13 (m, 2H), 0,89 (t, J = 7,2 Гц, 3H). MS-ESI: рассч. для [M+H-H2O]+ 303, обнаружено 303.
Вариант осуществления 15


Этап 1
Этил-2-(1,4-диоксаспиро[4.5]декан-8-илиден)ацетат
[140] Триэтилфосфоноацетат (12,2 г, 54,4 ммоль) растворяли в тетрагидрофуране (100 мл) добавляли порциями гидрид натрия (1,92 г, 48,0 ммоль) при 0°C, реакционную смесь перемешивали в атмосфере газообразного азота в течение 30 минут. Раствор 1,4-циклогександиона моноэтиленацеталя (5,00 г, 32,0 ммоль), растворенный в тетрагидрофуране (15 мл), добавляли по каплям в реакционный раствор при 0°C и реакционную смесь перемешивали при 25°C в течение 3 часов. Реакционную смесь гасили посредством добавления воды (25 мл) и экстрагировали дихлорметаном (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 5:1, Rf = 0,3) с получением этил-2-(1,4-диоксаспиро[4.5]декан-8-илиден)ацетата (6,30 г, бесцветное масло), выход: 93%.1H ЯМР: (400 МГц, CDCl3) δ 5,67 (s, 1H), 4,15 (q, J = 7,2 Гц, 2H), 3,98 (s, 4H), 3,00 (t, J = 6,4 Гц, 2H), 2,38 (t, J = 6,4 Гц, 2H), 1,84-1,68 (m, 4H), 1,28 (t, J = 7,2 Гц, 3H). MS-ESI: рассч. для [M+H]+ 227, обнаружено 227.
Этап 2
Этил-2-(1,4-диоксаспиро[4.5]декан-8-ил)ацетат
[141] Этил-2-(1,4-диоксаспиро[4.5]декан-8-илиден)ацетат (3,80 г, 17,9 ммоль) растворяли в метаноле (50 мл), добавляли сухой палладий на углероде (10% палладия, 1% воды, 400 мг), реакционную смесь подвергали реакции в атмосфере газообразного водорода (50 фунт/кв. дюйм) в течение 18 часов при комнатной температуре. Реакционный раствор фильтровали и фильтрат концентрировали при пониженном давлении с получением этил-2-(1,4-диоксаспиро[4.5]декан-8-ил)ацетата (3,50 г, бесцветное масло), выход: 91%.
[142]1H-ЯМР: (400 МГц, CDCl3) δ 4,12 (q, J = 7,2 Гц, 2H), 3,93 (s, 4H), 2,22 (d, J = 7,2 Гц, 2H), 1,90-1,64 (m, 5H), 1,63-1,48 (m, 2H), 1,40-1,16 (m, 5H). MS-ESI: рассч. для [M+H]+ 229, обнаружено 229.
Этап 3
2-(1,4-Диоксаспиро[4.5]декан-8-ил)этанол
[143] Этил-2-(1,4-диоксаспиро[4.5]декан-8-ил)ацетат (1,00 г, 4,38 ммоль) растворяли в тетрагидрофуране (20 мл), добавляли порциями алюмогидрид лития (216 мг, 5,69 ммоль) при 0°C и перемешивали в течение 18 часов в атмосфере газообразного азота. Реакционный раствор охлаждали до 0°C, медленно добавляли последовательно воду (0,2 мл), 15% водный раствор гидроксида натрия (0,2 мл) и воду (0,6 мл). Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением продукта 2-(1,4-диоксаспиро[4.5]декан-8-ил)этанола (780 мг, масло желтого цвета), выход: 96%.
[144]1H ЯМР: (400 МГц, CDCl3) δ 3,94 (s, 4H), 3,69 (t, J = 6,4 Гц, 2H), 1,79-1,65 (m, 4H), 1,59-1,38 (m, 5H), 1,34-1,17 (m, 2H). MS-ESI: рассч. для [M+H]+ 187, обнаружено 187.
Этап 4
2-(1,4-Диоксаспиро[4.5]декан-8-ил)этилметансульфонат
[145] 2-(1,4-Диоксаспиро[4.5]декан-8-ил)этанол (400 мг, 2,15 ммоль) и триэтиламин (435 мг, 4,30 ммоль) растворяли в дихлорметане (10 мл), медленно добавляли метансульфохлорид (369 мг, 3,23 ммоль) при 0°C. Реакционный раствор перемешивали при 0°C в течение 4 часов. Реакционную смесь гасили посредством добавления воды (10 мл) и экстрагировали дихлорметаном (30 мл × 2). Органические фазы объединяли, промывали насыщенным водным раствором бикарбоната натрия (50 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 2-(1,4-диоксаспиро[4.5]декан-8-ил)этилметансульфоната (500 мг неочищенного масла желтого цвета).
[146]1H ЯМР: (400 МГц, CDCl3) δ 4,28 (t, J = 6,4 Гц, 2H), 3,94 (s, 4H), 3,01 (s, 3H), 1,76-1,63 (m, 6H), 1,60-1,43 (m, 3H), 1,37-1,21 (m, 2H). MS-ESI: рассч. для [M+H]+ 265, обнаружено 265.
Этап 5
1-(2-(1,4-Диоксаспиро[4.5]декан-8-ил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[147] 3,7-Диметил-1H-пурин-2,6-(3H,7H)-дион (204 мг, 1,13 ммоль) растворяли в N,N-диметилформамиде (15 мл), добавляли 2-(1,4-диоксаспиро[4.5]декан-8-ил)этилметансульфонат (300 мг, 1,13 ммоль), карбонат калия (312 мг, 2,26 ммоль) и йодид калия (225 мг, 1,36 ммоль). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,2) с получением 1-(2-(1,4-диоксаспиро[4.5]декан-8-ил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (190 мг, твердое вещество белого цвета), выход: 48%.
[148]1H ЯМР: (400 МГц, CDCl3) δ 7,50 (s, 1H), 4,09-4,03 (m, 2H), 4,02 (s, 3H), 3,99 (s, 4H), 3,57 (s, 1H), 1,90-1,70 (m, 5H), 1,68-1,47 (m, 6H), 1,45-1,31 (m, 2H). MS-ESI: рассч. для [M+H]+ 349, обнаружено 349.
Этап 6
3,7-Диметил-1-(2-(4-оксоциклогексил)этил)-1H-пурин-2,6(3H,7H)-дион
[149] 1-(2-(1,4-Диоксаспиро[4.5]декан-8-ил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион (190 мг, 545 мкмоль) растворяли в тетрагидрофуране (3 мл) и добавляли конц. соляную кислоту (1 мл). Реакционный раствор перемешивали при комнатной температуре в течение 18 часов. Реакционный раствор концентрировали при пониженном давлении, показатель рН водной фазы нейтрализовали до 7 с помощью насыщенного водного раствора бикарбоната натрия и экстрагировали этилацетатом (20 мл × 2). Органические фазы объединяли, промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении и остаток очищали посредством колоночной хроматографии на силикагеле (этилацетат, Rf = 0,3) с получением 3,7-диметил-1-(2-(4-оксоциклогексил)этил)-1H-пурин-2,6(3H,7H)-диона (150 мг, бесцветное масло), выход: 90%.
[150] MS-ESI: рассч. для [M+H]+ 305, обнаружено 305.
Этап 7
3,7-Диметил-1-(2-(4-(трифторметил)-4-((триметилсилил)окси)циклогексил)этил)-1-пурин-2,6(3H,7H)-дион
[151] 3,7-Диметил-1-(2-(4-оксоциклогексил)этил)пурин-2,6-дион (145 мг, 0,476 ммоль) и фторид цезия (7,2 мг, 0,0476 ммоль) растворяли в тетрагидрофуране (10 мл), медленно добавляли трифторметилтриметилсилан (203 мг, 1,43 ммоль) в атмосфере газообразного азота. Реакционный раствор перемешивали при 25°C в течение 18 часов. Реакционный раствор разбавляли водой (20 мл) и экстрагировали этилацетатом (15 мл × 2). Органические фазы объединяли, промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении с получением 3,7-диметил-1-(2-(4-(трифторметил)-4-((триметилсилил)окси)циклогексил)этил)-1-пурин-2,6(3H,7H)-диона (170 мг, бесцветная жидкость), выход: 80%.
[152] MS-ESI: рассч. для [M+H]+ 447, обнаружено 447.
Этап 8
[153] 3,7-Диметил-1-[2-[4-(трифторметил)-4-триметилсилилоксициклогексил]этил]пурин-2,6-дион (160 мг, 0,358 ммоль) растворяли в тетрагидрофуране (3 мл) и добавляли конц. соляную кислоту (12 M, 0,107 мл). Реакционный раствор перемешивали при 25°C в течение 18 часов. Разбавляли водой реакционную смесь, показатель рН которой доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия (10 мл), экстрагировали этилацетатом (10 мл × 2). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении, а остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1 (40,0 мг, твердое вещество белого цвета) (изомер 1, первый пик), выход: 27%.1H ЯМР: (400 МГц, CDCl3) δ 8,01 (s, 1H), 4,09-3,94 (m, 5H), 3,53 (s, 3H), 1,97-1,79 (m, 4H), 1,76-1,62 (m, 3H), 1,61-1,45 (m, 4H). MS-ESI: рассч. для [M+H]+ 375, обнаружено 375.
[154] А также получили продукт 2 (15,0 мг, твердое вещество белого цвета) (изомер 2, второй пик), выход: 10%.1H-ЯМР: (400 МГц, CDCl3) δ 8,01 (s, 1H), 4,09-3,95 (m, 5H), 3,53 (s, 3H), 1,87-1,68 (m, 4H), 1,64-1,48 (m, 4H), 1,46-1,25 (m, 3H). MS-ESI: рассч. для [M+H]+ 375, обнаружено 375.
Вариант осуществления 16
1-((4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
Этил-8-метил-1,4-диоксаспиро[4.5]декан-8-карбоксилат
[155] Сложный этиловый эфир этил-1,4-диоксаспиро[4.5]декан-8-карбоновой кислоты (5,00 г, 23,3 ммоль) растворяли в безводном тетрагидрофуране (100 мл), в атмосфере газообразного азота медленно добавляли по каплям раствор диизопропиламида лития (2 M раствор тетрагидрофурана, 14,0 мл, 28,0 ммоль) при -78°C, реакционный раствор перемешивали при -78°C в течение 1 часа. Медленно добавляли йодметан (6,62 г, 46,7 ммоль) и реакционную смесь перемешивали в течение еще 1 часа. Реакционную смесь гасили посредством добавления воды (100 мл). Реакционную смесь экстрагировали этилацетатом (100 мл × 3) и объединяли органические фазы, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,4) с получением этил-8-метил-1,4-диоксаспиро[4.5]декан-8-карбоксилата (5,00 г, масло желтого цвета), выход: 94%.1H ЯМР: (400 МГц, метанол-d4) δ 4,16-4,10 (m, 2H), 3,93-3,86 (m, 4H), 2,13-2,06 (m, 2H), 1,61-1,48 (m, 6H), 1,25-1,22 (m, 3H), 1,15 (s, 3H).
Этап 2
Этил-1-метил-4-оксоциклогексанкарбоксилат
[156] Этил-8-метил-1,4-диоксаспиро[4.5]декан-8-карбоксилат (5,00 г, 21,9 ммоль) растворяли в тетрагидрофуране (50 мл) и добавляли по каплям 1 н. водный раствор соляной кислоты (20 мл) при 0°C, а затем перемешивали при 20°C в течение 1 часа. Смесь охлаждали до 0°C и реакционную смесь гасили посредством добавления водного раствора бикарбоната натрия (50 мл). Смесь экстрагировали этилацетатом (100 мл × 3). Органическую фазу промывали насыщенным солевым раствором (100 мл × 3), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,4) с получением этил-1-метил-4-оксоциклогексанкарбоксилата (3,00 г, бесцветное масло), выход 74%.1H ЯМР: (400 МГц, метанол-d4) δ 4,26-4,11 (m, 2H), 2,46-2,29 (m, 5H), 1,74-1,55 (m, 3H), 1,33-1,26 (m, 6H).
Этап 3
Этил-4-гидрокси-1-метил-4-(трифторметил)циклогексанкарбоксилат
[157] Этил-1-метил-4-оксоциклогексанкарбоксилат (3,00 г, 16,3 ммоль), фторид цезия (247 мг, 1,63 ммоль) растворяли в тетрагидрофуране (50 мл), а затем добавляли трифторметилтриметилсилан (4,63 г, 35,3 ммоль) при 0°C. В атмосфере газообразного азота реакционный раствор подвергали реакции при 20°C в течение 6 часов. Потом добавляли 4 н. водный раствор соляной кислоты (4 мл). В атмосфере газообразного азота смесь подвергали реакции при комнатной температуре в течение 6 часов. Реакционную смесь гасили насыщенным водным раствором бикарбоната натрия (30 мл) и экстрагировали этилацетатом (100 мл × 3), органическую фазу сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,3) с получением этил-4-гидрокси-1-метил-4-(трифторметил)циклогексанкарбоксилата (3,00 г, бесцветное масло), выход: 73%.1H ЯМР: (400 МГц, метанол-d4) δ 4,20-4,12 (m, 2H), 2,03-1,31 (m, 8H), 1,29-1,23 (m, 6H).
Этап 4
4-(Гидроксиметил)-4-метил-1-(трифторметил)циклогексанол
[158] Этил-4-гидрокси-1-метил-4-(трифторметил)циклогексанкарбоксилат (3,00 г, 11,8 ммоль) растворяли в безводном тетрагидрофуране (50 мл), добавляли алюмогидрид лития (896 мг, 23,6 ммоль) при 0°C. Реакционный раствор подогревали до 25°C и перемешивали в течение 1 часа. Реакционную смесь гасили посредством добавления воды (20 мл), экстрагировали этилацетатом (50 мл × 3), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 3:1, Rf = 0,2) с получением 4-(гидроксиметил)-4-метил-1-(трифторметил)циклогексанола (2,00 г, бесцветное масло), выход: 80%.1H ЯМР: (400 МГц, метанол-d4) δ 3,25 (s, 2H), 1,76-1,64 (m, 6H), 1,29-1,26 (m, 2H), 0,93-0,91 (m, 3H).
Этап 5
(4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метилметансульфонат
[159] 4-(Гидроксиметил)-4-метил-1-(трифторметил)циклогексанол (2,00 г, 9,42 ммоль) растворяли в дихлорметане (30 мл), добавляли триэтиламин (953 мг, 9,42 ммоль) и метансульфохлорид (1,08 г, 9,42 ммоль) при 0°C. Реакционный раствор подвергали реакции при 0°C в течение 2 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (10 мл), экстрагировали дихлорметаном (50 мл × 3), органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением (4-гидрокси-1-метил-4-(трифторметил)циклогексил)метилметансульфоната (2,00 г, масло желтого цвета), выход 73%.
Этап 6
1-((4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[160] (4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метилметансульфонат (100 мг, 0,344 ммоль), 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (62,1 мг, 0,344 ммоль), йодид калия (5,70 мг, 0,0344 ммоль) и карбонат калия (47,6 мг, 0,344 ммоль) растворяли в безводном N,N-диметилформамиде (5 мл). Реакционный раствор нагревали до 150°C посредством микроволнового излучения и подвергали реакции в течение 4 часов. Реакционный раствор охлаждали до 20°C, фильтровали, очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-((4-гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (3,0 мг, твердое вещество белого цвета), выход: 2%.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 3,98 (s, 3H), 3,96 (s, 2H), 3,54 (s, 3H), 1,81-1,64 (m, 6H), 1,63-1,34 (m, 2H), 1,00 (s, 3H). MS-ESI: рассч. для [M+H]+ 375, обнаружено 375.
Вариант осуществления 17
1-((4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион

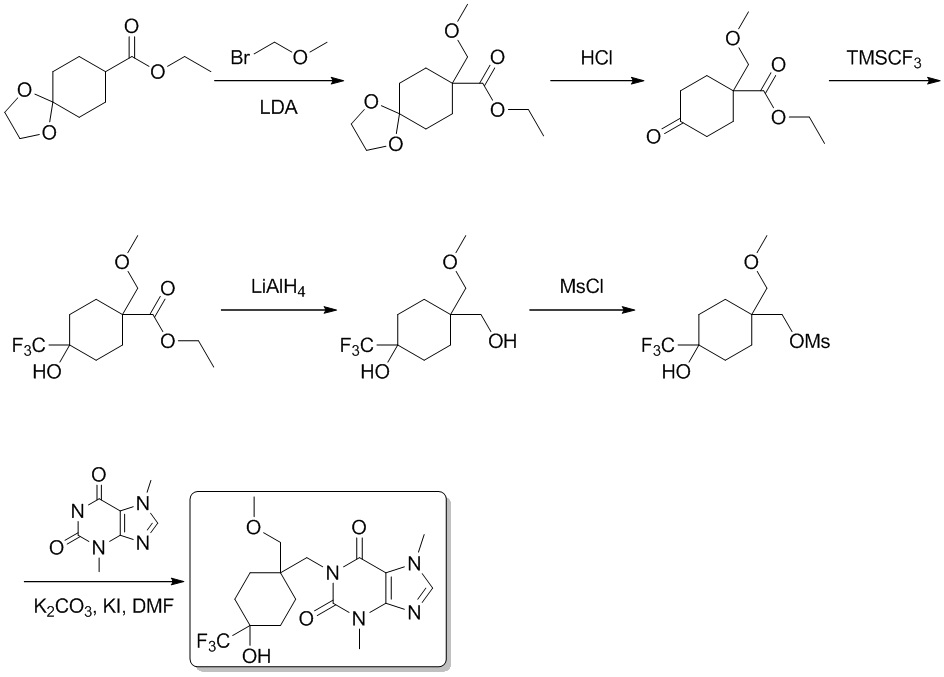
Этап 1
Этил-8-(метоксиметил)-1,4-диоксаспиро[4.5]декан-8-карбоксилат
[161] Этил-1,4-диоксаспиро[4.5]декан-8-карбоксилат (5,00 г, 23,3 ммоль) растворяли в безводном тетрагидрофуране (100 мл), в атмосфере газообразного азота медленно добавляли по каплям раствор диизопропиламида лития (2 M раствор н-гексана, 14,0 мл, 28,0 ммоль) при -78°C и реакционную смесь перемешивали при -78°C в течение 1 часа. Медленно добавляли метоксибромметан (5,83 г, 46,7 ммоль) и реакционную смесь перемешивали в течение еще 1 часа. Реакционную смесь гасили посредством добавления воды (100 мл). Реакционную смесь экстрагировали этилацетатом (100 мл × 3) и органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,3) с получением этил-8-(метоксиметил)-1,4-диоксаспиро[4.5]декан-8-карбоксилата (5,00 г, масло желтого цвета), выход: 83%.1H ЯМР: (400 МГц, метанол-d4) δ 4,18 (q, J = 6,8 Гц, 2H), 3,94 (s, 4H), 3,55 (s, 2H), 3,33 (s, 3H), 2,14-2,12 (m, 2H), 1,65-1,57 (m, 6H), 1,26 (t, J = 6,8 Гц, 3H).
Этап 2
Этил-1-(метоксиметил)-4-оксоциклогексанкарбоксилат
[162] Этил-8-(метоксиметил)-1,4-диоксаспиро[4.5]декан-8-карбоксилат (5,00 г, 19,4 ммоль) растворяли в тетрагидрофуране (50 мл), добавляли по каплям 1 н. разбавленную соляную кислоту (10 мл) при 0°C и перемешивали при 20°C в течение 1 часа. Смесь охлаждали до 0°C и гасили посредством добавления водного раствора бикарбоната натрия (50 мл). Смесь экстрагировали этилацетатом (100 мл × 3). Органическую фазу промывали насыщенным солевым раствором (100 мл × 3), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,4) с получением этил-1-(метоксиметил)-4-оксоциклогексанкарбоксилата (3,00 г, масло белого цвета), выход: 73%.1H ЯМР: (400 МГц, метанол-d4) δ 4,25 (q, J = 6,8 Гц, 2H), 3,52 (s, 2H), 3,34 (s, 3H), 2,52-2,30 (m, 6H), 1,82-1,78 (m, 2H), 1,30 (t, J = 6,8 Гц, 3H).
Этап 3
Этил-4-гидрокси-1-(метоксиметил)-4-(трифторметил)циклогексанкарбоксилат
[163] Этил-1-(метоксиметил)-4-оксоциклогексанкарбоксилат (3,00 г, 14,0 ммоль), фторид цезия (243 мг, 1,40 ммоль) растворяли в тетрагидрофуране (50 мл), а затем добавляли трифторметилтриметилсилан (3,98 г, 28,0 ммоль) при 0°C. В атмосфере газообразного азота реакционный раствор подвергали реакции при 20°C в течение 6 часов. Потом добавляли разбавленную 4 н. соляную кислоту (7 мл). В атмосфере газообразного азота смесь подвергали реакции при комнатной температуре в течение 6 часов. Реакционную смесь гасили насыщенным водным раствором бикарбоната натрия (30 мл) и экстрагировали этилацетатом (100 мл × 3), органическую фазу сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,4) с получением этил-4-гидрокси-1-(метоксиметил)-4-(трифторметил)циклогексанкарбоксилата (1,7 г, бесцветное масло), выход: 43%.1H ЯМР: (400 МГц, метанол-d4) 4,18-4,09 (m, 2H), 3,61 (s, 2H), 3,33 (s, 3H), 1,84-1,71 (m, 8H), 1,28-1,25 (m, 3H).
Этап 4
4-(Гидроксиметил)-4-(метоксиметил)-1-(трифторметил)циклогексанол
[164] Этил-4-гидрокси-1-(метоксиметил)-4-(трифторметил)циклогексанкарбоксилат (1,50 г, 5,28 ммоль) растворяли в безводном тетрагидрофуране (50 мл), добавляли алюмогидрид лития (220 мг, 5,81 ммоль) при 0°C. Реакционный раствор нагревали до 25°C и перемешивали в течение 1 часа. Реакционную смесь гасили посредством добавления воды (20 мл), экстрагировали этилацетатом (50 мл × 3), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,2) с получением 4-(гидроксиметил)-4-(метоксиметил)-1-(трифторметил)циклогексанола (1,20 г, бесцветное масло), выход: 84%.1H ЯМР: (400 МГц, метанол-d4) δ 3,33-3,32 (m, 7H), 1,67-1,63 (m, 4H), 1,52-1,48 (m, 4H).
Этап 5
(4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метилметансульфонат
[165] 4-(Гидроксиметил)-4-(метоксиметил)-1-(трифторметил)циклогексанол (1,20 г, 4,95 ммоль) растворяли в дихлорметане (20 мл), добавляли триэтиламин (851 мг, 9,91 ммоль) и метансульфохлорид (851 мг, 7,43 ммоль) при 0°C. Реакционный раствор подвергали реакции при 0°C в течение 2 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (10 мл), экстрагировали дихлорметаном (50 мл × 3), органические фазы объединяли, промывали насыщенным раствором хлорида натрия (50 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением (4-гидрокси-1-метил-4-(трифторметил)циклогексил)метилметансульфоната (1,30 г, масло желтого цвета), выход: 92%.
Этап 6
1-((4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[166] (4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метилметансульфонат (300 мг, 1,05 ммоль), 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (189 мг, 1,05 ммоль), йодид калия (17,4 мг, 0,105 ммоль) и карбонат калия (435 мг, 3,15 ммоль) растворяли в безводном N,N-диметилформамиде (5 мл). Реакционный раствор нагревали до 150°C посредством микроволнового излучения и подвергали реакции в течение 2 часов. Реакционный раствор охлаждали до 20°C, фильтровали, очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-((4-гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (12,0 мг, твердое вещество белого цвета), выход: 3%.1H ЯМР: (400 МГц, метанол-d4) δ 7,87 (s, 1H), 4,06 (s, 2H), 3,83 (s, 3H), 3,98 (s, 3H), 3,53 (s, 2H), 3,42 (s, 3H), 1,69-1,58 (m, 8H). MS-ESI: рассч. для [M+H]+ 405, обнаружено 405.
Вариант осуществления 18
1-((4-(3-Гидроксипентан-3-ил)-циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
Метил-4-(гидроксиметил)циклогексанкарбоксилат
[167] 4-(Метоксикарбонил)циклогексанкарбоновую кислоту (1,20 г, 6,45 ммоль) растворяли в безводном тетрагидрофуране (20 мл), в атмосфере газообразного азота медленно добавляли по каплям диметилсульфид-боран (10 M, 1,0 мл, 10,3 ммоль) при 0°C, реакционный раствор перемешивали при 0°C в течение 0,5 часа, медленно подогревали до 25°C, а затем перемешивали в течение еще 1 часа. Реакционную смесь гасили посредством добавления воды (40 мл) и реакционный раствор экстрагировали этилацетатом. Органические фазы объединяли, промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении с получением метил 4-(гидроксиметил)циклогексанкарбоксилата (1,00 г, твердое вещество белого цвета), выход: 91%.1H ЯМР: (400 МГц, CDCl3) δ 3,67 (s, 3H), 3,48-3,46 (m, 2H), 2,26-2,25 (m, 1H), 2,05-2,01 (m, 2H), 1,89-1,85 (m, 2H), 1,47-1,43 (m, 2H), 1,31 (s, 1H), 1,01-0,98 (m, 2H). MS-ESI: рассч. для [M+H]+ 173, обнаружено 173.
Этап 2
Метил-4-(((метилсульфонил)окси)метил)циклогексанкарбоксилат
[168] Метил-4-(гидроксиметил)циклогексанкарбоксилат (900 мг, 5,20 ммоль) и триэтиламин (1,58 г, 15,6 ммоль) растворяли в безводном дихлорметане (5 мл), в атмосфере газообразного азота добавляли метансульфохлорид (720 мг, 6,30 ммоль) при 0°C. Реакционный раствор подогревали до 25°C и перемешивали в течение 2 часов. Реакционную смесь гасили посредством добавления воды (60 мл) и реакционный раствор экстрагировали этилацетатом. Органические фазы объединяли, промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали с помощью пластин для препаративной TLC (петролейный эфир/этилацетат 3:1, Rf = 0,5) с получением метил-4-(((метилсульфонил)окси)метил)циклогексанкарбоксилата (1,00 г, твердое вещество белого цвета), выход: 91%.1H ЯМР: (400 МГц, CDCl3) δ 3,67 (s, 3H), 3,48-3,46 (m, 2H), 3,01 (s, 3H), 2,26-2,25 (m, 1H), 2,05-2,01 (m, 2H), 1,89-1,85 (m, 2H), 1,47-1,43 (m, 2H), 1,31 (s, 1H), 1,01-0,98 (m, 2H). MS-ESI: рассч. для [M+H]+ 251, обнаружено 251.
Этап 3
Метил-4-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)циклогексанкарбоксилат
[169] Метил-4-(((метилсульфонил)окси)метил)циклогексанкарбоксилат (350 мг, 2,32 ммоль) растворяли в 5 мл безводного N,N-диметилформамида, в атмосфере газообразного азота добавляли карбонат калия (640 мг, 4,64 ммоль), йодид калия (38,0 мг, 0,230 ммоль) и 2,6-гидрокси-3,7-диметилпурин (501 мг, 2,80 ммоль) при 25°C. Реакционный раствор перемешивали при 130°C в течение 3 часов. Добавляли 40 мл воды в реакционный раствор, который экстрагировали этилацетатом, органические фазы объединяли, промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали с помощью пластин для препаративной TLC с получением продукта метил-4-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)циклогексанкарбоксилата (400 мг, твердое вещество белого цвета), выход: 52%. MS-ESI: рассч. для [M+H]+ 335, обнаружено 335.
Этап 4
1-((4-(3-Гидроксипентан-3-ил)-циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[170] Метил-4-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)циклогексанкарбоксилат (100 мг, 0,30 ммоль) растворяли в 5 мл безводного тетрагидрофурана, в атмосфере газообразного азота медленно добавляли по каплям раствор бромэтилмагния (3 M раствор в эфире, 1 мл, 3,00 ммоль) при -65°C и реакционную смесь перемешивали при -65 C в течение 2 часов. В реакционный раствор добавляли воду (40 мл) и экстрагировали этилацетатом, органические фазы объединяли, промывали насыщенным водным раствором хлорида натрия (50 мл), сушили над безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1-((4-(3-гидроксипентан-3-ил)-циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (20,0 мг, твердое вещество белого цвета), выход: 19%.1H ЯМР: (400 МГц, CDCl3) δ 7,52 (s, 1H), 4,00 (s, 3H), 3,90-3,88 (m, 2H), 3,59 (s, 3H), 1,80-1,74 (m, 6H), 1,45 (m, 4H), 1,11-1,10 (m, 4H), 0,86-0,82 (m, 6H). MS ESI рассч. для [M+H]+ 363, обнаружено 363.
Вариант осуществления 19
3,7-Диметил-1-[[транс-4-(2,2,2-трифтор-1-гидрокси-1-метилэтил)циклогексил]метил]пурин-2,6-дион


Этап 1
Метил-транс-4-гидроксиметилциклогексанкарбоксилат
[171] Сложный монометиловый эфир транс-циклогексан-1,4-дикарбоновой кислоты (5,00 г, 26,8 ммоль) растворяли в тетрагидрофуране (100 мл), добавляли диметилсульфид-боран (3,06 г, 40,3 ммоль) при 0°C и реакционную смесь подвергали реакции при комнатной температуре в течение 2 часов. Реакционную смесь гасили посредством добавления насыщенного метанола (50 мл). После концентрирования добавляли воду (50 мл) в смесь, которую потом экстрагировали этилацетатом (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением метил-транс-4-гидроксиметилциклогексанкарбоксилата (4,00 г, масло желтого цвета), выход: 87%.1H ЯМР: (400 МГц, метанол-d4) δ 3,67 (s, 3H), 3,43-3,38 (m, 2H), 2,31-2,54 (m, 1H), 2,03-1,98 (m, 2H), 1,90-1,82 (m, 2H), 1,45-1,38 (m, 3H), 1,03-0,99 (m, 2H). MS-ESI: рассч. для [M+H]+ 173, обнаружено 173.
Этап 2
Транс-метил-4-(((метилсульфонил)окси)метил)циклогексанкарбоксилат
[172] Метил-транс-4-гидроксиметилциклогексанкарбоксилат (3,00 г, 23,2 ммоль) и триэтиламин (7,05 г, 69,6 ммоль) растворяли в дихлорметане (50 мл) и добавляли метансульфохлорид (7,98 г, 69,6 ммоль) при 0°C. Реакционный раствор медленно подогревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь гасили посредством добавления водного раствора бикарбоната натрия (50 мл). Полученную в результате смесь экстрагировали дихлорметаном (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением транс-метил-4-(((метилсульфонил)окси)метил)циклогексанкарбоксилата (5,80 г, масло желтого цвета), выход: 99%.1H ЯМР: (400 МГц, метанол-d4) δ 4,10-4,03 (m, 2H), 3,65 (s, 3H), 3,07 (s, 3H), 2,42-2,31 (m, 1H), 2,10-2,03 (m 2H), 1,90-1,82 (m, 2H), 1,75-1,66 (m, 1H), 1,48-1,42 (m, 2H), 1,21-1,10 (m, 2H). MS-ESI: рассч. для [M+H]+ 251, обнаружено 251.
Этап 3
Транс-метил-4-((3,7-диметил-2,6-диоксо-пурин-1-ил)метил)циклогексанкарбоксилат
[173] Транс-метил-4-(((метилсульфонил)окси)метил)циклогексанкарбоксилат (1,00 г, 4,00 ммоль), 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (719 мг, 4,00 ммоль), йодид калия (66,0 мг, 0,397 ммоль) и карбонат калия (1,10 г, 7,96 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (этилацетат, Rf = 0,1) с получением транс-метил-4-((3,7-диметил-2,6-диоксопурин-1-ил)метил)циклогексанкарбоксилата (800 мг, твердое вещество желтого цвета), выход: 60%.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 3,98 (s, 3H), 3,90-3,82 (m, 2H), 3,72 (s, 3H), 3,51 (s, 3H) 2,33-2,25 (m, 1H), 2,03-1,98 (m, 2H), 1,80-1,74 (m, 3H), 1,42-1,36 (m, 2H), 1,21-1,10 (m, 2H). MS-ESI: рассч. для[M+H]+ 335, обнаружено 335.
Этап 4
1-(Транс-4-ацетилциклогексилметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[174] Транс-метил-4-((3,7-диметил-2,6-диоксопурин-1-ил)метил)циклогексанкарбоновую кислоту (300 мг, 0,897 ммоль) и O,N-диметилгидроксиламина гидрохлорид (114 мг, 1,17 ммоль) растворяли в тетрагидрофуране (25 мл), добавляли метилмагния бромид (3 M эфирный раствор, 1,50 мл, 4,50 ммоль) при 0°C. Реакционный раствор медленно подогревали до комнатной температуры и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония (10 мл). Полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,4) с получением 1-(транс-4-ацетилциклогексилметил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (80,0 мг, масло желтого цвета), выход: 29%.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 3,98 (s, 3H), 3,92-3,84 (m, 2H), 3,55 (s, 3H), 2,42-2,33 (m, 1H), 2,15 (s, 3H), 1,98-1,88 (m, 2H), 1,85-1,75 (m, 3H), 1,32-1,10 (m, 4H). MS-ESI: рассч. для [M+H]+ 319, обнаружено 319.
Этап 5
3,7-Диметил-1-[[транс-4-(2,2,2-трифтор-1-гидрокси-1-метил-этил)циклогексил]метил]-1H-пурин-2,6(3H,7H)-дион
[175] 1-(Транс-4-ацетилциклогексилметил)-3,7-диметил-3,7-дигидропурин-2,6-дион (80,0 мг, 0,251 ммоль), фторид цезия (11,5 мг, 0,753 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (71,6 мг, 0,502 ммоль) при комнатной температуре и перемешивали в течение 12 часов. 1 н. соляную кислоту (10 мл) добавляли в реакционный раствор, который потом перемешивали при комнатной температуре в течение 1 часа, реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (50 мл). Полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. И далее очищали остаток посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-[[транс-4-(2,2,2-трифтор-1-гидрокси-1-метил-этил)циклогексил]метил]-1H-пурин-2,6(3H,7H)-диона (35,0 мг, твердое вещество желтого цвета), выход: 70%.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 3,98 (s, 3H), 3,88 (d, J = 6,8 Гц, 2H), 3,53 (s, 3H), 1,96-1,67 (m, 6H), 1,22 (s, 3H), 1,15-1,06 (m, 4H). MS-ESI: рассч. для [M+H]+ 389, обнаружено 389.
Вариант осуществления 20
3,7-Диметил-1-[транс-4-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)циклогексилметил]-3,7-дигидропурин-2,6-дион


Этап 1
3,7-Диметил-1-[транс-4-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)циклогексилметил]-3,7-дигидропурин-2,6-дион
[176] Транс-метил-4-((3,7-диметил-2,6-диоксопурин-1-ил)метил)циклогексанкарбоксилат (200 мг, 0,598 ммоль), фторид цезия (45,4 мг, 0,299 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (340 мг, 2,39 ммоль) при комнатной температуре и перемешивали в течение 12 часов. 1 н. соляную кислоту (10 мл) добавляли в реакционный раствор, который потом перемешивали при комнатной температуре в течение 1 часа, реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (50 мл). Полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. И далее очищали остаток посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-[транс-4-(2,2,2-трифтор-1-гидрокси-1-трифторметилэтил)циклогексилметил]-3,7-дигидропурин-2,6-диона (35,0 мг, твердое вещество желтого цвета), выход: 41%.
[177]1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 3,98 (s, 3H), 3,88 (d, J = 6,8 Гц, 2H), 3,53 (s, 3H), 2,08-1,79 (m, 6H), 1,30-1,24 (m, 2H), 1,11-1,08 (m, 2H). MS-ESI: рассч. для [M+H]+ 443, обнаружено 443.
Вариант осуществления 21
1-[[Транс-4-(1-гидроксициклопропил)циклогексил]метил]-3,7-диметилпурин-2,6-дион


Этап 1
1-[[Транс-4-(1-гидроксициклопропил)циклогексил]метил]-3,7-диметилпурин-2,6-дион
[178] Транс-метил-4-[(3,7-диметил-2,6-диоксопурин-1-ил)метил]циклогексанкарбоксилат (200 мг, 0,598 ммоль), тетраизопропилтитанат (340 мг, 1,20 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли этилмагния бромид (3 M эфирный раствор, 0,39 мл, 1,17 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония (50 мл). Полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-[[транс-4-(1-гидроксициклопропил)циклогексил)метил)-3,7-диметилпурин-2,6-диона (70,0 мг, твердое вещество желтого цвета), выход: 35%.
[179]1H ЯМР: (400 МГц, метанол-d4) δ 7,87 (s, 1H), 3,98 (s, 3H), 3,88 (d, J = 6,8 Гц, 2H), 3,53 (s, 3H), 1,79-1,71 (m, 5H), 1,29-1,07 (m, 5H), 0,60-0,57 (m, 2H), 0,42-0,39 (m, 2H). MS-ESI: рассч. для [M+H]+ 333, обнаружено 333.
Вариант осуществления 22
1-(2-(3-Этил-3-гидроксициклогексил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
2-(3-Этил-3-гидроксициклогексил)этилметансульфонат
[180] 1-Этил-3-(2-гидроксиэтил)циклогексанол (450 мг, 2,61 ммоль) и диизопропилэтиламин (500 мг, 3,92 ммоль) растворяли в дихлорметане (10 мл) и медленно добавляли метансульфохлорид (600 мг, 5,40 ммоль) при 0°C. Реакционный раствор перемешивали при 0°C в течение 0,5 часа. Реакционную смесь гасили посредством добавления воды и экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 10:1, Rf = 0,4) с получением продукта 2-(3-этил-3-гидроксициклогексил)этилметансульфоната (450 мг, масло желтого цвета), выход: 69%. MS-ESI: рассч. [M+H]+ 251, обнаружено 251.
Этап 2
1-(2-(3-Этил-3-гидроксициклогексил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[181] 2-(3-Этил-3-гидроксициклогексил)этилметансульфонат (200 мг, 0,790 ммоль), 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (144 мг, 0,790 ммоль) и карбонат калия (220 мг, 1,60 ммоль), йодид калия (13,1 мг, 0,0790 ммоль) растворяли в N,N-диметилформамид е (3 мл). Реакционный раствор нагревали до 130°C и перемешивали в течение 3 часов. Реакционный раствор охлаждали до 25°C, в который добавляли насыщенный солевой раствор, а затем экстрагировали этилацетатом (40 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1-(2-(3-этил-3-гидроксициклогексил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (70,0 мг, твердое вещество белого цвета), выход: 26%.1H ЯМР: (400 МГц, метанол-d4) δ 7,86 (s, 1H), 4,09-3,94 (m, 5H), 3,52 (s, 3H), 1,88-1,84 (m, 1H), 1,80-1,40 (m, 10H), 1,26-1,16 (m, 1H), 1,02-0,95 (m, 1H), 0,91 (t, J = 7,2 Гц, 3H). MS-ESI: рассч. для [M+H-18]+ 317, обнаружено 317.
Вариант осуществления 23


Этап 1
Этил-3-трифторметил-3-триметилсилилоксициклогексанкарбоксилат
[182] Этил-3-оксоциклогексанкарбоксилат (1,00 г, 5,88 ммоль), фторид цезия (446 мг, 2,94 ммоль) растворяли в тетрагидрофуране (30 мл), добавляли триметилтрифторметилсилан (1,67 г, 11,7 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл). Полученную в результате смесь экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (60 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением этил-3-трифторметил-3-триметилсилоксициклогексанкарбоксилата (1,40 г, масло желтого цвета), выход: 76%. MS-ESI: рассч. для [M+H]+ 313, обнаружено 313.
Этап 2
(3-Tрифторметил-3-триметилсиланилоксициклогексил)метанол
[183] Этил-3-трифторметил-3-триметилсилилоксициклогексанкарбоксилат (1,00 г, 3,20 ммоль) растворяли в тетрагидрофуране (10 мл) и добавляли тетрагидропиран лития (243 мг, 6,40 ммоль) при 0°C в течение 1 часа. Реакционную смесь гасили посредством добавления воды (10 мл). Полученную в результате смесь экстрагировали этилацетатом (20 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением (3-трифторметил-3-триметилсиланилоксициклогексил)метанола (800 мг, бесцветное масло), выход 92%. MS-ESI: рассч. для [M+H]+ 271, обнаружено 271.
Этап 3
[3-(Трифторметил)-3-триметилсилилоксициклогексил)метилметансульфонат
[184] (3-Tрифторметил-3-триметилсиланилоксициклогексил)метанол (850 мг, 3,14 ммоль) и триэтиламин (953 мг, 9,42 ммоль) растворяли в дихлорметане (15 мл), добавляли метансульфохлорид (719 мг, 6,28 ммоль) при 0°C. Реакционный раствор медленно подогревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь гасили посредством добавления водного раствора бикарбоната натрия (10 мл). Полученную в результате смесь экстрагировали дихлорметаном (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением [3-(трифторметил)-3-триметилсилилоксициклогексил)метилметансульфоната (900 мг, масло желтого цвета), выход: 82%.1H ЯМР: (400 МГц, метанол-d4) δ 4,36-4,32 (m, 1H), 4,17-4,13 (m, 1H), 3,08 (s, 3H), 2,12-1,60 (m, 9H), 0,16 (s, 9H). MS-ESI: рассч. для [M+H]+ 349, обнаружено 349.
Этап 4
3,7-Диметил-1-[[3-(трифторметил)-3-триметилсилилоксициклогексил]метил]пурин-2,6-дион
[185] [3-(Трифторметил)-3-триметилсилилоксициклогексил)метилметансульфонат (200 мг, 0,573 ммоль), 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (103 мг, 0,574 ммоль), йодид калия (28,6 мг, 0,172 ммоль) и карбонат калия (374 мг, 1,15 ммоль) растворяли в N,N-диметилформамиде (30 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали, фильтрат концентрировали при пониженном давлении, остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-[[3-(трифторметил)-3-триметилсилилоксициклогексил]метил]пурин-2,6-диона (150 мг, твердое вещество желтого цвета), выход: 60%.
[186] MS-ESI: рассч. для [M+H]+ 433, обнаружено 433.
Этап 5
[187] 3,7-Диметил-1-[[3-(трифторметил)-3-триметилсилилоксициклогексил]метил]пурин-2,6-дион (200 мг, 0,462 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли 1 н. соляную кислоту (10 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа, реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (50 мл). Реакционную смесь экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1 (10,0 мг, твердое вещество желтого цвета) (изомер 1, первый пик), выход: 6%.1H ЯМР: (400 МГц, метанол-d4) δ 7,87 (s, 1H), 3,97 (s, 3H), 3,89-3,83 (m, 2H), 3,52 (s, 3H), 2,23-2,22 (m, 1H), 1,76-1,07 (m, 8H). MS-ESI: рассч. для [M+H]+ 361, обнаружено 361.
[188] Продукт 2 (85,0 мг, твердое вещество желтого цвета) (изомер 2, второй пик), выход: 51%.1H ЯМР: (400 МГц, метанол-d4) δ 7,87 (s, 1H), 4,31-4,26 (m, 1H), 3,99-3,95 (m, 4H), 3,55 (s, 3H), 2,26-1,88 (m, 3H), 1,79-1,47 (m, 6H). MS-ESI: рассч. для [M+H]+ 361, обнаружено 361.
Вариант осуществления 24
1-((5-Гидрокси-5-(трифторметил)тетрагидро-2H-пиран-2-ил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
(3,4-Дигидро-2H-пиран-2-ил)метанол
[189] 3,4-Дигидро-2H-пиран-2-карбальдегид (3,00 г, 26,7 ммоль) растворяли в метаноле (20 мл), добавляли борогидрид натрия (2,02 г, 53,5 ммоль) при 0°C в течение 2 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония (30 мл). Полученную в результате смесь экстрагировали дихлорметаном (20 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением (3,4-дигидро-2H-пиран-2-ил)метанола (1,50 г, масло желтого цвета), выход: 49%.1H-ЯМР: (400 МГц, метанол-d4) δ 6,40 (d, J = 6,0 Гц, 1H), 4,71-4,68 (m, 1H), 3,86-3,83 (m, 1H), 3,82-3,61 (m, 2H), 2,13-2,12 (m, 1H), 2,10-2,08 (m, 1H), 2,02-2,01 (m, 1H), 1,68-1,63 (m, 1H).
Этап 2
(3,4-Дигидро-2H-пиран-2-ил)метилметансульфонат
[190] (3,4-Дигидро-2H-пиран-2-ил)метанол (1,50 г, 13,1 ммоль) и триэтиламин (2,66 г, 26,3 ммоль) растворяли в дихлорметане (20 мл) и добавляли метансульфохлорид (3,01 г, 26,3 ммоль) при 0°C. Реакционный раствор медленно подогревали до комнатной температуры и перемешивали в течение 2 часов. Hеакционную смесь гасили посредством добавления водного раствора бикарбоната натрия (10 мл). Полученную в результате смесь экстрагировали дихлорметаном (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением (3,4-дигидро-2H-пиран-2-ил)метилметансульфоната (1,70 г, масло желтого цвета), выход: 67%. MS-ESI: рассч. для [M+H]+ 193, обнаружено 193.
Этап 3
1-((3,4-Дигидро-2H-пиран-2-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[191] (3,4-Дигидро-2H-пиран-2-ил)метилметансульфонат (1,70 г, 8,84 ммоль), 3,7-диметил-1H-пурин-2,6-дион (1,59 г, 8,84 ммоль), йодид калия (146 мг, 0,884 ммоль) и карбонат калия (2,44 г, 17,7 ммоль) растворяли в N,N-диметилформамиде (50 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (этилацетат, Rf = 0,4) с получением 1-((3,4-дигидро-2H-пиран-2-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (1,30 г, твердое вещество желтого цвета), выход: 53%. MS-ESI: рассч. для [M+H]+ 277, обнаружено 277.
Этап 4
1-((5-Гидрокситетрагидро-2H-пиран-2-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[192] 1-((3,4-Дигидро-2H-пиран-2-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (600 мг, 2,17 ммоль) растворяли в тетрагидрофуране (30 мл) и добавляли диметилсульфид-боран (825 мг, 10,7 ммоль) при 0°C. Реакционный раствор медленно подогревали до комнатной температуры и перемешивали в течение 12 часов. Добавляли 3 н. водный раствор гидроксида натрия (30 мл) и перекись водорода (10 мл) и реакцию продолжали в течение 1 часа. Реакционную смесь гасили посредством добавления метанола (10 мл), промывали водным раствором тиосульфата натрия (30 мл) и экстрагировали дихлорметаном (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. И далее очищали остаток с помощью пластин для препаративной TLC (дихлорметан/метанол 20:1, Rf = 0,3) с получением 1-((5-гидрокситетрагидро-2H-пиран-2-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (130 мг, масло желтого цвета), выход: 20%.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 4,25-4,23 (m, 1H), 4,20 (s, 3H), 3,98-3,67 (m, 5H), 3,54 (s, 3H), 2,10-1,77 (m, 2H), 1,49-1,31 (m, 2H). MS-ESI: рассч. для [M+H]+ 295, обнаружено 295.
Этап 5
3,7-Диметил-1-((5-оксотетрагидро-2H-пиран-2-ил)метил)-1H-пурин-2,6-(3H,7H)-дион
[193] 1-((5-Гидрокситетрагидро-2H-пиран-2-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (130 мг, 0,441 ммоль) растворяли в дихлорметане (10 мл), добавляли перйодинан Десс-Мартина (138 мг, 1,33 ммоль), а затем подвергали реакции при 25°C в течение 3 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора тиосульфата натрия (20 мл), полученную в результате смесь экстрагировали дихлорметаном (10 мл × 3), органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью пластин для препаративной TLC (дихлорметан/метанол 20:1, Rf = 0,4) с получением 3,7-диметил-1-((5-оксотетрагидро-2H-пиран-2-ил)метил)-1H-пурин-2,6-(3H,7H)-диона (60,0 мг, твердое вещество желтого цвета), выход: 47%. MS-ESI: рассч. для [M+H]+ 293, обнаружено 293.
Этап 6
1-((5-Гидрокси-5-(трифторметил)тетрагидро-2H-пиран-2-ил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[194] 3,7-Диметил-1-((5-оксотетрагидро-2H-пиран-2-ил)метил)-1H-пурин-2,6-(3H,7H)-дион (60,0 мг, 0,205 ммоль), фторид цезия (6,24 мг, 0,0411 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (87,5 мг, 0,615 ммоль) при комнатной температуре и перемешивали в течение 5 часов. Добавляли 1 н. соляную кислоту (10 мл) и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (50 мл). Полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-((5-гидрокси-5-(трифторметил)тетрагидро-2H-пиран-2-ил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (15,0 мг, твердое вещество желтого цвета), выход: 30%.1H ЯМР: (400 МГц, метанол-d4) δ 8,28 (s, 1H), 4,39-4,10 (m, 2H), 4,05 (s, 3H), 3,93-3,89 (m, 2H), 3,55 (s, 3H), 3,32-3,27 (m, 1H), 1,89-1,65 (m, 4H). MS-ESI: рассч. для [M+H]+ 363, обнаружено 363.
Вариант осуществления 25
1-(4-(3-Гидроксипентан-3-ил)бензил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
Метил-4-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бензоат
[195] В атмосфере газообразного азота 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (180 мг, 1,00 ммоль), метил-4-(бромметил)бензоат (251 мг, 1,10 ммоль), йодид калия (55,0 мг, 0,33 ммоль) и карбонат калия (179 мг, 1,30 ммоль) растворяли в безводном N,N-диметилформамиде (4 мл) при 25°C, а затем нагревали до 110°C и перемешивали в течение 3 часов. После охлаждения до 25°C реакционную смесь разбавляли водой и экстрагировали этилацетатом (30 мл × 2). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством хроматографии на колонке с силикагелем (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением метил-4-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бензоата (300 мг, твердое вещество белого цвета), выход: 91%. MS-ESI: рассч. для [M+H]+ 329, обнаружено 329.
Этап 2
1-(4-(3-Гидроксипентан-3-ил)бензил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[196] Метил-4-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)бензоат (200 мг, 0,610 ммоль) растворяли в безводном тетрагидрофуране (3 мл). В атмосфере газообразного азота добавляли по каплям этилмагния бромид (3 M эфирный раствор, 1,2 мл, 3,60 ммоль) при -78°C. Реакционный раствор перемешивали при данной температуре в течение 0,5 часа и позволяли ему самопроизвольно нагреваться до 25°C в течение 1 часа, при этом реакцию продолжали в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония (5 мл) и полученную в результате смесь экстрагировали этилацетатом (30 мл × 2). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали с помощью пластин для препаративной TLC (петролейный эфир/этилацетат 1:3, Rf = 0,3) с получением 1-(4-(3-гидроксипентан-3-ил)бензил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (190 мг, твердое вещество белого цвета), выход: 87%.1H ЯМР: (400 МГц, метанол-d4) δ 7,85 (s, 1H), 7,32 (d, J = 8,0 Гц, 2H), 7,28 (d, J = 8,0 Гц, 2H), 5,25 (s, 2H), 3,96 (s, 3H), 3,52 (s, 3H), 1,82-1,72 (m, 4H), 0,69 (t, J = 7,2 Гц, 6H). MS-ESI: рассч. для [M+H]+ 357, обнаружено 357.
Вариант осуществления 26
3,7-Диметил-1-(3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
Этил-3-ацетилбензоат
[197] 3-Ацетилбензойную кислоту (500 мг, 3,05 ммоль) растворяли в N,N-диметилформамиде (20 мл), добавляли при комнатной температуре йодистый этил (475 мг, 3,05 ммоль) и карбонат калия (632 мг, 4,57 ммоль), после перемешивания при комнатной температуре в течение 2 часов реакционный раствор концентрировали и разбавляли этилацетатом (30 мл), органическую фазу промывали водой (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 5:1, Rf = 0,5) с получением этил-3-ацетилбензоата (530 мг, твердое вещество белого цвета), выход: 90%.1H ЯМР (400 МГц, CDCl3) δ 8,60 (s, 1H), 8,24 (d, J = 7,6 Гц, 1H), 8,15 (d, J = 7,6 Гц, 1H), 7,56 (t, J = 7,6 Гц, 1H), 4,41 (q, J = 7,2 Гц, 2H), 2,66 (s, 3H), 1,42 (t, J = 7,2 Гц, 3H). MS-ESI: рассч. для [M+H]+ 193, обнаружено 193.
Этап 2
Этил-3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензоат
[198] Этил-3-ацетилбензоат (500 мг, 2,60 ммоль) растворяли в тетрагидрофуране (20 мл), добавляли трифторметилтриметилсилан (370 мг, 2,60 ммоль) и фторид цезия (79,0 мг, 0,520 ммоль) при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре в течение 12 часов, разбавляли этилацетатом (30 мл), органическую фазу промывали водой (20 мл × 2), сушили безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 2:1, Rf = 0,5) с получением этил-3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензоата (600 мг, твердое вещество желтого цвета), выход: 88%.1H ЯМР: (400 МГц, CDCl3) δ 8,26 (s, 1H), 8,05 (d, J = 7,6 Гц, 1H), 7,80 (d, J = 7,6 Гц, 1H), 7,48 (t, J = 7,6 Гц, 1H), 4,39 (q, J = 7,2 Гц, 2H), 1,82 (s, 3H), 1,40 (t, J = 7,2 Гц, 3H). MS-ESI: рассч. для [M+H]+ 263, обнаружено 263.
Этап 3
1,1,1-Трифтор-2-(3-гидроксиметил)фенил)пропан-2-ол
[199] Этил-3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензоат (500 мг, 1,91 ммоль) растворяли в тетрагидрофуране (20 мл) и добавляли в реакционный раствор алюмогидрид лития (108 мг, 2,87 ммоль) при 0°C, смесь перемешивали при комнатной температуре в течение 2 часов, добавляли в реакционный раствор по отдельности воду (0,1 мл), 15% гидроксид натрия (0,1 мл) и воду (0,3 мл) и перемешивали в течение 20 минут. Реакционный раствор разбавляли этилацетатом (30 мл) и органическую фазу промывали водой (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1,1,1-трифтор-2-(3-гидроксиметил)фенил)пропан-2-ола (400 мг, твердое вещество желтого цвета), выход: 95%.
[200]1H-ЯМР: (400 МГц, CDCl3) δ 7,62 (s, 1H), 8,05 (d, J = 7,6 Гц, 1H), 7,41-7,37 (m, 2H), 4,73 (s, 2H), 1,80). MS-ESI: рассч. для [M+H]+ 221, обнаружено 221.
Этап 4
3-(1,1,1-Трифтор-2-гидроксипропан-2-ил)бензилметансульфонат
[201] 1,1,1-Трифтор-2-(3-гидроксиметил)фенил)пропан-2-ол (400 мг, 1,82 ммоль) и триэтиламин (275 мг, 2,72 ммоль) растворяли в дихлорметане (20 мл), добавляли в реакционный раствор метансульфохлорид (250 мг, 2,18 ммоль) при 0°C, перемешивали в течение 2 часов. Реакционный раствор разбавляли дихлорметаном (30 мл) и органическую фазу промывали водой (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензилметансульфоната (500 мг, масло желтого цвета), выход: 92%.
[202] MS-ESI: рассч. для [M+H]+ 299, обнаружено 299.
Этап 5
3,7-Диметил-1-(3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензил)-1H-пурин-2,6-(3H,7H)-дион
[203] 3-(1,1,1-Трифтор-2-гидроксипропан-2-ил)бензилметансульфонат (100 мг, 0,335 ммоль) и 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (60,0 мг, 0,335 ммоль) растворяли в N,N-диметилформамиде (20 мл), добавляли карбонат калия (70,0 мг, 0,502 ммоль) и йодид калия (6,00 мг, 0,0335 ммоль) при комнатной температуре, после перемешивания при 100°C в течение 2 часов реакционную смесь охлаждали и концентрировали, разбавляли этилацетатом (30 мл), органическую фазу промывали водой (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-(3-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензил)-1H-пурин-2,6-(3H,7H)-диона (30,0 мг, твердое вещество белого цвета), выход: 23%.1H ЯМР: (400 МГц, CDCl3) δ 7,90 (s, 1H), 7,70 (s, 1H), 7,49 (d, J = 7,6 Гц, 1H), 7,38-7,32 (m, 2H), 5,21 (s, 2H), 4,00 (s, 3H), 3,55 (s, 3H), 1,71 (s, 3H). MS-ESI: рассч. для [M+H]+ 383, обнаружено 383.
Вариант осуществления 27
3,7-Диметил-1-(4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)-1H-пурин-2,6(3H,7H)-дион


Этап 1
Метил-4-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензоат
[204] В атмосфере газообразного азота метил-4-ацетилбензоат (10,0 г, 56,1 ммоль) и триметил(трифторметил)силан (16,0 г, 112 ммоль) растворяли в безводном тетрагидрофуране (150 мл) при 0°C, медленно добавляли тетрабутиламмония фторид (22,0 г, 84,2 ммоль). Реакционную смесь медленно подогревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь гасили посредством добавления воды (50 мл). Полученную в результате смесь экстрагировали этилацетатом (50 мл × 3). Органические фазы объединяли, промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением продукта метил-4-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензоата (7,00 г, жидкость желтого цвета), выход: 50%.1H ЯМР: (400 МГц, CDCl3) δ 8,04 (d, J = 8,0 Гц, 2H), 7,68 (d, J = 8,0 Гц, 2H), 3,92 (s, 3H), 3,27 (s, 1H), 1,80 (s, 3H). MS-ESI: рассч. для [M+H]+ 249, обнаружено 249.
Этап 2
1,1,1-Трифтор-2-(4-(гидроксиметил)фенил)пропан-2-ол
[205] В атмосфере газообразного азота медленно добавляли алюмогидрид лития (1,61 г, 42,3 ммоль) к раствору метил-4-(1,1,1-трифтор-2-гидроксипропан-2-ил)бензоата (7,00 г, 28,2 ммоль) в тетрагидрофуране (150 мл). Реакционный раствор перемешивали при 0°C в течение 3 часов. Медленно добавляли последовательно воду (1,60 мл), 15% раствор гидроксида натрия (1,60 мл) и воду (4,80 мл) при 0°C. Фильтровали и фильтрат концентрировали при пониженном давлении с получением 1,1,1-трифтор-2-(4-(гидроксиметил)фенил)пропан-2-ола (2,40 г, жидкость желтого цвета), выход: 93%.1H-ЯМР: (400 МГц, CDCl3) δ 7,55 (d, J = 8,0 Гц, 2H), 7,34 (d, J = 8,0 Гц, 2H), 4,66 (s, 2H), 3,37 (s, 1H) (S, 1H), 1,75 (s, 3H). MS-ESI: рассч. для [M+H]+ 221, обнаружено 221.
Этап 3
4-(1,1,1-Трифтор-2-гидроксипропан-2-ил)фенилметансульфонат
[206] 1,1,1-Трифтор-2-(4-(гидроксиметил)фенил)пропан-2-ол (5,80 г, 26,3 ммоль) и диизопропилэтиламин (10,2 г, 79,0 ммоль) растворяли в дихлорметане (80 мл), медленно добавляли метансульфохлорид (4,53 г, 39,5 ммоль) при 0°C. Реакционный раствор перемешивали при 0°C в течение 0,5 часа. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония (50 мл) и экстрагировали дихлорметаном (20 мл × 3). Органические фазы объединяли, промывали насыщенным водным раствором бикарбоната натрия (50 мл), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 5:1, Rf = 0,4) с получением продукта 4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенилметансульфоната (3,45 г, масло желтого цвета), выход: 44%.1H ЯМР: (400 МГц, CDCl3) δ 7,66 (d, J = 8,0 Гц, 2H), 7,46 (d, J = 8,0 Гц, 2H), 5,26 (s, 2H), 2,96 (s, 3H), 2,84 (s, 1H), 1,80 (s, 3H). MS-ESI: рассч. для [M+H]+ 299, обнаружено 299.
Этап 4
3,7-Диметил-1-(4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)-1H-пурин-2,6(3H,7H)-дион
[207] 4-(1,1,1-Трифтор-2-гидроксипропан-2-ил)фенилметансульфонат (1,95 г, 10,8 ммоль), 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (652 мг, 3,62 ммоль), карбонат калия (2,99 г, 21,6 ммоль) и йодид калия (180 мг, 1,08 ммоль) растворяли в N,N-диметилформамиде (30 мл). Реакционный раствор нагревали до 130°C и перемешивали в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры, добавляли насыщенный солевой раствор (20 мл) и экстрагировали этилацетатом (100 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли и очищали продукт посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:2, Rf = 0,3) с получением 3,7-диметил-1-(4-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)-1H-пурин-2,6(3H,7H)-диона (1,27 г, твердое вещество белого цвета), выход: 31%.1H ЯМР: (400 МГц, CDCl3) δ 7,57-7,55 (m, 5H), 5,20 (s, 2H), 3,99 (s, 3H), 3,58 (s, 3H), 2,60 (s, 1H), 1,74(s, 3H). MS-ESI: рассч. для [M+H]+ 383, обнаружено 383.
Вариант осуществления 28


Этап 1
Метил-6-бромникотинат
[208] 6-Бромникотиновую кислоту (1,00 г, 4,95 ммоль) растворяли в N,N-диметилформамиде (30 мл), добавляли йодметан (0,703 г, 4,95 ммоль) и карбонат калия (1,03 г, 7,43 ммоль). Реакционный раствор перемешивали при 20°C в течение 12 часов. Реакционный раствор разбавляли водой (100 мл) и экстрагировали этилацетатом (30 мл × 3), органическую фазу сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 2:1, Rf = 0,5) с получением метил-6-бромникотината (1,00 г, твердое вещество белого цвета), выход: 94%. MS-ESI: рассч. для [M+H]+ 216 и 218, обнаружено 216 и 218.
Этап 2
(6-Бромпиридин-3-ил)метанол
[209] Метил-6-бромникотинат (1,00 г, 4,63 ммоль) растворяли в тетрагидрофуране (20 мл), добавляли алюмогидрид лития (351 мг, 9,26 ммоль) при 0°C и подвергали реакции в течение 1 часа. Реакционную смесь гасили посредством добавления воды (10 мл). Смесь экстрагировали этилацетатом (20 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением (6-бромпиридин-3-ил)метанола (600 мг, масло желтого цвета), выход: 69%. MS-ESI: рассч. для [M+H]+ 188 и 190, обнаружено 188 и 190.
Этап 3
(6-Бромпиридин-3-ил)метилметансульфонат
[210] (6-Бромпиридин-3-ил)метанол (1,00 г, 5,32 ммоль) и триэтиламин (1,18 г, 11,6 ммоль) растворяли в дихлорметане (20 мл) и добавляли метансульфохлорид (1,38 г, 12,0 ммоль) при 0°C. Реакционный раствор перемешивали при комнатной температуре в течение 2 часов, разбавляли дихлорметаном (20 мл), промывали насыщенным водным раствором бикарбоната натрия (30 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 4:1, Rf = 0,5) с получением (6-бромпиридин-3-ил)метилметансульфоната (1,20 г, бесцветное масло), выход: 85%. MS-ESI: рассч. для [M+H]+ 266 и 268, обнаружено 266 и 268.
Этап 4
1-((6-Бромпиридин-3-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[211] (6-Бромпиридин-3-ил)метилметансульфонат (500 мг, 1,88 ммоль) растворяли в N,N-диметилформамиде (20 мл), добавляли в реакционный раствор 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (338 мг, 1,88 ммоль), карбонат калия (389 мг, 2,82 ммоль) и йодид калия (184 мг, 1,11 ммоль) при комнатной температуре. Реакционный раствор нагревали до 100°C и подвергали реакции в течение 2 часов, потом разбавляли этилацетатом (20 мл) и органическую фазу промывали насыщенным водным раствором бикарбоната натрия (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением 1-((6-бромпиридин-3-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (300 мг, твердое вещество желтого цвета), выход: 46%. MS-ESI: рассч. для [M+H]+ 350 и 352, обнаружено 350 и 352.
Этап 5
1-((6-Ацетилпиридин-3-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[212] 1-((6-Бромпиридин-3-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион (2,00 г, 5,71 ммоль) растворяли в 1,4-диоксане (50 мл), добавляли в реакционный раствор трибутил(1-этоксивинил)станнан (8,25 г, 22,8 ммоль) и тетракис(трифенилфосфин)палладий (329 мг, 0,285 ммоль) при комнатной температуре. Реакционный раствор нагревали до 120°C и перемешивали в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры, разбавляли этилацетатом (70 мл), промывали насыщенным водным раствором бикарбоната натрия (20 мл) (30 мл × 2), сушили над безводным сульфатом натрия, фильтровали, концентрировали, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 3:1, Rf = 0,3) с получением 1-((6-ацетилпиридин-3-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (1,00 г, твердое вещество желтого цвета), выход: 56%.1H ЯМР: (400 МГц, CDCl3) δ 8,83 (s, 1H), 8,00-7,98 (m, 1H), 7,95-7,93 (m, 1H), 7,54 (s, 1H), 5,27 (s, 2H) 4,01 (s, 3H), 3,59 (s, 3H), 2,71 (s, 3H). MS-ESI: рассч. для [M+H]+ 314, обнаружено 314.
Этап 6
3,7-Диметил-1-((6-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиридин-3-ил)-1H-пурин-2,6(3H,7H)-дион
[213] 1-((6-Ацетилпиридин-3-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион (150 мг, 0,478 ммоль) растворяли в тетрагидрофуране (30 мл), добавляли трифторметилтриметилсилан (102 мг, 0,718 ммоль) и фторид цезия (73,0 мг, 0,478 ммоль) при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре в течение 12 часов, добавляли тетрабутиламмония фторид (50,0 мг, 0,207 ммоль), после перемешивания при комнатной температуре в течение 30 минут реакционную смесь разбавляли этилацетатом (20 мл) и органическую фазу промывали насыщенным водным раствором бикарбоната натрия (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении, а остаток очищали посредством высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-((6-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиридин-3-ил)-1H-пурин-2,6(3H,7H)-диона (50 мг, твердое вещество белого цвета), выход: 27%.1H ЯМР: (400 МГц, CDCl3) δ 8,76 (s, 1H), 7,99 (d, J = 8,0 Гц, 1H), 7,53 (s, 1H), 7,44 (d, J = 8,0 Гц, 1H), 5,23 (s, 2H), 3,99 (s, 3H), 3,58 (s, 3H), 1,68 (s, 3H). MS-ESI: рассч. для [M+H]+ 384, обнаружено 384.
Вариант осуществления 29
3,7-Диметил-1-(([[5-(2,2,2-трифтор-1-гидрокси-1-метилэтил)-2-пиридил]метил]-дион

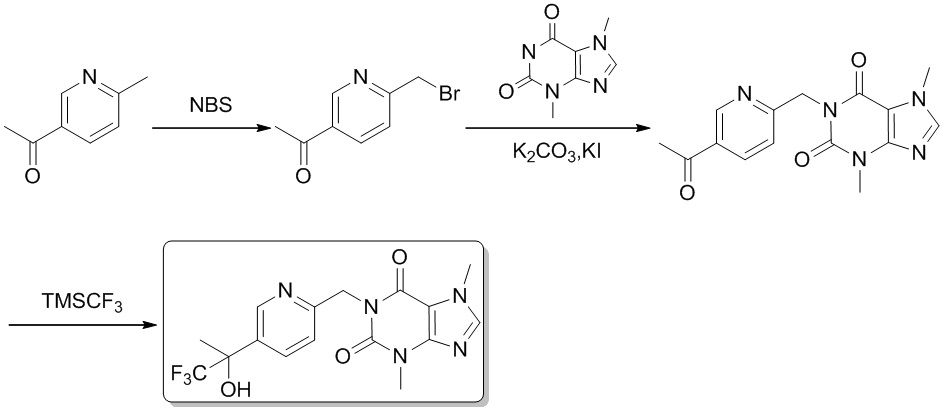
Этап 1
1-(6-(Бромметил)-3-пиридил)этанон
[214] 1-(6-Метил-3-пиридил)этанон (500 мг, 3,70 ммоль), N-бромсукцинимид (658 мг, 3,70 ммоль), Ошибка! Недопустимый объект гиперссылки. (182 мг, 1,11 ммоль) растворяли в четыреххлористом углероде (20 мл), что подвергали реакции при 90°C в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора тиосульфата натрия (30 мл). Смесь экстрагировали дихлорметаном (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-[6-(бромметил)-3-пиридил]этанона (125 мг, масло желтого цвета), выход: 16%. MS-ESI: рассч. для [M+H]+ 214, 216, обнаружено 214, 216.
Этап 2
1-((5-Ацетил-2-пиридил)метил)-3,7-диметилпурин-2,6-дион
[215] 1-(6-(Бромметил)-3-пиридил)этанон (100 мг, 0,467 ммоль), 3,7-диметилпурин-2,6-дион (84,2 мг, 0,467 ммоль), йодид калия (7,70 мг, 0,0467 ммоль) и карбонат калия (194 мг, 1,40 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,3) с получением 1-((5-ацетил-2-пиридил)метил)-3,7-диметилпурин-2,6-диона (50,0 мг, твердое вещество желтого цвета), выход: 34%. MS-ESI: рассч. для [M+H]+ 314, обнаружено 314.
Этап 3
3,7-Диметил-1-[[5-(2,2,2-трифтор-1-гидрокси-1-метилэтил)-2-пиридил]метил]пурин-2,6-дион
[216] 1-((5-Ацетил-2-пиридил)метил)-3,7-диметилпурин-2,6-дион (50,0 мг, 0,159 ммоль), фторид цезия (24,2 мг, 0,159 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (113 мг, 0,798 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл). Полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-[[5-(2,2,2-трифтор-1-гидрокси-1-метилэтил)-2-пиридил]метил]пурин-2,6-диона (10,0 мг, твердое вещество желтого цвета), выход: 16%.1H ЯМР: (400 МГц, метанол-d4) δ 8,96 (s, 1H), 8,75 (d, J = 8,0 Гц, 1H), 8,06 (d, J = 8,0 Гц, 1H), 7,97 (s, 1H), 5,55 (s, 2H), 4,00 (s, 3H), 3,57 (s, 3H), 1,86 (s, 3H). MS-ESI: рассч. для [M+H]+ 384, обнаружено 384.
Вариант осуществления 30
3,7-Диметил-1-((5-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиразин-2-ил)-пурин-2,6(3H,7H)-дион


Этап 1
N-метокси-N,5-диметилпиразин-2-карбоксамид
[217] 5-Метилпиразин-2-карбоновую кислоту (2,00 г, 14,5 ммоль), 1-гидроксибензотриазол (391 мг, 2,90 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (1,69 г, 17,4 ммоль) растворяли в безводном дихлорметане (10 мл) и трихлорметане (30 мл), в атмосфере газообразного азота медленно добавляли триэтиламин (1,76 г, 17,4 ммоль) при 0°C и реакционную смесь перемешивали при 25°C в течение 12 часов. Реакционную смесь гасили посредством добавления воды (50 мл). Полученную в результате смесь экстрагировали этилацетатом (50 мл × 3) и органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 20:1, Rf = 0,1) с получением N-метокси-N,5-диметилпиразин-2-карбоксамида (2,00 г, масло желтого цвета), выход: 76%.1H ЯМР: (400 МГц, CDCl3) δ 8,80 (s, 1H), 8,45 (s, 1H), 3,73 (s, 3H), 3,40 (s, 3H), 2,61 (s, 3H).
Этап 2
1-(5-Метилпиразин-2-ил)этанон
[218] N-метокси-N,5-диметилпиразин-2-карбоксамид (1,50 г, 8,28 ммоль) растворяли в тетрагидрофуране (30 мл), добавляли метилмагния бромид (3 M эфирный раствор, 13,3 мл, 39,9 ммоль) при 0°C с последующим перемешиванием при 25°C в течение 1 часа. Смесь охлаждали до 0°C и реакционную смесь гасили посредством добавления воды (10 мл). Смесь экстрагировали этилацетатом (30 мл × 3), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 20:1, Rf = 0,2) с получением 1-(5-метилпиразин-2-ил)этанона (700 мг, масло желтого цвета), выход: 62%. MS-ESI: рассч. для [M+H]+ 137, обнаружено 137.
Этап 3
1-(5-(Бромметил)пиразин-2-ил)этанон
[219] 1-(5-Метилпиразин-2-ил)этанон (700 мг, 5,14 ммоль) растворяли в четыреххлористом углероде (20 мл), а затем добавляли азобисизобутиронитрил (169 мг, 1,03 ммоль) и N-бромсукцинимид (1,14 г, 6,43 ммоль). Реакционный раствор подвергали реакции при 100°C в атмосфере газообразного азота в течение 5 часов. Реакционную смесь непосредственно фильтровали и концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 20:1, Rf = 0,5) с получением 1-(5-(бромметил)пиразин-2-ил)этанона (300 мг, масло желтого цвета), выход: 27%. MS-ESI: рассч. для [M+H]+ 215 и 217, обнаружено 215 и 217.
Этап 4
1-((5-Ацетилпиразин-2-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[220] 1-(5-(Бромметил)пиразин-2-ил)этанон (300 мг, 1,40 ммоль), 3,7-диметил-1H-пурин-2,6(3H,7H)-дион (251 мг, 1,40 ммоль), йодид калия (23,2 мг, 0,140 ммоль) и карбонат калия (578 мг, 4,19 ммоль) растворяли в безводном N,N-диметилформамиде (20 мл). Реакционный раствор нагревали до 120°C и подвергали реакции в течение 3 часов. Реакционный раствор охлаждали до 20°C, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (этилацетат, Rf = 0,3) с получением 1-((5-ацетилпиразин-2-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (300 мг, твердое вещество желтого цвета), выход: 68%. MS ESI рассч. для [M+H]+ 315, обнаружено 315.
Этап 5
3,7-Диметил-1-((5-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиразин-2-ил)-1H-пурин-2,6(3H,7H)-дион
[221] 1-((5-Ацетилпиразин-2-ил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион (300 мг, 0,954 ммоль), фторид цезия (14,5 мг, 0,0954 ммоль) растворяли в безводном тетрагидрофуране (10 мл). Потом добавляли триметилсилилтрифторметил (407 мг, 2,86 ммоль). В атмосфере газообразного азота реакционный раствор подвергали реакции при 25°C в течение 2 часов. Потом добавляли соляную кислоту (4 н, 4 мл). В атмосфере газообразного азота смесь подвергали реакции при комнатной температуре в течение 1 часа. Реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (10 мл), полученную в результате смесь экстрагировали этилацетатом (10 × 3 мл), органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением 3,7-диметил-1-((5-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиразин-2-ил)-1H-пурин-2,6(3H,7H)-диона (100 мг, твердое вещество белого цвета), выход: 40%.1H ЯМР: (400 МГц, метанол-d4) δ 8,85 (s, 1H), 8,65 (s, 1H), 7,92 (s, 1H), 5,40 (s, 2H), 3,99 (s, 3H), 3,56 (s, 3H), 1,78 (s, 3H). MS ESI рассч. для [M+H]+ 385, обнаружено 385.
Вариант осуществления 31
1-((3-(1,1,1,3,3,3-Гексафтор-2-гидроксипропан-2-ил)изоксазол-5-ил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
Метил-5-(бромметил)изоксазол-3-карбоксилат
[222] Сложный этиловый эфир метил-5-метилизоксазол-3-карбоновой кислоты (5,00 г, 35,4 ммоль), N-бромсукцинимид (6,31 г, 35,4 ммоль), пероксид бензоила (858 мг, 3,54 ммоль) растворяли в четыреххлористом углероде (20 мл), что потом подвергали реакции при 80°C в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора тиосульфата натрия (30 мл). Смесь экстрагировали дихлорметаном (20 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 3:1, Rf = 0,5) с получением сложного этилового эфира метил-5-(бромметил)изоксазол-3-карбоновой кислоты (2,00 г, масло желтого цвета), выход: 26%.1H ЯМР: (400 МГц, метанол-d4) δ 6,88 (s, 1H), 4,73 (s, 2H), 3,97 (s, 3H). MS-ESI: рассч. для [M+H]+ 220, 222, обнаружено 220, 222.
Этап 2
Метил-5-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)карбоксилат
[223] Этил-5-(бромметил)изоксазол-3-карбоксилат (2,00 г, 9,09 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (1,64 г, 9,09 ммоль), йодид калия (151 мг, 0,909 ммоль) и карбонат калия (2,51 г, 18,2 ммоль) растворяли в N,N-диметилформамиде (50 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Потом реакционную смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (этилацетат, Rf = 0,4) с получением метил-5-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)карбоксилата (1,70 г, твердое вещество желтого цвета), выход: 59%.1H ЯМР: (400 МГц, метанол-d4) δ 8,06 (s, 1H), 6,82 (s, 1H), 5,22 (s, 2H), 3,87 (s, 3H), 3,83 (s, 3H), 3,45 (s, 3H). MS-ESI: рассч. для [M+H]+ 320, обнаружено 320.
Этап 3
1-((3-(1,1,1,3,3,3-Гексафтор-2-гидроксипропан-2-ил)изоксазол-5-ил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[224] Метил-5-((3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)метил)карбоксилат (200 мг, 0,626 ммоль), фторид цезия (95,0 мг, 0,626 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (445 мг, 3,13 ммоль) при комнатной температуре и полученную в результате смесь перемешивали в течение 12 часов. Добавляли 1 н. соляную кислоту (10 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (50 мл). Смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-((3-(1,1,1,3,3,3-гексафтор-2-гидроксипропан-2-ил)изоксазол-5-ил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (10,0 мг, твердое вещество желтого цвета), выход: 4%.1H ЯМР: (400 МГц, метанол-d4) δ 7,95 (s, 1H), 6,52 (s, 1H), 5,37 (s, 2H), 4,00 (s, 3H), 3,57 (s, 3H). MS-ESI: рассч. для [M+H]+ 428, обнаружено 428.
Вариант осуществления 32
3,7-Диметил-1-((3-(1,1,1-трифтор-2-гидроксипропан-2-ил)изоксазол-5-ил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
1-(5-Метилизоксазол-3-ил)этанон
[225] Метил-5-метилизоксазол-3-карбоксилат (5,00 г, 35,4 ммоль) и триэтиламин (21,5 г, 213 ммоль) растворяли в тетрагидрофуране (80 мл), добавляли метилмагния бромид (3 M эфирный раствор, 35 мл, 105 ммоль) при 0°C, полученную в результате смесь подвергали реакции в течение 3 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония (30 мл). Смесь экстрагировали этилацетатом (30 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 3:1, Rf = 0,7) с получением 1-(5-метилизоксазол-3-ил)этанона (1,00 г, масло желтого цвета), выход: 23%.1H ЯМР: (400 МГц, метанол-d4) δ 6,39 (s, 1H), 2,58 (s, 3H), 2,49 (s, 3H). MS-ESI: рассч. для [M+H]+ 126, обнаружено 126.
Этап 2
1-(5-(Бромметил)изоксазол-3-ил)этанон
[226] 1-(5-Метилизоксазол-3-ил)этанон (100 мг, 0,799 ммоль), N-бромсукцинимид (142 мг, 0,799 ммоль), пероксид бензоила (19,3 г, 0,0800 ммоль) растворяли в четыреххлористом углероде (10 мл), что потом подвергали реакции при 90°C в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного раствора тиосульфата натрия (30 мл). Смесь экстрагировали дихлорметаном (10 мл x 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-(5-(бромметил)изоксазол-3-ил)этанона (150 мг, масло желтого цвета), выход: 93%. MS-ESI: рассч. для [M+H]+ 204 и 206, обнаружено 204 и 206.
Этап 3
1-((3-Ацетилизоксазол-5-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[227] 1-(5-(Бромметил)изоксазол-3-ил)этанон (150 мг, 0,735 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (132 мг, 0,735 ммоль), йодид калия (61,0 мг, 0,367 ммоль) и карбонат калия (305 мг, 2,21 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали, фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,3) с получением 1-((3-ацетилизоксазол-5-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (50,0 мг, твердое вещество желтого цвета), выход: 22%. MS-ESI: рассч. для [M+H]+ 304, обнаружено 304.
Этап 4
3,7-Диметил-1-((3-(1,1,1-трифтор-2-гидроксипропан-2-ил)изоксазол-5-ил)-1H-пурин-2,6-(3H,7H)-дион
[228] 1-[(3-Ацетилизоксазол-5-ил)метил]-3,7-диметилпурин-2,6-(3H,7H)-дион (50,0 мг, 0,164 ммоль), фторид цезия (25,0 мг, 0,164 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (70,3 мг, 0,494 ммоль) при комнатной температуре и полученную в результате смесь перемешивали в течение 12 часов. Добавляли 1 н. соляную кислоту (10 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа, реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (50 мл). Потом смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. И далее очищали остаток посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-((3-(1,1,1-трифтор-2-гидроксипропан-2-ил)изоксазол-5-ил)-1H-пурин-2,6-(3H,7H)-диона (22,0 мг, твердое вещество желтого цвета), выход: 36%.1H ЯМР: (400 МГц, метанол-d4) δ 7,98 (s, 1H), 6,48 (s, 1H), 5,33 (s, 2H), 4,01 (s, 3H), 3,57 (s, 3H), 1,71 (s, 3H). MS-ESI: рассч. для [M+H]+ 374, обнаружено 374.
Вариант осуществления 33
3,7-Диметил-1-((2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
1-(4-(Бромметил)тиазол-2-ил)этанон
[229] 1-(4-Метилтиазол-2-ил)этанон (200 мг, 1,42 ммоль), N-бромсукцинимид (252 мг, 1,42 ммоль) и азобисизобутиронитрил (46,6 мг, 0,284 ммоль) растворяли в четыреххлористом углероде (20 мл), что потом подвергали реакции при 80°C в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора тиосульфата натрия (30 мл). Смесь экстрагировали дихлорметаном (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-(4-(бромметил)тиазол-2-ил)этанона (200 мг, масло желтого цвета), выход: 64%.1H ЯМР: (400 МГц, метанол-d4) δ 7,97 (s, 1H), 4,73 (s, 2H), 2,66 (s, 3H). MS-ESI: рассч. для [M+H]+ 220, 222, обнаружено 220, 222.
Этап 2
1-((2-Ацетилтиазол-4-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[230] 1-(4-(Бромметил)тиазол-2-ил)этанон (100 мг, 0,454 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (81,9 мг, 0,454 ммоль), йодид калия (7,50 мг, 0,0454 ммоль) и карбонат калия (125 мг, 0,908 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов, потом охлаждали до комнатной температуры, фильтровали, фильтрат концентрировали при пониженном давлении и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,3) с получением 1-((2-ацетилтиазол-4-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (80,0 мг, твердое вещество желтого цвета), выход: 55%.1H ЯМР: (400 МГц, метанол-d4) δ 7,92 (s, 1H), 7,73 (s, IH), 5,38 (s, 2H), 4,00 (s, 3H), 3,57 (s, 3H) 2,64 (s, 3H). MS-ESI: рассч. для [M+H]+ 320, обнаружено 320.
Этап 3
3,7-Диметил-1-((2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)-метил-1H-пурин-2,6-(3H,7H)-дион
[231] 1-((2-Ацетилтиазол-4-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (200 мг, 0,626 ммоль), фторид цезия (95,0 мг, 0,626 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (267 мг, 1,88 ммоль) при комнатной температуре и перемешивали в течение 12 часов. реакционную смесь гасили посредством добавления воды (20 мл), полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. И далее очищали остаток посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-((2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)-метил-1H-пурин-2,6-(3H,7H)-диона (100 мг, твердое вещество желтого цвета), выход: 41%.1H ЯМР: (400 МГц, метанол-d4) δ 8,10 (s, 1H), 7,33 (s, 1H), 5,32 (s, 2H), 4,03 (s, 3H), 3,57 (s, 3H), 1,80 (s, 3H). MS-ESI: рассч. для [M+H]+ 390, обнаружено 390.
Вариант осуществления 34
3,7-Диметил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)-метил-1H-пурин-2,6-(3H,7H)-дион

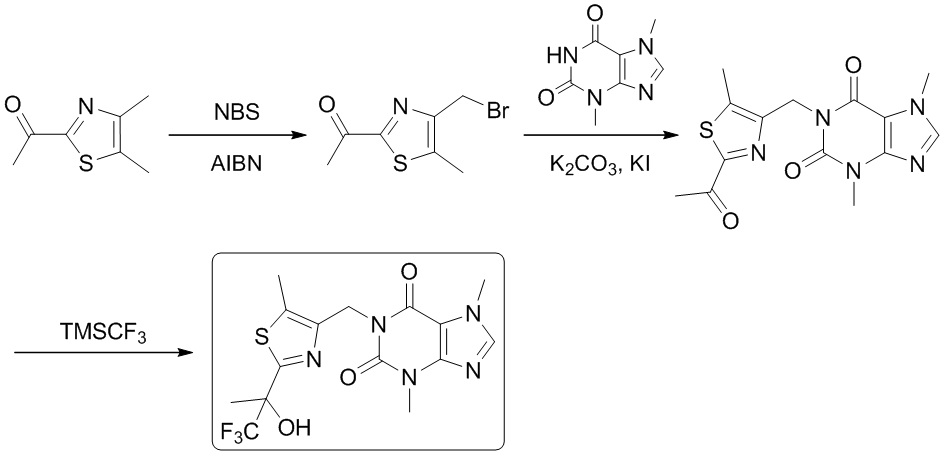
Этап 1
1-(4-(Бромметил)-5-метилтиазол-2-ил)этанон
[232] 1-(4,5-Диметилпиридин-2-ил)этанон (200 мг, 1,29 ммоль), N-бромсукцинимид (229 мг, 1,29 ммоль), азобисизобутиронитрил (21,1 мг, 0,129 ммоль) растворяли в четыреххлористом углероде (10 мл), что потом подвергали реакции при 80°C в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора тиосульфата натрия (30 мл). Смесь экстрагировали дихлорметаном (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-(4-(бромметил)-5-метилтиазол-2-ил)этанона (200 мг, масло желтого цвета), выход: 66%.1H ЯМР: (400 МГц, метанол-d4) δ 4,88 (s, 2H), 2,65 (s, 3H), 2,47 (s, 3H). MS-ESI: рассч. для [M+H]+ 234, 236, обнаружено 234, 236.
Этап 2
1-((2-Ацетил-5-метилтиазол-4-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[233] 1-(4-(Бромметил)-5-метилтиазол-2-ил)этанон (500 мг, 0,854 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (154 мг, 0,854 ммоль), йодид калия (14,0 мг, 0,0854 ммоль) и карбонат калия (354 мг, 2,56 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Потом реакционную смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,3) с получением 1-((2-ацетил-5-метилтиазол-4-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (200 мг, твердое вещество желтого цвета), выход: 70%.1H ЯМР: (400 МГц, метанол-d4) δ 7,90 (s, 1H), 5,35 (s, 2H), 4,00 (s, 3H), 3,55 (s, 3H), 2,66 (s, 3H), 2,61 (s, 3H). MS-ESI: рассч. для [M+H]+ 334, обнаружено 334.
Этап 3
3,7-Диметил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-дион
[234] 1-((2-Ацетил-5-метилтиазол-4-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (80,0 мг, 0,240 ммоль), фторид цезия (18,2 мг, 0,120 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (102 мг, 0,720 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл), экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. И далее очищали остаток посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-диона (35,0 мг, твердое вещество желтого цвета), выход: 36%.1H ЯМР: (400 МГц, метанол-d4) δ 8,27 (s, 1H), 5,36 (s, 2H), 4,06 (s, 3H), 3,57 (s, 3H), 2,73 (s, 3H), 1,90 (s, 3H). MS-ESI: рассч. для [M+H]+ 404, обнаружено 404.
Вариант осуществления 35
3,7-Диметил-1-((2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-5-ил)метил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
1-(5-Метилтиазол-2-ил)этилциклогексанон
[235] 5-Метилтиазол (2,00 г, 20,2 ммоль) растворяли в тетрагидрофуране (50 мл), в атмосфере газообразного азота медленно добавляли по каплям н-бутиллитий (2,5 M раствор тетрагидрофурана, 9,68 мл, 24,2 ммоль) при -78°C. Реакционную смесь перемешивали при -78°C в течение 0,5 часа и медленно добавляли по каплям раствор N-метокси-N-метилацетамида (2,50 г, 24,2 ммоль) в тетрагидрофуране (1 мл). Реакционный раствор подогревали до 0°C и перемешивали в течение 1,5 часа. Медленно добавляли в реакционный раствор воду (10 мл) при 0°C и полученную в результате смесь экстрагировали этилацетатом (30 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и перегоняли при пониженном давлении. Получаемый в результате продукт очищали с помощью пластин для высокоэффективной препаративной хроматографии (петролейный эфир/этилацетат 1:1, Rf = 0,7) с получением продукта 1-(5-метилтиазол-2-ил)этилциклогексанона (1,45 г, твердое вещество желтого цвета), выход: 51%.1H ЯМР: (400 МГц, метанол-d4) δ 7,73 (s, 1H), 2,61 (s, 3H), 2,57 (s, 3H). MS-ESI: рассч. для [M+H]+ 142, обнаружено 142.
Этап 2
1-(5-(Бромметил)тиазол-2-ил)этилциклогексанон
[236] 1-(5-Метилтиазол-2-ил)этилциклогексанон (200 мг, 1,42 ммоль) и азоизобутиронитрил (2,33 мг, 0,0142 ммоль) растворяли в хлороформе (5 мл), добавляли бромсукцинимид (252 мг, 1,42 ммоль) при комнатной температуре. Реакционную смесь нагревали до 78°C и перемешивали в течение 16 часов. Реакционный раствор охлаждали до комнатной температуры, медленно добавляли воду (30 мл) и полученную в результате смесь экстрагировали хлороформом (30 мл × 3). Органические фазы объединяли и сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта 1-(5-(бромметил)тиазол-2-ил)этилциклогексанона (290 мг, масло желтого цвета). MS-ESI: рассч. для [M+H]+ 220 и 222, обнаружено 220 и 222.
Этап 3
1-((2-Ацетилтиазол-5-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[237] 1-(5-(Бромметил)тиазол-2-ил)этилциклогексанон (290 мг, 1,05 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (284 мг, 1,58 ммоль) и йодид калия (17,5 мг, 0,105 ммоль) растворяли в N,N-диметилформамиде (5 мл), добавляли карбонат калия (437 мг, 3,16 ммоль) и полученную в результате смесь подвергали реакции при 130°C в течение 2,5 часов. Реакционный раствор охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении, получаемый в результате продукт очищали с помощью пластин для высокоэффективной препаративной хроматографии (этилацетат, Rf = 0,4) с получением продукта 1-((2-ацетилтиазол-5-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (292 мг, твердое вещество желтого цвета), выход: 87%. MS-ESI: рассч. для [M+H]+ 320, обнаружено 320.
Этап 4
3,7-Диметил-1-((2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-5-ил)метил)-1H-пурин-2,6-(3H,7H)-дион
[238] 1-((2-Ацетилтиазол-5-ил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (280 мг, 0,438 ммоль) и фторид цезия (6,66 мг, 0,0438 ммоль) растворяли в тетрагидрофуране (6 мл), в атмосфере газообразного азота добавляли медленно трифторметилтриметилсилан (75,0 мг, 0,500 ммоль). Реакционную смесь перемешивали при 25°C в течение 1,5 часов. После добавления 4 н водного раствора соляной кислоты (0,2 мл) и перемешивания в течение получаса при комнатной температуре показатель рН реакционной смеси доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия (10 мл), добавляли воду (20 мл) и смесь экстрагировали этилацетатом (50 мл × 3), органическую фазу сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, неочищенный продукт очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 3,7-диметил-1-((2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-5-ил)метил)-1H-пурин-2,6-(3H,7H)-диона (32,0 мг, твердое вещество белого цвета), выход: 19%.1H ЯМР: (400 МГц, метанол-d4) δ 7,89 (s, 1H), 7,82 (s, 1H), 5,35 (s, 2H), 4,00 (s, 3H), 3,56 (s, 3H), 1,76 (s, 3H). MS-ESI: рассч. для [M+H]+ 390, обнаружено 390.
Вариант осуществления 36
3,7-Диметил-1-(2-(4-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-5-ил)этил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
1-(5-(2-Гидроксиэтил)-4-метилтиазол-2-ил)этанон
[239] 2-(4-Метилтиазол-5-ил)этанол (500 мг, 3,49 ммоль) растворяли в тетрагидрофуране (100 мл), добавляли н-бутиллитий (3 M раствор н-гексана, 2,33 мл, 6,98 ммоль) при -78°C, после проведения реакции в течение получаса в реакционную смесь добавляли N-метокси-N-метилацетамид (432 мг, 4,19 ммоль), перемешивание продолжали в течение 3 часов. Hеакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония (50 мл), экстрагировали этилацетатом (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 5:1, Rf = 0,1) с получением 1-(5-(2-гидроксиэтил)-4-метилтиазол-2-ил)этанона (200 мг, масло желтого цвета), выход: 31%.1H ЯМР: (400 МГц, CDCl3) δ 3,78 (t, J = 6,4 Гц, 2H), 3,18 (t, J = 6,4 Гц, 2H), 2,67 (s, 3H), 2,47 (s, 3H). MS-ESI: рассч. для [M+H]+ 186, обнаружено 186.
Этап 2
2-(2-Ацетил-4-метилтиазол-5-ил)этилметансульфонат
[240] 1-(5-(2-Гидроксиэтил)-4-метилтиазол-2-ил)этанон (120 мг, 0,647 ммоль) и триэтиламин (196 мг, 1,94 ммоль) растворяли в дихлорметане (10 мл), добавляли метансульфохлорид (148 мг, 1,30 ммоль) при 0°C. Реакционный раствор медленно подогревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь гасили посредством добавления водного раствора бикарбоната натрия (50 мл), экстрагировали дихлорметаном (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC (петролейный эфир/этилацетат 1:1, Rf = 0,5) с получением 2-(2-ацетил-4-метил-тиазол-5-ил)этилметансульфоната (150 мг, масло желтого цвета), выход: 88%.1H-ЯМР (400 МГц, CDCl3) δ 4,41 (t, J = 6,4 Гц, 2H), 3,27 (t, J = 6,4 Гц, 2H), 3,01 (s, 3H), 2,67 (s, 3H), 2,46 (s, 3H). MS-ESI: рассч. для [M+H]+ 264, обнаружено 264.
Этап 3
1-(2-(2-Ацетил-4-метилтиазол-5-ил)этил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион
[241] 2-(2-Ацетил-4-метилтиазол-5-ил)этилметансульфонат (150 мг, 0,569 ммоль), 3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (102 мг, 0,569 ммоль), йодид калия (18,9 мг, 0,114 ммоль) и карбонат калия (236 мг, 1,71 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Потом смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении. И далее выделяли остаток и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,5) с получением 1-(2-(2-ацетил-4-метилтиазол-5-ил)этил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (30,0 мг, твердое вещество желтого цвета), выход: 15%. MS-ESI: рассч. для [M+H]+ 348, обнаружено 348.
Этап 4
3,7-Диметил-1-(2-(4-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-5-ил)этил)-1H-пурин-2,6-(3H,7H)-дион
[242] 1-(2-(2-Ацетил-4-метилтиазол-5-ил)этил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион (40,0 мг, 0,115 ммоль), фторид цезия (17,5 мг, 0,115 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (49,0 мг, 0,345 ммоль) при комнатной температуре и полученную в результате смесь перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл), полученную в результате смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 3,7-диметил-1-(2-(4-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-5-ил)этил-1H-пурин-2,6-(3H,7H)-диона (15,0 мг, твердое вещество желтого цвета), выход: 31%.1H ЯМР: (400 МГц, метанол-d4) δ 8,37 (s, 1H), 4,25 (t, J = 6,4 Гц, 2H), 4,01 (s, 3H), 3,54 (s, 3H), 3,26 (t, J = 6,4 Гц, 2H), 2,50 (s, 3H), 1,90 (s, 3H). MS-ESI: рассч. для [M+H]+ 418, обнаружено 418.
Вариант осуществления 37
1-(3-Гидрокси-2-(гидроксиметил)-2-метилпропил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион


[243] 3,7-Диметил-1-((3-метилоксетан-3-ил)метил)1H-пурин-2,6(3H,7H)-дион (20,0 мг, 0,0757 ммоль) растворяли в 0,16% соляной кислоте (0,5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 6 часов, показатель рН которой доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия, и очищали остаток посредством высокоэффективной жидкостной хроматографии с получением 1-(3-гидрокси-2-(гидроксиметил)-2-метилпропил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-диона (12,0 мг, твердое вещество белого цвета), выход: 56%.1H ЯМР: (400 МГц, CDCl3) δ 7,58 (s, 1H), 4,25-3,94 (m, 7H), 3,62 (s, 3H), 3,35-3,26 (m, 2H), 3,25-3,14 (m, 2H), 1,01 (s, 3H). MS-ESI: рассч. для [M+H]+ 283, обнаружено 283.
Вариант осуществления 38
1-(2-(2-Гидрокси-2-метилциклопропил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
Этил-2-(2-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)этокси)ацетат
[244] 1-(2-Гидроксиэтил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион (100 мг, 0,446 ммоль) добавляли к раствору гидрида натрия (21,0 мг, 0,890 ммоль) в N,N-диметилформамиде (10 мл) при комнатной температуре, реакционный раствор перемешивали при 25°C в течение 1 часа. Потом добавляли этил-2-бромацетат (149 мг, 0,890 ммоль). Реакционный раствор перемешивали в течение еще 16 часов. Нерастворимое вещество удаляли фильтрованием, а фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением этил-2-(2-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)этокси)ацетата (60,0 мг, твердое вещество белого цвета), выход: 43%.
[245] MS-ESI: рассч. для [M+H]+ 311, обнаружено 311.
Этап 2
1-(2-(2-Гидрокси-2-метилциклопропил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[246] Раствор метилмагния бромида (3 M раствор тетрагидрофурана, 0,43 мл, 1,29 ммоль) медленно добавляли по каплям к раствору этил-2-(2-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)этокси)ацетата в тетрагидрофуране (5 мл) при -78°C. Реакционный раствор перемешивали при -78°C в течение 2 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора хлорида аммония (20 мл). Смесь экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли и концентрировали при пониженном давлении, выделяли остаток и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-(2-(2-гидрокси-2-метилциклопропил)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (40,0 мг, бесцветное масло), выход: 42%.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 4,23 (t, J = 5,8 Гц, 2H), 3,98 (s, 3H), 3,72 (t, J = 5,8 Гц, 2H), 3,53 (s, 3H), 3,32 (s, 2H), 1,13 (s, 6H). MS-ESI: рассч. для [M+H]+ 296, обнаружено 296.
Вариант осуществления 39
1-(2-((1-Гидроксициклобутил)метокси)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
1-(Гидроксиметил)циклобутанол
[247] Раствор 1-гидроксициклобутановой кислоты (1,16 г, 10,0 ммоль) в тетрагидрофуране (10 мл) добавляли по каплям к раствору алюмогидрида лития (1,52 г, 40,0 ммоль) в тетрагидрофуране (30 мл) при 25°C. Реакционный раствор нагревали для кипения с обратным холодильником в течение 1 часа. Реакционный раствор охлаждали до 25°C, гасили посредством добавления воды (20 мл), экстрагировали этилацетатом (50 мл × 3), органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-(гидроксиметил)циклобутанола (0,800 г, бесцветное масло), выход: 80%.
Этап 2
2-(3,7-Диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)этилметансульфонат
[248] Триэтиламин (600 мг, 6,00 ммоль) и метансульфохлорид (342 мг, 3,00 ммоль) добавляли к раствору 1-(2-гидроксиэтил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (448 мг, 2,00 ммоль) в дихлорметане (25 мл). Реакционный раствор перемешивали при 0°C в течение 0,5 часа. Реакционную смесь гасили посредством добавления насыщенного водного раствора бикарбоната натрия (30 мл) и экстрагировали дихлорметаном (20 мл 3). Органическую фазу промывали насыщенным солевым раствором (20 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 2-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)этилметансульфоната (650 мг, масло желтого цвета), выход 100%.
Этап 3
1-(2-((1-Гидроксициклобутил)метокси)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[249] Карбонат калия (414 мг, 3,00 ммоль) и йодид калия (16,0 мг, 0,100 ммоль) добавляли к раствору смеси 1-(гидроксиметил)циклобутанола (102 мг, 1,00 ммоль) и 2-(3,7-диметил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)этилметансульфоната (450 мг, 1,50 ммоль) в N,N-диметилформамиде (5 мл). Реакционную смесь нагревали до 60°C и перемешивали в течение ночи. Потом реакционную смесь медленно охлаждали до комнатной температуры, гасили посредством добавления воды (20 мл). Смесь экстрагировали этилацетатом (20 мл × 3), органическую фазу промывали насыщенным солевым раствором (20 мл × 3) и сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, а остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-(2-((1-гидроксициклобутил)метокси)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (50,0 мг, твердое вещество белого цвета), выход: 16%.1H ЯМР: (400 МГц, метанол-d4) δ 7,88 (s, 1H), 4,57-4,59 (m, 2H), 4,21-4,24 (m, 2H), 3,98 (s, 3H), 3,80 (s, 2H), 3,54 (s, 3H), 2,07-1,95 (m, 4H), 1,52-1,54 (m, 2H). MS-ESI: рассч. для [M+H]+ 309, обнаружено 309.
Вариант осуществления 40
(S)-1-(2-((2-Гидроксипропил)амино)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион


Этап 1
1-(3-Хлорпропил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[250] 3,7-Диметил-1H-пурин-2,6(3H,7H)-дион (1,00 г, 5,56 ммоль) растворяли в метаноле (20 мл), добавляли 30% метилат натрия (9,64 г, 49,9 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 1 часа. Потом добавляли 1-бром-2-хлорэтан (47,2 г, 299 ммоль) и реакционную смесь перемешивали в течение еще 16 часов. Реакционную смесь гасили посредством добавления воды (30 мл), экстрагировали дихлорметаном (20 мл × 3), органическую фазу промывали насыщенным солевым раствором (20 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии (петролейный эфир/этилацетат 1:2) с получением 1-(3-хлорпропил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (230 мг, твердое вещество белого цвета), выход: 17%.1H ЯМР: (400 МГц, CDCl3) δ 7,50 (s, 1H), 4,36 (t, J = 6,4 Гц, 2H), 3,97 (s, 3H), 3,75 (t, J = 6,4 Гц, 2H), 3,56 (s, 3H).
Этап 2
(S)-1-(2-((2-Гидроксипропил)амино)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[251] Карбонат калия (138 мг, 1,03 ммоль) и йодид калия (86,3 мг, 0,517 ммоль) добавляли к раствору смеси 1-(3-хлорпропил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (62,4 мг, 0,826 ммоль) и (S)-1-аминопропан-2-ола (50,0 мг, 0,207 ммоль) в ацетонитриле (2 мл) при 25°C. Реакционный раствор перемешивали при 90°C в течение 4 часов. Реакционную смесь гасили посредством добавления воды (10 мл) и экстрагировали этилацетатом (20 мл × 3). Органическую фазу промывали насыщенным солевым раствором (20 мл × 3), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Выделяли остаток и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением (S)-1-(2-((2-гидроксипропил)амино)этил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (10,0 мг, твердое вещество белого цвета), выход: 17%.1H ЯМР: (400 МГц, метанол-d4) δ 7,86 (s, 1H), 4,16 (t, J = 6,4 Гц, 2H), 3,97 (s, 3H), 3,84 (m, 1H), 3,56 (s, 3H), 3,93 (m, 2H), 2,64 (m, 2H), 1,14 (d, J = 6,4 Гц, 3H). MS-ESI: рассч. для [M+H]+ 282, обнаружено 282.
Вариант осуществления 41


Этап 1
1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-7-(дифторметил)-3-метил-1H-пурин-2,6(3H,7H)-дион
1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-9-(дифторметил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[252] Смесь 7-(дифторметил)-3-метил-1H-пурин-2,6(3H,7H)-диона и 9-(дифторметил)-3-метил-2,6(3H,7H)-диона (200 мг, 0,930 ммоль) растворяли в N,N-диметилформамиде (20 мл), в реакционный раствор добавляли 1,4-диоксаспиро[4.5]декан-8-илметилметансульфонат (245 мг, 1,10 ммоль), йодид калия (183 мг, 1,10 ммоль) и карбонат калия (303 мг, 2,20 ммоль) при комнатной температуре. Реакционный раствор нагревали до 100°C и перемешивали в течение 2 часов. Реакционный раствор разбавляли этилацетатом (30 мл) и органическую фазу промывали водой (20 мл × 2), сушили над безводным сульфатом натрия и концентрировали с получением смеси 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-7-(дифторметил)-3-метил-1H-пурин-2,6(3H,7H)-диона и 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-9-(дифторметил)-3-метил-1H-пурин-2,6(3H,7H)-диона (234 мг, масло желтого цвета), выход: 68%.
[253] MS-ESI: рассч. для [M+H]+ 371, обнаружено 371.
Этап 2
7-(Дифторметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион
9-(Дифторметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион
[254] Смесь 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-7-(дифторметил)-3-метил-1H-пурин-2,6(3H,7H)-диона и 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-9-(дифторметил)-3-метил-1H-пурин-2,6(3H,7H)-диона (230 мг, 0,750 ммоль) растворяли в тетрагидрофуране (15 мл), добавляли 10% соляную кислоту (5 мл) при комнатной температуре и реакционную смесь нагревали до 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, добавляли этилацетат (20 мл) и органическую фазу промывали насыщенным водным раствором бикарбоната натрия (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 2:1, Rf = 0,3) с получением смеси 7-(дифторметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона и 9-(дифторметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона (200 мг, твердое вещество белого цвета), выход: 81%.
[255] MS-ESI: рассч. для [M+H]+ 327, обнаружено 327.
Этап 3
7-(Дифторметил)-1-(4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион
9-(Дифторметил)-1-(4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[256] Смесь 7-(дифторметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона и 9-(дифторметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона (168 мг, 0,515 ммоль) растворяли в тетрагидрофуране (30 мл), добавляли трифторметилтриметилсилан (109 мг, 0,773 ммоль) и фторид цезия (15,7 мг, 0,103 ммоль) при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре в течение 12 часов, добавляли тетрабутиламмония фторид (50,0 мг, 0,207 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение 30 минут, потом разбавляли этилацетатом (20 мл) и органическую фазу промывали насыщенным водным раствором бикарбоната натрия (20 мл × 2), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, а остаток очищали посредством высокоэффективной жидкостной хроматографии с получением 7-(дифторметил)-1-(4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-диона (54 мг, твердое вещество белого цвета), выход: 23%.1H ЯМР: (400 МГц, метанол-d4) δ 8,46 (s, 1H), 7,89-7,74 (m, 1H), 4,06 (d, J = 7,2 Гц, 2H), 3,59 (s, 3H), 2,19-2,17 (m, 1H), 2,05-1,99 (m, 2H), 1,88-1,81 (m, 2H), 1,61-1,58 (m, 2H), 1,51-1,47 (m, 2H). MS-ESI: рассч. для [M+H]+ 397, обнаружено 397.
[257] А также получили 9-(дифторметил)-1-(4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион (12 мг, твердое вещество белого цвета), выход: 10%.1H ЯМР: (400 МГц, метанол-d4) δ 8,49 (s, 1H), 7,93-7,89 (m, 1H), 4,07 (d, J = 7,2 Гц, 2H), 3,59 (s, 3H), 2,20-2,19 (m, 1H), 2,05-1,99 (m, 2H), 1,88-1,85 (m, 2H), 1,61-1,58 (m, 2H), 1,51-1,48 (m, 2H). MS-ESI: рассч. для [M+H]+ 397, обнаружено 397.
Вариант осуществления 42
7-Этил-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-дион


Этап 1
7-Этил-3-метил-1H-пурин-2,6(3H,7H)-дион
[258] 3-Метил-1H-пурин-2,6(3H,7H)-дион (500 мг, 3,00 ммоль), карбонат калия (414 мг, 3,00 ммоль) и йодид калия (4,0 мг, 0,300 ммоль) растворяли в N,N-диметилформамиде (15 мл). Реакционный раствор нагревали до 80°C в течение получаса. Добавляли йодистый этил (470 мг, 4,50 ммоль). Реакцию продолжали в течение 5 часов. Реакционную смесь гасили посредством вливания реакционного раствора в водный раствор гидроксида натрия (50 мл) и экстрагировали этилацетатом (20 мл × 3). Показатель рН водной фазы доводили до 7 с помощью 1 н. разбавленной соляной кислоты (10 мл), потом смесь фильтровали, осадок на фильтре сушили с получением 7-этил-3-метил-1H-пурин-2,6(3H,7H)-диона (500 мг, твердое вещество бледно-желтого цвета), выход: 86%.1H ЯМР: (400 МГц, DMSO-d6): δ 8,05 (s, 1H), 4,25-4,19 (m, 2H), 3,34 (s, 3H), 1,37 (t, J = 7,2 Гц, 3H). MS-ESI: рассч. для [M+H]+ 195, обнаружено 195.
Этап 2
Этил-5-(7-этил-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пуриг-1-ил)валат
[259] 7-Этил-3-метил-1H-пурин-2,6(3H,7H)-дион (0,300 г, 1,55 ммоль), этилбромвалерат (480 мг, 2,32 ммоль), карбонат калия (430 мг, 3,10 ммоль) и йодид калия (26,0 мг, 0,155 ммоль) растворяли в N,N-диметилформамиде (4 мл). Реакционный раствор нагревали до 110°C в течение 2 часов. Реакционную смесь гасили посредством вливания реакционного раствора в воду (20 мл) и смесь экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением этил-5-(7-этил-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)валата (320 мг, твердое вещество желтого цвета), выход: 62%. MS-ESI: рассч. для [M+H]+ 323, обнаружено 323.
Этап 3
7-Этил-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[260] Этил-5-(7-этил-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)валат (0,100 г, 0,310 ммоль) растворяли в безводном тетрагидрофуране (10 мл) и медленно добавляли по каплям бромэтилмагний (3 M раствор тетрагидрофурана, 0,62 мл, 1,86 ммоль) при -78°C. Реакционный раствор подвергали реакции при -78°C в течение 0,5 часа, медленно подогревали до 0°C и подвергали реакции в течение 0,5 часа. После того, как реакция завершилась, реакционный раствор выливали в воду (20 мл) и экстрагировали этилацетатом (30 мл × 3). Органическую фазу сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии на силикагеле с получением 7-этил-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-диона (30,0 мг, бесцветное масло), выход: 30%.
[261]1H ЯМР: (400 МГц, CDCl3): δ 7,56 (s, 1H), 4,37-4,32 (m, 2H), 4,05 (t, J = 7,2 Гц, 2H), 3,60 (s, 3H), 1,68-1,37 (m, 13H), 0,86 (t, J = 7,2 Гц, 6H). MS-ESI: рассч. для [M+H]+ 337, обнаружено 337.
Вариант осуществления 43
7-Этил-3-метил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-дион


Этап 1
7-Этил-3-метил-1-(5-оксогексил)-1H-пурин-2,6(3H,7H)-дион
[262] 7-Этил-3-метил-1H-пурин-2,6(3H,7H)-дион (0,100 г, 0,515 ммоль), 6-хлор-2-пентанон (90,0 мг, 0,670 ммоль), карбонат калия (140 мг, 1,03 ммоль) и йодид калия (8,5 мг, 0,0155 ммоль) растворяли в DMF (2 мл), получаемую в результате реакционную смесь нагревали до 110oC в течение двух часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили, фильтровали, концентрировали и промывали трет-бутилметиловым эфиром, твердое вещество сушили с получением целевого соединения 7-этил-3-метил-1-(5-оксогексил)-1H-пурин-2,6(3H,7H)-диона (100 мг, твердое вещество белого цвета), выход: 70%. MS-ESI: рассч. для [M+H]+ 293, обнаружено 293.
Этап 2
7-Этил-3-метил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-дион
[263] 7-Этил-3-метил-1-(5-оксогексил)-1H-пурин-2,6(3H,7H)-дион (100 мг, 0,340 ммоль) растворяли в 1 мл тетрагидрофурана, добавляли последовательно трифторметилтриметилсилан (53,0 мг, 0,370 ммоль) и фторид цезия (10,0 мг, 0,0340 ммоль) и подвергали реакции при 30°C в течение 3 часов. Реакционный раствор выливали в разбавленную соляную кислоту (10%, 10 мл) и перемешивали в течение получаса. Потом смесь экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили, концентрировали и очищали остаток посредством препаративной колоночной хроматографии с получением целевого соединения 7-этил-3-метил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-диона (20,0 мг, твердое вещество белого цвета), выход: 79%.1H ЯМР: (400 МГц, CDCl3): δ 7,95 (s, 1H), 4,39-4,33 (m, 2H), 4,04-4,00 (m, 2H), 3,53 (s, 3H), 1,71-1,64 (m, 4H), 1,50-1,46 (m, 5H), 1,28 (s, 3H). MS-ESI: рассч. для [M+H]+ 363, обнаружено 363.
Вариант осуществления 44
1-((4-Гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион


Этап 1
1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион
[264] 1,4-Диоксаспиро[4.5]декан-8-илметилметансульфонат (200 мг, 0,800 ммоль), 3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион (200 г, 0,800 ммоль), карбонат калия (334 мг, 2,42 ммоль) и йодид калия (14,0 мг, 0,0800 ммоль) растворяли в N,N-диметилформамиде (3 мл), реакционный раствор нагревали до 130°C и перемешивали в течение 3,5 часов. Реакционный раствор непосредственно фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-диона. MS-ESI: рассч. для [M+H]+ 403, обнаружено 403.
Этап 2
3-Метил-1-((4-оксоциклогексил)метил)-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион
[265] (1,4-Диоксаспиро[4.5]декан-8-илметил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион (2,50 г, 6,00 ммоль) растворяли в ацетоне (18 мл) и добавляли водный раствор соляной кислоты (4 н., 2,5 мл). Реакционную смесь перемешивали при 30°C в течение ночи, добавляли воду (50 мл) и полученную в результате смесь экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:3, Rf = 0,3) с получением продукта 3-метил-1-((4-оксоциклогексил)метил)-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-диона (220 мг, твердое вещество белого цвета), выход: 11%.1H ЯМР: (400 МГц, CDCl3) δ 7,68 (s, 1H), 5,08-4,99 (m, 2H), 4,00 (d, J = 7,0 Гц, 2H), 3,61 (s, 3H), 2,46-2,24 (m, 5H), 2,04-1,96 (m, 2H), 1,63-1,56 (m, 2H). MS-ESI: рассч. для [M+H]+ 359, обнаружено 359.
Этап 3
1-((4-Гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион
[266] 3-Метил-1-((4-оксоциклогексил)метил)-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион (128 мг, 0,360 ммоль) и фторид цезия (6,0 мг, 0,0360 ммоль) растворяли в тетрагидрофуране (3 мл). В атмосфере газообразного азота медленно добавляли трифторметилтриметилсилан (77,0 мг, 0,540 ммоль). Реакционный раствор перемешивали при 30°C в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры, добавляли 4 н водный раствор соляной кислоты (2,5 мл) и полученную в результате смесь перемешивали при 25°C в течение получаса, показатель рН которой доводили до 7, смесь разбавляли водой и экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении и очищали остаток посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-диона (14,0 мг, твердое вещество белого цвета), выход: 10%.1H ЯМР: (400 МГц, CDCl3) δ 8,09 (s, 1H), 5,27-5,20 (m, 2H), 4,08-3,91 (m, 2H), 3,58 (s, 3H), 2,07-1,98 (m, 2H), 1,89-1,80 (m, 2H), 1,62-1,46 (m, 5H). MS-ESI: рассч. для [M+H]+ 429, обнаружено 429.
Вариант осуществления 45

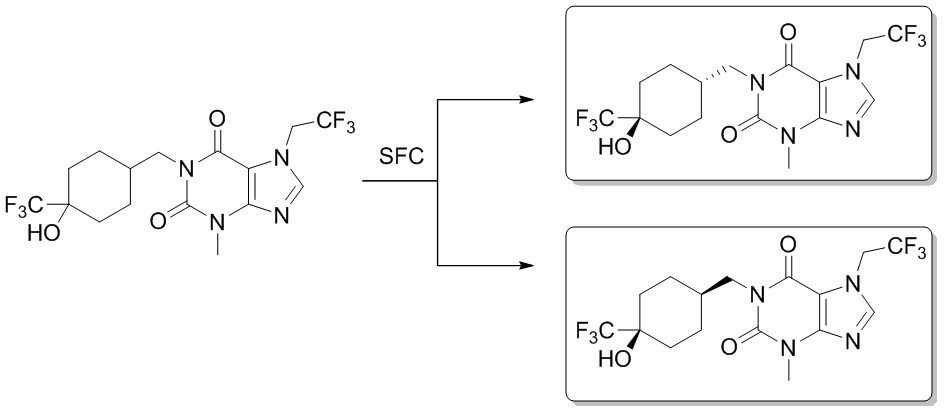
[267] 1-((4-Гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион (500 мг, 1,17 ммоль) разделяли посредством препаративной SFC с получением двух изомеров. Условия разделения: колонка: AD 250 мм× 30 мм, 10 мкм; подвижная фаза: A: углекислый газ в сверхкритическом состоянии, B: этанол (0,05% аммиак), A: B = 550:45; объемный расход: 80 мл/мин.; длина волны: 220 нм.
[268] Продукт 1 (изомер 1, первый пик) (300 мг, твердое вещество белого цвета), выход: 90%.1H ЯМР: (400 МГц, DMSO-d6) δ 8,23 (s, 1H), 5,64 (s, 1H), 5,31-5,24 (m, 2H), 3,89 (d, J = 3,6 Гц, 2H), 3,43(s, 3H), 2,06-2,05 (m, 1H), 1,87-1,81 (m, 2H), 1,73-1,61 (m, 2H), 1,49-1,45 (m, 2H), 1,33-1,31 (m, 2H). MS ESI рассч. для [M+H]+ 429, обнаружено 429.
[269] Продукт 2 (изомер 2, второй пик) (150 мг, твердое вещество белого цвета), выход: 90%.1H ЯМР: (400 МГц, DMSO-d6) δ 8,22 (s, 1H), 5,63 (s, 1H), 5,29-5,23 (m, 2H), 3,74 (d, J = 3,6 Гц, 2H), 3,42 (s, 3H), 1,68-1,66 (m, 3H), 1,45-1,31 (m, 6H). MS ESI рассч. для [M+H]+ 429, обнаружено 429.
Вариант осуществления 46


Этап 1
1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион
[270] 1,4-Диоксаспиро[4,5]декан-8-илметилметансульфонат (603 мг, 2,41 ммоль), 3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6-(3H,7H)-дион (500 мг, 2,01 ммоль) и йодид калия (33,3 мг, 0,201 ммоль) растворяли в N,N-диметилформамиде (8 мл), добавляли карбонат калия (555 мг, 4,02 ммоль) и реакционную смесь нагревали до 130°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-диона (980 мг, масло желтого цвета). MS-ESI: рассч. для [M+H]+ 403, обнаружено 403.
Этап 2
3-Метил-1-((4-оксоциклогексил)метил)-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион
[271] 1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-3-метил-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион (980 мг, 1,51 ммоль) растворяли в ацетоне (8 мл), добавляли водный раствор 4 н. соляной кислоты (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, добавляли воду (20 мл), а затем смесь экстрагировали этилацетатом (30 мл × 3), органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, получаемый в результате продукт очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением продукта 3-метил-1-((4-оксоциклогексил)метил)-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-диона (78,0 мг, твердое вещество желтого цвета), выход: 15%. MS-ESI: рассч. для [M+H]+ 359, обнаружено 359.
[272] 3-Метил-1-((4-оксоциклогексил)метил)-7-(2,2,2-трифторэтил)-1H-пурин-2,6(3H,7H)-дион (66,0 мг, 0,184 ммоль) растворяли в тетрагидрофуране (2 мл). В атмосфере газообразного азота медленно добавляли метиловый реактив Гриньяра (3 M эфирный раствор, 0,184 мл, 0,552 ммоль) при -78°C, полученную в результате смесь перемешивали при -78°C в течение получаса с последующим приведением в реакцию при 0°C в течение 2 часов. Добавляли воду (10 мл), потом смесь экстрагировали этилацетатом (30 мл × 3), органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1 (8,00 мг, твердое вещество белого цвета), выход: 12%.1H ЯМР: (400 МГц, метанол-d4) δ 8,08 (s, 1H), 5,27-5,19 (m, 2H), 3,92 (d, J = 7,2 Гц, 2H), 3,58 (s, 3H), 1,71-1,62 (m, 4H), 1,46-1,38 (m, 2H), 1,32-1,18 (m, 6H). MS-ESI: рассч. для [M+H-H2O]+ 357, обнаружено 357.
[273] Продукт 2 (12,0 мг, твердое вещество белого цвета) (изомер 2, второй пик), выход: 17%.1H ЯМР: (400 МГц, метанол-d4) δ 8,08 (s, 1H), 5,27-5,21 (m, 2H), 3,91 (d, J = 7,2 Гц, 2H), 3,57 (s, 3H), 1,69-1,66 (m, 2H), 1,49-1,44 (m, 3H), 1,37-1,28 (m, 4H), 1,17 (s, 3H). MS-ESI: рассч. для [M+H-H2O]+ 357, обнаружено 357.
Вариант осуществления 47
7-Циклопропил-3-метил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-дион


Этап 1
6-Амино-5-бром-1-метилпиримидин-2,4(1H,3H)-дион
[274] В атмосфере газообразного азота раствор смеси 6-амино-1-метилпиримидин-2,4(1H,3H)-диона (5,46 г, 40,0 ммоль) и бромсукцинимида (7,56 г, 42,0 ммоль) в ацетонитриле (100 мл) нагревали для кипения с обратным холодильником в течение 1,5 часа. Реакционный раствор охлаждали до комнатной температуры, фильтровали и удаляли растворитель, а получаемое в результате твердое вещество промывали водой (20 мл) и сушили с получением 6-амино-5-бром-1-метилпиримидин-2,4(1H,3H)-диона (8,6 г, твердое вещество белого цвета), выход: 98%.1H ЯМР: (400 МГц, DMSO-d6) δ 10,90 (s, 1H), 7,04 (s, 2H), 3,28 (s, 3H).
Этап 2
6-Амино-5-(циклопропиламин)-1-метилпиримидин-2,4(1H,3H)-дион
[275] 6-Амино-5-бром-1-метилпиримидин-2,4(1H,3H)-дион (2,19 г, 10,0 ммоль) растворяли в смешанном растворителе из циклопропиламина (20 мл) и воды (5 мл). Реакционный раствор нагревали для кипения с обратным холодильником в течение 5 часов. Реакционный раствор фильтровали для удаления растворителя с получением неочищенного продукта 6-амино-5-(циклопропиламин)-1-метилпиримидин-2,4(1H,3H)-диона, который непосредственно использовали на следующем этапе.
Этап 3
7-Циклопропил-3-метил-1H-пурин-2,6(3H,7H)-дион
[276] В атмосфере газообразного азота 6-амино-5-(циклопропиламин)-1-метилпиримидин-2,4(1H,3H)-дион (1,96 г, 10,0 ммоль), триметилортоформиат (2,12 г, 20,0 ммоль) и п-толуолсульфоновую кислоту (86,0 мг, 0,500 ммоль) растворяли в безводном N,N-диметилформамиде (20 мл). Реакционный раствор нагревали до 100°C в течение ночи. Реакционный раствор фильтровали и удаляли растворитель с получением неочищенного продукта 7-циклопропил-3-метил-1H-пурин-2,6(3H,7H)-диона, который непосредственно использовали на следующем этапе.
Этап 4
7-Циклопропил-3-метил-1-(5-оксогексан)-1H-пурин-2,6(3H,7H)-дион
[277] В атмосфере газообразного азота 7-циклопропил-3-метил-1H-пурин-2,6(3H,7H)-дион (100 мг, 0,480 ммоль), 6-хлоргексан-2-он (97,0 мг, 0,730 ммоль) и карбонат калия (132 мг, 0,960 ммоль) растворяли в N,N-диметилформамиде (5 мл). Реакционный раствор нагревали до 120°C в течение 3 часов. После охлаждения до комнатной температуры смесь разбавляли водой (20 мл) и этилацетатом (10 мл), экстрагировали этилацетатом (30 мл × 2), органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта 7-циклопропил-3-метил-1-(5-оксогексан)-1H-пурин-2,6(3H,7H)-диона, который непосредственно использовали на следующем этапе. MS-ESI: рассч. для [M+H]+ 305, обнаружено 305.
Этап 5
7-Циклопропил-3-метил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-дион
[278] В атмосфере газообразного азота 7-циклопропил-3-метил-1-(5-оксогексан)-1H-пурин-2,6(3H,7H)-дион (200 мг, 0,660 ммоль) растворяли в безводном тетрагидрофуране (3 мл), потом добавляли последовательно трифторметилтриметилсилан (0,2 мл, 0,990 ммоль) и фторид цезия (20,0 мг, 0,130 ммоль). Получаемый в результате реакционный раствор подвергали реакции при 30°C в течение 2 часов. Реакционную смесь разбавляли водой (30 мл) и экстрагировали этилацетатом (30 мл × 2), органическую фазу сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении, а остаток очищали с помощью пластин для препаративной TLC (петролейный эфир/сложный этиловый эфир 1:2, Rf = 0,3) с получением 7-циклопропил-3-метил-1-(6,6,6-трифтор-5-гидрокси-5-метилгексил)-1H-пурин-2,6(3H,7H)-диона (150 мг, твердое вещество белого цвета), выход: 61%.1H-ЯМР: (400 МГц, CDCl3) δ 7,55 (s, 1H), 4,13-4,02 (m, 2H), 3,63-3,61 (m, 1H), 3,55 (s, 3H), 2,96 (s, 1H), 1,90-1,68 (m, 2H), 1,67-1,64 (m, 2H), 1,47-1,45 (m, 2H), 1,28 (s, 3H), 1,18-1,16 (m, 2H), 1,06-1,04 (m, 2H). MS-ESI: рассч. для [M+H]+ 375, обнаружено 375.
Вариант осуществления 48
7-(Циклопропилметил)-1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион


Этап 1
1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-7-изопропил-3-метил-1H-пурин-2,6(3H,7H)-дион
[279] 1,4-Диоксаспиро[4.5]декан-8-илметилметансульфонат (250 мг, 1,00 ммоль), 7-изопропил-3-метил-1H-пурин-2,6(3H,7H)-дион (208 мг, 1,00 ммоль), йодид калия (15,8 мг, 0,100 ммоль) и карбонат калия (276 мг, 2,00 ммоль) растворяли в безводном N,N-диметилформамиде (8 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до 20°C, смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-7-изопропил-3-метил-1H-пурин-2,6(3H,7H)-диона (300 мг, масло белого цвета), выход: 83%. MS-ESI: рассч. [M+H]+ 362, обнаружено 362.
Этап 2
7-Изопропил-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион
[280] 1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-7-изопропил-3-метил-1H-пурин-2,6(3H,7H)-дион (300 мг, 0,828 ммоль) растворяли в ацетоне (10 мл), добавляли соляную кислоту (0,5 мл). Реакционный раствор перемешивали при комнатной температуре в течение 30 минут. Добавляли воду в реакционный раствор, показатель рН которого доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия (10 мл), и смесь экстрагировали этилацетатом (10 мл × 3), органические фазы объединяли, промывали насыщенным водным раствором хлорида натрия (20 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (этилацетат, Rf = 0,3) с получением 7-изопропил-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона (180 мг, масло белого цвета), выход: 68%. MS-ESI: рассч. для [M+H]+ 319, обнаружено 319.
Этап 3
7-Изопропил-3-метил-1-((4-гидрокси-4-(трифторметил)циклогексил)метил-1H-пурин-2,6(3H,7H)-дион
[281] 7-Изопропил-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион (122 мг, 0,382 ммоль) и фторид цезия (11,5 мг, 0,0763 ммоль) растворяли в безводном тетрагидрофуране (3 мл), в атмосфере газообразного азота добавляли трифторметилтриметилсилан (95,0 мг, 0,640 ммоль). Реакционный раствор нагревали до 30°C и перемешивали в течение 12 часов. Потом добавляли водный раствор соляной кислоты (1 н., 5 мл) и перемешивали в течение еще 30 минут. Добавляли воду в реакционный раствор, показатель рН которого доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия (10 мл), и смесь экстрагировали этилацетатом (10 мл × 3), органические фазы объединяли и промывали насыщенным водным раствором хлорида натрия (20 мл × 3), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и очищали остаток посредством препаративной высокоэффективной жидкостной хроматографии с получением 7-изопропил-3-метил-1-((4-гидрокси-4-(трифторметил)циклогексил)метил-1H-пурин-2,6(3H,7H)-диона (80,0 мг, твердое вещество белого цвета), выход: 53%.1H ЯМР: (400 МГц, метанол-d4) δ 8,10 (s, 1H), 5,06-5,00 (m, 1H), 4,08-3,91 (m, 2H), 3,55 (s, 3H), 2,17-2,00 (m, 2H), 1,88-1,84 (m, 2H), 1,61-1,40 (m, 6H), 1,59-1,57 (m, 5H). MS-ESI: рассч. для [M+H]+ 389, обнаружено 389.
Вариант осуществления 49
7-(Циклопропилметил)-1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион

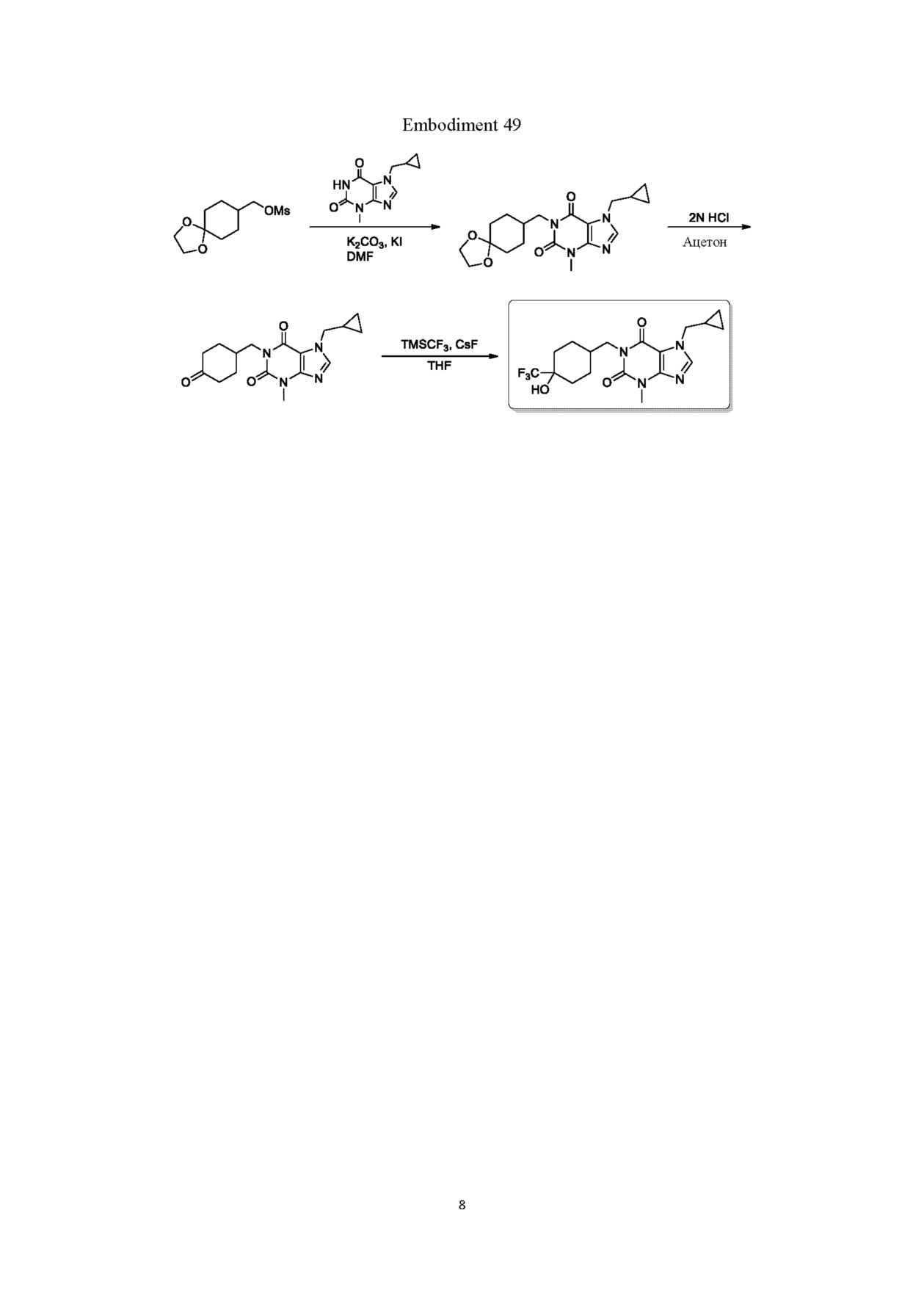
Этап 1
1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-7-(циклопропилметил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[282] (Циклопропилметил)-3-метил-1H-пурин-2,6(3H,7H)-дион (220 мг, 1,00 ммоль), 1,4-диоксаспиро[4.5]декан-8-илметилметансульфонат (250 мг, 1,00 ммоль), йодид калия (15,8 мг, 0,100 ммоль) и карбонат калия (276 г, 2,00 ммоль) растворяли в безводном N,N-диметилформамиде (8 мл), нагревали реакционный раствор до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до 20°C, смесь фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-7-(циклопропилметил)-3-метил-1H-пурин-2,6(3H,7H)-диона (300 мг, масло белого цвета), выход: 80%. MS-ESI: рассч. для [M+H]+ 375, обнаружено 375.
Этап 2
7-(Циклопропилметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион
[283] 1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-7-(циклопропилметил)-3-метил-1H-пурин-2,6(3H,7H)-дион (300 мг, 0,802 ммоль) растворяли в ацетоне (10 мл), добавляли соляную кислоту (0,5 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли воду (30 мл) в реакционный раствор, показатель рН которого доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия (10 мл), потом смесь экстрагировали этилацетатом (10 мл × 3), органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством колоночной хроматографии на силикагеле (этилацетат, Rf = 0,3) с получением 7-(циклопропилметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона (180 мг, масло белого цвета), выход: 75%. MS-ESI: рассч. для [M+H]+ 331, обнаружено 331.
Этап 3
7-(Циклопропилметил)-1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[284] 7-(Циклопропилметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион (126 мг, 0,382 ммоль) и фторид цезия (11,5 мг, 0,0763 ммоль) растворяли в безводном тетрагидрофуране (3 мл), в атмосфере газообразного азота добавляли трифторметилтриметилсилан (95,0 мг, 0,640 ммоль). Смесь перемешивали при 30°C в течение 12 часов. Потом добавляли 1 н. водный раствор соляной кислоты (5 мл) и перемешивание продолжали в течение еще 30 мин. Добавляли воду (30 мл) в реакционный раствор, показатель рН которого доводили до 7 с помощью насыщенного водного раствора бикарбоната натрия (10 мл), и экстрагировали этилацетатом (10 мл × 3), органические фазы объединяли и промывали насыщенным водным раствором хлорида натрия (30 мл × 2), сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 7-(циклопропилметил)-1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-диона (80,0 мг, твердое вещество белого цвета), выход: 53%.1H-ЯМР: (400 МГц, метанол-d4) δ 8,16-8,15 (m, 1H), 4,24-4,22 (m, 2H), 4,08-3,91 (m, 2H), 3,57 (s, 3H), 2,18-2,07 (m, 2H), 1,85-1,82 (m, 2H), 1,61-1,47 (m, 6H), 0,64-0,60 (m, 2H), 0,50-0,48 (m, 2H). MS-ESI: рассч. для [M+H]+ 401, обнаружено 401.
Вариант осуществления 50


[285] 7-(Циклопропилметил)-1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион (900 мг, 2,25 ммоль) разделяли посредством препаративной SFC с получением двух изомеров. Условия разделения: колонка: AD 250 мм× 30 мм, 5 мкм; подвижная фаза: A: углекислый газ в сверхкритическом состоянии, B: метанол (0,05% аммиак), A: B = 55:45; объемный расход: 40 мл/мин.; длина волны: 220 нм. Продукт 1 (изомер 1, первый пик) (600 мг, твердое вещество белого цвета), выход: 100%.1H ЯМР: (400 МГц, DMSO-d6) δ 8,11 (s, 1H), 5,62 (s, 1H), 4,08 (d, J = 7,6 Гц, 2H), 3,88 (d, J = 7,6 Гц, 2H), 3,43 (s, 3H), 2,05-2,04 (m, 1H), 1,85-1,82 (m, 2H), 1,48-1,45 (m, 2H), 1,33-1,32 (m, 2H), 1,30-1,28 (m, 3H), 0,48-0,46 (m, 2H), 0,41-0,39 (m, 2H). MS-ESI: рассч. для [M+H]+ 401, обнаружено 401.
[286] Продукт 2 (изомер 2, второй пик) (300 мг, твердое вещество белого цвета), выход: 100%.1H ЯМР: (400 МГц, DMSO-d6) δ 8,11 (s, 1H), 5,62 (s, 1H), 4,09 (d, J = 7,6 Гц, 2H), 3,74 (d, J = 7,6 Гц, 2H), 3,42 (s, 3H), 1,69-1,45 (m, 3H), 1,45-1,29 (m, 7H), 0,48-0,46 (m, 2H), 0,41-0,39 (m, 2H). MS-ESI: рассч. для [M+H]+ 401, обнаружено 401.
Вариант осуществления 51


Этап 1
1-(1,4-Диоксаспиро[4.5]декан-8-илметил-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион
[287] 1,4-Диоксаспиро[4.5]декан-8-илметилметансульфонат (682 мг, 2,72 ммоль), 7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион (500 мг, 2,27 ммоль) и йодид калия (37,7 мг, 0,227 ммоль) растворяли в N,N-диметилформамиде (10 мл), добавляли карбонат калия (627 мг, 4,54 ммоль) и реакционную смесь нагревали до 130°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта 1-(1,4-диоксаспиро[4.5]декан-8-илметил-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-диона (1,10 г, масло желтого цвета). MS-ESI: рассч. для [M+H]+ 375, обнаружено 375.
Этап 2
7-(Циклопропилметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6-(3H,7H)-дион
[288] 1-(1,4-Диоксаспиро[4.5]декан-8-илметил-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион (1,20 г, 2,09 ммоль) растворяли в ацетоне (12 мл), добавляли 4 н. водный раствор соляной кислоты (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, добавляли воду (20 мл) и смесь экстрагировали этилацетатом (30 мл × 3), органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, получаемый в результате продукт очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат 1:1, Rf = 0,3) с получением продукта 7-(циклопропилметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6-(3H,7H)-диона (52,0 мг, твердое вещество желтого цвета), выход: 8%. MS-ESI: рассч. для [M+H]+ 331, обнаружено 331.
Этап 3
[289] 7-(Циклопропилметил)-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6-(3H,7H)-дион (100 мг, 0,303 ммоль) растворяли в тетрагидрофуране (5 мл), в атмосфере газообразного азота медленно добавляли метиловый реактив Гриньяра (3 M эфирный раствор, 0,600 мл, 1,81 ммоль) при -78°C, реакционную смесь перемешивали при -78°C в течение получаса, потом подвергали реакции при 0°C в течение 2 часов. Добавляли воду (10 мл), потом смесь экстрагировали этилацетатом (30 мл × 3), органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1 (26,0 мг, твердое вещество белого цвета) (изомер 1, первый пик), выход: 25%.1H ЯМР: (400 МГц, метанол-d4) δ 7,99 (s, 1H), 4,19 (d, J = 7,6 Гц, 2H), 3,90 (d, J = 7,6 Гц, 2H), 3,54 (s, 3H), 1,90-1,79 (m, 1H), 1,70-1,61 (m, 4H), 1,45-1,36 (m, 3H), 1,27-1,16 (m, 5H), 0,65-0,55 (m, 2H), 0,49-0,42 (m, 2H). MS-ESI: рассч. для [M+H-H2O]+ 329, обнаружено 329.
[290] Продукт 2 (42,0 мг, твердое вещество белого цвета) (изомер 2, второй пик), выход: 40%.1H ЯМР: (400 МГц, метанол-d4) δ 7,99 (s, 1H), 4,19 (d, J = 7,6 Гц, 2H), 3,89 (d, J = 7,6 Гц, 2H), 3,54 (s, 3H), 1,81-1,70 (m, 1H), 1,69-1,62 (m, 2H), 1,51-1,41 (m, 4H), 1,39-1,25 (m, 3H), 1,15 (s, 3H), 0,63-0,56 (m, 2H), 0,48-0,42 (m, 2H). MS-ESI: рассч. для [M+H-H2O]+ 329, обнаружено 329.
Вариант осуществления 52
1-((4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6-(3H,7H)-дион


Этап 1
1-((4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-дион
[291] (4-Гидрокси-1-(метоксиметил)-4-(трифторметил)циклогексил)метилметансульфонат (100 мг, 0,349 ммоль), 7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион (76,9 мг, 0,349 ммоль), йодид калия (5,8 мг, 0,0349 ммоль) и карбонат калия (149 мг, 1,05 ммоль) растворяли в безводном N,N-диметилформамиде (5 мл). Реакционный раствор нагревали до 150°C посредством микроволнового излучения и подвергали реакции в течение 2 часов. Реакционный раствор охлаждали до 20°C, фильтровали, а остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 1-((4-гидрокси-1-метил-4-(трифторметил)циклогексил)метил)-3,7-диметил-1H-пурин-2,6(3H,7H)-диона (10,0 мг, твердое вещество белого цвета), выход: 6%.1H ЯМР: (400 МГц, DMSO-d6) δ 8,13 (s, 1H), 4,12 (s, 2H), 3,94 (s, 1H), 3,43-3,38 (m, 4H), 3,31 (s, 3H) 3,19 (s, 3H), 1,56-1,45 (m, 8H), 1,43-1,31 (m, 1H), 0,51-0,49 (m, 2H), 0,44-0,42 (m, 2H). MS-ESI: рассч. для [M+H]+ 445, обнаружено 445.
Вариант осуществления 53
7-(Циклопропилметил)-1-((4-гидрокси-1-метил-4-(трифторметил)циклогексил)-3-метил-1H-пурин-2,6-(3H,7H)-дион


Этап 1
7-(Циклопропилметил)-1-((4-гидрокси-1-метил-4-(трифторметил)циклогексил)-3-метил-1H-пурин-2,6-(3H,7H)-дион
[292] (4-Гидрокси-1-метил-4-(трифторметил)циклогексил)метилметансульфонат (100 мг, 0,344 ммоль), 7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион (75,9 мг, 0,344 ммоль), йодид калия (5,70 мг, 0,0344 ммоль) и карбонат калия (47,6 мг, 0,344 ммоль) растворяли в безводном N,N-диметилформамиде (5 мл). Реакционный раствор нагревали до 150°C и продолжали реакцию под действием микроволнового излучения в течение 4 часов. Реакционный раствор охлаждали до 20°C, фильтровали, концентрировали, а затем остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 7-(циклопропилметил)-1-((4-гидрокси-1-метил-4-(трифторметил)циклогексил)-3-метил-1H-пурин-2,6-(3H,7H)-диона (10,0 мг, твердое вещество белого цвета), выход: 7%.1H-ЯМР: (400 МГц, DMSO-d6) δ 8,13 (s, 1H), 4,13-4,09 (m, 2H), 3,83 (s, 1H), 3,43 (s, 3H), 3,34 (s, 2H), 1,67-1,53 (m, 6H), 1,23-1,20 (m, 3H), 0,88 (s, 3H), 0,50-0,42 (m, 4H). MS-ESI: рассч. для [M+H]+ 415, обнаружено 415.
Вариант осуществления 54
7-(Циклопропилметил)-3-метил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
1-(4-(Бромметил)-5-метилтиазол-2-ил)этанон
[293] 1-(4,5-Диметилпиридин-2-ил)этанон (200 мг, 1,29 ммоль), N-бромсукцинимид (229 мг, 1,29 ммоль), азобисизобутиронитрил (21,2 мг, 0,129 ммоль) растворяли в четыреххлористом углероде (20 мл), что потом подвергали реакции при 80°C в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора тиосульфата натрия (30 мл). Реакционную смесь экстрагировали дихлорметаном (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-(4-(бромметил)-5-метилтиазол-2-ил)этанона (200 мг, масло желтого цвета), выход: 46%. MS-ESI: рассч. для [M+H]+ 234, 236, обнаружено 234, 236.
Этап 2
1-((2-Ацетил-5-метилтиазол-4-ил)метил)-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион
[294] 1-(4-(Бромметил)-5-метилтиазол-2-ил)этанон (200 мг, 0,598 ммоль), 7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион (132 мг, 0,598 ммоль), йодид калия (19,8 мг, 0,119 ммоль) и карбонат калия (248 мг, 1,79 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC (петролейный эфир/этилацетат 1:1, величина Rf = 0,4) с получением 1-((2-ацетил-5-метилтиазол-4-ил)метил)-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-диона (100 мг, твердое вещество желтого цвета), выход: 45%.1H ЯМР: (400 МГц, метанол-d4) δ 8,02 (s, 1H), 5,35 (s, 2H), 4,21 (d, J = 7,6 Гц, 2H), 3,56 (s, 3H), 2,66 (s, 3H), 2,60 (s, 3H), 1,46-1,41 (m, 1H), 0,65-0,61 (m, 2H), 0,60-0,48 (m, 2H). MS-ESI: рассч. для [M+H]+ 374, обнаружено 374.
Этап 3
7-(Циклопропилметил)-3-метил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-дион
[295] 1-((2-Ацетил-5-метилтиазол-4-ил)метил)-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион (100 мг, 0,267 ммоль), фторид цезия (40,6 мг, 0,267 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (114 мг, 0,803 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл). Потом реакционную смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Потом остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 7-(циклопропилметил)-3-метил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-диона (50,0 мг, твердое вещество желтого цвета), выход: 42%.1H ЯМР: (400 МГц, метанол-d4) δ 8,11 (s, 1H), 5,33 (s, 2H), 4,23 (d, J = 7,6 Гц, 2H), 3,57 (s, 3H), 2,64 (s, 3H), 1,81 (s, 3H), 1,45-1,41 (m, 1H), 0,65-0,61 (m, 2H), 0,60-0,49 (m, 2H). MS-ESI: рассч. для [M+H]+ 444, обнаружено 444.
Вариант осуществления 55
7-(циклопропилметил)-3-метил-1-((6-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиридин-3-ил)метил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
1-[5-(Бромметил)-2-пиридил]этанон
[296] 1-(5-метил-2-пиридил)этанон (500 мг, 3.70 ммоль), N-бромсукцинимид (658 мг, 3.70 ммоль), азобисизобутиронитрил (182 мг, 1.11 ммоль) растворяли в четыреххлористом углероде (20 мл), который подвергали реакции при 90°C в течение 12 часов. Реакционную смесь гасили посредством добавления насыщенного водного раствора тиосульфата натрия (30 мл). Потом реакционную смесь экстрагировали дихлорметаном (10 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-[5-(бромметил)-2-пиридил]этанона (125 мг, масло желтого цвета), выход: 16%. MS-ESI: рассч. для [M+H]+ 214 и 216, обнаружено 214 и 216.
Этап 2
1-[(6-Ацетил-3-пиридил)метил]-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион
[297] 1-[5-(Бромметил)-2-пиридил]этанон (100 мг, 0,467 ммоль), 7-(циклопропилметил)-3-метил-1H-пурин-2,6-дион (103 мг, 0,467 ммоль), йодид калия (15,5 мг, 0,0934 ммоль) и карбонат калия (193 мг, 1.40 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Потом реакционную смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,4) с получением 1-[(6-ацетил-3-пиридил)метил-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-диона (50,0 мг, твердое вещество желтого цвета), выход: 30%. MS-ESI: рассч. для [M+H]+ 354, обнаружено 354.
Этап 3
7-(Циклопропилметил)-3-метил-1-((6-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиридин-3-ил)метил)-1H-пурин-2,6-(3H,7H)-дион
[298] 1-[(6-Ацетил-3-пиридил)метил]-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион (100 мг, 0,283 ммоль), фторид цезия (43,0 мг, 0,283 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (60,4 мг, 0,424 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл). Потом реакционную смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением 7-(циклопропилметил)-3-метил-1-((6-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиридин-3-ил)метил)-1H-пурин-2,6-(3H,7H)-диона (40,0 мг, твердое вещество желтого цвета), выход: 32%.1H ЯМР: (400 МГц, метанол-d4) δ 9,00 (s, 1H), 8,80-8,72 (m, 1H), 8,46 (s, 1H), 8,35-8,29 (m, 1H), 5,43 (s, 2H), 4,28 (d, J = 7,6 Гц, 2H), 3,58 (s, 3H), 1,95 (s, 3H), 1,50-1,46 (m, 1H), 0,68-0,64 (m, 2H), 0,53-0,51 (m, 2H). MS-ESI: рассч. для [M+H]+ 424, обнаружено 424.
Вариант осуществления 56
7-(Циклопропилметил)-3-метил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-дион


Этап 1
1-[(5-Ацетил-2-пиридил)метил]-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион
[299] 1-(6-(Бромметил)-3-пиридил]этанон (100 мг, 0,467 ммоль), 7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-дион (103 мг, 0,467 ммоль), йодид калия (15,5 мг, 0,0934 ммоль) и карбонат калия (193 мг, 1,40 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 120°C и перемешивали в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали, фильтрат концентрировали при пониженном давлении и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,5) с получением 1-((5-ацетил-2-пиридил)метил)-7-(циклопропилметил)-3-метил-1H-пурин-2,6-(3H,7H)-диона (50,0 мг, твердое вещество желтого цвета), выход: 30%. MS-ESI: рассч. для [M+H]+ 354, обнаружено 354.
Этап 2
7-(Циклопропилметил)-3-метил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-дион
[300] 1-[(5-Ацетил-2-пиридил)метил]-7-(циклопропилметил)-3-метил-1H-пурин-2,6(3H,7H)-дион (100 мг, 0,283 ммоль), фторид цезия (43,0 мг, 0,283 ммоль) растворяли в тетрагидрофуране (10 мл), добавляли триметилтрифторметилсилан (60,4 мг, 0,424 ммоль) при комнатной температуре и перемешивали в течение 12 часов. Реакционную смесь гасили посредством добавления воды (20 мл). Реакционную смесь экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. И далее очищали остаток посредством препаративной высокоэффективной жидкостной хроматографии с получением 7-(циклопропилметил)-3-метил-1-((5-метил-2-(1,1,1-трифтор-2-гидроксипропан-2-ил)тиазол-4-ил)метил)-1H-пурин-2,6-(3H,7H)-диона (10,0 мг, твердое вещество желтого цвета), выход: 8%.1H ЯМР: (400 МГц, метанол-d4) δ 8,92 (s, 1H), 8,75 (d, J = 7,6 Гц, 1H), 8,09 (d, J = 7,6 Гц, 1H), 7,97 (s, 1H), 5,54 (s, 1H), 4,21 (d, J = 7,6 Гц, 2H), 3,58 (s, 3H), 1,45-1,42 (m, 1H), 0,64-0,59 (m, 2H), 0,50-0,46 (m, 2H). MS-ESI: рассч. для [M+H]+ 424, обнаружено 424.
Вариант осуществления 57
1-((4-Гидрокси-4-(трифторметил)циклогексил)метил)-7-изобутил-3-метил-1H-пурин-2,6(3H,7H)-дион

Этап 1
1-(1,4-Диоксаспиро[4.5]декан-8-илметил)-7-изобутил-3-метил-1H-пурин-2,6(3H,7H)-дион
[301] 1,4-Диоксаспиро[4,5]декан-8-илметил метансульфонат (1,07 г, 4,81 ммоль), 7-изобутил-3-метил-1H-пурин-2,6(3H,7H)-дион (1,00 г, 4,01 ммоль) и карбонат калия (647 мг, 4.81 ммоль) растворяли в N,N-диметилформамиде (14 мл), добавляли йодид калия (66,5 мг, 0,401 ммоль) и реакционную смесь нагревали до 130°C и перемешивали при температуре флегмы в течение 3 часов. Реакционный раствор непосредственно фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-7-изобутил-3-метил-1H-пурин-2,6(3H,7H)-диона (2,56 г неочищенного продукта, масло коричневого цвета). MS-ESI: рассч. для [M+H]+ 377, обнаружено 377.
Этап 2
7-Изобутил-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион
[302] 1-(1,4-диоксаспиро[4.5]декан-8-илметил)-7-изoбутил-3-метил-1H-пурин-2,6(3H,7H)-дион (2,50 г, 6,00 ммоль) растворяли в ацетоне (12 мл), добавляли 4 н. водный раствор соляной кислоты (2 мл). Реакционную смесь перемешивали при 30°C в течение ночи и доводили pH до 7 посредством добавления насыщенного водного раствора бикарбоната натрия (8 мл). Добавляли в реакционный раствор воду (100 мл), который потом экстрагировали этилацетатом (150 мл × 3), органическую фазу сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении, получаемый в результате продукт очищали посредством колоночной хроматографии на силикагеле (1:2 петролейный эфир/этилацетат, Rf = 0,3) с получением продукта 7-изобутил-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-диона (150 мг, твердое вещество белого цвета), выход: 13%.1H ЯМР: (400 МГц, метанол-d4) δ 7,94 (s, 1H), 4,14 (d, J = 7,6 Гц, 2H), 3,99 (d, J = 7,6 Гц, 2H), 3,55 (s, 3H), 2,29-2,38 (m, 5H), 2,20-2,13 (m, 1H), 2,03-1,98 (m, 2H), 1,53-1,47 (m, 2H), 0,92 (d, J = 6,4 Гц, 6H). MS-ESI: рассч. для [M+H]+ 333, обнаружено 333.
Этап 3
1-((4-Гидрокси-4-(трифторметил)циклогексил)метил)-7-изобутил-3-метил-1H-пурин-2,6(3H,7H)-дион
[303] 7-Изобутил-3-метил-1-((4-оксоциклогексил)метил)-1H-пурин-2,6(3H,7H)-дион (150 мг, 0,450 ммоль) и фторид цезия (8,0 мг, 0,0450 ммоль) растворяли в тетрагидрофуране (3 мл), в атмосфере газообразного азота добавляли трифторметилтриметилсилан (950 мг, 0,640 ммоль). Реакционную смесь перемешивали при 30°C в течение 16 часов. Добавляли 4 н. водный раствор соляной кислоты (3 мл) и после перемешивания при 25°C в течение получаса подымали показатель рН реакционной смеси до 7 посредством добавления насыщенного водного раствора бикарбоната натрия (15 мл), добавляли воду (50 мл) и экстрагировали этилацетатом (50 мл × 3), органическую фазу сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали посредством препаративной высокоэффективной жидкостной хроматографии с получением продукта 1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-7-изобутил-3-метил-1H-пурин-2,6(3H,7H)-диона (86,0 мг, твердое вещество белого цвета), выход: 48%.1H ЯМР: (400 МГц, метанол-d4) δ 7,93 (s, 1H), 4,15-4,04 (m, 2H), 3,89 (d, J = 7,6 Гц, 1H), 3,54 (s, 3H), 2,20-1,98 (m, 3H), 1,86-1,79 (m, 2H), 1,61-1,42 (m, 5H), 0,92 (d, J = 6,4 Гц, 6H). MS-ESI: рассч. для [M+H]+ 403, обнаружено 403.
Вариант осуществления 58


[304] 1-((4-гидрокси-4-(трифторметил)циклогексил)метил)-7-изобутил-3-метил-1H-пурин-2,6(3H,7H)-дион (900 мг, 2.24 ммоль) разделяли посредством препаративной SFC с получением двух изомеров. Условия разделения для изомера 1: колонка: AD 250 мм x 30 мм, 5 мкм; подвижная фаза: A: углекислый газ в сверхкритическом состоянии, B: этанол (0,05% аммиак), A: B = 80:20; объемный расход: 50 мл/мин. длина волны: 220 нм. Условия разделения для изомера 2: колонка: WEEK-1 300 мм × 25 мм, 5 мкм; подвижная фаза: A: углекислый газ в сверхкритическом состоянии, B: этанол (0,05% аммиак), A: B = 60:40, объемный расход: 60 мл/мин., длина волны: 220 нм.
[305] Продукт 1 (изомер 1, первый пик) (216 мг, твердое вещество белого цвета), выход: 36%.1H-ЯМР (400 МГц, DMSO-d6) δ 8.09 (s, 1H), 5.65 (s, 1H), 4.07 (d, J = 7.2 Гц, 2H), 3.90 (d, J = 7.2 Гц, 2H), 3.43 (s, 3H), 2.14-2.00 (m, 2H), 1.92-1.80 (m, 2H), 1.77-1.66 (m, 2H), 1.52-1.44 (m, 2H), 1.37-1.30 (m, 2H) , 0.84 (d, J = 6.4 Гц, 6H). MS-ESI: рассч. для [M+H]+ 403, обнаружено 403.
[306] Продукт 2 (изомер 2, второй пик) (101 мг, твердое вещество белого цвета), выход 37%.1H-ЯМР (400 МГц, DMSO-d6) δ 8,07 (s, 1H), 5,64 (s, 1H), 4,05 (d, J = 7,6 Гц, 2H), 3,75 (d, J = 7,6 Гц, 2H), 3,42 (s, 3H), 2,16-2,03 (m, 1H), 1,71-1,66 (m, 3H), 1,48-1,30 (m, 6H), 0,83 (d, J = 6,4 Гц, 6H). MS-ESI: рассч. для [M+H]+ 403, обнаружено 403.
Вариант осуществления 59
7-(2,3-Дигидроксипропил)-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-дион


Этап 1
7-((2,2-Диметил-1,3-диоксолан-4-ил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[307] 3-метил-1H-пурин-2,6(3H,7H)-дион (200 мг, 1,20 ммоль), карбонат натрия (128 мг, 1,20 ммоль), 4-(хлорметил)-2,2-диметил-1,3-диоксолан (217 мг, 1,44 ммоль) и йодид калия (20,0 мг, 0,120 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 110°C и подвергали реакции в течение 36 часов. Реакционную смесь гасили посредством добавления воды (10 мл), потом реакционную смесь экстрагировали этилацетатом (10 мл × 3) и органическую фазу промывали насыщенным солевым раствором (5 мл), сушили над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,5) с получением 7-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион (169 мг, твердое вещество желтого цвета), выход: 50%. MS-ESI: рассч. для [M+H]+ 281, обнаружено 281.
Этап 2
Этил-5-(7-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пуринан-1-ил)валат
[308] 7-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3-метил-1H-пурин-2,6(3H,7H)-дион (169 мг, 0.604 ммоль), этил бромвалерат (178 мг, 0.906 ммоль), карбонат калия (167 мг, 1.21 ммоль) и йодид калия (20,0 мг, 0.0600 ммоль) растворяли в N,N-диметилформамид (10 мл). Реакционный раствор нагревали до 130°C, подвергали реакции в течение 3 часов, потом реакционную смесь фильтровали и концентрировали, выделяли остаток и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,4) с получением этил-5-(7-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пуринан-1-ил)валата (124 мг, твердое вещество желтого цвета), выход: 50%. MS-ESI: рассч. для [M+H]+ 409, обнаружено 409.
Этап 3
7-((2,2-диметил-1,3-диоксолан-4-ил)метил)-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[309] Этил 5-(7-((2,2-диметил-1,3-диоксолaн-4-ил)метил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пуринан-1-ил)валат (30,0 мг, 0,0750 ммоль) растворяли в безводном тетрагидрофуране (1 мл), этилмагния бромид (3 M раствор тетрагидрофурана, 0,15 мл, 0,450 ммоль) медленно добавляли по каплям при -65°C. Реакционную смесь подвергали реакции при -65°C в течение 0,5 часа а затем подвергали реакции при 0°C в течение 0,5 часа. Реакционную смесь гасили посредством вливания реакционного раствора в воду (5 мл), что потом экстрагировали этилацетатом (5 мл × 3), сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении и очищали с помощью пластин для препаративной TLC (этилацетат, Rf = 0,5) с получением 7-((2,2-диметил-1,3-диоксолан-4-ил)метил)-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-диона (20,0 мг, масло желтого цвета), выход: 63%. MS-ESI: рассч. для [M+H]+ 423, обнаружено 423.
Этап 4
7-(2,3-Дигидроксипропил)-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[310] 7-((2,2-диметил-1,3-диоксолан-4-ил)метил)-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-дион (20.0 мг, 0,0470 ммоль) растворяли в безводном тетрагидрофуране (1 мл) и разбавленной соляной кислоте (0,3 мл), подвергали реакции при 25°C в течение 36 часов. После того, как реакция завершилась, реакционную смесь концентрировали при пониженном давлении и очищали с помощью пластин для препаративной TLC (этилацетат/метанол 8:1, Rf = 0,3) с получением 7-(2,3-дигидроксипропил)-1-(5-этил-5-гидроксигептил)-3-метил-1H-пурин-2,6(3H,7H)-диона (5,0 мг, твердое вещество белого цвета), выход: 28%.1H ЯМР: (400 МГц, метанол-d4) δ 7.90 (s, 1H), 4.57-4.53 (m, 1H), 4.26-4.22 (m, 1H), 4.03-3.96 (m, 3H), 3.58-3.55 (m, 2H), 3.54 (s, 3H), 1.66-1.61 (m, 2H), 1.48-1.44 (m, 6H), 1.34-1.29 (m, 2H), 0.85 (t, J = 8.0 Гц, 6H). MS-ESI: рассч. для [M+H]+ 383, обнаружено 383.
Вариант осуществления 60
1-(5-Этил-5-гидроксигептил)-7-(2-гидроксиэтил)-3-метил-1H-пурин-2,6(3H,7H)-дион


Этап 1
7-(2-Гидроксиэтил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[311] 3-метил-1H-пурин-2,6(3H,7H)-дион (1,00 г, 6,00 ммоль), карбонат калия (830 мг, 6,00 ммоль) растворяли в N,N-диметилформамиде (10 мл). Реакционный раствор нагревали до 80°C в течение 0,5 часа и добавляли 2-бромэтанол (900 мг, 7,20 ммоль). Реакционный раствор нагревали до 130°C и подвергали реакции в течение ночи. Реакционный раствор концентрировали с получением неочищенного 7-(2-гидроксиэтил)-3-метил-1H-пурин-2,6(3H,7H)-диона, который непосредственно использовали на следующем этапе.
Этап 2
Этил-5-(7-(2-гидроксиэтил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)валат
[312] 7-(2-гидроксиэтил)-3-метил-1H-пурин-2,6(3H,7H)-дион (1,05 г, 5,00 ммоль), этил 5-бромвалерат (1,25 г, 6,00 ммоль) и карбонат калия (1,66 г, 12,0 ммоль) растворяли в N,N-диметилформамиде (3 мл). Реакционный раствор нагревали до 130°C в течение 3 часов. Реакционную смесь гасили посредством вливания реакционного раствора в воду (20 мл) и смесь потом экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении, выделяли остаток и очищали с помощью пластин для препаративной TLC с получением этил-5-(7-(2-гидроксиэтил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)валата (700 мг, масло желтого цвета), выход: 35%. MS-ESI: рассч. для [M+H]+ 339, обнаружено 339.
Этап 3
1-(5-Этил-5-гидроксигептил)-7-(2-гидроксиэтил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[313] Этил 5-(7-(2-гидроксиэтил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пурин-1-ил)валат (700 мг, 2,07 ммоль) растворяли в безводном тетрагидрофуране (7 мл), этилмагния бромид (3 M раствор тетрагидрофурана, 7 мл, 2,10 ммоль) медленно добавляли по каплям при -78°C. Реакционный раствор подвергали реакции при -78°C в течение 1 часа. Реакционную смесь гасили посредством вливания реакционного раствора в воду (20 мл) и смесь экстрагировали этилацетатом (20 мл × 3). Органическую фазу сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении, остаток выделяли и очищали посредством высокоэффективной жидкостной хроматографии с получением 1-(5-этил-5-гидроксигептил)-7-(2-гидроксиэтил)-3-метил-1H-пурин-2,6(3H,7H)-диона (110 мг, твердое вещество белого цвета), выход: 15%.1H ЯМР: (400 МГц, метанол-d4): δ 7,90 (s, 1H), 4,41 (t, J = 5,0 Гц, 2H), 4,00 (t, J = 7,6 Гц, 2H), 3,87 (t, J = 5,0 Гц, 2H), 1,68-1,59 (m, 2H), 1,50-1,42 (m, 5H), 1,39-1,29 (m, 3H), 0,95-0,77 (m, 6H). MS-EеSI: рассч. для [M+H-H2O]+ 335, обнаружено 335.
Вариант осуществления 61
1-(5-Этил-5-гидроксигептанол)-7-(2-гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-1H-2,6(3H,7H)-дион


Этап 1
1-Бром-3-((2-гидроксиэтил)(метил)амино)пропан-2-ол
[314] 2-(Метиламино)этанол (135 мг, 1,80 ммоль) растворяли в N,N-диметилформамиде (5 мл), 2-(Бромметил)оксиран (206 мг, 1.51 ммоль) добавляли и подвергали реакции при комнатной температуре в течение 1,5 часов. После того, как реакция завершилась, реакционный раствор непосредственно использовали на следующем этапе реакции.
Этап 2
7-(2-Гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-1H-пурин-2,6(3H,7H)-дион
[315] 3-метил-1H-пурин-2,6(3H,7H)-дион (100 мг, 0,602 ммоль), карбонат натрия (64,0 мг, 0,602 ммоль) и йодид калия (10,0 мг, 0,0600 ммоль) добавляли к раствору 1-бром-3-((2-гидроксиэтил)(метил)амино)пропан-2-ола. Реакционный раствор нагревали до 80°C и подвергали реакции в течение 10 часов. После того, как реакция завершилась, реакционную смесь фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта 7-(2-гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-1H-пурин-2,6(3H,7H)-диона, который непосредственно использовали на следующем этапе. MS-ESI: рассч. для [M+H]+ 298, обнаружено 298.
Этап 3
Этил-5-(7-(2-гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пуринан-1-ил)валат
[316] 7-(2-гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-1H-пурин-2,6(3H,7H)-дион (170 мг, 0.572 ммоль), этилбромвалерат (169 мг, 0,858 ммоль), карбонат калия (158 мг, 1,14 ммоль) и йодид калия (10,0 мг, 0,0570 ммоль) растворяли в N,N-диметилформамиде (5 мл). Реакционный раствор нагревали до 130°C и подвергали реакции в течение 3 часов. Реакционный раствор гасили посредством вливания в воду (5 мл), экстрагировали этилацетатом (10 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали, выделяли и очищали с помощью пластин для препаративной TLC (8:1 дихлорметан/метанол, Rf = 0,4) с получением этил 5-(7-(2-гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пуринан-1-ил)валата (118 мг, масло желтого цвета), выход: 49%. MS-ESI: рассч. для [M+H]+ 426, обнаружено 426.
Этап 4
1-(5-Этил-5-гидроксигептолол)-7-(2-гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-1H-2,6(3H,7H)-дион
[317] Этил-5-(7-(2-гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-2,6-диоксо-2,3,6,7-тетрагидро-1H-пуринан-1-ил)валат (100 мг, 0,235 ммоль) растворяли в безводном тетрагидрофуране (4 мл) и медленно добавляли по каплям бромэтилмагний (3 M раствор тетрагидрофурана, 0,47 мл, 1,41 ммоль) при -65°C. Реакционную смесь подвергали реакции при -65°C в течение 0,5 часа, а затем подвергали реакции при 0°C в течение 0,5 часа. После завершения реакции реакционный раствор гасили посредством вливания в воду (5 мл), экстрагировали этилацетатом (5 мл × 3), который затем сушили над безводным сульфатом натрия, фильтровали, концентрировали при пониженном давлении, выделяли и очищали с помощью пластин для препаративной TLC (6:1 этилацетат/метанол, Rf = 0,3) с получением 1-(5-этил-5-гидроксигептанол)-7-(2-гидрокси-3-((2-гидроксиэтил)(метил)амино)пропил)-3-метил-1H-2,6(3H,7H)-диона (3,0 мг, твердое вещество белого цвета), выход: 3%.1H ЯМР: (400 МГц, метанол-d4) δ 7.92 (s, 1H), 4.91-4.59 (m, 2H), 4.52-4.39 (m, 3H), 4.30-4.25 (m, 2H), 4.03-3.99 (m, 2H), 3.88-3.84 (m, 2H), 3.55 (s, 3H), 2.90 (s, 3H), 1.68-1.59 (m, 4H), 1.48-1.45 (m, 6H), 0.88-0.84 (m, 6H). MS-ESI: рассч. для [M+H]+ 440, обнаружено 440.
[318] Пример эксперимента 1: Оценка активности в отношении ингибирования фосфодиэстеразы PDE2 in vitro.
[319] Цель эксперимента Проводили обнаружение замещенного флуоресцентного красителя Alexa Fluor 633 на антителах AMP/GMP с помощью анализа флуоресцентной поляризации для определения концентрации AMP/GMP, продуцированных в реакционной системе, что использовалось для расчета величин IC50 исследуемых соединений в отношении фосфодиэстеразы PDE2.
[320] Материалы для экспериментов
[321] Измеренный буферный раствор: 10 мМ трис-HCl, pH 7,5, 5 мМ MgCl2, 0,01% Brij 35, 1 мМ DTT и 1% DMSO.
[322] Фермент Экспрессия рекомбинантного непроцессированного белка PDE2A в клетках Sf9 насекомых с использованием N-концевой GST-метки за счет бакуловируса.
[323] Субстрат: 1 мкМ cGMP.
[324] Способ обнаружения:
[325] Антитело Transcreener® AMP2 / GMP2, флуоресцентный краситель AMP2/GMP2 AlexaFluor 633.
[326] Операции эксперимента
[327] Готовили ферментный раствор с использованием свежеприготовленного буферного раствора, а затем вносили в реакционные лунки, добавляли DMSO-растворы исследуемых соединений с помощью бесконтактной акустической системы дозирования нанолитрических объемов Echo550, а потом предварительно инкубировали при комнатной температуре в течение 10 минут, реакцию инициировали посредством добавления субстрата (1 μM cGMP), и далее подвергали реакции при комнатной температуре в течение 1 часа. Помимо этого, добавляли систему обнаружения (антитело AMP2 / GMP2 Transcreener®, флуоресцентный краситель AMP2/GMP2 AlexaFluor 633), проводили реакцию при комнатной температуре в течение 90 минут, определяли флуоресцентную поляризацию с применением Ex / Em 620/688.
[328] Интенсивность флуоресцентной поляризации преобразовывали в концентрацию (нМ) с помощью калибровочной кривой AMP/GMP. Производили расчет соответствующей ферментативной активности относительно контрольного опыта с DMSO, производили расчет величин IC50 и построение кривых с применением пакетов программного обеспечения Prism (GraphPad Software, Сан-Диего, шт. Калифорния, США).
[329] Результаты эксперимента
Таблица 1. Результаты испытаний касательно активности в отношении ингибирования фосфодиэстеразы PDE2.



Примечание: 10 μM≤ “+” < 50 μM, 1 μM ≤ “++” < 10 μM, “+++” < 1 μM; -- нет данных.
Вывод: соединения согласно настоящему изобретению обладают значительной или даже неожиданной активностью в отношении ингибирования протеазы PDE2A.
[330] Пример эксперимента 2 Оценка влияния соединений на TNF-α в LPS-индуцированной крови крыс in vitro
[331] Цель эксперимента. Определить влияние соединений на TNF-α в LPS-индуцированной крови крыс in vitro, оценить ингибирующее действие соединений на TNF-α в LPS-индуцированной крови крыс.
[332] Материалы для экспериментов
[333] Крысы Sprague Dawley (самцы, 210-260 г, возрастом 8-10 недель, Shanghai Slack);
[334] Набор Rat TNF-alpha Quantikine ELISA (R&D, #SRTA00).
[335] Операции эксперимента
[336] Готовили растворы исследуемых соединений с концентрацией 1 мМ, 40 мкл которых (конечная концентрация соединения составляла 100 мкМ) вносили соответственно в 48-луночные планшеты для культуры клеток. Крыс анестезировали изофлураном, производили забор сердечной крови (для антикоагуляции использовали гепарин). Кровь вносили в 48-луночные планшеты, в которых содержались исследуемые соединения, 320 мкл на лунку. 48-Луночные планшеты помещали в клеточный инкубатор и инкубировали в течение 30 минут, добавляли 40 мкл раствора LPS (100 мкг/мл), перемешивали, помещали в инкубатор и продолжали инкубировать. Через 5 часов 48-луночные планшеты вынимали, образцы крови переносили в 1,5 мл центрифужные пробирки, центрифугировали в центрифуге (4500 об/мин, 4°C, 5 минут), верхнюю плазму отделяли, замораживали после хранения и хранили в холодильной установке при -80°C. На следующий день измеряли уровни TNF-α в образцах плазмы с использованием набора R & D ELISA в соответствии с инструкциями к набору.
[337] Результаты эксперимента
Таблица 2. Результаты испытаний касательно активности в отношении ингибирования TNF-α.

Примечание: 60% ≤ “+” ≤ 80%; 80% ≤ “++” ≤ 100%; -- нет данных
Вывод: соединения согласно настоящему изобретению обладают значительной или даже неожиданной активностью в отношении ингибирования TNF-α.
[338] Пример эксперимента 3 Фармакокинетическая оценка соединений.
[339] Цель эксперимента Фармакокинетика исследуемых соединений у крыс SD.
[340] Материалы для экспериментов
[341] Крысы Sprague Dawley (самцы, 200-300 г, возрастом 7-9 недель, Shanghai Slack).
[342] Операции эксперимента
[343] Исследовали фармакокинетические характеристики у грызунов после внутривенного и перорального ведения соединений в соответствии со стандартным протоколом; в эксперименте соединение-кандидат составляли в прозрачный раствор и крысам производили однократную внутривенную инъекцию и пероральное введение. Растворители для внутривенного и перорального ведения представляли собой некоторую долю водного раствора гидроксипропил-β-циклодекстрина или физиологического раствора. В течение 24 часов производили забор образцов крови, центрифугировали (3000 g) 15 минут, надосадочную жидкость разделяли с получением образцов плазмы, осаждали белок путем добавления 4-кратного объема раствора ацетонитрила, который содержал внутренний стандарт, центрифугировали, а затем центрифугировали надосадочную жидкость после добавления равного объема воды, далее производили инъекцию надосадочной жидкости, количественно анализировали концентрацию в плазме путем анализа с помощью LC-MS/MS и рассчитывали фармакокинетические параметры, такие как максимальная концентрация, время достижения максимальной концентрации, скорость выведения, время полураспада, площадь под кривой зависимости концентрации лекарственного средства от времени, биодоступность и т.п.
[344] Результаты эксперимента
Таблица 3. Результаты испытаний фармакокинетики
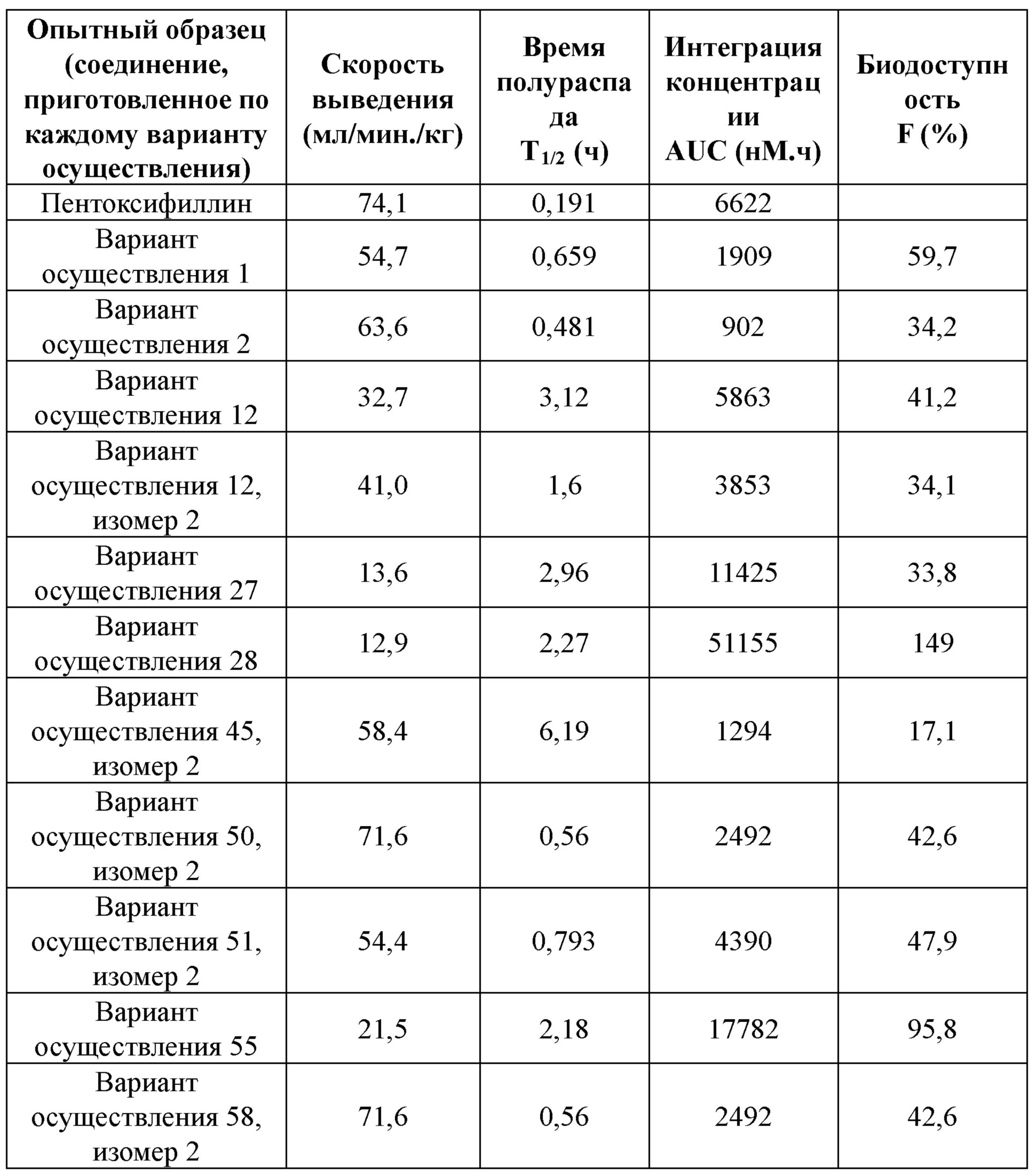
Вывод: соединения согласно настоящему изобретению могут значительно увеличить один или часть фармакокинетических показателей у крыс.
Реферат
Изобретение относится к новому соединению формулы (I), его (R)-изомеру или (S)-изомеру, или его фармацевтически приемлемой соли. Соединения обладают свойствами ингибиторов PDE2 или TNF-α и могут найти применение для лечения таких заболеваний, как например, легочная гипертензия. В соединении формулы (I)группаможет быть заменена наLотсутствует или означает C(R)(R'); каждый из R и R' независимо выбран из Н или необязательно замещенного С-Салкила или С-Сгетероалкила, содержащего в качестве гетероатома 1-2 атома кислорода, при этом заместители в R и R' выбраны из атомов галогена; при этом R, R' необязательно могут образовывать С-Сциклоалкил, 5-6-членный гетероциклоалкил с атомом кислорода в качестве гетероатома; А выбран изLвыбран из метилена,Rвыбран из необязательно замещенного С-Салкила, при этом заместители в Rвыбраны из атомов галогена, С-Салкила и С-Сциклоалкила. 4 н. и 3 з.п. ф-лы, 3 табл., 60 пр.
Формула

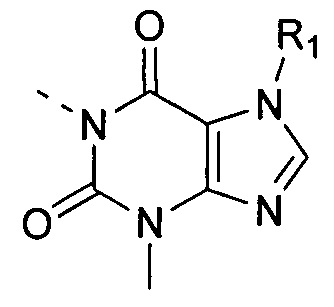






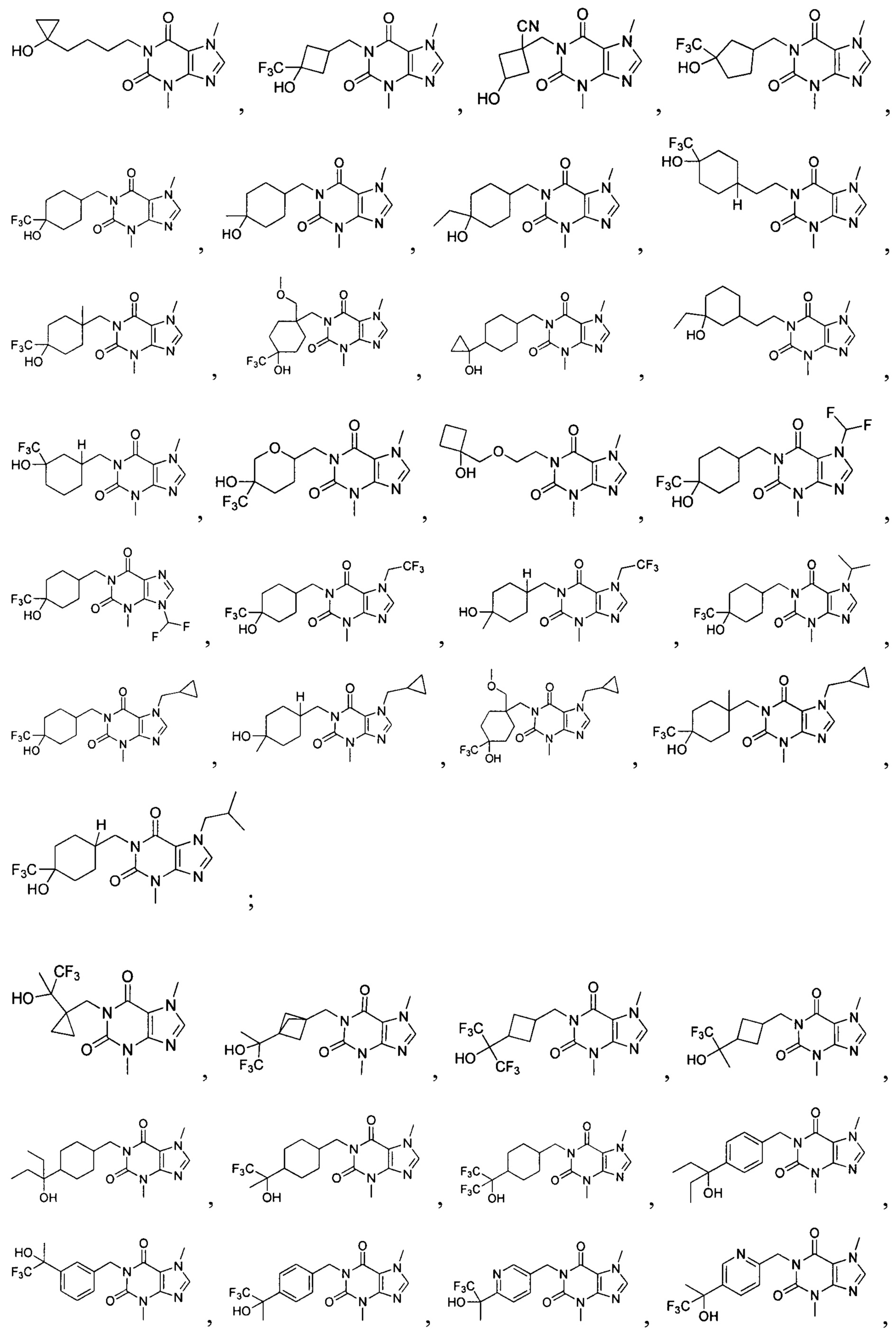

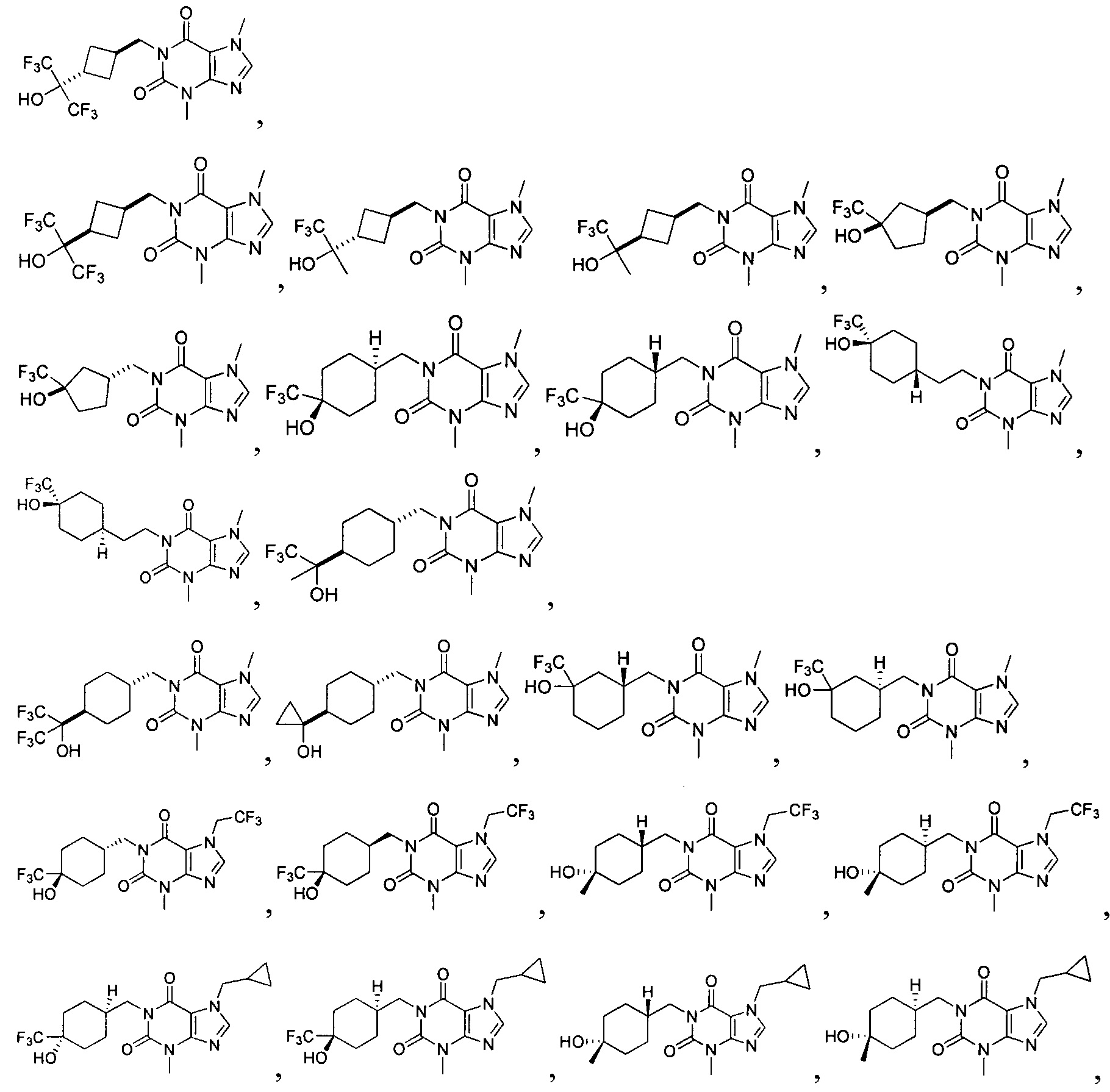


Комментарии