Местное применение антитела к hsv - RU2703903C2
Код документа: RU2703903C2
Чертежи




















Описание
Настоящее изобретение относится к антителу к HSV или его антигенсвязывающему фрагменту, предназначенному для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, которая вызывается HSV-1 или HSV-2, выбранной из группы, которая состоит из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения, а также к фармацевтической композиции, содержащей в эффективном количестве указанное антитело или его антигенсвязывающий фрагмент и по меньшей мере один фармацевтически приемлемый эксципиент.
Понятие «вирус герпеса простого» (HSV) относится к двум близко родственным представителям семейства герпесвирусов (Herpesviridae), вирусу герпеса простого типа 1 (HSV-1) и вирусу герпеса простого типа 2 (HSV-2). Вызываемые HSV-1 и HSV-2 инфекции относятся к наиболее распространенным во всем мире вирусным инфекциям. Вызываемые HSV-1 инфекции часто возникают в раннем детском возрасте в форме субклинических инфекций, хотя в ряде случаев они приводят к серьезному заболеванию. Заражение HSV-2, как правило, происходит при сексуальном контакте, и в основном он вызывает повреждения в области гениталий. Инфекции, вызываемые вирусом герпеса, подразделяют на несколько различных нарушений в зависимости от места инфекции. Оральный герпес (простой губной герпес), видимые симптомы которого называют лихорадочным герпесом или лихорадочными волдырями, представляет собой инфекцию на лице или во рту. Оральный герпес представляет собой наиболее распространенную форму инфекции. Генитальный герпес (простой генитальный герпес) представляет собой вторую из наиболее распространенных форм герпеса. Другие нарушения, такие как герпетический панацерий, герпес борцов-спортсменов, глазной герпес (простой герпес роговицы или простой герпетический кератит), вызываемый герпетической инфекцией энцефалит головного мозга, менингит Молларе, неонатальный герпес и, по-видимому, паралич Белла, все вызываются вирусом герпеса простого.
После первичного заражения HSV распространяется из инфицированных эпителиальных клеток в аксоны сенсорных нейронов, иннервирующих область первичной инфекции, после чего в результате ретроградного транспорта попадает в соответствующий дорсальный корневой ганглий, который становится латентным резервуаром для жизни HSV. HSV-инфекция нейронов находится в обратимом состоянии, и время от времени могут происходить эпизоды вирусной реактивации (вспышки). Реактивация вируса может запускаться широким разнообразием стрессовых стимулов (например, иммунодефицитом, травмой, высокой температурой, менструацией, УФ-светом и половым актом), которые воздействуют на нейрон или на периферическую область, иннервированную инфицированным ганглием, или воздействуют системно. Периодические реактивации HSV приводят к образованию инфекционных HSV в латентно инфицированных нейронах. После реактивации вирус транспортируется по нейрону назад в нервные окончания в эпителии.
Патология вызываемых HSV инфекций обусловлена главным образом прямым цитопатическим действием вируса, приводящим к клеточному лизису и очаговому некрозу инфицированной области. Вирус герпеса простого наиболее легко передается при прямом контакте с повреждением или общей водой организма инфицированного индивидуума. Оральный герпес легко диагностируется, если у пациента имеются видимые раны или язвы. Передача может осуществляться также при контакте кожа-с кожей во время периодов асимптоматического шелушения. Хотя большинство индивидуумов, инфицированных генитальным герпесом, являются асимптоматическими, могут возникать серьезные клинические проявления, прежде всего в популяциях, характеризующихся состояниями с ослабленным иммунитетом. HSV-2 увеличивает риск приобретения ВИЧ в два-три раза, а также передачу ВИЧ между дважды инфицированными индивидуумами. Кроме того, генитальный герпес может передаваться перинатально и вызывать угрожающую жизни неонатальную HSV-инфекцию. Методы с использованием барьеров для защиты являются наиболее надежными методами предупреждения передачи герпеса, однако они только снижают риск, но не устраняют его.
До настоящего времени не разработано лекарство от герпеса. После того, как однажды произошло инфицирование, вирус остается в организме на протяжении всей жизни. Время от времени может происходить повторное инфицирование (вспышки). Однако через несколько лет вспышки становятся менее серьезными и более спорадическими, и некоторые люди становятся постоянно асимптоматичными и более не испытывают вспышек, хотя они все еще могут оставаться заразными для других. Лечение противовирусными лекарственными средствами может снижать выделение вируса и ослаблять симптоматические эпизоды.
Простой губной герпес (который называют также лихорадочным герпесом, простым губным герпесом, рецидивирующим губным герпесом или оролабиальным герпесом) представляет собой тип простого герпеса, возникающего на губе, т.е. инфекцию, вызываемую вирусом герпеса простого (HSV). Вспышка, как правило, вызывает небольшие волдыри или язвы во рту или вокруг рта, которые обычно называют лихорадочным герпесом или лихорадочными волдырями. Язвы, как правило, заживают в течение 2-3 недель, но вирус герпеса остается в дремлющем состоянии в лицевых нервах после орофациальной инфекции, периодически реактивируясь (у симптоматических людей), в результате чего образуются язвы в той же самой области рта или лица, что и при первоначальной инфекции. Лихорадочный герпес возникает с определенной частотой, которая варьируется от редких эпизодов до 12 или большего количества рецидивов в год. Люди, находящиеся в таком состоянии, как правило, ежегодно испытывают от одного до трех приступов. Как правило, частота и серьезность вспышек снижается с течением времени.
Простой генитальный герпес (или генитальный герпес) представляет собой генитальную инфекцию, вызываемую вирусом герпеса простого. Проведенное в 1998 г. исследование продемонстрировало, что во многих случаях он представляет собой наиболее распространенную передаваемую половым путем инфекцию. Большинство индивидуумов, имеющих герпес, не знают, что они были инфицированы, и многие никогда не страдают от вспышек, при которых возникают волдыри, сходные с лихорадочным герпесом. Хотя исцеление от герпеса невозможно, указанные симптомы с течением времени становятся все более слабыми и вспышки становятся все более редкими. Как указано, HSV подразделяют на две различные категории, HSV-1 и HSV-2. Хотя ранее генитальный герпес вызывался в основном HSV-2, количество генитальных инфекций, вызываемых HSV-1, возрастает и в настоящее время на их долю приходится вплоть до 80% случаев инфекций. Когда инфекция является симптоматической, то типичным проявлением первичной вызываемой HSV-1 или HSV-2 генитальной инфекции являются кластеры генитальных язв, состоящих из воспаленных папул и везикул на внешней поверхности гениталий, которые напоминают лихорадочный герпес. Они появляются впервые, как правило, через 4-7 дней после контакта с HSV при половом акте. Рецидив генитальной инфекции, вызываемой HSV-1, возникает с частотой, составляющей примерно одну шестую от частоты генитальной инфекции, вызываемой HSV-2.
Простой герпетический кератит представляет собой воспаление глаза, вызываемое преимущественно рецидивирующей инфекцией роговицы, вызываемой HSV. Глазная инфекция, вызываемая HSV, может приводить к глазному заболеванию различной серьезности, от конъюнктивита и дендритного кератита до стромального отека и некротизирующего стромального кератита. На долю HSV-1 приходится более 90% глазных инфекций, вызываемых HSV, и он является главной причиной индуцируемой вирусом слепоты в развитых странах.
Кроме того, существуют другие, довольно редкие вызываемые HSV инфекции слизистой или эпидермальной ткани, которые вкратце описаны ниже.
Известны хронические или диссеминированные формы кожных инфекций, вызываемых вирусом герпеса простого, которые не ограничены лабиальной областью или генитальным трактом. В основном этим заболеванием поражены пациенты с иммунодефицитом, такие, например, как пациенты с гипогаммаглобулинемией или пациенты с кожными Т-клеточными лимфомами. Хронический простой кожный герпес представляет собой отличительное клиническое проявление присутствия вируса герпеса простого (HSV) в организме хозяина с ослабленным иммунитетом. Эту инфекцию можно определить как хронические активные деструктивные кожные повреждения, которые потенциально могут развиваться в диссеминированную (системную) форму. В то время как большинство вызываемых HSV инфекций проявляются в виде эпизодов, которые излечиваются в течение одной или двух недель, для повреждений при хроническом простом кожном герпесе характерно вяло текущее изменение, и они могут продолжаться в течение нескольких месяцев. Хронический простой кожный герпес, который распространен среди пациентов с ослабленным иммунитетом, отличается присутствием атипичных хронических и персистентных повреждений, которые ослабляют и замедляют установление диагноза. Это может приводить к смерти, вызываемой сопутствующими осложнениями. Жизненно важно, чтобы при оценке хронических язв, сохраняющихся в течение продолжительного времени, прежде всего, у детей, рассматривали возможность наличия хронической инфекции, вызываемой вирусом герпеса простого.
Герпес борцов-спортсменов представляет собой герпетическую кожную инфекцию, которая возникает в подростковом возрасте у борцов, но которая распространена также среди людей, занимающимися другими видами контактного спорта. Как правило, он возникает на голове, наиболее часто в области подбородка, шеи, груди, лица, живота и ног.
Герпетиформная экзема, известная также как форма вариоформного пустулеза Капоши, которая вызывается вирусной инфекцией, как правило, вирусом герпеса простого (HSV), представляет собой обширное везикулярное высыпание, которое возникает на фоне уже имеющегося кожного заболевания, как правило, атопического дерматита (AD). Для детей с AD существует более высокий риск развития герпетиформной экземы, наиболее распространенным патогеном которой является HSV типа 1 (HSV-1). Герпетиформная экзема может быть серьезной, прогрессируя до диссеминированной формы инфекции и приводя к смерти при отсутствии лечения.
Заболевания, вызываемые HSV, прежде всего, простой губной герпес и простой генитальный герпес, представляют собой наиболее распространенные заболевания кожи.
В настоящее время при осуществлении противовирусной терапии в случае HSV стандартом является применение вирустатических средств. Наиболее распространенные вирустатические средства (например, ацикловир, пенцикловир, фоскарнет, идоксуридин) представляют собой нуклеозидные или пирофосфатные аналоги, общий принцип действия которых основан на ингибировании синтеза ДНК в инфицированных вирусом клетках. Иными словами, указанные вирустатические средства обладают эффективностью только в инфицированных клетках пока вирус активно размножается. В двойном слепом плацебо-контролируемом исследовании с участием 1385 инфицированных пациентов, страдающих острой формой простого губного герпеса, было продемонстрировано, что ацикловир (в форме крема зовиракс позволял снижать продолжительность инфекции на 0,5 дней (а именно, с 5 дней до 4,5 дней) при ежедневном 5-кратном применении в течение 4 дней по сравнению с обработанными плацебо пациентами. Кроме того, указанная обработка имела недостаток, заключающийся в том, что она не позволяла предупреждать развитие повреждений, типичных для герпеса.
В последние годы были описаны мышиное и соответствующим образом гуманизированное антитело, специфически распознающее гликопротеин В (gB) HSV типа 1 (HSV-1) и HSV-2. HSV-gB представляет собой составную часть многокомпонентной слитой системы, которая требуется для проникновения вируса и слияния по типу клетка-клетка. Было продемонстрировано, что указанное антитело, а именно, моноклональное антитело 2с (МАт 2с), нейтрализует вирус, аннулируя распространение вируса от клетки к клетке, представляющий собой имеющий решающее значение механизм, посредством которого HSV-1/2 ускользает от гуморального иммунного надзора, независимо от антитело-обусловленной клеточной цитотоксичности (ADCC) и/или комплементзависимой цитотоксичности (CDC) (


Однако указанные антитела необходимо вводить только системно (а именно, например, путем внутривенного, внутримышечного или подкожного введения) в соответствии с принципом исключения орального введения антител вследствие их размера, гидрофобной природы и расщепления в желудке. Таким образом, известные из существующего уровня техники антитела не применяли местно на поверхности кожи, а применяли только системно.
В WO 2005/023303 описан метод лечения HSV путем внутривенного введения содержащих IgA фракций человеческой сыворотки или содержащих IgG фракций человеческой плазмы, хотя при этом упоминаются местное применение, а также заболевания губным герпесом и генитальным герпесом.
Хотя местное применение антител уже было описано ранее, такое применение предполагалось только для предупреждения передаваемых половым путем заболеваний, вызываемых HSV-2. У Sherwood и др., Nat. Biotechnol. 14(4), 1996, cc. 468-471 описаны результаты исследования профилактической пассивной иммунозащиты самок мышей от генитального герпеса путем местного применения антитела к HSV-2, проведенного на мышиной модели передаваемой через влагалище HSV-2-инфекции. Аналогично этому у Zeitlin и др., Virology 225(1), 1996, сс. 213-215, Zeitlin и др., Contraception 56(5), 1997, сс. 329-335, Zeitlin и др., J. Reprod. Immunol. 40(1), 1998, сс. 93-101 и Zeitlin и др., Nat. Biotechnol. 16(13), 1998, сс. 1361-1364 описано профилактическое местное применение антител к HSV-2 с целью предупреждения передачи HSV-2 половым путем.
Кроме того, ранее было описано, что антитело к TNF-альфа инфлуксимаб улучшает заживление хронических ран при его местном применении (Streit и др., International Wound Journal 3(3), 2006, сс. 171-179), было описано местное применение поликлональных и моноклональных антител против Pseudomonas aeruginosa (US 4994269). Кроме того, у Clement и др., ARVO, реферат/постер 6155/D1015, описано местное применение антитела, мишенью которого является фосфатидилсерин (PS), изученное на кроличьей модели острого кератита, вызываемого HSV-1, а у Yu и др., Eye Science 12(3), 1996, сс. 145-150 описано местное применение гликопротеинов, представляющих собой моноклональные антитела к HSV, при остром герпетическом кератите у кроликов, инфицированных HSV-1. В WO 2010/128053 описано применение фрагмента антитела, связывающегося с гликопротеином D вирусного поверхностного антигена, который нейтрализует HSV-1 и HSV-2, для местного введения в глаз для лечения глазных заболеваний типа глазного кератита.
Таким образом, существует необходимость в разработке улучшенных средств и методов лечения острых инфекций, вызываемых вирусом герпеса простого, которые облегчают осуществление режимов применения, известных в данной области, и позволяют предупреждать местное распространение инфекции.
В настоящем изобретении предложено антитело к HSV или его антигенсвязывающий фрагмент для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, которая вызывается HSV-1 или HSV-2, выбранной из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения, а также фармацевтическая композиция, содержащая в эффективном количестве указанное антитело или его антигенсвязывающий фрагмент и по меньшей мере один фармацевтически приемлемый эксципиент.
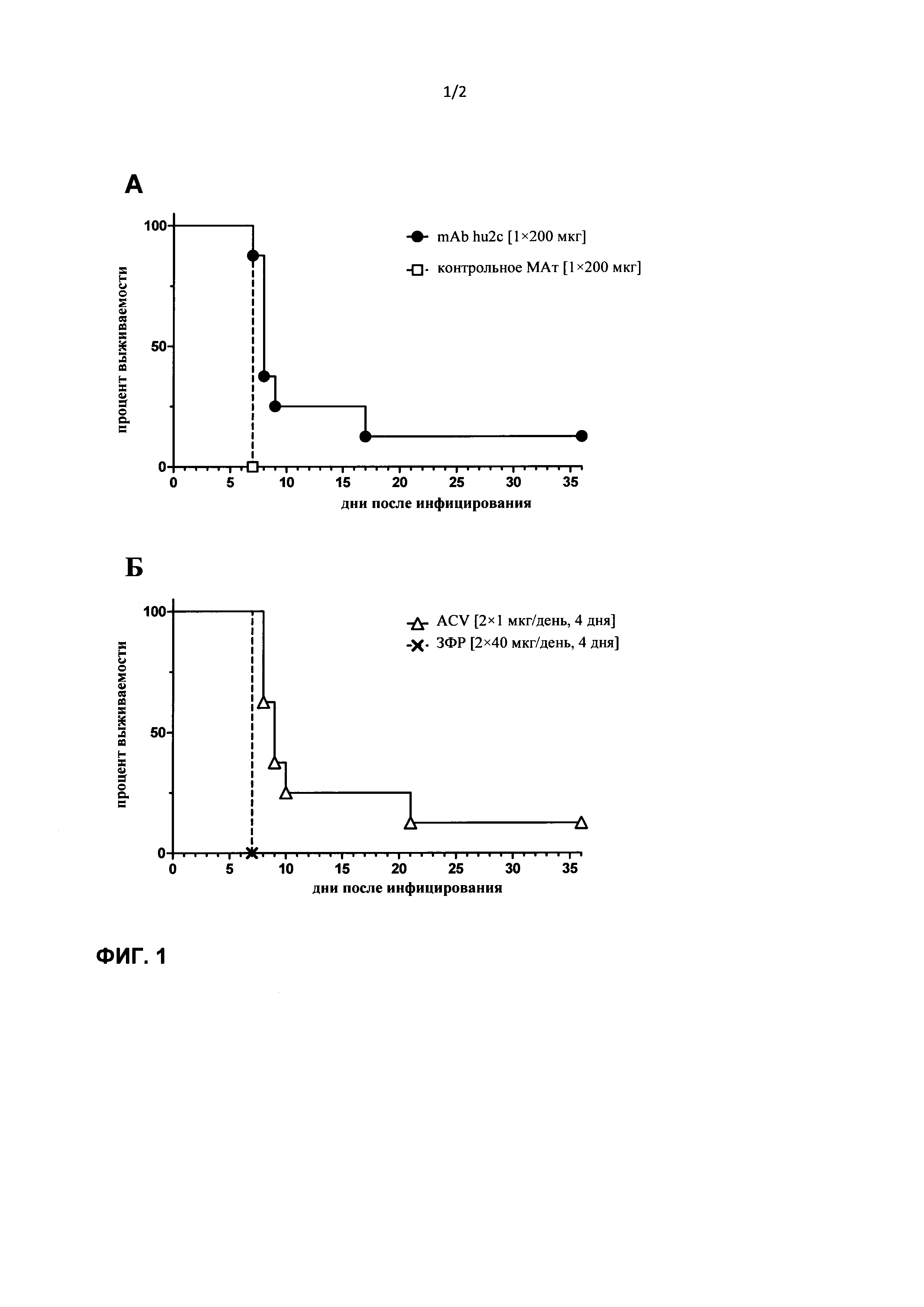
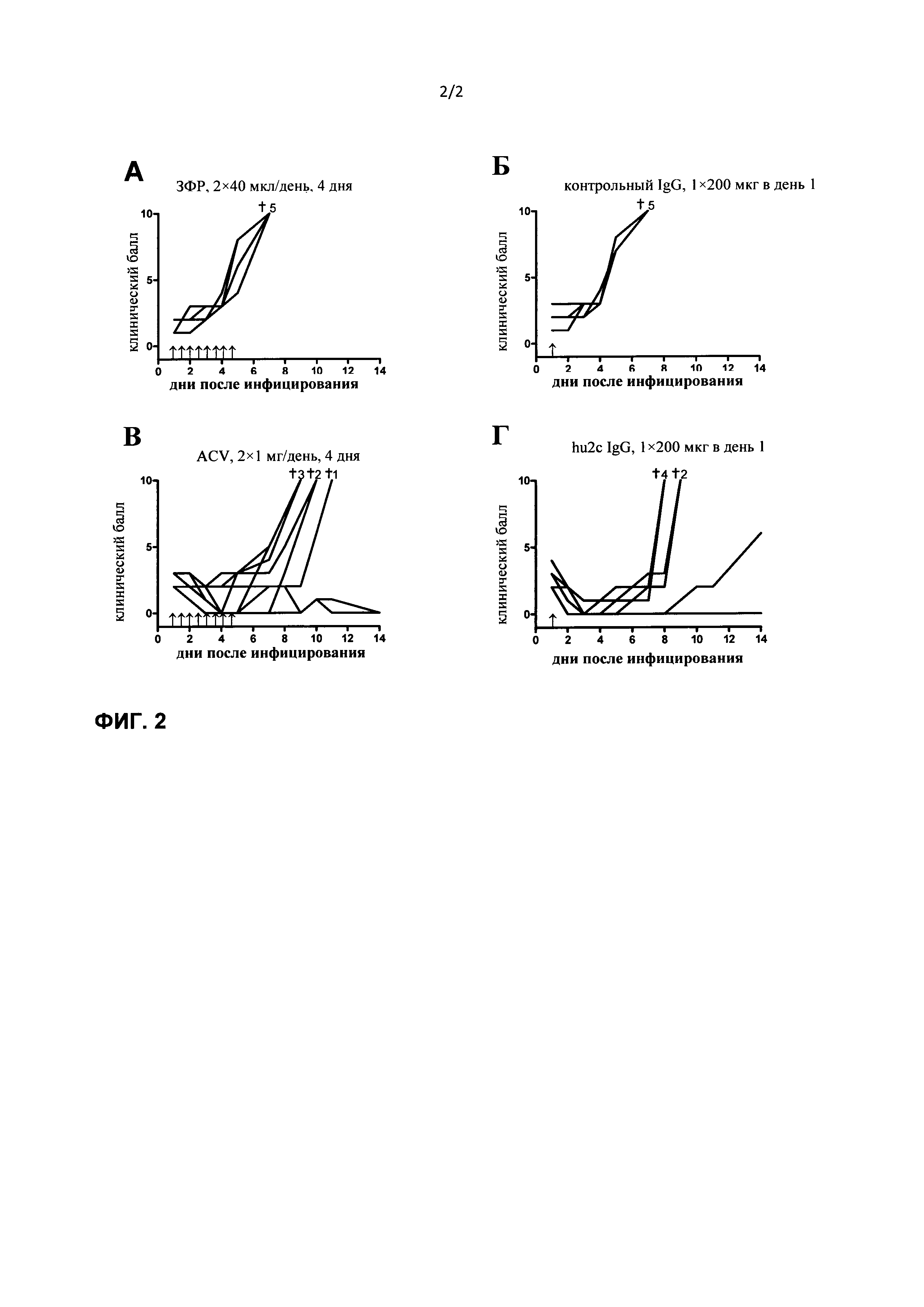
При создании настоящего изобретении неожиданно было установлено, что местное применение гуманизированного антитела к HSV при острой инфекции ткани губ в случае HSV-инфекции, позволяет устранять инфекцию в течение 24 ч, при этом предупреждается местное распространение вызываемой вирусом герпеса инфекции путем передачи от клетки к клетке, что позволяет избегать образования повреждений. В отличие от описанных выше вирустатических средств, применяемых для лечения вирусных инфекций типа простого губного герпеса антитело к HSV, предлагаемое и в настоящем изобретении, позволяет быстро нейтрализовать вирус посредством механизма, который не зависит от репликации вируса. Преимуществом является то, что, как было продемонстрировано, антитело, предлагаемое в изобретении, подавляет литический путь вируса, предупреждая тем самым повреждения кожи.
С учетом существующего уровня техники в основу настоящего изобретения была положена техническая задача разработать более эффективные средства и способы лечения острых инфекций, вызываемых вирусом герпеса простого, которые облегчают осуществление режимов применения, известных в данной области, и предупреждают местное распространение инфекции.
Указанная техническая задача решается с помощью вариантов осуществления, охарактеризованных в формуле изобретения.
Настоящее изобретение относится к антителу к HSV или его антигенсвязывающему фрагменту для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, которая вызывается HSV-1 или HSV-2, выбранной из группы, которая состоит из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения.
Как указано выше, при создании изобретения неожиданно было установлено, что, как продемонстрировано в прилагаемых примерах, местное применение гуманизированного антитела к HSV при острой инфекции ткани губ в случае HSV-инфекции приводит к быстрому устранению инфекции в течение 24 ч, при этом предупреждается местное распространение вызываемой вирусом герпеса инфекции путем передачи от клетки к клетке, что позволяет избегать образования повреждений.
Установление этого факта является особенно удивительным и неожиданным в свете обсужденных выше известных из существующего уровня техники данных, которые касаются системного введения, описанного у


В отличие от данных, известных из существующего уровня техники, было продемонстрировано, что местное применение гуманизированного антитела к HSV при острой инфекции ткани губ в случае HSV-инфекции приводит к быстрому устранению инфекции в течение 24 ч, при этом предупреждается местное распространение вызываемой вирусом герпеса инфекции путем передачи от клетки к клетке, что позволяет избегать образования повреждений.
Неожиданность указанного результата, а именно то, что гуманизированное антитело к HSV или его фрагмент можно применять для местной терапии рецидивирующих HSV-инфекций эпителия слизистой оболочки или кожи, является особенно удивительной и неожиданной, принимая во внимание основные сведения о структуре эпителия.
Слои человеческого кожного эпителия и эпителия слизистой мембраны физически отделяют организм от его окружения и служат в качестве первой линии структурной и функциональной защиты от дегидратации, воздействия химических субстанций, физических повреждений и микроорганизмов. Высоко поляризованные эпителиальные клетки образуют апикальные слои эпидермиса и менее дифференцированные клетки базальной области, где располагаются эпидермальные клетки-предшественники. Закрывающие соединения, так называемые плотные соединения (TJ), расположенные на латеральных плазматических мембранах большинства поверхностных живых слоев, зернистый слой (stratum granulosum) (Brandner и др., Eur J Cell Biol 81, 2002, cc. 253-263; Furuse и др., J Cell Biol 156, 2002, cc. 1099-1111) выполняет функцию эпидермального барьера между апикальным слоем (роговичный слой (stratum corneum)) и базолатеральными слоями (шиповатый слой (stratum spinosum), основной (цилиндрический) слой (stratum basale) и базальная пластинка (lamina basale)).
Основным местом репликации HSV и производства вирусного потомства в коже являются слабо дифференцированные пролиферирующие кератиноциты базальной области (основной слой) (Mingo и др., J Virol 86, 2012, сс. 7084-7097; Schelhaas и др., J Gen Virol 84, 2003, сс. 2473-2484).
Для патогенеза первичной инфекции необходимо, чтобы HSV достиг доступных имеющих ядра клеток в среднем-базальном эпидермисе через микроскопические бреши в эпидермисе, которые возникают, например, при половом акте.
Реактивация генома HSV из латентного состояния в ганглиях приводит к транспортированию новых образовавшихся вирионов через микротрубочки аксонов к синаптическим окончаниям в дермально-эпидермальном стыке или в среднем слое эпидермиса (Diefenbach и др., Rev Med Virol 18, 2008, сс. 35-51). HSV необходимо пройти через брешь между аксоном и эпителием для последующей репликации в базальной области эпидермиса.
Гуморальный иммунитет играет важную роль в контроле вызываемой HSV инфекции. При инфекции образуются антитела, циркулирующие в сыворотке, которые могут связывать гликопротеины вирусной оболочки, необходимые для проникновения вируса (Cohen и др., Journal of virology 49, 1984, сс. 102-108). Было установлено, что присутствие в материнской сыворотке специфических в отношении HSV антител снижает неонатальный перенос HSV-2 (Brown и др., N Engl J Med 324, 1991, сс. 1247-1252). Нейтрализующие антитела, присутствующие в сыворотке, обладают способностью связывать вирус в бреши между нейронными окончаниями и эпителиальными клетками и ограничивать перенос вируса в обоих направлениях между этими тканями (Mikloska и др., Journal of virology 73, 1999, сс. 5934-5944). Очевидно, что антитела, присутствующие в сыворотке, или введенные системным путем антитела ограничивают уровень HSV-инфекции.
Однако, плотные соединения (TJ), которые ограничивают зернистый слой, образуют барьер для более крупных молекул (Helfrich и др., J Invest Dermatol 127, 2007, сс. 782-791; Mertens и др., J Cell Biol 170, 2005, cc. 1029-1037; Yuki и др., Exp Dermatol 16, 2007, cc. 324-330). Поэтому в высшей степени неожиданно, что местное нанесение крупной молекулы, такой как антитело, на наружную поверхность кожи позволяет эффективно устранять рецидивирующую HSV-инфекцию и предупреждать образование повреждений. Таким образом, по указанной причине является неожиданным, что, как продемонстрировано в примерах, локальное, местное применение позволяет быстрее устранять инфекцию по сравнению с системным применением (введением).
Кроме того, хотя из существующего уровня техники известна защита от передаваемой половым путем первичной вызываемой HSV-2 инфекции посредством местного профилактического применения антител к HSV, лечение острой инфекции является неожиданным, поскольку в известных из существующего уровня техники экспериментальных условиях, описанных выше, антитела к HSV вводили местно во влагалище перед внесением вирусного инокулята. Нейтрализация вирусной загрузки происходила примерно таким же образом, как и в условиях двумерного анализа нейтрализации in vitro, в котором нейтрализующие антитела предупреждали присоединение свободных вирусных частиц к клеткам-мишеням, и репликация вируса фактически не происходила. Это разительно отличается от лечения острой инфекции, когда, как неожиданно было установлено, инфекцию можно быстро устранять посредством местного применения антитела, предлагаемого в настоящем изобретении, как это проиллюстрировано в примерах.
Кроме того, хотя из существующего уровня техники известно лечение острого кератита, вызываемого вирусом герпеса простого, путем местного применения антитела к гликопротеину HSV, применение антитела к HSV или его антигенсвязывающего фрагмента для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, выбранной из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, когда указанное антитело применяют местно, является неожиданным по следующим причинам. Основной областью репликации HSV и производства потомства вируса в коже являются слабо дифференцированные пролиферирующие кератиноциты базальной области (Mingo и др., J Virol 86, 2012, cc. 7084-7097; Schelhaas и др., J Gen Virol 84, 2003, cc. 2473-2484). Было продемонстрировано, что плотные соединения (TJ), которые ограничивают зернистый слой, образуют барьер для более крупных молекул (Helfrich и др., J Invest Dermatol 127, 2007, сс. 782-791; Mertens и др., J Cell Biol 170, 2005, cc. 1029-1037; Yuki и др., Exp Dermatol 16, 2007, cc. 324-330). Поэтому в высшей степени неожиданно, что местное нанесение крупной молекулы, такой как антитело, на наружную поверхность кожи позволяет эффективно устранять рецидивирующую HSV-инфекцию и предупреждать образование повреждений.
В отличие от кожного эпителия и эпителия слизистой мембраны роговица глаза представляет собой некератинизированный стратифицированный плоскоклеточный эпителий, который является очень тонким и состоит из быстро растущих и легко регенерирующих клеток. Все слои глазного эпителия постоянно подвергаются митозу. Роговичный эпителий представляет собой гладкую поверхность, которая абсорбирует кислород и питательные вещества для клеток из слез и затем распределяет питательные вещества по остальной части роговицы. Другое важное различие между кожным эпителием и эпителием слизистой мембраны состоит в определенной степени неплотности роговичного эпителия, что является важным для диффузии питательных веществ. Ультразвуковые исследования роговичного эпителия подтвердили, что существуют бреши в специфических белках плотных соединений и что плотные соединения роговицы представляют собой «негерметичные» соединения (Barry и др., Invest Ophthalmol Vis Sci 36, 1995, cc. 1115-1124; Noske и др., Ger J Ophthalmol 3, 1994, cc. 253-257; Petroll и др., Curr Eye Res 18, 1999, cc. 10-19). Роговица глаза представляет собой иммунологически привилегированную область. Поверхность глаза постоянно покрыта слезной пленкой, которая помимо того, что состоит в основном из воды, содержит также многочисленные белки, обладающие противовирусной активностью, такие как антитела в виде иммуноглобулина А, лизоцим, белки системы комплемента и амилаза. Было продемонстрировано присутствие антител к HSV в слезах (Centifanto и др., Ann NY Acad Sci 173, 1970, cc. 649-656; Fox и др., The British journal of ophthalmology 70, 1986, cc. 584-588; Shani и др., Curr Eye Res 4, 1985, cc. 103-111). Следовательно, местное применение рекомбинантных антител может оказаться благоприятным при лечении глазных герпетических инфекций. Однако, по указанным выше причинам оказалось неожиданным, что местное нанесение крупной молекулы, такое как антитело, на наружную поверхность кожи позволяет эффективно устранять рецидивирующую HSV-инфекцию и предупреждать образование повреждений.
Специалистам в данной области хорошо известны инфекции слизистой или эпидермальной ткани, подлежащие лечению с помощью антитела к HSV или его антигенсвязывающего фрагмента, которые вызываются HSV-1 или HSV-2, а именно, инфекции, выбранные из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, и они являются хорошо изученными заболеваниями. Как уже упоминалось выше, простой губной герпес (который называют также лихорадочным герпесом, простым губным герпесом, рецидивирующим губным герпесом или оролабиальным герпесом) представляет собой тип простого герпеса, возникающего на губе, т.е. инфекцию, вызываемую вирусом герпеса простого (HSV). Вспышка, как правило, вызывает небольшие волдыри или язвы на или вокруг рта, которые обычно называют лихорадочным герпесом или лихорадочными волдырями. Язвы, как правило, заживают в течение 2-3 недель, но вирус герпеса остается в дремлющем состоянии в лицевых нервах после орофациальной инфекции, периодически реактивируясь (у симптоматических людей), в результате чего образуются язвы в той же самой области рта или лица, что и при первоначальной инфекции. Лихорадочный герпес возникает с определенной частотой, которая варьируется от редких эпизодов до 12 или большего количества рецидивов в год. Люди, находящиеся в таком состоянии, как правило, ежегодно испытывают от одного до трех приступов. Как правило, частота и серьезность вспышек снижается с течением времени.
Простой генитальный герпес (или генитальный герпес) представляет собой генитальную инфекцию, вызываемую вирусом герпеса простого. Проведенное в 1998 г. исследование продемонстрировало, что во многих случаях он представляет собой наиболее распространенную передаваемую половым путем инфекцию. Большинство индивидуумов, имеющих герпес, не знают, что они были инфицированы, и многие никогда не страдают от вспышек, при которых возникают волдыри, сходные с лихорадочным герпесом. Хотя исцеление от герпеса невозможно, указанные симптомы с течением времени становятся все более слабыми и вспышки становятся все более редкими. Как указано, HSV подразделяют на две различные категории, HSV-1 и HSV-2. Хотя ранее генитальный герпес вызывался в основном HSV-2, количество генитальных инфекций, вызываемых HSV-1, возрастает и в настоящее время на их долю приходится вплоть до 80% случаев инфекций. Когда инфекция является симптоматической, то типичным проявлением первичной вызываемой HSV-1 или HSV-2 генитальной инфекции являются кластеры генитальных язв, состоящих из воспаленных папул и везикул на внешней поверхности гениталий, которые напоминают лихорадочный герпес. Они появляются впервые, как правило, через 4-7 дней после контакта с HSV при половом акте. Рецидив генитальной инфекции, вызываемой HSV-1, возникает с частотой, составляющей примерно одну шестую от частоты генитальной инфекции, вызываемой HSV-2.
Известны хронические или диссеминированные формы кожных инфекций, вызываемых вирусом герпеса простого, которые не ограничены лабиальным или генитальным трактом. Этим заболеванием поражаются в основном пациенты с иммунодефицитом, такие, например, как пациенты с гипогаммаглобулинемией или пациенты с кожными Т-клеточными лимфомами. Хронический простой кожный герпес представляет собой характерное клиническое проявление, вызываемое вирусом герпеса простого (HSV) у хозяина с ослабленным иммунитетом. Эту инфекцию можно определить как хронические активные деструктивные повреждения кожи, которые потенциально могут прогрессировать с превращением в диссеминированную (системную) форму. В то время как большинство вызываемых HSV инфекций проявляются в виде эпизодов, которые излечиваются в течение одной или двух недель, для повреждений при хроническом простом кожном герпесе характерно вяло текущее изменение, и они могут продолжаться в течение нескольких месяцев. Хронический простой кожный герпес, который распространен среди пациентов с ослабленным иммунитетом, отличается присутствием атипичных хронических и персистентных повреждений, которые ослабляют и замедляют установление диагноза. Это может приводить к смерти, вызываемой сопутствующими осложнениями. Жизненно важно, чтобы при оценке хронических язв, сохраняющихся в течение продолжительного времени, прежде всего, у детей, рассматривали возможность наличия хронической инфекции, вызываемой вирусом герпеса простого.
Герпес борцов-спортсменов представляет собой герпетическую кожную инфекцию, которая возникает в подростковом возрасте у борцов, но которая распространена также среди людей, занимающимися другими видами контактного спорта. Как правило, он возникает на голове, наиболее часто в области подбородка, шеи, груди, лица, живота и ног.
Герпетиформная экзема, известная также как форма вариоформного пустулеза Капоши, которая вызывается вирусной инфекцией, как правило, вирусом герпеса простого (HSV), представляет собой обширное везикулярное высыпание, которое возникает на фоне уже имеющегося кожного заболевания, как правило, атопического дерматита (AD). Для детей с AD существует более высокий риск развития герпетиформной экземы, наиболее распространенным патогеном которой является HSV типа 1 (HSV-1). Герпетиформная экзема может быть серьезной, прогрессируя до диссеминированной формы инфекции и приводя к смерти при отсутствии лечения.
В контексте настоящего изобретения на антитело или его фрагмент, предназначенное(ный) для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, не накладывается конкретных ограничений, если оно/он представляет собой «антитело к HSV или его антигенсвязывающий фрагмент». Так, антитело может представлять собой антитело, которое специфически связывается или специфически распознает или взаимодействует с HSV, а именно, с доменом или антигеном HSV.
Понятие «связывается с» в контексте настоящего изобретения обозначает связывание (взаимодействие) по меньшей мере двух «сайтов взаимодействия с антигеном» друг с другом. Понятие «сайт взаимодействия с антигеном» обозначает согласно настоящему изобретению мотив полипептида, т.е. часть антитела или антигенсвязывающего фрагмента, предлагаемого в настоящем изобретении, который обладает способностью к специфическому взаимодействию с конкретным антигеном или группой антигенов HSV. Указанное связывание/взаимодействие подразумевает, что имеет место «специфическое распознавание». В контексте настоящего изобретения понятие «специфическое распознавание» означает, что антитело обладает способностью специфически взаимодействовать и/или связываться по меньшей мере с двумя аминокислотами каждого из указанных выше HSV. Антитела могут распознавать, взаимодействовать и/или связываться с различными эпитопами на HSV. Это понятие относится к специфичности молекулы антитела, т.е. к ее способности различать специфические области HSV.
Понятие «специфическое взаимодействие» в контексте настоящего изобретения означает, что антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый в изобретении, не вступает в перекрестную реакцию или практически не вступает в перекрестную реакцию с (поли)пептидами, имеющими сходную структуру. Следовательно, антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый в изобретении, специфически связывается/взаимодействует со структурами HSV, предпочтительно HSV-1 или HSV-2. Конкретные примеры таких молекул, против которых направлены указанные первый и второй происходящие из Ig домены, представлены ниже в настоящем описании.
Перекрестную реактивность панели исследуемых антител или их антигенсвязывающих фрагментов можно анализировать, например, путем оценки связывания указанной панели исследуемых антител или их антигенсвязывающих фрагментов в стандартных условиях (см., например, Harlow и Lane, Antibodies: A Laboratory Manual, изд-во Cold Spring Harbor Laboratory Press, (1988) и Using Antibodies: A Laboratory Manual, изд-во Cold Spring Harbor Laboratory Press, (1999)) с представляющим интерес (поли)пептидом, а также с рядом более или менее близкородственных (структурно и/или функционально) (поли)пептидов. Только те конструкции (т.е. антитела, их антигенсвязывающие фрагменты и т.п.), которые связываются с определенной структурой HSV, например, со специфическим эпитопом или (поли)пептидом/белком HSV, но не связываются или практически не связываются ни с каким другим эпитопом или (поли)пептидами того же самого HSV, рассматриваются как специфические в отношении представляющего интерес эпитопа или (поли)пептида/белка, и их отбирают для дальнейших исследований согласно представленному в настоящем описании методу. Такие методы могут включать, среди прочего, исследования связывания, исследования блокирования и конкуренции со структурно и/или функционально близкородственными молекулами. Указанные исследования связывания могут включать также FACS-анализ, поверхностный плазмонный резонанс (SPR, например, с помощью BIAcore®), аналитическое ультрацентрифугирование, изотермическую титрационную калориметрию, флуоресцентную анизотропию, флуоресцентную спектроскопию или анализы связывания с использованием радиоактивно меченных лигандов.
Понятие «связывание с» относится не только к линейному эпитопу, но может относиться также к конформационному эпитопу, структурному эпитопу или прерывистому эпитопу, состоящему из двух областей человеческих молекул-мишеней или их частей. В контексте настоящего изобретения конформационный эпитоп определяется двумя или большим количеством дискретных аминокислотных последовательностей, отделенных друг от друга в первичной последовательности, которые соприкасаются друг с другом на поверхности молекулы, когда полипептид приобретает укладку нативного белка (Sela, Science 166, 1969, с. 1365 и Laver, Cell 61, 1990, сс. 553-536). Кроме того, понятие «связывается с» в контексте настоящего изобретения употребляют взаимозаменяемо с понятиями «взаимодействует с» или «распознает».
Следовательно, специфичность можно оценивать экспериментально с помощью методов, известных в данной области, и методов, представленных в настоящем описании. Такие методы включают (но не ограничиваясь только ими) вестерн-блоттинг, ELISA-, RIA-, ECL-, IRMA-анализы и пептидные сканирования.
Лечение согласно настоящему изобретению относится к лечению острых инфекций. В этом контексте понятие «острый» означает, что у индивидуума имеются симптомы заболевания. Иными словами, подлежащий лечению индивидуум действительно нуждается в лечении, и в контексте настоящего изобретения понятие «острое лечение» относится к мерам, предпринимаемым для фактического лечения заболевания после его начала или вспышки заболевания. Понятие «острый» в контексте настоящего изобретения является противоположным профилактическому лечению или превентивному лечению, т.е. мерам, предпринимаемым для предупреждения заболевания, например, для предупреждения инфекции и/или вспышки заболевания. Более конкретно, профилактическое лечение можно понимать в том смысле, что оно предупреждает присоединение свободных вирусных частиц (проникнувших извне в организм) к клеткам-мишеням, что, в свою очередь, предупреждает репликацию вируса. В отличие от этого, при острой инфекции (которая может представлять собой первичную или рецидивирующую инфекцию) в результате репликации HSV уже возникло потомство вируса. Таким образом, необходимо специально отметить, что в контексте настоящего изобретения «острое лечение» не относится к профилактическому или превентивному лечению инфекции, вызываемой HSV-1 или HSV-2.
Слизистая ткань, которая может подвергаться острой инфекции, относится к тканям слизистых мембран, которые представляют собой выстилки в основном эндодермального происхождения, присутствующие в эпителии, которые участвуют в абсорбции и секреции. Они выстилают полости, подвергающиеся воздействиям окружающей среды, и внутренние органы. В некоторых местах они образуют непрерывный контакт с кожей: например, в ноздрях, на губах рта, веках, в ушах, в области гениталий и в анусе.
Эпидермальная ткань, которая может подвергаться острой инфекции, относится к тканям эпидермиса, т.е. самым верхним слоям клеток кожи, которые вместе с дермой образуют кожу. Эпидермис представляет собой стратифицированный плоскоклеточный эпителий, состоящий из пролиферирующих базальных и дифференцированных супрабазальных кератиноцитов, которые действуют в качестве основного барьера против негостеприимной окружающей среды, препятствуя проникновению патогенов, в результате чего кожа является естественным барьером для инфекции. Она регулирует также количество воды, высвобождаемой из организма в атмосферу в результате трансэпидермальной потери воды.
Как указано, антитело к HSV или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, предназначено/предназначен для местного применения.
В контексте настоящего изобретения понятие «местное применение» относится к медикаментозному лечению, нанесению или применению, которое осуществляют на различных поверхностях тела, таких как кожа или слизистые мембраны, для лечения указанной выше инфекции с использованием большого разнообразия видов форм, пригодных для применения, включая (но не ограничиваясь только ими) кремы, пены, гели, лосьоны и мази. Следует иметь в виду, что в предпочтительном варианте осуществления изобретения местное применение должно быть накожным, это означает, что антитело к HSV или его антигенсвязывающий фрагмент наносят непосредственно на кожу. Не вдаваясь в теорию, а также для того, чтобы привести некоторые другие примеры, не ограничивающие объем изобретения, следует иметь в виду, что местное применение можно осуществлять также путем ингаляции, например, при медикаментозном лечении астмы, или нанесение можно осуществлять на поверхность тканей, отличных от кожи, как, например, в случае глазных капель, которые наносят на конъюнктиву, или ушных капель, которые вносят в ухо, или лекарственных средств, которые наносят на поверхность зуба. В качестве пути применения местное применение противопоставляется энтеральному (в пищеварительный тракт) и внутрисосудистому/внутривенному (инъекция в кровоток). В наиболее широком смысле можно считать, что местное действие относится с точки зрения фармакодинамики к локальной, а не системной мишени для лекарственного средства.
В предпочтительном варианте осуществления изобретения, антитело к HSV или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой моноклональное или поликлональное антитело. В другом предпочтительном варианте осуществления изобретения, антитело к HSV или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой гуманизированное или полностью человеческое антитело. В другом предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой мышиное антитело.
В контексте настоящего описания понятие «моноклональное антитело» относится к антителу, полученному из популяции практически гомогенных антител, это означает, что индивидуальные антитела, составляющие популяцию, являются идентичными за исключением возможных встречающихся в естественных условиях мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высоко специфическими и направлены против одного антигенного сайта. Моноклональные антитела обладают тем преимуществом, что их можно синтезировать с использованием культуры гибридом, при этом они практически не загрязнены другими иммуноглобулинами. Прилагательное «моноклональное» указывает на отличительную черту антитела как являющегося представителем практически гомогенной популяции антител, и его не следует рассматривать как требование, чтобы антитело было получено каким-либо конкретным методом. Как указано выше, моноклональное антитело, предназначенное для применения согласно настоящему изобретению, можно получать методом гибридом, описанным у Kohler, Nature 256, 1975, с. 495.
Понятие «поликлональное антитело» в контексте настоящего описания относится к антителу, которое было получено в числе или в присутствии одного или нескольких других неидентичных антител. Как правило, поликлональные антитела получают из В-лимфоцита в присутствии нескольких других В-лимфоцитов, которые продуцируют неидентичные антитела. Как правило, поликлональные антитела получают непосредственно из организма иммунизированного животного.
В контексте настоящего описания понятие «полностью человеческое антитело» относится к антителу, которое содержит белковые последовательности только человеческого иммуноглобулина. Полностью человеческое антитело может содержать мышиные углеводные цепи, если оно продуцируется в организме мыши, в мышиной клетке или в гибридоме, происходящей из мышиной клетки. Аналогично этому, понятие «антитело мыши» или «мышиное антитело» относится к антителу, которое содержит белковые последовательности только иммуноглобулина мыши/мышиного иммуноглобулина. В альтернативном варианте «полностью человеческое антитело» может содержать крысиные углеводные цепи, если оно продуцируется в организме крысы, в крысиной клетке или в гибридоме, происходящей из крысиной клетки. Аналогично этому, понятие «крысиное антитело» относится к антителу, которое содержит последовательности только крысиного иммуноглобулина. Полностью человеческие антитела можно получать, например, с помощью фагового дисплея, который представляет собой широко применяемую технологию скрининга, которая позволяет получать и осуществлять скрининг полностью человеческих антител. В контексте настоящего изобретения можно применять также полученные с использованием фага антитела. Методы фагового дисплея описаны, например, в US 5403484, US 5969108 и US 5885793. В другой технологии, которая позволяет создавать полностью человеческие антитела, используют модификацию технологии на основе мышиной гибридомы. В этом случае создают трансгенных мышей, которые содержат локус человеческого иммуноглобулина, которым заменены собственные мышиные гены (см., например, US 5877397).
Понятие «химерные антитела» относится к антителу, которое содержит вариабельную область, предлагаемую в настоящем изобретении, слитую или химеризованную с областью антитела (например, константной областью) из другого вида, из человека или видов кроме человека (например, мыши, лошади, кролика, собаки, коровы, курицы).
Понятие антитело относится к рекомбинантным человеческим антителам, гетерологичным антителам и гетерогибридным антителам. Понятие «рекомбинантное человеческое антитело» включает все человеческие последовательности антител, которые получают, экспрессируют, создают или выделяют с помощью методов рекомбинации, такие как антитела, выделенные из животного (например, мыши), которое является трансгенным по генам человеческого иммуноглобулина; антитела, экспрессированные с использованием рекомбинантного экспрессионного вектора, которым трансфектировали клетку-хозяина, антитела, выделенные из рекомбинантной комбинаторной библиотеки человеческих антител, или антитела, полученные, экспрессированные, созданные или выделенные с помощью любых других методов, в которых применяют сплайсинг последовательностей человеческого иммуноглобулина с другими ДНК-последовательностями. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области (если они присутствуют), происходящие из последовательностей иммуноглобулина человеческой зародышевой линии. Однако такие антитела можно подвергать мутагенезу in vitro (или, когда используют животное, трансгенное по последовательностям человеческого Ig, соматическому мутагенезу in vivo), и таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые хотя и происходят из VH- и VL-областей человеческой зародышевой линии, могут не встречаться в естественных условиях в спектре зародышевой линии человеческого антитела in vivo.
Понятие «гетерологичное антитело» следует рассматривать в контексте трансгенного организма кроме человека, продуцирующего указанное антитело. Это понятие относится к антителу, имеющему аминокислотную последовательность или кодирующую нуклеотидную последовательность, соответствующую последовательности, присутствующей в организме, не представляющем собой трансгенное животное кроме человека, и, как правило, происходящую из вида, отличного от вида, к которому относится трансгенное животное кроме человека.
Понятие «гетерогибридное антитело» относится к антителу, имеющему легкие и тяжелые цепи, происходящие из различных организмов. Например, антитело, имеющее человеческую тяжелую цепь, ассоциированную с мышиной легкой цепью, представляет собой гетерогибридное антитело. Примерами гетерогибридных антител являются химерные и гуманизированные антитела.
Понятие «антитело» относится также к гуманизированным антителам. «Гуманизированные» формы антител кроме человека (например, мышиных или кроличьих) представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую из иммуноглобулина видов кроме человека. Часто гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в котором остатки из гипервариабельной области (CDR) реципиента заменены на остатки из CDR видов кроме человека (донорское антитело), таких как мыши, крысы или кролики, обладающие требуемой специфичностью, аффинностью и эффективностью. В некоторых случаях остатки каркасного участка Fv человеческого иммуноглобулина заменены соответствующими остатками из видов кроме человека. Кроме того, гуманизированное антитело может содержать остатки, которые не присутствуют ни в реципиентном антителе, ни в импортированных последовательностях CDR или каркасного участка. Такие модификации осуществляют для дополнительного улучшения и оптимизации характеристик антитело. Как правило, гуманизированное антитело должно содержать практически полностью по меньшей мере один и, как правило, два вариабельных домена, в котором(ых) все или практически все участки CDR соответствуют участкам иммуноглобулина видов кроме человека, и все или практически все FR-участки представляют собой участки консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело может содержать также по меньшей мере часть константной области иммуноглобулина (Fc), как правило, из человеческого иммуноглобулина. Более подробное описание приведено у: Jones, Nature 321, 1986, сс. 522-525; Reichmann, Nature 332, 1998, сс. 323-327 и Presta, Curr Op Struct Biol 2, 1992, cc. 593-596.
В одном из широко распространенных методов гуманизации антител применяют трансплантацию CDR, заключающуюся в том, что функциональный антигенсвязывающий сайт из «донорского» антитела из видов кроме человека трансплантируют в человеческое «акцепторное» антитело. Методы трансплантации CDR известны в данной области и описаны, например, в US 5225539, US 5693761 и US 6407213. Другой пригодный для этой цели метод заключается в том, что гуманизированные антитела получают из трансгенных животных, которых создают с помощью генетической инженерии таким образом, чтобы они содержали один или несколько гуманизированных иммуноглобулиновых локусов, которые можно подвергать реаранжировке генов и конверсии генов (см., например, US 7129084).
Таким образом, в контексте настоящего изобретения понятие «антитело» относится к полным молекулам иммуноглобулина, а также к частям указанных молекул иммуноглобулина (т.е. их «антигенсвязывающему фрагменту»). Кроме того, понятие относится, как указано выше, к модифицированным и/или измененным молекулам антитела. Понятие относится также к рекомбинантно или синтетически созданным/синтезированным антителам. Понятие относится также к интактным антителам, а также к фрагментам антитела, таким как выделенные легкие и тяжелые цепи, Fab, Fv, Fab', Fab'-SH, F(ab')2. Понятие антитело включает также (но не ограничиваясь только ими) полностью человеческие антитела, химерные антитела, гуманизированное антитела, антитела с трансплантированными CDR и различные конструкции антитела, такие как одноцепочечные Fv (scFv) или слитые конструкции антитело-белки.
В предпочтительном варианте осуществления изобретения антитело к HSV, предназначенное для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения, представляет собой полноразмерное антитело, т.е. полноразмерную молекулу иммуноглобулина, которую часто обозначают также как полное антитело.
В контексте изобретения фрагменты антитела, представляющие собой «одноцепочечный Fv» или «scFv», имеют VH- и VL-домены антитела, где указанные домены присутствуют в одной полипептидной цепи. Как правило, полипептид scFv содержит также полипептидный линкер между VH- и VL-доменами, который позволяет scFv образовывать структуру, необходимую для связывания с антигеном. Описание методов получения одноцепочечных антител представлено, например, у

В контексте настоящего описания «Fab-фрагмент» содержит одну легкую цепь и СН1 и вариабельные области одной тяжелой цепи. Тяжелая цепь молекулы Fab не может образовывать дисульфидную связь с другой молекулой тяжелой цепи.
«Fc»-область содержит два фрагмента тяжелой цепи, содержащие CH2- и СН3-домены антитела. Два фрагмента тяжелой цепи соединены друг с другом с помощью двух или большего количества дисульфидных связей и посредством гидрофобных взаимодействий СН3-доменов.
«Fab'-фрагмент» содержит одну легкую цепь и часть одной тяжелой цепи, которая содержит VH-домен и СН1-домен, а также область между СН1- и CH2-доменами, так что между двумя тяжелыми цепями двух Fab'-фрагментов может образовываться межцепочечная дисульфидная связь, в результате чего образуется молекула F(ab')2.
«F(ab')2-фрагмент» содержит две легкие цепи и две тяжелые цепи, содержащие часть константной области между СН1- и CH2-доменами, так что между двумя тяжелыми цепями может образовываться межцепочечная дисульфидная связь. Таким образом, F(ab')2-фрагмент состоит из двух Fab'-фрагментов, которые соединены друг с другом с помощью дисульфидной связи между двумя тяжелыми цепями.
«Fv-область» содержит вариабельные области как из тяжелой, так и легкой цепей, но не содержит константные области.
Антитела, конструкции антител, фрагменты антител, производные антител (все происходящие из Ig), предназначенные для применения согласно изобретению, или их соответствующие иммуноглобулиновая(ые) цепь(и) можно дополнительно модифицировать с помощью стандартных методов, известных в данной области, например, осуществляя аминокислотную(ые) делецию(и), инсерцию(и), замену(ы), добавление(я) и/или рекомбинацию(и), и/или любую(ые) другую(ие) модификацию(и), известную(ые) в данной области, либо индивидуально, либо в виде комбинации. Методы интродукции таких модификаций в последовательность ДНК, кодирующую аминокислотную последовательность иммуноглобулиновой цепи, хорошо известны специалисту в данной области; см., например, Sambrook (1989), loc. cit. Понятие «происходящий из Ig домен» относится прежде всего к (поли)пептидным конструкциям, содержащим по меньшей мере один CDR. Фрагменты или производные указанных происходящих из Ig доменов представляют собой (поли)пептиды, которые являются частями указанных выше молекул антитела, и/или которые модифицируют с помощью химических/биохимических методов или методов молекулярной биологии. Соответствующие методы известны в данной области и описаны, среди прочего, в лабораторных справочниках (см. Sambrook и др., Molecular Cloning: A Laboratory Manual; изд-во Cold Spring Harbor Laboratory Press, 2-е изд., 1989 г. и 3-е изд., 2001 г.; Gerhardt и др., Methods for General and Molecular Bacteriology, изд-во ASM Press, 1994; Lefkovits, Immunology Methods Manual: The Comprehensive Sourcebook of Techniques; изд-во Academic Press, 1997; Golemis, Protein-Protein Interactions: A Molecular Cloning Manual, изд-во Cold Spring Harbor Laboratory Press, 2002).
На антитело или его фрагмент, предназначенные для применения в контексте настоящего изобретения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения, не накладываются никакие конкретные ограничения, если оно представляет собой «антитело к HSV или его антигенсвязывающий фрагмент». Так, антитело может представлять собой любое антитело, которое специфически связывается или специфически распознает или взаимодействует с HSV, а именно, с доменом, антигеном, предпочтительно поверхностным антигеном HSV. Специалист в данной области легко может создавать такое антитело к рассматриваемому домену (а именно, к антигену, предпочтительно поверхностному антигену HSV) и определять, обладает ли способностью соответствующее антитело обнаруживать/связывать рассматриваемый домен, антиген, предпочтительно поверхностный антиген HSV, предпочтительно HSV-1 и/или HSV-2, на основе общих сведений, известных специалисту, и представленных в настоящем описании методов.
В предпочтительном варианте осуществления изобретения антитело, предлагаемое в изобретении, связывается с/распознает вирусные антигенные гликопротеины D, В, С, Н, L, Е или I (а именно, gD, gB, gC, gH, gL, gE, gI). Гликопротеины D, В, С, H, L, E и I представляют собой поверхностные или оболочечные белки HSV-1 и/или HSV-2. Указанные белки могут находиться не только на поверхности или в структуре оболочки HSV-1 и/или HSV-2, т.е. на поверхности высвобождаемых инфекционных частиц (т.е. на оболочке свободных вирионов), но они могут присутствовать также на поверхности инфицированных клеток, т.е. на поверхности клеток. В еще более предпочтительном варианте осуществления изобретения антитело, предлагаемое в изобретении, связывается с/распознает антигенный гликопротеин вирусной поверхности D, В, С, Н, L, Е или I (т.е. gD, gB, gC, gH, gL, gE или gI) оболочки HSV-1 и/или HSV-2. В предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, распознает поверхностный гликопротеин В (gB) оболочки HSV-1 и/или HSV-2, предпочтительно его эпитоп. Гликопротеин В HSV-1 и/или HSV-2 хорошо охарактеризован и, если не ограничиваться конкретными последовательностями, то примерами последовательностей различных штаммов HSV-1 и HSV-2 соответственно могут служить последовательности, представленные в SEQ ID NO: 11-16. В SEQ ID NO: 11 представлена последовательность гликопротеина В штамма F HSV-1, в SEQ ID NO: 12 представлена последовательность гликопротеина В штамма KOS HSV-1, в SEQ ID NO: 13 представлена последовательность гликопротеина В штамма gC-39-R6 HSV-1, в SEQ ID NO: 14 HG52 HSV-2, в SEQ ID NO: 15 представлена последовательность гликопротеина В штамма 333 HSV-2 и в SEQ ID NO: 16 представлена последовательность гликопротеина В штамма ММА HSV-2. Сравнительный анализ первичной структуры указанных аминокислотных последовательностей гликопротеина В показал, что в целом гомология аминокислотных последовательностей gB HSV-1 и HSV-2 составляет 85%, при этом последовательности являются менее консервативными в N- и С-концевых областях белка.
В предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения, обладает способностью ингибировать распространение HSV от одной инфицированной клетки к другой смежной неинфицированной клетке (распространение от клетки к клетке).
Распространение от клетки к клетке представляет собой способность вируса герпеса распространяться на вторую неинфицированную клетку без высвобождения бесклеточных частиц. Снижение или элиминация способности вируса герпеса распространяться на соседнюю клетку оказывает благоприятное действие, заключающееся в том, что в этом случае не образуются повреждения. Для изучения того, способно ли антитело ингибировать распространение HSV от инфицированной клетки к соседней второй неинфицированной клетке (распространение от клетки к клетке), можно применять методы, хорошо известные специалисту в данной области. Например, можно применять следующий анализ: Клетки линии Vero, выращенные до конфлюэнтности на стеклянных покровных стеклах в 24-луночных планшетах для культур тканей, инфицируют в течение 4 ч при 37°С вирусом в постоянном количестве, соответствующим 400 TCID50/на лунку. Одна средняя цитопатогенная доза (1 TCID50) представляет собой количество цитопатогенного агента, такого как вирус, которая оказывает цитопатическое действие на 50% инокулированных клеточных культур. Затем вирусный инокулят удаляют, клетки отмывают дважды ЗФР и инкубируют еще в течение 2 дней при 37°С в 1 мл среды DMEM, 2% FCS, Pen/Strep, содержащей избыток либо другого антитела к HSV, либо поликлональной контрольной анти-HSV-сыворотки, для предупреждения распространения вируса через супернатант. Обнаружение вирусных антигенов инфицированных HSV клеток осуществляют с помощью несущей флуоресцентную метку поликлональной козьей анти-HSV-сыворотки (фирма BETHYL Laboratories, Монтгомери, шт. Техас, США, каталожный номер А190-136F, партия A190-136F-2). Предпочтительно считается, что антитело ингибирует распространение от клетки к клетке, если инфицировано менее 20% соседних клеток, предпочтительно менее чем 15%, менее чем 10%, менее чем 5%, более предпочтительно менее чем 3% и наиболее предпочтительно менее чем 1% соседних клеток по данным описанного выше анализа.
Распространение от клетки к клетке можно анализировать также следующим образом: Присутствие нейтрализующих антител не обязательно предупреждает распространение вируса герпеса от клетки к клетке. Для сравнения воздействия антител на нарушение распространения HSV-1 и HSV-2 от клетки к клетке эту конкретную форму диссеминации можно имитировать in vitro с помощью стандартных методов тестирования. Например, для инфицирования индивидуальных клеток сначала инкубируют конфлюэнтные монослои клеток линии Vero либо с HSV-1, либо с HSV-2 соответственно при низких уровнях MOI (например, 100 TCID50). После осуществления адсорбции в течение 4 ч при 37°С вирусный инокулят следует удалять. Для того, чтобы стимулировать прямой перенос от клетки к летке из индивидуальных инфицированных клеток, но предупреждать распространение вируса посредством вирусных частиц через супернатант клеточной культуры, монослои клеток линии Vero обрабатывают избытком нейтрализующих антител к gB, контролями или только средой. Через 48 ч распространение вируса можно обнаруживать с помощью иммуноокрашивания мышиным моноклональным антителом, специфическим в отношении общего эпитопа на гликопротеине D HSV-1 и HSV-2 (например, антитела фирмы Acris Antibody, Сан-Диего, шт. Калифорния, США), и конъюгированным с флуоресцентной меткой вторичным антителом. Иммунофлуоресцентные изображения можно получать с помощью флуоресцентного микроскопа при 100- или 400-кратном увеличении.
Кроме того, в предпочтительном варианте осуществления изобретения антитело к HSV, предлагаемое в настоящем изобретении, обладает способностью нейтрализовать HSV. В контексте настоящего описания понятие «нейтрализация» означает, что антитело опсонизирует вирус таким образом, что он не может инфицировать никакую другую клетку. Анализ для определения того, способно ли антитело в концентрации, например, составляющей максимум 20 нМ, нейтрализовать определенное количество HSV, например, составляющее 100 TCID50, описан у


Так, в предпочтительном варианте осуществления изобретения настоящее изобретение относится также к антителу к HSV или его антигенсвязывающему фрагменту, предназначенному для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения, где антитело обладает способностью ингибировать распространение от клетки к клетке независимо от антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) и/или комплементзависимой цитотоксичности (CDC).
Поскольку в указанном выше анализе для тестирования того, обладает ли антитело способностью ингибировать распространение от клетки к клетке, не используют систему комплемента и/или цитотоксичные эффекторные клетки, то этот же самый анализ можно применять для того, чтобы определять, способно ли антитело ингибировать распространение от клетки к клетке, независимо от антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) и/или комплементзависимой цитотоксичности (CDC).
В предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент для применения согласно настоящему изобретении, содержит гипервариабельные участки VHCDR1, содержащий SEQ ID NO: 1, VHCDR2, содержащий SEQ ID NO: 2, VHCDR3, содержащий SEQ ID NO: 3, VLCDR1, содержащий SEQ ID NO: 4, VLCDR2, содержащий SEQ ID NO: 5, и VLCDR3, содержащий SEQ ID NO: 6.
В контексте настоящего описания понятие «CDR» относится к «гипервариабельному участку», хорошо известному в данной области. CDR представляют собой участки иммуноглобулинов, которые определяют специфичность указанных молекул и вступают в контакт со специфическим лигандом. CDR представляют собой наиболее вариабельные участки молекулы и определяют разнообразие этих молекул. В каждом V-домене имеется три CDR-участка CDR1, CDR2 и CDR3. CDR-H обозначает CDR-участок вариабельной тяжелой цепи, a CDR-L относится к CDR-участку вариабельной легкой цепи. VH обозначает вариабельную тяжелую цепь, a VL обозначает вариабельную легкую цепь. CDR-участки происходящей из Ig области можно определять как описано у Kabat, «Sequences of Proteins of Immunological Interest», 5-е изд., публикация изд-ва NIH номер 91-3242, U.S. Department of Health and Human Services, 1991; Chothia, J. Mol. Biol. 196, 1987, cc. 901-917 или Chothia, Nature 342, 1989, cc. 877-883.
Таким образом, в контексте настоящего изобретения описанную выше молекулу антитела выбирают из группы, состоящей из полноразмерного антитела (иммуноглобулина, такого как IgG1, IgG2, IgG2a, IgG2b, IgA1, IgGA2, IgG3, IgG4, IgA, IgM, IgD или IgE), F(ab)-, Fab'-SH-, Fv-, Fab'-, F(ab')2-фрагмента, химерного антитела, антитела с трансплантированными CDR, полноразмерного человеческого антитела, двухвалентной конструкции антитела, слитой конструкции антитело-белок, синтетического антитела, двухвалентного одноцепочечного антитела, трехвалентного одноцепочечного антитела и много валентного одноцепочечного антитела.
«Подходы, основанные на гуманизации» хорошо известны в данной области, и они описаны, в частности, для молекул антитела, например, происходящих из Ig молекул. Понятие «гуманизированный» относится к гуманизированным формам нечеловеческих (например, мышиных) антител или их фрагментов (таких как Fv, Fab, Fab', F(ab'), scFvs или другие антигенсвязывающие частичные последовательности антитела), которые содержат некоторую часть последовательности, происходящей из нечеловеческого антитела. Гуманизированные антитела включают человеческие иммуноглобулины, в которых остатки из гипервариабельного участка (CDR) человеческого иммуноглобулина заменены на остатки из CDR видов кроме человека, таких как мыши, крысы или кролики, обладающие требуемой специфичностью связывания, аффинностью и эффективностью. Как правило, гуманизированное антитело должно содержать практически полностью по меньшей мере один и, как правило, два вариабельных домена, в котором(ых) все или практически все участки CDR соответствуют участкам нечеловеческого иммуноглобулина и все или практически все FR-участки представляют собой участки консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело предпочтительно может содержать также по меньшей мере часть константной области иммуноглобулина (Fc), как правило, из человеческого иммуноглобулина; см., среди прочего у Jones, Nature 321, 1986, сс. 522-525; Reichmann, Nature 332, 1998, сс. 323-327 и Presta, Curr Op Struct Biol 2, 1992, cc. 593-596. Методы гуманизации нечеловеческих антител хорошо известны в данной области. Как правило, гуманизированное антитело имеет одну или несколько аминокислот, интродуцированных в него из источника, который отличен от человека, но еще сохраняет активность связывания, присущую исходному антителу. Методы гуманизации антител/молекул антитела подробно описаны у Jones и др., Nature 321, 1986, сс. 522-525; Reichmann и др., Nature 332, 1988, сс. 323-327 и у Verhoeyen и др., Science 239, 1988, сс. 1534-1536. Конкретные примеры гуманизированных антител, например, антител, направленных против ЕрСАМ, известны в данной области, см., например, LoBuglio, Proceedings of the American Society of Clinical Oncology Abstract, 1997, c. 1562 и Khor, Proceedings of the American Society of Clinical Oncology Abstract, 1997, c. 847).
Таким образом, в настоящем изобретении предложены молекулы антител или их антигенсвязывающих фрагментов, которые являются гуманизированными и которые можно успешно применять в фармацевтических композициях.
Кроме того, в предпочтительном варианте осуществления изобретения антитело, предлагаемое в настоящем изобретении, представляет собой антитело или его антигенсвязывающий фрагмент, которое/который связывается с гликопротеином В (gB) HSV-1 и/или HSV-2, который/которое содержит или состоит из VH-домена (вариабельная область тяжелой цепи) и VL-домена (вариабельная область легкой цепи), а именно, аминокислотной последовательности вариабельной области тяжелой цепи антитела, представленной в SEQ ID NO: 9, и аминокислотной последовательности вариабельной области легкой цепи антитела, представленной в SEQ ID NO: 10.
Однако, антитело или его антигенсвязывающий фрагмент, применяемое/применяемый согласно настоящему изобретению, не ограничены только указанными вариабельными областями тяжелой и легкой цепей, но могут представлять собой также антитело или его антигенсвязывающий фрагмент, которое/который связывается с гликопротеином В (gB) оболочки HSV-1 и/или HSV-2, которое/который содержит или состоит из VH-домена и VL-домена, последовательности которых гомологичны по меньшей мере на 95%, 90%, 85%, 75%, 70%, 65%, 60%, 55% или 50% последовательностям SEQ ID NO: 9 и 10 соответственно, если антитело или антигенсвязывающий фрагмент обладают способностью оказывать действие в отношении лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, которая вызывается HSV-1 или HSV-2, указанной в настоящем изобретении, или обладают способностью ингибировать распространение HSV от инфицированной клетки к соседней второй неинфицированной клетке (распространение от клетки к клетке), или обладают способностью ингибировать распространение от клетки к клетке независимо от антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) и/или комплементзависимой цитотоксичности (CDC), как указано выше и ниже в настоящем описании. Кроме того, антитело или его антигенсвязывающий фрагмент представляет собой молекулу, которая содержит VH- и VL-домены, имеющие вплоть до 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или большее количество аминокислотных замен по сравнению с последовательностями SEQ ID NO: 9 и 10. Кроме того, антитело или его антигенсвязывающий фрагмент может представлять собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', Fab'-SH, FV, scFV, F(ab')2 и димерного антитела (диабоди).
Для определения того, обладает ли аминокислотная последовательность определенной степенью идентичности с последовательностями SEQ ID NO: 9 и 10, специалист в данной области может применять средства и методы, хорошо известные в данной области, например, сравнительные анализы первичной структуры последовательностей, которые осуществляют либо вручную, либо с использованием компьютерных программ, известных специалисту в данной области. Такой сравнительный анализ первичной структуры последовательностей можно осуществлять, например, с помощью средств и методов, известных специалисту в данной области, например, с использованием известного компьютерного алгоритма, такого как метод Липмана-Пирсона (Science, 227, 1985, с. 1435) или алгоритм CLUSTAL. Предпочтительно, чтобы при таком сравнительном анализе первичной структуры последовательностей консервативным аминокислотным остаткам, присутствующим в аминокислотной последовательности приписывалась максимальная степень гомологии. В предпочтительном варианте осуществления изобретения для сравнения аминокислотных последовательностей применяют программу ClustalW2. В случае попарных сравнений/выравниваний, предпочтительно выбирают следующие настройки: весовая матрица для белков: BLOSUM 62; открытие бреши: 10; расширение бреши: 0,1. В случае множественных сравнений/выравниваний, выбирают следующие настройки: весовая матрица для белков: BLOSUM 62; открытие бреши: 10; расширение бреши: 0,2; расстояние между брешами: 5; концевая брешь отсутствует.
Согласно настоящему изобретению понятие «идентичный» или «процент идентичности» в контексте двух или большего количества нуклеотидных или аминокислотных последовательностей относится к двум или большему количеству последовательностей или подпоследовательностей, которые являются одинаковыми или которые имеют определенный процент одинаковых аминокислотных остатков или нуклеотидов (например, обладают 60%-ной или 65%-ной идентичностью, предпочтительно, 70-95%-ной идентичностью, более предпочтительно по меньшей мере 95%-ной идентичностью с описанными выше нуклеотидными последовательностями или аминокислотными последовательностями, которые обладают способностью связываться с gB HSV-1 или HSV-2 и позволяют лечить острую инфекцию слизистой или эпидермальной ткани у индивидуума, которая вызывается HSV-1 или HSV-2, указанную в настоящем изобретении, или обладают способностью ингибировать распространение HSV от инфицированной клетки к соседней второй неинфицированной клетке (от клетки к клетке), или обладают способностью ингибировать распространение от клетки к клетке независимо от антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) и/или комплементзависимой цитотоксичности (CDC), как указано выше и ниже в настоящем описании, при сравнении и выравнивании для достижения максимального соответствия в окне сравнения или в специально выделенной области, по данным оценки с использованием алгоритма сравнения, известного в данной области, или проведенного вручную выравнивания и визуальной оценки. Последовательности, обладающие, например, 60-95%-ной или более высокой степенью идентичности рассматривают как практически идентичные. Такое определение применимо также к комплементу тестируемой последовательности. Предпочтительно указанная степень идентичности имеет место на протяжении области длиной по меньшей мере примерно 15-25 аминокислот или нуклеотидов, более предпочтительно, на протяжении области длиной по меньшей мере примерно 50-100 аминокислот или нуклеотидов. Специалистам в данной области должно быть известно, как определять процент идентичности между последовательностями/среди последовательностей с использованием, например, таких алгоритмов, как алгоритмы, основанные на компьютерной программе CLUSTALW (Thompson, Nucl. Acids Res. 2, 1994, cc. 4673-4680) или FASTDB (Brutlag, Comp. App. Biosci., 6, 1990, cc. 237-245), известные в данной области.
Хотя при расчетах с использованием алгоритма FASTDB, как правило, не учитываются внутренние несовпадающие делеции или добавления в последовательностях, т.е. бреши, это можно корректировать вручную для того, чтобы избежать завышенной оценки % идентичности. Однако, при расчетах идентичности с помощью программы CLUSTALW наличие брешей учитывается. Специалистам в данной области доступны также алгоритмы BLAST BLAST 2.0 (Altschul, Nucl. Acids Res. 25, 1997, cc. 3389-3402; Altschul, J. Mol. Evol. 36, 1993, cc. 290-300; Altschul, J. Mol. Biol. 215, 1990, cc. 403-410). В программе BLASTN для нуклеотидных последовательностей в качестве задаваемых по умолчанию параметров используют длину слова (W), равную 11, ожидание (Е), равное 10, М=5, N=4 и осуществляют сравнение обеих цепей. Для аминокислотных последовательностей в программе BLASTP в качестве задаваемых по умолчанию параметров используют длину слова (W), равную 3 и ожидание (Е), равное 10. В матрице баллов BLOSUM62 (Henikoff, PNAS 89, 1989, с. 10915) используют выравнивания (В), равные 50, ожидание (Е), равное 10, М=5, N=4 и осуществляют сравнение обеих цепей.
Предпочтительно аминокислотная(ые) замена(ы) представляет(ют) собой «консервативную(ые) замену(ы)», что означает замены аминокислот в белке на другие аминокислоты, имеющие сходные характеристики (например, заряд, размер боковой цепи, гидрофобность/гидрофильность, конформацию каркаса и степень жесткости и т.д.), благодаря чему замены часто могут быть сделаны без изменения биологической активности белка. Специалистам в данной области должно быть очевидно, что, как правило, одиночные аминокислотные замены в не имеющих решающего значения областях полипептида не приводят к существенному изменению биологической активности (см., например, Watson Molecular Biology of the Gene, изд-во The Benjamin/Cummings Pub. Co., 4-е изд., 1987, с. 224). Кроме того, менее вероятно, что замены структурно или функционально сходных аминокислот могут нарушать биологическую активность. В контексте настоящего изобретения связывающие соединения/антитела, предлагаемые в настоящем изобретении, содержат полипептидные цепи с последовательностями, которые включают вплоть до 0 (отсутствие изменений), 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 20 или большего количества консервативных аминокислотных замен по сравнению с конкретными аминокислотными последовательностями, представленными в настоящем описании, например, SEQ ID NO: 9 (относится к вариабельной области тяжелой цепи антитела) и SEQ ID NO: 10 (относится к вариабельной области легкой цепи антитела). В контексте настоящего описания выражение «вплоть до X» консервативных аминокислотных замен включает 0 замен и любое количество замен вплоть до 10, и включает 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 замен.
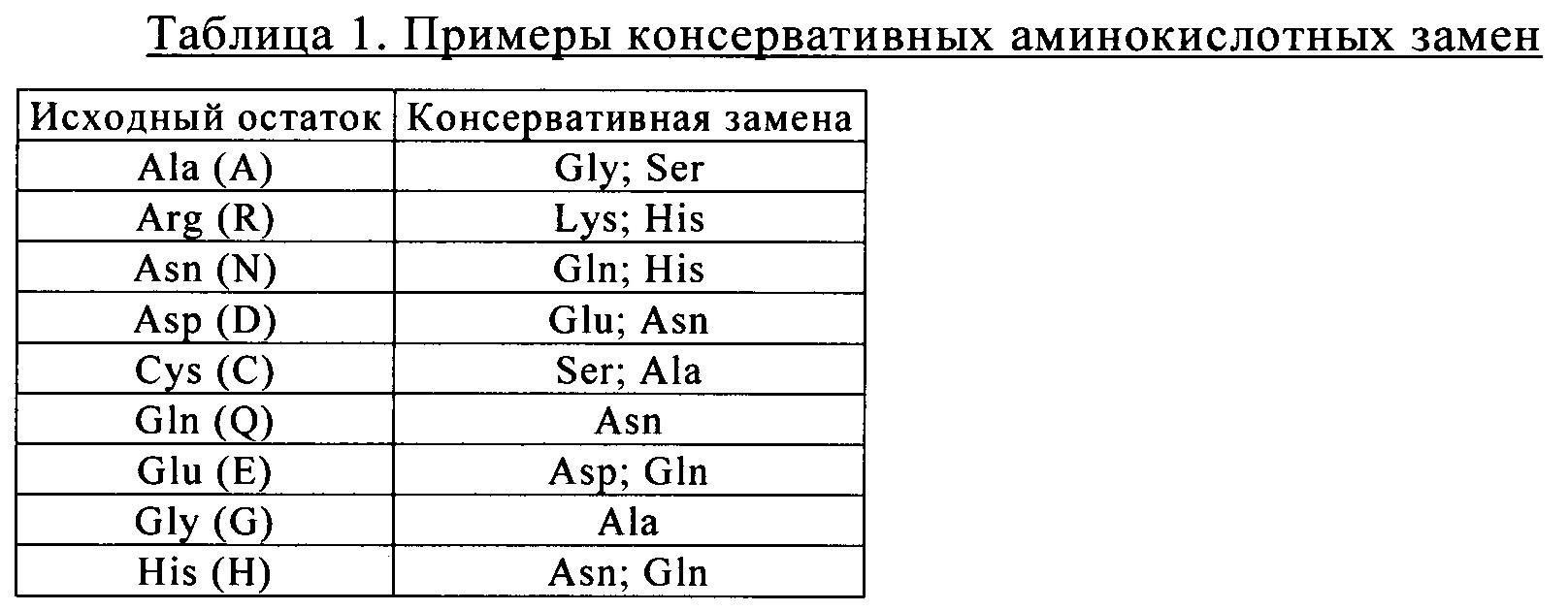
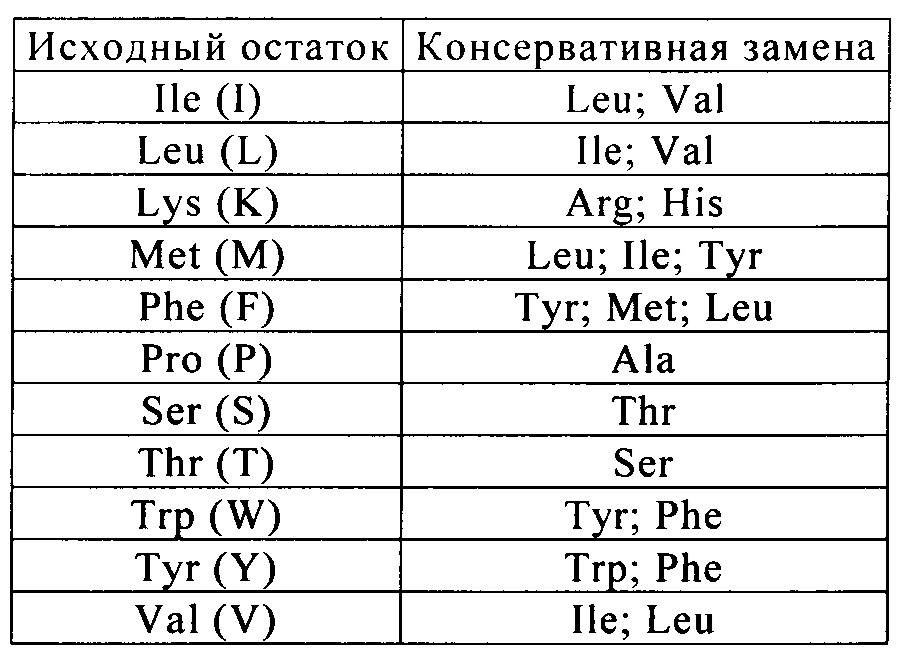
Такие указанные в качестве примера замены предпочтительно осуществляют в соответствии с заменами, представленными ниже в таблице 1:
Кроме того, в предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент для применения согласно настоящему изобретению, содержит аминокислотную последовательность, которая идентична по меньшей мере на 70% аминокислотным остаткам в положениях 1-30, 38-51, 68-99 и 112-122 SEQ ID NO: 7 и в положениях 1-23, 41-55, 63-94 и 104-114 SEQ ID NO: 8.
В другом предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент для применения согласно настоящему изобретению, содержит аминокислотную последовательность, последовательности каркасных участков которой в целом идентичны по меньшей мере на 75%, по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, по меньшей мере на 90%, еще более предпочтительно по меньшей мере на 95%, и наиболее предпочтительно 98% аминокислотным остаткам, присутствующим в положениях 1-30, 38-51, 68-99 и 112-122 SEQ ID NO: 7 и в положениях 1-23, 41-55, 63-94 и 104-114 SEQ ID NO: 8. Такие антитела пригодны для медицинского применения согласно настоящему изобретению, если антитело или его антигенсвязывающий фрагмент связывается с gB HSV-1 или HSV-2 и обладает способностью оказывать действие в отношении лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, которая вызывается HSV-1 или HSV-2, указанной в настоящем изобретении, или обладает способностью ингибировать распространение HSV от инфицированной клетки к соседней второй неинфицированной клетке (распространение от клетки к клетке), или обладает способностью ингибировать распространение от клетки к клетке независимо от антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) и/или комплементзависимой цитотоксичности (CDC), как указано выше и ниже в настоящем описании.
Так, в предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент для применения согласно настоящему изобретению, содержит аминокислотную последовательность, имеющую указанные выше вариабельные участки легких и тяжелых цепей (а именно, указанные выше CDR, т.е. VHCDR1, содержащий SEQ ID NO: 1, VHCDR2, содержащий SEQ ID NO: 2, VHCDR3, содержащий SEQ ID NO: 3, VLCDR1, содержащий SEQ ID NO: 4, VLCDR2, содержащий SEQ ID NO: 5, и VLCDR3, содержащий SEQ ID NO: 6), где хотя аминокислотная последовательность, имеет вариабельность в каркасном участке, в целом последовательности каркасных участков идентичны по меньшей мере на 75%, по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, по меньшей мере на 90%, еще более предпочтительно по меньшей мере на 95%, и наиболее предпочтительно на 98% аминокислотным остаткам, присутствующим в положениях 1-30, 38-51, 68-99 и 112-122 SEQ ID NO: 7 и в положениях 1-23, 41-55, 63-94 и 104-114 SEQ ID NO: 8.
В этом контексте выражение «последовательность каркасных участков полипептида идентична по меньшей мере на Х%» SEQ ID NO: 7 или SEQ ID NO: 8, если SEQ ID NO: 7 или SEQ ID NO: 8 выравнивают с наиболее совпадающей последовательностью представляющего интерес полипептида и устанавливают, что идентичность аминокислот двух выровненных последовательностей составляет по меньшей мере Х% в положениях 1-30, 38-51, 68-99 и 112-122 SEQ ID NO: 7 и положениях 1-23, 41-55, 63-94 и 104-114 SEQ ID NO: 8. Как указано выше, такой сравнительный анализ первичной структуры аминокислотных последовательностей можно осуществлять, например, с использованием публично доступных компьютерных программ оценки гомологии, таких как программа «BLAST», предлагаемая на домашней странице Национального центра биотехнологической информации (NCBI), с использованием указанных в этой программе задаваемых по умолчанию параметров. В данной области известны и другие методы расчета процента идентичности наборов аминокислотных последовательностей или нуклеотидных последовательностей.
Кроме того, в предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент для применения согласно настоящему изобретению, содержит VH, имеющую SEQ ID NO: 9, и VL, имеющую SEQ ID NO: 10.
Специфичность антитела или антигенсвязывающего фрагмента, предлагаемого в настоящем изобретении, может обусловливаться не только природой аминокислотной последовательности антитела или антигенсвязывающего фрагмента, указанного выше, но также и эпитопом, с которым может связываться антитело. Так, в предпочтительном варианте осуществления настоящего изобретения применяют антитело к HSV или его антигенсвязывающий фрагмент, предлагаемый в настоящем изобретении, которое/который распознает тот же самый эпитоп, что и описанное выше антитело, предпочтительно МАт hu2c. Как продемонстрировано в разделе «Примеры» и проиллюстрировано на фиг. 13А и фиг. 13В WO 2011/038933 А2, указанный эпитоп представляет собой прерывистый или скорее псевдонепрерывный эпитоп, частично устойчивый к денатурации, локализованный на аминокислотах 172-195 и 295-313 гликопротеина В HSV-1 HSV-2. В контексте настоящего описания эпитоп для антитела МАт 2с может быть локализован на участке, включающем первые 487 аминоконцевых остатков белка gB. Предпочтительно эпитоп может содержать по меньшей мере одну аминокислотную последовательность, находящуюся между положениями 172 и 307 аминокислотной последовательности белка gB.
Эпитоп может содержать непрерывную аминокислотную последовательность301YGYRE305 белка gB, предпочтительно непрерывную аминокислотную последовательность301YGYREG306 или300FYGYRE305, более предпочтительно последовательность может быть дополнительно удлинена на концах (т.е. может представлять собой299PFYGYRE305 или300FYGYREGS307). Эпитоп для антител, предлагаемых в настоящем изобретении, может содержать непрерывную аминокислотную последовательность 298-313 (298SPFYGYREGSHTEHTS313) gB.
Альтернативно этому эпитоп может быть локализован в непрерывной аминокислотной последовательности172QVWFGHRYSQFMGIFED188. Эпитоп может содержать непрерывную аминокислотную последовательность172QVWFGHRYSQFMG184.
Предпочтительно эпитоп может состоять более чем из одной непрерывной аминокислотной последовательности. Эпитоп может представлять собой частично прерывистый эпитоп. Более предпочтительно эпитоп может содержать две непрерывные аминокислотные последовательности. Такой эпитоп, состоящий из двух аминокислотных последовательностей, можно обозначить как «дуотоп» («двойной эпитоп»). Антитело может связываться с обеими аминокислотными последовательностями.
Более предпочтительно аминокислотные последовательности двойного эпитопа могут содержать аминокислотную последовательность300FYGYRE305 и аминокислотную последовательность, локализованную между аминокислотными положениями 172 и 188. Еще более предпочтительно эпитоп может содержать аминокислотную последовательность300FYGYRE305 и аминокислотную последовательность179YSQFMG184 белка gB. Альтернативно этому эпитоп или двойной эпитоп можно синтезировать химическим путем. Эпитоп может представлять собой синтезированный химическим путем эпитоп, имеющий последовательность YSQFMG-βA-FYGYRE. В настоящем описании сокращение βА используют для обозначения бета-аланина.
Наиболее предпочтительно эпитоп может содержать аминокислотную последовательность FYGYRE и аминокислотную последовательность FED белка gB. Эпитоп может представлять собой синтезированный химическим путем эпитоп, имеющий последовательность FED-βA-βA-FYGYRE или PFYGYREGFEDF.
Специалисту в данной области должно быть очевидно, что эпитопы могут содержаться в белке gB, но могут содержаться также и в продукте его расщепления или могут представлять собой синтезированный химическим путем пептид. Аминокислотные положения представлены только для указания положения соответствующей аминокислотной последовательности в последовательности белка gB. Под объем изобретения подпадают все пептиды, содержащие эпитоп. Пептид может представлять собой часть полипептида длиной более 100 аминокислот или может представлять собой небольшой пептид, состоящий менее чем из 100, предпочтительно менее чем из 50, более предпочтительно менее чем из 25 аминокислот, еще более предпочтительно менее чем из 16 аминокислот. Аминокислоты в таком пептиде могут представлять собой встречающиеся в естественных условиях аминокислоты или не встречающиеся в естественных условиях аминокислоты (например, бета-аминокислоты, гамма-аминокислоты, D-аминокислоты) или их комбинацию. Кроме того, под объем настоящего изобретения могут подпадать соответствующие ретро-инвертированные пептиды эпитопов. Пептид может быть несвязанным или связанным. Он может быть связан, например, с малой молекулой (например, с лекарственным средством или флуорофором), с высокомолекулярным полимером (например, с полиэтиленгликолем (ПЭГ), полиэтиленимином (ПЭИ), гидроксипропилметакрилатом (ГПМА) и т.д.) или с белком, жирной кислотой, сахарным фрагментом или может быть встроен в мембрану.
Для того, чтобы протестировать, распознают ли рассматриваемое антитело и антитело, предлагаемое в настоящем изобретении, один и тот же эпитоп, можно проводить следующее исследование в условиях конкуренции: Клетки линии Vero, инфицированные с множественностью заражения (MOI) 3, через 20 ч инкубируют в течение 1 ч с рассматриваемым антителом, взятым в различных концентрациях, в качестве конкурента. На второй стадии вносят антитело, предлагаемое в настоящем изобретении в постоянной концентрации 100 нМ и проводят обнаружение его связывания методом проточной цитометрии с использованием флуоресцентно меченного антитела к константным доменам антитела, предлагаемого в изобретении. Обнаружение связывания, характеризующегося обратно пропорциональной зависимостью от концентрации рассматриваемого антитела, свидетельствует о том, что оба антитела распознают один и тот же эпитоп. Однако, можно применять также и многочисленные другие анализы, известные в данной области.
Так, в предпочтительном варианте осуществления изобретения, антитело к HSV или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, распознает тот же самый эпитоп, что и МАт 2с, где указанный эпитоп локализован на аминокислотах 172-195 и 295-315 гликопротеина В HSV-1 и HSV-2. С использованием перекрывающихся 15-мерных пептидов, охватывающих область gB от аминокислоты 31 до аминокислоты 505, было установлено, как описано у
Последовательность гликопротеина В HSV-1 и/или HSV-2 хорошо охарактеризована, и, как указано выше, если не рассматривать конкретные последовательности, то примерами последовательностей различных штаммов HSV-1 и HSV-2 соответственно могут служить последовательности, представленные в SEQ ID NO: 11-16. Эпитоп, распознаваемый антителом МАт 2с, является высоко консервативным среди различных HSV-штаммов, а также между HSV-1 и HSV-2.
Указанное антитело или его антигенсвязывающий фрагмент, которое/который можно применять для лечения, указанного в настоящем изобретении, не ограничено антителом, обнаруживающим указанный выше эпитоп гликопротеина В HSV-1 и HSV-2. Фактически, для лечения, предлагаемого в настоящем изобретения, можно применять также и другие антитела, которые обнаруживают другой эпитоп гликопротеина В или даже эпитоп на другом белке или полипептиде HSV-1 и HSV-2, если такое антитело обладает способностью оказывать действие при лечении острой инфекции слизистой или эпидермальной ткани у индивидуума, которая вызывается HSV-1 или HSV-2, указанной в настоящем изобретении, или обладает способностью ингибировать распространение HSV от инфицированной клетки к соседней второй неинфицированной клетке (распространение от клетки к клетке), или обладает способностью ингибировать распространение от клетки к клетке независимо от антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) и/или комплементзависимой цитотоксичности (CDC), как указано выше и ниже в настоящем описании.
На основе сведений, которым обладает обычный специалист в данной области, и с помощью стандартных методов специалист в данной области легко может получать из представленных в настоящем описании последовательностей соответствующие эпитопы (а также функциональные фрагменты) полипептидов HSV, которые можно применять при создании антител, таких как поликлональные и моноклональные антитела. Однако, специалист в данной области легко может также сконструировать антитела, такие как антитела с трансплантированными CDR или также гуманизированные и полностью человеческие антитела, и т.п.
В контексте настоящего изобретения наиболее предпочтительными являются моноклональные антитела. Для получения моноклональных антител можно применять любой метод, который позволяет получать антитела, продуцируемые непрерывным культивированием клеточных линий. Примеры таких методов включают метод гибридомы, метод триомы, метод человеческой В-клеточной гибридомы и метод EBV-гибридомы для получения человеческих моноклональных антител (Shepherd и Dean, Monoclonal Atibodies: A Practical Approach, изд-во Oxford University Press, 2000, Goding и Goding, Monoclonal Atibodies: Principles and Practice - Production and Application of Monoclonal Atibodies in Cell Biology, Biochemistry and Immunology, изд-во Academic Pr Inc, USA, 1996).
С помощью пептидомиметиков можно получать также производные антител. Кроме того, можно адаптировать методы, описанные для производства одноцепочечных антител (см., среди прочего, US 4946778), для получения одноцепочечных антител, специфически распознающих антиген HSV. Можно использовать также трансгенных животных для экспрессии гуманизированных антител к полипептиду HSV.
Настоящее изобретение относится также к получению специфических антител против нативных полипептидов и рекомбинантных полипептидов гликопротеина В или любого другого белка или полипептида HSV-1 и HSV-2. Такое получение основано, например, на иммунизации животных, таких как мыши. Однако, можно применять также и других животных для получения антител/антисыворотки согласно настоящему изобретению. Например, моноклональные и поликлональные антитела можно получать с использованием кроликов, мышей, коз, ослов и т.п. Полинуклеотид, кодирующий выбранный соответствующим образом полипептид HSV-1 или HSV-2, можно субклонировать в пригодном векторе, при этом рекомбинантный полипептид должен быть предназначен для экспрессии в пригодном для экспрессии организме, например, в бактериях. Так, экспрессированный рекомбинантный белок можно вводить путем внутрибрюшинной инъекции мыши и образовавшееся специфическое антитело можно, например, получать из мышиной сыворотки, взятой посредством внутрисердечной пункции крови. В настоящем изобретении предложено также получение специфических антител против нативных полипептидов и рекомбинантных полипептидов с применением стратегии ДНК-вакцины, что проиллюстрировано в прилагаемых примерах. Стратегии ДНК-вакцины хорошо известны в данной области и они включают опосредуемую липосомой доставку, инъекцию с помощью генной пушки и струйную инъекцию и внутримышечную или внутрикожную инъекцию. Так, антитела, направленные против полипептида или белка, или эпитопа HSV-1 и HSV-2, можно получать непосредственно путем иммунизации животного, осуществляемой непосредственно путем внутримышечной инъекции вектора, экспрессирующего требуемый полипептид или белок, или эпитоп HSV-1 и HSV-2, прежде всего, эпитоп gB. Количество полученного специфического антитело можно оценивать с помощью ELISA, согласно описанной ниже процедуре. В данной области хорошо известны также и другие методы получения антител, см., например, Harlow и Lane, «Antibodies, A Laboratory Manual», изд-во CSH Press, Cold Spring Harbor, 1988.
В контексте настоящего описания понятие «специфически связывается» относится к реакции связывания, определяющим фактором которой является наличие требуемого полипептида или белка, или эпитопа HSV-1 и HSV-2, прежде всего эпитопа gB, и антитела в присутствии гетерогенной популяции белков и других биологических субстанций.
Так, в соответствующих условиях анализа определенные антитела и соответствующий полипептид или белок, или эпитоп HSV-1 и HSV-2, прежде всего эпитоп gB, связываются друг с другом и не связываются в существенной степени с другими компонентами, присутствующими в образце. Специфическое связывание с аналитом-мишенью в таких условиях может требовать наличия связывающего фрагмента, который выбирают, исходя из его специфичности в отношении конкретного аналита-мишени. Для отбора антител, обладающих специфической реактивностью в отношении конкретного антигена, можно использовать различные форматы иммуноанализа. Например, для отбора моноклональных антител, обладающих специфической иммунореактивностью в отношении аналита, применяют стандартные твердофазные иммуноанализы ELISA (см. описание форматов иммуноанализов и условий, которые можно использовать для определения специфической иммунореактивности у Shepherd и Dean, Monoclonal Antibodies: A Practical Approach, изд-во Oxford University Press, 2000) и/или Howard и Bethell, Basic Methods in Antibody Production and Characterization, изд-во Crc. Pr. Inc., 2000). Как правило, специфическая или избирательная реакция должна приводить к сигналу, более высокому по меньшей мере в два раза, чем фоновый шум, и более предпочтительно к сигналу, более высокому в 10-100 раз, чем фон. Специалист в данной области может разработать и создать специфические связывающие молекулы, направленные против новых полипептидов. Их можно легко применять для анализов специфического связывания для того, чтобы избежать нежелательной перекрестной реактивности, например, с помощью известных методов можно легко очищать и отбирать поликлональные антитела (см. Shepherd и Dean, loc. cit.).
Понятие «антитело к HSV или его антигенсвязывающий фрагмент» согласно настоящему изобретению означает, что молекула антитела или его антигенсвязывающего фрагмента обладает способностью специфически распознавать или специфически взаимодействовать, и/или связываться по меньшей мере с двумя аминокислотами требуемого полипептида или белка, или эпитопа HSV-1 и HSV-2, прежде всего эпитопа gB. Указанное понятие относится к специфичности молекулы антитела, т.е. к ее способности различать специфические области требуемого полипептида или белка, или эпитопа HSV-1 и HSV-2, прежде всего эпитопа gB. Таким образом, специфичность можно определять экспериментально с помощью методов, известных в данной области, и методов, представленных и описанных в настоящей заявке. Такие методы включают (но не ограничиваясь только ими) вестерн-блоттинг, ELISA-, RIA-, ECL-, IRMA-анализы и пептидные сканирования. Такие методы включают также определение величин KD, как проиллюстрировано, среди прочего, в прилагаемых примерах. Пептидное сканирование (pepspot-анализ) является стандартным методом, который применяют для картирования линейных эпитопов в полипептидном антигене. Осуществляют последовательный синтез первичной последовательности полипептида на активированной целлюлозе с использованием перекрывающихся друг с другом пептидов. Распознавание определенных пептидов антителом, подлежащим тестированию в отношении его способности обнаруживать или распознавать специфический антиген/эпитоп оценивают в баллах путем стандартного выявления окрашивания (вторичным антителом, конъюгированным с пероксидазой из хрена и 4-хлоронафтолом и пероксидом водорода) в результате хемилюминесцентной реакции или с помощью сходных средств, известных в данной области. В том случае, если, среди прочего, применяют хемолюминесцентные реакции, можно осуществлять количественную оценку реакций. Если антитело взаимодействует с определенным набором перекрывающихся пептидов, можно определять минимальную последовательность аминокислот, необходимых для реакции. С помощью этого же анализа можно выявлять два отделенных друг от друга кластера реакционноспособных пептидов, это свидетельствует о распознавании прерывистого, т.е. конформационного эпитопа в антигеном полипептиде (Geysen, Mol. Immunol. 23, 1986, сс. 709-715).
Предпочтительным эпитопом для антитела к HSV или его антигенсвязывающего фрагмента, как указано выше и ниже в настоящем описании, является тот же самый эпитоп, который распознается МАт 2с.
В предпочтительном варианте осуществления изобретения антитело к HSV (или его антигенсвязывающий фрагмент), предназначенное для применения согласно настоящему изобретению, представляет собой антитело МАт 2с (или его антигенсвязывающий фрагмент). Это моноклональное антитело МАт 2с описано в соответствующих разделах в настоящем описании, и было продемонстрировано, что оно нейтрализует вирус путем устранения распространения вируса от клетки к клетке, представляющего собой имеющий решающее значение механизм, посредством которого HSV-1/2 избегает гуморального иммунного надзора, независимо от антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) и/или комплементзависимой цитотоксичности (CDC) (см.


Антитела и их антигенсвязывающие фрагменты, указанные выше, наиболее предпочтительно используют в медицине в условиях, в которых используют местное применение. Так, как указано выше, настоящее изобретение относится к медицинскому применению антитела к HSV или его антигенсвязывающего фрагмента, в котором указанное антитело или его антигенсвязывающий фрагмент применяют местно. Таким образом, настоящее изобретение относится к антителу к HSV или его антигенсвязывающему фрагменту, предназначенному для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения.
В контексте настоящего описания понятие «лечение» и т.п., как правило, означают достижение требуемого фармакологического и/или физиологического действия. Как уже описано выше, понятие «лечение» согласно настоящему изобретению относится к лечению острых инфекций и, следовательно, исключает вариант, когда действие может быть профилактическим в смысле полного или частичного предупреждения заболевания или его симптомов. Скорее, понятие «лечение» следует понимать как терапевтическое с позиций частичного или полного излечения заболевания и/или неблагоприятного воздействия, и/или симптомов, обусловленных заболеванием, вызванным острой HSV-инфекцией, указанной выше. Таким образом, лечение согласно настоящему изобретению относится к лечению острых инфекций. В этом контексте понятие «острый» означает, что у индивидуума имеются симптомы заболевания. Иными словами, подлежащий лечению индивидуум действительно нуждается в лечении, и в контексте настоящего изобретения понятие «острое лечение» относится к мерам, предпринимаемым для фактического лечения заболевания после его начала или вспышки заболевания. Понятие «острый» в контексте настоящего изобретения является противоположным профилактическому лечению или превентивному лечению, т.е. мерам, предпринимаемым для предупреждения заболевания, например, для предупреждения инфекции и/или вспышки заболевания. Более конкретно, профилактическое лечение можно понимать в том смысле, что оно предупреждает присоединение свободных вирусных частиц (проникнувших извне в организм) к клеткам-мишеням, что, в свою очередь, предупреждает репликацию вируса. В отличие от этого, при острой инфекции (которая может представлять собой первичную или рецидивирующую инфекцию) в результате репликации HSV уже возникло потомство вируса. Таким образом, необходимо специально отметить, что в контексте настоящего изобретения «острое лечение» не относится к профилактическому или превентивному лечению инфекции, вызываемой HSV-1 или HSV-2. В контексте настоящего изобретения понятие «местное применение» относится к медикаментозному лечению, нанесению или применению, которое осуществляют на различных поверхностях тела, таких как кожа или слизистые мембраны, для лечения указанной выше инфекции с использованием большого разнообразия форм, пригодных для применения, включая (но не ограничиваясь только ими) кремы, пены, гели, лосьоны и мази. Следует иметь в виду, что в предпочтительном варианте осуществления изобретения местное применение должно быть накожным, это означает, что антитело к HSV или его антигенсвязывающий фрагмент наносят непосредственно на кожу. Не вдаваясь в теорию, а также для того, чтобы привести некоторые другие примеры, не ограничивающие объем изобретения, следует иметь в виду, что местное применение можно осуществлять также путем ингаляции, например, при медикаментозном лечении астмы, или нанесение можно осуществлять на поверхность тканей, отличных от кожи, как, например, в случае глазных капель, которые наносят на конъюнктиву, или ушных капель, которые вносят в ухо, или лекарственных средств, которые наносят на поверхность зуба. В качестве пути применения местное применение противопоставляется энтеральному (в пищеварительный тракт) и внутрисосудистому/внутривенному (инъекция в кровоток). В наиболее широком смысле можно считать, что местное действие относится с точки зрения фармакодинамики к локальной, а не системной мишени для лекарственного средства.
Не накладывается специальных ограничений на форму местного применения согласно настоящему изобретению, т.е. на лекарственное средство, фармацевтическую композицию или на нанесение или введение, которое применяют к поверхностям тела, таким как кожа или слизистые мембраны для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, и специалисту в данной области известны многие формы и препараты, которые можно использовать для местного применения. Ниже приведены примеры, не связанные с теоретическим объяснением и не ограничивающие объем изобретения. Существует много общих классов препаратов, пригодных для местного применения, при этом нет четкого разграничения между сходными препаратами. Например, можно применять раствор для местной обработки. Растворы для местной обработки, как правило, обладают низкой вязкостью и в качестве основы в них часто используют воду или спирт.
Другим примером является лосьон, который можно использовать для местного применения антитела к HSV. Лосьоны сходны с растворами, но они являются более густыми, и они обладают более мягчительными свойствами, чем раствор. Как правило, они представляют собой масло, смешанное с водой, и в большинстве случаев содержат меньше спирта, чем растворы.
В качестве другого примера, для местного применения антитела к HSV можно использовать крем. Крем, как правило, представляет собой эмульсию, состоящую из масла и воды в примерно равных пропорциях. Она хорошо проникает через роговой слой, представляющий собой наружный слой кожи. Крем гуще лосьона и он сохраняет свою форму при удалении из контейнера. Он характеризуется умеренной увлажняющей способностью.
В качестве другого примера, для местного применения антитела к HSV можно использовать мазь. Мазь обычно представляет собой гомогенный вязкий полутвердый препарат, чаще всего жирное густое масло (с содержанием масла 80%, воды 20%), обладающее высокой вязкостью, которое предназначено для наружного нанесения на кожу или слизистые мембраны. Масла характеризуются водным числом, определяющим максимальное количество воды, которое может содержаться в нем. Их можно использовать в качестве смягчающего средства или для применения антитела к HSV согласно настоящему изобретению для целей защиты кожи, терапевтических или профилактических целей и в тех случаях, когда требуется обеспечить определенную степень непроницаемости. Наполнитель мази называют основой мази. Выбор основы зависит от клинических показаний для применения мази, и соответствующий выбор находится в компетенции специалиста в данной области. Существуют различные типы основ мазей, которые могут представлять собой углеводородные основы, например, твердый парафин, полутвердый парафин, микрокристаллический воск и церезин; абсорбирующие основы, например, ланолин, пчелиный воск; водорастворимые основы, например, макрогели 200, 300, 400; эмульгирующиеся основы, например, эмульгирующийся воск, цетримид; растительные масла, например, оливковое масло, кокосовое масло, кунжутное масло, миндальное масло и арахисовое масло. Как правило, лекарственное средство, т.е. антитело к HSV, предлагаемое в настоящем изобретение, диспергируют в основе, и позднее оно отделяется от нее после проникновения в живые клетки кожи. Мази, как правило, приготавливают с использованием гидрофобных, гидрофильных или эмульгирующихся в воде основ для получения препаратов, которые не смешиваются, смешиваются с кожными секретами или образуют эмульсию при контакте с ними. Их можно приготавливать также с использованием углеводородных (жирных), абсорбирующих, водоотталкивающих или водорастворимых основ.
В качестве другого примера, для местного применения антитела к HSV можно использовать гель. Гели, как правило, являются более густыми по сравнению с растворами. Гели часто представляют собой полутвердую эмульсию в спиртовой основе. Некоторые из них могут плавиться при температуре тела. Гель может представлять собой целлюлозный гель, расщепляемый спиртом или ацетоном.
В качестве другого примера, для местного применения антитела к HSV можно использовать пену.
В качестве другого примера, для местного применения антитела к HSV можно использовать трансдермальный пластырь. Применение трансдермальных пластырей может представлять собой метод доставки лекарственного средства с очень точным высвобождением в зависимости от времени. Высвобождение активного компонента из трансдермальной системы доставки (пластыря) можно контролировать путем контроля диффузии через адгезив, покрывающий весь пластырь, диффузии через мембрану, которая снабжена адгезивом только на краях пластыря, или высвобождение лекарственного средства можно контролировать путем контроля высвобождения из полимерной матрицы.
В качестве другого примера, для местного применения антитела к HSV можно использовать порошок. Порошок представляет собой либо чистое лекарственное средство (порошок талька), либо состоит из лекарственного средства, смешанного с носителем, таким как кукурузный крахмал или порошок из сердцевины кукурузного початка (фирма Zeosorb AF - порошок миконазола).
В качестве другого примера, для местного применения антитела к HSV можно использовать твердую форму. Так, антитело к HSV может быть включено в твердую форму. Примерами являются дезодоранты, антиперсперанты, вяжущие вещества и гемостатические агенты. В предпочтительном варианте осуществления изобретения, прежде всего, в контексте местного применения антитела к HSV для лечения острой инфекции слизистой или эпидермальной ткани, которая вызывается HSV-1 или HSV-2, представляющей собой простой генитальный герпес, антитело к HSV можно вводить в форме суппозитория. Суппозиторий представляет собой систему доставки лекарственного средства, которая в контексте лечения простого генитального герпеса содержит антитело к HSV и которую можно вводить во влагалище (т.е. в форме вагинального суппозитория), где он растворяется или расплавляется и высвобождает антитело к HSV и, следовательно, выполняет функцию местной доставки антитела к HSV.
В качестве другого примера, для местного применения антитела к HSV можно использовать испарительное устройство. Так, антитело к HSV можно применять в форме мази или геля и доставлять к слизистой мембране посредством испарения.
В качестве другого примера, для местного применения антитела к HSV можно использовать пасту. Паста объединяет три агента - масло, воду и порошок. Она представляет собой мазь, в которой суспендируют порошок.
В качестве последнего (не ограничивающего объем изобретения) примера, для местного применения антитела к HSV можно использовать настойку.
Настойка представляет собой препарат для кожи, который содержит высокий процент спирта.
В другом варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, следует наносить местно на инфицированную слизистую или эпидермальную ткань. Не накладывается конкретных ограничений на область, на которую следует наносить антитело к HSV или его антигенсвязывающий фрагмент. Предпочтительно, выбирают область слизистой или эпидермальной ткани, на которой проявляются симптомы острой инфекции, вызываемой HSV-1 или HSV-2. Предпочтительно, указанными областями или частями тела индивидуума являются губы, гениталии, нос, уши, глаза, пальцы рук, пальцы ног и/или области кожи на всем теле, предпочтительно на голове, челюстной области, шее, груди, лице, животе и/или ногах. В частности, при описанной выше кожной инфекции, вызываемой вирусом герпеса простого, обычно могут поражаться области кожи (большего размера) по всему телу, в то время как при описанном выше герпесе борцов-спортсменов, как правило, это имеет место на голове, наиболее часто в челюстной области, на шее, груди, лице, животе и ногах. Следовательно, при этих заболеваниях местное нанесение согласно изобретению предпочтительно следует осуществлять на указанные части тела или области слизистой или эпидермальной ткани.
В другом предпочтительном варианте осуществления изобретения антитело к HSV или его антигенсвязывающий фрагмент для применения согласно настоящему изобретению, предназначено/предназначен для местного нанесения на области, окружающие инфицированную слизистую или эпидермальную ткань. Под областями, окружающими инфицированную слизистую или эпидермальную ткань следует понимать область, расположенную вокруг указанной инфицированной области ткани. Не накладывается конкретных ограничений на размер окружающей области, но она может охватывать, например, область, примыкающую/окружающую инфицированную ткань, которая составляет примерно 0,5 от размера инфицированной области, имеет тот же самый размер, что и инфицированная область, в 1,5 раза, предпочтительно в 2 раза или еще более предпочтительно в 3, 4 или 5 раз больше размера инфицированной области.
Антитело к HSV или его антигенсвязывающий фрагмент для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело к HSV или его антигенсвязывающий фрагмент предназначено/предназначен для местного применения, можно применять в комбинации с вирустатическим агентом. Предпочтительно такая комбинированная терапия синергетическое действие при лечении согласно настоящему изобретению.
В контексте настоящего описания понятие «комбинация» относится к комбинации антитела к HSV или его антигенсвязывающего фрагмента, указанного выше, с вирустатическим агентом, указанным ниже в настоящем описании. В предпочтительном варианте осуществления изобретения предлагается одновременное применение. Однако, использование комбинации включает также последовательное применение двух компонентов, а именно, антитела к HSV или его антигенсвязывающего фрагмента, указанного выше, и вирустатического агента, указанного ниже в настоящем описании. Так, один из указанных компонентов можно применять до, одновременно или после другого компонента, входящего в комбинацию, или наоборот. Следовательно, в контексте настоящего описания выражение «в комбинации» не ограничивает промежуток времени между применением антитела к HSV или его антигенсвязывающего фрагмента, описанного выше, и вирустатического агента, указанного ниже в настоящем описании. Так, когда два компонента не применяют одновременно/конкурентно, применения могут быть отделены друг от друга промежутком времени, составляющим 1 минуту, 5 минут, 15 минут, 30 минут, 45 минут, 1 ч, 2 ч, 4 ч, 6 ч, 12 ч, 24 ч, 48 ч или 72 ч, или любым пригодным промежутком времени, который легко может определять специалист в данной области, и/или который указан в настоящем описании.
Вирустатические агенты хорошо известны специалисту в данной области и обычно их называют также противовирусными лекарственными средствами, которые представляют собой класс медикаментозных средств, применяемых специально для лечения вирусных инфекций. Для конкретных вирусов применяют специфические противовирусные средства. В отличие от большинства антибиотиков противовирусные лекарственные средства не разрушают их патоген-мишень, а ингибируют его развитие.
Касательно HSV-инфекций, специалист в данной области может выбрать соответствующий вирустатический агент, пригодный для ингибирования развития вируса согласно настоящему изобретению. Например, вирустатический агент можно выбирать из группы, состоящей из классов лекарственных средств, представляющих собой нуклеозидные аналоги, пирофосфатные аналоги, нуклеотидные аналоги, производные амантадина и ингибиторы геликазы-примазы. Таким образом, настоящее изобретение относится к антителу к HSV или его антигенсвязывающему фрагменту, предназначенному для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело к HSV или его антигенсвязывающий фрагмент предназначено/предназначен для применения в комбинации с вирустатическим агентом, выбранным из группы, состоящей из классов лекарственных средств, представляющих собой нуклеозидные аналоги, пирофосфатные аналоги, нуклеотидные аналоги, и ингибиторы геликазы-примазы.
Нуклеозидные аналоги известны в данной области и они относятся к молекулам, которые функционируют аналогично нуклеозидам при синтезе ДНК. Они включают целый ряд противовирусных продуктов, применяемых для предупреждения репликации вирусов в инфицированных клетках. Поскольку они могут подвергаться фосфорилированию, они действуют в качестве антиметаболитов, будучи в достаточной степени сходными с нуклеотидами, подлежащими включению в растущие цепи ДНК, но они действуют также в качестве терминаторов цепи и прекращают действие вирусной ДНК-полимеразы. Известно, что нуклеозидные, нуклеотидные и пирофосфатные аналоги ингибируют синтез вирусных нуклеиновых кислот, блокируя репликацию вирусов. Нуклеозидные и нуклеотидные аналоги представляют собой противометаболитные лекарственные средства. Пирофосфатные аналоги (например, фоскарнет) структурно имитируют пирофосфатный анион и оказывают противовирусное действие посредством избирательного ингибирования сайта связывания пирофосфата на вирусспецифических ДНК-полимеразах в концентрациях, которые не влияют на клеточные ДНК-полимеразы. Нуклеотидные и пирофосфатные аналоги не требуют начальной активации (фосфорилирования) тимидинкиназами или другими киназами перед поглощением клетками. Ингибиторы геликазы-примазы представляют собой ненуклеозидные ингибиторы, мишенью которых является вирусная геликаза-примаза.
Предпочтительно можно применять широко известные и разрешенные вирустатические агенты, обзор которых приведен ниже. В качестве примера нуклеозидного аналога можно отметить соединение, выбранное из группы, состоящей из ацикловира, пенцикловира, валацикловира и фамацикловира, и его можно применять при осуществлении описанной выше комбинированной терапии. В качестве пирофосфатного аналога можно применять фоскарнет. В качестве нуклеотидного аналога можно применять цидофовир. В качестве ингибитора геликазы-примазы следует отметить прителивир. В качестве производного амантадина можно применять тромантадин.
Ацикловир, который называют также ациклогуанозином (ACV) или 2-амино-9-(2-гидроксиэтоксиметил)-3Н-пурин-6-оном, представляет собой являющееся аналогом гуанозина противовирусное лекарственное средство, поступающее в продажу под такими товарными знаками, как ACERPES®, Acic®, Aciclobeta®, AcicloCT®, Aciclostad®, ацикловир, Acic®, Ophtal®, Acivir®, ацивизион, Acyclovir®, Aviral®, цикловир, Helvevir®, герпекс, Supraviran®, Virucalm®, Virupos®, вирзин, Zoliparin®, зовир и Zovirax®.
Пенцикловир, т.е. (2-амино-9-[4-гидрокси-3-(гидроксиметил)бутил]-6,9-дигидро-3Н-пурин-6-он), представляет собой являющееся аналогом гуанина противовирусное лекарственное средство, поступающее в продажу под такими товарными знаками, как денавир и фенистил.
Фамцикловир, т.е. (2-[(ацетилокси)метил]-4-(2-амино-9Н-пурин-9-ил)бутилацетат), представляет собой пролекарство пенцикловира, обладающее улучшенной оральной биодоступностью.
Фоскарнет представляет собой конъюгат, основой которого является химическое соединение формулы НО2СРО3Н2, и он поступает в продажу под товарными знаками Foscavir® и Triapten®.
Валацикловир, известный также как (S)-2-[(2-амино-6-оксо-6,9-дигидро-3Н-пурин-9-ил)метокси]этил-2-амино-3-метилбутаноат, является пролекарством аналога гуанозина, представляющего собой противовирусное лекарственное средство ACV, поступающее в продажу под таким товарным знаком, как, например, Valtrex®.
Цидовир (CDV), также известный как (S)-1-[3-гидрокси-2-(фосфонилметоксипропил)]цитозин, представляет собой нуклеотидный аналог противовирусного лекарственного средства, поступающего в продажу под товарным знаком Visitde®.
Прителевир представляет собой тиазолиламид, также известный как AIC-316, или BAY 57-1293, является ингибитором геликазы-примазы, который в настоящее время проходит стадию II клинических испытаний в отношении лечения генитальных инфекций, вызываемых HSV-2.
Терапевтическое лекарственное средство для местного применения тромантандин (гель Виру-Мерц Серол (Viru-Merz Serol)) применяется исключительно для местной обработки при лечении кожных инфекций, вызываемых HSV. Тромантандин представляет собой производное амантадина. В патенте US 4351847 на имя Griffin описано, что производное амантадина обладает эффективностью в отношении вируса герпеса простого.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей в эффективном количестве антитело или его антигенсвязывающий фрагмент, описанное/описанный выше, и по меньшей мере один фармацевтически приемлемый эксципиент.
Эксципиент представляет собой неактивную субстанцию, включенную в препарат наряду с действующим веществом, т.е. антителом к HSV или антигенсвязывающим фрагментом, описанным выше, для увеличения объема препаратов, содержащих сильные действующие вещества. Эксципиенты часто называют «агентами для увеличения объема», «наполнителями» или «разбавителями». Увеличение объема позволяет удобно и точно распределять лекарственную субстанцию при приготовлении лекарственной формы. Эксципиенты могут также служить для различных усиливающих терапевтическое действие целей, таких как облегчение абсорбции или повышение растворимости лекарственного средства, или улучшения других фармакокинетических характеристик. Эксципиенты можно применять также в процессе производства для облегчения манипуляций с действующим веществом, например, для повышения текучести порошка или обеспечения неприлипаемости, в дополнение к тому, что они позволяют улучшать стабильность in vitro, например, путем предупреждения денатурации в течение ожидаемого срока хранения. Выбор пригодных эксципиентов зависит также от пути введения и лекарственной формы, а также от действующего вещества и других факторов.
Таким образом, как указано выше, фармацевтическая композиция, содержащая в эффективном количестве антитело или его антигенсвязывающий фрагмент, может находиться в твердой, жидкой или газообразной форме и может находиться, среди прочего, в форме порошка(ов), таблетки(ок), раствора(ов) или аэрозоля(ей). Предпочтительно указанная фармацевтическая композиция необязательно содержит фармацевтически приемлемый носитель и/или разбавитель.
Примеры пригодных фармацевтических носителей, эксципиентов и/или разбавителей хорошо известны в данной области и включают забуференные фосфатом физиологические растворы, воду, эмульсии, такие как эмульсии типа масло/вода, различные типы смачивающих агентов, стерильные растворы и т.д. Композиции, содержащие такие носители, можно приготавливать с помощью известных стандартных методов. Указанные фармацевтические композиции можно вводить индивидууму в пригодной дозе, т.е. в «эффективном количестве», которое специалист в данной области легко может определять с помощью методов, известных в данной области. Обработку пригодной фармацевтической композицией осуществляют согласно настоящему изобретению путем местного применения. Схему применения должен определять лечащий врач с учетом клинических факторов. Как хорошо известно в области медицины, дозы для любого пациента зависят от многих факторов, включая телосложение пациента или индивидуума, площадь поверхности тела, возраст, конкретное соединение, подлежащее введению, пол, период времени и путь введения, общее состояние здоровья и другие применяемые одновременно лекарственные средства. Белковая фармацевтически активная субстанция может присутствовать в количествах, составляющих 0,1-10 мкг/кг веса тела на дозу; однако можно рассматривать также и дозы, находящиеся ниже или выше этого приведенного в качестве примера диапазона, прежде всего, учитывая указанные выше факторы. Для местного применения, которое является наиболее предпочтительным в контексте настоящего изобретения, наиболее пригодны концентрации содержащей антитело фармацевтически активной субстанции, пригодной для местного применения, как указано выше и ниже в настоящем описании, составляющие от 0,1 до 10 мг/мл, предпочтительно от 0,5 до 5 мг/мл. Они соответствуют диапазонам, использованным в примерах, представленных ниже, в которых применяли антитело, находящееся в жидком растворе (ЗФР) или смешанное в соотношении 1:2 с кремом в концентрации от 0,5 до 5 мг/мл, что соответствует концентрации от 0,5 до 5 мг/г в ЗФР или креме, имеющем ту же плотность, что и ЗФР.
Таким образом, предпочтительно, антитело или его антигенсвязывающий фрагмент, и/или вирустатический агент включают в эффективном количестве. Понятие «эффективное количество» относится к количеству, достаточному для индукции обнаруживаемого терапевтического ответа у индивидуума, которому требуется вводить фармацевтическую композицию. В соответствии с вышеуказанным не накладывается ограничений на содержание антитела в фармацевтической композиции, если оно пригодно для лечения, описанного выше, но предпочтительно оно составляет 0,0000001-10 мас. % в пересчете на массу всей композиции. Кроме того, антитело, представленное в настоящем описании, предпочтительно применяют в носителе. Как правило, для того, чтобы сделать композицию изотонической, в носитель вносят в соответствующем количестве фармацевтически приемлемую соль. Примерами носителей являются (но не ограничиваясь только ими) соляной раствор, раствор Рингера и раствор декстрозы. Предпочтительно приемлемые эксципиенты, носители или стабилизаторы являются нетоксичными в применяемых дозах и концентрациях, они включают буферы, такие как цитратный, фосфатный буфер и другие органические кислоты; солеобразующие противоионы, например, натрий и калий; низкомолекулярные (содержащие > 10 аминокислотных остатков) полипептиды; белки, например, сывороточный альбумин или желатин; гидрофильные полимеры, например, поливинилпирролидон; аминокислоты, такие как гистидин, глутамин, лизин, аспарагин, аргинин или глицин; углеводы, включая глюкозу, маннозу или декстрины; моносахариды; дисахариды; другие сахара, например, сахарозу, маннит, трегалозу или сорбит; хелатирующие агенты, например, ЭДТК; неионогенные поверхностно-активные вещества, например, Твин, плюроники или полиэтиленгликоль; антиоксиданты, включая метионин, аскорбиновую кислоту и токоферол; и/или консерванты, например, хлорид октадецилдиметидбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, например, метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и мета-крезол). Более подробно пригодные носители и их препаративные формы описаны в Remington's Pharmaceutical Sciences, 17-е изд., изд-во Mack Publishing Co., 1985.
Мониторинг процесса можно осуществлять путем проведения периодических оценок. Антитело, его антигенсвязывающий фрагмент или фармацевтическую композицию, предлагаемые в изобретении применяют местно, как указано выше, в отличие от системного введения. Препараты для местного применения уже описаны выше, и они включают, среди прочего, стерильные водные или неводные растворы, суспензии и эмульсии, а также кремы и суппозитории. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и сложные органические эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая соляной раствор и забуференные среды. Могут присутствовать также консерванты и другие добавки, такие, например, как противомикробные средства, антиоксиданты, хелатирующие агенты и инертные газы, и т.п. Кроме того, фармацевтическая композиция, предлагаемая в изобретении, может содержать дополнительные агенты в зависимости от предполагаемой цели применения фармацевтической композиции. Указанные агенты могут представлять собой, например, Твин, ЭДТК, цитрат, сахарозу, а также другие агенты, пригодные для предполагаемой цели применения фармацевтической композиции, которые хорошо известны специалисту в данной области.
В контексте настоящего изобретения понятие «фармацевтическая композиция» относится к композиции, предназначенной для применения для пациента, предпочтительно больного человека. В контексте настоящего изобретения указанное лекарственное средство/указанная фармацевтическая композиция предназначено/предназначена для применения для пациента, который страдает острой инфекцией слизистой или эпидермальной ткани, вызываемой HSV-1 или HSV-2, согласно настоящему изобретению. В контексте настоящего изобретения понятие «индивидуум», т.е. «пациент» относится к больному человеку. Таким образом, настоящее изобретение относится также к фармацевтической композиции, содержащей в эффективном количестве антитело или его антигенсвязывающий фрагмент, которая предназначена для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, и по меньшей мере один фармацевтически приемлемый эксципиент. К предпочтительным вариантам фармацевтическая композиции применимо с соответствующими изменениями все, что было изложено выше в контексте антитела к HSV или его антигенсвязывающего фрагмента, предназначенного для применения для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело предназначено для местного применения, а также фармацевтической композиции, указанной выше.
Изобретение относится также к способу лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, заключающемуся в том, что осуществляют стадию, на которой применяют местно антитело или антигенсвязывающий фрагмент, как указано выше. Так, настоящее изобретение относится к способу лечения острых инфекций слизистой или эпидермальной ткани у индивидуума, вызываемых HSV-1 или HSV-2, которые выбраны из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы у индивидуума, в котором антитело или его антигенсвязывающий фрагмент применяют местно для индивидуума в терапевтически эффективном количестве. К предпочтительному варианту способа лечения применимо с соответствующими изменениями все изложенное выше в контексте антитела к HSV или его антигенсвязывающего фрагмента, или фармацевтической композиции, предназначенных для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы, где указанное антитело, а также фармацевтическая композиция, указанные выше, предназначены для местного применения.
В предпочтительном варианте осуществления настоящего изобретения индивидуум представляет собой млекопитающее, такое как собака, кошка, свинья, корова, овца, лошадь, грызун, например, крысу, мышь и морскую свинку, или примата, например, гориллу, шимпанзе и человека. В наиболее предпочтительном варианте осуществления изобретения индивидуум представляет собой человека.
Другие объекты и преимущества изобретения описаны в представленных ниже примерах, которые приведены для целей иллюстрации, но не для ограничения его объема. Каждая публикация, патент, заявка на патент или иной документ, процитированный в настоящем описании, полностью включен в настоящее описание в качестве ссылки.
На чертежах показано:
На фиг. 1 - сравнение выживаемости мышей с иммунодефицитом с острой генитальной инфекцией, вызванной HSV-2, после местного нанесения либо гуманизированного моноклонального антитела hu2c, либо ацикловира. Самок мышей (NOD.CB17-Prkdcscid/NCrHsd) обрабатывали характеризующимся продолжительным действием прогестином (Depo-Clinovir, фирма Pharmacia) за 7 дней до контрольного вирусного заражения для повышения чувствительности к HSV-2-инфекции и для элиминации различий, связанных с эстральным циклом. Осуществляли контрольное интравагинальное заражение анестезированных мышей с использованием летальной дозы HSV-2 G, составляющей 5×105 БОЕ (20 мкл). Мышей, у которых выявляли видимые признаки инфекции (потеря волос в промежности, покраснение, опухание) обрабатывали через один день после контрольного заражения вирусом (А) однократно 40 мкл hu2c (5 мг/мл) (•) или 40 мкл контрольного IgG (5 мг/мл) (

На фиг. 2 - балльная клиническая оценка острой генитальной инфекции, вызванной HSV-2, после местного лечения с помощью гуманизированного моноклонального антитела hu2c или ацикловира. Мышей, у которых выявляли видимые признаки инфекции (потеря волос в промежности, покраснение, опухание) обрабатывали через один день после контрольного интравагинального заражения мышей с использованием летальной дозы HSV-2 G, составляющей 5×105 БОЕ (20 мкл) обрабатывали (А и В) дважды в день в течение 4 дней (А) 40 мкл ЗФР или (В) 40 мкл ACV (25 мг/мл), или обрабатывали (Б и Г) один раз через 24 ч после инфицирования (Б) 40 мкл hu2c (5 мг/мл) или (Г) 40 мкл контрольного IgG (5 мг/мл). Растворы лекарственных средств или ЗФР наносили местно на наружный эпителий гениталий.
Инфицированных животных ежедневно обследовали и оценивали в баллах их клинический статус следующим образом: 0, отсутствие симптомов, повреждений нет; 1-2, покраснение и/или опухание (эрозия); 3, локализованное повреждение размером < 1 мм; 4-5, локализованная эрозия размером 2-3 мм; 6-7 локализованное повреждение размером 4-5 мм; 8-9, серьезная гиперемия, разрушение эпителия и стромы, сопровождающееся некрозом; 10, системные признаки, смерть. Животных с баллом > 8 умерщвляли для предотвращения излишних страданий. Тест-группы состояли из восьми животных каждая, контрольные группы состояли из пяти животных каждая. Стрелками указаны моменты времени, в которые проводили обработку.
Примеры
Пример 1: Местное нанесение гуманизированного антитела к HSV
1. Индивидуумы, материалы, методы
1.1 Создание и получение нейтрализующего HSV гуманизированного моноклонального антитела
В последние годы было продемонстрировано, что поперечное сшивание высококонсервативного эпитопа гликопротеина В HSV-1/2 с мышиным моноклональным антителом МАт 2с не только приводит к эффективной нейтрализации свободного вириона, но также и к ингибированию непосредственного распространения вируса от инфицированных клеток к неинфицированным клеткам (Krawczyk А. и др., Journal of virology; 85(4), 2011, сс. 1793-1803). Для того, чтобы использовать указанные уникальные свойства при терапевтическом применении на человеке, при создании изобретения было создано гуманизированное производное МАт 2с.
Для огромного большинства гуманизированных антител, как правило, требуется сохранение ряда потенциально иммуногенных мышиных остатков в человеческих каркасных участках для поддержания структурной целостности трансплантированных антигенсвязывающих петель. Для создания гуманизированного антитела с наиболее низким иммуногенным потенциалом, избегали любых манипуляций с каркасным участком путем тщательного отбора соответствующих последовательностей человеческой зародышевой линии и одновременного применения описанного авторами изобретения подхода, основанного на сравнительном анализе большого количества последовательностей (Krauss J. и др., Protein Eng, 16(10), 2003, сс. 753-759).
Для идентификации акцепторных каркасов человеческой зародышевой линии, пригодных для трансплантации гипервариабельных участков (CDR) МАт 2с, последовательности каркасного участка вариабельного домена МАт 2с выравнивали с соответствующими человеческими последовательностями из базы данных V (http://vbase.mrc-cpe.cam.ac.uk/). Было установлено, что наибольшая идентичность последовательности каркасного участка с соответствующей последовательностью вариабельной легкой (VL) и тяжелой (VH) цепи мышиного МАт 2с имела место для последовательностей человеческой зародышевой линии DP28 (88,5%) и DPK13 (88,9%) соответственно. Таким образом, генные сегменты, кодирующие CDR мышиного антитела-донора 2с (а именно, 2с VL-CDR1/2/3 и 2с VH-CDR1/2/3) трансплантировали в акцепторные каркасные участки, кодирующие DP28 и DPK13 соответственно. Затем кодирующие вариабельный домен гены химерной и гуманизированной VL-цепи и VH-цепи субклонировали в экспрессионных векторах для иммуноглобулина, содержащих человеческую константную тяжелую γ1-цепь и человеческую константную κ-цепь соответственно. Гуманизированное антитело получали либо из стабильно трансфектированных линий клеток мышиной миеломы Sp2/0, либо из кратковременно трансфектированных клеток линии HEK293 в бессывороточных условиях и очищали из супернатантов культур до гомогенного состояния с помощью хроматографии на белке А. Чистота по данным оценки с помощью гель-фильтрации (Superdex 200GL, фирма GE Healthcare) составляла ≥95% (Krawczyk А., и др., Proc Natl Acad Sci U S A; 110(17), 2013, cc. 6760-6765).
1.2 Описание опыта
В период 2010-2013 г.г., проводили лечение двенадцати здоровых добровольцев возрастом 30-59 лет (7 женщин, 5 мужчин) с острым рецидивом оральной герпетической инфекции (лихорадочный герпес). Волонтеры сами сообщали, когда у них появлялись начальные вызываемые HSV симптомы (зуд на губах, жжение или покалывание вблизи губ или в области рта) или развивались видимые нарушения кожи на наружной стороне губ. Наблюдаемые нарушения кожи включали волдыри от небольшого до крупного размера, наполненные прозрачной желтоватой жидкостью, или наружные герпетические повреждения, включая сочащиеся красные волдыри.
Оральная герпетическая инфекция ротовой области в основном вызывается вирусом герпеса простого типа 1 (HSV-1). Однако, иногда во время орального секса в рот попадает HSV-2, вызывая оральный герпес. Тип вызываемой HSV инфекции (HSV-1 или HSV-2) не анализировали.
Антитело находилось в составе стерильных растворов либо в ЗФР, либо в ЗФР/зольной воде (соотношение 1:1) в концентрациях 0,7-1 мг/мл. Участники наносили местно примерно 10 мкл антитела однократно, один раз в день в течение двух дней или в общей сложности максимум три раза.
2. Результаты
Крем зовиракс (ZOVIRAX) оценивали в 2 двойных-слепых рандомизированных плацебо- (наполнитель)-контролируемых опытах (см. Zovirax N-. Инструкция по медицинскому применению зовиракса. http://wwwaccessdatafdagov/drugsatfda_docs/label/2002/21478_zovirax_lblpdf#page=1&zoom=auto,0,792).
В опытах по изучению зовиракса индивидуумы получали инструкцию начинать лечение в течение 1 ч после того, как были замечены признаки или симптомы, и продолжать лечение в течение 4 дней, нанося исследуемое лекарственное средство 5 раз в день. В обоих опытах было установлено, что средняя продолжительность рецидива эпизода губного герпеса у индивидуумов, которые лечились кремом зовиракс (n=682), была примерно на полдня короче, чем у индивидуумов, которые применяли плацебо (n=703) (примерно 4,5 дня по сравнению с 5 днями соответственно). Не было выявлено значимого различия между индивидуумами, применявшими крем зовиракс и наполнитель, с точки зрения предупреждения развития обусловленных лихорадочным герпесом повреждений.
По сравнению с предшествующими обусловленными HSV вспышками, которые лечили ацикловиром (крем зовиракс), все участники, применявшие раствор антитела, сообщали о быстром ослаблении симптома и боли в течение 24 ч после нанесения антитела. В отличие от того, что имело место при лечении ацикловиром, происходил регресс активных волдырей и они не превращались в мокнущие волдыри, когда их местно обрабатывали антителом. Когда лечение антителом начинали на стадии видимых наружных герпетических повреждений, участники сообщали о быстром заживлении и исчезновении покрытых коростой областей. Все участники сообщали, что в отличие от того, что имел место при применении зовиракса, инфицированная область не расширялась после обработки антителом.
У одного волонтера губной герпес возник одновременно и на верхней губе, и на нижней губе, и он начал обработку верхней губы антителом (три раза), а обработку нижней губы зовираксом (3-4 раза в день в течение 3 дней). При обработке имелось несколько видимых небольших волдырей. В случае лечения HSV-инфекции антителом наблюдалось быстрое выздоровление. Волдыри на верхней губе исчезли в течение 24 ч, опухание было устранено в течение 48 ч и повреждений не возникло. Болезненное состояние нижней губы, обработанной зовираксом, сохранялось в течение 3 дней, волдыри росли и сливались в большой волдырь, который, в конце концов, лопнул. Потребовалось две недели для того, чтобы возникшие повреждения зажили.
Эффективность лечения оказалась независимой от препарата антитела (ЗФР или ЗФР/зольная вода).
Важно отметить, что все участники выражали мнение о том, что имела место тенденция к снижению общего показателя клинической реактивации.
Пример 2: Местное нанесение МАт к HSV hu2c в экспериментах на животных
Исследовали способность гуманизированного моноклонального антитела hu2c изменять клиническое протекание острой генитальной инфекции, вызываемой HSV-2, у мышей с иммунодефицитом, после однократной местной обработки 200 мкг МАт hu2c (5 мг/мл). Для инфицирования 100% мышей по данным оценки видимых повреждений и культуры, присутствующей в вагинальном лаваже, во влагалище анестезированных мышей вносили вирусный инокулят 5×105 БОЕ HSV-2 G.
Хотя известно, что острые инфекции, вызываемые HSV-1 или HSV-2, приводят к фатальному исходу для 100% мышей с серьезным комбинированным иммунодефицитом по сравнению с 70-90%-ной смертностью у иммунокомпетентных мышей, тем не менее, была выбрана модель с использованием животных с иммунодефицитом для того, чтобы отличить возможную клиническую эффективность терапии от элиминации вирусной инфекции, обусловленной иммунными эффекторными клетками мыши (Minagawa и др., Arch Virol 103, 1988, сс. 73-82; Nagafuchi и др., J Gen Virol 44, 1979, сс. 715-723). В генитальной слизистой оболочке скорости распространения HSV-2 особенно велики. Через 24 ч после контрольного вирусного заражения инфицированным мышам наносили местно на инфицированную область либо дважды в день в течение 4 дней 1 мг ацикловира (ACV) (25 мг/мл), или 40 мкл буфера (ЗФР), либо осуществляли однократную обработку с использованием 200 мкг МАт hu2c (5 мг/мл) или 200 мкг контрольного МАт (5 мг/мл). Клиническую эффективность HSV-специфического МАт сравнивали с эффективностью обработки нерелевантным МАт (контроль изотипа), ACV и ЗФР с использованием кривых выживаемости Каплана-Мейера и ежедневной оценки клинического статуса слизистых мембран генитальной и анальной области. Через 24 ч после инфекции оценивали результаты, полученные на мышах с видимыми проявлениями инфекции (потеря волос в промежности, покраснение, опухание) и обнаруживаемой периферической репликацией.
Как и ожидалось, не было обнаружено значимых различий в общей выживаемости в контрольных группах, обработанных либо нерелевантным МАт, либо ЗФР, и все мыши погибли ко дню 7 после заражения (фиг. 1А и Б). Неожиданно было установлено, что однократное местное нанесение МАт hu2c на инфицированный наружный эпителий гениталий приводило к статистически значимому различию кривых выживаемости (Р=0,003) при сравнении с контрольными группами (фиг. 1А) и даже позволило предупредить летальный исход заражения у одной мыши. Между кривыми выживаемости в обработанной антителом hu2c группе (фиг. 1А) и обработанной ACV группе (фиг. 1Б) не обнаружено значимых различий (Р > 0,5), хотя следует отметить, что ACV наносили дважды в день в течение 4 дней.
Медицинское преимущество местной терапии с применением антитела по сравнению со стандартной терапией с применением ACV становится еще более очевидным при сравнении клинического статуса острой генитальной инфекции в течение периода, составляющего 14 дней (фиг. 2). Клиническая балльная оценка, которую можно применять для исследования клинического протекания инфекции, может изменяться после лечения (Minagawa и др., Arch Virol 103, 1988, сс. 73-82; Sanna и др., Virology 215, 1996, сс. 101-106).
Клинический статус вагинита/вульвита оценивали в баллах следующим образом: 0, отсутствие симптомов, повреждений нет; 1-2, покраснение и/или опухание (эрозия); 3, локализованное повреждение размером < 1 мм; 4-5, локализованное повреждение размером 2-3 мм; 6-7 локализованное повреждение размером 4-5 мм; 8-9, серьезная гиперемия, разрушение эпителия и стромы, сопровождающееся некрозом; 10, системные признаки, смерть.
Острая генитальная вызываемая HSV-2 инфекция устранялась у 7 из 8 мышей (88%) в течение 48 ч после однократного местного нанесения антитела к HSV МАт hu2c (фиг. 2Г).
В отличие от этого, животные, обработанные ACV, характеризовались очень гетерогенными клиническими баллами. Через 48 ч после начала обработки с помощью ACV (дважды в день в течение 4 дней) местные генитальный симптомы устранялись только у 1 из 8 мышей (13%), а через 72 ч после начала обработки с помощью ACV только у 5 из 8 мышей (63%) отсутствовали местные признаки (фиг. 2В). Хотя оба лекарственных средства, и антитело hu2c антитело, и ACV, наносили только местно, в обоих случаях оказалось возможным предупредить вызываемый HSV-2 летальный энцефалит у 1 из 8 мышей.
У мышей, обработанных либо буфером, либо нерелевантным МАт, местные HSV-2-инфекции, распространявшиеся в генитальной и анальной областях, и системная диссеминация вируса приводили к гибели всех животных ко дню 7 (фиг. 2А и Б).
Реферат
Настоящее изобретение относится к области биотехнологии, а именно к применению антитела к HSV и фармацевтической композиции для местного нанесения при лечении острой инфекции слизистой или эпидермальной ткани у индивидуума. Антитело к HSV, которое распознает гликопротеин В (gB) HSV-1 и/или HSV-2 и обладает способностью ингибировать распространение HSV от инфицированной клетки к соседней второй неинфицированной клетке (распространение от клетки к клетке), или его антигенсвязывающего фрагмента для лечения острой инфекции слизистой или эпидермальной ткани у индивидуума, вызываемой HSV-1 или HSV-2, которая выбрана из группы, состоящей из простого губного герпеса, простого генитального герпеса, инфекции, представляющей собой хроническую или диссеминированную форму простого кожного герпеса, герпеса борцов-спортсменов и герпетиформной экземы используют для местного применения. Указанное антитело содержится в фармацевтической композиции для местного нанесения при лечении острой инфекции слизистой или эпидермальной ткани у индивидуума. Изобретение позволяет расширить арсенал технических средств. 2 н. и 22 з.п. ф-лы, 2 ил., 1 табл., 2 пр.

Комментарии