Производные хиназолина - RU2302244C2
Код документа: RU2302244C2
Описание
Настоящее изобретение относится к бициклическим соединениям, в частности к 4-арил-2(1Н)-хиназолиноновым производным и 2-замещенным 4-арилхиназолиновым производным, и к их новым фармацевтическим применениям.
Производные 4-арил-2(1Н)-хиназолинона описаны и предложены для терапевтического применения в качестве противовоспалительных, анальгезирующих и жаропонижающих средств; они описаны, например, в следующих опубликованных патентах и заявках на патенты: GB 1181570 (фирма Roussel Uclaf), DE OS A 1805501 (фирма Sandoz), US 3925548 (фирма Sandoz), DE OS A 1935404, US 4067868, US 3953446, CH 612186 и US 4387223 (фирма Sumitomo). Фирмой Sandoz в качестве противовоспалительного и анальгезирующего средства на рынок был продвинут биаризон (1-изопропил-7-метил-4-фенил-2(1Н)-хиназолинон).

Аналогичным образом были описаны и предложены для применения в качестве противовоспалительных, анальгезирующих и жаропонижающих средств 2-замещенные 4-арилхиназолины. Так, например, в ЕР А 0567107 (Takeda) описано получение производных хинолина и хиназолина и их применение в качестве противовоспалительного средства, в частности, для лечения артрита. Takeda также предложил (ЕР А 0634169) использовать аналогичные производные хинолина и хиназолина для ингибирования резорбции кости и лечения остеопороза и, кроме того, предложил применять такие соединения в качестве иммунодепрессантов для лечения различных аутоиммунных болезней.
При создании настоящего изобретения было установлено, что некоторые производные 4-арил-2(1Н)-хиназолинона и 2-замещенные 4-арилхиназолина обладают дополнительным целевым действием, которое показывает, что эти производные можно использовать в других фармацевтических применениях.
Таким образом, по изобретению предлагается применение соединения формулы I
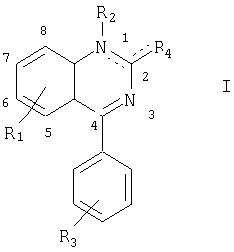
в которой

обозначает

в которой Y обозначает О или S;
R1 обозначает от 1 до 3 заместителей, независимо выбранных из ОН, SH, гало, NO2 и необязательно замещенных низшего алкила, соответственно (низш.)алкила, (низш.)алкокси, (низш.)алкенила, (низш.)алкенилокси, (низш.)алкинила, (низш.)алкинилокси, (низш.)алканоила, (низш.)алкилсульфона, (низш.)алкилсульфоксида и аминогруппы;
R2 обозначает Н или необязательно замещенный (низш.)алкил, арил, арил(низш.)алкил, циклоалкил, циклоалкил(низш.)алкил или карбонил(низш.)алкил;
R3 обозначает от 1 до 3 заместителей, выбранных из гало и необязательно замещенных (низш.)алкила, циклоалкила, (низш.)алкокси и аминогруппы;
R4' обозначает цианогруппу, гало, азид (-N=N=N) или необязательно замещенный (низш.)алкил, (низш.)алкокси, (низш.)тиоалкокси, арилокси, арил(низш.)алкокси или аминогруппу,
или его фармацевтически приемлемого и расщепляемого сложного эфира или кислотно-аддитивной соли при приготовлении лекарственного средства для стимуляции выхода паратироидного гормона.
Установлено, что контролируемое лечение пациентов паратироидным гормоном (РТН) и его аналогами и фрагментами может оказывать на остеогенез ярко выраженное анаболическое действие. Таким образом, соединения, которые стимулируют выход РТН, такие как соединения, предназначенные для применения при выполнении настоящего изобретения, можно использовать для профилактики или лечения заболеваний кости, которые связаны с увеличенной потерей кальция или резорбцией или при которых требуется стимуляция остеогенеза и фиксация кальция в кости.
Таким образом, другим объектом изобретения является способ профилактики или лечения заболеваний кости, которые связаны с увеличенной потерей кальция или резорбцией или при которых требуется стимуляция остеогенеза и фиксация кальция в кости и при которых пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы I, как оно представлено выше, или его фармацевтически приемлемого и расщепляемого сложного эфира, или кислотно-аддитивной соли.
Тем не менее еще одним объектом изобретения является фармацевтическая композиция для профилактики или лечения заболеваний кости, которые связаны с увеличенной потерей кальция или резорбцией или при которых требуется стимуляция остеогенеза и фиксация кальция в кости, включающая соединение формулы I, как оно представлено выше, или его фармацевтически приемлемый и расщепляемый сложный эфир или кислотно-аддитивную соль в смеси с фармацевтически приемлемыми наполнителем, разбавителем или носителем.
Использованные в настоящем описании выше и ниже понятия имеют следующие значения.
Гало или атом галогена представляет собой I, Br, Cl или F.
Понятие "низший", относящееся к вышеизложенному и последующему в настоящем описании в связи с органическими радикалами или соединениями, обозначает соответственно их разветвленные или неразветвленные варианты, содержащие до и включительно 7, предпочтительно до и включительно 4 и целесообразно один или два углеродных атома.
(Низш.)алкильная группа является разветвленной или неразветвленной и включает от 1 до 7 углеродных атомов, предпочтительно от 1 до 4 углеродных атомов. (Низш.)алкил представляет собой, например, метил, этил, пропил, бутил, изопропил, изобутил или третичный бутил.
Галозамещенный (низш.)алкил представляет собой С1-С7-(низш.)алкил, замещенный атомами галогена в количестве до 6.
(Низш.)алкоксигруппа является разветвленной или неразветвленной и включает от 1 до 7 углеродных атомов, предпочтительно от 1 до 4 углеродных атомов. (Низш.)алкокси представляет собой, например, метокси, этокси, пропокси, бутокси, изопропокси, изобутокси или третичный бутокси.
(Низш.)алкеновая, алкенильная или алкенилоксигруппа является разветвленной или неразветвленной и включает от 2 до 7 углеродных атомов, предпочтительно от 1 до 4 углеродных атомов, и содержит по меньшей мере одну углерод-углеродную двойную связь. (Низш.)алкен, (низш.)алкенил или (низш.)алкенилокси представляет собой, например, винил, проп-1-енил, аллил, бутенил, изопропенил или изобутенил и их оксиэквиваленты.
(Низш.)алкиновая, алкинильная или алкинилоксигруппа является разветвленной или неразветвленной и включает от 2 до 7 углеродных атомов, предпочтительно от 1 до 4 углеродных атомов, и содержит по меньшей мере одну углерод-углеродную тройную связь. (Низш.)алкин или алкинил представляет собой, например, этинил, проп-1-инил, пропаргил (пропаргил), бутинил, изопропинил или изобутинил и их оксиэквиваленты.
В настоящем описании кислородсодержащие заместители, например алкокси, алкенилокси, алкинилокси, карбонил и т.д., охватывают их серосодержащие гомологи, например тиоалкокси, тиоалкенилокси, тиоалкинилокси, тиокарбонил, сульфон, сульфоксид и т.д.
Арил представляет собой карбоциклический или гетероциклический арил.
Карбоциклический арил представляет собой моноциклический, бициклический или трициклический арил, например фенил или фенил, моно-, ди- или тризамещенный одним, двумя или тремя радикалами, выбранными из (низш.)алкила, (низш.)алкокси, арила, гидрокси, атомов галогена, цианогруппы, трифторметила, (низш.)алкилендиокси и окси-С2-С3алкилена; 1- или 2-нафтил; 1- или 2-фенантренил. (Низш.)алкилендиокси представляет собой двухвалентный заместитель, присоединенный к двум смежным углеродным атомам фенила, например метилендиокси или этилендиокси. Окси-С2-С3алкилен представляет собой также двухвалентный заместитель, присоединенный к двум смежным углеродным атомам фенила, например оксиэтиленовый или оксипропиленовый. Примером окси-С2-С3алкиленфенила служит 2,3-дигидробензофуран-5-ил.
Предпочтительный карбоциклический арил представляет собой нафтил, фенил или фенил, моно- или дизамещенный (низш.)алкокси, фенилом, атомом галогена, (низш.)алкилом или трифторметилом, преимущественно фенилом или фенилом, моно- или дизамещенным (низш.)алкокси, атомом галогена или трифторметилом, а в частности фенилом.
Гетероциклический арил представляет собой моноциклический или бициклический гетероарил, например пиридил, индолил, хиноксалинил, хинолинил, изохинолинил, бензотиенил, бензофуранил, бензопиранил, бензотиопиранил, бензотиадиазолил, фуранил, пирролил, тиазолил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил, имидазолил, тиенил или любой упомянутый радикал, замещенный, преимущественно моно- или дизамещенный, так как указано выше.
Предпочтительный гетероциклический арил представляет собой пиридил, индолил, хинолинил, пирролил, тиазолил, изоксазолил, триазолил, тетразолил, пиразолил, имидазолил, тиенил или любой упомянутый радикал, замещенный, преимущественно моно- или дизамещенный, так как указано выше.
Циклоалкил является насыщенным циклическим углеводородом, необязательно замещенным (низш.)алкилом, который содержит от 3 до 10 кольцевых углеродных атомов и в целесообразном варианте представляет собой циклопропил, циклопентил, циклогексил, циклогептил или циклооктил, необязательно замещенный (низш.)алкилом.
R1 может обозначать от 1 до 3 заместителей, хотя в более предпочтительном варианте обозначает 1 или 2 заместителя. Заместители R1 могут находиться в любом из положений 5, 6, 7 и 8, например в положениях 5, 6 и 7. Так, в частности, когда R1 обозначает 2 заместителя, они могут находиться в положениях 5 и 6 или 6 и 7. В предпочтительном варианте по меньшей мере один из заместителей R1 находится в положении 6.
R1 как необязательно замещенный (низш.)алкил, (низш.)алкокси, (низш.)алкенил, (низш.)алкенилокси, (низш.)алкинил, (низш.)алкинилокси, (низш.)алканоил или аминогруппа может быть замещен 1 или 2 заместителями, независимо выбранными из гало, например Cl, (низш.)алкила, например этила или метила, (низш.)алкенила, (низш.)алкинила, циклоалкила, например С3-С6циклоалкила, или цианогруппы.
Особенно предпочтительными значениями R1 являются пропаргилокси, метокси, этокси, аллилокси, 2-хлорэтокси, изопропокси, н-пропокси, циклопропилметокси, 3-хлорпропокси, 2-метилаллилокси, н-бутокси, аллил, аминогруппа, ацетонитрилокси, метиламино-, диметиламино-, пропаргиламино- или аллиламиногруппа, как это изложено, в частности, в настоящем описании в дальнейшем и в примерах.
R2 как необязательно замещенный (низш.)алкил, арил, арил(низш.)алкил, циклоалкил, циклоалкил(низш.)алкил или карбонил(низш.)алкил, может быть замещен до 5, обычно 1, 2 или 3, заместителями, независимо выбранными из гало, нитро-, циано-, аминогрупп, ОН, SH, (низш.)алкила, (низш.)алкокси, (низш.)тиоалкокси, (низш.)алкоксикарбонила, (низш.)алкилсульфонила, (низш.)алкоксисульфонила, (низш.)алкилкарбонилокси, трифторметила, необязательно галозамещенного арила, необязательно оксозамещенного пирролидинила или группы -X-A-Z, в которой
-Х- обозначает -СО-O-, -О-, -СН2-O-, -CO-NR5-, -NR5-, -CH2-NR5-, -СО-СН2-, -S-, -SO-NR5-, -SO2-NR5-, -NR5-СО или -O-СО-, где R5 обозначает Н или необязательно замещенный (низш.)алкил, (низш.)алкенил, (низш.)алкокси(низш.)алкил, арил(низш.)алкил или необязательно моно- или ди(низш.)алкилзамещенный амино(низш.)алкил, -А-обозначает C1-С10алкил, предпочтительно С2-С3алкил, необязательно прерываемый одной или несколькими, например до 4, предпочтительно 1, 2 или 3, группами -О-, -S и -NR5-,
а Z обозначает Н, гало, (низш.)алкокси, (низш.)алкокси(низш.)алкокси, -NR5R5',
-N+R5R5'R5'', -COOH, имидазолил, необязательно R5-замещенный пиперазинил, -СН(СООН)2, -SO3-, -NR5-(CH2)n-CH2-NR5R5', -NR5-(CH2)n-CH2-OR5, морфолино или тетрагидропиранил, где каждый из R5, R5' и R5'' независимо обозначает Н или необязательно замещенный (низш.)алкил, (низш.)алкокси(низш.)алкил или арил(низш.)алкил, например индолилэтил, или
R5, R5' и R5'' могут быть связаны между собой в необязательно замещенном N-гетероциклическом кольце, содержащем от 3 до 8 кольцевых атомов, один или несколько из которых могут включать дополнительный гетероатом, выбранный из О, S и -NR5-, где R5 имеет приведенные выше значения.
R2 как арил(низш.)алкил или циклоалкил(низш.)алкил в предпочтительном варианте обозначает арилметил, например фуранилметил, пиридилметил, нафтилметил или хинолинилметил, или преимущественно бензил или циклоалкилметил, например С3-С6циклоалкилметил, причем все они необязательно замещены так, как представлено выше, предпочтительно группой -X-A-Z.
В группе X-A-Z
Х в предпочтительном варианте обозначает -СО-O-, -О-, -CH2-O-, -CO-NR5-, -NR5-, -CH2-NR5-, -СО-СН3- или -NR5-CO-;
А в предпочтительном варианте обозначает -СН2-СН2-О-СН2-СН2-, СН2-СН2-СН2-O-СН2-СН2-, -СН2-Н(СН3)-СН2-СН2 -СН2- или С3-С6алкилен, а Z в предпочтительном варианте обозначает кислотную или основную группу, выбранную из -NR5R5', -N+ R5R5'R5'', -COOH, имидазолила, морфолино, необязательно R5-замещенного пиперазинила, -СН(СООН)2 или -SO2-, в которой R, R' и R'' имеют указанные выше значения.
R2 как карбонил(низш.)алкил в предпочтительном варианте обозначает (низш.)алкилоксикарбонилметил, например этоксикарбонилметил или арилкарбонилметил, например фенилкарбонилметил или аминокарбонилметил.
Предпочтительные значения R2 включают метил, этил, изопропил, 3-хлорпропил, изобутил, бензил, циклопентил, фенилкарбонилметил, цианометил, этоксикарбонилметил, 2-гидроксибензил, 2-метилбензил, 2-нитробензил, 2-аминобензил, 2-хлорбензил, 2-фторбензил, 2-(6-хлоргексилокси)бензил, 2-(6-диметиламиногексилокси)бензил, 2-(6-имидазол-1-илгексилокси)бензил, 3-гидроксибензил, 3-хлорбензил,3-фторбензил, 3-метоксибензил, 3-метоксикарбонилбензил, 3-(7-пиперидин-1-илгептилокси)бензил, 4-(3-диметиламинопропил)-N-метилкарбамоил)бензил, 4-нитробензил, 4-бромбензил, 4-хлорбензил, 4-фторбензил, 4-аминобензил, 4-гидроксибензил, 4-метоксибензил, 4-трифторметилбензил, 4-трет-бутилбензил, 4-метилтиобензил, 4-метоксикарбонилбензил, 4-метоксикарбонил-2-метоксибензил, 4-метилсульфонилбензил, 4-метилкарбонилоксибензил, 2,6-дифторбензил, 2,4-дифторбензил, 3,4-дифторбензил, 3,4-дихлорбензил, 2,4,6-трифторбензил, 2,3,4,5,6-пентафторбензил, 5-нитрофуран-2-илметил, 2-цианобензил, 3-цианобензил, 4-цианобензил, 5-цианобензил, 4-цианометоксибензил, 7-фторхинолин-2-илметил, нафт-2-илметил, 3-пиридилметил, 4-пиридилметил, 3-[4-[4-(2-метоксиэтил)пиперазин-1 -ил]бутил]карбониламинобензил, 3-(2-оксопирролидин-1-ил)бензил, 3-[(3-диметиламинопропил)-N-метиламинокарбониламино]бензил, 3-(4-аллилпиперазин-1-ил)ацетамидобензил, 3-(4-метилпиперазин-1-ил)ацетамидобензил, 3-(4-(2-метоксиэтил)пиперазин-1-ил)ацетамидобензил, 3-(4-(2-метоксиэтил)пиперазин-1-ил)-N-метилацетамидобензил, 3-(4-(3-диметиламинопропил)пиперазин-1- ил)ацетамидобензил, 3-(2-(4-метилпиперазин-1-ил)ацетамидо)бензил, 3-(4-(4-(3-диметиламинопропил)пиперазин-1-ил)бутирамидо)бензил, 3-(4-[(2-метоксиэтил)-N-метиламино]бутирамидо)бензил, 3-(4-морфолин-4-илбутирамидо)бензил, 3-(4-метилпиперазин-1-ил)бутирамидобензил, фенилэтил, бензо[1,2,5]тиадиазол-5-илметил, тиазол-2-илметил, 3-[2-(2-метоксиэтокси)этокси]бензил, 3-(2-{2-[2-(2-метоксиэтокси)этокси]этокси}этокси)бензил, 4-(2-{2-[2-(2-метоксиэтокси)этокси]этокси}этокси)бензил, 3-(2-метоксиэтокси)бензил, 3-{2-[2-(2-метоксиэтокси)этокси]этокси}бензил, 3-[2-(тетрагидропиран-2-илокси)этокси]бензил, 3-(2-гидроксиэтокси)бензил, 2-{2-[2-(2-метоксиэтокси)этокси]этокси} бензил, 2-метансульфонилбензил, 2-гидрокси-2-фенилэтил, 2-ацетил-2-фенилэтил, 2-оксо-2-фенилэтил, 2-(4-фторфенил)-2-оксоэтил, циклогексилметил, 3-(2-(2- диметиламиноэтокси)этилоксикарбонил)бензил, как это изложено, в частности, в настоящем описании в дальнейшем и в примерах.
R3 обозначает 1, 2 или 3 заместителя, например 1, в положении 2 или положении 3, или, что более предпочтительно, в положении 4, выбранные из гало, необязательно замещенного (низш.)алкила или аминогруппы, где (низш.)алкил в предпочтительном варианте является незамещенным, а аминогруппа в предпочтительном варианте является моно- или дизамещенной (низш.)алкилом.
Предпочтительные значения R3 включают метил, этил, изопропил, трет-бутил или хлор. Наиболее предпочтительным значением R3 является изопропил в положении 4.
R4 в качестве (низш.)алкила в предпочтительном варианте является незамещенным, например, метилом или этилом, или галозамещенным, например трифторметилом.
R4 в качестве (низш.)алкокси (включая тиоалкокси) в предпочтительном варианте обозначает С1-С4алкокси, например метокси, этокси, изопропокси или бутоксирадикал, необязательно замещенный предпочтительно одним заместителем, выбранным из ОН или арила, например фенила или пиридила.
R4 в качестве арилокси в предпочтительном варианте обозначает фенокси или пиридилоксиарил, например 3-пиридилокси.
R4 в качестве аминогруппы может быть незамещенным, замещенным, необязательно галозамещенным моно- или ди(низш.)алкилом, дизамещенным с образованием необязательно моно- или ди(низш.)алкилзамещенного 5-7-членного гетероциклического кольца, необязательно содержащего дополнительный гетероатом, выбранный из О, S, N и NR, где R обозначает Н или (низш.)алкил.
Предпочтительные значения R4 включают хлор, фтор, цианогруппу, метил, -N=N=N, трифторметил, метокси, изопропокси, тиоизопропокси, 3-пиридокси, 4-метил-3-пиридокси, фенокси, 2,2,2-трифторэтиламиногруппу, 2-гидроксиэтокси, 3,5-диметилморфолино, 2-метилбензилокси, 3-пиридилметокси, как это изложено, в частности, в настоящем описании в дальнейшем и в примерах.
В предпочтительных вариантах выполнения изобретения предлагается применение соединения формулы II или III


в которых Y обозначает О или S;
R1' обозначает 1 или 2 заместителя, независимо выбранных из Н, ОН, гало, NO2 и необязательно замещенных (низш.)алкила, (низш.)алкокси, (низш.)алкенила, (низш.)алкенилокси, (низш.)алкинила, (низш.)алкинилокси, (низш.)алканоила и аминогруппы, где необязательными заместителями являются 1 или 2 заместителя, независимо выбранных из гало, например Cl, (низш.)алкила, например этила или метила, (низш.)алкенила, например аллила, (низш.)алкинила, например пропаргила, циклоалкила, например С3-С6 циклоалкила, и цианогруппы;
R2' обозначает Н или необязательно замещенный (низш.)алкил, арил, арил(низш.)алкил, циклоалкил, циклоалкил(низш.)алкил или карбонил(низш.)алкил, который может быть замещен до 5, обычно 1, 2 или 3, заместителями, независимо выбранными из гало, нитро-, циано-, аминогрупп, ОН, SH, (низш.)алкила, (низш.)алкокси, (низш.)тиоалкокси, (низш.)алкоксикарбонила, (низш.)алкилсульфонила, (низш.)алкоксисульфонила, (низш.)алкилкарбонилокси, трифторметила, необязательно галозамещенного арила, необязательно оксозамещенного пирролидинила и группы -X-A-Z,
в которой
-Х- обозначает -СО-O-, -О-, -CH2-O-, -CO-NR5-, -NR5-, -CH2-NR5-, -СО-СН2-, -S-, -SO-NR5-, -SO2-NR5-, -NR5-СО или -O-СО-, где R5 обозначает Н или необязательно замещенный (низш.)алкил, (низш.)алкенил, (низш.)алкокси(низш.)алкил, арил(низш.)алкил или необязательно моно- или ди(низш.)алкилзамещенный амино(низш.)алкил,
А- обозначает C1-С10алкил, предпочтительно С3-С8алкил, необязательно прерываемый одной или несколькими, например до 4, предпочтительно 1, 2 или 3, группами -О-, -S- или -NR5-, а
Z обозначает Н, гало, (низш.)алкокси, (низш.)алкокси(низш.)алкокси, -NR5R5', -N+R5R5'R5'', -COOH, имидазолил, необязательно R5-замещенный пиперазинил, -СН(СООН)2, -

R5, R5' или R5'' могут быть связаны между собой в необязательно замещенном N-гетероциклическом кольце, содержащем от 3 до 8 кольцевых атомов, один или несколько из которых могут включать дополнительный гетероатом, выбранный из О, S и -NR5-, где R5 имеет приведенные выше значения;
R3' обозначает 1 заместитель в положении 4, выбранный из необязательно замещенных (низш.)алкила и аминогруппы, где (низш.)алкил в предпочтительном варианте является незамещенным, а аминогруппа в предпочтительном варианте является моно- или дизамещенной (низш.)алкилом;
R4' обозначает гало, цианогруппу, незамещенный (низш.)алкил или С1-С4алкокси, фенокси или пиридилоксирадикал, необязательно замещенный одним заместителем, выбранным из ОН и арила, например фенил или пиридил, или незамещенную аминогруппу, аминогруппу, замещенную необязательно галозамещенным моно- или ди(низш.)алкилом, или аминогруппу, дизамещенную с образованием необязательно моно- или ди(низш.)алкилзамещенного 5-7-членного гетероциклического кольца, необязательно содержащего дополнительный гетероатом, выбранный из О, S, N и NR, где R обозначает Н или (низш.)алкил,
или его фармацевтически приемлемого и расщепляемого сложного эфира или кислотно-аддитивной соли при приготовлении лекарственного средства для стимуляции выхода паратироидного гормона.
Соединения формулы I включают много соединений, которые являются новыми, и такие новые соединения включены в объем изобретения.
Таким образом, объектом изобретения являются соединения формулы IV

в которой R1' имеет указанные выше значения, R3'' обозначает (низш.)алкил, а R2'' обозначает необязательно замещенный (низш.)алкил, например изопропил, арил(низш.)алкил, например бензил, циклоалкил(низш.)алкил, например циклогексилметил, арил, например фенил, или циклоалкил, например циклопентил или циклогексил;
при условии, что соединение формулы IV не обозначает 1-бензил-4-фенил-6-нитро-2(1Н)-хиназолинона, 1-(2-пиридилметил)-4-фенил-6-нитро-2(1Н)- хиназолинона, 1-(2-фурилметил)-4-фенил-6-нитро-2(1Н)-хиназолинона или 1-(2-тиенилметил)-4-фенил-6-нитро-2(1Н)-хиназолинона,
или их фармацевтически приемлемые и расщепляемые сложные эфиры или кислотно-аддитивные соли.
Предпочтительным значением R2'' является необязательно замещенный арилметил, преимущественно бензил. Необязательными заместителями могут быть те, которые указаны выше.
В другом варианте объектом изобретения являются также соединения формулы V

в которой R1 ' и R2' имеют вышеуказанные значения, a R4'' обозначает гало, цианогруппу, метил, этил, трифторметил или С2-С4алкокси, фенокси или пиридилокси, необязательно замещенный одним заместителем, выбранным из ОН и арила, например фенил или пиридил, или незамещенную аминогруппу, аминогруппу, замещенную необязательно галозамещенным моно- или ди(низш.)алкилом, или аминогруппу, дизамещенную с образованием необязательно моно- или ди(низш.)алкилзамещенного 5-7-членного гетероциклического кольца, необязательно содержащего дополнительный гетероатом, выбранный из О, S, N и NR, где R обозначает Н или (низш.)алкил,
или их фармацевтически приемлемые и расщепляемые сложные эфиры или кислотно-аддитивные соли.
Объектом изобретения являются, в частности, соединения формулы IV, как они представлены в дальнейшем в настоящем описании и примерах. Особенно предпочтительные соединения формулы IV включают
6-пропаргиламино-1-бензил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он,
6-аллиламино-1-бензил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он,
1-бензил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он,
6-аллилокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он,
1-изопропил-4-(4-изопропилфенил)-6-пропаргилокси-1.Н.-хиназолин-2-он,
5-аллил-6-гидрокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он,
2-(2-диметиламиноэтокси)этиловый эфир 3-[4-(4-изопропилфенил)-2-оксо-6-проп-2-инилокси-2Н-хиназолин-1-илметил]бензойной кислоты (соль трифторуксусной кислоты),
1-(2-фторбензил)-4-(4-изопропилфенил)-6,7-диметокси-1Н-хиназолин-2-он,
1-бензил-4-(4-изопропилфенил)-6-пропаргилокси-1.Н.-хиназолин-2-он,
6-аллилокси-1-бензил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он,
4-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2.Н.-хиназолин-1-илметил]фениловый эфир уксусной кислоты,
1-бензо[1,2,5]тиадиазол-5-илметил-4-(4-изопропилфенил)-6-пропаргилокси-1Н-хиназолин-2-он,
1-(2-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он,
1-(2-гидроксибензил)-4-(4-изопропилфенил)-6,7-диметокси-1Н-хиназолин-2-он,
1 -(3-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он,
1-[2-(6-имидазол-1-илгексилокси)бензил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он,
4-(4-изопропилфенил)-1-[3-(7-пиперидин-1-илгептилокси)бензил]-6-проп-2-инилокси-1Н-хиназолин-2-он (соль трифторуксусной кислоты),
4-(4-изопропилфенил)-1-{3-[2-(2-метоксиэтокси)этокси]бензил}-6-проп-2-инилокси-1Н-хиназолин-2-он,
4-(4-изопропилфенил)-1-[3-(2-{2-[2-(2- метоксиэтокси)этокси]этокси}этокси)бензил]-6-проп-2-инилокси-1Н-хиназолин-2-он,
4-(4-изопропилфенил)-1-[3-(2-метоксиэтокси)бензил]-6-проп-2-инилокси-1Н-хиназолин-2-он,
4-(4-изопропилфенил)-1-(3-{2-[2-(2-метоксиэтокси)этокси]этокси}бензил)-6-проп-2-инилокси-1Н-хиназолин-2-он,
4-(4-изопропилфенил)-1-{2-[2-(2-метоксиэтокси)этокси]бензил}-6-проп-2-инилокси-1Н-хиназолин-2-он,
1-[3-(2-гидроксиэтокси)бензил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он,
4-(4-изопропилфенил)-1-(2-{2-[2-(2-метоксиэтокси)этокси]этокси}бензил)-6-проп-2-инилокси-1Н-хиназолин-2-он,
2-[4-(4-изопропилфенил)-2-оксо-6-проп-2-инилокси-2Н-хиназолин-1-илметил]фениловый эфир метансульфоновой кислоты,
2-[(3-диметиламинопропил)метиламино]-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}ацетамид,
4-(4-изопропилфенил)-1-[3-(2-оксопирролидин-1-ил)бензил]-6-пропаргилокси-1Н-хиназолин-2-он,
2-[(3-диметиламинопропил)метиламино]-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}ацетамид,
N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-2-(4-метилпиперазин-1-ил)ацетамид,
N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-2-[4-(2-метоксиэтил)пиперазин-1-ил]ацетамид,
4-[4-(3-диметиламинопропил)пиперазин-1-ил]-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}бутирамид,
N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-4-[(2-метоксиэтил)метиламино]бутирамид,
N-{3-[6-аллилокси-4-(4-изопропилфенил)-2-оксо-2Н-хиназолин-1-илметил]фенил}-4-(4-метилпиперазин-1-ил)бутирамид,
1-бензил-4-(3-хлор-4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он,
1-циклогексилметил-4-(4-изопропилфенил)-6,7-диметокси-1Н-хиназолин-2-он,
{2-[2-(3,5-диметоксифенил)-2-метилпропиламино]-4,5-диметоксифенил}-(4-изопропилфенил)метанон,
1-(2-гидроксибензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он,
1-[2-(4-фторфенил)-2-оксоэтил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1H-хиназолин-2-он
и их фармацевтически приемлемые и расщепляемые сложные эфиры или кислотно-аддитивные соли.
Представленные в настоящем описании ниже соединения формулы II могут быть получены циклизацией соединения формулы VII

в которой R1', R2' и R3' имеют указанные выше значения.
Соединения формулы VII проявляют действие стимуляторов выхода РТН и включены в объем настоящего изобретения для применения в качестве стимуляторов выхода РТН и как сами по себе новые соединения.
Таким образом, по изобретению предлагается (для применения) соединение формулы VII'

в которой R1, R2 и R3 имеют указанные выше значения, приведенные для формулы I,
или R1 в качестве заместителя в положении 2 соединен с R2 с образованием необязательно замещенного N-содержащего гидрокарбильного кольца, включающего от 4 до 8 кольцевых членов и необязательно включающего дополнительный гетероатом, выбранный из О, S и NR5, где R5 обозначает Н или необязательно замещенный (низш.)алкил, (низш.)алкокси(низш.)алкил или арил(низш.)алкил,
или его фармацевтически приемлемый и расщепляемый сложный эфир или кислотно-аддитивная соль (при приготовлении лекарственного средства для стимуляции выхода паратироидного гормона).
Аналогичным образом объектом изобретения являются способы и фармацевтические композиции для профилактики и лечения заболеваний кости, которые связаны с увеличенной потерей кальция или резорбцией или при которых требуется стимуляция остеогенеза и фиксация кальция в кости, с использованием соединений формулы VII' и их сложных эфиров и солей.
У соединений формулы VII' R1, R2 и R3 имеют такие же предпочтительные значения, как приведенные для соединений формулы I. В предпочтительном варианте заместители R1 могут находиться в любом из положений 2, 3, 4 и 5 анилинового кольца, например в положениях 2, 3 и 4. Так, в частности, когда R1 обозначает 2 заместителя, они могут находиться в положениях 3 и 4 или 4 и 5. В предпочтительном варианте по меньшей мере один из заместителей R1 находится в положении 4.
Таким образом, в предпочтительных вариантах по изобретению предлагается (для применения) соединение формулы VII

в которой R1', R2' и R3' имеют значения, указанные выше для формулы II,
или его фармацевтически приемлемый и расщепляемый сложный эфир или кислотно-аддитивная соль (при приготовлении лекарственного средства для стимуляции выхода паратироидного гормона).
Соединения формулы VII' включают много соединений, которые являются новыми, и такие новые соединения включены в объем изобретения.
Таким образом, объектом изобретения являются соединения формулы VII''

в которой каждый R1'' независимо обозначает Н, (низш.)алкокси, (низш.)алкенилокси, (низш.)алкинилокси, (низш.)алкиламино-, (низш.)алкениламино- или (низш.)алкиниламиногруппу;
R2''' обозначает (низш.)алкил, арилметил, циклоалкилметил или арилметил, или циклоалкилметил, замещенный до 5 заместителями, выбранными независимо из гало, нитро-, цианогрупп, ОН, SH, (низш.)алкила, (низш.)алкокси, (низш.)тиоалкокси, (низш.)алкоксикарбонила, (низш.)алкоксисульфонила, (низш.)алкоксикарбонилокси, трифторметила, фенила и группы -X-A-Z, в которой -Х-, -А- и -Z имеют указанные выше значения;
R3'' обозначает необязательно замещенный (низш.)алкил или аминогруппу,
или их фармацевтически приемлемые и расщепляемые сложные эфиры или кислотно-аддитивные соли.
Объектом изобретения являются, в частности, соединения формулы VII'', как они представлены в дальнейшем в настоящем описании и примерах.
Соединения формул I, II, III, IV, V, VII, VII' и VII'', как и те, которые перечислены выше, в дальнейшем в настоящем носят название агентов по изобретению.
Агенты по изобретению, которые включают свободные гидроксильные группы, можно также использовать в форме фармацевтически приемлемых, физиологически расщепляемых сложных эфиров, а в тех случаях, когда они являются новыми, они включены в объем изобретения. В предпочтительном варианте такие фармацевтически приемлемые сложные эфиры представляют собой пролекарственные сложноэфирные производные, которые вследствие сольволиза или расщепления в физиологических условиях способны превращаться в соответствующие агенты по изобретению, которые содержат свободные гидроксильные группы. Пригодные фармацевтически приемлемые пролекарственные сложные эфиры являются эфирами, дериватизированными из карбоновой кислоты, моноэфира карбоновой кислоты или карбаминовой кислоты, целесообразно сложными эфирами, дериватизированными из необязательно замещенной (низш.)алифатической кислоты или арилкарбоновой кислоты.
Агенты по изобретению могут также существовать в форме фармацевтически приемлемых солей, и в тех случаях, когда они являются новыми, они включены в объем изобретения. Фармацевтически приемлемые соли включают кислотно-аддитивные соли с обычными кислотами, например минеральными кислотами, в частности с соляной кислотой, серной или фосфорной кислотой, или органическими кислотами, в частности с алифатическими или ароматическими карбоновыми или сульфоновыми кислотами, например с уксусной, трифторуксусной, пропионовой, янтарной, гликолевой, молочной, яблочной, винной, лимонной, аскорбиновой, малеиновой, фумаровой, гидроксималеиновой, пировиноградной, памовой, метансульфоновой, толуолсульфоновой, нафталинсульфоновой, сульфаниловой или циклогексилсульфаминовой кислотой, а также с аминокислотами, такими как аргинин и лизин. Что касается соединений по изобретению, содержащих кислотные группы, например свободную карбоксильную группу, то примерами фармацевтически приемлемых солей служат также соли металлов и аммония, такие как соли щелочных металлов и щелочно-земельных металлов, например натриевые, калиевые, магниевые или кальциевые соли, равно как и аммониевые соли, которые образуют аммиак и приемлемые органические амины.
Агенты по изобретению формул II и III могут быть получены следующим образом.
Агенты по изобретению формулы II

в которой R1', R2' и R3' имеют указанные выше значения,
могут быть получены циклизацией соединения формулы VII

с использованием агента конденсации, такого как хлорсульфонилизоцианат (ClSO2NCO) или цианат натрия, или тиоцианат натрия и уксусная кислота, и последующим, если требуется, превращением остатков R1', R2' или R3' в другие остатки R1', R2' или R3' с получением другого соединения формулы II. Так, например, бензофенон формулы VII в растворе обрабатывают раствором хлорсульфонилизоцианата, например, в бензоле с охлаждением, например, при 0°С.
Агенты по изобретению формулы II, в которой R1' обозначает нитрогруппу, можно превращать в агенты формулы II, в которой R1' обозначает аминогруппу, восстановлением нитрогруппы, например, с никелем Ренея в растворе EtOH/ТГФ или железом в растворе АсОН. Агенты по изобретению формулы II, в которой R1' обозначает аминогруппу, можно превращать в соответствующие агенты по изобретению, у которых R1' обозначает аминогруппу, моно- или дизамещенную (низш.)алкенилом, (низш.)алкилом или (низш.)алкинилом, взаимодействием с соответствующим галогенидом, например бромидом, в присутствии соответствующего основания и других соответствующих реагентов, например в случае моноалкилирования в присутствии ТМСХл (триметилсилилхлорид) в качестве промежуточной защитной группы с целью обеспечить in situ монозащиту и основания Хюнига в CH2Cl2 или K2СО3/ДМФ.
Бензофеноновые соединения формулы VII, в которой R1' обозначает активирующую группу, например NO2 в положении 6, могут быть получены аминированием соответствующего хлорсодержащего предшественника формулы VIII

в которой R1' и R3' имеют указанные выше значения,
соответствующим амином, R2'NH2, например выдержкой соединения формулы VIII с амином при повышенной температуре, в частности при 65°С, в течение 10 ч в герметичной трубке.
Соединение формулы VIII может быть получено окислением соответствующего спирта формулы IX

в которой R1' и R3' имеют указанные выше значения,
например реактивом Джонса.
Спирт формулы IX может быть получен реакцией сочетания 2-хлорбензальдегидного соединения формулы Х с соответствующим металлорганическим соединением формулы XI

в которых R1' и R3' имеют указанные выше значения, а М обозначает, например, MgBr, Li или Ti(OR)3, в частности так, как изложено ниже в настоящем описании и примерах.
По другому варианту бензофеноновые соединения формулы VII могут быть получены обработкой соответствующего амина формулы XXX

соответствующим бромидом, R2' Br, и приемлемым основанием, таким как К2СО3.
По другому варианту соединения формулы VII могут быть получены гидроаминированием соответствующего альдегида амином XXX с использованием Ti(I-Opr)4 в качестве обезвоживающего агента и NaBH(ОАс)3 в качестве восстановителя, причем амин XXX может быть получен из соответствующего нитропроизводного восстановлением, например, с никелем Ренея, причем нитропроизводное может быть получено нитрованием, например, дымящей азотной кислотой соответствующего бензофенона формулы XXXI

в которой R3' имеет указанные выше значения, a R1'' обозначает активирующую группу.
В свою очередь соединение формулы XXXI может быть получено окислением, например, реактивом Джонса соответствующего спирта, который может, в свою очередь, быть получен реакцией сочетания металлорганического соединения, дериватизированного из соответствующих бромида формулы XXXIII и альдегида формулы XXXII, в частности так, как изложено в примерах.

Амин формулы XXX может быть получен по другому варианту, непосредственно реакцией сочетания 2-аминонитрила формулы XV с R3'-замещенным бромидом формулы XXXIV

включая, например, присоединение 2-аминонитрильного соединения к продукту присоединения бромида и BuLi, как правило, с охлаждением, в частности так, как изложено ниже в настоящем описании и примерах.
По другому варианту агенты по изобретению формулы II могут быть получены циклизацией соединения формулы XII

фосгеном, например так, как изложено в дальнейших примерах, и последующим, если если необходимо, превращением остатков R1', R2' или R3' в другие остатки R1', R2' или R3' с получением другого соединения формулы II.
Например, соединение формулы II, в которой R1' обозначает ди(низш.)алкокси, в частности 6,7-диметокси, можно превращать в соответствующее дигидроксисоединение, например, обработкой BBr3, а дигидроксисоединение можно, в свою очередь, превращать в соответствующее диалкенилоксисоединение обработкой соответствующим алкенилбромидом, в частности аллилбромидом.
В еще одном альтернативном, заслуживающим особого внимания варианте хиназолинтионовые агенты по изобретению могут быть получены согласно варианту способа, описанному непосредственно выше, в котором вместо фосгена используют тиофосген.
Иминовое соединение формулы XII может быть получено реакцией сочетания соответствующего нитрила формулы XIII с соответствующим реактивом Гриньяра или фениллитиевым соединением формулы XIV, причем, например, это последнее получают из бутиллития и соответствующего бромбензольного соединения

а нитрил формулы XIII может быть получен из соответствующего 2-аминонитрила формулы XV реакцией с иодидом или бромидом R2', в частности так, как изложено в примерах.

В еще одном варианте агенты по изобретению формулы II могут быть получены окислением соединения формулы XVII

например, в присутствии периодата натрия и следов гидрата трихлорида рутения.
3, 4-Дигидро-1.Н.-хиназолин-2-он формулы XVII может быть получен реакцией сочетания фенилмочевинового соединения формулы XVIII с альдегидом формулы XIX

в частности так, как изложено в примерах. Производное мочевины формулы XVIII может быть получено обработкой предшественника формулы XX

цианатом натрия в уксусной кислоте, а соединение формулы XX может быть получено обработкой соответствующего амина соответствующим R2' галогенидом, в частности так, как изложено в примерах.
Тем не менее в еще одном альтернативном варианте агенты по изобретению формулы II, в которой R2' обозначает необязательно замещенный бензил, могут быть получены алкилированием агента по изобретению формулы XXXXII

в положении 1 соответствующим необязательно замещенным бензилгалогенидом, в частности, в присутствии, например, ГМДС-Li (гексаметилдисилоксан Li) и Nal, в растворе, например в ТГФ/ДМФ, с умеренным нагреванием. Агент формулы XXXXII может быть получен обработкой соответствующего соединения формулы III, в которой R4' обозначает хлор, HCl в диоксане с нагреванием. Соединение формулы III, в которой R4' обозначает хлор, может быть получено реакцией сочетания соответствующей R3'-замещенной бензолборной кислоты с соответствующим R1'-замещенным 2,4-дихлорхиназолином формулы XXXXIII
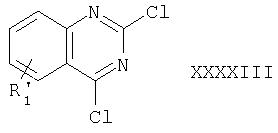
как правило, в присутствии катализатора, такого как ацетат палладия(II), и раствора К2CO3 с нагреванием, в частности так, как изложено в дальнейшем в настоящем описании и примерах. Дихлорсодержащее соединение формулы XXXXIII может быть получено из соответствующего 2,4-диона, например, обработкой POCl3 в присутствии N,N-диэтиланилина, в частности так, как изложено в примерах. В свою очередь, 2,4-дион можно получить циклизацией соответствующей 2-аминобензойной кислоты, например, обработкой цианатом калия в присутствии уксусной кислоты, в частности так, как изложено в дальнейшем в настоящем описании и примерах.
Агенты по изобретению формулы III могут быть получены следующим образом.
Так, например, агенты формулы III

в которой R1', R2' и R4' имеют вышеуказанные значения, в частности, где R4' обозначает гало, например атом хлора,
могут быть получены реакцией сочетания соответствующего 4-галосоединения, в частности хлорзамещенного хинолена формулы ХХХХ
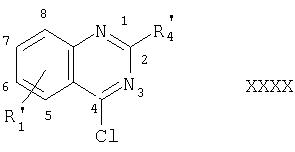
с соответствующей бензолборной кислотой формулы XXXXI

например, в растворе, в частности в ДМФ, в присутствии, например, три-O-толилфосфина, ацетата палладия(II) и водного раствора К2СО3.
Агенты по изобретению формулы III, в которой R4' обозначает гало, например, атом хлора, можно превращать в другие соединения формулы III замещением галозаместителя R4'. Так, например,
агенты, у которых R4' обозначает CN, могут быть получены обработкой содержащего галозаместитель R4' агента, в частности KCN, в присутствии ДАБЦО (1,4-диазабицикло(2.2.2)октан) в растворе, например в ДМСО/Н2О, с нагреванием;
агенты, у которых R4' обозначает F, могут быть получены обработкой KF, например, в присутствии ДМА с нагреванием;
агенты, у которых R4' обозначает необязательно замещенный арилокси, могут быть получены обработкой соответствующим гидроксиариловым предшественником, например, в присутствии NaH, с нагреванием;
агенты, у которых R4' обозначает необязательно замещенный алкокси, могут быть получены обработкой соответствующим гидроксиалкильным предшественником, например, в присутствии NaH с нагреванием, в частности так, как изложено в дальнейшем в настоящем описании и примерах.
Соответственно, объектом изобретения являются способы получения агентов по изобретению формул II и III

в которых символы имеют указанные выше значения, включающие
а) в случае агента по изобретению формулы II

в которой R1', R2' и R3' имеют указанные значения,
циклизацию соединения формулы VII

агентом конденсации, таким как хлорсульфонилизоцианат (ClSO2NCO) или цианат натрия, или тиоцианат натрия;
б) в случае агента по изобретению формулы II циклизацию соединения формулы XII
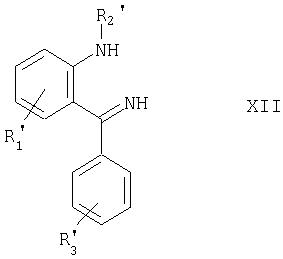
в которой R1', R2' и R3' имеют указанные выше значения,
агентом конденсации, таким как фосген или тиофосген;
в) в случае агента по изобретению формулы II, в которой R2' обозначает необязательно замещенный бензил, алкилирование агента по изобретению формулы XXXXII

в положении 1 соответствующим необязательно замещенным бензилгалогенидом;
г) в случае агентов по изобретению формулы II окисление соединения формулы XVII

например, в присутствии периодата натрия и следов гидрата трихлорида рутения;
д) в случае агента по изобретению формулы III

в которой R1' и R3' имеют вышеуказанные значения и где R4' обозначает гало, например атом хлора,
реакцию сочетания соответствующего 4-галосоединения, например хлорзамещенного хинолена формулы ХХХХ

с соответствующей бензолборной кислотой формулы XXXXI

и последующее, если необходимо, превращение остатков R1', R2', R3' или R4' в другие остатки R1', R2', R3' или R4' с получением другого соединения формулы II или III.
Объем изобретения включает также получение агентов по изобретению формулы VII', которое описано выше.
Соответственно, еще одним объектом изобретения являются способы получения агентов по изобретению формулы VII

в которой R1', R2' и R3' имеют указанные выше значения,
включающие
а) алкилирование соответствующего аминобензофенонового соединения формулы XXX

в которой R1 и R3 имеют указанные выше значения, или
б) аминирование галосодержащего, например хлорсодержащего, предшественника формулы VIII

в которой R1' и R3' имеют указанные выше значения (например, когда R1' обозначает активирующую группу, в частности NO2, в положении 4 анилинового кольца), соответствующим амином, R2-NH2 и последующее, если необходимо, превращение остатков R1', R2' или R3' в другие остатки R1', R2' или R3' с получением другого соединения формулы I.
В следующих неограничивающих примерах, которые относятся к получению соединений по изобретению формул II, III и IV, изобретение представлено только в целях его иллюстрации.
ПРИМЕРЫ
Синтез 6-нитро-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она и его производных

Пример 1
6-Нитро-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он
А. Синтез (2-хлор-5-нитрофенил)-(4-изопропилфенил)метанола.

Раствор 11,1 г (60 ммолей) 2-хлор-5-нитробензальдегида в 140 мл безводного ТГФ при -75°С обрабатывают добавлением по каплям 86 мл 0,72 М 4-изопропилфенилмагнийбромида (получен из 4-изопропилбромбензола и магния). После завершения добавления смеси дают возможность достичь КТ. В результате экстракционной обработки разбавленным раствором HCl/этилацетатом в виде темного масла получают 20 г продукта, который очищают экспресс-хроматографией (гексан/этилацетат в соотношении 98:2). Выход 15 г (81%) вещества в виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 8,71 (d, 1H), 8,10 (dd, 1H), 7,49 (d, 1H), 7,31 (d, 2H), 7,22 (d, 2H), 6,17 (d, 1H), 2,90 (гепт., 1H), 2,88 (d, ОН), 1,24 (d, 6H).
Б. Синтез 2-хлор-5-нитро-4'-изопропилбензофенона.

Спирт, полученный на стадии А (1,2 г, 4,14 ммоля), в 10 мл ацетона при 0°С обрабатывают реактивом Джонса. Перемешивание продолжают при КТ в течение ночи. Под вакуумом удаляют ацетон с последующей экстракционной обработкой этилацетатом/водой. Выход 1,09 г (96%) желтого твердого вещества, tпл 86-89°С.
1H-ЯМР (300 МГц, CDCl3): 8,29 (dd, 1H), 8,23 (d, 1H), 7,73 (d, 2H), 7,67 (d, 1H), 7,36 (d, 2H), 3,00 (гепт., 1H), 1,29 (d, 6H).
В. Синтез 2-изопропиламино-5-нитро-4'-изопропилбензофенона.
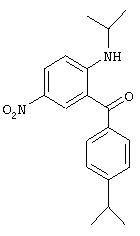
Смесь 300 мг (0,95 ммоля) соединения, полученного на стадии Б, в 15 мл изопропиламина в течение 10 ч выдерживают в герметизированной трубке при 65°С. Под вакуумом выпаривают избыток амина. Экстракцией остатка этилацетатом/водой в виде желтой смолы с количественным выходом получают продукт, который используют без очистки на следующей стадии.
1Н-ЯМР (300 МГц, CDCl3): 9,24 (широкий d, NH), 8,54 (d, 1H), 8,23 (dd, 1H), 7,57 (d, 2H), 7,35 (d, 2H), 6,78 (d, 1H), 3,88 (система из 8 линий, 1H), 3,00 (гепт., 1H), 1,36 (d, 6H), 1,31 (d, 6H).
МС: 327 (М+1)+.
Г. Синтез 1-изопропил-4-(4-изопропилфенил)-6-нитро-1.Н.-хиназолин-2-она.

1 Сырое производное бензофенона, полученное на стадии В, растворяют в 10 мл бензола и обрабатывают медленным добавлением 0,10 мл (1,2 ммоля) хлорсульфонилизоцианата (разбавленного 2 мл бензола). По истечении 1 ч выдержки при КТ экстракционной обработкой этилацетатом/водой получают сырой продукт, который очищают экспресс-хроматографией (петролейный эфир/этилацетат). Выход (после перекристаллизации из диэтилового эфира) 140 мг (40%) слегка желтого твердого вещества, tпл 208-209°С.
1Н-ЯМР (300 МГц, CDCl3): 8,79 (d, 1H), 8,53 (dd, 1H), 7,71 (d, 2H), 7,67 (d, 1H), 7,43 (d, 1H), 5,14 (гепт., 1H), 3,03 (гепт., 1H), 1,73 (d, 6H), 1,33 (d, 6H).
МС: 352 (M+1)+.
Пример 2
Синтез 6-амино-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она

Каталитической гидрогенизацией раствора 4,05 г (11,5 ммоля) 6-нитроизопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она (стадия Г) в 150 мл этанола/50 мл ТГФ над никелем Ренея (1 г) получают 3,6 г (количественный выход) красного твердого вещества tпл 218-220°С.
1Н-ЯМР (300 МГц, CDCl3): 7,65 (d, 2Н), 7,42 (d, 1H), 7,34 (d, 2H), 7,08-7,13 (m, 2H), 5,18 (широкий гепт., 1H), 3,67 (широкий, NH2), 2,99 (гепт., 1H), 1,67 (d, 6Н), 1,30 (d, 6H).
МС: 322 (М+1)+.
Пример 3
Синтез 6-диаллиламино-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она

Смесь 100 мг (0,311 ммоля) амина, полученного в примере 2, в 5 мл дихлорметана и 130 мг (0,93 ммоля) карбоната калия при 0°С обрабатывают 80 мкл (0,93 ммоля, 3 экв.) аллилбромида. Перемешивание продолжают при 50°С в течение ночи. В результате обработки в виде красного масла получают продукт, который очищают экспресс-хроматографией (петролейный эфир/этилацетат). Выход 25 мг (20%) вещества в виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 7,66 (d, 2H), 7,45 (d, 1H), 7,32 (d, 2H), 7,15 (dd, 1H), 7,06 (d, 1H), 5,71-5,86 (m, 2H), 5,21 (гепт., 1H), 5,15 (d, 2H), 5,09 (d, 2H), 3,88 (d, 4H), 2,98 (гепт., 1H), 1,66 (d, 6H), 1,29 (d, 6H).
МС: 402 (М+1)+.
Пример 4
Синтез 6-аллиламино-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она

В раствор 40 мг (0,124 ммоля) амина, полученного в примере 2, и 50 мкл (0,29 ммоля) диизопропилэтиламина (в 2 мл дихлорметана) по каплям добавляют 16 мкл (0,13 ммоля) триметилсилилхлорида. После перемешивания в течение одного часа при 50°С добавляют один эквивалент аллилбромида (11 мкл, 0,13 ммоля). Реакционную смесь выдерживают при этой температуре в течение 6 ч. Сырой продукт, выделенный после экстракционной обработки этилацетатом/водой, очищают экспресс-хроматографией (этилацетат/гексан). Выход 10 мг (33%), tпл 209-211°С.
1Н-ЯМР (300 МГц, CDCl3): 7,67 (d, 2H), 7,43 (d, 1H), 7,33 (d, 2H), 7,07 (dd, 1H), 6,99 (d, 1H), 5,80-5,94 (m, 1H), 5,13-5,26 (m, 3Н), 3,89 (широкий s, NH), 3,72 (широкий d, 2H), 2,98 (гепт., 1H), 1,66 (d, 6H), 1,29 (d, 6H).
МС (ES+): 362 (M+1)+.
Аналогично вышеописанным примерам получают соединения следующих примеров.
Пример 5
6-Диметиламино-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,73 (d, 2H), 7,51 (d, 1H), 7,35 (d, 2H), 7,23 (d, 1H), 7,12 (d, 1H), 5,23 (гепт., 1H), 3,00 (гепт., 1H), 2,91 (s, 6H), 1,68 (d, 6H), 1,31 (d, 6H).
МС: 350 (M+1)+.
Пример 6
6-Диэтиламино-1 -изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

tпл 170-172°C.
1Н-ЯМР (300 МГц, CDCl3): 7,71 (d, 2H), 7,48 (d, 1H), 7, 35 (d, 2H), 7,18 (dd, 1H), 7,04 (d, 1H), 5,23 (широкий гепт., 1H), 3,29 (q, 4H), 2,99 (гепт., 1H), 1,30 (d, 6H), 1,12 (t, 6Н).
МС: 378 (М+1)+.
Пример 7
6-(Дипропиламино)-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

tпл 182-184°C.
1Н-ЯМР (300 МГц, CDCl3): 7,68 (d, 2H), 7,46 (d, 1H), 7,33 (d, 2H), 7,12 (dd, 1H), 6,91 (d, 1H), 5,24 (широкий гепт., 1H), 3,16 (t, 4H), 2,98 (гепт., 1H), 1,67 (d, 6Н), 1,54 (система из 6 линий, 4H), 1,28 (d, 6H), 0,85 (t, 6H).
МС: 406 (М+1)+.
Пример 8
6-(Этиламино)-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

tпл 225-227°C.
1Н-ЯМР (300 МГц, CDCl3): 7,69 (d, 2H), 7,45 (d, 1H), 7,85 (d, 2H), 7,06 (dd, 1H), 6,99 (d, 1H), 5,21 (широкий гепт., 1H), 3,69 (широкий s, NH), 3,10 (q, 2H), 2,99 (гепт., 1H), 1,68 (d, 6Н), 1,30 (d, 6H), 1,24 (t, 3Н).
МС: 350 (М+1)+.
Пример 9
6-Пропиламино-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

tпл 231-233°С.
1H-ЯМР (300 МГц, CDCl3): 7,69 (d, 2H), 7,44 (d, 1H), 7,34 (d, 2H), 7,05 (dd, 1H), 6,97 (d, 1H), 5,20 (система из 5 широких линий, 1H), 3,66 (широкий, NH), 2,93-3,06 (m, 3Н), 1,67 (d, 6H), 1,62 (система из 6 линий, частично перекрываемая смежным сигналом, 2H), 1,30 (d, 6H), 0,97 (t, 3Н).
МС: 364 (M+1)+.
Пример 10
1-Изопропил-4-(4-трет-бутилфенил)-6-нитро-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 8,80 (d, 1H), 8,53 (dd, 1H), 7,72 (d, 2H), 7,67 (d, 1H), 7,59 (d, 2H), 5,15 (гепт., 1H), 1,73 (d, 6H), 1,40 (s, 9H).
МС: 366 (M+1)+.
Пример 11
6-Амино-1-бензил-4-(4-трет-бутилфенил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,70 (d, 1H), 7,53 (d, 2H), 7,20-7,32 (m, 6H), 7,10-7,14 (m, 2H), 7,00 (dd, 1H), 5,52 (широкий s, 2H), 3,70 (широкий, NH2), 1,38 (s, 9H).
МС: 384 (М+1)+.
Пример 12
6-Дипропаргиламино-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,75 (d, 2H), 7,52-7,59 (m, 1H), 7,40-7,48 (m, 2H), 7,36 (d, 2H), 5,21 (широкий гепт., 1H), 4,06 (d, 4H), 3,00 (гепт., 1H), 2,28 (широкий s, 2H), 1,69 (d, 6H), 1,31 (d, 6H).
МС: 398 (M+1)+.
Пример 13
6-Пропаргиламино-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, CDCl3): 7,72 (d, 2H), 7,49 (d, 1H), 7,35 (d, 2H), 7,12-7,18 (m, 2H), 5,21 (широкий гепт., 1H), 3,87-4,00 (m, 3H), 3,00 (гепт., 1H), 2,24 (широкий s, 1H), 1,68 (d, 6H), 1,31 (d, 6H).
МС: 360 (M+1)+.
Пример 14
6-Пропаргиламино-1-бензил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, CDCl3): 7,77 (d, 2H), 7,13-7,45 (m, 9H), 7,05 (d, 1H), 5,55 (широкий s, 2H), 3,96 (широкий s, NH), 3,89 (широкий s, 2H), 3,02 (гепт., 1H), 2,23 (s, 1H), 1,33 (d, 6H).
МС: 408 (М+1)+.
Пример 15
6-Аллиламино-1-бензил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,72 (d, 2Н), 7,73 (d, 2H), 7,29-7,33 (m, 5H), 7,14 (d, 1H), 7,03 (d, 1H), 6,98 (dd, 1H), 5,78-5,93 (m, 1H), 5,54 (s, 2H), 5,21 (dd, 1H), 5,16 (dd, 1H), 3,89 (широкий s, NH), 3,70 (широкий s, 2H), 3,01 (гепт., 1H), 1,32 (d, 6H).
МС: 410 (M+1)+ .
Синтез 1-изопропил-4-(4-изопропилфенил)-6,7-диметокси-1.Н.-хиназолин-2-она и родственных соединений
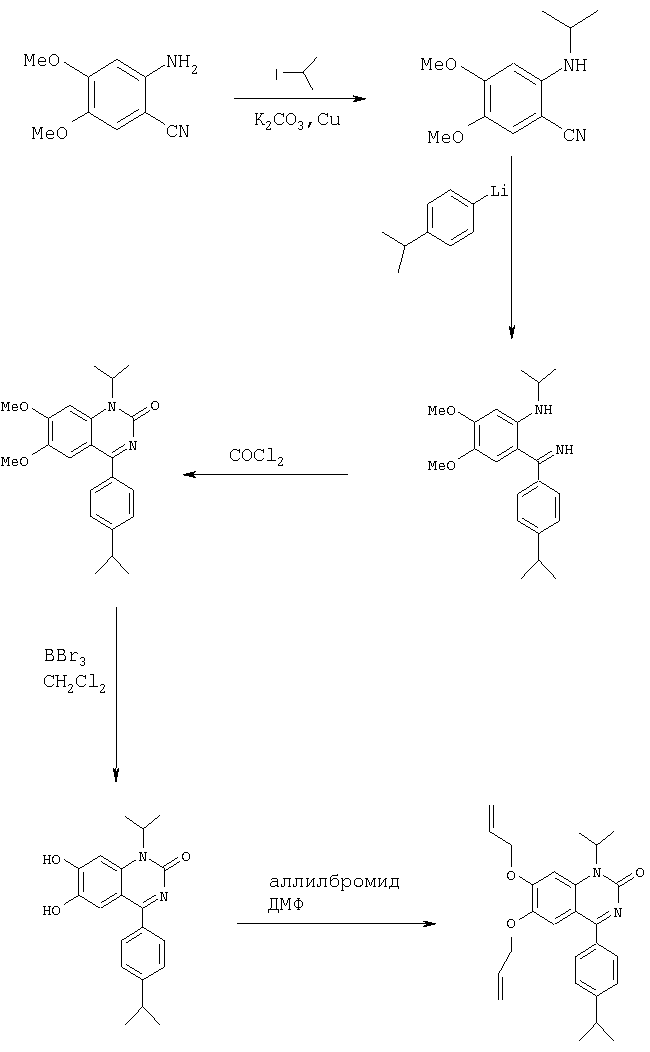
Пример 16
1-Изопропил-4-(4-изопропилфенил)-6,7-диметокси-1.Н.-хиназолин-2-он
А. Синтез 2-изопропиламино-4, 5-диметоксибензонитрила.

Суспензию 4,52 г (25,4 ммоля) 2-амино-4, 5-диметоксибензонитрила, 4,38 г (31,7 ммоля) карбоната калия и 100 мг медного порошка в 15 мл 2-иодпропана перемешивают при 90°С в течение 5 дней. Экстракционной обработкой этилацетатом/водой и концентрированием под вакуумом в виде темного масла получают продукт, который очищают экспресс-хроматографией (этилацетат/гексан). Выход 4,15 г (74%) вещества в виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 6,81 (s, 1H), 6,16 (s, 1H), 3,89 (s, 3H), 3,78 (s, 3H), 3,67 (система из 8 линий, 1H), 1,26 (d, 6H).
МС: 221 (M+1)+.
Б. Синтез {2-[имино(4-изопропилфенил)метил]-4,5-диметоксифенил}изопропиламина.

Холодный как лед раствор 1,24 г (6,27 ммоля) 4-изопропилбромбензола в 7 мл безводного диэтилового эфира обрабатывают 4,3 мл 1,6 М (6,87 ммоля) бутиллития (в гексане). По завершении добавления перемешивание продолжают в течение еще 30 мин. Затем по каплям добавляют 500 мг (2,27 ммоля) нитрила (разбавленного 7 мл диэтилового эфира), полученного на стадии А. Охлаждающую баню удаляют и реакционную смесь нагревают до КТ. Образовавшуюся оранжевую суспензию выливают на лед и экстрагируют этилацетатом. Очисткой сырого продукта экспресс-хроматографией (этилацетат/гексан) получают 223 мг (29%-ный выход) вещества в виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 9,4 (широкий NH), 9,1 (широкий NH), 7,24-7,30 (m, 4H), 6,69 (s, 1H), 6,28 (s, 1H), 3,93 (s, 3H), 3,75 (широкий m, 1H), 3,59 (s, 3H), 2,96 (гепт., 1H), 1,33 (d, 6H), 1,29 (d, 6H).
МС: 341 (M+1)+.
В. Синтез 1-изопропил-4-(4-изопропилфенил)-6,7-диметокси-1.Н,-хиназолин-2-она.

Раствор 200 мг (0,587 ммоля) имина, полученного на стадии Б, и 0,24 мл (1,72 ммоля) триэтиламина в 2 мл толуола обрабатывают добавлением по каплям 0,43 мл (0,82 ммоля) раствора фосгена (1,9 М в толуоле). Охлаждающую баню удаляют и когда смесь достигает КТ, реакцию завершают. Экстракционной обработкой этилацетатом/водой с последующей экспресс-хроматографией (этилацетат/гексан) сырого продукта получают 102 мг (47%-ный выход) хиназолинона, tпл 160-162°С.
1Н-ЯМР (300 МГц, CDCl3): 7,69 (d, 2Н), 7,36 (2, 2Н), 7,26 (s, 1H), 6,98 (s, 1H), 5,27 (широкий m, 1H), 4,05 (s, 3H), 3,82 (s, 3H), 2,99 (гепт., 1H), 1,71 (d, 6H), 1,30 (d, 6H).
MC: 367 (М+1)+.
Аналогичным образом получают соответствующее соединение, где R3' обозначает трет-бутил, (4-трет-бутилфенил)-(2-изопропиламино-4,5-диметоксифенил)метанон

1Н-ЯМР (300 МГц, CDCl3): 8,9 (широкий NH), 7,54 (d, 2H), 7,44 (d, 2H), 7,07 (s, 1H), 6,23 (s, 1H), 3,94 (s, 3H), 3,73 (система из 8 линий, 1H), 3,67 (s, 3H), 1,35 (s, 9H).
MC: 356 (М+1)+.
Пример 17
Синтез 6,7-дигидрокси-1 -изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она

1,1 мл (1,09 ммоля) раствора BBr3 (1,0 М в дихлорметане) добавляют к 100 мг (0,272 ммоля) 1-изопропил-4-(4-изопропилфенил)-6,7-диметокси-1.Н.-хиназолин-2-она. После перемешивания в течение 30 мин при КТ раствор выливают в 100 мл воды. Образовавшийся желтый осадок отфильтровывают, промывают диэтиловым эфиром, сушат и подвергают хроматографии (гексан/этилацетат) с получением продукта в виде желтого твердого вещества.
1H-ЯМР (300 МГц, CD3OD): 7,66 (d, 2Н), 7,61 (dd, 1H). 7,23 (s, 1H), 7,14 (s, 1H), 5,21 (m, 1H), 3,09 (гепт., 1H), 1,71 (d, 6Н), 1,34 (d, 6H).
МС: 339 (M+1)+.
Пример 18
6,7-Бисаллилокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

В раствор 75 мг (0,204 ммоля) 6,7-дигидрокси-1 -изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она в 2 мл ДМФ вводят 0, 5 мл аллилбромида и 21 мг (0,9 ммоля) NaH. Реакционную смесь перемешивают в течение 4 ч при КТ, разбавляют дихлорметаном и экстрагируют водой. Органический слой сушат и выпаривают. После хроматографии (дихлорметан/МеОН) продукт получают виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 7,65 (d, 2H), 7,36 (d, 2H), 7,28 (s, 1H), 7,00 (s, 1H), 6,19-5,94 (m, 2 H), 5, 54-5,28 (m, 5H), 4,80 (d, 2H), 4,54 (d, 2H), 3,00 (гепт., 1H), 1,67 (d, 6H) 1,31 (d, 6H).
МС: 419 (М+1)+.
Аналогично примеру 16 получают соединения следующих примеров.
Пример 19
1-Изопропил-4-(4-изопропилфенил)-5-метил-1.Н.-хиназолин-2-он

tпл 149°C.
1Н-ЯМР (300 МГц, CDCl3): 7,56 (d, 1H), 7,69 (s, 1H), 7,4 (d, 2H), 7,29 (d, 2H), 7,00 (d, 1H), 4,95 (гепт., 1H), 2,97 (гепт., 1H), 2,04 (s, 3Н), 1,69 (d, 6H), 1,30 (d, 6H).
МС: 321 (М+1)+.
Пример 20
1-Изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

tпл 128° С.
1Н-ЯМР (300 МГц, CDCl3): 7,89 (dd, 1H), 7,66-7,74 (m, 3Н), 7,57 (d, 1H), 7,36 (d, 2H), 7,18 (t, 1H), 5,19 (широкий гепт., 1H), 3.00 (гепт., 1H), 1,72 (d, 6H), 1,31 (d,6H).
МС: 307 (M+1)+.
Пример 21
1-Изопропил-4-(3-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, CDCl3): 7,63 (s, 1H), 7,53-7,59 (m, 2H), 7,39-7,47 (m, 2H), 7,36 (dd, 1H), 7,26 (s, 1H), 5,23 (широкий гепт., 1H), 3,75 (s, 3Н), 3,00 (гепт., 1H), 1,68 (d, 6H), 1,30 (d, 6H).
МС: 337 (M+1)+.
Пример 22
1-Изопропил-4-(4-изопропилфенил)-5-метокси-1.Н.-хиназолин-2-он

tпл 165°С.
1Н-ЯМР (300 МГц, CDCl3): 7,61 (t, 1H), 7,51 (d, 2H), 7,24 (d, 2H), 7,12 (d, 1H), 6,63 (d, 1H), 4,96 (широкий гепт., 1H), 3,57 (s, 3H), 2,96 (гепт., 1H), 1,68 (d, 6H), 1,27 (d, 6H).
МС: 337 (M+1)+.
Пример 23
1-Изопропил-4-(4-изопропилфенил)-6-метил-1.Н.-хиназолин-2-он

tпл 87-89°C.
1Н-ЯМР (300 МГц, CDCl3): 7,68 (d, 2Н), 7,66 (s, 1H), 7,46-7,56 (m, 2H), 7,37 (d, 2H), 5,20 (широкий гепт., 1H), 3,01 (гепт., 1H), 2,37 (s, 3Н), 1,69 (d, 6H), 1,31 (d, 6H).
МС: 321 (M+1)+.
Пример 24
1 -Изопропил-4-(4-изопропилфенил)-б-метокси-1.Н.-хиназолин-2-он

А. Синтез изопропил(4-метоксифенил)амина (известен).

Раствор 5 г (40,6 ммоля) п-анизидина, 4,1 мл (40,6 ммоля) изопропилиодида и 5,7 мл (40,6 ммоля) триэтиламина в 40 мл метанола кипятят с обратным холодильником в течение 18 ч. Реакционную смесь экстрагируют диэтиловым эфиром/водой и органические слои выпаривают. Сырой продукт очищают экспресс-хроматографией с использованием дихлорметана/МеОН (98:2) в качестве элюента с получением изопропил(4-метоксифенил)амина.
1H-ЯМР (300 МГц, CDCl3): 6,78 (d, 2H), 6,58 (d, 2H), 3,75 (s, 3H), 3,55 (гепт., 1Н), 1,09 (d, 6H).
MC: 166 (M+1)+.
Б. Синтез 1-изопропил-1-(4-метоксифенил)мочевины (известен).

В раствор 4,47 г (27,1 ммоля) изопропил(4-метоксифенил)амина в 70 мл уксусной кислоты небольшими порциями вводят 1,72 г (25,4 ммоля) цианата натрия, одновременно с помощью ледяной бани поддерживая температуру ниже 15°С. После перемешивания в течение 2 ч при комнатной температуре уксусную кислоту выпаривают, остаток растворяют в дихлорметане и промывают водным раствором гидроксида натрия (1 М). Органическую фазу выпаривают и сырой продукт очищают перекристаллизацией из дихлорметана/гексанов с получением 1-изопроил-1-(4-метоксифенил)мочевины.
1Н-ЯМР (300 МГц, CDCl3): 7,10 (d, 2H), 6,94 (d, 2H), 4,85 (гепт. 1Н), 4,14 (широкий, 2H), 3,83 (s, 3H), 1,04 (d, 6H).
MC: 209 (М+1)+.
В. Синтез 1-изопропил-4-(4-изопропилфенил)-6-метокси-3,4-дигидро-1.Н.-хиназолин-2-она.

Раствор 1,0 г (4,8 ммоля) 1-изопропил-1-(4-метоксифенил)мочевины, 0,87 мл (5,76 ммоля) куминового альдегида и 156 мкл (2,4 ммоля) метансульфоновой кислоты в 10 мл толуола выдерживают при температуре кипения с обратным холодильником в течение 3 дней. После экстракции водой и этилацетатом сырой продукт очищают экспресс-хроматографией с использованием гексанов/этилацетата (1:1) в качестве элюента и получением 1-изопропил-4-(4-изопропилфенил)-6-метокси-3,4-дигидро-1.Н.-хиназолин-2-она.
1Н-ЯМР (300 МГц, ДМСО): 7,36 (d, 1H), 7,16 (d, 2H), 7,15 (d, 2H), 7,01 (d, 1H), 6,83 (d, 1H), 6,78 (dd, 1H), 5,13 (d, 1H), 4,32 (гепт., 1H), 3,66 (s, 3H), 2,81 (гепт., 1H), 1,40 (d, 3H), 1,37 (d, 3H), 1,13 (d, 6Н).
МС: 339 (M+1)+.
Г. Синтез 1-изопропил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она.
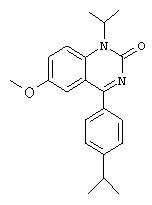
В смесь 3,65 г (10,8 ммоля) 1-изопропил-4-(4-изопропилфенил)-6-метокси-3,4-дигидро-1.Н.-хиназолин-2-она, 4 мл CCl4, 4 мл ацетонитрила и 8 мл воды вводят 3,45 г (16,2 ммоля) периодата натрия и следовое количество гидрата трихлорида рутения. После перемешивания в течение ночи добавляют воды и реакционную смесь экстрагируют дихлорметаном. Органический слой сушат над MgSO4 и полностью выпаривают. Оставшееся твердое вещество промывают диэтиловым эфиром с получением 1-изопропил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она.
1Н-ЯМР (CDCl3, 300 МГц): 7,70 (d, 2H), 7,54 (d, 1H), 7,38-7,31 (m, 4H), 5,21 (гепт., 1H), 3,78 (s, 3H), 3,00 (гепт., 1H), 1,69 (d, 7,0, 6Н), 1.30 (d, 7,0, 6Н).
МС: 337 (M+1)+.
Аналогично только что описанному примеру получают соединения следующих примеров.
Пример 25
1-Изопропил-4-(4-изопропил-2-метилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,54 (d, 1H), 7,33 (dd, 1H), 7,26 (d, 1H), 7,15 (m, 2H), 6,87 (d, 1H), 5,28 (m, 1H), 3,71 (s, 3Н), 2,94 (гепт., 1H), 2,22 (s, 3Н), 1,70 (d, 6Н), 1,28 (d, 6H).
МС: 351 (M+1)+.
Пример 26
4-(4-Этилфенил)-1-изопропил-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,69 (d, 2H), 7,54 (d, 1H), 7,36-7,29 (m, 4H), 5,22 (гепт., 1H), 3,77 (s, 3Н), 2, 74 (q, 2H), 1,68 (d, 6H), 1,29 (t, 3Н).
Пример 27
4-(4-трет-Бутилфенил)-1-изопропил-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,71 (d, 2Н), 7,54 (d, 1H), 7,35-7,31 (m, 4H), 5,21 (гепт., 1H), 3,79 (s, 3Н), 1, 69 (d, 6H), 1,38 (s, 9H).
МС: 351 (М+1)+.
Пример 28
1-Циклопентил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CD3OD): 7,78 (d, 1H), 7,68 (d, 2H), 7,51 (dd, 1H), 7,47 (d, 2H), 7,28 (d, 1H), 5,32 (квинт., 1H), 3,77 (s, 3Н), 3,04 (гепт., 1H), 2,41-2,29 (m, 2H), 2,19-2,00 (m, 4H), 1,84-1,73 (m, 2H), 1,33 (d, 6H).
МС: 363 (M+1)+.
Пример 29
1-Бензил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,73 (d, 2H), 7,40 (d, 2H), 7,35 (t, 1H), 7,33-7,24 (m, 7H), 5,56 (s, 2H), 3,76 (s, 3Н), 3,02 (гепт., 1H), 1,32 (d, 6H).
МС: 385 (М+1)+.
Пример 30
1-(3-Хлорпропил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

Это соединение получают аналогично 1-изопропил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-ону, исходя из 4-метоксианилина и 1-бром-3-хлорпропана.
1Н-ЯМР (300 МГц, CD3OD): 7,74 (d, 2Н), 7,71 (d, 1H), 7,63 (dd, 1H), 7,51 (d, 1H), 7,33 (d, 1H), 4,51 (m, 2H), 3,80 (s, 3H), 3,78 (t, 2H), 3, 06 (гепт., 1Н), 2,29 (m, 2H), 1,34 (d, 6H).
МС: 377 (М+1)+.
Синтез 6-гидрокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она и 6-аллилокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она

Пример 31
Синтез 6-гидрокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она

К 4,63 г (13,8 ммоля) 1-изопропил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она вначале добавляют 10 мл дихлорметана, а затем 27,6 мл (27,6 ммоля) 1 М раствора BBr3 в дихлорметане. После перемешивания в течение ночи при комнатной температуре добавляют дополнительно 14 мл (14 ммолей) раствора BBr3. По прошествии одного часа реакционную смесь выливают в воду и экстрагируют дихлорметаном. Органическую фазу выпаривают и остаток перекристаллизовывают из диэтилового эфира.
1Н-ЯМР (CD3OD, 300 МГц): 8,00 (d, 1H), 7,76 (d, 2H), 7,74 (dd, 1H), 7,65 (d, 2H), 7,28 (d, 1H), 5,34 (m, 1H), 3,12 (гепт., 1H), 1,72 (d, 6H), 1,36 (d, 6H).
МС: 323 (М+1)+.
Пример 32
Синтез 6-аллилокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она

В раствор 0,2 г (0,62 ммоля) 6-гидрокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она в 1 мл ДМЕИ добавляют 0,303 г (0,93 ммоля) карбоната цезия и 78,8 мкл (0,93 ммоля) аллилбромида. После перемешивания в течение 3 дней при комнатной температуре реакционную смесь экстрагируют водой/дихлорметаном. Выпариванием органической фазы с последующей препаративной ВЭЖХ получают 6-аллилокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он.
1Н-ЯМР (CDCl3, 300 МГц): 7,68 (dt, 2H), 7,52 (d, 1H), 7,38-7,32 (m, 4H), 6,00 (ddt, 1H), 5,37 (dq, 1H), 5,31 (dq, 1H), 5,20 (гепт., 1H), 4,50 (dt, 1H), 3,00 (гепт., 1H), 1,69 (d, 6H), 1,31 (d, 6H).
МС: 363 (M+1)+.
Аналогично только что описанному примеру получают соединения следующих примеров.
Пример 33
1-Изопропил-4-(4-изопропилфенил)-6-пропокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,70 (d, 2Н), 7,52 (d, 1H), 7,37 (d, 2H), 7,34 (dd, 1H), 7,31 (d, 1H), 5, 21 (гепт., 1H), 3,87 (t, 2H), 3,00 (гепт., 1H), 1,79 (гекс, 2H), 1,71 (d, 6H), 1,31 (d, 6H), 1,02 (t, 3H).
МС: 365 (M+1)+.
Пример 34
6-Этокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1 Н-ЯМР (300 МГц, CDCl3): 7,70 (d, 2H), 7,53 (d, 1H), 7,37 (d, 2H), 7,33 (d,1H), 7,31 (s, 1H), 5,21 (гепт., 1H), 3,98 (q, 2H), 3,00 (гепт., 1H), 1,69 (d, 6H), 1,40 (t, 3H), 1,31 (d, 6H).
МС: 351 (M+1)+.
Пример 35
6-Изопропокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,69 (d, 2Н), 7,52 (m, 1H), 7,37 (d, 2H), 7,34-7,30 (m, 3H), 5,21 (гепт., 1H), 4, 45 (гепт., 1H), 3,00 (гепт., 1H), 1,69 (d, 6H), 1,31 (d, 6H), 1,31 (d, 6H).
МС: 365 (M+1)+.
Пример 36
6-Бутокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он
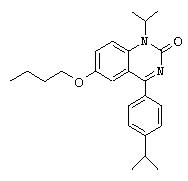
1 H-ЯМР (300 МГц, CDCl3): 7,70 (d, 2H), 7,53 (d, 1H), 7,37 (d, 2H), 7,35-7,30 (m, 2H), 5,21 (гепт., 1H), 3,91 (t, 2H), 3,00 (гепт., 1H), 1,75 (квинт., 2H), 1,69 (d, 6H), 1,47 (гекс, 2H), 1,31 (d, 6H), 0,95 (t, 3H).
МС: 379 (M+1)+.
Пример 37
1-Изопропил-4-(4-изопропилфенил)-6-пропаргилокси-1.Н.-хиназолин-2-он
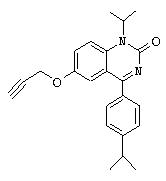
1H-ЯМР (300 МГц, CDCl3): 7,72 (d, 2H). 7,55 (d, 1H), 7,45 (d, 1H), 7,40 (dd, 1H), 7,36 (d, 2H), 5,20 (гепт., 1H), 4,66 (d, 2H), 3,00 (гепт., 1H), 2,56 (t, 1H), 1,69 (d, 6H), 1,31 (d, 6H).
МС: 361 (M+1)+.
Пример 38
1-Изопропил-4-(4-изопропилфенил)-6-(2-метилаллилокси)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,68 (d, 2H), 7,52 (d, 1H), 7,37-7,29 (m, 4H), 5,20 (гепт., 1H), 5,01 (s, 2Н), 4,40 (s, 2H), 2,99 (гепт., 1H), 1,78 (s, 3Н), 1,69 (d, 6H), 1,30 (d, 6H).
МС: 377 (М+1)+.
Пример 39
6-(2-Хлорэтокси)-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,68 (d, 2H), 7,55 (d, 1H), 7,40-7,33 (m, 4H), 5,20 (гепт., 1H), 4,19 (t, 2H), 3, 81 (t, 2H), 3,01 (гепт., 1H), 1,69 (d, 6H), 1,31 (d, 6H).
МС: 387 (30), 385 (100) (спектр изотопов хлора) (М+1)+.
Пример 40
6-(3-Хлорпропокси)-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,71 (d, 2Н), 7,55 (dd, 1H), 7,39 (d, 2H), 7,37 (m, 1H), 7,34 (m, 1H), 5,21 (гепт., 1H), 4,08 (t, 2H), 3,74 (t, 2H), 3,01 (гепт., 1H), 2,22 (квинт., 2H), 1,69 (d, 6H), 1,31 (d, 6H).
МС: 401 (30), 399 (100) (спектр изотопов хлора) (М+1)+.
Пример 41
6-Циклопропилметокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,69 (d, 2H), 7,53 (d, 1H), 7,37 (d, 2H), 7,35 (dd, 1H), 7,31 (d, 1H), 5,20 (гепт., 1H), 3,76 (d, 2H), 3,00 (гепт., 1H), 1,69 (d, 6H), 1,31 (d, 6H), 1,25 (m, 1H), 0,68-0,62 (m, 2H), 0,36-0,31 (m, 2H).
МС: 377 (М+1)+.
Пример 42
Синтез 5-аллил-6-гидрокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она

Раствор 40 мг (0,11 ммоля) 6-аллилокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она в 4 мл ДМЕИ выдерживают на масляной бане при 200°С в течение 2 ч. Препаративной ВЭЖХ реакционной смеси получают 5-аллил-6-гидрокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он.
1Н-ЯМР (300 МГц, CDCl3): 7,51 (d, 1H), 7,48 (d, 2H), 7,39 (d, 1H), 7,25 (d, 2H), 5,63 (ddt, 1H), 5,02 (d, 1H), 4,94 (m, 1H), 4,87 (d, 1H), 3.23 (d, 2H), 2,94 (гепт., 1H), 1,69 (d, 6H), 1,26 (d, 6H).
МС: 363 (М+1)+.
Пример 43
Синтез 5-аллил-1-изопропил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она

Смесь 10 мг (27,6 мкмоля) 5-аллил-6-гидрокси-1-изопропил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-она, 13,5 мг (41,4 мкмоля) карбоната цезия, 0,3 мл ДМЕИ и 2,6 мкл (41,4 мкмоля) метилиодида перемешивают в течение ночи. После экстракции водой/дихлорметаном сырой продукт очищают препаративной ВЭЖХ.
1H-ЯМР (300 МГц, CDCl3): 7,49 (d, 2H), 7,42 (d, 1H), 7, 35 (d, 1H), 7,26 (d, 2H), 5,51 (ddt, 1H), 4,89 (гепт., 1H), 4,74 (d, 1H), 4,47 (d, 1H), 3,87 (s, 3Н), 3,26 (d, 2H), 2,95 (гепт., 1H), 1,68 (d, 6H), 1,26 (d, 6H).
МС: 377 (М+1)+.
Аналогично только что описанному примеру получают соединение следующего примера.
Пример 44
5-Аллил-1-изопропил-4-(4-изопропилфенил)-6-пропаргилокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,50 (d, 2Н), 7,49, (d, 1H), 7,43 (d, 1H), 7,26 (d, 2H), 5,50, (ddt, 1H), 4,88 (гепт., 1H), 4,76 (d, 1H), 4,74 (d, 2H), 4,49 (d, 1H), 3,29 (d, 2H), 2,95 (гепт., 1H), 2,53 (t, 2H), 1,68 (d, 6H), 1,26 (d, 6H).
МС: 401 (M+1)+.
Пример 45
[1-Бензил-4-(4-изопропилфенил)-2-оксо-1, 2-дигидрохиназолин-6-илокси]ацетонитрил
А. Синтез 1-бензил-6-гидрокси-4-(4-изопропилфенил)-1Н-хиназолин-2-она

Раствор 470 мг (1,22 ммоля) 1-бензил-4-(4-изопропилфенил)-6-метокси-1Н-хиназолин-2-она в 5 мл безводного ТГФ при 0°С обрабатывают добавлением по каплям 2,44 мл 1,0 М (2,44 ммоля, 2 экв.) раствора трибромида бора (в метиленхлориде). После завершения добавления смеси дают возможность достичь КТ и перемешивают в течение 4 ч. Желто-красный раствор выливают в воду и экстрагируют СН2Cl2. Концентрированном под вакуумом получают желтый твердый продукт. Выход 360 мг (80%), tпл >270°C.
1Н-ЯМР (300 МГц, CDCl3): 7,64 (d, 2H), 7,17-7,37 (m, 12H), 5,53 (широкий, 1H), 2,94 (гепт., 1H), 1,26 (d, 6H).
МС: 371 (М+1)+.
Б. Синтез [1-бензил-4-(4-изопропилфенил)-2-оксо-1,2-дигидрохиназолин-6-илокси] ацетонитрила

Смесь 100 мг (0,27 ммоля) производного фенола, полученного на предыдущей стадии, 22 мкл (0,35 ммоля, 1,3 экв.) хлорацетонитрила и 44,8 мг (0,32 ммоля, 1,2 экв.) карбоната калия перемешивают в течение 6 ч при 60°С. Поскольку данные ТСХ указывают на незавершенность реакции, дополнительно добавляют 1,5 экв. хлорацетонитрила и перемешивание продолжают в течение 4 ч. Темную суспензию экстрагируют этилацетатом/водой. Очисткой хроматографией в колонке (этилацетат/петролейный эфир) получают 66 мг (60%-ный выход)указанного в заглавий соединения, tпл 139-141°С.
1Н-ЯМР (300 МГц, CDCl3): 7,77 (d, 2Н), 7,50 (широкий s, 1H), 7,42 (d, 2H), 7,27-7,39 (m, 7Н), 5,57 (широкий s, 2H), 4,72 (s, 2H), 3,03 (гепт., 1H), 1,34 (d, 6Н).
МС: 410 (М+1)+.
Пример 46
Синтез 1-(3-хлорбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она

А. Синтез (4-изопропилфенил)-(3-метоксифенил)метанола

К 3,4 г (139 ммолей) магния, покрытого ТГФ, вначале добавляют небольшую порцию раствора 26 г (139 ммолей) 3-броманизола в 150 мл ТГФ. Осторожным нагреванием инициируют реакцию Гриньяра и по каплям добавляют оставшуюся часть раствора 3-броманизола. После остановки реакции при 20-30°С медленно добавляют раствор 20,9 мл (139 ммолей) куминового альдегида в 100 мл ТГФ. После перемешивания в течение 3 ч при КТ реакционную смесь выливают в насыщенный водный раствор аммонийхлорида и экстрагируют диэтиловым эфиром. После выпаривания растворителя получают сырой (4-изопропилфенил)-(3-метоксифенил)метанол, который на следующей стадии подвергают прямому окислению.
МС: 239 (М+1)+.
Б. Синтез (4-изопропилфенил)-(3-метоксифенил)метанона
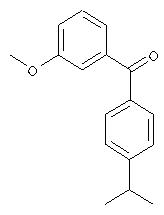
В раствор 34,5 г (134 ммоля) (4-изопропилфенил)-(3-метоксифенил)метанола в 200 мл ацетона медленно добавляют 50 мл реактива Джонса (берут из 100 мл водного расходного раствора, содержащего 26,7 г CrO3 и 23 мл H2SO4). По истечении 1 ч перемешивания при КТ добавляют 80 мл изопропанола и 50 мл бисульфита натрия (40%-ный в воде). Реакционную смесь выливают в насыщенный раствор аммонийхлорида и экстрагируют дихлорметаном. После выпаривания растворителя с последующей экспресс-хроматографией с использованием градиента перехода от гексанов к гексанам/этилацетату (9:1) получают (4-изопропилфенил)-(3-метоксифенил)метанон.
1Н-ЯМР (300 МГц, CDCl3): 7,77 (d, 2H), 7,40-7,32 (m, 5H), 7,13 (m, 1H), 3,86 (s, 3H), 2,99 (гепт., 1H), 1,30 (d, 6H).
МС: 255 (М+1)+.
В. Синтез (4-изопропилфенил)-(5-метокси-2-нитрофенил)метанона (4-изопропилфенил)-(3-метокси-2-нитрофенил)метанона

В раствор 21,6 г (84,9 ммоля) (4-изопропилфенил)-(3-метоксифенил)метанона при 5-10°С медленно добавляют 60 мл азотной кислоты (100%-ная). После перемешивания в течение ночи реакционную смесь нейтрализуют водным гидроксидом натрия (20%-ный) и экстрагируют дихлорметаном. Разные изомеры выделяют с помощью хроматографии в колонке с использованием градиента перехода от гексанов к гексанам/этилацетату (8:1).
Для (4-изопропилфенил)-(5-метокси-2-нитрофенил)метанона
1H-ЯМР (300 МГц, CDCl3): 8,25 (d, 1H), 7,69 (d, 2H), 7,30 (d, 2H), 7,07 (dd, 1H), 6,87 (d, 1H), 3,91 (s, 3H), 2,96 (гепт., 1H), 1,26 (d, 6H).
МС: 330 (35) (М+1)+, 270 (100).
Для (4-изопропилфенил)-(3-метокси-2-нитрофенил)метанона (RE 1445, неизвестен)
1Н-ЯМР (300 МГц, CDCl3): 7,75 (d, 2H), 7,53 (t, 1H), 7,31 (d, 2H), 7,23 (d, 1H), 7,08 (d, 1H), 3,98 (s, 3H), 2,97 (гепт., 1H), 1,27 (d, 6H).
МС: 300 (7) (M+1)+, 270 (100).
Г. Синтез (2-амино-5-метоксифенил)-(4-изопропилфенил)метанона

Раствор 5,6 г (18,7 ммоля) (4-изопропилфенил)-(5-метокси-2-нитрофенил)метанона в 100 мл метанола гидрируют в присутствии 2 г никеля Ренея под давлением 5 бар в течение 5 ч. Реакционную смесь фильтруют и фильтрат выпаривают. Остаток растворяют в диэтиловом эфире и продукт осаждают добавлением газообразной соляной кислоты в виде гидрохлорида.
1Н-ЯМР (300 МГц, CDCl3): 8,03 (d, 1H), 7,70 (d, 2H), 7,28 (d, 2H), 7,12 (d, 1H), 7,07 (dd, 1H), 3,77 (s, 3H), 2,96 (гепт., 1H), 1,27 (d, 6H).
МС: 270 (M+1)+.
Д. Синтез [2-(3-хлорбензиламино)-5-метоксифенил]-(4-изопропилфенил)метанона
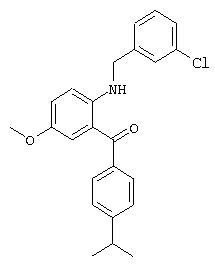
В раствор 100 мг (0,327 ммоля) (2-амино-5-метоксифенил)-(4-изопропилфенил)метанона в 1 мл дихлорметана добавляют 140 мкл (0,818 ммоля) N,N-диизопропилэтиламина и 48,7 мкл (0,360 ммоля) 3-хлорбензилбромида. Реакционную смесь выдерживают при кипячении с обратным холодильником в течение 4 дней и экстрагируют водой/дихлорметаном. Органический остаток хроматографируют. Для дополнительной очистки добавлением газообразной соляной кислоты из эфирного раствора осаждают соответствующий гидрохлорид.
1H-ЯМР (300 МГц, CD3OD): 7,67 (d, 2H), 7,43 (d, 2H), 7,47-7,19 (m, 5H), 7, 16 (d, 1H), 7,07 (широкий t, 1H), 4,66 (s, 2H) 3,81 (s, 3H), 3,03 (гепт., 1Н), 1,31 (d, 6H).
МС: 396 (30), 394 (100) (спектр изотопов хлора) (М+1)+.
Е. Синтез 1-(3-хлорбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она

Раствор 40 мг (102 мкмоля) [2-(3-хлорбензиламино)-5-метоксифенил]-(4-изопропилфенил)метанона в форме его свободного основания в 0,8 мл уксусной кислоты обрабатывают 6,6 мг (102 мкмоля) цианата натрия и перемешивают в течение ночи при КТ. Реакционную смесь подщелачивают водным раствором гидроксида натрия (1 М), экстрагируют этилацетатом и очищают препаративной ВЭЖХ.
1 Н-ЯМР (300 МГц, CDCl3): 7,74 (d, 2H), 7,41-7,37 (d, 3Н), 7,29-7,16 (m, 6H), 5,52 (s, 2H), 3,77 (s, 3Н), 3,01 (гепт., 1H), 1,32 (d, 6Н).
МС: 421 (30), 419 (100) (спектр изотопов хлора) (M+1)+.
Аналогично стадиям с А по Д только что описанного примера получают следующий метанон:
(2-изопропиламино-5-метоксифенил)-(4-изопропилфенил)метанон

1Н-ЯМР (300 МГц, CDCl3): 8,06 (d, NH), 7,58 (d, 2H), 7,29 (d, 2H), 7,03-7,10 (m, 2H), 4,76 (d, 1H), 5,75 (гепт., 1H), 3,67 (s, ЗН), 2,97 (гепт., 1H), 1,29 (d, 6H), 1,28 (d, 6H).
МС: 312 (М+1)+.
Аналогично примеру 46 получают соединения следующих примеров.
Пример 47
1-(3-Фторбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,74 (d, 2Н), 7,39 (d, 2H), 7,37 (m, 1H), 7,32-7,24 (m, 2H), 7,18 (d, 1H), 7,09 (d, 1H), 7,00-6.92 (m, 2H), 5,53 (s, 2H), 3,76 (s, 3H), 3,01 (гепт., 1H), 1,31 (d,6H).
MC: 403 (M+1)+.
Пример 48
4-(4-Изопропилфенил)-6-метокси-1-нафталин-2-илметил-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,83-7,72 (m, 6H), 7,49-7,36 (m, 6H), 7,31-7,18 (m, 2H), 5,72 (s, 2H), 3,74 (s, 3H), 3,02 (гепт., 1H), 1,32 (d, 6H).
MC: 435 (M+1)+.
Пример 49
4-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензонитрил

1H-ЯМР (300 МГц, CDCl3): 7,74 (d, 2Н), 7,63 (d, 2H), 7,42-7,39 (m, 5H), 7,27 (m, 1H), 7,09 (d, 1H), 5,59 (s, 2H), 3,77 (s, 3H), 3,02 (гепт., 1H), 1,32 (d, 6H).
MC: 410 (M+1)+.
Пример 50
Метиловый эфир 4-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]-3-метоксибензойной кислоты

1Н-ЯМР (300 МГц, CDCl3): 7,75 (d, 2H), 7,59 (s, 1H), 7,50 (d, 1H), 7,40 (d, 2H), 7,37 (d, 1H), 7,23 (dd, 1H), 7,12 (d, 1H), 6,99 (d, 1H), 5,57 (s, 2H), 4,02 (s, 3H), 3,88 (s, 3H), 3,76 (s, 3H), 3,01 (гепт., 1H), 1,32 (d, 6H).
МС: 473 (M+1)+.
Пример 51
{4-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]фенокси}ацетонитрил

1Н-ЯМР (300 МГц, CDCl3): 7,73 (d, 2Н), 7,40 (d, 2H), 7,36 (d, 1H), 7,33 (d, 2H), 7,27-7,21 (m, 2H), 6,94 (d, 2H), 5,51 (s, 2H), 4, 74 (s, 2H), 3,76 (s, 3H), 3,01 (гепт., 1H), 1,32 (d, 6H).
МС: 440 (М+1)+.
Пример 52
Метиловый эфир 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты

1Н-ЯМР (300 МГц, CDCl3): 8,02 (s, 1H), 7,95 (d, 1H), 7,75 (d, 2H), 7,50 (d, 1H), 7,40 (d, 2H), 7,39 (m, 1H), 7,37 (d, 1H), 7,25 (dd, 1H), 7,19 (d, 1H), 5,58 (s, 2H), 3, 90 (s, 3H), 3,76 (s, 3H), 3,02 (гепт., 1H), 1,32 (d, 6H).
МС: 443 (М+1)+.
Пример 53
4-(4-Изопропилфенил)-6-метокси-1-(3-нитробензил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 8,18 (s, 1H), 8,15 (d, 1H), 7,75 (d, 2H), 7,67 (d, 1H), 7,52 (t, 1H), 7,41 (d, 2H), 7,41 (d, 1H), 7,29 (dd, 1H), 7,16 (d, 1H), 5,63 (s, 2H), 3,77 (s, 3H), 3, 02 (гепт., 1H), 1,32 (d, 6H).
МС: 430 (M+1)+.
Синтез 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты и 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензамида

Пример 54
3-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойная кислота
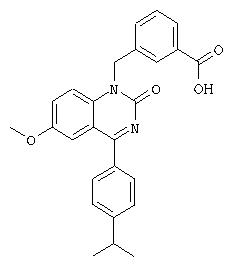
Раствор 0,67 г (1,51 ммоля) метилового эфира 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты (4 мл) в метаноле обрабатывают 2,27 мл (2,27 ммоля) водного раствора гидроксида натрия (1 М). После перемешивания в течение ночи реакционную смесь подкисляют и экстрагируют водой/дихлорметаном. Выпариванием органической фазы получают 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойную кислоту.
1Н-ЯМР (300 МГц, CDCl3): 8,07 (s, 1H), 8,00 (d, 1H), 7,76 (d, 2H), 7,56 (d, 1H), 7,41 (d, 2H), 7,42 (t, 1H), 7,38 (d, 1H), 7,30 (dd, 1H), 7,24 (d, 1H), 5,61 (s, 2H), 3,76 (s, 3H), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 429 (М+1)+.
Пример 55
Синтез 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензамида
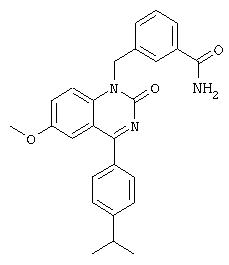
Раствор 0,60 г (1,40 ммоля) 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты в 5 мл дихлорметана обрабатывают 144 мкл (1,68 ммоля) оксалилхлорида. После перемешивания в течение ночи растворитель и избыток реагента выпаривают, а сырой хлорангидрид кислоты без очистки используют при последующей реакции ацилирования.
Раствор 30 мг (0,067 ммоля) хлорангидрида кислоты в 0,3 мл диоксана обрабатывают 0,3 мл водного аммиака (25%-ный). После перемешивания в течение 1 ч реакционную смесь экстрагируют водой/дихлорметаном. Выпариванием органической фазы получают 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензамид.
1Н-ЯМР (300 МГц, CDCl3): 7,83 (s, 1H), 7,71 (d, 2H), 7,71 (d, 1H), 7,42 (d, 1H), 7,38 (d, 2H), 7,35 (t, 1H), 7,35 (d, 1H), 7,25 (dd, 1H), 7,21 (d, 1H), 6,54 (широкий, 1H), 5,80 (широкий, 1H), 5,54 (s, 2H), 3,74 (s, 3Н), 3,00 (гепт., 1H), 1,30 (d, 6H).
MC: 428 (M+1)+.
Аналогично только что описанному примеру получают соединения следующих примеров.
Пример 56
3-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]-N,N-диметилбензамид

1Н-ЯМР (300 МГц, CDCl3): 7,74 (d, 2H), 7,39 (d, 2H), 7,36-7,27 (m, 5H), 7,24 (dd, 1H), 7,18 (d, 1H) 5,56 (s, 2H), 3,75 (s, 3Н), 3, 07 (s, 3Н), 3,01 (гепт., 1H), 2,92 (s, 3H) 1,31 (d, 6H).
MC: 456 (M+1)+.
Пример 57
2-Диметиламиноэтиловый эфир 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты

1Н-ЯМР (300 МГц, CDCl3): 8,01 (s, 1H), 7,94 (d, 1H), 7,73 (d, 2H), 7,47 (d, 1H), 7,39 (d, 2H), 7,36 (d, 1H), 7,40-7,35 (m, 1H), 7,24 (dd, 1H), 7,18 (d, 1H), 5,58 (широкий s, 2H), 4,42 (t, 2H), 3,75 (s, 3Н), 3,01 (гепт., 1H), 2,72 (t, 2H), 2,33 (s, 6Н), 1,31 (d,6H).
MC: 500 (M+1)+.
Пример 58
3-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]-N-метилбензамид

1Н-ЯМР (300 МГц, CDCl3): 7,74 (s, 1H), 7,73 (d, 2H), 7,67 (d, 1H), 7,45-7,35 (m, 5H), 7,27-7,20 (m, 2H), 6,32 (широкий, 1H), 5,55 (широкий, 2H), 3,75 (s, 3H), 3,01 (гепт., 1H), 2,96 (d, 3H), 1,31 (d, 6H).
MC: 442 (M+1)+.
Пример 59
Изопропиловый эфир 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты

1Н-ЯМР (300 МГц, CDCl3): 8,03 (s, 1H), 7,93 (d, 1H), 7,74, (d, 2H), 7,47-7,35 (m, 5H), 7,28-7,19 (m, 2H), 5,59 (широкий, 2H), 5,24 (гепт., 1H), 3,76 (s, 3Н), 3,01 (гепт., 1H), 1,36 (d, 6H), 1,32 (d, 6H).
МС: 470 (М+1)+.
Пример 60
2-(2-Диметиламиноэтокси)этиловый эфир 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты

1H-ЯМР (300 МГц, CDCl3): 8,04 (s, 1H), 7,96 (d, 1H), 7,74 (d, 2H), 7,47 (d, 1H), 7,40 (d, 2H), 7,41-7,36 (m, 2H), 7,27-7,17 (m, 2H), 5,59 (s, 2H), 4,47 (t, 2H), 3,79 (t, 2H), 3,76 (s, 3H), 3,62 (t, 2H), 3,01 (гепт., 1H), 2,52 (t, 2H), 2,26 (s, 6H), 1,32 (d, 6H).
МС: 544 (M+1)+.
Пример 61
2-(2-Диметиламиноэтокси)этиловый эфир 3-[4-(4-изопропилфенил)-2-оксо-6-проп-2-инилокси-2Н-хиназолин-1-илметил]бензойной кислоты (соль трифторуксусной кислоты)

1Н-ЯМР (300 МГц, CDCl3): 8,07 (s, 1H), 7,99 (d, 1H), 7,73 (d, 2H), 7,61 (d, 1H), 7,54 (s, 1H), 7, 50-7,40 (m, 5H), 5,61 (s, 2H), 4,68 (d, 2H), 4,44 (dd, 2H), 3,92 (dd, 2H), 3,79 (dd, 2H), 3,32 (m, 2H), 2,89 (s, 6H), 1,33 (d, 6H).
МС: 568 (М+1)+.
Пример 62
4-Диметиламинобутиловый эфир 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты

1Н-ЯМР (300 МГц, CDCl3): 8,03 (s, 1H), 7,94 (d, 1H), 7,75 (d, 2H), 7,48 (d, 1H), 7,40 (d, 2H), 7,41-7,37 (m, 2H), 7,28-7,18 (m, 2H), 5,59 (s, 2H), 4,83 (t, 2H), 3,76 (s, 3Н), 3,02 (гепт., 1H), 2,84 (t, 2H), 2,24 (s, 6H), 1,80 (квинт., 2H), 1,62 (квинт., 2H), 1,32 (d, 6H).
МС: 528 (М+1)+ .
Пример 63
3-Диметиламинопропиловый эфир 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты

1Н-ЯМР (300 МГц, COCl3): 8,02 (s, 1H), 7,94 (d, 1H), 7,74 (d, 2H), 7,49 (d, 1H), 7,40 (d, 2H), 7, 41-7,37 (m, 2H), 7,27-7,18 (m, 2H), 5,59 (s, 2H), 4,36 (t, 2H), 3,76 (s, 3H), 3,02 (гепт., 1H), 2,42 (t, 2H), 2,25 (s, 6H), 1,94 (квинт., 2Н), 1,32 (d, 6Н).
МС: 514 (M+1)+ .
Пример 64
3-(4-Метилпиперазин-1-ил)пропиловый эфир 3-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты

1Н-ЯМР (300 МГц, CDCl3): 8,01 (s, 1H), 7,93 (d, 1H), 7,75 (d, 2H), 7,49 (d, 1H), 7,41 (d, 2H), 7,42-7,37 (m, 2H), 7,28-7,18 (m, 2H), 5,60 (s, 2H), 4,36 (t, 2H), 3,76 (s, 3H), 3,02 (гепт., 1H), 2,52-2,47 (m, 10Н), 2,31 (s, 3H), 1,95 (квинт., 2H), 1,32 (d, 6H).
МС: 569 (M+1)+.
Пример 65
1-(3-Аминобензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

В раствор 260 мг (0,610 ммоля) 4-(4-изопропилфенил)-6-метокси-1-(3-нитробензил)-1.Н.-хиназолин-2-она в 2,5 мл дихлорметана добавляют 2, 5 мл уксусной кислоты и 136 мг (2,44 ммоля) железного порошка. После перемешивания в течение ночи реакционную смесь подщелачивают гидроксидом натрия и экстрагируют водой/дихлорметаном. Органические слои выпаривают с получением 1-(3-аминобензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она.
1H-ЯМР (300 МГц, CDCl3): 7,71 (d, 2Н), 7,38 (d, 2H), 7,33 (d, 1H), 7,27-7,25 (m, 2H), 7,13 (t, 1H), 6,91-6,74 (m, 3Н), 5,45 (s, 2H), 3,74 (s, 3H), 3,00 (гепт., 1H), 1,30 (d, 6H).
МС: 400 (M+1)+.
Пример 66
1-(3-Формиламинобензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

Раствор 20 мг (50 мкмолей) 1-(3-аминобензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она в 1 мл муравьиной кислоты выдерживают в течение 2 ч при 100°C. После выпаривания муравьиной кислоты остаток промывают диэтиловым эфиром с получением 1-(3-формиламинобензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она.
1Н-ЯМР (300 МГц, CDCl3), смесь двух ротамеров: 8,62 (d, 0,4H), 8,32 (s, 0,6Н), 7,74-7,62 (m, 3Н), 7,55-7,22 (m, 6,5Н), 7,18-7,13 (m, 0,5H), 7,07 (d, 0,5H), 7,00-6,98 (m, 0,5Н), 5,33-5,49 (m, 2H), 3,76 (s, 1,2Н), 3, 75 (s, 1,8H), 3,07-2,94 (m, 1Н), 1,32 (d, 2,4H), 1,32 (d, 3,6H).
МС: 428 (M+1)+.
Пример 67
Синтез (2-амино-3-метоксифенил)-(4-изопропилфенил)метанона

Раствор 6,8 г (22 ммоля) (4-изопропилфенил)-(3-метокси-2-нитрофенил)метанона в 90 мл метанола и 40 мл ТГФ гидрируют под нормальным давлением и при КТ в течение 20 ч в присутствии 2 г никеля Ренея. После фильтрования и выпаривания растворителя остаток растворяют в диэтиловом эфире и добавлением насыщенного раствора соляной кислоты в диэтиловом эфире в виде гидрохлорида осаждают (4-изопропилфенил)-(3-метокси-2-нитрофенил)метанон.
1Н-ЯМР (300 МГц, CDCl3: 7,72 (d, 2H), 7,31 (d, 2H), 7,24-7,13 (m, 3Н), 6,91 (широкий, 3Н), 4,02 (s, 3Н), 2,97 (гепт., 1Н), 1,28 (d, 6H).
МС: 270 (M+1)+.
Пример 68
Синтез (2-амино-3-гидроксифенил)-(4-изопропилфенил)метанона и (3,4-дигидро-2.Н.-бензо[1, 4]оксазин-5-ил)-(4-изопропилфенил)метанона

А. (2-Амино-3-гидроксифенил)-(4-изопропилфенил)метанон

В раствор 0,5 г (1,64 ммоля) (2-амино-3-метоксифенил)-(4-изопропилфенил)метанона в 5 мл дихлорметана в инертной атмосфере вводят 3,3 мл (3,3 ммоля) 1 М раствора BBr3 в дихлорметане. После перемешивания в течение 48 ч реакционную смесь выливают в 1 М водный раствор тиосульфата и экстрагируют дихлорметаном с получением (2-амино-3-гидроксифенил)-(4-изопропилфенил)метанона.
1H-ЯМР (300 МГц, CDCl3): 7,61 (d, 2H), 7,30 (d, 2H), 7,13 (d, 1H), 6,86 (d, 1H), 6,48 (t, 1H), 5,0 (широкий, 3Н), 2,98 (гепт., 1H), 1,29 (d, 6H).
МС: 256 (М+1)+.
Б. (3,4-Дигидро-2.Н.-бензо[1,4]оксазин-5-ил)-(4-изопропилфенил)метанон

Раствор 0,5 г (1,96 ммоля) (2-амино-3-гидроксифенил)-(4-изопропилфенил)метанона, 0,85 мл (9,8 ммоля) дибромэтана и 0,67 мл (3,9 ммоля) N-этилдиизопропиламина в 3 мл диоксана при 100°C выдерживают в течение 5 дней. После экстракции водой/дихлорметаном сырой продукт очищают экспресс-хроматографией с использованием градиента перехода от гексанов к гексанам/этилацетату в соотношении 7:1 с получением (3,4-дигидро-2.Н.-бензо[1,4]оксазин-5-ил)-(4-изопропилфенил)метанона.
1Н-ЯМР (300 МГц, CDCl3): 7,56 (d, 2Н), 7,29 (d, 2H), 7,13 (d, 1H), 6,92 (d, 1H), 6,45 (t, 1H), 4,25 (t, 2H), 3,58 (t, 2H), 2,97 (гепт., 1H), 1,28 (d, 6H).
МС: 282 (M+1)+.
Синтез (2-амино-5-метоксифенил)-(4-изопропилфенил)метанона и (4-изопропилфенил)-{5-метокси-2-[(пиридин-2-илметил)амино]фенил}метанона

Пример 69
(2-Амино-5-метоксифенил)-(4-изопропилфенил)метанон
А. Синтез 5,N-диметокси-N-метил-2-нитробензамида

2,4 г (12,2 ммоля) 5-метокси-2-нитробензойной кислоты растворяют в 50 мл метиленхлорида. Добавляют оксалилхлорида (1,2 мл, 13,4 ммоля) и раствор охлаждают до 0°С. После добавления двух капель ДМФ раствор перемешивают в течение ночи и выпаривают. Сырой материал растворяют в 50 мл хлороформа, добавляют N,O-диметилгидроксиламина (1,28 г, 13,4 ммоля) и пиридина (2,2 мл, 26,8 ммоля) и реакционную смесь перемешивают в течение двух часов.
Реакционную смесь экстрагируют диэтиловым эфиром/рассолом, органический слой сушат и выпаривают. Кристаллизацией из этилацетата/гексанов в виде желтого твердого вещества получают 2,1 г (69%-ный выход) продукта.
1Н-ЯМР (300 МГц, CDCl3): 8, 17 (d, 1H), 7,00-6,94 (m, 2H), 3,92 (s, 3H), 3,38 (d, 3H).
MC: 241 (М+1)+.
Б. Синтез 2-амино-5,N-диметокси-N-метилбензамида

Гидрогенизацией раствора 1,65 г (6,87 ммоля) материала, полученного на стадии А, над Pd/C после фильтрования в виде желтого масла выделяют 83% целевого продукта.
1H-ЯМР (300 МГц, ДМСО-d6): 6,80-6,61 (m, 3H), 4,8 (широкий, 2H), 3,63 (s, 3H), 3,54 (s, 3H), 3, 20 (s, 3H).
MC: 211 (M+1)+.
В. Синтез (2-амино-5-метоксифенил)-(4-изопропилфенил)метанона

610 мг (2,9 ммоля) материала, полученного на стадии Б, и 578 мг (2,9 ммоля) 4-изопропилфенилбромида растворяют в 11 мл ТГФ. Раствор охлаждают до -78°C и по каплям добавляют BuLi (3,6 мл, 1,6 М в гексанах). Спустя 30 мин раствор разбавляют 1 н. HCl, а по завершении экстрагируют этилацетатом. Органический слой сушат и выпаривают. После хроматографии (гексан/этилацетат) продукт (570 мг, 73%-ный выход) получают виде желтого масла.
1Н-ЯМР (300 МГц, ДМСО-d6): 7,53 (d, 2H), 7,37 (d, 2H), 7,05 (dd, 1H), 6,84-6,75 (m, 2H), 6,58 (широкий, 2H), 3,56 (s, 3H), 2,96 (гепт., 1H), 1,23 (d, 2H).
МС: 270 (М+1)+.
Пример 70
(4-Изопропилфенил)-{5-метокси-2-[(пиридин-2-илметил)амино]фенил}метанон

410 мг (2,97 ммоля) карбоната калия и 150 мг (0,59 ммоля) 2-бромэтилпиридингидробромида вводят в раствор 160 мг (0,59 ммоля) (2-амино-5-метоксифенил)-(4-изопропилфенил)метанона в 3 мл ацетона. Реакционную смесь перемешивают в течение 2 дней при 90°С, разбавляют этилацетатом и экстрагируют рассолом. Органический слой сушат и выпаривают. После хроматографии (гексан/этилацетат) продукт получают в виде желтого масла.
1H-ЯМР (300 МГц, ДМСО-d6): 8,53 (d, 1H), 8,49 (t, 1H), 7,74 (d, 1H), 7,55 (d, 2H), 7,37 (m, 3H), 7,25 (m, 1H), 7,07 (m, 1H), 6,90 (d, 1H), 6, 75 (d, 1H) 4,52 (d, 2H), 3,57 (s, 3H), 2,96 (гепт., 1H), 1,23 (d, 6H).
МС: 361 (М+1)+.
Аналогично только что описанному примеру получают соединение следующего примера.
Пример 71
(4-Изопропилфенил)-{5-метокси-2-[(пиридин-3-илметил)амино]фенил}метанон

1Н-ЯМР (300 МГц, CDCl3): 8,63 (d, 1H), 8,51 (d, 1H), 8,42 (t, 1H), 7,70 (m, 1H), 7,61 (d, 2H), 7,31 (m, 3H), 7,11 (d, 1H), 7,00 (dd, 1H), 6,64 (d, 1H), 4,49 (d, 2H), 3,67 (s, 3H), 2,97 (гепт., 1H), 1,29 (d, 6H).
МС: 361 (М+1)+.
Пример 72
1-Бензил-4-(4-изопропилфенил)-6,7-диметокси-1.Н.-хиназолин-2-он

А. Синтез (2-амино-4,5-диметоксифенил)-(4-изопропилфенил)метанона

18,8 мл (30 ммолей) BuLi (1,6 М в гексане) по каплям вводят в охлажденный (-5°С) раствор 6 г (30 ммолей) 4-изопропил-1-бромбензола в 25 мл диэтилового эфира. Реакционную смесь перемешивают в течение 15 мин при -5°С и еще в течение часа при КТ. По прошествии этого времени раствор охлаждают до -5°С и по каплям добавляют раствор 1,8 г (10 ммолей) 2-амино-4,5-диметоксибензонитрила в 20 мл диэтилового эфира/ТГФ (1:1). Спустя 30 мин реакционную смесь медленно выливают в воду и экстрагируют этилацетатом. Органический слой сушат и выпаривают. Сырой материал растворяют в 200 мл диэтилового эфира и перемешивают в течение одного часа с 100 мл 2 н. HCl.
После хроматографии (ДХМ/МеОН в соотношении 15:1) продукт получают виде желтого масла.
1Н-ЯМР (300 МГц, ДМСО-d6): 7,47 (d, 2Н), 7,37 (d, 2Н), 7,11 (широкий, 2Н), 6,79 (s, 1H), 6,41 (s, 1H), 3,77 (s, 3H), 3,49 (s, 3H), 2,95 (гепт., 1H), 1,23 (d, 2H).
МС: 300 (M+1)+.
Б. Синтез (2-бензиламино-4,5-диметоксифенил)-(4-изопропилфенил)метанона

228 мг (1,65 ммоля) карбоната калия и 43 мкл (0,36 ммоля) бензилбромида вводят в раствор 100 мг (0,33 ммоля) (2-амино-4,5-диметоксифенил)-(4-изопропилфенил)метанона в 3 мл диоксана. Реакционную смесь перемешивают в течение 3 дней при 90°С, разбавляют этилацетатом и экстрагируют рассолом. Органический слой сушат и выпаривают. После хроматографии (гексан/этилацетат) продукт получают виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 9,38 (t, 1H), 7,57 (d, 2H), 7,42-7,20 (m, 7H), 7,15 (s, 1H), 6,17 (s, 1H), 4,49 (d, 2H), 3,78 (s, 3H), 3,64 (s, 3Н), 2,97 (гепт., 1H), 1,27 (d, 6H).
МС: 390 (М+1)+.
В. Синтез 1-бензил-4-(4-изопропилфенил)-6, 7-диметокси-1.Н.-хиназолин-2-она
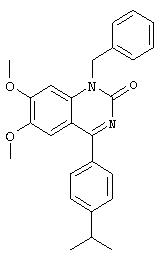
В охлажденный раствор 100 мг (0,26 ммоля) (2-амино-4,5-диметоксифенил)-(4-изопропилфенил)метанона в 3 мл бензола вводят 22 мкл (0,26 ммоля) хлорсульфонилизоцианата. По истечении 2 ч бензол отгоняют, а остаток растворяют в 4 мл ТГФ/воды (1:1). После перемешивания в течение одного часа при КТ реакционную смесь разбавляют этилацетатом и экстрагируют рассолом. Органический слой сушат, выпаривают и остаточный продукт в виде масла кристаллизуют из диэтилового эфира.
1H-ЯМР (300 МГц, CDCl3): 7,72 (d, 2H), 7,40-7,20 (m, 7H), 7,05 (s, 1H), 6,71 (s, 1H), 5,58 (s, 2H), 3,82 (s, 3Н), 3,80 (s, 3Н), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 415 (M+1)+.
Аналогично изложенному выше получают соответствующие перечисленные ниже метаноновые соединения.
[2-(3-Фторбензиламино)-4,5-диметоксифенил]-(4-изопропилфенил)метанон

1Н-ЯМР (300 МГц, ДМСО-d6): 9,18 (t, 1H), 7,50-6,98 (m, 8H), 6,90 (s, 1H), 6,29 (s, 1H), 4,50 (d, 2H), 3,71 (s, 3Н), 3,48 (s, 3Н), 2,94 (гепт., 1H), 1,21 (d, 6H).
МС: 408 (М+1)+.
4-{[2-(4-Изопропилбензоил)-4,5-диметоксифениламино]метил}бензонитрил

1Н-ЯМР (300 МГц, ДМСО-d6): 9,41 (t, 1H), 7,66-7,28 (m, 8H), 7,11 (s, 1H), 6,02 (s, 1H), 4,58 (d, 2H), 3,75 (s, 3Н), 3,68 (s, 3Н), 2, 99 (гепт., 1H), 1,30 (d, 6H).
МС: 415 (M+1)+.
[2-(3-Хлорбензиламино)-4,5-диметоксифенил]-(4-изопропилфенил)метанон

1Н-ЯМР (300 МГц, CDCl3): 9,36 (t, 1H), 7,57 (d, 2H), 7,40-7,22 (m, 6H), 7,10 (s, 1H), 6,10 (s, 1H), 4,48 (d, 2H), 3,78 (s, 3Н), 3,67 (s, 3Н), 2,97 (гепт., 1H), 1,32 (d, 6H).
МС: 424 (М+1)+.
(2-Изопропиламино-4, 5-диметоксифенил)-(4-изопропилфенил)метанон

1Н-ЯМР (300 МГц, CDCl3): 8,96 (d, 1H), 7,52 (d, 2H), 7,31 (d, 2H), 7,06 (s, 1H), 6,27 (s, 1H), 3,94 (s, 3Н), 3,76 (гепт., 1H), 3,67 (s, 3Н), 2,97 (гепт., 1H), 1,22-1,34 (m, 12H).
МС: 342 (M+1)+.
Аналогично примеру 72 получают соединения следующих примеров.
Пример 73
1-Изобутил-4-(4-изопропилфенил)-6, 7-диметокси-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, CDCl3): 7,70 (d, 2H), 7,39 (d, 2H), 7,29 (s, 1H), 6,78 (s, 1H), 4,21 (d, 2H), 4,06 (s, 3Н), 3,84 (s, 3Н), 3,01 (гепт., 1H), 2,35 (гепт., 1H), 1,32 (d, 6H), 1,08 (d, 6H).
МС: 381 (M+1)+.
Пример 74
1-Этил-4-(4-изопропилфенил)-6,7-диметокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,68 (d, 2Н), 7,37 (d, 2H), 7,29 (s, 1H), 6,78 (s, 1H), 4,36 (q, 2H), 4,05 (s, 3H), 3,82 (s, 3H), 2,98 (гепт., 1H), 1,41 (t, 3Н), 1,32 (d, 6H).
МС: 353 (M+1)+.
Пример 75
1-(2-Фторбензил)-4-(4-изопропилфенил)-6,7-диметокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,71 (d, 2H), 7,47 (td, 1H), 7,38 (d, 2H), 7,30-7,23 (m, 1H), 7,26 (s, 1H), 7,12 (d, 1H), 7,06 (dd, 1H), 6,84 (s, 1H), 5,62 (s, 2H), 3,93 (s, 3Н), 3,79 (s, 3H), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 433 (M+1)+ .
Пример 76
1-(4-Фторбензил)-4-(4-изопропилфенил)-6,7-диметокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,71 (d, 2H), 7,39 (d, 2H), 7,34 (dd, 2H), 7,27 (s, 1H), 7,02 (t, 2H), 6,66 (s, 1H), 5,53 (s, 2H), 3,84 (s, 3Н), 3,80 (s, 3Н), 3,01 (гепт., 1Н), 1,32 (d, 6H).
МС: 433 (M+1)+.
Пример 77
4-(4-трет-Бутилфенил)-1-изопропил-6, 7-диметокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, ДМСО-d6 ): 7,64 (d, 2H), 7,58 (d, 2H), 7,14 (s, 1H), 7,13 (s, 1H), 5,11 (гепт., 1H), 3,98 (s, 3Н), 3,68 (s, 3Н), 1,57 (d, 6H), 1,34 (s, 9H).
МС: 381 (М+1)+.
Следующее альтернативное метаноновое соединение получают так, как изложено ниже.
Синтез 2-хлор-N-[2-(4-изопропилбензоил)-4,5-диметоксифенил]-2-фенилацетамида

В раствор 50 мг (0,17 ммоля) (2-амино-4,5-диметоксифенил)-(4-изопропилфенил)метанона в 3 мл дихлорметана вводят α-хлорфенилацетилхлорид (27 мкл, 0,18 ммоля) и триэтиламин (58 мкл, 0,42 ммоля). После перемешивания в течение 48 ч при КТ раствор экстрагируют хлороформом/рассолом. Органический слой сушат и выпаривают. После хроматографии (гексан/этилацетат) продукт получают в виде желтого масла.
1H-ЯМР (300 МГц, CDCl3): 12,12 (s, 1Н), 8,43 (s, 1H), 7,68-7,36 (m, 9H), 7,13 (s, 1H), 5,46 (s, 1H), 3,97 (s, 3Н), 3,75 (s, 3H), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 452 (M+1)+.
Пример 78
Синтез 1-изопропил-4-(4-изопропилфенил)-6,7-диметокси-1.Н.-хиназолин-2-тиона

В раствор 100 мг (2,94 ммоля) {2-[имино(4-изопропилфенил)метил]-4,5-диметоксифенил}изопропиламина (получен так, как изложено в примере 16) в 1 мл дихлорметана вводят 164 мкл (5,88 ммоля) триэтиламина и 46 мкл (5,88 ммоля) тиофосгена. Приготовленную смесь перемешивают при 0°С в течение 2 дней. По прошествии этого времени реакционную смесь разбавляют водой и экстрагируют дихлорметаном. Органический слой сушат и выпаривают. Хроматографией (гексан/этилацетат в соотношении 4:1) целевой продукт получают в виде желтого масла.
1H-ЯМР (300 МГц, ДМСО-d6 ): 7,73 (d, 2Н), 7,46 (d, 2Н), 7,25-7,20 (m, 2H), 6,49 (гепт., 1H), 4,04 (s, 3Н), 3,75 (s, 3Н), 3,00 (гепт., 1H), 1,70 (d, 6H), 1,26 (d, 6H).
МС: 383 (М+1)+.
Синтез 1-бензил-4-(4-изопропилфенил)-6-пропаргилокси-1.Н.-хиназолин-2-она

Пример 79А
(2-Амино-5-пропаргилоксифенил)-(4-изопропилфенил)метанон
А. Синтез 2-нитро-5-пропаргилоксибензальдегида

Смесь 25 г (150 ммоля) 5-гидрокси-2-нитробензальдегида, 44,9 г (299 ммолей) иодида натрия, 44,5 г пропаргилбромида (80%-ный в толуоле), 42 мл N-этилдиизопропиламина и 400 мл ацетона при КТ перемешивают в течение 6 дней. Реакционную смесь фильтруют, концентрируют, растворяют в 1 М водной соляной кислоте и экстрагируют этилацетатом с получением 2-нитро-5-пропаргилоксибензальдегида.
1Н-ЯМР (300 МГц, CDCl3): 10,49 (s, 1H), 8,19 (d, 1H), 7,43 (s, 1H), 7,25 (d, 2H), 4,85 (s, 2H), 2, 60 (s, 1H).
Б. Синтез (4-изопропилфенил)-(2-нитро-5-пропаргилоксифенил)метанола
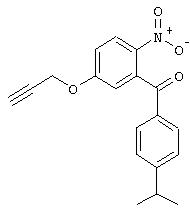
В раствор 30,7 г (150 ммолей) 2-нитро-5-пропаргилоксибензальдегида в 200 мл ТГФ в течение 40 мин при -75°C вводят 200 мл (175 ммолей) 0,88 М раствора 4-изопропилмагнийбромида в ТГФ. После перемешивания в течение 1 ч при -75°C добавляют насыщенного водного раствора аммонийхлорида и реакционную смесь экстрагируют порциями этилацетата. Выпариванием органических фаз получают (4-изопропилфенил)-(2-нитро-5-пропаргилоксифенил)метанол.
1H-ЯМР (300 МГц, CDCl3): 8,09 (d, 1H), 7,45 (d, 1H), 7,26 (d, 2H), 7,19 (d, 2H), 6,98 (dd, 1H), 6,52 (широкий, 1H), 4,80 (d, 2H), 2,88 (гепт., 1H), 2,71 (широкий, 1H), 2,56 (t, 1H), 1,23 (d, 6H).
МС: 308 (100) (М-ОН)+, 294 (50).
В. Синтез (4-изопропилфенил)-(2-нитро-5-пропаргилоксифенил)метанона

В холодный как лед раствор (4-изопропилфенил)-(2-нитро-5-пропаргилоксифенил)метанола в 200 мл ацетона по каплям добавляют 60 мл реактива Джонса. После перемешивания в течение 2 ч при КТ реакцию гасят добавлением изопропанола и раствора бисульфита натрия (40%-ный). Экстракцией дихлорметаном получают (4-изопропилфенил)-(2-нитро-5-пропаргилоксифенил)метанон.
1H-ЯМР (300 МГц, CDCl3): 8,27 (d, 1H), 7,70 (d, 2H), 7,30 (d, 2H), 7,18 (dd, 1H), 6,97 (d, 1H), 4,81 (d, 2H), 2,96 (гепт., 1H), 2,59 (t, 1H), 1,27 (d, 6H).
Г. Синтез (2-амино-5-пропаргилоксифенил)-(4-изопропилфенил)метанона

В раствор 10,59 г (30,7 ммоля) (4-изопропилфенил)-(2-нитро-5-пропаргилоксифенил)метанона в 250 мл уксусной кислоты вводят 13,6 г (246 ммолей) железного порошка. После перемешивания в течение 20 ч при КТ реакционную смесь подщелачивают добавлением 2 М раствора гидроксида натрия, фильтруют и экстрагируют дихлорметаном. После очистки хроматографией с использованием гексанов/этилацетата (7:3) в качестве элюента получают (2-амино-5-пропаргилоксифенил)-(4-изопропилфенил)метанон.
1Н-ЯМР (300 МГц, CDCl3): 7,64 (d, 2H), 7,30 (d, 2H), 7,12 (s, 1H), 7,05 (d, 1H), 6,72 (d, 1H), 5,71 (широкий, 2H), 4,64 (s, 2H), 2,98 (гепт., 1H), 2,48 (s, 1H), 1,30 (d, 6H).
МС: 294 (M+1)+.
Пример 79Б
Синтез (2-бензиламино-5-пропаргилоксифенил)-(4-изопропилфенил)метанона
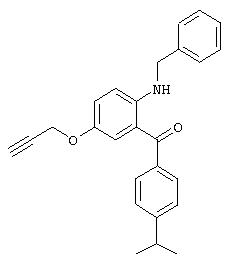
Раствор 100 мг (0,341 ммоля) (2-амино-5-пропаргилоксифенил)-(4-изопропилфенил)метанона, 44,6 мкл (0,375 ммоля) бензилбромида и 32 мкл (0,375 ммоля) N-этилдиизопропиламина в 2 мл диоксана выдерживают при 100°C в течение 90 ч. Реакционную смесь концентрируют, остаток растворяют в 0,1 М растворе гидроксида натрия и экстрагируют дихлорметаном. Препаративной ВЭЖХ получают (2-бензиламино-5-пропаргилоксифенил)-(4-изопропилфенил)метанон.
1Н-ЯМР (300 МГц, CD3OD): 7,58 (d, 2H), 7,39-7,31 (m, 6H), 7,27-7,22 (m, 1H), 7,13-7,08 (m, 2H), 6, 78 (d, 1H), 4,53 (s, 2H), 4,48 (s, 2H), 3,00 (гепт., 1Н), 2,91 (s, 1H), 1,30 (d, 6H).
МС: 384 (М+1)+.
Пример 80
1-Бензил-4-(4-изопропилфенил)-6-пропаргилокси-1.Н.-хиназолин-2-он

В раствор 66 мг (0,172 ммоля) (2-бензиламино-5-пропаргилоксифенил)-(4-изопропилфенил)метанона в 2 мл уксусной кислоты вводят 11,7 мг (0,172 ммоля) цианата натрия. После перемешивания в течение 3 ч объем реакционной смеси уменьшают и остаток экстрагируют 1 М раствором гидроксида натрия и дихлорметаном. После выпаривания органической фазы сырой продукт очищают препаративной ВЭЖХ с получением 1-бензил-4-(4-изопропилфенил)-6-пропаргилокси-1.Н.-хиназолин-2-она.
1Н-ЯМР (300 МГц, CD3OD): 7,75 (d, 2H), 7,51-7,43 (m, 5H), 7,37-7,23 (m, 5H), 5,61 (s, 2H), 4, 71 (s, 2H), 3,07 (s, 1H), 3,05 (гепт., 1H), 1,34 (d, 6H).
МС: 409 (M+1)+.
Аналогичным образом получают следующее метаноновое соединение.
4-{[2-(4-Изопропилбензоил)-4-пропаргилоксифениламино]метил}фениловый эфир уксусной кислоты

1Н-ЯМР (300 МГц, CD3OD): 7,59 (d, 2H), 7,42-7,36 (m, 4H), 7,13-7,05 (m, 4Н), 6,78 (d, 1H), 4,53 (s, 2H), 4,49 (s, 2H), 3,00 (гепт., 1Н), 2,91 (s, 1H), 2,26 (s, 3Н), 1,30 (d, 6H).
МС: 442 (M+1)+.
Аналогично примеру 79 получают соединения следующих примеров.
Пример 81
6-Аллилокси-1-бензил-4-(4-изопропилфенил)-1.Н.-хиназолин-2-он

1 Н-ЯМР (300 МГц, CD3OD): 7,71 (d, 2H); 7,50-7,39 (m, 4H), 7,36-7,23 (m, 6Н), 5,98 (ddt, 1H), 5,60 (s, 2H), 5,31 (d, 1H), 5,25 (d, 1H), 4,51 (d, 2H), 3,05 (гепт., 1H), 1,34 (d, 6H).
МС: 411 (М+1)+.
Пример 82
4-[6-Аллилокси-4-(4-изопропилфенил)-2-оксо-2.Н.-хиназолин-1-илметил]фениловый эфир уксусной кислоты

1H-ЯМР (300 МГц, CD3OD): 7,70 (d, 2H), 7,53-7,41 (m, 4H), 7,37-7,32 (m, 3Н), 7,08 (d, 2H), 5,98 (ddt, 1H), 5,59 (s, 2H), 5,31 (d, 1H), 5,25 (d, 1H), 4,52 (d, 2H), 3,05 (гепт., 1H), 2,24 (s, 3Н) 1,34 (d, 6H).
МС: 469 (М+1)+.
Пример 83
4-[4-(4-Изопропилфенил)-2-оксо-6-пропаргилокси-2.Н.-хиназолин-1-илметил]фениловый эфир уксусной кислоты

1Н-ЯМР (300 МГц, CDCl3): 7,75 (d, 2H), 7,50 (s, 1H), 7,40-7,26 (m, 6H), 7,05 (d, 2H), 5,54 (s, 2H), 4,65 (s, 2H), 3,02 (гепт., 1H), 2,55 (s, 1H), 2,28 (s, 3Н), 1,32 (d, 6H).
МС: 467 (М+1)+.
Пример 84
1-Бензо[1,2, 5]тиадиазол-5-илметил-4-(4-изопропилфенил)-6-пропаргилокси-1Н-хиназолин-2-он
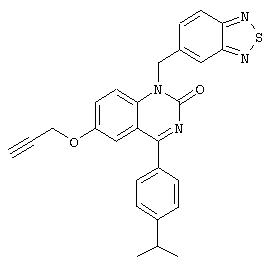
1Н-ЯМР (300 МГц, CDCl3): 8,01 (d, 1H), 7,75-7,80 (m, 3Н), 7,64 (dd, 1H), 7,53 (d, 1H), 7,41 (d, 2H), 7,21-7,34 (m, 2H + CHCl3), 5,73 (широкий s, 2H), 4,64 (d, 2H), 3, 03 (гепт., 1H), 2,55 (t, 1H), 1,33 (d, 6H).
МС: 467 (M+1)+.
Пример 85
4-(4-Изопропилфенил)-6-пропаргилокси-1-тиазол-2-илметил-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,78 (d, 1H), 7,70-7,75 (m, 3Н), 7,48 (d, 1H), 7,42 (dd, 1H), 7,37 (d, 2H), 7,34 (d, 1H), 5,78 (s, 2H), 4,66 (d, 2H), 3,01 (гепт., 1H), 2,55 (t, 1H), 1,31 (d, 6H).
MC: 416 (M+1)+.
Следующие 1-(гидроксибензил)-замещенные соединения получают по существу аналогично примеру 66 с изменением в том, что для защиты бензильной гидроксильной группы во время синтеза используют метоксиметил (MOM).
Пример 86
[2-(2-Гидроксибензиламино)-4,5-диметоксифенил]-(4-изопропилфенил)метанон

1Н-ЯМР (300 МГц, ДМСО-d6): 9,69 (s, 1H), 9,16 (t, 1H), 7,45 (d, 2H), 7,33 (d, 2H), 7,24 (dd, 1H), 7,07 (td, 1H), 6,88 (s, 1H), 6,83 (dd, 1H), 6,75 (td, 1H), 6,43 (s, 1H), 4,40 (d, 2H), 3,80 (s, 3Н), 3,48 (s, 3H), 2,94 (гепт., 1H), 1,22 (d, 6H).
МС: 406 (М+1)+.
Пример 87
1-(2-Гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он
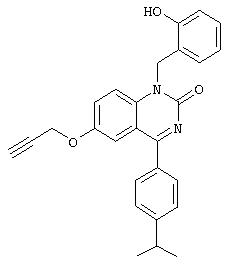
1Н-ЯМР (300 МГц, CDCl3): 7,88 (d, 1H), 7,72 (d, 2H), 7,54 (s, 1H), 7,51 (dd, 1H), 7,47 (dd, 1H), 7,38 (d, 2H), 7,23 (ddd, 1H), 6,97 (dd, 1H), 6,86 (td, 1H), 5,48 (широкий s, 2H), 4,69 (d, 2H), 3,01 (гепт., 1H), 2,57 (t, 1H), 1,32 (d, 6H).
МС: 425 (M+1)+.
Пример 88
1-(2-Гидроксибензил)-4-(4-изопропилфенил)-6,7-диметокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,69 (d, 2Н), 7,46 (d, 1H), 7,39 (d, 2H), 7,31 (s, 1H), 7,30 (s, 1H), 7,23 (t, 1H), 7,01 (d, 1H), 6,85 (t, 1H), 5,48 (широкий s, 2H), 4, 10 (s, 3Н), 3,82 (s, 3Н), 3,01 (гепт., 1H), 1,32 (d, 6H).
MC: 431 (М+1)+.
Следующие 1-(гидроксибензил)-замещенные соединения получают по существу аналогично вышеизложенному с изменением в том, что для защиты бензильной гидроксильной группы во время синтеза используют ацетил.
Пример 89
1-(3-Гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он
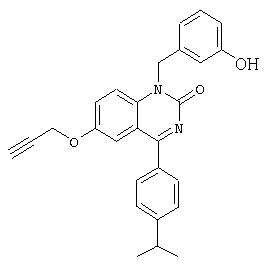
1Н-ЯМР (300 МГц, ДМСО-d6): 9,37 (s, 1H), 7,71 (d, 2H), 7,50-7,41 (m, 4H), 7,35 (d, 1H), 7,11 (dd, 1H), 6,72 (d, 1H), 6,63-6,60 (m, 2H), 5,41 (s, 2H), 4,78 (d, 2H), 3,67 (t, 1H), 3,01 (гепт., 1H), 1,28 (d, 6H).
МС: 425 (M+1)+.
Пример 90
1-(4-Гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,76 (d, 2Н), 7,48 (d, 1H), 7,38 (d, 1H), 7,32 (d, 2H), 7,18 (d, 2H), 6,76 (d, 2H), 5,45 (широкий s, 3 H), 4,65 (d, 2H), 3,02 (гепт., 1H), 2,55 (t, 1H), 1,33 (d, 6H).
МС: 425 (М+1)+.
Пример 91
Синтез 1-[2-(6-хлоргексилокси)бензил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она

В раствор 482 мг (1,13 ммоля) 1-(2-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в 2 мл дихлорметана вводят 1 мл 1 М водного NaOH. После перемешивания в течение 5 мин растворители выпаривают. Остаток растворяют в 4,8 мл ДМЕИ и добавляют 0,25 мл (1,70 ммоля) 1-бром-6-хлоргексана. После перемешивания в течение 3 дней при КТ дополнительно добавляют 0,083 мл 1-бром-6-хлоргексана и перемешивание при КТ продолжают в течение 1 дня. Реакционную смесь выливают в воду, экстрагируют этилацетатом и очищают экспресс-хроматографией (гексаны/этилацетат в соотношении 6:1).
1Н-ЯМР: 7,76 (d, 2H), 7,49 (d, 1H), 7,38 (d, 2H), 7,32-7,26 (m, 2H), 7,21 (ddd, 1H), 6,99 (dd, 1H), 6,90 (d, 1H), 6,80 (t, 1H), 5,56 (s, 2H), 4,43 (d, 2H), 4,10 (t, 2H), 3,56 (t, 2Н), 3,02 (гепт., 1H), 2,54 (t, 1H), 1,96-1,79 (m, 4H), 1,63-1,56 (m, 4H), 1,33 (d, 6H).
МС: 545 (40), 543 (100) (спектр изотопов хлора) (М+1)+.
Пример 92
Синтез 1-[2-(6-диметиламиногексилокси)бензил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она

Смесь 50 мг (92,1 мкмоля) 1-[2-(6-хлоргексилокси)бензил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она и 160 мкл этанольного раствора диметиламина (33%-ный) выдерживают при 60°С в течение 18 ч. Экстракцией дихлорметаном и водным 0,1 M NaOH получают указанное в заглавии соединение.
1H-ЯМР (300 МГц, CDCl3): 7,75 (d, 2Н), 7,48 (d, 1H), 7,38 (d, 2H), 7,27 (m, 2Н), 7,10 (td, 1H), 6,98 (dd, 1H), 6,90 (d, 1H), 6,80 (t, 1H), 5,55 (s, 2H), 4,63 (d, 2H), 4,09 (t, 2H), 3,01 (гепт., 1H), 2,54 (t, 1H), 2,34 (dd, 2H), 2,27 (s, 6H), 1,90 (квинт., 2H), 1,63-1,40 (m, 6H), 1,32 (d, 6H).
МС: 552 (M+1)+.
Аналогично только что описанным примерам получают соединения следующих примеров.
Пример 93
1-[2-(6-Имидазол-1-илгексилокси)бензил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,75 (d, 2Н), 7,48-7,45 (m, 2H), 7,38 (d, 2H), 7,27 (dd, 1H), 7,24 (s, 1H), 7,20 (td, 1H), 7,03 (s, 1H), 6,96-6,86 (m, 3H), 6,80 (t, 1H), 5,55 (s, 1H), 4,63 (d, 2H), 4,06 (t, 2H), 3,95 (t, 2H), 3,01 (гепт., 1H), 2,54 (t, 1H), 1,88-1,78 (m, 4Н), 1,58 (квинт., 2H), 1,45-1,37 (m, 2H), 1,32 (d, 6H).
МС: 575 (M+1)+.
Пример 94
4-(4-Изопропилфенил)-1-[3-(7-пиперидин-1-илгептилокси)бензил]-6-проп-2-инилокси-1Н-хиназолин-2-он (соль трифторуксусной кислоты)

1H-ЯМР (300 МГц, CDCl3): 7,73 (d, 2H), 7,50 (d, 1H), 7,40 (d, 2H), 7,36 (dd, 1H), 7,32 (d, 1H), 7,24 (t, 1H), 6,90 (d, 1H), 6,82 (s, 1H), 6,79 (d, 1H), 5,52 (s, 2H), 4,65 (d, 2H), 3,90 (t, 2H), 3,61 (широкий d, 2H), 3,03 (гепт., 1H), 2,98 (широкий m, 2H), 2,66 (широкий m, 2H), 2,56 (t, 1H), 2,03-1,32 (m, 16H), 1,33 (d, 6H).
МС: 606 (M+1)+.
Пример 95
4-[4-(4-Изопропилфенил)-2-оксо-6-проп-2-инилокси-2Н-хиназолин-1-илметил]фениловый эфир (3-диметиламинопропил)метилкарбаминовой кислоты (соль трифторуксусной кислоты)

К избытку фосгена, растворенного в толуоле, при 0°С добавляют 41,5 мкл (0,283 ммоля) N,N, N'-триметил-1,3-пропандиамина. По прошествии 5 мин растворитель выпаривают и остаток растворяют в 2 мл дихлорметана. При 0°С добавляют триэтиламина (79,2 мкл, 0,566 ммоля) и раствора 100 мг (0, 236 ммоля) 1-(4-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в 2 мл дихлорметана. После перемешивания в течение 20 ч при КТ добавляют водного аммиака и 0,1 М NaOH. Указанное в заглавии соединение получают экстракцией дихлорметаном с последующей препаративной ВЭЖХ с обращенной фазой.
1H-ЯМР (300 МГц, CDCl3): 7,73 (d, 2Н), 7, 54 (d, 1H), 7,45-7,30 (m, 4H), 7,42 (d, 2H), 7,10 (d, 2H), 5,56 (s, 2H), 4,68 (d, 2H), 3,44 (t, 2H), 3,20-3,07 (m, 2H), 3,03 (гепт., 1H), 2,87 (m, 6Н), 2,57 (t, 1H), 2,19 (s, 3Н), 2,19-2,07 (m, 2H), 1, 33 (d, 6H).
МС: 567 (M+1)+.
Пример 96
Синтез 4-(4-изопропилфенил)-1-{3-[2-(2-метоксиэтокси)этокси]бензил}-6-проп-2-инилокси-1Н-хиназолин-2-она

В раствор 100 мг (0,236 ммоля) 1-(3-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в безводном ДМФ (5 мл) вводят NaH (11 мг, 0,471 ммоля) и раствор перемешивают до тех пор, пока не прекращается выделение газа. Добавляют 1-бром-2-(2-метоксиэтокси)этана (34 мкл, 0,247 ммоля) и смесь выдерживают в течение 20 ч при 60°С. После охлаждения до комнатной температуры реакцию в реакционной смеси гасят водой и смесь экстрагируют дихлорметаном (2 порции по 20 мл). Объединенные органические слои промывают рассолом, сушат (Na2SO4), фильтруют и выпаривают под вакуумом с получением желтого твердого вещества, которое очищают экспресс-хроматографией на силикагеле с использованием петролейного эфира/этилацетата (1:1) и выделением указанного в заглавии соединения в виде желтого масла. Выход 111 мг (85%-ный).
1H-ЯМР (300 МГц, CDCl3): 7,76 (d, 2Н), 7,49 (d, 1H), 7,38 (d, 2H), 7,32 (dd, 1H), 7,20-7,28 (m, 2H), 6,90 (dd, 1H), 6,86 (m, 1H), 6,80 (dd, 1H), 5,51 (широкий s, 2H), 4,65 (d, 2H), 4,10 (t, 2H), 3,84 (t, 2H), 3,70 (m, 2H), 3,58 (m, 2H), 3,38 (s, 3Н), 3,02 (гепт., 1H), 2, 55 (t, 1H), 1,33 (d, 6H).
МС: 527 (М+1)+.
Пример 97
Синтез 4-(4-изопропилфенил)-1-[3-(2-{2-[2-(2-метоксиэтокси)этокси]этокси}этокси)бензил]-6-проп-2-инилокси-1Н-хиназолин-2-она

А. Получение мезилата.
В раствор триэтиленгликольмонометилового эфира (0,5 мл, 3,1 ммоля) в безводном ТГФ при комнатной температуре вводят триэтиламин (516 мкМ, 3,71 ммоля), после чего метансульфонилхлорид (265 мкМ, 3,41 ммоля). Реакционную смесь перемешивают в течение 2,5 ч, по прошествии которых данные ТСХ указывают на полноту превращения. Образовавшийся раствор используют в этом виде на стадии Б.
Б. Алкилирование фенола мезилатом.
В раствор 100 мг (0,236 ммоля) 1-(3-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в ацетоне (5 мл) вводят карбонат калия (326 мг, 2,36 ммоля), после чего мезилат, полученный на стадии А (5 мл, 1,18 ммоля). Реакционную смесь кипятят с обратным холодильником в течение 2 дней. После охлаждения до комнатной температуры реакцию в реакционной смеси гасят водой и смесь экстрагируют EtOAc (2 порции по 20 мл). Объединенные органические слои промывают рассолом, сушат (Na2SO4), фильтруют и под вакуумом выпаривают с получением в виде желтого масла продукта, который очищают экспресс-хроматографией на силикагеле с использованием дихлорметана/трет-бутилметилового эфира (1:1) и выделением указанного в заглавии соединения в виде желтого масла. Выход 54 мг (35%-ный).
1Н-ЯМР (300 МГц, CDCl3): 7,76 (d, 2Н), 7,49 (d, 1H), 7,39 (d, 2H), 7,32 (dd, 1H), 7,20-7,28 (m, 2H), 6,90 (dd, 1H), 6,86 (m, 1H), 6,80 (dd, 1H), 5,52 (широкий s, 2 H), 4,65 (d, 2H), 4,09 (t, 2H), 3,82 (t, 2H), 3,60-3,72 (m, 10Н), 3,55 (m, 2H), 3,37 (s, 3Н), 3,03 (гепт., 1H), 2,56 (t, 1H), 1,33 (d, 6H).
МС: 615 (М+1)+.
Пример 98
Синтез 4-(4-изопропилфенил)-1-[4-(2-{2-[2-(2-метоксиэтокси)этокси]этокси}этокси)бензил]-6-проп-2-инилокси-1Н-хиназолин-2-она

В раствор 100 мг (0,236 ммоля) 1-(4-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в ацетоне (5 мл) вводят карбонат калия (326 мг, 2,36 ммоля), после чего мезилат (5 мл, 1,18 ммоля), полученный на вышеописанной стадии А (см. пример RT-3). Реакционную смесь кипятят с обратным холодильником в течение 2 дней. После охлаждения до комнатной температуры реакцию в реакционной смеси гасят водой и смесь экстрагируют EtOAc (2 порции по 20 мл). Объединенные органические слои промывают рассолом, сушат (Na2SO4), фильтруют и под вакуумом выпаривают с получением в виде желтого масла продукта, который очищают экспресс-хроматографией на силикагеле с использованием дихлорметана/трет-бутилметилового эфира (1:1) и выделением указанного в заглавии соединения в виде желтого масла. Выход 44 мг (30%-ный).
1Н-ЯМР (300 МГц, CDCl3): 7,76 (d, 2Н), 7,49 (d, 1H), 7,39 (d, 2H), 7,32 (m, 2H), 7,25-7,28 (m, 2H), 6,87 (d, 2H), 5,49 (широкий s, 2Н), 4,65 (d, 2H), 4,08 (t, 2H), 3,82 (t, 2H), 3,60-3,72 (m, 10Н), 3,54 (m, 2H), 3,37 (s, 3H), 3,03 (гепт., 1Н), 2,55 (t, 1H), 1,33 (d, 6H).
МС: 615 (M+1)+.
Пример 99
Синтез 4-(4-изопропилфенил)-1-[3-(2-метоксиэтокси)бензил]-6-проп-2-инилокси-1Н-хиназолин-2-она

В раствор 100 мг (0,236 ммоля) 1-(3-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в безводном ДМФ (5 мл) вводят NaH (11 мг, 0,471 ммоля) и раствор перемешивают до тех пор, пока не прекращается выделение газа. Добавляют 1-бром-2-метоксиэтана (34 мкл, 0,236 ммоля) и смесь выдерживают в течение 2 дней при 60°С. После охлаждения до комнатной температуры реакцию в реакционной смеси гасят водой и смесь подкисляют 10%-ной лимонной кислотой до рН 3. Смесь экстрагируют диэтиловым эфиром (2 порции по 20 мл). Объединенные органические слои промывают рассолом, сушат (Na2SO4), фильтруют и под вакуумом выпаривают с получением желтого твердого продукта, который очищают экспресс-хроматографией на силикагеле с использованием петролейного эфира/этилацетата (с 9:1 по 1:1) и выделением указанного в заглавии соединения в виде желтого масла. Выход 56 мг (49%-ный).
1H-ЯМР (300 МГц, CDCl3): 7,76 (d, 2Н), 7,49 (d, 1H), 7,38 (d, 2H), 7,32 (dd, 1H), 7,20-7,28 (m, 2H), 6,86-6,90 (m, 2H), 6,81 (dd, 1H), 5,52 (широкий s, 2H), 4,65 (d, 2H), 4,08 (t, 2H), 3,71 (m, 2H), 3,43 (s, 3Н), 3,02 (гепт., 1H), 2,55 (t, 1H), 1,33 (d, 6H).
МС: 483 (М+1)+.
Пример 100
Синтез 4-(4-изопропилфенил)-1-(3-{2-[2-(2-метоксиэтокси)этокси]этокси}бензил)-6-проп-2-инилокси-1Н-хиназолин-2-она

А. Получение мезилата.
В раствор триэтиленгликольмонометилового эфира (0,5 г, 2,35 ммоля) в безводном ТГФ при комнатной температуре вводят триэтиламин (392 мкл, 2,82 ммоля), после чего метансульфонилхлорид (201 мкл, 2,59 ммоля). Реакционную смесь перемешивают в течение 2,5 ч, по прошествии которых данные ТСХ указывают на полноту превращения. Образовавшийся раствор используют в этом виде на стадии Б.
Б. Алкилирование фенола мезилатом.
В раствор 100 мг (0,236 ммоля) 1-(3-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в ацетоне (5 мл) вводят карбонат калия (326 мг, 2,36 ммоля), после чего мезилат, полученный на стадии А (5 мл, 1,18 ммоля). Реакционную смесь кипятят с обратным холодильником в течение 2 дней. После охлаждения до комнатной температуры реакцию в реакционной смеси гасят водой и смесь экстрагируют EtOAc (2 порции по 20 мл). Объединенные органические слои промывают рассолом, сушат (Na2SO4), фильтруют и под вакуумом выпаривают с получением в виде желтого масла продукта, который очищают экспресс-хроматографией на силикагеле с использованием дихлорметана/трет-бутилметилового эфира (1:1) и выделением указанного в заглавии соединения в виде желтого масла. Выход 101 мг (75%-ный).
1Н-ЯМР (300 МГц, CDCl3): 7,76 (d, 2Н), 7,49 (d, 1H), 7,40 (d, 2H), 7,32 (dd, 1H), 7,20-7,28 (m, 2H), 6,86-6,90 (m, 2H), 6,80 (dd, 1H), 5,52 (широкий s, 2Н), 4,65 (d, 2H), 4,07 (t, 2H), 3,83 (t, 2H), 3,60-3,72 (m, 6Н), 3,55 (m, 2H), 3,37 (s, 3Н), 3,03 (гепт., 1H), 2,56 (t, 1H), 1,33 (d, 6H).
МС: 571 (М+1)+.
Аналогично вышеприведенному примеру получают соединения следующих примеров.
Пример 101
4-(4-Изопропилфенил)-1-{2-[2-(2-метоксиэтокси)этокси]бензил}-6-проп-2-инилокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7.75 (d, 2H), 7,50 (d, 2H), 7,41 (m, 3Н), 7,23 (t, 1H), 7,09 (d, 1H), 6,94 (d, 1H), 6,86 (t, 1H), 5,64 (широкий s, 2Н), 4,66 (s, 2H), 4,30 (t, 2H), 3,97 (t, 2H), 3,78 (t, 2H), 3,60 (t, 2H), 3,40 (s, 3Н), 3,04 (гепт., 1H), 2,56 (t, 1H), 1,34 (d, 6H).
МС: 527 (М+1)+.
Пример 102
Синтез 1-[3-(2-гидроксиэтокси)бензил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она

В раствор 76 мг (0,14 ммоля) 4-(4-изопропилфенил)-6-проп-2-инилокси-1-{3-[2-(тетрагидропиран-2-илокси)этокси]бензил}-1Н-хиназолин-2-она (пример RT-6) в МеОН (10 мл) вводят 10 мас.% продукта Dowex-50 и смесь интенсивно перемешивают в течение 3 дней. Реакционную смесь фильтруют и растворитель удаляют под вакуумом. Остаток растворяют в СН2 CH2 и экстрагируют водой, а затем рассолом, сушат (MgSO4), фильтруют и под вакуумом выпаривают с получением в виде желтого масла продукта, который очищают препаративной ТСХ на силикагеле с использованием дихлорметана/диэтилового эфира (1:1) и выделением указанного в заглавии соединения в виде желтого масла. Выход 11 мг (17%-ный).
1H-ЯМР (300 МГц, MeOD): 7,75 (d, 2Н), 7,45-7,51 (m, 5H), 7,25 (t, 1H), 6,85-6,89 (m, 3Н), 5,58 (широкий s, 2Н), 4,71 (d, 2Н), 4,62 (широкий s, 1H), 4,01 (t, 2Н), 3,83 (t, 2H), 3,04-3,08 (m, 2H), 1,35 (d, 6H).
МС: 469 (М+1)+.
Пример 103
Синтез 4-(4-изопропилфенил)-6-проп-2-инилокси-1-{3-[2-(тетрагидропиран-2-илокси)этокси]бензил}-1Н-хиназолин-2-она

В раствор 640 мг (1,51 ммоля) 1-(3-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в ацетоне (20 мл) вводят карбонат калия (2,08 г, 15,1 ммоля), после чего 2-(2-бромэтокси)тетрагидропиран (475 мкл, 3,02 ммоля). Реакционную смесь кипятят с обратным холодильником в течение 2 дней. После охлаждения до комнатной температуры реакцию в реакционной смеси гасят водой и смесь экстрагируют EtOAc (2 порции по 20 мл).
Объединенные органические слои промывают рассолом, сушат (Na2SO4), фильтруют и под вакуумом выпаривают с получением в виде желтого масла продукта, который очищают экспресс-хроматографией на силикагеле с использованием дихлорметана/трет-бутилметилового эфира (1:1) и выделением указанного в заглавии соединения в виде желтого масла. Выход 830 мг (71%-ный).
1H-ЯМР (300 МГц, CDCl3): 7,75 (d, 2Н), 7,49 (d, 1H), 7,40 (d, 2H), 7,32 (dd, 1H), 7,20-7,28 (m, 2H), 6,86-6,90 (m, 2H), 6,80 (dd, 1H), 5,52 (широкий s, 2Н), 4,68 (m, 1Н), 4,65 (d, 2H), 4,07 (m, 2H), 4,00-4,05 (m, 1H), 3,84-3,88 (m, 1Н), 3,74-3,81 (m, 1Н), 3,49-3,53 (m, 1Н), 3,02 (гепт., 1H), 2,56 (t, 1H), 1,49-1,72 (m, 6Н), 1,33 (d, 6H).
МС: 553 (М+1)+, также отмечают 469 (М-ТНР+1).
Пример 104
Синтез 4-(4-изопропилфенил)-1-(2-{2-[2-(2-метоксиэтокси)этокси]этокси}бензил)-6-проп-2-инилокси-1Н-хиназолин-2-она
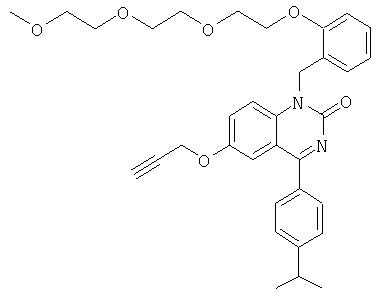
В раствор 125 мг (0,29 ммоля) 1-(2-гидроксибензил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в ацетоне (5 мл) вводят карбонат калия (407 мг, 2,94 ммоля), после чего 2-[2-(2-метоксиэтокси)этокси]этилметансульфонат (в том виде, как он получен на стадии А, пример RT-5) (357 мг, 1,47 ммоля). Реакционную смесь кипятят с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакцию в реакционной смеси гасят водой и смесь экстрагируют EtOAc (2 порции по 20 мл). Объединенные органические слои промывают рассолом, сушат (Na2SO4), фильтруют и под вакуумом выпаривают с получением в виде желтого масла продукта, который очищают препаративной ТСХ на силикагеле с использованием дихлорметана/диэтилового эфира (1:1) и выделением указанного в заглавии соединения в виде желтого масла. Выход 29 мг(17%-ный).
1H-ЯМР (300 МГц, CDCl3): 7,76 (d, 2Н), 7,49 (d, 1H), 7,38 (d, 2H), 7,32 (dd, 1H), 7,20-7,28 (m, 2H), 6,86-6,90 (m, 2H), 6,81 (dd, 1H), 5,60 (широкий s, 2H), 4,65 (d, 2H), 4,28 (dd, 2H), 3,97 (dd, 2H), 3,78 (m, 2H), 3,63-3,68 (m, 4H), 3,55 (m, 2H), 3,36 (s, 3H), 3,02 (гепт., 1H), 2,55 (t, 1H), 1,33 (d, 6H).
МС: 571 (M+1)+.
Пример 105
2-[4-(4-Изопропилфенил)-2-оксо-6-проп-2-инилокси-2Н-хиназолин-1-илметил]фениловый эфир метансульфоновой кислоты

Указанное в заглавии соединение выделяли в качестве побочного продукта в процессе получения в примере 104. Выход 55 мг (37%-ный).
1Н-ЯМР (300 МГц, CDCl3): 7,77 (d, 2H), 7,49 (d, 1H), 7,17-7,44 (m, 7H), 7,03 (d, 1H), 5,69 (широкий s, 2H), 4,66 (d, 2H), 3,36 (s, 3H), 3,03 (гепт., 1H), 2,56 (t, 1H), 1,33 (d, 6H).
МС: 503 (М+1)+.
Пример 106
2-[(3-Диметиламинопропил)метиламино]-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}ацетамид
А. Синтез (4-изопропилфенил)-[2-(3-нитробензиламино)-5-пропаргилоксифенил]метанона

Смесь 30 г (102 ммоля) (2-амино-5-пропаргилоксифенил)-(4-изопропилфенил)метанона, 23,8 г (110 ммолей) 3-нитробензилбромида и 21 мл (120 ммолей) основания Хюнига в 160 мл метиленхлорида перемешивают в течение ночи при 45°С. Полученный темный раствор дважды промывают 200 мл воды и рассолом. Очисткой сырого продукта хроматографией (СН2Cl2/петролейный эфир в соотношении 1:1) получают 34,4 г (79%-ный выход) продукта в виде вязкого красного масла.
1H-ЯМР (300 МГц, CDCl3): 8,60 (широкий t, 1Н), 8,20 (s, 1H), 8,11 (d, 1H), 7,66 (d, 1H), 7,58 (d, 2Н), 7,47 (t, 1H), 7,30 (d, 2H), 7,24 (d, 1H), 7,05 (dd, 1H), 6,55 (d, 1H), 4,57 (d, 2H), 4,51 (d, 2H), 2,99 (гепт., 1H), 2,47 (t, 1H), 1,29 (d, 6H). Демонстрационная версия
МС: 429 (M+1)+.
Б. Синтез 4-(4-изопропилфенил)-1-(3-нитробензил)-6-пропаргилокси-1Н-хиназолин-2-она

Красный раствор 34 г (79,4 ммоля) бензофенона, полученного на стадии А, в 200 мл уксусной кислоты обрабатывают 6,2 г (95 ммолей) цианата натрия при интенсивном перемешивании, которое продолжают в течение ночи. Смесь разбавляют водой и экстрагируют этилацетатом. Концентрированием после промывки раствором бикарбоната получают несколько порций продукта. В то время как начальные порции являются желтыми и чистыми, последующие обладают оранжевой окраской, и их необходимо очищать экспресс-хроматографией. Совокупный выход 25,9 г (72%-ный), tпл 167-168°С.
1H-ЯМР (300 МГц, CDCl3): 8,18 (s, 1H), 8,13 (d, 1H), 7,75 (d, 2H), 7,66 (d, 1H), 7,53 (d, 1H), 7,51 (t, 2H), 7,39 (d, 1H), 7,33 (dd, 1H), 7,16 (d, 1H), 5,62 (широкий s, 2H), 4,66 (d, 2H), 3,03 (гепт., 1H), 2,57 (t, 1H), 1,33 (d, 6H).
МС: 454 (M+1)+.
В. Синтез 1-(3-аминобензил)-4-(4-изопропилфенил)-6-пропаргилокси-1Н-хиназолин-2-она

Смесь 5,7 г (12,57 ммоля) ароматического нитросоединения, полученного на стадии Б, и 5,7 г (0,10 моля; 8 экв.) железного порошка в 85 мл уксусной кислоты выдерживают при 40°С и перемешивают в течение ночи. По истечении 16 ч добавляют еще 3,5 г железного порошка и перемешивание продолжают в течение 4 ч. Коричневую суспензию распределяют между этилацетатом и водой. Органический слой промывают раствором бикарбоната натрия и рассолом. В результате концентрирования под вакуумом в виде желтой пены остаются 5,88 г продукта. Экспресс-хроматографией (петролейный эфир/этилацетат) получают 2,80 г (53%-ный выход) желтого твердого вещества, tпл 186°С.
1H-ЯМР (300 МГц, CDCl3): 7,76 (d, 2H), 7,48 (s, 1H), 7,39 (d, 2H), 7,30 (s, 2H), 7,11 (t, 1H), 6,73 (d, 1H), 6,62 (s, 1H), 6,57 (d, 1H), 5,46 (широкий s, 2H), 4,64 (d, 2H), 3,65 (широкий s, NH2), 3,02 (гепт., 1H), 2,64 (t, 1H), 1,32 (d, 6H).
МС: 424 (M+1)+.
Г. Синтез 4-бром-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}бутирамида
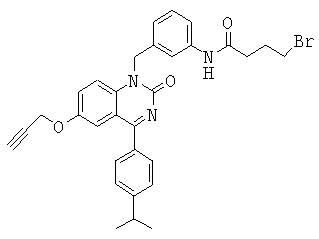
Раствор 5,0 г (11,8 ммоля) анилина (стадия В) вводят в 40 мл CH2Cl2 и охлаждают ледяной баней. При температуре примерно от 3 до 4°С добавляют 2,3 г (17,7 ммоля, 1,5 экв.) основания Хюнига с последующим добавлением по каплям 2,62 г 4-бромбутирилхлорида (в 10 мл СН2Cl2). Оранжевый раствор оставляют перемешиваться в течение ночи при КТ. Образовавшуюся желтую суспензию распределяют между метиленхлоридом и водой. Остаток, полученный после концентрации под вакуумом, хроматографируют (СН2Cl2/МеОН) с выделением 2,4 г (53%-ный выход) бежевого твердого вещества, tпл 121-122°C.
1Н-ЯМР (300 МГц, ДМСО): 9,92 (s, NH), 7,71 (d, 2H), 7,60 (d, 1H), 7,30-7,50 (m, 6H), 7,24 (t, 1H), 6,96 (d, 1H), 5,45 (широкий s. 2H), 4,79 (d, 2H), 3,66 (t, 2H), 3,02 (гепт., 1H), 2,41 (t, 2H), 1,98 (квинт., 2H), 1,28 (d, 6H).
МС: 492 (M+1-HBr)+.
Д. Синтез N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-4-[4-(2-метоксиэтил)пиперазин-1-ил]бутирамида

Раствор, включающий 260 мг (0,45 ммоля) бромида, полученного по вышеизложенному, 98 мг (0,68 ммоля, 1,5 экв.) N-метоксиэтилпиперазина и 130 мг (0,94 ммоля) карбоната калия в 1 мл 1,3-диметил-2-имидазолидинона (ДМЕИ) перемешивают в течение 90 мин при 60°С. Смесь выливают в воду и экстрагируют этилацетатом. Очисткой хроматографией выделяют 65 мг (24%-ный выход) темно-желтого твердого вещества, tпл 140-141°С.
1H-ЯМР (300 МГц, CDCl3): 8,63 (s, 1H), 7,74 (d, 2H), 7,51 (d, 1H), 7,45-7,49 (m, 2H), 7,36 (d, 2H), 7,24-7,32 (m, 3H), 7,04 (d, 1H), 5,51 (широкий s, 2H), 4,62 (d, 2H), 3,47 (t, 2H), 3,33 (s, 3H), 3,01 (гепт., 1H), 2,48-2,56 (m, 8H), 2,38-2,48 (m, 6H), 1,88 (квинт., 2H), 1,33 (d, 6H).
МС: 636 (M+1)+.
Пример 107
4-(4-Изопропилфенил)-1-[3-(2-оксопирролидин-1-ил)бензил]-6-пропаргилокси-1Н-хиназолин-2-он

Раствор 300 мг (0,52 ммоля) 4-бром-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}бутирамида в 0,5 мл ТГФ обрабатывают 25 мг гидрида натрия (примерно 55%-ная дисперсия в минеральном масле; 0,57 ммоля) при 0°С. Ледяную баню удаляют и смеси дают достичь КТ. В результате обработки после 30 мин водой/этилацетатом с последующей хроматографией получают 100 мг (39%-ный выход) продукта в виде желтого твердого вещества, tпл 68-69°С.
1Н-ЯМР (300 МГц, CDCl3): 7,74 (d, 2H), 7,68-7,71 (m, 1H), 7,47-7,54 (m, 2H), 7,31 (d, 2H), 7,26-7,33 (m, 3H), 7,07 (d, 1H), 5,54 (широкий s, 2H), 4,64 (d, 2H), 3,83 (t, 2H), 3,02 (гепт., 1H), 2,59 (t, 2H), 2,55 (t, 1H), 2,14 (квинт., 2Н), 1,32 (d, 6H).
МС: 492 (M+1)+.
Пример 108
2-[(3-Диметиламинопропил)метиламино]-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил} ацетамид

А. Синтез 2-хлор-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}ацетамида
Раствор 200 мг (0,47 ммоля) 1-(3-аминобензил)-4-(4-изопропилфенил)-6-пропаргилокси-1Н-хиназолин-2-она в 3 мл CH2Cl2 при 0°С обрабатывают 41 мкл (0,52 ммоля, 1,1 экв.) хлорацетилхлорида и 79 мкл (0,57 ммоля, 1,2 экв.) триэтиламина. Смеси дают возможность достичь КТ. Экстракционной обработкой водой/СН2Cl2 получают 225 мг (95%-ный выход) желтого твердого вещества, tпл 170-172°C.
1Н-ЯМР (300 МГц, CDCl3): 8,31 (s, 1H), 7,75 (d, 2H), 7,61 (d, 1H), 7,51 (d, 1H), 7,47 (s, 1H), 7,39 (d, 2H), 7,27-7,37 (m, 3Н), 7,13 (d, 1H), 5,54 (широкий s, 2H), 4,65 (d, 2H), 4,17 (s, 2H), 3,02 (гепт., 1H), 2,55 (t, 1H), 1,32 (d, 6H).
МС: 500 (М+1)+.
Б. Синтез 2-[(3-диметиламинопропил)метиламино]-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}ацетамида

Раствор 100 мг (0,20 ммоля) хлорида, полученного на стадии А, в 5 мл CH2Cl2 при КТ обрабатывают 35 мкл (0,24 ммоля, 1,2 экв.) N,N,N-триметил-1,3-пропандиамина и 36 мг (0,26 ммоля, 1,3 экв.) карбоната калия. Спустя 30 мин температуру повышают до 40°С и перемешивание продолжают в течение 20 ч. Водной обработкой с последующей хроматографией (СН2Cl2/МеОН/NH3 в соотношении 100:10:1) получают 28 мг (24%-ный выход) желтого твердого вещества, tпл 122-124°C.
1H-ЯМР (300 МГц, CDCl3): 9,31 (s, 1Н), 7,76 (d, 2Н), 7,57 (s, 2H), 7,50 (s, 1H), 7,39 (d, 2H), 7,27-7,35 (m, 3Н), 7,06 (d, 1H), 5,54 (широкий s, 2H), 4,65 (s, 2H), 3,13 (s, 2H), 3,02 (гепт., 1H), 2,49-2,58 (m, 3Н), 2,30-2,40 (m, 5H), 2,21 (s, 6Н), 1,57-1,77 (широкий квинт., 2H), 1,33 (d, 6H).
МС: 580 (М+1)+.
Аналогично только что описанному примеру получают соединения следующих примеров.
Пример 109
2-(4-Аллилпиперазин-1-ил)-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}ацетамид

tпл 203-205°С.
1Н-ЯМР (300 МГц, CDCl3): 9,07 (s, NH), 7,76 (d, 2H), 7,47-7,62 (m, 3Н), 7,39 (d, 2H), 7,28-7,35 (m, 3Н), 7,05 (d, 1H), 5,78-5,96 (m, 1H), 5,54 (широкий s, 2H), 5,12-5,26 (m, 2H), 4,65 (d, 2H), 3,13 (s, 2H), 2,96-3,09 (m, 3Н), 2,48-2,73 (m, 9H) 1,33 (d, 6H).
МС: 590 (М+1)+.
Пример 110
N-{3-[4-(4-Изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-2-(4-метилпиперазин-1-ил)ацетамид

tпл 159-161°С.
1H-ЯМР (300 МГц, CDCl3 ): 9,06 (s, NH), 7,75 (d, 2H), 7,59 (s, 1H), 7,52 (d, 1H), 7,49 (d, 1H), 7,38 (d, 2H), 7,27-7,33 (m, 3H), 7,05 (d, 1H), 5,54 (широкий s, 2H), 4,64 (d, 2H), 3,13 (s, 2H), 3,02 (гепт., 1H), 2,60-2,70 (широкий, 4Н), 2,54 (t, 1H), 2,45-2,57 (широкий, 4Н), 2,32 (s, 3H), 1,32 (d, 6H).
МС: 564 (M+1)+.
Пример 111
N-{3-[4-(4-Изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-2-[4-(2-метоксиэтил)пиперазин-1-ил]ацетамид

tпл 198-200°С. МС: 608 (M+1)+.
1Н-ЯМР (300 МГц, CDCl3): 9,08 (s. NH), 7,75 (d, 2H), 7,69 (s, 1H), 7,46-7,56 (m, 2H), 7,39 (d, 2H), 7,27-7,35 (m, 3H), 7,05 (d, 1H), 5,54 (широкий s, 2H), 4,64 (d, 2H), 3,51 (t, 2H), 3,36 (s, 3H), 3,12 (s, 2H), 3,02 (гепт., 1H), 2,60-2,72 (m, 11H), 1,32 (d, 6H).
Пример 112
N-{3-[4-(4-Изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-2-[4-(2-метоксиэтил)пиперазин-1-ил]-N-метилацетамид

Раствор 1,20 г (2 ммоля) N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-2-[4-(2-метоксиэтил)пиперазин-1-ил]ацетамида обрабатывают 4,1 мл 0,5 М раствора ДАЛ (в ТГФ) и 0,35 мл (2,0 ммоля) ТГМФ при -78°С. Охлаждающую баню удаляют и перемешивание продолжают в течение получаса, причем за это время раствор медленно становится красным. Реакционную смесь вновь охлаждают до -78°С и добавляют 284 мкл метилиодида (2 ммоля, разбавленного 5 мл ТГФ). После перемешивания в течение ночи при КТ оранжевый раствор концентрируют под вакуумом и желтый пенящийся остаток очищают хроматографией (СН2Cl2/МеОН в соотношении 9:1). Выход 480 мг (13%-ный выход) продукта в виде желтой пены.
1Н-ЯМР (300 МГц, CDCl3): 7,74 (d, 2Н), 7,51 (d, 1H), 7,37 (d, 2H), 7,27-7,37 (m, 3H), 7,20 (d, 1H), 7,04-7,11 (m, 2H), 5,54 (широкий s, 2H), 4,65 (d, 2H), 3,53 (t, 2H), 3,30 (s, 3H), 3,16 (широкий s, 3H), 3,03 (гепт., 1H), 2,79 (широкий s, 2H), 2,57-2,68 (m, 9H), 2,40-2,52 (широкий, 2H), 1,31 (d, 6H).
МС: 622 (М+1)+.
Пример 113
N-[4-(3-Диметиламинопропил)пиперазин-1-ил]-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}ацетамид

tпл 170-172°C.
1H-ЯМР (300 МГц, CDCl3): 9,08 (s, NH), 7,76 (d, 2H), 7,60 (s, 1H), 7,48-7,56 (m, 2H), 7,39 (d, 2H), 7,27-7,35 (m, 3Н), 7,04 (d, 1H), 5,54 (широкий s, 2H), 4,65 (d, 2H), 3,12 (s, 2H), 3,02 (гепт., 1H), 2,59-2,70 (широкий, 4Н), 2,48-2,58 (широкий, 4Н), 2,41 (t, 2H), 2,32 (t, 2H), 2,24 (s, 6H), 1,68 (квинт., 2H + H2O), 1,32 (d, 6H).
MC: 635 (М+1)+.
Пример 114
N-{3-[4-(4-Циклопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-2-(4-метилпиперазин-1-ил)ацетамид

1Н-ЯМР (300 МГц, CDCl3): 9,08 (s, NH), 7,72 (d, 2H), 7,58 (s, 1H), 7,53 (d, 1H), 7,47 (s, 1H), 7,26-7,33 (m, 3Н), 7,21 (d, 2H), 7, 01 (d, 1H), 5,53 (широкий s, 2H), 4,63 (d, 2H), 3,13 (s, 2H), 2,59-2,72 (широкий, 4Н), 2,55 (t, 1H), 2,46-2,58 (широкий, 4Н), 2,33 (s, 3Н), 2,02 (m, 1H), 1,06-1,13 (m, 2H), 0,80-0,86 (m, 2H).
MC: 562 (M+1)+.
Аналогично примеру 106 получают следующие соединения.
Пример 115
4-[4-(3-Диметиламинопропил)пиперазин-1-ил]-N-{3-[4-(4-изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}бутирамид

tпл 129-130°C.
1H-ЯМР (300 МГц, CDCl3): 8,66 (s, NH), 7,72 (d, 2H), 7,54 (d, 1H), 7,46 (s, 2H), 7,37 (d, 2H), 7,26-7,32 (m, 3Н), 7,01 (d, 1H), 5,53 (широкий s, 2H), 4,64 (d, 2H), 3,02 (гепт., 1H), 2,34-2,58 (m, 17H), 2,33 (s, 6H), 1,90 (квинт., 2Н), 1,74 (квинт., 2Н), 1,33 (d, 6H).
МС: 663 (М+1)+.
Пример 116
N-{3-[4-(4-Изоропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-4-[(2-метоксиэтил)метиламино]бутирамид

tпл 124-125°С.
1H-ЯМР (300 МГц, CDCl3): 9,70 (s, NH), 7,74 (d, 2H), 7,61 (d, 1H), 7,47 (d, 1H), 7,42 (s, 1H), 7,37 (d, 2H), 7,26-7,31 (m, 3Н), 7,01 (d, 1H), 5,52 (широкий s, 2H), 4,63 (d, 2H), 3,43 (t, 2H), 3,16 (s, 3Н), 3,02 (гепт., 1H), 2,42-2,76 (m, 7H), 2,23 (s, 3Н), 1,84 (квинт., 2H), 1,30 (d, 6H).
МС: 581 (M+1)+.
Пример 117
N-{3-[4-(4-Изопропилфенил)-2-оксо-6-пропаргилокси-2Н-хиназолин-1-илметил]фенил}-4-морфолин-4-илбутирамид

tпл 81-82°C.
1H-ЯМР (300 МГц, CDCl3): 8,33 (s, NH), 7,69 (d, 2H), 7,61 (d, 1H), 7,46 (d, 1H), 7, 25-7,41 (m, 5H), 7,04 (d, 1H), 5,50 (широкий s, 2H), 4,62 (d, 2H), 3,66 (t, 4Н), 3,02 (гепт., 1H), 2,54 (t, 1H), 2,36-2,46 (m, 8H), 1,87 (квинт., 2H), 1,32 (d, 6Н).
МС: 579 (М+1)+.
Пример 118
N-{3-[6-Аллилокси-4-(4-изопропилфенил)-2-оксо-2Н-хиназолин-1-илметил]фенил}-4-(4-метилпиперазин-1-ил)бутирамид

tпл 152-153°С.
1Н-ЯМР (300 МГц, CDCl3): 8, 52 (s, NH), 7,70 (d, 2H), 7,55 (d, 1H), 7,32-7,45 (m, 5H), 7,25-7,29 (m, 2H + CDCl3), 7,03 (d, 1H), 5,90-6,06 (m, 1H), 5,52 (широкий s, 2H), 5,26-5,38 (m, 2H), 4,48 (m, 2H), 3,02 (гепт., 1H), 2,35-2,57 (m, 12H), 2,24 (s, 3Н), 1,89 (квинт., 2H), 1,32 (d, 6H).
МС: 594 (M+1)+.
Соединения следующих примеров, содержащие азотный заместитель при R2 в пара- или орто-положении, получают аналогично приведенным выше примерам соединений, обладающим такими заместителями в мета-положении.
Пример 119
4-(4-Изопропилфенил)-1-(4-нитробензил)-6-пропаргилокси-1Н-хиназолин-2-он

tпл 172°С. МС: 454 (М+1).
1H-ЯМР (300 МГц, CDCl3): 8,19 (d, 2Н), 7,76 (d, 2H), 7,54 (d, 1H), 7,48 (d, 2H), 7,41 (d, 2H), 7,31 (dd, 1H), 7,12 (d, 1H), 5,64 (широкий s, 2H), 4,65 (d, 2H), 3,02 (гепт., 1H), 2,55 (t, 1H), 1,32 (d, 6H).
Пример 120
1-(4-Аминобензил)-4-(4-изопропилфенил)-6-пропаргилокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 8,19 (d, 2H), 7,76 (d, 2H), 7,54 (d, 1H), 7,48 (d, 2H), 7,41 (d, 2H), 7,31 (dd, 1H), 7,12 (d, 1H), 5,64 (широкий s, 2H), 4,65 (d, 2H), 3,02 (гепт., 1H), 2,55 (t, 1H), 1,32 (d, 6H).
МС: 424 (М+1)+.
Пример 121
1-(2-Нитробензил)-4-(4-изопропилфенил)-6-пропаргилокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 8,24 (d, Н), 7,78 (d, 2H), 7,56 (d, 1H), 7,48 (t, 2H), 7,41 (d, 2H), 7,29-7,35 (m, 1H), 7,03 (d, 2H), 5,94 (s, 2H), 4,68 (d, 2H), 3,03 (гепт., 1H), 2,57 (t, 1H), 1,35 (d, 6H).
МС: 454 (M+1)+.
Пример 122
1-(2-Аминобензил)-4-(4-изопропилфенил)-6-пропаргилокси-1Н-хиназолин-2-он

tПЛ 74-75°C.
1Н-ЯМР (300 МГц, CDCl3): 7,73 (d, 2H), 7,47 (d, 1H), 7,30-7,38 (m, 4H), 7,15 (d, 2H), 6,62 (d, 2H), 5,40 (s, 2H), 4,63 (d, 2H), 3,66 (широкий s, NH2), 3,01 (гепт., 1H), 2,55 (t, 1H), 1,33 (d, 6H).
МС: 424 (М+1)+.
Пример 123
Синтез 1-бензил-4-(3-хлор-4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она

А. Синтез (2-амино-5-проп-2-инилоксифенил)-(3-хлор-4-изопропилфенил)метанона

В раствор 825 г (2,43 моля) (4-изопропилфенил)-(2-нитро-5-проп-2-инилоксифенил)метанола в 8,25 л уксусной кислоты вводят 1,70 л водного раствора гипохлорита натрия (примерно 15%-ный), в качестве примеси содержащего растворенный хлор. Небольшими порциями добавляют 40 г RuCl3. По прошествии 5 ч перемешивания при КТ реакционную смесь экстрагируют водой и трет-бутилметиловым эфиром. Органический слой выпаривают, получая сырой промежуточный продукт.
Часть этого последнего (387,3 г) растворяют в 6,0 л уксусной кислоты с последующим добавлением 535 г железного порошка. После перемешивания в течение 14 ч при 40°С реакционную смесь экстрагируют водой и этилацетатом. Органический слой промывают водным раствором бикарбоната натрия и выпаривают. Хроматографией в колонке помимо (2-амино-5-проп-2-инилоксифенил)-(4-изопропилфенил)метанона получают также (2-амино-5-проп-2-инилоксифенил)-(3-хлор-4-изопропилфенил)метанон.
1H-ЯМР (400 МГц, CDCl3): 7,67 (d, 1H), 7,56 (dd, 1H), 7,38 (d, 1H), 7,10 (d, 1H), 7,06 (dd, 1H), 6,72 (d, 1H), 5,78 (широкий s, 2H), 4,55 (d, 2H), 3,47 (гепт., 1H), 2,54 (t, 1H), 1,30 (d,6H).
tпл 94°С (гексаны/диэтиловый эфир).
Б. Синтез (2-бензиламино-5-проп-2-инилоксифенил)-(3-хлор-4-изопропилфенил)метанона (соль соляной кислоты)

В раствор 100 мг (0,305 ммоля) амина, полученного по вышеизложенному, в 1 мл ДМЕИ добавляют 28,5 мкл (0,336 ммоля) ДИЭА и 40 мкл (0,336 мкмоля) бензилбромида. После выдержки в течение 6 ч при 60°С реакционную смесь экстрагируют разбавленной соляной кислотой и диэтиловым эфиром. Сырой продукт очищают препаративной ВЭЖХ с обращенной фазой. Обработкой раствора свободного амина в диэтиловом эфире газообразной HCl получают соль соляной кислоты.
1H-ЯМР (300 МГц, CDCl3): 8,12 (d, 1H), 7,43 (dd, 1H), 7,36 (d, 1H), 7,33 (d, 1H), 7,30-7,22 (m, 3Н), 7,17-7,14 (m, 3H), 7,09 (d, 1H), 4,69 (d, 2H), 4,53 (s, 2H), 3,46 (гепт., 1H), 2,61 (t, 1H), 1,30 (d, 6H).
МС: 420 (30), 418 (100) (M+1)+ (спектр изотопов хлора).
В. Синтез 1-бензил-4-(3-хлор-4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она

Указанное в заглавии соединение получают из (2-бензиламино-5-проп-2-инилоксифенил)-(3-хлор-4-изопропилфенил)метанона (соль соляной кислоты) циклизацией цианатом натрия аналогично методу, описанному в примере получения 62.
1H-ЯМР (300 МГц, CDCl3): 7,80 (d, 1Н), 7,70 (dd, 1H), 7,49 (s, 1H), 7,48 (d, 1H), 7,37-7,27 (m, 7H), 5,59 (s, 2H), 4,67 (d, 2H), 3,51 (гепт., 1H), 2,64 (t, 1H), 1,33 (d, 6H).
МС: 445 (30), 443 (100) (М+1)+ (спектр изотопов хлора).
Пример 124
Синтез 1-(3-фторбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-тиона

В раствор 18 мг (47,7 мкмоля) [2-(3-фторбензиламино)-5-метоксифенил]-(4-изопропилфенил)метанона в 0,5 мл ТГФ добавляют 6,9 мг (71,5 мкмоля) тиоцианата калия и 0,5 мл уксусной кислоты. После перемешивания в течение ночи при 60°C дополнительно добавляют 20,9 мг (215 мкмолей) цианата калия и при 80°C перемешивание продолжают в течение еще 24 ч. Экстракцией водным гидроксидом натрия и дихлорметаном с последующей препаративной ВЭЖХ получают 1-(3-фторбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-тион.
1Н-ЯМР (300 МГц, CDCl3): 7,78 (d, 2H), 7,40-7,24 (m, 6H), 7,07 (d, 1H), 6,99-6,94 (m, 2H), 6,20 (широкий, 2H), 3,78 (s, 3Н), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 419 (M+1)+.
Пример 125
4-(4-Изопропилфенил)-6-метокси-1-(4-метоксифенил)-1.Н.-хиназолин-2-он

А. Синтез бис(4-метоксифенил)амина

С использованием 0,72 г (30 ммолей) магниевого порошка в ТГФ (30 мл) готовят 5,61 г (30 ммолей) 4-броманизольного реактива Гриньяра. К реактиву Гриньяра по каплям добавляют раствор амилнитрита (1,33 мл, 10 ммолей) в ТГФ (30 мл), одновременно поддерживая температуру на уровне примерно комнатной температуры охлаждением в бане с холодной водой. По истечении 2 ч перемешивания при комнатной температуре осторожно добавляют 0, 873 мл (10 ммолей) трихлорида фосфора, растворенного в 10 мл ТГФ. По прошествии еще 2 ч добавляют 100 мл водного гидроксида натрия (1 М) и органический растворитель выпаривают. Экстракцией дихлорметаном с последующей экспресс-хроматографией получают бис(4-метоксифенил)амин.
1H-ЯМР (300 МГц, CDCl3): 6,83 (широкий, 8Н), 3,78 (широкий, 6Н).
Б. Синтез 1,1-бис(4-метоксифенил)мочевины

Раствор 423 мг (1,85 ммоля) бис(4-метоксифенил)амина в 8 мл уксусной кислоты обрабатывают 120 мг (1,85 ммоля) цианата натрия. По прошествии 4,5 ч реакционную смесь выливают в раствор 8 г гидроксида натрия в 100 мл воды. Образовавшийся осадок отфильтровывают и сушат.
1Н-ЯМР (400 МГц, CDCl3): 7,26-7,22 (m, 4H), 6,89-6,85 (m, 4H) [спектр не первого порядка], 4,66 (широкий, 2Н), 3, 79 (s, 3Н).
МС: 273 (М+1)+.
В. Синтез 4-(4-изопропилфенил)-6-метокси-1-(4-метоксифенил)-1.Н.-хиназолин-2-она

Раствор 144 мг (0,53 ммоля) 1,1-бис(4-метоксифенил)мочевины, 160 мкл (1,06 ммоля) куминового альдегида и 16 мкл (0,27 ммоля) метансульфоновой кислоты в 1 мл диглима выдерживают при 100°C в течение 4 дней. Реакционную смесь экстрагируют водой/дихлорметаном и препаративной ВЭЖХ выделяют промежуточный дигидрохиназолинон. Окислением периодатом натрия с трихлоридом рутения, как это изложено выше, получают 4-(4-изопропилфенил)-6-метокси-1-(4-метоксифенил)-1.Н.-хиназолин-2-он.
1Н-ЯМР (300 МГц, CDCl3): 7,76 (d, 2Н), 7,42 (d, 2H), 7,38 (d, 1H), 7,29 (d, 2H), 7,23 (dd, 1H), 7,11 (d, 2H), 6,81 (d, 1H), 3,89 (s, 3Н), 3,79 (s, 3H), 3,03 (гепт., 1H), 1,33 (d, 6H).
МС: 401 (М+1)+.
Синтез 2-хлор-4-(4-изопропилфенил)-6,7-диметоксихиназолина и родственных соединений.

Пример 126
2-Хлор-4-(4-изопропилфенил)-6,7-диметоксихиназолин

В раствор 1,4 г (5,5 ммоля) 2,4-дихлор-6,7-диметоксихиназолина в 25 мл ДМФ вводят 334 мг (1,1 ммоля) три-O-толилфосфина, 1,0 г (6,1 ммоля) 4-изопропилбензолборной кислоты, 142 мг (0,63 ммоля) ацетата палладия(II) и 5,5 мл водного 2 н. раствора К3СО3. После выдержки в течение трех часов при 110°С смесь охлаждают до КТ и фильтруют (броунмиллерит). Раствор экстрагируют диэтиловым эфиром/рассолом, органический слой сушат и выпаривают. Кристаллизацией из диэтилового эфира в виде желтого твердого вещества получают целевой продукт.
1Н-ЯМР (300 МГц, CDCl3): 7,73 (d, 2Н), 7,43 (d, 2H), 7,37 (s, 1H), 7,30 (s, 1H), 4, 08 (s, 3H), 3,93 (s, 3H), 3,02 (гепт., 1H), 1,32 (d, 6H).
МС: 343 (М+1)+.
Пример 127
2-Изопропокси-4-(4-изопропилфенил)-6, 7-диметоксихиназолин

11 мг (0,44 ммоля) NaH растворяют в 2 мл изопропанола и перемешивают в течение 2 ч при КТ. По прошествии этого времени добавляют 30 мг (0,088 ммоля) 2-хлор-4-(4-изопропилфенил)-6,7-диметоксихиназолина и раствор перемешивают в течение ночи при 55°С. Реакционную смесь разбавляют этилацетатом и экстрагируют рассолом. Органический слой сушат и выпаривают. После хроматографии (гексан/этилацетат) продукт получают виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 7,73 (d, 2H), 7,40 (d, 2H), 7,34 (s, 1H), 7,20 (s, 1H), 5,49 (гепт., 1H), 4,06 (s, 3H), 3,89 (s, 3H), 3,02 (гепт., 1H), 1,46 (d, 6H), 1,32 (d, 6H).
МС: 367 (М+1)+.
Пример 128
Синтез 4-(4-изопропилфенил)-6,7-диметокси-2-феноксихиназолина
216 мг (2,30 ммоля) фенола и 11 мг (0,44 ммоля) растворяют в 2 мл трет-бутанола и полученный раствор перемешивают в течение 3 ч при КТ. По прошествии этого времени добавляют 80 мг (0,23 ммоля) 2-хлор-4-(4-изопропилфенил)-6,7-диметоксихиназолина и при 85°С раствор перемешивают в течение ночи. Реакционную смесь разбавляют диэтиловым эфиром и экстрагируют рассолом. Органический слой сушат и выпаривают. После хроматографии (гексан/этилацетат) продукт получают в виде желтого твердого вещества.
1H-ЯМР (300 МГц, CDCl3): 7,75 (d, 2Н), 7,46-7,19 (m, 9H), 4,01 (s, 3H), 3,91 (s, 3H), 3,02 (гепт., 1Н), 1,32 (d, 6H).
МС: 401 (M+1)+.
Пример 129
Синтез 2-фтор-4-(4-изопропилфенил)-6,7-диметоксихиназолина
Раствор 80 мг (0,23 ммоля) 2-хлор-4-(4-изопропилфенил)-6,7-диметоксихиназолина и 100 мг (1,70 ммоля) KF в 1 мл диметилацетамида при 90°С перемешивают в течение 5 дней. После экстракции (этилацетатом/рассолом) органический слой сушат и выпаривают. Экспресс-хроматографией (гексан/этилацетат) получают 25 мг (33%-ный выход) продукта в виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 7,75 (d, 2Н), 7,46-7,41 (m, 3H), 7,30 (s, 1H), 4,07 (s, 3H), 3,93 (s, 3H), 3,03 (гепт., 1H), 1,33 (d, 6H).
МС: 327 (М+1)+.
Пример 130
Синтез 4-(4-изопропилфенил)-6,7-диметоксихиназолин-2-карбонитрила
В раствор 30 мг (0,49 ммоля) KCN и 5,7 мг (0,05 ммоля) ДАБЦО в 2 мл ДМСО вводят 1 мл воды. Добавляют 70 мг (0,20 ммоля) 2-хлор-4-(4-изопропилфенил)-6, 7-диметоксихиназолина и образовавшуюся смесь при 80°С перемешивают в течение 4 дней. После экстракции (этилацетатом/рассолом) органический слой сушат и выпаривают. Экспресс-хроматографией (гексан/этилацетат) получают 18 мг (27%-ный выход) продукта в виде желтого масла.
1Н-ЯМР (300 МГц, CDCl3): 7,74 (d, 2Н), 7,48-7,42 (m, 4H), 4,10 (s, 3H), 3,97 (s, 3H), 3,04 (гепт., 1Н), 1,34 (d, 6H).
MC: 334 (M+1)+.
Аналогично только что описанным примерам получают соединения следующих примеров.
Пример 131
4-(4-Изопропилфенил)-6,7-диметокси-2-(6-метилпиридин-3-илокси)хиназолин

1Н-ЯМР (300 МГц, CDCl3): 8,60 (d, 1H), 7,74 (d, 2H), 7,61 (dd, 1H), 7,43-7,39 (m, 3H), 7,26 (d, 1H), 7,14 (s, 1H), 4,02 (s, 3H), 3,91 (s, 3H), 3,02 (гепт., 1H), 2,63 (s, 3H), 1,33 (d, 6H).
МС: 416 (М+1)+.
Пример 132
4-(4-Изопропилфенил)-6,7-диметокси-2-(пиридин-3-илокси)хиназолин

1Н-ЯМР (300 МГц, CDCl3): 8,84 (широкий, 1Н), 8,54 (d, 1H), 7, 92 (широкий, 1H), 7,74 (d, 2Н), 7,60 (широкий, 1H), 7,44-7,40 (m, 3H), 7,17 (s, 1H), 4,05 (s, 3Н), 3,92 (s, 3Н), 3,03 (гепт., 1H), 1,33 (d, 6H).
МС: 402 (М+1)+.
Пример 133
2-Изобутокси-4-(4-изопропилфенил)-6,7-диметоксихиназолин
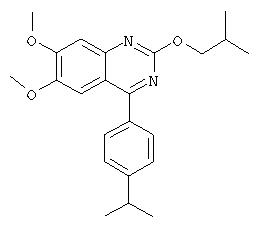
1Н-ЯМР (300 МГц, CDCl3): 7,72 (d, 2H), 7,42 (d, 2H), 7,34 (s, 1H), 7,26 (s, 1H), 4,29 (d, 2H), 4,08 (s, 3Н), 3,90 (s, 3Н), 3,03 (гепт., 1H), 2,20 (гепт., 1H), 1,34 (d, 6H), 1,09 (d, 6H).
МС: 381 (M+1)+.
Пример 134
4-(4-Изопропилфенил)-2,6,7-триметоксихиназолин

1H-ЯМР (300 МГц, CDCl3): 7,76 (d, 2H), 7,41 (d, 2H), 7,37 (s, 1H), 7,22 (s, 1H), 4,18 (s, 3H), 4,07 (s, 3H), 3,88 (s, 3H), 3,01 (гепт., 1H), 1,34 (d, 6H).
МС: 339 (M+1)+.
Пример 135
4-(4-Изопропилфенил)-2-изопропилсульфанил-6,7-диметоксихиназолин

1 H-ЯМР (300 МГц, CDCl3): 7,80 (d, 2H), 7,52-7,40 (m, 4H), 4,38 (гепт., 1H), 4,18 (s, 3H), 3,94 (s, 3H), 3,07 (гепт., 1H), 1,53 (d, 6H), 1,36 (d, 6H).
МС: 383 (М+1)+.
Пример 136
2-Азидо-4-(4-изопропилфенил)-6,7-диметоксихиназолин

1H-ЯМР (300 МГц, CDCl3): 8,13 (s, 1H), 7,78 (d, 2H), 7,62 (s, 1H), 7,44 (d, 2H), 4,22 (s, 3H), 3,96 (s, 3H), 3,03 (гепт., 1H), 1, 36 (d, 6H).
МС: 350 (М+1)+.
Пример 137
4-(4-трет-Бутилфенил)-2-хлор-6,7-диметоксихиназолин

1Н-ЯМР (300 МГц, ДМСО-d6): 7,78 (d, 2H), 7,63 (d, 2H), 7,42 (s, 1H), 7,33 (s, 1H), 3,98 (s, 3H), 3,83 (s, 3H), 1,37 (s, 9H).
MC: 357 (M+1)+.
Пример 138
4-(4-трет-Бутилфенил)-2,6,7-триметоксихиназолин

1Н-ЯМР (300 МГц, CDCl3): 7,77 (d, 2H), 7,57 (d, 2H), 7,37 (s, 1H), 7,26 (s, 1H), 4,18 (s, 3H), 4,07 (s, 3H), 3,83 (s, 3H), 1,38 (s, 9H).
MC: 353 (M+1)+.
Пример 139
2-Хлор-4-(4-изопропилфенил)-6-метоксихиназолин

1Н-ЯМР (300 МГц, CDCl3): 7,96 (d, 1H), 7,75 (d, 2H), 7,56 (dd, 1H), 7,45-7,39 (m, 3H), 3,83 (s, 3H), 3,03 (гепт., 1H), 1,35 (d, 6H).
MC: 313 (M+1)+.
Пример 140
4-(4-Изопропилфенил)-6-метокси-2-(пиридин-3-илметокси)хиназолин

1 H-ЯМР (300 МГц, CDCl3): 8,92 (широкий, 1H), 8,64 (d, 1H), 8,36 (d, 1H), 7,82-7,39 (m, 8H), 5,70 (s, 2H), 3,83 (s, 3H), 3,02 (гепт., 1H), 1,33 (d, 6H).
МС: 386 (М+1)+.
Пример 141
4-(4-Изопропилфенил)-6-метоксихиназолин-2-карбонитрил
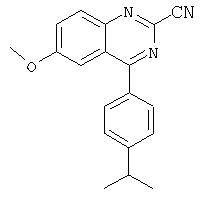
1Н-ЯМР (300 МГц, CDCl3): 8,08 (d, 1H), 7,76 (d, 2H), 7,65 (dd, 1H), 7,52-7,43 (m, 3H), 3,91 (s, 3H), 3,04 (гепт., 1H), 1,34 (d, 6H).
МС: 304 (M+1)+.
Пример 142
4-(4-Изопропилфенил)-6,7-диметокси-2-трифторметилхиназолин

Смесь 100 мг (0,29 ммоля) 2-хлор-4-(4-изопропилфенил)-6,7-диметоксихиназолина, 45 мг (1,16 ммоля) медного порошка и 107 мкл (1,16 ммоля) CF2Br2 в 2 мл диметилацетамида при 150°С перемешивают в течение 2 дней. После экстракции водой и этилацетатом экспресс-хроматографией выделяют указанное в заглавии соединение.
1H-ЯМР (300 МГц, CDCl3): 7,77 (d, 2Н), 7,53 (s, 1H), 7,49 (s, 1H), 7,45 (d, 2H), 4,10 (s, 3H), 3,97 (s, 3H), 3,03 (гепт., 1H), 1, 33 (d, 6H).
МС: 377 (М+1)+.
Пример 143
Синтез 4-(4-изопропилфенил)-6,7-диметокси-2-метилхиназолина

К 166 мг (1,16 ммоля) CuBr в 4 мл ТГФ при -78°С по каплям добавляют 773 мкл (2,32 ммоля) 3 М раствора метилмагнийиодида. После перемешивания в течение 20 мин при той же температуре добавляют 50 мг (0,145 ммоля) 2-хлор-4-(4-изопропилфенил)-6,7-диметоксихиназолина. После перемешивания в течение 1 ч реакционной смеси дают возможность достичь КТ и перемешивание продолжают в течение ночи. После разбавления 50 мл этилацетата и фильтрования реакционную смесь экстрагируют рассолом. Выпариванием органической фазы получают указанное в заглавии соединение.
1Н-ЯМР (300 МГц, CDCl3): 7,70 (d, 2H), 7,44-7,33 (m, 4H), 4,07 (s, 3H), 3,91 (s, 3H), 3, 02 (гепт., 1H), 2,89 (s, 3H), 1,32 (d, 6H).
МС: 323 (М+1)+.
Пример 144
Синтез 1-циклогексилметил-4-(4-изопропилфенил)-6, 7-диметокси-1Н-хиназолин-2-она

А. Синтез [2-(Циклогексилметиламино)-4, 5-диметоксифенил]-(4-изопропилфенил)метанона

В смесь 100 мг (0,334 ммоля) (2-амино-4,5-диметоксифенил)-(4-изопропилфенил)метанона, 37 мкл (0,306 ммоля) циклогексилальдегида, 765 мг молекулярных сит (3Å) и 22 мкл уксусной кислоты в 2 мл метанола после1 /2 ч перемешивания добавляют 21 мг (0,327 ммоля) NaCHBH3. По истечении 20 ч перемешивания при КТ добавляют дополнительно 37 мкл (0,306 ммоля) циклогексилальдегида и 21 мг (0,327 ммоля) NaCHBH3 и перемешивание продолжают в течение еще 48 ч. После фильтрования через броунмиллерит реакционную смесь экстрагируют водным раствором бикарбоната и этилацетатом. Продукт очищают препаративной ВЭЖХ с обращенной фазой.
1H-ЯМР (300 МГц, CDCl3): 7,54 (d, 2H), 7,29 (d, 2H), 7,06 (s, 1H), 6,27 (широкий s, 1H), 3,96 (s, 3Н), 3,68 (s, 3Н), 3,08 (d, 2H), 2,97 (гепт., 1H), 1,94-1,89 (m, 2H), 1,88-1,49 (m, 5H), 1,32-1,01 (m, 4H), 1,29 (d, 6H).
МС: 396 (M+1)+.
Б. Синтез 1-циклогексилметил-4-(4-изопропилфенил)-6,7-диметокси-1Н-хиназолин-2-она

В раствор 50 мг (0,126 ммоля) (2-амино-4,5-диметоксифенил)-(4-изопропилфенил)метанона в 1 мл уксусной кислоты вводят 8 мг (0,126 ммоля) цианата натрия. После перемешивания в течение 24 ч при КТ растворитель выпаривают и остаток экстрагируют дихлорметаном/0,1 М NaOH. Перекристаллизацией из диэтилового эфира/гексанов получают указанное в заглавии соединение.
1Н-ЯМР (300 МГц, CDCl3): 7,69 (d, 2Н), 7,38 (d, 2H), 7,27 (s, 1H), 6,77 (s, 1H), 4,19 (m, 2H), 4,05 (s, 3H), 3,83 (s, 3H), 3,00 (гепт., 1H), 2,04-1,62 (m, 7H), 1,31 (d, 6H), 1,32-1,16 (m, 4H).
МС: 421 (M+1)+.
Аналогично только что описанному примеру получают метаноновое соединение следующего примера.
Пример 145
{2-[2-(3,5-Диметоксифенил)-2-метилпропиламино]-4,5-диметоксифенил}-(4-изопропилфенил)метанон
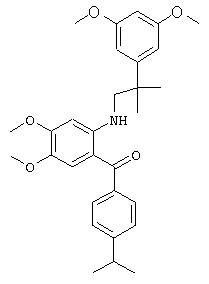
1H-ЯМР (300 МГц, CDCl3): 7,50 (d, 2H), 7,28 (d, 2H), 7,01 (s, 1H), 6,61 (d, 2H), 6,31 (t, 1H), 6,16 (s, 1H), 3,88 (s, 3H), 3,77 (s, 6H), 3,65 (s, 3H), 3,35 (s, 2H), 2,97 (гепт., 1H), 1,49 (s, 6H), 1,29 (d, 6H).
МС: 492 (M+1)+.
Синтез 2-хлор-4-(4-изопропилфенил)-6-метоксихиназолина и родственных соединений

Пример 146
Синтез 2-хлор-4-(4-изопропилфенил)-6-метоксихиназолина
А. Синтез 6-метокси-1.Н.-хиназолин-2,4-диона

В раствор 15 г (90 ммолей) 2-амино-5-метоксибензойной кислоты в 100 мл диоксана вводят 6,6 мл (117 ммолей) уксусной кислоты. Реакционную смесь охлаждают (15°С) и по каплям в течение двух часов добавляют раствор 9, 4 г (117 ммолей) цианата калия в 22 мл воды. По прошествии этого времени добавляют 57,4 г (1,43 моля) NaOH и реакционную смесь кипятят с обратным холодильником в течение 90 мин. После охлаждения реакционную смесь медленно подкисляют 260 мл 12 н. HCl (рН 3). Полученный осадок отфильтровывают и промывают водой, ацетоном и, наконец, диэтиловым эфиром с получением слегка коричневых кристаллов.
1Н-ЯМР (300 МГц, ДМСО-d6): 11,25 (s, 1Н), 11,00 (s, 1H), 7,31-7,08 (m, 3Н), 3,77 (s, 3Н).
МС: 193 (M+1)+.
Б. Синтез 2, 4-дихлор-6-метоксихиназолина

12,4 мл (136,3 ммоля) POCl3 и 32,7 мл (204,5 ммоля) N,N-диэтиланилина вводят в суспензию 13,1 г (68,2 ммоля) 6-метокси-1.Н.-хиназолин-2,4-диона и полученную смесь кипятят с обратным холодильником в течение 4 ч. После охлаждения реакционную смесь выливают в 600 мл воды. После экстракции 400 мл этилацетата органический слой сушат и выпаривают до объема 30 мл с получением оранжевого осадка. Осадок отфильтровывают, промывают толуолом и гексаном и сушат.
1H-ЯМР (300 МГц, ДМСО-d6): 7,97 (d, 1Н), 7,80 (dd, 1H), 7,47 (d, 1H), 3,98 (s, 3H).
MC: 229 (M+1)+.
В. Синтез 2-хлор-4-(4-изопропилфенил)-6-метоксихиназолина

В раствор 6,2 г (27 ммолей) 2,4-дихлор-6-метоксихиназолина в 100 мл ДМФ вводят 1,9 г (6,2 ммоля) три-O-толилфосфина, 4,2 г (26 ммолей) 4-изопропилбензолборной кислоты, 620 мг (2,7 ммоля) ацетата палладия(II) и 24 мл водного 2 н. раствора К2СО3. После выдержки в течение трех часов при 110°С смесь охлаждают до КТ и фильтруют (через броунмиллерит). Раствор экстрагируют диэтиловым эфиром/рассолом, органический слой сушат и выпаривают. Хроматографией (гексаны/этилацетат) в виде желтого масла получают целевой продукт.
1Н-ЯМР (300 МГц, CDCl3: 7,92 (d, 1H), 7,75 (d, 2H), 7,37 (dd, 1H), 7,25-7,21 (m, 3H), 3,93 (s, 3H), 3,02 (гепт., 1H), 1,32 (d, 6H).
МС: 313 (M+1)+.
Пример 147
Синтез 4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она

В суспензию 2,7 г (8,7 ммоля) хлор-4-(4-изопропилфенил)-6-метоксихиназолина в 20 мл диоксана вводят 20 мл 4 н. HCl. Реакционную смесь перемешивают при 90°С в течение ночи. Диоксан выпаривают и конц. NaOH pH остаточной водной фазы доводят до 12. Полученный осадок экстрагируют этилацетатом, органический слой сушат и выпаривают с получением целевого продукта в виде желтого твердого вещества.
1H-ЯМР (300 МГц, ДМСО-d6): 7,63 (d, 2H), 7,42 (d, 2H), 7,26 (m, 2H), 7,03 (d, 1H), 3,67 (s, 3Н), 3,29 (гепт., 1H), 1,26 (d, 6H).
МС: 295 (M+1)+.
Пример 148
Синтез 1-(4-хлорбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она

В раствор 100 мг (0,34 ммоля) 4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-она в 3 мл ТГФ/ДМФ (7:1) вводят ГМДС-Li (510 мкл 1 М раствора в ТГФ), 109 мг (0,68 ммоля) 4-хлорбензилхлорида и 76 мг (0,51 ммоля) иодида натрия. Реакционную смесь выдерживают при 50°С в течение ночи. После экстракции этилацетатом/рассолом органический слой сушат и выпаривают. После хроматографии (гексан/этилацетат) продукт получают виде желтого масла.
1Н-ЯМР (300 МГц, ДМСО-d6 ): 7,70 (d, 2Н), 7,48-7,29 (m, 8H), 7,20 (s, 1H), 5,58 (s, 2Н), 3,71 (s, 3Н), 3,02 (гепт., 1H), 1,27 (d, 6H).
MC: 419 (M+1)+.
Аналогично только что приведенным примерам получают соединения следующих примеров.
Пример 149
1-(4-Бромбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, CDCl3): 7,72 (d, 2Н), 7,46-7,36 (m,5H), 7,27-7,16 (m, 4Н), 5,49 (s, 2H), 3,70 (s, 3Н), 3,00 (гепт., 1H), 1,32 (d, 6H).
MC: 465 (M+1)+.
Пример 150
1-(4-Фторбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,72 (d, 2H), 7,40-7,20 (m, 7H), 7,04-6,98 (m, 2H), 5,51 (s, 2H), 3,76 (s, 3Н), 3,01 (гепт., 1H), 1,32 (d, 6H).
MC: 403 (M+1)+.
Пример 151
4-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]фениловый эфир уксусной кислоты

1Н-ЯМР (300 МГц, CDCl3): δ 7,77 (d, 2Н), 7,42-7,21 (m, 7H), 7,04 (d, 2H), 5,57 (s, 2H), 3,78 (s, 3Н), 3, 02 (гепт., 1Н), 2,25 (s, 3Н), 1,35 (d, 6H).
МС: 443 (M+1)+.
Пример 152
4-(4-Изопропилфенил)-6-метокси-1-(4-метоксибензил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, ДМСО-d6): 7,68 (d, 2H), 7,50-7,41 (m, 4H), 7,25-7,17 (m, 3Н), 6,87 (d, 2H), 5,41 (s, 2H), 3,69 (s, 3Н), 3,68 (s, 3Н), 3,00 (гепт., 1Н), 1,26 (d, 6H).
MC: 415 (M+1)+.
Пример 153
1-(4-Гидроксибензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он
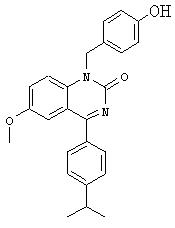
1Н-ЯМР (300 МГц, CDCl3): 7,67 (d, 2Н), 7,42-7,25 (m, 5H), 7,13 (d, 2H), 6,77 (d, 2H), 5,42 (s, 2H), 3,78 (s, 3Н), 2,99 (гепт., 1H), 1,26 (d, 6H).
МС: 401 (М+1)+.
Пример 154
4-(4-Изопропилфенил)-6-метокси-1-(4-трифторметилбензил)-1.Н.-хиназолин-2-он
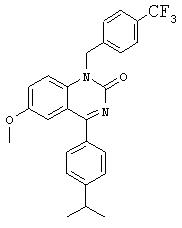
1Н-ЯМР (300 МГц, CDCl3): 7,74 (d, 2H), 7,59 (d, 2H), 7,42-7,20 (m, 6H), 7,15 (d, 1H), 5,60 (s, 2H), 3,77 (s, 3Н), 3,02 (гепт., 1H), 1,32 (d, 6H).
МС: 453 (М+1)+.
Пример 155
4-(4-Изопропилфенил)-6-метокси-1-(4-нитробензил)-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, ДМСО-d6): 8,18 (d, 2Н), 7,71 (d, 2H), 7,55-7,22 (m, 7H), 5,63 (s, 2H), 3,72 (s, 3Н), 3,01 (гепт., 1H), 1,27 (d, 6H).
МС: 430 (М+1)+.
Пример 156
4-(4-Изопропилфенил)-6-метокси-1-(4-метилсульфанилбензил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, ДМСО-d6): 7,69 (d, 2H), 7,49-7,44 (m, 4Н), 7,22-7,17 (m, 5Н), 5,44 (s, 2H), 3,70 (s, 3Н), 3,01 (гепт., 1H), 2,41 (s, 3Н), 1,27 (d, 6H).
МС: 431 (М+1)+.
Пример 157
1-(4-Аминобензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,71 (d, 2H), 7,53 (d, 1H), 7,39-7,06 (m, 6H), 6,72-6,64 (m, 2H), 5,48 (s, 2H), 3,75 (s, 3H), 3,00 (гепт., 1H), 1,31 (d, 6H).
МС: 400 (М+1)+.
Пример 158
Метиловый эфир 4-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензойной кислоты

1Н-ЯМР (300 МГц, ДМСО-d6): 7,90 (d, 2H), 7,71 (d, 2H), 7,49-7,36 (m, 6H), 7, 20 (d, 1H), 5.56 (s, 2H), 3,81 (s, 3H), 3,70 (s, 3H), 3,01 (гепт., 1H), 1,27 (d, 6H).
МС: 443 (М+1)+.
Пример 159
4-(4-Изопропилфенил)-1-(4-метансульфонилбензил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, ДМСО-d6): 7,87 (d, 2H), 7,71 (d, 2H), 7,54-7,42 (m, 6H), 10 7,21 (d, 1H), 5,60 (s, 2H), 3,71 (s, 3H), 3,01 (гепт., 1H), 1,27 (d, 6H).
МС: 463 (M+1)+.
Пример 160
1-[4-(2-Хлорэтокси)бензил]-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, CDCl3): 7,71 (d, 2Н), 7,41-7,20 (m, 7H), 6,83 (d, 2H), 5,48 (s, 2H), 4,18 (t, 3Н), 3, 81-3,73 (m, 5H), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 463 (М+1)+.
Пример 161
N-(2-Диметиламиноэтил)-4-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензамид

1Н-ЯМР (300 МГц, CDCl3): 7,79-7,71 (m, 4H), 7,42-7,13 (m, 7H), 6,85 (широкий, 1H), 5,59 (s, 2H), 3,76 (s, 3Н), 3,52 (q, 2H), 3,02 (гепт., 1H), 2,51 (t, 2H), 2,26 (s, 6H), 1,32 (d, 6H).
МС: 499 (M+1)+.
Пример 162
4-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]-N-(2-пирролидин-1-илэтил)бензамид

1Н-ЯМР (300 МГц, CDCl3): 7,79 (d, 2Н), 7,71 (d, 2H), 7,42-7,13 (m, 7H), 5,57 (s, 2H), 3,75 (s, ЗН), 3,57 (q, 2H), 3,01 (гепт., 1H), 2,78 (t, 2H), 2,66 (s, 4H), 1,82 (s, 4Н), 1,32 (d. 6H).
МС: 525 (M+1)+.
Пример 163
N-(2-Этиламиноэтил)-4-[4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил]бензамид

1H-ЯМР (300 МГц, MeOD): 7,81 (d, 2H), 7,72 (d, 2H), 7,52-7,32 (m, 7H), 5,63 (s, 2H), 3,75 (s, 3H), 3,63 (t, 2H), 3,16-2,97 (m, 5H), 1.34 (d, 6H), 1,26 (t, 3H).
МС: 499 (M+1)+.
Пример 164
1-(2-Гидроксибензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, CDCl3): 9,94 (s, 1H), 7,86 (d, 1H), 7,69 (d, 2H), 7,50-7,20 (m, 6H), 6,98 (d, 1H), 6,86 (t, 1H), 5,48 (s, 2H), 3,80 (s, 3Н), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 401 (М+1)+.
Пример 165
1-(2-Хлорбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,75 (d, 2H), 7,45-6,93 (m, 9H), 5,63 (s, 2H), 3,76 (s, 3Н), 3,02 (гепт., 1H), 1,32 (d, 6H).
МС: 419 (M+1)+.
Пример 166
4-(4-Изопропилфенил)-6-метокси-1-(2-метилбензил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, ДМСО-d6): 7,73 (d, 2H), 7,50-6,88 (m, 8H), 6.53 (d, 1H), 5,40 (s, 2H), 3,72 (s, 3Н), 3,03 (гепт., 1H), 2,41 (s, 3Н), 1,28 (d, 6H).
МС: 399 (M+1)+.
Пример 167
4-(4-Изопропилфенил)-6-метокси-1-(2-нитробензил)-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, ДМСО-d6): 8,24 (dd, 1H), 7,60-7,39 (m, 8H), 6,92 (dd, 1H), 5,79 (s, 2H), 3,73 (s, 3H), 3,03 (гепт., 1H), 1,28 (d, 6H).
МС: 430 (M+1)+.
Пример 168
2-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил] бензонитрил

1Н-ЯМР (300 МГц, ДМСО-d6): 7,92 (d, 1H), 7, 71 (d, 2H), 7,61-7.39 (m, 6H), 7,23 (d, 1H), 7,00 (d, 1H), 5,63 (s, 2H), 3,73 (s, 3Н), 3,03 (гепт., 1H), 1,27 (d, 6H).
МС: 410 (M+1)+.
Пример 169
4-(4-Изопропилфенил)-6-метокси-1-(3-метоксибензил)-1.Н.-хиназолин-2-он
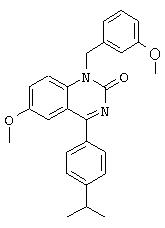
1Н-ЯМР (300 МГц, ДМСО-d6): 7,70 (d, 2H), 7,49-7,44 (m, 4H), 7,26-7,18 (m, 2Н), 6,89-6,75 (m, 3Н), 5,46 (s, 2H), 3,71 (s, 6Н), 3,01 (гепт., 1Н), 1,27 (d, 6H).
MC: 415 (M+1)+.
Пример 170
3-[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-илметил] бензонитрил

1Н-ЯМР (300 МГц, ДМСО-d6): 7,82-7,42 (m, 10Н), 7,20 (s, 1H), 5,53 (s, 2H), 3, 71 (s, 3Н), 3,01 (гепт., 1H), 1,27 (d, 6H).
МС: 410 (М+1)+.
Пример 171
1-(2, 6-Дифторбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,72 (d, 2Н), 7,40-7,23 (m, 6H), 6,87 (t, 2H), 5,71 (s, 2H), 3,75 (s, 3Н), 3,00 (гепт., 1H), 1,31 (d, 6H).
МС: 421 (М+1)+.
Пример 172
1-(2,4-Дифторбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он
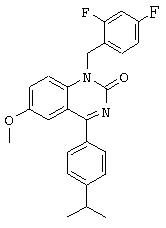
1Н-ЯМР (300 МГц, CDCl3): 7,72 (d, 2H), 7,43-7,20 (m, 6H), 6,62-6,73 (m, 2H), 5,54 (s, 2H), 3,77 (s, 3Н), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 421 (M+1)+.
Пример 173
1-(3,4-Дифторбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,73 (d, 2Н), 7,42-7,05 (m, 8H), 5,49 (s, 2H), 3,77 (s, 3Н), 3,02 (гепт., 1H), 1,32 (d, 6Н).
МС: 421 (М+1)+.
Пример 174
1-(3, 4-Дихлорбензил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,71 (d, 2H), 7,42-7,13 (m, 8H), 5,49 (s, 2H), 3,77 (s, 3H), 3,02 (гепт., 1H), 1,32 (d, 6H).
МС: 453 (М+1)+.
Пример 175
4-(4-Изопропилфенил)-6-метокси-1-(2,4,6-трифторбензил)-1.Н.-хиназолин-2-он
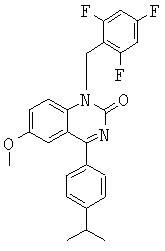
1Н-ЯМР (300 МГц, CDCl3): 7,72 (d, 2Н), 7,40-7,25 (m, 5H), 6,66 (t, 2H), 5,64 (s, 2H), 3,76 (s, 3Н), 3,00 (гепт., 1Н), 1,31 (d, 6H).
МС: 439 (M+1)+.
Пример 176
4-(4-Изопропилфенил)-6-метокси-1-пентафторфенилметил-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 7,71 (d, 2H), 7,42-7,20 (m, 5H), 5,68 (s, 2H), 3,78 (s, 3Н), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 475 (M+1)+.
Пример 177
4-(4-Изопропилфенил)-6-метокси-1-пиридин-3-илметил-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 9,17 (s, 1H), 8,74 (d, 1H), 8,58 (d, 1H), 7,90 (t, 1H), 7,73 (d, 2H), 7,46-7,35 (m, 4H), 5,78 (s, 2H), 3,79 (s, 3Н), 3,02 (гепт., 1H), 1,33 (d, 6H).
МС: 386 (М+1)+.
Пример 178
4-(4-Изопропилфенил)-6-метокси-1-пиридин-2-илметил-1.Н.-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 8,57 (s, 1H), 7,71 (d, 2H), 7,62 (t, 1H), 7,53 (d, 1H), 7,41-7,175 (m, 6H), 5,65 (s, 2H), 3,75 (s, 3H), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 386 (M+1)+.
Пример 179
1-(6-Хлорпиридин-3-илметил)-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он
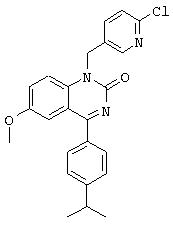
1H-ЯМР (300 МГц, CDCl3): 8,46 (d, 1H), 7,74-7,65 (m, 3Н), 7,41-7,16 (m, 6H), 5,52 (s, 2H), 3,77 (s, 3Н), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 420 (M+1)+.
Пример 180
4-(4-Изопропилфенил)-6-метокси-1-(5-нитрофуран-2-илметил)-1.Н.-хиназолин-2-он

1H-ЯМР (300 МГц, CDCl3): 7,69 (d, 2H), 7,56-7,37 (m, 6H), 6,70 (d, 1H), 5,53 (s, 2H), 3,80 (s, 3Н), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 420 (M+1)+.
Пример 181
4-(4-Изопропилфенил)-6-метокси-1-(2-оксо-2-фенилэтил)-1.Н.-хиназолин-2-он
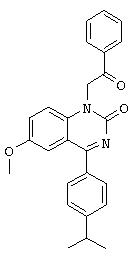
1Н-ЯМР (300 МГц, CDCl3): 8,09 (d, 2Н), 7,75-7,22 (m, 9H), 6,97 (d, 1H), 5,82 (s, 2H), 3,78 (s, 3Н), 3,01 (гепт., 1H), 1,32 (d, 6H).
МС: 413 (M+1)+.
Пример 182
1-Изобутил-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он

1 Н-ЯМР (300 МГц, ДМСО-d6): 7,72-7,40 (m, 6H), 7,18 (d, 1H), 4,08 (d, 2H), 3,75 (s, 3Н), 3,00 (гепт., 1H), 2,15 (гепт., 1H), 1,23 (d, 6H), 0,95 (d, 6H).
МС: 351 (M+1)+.
Пример 183
1-[2-(1.Н.-Индол-2-ил)этил]-4-(4-изопропилфенил)-6-метокси-1.Н.-хиназолин-2-он
1Н-ЯМР (300 МГц, CDCl3): 8,12 (широкий, 1H), 7,75-7,67 (m, 3Н), 7,42-7,12 (m, 9Н), 4,58 (t, 2H), 3,78 (s, 3Н), 3, 30 (t, 3Н), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 438 (M+1)+.
Пример 184
4-(4-Изопропилфенил)-6-метокси-1-фенетил-1Н-хиназолин-2-он

tпл 133-135°C.
1H-ЯМР (300 МГц, CDCl3): 7,70 (d, 2H), 7,20-7,45 (m, 10Н), 4,49 (t, 2H), 3,79 (s, 3Н), 3,12 (t, 2H), 3,01 (гепт., 1H), 1,33 (d, 6H).
МС: 399 (М+1)+.
Пример 185
Этиловый эфир [4-(4-изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-ил]уксусной кислоты

1H-ЯМР (300 МГц, CDCl3): 7,70 (d, 2Н), 7,40-7,31 (m, 4H), 7,08 (d, 1H), 5,08 (d, 2H), 4,25 (q, 2H), 3,78 (s, 3H), 3,00 (гепт., 1H), 2,15 (гепт., 1H), 1,32-1,26 (m, 9Н).
МС: 381 (M+1)+.
Пример 186
[4-(4-Изопропилфенил)-6-метокси-2-оксо-2.Н.-хиназолин-1-ил]ацетонитрил

1H-ЯМР (300 МГц, CDCl3): 7,69 (d, 2H), 7,51-7.20 (m, 5H), 5,26 (d. 2H), 3,81 (s, 3H), 3,01 (гепт., 1H), 1,31 (d, 6H).
МС: 334 (М+1)+.
Пример 187
1-(2-Гидрокси-2-фенилэтил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он

Смесь 2,00 г (6,28 ммоля) 4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она, 0,72 мл (6,28 ммоля) эпоксистирола, 0,143 г (0,628 ммоля) бензилтриэтиламмонийхлорида (ТЭБА), 0,086 г (0, 628 ммоля) карбоната калия и 5 мл диоксана выдерживают при 90°С в течение 18 ч. Водной обработкой с последующей хроматографией на диоксиде кремния получают 1-(2-гидрокси-2-фенилэтил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он.
1H-ЯМР (300 МГц, CDCl3): 7,72 (d, 2Н), 7,56 (d, 2H), 7,49 (m, 1H), 7,43-7,30 (m, 7H), 5,31 (dd, 1H), 4,68 (d, 2H), 4,66 (dd, 1H), 4,39 (dd, 1H), 3,02 (гепт., 1H), 2,55 (t, 1H), 1,32 (d, 6H).
MC: 439 (М+1)+.
Пример 188
2-[4-(4-Изопропилфенил)-2-оксо-6-проп-2-инилокси-2Н-хиназолин-1-ил]-1-фенилэтиловый эфир уксусной кислоты

Раствор 100 мг (0,228 ммоля) 1-(2-гидрокси-2-фенилэтил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в 1 мл уксусного ангидрида выдерживают при 100°С в течение 18 ч. Реакционную смесь выливают в 1 М водный NaOH и экстрагируют диэтиловым эфиром. Продукт очищают препаративной ВЭЖХ с обращенной фазой.
1 H-ЯМР (300 МГц, CDCl3): 7,71 (d, 2H), 7,60-7,33 (m, 10Н), 6,31 (dd, 1H), 4,72 (dd, 1H), 4,68 (d, 2H), 4,59 (dd, 1H), 3,01 (гепт., 1H), 2,58 (t, 1H), 1,93 (s, 3Н), 1,32 (d, 6H).
МС: 481 (М+1)+.
Пример 189
4-(4-Изопропилфенил)-1-(2-оксо-2-фенилэтил)-6-проп-2-инилокси-1Н-хиназолин-2-он

В раствор 200 мг (0,456 ммоля) 1-(2-гидрокси-2-фенилэтил)-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-она в 2 мл ацетона вводят 0,17 мл (0,45 ммоля) реактива Джонса. После перемешивания в течение 30 мин при КТ водной обработкой с последующей перекристаллизацией из этилацетата получают 4-(4-изопропилфенил)-1-(2-оксо-2-фенилэтил)-6-проп-2-инилокси-1Н-хиназолин-2-он.
1Н-ЯМР (300 МГц, CDCl3): 8,09 (d, 2H), 7,75 (d, 2H), 7,67 (t, 1H), 7,54 (t, 2H), 7,52 (d, 1H), 7,38 (d, 2H), 7,34 (dd, 1H), 6,98 (d, 1H), 5,82 (s, 2H), 4,66 (d, 2H), 3,02 (гепт., 1H), 2,56 (t, 1H), 1,33 (d, 6H).
МС: 437 (М+1)+.
Пример 190
1-[2-(4-Фторфенил)-2-оксоэтил]-4-(4-изопропилфенил)-6-проп-2-инилокси-1Н-хиназолин-2-он

1Н-ЯМР (300 МГц, CDCl3): 8,13 (dd, 2Н), 7,76 (d, 2H), 7,53 (d, 1H), 7, 39 (d, 2H), 7,36 (dd, 1H), 7,22 (t, 2H), 7,00 (d, 1H), 5,78 (s, 2H), 4,67 (d, 2H), 3,02 (гепт., 1H), 2,56 (t, 1H), 1,33 (d, 6H).
МС: 455 (М+1)+.
Агенты по изобретению, которые представлены выше, например, формулы I, в частности приведенные в качестве примеров, в свободной форме или в форме фармацевтически приемлемых кислотно-аддитивных солей проявляют фармакологическую активность, и могут быть использованы в виде фармацевтических препаратов, например, для терапии, при лечении заболеваний и состояний, которые указаны в настоящем описании ниже.
Определение образования инозитфосфата
Для определения антагонистической активности к кальций-чувствительному паратироидному рецептору человека (PCaR) соединения испытывали в функциональных опытах с определением ингибирования кальций-индуцируемого образования инозитфосфата в CCL39 фибробластах, стабильно трансфектированных PCaR человека.
Клетки засевали в 24-луночные планшеты и выращивали до слияния. Затем культуры помечали [3Н]инозитом (74 Mbq/мл) в течение 24 ч в среде без сыворотки. После того как клетки были помечены, их один раз промывали модифицированным солевым раствором в буфере Hepes (mHBS: 130 мМ NaCl, 5,4 мМ KCl, 0,5 мМ CaCl2, 0,9 мМ MgSO4, 10 мМ глюкоза, 20 мМ HEPES, pH 7,4) и инкубировали в mHBS при 37°С в присутствии 20 мМ LiCl, чтобы блокировать активность инозитмонофосфатазы. За 3 мин до стимуляции PCAR 5,5 мМ кальцием добавляли тестируемые соединения и затем продолжали инкубирование в течение еще 20 мин. После этого клетки экстрагировали 10 мМ холодной как лед муравьиной кислотой и с помощью анионообменной хроматографии и жидко-сцинтилляционного счетчика определяли образовавшиеся инозитфосфаты.
Определение внутриклеточного свободного кальция
Альтернативный способ определения антагонизма к PCaR заключается в определении ингибирования внутриклеточного переноса кальция, стимулированного внеклеточным кальцием. CCL39 фибробласты, стабильно трансфектированные PCaR человека, высевали в 96-луночный планшет (Viewplates) при плотности 40000 клеток/лунку и инкубировали в течение 24 ч. Затем среду удаляли и заменяли свежеприготовленной средой, содержавшей 2 мкМ Fluo-3 AM (фирмы Molecular Probes, Лейден, Нидерланды). В обычных опытах клетки инкубировали в течение 1 ч при 37°С в атмосфере, содержавшей 5% CO2. После этого планшеты дважды промывали mHBS и лунки вновь заполняли 100 мкл mHBS, содержавшего тестируемые соединения. Инкубирование продолжали при комнатной температуре в течение 15 мин. Для записи изменений количества внутриклеточного свободного кальция планшеты переносили в флуорометрический ридер для планшетов (фирмы Molecular Devices, Саннивейл, шт.Калифорния, США). Записывали базовую линию, которая включала 5 измерений по 0,4 с каждое (возбуждение лазером при 488 нм). Затем клетки стимулировали кальцием (конечная концентрация 2,5 мМ) и в течение 3 мин регистрировали флуоресценции.
После проведения измерений в вышеописанных испытаниях получали данные, показывающие, что значения ИК50 агентов по изобретению, как правило, находятся в интервале концентраций примерно от 50 мкМ вплоть до примерно 10 нМ и даже меньше.
Поэтому агенты по изобретению показаны для профилактики или лечения всех заболеваний кости, которые связаны с увеличенной потерей кальция или резорбцией или при которых желательна стимуляция остеогенеза и фиксация кальция в кости, например остеопороз различного происхождения (в частности, ювенильный, менопаузный, постклимактерический, посттравматический, вызванный пожилым возрастом или кортикостероидной терапией или неактивностью), переломы, остеопатия, включая острые и хронические состояния, связанные со скелетной деминерализацией, остеомаляцию, периодонтальный остеопороз и остеопороз в результате артрита или остеоартрита, или для лечения гипопаратиреоза.
Кроме того, болезни и расстройства, которые можно предотвратить или лечить, включают, например, эпилептические припадки, внезапный приступ, травму головы, ранение спинного мозга, поражение нервных клеток, индуцированное гипоксией, такое как при остановке сердца или неонатальном дистрессе, эпилепсию, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Хантингтона и болезнь Паркинсона, деменцию, ригидность мышц, депрессию, страх, панику, навязчиво-компульсивное расстройство, посттравматический стресс, шизофрению, нейролептический злокачественный синдром, застойную сердечную недостаточность; гипертензию; кишечные расстройства, такие как диарея и слизистый колит, и дерматологические нарушения, например, при лечении тканей, в частности ожогов, язв и ранений.
Агенты по изобретению особенно показаны для профилактики или лечения остеопороза различного происхождения.
Для применения со всеми вышеупомянутыми целями указываемая ежедневная доза находится в интервале от примерно 0,03 до примерно 300 мг, предпочтительно от 0,03 до 30, более предпочтительно от 0,1 до 10 мг, соединения по изобретению. Агенты по изобретению можно вводить дважды в день или до двух раз в неделю.
Агенты по изобретению можно вводить в свободной форме или в форме фармацевтически приемлемых кислотно-аддитивных солей. Такие соли могут быть получены обычным путем, они проявляют активность такого же порядка, как свободные соединения. По настоящему изобретению предлагается также фармацевтическая композиция, включающая агент по изобретению в форме свободного основания или в форме фармацевтически приемлемой соли в сочетании с фармацевтически приемлемым разбавителем или носителем. Такие композиции могут быть приготовлены обычным путем. Агенты по изобретению можно вводить любым обычным путем, например парентерально, в частности, в форме растворов или суспензий для инъекций, энтерально, например перорально, в частности, в форме таблеток или капсул, или трансдермально, назально или в форме суппозиториев.
В соответствии с вышеизложенным по настоящему изобретению далее предлагаются
а) агент по изобретению или его фармацевтически приемлемая соль для применения в виде фармацевтического препарата;
б) способ профилактики или лечения вышеупомянутых расстройств и заболеваний у субъекта, нуждающегося в таком лечении, причем этот способ включает введение в организм указанного субъекта эффективного количества агента по изобретению или его фармацевтически приемлемой соли;
с) агент по изобретению или его фармацевтически приемлемая соль для применения при приготовлении фармацевтической композиции, предназначенной, например, для применения в способе, описанном выше в разделе б).
В соответствии с еще одним вариантом выполнения изобретения агенты по изобретению можно применять в качестве вспомогательного средства или адъюванта для другой терапии, в частности в терапии с использованием ингибитора резорбции кости, например в терапии остеопороза, в частности в терапии с применением кальция, кальцитонина или его аналогов или производных, например кальцитонина лососевых, угря или человека, стероидного гормона, например эстрогена, в частности агониста эстрогена или сочетания эстроген/гестаген, СМРЭ (селективный модулятор рецептора эстрогена), например ралоксифена, лазофоксифена, TSE-424, FC1271, тиболона (фирменное название Livial®), витамина Д или его аналога или РТН, фрагмента РТН или производного РТН, например РТН (1-84), РТН (1-34), РТН (1-36), РТН (1-38), РТН (1-31)NH2 или PTS 893.
Когда агенты по изобретению вводят в организм в сочетании, например, с адъювантом в терапии ингибирования резорбции кости, дозы для совместно вводимого ингибитора обычно варьируют, разумеется, в зависимости от типа используемого ингибирующего лекарственного средства, например от того, является ли оно стероидом или кальцитонином, от состояния, при котором проводят лечение, является ли терапия лечебной или профилактической, от режима и т.д.
Реферат
Настоящее изобретение относится к медицине и касается соединений формулы IV или их кислотно-аддитивных солей, способа их получения и применения при приготовлении лекарственного средства для лечения заболеваний кости, которые связаны с увеличенной потерей кальция или резорбцией, при которых требуется стимуляция остеогенеза и фиксация кальция в кости, 6 н.п. ф-лы.

Формула





Комментарии