Терапевтическая композиция для снижения устойчивости к ингибиторам тирозинкиназы - RU2735493C2
Код документа: RU2735493C2
Чертежи












































Описание
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Варианты осуществления настоящего изобретения относятся к способам лечения и предупреждения состояний заболевания, такого как рак, в частности у тех индивидуумов, у которых развилась устойчивость, или которые не отвечают на терапию ингибитором тирозинкиназы (TKI).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Немелкоклеточный рак легкого (NSCLC) является основной причиной связанных с раком смертей в мире, и несмотря на последние успехи в лечении и диагностике, 5-летняя выживаемость составляет ~16%. Данный неблагоприятный исход во многом обусловлен поздней стадией заболевания, устойчивым характером заболевания и степенью метастазирования при постановке диагноза. Несмотря на значительные успехи в выявлении геномных аномалий, являющихся причиной появления злокачественных раковых клеток, доступная на данный момент химиотерапия остается неудовлетворительной, и прогноз для большинства пациентов с диагнозом рака остается неутешительным.
Большинство химиотерапевтических средств целенаправленно воздействуют на определенную молекулярную мишень, которая, как считается, участвует в развитии злокачественного фенотипа. Однако клеточную пролиферацию регулирует сложная сеть сигнальных путей, и большинство злокачественных форм рака облегчается множественными генетическими аномалиями в этих путях. Хотя лечение форм рака легкого стандартными цитотоксическими химиотерапевтическими средствами была оптимизировано в отношении эффективности, более поздние подходы к терапевтическим препаратам против NSCLC основываются на классифицировании NSCLC на молекулярные подмножества на основании их отличительного онкогенного фактора. Эти молекулярные факторы NSCLC могут быть атакованы терапевтически средствами целенаправленного воздействия, направленными против специфических онкогенов.
Большинство предыдущих химиотерапевтических лекарственных средств против рака были неселективными по своей активности. Хотя их точные механизмы действия были разнообразными и сложными, они обычно работали путем повреждения клеток, подвергающихся митозу, который обычно чаще встречается в злокачественных опухолях, чем в большинстве нормальных тканей. Средства целенаправленного воздействия предназначены для того, чтобы быть селективными по своим эффектам благодаря модуляции активности белков, необходимых и незаменимых для онкогенеза и поддержания рака, особенно ферментов, управляющих неконтролируемым ростом, ангиогенезом, инвазивностью и метастазисом, характерными для злокачественных опухолей. Повышенная дифференциальная активность обычно приводит к меньшему количеству вредных побочных эффектов у пациентов с раком, особенно к снижению тошноты, рвоты и смерти клеток в костном мозге и желудочно-кишечном тракте, а также к повышению эффективности против опухолевых клеток.
Перспективный набор мишеней для терапевтического вмешательства при лечении рака предусматривает представителей HER-киназной системы. Они часто активируются при солидных эпителиальных опухолях, как пример, предстательной железы, легкого и молочной железы, а также активируются в опухолях, представляющих собой глиобластому. Рецептор эпидермального фактора роста (EGFR) является представителем ElER-киназной системы, и был выбран мишенью при разработке некоторых различных видов терапии рака. К этим терапевтическим средствам относятся ингибиторы EGFR-тирозинкиназ (EGFR-TKI), поскольку обратимое фосфорилирование остатков тирозина требуется для активации пути EGFR. Другими словами, EGFR-TKI блокирует рецептор клеточной поверхности, отвечающий за запуск и/или поддержание сигнального пути клетки, который индуцирует рост и деление опухолевых клеток. В частности полагают, что такие ингибиторы взаимодействуют с доменом EGFR-киназы, называемым HER-1. Среди наиболее перспективных EGFR-TKI - три ряда соединений: хиназолины, пиридопиримидины и пирролопиримидины.
Было обнаружено, что рецептор эпидермального фактора роста (EGFR) в высокой степени экспрессируется или амплифицируется у многих пациентов с NSCLC, хотя при клиническом исследовании с ингибиторами EGFR-специфических тирозинкиназ (TKI) идентифицировали пациентов, опухоли которых несут мутации с приобретением функции EGFR, как подгруппу с наилучшей ответной реакцией. Несмотря на то, что эти пациенты первоначально отвечают на виды терапии, целенаправленно воздействующие на EGFR, у всех, к сожалению, в конечном итоге проявятся рецидивы, что является проблематичным ограничением долгосрочной эффективности целенаправленно воздействующих видов терапии. В целом, среднее время до прогрессирования в отношении видов терапии, целенаправленно воздействующих на EGFR, составляет приблизительно 8-14 месяцев. У пациентов были обнаружены и подтверждены многочисленные механизмы приобретенной устойчивости к ингибиторам, целенаправленно воздействующим на EGFR.
Два из наиболее популярных одобренных FDA TKI в клиническом применении против NSCLC включают в себя гефитиниб (AstraZeneca UK Ltd.; торговая марка IRESSA®); далее в данном документе «IRESSA», или «гефитиниб» и эрлотиниб (Genentech, Inc. торговая марка TARCEVA®; далее в данном документе «TARCEVA» или эрлотиниб); оба у некоторых пациентов вызывали обнадеживающие клинические результаты и в настоящее время являются стандартом ухода при лечении первой линии для пациентов с NSCLC поздней стадии с мутацией, воздействующей на EGFR.
Существенным ограничением в применении таких соединений является то, что у их реципиентов может развиваться устойчивость к их терапевтическим эффектам после того, как изначально они отвечали на терапию, или они могут не отвечать на EGFR-TKI в любой измеримой степени. Таким образом, хотя соединения могут, во-первых, проявлять сильные противоопухолевые свойства, они могут вскоре стать менее эффективными или полностью неэффективными при лечении рака. Более того, поскольку медицинское исследование до сих пор не полностью выяснило биомолекулярный или патологический механизм, отвечающий за эту устойчивость, для некоторых пациентов, которые до сих пор демонстрировали такую устойчивость, осталось немного терапевтических альтернатив для лечения их заболевания.
Вторичная мутация Т790М привратника, которая увеличивает аффинность связывания EGFR-АТФ, встречается у 50% пациентов, у которых опухоли развиваются на TKI, специфичных к EGFR. Кроме того, МЕТ-амплификацию после лечения с ингибиторами EGFR регистрировали у приблизительно 5-15% пациентов с NSCLC. EGFR-T790M и МЕТ-амплифицированные опухолевые клетки могут быть выявлены в опухолях перед проведением видов терапии, целенаправленно воздействующих на EGFR, что позволяет предположить, что эти клетки селективно обогащаются при лечении. Более того, выявление либо Т790М, либо амплифицированного МЕТ с экспрессией FIGF перед обработкой EGFR-TKI связано с уменьшением продолжительности ответной реакции на методы лечения, целенаправленно воздействующие на EGFR.
Без привязки к какой-либо конкретной теории полагают, что альтернативные рецепторные тирозинкиназы, которые ни мутируют, ни амплифицируются, также могут способствовать приобретенной устойчивости к видам терапии, целенаправленно воздействующих на EGFR. Альтернативные рецепторные тирозинкиназы, также называемые «обходными путями», были идентифицированы как механизмы и врожденной, и приобретенной устойчивости к терапевтическим препаратам, целенаправленно воздействующим на EGFR, в том числе EGFR-TKI. По сравнению с устойчивостью посредством приобретения мутаций привратника, механизмы приобретенной устойчивости, предусматривающие индуцирование отдельных сигнальных путей, не имеющих генетических изменений, имеют меньше документальных подтверждений в литературе.
Лечение ингибиторами рецепторной тирозинкиназы (TKI) улучшало выживаемость без прогрессирования и общую выживаемость у пациентов с запущенным немелкоклеточным раком легкого (NSCLC). Несмотря на начальные ответные реакции и значительные ремиссии, развитие вторичной устойчивости неизбежно приводит к неудаче в лечении. По-видимому, метод воздействия с участием отдельно взятых ингибиторов тирозинкиназы, таких как гефитиниб или эрлотиниб, может обеспечивать лишь временный успех. Похоже, что решение данной проблемы в отношении устойчивости заключается в их комбинации с дополнительными терапевтическими препаратами, такими как малые молекулы или антитела, с TKI для преодоления вторичной устойчивости к EGFR-TKI в ближайшем будущем.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является способ лечения пациентов, страдающих формами рака, вызванными дерегулированным рецептором эпидермального фактора роста человека (HER/EGFR человека), предусматривающий назначение пациенту, при необходимости такого лечения, гибкой и активной схемы с целью объединения ингибитора тирозинкиназы (TKI) с активной иммунизацией пути EGF (PTI EGF), с целью ингибирования пути, активированного EGF-EGFR, где в данном способе TKI назначают в соответствии с непрерывной схемой из расчета средней суточной дозы в диапазоне от 10 до 50 мг, и при этом PTI EGF назначают совместно в соответствии со схемой введения дозы с достижением терапевтически эффективного количества, введение которого повторяют три раза, два раза или один раз в неделю, один раз в две недели, один раз в три недели или по меньшей мере один раз в месяц.
Дополнительной целью настоящего изобретения является способ лечения пациента, страдающего немелкоклеточным раком легкого (NSCLC), вызванным дерегулированным рецептором эпидермального фактора роста человека (HER 1/EGFR человека), при этом у пациента имеется опухоль, экспрессирующая мутантные формы EGFR, предусматривающий назначение пациенту, при необходимости такого лечения, гибкой и активной схемы с объединением ингибитора тирозинкиназы (TKI) и активной иммунизации, целенаправленно воздействующей на EGF, где в данном способе TKI назначают в соответствии с непрерывной схемой из расчета средней суточной дозы в диапазоне от приблизительно 10 до 150 мг, и при этом активную иммунизацию PTI EGF назначают совместно в соответствии с терапевтически эффективным количеством, повторяемым три раза, два раза или один раз в неделю, один раз в две недели, один раз в три недели или по меньшей мере один раз в месяц, где способ обеспечивает предупреждение возникновения приобретенной устойчивости к лечению TKI.
Другой целью настоящего изобретения является фармацевтический набор, содержащий первый компонент, который содержит эффективное количество антител, целенаправленно воздействующих на EGF, и второй компонент, который содержит эффективное количество TKI.
Дополнительной целью настоящего изобретения является фармацевтический набор, содержащий первый компонент, который содержит эффективное количество вакцины, дающей иммунную ответную реакцию на EGF, и второй компонент, который содержит эффективное количество TKI.
Другой целью настоящего изобретения является фармацевтический набор, содержащий первый компонент, который содержит эффективное количество вакцины, дающей иммунную ответную реакцию на EGFR, и второй компонент, который содержит эффективное количество TKI.
Дополнительной целью настоящего изобретения является TKI для применения в способе лечения пациента, страдающего от рака, вызванного дерегулированным рецептором эпидермального фактора роста человека (HER/EGFR человека), путем совместного введения с вакциной, дающей иммунную ответную реакцию на EGF, при этом TKI вводят в соответствии с непрерывной схемой из расчета средней суточной дозы в диапазоне от приблизительно 10 до 150 мг, и при этом вакцину, дающую иммунную ответную реакцию на EGF, вводят пациенту совместно, при необходимости такого лечения, в соответствии с терапевтически эффективным количеством, повторяемым три раза, два раза или один раз в неделю, один раз в две недели, один раз в три недели или по меньшей мере один раз в месяц.
Дополнительной целью настоящего изобретения является применение TKI для получения фармацевтического набора для лечения пациентов, страдающих формами рака, вызванными дерегулированным рецептором эпидермального фактора роста человека (HER/EGFR человека), содержащего первый компонент, который содержит эффективное количество вакцины, дающей иммунную ответную реакцию на EGF, и второй компонент, который содержит эффективное количество TKI, где TKI подлежит введению в соответствии с непрерывной схемой из расчета средней суточной дозы в диапазоне от приблизительно 10 до 150 мг, и при этом вакцину вводят до начала TKI-терапии в соответствии со схемой введения пациенту, при необходимости такого лечения, дозы, варьирующей от средней недельной дозы терапевтически эффективного количества, введение которого повторяют три раза, два раза или один раз в неделю, один раз в две недели, один раз в три недели или по меньшей мере один раз в месяц.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Далее настоящее раскрытие описывается в следующем подробном описании со ссылкой на прилагаемое множество графических материалов с помощью неограничивающих примеров вариантов осуществления настоящего раскрытия, в которых одинаковые номера позиций представляют одинаковые части в нескольких видах графических изображений.
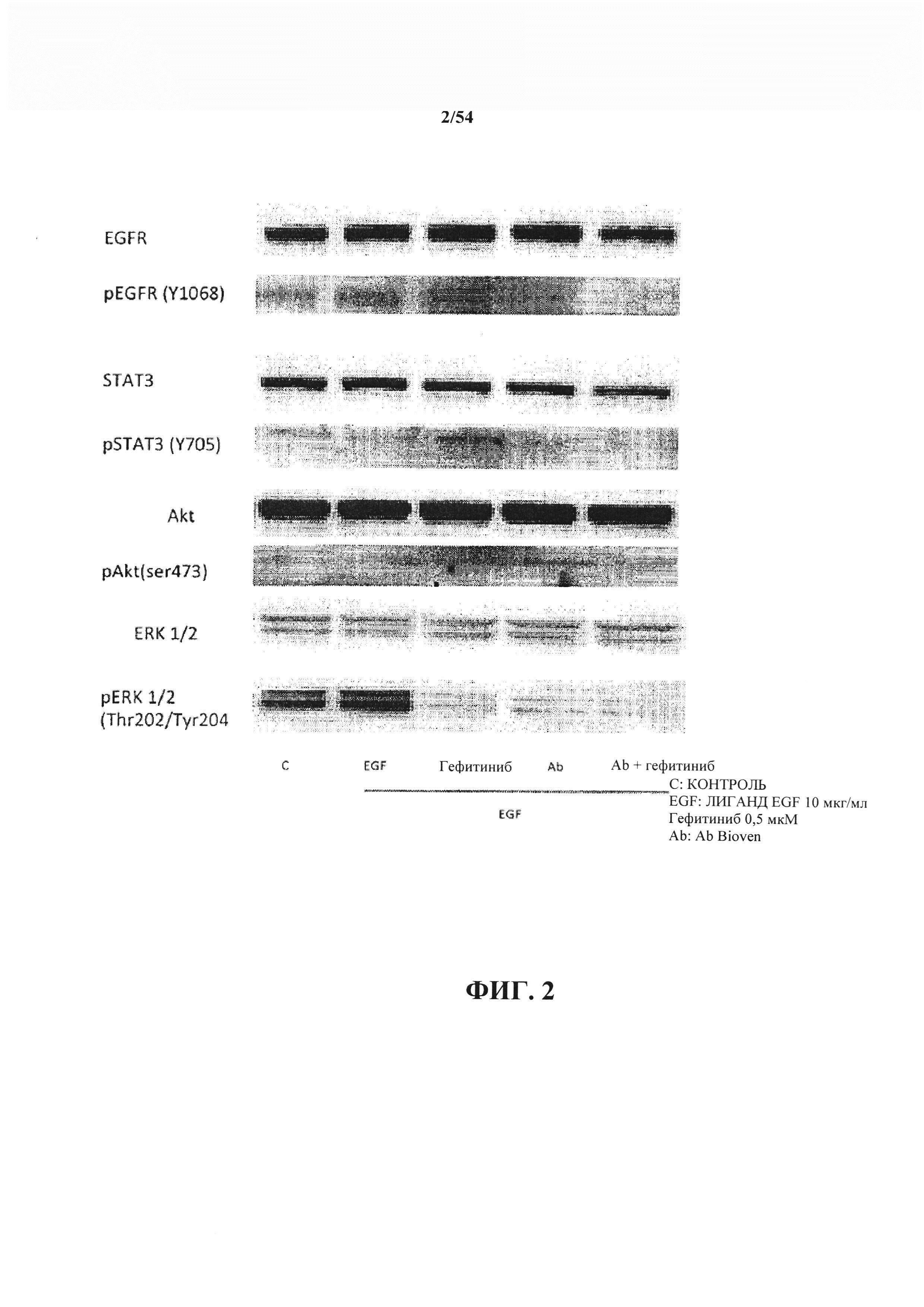
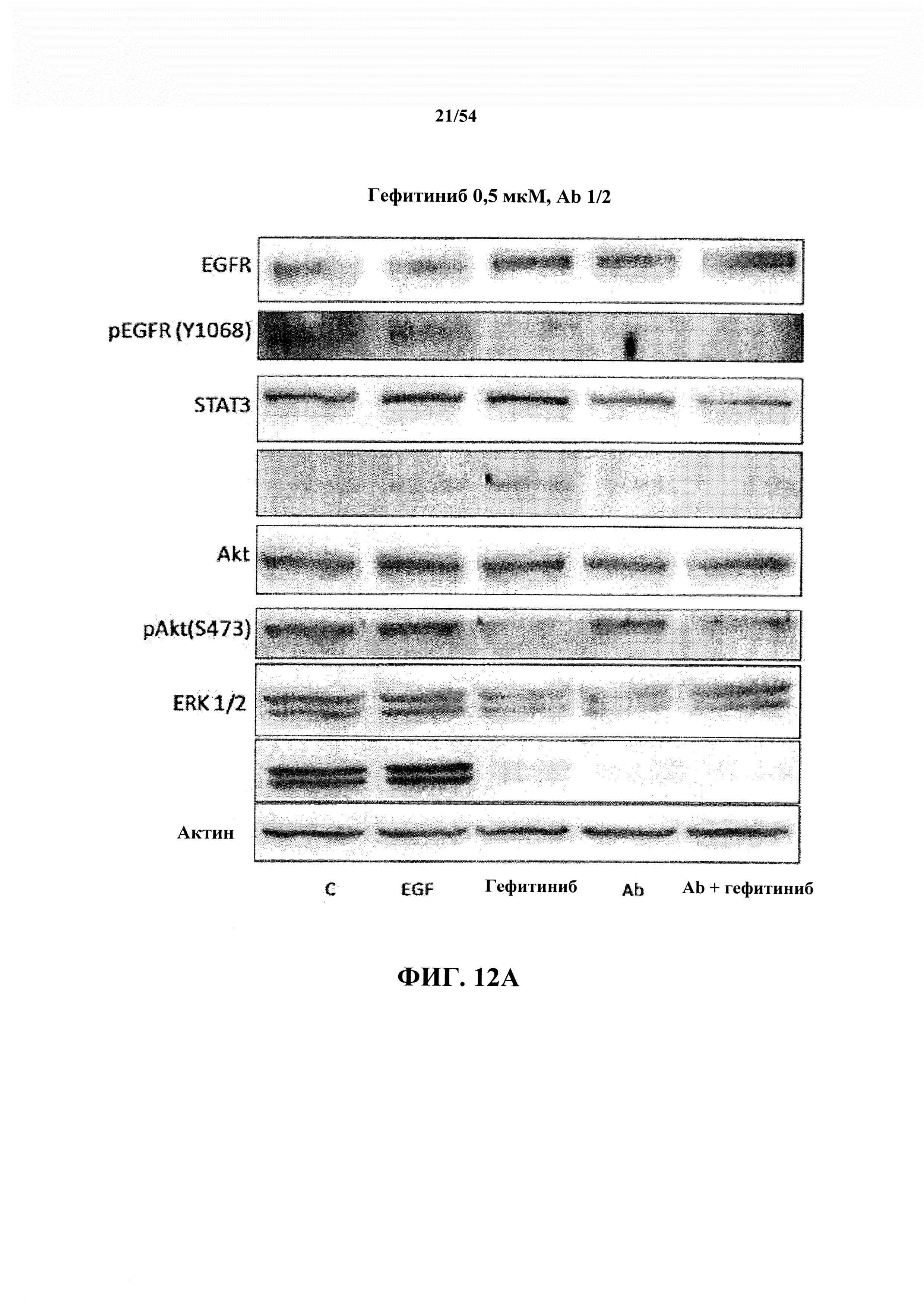
На ФИГ. 1 показан SDS-PAGE-WB (вестерн-блоттинг), демонстрирующий антитело к EGF в ингибировании пути EGF/EGFR.
На ФИГ. 2 показан SDS-PAGE-WB, демонстрирующий, что комбинированное лечение в соответствии с настоящим раскрытием обращало активацию STAT 3 гефитинибом, что подтверждает, что комбинированное лечение могло бы быть успешным у мутантных по EGFR пациентов с NSCLC.
На ФИГ. 3 показан SDS-PAGE-WB, демонстрирующий результаты антител к EGF, которые тестировали только при разбавлении 1 к 2. Концентрация эрлотиниба составляла 0,5 микромоля.
На ФИГ. 4 изображено сравнение уровней EGFR, STAT3 и ERK1/2 после лечения гефитинибом, антителами к EGF и комбинацией гефитиниба с антителами к EGF.
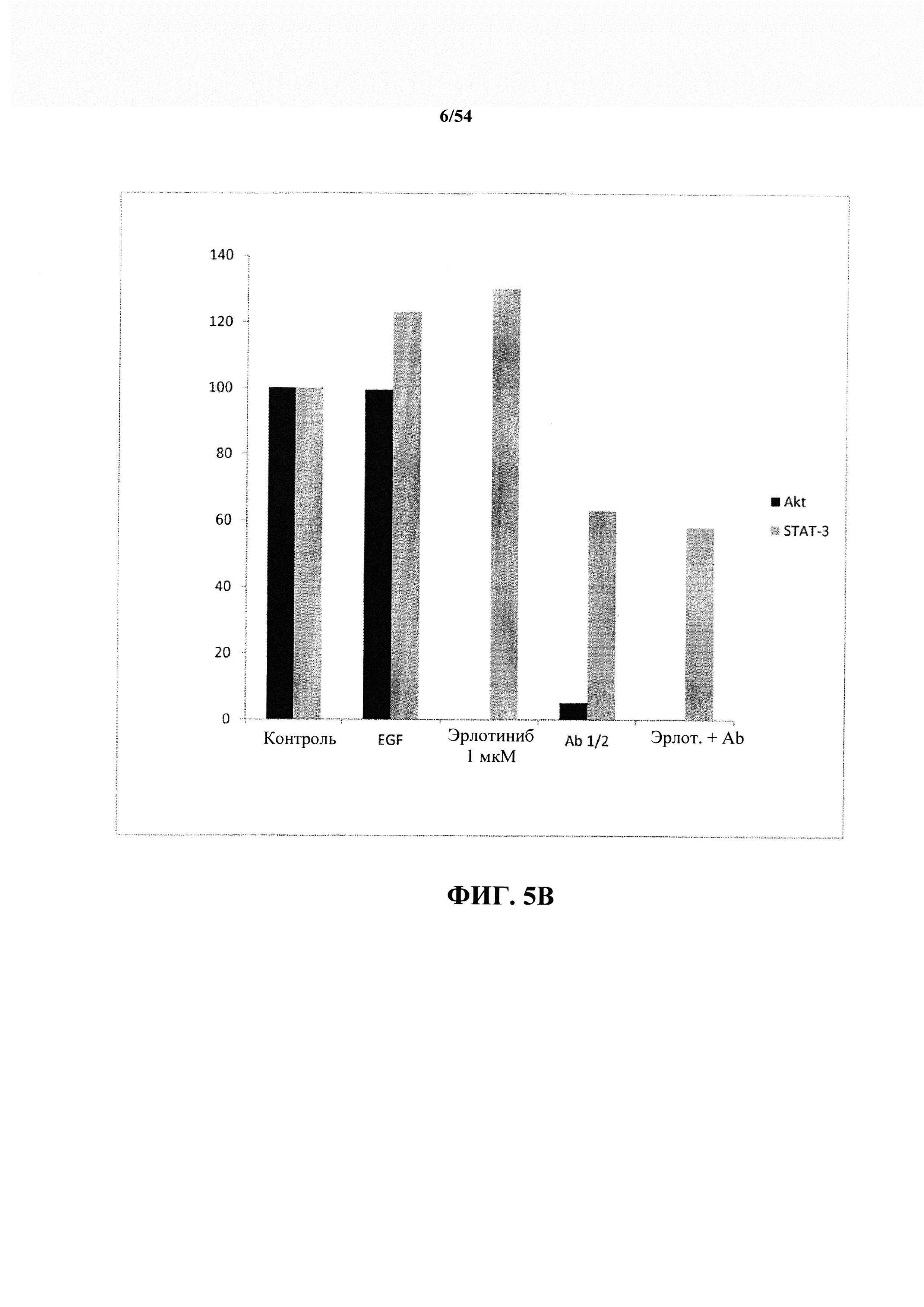
На ФИГ. 5А и 5В изображено сравнение уровней EGFR, STAT3 и ERK1/2 после лечения эрлотинибом, антителами к EGF и комбинацией эрлотиниба и антител к EGF, что кратко описано в таблице 1.
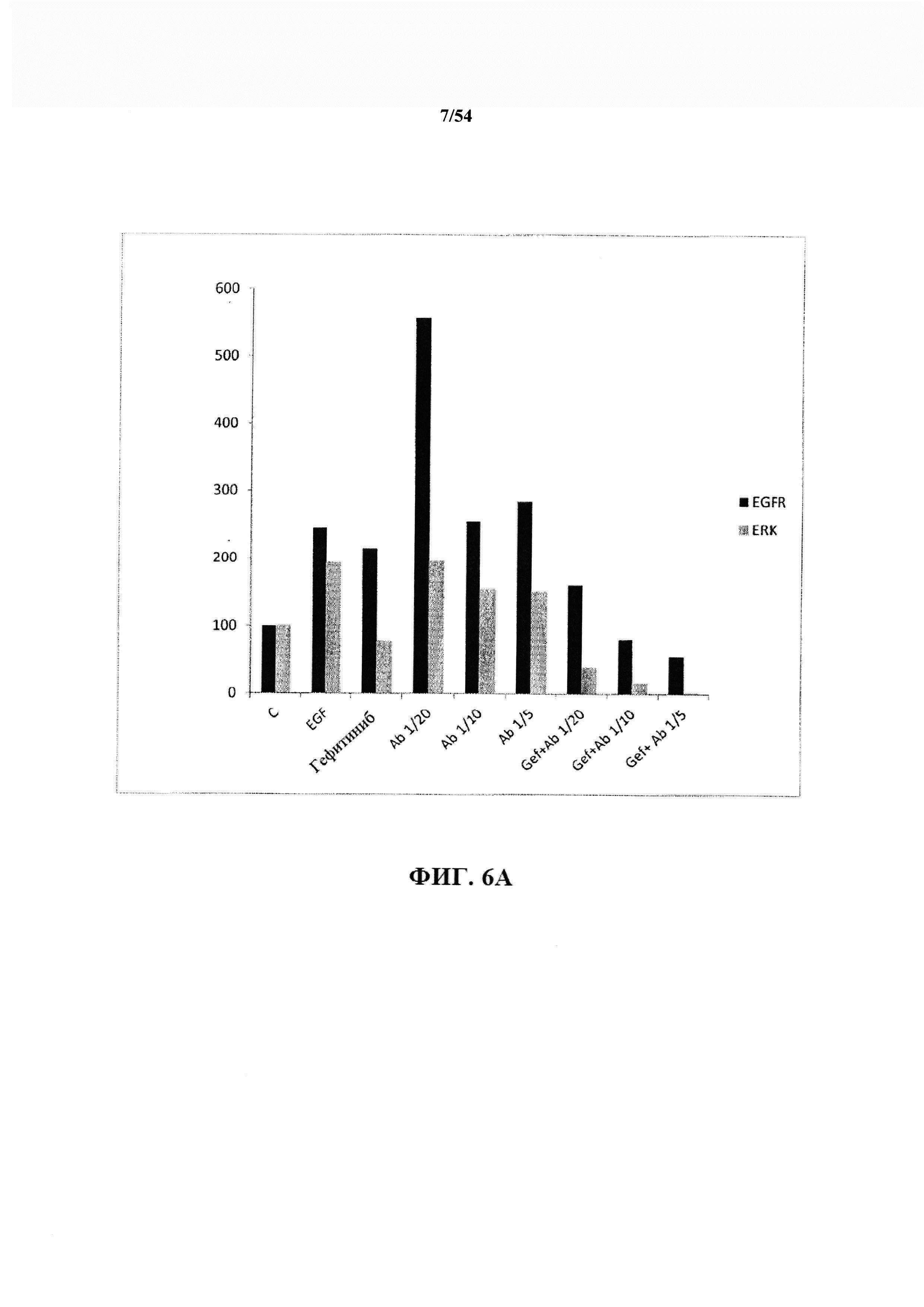
На ФИГ. 6А, 6В и 6С представлены результаты комбинации гефитиниб + антитело к EGFR, фосфорилирование четырех белков было ингибировано.
На ФИГ. 7А и 7В представлены результаты комбинации гефитиниба и повышенной концентрации антител к EGF.
На ФИГ. 8А и 8В представлены необработанные данные комбинации антитела к EGF и гефитиниба, демонстрирующие, что Erk, STAT3 и EGFR были почти полностью инактивированы.
На ФИГ. 9А и 9В показаны необработанные данные другого эксперимента, который выполняли при «условиях сывороточного голодания» и индуцирование с EGFR. Время инкубации составляло 2 ч., и концентрация гефитиниба составляла 0,5 мкМ.
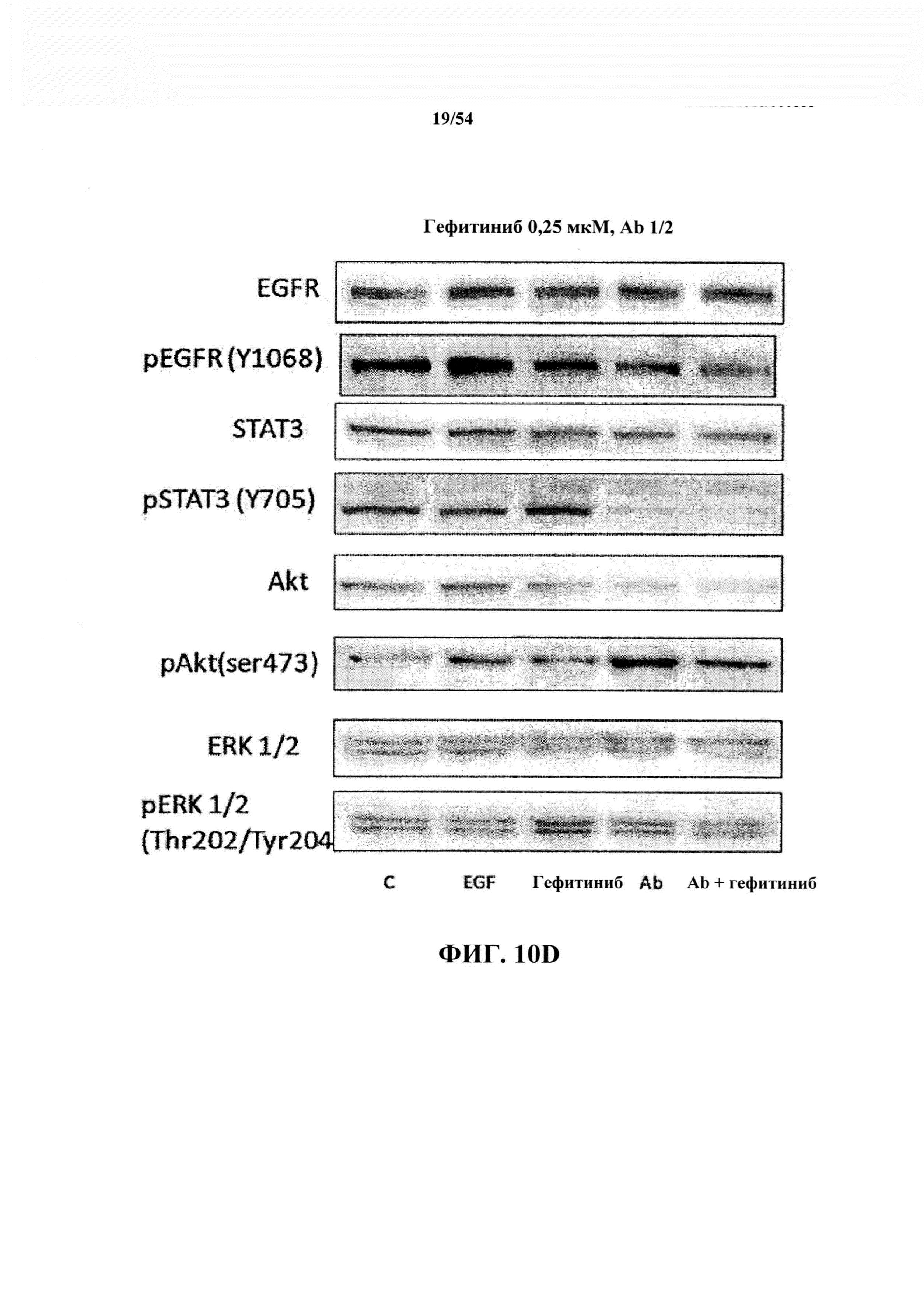
На ФИГ. 10А, 10В, IOC и 10D показаны необработанные данные другого ряда дополнительных экспериментов, выполненных с использованием концентраций гефитиниба, лучше соответствующим физиологическим условиям, наблюдаемым у пациентов, получающих данное лекарственное средство: 0,1 и 0,25 мкМ.
На ФИГ. 11 показаны необработанные данные эксперимента с комбинацией гефитиниб + антитело к EGF с 24 ч. сывороточным голоданием и лечением лекарственным средством.
На ФИГ. 12А, 12В и 12С показаны необработанные данные дополнительного эксперимента, включающие в себя белок «домашнего хозяйства» (актин) для нормализации общего количества белков, при этом экспериментальные данные показывают, что фосфорилирование ERK и EGFR было выполнено с комбинацией антитело к EGF плюс гефитиниб.
На ФИГ. 13А и 13В показаны необработанные данные дополнительного эксперимента с эрлотинибом и антителом к EGF при «нестандартных условиях», при этом время инкубации с лекарственными средствами составляло 2 часа, и концентрация эрлотиниба составляла 1 мкМ.
На ФИГ. 14А и 14В показаны необработанные данные дополнительного эксперимента с эрлотинибом и антителом к EGF при «сывороточном голодании», при этом время инкубации с лекарственными средствами составляло 2 часа, и концентрация эрлотиниба составляла 1 мкМ.
На ФИГ. 15А и 15В показаны необработанные данные следующего эксперимента с использованием TKI AZD929l с антителом к EGF, тестируемым при условиях «сывороточного голодания».
На ФИГ. 16А и 16В показаны необработанные данные для другого эксперимента с использованием AZD929l и антитела к EGF (Abl) на клетках РС9.
На ФИГ. 16С представлены вычисленные результаты тестирования отдельно взятого и комбинированного лечения с широкими параметрами конечной точки WB.
На ФИГ. 17 показаны необработанные данные следующего эксперимента, при котором клетки РС9 инкубировали в течение 24 ч. с лекарственным средством AZD929l, концентрацию которого снижали до 0,1 мкМ для предупреждения полной инактивации EGFR и Erk лекарственным средством.
На ФИГ. 18А и 18В показаны необработанные данные другого эксперимента с AZD929l (0,2 мкМ AZD929l) и антителом к EGF (Abl) в PC9-GR4 (Т790М положительным) в течение 2-часового периода инкубации.
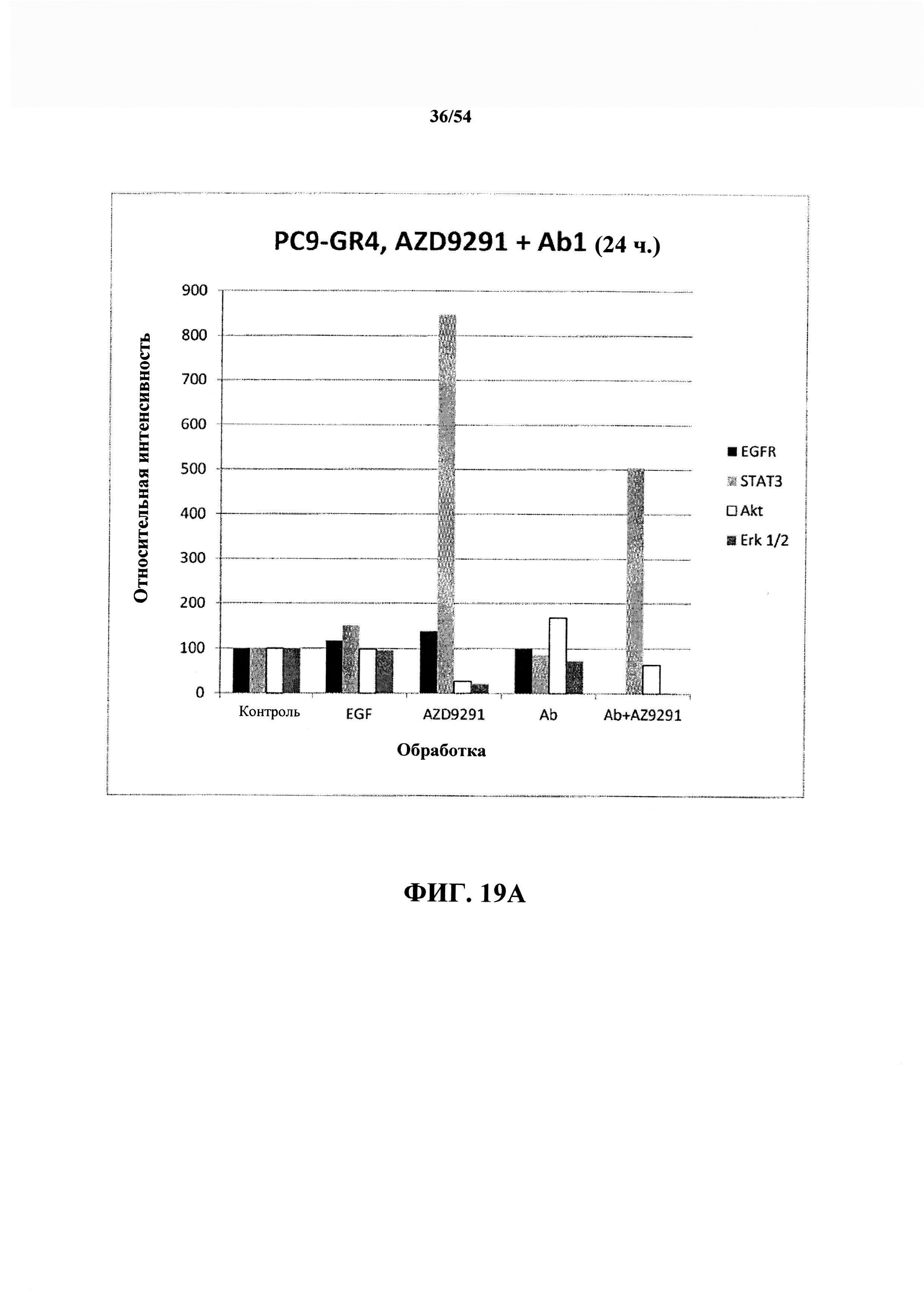
На ФИГ 19А и 19В показаны необработанные данные другого эксперимента с AZD929l (0,2 мкМ AZD929l) и антителом к EGF (Abl) в PC9-GR4 (Т790М положительном) в течение 24-часового периода инкубации.
На ФИГ. 20А и 20В показаны последовательности слитых белков в соответствии с настоящим изобретением, в ответ на которые продуцируются антитела к EGF.
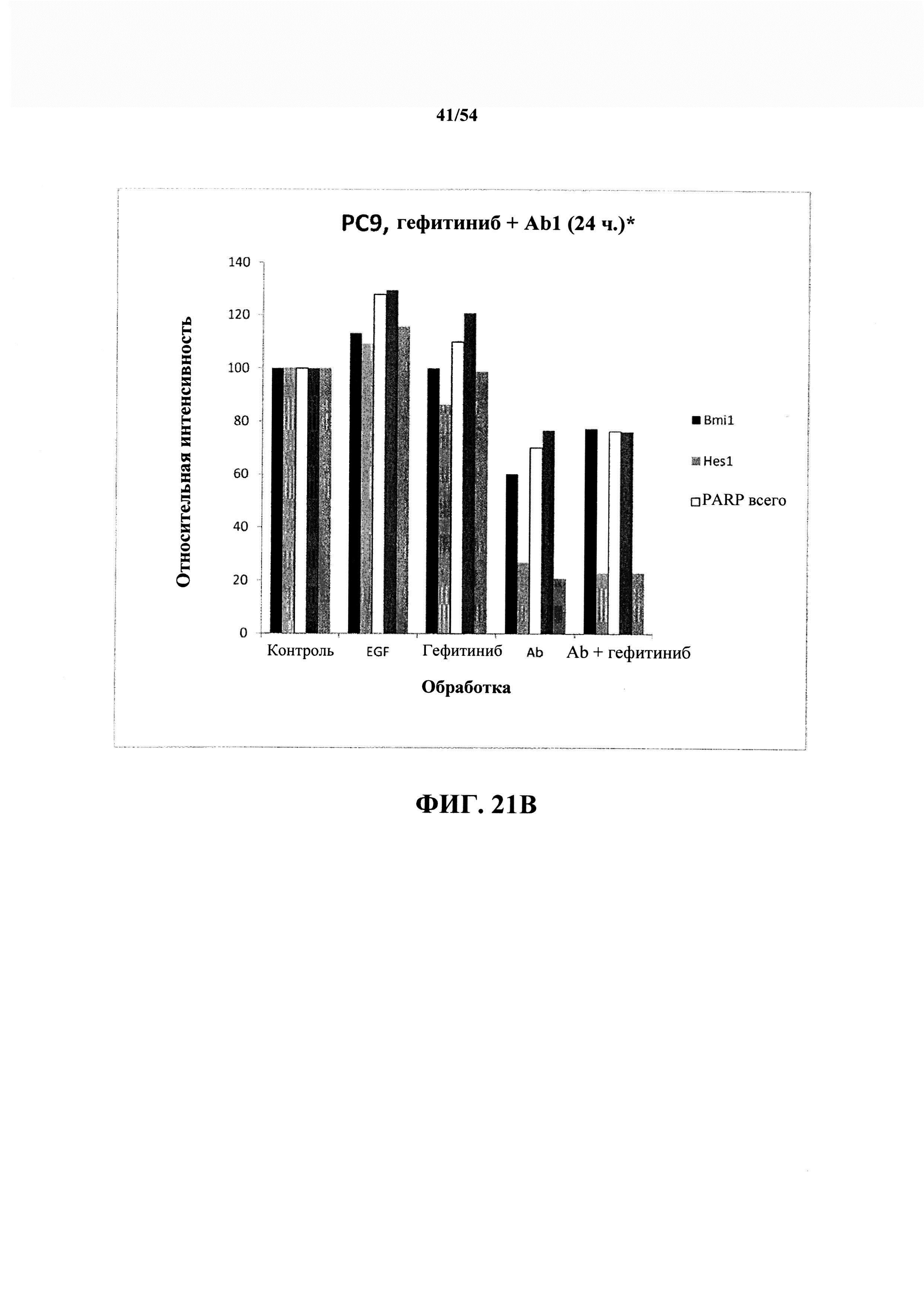
На ФИГ. 21A, 2IB, 21С и 21D показаны необработанные данные следующего эксперимента с гефитинибом и антителом к EGF (Abl) на клетках РС9 и эффект в отношении дополнительных маркеров.
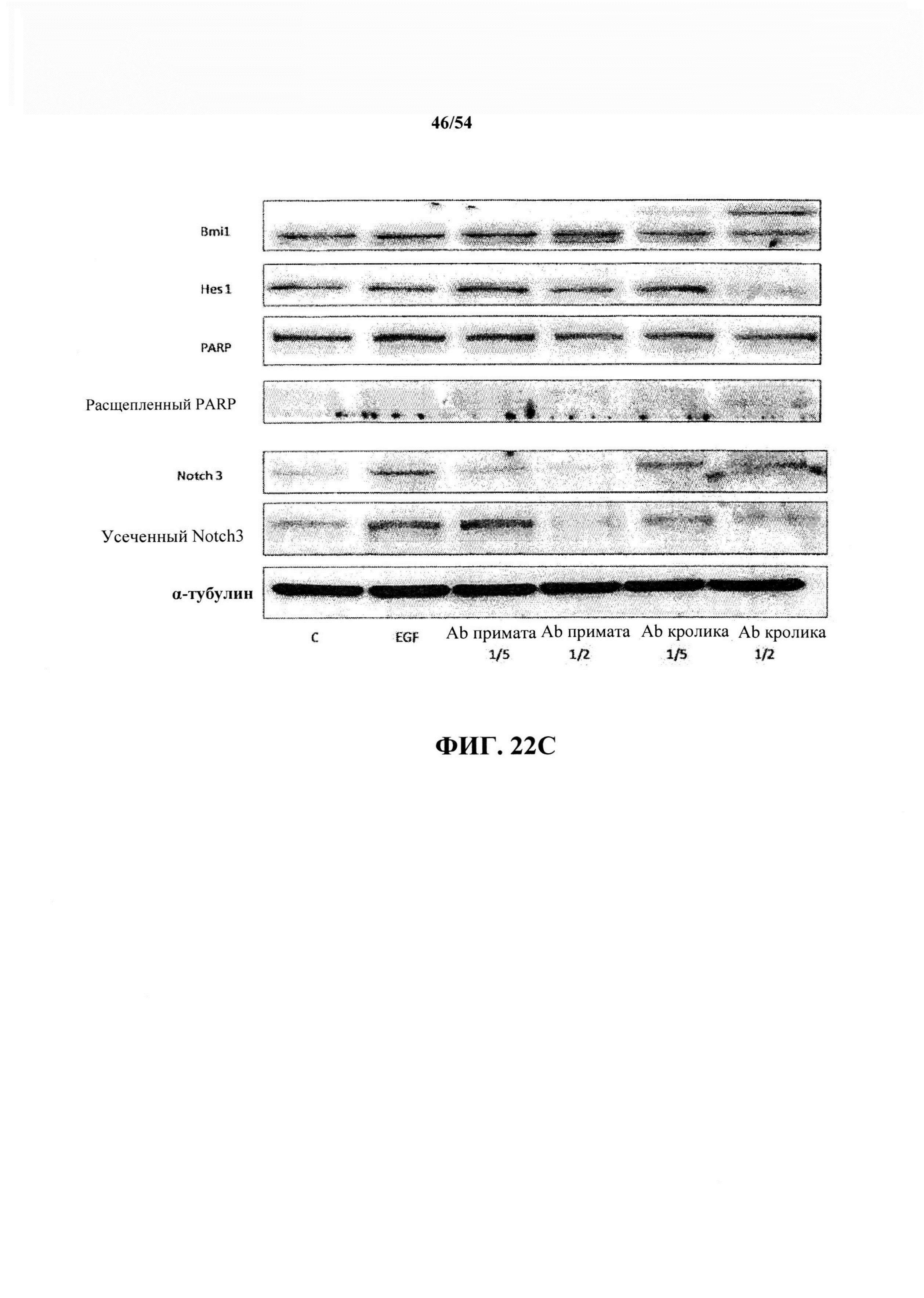
На ФИГ. 22А, 22В, 22С и 22D показаны необработанные данные следующего эксперимента, демонстрирующего сравнение антител к EGF Abl и Ab2 на клетках РС9, в том числе дополнительных маркеров.
На ФИГ. 23 показаны необработанные данные для клеток, которые выращивали на сыворотке человека, вместо того, чтобы индуцировать их с помощью EGF, демонстрирующие появление полосок гиперфосфорилированного Notch3, Akt и STAT-3 с молекулярным весом ниже чем у белка дикого типа.
На ФИГ. 24 показано сильное индуцирование расщепления PARP с помощью Ab2, значительно более сильное, чем наблюдаемое через 24 часа.
На ФИГ. 25 показано, что антитело к EGF ингибирует активацию пути EGFR/EGF в клетках Н2228 NSCLC, транслокацию ALK.
На ФИГ. 26 показано влияние комбинированной терапии в соответствии с настоящим раскрытием на ингибирование горизонтального пути: ЕМТ.
На ФИГ. 27 представлена схематическая демонстрация эффекта TKI в отношении ингибирования пути.
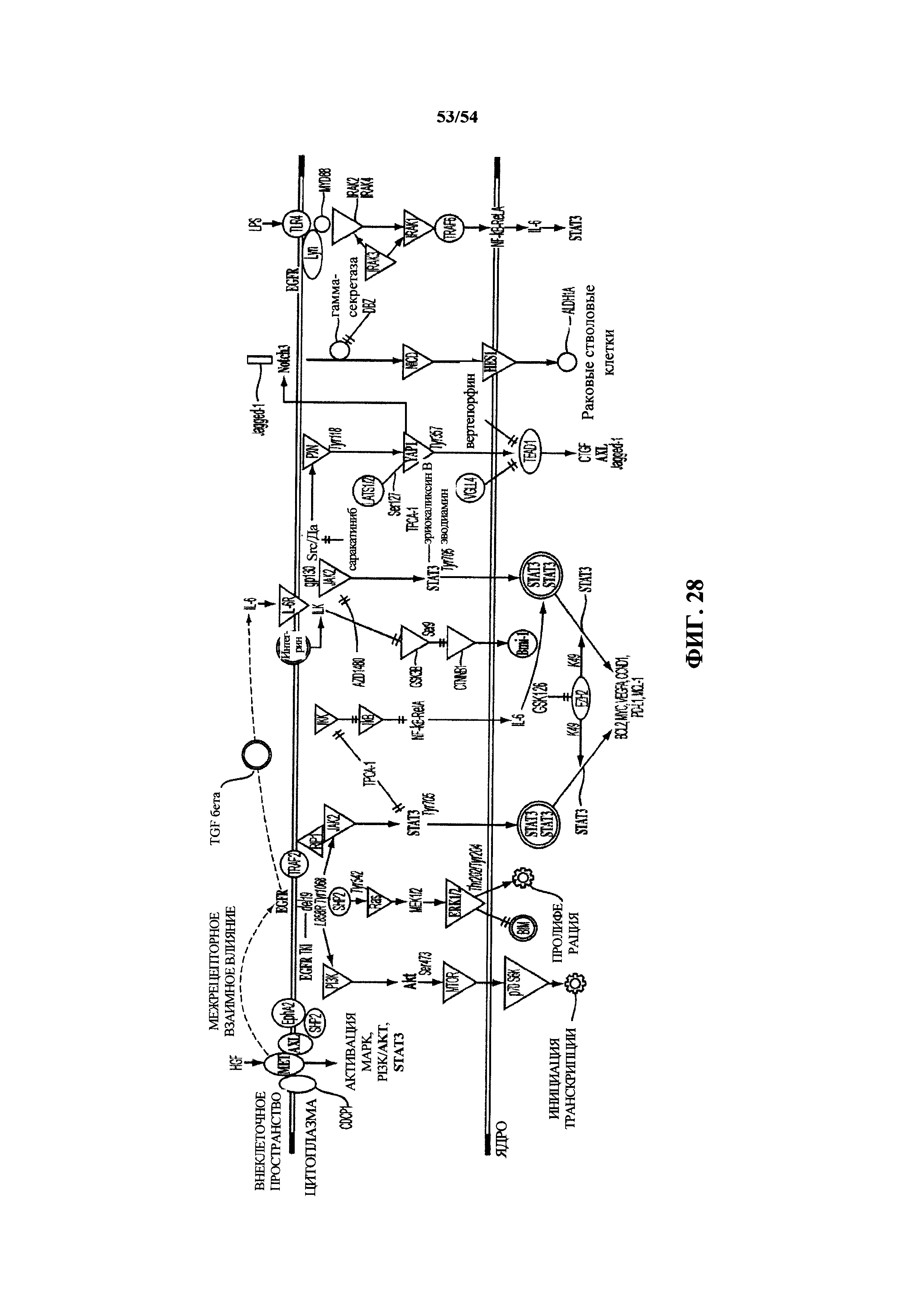
На ФИГ. 28 представлена схематическая демонстрация эффекта антитела к EGF в отношении ингибирования пути.
На ФИГ. 29 представлена схематическая демонстрация эффекта комбинации EGF-PTI и TKI в отношении ингибирования пути.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Варианты осуществления технологии, описываемой в данном документе, основываются на открытии того, что антитела к EGF при физиологических концентрациях обладают ингибиторными эффектами в отношении фосфорилирования EGFR, Akt и ERK1/2, которые по меньшей мере столь же значительны, как и эффект TKI в отношении этих сигнальных молекул. Кроме того, было обнаружено, что комбинированное лечение антителами к EGF и TKI демонстрирует дополнительный эффект в отношении ингибирования pEGFR, pAkt, pERK1/2 и pSTAT-3. В некоторых вариантах осуществления такие антитела или их антиген-связывающие фрагменты могут быть использованы в способах лечения NSLC. Объем настоящего раскрытия предусматривает, что антитела к EGF могут быть активно получены in vivo путем введения вакцины, дающей иммунную ответную реакцию на EGF. Кроме того, объем настоящего раскрытия предусматривает, что могут быть введены пассивные моноклональные антитела к EFG.
Для удобства, в данном документе собраны некоторые термины, используемые в описании, примерах и прилагаемой формуле изобретения. Если не указано иное или не подразумевается из контекста, то следующие термины и фразы включают в себя значения, приведенные ниже. Если четко не указано иное или не очевидно из контекста, то приведенные ниже термины и фразы не исключают значения, которые этот термин или фраза приобрела в области техники, к которой они относятся. Определения представлены с целью описания конкретных вариантов осуществления и не предназначены для ограничения заявляемого изобретения, поскольку объем настоящего изобретения ограничивается исключительно формулой изобретения. Если не указано иное, то все технические и научные термины, используемые в данном документе, имеют то же значения, которые обычно известны специалисту в области техники, к которой относится настоящее изобретение.
Термины «уменьшать», «снижать», «сниженный», «снижение», «уменьшение» и «ингибировать» используются в данном документе в основном для обозначения уменьшения на статистически значимую величину относительно эталона. Однако во избежание неопределенности термины «снижать», «снижение», или «уменьшать», или «ингибировать», как правило, означают снижение по меньшей мере на 10% по сравнению с эталонным уровнем и может включать в себя, например, снижение по меньшей мере на приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, включительно до полного отсутствия данного объекта или параметра по сравнению с эталонным уровнем, или любое уменьшение от 10 до 99% по сравнению с отсутствием данного лечения.
Термины «повышенный», «повышать», или «усиливать», или «активировать» используются в данном документе в основном для обозначения повышения на статистически значимую величину; во избежание неопределенности, термины «повышенный», «повышать», или «усиливать», или «активировать» означают повышение по меньшей мере на 10% по сравнению
с эталонным уровнем, например, повышение по меньшей мере на приблизительно 20%, или по меньшей мере приблизительно 30%, или по меньшей мере приблизительно 40%, или по меньшей мере приблизительно 50%, или по меньшей мере приблизительно 60%, или по меньшей мере приблизительно 70%, или по меньшей мере приблизительно 80%, или по меньшей мере приблизительно 90% или включительно до 100% повышения, или любое повышение от 10 до 100% по сравнению с эталонным уровнем, или по меньшей мере в приблизительно 2 раза, или по меньшей мере в приблизительно 3 раза, или по меньшей мере в приблизительно 4 раза, или по меньшей мере в приблизительно 5 раз или по меньшей мере в приблизительно 10 раз, или любое повышение от 2 раз до 10 раз или больше по сравнению с эталонным уровнем.
Термины «выделенный» или «частично очищенный», используемые в данном документе, в случае нуклеиновой кислоты или полипептида относятся к нуклеиновой кислоте или полипептиду, отделенным по меньшей мере от одного другого компонента (например, нуклеиновой кислоты или полипептида), который присутствует с нуклеиновой кислотой или полипептидом, найденными в их природном источнике, и/или который может присутствовать с нуклеиновой кислотой или полипептидом при экспрессии клеткой или секреции, в случае секретируемых полипептидов. Химически синтезированные нуклеиновая кислота или полипептид, или синтезированные с использованием транскрипции/трансляции in vitro, считают «выделенными». Термины «очищенный» или «практически очищенный» относятся к выделенным нуклеиновой кислоте или полипептиду, которые составляют по меньшей мере 95% по весу рассматриваемых нуклеиновой кислоты или полипептида, в том числе, например, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или больше.
Термины «белки» и «полипептиды», используемые в данном документе, используются в данном документе взаимозаменяемо для обозначения серий аминокислотных остатков, соединенных друг с другом пептидными связями между альфа-амино- и карбокси-группами соседних остатков. Термины «белок» и «полипептид», которые используются в данном документе взаимозаменяемо, относятся к полимеру аминокислот белка, в том числе модифицированных аминокислот (например, фосфорилированных, гликированных, гликозилированных и т.д.) и аналогов аминокислот, независимо от их размера или функции. Термины «белок» и «полипептид» зачастую используются для обозначения относительно больших полипептидов, тогда как термин «пептид» часто используется для обозначения небольших полипептидов, однако применение данных терминов в уровне техники перекрывается. Термины «белок» и «полипептид» используются в данном документе взаимозаменяемо при упоминании кодируемого геном продукта и его фрагментов. Таким образом, типичные полипептиды или белки включают в себя генные продукты, встречающиеся в природе белки, гомологи, ортологи, паралоги, фрагменты и другие эквиваленты, варианты, фрагменты и аналоги вышеупомянутых.
Термин «антитело», используемый в данном документе, включает любую иммуноглобулиновую молекулу, которая распознает и специфически связывается с мишенью, такой как белок, полипептид, пептид, углевод, полинуклеотид, липид и т.д., через по меньшей мере один сайт распознавания антигена в вариабельной области иммуноглобулиновой молекулы. Термин, используемый в данном документе, используется в широком смысле и охватывает интактные поликлональные антитела, интактные моноклональные антитела, фрагменты антител (такие как фрагменты Fab, Fab', F(ab').sub.2, и Fv), мутанты одноцепочечного Fv (scFv), мультиспецифичные антитела, такие как биспецифичные антитела, образованные по меньшей мере из двух интактных антител, слитые белки, содержащие часть антитела, и любую другую модифицированную иммуноглобулиновую молекулу, содержащую сайт распознавания антигена, при условии, что антитела проявляют требуемую биологическую активность. Антитело может принадлежать к любому из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, или к их подклассам (изотипам) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), основанным на идентичности их константных доменов тяжелой цепи, называемых соответственно альфа, дельта, эпсилон, гамма и мю. Разные классы иммуноглобулинов имеют различные и хорошо известные структуры субъединиц и трехмерные конфигурации. Антитела могут быть «голыми» или конъюгированными с другими молекулами, такими как цитотоксины, токсины, радиоизотопы и т.д. Антитела могут быть введены путем их активного продуцирования in vivo или пассивного введения моноклональных антител.
Термины «полинуклеотид» или «нуклеиновая кислота», используемые в данном документе взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть включен в полимер с помощью ДНК- или РНК-полимеразы или с помощью реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги.
«Антитела» (Ab) и «иммуноглобулины» (Ig) представляют собой гликопротеины, обладающие одинаковыми структурными характеристиками. Несмотря на то, что антитела проявляют специфичность связывания с определенным антигеном, иммуноглобулины включают в себя как антитела, так и другие антителоподобные молекулы, которые обычно не имеют антигенной специфичности. Например, полипептиды последнего вида продуцируются с низкими уровнями содержания лимфатической системой и с повышенными уровнями содержания - миеломами.
Термины «антитело» и «иммуноглобулин» используются взаимозаменяемо в широком смысле и включают моноклональные антитела (например, полной длины или интактные моноклональные антитела), поликлональные антитела, моновалентные, поливалентные антитела, мультиспецифичные антитела (например, биспецифичные антитела, при условии, что они обладают требуемой биологической активностью), а также могут включать некоторые фрагменты антител (описываемые более подробно в данном документе). Антитело может быть химерным, человеческим, гуманизированным и/или с созревшей аффинностью.
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей, антитела (иммуноглобулины) могут быть отнесены к разным классам. Существуют пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и несколько из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG-1, IgG-2, IgA-1, IgA-2 и т.д. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются соответственно α, δ, ε, γ и μ. Субъединичные структуры и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны и в общих чертах описываются, например, в Abbas et al. Cellular and Mol. Immunology, 4th ed. (2000). Антитело может быть частью более крупной слитой молекулы, образованной ковалентной или нековалентной связью антитела с одним или несколькими другими белками или пептидами.
Термины «антитело полной длины», «интактное антитело» и «цельное антитело» используются в данном документе взаимозаменяемо и относятся к антителу и его практически интактной форме, а не к фрагментам антитела, как описывается ниже. В частности, термины относятся к антителу с тяжелыми цепями, которые содержат Fc-область.
«Фрагменты антитела» содержат только часть интактного антитела, где часть предпочтительно сохраняет по меньшей мере одну, предпочтительно большую часть или все функции, в норме ассоциированные с этой частью, в случае присутствия в интактном антителе. В одном варианте осуществления фрагмент антитела содержит антигенсвязывающий сайт интактного антитела и, таким образом, сохраняет способность связывать антиген. В другом варианте осуществления фрагмент антитела, например фрагмент, который содержит Fc-область, сохраняет по меньшей мере одну из биологических функций, в норме ассоциированных с Fc-областью, в случае присутствия в интактном антителе, таких как связывание FcRn, модулирование времени полужизни антитела, функция ADCC и связывание комплемента. В одном варианте осуществления фрагмент антитела представляет собой моновалентное антитело, которое характеризуется in vivo временем полужизни, по сути подобным таковому у интактного антитела. Например, такой фрагмент антитела может содержать антигенсвязывающее плечо, соединенное с Fc-последовательностью, способной обеспечивать in vivo стабильность фрагмента.
Термин «моноклональное антитело», используемый в данном документе, относится к антителу, полученному из популяции практически однородных антител, т.е. к отдельным антителам в популяции, которая содержит практически идентичную аминокислотную последовательность, за исключением возможных встречающиеся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, направленными против отдельно взятого антигена. Более того, в отличие от препаратов поликлонального антитела, которые как правило включают в себя различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональные антитело направлено против отдельно взятой детерминанты в антигене.
В настоящем документе моноклональные антитела, в частности, включают в себя «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих к конкретному классу или подклассу антител, тогда как оставшаяся цепь(-и) идентична или гомологична соответствующим последовательностям в антителах, полученных от других видов или принадлежащих к другому классу или подклассу антител, а также фрагментах таких антител, при условии, что они обладают требуемой биологической активностью (патент США №4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Человеческое антитело» является антителом, которое имеет аминокислотную последовательность, которая соответствует таковой антитела, полученного от человека и/или полученного с использованием какой-либо из методик получения человеческих антител, описываемых в данном документе. Такое определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, не являющиеся человеческими.
Термин «опухоль», используемый в данном документе, относится к росту и пролиферации всех неопластических клеток, будь то злокачественные или доброкачественные, и всех предраковых и раковых клеток и тканей. Термины «рак», «раковый», «нарушение клеточной пролиферации», «пролиферативное нарушение» и «опухоль» не являются взаимоисключающими, как указывается в данном документе.
Термины «рак» и «раковый» относятся к физиологическому состоянию у млекопитающих или описывают таковое, которое, как правило, характеризуется неконтролируемыми ростом/пролиферацией клеток. Примеры рака включают без ограничения карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких форм рака включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, рак брюшины, печеночноклеточный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак влагалища, рак щитовидной железы, карциному печени и различные типы рака головы и шеи.
Термин «лечение», используемый в данном документе, относится к клиническому вмешательству в попытке изменить естественное течение заболевания индивидуума или клетки, подлежащих лечению, и может осуществляться либо для профилактики, либо в течение клинической патологии. Требуемые эффекты лечения предусматривают предупреждение возникновения или рецидива заболевания, облегчение симптомов, уменьшение любых прямых или опосредованных патологических проявлений заболевания, предупреждение или снижение воспаления и/или повреждения ткани/органа, снижение скорости прогрессирования заболевания, облегчение или паллиативное устранение состояния заболевания и ремиссию или улучшенный прогноз. В некоторых вариантах осуществления антитела по настоящему изобретению используются для замедления развития заболевания или нарушения.
«Фармацевтическое вспомогательное средство» означает средство, которое обычно используется в фармацевтической отрасли и, в частности, средство из «Handbook of excipients», (Raymond С. Rowe, Paul J. Sheskey, Paul J. Weller-4th Edition, 2003), содержание которой включено во всей своей полноте.
«Терапевтически эффективное количество» вещества/молекулы по настоящему изобретению может варьировать в соответствии с факторами, такими как состояние заболевания, возраст, пол и вес индивидуума, а также способностью вещества/молекулы вызывать требуемую ответную реакцию у индивидуума. Терапевтически эффективное количество также представляет собой таковое, при котором любые токсические или вредные эффекты вещества/молекулы компенсируются терапевтически полезными эффектами. Термин «профилактически эффективное количество» относится к количеству, эффективному при дозировках и в течение периодов времени, необходимых для достижения требуемого профилактического результата. Как правило, но не обязательно, поскольку профилактическую дозу используют для субъектов до заболевания или на его ранней стадии, профилактически эффективное количество может быть меньше чем терапевтически эффективное количество.
«Химиотерапевтическое средство» представляет собой химическое соединение, применимое при лечении рака. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, в том числе алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетоненины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; кампотецин (в том числе синтетический аналог топотекан (HYCAMTIN®), СРТ-11 (иринотекан, CAMPTOSAR®), ацетилкампотецин, скополектин и 9-аминокампотецин); бриостатин; каллистатин; СС-1065 (в том числе его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, окись мехлорэтамина гидрохлорида, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацила иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, форемустин, ломустин, нимустин, ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма II и калихеамицин омега II (см., например, Agnew, Chem Inti. Ed. Engl, 33: 183-186 (1994)); динемицин, в том числе динемицин А; эсперамицин; а так же неокарциностатина хромофор и родственные хромопротеиновые энедииновые антибактериальные хромофоры), аклациномицины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубинцин (в том числе ADRJAMYCIN®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, липосомная инъекция доксорубицина HCl (DOXIL®) и деоксидоксорубицина), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пиромицин, квеламицин, родорубицин, стрептонигрин, стрептозицин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как демоптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, каннофур, цитарабин, дидеоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренальные препараты, такие как аминоглютетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогвазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, Oreg.); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно Т-2 токсин, верракурин А, роридин А и ангвидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); тиопета; таксоиды, например, паклитаксел (TAXOL®), состав паклитаксела на основе сконструированных наночастиц альбумина (ABRAXANE™) и доксетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопсид (VP-16); ифосфамид; митроксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новатрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любого из вышеупомянутых; а также комбинации двух или более из вышеупомянутых, такие как CHOP, сокращение для комбинированной терапии циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, сокращение для схемы лечения с оксалиплатином (ELOXATIN™) в комбинации с 5-FU и лейковорином.
«Ответная реакция пациента» может быть оценена с использованием любой конечной точки, показывающей пользу для пациента, в том числе без ограничения (1) ингибирования, до некоторой степени, прогрессирования заболевания, в том числе замедления и полного прекращения; (2) уменьшения числа случаев и/или симптомов заболевания; (3) уменьшения размера повреждения; (4) ингибирования (т.е. снижения, замедления или полной остановки) инфильтрации больных клеток в соседние периферические органы и/или ткани; (5) ингибирования (т.е. снижения, замедления или полной остановки) распространения заболевания; (6) уменьшения пролиферации клеток, инвазии или метастазиса, что может, но не обязательно, приводить к регрессии или абляции очага заболевания; (7) облегчения, до некоторой степени, одного или нескольких симптомов, связанных с нарушением; (8) повышения продолжительности периода отсутствия заболевания после лечения и/или (9) снижения смертности в данный момент времени после лечения.
«Образец ткани или клеток» означает совокупность подобных клеток, полученных из ткани субъекта или пациента. Источником образца ткани или клеток может быть твердая ткань в виде образца свежих, замороженных и/или законсервированных органа или ткани, или биоптата, или аспирата; кровь или любые компоненты крови; жидкости организма, такие как спинномозговая жидкость, амниотическая жидкость, перитонеальная жидкость или межклеточная жидкость; клетки в любой момент созревания или развития субъекта. Образцом ткани также могут быть первичные или культивируемые клетки или клеточные линии. Необязательно образец ткани или клеток получают из больной ткани/органа. Образец ткани может содержать соединения, которые в природных условиях не смешиваются с тканью, такие как консерванты, антикоагулянты, буферы, фиксаторы, питательные вещества, антибиотики или им подобное.
Средства на основе EGFR-TKI
Способы в соответствии с настоящим изобретением предусматривают введение субъекту средства на основе EGFR-TKI. Семейство рецепторов эпидермального фактора роста (EGFR) содержит четыре структурно родственных тирозинкиназ рецепторов клеточной поверхности, которые связывают и вызывают функциональные активности в ответной реакции на представителей семейства эпидермального фактора роста (EGF). У людей оно включает в себя EGFR, также известный как Her-1 и ErbB1, Her-2, также называемый Neu и ErbB2, Her-3 (ErbB3) и Fler-4 (ErbB4). Гиперактивация передачи сигнала ErbB ассоциируется с развитием широкого ряда солидных опухолей. Следовательно, в различных дополнительных вариантам осуществления, настоящее изобретение предусматривает комбинации антител к EGF с эрлотинибом, а также другие ингибиторы EGFR, такие как гефитиниб, афатиниб, панитумумаб и цетуксимаб, а также ингибиторы HER2, такие как лапатиниб, пертузумаб и трастузумаб. В некоторых вариантах осуществления EGFR-TKI представляет собой эрлотиниб, активный ингредиент лекарственного средства, продаваемый в настоящее время под торговой маркой TARCEVA®.
Эрлотиниб представляет собой ингибитор тирозинкиназы хиназолинамин с химическим названием N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин. В конкретных вариантах осуществления эрлотиниб представляет собой гидрохлорид эрлотиниба. Таблетки TARCEVA® для перорального введения доступны в трех дозировках, содержащих гидрохлорид эрлотиниба (27,3 мг, 109,3 мг и 163,9 мг), эквивалентных 25 мг, 100 мг и 150 мг эрлотиниба, и следующие неактивные ингредиенты: моногидрат лактозы, гипромеллозу, гидроксипропилцеллюлозу, стеарат магния, микрокристаллическую целлюлозу, крахмалгликолят натрия, лаурилсульфат натрия и диоксид титана. Для идентификации продукта таблетки также содержат следовые количества красящих добавок, в том числе FD&C Yellow №6 (только 25 мг). Дополнительная информация доступна из одобренной инструкции по применению лекарственного препарата. Одобренная рекомендованная доза TARCEVA® при NSCLC составляет 150 мг/сутки; одобренная доза при раке поджелудочной железы составляет 100 мг/сутки. Дозы при необходимости могут быть снижены со степенями уменьшения по 50 мг.
Согласно другим вариантам осуществления средство на основе EGFR-TKI представляет собой гефитиниб, активный ингредиент лекарственного средства, продаваемый в настоящее время под торговой маркой IRESSA®. Гефитиниб является ингибитором тирозинкиназы с химическим названием 4-хиназолинамин, N-(3-хлор-4-фторфенил)-7-метокси-6-[3-4-морфолин)пропокси]. Клинический состав поставляется в виде 250 мг таблеток, содержащих активный ингредиент, моногидрат лактозы, микрокристаллическую целлюлозу, кроскармеллозу натрия, повидон, лаурилсульфат натрия и стеарат магния. Рекомендованная доза в виде однократной терапии составляет одну 250 мг таблетку в сутки. Дополнительную информацию можно найти в одобренной инструкции по применению лекарственного препарата.
Другие ингибиторы EGFR, такие как афатиниб, панитумумаб и цетуксимаб, а также ингибиторы HER2, такие как лапатиниб, пертузумаб и трастузумаб, известны из уровня техники, и таким образом специалист обычной квалификации легко найдет известные ему структуру, состав, дозировку, путь введения и т.д. (например, на основании опубликованной медицинской информации, такой как одобренная инструкция по применению лекарственного препарата), как это требуется при применении согласно настоящему изобретению.
Низкомолекулярные ингибиторы EGFR приводят к клинической ответной реакции у некоторых пациентов с NSCLC, и эта ответная реакция коррелирует с активирующими мутациями в киназном домене EGFR. Эти мутантные белки являются достаточными для трансформации эпителиальных клеток человека и необходимы для выживания клеточных линий NSCLC. Понимание биологических изменений, вызванных мутантным EGFR, а также его вклада в онкогенез, требует глубокого понимания путей нисходящей передачи сигнала, которые он активирует. Переносчик сигнала и активатор транскрипции 3 (STAT3) представляет собой онкогенный фактор транскрипции, который является активным при многих формах рака у человека и регулирует транскрипцию нескольких генов, которые вовлечены в развитие клеточного цикла, антиапоптоз, выживаемость клетки и ангиогенез.
STAT3 может быть активирован с помощью EGFR, JAK2 и других тирозинкиназ, активация которых может быть опосредована EGF, лейкоз-ингибирующим фактором (LIF) и другими цитокинами. Следовательно, STAT3 является конвергентной точкой многих сигнальных путей и играет главную роль в онкогенезе и метастазе опухоли. Считается, что STAT3 активируется разными формами мутантного EGFR и может содействовать онкогенным эффектам таких мутантов в фибробластах и клетках рака легкого человека.
После активации с помощью либо связывания лиганда, либо мутации, EGFR инициирует каскад путей передачи сигнала, которые изменяют биологию клетки посредством транскрипционных и посттрансляционных механизмов. Сигнальные пути, которые опосредуют такие изменения, включают в себя Ras-Raf-митоген-активированный белок (MAP) - киназу (MAPK), фосфоинозитид-3-киназу-AKT, а также переносчики сигнала и активаторы транскрипции (STAT) 3 и пути передачи сигнала STAT5. Семейства STAT факторов транскрипции активируются путем фосфорилирования по консервативному тирозиновому остатку, что ведет к димеризации, ядерной транслокации и связыванию ДНК. STAT1, STAT3 и STAT5 также фосфорилированы по сериновому остатку на их СООТ-конце; такое фосфорилирование считается необязательным для димеризации, ядерной транслокации и связывания ДНК, однако необходимым для максимальной транскрипционной активности некоторых генов.
Некоторые линии клеток немелкоклеточного рака легкого содержат конститутивно активный STAT3. Недавно было показано, что STAT3 активируется несколькими из этих мутантов EGFR в генетически определенной системе. Неизвестно, какие из путей передачи сигнала в прямом направлении в отношении мутантного EGFR необходимы для опосредования его онкогенных свойств, однако учитывая роль STAT3 в широком диапазоне злокачественных опухолей человека, а также тот факт, что он активируется EGF в различных типах клеток, полагают, что STAT3 необходим для онкогенных эффектов соматических мутантных EGFR. Сообщалось, что STAT3 активируется в фибробластах, экспрессирующих мутантные EGFR, а также в двух линиях NSCLC с природными мутациями EGFR, и что такая активация необходима для трансформации и выживания этих клеток.
Активация STAT3 зачастую предусматривает взаимодействие лиганд-рецептор. STAT3 может быть активирован многими различными цитокинами, в том числе интерферонами, EGF, G-CSF и цитокинами семейства интерлейкинов (IL-6). Связывание цитокинов с их когнатными рецепторами приводит к фосфорилированию JAK, димеризации STAT3, ядерной транслокации, связыванию ДНК и генной активации (12, 13). Кроме того, фосфорилирование STAT3 также может быть индуцировано цитоплазматической тирозинкиназой, такой как киназа (14) семейства Src. Сообщалось, что повышенная активность EGFR и активация STAT3 положительно коррелируют во многих образцах первичной опухоли и в полученных из опухоли линиях клеток, в том числе NSCLC, рака молочной железы и карцином головы и шеи.
Повышенную активность STAT3 наблюдают в аденокарциномах легкого и в клеточных линиях, экспрессирующих мутантные EGFR. Без привязки к какой-либо конкретной теории считается, что STAT3 необходим для мутантных EGFR, а также необходим для его фенотипических эффектов в прямом направлении. Ингибирование функции STAT3 в фибробластах отменяет трансформацию мутантным EGFR. К сожалению, целенаправленно воздействующие виды терапии, такие как TKI, не могут полностью отменить активность STAT3 в клеточных линиях NSCLC.
Предыдущие исследования подтверждают, что мутантный EGFR индуцирует активацию пути gpl3O/JAK/STAT3 посредством активации IL-6. Экспрессия опухолью компонентов рецепторов IL-6 и IL-6 gp8O и gpl3O была обнаружена в образцах NSCLC (20). Также наблюдали, что повышенные уровни провоспалительных цитокинов, таких как IL-6 и IL-8, также связаны с опухолеобразованием NSCLC и прогнозом. Это указывает а то, что IL-6 и его прямой путь являются потенциальной мишенью для пациента с NSCLC, содержащим мутацию EGFR. Однако механизм индуцирования IL-6 путем онкогенных мутаций EGFR в NSCLC остается неясным; тем не менее, считается, что передача сигнала NF-kB и STAT3 отвечает за регулирование аутокринного IL-6 при раке легкого.
В соответствии с одним аспектом настоящего изобретения антитела к EGF используются для лечения пациентов, страдающих формами рака, вызванными дерегулированным рецептором эпидермального фактора роста человека 1 (HER 1/EGFR человека), путем введения пациенту, при необходимости такого лечения, гибкой и активной схемы с целью объединения ингибитора тирозинкиназы (TKI) и антитела к EGF в соответствии с настоящим изобретением с целью ингибирования пути, активированного связыванием EGF-EGFR (mAb), при этом TKI вводят в соответствии с непрерывной схемой из расчета средней суточной дозы в диапазоне от приблизительно 10 до 250 мг, и EGF-TPI в соответствии с настоящим изобретением назначают совместно в соответствии со схемой введения дозы с достижением терапевтически эффективного количества, введение которого повторяют три раза, два раза или один раз в неделю, один раз в две недели, один раз в три недели или по меньшей мере один раз в месяц.
В соответствии с дополнительным аспектом настоящего изобретения антитела к EGF создают путем вакцинации пациентов, страдающих формами рака, вызванными дерегулированным рецептором эпидермального фактора роста человека (HER 1/EGFR человека), путем введения пациенту, при необходимости такого лечения, гибкой и активной схемы с целью объединения ингибитора тирозинкиназы (TKI) и вакцины, дающей иммунную ответную реакцию на EGF, при этом TKI вводят в соответствии с непрерывной схемой из расчета средней суточной дозы в диапазоне от приблизительно 10 до 250 мг, и при этом вакцину в соответствии с настоящим изобретением назначают совместно в соответствии со схемой введения дозы с достижением терапевтически эффективного количества, введение которого повторяют три раза, два раза или один раз в неделю, один раз в две недели, один раз в три недели или по меньшей мере один раз в месяц.
В соответствии с дополнительным аспектом настоящего изобретения наблюдали, что эффект антител к EGF при физиологических концентрациях в отношении фосфорилирования EGFR, Akt и ERK1/2 является по меньшей мере столь же значительным, как и эффект TKI, таких как гефитиниб, в отношении этих сигнальных молекул. Объем настоящего изобретения предусматривает, что комбинированное лечение антителами к EGF и TKI, такими как гефитиниб, демонстрирует неожиданный и значительный синергический эффект в отношении ингибирования pEGFR, pAkt, pERKl/2. Без привязки к какой-либо конкретной теории полагают, что введение гефитиниба в клетки с мутантным EGFR приводит к активации STAT3, рассматриваемой как первая стадия приобретения устойчивости к терапии, и что комбинация антител к EGF в соответствии с настоящим изобретением ингибирует такую активацию.
Традиционные терапевтические препараты на основе TKI, такие как гефитиниб и эрлотиниб, обсуждаемые выше, показаны для введения пациентам по суточной схеме для лечения рака при дозировках, предназначенных для блокировки активации EGFR. Однако, выше также обсуждалось, что у пациентов часто развивается устойчивость к такому лечению. Настоящее раскрытие основывается на неожиданном открытии заявителей того, что схема введения дозы TKI в комбинации с активным или пассивным применением антител к EGF может быть введена пациентам с устойчивостью для преодоления у них устойчивости или пациентам, которые не отвечают на TKI-терапию для преодоления у них отсутствия ответной реакции (оба признака далее включаются в термин «устойчивый» при использовании для описания индивидуумов с раком). Такая схема комбинированного дозирования на удивление хорошо переносится. Следующие варианты осуществления настоящего изобретения основываются на идентификации авторами настоящего изобретения метаболического пути STAT3 как отвечающего за его устойчивость или отсутствие ответной реакции.
Способы по настоящему изобретению не ограничиваются лечением NSLC. Вместо этого легко понять, что рассматриваемые биомолекулярные пути и устранение устойчивости к TKI с помощью способов по настоящему изобретению могут найти применение в лечении других состояний заболевания; любого состояния заболевания, лечение которого с помощью TKI приведет к положительному результату для пациента, подвергаемого лечению. «Положительные результаты» могут включать в себя без ограничения ослабление тяжести состояния заболевания, предупреждение ухудшения состояния заболевания, излечение состояния заболевания и продление жизни пациента или продолжительности жизни. Такие состояния заболевания могут быть связаны или быть модулированы EGFR или любой другой киназой, на которые можно клинически воздействовать способами по настоящему изобретению.
Более конкретно, экспериментальные исследования авторов данного изобретения, изложенные в следующих примерах, продемонстрировали клиническую активность TKI при суточных схемах введения дозы дозы в молекулярных исследованиях на этих опухолях, демонстрирующих эффективное ингибирование каскада передачи сигнала EGFR. Примеры подтвердили, что молекулярные исследования правильно отражают поведение этих TKI, как это наблюдали в других модельных системах. Настоящее раскрытие также неожиданно демонстрирует, что TKI в комбинации с антителами к EGF, которые пассивно вводятся или активно продуцируются путем введения вакцины, продуцирующей такие антитела, могут эффективно ингибировать рост опухоли на молекулярных моделях, даже у опухолей, которые демонстрировали устойчивость к традиционной TKI-терапии.
В одном иллюстративном варианте осуществления антитела к EGF, используемые в доклинических исследованиях, активно продуцировались с помощью иммунизаций с конъюгатом rEGF-rP64k, вакциной CIMAvax-EGF, как описано в Manufacturing Process Development for an Epidermal Growth Factor-Based Cancer Vaccine, Rodriguez et al., (Supplement to Biopharm International October 2008, содержание которой включено во всей своей полноте с помощью ссылки), составленной с адъювантом Montanide. Объем настоящего раскрытия предусматривает, что могут использоваться другие составы вакцины, которые дают иммунную ответную реакцию на EGF или EGFR. Также объем настоящего раскрытия предусматривает, что также могут быть использованы вакцины, дающие иммунную ответную реакцию на другие факторы роста или их рецепторы. В частности, для получения антител к EGF в соответствии с настоящим раскрытием могут использоваться иммуногенные белки, изложенные в WO 2013/076580 и WO 2014/140894, содержание которых включено во всей своей полноте с помощью ссылки.
Не желая быть связанным какой-либо теорией полагают, что такая супрессия метаболического пути STAT3, которая необходима для стимуляции сигнальных путей клетки, отвечающих за пролиферацию клеток; также полагают, что дополнительное ингибирование STAT3 с помощью комбинированной схемы введения дозы согласно настоящему изобретению является эффективным при ингибировании или подавлении этой передачи сигнала клетками. Более того, даже те пациенты, которые являются устойчивыми к традиционной TKI-терапии, могут получать полезный противоопухолевый эффект с помощью комбинированной схемы введения дозы согласно настоящему изобретению, поскольку STAT3 также ингибируется. Комбинированная терапия по настоящему раскрытию может быть связана с осложнением состояния заболевания, когда традиционные терапевтические препараты на основе TKI не работают. Следовательно, с помощью способов по настоящему изобретению можно преодолевать устойчивость или отсутствие ответной реакции на TKI-терапию, действуя по-другому, чем традиционные способы на клеточном и молекулярном уровнях.
В конкретных вариантах осуществления комбинированная дозировка TKI с антителами к EGF может быть эффективной в лечении рака, и особенно рака легкого, молочной железы и предстательной железы, у индивидуума с устойчивостью к традиционной TKI-терапии. Другие формы рака, которые можно лечить способами по настоящему изобретению, включают без ограничения рак желудка, ободочной и прямой кишки и яичника, а также опухоли, представляющие собой глиобластому. Каждая их этих форм рака демонстрирует значительную экспрессию EGFR, что делает их подходящими мишенями для лечения в соответствии со способами по настоящему изобретению.
TKI, подходящие для применения в соответствии со способами по настоящему изобретению, могут включать в себя без ограничения TKI, которые обычно известны для применения в лечении рака, и в частности рака молочной железы, легкого и предстательной железы. В качестве примера, такие TKI могут включать в себя без ограничения IRESSA® и TARCEVA®, описываемые выше, но кроме того могут включать в себя Cl 1033 (доступный от Pfizer Inc.), PKI166 (доступный от Novartis AG), GW2016 (доступный от GlaxoSmithKline), EKB569 (доступный от Wyeth), IMC-C225 (доступный от ImClone Systems Inc. и Bristol-Myers Squibb Co.), а также их фармацевтически приемлемые соли или эквиваленты; при этом каждый из последней группы в настоящее время проходит стадию клинического испытания фазы I или фазы II, причем все из них включены под терминами «ингибиторы киназы» или «TKI».
В частности обнаружилось, что некоторые TKI обладают эффективной противоопухолевой активностью и были одобрены или проходят клинические испытания. Примеры таковых включают в себя без ограничения Zactima (ZD6474), Iressa® (гефитиниб) и Tarceva® (эрлотиниб), мезилат иматиниба (STI57l; Gleevec), эрлотиниб (OSI-1774; Tarceva®), канертиниб (Cl 1033), семаксиниб (SU5416), ваталаниб (PTK787/ZK222584), сорафениб (BAY 43-9006), сутент (SU11248) и лефлуномид (SU101).
Эффективность данного лечения в отношении рака может быть определена опытным клиницистом. Однако лечение считают «эффективным лечением», при использовании этого термина в данном документе, если какой-либо один или все из признаков или симптомов, например опухоли, изменяются в положительную сторону, или улучшаются другие клинически принятые симптомы, или даже облегчаются, например по меньшей мере на 10% после лечения средством, описываемым в данном документе. Эффективность также может быть измерена по прекращению ухудшения у индивидуума при оценке в условиях госпитализации или необходимости медицинского вмешательства (т.е. прекращению прогрессирования заболевания). Способы измерения таких признаков известны специалистам в данной области техники и/или описываются в данном документе.
Эффективное количество для лечения заболевания означает такое количество, которое при введении млекопитающему, при необходимости в этом, является достаточным для обеспечения эффективного лечения такого заболевания, в рамках определения этого термина в данном документе. Эффективность средства может быть определена с помощью оценки физических показаний, например для рака, например, размера опухоли, массы опухоли, плотности опухоли, ангиогенеза, скорости роста опухоли и т.д. Кроме того, эффективность средства может быть измерена путем снижения MIC циркулирующих пептидов или их фрагментов у субъекта, подвергаемого лечению средством, содержащим антитело или его антигенсвязывающую часть, описываемые в данном документе, или нуклеиновую кислоту, кодирующую антитело или его антигенсвязывающую часть, описываемые в данном документе.
Описание вариантов осуществления настоящего раскрытия не является исчерпывающим или не ограничивает настоящее раскрытие раскрываемой точной формой. Между тем как конкретные варианты осуществления и примеры раскрытия описываются в данном документе в иллюстративных целях, в объеме настоящего раскрытия возможны различные эквивалентные модификации, очевидные для специалистов в данной области техники. Идеи настоящего раскрытия, представленные в данном документе, при необходимости могут быть использованы для других процедур или способов. Разные варианты осуществления, описываемые в данном документе, могут быть объединены с обеспечением дополнительных вариантов осуществления. При необходимости, аспекты настоящего раскрытия могут быть модифицированы для использования композиций, функций и концепций вышеупомянутых ссылок и заявки с обеспечением дополнительных вариантов осуществления настоящего раскрытия. Эти и другие изменения могут быть выполнены в настоящем раскрытии в свете подробного описания.
Определенные элементы любого из вышеупомянутых вариантов осуществления могут быть объединены или заменены элементами в других вариантах осуществления. Более того, хотя преимущества, связанные с определенными вариантами осуществления настоящего раскрытия, были описаны в контексте этих вариантов осуществления, другие варианты осуществления также могут проявлять такие преимущества, но не все варианты осуществления, чтобы попасть в объем настоящего раскрытия, обязательно должны демонстрировать такие преимущества.
Примеры
Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые не следует рассматривать как ограничение.
Пример I. Оценка антитела к EGF в отношении ингибирования пути EGF/EGFR с WB в качестве конечной точки
Цели: сравнить в линии клеток РС9 от пациентов с NSCLC эффект антител к EGF с гефитинибом в отношении ингибирования пути, активированного связыванием EGF-EGFR. Оценить, будет ли в той же клеточной линии комбинация антитела к EGF и гефитиниба иметь синергический эффект.
Материалы и способы для тестирования активации с помощью метода вестерн-блоттинга (WB)
Линия клеток РС9 несет делецию в экзоне 19, что делает эту линию клеток чувствительной к TKI. Она представляет собой модель для мутантного сегмента EGFR у группы пациентов с NSCLC, получающих лечение TKI первой линии.
Все материалы культуры тканей для этих экспериментов получали от Biological Industries (Киббуц Бейт Хэмек, Израиль) или Invitrogen (Пэйсли, Шотландия, Великобритания). Линия клеток РС9 была любезно предоставлена компанией F. Hoffman-La Roche Ltd (Базель, Швейцария). Клетки поддерживали в среде RPMI, дополненной 10% фетальной бычьей сывороткой (FBS), 50 мкг/мл пенициллина-стрептомицина и 2 мМ L-глутамина. Клетки росли в увлажненной атмосфере с 5% СО2 при 37°С.
Антитела против EGF, используемые в данном проекте, получали из исследования иммунизации на обезьянах, которые получали 4 иммунизации вакциной CIMAvax-EGF с конъюгатом rEGF-rP64k, составленной с адъювантом Montanide (Abl), как описано выше. Сыворотку обрабатывали в геле Mellon для удаления примесей, таких как комплемент.Очистку проводили в Шотландии, Абердин, Великобритания. Титр Elisa составлял около 1/60000.
Эксперимент 1: в типичном стандартном эксперименте исследуемую линию клеток в пяти колбах Т-75 культивировали до конфлюентности около 70%, дважды промывали с помощью PBS и выращивали на протяжении ночи в среде без сыворотки. Затем выращенные в условиях сывороточного голодания клетки снова промывали и обрабатывали следующим образом.
Для первых экспериментов разбавления антитела к EGF тестировали при 1 к 20, 1 к 10 и один к 5 отдельно или в комбинации с гефитинибом. Гефитиниб использовали при концентрации среды приблизительно 40 наномоль, EGF и антитело или гефитиниб, или как антитело к EGF, так и гефитиниб смешивали и предварительно инкубировали при приблизительно 37°С в течение приблизительно 10 мин. перед добавлением в клетки. Обработка длилась в течение приблизительно 15 минут.
Эксперимент 2: во втором эксперименте антитело к EGF тестировали только при разбавлении 1 к 2. Концентрация гефитиниба составляла 0,5 микромоля. В данном эксперименте обработку продлевали до приблизительно 2 часов.
После обработки в экспериментах 1 и 2 культуры промывали с помощью PBS и лизировали в буфере для лизиса, содержащем ингибиторы протеазы и фосфатазы. Равные количества белка загружали в гель SDS-PAGE, переносили на мембрану и подвергали блоттингу с антителами к EGFR, p-EGFR, ERK1/2, p-ERK1/2, Akt, p-Akt, STAT 3 и pSTAT-3. Интенсивность полосок определяли с использованием программы ImageJ, а затем подвергали двухстадийной нормализации. Сначала интенсивность фосфорилированной полоски делили на интенсивность полоски, соответствующей общему количеству белка в том же образце. Затем это значение делили на значение, полученное в клетках, обработанных EGF, для того же белка. Как EGF, так и антитела к EGF, используемые в данном проекте, получали из исследования иммунизации на обезьянах, которые получали 4 иммунизации вакциной CIMAvax-EGF с конъюгатом rEGF-rP64k, составленной с адъювантом Montanide. Вакцина и полученные в результате антитела к EGF были предоставлены компанией Bioven (Europe) Ltd, Cruikshank Building North, Aberdeen Biotechnology, Крейбстоун Абердин, Великобритания, Шотландия. Антитела для вестерн-блоттинга приобретали у компании Santa Cruz Biotechnologies (Пало-Альто, Калифорния). Необработанные данные экспериментального проекта представлены на ФИГ. 1.
Результаты экспериментов 1 и 2 (2-часовая инкубация): результаты второго эксперимента показаны на ФИГ. 2, представленной в настоящем документе, со следующими наблюдениями. Результаты эксперимента 1, представленные на ФИГ. 1, подтверждают эффекты, свидетельствующие о том, что длительная инкубация оказывает значительное влияние на фосфорилирование STAT3. Также наблюдали, что эффект антитела к EGF в отношении фосфорилирования EGFR, Akt и ERK1/2 является по меньшей мере столь же значительным, как и эффект гефитиниба в отношении этих сигнальных молекул. Также заключили, что комбинированное лечение антителом к EGF и гефитинибом демонстрирует дополнительный эффект в отношении ингибирования pEGFR, pAkt, pERKl/2. Без привязки к какой-либо конкретной теории полагают, что введение гефитиниба в клетки с мутантным EGFR приводит к активации STAT3, рассматриваемой как первая стадия приобретения устойчивости к терапии.
Исходя из экспериментального воздействия антитела к EGF на клетки РС9 становится ясно, что антитело к EGF не активирует STAT3, а напротив, - оказывает несколько ограниченный ингибиторный эффект. Кроме того, был сделан вывод о том, что, неожиданно, комбинированное лечение полностью обращало активацию STAT3 гефитинибом, что подтверждает, что комбинированное лечение может быть успешным у мутантных по EGFR пациентов с NSCLC, как подтверждается на ФИГ. 2.
Эксперимент 3: в третьем эксперименте антитело к EGF тестировали только при разбавлении 1 к 2. Концентрация эрлотиниба составляла 0,5 микромоля. В данном эксперименте обработку продлевали до приблизительно 2 часов. После обработки культуры промывали с помощью PBS и лизировали в буфере для лизиса, содержащем ингибиторы протеазы и фосфатазы. Равные количества белка загружали в гель SDS-PAGE, переносили на мембрану и подвергали блоттингу с антителами к EGFR, p-EGFR, ERK1/2, p-ERK1/2, Akt, p-Akt, STAT 3 и pSTAT-3. Интенсивность полосок определяли с использованием программы ImageJ, а затем подвергали двухстадийной нормализации. Сначала интенсивность фосфорилированной полоски делили на интенсивность полоски, соответствующей общему количеству белка в том же образце. Затем это значение делили на значение, полученное в клетках, обработанных EGF, для того же белка. Как EGF, так и антитело к EGF были предоставлены компанией Bioven. Антитела для вестерн-блоттинга приобретали у компании Santa Cruz Biotechnologies (Пало-Альто, Калифорния). Необработанные данные экспериментального проекта отображены на ФИГ. 3 и кратко описаны в таблице 1 ниже.

Пример 2. Оценка антитела к EGF (отдельно взятого средства и в комбинации с гефитинибом) в отношении ингибирования путей EGF/EGFR с WB в качестве конечной точки
Следующий эксперимент выполняли для сравнения в линии клеток РС9 NSCLC эффектов антител к EGF и гефитиниба, а также эрлотиниба в отношении ингибирования путей, активированных связыванием EGF-EGFR, для оценки того, превосходила ли комбинация антитела к EGF и гефитиниба или эрлотиниба в той же линии клеток лечение с помощью отдельно взятого средства. Эксперимент разрабатывали для сравнения в линии клеток РС9, устойчивой к гефитинибу и несущей мутацию Т790М (PC9-GR4), эффектов антител к EGF и TAGRISSO™ AstraZeneca (AZD929l), которое одобрено US FDA для пациентов с метастатическим немелкоклеточным раком легкого, позитивным по мутации Т790М EGFR, в отношении ингибирования путей, активированных связыванием EGF-EGFR, а также для оценки того, превосходила ли комбинация антитела к EGF и AZD929l на той же линии клеток методы лечения с помощью отдельно взятого средства.
Материалы и способы для тестирования активации методом вестерн-блоттинга (WB) клеточных линий
При выполнении данного исследования использовали линии клеток, полученные из РС9, которые являются устойчивыми к TKI. Исходная РС9 представляет собой клетки, полученные из NSCLC, которые содержат делецию 15 пар оснований в экзоне 19 и чрезвычайно чувствительны к гефитинибу и форетинибу (IC50 в нМ диапазоне). Они представляют собой модель для мутантного сегмента EGFR в популяции пациентов с NSCLC, получающих лечение TKI первой линии. Клетки РС9 обрабатывали повышающимися концентрациями эрлотиниба и гефитиниба в течение 2-месячного периода и получали 6 разных линий (PC9-ER и GR1 - GR5), которые были устойчивыми как к гефитинибу, так и к эрлотинибу (IC50 примерно 5-10 мкМ). Подобно пациентам, ни одна из 6 линий не утратила сенсибилизирующую мутацию (делецию 15 пар оснований), однако мутация устойчивости Т790М присутствовала в двух из них. Эти две линии клеток (PC9-GR1 и GR4) являются чувствительными к новому поколению TKI EGFR, разработанному компанией Astra Zeneca (AZD929l), которое также может связываться с мутантным белком Т790М EGFR.
Материалы
Все материалы культуры ткани получали от Biological Industries (киббуц Бейт Хэмек, Израиль) или Invitrogen (Пэйсли, Шотландия, Великобритания). Линия клеток РС9 была любезно предоставлена компанией F. Hoffman-La Roche Ltd (Базель, Швейцария) с авторизацией Dr. Mayumi Ono, исследователя, который основал эту линию клеток. Клетки культивировали в среде RPMI, дополненной 10% фетальной бычьей сывороткой (FBS), 50 мкг/мл пенициллина-стрептомицина и 2 мМ L-глутамина, и поддерживали в увлажненной атмосфере с 5% СО2 при 37°С. Антитела к EGF предоставлялись Bioven. Антитела к EGF, используемые в данном проекте, получали из исследования иммунизации на обезьянах, которые получали 4 иммунизации конъюгатом rEGF-rP64k, составленным с адъювантом Montanide. Сыворотку обрабатывали в геле Mellon для удаления примесей, таких как комплемент. Стадию очистки проводили в Шотландии, Абердин, Великобритания. Титр Elisa составлял 1/60000. Гефитиниб приобретали у Selleck Chemicals (Хьюстон, Техас). EGF и антитела для вестерн-блоттинга приобретали у Santa Cruz Biotechnologies (Пало Альто, Калифорния).
Обработки
В экспериментах №1 и №2 линию клеток РС9 в девяти колбах Т-75 культивировали до конфлюентности 70%, дважды промывали с помощью PBS и выращивали на протяжении ночи в среде без сыворотки. Затем выращенные в условиях сывороточного голодания клетки снова промывали (х2) и обрабатывали антителом к EGF (отдельно взятое средство и комбинация с гефитинибом), предварительно инкубированным при 37°С в течение 10 мин. с бессывороточной средой, содержащей 10 нг EGF/мл. Время инкубации клеток с лекарственными средствами составляло приблизительно 10 мин.; концентрация гефитиниба составляла 40 нМ во всех случаях, при этом разбавления антитела варьировали от 1/20 до 1/2. Затем выполняли три типа экспериментов.
A. Сывороточное голодание: в экспериментах «с 24 ч. сывороточным голоданием» линию клеток РС9 в пяти колбах Т-75 подвергали сывороточному голоданию (на протяжении ночи), промывали (х2) и обрабатывали антителом к EGF (отдельно взятым средством и комбинацией с гефитинибом), предварительно инкубировали при 37°С в течение 10 мин. с бессывороточной средой, содержащей 10 нг EGF/мл. Время инкубации клеток с лекарственными средствами составляло 15 мин. или 2 ч.; гефитиниб тестировали при различных концентрациях, концентрация AZD929l всегда составляла 0,5 мкМ, эрлотиниба -1 мкМ, и антитело к EGF добавляли при разбавлении

B. Сывороточное голодание/обработка лекарственным средством: в экспериментах «с 24 ч. сывороточным голоданием и обработкой лекарственным средством» линию клеток РС9 в пяти колбах Т-75 одновременно подвергали сывороточному голоданию и обрабатывали гефитинибом, антителом или как тем, так и другим в течение 24 ч. На следующий день клетки обрабатывали антителом к EGF (отдельно взятым средством и комбинацией с гефитинибом), предварительно инкубировали при 37°С в течение 10 мин. с бессывороточной средой, содержащей 10 нг EGF/мл. Дополнительное время инкубации клеток с лекарственными средствами составляло 2 ч.; гефитиниб тестировали пи 0,5 мкМ; и
C. Нестандартные условия: в экспериментах «при нестандартных условиях» клетки РС9 (4 колбы) не подвергали сывороточному голоданию, а активировали фетальной бычьей сывороткой вместо использования человеческого EGF. Их промывали с помощью PBS (х2), добавляли лекарственные средства в среду, содержащую 10% FBS, и инкубировали в течение 2 часов. Опять-таки, концентрация гефитиниба и AZD929l составляла 0,5 мкМ, эрлотиниба - 1 мкМ, и антитело к EGF добавляли при разбавлении

Вестерн-блоттинг
После обработки культуры промывали с помощью PBS и лизировали в буфере для лизиса, содержащем ингибиторы протеазы и фосфатазы. Равные количества белка загружали в гель SDS-PAGE, переносили на мембрану и подвергали блоттингу с антителами к EGFR, p-EGFR, ERK1/2, p-ERK1/2, Akt, p-Akt, STAT 3 и pSTAT-3. Интенсивность полосок определяли с использованием программы ImageJ, а затем подвергали двухстадийной нормализации. Сначала интенсивность фосфорилированной полоски делили на интенсивность полоски, соответствующей общему количеству белка в том же образце. Затем это значение делили на значение, полученное в клетках, обработанных EGF, для того же белка.
Результаты
Гефитиниб и антитело к EGF в клетках РС9 (15 мин., 40 нМ гефитиниба)
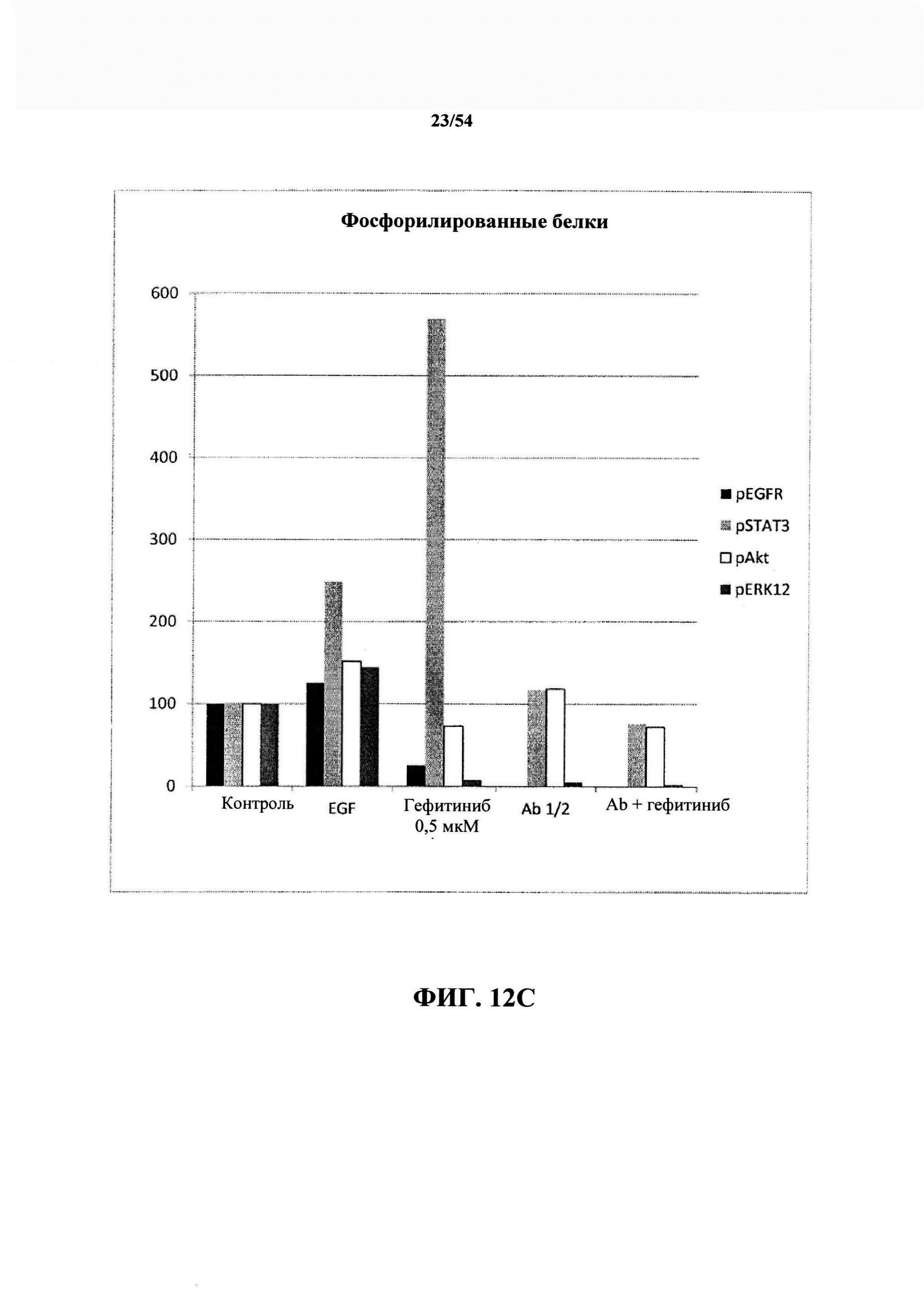
Результаты первого эксперимента (вестерн-блоттинг и количественное определение фосфорилированных белков) представлены на ФИГ. 6А, 6В и 6С. Из этого первого эксперимента очевидно, что гефитиниб ингибировал фосфорилирование EGFR, Erk и Akt, но активировал STAT3. Оказалось, что антитела к EGF от Bioven активировали EGFR (активацию наблюдали только при физиологических разбавлениях 1/20 и 1/10. При 1/5 активацию не наблюдали) и Akt и ингибировали Erk и STAT3. При комбинации гефитиниб + антитело к EGFR фосфорилирование четырех белков было ингибировано. В свете данных, показанных на ФИГ. 6А, 6В и 6С, комбинированное лечение превосходило методы лечения отдельно взятым средством.
Второй эксперимент (15 мин., 0,5 мкМ гефитиниба)
Этот второй эксперимент выполняли как подтверждение результатов первого эксперимента с повышением концентрации антитела к EGF. В случае Akt и STAT-3 не было возможности анализировать результаты из-за проблем эксперимента с линией гефитиниба в виде отдельно взятого средства, и количественное определение не было представлено. Второй эксперимент подтвердил результаты, полученные для EGFR и Erk в первом эксперименте, и превосходство комбинации антитело к EGF плюс гефитиниб в свете данных, показанных на ФИГ. 7А и 7В.
Третий ряд экспериментов (2 ч.)
Третий ряд экспериментов выполняли с использованием времени инкубации 2 ч. Первый анализ выполняли при «нестандартных условиях» с клетками, которые не подвергали сывороточному истощению и не индуцировали с помощью EGF. Время инкубации с лекарственными средствами было намного больше, чем в предыдущих экспериментах (2 ч.), и концентрацию гефитиниба повышали до 0,5 мкМ. Было очевидно, что гефитиниб в качестве отдельно взятого средства инактивировал EGFR и Erk, но активировал STAT-3. При этих условиях антитела к EGF от Bioven инактивировали Erk, STAT-3 и EGFR (в меньшей степени), но активировали Akt. При объединении антител к EGF от Bioven и гефитиниба, Erk, STAT3 и EGFR были почти полностью инактивированы в свете данных, показанных на ФИГ. 8А и 8В.
Третий рад экспериментов (условия сывороточного голодания)
Другой эксперимент выполняли при «условиях сывороточного голодания» и индуцирования с EGFR. Время инкубации составляло 2 ч., и концентрация гефитиниба составляла 0,5 мкМ (также как и в третьем эксперименте). Снова было очевидно, что гефитиниб в качестве отдельно взятого средства инактивировал EGFR и Erk, но активировал STAT-3 даже сильнее, чем при «нестандартных» условиях. Антитело к EGF в виде отдельно взятого средства существенно инактивировало Erk, STAT3 и EGFR, но активировало Akt. При объединении антитела к EGF и гефитиниба, Erk, STAT3 и EGFR были почти полностью инактивированы, и Akt был также существенно ингибирован в свете данных, показанных на ФИГ. 9А и 9В.
Выполняли два дополнительных эксперимента с использованием концентраций гефитиниба, лучше соответствующих физиологическим условиям, наблюдаемым у пациентов, получающих данное лекарственное средство: 0,1 и 0,25 мкМ. В экспериментах антитело к EGF предупреждало активацию STAT3 гефитинибом, и наблюдался синергический эффект комбинации в отношении pEGFR. Результаты для Akt (но не для ERK) согласовывались с предыдущим испытанием в случае 0,25 мкМ, а для 0,1 мкМ наоборот (согласованность для ERK, но не для Akt), как показано на ФИГ. 10А, 10В, 10С и 10D. Вероятно, эти несоответствия можно объяснить ошибками эксперимента.
Четвертый ряд экспериментов (24 ч.)
Два конечных эксперимента с комбинацией гефитиниб + антитело к EGF выполняли с 24 ч. сывороточным голоданием и обработкой лекарственным средством (см. способы). Первый эксперимент (см. ниже) отчасти не удался, и авторы настоящего изобретения не смогли определить некоторые белки. Однако наблюдали полное (или почти полное) ингибирование ERK гефитинибом, антителом к EGF и комбинацией, и, как представляется, присутствовало умеренное снижение общего количества STAT3 антителом к EGF, как показано на ФИГ. 11. Для подтверждения данного результата выполняли второй эксперимент, предусматривающий белок "домашнего хозяйства" (актин) для нормализации общего количества белков. В этом эксперименте фосфорилирование ERK и EGFR было полным с комбинацией антитело к EGF плюс гефитиниб. Также, в комбинации, антитело к EGF полностью обращало индуцированную гефитинибом активацию STAT3, и гефитиниб блокировал активацию Akt, индуцированную антителом к EGF. Наконец, наблюдали умеренное снижение уровней общего количества STAT3 в присутствии антитела или комбинации, как показано на ФИГ. 12А, 12В и 12С и кратко описано в таблице 2 ниже.

Эрлотиниб и антитело к EGF в клетках РС9
На основании результатов, полученных с гефитинибом, выполняли два дополнительных эксперимента с эрлотинибом и антителом к EGF при «нестандартных условиях» и «сывороточном голодании». Время инкубации с лекарственными средствами составляло 2 часа, и концентрация эрлотиниба составляла 1 мкМ. Результаты обоих экспериментов показаны для нестандартных условий на ФИГ. 13А и 13В, а для «сывороточного голодания» - на ФИГ. 14А и 14В.
Результаты согласуются с результатами, полученными с гефитинибом. Эрлотиниб в качестве отдельно взятого средства инактивировал EGFR и Erk, но активировал STAT3. Антитело к EGF в виде отдельно взятого средства существенно инактивировало Erk, EGFR и STAT3 (в частности при сывороточном голодании, как показано на ФИГ. 14А и 14В), но активировало Akt. При объединении антитела к EGF и эрлотиниба, Erk, Akt и EGFR были почти полностью инактивированы, и STAT3 был также существенно ингибирован по сравнению с клетками, обработанными эрлотинибом. Такой синергический эффект комбинации эрлотиниб + антитело наблюдали как при сывороточном голодании, так и при стандартных условиях.
AZD9291 и антитело к EGF в клетках РС9
В следующем эксперименте использовали AZD9291, который представляет собой новое поколение TKI, способное связываться с белком EGFR с сенсибилизирующими мутациями, а также мутациями устойчивости (Т790М). Он получил разрешение на продажу в США и ЕС и коммерциализирован с показаниями к применению для пациентов с NSCLC, которые перешли на эрлотиниб/гефитиниб. Взаимодействие AZD9291 с антителом к EGF тестировали при условиях «сывороточного голодания», и результаты показаны на ФИГ. 15А и 15В. Антитело к EGF полностью блокировало ERK, а также ингибировало фосфорилирование EGFR, при этом эффект был столь же мощным, как и эффект AZD9291 второго поколения TKI. И снова, антитело к EGF индуцировало Akt.
Результаты
Введение гефитиниба или эрлотиниба в EGFR-мутантные клетки РС9, чувствительные к TKI, приводило к активации STAT3, рассматриваемой как первая стадия приобретения устойчивости к терапии. Инкубационные периоды 2- и 24-часовой инкубации кардинально усиливали данный эффект при сывороточном голодании.
Воздействие на клетки РС9 антитела к EGF не активирует STAT3. Напротив, оно обладает некоторым ингибиторным эффектом, который является воспроизводимым и более значительным при 2- и 24-часовой инкубации.
Антитело к EGF в виде отдельно взятого средства активирует Akt, но данный эффект является обратимым, если присутствует также гефитиниб или эрлотиниб. В экспериментах при условиях «сывороточного голодания» эффект антитела к EGF в отношении фосфорилирования EGFR и ERK 1/2 является по меньшей мере столь же значительным, как и эффект гефитиниба или эрлотиниба в отношении этих сигнальных молекул. Комбинированная обработка гефитинибом и антителом к EGF демонстрирует дополнительный (по-видимому синергический) эффект в отношении ингибирования pEGFR и pERKl/2 и блокирует активацию четырех исследуемых белков EGFR, ERK, Akt и STAT3.
Неожиданно, комбинированная обработка воспроизводимо обращает активацию STAT-3 гефитинибом или эрлотинибом как при «сывороточном голодании», так и при «нестандартных» условиях. Обращение является полным в случае гефитиниба при продлении инкубационных периодов до 2 или 24 часов, при этом фосфорилирование STAT3 снижается до уровней неиндуцированных клеток, выращенных в условиях сывороточного голодания. В случае 24-часовой инкубации также наблюдали умеренное уменьшение общего количества белка STAT3 антителом к EGF.
Все эти вышеприведенные данные подтверждают, что комбинированное лечение первой линии может быть успешным у мутантных по EGFR пациентов с NSCLC, поскольку оно обладает потенциальной способностью замедлять появление устойчивости к TKI. Антитело к EGF по сути блокирует Erk и частично ингибирует фосфорилирование EGFR в устойчивой к TKI линии клеток Т790М, полученной из РС9. Антитело к EGF является столь же эффективным, как и лекарственное средство второго поколения AZD9291 в виде монотерапии.
Пример 3. Оценка антитела к EGF (отдельно взятого средства и в комбинации с TKI) в отношении ингибирования путей EGF/EGFR с WB в качестве конечной точки
Следующий эксперимент выполняли для сравнения в линии клеток РС9 NSCLC эффектов антител к EGF с AZD9291 (TKI третьего поколения) в отношении ингибирования путей, активированных связыванием EGF-EGFR. Эксперимент разрабатывали для оценки того, превосходит ли в той же линии клеток комбинация антитела к EGF и TKI лечение отдельно взятым средством. Его также разрабатывали для сравнения в линии клеток РС9, устойчивой к гефитинибу, несущей мутацию Т790М (PC9-GR4), эффектов антител к EGF и AZD9291 в отношении ингибирования путей, активированных связыванием EGF-EGFR, и для оценки того, превосходит ли в той же линии клеток комбинация антитела к EGF и AZD9291 методы лечения отдельно взятым средством. Наконец, эксперимент служил попыткой определения в линии клеток РС9 NSCLC эффектов антитела к EGF в отношении молекулярных механизмов, вовлеченных в устойчивость к TKI.
Материалы и способы для тестирования активации методом вестерн-блоттинга (WB) клеточных линий
Как описывается выше, линия клеток РС9 несет делецию 15 пар оснований в экзоне 19 EGFR, что делает эту линию клеток чувствительной к TKI. Она представляет собой модель для мутантного сегмента EGFR у группы пациентов с NSCLC, получающих лечение TKI. Как часть этой попытки, разрабатывали полученные из РС9 линии клеток, которые являются устойчивыми к TKI. Исходная РС9 представляет собой клетки, полученные из NSCLC, которые содержат делецию 15 пар оснований и чрезвычайно чувствительны к TKI первого, второго и третьего поколений, таким как гефитиниб и AZD9291 (IC50 в нМ диапазоне). Клетки РС9 обрабатывали повышающимися концентрациями эрлотиниба и гефитиниба в течение 2-месячного периода и получали 6 разных линий (PC9-ER и GR1 - GR5), которые были устойчивыми как к гефитинибу, так и к эрлотинибу (IC50 примерно 5-10 мкМ). Подобно пациентам, ни одна из 6 линий не утратила сенсибилизирующую мутацию (делецию 15 пар оснований), однако мутация устойчивости Т790М присутствовала в двух из них. Эти две линии клеток (PC9-GR1 и GR4) являются чувствительными к новому поколению TKI EGFR, разработанному компанией Astra Zeneca (AZD929l), которое также может связываться с мутантным белком Т790М EGFR.
Материалы
Все материалы культуры ткани получали от Biological Industries (киббуц Бейт Хэмек, Израиль) или Invitrogen (Пэйсли, Шотландия, Великобритания). Линия клеток РС9 была любезно предоставлена компанией F. Hoffman-La Roche Ltd (Базель, Швейцария) с авторизацией Dr. Mayumi Ono, исследователя, который основал эту линию клеток. Клетки культивировали в среде RPMI, дополненной 10% фетальной бычьей сывороткой (FBS), 50 мкг/мл пенициллина-стрептомицина и 2 мМ L-глутамина, и поддерживали в увлажненной атмосфере с 5% СО2 при 37°С. Антитела к EGF предоставлялись Bioven.
В данном исследовании использовали два вида антител.
- Abl: антитела к EGF получали из исследования иммунизации на обезьянах, которые получали 4 иммунизации CIMAvax-EGF с конъюгатом rEGF-rP64k, составленной с адъювантом Montanide (Abl), как описывается выше. Это так называемые «Abl» или «антитела к EGF от Bioven». Сыворотку обрабатывали в геле Mellon для удаления примесей, таких как комплемент. Стадию очистки проводили в Шотландии, Абердин, Великобритания. Титр Elisa перед лечением составлял 1/60000. Гефитиниб приобретали у Selleck Chemicals (Хьюстон, Техас). EGF и антитела для вестерн-блоттинга приобретали у Santa Cruz Biotechnologies (Пало Альто, Калифорния).
- Ab2: антитела к EGF получали с помощью иммунизации кроликов рекомбинантной слитой молекулой, содержащей модифицированные последовательности СТВ и EGF. Это так называемые «Ab2» или «антитела к EGF2 от Bioven». Иммуногенная рекомбинантная слитая молекула, содержащая модифицированные последовательности СТВ и EGF и показанная в последовательности 1, а также дополнительно описанная на ФИГ. 20А (и дополнительно описанная в WO 2013/076580, включенной с помощью ссылки во всей своей полноте), имеет следующую последовательность.
Последовательность 1:
MNSYPGCPSSYDGYCLNGGVCMHIESLDSYTCNCVIGYSGDRCQTRDLRWW ELRGSSGNSDSECPLSHDGYCLHDGVCMYIEALDKYACNCWGYIGERCQYRDLKWWE LRGGSGGTSGGGGGSGTPQNITDLCAEYHNTQIHTLNDKIFSYTESLAGKREMAIITFKNGATFQVEVPGSQHIDSQKKAIERMKDTLRIAYLTEAKVEKLCVWNNKTPHAIAAISMANHHHHHH
Дополнительные антитела к EGF, хотя они и не использовались в данном эксперименте, могут быть получены в результате иммунизации кроликов рекомбинантной слитой молекулой, содержащей модифицированные последовательности СТВ и EGF, показанные в последовательности 2 и дополнительно описанные на ФИГ. 20А (как описано в WO 2013/076580, включенной с помощью ссылки во всей своей полноте), имеющей следующую последовательность.
Последовательность 2:
NSDSECPLSHDGYCLHDGVCMYIEALDKYACNCWGYIGERCQYRDLKWWE LRGSSGNSDSECPLSHDGYCLHDGVCMYIEALDKYACNCVVGYIGERCQYRDLKWWE LRGGSGGTSGGGGGSGTPQNITDLCAEYHNTQIHTLNDKIFSYTESLADKREMAIITFKN GATFQVEVPGSQHIDSQKKAIERMKDTLRIAYLTEAKVEKLCVWNNKTPPAIAAISMAN
Следующие гибридомы были депонированы в Европейской коллекции клеточных культур, Коллекциях культур Министерства здравоохранения Англии, Портон-Даун, Солсбери, Wiltshire SP4 OJG (ЕСАСС).


Эти депонирования были сделаны в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов в целях патентной процедуры и положений, действующих в соответствии с ним (Будапештский договор). Это гарантирует поддержание жизнеспособного депонируемого объекта в течение 30 лет со дня депонирования. Эти клеточные линии будут доступны АТСС в соответствии с положениями Будапештского договора и будут согласованы между Bioven и АТСС, что гарантирует постоянную и неограниченную доступность клеточных линий для открытого доступа после выдачи соответствующего патента США или после опубликования любой патентной заявки в США или другой стране, в зависимости от того, что наступит раньше, и гарантирует доступность клеточных линий кому-либо, определенному комиссаром США по патентам и товарным знакам, который будет иметь на это право согласно статье 35 USC §122 и прилагаемым к ней правилам комиссара (в том числе 37 CFR §1.14, с обращением особого внимания на 886 OG 638).
Кровь собирали до иммунизации и после нескольких иммунизаций. Сыворотку очищали в геле Mellon с целью удаления всего отличного от иммуноглобулина, в том числе комплемента. Стадию очистки проводили в Шотландии, Абердин, Великобритания.
Обработки
В стандартном эксперименте линию клеток РС9 или PC9-GR4 в колбах Т-75 подвергали сывороточному голоданию (на протяжении ночи), промывали (х2) и обрабатывали антителом к EGF (отдельно взятым средством и комбинацией с гефитинибом или AZD929l), предварительно инкубировали при 37°С в течение 10 мин. с бессывороточной средой, содержащей 10 нг EGF/мл. Время инкубации клеток с лекарственными средствами составляло 2 или 24 ч. Концентрации гефитиниба или AZD9291 тестировали при концентрациях, зависящих от линий клеток. В 5-дневных экспериментах клетки РС9 не подвергали сывороточному голоданию, а культивировали с человеческой сывороткой. Их промывали с помощью PBS (х2), добавляли лекарственные средства (антитело к EGF, гефитиниб или комбинацию) в среду, содержащую 10% человеческой сыворотки, и инкубировали в течение 5 дней.
Вестерн-блоттинг
После обработки культуры промывали с помощью PBS и лизировали в буфере для лизиса, содержащем ингибиторы протеазы и фосфатазы. Равные количества белка загружали в гель SDS-PAGE, переносили на мембрану и подвергали блоттингу с антителами к EGFR, p-EGFR, ERK1/2, p-ERK1/2, Akt, p-Akt, STAT-3, pSTAT-3, Bmil, HES1, PARP, расщепленного PARP, Notch3, усеченного Notch3, AXL, pYAP и тубулина. Интенсивность полосок определяли с использованием программы ImageJ, а затем подвергали двухстадийной нормализации. Сначала интенсивность фосфорилированной полоски делили на интенсивность полоски, соответствующей общему количеству белка в том же образце. Затем это значение делили на значение, полученное в клетках, обработанных EGF, для того же белка.
Результаты первого эксперимента с AZD9291 и антителом к EGF (Abl) на клетках РС9 (2 ч., 0,2 мкМ гефитиниба)
Результаты первого эксперимента (вестерн-блоттинг и количественное определение фосфорилированных белков) представлены на ФИГ. 16А и 16В. Как показано на фигурах, наблюдалось ингибирование фосфорилирования EGFR, STAT3, Akt и Erk с помощью AZD9291 при 0,2 мкМ. Как обычно, антитело в виде отдельно взятого средства ингибировало pSTAT3 и pErk, но активировало Akt. Комбинация явно превосходила два лекарственных средства отдельно в случае pEGFR и pErk. Также pAkt был полностью ингибирован, а содержание pSTAT3 падало ниже исходного уровня, как кратко описано в таблице 3 ниже.

Второй эксперимент (24 ч., 0,1 мкМ AZD9291)
В следующем эксперименте клетки РС9 инкубировали в течение 24 ч. с лекарственными средствами. Из-за такого более длительного времени инкубации концентрацию AZD9291 снижали до 0,1 мкМ с целью предупреждения полной инактивации EGFR и Erk лекарственным средством. Результаты показаны на ФИГ. 17. Единственным эффектом антитела к EGF в виде отдельно взятого средства была активация Akt, что вызывало обеспокоенность по поводу возможной инактивации аликвоты используемого антитела (примечание: из-за этих сомнений данный вестерн-блоттинг не был количественным).
Первый эксперимент с AZD9291 и антителом к EGF (Abl) на PC9-GR4 (Т790М-позитивных) (2 ч., 0,2 мкМ AZD9291)
В этой линии клеток не наблюдали значительного эффекта EGF в отношении фосфорилирования Erk, STAT-3 или Akt, и по-видимому даже наблюдался ингибирующий эффект в отношении pEGFR. Через 2 ч. AZD9291 (при 0,2 мкМ) полностью блокировал pEGFR и частично pAkt и pErk. Явного стимулирующего эффекта в отношении pSTAT3 не наблюдали. Антитело к EGF стимулировало фосфорилирование Akt (также как и в исходной РС9). Комбинация обоих средств находилась в диапазоне AZD9291 в виде отдельно взятого средства в случае pSTAT-3 и pAkt, и была превосходящей в случае pEGFR и особенно pErk. Это показано на ФИГ. 18А и 18В и кратко описано в таблице 4.

Второй эксперимент (24 ч., 0,2 мкМ AZD9291)
Следующий эксперимент выполняли через 24 ч. и с той же концентрацией AZD9291 (которая попадала в диапазон физиологических концентраций, достигаемых у пациентов). TKI третьего поколения ингибировал фосфорилирование EGFR, Akt и Erk, но явно активировал STAT3 (подобно наблюдениям в случае гефитиниба и чувствительной линии клеток РС9). Антитело к EGF в виде отдельно взятого средства стимулировало pAkt и, по-видимому, не оказывало существенного эффекта в отношении других маркеров. Однако комбинация явно превосходила оба средства, с полным ингибированием pEGFR и pErk, обращением с помощью AZD9291 антитело-индуцированного фосфорилирования Akt и блокированием антителом активации STAT3 с помощью AZD9291. Это показано на ФИГ. 19А и 19В и кратко описано в таблице 5.

Гефитиниб и антитело к EGF (Abl) в клетках РС9 Дополнительные маркеры
В дополнение к STAT3, другие маркеры и пути были связаны с возникновением устойчивости к гефитинибу в опухолевых клетках, мутантных по EGFR. Выполняли предварительный анализ с целью тестирования некоторых из них: расщепленный Notch3 (активная форма Notch3), фосфор-YAP, Bmil и Hesl (связанный со стволовыми клетками) и AXL (связанный с ЕМТ переходом). Также исследовали PARP для определения того, индуцируют ли антитела апоптоз. Использовали экстракты линии клеток РС9, полученные в предыдущих экспериментах. В первом эксперименте оценивали эффекты через 24 ч. Abl, гефитиниба 0,5 мкМ и комбинации в отношении маркеров, упоминаемых выше. Антитело к EGF существенно подавляло Hesl и AXL и ингибировало фосфорилирование расщепленного Notch и YAP. Также наблюдали не столь значительное подавление Bmil. Гефитиниб не оказывал какого-либо из этих эффектов. Что касается расщепления PARP, то оба лекарственных средства были способны индуцировать его через 24 ч., как показано на ФИГ. 21A, 2IB, 21С и 2ID и кратко описано в таблицах 6 и 7.


Сравнение антител к EGF Abl и Ab2 в клетках РС9 (в том числе дополнительные маркеры)
В первом 24 ч. эксперименте сравнивали эффекты Abl и Ab2 в виде отдельно взятого средства. Оба антитела стимулировали pAkt подобным образом. В данном эксперименте они не оказывали эффекта в отношении pErk (но EGF также не смог индуцировать его). Что касается STAT-3, то Ab2 при



Результаты
Ввиду положительных результатов, полученных в данном эксперименте, оценивали эффекты двух антител в виде отдельно взятого средства и в комбинации с гефитинибом после 5 дней инкубации. Клетки выращивали в человеческой сыворотке вместо того, чтобы индуцировать их с EGF (см. способы). Одним из наиболее примечательных результатов было появление полос гиперфосфорилированных Notch3, Akt и STAT-3 с молекулярным весом ниже чем вес белка дикого типа, как показано на ФИГ. 23. Эти полосы могли быть вызваны несколькими причинами, при этом наиболее вероятной было протеолитическое расщепление. Через 24 ч. эффекты в отношении Bmil и Hesl были все еще не заметны. Напротив, наблюдали сильное индуцирование расщепления PARP с помощью Ab2, значительно более сильное, чем наблюдаемое через 24 ч., как показано на ФИГ. 24 (примечание: Вестерн-блоттинги не были количественно описаны из-за появления экстраполос).
Заключения
Введение AZD9291 в течение 24 ч. в чувствительные к TKI клетки РС9, мутантные по EGFR, и в чувствительные к AZD9291 клетки PC9-GR4, мутантные по Т790М, EGFR, приводит к активации STAT3, рассматриваемой как первая стадия приобретения устойчивости к терапии.
Антитело к EGF (Abl) в виде отдельно взятого средства активирует Akt, но данный эффект является обратимым, в случае если присутствует также AZD9291.
Комбинированная обработка с AZD9291 и антителом к EGF (Abl) демонстрирует синергический эффект ингибирования pEGFR и pERKl/2 и блокирует активацию четырех исследуемых белков (EGFR, ERK, Akt, STAT3) на двух тестируемых линиях клеток (РС9, PC9-GR4). Следует отметить, что комбинированная обработка воспроизводимо обращает активацию STAT3 гефитинибом или AZD9291.
В комбинации, добавление антитела к EGF (Abl) оказывает следующие эффекты на эффект гефитиниба в качестве иммунотерапии: ингибирует YAP3, на который не воздействует TKI; ингибирует AXL, маркер ЕМТ, на который не воздействует TKI; ингибирует расщепление Notch3, на которое не воздействует TKI; снижает HES1, маркер раковых стволовых клеток, на который не воздействует TKI; и повышает расщепление PARP.
Более того, добавление антитела к EGF к TKI обращает активацию STAT3, что является одним из характерных признаков TKI, однако непосредственно связано с возникновением устойчивости.
Антитело к EGF (Abl) в виде отдельно взятого средства также влияет на множественность путей, вовлеченных в устойчивость к TKI. Через 24 часа оно блокирует фосфорилирование YAP, расщепление Notch и подавляет AXL и Hesl. Как гефитиниб, так и антитело индуцируют расщепление PARP (маркер апоптоза).
Эти экспериментальные данные далее дополнительно подтверждают предыдущие выводы о том, что комбинированное лечение первой линии может быть успешным у мутантных по EGFR пациентов с NSCLC, поскольку оно обладает потенциалом замедления появления устойчивости к TKI.
Антитело, полученное от кролика (Ab2), превосходит или по меньшей мере не уступает антителу, полученному от примата (Abl), в отношении блокады pSTAT3, подавления маркеров стволовых клеток и индуцирования апоптоза.
Антитело Ab2 индуцирует расщепление некоторых ключевых белков, таких как Notch3, STAT3 или Akt, явление, которое необходимо в дальнейшем учитывать. Из литературы известно, что каспаза 3 способна расщеплять Akt.
Как хорошо известно, лечение с TKI первой линии у пациентов с NSCLC, мутантных по EGFR, приводит к устойчивости к лечению и внезапному рецидиву метастатического заболевания. Параметры, вовлеченные в возникновение устойчивости к существующим TKI первой линии, включают в себя активацию STAT3 и YAP, усиленную экспрессию AXL и МЕТ, как наблюдалось в исследовании на линиях опухолевых клеток, у животных и в образцах, собранных от пациентов, получающих лечение.
Без привязки к какой-либо конкретной теории, как подтверждается в вышеприведенных примерах, комбинация TKI плюс PTI EGF по-видимому устраняет pSTAT3, протеолитическое расщепление Notch3 и его целевой ген HES1 являются чувствительными к этой комбинации, как показано на ФИГ. 29. Наоборот, по-видимому монотерапия TKI не оказывает какого-либо эффекта в отношении pSTAT3, протеолитического расщепления Notch3 и его целевого гена HES1, как показано на ФИГ. 27. Также следует отметить, что молекулы, такие как AXL, МЕТ, которые активируются лечением одним лишь TKI, подавляются комбинацией TKI плюс PTI EGF. Кроме того, с TKI плюс PTI EGF наблюдается большее расщепление PARP, чем расщепление с одним лишь TKI. Комбинированная терапия в соответствии с настоящим раскрытием предлагает подход для неудовлетворенной потребности в обоснованной стратегии, направленной на усиление начальной ответной реакции на TKI EGFR и предотвращение возникновения устойчивости, и комбинация TKI EGFR с PTI EGF является одним из таких терапевтических подходов.
Хотя типичные варианты осуществления представлены для дополнительного объяснения этих идей, следует отметить, что эти идеи не ограничиваются только данным типичным вариантом осуществления.
Несмотря на то, что настоящее изобретение описывается в отношении различных вариантов осуществления, эти идеи также могут быть реализованы широким выбором дополнительных и иных вариантов осуществления, не выходящих за рамки сущности и объема прилагаемой формулы изобретения.
Хотя настоящее изобретение описано в отношении различных вариантов осуществления, демонстрирующих синергические комбинации TKI и антител к EGF, специалисту в данной области техники будет понятно, что комбинированное лечение может быть дополнительно объединено с различными химиотерапевтическими схемами для усиления терапевтического эффекта химиотерапии при лечении рака.
Настоящее описание легче понять в свете основополагающих ссылок, упоминаемых в настоящем описании. Варианты осуществления в пределах настоящего описания служат иллюстрацией вариантов осуществления настоящего изобретения и их не следует рассматривать как ограничивающие объем настоящего изобретения. Специалист в данной области техники легко поймет, что настоящее изобретение охватывает многие другие варианты осуществления. Специалисты в данной области техники поймут или смогут установить, используя не более чем стандартные эксперименты, многие эквиваленты конкретных вариантов осуществления настоящего изобретения, описанного в данном документе. Предполагается, что такие эквиваленты должны охватываться следующей прилагаемой формулой изобретения.
Реферат
Изобретение относится к лечению форм рака, вызванных дерегулированным рецептором эпидермального фактора роста человека. Терапевтическая композиция для снижения устойчивости к ингибиторам тирозинкиназы TKI содержит TKI и рекомбинантный белок, содержащий полипептид, содержащий полноразмерный эпидермальный фактор роста (EGF) или его часть, иммуногенный полипептид, содержащий полипептид холерного токсина В (СТВ), и линкер, причем полипептид отделен от иммуногенного полипептида посредством линкера. Изобретение обеспечивает лечение рака у индивидуумов, у которых развилась устойчивость или которые не отвечают на терапию ингибитором TKI. 11 з.п. ф-лы, 54 ил., 9 табл., 3 пр.

Комментарии