Новые производные фенилаланина - RU2390520C2
Код документа: RU2390520C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым производным фенилаланина и применению производных фенилаланина в качестве лекарственных средств. Настоящее изобретение также относится к соединениям, которые можно использовать в качестве терапевтических средств или профилактических средств против воспалительных заболеваний, при которых в патологии участвует процесс адгезии, зависимый от α-4 интегрина. Известно, что α-4 интегрин участвует в развитии ревматоидного артрита, воспалительных кишечных заболеваний (включая болезнь Крона и язвенный колит), системной красной волчанки, рассеянного склероза, синдрома Шегрена, астмы, псориаза, аллергии, сахарного диабета, сердечно-сосудистых заболеваний, артериального склероза, рестеноза, опухолевой пролиферации, метастазирования опухолей и отторжения трансплантата. Соединения по настоящему изобретению, обладающие антагонистическим действием на α-4 интегрины можно использовать в качестве терапевтических средств или профилактических средств против указанных выше заболеваний.
Кроме того, известно, что α-4 интегрины способны участвовать в развитии преэклампсии, ишемических сердечно-сосудистых расстройств (включая инфаркт мозга), склеродермии, анкилозирующего спондилита, псориатического артрита, саркоидоза, гигантоклеточного артериита, увеитов, пневмосклероза, хронического обструктивного легочного заболевания, остеоартрита, болезни Альцгеймера, повреждения спинного мозга, травматического повреждения мозга, первичного склерозирующего холангита, цирроза печени, вызванного гепатитом С, активного хронического гепатита, сакроилиита, анкилозирующего спондилита, эписклерита, ирита, увеитов, узелковой эритемы, гангренозной пиодермии и аутоиммунного гепатита. Соединения по настоящему изобретению можно также использовать в качестве терапевтических средств или профилактических средств против указанных выше заболеваний.
Кроме того, соединения по настоящему изобретению можно также использовать в качестве терапевтических средств или профилактических средств против не только указанных выше заболеваний, но также заболеваний, в патологии которых могут принимать участие α-4 интегрины.
Настоящее изобретение также относится к способам получения указанных выше производных фенилаланина и к синтезу их промежуточных соединений.
Предпосылки изобретения
В общем известно, что при воспалительных реакциях, когда микроорганизм внедряется в ткань, или когда ткань повреждена, лейкоциты играют важную роль в удалении микроорганизма или в восстановлении поврежденной ткани. Также считается, что в таких случаях лейкоциты, обычно циркулирующие в крови, должны проникнуть через сосудистую стенку и вновь подаваться к поврежденной ткани. Было установлено, что инфильтрация лейкоцитов из кровеносного сосуда в ткань осуществляется молекулами интегрина, которые представляют собой группу гетеродимерных белков, экспрессированных на лейкоцитах. Молекулы интегрина делятся, по меньшей мере, на 8 подсемейств (подсемейства с β1 до β8), в зависимости от их β-цепей. Известные типичные подсемейства представляют собой подсемейства β1 и β3, участвующие в адгезии клеточных ингредиентов к внеклеточной матрице, таких как коллаген и фибронектин; подсемейство β2, участвующее в межклеточной адгезии в иммунной системе; и подсемейство β7, которое, главным образом, участвует в инфильтрации лейкоцитов в слизистые ткани (не патентная публикация 1). Что касается описанных выше α4 интегринов, то известны 2 вида их молекул. Они представляют собой молекулу VLA-4 (очень позднего антигена-4), относящуюся к подсемейству β1, и включающую β1 цепь α4, и молекулу LPAM-1 (молекула-1 адгезии HEV лимфоцитарной пейеровой бляшки), относящиеся к подсемейству β7 и включающие β7 цепь α4. Обычно большинство лейкоцитов, циркулирующих в крови, имеют лишь низкий аффинитет адгезии к клеткам сосудистого эндотелия, и они не могут выходить из кровеносного сосуда. Однако лимфоциты, главным образом включающие Т-клетки и В-клетки, способны выходить из кровеносных сосудов с помощью так называемого феномена хоминга лимфоцитов, при котором они движутся из крови в лимфоидную ткань через лимфатический сосуд в физиологических условиях. Известно, что молекулы LPAM-1 участвуют в хоминге лимфоцитов в лимфоидную ткань кишечного тракта, такую как пейерова бляшка (не патентная публикация 2). С другой стороны, когда происходит воспаление, клетки сосудистого эндотелия активируются цитокином и хемокином, высвобождаемыми из воспаленной ткани, вызывается экспрессия группы антигенов клеточной поверхности (адгезионных молекул), участвующих в адгезии лейкоцитов к клеткам сосудистого эндотелия, и множество лейкоцитов выходят из кровеносного сосуда в направлении воспаленной ткани посредством адгезионных молекул и инфильтруют ее.
В качестве антигенов клеточной поверхности на клетках сосудистого эндотелия, участвующих в адгезии лейкоцитов, были известны Е-селектин (адгезионная молекула, главным образом, участвующая в адгезии нейтрофилов), ICAM-1 и VCAM-1, главным образом, участвующие в адгезии лимфоцитов в лимфоидной ткани кишечного тракта, такой как пейерова бляшка (не патентная публикация 1). Известно, что эти адгезионные молекулы, VCAM-1, действуют как лиганд и VLA-4, и LPAM-1, и что MAdCAM-1 действует в качестве лиганда LPAM-1. В качестве лиганда и VLA-4, и LPAM-1, также известен фибронектин, который представляет собой вид внеклеточной матрицы (не патентная публикация 1). Подсемейство β1 интегрина, к которому относится VLA-4, включает, по меньшей мере, 6 интегринов (с VLA-1 по VLA-6), использующих внеклеточные матрицы, такие как фибронектин, коллаген и ламинин, в качестве лигандов. Многие интегрины, использующие внеклеточные матрицы в качестве лигандов, такие как VLA-5, подсемейство β3 и подсемейство β5, распознают последовательность аргинин-глицин-аспарагиновая кислота (RGD) в фибронектине, витронектине, тенасцине и остеопонтине. С другой стороны, при взаимодействии VLA-4 и фибронектина последовательность RGD не участвует, но сегмент пептида CS-1, включающий лейцин - аспарагиновую кислоту - валин (LDV) в качестве сердцевинной последовательности, участвует в этом взаимодействии (не патентная публикация 3). Cltmtnts et al. обнаружили последовательность, аналогичную LDV, в аминокислотных последовательностях VCAM-1 и MAdCAM-1. Было выяснено, что вариант, полученный частичной модификацией CS-1-подобной последовательности молекул VCAM-1 и MAdCAM-1, не может взаимодействовать с VLA-4 или LPAM-1 (не патентные публикации 4-7). Таким образом, было обнаружено, что CS-1-подобная последовательность важна для взаимодействия VLA-4 с LPAM-1 и VCAM-1 с MAdCAM-1.
Сообщалось, что циклический пептид, имеющий CS-1-подобную структуру, является антагонистическим в отношении взаимодействия VLA-4 или LPAM-1 с VCAM-1, MAdCAM-1 или пептидом Cs-1 (не патентная публикация 8). Описанные выше факты указывают на то, что все взаимодействия α4 интегрина и VCAM-1, MAdCAM-1 или фибронектином можно блокировать использованием подходящего антагониста α4 интегрина (термин «антагонист α4 интегрина» в описании указывает вещество, антагонистичное в отношении α4β1 и/или α4β7 интегрина).
Также известно, что экспрессия VCAM-1 в клетках сосудистого эндотелия вызвана воспалительными факторами, такими как LPS, TNF-α или IL-1, и что, когда возникает воспаление, инфильтрация лейкоцитов из кровеносного сосуда в ткань осуществляется механизмом адгезии VLA-4 с VCAM-1 (не патентные публикации 9-11). Ввиду того, что VLA-4 экспрессирован на поверхностях активированных лимфоцитов, моноцитов, эозинофилов, тучных клеток и нейтрофилов, механизм адгезии VLA-4/VCAM-1 играет важную роль в инфильтрации этих клеток в воспаленную ткань. Сообщалось, что VLA-4 экспрессирован на различных саркоматозных клетках, таких как клетки меланомы, и было выяснено, что механизм адгезии VLA-4/VCAM-1 участвует в метастазировании этих опухолей. В результате исследования экспрессии VCAM-1 в различных патологических тканях стало очевидным, что механизм адгезии VLA-4/VCAM-1 участвует в различных патологических состояниях. А именно, сообщалось, что в дополнение к активированным клеткам сосудистого эндотелия, экспрессия VCAM-1 увеличивается в воспаленных тканях у пациентов с аутоиммунными заболеваниями, такими как ревматоидное поражение синовиальной оболочки (не патентные публикации 12 и 13), поражение легких и дыхательных путей при астме (не патентная публикация 14) и аллергические заболевания (не патентная публикация 15), системная красная волчанка (не патентная публикация 16), синдром Шегрена (не патентная публикация 17), рассеянный склероз (не патентная публикация 18) и псориаз (не патентная публикация 19); атеросклеротические бляшки (не патентная публикация 20), в кишечных тканях пациентов с воспалительными кишечными заболеваниями, такими как болезнь Крона и язвенный колит (не патентные публикации 21 и 22), в воспаленной ткани островков Лангерганса пациентов с сахарным диабетом (не патентная публикация 23) и в имплантатах во время отторжения трансплантата сердца или почки (не патентная публикация 24 и 25). Механизм адгезии VLA-4/VCAM-1 участвует в развитии этих различных заболеваниях.
Имеется много сообщений, показывающих, что введение антитела VLA-4 или VCAM-1 in vivo было эффективным в облегчении течения заболеваний на экспериментальных моделях этих воспалительных заболеваний. В частности, Yednock et al. и Baron et al. сообщали, что введение in vivo антитела против α4 интегринов было эффективным в борьбе с заболеваемостью или при борьбе с энцефаломиелитом на моделях экспериментального аутоиммунного энцефаломиелита, т.е. моделях рассеянного склероза (не патентные публикации 26 и 27). Zeidler et al. сообщили, что введение in vivo антитела против α4 интегрина было эффективным в борьбе с заболеваемостью мышиным коллагеновым артритом (модели ревматоидного артрита) (не патентная публикация 28). О терапевтическом эффекте антитела против α4 интегрина на моделях астмы сообщали Abraham et al. и Sagara et al. (не патентные публикации 29 и 30). Об эффекте антитела против α4 интегрина на моделях воспалительных кишечных заболеваний сообщали Podolsky et al. (не патентная публикация 31). Об эффекте антитела против α4 интегрина и антитела против VCAM на моделях инсулинозависимого сахарного диабета сообщали Baron et al. (не патентная публикация 32). На основании исследований на моделях у бабуинов стало очевидно, что рестеноз кровеносных сосудов после ангиопластики, проведенной ввиду атеросклероза, можно ингибировать введением антитела против α4 интегрина (не патентная публикация 33). Сообщалось также, что антитело против α4 интегрина или против VCAM эффективны при ингибировании отторжения имплантата или ингибировании метастазирования рака (не патентные публикации 34 и 35). О терапевтическом эффекте антитела против VCAM-1 на моделях воспалительных кишечных заболеваний сообщали Sans et al. (не патентная публикация 44).
Как описано выше, в отличие от VCAM-1, MAdCAM-1, которая представляет собой лиганд LPAM-1, конститутивно экспрессируется в высокоэндотелиальных венулах (HEV) в слизистой оболочке кишечника, брыжеечных лимфоузлах, пейеровских бляшках и селезенке, и она участвует в хоминге лимфоцитов слизистой оболочки. Известно также, что механизм адгезии LPAM-1/MAdCAM-1 не только играет физиологические роли в хоминге лимфоцитов, но также участвует в некоторых патологических процессах. Briskin et al. сообщили об увеличении экспрессии MAdCAM-1 в воспаленных областях кишечного тракта пациентов с воспалительным кишечным заболеванием, таким как болезнь Крона и язвенный колит (не патентная публикация 36). Hanninen et al. сообщили о том, что индукция экспрессии наблюдается в воспаленной ткани островков Лангерганса мышей NOD, которые представляют собой модель инсулинозависимого сахарного диабета (не патентная публикация 37). Тот факт, что механизм адгезии LPAM-1/MAdCAM-1 принимает участие в прогрессировании заболеваний, очевиден из того обстоятельства, что состояния воспалительных кишечных заболеваний на мышиных моделях (не патентная публикация 38) и описанной выше модели на мышах NOD, облегчаются введением in vivo антитела к MAdCAM или антитела к β7 интегрину (не патентные публикации 39 и 40).
Описанные выше факты указывают на возможность того, что использование блокирования механизма адгезии VLA-4/VCAM-1, LPAM-1/VCAM-1 или LPAM-1/MAdCAM-1 подходящим антагонистом эффективно при лечении описанных выше хронических воспалительных заболеваний. Что касается терапевтического эффекта подходящего антагониста (антагонистов), то в нем можно убедиться на экспериментальных моделях, описанных в приведенных выше литературных источниках или в других публикациях, таких как не патентные публикации 45 и 46. Использование антитела против VLA-4 в качестве антагониста VLA-4 описано в патентных публикациях 1-4. Пептидные соединения в качестве антагонистов VLA-4 описаны в патентных публикациях 5-8. Аминокислотные производные, которые можно использовать в качестве антагонистов VLA-4, описаны в патентных публикациях 9-13. Низкомолекулярный ингибитор α4 интегрина, который можно вводить орально, описан в патентных публикациях 14 и 15.
[Патентная публикация l] WO 93/13798.
[Патентная публикация 2] WO 93/15764.
[Патентная публикация 3] WO 94/16094.
[Патентная публикация 4] WO 95/19790.
[Патентная публикация 5] WO 94/15958.
[Патентная публикация 6] WO 95/15973.
[Патентная публикация 7] WO 96/00581.
[Патентная публикация 8] WO 96/06108.
[Патентная публикация 9] WO 99/10312.
[Патентная публикация 10] WO 99/10313.
[Патентная публикация ll] WO 99/36393.
[Патентная публикация 12] WO 99/37618.
[Патентная публикация 13] WO 99/43642.
[Патентная публикация 14] WO 02/16329.
[Патентная публикация 15] WO 03/070709.
[Не патентная публикация l] Shimizu et al. Adv. Immunol. 72: 325-380, 1999.
[Не патентная публикация 2] Butcher et al. Adv. Immunol. 72: 209-253, 1999.
[Не патентная публикация 3] Pulido et al. J.Biol. Chem. 266: 10241-10245, 1991.
[Не патентная публикация 4] Clements et al. J. Cell Sci. 107: 2127-2135, 1994.
[Не патентная публикация 5] Vonderheide et al. J. Cell Biol. 125: 215-222, 1994.
[Не патентная публикация 6] Renz et al. J. Cell Biol. 125: 1395-1406, 1994.
[Не патентная публикация 7] Kilger et al. Int. Immunol. 9: 219-226, 1997.
[Не патентная публикация 8] Vanderslice et al. J. Immunol. 158: 1710-1718, 1997.
[Не патентная публикация 9] Elices, Cell 60: 577-584, 1990.
[Не патентная публикация 10] Osborn et al. Cell 59: 1203-1211, 1989.
[Не патентная публикация 11] Issekutz et al. J. Eex.Med. 183: 2175-2184, 1996.
[Не патентная публикация 12] van Dinther-Janssen, J. Immunol. 147: 4207-4210, 1991.
[Не патентная публикация 13] Morales-Ducret et al. J. Immunol. 149: 1424-1431, 1992.
[Не патентная публикация 14] ten Hacken et al. Clin. Exp. Allergy 12: 1518-1525, 1998.
[Не патентная публикация 15] Randolph et al. J. Clin. Invest. 104: 1021-1029, 1999.
[Не патентная публикация 16] Takeuchi et al. J. Clin. Invest. 92: 3008-3016, 1993.
[Не патентная публикация 17] Edwards et al. Ann. Rheum. Dis. 52: 806-811, 1993.
[Не патентная публикация 18] Steffen et al. Am. J. Pathol. 145: 189-201, 1994.
[Не патентная публикация 19] Groves et al. J. Am. Acad. Dermatol. 29: 67-72, 1993.
[Не патентная публикация 20] O'Brien et al. J. Clin. Invest. 92: 945-951, 1993.
[Не патентная публикация 21] Koizumi et al. Gastroenterol. 10: 840-847, 1992.
[Не патентная публикация 22] Nakamura et al. Lab. Invest. 69: 77-85, 1993.
[Не патентная публикация 23] Martin et al. J. Autoimmun. 9: 637-643, 1996.
[Не патентная публикация 24] Herskowitz et al. Am. J. Pathol. 145: 1082-1094, 1994.
[Не патентная публикация 25] Hill et al. Kidney Int. 47: 1383-1391, 1995.
[Не патентная публикация 26] Yednock et al. Nature 356: 63-66, 1992.
[Не патентная публикация 27] Baron et al. J. Exp. Med. 177: 57-68, 1993.
[Не патентная публикация 28] Zeidler et al. Autoimmunity 21: 245-252, 1995.
[Не патентная публикация 29] Abraham et al. J. Clin. Invest. 93: 776-787, 1994.
[Не патентная публикация 30] Sagara et al. Int. Arch. Allergy Immunol. 112: 287-294, 1997.
[Не патентная публикация 3l] Podolsky et al. J. Clin. Invest. 92: 372-380, 1993.
[Не патентная публикация 32] Baron et al. J. Clin. Invest. 93: 1700-1708, 1994.
[Не патентная публикация 33] Lumsden et al. J. Vase. Surg. 26: 87-93, 1997.
[Не патентная публикация 34] Isobe et al. J. Immunol. 153: 5810-5818, 1994.
[Не патентная публикация 35] Okahara et al. Canser Res. 54: 3233-3236, 1994.
[Не патентная публикация 36] Briskin et al. Am. J. Pathol. 151- 97-110, 1997.
[Не патентная публикация 37] Hanninen et al. J. Immunol. 160: 6018-6025, 1998.
[Не патентная публикация 38] Picarella et al. J. Immunol. 158: 2099-2106, 1997.
[Не патентная публикация 39] Hanninen et al. J. Immunol. 160: 6018-6025, 1998.
[Не патентная публикация 40] Yang et al. Diabetes 46: 1542-1547, 1997.
[Не патентная публикация 41] Prog.Med. 5: 2157-2161, 1985.
[Не патентная публикация 42] lyakuhin no kaihatsu (Hirokawa Shoten) vol. 7: 163-198, 1990.
[Не патентная публикация 43] Saishin Soyakkagaku (Technomics, Inc.) Gekan: 271-298, 1999.
[Не патентная публикация 44] Sans, M. et al. Gastroenterology 116-874-883, 1999.
[Не патентная публикация 45] Leone, D. R. et al. J. Pharmacol. Exp. Ther 305: 1150-1162, 2003.
[Не патентная публикация 46] Kudlacz E. et al. J. Pharmacol. Exp. Ther 301: 747-752, 2002.
[Не патентная публикация 47] Gordon, F. H. et al. Gastroenterology 121: 268-274, 2001.
Описание изобретения
Объектом настоящего изобретения является предоставление новых соединений, обладающих антагонистическим эффектом в отношении α4 интегрина.
Другим объектом настоящего изобретения является предоставление новых соединений, обладающих антагонистическим эффектом в отношении α4 интегрина, которые можно вводить орально.
Еще одним объектом настоящего изобретения является предоставление фармацевтической композиции, включающей такие новые соединения, и их фармацевтически приемлемый носитель.
Дополнительным объектом настоящего изобретения является предоставление лекарственного средства, содержащего такие новые соединения.
Дополнительным объектом настоящего изобретения является предоставление антагонистов α4 интегрина.
Еще одним дополнительным объектом настоящего изобретения является предоставление терапевтических средств или профилактических средств против заболеваний, в развитии патологии которых принимает участие процесс зависимой от α4 интегрина адгезии, таких как воспалительные заболевания, ревматоидный артрит, воспалительные кишечные заболевания (включая болезнь Крона и язвенный колит), системная красная волчанка, рассеянный склероз, синдром Шегрена, астма, псориаз, аллергия, сахарный диабет, сердечно-сосудистые заболевания, артериальный склероз, рестеноз, опухолевая пролиферация, метастазирование опухолей и отторжение трансплантата.
Еще одним дополнительным объектом настоящего изобретения является предоставление терапевтических средств или профилактических средств против таких заболеваний, как преэклампсия, ишемические сердечно-сосудистые расстройства (включая инфаркт мозга), склеродермия, анкилозирующий спондилит, псориатический артрит, саркоидоз, гигантоклеточный артериит, увеиты, пневмосклероз, хроническое обструктивное легочное заболевание, остеоартрит, болезнь Альцгеймера, повреждение спинного мозга, травматическое повреждение мозга, первичный склерозирующий холангит, цирроз печени, вызванный гепатитом С, активный хронический гепатит, сакроилиит, анкилозирующий спондилит, эписклерит, ирит, увеиты, узелковая эритема, гангренозная пиодермия и аутоиммунный гепатит.
Еще одним дополнительным объектом настоящего изобретения является предоставление терапевтических средств или профилактических средств против не только указанных выше заболеваний, но также заболеваний, при которых α4 интегрины могут участвовать в развитии патологии.
Еще одним дополнительным объектом настоящего изобретения являются способы получения указанных выше новых соединений и синтез их промежуточных соединений.
С целью разрешения описанных выше проблем заявители синтезировали различные производные фенилаланина и обнаружили, что определенные, новые производные фенилаланина обладают отличной антагонистической активностью в отношении α4 интегрина при наличии сыворотки, и что их общее выведение из организма низкое. Заявители также обнаружили, что определенные, новые производные фенилаланина проявляют высокую площадь под кривой динамики изменений во времени концентрации в плазме крови (AUC) и высокую биологическую доступность при оральном введении. Они, кроме того, обнаружили, что такие производные обладают высокой антагонистической активностью в отношении α4 интегрина in vivo при оральном введении. Настоящее изобретение было создано на основании этих данных. Осуществление настоящего изобретения обеспечивает возможность снижения дозировки и количества доз препарата, содержащего производное фенилаланина.
А именно, настоящее изобретение описывается следующим образом:
[1] Производные фенилаланина следующей формулы (1) или их фармацевтически приемлемые соли:

где R11 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, которые могут иметь заместитель (заместители), морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами), R12 и R13 каждый независимо представляет атом водорода, алкильную группу, имеющую 1-6 атомов углерода, ацетильную группу или метилоксикарбонильную группу, или N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу, 4-тиоморфолинильную группу, 3-тетрагидротиазолильную группу или 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода, R14 представляет метильную группу или этильную группу,
R1' представляет атом водорода, атом фтора или атом хлора,
Х1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)-, -CH(R1a)CH(R1b)CH(R1c)-, -CH(R1a)CH(R1b)CH(R1c)CH(R1d)-, -N(R1a)CH(R1b)CH(R1c)-, -OCH(R1a)CH(R1b)-, -OCH(R1a)CH(R1b)CH(R1c)- или 1,3-пирролидинилен, где R1a, R1b, R1c и R1d каждый независимо представляет атом водорода или метильную группу, и
Y11 и Y12 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[20] Производные фенилаланина следующей формулы (2) или их фармацевтически приемлемые соли:

где R21 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами),
R22 представляет атом водорода или алкильную группу, имеющую 1-3 атома углерода,
R24 представляет метильную группу или этильную группу,
R2' представляет атом водорода, атом фтора или атом хлора,
Х2 представляет -CH(R2a)-, -CH2CH2- или -N(R2a)CH2CH2-, где R2a представляет атом водорода или метильную группу, и
Y21 и Y22 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[23] Производные фенилаланина следующей формулы (3) или их фармацевтически приемлемые соли:

где R31 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами),
R34 представляет метильную группу или этильную группу,
R3' представляет атом водорода или атом фтора,
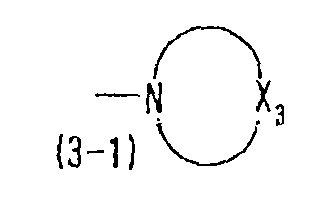
формула (3-1) представляет 4-морфолинильную группу, 4-тиоморфолинильную группу, 3-тетрагидротиазолильную группу, 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода, или 1-имидазолильную группу, которая может быть замещена метильной группой, этильной группой или аминогруппой,
где Х3 представляет атом кислорода, атом азота, который может быть замещен алкильной группой, имеющей 1-3 атома углерода, или атом серы, и
Y31 и Y32 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[28] Производные фенилаланина следующей формулы (4) или их фармацевтически приемлемые соли:

где R41 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами),
Кольцо представляет бензольное кольцо, пиридиновое кольцо, тиофеновое кольцо, пиперидиновое кольцо, первое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода, пиперазиновое кольцо, первое и/или четвертое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода, или пирролидиновое кольцо, первое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода.
R44 представляет метильную группу или этильную группу, и
Y41 и Y42 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[30] Производные фенилаланина следующей формулы (5) или их фармацевтически приемлемые соли:
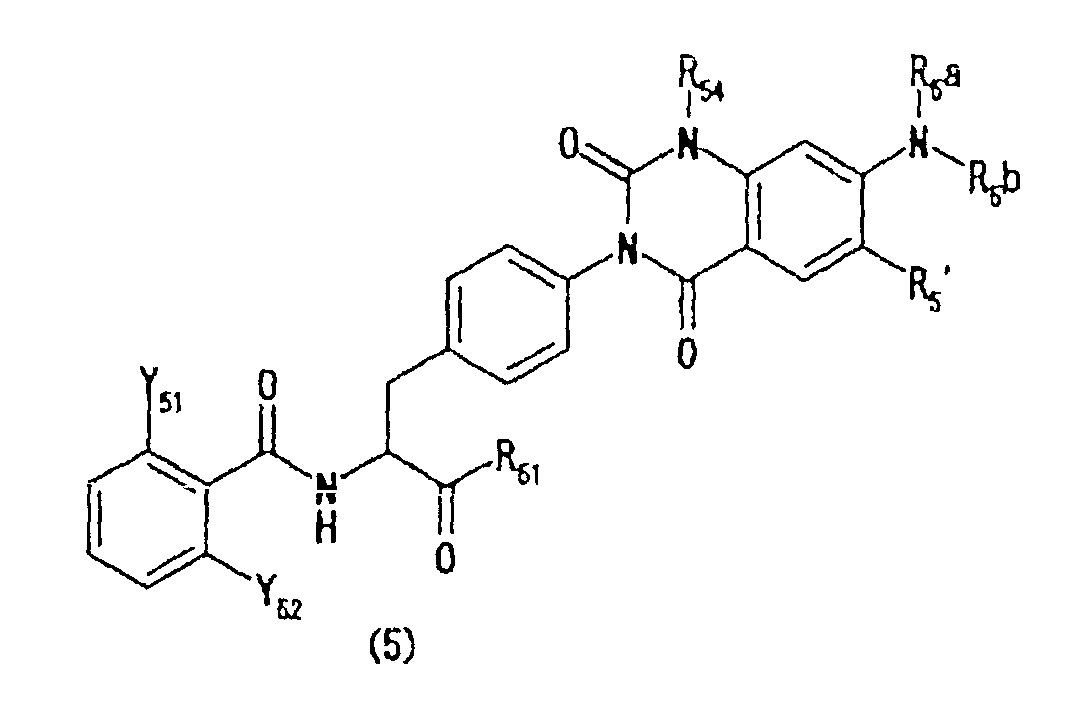
где R51 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами),
R54 представляет метильную группу или этильную группу,
R5' представляет атом водорода или атом фтора,
R5a и R5b каждый независимо представляет атом водорода или алкильную группу, имеющую 1-3 атома углерода, или
N(R5a)R5b представляет 1-пирролидинильную группу или 1-пиперидинильную группу, и
Y51 и Y52 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[32] Производные фенилаланина следующей формулы (6) или их фармацевтически приемлемые соли:
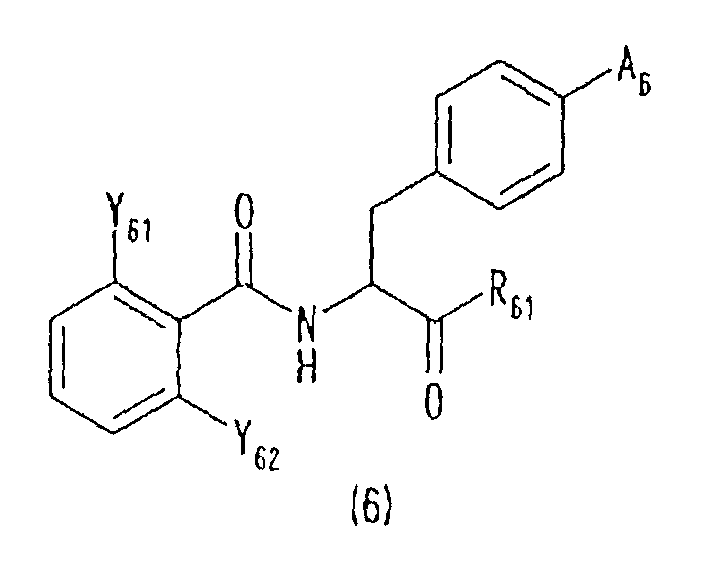
где R61 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами),
А6 представляет любую из следующих формул (6-1)-(6-6):

и Y61 и Y62 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[35] Производные фенилаланина следующей формулы (7) или их фармацевтически приемлемые соли:

где R71 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами),
R74 представляет метильную группу или этильную группу,
R7 представляет алкинильную группу, имеющую 3-5 атомов углерода, циклоалкилметильную группу, имеющую 4-6 атомов углерода, циклоалкильную группу, имеющую 3-6 атомов углерода, или пропильную группу, и
Y71 и Y72 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[38] Производные фенилаланина следующей формулы (8) или их фармацевтически приемлемые соли:

где R81 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу, бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами), или гидроксиэтильную группу,
R82 представляет метильную группу или этильную группу,
R84 представляет метильную группу или этильную группу,
n8 представляет целое число от 0 до 2, и
Y81 и Y82 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[41] Производные фенилаланина следующей формулы (9) или их фармацевтически приемлемые соли:

где R91 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами),
R92 представляет гидроксильную группу, алкоксильную группу, имеющую от 1 до 6 атомов углерода, амино группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами),
R94 представляет метильную группу или этильную группу,
Х9 представляет атомную связь, -СН2-, -СН2СН2-,или -СН=СН-, и
Y91 и Y92 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[44] Производные фенилаланина следующей формулы (10) или их фармацевтически приемлемые соли:

где R101 представляет алкоксильную группу, имеющую 2-6 атомов углерода, или морфолиноэтилокси группу,
R10представляет метильную группу или этильную группу,
R104 представляет метильную группу или этильную группу, и
Y101 и Y102 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[46] Производные фенилаланина следующей формулы (11) или их фармацевтически приемлемые соли:

где R111 представляет алкоксильную группу, имеющую 1-6 атомов углерода, или морфолиноэтилокси группу,
R114 представляет метильную группу или этильную группу, и
Y111 и Y112 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[47] Производные фенилаланина следующей формулы (12) или их фармацевтически приемлемые соли:

где R121 представляет алкоксильную группу, имеющую 1-6 атомов углерода, или морфолиноэтилокси группу,
R124 представляет метильную группу или этильную группу, и
А представляют любую из следующих формул (12-1) и (12-2):

[48] Производные фенилаланина следующей формулы (13) или их фармацевтически приемлемые соли:

где R131 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами), R13a и R13b каждый независимо представляет атом водорода или алкильную группу, имеющую 1-3 атома углерода, или N(R13a)R13b представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу, 4-тиоморфолинильную группу, 3-тетрагидротиазолильную группу или 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода, и
Y131 и Y132 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[49] Производные фенилаланина следующей формулы (14) или их фармацевтически приемлемые соли:

где R141 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, или морфолиноэтилокси группу,
R144 представляет метильную группу или этильную группу,
гидроксильная группа на хиназолиндионовом кольце расположена в шестом или седьмом положении кольца, и
Y141 и Y142 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[51] Фармацевтическая композиция, включающая производное фенилаланина или его фармацевтически приемлемую соль по любому из представленных выше пп.1-50 в качестве активного ингредиента и фармацевтически приемлемый носитель.
[52] Антагонист α4 интегрина, включающий производное фенилаланина или его фармацевтически приемлемую соль по любому из представленных выше пп.1-50 в качестве активного ингредиента.
[53] Терапевтическое средство или профилактическое средство против воспалительных заболеваний, в патологии которых участвует процесс адгезии, зависимый от α4 интегрина, включающее производное фенилаланина или его фармацевтически приемлемую соль по любому из представленных выше пп.1-50 в качестве активного ингредиента.
[54] Терапевтическое средство или профилактическое средство против ревматоидного артрита, воспалительных кишечных заболеваний (включая болезнь Крона м язвенный колит), системной красной волчанки, рассеянного склероза, синдрома Шегрена, астмы, псориаза, аллергии, сахарного диабета, сердечно-сосудистых заболеваний, артериального склероза, рестеноза, опухолевой пролиферации, метастазирования опухолей и отторжения трансплантата, которое содержит производное фенилаланина или его фармацевтически приемлемую соль по любому из представленных выше пп.1-50 в качестве активного ингредиента.
[55] Терапевтическое средство или профилактическое средство против преэклампсии, ишемических сердечно-сосудистых расстройств (включая инфаркт мозга), склеродермии, анкилозирующего спондилита, псориатического артрита, саркоидоза, гигантоклеточного артериита, увеитов, пневмосклероза, хронического обструктивного легочного заболевания, остеоартрита, болезни Альцгеймера, повреждения спинного мозга, травматического повреждения мозга, первичного склерозирующего холангита, цирроза печени, вызванного гепатитом С, активного хронического гепатита, сакроилиита, анкилозирующего спондилита, эписклерита, ирита, увеитов, узелковой эритемы, гангренозной пиодермии и аутоиммунного гепатита, включающее производное фенилаланина или его фармацевтически приемлемую соль по любому из представленных выше пп.1-50 в качестве активного ингредиента.
[56] Терапевтическое средство или профилактическое средство против заболеваний, в патологии которых могут участвовать α4 интегрины, включающее производное фенилаланина или его фармацевтически приемлемую соль по любому из представленных выше пп.1-50 в качестве активного ингредиента.
Настоящее изобретение также предоставляет следующие соединения, которые являются промежуточными соединениями синтеза производных фенилаланина формулы (1): изопропил(S)-2-(2,6-дихлорбензоиламино)-3-(4-нитрофенил)пропионат, изопропил(S)-2-(2,6-дихлорбензоиламино)-3-(4-аминофенил)пропионат, изопропил(S)-3-[4-(2-амино-5-йодбензоиламино)фенил]-2-(2,6-дихлорбензоиламино)пропионат, изопропил(S)-2-(2,6-дихлорбензоиламино)-3-[4-(6-йод-2,4-диоксо-1,2,3,4-тетрагидро-2Н-хиназолин-3-ил)фенил]пропионат, изопропил(S)-2-(2,6-дихлорбензоиламино)-3-[4-(6-йод-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-2Н-хиназолин-3-ил)фенил]пропионат, (S)-3-{4-[2-(2,6-дихлорбензоиламино)-2-изопропоксикарбонилэтил]фенил}-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-карбоновая кислота, изопропил(S)-2-(2,6-дихлорбензоиламино)-3-[4-(6-гидроксиметил-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-2Н-хиназолин-3-ил)фенил]пропионат, изопропил(S)-3-[4-(6-хлорметил-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-2Н-хиназолин-3-ил)фенил]-2-(2,6-дихлорбензоиламино)пропионат и изопропил(S)-2-(2,6-дихлорбензоиламино)-3-[4-(6-гидрокси-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-2Н-хиназолин-3-ил)фенил]пропионат.
Наилучший способ осуществления изобретения
«Алкильная группа, имеющая 1-6 атомов углерода» является либо прямой, или разветвленной, или циклической. Ее примерами являются метильная, этильная, пропильная и изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, циклопропилметильная группа, циклобутильная группа, пентильная группа, изопентильная группа, гексильная группа, 1-метилбутокси группа, 1,1-диметилпропильная группа, циклопропильная группа, циклопентильная группа и циклогексильная группа. Дополнительно, «алкильная группа, имеющая 1-3 атома углерода» является либо прямой, или разветвленной и указывает на метильную, этильную, пропильную и изопропильную группу.
«Алкоксильная группа, имеющая 1-6 атомов углерода» указывает на те группы, алкильная часть которых является прямой или разветвленной, или циклической. Ее примерами являются метокси, этокси, пропилокси, изопропилокси, бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси, пентилокси, изопентилокси, 1-метилбутилокси, 1,1-диметилпропилокси, 2-метилбутокси, неопентилокси, гексилокси, изогексилокси, 1-метилпентилокси, 1,1-диметилбутилокси, циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси группа.
«Алкоксильная группа, имеющая 2-6 атомов углерода» указывает на те группы, алкильная часть которых является прямой или разветвленной, или циклической. Ее примерами являются этокси, пропилокси, изопропилокси, бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси, пентилокси, изопентилокси, 1-метилбутилокси, 1,1-диметилпропилокси, 2-метилбутокси, неопентилокси, гексилокси, изогексилокси, 1-метилпентилокси, 1,1-диметилбутилокси, циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси группа.
«Разветвленная алкоксильная группа, имеющая 3-6 атомов углерода» указывает на те группы, алкильная часть которых является разветвленной или циклической. Они могут быть замещены метокси группой или гидроксильной группой. Ее примерами являются изопропилокси, втор-бутилокси, трет-бутилокси, 1-метилбутилокси, 1,1-диметилпропилокси, 2-метилбутокси, неопентилокси, 1-метилпентилокси, 1,1-диметилбутилокси, циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси группа. Среди них, предпочтительными являются изопропилокси группа, втор-бутилокси группа, 1-метилбутилокси группа, циклоппентилокси группа и циклогексилокси группа является предпочтительной, и особенно предпочтительной является изопропилокси группа.
В «алкинильной группе, имеющей 3-5 атомов углерода», атом (атомы) углерода, имеющие свободный радикал (радикалы) не ограничивается атомом (атомами) SP. Ее примерами являются 2-пропинильная, 3-бутинильная, 2-бутинильная, 4-пентинильная, 3-пентинильная и 2-пентинильная группы.
«Циклоалкилметильная группа, имеющая 4-6 атомов углерода» указывает на циклопропилметильную, циклобутилметильную и циклопентилметильную группы.
«Циклоалкильная группа, имеющая 3-6 атомов углерода» указывает на циклопропильную, циклобутильную, циклопентильную и циклогексильную группы.
«Пиперазинильная группа, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода», указывает на пиперазинильную, N-метилпиперазинильную, N-этилпиперазинильную, N-пропилпиперазинильную и N-изопропилпиперазинильную группы.
В «пиперазиновом кольце, первое и/или четвертое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода», заместитель (заместители) на азоте его первого и/или четвертого положения могут быть одинаковыми или отличными друг от друга. Примерами комбинации заместителей являются (H, H), (H, Me), (H, Et), (H, Pr), (H, isoPr), (Me, Me), (Me, Et), (Me, Pr), (Me, isoPr), (Et, Et), Et, Pr), (Et, isoPr), (Pr, Pr), (Pr, isoPr) и (isoPr, isoPr).
Пятое, шестое, седьмое и восьмое положения хиназолиндионового кольца указывают следующую формулу:

-CO-R11, -CO-R21, -CO-R31, -CO-R41, -CO-R51, -CO-R61, -CO-R71, -CO-R81, -CO-R91, -CO-R101, -CO-R111, -CO-R121, -CO-R131, и -CO-R141 в формулах (1)-(14) настоящего изобретения указывают на карбоксильную группу или карбоксильную группу в пролекарственной модификации, которая превращается в карбоксильную группу in vivo. А именно, R11, R21, R31, R41, R51, R61, R71, R81, R91, R101, R111, R121, R131, и R141 (далее обозначаемые как R11-R141) указывают на гидроксильную группу или на группу, которая замещается карбоксильной группой in vivo. Конкретные примеры карбоксильной группы в пролекарственной модификации описаны, например, в не патентных публикациях 41-43.
R11-R141 включает, например, алкоксильную группу, имеющую 1-8 атомов углерода, которая может иметь заместитель (заместители), арилоксильную группу, которая может иметь заместитель (заместители), арилалкилокси группу, которая может иметь заместитель (заместители), гетероарилокси группу, которая может иметь заместитель (заместители), и гетероарилалкилокси группу, которая может иметь заместитель (заместители).
Алкоксильная группа, имеющая 1-8 атомов углерода, указывает здесь на те группы, алкильная часть которых является прямой, или разветвленной, или циклической. Ее примерами являются метокси, этокси, пропилокси, изопропилокси, бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси, пентилокси, изопентилокси, 1-метилбутилокси, 1,1-диметилпропилокси, 2-метилбутилокси, неопентилокси, гексилокси, изогексилокси, 1-метилпентилокси, 1,1-диметилбутилокси, гептилокси, октилокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси и циклооктилокси группа.
Алкоксильная группа, имеющая 1-8 атомов углерода, представляет собой предпочтительно алкоксильную группу, имеющую 1-6 атомов углерода. Конкретно, они включают метокси группу, этокси группу, изопропилокси группу, бутилокси группу, изобутилокси группу, втор-бутилокси группу, пентилокси группу и циклопентилокси группу. Особенно предпочтительно, они включают метокси группу, этокси группу, изопропилокси группу и бутилокси группу.
Алкоксильная группа, имеющая 1-6 атомов углерода, которая имеет заместитель (заместители), предпочтительно включает морфолиноэтокси группу, 2-метоксиэтокси группу и 1-метил-2-метоксиэтилокси группу; арилалкилокси группа, которая может иметь заместитель (заместители), предпочтительно включает бензилокси группу; арилокси группа, которая может иметь заместитель (заместители), предпочтительно включает фенилокси группу и 2-метоксифенилокси группу; и гетероарилокси группа, которая может иметь заместитель (заместители), предпочтительно включает фуранилокси группу.
Термин «арил» в «арилокси группе» указывает на фенил и нафтил.
Термин «гетероарил» в «гетероарилокси группе» указывает на 5-8-членное моно-, би- или трициклическую гетероароматическую кольцевую группу, содержащую 1, 2, 3 или 4 гетероатома, выбранных из группы, состоящей из атомов кислорода, серы и азота в качестве кольцевого атома. Например, они включают пиридил, пиридазинил, пиримидил (= пиримидинил), пиразинил, фурил, тиенил, пирролил, изоксазолил, оксазолил, изотиазолил, тиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, бензофуранил, бензотиенил, индолил, изоиндолил, бензоксазолил, бензотиазолил, бензимидазолил, индазолил, бензизоксазолил, бензизотиазолил, бензофуразанил, бензотиадиазолил, пуринил, хинолил (= хинолинил), изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, перидинил, имидазоксазолил, имидазотиазолил, имидазоимидазолил, дибензофуранил, дибензотиенил, карбазолил и акридинил.
Заместитель (заместители) в «алкоксильной группе, которая может иметь заместитель (заместители)» включает, например, морфолинильную группу, пиперидинильную группу, пирролидинильную группу, диметиламино группу, диэтиламино группу, метокси группу, пивалоилокси группу, этоксикарбонилокси группу, циклогексилоксикарбонилокси группу, (5-метил-2-оксо-1,3-диоксол-4-ил)метильную группу, О,2-бензоилоксиреновую группу и гидрокси группу. Метокси группы, имеющие О,2-бензоилоксиреновую группу в качестве заместителя (заместителей), указывает на 3-оксо-1,3-дигидро-2-бензофуран-1-илокси группу.
Заместитель (заместители) в «арилокси группе, которая может иметь заместитель (заместители)» включает метокси группу и метильную группу.
Заместитель (заместители) в «гетероарилокси группе, которая может иметь заместитель (заместители)» включает метокси группу и метильную группу.
Можно считать, что производные фенилаланина формул (1)-(14) представляют собой оптические изомеры и соединения, указанные в настоящем изобретении, включают все указанные оптические изомеры. Более того, оба соединения, образованные одним оптическим изомером, и смесью нескольких оптических изомеров, включены в соединения по настоящему изобретению. Далее, в отношении стереохимии фенилаланиновой части, точно указанной в формулах (1)-(14), предпочтительна L-форма.
Можно считать, что производные фенилаланина формул (1)-(14), представляющие собой диастереомеры, и диастереомер и смесь диастереомеров включены в соединения по настоящему изобретению. Когда производные фенилаланина формул (1)-(14) по настоящему изобретению включают подвижный атом водорода, то можно считать, что производные фенилаланина формул (1)-(14) по настоящему изобретению включают разнообразные таутомерные формы и соединения, указанные в настоящем изобретении, включают указанные таутомерные формы.
Предпочтительные примеры каждого обозначения в формуле (1)
R11 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода или бензилокси группу, а предпочтительнее, гидроксильную группу, изопропилокси группу, бутилокси группу, фенилокси группу, бензилокси группу, втор-бутильную группу, трет-бутильную группу, 1-метилбутокси группу, 1,1-диметилпропильную группу, 1-метилпентилокси группу, 1,1-диметилбутилокси группу, циклопропильную группу, циклобутильную группу, циклопентильную группу или циклогексильную группу. Среди них особенно предпочтительными являются гидроксильная группа и изопропилокси группа.
Алкильная группа в R12 и R13 представляет собой предпочтительно алкильную группу, имеющую 1-3 атома углерода.
R12 представляет собой предпочтительно атом водорода, метильную группу или этильную группу, а особенно предпочтительно, метильную группу или этильную группу.
R13 представляет собой предпочтительно атом водорода или метильную группу, а особенно предпочтительно, атом водорода.
Среди указанных выше, N(R12)R13 представляет собой предпочтительно диметиламино группу, этиламино группу или метиламино группу, или N(R12)R13 также представляет собой предпочтительно 1-пирролидинильную группу, 1-пиперидинильную группу или 4-морфолинильную группу.
R14 представляет собой предпочтительно метильную группу.
R1' представляет собой предпочтительно атом водорода или атом фтора, а особенно предпочтительно, атом водорода.
Замещающее положение R1' является предпочтительно шестое или седьмое положение хиназолиндионового кольца.
Х1 представляет собой предпочтительно -CH(R1a)-, -CH(R1a)CH(R1b)-, -N(R1a)CH(R1b)CH(R1c)-, -OCH(R1a)CH(R1b)- или 1,3-пирролидинилен, а особенно предпочтительно, -СН2-.
Замещающее положение Х1 представляет собой предпочтительно шестое, седьмое или восьмое положение хиназолиндионового кольца, а предпочтительнее, его шестое или седьмое положение, а особенно предпочтительно, его шестое положение.
R1a, R1b, R1c и R1d представляют собой предпочтительно атом водорода.
И Y11, и Y12 представляют собой предпочтительно атом хлора.
[2] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[1], в которых в формуле (1) R11 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами), алкильная группа в R12 и R13 представляет алкильную группу, имеющую 1-3 атома углерода, и Х1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)-, -N(R1a)CH(R1b)CH(R1c)-, -OCH(R1a)CH(R1b)- или 1,3-пирролидинилен.
[3] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[2], в которых в формуле (1) Х1 представляет -CH(R1a)-, -СН2СН2-, -N(R1a)СН2СН2- или 1,3-пирролидинилен, где R1a представляет атом водорода или метильную группу.
[4] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[3], в которых в формуле (1) R12 и R13 каждый представляет атом водорода или алкильную группу, имеющую 1-3 атома углерода, или N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу, 4-тиоморфолинильную группу, 3-тетрагидротиазолильную группу или 1-пиперазинильную группу, четвертое положение которой может быть замещено алькильной группой, имеющей 1-3 атома углерода.
[5] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[3], в которых в формуле (1) R12 представляет метильную группу или этильную группу,
R13 представляет атом водорода, метильную группу или этильную группу, или
N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу или 4-морфолинильную группу,
R14 представляет метильную группу,
R1' представляет атом водорода,
Х1 представляет -СН2-, который расположен в шестом, седьмом или восьмом положении хиназолиндионового кольца, и
Y11 и Y12 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
Далее, предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[5], в которых в формуле (1) и Y11, и Y12 представляют атом хлора.
[6] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[3], в которых в формуле (1) R13 представляет атом водорода, метильную группу или этильную группу,
Х1 представляет -СН2-, который расположен в шестом, седьмом или восьмом положении хиназолиндионового кольца, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
[7] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[6], в которых в формуле (1)
R13 представляет атом водорода, метильную группу или этильную группу, и
Х1 представляет -СН2-, который расположен в шестом положении хиназолиндионового кольца.
[8] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[6], в которых в формуле (1)
R13 представляет атом водорода, метильную группу или этильную группу, и
Х1 представляет -СН2-, который расположен в седьмом положении хиназолиндионового кольца.
[9] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[3], в которых в формуле (1)
R12 и R13 каждый независимо представляет метильную группу или этильную группу,
R14 представляет метильную группу,
R1' представляет атом водорода или атом фтора, который расположен в шестом или седьмом положении хиназолиндионового кольца,
Х1 представляет -N(СН3)СН2СН2- или 1,3-пирролидинилен, который расположен в шестом или седьмом положении хиназолиндионового кольца, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
[10] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[2], в которых в формуле (1) R12 и R13 каждый независимо представляет атом водорода, метильную группу или этильную группу, или N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу или 4-морфолинильную группу,
R14 представляет метильную группу или этильную группу,
R1' представляет атом водорода,
Х1 представляет -OCH(R1a)CH(R1b), где R1a и R1b каждый независимо представляет атом водорода или метильную группу, и
Y11 и Y12 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F), (F, F) и (F, Me).
[11] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[10], в которых в формуле (1) R12 и R13 каждый независимо представляет атом водорода, метильную группу или этильную группу,
R14 представляет метильную группу и
Y11 и Y12 представляют комбинацию (Cl, Cl).
[12] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[1], в которых в формуле (1)
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода, которые могут иметь метокси группу (группы) в качестве заместителя (заместителей),
R12 представляет атом водорода или алкильную группу, имеющую 1-6 атомов углерода,
R13 представляет атом водорода, метильную группу или этильную группу, или
N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу, 4-тиоморфолинильную группу, 3-тетрагидротиазолильную группу или 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода,
R14 представляет метильную группу,
R1' представляет атом водорода,
Х1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)-, -CH(R1a)CH(R1b)CH(R1c)- или -OCH(R1a)CH(R1b)-, который расположен в шестом положении хиназолиндионового кольца, где R1a, R1b и R1c каждый представляет атом водорода, и
Y11, и Y12 представляют комбинацию (Cl, Cl).
[13] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[1], в которых в формуле (1)
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет алкильную группу, имеющую 1-6 атомов углерода,
R13 представляет атом водорода, метильную группу или этильную группу,
R14 представляет метильную группу,
R1' представляет атом водорода,
Х1 представляет -CH(R1a)- или -CH(R1a)CH(R1b)-, который расположен в шестом положении хиназолиндионового кольца, где R1a и R1b каждый представляет атом водорода, и
Y11, и Y12 представляют комбинацию (Cl, Cl).
[14] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[1], в которых в формуле (1)
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет алкильную группу, имеющую 1-5 атомов углерода,
R13 представляет атом водорода,
R14 представляет метильную группу,
R1' представляет атом водорода,
Х1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)- или -CH(R1a)CH(R1b)CH(R1c)-, который расположен в шестом положении хиназолиндионового кольца, где R1a, R1b и R1c каждый представляет атом водорода, и
Y11, и Y12 представляют комбинацию (Cl, Cl).
[15] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[1], в которых в формуле (1)
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет метильную группу или этильную группу,
R13 представляет атом водорода,
R14 представляет метильную группу,
R1' представляет атом водорода,
Х1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)- или -CH(R1a)CH(R1b)CH(R1c)-, который расположен в шестом положении хиназолиндионового кольца, где R1a, R1b и R1c каждый представляет атом водорода, и
Y11, и Y12 представляют комбинацию (Cl, Cl).
[16] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[1], в которых в формуле (1)
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет метильную группу, этильную группу, изобутильную группу, циклопропилметильную группу, циклобутильную группу, втор-бутильную группу или изопентильную группу,
R13 представляет атом водорода,
R14 представляет метильную группу,
R1' представляет атом водорода,
Х1 представляет -CH(R1a)-, который расположен в шестом положении хиназолиндионового кольца, где R1a представляет атом водорода, и
Y11, и Y12 представляют комбинацию (Cl, Cl).
[17] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[1], в которых в формуле (1)
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет атом водорода или алкильную группу, имеющую 1-3 атома углерода,
R13 представляет атом водорода, метильную группу или этильную группу, или
N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу, 4-тиоморфолинильную группу, 3-тетрагидротиазолильную группу или 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода,
R14 представляет метильную группу,
R1' представляет атом водорода,
Х1 представляет -О-CH(R1a)CH(R1b)- или -O-CH(R1a)CH(R1b)CH(R1c)-, который расположен в шестом положении хиназолиндионового кольца, где R1a, R1b и R1c каждый независимо представляет атом водорода или метильную группу, и
Y11, и Y12 представляют комбинацию (Cl, Cl).
[18] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по любому из указанных выше пп.[1]-[17], в которых в формуле (1) R11 представляет разветвленную алкоксильную группу, имеющую 3-6 атомов углерода.
[19] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[1], представленные следующими формулами:





Предпочтительные примеры каждого обозначения в формуле (2)
R21 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода или морфолиноэтилокси группу, а особенно предпочтительно, гидроксильную группу, метокси группу, этокси группу, изопропилокси группу, бутилокси группу или морфолиноэтокси группу.
R22 представляет собой предпочтительно метильную группу или этильную группу.
R24 представляет собой предпочтительно метильную группу.
R2' представляет собой предпочтительно атом водорода или атом фтора.
Замещающее положение R2' представляет собой предпочтительно шестое или седьмое положение хиназолиндионового кольца.
Х2 представляет собой предпочтительно -CH2-, -NHCH2CH2- или -N(Me)CH2CH2-.
Замещающее положение Х2 представляет собой предпочтительно шестое, седьмое или восьмое положение хиназолиндионового кольца, а предпочтительнее, его седьмое или восьмое положение.
И Y21, и Y22 представляют собой предпочтительно атом хлора.
[21] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[20], в которых в формуле (2)
R22 представляет метильную группу или этильную группу,
R24 представляет метильную группу,
R2' представляет атом водорода,
Х2 представляет -CH2-, который расположен в шестом, седьмом или восьмом положении хиназолиндионового кольца, и
Y21, и Y22 представляют комбинацию (Cl, Cl).
[22] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[20], в которых в формуле (2)
R22 представляет атом водорода, метильную группу или этильную группу,
R24 представляет метильную группу,
R2' представляет атом водород или атом фтора, который расположен в шестом или седьмом положении хиназолиндионового кольца,
Х2 представляет -N(CH3)CH2CH2- или -NHCH2CH2-, который расположен в шестом или седьмом положении хиназолиндионового кольца, и
Y21, и Y22 представляют комбинацию (Cl, Cl).
Предпочтительные примеры каждого обозначения в формуле (3)
R31 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода или морфолиноэтилокси группу или бензилокси группу, а особенно предпочтительно, гидроксильную группу, метокси группу, этокси группу, изопропилокси группу, бутилокси групп, пентилокси группу, морфолиноэтилокси группу или бензилокси группу.
R34 представляет собой предпочтительно метильную группу.
R3' представляет собой предпочтительно атом водорода.
Указанная выше формула (3-1) представляет собой предпочтительно 4-морфолинильную группу, 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода, или 1-имидазолильную группу, которая может быть замещена метильной группой, этильной группой или амино группой. Связи в формуле (3-1) могут быть насыщенными или ненасыщенными. Х3 в формуле (3-1) представляет собой предпочтительно атом кислорода или атом азота. Указанная выше формула (3-1) представляет собой предпочтительно 4-морфолинильную группу, 4-метил-1-пиперазинильную группу или 2-амино-1-имидазолильную группу.
И Y31, и Y32 представляют собой предпочтительно атом хлора.
[24] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[23], в которых формула (3-1) представляет 4-морфолинильную группу, 4-тиоморфолинильную группу, 3-тетрагидротиазолильную группу, 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода, или 1-имидазолильную группу, которая может быть замещена метильной группой или аминогруппой.
где Х3 представляет атом кислорода, атом азота, который может быть замещен алкильной группой, имеющей 1-3 атома углерода, или атом серы.
[25] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[24], в которых в формуле (3)
R34 представляет метильную группу,
R3' представляет атом водорода,
Формула (3-1) представляет 4-морфолинильную группу или 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода, и
Y31, и Y32 представляют комбинацию (Cl, Cl).
[26] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[24], в которых в формуле (3)
R34 представляет метильную группу,
R3' представляет атом водорода,
Формула (3-1) представляет 2-амино-1-имидазолильную группу, и
Y31 и Y32 представляют комбинацию (Cl, Cl).
[27] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[23], в которых в формуле (3)
R34 представляет метильную группу,
R3' представляет атом водорода или атом фтора,
Формула (3-1) представляет 1-имидазолильную группу, второе положение которой может быть замещено метильной группой или этильной группой, и
Y31, и Y32 представляют комбинацию (Cl, Cl).
Предпочтительные примеры каждого обозначения в формуле (4)
Кольцо представляет собой предпочтительно бензольное кольцо, пиридиновое кольцо, тиофеновое кольцо, пиперидиновое кольцо, первое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода, или пиперазиновое кольцо, первое и/или четвертое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода.
R41 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, а особенно предпочтительно, гидроксильную группу, метокси группу, этокси группу, изопропилокси группу, бутилокси группу, пентилокси группу, морфолиноэтилокси группу или бензилокси группу.
Кольцо представляет собой предпочтительно бензольное кольцо, пиридиновое кольцо, первое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода, или пиперазиновое кольцо, первое и/или четвертое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода, а особенно предпочтительно, пиперазиновое кольцо, первое и/или четвертое положение которого может быть замещено метильной группой.
R44 представляет собой предпочтительно метильную группу.
И Y41, и Y42 представляют собой предпочтительно атом хлора.
[29] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[28], в которых в формуле (4) кольцо представляет пиперазиновое кольцо, первое и/или четвертое положение которого может быть замещено метильной группой,
R44 представляет метильную группу и
Y41, и Y42 представляют комбинацию (Cl, Cl).
Предпочтительные примеры каждого обозначения в формуле (5)
R51 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, или морфолиноэтилокси группу, а особенно предпочтительно, гидроксильную группу, метокси группу, этокси группу, изопропильную группу, бутилокси группу или морфолиноэтокси группу.
R54 представляет собой предпочтительно метильную группу.
R5' представляет собой предпочтительно атом водорода.
N(R5a)R5b представляет собой предпочтительно этиламино группу или 1-пирролидинильную группу.
И Y51, и Y52 представляют собой предпочтительно атом хлора.
[31] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[30], в которых в формуле (5),
R54 представляет метильную группу,
R5' представляет атом водорода,
N(R5a)R5b представляет этиламино группу или 1-пирролидинильную группу, и
Y51, и Y52 представляют комбинацию (Cl, Cl).
Предпочтительные примеры каждого обозначения в формуле (6)
R61 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, а особенно предпочтительно, гидроксильную группу, метокси группу, этокси группу, изопропильную группу, бутилокси группу, пентилокси группу, морфолиноэтокси группу или бензилокси группу.
А представляет собой предпочтительно любую из формул (6-1)-(6-6).
И Y61, и Y62 представляют собой предпочтительно атом хлора.
[33] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[32], в которых в формуле (6)
А6 представляет любую из указанных выше формул (6-1)-(6-4).
[34] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[32], в которых в формуле (6)
R61 представляет гидроксильную группу, а Y61, и Y62 представляют комбинацию (Cl, Cl).
Предпочтительные примеры каждого обозначения в формуле (7)
R71 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, или морфолиноэтилокси группу, а особенно предпочтительно, гидроксильную группу, метокси группу, этокси группу, изопропильную группу, бутилокси группу или морфолиноэтилокси группу.
R74 представляет собой предпочтительно метильную группу,
R7 представляет собой предпочтительно 2-пропинильную группу, циклопропилметильную группу, пропильную группу или циклопентильную группу.
И Y71, и Y72 представляют собой предпочтительно атом хлора.
[36] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[35], в которых в формуле (7)
R74 представляет метильную группу,
R7 представляет 2-пропинильную группу или циклопропилметильную группу, и
Y71, и Y72 представляют комбинацию (Cl, Cl).
[37] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[35], в которых в формуле (7)
R74 представляет метильную группу,
R7 представляет пропильную группу, и
Y71, и Y72 представляют комбинацию (Cl, Cl).
Предпочтительные примеры каждого обозначения в формуле (8)
R81 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, или морфолиноэтилокси группу, а особенно предпочтительно, гидроксильную группу, метокси группу, этокси группу, изопропилокси группу, бутилокси группу или морфолиноэтилокси группу.
R82 представляет собой предпочтительно метильную группу.
R84 представляет собой предпочтительно метильную группу.
n8 представляет собой предпочтительно одно из целых числе 0 или 2, а особенно предпочтительно, 0.
S(=(0)n8)R82 представляет собой предпочтительно метилтио группу или метансульфонильную группу.
Замещающее положение S представляет собой предпочтительно шестое положение хиназолиндионового кольца.
И Y81, и Y82 представляют собой предпочтительно атом хлора.
[39] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[38], в которых в формуле (8),
R81 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, и морфолиноэтилокси группу или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами).
[40] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[38], в которых в формуле (8),
R82 представляет собой предпочтительно метильную группу.
R84 представляет собой предпочтительно метильную группу.
n8 представляет собой предпочтительно одно из целых числе 0 или 2,
S расположен в шестом положении хиназолиндионового кольца, и
Y81, и Y82 представляют комбинацию (Cl, Cl).
Предпочтительные примеры каждого обозначения в формуле (9)
R91 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилокси группу или бензилокси группу, а особенно предпочтительно, гидроксильную группу, метокси группу, этокси группу, изопропилокси группу, бутилокси группу, пентилокси группу, морфолиноэтилокси группу или бензилокси группу.
R92 представляет собой предпочтительно гидроксильную группу, бензилокси группу, метокси группу или аминогруппу. CO-R92 может представлять собой карбоксильную группу в пролекарственной форме, которая превращается в карбоксильную группу in vivo. А именно, R92 представляет собой предпочтительно гидроксильную группу или группу, которая замещается гидроксильной группой in vivo.
Конкретные примеры группы (групп), которые замещаются гидроксильной группой in vivo, приведены выше.
R94 представляет собой предпочтительно метильную группу.
Х9 представляет собой предпочтительно атомную связь.
Замещающее положение Х9 представляет собой предпочтительно шестое положение хиназолиндионового кольца.
И Y91, и Y92 представляют собой предпочтительно атом хлора.
[42] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[41], в которых в формуле (9),
Х9 представляет -СН2СН2- или -СН=СН- и R92 представляет гидроксильную группу,
или Х9 представляет атомную связь, а R92 представляет бензилокси группу,
Х9 расположен в шестом положении хиназолиндионового кольца,
R94 представляет метильную группу, и
Y91, и Y92 представляют комбинацию (Cl, Cl).
[43] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[41], в которых в формуле (9),
Х9 представляет атомную связь, а R92 представляет гидроксильную группу, метокси группу или амино группу,
Х9 расположен в шестом положении хиназолиндионового кольца,
R94 представляет метильную группу, и
Y91, и Y92 представляют комбинацию (Cl, Cl).
Предпочтительные примеры каждого обозначения в формуле (10)
R101 представляет собой предпочтительно алкоксильную группу, имеющую 2-4 атома углерода, или морфолиноэтилокси группу, а особенно предпочтительно, этокси группу, изопропилокси группу, бутилокси группу или морфолиноэтилокси группу.
R10 представляет собой предпочтительно метильную группу или этильную группу, а особенно предпочтительно этильную группу.
R104 представляет собой предпочтительно метильную группу.
И Y101, и Y102 представляют собой предпочтительно атом хлора.
[45] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[44], в которых в формуле (10), R10 представляет этильную группу.
Предпочтительные примеры каждого обозначения в формуле (11)
R111 представляет собой предпочтительно алкоксильную группу, имеющую 1-4 атома углерода, или морфолиноэтилокси группу, а особенно предпочтительно, метокси группу, этокси группу, изопропилокси группу, бутилокси группу или морфолиноэтилокси группу.
R114 представляет собой предпочтительно метильную группу.
И Y111, и Y112 представляют собой предпочтительно атом хлора.
Предпочтительные примеры каждого обозначения в формуле (12)
R121 представляет собой предпочтительно алкоксильную группу, имеющую 1-4 атома углерода, или морфолиноэтилокси группу, а особенно предпочтительно, метокси группу, этокси группу, изопропилокси группу, бутилокси группу или морфолиноэтилокси группу.
R124 представляет собой предпочтительно метильную группу,
А представляет собой предпочтительно формулу (12-1).
Предпочтительные примеры каждого обозначения в формуле (13)
R131 представляет собой предпочтительно алкоксильную группу, имеющую 1-6 атома углерода, или бензилокси группу, которая может быть замещена метильной группой (группами) или метокси группой (группами), а особенно предпочтительно, этокси группу или бензилокси группу.
Замещающее положение аммониевой боковой цепи представляет собой предпочтительно шестое, седьмое или восьмое положение хиназолиндионового кольца, а предпочтительнее, его восьмое положение.
R13a и R13b представляют собой предпочтительно метильную группу или N(R13a)R13b представляет собой предпочтительно 1-пирролидинильную группу.
Y131, и Y132 представляют собой предпочтительно (Cl, Cl), (Cl, Me) или (Cl, F).
Предпочтительные примеры каждого обозначения в формуле (14)
R141 представляет собой предпочтительно гидроксильную группу, алкоксильную группу, имеющую 1-6 атома углерода, или морфолиноэтилокси группу, а особенно предпочтительно, этокси группу или бензилокси группу.
R144 представляет собой предпочтительно метильную группу или этильную группу.
Замещающее положение гидроксильной группы на хиназолиндионовом кольце представляет собой предпочтительно шестое или седьмое положение кольца, а предпочтительнее, его восьмое положение.
Y141, и Y142 представляют собой предпочтительно (Cl, Cl), (Cl, Me), (Cl, F), (F, F) или (F, Me), а особенно предпочтительно, (Cl, Cl), (Cl, Me) или (Cl, F).
[50] Предпочтительны производные фенилаланина или их фармацевтически приемлемые соли по указанному выше п.[49], в которых в формуле (14), R144 представляет метильную группу,
гидроксильная группа расположена в шестом положении хиназолиндионового кольца, и
Y141, и Y142 представляют комбинацию (Cl, Cl).
Предпочтительными соединениями формул (1)-1(14) являются соединения, описанные в разделе «Примеры». Особенно предпочтительными соединениями являются соединения, описанные в примерах 7, 8, 12, 21, 28, 30, 34, 37, 40, 46, 54, 59, 90, 91, 92, 99, 103, 106, 111, 116, 124, 136, 138, 139, 141, 142, 143, 144, 145, 147, 148, 149, 150, 151, 153, 154, 155, 156, 157, 159, 162, 163, 164, 165, 166, 170, 171, 172, 173, 174, 176, 179, 181, 184, 185, 189, 191, 193, 196, 198, 201, 210, 213, 214, 216, 217, 218, 219, 220, 222, 223, 224, 225, 226, 229, 207, 230, 232, 233, 234 и 235.
Среди соединений формул (1)-(14) особенно предпочтительно соединение формулы (1), а особенно, соединения, где R11 представляет гидроксильную группу; эти соединения проявляют отличную антагонистическую активность против связывания α4β1, но также проявляют крайне низкое общее выведение из организма (CLtot). Поэтому, соединения имеют отличные характеристики в качестве активной формы для орально вводимого антагониста α4 интегрина (пролекарства), который эффективен в более низкой дозировке и при меньшем количестве доз.
В частности, соединения, где R11 представляет разветвленную алкоксильную группу, имеющую 3-6 атомов углерода, проявляют отличную длительность действия при оральном введении.
Когда соединения формул (1)-(14) по настоящему изобретению могут образовывать соли, достаточно, чтобы соли были фармацевтически приемлемыми. Когда соединение имеет в формуле кислотную группу, такую как карбоксильная группа, то соли могут представлять собой соли аммония, или их соли со щелочными металлами, например натрием и калием, их соли со щелочноземельными металлами, например кальцием и магнием, их соли с алюминием, их соли с цинком, их соли с органическими аминами, например триэтиламином, этаноламином, морфолином, пиперидином и дициклогексиламином, и их соли с основными аминокислотами, например аргинином и лизином. Когда соединение имеет основную группу в формуле, то соли могут представлять собой соли с неорганическими кислотами, например хлористоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и бромистоводородной кислотой; соли с органическими карбоновыми кислотами, например уксусной кислотой, лимонной кислотой, бензойной кислотой, малеиновой кислотой, фумаровой кислотой, винной кислотой, янтарной кислотой, дубильной кислотой, масляной кислотой, гибензоевой кислотой, памовой кислотой, энантовой кислотой, деканоевой кислотой, теокловой кислотой, салициловой кислотой, молочной кислотой, щавелевой кислотой, миндальной кислотой, и яблочной кислотой; и соли с органосульфоновыми кислотами, например метансульфоновой кислотой, бензолсульфоновой кислотой, и п-толуолсульфоновой кислотой. Соли можно образовывать смешиванием соединения формул (1)-(14) с необходимой кислотой или основанием в соответствующем соотношении в растворителе или диспергирующем соединении, или реакцией катионного обмена или анионного обмена с другой солью.
Соединения по настоящему изобретению включают также сольваты соединений формул (1)-(14), такие как гидраты, и их спиртовые аддукты.
Соединения по настоящему изобретению можно модифицировать в пролекарственные формы. Пролекарство в настоящем изобретении означает соединение (соединения), которое превращается в соединения по настоящему изобретению in vivo. Например, когда активное соединение содержит карбоксильную группу, фосфорную группу и им подобную, то соединения в пролекарственной модификации включают их сложные эфиры, амиды и им подобные соединения. Когда активное соединение содержит аминогруппу, то соединения в пролекарственной модификации включают их амиды, карбаматы и им подобные соединения. Когда активное соединение содержит гидроксильную группу, соединения в пролекарственной модификации включают их сложные эфиры, карбонаты, карбаматы и им подобные соединения. Когда соединения по настоящему изобретению модифицируются в пролекарственные формы, то соединения могут соединяться с аминокислотами или сахаридами.
Настоящее изобретение также включает метаболиты соединений по настоящему изобретению. Метаболиты соединений по настоящему изобретению означают соединения, в которые соединения по настоящему изобретению были превращены метаболическими ферментами и т.д. in vivo. Их примерами являются соединения, где гидроксильная группа была введена в бензольное кольцо метаболизмом; соединения, где алкоксильная группа была превращена в гидроксильную группу метаболизмом; и соединения, где алкильная группа на атоме азота была деалкилирована метаболизмом. Далее, они включают соединения, где глюкуроновая кислота, глюкоза, аминокислота или серная кислота, соединились с карбоновокислотной частью соединений по настоящему изобретению, с гидроксильногрупповой частью соединений по настоящему изобретению или с гидроксильногрупповой частью, введенной метаболизмом.
Соединения по настоящему изобретению оказывают превосходное антагонистическое действие против адгезии клеток посредством α4 интегринов и имеют превосходную биологическую доступность и устойчивость после орального введения. Кроме того, они имеют превосходную устойчивость даже при парентеральном введении. Эти характеристики отражают отличный аффинитет к α4 интегринам, связывание с белками плазмы, растворимость, полное выведение из организма или проницаемость через слизистую оболочку кишечного тракта.
В частности, поскольку соединения по настоящему изобретению имеют высокую антагонистическую активность в отношении α4 интегринов даже в условиях существования белка плазмы, при введении in vivo может быть эффективна низкая дозировка соединения по настоящему изобретению.
Кроме того, общее выведение из организма соединений по настоящему изобретению низкое, и поэтому они имеют превосходный, продолжительный фармакодинамический профиль в плазме крови. Эти характеристики дают возможность снизить их дозировку и количество доз. Кроме того, можно поддерживать уровень соединений по настоящему изобретению в плазме крови, и, следовательно, можно эффективно ингибировать адгезию клеток, происходящую посредством α4 интегрина.
Соединения по настоящему изобретению имеют высокую проницаемость через мембраны и большую площадь под кривой динамики во времени концентрации в плазме крови (AUC) и высокую биологическую доступность при оральном введении.
Кроме того, соединения по настоящему изобретению имеют высокую безопасность.
В частности, соединение формулы (1) из соединений формул (1)-(14) проявляет высокую растворимость и является полезным.
Поэтому, новые производные фенилаланина по настоящему изобретению и их соли предоставляют превосходные антагонисты α4 интегрина и терапевтические средства или профилактические средства против заболеваний, при которых в патологии принимает участие процесс адгезии, зависимый от α4 интегрина, таких как воспалительные заболевания, такие как ревматоидный артрит, воспалительные кишечные заболевания (включая болезнь Крона и язвенный колит), системная красная волчанка, рассеянный склероз, синдром Шегрена, астма, псориаз, аллергия, сахарный диабет, сердечно-сосудистые заболевания, артериальный склероз, рестеноз, опухолевая пролиферация, метастазирование опухолей и отторжение трансплантата.
Они также предоставляют терапевтические средства или профилактические средства против таких заболеваний, как преэклампсия, ишемические сердечно-сосудистые расстройства (включая инфаркт мозга), склеродермия, анкилозирующий спондилит, псориатический артрит, саркоидоз, гигантоклеточный артериит, увеиты, пневмосклероз, хроническое обструктивное легочное заболевание, остеоартрит, болезнь Альцгеймера, повреждение спинного мозга, травматическое повреждение мозга, первичный склерозирующий холангит, цирроз печени, вызванный гепатитом С, активный хронический гепатит, сакроилиит, анкилозирующий спондилит, эписклерит, ирит, увеиты, узелковая эритема, гангренозная пиодермия и аутоиммунный гепатит.
Кроме того, они предоставляют терапевтические средства или профилактические средства против не только указанных выше заболеваний, но также заболеваний, при которых α4 интегрины могут участвовать в развитии патологии.
Доза соединений по настоящему изобретению или его солей, используемых в указанных выше целях, варьируется, в зависимости от используемого соединения, предполагаемого терапевтического эффекта, способа введения, периода лечения и возраста и массы тела пациента. Доза составляет обычно от 1 мкг до 5 г/д для взрослых при оральном введении и от 0,011 мкг до 5 г/д для взрослых при парентеральном введении (например, внутривенно, подкожно, внутримышечно, в виде суппозитории, бариевой клизмы, мази, липкой накладки на кожу, сублингвально и в виде глазных капель).
Соединения по настоящему изобретению имеют высокую устойчивость в кислотном или щелочном растворе, и они полезны, поскольку их можно применять в различных лекарственных формах.
Соединения по настоящему изобретению или его соли вводятся пациенту в чистом виде или в форме различных фармацевтических композиций, имеющих фармацевтически приемлемый носитель.
Фармацевтически приемлемые носители включают, например, различные органические или неорганические материалы носителей, обычно используемые в качестве материалов для получения лекарственных препаратов. Их примерами являются разбавители, смазывающие вещества, связывающие вещества, разрыхлители, растворимые в воде полимеры и основные неорганические соли в твердых препаратах; и растворители, солюбилизирующие агенты, суспендирующие агенты, изотонизирующие агенты, забуферивающие агенты и смягчающие агенты в жидких растворах. Кроме того, при необходимости, можно использовать добавки, такие как антисептические агенты, антиоксиданты, красящие агенты, подслащивающие агенты, подкисляющие агенты, пенообразующие агенты и ароматизирующие материалы.
Лекарственные формы фармацевтических композиций представляют собой, например, таблетки, порошки, пилюли, гранулы, капсулы, суппозитории, растворы, покрытые сахаром таблетки, депо-формы, сиропы, суспензионные средства, эмульсии, троше, сублингвальные формы, наклеиваемые на кожу накладки, разрушающиеся при оральном приеме средства (таблетки), ингаляционные средства, бариевая клизма, мази, пластыри и глазные капли. Их можно получить с обычными вспомогательными средствами, используемыми при изготовлении, с помощью обычного способа.
Фармацевтические композиции по настоящему изобретению можно получить способами, обычно используемыми в области техники получения композиций и, например, способами, описанными в Японской Фармакопее. Способы получения описаны в деталях ниже.
Например, когда соединения по настоящему изобретению получают в виде орального препарата, к ним добавляются разбавители и, при необходимости, связывающие вещества, разрыхляющие агенты, смазывающие вещества, красящие агенты, ароматизирующие агенты. Затем обычными способами их можно формовать в виде, например, таблеток, порошков, пилюль, гранул, капсул, суппозиторий, растворов, покрытых сахаром таблеток, депо-форм, сиропов, суспензионных средств, эмульсий, троше, сублингвальных средств, разрушающихся при оральном приеме средств (таблеток), ингаляционных средств. В качестве разбавителей используются, например, лактоза, кукурузный крахмал, сахароза, глюкоза, сорбит и кристаллическая целлюлоза; в качестве связывающих средств, используются, например, поливиниловый спирт, простой поливиниловый эфир, этилцеллюлоза, метилцеллюлоза, акация, трагакант, желатин, шеллак, гидроксипропилцеллюлоза, гидроксипропилкрахмал и поливинилпирролидон; в качестве разрыхляющих агентов, используются, например, крахмал, агар, желатиновый порошок, кристаллическая целлюлоза, карбонат кальция, гидрокарбонат натрия, цитрат кальция, декстран и пектин; в качестве смазывающих агентов, используются стеарат магния, тальк, полиэтиленгликоль, диоксид кремния, гидрированное растительное масло и им подобные; материалы, которые допущены для добавления к лекарственным препаратам, используются в качестве красящих агентов; и в качестве ароматизирующих агентов, используются, например, порошок какао, ментол, ароматическая кислота, масло мяты перечной, порошок борнеола и коричного дерева. Эти таблетки или гранулы могут быть при необходимости покрыты сахаром, желатином и им подобными материалами.
Когда получают инъекционные средства, к ним, при необходимости, добавляют регуляторы рН, забуферивающие агенты, стабилизирующие агенты и консерванты, и затем их обычными способами получают в виде подкожно, внутримышечно и внутривенно вводимых средств.
Производные фенилаланина (1) по настоящему изобретению можно получить, например, описанными ниже способами. Производные фенилаланина (2)-(14) можно получить такими же способами как способы, описанные ниже.
Подходящим образом защищенную карбоновую кислоту (S-1) загружают в смолу обычным способом. Заместитель Q карбоновой кислоты (S-1) имеет структуру 2-Y11-6-Y12-Ph-CO, как описано выше со ссылкой на формулу (1), он представляет собой заместитель, который может быть превращен в 2-Y11-6-Y12-Ph-CO на любой стадии синтеза, или он представляет собой защитную группу аминогруппы. Заместитель R карбоновой кислоты (S-1) имеет структуру заместителя, который может быть превращен в NH2 или подходяще защищен от группы NH2.
Что касается реакции загрузки, то реакцию можно проводить при использовании, при необходимости, подходящей добавки, такой как HOAt (1-гидрокси-7-азабензотриазол), HOBt (1-гидроксибензотриазол) или DMAP (диметиламинопиридин), и конденсирующего агента, такого как DIC (диизопропилкарбодиимид), DCC (дициклогексилкарбодиимид) или EDC (1-этил-3-(3-диметиламинопропил)карбодиимид) в органическом растворителе, таком как дихлорметан, DMF (N,N-диметилформамид) или NMP (N-метил-2-пирролидон). Например, когда используется смола Wang, реакция проводится в присутствии DIC и DMAP в DMF для получения сложного эфира (S-2).

Когда Q представляет собой, например, защитную группу Е (S-3) аминогруппы, то защитную группу можно удалить, в зависимости от защитной группы Е в соответствующих условиях, для получения амина (S-4). Например, в случае использования группы Fmoc (группы 9-фторенилметоксикарбонильной группы) в качестве Е, защитную группу можно удалить основанием, таким как пиперидин, в растворителе, таком как DMF. Амид (S-5) можно получить взаимодействием амина (S-4) с соответствующей карбоновой кислотой использованием конденсирующего агента, такого как DIC, и, при необходимости, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как DMF, NMP или дихлорметан. Амид (S-5) можно также получить взаимодействием соответствующего хлорид кислоты в присутствии основания.

Сложный эфир (S-2) можно заменить на амин (S-6) в подходящих условиях, в зависимости от заместителя R. Например, когда нитро группа используется в качестве R, то сложный эфир (S-2) может быть заменен на амин (S-6) в присутствии восстанавливающего агента, такого как SnCl2 или его гидраты, в растворителе, таком как NMP, DMF или этанол. В случае амина, защищенного группой Fmoc (9-фторенилметоксикарбонильной группы) (FmocNH), защитную группу можно удалить основанием, таким как пиперидин, в растворителе, таком как DMF, для получения амина (S-6).

Хиназолиндион (S-9) можно синтезировать следующим способом. Во-первых, амид (S-7) можно получить взаимодействием амина (S-6) с галидом бензойной кислоты, имеющим нитро группу в орто положении, в условиях наличия 2,6-лутидинового основания в расторителе, таком как NMP, или взаимодействием его с карбоновой кислотой, имеющей нитро группу в орто положении, активированную использованием конденсирующего агента, такого как DIC, и, при необходимости, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как DMF, NMP или дихлорметан. Затем амин (S-8) получают восстановлением нитро группы SnCl2 или его гидратами и циклизуют такими реагентами как CDI (карбонилдиимидазол), трифосген или п-нитрофенилхлорформат, для получения хиназолиндиона (S-9).
В качестве других способов синтеза хиназолиндион (S-9) можно также получить следующим способом. Во-первых, амид (S-8) можно получить взаимодействием амина (S-6) с карбоновой кислотой, имеющей аминогруппу в орто положении, активированную использованием конденсирующего агента, такого как DIC, и, при необходимости, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как DMF, NMP или дихлорметан. Затем амид (S-8) циклизуется тем же способом, как указано выше, для получения хиназолиндиона (S-9).
Заместители R' R”' в формулах (S-7)-(S-9) представляют собой группы, которые получают из производных бензойной кислоты, используемых в указанной выше реакции. Они представляют собой R1' или -X1-N(R12)R13, описанные в формуле (1), или группы, которые можно превратить в R1' или -X1-N(R12)R13 на любой стадии синтеза.

В формуле (S-10) соединения, где R” представлен метильной группой, можно получить реакцией Mitsunobu с хиназолиндионом (S-9), используя метанол, диизопропилазодикарбоновую кислоту и подобные соединения. Их можно также получить взаимодействием метилйодида при наличии основания, такого как карбонат калия.

Полученный таким образом сложный эфир (S-10) отщепляется от смолы в подходящих условиях для получения карбоновой кислоты (S-11).
Например, когда используется смола Wang, в сложном эфире (S-10) каждый из Q, R', R” и R”' при необходимости превращается в 2-Y11-6-Y12-Ph-CO, -X1-N(R12)R13, метильную группу или R1', или группы, которые превращаются в 2-Y11-6-Y12-Ph-CO, , -X1-N(R12)R13, метильную группу или R1' в условиях удаления смолы. Затем, сложный эфир (S-10) обрабатывают кислотным раствором, включающим, например, добавленную к ней TFA (трифторуксусную кислоту) для получения раствора карбоновой кислоты (1: R1 = OH), где в формуле (1) R1 представлен гидроксильной группой. Далее, чистую карбоновую кислоту (1: R1 = OH) можно получить применением хорошо известных способов выделения и очистки, таких как концентрация, экстракция, кристаллизация, колоночная хроматография, ВЭЖХ и рекристаллизации в полученную таким образом карбоновую кислоту (1: R1 = OH).
Кроме того, карбоновую кислоту (1: R1 = OH) можно также получить применением способов синтеза на твердой фазе до жидкофазного способа, где выбирается подходящая защитная группа и используются хорошо известные способы выделения и очистки.
В карбоновой кислоте (S-11) каждый из Q, R', R” и R”' представляет 2-Y11-6-Y12-Ph-CO, -X1-N(R12)R13, метильную группу или R1', или группы, которые могут превращаются в 2-Y11-6-Y12-Ph-CO, , -X1-N(R12)R13, метильную группу или R1' в последующих способах. Карбоксильная группа в формуле (S-11) может быть превращена в группу -CO-R11 (где R11 представляет алкоксильную группу) хорошо известной эстерификацией. Конкретнее, способы представляют собой следующие. Карбоксильную группу обрабатывают подходящим спиртом в условиях дегидратации в присутствии кислотного катализатора; ее обрабатывают О-алкилирующими агентами, такими как алкилгалид, при необходимости, в условиях присутствия основания или кислоты; при необходимости, ее обрабатывают подходящим спиртом в условиях присутствия основания, после превращения в галид кислоты тионилхлоридом и подобными соединениями; конкретнее, ее обрабатывают, например, этилхлорформиатом в условиях присутствия основания для превращения в ангидрид кислоты. Затем реакционное вещество при необходимости обрабатывают подходящим спиртом в условиях присутствия основания. Далее, его обрабатывают подходящим спиртом в условиях присутствия конденсирующего агента, такого как дициклогексилкарбодиимид, и, при необходимости, катализатора, такого как диметиламинопиридина.
После этих способов соединения по настоящему изобретению (1 : R1 представляет собой алкоксильную группу) можно получить при необходимости превращением Q, R', R” и R”'.
В формуле (1), например, соединение (S-15), где Х1 представляет СН2, можно синтезировать следующим образом. В формуле R11a представляет R11 или функциональную группу, которую можно превратить в R11 на любой стадии синтеза.

Нитро соединение (S-12), которое представляет собой исходный материал, можно получить, например, процедурой синтеза, такой как процедура синтеза сложного изопропилового эфира (S)-2-(2,6-дихлорбензоиламино)-3-(4-нитрофенил)пропионовой кислоты в Способе 1 Справочного примера 4. Нитро соединение (S-12) восстанавливается в анилиновое соединение взаимодействием с SnCl2, реакцией гидрирования в присутствии металлического катализатора и им подобными. Конкретнее, соответствующие анилиновые соединения можно получить, например, процедурой синтеза, такой как процедура синтеза сложного изопропилового эфира (S)-2-(2,6-дихлорбензоиламино)-3-(4-аминофенил)пропионовой кислоты в Способе 2 Справочного примера 4. После конденсации полученных таким образом анилиновых соединений и антраниловой кислоты, замещенной Ха (Ха представляет атом галогена, группу трифлата и им подобные) использованием подходящего конденсирующего агент (агентов), циклизацию проводят реагентами, такими как CDI (карбонилдиимидазол), этилхлорформат и трифосген для получения (S-13). Другие способы получения (S-13) следующие. Указанные выше анилиновые соединения взаимодействуют с хлоридом 2-нитробензойной кислоты, замещенным Ха, в условиях присутствия подходящего основания; и затем нитро группа восстанавливается SnCl2, реакцией гидрирования в присутствии металлического катализатора и им подобных и циклизуется реагентами, такими как CDI, этилхлорформиат и трифосген. Дополнительный другой способ получения (S-13) следующий. Мочевинная связь формируется между указанными выше анилиновыми соединениями и сложным эфиром антраниловой кислоты, замещенным Ха, использованием CDI, этилхлорформиата и трифосгена и им подобных; и затем при необходимости реакционную смесь циклизуют взаимодействием с подходящим основанием. Затем R14 вводится такими способами как взаимодействие соединения (S-13) с алкилгалидом в условиях существования подходящего основания и реакции Mitsunobu с использованием спирта. Затем Ха превращается в карбоновую кислоту, например, реакцией превращения, используя палладиевый катализатор и монооксид углерода. Карбоновая кислота превращается в спиртовое соединение (S-14, Xb = OH) таким способом как восстановительная реакция посредством смешанного ангидрида кислоты. Далее, Xb превращается в уходящую группу (Xb = группа галогена, группа трифлата, группа месилата, группа тосилата и т.д.) с использованием подходящего галида кислоты, сульфонилгалида, тионилгалида, фосфорилгалида и им подобных. Затем проводится реакция их замещения с использованием подходяще замещенного амина для получения целевого соединения (S-15).
Настоящее соединение предоставляет соединения, имеющие антагонистическую активность в отношении α4 интегрина, или их фармацевтически приемлемые соли. Настоящие соединения можно использовать для лечения или профилактики заболеваний, в патологии которых принимает участие процесс адгезии, зависимый от α4 интегрина, такие как воспалительные заболевания, ревматоидный артрит, воспалительные кишечные заболевания (включая болезнь Крона и язвенный колит), системная красная волчанка, рассеянный склероз, синдром Шегрена, астма, псориаз, аллергия, сахарный диабет, сердечно-сосудистые заболевания, артериальный склероз, рестеноз, опухолевая пролиферация, метастазирование опухолей и отторжение трансплантата.
Настоящие соединения также можно использовать для лечения или профилактики преэклампсии, ишемических сердечно-сосудистых расстройств (включая инфаркт мозга), склеродермии, анкилозирующего спондилита, псориатического артрита, саркоидоза, гигантоклеточного артериита, увеитов, пневмосклероза, хронического обструктивного легочного заболевания, остеоартрита, болезни Альцгеймера, повреждения спинного мозга, травматического повреждения мозга, первичного склерозирующего холангита, цирроза печени, вызванного гепатитом С, активного хронического гепатита, сакроилиита, анкилозирующего спондилита, эписклерита, ирита, увеитов, узелковой эритемы, гангренозной пиодермии и аутоиммунного гепатита. Кроме того, соединения по настоящему изобретению можно использовать для лечения или профилактики не только указанных выше заболеваний, но также заболеваний, при которых α-4 интегрины могут принимать участие в патологии.
ПРИМЕРЫ
Следующие примеры дополнительно проиллюстрируют настоящее изобретение, которые представляют собой только предпочтительные варианты осуществления изобретения, и которые ни в коей мере не ограничивают изобретение.
В следующих примерах, хотя соли предполагаемых соединений могут не описываться, их получают в виде солей трифторуксусной кислоты (TFA) в случае соединений, способных свои соли TFA. Это происходит потому, что предполагаемые соединения были получены очисткой растворителем, содержащим 0,1% TFA, и лиофилизированы в конечном процессе.
Пример 1. Синтез соединения следующей формулы (Е-1), которое имеет заместитель (заместители) примера 1 табл.1
Процесс 1. Загрузка в смолу
Fmoc-Phe(4-нитро)-ОН (25 г), DIC (8,9 мл), DMAP (281 мг) и DMF (193 мл) добавляют к смоле Wang (1,2 ммоль/г, 19,3 г) и перемешивают при комнатной температуре в течение 3 ч. После удаления избыточного растворителя смолу промывают DMF, метанолом, дихлорметаном и DMF 3 раза каждым. Для проведения кэппирования не вступивших в реакцию гидроксильных групп на смоле, смолу обрабатывают уксусным ангидридом (19,6 мл), пиридином (16,8 мл) и DMF (193 мл) в течение 2 ч. После удаления избыточного растворителя, смолу промывают DMF, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 2. Удаление группы Fmoc
Раствор в DMF 20% пиперидина (200 мл) добавляют к смоле, полученной в процессе 1, и взаимодействие продолжают в течение 15 мин. Реакционная смесь далее взаимодействует с раствором в DMF 20% пиперидина (200 мл) в течение 15 мин. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 3. Реакция ацилирования
2,6-дихлорбензоилхлорид (10,3 мл), 2,6-лутидин (13,7 мл) и NMP (120 мл) добавляют к смоле, полученной в процессе 2, и взаимодействие продолжают в течение 14 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 4. Восстановление нитрогруппы
SnCl2·2H2O (150 г), NMP (300 мл) и EtOH (15 мл) добавляют к смоле, полученной в процессе 3, и взаимодействие продолжают в течение 14 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 5. Реакция ацилирования
5-фтор-2-нитробензойную кислоту (1,63 г), DIC (675 мкл), HOAt (1,2 г) и NMP (25 мл) смешивают и перемешивают в течение 1 ч и затем добавляют к 1 г смолы, полученной в процессе 4, и взаимодействие продолжают в течение 14 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 6. Замещение фтор-группы амином
Морфолин (400 мкл) и NMP (2 мл) добавляют к 200 мг смолы, полученной в процессе 5, и взаимодействие продолжают в течение 14 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 7. Восстановление нитро группы
Восстановление нитро группы проводят в смоле, полученной в процессе 6, той же процедурой, что в процессе 4 в примере 1.
Процесс 8. Конструирование хиназолиндионового кольца карбонилдиимидазолом
Карбонилдиимидазол (400 мг) и NMP (2 мл) добавляют к смоле, полученной в процессе 7, и перемешивают при 95°С в течение 14 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 9. Алкилирование
Трифенилфосфин (520 мг), метанол (80 мкл), 40% раствор диизопропилазодикарбоновой кислоты в толуоле (1 мл) и дихлорметан (2 мл) добавляют к смоле, полученной в процессе 8, и перемешивают в течение 14 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 10. Отщепление от смолы
Смолу, полученную в процессе 9, обрабатывают трифторуксусной кислотой, содержащей 5% воды, в течение 1 ч. После фильтрации фильтрат концентрируют под пониженным давлением. Остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 597
Примеры 2-6. Синтез соединений следующей формулы (Е-1), в которой имеется заместитель (заместители) примеров 2-6 табл.1
Соединения примеров 2-6 табл.1 следующей формулы (Е-1), в которой имеется заместитель (заместители), синтезируют той же процедурой, что и в примере 1, за исключением того, что в процессе 6 примера 1 используют соответствующие амины.
Пример 7. Синтез соединений следующей формулы (Е-2), в которой имеется заместитель (заместители) примера 7 табл.2
Процесс 1. Реакция ацилирования
1 г смолы, полученной в процессе 4 примера 1, ацилируют той же процедурой, что и процедура процесса 5 в примере 1, за исключением того, что в процессе используют 2-амино-5-нитробензойную кислоту.
Процесс 2. Конструирование хиназолиндионового кольца
Конструирование хиназолиндионового кольца проводят в смоле, полученой в процессе 1, той же процедурой, что и процедура процесса 8 в примере 1.
Процесс 3. Алкилирование
Метилйодид (1 мл), диизопропилэтиламин (1 мл) и NMP (5 мл) добавляют к смоле, полученной в процессе 2, и перемешивают в течение 14 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 4. Восстановление нитро группы
Восстановление нитро группы проводят в смоле, полученной в процессе 1, той же процедурой, что в процессе 4 в примере 1.
Процесс 5. 2-нитросульфонилирование
2-нитросульфонилхлорид (1 г), 2,6-ди-трет-бутил-4-метилпиридин (1 мл) и дихлорметан (15 мл) добавляют к смоле, полученной в процессе 4, и перемешивают при 4°С в течение 24 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 6. Алкилирование
Пропилйодид (400 мкл), диизопропилэтиламин (400 мкл) и NMP (2 мл) добавляют к 200 мг смолы, полученной в процессе 5, и перемешивают в течение 14 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 7. Удаление 2-нитросульфонильной группы
2-меркаптоэтанол (200 мкл), 1,8-диазобицикло[5.4.0]ундек-7-ен (100 мкл) и NMP (2 мл) добавляют к смоле, полученной в процессе 6, и перемешивают в течение 1 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 8. Отщепление от смолы, очистка
Отщепление от смолы и очистку смолы, полученной в процессе 7, проводят той же процедурой, что и в процессе 10 в примере 1, для получения 38 мг желаемого соединения.
MS(ESI MH+): 569
Примеры 8-12. Синтез соединений следующей формулы (Е-2), которые имеют заместитель (заместители) примеров 8-12 табл.2
Соединения примеров 8-12 табл.2 следующей формулы (Е-2), которые имеют заместитель (заместители), синтезируют той же процедурой, что и в примере 7, за исключением того, что в процессе 6 примера 7 используют соответствующие галиды.
Пример 13. Синтез соединений следующей формулы (Е-3), которые имеют заместитель (заместители) примера 13 табл.3
Процесс 1. Реакция ацилирования
1 г смолы, полученной в процессе 4 примера 1, ацилируют такой же процедурой, что и процедура процесса 5 в примере 1, за исключением того, что в процессе используют 2-амино-4,5-дифторбензойную кислоту.
Процесс 2. Конструирование хиназолиндионового кольца
Карбонилдиимидазол (3 г) и NMP (15 мл) добавляют к смоле, полученной в процессе 1, и перемешивают в течение 14 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 3. Замещение фтор-группы амином
N,N,N'-триметилэтилендиамин (400 мкл) и NMP (2 мл) добавляют к 200 мг смолы, полученной в процессе 2, и перемешивают при 90°С в течение 14 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 4. Алкилирование
Смолу, полученную в процессе 3, алкилируют такой же процедурой, что и процедура процесса 9 примера 1.
Процесс 5. Отщепление от смолы, очистка
Отщепление от смолы и очистку смолы, полученной в процессе 4, проводят той же процедурой, что и в процессе 10 в примере 1, для получения 39 мг желаемого соединения.
MS(ESI MH+): 630
Примеры 14-15. Синтез соединений следующей формулы (Е-3), которые имеют заместитель (заместители) примеров 14-15 табл.3
Соединения примеров 14-15 табл.3 следующей формулы (Е-3), которые имеют заместитель (заместители), синтезируют той же процедурой, что и в примере 13, за исключением того, что в процессе 3 примера 13 используют соответствующие амины.
Пример 16. Синтез соединения следующей формулы (Е-4)
Процесс 1. Реакция ацилирования
200 мг смолы, полученной в процессе 4 примера 1, ацилируют такой же процедурой, что и процедура процесса 5 в примере 1, за исключением того, что в процессе используют 2-амино-4,5-дифторбензойную кислоту.
Процесс 2. Замещение фтор-группы амином
Замещение фтор-группы амином проводят в смоле, полученной в процессе 1, той же процедурой, что и процедура процесса 6 в примере 1, за исключением того, что в процессе используют N-метилэтиламин.
Процесс 3. Восстановление нитрогруппы, конструирование хиназолиндионового кольца, алкилирование, отщепление от смолы, очистка
Восстановление нитрогруппы проводят в смоле, полученной в процессе 2, такой же процедурой, как процедура процесса 4 в примере 1; конструирование хиназолиндионового кольца проводят в смоле, такой же процедурой, как процедура процесса 8 в примере 1; алкилирование проводят в смоле, такой же процедурой, как процедура процесса 9 в примере 1, и затем отщепление от смолы и очистку смолы проводят такой же процедурой, как процедура процесса 10 в примере 1, для получения 59 мг желаемого соединения.
MS(ESI MH+): 617
Пример 17. Синтез соединения следующей формулы (Е-5)
Процесс 1. Замещение фтор-группы амином
Замещение фтор-группы амином проводят в 200 мг смолы, полученной в процессе 1 примера 16, той же процедурой, что и процедура процесса 3 в примере 13, за исключением того, что в процессе используют N,N'-диметилэтилендиамин.
Процесс 2. Восстановление нитрогруппы, конструирование хиназолиндионового кольца, алкилирование, отщепление от смолы, очистка
Восстановление нитрогруппы проводят в смоле, полученной в процессе 1, той же процедурой, что и процедура процесса 4 в примере 1; конструирование хиназолиндионового кольца проводят в смоле той же процедурой, что и процедура процесса 8 в примере 1; алкилирование проводят в смоле той же процедурой, что и процедура процесса 9 в примере 1; и затем проводят отщепление от смолы и очистку смолы проводят той же процедурой, что и процедура процесса 10 в примере 1, для получения 16 мг желаемого соединения.
MS(ESI MH+): 596
Пример 18. Синтез соединения следующей формулы (Е-6)
Процесс 1. Реакция ацилирования
200 мг смолы, полученной в процессе 4 примера 1, ацилируют такой же процедурой, что и процедура процесса 5 в примере 1, за исключением того, что в процессе используют 1-метил-5-нитро-1Н-пиразол-4-карбоновую кислоту.
Процесс 2. Восстановление нитрогруппы, конструирование хиназолиндионового кольца, алкилирование, отщепление от смолы, очистка
Восстановление нитрогруппы проводят в смоле, полученной в процессе 1, той же процедурой, что и процедура процесса 4 в примере 1; конструирование хиназолиндионового кольца проводят в смоле той же процедурой, что и процедура процесса 8 в примере 1; алкилирование проводят в смоле той же процедурой, что и процедура процесса 9 в примере 1; и затем проводят отщепление от смолы и очистку смолы проводят той же процедурой, что и процедура процесса 10 в примере 1, для получения 15 мг желаемого соединения.
MS(ESI MH+): 516
Пример 19. Синтез соединения следующей формулы (Е-7)
Процесс 1. Реакция ацилирования
1 г смолы, полученной в процессе 4 примера 1, ацилируют такой же процедурой, что и процедура процесса 5 в примере 1, за исключением того, что в процессе используют 2-амино-4-нитробензойную кислоту.
Процесс 2. Конструирование хиназолиндионового кольца, алкилирование, восстановление нитрогруппы
Конструирование хиназолиндионового кольца проводят в смоле, полученной в процессе 1 той же процедурой, что и процедура процесса 8 в примере 1; алкилирование проводят в смоле той же процедурой, что и процедура процесса 3 в примере 7; и затем восстановление нитрогруппы проводят в смоле той же процедурой, что и процедура процесса 4 в примере 1.
Процесс 3. Алкилирование
Этилйодид (200 мкл), карбонат калия (200 мг) и NMP (4 мл) добавляют к 400 мг смолы, полученной в процессе 2, и перемешивают при 80°С в течение 9 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 4. Отщепление от смолы, очистка
Отщепление от смолы и ее очистку проводят в смоле, полученной в процессе 3, той же процедурой, что и процедура процесса 10 в примере 1, для получения 43 мг желаемого соединения.
MS(ESI MH+): 555
Пример 20. Синтез соединения следующей формулы (Е-8)
Процесс 1. Замещение фтор-группы амином
Замещение фтор-группы амином проводят в 200 мг смолы, полученной в процессе 5 примера 1, той же процедурой, что и процедура процесса 6 в примере 1, за исключением того, что в процессе используют 2-(метиламино)этанол.
Процесс 2. Защита гидроксильной группой ацетильной группой
Уксусный ангидирид (200 мкл), пиридин (200 мкл) и NMP (2 мл) добавляют к смоле, полученной в процессе 1, и перемешивают в течение 14 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 3. Восстановление нитрогруппы, конструирование хиназолиндионового кольца, алкилирование
Восстановление нитрогруппы проводят в смоле, полученной в процессе 2, той же процедурой, что и процедура процесса 4 в примере 1; конструирование хиназолиндионового кольца проводят в смоле той же процедурой, что и процедура процесса 8 в примере 1; и затем алкилирование проводят в смоле той же процедурой, что и процедура процесса 9 в примере 1.
Процесс 4. Отщепление от смолы, отщепления ацетильной группы от защитной группы
Смолу, полученную в процессе 3, обрабатывают трифторуксусной кислотой, содержащей 5% воды, в течение 1 ч. После фильтрации фильтрат концентрируют под пониженным давлением. 4М раствор гидрохлорида диоксана (3 мл) и воду (600 мкл) добавляют к полученному остатку и перемешивают при 90°С в течение 1,5 ч. Затем остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 42 мг желаемого соединения.
MS(ESI MH+): 585
Пример 21. Синтез соединения следующей формулы (Е-9), которое имеет заместитель (заместители) примера 21 табл.4
Процесс 1. Метилэстерификация
2М раствор в гексане (4,5 мл) триметилсилилдиазометана добавляют к смеси 2-нитро-3-метилбензойной кислоты (1,6 г) и ацетона (15 мл) и перемешивают в течение 3 ч. После удаления растворителя остаток разводят этилацетатом и промывают соответственно 1М водным раствором гидрата натрия, водой и насыщенным водным раствором хлорида натрия. Затем полученное вещество концентрируют и сушат для получения метил-2-нитро-3-метилбензоата.
Процесс 2. Бромирование
Бензоилпероксид добавляют к смеси метил-2-нитро-3-метилбензоата (1,6 г), N-бромсукциимида (2,0 г) и бензола (15 мл) и перемешивают при 90°С в течение ночи. После удаления растворителя остаток разводят этилацетатом и промывают соответственно водным раствором тиосульфата натрия, 1М водным раствором гидрата натрия, водой и насыщенным водным раствором хлорида натрия. Затем полученное вещество концентрируют и сушат, и полученный неочищенный материал очищают хроматографией на колонке силикагеля для получения метил-3-бромметил-2-нитробензоата.
Процесс 3. Аминирование
Метил-3-бромметил-2-нитробензоат (1,6 г) растворяют в метаноле (5 мл). К нему добавляют раствор 2М диметиламина в метаноле (6 мл) и перемешивают в течение ночи. После удаления растворителя остаток разводят 1М хлористоводородной кислотой и промывают этилацетатом. Водный слой ощелачивают водным раствором гидрата натрия и экстрагируют этилацетатом. Проводят обычную процедуру обработки для получения метил-3-диметиламинометил-2-нитробензоата.
Процесс 4. Гидролиз сложного эфира
Смесь метил-3-диметиламинометил-2-нитробензоата (0,72 г) и 6М хлористоводородной кислоты перемешивают при 100°С в течение ночи. После охлаждения смеси до комнатной температуры осажденные кристаллы отфильтровывают, промывают простым диэтиловым эфиром и сушат под пониженным давлением для получения гидрохлорида 3-диметиламинометил-2-нитробензойной кислоты.
Н-ЯМР(ДМСО) δ 2,70 (с, 6Н), 4,31 (с, 2Н), 7,84 (м,1Н), 8,07 (1Н, д, J=7,8 Гц), 8,32 (1Н, д, J=7,5 Гц).
Процесс 5. Образование хлорида кислоты
Смесь гидрохлорида 3-диметиламинометил-2-нитробензойной кислоты (0,1 г) и тионилхлорида (5 мл) перемешивают при 80°С в течение 3 ч. Растворитель удаляют, и остаток сушат для получения 3-диметиламинометил-2-нитробензоилхлорида.
Процесс 6. Реакция ацилирования
3-диметиламинометил-2-нитробензоилхлорид (0,69 г), 0,11 г смолы, полученной в процессе 4 примера 1, 2,6-лутидин (0,04 мл) и NMP (1,5 мл) смешивают и взаимодействие производят в течение ночи. После удаления избытка растворителя остаток промывают NMP, метанолом и дихлорметаном по 3 раза каждым и сушат под пониженным давлением.
Процесс 7. Восстановление нитрогруппы
Восстановление нитрогруппы проводят в смоле, полученной в процессе 6, той же процедурой, что и процедура процесса 7 в примере 1.
Процесс 8. Конструирование хиназолиндионового кольца карбонилдиимидазолом
Конструирование хиназолиндионового кольца проводят в смоле, полученной в процессе 7, той же процедурой, что и в процессе 8 в примере 1.
Процесс 9. Алкилирование
Смолу, полученную в процессе 8, алкилируют такой же процедурой, как процедура процесса 9 в примере 1.
Процесс 10. Отщепление от смолы
Отщепление от смолы, полученной в процессе 9, проводят такой же процедурой, как процедура процесса 10 в примере 1, для получения 12 мг желаемого соединения.
MS(ESI MH+): 569
Пример 22. Синтез соединения следующей формулы (Е-9), которое имеет заместитель (заместители) примера 22 таблицы 4
Метил-3-(1-пирролидинилметил)-2-нитробензоат получают использованием пирролидина вместо диметиламина в процессе 3 примера 21. Затем желаемое соединение получают такими же процедурами, как процедуры процессов 4-10 в примере 21.
MS(ESI MH+): 595
Пример 23. Синтез соединения следующей формулы (Е-9), которое имеет заместитель (заместители) примера 23 табл.4
Смесь 4 мг соединения примера 21, этанола (3 мл) и 4М раствора гидрохлорида/диоксана (2 мл) перемешивают при 85°С в течение 5 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 3,6 мг желаемого соединения.
MS(ESI MH+): 597
Пример 24. Синтез соединения следующей формулы (Е-9), которое имеет заместитель (заместители) примера 24 табл.4
Смесь 4 мг соединения примера 21, дихлорметана (2 мл), триэтиламина (10 мкл), изопропанола (1 мл), HOBt (15 мг) и гидрохлорида EDC (20 мг) перемешивают в течение ночи. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 3,6 мг желаемого соединения.
MS(ESI MH+): 611
Примеры 25-27. Синтез соединения следующей формулы (Е-9), которое имеет заместитель (заместители) примера 25-97 табл.4
Соединения синтезируют такой же процедурой, как процедура примера 24, за исключением того, что соответствующие спирты используют вместо изопропанола.
Пример 28. Синтез соединения следующей формулы (Е-10), которое имеет заместитель (заместители) примера 28 табл.5
Желаемое соединение получают такой же процедурой, как процедура примера 21, за исключением того, что в качестве исходного материала используют 2-нитро-5-метилбензойную кислоту.
MS(ESI MH+): 569
Примеры 29-33. Синтез соединения следующей формулы (Е-10), которое имеет заместитель (заместители) примеров 29-33 табл.5
Желаемое соединение получают такой же процедурой, как процедура примера 23 или 24, за исключением того, что в качестве исходного материала используют соединение примера 28.
Пример 34. Синтез соединения следующей формулы (Е-11), которое имеет заместитель (заместители) примера 34 табл.6: Синтез N-(2,6-дихлорбензоил)-4-[7-[(диметиламино)метил]-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланинтрифторацетата
Процесс 1. Синтез сложного метилового эфира 4-(гидроксиметил)-2-нитробензойной кислоты
0,51 мл (5,36 ммоль) этилхлорформата добавляют к смеси 1,0 г (4,46 ммоль) 4-метоксикарбонил-3-нитробензойной кислоты, 15 мл тетрагидрофурана и 1,55 мл (11,2 ммоль) триэтиламина в условиях охлаждения льдом. После перемешивания в течение 30 мин осажденные соли отфильтровывают и к фильтрату добавляют 0,17 г (4,46 ммоль) боргидрида натрия и 2 г льда. После перемешивания смеси при комнатной температуре в течение ночи растворитель удаляют, и с остатком проводят обычную процедуру обработки. Затем полученный материал очищают хроматографией на колонке силикагеля (30% этилацетат/гексан) для получения указанного в заголовке соединения. Выход: 0,64 г (3,04 ммоль), 68%.
Процесс 2. Синтез гидрохлорида 4-[(диметиламино)метил]-2-нитробензоилхлорида
0,64 г (3,04 ммоль) соединения, полученного в процессе 1, растворяют в 10 мл метиленхлорида и 0,635 мл (4,56 ммоль) триэтиламина, и к нему по каплям в условиях охлаждения льдом добавляют 0,282 мл (3,64 ммоль) метансульфонилхлорида. После его перемешивания в течение 2 ч, проводят обычную процедуру обработки смеси в соответствии с обычным способом для получения неочищенного материала. Полученный неочищенный материал обрабатывают такими же процедурами, как процедуры процессов 3, 4 и 5 в примере 21, для получения указанного в заголовке соединения.
Выход: 0,64 г (2,20 ммоль), 75%
Процесс 3
Последовательно проводят такие же процедуры, как процедуры процесса 6 в примере 21 и в процессах 7, 8, 9 и 10 в примере 1, используя хлорид кислоты, полученный в процессе 2, и смолу, полученную в процессе 4 примера 1, для получения указанного в заголовке соединения.
MS(ESI MH+): 569
Пример 35. Синтез соединения следующей формулы (Е-11), которое имеет заместитель (заместители) примера 35 табл.6: Синтез трифторацетата N-(2,6-дихлорбензоил)-4-[1-метил-7-(пирролидин-1-илметил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Процесс 1. Синтез гидрохлорида 2-нитро-4-(пирролидин-1-илметил)бензоилхлорида
Указанное в заголовке соединение получают такой же процедурой, как процедура примера 34, за исключением того, что в качестве амина вместо диметиламина в процессе 2 примера 34 используют амин.
Процесс 2. Синтез трифторацетата N-(2,6-дихлорбензоил)-4-[1-метил-7-(пирролидин-1-илметил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Последовательно проводят такие же процедуры, как процедуры процесса 6 в примере 21 и в процессах 7, 8, 9 и 10 в примере 1, используя хлорид кислоты, полученный в процессе 1, и смолу, полученную в процессе 4 примера 1, для получения указанного в заголовке соединения.
MS(ESI MH+): 595
Пример 36. Синтез соединения следующей формулы (Е-12): Синтез N-(2,6-дихлорбензоил)-4-[1-метил-2,4-диоксо-1,2,3,4-тетрагидробензо[g]хиназолин-3(2Н)-ил)]-L-фенилаланина
Указанное в заголовке соединение получают такими же процедурами, как процедуры процессов 5, 8, 9 и 10 в примере 1, за исключением того, что в качестве исходных материалов используют 3-амино-2-нафталинкарбоновую кислоту и смолу, полученную в процессе 4 примера 1.
MS(ESI MH+): 562
Пример 37. Синтез соединения следующей формулы (Е-13), которое имеет заместитель (заместители) примера 37 табл.7: Синтез N-(2,6-дихлорбензоил)-4-[1-метил-6-(метилтио)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Процесс 1. Синтез 5-метилтио-2-нитробензоилхлорида
2,5 мл 15% водного раствора натрийметилмеркаптана добавляют к смеси 1,0 г (5,40 ммоль) 5-фтор-2-нитробензойной кислоты и 5 мл этанола и перемешивают в течение 2 ч. Затем добавляют 10 мл воды и рН смеси доводят до 1 концентрированной хлористоводородной кислотой. После отделения фильтрованием осажденного соединения, его промывают водой, простым эфиром и гексаном и сушат для получения неочищенного материала 5-метилтио-2-нитробензойной кислоты. 3 мл тионилхлорида добавляют к полученному неочищенному материалу и перемешивают в течение 5 ч. Тионилхлорид удаляют для получения указанного в заголовке соединения.
Процесс 2. N-(2,6-дихлорбензоил)-4-[1-метил-6-(метилтио)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Указанное в заголовке соединение получают такими же процедурами, как процедуры процесса 6 в примере 21 и процессов 7, 8, 9 и 10 примера 1, за исключением того, что в качестве исходных материалов используют хлорид кислоты, полученный в процессе 1, и смолу, полученную в процессе 4 примера 1.
MS(ESI MH+): 558
Пример 38. Синтез соединения следующей формулы (Е-13), которое имеет заместитель (заместители) примера 38 табл.7: Синтез N-(2,6-дихлорбензоил)-4-[1-метил-6-(метилсульфонил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Процесс 1. Окисление
Взаимодействие смеси 130 мг смолы в процессе 2 примера 37 перед проведением такой же процедуры, как процедура процесса 10 в примере 1 (отщепление от смолы), 1,5 мл метиленхлорида и 0,20 г мета-хлорпербензойной кислоты проводят в течение 24 ч. Полученную смолу промывают NMP, смешанным водным раствором гидрокарбоната натрия и тиосульфата натрия, метанола и метиленхлорида по 3 раза каждым и сушат под пониженным давлением.
Процесс 2. Синтез N-(2,6-дихлорбензоил)-4-[1-метил-6-(метилсульфонил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смолу, полученную в процессе 1, обрабатывают такой же процедурой, как процедура процесса 10 в примере 1, для получения указанного в заголовке соединения.
MS(ESI MH+): 590
Пример 39. Синтез соединения следующей формулы (Е-14), которое имеет заместитель (заместители) примера 39 табл.8: Синтез трифторацетата N-(2,6-дихлорбензоил)-4-[1-метил-7-(морфолин-4-ил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Процесс 1. Синтез 4-фтор-2-нитробензоилхлорида
5 мл тионилхлорида добавляют к 0,5 г 4-фтор-2-нитробензойной кислоты и перемешивают в течение ночи. Тионилхлорид удаляют для получения указанного в заголовке соединения.
Процесс 2. Синтез трифторацетата N-(2,6-дихлорбензоил)-4-[1-метил-7-(морфолин-4-ил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Указанное в заголовке соединение получают такими же процедурами, как процедуры процесса 6 в примере 21 и процессов 6, 7, 8, 9 и 10 примера 1, используя в качестве исходных материалов хлорид кислоты, полученный в процессе 1, и смолу, полученную в процессе 4 примера 1.
MS(ESI MH+): 596
Пример 40. Синтез соединения следующей формулы (Е-14), которое имеет заместитель (заместители) примера 40 табл.8: Синтез трифторацетата N-(2,6-дихлорбензоил)-4-[1-метил-7-(пирролидин-1-ил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Указанное в заголовке соединение получают такими же процедурами, как процедуры примера 39, за исключением того, что пирролидин используют вместо морфолина при проведении такой же процедуры, как процедура процесса 6 в примера 1 и процесса 2 примера 39.
MS(ESI MH+): 581
Примеры 41-42. Синтез соединений следующей формулы (Е-15), которые имеют заместитель (заместители) примеров 41-42 табл.9
Соединения следующей формулы (Е-15), которые имеют заместитель (заместители) примеров 41-42 табл.9, синтезируют такой же процедурой, как процедура примера 1, за исключением того, что в процессе 6 примера 1 используют соответствующие амины.
Пример 43. Синтез соединения следующей формулы (Е-16), которое имеет заместитель (заместители) примера 43 табл.10
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[(2-амино-5-йодбензоил)амино]-L-фенилаланина
Смесь сложного метилового эфира N-(2,6-дихлорбензоил)-4-амино-L-фенилаланина (2,22 г), EDC/HCl (960 мг), HOBT (675 мг), триэтиламина (834 мкл), 2-амино-5-йодбензойной кислоты (1,3 г) и дихлорметана (100 мл) перемешивают в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения неочищенного материала желаемого соединения.
Процесс 2. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[6-йод-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 1, DMF (120 мл) и карбонилдиимидазола (4,5 г), перемешивают при 80°С в течение 4 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Процесс 3. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-йод-2,4-хиназолиндион-3-ил]-L-фенилаланина
DMF (20 мл), карбонат калия (648 мг) и метилйодид (176 мкл) добавляют к неочищенному материалу, полученному в процессе 2, и перемешивают при комнатной температуре в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом.
Процесс 4. N-(2,6-дихлорбензоил)-4-[1-метил-6-йод-2,4-хиназолиндион-3-ил]-L-фенилаланин
Смесь неочищенного материала, полученного в процессе 3 (20 мг), 4М раствор гидрохлориддиоксана (1 мл) и воды (100 мкл), перемешивают при 90°С в течение 4 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 3 мг желаемого соединения.
MS(ESI MH+): 638
Пример 44. Синтез соединения следующей формулы (Е-16), которое имеет заместитель (заместители) примера 44 табл.10
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-циано-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 3 примера 43 (220 мг), DMF (2 мл), тетракиз(трифенилфосфин)палладия (5 мг) и цианида цинка (79 мг), перемешивают при 90°С в течение 4 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Процесс 2. N-(2,6-дихлорбензоил)-4-[1-метил-6-циано-2,4-хиназолиндион-3-ил]-L-фенилаланин
Неочищенный материал, полученный в процессе 1 (60 мг), обрабатывают такой же процедурой, как процедура процесса 4 в примере 43, для получения указанного в заголовке соединения.
MS(ESI MH+): 537
Примеры 45 и 46. Синтез соединений следующей формулы (Е-16), которые имеют заместитель (заместители) примеров 45-46 табл.10
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-бензилоксикарбонил-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 3 примера 43 (311 мг), ацетата палладия (10 мг), бензилового спирта (99 мкл) и триэтиламина (134 мкл) перемешивают в условиях присутствия моноксида углерода при 100°С в течение 3 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения неочищенного материала указанного в заголовке соединения.
Процесс 2. N-(2,6-дихлорбензоил)-4-[1-метил-6-бензилоксикарбонил-2,4-хиназолиндион-3-ил]-L-фенилаланин и N-(2,6-дихлорбензоил)-4-[1-метил-6-карбоксил-2,4-хиназолиндион-3-ил]-L-фенилаланин
Смесь неочищенного материала, полученного в процессе 1 (60 мг), 4М раствора гидрохлориддиоксана (1 мл) и воды (100 мкл), перемешивают при 90°С в течение 4 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения, 6-карбоксильного соединения (5 мг) и 6-бензилоксикарбонильного соединения (1 мг).
MS(ESI MH+): 556 (6-карбоксильное соединение)
MS(ESI MH+): 646 (6-бензилоксикарбонильное соединение)
Пример 47. Синтез соединения следующей формулы (Е-17)
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)пиридо[3,2-d]пиримидинил]-L-фенилаланина
Указанное в заголовке соединение получают такими же процедурами, как и процедуры процесса 1 в примере 43, за исключением того, что используют 2-карбокси-3-аминопиридин вместо 2-амино-5-йодбензойной кислоты, а затем процесса 2 в примере 43.
Процесс 2. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)пиридо[3,2-d]пиримидинил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 1, трифенилфосфина (61 мг), метанола (15 мкл), 40% раствора в толуоле (118 мг) диизопропилазодикарбоновой кислоты и дихлорметана (2 мл) перемешивают в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Процесс 3. N-(2,6-дихлорбензоил)-4-[1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)пиридо[3,2-d]пиримидинил]-L-фенилаланина
Неочищенный материал, полученный в процессе 2 (20 мг), обрабатывают такой же процедурой, как процедура процесса 4 в примере 43, для получения указанного в заголовке соединения.
MS(ESI MH+): 513
Пример 48. Синтез соединения следующей формулы (Е-18)
Соединение получают такой же процедурой, как процедура примера 47, за исключением того, что используют 3-амино-4-карбоксипиридин вместо 2-карбокси-3-аминопиридина в процессе 1 примера 47.
Пример 49. Синтез соединения следующей формулы (Е-19), которое имеет заместитель (заместители) примера 49 табл.11
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-(2-т-бутоксикарбонилэтенил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 3 примера 43 (630 мг), DMF (5 мл), ацетата палладия (22 мг), т-бутилакрилата (283 мкл) и триэтиламина (270 мкл) перемешивают при 70°С в течение 3 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Процесс 2
Смесь неочищенного материала, полученного в процессе 1, дихлорметана и TFA перемешивают при комнатной температуре в течение 1 ч. После удаления растворителя смесь полученного неочищенного материала, 4М раствора гидрохлориддиоксана и воды перемешивают при 90°С в течение 4 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 10 мг желаемого соединения.
MS(ESI MH+): 582
Пример 50. Синтез соединения следующей формулы (Е-19), которое имеет заместитель (заместители) примера 50 табл.11
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-(триметилсилилэтилоксикарбонил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 3 примера 43 (6,58 мг), DMF (5 мл), ацетата палладия (226 мг), триметилсилилэтанола (2,9 мл) и триэтиламина (2,8 мл) перемешивают в условиях присутствия монооксида углерода при 50°С в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Процесс 2. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-карбокси-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 1 (4,2 г), тетрагидрофурана (100 мл) и фторида тетрабутиламмония (3,3 г) перемешивают при комнатной температуре в течение 2 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Процесс 3
Триэтиламин (70 мкл) и этилхлорформиат (28 мкл) добавляют к смеси неочищенного материала, полученного в процессе 2 (142 мг), и тетрагидрофурана (50 мл) в условиях охлаждения льдом и перемешивают в течение 30 мин. После добавления аммиачной воды (1 мл) в реакционный растворитель и согревания его до комнатной температуры, реакционную смесь перемешивают в течение 2 ч. Затем смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Смесь неочищенного материала, 4М раствор гидрохлориддиоксана (2 мл) и воды (200 мкл) перемешивают при 90°С в течение 4 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 7 мг желаемого соединения.
MS(ESI MH+): 555
Пример 51. Синтез соединения следующей формулы (Е-19), которое имеет заместитель (заместители) примера 51 табл.11
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-(2-т-бутоксикарбонилэтил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь количества 5/6 неочищенного материала, полученного в процессе 1 примера 49, метанола (10 мл), никель-хлорид-6-гидрата (191 мг) и боргидрида натрия (62 мг) перемешивают при комнатной температуре в течение 6 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Процесс 2. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-(2-карбонилэтил)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 1, дихлорметана (2 мл) и TFA (2 мл) перемешивают при комнатной температуре в течение 1 ч. Растворитель удаляют для получения неочищенного материала желаемого соединения.
Процесс 3
Смесь неочищенного материала, полученную в процессе 2, 4М раствор гидрохлориддиоксана и воды перемешивают при 90°С в течение 4 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 584
Пример 52. Синтез соединения следующей формулы (Е-19), которое имеет заместитель (заместители) примера 52 табл.11
Триэтиламин (190 мкл) и этилхлорформиат (80 мкл) добавляют к смеси количества 5/6 неочищенного материала, полученного в процессе 2 примера 51, и тетрагидрофурана (20 мл) в условиях охлаждения льдом и перемешивают в течение 30 мин. После добавления двух или трех кусочков льда и боргидрида натрия (20 мг) к реакционному растворителю и согревания его до комнатной температуры, реакционную смесь перемешивают в течение 2 ч. Затем смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал растворяют в 4М растворе гидрохлориддиоксана (2 мл) и воды (200 мкл) и перемешивают при 90°С в течение 4 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 7 мг желаемого соединения.
MS(ESI MH+): 570
Пример 53. Синтез соединения следующей формулы (Е-20), которое имеет заместитель (заместители) примера 53 табл.12
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-гидроксиметил-2,4-хиназолиндион-3-ил]-L-фенилаланина
Триэтиламин (970 мкл) и этилхлорформат (400 мкл) добавляют к смеси неочищенного материала, полученного в процессе 2 примера 50 (142 мг), и тетрагидрофурана (100 мл) в условиях охлаждения льдом и перемешивают в течение 30 мин. После фильтрации к фильтрату добавляют 2 или 3 кусочка льда и боргидрид натрия (160 мг). После согревания ее до комнатной температуры реакционную смесь перемешивают в течение 2 ч. Затем смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения желаемого соединения.
Процесс 2. N-(2,6-дихлорбензоил)-4-[1-метил-6-хлорметил-2,4-хиназолиндион-3-ил]-L-фенилаланин
Смесь неочищенного материала, полученного в процессе 1, 4М раствора гидрохлориддиоксана (4 мл) и воды (400 мкл), перемешивают при 80°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 7 мг желаемого соединения.
Процесс 3
Смесь вещества, полученного в процессе 2 (20 мг), ацетонитрила (1 мл) и морфолина (6 мкл) перемешивают при комнатной температуре в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 3 мг желаемого соединения.
MS(ESI MH+): 611
Примеры 54-58. Синтез соединений следующей формулы (Е-20), которые имеют заместитель (заместители) примеров 54-58 табл.12
Эти соединения синтезируют той же процедурой, как процедура процесса 3 в примере 53, за исключением того, что в процессе вместо морфолина используют соответствующие амины.
Данные ЯМР соединения примера 54:
1Н-ЯМР (ДМСО-d6) δ 9,13 (д, 1H, J=8,4 Гц), 8,69-8, 97 (ушир., 2H), 8,23 (д, 1Н, J=2,1 Гц), 7,86 (дд, 1H, J= 8,6, 2,l Гц), 7,57 (д, 1H, J=8,7 Гц), 7,34-7,43 (м, 6H), 7,18 (д, 2H, J=8,4 Гц), 4,70-4,78 (м, 1H), 4,22-4,26 (м, 2H), 3,53 (с, 3H), 3,22 (дд, 1Н, J=14,2, 4,3 Гц), 2,91-3,00 (м, 3H), 1,19 (т, 3H, J=7,3 Гц).
Пример 59. Синтез соединения следующей формулы (Е-21)
Процесс 1
Смесь неочищенного материала, полученного в процессе 3 примера 43, DMSO (2 мл), йодида меди (11 мг), карбоната калия (273 мг) и аминоимидазола (273 мг) перемешивают при 130°С в течение 2 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) и проводят гидролиз сложного эфира такой же процедурой, как процедура процесса 4 в примере 43, для получения указанного в заголовке соединения.
MS(ESI MH+): 593
Пример 60. Синтез соединения следующей формулы (Е-22), которое имеют заместитель (заместители) примера 60 табл.13
Смесь сложного метилового эфира N-(2,6-дихлорбензоил)-4-[1-метил-6-гидроксиметил-2,4-хиназолиндион-3-ил]-L-фенилаланина (7 мг), который получают такой же процедурой, как процедура процесса 1 в примере 53, и очисткой высокоэффективной жидкостной хроматографией, тетрагидрофурана (1 мл), воды (1 мл) и гидроксида лития (1,2 мг) перемешивают при комнатной температуре в течение 2 ч. Смесь экстрагируют этилацетатом, обрабатывают в соответствии с обычным способом и очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 1 мг желаемого соединения.
MS(ESI MH+): 542
Пример 61. Синтез соединения следующей формулы (Е-22), которое имеют заместитель (заместители) примера 61 табл.13
Смесь вещества, полученного в процессе 2 примера 53 (40 мг), метанола (1 мл) и 40% раствора метоксида натрия в метаноле (1 мл) перемешивают при комнатной температуре в течение 2 ч. Смесь обрабатывают в соответствии с обычным способом и очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 4 мг желаемого соединения.
MS(ESI MH+): 556
Пример 62. Синтез соединения следующей формулы (Е-23), которое имеют заместитель (заместители) примера 62 табл.14
Процесс 1. Реакция ацилирования
3-диметоксиметил-2-нитробензойную кислоту (160 мг), DIC (58 мкл), HOAt (101 мг) и NMP (1,5 мл) смешивают и перемешивают в течение 3 ч. Затем смесь добавляют к 200 мг смолы, полученной в процессе 4 в примере 1, и взаимодействие проводят в течение 17 ч. После удаления избытка растворителя, смолу промывают NMP, метанолом и дихлорметаном по 3 раза каждым и сушат под пониженным давлением.
Процесс 2. Восстановление нитрогруппы
SnCl2·2H2O (1,5 г), NMP (3 мл) и EtOH (150 мкл) добавляют к смоле, полученной в процессе 1, и взаимодействие проводят при комнатной температуре в течение 16 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 3. Конструирование хиназолиндионового кольца карбонилдиимидазолом
Карбонилдиимидазол (400 мг) и NMP (2 мл) добавляют к смоле, полученной в процессе 2, и перемешивают при 90°С в течение 21 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 4. Алкилирование
Метилйодид (200 мкл), тетраметилгуанидин (200 мкл) и NMP (2,5 мл) добавляют к смоле, полученной в процессе 3, перемешивают в течение 1 ч и промывают метанолом и NMP 3 раза каждым после удаления избытка растворителя. После повторения каждого из этих процессов по 3 раза, смолу промывают метанолом и дихлорметаном по 3 раза каждым и сушат под пониженным давлением.
Процесс 5. Отщепление от смолы
Смолу, полученную в процессе 4, обрабатывают трифторуксусной кислотой, содержащей 5% воды, в течение 1 ч. После фильтрации фильтрат концентрируют под пониженным давлением. Остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 556
Пример 63. Синтез соединения следующей формулы (Е-23), которое имеют заместитель (заместители) примера 63 табл.14
Желаемое соединение получают такой же процедурой, как процедура примера 62, за исключением того, что 4-метоксиметил-2-нитробензойную кислоту используют вместо 3-метоксиметил-2-нитробензойной кислоты.
MS(ESI MH+): 556
Пример 64. Синтез соединения следующей формулы (Е-24)
Процесс 1. Нитрование
Β-пиколин-N-оксид (10 мг) медленно добавляют к смешанной концентрированной серной кислоте (35 мл) и концентрированной азотной кислоте (27,5 мл) при 0°С, постепенно согревают до 105°С и перемешивают в течение 4 ч. Реакционный растворитель, который охлажден до комнатной температуры, вливают в лед (100 г) и к нему добавляют карбонат натрия (60 г). После отделения фильтрацией осадка реакционную смесь промывают водой и сушат под пониженным давлением для получения 5,83 г 3-метил-4-нитропиридин-N-оксида.
Процесс 2. Окисление
Вещество, полученное в процессе 1 (5,83 г), и дигидрохромат натрия (11,4 г) медленно добавляют к концентрированной серной кислоте (39,5 мл) при 0°С и проводят взаимодействие при комнатной температуре в течение 4 ч. Реакционный растворитель выливают в лед (80 г) и к нему медленно добавляют воду (100 мл). Затем к нему добавляют гидросульфат натрия до исчезновения оранжевого цвета шестивалентного хрома, и осадок отделяют фильтрацией. К отфильтрованному твердому веществу добавляют этилацетат и 1 н. хлористоводородную кислоту, экстрагируют и промывают. Слой этилацетата концентрируют под пониженным давлением для получения порошка 4-нитроникотиновой кислоты-N-оксида (3,23 г).
Процесс 3. Каталитическое восстановление
Воду (75 мл), 28% аммиачную воду (1,2 мл) и 10% Pd/C (0,8 г) добавляют к веществу, полученному в процессе 2 (1,5 г), и перемешивают в атмосфере водорода (3,8 кг/см2) в течение 8 ч. Реакционный растворитель фильтруют и фильтрат концентрируют под пониженным давлением с тем, чтобы его жидкая мера стала 15 мл. Добавляют 1 н. хлористоводородную кислоту для того, чтобы растворитель стал слегка кислотным, и осажденные нерастворимые материалы отфильтровывают. Остаток промывают водой и сушат под пониженным давлением для получения порошка 4-аминоникотиновой кислоты (620 мг).
Процесс 4. Реакция ацилирования
Вещество, полученное в процессе 3 (207 мг), DIC (116 мкл), HOAt (204 мг), DIEA (131 мкл) и NMP (3 мл), смешивают и перемешивают в течение 10 ч. Затем смесь добавляют к 200 мг смолы, полученной в процессе 4 в примере 1, и взаимодействие продолжают в течение 14 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном по 3 раза каждым и сушат под пониженным давлением.
Процесс 5. Конструирование хиназолиндионового кольца карбонилдиимидазолом
Карбонилдиимидазол (400 мг) и NMP (2 мл) добавляют к смоле, полученной в процессе 4, и перемешивают при 90°С в течение 18 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 6. Алкилирование
Трифенилфосфин (520 мг), метанол (80 мкл), 40% раствор диизопропилазодикарбоновой кислоты в толуоле (1 мл) и дихлорметан (2 мл) добавляют к смоле, полученной в процессе 5, и перемешивают в течение 19 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном по 3 раза каждым и сушат под пониженным давлением.
Процесс 7. Отщепление от смолы
Смолу, полученную в процессе 6, обрабатывают трифторуксусной кислотой, содержащей 5% воды, в течение 1 ч. После фильтрации фильтрат концентрируют под пониженным давлением. Остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 28 мг желаемого соединения.
MS(ESI MH+): 513
Примеры 65-81. Синтез соединений следующей формулы (Е-25), которые имеют заместитель (заместители) примеров 65-81 табл.15-1 и 15-2
Желаемые соединения получают следующими способами А-С:
А (Метилэстерификация)
Соответствующие карбоновые кислоты добавляют к смеси метанола и тионилхлорида и перемешивают в течение ночи. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
В. Смесь соответствующих карбоновых кислот, подходящего растворителя (растворителей), таких как DMF и дихлорметан, подходящего органического основания (оснований), таких как триэтиламин и диизопропилэтиламин, соответствующих спиртов, если необходимо, HOBt и EDC гидрохлорида перемешивают в течение ночи. После концентрации смесь очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
С. Смесь соответствующих карбоновых кислот, соответствующих спиртов и 4М раствора гидрохлориддиоксана, перемешивают при 90°С в течение нескольких часов. После удаления растворителя полученный неочищенный материал очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
Примеры 82-86. Синтез соединений следующей формулы (Е-26), которые имеют заместитель (заместители) примеров 82-86 табл.16
Желаемые соединения получают такими же процедурами, как процедуры любого из пунктов А, В, С в указанных выше примерах.
Примеры 87-88. Синтез соединений следующей формулы (Е-27), которые имеют заместитель (заместители) примеров 87-88 табл.17
Пример 87
Вещество, полученное в процессе 2 примера 50, очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 570
Пример 88
Метанол (2 мл) и 2М раствор триметилсилилдиазометана в гексане (1 мл) добавляют к веществу, полученному в процессе 2 примера 50, и перемешивают в течение 3 ч. После удаления растворителя полученное вещество очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 584
Пример 89. Синтез соединения следующей формулы (Е-28)
Процесс 1. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-6-(гидроксиметиламино)-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 3 примера 43 (100 мг), диметилацетоамида (2 мл), йодида меди (3 мг), аминоэтанола (0,011 мл) и карбомата калия (41 мг) перемешивают при 80°С в течение ночи. После экстрагирования смеси этилацетатом и удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
Процесс 2.
Смесь неочищенного материала, полученного в процессе 2, 4М раствора гидрохлориддиоксана (2 мл) и воды (200 мкл), перемешивают при 90°С в течение 4 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 1 мг желаемого соединения.
MS(ESI MH+): 571
Пример 90. Синтез соединения следующей формулы (Е-29)
Смесь 40 мг карбоновой кислоты, полученной в примере 34, 5 мл этанола и 5 мл раствора диоксана, содержащего 4М гидрохлорид, перемешивают при 90°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 597
Н-ЯМР (ДМСО) δ 1,20 (3H, т), 2,80 (6H, с), 2,95-3,25 (2H, м), 3,55 (3H, с), 4,15 (2H, кв.), 4,45 (2H, с), 4,80 (1Н, м), 7,20 (2H, д), 7,35-7,50 (6H, м), 7,70 (1H, с), 8,15 (1Н, д), 9,25 (1Н, д).
Пример 91. Синтез соединения следующей формулы (Е-30)
Смесь 50 мг карбоновой кислоты, полученной в примере 54, 0,5 мл бензилового спирта, и 1 мл раствора диоксана, содержащего 4М гидрохлорид, перемешивают при 90°С в течение 4 ч. После концентрации реакционного растворителя смесь очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 659
Н-ЯМР (ДМСО) δ 1,20 (3H, с), 2,90-3,40 (4H, м), 3,55 (3H, с), 4,25 (2H, т), 4,90 (1H, м), 5,20 (2H, с), 7,20 (2H, д), 7,30-7,50 (10H, м), 7,60 (1Н, д), 7,90 (1H, д), 8,25 (1H, д), 8,80 (2H, ушир.), 9,30 (1Н, д).
Пример 92. Синтез соединения следующей формулы (Е-31)
Процесс 1. Реакция ацилирования
Смесь 600 мг N-(2,6-дихлорбензоил)-4-амино-L-фенилаланина, полученного в процессе 4 примера 1, где карбоксильная группа связана со смолой Wang, 730 мг 2-амино-4,5-дифторбензойной кислоты, 320 мкл DIC (диизопропилкарбодиимида), 570 мг HOAt (1-гидрокси-7-азабензотриазола) и 6 мл NMP (N-метилпирролидона) встряхивают при комнатной температуре в течение ночи. После удаления растворителя остаток промывают NMP, метанолом, дихлорметаном и простым диэтиловым эфиром и сушат под пониженным давлением.
Процесс 2. Конструирование хиназолиндионового кольца карбонилдиимидазолом
Карбонилдиимидазол (600 мг) и NMP (4,9 мл) добавляют к смоле, полученной в процессе 1, и перемешивают при комнатной температуре в течение 13 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 4 раза каждым и сушат под пониженным давлением. Карбонилдиимидазол (600 мг) и NMP (4,9 мл) добавляют к смоле и перемешивают при комнатной температуре в течение 16 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 4 раза каждым и сушат под пониженным давлением.
Процесс 3. Замещение фтор-группы амином
Имидазол (600 мг), диизопропилэтиламин (600 мкл) и NMP (3 мл) добавляют к 340 мг смолы, полученной в процессе 2, и взаимодействие проводят в течение 14,5 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 4 раза каждым и сушат под пониженным давлением.
Процесс 4. Алкилирование
Трифенилфосфин (780 мг), метанол (120 мкл), 40% раствор диизопропилазодикарбоновой кислоты в толуоле (1,5 мл) и дихлорметан (3 мл) добавляют к смоле, полученной в процессе 3, и перемешивают в течение 18,5 ч. После удаления избытка растворителя смолу промывают NMP, метанолом и дихлорметаном 4 раза каждым и сушат под пониженным давлением.
Процесс 5. Отщепление от смолы, очистка
Отщепление от смолы и очистку смолы, полученной в процессе 4, проводят той же процедурой, что и в процессе 10 в примере 1, для получения 95 мг желаемого соединения.
MS(ESI MH+): 596
1Н-ЯМР (ДМСО-d6) δ 2,94-3,04 (1Н, м), 3,20-3,27 (1Н, м), 4,71-4,80 (1Н, м), 7,23 (2H, д, J=8,4 Гц), 7,39-7,47 (5H, м), 7,58 (1Н, с), 7,87 (1Н, д, J=6,0 Гц), 8,04-8,10 (2H, м), 8,96 (1Н, с), 9,15 (1Н, д, J=8,l Гц), 12,80 (1Н, ушир.с).
Пример 93. Синтез соединения следующей формулы (Е-32)
Процесс 1. Сложный метиловый эфир N-(трет-бутоксикарбонил)-4-(6-диметиламино-2,4-хиназолиндион-3-ил)-L-фенилаланина
3 г сложного метилового эфира N-(т-бутоксикарбонил)-4-амино-L-фенилаланина, 2,73 г дигидрохлорида метил-2-амино-5-(диметиламино)бензоата, 1,65 г CDI (карбонилдиимидазола) и 50 мл ацетонитрила перемешивают при комнатной температуре. Затем к нему добавляют 2,8 мл триэтиламина и перемешивают при 60°С в течение ночи. После удаления растворителя полученный остаток экстрагируют этилацетатом, промывают водой и насыщенным водным раствором хлорида натрия и сушат над сульфатом магния. После удаления растворителя полученный остаток очищают хроматографией на колонке силикагеля для получения 2 г указанного в заголовке соединения.
Процесс 2. Синтез дигидрохлорида сложного метилового эфира 4-(6-диметиламино-1-метил-2,4-хиназолиндион-3-ил)-L-фенилаланина
Смесь 500 мг хиназолиндиона, полученного в процессе 1, 0,3 мл метанола, 0,4 г трифенилфосфина, 0,7 мл 45% раствора диизопропилазодикарбоновой кислоты в толуоле и дихлорметана перемешивают в течение ночи. После удаления растворителя остаток обрабатывают в соответствии с обычным способом, используя дихлорметан в качестве экстрагирующего растворителя для получения неочищенного материала сложного метилового эфира N-(т-бутоксикарбонил)-4-(6-диметиламино-1-метил-2,4-хиназолиндион-3-ил)-L-фенилаланина. Смесь неочищенного материала, 5 мл раствора диоксана, содержащего 4М гидрохлорид, и 5 мл дихлорметана, перемешивают при комнатной температуре в течение 5 ч. После удаления растворителя полученный остаток промывают дихлорметаном для получения неочищенного материала указанного в заголовке соединения.
Процесс 3. Синтез сложного метилового эфира трифторацетата N-(2-хлор-6-фторбензоил)-4-(6-диметиламино-1-метил-2,4-хиназолиндион-3-ил)-L-фенилаланина
Смесь 100 мг аминного неочищенного материала, полученного в процессе 2, 80 мг 2-хлор-6-фторбензоилхлорида, 100 мкл триэтиламина и 4 мл DMF (диметилформамида) перемешивают при комнатной температуре и обрабатывают в соответствии с обычным способом, используя этилацетат в качестве экстрагирующего растворителя, для получения неочищенного материала. Полученный неочищенный материал очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 51 мг желаемого соединения.
MS(ESI MH+): 553
Процесс 4. Синтез трифторацетата N-(2-хлор-6-фторбензоил)-4-(6-диметиламино-1-метил-2,4-хиназолиндион-3-ил)-L-фенилаланина
Смесь 15 мг соединения сложного метилового эфира, полученного в процессе 3 примера 93, 3 мл раствора диоксана, содержащего 4М гидрохлорид, и 2 мл воды перемешивают при 80°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 539
Пример 94. Синтез соединения следующей формулы (Е-33)
Процесс 1. Реакция ацилирования
Смесь 50 мг соединения амина, полученного в процессе 2 примера 93, 38 мг 2,4-дихлорпиридин-2-карбоновой кислоты, полученной такой же процедурой, как процедура Eur. J. Org. Chem. 2001, 1371-1376, 30 мг HOAt, 38 мг EDC/HCl (гидрохлорида 1-диметиламинопропил-3-этилкарбодиимида), 560 мкл триэтиламина и 2 мл DMF перемешивают при 40°С. Реакционный растворитель очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA (трифторуксусную кислоту)) для получения желаемого соединения.
MS(ESI MH+): 570
Процесс 2. Гидролиз сложного эфира
Желаемое соединение получают такой же процедурой, как процедура процесса 4 в примере 93, используя сложный эфир, полученный в процессе 1.
MS(ESI MH+): 556
Пример 95. Синтез соединения следующей формулы (Е-34)
Желаемое соединение получают такой же процедурой, как процедура процесса 4 в примере 92, используя смолу, полученную такой же процедурой, как процедура процесса 2 в примере 92.
MS(ESI MH+): 548
Пример 96. Синтез соединения следующей формулы (Е-35)
Гидрохлорид лития (7 мг), метанол (3,5 мл), тетрагидрофуран (0,5 мл) и ацетон (2,0 мл) добавляют к соединению, полученному в примере 88 (60 мг), и перемешивают при комнатной температуре в течение 30 мин. После удаления избытка растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ ацетонитрил, каждый, содержащий 0,1% TFA) для получения 6,3 мг желаемого соединения.
MS(ESI MH+): 570
Пример 97. Синтез соединения следующей формулы (Е-36):
Процесс 1. N-(2,6-дихлорбензоил)-4-(1-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидо[4,5-d]пиримидин-3(2Н)-ил)-L-фенилаланин
Смесь соединения, полученного в примере 131 (15 мг), 4М раствора гидрохлориддиоксана (1 мл) и воды (200 мкл) перемешивают при 90°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ ацетонитрил, каждый, содержащий 0,1% TFA) для получения 12 мг желаемого соединения.
MS(ESI MH+): 514
Примеры 98-99. Синтез соединений следующей формулы (Е-37), которые имеют заместитель (заместители) примеров 98-99 табл.18
Соединения синтезируют такой же процедурой, как процедура процесса 3 в примере 53, за исключением того, что, вместо морфолина, используют соответствующие амины.
MS(ESI MH+) данные соединения примера 99: 555
Данные ЯМР соединения примера 99:
1Н-ЯМР (ДМСО-d6) δ 2,58 (3H, т, J=5,1 Гц), 2,98 (1Н, дд, J=14,1, 10,5 1Н) 3,24 (1H, дд, J=14,1, 4,5 Гц), 3,55 (3H, с), 4,22-4,28 (1Н, м), 4,6l-4,80 (1Н, м), 7,20 (2H, д, J=8,4 Гц), 7,39-7,46 (5H, м), 7,60 (1Н, д, J=9,0 Гц), 7,88 (1Н, д, J=6,9 Гц), 8,24 (1H, д, J=1,5 Гц), 8,80 (2H, ушир.с), 9,15 (1Н, д, J=8,7 Гц), 12,90 (1Н, ушир.с)
Пример 100. Синтез соединения следующей формулы (Е-38):
Процесс 1. Алкилирование
Метилйодид (200 мкл), карбонат калия (200 мг) и NMP (4 мл) добавляют к смоле, полученной в процессе 2 примера 19 (400 мг), и перемешивают при 60°С в течение 9 ч. После удаления растворителя смолу промывают NMP, метанолом и дихлорметаном 3 раза каждым и сушат под пониженным давлением.
Процесс 2. Отщепление от смолы, очистка
Отщепление от смолы и ее очистку проводят в смоле, полученной в процессе 1, такой же процедурой, как процедура процесса 10 в примере 1, для получения 31 мг желаемого соединения.
MS(ESI MH+): 555
Примеры 101-121. Синтез соединений следующей формулы (Е-39), которые имеют заместитель (заместители) примеров 101-121 табл.19-1, 19-2 и 19-3
Желаемые соединения получают следующими способами А-Е:
А (Метилэстерификация)
Соответствующие карбоновые кислоты добавляют к смеси метанола и тионилхлорида и перемешивают в течение ночи. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
В. Смесь соответствующих карбоновых кислот, подходящего растворителя (растворителей), таких как DMF и дихлорметан, подходящего органического основания (оснований), таких как триэтиламин и диизопропилэтиламин, соответствующих спиртов, если необходимо, HOBt и EDC гидрохлорида перемешивают в течение ночи. После концентрации смесь очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
С. Смесь соответствующих карбоновых кислот, соответствующих спиртов и 4М раствора гидрохлориддиоксана, перемешивают при 90°С в течение нескольких часов. После удаления растворителя полученный неочищенный материал очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
D. Смесь соответствующих карбоновых кислот, метилового спирта и 2,0М раствора триметилсилилдиазометана в гексане перемешивают при комнатной температуре в течение нескольких минут. После удаления растворителя полученный неочищенный материал очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
Е. Смесь соответствующих карбоновых кислот, этиленового гликоля, EDC/HCl, HOAt и дихлорметана перемешивают. После удаления растворителя полученный неочищенный материал очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
Данные ЯМР соединения примера 111:
1Н-ЯМР (ДМСО-d6) δ 9,23 (д, 1H, J=8,l Гц), 8,64-8,79 (ушир., 2H), 8,23 (д, 1Н, J=2,2 Гц), 7,86 (дд, 1H, J=2,l Гц, J=8,7 Гц), 7,57 (д, 1H, J=8,7 Гц), 7,35-7,45 (м, 6H), 7,19 (д, 2H, J=8,3 Гц), 4,93 (септ., 1H, J=6,3 Гц), 4,75 (м, 1H), 4,24 (м, 2H), 3,53 (с, 3H), 3,17 (дд, 1Н, J=5,0 Гц, J=14,5 Гц), 2,94-3,00 (м, 3H), 1,21 (д, 3H, J=6,2 Гц), 1,19 (т, 3H, J=7,3 Гц), 1,17 (д, 3H, J=6,2 Гц).
Соответствующая карбоновая кислота, которая представляет собой синтетический сырьевой материал соединения примера 111, является соединением примера 54.
Кроме того, соединение примера 111 получают такой же процедурой, как процедура процесса 3 в примере 53, за исключением того, что соединение процесса 1 в примере 174 используют в качестве сырьевого материала, а этиламин используют вместо морфолина.
Примеры 122-123. Синтез соединений следующей формулы (Е-40), которые имеют заместитель (заместители) примеров 122-123 табл.20
Желаемые соединения получают такой же процедурой, как процедура любого из пунктов C или D в указанных выше примерах.
Пример 124. Синтез соединений следующей формулы (Е-41)
Желаемое соединение получают такой же процедурой, как процедура пункта D в указанных выше примерах 101-121.
MS(ESI MH+): 610
Пример 125. Синтез соединений следующей формулы (Е-42)
Желаемое соединение получают такой же процедурой, как процедура пункта D в указанных выше примерах 101-121.
MS(ESI MH+): 530
Примеры 126-127. Синтез соединений следующей формулы (Е-43), которые имеют заместитель (заместители) примеров 126-127 табл.21
Пример 126
Неочищенный материал, полученный в процессе 2 примера 47, обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Пример 127
Изопропанол (2 мл) и концентрированную серную кислоту (0,1 мл) добавляют к веществу, полученному в примере 47 (50 мг), и нагревают кипячением в сосуде с обратным холодильником в течение 2 ч. После удаления растворителя реакционную смесь обрабатывают в соответствии с обычным способом для получения указанного в заголовке соединения.
Пример 128. Синтез соединений следующей формулы (Е-44)
Желаемое соединение получают такой же процедурой, как процедура пункта D в указанных выше примерах 101-121.
MS(ESI MH+): 527
Пример 129. Синтез соединений следующей формулы (Е-45)
Процесс 1. Сложный метиловый эфир 4-[(4-аминопиримидин-5-ил)карбонил]амино-N-(2,6-дихлорбензоил)-L-фенилаланина
Смесь сложного метилового эфира N-(2,6-дихлорбензоил)-4-амино-L-фенилаланина (1,0 г), EDC/HCl (783 мг), HOAt (555 мг), триэтиламина (747 мкл), 4-аминопиримидин-5карбоновой кислоты (417 мг) и дихлорметана (15 мл) перемешивают в течение ночи. После разведения смеси дихлорметаном и промывания насыщенным бикарбонатом натрия и водой, ее органический слой сушат над сульфатом натрия и концентрируют. Остаток промывают дихлорметаном для получения 145 мг неочищенного материала указанного в заголовке соединения.
Процесс 2. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-(2,4-диоксо-1,2,3,4-тетрагидропиримидо[4,5-d]пиримидин-3-(2Н)-ил)-L-фенилаланина
Смесь неочищенного материала, полученного в процессе 1 (145 мг), DMF (10 мл) и карбонилдиимидазола (482 мг), перемешивают при 110°С в течение 24 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом для получения неочищенного материала указанного в заголовке соединения.
Процесс 3. Сложный метиловый эфир N-(2,6-дихлорбензоил)-4-(1-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидо[4,5-d]пиримидин-3-(2Н)-ил)-L-фенилаланина
DMF (2 мл), карбонат калия (62 мг) и метилйодид (40 мкл) добавляют к неочищенному материалу, полученному в процессе 2, и перемешивают при комнатной температуре в течение 3 ч. Смесь экстрагируют этилацетатом и очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения (соединений).
MS(ESI MH+): 528
Пример 131. Синтез соединения следующей формулы (Е-46)
Желаемое соединение получают такой же процедурой, как процедура пункта D в указанных выше примерах 101-121.
MS(ESI MH+): 583
Пример 132. Синтез соединений следующей формулы (Е-47)
Желаемое соединение получают такой же процедурой, как процедура пункта С в указанных выше примерах 101-121.
MS(ESI MH+): 624
Примеры 133-134. Синтез соединений следующей формулы (Е-48), которые имеют заместитель (заместители) примеров 133-134 табл.22
Пример 133
Смесь соединения примера 54 (19 мг), ацетонитрила (3 мл), триэтиламина (18 мкл) и метилхлорформиата (5 мкл) перемешивают при комнатной температуре в течение 5 мин. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 17 мг желаемого соединения (соединений).
MS(ESI MH+): 641
Пример 134
Смесь соединения примера 54 (26 мг), ацетонитрила (3 мл), триэтиламина (20 мкл) и ацетилхлорида (6 мкл) перемешивают при комнатной температуре в течение 10 мин. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 22 мг желаемого соединения (соединений).
MS(ESI MH+): 625
Эталонный пример 1. Синтез 3-метоксиметил-2-нитробензойной кислоты
Процесс 1. Метоксилирование
Раствор метоксида натрия (197 мг) в метаноле (4,7 мл) добавляют по каплям к смеси метил-3-бромметил-2-нитробензоата (1 г) и метанола (7 мл) при нагревании кипячением с обратным холодильником. Через 2 мин смесь охлаждают льдом, и в нее по каплям добавляют 1,82 мл 4М раствора гидрохлориддиоксана. После удаления растворителя добавляют простой диэтиловый эфир и воду, и его органический слой сушат над сульфатом натрия. После удаления растворителя полученный остаток очищают хроматографией на колонке силикагеля для получения 621 мг метил-3-метоксиметил-2-нитробензоата.
Процесс 2. Гидролиз сложного метилового эфира
Смесь 582 мг вещества, полученного в процессе 1, 10 мл 1,4-диоксана и 10 мл 6М хлористоводородной кислоты перемешивают при 80°С в течение двух ночей. После добавления этилацетата и 1N хлористоводородной кислоты к реакционной смеси и ее экстрагирования, органический слой промывают водным раствором гидроксида натрия. Далее, водный слой подкисляют хлористоводородной кислотой и экстрагируют этилацетатом. После удаления растворителя остаток сушат под пониженным давлением для получения 288 мг указанного в заголовке соединения.
Эталонный пример 2. Синтез 4-метоксиметил-2-нитробензойной кислоты
Процесс 1. Восстановление карбоновой кислоты
Раствор 1,0М комплекса борана-тетрагидрофурана в тетрагидрофуране добавляют по каплям к раствору 2,25 г 4-метоксикарбонил-3-нитробензойной кислоты в тетрагидрофуране (45 мл) и перемешивают при комнатной температуре в течение 48 ч. К нему добавляют метиловый спирт (2 мл) и 1 н. хлористоводородную кислоту (10 мл) и концентрируют. После добавления этилацетата и воды проводят разделение жидкостей. Органический слой промывают насыщенным гидрокарбонатом натрия и сушат над сульфатом натрия. После удаления растворителя полученный неочищенный материал очищают хроматографией на колонке силикагеля для получения 1,33 г метил-4-гидроксиметил-2-нитробензоата.
Процесс 2. Хлорирование
Смесь 1,33 г бензилового спирта, полученного в процессе 1, 18 мл тетрагидрофурана, 60 мл простого диэтилового эфира, 1,8 мл тионилхлорида и 91 мкл пиридина перемешивают при комнатной температуре в течение ночи. После добавления этилацетата и 10 мл 1 н. хлористоводородной кислоты проводят разделение жидкостей. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. После удаления растворителя смесь сушат под пониженным давлением для получения 1,29 г метил-4-хлорметил-2-нитробензоата.
Процесс 3. Метокисление, гидролиз сложного метилового эфира
40 мл метилового спирта и 1,22 г метоксида натрия добавляют к 1,29 г бензилхлорида, полученного в процессе 2, и перемешивают при 80°С в течение 1,5 ч. После охлаждения реакционного раствора до комнатной температуры, к нему добавляют 10 мл воды и перемешивают в течение ночи. К нему добавляют этилацетат и воду, водный раствор 0,1 н. гидроксида натрия и насыщенный водный раствор хлорида натрия и проводят разделение жидкостей. Водный слой подкисляют хлористоводородной кислотой и экстрагируют этилацетатом. После удаления растворителя полученный неочищенный материал очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 450 мг желаемого соединения.
Эталонный пример 3. Синтез метил-2-амино-5-(диметиламино)бензоата/дигидрохлорида
Процесс 1:
30,0 г (148 ммоль) 5-хлор-2-нитробензойной кислоты растворяют в 78 мл (744 ммоль) водного раствора 50% диметиламина в условиях охлаждения в ледяной бане. Раствор нагревают при 60°С в герметизированной пробирке в течение 23 ч. Реакционный раствор полностью охлаждают, и его внутреннее давление понижают до атмосферного. После проверки завершения реакции анализом с помощью ВЭЖХ реакционный раствор помещают в контейнер (используя примерно 50 мл воды), и к нему добавляют 49,6 мл концентрированной хлористоводородной кислоты, а затем 200 мл воды.
Желтые кристаллы осаждают добавлением хлористоводородной кислоты. После созревания кристаллического раствора при 10°С в течение ночи, его отфильтровывают и сушат под пониженным давлением для получения 30,95 г 5-диметиламино-2-нитробензойной кислоты (выход 99%).
1Н-ЯМР (400 МГц, ДМСО-d6): 8,88 (ушир.с, 1H), 7,97 (д, 1Н, J=9,4 Гц, соединение арила = 1,76 Гц), 6,78 (д, 1H, J=9,4 Гц, соединение арила = 2,84 и 1,92 Гц), 6,71 (с, 1H, соединение арила = 2,88 и 1,60 Гц), 3,08 (с, 6H).
13C ЯМР (100 МГц, ДМСО-d6): 168,58, 153,86, 133,94, 132,85, 127,03, 111,44, 109,69, 40,24.
MS (ESI): m/z 211,17 (м+H)+, 209,27 (М-Н)-
Процесс 2:
40,0 г (190,30 ммоль) 5-диметиламино-2-нитробензойной кислоты суспендируют в 160 мл метанола при 25°С. Суспензию охлаждают в ледяной бане и к ней добавляют 53,6 мл концентрированной серной кислоты. После добавления концентрированной серной кислоты температура раствора возрастает примерно до 30°С. Раствор в этом состоянии помещают в баню при 60°С и перемешивают в условиях нагревания в течении 20 ч. После проверки хода реакции с помощью ВЭЖХ и подтверждения исчезновения исходного материала к раствору добавляют 400 мл толуола и разбавляют. Затем к нему добавляют 200 мл воды и водного раствора гидроксида натрия (где 38,06 г гидроксида натрия растворяют в 200 мл воды). Затем водный слой экстрагируют 200 мл толуола, и раствор толуола объединяют с ним. Слой толуола промывают 300 мл насыщенного водного раствора бикарбоната натрия. Затем слой толуола концентрируют под пониженным давлением (при температуре в бане 50°С) так, что содержание желаемого соединения становится примерно 20 мас.%. После удаления растворителя под пониженным давлением кристаллы желаемого соединения осаждают и проводят их созревание при комнатной температуре в течение 1 ч. К ним добавляют 220 мл н-гептана и дополнительно перемешивают при 5°С в течение ночи. Кристаллы отделают всасывающим фильтрованием и промывают 100 мл н-гептана. Влажные кристаллы сушат под пониженным давлением при 60°С в течение 3 ч для получения 34,82 г желтого кристаллического порошка метил-5-диметиламино-2-нитробензоата. (Выход 82%).
1Н-ЯМР (400 МГц, ДМСО-d6): 8,02 (д, 1Н, J=9,4, Гц), 6,82 (д, 1H, J=9,36 Гц, соединение арила = 2,56, Гц), 6,78 (с, 1Н, соединение арила = 2,4, Гц), 3,83 (с, 3H), 3,10 (с, 6H).
13C NMR (100 МГц, ДМСО-d6): 167,70, 153,92, 132,71, 132,34, 127,24, 111,87, 110,07, 53,21, 40,28.
MS (FAB): m/z 224,24 (М)+
HR MS (FAB): m/z 224,0830 (М)+
Процесс 3:
10,06 г (44,9 ммоль) метил-5-диметиламино-2-нитробензоата добавляют к 50 мл метанола и суспендируют, и к нему добавляют 9,0 мл 10М хлористоводородной кислоты и 1,96 г (влажного, 1 моль% на субстрат) 5% активированного угля с палладием. Содержащийся в реакционном сосуде воздух замещают газообразным водородом и содержимое перемешивают при комнатной температуре в течение ночи. После отделения фильтрованием палладиевого катализатора фильтрацией через целит фильтрат концентрируют под пониженным давлением для того, чтобы он был доведен примерно до половины его количества. К раствору добавляют 80 мл ацетона и концентрируют под пониженным давлением 3 раза для осаждения соединения формулы (12). После созревания соединения при температуре ниже 10°С соединение сушат под пониженным давлением для получения 11,16 г метил-2-амино-5-(диметиламино)бензоата/ дигидрохлорида. (Выход 93%).
1Н-ЯМР (400 МГц, ДМСО-d6): 8,09 (с, 1Н), 7,72 (д, 1Н, J=9,0 Гц), 6,96 (д, 1H, 9,08 Гц), 5,50 ушир.с), 3,83 (с, 3H), 3,04 (с, 6H).
13C ЯМР (100 МГц, ДМСО-d6): 167,12, 131,64, 126,66, 123,29, 118,7, 108,88, 52,18, 45,84.
MS (FAB): m/z 195,3 (м+H)+
HR MS (FAB): m/z 195,1122 (м+H)+
Пример 135. Синтез соединения следующей формулы (Е-49), которое имеет заместитель (заместители) примера 135 табл.23
Процесс 1. Сложный метиловый эфир N-(т-бутоксикарбонил)-4-(6-йод-1-метил-2,4-хиназолиндион-3-ил)-L-фенилаланина
Смесь сложного метилового эфира N-(т-бутоксикарбонил)-4-амино-L-фенилаланина (10,25 г), 2-амино-5-йодбензойной кислоты (9,18 г), EDC/HCl (6,8 г), HOBT (4,8 г), триэтиламина (6,6 мл) и тетрагидрофурана (300 мл) перемешивают при 40°С в течение ночи. Раствор, где примерно половина количества растворителя была удалена, разводят водой и этилацетатом, и проводят жидкостное разделение. Органический слой промывают водой, насыщенным водным раствором хлорида аммония, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Растворитель удаляют для получения 22 г неочищенного материала. Неочищенный материал (22 г), CDI (карбонилдиимидазол) (17 г) и DMF (200 мл) перемешивают при 80°С в течение ночи. Реакционный раствор разбавляют водой и этилацетатом и проводят жидкостное разделение. Органический слой промывают водой и сушат над безводным сульфатом натрия. Растворитель удаляют для получения 23,4 г неочищенного материала. Неочищенный материал (23,4 г), метилйодид (3 мл), карбонат калия (10,0 г) и DMF (100 мл) перемешивают при комнатной температуре в течение ночи. Реакционный раствор разводят водой и этилацетатом и проводят жидкостное разделение. Органический слой промывают водой и сушат над безводным сульфатом натрия. Растворитель удаляют для получения 15 г желаемого соединения.
Процесс 2. Сложный метиловый эфир N-(2-хлор-6-фторбензоил)-4-(6-йод-1-метил-2,4-хиназолиндион-3-ил)-L-фенилаланина
Вещество, полученное в процессе 1 (5 г), трифторуксусную кислоту (3 мл) и дихлорметан (100 мл), перемешивают при комнатной температуре в течение 3 ч. Затем к нему добавляют трифторуксусную кислоту (10 мл) и перемешивают при комнатной температуре в течение 2 ч. После удаления растворителя к нему добавляют 4 н. раствор гидрохлориддиоксана и концентрируют. Остаток разбавляют дихлорметаном, промывают насыщенным водным раствором гидрокарбоната натрия и сушат над безводным сульфатом натрия. Растворитель удаляют для получения неочищенного материала. Неочищенный материал, хлорид 2-хлор-6-фторбензоила (2,5 г), триэтиламин (5 мл) и дихлорметан (100 мл) перемешивают при комнатной температуре в течение ночи. Реакционный раствор разбавляют водой и дихлорметаном и проводят жидкостное разделение. Органический слой промывают разбавленной хлористоводородной кислотой, водным раствором гидроксида натрия и сушат над безводным сульфатом натрия. Растворитель удаляют для получения неочищенного материала. Неочищенный материал очищают хроматографией на колонке силикагеля (гексан/этилацетат) для получения 2,7 г желаемого соединения.
Процесс 3. Сложный метиловый эфир N-(2-хлор-6-фторбензоил)-4-(1-метил-6-хлорметил-2,4-хиназолиндион-3-ил)-L-фенилаланина
Вещество, полученное в процессе 2, обрабатывают такими же процедурами, как соответственно процедуры процесса 1 и 2 в примере 50, и процесса 1 и 2 в примере 53, для получения указанного в заголовке соединения.
Процесс 4
Смесь вещества, полученного в процессе 3 (300 мг), тетрагидрофурана (20 мл) и 2М раствора этиламина-тетрагидрофурана (14 мл), перемешивают при комнатной температуре в течение ночи. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 70 мг желаемого соединения.
MS(ESI MH+): 553
Пример 136. Синтез соединения следующей формулы (Е-49), которое имеет заместитель (заместители) примера 136 табл.23
Вещество, полученное в процессе 3 в примере 135, взаимодействует такой же процедурой, как процедура процесса 4 в примере 135, с использованием 2М раствора метиламина-тетрагидрофурана для получения желаемого соединения.
MS(ESI MH+): 539
Пример 137. Синтез соединения следующей формулы (Е-49), которое имеет заместитель (заместители) примера 137 табл.23
Процесс 1. Сложный метиловый эфир N-(2-хлор-6-метилбензоил)-4-(6-йод-1-метил-2,4-хиназолиндион-3-ил)-L-фенилаланина
Вещество, полученное в процессе 1 примера 135 (5 г), трифторуксусную кислоту (10 мл) и дихлорметан (100 мл) перемешивают при комнатной температуре в течение 2 ч. После удаления растворителя остаток разбавляют дихлорметаном, промывают насыщенным водным раствором гидрокарбоната натрия и сушат над безводным сульфатом натрия. Растворитель удаляют для получения неочищенного материала. Смесь неочищенного материала, 2-хлор-6-метилбензойной кислоты (2,2 г), EDC/HCl (2,7 г), HOBT (2,1 г) и DMF (20 мл) перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Растворитель удаляют для получения неочищенного материала. Неочищенный материал очищают хроматографией на колонке силикагеля (гексан/этилацетат) для получения 1,1 г желаемого соединения.
Процесс 2
Вещество, полученное в процессе 1, взаимодействует такой же процедурой, как процедуры процесса 3 и 4 в примере 135, для получения 90 мг желаемого соединения.
MS(ESI MH+): 549
Пример 138. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 138 табл.25
Сложный изопропиловый эфир N-(2,6-дихлорбензоил)-4-[6-этилметиламино-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланина
Смесь вещества, полученного в процессе 2 примера 53 (250 мг), изопропанола (6 мл) и 4 н. раствора гидрохлориддиоксана (6 мл) перемешивают при 70°С в течение 3 ч. После удаления растворителя к смеси добавляют изопропанол (5 мл), ацетонитрил (2 мл) и метилэтиламин (0,4 мл) и перемешивают при комнатной температуре в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 138 мг желаемого соединения.
MS(ESI MH+): 625
Пример 139. Синтез соединения следующей формулы (Е-49), которое имеет заместитель (заместители) примера 139 табл.23:
N-(2,6-дихлорбензоил)-4-[6-этилметиламино-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланин
4 н. раствор 250 мг), изопропанола (6 мл) и 4 н. раствора гидрохлориддиоксана (2 мл) и воды (200 мкл) добавляют к соединению примера 138 (30 мг) и перемешивают при 80°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 15 мг желаемого соединения.
MS(ESI MH+): 583
Пример 140. Синтез соединения следующей формулы (Е-49), которое имеет заместитель (заместители) примера 140 табл.23:
N-(2,6-дихлорбензоил)-4-[6-гидрокси-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланин
Добавляют смесь 2-нитро-5-метоксибензойной кислоты (4 г), тетрагидрофурана (200 мл), сложного метилового эфира N-(2,6-дихлорбензоил)-4-амино-L-фенилаланина (6 г), EDC/HCl (3,6 г), HOBT (3,0 г) и триэтиламина (4,4 мл) и перемешивают при 40°С в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычном способом. Полученный неочищенный материал растворяют в этилацетате (20 мл) и к нему добавляют 1 г 10% активированного угля с палладием и перемешивают в атмосфере водорода при комнатной температуре в течение ночи. После фильтрации через целит остаток обрабатывают в соответствии с обычным способом. К полученному неочищенному материалу добавляют DMF (200 мл) и карбонилдиимидазол (5,2 г) и перемешивают при 80°С в течение 4 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. К полученному неочищенному материалу добавляют DMF (200 мл), карбонат калия (4,4 г) и метилйодид (1,2 мл) и перемешивают при комнатной температуре в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. К полученному неочищенному материалу добавляют 1М раствор трибромида бора-дихлорметана (50 мл) и перемешивают при комнатной температуре в течение 3 ч. Смесь экстрагируют дихлорметаном и обрабатывают в соответствии с обычным способом. К полученному неочищенному материалу добавляют воду/ацетонитрил (1:1) и осажденные вещества отфильтровывают для получения 2,2 г неочищенного материала желаемого соединения. Фильтрат концентрируют и очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 138 мг желаемого соединения.
MS(ESI MH+): 528
Пример 141. Синтез соединения следующей формулы (Е-49), которое имеет заместитель (заместители) примера 141 табл.23:
Сложный изопропиловый эфир N-(2,6-дихлорбензоил)-4-[6-((2S)-2-аминопропокси)-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланина
Процесс 1. т-бутил(1S)-2-гидрокси-1-метилэтилкарбамат
Ди-т-бутилдикарбонат (17 г), триэтиламин (9 мл) и дихлорметан (100 мл) добавляют к L-аланинолу (5 г) и перемешивают при комнатной температуре в течение 2 ч. Смесь разбавляют дихлорметаном и промывают водой, и органический слой сушат над безводным сульфатом магния. После удаления растворителя полученный неочищенный материал очищают хроматографией на колонке силикагеля (этилацетат - гексан) для получения 5,9 г указанного в заголовке соединения.
Процесс 2. т-бутил(1S)-2-хлор-1-метилэтилкарбамат
Метансульфонилхлорид (3,1 мл), триэтиламин (9,0 мл) и дихлорметан (150 мл) добавляют к соединению, полученному в процессе 1 (5,9 г), и перемешивают при 0°С в течение 2 ч. Смесь разводят дихлорметаном и промывают водой, и органический слой сушат над безводным сульфатом магния. После удаления растворителя к полученному неочищенному материалу добавляют хлорид лития (2,8 г) и DMF (100 мл) и перемешивают при 40°С в течение ночи. Смесь разбавляют этилацетатом и промывают водой, и органический слой сушат над безводным сульфатом магния. После удаления растворителя полученный неочищенный материал очищают хроматографией на колонке силикагеля (этилацетат - гексан) для получения 3,6 г указанного в заголовке соединения.
Процесс 3
Соединение, полученное в процессе 2 (15 мг), DMF (2 мл) и карбонат калия (14 мг) добавляют к соединению примера 154 (30 мг) и перемешивают при 90°С в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал растворяют в 4 н. растворе гидрохлориддиоксана (2 мл) и перемешивают при комнатной температуре в течение 2 ч. К нему добавляют воду (200 мкл) и перемешивают при 80°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 10 мг желаемого соединения.
MS(ESI MH+): 528
Пример 142. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 142 табл.23:
N-(2,6-дихлорбензоил)-4-[6-(2-диметиламиноэтокси)-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланина
Т-бутил-2-хлорэтилкарбамат (157 мг), DMF (3 мл) и карбонат калия (1384 мг) добавляют к соединению примера 154 (450 мг) и перемешивают при 90°С в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал растворяют в 4 н. растворе гидрохлориддиоксана (2 мл) и перемешивают при комнатной температуре в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 350 мг очищенного материала. К полученному очищенному материалу (170 мг) добавляют ацетонитрил (5 мл), формалин (37 мкл), уксусную кислоту (26 мкл) и триацетоксинатрий-бор (98 мг) и перемешивают при комнатной температуре в течении 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 150 мг очищенного материала. К полученному очищенному материалу (20 мг) добавляют 4 н. раствор гидрохлориддиоксана (1 мл) и воды (200 мл) и перемешивают при 90°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 11 мг очищенного материала.
MS(ESI MH+): 599
Пример 143. Синтез соединения следующей формулы (Е-50), которое имеет заместитель (заместители) примера 143 табл.24:
N-(2,6-дихлорбензоил)-4-[7-этиламинометил-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланин
Процесс 1. Метил-4-[(т-бутоксикарбонилэтиламино)метил]-2-нитробензоат
Триэтиламин (1,9 мл) и этилхлорформиат (1,0 мл) добавляют к смеси 1-метил-2-нитротерефталата (2,0 г) и тетрагидрофурана (120 мл) в условиях охлаждения льдом и перемешивают в течение 30 мин. К реакционному раствору добавляют боргидрид натрия (500 мл) и затем 3 кусочка льда и перемешивают при комнатной температуре в течение 2 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал (565 мг) растворяют в дихлорметане (10 мл). К нему в условиях охлаждения льдом добавляют триэтиламин (0,74 мл) и метансульфонилхлорид (0,25 мл) и перемешивают в течение 2 ч. Смесь экстрагируют дихлорметаном и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал растворяют в ацетонитриле (20 мл) и к нему добавляют 2,0М раствор моноэтиламина в тетрагидрофуране (2,68 мл) и перемешивают при комнатной температуре в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал растворяют в дихлорметане (10 мл). К нему в условиях охлаждения льдом добавляют триэтиламин (0,74 мл) и ди-т-бутилдикарбонат (700 мг) и перемешивают в течение 2 ч. Смесь экстрагируют дихлорметаном и обрабатывают в соответствии с обычным способом для получения 520 мг указанного в заголовке соединения.
Процесс 2
Вещество, полученное в процессе 1 (520 мг), растворяют в тетрагидрофуране (20 мл), 1М водном растворе гидроксида натрия (5 мл) и метаноле (10 мл) и перемешивают при комнатной температуре в течение 2 ч и затем при 40°С в течение 2 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. К ней добавляют тетрагидрофуран (20 мл), сложный метиловый эфир N-(2,6-дихлорбензоил)-4-амино-L-фенилаланина (563 мг), EDC/HCl (352 мг), HOBT (248 мг) и триэтиламин (425 мкл) и перемешивают при 40°С в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал растворяют в этилацетате (20 мл) и к нему добавляют 20 мг 10% активированного угля с палладием и перемешивают в условиях присутствия водорода при комнатной температуре в течение ночи. После фильтрации через целит остаток обрабатывают в соответствии с обычным способом. К полученному неочищенному материалу добавляют DMF (10 мл) и карбонилдиимидазол (374 мг) и перемешивают при 80°С в течение 4 ч. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. К полученному неочищенному материалу добавляют DMF (10 мл), карбонат калия (212 мг) и метилйодид (58 мкл) и перемешивают при комнатной температуре в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал растворяют в 4 н. растворе гидрохлориддиоксана (2 мл) и перемешивают при комнатной температуре в течение 4 ч. После концентрации растворителя к нему добавляют 4 н. раствор гидрохлориддиоксана (2 мл) и воду (200 мкл) и перемешивают при 80°С в течении 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 40 мг желаемого материала.
MS(ESI MH+): 569
Пример 144. Синтез соединения следующей формулы (Е-50), которое имеет заместитель (заместители) примера 144 табл.24:
N-(2,6-дихлорбензоил)-4-[7-метиламинометил-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланин
Желаемое соединение получают такими же процедурами, как процедуры процесса 1 и 2 в примере 143, за исключением того, что вместо 2,0М раствора моноэтиламина в тетрагидрофуране используют 2,0М раствора монометиламина в тетрагидрофуране.
MS(ESI MH+): 555
Пример 145. Синтез соединения следующей формулы (Е-50), которое имеет заместитель (заместители) примера 145 табл.24:
N-(2,6-дихлорбензоил)-4-[1-метил-7-пропиламинометил-2,4-хиназолиндион-3-ил]-L-фенилаланин
Желаемое соединение получают такими же процедурами, как процедуры процесса 1 и 2 в примере 143, за исключением того, что вместо 2,0М раствора моноэтиламина в тетрагидрофуране используют пропиламин.
MS(ESI MH+): 583
Пример 146. Синтез соединения следующей формулы (Е-50), которое имеет заместитель (заместители) примера 146 табл.24:
N-(2,6-дихлорбензоил)-4-[1-метил-7-диэтиламинометил-2,4-хиназолиндион-3-ил]-L-фенилаланин
Желаемое соединение получают такими же процедурами, как процедуры процесса 1 и 2 в примере 143, за исключением того, что вместо 2,0М раствора моноэтиламина в тетрагидрофуране используют диэтиламин.
MS(ESI MH+): 597
Пример 147. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 147 табл.25:
Желаемое соединение получают такой же процедурой, как процедура пункта С описанных выше примеров 101-121 с использованием соединения примера 54.
MS(ESI MH+): 652
Пример 148. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 148 табл.25:
Желаемое соединение получают такой же процедурой, как процедура пункта С описанных выше примеров 101-121 с использованием соединения примера 54.
MS(ESI MH+): 625
Пример 149. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 149 табл.25:
Желаемое соединение получают такой же процедурой, как процедура пункта С описанных выше примеров 101-121 с использованием соединения примера 54.
MS(ESI MH+): 597
Пример 150. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 150 табл.25:
Желаемое соединение получают такой же процедурой, как процедура пункта С описанных выше примеров 101-121 с использованием соединения примера 99.
MS(ESI MH+): 583
Пример 151. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 151 табл.25:
Желаемое соединение получают такой же процедурой, как процедура пункта С описанных выше примеров 101-121 с использованием соединения примера 99.
MS(ESI MH+): 597
1Н-ЯМР (ДМСО-d6) δ 1,19 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=6,3 Гц), 2,57 (3H, т, J=5,1 Гц), 3,0l (1Н, дд, J=14,1, 9,9 Гц), 3,19 (1Н, дд, J=14,1, 5,1 Гц), 3,55 (3H, с), 4,24 (2H, т, J=5,4 Гц), 4,72-4,82 (1Н, м), 4,95 (1Н, септ., J=6,3 Гц), 7,2l (2H, д, J=8,4 Гц), 7,37-7,48 (5H, м), 7,59 (1Н, д, J=8,7 Гц), 7,88 (1Н, дд, J=8,7, 2,1 Гц), 8,24 (1H, д, J=2,l Гц), 8,58 (2H, ушир.с), 9,25 (1Н, д, J=8,1 Гц).
Далее, соединение примера 151 получают такой же процедурой, как процедура процесса 3 в примере 53, за исключением того, что соединение процесса 1 в примере 174 используют в качестве сырьевого материала и метиламин используют вместо морфолина.
Пример 152. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 152 табл.25:
Желаемое соединение получают такой же процедурой, как процедура пункта С описанных выше примеров 101-121 с использованием соединения примера 99.
MS(ESI MH+): 611
Пример 153. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 153 табл.25:
Желаемое соединение получают такой же процедурой, как процедура пункта С описанных выше примеров 101-121 с использованием соединения примера 140.
MS(ESI MH+): 556
Пример 154. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 150 табл.25:
Желаемое соединение получают такой же процедурой, как процедура пункта С описанных выше примеров 101-121 с использованием соединения примера 140.
MS(ESI MH+): 570
Пример 155. Синтез соединения следующей формулы (Е-51), которое имеет заместитель (заместители) примера 155 табл.25:
Сложный изопропиловый эфир N-(2,6-дихлорбензоил)-4-[6-(2-диметиламиноэтокси)-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланина
Т-бутил-2-хлорэтилкарбамат (157 мг), DMF (3 мл) и карбонат калия (1384 мг) добавляют к соединению примера 154 (450 мг) и перемешивают при 90°С в течение ночи. Смесь экстрагируют этилацетатом и обрабатывают в соответствии с обычным способом. Полученный неочищенный материал растворяют в 4 н. растворе гидрохлориддиоксана (2 мл) и перемешивают при комнатной температуре в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 350 мг очищенного материала. К полученному очищенному материалу (170 мг) добавляют ацетонитрил (5 мл), формалин (37 мкл), уксусную кислоту (26 мкл) и триацетоксинатрий-бор (98 мг) и перемешивают при комнатной температуре в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 150 мг желаемого материала.
MS(ESI MH+): 641
Пример 156. Синтез соединения следующей формулы (Е-52), которое имеет заместитель (заместители) примера 156 табл.26:
Сложный изопропиловый эфир N-(2,6-дихлорбензоил)-4-[7-этиламинометил-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланина
4 н. раствор гидрохлориддиоксана (2 мл) и изопропанол (2 мл) добавляют к соединению примера 143 (20 мг) и перемешивают при 80°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 611
Пример 157. Синтез соединения следующей формулы (Е-52), которое имеет заместитель (заместители) примера 157 табл.26:
Сложный циклопентиловый эфир N-(2,6-дихлорбензоил)-4-[7-метиламинометил-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланина
4 н. раствор гидрохлориддиоксана (2 мл) и циклопентанол (2 мл) добавляют к соединению примера 144 (20 мг) и перемешивают при 80°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 15 мг желаемого соединения.
MS(ESI MH+): 623
Пример 158. Синтез соединения следующей формулы (Е-52), которое имеет заместитель (заместители) примера 158 табл.26:
Сложный изобутиловый эфир N-(2,6-дихлорбензоил)-4-[7-метиламинометил-1-метил-2,4-хиназолиндион-3-ил]-L-фенилаланина
4 н. раствор гидрохлориддиоксана (2 мл) и изобутанол (2 мл) добавляют к соединению примера 144 (20 мг) и перемешивают при 80°С в течение 2 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 12 мг желаемого соединения.
MS(ESI MH+): 611
Пример 159. Синтез соединения следующей формулы (Е-52), которое имеет заместитель (заместители) примера 159 табл.26:
Сложный изопропиловый эфир N-(2,6-дихлорбензоил)-4-[1-метил-7-пропиламинометил-2,4-хиназолиндион-3-ил]-L-фенилаланина
4 н. раствор гидрохлориддиоксана (2 мл) и изопропанол (2 мл) добавляют к соединению примера 145 (50 мг) и перемешивают при 80°С в течение 3 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 25 мг желаемого соединения.
MS(ESI MH+): 625
Пример 160. Синтез соединения следующей формулы (Е-53), которое имеет заместитель (заместители) примера 160 табл.27:
Желаемое соединение получают такой же процедурой, как процедура примера 92, за исключением того, что вместо имидазола используют 2-метилимидазол.
MS(ESI MH+): 610
Пример 161. Синтез соединения следующей формулы (Е-53), которое имеет заместитель (заместители) примера 161 табл.27:
Желаемое соединение получают такой же процедурой, как процедура примера 92, за исключением того, что вместо имидазола используют 2-этилимидазол.
MS(ESI MH+): 624
Пример 162. Синтез соединения следующей формулы (Е-53), которое имеет заместитель (заместители) примера 162 табл.27:
Желаемое соединение получают такой же процедурой, как процедура пункта С в приведенных выше примерах 101-121, используя соединение примера 92.
MS(ESI MH+): 638
1Н-ЯМР (ДМСО-d6) δ 1,19 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=6,3 Гц), 3,02 (1Н, дд, J=14,1, 9,9 Гц), 3,20 (1H, дд, J=14,1, 5,4 Гц), 3,59 (3Н, с), 4,72-4,82 (1Н, м), 4,95 (1H, септ., J=6,3 Гц), 7,24 (2H, д, J=8,l Гц), 7,38-7,48 (5H, м), 7,69 (1Н, с), 7,91 (1H, д, J=6,0 Гц), 8,07-8,14 (2H, м), 9,15 (1Н, с), 9,25 (1Н, д, J=7,8 Гц).
Примеры 163-173. Синтез соединений следующей формулы (Е-54), которое имеет заместители в примерах 163-173 табл.А:
Соединения, полученные в примерах 163-173, синтезируют такой же процедурой, как процедура пункта С в примерах 65-81.
Пример 174. Синтез соединения следующей формулы (Е-55), которое имеет заместитель (заместители) примера 174 табл.В:
Процесс 1. Сложный изопропиловый эфир 4-[6-(хлорметил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил]-N-(2,6-дихлорбензоил)-L-фенилаланина
Смешанный растворитель метиленхлорида (140 мл) и диметилформамида (140 мл) охлаждают до 0°С. К нему добавляют оксихлорид фосфора (4,1 мл) и перемешивают в течение 30 мин. Соединение примера 234 (25,7 г) добавляют при 0°С и перемешивают при комнатной температуре в течение 1 ч. К нему далее добавляют оксихлорид фосфора (0,4 мл) и перемешивают в течение 1 ч. Затем к нему добавляют этилацетат (500 мл) и воду, насыщенную бикарбонатом натрия (100 мл), и активно перемешивают. После добавления к нему этилацетата (500 мл) и воды (200 мл) для разделения его на слои, органический слой промывают водой, насыщенной бикарбонатом натрия (200 мл), 1 н. раствор гидроксида натрия (100 мл) и насыщенный водный раствор хлорида натрия (200 мл) и сушат над безводным сульфатом натрия. Растворитель удаляют под пониженным давлением для получения неочищенного материала. Указанное в заголовке соединение получают кристаллизацией из метиленхлорида и гексана.
Выход: 20,32 г
MS(ESI MH+): 602
Процесс 2. Изопропил(2S)-3-[4-(6-(азидометил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]-2-[(2,6-дихлорбензоил)амино]пропионат
Азид натрия (56 мг) и диметилсульфоксид (5 мл) добавляют к соединению (400 мг), полученному в процессе 1, и перемешивают в течение 2,5 ч. После разбавления этилацетатом и промывания водой, органический слой сушат над безводным сульфатом натрия. Растворитель удаляют под пониженным давлением, и остаток очищают хроматографией на силикагеле (гексан - этилацетат) для получения указанного в заголовке соединения (350 мг).
Процесс 3. Изопропил(2S)-3-[4-(6-(аминометил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]-2-[(2,6-дихлорбензоил)амино]пропионат
Трифенилфосфин (52 мг) и тетрагидрофуран (2 мл) добавляют к соединению (100 мг), полученному в процессе 2, и перемешивают в течение 30 мин. Воду (200 мкл) добавляют к реакционному раствору и затем перемешивают в течение ночи. После удаления растворителя, остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 76 мг желаемого соединения.
Примеры 175-183. Синтез соединений следующей формулы (Е-55), которые имеют заместители примеров 175-183 табл.В:
Соединения синтезируют такой же процедурой, как процедура процесса 3 в примере 53, за исключением того, что вместо морфолина в качестве исходного материала используют соединение процесса 1 в примере 174 и соответствующие амины.
Пример 184. Синтез соединения следующей формулы (Е-56), которое имеет заместитель (заместители) примера 184 табл.С:
Процесс 1. Изопропил(2S)-2-[(2,6-дихлорбензоил)амино]-3-[4-(7-фтор-6-йод-1-метил-6-[(метиламино)метил]-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]пропаноат
Указанное в заголовке соединение синтезируют такой же процедурой, как процедуры процессов 1-3 в примере 43, за исключением того, что сложный изопропиловый эфир N-(2,6-дихлорбензоил)-4-[(2-амино-5-йодбензоил)амино]-L-фенилаланина, полученный в процессе 1 примера 234, используют вместо сложного метилового эфира N-(2,6-дихлорбензоил)-4-[(2-амино-5-йодбензоил)амино]-L-фенилаланина и 2-амино-4-фтор-5-йодбензойной кислоты используют вместо 2-амино-5-йодбензойной кислоты.
Процесс 2. Изопропил(2S)-2-[(2,6-дихлорбензоил)амино]-3-[4-(7-фтор-1-метил-6-[(метиламино)метил]-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]пропаноат
Соединение, полученное в процессе 1, обрабатывают такими же процедурами, как процедуры процессов 4 и 5 в примере 234, процесса 1 в примере 174 и примере 175 для получения указанного в заголовке соединения.
Пример 185 и 186. Синтез соединений следующей формулы (Е-56), которые имеют заместители примеров 185 и 186 табл.С:
Соединения синтезируют такой же процедурой, как процедура примера 184, за исключением того, что соответствующие амины используют в процессе 2 примера 184.
Пример 187. Синтез соединения следующей формулы (Е-57), которое имеют заместитель (заместители) примера 187 табл.D:
Процесс 1. Метил(2S)-2-амино-3-[4-(6-йод-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]пропаноатгидрохлорид
4 н. раствор гидрохлориддиоксана добавляют к метил(2S)-2-[(трет-бутоксикарбонил)амино-3-[4-(6-йод-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]пропаноату (5 г), полученному в процессе 1 примера 135, и перемешивают в течение 3 ч. Растворитель удаляют для получения указанного в заголовке соединения (4,2 г).
Процесс 2. Метил(2S)-2-[(2-хлор-6-метилбензоил)амино]-3-[4-(6-йод-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]пропаноат
2-Хлор-6-метилбензойную кислоту (1,7 г), EDC/HCl (1,9 г), HOAt (1,4 г), триэтиламин (2,2 мл) и дихлорметан (42 мл) добавляют к соединению, полученному в процессе 1 (2,1 г), и перемешивают в течение ночи. После разбавления реакционной смеси этилацетатом и промывания 1 н. хлористоводородной кислотой, водой, насыщенной бикарбонатом натрия и насыщенным водным раствором хлорида натрия, органический слой сушат над безводным сульфатом натрия. Растворитель удаляют для получения неочищенного материала указанного в заголовке соединения.
Процесс 3. Изопропил(2S)-2-[(2-хлор-6-метилбензоил)амино]-3-[4-(6-йод-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]пропаноат
4 н. раствор гидрохлориддиоксана (30 мл) и воду (6 мл) добавляют к соединению, полученному в процессе 2, и перемешивают при 90°С в течение ночи. После удаления растворителя к остатку добавляют 4 н. раствор гидрохлориддиоксана (25 мл) и изопропиловый спирт (25 мл) и перемешивают при 90°С в течение 3,5 ч. После разбавления реакционной смеси этилацетатом и промывания 1 н. хлористоводородной кислотой, водой, насыщенной бикарбонатом натрия, и насыщенным водным раствором хлорида натрия, органический слой сушат над безводным сульфатом натрия. Растворитель удаляют для получения неочищенного материала указанного в заголовке соединения.
Процесс 4. Изопропил(2S)-2-[(2-хлор-6-метилбензоил)амино]-3-[4-(1-метил-6-[(метиламино)метил]-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]пропаноат
Соединение, полученное в процессе 3, обрабатывают такими же процедурами, как процедуры процессов 4 и 5 в примере 234, процессе 1 в примере 174 и примере 175, для получения указанного в заголовке соединения.
Пример 188. Синтез соединения следующей формулы (Е-57), которое имеет заместитель (заместители) примера 188 табл.D:
Соединение синтезируют такой же процедурой, как процедура примера 187, за исключением того, что соответствующий амин используют в процессе 4 примера 187.
Пример 189. Синтез соединения следующей формулы (Е-57), которое имеет заместитель (заместители) примера 189 табл.D:
Соединение, полученное в процессе 2 примера 135, обрабатывают такими же процедурами, как процедуры процессов 4 и 5 в примере 234, процессе 1 в примере 174 и примере 175 для получения указанного в заголовке соединения.
Пример 190. Синтез соединения следующей формулы (Е-57), которое имеет заместитель (заместители) примера 190 табл.D:
Соединение синтезируют такой же процедурой, как процедура примера 189, за исключением того, что соответствующий амин используют в примере 189.
Примеры 191-206. Синтез соединений следующей формулы (Е-58), которые имеют заместители) примеров 191-206 табл.Е:
Соединения синтезируют такой же процедурой, как процедура процесса 4 примера 43, за исключением того, что в качестве исходных материалов используют соединения примеров 174-188 и 190.
Пример 207. Синтез соединения следующей формулы (Е-59), которое имеет заместитель (заместители) примера 207 табл.F:
Метансульфонилхлорид (30 мкл), триэтиламин (80 мкл) и дихлорметан (3 мл) добавляют к метил(2S)-2-[(2,6-дихлорбензоил)амино]-3-[4-(6-(3-гидроксипропил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидро-3-(2Н)-хиназолинил)фенил]пропаноату (150 мг), который представляет собой синтетическое промежуточное соединение примера 52, и перемешивают при 0°С в течение 2,5 ч. После разбавления реакционного растворителя этилацетатом и промывания 1 н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, органический слой сушат над безводным сульфатом натрия и растворитель удаляют под пониженным давлением. Полученный осадок растворяют в ацетонитриле (6 мл), добавляют по каплям к 2М раствору метиламина-тетрагидрофурана (9 мл) и перемешивают при 50°С в течение ночи. После удаления растворителя к остатку добавляют 4 н. раствор гидрохлориддиоксана (6 мл) и воду (1,2 мл) и перемешивают при 90°С в течение 2 ч. После удаления растворителя остаток и очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 70 мг желаемого соединения.
Примеры 208 и 209. Синтез соединений следующей формулы (Е-59), которые имеют заместители примеров 208 и 209 табл.F:
Соединения синтезируют такой же процедурой, как процедура примера 207, за исключением того, что, вместо 2М раствора метиламина-тетрагидрофурана, используют раствор в тетрагидрофуране каждого соответствующего амина.
Пример 210. Синтез соединения следующей формулы (Е-59), которое имеет заместитель (заместители) примера 210 табл.F:
4 н. раствор гидрохлориддиоксана (2 мл) и изопропанол (2 мл) добавляют к соединению примера 207 (65 мг) и перемешивают при 90°С в течение 3,5 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 60 мг желаемого соединения.
Примеры 211 и 212. Синтез соединений следующей формулы (Е-59), которые имеют заместители примеров 211 и 212 табл.F:
Соединения синтезируют такой же процедурой, как процедура примера 210, используя соединения, полученные в примерах 208 и 209.
Примеры 213-218. Синтез соединений следующей формулы (Е-60), которые имеют заместители примеров 213-218 табл.G:
Процесс 1. Неочищенный материал соединения примера 140 (2,49 г), 4 н. раствор гидрохлориддиоксана (50 мл) и изопропиловый спирт (50 мл) перемешивают при 80°С в течение 1,5 ч и из него удаляют растворитель. Смесь полученного неочищенного материала, 1-бром-2-хлорэтана (3,92 мл), карбоната калия (6,51 г) и ацетона (100 мл) перемешивают при 50°С в течение 3 ч. После удаления растворителя остаток разбавляют водой и этилацетатом и проводят жидкостное разделение. После промывания органического слоя насыщенным водным раствором хлорида натрия растворитель удаляют для получения неочищенного материала (2,85 г).
Процесс 2. Желаемое соединение получают следующими способами А, В и С.
А. Смесь алкилгалида в процессе 1, соответствующего амина и подходящего растворителя (растворителей), такого как ацетонитрил, перемешивают при 80°С в течение периода от ночи до 3 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
В. Смесь алкилгалида в процессе 1, соответствующего амина (или гидрохлорида соответствующего амина и основания (оснований), таких как триэтиламин) и подходящего растворителя (растворителей), такого как ацетонитрил, перемешивают в наклонной трубе при 80°С в течение периода от ночи до 3 ч. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
С. Смесь алкилгалида в процессе 1, соответствующего амина и подходящего растворителя (растворителей), такого как ацетонитрил, перемешивают при 50°С в течение периода от ночи до 3 д. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
Примеры 219-224. Синтез соединений следующей формулы (Е-60), которые имеют заместители примеров 219-224 табл.G:
Смесь соответствующего сложного эфира, 4 н. раствора гидрохлориддиоксана и воды перемешивают при 80°С в течение периода от нескольких часов до ночи. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
Пример 225. Синтез соединения следующей формулы (Е-61), которое имеет заместитель (заместители) примера 225 табл.H:
Желаемое соединение синтезируют такими же процедурами, как процедуры примеров 213-218, за исключением того, что, вместо 1-бром-2-хлорэтана, используют 1-бром-2-хлорпропан.
Примеры 226 и 227. Синтез соединений следующей формулы (Е-61), которые имеют заместители примеров 226 и 227 табл.H:
Желаемые соединения синтезируют такой же процедурой, как процедура примеров 219-224.
Пример 228. Синтез соединения следующей формулы (Е-62):
Процесс 1. Синтез сложного изопропилового эфира N-(2,6-дихлорбензоил)-4-[7-фтор-6-(2-гидроксиэтил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил]-L-фенилаланина
В атмосфере аргона ацетат палладия (6,5 мг) и трифенилфосфин (30 мг) суспендируют в 5 мл простого диэтилового эфира и перемешивают в течение 10 мин. После двукратного проведения декантации простым диэтиловым эфиром к смеси добавляют сложный изопропиловый эфир N-(2,6-дихлорбензоил)-4-[7-фтор-1-метил-2,4-диоксо-6-йод-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил]-L-фенилаланина (374 мг), комплекс 2,4,6-тривинилциклотрибороксана-пиридина (138 мг), диэтилформамид (5 мл) и водный раствор 2М карбоната натрия (1,15 мл) и перемешивают при 90°С в течение 1,5 ч. После удаления нерастворимых материалов фильтрацией через целит проводят обычную обработку для получения неочищенного материала (0,36 г). Полученный неочищенный материал растворяют в тетрагидрофуране (3 мл) и охлаждают до 0°С. Затем к нему добавляют боргидрид натрия (35 мг) и комплекс трифторборана - простого диэтилового эфира (81 мкл) и перемешивают при 0°С в течение 1 ч. Реакционную смесь дополнительно перемешивают при комнатной температуре в течение 1 ч и снова охлаждают до 0°С, и к нему медленно добавляют воду (0,26 мл). После перемешивания реакционной смеси при комнатной температуре в течение 1 ч и снова охлаждения до 0°С, к ней добавляют водный раствор (5 мл) Oxone (зарегистрированная торговая марка) (1,3 г закупленного у Sigma-Aldrich) и перемешивают при комнатной температуре в течение 3,5 ч. Далее к ней добавляют бисульфит натрия, экстрагируют этилацетатом, промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия для получения неочищенного материала. Полученный неочищенный материал очищают хроматографией на колонке силикагеля (градиент хлороформ : метанол = от 49:1 до 4:1) для получения указанного в заголовке соединения.
Выход: 0,197 г (0,32 ммоль, 60%)
MS(ESI MH+): 616
Процесс 2. Синтез сложного изопропилового эфира N-(2,6-дихлорбензоил)-4-{7-фтор-1-метил-6-[2-(метиламино)этил]-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил}-L-фенилаланина
Соединение, полученное в процессе 1 (0,179 г), растворяют в метиленхлориде (2 мл) и добавляют триэтиламин (67 мкл) и метансульфонилхлорид (32 мкл) при 0°С. После перемешивания смеси в течение 2 ч проводят обычную обработку для получения неочищенного материала.
Раствор 2М метиламина и ацетонитрила (6 мл) в тетрагидрофуране (10 мл) нагревают до 50°С, и к нему медленно по каплям добавляют раствор в ацетонитриле (6 мл) неочищенного материала и перемешивают в течение ночи. После удаления растворителя под пониженным давлением остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
Выход: 51,7 мг
MS(ESI MH+): 629
Пример 229. Синтез соединения следующей формулы (Е-63):
Синтез N-(2,6-дихлорбензоил)-4-{7-фтор-1-метил-6-[2-(метиламино)этил]-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил}-L-фенилаланина
4 н. раствор гидрохлориддиоксана (4 мл) и воду (0,8 мл) добавляют к соединению примера 228 (10 мг) и перемешивают при 90°С в течение 2 ч. После удаления растворителя под пониженным давлением остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения указанного в заголовке соединения.
Выход: 5,3 мг
MS(ESI MH+): 587
Пример 230. Синтез соединения следующей формулы (Е-64):
Синтез N-(2,6-дихлорбензоил)-4-{1-метил-6-[2-(метиламино)этил]-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил}-L-фенилаланина
Указанное в заголовке соединение получают такими же процедурами, как процедуры процессов 1 и 2 в пример 228, и затем примера 229, за исключением того, что в качестве исходного материала используют сложный метиловый эфир N-(2,6-дихлорбензоил)-4-(1-метил-2,4-диоксо-6-йод-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил)-L-фенилаланина.
MS(ESI MH+): 569
Пример 231. Синтез соединения следующей формулы (Е-65):
Соединение примера 52 (351 мг) растворяют в дихлорметане (10 мл) и триэтиламине (0,16 мл, 1,2 ммоль). К нему по каплям в условиях охлаждения льдом добавляют метансульфонилхлорид (0,116 мл, 1,2 ммоль) и перемешивают в течение 2 ч. Обычную обработку проводят для получения неочищенного материала. К неочищенному материалу добавляют ацетонитрил (5 мл), карбонат калия (170 мг) и 2М раствор диметиламинтетрагидрофурана (616 мкл) и перемешивают при комнатной температуре в течение ночи. После удаления растворителя остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения 40 мг желаемого соединения.
MS(ESI MH+): 611
Пример 232. Синтез соединения следующей формулы (Е-66):
4 н. раствор гидрохлориддиоксана и изопропанол добавляют к соединению примера 144 и перемешивают при 80°С в течение 2 ч. После удаления растворителя под пониженным давлением остаток очищают высокоэффективной жидкостной хроматографией (вода/ацетонитрил, каждый, содержащий 0,1% TFA) для получения желаемого соединения.
MS(ESI MH+): 597
Пример 233. Синтез соединения следующей формулы (Е-67):
Желаемое соединение получают такой же процедурой, как процедура пункта С в указанных выше примеров 101-121, с использованием неочищенного материала соединения примера 140.
MS(ESI MH+): 542
Пример 234. Синтез соединения следующей формулы (Е-68):
Процесс 1. Синтез сложного изопропилового эфира 4-[(2-амино-5-йодбензоил)амино]-N-(2,6-дихлорбензоил)-L-фенилаланина
Сложный изопропиловый эфир 4-амино-N-(2,6-дихлорбензоил)-L-фенилаланина, 1-гидроксибензотриазолмоногидрат (11,5 г) и 5-йодантраниловую кислоту (17,8 г) растворяют в диметилформамиде (200 мл) и охлаждают до 0°С. К ним добавляют 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид (13,7 г) и перемешивают при комнатной температуре в течение 16 ч. Органический слой, в который добавляют этилацетат (1 л) промывают соответственно 0,1 н. водным раствором гидроксида натрия (200 мл, 100 мл), водой (100 мл), 0,1 н. хлористоводородой кислотой (200 мл) и насыщенным водным раствором хлорида натрия (200 мл, 100 мл). После сушки органического слоя над безводным сульфатом натрия и удаления растворителя твердый материал, полученный из смешанного растворителя метиленхлорида и гексана, фильтруют для получения указанного в заголовке соединения.
Выход: 37,06 г (57,88 ммоль)
MS(ESI MH+): 640
Процесс 2. Синтез сложного изопропилового эфира N-(2,6-дихлорбензоил)-4-(6-йод-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил)-L-фенилаланина
N,N-карбонилдиимидазол (28,16 г) растворяют в 150 мл диметилформамида и нагревают до 80°С. К нему по каплям добавляют раствор в диметилформамиде (150 мл) соединения, полученного в процессе 1 (37,06 г), и перемешивают в течение ночи. После охлаждения смеси до комнатной температуры к ней добавляют этилацетат (1 л) и воду (500 мл) и проводят экстракцию. Полученный органический слой промывают водой (300 мл, 200 мл, 200 мл) и насыщенным водным раствором хлорида натрия (100 мл) и сушат над безводным сульфатом натрия. После удаления растворителя под пониженным давлением полученный твердый материал суспендируют в метиленхлориде и гексане. Полученный твердый материал фильтруют и сушат для получения указанного в заголовке соединения.
Выход: 33,06 г
MS(ESI MH+): 666
Процесс 3. Синтез сложного изопропилового эфира N-(2,6-дихлорбензоил)-4-(6-йод-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил)-L-фенилаланина
Соединение, полученное в процессе 2 (33,06 г), и карбонат калия (14,5 г) добавляют к диметилформамиду (200 мл), и затем к нему далее добавляют йодметан (10 мл) и перемешивают при комнатной температуре в течение 4 ч. После удаления нерастворимых материалов фильтрацией через целит к фильтрату добавляют этилацетат (1 л) и воду (300 мл) и проводят экстракцию. Полученный органический слой промывают соответственно 1 н. хлористоводородной кислотой (250 мл), водой, насыщенной бикарбоната натрия (250 мл), и насыщенным водным раствором хлорида натрия (200 мл). После удаления растворителя полученный твердый материал суспендируют в метиленхлориде и гексане. Полученный твердый материал фильтруют и сушат для получения указанного в заголовке соединения.
Выход: 31,85 г
MS(ESI MH+): 680
Процесс 4. Синтез сложного изопропилового эфира N-(2,6-дихлорбензоил)-4-(6-карбокси-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил)-L-фенилаланина
Соединение, полученное в процессе 3, растворяют в диметилформамиде (140 мл), и к нему добавляют триэтиламин (13,1 мл) и воду (8,5 мл). После барботирования моноксидом углерода добавляют ацетат палладия (52 мг) и перемешивают в атмосфере моноксида углерода при 70°С в течение 11 ч. После удаления нерастворимых материалов фильтрацией через целит диметилформамид (примерно 100 мл) удаляют под пониженным давлением. Затем к нему добавляют этилацетат (1 л) и 1 н. хлористоводородную кислоту (300 мл) и проводят экстракцию. Полученный органический слой промывают 1 н. хлористоводородной кислотой (200 мл) и насыщенным водным раствором хлорида натрия (200 мл, 200 мл) и сушат над безводным сульфатом натрия. После удаления растворителя под пониженным давлением полученный твердый материал суспендируют в метиленхлориде и гексане. Полученный твердый материал фильтруют и сушат для получения указанного в заголовке соединения.
Выход: 27,23 г
MS(ESI MH+): 598
Процесс 5. Синтез сложного изопропилового эфира N-(2,6-дихлорбензоил)-4-[6-(гидроксиметил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-3-(2Н)-ил]-L-фенилаланина
Соединение, полученное в процессе 4, растворяют в тетрагидрофуране (200 мл). К нему добавляют триэтиламин (9,51 мл) и охлаждают до 0°С. По каплям добавляют этилхлорформиат (4,56 мл) и перемешивают в течение 30 мин. После отделения фильтрацией нерастворимых материалов фильтрат охлаждают до 0°С и добавляют боргидрид натрия (2,58 г) и лед (5 кусочков) и перемешивают в течение 1 ч. Затем к нему дополнительно добавляют боргидрид натрия (0,25 г) и перемешивают в течение 20 мин. Соответственно добавляют 1 н. хлористоводородную кислоту (74,8 мл), этилацетат и воду и проводят экстракцию. Органический слой промывают 0,3 н. хлористоводородной кислотой, водой, насыщенной бикарбонатом натрия, и насыщенным водным раствором хлорида натрия. После удаления растворителя полученный твердый материал суспендируют в метиленхлориде и гексане. Полученный твердый материал фильтруют и сушат для получения указанного в заголовке соединения.
Выход: 25,69 г
MS(ESI MH+): 584
Пример 235. Синтез соединения следующей формулы (Е-69):
Желаемое соединение получают в виде материала побочного продукта соединения примера 228.
MS(ESI MH+): 609
Пример 236. Синтез соединения следующей формулы (Е-70):
Желаемое соединение получают в виде материала побочного продукта соединения примера 229.
MS(ESI MH+): 567
Эталонный пример 4. Синтез сложного изопропилового эфира 4-амино-N-(2,6-дихлорбензоил)-L-фенилаланина (а именно, синтез изопропил-(S)-2-(2,6-дихлорбензоиламино)-3-(4-нитрофенил)пропионата
Процесс 1: Синтез сложного изопропилового эфира 4-нитро-N-(2,6-дихлорбензоил)-L-фенилаланина
Изопропанол (130 мл), тетрагидрофуран (50 мл) и серную кислоту (0,44 мл) добавляют к 4-нитро-N-(2,6-дихлорбензоил)-L-фенилаланину (2,95 г, 7,70 ммоль) и перемешивают при 50°С в течение 5 ч. После удаления растворителя под пониженным давлением полученный твердый материал промывают водой и сушат для получения 3,28 г белого твердого материала.
MS(ESI) m/z 425(MH+)
Процесс 2: Синтез сложного изопропилового эфира 4-амино-N-(2,6-дихлорбензоил)-L-фенилаланина (а именно, синтез изопропил-(S)-2-(2,6-дихлорбензоиламино)-3-(4-нитрофенил)пропионата
Изопропанол (6 мл), тетрагидрофуран (3 мл) и 3% Pt-S/C (20 мг) добавляют к твердому материалу, полученному в процессе 1 (98 мг), и перемешивают в атмосфере водорода при комнатной температуре в течение ночи. После фильтрации реакционного раствора фильтрат промывают изопропанолом и удаляют под пониженным давлением для получения 92 мг указанного в заголовке соединения.
MS(ESI) m/z 395(MH+)
Ниже показаны структурные формулы соединения, приведенных в примерах.
Таблица 1

Таблица 2

Таблица 3

Соединение примеров 16-20

Таблица 5

Таблица 6

Соединение примера 36

Таблица 7

Таблица 8

Соединение примеров 47 и 48


Таблица 12

Соединение примера 59

Соединение примера 64

Таблица 15-1

Таблица 15-2

Таблица 16

Таблица 17

Соединения примеров 89-97

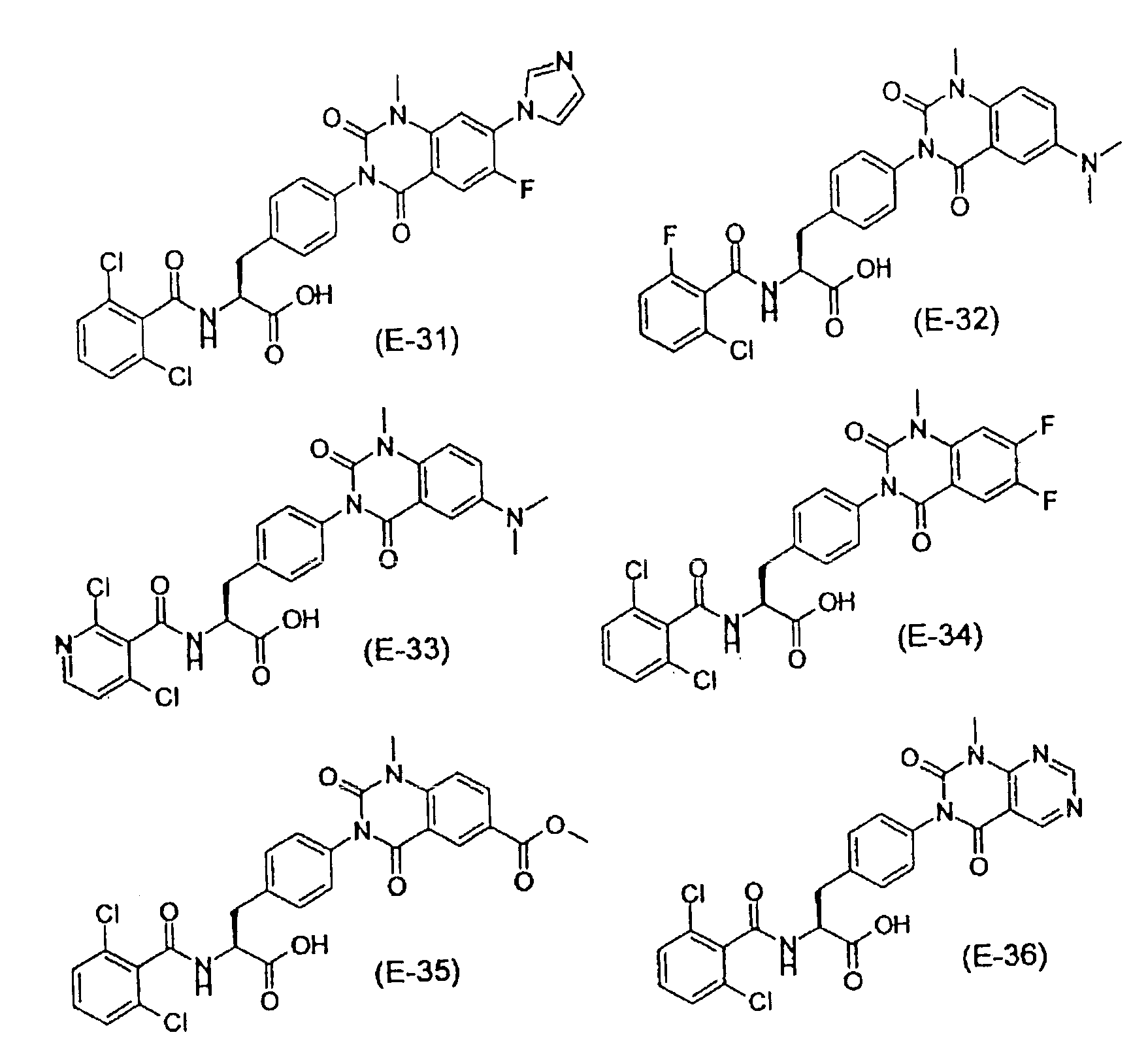
Таблица 18

Соединение примера 100
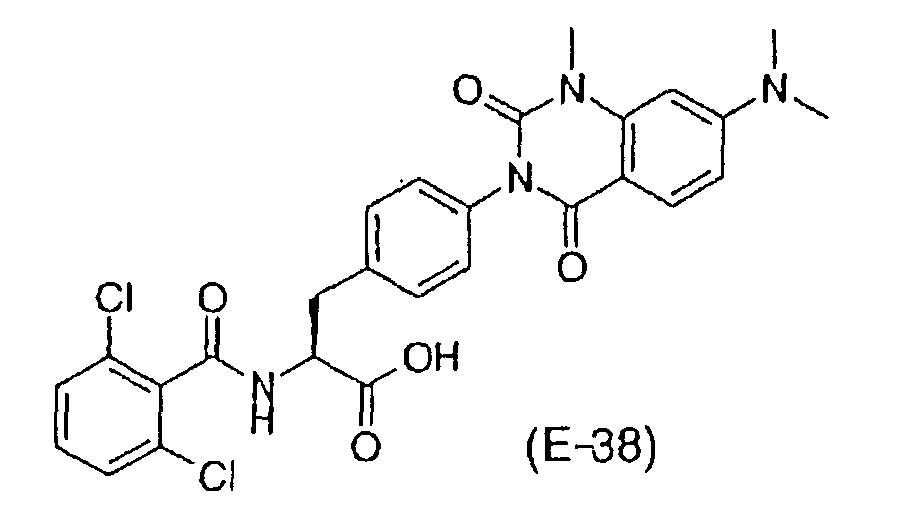
Таблица 19-1

Таблица 19-2

Таблица 19-3

Таблица 20

Соединение примеров 124 и 125

Таблица 21

Соединение примеров 128-132

Таблица 22
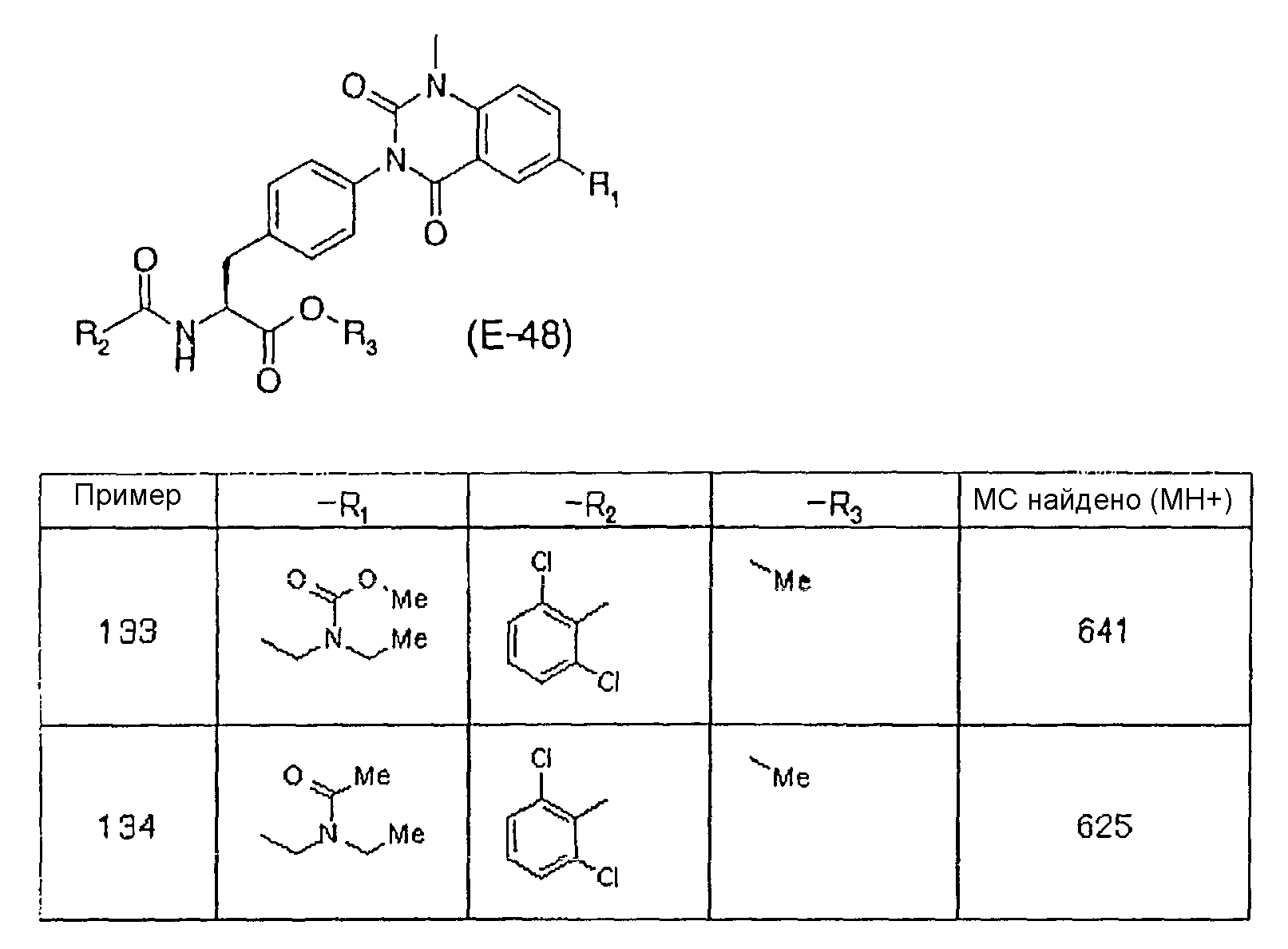
Таблица 23

Таблица 24

Таблица 25

Таблица 26

Таблица 27

Таблица А
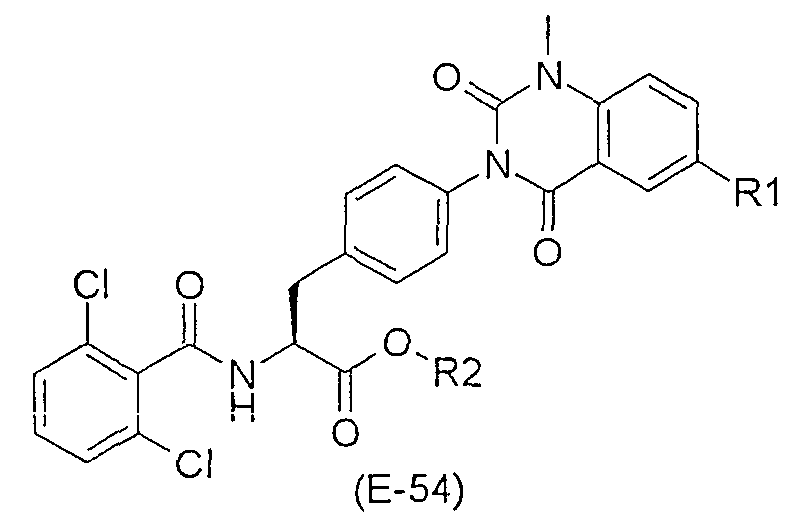

Таблица В
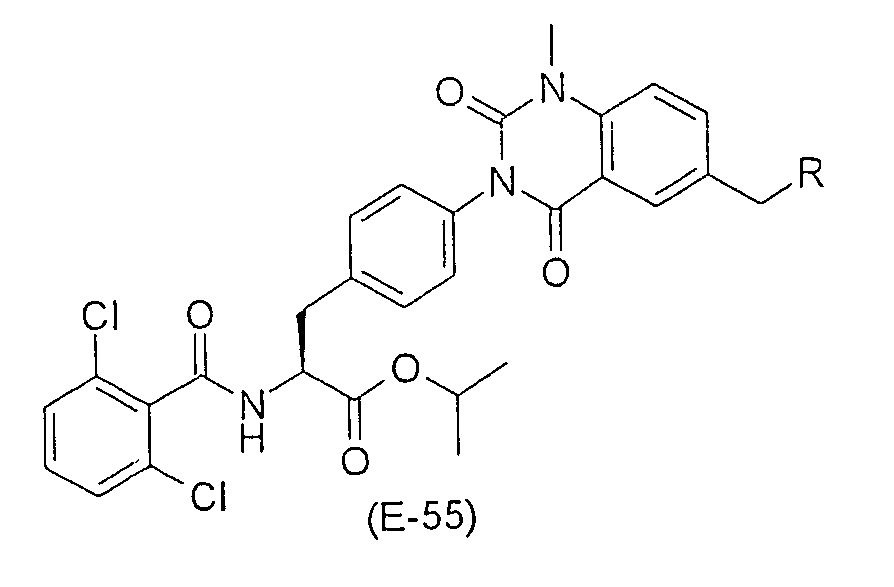
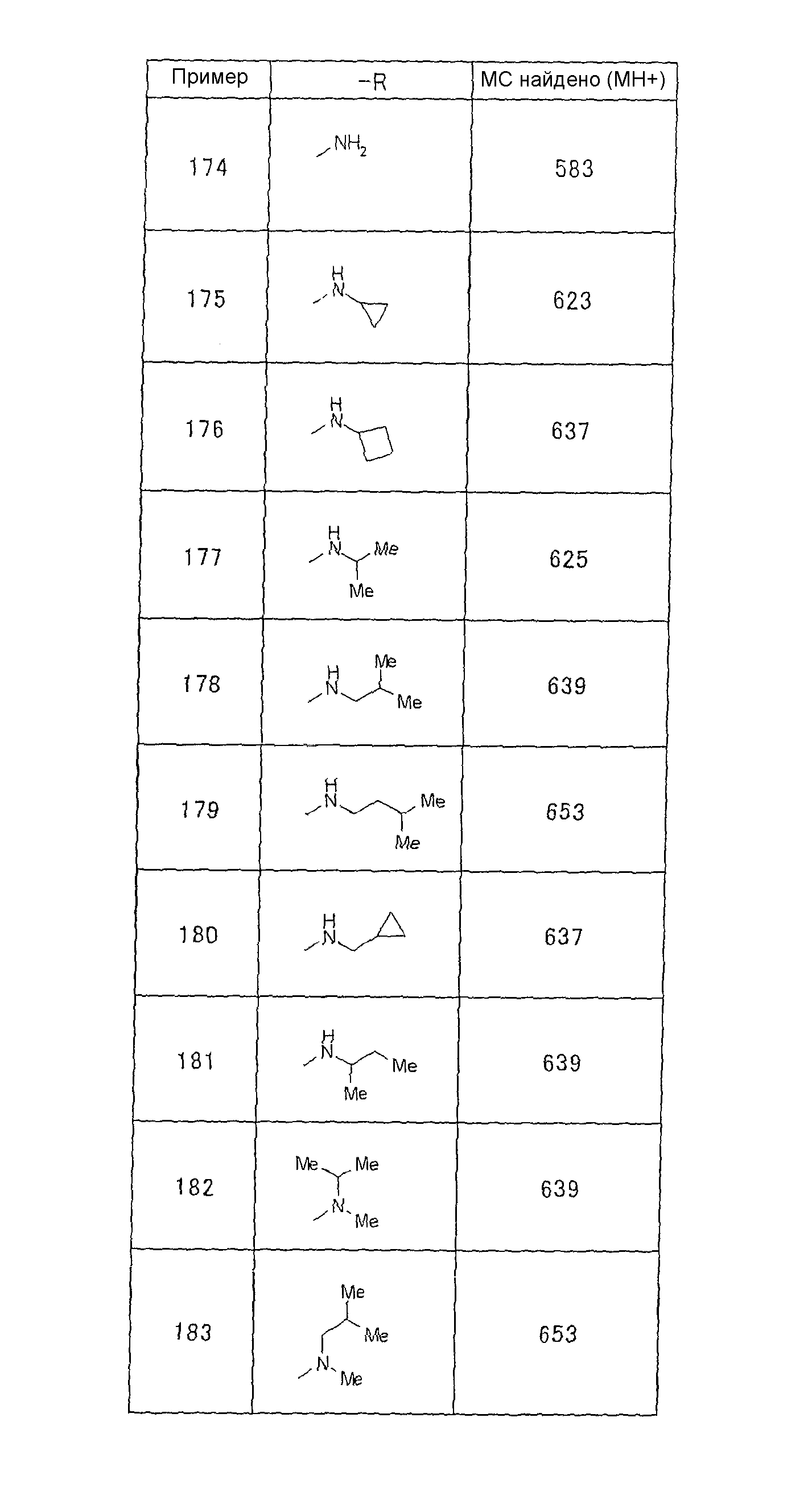
Таблица С

Таблица D
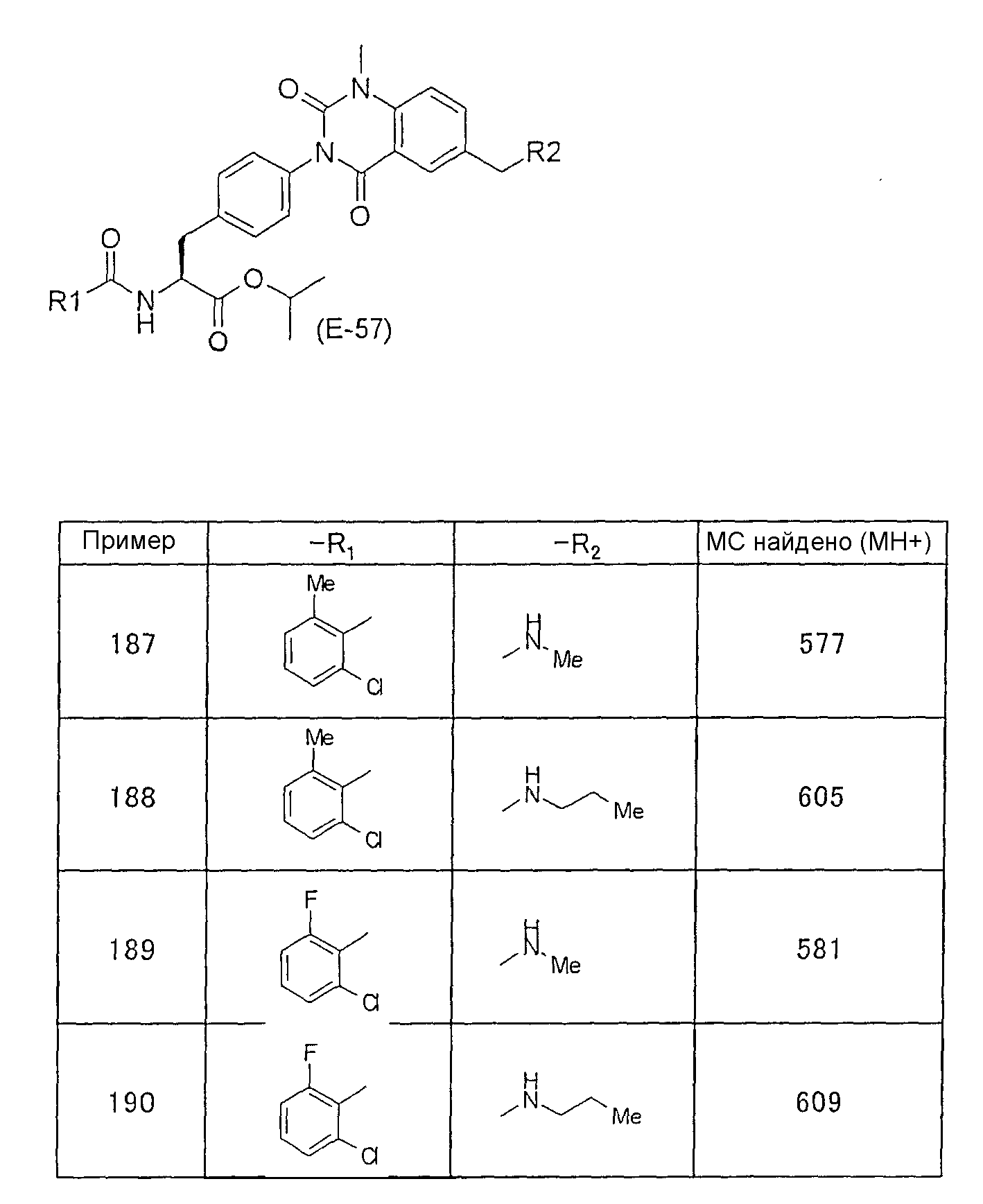
Таблица Е-1

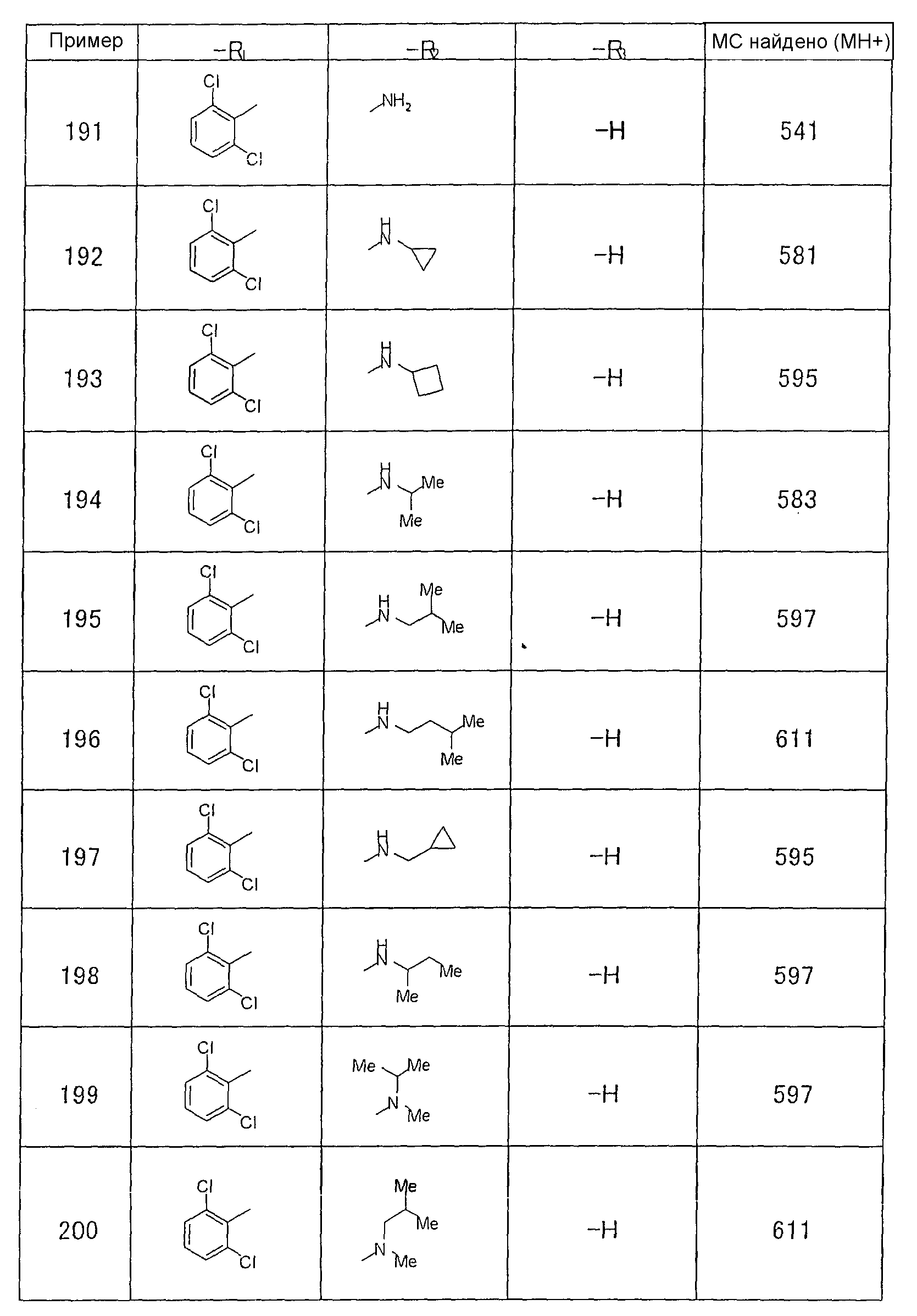
Таблица Е (продолжение)

Таблица F
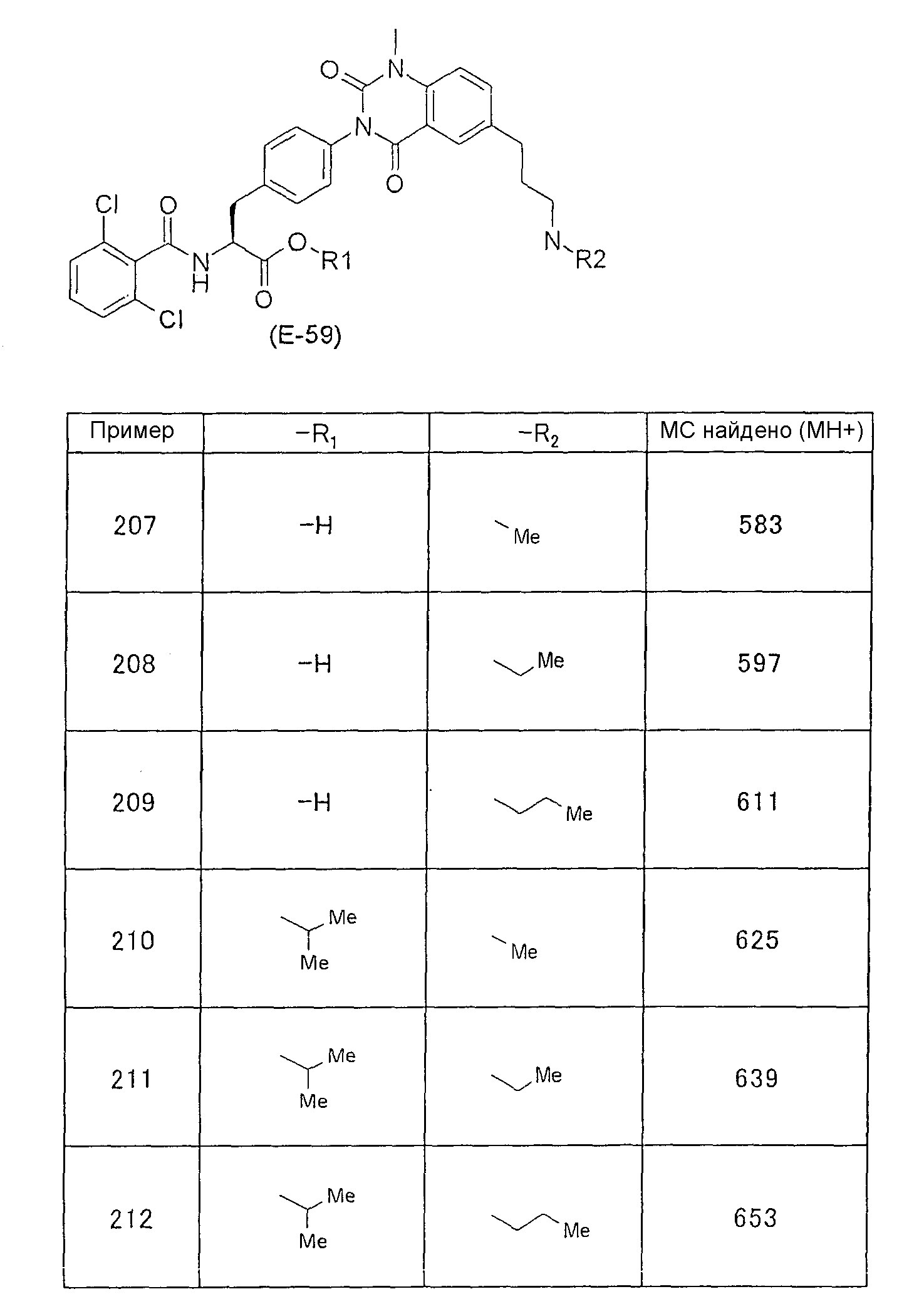
Таблица G


Таблица H

Соединение примеров 228-236



Дополнительно, соединения, охарактеризованные следующими структурными формулами, легко могут быть получены теми же самыми методами, как и соединения, описанные выше. Примеры или методы синтезирования таких же модификаций, которые являются очевидными для специалистов в данной области, касающейся этих методов.
Таблица 28

Таблица 29

Таблица 30

Таблица 31

Таблица 32

Таблица 33

Таблица 34
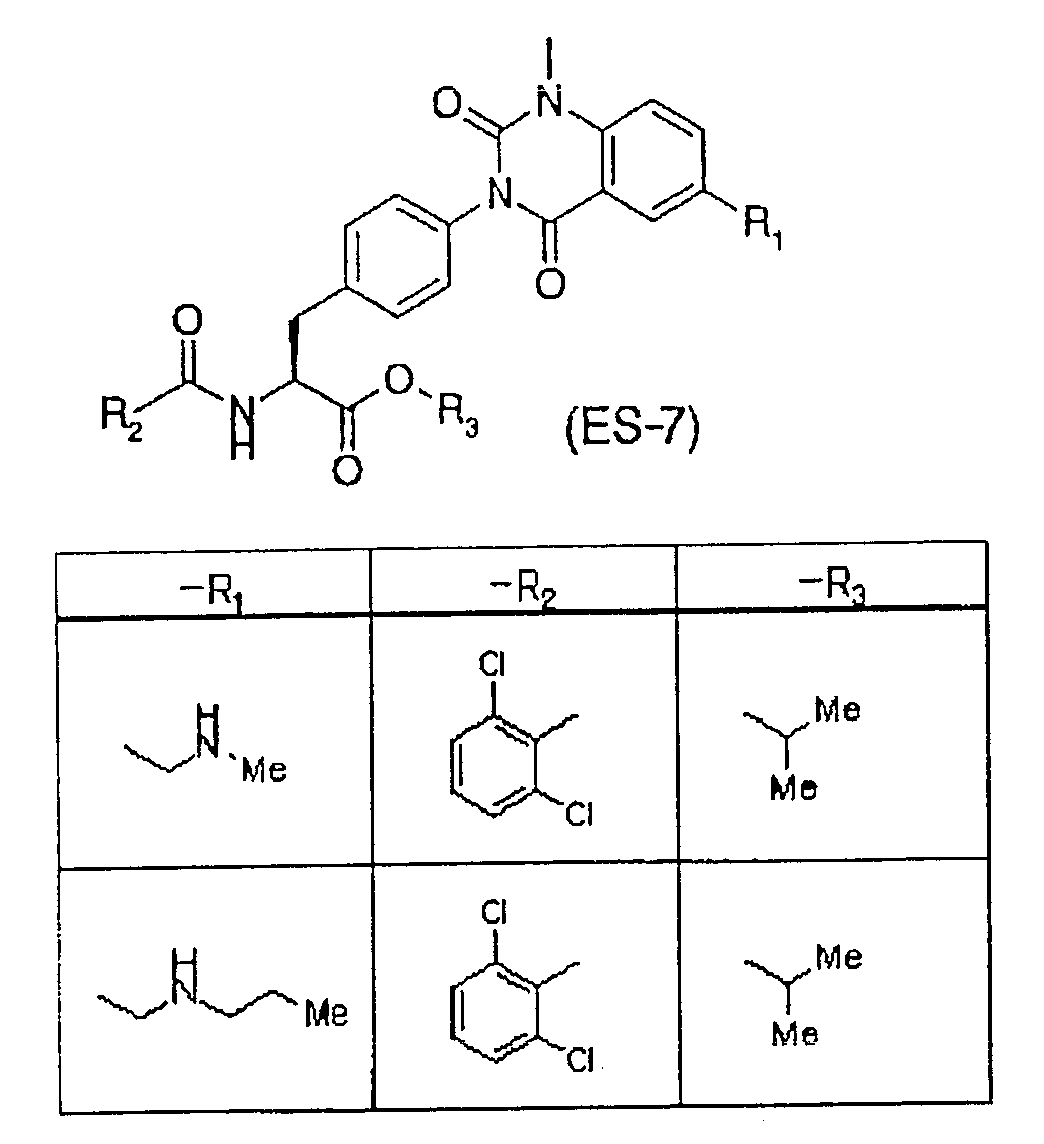
Таблица 35

Таблица 36

Таблица 37

Таблица 38

Таблица 39

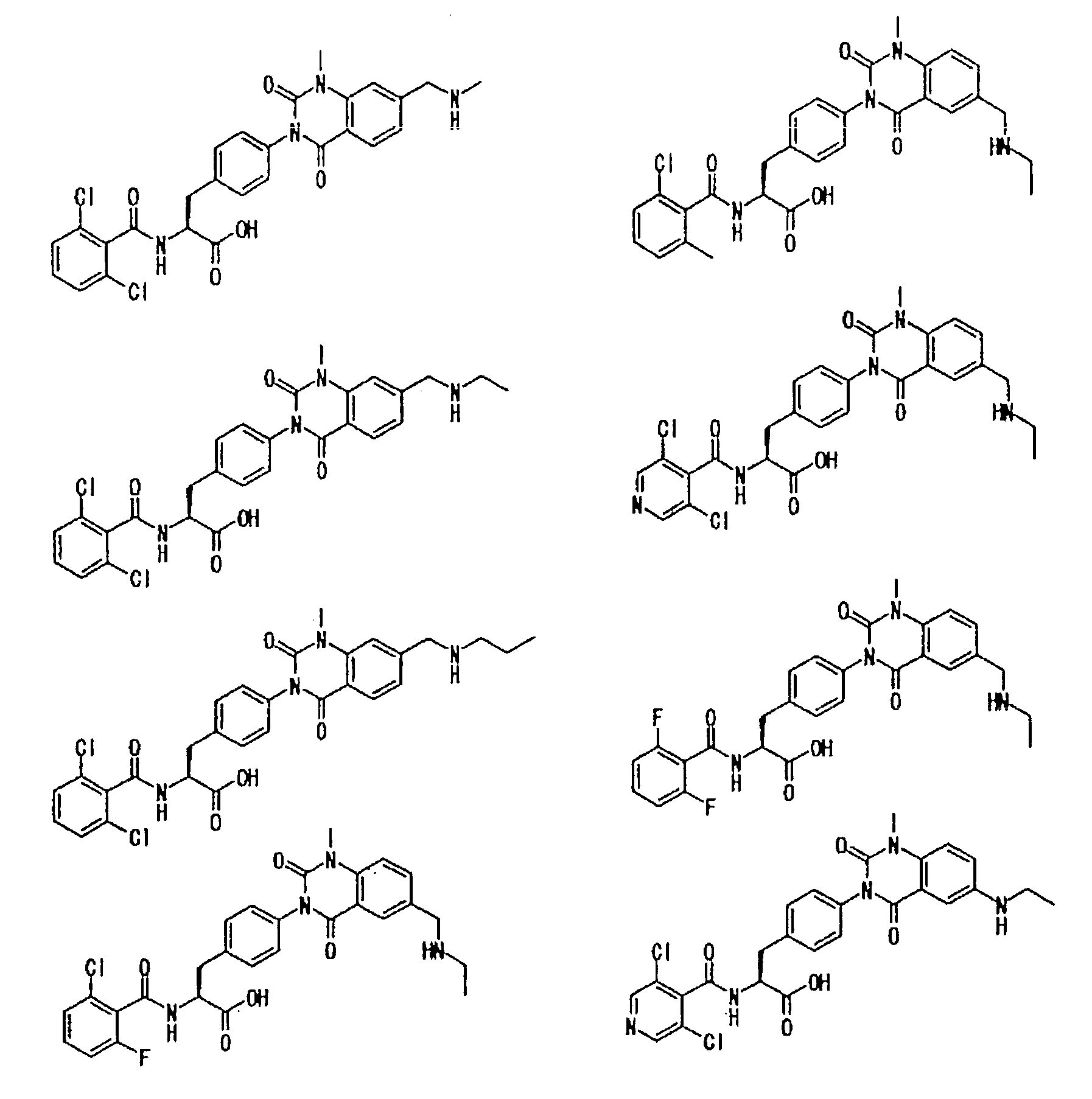




Пример 1 испытаний
Анализ антагонистической активности в отношении связывания VCAM-1/α4β1 интегрина в условиях присутствия сыворотки крови
Определяют способность тестируемого вещества противодействовать связыванию линии Т-клеток человека, Jurkat (ATCC TIB-152), которые, как известно, экспрессируют α4β1 интегрин, с VCAM-1.
50 мкл/лунку раствора (500 нг/мл) рекомбинантного человеческого VCAM-1/Fc (R&D systems) разбавляют буфером А (0,1М NaHCO3, рН 9,6) добавляют в 96-луночную титровочную микропланшету (Nunc Maxicorp.). После инкубации при 4°С в течение ночи и однократного промывания PBS добавляют буфер (буфер В), полученный разведением Block Ace (Snow Brand Milk Products Co., Ltd.) с использованием PBS до концентрации ½ в количестве 150 мкл/лунку. После инкубации при комнатной температуре в течение 2 ч, буфер В удаляют и планшету однократно промывают PBS.
Клетки Jurkat однократно промывают модифицированной Дульбекко средой Игла (SIGMA, далее именуемой “DMEM”). Затем клетки снова суспендируют в связывающем буфере (DMEM, содержащей 20 мМ HEPES, 0,1% BSA (бычьего сывороточного альбумина), 2 мМ MnCl2 и 50% человеческую сыворотку крови (Sigma)) для доведения концентрации до 1×106 клеток/мл.
60 мкл различных концентраций испытуемого вещества, полученных разведением связывающим буфером, добавляют в 96-луночную планшету с круглым дном (IWAKI). Сразу после этого, в них добавляют 60 мкл клеток Jurkat (1×106 клеток/мл) и встряхивают на вибраторе для планшет (IKA-Labortechnik, IKA-SCHUTTLER MTS-4) при 1000 об/мин в течение 10 с. В 120 мкл клеточной суспензии, к которой добавляют испытуемое вещество, каждые их 100 мкл переносят на покрытую VCAM-1/Fc планшету и инкубируют в темном месте при комнатной температуре в течение 60 мин. После встряхивания на вибраторе для планшет при 1000 об/мин в течение 30 с, раствор сразу удаляют. Затем несвязанные клетки удаляют однократным промыванием их PBS. В планшету добавляют буфер С (PBS, содержащая 0,82% Triton X-100) в количестве 70 мкл/лунку. После встряхивания на вибраторе для планшет при 1000 об/мин в течение 5 мин, связанные клетки Jurkat лизируются. После центрифугирования клеток на планшетной центрифуге (SIGMA 4-15C) при комнатной температуре при 2500 об/мин в течение 5 мин, 50 мкл их надосадочной жидкости переносят в 96-луночную титровочную микропланшету (Nune Maxisorp). В нее добавляют каждые 50 мкл субстратного буфера (нерадиоактивный анализ цитотоксичности Promega, CytoTox 96), встряхивают на вибраторе для планшет при 1000 об/мин в течение 10 с и обеспечивают взаимодействие в темном месте при комнатной температуре в течение 30 мин. Затем в них добавляют каждый 50 мкл останавливающего раствора (нерадиоактивный анализ цитотоксичности Promega, CytoTox 96) и встряхивают на вибраторе для планшет при 1000 об/мин в течение 10 с. Его спектральную поглощательную способность при 490 нм определяют прибором для считывания планшет (Molecular Devices, Vmax). Полученная таким способом спектральная поглощательная способность выявляет активность лактатдегидрогеназы (LDH), растворенной в надосадочной жидкости каждой лунки. А именно, спектральная поглощательная способность пропорциональна количеству остающихся клеток Jurkat на планшете посредством связывания с VCAM-1. Испытание проводят дважды, и скорость связывания каждого испытуемого вещества в различных концентрациях, тогда как, по данным измерения, спектральная поглощательная способность лунки без испытуемого вещества составляет 100%, а спектральная поглощательная способность лунки без клеток Jurkat, по определению, составляет 0%. Рассчитывают концентрацию для ингибирования связывания на 50%, IC50. Полученные результаты показаны в таблице 1 результатов.
Пример 2 испытаний
Фармакокинетическое исследование внутривенным введением крысе
После взвешивания на весах соединений по настоящему изобретению, где R11-R141 представляют собой гидроксильную группу, которые являются активными формами, их концентрацию доводят диметилсульфоксидом до 10 мг/мл. К ним добавляют полиэтиленгликоль 400 и дистиллированную воду для получения вводимого раствора с концентрацией 1 мг/мл. Вводимый раствор с концентрацией 1 мг/мл внутривенно вводят в виде однократной дозы крысе Wistar в количестве 1 мл/кг. Через 1, 5, 10, 30, 60 и 180 мин концентрацию препарата в плазме крови, полученной взятием крови из ее центральной вены, определяют в динамике под анестезией с помощью LC/MS (жидкостной хроматографии/масс спектрометрии). По полученным результатам площадь под кривой динамики во времени концентрации в плазме от нуля до бесконечности (AUCinf (iv)) рассчитывают в соответствии с трапециевидным способом фармакокинетического анализа. Общее выведение из организма (CLtot, [L/ч/кг]) рассчитывают как показатель исчезновения дозы [мг/кг] препарата в плазме крови и AUC [мкг×ч/мл], в соответствии с формулой: CLtot = доза + AUCinf (iv). Полученные результаты показаны в таблице 2 результатов.
Пример 3 испытаний
Фармакокинетическое исследование при помощи орального введения крысе
После взвешивания на весах соединений по настоящему изобретению, где R11-R141 представляют собой радикалы, отличные от гидроксильной группы, которые представляют собой пролекарственные соединения, их растворяют диметилсульфоксидом для доведения концентрации до 100 мг/мл. К ним добавляют смешанный раствор полиэтиленгликоля 400 : пропиленгликоля = 1:1 для получения вводимого раствора с концентрацией 2,5 мг/мл. 2,5 мг/мл вводимого раствора орально вводят самцу крысы Wistar (в возрасте 7-9 нед) в количестве 4 мл/кг. Через 0,25, 0,5, 1, 2, 4, 6 или 8 ч кровь берут из его шейной вены под анестезией шприцем, обработанным дихлофосом, который представляет собой ингибитор эстеразы. Затем кровь переносят в пробирку, обработанную гепарином, и центрифугируют, получая плазму крови. Ацетонитрил, содержащий вещество внутреннего стандарта, добавляют в его двух частях к полученной плазме крови и концентрацию соответствующей активной формы, где R11-R141 представляют собой гидроксильную группу, определяют LC/MS/MS. По полученным результатам рассчитывают площадь под кривой динамики во времени концентрации в плазме от нулевого времени до бесконечности, а именно, AUCinf (po). Биологическую доступность (ВА) рассчитывают по AUCinf (iv) активной формы при внутривенном введении, полученной по примеру 2 испытания по следующей формулы:
BA(%)=[AUCinf(po)/Dose(po)]/AUCinf(iv)/Dose(iv)]×100
AUCinf: площадь под кривой динамики во времени концентрации в плазме от нулевого времени до бесконечности активной формы при оральном или внутривенном ведении
Доза: оральная или внутривенная доза (в виде активной формы)
Полученные результаты показаны в таблице 3 результатов.
Пример 4 испытаний
Активность в увеличении количества лимфоцитов в периферической крови у крысы
После введения вещества, ингибирующего связь между α4 интегрином и VCAM-1, in vivo, в случае эффективной ингибирующей активности, то предполагается, что количество лимфоцитов в периферической крови увеличивается ингибированием адгезии лимфоцитов к кровеносным сосудам органов (не патентные публикации 45 и 47). Исследовали активность соединений по настоящему изобретению в плане увеличения количества лимфоцитов у крысы.
Вводимый раствор получали растворением соединений по настоящему изобретению диметилсульфоксидом, добавляя смешанный раствор полиэтиленгликоля 400 : пропиленгликоля = 1:1 и повторно переворачивая пробирки вверх и вниз дном. Конечную концентрацию DMSO доводили до уровня 2,5%.
Вводимый раствор испытуемого вещества (3 мг/кг, 10 мг/кг или 30 мг/кг) орально вводят самцу крысы Wistar (в возрасте от 6 до 8 нед) в количестве 4 мл/кг. В установленные точки времени после введения кровь берут из его большой брюшной вены под анестезией и перемешивают в контейнере, покрытом EDTA-2K, для сбора крови. Затем количество лимфоцитов в периферической крови определяют автоматизированным анализатором полного набора гематологических показателей (SF-3000, Sysmex). Испытание проводят у 5 животных, и рассчитывают отношение (%) количества лимфоцитов в периферической крови у группы, которой вводят испытуемое вещество, к количеству лимфоцитов у группы, получавшей носитель (контрольной группы), тогда как средняя величина количества лимфоцитов в периферической крови у контрольной группы определяют как равное 100%.
Полученные результаты показаны в таблице 4 результатов.
Реферат
Настоящее изобретение относится к производным фенилаланина и их фармацевтически приемлемым солям. В формуле (1) ! ! R11 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, которая может быть замещена метокси группой, циклоалкоксильную группу, имеющую 3-6 атомов углерода, или бензилокси группу; R12 и R13 каждый независимо представляет атом водорода, алкильную группу, имеющую 1-6 атомов углерода, циклоалкильную группу, имеющую 3-6 атомов углерода, ацетильную группу или метилоксикарбонильную группу, или N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу; R14 представляет метильную группу; R1' представляет атом водорода, атом фтора; X1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)-, -CH(R1a)CH(R1b)CH(R1c)-, -N(R1a)CH(R1b)CH(R1c)-, -OCH(R1a)CH(R1b)-, -OCH(R1a)CH(R1b)CH(R1c)- или 1,3-пирролидинилен, где R1a, R1b, каждый независимо представляет атом водорода или метильную группу, a R1c представляет атом водорода; Y11 и Y12 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F). Изобретение также относится к производным фенилаланина формул (2)-(14), представленным в формуле настоящего изобретения, а также к фармацевтической композиции, обладающей антагонистической активностью в отношении α4-интегрина, содержащей производное фенилаланина в качестве активного ингредиента, к антагонисту α4-интегрина, к терапевтическому средству. 18 н. и 47 з.п. ф-лы, 51 табл.
Формула

где R11 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, которая может быть замещена метоксигруппой, циклоалкоксильную группу, имеющую 3-6 атомов углерода, или бензилоксигруппу;
R12 и R13 каждый независимо представляет атом водорода, алкильную группу, имеющую 1-6 атомов углерода, циклоалкильную группу, имеющую 3-6 атомов углерода, ацетильную группу или метилоксикарбонильную группу, или N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу;
R14 представляет метильную группу;
R1' представляет атом водорода, атом фтора;
X1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)-,
-CH(R1a)CH(R1b)CH(R1c)-, -N(R1a)CH(R1b)CH(R1c)-, -OCH(R1a)CH(R1b)-, -OCH(R1a)CH(R1b)CH(R1c)- или 1,3-пирролидинилен, где R1a, R1b, каждый независимо представляет атом водорода или метильную группу, a R1c представляет атом водорода;
Y11 и Y12 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F).
R12 и R13 каждый независимо представляет атом водорода, алкильную группу, имеющую 1-3 атомов углерода, ацетильную группу или метилоксикарбонильную группу, или N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу; и
X1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)-, -N(R1a)CH(R1b)CH(R1c)-, -OCH(R1a)CH(R1b)- или 1,3-пирролидинилен.
R13 представляет атом водорода, метильную группу или этильную группу, или
N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу или 4-морфолинильную группу,
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -СН2-, который расположен в шестом, седьмом или восьмом положении хиназолиндионового кольца, и
Y11 и Y12 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F).
X1 представляет -СН2-, который расположен в шестом, седьмом или восьмом положении хиназолиндионового кольца, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
X1 представляет -СН2-, который расположен в шестом положении хиназолиндионового кольца.
X1 представляет -СН2-, который расположен в седьмом положении хиназолиндионового кольца.
R14 представляет метильную группу,
R1' представляет атом водорода или атом фтора, который расположен в шестом или седьмом положении хиназолиндионового кольца,
X1 представляет -N(СН3)СН2СН2-, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -OCH(R1a)CH(R1b), в котором R1a и R1b каждый независимо представляет атом водорода или метильную группу, и
Y11 и Y12 представляют любую из комбинаций (Cl, Cl), (Cl, Me), (Cl, F).
R14 представляет метильную группу и
Y11 и Y12 представляют комбинацию (Cl, Cl).
R12 представляет атом водорода или алкильную группу, имеющую 1-6 атомов углерода,
R13 представляет атом водорода, метильную группу или этильную группу, или
N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу,
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)-, -CH(R1a)CH(R1b)CH(R1c)- или -OCH(R1a)CH(R1b)-, который расположен в шестом положении хиназолиндионового кольца, где каждый R1a, R1b и R1c представляет атом водорода, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет алкильную группу, имеющую 1-6 атомов углерода,
R13 представляет атом водорода, метильную группу или этильную группу,
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -CH(R1a)- или -CH(R1a)CH(R1b)-, который расположен в шестом положении хиназолиндионового кольца, где каждый R1a и R1b представляет атом водорода, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет алкильную группу, имеющую 1-5 атомов углерода,
R13 представляет атом водорода,
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)- или -CH(R1a)CH(R1b)CH(R1c)-, который расположен в шестом положении хиназолиндионового кольца, где каждый R1a, R1b и R1c представляет атом водорода, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет метильную группу или этильную группу,
R13 представляет атом водорода,
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -CH(R1a)-, -CH(R1a)CH(R1b)- или -CH(R1a)CH(R1b)CH(R1c)-, который расположен в шестом положении хиназолиндионового кольца, где каждый R1a, R1b и R1c представляет атом водорода, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет метильную группу, этильную группу, изобутильную группу, циклопропилметильную группу, циклобутильную группу, втор-бутильную группу или изопентильную группу,
R13 представляет атом водорода,
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -CH(R1a)-, который расположен в шестом положении хиназолиндионового кольца, где R1a представляет атом водорода, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
R11 представляет гидроксильную группу или алкоксильную группу, имеющую 1-6 атомов углерода,
R12 представляет атом водорода или алкильную группу, имеющую 1-3 атома углерода,
R13 представляет атом водорода, метильную группу или этильную группу, или
N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу, 4-морфолинильную группу,
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -O-CH(R1a)CH(R1b)- или -O-CH(R1a)CH(R1b)CH(R1c)-, который расположен в шестом положении хиназолиндионового кольца, где каждый R1a, R1b независимо представляет атом водорода или метильную группу, а R1c представляет атом водорода, и
Y11 и Y12 представляют комбинацию (Cl, Cl).
R13 представляет атом водорода, метильную группу или этильную группу, или
N(R12)R13 представляет 1-пирролидинильную группу, 1-пиперидинильную группу или 4-морфолинильную группу,
R14 представляет метильную группу,
R1' представляет атом водорода,
X1 представляет -СН2-, который расположен в шестом, седьмом или восьмом положении хиназолиндионового кольца, и
Y11 и Y12 представляют комбинацию (Cl, Cl).




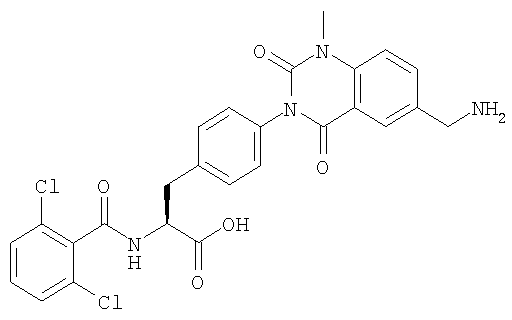



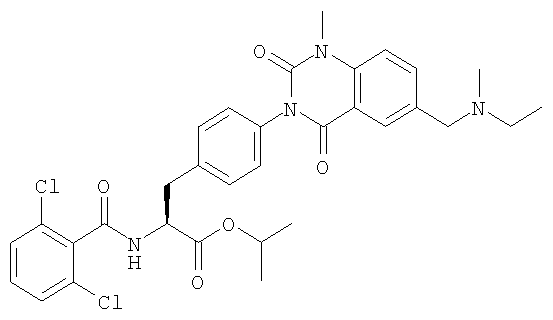


где R21 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода,
R22 представляет атом водорода или алкильную группу, имеющую 1-3 атома углерода,
R24 представляет метильную группу,
R1' представляет атом водорода,
Х2 представляет -CH(R2a)-, -СН2СН2- или -N(R2a)CH2CH2-, где R2a представляет атом водорода или метильную группу, и
Y21 и Y22 представляют любую из комбинаций (Cl, Cl).
R22 представляет метильную группу или этильную группу,
R24 представляет метильную группу,
R2' представляет атом водорода,
Х2 представляет -СН2-, который расположен в шестом, седьмом или восьмом положении хиназолиндионового кольца, и
Y21 и Y22 представляют комбинацию (Cl, Cl).
R22 представляет атом водорода, метильную группу или этильную группу,
R24 представляет метильную группу,
R2' представляет атом водород,
Х2 представляет -N(СН3)СН2СН2- или -NHCH2CH2-, который расположен в шестом или седьмом положении хиназолиндионового кольца, и
Y21 и Y22 представляют комбинацию (Cl, Cl).

где R31 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода,
R34 представляет метильную группу,
R3' представляет атом водорода или атом фтора,

формула (3-1) представляет 4-морфолинильную группу, 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода, или 1-имидазолильную группу, которая может быть замещена метильной группой, этильной группой или амино группой, и
Y31 и Y32 представляют комбинацию (Cl, Cl).
R34 представляет метильную группу,
R3' представляет атом водорода,
формула (3-1) представляет 4-морфолинильную группу или 1-пиперазинильную группу, четвертое положение которой может быть замещено алкильной группой, имеющей 1-3 атома углерода, и
Y31 и Y32 представляют комбинацию (Cl, Cl).
R34 представляет метильную группу,
R3' представляет атом водорода,
формула (3-1) представляет 2-амино-1-имидазолильную группу, и
Y31 и Y32 представляют комбинацию (Cl, Cl).
R34 представляет метильную группу,
R3' представляет атом водорода или атом фтора,
формула (3-1) представляет 1-имидазолильную группу, второе положение которой может быть замещено метильной группой или этильной группой, и
Y31 и Y32 представляют комбинацию (Cl, Cl).

где R41 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода,
кольцо представляет бензольное кольцо, пиперазиновое кольцо, первое и четвертое положение которого замещено алкильной группой, имеющей 1-3 атома углерода, или пирролидиновое кольцо, первое положение которого может быть замещено алкильной группой, имеющей 1-3 атома углерода,
R44 представляет метильную группу, и
Y41 и Y42 представляют любую из комбинаций (Cl, Cl).
R44 представляет метильную группу, и
Y41 и Y42 представляют комбинацию (Cl, Cl).

где R51 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода,
R54 представляет метильную группу,
R5' представляет атом водорода,
R5a представляет атом водорода или алкильную группу, имеющую 1-3 атома углерода, и R5b представляет алкильную группу, имеющую 1-3 атома углерода, или
N(R5a)R5b представляет 1-пирролидинильную группу, и
Y51 и Y52 представляют комбинацию (Cl, Cl).
R54 представляет метильную группу,
R5' представляет атом водорода,
N(R5a)R5b представляет 1-пирролидинильную группу, и
Y51 и Y52 представляют комбинацию (Cl, Cl).
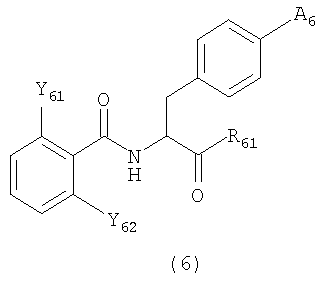
где R61 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода,
А6 представляет любую формулу из следующих формул (6-1)-(6-6)






и Y61 и Y62 представляют комбинацию (Cl, Cl).
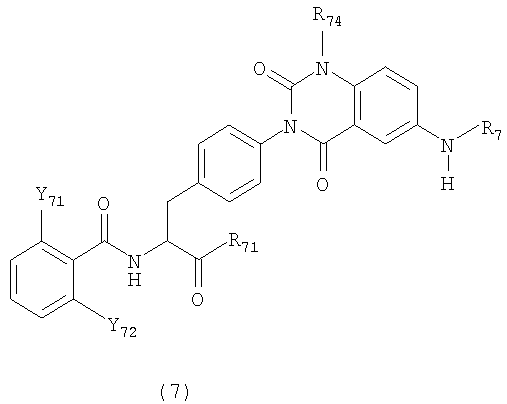
где R71 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, морфолиноэтилоксигруппу,
R74 представляет метильную группу,
R7 представляет алкинильную группу, имеющую 3-5 атомов углерода, циклоалкилметальную группу, имеющую 4-6 атомов углерода, циклоалкильную группу, имеющую 3-6 атомов углерода, или пропильную группу, и
Y71 и Y72 представляют комбинацию (Cl, Cl).
R74 представляет метильную группу,
R7 представляет 2-пропинильную группу или циклопропилметильную группу, и
Y71 и Y72 представляют комбинацию (Cl, Cl).
R74 представляет метильную группу,
R7 представляет пропильную группу, и
Y71 и Y72 представляют комбинацию (Cl, Cl).
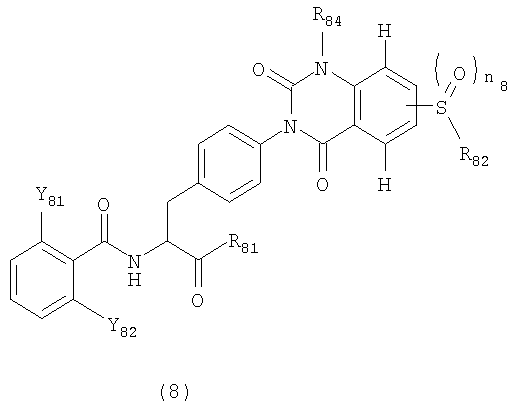
где R81 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода, или гидроксиэтильную группу,
R82 представляет метильную группу,
R84 представляет метильную группу,
n8 представляет целое число от 0 до 2, и
Y81 и Y82 представляют комбинацию (Cl, Cl).
R81 представляет собой гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода.
R82 представляет собой метильную группу,
R84 представляет собой метильную группу,
n8 представляет собой одно из целых числе 0 или 2,
S расположен в шестом положении хиназолиндионового кольца, и
Y81 и Y82 представляют комбинацию (Cl, Cl).
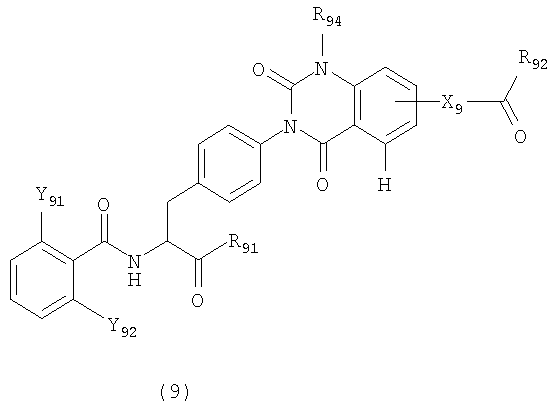
где R91 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода,
R92 представляет гидроксильную группу, алкоксильную группу, имеющую от 1 до 6 атомов углерода, аминогруппу или бензилоксигруппу,
R94 представляет метильную группу,
Х9 представляет атомную связь, -CH2CH2- или -СН=СН-, и
Y91 и Y92 представляют комбинацию (Cl, Cl).
Х9 представляет -СН2СН2- или -СН=СН-, и R92 представляет гидроксильную группу,
или Х9 представляет атомную связь, a R92 представляет бензилоксигруппу,
Х9 расположен в шестом положении хиназолиндионового кольца,
R94 представляет метильную группу, и
Y91 и Y92 представляют комбинацию (Cl, Cl).
Х9 представляет атомную связь, а R92 представляет гидроксильную группу, метоксигруппу или аминогруппу,
Х9 расположен в шестом положении хиназолиндионового кольца,
R94 представляет метильную группу, и
Y91 и Y92 представляют комбинацию (Cl, Cl).

где R101 представляет алкоксильную группу, имеющую 2-6 атомов углерода, или морфолиноэтилоксигруппу,
R10 представляет метильную группу или этильную группу,
R104 представляет метильную группу, и
Y101 и Y102 представляют комбинацию (Cl, Cl).
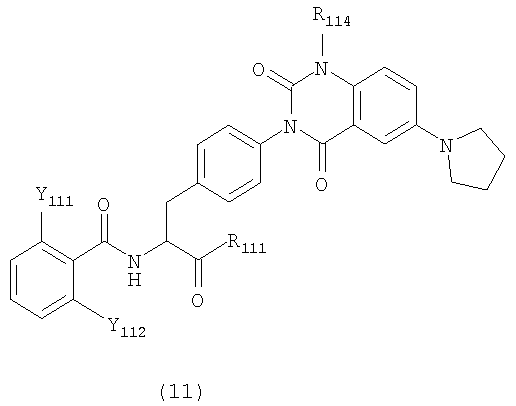
где R111 представляет алкоксильную группу, имеющую 1-6 атомов углерода,
R114 представляет метильную группу, и
Y111 и Y112 представляют комбинацию (Cl, Cl).

где R121 представляет алкоксильную группу, имеющую 1-6 атомов углерода,
R124 представляет метильную группу, и
А представляют любую из следующих формул (12-1) и (12-2)



где R131 представляет алкоксильную группу, имеющую 1-6 атомов углерода,
N(R13a)R13b представляет 1-пирролидинильную группу, и
Y131 и Y132 представляют комбинацию (Cl, Cl).

где R141 представляет гидроксильную группу, алкоксильную группу, имеющую 1-6 атомов углерода,
R144 представляет метильную группу,
гидроксильная группа на хиназолиндионовом кольце расположена в шестом или седьмом положении кольца, и
Y141 и Y142 представляют комбинацию (Cl, Cl).
R144 представляет метильную группу,
гидроксильная группа расположена в шестом положении хиназолиндионового кольца, и
Y141 и Y142 представляют комбинацию (Cl, Cl).








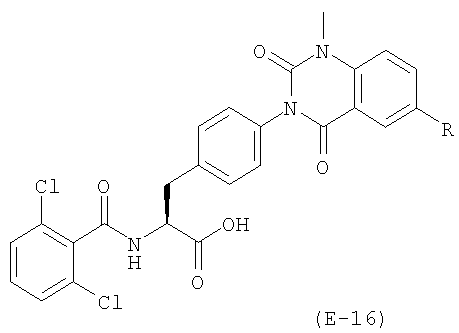










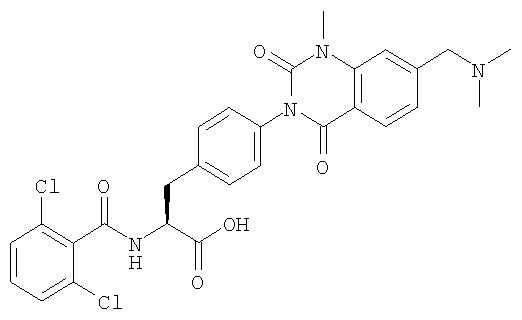
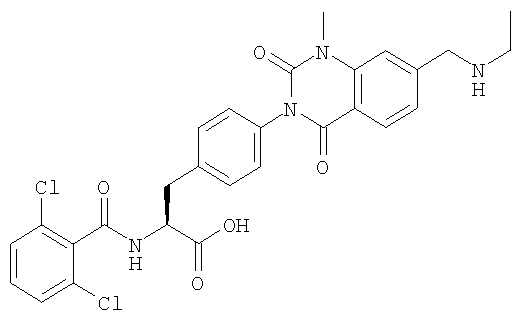


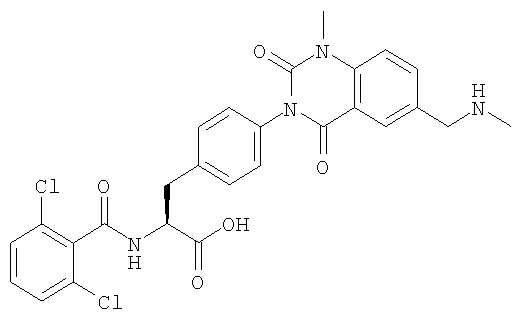


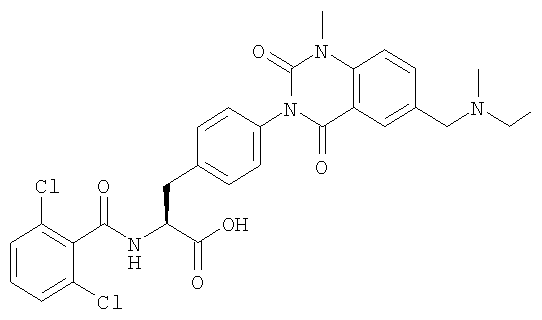

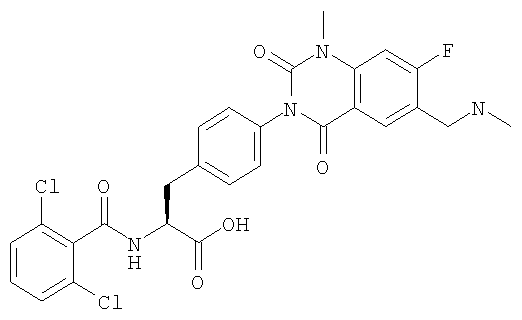


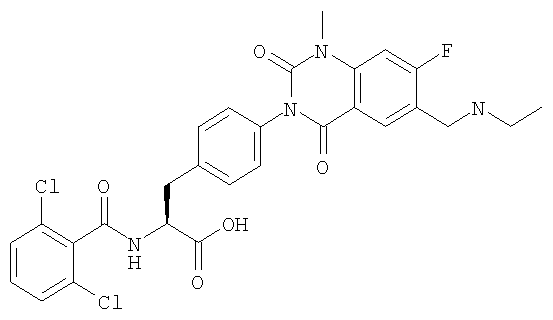

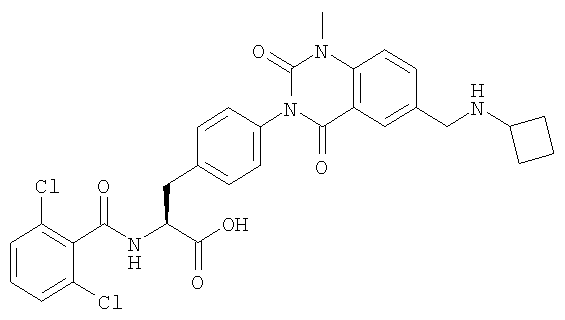
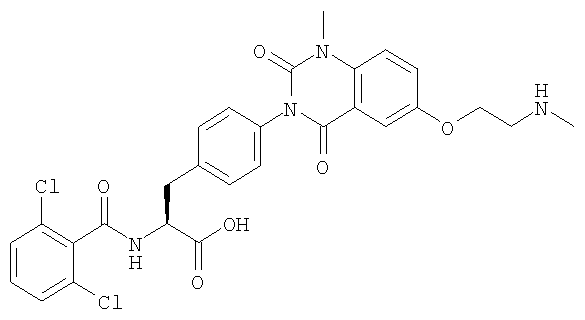
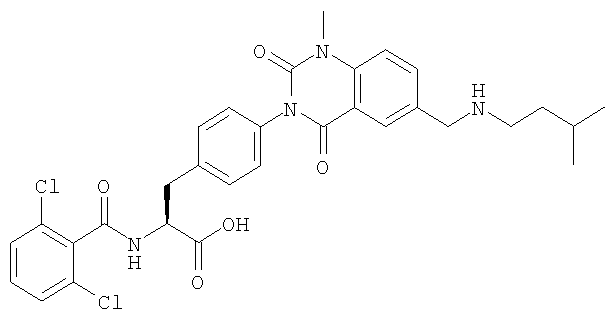




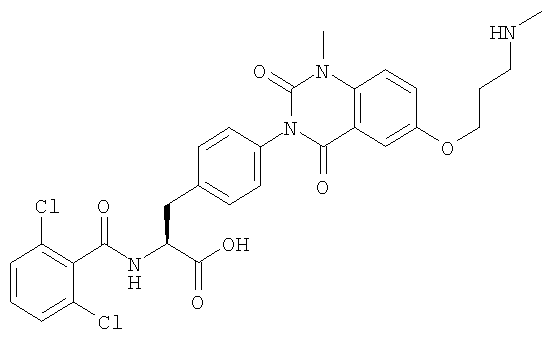




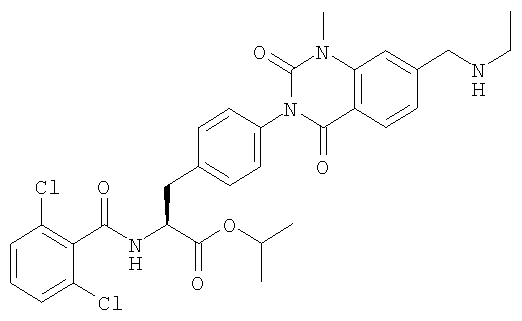


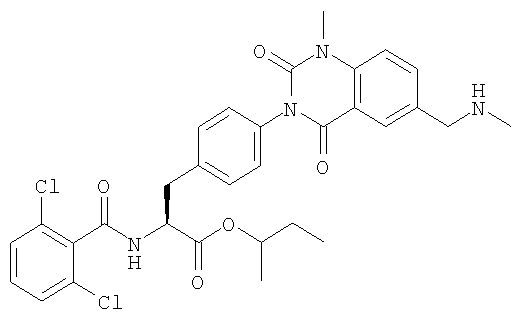

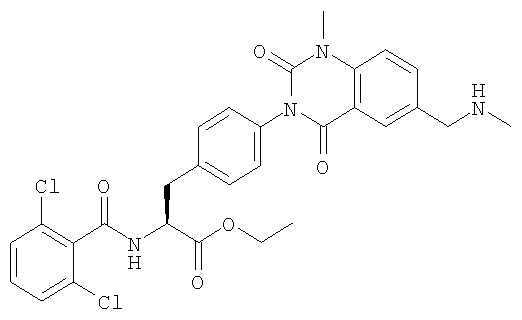







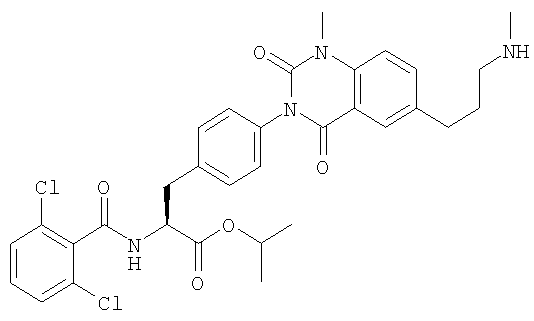
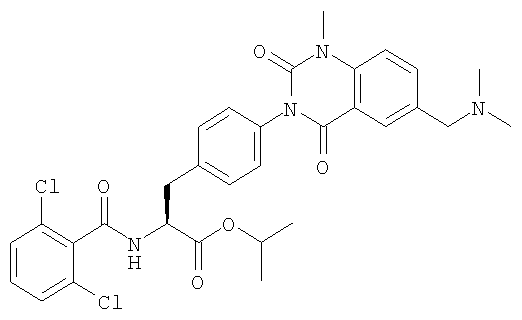


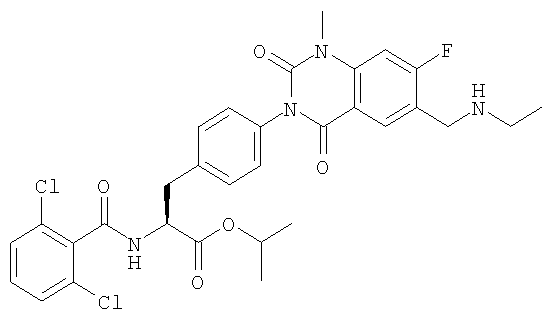





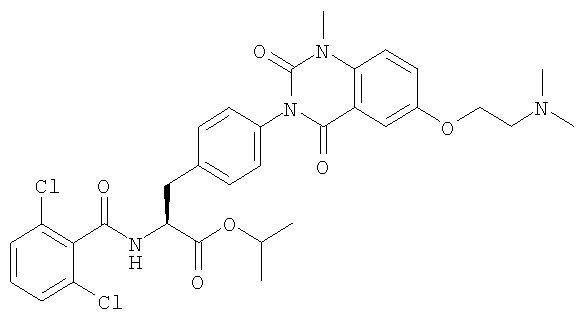
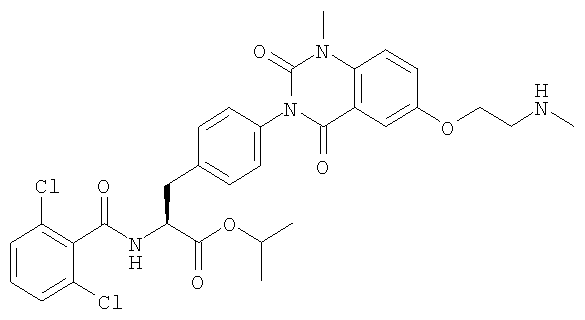






Комментарии