Производное дигидропиридазин-3,5-диона - RU2662832C2
Код документа: RU2662832C2
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к производному дигидропиридазин-3,5-диона или его соли, или сольвату соединения или сольвату соли соединения. Настоящее изобретение также относится к лекарственному препарату, фармацевтической композиции, ингибитору натрий-зависимого транспортера фосфата и профилактическому и/или терапевтическому средству для гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности, содержащему производное дигидропиридазин-3,5-диона или его соль, сольват соединение или сольват соли соединения в качестве активного ингредиента, и к способу профилактики и/или лечения.
УРОВЕНЬ ТЕХНИКИ
[0002] Фосфор обнаруживается в любой клетке и составляет 1% от массы тела человека. Этот элемент играет важную роль в поддержании жизни, а именно в энергетическом метаболизме клеток. Концентрация фосфора в крови определяется его абсорбцией из желудочно-кишечного тракта и экскрецией из почек, так же как и костеобразованием и костной резорбцией, и устанавливается на постоянном уровне. Абсорбция фосфора в желудочно-кишечном тракте осуществляется в основном натрий-зависимым транспортером фосфата NaPi-IIb (SLC34A2) (непатентные документы 1 и 2). Фосфор в крови фильтруется почечными клубочками и реабсорбируется в необходимых количествах, главным образом, NaPi-IIa (SLC34A1) и NaPi-IIc (SLC34A3) в почечном канальце (непатентные документы 1 и 3). Почки играют очень важную роль в регуляции фосфора in vivo. У пациентов с конечной стадией почечной недостаточности и у диализных пациентов с нарушенными функциями почек, фосфор накапливается в организме, что приводит к росту концентрации фосфора в крови, то есть, к гиперфосфатемии.
[0003] Гиперфосфатемия служит причиной кальцификации мягких тканей. В частности, считается, что кальцификация сосудов обуславливает дисфункцию сердца, приводящую к смерти пациента. Гиперфосфатемия также служит причиной гиперсекреции паратиреоидных гормонов, то есть, вторичного гиперпаратиреоза, и вызывает поражения костей. Поэтому, гиперфосфатемия рассматривается в качестве проблематичного фактора, который ухудшает прогноз и качество жизни пациентов с конечной стадией почечной недостаточности и диализных пациентов.
[0004] В современных методах лечения гиперфосфатемии применяют адсорбенты фосфора с целью подавления абсорбции фосфора в желудочно-кишечном тракте. В качестве адсорбентов фосфора используют несодержащие металл полимерные адсорбенты, типичным примером которых является севеламера гидрохлорид, препараты солей кальция, типичным примером которых является осажденный карбонат кальция, или металлические адсорбенты, типичным примером которых является карбонат лантана. Однако сообщалось, что эти адсорбенты обладают нежелательным побочным действием, таким как нарушения со стороны желудочно-кишечного тракта, включающие констипацию и диарею, гиперкальцемия, вызываемая ростом концентрации кальция в сыворотке, и in vivo накопление металла. Кроме того, эти адсорбенты требуют суточного введения в количестве нескольких грамм и, в силу этого, у пациентов могут возникать проблемы с несоблюдение режима приема лекарственного средства. Соответственно, существует большая потребность в разработке новой терапии гиперфосфатемии, в которой были бы решены проблемы, связанные с адсорбентами фосфора.
[0005] Ингибирование NaPi-IIb, который играет важную роль в абсорбции фосфора в желудочно-кишечном тракте, может подавлять абсорбцию фосфора в желудочно-кишечном тракте, также как это делают адсорбенты фосфора, снижая концентрацию фосфора в крови (непатентные документы 2 и 4). Кроме того, PiT-1 (SLC20A1) и PiT-2 (SLC20A2), которые так же, как и NaPi-IIb, являются натрий-зависимыми транспортерами фосфата, частично влияют на абсорбцию фосфора в желудочно-кишечном тракте (непатентные документы 1 и 6). Поэтому, можно ожидать, что соединение, которое ингибирует NaPi-IIb, PiT-1 и PiT-2, будет оказывать более сильный ингибирующий эффект на абсорбцию фосфора и более эффективно снижать концентрацию фосфора в крови по сравнению с ингибитором только для NaPi-IIb. При этом, подавление абсорбции фосфора путем ингибирования этих натрий-зависимых транспортеров фосфата основано на механизме действия, который отличается от механизма действия используемых в настоящее время адсорбентов фосфора. Поэтому, можно ожидать, что ингибитор натрий-зависимого транспортера фосфата будет служить в качестве нового профилактического и/или терапевтического средства для гиперфосфатемии вместо традиционных адсорбентов фосфора. Кроме того, ожидается, что ингибитор натрий-зависимого транспортера фосфата будет оказывать профилактическое и/или терапевтическое действие на вторичный гиперпаратиреоз и хроническую почечную недостаточность в результате снижения концентрации фосфора в крови (непатентный документ 5). К настоящему времени в качестве ингибиторов NaPi-IIb были предложены NTX1942 (патентный документ 1) и соединения, описанные в патентных документах 2 и 4. Кроме того, в патентном документе 3 было упомянуто соединение, имеющее скелет пиридазина, которое может применяться для лечения анемии, ишемии и гипоксии за счет ингибирующей активности этого соединения в отношении гидроксилазы индуцируемого гипоксией фактора (HIF).
ПЕРЕЧЕНЬ ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0006] Патентный документ 1: WO2012/006475
Патентный документ 2: WO2011/136269
Патентный документ 3: WO2011/048611
Патентный документ 4: WO2013/062065
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0007] Непатентный документ 1: J Pharm Sci. 2011 Sep; 100 (9): 3719-30;
Непатентный документ 2: J Am Soc Nephrol. 2009 Nov; 20 (11): 2348-58;
Непатентный документ 3: Pflugers Arch. 2004 Feb; 447(5): 763-7;
Непатентный документ 4: Am J Physiol Renal Physiol. 2011 Nov; 301 (5): F1105-13;
Непатентный документ 5: Kidney Int. 2003 Nov; 64 (5): 1653-61; и
Непатентный документ 6: Mol Aspects Med. 2013 Apr-Jun; 34 (2-3): 386-95.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
[0008] Существует большая потребность в разработке новой терапии гиперфосфатемии, в которой были бы решены проблемы, возникающие при применении адсорбентов фосфора.
РЕШЕНИЕ ЗАДАЧИ
[0009] Авторы настоящего изобретения провели необходимые исследования в свете описанных выше проблем и в результате создали настоящее изобретение, в процессе работы над которым было впервые обнаружено, что соединение, представленное приведенной ниже формулой (I), которое в значительной мере отличается по химическому строению от известных в технике ингибиторов NaPi-IIb, обладает исключительным ингибирующим действием в отношении NaPi-IIb, ингибирующим действием в отношении PiT-1 и/или ингибирующим действием в отношении PiT-2, может применяться для профилактики и/или лечения гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности и обладает исключительным фармакологическим воздействием на эти заболевания. В частности, один аспект настоящего изобретения предлагает приведенные ниже соединения или их соли, или сольваты соединений или сольваты их солей.
[0010] Один вариант осуществления настоящего изобретения предлагает следующие соединения (1-1) - (1-55):
[0011] (1-1) Соединение, представленное формулой (I), или его соль, или сольват соединения или сольват соли соединения:
[0012]
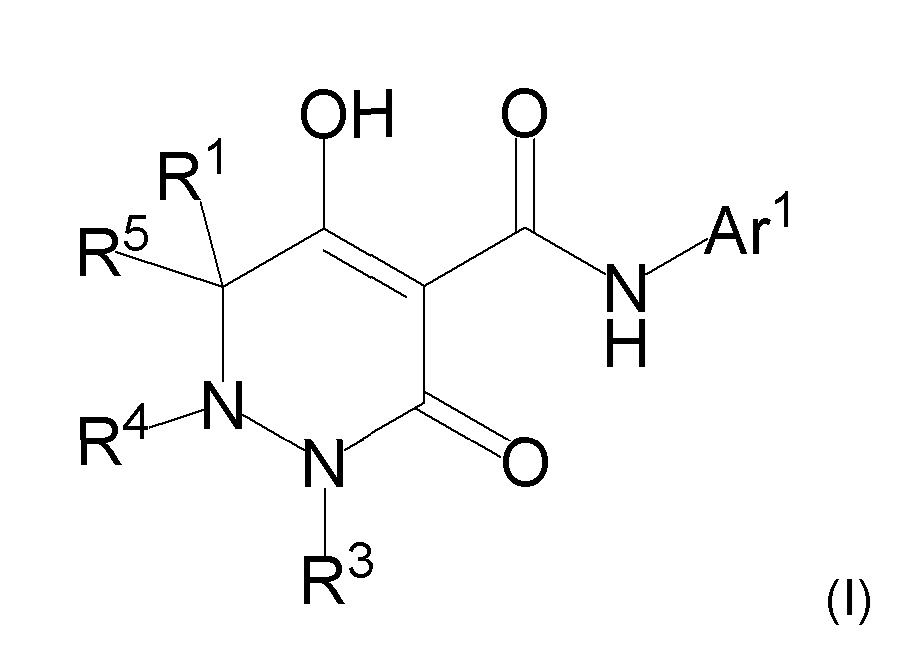
[0013] где R1, R4, и R5 определены в одном из следующих пунктов (1) - (3):
(1) R1 представляет собой атом водорода или C1-10 алкил;
R4 представляет собой атом водорода, C1-4 алкил, необязательно замещенный одним или более заместителями Rf, C6-10 арил, необязательно замещенный одним или более заместителями Rg, (C1-6 алкил)карбонил, (C6-10 арил)карбонил, группу -C(O)NR37R38, C3-7 циклоалкил или 5-8 членный гетероциклоалкил; и
R5 представляет собой атом водорода или C1-4 алкил;
(2) R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо; и
R4 определен выше; и
(3) R1 представляет собой атом водорода или линейный C1-10 алкил;
R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, образуют 5-8 членное насыщенное гетероциклическое кольцо, где насыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями R2;
R3 представляет собой C1-10 алкил, необязательно замещенный одним или более заместителями Rh, или R3 представляет собой C1-4 алкил, замещенный Re;
R37 и R38 каждый независимо выбирают из атома водорода и C1-3 алкил;
каждый R2 независимо выбирают из C1-5 алкила и атома галогена; и/или
два или более заместителей R2 на 5-8 членном насыщенном гетероциклическом кольце могут вместе образовывать C1-5 алкилен, который связывает кольцевые атомы, к которым они присоединены;
каждый Rh независимо выбирают из атома галогена, (C1-4 алкокси)карбонила и группы -(O(CH2)a)b-C1-4 алкокси, где a представляет собой целое число, выбранное в диапазоне от 2 до 4, и b представляет собой целое число, выбранное в диапазоне от 1 до 4;
Re представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ra, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями Ra;
каждый Rf независимо выбирают из атома галогена, гидрокси, циано, карбокси, (C1-6 алкокси)карбонила, C1-6 алкокси и C6-10 арила, необязательно замещенного одним или более заместителями Rg;
каждый Rg независимо выбирают из атома галогена, C1-6 алкила, C2-6 алкинила, и C1-6 алкокси, где алкильная, алкинильная и алкоксильная группы каждая независимо замещена одним или более заместителями, выбранными из гидрокси и циано;
каждый Ra независимо выбирают из атома галогена, гидрокси, нитро, циано, (C1-4 алкокси)карбонила, 3-10 членного гетероциклоалкилокси (гетероциклоалкилоксильная группа, необязательно замещена с помощью необязательно замещенного C1-4 алкоксизамещенного C1-4 алкила), C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкенила, необязательно замещенного одним или более заместителями R15, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, C1-4 алкилтио, необязательно замещенного одним или более заместителями R13, группы -(O(CH2)q1)q2-NR41R42 (где q1 представляет собой целое число, выбранное в диапазоне от 1 до 4, и q2 представляет собой целое число, выбранное в диапазоне от 2 до 6, группы -(O(CH2)r1)r2-C(O)NR43R44 (где r1 представляет собой целое число, выбранное в диапазоне от 1 до 4, и r2 представляет собой целое число, выбранное в диапазоне от 1 до 4), группы -(O(CH2)s1)s2-NR45-C(O)R46 (где s1 и s2 каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4), группы -C(O)NR47R48, пиридинила, пирролила, группы -NR49R50 и группы -(O(CH2)y1)y2-O-CH2-C(O)NR51R52 (где y1 представляет собой целое число, выбранное в диапазоне от 1 до 4, и y2 представляет собой целое число, выбранное в диапазоне от 1 до 4);
R10, R11, R12, R13 и R15 каждый независимо выбирают из атома галогена, гидрокси, карбокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-4 алкокси)C1-6 алкокси, (C1-4 алкокси)карбонила, группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4), C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами, 3-10 членного гетероциклоалкила, 5-10 членного гетероарила и группы -NR39R40, где 3-10 членная гетероциклоалкильная группа необязательно замещена одним или более заместителями, выбранными из оксо, атома галогена, C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами), (C1-4 алкокси)C1-4 алкила (где алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), C1-4 алкокси, (C1-4 алкокси)карбонила, C1-4 алкилтио, морфолино, (C1-3 алкил)сульфонила и -C(O)NR53R54;
Ar1 представляет собой C6-10 арил или 5-10 членный гетероарил, где арильная и гетроарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc, и Rd каждый независимо выбирают из необязательно C1-4 алкоксизамещенного C1-5 алкокси, атома галогена, C1-10 алкила, необязательно замещенного одним или более атомами галогена, группы -SF5, циано, гидрокси, 5-10 членного гетероциклоалкила, необязательно замещенного одним или более заместителями R14, C6-10 арила, необязательно замещенного одним или более заместителями R14 и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R14;
каждый R14 независимо выбирают из атома галогена, оксо, циано, нитро, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, необязательно замещенного одним или более атомами галогена, (C1-6 алкокси)карбонила, группы -NR27R28, группы -SO2NR35R36, C1-4 алкилтио и 5-10 членного гетероциклоалкила;
R27 и R28 каждый независимо выбирают из атома водорода и C1-4 алкила, необязательно замещенного (C1-4 алкокси)карбонилом;
R35 и R36 каждый независимо выбирают из атома водорода и C1-4 алкила;
R39 представляет собой атом водорода или необязательно C1-6 алкоксизамещенный C1-6 алкил;
R40 представляет собой атом водорода, необязательно C1-6 алкоксизамещенный C1-6 алкил, (C1-4 алкокси)карбонил)C1-6 алкил, гидроксизамещенный C1-6 алкил, группу -(CH2)u-NR55R56 (где u представляет собой целое число, выбранное в диапазоне от 1 до 4), группу -CH((CH2)v1COOR57)-(CH2)v2-COOR57 (где v1 представляет собой целое число, выбранное в диапазоне от 0 до 2, и v2 представляет собой целое число, выбранное в диапазоне от 1 до 3), группу -(CH2)w-SO3H (где w представляет собой целое число, выбранное в диапазоне от 1 до 4), группу -(CH2)x1-CH(COOH)-(CH2)x2-SO3H (где x1 представляет собой целое число, выбранное в диапазоне от 0 до 2, и x2 представляет собой целое число, выбранное в диапазоне от 1 до 3), 3-6 членный оксациклоалкил или группу -(CH2)t1-O-(CH2)t2-C(O)NR58R59 (где t1 и t2 каждый независимо представляет собой целое число, выбранное в диапазоне от 1 до 3);
R41 представляет собой атом водорода или C1-3 алкил;
R42 представляет собой C1-8 алкил, замещенный одной или более гидроксильными группами, или (C1-3 алкокси)C1-4 алкил;
R43 представляет собой атом водорода или C1-3 алкил;
R44 представляет собой C1-8 алкил, замещенный одной или более гидроксильными группами, или
R43 и R44 вместе с атомом азота, к которому они присоединены, могут образовывать морфолино;
R45 представляет собой атом водорода или C1-3 алкил;
R46 представляет собой C1-6 алкил, замещенный одной или более гидроксильными группами;
R47 представляет собой C1-3 алкил;
R48 представляет собой (C1-3 алкокси)C1-4 алкил;
R49 представляет собой атом водорода и C1-4 алкил;
R50 представляет собой -(CH2)z-NR60R61 (z представляет собой целое число, выбранное в диапазоне от 1 до 4, R60 представляет собой атом водорода или C1-4 алкил, и R61 представляет собой (C1-3 алкокси)C1-4 алкил, или R60 и R61 вместе с атомом азота, к которому они присоединены, могут образовывать морфолино);
R51 представляет собой атом водорода или C1-4 алкил;
R52 представляет собой C1-8 алкил, замещенный одной или более гидроксильными группами;
R53 и R54 каждый независимо выбирают из атома водорода и C1-4 алкила;
R55 представляет собой атом водорода или C1-4 алкил;
R56 представляет собой (C1-4 алкил)карбонил;
R57 представляет собой атом водорода или C1-4 алкил;
R58 представляет собой атом водорода или C1-3 алкил; и
R59 представляет собой C1-8 алкил, замещенный одной или более гидроксильными группами.
[0014] (1-2) Соединение по пункту (1-1) или его соль, или сольват соединения или сольват соли соединения, где
каждый Ra независимо выбирают из атома галогена, гидрокси, нитро, циано, (C1-4 алкокси)карбонила, 3-10 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкенила, необязательно замещенного одним или более заместителями R15, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, и C1-4 алкилтио, необязательно замещенного одним или более заместителями R13;
R10, R11, R12, R13, и R15 каждый независимо выбирают из атома галогена, гидрокси, карбокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-4 алкокси)карбонила, группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4), C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами, 3-10 членного гетероциклоалкила, 5-10 членного гетероарила и группы -NR39R40, где 3-10 членная гетероциклоалкильная группа необязательно замещена одним или более заместителями, выбранными из оксо, атома галогена и C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами); и
R39 и R40 каждый независимо выбирают из атома водорода и необязательно C1-6 алкоксизамещенного C1-6 алкила.
[0015] (1-3) Соединение по пункту (1-1) или (1-2) или его соль, или сольват соединения или сольват соли соединения, где
3-10 членный гетероциклоалкилокси при определении Ra представляет собой 3-6 членный гетероциклоалкилокси;
3-10 членный гетероциклоалкил при определении R10, R11, R12, R13 и R15 представляет собой 3-6 членный гетероциклоалкил; и
5-10 членный гетероарил при определении R10, R11, R12, R13 и R15 представляет собой 5-6 членный гетероарил.
[0016] (1-4) Соединение по любому одному из пунктов (1-1) - (1-3) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой необязательно C1-4 алкоксизамещенный C1-5 алкокси или атом галогена;
Rc представляет собой атом галогена, C1-10 алкил, необязательно замещенный одним или более атомами галогена, или группу -SF5; и
Rd представляет собой циано, гидрокси, атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, 5-10 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R14, C6-10 арил, необязательно замещенный одним или более заместителями R14, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями R14.
[0017] (1-5) Соединение по любому одному из пунктов (1-1) - (1-4) или его соль, или сольват соединения или сольват соли соединения, где
каждый Ra независимо выбирают из атома галогена, нитро, циано, (C1-4 алкокси)карбонила, 3-6 членного гетероциклоалкилокси (гетероциклоалкилоксильная группа необязательно замещена с помощью необязательно замещенного C1-4 алкоксизамещенного C1-4 алкила), C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, C1-4 алкилтио, необязательно замещенного одним или более заместителями R13, группы -(O(CH2)q1)q2-NR41R42, группы -(O(CH2)r1)r2-C(O)NR43R44, группы -(O(CH2)s1)s2-NR45-C(O)R46, группы -C(O)NR47R48, пиридинила, пирролила, группы -NR49R50 и группы -(O(CH2)y1)y2-O-CH2-NR51R52;
R10 представляет собой карбокси, 3-6 членный гетероциклоалкил, C1-6 алкокси, необязательно замещенный одной или более гидроксильными группами, или группу -(O(CH2)o)p-OH;
R11 представляет собой гидрокси, карбокси, 5-6 членный гетероциклоалкил, необязательно замещенный одной или более оксогруппами, C1-6 алкокси, необязательно замещенный одной или более гидроксильными группами, группу -(O(CH2)o)p-OH, C3-6 циклоалкил, необязательно замещенный одной или более гидроксильными группами, или группу -NR39R40;
R12 представляет собой атом галогена, гидрокси, карбокси, C1-6 алкокси, необязательно замещенный одной или более гидроксильными группами, (C1-4 алкокси)C1-6 алкокси, (C1-3 алкокси)карбонил, 3-6 членный гетероциклоалкил, 5-6 членный гетероарил или группу -NR39R40, где 3-6 членная гетероциклоалкильная группа необязательно замещена одним или более заместителями, выбранными из оксо, атома галогена, C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами), (C1-4 алкокси)C1-4 алкила (где алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), C1-4 алкокси, (C1-4 алкокси)карбонила, C1-4 алкилтио, морфолинила, (C1-3 алкил)сульфонила и -C(O)NR53R54;
R13 представляет собой 5-6 членный гетероциклоалкил; и
o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4.
[0018] (1-6) Соединение по любому одному из пунктов (1-1) - (1-5) или его соль, или сольват соединения или сольват соли соединения, где
каждый Ra независимо выбирают из атома галогена, нитро, циано, (C1-4 алкокси)карбонила, 3-6 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, и C1-4 алкилтио, необязательно замещенного одним или более заместителями R13;
каждый R10 независимо выбирают из карбокси, 3-6 членного гетероциклоалкила, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, и группы -(O(CH2)o)p-OH;
каждый R11 независимо выбирают из гидрокси, карбокси, 5-6 членного гетероциклоалкила, необязательно замещенного одной или более оксогруппами, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, группы -(O(CH2)o)p-OH и C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами;
каждый R12 независимо выбирают из атома галогена, гидрокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси)карбонила, 3-6 членного гетероциклоалкила, 5-6 членного гетероарила и группы -NR39R40;
R13 представляет собой 5-6 членный гетероциклоалкил; и
o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4.
[0019] (1-7) Соединение по любому одному из пунктов (1-1) - (1-5) или его соль, или сольват соединения или сольват соли соединения, где каждый Ra независимо выбирают из атома галогена, гидрокси, нитро, циано, C1-6 алкила, (карбокси)C1-8 алкила, (морфолино)C1-4 алкила, [HO-((CH2)oO)p]C1-6 алкила, (C1-6 алкокси)C1-8 алкила, необязательно замещенного одной или более гидроксильными группами, C1-6 алкокси, необязательно замещенного одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, C1-6 алкокси, замещенного одной или более гидроксильными группами, ((C1-3 алкокси)карбонил)C1-3 алкокси, (C1-6 алкокси)C1-8 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси(C1-4 алкокси))C1-4 алкокси, (карбокси)C1-8 алкокси, (3-6 членный гетероциклоалкил)C1-6 алкокси (гетероциклоалкильного фрагмента, необязательно замещенного одним или более заместителями, выбранными из оксо, атома галогена, C1-4 алкила, необязательно замещенного одной или более гидроксильными группами, (C1-4 алкокси)C1-4 алкила (алкоксильного фрагмента, необязательно замещенного одной или более гидроксильными группами), C1-4 алкокси, (C1-4 алкокси)карбонила, C1-4 алкилтио, морфолино, (C1-3 алкил)сульфонила и (ди(C1-3 алкил)амино)карбонил), C1-4 алкокси, замещенного группой -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(3-6 членный оксациклоалкил)-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди((гидрокси)C1-4 алкил)амино]C1-4 алкокси, [N-((C1-3 алкокси)карбонил)C1-3 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, (пиридинил)C1-4 алкокси, (пиримидинил)C1-4 алкокси, (1,2,4-триазолил)C1-4алкокси, [N-(гидрокси)C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди((C1-3 алкокси)C1-4 алкил)амино]C1-6 алкокси, [N,N-ди(C1-3алкил)амино]C1-6 алкокси, [N-[N-(C1-4алкил)карбонил-N-(C1-3алкил)амино]C1-4алкил-N-(C1-3 алкил) амино]C1-4 алкокси, [N-[N-(C1-4алкил)карбонил-амино]C1-4алкил-N-(C1-3 алкил)амино]C1-4 алкокси, группы -(O(CH2)r1)r2-C(O)NR43R44, группы -(O(CH2)q1)q2-NR41R42, C1-4 алкокси, замещенного группой -NH-(CH2)w-SO3H, C1-4 алкокси, замещенного группой -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, групы -(O(CH2)s1)s2-NR45-C(O)R46, группы -C(O)NR47R48, пиридинила, группы -NR49R50, группы -(O(CH2)y1)y2-O-CH2-C(O)NR51R52, (карбокси)C2-6 алкинила, (3-6 членный гетероциклоалкил)C2-6 алкинила, необязательно замещенного одной или более оксогруппами, C2-8 алкинила, необязательно замещенного одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинила, (C1-6 алкокси)C2-8 алкинила, необязательно замещенного одной или более гидроксильными группами, (C3-6 циклоалкил)C2-6 алкинила, необязательно замещенного одной или более гидроксильными группами, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C2-6 алкинила, (C1-3 алкокси)карбонила, (морфолино)C1-4 алкилтио, необязательно замещенного одной или более оксогруппами, 3-6 членного оксациклоалкилокси или 4-6 членного азотсодержащего гетероциклоалкилокси (азотсодержащий гетероциклоалкильный фрагмент необязательно замещен одним заместителем, выбранным из (C1-3 алкокси)C1-4 алкила и C1-3 алкила).
[0020] (1-8) Соединение по любому одному из пунктов (1-1) - (1-7) или его соль, или сольват соединения или сольват соли соединения, где каждый Ra независимо выбирают из атома галогена, гидрокси, циано, C1-6 алкила, (карбокси)C1-8 алкила, (морфолино)C1-4алкила, (C1-6 алкокси)C1-8 алкила, замещенного одной или более гидроксильными группами, C1-6 алкокси, необязательно замещенного одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, (морфолино)C1-6 алкокси (фрагмента морфолино, необязательно замещенного одним или двумя заместителями, выбранными из оксо и C1-3 алкила), (C1-6 алкокси)C1-8 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси(C1-4 алкокси))C1-4 алкокси, (карбокси)C1-8 алкокси, (пирролидинил)C1-4 алкокси (пирролидинильного фрагмента, необязательно замещенного с помощью (C1-3 алкил)C1-4 алкокси), C1-4 алкокси, замещенного группой -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(оксетанил)-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди(C1-3 алкил)амино]C1-6 алкокси, группы -(O(CH2)r1)r2-C(O)NR43R44, группы -(O(CH2)q1)q2-NR41R42, C1-4 алкокси, замещенного группой -NH-(CH2)w-SO3H, C1-4 алкокси, замещенного группой -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, (карбокси)C2-6 алкинила, (морфолино)C2-6 алкинила, C2-8 алкинила, необязательно замещенного одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинила, (C1-6 алкокси)C2-8 алкинила, замещенного одной или более гидроксильными группами, или (C1-3 алкокси)карбонила.
[0021] (1-9) Соединение по любому одному из пунктов (1-1) - (1-8) или его соль, или сольват соединения или сольват соли соединения, где каждый Ra независимо выбирают из атома галогена, гидрокси, циано, C1-3 алкила, (карбокси)C1-8 алкила, (C1-6 алкокси)C1-8 алкила, замещенного одной или более гидроксильными группами, C1-3 алкокси, необязательно замещенного одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, (морфолино)C1-6 алкокси, (C1-6 алкокси)C1-8 алкокси, замещенного одной или более гидроксильными группами, (карбокси)C2-6 алкинила, (морфолино)C2-6 алкинила, C2-8 алкинила, необязательно замещенного одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинила, (C1-6 алкокси)C2-8 алкинила, замещенного одной или более гидроксильными группами, и (C1-3 алкокси)карбонила.
[0022] (1-10) Соединение по любому одному из пунктов (1-1) - (1-9) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой метил, замещенный с помощью Re.
[0023] (1-11) Соединение по любому одному из пунктов (1-1) - (1-10) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой бензил, необязательно замещенный одним или более заместителями Ra на бензольном кольце.
[0024] (1-12) Соединение по любому одному из пунктов (1-1) - (1-11) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой бензил, необязательно замещенный одним-тремя заместителями Ra на бензольном кольце.
[0025] (1-13) Соединение по любому одному из пунктов (1-1) - (1-6), и (1-10) - (1-12) или его соль, или сольват соединения или сольват соли соединения, где Re представляет собой фенил, необязательно замещенный одним-тремя заместителями Ra;
от одного до трех заместителей Ra представляют собой один заместитель, выбранный из Ri, Rj и Rk, два заместителя, выбранные из комбинации Ri и Rj, Ri и Rk, и Rj и Rk, или три заместителя Ri, Rj и Rk;
Ri представляет собой атом галогена или C1-3 алкокси;
Rj представляет собой атом галогена, нитро, или циано; и
Rk представляет собой гидрокси, атом галогена, (C1-4 алкокси)карбонил, 5-10 членный гетероциклоалкилокси (гетероциклоалкилоксильную группу, необязательно замещенную с помощью необязательно замещенного C1-4 алкоксизамещенного C1-4 алкила), C1-10 алкил, необязательно замещенный одним или более заместителями R10, C2-10 алкенил, необязательно замещенный одним или более заместителями R15, C2-10 алкинил, необязательно замещенный одним или более заместителями R11, C1-8 алкокси, необязательно замещенный одним или более заместителями R12, C1-4 алкилтио, необязательно замещенный одним или более заместителями R13, группу -(O(CH2)q1)q2-NR41R42, группу -(O(CH2)r1)r2-C(O)NR43R44, группу -(O(CH2)s1)s2-NR45-C(O)R46, группу -C(O)NR47R48, пиридинил, пирролил, группу -NR49R50 или группу -(O(CH2)y1)y2-O-CH2-C(O)NR51R52.
[0026] (1-14) Соединение по пункту (1-13) или его соль, или сольват соединения или сольват соли соединения, где
Rk представляет собой гидрокси, атом галогена, (C1-4 алкокси)карбонил, 3-6 членный гетероциклоалкилокси (гетероциклоалкилоксильную группу, необязательно замещенную с помощью необязательно замещенного C1-4 алкоксизамещенного C1-4 алкила), C1-10 алкил, необязательно замещенный одним или более заместителями R10, C2-10 алкинил, необязательно замещенный одним или более заместителями R11, C1-8 алкокси, необязательно замещенный одним или более заместителями R12, C1-4 алкилтио, необязательно замещенный одним или более заместителями R13, группу -(O(CH2)q1)q2-NR41R42, группу -(O(CH2)r1)r2-C(O)NR43R44, группу -(O(CH2)s1)s2-NR45-C(O)R46, группу -C(O)NR47R48, пиридинил, пирролил, группу -NR49R50 или группу -(O(CH2)y1)y2-O-CH2-C(O)NR51R52;
R10 представляет собой карбокси, гидрокси, морфолинил, C1-6 алкокси, необязательно замещенный одной или более гидроксильными группами, или группу -(O(CH2)o)p-OH;
R11 представляет собой гидрокси, карбокси, морфолинил, необязательно замещенный одной или более оксогруппами, C1-6 алкокси, необязательно замещенный одной или более гидроксильными группами, группу -(O(CH2)o)p-OH, C3-6 циклоалкил, необязательно замещенный одной или более гидроксильными группами, или группу -NR39R40;
R12 представляет собой атом галогена, гидрокси, карбокси, C1-6 алкокси, необязательно замещенный одной или более гидроксильными группами, (C1-4 алкокси)C1-6 алкокси, (C1-3 алкокси)карбонил, 3-6 членный гетероциклоалкил, 5-6 членный гетероарил, содержащий один атом азота, или группу -NR39R40,
где 3-6 членная гетероциклоалкильная группа, необязательно замещена одним или более заместителями, выбранными из оксо, атома галогена, C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами), (C1-4 алкокси)C1-4 алкила (где алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), C1-4 алкокси, (C1-4 алкокси)карбонила, C1-4 алкилтио, морфолинила, (C1-3 алкил)сульфонила и -C(O)NR53R54;
R13 представляет собой морфолинил; и
o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4.
[0027] (1-15) Соединение по любому одному из пунктов (1-1) - (1-6) и (1-10) - (1-13) или его соль, или сольват соединения или сольват соли соединения,
где Re представляет собой фенил, необязательно замещенный одним-тремя заместителями Ra;
от одного до трех заместителей Ra представляют собой один заместитель, выбранный из Ri, Rj и Rk, два заместителя, выбранные из комбинации Ri и Rj, Ri и Rk, и Rj и Rk, или три заместителя Ri, Rj и Rk;
Ri представляет собой атом галогена или C1-3 алкокси;
Rj представляет собой атом галогена, нитро или циано; и
Rk представляет собой гидрокси, атом галогена, (C1-4 алкокси)карбонил, 5-10 членный гетероциклоалкилокси, C1-10 алкил, необязательно замещенный одним или более заместителями R10, C2-10 алкенил, необязательно замещенный одним или более заместителями R15, C2-10 алкинил, необязательно замещенный одним или более заместителями R11, C1-8 алкокси, необязательно замещенный одним или более заместителями R12, или C1-4 алкилтио, необязательно замещенный одним или более заместителями R13.
[0028] (1-16) Соединение по пункту (1-14) или (1-15) или его соль, или сольват соединения или сольват соли соединения,
где Rk представляет собой гидрокси, атом галогена, (C1-4 алкокси)карбонил, 3-6 членный гетероциклоалкилокси, C1-10 алкил, необязательно замещенный одним или более заместителями R10, C2-10 алкинил, необязательно замещенный одним или более заместителями R11, C1-8 алкокси, необязательно замещенный одним или более заместителями R12, или C1-4 алкилтио, необязательно замещенный одним или более заместителями R13;
каждый R10 независимо выбирают из гидрокси, карбокси, морфолинила, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, и группы -(O(CH2)o)p-OH;
каждый R11 независимо выбирают из гидрокси, карбокси, морфолинила, необязательно замещенного одной или более оксогруппами, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, группы -(O(CH2)o)p-OH, и C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами;
каждый R12 независимо выбирают из атома галогена, гидрокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси)карбонила, 3-6 членного гетероциклоалкила, пиридинила, пирролила и группы -NR39R40;
R13 представляет собой морфолинил; и
o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4.
[0029] (1-17) Соединение по пункту (1-13) или (1-14) или его соль, или сольват соединения или сольват соли соединения, где Rk представляет собой атом галогена, гидрокси, C1-6 алкил, (карбокси)C1-8 алкил, (морфолино)C1-4 алкил, [HO-((CH2)oO)p]C1-6 алкил, (C1-6 алкокси)C1-8 алкил, необязательно замещенный одной или более гидроксильными группами, C1-6 алкокси, необязательно замещенный одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, C1-6 алкокси, замещенный одной или более гидроксильными группами, ((C1-3 алкокси)карбонил)C1-3 алкокси, (C1-6 алкокси)C1-8 алкокси, необязательно замещенный одной или более гидроксильными группами, (C1-3 алкокси(C1-4 алкокси))C1-4 алкокси, (карбокси)C1-8 алкокси, (3-6 членный гетероциклоалкил)C1-6 алкокси (гетероциклоалкильный фрагмент содержит от одного до трех гетероатомов, выбранных из O или N, и необязательно замещен одним или более заместителями, выбранными из оксо, атома галогена, C1-4 алкила (где алкильный фрагмент необязательно замещен одной или более гидроксильными группами), (C1-4 алкокси)C1-4 алкил (алкоксильный фрагмент, необязательно замещенный одной или более гидроксильными группами), C1-4 алкокси, (C1-4 алкокси)карбонил, C1-4 алкилтио, морфолино, (C1-3 алкил)сульфонил и (ди(C1-3 алкил)амино)карбонил), C1-4 алкокси, замещенный группой -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(3-6 членный оксациклоалкил)-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди((гидрокси)C1-4 алкил)амино]C1-4 алкокси, [N-((C1-3 алкокси)карбонил)C1-3 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, (пиридинил)C1-4 алкокси, (пиримидинил)C1-4 алкокси, (1,2,4-триазолил)C1-4 алкокси, [N-(гидрокси)C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди(C1-3 алкокси(C1-3 алкил))амино]C1-6 алкокси, [N,N-ди(C1-3алкил)амино]C1-6алкокси, [N-[N-(C1-4 алкил)карбонил-N-(C1-3 алкил)амино]C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, [N-[N-(C1-4 алкил)карбонил-амино]C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, группу -(O(CH2)r1)r2-C(O)NR43R44, группу -(O(CH2)q1)q2-NR41R42, C1-4 алкокси, замещенный группой -NH-(CH2)w-SO3H, C1-4 алкокси, замещенный группой -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, группу -(O(CH2)s1)s2-NR45-C(O)R46, группу -C(O)NR47R48, пиридинил, группу -NR49R50, группу -(O(CH2)y1)y2-O-CH2-C(O)NR51R52, (карбокси)C2-8 алкинил, (3-6 членный гетероциклоалкил)C2-6 алкинил, необязательно замещенный одной или более оксогруппами, C2-8 алкинил, необязательно замещенный одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинил, (C1-6 алкокси)C2-8 алкинил, необязательно замещенный одной или более гидроксильными группами, (C3-6 циклоалкил)C2-6 алкинил, необязательно замещенный одной или более гидроксильными группами, (C1-3 алкокси)карбонил, (морфолино)C1-4 алкилтио, 3-6 членный оксациклоалкилoокси или 3-6 членный азотсодержащий гетероциклоалкилокси (азотсодержащий гетероциклоалкильный фрагмент необязательно замещенный одним заместителем, выбранным из (C1-3 алкокси)C1-4 алкила и C1-3 алкила).
[0030] (1-18) Соединение по любому одному из пунктов (1-13), (1-14) и (1-17) или его соль, или сольват соединения или сольват соли соединения, где Rk представляет собой гидрокси, атом галогена, C1-6 алкил, (карбокси)C1-8 алкил, (морфолино)C1-4 алкил, (C1-6 алкокси)C1-8 алкил, замещенный одной или более гидроксильными группами, C1-6 алкокси, необязательно замещенный одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, (морфолино)C1-6 алкокси, (C1-6 алкокси)C1-8 алкокси, необязательно замещенный одной или более гидроксильными группами, (C1-3 алкокси(C1-4 алкокси))C1-4 алкокси, (карбокси)C1-8 алкокси, (пирролидинил)C1-4 алкокси (пирролидинильный фрагмент, замещенный с помощью (C1-3 алкил)C1-4 алкокси), C1-4 алкокси, замещенный группой -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(оксетанил)-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди(C1-3 алкил)амино]C1-6 алкокси, группу -(O(CH2)r1)r2-C(O)NR43R44, группу -(O(CH2)q1)q2-NR41R42, C1-4 алкокси, замещенный группой -NH-(CH2)w-SO3H, C1-4 алкокси, замещенный группой -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, (карбокси)C2-8 алкинил, (морфолино)C2-6 алкинил, C2-8 алкинил, необязательно замещенный одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинил, (C1-6 алкокси)C2-8 алкинил, замещенный одной или более гидроксильными группами, или (C1-3 алкокси)карбонил.
[0031] (1-19) Соединение по любому одному из пунктов (1-13) - (1-18) или его соль, или сольват соединения или сольват соли соединения, где Rk представляет собой гидрокси, атом галогена, C1-6 алкил, (карбокси)C1-8 алкил, (C1-6 алкокси)C1-8 алкил, замещенный одной или более гидроксильными группами, C1-3 алкокси, необязательно замещенный одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, (морфолино)C1-6 алкокси, (C1-6 алкокси)C1-8 алкокси, замещенный одной или более гидроксильными группами, (карбокси)C2-8 алкинил, (морфолино)C2-6 алкинил, C2-8 алкинил, необязательно замещенный одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинил, (C1-6 алкокси)C2-8 алкинил, замещенный одной или более гидроксильными группами, или (C1-3 алкокси)карбонил.
(1-20) Соединение по любому одному из пунктов (1-1) - (1-19) или его соль, или сольват соединения или сольват соли соединения,
где R1, R4, и R5 определены в одном из следующих пунктов (1) - (3):
(1) R1 представляет собой атом водорода или C1-6 алкил;
R4 представляет собой C1-4 алкил, необязательно замещенный одним или более атомами галогена, или фенил; и
R5 представляет собой атом водорода или C1-4 алкил;
(2) R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо; и
R4 определен выше; и
(3) R1 представляет собой атом водорода или линейный C1-6 алкил;
R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, образуют 5-8 членное насыщенное гетероциклическое кольцо.
[0032] (1-21) Соединение по любому одному из пунктов (1-1) - (1-3), (1-10) - (1-12), и (1-20) или его соль, или сольват соединения или сольват соли соединения, где
R1, R4, и R5 определены в следующих пунктах (1) или (2):
(1) R1 выбирают из C1-6 алкила;
R4 представляет собой необязательно галогензамещенный C1-4 алкил или фенил; и
R5 представляет собой атом водорода или C1-4 алкил; или
(2) R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо; и
R4 определен выше;
R3 представляет собой C1-4 алкил, замещенный с помощью Re;
Re представляет собой фенил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена, C2-6 алкинила, необязательно замещенного одним или более заместителями R11, C1-6 алкокси, необязательно замещенного одним или более заместителями R12, 3-6 членного гетероциклоалкилокси (гетероциклоалкилоксильной группы, необязательно замещенной с помощью необязательно замещенного C1-4 алкоксизамещенного C1-4 алкила), группы -(O(CH2)q1)q2-NR41R42, группы -(O(CH2)r1)r2-C(O)NR43R44, группы -(O(CH2)s1)s2-NR45-C(O)R46, группы -C(O)NR47R48, пиридинила, пирролила, группы -NR49R50 и группы -(O(CH2)y1)y2-O-CH2-C(O)NR51R52;
R11 и R12 каждый независимо выбирают из атом галогена, гидрокси, карбокси, C1-6алкокси, необязательно замещенного одним или более гидрокси, (C1-4 алкокси)C1-6 алкокси, 3-6 членного гетероциклоалкила, 5-6 членного гетероарила и группы -NR39R40, где 3-6 членная гетероциклоалкиьная группа необязательно замещена одним или двумя заместителями, выбранными из оксо, атома галогена, C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами), (C1-4 алкокси)C1-4 алкила (где алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), C1-4 алкокси, (C1-4 алкокси)карбонила, C1-4 алкилтио, морфолино, (C1-3 алкил)сульфонила и -C(O)NR53R54;
Ar1 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc, и Rd;
Rb, Rc и Rd каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, фенила, необязательно замещенного одним или более заместителями R14, и 5-6 членного гетероарила, необязательно замещеного одним или более заместителями R14; и
каждый R14 независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, группы -SO2NR35R36 (где R35 и R36 каждый независимо выбирают из C1-4 алкила) и C1-4 алкилтио.
[0033] (1-22) Соединение по любому одному из пунктов (1-1) - (1-3), (1-5) - (1-7), (1-10) - (1-12), (1-20), и (1-21) или его соль, или сольват соединения или сольват соли соединения, где каждый Ra независимо выбирают из атома галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, (C1-4 алкокси)C1-6 алкокси (C1-4 алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), (C1-3 алкокси(C1-4 алкокси))C1-4 алкокси, (карбокси)C1-6 алкокси, (3-6 членный гетероциклоалкил)C1-6 алкокси (гетероциклоалкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из оксо, атома галогена, C1-4 алкила, необязательно замещенного одной или более гидроксильными группами, (C1-4 алкокси)C1-4 алкила (алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), C1-4алкокси, (C1-4 алкокси)карбонила, C1-4 алкилтио, морфолино, (C1-3 алкил)сульфонила, и (ди(C1-3 алкил)амино)карбонил), C1-4 алкокси, замещенного группой -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(3-6 членный оксациклоалкил)-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди((гидрокси)C1-4 алкил)амино]C1-4 алкокси, [N-((C1-3 алкокси)карбонил)C1-3 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, (1,2,4-триазолил)C1-4алкокси, [N-(гидрокси)C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди((C1-3 алкокси)C1-4 алкил)амино]C1-6 алкокси, [N,N-ди(C1-3алкил)амино]C1-6 алкокси, [N-[N-(C1-4алкил)карбонил-N-(C1-3алкил)амино]C1-4алкил-N-(C1-3 алкил) амино]C1-4 алкокси, [N-[N-(C1-4алкил)карбонил-амино]C1-4алкил-N-(C1-3 алкил) амино]C1-4 алкокси, C1-6 алкокси, необязательно замещенного одним или более атомами галогена, группы -(O(CH2)r1)r2-C(O)NR43R44, группы -(O(CH2)q1)q2-NR41R42, C1-4 алкокси, замещенного группой -NH-(CH2)w-SO3H, C1-4 алкокси, замещенного группой -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, группы -(O(CH2)s1)s2-NR45-C(O)R46, группы -C(O)NR47R48, пиридинилы, группы -NR49R50, группы -(O(CH2)y1)y2-O-CH2-C(O)NR51R52, (3-6 членный гетероциклоалкил)C2-6 алкинила (гетероциклоалкильный фрагмент необязательно замещен одной или более оксогруппами), [N-((C1-3алкокси)C1-4алкил-N-(C1-3алкил)амино]C2-6алкинила, C2-8 алкинила, необязательно замещенного одной или более гидроксильными группами, 3-6 членного оксациклоалкилокси, или 4-6 членного азотсодержащего гетероциклоалкилокси (гетероциклоалкильный фрагмент необязательно замещен одним заместителем, выбранным из (C1-3 алкокси)C1-4 алкила и C1-3 алкила).
[0034] (1-23) Соединение по любому одному из пунктов (1-1) - (1-3), (1-10) - (1-13), (1-20), и (1-21) или его соль, или сольват соединения или сольват соли соединения, где Re представляет собой фенил, необязательно замещенный одним-тремя заместителями Ra;
от одного до трех заместителей Ra представляют собой один заместитель, выбранный из Ri, Rj и Rk, два заместителя, выбранные из комбинации Ri и Rj, Ri и Rk, и Rj и Rk, или три заместителя Ri, Rj и Rk;
Ri представляет собой атом галогена;
Rj представляет собой атом галогена; и
Rk представляет собой атом галогена, 3-6 членный гетероциклоалкилокси (гетероциклоалкильный фрагмент включает один гетероатом, выбранный из O и N, и представляет собой необязательно замещенный с помощью необязательно C1-4 алкоксизамещенного C1-4 алкила), необязательно R11-замещенный C2-6 алкинил, необязательно R12-замещенный C1-6 алкокси, группу -(O(CH2)q1)q2-NR41R42, группу -(O(CH2)r1)r2-C(O)NR43R44, группу -(O(CH2)s1)s2-NR45-C(O)R46, группу -C(O)NR47R48, группу -NR49R50 или группу -(O(CH2)y1)y2-O-CH2-C(O)NR51R52.
[0035] (1-24) Соединение по пункту (1-21) или (1-23) или его соль, или сольват соединения или сольват соли соединения, где
R11 представляет собой морфолино;
R12 выбирают из 5-6 членного гетероциклоалкила, который содержит один или два гетероатома, выбранных из O и N, (C1-4алкокси)C1-6алкокси или группы -NR39R40.
[0036] (1-25) Соединение по любому одному из пунктов (1-13), (1-14), (1-17) и (1-23) или его соль, или сольват соединения или сольват соли соединения,
где Rk представляет собой [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, (C1-4 алкокси)C1-6 алкокси (C1-4 алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), (C1-3 алкокси(C1-4 алкокси))C1-4 алкокси, (карбокси)C1-6 алкокси, (3-6 членный гетероциклоалкил)C1-6 алкокси (гетероциклоалкильный фрагмент включает в себя от одного до трех атомов, которые выбирают из O или N, и необязательно замещен одним или двумя заместителями, выбранными из оксо, атома галогена, C1-4 алкила (где алкильный фрагмент необязательно замещен одной или более гидроксильными группами), (C1-4 алкокси)C1-4 алкил (алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), C1-4 алкокси, (C1-4 алкокси)карбонил, C1-4 алкилтио, морфолино, (C1-3 алкил)сульфонил, и (ди(C1-3 алкил)амино)карбонил), C1-4 алкокси, замещенный группой -NH-CH((CH2)v1COOR57)-(CH2)v2-COOR57, [N-(3-6 членный оксациклоалкил)-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди((гидрокси)C1-4 алкил)амино]C1-4 алкокси, [N-((C1-3 алкокси)карбонил)C1-3 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, (1,2,4-триазолил)C1-4 алкокси, [N-(гидрокси)C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, [N,N-ди(C1-3 алкокси(C1-4 алкил))амино]C1-6 алкокси, [N,N-ди(C1-3алкил)амино]C1-6алкокси, [N-[N-(C1-4 алкил)карбонил-N-(C1-3 алкил)амино]C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, [N-[N-(C1-4 алкил)карбониламино]C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси, группу -(O(CH2)r1)r2-C(O)NR43R44, группу -(O(CH2)q1)q2-NR41R42, C1-4 алкокси, замещенный группой -NH-(CH2)w-SO3H, C1-4 алкокси, замещенный группой -NH-(CH2)x1-CH(COOH)-(CH2)x2-SO3H, группу -(O(CH2)s1)s2-NR45-C(O)R46, группу -C(O)NR47R48, пиридинил, группу -NR49R50, группу -(O(CH2)y1)y2-O-CH2-C(O)NR51R52, (3-6 членный гетероциклоалкил)C2-6 алкинил, необязательно замещенный одной или более оксогруппами (гетероциклоалкильный фрагмент включает от одного до трех гетероатомов, выбранных из O и N), [N-((C1-3алкокси)C1-4алкил-N-(C1-3алкил)амино]C2-6алкинил, 3-6 членный оксациклоалкилокси или 4-6 членный азотсодержащий гетероциклоалкилокси (азотсодержащий гетероциклоалкильный фрагмент необязательно замещен одним заместителем, выбранным из (C1-3 алкокси)C1-4 алкила и C1-3 алкила).
[0037] (1-26) Соединение по любому одному из пунктов (1-1) - (1-3), (1-5), (1-7), (1-8), (1-10) - (1-20), и (1-21) или его соль, или сольват соединения или сольват соли соединения, где
R1, R4, и R5 определены в следующих пунктах (1) или (2):
(1) R1 представляет собой C1-6 алкил;
R4 представляет собой необязательно галогензамещенный C1-4 алкил или фенил; и
R5 представляет собой атом водорода или C1-4 алкил; или
(2) R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо; и
R4 определен выше;
R3 представляет собой C1-4 алкил, замещенный Re;
Re представляет собой фенил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена, необязательно R11-замещенного C2-6 алкинила и необязательно R12-замещенного C1-6 алкокси;
R11 и R12 каждый независимо выбирают из 5-6 членного гетероциклоалкила и -NR39R40;
R39 и R40 каждый независимо выбирают из атома водорода и необязательно C1-6 алкоксизамещенного C1-6алкила;
Ar1 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc и Rd каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, фенила, необязательно замещенного одним или более заместителями R14, и 5-6 членного гетероарила, необязательно замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, группы -SO2NR35R36 (где R35 и R36 каждый независимо выбирают из C1-4 алкила) и C1-4 алкилтио.
[0038] (1-27) Соединение по любому одному из пунктов (1-1) - (1-26) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой атом галогена;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd представляет собой атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, фенил, необязательно замещенный одним или более заместителями R14, или 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R14.
[0039] (1-28) Соединение по любому одному из пунктов (1-1) - (1-12), (1-20), (1-21), (1-23), (1-26) и (1-27) или его соль, или сольват соединения или сольват соли соединения, где
Re представляет собой фенил необязательно замещенный одним или более заместителями Ra;
R11 и R12 каждый независимо выбирают из морфолинила и группы -NR39R40;
R4 представляет собой необязательно галогензамещенный C1-4 алкил или фенил;
Ar1 представляет собой фенил, пиридинил или пиримидинил, где фенильная, пиридинильная и пиримидинильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb представляет собой атом галогена;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd представляет собой атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, фенил, пиридинил или пиримидинил, где фенильная, пиридильная и пиримидинильная группы каждая необязательно замещена одним или более заместителями R14.
[0040] (1-29) Соединение по любому одному из пунктов (1-1) - (1-4), (1-10) - (1-17), (1-20), (1-21), (1-23), и (1-26) - (1-28) или его соль, или сольват соединения или сольват соли соединения, где
Re представляет собой фенил, необязательно замещенный одним-тремя заместителями Ra;
от одного до трех заместителей Ra представляют собой один заместитель, выбранный из Ri, Rj и Rk, два заместителя, выбранные из комбинации Ri и Rj, Ri и Rk, и Rj и Rk, или три заместителя Ri, Rj и Rk;
Ri представляет собой атом галогена;
Rj представляет собой атом галогена; и
Rk представляет собой гидрокси, C2-6 алкинил, необязательно замещенный заместителем R11, или C1-6 алкокси, необязательно замещенный заместителем R12.
[0041] (1-30) Соединение по любому одному из пунктов (1-26) - (1-29) или его соль, или сольват соединения или сольват соли соединения, где R11 и R12 каждый независимо выбирают из морфолинила, [N-((C1-3 алкокси)C1-4алкил)-N-(C1-3 алкил)амино] и [N,N-ди(C1-3алкил)амино].
[0042] (1-31) Соединение по любому одному из пунктов (1-26) - (1-30) или его соль, или сольват соединения или сольват соли соединения, где R11 и R12 каждый независимо выбирают из морфолинила, и [N-((метокси)этил)-N-(метил)амино].
[0043] (1-32) Соединение по любому одному из пунктов (1-1) - (1-31) или его соль, или сольват соединения или сольват соли соединения, где R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо, и R4 представляет собой C1-4 алкил.
[0044] (1-33) Соединение по любому одному из пунктов (1-1) - (1-3), (1-5), (1-6), (1-10) - (1-12) и (1-20) или его соль, или сольват соединения или сольват соли соединения, где
R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо;
R4 представляет собой C1-4 алкил;
R3 представляет собой C1-4 алкил, замещенный Re;
Re представляет собой фенил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена и C1-4 алкокси, необязательно замещенного одним или более заместителями R12;
каждый R12 независимо выбирают из 5-6 членного гетероциклоалкила и -NR39R40;
R39 и R40 каждый независимо выбирают из атома водорода и необязательно C1-4 алкоксизамещенного C1-4 алкила;
Ar1 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc и Rd каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, и 5-6 членного гетероарила, необязательно замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, и C1-4 алкилтио.
[0045] (1-34) Соединение по любому одному из пунктов (1-1) - (1-33) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой атом галогена;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd представляет собой атом галогена или 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R14.
[0046] (1-35) Соединение по любому одному из пунктов (1-1) - (1-34) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой бензил, необязательно замещенный одним-тремя заместителями Ra на бензольном кольце.
[0047] (1-36) Соединение по любому одному из пунктов (1-1) - (1-35) или его соль, или сольват соединения или сольват соли соединения, где Ra выбирают из атома галогена, (морфолино)C1-4алкокси, [N-((C1-3алкокси)C1-4 алкил)-N-(C1-3алкил)амино]C1-4 алкокси, [N,N-ди(C1-3 алкил)амино]C1-4 алкокси.
[0048] (1-37) Соединение по любому одному из пунктов (1-1) - (1-5), (1-10) - (1-16), (1-20), и (1-33) - (1-36) или его соль, или сольват соединения или сольват соли соединения, где
Re представляет собой фенил, необязательно замещенный одним-тремя заместителями Ra;
от одного до трех заместителей Ra представляют собой один заместитель, выбранный из Ri, Rj и Rk, два заместителя, выбранные из комбинации Ri и Rj, Ri и Rk, и Rj и Rk, или три заместителя Ri, Rj и Rk;
Ri и Rj каждый представляют собой независимо атом галогена; и
Rk представляет собой C1-4 алкокси, необязательно замещенный одним или более заместителями R12.
[0049] (1-38) Соединение по любому одному из пунктов (1-13) - (1-18), (1-20), (1-25), (1-29) и (1-37) или его соль, или сольват соединения или сольват соли соединения, где
Rk представляет собой атом галогена, (морфолино)C1-4 алкокси, [N-((C1-3алкокси)C1-4 алкил)-N-(C1-3алкил)амино]C1-4 алкокси, [N,N-ди(C1-3 алкил)амино]C1-4 алкокси.
[0050] (1-39) Соединение по любому одному из пунктов (1-1) - (1-6), (1-10) - (1-16), (1-20) - (1-23), (1-26), (1-33) - (1-35), (1-37) и (1-38) или его соль, или сольват соединения или сольват соли соединения, где
Ar1 представляет собой фенил или пиридинил;
Rd представляет собой пиридинил или пиримидинил;
R12 выбирают из морфолинила, [N-(2-(метокси)этил)-N-(метил)амино], [N,N-диметиламино].
[0051] (1-40) Соединение по любому одному из пунктов (1-1) - (1-39) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой атом галогена;
Rc представляет собой атом галогена, метил или трифторметил;
Rd представляет собой атом галогена, трифторметил, фенил, необязательно замещенный одним-тремя заместителями R14, и 5-6 членный гетероарил, необязательно замещенный с одним-тремя заместителями R14, где гетероарил включает в себя от одного до трех гетероатомов, выбранных из O, S, и N.
[0052] (1-41) Соединение по любому одному из пунктов (1-1) - (1-40) или его соль, или сольват соединения или сольват соли соединения, где
R14 каждый выбирают из метила, трифторметила, циано, нитро, атома галогена, метокси, этокси, трифторметокси, метилтио, метоксикарбонила и диметиламиносульфонила.
[0053] (1-42) Соединение по любому одному из пунктов (1-1) - (1-41) или его соль, или сольват соединения или сольват соли соединения, где
R14 каждый выбирают из метила, трифторметила, циано, атома хлора и метилтио.
[0054] (1-43) Соединение по любому одному из пунктов (1-1) - (1-42) или его соль, или сольват соединения или сольват соли соединения, где
Ar1 представляет собой фенил или 5-6 членный гетероарил, который включает в себя от одного до трех гетероатомов, выбранных из O, S, и N, где фенил и гетероарил замещены одним-тремя заместителями, выбранными из Rb, Rc и Rd.
[0055] (1-44) Соединение по любому одному из пунктов (1-1) - (1-11), (1-20) - (1-22), (1-24), (1-26) - (1-28), (1-30) - (1-36), и (1-39) - (1-43) или его соль, или сольват соединения или сольват соли соединения, где соединение представлено формулой (I-c);
[0056]
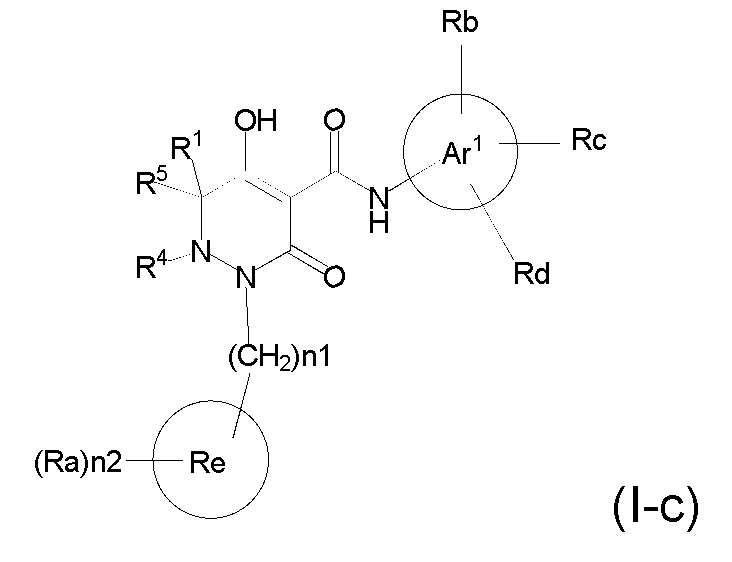
[0057] где, n1 представляет собой целое число, выбранное в диапазоне от 1 до 4, n2 представляет собой целое число, выбранное в диапазоне от 0 или более, R1, R4, R5, Ar1, Ra, Rb, Rc, Rd, Re опрределены в любом одном из пунктов (1-1) - (1-11), (1-20) - (1-22), (1-24), (1-26) - (1-28), (1-30) - (1-36), и (1-39) - (1-43).
[0058] (1-45) Соединение по пункту (1-44) или его соль, или сольват соединения или сольват соли соединения, где n1 представляет собой 1, и n2 представляет собой 3.
[0059] (1-46) Соединение по любому одному из пунктов (1-13) - (1-20), (1-23) - (1-25), (1-29) - (1-32) и (1-37) - (1-43) или его соль, или сольват соединения или сольват соли соединения, где соединение представлено формулой (I-д);
[0060]
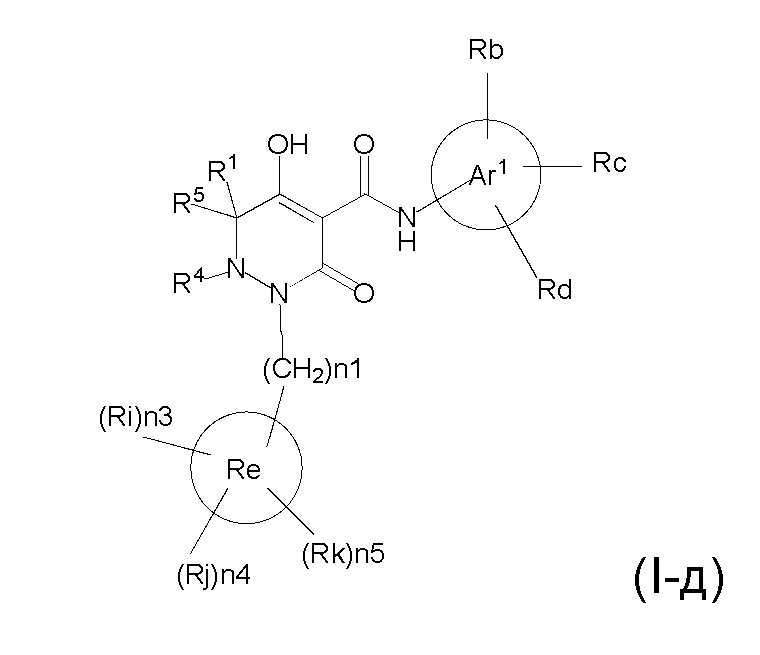
[0061] где n1 представляет собой целое число, выбранное в диапазоне от 1 до 4, n3, n4 и n5 представляет собой целое число, независимо выбранное из 0 или 1, при условии, что, по меньшей мере, один из n3, n4 и n5 представляет собой 1, R1, R4, R5, Ar1, Ra, Rb, Rc, Rd, Re, Ri, Rj, и Rk определены в любом одном из пунктов (1-13) - (1-20), (1-23) - (1-25), (1-29) - (1-32), и (1-37) - (1-43).
[0062] (1-47) Соединение по пункту (1-46) или его соль, или сольват соединения или сольват соли соединения, где n1 представляет собой 1.
[0063] (1-48) Соединение по любому одному из пунктов (1-1) - (1-47) или его соль, или сольват соединения или сольват соли соединения, где
Ar1 представляет собой 4-(трифторметил)-2-(6-метилтиопиридин-3-ил)фенил, 4-(трифторметил)-2-(6-трифтор-метилпиридин-3-ил)фенил, 4-(трифторметил)-2-(4-трифторметил-пиримидин-5-ил)фенил, 4-(трифторметил)-2-(6-трифторметил-пиримидин-4-ил)фенил, 4-(трифторметил)-2-(6-циано-5-метил-пиримидин-4-ил)фенил, 4-(трифторметил)-2-(2-цианопиридин-4-ил)фенил, 4-хлор-2-(6-метилтиопиридин-3-ил)фенил, 4-хлор-2-(6-трифторметилпиридин-3-ил)фенил, 4-хлор-2-(4-трифторметил-пиримидин-5-ил)фенил, 4-хлор-2-(6-циано-5-метилпиримидин-4-ил)-фенил, 4-хлор-2-(6-трифторметилпиримидин-4-ил)фенил или 4-хлор-2-(2-цианопиридин-4-ил)фенил.
[0064] (1-49) Соединение, выбранное из следующих соединений:
(4aR)-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
(4aR)-N-[2-(6-циано-5-метилпиримидин-4-ил)-4-(трифтор-метил)фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(4aR)-N-[2-(2-цианопиридин-4-ил)-4-(трифторметил)фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
6-[4-[[(4aR)-4-гидрокси-4a-метил-2-оксо-3-[[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенил]-гекс-5-иновая кислота;
(4aR)-1-[[2,3-дифтор-4-(3-морфолин-4-илпроп-1-инилфенил]-метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(4aR)-1-[[4-[3-[(2R)-2,3-дигидроксипропокси]пропокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
(4aR)-1-[[4-[4-[(2R)-2,3-дигидроксипропокси]бутокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
(4aR)-1-[[4-[6-[(2R)-2,3-дигидроксипропокси]гексокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[2-(трифтор-метил)-4-[6-(трифторметил)пиридин-3-ил]пиримидин-5-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
(4aR)-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(4aR)-1-[[2,3-дифтор-4-(морфолин-4-илметил)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(4aR)-N-(4-бром-3,5-дифторфенил)-1-[(3-хлор-2-фторфенил)-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(3S)-3-третбутил-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)-фенил]метил]-4-гидрокси-2-метил-6-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-3H-пиридазин-5-карбоксамид;
(3S)-3-третбутил-N-[4-хлор-2-[6-(трифторметил)пиримидин-4-ил]фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоксамид;
(3S)-3-третбутил-N-[4-хлор-2-[6-(трифторметил)пиридин-3-ил]фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоксамид;
(3S)-3-третбутил-N-[4-хлор-2-(6-метилсульфанилпиридин-3-ил)фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоксамид;
(3S)-3-третбутил-N-[2-(6-циано-5-метилпиримидин-4-ил)-4-(трифторметил)фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)-фенил]метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоксамид;
6-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид;
7-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
6-[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид;
7-[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
4-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(три-фторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]бутановая кислота;
5-[2,3-[дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(три-фторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]пентановая кислота;
6-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(три-фторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]гексановая кислота;
7-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-гептановая кислота;
7-[[2,3-дифтор-4-[2-[(2S)-2-(метоксиметил)пирролидин-1-ил]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамид;
(2S)-2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этил-амино]этандикарбоновая кислота;
3-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этил-амино]глутаровая кислота;
6-(2,3-дифтор-4-(2-(метил(оксетан-3-ил)амино)этокси)-бензил)-9-гидрокси-5-метил-7-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид;
7-[[2,3-дифтор-4-[2-[метил(оксетан-3-ил)амино]этокси]-фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
7-(2,3-дифтор-4-(2-(метил(оксетан-3-ил)амино)этокси)-бензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
7-(4-(3-(диметиламино)-2,2-диметилпропокси)-2,3-дифтор-бензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
6-[[2,3-дифтор-4-[1-(2-метоксиэтил)азетидин-3-ил]окси-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид;
7-[[2,3-дифтор-4-[4-[метил-[(2S,3R,4R,5R)-2,3,4,5,6-пента-гидроксигексил]амино]-4-оксобутокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
7-[[2,3-дифтор-4-[2-[2-[метил-[(2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексил]амино]этокси]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
7-[[2,3-дифтор-4-[2-[2-[2-[2-[2-метоксиэтил(метил)амино]-этокси]этокси]этокси]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этил-амино]этансульфоновая кислота и
2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этил-амино]этансульфоновая кислота
или его соль, или сольват соединения или сольват соли соединения.
[0065] (1-50) Соединение по любому одному из пунктов (1-1) - (1-49) или его соль, или сольват соединения или сольват соли соединения для использования при профилактике и/или лечении заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности.
[0066] (1-51) Ингибитор NaPi-IIb, включающий соединение по любому одному из пунктов (1-1) - (1-49) или его соль, или сольват соединения или сольват соли соединения.
[0067] (1-52) Ингибитор PiT-1, включающий соединение по любому одному из пунктов (1-1) - (1-49) или его соль, или сольват соединения или сольват соли соединения.
[0068] (1-53) Ингибитор PiT-2, включающий соединение по любому одному из пунктов (1-1) - (1-49) или его соль, или сольват соединения или сольват соли соединения.
[0069] (1-54) Профилактическое и/или терапевтическое средство для заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности, где средство включает соединение по любому одному из пунктов (1-1) - (1-49) или его соль, или сольват соединения или сольват соли соединения в качестве активного ингредиента.
[0070] (1-55) Способ профилактики и/или лечения заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности, включающий введение терапевтически эффективного количества соединения по любому одному из пунктов (1-1) - (1-49) или его соль, или сольват соединения или сольват соли соединения пациенту.
[0071] Другой вариант осуществления настоящего изобретения предлагает следующие соединения (2-1) - (2-26):
[0072] (2-1) Соединение, представленное формулой (I), или его соль, или сольват соединения или сольват соли соединения:
[0073]
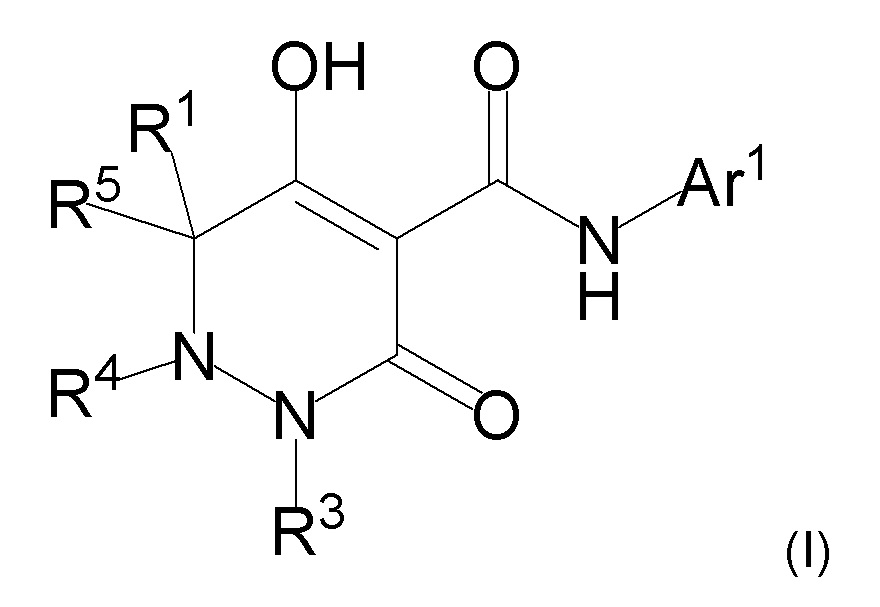
[0074] где R1, R4, и R5 определены в одном из следующих пунктов (1) - (3):
(1) R1 представляет собой атом водорода или C1-10 алкил;
R4 представляет собой атом водорода, C1-4 алкил, необязательно замещенный одним или более заместителями Rf, C6-10 арил, необязательно замещенный одним или более заместителями Rg, (C1-6 алкил)карбонил, (C6-10 арил)карбонил, группу -C(O)NR37R38, C3-7 циклоалкил или 5-8 членный гетероциклоалкил; и
R5 представляет собой атом водорода или C1-4 алкил;
(2) R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо; и
R4 определен выше; и
(3) R1 представляет собой атом водорода или линейный C1-10 алкил;
R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, образуют 5-8 членное насыщенное гетероциклическое кольцо, где насыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями R2;
R3 представляет собой C1-10 алкил, необязательно замещенный одним или более заместителями Rh, или C1-4 алкил, замещенный Re;
R37 и R38 каждый независимо выбирают из атома водорода и C1-3 алкила;
каждый R2 независимо выбирают из C1-5 алкила и атома галогена; и/или
два или более заместителей R2 на 5-8 членном насыщенном гетероциклическом кольце могут вместе образовывать C1-5 алкилен, который связывает кольцевые атомы, к которым они присоединены;
каждый Rh независимо выбирают из атома галогена, (C1-4 алкокси)карбонила и группы -(O(CH2)a)b-C1-4 алкокси (где a представляет собой целое число, выбранное в диапазоне от 2 до 4, и b представляет собой целое число, выбранное в диапазоне от 1 до 4);
Re представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ra, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями Ra;
каждый Rf независимо выбирают из атома галогена, гидрокси, циано, карбокси, (C1-6 алкокси)карбонила, C1-6 алкокси и C6-10 арила, необязательно замещенного одним или более заместителями Rg;
каждый Rg независимо выбирают из атома галогена, C1-6 алкила, C2-6 алкинила и C1-6 алкокси, где алкильная, алкинильная и алкоксильная группы каждая независимо замещена одним или более заместителями, выбранными из гидрокси и циано;
каждый Ra независимо выбирают из атома галогена, гидрокси, нитро, циано, (C1-4 алкокси)карбонила, 3-10 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкенила, необязательно замещенного одним или более заместителями R15, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, и C1-4 алкилтио, необязательно замещенного одним или более заместителями R13;
R10, R11, R12, R13, и R15 каждый независимо выбирают из атома галогена, гидрокси, карбокси, C1-6 алкокси, необязательно замещеного одной или более гидроксильными группами, (C1-4 алкокси)карбонила, группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4), C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами, 3-10 членного гетероциклоалкила, 5-10 членного гетероарила и группы -NR39R40, где 3-10 членная гетероциклоалкильная группа необязательно замещена одним или более заместителями, выбранными из оксо, атома галогена и C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами);
Ar1 представляет собой C6-10 арил или 5-10 членный гетероарил, где арильная и гетроарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc, и Rd каждый независимо выбирают из необязательно C1-4 алкоксизамещенного C1-5 алкокси, атома галогена, C1-10 алкила, необязательно замещенного одним или более атомами галогена, группы -SF5, циано, гидрокси, 5-10 членного гетероциклоалкила, необязательно замещенного одним или более заместителями R14, C6-10 арила, необязательно замещенного одним или более заместителями R14, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R14;
каждый R14 независимо выбирают из атома галогена, оксо, циано, нитро, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, необязательно замещенного одним или более атомами галогена, (C1-6 алкокси)карбонила, группы -NR27R28, группы -SO2NR35R36, C1-4 алкилтио и 5-10 членного гетероциклоалкила;
R27 и R28 каждый независимо выбирают из атома водорода и необязательно (C1-4 алкокси)карбонилзамещенного C1-4 алкила;
R35 и R36 каждый независимо выбирают из атома водорода и C1-4 алкила; и
R39 и R40 каждый независимо выбирают из атома водорода и необязательно C1-6 алкоксизамещенного C1-6 алкила.
[0075] (2-2) Соединение по пункту (2-1) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой необязательно C1-4 алкоксизамещенный C1-5 алкокси или атом галогена;
Rc представляет собой атом галогена, C1-10 алкил, необязательно замещенный одним или более атомами галогена, или группу -SF5; и
Rd представляет собой циано, гидрокси, атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, 5-10 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R14, C6-10 арил, необязательно замещенный одним или более заместителями R14, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями R14.
[0076] (2-3) Соединение по пункту (2-1) или (2-2) или его соль, или сольват соединения или сольват соли соединения, где
каждый Ra независимо выбирают из атома галогена, нитро, циано, (C1-4 алкокси)карбонила, 3-6 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, и C1-4 алкилтио, необязательно замещенного одним или более заместителями R13;
каждый R10 независимо выбирают из карбокси, 3-6 членного гетероциклоалкила, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, и группы -(O(CH2)o)p-OH;
каждый R11 независимо выбирают из гидрокси, карбокси, 5-6 членного гетероциклоалкила, необязательно замещенного одной или более оксогруппами, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, группы -(O(CH2)o)p-OH и C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами;
каждый R12 независимо выбирают из атома галогена, гидрокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси)карбонила, 3-6 членного гетероциклоалкила, 5-6 членного гетероарила и группы -NR39R40;
R13 представляет собой 5-6 членный гетероциклоалкил; и
o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4.
[0077] (2-4) Соединение по любому одному из пунктов (2-1) - (2-3) или его соль, или сольват соединения или сольват соли соединения, где каждый Ra независимо выбирают из атома галогена, гидрокси, нитро, циано, C1-6 алкила, (карбокси)C1-8 алкила, (морфолино)C1-4 алкила, (оксетанил)C1-4 алкила, [HO-((CH2)oO)p]C1-6 алкила, (C1-6 алкокси)C1-8 алкила, необязательно замещенного одной или более гидроксильными группами, C1-3 алкокси, замещенного одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, ((C1-3 алкокси)карбонил)C1-3 алкокси, (морфолино)C1-6 алкокси, необязательно замещенного одной или более оксогруппами, (3-6 членный оксациклоалкил)C1-4 алкокси, (пиридинил)C1-4 алкокси, (пиримидинил)C1-4 алкокси, (C1-6 алкокси)C1-8 алкокси, необязательно замещенного одной или более гидроксильными группами, (карбокси)C2-6 алкинила, (морфолино)C2-6 алкинила, необязательно замещенного одной или более оксогруппами, (3-6 членный оксациклоалкил)C2-6 алкинила, (пирролидинo)C2-6 алкинила, необязательно замещенного одной или более оксогруппами, C2-8 алкинила, необязательно замещенного одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинила, (C1-6 алкокси)C2-8 алкинила, необязательно замещенного одной или более гидроксильными группами, (C3-6 циклоалкил)C2-6 алкинила, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси)карбонила, (морфолино)C1-4 алкилтио, необязательно замещенного одной или более оксогруппами, и 3-6 членного оксациклоалкилокси.
[0078] (2-5) Соединение по любому одному из пунктов (2-1) - (2-4) или его соль, или сольват соединения или сольват соли соединения, где каждый Ra независимо выбирают из атома галогена, гидрокси, циано, C1-3 алкила, (карбокси)C1-8 алкила, (C1-6 алкокси)C1-8 алкила, замещенного одной или более гидроксильными группами, C1-3 алкокси, необязательно замещенного одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, (морфолино)C1-6 алкокси, (C1-6 алкокси)C1-8 алкокси, замещенного одной или более гидроксильными группами, (карбокси)C2-6 алкинила, (морфолино)C2-6 алкинила, C2-8 алкинила, необязательно замещенного одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинила, (C1-6 алкокси)C2-8 алкинила, замещенный одной или более гидроксильными группами, и (C1-3 алкокси)карбонила.
[0079] (2-6) Соединение по любому одному из пунктов (2-1) - (2-5) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой метил, замещенный с помощью Re.
[0080] (2-7) Соединение по любому одному из пунктов (2-1) - (2-6) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой бензил, необязательно замещенный одним или более заместителями Ra на бензольном кольце.
[0081] (2-8) Соединение по любому одному из пунктов (2-1) - (2-7) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой бензил, необязательно замещенный одним-тремя заместителями Ra на бензольном кольце.
[0082] (2-9) Соединение по любому одному из пунктов (2-1), (2-4) и (2-6) - (2-8) или его соль, или сольват соединения или сольват соли соединения, где Re представляет собой фенил, необязательно замещенный одним-тремя заместителями й Ra;
от одного до трех заместителей Ra представляют собой один заместитель, выбранный из Ri, Rj и Rk, два заместителя, выбранные из комбинации Ri и Rj, Ri и Rk, и Rj и Rk, или три заместителя Ri, Rj и Rk;
Ri представляет собой атом галогена или C1-3 алкокси;
Rj представляет собой атом галогена, нитро, или циано; и
Rk представляет собой гидрокси, атом галогена, (C1-4 алкокси)карбонил, 5-10 членный гетероциклоалкилокси, C1-10 алкил, необязательно замещенный одним или более заместителями R10, C2-10 алкенил, необязательно замещенный одним или более заместителями R15, C2-10 алкинил, необязательно замещенный одним или более заместителями R11, C1-8 алкокси, необязательно замещенный одним или более заместителями R12, или C1-4 алкилтио, необязательно замещенный одним или более заместителями R13.
[0083] (2-10) Соединение по пункту (2-9) или его соль, или сольват соединения или сольват соли соединения, где Rk представляет собой гидрокси, атом галогена, C1-6 алкил, (карбокси)C1-8 алкил, (C1-6 алкокси)C1-8 алкил, замещенный одной или более гидроксильными группами, C1-3 алкокси, необязательно замещенный одним или более атомами галогена, [N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси, (морфолино)C1-6 алкокси, (C1-6 алкокси)C1-8 алкокси, замещенный одной или более гидроксильными группами, (карбокси)C2-8 алкинил, (морфолино)C2-6 алкинил, C2-8 алкинил, необязательно замещенный одной или более гидроксильными группами, [HO-((CH2)oO)p]C2-8 алкинил, (C1-6 алкокси)C2-8 алкинил, замещенный одной или более гидроксильными группами, или (C1-3 алкокси)карбонил.
[0084] (2-11) Соединение по пункту (2-1) или его соль, или сольват соединения или сольват соли соединения, где
R1, R4, и R5 определены в следующих пунктах (1) или (2):
(1) R1 представляет собой атом водорода или C1-6 алкил;
R4 представляет собой атом водорода, C1-4 алкил, необязательно замещенный одним или более заместителями Rf, C6-10 арил, необязательно замещенный одним или более заместителями Rg, (C1-6 алкил)карбонил, (C6-10 арил)карбонил, -C(O)NR37R38, C3-7 циклоалкил или 5-8 членный гетероциклоалкил; и
R5 представляет собой атом водорода или C1-4 алкил; или
(2) R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо; и
R4 определен выше;
R3 представляет собой C1-4 алкил, замещенный Re;
Re представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена, циано, гидрокси, C1-6 алкила, необязательно замещенного одним или более заместителями R10, C2-6 алкинила, необязательно замещенного одним или более заместителями R11, и C1-6 алкокси, необязательно замещенного одним или более заместителями R12;
R10, R11, и R12 каждый независимо выбирают из 4-10 членного гетероциклоалкила, необязательно замещенного одним или более заместителями, и группв -NR39R40, где заместители каждый независимо выбирают из оксо, атома галогена и C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами);
Ar1 представляет собой C6-10 арил или 5-10 членный гетероарил, где арильная и гетроарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc и Rd каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, необязательно C1-4 алкилзамещенного 5-10 членного гетероциклоалкила, C6-10 арила, необязательно замещенного одним или более заместителями R14, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, группы -SO2NR35R36 и C1-4 алкилтио.
[0085] (2-12) Соединение по пункту (2-11) или его соль, или сольват соединения или сольват соли соединения, где R10, R11 и R12 каждый независимо выбирают из 5-6 членного гетероциклоалкила, необязательно замещенного одним или более заместителями.
[0086] (2-13) Соединение по любому одному из пунктов (2-1) и (2-11) или его соль, или сольват соединения или сольват соли соединения, где
R1, R4 и R5 определены в следующих пунктах (1) или (2):
(1) R1 представляет собой C1-6 алкил;
R4 представляет собой необязательно галогензамещенный C1-4 алкил или фенил; и
R5 представляет собой атом водорода или C1-4 алкил; или
(2) R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо; и
R4 определен выше;
R3 представляет собой C1-4 алкил, замещенный Re;
Re представляет собой фенил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена, необязательно R11-замещенного C2-6 алкинила и необязательно R12-замещенного C1-6 алкокси;
R11 и R12 каждый независимо выбирают из 5-6 членного гетероциклоалкила и -NR39R40;
Ar1 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc и Rd каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, фенила, необязательно замещенного одним или более заместителями R14, и 5-6 членного гетероарила, необязательно замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, группы -SO2NR35R36 (где R35 и R36 каждый независимо выбирают из C1-4 алкила) и C1-4 алкилтио.
[0087] (2-14) Соединение по любому одному из пунктов (2-11) - (2-13) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой атом галогена;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd представляет собой атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, фенил, необязательно замещенный одним или более заместителями R14, или 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R14.
[0088] (2-15) Соединение по пункту (2-13) или его соль, или сольват соединения или сольват соли соединения, где
Re представляет собой фенил, необязательно замещенный одним или более заместителями Ra;
R11 и R12 каждый независимо выбирают из морфолинила и группы -NR39R40;
R4 представляет собой необязательно галогензамещенный C1-4 алкил или фенил;
Ar1 представляет собой фенил, пиридинил, или пиримидинил, где фенильная, пиридинильная и пиримидинильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb представляет собой атом галогена;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd представляет собой атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, фенил, пиридинил, или пиримидинил, где фенильная, пиридильная и пиримидинильная группы каждая необязательно замещена одним или более заместителями R14.
[0089] (2-16) Соединение по пункту (2-15) или его соль, или сольват соединения или сольват соли соединения, где R11 и R12 каждый независимо выбирают из морфолинила и [N-((метокси)этил)-N-(метил)амино].
[0090] (2-17) Соединение по пункту (2-11) или (2-12) или его соль, или сольват соединения или сольват соли соединения, где R10, R11 и R12 каждый независимо выбирают из морфолинила, тиоморфолинила, азетидинила, пирролидинила, 2-окса-6-азаспиро[3.3]гептанила, 3,7-диокса-9-азабицикло[3.3.1]нонанила, пиперазинила, пиперидила, и [N-((метокси)этил)-N-(метил)амино].
[0091] (2-18) Соединение по любому одному из пунктов (2-1) - (2-17) или его соль, или сольват соединения или сольват соли соединения, где
R1, R4, и R5 определены в одном из следующих пунктов (1) - (3):
(1) R1 представляет собой атом водорода, и R4 и R5 каждый независимо выбирают из C1-6 алкила;
(2) R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-5 насыщенное карбоциклическое кольцо, и R4 представляет собой C1-6 алкил; и
(3) R1 представляет собой линейный C1-6 алкил, и
R4 и R5 вместе с углеродным атомом, к которому они присоединены, образуют пирролидиновое кольцо;
R3 представляет собой бензил, замещенный одним или более заместителями Ra на бензольном кольце;
каждый Ra независимо выбирают из атома галогена, (морфолино)C2-6 алкокси, (морфолино)C1-6 алкила, (карбокси)C2-6 алкинила, (C1-6 алкокси)C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, и [N-((метокси)этил)-N-(метил)амино]этокси;
Ar1 представляет собой фенил или пиримидил, где эти группы каждая замещена одной-тремя группами, каждая из которых независимо выбрана из атома галогена, трифторметила, пиридинила, замещенного одним или более заместителями R14, и пиримидила, замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из метила, циано, трифторметила и метилтио.
[0092] (2-19) Соединение по любому одному из пунктов (2-1) - (2-18) или его соль, или сольват соединения или сольват соли соединения, где Ar1 представляет собой 4-(трифторметил)-2-(6-метилтиопиридин-3-ил)фенил, 4-(трифторметил)-2-(6-трифторметил-пиридин-3-ил)фенил, 4-(трифторметил)-2-(4-трифторметилпиримидин-5-ил)фенил, 4-(трифторметил)-2-(6-трифторметилпиримидин-4-ил)-фенил, 4-(трифторметил)-2-(6-циано-5-метилпиримидин-4-ил)фенил, 4-(трифторметил)-2-(2-цианопиридин-4-ил)фенил, 4-хлор-2-(6-метилтиопиридин-3-ил)фенил, 4-хлор-2-(6-трифторметилпиридин-3-ил)фенил, 4-хлор-2-(4-трифторметилпиримидин-5-ил)фенил, 4-хлор-2-(6-циано-5-метилпиримидин-4-ил)фенил, 4-хлор-2-(6-трифтор-метилпиримидин-4-ил)фенил или 4-хлор-2-(2-цианопиридин-4-ил)-фенил.
[0093] (2-20) Соединение по любому одному из пунктов (2-1) - (2-19) или его соль, или сольват соединения или сольват соли соединения, где
R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо;
R4 представляет собой C1-4 алкил;
R3 представляет собой C1-4 алкил, замещенный Re;
Re представляет собой фенил необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена и C1-4 алкокси, необязательно замещенного одним или более заместителями R12;
каждый R12 независимо выбирают из 5-6 членного гетероциклоалкила и группы -NR39R40;
R39 и R40 каждый независимо выбирают из атома водорода и необязательно C1-4 алкоксизамещенного C1-4 алкила;
Ar1 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc и Rd каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, и 5-6 членного гетероарила, необязательно замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, и C1-4 алкилтио.
[0094] (2-21) Соединение по пункту (2-20) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой атом галогена;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd выбирают из атома галогена и 5-6 членного гетероарила, необязательно замещенного одним или более заместителями R14.
[0095] (2-22) Соединение по любому одному из пунктов (2-1), (2-20) и (2-21) или его соль, или сольват соединения или сольват соли соединения, где
Re представляет собой фенил, необязательно замещенный одним-тремя заместителями Ra;
от одного до трех заместителей Ra представляют собой один заместитель, выбранный из Ri, Rj и Rk, два заместителя, выбранные из комбинации Ri и Rj, Ri и Rk, и Rj и Rk, или три заместителя Ri, Rj и Rk;
Ri и Rj каждый представляет собой независимо атом галогена; и
Rk представляет собой C1-4 алкокси, необязательно замещенный одним или более заместителями R12.
[0096] (2-23) Соединение по любому одному из пунктов (2-20) - (2-22) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой бензил, где бензильная группа необязательно замещена одним-тремя заместителями Ra.
[0097] (2-24) Соединение по любому одному из пунктов (2-20) - (2-23) или его соль, или сольват соединения или сольват соли соединения, где
Ar1 представляет собой фенил или пиридинил;
Rd представляет собой пиридинил или пиримидинил; и
R12 представляет собой морфолинил или [N-((метокси)этил)-N-(метил)амино].
[0098] (2-25) Соединение по любому одному из пунктов (2-1) - (2-24) или его соль, или сольват соединения или сольват соли соединения, где соединение представлено формулой I-a:
[0099]
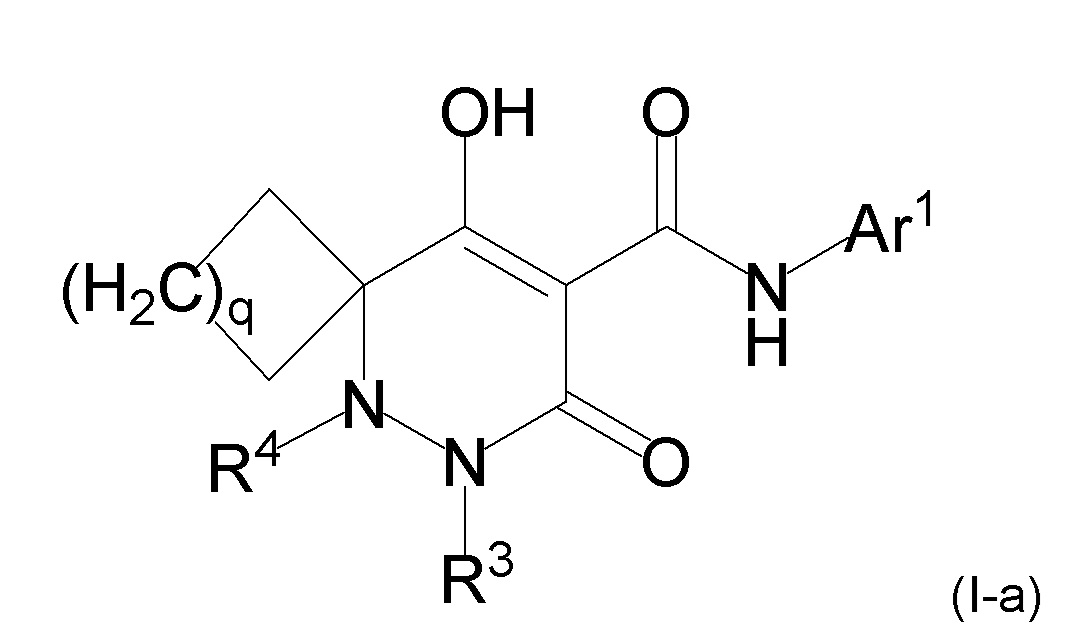
[0100] где к представляет собой целое число, выбранное в диапазоне от 0 до 3, и R3, R4 и Ar1 определены выше в любом из пунктов (2-1) - (2-24).
[0101] (2-26) Соединение, выбранное из следующих соединений:
(4aR)-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
(4aR)-N-[2-(6-циано-5-метилпиримидин-4-ил)-4-(трифтор-метил)фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(4aR)-N-[2-(2-цианопиридин-4-ил)-4-(трифторметил)фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
6-[4-[[(4aR)-4-гидрокси-4a-метил-2-оксо-3-[[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенил]-гекс-5-иновая кислота;
(4aR)-1-[[2,3-дифтор-4-(3-морфолин-4-илпроп-1-инилфенил]-метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(4aR)-1-[[4-[3-[(2R)-2,3-дигидроксипропокси]пропокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
(4aR)-1-[[4-[4-[(2R)-2,3-дигидроксипропокси]бутокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
(4aR)-1-[[4-[6-[(2R)-2,3-дигидроксипропокси]гексокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[2-(трифтор-метил)-4-[6-(трифторметил)пиридин-3-ил]пиримидин-5-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид;
(4aR)-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(4aR)-1-[[2,3-дифтор-4-(морфолин-4-илметил)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(4aR)-N-(4-бром-3,5-дифторфенил)-1-[(3-хлор-2-фторфенил)-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид;
(3S)-3-третбутил-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)-фенил]метил]-4-гидрокси-2-метил-6-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-3H-пиридазин-5-карбоксамид;
(3S)-3-третбутил-N-[4-хлор-2-[6-(трифторметил)пиримидин-4-ил]фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоксамид;
(3S)-3-третбутил-N-[4-хлор-2-[6-(трифторметил)пиридин-3-ил]фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоксамид;
(3S)-3-третбутил-N-[4-хлор-2-(6-метилсульфанилпиридин-3-ил)фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоксамид;
(3S)-3-третбутил-N-[2-(6-циано-5-метилпиримидин-4-ил)-4-(трифторметил)фенил]-1-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)-фенил]метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоксамид;
6-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид;
7-[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид;
6-[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид и
7-[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
или его соль, или сольват соединения или сольват соли соединения.
[0102] Другой вариант осуществления настоящего изобретения предлагает следующие соединения (3-1) - (3-13):
[0103] (3-1) Соединение, представленное формулой (I), или его соль или сольват соединения или сольват соли соединения:
[0104]
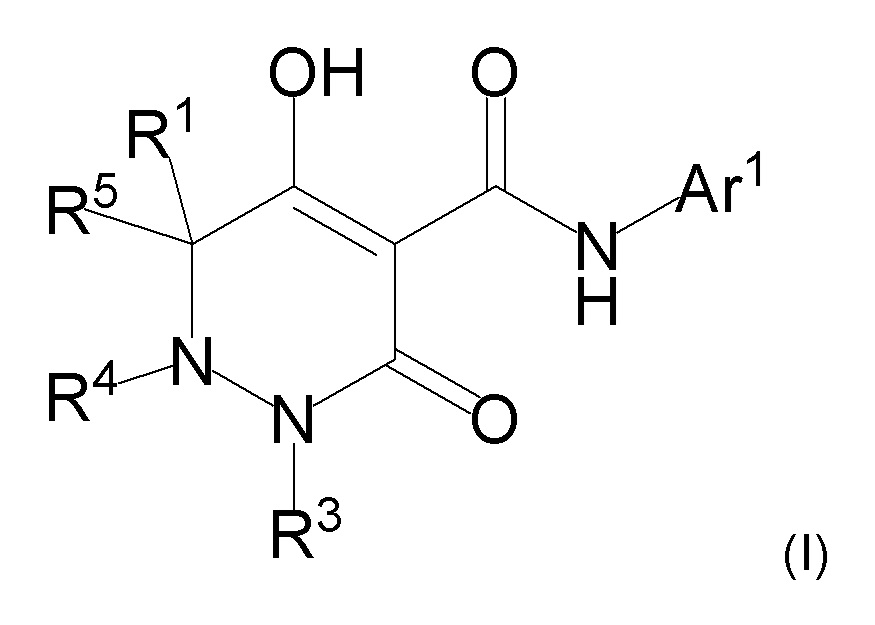
[0105] где
R1 представляет собой атом водорода или C1-10 алкил;
R4 представляет собой атом водорода, C1-4 алкил, необязательно замещенный одним или более заместителями Rf, C6-10 арил, необязательно замещенный одним или более заместителями Rg, (C1-6 алкил)карбонил, (C6-10 арил)карбонил, -C(O)NR37R38, C3-7 циклоалкил или 5-8 членный гетероциклоалкил;
R5 представляет собой атом водорода или C1-4 алкил; или
R1 и R5 вместе с углеродным атомом, к которому они присоединены, могут образовывать C3-6 насыщенное карбоциклическое кольцо; или
R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, могут образовывать 5-8 членное насыщенное гетероциклическое кольцо, где 5-8 членное насыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями R2;
R3 представляет собой C1-10 алкил, необязательно замещенный одним или более заместителями Rh, или C1-4 алкил, замещенный Re;
R37 и R38 каждый независимо выбирают из атома водорода и C1-3 алкила;
каждый R2 независимо выбирают из C1-5 алкила и атома галогена; и/или
два или более заместителей R2 на 5-8 членном насыщенном гетероциклическом кольце могут вместе образовывать C1-5 алкилен, который связывает кольцевые атомы, к которым они присоединены;
каждый Rh независимо выбирают из атома галогена, (C1-4 алкокси)карбонила и -(O(CH2)a)b-C1-4 алкокси (где a представляет собой целое число, выбранное в диапазоне от 2 до 4, и b представляет собой целое число, выбранное в диапазоне от 1 до 4);
Re представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ra, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями Ra;
каждый Rf независимо выбирают из атома галогена, гидрокси, циано, карбокси, (C1-6 алкокси)карбонила, C1-6 алкокси и C6-10 арила, необязательно замещенного одним или более заместителями Rg;
каждый Rg независимо выбирают из атома галогена, C1-6 алкила, C2-6 алкинила и C1-6 алкокси, где алкильная, алкинильная и алкоксильная группы каждая независимо замещена одним или более заместителями, выбранными из гидрокси и циано;
каждый Ra независимо выбирают из атома галогена, гидрокси, нитро, циано, (C1-4 алкокси)карбонила, 5-10 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкенила, необязательно замещенного одним или более заместителями R15, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, и C1-4 алкилтио, необязательно замещенного одним или более заместителями R13;
заместители R10, R11, R12, R13, и R15 каждый независимо выбирают из атома галогена, гидрокси, карбокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-4 алкокси)карбонила, группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4), C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами, 4-10 членного гетероциклоалкила и 5-10 членного гетероарила, где 4-10 членный гетероциклоалкил необязательно замещен одним или более заместителями, выбранными из оксо, атома галогена и C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами);
Ar1 представляет собой C6-10 арил или 5-10 членный гетероарил, где арильная и гетроарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc и Rd каждый независимо выбирают из необязательно C1-4 алкоксизамещенного C1-5 алкокси, атома галогена, C1-10 алкила, необязательно замещенного одним или более атомами галогена, группы -SF5, циано, гидрокси, 5-10 членного гетероциклоалкила, необязательно замещенного одним или более заместителями R14, C6-10 арила, необязательно замещенного одним или более заместителями R14, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R14;
каждый R14 независимо выбирают из атома галогена, оксо, циано, нитро, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, необязательно замещенного одним или более атомами галогена, (C1-6 алкокси)карбонила, -NR27R28, -SO2NR35R36, C1-4 алкилтио и 5-10 членного гетероциклоалкила;
R27 и R28 каждый независимо выбирают из атома водорода и необязательно (C1-4 алкокси)карбонилзамещенного C1-4 алкила; и
R35 и R36 каждый независимо выбирают из атома водорода и C1-4 алкила.
[0106] (3-2) Соединение по пункту (3-1) или его соль, или сольват соединения или сольват соли соединения, где R1 представляет собой C1-10 алкил.
[0107] (3-3) Соединение по пункту (3-1) или (3-2) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой необязательно C1-4 алкоксизамещенный C1-5 алкокси или атом галогена;
Rc представляет собой атом галогена, C1-10 алкил, необязательно замещенный одним или более атомами галогена, или группу -SF5; и
Rd выбирают из циано, гидрокси, атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, 5-10 членного гетероциклоалкила, необязательно замещенного одним или более заместителями R14, C6-10 арила, необязательно замещенного одним или более заместителями R14, или 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R14.
[0108] (3-4) Соединение по любому одному из пунктов (3-1) - (3-3) или его соль, или сольват соединения или сольват соли соединения, где
каждый Ra независимо выбирают из атома галогена, нитро, циано, (C1-4 алкокси)карбонила, 5-6 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, и C1-4 алкилтио, необязательно замещенного одним или более заместителями R13;
каждый R10 независимо выбирают из карбокси, 5-6 членного гетероциклоалкила, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, и группы -(O(CH2)o)p-OH;
каждый R11 независимо выбирают из гидрокси, карбокси, 5-6 членного гетероциклоалкила, необязательно замещенного одной или более оксогруппами, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, группы -(O(CH2)o)p-OH, и C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами;
каждый R12 независимо выбирают из атома галогена, гидрокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси)карбонила, 5-6 членного гетероциклоалкила и 5-6 членного гетероарила;
каждый R13 независимо выбирают из 5-6 членного гетероциклоалкила; и
o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4.
[0109] (3-5) Соединение по любому одному из пунктов (3-1) - (3-4) или его соль, или сольват соединения или сольват соли соединения, где
R1 выбирают из C1-4 алкила;
R3 выбирают из C1-4 алкила, замещенного Re;
Re выбирают из C6-10 арила, необязательно замещенного одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена и необязательно R12-замещенного C1-6 алкокси;
R4 выбирают из C1-4 алкила;
R5 выбирают из C1-4 алкила; или
из R1, R4, и R5, R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо, или R4 и R5 вместе с атомом азота и углеродным атомом, к которым они присоединены, образуют 5-8 членное насыщенное гетероциклическое кольцо;
Ar1 представляет собой C6-10 арил, где арильная группа замещена двумя заместителями, выбранными из Rc и Rd;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена;
Rd представляет собой 5-10 членный гетероциклоалкил, необязательно замещенный одним или более C1-4 алкильными группами, и 5-10 членный гетероарил, необязательно замещенный одним или более заместителями R14;
R12 представляет собой 5-10 членный гетероциклоалкил; и
R14 представляет собой C1-4 алкил, необязательно замещенный одним или более атомами галогена.
[0110] (3-6) Соединение по пункту (3-1) или (3-2) или его соль, или сольват соединения или сольват соли соединения, где
R1 представляет собой атом водорода или C1-6 алкил;
R3 представляет собой C1-4 алкил, замещенный Re;
Re представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена, циано, гидрокси, C1-6 алкила, необязательно замещенного одним или более заместителями R10, C2-6 алкинила, необязательно замещенного одним или более заместителями R11, и C1-6 алкокси, необязательно замещенного одним или более заместителями R12;
R10, R11 и R12 каждый независимо выбирают из 4-10 членного гетероциклоалкила, необязательно замещенного одним или более заместителями, где заместители каждый независимо выбирают из оксо, атома галогена и C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами);
R4 представляет собой атом водорода, C1-4 алкил, необязательно замещенный одним или более заместителями Rf, C6-10 арил, необязательно замещенный одним или более заместителями Rg, (C1-6 алкил)карбонил, (C6-10 арил)карбонил, -C(O)NR37R38, C3-7 циклоалкил или 5-8 членный гетероциклоалкил;
R5 представляет собой атом водорода или C1-4 алкил; или
R1 и R5 вместе с углеродным атомом, к которому они присоединены, могут образовывать C3-6 насыщенное карбоциклическое кольцо;
Ar1 представляет собой C6-10 арил или 5-10 членный гетероарил, где арильная и гетроарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc и Rd каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, необязательно C1-4 алкилзамещенного 5-10 членного гетероциклоалкила, C6-10 арила, необязательно замещенного одним или более заместителями R14, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, -SO2NR35R36 и C1-4 алкилтио.
[0111] (3-7) Соединение по любому одному из пунктов (3-1), (3-2), и (3-6) или его соль, или сольват соединения или сольват соли соединения, где
R1 представляет собой C1-6 алкил;
R3 представляет собой C1-4 алкил, замещенный Re;
Re представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена, необязательно R11-замещенного C2-6 алкинила, и необязательно R12-замещенного C1-6 алкокси;
R11 и R12 каждый независимо выбирают из 5-10 членного гетероциклоалкила;
R4 представляет собой необязательно галогензамещенный C1-4 алкил или C6-10 арил;
R5 представляет собой атом водорода или C1-4 алкил; или
R1 и R5 вместе с углеродным атомом, к которому они присоединены, могут образовывать C3-6 насыщенное карбоциклическое кольцо;
Ar1 представляет собой C6-10 арил или 5-10 членный гетероарил, где арильная и гетроарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb, Rc и Rd каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C6-10 арила, необязательно замещенного одним или более заместителями R14, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, -SO2NR35R36 (где R35 и R36 каждый независимо выбирают из C1-4 алкила) и C1-4 алкилтио.
[0112] (3-8) Соединение по пункту (3-7) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой атом галогена;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd представляет собой атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, C6-10 арил, необязательно замещенный одним или более заместителями R14, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями R14.
[0113] (3-9) Соединение по пункту (3-7) или его соль, или сольват соединения или сольват соли соединения, где
Re представляет собой фенил, необязательно замещенный одним или более заместителями Ra;
R11 и R12 каждый представляет собой независимо морфолинил;
R4 представляет собой необязательно галогензамещенный C1-4 алкил или фенил;
Ar1 представляет собой фенил, пиридинил, или пиримидинил, где фенильная, пиридинильная и пиримидинильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb представляет собой атом галогена;
Rc представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd представляет собой атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, фенил, пиридинил, или пиримидинил, где фенильная, пиридильная и пиримидинильная группы каждая необязательно замещена одним или более заместителями R14.
[0114] (3-10) Соединение по пункту (3-6) или (3-7) или его соль, или сольват соединения или сольват соли соединения, где R10, R11 и R12 каждый независимо выбирают из морфолинила, тиоморфолинила, азетидинила, пирролидинила, 2-окса-6-азаспиро[3.3]гептанила, 3,7-диокса-9-азабицикло[3.3.1]нонанила, пиперазинила и пиперидила.
[0115] (3-11) Соединение по любому одному из пунктов (3-1) - (3-10) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой бензил, необязательно замещенный одним или более заместителями Ra на бензольном кольце.
[0116] (3-12) Соединение по пункту (3-1) или его соль, или сольват соединения или сольват соли соединения, где
R1 представляет собой C1-6 алкил, и R4 и R5 вместе с углеродным атомом, к которому они присоединены, образуют пирролидиновое кольцо; или
R1 представляет собой атом водорода, и R4 и R5 каждый независимо выбирают из C1-6 алкила; или
R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-5 насыщенное карбоциклическое кольцо, и R4 представляет собой C1-6 алкил;
R3 представляет собой бензил, замещенный одним или более заместителями Ra на бензольном кольце;
каждый Ra независимо выбирают из атома галогена, (морфолино)C2-6 алкокси, (морфолино)C1-6 алкила, (карбокси)C2-6 алкинила и (C1-6 алкокси)C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами;
Ar1 представляет собой фенил или пиримидил, где эти группы каждая замещена одной-тремя группами, каждую из которых независимо выбирают из атома галогена, трифторметила, пиридинила, замещенного одним или более заместителями R14, и пиримидила, замещенного одним или более заместителями R14; и
каждый R14 независимо выбирают из метила, циано, трифторметила и метилтио.
[0117] (3-13) Соединение по любому одному из пунктов (3-1) - (3-11) или его соль, или сольват соединения или сольват соли соединения, где Ar1 представляет собой 4-(трифторметил)-2-(6-метилтиопиридин-3-ил)фенил, 4-(трифторметил)-2-(6-трифторметил-пиридин-3-ил)фенил, 4-(трифторметил)-2-(4-трифторметилпиримидин-5-ил)фенил, 4-(трифторметил)-2-(6-трифторметилпиримидин-4-ил)-фенил, 4-(трифторметил)-2-(6-циано-5-метилпиримидин-4-ил)фенил, 4-(трифторметил)-2-(2-цианопиридин-4-ил)фенил, 4-хлор-2-(6-метилтиопиридин-3-ил)фенил, 4-хлор-2-(6-трифторметилпиридин-3-ил)фенил, 4-хлор-2-(4-трифторметилпиримидин-5-ил)фенил, 4-хлор-2-(6-циано-5-метилпиримидин-4-ил)фенил, 4-хлор-2-(6-трифтор-метилпиримидин-4-ил)фенил или 4-хлор-2-(2-цианопиридин-4-ил)-фенил.
[0118] Альтернативный аспект настоящего изобретения предлагает лекарственный препарат, включающий соединение по любому из пунктов (2-1) - (2-26) и (3-1) - (3-13) или его соль, или сольват соединения или сольват соли соединения.
[0119] Дополнительный альтернативный аспект настоящего изобретения предлагает фармацевтическую композицию, включающую соединение по любому из пунктов (2-1) - (2-26) и (3-1) - (3-13) или его соль, или сольват соединения или сольват соли соединения.
[0120] Дополнительный альтернативный аспект настоящего изобретения предлагает соединение по любому одному из пунктов (2-1) - (2-26) и (3-1) - (3-13) или его соль, или сольват соединения или сольват соли соединения для использования при профилактике и/или лечении заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности.
[0121] Дополнительный альтернативный аспект настоящего изобретения предлагает ингибитор NaPi-IIb, включающий соединение по любому одному из пунктов (2-1) - (2-26) и (3-1) - (3-13) или его соль, или сольват соединения или сольват соли соединения.
[0122] Дополнительный альтернативный аспект настоящего изобретения предлагает профилактическое и/или терапевтическое средство для заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности, где средство включает соединение по любому из пунктов (2-1) - (2-26) и (3-1) - (3-13) или его соль, или сольват соединения или сольват соли соединения в качестве активного ингредиента.
[0123] Дополнительный альтернативный аспект настоящего изобретения предлагает способ профилактики и/или лечения заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности, включающий введение терапевтически эффективного количества соединения по любому из пунктов (2-1) - (2-26) и (3-1) - (3-13) или его соль, или сольват соединения или сольват соли соединения пациенту.
[0124] Согласно одному варианту осуществления соединения, представленного формулой (I), где R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, образуют 5-8 членное насыщенное гетероциклическое кольцо, предлагается следующее соединение (4-1):
[0125] (4-1) Соединение, представленное формулой (II), или его соль, или сольват соединения или сольват соли соединения:
[0126]
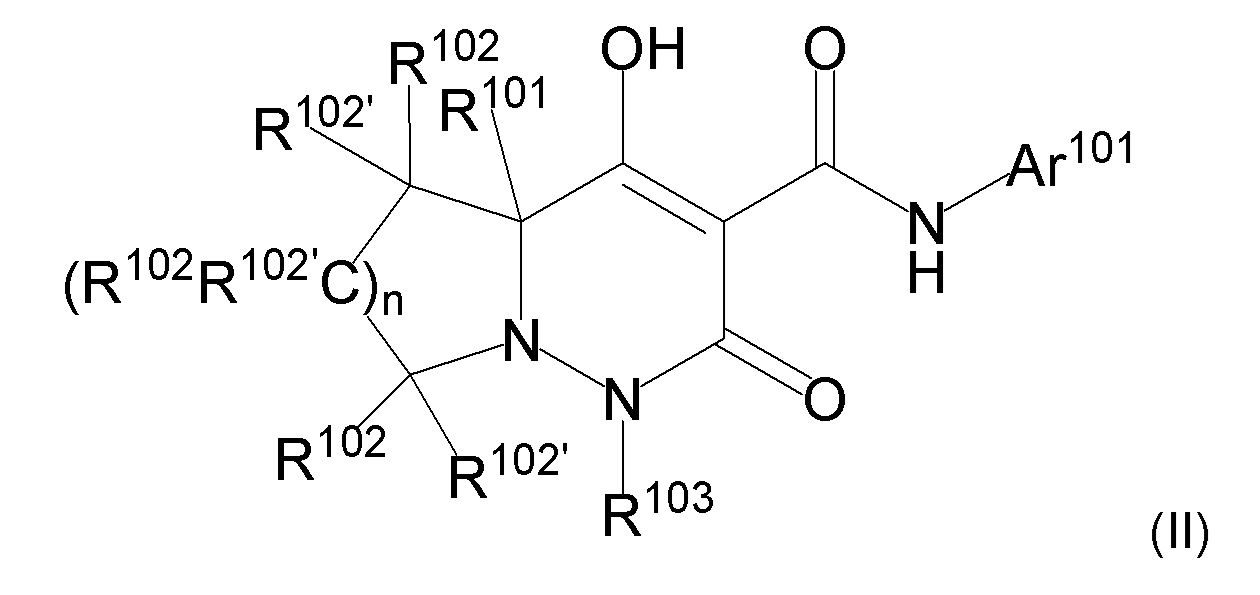
[0127] где R101 выбирают из атома водорода и линейного C1-10 алкила;
R102 может быть одинаковым или различным и каждый независимо выбирают из атома водорода, C1-5 алкила и атома галогена; или
два R102 фрагмента, соединенных с различными углеродными атомами, могут вместе образовывать C1-5 алкилен, который связывает углеродные атомы;
R102' может быть одинаковым или различным и каждый независимо выбирают из атома водорода, C1-5 алкила и атома галогена;
n представляет собой целое число, выбранное в диапазоне от 1 до 4;
R103 представляет собой C1-10 алкил, необязательно замещенный одним или более заместителями Rw, или C1-4 алкил, замещенный одним или более заместителями Rx;
каждый Rw независимо выбирают из атома галогена, (C1-4 алкокси)карбонила и группы -(O(CH2)a)b-C1-4 алкокси (где a представляет собой целое число, выбранное в диапазоне от 2 до 4, и b представляет собой целое число, выбранное в диапазоне от 1 до 4);
каждый Rx независимо выбирают из C6-10 арила, необязательно замещенного одним или более заместителями Ry, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями Ry;
каждый Ry независимо выбирают из атома галогена, гидрокси, нитро, циано, (C1-4 алкокси)карбонила, 5-10 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R110, C2-10 алкенила, необязательно замещенного одним или более заместителями R115, C2-10 алкинила, необязательно замещенного одним или более заместителями R111, C1-8 алкокси, необязательно замещенного одним или более заместителями R112, и C1-4 алкилтио, необязательно замещенного одним или более заместителями R113;
R110, R111, R112, R113 и R115 каждый независимо выбирают из атома галогена, гидрокси, карбокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-4 алкокси)карбонила, группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4), C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами, 5-10 членного гетероциклоалкила, необязательно замещенного одной или более оксогруппами, и 5-10 членного гетероарила;
Ar101 представляет собой C6-10 арил или 5-10 членный гетероарил, где C6-10 арильная и 5-10 членная гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rz1, Rz2 и Rz3;
Rz1, Rz2 и Rz3 каждый независимо выбирают из необязательно C1-4 алкоксизамещенного C1-5 алкокси, атома галогена, C1-10 алкила, необязательно замещенного одним или более атомами галогена, группы -SF5, циано, гидрокси, 5-10 членного гетероциклоалкила, необязательно замещенного одним или более заместителями R114, C6-10 арила, необязательно замещенного одним или более заместителями R114, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R114; и
каждый R114 независимо выбирают из атома галогена, циано, нитро, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, необязательно замещенного одним или более атомами галогена, (C1-6 алкокси)карбонила, группы -NR127R128 (где R127 и R128 каждый независимо выбирают из атома водорода и необязательно (C1-4 алкокси)карбонилзамещенного C1-4 алкила), группы -SO2NR135R136 (где R135 и R136 каждый независимо выбирают из атома водорода и C1-4 алкила), C1-4 алкилтио и 5-10 членного гетероциклоалкила.
[0128] Согласно другому варианту осуществления, настоящее изобретение предлагает следующие соединения (4-2) - (4-12), представленные формулой (II).
[0129] (4-2) Соединение по пункту (4-1) или его соль, или сольват соединения или сольват соли соединения, где
Rz1 представляет собой необязательно C1-4 алкоксизамещенный C1-5 алкокси или атом галогена;
Rz2 представляет собой атом галогена, C1-10 алкил, необязательно замещенный одним или более атомами галогена, и группу -SF5; и
Rz3 представляет собой циано, гидрокси, атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, 5-10 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R114, C6-10 арил, необязательно замещенный одним или более заместителями R114, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями R114.
[0130] (4-3) Соединение по пункту (4-1) или (4-2) или его соль, или сольват соединения или сольват соли соединения, где Rz3 представляет собой циано, гидрокси, атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, фенил, и 5-6 членный гетероарил, где фенил и 5-6 членный гетероарил могут быть замещены одним или двумя заместителями R114.
[0131] (4-4) Соединение по любому одному из пунктов (4-1) - (4-3) или его соль, или сольват соединения или сольват соли соединения, где
R101 представляет собой атом водорода или линейный C1-6 алкил;
R102 может быть одинаковым или различным и каждый независимо выбирают из атома водорода, C1-3 алкила и атома галогена;
R102' может быть одинаковым или различным и каждый независимо выбирают из атома водорода, C1-3 алкила и атома галогена;
n представляет собой целое число, выбранное в диапазоне от 1 до 3;
Rx независимо выбирают из C6-10 арила, необязательно замещенного одним или более заместителями Ry, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями Ry;
Ry независимо выбирают из атома галогена, гидрокси, нитро, циано, (C1-3 алкокси)карбонила, 5-10 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R110, C2-10 алкинила, необязательно замещенного одним или более заместителями R111, C1-8 алкокси, необязательно замещенного одним или более заместителями R112, и C1-3 алкилтио, необязательно замещенного одним или более заместителями R113;
R110 независимо выбирают из карбоксила, 5-10 членного гетероциклоалкила, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, и группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4);
R111 независимо выбирают из гидрокси, карбокси, 5-10 членного гетероциклоалкила, необязательно замещенного одной или более оксогруппами, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4) и C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами;
R112 независимо выбирают из атома галогена, гидрокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси)карбонила, 5-10 членного гетероциклоалкила и 5-10 членного гетероарила;
R113 независимо выбирают из 5-10 членного гетероциклоалкила;
Rz1 выбирают из необязательно C1-3 алкоксизамещенного C1-4 алкокси и атома галогена; и
R114 независимо выбирают из атома галогена, циано, нитро, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, необязательно замещенного одним или более атомами галогена, (C1-6 алкокси)карбонила, группы -NR127R128 (где R127 и R128 каждый независимо выбирают из атома водорода и необязательно (C1-3 алкокси)карбонилзамещенного C1-4 алкила), группы -SO2NR135R136 (где R135 и R136 каждый независимо выбирают из атома водорода и C1-3 алкила), C1-3 алкилтио и 5-10 членного гетероциклоалкила.
[0132] (4-5) Соединение по любому одному из пунктов (4-1) - (4-4) или его соль, или сольват соединения или сольват соли соединения, где Rx представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ry.
[0133] (4-6) Соединение по любому одному из пунктов (4-1) - (4-5) или его соль, или сольват соединения или сольват соли соединения, где
Ar101 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена с помощью Rz1, Rz2 и/или Rz3;
Rz1 представляет собой атом галогена или необязательно C1-3 алкоксизамещенный C1-4 алкокси;
Rz2 представляет собой атом галогена или C1-10 алкил, необязательно замещенный одним или более атомами галогена; и
Rz3 представляет собой 5-6 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R114, фенил, необязательно замещенный одним или более заместителями R114, или 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R114.
[0134] (4-7) Соединение по любому одному из пунктов (4-1) - (4-6) или его соль, или сольват соединения или сольват соли соединения, где
Ar101 представляет собой фенил или 5-6 членный гетероарил, где арильная и гетроарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rz1, Rz2 и Rz3;
Rz1 представляет собой атом галогена;
Rz2 выбирают из атома галогена, C1-10 алкила, необязательно замещенного одним или более атомами галогена, и группы -SF5; и
Rz3 представляет собой циано, гидрокси или атом галогена.
[0135] (4-8) Соединение по любому одному из пунктов (4-1) - (4-7) или его соль, или сольват соединения или сольват соли соединения, где Rz3 представляет собой фенил, тиенил, пиридинил, пиримидинил, или хинолинил, где эти группы каждая необязательно замещена одним или более заместителями R114.
[0136] (4-9) Соединение по любому одному из пунктов (4-1) - (4-8) или его соль, или сольват соединения или сольват соли соединения, где каждый R114 независимо выбирают из атома галогена, циано, нитро, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, необязательно замещенного одним или более атомами галогена, (C1-6 алкокси)карбонила, группы -NR127R128 (каждый R127 и R128 независимо выбирают из атома водорода, и C1-4 алкила, необязательно замещенного с помощью (C1-4 алкокси)карбонила, группы -SO2NR135R136 (каждый R135 и R136 независимо выбирают из атома водорода и C1-4 алкила) и C1-4 алкилтио.
[0137] (4-10) Соединение по любому одному из пунктов (4-1) - (4-9) или его соль, или сольват соединения или сольват соли соединения, где R101 представляет собой линейный C1-6 алкил.
[0138] (4-11) Соединение по любому одному из пунктов (4-1) - (4-10) или его соль, или сольват соединения или сольват соли соединения, где R102 и R102' представляют собой атом водорода.
[0139] (4-12) Соединение по любому одному из пунктов (4-1) - (4-11) или его соль, или сольват соединения или сольват соли соединения, где
R101 представляет собой линейный C1-6 алкил;
R102 и R102' представляют собой атом водорода;
R103 представляет собой C1-10 алкил, необязательно замещенный с помощью Rx;
Rx представляет собой фенил, необязательно замещенный одним или более заместителями Ry;
каждый Ry независимо выбирают из атома галогена и C1-8 алкокси, необязательно замещенного с помощью R112;
R112 представляет собой 5-6 членный гетероциклоалкил;
Ar101 представляет собой фенил, необязательно замещенный одним-тремя заместителями, выбранными из Rz1, Rz2 и Rz3;
Rz1 представляет собой необязательно C1-3 алкоксизамещенный C1-4 алкокси или атом галогена;
Rz2 представляет собой атом галогена или C1-10 алкил, необязательно замещенный одним или более атомами галогена;
Rz3 представляет собой 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R114; и
каждый R114 выбирают независимо из C1-4 алкила, необязательно замещенного одним или более атомами галогена.
[0140] (4-13) Соединение по любому одному из пунктов (4-1) - (4-12) или его соль, или сольват соединения или сольват соли соединения, где Rz3 замещен одним или двумя заместителями R114.
[0141] (4-14) Соединение по любому одному из пунктов (4-1) - (4-13) или его соль, или сольват соединения или сольват соли соединения, где R110, R111, R112, R113 и R115 каждый независимо выбирают из тетрагидрофуранила, пирролидинила, морфолинила, циклопентила и пиридинила.
[0142] (4-15) Соединение по любому одному из пунктов (4-1) - (4-14) или его соль, или сольват соединения или сольват соли соединения, где R103 представляет собой бензил, необязательно замещенный одним или более заместителями Ry на бензольном кольце.
[0143] (4-16) Соединение по любому одному из пунктов (4-1) - (4-15) или его соль, или сольват соединения или сольват соли соединения, где R103 представляет собой бензил, необязательно замещенный одним-тремя заместителями Ry на бензольном кольце.
[0144] (4-17) Соединение по любому одному из пунктов (4-1) - (4-16) или его соль, или сольват соединения или сольват соли соединения, где от одного до трех заместителей Ry представляют собой один заместитель, выбранный из Ri', Rj' и Rk', два заместителя, выбранные из комбинации Ri' и Rj', Ri' и Rk', и Rj' и Rk', или три заместителя Ri', Rj' и Rk';
Ri' представляет собой атом галогена или C1-3 алкокси;
Rj' представляет собой атом галогена, нитро, или циано; и
Rk' представляет собой гидрокси, атом галогена, C1-6 алкил, (карбокси)C1-8 алкил, (морфолино)C1-4 алкил, (C1-6 алкокси)C1-8 алкил, (алкокси необязательно замещен одной или более гидроксильными группами), (5-6 членный гетероциклоалкил)C1-6 алкокси, [HO-((CH2)oO)p]C1-6 алкил, (карбокси)C2-6 алкинил, (3-6 членный гетероциклоалкил)C2-6 алкинил (гетероциклоалкильный фрагмент необязательно замещен с помощью оксо), C1-3 алкокси, необязательно замещенный одним или более атомами галогена, C1-6 алкокси, замещенный одной или более гидроксильными группами, ((C1-3 алкокси)карбонил)C1-3 алкокси, (пиридинил)C1-4 алкокси, (C1-6 алкокси)C1-8 алкокси (C1-6 алкокси необязательно замещен одной или более гидроксильными группами), необязательно гидрокси-замещенный C2-8 алкинил, (C3-6 циклоалкил)C2-6 алкинил (циклоалкил необязательно замещен гидроксильной группой), [HO-((CH2)oO)p]C2-8 алкинил, (C1-6 алкокси)C2-8 алкинил (алкокси необязательно замещен одной или более гидроксильными группами), (морфолино)C1-4 алкилтио, 3-6 членный оксациклоалкилокси или (C1-3 алкокси)карбонил.
[0145] Альтернативный вариант осуществления настоящего изобретения предлагает следующие соединения (5-1) - (5-12), представленные формулой (I):
[0146] (5-1) Соединение по пункту (1-1), (2-1) или (3-1) или его соль, или сольват соединения или сольват соли соединения, где
R1 представляет собой атом водорода или линейный C1-10 алкил; и
R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, образуют 5-8 членное насыщенное гетероциклическое кольцо, где насыщенное гетероциклическое кольцо необязательно замещено одним или более заместителями R2.
[0147] (5-2) Соединение по пункту (5-1) или его соль, или сольват соединения или сольват соли соединения, где
Rb представляет собой необязательно C1-4 алкоксизамещенный C1-5 алкокси или атом галогена; и/или
Rc представляет собой атом галогена, C1-10 алкил, необязательно замещенный одним или более атомами галогена, или группу -SF5; и/или
Rd представляет собой циано, гидрокси, атом галогена, C1-4 алкил, необязательно замещенный одним или более атомами галогена, 5-10 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R14, C6-10 арил, необязательно замещенный одним или более заместителями R14, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями R14.
[0148] (5-3) Соединение по пункту (5-1) или (5-2) или его соль, или сольват соединения или сольват соли соединения, где
R1 представляет собой атом водорода или линейный C1-6 алкил;
R2 может быть одинаковым или различным и каждый независимо выбирают из C1-3 алкила и атома галогена;
Re представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ra, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена, гидрокси, нитро, циано, (C1-3 алкокси)карбонила, 5-10 членного гетероциклоалкилокси, C1-10 алкила, необязательно замещенного одним или более заместителями R10, C2-10 алкинила, необязательно замещенного одним или более заместителями R11, C1-8 алкокси, необязательно замещенного одним или более заместителями R12, и C1-3 алкилтио, необязательно замещенного одним или более заместителями R13;
каждый R10 независимо выбирают из карбоксила, 5-10 членного гетероциклоалкила, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, и группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4);
каждый R11 независимо выбирают из гидрокси, карбокси, 5-10 членного гетероциклоалкила, необязательно замещенного одной или более оксогруппами, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, группы -(O(CH2)o)p-OH (где o и p каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4) и C3-6 циклоалкила, необязательно замещенного одной или более гидроксильными группами;
каждый R12 выбирают из атома галогена, гидрокси, C1-6 алкокси, необязательно замещенного одной или более гидроксильными группами, (C1-3 алкокси)карбонила, 5-10 членного гетероциклоалкила и 5-10 членного гетероарила;
каждый R13 независимо выбирают из 5-10 членного гетероциклоалкила;
Rb представляет собой необязательно C1-3 алкоксизамещенный C1-4 алкокси или атом галогена; и
каждый R14 независимо выбирают из атома галогена, циано, нитро, C1-4 алкила, необязательно замещенного одним или более атомами галогена, C1-4 алкокси, необязательно замещенного одним или более атомами галогена, (C1-6 алкокси)карбонила, группы -NR27R28 (где R27 и R28 каждый независимо выбирают из атома водорода и необязательно (C1-3 алкокси)карбонилзамещенного C1-4 алкила), группы -SO2NR35R36 (где R35 и R36 каждый независимо выбирают из атома водорода и C1-3 алкила), C1-3 алкилтио и 5-10 членного гетероциклоалкила.
[0149] (5-4) Соединение по любому одному из пунктов (5-1) - (5-3) или его соль, или сольват соединения или сольват соли соединения, где Re выбирают из C6-10 арила, необязательно замещенного одним или более заместителями Ra.
[0150] (5-5) Соединение по любому одному из пунктов (5-1) - (5-4) или его соль, или сольват соединения или сольват соли соединения, где
Ar1 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена с помощью Rb, Rc и/или Rd;
Rb представляет собой атом галогена или необязательно C1-3 алкоксизамещенный C1-4 алкокси; и/или
Rc представляет собой атом галогена или C1-10 алкил, необязательно замещенный одним или более атомами галогена; и/или
Rd представляет собой 5-6 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R14, фенил, необязательно замещенный одним или более заместителями R14, или 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R14.
[0151] (5-6) Соединение по любому одному из пунктов (5-1) - (5-5) или его соль, или сольват соединения или сольват соли соединения, где
Ar1 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb представляет собой атом галогена;
Rc представляет собой атом галогена, C1-10 алкил, необязательно замещенный одним или более атомами галогена, или группу -SF5; и
Rd представляет собой циано, гидрокси или атом галогена.
[0152] (5-7) Соединение по любому одному из пунктов (5-1) - (5-6) или его соль, или сольват соединения или сольват соли соединения, где Rd представляет собой фенил, тиенил, пиридинил, пиримидинил или хинолинил, где эти группы каждая необязательно замещена одним или более заместителями R14.
[0153] (5-8) Соединение по любому одному из пунктов (5-1) - (5-7) или его соль, или сольват соединения или сольват соли соединения, где R1 представляет собой линейный C1-6 алкил.
[0154] (5-9) Соединение по любому одному из пунктов (5-1) - (5-8) или его соль, или сольват соединения или сольват соли соединения, где R2 представляет собой атом водорода.
[0155] (5-10) Соединение по любому одному из пунктов (5-1) - (5-9) или его соль, или сольват соединения или сольват соли соединения, где
R1 представляет собой линейный C1-6 алкил;
R2 представляет собой атом водорода;
R3 представляет собой C1-4 алкил, замещенный Re;
Re представляет собой фенил, необязательно замещенный одним или более заместителями Ra;
каждый Ra независимо выбирают из атома галогена и необязательно R12-замещенного C1-8 алкокси;
каждый R12 независимо выбирают из 5-6 членного гетероциклоалкила;
Ar1 представляет собой фенил, необязательно замещенный одним-тремя заместителями, выбранными из Rb, Rc и Rd;
Rb представляет собой необязательно C1-3 алкоксизамещенный C1-4 алкокси и атом галогена; и/или
Rc представляет собой атом галогена или C1-10 алкил, необязательно замещенный одним или более атомами галогена; и/или
Rd представляет собой 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R14; и
каждый R14 независимо выбирают из C1-4 алкила, необязательно замещенного одним или более атомами галогена.
[0156] (5-11) Соединение по любому одному из пунктов (5-1) - (5-10) или его соль, или сольват соединения или сольват соли соединения, где R10, R11, R12, R13 и R15 каждый независимо выбирают из тетрагидрофуранила, пирролидинила, морфолинила, циклопентила и пиридинила.
[0157] (5-12) Соединение по любому одному из пунктов (5-1) - (5-11) или его соль, или сольват соединения или сольват соли соединения, где R3 представляет собой бензил, необязательно замещенный одним или более заместителями Ra на бензольном кольце.
[0158] Альтернативный вариант осуществления настоящего изобретения предлагает следующие соединения (6-1) - (6-10), представленные формулой (I):
[0159] (6-1) Соединение, представленное формулой I-b или его соль, или сольват соединения или сольват соли соединения:
[0160]
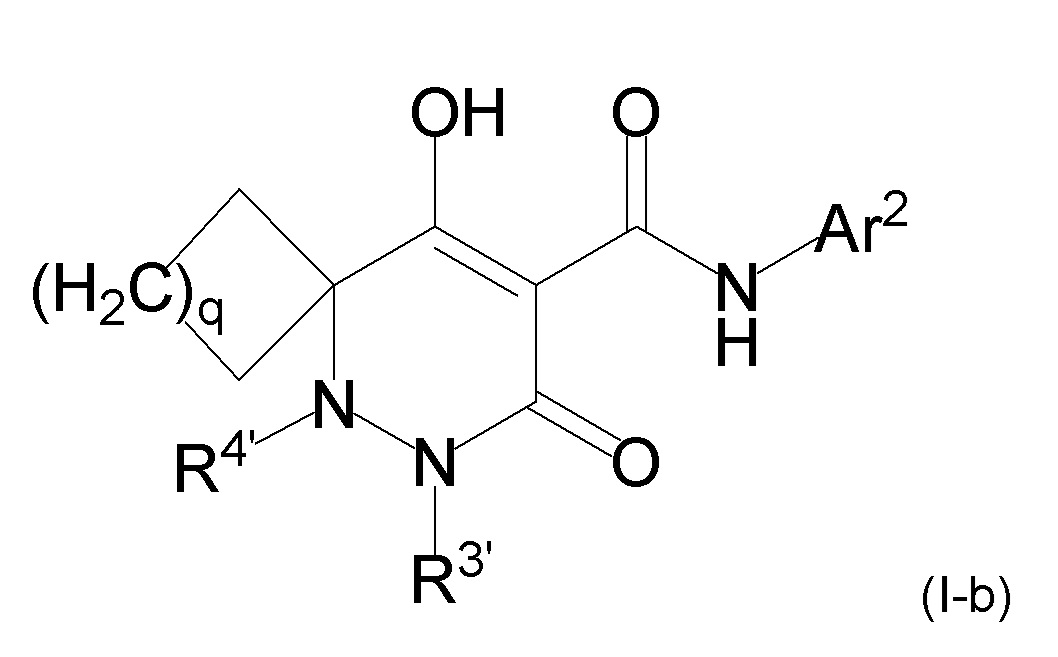
[0161] где
R4' выбирают из C1-4 алкила;
к представляет собой целое число, выбранное в диапазоне от 0 до 3;
R3' выбирают из C1-4 алкила, замещенного Re';
Re' представляет собой C6-10 арил, где арильная группа необязательно замещена одним-тремя заместителями, каждый из которых независимо выбирают из атома галогена, C1-4 алкокси, необязательно замещенного одним или более заместителями R12', 4-6 членный гетероциклоалкилокси (гетероциклоалкилоксильная группа необязательно замещена необязательно замещенным C1-4 алкоксизамещенным C1-4 алкилом), группу -(O(CH2)q1)q2-NR41'R42' (где q1 представляет собой целое число, выбранное в диапазоне от 1 до 4, и q2 представляет собой целое число, выбранное в диапазоне от 2 до 6, группу -(O(CH2)r1)r2-C(O)NR43'R44' (где r1 представляет собой целое число, выбранное в диапазоне от 1 до 4, и R2 представляет собой целое число, выбранное в диапазоне от 1 до 4), группу -(O(CH2)s1)s2-NR45'-C(O)R46' (где s1 и s2 каждый независимо представляет собой целое число, выбранное в диапазоне от 2 до 4), группу -C(O)NR47'R48', пиридинил, пирролил, группу -NR49'R50' и группу -(O(CH2)y1)y2-O-CH2-C(O)NR51'R52' (где y1 представляет собой целое число, выбранное в диапазоне от 1 до 4, и y2 представляет собой целое число, выбранное в диапазоне от 1 до 4);
каждый R12' независимо выбирают из (C1-4 алкокси)C1-6 алкокси, 5-6 членного гетероциклоалкила и группы -NR39'R40', где 5-6 членная гетероциклоалкильная группа необязательно замещена одним или более заместителями, выбранными из оксо, атома галогена, C1-4 алкила (где алкильная группа необязательно замещена одной или более гидроксильными группами), (C1-4 алкокси)C1-4 алкила (где алкоксильный фрагмент необязательно замещен одной или более гидроксильными группами), C1-4 алкокси, C1-4 алкоксикарбонила, C1-4 алкилтио, морфолино, (C1-3 алкил)сульфонила и -C(O)NR53'R54';
R39' выбирают из атома водорода и необязательно C1-6 алкоксизамещенного C1-6 алкила;
R40' независимо выбирают из атома водорода, необязательно C1-6 алкоксизамещенного C1-6 алкила, ((C1-4 алкокси)карбонил)C1-6 алкила, гидроксизамещенного C1-6 алкила, группы -(CH2)u-NR55'R56' (где u представляет собой целое число, выбранное в диапазоне от 1 до 4), группы -CH((CH2)v1COOR57')-(CH2)v2-COOR57' (где v1 представляет собой целое число, выбранное в диапазоне от 0 до 2, и v2 представляет собой целое число, выбранное в диапазоне от 1 до 3), группы -(CH2)w-SO3H (где w представляет собой целое число, выбранное в диапазоне от 1 до 4), группы -(CH2)x1-CH(COOH)-(CH2)x2-SO3H (где x1 представляет собой целое число, выбранное в диапазоне от 0 до 2, и x2 представляет собой целое число, выбранное в диапазоне от 1 до 3), 3-6 членного оксациклоалкила и группы -(CH2)t1-O-(CH2)t2-C(O)NR58'R59' (где t1 и t2 каждый независимо представляет собой целое число, выбранное в диапазоне от 1 до 3);
R41' представляет собой атом водорода или C1-3 алкил;
R42' представляет собой C1-8 алкил, замещенный одной или более гидроксильными группами, или (C1-3 алкокси)C1-4 алкил:
R43' представляет собой атом водорода или C1-3 алкил;
R44' представляет собой C1-8 алкил, замещенный одной или более гидроксильными группами, где
R43' и R44' вместе с атомом азота, к которому они присоединены, могут образовывать морфолино;
R45' представляет собой атом водорода и C1-3 алкил;
R46' представляет собой C1-6 алкил, замещенный одной или более гидроксильными группами;
R47' представляет собой C1-3 алкил;
R48' представляет собой (C1-3 алкокси)C1-4 алкил;
R49' представляет собой атом водорода или C1-4 алкил;
R50' представляет собой -(CH2)z-NR60'R61' (z представляет собой целое число, выбранное в диапазоне от 1 до 4, R60' представляет собой атом водорода и C1-4 алкил, и R61' представляет собой (C1-3 алкокси)C1-4 алкил, или R60' и R61' вместе с атомом азота, к которому они присоединены, могут образовывать морфолино);
R51' представляет собой атом водорода и C1-4 алкил;
R52' представляет собой C1-8 алкил, замещенный одной или более гидроксильными группами;
R53' и R54' каждый независимо выбирают из атома водорода и C1-4 алкила;
R55' представляет собой атом водорода или C1-4 алкил;
R56' представляет собой (C1-4 алкил)карбонил;
R57' представляет собой атом водорода или C1-4 алкил;
R58' представляет собой атом водорода или C1-3 алкил;
R59' представляет собой C1-8 алкил, замещенный одной или более гидроксильными группами;
Ar2 представляет собой фенил или 5-6 членный гетероарил, где арильная и гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb', Rc' и Rd';
Rb', Rc' и Rd' каждый независимо выбирают из необязательно C1-4 алкоксизамещенного C1-5 алкокси, атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, и 5-6 членного гетероарила, необязательно замещеного одним или более заместителями R14'; и
каждый R14' независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, и C1-4 алкилтио.
[0162] (6-2) Соединение по пункту (6-1) или его соль, или сольват соединения или сольват соли соединения, где
R4' представляет собой C1-4 алкил;
к представляет собой целое число, выбранное в диапазоне от 0 до 3;
R3' представляет собой C1-4 алкил, замещенный Re';
Re' представляет собой C6-10 арил, где арильная группа необязательно замещена одним-тремя заместителями, каждый из которых независимо выбирают из атома галогена и C1-4 алкокси, необязательно замещенного одним или более заместителями R12';
каждый R12' независимо выбирают из 5-6 членного гетероциклоалкила и группы -NR39'R40';
R39' и R40' каждый независимо выбирают из атома водорода и необязательно C1-4 алкоксизамещенного C1-4 алкила;
Ar2 представляет собой фенил или 5-6 членный гетероарил, где фенильная и гетероарильная группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb', Rc' и Rd';
Rb', Rc' и Rd' каждый независимо выбирают из атома галогена, C1-4 алкила, необязательно замещенного одним или более атомами галогена, и 5-6 членного гетероарила, необязательно замещенного одним или более заместителями R14'; и
каждый R14' независимо выбирают из атома галогена, циано, C1-4 алкила, необязательно замещенного одним или более атомами галогена, и C1-4 алкилтио.
[0163] (6-3) Соединение по пункту (6-1) или (6-2) или его соль, или сольват соединения или сольват соли соединения, где
Rb' представляет собой атом галогена;
Rc' представляет собой атом галогена или C1-4 алкил, необязательно замещенный одним или более атомами галогена; и
Rd' представляет собой атом галогена или 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R14'.
[0164] (6-4) Соединение по любому одному из пунктов (6-1) - (6-3) или его соль, или сольват соединения или сольват соли соединения, где R3' представляет собой бензил, где фенил в бензильной группе необязательно замещен одним-тремя заместителями, каждый из которых независимо выбран из атома галогена и C1-4 алкокси, необязательно замещенного одним или более заместителями R12'.
[0165] (6-5) Соединение по любому одному из пунктов (6-1) - (6-4) или его соль, или сольват соединения или сольват соли соединения, где Re' представляет собой фенил, где фенильная группа необязательно замещена одним заместителем, выбранным из Ri', Rj' и Rk', двумя заместителями, выбранными из комбинации Ri' и Rj', Ri' и Rk', и Rj' и Rk', или тремя заместителями Ri', Rj' и Rk';
Ri' и Rj' каждый представляет собой независимо атом галогена; и
Rk' представляет собой C1-4 алкокси, необязательно замещенный одним или более заместителями R12'.
[0166] (6-6) Соединение по любому одному из пунктов (6-1) - (6-5) или его соль, или сольват соединения или сольват соли соединения, где
Ar2 представляет собой фенил или пиридинил;
Rd' представляет собой пиридинил или пиримидинил; и
R12' представляет собой морфолинил или -NR39'R40'.
[0167] (6-7) Соединение по любому одному из пунктов (6-1) - (6-6) или его соль, или сольват соединения или сольват соли соединения, где R12' выбирают из морфолинила, [N-((C1-3алкокси)C1-4 алкил)-N-(C1-3алкил)амино] и [N,N-ди(C1-3 алкил)амино].
[0168] (6-8) Соединение по любому одному из пунктов (6-1) - (6-3) или его соль, или сольват соединения или сольват соли соединения, где Ra выбирают из атома галогена, (морфолино)C1-4алкокси, [N-((C1-3алкокси)C1-4 алкил)-N-(C1-3алкил)амино]C1-4 алкокси и [N,N-ди(C1-3 алкил)амино]C1-4алкокси.
[0169] (6-9) Соединение по пункту (6-5) или (6-6) или его соль, или сольват соединения или сольват соли соединения, где Rk выбирают из (морфолино)C1-4алкокси, [N-((C1-3алкокси)C1-4 алкил)-N-(C1-3алкил)амино]C1-4 алкокси и [N,N-ди(C1-3 алкил)амино]C1-4алкокси.
[0170] (6-10) Соединение по любому одному из пунктов (6-1) - (6-6) или его соль, или сольват соединения или сольват соли соединения, где R12' представляет собой группу -NR39'R40'.
[0171] Альтернативный аспект настоящего изобретения предлагает лекарственный препарат, включающий соединение по любому из пунктов (4-1) - (4-12), (5-1) - (5-12), и (6-1) - (6-10) или его соль, или сольват соединения или сольват соли соединения.
[0172] Дополнительный альтернативный аспект настоящего изобретения предлагает фармацевтическую композицию, включающую соединение по любому из пунктов (4-1) - (4-12), (5-1) - (5-12), и (6-1) - (6-10) или его соль, или сольват соединения или сольват соли соединения.
[0173] Дополнительный альтернативный аспект настоящего изобретения предлагает соединение по любому одному из пунктов (4-1) - (4-12), (5-1) - (5-12), и (6-1) - (6-10) или его соль, или сольват соединения или сольват соли соединения для использования при профилактике и/или лечении заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности.
[0174] Дополнительный альтернативный аспект настоящего изобретения предлагает ингибитор NaPi-IIb, включающий соединение по любому одному из пунктов (4-1) - (4-12), (5-1) - (5-12), и (6-1) - (6-10) или его соль, или сольват соединения или сольват соли соединения.
[0175] Дополнительный альтернативный аспект настоящего изобретения предлагает профилактическое и/или терапевтическое средство для заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности, где средство включает соединение по любому из пунктов (4-1) - (4-12), (5-1) - (5-12), и (6-1) - (6-10) или его соль, или сольват соединения или сольват соли соединения в качестве активного ингредиента.
[0176] Дополнительный альтернативный аспект настоящего изобретения предлагает способ профилактики и/или лечения заболевания, выбранного из гиперфосфатемии, вторичного гиперпаратиреоза и хронической почечной недостаточности, включающий введение терапевтически эффективного количества соединения по любому из пунктов (4-1) - (4-12), (5-1) - (5-12), и (6-1) - (6-10) или его соль, или сольват соединения или сольват соли соединения пациенту.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0177] Соединение, его соль и сольват соединения или сольват соли соединения обладают исключительным ингибирующим действием в отношении NaPi-IIb, ингибирующим действием в отношении PiT-1 или ингибирующим действием в отношении PiT-2 и применяются в качестве профилактического и/или лечебного средства при гиперфосфатемии. Кроме того, соединение, его соль и сольват соединения или сольват соли соединения применяются в качестве профилактического и/или лечебного средства при вторичном гиперпаратиреозе или хронической почечной недостаточности.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0178] Далее будут описаны соединение настоящего изобретения или его соль, или сольват соединения или сольват соли соединения, способ получения соединения и лекарственный препарат, содержащий это соединение.
[0179] Определения
В настоящем изобретении, "атом галогена" означает атом фтора, атом хлора, атом брома, атом йода и другой подобный атом. В настоящем изобретении, предпочтительные примеры атома галогена, используемого в качестве заместителя для арила, гетероарила и так далее, включают атом фтора, атом хлора, и атом брома. В настоящем изобретении, предпочтительные примеры атома галогена, используемого в качестве заместителя для алкила или группы, частично содержащей алкил (алкокси, алкенил, алкилтио, и так далее), включают атом фтора. Конкретные примеры групп, имеющих атом галогена в качестве заместителя, включают трифторметил, пентафторэтил, трифторметокси, пентафторэтокси, трифторметилтио, и пентафторэтилтио.
[0180] В настоящем изобретении, "C1-3 алкил" относится к одновалентной группе, образующейся из линейного или разветвленного насыщенного алифатического углеводорода, имеющего от 1 до 3 углеродных атомов, в результате потери одного произвольного атома водорода. Его конкретные примеры включают метил, этил, н-пропил и изопропил.
[0181] В настоящем изобретении, "C1-4 алкил" относится к одновалентной группе, образующейся из линейного или разветвленного насыщенного алифатического углеводорода, имеющего от 1 до 4 углеродных атомов, в результате потери одного произвольного атома водорода. Его конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, третбутил и 1-метилпропил.
[0182] В настоящем изобретении, "C1-5 алкил" относится к одновалентной группе, образующейся из линейного или разветвленного насыщенного алифатического углеводорода, имеющего от 1 до 5 углеродных атомов, в результате потери одного произвольного атома водорода. Его конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, третбутил, 1-метилпропил, н-пентил, изопентил, 2-метилбутил, 1,1-диметилпропил и 1-этилпропил.
[0183] В настоящем изобретении, "C1-6 алкил" относится к одновалентной группе, образующейся из линейного или разветвленного насыщенного алифатического углеводорода, имеющего от 1 до 6 углеродных атомов, в результате потери одного произвольного атома водорода. Его конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, третбутил, 1-метилпропил, н-пентил, изопентил, 2-метилбутил, 1,1-диметилпропил, 1-этилпропил, гексил, 4-метилпентил и 2-этилбутил.
[0184] В настоящем изобретении, "C1-8 алкил" относится к одновалентной группе, образующейся из линейного или разветвленного насыщенного алифатического углеводорода, имеющего от 1 до 8 углеродных атомов, в результате потери одного произвольного атома водорода. Его конкретные примеры включают группы, перечисленные выше при определении "C1-6 алкила", а также н-гептил, 5-метилгексил, 1-пропилбутил, 2-этил-2-метилбутил, н-октил, 5-метилгептил, 2,3-диметилгексил, 1-метил-1-пропилбутил и 2,2-диэтилбутил.
[0185] В настоящем изобретении, "C1-10 алкил" относится к одновалентной группе, образующейся из линейного или разветвленного насыщенного алифатического углеводорода, имеющего от 1 до 10 углеродных атомов, в результате потери одного произвольного атома водорода. Его конкретные примеры включают группы, перечисленные выше при определении "C1-8 алкила", а также 7-метилоктил, 5-этилгептил, н-децил, 8-метилнонил, 5,5-диметилоктил и 4-этил-6-метилгептил.
[0186] В настоящем изобретении, "линейный C1-6 алкил" относится к одновалентной группе, образующейся из линейного насыщенного алифатического углеводорода, имеющего от 1 до 6 углеродных атомов, в результате потери одного произвольного атома водорода. "Линейный C1-6 алкил" конкретно означает метил, этил, н-пропил, н-бутил, н-пентил и н-гексил.
[0187] В настоящем изобретении, "линейный C1-10 алкил" относится к одновалентной группе, образующейся из линейного насыщенного алифатического углеводорода, имеющего от 1 до 10 углеродных атомов, в результате потери одного произвольного атома водорода. "Линейный C1-10 алкил" конкретно означает метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил, н-октил, n-нонил и н-децил.
[0188] В настоящем изобретении, "морфолино" означает морфолин-4-ил.
[0189] В настоящем изобретении, "(морфолино)C1-6 алкил" означает C1-6 алкильную группу, замещенную с помощью морфолино. "C1-6 алкил" определен выше. Его конкретные примеры включают морфолинометил, морфолиноэтил, морфолино-н-пропил, морфолиноизопропил, морфолино-н-бутил, морфолиноизобутил, морфолино-вторбутил, морфолино-третбутил, морфолино-1-метилпропил, морфолино-н-пентил, морфолиноизопентил, морфолино-2-метилбутил, морфолино-1,1-диметилпропил, морфолино-1-этилпропил, морфолиногексил, морфолино-4-метилпентил и морфолино-2-этилбутил. Его предпочтительные примеры включают морфолинометил.
[0190] В настоящем изобретении, "(морфолино)C1-4 алкил" означает C1-4 алкильную группу, замещенную с помощью морфолино. "C1-4 алкил" определен выше. Его конкретные примеры включают морфолинометил, морфолиноэтил, морфолино-н-пропил, морфолиноизопропил, морфолино-н-бутил, морфолиноизобутил, морфолино-вторбутил, морфолино-третбутил, и морфолино-1-метилпропил. Его предпочтительные примеры включают морфолинометил.
[0191] В настоящем изобретении, "(оксетанил)C1-4 алкил" означает C1-4 алкильную группу, замещенную с помощью оксетанила. "C1-4 алкил" определен выше. Его конкретные примеры включают оксетанилметил, оксетанилэтил, оксетанил-н-пропил, оксетанилизопропил, оксетанил-н-бутил, оксетанилизобутил, оксетанил-вторбутил, оксетанил-третбутил, и оксетанил-1-метилпропил. Его предпочтительные примеры включают оксетанилметил.
[0192] В настоящем изобретении, "(4-6 членный гетероциклоалкил)C1-4 алкил" означает C1-4 алкил, замещенный 4-6 членным гетероциклоалкилом. "C1-4 алкил" определен выше. "4-6 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 4 до 6 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S, и N. "(4-6 членный гетероциклоалкил)C1-4 алкил" включает "(морфолино)C1-4 алкил" и "(оксетанил)C1-4 алкил".
[0193] В настоящем изобретении, "(карбокси)C1-8 алкил" означает C1-8 алкил, замещенный с помощью карбокси. "C1-8 алкил" определен выше. Его конкретные примеры включают карбокси-н-гексил, карбокси-н-гептил, карбокси-5-метилгексил, карбокси-1-пропилбутил, карбокси-2-этил-2-метилбутил, карбокси-н-октил, карбокси-5-метилгептил, карбокси-2,3-диметилгексил, карбокси-1-метил-1-пропилбутил, и карбокси-2,2-диэтилбутил. Его предпочтительные примеры включают карбокси-н-гексил, карбокси-н-гептил и карбокси-н-октил.
В настоящем изобретении, "(C1-6 алкокси)C1-8 алкил" означает C1-8 алкил, замещенный с помощью C1-6 алкокси. "C1-6 алкокси" и "C1-8 алкил" определены выше и ниже. Его конкретные примеры включают этокси-н-пропил, н-пропокси-н-пропил, н-бутокси-н-пропил, н-гептоксипропил, н-пропокси-н-гексил, н-бутокси-н-гексил, н-пропокси-н-гептил, и н-бутокси-н-гептил. Его предпочтительные примеры включают н-пропокси-н-пропил и н-бутокси-н-гептил.
[0194] В настоящем изобретении, "(C1-3 алкокси)C1-4 алкил" означает C1-4 алкил, замещенный с помощью C1-3 алкокси. "C1-3 алкокси" и "C1-4 алкил" определены выше и ниже. Его конкретные примеры включают метоксиметил, метоксиэтил, этоксиметил, метокси-н-пропил, этокси-н-пропил, метокси-н-бутил и этокси-н-бутил.
[0195] В настоящем изобретении, "(C1-4 алкокси)C1-4 алкил" означает C1-4 алкил, замещенный с помощью C1-4 алкокси. "C1-4 алкокси" и "C1-4 алкил" определены выше и ниже. Его конкретные примеры включают группы, перечисленные выше при определении "(C1-3 алкокси)C1-4 алкила", а также н-бутоксиметил, н-бутоксиэтил, н-бутокси-н-пропил, и н-бутокси-н-бутил.
[0196] В настоящем изобретении, "(C1-3 алкокси)C1-6 алкил" означает C1-6 алкил, замещенный с помощью C1-3 алкокси. "C1-3 алкокси" и "C1-6 алкил" определены выше и ниже. Его конкретные примеры включают группы, перечисленные выше при определении "(C1-3 алкокси)C1-4 алкила" и "(C1-4 алкокси)C1-4 алкила". Его предпочтительные примеры включают метокси-н-пропил.
[0197] В настоящем изобретении, "[HO-((CH2)oO)p]C1-6 алкил" относится к C1-6 алкилу, замещенному с помощью группы -(O(CH2)o)p-OH. C1-6 алкил определен выше. Его конкретные примеры включают [HO-((CH2)2O)3]пропил.
[0198] В настоящем изобретении, "C1-5 алкилен" относится к двухвалентной группе, образующейся из линейного или разветвенного насыщенного алифатического углеводорода, имеющего от 1 до 5 углеродных атомов, в результате потери двух произвольных атомов водорода. "C1-5 алкилен" включает "C1-3 алкилен". Его конкретные примеры включают -CH2-, -CH(CH3)-, -C(CH3)2-, -CH2CH2-, -CH2CH(CH3)-, -CH2C(CH3)2-, -CH(CH2CH3)-, -C(CH2CH3)2-, и -CH(CH2CH2CH3)-. Предпочтительным является -CH2-.
[0199] В настоящем изобретении, два или более заместителей R2 на 5-8 членном насыщенном гетероциклическом кольце могут вместе образовывать C1-5 алкилен, который связывает кольцевые атомы, к которым они присоединены. В этом случае, насыщенное гетероциклическое кольцо образует бициклическое кольцо или трициклическое кольцо и так далее.
[0200] В настоящем изобретении, "C2-10 алкинил" относится к относится к одновалентной группе, образующейся из линейного или разветвленного алифатического углеводорода, имеющего от 2 до 10 углеродных атомов и имеющего, по меньшей мере, одну тройную связь (два смежных SP углеродных атомов), в результате потери одного произвольного атома водорода. Его конкретные примеры включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 3-метил-1-бутинил, 1,1-диметил-2-пропинил, 1-гексинил, гептинил, гептадиинил, октинил и октадиинил.
[0201] В настоящем изобретении, "необязательно замещенный C2-10 алкинил" означает описанный выше незамещенный C2-10 алкинил или C2-10 алкинил, в котором один или более атомов водорода заменены на заранее определенный заместитель (заместители). Два или более заместителей на этой группе могут быть одинаковыми или отличаться друг от друга. Один углеродный атом может быть замещен с помощью множества заместителей.
[0202] В настоящем изобретении, "C2-6 алкинил" относится к одновалентной группе, образующейся из линейного или разветвленного алифатического углеводорода, имеющего от 2 до 6 углеродных атомов и имеющего, по меньшей мере, одну тройную связь (два смежных SP углеродных атомов), в результате потери одного произвольного атома водорода. Его конкретные примеры включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 3-метил-1-бутинил, 1,1-диметил-2-пропинил, и 1-гексинил.
[0203] В настоящем изобретении, "необязательно замещенный C2-6 алкинил" означает описанный выше незамещенный C2-6 алкинил или C2-6 алкинил, в котором один или более атомов водорода заменены на заранее определенный заместитель (заместители). Два или более заместителей на этой группе могут быть одинаковыми или отличаться друг от друга. Один углеродный атом может быть замещен с помощью множества заместителей.
[0204] В настоящем изобретении, "(карбокси)C2-6 алкинил" означает C2-6 алкинил, замещенный с помощью карбокси. C2-6 алкинил определен выше. Его конкретные примеры включают карбоксиэтинил, карбокси-1-пропинил, карбокси-2-пропинил, карбокси-1-бутинил, карбокси-2-бутинил, карбокси-3-бутинил, карбокси-1-метил-2-пропинил, карбокси-1-пентинил, карбокси-2-пентинил, карбокси-3-пентинил, карбокси-4-пентинил, карбокси-1-метил-2-бутинил, карбокси-1-метил-3-бутинил, карбокси-2-метил-3-бутинил, карбокси-3-метил-1-бутинил, карбокси-1,1-диметил-2-пропинил и карбокси-1-гексинил. Его предпочтительные примеры включают карбокси-1-пентинил и карбокси-1-гексинил.
[0205] В настоящем изобретении, "(C1-6 алкокси)C2-8 алкинил" означает C2-8 алкинил, замещенный с помощью C1-6 алкокси. C1-6 алкокси и C2-8 алкинил определены выше. Его конкретные примеры включают этокси-1-пропинил, пропокси-1-пропинил, бутокси-1-пропинил, пропокси-1-бутинил, пропокси-1-гексинил, бутокси-1-гексинил, пропокси-1-гептинил, и бутокси-1-гептинил. Его предпочтительные примеры включают этокси-1-пропинил, пропокси-1-пропинил, бутокси-1-пропинил, пропокси-1-бутинил, пропокси-1-гексинил и бутокси-1-гептинил.
[0206] В настоящем изобретении, "(морфолино)C2-6 алкинил" означает C2-6 алкинил, замещенный с помощью морфолино. C2-6 алкинил определен выше. Его конкретные примеры включают морфолиноэтинил, морфолино-1-пропинил, морфолино-2-пропинил, морфолино-1-бутинил, морфолино-2-бутинил, морфолино-3-бутинил, морфолино-1-пентинил, морфолино-2-пентинил, морфолино-3-пентинил, морфолино-4-пентинил и морфолино-1-гексинил. Его предпочтительные примеры включают морфолино-1-пропинил, морфолино-1-бутинил и морфолино-1-гептинил.
[0207] В настоящем изобретении, примеры "(морфолино)C2-6 алкинила, замещенного оксогруппой (оксогруппами)" включают (морфолино)C2-6 алкинил, замещенный одной или двумя оксогруппами. Его предпочтительные примеры включают 3-(3-оксоморфолин-4-ил)-1-пропинил и (1,1-диоксотиоморфолин-4-ил)-1-пропинил.
[0208] В настоящем изобретении, "(3-6 членный оксациклоалкил)C2-6 алкинил" означает C2-6 алкинил, замещенный с помощью 3-6 членного оксациклоалкила. 3-6 членный оксациклоалкил и C2-6 алкинил определены в описании изобретения.
[0209] В настоящем изобретении, "(оксетанил)C2-6 алкинил" означает C2-6 алкинил, замещенный с помощью оксетанила. C2-6 алкинил определен выше. Его конкретные примеры включают оксетанилэтинил, оксетанил-1-пропинил, оксетанил-2-пропинил, оксетанил-1-бутинил, оксетанил-2-бутинил, оксетанил-3-бутинил, оксетанил-1-пентинил, оксетанил-2-пентинил, оксетанил-3-пентинил, оксетанил-4-пентинил и оксетанил-1-гексинил. Его предпочтительные примеры включают оксетанил-1-пропинил, оксетанил-1-бутинил и оксетанил-1-пентинил.
[0210] В настоящем изобретении, "(пирролидинo)C2-6 алкинил" означает C2-6 алкинил, замещенный с помощью пирролидинo. C2-6 алкинил определен выше. Его конкретные примеры включают пирролидинoэтинил, пирролидинo-1-пропинил, пирролидинo-2-пропинил, пирролидинo-1-бутинил, пирролидинo-2-бутинил, пирролидинo-3-бутинил, пирролидинo-1-пентинил, пирролидинo-2-пентинил, пирролидинo-3-пентинил, пирролидинo-4-пентинил и пирролидинo-1-гексинил. Его предпочтительные примеры включают пирролидинo-1-пропинил.
[0211] В настоящем изобретении, "(C3-6 циклоалкил)C2-6 алкинил" означает C2-6 алкинил, замещенный с помощью C3-6 циклоалкила. C3-6 циклоалкил и C2-6 алкинил определены выше. Его конкретные примеры включают циклопропилэтинил, циклобутилэтинил, циклопентилэтинил, циклогексилэтинил, циклопропил-1-пропинил, циклобутил-1-пропинил, циклопентил-1-пропинил, циклогексил-1-пропинил, циклопропил-1-бутинил, циклобутил-1-бутинил, циклопентил-1-бутинил и циклогексил-1-бутинил. Его предпочтительные примеры включают циклопропилэтинил, циклобутилэтинил, циклопентилэтинил, циклопропил-1-пропинил, циклобутил-1-пропинил и циклопентил-1-пропинил.
[0212] В настоящем изобретении, "[HO-((CH2)oO)p]C2-8 алкинил" означает C2-8 алкинил, замещенный группой -(O(CH2)o)p-OH. C2-8 алкинил определен выше. Его конкретные примеры включают [HO-((CH2)2O)3]пропинил и [HO-((CH2)2O)2]пропинил.
[0213] В настоящем изобретении, "[N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C2-6 алкинил" означает C2-6алкинил, замещенный с помощью N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино. В этом контексте, "[N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]" и "C2-6 алкинил" определены в этом описании изобретения. Конкретные примеры включают [N-(2-метоксиэтил)-N-(метил)амино]этинил, [N-(2-метокси-1,1-диметилэтил)-N-(метил)амино]этинил и [N-(2-метокси-2-метил-1-пропил)-N-(метил)амино]этинил.
[0214] В настоящем изобретении, "C1-3 алкокси" означает группу C1-3 алкил-O-. В этом контексте, C1-3 алкил определен выше. Его конкретные примеры включают метокси, этокси, 1-пропокси и 2-пропокси.
[0215] В настоящем изобретении, "C1-4 алкокси" означает группу C1-4 алкил-O-. В этом контексте, C1-4 алкил определен выше. Его конкретные примеры включают метокси, этокси, 1-пропокси, 2-пропокси, н-бутокси, изобутокси, вторбутокси и третбутокси.
[0216] В настоящем изобретении, "C1-5 алкокси" означает группу C1-5 алкил-O-. В этом контексте, C1-5 алкил определен выше. Его конкретные примеры включают метокси, этокси, 1-пропокси, 2-пропокси, н-бутокси, изобутокси, вторбутокси, третбутокси и 1-пентилокси.
[0217] В настоящем изобретении, "C1-6 алкокси" означает группу C1-6 алкил-O-. В этом контексте, C1-6 алкил определен выше. Его конкретные примеры включают метокси, этокси, 1-пропокси, 2-пропокси, н-бутокси, изобутокси, вторбутокси, третбутокси, 1-пентилокси и 1-гексилокси.
[0218] В настоящем изобретении, "C1-8 алкокси" означает группу C1-8 алкил-O-. Его конкретные примеры включают группы, перечисленные выше при определении "C1-6 алкокси", а также 1-гептилокси и 1-октилокси.
[0219] В настоящем изобретении, "(карбокси)C1-8 алкокси" означает C1-8 алкокси, замещенный с помощью одной карбоксильной группы. "C1-8 алкокси" определен выше. Его конкретные примеры включают карбокси-н-пропокси, карбокси-н-бутокси, карбокси-н-пентокси и карбокси-н-гексокси.
[0220] В настоящем изобретении, "(морфолино)C1-6 алкокси" означает C1-6 алкокси, замещенный с помощью морфолино. "C1-6 алкокси" определен выше. Его конкретные примеры включают морфолинометокси, морфолиноэтокси, морфолино-1-пропокси, морфолино-2-пропокси, морфолино-н-бутокси, морфолино-изобутокси, морфолино-вторбутокси, морфолино-третбутокси, морфолино-1-пентилокси и морфолино-1-гексилокси. Его предпочтительные примеры включают морфолиноэтокси.
[0221] В настоящем изобретении, "(3-6 членный оксациклоалкил)C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью 3-6 членного оксациклоалкила. "C1-4 алкокси" определен выше. 3-6 членный оксациклоалкил означает насыщенную гетероциклическую группу, состоящую из от 3 до 6 образующих кольцо атомов, содержащих один или два (предпочтительно один) атом кислорода. "(3-6 членный оксациклоалкил)C1-4 алкокси" включает (оксиранил)C1-4 алкокси, (оксетанил)C1-4 алкокси и (оксоланил)C1-4 алкокси. Его конкретные примеры включают оксиранилметокси, оксиранилэтокси, оксиранил-1-пропокси, оксиранил-н-бутокси, оксетанилметокси, оксетанилэтокси, оксетанил-1-пропокси, оксетанил-н-бутокси, оксоланилметокси, оксоланилэтокси, оксоланил-1-пропокси и оксоланил-н-бутокси. Его предпочтительные примеры включают оксоланилметокси, оксиранилметокси и оксетанилметокси.
[0222] В настоящем изобретении, "3-6 членный оксациклоалкилокси" означает 3-6 членный оксациклоалкил-O-. "3-6 членный оксациклоалкил" определен выше. Его конкретные примеры включают оксиранилокси, оксетанилокси, оксоланилокси и оксанилокси. Предпочтительными являются оксетанилокси, оксоланилокси или оксанилокси.
[0223] В настоящем изобретении, "4-6 членный азотсодержащий гетероциклоалкилокси" означает 4-6 членный азотсодержащий гетероциклоалкил-O-. "4-6 членный азотсодержащий гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 4 до 6 образующих кольцо атомов, содержащих один или два атома азота. Его конкретные примеры включают пирролидинилокси и азетидинилокси.
[0224] В настоящем изобретении, "(пиридинил)C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью пиридинила. "C1-4 алкокси" определен выше. Его конкретные примеры включают пиридинилметокси, пиридинилэтокси, пиридинил-1-пропокси и пиридинил-н-бутокси. Его предпочтительные примеры включают пиридинилметокси.
[0225] В настоящем изобретении, "(пиримидинил)C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью пиримидинила. "C1-4 алкокси" определен выше. Его конкретные примеры включают пиримидинилметокси, пиримидинилэтокси, пиримидинил-1-пропокси и пиримидинил-н-бутокси. Его предпочтительные примеры включают пиримидинилметокси.
[0226] В настоящем изобретении, "(1,2,4-триазолил)C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью 1,2,4-триазолила. "C1-4 алкокси" определен выше. Его конкретные примеры включают 1,2,4-триазолилметокси, 1,2,4-триазолилэтокси, 1,2,4-триазолил-1-пропокси и 1,2,4-триазолил-н-бутокси. Его предпочтительные примеры включают 1,2,4-триазолилэтокси.
[0227] В настоящем изобретении, "(3-6 членный гетероциклоалкил)C1-6 алкокси" означает C1-6 алкокси, замещенный с помощью 3-6 членного гетероциклоалкила. 3-6 членный гетероциклоалкил означает насыщенную гетероциклическую группу, состоящую из от 3 до 6 образующих кольцо атомов, сордержащих от одного до трех гетероатомов, выбранных из O, S, и N. C1-6 алкокси определен выше. “(3-6 членный гетероциклоалкил)C1-6 алкокси" включает (морфолино)C1-6алкокси, (3-6 членный оксациклоалкил)C1-4 алкокси, (пирролидинил)C1-4 алкокси, (азетидинил)C1-4 алкокси и (пиперидинил)C1-4алкокси. Его конкретные примеры включают морфолинометокси, морфолиноэтокси, морфолино-1,1-диметил-этокси(морфолино-третбутокси), морфолино-1-метил-этокси(морфолино-2-пропокси), тетрагидрофуранилметокси, пирролидинилметокси, пирролидинилэтокси, азетидинилметокси, азетидинилэтокси, пиперидинилметокси, пиперидинилэтокси, пиперазинилметокси, пиперазинилэтокси.
[0228] В настоящем изобретении, "(5-6 членный гетероарил)C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью 5-6 членного гетероарила. 5-6 членный гетероарил и C1-4 алкокси определены в изобретении. Его конкретные примеры включают 1,2,4-триазолилэтокси.
[0229] В настоящем изобретении, "(C1-6 алкокси)C1-6 алкокси" означает C1-6 алкокси, замещенный с помощью C1-6 алкокси. "C1-6 алкокси" определен выше. "(C1-6 алкокси)C1-6 алкокси" включает "(C1-4 алкокси)C1-6 алкокси", "C1-3 алкокси(C1-4 алкокси)" и другую подобную группу. Его конкретные примеры включают метоксиметокси, метоксиэтокси, этоксиметокси, этоксиэтокси, метоксипропокси, этоксипропокси, пропоксиметокси, пропоксиэтокси, пропоксипропокси, метоксибутокси, этоксибутокси, пропоксибутокси, бутоксиметокси, бутоксиэтокси, бутоксипропокси, бутоксибутокси, метоксипентокси, этоксипентокси, пропоксипентокси, бутоксипентокси, пентоксиметокси, пентоксиэтокси, пентоксипропокси, пентоксибутокси, пентоксипентокси, метоксигексокси, этоксигексокси, пропоксигексокси, бутоксигексокси, пентоксигексокси, гексоксиметокси, гексоксиэтокси, гексоксипропокси, гексоксибутокси, гексоксипентокси, и гексоксигексокси. Его предпочтительные примеры включают пропоксибутокси, пропоксипентокси и пропоксигексокси.
[0230] В настоящем изобретении, "(C1-6 алкокси)C1-8 алкокси" означает C1-8 алкокси, замещенный с помощью C1-6 алкокси. "C1-6 алкокси" и "C1-8 алкокси" определены выше. Его конкретные примеры включают группы, перечисленные выше при определении "(C1-6 алкокси)C1-6 алкокси", а также гексоксигептилокси и гексоксиоктилокси.
[0231] В настоящем изобретении, "(C1-3 алкокси(C1-4 алкокси))C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью C1-3 алкокси(C1-4 алкокси). "C1-3 алкокси(C1-4 алкокси)" означает C1-4 алкокси, замещенный с помощью C1-3 алкокси. "C1-4 алкокси" и "C1-3 алкокси" определены выше. Его конкретные примеры включают метоксиэтоксиэтокси, этоксиэтоксиэтокси и метоксиэтоксиметокси.
[0232] В настоящем изобретении, "[N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино. В этом контексте, "[N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]" означает амино, замещенный с помощью (C1-3 алкокси)C1-4 алкила и C1-3 алкила. (C1-3 алкокси)C1-4 алкил и C1-3 алкил определены выше. Конкретные примеры "[N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]C1-4 алкокси" включают [N-(метоксиэтил)-N-(метил)амино]этокси, [N-(метокси-1,1-диметилэтил)-N-(метил)амино]этокси и [N-(-метокси-2-метил-1-пропил)-N-(метил)амино]этокси.
[0233] В настоящем изобретении, "[N-(3-6 членный гетероциклоалкил)-N-(C1-3 алкил)амино]C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью N-(3-6 членный гетероциклоалкил)-N-(C1-3 алкил)амино. В этом контексте, "[N-(3-6 членный гетероциклоалкил)-N-(C1-3 алкил)амино]" означает амино, замещенный с помощью 3-6 членного гетероциклоалкила и C1-3 алкила. 3-6 членный гетероциклоалкил определен в изобретении. Его конкретные примеры включают [N-тетрагидрофуранил-N-(метил)амино]этокси, [N-тетрагидропиранил-N-(метил)амино]этокси и [N-оксетанил-N-(метил)амино]этокси.
[0234] В настоящем изобретении, [N,N-ди((гидрокси)C1-4 алкил)амино]C1-4 алкокси означает C1-4 алкокси, замещенный с помощью N,N-ди((гидрокси)C1-4 алкил)-амино. "[N,N-ди((гидрокси)C1-4 алкил)амино]" означает амино, замещенный с помощью двух (гидрокси)C1-4 алкильных групп.(Гидрокси)C1-4 алкил означает C1-4 алкил, замещенный одной гидроксильной группой. Его конкретные примеры включают [N,N-ди(2-гидроксиэтил)амино]этокси.
[0235] В настоящем изобретении, "[N-((C1-3 алкокси)карбонил)C1-3 алкил-N-(C1-3 алкил)амино]C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью N-((C1-3 алкокси)карбонил)C1-3 алкил-N-(C1-3 алкил)амино. [N-((C1-3 алкокси)карбонил)C1-3 алкил-N-(C1-3 алкил)амино] означает амино, замещенный с помощью ((C1-3 алкокси)карбонил)C1-3 алкила и C1-3 алкила. "((C1-3 алкокси)карбонил)C1-3 алкил" означает C1-3 алкил, замещенный с помощью (C1-3 алкокси)карбонила. Его конкретные примеры включают [N-((метокси)карбонил)метил-N-метиламино]этокси.
[0236] В настоящем изобретении, "[N-(гидрокси)C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью N-(гидрокси)C1-4 алкил-N-(C1-3 алкил)амино. "N-(гидрокси)C1-4 алкил-N-(C1-3 алкил)амино" означает амино, замещенный с помощью (гидрокси)C1-4 алкила и C1-3 алкила. "(Гидрокси)C1-4 алкил" означает C1-4 алкил, замещенный одной гидроксильной группой. Его конкретные примеры включают [N-(2-гидроксиэтил)-N-метиламино]этокси.
[0237] В настоящем изобретении, "[N,N-ди((C1-3 алкокси)C1-4 алкил)амино]C1-6 алкокси" означает C1-6 алкокси, замещенный с помощью N,N-ди((C1-3 алкокси)C1-4 алкил)амино. "N,N-ди((C1-3 алкокси)C1-4 алкил)амино" означает амино, замещенный с помощью двух (C1-3 алкокси)C1-4 алкильных групп."(C1-3 алкокси)C1-4 алкил" определен выше. Его конкретные примеры включают [N,N-ди((метокси)этокси)амино]этокси.
[0238] В настоящем изобретении, "[N,N-ди(C1-3 алкил)амино]C1-6 алкокси" означает C1-6 алкокси, замещенный с помощью N,N-ди(C1-3 алкил)амино. "N,N-ди(C1-3 алкил) амино" означает амино, замещенный с помощью двух C1-3 алкильных групп."C1-6 алкокси" и "C1-3 алкил" определены выше. Его конкретные примеры включают 3-[N,N-ди(метил)амино]-2,2-диметил-пропокси.
[0239] В настоящем изобретении, "[N-[N-(C1-4 алкил)карбонил-N-(C1-3алкил)амино] C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью N-[N-(C1-4 алкил) карбонил-N-(C1-3алкил) амино] C1-4 алкил-N-(C1-3 алкил)амино. C1-4 алкокси определен ранее. "N-[N-(C1-4 алкил)карбонил-N-(C1-3алкил) амино] C1-4 алкил-N-(C1-3 алкил)амино" означает амино, замещенный с помощью [N-(C1-4 алкил)карбонил-N-(C1-3алкил)амино] C1-4 алкила и C1-3 алкила. C1-3 алкил определен ранее. "[N-(C1-4 алкил) карбонил-N-(C1-3алкил) амино] C1-4 алкил" означает C1-4 алкил, замещенный с помощью N-(C1-4 алкил)карбонил-N-(C1-3алкил)амино. "N-(C1-4 алкил) карбонил-N-(C1-3алкил)амино" означает амино, замещенный с помощью (C1-4 алкил)карбонила и C1-3 алкила. Его конкретные примеры включают 2-[N-[2-(N-ацетил-N-(метил)амино)этил]-N-(метил)амино]-этокси.
[0240] В настоящем изобретении, "[N-[N-(C1-4 алкил)карбонил-амино]C1-4 алкил-N-(C1-3 алкил)амино]C1-4 алкокси" означает C1-4 алкокси, замещенный с помощью N-[N-(C1-4 алкил)карбонил-амино]C1-4 алкил-N-(C1-3 алкил)амино. C1-4 алкокси определен ранее. "N-[N-(C1-4 алкил)карбонил-амино]C1-4 алкил-N-(C1-3 алкил)амино" означает амино, замещенный с помощью [N-(C1-4 алкил)карбонил-амино]C1-4 алкила и C1-3 алкила. C1-3 алкил определен ранее. "[N-(C1-4 алкил) карбонил-амино]C1-4 алкил" означает C1-4 алкил, замещенный с помощью N-(C1-4 алкил)карбонил-амино. "N-(C1-4 алкил)карбонил-амино" означает амино, замещенный с помощью (C1-4 алкил)карбонила. Его конкретные примеры включают 2-[N-[2-(ацетиламино)этил]-N-(метил)амино]этокси.
[0241] В настоящем изобретении, "C1-3 алкилтио" означает группу C1-3 алкил-S-. В этом контексте, C1-3 алкил определен выше. Его конкретные примеры включают метилтио, этилтио, н-пропилтио и изопропилтио.
[0242] В настоящем изобретении, "C1-4 алкилтио" означает группу C1-4 алкил-S-. В этом контексте, C1-4 алкил определен выше. Его конкретные примеры включают метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио и третбутилтио.
[0243] В настоящем изобретении, "(морфолино)C1-4 алкилтио" означает C1-4 алкилтио, замещенный с помощью морфолино. C1-4 алкилтио определен выше. Его конкретные примеры включают морфолинометилтио, морфолиноэтилтио, морфолино-н-пропилтио, морфолино-изопропилтио, морфолино-н-бутилтио, морфолино-изобутилтио и морфолино-третбутилтио. Его предпочтительные примеры включают морфолиноэтилтио.
[0244] В настоящем изобретении, "(5-6 членный гетероциклоалкил)C1-4 алкилтио" означает C1-4 алкилтио, замещенный с помощью 5-6 членного гетероциклоалкила. 5-6 членный гетероциклоалкил и C1-4 алкилтио определены в изобретении. "(5-6 членный гетероциклоалкил)C1-4 алкилтио" включает "(морфолино)C1-4 алкилтио". Его предпочтительные примеры включают 2-морфолиноэтилтио.
[0245] В настоящем изобретении, "(C1-6 алкил)карбонил" означает группу C1-6 алкил-C(O)-. В этом контексте, C1-6 алкил определен выше. "(C1-6 алкил)карбонил" включает "(C1-4 алкил)карбонил". Его конкретные примеры включают метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, вторбутилкарбонил, третбутилкарбонил, 1-метилпропилкарбонил, н-пентилкарбонил, изопентилкарбонил, 2-метилбутилкарбонил, 1,1-диметилпропилкарбонил, 1-этилпропилкарбонил, гексилкарбонил, 4-метилпентилкарбонил и 2-этилбутилкарбонил.
[0246] В настоящем изобретении, "ди(C1-3 алкил)амино)карбонил" означает карбонил, замещенный с помощью ди(C1-3 алкил)амино. "Ди(C1-3 алкил)амино" означает амино, замещенный с помощью двух C1-3 алкильных групп.Его конкретные примеры включают диметиламинокарбонил и диэтиламинокарбонил.
[0247] В настоящем изобретении, "(C1-3 алкил)сульфонил" означает группу C1-3 алкил-SO2-. В этом контексте, C1-3 алкил определен выше. Его конкретные примеры включают метилсульфонил, этилсульфонил и н-пропилсульфонил. Его предпочтительные примеры включают метилсульфонил.
[0248] В настоящем изобретении, "(C1-6 алкокси)карбонил" означает группу C1-6 алкил-O-C(O)-. В этом контексте, C1-6 алкил определен выше. Его конкретные примеры включают группы, перечисленные при определении "(C1-4 алкокси)карбонила", а также н-пентилоксикарбонил, изопентилоксикарбонил, 2-метилбутокси-карбонил, 1,1-диметилпропоксикарбонил, 1-этилпропоксикарбонил, гексилоксикарбонил, 4-метилпентилоксикарбонил и 2-этилбутокси-карбонил.
[0249] В настоящем изобретении, "(C1-4 алкокси)карбонил" означает группу C1-4 алкил-O-C(O)-. В этом контексте, C1-4 алкил определен выше. Его конкретные примеры включают метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, вторбутоксикарбонил, третбутоксикарбонил и 1-метилпропоксикарбонил.
[0250] В настоящем изобретении, "(C1-3 алкокси)карбонил" означает группу C1-3 алкил-O-C(O)-. В этом контексте, C1-3 алкил определен выше. Его конкретные примеры включают метоксикарбонил, этоксикарбонил, н-пропоксикарбонил и изопропоксикарбонил.
[0251] В настоящем изобретении, "((C1-4 алкокси)карбонил)C1-6 алкил" означает C1-6 алкил, замещенный с помощью (C1-4 алкокси)карбонила. В этом контексте, (C1-4 алкокси)карбонил и C1-6 алкил определены выше. Его конкретные примеры включают метоксикарбонилметил, метоксикарбонилэтил, этоксикарбонилметил, этоксикарбонилэтил, н-пропоксикарбонилметил и изопропокси-карбонилметил. Его предпочтительные примеры включают метоксикарбонилметил и метоксикарбонилэтил.
[0252] В настоящем изобретении, "((C1-3 алкокси)карбонил)C1-3 алкокси" означает C1-3 алкокси, замещенный с помощью (C1-3 алкокси)карбонильной группы. В этом контексте, (C1-3 алкокси)карбонил и C1-3 алкил определены выше. Его конкретные примеры включают метоксикарбонилметокси, метоксикарбонилэтокси, этоксикарбонилметокси, этоксикарбонилэтокси, н-пропоксикарбонил-метокси и изопропоксикарбонилметокси. Его предпочтительные примеры включают метоксикарбонилметокси и метоксикарбонилэтокси.
[0253] В настоящем изобретении, "C6-10 арил" означает одновалентную ароматическую углеводородную кольцевую группу. Примеры C6-10 арила включают фенил, 1-нафтил, и 2-нафтил.
[0254] В настоящем изобретении, "(C6-10 арил)карбонил" означает группу C6-10 арил-C(O)-. В этом контексте, C6-10 арил определен выше. Его конкретные примеры включают фенилкарбонил, 1-нафтилкарбонил и 2-нафтилкарбонил.
[0255] В настоящем изобретении, "5-10 членный гетероарил" означает ароматическую кольцевую группу, состоящую из от 5 до 10 образующих кольцо атомов, содержащих один или несколько (например, от 1 до 5, предпочтительно, от 1 до 3) гетероатомов. Кольцо может представлять собой моноциклическое или бициклическое кольцо. Примеры "5-10 членного гетероарила" включают "5-6 членный гетероарил". Конкретные примеры "5-10 членного гетероарила" включают тиенил, пиридазинил, пиразинил, тиазолил, оксазолил, изотиазолил, тиадиазолил, оксадиазолил, изоксазолил, пиразолил, хинолинил, изохинолил, бензотиазолил, бензоксазолил, бензимидазолил, пиридинил, пиримидинил, индолил, имидазолил, фурил, тиоксазолил, пирролил, тетразолил, оксопиримидинил, нафтил, бензодиоксинил, бензизоксазолил, бензизотиазолил, индазолил, бензотиенил, бензофуранил, бензопиранил и триазолил.
[0256] В настоящем изобретении, "5-6 членный гетероарил" означает ароматическую кольцевую группу, состоящую из 5 или 6 образующих кольцо атомов, содержащих один или несколько (например, от 1 до 4, предпочтительно, от 1 до 3, более предпочтительно 1 или 2) гетероатомов. Его конкретные примеры включают тиенил, пиридазинил, пиразинил, тиазолил, оксазолил, изотиазолил, тиадиазолил, оксадиазолил, изоксазолил, пиразолил, пиридинил, пиримидинил, фурил, тиоксазолил и триазолил.
[0257] В настоящем изобретении, "C3-6 насыщенное карбоциклическое кольцо" относится к циклоалкановому кольцу, имеющему от 3 до 6 образующих кольцо углеродных атомов, и оно включает, например, циклопропан, циклобутан, циклопентан и циклогексан. В формуле (I), R1 и R5 вместе с углеродным атомом, к которому они присоединены, могут образовывать C3-6 насыщенное карбоциклическое кольцо. В этом случае, C3-6 насыщенное карбоциклическое кольцо образует спирокольцо. В формуле (I), C3-6 насыщенное карбоциклическое кольцо, образованное R1 и R5 вместе с углеродным атомом, к которому они присоединены, представляет собой, предпочтительно, циклобутан, циклопентан или циклогексан, особенно предпочтительно, циклобутан или циклопентан.
[0258] В настоящем изобретении, "5-8 членное насыщенное гетероциклическое кольцо" означает насыщенную гетероциклическую группу, состоящую от 5 до 8 образующих кольцо атомов, содержащих один N в качестве гетероатома. Его конкретные примеры включают пирролидин, пиперидин, азепан и азокан, и, в частности, включают пирролидин и пиперидин.
[0259] В настоящем изобретении, n представляет собой, предпочтительно, целое число, выбранное в диапазоне от 1 до 3, особенно предпочтительно, 1 или 2.
[0260] Когда Re (или Rx) представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Ra (или Ry), или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями Ra (или Ry), C6-10 арил представляет собой, предпочтительно, фенил, и 5-10 членный гетероарил представляет собой, предпочтительно, индолил. В частности, когда R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, не образуют 5-8 членное насыщенное гетероциклическое кольцо, Re представляет собой, предпочтительно, фенил.
[0261] В настоящем изобретении, Ar1 (или Ar101) представляет собой, предпочтительно, фенил, нафтил, фурил, тиенил, пиридазинил, пиразинил, тиазолил, оксазолил, изотиазолил, тиадиазолил, оксадиазолил, изоксазолил, пиразолил, хинолинил, изохинолил, бензотиазолил, бензоксазолил, бензимидазолил, пиридинил, пиримидинил или индолил. Эти группы каждая необязательно замещена одним-тремя заместителями, выбранными из Rb (или Rz1), Rc (или Rz2), и Rd (или Rz3). Когда R4 и R5 вместе с углеродным атомом, к которому они присоединены, образуют 5-8 членное насыщенное гетероциклическое кольцо или в случае соединения, представленного формулой (II), Ar1 (или Ar101) представляет собой, более предпочтительно, фенил, фурил, пиридинил или пиримидинил.
[0262] Когда R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, не образуют 5-8 членное насыщенное гетероциклическое кольцо, Ar1 представляет собой, предпочтительно, фенил, пиридинил или пиримидинил.
[0263] В настоящем изобретении, Rd (или Rz3) представляет собой, предпочтительно, фенил, тиенил, пиридинил, пиримидинил, хинолинил, пиразолил, имидазолил, изоксазолил, оксазолил, тиазолил, изотиазолил, пиридазинил, пиразинил, фурил, тиадиазолил, тиоксазолил, оксадиазолил, пирролил, тетразолил, оксопиримидинил, нафтил, бензодиоксинил, изохинолинил, бензоксазолил, бензотиазолил, бензизоксазолил, бензизотиазолил, индолил, индазолил, бензотиенил, бензофуранил, бензопиранил, пиперазинил, пиперидил, морфолинил, тиоморфолинил, пирролидинил, диоксопирролидинил, диоксопиперидинил, диоксотетрагидро-пиримидинил, оксоимидазолидинил или диоксоимидазолидинил. Эти группы каждая необязательно замещена одним или более заместителями R14. Когда R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, образуют 5-8 членное насыщенное гетероциклическое кольцо или в случае соединения, представленного формулой (II), Rd (или Rz3) представляет собой, предпочтительно, фенил, тиенил, пиридинил, пиримидинил, хинолинил, пиперидинил, морфолинил, тиоморфолинил, или пиперазинил, более предпочтительно, фенил, тиенил, пиридинил, пиримидинил, хинолинил или пиперидинил. Когда R4 и R5 вместе с углеродным атомом и атомом азота, к которым они присоединены, не образуют 5-8 членное насыщенное гетероциклическое кольцо, Rd (или Rz3) представляет собой, предпочтительно, фенил, пиридинил, пиримидинил, морфолинил, тиоморфолинил, пиперидинил, или пиперазинил, более предпочтительно, фенил, пиридинил или пиримидинил.
[0264] В настоящем изобретении, "C3-6 циклоалкил" означает циклическую насыщенную алифатическую углеводородную группу, имеющую от 3 до 6 углеродных атомов. Его конкретные примеры включают циклопропил, циклобутил, циклопентил и циклогексил.
[0265] В настоящем изобретении, "C3-7 циклоалкил" означает циклическую насыщенную алифатическую углеводородную группу, имеющую от 3 до 7 углеродных атомов. Его конкретные примеры включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
[0266] В настоящем изобретении, "3-10 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 3 до 10 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных их O, S и N. Гетероциклоалкил может представлять собой моноциклический, бициклический или спироциклический гетероциклоалкил. Конкретные примеры "3-10 членного гетероциклоалкила" включают группы, перечисленные позже при определении "4-10 членного гетероциклоалкила", а также оксиранил.
[0267] В настоящем изобретении, "4-10 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 4 до 10 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S, и N. Гетероциклоалкил может представлять собой моноциклический, бициклический или спироциклический гетероциклоалкил. Примеры "4-10 членного гетероциклоалкила" включают "5-10 членный гетероциклоалкил", "5-8 членный гетероциклоалкил", "6-8 членный гетероциклоалкил" и "5-6 членный гетероциклоалкил". Конкретные примеры "4-10 членного гетероциклоалкила" включают группы, перечисленные позже при определении "5-10 членного гетероциклоалкила", а также оксетанил, азетидинил и 3,7-диокса-9-азабицикло[3.3.1]нонанил.
[0268] В настоящем изобретении, "5-10 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 5 до 10 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S и N. Гетероциклоалкил может представлять собой моноциклический, бициклический или спироциклический гетероциклоалкил. Примеры "5-10 членного гетероциклоалкила" включают "6-8 членный гетероциклоалкил" и "5-6 членный гетероциклоалкил". Конкретные примеры "5-10 членного гетероциклоалкила" включают пиперазинил, пиперидинил, морфолинил, тиоморфолинил, пирролидинил, тетрагидропиранил, тетрагидрофуранил, 2-окса-6-азаспиро[3.3]гептил, 2-азаспиро[3.3]гептил, 2,6-диазаспиро[3.3]гептил и 2-тиа-6-азаспиро[3.3]гептил.
[0269] В настоящем изобретении, "4-8 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 4 до 8 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S и N. Гетероциклоалкил может представлять собой моноциклический, бициклический или спироциклический гетероциклоалкил. Конкретные примеры "4-8 членного гетероциклоалкила" включают примеры, описанные в качестве конкретных примеров "5-8 членного гетероциклоалкила".
[0270] В настоящем изобретении, "5-8 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 5 до 8 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S и N. Гетероциклоалкил может представлять собой моноциклический, бициклический или спироциклический гетероциклоалкил. Примеры "5-8 членного гетероциклоалкила" включают "6-8 членный гетероциклоалкил" и "5-6 членный гетероциклоалкил". Конкретные примеры "5-8 членного гетероциклоалкила" включают примеры, описанные в качестве конкретных примеров "6-8 членного гетероциклоалкила".
[0271] В настоящем изобретении, "6-8 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 6 до 8 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S и N. Гетероциклоалкил может представлять собой моноциклический, бициклический или спироциклический гетероциклоалкил. Его конкретные примеры включают пиперазинил, пиперидинил, морфолинил, тиоморфолинил, тетрагидрофуранил, 2-окса-6-азаспиро[3.3]гептил, 2-азаспиро[3.3]гептил, 2,6-диазаспиро[3.3]гептил, и 2-тиа-6-азаспиро[3.3]гептил и, в частности, включают 2-оксо-6-азаспиро[3.3]гептил, 2-азаспиро[3.3]гептил, 2,6-диазаспиро[3.3]-гептил и 2-тиа-6-азаспиро[3.3]гептил.
[0272] В настоящем изобретении, "3-6 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 3 до 6 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S и N. Его конкретные примеры включают группы, перечисленные позже при определении "5-6 членного гетероциклоалкила", а также оксетанил.
[0273] В настоящем изобретении, "4-6 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 4 до 8 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S и N. Его конкретные примеры включают группы, перечисленные позже при определении "5-6 членного гетероциклоалкила".
[0274] В настоящем изобретении, "5-6 членный гетероциклоалкил" означает насыщенную гетероциклическую группу, состоящую из 5 или 6 образующих кольцо атомов, содержащих от одного до трех гетероатомов, выбранных из O, S и N. Конкретные примеры гетероциклоалкила включают пиперазинил, пиперидинил, морфолинил, тиоморфолинил, пирролидинил, тетрагидропиранил и тетрагидрофуранил.
[0275] В настоящем изобретении, "3-6 членный оксациклоалкил" означает насыщенную гетероциклическую группу, состоящую из от 3 до 6 образующих кольцо атомов, содержащих один или два атома кислорода. Его конкретные примеры включают оксетанил, тетрагидрофуранил и тетрагидропиранил.
[0276] В настоящем изобретении, "3-10 членный гетероциклоалкилокси" означает группу 3-10 членный гетероциклоалкил-O-. В этом контексте, 3-10 членный гетероциклоалкил определен выше. Его конкретные примеры включают оксиранилокси, оксетанилокси, тетрагидрофуранилокси и тетрагидропиранилокси. Предпочтительным является тетрагидропиранилокси.
[0277] В настоящем изобретении, "5-10 членный гетероциклоалкилокси" означает группу 5-10 членный гетероциклоалкил-O-. В этом контексте, 5-10 членный гетероциклоалкил определен выше. "5-10 членный гетероциклоалкилокси" представляет собой, предпочтительно, тетрагидропиранилокси или тетрагидрофуранилокси, особенно предпочтительно, тетрагидропиранилокси.
[0278] В настоящем изобретении, "4-6 членный гетероциклоалкилокси" означает группу 4-6 членный гетероциклоалкил-O-. В этом контексте, 4-6 членный гетероциклоалкил определен выше.
[0279] В настоящем изобретении, "5-6 членный гетероциклоалкилокси" означает группу 5-6 членный гетероциклоалкил-O-. В этом контексте, 5-6 членный гетероциклоалкил определен выше.
[0280] В настоящем изобретении, "3-6 членный гетероциклоалкилокси" означает группу 3-6 членный гетероциклоалкил-O-. В этом контексте, 3-6 членный гетероциклоалкил определен выше.
[0281] В настоящем изобретении, "3-10 членный гетероциклоалкил", "4-10 членный гетероциклоалкил", "5-10 членный гетероциклоалкил", "5-8 членный гетероциклоалкил", "6-8 членный гетероциклоалкил", "4-8 членный гетероциклоалкил", "3-6 членный гетероциклоалкил", "5-6 членный гетероциклоалкил", "5-10 членный гетероциклоалкилокси", "3-6 членный гетероциклоалкилокси", "5-6 членный гетероциклоалкилокси" или "4-6 членный азотсодержащий гетероциклоалкилокси" могут быть замещены заранее определенным заместителем (заместителями). В этом случае, заместитель (заместители) вводят в каждую из этих групп через углеродный атом или гетероатом, образующие кольцо гетероциклоалкила или гетероциклоалкилокси.
[0282] Когда Re (или Rx) представляет собой 5-10 членный гетероарил, необязательно замещенный одним или более заместителями Ra (или Ry), эта группа содержит, например, от одного до трех атомов азота в качестве образующих кольцо групп.
[0283] Когда Ra (или Ry) представляет собой 5-10 членный гетероциклоалкилокси, 3-6 членный гетероциклоалкилокси или 4-6 членный гетероциклоалкилокси, эта группа содержит, например, от одного до трех атомов кислорода или один атом азота в качестве образующих кольцо групп.Примеры гетероциклоалкилоксильной группы включают тетрагидропиранилокси, оксетанилокси, пирролидинилокси, азетидинилокси и пиперидинилокси.
[0284] Когда R10 (или R110) представляет собой 3-10 членный гетероциклоалкил, 4-10 членный гетероциклоалкил, 5-10 членный гетероциклоалкил, 3-6 членный гетероциклоалкил или 5-6 членный гетероциклоалкил, эта группа содержит, например, от одного до трех гетероатомов, выбранных из атома азота, атома кислорода и атома серы, предпочтительно, атом азота и атом кислорода в качестве образующих кольцо групп.Когда R10 (или R110) представляет собой 3-10 членный гетероциклоалкил, 4-10 членный гетероциклоалкил, 5-10 членный гетероциклоалкил, 3-6 членный гетероциклоалкил или 5-6 членный гетероциклоалкил, эта группа представляет собой, предпочтительно, морфолинил, гомоморфолинил, тиоморфолинил, пиперидинил, пиперазинил, гомопиперазинил, пирролидинил, азетидинил, тетрагидропиранил или тетрагидрофуранил, более предпочтительно, морфолинил. Эти группы каждая необязательно замещена заместителем (заместителями), описанным в качестве заместителей для соответствующей гетероциклоалкильной группы.
[0285] Когда R11 (или R111) представляет собой 3-10 членный гетероциклоалкил, 4-10 членный гетероциклоалкил, 5-10 членный гетероциклоалкил, или 5-6 членный гетероциклоалкил, эта группа содержит, например, от одного до трех гетероатомов, выбранных из атома азота и атома кислорода в качестве образующих кольцо групп.
[0286] Когда R11 (или R111) представляет собой C3-6 циклоалкил, 3-10 членный гетероциклоалкил, 4-10 членный гетероциклоалкил, 5-10 членный гетероциклоалкил, или 5-6 членный гетероциклоалкил, эта группа представляет собой, предпочтительно, циклопентил, морфолинил, пирролидинил, гомоморфолинил, тиоморфолинил, пиперидинил, пиперазинил, гомопиперазинил, тетрагидропиранил или тетрагидрофуранил, более предпочтительно, циклопентил, морфолинил или пирролидинил. Эти группы каждая необязательно замещена заместителем (заместителями), описанным в качестве заместителей для соответствующей циклоалкильной или гетероциклоалкильной группы.
[0287] Когда R12 (или R112) представляет собой 3-10 членный гетероциклоалкил, 4-10 членный гетероциклоалкил, 5-10 членный гетероциклоалкил, 3-6 членный гетероциклоалкил, или 5-6 членный гетероциклоалкил, эта группа содержит, например, от одного до трех гетероатомов, выбранных из атома азота, атома кислорода и атома серы, предпочтительно, атома азота и атома кислорода в качестве образующих кольцо групп.
[0288] Когда R12 (или R112) представляет собой 5-10 членный гетероарил или 5-6 членный гетероарил, эта группа содержит, например, от одного до трех гетероатомов, выбранных из атома азота, атома кислорода и атома серы, предпочтительно, атома азота и атома кислорода в качестве образующих кольцо групп. Более предпочтительно, чтобы эта группа содержала один атом азота в качестве гетероатома.
[0289] Когда R12 (или R112) представляет собой 3-10 членный гетероциклоалкил, 4-10 членный гетероциклоалкил, 5-10 членный гетероциклоалкил, 3-6 членный гетероциклоалкил, 5-6 членный гетероциклоалкил, 5-10 членный гетероарил, или 5-6 членный гетероарил, эта группа представляет собой предпочтительно морфолинил, тетрагидрофуранил, тетрагидропиранил, пирролидинил, пиперидинил, пиперазинил, азетидинил, тиоморфолинил, оксетанил, пиридинил или 1,2,4-триазолил, более предпочтительно, морфолинил, тетрагидрофуранил, пиридинил или 1,2,4-триазолил. Эти группы каждая необязательно замещена заместителем (заместителями), описанным в качестве заместителей для соответствующей гетероциклоалкильной или гетероарильной группы.
[0290] Когда R13 (или R113) представляет собой 3-10 членный гетероциклоалкил, 4-10 членный гетероциклоалкил, 5-10 членный гетероциклоалкил, или 5-6 членный гетероциклоалкил, эта группа содержит, например, от одного до трех гетероатомов, выбранных из атома азота, атома кислорода и атома серы, предпочтительно, атома азота и атома кислорода в качестве образующих кольцо групп.
[0291] Когда R13 (или R113) представляет собой 4-10 членный гетероциклоалкил, 5-10 членный гетероциклоалкил, или 5-6 членный гетероциклоалкил, эта группа представляет собой предпочтительно морфолинил, гомоморфолинил, тиоморфолинил, пиперидинил, пиперазинил, гомопиперазинил, пирролидинил, азетидинил или тетрагидропиранил, более предпочтительно, морфолинил. Эти группы каждая необязательно замещена заместителем (заместителями), описанным в качестве заместителей для соответствующей гетероциклоалкильной группы.
[0292] Когда R10 (или R110), R11 (или R111), R12 (или R112), R13 (или R113), или R15 (или R115) представляет собой C3-6 циклоалкил, необязательно замещенный одной или более гидроксильными группами, 3-10 членный гетероциклоалкил, 3-8 членный гетероциклоалкил, 5-6 членный гетероциклоалкил (эти гетероциклоалкильные группы каждая необязательно замещена одним или более заместителями, выбранными из заместителей, описанных в качестве заместителей для соответствующей гетероциклоалкильной группы, таких как оксо, атом галогена, C1-4 алкил (где C1-4 алкильная группа необязательно замещена одной или более гидроксильными группами)), или 5-10 членный гетероарил, эта циклоалкильная группа представляет собой, предпочтительно, циклопентил, циклогексил или циклобутил (эти группы каждая необязательно замещена одной или более гидроксильными группами); эта гетероциклоалкильная группа представляет собой, предпочтительно, тетрагидрофуранил, пирролидинил, морфолинил, гомоморфолинил, тиоморфолинил, пиперидинил, пиперазинил, гомопиперазинил, азетидинил или тетрагидропиранил (эти группы каждая необязательно замещена одним или более заместителями, выбранными выше); и эта гетероарильная группа представляет собой, предпочтительно, пиридинил, пиримидинил, пиридазинил, пиразинил, 1,2,4-триазолил. Циклоалкильная группа представляет собой, более предпочтительно, циклопентил (эта группа необязательно замещена одной или более гидроксильными группами); гетероциклоалкильная группа представляет собой, более предпочтительно, тетрагидрофуранил, пирролидинил или морфолинил (эти группы каждая необязательно замещена одним или более заместителями, описанными выше); и гетероарильная группа представляет собой, более предпочтительно, пиридинил.
[0293] Когда Ar1 (или Ar101) представляет собой 5-10 членный гетероарил или 5-6 членный гетероарил, эта группа содержит, например, от одного до трех гетероатомов, выбранных из атома азота, атома кислорода и атома серы в качестве образующих кольцо групп.Ar1 (или Ar101) необязательно замещен одним-тремя заместителями, выбранными из Rb (или Rz1; то же самое относится к описанию ниже), Rc (или Rz2; то же самое относится к описанию ниже), и Rd (или Rz3; то же самое относится к описанию ниже), то есть, необязательно замещен с помощью Rb, Rc или Rd, Rb и Rc, Rc и Rd, или Rb и Rd, или Rb, Rc и Rd.
[0294] Когда Rd (или Rz3) представляет собой 5-10 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R14 (или R114), эта группа содержит, например, от одного до трех гетероатомов, выбранных из атом азота, атома кислорода и атома серы, в качестве образующих кольцо групп.
[0295] Когда Rd (или Rz3) представляет собой 5-10 членный гетероарил или 5-6 членный гетероарил, необязательно замещенный одним или более заместителями R14 (или R114), эта группа содержит, например, от одного до трех гетероатомов, выбранных из атома азота и атома серы, в качестве образующих кольцо групп.
[0296] Когда R14 (или R114; то же самое относится к описанию ниже) представляет собой 5-10 членный гетероциклоалкил, эта группа содержит, например, от одного до трех гетероатомов, выбранных из атома азота и атома кислорода, в качестве образующих кольцо групп.Когда R14 представляет собой 5-10 членный гетероциклоалкил, эта группа представляет собой предпочтительно 2-окса-6-азаспиро[3.3]гептил, 2-азаспиро[3.3]гептил, 2,6-диазаспиро[3.3]гептил или 2-тиа-6-азаспиро[3.3]гептил, особенно предпочтительно, 2-окса-6-азаспиро[3.3]гептил.
[0297] Когда Re (или Rx) представляет собой C6-10 арил (например, фенил), необязательно замещенный одним или более заместителями Ra (или Ry), или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями Ra (или Ry), эта группа замещена, например, с помощью от 1 до 4 заместителей Ra (или Ry), предпочтительно, от 1 до 3 заместителей Ra (или Ry).
[0298] Когда R10 (или R110; то же самое относится к описанию ниже), R11 (или R111; то же самое относится к описанию ниже), R12 (или R112; то же самое относится к описанию ниже), R13 (или R113; то же самое относится к описанию ниже), или R15 (или R115; то же самое относится к описанию ниже) представляет собой C1-6 алкокси, необязательно замещенный одной или более гидроксильными группами, эта группа замещена, например, с помощью от 1 до 5 гидроксильных групп, предпочтительно, от 1 до 4 гидроксильных групп.
[0299] Когда R10, R11, R12, R13, или R15 представляет собой 5-10 членный гетероциклоалкил, необязательно замещенный одной или более оксогруппами, этьа группа замещена, например, с помощью от 1 до 3 оксогрупп, предпочтительно, 1 или 2 оксогрупп.
[0300] Когда R10, R11, R12, R13, или R15 представляет собой C3-6 циклоалкил, необязательно замещенный одной или более гидроксильными группами, эта группа замещена, например, с помощью от 1 до 3 гидроксильных групп, предпочтительно, 1 или 2 гидроксильных групп.
[0301] Когда Rb, Rc или Rd представляет собой 5-10 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R14, C6-10 арил, необязательно замещенный одним или более заместителями R14, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями R14, эта группа замещена, например, с помощью от 1 до 4 заместителей R14, предпочтительно, от 1 до 3 заместителей R14.
[0302] Когда R4 представляет собой C6-10 арил, необязательно замещенный одним или более заместителями Rg, эта C6-10 арильная gгруппа представляет собой, предпочтительно, фенил.
[0303] В группе -NR39R40, R39 представляет собой, предпочтительно, атом водорода или C1-3 алкил, более предпочтительно, метил. R40 представляет собой, предпочтительно, C1-3 алкил, C1-3 алкоксизамещенный C1-4 алкил, группу -CH((CH2)v1COOR57)-(CH2)v2-COOR57, 4-6 членный гетероциклоалкил, группу -(CH2)w-SO3H или группу -(CH2)x1-CH(COOH)-(CH2)x2-SO3H, более предпочтительно, метоксиэтил, 2-метокси-1,1-диметилэтил, 2-метокси-2-метил-1-пропил, группу -C2H3-(COOH)2, группу -C3H5-(COOH)2, оксетанил, метил, группу -C2H4-SO3H, или группу -CH(COOH)-CH2-SO3H. Примеры группы -NR39R40 включают N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино. В этом контексте, "[N-((C1-3 алкокси)C1-4 алкил)-N-(C1-3 алкил)амино]" определен выше. Группа -NR39R40 представляет собой, предпочтительно, N-(2-метоксиэтил)-N-(метил)амино, [N-(2-метокси-1,1-диметилэтил)-N-(метил)амино]этокси, [N-(2-метокси-2,2-диметилэтил)-N-(метил)амино]этокси, группу -NH-CH(COOH)-CH2(COOH), группу -NH-CH(CH2COOH)-CH2COOH, N-оксетанил-N-метиламино, диметиламино, группу -NH-C2H4-SO3H или группу -NH-CH(COOH)-CH2-SO3H.
[0304] В группе -(O(CH2)q1)q2-NR41R42, q1 представляет собой, предпочтительно, 2, и q2 представляет собой, предпочтительно, целое число, выбранное в диапазоне от 2 до 5. R41 представляет собой, предпочтительно, атом водорода или метил, и R42 представляет собой, предпочтительно, C1-6 алкил (предпочтительно, н-гексил), замещенный с помощью от 1 до 5 гидроксильных групп (предпочтительно, 5 гидроксильных групп) или метоксиэтил.
[0305] В группе -(O(CH2)r1)r2-C(O)NR43R44, r1 представляет собой, предпочтительно, 2 или 3, и R2 представляет собой предпочтительно 1. R43 представляет собой, предпочтительно, метил. R44 представляет собой, предпочтительно, C1-6 алкил (предпочтительно, н-гексил), замещенный с помощью от 1 до 5 гидроксильных групп (предпочтительно, 5 гидроксильных групп).
[0306] Соединение формулы (I), где R1 и R5 вместе с углеродным атомом, к которому они присоединены, образуют C3-6 насыщенное карбоциклическое кольцо, могут быть представлены следующей формулой (I-a) или (I-b):
[0307]
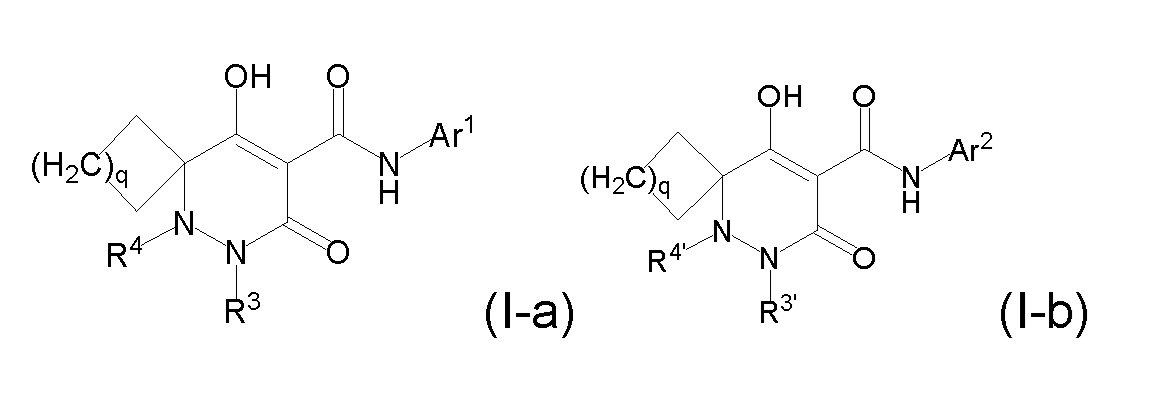
[0308] Группа -(CH2)к-, где к представляет собой 0, означает одинарную химическую связь.
[0309] В настоящем изобретении, соединение формулы (I), где R3 представляет собой C1-4 алкил, замещенный Re, может быть представлено формулой (I-c), приведенной ниже. В настоящем изобретении, соединение формулы (I), где R3 представляет собой C1-4 алкил, замещенный Re, Re замещен с помощью от одного до трех заместителей Ra, и от одного до трех заместителей Ra представляют собой один заместитель, выбранный из Ri, Rj и Rk, два заместителя, выбранные из комбинации Ri и Rj, Ri и Rk, и Rj и Rk, или три заместителя Ri, Rj и Rk, может быть представлено формулой (I-д), приведенной ниже.
[0310]
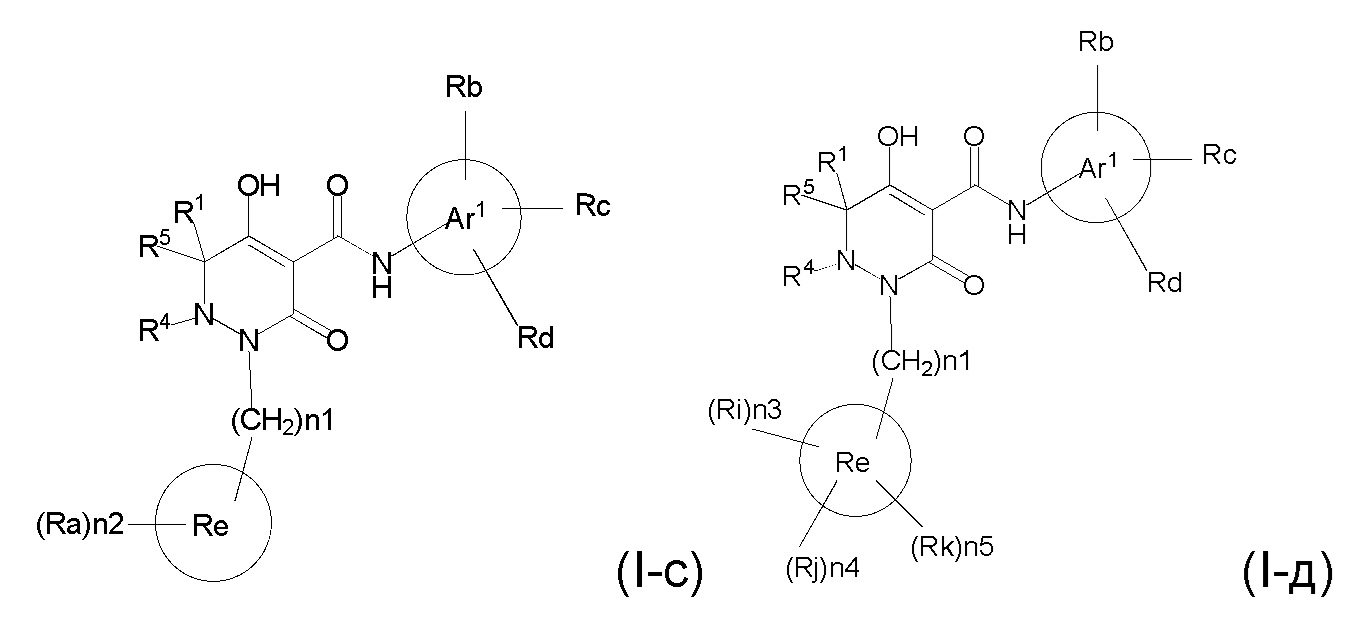
[0311] В формуле (I-c), n1 представляет собой целое число, выбранное в диапазоне от 1 до 4; n2 представляет собой целое число, выбранное в диапазоне от 0 или более; и R1, R4, R5, Ar1, Ra, Rb, Rc, Rd и Re определены в любом одном из пунктов (1-1) - (1-48), (2-1) - (2-25), (3-1) - (3-12), (4-1) - (4-12), (5-1) - (5-12), и (6-1) - (6-10). В формуле (I-д), n3, n4, и n5 каждый независимо представляет собой целое число, выбранное из 0 и 1, при условии, что, по меньшей мере, один из n3, n4 и n5 представляет собой 1; n1 определен выше; R1, R4, R5, Ar1, Rb, Rc, Rd, и Re определены в любом одном из пунктов (1-1) - (1-48), (2-1) - (2-25), (3-1) - (3-12), (4-1) - (4-12), (5-1) - (5-12), и (6-1) - (6-10).
В настоящем изобретении, n2 представляет собой, предпочтительно, целое число, выбранное в диапазоне от 1 до 4, более предпочтительно, целое число, выбранное в диапазоне от 1 до 3.
[0312] В настоящем изобретении, фраза "необязательно замещенный" или "замещенный" означает "необязательно замещенный с помощью одного заместителя" или "замещенный с помощью одного заместителя", соответственно, за исключением случаев, когда указано число заместителей (например, "с помощью одного или более", "с помощью от одного до трех", "с помощью одного или двух", "с помощью двух" или "с помощью одного"). Например, "B необязательно замещен с помощью A" и "B замещен с помощью A", означает "B необязательно замещен с помощью одного A" и "B замещен с помощью одного A", соответственно.
[0313] В настоящем изобретении, примеры соли соединения, представленного формулой (I), (II), (III), (I-a), (I-b), (I-c), или (I-д), включают соли присоединения кислоты и соли присоединения основания. Примеры солей присоединения кислоты включают гидрохлорид, гидробромид, гидройодид, фосфат, фосфонат и сульфат; сульфонаты, такие как метансульфонат, этансульфонат, бензолсульфонат и п-толуолсульфонат; и карбоксилаты, такие как ацетат, цитрат, малат, тартрат, сукцинат, салицилат, малеат, фумарат, бензоат, малонат, гликолат, оксалат, глюкуронат, адипат, глутарат, кетоглутарат, и гиппурат. Примеры солей присоединения основания включают соли щелочных металлов, такие как натриевая соль и калиевая соль; соли щелочноземельных металлов, такие как магниевая соль и кальциевая соль; соли аммония, такие как соль аммония, соль алкиламмония, соль диалкиламмония, соль триалкиламмония и соль тетраалкиламмония; и соли аминокислот, такие как соль лизина, соль аргинина, соль глицина, соль валина, соль треонина, соль серина, соль пролина и соль аланина. Каждую из этих солей получают путем контактирования соединения с кислотой или основанием, применяемыми в фармацевтитческом производстве.
[0314] В настоящем изобретении, соединение, представленное формулой (I), (II), (III), (I-a), (I-b), (I-c) или (I-д) или его соль может представлять собой ангидрат или может образовывать сольват, такой как гидрат. В этом контексте, "сольват" относится к твердому веществу, образованному комплексом молекулы соединения и молекулы растворителя, и он относится, например, к гидрату, образованному из воды в качестве растворителя. Сольват, не являющийся гидратом, включает твердое вещество, содержащее спирт (например, метанол, этанол и н-пропанол), диметилформамид или другие подобные растворители.
[0315] Соединение, представленное формулой (I), (II), (III), (I-a), (I-b), (I-c), или (I-д) и его соль могут существовать в виде нескольких таутомеров, например, в кето и энольных формах, иминовых и енаминовых формах и в виде их смесей. Такие таутомеры присутствуют в виде таутомерной смеси в растворе. В твердой форме, один из таутомеров обычно является преобладающим. Несмотря на то, что в изобретении может быть описан один из таутомеров, тем не менее, все таутомеры соединения настоящего изобретения всклочены в настоящее изобретение.
[0316] Настоящее изобретение дополнительно включает все стереоизомеры (например, энантиомеры и диастереомеры (в том числе цис- и транс-геометрические изомеры)) соединения, представленного формулой (I), (II), (III), (I-a), (I-b), (I-c), или (I-д), рацематы изомеров и другие смеси. Соединение настоящего изобретения может иметь, например, один или более асимметрических атомов. Соединение настоящего изобретения включает рацемические смеси, диастереоизомерные смеси и энантиомеры такого соединения.
[0317] Соединение, представленное формулой (I), (II), (III), (I-a), (I-b), (I-c) или (I-д), может быть получено в свободной форме. В этом случае, соединение в свободной форме может быть превращено стандартным методом в соль, которую может образовывать соединение, или в гидрат или сольват соединения или соли соединения.
[0318] В качестве варианта, соединение, представленное формулой (I), (II), (III), (I-a), (I-b), (I-c) или (I-д), может быть получено в виде соли, гидрата или сольвата соединения. В этом случае, эта форма может быть превращена в свободную форму соединения стандартным методом.
[0319] Каждый элемент, входящий в состав соединения, представленного формулой (I), (II), (III), (I-a), (I-b), (I-c) или (I-д), может представлять собой любой изотоп. Настоящее изобретение включает в себя соединение формулы (I), (II), (III), (I-a), (I-b), (I-c) или (I-д), содержащее такой изотоп. Изотоп в соединении относится к разновидности элемента, при которой, по меньшей мере, один атом заменен на атом с таким же атомным номером (с таким же числом протонов), но с отличающимся массовым числом (суммарным числом протонов и нейтронов). Примеры изотопа, содержащегося в лекарственном препарате настоящего изобретения, включают атом водорода, атом углерода, атом азота, атом кислорода, атом фосфора, атом серы, атом фтора и атом хлора, в том числе2H,3H,13C,14C,15N,17O,18O,31P,32P,35S,18F и36Cl. В частности, радиоизотоп, такой как3H или14C, которые подвергаются радиоактивному распаду, применяют, например, при исследовании in vivo распределения лекарственного препарата или соединения в тканях. Стабильные изотопы редко отклоняются от своей распространенности в природе без распада и также не обладают радиоактивностью. Поэтому, эти стабильные изотопы при применении безопасны. Изотоп в соединении, служащем в качестве активного ингредиента в лекарственном препарате настоящего изобретения, может быть превращен стандартным методом путем замены реагента, используемого в синтезе, на реагент, содержащий соответствующий изотоп.
[0320] Соединение, представленное формулой (I), (II), (III), (I-a), (I-b), (I-c) или (I-д), может быть введено в форме пролекарства. Настоящее изобретение также включает такое пролекарство соединения, представленного формулой (I), (II), (III), (I-a), (I-b), (I-c) или (I-д). В этом контексте, "пролекарство" настоящего изобретения означает производное соединения формулы (I), (II), (III), (I-a), (I-b), (I-c) или (I-д), которое превращается после введения в соединение формулы (I), (II), (III), (I-a), (I-b), (I-c) или (I-д) или его фармацевтически приемлемую соль ферментативного или неферментативного распада при физиологических условиях. Пролекарство может быть неактивным, когда его вводят пациенту. Пролекарство превращается in vivo в активное соединение формулы (I), (II), (III), (I-a), (I-b), (I-c) или (I-д).
[0321] Пролекарство превращается, например, в требуемую фармацевтическую форму при корнкретной величине pH или в результате воздействия фермента. Пролекарство обычно представляет собой соединение, которое образует свободную кислоту in vivo, и соединение, имеющее гидролизующуюся эфирную группу. Такая гидролизующаяся эфирная группа представляет собой, например, но этим не ограничивая, группу, представленную формулой -COORx, где Rx выбирают из C1-4 алкила, C2-7 алканоилоксиметила, 1-(C4-9 алканоилокси)этила, 1-метил-1-(C5-10 алканоилокси)этила, (C3-6 алкокси)карбонилоксиметила, 1-[(C4-7 алкокси)-карбонилокси]этила, 1-метил-1-[(C5-8 алкокси)карбонил-окси]этила, N-[(C3-9 алкокси)карбонил]аминометила, 1-(N-[(C4-10 алкокси)-карбонил]амино)этила, 3-фталидила, 4-кротонолактонила, γ-бутиролактон-4-ила, [N,N-ди(C1-2 алкил)амино]C2-3 алкила (например, N,N-диметиламиноэтила), (карбамоил)C1-2 алкила, [N,N-ди(C1-2 алкил)карбамоил]C1-2 алкила, (пиперидино)C2-3 алкила, (пирролидинo)C2-3 алкила и (морфолино)C2-3 алкила.
[0322] Лекарственный препарат настоящего изобретения
Один аспект настоящего изобретения предлагает лекарственный препарат и фармацевтическую композицию, содержащую соединение, представленное формулой (I), (II), (III), (I-a), (I-b), (I-c) или (I-д) или его соль, или сольват соединения или сольват соли соединения.
[0323] Лекарственный препарат настоящего изобретения содержит соединение, представленное формулой (I), (II), (III), (I-a), (I-b), (I-c) или (I-д) в качестве активного ингредиента и дополнительно содержит фармацевтически приемлемый носитель. Используемый в изобретении термин "фармацевтически приемлемый носитель" означает одно или более совместимых твердых или жидких вспомогательных веществ или инкапсулирующих материалов, которые подходят для введения млекопитающим. Используемый в изобретении термин "фармацевтически приемлемый" означает фармацевтически приемлемый с точки зрения эффективности, безопасности и так далее. Используемый фармацевтически приемлемый носитель подходит для введения животному, предпочтительно, млекопитающему, подвергаемому лечению, с точки зрения безопасности, и имеет достаточно высокую чистоту.
[0324] Примеры материала, который может быть использован в качестве фармацевтически приемлемого носителя, включают сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и метилцеллюлоза; порошок трагантовой камеди; солод; желатин; тальк; твердые скользящие вещества, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, сезамовое масло, оливковое масло, кукурузное масло и масло какао; многоатомные спирты, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновую кислоту; эмульгаторы, такие как TWEEN; увлажняющие средства, такие как лецитин; окрашивающие вещества; ароматизаторы; таблетирующие вещества; стабилизаторы; антиоксиданты; антисептики; апирогенную воду; изотонический физиологический раствор; и растворы фосфатного буфера.
[0325] Соединение настоящего изобретения могут применяться в качестве ингибитора NaPi-IIb или в качестве профилактического и/или терапевтического средства для гиперфосфатемии, вторичного гиперпаратиреоза или хронической почечной недостаточности. В этом случае, примеры способа введения включают пероральный, ректальный, парентеральный (внутривенный, внутримышечный или подкожный), интрацистернальный, интравагинальный, интраперитонеальный, интравезикальный и местный (капли, порошок, мазь, гель или крем) способы и ингаляцию (в полость рта или с использованием назальных спреев). Примеры лекарственной формы включают таблетки, капсулы, гранулы, порошки, пилюли, водные и неводные пероральные растворы и суспензии и парентеральные растворы, загруженные в контейнеры, предназначенные для разделения на индивидуальные дозы. В качестве варианта, лекарственная форма может быть предназначена для различных способов введения, включая формы с контролируемым высвобождением в виде подкожного имплантата.
[0326] Эти препараты получают хорошо известным методом с использованием добавок, таких как наполнители, скользящие вещества (вещества для образования покрытия), связующие, дезинтегранты, стабилизаторы, корригирующие вещества и разбавители.
[0327] Примеры наполнителей могут включать крахмалы, такие как крахмал, картофельный крахмал и кукурузный крахмал, лактозу, кристаллическую целлюлозу и гидрофосфат кальция.
[0328] Примеры веществ для образования покрытия могут включать этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропил-метилцеллюлозу, шеллак, тальк, карнаубский воск и парафин.
[0329] Примеры связующих могут включать поливинилпирролидон, макрогол и те же соединения, которые перечислены в качестве наполнителей.
[0330] Примеры дезинтегрантов могут включать те же соединения, которые перечислены в качестве наполнителей, и химически модифицированные крахмалы и целлюлозы, такие как кроскарбоксиметилцеллюлоза натрия, карбоксиметилкрахмал натрия, и сшитый поливинилпирролидон.
[0331] Примеры стабилизаторов могут включать: п-гидрокси-бензоатные эфиры, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт, и фенилэтиловый спирт; бензaлкония хлорид; фенолы, такие как фенол и крезол; тимеросал; дегидроуксусную кислоту и сорбиновую кислоту.
[0332] Примеры корригирующих веществ могут включать обычно используемые подсластители, подкислители и ароматизаторы.
[0333] Жидкие препараты могут быть приготовлены с использованием растворителя, такого как этанол, фенол, хлоркрезол, очищенная вода или дистиллированная вода.
[0334] Примеры поверхностно-активных веществ или эмульгаторов могут включать полиоксил 40 стеарат и лауромакрогол.
[0335] Когда соединение настоящего изобретения применяют в качестве ингибитора NaPi-IIb, ингибитора PiT-1, ингибитора PiT-2 или профилактического и/или терапевтического средства для гиперфосфатемии, вторичного гиперпаратиреоза или хронической почечной недостаточности, используемое количество лекарственного препарата настоящего изобретения будет различным в зависимости от симптомов, возраста, массы тела, относительного состояния здоровья, присутствия других медикаментов, способов введения и жругих подобных факторов. В случае пероральных средств, общее эффективное количество, например, для пациента (теплокровного животного, в частности, человека), составляет, предпочтительно, от 1 до 20 мг/кг массы тела, более предпочтительно, от 1 до 10 мг/кг массы тела, в сутки в расчете на количество активного ингредиента (соединения настоящего изобретения, представленного формулой (I)). Суточная доза для взрослого пациента, имеющего нормальную массу тела, составляет, предпочтительно, величину в диапазоне от 60 до 1200 мг.
[0336] Далее будут приведены общие методы синтеза соединения настоящего изобретения и примеры.
[0337] Общий метод синтеза
Соединение настоящего изобретения могут быть синтезированы различными методами. Некоторые из методов будут описаны со ссылкой на схемы, показанные ниже. Эти схемы приводятся только с целью иллюстрации, и настоящее изобретение не ограничивается химическими реакциями и условиями, описанными в них. Несмотря на то, что некоторые заместители исключены из приведенных ниже схем, для того чтобы было легче разобраться в схемах, тем не менее, такое исключение не следует рассматривать в качестве ограничения при раскрытии схем. Типичные соединения настоящего изобретения могут быть синтезированы с использованием соответствующих промежуточных соединений, известных в техники соединений и реагентов. В описанных ниже схемах общих методов синтеза, переменные группы, представленные R1, R2 и так далее, и переменные, представленные n и так далее, имеют такие же значения, как значения переменных групп, представленных R1, R2 и так далее, и переменных, представленных n и так далее, в соединениях, представленных определенными в изобретении общими формулами.
[0338] Соединение настоящего изобретения может быть синтезировано с помощью методов синтеза, показанных ниже.
[0339] Схема 1 (Метод A)
[0340]
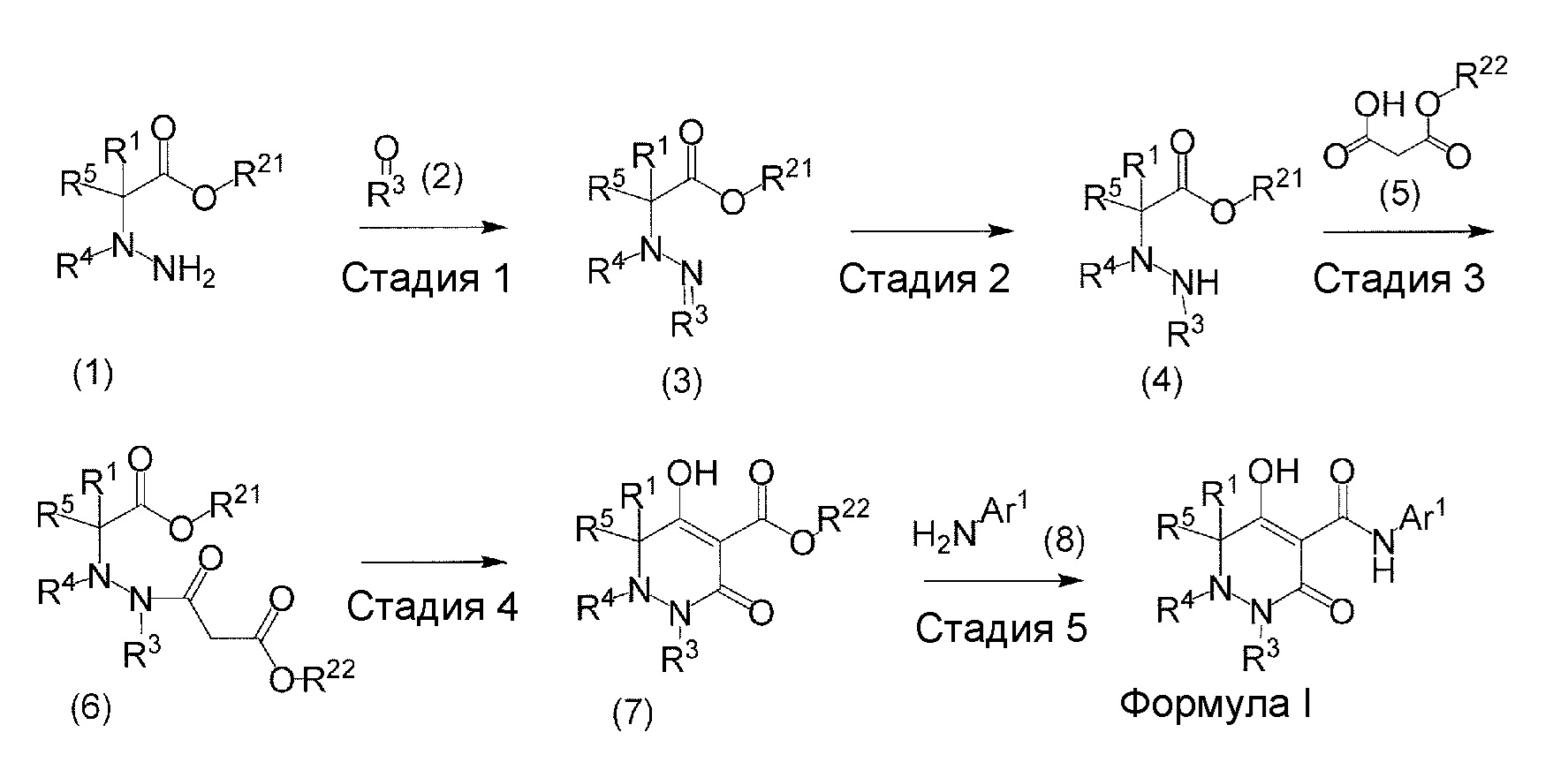
[0341] где R21 представляет C1-3 алкил, R22 представляет C1-5 алкил, и R3=O (2) представляет альдегид или кетон, образующийся в результате превращения углеродного атома в положении образования связи в алкиле, представленном R3, в карбонил.
Стадия 1 включает реакцию соединения формулы (1) с альдегидом или кетоном (2) в соответствующем растворителе, таком как метанол или дихлорметан, с получением соединения (3). Реакцию проводят при температуре, например, от 0°C до комнатной температуры, в течение времени, например, от 0,5 часа до 24 часов. Полученное производное гидразона (3) выделяют с помощью общего метода, и оно может быть очищено, если это необходимо, кристаллизацией или хроматографией.
[0342] В научной литературе описано большое число применимых методов для синтеза гидразина (1), показанного на схеме 1 (эта реакция может быть осуществлена в соответствии с методиками, описанными, например, в публикациях Synthetic communications, 40, 654-660; 2010, Journal of Heterocyclic Chemistry, 24 (3), 725-731; 1987, и Synthesis, (6), 423-424; 1979).
[0343] Стадия 2 включает восстановление гидразона (3) в присутствии восстановителя, такого как цианоборгидрид натрия или пиридин-боран, в соответствующем растворителе, таком как метанол или уксусная кислота, с получением гидразина (4). Реакцию проводят при температуре, например, от 0°C до 50°C, в течение времени, например, от 0,5 часа до 60 часов. Полученный гидразин (4) выделяют с помощью общего метода, и он может быть очищен, если это необходимо, кристаллизацией или хроматографией.
[0344] Стадия 3 включает реакцию гидразина (4) с полуэфиром (5) при использовании конденсирующего реагента, такого как N,N'-дициклогексилкарбодиимид (DCC), 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорида n-гидрат (DMT-MM), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилметилурония гексафтор-фосфат (HATU), бром-трис-пирролидинo-фосфония гексафторфосфат (PyBrop) или 1-пропанфосфиновой кислоты циклический ангидрид (T3P), в соответствующем растворителе, таком как дихлорметан, N,N-диметилформамид, N,N-диметилацетамид, ацетонитрил, тетрагидрофуран или этилацетат. Реакцию проводят при температуре, например, от 0°C до 50°C, в течение времени, например, от 0,5 часа до 24 часов. Полученную эфирную форму (6) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0345] Полуэфир (5), показанный на схеме 1 может быть синтезирован из кислоты Мельдрума и спирта (эта реакция может быть осуществлена в соответствии с методикой, описанной, например, в публикации Organic Letters, 7 (3), 463-465; 2005).
[0346] Стадия 4 включает циклизацию эфирной формы (6) с использованием основания, такого как карбонат калия, карбонат цезия, метоксид натрия или гидрид натрия в соответствующем растворителе, таком как метанол, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, диэтиловый эфир или тетрагидрофуран. Реакцию проводят при температуре, например, от 0°C до 110°C, в течение времени, например, от 0,5 часа до 24 часов. Полученную циклизированную форму (7) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0347] Стадия 5 включает реакцию циклизированной формы (7) с различными аминами (8) в соответствующем растворителе, таком как бензол, толуол, ксилол, этилацетат, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид или диметилсульфоксид. Реакцию проводят при температуре, например, от 50°C до 120°C в течение времени, например, от 0,5 часа до 5 часов. Полученную амидную форму (формула I) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0348] R21 представляет собой, предпочтительно, метил, и R22 представляет собой, предпочтительно, метил или изобутил.
[0349] Соединение формулы I может быть также синтезировано с помощью реакции между кето-формой (9) и изоцианатом, как показано на схеме 2 (метод B).
[0350] Схема 2 (метод B)
[0351]
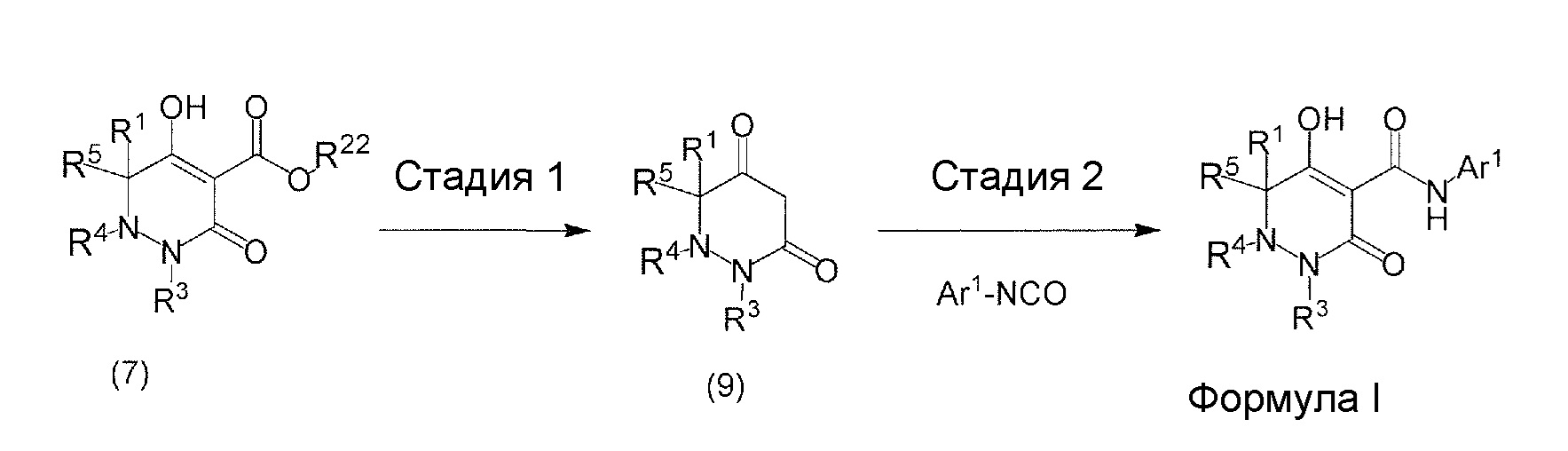
[0352] где R22 определен на схеме 1.
Кето-форма (9) в качестве продукта стадии 1 может быть синтезирована путем декарбоксилирования эфирной формы (7) (эту реакцию можно осуществить в соответствии с методикой, описанной, например, в публикации Synthesis, (15), 2487-2491; 2009).
[0353] Стадия 2 включает реакцию кето-формы (9) с изоцианатом в присутствии основания, такого как гидрид натрия, карбонат калия или карбонат цезия, в соответствующем растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид или тетрагидрофуран. Реакцию проводят при температуре, например, от 0°C до 50°C, в течение времени, например, от 0,5 часа до 5 часов. Полученную амидную форму (формула I) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0354] Соединение формулы I может быть также синтезировано путем циклизации амидной формы, как показано на схеме 3 (метод C).
[0355] Схема 3 (метод C)
[0356]
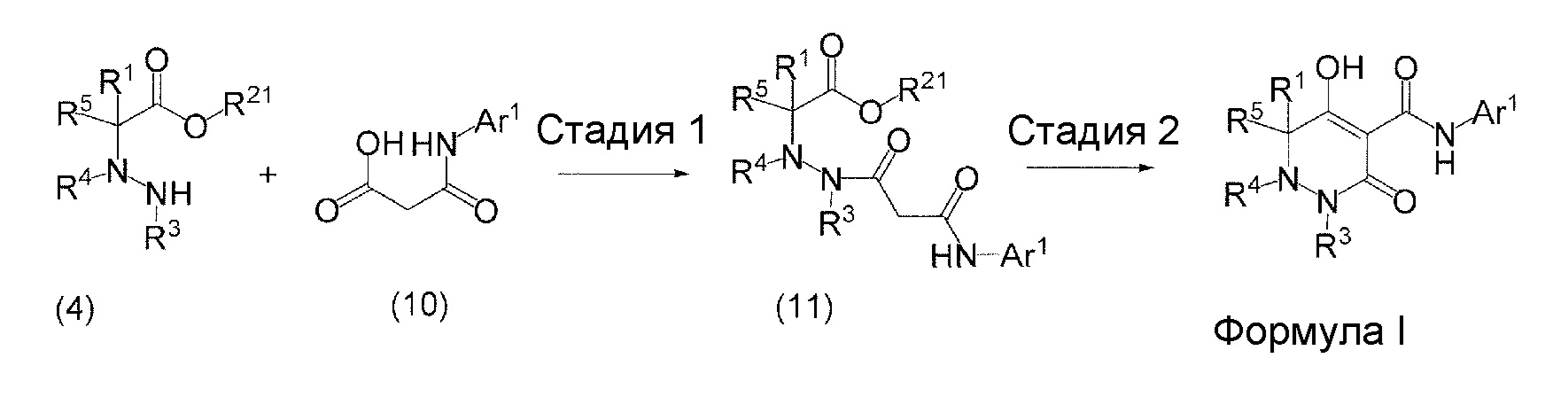
[0357] где R21 определен на схеме 1.
[0358] Стадия 1 включает реакцию гидразина (4) с полуамидом (10) в присутствии конденсирующего реагента, такого как N,N'-дициклогексилкарбодиимид (DCC), 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорида n-гидрат (DMT-MM), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), бром-трис-пирролидинoфосфония гексафторфосфат (PyBrop), или 1-пропанфосфиновой кислоты циклический ангидрид (T3P), в соответствующем растворителе, таком как дихлорметан, N,N-диметилформамид, N,N-диметилацетамид, ацетонитрил, тетрагидрофуран, или этилацетат. Реакцию проводят при температуре, например, от 0°C до 50°C, в течение времени, например, от 0,5 часа до 24 часов. Полученную амидную форму (11) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0359] Полуамид (10), показанный на схеме 3, может быть синтезирован из кислоты Мельдрума и амина (эту реакцию можно осуществить в соответствии с методикой, описанной, например, в публикации Bioorganic & Medicinal Chemistry Letters, 19 (13), 3632-3636; 2009).
[0360] Стадия 2 включает циклизацию амидной формы (11) при использовании основания, такого как метоксид натрия, карбонат калия, карбонат цезия или гидрид натрия, в соответствующем растворителе, таком как метанол, N,N-диметилформамид, N,N-диметилацетамид или тетрагидрофуран. Реакцию проводят при температуре, например, от 0°C до 110°C, в течение времени, например, от 0,5 часа до 24 часов. Полученное соединение формулы I выделяют с помощью общего метода, и оно может быть очищено, если это необходимо, кристаллизацией или хроматографией.
[0361] Соединение формулы I может быть также синтезировано путем алкилирования, как показано на схеме 4 (метод D).
[0362] Схема 4 (метод D)
[0363]
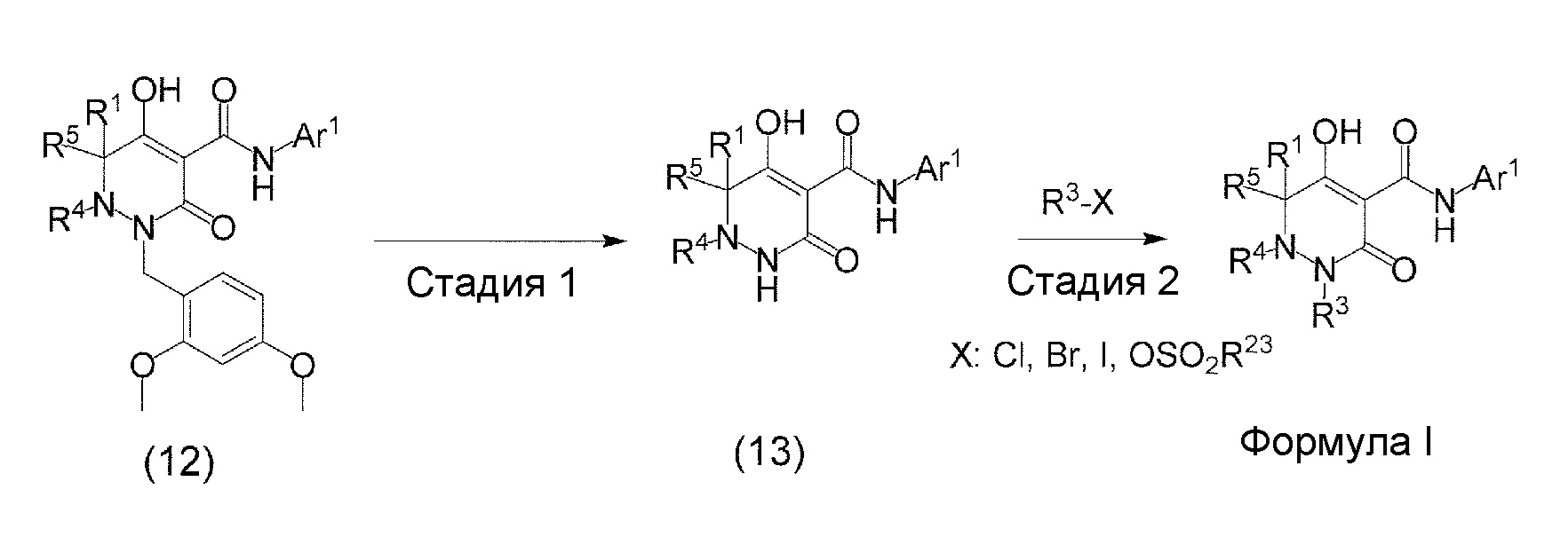
[0364] Ниже будут показаны три типичных метода проведения стадии 1.
[0365] Метод 1 включает дебензилирование соединения (12) с использованием палладиевого катализатора, такого как палладий(0)-уголь или гидроксид палладия(II)-уголь, или платиновый катализатор, такой как оксид платины (PtO2), в соответствующем растворителе, таком как метанол, этилацетат, N,N-диметилформамид или N,N-диметилацетамид, в атмосфере водорода. Реакцию проводят при температуре, например, от комнатной температуры до температуры кипения растворителя, в течение времени, например, от 1 часа до 24 часов. Метод 2 включает реакцию соединения (12) в присутствии окислителя, такого как 2,3-дихлор-5,6-дициано-п-бензохинон или гексанитратоцерат(IV) аммония в соответствующем растворителе, таком как дихлорметан или ацетонитрил. Реакцию проводят при температуре, например, от комнатной температуры до температуры кипения растворителя, в течение времени, например, от 1 часа до 60 часов. Метод 3 включает реакцию соединения (12) в присутствии органической кислоты, такой как трифторуксусная кислота или трифторметансульфоновая кислота, в соответствующем растворителе, таком как дихлорметан или метанол. Реакцию проводят при температуре, например, от 0°C до температуры кипения растворителя, в течение времени, например, от 0,5 часа до 5 часов. Полученную NH форму (13) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0366] Стадия 2 включает реакцию NH формы (13) с алкилирующим реагентом, таким как алкилгалогенид или алкилсульфонат, в присутствии соответствующего основания, такого как гидрид натрия, третбутоксид калия или третамилат калия в соответствующем растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, тетрагидрофуран или диметилсульфоксид. Реакцию проводят при температуре, например, от 0°C до температуры кипения растворителя в течение времени, например, от 0,5 часа до 24 часов. Полученное соединение формулы I выделяют с помощью общего метода, и оно может быть очищено, если это необходимо, кристаллизацией или хроматографией.
[0367] В фрагменте -OSO2R23, показанном на этой схеме, R23 представляет собой C1-5 алкил, необязательно замещенный одним или более атомами галогена, или арил, где арильная группа необязательно замещена одним или более атомами галогена или алкильными группами. Конкретные примеры R23 включают метил, трифторметил, фенил, и 4-метилфенил.
[0368] Соединение формулы I может быть также синтезировано путем алкилирования, как показано на схеме 5 (метод E).
[0369] Схема 5 (Метод E)
[0370]
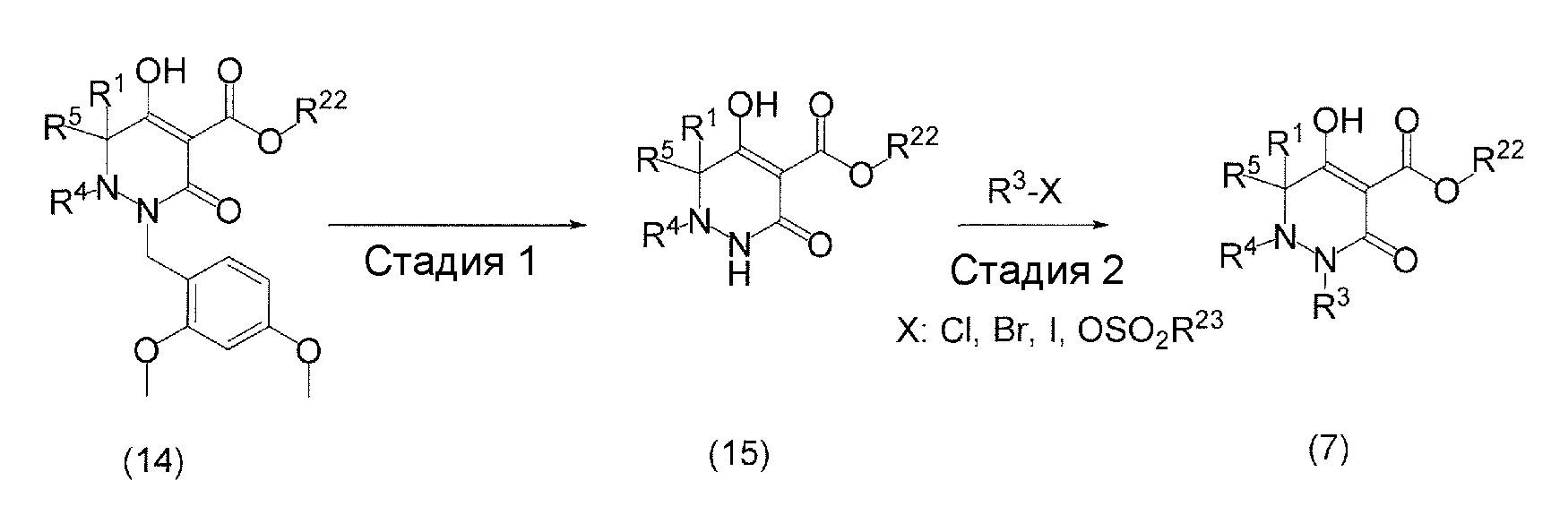
[0371] где R22 определен на схеме 1.
Реакция на стадии 1 схемы 5 (метод E) может быть осуществлена таким же образом, как на стадии 1 схемы 4 (метод D).
[0372] Реакция на стадии 2 схемы 5 (метод E) может быть осуществлена таким же образом, как на стадии 2 схемы 4 (метод D). Соединение формулы I может быть получено таким же образом, как на стадии 5 схемы 1, из полученной эфирной формы (7).
[0373] Метод введения боковой цепи
Схема 6 (метод F)
[0374]
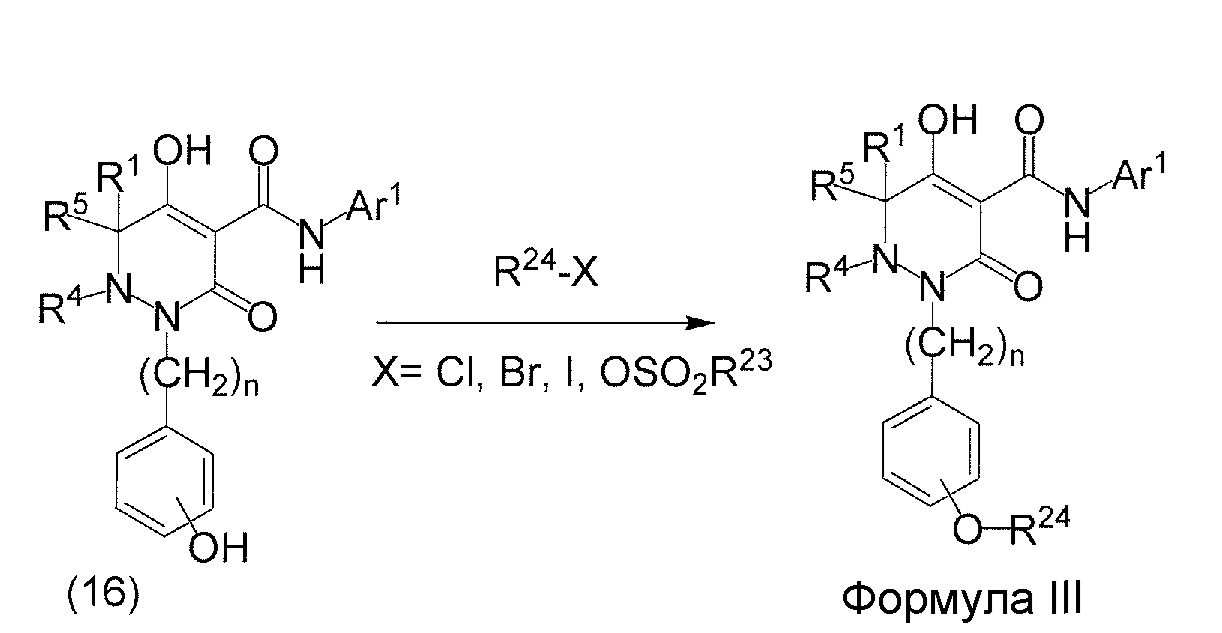
[0375] где n представляет собой целое число, выбранное в диапазоне от 1 до 10, и R24 представляет собой C1-8 алкокси, необязательно замещенный одним или более заместителями R12.
Метод на схеме 6 (метод F) включает реакцию производного фенола (16) с алкилирующим реагентом, таким как алкилгалогенид или алкилсульфонат, в присутствии соответствующего основания, такого как гидрид натрия, карбонат калия, карбонат цезия, третбутоксид калия или пентоксид калия, в соответствующем растворителе, таком как тетрагидрофуран, ацетонитрил, N,N-диметилформамид, N,N-ацетамид, диметилсульфоксид или ацетон. Реакцию проводят при температуре, например, от 0°C до температуры кипения растворителя, в течение времени, например, от 0,5 часа до 12 часов. Полученное соединение, представленное формулой III, выделяют с помощью общего метода, и оно может быть очищено, если это необходимо, кристаллизацией или хроматографией. Соединение, полученное по схеме 6, может быть подвергнуто, если это необходимо, реакции удаления различных защитных групп и другим превращениям для синтеза производного.
[0376] Схема 7 (метод G)
[0377]
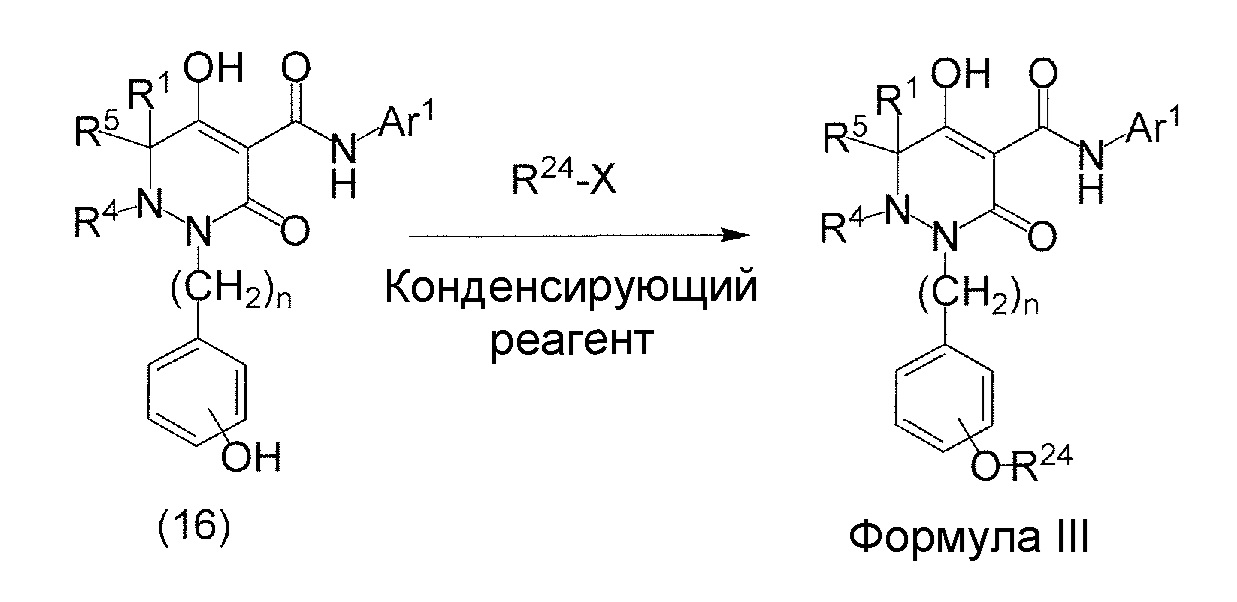
где n и R24 определены на схеме 6.
[0378] Метод по схеме 7 (метод G) включает реакцию производного фенола (16) с различными спиртами с использованием соответствующего реагента Мицунобу, такого как диэтил азодикарбоксилат (DEAD), диизопропил азодикарбоксилат (DIAD), N,N,N',N'-тетраизопропилазодикарбоксамид (TIPA), 1,1'-(азодикарбонил)дипиперидин (ADDP), или N,N,N',N'-тетраметилазодикарбоксамид (TMAD), в присутствии соответствующего органического реагента трехвалентного фосфора, такого как трифенилфосфин или трибутилфосфин, в соответствующем растворителе, таком как дихлорметан, тетрагидрофуран, ацетонитрил, толуол, или бензол. Реакцию проводят при температуре, например, от 0°C до температуры кипения растворителя в течение времени, например, от 0,5 часа до 24 часов. Полученное соединение, представленное формулой III, выделяют с помощью общего метода, и оно может быть очищено, если это необходимо, кристаллизацией или хроматографией. Соединение, полученное по схеме 7, может быть подвергнуто, если это необходимо, реакции удаления различных защитных групп и другим превращениям для синтеза производного.
[0379] Схема 8 (метод H)
[0380]
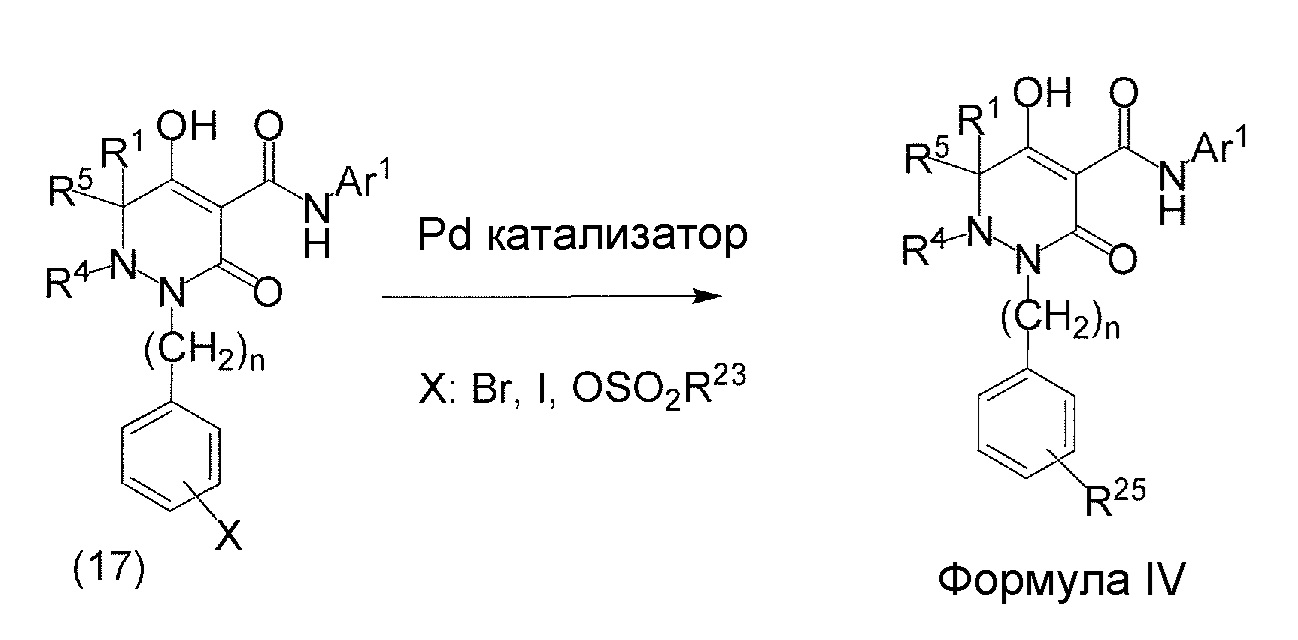
[0381] где n представляет собой целое число, выбранное в диапазоне от 1 до 10, и R25 представляет собой (C1-4 алкокси)карбонил, C1-10 алкил, необязательно замещенный одним или более заместителями R10, C2-10 алкинил, необязательно замещенный одним или более заместителями R11, или C1-4 алкилтио, необязательно замещенный одним или более заместителями R13.
Метод по схеме 8 (метод H) включает реакцию производного бромбензола или йодбензола (17) с использованием палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0) (Pd(Ph3P)4), трис(дибензилиденацетон)дипалладий(0) (Pd2(dba)3), комплекс 1,1'-бис(дифенилфосфино)ферроценпалладия(II) дихлорид-дихлорметан (PdCl2(dppf)⋅CH2Cl2), ацетат палладия(II) (Pd(OAc)2), или дихлорбис(трифенилфосфин)палладий(II) (PdCl2(Ph3P)2), дополненного, если это необходимо, фосфиновым лигандом, таким как трифенилфосфин (Ph3P), тритретбутилфосфин (tBu3P), или три-o-толилфосфин ((o-tol)3P), медного катализатора, такого как йодид меди(I), и соответствующего основания, такого как карбонат натрия, триэтиламин или карбонат калия, в соответствующем растворителе, таком как дихлорметан, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, толуол, бензол, 1,2-диметоксиэтан, 1,4-диоксан, этанол или ацетонитрил, для того чтобы ввести в него, например, серу, алкан, алкин или алкоксикарбонил. Когда R25 представляет собой (C1-4 алкокси)карбонил, в качестве реагента в реакции могут быть использованы, например, монооксид углерода и C1-4 спирт. Когда R25 представляет собой C1-10 алкил, необязательно замещенный одним или более заместителями R10, или C2-10 алкинил, в качестве реагента в реакции могут быть использованы, например, ацетилен или (C1-8 алкил)-C≡CH. Когда R25 представляет собой C1-4 алкилтио, необязательно замещенный одним или более заместителями R13, в качестве реагента в реакции могут быть использованы, например, C1-4 алкилмеркаптан. Реакцию проводят при температуре, например, от 0°C до температуры кипения растворителя, в течение времени, например, от 0,5 часа до 60 часов. Полученное соединение, представленное формулой IV, выделяют с помощью общего метода, и оно может быть очищено, если это необходимо, кристаллизацией или хроматографией. Соединение, полученное по схеме 8, может быть подвергнуто, если это необходимо, реакции гидрирования двойной связи или тройной связи, реакции окисления или реакции алкилирования атомы серы, реакции удаления различных защитных групп и другим превращениям для синтеза производного.
[0382] Схема 9 (метод I)
[0383]
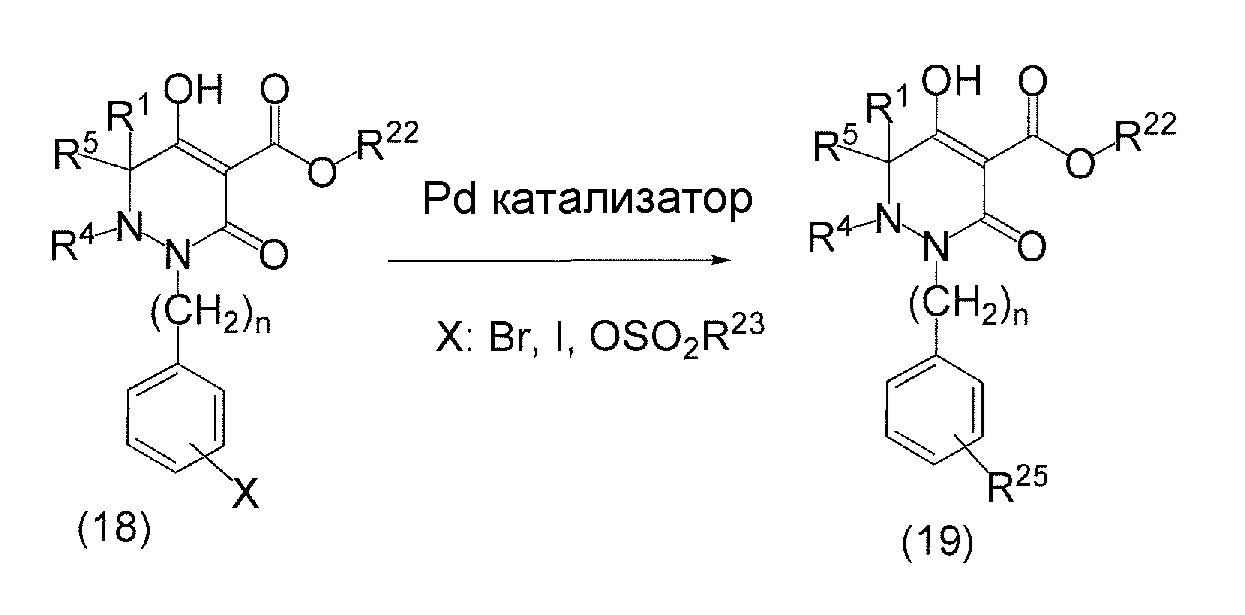
[0384] где R22, R23 и R25 определены в схемах 1 и 8.
Реакция по схеме 9 (метод I) может быть осуществлена таким же образом, как на схеме 8, с соединением (18) в качестве исходного материала. Соединение формулы IV может быть получено таким же образом, как на стадии 5 схемы 1, из полученной эфирной формы (19).
[0385] Схема 10 (метод J)
[0386]
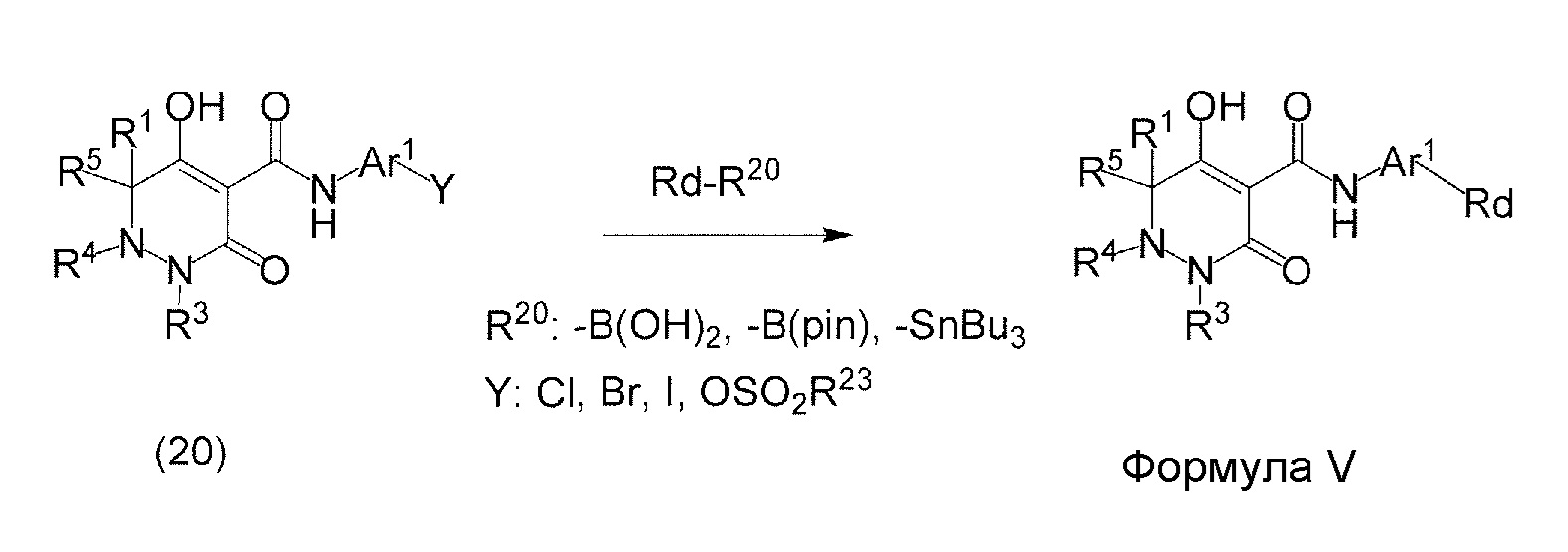
[0387] где
Ar1 представляет собой C6-10 арил или 5-10 членный гетероарил, где эта группа необязательно замещена с помощью Rb и/или Rc; и
Rd выбирают из 5-10 членного гетероциклоалкила, необязательно замещенного одним или более заместителями R14, C6-10 арила, необязательно замещенного одним или более заместителями R14, и 5-10 членного гетероарила, необязательно замещенного одним или более заместителями R14.
Примеры -B(pin) в приведенной выше формуле включают следующую структуру:
[0388]
[0389] Метод по схеме 10 (метод J) включает реакцию производного арилгалогенида (20) с арилбороновой кислотой, гетероарилбороновой кислотой, гетероциклоалкилбороновой кислотой, сложным эфиром арилбороновой кислоты, сложным эфиром гетероарилбороновой кислоты, сложным эфиром гетероциклоалкил-бороновой кислоты, арилтриалкилоловом, гетероарилтриалкилоловом, гетероциклоалкилтриалкилоловом или другими подобными реагентам, с использованием палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0) (Pd(Ph3P)4), трис-(дибензилиденацетон)дипалладий(0) (Pd2(dba)3), комплекс 1,1'-бис-(дифенилфосфино)ферроценпалладия(II) дихлорид - дихлорметан (PdCl2(dppf)⋅CH2Cl2) или ацетат палладия(II) (Pd(OAc)2) дополненного, если это необходимо, фосфиновым лигандом, таким как трифенилфосфин (Ph3P), тритретбутилфосфин (tBu3P) или три-o-толилфосфин ((o-tol)3P), и соответствующего основания, такого как карбонат натрия, триэтиламин или карбонат калия, в соответствующем растворителе, таком как тетрагидрофуран, ацетонитрил, толуол, N,N-диметилформамид, N,N-диметилацетамид, 1,2-диметоксиэтан (DME) или 1,4-диоксан, в атмосфере азота, для того чтобы ввести в него арильную группу. Реакцию проводят при температуре, например, от комнатной температуры до температуры кипения растворителя в течение времени, например, от 0,5 часа до 12 часов. Полученную бисарильную форму (формула V) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0390] Схема 11 (метод K)
[0391]
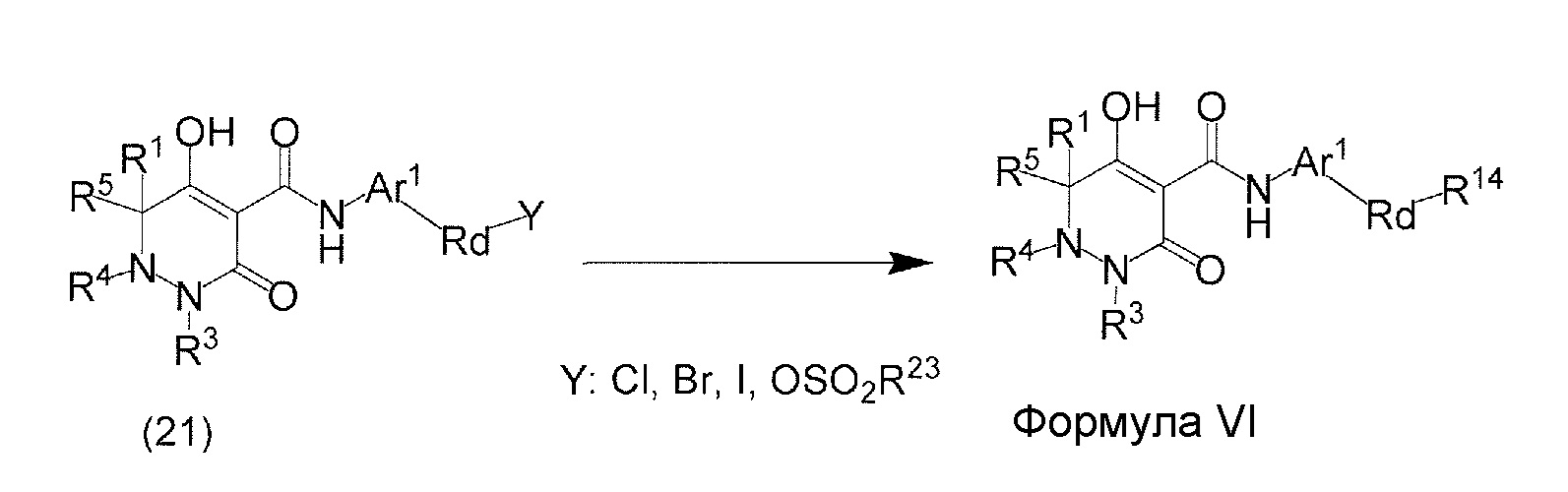
[0392] где
R23 определен выше;
Ar1 и Rd определены в схеме 10; и
R14 выбирают из циано, C1-4 алкокси, необязательно замещенного одним или более атомами галогена, и -NR27R28 (R27 и R28 каждый независимо выбирают из необязательно (C1-3 алкокси)карбонилзамещенного C1-4 алкила).
Метод по схеме 11 (метод K) включает реакцию гетероарилгалогенида или гетероарилового эфира сульфоновой кислоты (21) с нуклеофилом, таким как амин, нитрил или спирт, если это необходимо, в присутствии основания, такого как гидрид натрия, алкоксид натрия, карбонат калия, карбонат натрия, триэтиламин, диизопропилэтиламин или диазабициклоундецен (DBU), в соответствующем растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, тетрагидрофуран или диметилсульфоксид. Реакцию проводят при температуре, например, от комнатной температуры до температуры кипения растворителя, в течение времени, например, от 0,5 часа до 24 часов. Полученную бисарильную форму (формула VI) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0393] Схема 12 (метод L)
[0394]
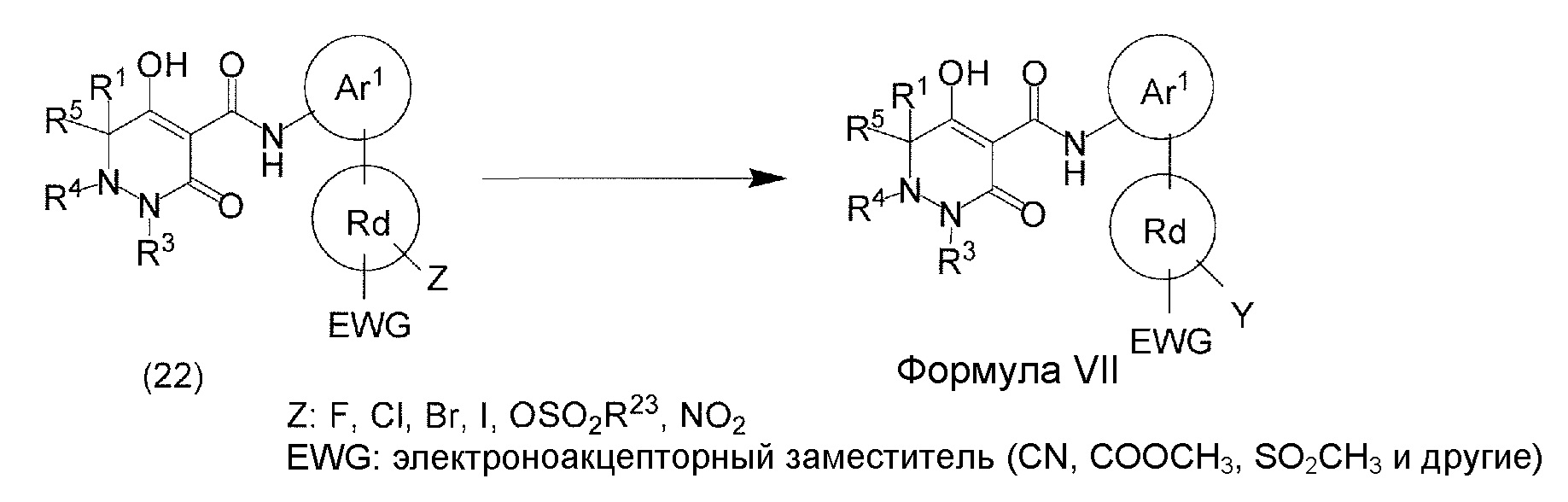
[0395] где
R23 определен на схеме 11;
Rd представляет собой 5-10 членный гетероциклоалкил, C6-10 арил или 5-10 членный гетероарил; и
Y выбирают из циано, C1-4 алкокси, необязательно замещенный одним или более атомами галогена, и -NR27R28 (R27 и R28 каждый независимо выбирают из необязательно (C1-4 алкокси)карбонил-замещенного C1-4 алкила).
Метод по схеме 12 (метод L) включает реакцию гетероарилгалогенида, гетероарилового эфира сульфоновой кислоты или нитрогетероарила (22), имеющего электроноакцепторный заместитель (EWG), с нуклеофилом, таким как амин, нитрил или спирт, если это необходимо, в присутствии основания, такого как гидрид натрия, алкоксид натрия, карбонат калия, карбонат натрия, триэтиламин, диизопропилэтиламин или диазабициклоундецен (DBU), в соответствующем растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, тетрагидрофуран, диметилсульфоксид или спиртовой растворитель. Реакцию проводят при температуре, например, от комнатной температуры до температуры кипения растворителя, в течение времени, например, от 0,5 часа до 24 часов. Полученную бисарильную форму (формула VII) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0396] Синтез исходного материала
Схема 13 (метод M)
[0397]
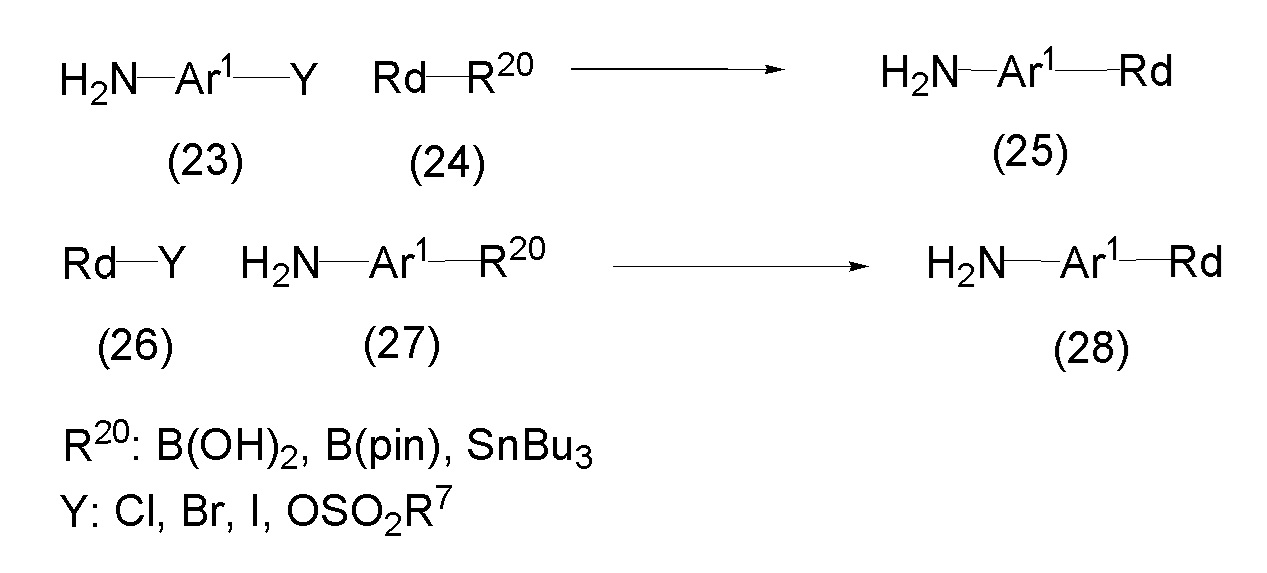
[0398] где Ar1 и Rd определены на схеме 10.
Согласно схеме 13 (метод M), синтезируют ариламин (8) (где Rd представляет собой 5-10 членный гетероциклоалкил, необязательно замещенный одним или более заместителями R14, C6-10 арил, необязательно замещенный одним или более заместителями R14, или 5-10 членный гетероарил, необязательно замещенный одним или более заместителями R14) для использования в реакции на стадии 5 схемы 1. Этот метод включает реакцию арилгалогенида (23) или (26) с арилбороновой кислотой, сложным эфиром арилбороновой кислоты, арилтриалкилоловом или другим подобным реагентом в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0), дополненного, если это необходимо, основанием, таким как триэтиламин, карбонат натрия, карбонат калия, карбонат цезия или гидроксид натрия, в соответствующем растворителе, таком как вода, толуол, этанол, N,N-диметилформамид, N,N-диметилацетамид, 1,4-диоксан, 1,2-диметоксиэтан или тетрагидрофуран. Реакцию проводят при температуре, например, от комнатной температуры до температуры кипения растворителя, в течение времени, например, от 0,5 часа до 24 часов. Полученную бисарильную форму (25) или (28) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0399] Схема 14 (метод N)
[0400]
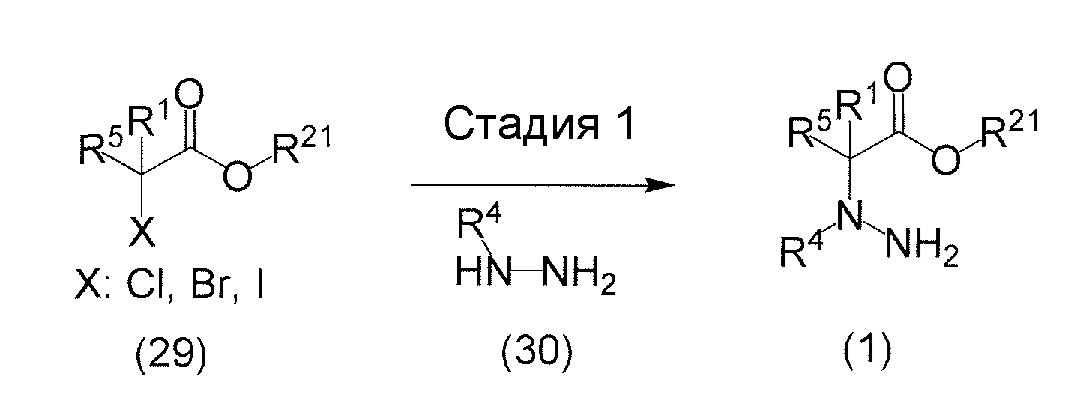
[0401] где R1, R4, R5 и R21 определены выше.
В соответствии со схемой 14 (метод N), синтезируют гидразин для использования в реакции на стадии 1 схемы 1. Соединение (1) может быть синтезировано, как описано, например, в публикации Bioorganic & Medicinal Chemistry Letters 13 (2003) 2413-2418.
[0402] Схема 15 (метод O)
[0403]
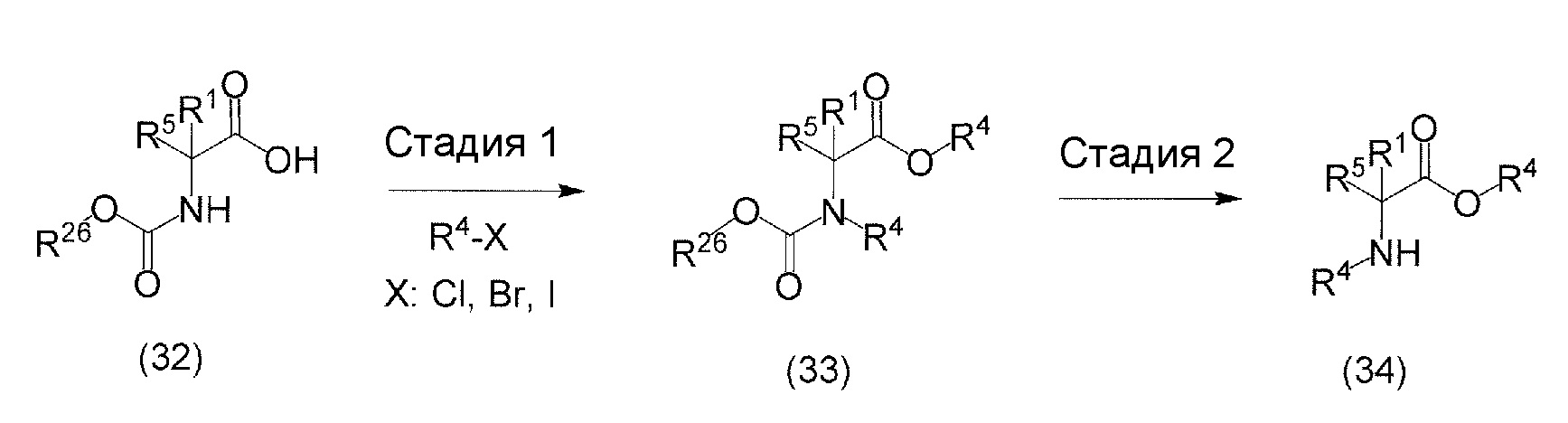
[0404] где R26 представляет собой бензил, метил или третбутил, и R1, R4 и R5 определены выше.
В соответствии со схемой 15 (метод O), синтезируют амин (34) для получения гидразина (1) для использования в реакции на стадии 1 схемы 1.
[0405] Стадия 1 включает N-алкилирование карбамат-замещенной аминокислоты с использованием соответствующего основания, такого как гидрид натрия, карбонат калия или карбонат цезия, или соли серебра, такой как оксид серебра(I), в присутствии алкилгалогенида в соответствующем растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, тетрагидрофуран или диметилсульфоксид. Реакцию проводят при температуре, например, от 0°C до 80°C, в течение времени, например, от 0,5 часа до 5 часов. Полученную N-алкильную форму (33) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией.
[0406] Стадия 2 включает удаление защитной карбаматной группы (33), например, в присутствии кислоты, такой как хлористоводородная кислота или трифторуксусная кислота, или путем каталитического восстановления водородом в присутствии катализатора, такого как палладий. Реакцию проводят при температуре, например, от 0°C до 50°C в течение времени, например, от 0,5 часа до 24 часов. Используемый реакционный растворитель представляет собой, например, соответствующий растворитель для кислотных условий, такой как дихлорметан или ацетонитрил, или, например, растворитель для каталитического восстановления водородом, такой как этилацетат, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид или метанол. Полученную N-алкильную форму (34) выделяют с помощью общего метода, и она может быть очищена, если это необходимо, кристаллизацией или хроматографией. Гидразин (1), показанный на схеме 1, может быть синтезирован из амина (34) в соответствии с методикой, описанной, например, в публикации Synthetic communications, 40, 654-660; 2010, Journal of Heterocyclic Chemistry, 24 (3), 725-731; 1987, и Synthesis, (6), 423-424; 1979.
[0407] Схема 16 (метод P)
[0408]
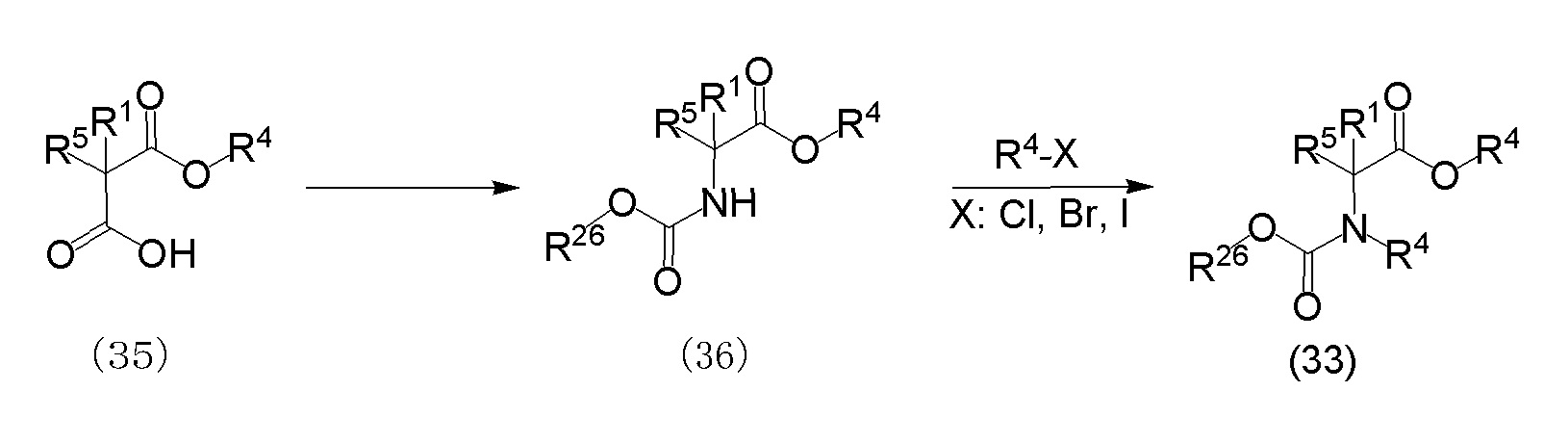
[0409] где R1, R4, R5 и R26 определены выше.
В соответствии со схемой 16 (метод P), синтезируют карбамат-защищенную аминокислоту (36) для получения соединения (33) для использования в реакции на стадии 1 схемы 15. Соединение (36) может быть синтезировано с использованием перегруппировки Курциуса для карбоновой кислоты (35) (эту реакцию можно осуществить в соответствии с методикой, описанной, например, в публикации J. Org. Chem., 1994, 59 (26), 8215-8219). Соединение (33) может быть синтезировано таким же образом, как на стадии 1 схемы 15.
[0410] Далее, настоящее изобретение будет описано более подробно с помощью справочных примеров и примеров. Однако настоящее изобретение не ограничивается этими примерами.
ПРИМЕРЫ
[0411] Сущность настоящего изобретения будет дополнительно объяснена с помощью примеров и справочных примеров ниже. Однако настоящее изобретение не ограничивается содержанием этих примеров. Все исходные материалы и реагенты были приобретены у фирм-производителей или синтезированы с помощью хорошо известных методов. Каждое соединение очищают высокоэффективной жидкостной хроматографией (ВЭЖХ) с использованием системы AutoPurification HPLC/MS System (фирмы Waters Corp.).1H-ЯМР или13C-ЯМР спектры регистрировали, используя Me4Si в качестве внутреннего эталона и ЯМР-спектрометр Agilent 400-MR (фирмы Agilent Technologies, Inc.) или AVANCE3 Cryo-TCI (фирмы Bruker Corp.) (с = синглет, ус = уширенный синглет, д = дуплет, т = триплет, к = квартет, дд = двойной дуплет, ддд = двойной дублет дублетов, дт = двойной триплет, тд = тройной дуплет и м = мультиплет). Масс-спектрометрию проводили с использованием масс-спектрометра SQD (фирмы Waters Corp.), 2020 (фирмы Shimadzu Corp.) или 2010EV (фирмы Shimadzu Corp.). Измерение времени удерживания и масс-спектрометрию при жидкостной хроматомасс-спектрометрии (LCMS) проводили, используя следующие приборы и условия анализа:
[0412]
[0413] Соединение, имеющее связь C=N в структурной формуле гидразона, представленного следующей формулой
[0414]
[0415] использовали в следующей реакции без конкретного указания, находилось ли соединение в цис-форме или транс-форме, или оно являлось их смесью.
<Пример 1>
(4aS)-1-[(3-Фторфенил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-4a,5,6,7-тетрагидропирроло[1,2-b]пиридазин-3-карбоксамид
Первая стадия
(S)-1-[(3-Фторбензилиден)амино]пирролидин-2-карбоновой кислоты метиловый эфир
[0416]
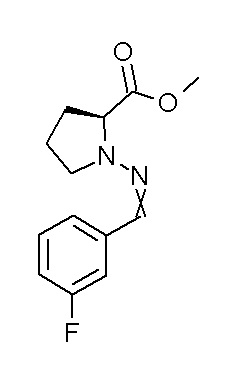
[0417] Гидрохлорид метилового эфира L-пролина (5,00 г, 30,2 ммоль) суспендировали в дихлорметане (60,4 мл), добавляли моногидрат п-толуолсульфоновой кислоты (6,03 г, 31,7 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 10 минут. Затем реакционную смесь концентрировали при пониженном давлении и добавляли толуол (60,4 мл) для азеотропного удаления воды, суспендированной в дихлорметане, добавляли нитрит натрия (2,19 г, 31,7 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. Затем реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении с получением метилового эфира (S)-1-нитрозопирролидин-2-карбоновой кислоты в виде неочищенного продукта. Полученный неочищенный продукт растворяли в уксусной кислоте (30,2 мл) и воде (30,2 мл), затем добавляли цинк (19,7 г, 302 ммоль) при 0°C, и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли бикарбонат натрия при 0°C, добавляли метанол (60,4 мл) и 3-фторбензальдегид (3,20 мл, 30,2 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. Затем реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении и затем экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (5,68 г, 75%).
[0418] LCMS: м/z 251[M+H]+
Время удерживания при ВЭЖХ: 0,97 минут (условия проведения анализа SQD-AA05)
[0419] Вторая стадия
(4aS)-1-[(3-Фторфенил)метил]-4a,5,6,7-тетрагидропирроло-[1,2-b]пиридазин-2,4-дион
[0420]
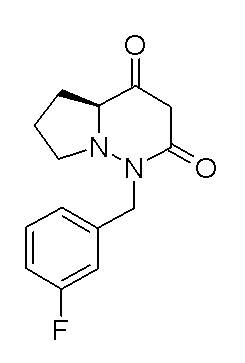
[0421] (S)-1-[(3-Фторбензилиден)амино]пирролидин-2-карбоновой кислоты метиловый эфир (5,68 г, 22,7 ммоль) растворяли в уксусной кислоте (22,7 мл) и метаноле (22,7 мл), добавляли цианоборгидрид натрия (5,70 г, 90,8 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 14 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, затем смесь концентрировали при пониженном давлении и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (S)-1-(3-фторбензиламино)пирролидин-2-карбоновой кислоты метилового эфира в виде неочищенного продукта. Полученный неочищенный продукт растворяли в тетрагидрофуране (22,7 мл), добавляли трикалийфосфат (9,64 г, 45,4 ммоль) и хлоркарбонилуксусной кислоты метиловый эфир (2,67 мл, 45,4 ммоль) при 0°C, и смесь перемешивали в атмосфере азота при комнатной температуре в течение 3 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (S)-1-[(3-фтор-бензил)-(2-метоксикарбонил-ацетил)амино]пирролидин-2-карбоновой кислоты метилового эфира в виде неочищенного продукта. Полученный неочищенный продукт растворяли в N,N-диметилформамиде (22,7 мл), добавляли карбонат цезия (22,2 г, 68,1 ммоль), и смесь перемешивали в атмосфере азота при 80°C в течение 9 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (S)-1-(3-фторбензил)-4-гидрокси-2-оксо-1,2,4a,5,6,7-гексагидропирроло-[1,2-b]пиридазин-3-карбоновой кислоты метилового эфира в виде неочищенного продукта. Полученный неочищенный продукт растворяли в ацетонитриле (227 мл), добавляли воду (0,41 мл, 22,7 ммоль), и смесь кипятили с обратным холодильником в течение 2 часов в атмосфере азота. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (4,01 г, 67%).
[0422] LCMS: м/z 263[M+H]+
Время удерживания при ВЭЖХ: 0,81 минут (условия проведения анализа SQD-AA05)
[0423] Третья стадия
(4aS)-1-[(3-Фторфенил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-4a,5,6,7-тетрагидропирроло[1,2-b]пиридазин-3-карбоксамид
[0424]
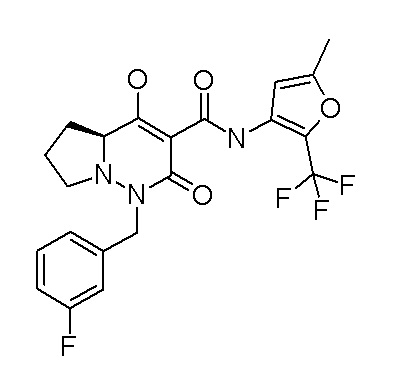
[0425] (4aS)-1-[(3-Фторфенил)метил]-4a,5,6,7-тетрагидро-пирроло[1,2-b]пиридазин-2,4-дион (1,50 г, 5,72 ммоль) растворяли в N,N-диметилформамиде (4,00 мл), и затем добавляли 3-изоцианато-5-метил-2-трифторметилфуран (1,20 г, 6,29 ммоль) и гидрид натрия (50% по массе дисперсия в минеральном масле, 0,33 г, 6,86 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 90 минут. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (1,62 г, 63%).
[0426] LCMS: м/z 454[M+H]+
Время удерживания при ВЭЖХ: 1,10 минут (условия проведения анализа SQD-AA05)
[0427] <Пример 2>
(4aR)-1-[(3-Фторфенил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-4a,5,6,7-тетрагидропирроло[1,2-b]пиридазин-3-карбоксамид
Соединения, описанные в следующей таблице, синтезировали из гидрохлорида метилового эфира D-пролина и 3-фторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0428]
[0429] <Пример 3>
(4aS)-1-[(3-Фторфенил)метил]-4-гидрокси-6,6-диметил-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-5,7-дигидро-4aH-пирроло[1,2-b]пиридазин-3-карбоксамид
Первая стадия
(S)-4,4-Диметилпирролидин-2-карбоновой кислоты этилового эфира гидрохлорид
[0430]
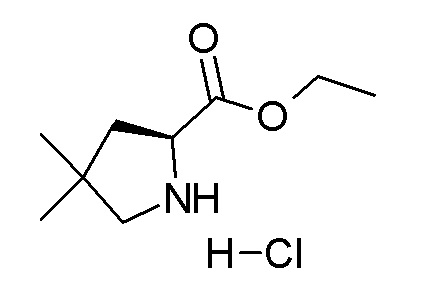
[0431] Раствор хлористого водорода в 1,4-диоксане (4 M, 5,00 мл) добавляли к 1-третбутиловому эфиру 2-этиловому эфиру (S)-4,4-диметилпирролидин-1,2-дикарбоновой кислоты (500 мг, 1,84 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и добавляли толуол для азеотропного удаления с получением названного соединения в виде неочищенного продукта.
[0432] Вторая стадия
Соединения, описанные в следующей таблице, синтезировали из полученного (S)-4,4-диметилпирролидин-2-карбоновой кислоты этилового эфира гидрохлорида и 3-фторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0433]
[0434] <Пример 4>
(4aS)-1-[(3-Фторфенил)метил]-4-гидрокси-7,7-диметил-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-5,6-дигидро-4aH-пирроло[1,2-b]пиридазин-3-карбоксамид
Первая стадия
(S)-5,5-Диметилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид
[0435]
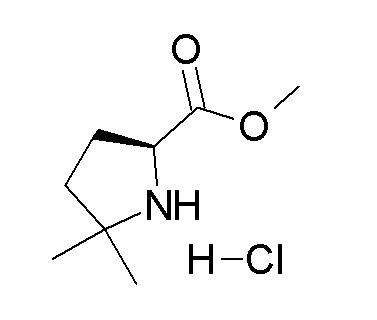
[0436] (S)-5,5-Диметилпирролидин-1,2-дикарбоновой кислоты 1-третбутиловый эфир (500 мг, 2,06 ммоль) растворяли в N,N-диметилформамиде (2,06 мл), и затем добавляли карбонат цезия (1,00 г, 3,08 ммоль) и йодметан (0,154 мл, 2,47 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали водой, насыщенным раствором бикарбоната натрия и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (S)-5,5-диметилпирролидин-1,2-дикарбоновой кислоты 1-третбутиловый эфир 2-метиловый эфир в виде неочищенного продукта. К полученному неочищенному продукту добавляли раствор хлористого водорода в 1,4-диоксане (4 M, 5,00 мл), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и добавляли толуол для азеотропного удаления с получением названного соединения в виде неочищенного продукта.
[0437] Вторая стадия
Соединения, описанные в следующей таблице, синтезировали из полученного (S)-5,5-диметилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорида и 3-фторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0438]
[0439] <Пример 5>
(4aS)-1-[(2,3-Дифторфенил)метил]-6,6-дифтор-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-5,7-дигидро-4aH-пирроло[1,2-b]пиридазин-3-карбоксамид
Для синтеза соединений, описанных в следующей таблице, (S)-4,4-Дифторпирролидин-1,2-дикарбоновой кислоты 2-метиловый 1-третбутиловый диэфир использовали в качестве исходного материала, 2,3-дифторбензальдегид использовали в качестве реагента, и проводили такие же операции, как в примере 3.
[0440]
[0441] <Пример 6>
(4aR)-1-[(3-Фторфенил)метил]-4-гидрокси-4a-метил-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
Первая стадия
(R)-2-Метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид
[0442]
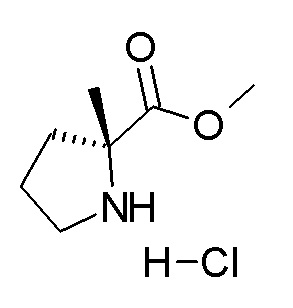
[0443] (R)-2-Метилпирролидин-2-карбоновую кислоту (300 мг, 2,32 ммоль) растворяли в диоксане (1,20 мл) и воде (0,60 мл), и затем добавляли гидроксид натрия (139 мг, 3,48 ммоль) и дитретбутилдикарбонат (608 мг, 2,79 ммоль) при 0°C, и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (R)-2-метилпирролидин-1,2-дикарбоновой кислоты 1-третбутилового эфира в виде неочищенного продукта. Из полученного (R)-2-метил-пирролидин-1,2-дикарбоновой кислоты 1-третбутилового эфира получали названное соединение в виде неочищенного продукта таким же методом, как на первой стадии примера 4.
[0444] Вторая стадия
Соединения, описанные в следующей таблице, синтезировали из полученного (R)-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорида и 3-фторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0445]
[0446] <Пример 7>
(4aR)-1-[(2,3-Дифторфенил)метил]-4-гидрокси-4a-метил-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
Первая стадия
Соединения, описанные в следующей таблице, синтезировали из (R)-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорида, полученного на первой стадии примера 6, и 2,3-дифторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0447]
[0448] <Пример 8>
(4aS)-1-[(3-Фторфенил)метил]-4-гидрокси-4a-метил-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
Первая стадия
(S)-2-Метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид
[0449] [Формула 35]
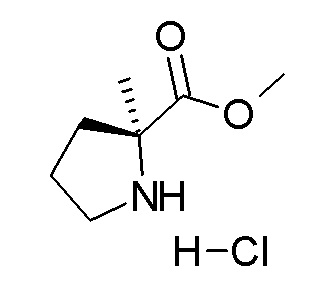
[0450] Названное соединение получали из (S)-2-метил-пирролидин-2-карбоновой кислоты в виде неочищенного продукта таким же методом, как на первой стадии примера 6.
[0451] Вторая стадия
Соединения, описанные в следующей таблице, синтезировали из (S)-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорида, полученного на первой стадии, и 3-фтор-бензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0452]
[0453] <Пример 9>
(4aR)-4a-Этил-1-[(3-фторфенил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
Соединения, описанные в следующей таблице, синтезировали из (S)-2-этилпирролидин-2-карбоновой кислоты этилового эфира гидрохлорида и 3-фторбензальдегида путем проведения таких же превращений, как на первой - третьей стадиях примера 1.
[0454]
[0455] <Пример 10>
(4aR)-1-[(2,3-Дифторфенил)метил]-4a-этил-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
Соединения, описанные в следующей таблице, синтезировали из (R)-2-этилпирролидин-2-карбоновой кислоты этилового эфира гидрохлорида и 2,3-дифторбензальдегида путем проведения таких же превращений, как на первой - третьей стадиях примера 1.
[0456]
[0457] <Пример 11>
(4aR)-1-[(3-Фторфенил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-4a-пропил-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
Соединения, описанные в следующей таблице, синтезировали из (R)-2-метил-пирролидин-2-карбоновой кислоты этилового эфира гидрохлорида и 3-фторбензальдегида путем проведения таких же превращений, как на первой - третьей стадиях примера 1.
[0458]
[0459] <Пример 12>
(4aR)-1-[(2,3-Дифторфенил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-4a-пропил-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
Соединения, описанные в следующей таблице, синтезировали из (R)-2-пропилпирролидин-2-карбоновой кислоты этилового эфира гидрохлорида и 2,3-дифторбензальдегида путем проведения таких же превращений, как на первой - третьей стадиях примера 1.
[0460]
[0461] <Пример 13>
6-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
Первая стадия
2,3-Дифтор-1-[2-[2-метоксиэтил(метил)амино]этокси]бензол
[0462]
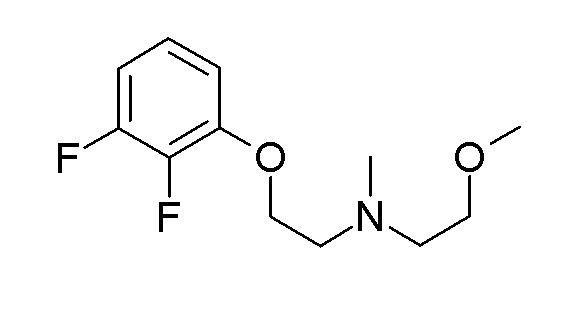
[0463] 2,3-Дифтор-1-[2-хлорэтокси]бензол (4,20 г, 22,0 ммоль) растворяли в N,N-диметилформамиде (32,9 мл), добавляли N-(2-метоксиэтил)-N-метиламин (4,35 г, 48,8 ммоль), йодид калия (6,08 г, 36,6 ммоль) и трикалийфосфат (7,77 г, 36,6 ммоль) при 25°C, и смесь перемешивали в атмосфере азота при 100°C в течение 2 часов. Затем реакционную смесь охлаждали до 25°C, добавляли воду (47,0 мл), и полученную смесь экстрагировали изопропилацетатом (47,0 мл). Для экстракции к органическому слою добавляли 1N хлористоводородную кислоту (47,0 мл), для подщелачивания к полученному водному раствору добавляли 5N водный раствор гидроксида натрия (14,1 мл), и смесь экстрагировали изопропилацетатом (47,0 мл). Органический слой концентрировали при пониженном давлении с получением названного соединения (5,15 г, 95%).
[0464]1H-ЯМР (DMSO-D6) δ: 7,16-7,10 (1H, м), 7,06-7,03 (1H, м), 6,99-6,96 (1H, м), 4,15 (2H, т, J=5,7 Гц), 3,41 (2H, т, J=6,0 Гц), 3,22 (3H, с), 2,78 (2H, т, J=6,0 Гц), 2,59 (2H, т, J=6,0 Гц), 2,28 (3H, с).
[0465] Вторая стадия
2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-бензальдегид
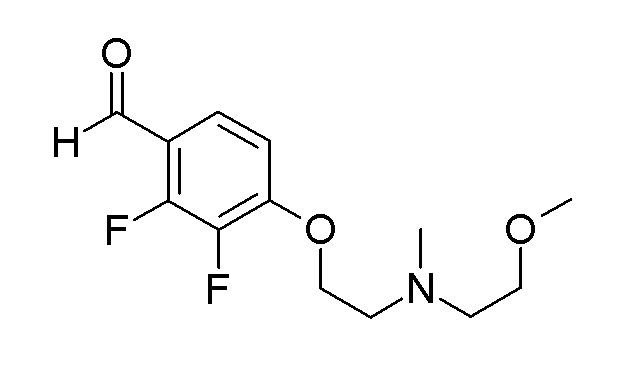
[0467] N,N-Диизопропиламин (5,92 мл) растворяли в тетрагидрофуране (62,6 мл), и добавляли по каплям раствор н-бутиллития в гексане (1,6 M, 26,2 мл, 41,9 ммоль) при -20°C. Затем смесь перемешивали при -20°C в течение 30 минут, охлаждали ее до -50°C, и добавляли по каплям раствор 2,3-дифтор-1-[2-[2-метоксиэтил(метил)амино]этокси]бензола (5,15 г, 21,0 ммоль) в тетрагидрофуране (21,0 мл). Затем смесь перемешивали при -40°C в течение 2 часов, добавляли N,N-диметилформамид (4.,94 мл), и смесь перемешивали в течение 30 минут. Затем реакционную смесь нагревали до -15°C, добавляли раствор уксусной кислоты (7,31 мл) в воде (26,1 мл) и толуол (15,7 мл) для проведения жидкостной экстракции. Органический слой концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан/триэтиламин) с получением названного соединения (2,90 г, 50%).
[0468]1H-ЯМР (DMSO-D6) δ: 10,04 (1H, с), 7,69-7,64 (1H, м), 7,27-7,24 (1H, м), 4,28 (2H, т, J=5,7 Гц), 3,41 (2H, т, J=6,0 Гц), 3,22 (3H, с), 2,81 (2H, т, J=5,7 Гц), 2,60 (2H, т, J=6,0 Гц), 2,28 (3H, с).
[0469] Третья стадия
Метил 1-[[(E)-2,3-дифтор-4-[2-[2-[метоксиэтил(метил)амино]-этокси]фенил]метилиденамино]метиламино]циклобутан-1-карбоксилат
[0470]
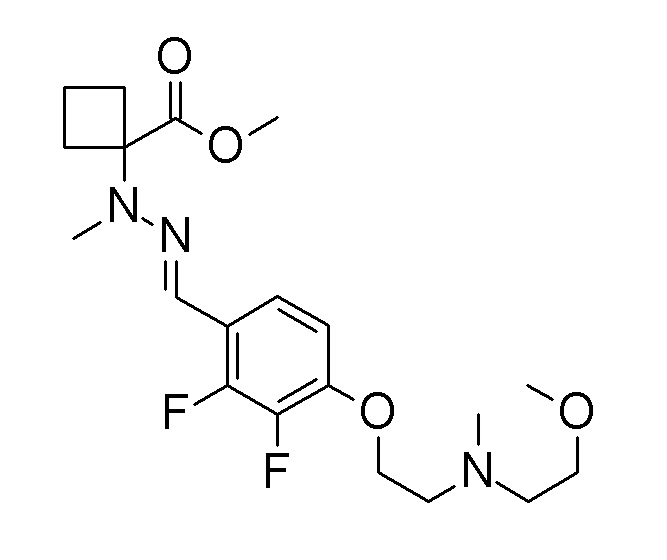
[0471] Метил 1-(метиламино)циклобутанкарбоксилат паратолуол-сульфонат (1,75 г, 5,54 ммоль) (смотрите справочный пример 86) растворяли в уксусной кислоте (1,60 мл, 27,7 ммоль) и воде (9,0 мл), добавляли раствор нитрита натрия (0,45 г, 6,59 ммоль), растворенного в воде (1,00 мл) при 25°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли этилацетат (3,50 мл) и хлорид натрия (1,00 г), и органический слой после проведения жидкостной экстракции промывали 15% водным раствором гидрофосфата калия. После промывки, к органическому слою добавляли метанол (10,0 мл), и добавляли 12N хлористоводородную кислоту (3,60 мл) при -10°C. К реакционной смеси добавляли цинковую пыль (0,73 г, 11,1 ммоль) при -30°C, и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли 28% водный аммиак (3,66 мл), добавляли раствор 2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]бензальдегида (1,00 г, 3,66 ммоль) в этилацетате (2,75 мл) при 0°C, и смесь перемешивали в течение 30 минут. Затем реакционную смесь концентрировали, добавляли этилацетат и 15% водный раствор динидрофосфапта калия для проведения жидкостной экстракции, и органический слой последовательно промывали 15% водным раствором гидросульфита натрия и 15% водным раствором гидрофосфата калия. Органический слой концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол) с получением названного соединения (1,07 г, 70%).
[0472] LCMS: м/z 414[M+H]+
[0473] Время удерживания при ВЭЖХ: 0,65 минут (SQD-TFA05)
[0474] Четвертая стадия
Метил 1-[[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]-этокси]фенил]метил-[3-оксо-3-[4-(трифторметил)-2-[6-(трифтор-метил)пиримидин-4-ил]анилино]пропаноил]амино]метиламино]-циклобутан-1-карбоксилат
[0475]
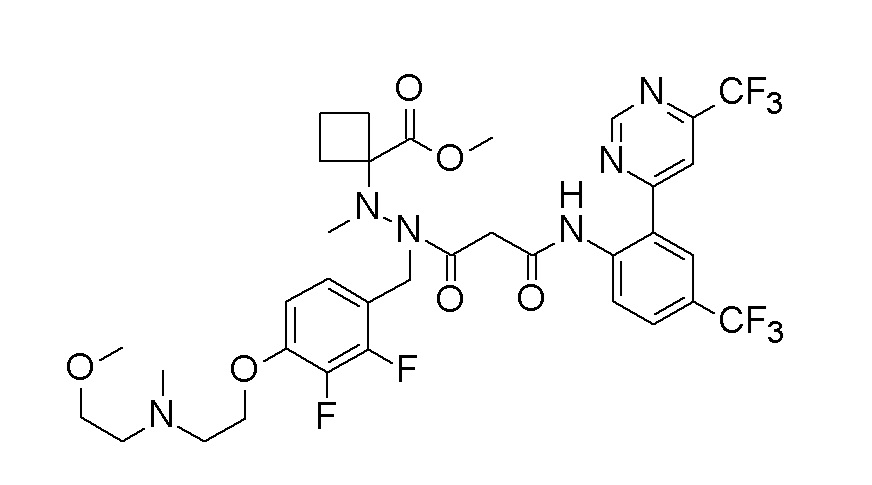
[0476] Метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метилиденамино]метиламино]циклобутан-1-карбоксилат (1,00 г, 2,42 ммоль) растворяли в этилацетате (8,1 мл), добавляли метансульфоновую кислоту (1,18 мл, 18,1 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 10 минут. К реакционной смеси добавляли комплекс 5-этил-2-метилпиридина с бораном (0,72 мл, 4,84 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 30 минут. Затем к реакционной смеси добавляли метанол (0,81 мл) при 0°C, добавляли 5M водный раствор гидроксида натрия (2,44 мл), и смесь перемешивали при 0°C в течение 1 часа. К реакционной смеси добавляли 25% водный раствор трикалийфосфата для проведения жидкостной экстракции. Органический слой промывали 15% водным раствором хлорида натрия и концентрировали его при пониженном давлении с получением метил 1-[[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]фенил]метиламино]метиламино]-циклобутан-1-карбоксилата в виде неочищенного продукта.
[0477] Полученный неочищенный продукт и 3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]анилино]-пропаноат (справочный пример 82) (1,05 г, 2,66 ммоль) растворяли в этилацетате (8,00 мл) и N,N-диметилформамиде (4,00 мл), добавляли пиридин (1,00 мл) и 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид (1,7M этилацетатный раствор, 2,85 мл, 4,84 ммоль) при -10°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли 10% водный раствор хлорида натрия для проведения жидкостной экстракции. Органический слой промывали 15% водный раствор гидрофосфата калия и концентрировали его при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол) с получением названного соединения (1,90 г, 97%).
[0478] LCMS: м/z 791[M+H]+
[0479] Время удерживания при ВЭЖХ: 0,81 минут (SQD-TFA05)
[0480] Пятая стадия
6-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-бензил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[0481]
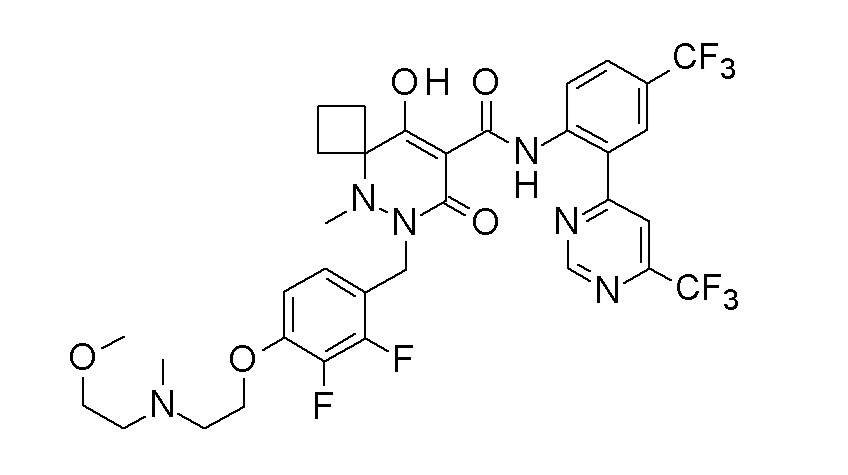
[0482] Метил 1-[[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метил-[3-оксо-3[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]анилино]пропаноил]амино]-метиламино]циклобутан-1-карбоксилат (2,06 г, 2,60 ммоль) суспендировали в изопропаноле (28,8 мл), добавляли карбонат калия (718 мг, 5,20 ммоль), и смесь перемешивали в атмосфере азота при 50°C в течение 8 часов. Затем реакционную смесь концентрировали, добавляли 1M хлористоводородную кислоту (2,60 мл, 2,60 ммоль) и экстрагировали этилацетатом. Затем органический слой промывали 10% водным раствором дигидрофосфата калия и 10% водным раствором хлорида натрия, и органический слой концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол) с получением названного соединения (1,72 г, 87%).
[0483] Несмотря на то, что у названного соединения существуют таутомеры, тем не менее, в одних случаях изомеры можно обнаружить, а в других случаях нет, в зависимости от типа растворителя, используемого для измерения. Например,1H-ЯМР и13C-ЯМР спектры основных таутомеров (хлороформ-D) являются следующими.
[0484] LCMS: м/z 759[M+H]+
[0485] Время удерживания при ВЭЖХ: 0,91 минут (SQD-TFA05)
[0486]1H-ЯМР (CDCl3) δ: 16,57 (1H, с), 12,81 (1H, с), 9,61 (1H, с), 8,50 (1H, д, J=8,7 Гц), 7,95 (1H, с), 7,90 (1H, д, J=1,6 Гц), 7,80 (1H, дд, J=8,7, 1,6 Гц), 7,01 (1H, ддд, J=9,1, 7,2, 1,8 Гц), 6,72 (1H, ддд, J=8,7, 7,2, 1,3 Гц), 5,08-5,03 (1H, м), 4,19-4,16 (1H, м), 4,19-4,16 (1H, м), 3,54-3,51 (2H, м), 3,37 (3H, с), 2,93 (2H, ушир.с), 2,73 (2H, ушир.с), 2,56 (1H, м), 2,43 (3H, ушир.с), 2,41 (3H, с), 1,86 (1H, м), 1,84 (1H, м), 1,82 (1H, м), 1,71 (1H, м), 1,58 (1H, м).
[0487]13C-ЯМР (CDCl3) δ: 186,1 (кв.C), 169,8 (кв.C), 165,7 (кв.C), 162,8 (кв.C), 159,3 (CH), 156,6 (кв.C, кв., JCF = 36,3 Гц), 150,4 (кв.C, дд, JCF = 248,4, 10,5 Гц), 147,9 (кв.C), 141,1 (кв.C, дд, JCF = 248,0, 15,0 Гц), 138,8 (кв.C), 128,3 (CH, кв., JCF = 3,3 Гц), 127,8 (кв.C), 127,1 (CH), 126,9 (кв.C, кв., JCF = 33,6 Гц), 125,1 (CH), 124,7 (CH), 123,6 (кв.C, кв., JCF = 271,8 Гц), 120,5 (кв.C, кв., JCF = 275,4 Гц), 117,9 (кв.C, д, JCF = 11,8 Гц), 115,9 (CH), 109,2 (CH, с), 92,3 (кв.C), 70,5 (CH2), 68,1 (CH2), 64,1 (кв.C), 58,9 (CH3), 57,4 (CH2), 56,3 (CH2), 43,4 (CH3), 41,5 (CH2), 35,0 (CH3), 32,4 (CH2), 24,4 (CH2), 13,4 (CH2).
[0488] <Пример 14>
7-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
Первая стадия
Метил 1-[[(E)-2,3-[дифтор-4-[2-[2-метоксиэтил(метил)амино]-этокси]фенил]метилиденамино]метиламино]циклопентан-1-карбоксилат
[0489]
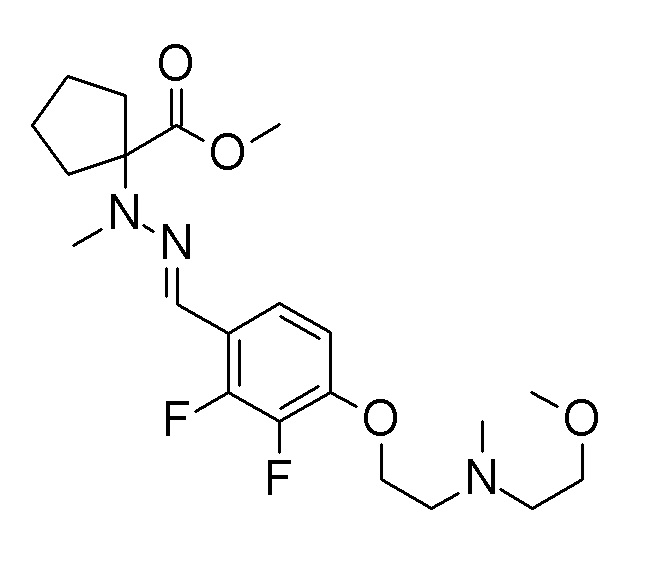
[0490] Метил 1-(метиламино)циклопентанкарбоксилат паратолуолсульфонат (3,60 г, 10,9 ммоль) (смотрите справочный пример 88) растворяли в уксусной кислоте (3,10 мл, 54,2 ммоль) и воде (18,0 мл), добавляли раствор нитрита натрия (0,91 г, 13,2 ммоль), растворенного в воде (2,00 мл), при 25°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли этилацетат (7,00 мл) и хлорид натрия (2,00 г), и после жидкостной экстракции органический слой промывали 15% водным раствором гидрофосфата калия. После промывки, к органическому слою добавляли метанол (20,0 мл), и добавляли 12N хлористоводородную кислоту (7,30 мл) при -10°C. К реакционной смеси добавляли цинковую пыль (1,44 г, 22,0 ммоль) при -30°C, и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли 28% водный аммиак (7,30 мл), добавляли раствор 2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]бензальдегида (2,00 г, 7,30 ммоль) (вторая стадия примера 13) в этилацетате (5,40 мл) при 0°C, и смесь перемешивали в течение 30 минут. Затем реакционную смесь концентрировали, добавляли этилацетат и 15% водный раствор дигидрофосфата калия для проведения жидкостной экстракции, и органический слой последовательно промывали 15% водным раствором гидросульфита натрия и 15% водным раствором гидрофосфата калия. Органический слой концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол) с получением названного соединения (2,82 г, 90%).
[0491] LCMS: м/z 428[M+H]+
[0492] Время удерживания при ВЭЖХ: 0,61 минут (SQD-FA05)
[0493] Вторая стадия
Метил 1-[[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]-этокси]фенил]метил-[3-оксо-3-[4-(трифторметил)-2-[6-(трифтор-метил)пиримидин-4-ил]анилино]пропаноил]амино]метиламино]-циклопентан-1-карбоксилат
[0494]
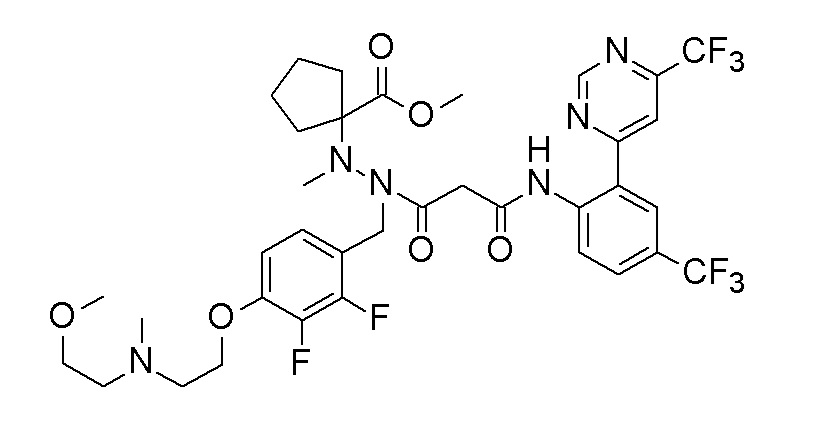
[0495] Метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метилиденамино]-метиламино]циклопентан-1-карбоксилат (1,00 г, 2,34 ммоль) растворяли в этилацетате (10,0 мл), добавляли метансульфоновую кислоту (1,14 мл, 17,6 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 10 минут. К реакционной смеси добавляли комплекс 5-этил-2-метилпиридина с бораном (0,70 мл, 4,70 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 30 минут. Затем к реакционной смеси добавляли метанол (1,00 мл) при 0°C, добавляли 5M водный раствор гидроксида натрия (3,00 мл), и смесь перемешивали при 0°C в течение 1 часа. К реакционной смеси добавляли 25% водный раствор трикалийфосфата для проведения жидкостной экстракции. Органический слой промывали 15% водным раствором хлорида натрия, и концентрировали его при пониженном давлении с получением метил 1-[[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]фенил]метиламино]метиламино]-циклопентан-1-карбоксилата в виде неочищенного продукта.
[0496] Полученный неочищенный продукт и 3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]анилино]-пропаноат (1,00 г, 2,54 ммоль) растворяли в этилацетате (8,00 мл) и N,N-диметилформамиде (4,00 мл), и затем добавляли пиридин (1,00 мл) и 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид (1,7M этилацетатный раствор, 2,75 мл, 4,68 ммоль) при -10°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли 10% водный раствор хлорида натрия для проведения жидкостной экстракции. Органический слой промывали 15% водным раствором гидрофосфата калия, и концентрировали его при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол) с получением названного соединения (1,82 г, 97%).
[0497] LCMS: м/z 805[M+H]+
[0498] Время удерживания при ВЭЖХ: 0,74 минут (SQD-FA05)
[0499] Третья стадия
7-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[0500]
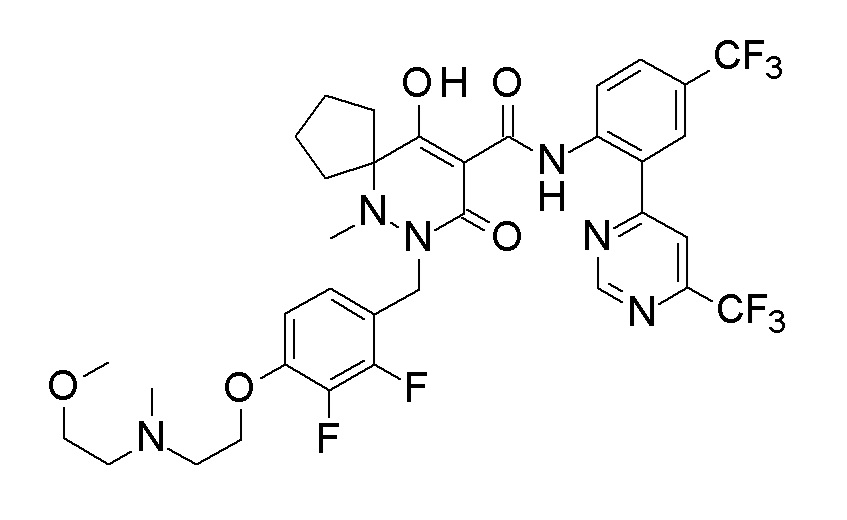
[0501] Метил 1-[[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метил-[3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]анилино]пропаноил]амино]метил-амино]циклопентан-1-карбоксилат (500 мг, 0,62 ммоль) суспендировали в изопропаноле (7,00 мл), добавляли карбонат калия (175 мг, 1,27 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 8 часов. Затем реакционную смесь концентрировали, добавляли 1M хлористоводородную кислоту (1,24 мл, 1,24 ммоль), и смесь экстрагировали этилацетатом. Затем органический слой промывали 10% водным раствором дигидрофосфата калия и 10% водным раствором хлорида натрия, и органический слой концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол) с получением названного соединения (432 мг, 90%).
[0502] Несмотря на то, что у названного соединения существуют таутомеры, тем не менее, в одних случаях изомеры можно обнаружить, а в других случаях нет, в зависимости от типа растворителя, используемого для измерения. Например,1H-ЯМР и13C-ЯМР спектры основных таутомеров (хлороформ-D) являются следующими.
[0503] LCMS: м/z 773[M+H]+
[0504] Время удерживания при ВЭЖХ: 0,95 минут (SQD-FA05)
[0505]1H-ЯМР (CDCl3) δ: 16,55 (1H, с), 12,83 (1H, с), 9,62 (1H, с), 8,49 (1H, д, J=8,7 Гц), 7,96 (1H, д, J=1,2 Гц), 7,90 (1H, д, J=1,6 Гц), 7,79 (1H, дд, J=8,7, 2,0 Гц), 7,04 (1H, дд, J=7,4, 7,4 Гц), 6,73 (1H, дд, J=7,4, 7,4 Гц), 5,05 (1H, д, J=14,2 Гц), 4,19-4,18 (1H, м), 4,19 (2H, ушир.с), 3,55 (2H, ушир.с), 3,37 (3H, с), 2,96 (2H, с), 2,76 (2H, с), 2,48 (3H, с), 2,45 (3H, с), 2,15 (1H, м), 1,74 (2H, м), 1,57 (1H, м), 1,50 (1H, м), 1,45 (2H, м), 1,30 (1H, м).
[0506]13C-ЯМР (CDCl3) δ: 187,8 (кв.C), 169,9 (кв.C), 165,7 (кв.C), 163,1 (кв.C), 159,3 (CH), 156,6 (кв.C, кв., J=36,3 Гц), 150,4 (кв.C, дд, JCF = 248,6, 10,6 Гц), 147,9 (кв.C), 141,1 (кв.C, дд, JCF = 248,3, 14,7 Гц), 138,8 (кв.C), 128,3 (CH), 127,8 (кв.C), 127,1 (CH), 126,9 (кв.C, кв., JCF = 33,4 Гц), 125,5 (CH), 124,7 (CH), 123,6 (кв.C, кв., JCF = 272,1 Гц), 120,5 (кв.C, кв., JCF = 275,4 Гц), 117,6 (кв.C, кв., JCF = 12,7 Гц), 116,0 (CH), 109,3 (CH), 93,1 (кв.C), 71,4 (кв.C), 70,4 (CH2), 68,0 (CH2), 58,9 (CH3), 57,3 (CH2), 56,3 (CH2), 43,3 (CH3), 41,6 (CH2), 37,6 (CH2), 36,8 (CH3), 31,4 (CH2), 24,8 (CH2), 23,3 (CH2).
[0507] <Пример 15>
(4aR)-1-[(3-Фторфенил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-5,6,7,8-тетрагидро-4aH-пиридо[1,2-b]пиридазин-3-карбоксамид
Первая стадия
(R)-Пиперидин-2-карбоновой кислоты метилового эфира гидрохлорид
[0508]
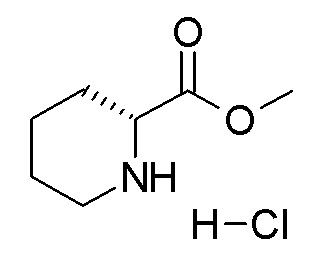
[0509] (R)-Пиперидин-2-карбоновую кислоту (300 мг, 2,32 ммоль) растворяли в метаноле (4,64 мл), добавляли по каплям тионилхлорид (0,508 мл, 6,97 ммоль) при 0°C, и смесь перемешивали при 50°C в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли толуол для азеотропного удаления с получением названного соединения в виде неочищенного продукта.
[0510] Вторая стадия
Соединения, описанные в следующей таблице, синтезировали из полученного (R)-пиперидин-2-карбоновой кислоты метилового эфира гидрохлорида и 3-фторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0511]
[0512] <Пример 16>
(4aS)-1-[(3-Фторфенил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-5,6,7,8-тетрагидро-4aH-пиридо[1,2-b]пиридазин-3-карбоксамид
Соединения, описанные в следующей таблице, синтезировали из (S)-пиперидин-2-карбоновой кислоты метилового эфира гидрохлорида и 3-фторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0513]
[0514] <Пример 17>
(4aS)-1-[(5,6-Дифтор-1H-индол-7-ил)метил]-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-5,6,7,8-тетрагидро-4aH-пиридо[1,2-b]пиридазин-3-карбоксамид
Соединения, описанные в следующей таблице, синтезировали из (S)-пиперидин-2-карбоновой кислоты метилового эфира гидрохлорида и 5,6-дифтор-1H-индол-7-карбальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0515]
[0516] <Пример 18>
1-[(3-Фторфенил)метил]-4-гидрокси-4a-метил-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-5,6,7,8-тетрагидропиридо[1,2-b]пиридазин-3-карбоксамид
Первая стадия
2-Метил-пиперидин-2-карбоновая кислота метиловый эфир гидрохлорид
[0517]
[0518] Названное соединение получали из 2-метилпиперидин-1,2-дикарбоновой кислоты 1-третбутилового эфира в виде неочищенного продукта таким же методом, как на первой стадии примера 4.
[0519] Вторая стадия
Соединения, описанные в следующей таблице, синтезировали из полученного 2-метилпиперидин-2-карбоновой кислоты метилового эфира гидрохлорида и 3-фторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0520]
[0521] <Пример 19>
1-[2,3-(Дифторфенил)метил]-4a-этил-4-гидрокси-N-[5-метил-2-(трифторметил)фуран-3-ил]-2-оксо-5,6,7,8-тетрагидропиридо[1,2-b]пиридазин-3-карбоксамид
Первая стадия
2-Этилпиперидин-2-карбоновой кислоты метилового эфира гидрохлорид
[0522]
[0523] Названное соединение получали из 2-этилпиперидин-2-карбоновой кислоты гидрохлорида в виде неочищенного продукта таким же методом, как на первой стадии примера 6.
[0524] Вторая стадия
Соединения, описанные в следующей таблице, синтезировали из полученного 2-этилпиперидин-2-карбоновой кислоты метилового эфира гидрохлорида и 2,3-дифторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0525]
[0526] <Пример 20>
(4aS,5S,8R)-1-(3-Фторбензил)-4-гидрокси-N-(5-метил-2-(трифторметил)фуран-3-ил)-2-оксо-2,4a,5,6,7,8-гексагидро-1H-5,8-mэтанoпиридо[1,2-b]пиридазин-3-карбоксамид
Первая стадия
(1S,3S,6R)-2-Азабицикло[2,2.1]гептан-3-карбоновой кислоты метилового эфира гидрохлорид
[0527]
[0528] (1R,3S,4S)-2-Азабицикло[2,2.1]гептан-2,3-дикарбоновой кислоты 2-третбутиловый эфир (500 мг, 2,07 ммоль) растворяли в N,N-диметилформамиде (2,07 мл), добавляли карбонат цезия (1,01 г, 3,11 ммоль) и йодметан (0,155 мл, 2,49 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали водой, насыщенным раствором бикарбоната натрия, 10% водным раствором тиосульфата натрия и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (1R,3S,4S)-2-азабицикло[2,2.1]гептан-2,3-дикарбоновой кислоты 2-третбутилового эфира 3-метилового эфира в виде неочищенного продукта. К полученному неочищенному продукту добавляли раствор хлористого водорода в 1,4-диоксане (4M, 5,00 мл), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и добавляли толуол для азеотропного удаления с получением названного соединения в виде неочищенного продукта.
[0529] Вторая стадия
Соединения, описанные в следующей таблице, синтезировали из полученного (1S,3S,6R)-2-азабицикло[2,2.1]гептан-3-карбоновой кислоты метилового эфира гидрохлорида и 3-фторбензальдегида таким же методом, как на первой - третьей стадиях примера 1.
[0530]
[0531] <Справочный пример 1-1>
(4aR)-1-[(2,3-Дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир
[0532]
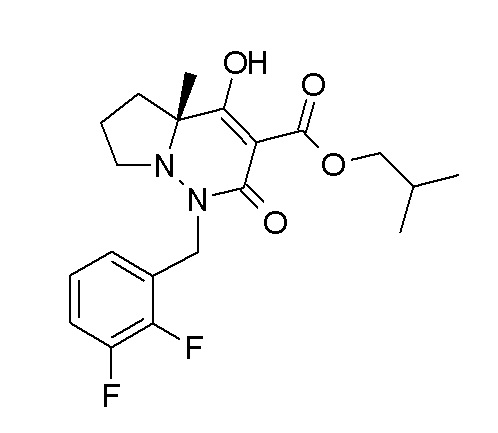
[0533] Первая стадия
[0534]
[0535] (R)-1-((2,3-(Дифторбензилиден)амино)-2-метил-пирролидин-2-карбоновой кислоты метиловый эфир (1,31 г, 4,63 ммоль) растворяли в метаноле (4,6 мл) и уксусной кислоте (4,6 мл), добавляли цианоборгидрид натрия (1,19 г, 18,98 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли насыщенный водный раствор бикарбоната натрия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали, и растворитель отгоняли при пониженном давлении с получением неочищенного продукта (1,34 г, 102%) (R)-1-((2,3-(дифторбензил)-амино)-2-метилпирролидин-2-карбоновой кислоты метилового эфира.
[0536] Вторая стадия
[0537]
[0538] (R)-1-((2,3-(Дифторбензил)амино)-2-метилпирролидин-2-карбоновой кислоты метиловый эфир (3,24 г, 11,39 ммоль) и 3-бутилокси-3-пропионовую кислоту (2,19 г, 13,67 ммоль) растворяли в дихлорметане (17,7 мл) и затем добавляли бромтри(пирролидин-1-ил)фосфония гексафторфосфат (6,9 г, 14,81 ммоль) и триэтиламин (6,37 мл, 45,6 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли дихлорметан и 1N хлористоводородную кислоту, и смесь перемешивали при комнатной температуре в течение 10 минут. Органический слой отделяли и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением (R)-1-(N-(2,3-дифторбензил)-3-изобутокси-3-оксопропанамид)-2-метилпирролидин-2-карбоновой кислоты метилового эфира (4,58 г, 94%).
[0539] LCMS: м/z 427[M+H]+
Время удерживания при ВЭЖХ: 1,33 минут (условия проведения анализа SMD-TFA05)
[0540] Третья стадия
(R)-1-(N-(2,3-Дифторбензил)-3-изобутокси-3-оксопропанамид)-2-метилпирролидин-2-карбоновой кислоты метиловый эфир (30,4 г, 71,2 ммоль) растворяли в N,N-диметилформамиде (142 мл), добавляли карбонат цезия (69,6 г, 214 ммоль), и смесь перемешивали при 80°C в течение 1 часа. Затем смесь охлаждали, концентрировали при пониженном давлении, добавляли 2N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (0-80% этилацетат/гексан) с получением названного соединения (25,33 г, 90%).
[0541] LCMS: м/z 395[M+H]+
Время удерживания при ВЭЖХ: 1,05 минут (условия проведения анализа SQD-FA05)
[0542] <Справочный пример 1-2>
Метил (4aR)-4-гидрокси-4a-метил-2-оксо-1-пентил-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксилат
[0543]
[0544] В качестве реагента использовали нормальный пентиловый альдегид (0,959 г, 11,1 ммоль), и проводили такие же операции, как на первой стадии справочного примера 1-1, с получением (R)-1-(пентиламино)-2-метилпирролидин-2-карбоновой кислоты метилового эфира (1,73 г) в виде неочищенного продукта. Полученное производное гидразина растворяли в тетрагидрофуране (14 мл), добавляли трикалийфосфат (6,41 г, 30,2 ммоль) и метил 3-хлор-3-оксопропаноат (1,62 мл, 15,1 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли этилацетат (100 мл), и затем органический слой промывали 1N хлористоводородной кислотой, водой и солевым раствором, сушили его над сульфатом магния. Затем его фильтровали, фильтрат концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением (R)-1-(3-метокси-3-оксо-Н-пентилпропанамид)-2-метилпирролидин-2-карбоновой кислоты метилового эфира (1,84 г, 84%) в виде желтого масла. Полученное соединение амида (1,84 г, 5,59 ммоль) растворяли в N,N-диметилформамиде (25 мл), добавляли карбонат цезия (5,47 г, 16,8 ммоль), и смесь перемешивали при 80°C в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры, добавляли этилацетат (50 мл), и затем органический слой промывали 1N хлористоводородной кислотой, водой и солевым раствором, сушили над сульфатом магния. Затем его фильтровали, фильтрат концентрировали при пониженном давлении с получением названного соединения (1,84 г).
[0545] LCMS: м/z 297[M+H]+
Время удерживания при ВЭЖХ: 1,22 минут (условия проведения анализа SMD-TFA05)
[0546] <Справочный пример 2>
(R)-2,5,5-Триметилпирролидин-2-карбоновой кислоты метиловый эфир
[0547]
[0548] Первая стадия
[0549]
[0550] 4-Хлорбензальдегид (0,736 г, 5,23 ммоль) добавляли к суспензии 2-аминопропаноата третбутилового эфира (0,80 г, 5,51 ммоль) и сульфата магния (0,66 г, 5,51 ммоль) в дихлорметане (7,3 мл), и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток растворяли в диэтиловом эфире, промывали водой и солевым раствором, и органический слой сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 2-((4-хлорбензилиден)амино)пропаноат третбутиловый эфир (1,29 г) в виде неочищенного продукта.
[0551] Вторая стадия
[0552]
[0553] 2-((4-Хлорбензилиден)амино)пропаноата третбутиловый эфир (2,18 г, 12,2 ммоль), полученный на первой стадии, и (S)-4,4-дибутил-2,6-бис(3,4,5-трифторфенил)-4,5-дигидро-3H-динафто-[7,6,1,2-cde]азепиния бромид (91 мг, 0,122 ммоль) растворяли в толуоле (85 мл), и добавляли 1-бром-3-метил-2-бутен (1,71 мл, 14,61 ммоль) и гидроксид цезия (9,13 г, 60,9 ммоль) при 0°C. Затем реакционную смесь перемешивали при 0°C в течение 4 часов, добавляли воду, и смесь экстрагировали дихлорметаном. Органический слой промывали солевым раствором, сушили над сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении с получением (R)-2-((4-хлорбензилиден)амино)-2,5-диметилгекс-4-еновой кислоты трет-бутилового эфира в виде неочищенного продукта.
[0554] Третья стадия
[0555]
[0556] 1N хлористоводородную кислоту (97 мл, 97 ммоль) медленно добавляли к раствору (R)-2-((4-хлорбензилиден)амино)-2,5-диметилгекс-4-еновой кислоты третбутилового эфира (4,09 г, 12,2 ммоль), полученного на второй стадии, в диэтиловом эфире (97 мл). Реакционную смесь интенсивно перемешивали при комнатной температуре в течение 4 часов. Органический слой отделяли, и водный слой промывали диэтиловым эфиром. Затем величину рН водного слоя доводили до pH 9, экстрагировали дихлорметаном. Экстракты объединяли, сушили и фильтровали, и фильтрат концентрировали при пониженном давлении с получением (R)-2-амино-2,5-диметилгекс-4-еновой кислоты третбутилового эфира в виде неочищенного продукта.
[0557] Четвертая стадия
[0558]
[0559] (R)-2-Амино-2,5-диметилгекс-4-еновой кислоты трет-бутиловый эфир (1,03 г, 4,83 ммоль), полученный на третьей стадии, растворяли в дихлорметане (9,7 мл), добавляли п-толуолсульфонилхлорид (1,11 г, 5,79 ммоль), триэтиламин (0,81 мл, 5,79 ммоль) и 4-диметиламинопиридин (5,90 мг, 0,048 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали дихлорметаном. Экстракты объединяли, промывали солевым раствором, сушили над сульфатом натрия и фильтровали, и затем фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением (R)-2,5-диметил-2-(4-метилфенилсульфонамид)гекс-4-еновой кислоты третбутилового эфира (1,47 г, 83%) в виде желтого масла.
[0560] LCMS: м/z 368[M+H]+
Время удерживания при ВЭЖХ: 1,40 минут (условия проведения анализа SMD-TFA05)
[0561] Пятая стадия
[0562]
[0563] (R)-2,5-Диметил-2-(4-метилфенилсульфонамид)гекс-4-еновой кислоты третбутиловый эфир (1,47 г, 4,00 ммоль), полученный на четвертой стадии, растворяли в хлороформе (16,0 мл), и раствор охлаждали до 0°C. Добавляли трифторметан-сульфоновую кислоту (0,14 мл, 1,60 ммоль) при 0°C, и реакционную смесь перемешивали при 0°C в течение 1 часа, и при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный раствор бикарбоната натрия, и смесь экстрагировали дихлорметаном. Экстракты объединяли, промывали солевым раствором и сушили над сульфатом натрия. Затем экстракт фильтровали, фильтрат концентрировали при пониженном давлении с получением (R)-2,5,5-триметил-1-тозилпирролидин-2-карбоновой кислоты в виде неочищенного продукта.
[0564] Шестая стадия
[0565]

[0566] Йодметан (2,99 мл, 4,80 ммоль) добавляли к суспензии (R)-2,5,5-триметил-1-тозилпирролидин-2-карбоновой кислоты (1,25 г, 4,00 ммоль), полученной на пятой стадии, и карбоната калия (829 мг, 6,00 ммоль) в N,N-диметилформамиде (16,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Экстракты объединяли, промывали солевым раствором и сушили над сульфатом натрия. Затем экстракт фильтровали, фильтрат концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением (R)-2,5,5-триметил-1-тозилпирролидин-2-карбоновой кислоты метилового эфира (1,24 г, 3,81 ммоль) в виде бледно-желтого твердого вещества.
[0567] LCMS: м/z 326[M+H]+
Время удерживания при ВЭЖХ: 1,20 минут (условия проведения анализа SMD-TFA05)
[0568] Седьмая стадия
(R)-2,5,5-Триметил-1-тозилпирролидин-2-карбоновой кислоты метиловый эфир (1,24 г, 3,81 ммоль), полученный на шестой стадии, растворяли в метаноле (38,1 мл) и добавляли магний (1,85 г, 76 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 28 часов. Добавляли 1N хлористоводородную кислоту, и водный слой промывали дихлорметаном. Величину рН водного слоя доводили до pH 9 и экстрагировали дихлорметаном. Экстракты объединяли, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением названного соединения (611 мг, 3,57 ммоль) в виде бесцветного масла.
[0569]1H-ЯМР (CDCl3) δ: 3,73 (3H, с), 2,36-2,30 (1H, м), 1,88-1,80 (1H, м), 1,69-1,53 (2H, м), 1,39 (3H, с), 1,18 (3H, с), 1,17 (3H, с).
[0570] <Справочный пример 3>
2,3-Дифтор-4-(2-морфолиноэтокси)бензальдегид
[0571]
[0572] Первая стадия
[0573]

[0574] 4-(2-Хлорэтил)морфолина гидрохлорид (4,72 г, 25,4 ммоль), карбонат цезия (18,8 г, 57,7 ммоль) и тетрабутиламмония йодид (0,511 г, 1,38 ммоль) добавляли к раствору 2,3-дифторфенола (3,00 г, 23,1 ммоль) в ацетонитриле (46,1 мл), и смесь перемешивали при 65°C в течение 4 часов. После охлаждения до комнатной температуры, реакционную смесь фильтровали через слой целита, и фильтрат концентрировали при пониженном давлении. Остаток растворяли в этилацетате, промывали водой, 2N водным раствором гидроксида натрия, водой и солевым раствором, и органический слой сушили над сульфатом натрия. Затем фильтровали, фильтрат концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением 4-(2-(2,3-дифторфенокси)этил)-морфолина (5,60 г, 99%) в виде бесцветного масла.
[0575] LCMS: м/z 244[M+H]+
Время удерживания при ВЭЖХ: 0,68 минут (условия проведения анализа SMD-TFA05)
[0576] Вторая стадия
Раствор 4-(2-(2,3-дифторфенокси)этил)морфолина (1,00 г, 4,11 ммоль) и N,N,N',N'-тетраметилэтилендиамина (0,62 мл, 4,11 ммоль) в тетрагидрофуране (13,7 мл) охлаждали до -78°C и добавляли н-бутиллитий (2,14 мл, 5,34 ммоль). Затем смесь перемешивали при -78°C в течение 1 часа, добавляли N,N-диметилформамид (0,35 мл, 4,52 ммоль) при -78°C. Реакционную смесь медленно нагревали до -10°C, и реакцию прерывали с помощью насыщенный водный раствор хлорида аммония. Водный слой экстрагировали этилацетатом, и экстракты объединяли и промывали солевым раствором, сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения (758 мг, 68%) в виде желтого масла.
[0577] LCMS: м/z 272[M+H]+
Время удерживания при ВЭЖХ: 0,62 минут (условия проведения анализа SMD-TFA05)
[0578] <Справочный пример 4>
(4aR)-1-[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир
[0579]
[0580] Первая стадия
[0581]
[0582] Для синтеза метил (2R)-1-[(E)-[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метилиденамино]-2-метилпирролидин-2-карбоксилата использовали 2,3-дифтор-4-(2-морфолиноэтокси)-бензальдегид и метил (R)-2-метилпирролидин-2-карбоновой кислоты гидрохлорид, и проводили такие же операции, как на первой - третьей стадиях примера 1.
[0583] LCMS: м/z 412[M+H]+
Время удерживания при ВЭЖХ: 0,95 минут (условия проведения анализа SMD-TFA05)
[0584] Вторая стадия
[0585]
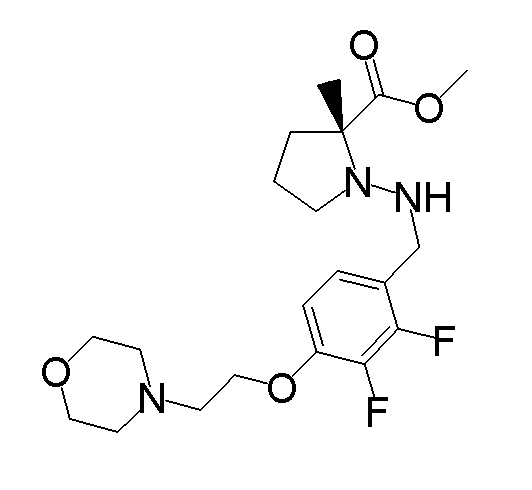
[0586] Для получения (R)-1-((2,3-дифтор-4-(2-морфолино-этокси)бензил)амино)-2-метилпирролидин-2-карбоновой кислоты метилового эфира в виде неочищенного продукта использовали (R)-1-((2,3-дифтор-4-(2-морфолино-этокси)бензилиден)амино)-2-метил-пирролидин-2-карбоновой кислоты метиловый эфир и проводили такие же операции, как на первой стадии справочного примера 1-1.
[0587] LCMS: м/z 414[M+H]+
Время удерживания при ВЭЖХ: 0,63 минут (условия проведения анализа SMD-TFA05)
[0588] Третья стадия
[0589]
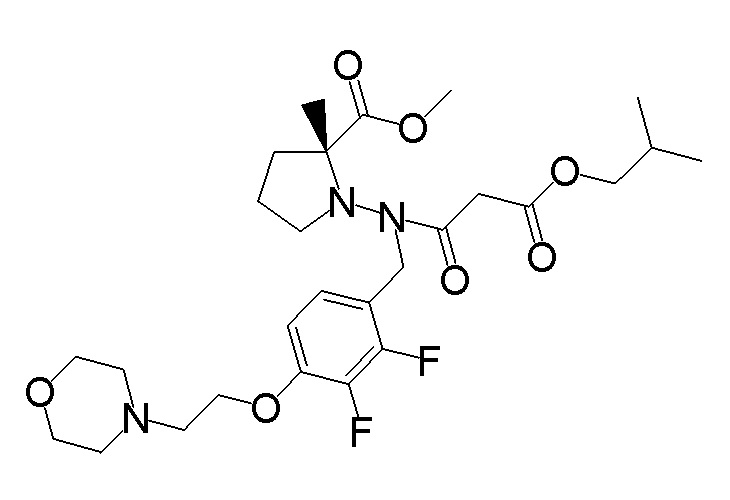
[0590] Для синтеза (R)-1-(N-(2,3-дифтор-4-(2-морфолино-этокси)бензил)-3-изобутокси-3-оксопропанамид)-2-метилпирролидин-2-карбоновой кислоты метилового эфира использовали (R)-1-((2,3-дифтор-4-(2-морфолиноэтокси)бензил)амино)-2-метилпирролидин-2-карбоновой кислоты метиловый эфир и 3-бутилокси-3-пропионовую кислоту, и проводили такие же операции, как в справочном примере 1-2.
[0591] LCMS: м/z 556[M+H]+
Время удерживания при ВЭЖХ: 1,03 минут (условия проведения анализа SMD-TFA05)
[0592] Четвертая стадия
Для синтеза названного соединения использовали (R)-1-(N-(2,3-дифтор-4-(2-морфолиноэтокси)-бензил)-3-изобутокси-3-оксо-пропанамид)-2-метилпирролидин-2-карбоновой кислоты метиловый эфир и проводили такие же операции, как в справочном примере 1-2.
[0593] LCMS: м/z 524[M+H]+
Время удерживания при ВЭЖХ: 1,04 минут (условия проведения анализа SMD-TFA05)
[0594] Синтезировали эфирные производные, описанные в следующей таблице, используя соответствующие альдегидные реагенты и производные пролина для проведения таких же превращений, как в справочном примере 1-1 или справочном примере 1-2.
[0595]
[0596]
[0597] <Справочный пример 13>
4-(Трифторметил)-2-[6-(трифторметил)пиридин-3-ил]анилин
[0598]
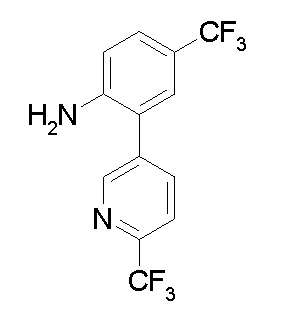
[0599] Толуол (900 мл), этанол (226 мл) и воду (450 мл) добавляли к 2-(тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифтор-метил)анилину (60,00 г, 209 ммоль), 5-бром-2-(трифторметил)-пиридину (50,80 г, 225 ммоль), тетракис(трифенилфосфин)палладию (9,000 г, 7,79 ммоль) и карбонату калия (129,0 г, 930 ммоль) в атмосфере азота, и смесь перемешивали при 110°C в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, добавляли воду (1000 мл), и смесь экстрагировали этилацетатом. Органический слой промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир) с получением названного соединения (63 г, 98%).
[0600] LCMS: м/z 307[M+H]+
Время удерживания при ВЭЖХ: 0,99 минут (условия проведения анализа SQD-AA05)
[0601] <Справочный пример 14>
2-Йод-5-(2-метоксиэтокси)-4-(трифторметил)анилин
[0602]
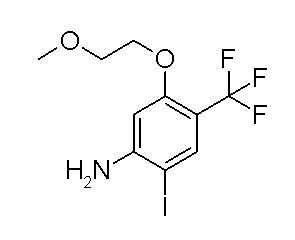
[0603] Первая стадия
[0604]
[0605] 2-Метоксиэтанол (0,097 мл, 1,24 ммоль) растворяли в N-метилпирролидоне (2 мл) в атмосфере азота, добавляли гидрид натрия (60 масс.% дисперсия в минеральном масле, 30 мг, 1,24 ммоль), и затем смесь перемешивали при комнатной температуре в течение 30 минут, добавляли 4-бром-2-фтор-1-(трифторметил)бензол (0,118 мл, 0,823 ммоль), и смесь перемешивали при комнатной температуре в течение 7 дней. К реакционной смеси добавляли 0,37M водный раствор дигидрофосфата калия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (0-10% этилацетат/гексан) с получением 4-бром-2-(2-метоксиэтокси)-1-(трифторметил)бензола (231,2 мг, 94%).
[0606] Время удерживания при ВЭЖХ: 0,63 минут (условия проведения анализа SQD-AA50)
[0607] ТСХ (пластинка с силикагелем) величина Rf: 0.,37 (10% этилацетат/гексан)
[0608] Вторая стадия
[0609]
[0610] 4-Бром-2-(2-метоксиэтокси)-1-(трифторметил)бензол (231,2 мг, 0,773 ммоль), карбаминовой кислоты третбутиловый эфир (109 мг, 0,928 ммоль), ацетат палладия(II) (5,21 мг, 0,023 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенил (33,2 мг, 0,07 ммоль) и карбонат цезия (353 мг, 1,08 ммоль) растворяли в 1,4-диоксане (5,2 мл), и смесь перемешивали в атмосфере азота при 100°C в течение ночи. К реакционной смеси добавляли 0,37M водный раствор дигидрофосфата калия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (0-20% этилацетат/гексан) с получением (3-(2-метоксиэтокси)-4-(трифторметил)фенил)карбаминовой кислоты третбутилового эфира (192,5 мг, 74%).
[0611] LCMS: м/z 334[M-H]-
Время удерживания при ВЭЖХ: 1,02 минут (условия проведения анализа SQD-AA05)
[0612] Третья стадия
[0613]
[0614] Раствор 4N хлористого водорода/1,4-диоксан (3,9 мл) добавляли к (3-(2-метоксиэтокси)-4-(трифторметил)фенил)- карбаминовой кислоты третбутиловому эфиру (192,5 мг, 0,574 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли эфир/гексан (1/3), осажденное твердое вещество собирали фильтрацией и сушили под вакуумом с получением 3-(2-метоксиэтокси)-4-(трифторметил)-анилина гидрохлорида (128,1 мг, 82%).
[0615] LCMS: м/z 236[M+H]+
Время удерживания при ВЭЖХ: 0,83 минут (условия проведения анализа SQD-AA05)
[0616] Четвертая стадия
3-(2-Метоксиэтокси)-4-(трифторметил)анилина гидрохлорид (55,9 мг, 0,206 ммоль) растворяли в уксусной кислоте (1,03 мл), добавляли N-йодсукцинимид (50,9 мг, 0,226 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов и 20 минут. Реакционную смесь концентрировали при пониженном давлении, добавляли этилацетат, промывали 0,5N гидроксидом натрия и солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (0-40% этилацетат/гексан) с получением названного соединения (69,2 мг, 93%).
[0617] LCMS: м/z 362[M+H]+
Время удерживания при ВЭЖХ: 1,19 минут (условия проведения анализа SMD-TFA05)
[0618] <Справочный пример 15>
2',3'-Диметокси-4-(2-метоксиэтокси)-5-(трифторметил)-[1,1'-бифенил]-2-амин
[0619]
[0620] Толуол (2,7 мл) и этанол (1,1 мл) добавляли к 2-йод-5-(2-метоксиэтокси)-4-(трифторметил)анилину (69,2 мг, 0,192 ммоль), (2,3-диметоксифенил)бороновой кислоте (34,9 мг, 0,192 ммоль) и 1,1'-бис(дифенилфосфино)ферроцендихлорпалладию(II) (7,9 мг, 0,0096 ммоль), затем добавляли 2M водный раствор карбоната калия (0,38 мл), и смесь перемешивали в атмосфере азота при 100°C в течение 1 часа. К реакционной смеси добавляли 0,37 M водный раствор дигидрофосфата калия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (0-40% этилацетат/гексан), с получением названного соединения (41,1 мг, 58%).
[0621] LCMS: м/z 372[M+H]+
Время удерживания при ВЭЖХ: 1,21 минут (условия проведения анализа SMD-TFA05)
[0622] Для синтеза производных анилина, описанных в следующей таблице, использовали производные бороновой кислоты и галогениды, описанные в следующей таблице, и проводили такие же операции, как в справочном примере 13 или справочном примере 15.
[0623]
[0629] <Справочный пример 63>
6-(2-Амино-5-(трифторметил)фенил)пиримидин-4-карбонитрил
[0630]
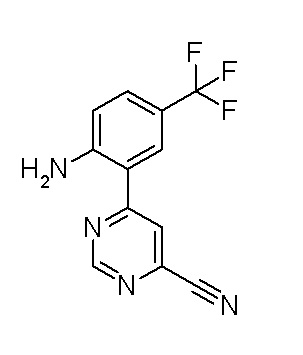
[0631] 2-(6-Хлорпиримидин-4-ил)-4-(трифторметил)анилин (1,0 г, 3,65 ммоль) и 1,4-диазабицикло[2,2,2]октан (0,246 г, 2,19 ммоль) растворяли в диметилсульфоксиде (3 мл), добавляли водный раствор (3 мл) цианида калия (0,95 г, 14,6 ммоль) при 0°C, и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 0,37 M водный раствор дигидрофосфата калия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (40-100% ацетонитрил/вода) с получением названного соединения (365,6 мг, 38%).
[0632] LCMS: м/z 265[M+H]+
Время удерживания при ВЭЖХ: 1,16 минут (условия проведения анализа SMD-TFA05)
[0633] <Справочный пример 64>
5-(2-Амино-5-(трифторметил)фенил)-4-метоксипиримидин-2-карбонитрил
[0634]
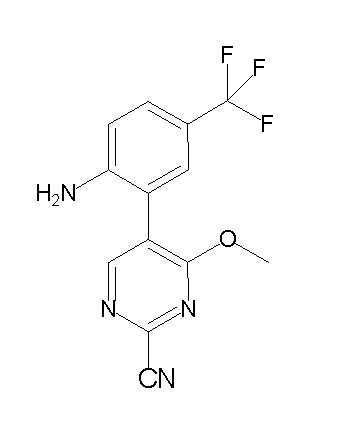
[0635] Смесь 2-(2-хлор-4-метоксипиримидин-5-ил)-4-(трифтор-метил)анилина (89 мг, 0,293 ммоль), дицианида цинка (20,65 мг, 0,176 ммоль), 1,1'-бис(дифенилфосфино)ферроцена (18,07 мг, 0,032 ммоль), и аддукта трис(дибензилиденацетон)дипалладий(0)⋅хлороформ (30,3 мг, 0,029 ммоль) в N,N-диметилформамиде (1,5 мл) нагревали и перемешивали в атмосфере азота при 80°C в течение 1 часа. Затем реакционную смесь нагревали и перемешивали при 110°C в течение 9 часов. Реакционную смесь очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил-вода, 0,03% муравьиная кислота) с получением 5-(2-амино-5-(трифторметил)-фенил)-4-метоксипиримидин-2-карбонитрила (57 мг, 66%).
[0636] LCMS: м/z 295[M+H]+
Время удерживания при ВЭЖХ: 0,82 минут (условия проведения анализа SQD-FA05)
[0637] <Справочный пример 65>
6-(2-Амино-5-(трифторметил)фенил)-5-хлорпиримидин-4-карбонитрил
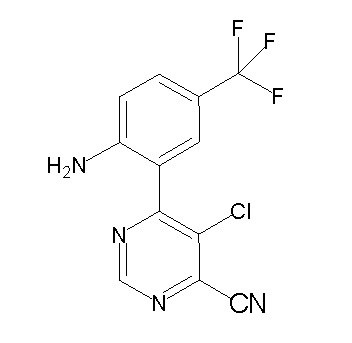
[0639] Для синтеза названного соединения использовали 2-(5,6-дихлорпиримидин-4-ил)-4-(трифторметил)анилин и проводили такие же операции, как в справочном примере 63.
[0640] LCMS: м/z 299[M+H]+
Время удерживания при ВЭЖХ: 0,82 минут (условия проведения анализа SQD-FA05)
[0641] <Справочный пример 66>
6-(2-Амино-5-(трифторметил)фенил)-5-метоксипиримидин-4-карбонитрил
[0642]
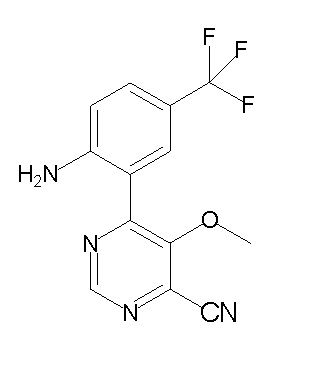
[0643] Для синтеза названного соединения использовали 2-(6-хлор-5-метоксипиримидин-4-ил)-4-(трифторметил)анилин и проводили такие же операции, как в справочном примере 63.
[0643] LCMS: м/z 295[M+H]+
Время удерживания при ВЭЖХ: 0,81 минут (условия проведения анализа SQD-FA05)
[0645] <Справочный пример 67>
6-(2-Амино-5-(трифторметил)фенил)-5-метилпиримидин-4-карбонитрил
[0646]
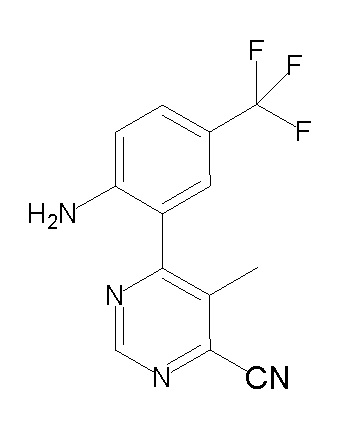
[0647] Для синтеза названного соединения использовали 2-(6-хлор-5-метилпиримидин-4-ил)-4-(трифторметил)анилин и проводили такие же операции, как в справочном примере 63.
[0648] LCMS: м/z 279[M+H]+
Время удерживания при ВЭЖХ: 0,78 минут (условия проведения анализа SQD-FA05)
[0649] <Справочный пример 68>
5-(2-Амино-5-(трифторметил)фенил)пиразин-2-карбонитрил
[0650]
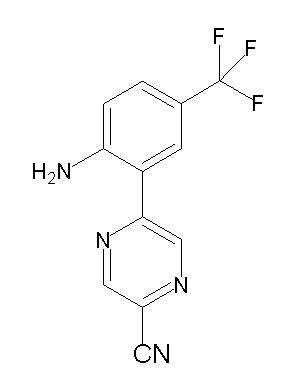
[0651] Смесь 2-(5-бромпиразин-2-ил)-4-(трифторметил)анилина (27,6 мг, 0,087 ммоль), дицианида цинка (6,1 мг, 0,052 ммоль) и тетракис(трифенилфосфин)палладия(0) (5 мг, 0,0043 ммоль) в N,N-диметилформамиде (0,4 мл) нагревали и перемешивали в атмосфере азота при 80°C в течение 18 часов. Реакционную смесь очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил-вода, 0,03% муравьиная кислота) с получением 5-(2-амино-5-(трифторметил)фенил)пиразин-2-карбонитрила.
[0652] LCMS: м/z 265[M+H]+
Время удерживания при ВЭЖХ: 0,81 минут (условия проведения анализа SQD-FA05)
[0653] <Справочный пример 69>
2-(6-Метилпиримидин-4-ил)-4-(трифторметил)анилин
[0654]
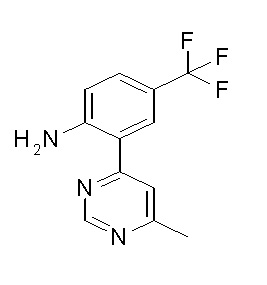
[0655] 2-(6-Хлорпиримидин-4-ил)-4-(трифторметил)анилин (51,9 мг, 0,19 ммоль), триметилбороксин (0,053 мл, 0,379 ммоль), бис(трифенилфосфин)палладия(II) хлорид (13,3 мг, 0,019 ммоль) и трикалийфосфат (161 мг, 0,759 ммоль) растворяли в 1,4-диоксане (0,95 мл), и смесь перемешивали при 90°C в течение 1 часа. К реакционной смеси добавляли 0,37M водный раствор дигидрофосфата калия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (0-30% этилацетат/гексан) с получением названного соединения (27,4 мг, 57%).
[0656] LCMS: м/z 254[M+H]+
Время удерживания при ВЭЖХ: 0,93 минут (условия проведения анализа SQD-AA05)
[0657] <Справочный пример 70>
2-(Трифторметил)-4-(6-(трифторметил)пиридин-3-ил)пиримидин-5-амин
[0658]
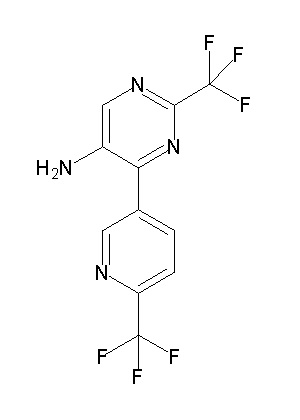
[0659] Первая стадия
[0660]
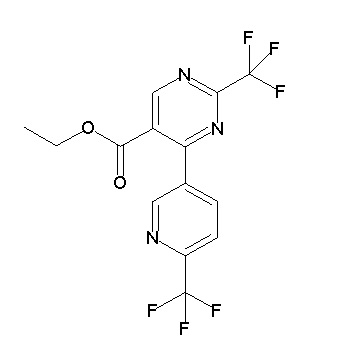
[0661] Для синтеза 2-(трифторметил)-4-(6-(трифторметил)-пиридин-3-ил)пиримидин-5-карбоновой кислоты этилового эфира использовали 4-йод-2-(трифторметил)пиримидин-5-карбоновой кислоты этиловый эфир и (6-(трифторметил)пиридин-3-ил)бороновую кислоту, и проводили такие же операции, как в справочном примере 13.
[0662] LCMS: м/z 366[M+H]+
Время удерживания при ВЭЖХ: 1,26 минут (условия проведения анализа SMD-TFA05)
[0663] Вторая стадия
[0664]
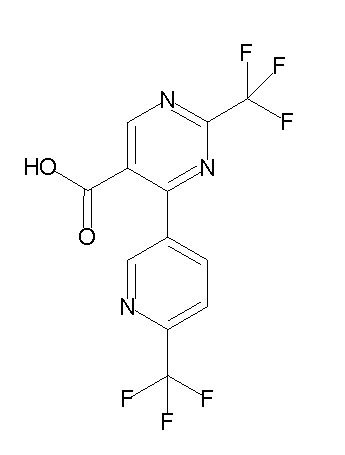
[0665] 2-(Трифторметил)-4-(6-(трифторметил)пиридин-3-ил)-пиримидин-5-карбоновой кислоты этиловый эфир, полученный на первой стадии (36 мг, 0,10 ммоль), растворяли в смешанном растворе этанола (1 мл) и воды (1 мл) и добавляли гидроксид натрия (7,9 мг, 0,20 ммоль) при комнатной температуре. Затем смесь перемешивали при комнатной температуре в течение 1 часа, растворитель концентрировали при пониженном давлении, и к остатку добавляли 1N хлористоводородную кислоту (5 мл). Затем экстрагировали этилацетатом, органический слой сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 2-(трифторметил)-4-(6-(трифторметил)пиридин-3-ил)пиримидин-5-карбоновой кислоты в виде неочищенного продукта (30 мг).
[0666] LCMS: м/z 338[M+H]+
Время удерживания при ВЭЖХ: 1,05 минут (условия проведения анализа SMD-TFA05)
[0667] Третья стадия
N,N-диметилформамид (1,5 мл) добавляли к 2-(трифторметил)-4-(6-(трифторметил)пиридин-3-ил)пиримидин-5-карбоновой кислоте (30 мг, 0,09 ммоль), полученной на второй стадии, триэтиламину (8,9 мг, 0,09 ммоль) и дифенилфосфорилазиду (DPPA, 24,3 мг, 0,09 ммоль), и смесь перемешивали при 60°C в течение 3 часов. К реакционной смеси добавляли воду (1,5 мл) и перемешивали при 80°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, a добавляли 1N водный раствор гидроксида натрия и затем экстрагировали этилацетатом, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении с получением названного соединения (26 мг) в виде неочищенного продукта.
[0668] LCMS: м/z 309[M+H]+
Время удерживания при ВЭЖХ: 1,08 минут (условия проведения анализа SMD-TFA05)
[0669] <Справочный пример 71>
4-Бром-2-(6-(трифторметил)пиримидин-4-ил)анилин
[0670]
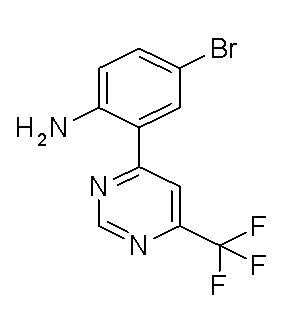
[0671] Для получения 2-(6-(трифторметил)пиримидин-4-ил)-анилина использовали 2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин и 4-хлор-6-(трифторметил)пиримидин в качестве реагента и исходного материала, соответственно, и проводили такие же операции, как в справочном примере 13. 1-Бромпирролидин-2,5-дион (66,2 мг, 0,372 ммоль) добавляли к раствору 2-(6-(трифторметил)пиримидин-4-ил)анилина (89 мг, 0,372 ммоль) в уксусной кислоте (0,94 мл)/воде (0,0067 мл) при комнатной температуре. Реакционную смесь нагревали до 55°C и перемешивали в течение 3,5 часов. Реакционную смесь охлаждали до комнатной температуры, и проводили три раза азеотропное удаление с помощью толуола. Остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения (60 мг, 50%) в виде желтого твердого вещества.
[0672] LCMS: м/z 318[M+H]+
Время удерживания при ВЭЖХ: 1,24 минут (условия проведения анализа SMD-TFA05)
[0673] <Пример 21>
(4aR)-1-[(2,3-Дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0674]
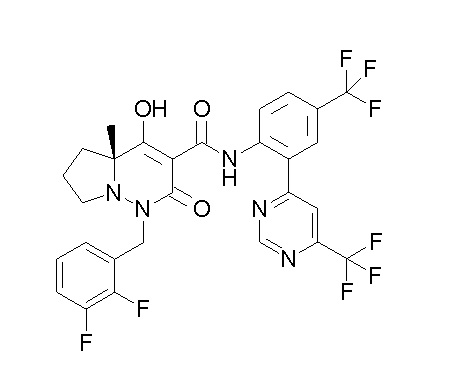
[0675] (4aR)-1-[(2,3-Дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир (20 мг, 0,0567 ммоль) и 4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)анилин (справочный пример 50, 18 мг, 0,0596 ммоль) растворяли в толуоле (0,2 мл), и смесь перемешивали при 90°C в течение 3,5 часов. Затем смесь охлаждали, концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения (36 мг, 99%).
[0676] LCMS: м/z 628[M+H]+
Время удерживания при ВЭЖХ: 1,17 минут (условия проведения анализа SQD-AA05)
[0677] Основной таутомер
1H-ЯМР (CDCl3) δ: 16,47 (1H, с), 12,91 (1H, с), 9,60 (1H, с), 8,47 (1H, д, J=8,7 Гц), 7,95 (1H, с), 7,90 (1H, с), 7,79 (1H, д, J=8,7 Гц), 7,13-7,10 (2H, м), 7,05-7,03 (1H, м), 5,08 (1H, д, J=14,3 Гц), 4,47 (1H, д, J=14,3 Гц), 3,33 (1H, ддд, J=9,0, 9,0, 3,2 Гц), 2,76 (1H, ддд, J=9,0, 8,7, 8,7 Гц), 2,56-2,54 (1H, м), 1,76-1,73 (1H, м), 1,69-1,64 (2H, м), 1,00 (3H, с).
[0678] Второстепенный таутомер
1H-ЯМР (CDCl3) δ: 18,22 (1H, с), 12,98 (1H, с), 9,59 (1H, с), 8,33 (1H, д, J=8,7 Гц), 7,92 (2H, д, J=9,6 Гц), 7,79 (1H, д, J=8,7 Гц), 7,14-7,06 (3H, м), 5,10 (1H, д, J=14,0 Гц), 4,52 (1H, д, J=14,6 Гц), 3,29-3,25 (1H, м), 2,78-2,75 (1H, м), 2,64-2,59 (1H, м), 1,73-1,66 (2H, м), 1,49-1,46 (1H, м), 0,84 (3H, с).
[0679] Для синтеза соединений, описанный в следующей таблице, использовали соответствующие анилиновые реагенты справочных примеров 13 и 15-71 и соответствующие эфирные производные справочных примеров 1-1 и 1-2 и справочных примеров 4-12, и проводили такие же операции, как в примере 21. Следует отметить, что в примерах 59 и 60 в качестве растворителя вместо толуола использовали N,N-диметилформамид.
[0680]
[0681]
[0682]
[0683]
[0684]
[0685]
[0686]
[0687]
[0688]
[0689]
[0690] В связи с тем, что для соединений, описанных в этой таблице, существуют таутомеры, далее приводятся, например, данные1H-NMR для примеров 22 и 52.
<Пример 22>
Основной таутомер
1H-ЯМР (CDCl3) δ: 16,12 (1H, с), 11,93 (1H, с), 9,35 (1H, с), 8,54 (1H, д, J=8,8 Гц), 7,77 (1H, д, J=8,9 Гц), 7,59 (1H, с), 6,97 (1H, дд, J=7,8, 7,8 Гц), 6,76 (1H, дд, J=7,8, 7,8 Гц), 4,81 (1H, д, J=14,2 Гц), 4,32 (1H, д, J=14,3 Гц), 4,20 (2H, т, J=5,7 Гц), 3,74 (4H, т, J=4,5 Гц), 3,29 (1H, ддд, J=8,8, 8,7, 3,0 Гц), 2,84 (2H, т, J=5,6 Гц), 2,67 (1H, ддд, J=8,8, 8,8, 8,8 Гц), 2,61-2,59 (4H, м), 2,55-2,53 (1H, м), 2,45 (3H, с), 1,74-1,71 (1H, м), 1,67-1,62 (2H, м), 0,99 (3H, с).
[0691] Второстепенный таутомер
1H-ЯМР (CDCl3) δ: 17,93 (1H, с), 12,03 (1H, с), 9,32 (1H, с), 8,36 (1H, д, J=8,9 Гц), 7,77 (1H, д, J=8,9 Гц), 7,61 (1H, с), 7,06 (1H, дд, J=18,5, 10,0 Гц), 6,73 (1H, т, J=10,0 Гц), 5,00 (1H, д, J=14,4 Гц), 4,42 (1H, д, J=14,6 Гц), 4,19 (2H, кв., J=6,7 Гц), 3,74 (4H, т, J=4,5 Гц), 3,24-3,22 (1H, м), 2,84 (2H, т, J=5,6 Гц), 2,70-2,66 (1H, м), 2,60 (4H, с), 2,55-2,49 (1H, м), 2,40 (3H, с), 1,67-1,62 (2H, м), 1,44-1,41 (1H, м), 0,79 (3H, с).
<Пример 52>
Основной таутомер
1H-ЯМР (CDCl3) δ: 16,13 (1H, с), 11,97 (1H, с), 8,87 (1H, д, J=5,0 Гц), 8,46 (1H, д, J=8,6 Гц), 7,81 (1H, с), 7,74 (1H, д, J=8,6 Гц), 7,60 (1H, д, J=4,9 Гц), 7,53 (1H, с), 6,99 (1H, дд, J=7,8, 7,8 Гц), 6,78 (1H, дд, J=7,8, 7,8 Гц), 4,83 (1H, д, J=14,3 Гц), 4,31 (1H, д, J=14,3 Гц), 4,20 (2H, т, J=5,7 Гц), 3,74 (4H, т, J=4,2 Гц), 3,31 (1H, ддд, J=8,8, 8,8, 3,0 Гц), 2,85-2,83 (2H, м), 2,69 (1H, ддд, J=8,8, 8,8, 8,8 Гц), 2,61 (4H, ушир.с), 2,56-2,51 (1H, м), 1,75-1,72 (1H, м), 1,67-1,65 (2H, м), 0,99 (3H, с).
[0692] Второстепенный таутомер
1H-ЯМР (CDCl3) δ: 17,91 (1H, с), 12,05 (1H, с), 8,82 (1H, д, J=4,9 Гц), 8,24 (1H, д, J=8,5 Гц), 7,77 (1H, с), 7,74 (1H, д, J=8,6 Гц), 7,58 (1H, д, J=5,0 Гц), 7,54 (1H, ушир.с), 7,06 (1H, т, J=7,8 Гц), 6,73 (1H, т, J=7,7 Гц), 5,01 (1H, д, J=14,4 Гц), 4,43 (1H, д, J=14,5 Гц), 4,19 (2H, дд, J=12,1, 6,2 Гц), 3,74 (4H, т, J=4,2 Гц), 3,27-3,24 (1H, м), 2,84 (2H, с), 2,74-2,72 (1H, м), 2,61 (3H, ушир.с), 2,50-2,46 (1H, м), 1,78-1,63 (3H, м), 1,45-1,42 (1H, м), 0,81 (3H, с).
[0693] <Пример 109>
(4aR)-N-[2-(5-Циано-6-метилпиридин-3-ил)-4-(трифторметил)-фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0694]
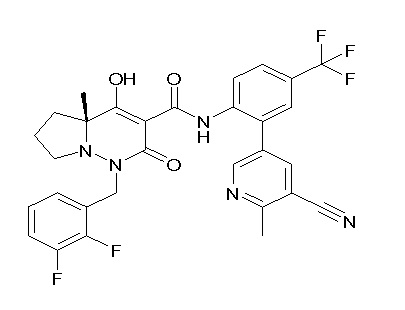
[0695] Для получения названного соединения использовали (4aR)-N-[2-(6-хлор-5-цианопиридин-3-ил)-4-(трифторметил)фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 68) в качестве исходного материала и проводили такие же операции, как в справочном примере 69.
[0696] LCMS: м/z 598[M+H]+
Время удерживания при ВЭЖХ: 1,63 минут (условия проведения анализа QC-SMD-TFA05)
[0697] <Пример 110>
(4aR)-1-[(2,3-(Дифторфенил)метил]-N-[2-[1-(диметил-сульфамоил)пиперидин-4-ил]-4-(трифторметил)фенил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0698]
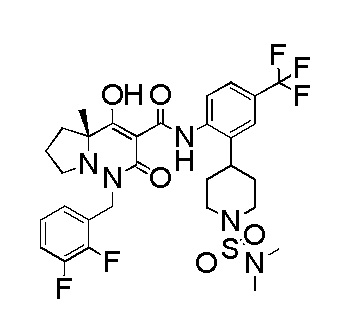
[0699] Первая стадия
[0700]
[0701] Для получения 4-(2-амино-5-(трифторметил)фенил)-5,6-дигидропиридинe-1(2H)-карбоновой кислоты третбутилового эфира использовали 2-бром-4-(трифторметил)анилин и (1-(третбутокси-карбонил)-1,2,3,6-тетрагидропиридин-4-ил)бороновую кислоту в качестве реагента и исходного материала, соответственно, и проводили такие же операции, как в справочном примере 13.
[0702] LCMS: м/z 243[M+H-C4H9OCO]+
Время удерживания при ВЭЖХ: 1,31 минут (условия проведения анализа SMD-TFA05)
[0703] Вторая стадия
[0704]
[0705] Производное анилина, полученное на первой стадии (0,73 г, 2,13 ммоль), растворяли в метаноле (21,2 мл), добавляли гидроксид палладия - уголь (20 масс.%, 0,15 г, 0,21 ммоль), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение ночи. Затем реакционную смесь фильтровали через слой целлита, фильтрат концентрировали при пониженном давлении с получением 4-(2-амино-5-(трифторметил)фенил)-пиперидин-1-карбоновой кислоты третбутилового эфира (0,70 г, 91%) в виде неочищенного продукта.
[0706] Третья стадия
[0707]
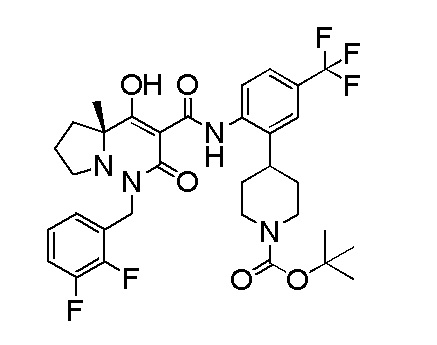
[0708] Для получения 4-[2-[[(4aR)-1-[(2,3-дифторфенил)-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбонил]амино]-5-(трифторметил)фенил]пиперидин-1-карбоновой кислоты третбутилового эфира использовали производное анилина, полученное на второй стадии, и соединение, описанное в справочном примере 1-1, в качестве реагента и исходного материала, соответственно, и проводили такие же операции, как в примере 21.
[0709] LCMS: м/z 565[M+H-C4H9OCO]+
Время удерживания при ВЭЖХ: 1,78 минут (условия проведения анализа SMD-TFA05)
[0710] Четвертая стадия
[0711]
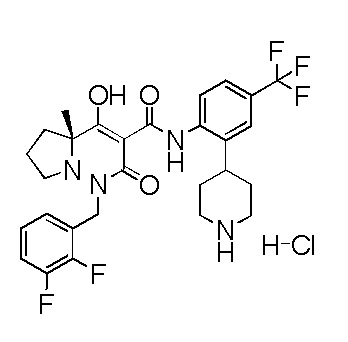
[0712] Раствор 4N хлористый водород/диоксан (5 мл) добавляли к амидному производному, полученному на третьей стадии (0,81 г, 1,23 ммоль), при 0°C, и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении с получением (4aR)-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[2-пиперидин-4-ил-4-(трифторметил)фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамида гидрохлорида (776 мг) в виде желтого аморфного твердого вещества.
[0713] LCMS: м/z 565[M+H]+
Время удерживания при ВЭЖХ: 1,24 минут (условия проведения анализа SMD-TFA05)
[0714] Пятая стадия
Гидрохлорид, полученный на четвертой стадии (0,030 г, 0,050 ммоль), растворяли в N,N-диметилформамиде (0,25 мл), и затем добавляли триэтиламин (0,021 мл, 0,15 ммоль) и диметил-сульфамоилхлорид (0,0054 мл, 0,050 ммоль) при комнатной температуре, и смесь перемешивали в течение 2 часов. Реакционную смесь непосредственно очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения (24 мг, 71%) в виде белого аморфного твердого вещества.
[0715] LCMS: м/z 672[M+H]+
Время удерживания при ВЭЖХ: 1,66 минут (условия проведения анализа QC-SMD-TFA05)
[0716] <Пример 111>
(4aR)-N-[2-[5-Циано-6-(2-окса-6-азаспиро[3,3]гептан-6-ил)пиридин-3-ил]-4-(трифторметил)фенил]-1-[(2,3-дифторфенил)-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0717]
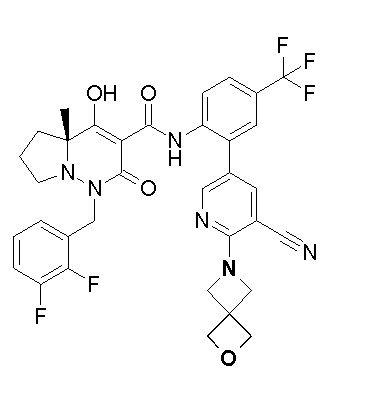
[0718] (4aR)-N-[2-(6-Хлор-5-цианопиридин-3-ил)-4-(трифтор-метил)фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 68) (20 мг, 0,032 ммоль) растворяли в 1,2-дихлорэтане (0,32 мл) в атмосфере азота, добавляли 2-окса-6-азаспиро[3,3]гептана оксалат (24,5 мг, 0,129 ммоль) и N,N-диизопропилэтиламин (0,068 мл, 0,388 ммоль), и смесь перемешивали при комнатной температуре в течение ночи, и при 60°C в течение 2 дней. К реакционной смеси добавляли 0,37 M водный раствор дигидрофосфата калия и дихлорметан, смесь интенсивно перемешивали, и затем водный слой отделяли с помощью сепаратора фаз, и органический слой концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (30-95% ацетонитрил/вода) с получением названного соединения (19,7 мг, 89%).
[0719] LCMS: м/z 681[M+H]+
Время удерживания при ВЭЖХ: 0,99 минут (условия проведения анализа SMD-TFA50)
[0720] <Пример 112>
Метил 2-[[5-[2-[[(4aR)-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбонил]амино]-5-(трифторметил)фенил]-3-цианопиридин-2-ил]-метиламино]ацетат
[0721]
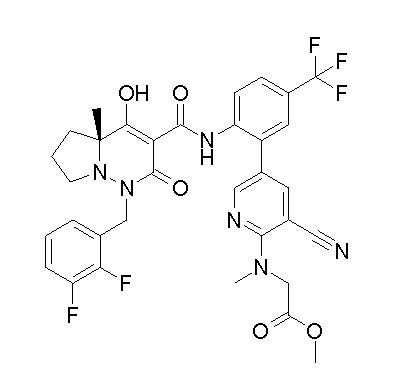
[0722] Для синтеза названного соединения использовали N-метилглицина метиловый эфир в качестве реагента и проводили такие же операции, как в примере 111.
[0723] LCMS: м/z 685[M+H]+
Время удерживания при ВЭЖХ: 1,65 минут (условия проведения анализа QC-SMD-TFA05)
[0724] <Пример 113>
(4aR)-N-[2-(6-Циано-5-метилсульфанилпиридин-3-ил)-4-(трифторметил)фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0725]
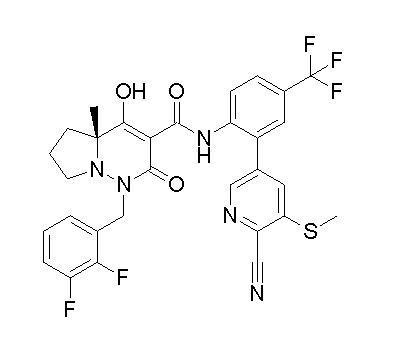
[0726] (4aR)-N-[2-(6-Циано-5-нитропиридин-3-ил)-4-(трифтор-метил)фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 99) (26,1 мг, 0,042 ммоль) растворяли в N,N-диметилформамиде (0,3 мл), добавляли тиометоксид натрия (2,91 мг, 0,042 ммоль), и смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли 0,37M водный раствор дигидрофосфата калия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (30-90% ацетонитрил (0,1% муравьиная кислота)/вода (0,1% муравьиная кислота) с получением названного соединения (17,7 мг, 49%).
[0727] LCMS: м/z 630[M+H]+
Время удерживания при ВЭЖХ: 1,04 минут (условия проведения анализа SMD-TFA50)
[0728] <Пример 114>
(4aR)-N-[2-(6-Циано-5-метоксипиридин-3-ил)-4-(трифтор-метил)фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0729]
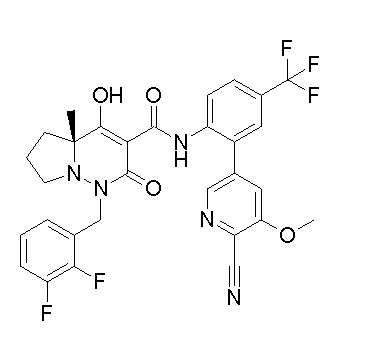
[0730] Для синтеза названного соединения использовали метоксид натрия в качестве реагента и проводили такие же операции, как в примере 113.
[0731] LCMS: м/z 614[M+H]+
Время удерживания при ВЭЖХ: 1,62 минут (условия проведения анализа QC-SMD-TFA05)
[0732] <Справочный пример 72>
7-[4-[[(4aR)-4-Гидрокси-4a-метил-3-(2-метилпропокси-карбонил)-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]-метил]-2,3-дифторфенил]гепт-6-иноат
[0733]
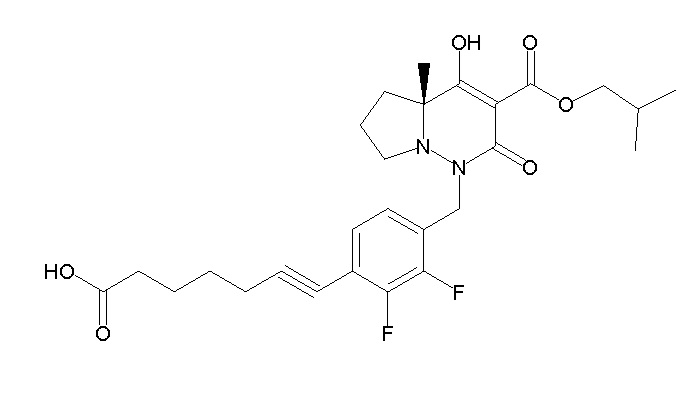
[0734] Суспензию (4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропилового эфира (справочный пример 5) (250 мг, 0,480 ммоль), гепт-6-иновой кислоты (0,182 мл, 1,44 ммоль), йодида меди(I) (18,3 мг, 0,0960 ммоль), триэтиламина (0,335 мл, 2,40 ммоль) и бис(трифенилфосфин)палладия(II) хлорида (33,7 мг, 0,0480 ммоль) в тетрагидрофуране (0,961 мл) перемешивали в атмосфере азота при комнатной температуре в течение 2,5 часов. В это же время, точно такую же реакцию проводили в другом реакционном сосуде с такой же загрузкой реагентов, и продукты обеих реакций объединяли и очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (328 мг, 66%) в виде желтого масла.
[0735] LCMS: м/z 519[M+H]+
Время удерживания при ВЭЖХ: 1,00 минута (условия проведения анализа SQD-FA05)
[0736] <Справочный пример 73>
7-[4-[[(4aR)-4-Гидрокси-4a-метил-3-(2-метилпропокси-карбонил)-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]-метил]-2,3-дифторфенил]гептаноат
[0737] [
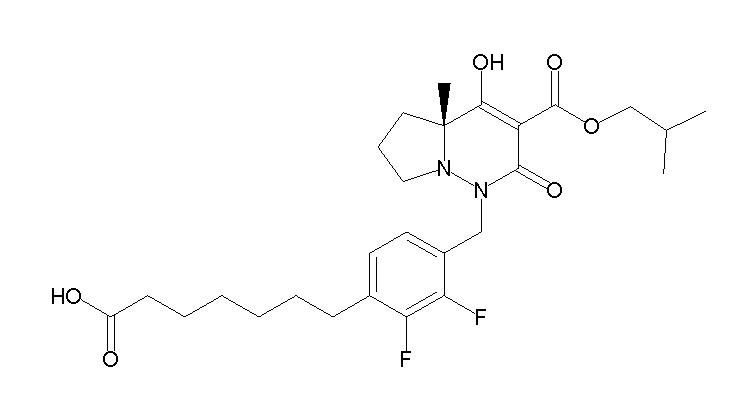
[0738] Раствор 7-[4-[[(4aR)-4-гидрокси-4a-метил-3-(2-метил-пропоксикарбонил)-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенил]гепт-6-иновой кислоты (справочный пример 72) (358 мг, 0,69 ммоль) и гидроксид палладия - уголь (20 масс.%, около 50% влажности, 145 мг) в 2,2,2-трифторэтаноле (7 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Затем добавляли гидроксид палладия - уголь (20 масс.%, около 50% влажности, 145 мг), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь фильтровали через слой целита, фильтрат концентрировали с получением названного соединения (361 мг, 100%) в виде светло-коричневого масла.
[0739] LCMS: м/z 523[M+H]+
Время удерживания при ВЭЖХ: 1,05 минут (условия проведения анализа SQD-AA05)
[0740] <Пример 115>
7-[4-[[(4aR)-4-Гидрокси-4a-метил-3-[[2-(6-метилсульфанил-пиридин-3-ил)-4-(трифторметил)фенил]карбамоил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенил]-гептаноат
[0741] [
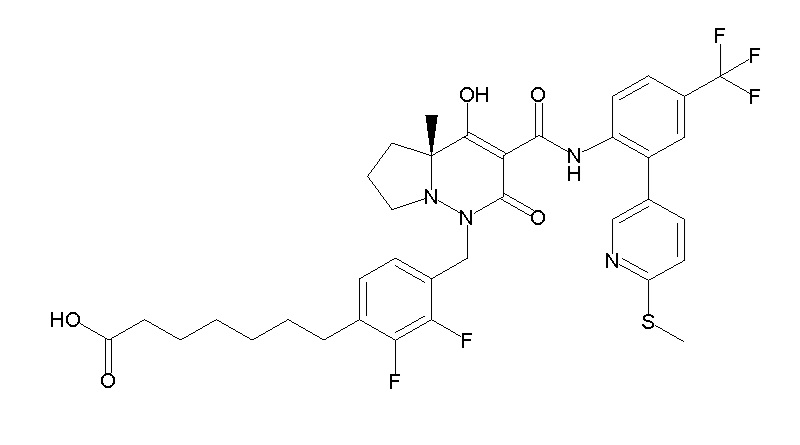
[0742] Для синтеза названного соединения использовали 7-[4-[[(4aR)-4-гидрокси-4a-метил-3-(2-метилпропоксикарбонил)-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифтор-фенил]гептаноат (справочный пример 73) и 2-(6-(метилтио)пиридин-3-ил)-4-(трифторметил)анилин, и проводили такие же операции, как в примере 21.
[0743] LCMS: м/z 733[M+H]+
Время удерживания при ВЭЖХ: 1,25 минут (условия проведения анализа SQD-FA05)
[0744] <Пример 116>
7-[4-[[(4aR)-3-[[4-Хлор-2-[6-(трифторметил)пиридин-3-ил]-фенил]карбамоил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенил]гептаноат
[0745]
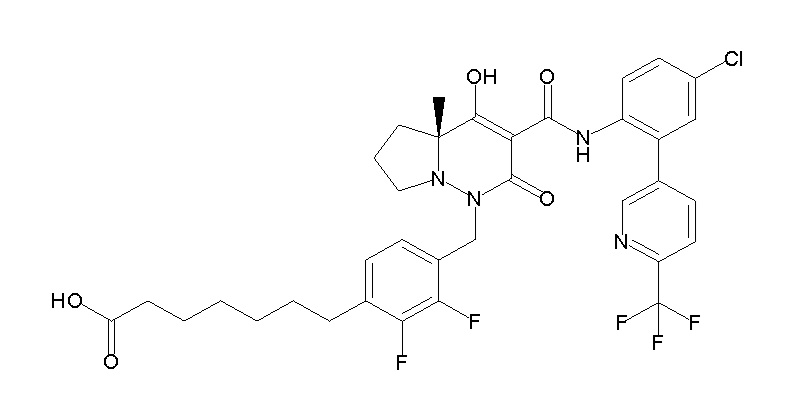
[0746] Для синтеза названного соединения использовали 7-[4-[[(4aR)-4-гидрокси-4a-метил-3-(2-метилпропоксикарбонил)-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифтор-фенил]гептаноат (справочный пример 73) и 4-хлор-2-(6-(трифторметил)пиридин-3-ил)анилин и проводили такие же операции, как в примере 21.
[0747] LCMS: м/z 721[M+H]+
Время удерживания при ВЭЖХ: 1,22 минут (условия проведения анализа SQD-FA05)
[0748] <Пример 117>
7-[4-[[(4aR)-4-Гидрокси-4a-метил-3-[[2-(6-метилсульфанил-пиридин-3-ил)-4-(трифторметил)фенил]карбамоил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенил]-гепт-6-иноат
[0749]
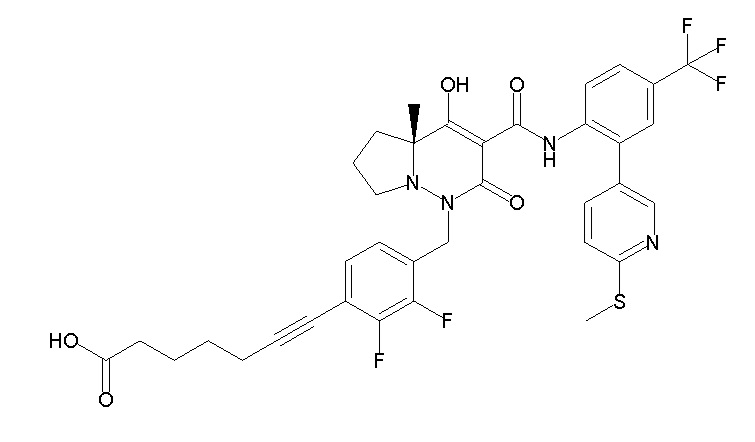
[0750] Для синтеза названного соединения использовали 7-[4-[[(4aR)-4-гидрокси-4a-метил-3-(2-метилпропоксикарбонил)-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифтор-фенил]гепт-6-иновую кислоту (справочный пример 72) в качестве исходного материала, использовали 2-(6-(метилтио)пиридин-3-ил)-4-(трифторметил)анилин в качестве реагента и проводили такие же операции, как в примере 21.
[0751] LCMS: м/z 729[M+H]+
Время удерживания при ВЭЖХ: 1,61 минут (условия проведения анализа SMD-TFA05)
[0752] <Пример 118>
7-[4-[[(4aR)-4-Гидрокси-4a-метил-3-[[2-(2-метилсульфанил-пиримидин-5-ил)-4-(трифторметил)фенил]карбамоил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенил]-гепт-6-иноат
[0753]
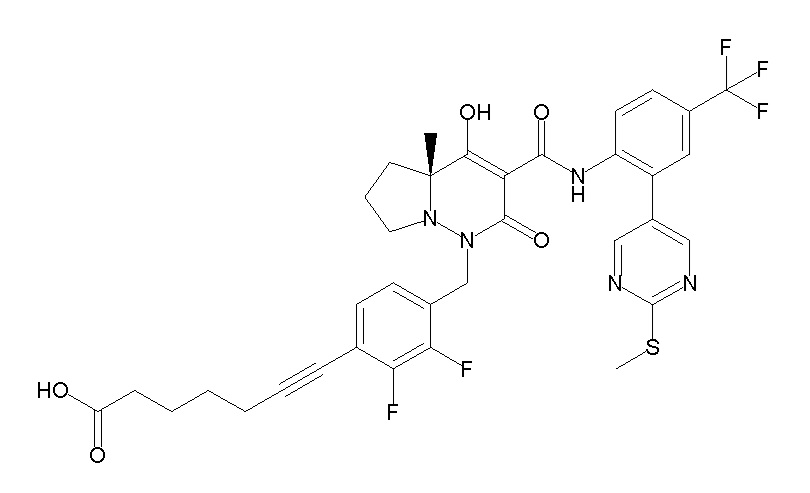
[0754] Для синтеза названного соединения использовали 7-[4-[[(4aR)-4-гидрокси-4a-метил-3-(2-метилпропоксикарбонил)-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифтор-фенил]гепт-6-иновую кислоту (справочный пример 72) и 2-(2-(метилтио)пиримидин-5-ил)-4-(трифторметил)анилин и проводили такие же операции, как в примере 21.
[0755] LCMS: м/z 730[M+H]+
Время удерживания при ВЭЖХ: 1,58 минут (условия проведения анализа SMD-TFA05)
[0756] <Пример 119>
7-[4-[[(4aR)-4-Гидрокси-4a-метил-2-оксо-3-[[4-(трифтор-метил)-2-[5-(трифторметил)пиридин-3-ил]фенил]карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенил]-гепт-6-иноат
[0757] [
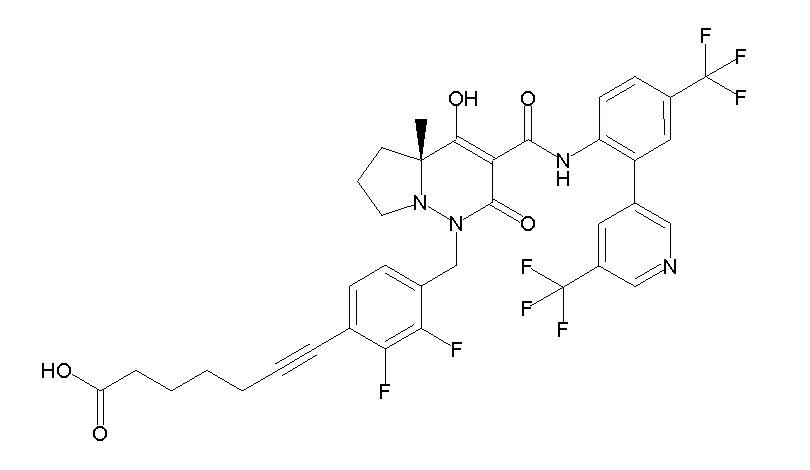
[0758] Для синтеза названного соединения использовали 7-[4-[[(4aR)-4-гидрокси-4a-метил-3-(2-метилпропокси-карбонил)-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифтор-фенил]гепт-6-иновую кислоту (справочный пример 72) и 4-(трифторметил)-2-(5-(трифторметил)пиридин-3-ил)анилин и проводили такие же операции, как в примере 21.
[0759] LCMS: м/z 751[M+H]+
Время удерживания при ВЭЖХ: 1,60 минут (условия проведения анализа SMD-TFA05)
[0760] <Справочный пример 74>
(4aR)-1-[[4-[4-[[(4S)-2,2-Диметил-1,3-диоксолан-4-ил]-метокси]бутокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир
[0761] [
[0762] Первая стадия
[0763]
[0764] Для синтеза (4aR)-1-[(2,3-дифтор-4-фенилметокси-фенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло-[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропилового эфира использовали 4-(бензилокси)-2,3-дифторбензальдегид и (R)-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид в качестве реагента и исходного материала, соответственно, и проводили такие же операции, как на первой стадии примера 1 и в справочном примере 1-1.
[0765] Вторая стадия
[0766]
[0767] Палладий-углерод (10 масс.%, 120 мг) добавляли к раствору (4aR)-1-[(2,3-дифтор-4-фенилметоксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропилового эфира (1,56 г, 3,12 ммоль) в этилацетате (100 мл), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 30 минут. Реакционную смесь фильтровали через целит, фильтрат концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (дихлорметан/метанол) с получением (4aR)-1-[(2,3-дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир (1,02 г, 80%).
[0768] LCMS: м/z 411[M+H]+
Время удерживания при ВЭЖХ: 1,24 минут (условия проведения анализа SMD-TFA05)
[0769] Третья стадия
[0770]
[0771] Раствор 60% гидроксида натрия (2 мл, 30,3 ммоль) добавляли к смеси (S)-(2,2-диметил-1,3-диоксолан-4-ил)метанола (2,00 г, 15,1 ммоль) и 1,4-дибромбутана (5,42 мл, 45,4 ммоль). К этой смеси добавляли тетрабутиламмония гидросульфат (257 мг, 0,757 ммоль) и интенсивно перемешивали при комнатной температуре в течение ночи. Затем добавляли воду, слой экстрагировали четыре раза сместью гексан/диэтиловый эфир (1:4), и органические слои лбъединяли и сушили над сульфатом магния. Затем органический слой фильтровали, фильтрат концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением (S)-4-((4-бромбутокси)метил)-2,2-диметил-1,3-диоксолана (2,54 г, 63%) в виде бесцветного масла.
[0772] Четвертая стадия
Карбонат цезия (1,20 мг, 3,65 ммоль) добавляли к раствору (4aR)-1-[(2,3-дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропилового эфира (500 мг, 1,22 ммоль) и (S)-4-((4-бромбутокси)метил)-2,2-диметил-1,3-диоксолана (374 мг, 1,40 ммоль) в ацетонитриле (15,2 мл), и смесь перемешивали при 70°C в течение 1 часа. Затем смесь охлаждали до комнатной температуры, добавляли 0,37M водный раствор дигидрофосфата калия, и водный слой экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором и сушили над сульфатом магния. Затем фильтровали, фильтрат концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (дихлорметан/метанол) с получением названного соединения (414 мг, 57%).
[0773] LCMS: м/z 597[M+H]+
Время удерживания при ВЭЖХ: 1,52 минут (условия проведения анализа SMD-TFA05)
[0774] <Пример 120>
(4aR)-1-[[4-[4-[(2R)-2,3-Дигидроксипропокси]бутокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-N-[2-(6-метилсульфанил-пиридин-3-ил)-4-(трифторметил)фенил]-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0775]

[0776] (4aR)-1-[[4-[4-[[(4S)-2,2-Диметил-1,3-диоксолан-4-ил]метокси]бутокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир (справочный пример 74) (10,6 мг, 0,018 ммоль) и 2-(6-(метилтио)пиридин-3-ил)-4-(трифторметил)-анилин (5,1 мг, 0,018 ммоль) растворяли в толуоле (0,5 мл), и смесь перемешивали при 100°C в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, полученный остаток растворяли в метаноле (0,5 мл), добавляли моногидрат п-толуолсульфоновой кислоты (3,4 мг, 0,018 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа 30 минут. К реакционной смеси добавляли воду, и полученный белый непрозрачный раствор очищали колоночной хроматографией с обращенной фазой С18 (30-90% ацетонитрил (0,1% трифторуксусная кислота)/вода (0,1% трифторуксусная кислота)) с получением названного соединения (6,3 мг, 46%) в виде светло-коричневого аморфного твердого вещества.
[0777] LCMS: м/z 767[M+H]+
Время удерживания при ВЭЖХ: 1,51 минут (условия проведения анализа QC-SMD-TFA05)
[0778] <Пример 121>
(4aR)-N-[4-Хлор-2-[6-(трифторметил)пиридин-3-ил]фенил]-1-[[4-[4-[(2R)-2,3-дигидроксипропокси]бутокси]-2,3-дифторфенил]-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид
[0779]
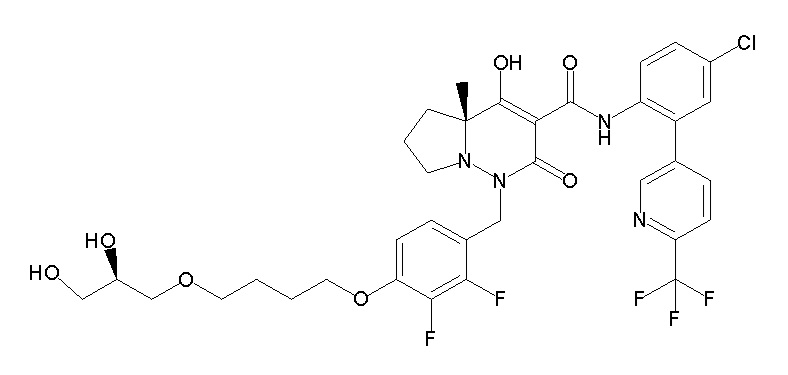
[0780] Для синтеза названного соединения использовали (4aR)-1-[[4-[4-[[(4S)-2,2-диметил-1,3-диоксолан-4-ил]метокси]бутокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метил-пропиловый эфир (справочный пример 74) и 4-хлор-2-(6-(трифторметил)пиридин-3-ил)анилин, и проводили такие же операции, как в примере 120.
[0781] LCMS: м/z 755[M+H]+
Время удерживания при ВЭЖХ: 1,50 минут (условия проведения анализа QC-SMD-TFA05)
[0782] <Пример 122>
(4aR)-N-[4-Бром-2-(6-хлорпиридин-3-ил)фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0783]

[0784] Диметоксиэтан (0,2 мл), этиленгликоль (0,2 мл) и воду (0,1 мл) добавляли к (4aR)-N-(4-бром-2-йодфенил)-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамиду (пример 331) (14,8 мг, 0,02 ммоль), карбонату калия (9,7 мг, 0,07 ммоль), тетракис(трифенилфосфин)палладию (2,3 мг, 0,002 ммоль) и (6-хлорпиридин-3-ил)бороновой кислоте (3,1 мг, 0,02 ммоль), и смесь перемешивали при 100 °C в течение 2 часов. Нерастворимые вещества фильтровали, и фильтрат непосредственно очищали с помощью ВЭЖХ (YMC-Actus ODS-A 20 × 100 мм 0,005 мм, 0,1% муравьиная кислота ацетонитрил/0,1% муравьиная кислота вода) с получением названного соединения (4,8 мг, 40%) в виде белого аморфного твердого вещества.
[0785] LCMS: м/z 604[M+H]+
Время удерживания при ВЭЖХ: 0,89 минут (условия проведения анализа SQD-FA05)
[0786] <Справочный пример 75>
((4S,5S)-5-((Гепт-6-ин-1-илокси)метил)-2,2-диметил-1,3-диоксолан-4-ил)метанол
[0787]
[0788] Гидрид натрия (60 масс.%, дисперсия в минеральном масле, 36 мг, 0,824 ммоль) добавляли к раствору ((4S,5S)- 2,2-диметил-1,3-диоксолан-4,5-диил)диметанола (133 мг, 0,824 ммоль) в N,N-диметилформамиде (1,1 мл) при комнатной температуре. Затем реакционную смесь перемешивали при комнатной температуре в течение 30 минут, добавляли гепт-6-ин-1-ила метансульфонат (105 мг, 0,550 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли медленно воду и экстрагировали этилацетатом. Органические слои объединяли и концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле с получением ((4S,5S)-5-((гепт-6-ин-1-илокси)метил)-2,2-диметил-1,3-диоксолан-4-ил)-метанола (99,6 мг, 71%).
[0789] <Справочный пример 76>
(R)-4-((3-Бромпропокси)метил)-2,2-диметил-1,3-диоксолан
[0790]
[0791] (R)-(-)-2,2-Диметил-1,3-диоксолан-4-метанол (615 мг, 4,66 ммоль) 6-бром-1-гексин (500 мг, 3,1 ммоль) растворяли в N,N-диметилформамиде (10 мл), добавляли гидрид натрия (60 масс.%, дисперсия в минеральном масле, 186 мг, 4,66 ммоль), и смесь перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь добавляли к воде и экстрагировали диэтиловым эфиром. Затем органический слой промывали солевым раствором и сушили над сульфатом натрия, концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле с получением (R)-4-((гекс-5-ин-1-илокси)метил)-2,2-диметил-1,3-диоксолана (390 мг, 59%) в виде прозрачной жидкости.
[0792]1H-ЯМР (CDCl3) δ: 4,24 (1H, дт, J=12,0, 6,4 Гц), 4,04 (1H, дд, J=8,0, 6,4 Гц), 3,71 (1H, дд, J=8,3, 6,4 Гц), 3,54-3,44 (3H, м), 3,41 (1H, дд, J=11,0, 5,0 Гц), 2,20 (4H, тд, J=7,0, 3,0 Гц), 1,92 (4H, т, J=3,0 Гц), 1,72-1,64 (2H, м), 1,62-1,53 (2H, м), 1,40 (3H, с), 1,34 (3H, с).
[0793] <Справочный пример 77>
4-(Проп-2-ин-1-ил)морфолин-3-он
[0794]
[0795] Гидрид натрия (60 масс.%, дисперсия в минеральном масле, 187 мг, 4,68 ммоль) добавляли к раствору морфолин-3-она (430 мг, 4,25 ммоль) в тетрагидрофуране (5 мл) при 0°C, и смесь перемешивали при комнатной температуре в течение 10 минут, и к реакционной смеси добавляли 3-бромпроп-1-ин (607 мг, 5,1 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли этилацетатом (50 мл), и затем реакционную смесь промывали последовательно насыщенным водным раствором хлорида аммония, водой и солевым раствором и сушили над сульфатом магния, концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле с получением названного соединения (312 мг, 53%) в виде прозрачного масла.
[0796]1H-ЯМР (CDCl3) δ: 4,29 (2H, д, J=2,4 Гц), 4,19 (2H, с), 3,93 (2H, т, J=5,2 Гц), 3,51 (2H, т, J=5,2 Гц), 2,25 (1H, м).
[0797] <Пример 123>
(4aR)-1-[[2,3-Дифтор-4-[3-(4-гидроксибутокси)проп-1-ин-ил]фенил]метил]-N-[2-(2,3-диметоксифенил)-4-(трифторметил)-фенил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид
[0798]
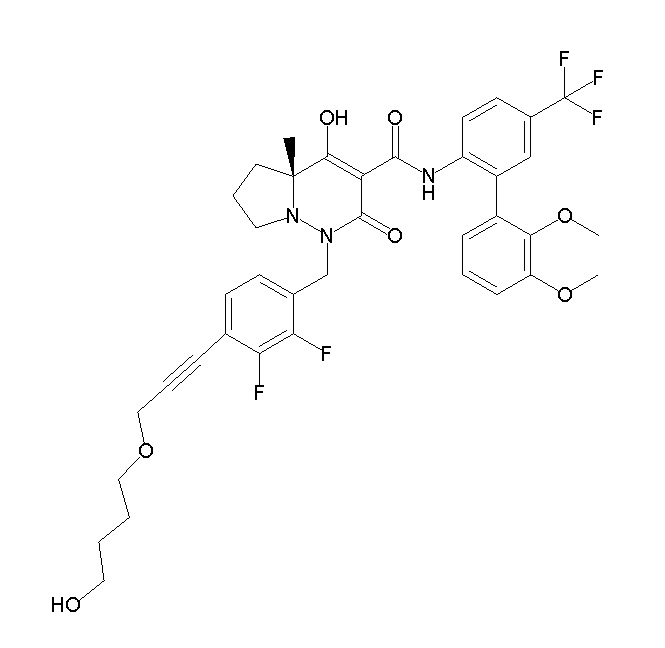
[0799] 4-(Проп-2-ин-1-илокси)бутан-1-ол (15,5 мг, 0,121 ммоль) и триэтиламин (0,020 мл, 0,141 ммоль) добавляли к раствору (4aR)-1-[2,3-(дифтор-4-йодфенил)метил]-N-[2-(2,3-диметоксифенил)-4-(трифторметил)фенил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида (пример 321) (30 мг, 0,040 ммоль), бис(трифенилфосфин)-палладия(II) хлорида (2,83 мг, 0,0404 ммоль), и йодида меди(I) (1,54 мг, 0,0081 ммоль) в N,N-диметилформамиде (0,40 мл) в атмосфере азота при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли муравьиную кислоту, и смесь непосредственно очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (15 мг, 50%) в виде белого аморфного твердого вещества.
[0800] LCMS: м/z 744[M+H]+
Время удерживания при ВЭЖХ: 1,63 минут (условия проведения анализа QC-SMD-TFA05)
[0801] <Пример 124>
(4aR)-1-[[2,6-Дифтор-4-[7-[(2S,3S)-2,3,4-тригидрокси-бутокси]гепт-1-инил]фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0802] [
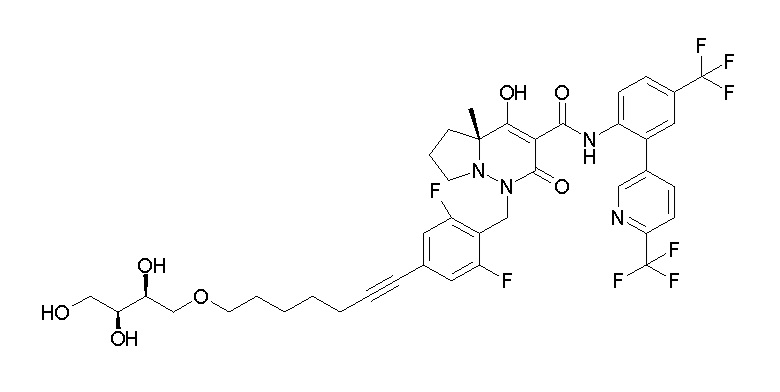
[0803] ((4S,5S)-2,2-Диметил-1,3-диоксолан-4,5-диил)диметанол (23,9 мг, 0,093 ммоль) и триэтиламин (0,019 мл, 0,140 ммоль) добавляли к раствору (4aR)-1-[(2,6-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамида (пример 322) (35 мг, 0,047 ммоль), бис(трифенилфосфин)палладия(II) хлорида (3,27 мг, 0,0465 ммоль) и йодида меди(I) (1,77 мг, 0,0093 ммоль) в N,N-диметилформамиде (0,47 мл) в атмосфере азота при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли трифторуксусную кислоту/воду (1:1, 1,4 мл) и диметилсульфоксид (0,7 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь непосредственно очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (32 мг, 82%) в виде оранжевого аморфного твердого вещества.
[0804] LCMS: м/z 841[M+H]+
Время удерживания при ВЭЖХ: 0,90 минут (условия проведения анализа SMD-TFA50)
[0805] <Пример 125>
(4aR)-1-[[2,6-Дифтор-4-[7-[(2S,3S)-2,3,4-тригидрокси-бутокси]гептил]фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0806]
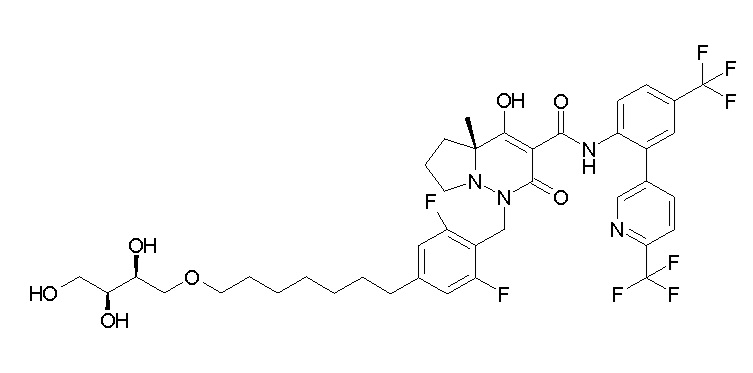
[0807] Суспензию (4aR)-1-[[2,6-дифтор-4-[7-[(2S,3S)-2,3,4-тригидроксибутокси]гепт-1-инил]фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиридин-3-ил]-фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида (пример 124) (20 мг, 0,024 ммоль) и гидроксид палладий - уголь (20 масс.%, 3,34 мг, 0,00476 ммоль) в этилацетате перемешивали в атмосфере водорода при комнатной температуре в течение 10 часов. Реакционную смесь фильтровали через слой целита, и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (11,5 мг, 57%) в виде бесцветного аморфного твердого вещества.
[0808] LCMS: м/z 845[M+H]+
Время удерживания при ВЭЖХ: 1,60 минут (условия проведения анализа QC-SMD-TFA05)
[0809] <Пример 126>
(4aR)-1-[(4-Этинил-2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0810]
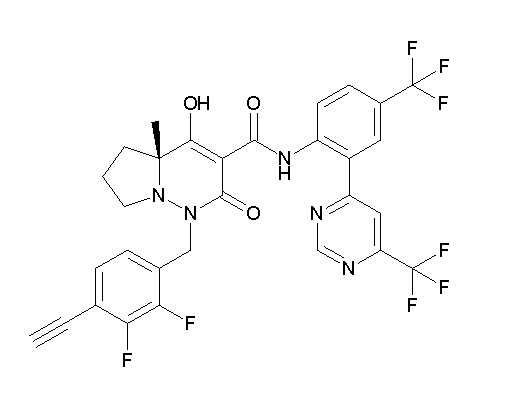
[0811] Для получения (4aR)-1-[[2,3-дифтор-4-[2-три(пропан-2-ил)силилэтинил]фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида в виде неочищенного продукта использовали триизопропилсилилацетилен в качестве реагента и проводили такие же операции, как на первой стадии примера 123. Полученный неочищенный продукт растворяли в тетрагидрофуране (0,15 мл), добавляли 1M раствор тетрабутиламмония фторида в тетрагидрофуране (0,12 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли трифторуксусную кислоту (0,5 мл), воду (0,5 мл) и диметилсульфоксид (1 мл), и смесь очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (22 мг, 84%) в виде белого аморфного твердого вещества.
[0812] LCMS: м/z 652[M+H]+
Время удерживания при ВЭЖХ: 0,87 минут (условия проведения анализа SQD-FA50).
[0813] Для синтеза соединений, описанных в следующей таблице, использовали соответствующие йодидные производные примеров 319-323 и соответствующие реагенты с терминальным алкином и проводили такие же операции, как в примере 123.
[0814]
[0815]
[0816] Несмотря на то, что у названного соединения существуют таутомеры, тем не менее, в одних случаях изомеры можно обнаружить, а в других случаях нет, в зависимости от типа растворителя, используемого для измерения. Например,1H-ЯМР спектры соединения примера 129 (диметилсульфоксид-D6) и примера соединения 140 (хлороформ-D) являются следующими.
<Пример 129>
1H-ЯМР (DMSO-D6) δ: 16,58 (1H, ушир.с), 12,80 (1H, ушир.с), 12,15 (1H, ушир.с), 9,59 (1H, с), 8,59-8,56 (1H, ушир.м), 8,48-8,38 (1H, м), 8,27 (1H, ушир.с), 7,99 (1H, д, J=9,8 Гц), 7,28 (1H, кв., J=6,8 Гц), 7,24 (1H, кв., J=7,3 Гц), 5,11 (1H, д, J=14,7 Гц), 4,47-4,38 (1H, м), 3,41-3,30 (2H, м), 2,73 (1H, кв., J=8,6 Гц), 2,54 (2H, т, J=6,4 Гц), 2,49-2,36 (1H, м), 2,40 (2H, т, J=7,8 Гц), 1,84-1,75 (2H, м), 1,63 (2H, ушир.с), 0,92 (3H, ушир.с).
[0817] <Пример 140>
Основной таутомер
1H-ЯМР (CDCl3) δ: 11,82 (1H, с), 8,78 (1H, д, J=2,0 Гц), 8,44 (1H, д, J=8,6 Гц), 7,97 (1H, дд, J=8,1, 1,9 Гц), 7,86 (1H, д, J=8,2 Гц), 7,73 (1H, дд, J=8,7, 1,9 Гц), 7,56 (1H, д, J=1,8 Гц), 7,15-7,11 (1H, м), 6,98-6,94 (1H, м), 4,84 (1H, д, J=14,3 Гц), 4,32 (1H, д, J=13,9 Гц), 3,85-3,79 (4H, м), 3,68 (2H, с), 3,27 (1H, тд, J=8,7, 3,2 Гц), 2,83-2,77 (4H, м), 2,73-2,64 (1H, м), 2,58-2,48 (1H, м), 1,80-1,58 (3H, м), 0,99 (3H, с).
[0818] Второстепенный таутомер
1H-ЯМР (CDCl3) δ: 11,91 (1H, с), 8,72 (1H, д, J=2,2 Гц), 8,19 (1H, д, J=8,2 Гц), 7,96-7,92 (1H, м), 7,80 (1H, д, J=8,2 Гц), 7,75-7,71 (1H, м), 7,58-7,55 (1H, м), 7,17-7,07 (1H, м), 6,99-6,93 (1H, м), 5,07 (1H, д, J=14,7 Гц), 4,47 (1H, д, J=14,9 Гц), 3,79-3,85 (4H, м), 3,67 (2H, с), 3,30-3,20 (1H, м), 2,83-2,77 (4H, м), 2,73-2,64 (1H, м), 2,58-2,48 (1H, м), 1,81-1,58 (3H, м), 0,79 (3H, с).
[0819] Для синтеза соединений, описанных в следующей таблице, использовали соответствующие йодидные производные примеров 319-323 и соответствующие реагенты с терминальным алкином и проводили такие же операции, как в примере 123 и примере 125.
[0820]
[0821] Для синтеза соединений, описанных в следующей таблице, использовали соответствующие йодидные производные примеров 319-323 и соответствующие реагенты с терминальным алкином, включая реагент справочного примера 76, и проводили такие же операции, как в примере 124.
[0822] [Таблица 24]
[0823] <Пример 146>
(4aR)-1-[[2,6-Дихлор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[2-(трифторметил)-4-[6-(трифтор-метил)пиридин-3-ил]пиримидин-5-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид гидрохлорид
[0824]
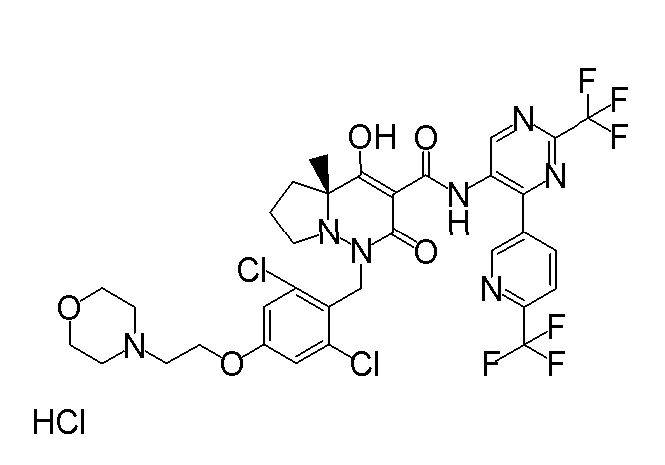
[0825] (4aR)-1-[(2,6-Дихлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[2-(трифторметил)-4-[6-(трифтор-метил)пиридин-3-ил]пиримидин-5-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 328) (22 мг, 0,032 ммоль), 4-(2-хлорэтил)морфолина гидрохлорид (12,1 мг, 0,065 ммоль) и тетра-н-бутиламмония йодид (1,2 мг, 0,0033 ммоль) растворяли в N,N-диметилформамиде (0,2 мл), добавляли карбонат цезия (64 мг, 0,20 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 3 часов. К реакционной смеси добавляли диметилсульфоксид (0,4 мл) и концентрированную хлористоводородную кислоту (0,1 мл) при 0°C, и затем смесь перемешивали в течение 5 минут и непосредственно очищали колоночной хроматографией на силикагеле с обращенной фазой C-18 (вода/ацетонитрил) с получением названного соединения (23 мг, 88%) в виде белого аморфного твердого вещества.
[0826] LCMS: м/z 790[M+H]+
Время удерживания при ВЭЖХ: 1,26 минут (условия проведения анализа SMD-TFA05)
[0827] <Пример 147>
(4aR)-1-[[4-[3-[(2R)-2,3-Дигидроксипропокси]пропокси]-2,3-дифторфенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0828]
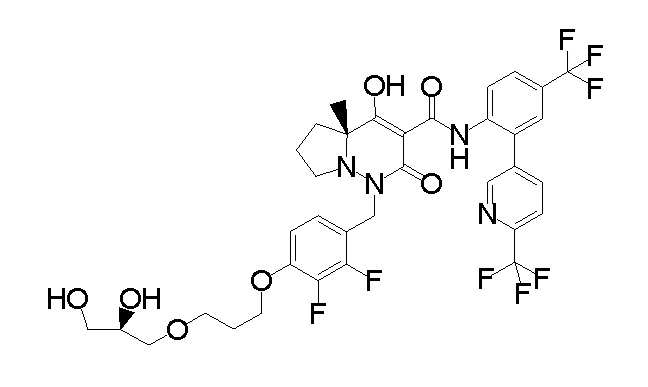
[0829] Первая стадия
[0830]
[0831] Воду (10 мл) и гидроксид натрия (1,75 г, 43,8 ммоль) добавляли к 1,3-дибромпропану (9,17 г, 45,4 ммоль), (S)-(2,2-диметил-1,3-диоксолан-4-ил)метанолу (1,5 г, 11,4 ммоль) и гидросульфату тетра-н-бутиламмония (0,19 г, 0,57 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 16 часов. К реакционной смеси добавляли воду (30 мл) и затем экстрагировали диэтиловым эфиром, органический слой сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением (S)-4-((3-бромпропокси)метил)-2,2-диметил-1,3-диоксолана (640 мг, 22%) в виде прозрачной жидкости.
[0832] Вторая стадия
(4aR)-1-[(2,3-Дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 324) (1,0 г, 1,56 ммоль) и (S)-4-((3-бромпропокси)метил)-2,2-диметил-1,3-диоксолан (0,47 г, 1,87 ммоль) растворяли в N,N-диметилформамиде (3 мл), добавляли карбонат цезия (0,86 г, 6,23 ммоль), и смесь перемешивали в атмосфере азота при 80°C в течение 2 часов. К реакционной смеси добавляли диэтиловый эфир (30 мл), отфильтровывали нерастворимые примеси, и концентрировали при пониженном давлении. Затем к полученному остатку добавляли метанол (10 мл), добавляли по каплям концентрированную хлористоводородную кислоту (2 мл) при 0°C, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь продували азотом в течение 1 часа для удаления избыточного количества хлористого водорода, и затем добавляли диметилсульфоксид (5 мл), метанол удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле с обращенной фазой С-18 (вода/ацетонитрил) с получением названного соединения (1,2 г, 95%) в виде белого аморфного твердого вещества.
[0833] LCMS: м/z 775[M+H]+
Время удерживания при ВЭЖХ: 1,49 минут (условия проведения анализа SMD-TFA05)
[0834] Основной таутомер
1H-ЯМР (CDCl3) δ: 16,21 (1H, с), 11,91 (1H, с), 8,78 (1H, с), 8,44 (1H, д, J=8,7 Гц), 7,98 (1H, д, J=8,0 Гц), 7,87 (1H, д, J=8,0 Гц), 7,73 (1H, д, J=8,7 Гц), 7,55 (1H, с), 6,92 (1H, дд, J=7,8, 7,5 Гц), 6,71 (1H, дд, J=7,8, 7,5 Гц), 4,73 (1H, д, J=14,2 Гц), 4,30 (1H, д, J=14,2 Гц), 4,14 (2H, т, J=6,2 Гц), 3,89-3,87 (1H, м), 3,72-3,69 (3H, м), 3,65-3,64 (1H, м), 3,57-3,54 (2H, м), 3,27-3,24 (1H, м), 2,70-2,62 (1H, м), 2,56-2,55 (1H, м), 2,53-2,50 (1H, м), 2,12-2,08 (3H, м), 1,73-1,70 (1H, м), 1,67-1,61 (2H, м), 1,00 (3H, с).
[0835] Второстепенный таутомер
1H-ЯМР (CDCl3) δ: 17,97 (1H, с), 11,89 (1H, с), 8,71 (1H, с), 8,19 (1H, д, J=8,6 Гц), 7,94 (1H, д, J=7,9 Гц), 7,79 (1H, д, J=8,0 Гц), 7,73 (1H, д, J=8,6 Гц), 7,55 (1H, с), 7,06-7,04 (1H, м), 6,73-6,70 (1H, м), 4,99 (1H, д, J=14,4 Гц), 4,42 (1H, д, J=14,4 Гц), 4,14 (2H, т, J=6,2 Гц), 3,89-3,88 (1H, м), 3,72-3,69 (3H, м), 3,65-3,64 (1H, м), 3,57-3,54 (2H, м), 3,25-3,24 (1H, м), 2,70-2,62 (2H, м), 2,41-2,39 (1H, м), 2,12-2,08 (3H, м), 1,67-1,61 (2H, м), 1,43-1,37 (1H, м), 0,77 (3H, с).
[0836] <Справочный пример 78>
(S)-4-(((5-Бромпентил)окси)метил)-2,2-диметил-1,3-диоксолан
[0837]
[0838] Для получения (S)-4-((гекс-5-ин-1-илокси)метил)-2,2-диметил-1,3-диоксолана в виде прозрачной жидкости использовали 1,5-дибромпентан и (S)-(2,2-диметил-1,3-диоксолан-4-ил)метанол и проводили такие же операции, как на первой стали примера 147.
[0839]1H-ЯМР (CDCl3) δ: 4,25 (1H, дт, J=12,0, 6,0 Гц), 4,05 (1H, дд, J=6,4, 8,0 Гц), 3,72 (1H, дд, J=6,4, 8,0 Гц), 3,53-3,37 (6H, м), 1,87 (2H, дт, J=14,2, 7,1 Гц), 1,64-1,54 (2H, м), 1,54-1,44 (2H, м), 1,41 (3H, с), 1,35 (3H, с).
[0840] <Справочный пример 79>
(R)-4-(((5-Бромпентил)окси)метил)-2,2-диметил-1,3-диоксолан
[0841]
[0842] Для получения (R)-4-(((5-бромпентил)окси)метил)-2,2-диметил-1,3-диоксолана использовали 1,5-дибромпентан и (R)-(2,2-диметил-1,3-диоксолан-4-ил)метанол и проводили такие же операции, как на первой стадии примера 147.
[0843] <Пример 148>
(4aR)-1-[[2,6-Дихлор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[6-(трифторметил)-2-[6-(трифтор-метил)пиридин-3-ил]пиридин-3-ил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамида гидрохлорид
[0844]
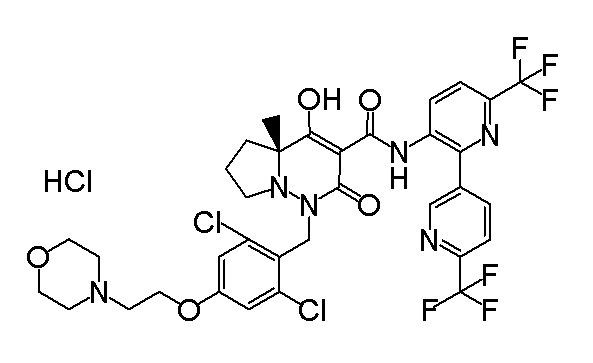
[0845] Для синтеза названного соединения использовали (4aR)-1-[(2,6-дихлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[6-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]-пиридин-3-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 329) и 4-(2-хлорэтил)морфолина гидрохлорид и проводили такие же операции, как в примере 146.
[0846] LCMS: м/z 789[M+H]+
Время удерживания при ВЭЖХ: 1,29 минут (условия проведения анализа QC-SMD-TFA05)
[0847] <Пример 149>
(4aR)-1-[[3-Хлор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид
[0848]
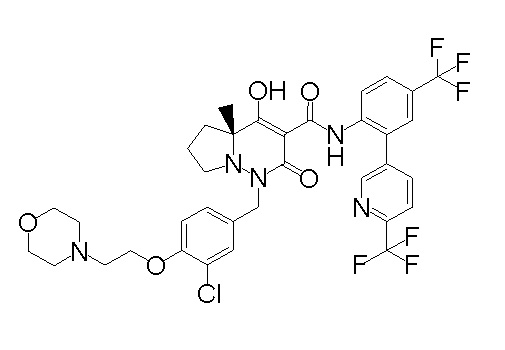
[0849] Первая стадия
[0850]
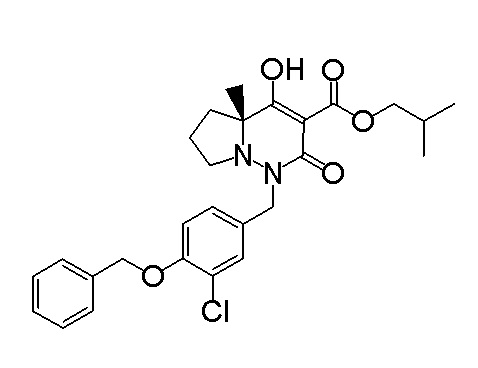
[0851] Для синтеза (4aR)-1-[(3-хлор-4-фенилметоксифенил)-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоновой кислоты 2-метилпропилового эфира использовали 4-(бензилокси)-3-хлорбензальдегид и (R)-2-метил-пирролидин-2-карбоновой кислоты метилового эфира гидрохлорид и проводили такие же операции, как в справочном примере 4.
[0852] Вторая стадия
[0853]
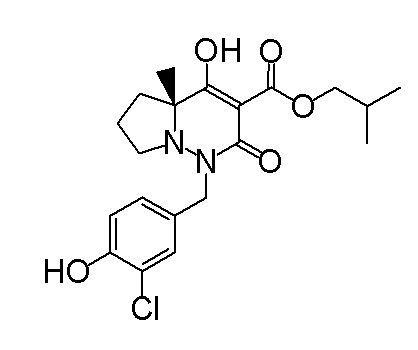
[0854] Для синтеза (4aR)-1-[(3-хлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоновой кислоты 2-метилпропилового эфира использовали (4aR)-1-[(3-хлор-4-фенилметоксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир и проводили такие же операции, как на второй стадии справочного примера 74.
[0855] Третья стадия
[0856]
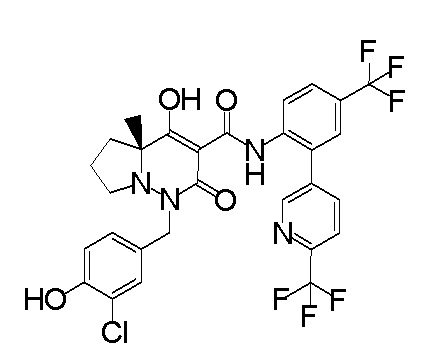
[0857] Для синтеза (4aR)-1-[(3-хлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамида использовали (4aR)-1-[(3-хлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир и 4-(трифторметил)-2-(6-(трифторметил)пиридин-3-ил)анилин (справочный пример 13), и проводили такие же операции, как в примере 21.
[0858] Четвертая стадия
Для синтеза названного соединения использовали (4aR)-1-[(3-хлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид и 4-(2-хлор-этил)морфолина гидрохлорид и проводили такие же операции, как в примере 146.
[0859] LCMS: м/z 754[M+H]+
Время удерживания при ВЭЖХ: 1,32 минут (условия проведения анализа QC-SMD-TFA05)
[0860] <Пример 150>
Метил 2-[4-[[(4aR)-4-гидрокси-4a-метил-2-оксо-3-[[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифтор-фенокси]ацетат
[0861]
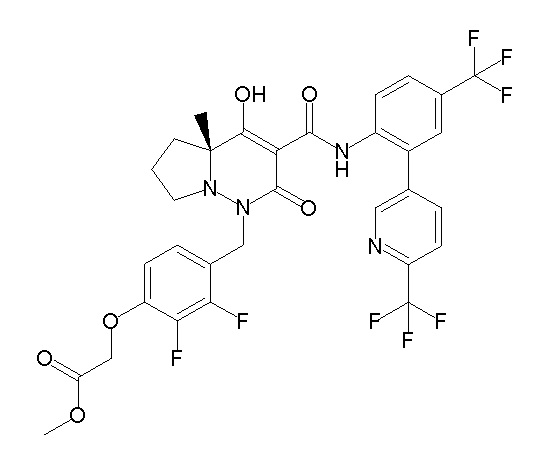
[0862] Первая стадия
[0863]
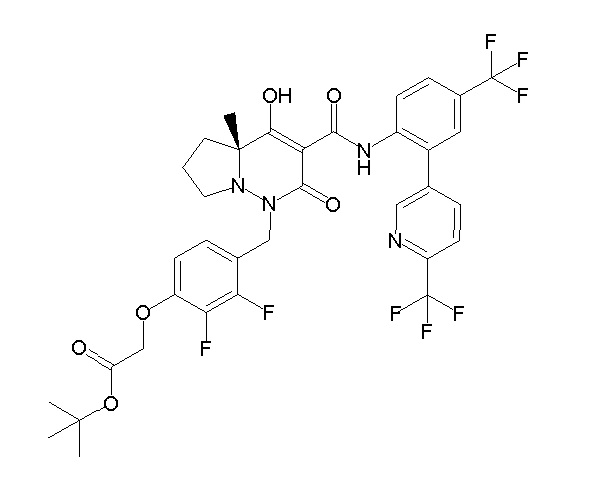
[0864] Для синтеза 2-[4-[[(4aR)-4-гидрокси-4a-метил-2-оксо-3-[[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенокси]уксусной кислоты третбутилового эфира использовали (4aR)-1-[(2,3-дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид (пример 324) и бромуксусной кислоты третбутиловый эфир и проводили такие же операции, как в примере 146.
[0865] LCMS: м/z 757[M+H]+
Время удерживания при ВЭЖХ: 1,23 минут (условия проведения анализа SQD-FA05)
[0866] Вторая стадия
[0867]
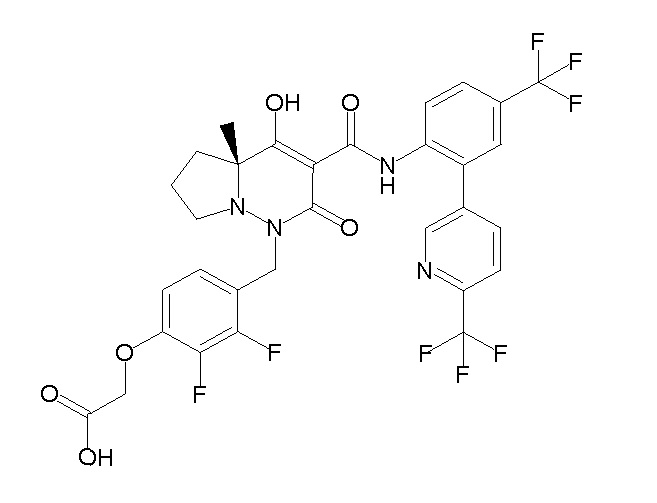
[0868] Трифторуксусную кислоту (0,3 мл, 4 ммоль) добавляли к раствору 2-[4-[[(4aR)-4-гидрокси-4a-метил-2-оксо-3-[[4-(трифтор-метил)-2-[6-(трифторметил)пиридин-3-ил]фенил]карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифтор-фенокси]уксусной кислоты третбутилового эфира (14,7 мг, 0,019 ммоль) в дихлорметане (0,075 мл) при комнатной температуре, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой (0,1% муравьиная кислота, ацетонитрил/вода) с получением 2-[4-[[(4aR)-4-гидрокси-4a-метил-2-оксо-3-[[4-(три-фторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифтор-фенокси]уксусной кислоты (12,3 мг, 90%).
[0869] LCMS: м/z 701[M+H]+
Время удерживания при ВЭЖХ: 1,08 минут (условия проведения анализа SQD-FA05)
[0870] Третья стадия
(Диазометил)триметилсилан (0,0125 мл, 0,025 ммоль) добавляли к раствору 2-[4-[[(4aR)-4-гидрокси-4a-метил-2-оксо-3-[[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-2,3-дифторфенокси]уксусной кислоты (9 мг, 0,013 ммоль) в бензоле (0,13 мл)-метаноле (0,08 мл) при комнатной температуре, и смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли муравьиную кислоту (0,005 мл), концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой (0,1% муравьиная кислота, ацетонитрил/вода) с получением названного соединения (8,3 мг, 90%) в виде белого аморфного твердого вещества.
[0871] LCMS: м/z 715[M+H]+
Время удерживания при ВЭЖХ: 1,60 минут (условия проведения анализа QC-SMD-TFA05)
[0872] <Пример 151>
(4aR)-1-[[2,3-Дифтор-4-(пиридин-4-илметокси)фенил]метил]-N-[2-(2,3-диметоксифенил)-4-(трифторметил)фенил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0873]

[0874] Для синтеза названного соединения использовали (4aR)-1-[(2,3-дифтор-4-гидроксифенил)метил]-N-[2-(2,3-диметоксифенил)-4-(трифторметил)фенил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 325) и 4-(бром-метил)пиридина гидробромат и проводили такие же операции, как в примере 146.
[0875] LCMS: м/z 725[M+H]+
Время удерживания при ВЭЖХ: 1,37 минут (условия проведения анализа QC-SMD-TFA05)
[0876] Для синтеза соединений примеров, описанных в следующей таблице, использовали фенольные производные примеров 326, 327 и 330 и алкилбромиднве реагенты, включая реагенты в справочных примерах 78 и 79, и проводили такие же операции, как на второй стадии примера 147.
[0877]
[0878] Несмотря на то, что у названного соединения существуют таутомеры, тем не менее, в одних случаях изомеры можно обнаружить, а в других случаях нет, в зависимости от типа растворителя, используемого для измерения. Например,1H-ЯМР спектры соединения примера 152 (хлороформ-D) и примера соединения 156 (диметилсульфоксид-D6) и являются следующими
<Пример 152>
Основной таутомер
1H-ЯМР (CDCl3) δ: 16,43 (1H, с), 12,92 (1H, с), 9,61 (1H, с), 8,47 (1H, д, J=8,7 Гц), 7,95 (1H, с), 7,90 (1H, с), 7,79 (1H, д, J=8,7 Гц), 7,04 (1H, дд, J=8,1, 8,1 Гц), 6,70 (1H, дд, J=8,1, 8,1 Гц), 4,98 (1H, д, J=14,3 Гц), 4,41 (1H, д, J=14,3 Гц), 4,07 (2H, т, J=6,2 Гц), 3,87 (1H, ушир.с), 3,73-3,71 (1H, м), 3,66-3,64 (1H, м), 3,56 (2H, м), 3,53-3,52 (2H, м), 3,33-3,31 (1H, м), 2,74 (1H, ддд, J=8,5, 8,5, 8,5 Гц), 2,55-2,53 (2H, м), 2,11 (1H, ушир.с), 1,92-1,88 (2H, м), 1,82-1,77 (2H, м), 1,74-1,73 (1H, м), 1,68-1,62 (2H, м), 1,01 (2H, с).
[0879] Второстепенный таутомер
1H-ЯМР (CDCl3) δ: 18,16 (1H, с), 12,97 (1H, с), 9,59 (1H, с), 8,33 (1H, д, J=8,7 Гц), 7,92 (2H, д, J=10,9 Гц), 7,79 (1H, д, J=8,4 Гц), 7,04 (1H, т, J=8,1 Гц), 6,70 (1H, т, J=7,5 Гц), 5,01 (1H, д, J=17,3 Гц), 4,45 (1H, д, J=14,6 Гц), 4,07 (2H, т, J=6,2 Гц), 3,87 (1H, с), 3,72 (1H, д, J=10,7 Гц), 3,65 (1H, д, J=11,9 Гц), 3,54 (4H, дт, J=19,0, 6,0 Гц), 3,26 (1H, с), 2,74 (1H, дд, J=16,6, 8,5 Гц), 2,63-2,61 (2H, м), 2,11 (1H, с), 1,92-1,88 (2H, м), 1,74-1,73 (2H, м), 1,67-1,65 (2H, м), 1,50-1,47 (1H, м), 0,85 (3H, с).
[0880] <Пример 156>
1H-ЯМР (DMSO-D6) δ: 15,77 (1H, ушир.с), 12,17 (1H, ушир.с), 9,71 (1H, с), 9,14 (1H, с), 8,54 (1H, д, J=6,6 Гц), 8,16 (1H, д, J=8,1 Гц), 7,13 (1H, ушир.с), 7,00 (1H, т, J=6,8 Гц), 4,99-4,17 (3H, м), 4,08 (2H, т, J=6,1 Гц), 3,59-3,54 (1H, м), 3,41-3,24 (6H, м), 2,70 (1H, кв., J=8,1 Гц), 2,41 (1H, ушир.с), 1,79-1,48 (8H, м), 1,47-1,31 (4H, м), 0,92 (3H, ушир.с).
[0881] <Пример 157>
(4aR)-1-[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид
[0882]
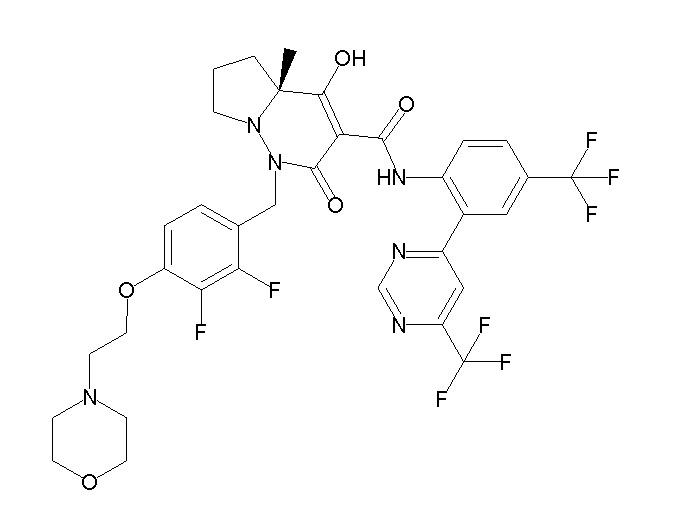
[0883] Трифенилфосфин (17,2 мг, 0,066 ммоль), N-(2-гидрокси-этил)морфолин (7,5 мг, 0,057 ммоль) и диэтил азодикарбоксилат (0,03 мл, 0,065 ммоль) добавляли к раствору (4aR)-1-[(2,3-дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида (пример 327) (10,6 мг, 0,016 ммоль) в тетрагидрофуране (0,2 мл), и смесь перемешивали при комнатной температуре в течение 1,5 часов. Затем реакционную смесь концентрировали, остаток очищали колоночной хроматографией с обращенной фазой на силикагеле с получением названного соединения (8,0 мг, 0,011 ммоль) в виде белого твердого вещества. Методом1H-ЯМР и13C-ЯМР было подтверждено, что это твердое вещество включало два таутомера.
[0884] LCMS: м/z 757[M+H]+
Время удерживания при ВЭЖХ: 1,30 минут (SMD-TFA05)
[0885] Основной таутомер
1H-ЯМР (CDCl3) δ: 16,44 (1H, с), 12,92 (1H, с), 9,61 (1H, д, J=1,0 Гц), 8,47 (1H, д, J=8,7 Гц), 7,95 (1H, д, J=1,0 Гц), 7,90 (1H, д, J=2,0 Гц), 7,79 (1H, дд, J=8,7, 2,0 Гц), 7,05 (1H, ддд, J=9,0, 6,8, 2,2 Гц), 6,71 (1H, ддд, J=9,0, 7,5, 1,2 Гц), 4,99 (1H, д, J=14,2 Гц), 4,40 (1H, д, J=14,2 Гц), 4,19 (2H, т, J=5,7 Гц), 3,74 (4H, т, J=4,6 Гц), 3,32 (1H, ддд, J=8,9, 8,9, 3,5 Гц), 2,84 (2H, т, J=5,7 Гц), 2,74 (1H, ддд, J=8,9, 8,9, 8,9 Гц), 2,61-2,59 (4H, м), 2,56-2,54 (1H, м), 1,76-1,73 (1H, м), 1,68-1,63 (2H, м), 1,00 (3H, с).
[0886]13C-ЯМР (CDCl3) δ: 187,4 (кв.C), 169,8 (кв.C), 165,7 (кв.C), 162,5 (кв.C), 159,3 (CH), 156,6 (кв.C, JCF = 36,3 Гц), 150,3 (кв.C, JCF = 248,7, 10,5 Гц), 147,8 (кв.C, JCF = 5,5 Гц), 141,3 (кв.C, JCF = 247,9, 14,6 Гц), 138,7 (кв.C), 128,3 (CH, JCF = 3,3 Гц), 128,0 (кв.C), 127,1 (CH, JCF = 3,8 Гц), 127,0 (кв.C, JCF = 33,5 Гц), 125,1 (CH), 124,8 (CH), 123,6 (кв.C, JCF = 272,0 Гц), 120,5 (кв.C, JCF = 275,4 Гц), 118,4 (кв.C, JCF = 12,7 Гц), 116,0 (CH, JCF = 2,5 Гц), 109,5 (CH, JCF = 2,5 Гц), 93,6 (кв.C), 68,0 (CH2), 66,9 (CH2x2), 64,2 (кв.C), 57,5 (CH2), 54,1 (CH2x2), 51,9 (CH2), 43,2 (CH2), 31,9 (CH2), 22,4 (CH3), 19,1 (CH2).
[0887] Второстепенный таутомер
1H-ЯМР (CDCl3) δ: 18,17 (1H, с), 12,97 (1H, с), 9,59 (1H, с), 8,33 (1H, д, J=8,7 Гц), 7,93 (1H, с), 7,91 (1H, д, J=2,0 Гц), 7,79 (1H, дд, J=8,7, 2,0 Гц), 7,05 (1H, ддд, J=9,0, 6,8, 2,2 Гц), 6,71 (1H, ддд, J=9,0, 7,5, 1,2 Гц), 5,02 (1H, д, J=14,5 Гц), 4,45 (1H, д, J=14,5 Гц), 4,19 (2H, т, J=5,7 Гц), 3,74 (4H, т, J=4,6 Гц), 3,25 (1H, ддд, J=8,8, 8,8, 3,2 Гц), 2,84 (2H, т, J=5,7 Гц), 2,74 (1H, ддд, J=8,9, 8,9, 8,9 Гц), 2,61-2,59 (4H, м), 2,56-2,54 (1H, м), 1,76-1,73 (1H, м), 1,68-1,63 (1H, м), 1,49-1,47 (1H, м), 0,84 (3H, с).
[0888]13C-ЯМР (CDCl3) δ: 191,8 (кв.C), 170,2 (кв.C), 168,1 (кв.C), 165,5 (кв.C), 159,3 (CH), 156,6 (кв.C, JCF = 36,3 Гц), 150,3 (кв.C, JCF = 248,7, 10,5 Гц), 147,8 (кв.C, JCF = 5,5 Гц), 141,3 (кв.C, JCF = 247,9, 14,6 Гц), 138,7 (кв.C), 128,2 (CH, JCF = 3,3 Гц), 128,2 (кв.C), 127,1 (CH, JCF = 3,8 Гц), 127,0 (кв.C, JCF = 33,5 Гц), 125,1 (CH), 125,4 (CH), 123,6 (кв.C, JCF = 272,0 Гц), 120,5 (кв.C, JCF = 275,4 Гц), 118,4 (кв.C, JCF = 12,7 Гц), 116,0 (CH, JCF = 2,5 Гц), 109,5 (CH, JCF = 2,5 Гц), 84,3 (кв.C), 68,0 (CH2), 66,9 (CH2x2), 64,2 (кв.C), 57,5 (CH2), 54,1 (CH2x2), 50,7 (CH2), 44,0 (CH2), 31,1 (CH2), 21,8 (CH3), 18,6 (CH2).
[0889] Для синтеза соединений примеров, описанных в следующей таблице, использовали соответствующие фенольные производные примеров 324, 325 и 327 и соответствующие спиртовые реагенты и проводили такие же операции, как в примере 156.
[0890]
[0891] <Пример 163>
(4aR)-1-[[2,3-Дифтор-4-(2-морфолин-4-илэтилсульфанил)-фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида гидрохлорид
[0892]
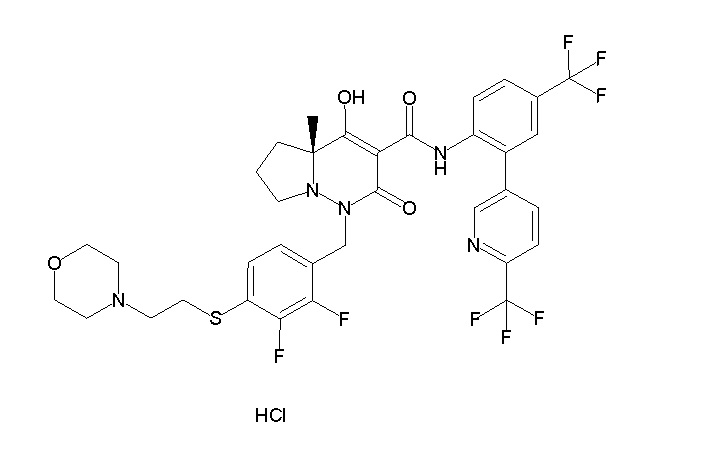
[0893] Карбонат цезия (67 мг, 0,206 ммоль) добавляли к раствору (4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида (пример 320) (30 мг, 0,04 ммоль), ацетата палладия (1,79 мг, 0,0080 ммоль), трифенилфосфина (8,37 мг, 0,032 ммоль) и триизопропилсилантиола (9,87 мг, 0,052 ммоль) в толуоле (0,399 мл), и смесь перемешивали при 100°C в течение 2 часов и 45 минут. Затем добавляли дополнительные количества ацетата палладия (1,79 мг, 0,0080 ммоль), триизопропилсилантиола (9,87 мг, 0,052 ммоль) и 1,4-диоксана (0,4 мл), и смесь перемешивали при 110°C в течение 2 часов.
[0894] Затем реакционную смесь охлаждали до комнатной температуры, к этой реакционной смеси добавляли 4-(2-хлорэтил)морфолина гидрохлорид (37,1 мг, 0,199 ммоль) и затем нагревали при 100°C в течение нескольких часов и охлаждали до комнатной температуры. Эту реакционную смесь очищали колоночной хроматографией с обращенной фазой С18. К полученному соединению добавляли 4N раствор хлористого водорода в 1,4-диоксане, и раствор концентрировали и сушили с получением названного соединения (17 мг, 53%) в виде белого твердого вещества.
[0895] LCMS: м/z 772[M+H]+
Время удерживания при ВЭЖХ: 1,35 минут (условия проведения анализа QC-SMD-TFA05)
[0896] <Пример 164>
(4aR)-1-[[2,3-Дифтор-4-(морфолин-4-илметил)фенил]метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифтор-метил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамида гидрохлорид
[0897]
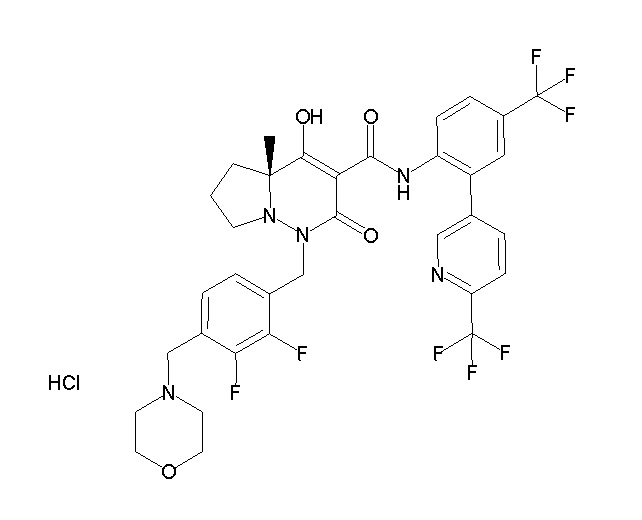
[0898] Первая стадия
[0899]
[0900] Раствор (бромметил)калия трифторбората (100 мг, 0,50 ммоль), морфолина (45,7 мг, 0,525 ммоль) и карбоната калия (69,1 мг, 0,50 ммоль) в тетрагидрофуране (0,50 мл) нагревали при 80°C в течение 1 часа и затем охлаждали до комнатной температуры. Затем реакционную смесь фильтровали и промывали ацетоном (15 мл), раствор сушили с получением трифтор(морфолинометил)калия бората (68 мг, 66%) в виде неочищенного продукта.
[0901] Вторая стадия
Ацетат палладия (2,45 мг, 0,0109 ммоль), дициклогексил-(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфин (10,39 мг, 0,022 ммоль) и карбонат цезия (89 мг, 0,272 ммоль) дважды добавляли к раствору трифтор(морфолинометил)калия бората (28,2 мг, 0,136 ммоль), полученного на первой стадии, и (4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(три-фторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида (пример 320) (41 мг, 0,054 ммоль) в смеси диоксана и воды (0,495 мл и 0,0495 мл), и смесь нагревали и перемешивали при 80°C в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры, эту реакционную смесь очищали колоночной хроматографией с обращенной фазой. Полученное соединение растворяли в этаноле, затем добавляли 4N раствор хлористого водорода в диоксане и сушили с получением названного соединения (28 мг, 68%) в виде белого твердого вещества.
[0902] LCMS: м/z 726[M+H]+
Время удерживания при ВЭЖХ: 1,28 минут (условия проведения анализа QC-SMD-TFA05)
[0903] Основной таутомер
1H-ЯМР (CDCl3) δ: 13,60 (1H, с), 11,74 (1H, с), 8,74 (1H, д, J=2,0 Гц), 8,44 (1H, д, J=8,6 Гц), 7,95 (1H, дд, J=8,0, 1,8 Гц), 7,86 (1H, д, J=8,0 Гц), 7,75 (1H, м), 7,72 (1H, дд, J=8,6, 2,0 Гц), 7,54 (1H, д, J=1,8 Гц), 7,17 (1H, т, J=6,7 Гц), 4,86 (1H, д, J=14,9 Гц), 4,37-4,22 (4H, м), 3,97 (2H, дд, J=13,2, 2,6 Гц), 3,35 (2H, д, J=10,4 Гц), 3,27 (1H, дт, J=8,7, 3,2 Гц), 2,92 (2H, м), 2,71 (1H, дд, J=16,7, 8,7 Гц), 2,60-2,51 (1H, м), 1,87-1,58 (4H, м), 1,04 (3H, с).
[0904] Второстепенный таутомер
1H-ЯМР (CDCl3) δ: 11,91 (1H, с), 8,70 (1H, д, J=2,0 Гц), 8,17 (1H, д, J=8,6 Гц), 7,80 (1H, д, J=8,0 Гц), 7,57 (1H, д, J=2,0 Гц), 7,32 (1H, т, J=6,9 Гц), 5,12 (1H, д, J=14,9 Гц), 4,48-4,38 (4H, м), 0,80 (3H, с).
[0905] <Пример 165>
Метил 4-[[(4aR)-4-Гидрокси-4a-метил-2-оксо-3-[[4-(трифтор-метил)-2-[6-(трифторметил)пиридин-3-ил]фенил]карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]метил]-3,5-дифторбензоат
[0906]
[0907] Гексакарбонил молибдена (70,2 мг, 0,266 ммоль), 1,1'-бис(дифенилфосфино)ферроцендихлорпалладий (II) (1:1 комплекс с дихлорметаном) (4,4 мг, 0,0053 ммоль) и 1,8-диазабицикло-[5,4,0]ундец-7-ен (0,0024 мл, 0,159 ммоль) добавляли к раствору (4aR)-1-[(2,6-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида (пример 322) (40 мг, 0,053 ммоль) в метаноле (2 мл), и смесь перемешивали в атмосфере азота при 70°C в течение 4 часов. Реакционную смесь добавляли к 1N хлористоводородной кислоте, экстрагировали дихлорметаном, и затем органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали препаративной ТСХ (гексан:этилацетат = 2:1) с получением названного соединения (29,3 мг, 81%) в виде светло-коричневого масла.
[0908] LCMS: м/z 685[M+H]+
Время удерживания при ВЭЖХ: 1,68 минут (условия проведения анализа QC-SMD-TFA05)
[0909] <Справочный пример 80>
(4aR)-N-(4-Бром-3,5-дифторфенил)-4-гидрокси-4a-метил-2-оксо-1,5,6,7-тетрагидропирроло[1,2-b]пиридазин-3-карбоксамид
[0910]
[0911] Первая стадия
[0912]
[0913] Раствор 4-бром-3,5-дифторанилина (2,00 г, 9,62 ммоль) и кислоты Мельдрума (2,77 г, 19,2 ммоль) в толуоле (18 мл) перемешивали при 90°C в течение 3 часов. Затем реакционную смесь охлаждали до 0°C, осадок собирали фильтрацией. Полученное твердое вещество очищали колоночной хроматографией с обращенной фазой (0,1% муравьиная кислота вода/ацетонитрил) с получением 3-((4-бром-3,5-дифторфенил)амино)-3-оксопропаноата (2,00 г, 71%) в виде белого порошка.
[0914] LCMS: м/z 294[M+H]+
Время удерживания при ВЭЖХ: 0,66 минут (условия проведения анализа SQD-FA05)
[0915] Вторая стадия
[0916]
[0917] Для синтеза (4aR)-N-(4-бром-3,5-дифторфенил)-1-[(2,4-(диметоксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида использовали 2,4-диметоксибензальдегид, (R)-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид и 3-((4-бром-3,5-дифторфенил)амино)-3-оксопропаноат и проводили такие же операции, как в справочном примере 1-1.
[0918] LCMS: м/z 554[M+H]+
Время удерживания при ВЭЖХ: 1,64 минут (условия проведения анализа SQD-FA05)
[0919] Третья стадия
(4aR)-N-(4-Бром-3,5-дифторфенил)-1-[(2,4-(диметоксифенил)-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид (910 мг, 1,65 ммоль) и триизопропилсилан (0,68 мл, 3,29 ммоль) растворяли в трифторуксусной кислоте (6 мл), и затем смесь охлаждали до 0°C, добавляли по каплям трифторметансульфоновую кислоту (0,15 мл, 1,65 ммоль). Затем смесь перемешивали при комнатной температуре в течение 30 минут, реакционную смесь добавляли к ледяной воде (50 мл), нейтрализовывали карбонатом калия (5,5 г, 39,8 ммоль) и экстрагировали три раза этилацетатом (100 мл). Затем органический слой промывали солевым раствором, сушили над сульфатом натрия. Затем органический слой фильтровали, фильтрат концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой С-18 (0,1% муравьиная кислота вода/ацетонитрил) с получением названного соединения (590 мг, 89%) в виде белого твердого вещества.
[0920] LCMS: м/z 402[M+H]+
Время удерживания при ВЭЖХ: 0,70 минут (условия проведения анализа SQD-FA05)
[0921] <Справочный пример 81>
(4aR)-4-Гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-1,5,6,7-тетрагидропирроло[1,2-b]пиридазин-3-карбоксамид
[0922]
[0923] Первая стадия
[0924]
[0925] 4-(Трифторметил)-2-(6-(трифторметил)пиридин-3-ил)-анилин (справочный пример 42) (2,0 г) растворяли в тетрагидрофуране (30 мл), добавляли трикалийфосфат (4,16 г), и смесь перемешивали при комнатной температуре в течение 3 минут. Добавляли метил 3-хлор-3-оксопропаноат (1,40 мл), и смесь перемешивали при комнатной температуре в течение 10 минут. Для роазделения добавляли этилацетат (100 мл) и воду (100 мл), и органический слой промывали 12% солевым раствором и концентрировали при пониженном давлении с получением малоновой кислоты 3-O-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил] 1-O-метила в виде неочищенного продукта.
[0926] LCMS: м/z 407[M+H]+
Время удерживания при ВЭЖХ: 0,81 минут (условия проведения анализа SQD-FA05)
[0927] Вторая стадия
[0928]
[0929] Метанол (20 мл) и 10N водный раствор гидроксида натрия (1,96 мл) добавляли к 3-O-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил] 1-O-метилу, полученному на первой стадии, и смесь перемешивали при комнатной температуре в течение 10 часов. Добавляли 6N хлористоводородную кислоту для доведения величины pH до 3, для разделения добавляли этилацетат и воду, и органический слой сушили над безводным сульфатом магния, и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли гексан (90 мл) и этилацетат (10 мл), смесь перемешивали и затем фильтровали, и полученное твердое вещество сушили с получением 3-оксо-3-((4-(трифторметил)-2-(6-(трифторметил)пиридин-3-ил)фенил)амино)-пропаноата (2,34 г, выход за две стадии 91%).
[0930] LCMS: м/z 393[M+H]+
Время удерживания при ВЭЖХ: 0,29 минут (условия проведения анализа SQD-FA50)
[0931] Третья стадия
[0932]

[0933] (R)-2-Метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид (8,4 г, 46,8 ммоль) суспендировали в дихлорметане (50 мл), добавляли моногидрат п-толуолсульфоновой кислоты (9,34 г, 49,1 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 10 минут. Реакционную смесь концентрировали при пониженном давлении, добавляли толуол для азеотропного удаления, затем остаток суспендировали в дихлорметане (50 мл), добавляли нитрит натрия (3,55 г, 69,0 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. Затем реакционную смесь фильтровали, концентрировали при пониженном давлении с получением (S)-1-нитроso-пирролидин-2-карбоновой кислоты метилового эфира в виде неочищенного продукта. Полученный неочищенный продукт растворяли в уксусной кислоте (200 мл) и метаноле (30 мл), добавляли порциями порошок цинка (29,4 г, 45,01 ммоль) в токе азота при 0°C, и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли метанол (100 мл), смесь фильтровали через слой целита, и затем фильтрат концентрировали при пониженном давлении. После того, как эту операцию повторяли два раза, полученный остаток очищали колоночной хроматографией на силикагеле (дихлорметан/метанол). Затем к полученной фракции добавляли 4N раствор хлористого водорода в 1,4-диоксане и концентрировали при пониженном давлении с получением (R)-1-амино-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорида (6,4 г, 70%).
[0934] LCMS: м/z 158,9[M+H]+
Время удерживания при ВЭЖХ: 0,33 минут на масс-хроматограмме (условия проведения анализа SMD-TFA05)
[0935] Четвертая стадия
[0936]
[0937] Для синтеза (R)-2-метил-1-(3-оксо-3-((4-(трифтор-метил)-2-(6-(трифторметил)пиридин-3-ил)фенил)амино)пропанамид)-пирролидин-2-карбоновой кислоты метилового эфира использовали (R)-2-Метил-1-(3-оксо-3-((4-(трифторметил)-2-(6-(трифторметил)-пиридин-3-ил)фенил)амино)пропанамид)пирролидин-2-карбоновой кислоты метиловый эфир и (R)-1-амино-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид в качестве реагента и исходного материала, соответственно, и проводили такие же операции, как на второй стадии справочного примера 1-1.
[0938] LCMS: м/z 531[M-H]-
Время удерживания при ВЭЖХ: 0,88 минут (SQD-FA05)
[0939] Пятая стадия
Для синтеза названного соединения использовали (R)-2-метил-1-(3-оксо-3-((4-(трифторметил)-2-(6-(трифтор-метил)-пиридин-3-ил)фенил)амино)пропанамид)пирролидин-2-карбоновой кислоты метиловый эфир и проводили такие же операции, как на третьей стадии справочного примера 1-1.
[0940] LCMS: м/z 501[M+H]+
Время удерживания при ВЭЖХ: 1,03 минут (SQD-FA05)
[0941] <Справочный пример 82>
(4aR)-4-Гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-1,5,6,7,-тетрагидропирроло-[1,2-b]пиридазин-3-карбоксамид
[0942]
[0943] Первая стадия
[0944]
[0945] Для синтеза 3-оксо-3-((4-(трифторметил)-2-(6-(три-фторметил)пиримидин-4-ил)фенил)амино)пропаноата использовали 4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)анилин (справочный пример 50) и кислоту Мельдрума и проводили такие же операции, как на второй стадии справочного примера 80.
[0946] Вторая стадия
Для синтеза названного соединения использовали (R)-1-амино-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид и 3-оксо-3-((4-(трифторметил)-2-(6-(трифторметил)-пиримидин-4-ил)фенил)амино)пропаноат и проводили такие же операции, как на четвертой и пятой стадиях справочного примера 81.
[0947] LCMS: м/z 502[M+H]+
Время удерживания при ВЭЖХ: 1,02 минут (SQD-FA05)
[0948] <Пример 166>
(4aR)-N-(4-Бром-3,5-дифторфенил)-1-[(4-бром-2-фторфенил)-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид
[0949]
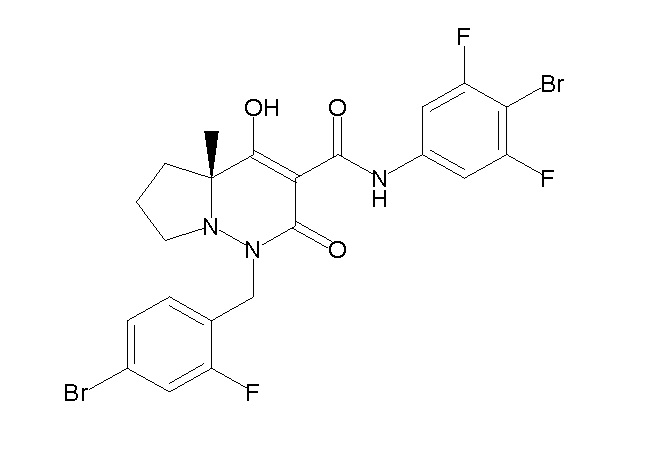
[0950] 1,7N толуольный раствор (0,0644 мл, 0,109 ммоль) 4-бром-1-(бромметил)-2-фторбензола (14,7 мг, 0,055 ммоль) и калия 2,2-диметилпропан-1-олата добавляли к раствору (4aR)-N-(4-бром-3,5-дифторфенил)-4-гидрокси-4a-метил-2-оксо-1,5,6,7-тетрагидро-пирроло[1,2-b]пиридазин-3-карбоксамида (справочный пример 80) (20,0 мг, 0,050 ммоль) в N,N-диметилформамиде (0,249 мл), и смесь перемешивали при комнатной температуре в течение 15 минут. Реакционную смесь непосредственно очищали колоночной хроматографией с обращенной фазой С18 (0,1% муравьиная кислота ацетонитрил/вода) с получением названного соединения (6,0 мг, 20%) в виде серовато-белого аморфного твердого вещества.
[0951] LCMS: м/z 588[M-H]-
Время удерживания при ВЭЖХ: 1,32 минут (SQD-FA05)
[0952] Для синтеза соединений примеров, описанных в следующей таблице, использовали соответствующие производные пиридазинoна справочных примеров 80-82 и соответствующие бензилгалогенидные реагенты и проводили такие же операции, как в примере 166.
[0953]
[0954]
[0955]
[0956]
[0957]
[0958]
[0959]
[0960]
[0961] В связи с тем, что для соединений, описанных в этой таблице, существуют таутомеры, далее приводятся, например, данные1H-NMR для примера 196.
[0962] Основной таутомер
1H-ЯМР (400 MHz, CDCl3) δ: 16,40 (1H, с), 12,00 (1H, с), 7,40-7,28 (4H, м), 7,11-7,04 (1H, м), 5,14 (1H, д, J=14,1 Гц), 4,47 (1H, д, J=14,1 Гц), 3,37-3,32 (1H, м), 2,82-2,76 (1H, м), 2,61-2,54 (1H, м), 1,76-1,61 (3H, м), 1,01 (3H, с).
[0963] Второстепенный таутомер
1H-ЯМР (400 MHz, CDCl3) δ: 16,40 (1H, с), 12,18 (1H, с), 7,40-7,28 (4H, м), 7,11-7,04 (1H, м), 5,11 (1H, д, J=14,4 Гц), 4,53 (1H, д, J=14,4 Гц), 3,32-3,26 (1H, м), 2,84-2,77 (1H, м), 2,65-2,61 (1H, м), 1,81-1,70 (3H, м), 0,88 (3H, с).
[0964] <Пример 234>
(4aR)-4-Гидрокси-4a-метил-2-оксо-1-(4,4,4-трифторбутил)-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0965]
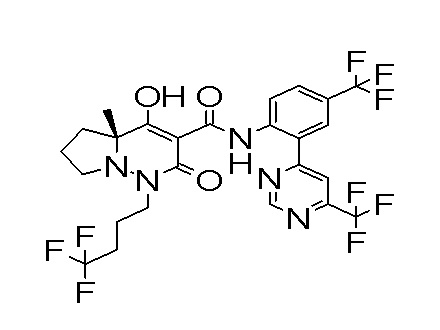
[0966] Для получения названного соединения использовали метил (4aR)-1-[(2,4-диметоксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксилат (справочный пример 12) и 1,1,1-трифтор-4-йодбутан и проводили последовательно такие же операции, как на третьей стадии справочного примера 80, примера 166 и примера 21.
[0967] LCMS: м/z 612[M+H]+
Время удерживания при ВЭЖХ: 1,63 минут (условия проведения анализа SMD-TFA05)
[0968] <Пример 235>
Этил 7-[(4aR)-4-гидрокси-4a-метил-2-оксо-3-[[4-(трифтор-метил)-2-[6-(трифторметил)пиридин-3-ил]фенил]карбамоил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-1-ил]гептаноат
[0969]
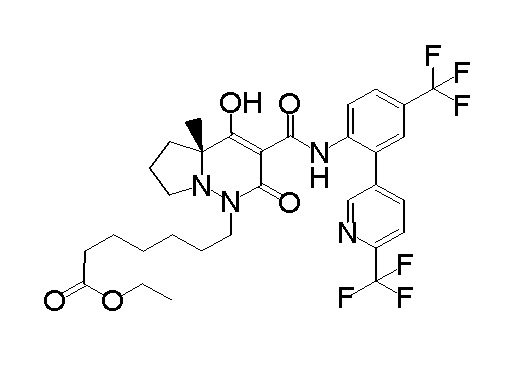
[0970] Для получения названного соединения использовали метил (4aR)-1-[(2,4-диметоксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксилат (справочный пример 12) и этил 7-бромгептаноат и проводили такие же операции, как в примере 234.
[0971] LCMS: м/z 657[M+H]+
Время удерживания при ВЭЖХ: 1,70 минут (условия проведения анализа QC-SMD-TFA05)
[0972] <Пример 236>
(4aR)-4-Гидрокси-1-[8-[2-(2-метоксиэтокси)этокси]октил]-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[0973]
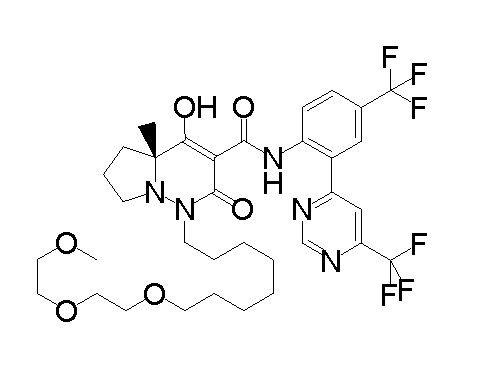
[0974] Первая стадия
[0975]
[0976] Йодид натрия добавляли к раствору 1-бром-8-(2-(2-метоксиэтокси)этокси)октана (1,00 г, 3,21 ммоль) в ацетоне, и смесь перемешивали при 60°C в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры, осадок отделяли фильтрованием, и затем фильтрат промывали тиосульфатом натрия и солевым раствором, сушили над сульфатом натрия. Затем фильтровали, фильтрат концентрировали при пониженном давлении с получением 1-йод-8-(2-(2-метоксиэтокси)этокси)октана (1,05 г, 91%) в виде желтого масла.
[0977] Вторая стадия
Для получения названного соединения использовали метил (4aR)-1-[(2,4-(диметоксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксилат (справочный пример 12) и соединение йода, полученное на первой стадии, и проводили такие же операции, как в примере 234.
[0978] LCMS: м/z 732[M+H]+
Время удерживания при ВЭЖХ: 1,76 минут (условия проведения анализа QC-SMD-TFA05)
[0979] <Пример 237>
(3S)-3-Третбутил-N-[4-хлор-2-[6-(трифторметил)пиримидин-4-ил]фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-2-метил-6-оксо-3H-пиримидин-5-карбоксамид
Первая стадия
Метил (2S)-3,3-диметил-2-[метил-[(2-метилпропан-2-ил)-оксикарбонил]амино]бутаноат
[0980]
[0981] (S)-2-((Третбутоксикарбонил)амино)-3,3-диметил- бутановую кислоту (11,3 г, 48,9 ммоль) растворяли в N,N-диметилформамиде (114 мл), добавляли оксид серебра (34,0 г, 147 ммоль) и йодметан (18,3 мл, 294 ммоль), и смесь перемешивали в атмосфере азота при 45°C в течение ночи. Реакционную смесь разбавляли этилацетатом (200 мл) и фильтровали, добавляли воду и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (12,7 г, 100%).
[0982]1H-ЯМР (CDCl3) δ: 4,75 (1H, с), 3,71 (3H, с), 2,94 (3H, с), 1,48 (9H, с), 1,08 (9H, с).
[0983] Вторая стадия
Метил (S)-3,3-диметил-2-(метиламино)бутаноата гидрохлорид
[0984]

[0985] Хлористоводородную кислоту (диоксановый раствор, 122 мл, 489 ммоль) добавляли к метил ((2S)-3,3-диметил-2-[метил-[(2-метилпропан-2-ил)оксикарбонил]амино]бутаноату (12,69 г), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении с получением названного соединения (9,58 г, 100%).
[0986]1H-ЯМР (DMSO-D6) δ: 9,00 (1H, ушир.с), 3,89-3,86 (1H, м), 3,79 (3H, с), 2,54 (3H, с), 1,02 (9H, с).
[0987] Третья стадия
Метил (2S)-2-[[(2,3-дифторфенил)метилиденамино]метил-амино]-3,3-диметилбутаноат
[0988]
[0989] Метил (S)-3,3-диметил-2-(метиламино)бутаноата гидрохлорид (70,0 мг, 0,358 ммоль) растворяли в уксусной кислоте (3,58 ммоль, 205 мкл) и воде (716 мкл), добавляли нитрит натрия (33,4 мг, 0,393 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 1 часа. К реакционной смеси добавляли цинк (19,7 г, 302 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 4 часов. Затем реакционную смесь фильтровали, добавляли метанол (3,58 мл) и 2,3-дифторбензальдегид (39,1 мкл, 0,358 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и разбавляли этилацетатом, и органический слой промывали насыщенным раствором бикарбоната натрия и солевым раствором и затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (44,2 мг, 41%).
[0990] LCMS: м/z 299[M+H]+
Время удерживания при ВЭЖХ: 1,13 минут (условия проведения анализа SQD-AA05)
[0991] Четвертая стадия
(3S)-3-третбутил-1-[(2,3-дифторфенил)метил]-4-гидрокси-2-метил-6-оксо-3H-пиримидин-5-карбоновой кислоты 2-метилпропиловый эфир
[0992]

[0993] Метил ((2S)-2-[[(2,3-дифторфенил)метилиденамино]-метиламино]-3,3-диметилбутаноат (44,2 мг, 0,148 ммоль)) растворяли в хлористоводородной кислоте (метанольном растворе, 442 мкл), добавляли боран-пиридин (29,9 мкл, 0,296 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и разбавляли этилацетатом, органический слой промывали 1N водным раствором гидрофосфата калия и солевым раствором, и водный слой отделяли с помощью фазового сепаратора и концентрировали при пониженном давлении с получением метил (2S)-2-[[(2,3-дифторфенил)метиламино]метиламино]-3,3-диметилбутаноата в виде неочищенного продукта. Полученный неочищенный продукт растворяли в этилацетате (750 мкл), и затем добавляли 3-изобутокси-3-оксопропаноат (0,026 г, 0,163 ммоль), пиридин (35,8 мкл, 0,444 ммоль) и 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (этилацетатный раствор, 174 мкл, 0,296 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 1 часа. К реакционной смеси добавляли воду и экстрагировали этилацетатом. Органический слой промывали 1N водным раствором гидрофосфата калия и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением метил (2S)-2-[[(2,3-дифторфенил)метил-[3-(2-метилпропокси)-3-оксопропаноил]амино]-метиламино]-3,3-диметил-бутаноата в виде неочищенного продукта. Полученный неочищенный продукт растворяли в N,N-диметилформамиде (750 мкл), добавляли карбонат цезия (121 мг, 0,370 ммоль), и смесь перемешивали в атмосфере азота при 80°C в течение 2 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту при 0°C и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения (48,1 мг, 79%).
LCMS: м/z 411,5[M+H]+
Время удерживания при ВЭЖХ: 1,03 минут (условия проведения анализа SQD-AA05)
Пятая стадия
(3S)-3-Третбутил-N-[4-хлор-2-[6-(трифторметил)пиримидин-4-ил]фенил]-1-[(2,3-дифторфенил)метил]-4-гидрокси-2-метил-6-оксо-3H-пиримидин-5-карбоксамид
[0994]
[0995] (3S)-3-третбутил-1-[(2,3-дифторфенил)метил]-4-гидрокси-2-метил-6-оксо-3H-пиридазин-5-карбоновой кислоты 2-метилпропиловый эфир (6,3 мг, 0,015 ммоль) растворяли в толуоле (200 мкл), добавляли 4-хлор-2-(6-(трифторметил)пиримидин-4-ил)анилин (справочный пример 53) (4,2 мг, 0,015 ммоль), и смесь нагревали в течение 1 часа. Реакционную смесь концентрировали, и полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения (8,0 мг, 85%).
[0996] LCMS: м/z 610,3[M+H]+
Время удерживания при ВЭЖХ: 1,72 минут (условия проведения анализа QC-SMD-TFA05)
[0997] <Справочный пример 83>
Метил (S)-2-(этиламино)-3,3-диметилбутаноата гидрохлорид
Первая стадия
Метил (2S)-2-[бензил(этил)амино]-3,3-диметилбутаноат
[0998]
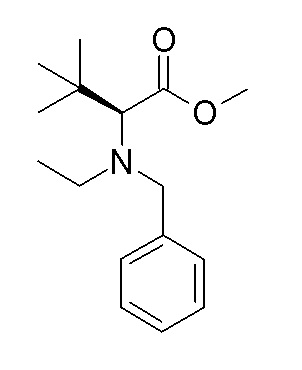
[0999] Метил (2S)-2-амино-3,3-диметилбутаноата гидрохлорид (5,27 г, 29,0 ммоль) суспендировали в дихлорэтане (250 мл), и затем добавляли бензальдегид (2,93 мл, 29,0 ммоль) и триацетоксигидроборат натрия (12,3 г, 58,0 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 10 часов. Реакционную смесь разбавляли этилацетатом (200 мл) и фильтровали, добавляли воду и экстрагировали этилацетатом. К реакционной смеси добавляли насыщенный раствор бикарбоната натрия при 0°C, и смесь экстрагировали дихлорметаном. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (2S)-2-(бензиламино)-3,3-диметилбутаноата метилового эфира (6,82 г) в виде неочищенного продукта. Часть полученного неочищенного продукта (2,00 г, 8,50 ммоль) растворяли в дихлорметане (42,5 мл), добавляли ацетальдегид (2,39 мл, 42,5 ммоль) и триацетоксигидроборат натрия (3,60 г, 17,0 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 24 часов. К реакционной смеси добавляли насыщенный раствор бикарбоната натрия при 0°C, и смесь экстрагировали дихлорметаном. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (1,65 г, 88%).
[1000] LCMS: м/z 264,3[M+H]+
Время удерживания при ВЭЖХ: 1,14 минут (условия проведения анализа SMD-TFA05)
[1001] Вторая стадия
Метил (S)-3,3-диметил-2-(метиламино)бутаноата гидрохлорид
[1002]
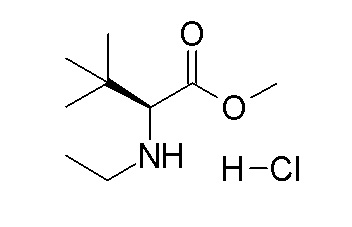
[1003] Метил (2S)-2-[бензил(этил)амино]-3,3-диметилбутаноат (1,64 г, 6,23 ммоль) растворяли в этилацетате (6,23 мл), добавляли гидроксид палладия-уголь (20 масс.%, 328 мг), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 6 часов. Реакционную смесь фильтровали, добавляли хлористоводородную кислоту (диоксановый раствор, 4,67 мл, 18,7 ммоль) и затем концентрировали при пониженном давлении с получением названного соединения (922 мг, 71%).
[1004]1H-ЯМР (DMSO-D6) δ: 8,98 (1H, ушир.с), 8,76 (1H, ушир.с), 3,88 (1H, д, J=10,0 Гц), 3,78 (3H, с), 2,94 (2H, кв., J=6,0 Гц), 1,22 (3H, т, J=7,3 Гц), 1,04 (9H, с).
[1005] <Справочный пример 84>
Метил (2S)-3,3-диметил-2-(2,2,2-трифторэтиламино)бутаноат
[1006]
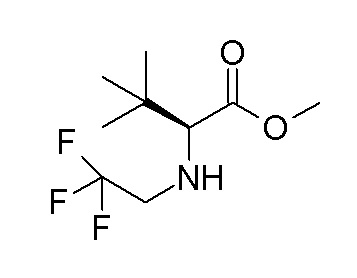
[1007] Метил (2S)-2-амино-3,3-диметилбутаноата гидрохлорид (1,00 г, 5,50 ммоль) суспендировали в тетрагидрофуране (250 мл), и затем добавляли трифторметансульфоновой кислоты 2,2,2-трифторэтил (1,59 мл, 11,0 ммоль) и диизопропилэтиламин (4,79 мл, 27,5 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 27 часов. Затем смесь охлаждали до комнатной температуры, реакционную смесь фильтровали, добавляли концентрированную хлористоводородную кислоту, концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения в виде раствора в смеси ацетонитрил/вода.
[1008] LCMS: м/z 228,3[M+H]+
Время удерживания при ВЭЖХ: 1,19 минут (условия проведения анализа SMD-TFA05)
[1009] <Справочный пример 85>
Метил 1-(метиламино)циклобутанкарбоксилата гидрохлорид
Первая стадия
Метил 1-((третбутоксикарбонил)(метил)амино)циклобутан-карбоксилат
[1010]
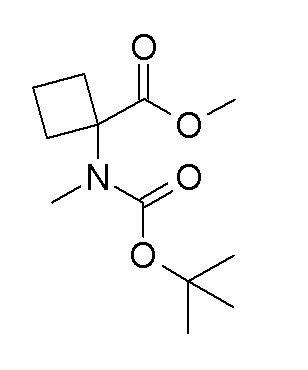
[1011] 1-((третбутоксикарбонил)амино)циклобутанкарбоновую кислоту (1,00 г, 4,65 ммоль) растворяли в N,N-диметилформамиде (9,29 мл), и затем добавляли гидрид натрия (55%, 0,61 г, 13,9 ммоль) и метилйодид (1,45 мл, 23,3 ммоль) при 0°C, и смесь перемешивали в атмосфере азота при комнатной температуре в течение 3 часов. К реакционной смеси добавляли 1N водный раствор хлористоводородной кислоты при 0°C, и смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой, насыщенным раствором бикарбоната натрия, 10 масс.% водным раствором тиосульфата натрия и солевым раствором, водный слой отделяли с помощью фазового сепаратора, концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (1,13 г, 100%).
[1012] LCMS: м/z 266,3[M+Na]+
Время удерживания при ВЭЖХ: 0,92 минут (условия проведения анализа SQD-AA05)
Вторая стадия
Метил 1-(метиламино)циклобутанкарбоксилата гидрохлорид
[1013]
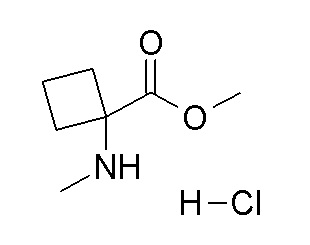
[1014] Названное соединение синтезировали из метил 1-((трет-бутоксикарбонил)(метил)амино)циклобутанкарбоксилата таким же методом, как на второй стадии примера 237.
[1015]1H-ЯМР (DMSO-D6) δ: 9,97 (2H, ушир.с), 3,86 (3H, с), 2,60-2,57 (2H, м), 2,50-2,46 (5H, м), 2,06-2,03 (2H, м).
[1016] <Справочный пример 86>
Метил 1-(метиламино)циклобутанкарбоксилат 4-толуол-сульфоната
[1017]
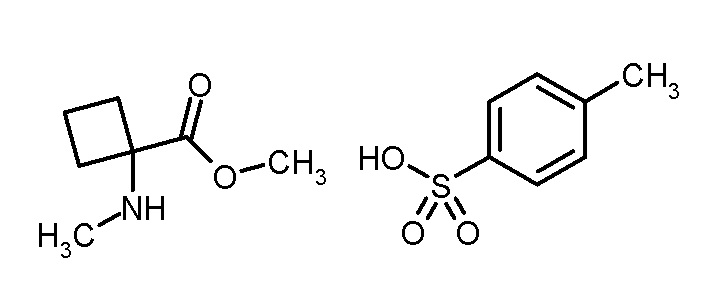
[1018] Метил 1-(метиламино)циклобутанкарбоксилата гидрохлорид (1,39 г, 7,75 ммоль) растворяли в этилацетате (15 мл) и затем добавляли 4-толуолсульфонат моногидрат (1,47 г, 7,75 ммоль), смесь концентрировали при пониженном давлении, добавляли этилацетат (15 мл) и фильтровали с получением названного соединения (1,96 г, 80%).
[1019]1H-ЯМР (DMSO-D6) δ: 9,10 (2H, ушир.с), 7,48 (2H, д, J=7,9 Гц), 7,12 (2H, д, J=7,9 Гц), 3,82 (3H, с), 2,56-2,31 (7H, м), 2,29 (3H, с), 2,05-1,99 (2H, м).
[1020] <Справочный пример 87>
Метил 1-(метиламино)циклопентанкарбоксилата гидрохлорид
[1021]
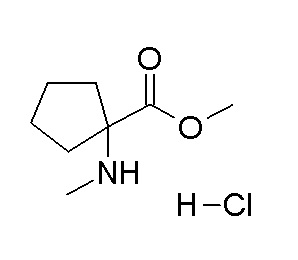
[1022] Названное соединение синтезировали из 1-((трет-бутоксикарбонил)амино)циклопентанкарбоновой кислоты таким же методом, как на первой и второй стадиях справочного примера 85.
[1023]1H-ЯМР (DMSO-D6) δ: 9,71 (2H, ушир.с), 3,79 (3H, с), 3,34 (3H, с), 2,20-2,13 (2H, м), 2,05-1,98 (2H, м), 1,89-1,86 (2H, м), 1,74-1,71 (2H, м).
[1024] <Справочный пример 88>
Метил 1-(метиламино)циклопентанкарбоксилата 4-толуол-сульфонат
[1025]
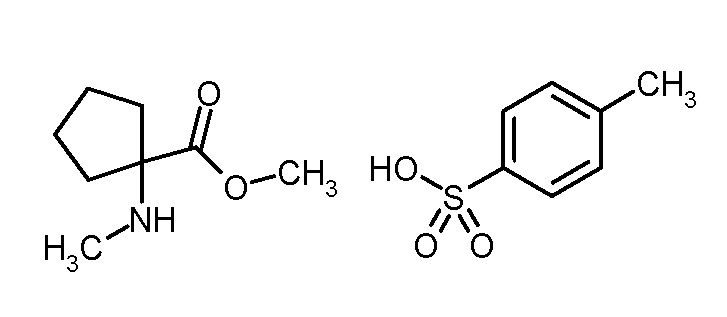
[1026] Метил 1-(метиламино)циклопентанкарбоксилата гидрохлорид (1,50 г, 7,75 ммоль) растворяли в этилацетате (15 мл) и затем добавляли 4-толуолсульфоната моногидрат (1,47 г, 7,75 ммоль), смесь концентрировали при пониженном давлении, добавляли этилацетат (15 мл) и фильтровали с получением названного соединения (2,00 г, 78%).
[1027]1H-ЯМР (DMSO-D6) δ: 9,18 (2H, ушир.с), 7,48 (2H, д, J=7,9 Гц), 7,11 (2H, д, J=7,9 Гц), 3,79 (3H, с), 2,57 (3H, ушир.с), 2,29 (3H, с), 2,24-2,10 (2H, м), 1,99-1,86 (2H, м), 1,86-1,65 (2H, м).
[1028] <Справочный пример 89>
Метил 1-(метиламино)циклогексанкарбоксилата гидрохлорид
[1029]
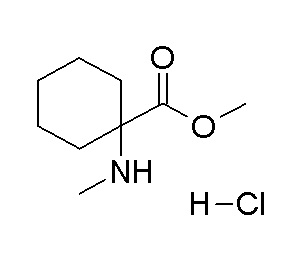
[1030] Названное соединение синтезировали из 1-((трет-бутоксикарбонил)амино)циклогексанкарбоновой кислоты таким же методом, как на первой и второй стадиях справочного примера 85.
[1031]1H-ЯМР (DMSO-D6) δ: 9,43 (2H, ушир.с), 3,84 (3H, с), 2,51 (3H, с), 2,15-2,12 (2H, м), 1,77-1,73 (4H, м), 1,58-1,55 (1H, м), 1,47-1,44 (2H, м), 1,35-1,29 (1H, м).
LCMS: м/z 172,5 [M+H]+
[1032] LCMS: м/z 172,5[M+H]+
Время удерживания при ВЭЖХ: 0,52 минут (условия проведения анализа SMD-TFA05)
[1033] <Справочный пример 90>
Метил 2-этил-2-(метиламино)бутаноата гидрохлорид
Первая стадия
2-(((Бензилокси)карбонил)амино)-2-этилбутаноата метиловый эфир
[1034] [
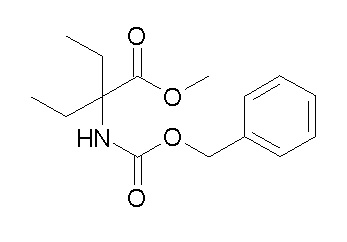
[1035] 2-Этил-2-(метоксикарбонил)бутаноат (307,0 мг, 1,76 ммоль) растворяли в толуоле (11,7 мл) и затем добавляли триэтиламин (295 мкл, 2,12 ммоль) и дифенилфосфорилазид (458 мкл, 2,12 ммоль), и смесь перемешивали при комнатной температуре в течение 1,5 часов и при 95°C в течение 0,5 часов. Добавляли бензиловый спирт (1,1 мл, 10,6 ммоль), и смесь перемешивали при 95°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении, разбавляли диэтиловым эфиром и промывали 1N хлористоводородной кислотой, насыщенным раствором бикарбоната натрия и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением названного соединения (488,1 мг, 99%).
[1036] LCMS: м/z 280[M+H]+
Время удерживания при ВЭЖХ: 1,11 минут (условия проведения анализа SMD-TFA05)
[1037] Вторая стадия
Метил 2-(((бензилокси)карбонил)(метил)амино)-2-этилбутаноат
[1038]
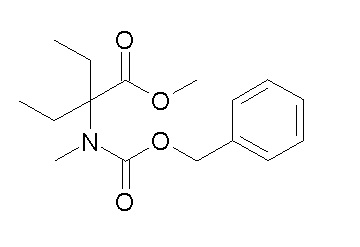
[1039] Раствор метил 2-(((бензилокси)карбонил)амино)-2-этилбутаноата (481,3 мг, 1,72 ммоль) в N,N-диметилформамиде (3,4 мл) добавляли к гидриду натрия (83 мг, 3,45 ммоль) при 0°C, добавляли метилйодид (269 мкл, 4,31 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли диэтиловым эфиром и промывали 1N хлористоводородной кислотой, водой, насыщенным раствором бикарбоната натрия, водным раствором тиосульфата натрия и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением названного соединения (438,5 мг, 87%).
[1040] LCMS: м/z 294[M+H]+
Время удерживания при ВЭЖХ: 1,14 минут (условия проведения анализа SMD-TFA05)
[1041] Третья стадия
Метил 2-этил-2-(метиламино)бутаноата гидрохлорид
[1042]
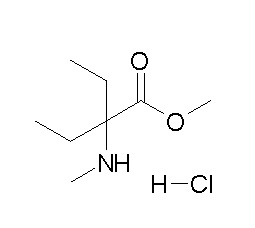
[1043] Палладий-уголь (10 масс.%, 15,8 мг) добавляли к раствору метил 2-(((бензилокси)карбонил)(метил)амино)-2-этил-бутаноата (434,5 мг, 1,48 ммоль) в метаноле (7,4 мл), и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 1 часа. К реакционной смеси добавляли раствор хлористоводородная кислота-метанол (0,5 M, 14,8 мл) и фильтровали и концентрировали при пониженном давлении с получением названного соединения (281,9 мг, 97%).
[1044]1H-ЯМР (CD3OD) δ: 3,92 (3H, с), 3,34 (1H, м), 2,69 (3H, с), 2,04 (4H, м), 0,99 (6H, т).
[1045] LCMS: м/z 160[M+H]+
Время удерживания при ВЭЖХ: 0,49 минут (условия проведения анализа SMD-TFA05)
[1046] <Справочный пример 91>
4-Хлор-5-метил-6-(трифторметил)пиримидин
Первая стадия
5-Метил-6-(трифторметил)пиримидин-4(3H)-он
[1047]
[1048] Этил 4,4,4-трифтор-2-метил-3-оксобутаноат (200 мг, 1,01 ммоль) и формамидина гидрохлорид (122 мг, 1,51 ммоль) растворяли в этаноле (2,0 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли этоксид натрия (172 мг, 2,52 ммоль), и смесь перемешивали при 80°C в течение 4 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту и воду и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром с получением названного соединения (158 мг, 88%).
[1049] LCMS: м/z 179[M+H]+
Время удерживания при ВЭЖХ: 0,46 минут (условия проведения анализа SQD-FA05)
[1050] Вторая стадия
4-Хлор-5-метил-6-(трифторметил)пиримидин
[1051]
[1052] Фосфорилхлорид (1,06 мл, 11,4 ммоль) добавляли к 5-метил-6-(трифторметил)пиримидин-4(3H)-ону (135 мг, 0,758 ммоль), и смесь перемешивали при 100°C в течение 1 часа. К реакционной смеси добавляли насыщенный раствор бикарбоната натрия и экстрагировали дихлорметаном. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением названного соединения в виде неочищенного продукта.
[1053] LCMS: м/z 197[M+H]+
Время удерживания при ВЭЖХ: 0,95 минут (условия проведения анализа SMD-TFA05)
[1054] <Справочный пример 92>
4,5-Дихлор-6-(трифторметил)пиримидин
Первая стадия
5-Хлор-6-(трифторметил)пиримидин-4(3H)-он
[1055]
[1056] 6-(Трифторметил)пиримидин-4(3H)-он (1,0 г, 6,1 ммоль) и N-хлорсукцинимид (1,1 г, 7,9 ммоль) растворяли в N,N-диметилформамиде (5,0 мл), и смесь перемешивали при 50°C в течение 9 часов. Реакционную смесь разбавляли этилацетатом и промывали водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (вода/ацетонитрил, 0,1% муравьиная кислота) с получением названного соединения (368,5 мг, 31%).
[1057] LCMS: м/z 199[M+H]+
Время удерживания при ВЭЖХ: 0,68 минут (условия проведения анализа SMD-TFA05)
[1058] Вторая стадия
4,5-Дихлор-6-(трифторметил)пиримидин
[1059]
[1060] Фосфорилхлорид (1,4 мл, 15,1 ммоль) добавляли к 5-хлор-6-(трифторметил)пиримидин-4(3H)-ону (150,0 мг, 0,756 ммоль), и смесь перемешивали при 100°C в течение 1,5 часов. К реакционной смеси добавляли смесь лед-вода и экстрагировали дихлорметаном, органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением названного соединения (121,5 мг) в виде неочищенного продукта.
LCMS: м/z 217[M+H]+
Время удерживания при ВЭЖХ: 1,03 минут (условия проведения анализа SMD-TFA05)
[1061] <Справочный пример 93>
4-Хлор-2-(6-хлорпиримидин-4-ил)анилин
[1062]
[1063] Диоксан (9,6 мл) добавляли к 2-амино-4-хлор-фенилбороновой кислоты пинаколовому эфиру (608 мг, 2,4 ммоль), 4,6-дихлорпиридину (892 мг, 6,0 ммоль), тетракис(трифенил-фосфин)палладию (138 мг, 0,12 ммоль) и фосфату калия (2,03 г, 9,6 ммоль), и смесь перемешивали при 90°C в течение 3 часов. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением названного соединения (349,6 мг, 59%).
[1064] LCMS: м/z 240[M+H]+
Время удерживания при ВЭЖХ: 1,14 минут (условия проведения анализа SMD-TFA05)
[1065] Для синтеза производных анилина, описанных в следующей таблице, использовали производные бороновой кислоты и галогенида, описанные в следующей таблице, и проводили такие же операции, как в справочном примере 93.
[1066]
[1067] <Справочный пример 99>
6-(2-Амино-5-хлорфенил)пиримидин-4-карбонитрил
[1068]
[1069] Для синтеза названного соединения использовали 4-хлор-2-(6-хлорпиримидин-4-ил)анилин и проводили такие же операции, как в справочном примере 63.
[1070] LCMS: м/z 265[M+H]+
Время удерживания при ВЭЖХ: 1,16 минут (условия проведения анализа SMD-TFA05)
<Справочный пример 100>
6-(2-Амино-5-хлорфенил)-5-метилпиримидин-4-карбонитрил
[1071]
[1072] Для синтеза названного соединения использовали 4-хлор-2-(6-хлорпиримидин-4-ил)анилин и проводили такие же операции, как в справочном примере 63.
[1073] LCMS: м/z 245[M+H]+
Время удерживания при ВЭЖХ: 0,75 минут (условия проведения анализа SQD-FA05)
[1074] <Примеры 238-300>
Для синтеза соединений, описанных в следующей таблице, использовали соответствующие анилиновые реагенты справочных примеров 94-100, описанных в таблице 30, соответствующие производные бензальдегида справочного примера 3 и производные бензальдегида, описанные в литературе или выпускаемые промышленностью, и соответствующие амины справочных примеров 85-90 и амины, описанные в литературе или выпускаемые промышленностью, и проводили такие же операции, как на третьей - пятой стадиях примера 237.
Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (без добавки), MeCN/вода (0,1% муравьиная кислота), MeCN/вода (0,1% NEt3) или CHCl3
Колонка:
YMC-Actus ODS-A (100 × 20 мм в.д., S - 5 мкм, 12 нм)
YMC-Actus Triart C18 (100 × 30 мм в.д., S - 5 мкм, 12 нм)
YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
JAI JAIGEL-H (600 × 20 мм в.д., GPC)
[1075]
[1076]
[1077]
[1078]
[1079]
[1080]
[1081]
[1082] <Справочный пример 101>
Метил 2-(2,3-дифторбензил)-5-гидрокси-6,6-диметил-3-оксо-1-фенил-1,2,3,6-тетрагидропиридазин-4-карбоксилат
Первая стадия
[1083]
[1084] Фенилгидразин (0,76 г, 7,1 ммоль) и этил 2-бром-2-метилпропионат (1,93 г, 9,9 ммоль) растворяли в N,N-диизопропилэтиламине (1,00 г, 7,8 ммоль), и смесь перемешивали и нагревали в атмосфере азота при 110°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта. К полученному неочищенному продукту добавляли метанол (6 мл) и 2,3-дифторбензальдегид (0,77 мл, 7,1 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле с обращенной фазой С-18 (0,1% муравьиная кислота вода/0,1% муравьиная кислота ацетонитрил) с получением этил 2-(2-(2,3-дифторбензилиден)-1-фенилгидразинил)-2-метилпропаноата (0,51 г, 21%) в виде желтого масла.
[1085] LCMS: м/z 347[M+H]+
Время удерживания при ВЭЖХ: 1,12 минут (условия проведения анализа SQD-FA05)
[1086] Вторая стадия
[1087]
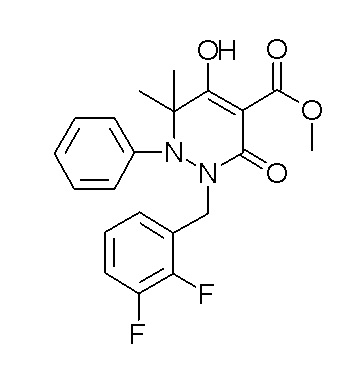
[1088] Для получения названного соединения (0,38 г, 65%) в виде желтого масла использовали этил 2-(2-(2,3-дифтор-бензилиден)-1-фенилгидразинил)-2-метилпропаноат, полученный на первой стадии, и проводили такие же операции, как в справочном примере 1-2.
[1089] LCMS: м/z 403[M+H]+
Время удерживания при ВЭЖХ: 0,97 минут (условия проведения анализа SQD-FA05)
[1090] <Справочный пример 102>
Метил 6-(2,3-дифторбензил)-9-гидрокси-5-метил-7-оксо-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксилат
Первая стадия
[1091]
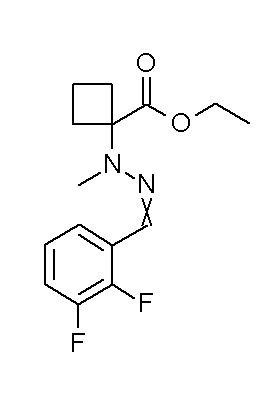
[1092] Метилгидразин (0,10 г, 2,17 ммоль) и этил 1-бромциклобутанкарбоксилат (0,23 г, 1,1 ммоль) растворяли в N,N-диизопропилэтиламине (0,30 г, 2,3 ммоль), и смесь перемешивали и нагревали в атмосфере азота при 110°C в течение 15 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали, концентрировали при пониженном давлении и экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта. К реакционной смеси добавляли полученный неочищенный продукт и затем добавляли метанол (2 мл) и 2,3-дифторбензальдегид (0,12 мл, 1,1 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле с обращенной фазой С-18 (0,1% муравьиная кислота вода/0,1% муравьиная кислота ацетонитрил) с получением этил 1-(2-(2,3-дифторбензилиден)-1-метилгидразинил)циклобутан-карбоксилата (36 мг, 11%) в виде бесцветного масла.
[1093] LCMS: м/z 297[M+H]+
Время удерживания при ВЭЖХ: 1,15 минут (условия проведения анализа SQD-FA05)
[1094] Вторая стадия
[1095]
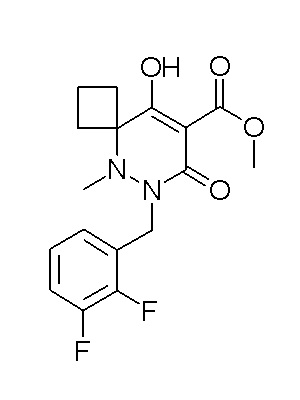
[1096] Для получения названного соединения (50 мг, 78%) в виде красного масла использовали этил 1-(2-(2,3-дифтор-бензилиден)-1-метилгидразинил)циклобутанкарбоксилат, полученный на первой стадии, и проводили такие же операции, как на второй стадии справочного примера 101.
[1097] LCMS: м/z 353[M+H]+
Время удерживания при ВЭЖХ: 0,93 минут (условия проведения анализа SQD-FA05)
[1098] <Справочный пример 103>
Метил 2-(2,3-дифторбензил)-5-гидрокси-1,6,6-триметил-3-оксо-1,2,3,6-тетрагидропиридазин-4-карбоксилат
Первая стадия
[1099]
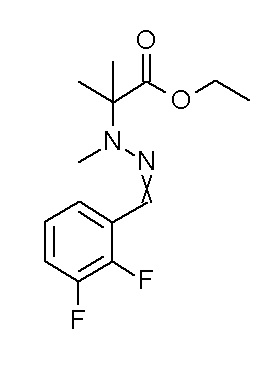
[1100] Метилгидразин (0,46 г, 1,0 ммоль) и этил 2-бром-2-метилпропионат (1,07 г, 5,5 ммоль) растворяли в тетрагидрофуране (5,0 мл) и затем добавляли N,N-диизопропилэтиламин (0,84 г, 6,5 ммоль), и смесь перемешивали и нагревали в атмосфере азота при 60°C в течение 66 часов. Затем реакционную смесь охлаждали до комнатной температуры, к реакционной смеси добавляли метанол (60 мл) и 2,3-дифторбензальдегид (0,55 мл, 5,0 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле с обращенной фазой С-18 (0,1% муравьиная кислота вода/0,1% муравьиная кислота ацетонитрил) с получением этил 2-[2-(2,3-дифторбензилиден)-1-метилгидразинил]-2-метилпропионата (0,8 г, 56%) в виде бесцветного масла.
[1101] LCMS: м/z 285[M+H]+
Время удерживания при ВЭЖХ: 1,00 минута (условия проведения анализа SQD-FA05)
[1102] Вторая стадия
[1103]
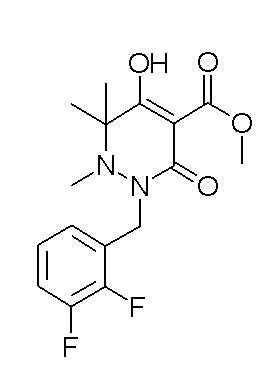
[1104] Для получения названного соединения (650 мг, 68%) в виде желтого масла использовали этил 2-[2-(2,3-дифтор-бензилиден)-1-метилгидразинил]-2-метилпропионат, полученный на первой стадии, и проводили такие же операции, как на второй стадии справочного примера 101.
[1105] LCMS: м/z 341[M+H]+
Время удерживания при ВЭЖХ: 0,81 минут (условия проведения анализа SQD-FA05)
[1106] Для синтеза соединений, описанных в следующей таблице, использовали соответствующие анилиновые реагенты и соответствующие эфирные производные справочных примеров 101-103 и проводили такие же операции, как на пятой стадии примера 237.
[1107]
[1108]
[1109] <Пример 313>
2-[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-5-гидрокси-1,6,6-триметил-3-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]пиридазин-4-карбоксамид
Первая стадия
[1110]
[1111] Для получения этил 2-(2-(2,3-дифтор-4-(2-морфолиноэтокси)бензилиден)-1-метилгидразинил)-2-метилпропаноата использовали метилгидразин, этил 2-бром-2-метилпропионат и альдегидный реагент, синтезированный в справочном примере 3, и проводили такие же операции, как на первой стадии справочного примера 103.
[1112] LCMS: м/z 414[M+H]+
Время удерживания при ВЭЖХ: 0,96 минут (условия проведения анализа SMD-TFA05)
[1113] Вторая стадия
[1114]
[1115] Этил 2-(2-(2,3-дифтор-4-(2-морфолиноэтокси)-бензилиден)-1-метилгидразинил)-2-метилпропаноат (50 мг, 0,12 ммоль), полученный на первой стадии, растворяли в растворе 10% хлористоводородная кислота-метанол (1,8 мл), добавляли боран-пиридин (28 мг, 0,30 ммоль) при 0°C, и смесь перемешивали в течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении, добавляли 1N водный раствор гидрофосфата калия, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали, и растворитель отгоняли при пониженном давлении с получением этил 2-(2-(2,3-дифтор-4-(2-морфолиноэтокси)бензил)-1-метилгидразинил)-2-метилпропаноата в виде неочищенного продукта.
[1116] LCMS: м/z 416[M+H]+
Время удерживания при ВЭЖХ: 0,63 минут (условия проведения анализа SMD-TFA05)
[1117] Третья стадия
[1118]
[1119] Неочищенный продукт этил 2-(2-(2,3-дифтор-4-(2-морфолиноэтокси)бензил)-1-метилгидразинил)-2-метилпропаноат, полученный на второй стадии, растворяли в этилацетате (800 мкл) и затем добавляли карбоновую кислоту, синтезированную на первой стадии справочного примера 82, пиридин (20 мкл, 0,242 ммоль) и 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (этилацетатный раствор, 92 мкл, 0,145 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение ночи. К реакционной смеси добавляли воду и экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением этил 2-(2-(2,3-дифтор-4-(2-морфолиноэтокси)бензил)-1-метил-2-(3-оксо-3-((4-(трифторметил)-2-(6-(трифторметил)-пиримидин-4-ил)фенил)амино)пропаноил)гидразинил)-2-метил-пропаноата в виде неочищенного продукта.
[1120] LCMS: м/z 791[M+H]+
Время удерживания при ВЭЖХ: 1,19 минут (условия проведения анализа SMD-TFA05)
[1121] Четвертая стадия
[1122]

[1123] Для синтеза названного соединения (35,1 мг, 39% выход за три стадии) использовали этил 2-(2-(2,3-дифтор-4-(2-морфолиноэтокси)бензил)-1-метил-2-(3-оксо-3-((4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)амино)пропаноил)-гидразинил)-2-метилпропаноат, полученный на третьей стадии, и проводили такие же операции, как на третьей стадии справочного примера 1-1.
[1124] LCMS: м/z 745[M+H]+
Время удерживания при ВЭЖХ: 1,27 минут (условия проведения анализа QC-SMD-TFA05)
[1125] <Пример 314>
2-[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-5-гидрокси-1,6,6-триметил-3-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]пиридазин-4-карбоксамид
[1126]
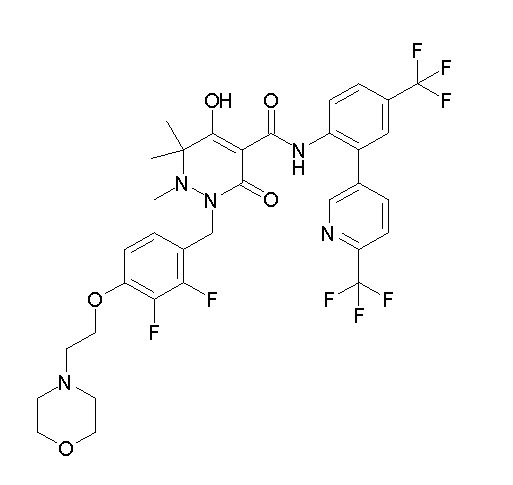
[1127] Для синтеза названного соединения (36,6 мг, 41% выход за три стадии) использовали этил 2-(2-(2,3-дифтор-4-(2-морфолиноэтокси)бензил)-1-метилгидразинил)-2-метилпропаноат, синтезированный на второй стадии примера 313, и карбоновую кислоту, синтезированную на первой стадии справочного примера 81, и проводили такие же операции, как в примере 313.
[1128] LCMS: м/z 744[M+H]+
Время удерживания при ВЭЖХ: 1,28 минут (условия проведения анализа QC-SMD-TFA05)
[1129] <Пример 315>
2-[[2,3-Дифтор-4-(3-морфолин-4-илпроп-1-инил)фенил]метил]-5-гидрокси-1,6,6-триметил-3-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]пиридазин-4-карбоксамид
Первая стадия
[1130]
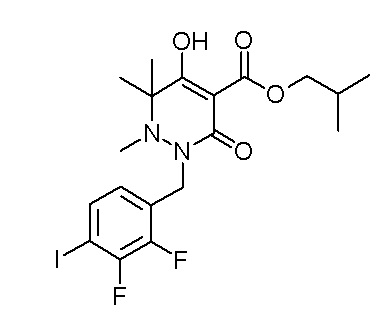
[1131] Для синтеза изобутил 2-(2,3-дифтор-4-йодбензил)-5-гидрокси-1,6,6-триметил-3-оксо-1,2,3,6-тетрагидропиридазин-4-карбоксилата использовали 2,3-дифтор-4-йодбензальдегид и 3-изобутилокси-3-оксопропионат, и проводили такие же операции, как на первой и второй стадиях справочного примера 103.
[1132] LCMS: м/z 509[M+H]+
Время удерживания при ВЭЖХ: 1,10 минут (условия проведения анализа SQD-FA05)
[1133] Вторая стадия
[1134]
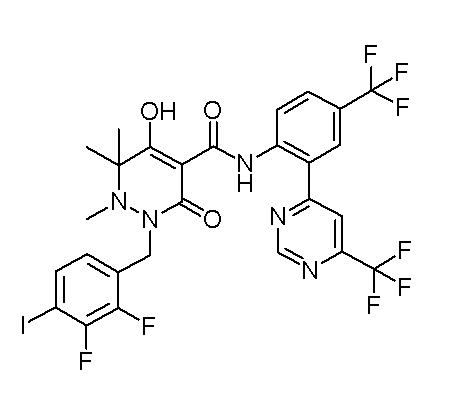
[1135] Для синтеза 2-(2,3-дифтор-4-йодбензил)-5-гидрокси-1,6,6-триметил-3-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)-пиримидин-4-ил)фенил)-1,2,3,6-тетрагидропиридазин-4-карбоксамида использовали (2-(2,3-дифтор-4-йодбензил)-5-гидрокси-1,6,6-триметил-3-оксо-1,2,3,6-тетрагидропиридазин-4-карбоновой кислоты изобутиловый эфир, синтезированный на первой стадии, и 4-(три-фторметил)-2-(6-(трифторметил)пиримидин-4-ил)анилин (справочный пример 50) и проводили такие же операции, как на пятой стадии примера 237.
[1136] LCMS: м/z 742[M+H]+
Время удерживания при ВЭЖХ: 1,25 минут (условия проведения анализа SQD-FA05)
[1137] Третья стадия
[1138]
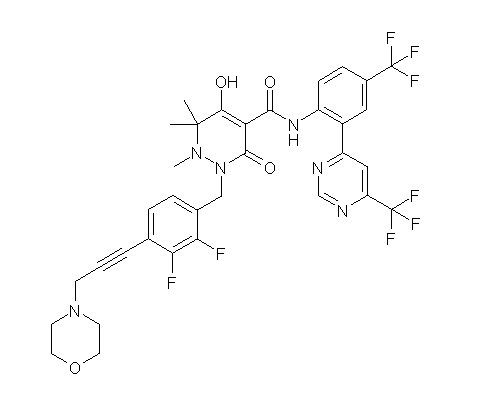
[1139] Для синтеза названного соединения использовали соединение йода, синтезированное на второй стадии, и 4-(проп-2-ин-1-ил)морфолин и проводили такие же операции, как в примере 123.
[1140] LCMS: м/z 739[M+H]+
Время удерживания при ВЭЖХ: 1,31 минут (условия проведения анализа QC-SMD-TFA05)
[1141] <Пример 316>
N-[4-Хлор-2-[6-(трифторметил)пиримидин-4-ил]фенил]-2-[[2,3-дифтор-4-(3-морфолин-4-илпроп-1-инил)фенил]метил]-5-гидрокси-1,6,6-триметил-3-оксопиридазин-4-карбоксамид
[1142]
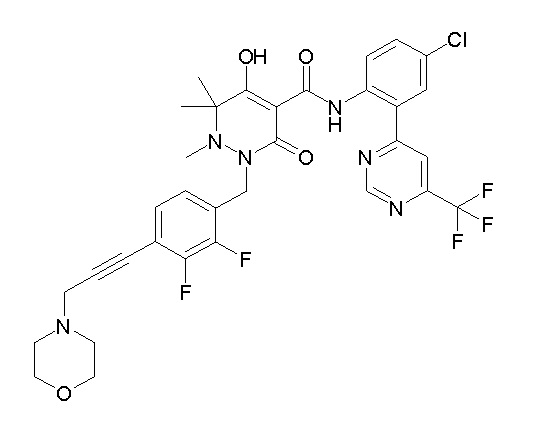
[1143] Для синтеза названного соединения использовали анилиновый реагент, синтезированный в справочном примере 53, и проводили такие же операции, как в примере 315.
[1144] LCMS: м/z 705[M+H]+
Время удерживания при ВЭЖХ: 1.,29 минут (условия проведения анализа QC-SMD-TFA05)
[1145] <Пример 317>
6-[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
Первая стадия
Метил 1-[[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]-метилиденамино]метиламино]циклобутан-1-карбоксилат
[1146]
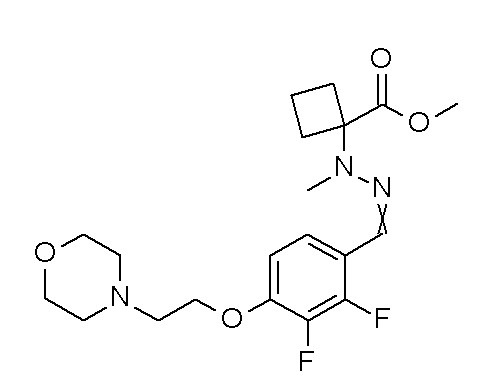
[1147] Метил 1-(метиламино)циклобутанкарбоксилата гидрохлорид (справочный пример 85) (300 мг, 1,67 ммоль) растворяли в уксусной кислоте (16,7 ммоль, 956 мкл) и воде (956 мкл) и затем добавляли нитрит натрия (132 мг, 1,91 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли цинк (1,09 г, 16,7 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 1,5 часов. Затем реакционную смесь фильтровали, добавляли метанол (9,56 мл) и 2,3-дифтор-4-(2-морфолиноэтокси)бензальдегид (324 мг, 1,19 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и разбавляли этилацетатом, органический слой промывали 1M водным раствором гидрофосфата калия и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (аминосиликагель, гексан/этилацетат) с получением названного соединения (402 мг, 82%).
[1148] LCMS: м/z 412[M+H]+
Время удерживания при ВЭЖХ: 0,91 минут (условия проведения анализа SMD-TFA05)
[1149] Вторая стадия
Метил 1-[[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метил-[3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-анилино]пропаноил]амино]метиламино]циклобутан-1-карбоксилат
[1150]
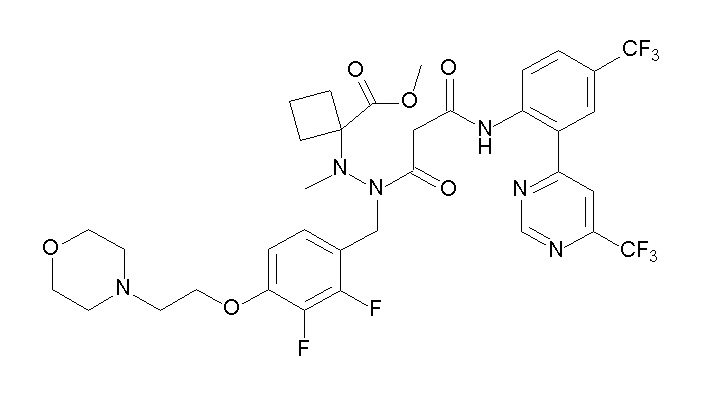
[1151] Метил 1-[[[2,3-дифтор-4-(2-морфолин-4-илэтокси)-фенил]метилиденамино]метиламино]циклобутан-1-карбоксилат (27,5 г, 66,9 ммоль) растворяли в этилацетате (158 мл) и затем добавляли хлористоводородную кислоту (4M этилацетатный раствор, 158 мл) при 0°C, и смесь перемешивали в атмосфере азота в течение 10 минут. К реакционной смеси добавляли комплекс 5-этил-2-метилпиридина и борана (19,9 мл, 134 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 30 минут. Затем к реакционной смеси добавляли водный раствор гидроксида натрия (5 M, 115 мл) и водный раствор фосфата калия (1 M, 50,0 мл), смесь разбавляли этилацетатом, органический слой промывали 1M водным раствором гидрофосфата калия и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением метил 1-[[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метиламино]метиламино]циклобутан-1-карбоксилата в виде неочищенного продукта. Полученный неочищенный продукт и 3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-анилино]пропаноат (первая стадия справочного примера 82) (27,6 г, 70,2 ммоль) растворяли в этилацетате (279 мл) и N,N-диметилформамиде (139 мл), и затем добавляли пиридин (5,40 мл, 66,9 ммоль) и 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (1,7M этилацетатный раствор, 79,0 мл, 134 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли солевой раствор, и смесь экстрагировали этилацетатом. Органический слой промывали 1M водным раствором гидрофосфата калия и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением названного соединения (1,15 г, 100%).
[1152] LCMS: м/z 789,1[M+H]+
Время удерживания при ВЭЖХ: 1,01 минут (условия проведения анализа SMD-FA05)
[1153] Третья стадия
6-[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1154]
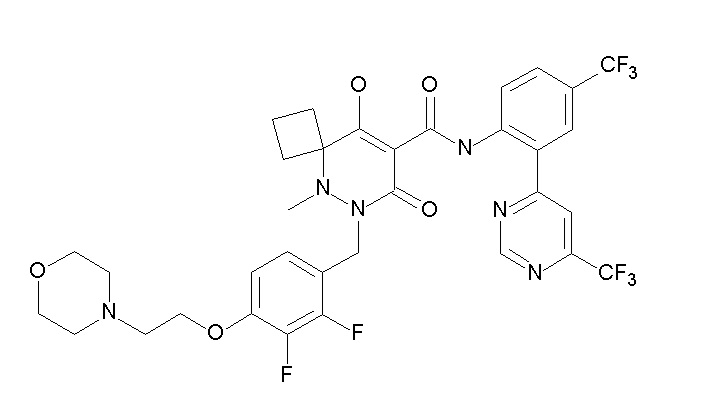
[1155] Метил 1-[[[2,3-дифтор-4-(2-морфолин-4-илэтокси)-фенил]метил[3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]анилино]пропаноил]амино]метиламино]циклобутан-1-карбоксилат (1,14 г, 1,45 ммоль) растворяли в метаноле (7,27 мл) и N,N-диметилформамиде (7,27 мл) и затем добавляли карбонат калия (602 мг, 4,36 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли муравьиную кислоту и воду, и смесь очищали колоночной хроматографией с обращенной фазой С18 (метанол/вода) с получением названного соединения (840 мг, 76%).
[1156] LCMS: м/z 757,4[M+H]+
Время удерживания при ВЭЖХ: 1,27 минут (условия проведения анализа SMD-TFA05)
[1157] Несмотря на то, что у названного соединения существуют таутомеры, тем не менее, в одних случаях изомеры можно обнаружить, а в других случаях нет, в зависимости от типа растворителя, используемого для измерения. Например,1H-ЯМР и13C-ЯМР спектры основных таутомеров в хлороформе-D являются следующими.
[1158] <Пример 317: Основной таутомер>
1H-ЯМР (CDCl3) δ: 16,58 (1H, с), 12,81 (1H, с), 9,60 (1H, с), 8,50 (1H, д, J=8,6 Гц), 7,95 (1H, с), 7,90 (1H, д, J=1,6 Гц), 7,80 (1H, дд, J=8,6, 1,6 Гц), 7,02 (1H, ддд, J=8,6, JCF = 7,2, 1,6 Гц), 6,72 (1H, ддд, J=8,6, JCF = 7,2, 1,6 Гц), 5,06 (1H, ушир.с), 4,20 (1H, ушир.с), 4,20 (2H, т, J=5,5 Гц), 3,74 (4H, т, J=4,1 Гц), 2,85 (2H, ушир.с), 2,61 (4H, ушир.с), 2,52 (1H, м), 2,41 (3H, с), 1,85-1,83 (3H, м), 1,73 (1H, м), 1,60 (1H, м).
[1159]13C-ЯМР (CDCl3) δ: 186,1 (кв.C), 169,8 (кв.C), 165,7 (кв.C), 162,8 (кв.C), 159,3 (кв.C), 156,6 (кв.C, кв., J=36,4 Гц), 150,4 (кв.C, дд, J=248,7, 10,5 Гц), 147,8 (кв.C, д, J=5,5 Гц), 141,3 (кв.C, дд, J=248,1, 14,6 Гц), 138,8 (кв.C), 128,3 (CH, кв., J=3,3 Гц), 127,7 (кв.C), 127,1 (CH), 127,0 (кв.C, кв., J=33,4 Гц), 125,1 (CH), 124,7 (CH), 123,6 (кв.C, кв., J=271,8 Гц), 120,5 (кв.C, кв., J=275,4 Гц), 118,2 (кв.C, д, J=12,4 Гц), 115,9 (CH, кв., J=2,5 Гц), 109,6 (CH, д, J=1,9 Гц), 92,3 (кв.C), 67,9 (CH2), 66,9 (CH2x2), 64,2 (кв.C), 57,5 (CH2), 54,1 (CH2x2), 41,6 (CH2), 35,1 (CH3), 32,4 (CH2), 24,5 (CH2), 13,4 (CH2).
[1160] <Пример 318>
7-[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
Первая стадия
Метил 1-[[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]-метилиденамино]метиламино]циклопентан-1-карбоксилат
[1161]
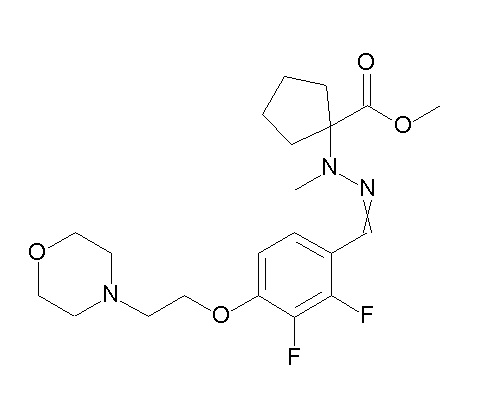
[1162] Метил 1-(метиламино)циклопентанкарбоксилата гидрохлорид (300 мг, 1,55 ммоль) растворяли в уксусной кислоте (15,5 ммоль, 887 мкл) и воде (887 мкл) и затем добавляли нитрит натрия (122 мг, 1,77 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 1 часа. К реакционной смеси добавляли цинк (1,01 г, 15,5 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 1,5 часов. Затем реакционную смесь фильтровали, добавляли метанол (8,87 мл) и 2,3-дифтор-4-(2-морфолиноэтокси)бензальдегид (300 мг, 1,11 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и разбавляли этилацетатом, органический слой промывали 1M водным раствором гидрофосфата калия и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (аминосиликагель, гексан/этилацетат) с получением названного соединения (375 мг, 80%).
[1163] LCMS: м/z 426,2[M+H]+
Время удерживания при ВЭЖХ: 0,93 минут (условия проведения анализа SMD-TFA05)
[1164] Вторая стадия
1-[[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил-[3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-анилино]пропаноил]амино]метиламино]циклопентан-1-карбоновая кислота
[1165]
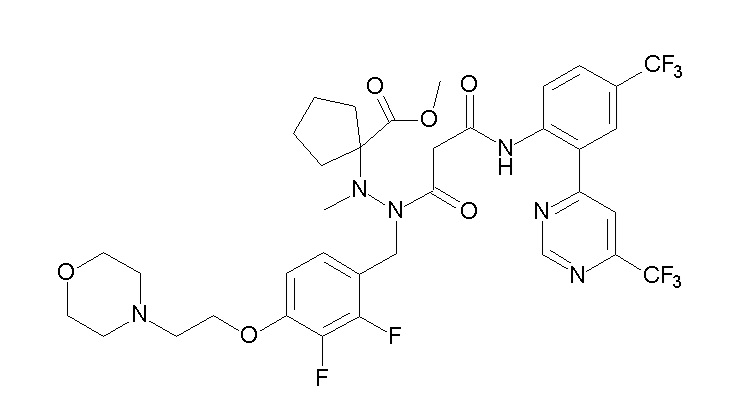
[1166] Метил 1-[[[2,3-дифтор-4-(2-морфолин-4-илэтокси)-фенил]метилиденамино]метиламино]циклопентан-1-карбоксилат (29,8 г, 70,3 ммоль) растворяли в этилацетате (172 мл) и затем добавляли хлористоводородную кислоту (4M этилацетатный раствор, 172 мл) при 0°C, и смесь перемешивали в атмосфере азота в течение 10 минут. К реакционной смеси добавляли комплекс 5-этил-2-метилпиридина и борана (20,9 мл, 141 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 30 минут. Затем к реакционной смеси добавляли водный раствор гидроксида натрия (5 M, 125 мл) и водный раствор фосфата калия (1 M, 50,0 мл), смесь разбавляли этилацетатом, органический слой промывали 1M водным раствором фосфата калия и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением метил 1-[[[2,3-дифтор-4-(2-морфолин-4-илэтокси)фенил]метиламино]-метиламино]циклопентан-1-карбоксилата в виде неочищенного продукта.
[1167] Полученный неочищенный продукт и 3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]анилино]-пропаноат (первая стадия справочного раствора 82) (29,0 г, 73,8 ммоль) растворяли в этилацетате (293 мл) и N,N-диметилформамиде (146 мл) и затем добавляли пиридин (5,67 мл, 70,3 ммоль) и 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (1,7 M этилацетатный раствор, 83,0 мл, 141 ммоль) при 0°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли солевой раствор и экстрагировали этилацетатом. Органический слой промывали 1M водным раствором гидрофосфата калия и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, и полученный остаток промывали метанолом с получением названного соединения (39,4 г, 70%).
[1168] LCMS: м/z 803,1[M+H]+
Время удерживания при ВЭЖХ: 1,03 минут (условия проведения анализа SMD-FA05)
Третья стадия
7-[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1169]
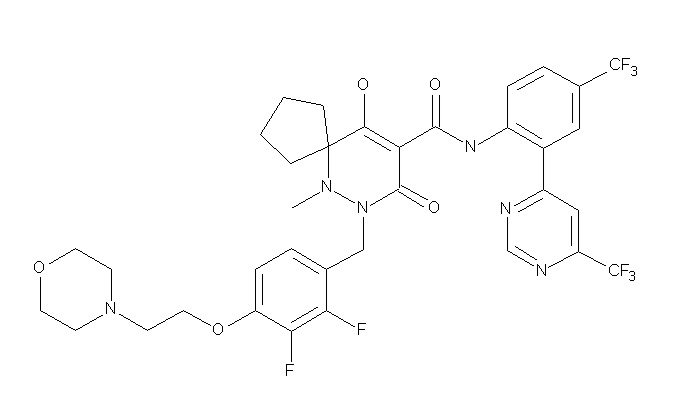
[1170] 1-[[[2,3-Дифтор-4-(2-морфолин-4-илэтокси)фенил]метил-[3-оксо-3-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]анилино]пропаноил]амино]метиламино]циклопентан-1-карбоновую кислоту (15,0 г, 18,7 ммоль) растворяли в метаноле (94,0 мл) и N,N-диметилформамиде (94,0 мл) и затем добавляли карбонат калия (7,76 г, 56,1 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли муравьиную кислоту и воду, и смесь очищали колоночной хроматографией с обращенной фазой С18 (метанол/вода) с получением названного соединения (13,3 г, 92%).
[1171] LCMS: м/z 771,3[M+H]+
Время удерживания при ВЭЖХ: 1,29 минут (условия проведения анализа SMD-TFA05)
Несмотря на то, что у названного соединения существуют таутомеры, тем не менее, в одних случаях изомеры можно обнаружить, а в других случаях нет, в зависимости от типа растворителя, используемого для измерения. Например,1H-ЯМР и13C-ЯМР спектры основных таутомеров в хлороформе-D являются следующими.
[1172] <Пример 318: Основной таутомер>
1H-ЯМР (CDCl3) δ: 16,55 (1H, с), 12,83 (1H, с), 9,62 (1H, с), 8,49 (1H, д, J=8,8 Гц), 7,96 (1H, с), 7,90 (1H, д, J=1,5 Гц), 7,79 (1H, дд, J=8,8, 1,5 Гц), 7,05 (1H, дд, J=8,1, 7,4 Гц), 6,73 (1H, дд, J=8,1, 7,4 Гц), 5,05 (1H, д, J=14,2 Гц), 4,21 (1H, д, J=14,2 Гц), 4,19 (2H, т, J=5,7 Гц), 3,74 (4H, т, J=4,6 Гц), 2,84 (2H, т, J=5,7 Гц), 2,60 (4H, м), 2,48 (3H, с), 2,16 (1H, м), 1,74 (2H, м), 1,59 (1H, м), 1,52 (1H, м), 1,47 (2H, м), 1,31 (2H, м).
[1173]13C-ЯМР (CDCl3) δ: 187,7 (кв.C), 169,9 (кв.C), 165,7 (кв.C), 163,2 (кв.C), 159,3 (CH), 156,6 (кв.C, кв., JCF = 36,3 Гц), 150,4 (кв.C, дд, JCF = 248,7, 10,5 Гц), 147,9 (кв.C, д, JCF = 5,8 Гц), 141,3 (кв.C, дд, JCF = 248,3, 14,7 Гц), 138,8 (кв.C), 128,3 (CH, кв., JCF = 3,3 Гц), 127,8 (кв.C), 127,1 (CH, кв., JCF = 3,9 Гц), 126,9 (кв.C, кв., JCF = 33,4 Гц), 125,5 (CH), 124,7 (CH), 123,6 (кв.C, кв., JCF = 272,1 Гц), 120,5 (кв.C, кв., JCF = 275,4 Гц), 117,8 (кв.C, д, JCF = 12,9 Гц), 116,0 (CH, кв., JCF = 2,5 Гц), 109,7 (CH), 93,1 (кв.C), 71,4 (кв.C), 68,1 (CH2), 66,9 (CH2x2), 57,5 (CH2), 54,2 (CH2x2), 41,7 (CH2), 37,6 (CH2,), 36,8 (CH2), 31,4 (CH2), 24,8 (CH2), 23,3 (CH2).
[1174] <Пример 319>
(4aR)-N-(4-Бром-3-фторфенил)-1-[(2,3-дифтор-4-йодфенил)-метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]-пиридазин-3-карбоксамид
[1175]
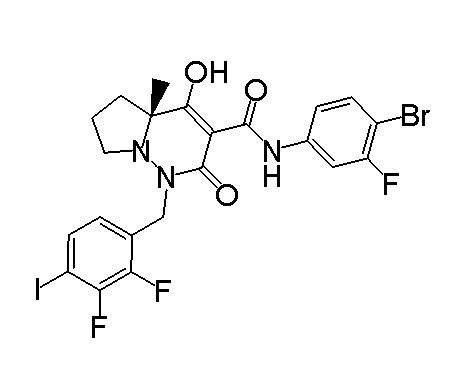
[1176] Первая стадия
[1177]
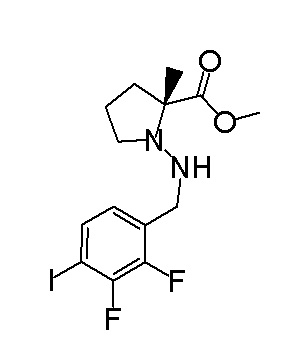
[1178] Использовали (R)-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид и 2,3-дифторбензальдегид, и затем растворяли в уксусной кислоте (5,0 мл) и метаноле (5,5 мл) (R)-1-((2,3-дифтор-4-йодбензилиден)амино)-2-метилпирролидин-2-карбоновой кислоты метиловый эфир (2,24 г, 5,49 ммоль), полученный путем проведения таких же операций, как в примере 1, и затем добавляли цианоборгидрид натрия (1,76 г, 28,0 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 14 часов. К реакционной смеси добавляли насыщенный раствор бикарбоната натрия и концентрировали при пониженном давлении и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (R)-1-((2,3-дифтор-4-йодбензил)амино)-2-метил-пирролидин-2-карбоновой кислоты метилового эфира в виде неочищенного продукта.
[1179] Вторая стадия
[1180]
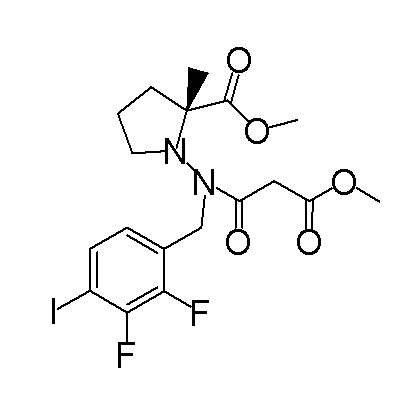
[1181] Неочищенный продукт, полученный на первой стадии, растворяли в тетрагидрофуране (5,5 мл) и затем добавляли трикалийфосфат (2,38 г, 11,2 ммоль) и хлоркарбонилуксусной кислоты метиловый эфир (1,00 мл, 9,06 ммоль) при 0°C, и смесь перемешивали в атмосфере азота при комнатной температуре в течение 3 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором бикарбоната натрия и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (S)-1-[(3-фтор-бензил)-(2-метоксикарбонилацетил)-амино]пирролидин-2-карбоновой кислоты метилового эфира в виде неочищенного продукта.
[1182] Третья стадия
[1183]
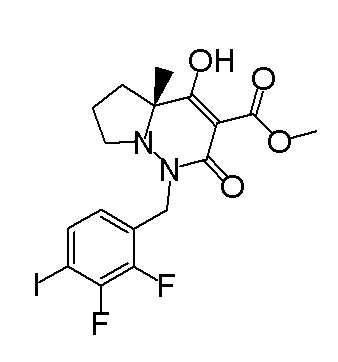
[1184] Полученный неочищенный продукт растворяли в N,N-диметилформамиде (1,5 мл) и затем добавляли карбонат цезия (672 мг, 2,06 ммоль), и смесь перемешивали в атмосфере азота при 80°C в течение 5,5 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту, и смесь экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением метил (4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксилата в виде неочищенного продукта.
[1185] Четвертая стадия
Неочищенный продукт (328 мг, 0,686 ммоль), полученный на третьей стадии, и 4-бром-3-фторанилин (145 мг, 0,763 ммоль) растворяли в толуоле (3,4 мл), и смесь перемешивали при 110°C в течение 1 часа. Затем реакционную смесь охлаждали, концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (402 мг, 92%) в виде серовато-белого твердого вещества.
[1186] LCMS: м/z 479[M+H]+
Время удерживания при ВЭЖХ: 0,97 минут (условия проведения анализа SQD-FA05)
[1187] <Пример 320>
(4aR)-1-[(2,3-Дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]-фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1188]
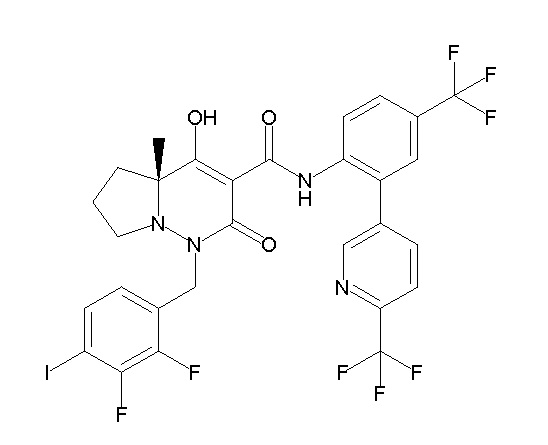
[1189] (4aR)-1-[(2,3-Дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир (справочный пример 5) (100 мг, 0,192 ммоль) и 4-(трифторметил)-2-(6-(трифторметил)пиридин-3-ил)анилин (справочный пример 42) (73,6 мг, 0,240 ммоль) растворяли в толуоле (0,96 мл), и смесь перемешивали при 100°C в течение 40 минут. Затем реакционную смесь охлаждали, концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (120 мг, 83%) в виде белого аморфного твердого вещества.
[1190] LCMS: м/z 753[M+H]+
Время удерживания при ВЭЖХ: 0,93 минут (условия проведения анализа SQD-FA50)
[1191] <Пример 321>
(4aR)-1-[(2,3-Дифтор-4-йодфенил)метил]-N-[2-(2,3-диметоксифенил)-4-(трифторметил)фенил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1192]
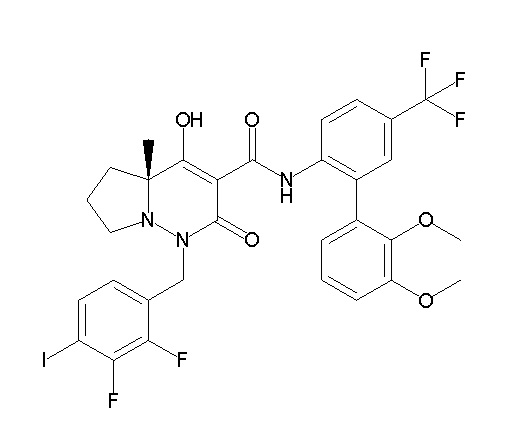
[1193] Для синтеза названного соединения использовали (4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метил-пропиловый эфир (справочный пример 5) и 2',3'-диметокси-5-(трифторметил)-[1,1'-бифенил]-2-амин (справочный пример 16) и проводили такие же операции, как на четвертой стадии примера 319.
[1194] LCMS: м/z 744[M+H]+
Время удерживания при ВЭЖХ: 1,19 минут (SMD-TFA05)
[1195] <Пример 322>
(4aR)-1-[(2,6-Дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]-фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1196]
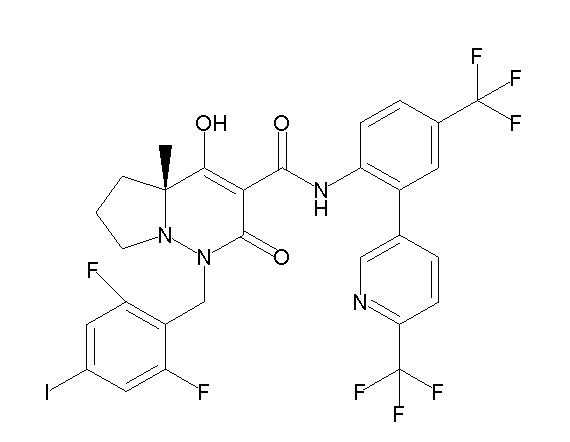
[1197] Первая стадия
[1198]
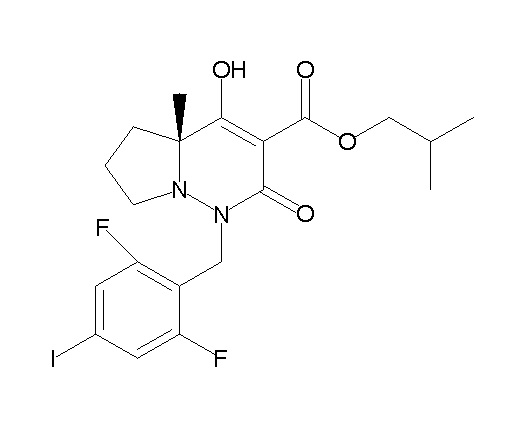
[1199] Для синтеза (4aR)-1-[(2,6-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропилового эфира использовали 2,6-дифтор-4-йодбензальдегид и проводили такие же операции, как на первой - третьей стадиях примера 319.
[1200] LCMS: м/z 521[M+H]+
Время удерживания при ВЭЖХ: 1,51 минут (условия проведения анализа SMD-TFA05)
[1201] Вторая стадия
Для синтеза названного соединения использовали (4aR)-1-[(2,6-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метил-пропиловый эфир и 4-(трифторметил)-2-(6-(трифторметил)пиридин-3-ил)анилин (справочный пример 42) и проводили такие же операции, как на четвертой стадии примера 319.
[1202] LCMS: м/z 753[M+H]+
Время удерживания при ВЭЖХ: 1,76 минут (условия проведения анализа QC-SMD-TFA05)
[1203] <Пример 323>
(4aR)-1-[(2,3-Дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1204]
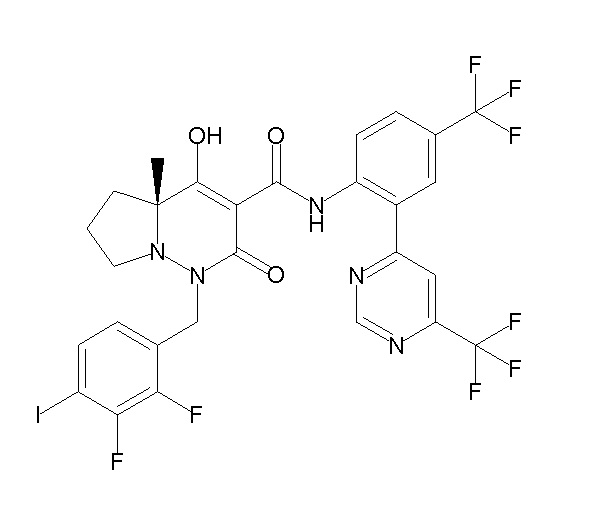
[1205] Для синтеза названного соединения использовали (4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метил-пропиловый эфир (справочный пример 5) и 4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)анилин (справочный пример 50) и проводили такие же операции, как на четвертой стадии примера 319.
[1206] LCMS: м/z 754[M+H]+
Время удерживания при ВЭЖХ: 0,93 минут (условия проведения анализа SQD-FA50)
[1207] <Пример 324>
(4aR)-1-[(2,3-Дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1208]
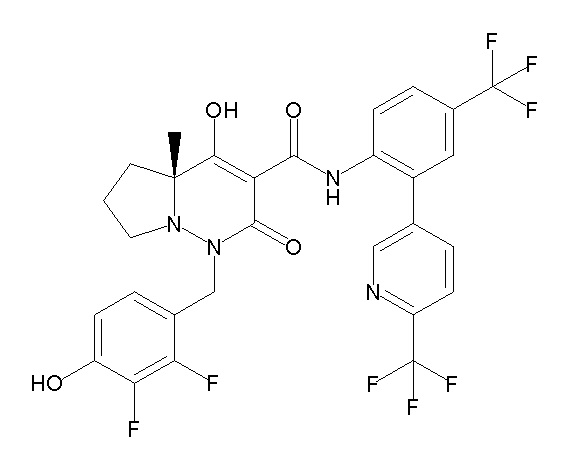
[1209] (4aR)-1-[(2,3-Дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир (справочный пример 5) (1,086 г, 1,444 ммоль), йодид меди (31,2 мг, 0,164 ммоль) и 2-метил-8-хинолинол (52,7 мг, 0,331 ммоль) растворяли в диметилсульфоксиде (4,1 мл) в атмосфере азота, добавляли тетрабутиламмония гидроксид (4,24 г, 6,54 ммоль) и воду (1,56 мл), и смесь перемешивали в атмосфере азота при 100°C в течение 5 часов. Затем реакционную смесь охлаждали, к реакционной смеси добавляли 1N хлористоводородную кислоту (5,1 мл), воду (30 мл) и соответствующее количество N-ацетил-L-цистеина и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле с получением названного соединения (834 мг, 90%) в виде бледно-желтого аморфного твердого вещества.
[1210] LCMS: м/z 643[M+H]+
Время удерживания при ВЭЖХ: 1,12 минут (условия проведения анализа SQD-FA05)
[1211] <Пример 325>
(4aR)-1-[2,3-(Дифтор-4-гидроксифенил)метил]-N-[2-(2,3-диметоксифенил)-4-(трифторметил)фенил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1212]
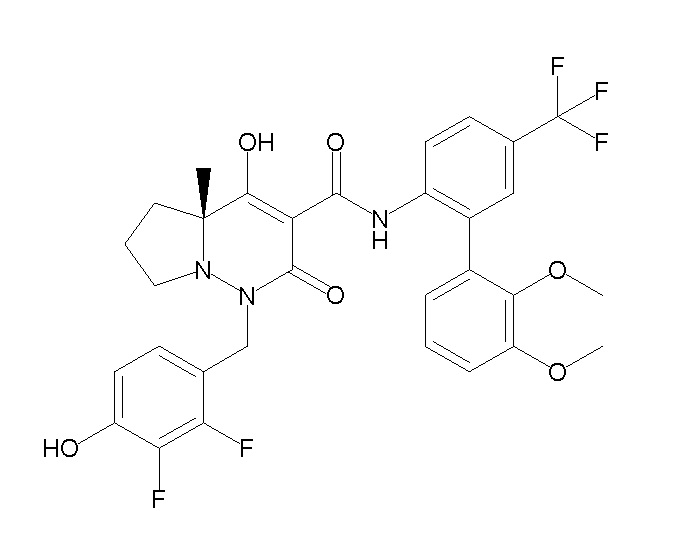
[1213] Для синтеза названного соединения использовали (4aR)-1-[2,3-(дифтор-4-йодфенил)метил]-N-[2-(2,3-диметоксифенил)-4-(трифторметил)фенил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 321) и проводили такие же операции, как в примере 324.
[1214] LCMS: м/z 634[M+H]+
Время удерживания при ВЭЖХ: 1,14 минут (условия проведения анализа SQD-FA05)
[1215] <Пример 326>
(4aR)-1-[(2,6-Дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1216]

[1217] Для синтеза названного соединения использовали (4aR)-1-[(2,6-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 322) и проводили такие же операции, как в примере 324.
[1218] LCMS: м/z 643[M+H]+
Время удерживания при ВЭЖХ: 1,12 минут (условия проведения анализа SQD-FA05)
[1219] <Пример 327>
(4aR)-1-[(2,3-Дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1220]
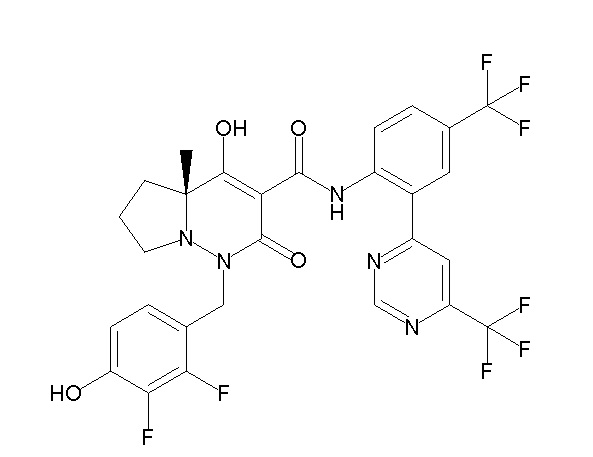
[1221] Для синтеза названного соединения использовали (4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид (пример 323) и проводили такие же операции, как в примере 324.
[1222] LCMS: м/z 644[M+H]+
Время удерживания при ВЭЖХ: 1,11 минут (условия проведения анализа SQD-FA05)
[1223] <Пример 328>
(4aR)-1-[(2,6-Дихлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[2-(трифторметил)-4-[6-(трифторметил)пиридин-3-ил]пиримидин-5-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1224]
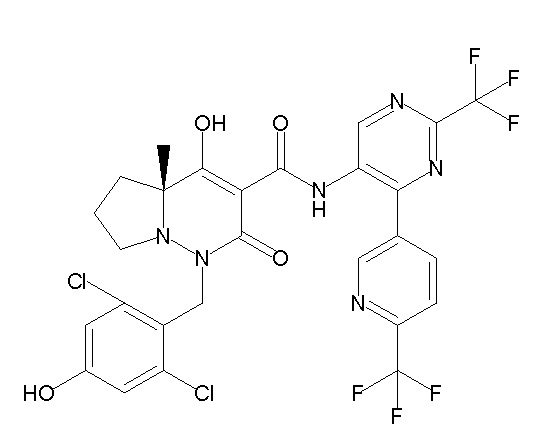
[1225] Первая стадия
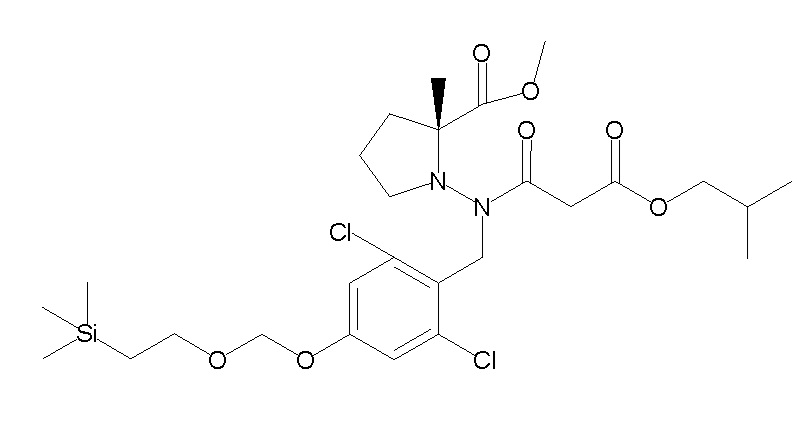
[1227] Метил (R)-2-метилпирролидин-2-карбоксилата гидрохлорид (20 г, 111 ммоль) суспендировали в дихлорметане (100 мл) и затем добавляли моногидрат п-толуолсульфоновой кислоты (25 г, 145 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 10 минут. Реакционную смесь концентрировали при пониженном давлении, добавляли толуол для азеотропного удаления, и затем остаток суспендировали в дихлорметане (250 мл), добавляли нитрит натрия (11,4 г, 165 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали и затем концентрировали при пониженном давлении с получением (S)-1-нитрозопирролидин-2-карбоновой кислоты метилового эфира в виде неочищенного продукта. Полученный неочищенный продукт (362 мг, 2,10 ммоль) растворяли в уксусной кислоте (10 мл) и метаноле (1,0 мл) и затем добавляли цинк (725 мг, 11,2 ммоль) при 9°C, и смесь перемешивали в атмосфере азота при 9°C в течение 1 часа. Затем реакционную смесь фильтровали через слой целита, фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли метанол (1,0 мл) и 2,4-дихлор-4-гидроксибензальдегид (200 мг, 1,05 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали и затем концентрировали при пониженном давлении и экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением метил (R)-1-((2,6-дихлор-4-гидроксибензилиден)амино)-2-метилпирролидин-2-карбоксилата. Полученный продукт (5,3 г, 16,0 ммоль) растворяли в ацетонитриле (50 мл) и затем добавляли 2-(хлорметокси)этилтриметилсилан (3,2 г, 19,2 ммоль) и карбонат цезия (6,3 г, 19,3 ммоль), и смесь перемешивали в атмосфере азота при 25°C в течение 24 часов. К реакционной смеси добавляли воду (100 мл) и три раза экстрагировали этилацетатом (100 мл). Органический слой промывали водой и солевым раствором и затем сушили над сульфатом натрия. Сульфат натрия отфильтровывали, и полученный органический слой концентрировали при пониженном давлении с получением неочищенного продукта метил (R)-1-((2,6-дихлор-4-((2-(триметилсилил)этокси)метокси)бензилиден)амино)-2-метил-пирролидин-2-карбоксилата в виде белого твердого вещества. Полученный неочищенный продукт использовали для получения метил (R)-1-N-(2,6-дихлор-4-((2-(триметилсилил)этокси)метокси)бензил)-3-изобутокси-3-оксопропанамид)-2-метилпирролидин-2-карбоксилата путем проведения первой и второй стадий справочного примера 1-1.
[1228] LCMS: м/z 461[M+H]+
Время удерживания при ВЭЖХ: 4,73 минут (условия проведения анализа Ph-SMD-TFA05)
[1229] Вторая стадия
[1230]
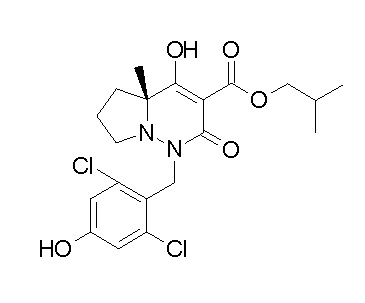
[1231] Метил (R)-1-(N-(2,6-дихлор-4-((2-(триметилсилил)-этокси)метокси)бензил)-3-изобутокси-3-оксопропанамид)-2-метил-пирролидин-2-карбоксилат (7,02 г, 11,6 ммоль) растворяли в дихлорметане (85 мл), добавляли трифторуксусную кислоту (35 мл), и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением метил (R)-1-N-(2,6-дихлор-4-гидроксибензил)-3-изобутокси-3-оксопропанамид)-2-метил-пирролидин-2-карбоксилата (5,0 г, 91%). Для получения (4aR)-1-[(2,6-дихлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропилового эфира использовали полученный метил (R)-1-N-(2,6-дихлор-4-гидроксибензил)-3-изобутокси-3-оксопропанамид)-2-метилпирролидин-2-карбоксилат (5,0 г, 10,5 ммоль) и проводили такие же операции, как на третьей стадии справочного примера 1-1.
[1232] LCMS: м/z 443[M+H]+
Время удерживания при ВЭЖХ: 1,32 минут (условия проведения анализа SMD-TFA05)
[1233] Третья стадия
Для получения названного соединения использовали (4aR)-1-[(2,6-дихлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир и 2-(трифторметил)-4-(6-(трифторметил)-пиридин-3-ил)пиримидин-5-амин (справочный пример 70) и проводили такие же операции, как в примере 21.
[1234] LCMS: м/z 677[M+H]+
Время удерживания при ВЭЖХ: 1,51 минут (условия проведения анализа SMD-TFA05)
[1235] <Пример 329>
(4aR)-1-[2,6-(-Дихлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[6-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]пиридин-3-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1236]
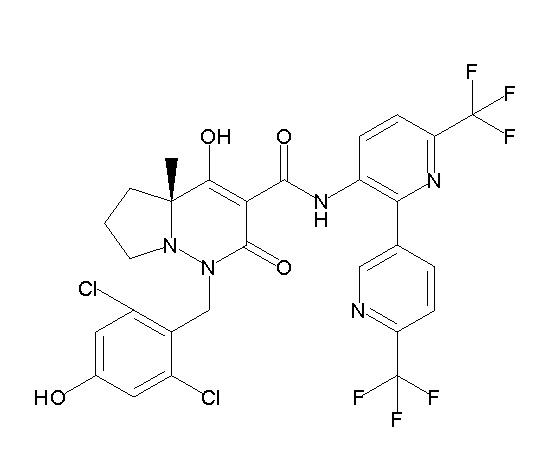
[1237] Для получения названного соединения использовали (4aR)-1-[(2,6-дихлор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоновой кислоты 2-метилпропиловый эфир (вторая стадия примера 328) и 6,6'-бис(трифторметил)-[2,3'-бипиридин]-3-амин (справочный пример 44) и проводили такие же операции, как на третьей стадии примера 328.
[1238] LCMS: м/z 676[M+H]+
Время удерживания при ВЭЖХ: 1,55 минут (условия проведения анализа SMD-TFA05)
[1239] <Пример 330>
(4aR)-1-[2,3-(Дифтор-4-гидроксифенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[2-(трифторметил)-4-[6-(трифторметил)пиридин-3-ил]пиримидин-5-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1240]
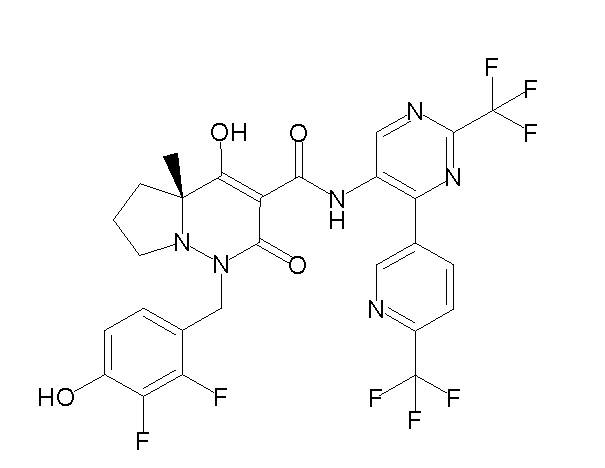
[1241] Первая стадия
[1242]
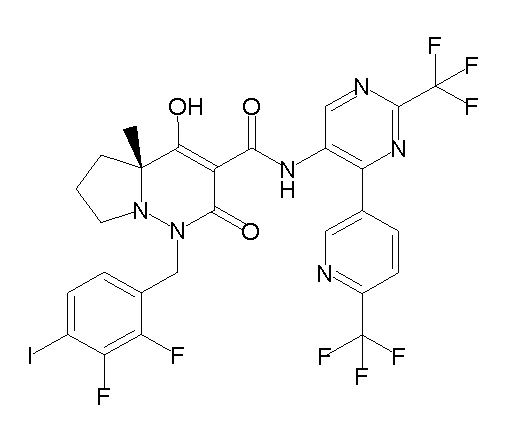
[1243] Для синтеза ((4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-N-[2-(трифторметил)-4-[6-(трифтор-метил)пиридин-3-ил]пиримидин-5-ил]-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамида использовали метил (4aR)-1-[(2,3-дифтор-4-йодфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксилат (третья стадия примера 319) и 2-(трифторметил)-4-(6-(трифторметил)пиридин-3-ил)-пиримидин-5-амин (справочный пример 70) и проводили такие же операции, как на четвертой стадии примера 319.
[1244] LCMS: м/z 755[M+H]+
Время удерживания при ВЭЖХ: 1,05 минут (условия проведения анализа SMD-TFA50)
[1245] Вторая стадия
Для синтеза названного соединения использовали йодидное производное, полученное на первой стадии, и проводили такие же операции, как в примере 324.
[1246] LCMS: м/z 645[M+H]+
Время удерживания при ВЭЖХ: 1,43 минут (условия проведения анализа SMD-TFA05)
[1247] <Пример 331>
(4aR)-N-(4-Бром-2-йодфенил)-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксамид
[1248]
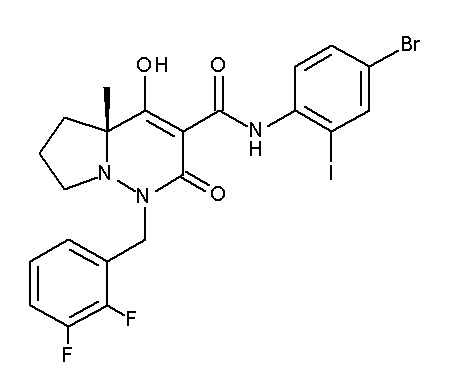
[1249] Первая стадия
[1250]
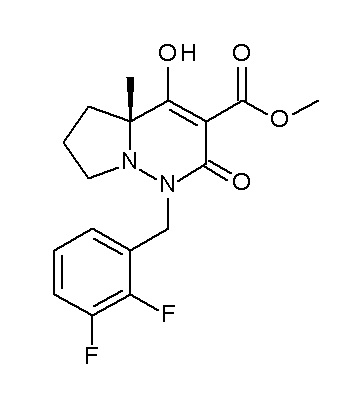
[1251] Для синтеза метил (4aR)-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксилата использовали (R)-2-метилпирролидин-2-карбоновой кислоты метилового эфира гидрохлорид и 2,3-дифторбензальдегид и проводили такие же операции, как на первой - третьей стадиях примера 319.
[1252] Вторая стадия
Для синтеза названного соединения использовали в качестве реагентов метил (4aR)-1-[(2,3-дифторфенил)метил]-4-гидрокси-4a-метил-2-оксо-6,7-дигидро-5H-пирроло[1,2-b]пиридазин-3-карбоксилат и 4-бром-2-йоданилин и проводили такие же операции, как в примере 21.
[1253] LCMS: м/z 618[M+H]+
Время удерживания при ВЭЖХ: 1,16 минут (условия проведения анализа SMD-TFA05)
[1254] <Справочный пример 104>
Метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]-этокси]фенил]метилиденамино]метиламино]циклобутан-1-карбоксилата гидрохлорид
[1255]
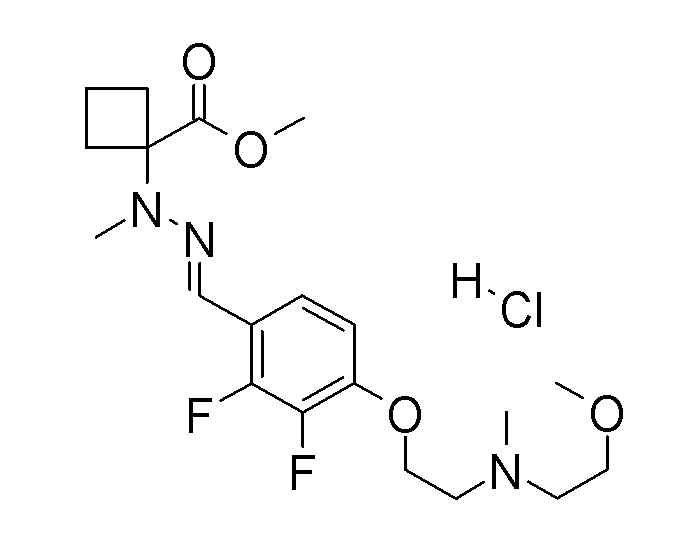
[1256] Метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метилиденамино]метиламино]циклобутан-1-карбоксилат (третья стадия примера 13) (300 мг, 0,726 ммоль) растворяли в 2-бутаноне (1,50 мл) и добавляли пиридина гидрохлорид (84,0 мг, 0,727 ммоль) при 25°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли гептан (1,50 мл) и кристаллы для затравки (1,00 мг, 0,00222 ммоль), и затем смесь перемешивали в течение 1 часа. К реакционной смеси добавляли гептан (3,00 мл), смесь перемешивали в течение 16 часов, и затем выпавшие в осадок кристаллы собирали фильтрацией с получением названного соединения (271 мг, 88%).
[1257] Температура плавления: 108°C
1H-ЯМР (DMSO-D6) δ: 10,32 (1H, ушир.с), 7,44 (1H, м), 7,29 (1H, с), 7,07 (1H, м), 4,49 (2H, т, J=4,4 Гц), 3,72 (2H, т, J=5,0 Гц), 3,63 (3H, с), 3,55-3,36 (4H, м), 3,44 (3H, с), 2,87 (3H, ушир.с), 2,80 (3H, с), 2,48 (4H, м), 1,93 (2H, м).
[1258] Кристаллы для затравки, использованные в справочном примере 104, получали следующим методом.
[1259] Метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метилиденамино]метиламино]циклобутан-1-карбоксилат (75,3 мг, 0,182 ммоль) растворяли в диметилсульфоксиде (0,317 мл) и добавляли 2M хлористоводородную кислоту (93,0 мкл, 0,186 ммоль). Полученный раствор (15,0 мкл) лиофилизировали, к полученному порошку добавляли 2-бутанон (15,0 мкл) и гептан (15,0 мкл) при 25°C, и смесь перемешивали в течение 4 дней с получением осадка.
[1260] <Справочный пример 105>
Метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метилиденамино]метиламино]циклопентан-1-карбоксилата гидрохлорид
[1261]
[1262] Метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метилиденамино]метиламино]циклопентан-1-карбоксилат (первая стадия примера 14) (300 мг, 0,702 ммоль) растворяли в 2-бутаноне (3,00 мл), добавляли пиридина гидрохлорид (81,0 мг, 0,701 ммоль) при 25°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли гептан (1,00 мл) и кристаллы для затравки (1,00 мг, 0,00215 ммоль), и затем смесь перемешивали в течение 1 часа. К реакционной смеси добавляли гептан (2,00 мл), затем смесь перемешивали в течение 2 часов, и выпавшие в осадок кристаллы собирали фильтрацией с получением названного соединения (225 мг, 69%).
[1263] Температура плавления: 97°C
1H-ЯМР (DMSO-D6) δ: 10,34 (1H, ушир.с), 7,44 (1H, м), 7,26 (1H, с), 7,08 (1H, м), 4,50 (2H, т, J=4,4 Гц), 3,72 (2H, т, J=5,0 Гц), 3,60 (3H, с), 3,55-3,44 (4H, м), 3,35 (3H, с)2,87 (3H, ушир.с), 2,85 (3H, с), 2,25 (2H, м), 2,14 (2H, м), 1,70 (4H, м).
[1264] Кристаллы для затравки, использованные в справочном примере 105, получали следующим методом.
[1265] Метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метилиденамино]метиламино]циклопентан-1-карбоксилат (50,0 мг, 0,117 ммоль) растворяли в 2-бутаноне (0,500 мл), добавляли пиридина гидрохлорид (15,0 мг, 0,130 ммоль) при 25°C, и смесь перемешивали в атмосфере азота в течение 30 минут. К реакционной смеси добавляли гептан (0,500 мл) и метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]-этокси]фенил]метилиденамино]метиламино]циклобутан-1-карбоксилата гидрохлорид (1,00 мг, 0,00222 ммоль), и смесь перемешивали в течение 1 часа. Выпавшие в осадок кристаллы собирали фильтрацией с получением осадка (36,6 мг).
[1266] <Пример 332>
4-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(триф-торметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]бутаноат
[1267]
[1268] Первая стадия
7-[(2,3-Дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-6,7-диазаспиро[4.5]дец-9-ен-9-карбоновой кислоты 2-метил-пропиловый эфир
[1269]
[1270] Для синтеза названного соединения использовали 2,3-дифтор-4-гидроксибензальдегид и метил 1-(метиламино)циклопентан-карбоксилата гидрохлорид (справочный пример 87) и такой же метод, как в справочном примере 1-1.
[1271] LCMS: м/z 411[M+H]+
[1272] Время удерживания при ВЭЖХ: 1,18 минут (SMD-TFA05)
[1273] Вторая стадия
[1274]
[1275] Для синтеза 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамида использовали 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-6,7-диазаспиро[4.5]дец-9-ен-9-карбоновой кислоты 2-метилпропиловый эфир и 4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]анилин (справочный пример 50) и ткой же метод, как в примере 21.
[1276] LCMS: м/z 658[M+H]+
[1277] Время удерживания при ВЭЖХ: 1,57 минут (SMD-TFA05)
[1278] Третья стадия
[1279]
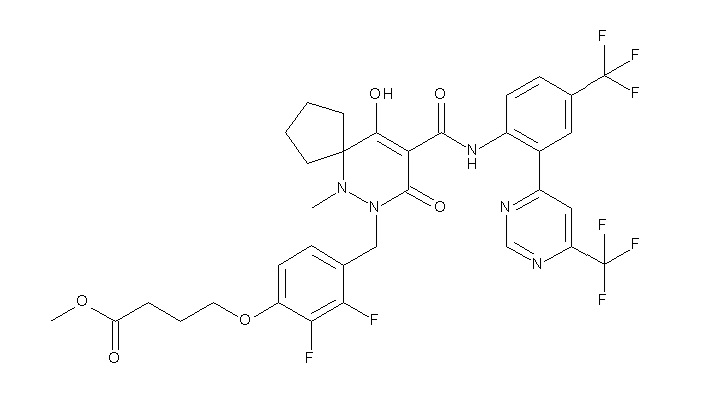
[1280] Карбонат цезия (20,4 мг, 0,113 ммоль) добавляли к раствору 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамида (24,7 мг, 0,038 ммоль) и метил 4-бромбутирата (24,48 мг, 0,075 ммоль) в ацетонитриле (0,4 мл), и смесь перемешивали при 70°C в течение 1 часа. Реакционную смесь охлаждали до 0°C, добавляли 1N водный раствор хлористоводородной кислоты (0,063 мл, 0,375 ммоль), и смесь перемешивали в течение 10 минут. Полученную смесь разбавляли N,N-диметилформамидом (0,6 мл) и очищали с помощью ВЭЖХ с получением метил 4-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]-фенокси]бутирата (10,6 мг, 37%).
[1281] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 758[M+H]+
[1282] Время удерживания при ВЭЖХ: 1,72 минут (SMD-FA05)
[1283] Четвертая стадия
Триметилсиланолат калия (5,38 мг, 0,042 ммоль) добавляли к раствору метил 4-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-бутирата (10,6 мг, 0,014 ммоль) в тетрагидрофуране (0,4 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Затем реакционную смесь концентрировали, разбавляли N,N-диметил- формамидом (0,6 мл) и очищали с помощью ВЭЖХ с получением названного соединения (6,2 мг, 60%).
[1284] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 744[M+H]+
[1285] Время удерживания при ВЭЖХ: 1,60 минут (SMD-FA05)
[1286] Для синтеза соединений, описанных в следующей таблице, в примерах 333 335 использовали соответствующие алкилбромиды и проводили такие же операции, как в примере 332.
[1287]
[1288] <Справочный пример 106>
6-[(2,3-Дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-5,6-диазаспиро[3.5]нон-8-ен-8-карбоновой кислоты 2-метил-пропиловый эфир
[1289]
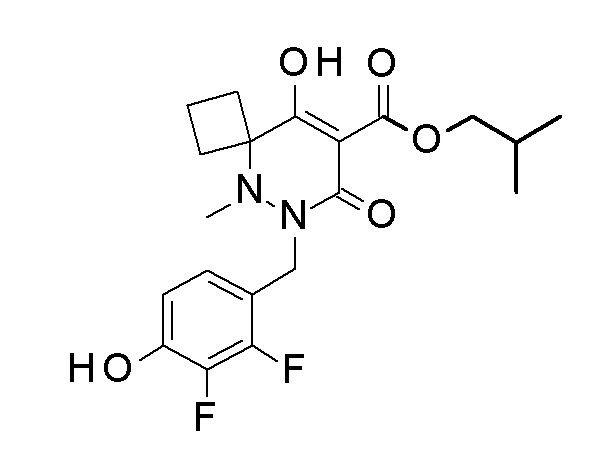
[1290] Для синтеза названного соединения использовали метил 1-(метиламино)циклобутанкарбоксилата гидрохлорид в качестве исходного материала (справочный пример 85) и такой же метод, как в примере 332.
[1291] LCMS: м/z 411[M+H]+
[1292] Время удерживания при ВЭЖХ: 1,18 минут (SMD-TFA05)
[1293] <Справочный пример 107>
6-[(2,3-Дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1294]
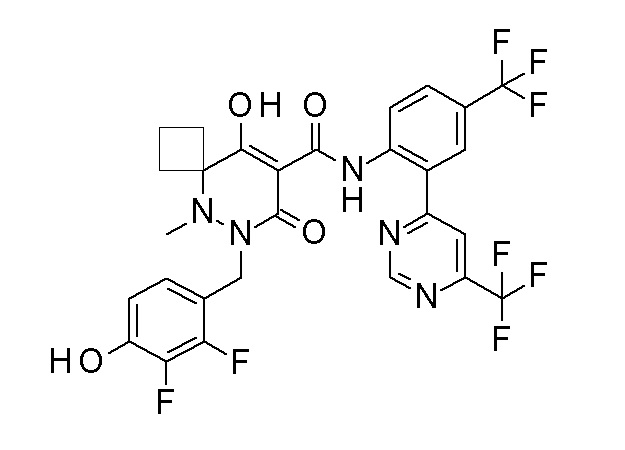
[1295] Для синтеза названного соединения использовали метил 1-(метиламино)циклобутан-1-карбоксилата гидрохлорид в качестве исходного материала и такой же метод, как в примере 332.
[1296] LCMS: м/z 658[M+H]+
[1297] Время удерживания при ВЭЖХ: 1,48 минут (SMD-TFA05)
[1298] <Пример 336>
8-[[2,3-Дифтор-4-(2-морфолин-2-оксо-этокси)фенил]метил]-5-гидрокси-9-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-8,9-диазаспиро[3.5]нон-5-ен-6-карбоксамид
[1299]
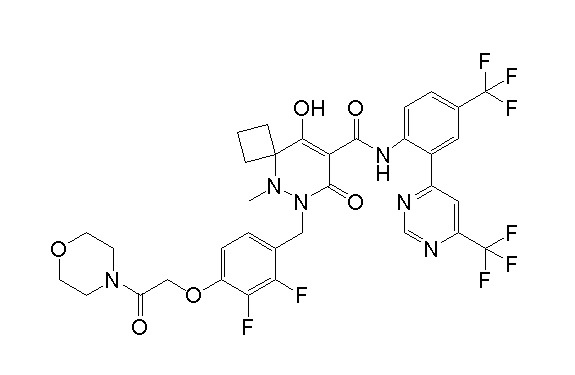
[1300] Названное соединение синтезировали из 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро-[3.5]нон-8-ен-8-карбоксамида и 2-хлор-1-морфолин-4-ил-этанона (Kapanda, Coco N. Journal of Medicinal Chemistry, 52 (22), 7310-7314; 2009) таким же методом, как на третьей стадии примера 322.
[1301] LCMS: м/z 771[M+H]+
[1302] Время удерживания при ВЭЖХ: 1,43 минут (условия проведения анализа SMD-TFA05)
[1303] <Пример 337>
8-[[2,3-Дифтор-4-[2-(2-оксоморфолин-4-ил)этокси]фенил]-метил]-5-гидрокси-9-метил-7-оксо-N-[4-(трифторметил)-2-[6-(три-фторметил)пиримидин-4-ил]фенил]-8,9-диазаспиро[3.5]нон-5-ен-6-карбоксамид
[1304]
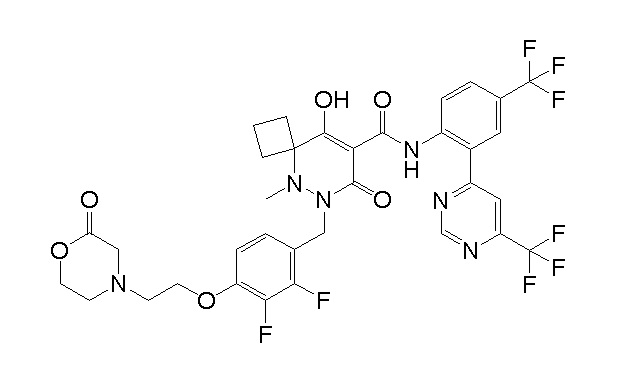
[1305] Названное соединение получали из 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро-[3.5]нон-8-ен-8-карбоксамида и 4-(2-гидроксиэтил)морфолин-2-она (Khromov-Borisov, N. V. и Remizov, A. L., Zhurnal Obshchei Khimii, 23, 598-605; 1953) путем проведения таких же операций, как в примере 407.
[1306] LCMS: м/z 771[M+H]+
[1307] Время удерживания при ВЭЖХ: 1,38 минут (условия проведения анализа SMD-TFA05)
[1308] <Справочный пример 108>
6-[[4-(2-Бромэтокси)-2,3-дифторфенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1309]
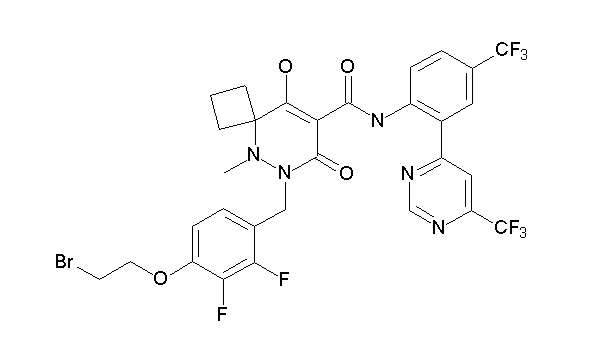
[1310] 6-[(2,3-Дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид (справочный пример 107) (3,00 г, 4,66 ммоль) растворяли в ацетоне (23,3 мл), затем добавляли 1,2-дибромэтан (6,85 мл, 79,0 ммоль) и карбонат калия (1,29 г, 9,32 ммоль), и смесь перемешивали в атмосфере азота при 60°C в течение 15 часов. К реакционной смеси добавляли 1N хлористоводородную кислоту при 0°C, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, водный слой отделяли с помощью фазового сепаратора, органический слой концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения (3,19 г, 91%).
[1311] LCMS: м/z 749[M+H]+
Время удерживания при ВЭЖХ: 1,58 минут (условия проведения анализа SMD-TFA05)
<Справочный пример 109>
7-[[4-(2-Бромэтокси)-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1312]
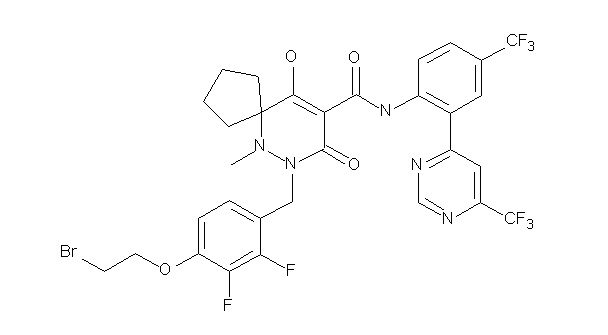
[1313] Названное соединение синтезировали из 7-[(2,3-дифтор-4-гидроксибензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифтор-метил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамида (пример 332) таким же методом, как в справочном примере 106.
[1314] LCMS: м/z 764[M+H]+
Время удерживания при ВЭЖХ: 1,62 минут (условия проведения анализа SMD-TFA05)
<Пример 338>
6-[[2,3-Дифтор-4-[2-[метил(оксолан-3-ил)амино]этокси]-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1315]
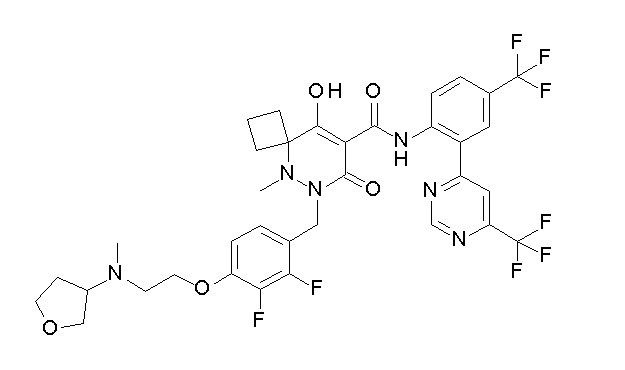
[1316] 6-[[4-(2-Бромэтокси)-2,3-дифторфенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид (10,0 мг, 13,0 мкмоль) и N-метилтетрагидрофуран-3-амин (2,70 мг, 27,0 мкмоль) растворяли в N,N-диметилформамиде (100 мкл), затем добавляли N-этил-N-изопропилпропан-2-амин (4,6 мкл, 27,0 мкмоль) и тетрабутиламмония йодид (0,5 мг, 1,33 мкмоль), и смесь перемешивали при 80°C в течение 1,5 часов. Реакционную смесь разбавляли N,N-диметилформамидом (0,5 мл) и очищали с помощью ВЭЖХ с получением названного соединения (8,0 мг, 78%).
[1317] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 771[M+H]+
Время удерживания при ВЭЖХ: 1,31 минут (условия проведения анализа SMD-TFA05)
[1318] <Примеры 339-380>
Для синтеза соединений, описанных в следующей таблице, использовали различные амины, которые описаны в литературе или производятся в промышленности, и проводили такие же операции, как в примере 338. Следует отметить, что если амин представлял собой гидрохлорид, то амин непосредственно не использовали в реакции, а использовали в реакции только после взаимодействия с йодистоводородной кислотой (57 масс.%, 2 эквивалента) и образования соответствующего гидройодида.
[1319] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм, 100 × 30 мм в.д., S - 5 мкм, 12 нм).
[1320]
[1321]
[1322]
[1323]
[1324]
[1325] <Пример 381>
(2S)-2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этиламино]бутандиоат
[1326]
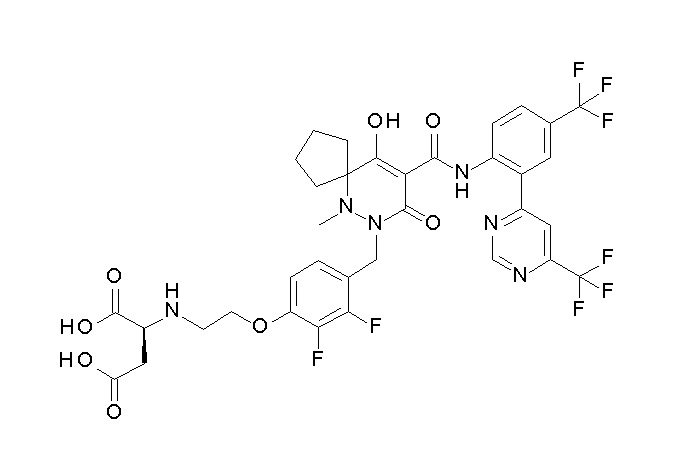
[1327] L-аспартата диметилового эфира гидрохлорид (142 мг, 0,72 ммоль) растворяли в метаноле (1,00 мл), добавляли йодистоводородную кислоту (57 масс.%, 95,0 мкл), и смесь перемешивали в течение 1 минуты. Затем реакционную смесь концентрировали при пониженном давлении, добавляли метанол и толуол для азеотропного удаления с получением L-аспартата диметилового эфира гидройодида в виде неочищенного продукта. Полученный гидройодид амина и 7-[[4-(2-бромэтокси)-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамид (110 мг, 0,14 ммоль) (справочный пример 109) растворяли в N,N-диметилформамиде (480 мкл), и затем добавляли фосфат калия (92,0 мг, 0,43 ммоль) и тетрабутиламмония йодид (5,3 мг, 14,0 мкмоль), и смесь перемешивали при 80°C в течение 2 часов. Затем реакционную смесь разбавляли тетрагидрофураном (480 мкл), добавляли триметилсиланолат калия (92,0 мг, 0,72 ммоль), и смесь перемешивали при 50°C в течение 30 минут и при 70°C в течение 2 часов. Реакционную смесь разбавляли муравьиной кислотой и водой и очищали с помощью ВЭЖХ с получением названного соединения (71,5 мг, 61%).
[1328] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (100 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 817[M+H]+
Время удерживания при ВЭЖХ: 1,32 минут (условия проведения анализа SMD-TFA05)
<Пример 382>
3-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этиламино]пентандиоат
[1329]
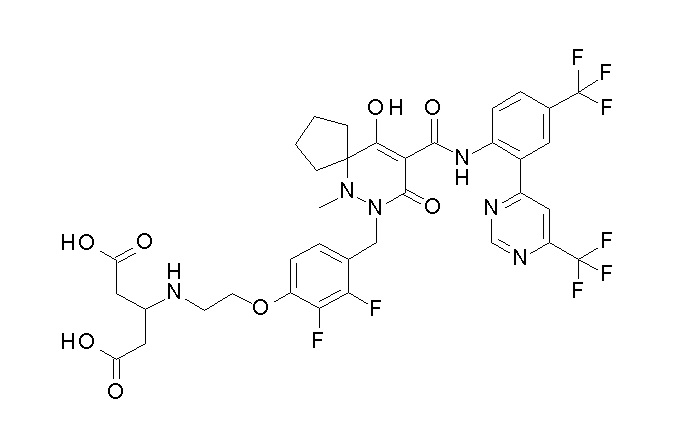
[1330] Первая стадия
[1331]
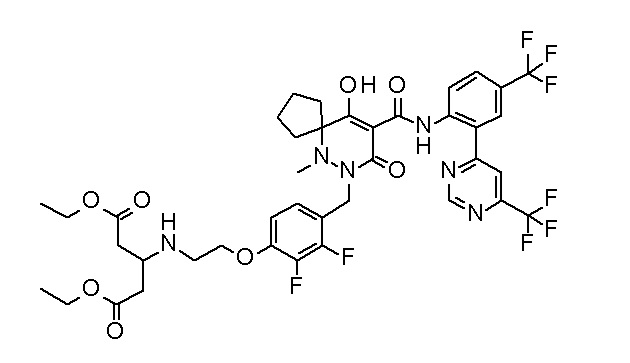
[1332] Для синтеза диэтил 3-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этиламино]пентандиоата использовали в качестве реагентов 7-[[4-(2-бромэтокси)-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (справочный пример 109) и диэтил 3-аминопентандиоат и проводили такие же операции, как в примере 337.
[1333] Вторая стадия
Диэтил 3-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этиламино]пентандиоат (48,0 мг, 54,0 мкмоль) растворяли в тетрагидрофуране (200 мкл), добавляли триметилсиланолат калия (34,7 мг, 0,27 ммоль), и смесь перемешивали при 50°C в течение 30 минут. Реакционную смесь разбавляли муравьиной кислотой и водой и очищали с помощью ВЭЖХ с получением названного соединения (32,4 мг, 72%).
[1334] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 831[M+H]+
Время удерживания при ВЭЖХ: 1,32 минут (условия проведения анализа SMD-TFA05)
[1335] <Пример 383>
6-[[4-[3-[(2R)-2,3-Дигидроксипропокси]пропокси]-2,3-дифтор-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1336]
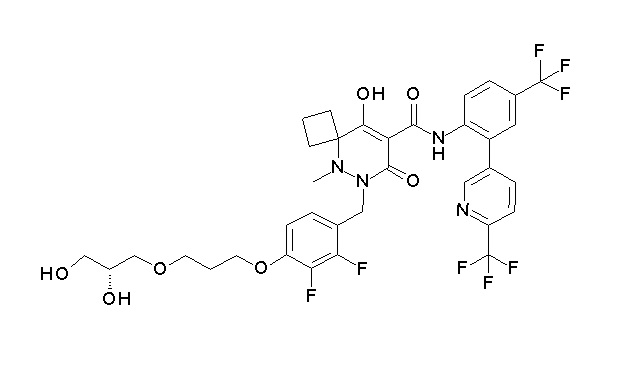
[1337] Первая стадия
[1338]
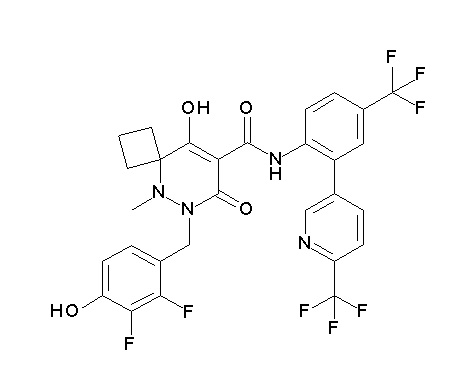
[1339] Для синтеза 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиридин-3-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамида использовали в качестве реагентов 6-[(2,3-дифтор-4-гидрокси-фенил)метил]-9-гидрокси-5-метил-7-оксо-5,6-диазаспиро[3.5]нон-8-ен-8-карбоновой кислоты 2-метилпропиловый эфир (справочный пример 106) и 4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]анилин (справочный пример 13) и проводили такие же операции, как на третьей стадии примера 149.
[1340] Вторая стадия
[1341]
[1342] (S)-3-((2,2-Диметил-1,3-диоксолан-4-ил)метокси)-пропан-1-ол (300 мг, 1,58 ммоль) и триэтиламин (0,33 мл, 2,37 ммоль) растворяли в тетрагидрофуране (7,88 мл), добавляли метансульфонилхлорид (0,15 мл, 1,89 ммоль) при 0°C, и смесь перемешивали при комнатной температуре в течение 3 часов. Затем к реакционной смеси добавляли 1N водный раствор гидрофосфата калия, и смесь экстрагировали этилацетатом, органический слой промывали насыщенным раствором бикарбоната натрия и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением 3-[[(4S)-2,2-диметил-1,3-диоксолан-4-ил]метокси]пропилметансульфоната (316 мг, 75%).
[1343] LCMS: м/z 269[M+H]+
Время удерживания при ВЭЖХ: 0,77 минут (условия проведения анализа SMD-TFA05)
[1344] Третья стадия
6-[(2,3-Дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид (15,0 мг, 23,0 мкмоль) и 3-[[(4S)-2,2-диметил-1,3-диоксолан-4-ил]метокси]пропилметан-сульфонат (8,77 мг, 33,0 мкмоль) растворяли в ацетонитриле (117 мкл), добавляли карбонат цезия (22,8 мг, 233 мкмоль), и смесь перемешивали при 75°C в течение 1,5 часов. Затем реакционную смесь охлаждали до комнатной температуры, добавляли водный раствор хлористоводородной кислоты (6N, 38,9 мкл, 233 мкмоль) и метанол (38,9 мкл), и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 6N водный раствор гидроксида натрия, и затем смесь фильтровали и концентрировали, разбавляли N,N-диметилформамидом (0,5 мл) и очищали с помощью ВЭЖХ с получением названного соединения (11,9 мг, 66%).
[1345] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (100 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 775[M+H]+
[1346] Время удерживания при ВЭЖХ: 1,40 минут (условия проведения анализа SMD-TFA05)
[1347] <Примеры 384-400>
Для синтеза соединений, описанных в следующей таблице, использовали бромид (2-[2-(3-бромпропокси)этокси]оксана, 2-[2-(4-бромбутокси)этокси]оксана, 2-[2-(5-бромпентокси)этокси]оксана, 2-[3-(3-бромпропокси)пропокси]оксана, 2-[3-(4-бромбутокси)-пропокси]оксана, 2-[3-(5-бромпентокси)пропокси]оксана, синтезированные таким же методом, как на первой стадии примера 147, путем использования спирта (2-(оксан-2-илокси)этанол, 3-(оксан-2-илокси)пропан-1-ол) и дибромида (1,3-дибромпропана, 1,4-дибромбутана, 1,5-дибромпентана), которые описаны в литературе или производятся промышленностью, и 3-[[(4S)-2,2-диметил-1,3-диоксолан-4-ил]метокси]пропилметансульфонат (пример 383), (S)-4-((4-бромбутокси)метил)-2,2-диметил-1,3-диоксолан (справочный пример 74) и (S)-4-(((5-бромпентил)окси)метил)-2,2-диметил-1,3-диоксолан (справочный пример 78), 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамид, синтезированный таким же методом, как на первой стадии примера 383, путем использования 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-6,7-диазаспиро[4.5]дец-9-ен-9-карбоновой кислоты 2-метилпропилового эфира (пример 332) и 4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]анилина (справочный пример 13), 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиридин-3-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамида (пример 383), 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамида (справочный пример 107) или 7-(2,3-дифтор-4-гидроксибензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамида (пример 332), и для синтеза соединений, описанных в следующей таблице, проводили такие же операции, как в примере 383.
[1348] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм, 100 × 30 мм в.д., S - 5 мкм, 12 нм)
[1349]
[1350]
[1351] <Пример 401>
6-[[2,3-Дифтор-4-[2-(2-метоксиэтокси)этокси]фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1352]

[1353] Названное соединение синтезировали из 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро-[3.5]нон-8-ен-8-карбоксамида (справочный пример 107) и 1-бром-2-(2-метоксиэтокси)этана таким же методом, как на третьей стадии справочного приметра 383.
[1354] LCMS: м/z 746[M+H]+
Время удерживания при ВЭЖХ: 1,66 минут (условия проведения анализа SMD-TFA05)
<Пример 402>
6-(2,3-Дифтор-4-(2-(метил(оксетан-3-ил)амино)этокси)-бензил)-9-гидрокси-5-метил-7-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
Первая стадия
[1355]
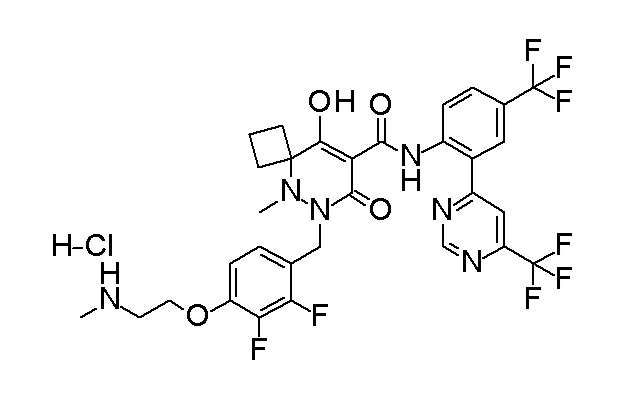
[1356] 6-(4-(2-Бромэтокси)-2,3-дифторбензил)-9-гидрокси-5-метил-7-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид (10,0 мг, 0,013 ммоль) (справочный пример 108) растворяли в 1,3-диметил-2-имидазолидиноне (100 мкл), и затем добавляли 2,0M раствор метиламина в тетрагидрофуране (400 мкл, 0,800 ммоль), N,N-диизопропилэтиламин (4,6 мкл, 0,027 ммоль), затем тетрабутил- аммония йодид (0,5 мг, 0,001 ммоль), и смесь перемешивали при 80°C в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, добавляли раствор 0,5M хлористоводородная кислота-метанол (80 мкл, 0,040 ммоль), и добавляли нормальный бутанол и толуол для азеотропного удаления с получением 6-(2,3-дифтор-4-(2-(метиламино)этокси)бензил)-9-гидрокси-5-метил-7-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)-фенил)-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамида гидрохлорида в виде неочищенного продукта.
[1357] LCMS: м/z 701[M+H]+
[1358] Время удерживания при ВЭЖХ: 1,27 минут (условия проведения анализа SMD-TFA05)
[1359] Вторая стадия
[1360]
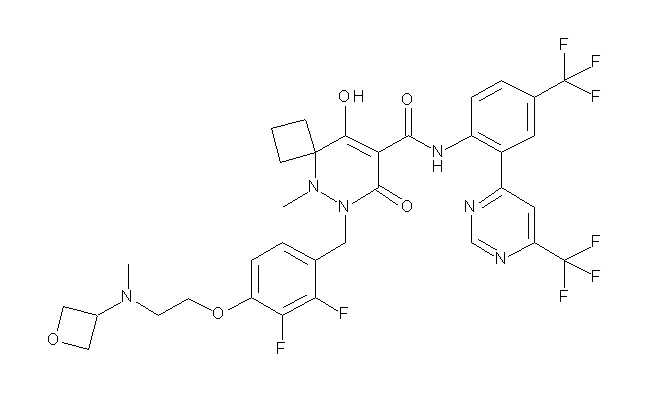
[1361] Неочищенный продукт 6-(2,3-дифтор-4-(2-(метиламино)этокси)бензил)-9-гидрокси-5-метил-7-оксо-N-(4-(три-фторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-5,6-диаза-спиро[3.5]нон-8-ен-8-карбоксамида гидрохлорида растворяли в 1,2-дихлорэтане (0,5 мл), затем добавляли оксетан-3-он (6,25 мкл, 0,104 ммоль), триацетоксиборгидрид натрия (16,5 мг, 0,078 ммоль) и уксусную кислоту (10 мкл, 0,175 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли дополнительные количества оксетан-3-она (6,25 мкл, 0,104 ммоль) и триацетоксиборгидрида натрия (16,5 мг, 0,078 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрировали и разбавляли N,N-диметил- формамидом, очищали с помощью ВЭЖХ с получением названного соединения (3,8 мг, выход за две стадии 39%).
[1362] LCMS: м/z 757[M+H]+
[1363] Время удерживания при ВЭЖХ: 1,25 минут (условия проведения анализа SMD-TFA05)
[1364] <Пример 403>
6-(2,3-Дифтор-4-(оксетан-3-илокси)бензил)-9-гидрокси-5-метил-7-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1365]
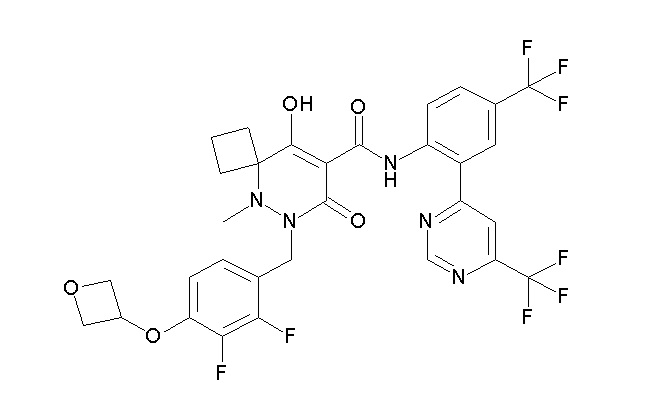
[1366] 6-[(2,3-Дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид (справочный пример 107) растворяли в ацетонитриле (200 мкл), затем добавляли оксетан-3-ил 4-метилбензолсульфонат (14,2 мг, 0,062 ммоль) и карбонат цезия (30,4 мг, 0,093 ммоль), и смесь перемешивали при 80°C в течение ночи. Затем реакционную смесь N,N-диметил- формамидом и водой, очищали с помощью ВЭЖХ с получением названного соединения (14,1 мг, 65%).
[1367] LCMS: м/z 700[M+H]+
[1368] Время удерживания при ВЭЖХ: 1,62 минут (условия проведения анализа SMD-TFA05)
[1369] <Пример 404>
6-[[2,3-Дифтор-4-[[(2S)-1-(2-метоксиэтил)пирролидин-2-ил]метокси]фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1370]
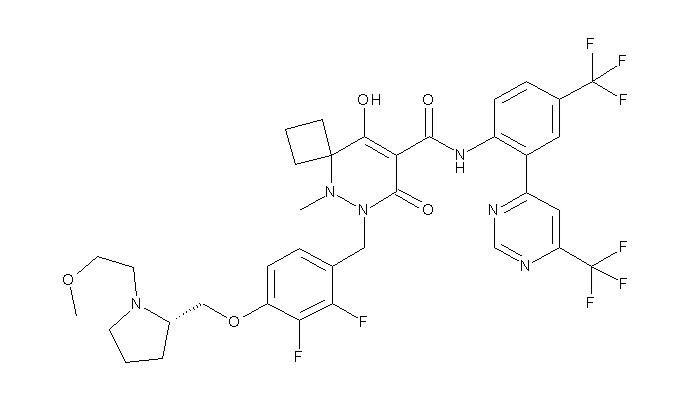
[1371] Первая стадия
[1372]
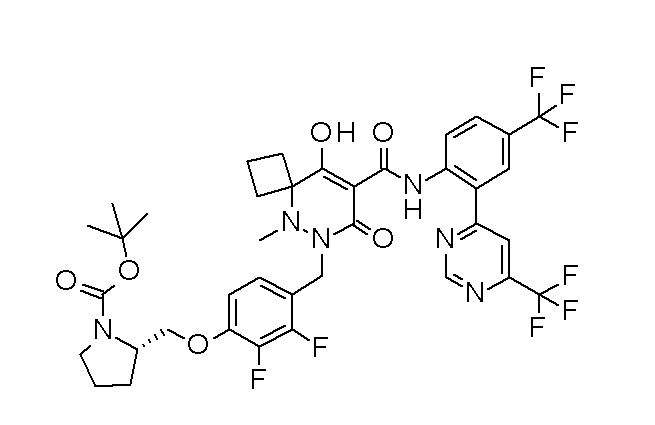
[1373] 6-[(2,3-Дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид (справочный пример 107) (100 мг, 0,16 ммоль) и (S)-третбутил 2-(гидроксиметил)пирролидин-1-карбоксилат (62,6 мг, 0,31 ммоль) растворяли в тетрагидрофуране (311 мкл), затем добавляли N,N,N',N'-тетраметилазодикарбоксамид (53,5 мг, 0,31 ммоль), и смесь перемешивали при 70°C в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением третбутил (2S)-2-[[2,3-дифтор-4-[[9-гидрокси-5-метил-7-оксо-8-[[4-(трифторметил)-2-[6-(трифтор-метил)пиримидин-4-ил]фенил]карбамоил]-5,6-диазаспиро[3.5]нон-8-ен-6-ил]метил]фенокси]метил]пирролидин-1-карбоксилата (115 мг, 90%).
[1374] LCMS: м/z 827[M+H]+
Время удерживания при ВЭЖХ: 1,68 минут (условия проведения анализа SMD-TFA05)
[1375] Вторая стадия
[1376]
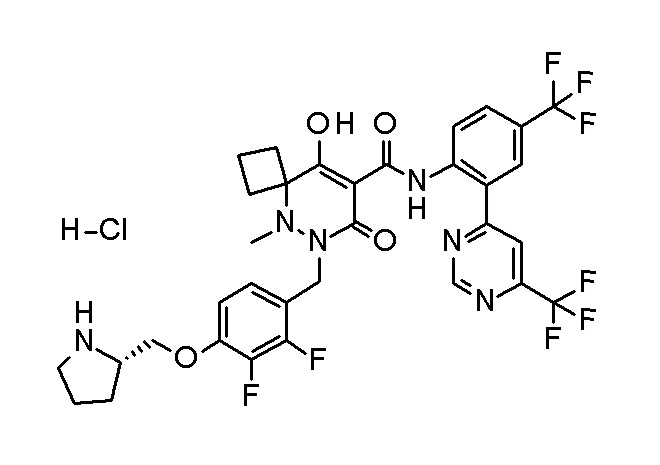
[1377] Хлористоводородную кислоту (диоксановый раствор, 4N, 1,00 мл, 4,00 ммоль) добавляли к третбутил (2S)-2-[[2,3-дифтор-4-[[9-гидрокси-5-метил-7-оксо-8-[[4-(трифторметил)-2-[6-(три-фторметил)пиримидин-4-ил]фенил]карбамоил]-5,6-диазаспиро[3.5]-нон-8-ен-6-ил]метил]фенокси]метил]пирролидин-1-карбоксилат (104 мг, 0,13 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрировали при пониженном давлении, добавляли толуол для азеотропного удаления с получением (S)-6-(2,3-дифтор-4-(пирролидин-2-илметокси)-бензил)-9-гидрокси-5-метил-7-оксо-N-(4-(трифторметил)-2-(6-(три-фторметил)пиримидин-4-ил)фенил)-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамида гидрохлорида (96 мг, 100%).
[1378] LCMS: м/z 727[M+H]+
Время удерживания при ВЭЖХ: 1,27 минут (условия проведения анализа SMD-TFA05)
Третья стадия
(S)-6-(2,3-Дифтор-4-(пирролидин-2-илметокси)бензил)-9-гидрокси-5-метил-7-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)-пиримидин-4-ил)фенил)-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамида гидрохлорид (10,0 мг, 13,0 мкмоль) и 1-бром-2-метоксиэтан (3,64 мг, 26,0 мкмоль) растворяли в N,N-диметилформамиде (100 мкл), затем добавляли N-этил-N-изопропилпропан-2-амин (6,9 мкл, 39,0 мкмоль) и тетрабутиламмония йодид (0,5 мг, 1,31 мкмоль), и смесь перемешивали при 80°C в течение 1,5 часов. Реакционную смесь разбавляли N,N-диметилформамидом (0,5 мл) и очищали с помощью ВЭЖХ с получением названного соединения (3,2 мг, 31%).
[1379] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 785[M+H]+
Время удерживания при ВЭЖХ: 1,32 минут (условия проведения анализа SMD-TFA05)
<Пример 405>
6-[[2,3-Дифтор-4-[(3R)-1-(2-метоксиэтил)пирролидин-3-ил]оксифенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро-[3.5]нон-8-ен-8-карбоксамид
[1380]
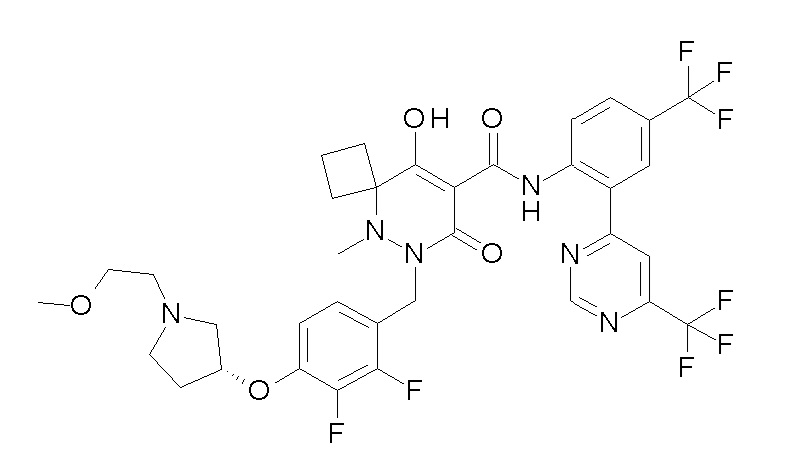
[1381] Названное соединение синтезировали из 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро-[3.5]нон-8-ен-8-карбоксамида (справочный пример 107) и (S)-третбутил 3-гидроксипирролидин-1-карбоксилата таким же методом, как на первой - третьей стадиях примера 404.
[1382] LCMS: м/z 771[M+H]+
Время удерживания при ВЭЖХ: 1,30 минут (условия проведения анализа SMD-TFA05)
<Пример 406>
6-[[2,3-Дифтор-4-[1-(2-метоксиэтил)азетидин-3-ил]окси-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1383]
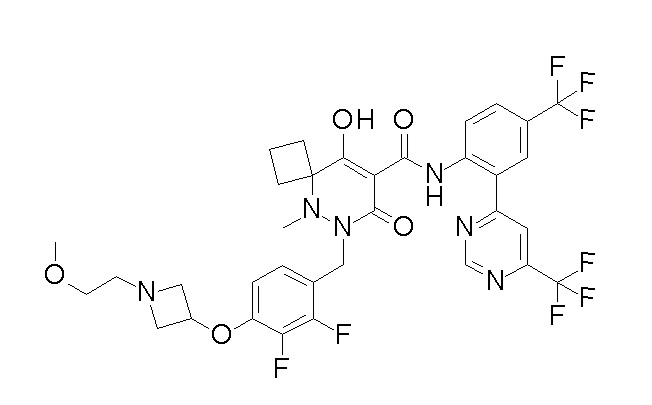
[1384] Названное соединение синтезировали из 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро-[3.5]нон-8-ен-8-карбоксамида (справочный пример 107) и третбутил 3-гидроксиазетидин-1-карбоксилата таким же методом, как на первой - третьей стадиях примера 404.
[1385] LCMS: м/z 756[M+H]+
Время удерживания при ВЭЖХ: 1,33 минут (условия проведения анализа SMD-TFA05)
<Пример 407>
6-[[2,3-Дифтор-4-(2-метил-1-морфолин-4-илпропан-2-ил)окси-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1386]
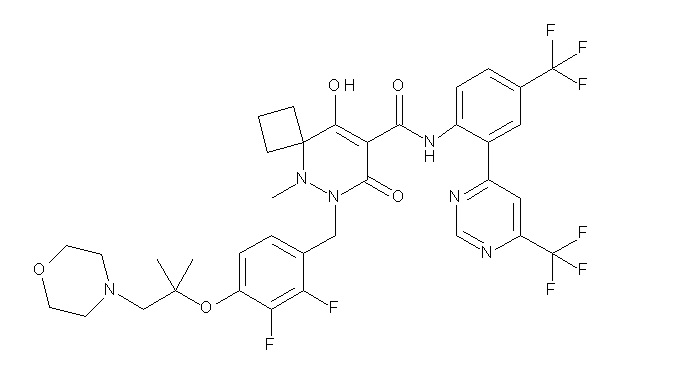
[1387] Тетрагидрофурановый раствор (1M) (0,109 мл, 0,109 ммоль) триметилфосфина добавляли в течение 30 секунд к раствору 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамида (10 мг, 0,016 ммоль), 2-метил-2-морфолинопропан-1-ола (17 мг, 0,106 ммоль) и N,N,N',N'-тетраметилазодикарбоксамида (18,7 мг, 0,106 ммоль) в тетрагидрофуране (0,3 мл) при нагревании до 60°C. Реакционную смесь перемешивали при 60°C в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры, продували через нее азот для удаления растворителя. Остаток растворяли в диметилформамиде и муравьиной кислоте и очищали с помощью ВЭЖХ (0,1% муравьиная кислота вода/0,1% муравьиная кислота ацетонитрил) с получением названного соединения (4,3 мг, 34%).
[1388] LCMS: м/z 785[M+H]+
[1389] Время удерживания при ВЭЖХ: 1,30 минут (SMD-TFA05)
[1390] <Примеры 408-411>
Для синтеза соединений, описанных в следующей таблице, использовали соответствующие алкиловые спирты и проводили такие же операции, как в примере 407.
[1391]
[1392] <Пример 412>
7-(2,3-Дифтор-4-(2-(метил(оксетан-3-ил)амино)этокси)-бензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
Первая стадия
[1393]
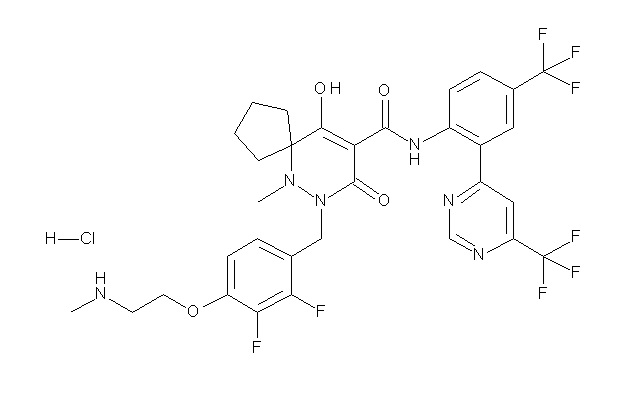
[1394] Для получения неочищенного продукта 7-(2,3-дифтор-4-(2-(метиламино)этокси)бензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид гидрохлорида использовали 7-[[4-(2-бромэтокси)-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]-фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (20,0 мг, 0,026 ммоль) (справочный пример 109) и проводили такие же операции, как на первой стадии примера 402.
[1395] LCMS: м/z 715[M+H]+
[1396] Время удерживания при ВЭЖХ: 1,29 минут (условия проведения анализа SMD-TFA05)
[1397] Вторая стадия
[1398]
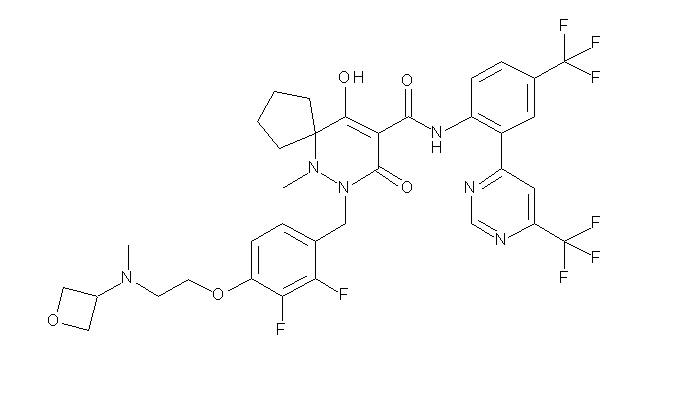
[1399] Для получения названного соединения (11,3 мг, выход за две стадии 56%) использовали 7-(2,3-дифтор-4-(2-(метиламино)этокси)бензил)-10-гидрокси-6-метил-8-оксо-N-(4-(три-фторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диаза-спиро[4.5]дец-9-ен-9-карбоксамида гидрохлорид и проводили такие же операции, как на второй стадии примера 402.
[1400] LCMS: м/z 771[M+H]+
[1401] Время удерживания при ВЭЖХ: 1,19 минут (условия проведения анализа SMD-TFA05)
[1402]1H-ЯМР (DMSO-D6) δ: 12,72 (1H, с), 9,59 (1H, с), 8,56 (1H, с), 8,42 (1H, д, J=8,8 Гц), 8,24 (1H, с), 7,97 (1H, д, J=7,3 Гц), 7,16 (1H, т, J=7,3 Гц), 7,04 (1H, т, J=7,6 Гц), 5,07 (1H, д, J=13,7 Гц), 4,52 (2H, т, J=6,6 Гц), 4,41 (2H, т, J=6,1 Гц), 4,16 (3H, т, J=5,4 Гц), 3,66 (1H, кв., J=6,5 Гц), 2,67 (2H, т, J=5,4 Гц), 2,46 (3H, с), 2,18 (3H, с), 2,01 (1H, м), 1,59 (3H, м), 1,27 (3H, м), 1,07 (1H, м).
[1403] <Пример 413>
6-[[2,3-Дифтор-4-[1-(2-метоксиэтил)азетидин-3-ил]окси-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1404]
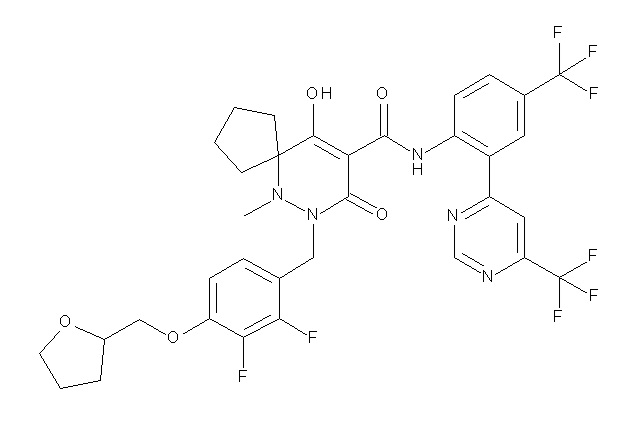
[1405] Названное соединение синтезировали из 6-[(2,3-дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро-[3.5]нон-8-ен-8-карбоксамида (справочный пример 107) и 2-(хлорметил)тетрагидрофурана таким же методом, как на третьей стадии примера 383.
[1406] LCMS: м/z 742[M+H]+
Время удерживания при ВЭЖХ: 1,61 минут (условия проведения анализа SMD-TFA05)
<Пример 414>
7-(4-(3-(Диметиламино)-2,2-диметилпропокси)-2,3-дифтор-бензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1407]
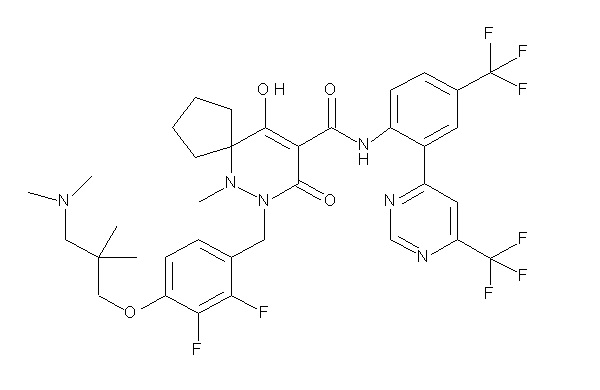
[1408] Названное соединение синтезировали из 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамида и 3-(диметиламино)-2,2-диметил-пропан-1-ола таким же методом, как в примере 407.
[1409] LCMS: м/z 771[M+H]+
[1410] Время удерживания при ВЭЖХ: 1,25 минут (условия проведения анализа SQD-FA05)
[1411]1H-ЯМР (CDCl3) δ: 16,47 (1H, с), 12,87 (1H, с), 9,60 (1H, с), 8,47 (1H, д, J=8,4 Гц), 7,95 (1H, с), 7,93 (1H, с), 7,79 (1H, д, J=8,4 Гц), 6,99 (1H, м), 6,72 (1H, м), 5,04 (1H, д, J=14,4 Гц), 4,4,19 (1H, д, J=14,4 Гц), 3,80 (2H, с), 2,48 (3H, с), 2,43-2,36 (8H, м), 1,85-1,32 (10H, м), 1,02 (6H, с).
[1412] <Пример 415>
1-(2-(2,3-Дифтор-4-((10-гидрокси-6-метил-8-оксо-9-((4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-карбамоил)-6,7-диазаспиро[4.5]дец-9-ен-7-ил)метил)фенокси)этил)-1,4-диазабицикло[2,2,2]октан-1-ия формиат
[1413]
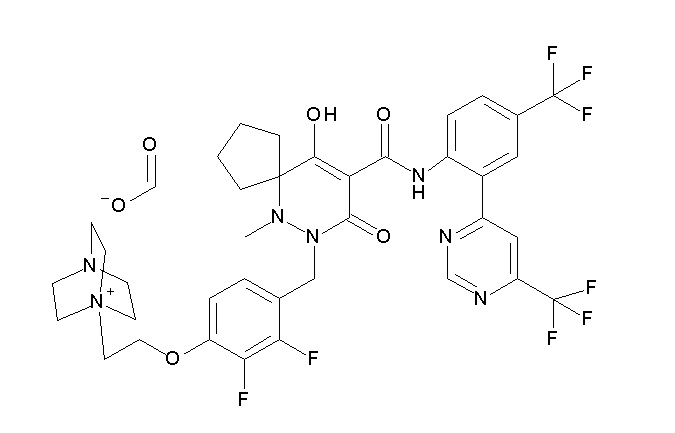
[1414] Первая стадия
[1415]
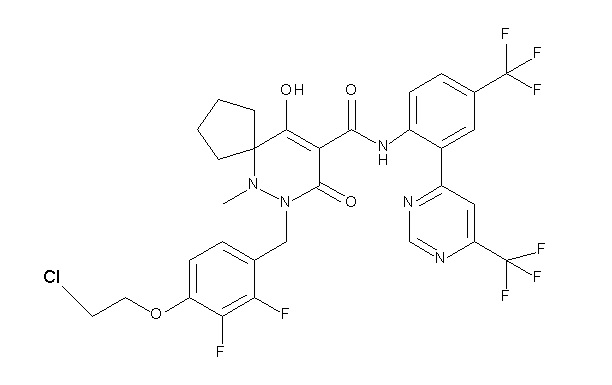
[1416] Раствор 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-6,7-диазаспиро[4.5]дец-9-ен-9-карбоновой кислоты 2-метилпропилового эфира, 4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]анилина (100 мг, 0,152 ммоль), 1,2-дихлорэтана (151 мг, 1,52 ммоль) и карбоната калия (42 мг, 0,304 ммоль) в N,N-диметилформамиде (1,01 мл) нагревали при 60°C в течение 18 часов. Остаток растворяли в N,N-диметилформамиде и муравьиной кислоте, и реакционную смесь очищали колоночной хроматографией на силикагеле с обращенной фазой С-18 (0,1% муравьиная кислота вода/0,1% муравьиная кислота ацетонитрил) с получением 7-(4-(2-хлорэтокси)-2,3-дифторбензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамида (91 мг, 83%).
[1417] LCMS: м/z 720[M+H]+
[1418] Время удерживания при ВЭЖХ: 1,697 минут (SMD-TFA05)
[1419] Вторая стадия
Раствор 7-(4-(2-хлорэтокси)-2,3-дифторбензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамида (93 мг, 0,126 ммоль), 1,4-диазабицикло[2,2,2]октана (142 мг, 1,26 ммоль) и карбоната калия (175 мг, 1,26 ммоль) в ацетоне (3,16 мл) перемешивали при 60°C в течение 4 дней. Затем реакционную смесь охлаждали до комнатной температуры, продували через нее газообразный азот для удаления растворителя. Остаток растворяли в N,N-диметилформамиде и муравьиной кислоте и очищали с помощью ВЭЖХ (0,1% муравьиная кислота вода/0,1% муравьиная кислота ацетонитрил) с получением названного соединения (78 мг, 73%).
[1420] LCMS: м/z 796[M]+
[1421] Время удерживания при ВЭЖХ: 1,05 минут (условия проведения анализа SQD-FA05)
[1422] <Пример 416>
6-[[2,3-Дифтор-4-[1-(2-метоксиэтил)азетидин-3-ил]окси-фенил]метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид
[1423]
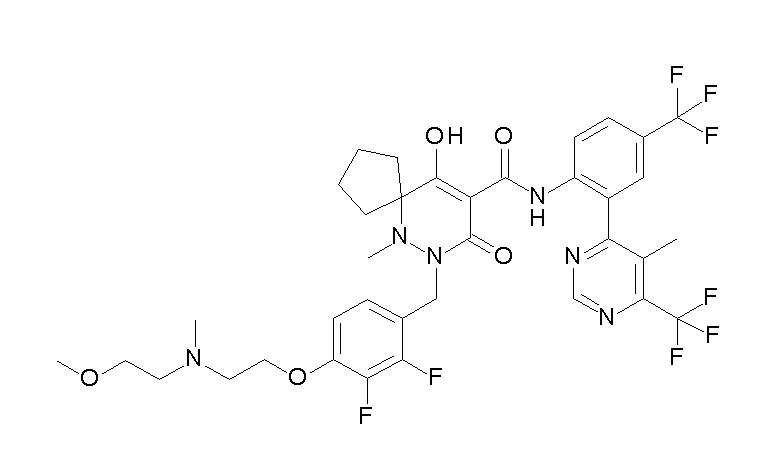
[1424] Первая стадия
[1425]
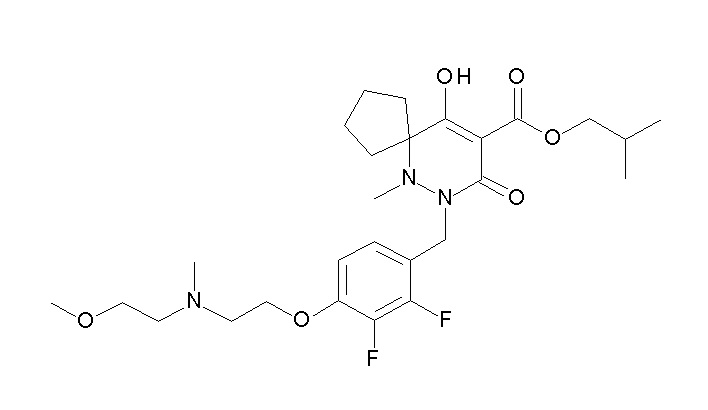
[1426] 7-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]-этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоновой кислоты 2-метилпропиловый эфир синтезировали из метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]фенил]метилиденамино]метиламино]-циклопентан-1-карбоксилата гидрохлорида (справочный пример 105) таким же методом, как на четвертой стадии примера 237.
[1427] LCMS: м/z 540[M+H]+
Время удерживания при ВЭЖХ: 1,11 минут (условия проведения анализа SMD-TFA05)
[1428] Вторая стадия
Названное соединение синтезировали из 7-[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-6,7-диазаспиро[4.5]дец-9-ен-9-карбоновой кислоты 2-метилпропилового эфира и 2-(5-метил-6-(трифторметил)пиримидин-4-ил)-4-(трифторметил)анилина (справочный пример 96) таким же методом, как на пятой стадии примера 237.
[1429] LCMS: м/z 787[M+H]+
Время удерживания при ВЭЖХ: 1,41 минут (условия проведения анализа SMD-TFA05)
[1430] <Пример 417>
7-(2,3-Дифтор-4-((2-((2-метоксиэтил)(метил)амино)этил)-амино)бензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1431]
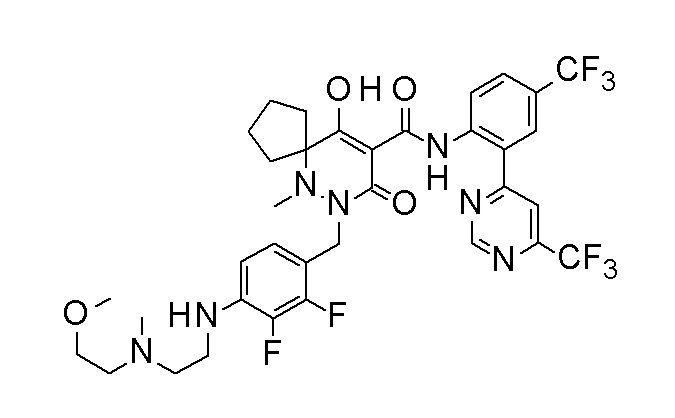
[1432] Первая стадия
[1433]
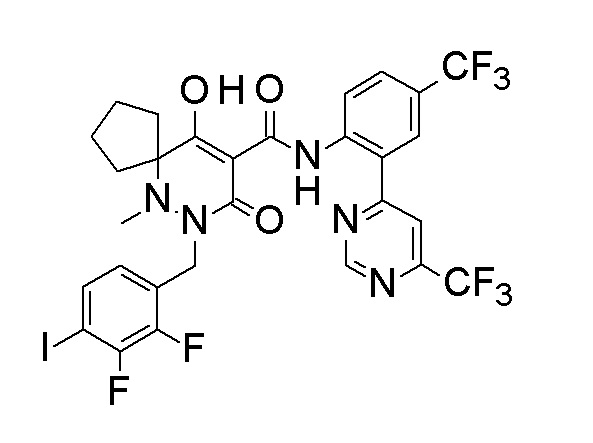
[1434] Для синтеза названного соединения (2,69 г, выход за три стадии 69%) использовали 2,3-дифтор-4-йодбензальдегид и метил 1-(метиламино)циклопентанкарбоксилата гидрохлорид и проводили такие же операции, как на третьей - пятой стадиях примера 13.
[1435] LCMS: м/z 768[M+H]+
Время удерживания при ВЭЖХ: 0,99 минут (условия проведения анализа SQD-FA50)
[1436] Вторая стадия
[1437]
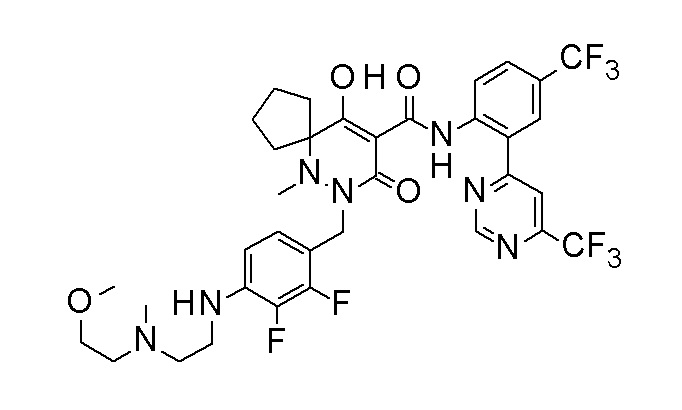
[1438] Диметилсульфоксид (1,07 мл) добавляли к смеси 7-(2,3-дифтор-4-йодбензил)-10-гидрокси-6-метил-8-оксо-N-(4-(трифтор-метил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамида (205 мг, 0,267 ммоль), йодида меди(I) (10,2 мг, 0,053 ммоль), 2-((2,6-диметилфенил)амино)-2-оксоацетата (20,6 мг, 0,107 ммоль), фосфата калия (284 мг, 1,336 ммоль) и N1-(2-метоксиэтил)-N1-метилэтан-1,2-диамина (70,6 мг, 0,534 ммоль), и смесь перемешивали в атмосфере азота при 90°C в течение 5 часов. К реакционной смеси добавляли водный аммиак, и смесь экстрагировали этилацетатом. Остаток очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (210 мг, 95%).
[1439] LCMS: м/z 772[M+H]+
Время удерживания при ВЭЖХ: 0,83 минут (условия проведения анализа SQD-FA05)
[1440] <Пример 418>
7-[[2,3-Дифтор-4-[4-[метил-[(2S,3R,4R,5R)-2,3,4,5,6-пента-гидроксигексил]амино]-4-оксобутокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1441]
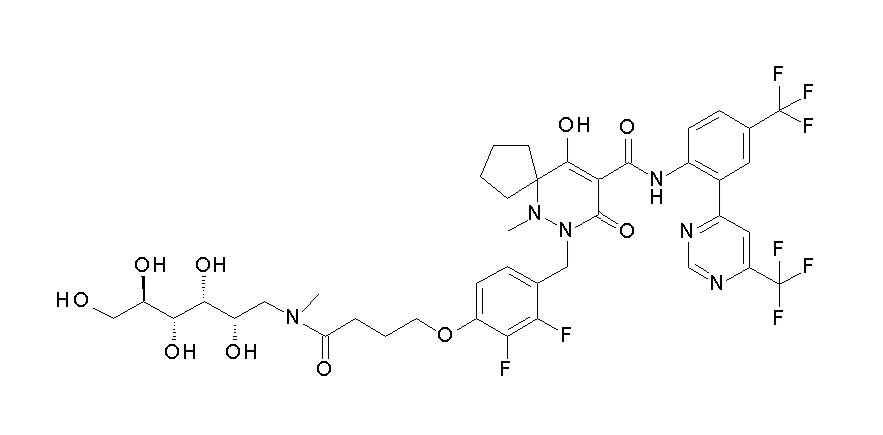
[1442] 4-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-бутаноат (40 мг, 0,054 ммоль) (пример 332) растворяли в N,N-диметилформамиде (1 мл), затем добавляли (2R,3R,4R,5S)-6-(метиламино)гексан-1,2,3,4,5-пентол (31,5 мг, 0,161 ммоль), HATU (40,9 мг, 0,108 ммоль) и N-этил-N-изопропилпропан-2-амин (20,86 мг, 0,161 ммоль), и смесь перемешивали при комнатной температуре в течение 15 часов. К реакционной смеси добавляли воду (0,2 мл) и очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (32 мг, 65%) в виде белого аморфного твердого вещества.
[1443] LCMS: м/z 921[M+H]+
[1444] Время удерживания при ВЭЖХ: 1,01 минут (условия проведения анализа SQD-FA05)
[1445] <Пример 419>
7-[[4-[2-[2-(2,3-Дигидроксипропиламино)этокси]этокси]-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамид
[1446]
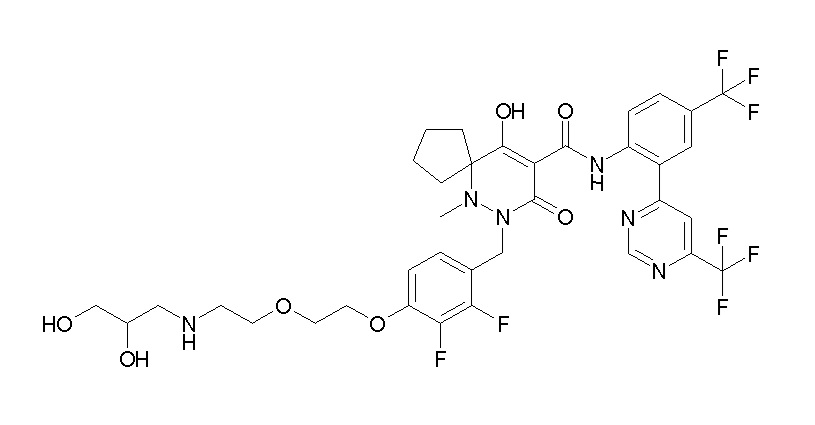
[1447] Первая стадия
2-[2-(4-Метилфенил)сульфонилоксиэтокси]этил 4-метилбензол-сульфонат
[1448]
[1449] 2,2'-Оксидиэтанол (200 мг, 1,9 ммоль) и триэтиламин (572 мг, 5,65 ммоль) растворяли в дихлорметане (10 мл), затем добавляли тозилхлорид (898 мг, 4,7 mol), и смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь очищали хроматографией на силикагеле (гексан:этилацетат = 2:1) с получением названного соединения (620 мг, 79%) в форме кристаллов в виде белых пластинок.
[1450] LCMS: м/z 415[M+H]+
[1451] Время удерживания при ВЭЖХ: 0,88 минут (условия проведения анализа SQD-FA05)
[1452] Вторая стадия
2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(три-фторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этокси]этил 4-метилбензолсульфонат
[1453]
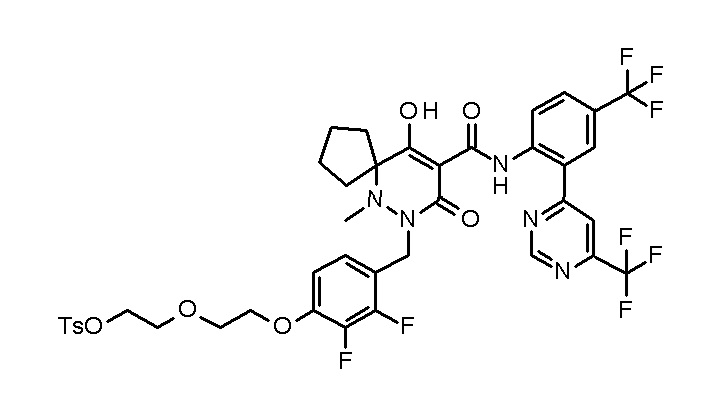
[1454] 7-[(2,3-Дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (100 мг, 0,152 ммоль) растворяли в ацетонитриле (5 мл), затем добавляли оксибис(этан-2,1-диил)бис(4-метилбензолсульфонат), полученный на первой стадии (252 мг, 0,61 ммоль), и карбонат цезия (49,6 мг, 0,152 ммоль), и смесь перемешивали при 50°C в течение 4 часов. Реакционную смесь очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (115 мг, 84%) в виде белого аморфного твердого вещества.
[1455] LCMS: м/z 900[M+H]+
[1456] Время удерживания при ВЭЖХ: 1,25 минут (условия проведения анализа SQD-FA05)
[1457] Третья стадия
2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(три-фторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этокси]этил 4-метилбензолсульфонат, полученный на второй стадии (30 мг, 0,033 ммоль), и 3-аминопропан-1,2-диол (9,11 мг, 0,1 ммоль) растворяли в ацетонитриле (1 мл), и смесь перемешивали при 50°C в течение 5 часов. Реакционную смесь очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (18 мг, 66%) в виде белого аморфного твердого вещества.
[1458] LCMS: м/z 819[M+H]+
[1459] Время удерживания при ВЭЖХ: 0,82 минут (условия проведения анализа SQD-FA05)
[1460] <Пример 420>
7-[[2,3-Дифтор-4-[2-[2-[метил-[(2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексил]амино]этокси]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1461]
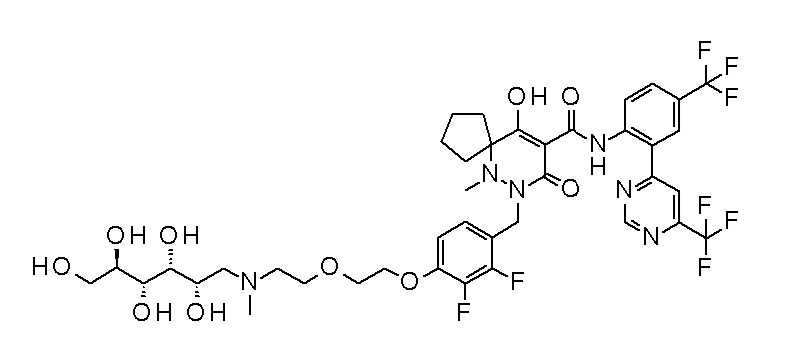
[1462] Для синтеза названного соединения использовали (2R,3R,4R,5S)-6-(метиламино)гексан-1,2,3,4,5-пентол в качестве исходного сырья и проводили такие же операции, как в примере 419.
[1463] LCMS: м/z 923[M+H]+
[1464] Время удерживания при ВЭЖХ: 0,79 минут (условия проведения анализа SQD-FA05)
[1465] <Пример 421>
7-[[2,3-Дифтор-4-[2-[2-[2-[2-[2-[метил-[(2R,3S,4S,5S)-2,3,4,5,6-пентагидроксигексил]амино]этокси]этокси]этокси]-этокси]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1466]
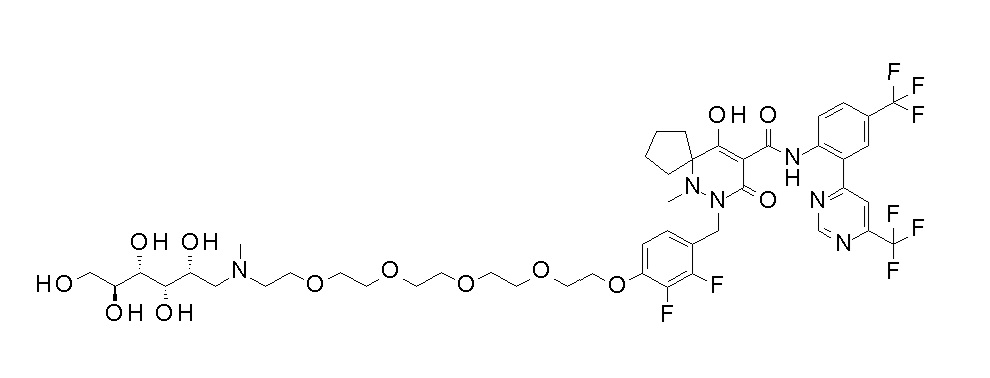
[1467] Для синтеза названного соединения использовали 2-[2-[2-[2-(2-гидроксиэтокси)этокси]этокси]этокси]этанол в качестве исходного сырья и проводили такие же операции, как в примере 419.
[1468] LCMS: м/z 1055[M+H]+
[1469] Время удерживания при ВЭЖХ: 0,81 минут (условия проведения анализа SQD-FA05)
[1470] <Пример 422>
7-[[2,3-Дифтор-4-[2-[2-[3-метил-[(2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексил]амино]-3-оксопропокси]этокси]этокси]фенил]-метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1471]
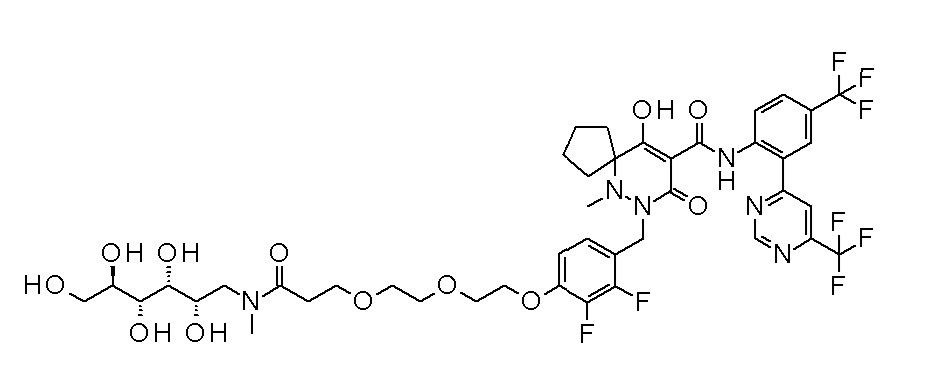
[1472] Первая стадия
Третбутил 3-[2-[2-(2-гидроксиэтокси)этокси]этокси]пропаноат
[1473]
[1474] 2-[2-(2-Гидроксиэтокси)этокси]этанол (2 г, 13,3 ммоль) растворяли в THF (5 мл) и добавляли NaH (8 мг, 0,2 моль). Затем смесь перемешивали при комнатной температуре в течение 10 минут, медленно добавляли третбутил проп-2-еноат (0,5 г, 3,9 ммоль), и смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали, и полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат) с получением целевого названного соединения (488 мг, 45%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 3,68-3,65 (4H, м), 3,62-3,55 (10H, м), 2,47 (2H, т, J=6,4 Гц), 1,44 (9H, с).
[1475] Вторая стадия
третбутил 3-[2-[2-[2-(4-метилфенил)сульфонилоксиэтокси]-этокси]этокси]пропаноат
[1476]
[1477] Третбутил 3-[2-[2-(2-гидроксиэтокси)этокси]этокси]-пропаноат (488 мг, 1,75 ммоль) и триэтиламин (532 мг, 5,26 ммоль) растворяли в дихлорметане (15 мл) и добавляли тозилхлорид (435 мг, 2,28 ммоль). Затем смесь перемешивали при комнатной температуре в течение 17 часов, реакционную смесь концентрировали, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат =1:2) с получением названного соединения (550 мг, 73%) в виде бесцветного масла.
[1478] LCMS: м/z 450[M+H2O]+
[1479] Время удерживания при ВЭЖХ: 0,90 минут (условия проведения анализа SQD-FA05)
[1480] Третья стадия
Третбутил 3-[2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]-фенокси]этокси]этокси]пропаноат
[1481]
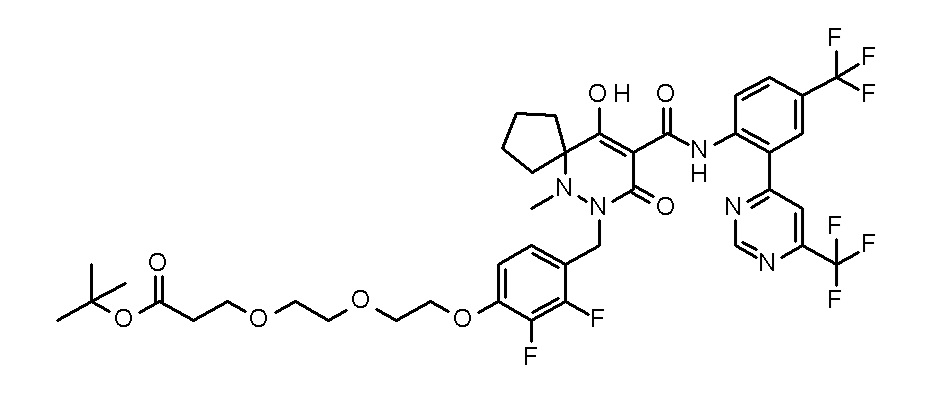
[1482] Третбутил 3-[2-[2-[2-(4-метилфенил)сульфонилокси-этокси]этокси]этокси]пропаноат (70 мг, 0,18 ммоль) и 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (79 мг, 0,12 ммоль) растворяли в ацетонитриле (2 мл), добавляли карбонат цезия (117 мг, 1,36 моль), и смесь перемешивали при 70°C в течение 2 часов. Затем к реакционной смеси добавляли воду (0,1 мл) и очищали ее колоночной хроматографией с обращенной фазой С18 с получением названного соединения (18 мг, 66%) в виде белого аморфного твердого вещества.
[1483] LCMS: м/z 874[M+H]+
[1484] Время удерживания при ВЭЖХ: 1,29 минут (условия проведения анализа SQD-FA05)
[1485] Четвертая стадия
3-[2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этокси]этокси]пропаноат
[1486]
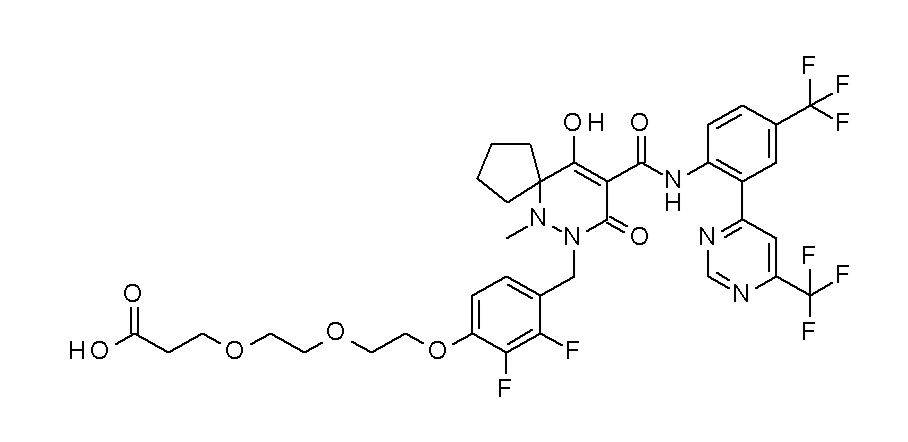
[1487] Третбутил 3-[2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]-фенокси]этокси]этокси]пропаноат (100 мг, 0,114 ммоль) растворяли в дихлорметане (2 мл) и добавляли TFA (0,54 мл) при комнатной температуре. Затем реакционную смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали для отгонки TFA. Полученный остаток непосредственно использовали для следующей реакции.
[1488] LCMS: м/z 818[M+H]+
[1489] Время удерживания при ВЭЖХ: 1,15 минут (условия проведения анализа SQD-FA05)
[1490] Пятая стадия
3-[2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этокси]этокси]пропаноат (40 мг, 0,05 ммоль), 3-аминопропан-1,2-диол (9 мг, 0,1 моль), и HATU (37,2 мг, 0,1 моль) растворяли в DMF (1 мл), затем добавляли диизопропилэтиламин (12,6 мг, 0,1 ммоль), и смесь перемешивали при комнатной температуре в течение 15 часов. К реакционной смеси добавляли воду (0,1 мл) и очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (18 мг, 41%) в виде белого аморфного твердого вещества.
[1491] LCMS: м/z 995[M+H]+
[1492] Время удерживания при ВЭЖХ: 1,01 минут (условия проведения анализа SQD-FA05)
[1493] <Примеры 423 и 424>
Соединения, описанные в следующей таблице, синтезировали путем проведения таких же стадий, как в примере 422, используя 2-[2-(2-гидроксиэтокси)этокси]этанол в качестве исходного материала.
[1494]
[1495] <Примеры 425 и 426>
Соединения, описанные в следующей таблице, синтезировали путем проведения таких же стадий, как в примере 422, используя 2-[2-гидроксиэтил(метил)амино]этанол в качестве исходного материала.
[1496]
[1497] <Пример 427>
7-[[2,3-Дифтор-4-[2-[2-[[(2S,3R,4S,5S)-2,3,4,5,6-пента-гидроксигексаноил]амино]этокси]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1498]
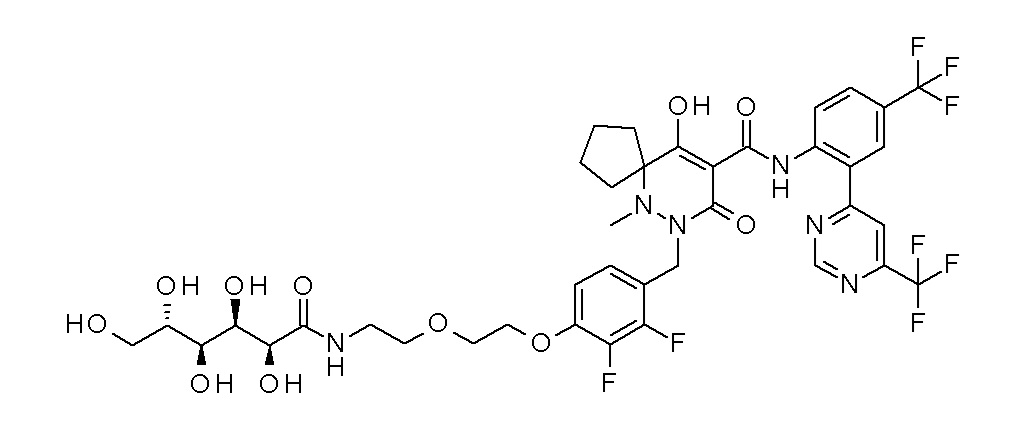
[1499] Первая стадия
Третбутил N-[2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]-фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]-фенокси]этокси]этил]карбамат
[1500]
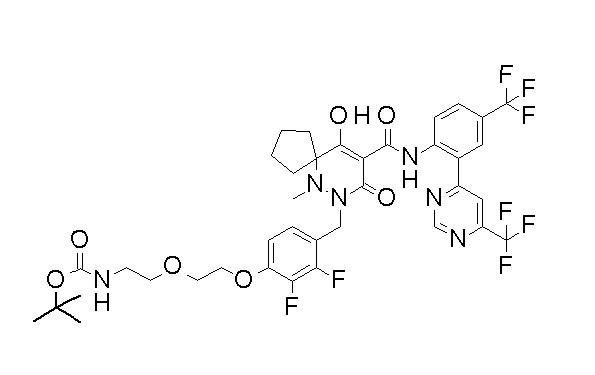
[1501] Третбутил N-[2-(2-гидроксиэтокси)этил]карбамат (28 мг, 0,137 ммоль), 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (30 мг, 0,046 ммоль) и TMAD (15,7 мг, 0,091 ммоль) растворяли в THF (1 мл), затем добавляли трибутилфосфин (18,5 мг, 0,091 ммоль). Затем смесь перемешивали при комнатной температуре в течение 5 часов, концентрировали, и остаток очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (28 мг, 74%) в виде белого аморфного твердого вещества.
LCMS: м/z 845[M+H]+
[1502] Время удерживания при ВЭЖХ: 1,25 минут (условия проведения анализа SQD-FA05)
[1503] Вторая стадия
7-[[4-[2-(2-Аминоэтокси)этокси]-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1504]
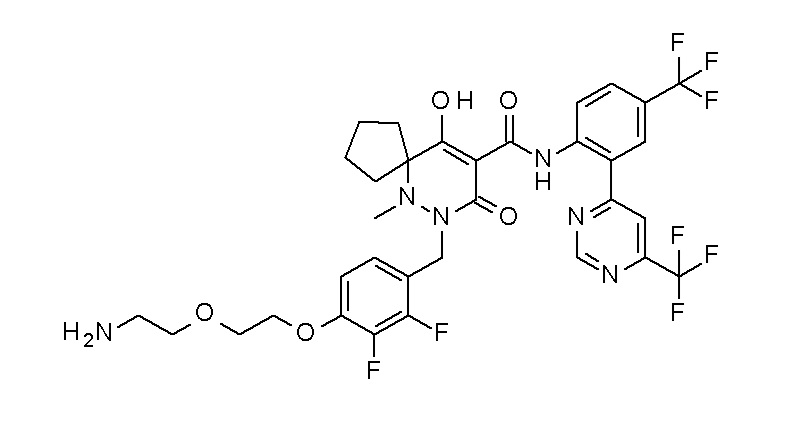
[1505] Третбутил N-[2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]-фенокси]этокси]этил]карбамат (30 мг, 0,036 ммоль) растворяли в этилацетате (0,3 мл), затем добавляли 4N-HCl этилацетат (1 мл), и смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали, и полученный остаток использовали для следующей реакции без очистки.
[1506] LCMS: м/z 745[M+H]+
[1507] Время удерживания при ВЭЖХ: 0,81 минут (условия проведения анализа SQD-FA05)
[1508] Третья стадия
7-[[4-[2-(2-Аминоэтокси)этокси]-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (42 мг, 0,054 ммоль) и (3R,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)оксан-2-он (19,2 мг, 0,108 ммоль) растворяли в метаноле (1 мл) и перемешивали в герметизированной пробирке при 70°C в течение 20 часов. К реакционной смеси добавляли воду (0,1 мл) и очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (30 мг, 61%) в виде белого аморфного твердого вещества.
[1509] LCMS: м/z 923[M+H]+
[1510] Время удерживания при ВЭЖХ: 1,00 минута (условия проведения анализа SQD-FA05)
[1511] <Пример 428>
7-[[2,3-Дифтор-4-[2-[2-[2-[2-[[(2S,3R,4S,5S)-2,3,4,5,6-пентагидроксигексаноил]амино]этокси]этокси]этокси]этокси]фенил]-метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(три-фторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1512]
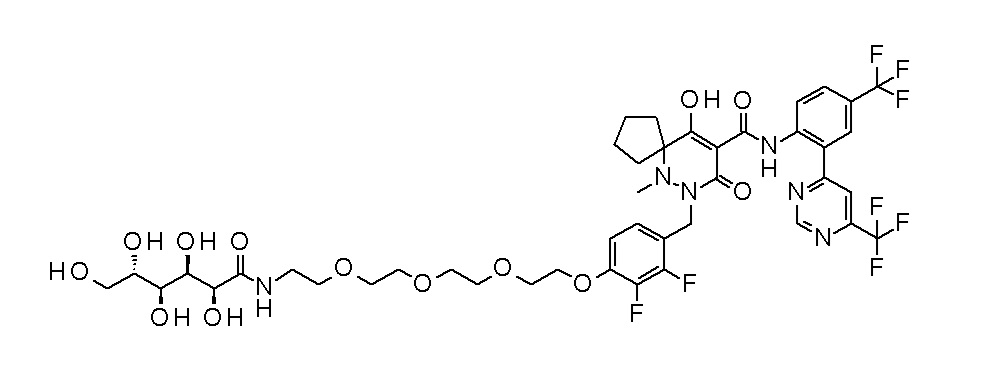
[1513] Названное соединение синтезировали путем провидения таких же стадий, как в примере 427, используя третбутил N-[2-[2-[2-(2-гидроксиэтокси)этокси]этокси]этил]карбамат в качестве исходного материала.
[1514] LCMS: м/z 1011[M+H]+
[1515] Время удерживания при ВЭЖХ: 1,01 минут (условия проведения анализа SQD-FA05)
[1516] <Пример 429>
7-[[2,3-Дифтор-4-[2-[2-[2-метоксиэтил(метил)амино]этокси]-этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамид
[1517]
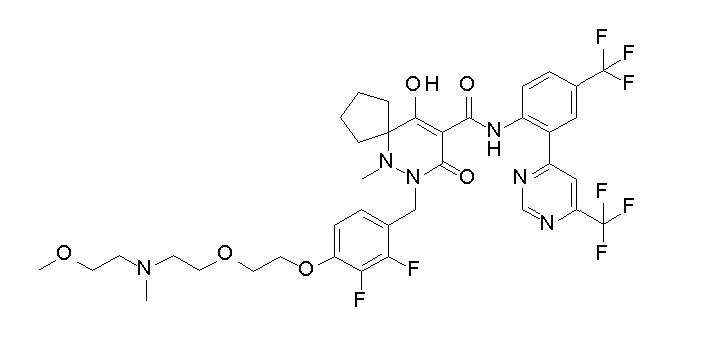
[1518] Первая стадия
[1519]

[1520] 2-[2-(4-Метилфенил)сульфонилоксиэтокси]этил 4-метил-бензолсульфонат (79 мг, 0,192 ммоль) и карбонат цезия (15,6 мг, 0,048 ммоль) добавляли к раствору 7-[(2,3-дифтор-4-гидроксифенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамида (вторая стадия примера 332) (31,5 мг, 0,048 ммоль) в ацетонитриле (1 мл), и смесь перемешивали при 50°C в течение 4 часов. Затем реакцию завершали, реакционную смесь нейтрализовывали муравьиной кислотой, и реакционную смесь очищали колоночной хроматографией с обращенной фазой С18 с получением 2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этокси]этил 4-метилбензолсульфоната (35,9 мг, 83%).
[1521] LCMS: м/z 900[M+H]+
Время удерживания при ВЭЖХ: 1,73 минут (условия проведения анализа SMD-TFA05)
[1522] Вторая стадия
2-Метокси-N-метилэтанамин (0,043 мл, 0,399 ммоль) добавляли к раствору 2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этокси]этил 4-метилбензолсульфоната (35,9 мг, 0,04 ммоль) в ацетонитриле (0,6 мл), и смесь перемешивали при 50°C в течение 6 часов. После завершения реакции, реакционную смесь очищали колоночной хроматографией с обращенной фазой С18 с получением названного соединения (22,3 мг, 68%).
[1523] LCMS: м/z 817[M+H]+
Время удерживания при ВЭЖХ: 1,43 минут (условия проведения анализа SMD-TFA05)
[1524] <Примеры 430-434>
Для синтеза соединений, описанных в следующей таблице, использовали соответствующие алкилирующие реагенты и производимые промышленностью амины проводили такие же операции, как в примере 429.
[1525]
[1526] <Пример 435>
2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(три-фторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этиламино]этан-сульфоновая кислота
[1527]
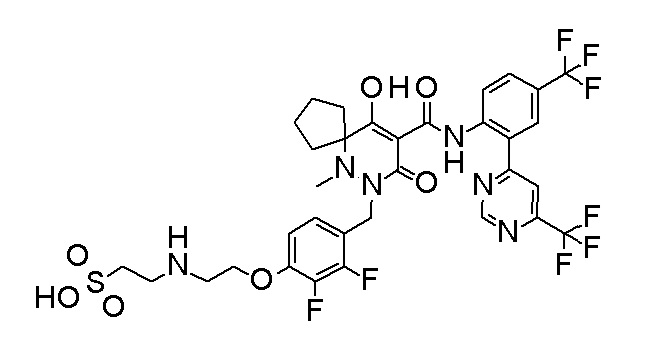
[1528] 7-[[4-(2-Бромэтокси)-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (20 мг, 26,0 мкмоль) (справочный пример 109) растворяли в N,N-диметилформамиде (200 мкл), затем добавляли фосфат калия (27,8 мг, 0,13 ммоль) и тетрабутиламмония йодид (1,0 мг, 2,6 мкмоль), и смесь перемешивали при 80°C в течение 3 часов. Затем реакционную смесь разбавляли муравьиной кислотой и водой и фильтровали, очищали с помощью ВЭЖХ с получением названного соединения (8,0 мг, 38%).
[1529] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 809,1[M+H]+
Время удерживания при ВЭЖХ: 1,32 минут (условия проведения анализа SMD-TFA05)
[1530] <Пример 436>
2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(три-фторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]этиламино]этан-сульфоновая кислота
[1531]
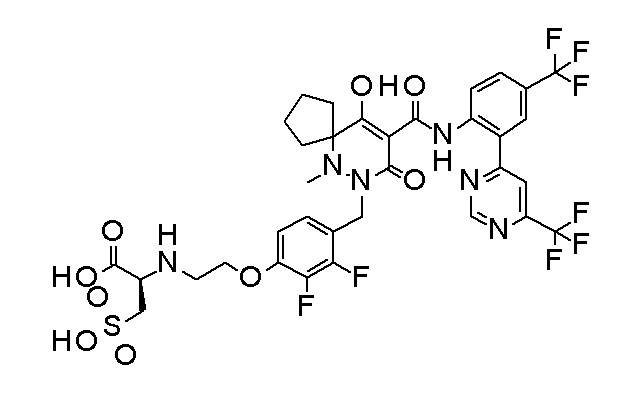
[1532] Первая стадия
(2R)-2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этиламино]-3-метокси-3-оксопропан-1-сульфоновая кислота
[1533]
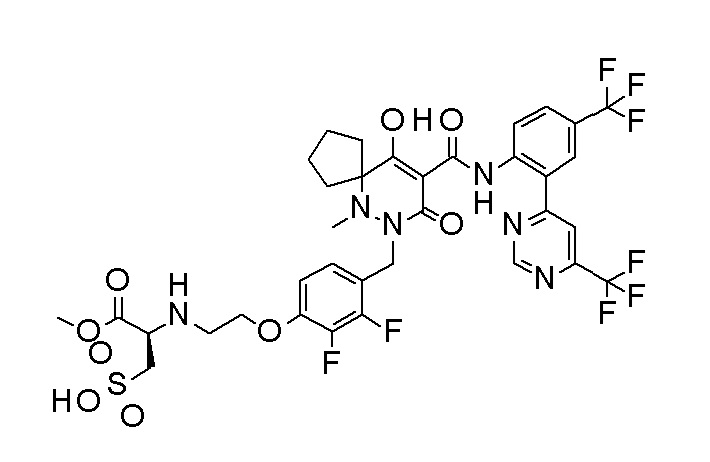
[1534] (2R)-2-[2-[2,3-Дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]фенокси]-этиламино]-3-метокси-3-оксопропан-1-сульфоновую кислоту синтезировали из 7-[[4-(2-бромэтокси)-2,3-дифторфенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)-пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамида (справочный пример 109) и (R)-2-амино-3-метокси-3-оксопропан-1-сульфоновой кислоты гидрохлорида таким же методом, как в примере 381.
[1535] LCMS: м/z 867,0[M+H]+
Время удерживания при ВЭЖХ: 1,37 минут (условия проведения анализа SMD-TFA05)
[1536] Вторая стадия
Названное соединение синтезировали из (2R)-2-[2-[2,3-дифтор-4-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро-[4.5]дец-9-ен-7-ил]метил]фенокси]этиламино]-3-метокси-3-оксопропан-1-сульфоновой кислоты таким же методом, как в справочном примере 381.
[1537] LCMS: м/z 853,0[M+H]+
Время удерживания при ВЭЖХ: 1,31 минут (условия проведения анализа SMD-TFA05)
[1538] <Справочный пример 110>
2-Хлор-N-(2-метоксиэтил)-N-метилэтанамина гидрохлорид
[1539]
[1540] Первая стадия
2-Метокси-N-метилэтанамин (17,0 г, 191 ммоль) растворяли в толуоле (381 мл), затем добавляли 2-бромэтанол (13,6 мл, 191 ммоль) и триэтиламин (26,6 мл, 191 ммоль), и смесь перемешивали при 100°C в течение 2 часов. Реакционную смесь сушили над сульфатом магния и фильтровали и концентрировали при пониженном давлении с получением 2-((2-метоксиэтил)(метил)амино)этанола (16,5 г) в виде неочищенного продукта.
[1541] Вторая стадия
2-((2-Метоксиэтил)(метил)амино)этанол (16,4 г, 124 ммоль) растворяли в этилацетате (124 мл), затем добавляли тионилхлорид (13,4 мл, 186 ммоль) при 0°C, и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении с получением названного соединения (20,5 г, 88%).
[1542]1H-ЯМР (DMSO-D6) δ: 10,36 (1H, ушир.с), 4,00 (2H, т, J=6,8 Гц), 3,70 (2H, т, J=4,9 Гц), 3,51-3,43 (4H, м), 3,30 (3H, с), 2,81 (3H, с).
[1543] <Пример 437>
7-[[2,3-Дифтор-5-йод-4-[2-[2-метоксиэтил(метил)амино]-этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро-[4.5]дец-9-ен-9-карбоксамид
[1544]
[1545] Первая стадия
[1546]
[1547] 6-[(2,3-Дифтор-4-гидроксифенил)метил]-9-гидрокси-5-метил-7-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-5,6-диазаспиро[3.5]нон-8-ен-8-карбоксамид (справочный пример 107) (500 мг, 0,76 ммоль) растворяли в N,N-диметилформамиде (2,54 мл), затем добавляли N-йодсукцинимид (222 мг, 0,99 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 часов. К реакционной смеси добавляли метанол, и смесь очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением 7-[(2,3-дифтор-4-гидрокси-5-йодфенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамида (569 мг, 96%).
[1548] LCMS: м/z 784,1[M+H]+
Время удерживания при ВЭЖХ: 1,67 минут (условия проведения анализа SMD-TFA05)
Вторая стадия
7-[(2,3-Дифтор-4-гидрокси-5-йодфенил)метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (341 мг, 0,43 ммоль), 2-хлор-N-(2-метоксиэтил)-N-метилэтанамина гидрохлорид (82,0 мг, 0,43 ммоль), карбонат цезия (425 мг, 1,31 ммоль), тетрабутиламмония йодид (16,1 мг, 44,0 мкмоль) и метанол (17,7 мкл) растворяли в ацетонитриле (4,35 мл), и смесь перемешивали в атмосфере азота при 65°C в течение 1,5 часов. К реакционной смеси добавляли водный раствор муравьиной кислоты и очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением названного соединения (341 мг, 87%).
[1549] LCMS: м/z 899,2[M+H]+
Время удерживания при ВЭЖХ: 1,46 минут (условия проведения анализа SMD-TFA05)
<Пример 438>
7-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-5-[3-метоксипропил(метил)карбамоил]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1550]
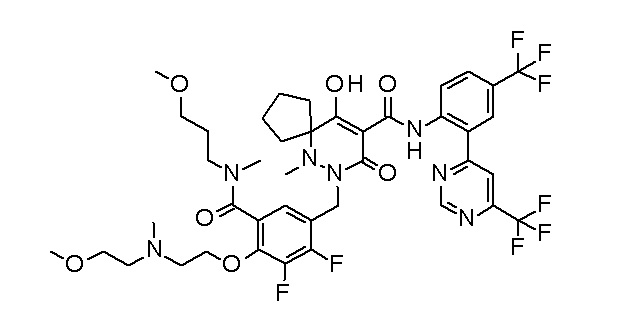
[1551] Первая стадия
[1552]
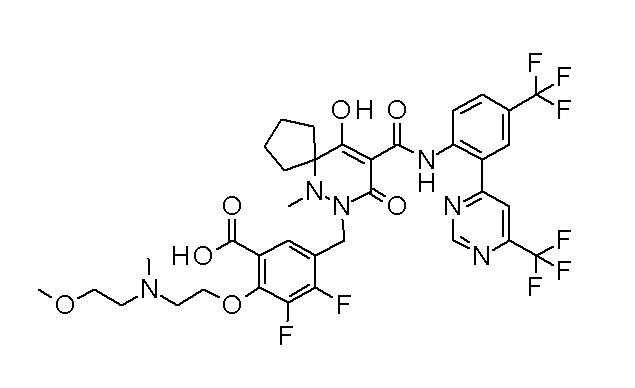
[1553] 7-[[2,3-Дифтор-5-йод-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (140 мг, 156 мкмоль), хлороформенный комплекс трис(дибензилиденацетон)дипалладия (16,1 мг, 16,0 мкмоль), ксантфос (9,0 мг, 16,0 мкмоль), хлорид лития (39,6 мг, 0,94 ммоль), формиат лития (40,5 мг, 0,78 ммоль) и триметилсиланолат калия (60,0 мг, 0,47 ммоль) растворяли в N,N-диметилформамиде (1,04 мл), затем добавляли уксусный ангидрид (58,5 мкл, 0,62 ммоль), и смесь перемешивали в атмосфере азота при 85°C в течение 30 минут. К реакционной смеси добавляли N,N-диметилформамид и метанол и очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением 3,4-дифтор-5-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифторметил)-2-[6-(три-фторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]-дец-9-ен-7-ил]метил]-2-[2-[2-метоксиэтил(метил)амино]этокси]-бензоата (98,4 мг, 77%).
[1554] LCMS: м/z 817,3[M+H]+
Время удерживания при ВЭЖХ: 1,41 минут (условия проведения анализа SMD-TFA05)
Вторая стадия
3,4-Дифтор-5-[[10-гидрокси-6-метил-8-оксо-9-[[4-(трифтор-метил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]карбамоил]-6,7-диазаспиро[4.5]дец-9-ен-7-ил]метил]-2-[2-[2-метоксиэтил(метил)-амино]этокси]бензоат (15,0 мг, 18,0 мкмоль), 3-метокси-N-метилпропан-1-амин (3,79 мг, 37,0 мкмоль), 2-(3H-[1,2,3]-триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гекса-фторфосфат (10,5 мг, 28,0 мкмоль) и N-этил-N-изопропилпропан-2-амин (9,6 мкл, 55,0 мкмоль) растворяли в N,N-диметилформамиде (100 мкл), и смесь перемешивали в атмосфере азота при 40°C в течение 2 часов. К реакционной смеси добавляли водный раствор муравьиной кислоты и очищали с помощью ВЭЖХ с получением названного соединения (8,0 мг, 38%).
[1555] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 902,1[M+H]+
Время удерживания при ВЭЖХ: 1,17 минут (условия проведения анализа SMD-FA05)
<Справочный пример 111>
5-(2-Метоксиэтокси)-2-[5-метил-6-(трифторметил)пиримидин-4-ил]-4-(трифторметил)анилин
[1556]
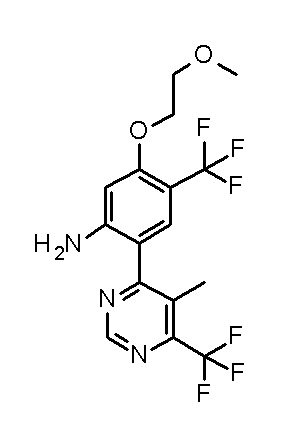
[1557] Первая стадия
[1558]
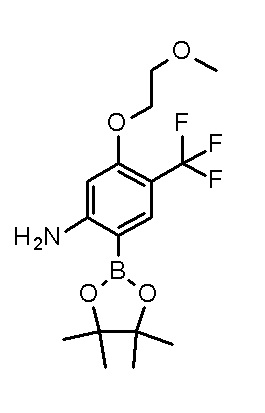
[1559] 2-Йод-5-(2-метоксиэтокси)-4-(трифторметил)анилин (1,30 г, 3,60 ммоль) (справочный пример 13), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (2,74 г, 10,8 ммоль), дициклогексил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфин (172 мг, 0,36 ммоль), ацетат калия (1,06 г, 10,8 ммоль) и ацетат палладия (40,0 мг, 0,18 ммоль) растворяли в диоксане (12,0 мл), и смесь перемешивали в атмосфере азота при 110°C в течение 4 часов. К реакционной смеси добавляли этилацетат, смесь фильтровали, концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией с обращенной фазой С18 (ацетонитрил/вода) с получением 5-(2-метоксиэтокси)-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)анилина (183 мг, 14%).
[1560] LCMS: м/z 362,3[M+H]+
Время удерживания при ВЭЖХ: 0,99 минут (условия проведения анализа SQD-FA05)
[1561] Вторая стадия
5-(2-Метоксиэтокси)-2-(4,4,5,5-тетраметил-1,3,2-диокса-боролан-2-ил)-4-(трифторметил)анилин (183 мг, 0,51 ммоль), 4-хлор-5-метил-6-(трифторметил)пиримидин (справочный пример 91) (199 мг, 1,01 ммоль), комплекс 1,1'-бис(дифенилфосфино)-ферроценпалладия(II) дихлорид - дихлорметан (41,7 мг, 51,0 мкмоль) и карбонат калия (210 мг, 1,52 моль) растворяли в диоксане (2,94 мл) и воде (0,44 мл), и смесь перемешивали в атмосфере азота при 90°C в течение 1 часа. К реакционной смеси добавляли воду и экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, водный слой отделяли с помощью фазового сепаратора, органический слой концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат) с получением названного соединения (180 мг, 90%).
[1562] LCMS: м/z 396,1[M+H]+
Время удерживания при ВЭЖХ: 1,24 минут (условия проведения анализа SMD-TFA05)
[1563] <Справочный пример 112>
7-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-10-гидрокси-6-метил-8-оксо-6,7-диазаспиро[4.5]дец-9-ен-9-карбоновой кислоты 2-метилпропиловый эфир
[1564]
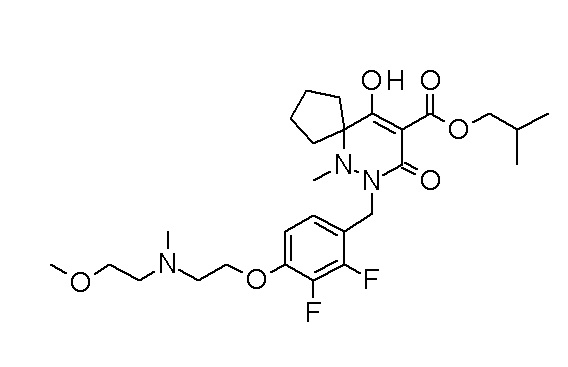
[1565] Для синтеза названного соединения использовали метил 1-[[(E)-[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метилиденамино]метиламино]циклопентан-1-карбоксилата гидрохлорид (справочный пример 105) и проводили такие же операции, как на четвертой стадии примера 237.
[1566] LCMS: м/z 540,2[M+H]+
Время удерживания при ВЭЖХ: 1,11 минут (условия проведения анализа SMD-TFA05)
[1567] <Пример 439>
7-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-фенил]метил]-10-гидрокси-N-[5-(2-метоксиэтокси)-2-[5-метил-6-(трифторметил)пиримидин-4-ил]-4-(трифторметил)фенил]-6-метил-8-оксо-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1568]
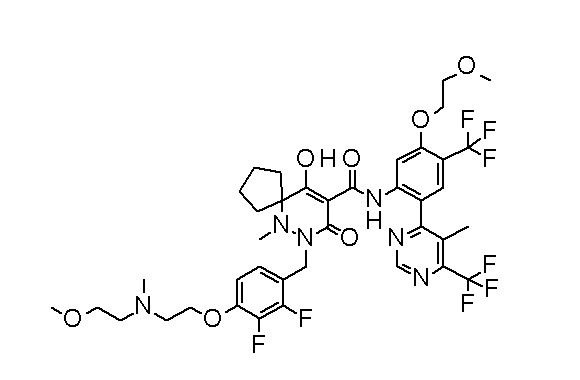
[1569] Для синтеза названного соединения использовали 7-[[2,3-дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]фенил]-метил]-10-гидрокси-6-метил-8-оксо-6,7-диазаспиро[4.5]дец-9-ен-9-карбоновой кислоты 2-метилпропиловый эфир и 5-(2-метоксиэтокси)-2-[5-метил-6-(трифторметил)пиримидин-4-ил]-4-(трифторметил)-анилин и проводили такие же операции, как на пятой стадии примера 237.
[1570] LCMS: м/z 861,4[M+H]+
Время удерживания при ВЭЖХ: 1,40 минут (условия проведения анализа SMD-TFA05)
<Пример 440>
9-[[2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-5-(3-пиридинил)фенил]метил]-6-гидрокси-10-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-9,10-диазаспиро[4.5]дец-6-ен-7-карбоксамид
[1571]
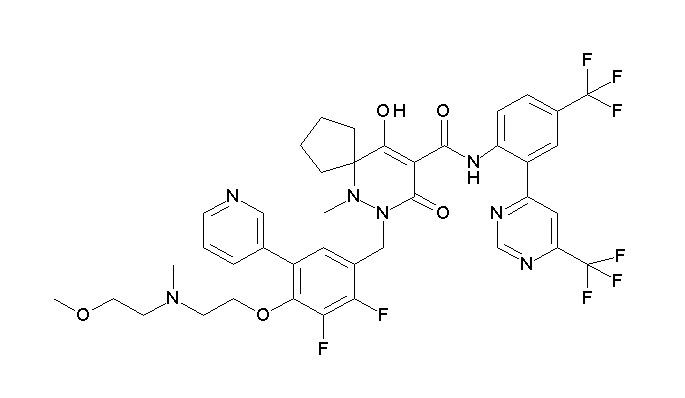
[1572] 7-[[2,3-Дифтор-5-йод-4-[2-[2-метоксиэтил(метил)-амино]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид (10 мг, 11,0 мкмоль) (пример 437) растворяли в 1,2-диметоксиэтане (80 мкл), этаноле (80 мкл) и воде (80 мкл), затем добавляли 3-пиридинилборат (2,1 мг, 17,0 мкмоль), тетракис(трифенилфосфин)палладий (3,9 мг, 3,3 мкмоль) и карбонат натрия (3,9 мг, 33 мкмоль), и смесь перемешивали при 80°C в течение 16 часов. Затем реакционную смесь разбавляли муравьиной кислотой и водой и фильтровали, затем очищали с помощью ВЭЖХ с получением названного соединения (2,3 мг, 24%).
[1573] Условия очистки: ВЭЖХ
Подвижная фаза: MeCN/вода (0,1% муравьиная кислота)
Колонка: YMC-Actus Triart C18 (50 × 30 мм в.д., S - 5 мкм, 12 нм)
LCMS: м/z 850[M+H]+
Время удерживания при ВЭЖХ: 1,26 минут (условия проведения анализа SMD-TFA05)
<Пример 441>
7-[[2,3-Дифтор-4-[2-[2-[2-[2-[2-[метил-[(2S,3R,4R,5R)-2,3,4,5,6-пентагидроксигексил]амино]-2-оксоэтокси]этокси]-этокси]этокси]этокси]фенил]метил]-10-гидрокси-6-метил-8-оксо-N-[4-(трифторметил)-2-[6-(трифторметил)пиримидин-4-ил]фенил]-6,7-диазаспиро[4.5]дец-9-ен-9-карбоксамид
[1574]
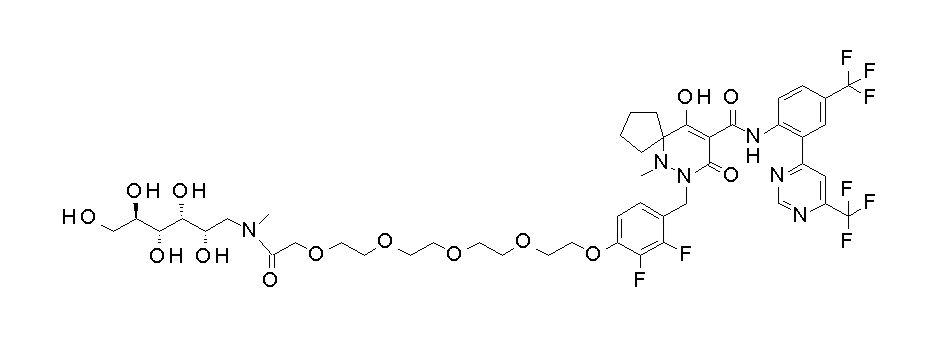
[1575] Названное соединение синтезировали путем проведения таких же стадий и проведения таких же операций, как в примере 422, используя 2-[2-[2-[2-(2-гидроксиэтокси)этокси]этокси]-этокси]этанол и третбутил 2-бромацетат в качестве исходного материала.
[1576] LCMS: м/z 1069[M+H]+
[1577] Время удерживания при ВЭЖХ: 1,00 минута (условия проведения анализа SQD-FA05)
[1578] <Примеры 442-445>
Для синтеза соединений, описанных в следующей таблице, использовали соединение анилина примера 417 и соответствующие альдегиды или кетоны и проводили следующие операции.
[1579] Для синтеза соединений примеров, описанных в следующей таблице, 7-(2,3-Дифтор-4-((2-((2-метоксиэтил)(метил)-амино)этил)амино)бензил)-10-гидрокси-6-метил-8-оксо-N-(4-(три-фторметил)-2-(6-(трифторметил)пиримидин-4-ил)фенил)-6,7-диаза-спиро-[4.5]дец-9-ен-9-карбоксамид и соответствующий альдегид или кетон растворяли в тетрагидрофуране и добавляли 18M серную кислоту в количестве, эквивалентном одной пятой количества тетрагидрофурана при 0°C. Затем добавляли тремя порциями тетрагидроборат натрия, и смесь перемешивали при 0°C или при комнатной температуре в течение 3 часов и более. К реакционной смеси добавляли триэтиламин, воду и диметилсульфоксид, и полученный раствор очищали колоночной хроматографией с обращенной фазой С18.
[1580]
[1581] <Примеры 446 и 447>
Для синтеза соединений, описанных в следующей таблице, использовали соответствующее йодидное производное примера 417, 3-морфолинопропан-1-амин и 2-морфолиноэтанамин и проводили такие же операции, как в примере 417.
[1582]
[1583] <Справочный пример 113>
Метил 1-((метиламино)циклопентанкарбоксилат 4-толуол-сульфонат
Первая стадия
Метил 1-((третбутоксикарбонил)амино)циклопентан карбоксилат
[1584]
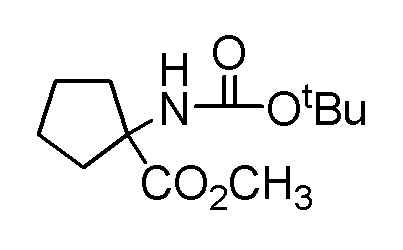
[1585] 1-Аминоциклопентанкарбоновой кислоты гидрохлорид (3,00 г, 18,1 ммоль) растворяли в метаноле (18,0 мл), затем добавляли тионилхлорид (1,32 мл, 18,1 ммоль) при 0°C, и смесь перемешивали в атмосфере азота при 50°C в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и к полученному остатку добавляли воду (6,00 мл) и триэтиламин (7,55 мл, 54,3 ммоль). К этому раствору добавляли дитретбутил- дикарбонат (3,95 г, 18,1 ммоль) и третбутилметиловый эфир (24,0 мл), и смесь перемешивали при 50°C в течение 1 часа. Водный слой отделяли, к органическому слою добавляли тетрагидрофуран (9,00 мл) и концентрировали при пониженном давлении. К полученному остатку добавляли тетрагидрофуран (15,0 мл) и концентрировали при пониженном давлении с получением названного соединения в виде бледно-желтого масла.
[1586]1H-ЯМР (DMSO-D6) δ: 7,28 (1H, ушир.с), 3,58 (3H, с), 2,10-1,80 (4H, м), 1,67-1,55 (4H, м), 1,36 (9H, с).
[1587] Вторая стадия
Метил 1-((третбутоксикарбонил)метиламино)циклопентан-карбоксилат
[1588]
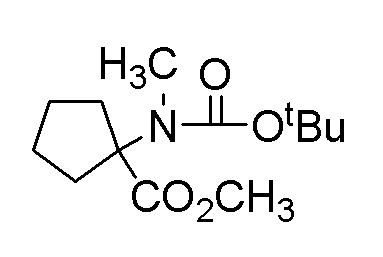
[1589] Метил 1-((третбутоксикарбонил)амино)циклопентан-карбоксилат, полученный на первой стадии, растворяли в 1-метил- 2-пирролидиноне (24,0 мл), затем добавляли гидроксид натрия (1,45 г, 36,2 ммоль) и метилйодид (3,38 мл, 54,3 ммоль), и смесь перемешивали при 50°C в течение 7 часов. К этой реакционной смеси добавляли воду (30,0 мл) при комнатной температуре и экстрагировали два раза изопропилацетатом (15,0 мл). Полученный органический слой промывали последовательно 10% водным раствором тиосульфата натрия (15,0 мл) и 10% водным раствором хлорида натрия (15,0 мл). Полученный органический слой концентрировали при пониженном давлении с получением названного соединения (5,88 г, 83%).
[1590]1H-ЯМР (DMSO-D6) δ: 3,60 (3H, с), 2,87 (3H, с), 2,20-2,10 (2H, м), 1,96-1,87 (2H, м), 1,75-1,60 (4H, м), 1,34 (9H, с).
[1591] Третья стадия
Метил 1-(метиламино)циклопентанкарбоксилат 4-толуол-сульфонат
[1592]
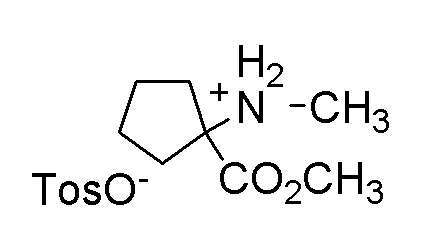
[1593] Названное соединение синтезировали из 1-((трет-бутоксикарбонил)амино)циклопентанкарбоновой кислоты таким же методом, как в справочных примерах 87 и 88.
[1594] <Справочный пример 114>
2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-бензальдегида гидрохлорид
[1595]
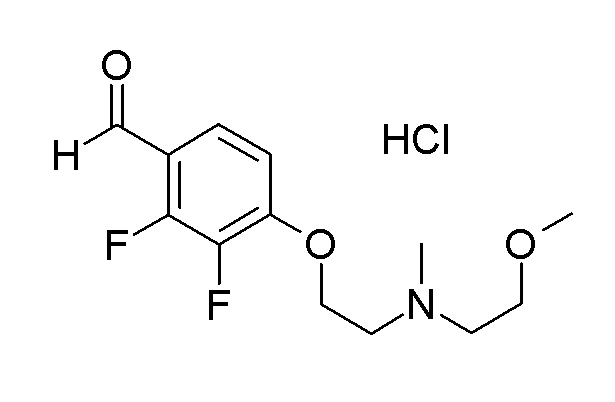
[1596] 2,3-Дифтор-4-[2-[2-метоксиэтил(метил)амино]этокси]-бензальдегид (200 мг, 0,73 ммоль) растворяли в 1 мл диметоксиэтана. Добавляли пиридина гидрохлорид (85 мг, 0,73 ммоль), и смесь перемешивали. Образовавшиеся кристаллы фильтровали и сушили при пониженном давлении с получением названного соединения (68 мг, 30%).
[1597]1H-ЯМР (DMSO-D6) δ: 10,99 (1H, ушир.с), 10,07 (1H, с), 7,73 (1H, м), 7,30 (1H, м), 4,67 (2H, т, J=4,9 Гц), 3,75 (2H, т, J=5,1 Гц), 3,30 (3H, с), 3,30-3,74 (4H, м), 2,87 (3H, brd, J=3,7 Гц).
[1598] Фармакологические испытания
Пример испытания 1: Ингибирующее воздействие на поглощение33PO4 в мембранных везикулах щеточной каймы тонкого кишечника крыс
Мембранные везикулы щеточной каймы (BBMVs) приготавливали, используя верхнюю область тонкого кишечника каждой из самок мышей линии Wistar (в возрасте 4-5 недель). Приготовление мембранных везикул щеточной каймы проводили методом Murer et al. (Murer H, Hopfer U, Kinne R. Sodium/proton antiport in brush-border-membrane vesicles isolated from rat small intestine и kidney. 1976. J Am Soc Nephrol. 1998 Jan; 9 (1): 143-50). Активность мембранных везикул щеточной каймы тонкого кишечника в отношении транспортировки33PO4определяли методом быстрой фильтрации. Каждое испытуемое соединение добавляли при конечной концентрации 1 мкM к буферу A (110 мM NaCl, 60 мM маннит и 10 мM HEPES (pH 7,5)), содержащему 340 килобеккерель/мл33PO4, или DMSO добавляли к буферу B (110 мM KCl, 60 мM маннит и 10 мM HEPES (pH 7,5)), содержащему 340 килобеккерель/мл33PO4, и каждый полученный раствор добавляли в образец мембранных везикул щеточной каймы и давали возможность произойти взаимодействию в течение 60 секунд. Затем в каждую реакционную смесь добавляли очень холодный буфер C (110 мM NaCl, 1 мM KH2PO4 и 10 мM HEPES (pH 7,5)), и реакционную смесь сразу же фильтровали с отсасыванием через миллипоровый фильтр. Фильтр промывали буфером C, и каждый образец затем растворяли в жидком сцинтилляторе. Количество33PO4,поглощенное мембранными везикулами щеточной каймы, определяли с помощью жидкостного сцинтилляционного счетчика. Степень ингибирования определяли по следующей формуле:
[1599] Степень (%) ингибирования = (1 - (количество33PO4, поглощенное BBMVs, подвергнутых обработке введенным испытуемым соединением и буфером А - количество33PO4, поглощенное BBMVs, подвергнутых обработке введенным DMSO и буфером B) / (количество33PO4, поглощенное BBMVs, подвергнутых обработке введенным DMSO и буфером A - количество33PO4, поглощенное BBMVs, подвергнутых обработке введенным DMSO и буфером B)) × 100
Степень ингибирования поглощение33PO4 в мембранных везикулах щеточной каймы тонкого кишечника крыс при воздействии 1 мкM испытуемого соединения (степень ингибирования поглощения) приведена в таблицах 40-1 - 40-8.
[1600]
[1601]
[1602]
[1603]
[1604]
[1605]
[1606]
[1607]
[1608] Пример испытания 2: Ингибирующее воздействие на поглощение33PO4 клетками человека, экспрессирующими NaPi-IIb
Клетки CHO трансфицировали с помощью плазмид экспрессии NaPi-IIb человека и с помощью G418a получали линию клеток человека, стабильно экспрессирующую NaPi-IIb. Клетки человека, стабильно экспрессирующие NaPi-IIb, высевали в 96-луночном планшете и инкубировали в течение ночи в CO2 инкубаторе. Среду заменяли на буфер A (145 мM холинхлорид, 3 мM KCl, 1 мM CaCl2, 0,5 мM MgCl2, 5 мM глюкоза и 5 мM MES (pH 6,5)) и затем заменяли на буфер B (145 мM NaCl, 3 мM KCl, 1 мM CaCl2, 0,5 мM MgCl2, 5 мM глюкоза и 5 мM MES (pH 6,5)), дополненный каждым испытуемым соединением при конечной концентрации 1,3, 10 или 30 мкM, или на буфер A, дополненный DMSO. Через заданное время, добавляли 1/20 объема буфера A, содержащего33PO4, и давали возможность произойти взаимодействию при комнатной температуре. После промывки очень холодным буфером A, в каждую реакционную смесь добавляли жидкий сцинтиллятор, и количество поглощенного33PO4 измеряли с помощью сцинтилляционного счетчика TopCount. Степень ингибирования определяли по следующей формуле:
[1609] Степень (%) ингибирования = (1 - (количество33PO4, поглощенное в лунке, подвергнутой обработке введенным испытуемым соединением и буфером B - количество33PO4, поглощенное в лунке, подвергнутой обработке введенным DMSO и буфером A) / (количество33PO4, поглощенное в лунке, подвергнутой обработке введенным DMSO и буфером B - количество33PO4, поглощенное в лунке, подвергнутой обработке введенным DMSO и буфером A)) × 100
Значения IC50 (мкM) рассчитывали из прямой, построенной по двум точкам, пересекающей величину 50% степени ингибирования. Значения IC50 для некоторых соединений в отношении поглощения33PO4 клетками человека, экспрессирующими NaPi-IIb, приведены в таблицах 41-1 - 41-7.
[1610]
[1611]
[1612]
[1613]
[1614]
[1615]
[1616]
[1617]
Пример испытания 3: Ингибирующее воздействие на поглощение33PO4 клетками человека, экспрессирующими PiT-1
Клетки CHO трансфицировали с помощью плазмид экспрессии PiT-1 человека или пустых векторов для получения клеток человека, экспрессирующих PiT-1, и клеток человека, экспрессирующих пустой вектор. Клетки человека, экспрессирующие PiT-1, или клетки человека, экспрессирующие пустой вектор, высевали в 96-луночном планшете и инкубировали в течение ночи в CO2 инкубаторе. Среду заменяли на буфер A (145 мM холинхлорид, 3 мM KCl, 1 мM CaCl2, 0,5 мM MgCl2, 5 мM глюкоза и 5 мM MES (pH 6,5)) и затем заменяли на буфер B (145 мM NaCl, 3 мM KCl, 1 мM CaCl2, 0,5 мM MgCl2, 5 мM глюкоза и 5 мM MES (pH 6,5)), дополненный каждым испытуемым соединением при конечной концентрации 0,24, 1,2, 6 или 30 мкM, или на буфер B, дополненный DMSO. Через заданное время, добавляли 1/20 объема буфера A, содержащего33PO4, и давали возможность произойти взаимодействию при комнатной температуре. После промывки очень холодным буфером A, в каждую реакционную смесь добавляли жидкий сцинтиллятор, и количество поглощенного33PO4 измеряли с помощью сцинтилляционного счетчика TopCount. Степень ингибирования определяли по следующей формуле:
[1618] Степень (%) ингибирования = (1 - (количество33PO4, поглощенное в лунке, содержащей клетки человека, экспрессирующие PiT-1, в которую добавили соединение - количество33PO4, поглощенное в лунке, содержащей клетки человека, экспрессирующие пустой вектор, в которую добавили соединение) / (количество33PO4, поглощенное в лунке, содержащей клетки человека, экспрессирующие PiT-1, в которую добавили DMSO - количество33PO4, поглощенное в лунке, содержащей клетки человека, экспрессирующие пустой вектор, в которую добавили DMSO)) × 100
Значения IC50 (мкM) рассчитывали из прямой, построенной по двум точкам, пересекающей величину 50% степени ингибирования. Значения IC50 для некоторых соединений в отношении поглощения33PO4 клетками человека, экспрессирующими PiT-1, приведены в таблице 42.
[1619]
[1620] Пример испытания 4: Ингибирующее воздействие на поглощение33PO4 клетками человека, экспрессирующими PiT-2
Клетки CHO трансфицировали с помощью плазмид экспрессии PiT-2 человека или пустых векторов для получения клеток человека, экспрессирующих PiT-2, и клеток человека, экспрессирующих пустой вектор. Клетки человека, экспрессирующие PiT-2, или клетки человека, экспрессирующие пустой вектор, высевали в 96-луночном планшете и инкубировали в течение ночи в CO2 инкубаторе. Среду заменяли на буфер A (145 мM холинхлорид, 3 мM KCl, 1 мM CaCl2, 0,5 мM MgCl2, 5 мM глюкоза и 5 мM MES (pH 6,5)) и затем заменяли на буфер B (145 мM NaCl, 3 мM KCl, 1 мM CaCl2, 0,5 мM MgCl2, 5 мM глюкоза и 5 мM MES (pH 6,5)), дополненный каждым испытуемым соединением при конечной концентрации 0,24, 1,2, 6 или 30 мкM, или на буфер B, дополненный DMSO. Через заданное время, добавляли 1/20 объема буфера A, содержащего33PO4, и давали возможность произойти взаимодействию при комнатной температуре. После промывки очень холодным буфером A, в каждую реакционную смесь добавляли жидкий сцинтиллятор, и количество поглощенного33PO4 измеряли с помощью сцинтилляционного счетчика TopCount. Степень ингибирования определяли по следующей формуле:
[1621] Степень (%) ингибирования = (1 - (количество33PO4, поглощенное в лунке, содержащей клетки человека, экспрессирующие PiT-2, в которую добавили соединение - количество33PO4, поглощенное в лунке, содержащей клетки человека, экспрессирующие пустой вектор, в которую добавили соединение) / (количество33PO4, поглощенное в лунке, содержащей клетки человека, экспрессирующие PiT-2, в которую добавили DMSO - количество33PO4, поглощенное в лунке, содержащей клетки человека, экспрессирующие пустой вектор, в которую добавили DMSO)) × 100
Значения IC50 (мкM) рассчитывали из прямой, построенной по двум точкам, пересекающей величину 50% степени ингибирования. Значения IC50 для некоторых соединений в отношении поглощения33PO4 клетками человека, экспрессирующими PiT-2, приведены в таблице 43.
[1622]
[1623] Пример испытания 5: Подавление роста концентрации фосфора в сыворотке при вызванной аденином почечной недостаточности у крыс
Аденин принудительно вводили перорально самцам крыс линии Wistar (в возрасте 7-8 недель) с целью нарушения функции почек, в результате чего получали модель гиперфосфатемии (Katsumata K, Kusano K, Hirata M, Tsunemi K, Nagano N, Burke SK, Fukushima N. Sevelamer hydrochloride prevents ectopic calcification and renal osteodystrophy in chronic renal failure rats. Kidney Int. 2003 Aug; 64 (2): 441-50). Каждое испытуемое соединение смешивали с кормом в соотношении 0,1% по массе. Животному вводили заданное количество корма в течение 3 дней. Группу, в которой вводили корм без добавленного испытуемого соединения, использовали в качестве референтной патологической группы, и группу, которую не подвергали воздействию аденина и которой вводили корм без добавки испытуемого соединения, использовали в качестве нормальной группы. Через 3 дня после начала введения испытуемого соединения, собирали кровь из яремной вены и собирали сыворотку. Концентрации фосфора в сыворотке определяли методом Фиске-Субарроу. Степень подавления роста концентрации фосфора в сыворотке определяли по следующей формуле:
[1624] Степень (%) подавления роста концентрации фосфора в сыворотке = (1 - [(концентрация фосфора в сыворотке в патологической группе, обработанной испытуемым соединением) - (концентрация фосфора в сыворотке в нормальной группе)] / [(концентрация фосфора в сыворотке в референтной патологической группе) - (концентрация фосфора в сыворотке в нормальной группе)]) × 100
В результате, было подтверждено, что каждое испытуемое соединение обладает эффектом подавления роста концентрации фосфора в сыворотке. В таблице 44 приведена степень (%) подавления роста концентрации фосфора в сыворотке для каждого испытуемого соединения.
[1625]
[1626]
[1627]
[1628]
[1629]
[1630] Пример испытания 6: Подавление роста концентрации фосфора в сыворотке при вызванной аденином почечной недостаточности у крыс
Каждую крысу с почечной недостаточностью, вызванной аденином, готовили так же, как в примере испытания 5. Каждое испытуемое соединение смешивали с кормом в соотношении 0,05% по массе. Животному вводили заданное количество корма в течение 8 дней. Группу, в которой вводили корм без добавленного испытуемого соединения, использовали в качестве референтной патологической группы, и группу, которую не подвергали воздействию аденина и которой вводили корм без добавки испытуемого соединения, использовали в качестве нормальной группы. Через 8 дней после начала введения испытуемого соединения, собирали кровь из яремной вены и собирали сыворотку. Концентрации фосфора в сыворотке определяли методом Фиске-Субарроу. Степень подавления роста концентрации фосфора в сыворотке определяли по следующей формуле:
[1631] Степень (%) подавления роста концентрации фосфора в сыворотке = (1 - [(концентрация фосфора в сыворотке в патологической группе, обработанной испытуемым соединением) - (концентрация фосфора в сыворотке в нормальной группе)] / [(концентрация фосфора в сыворотке в референтной патологической группе) - (концентрация фосфора в сыворотке в нормальной группе)]) × 100
В результате, было подтверждено, что каждое испытуемое соединение обладает эффектом подавления роста концентрации фосфора в сыворотке. В таблице 45 приведена степень (%) подавления роста концентрации фосфора в сыворотке для каждого испытуемого соединения.
[1632] [Таблица 45]
Реферат
Настоящее изобретение предлагает производное дигидропиридазин-3,5-диона или его фармацевтически приемлемую соль, профилактическое и/или терапевтическое средство при гиперфосфатемии, вторичном гиперпаратиреозе и хронической почечной недостаточности, включающие соединение в качестве активного ингредиента. Предлагаемое изобретение позволяет решить проблемы, возникающие при применении адсорбентов фосфора. 4 н. и 14 з.п. ф-лы, 45 табл., 418 пр.
Формула
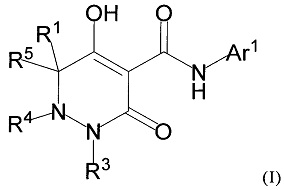
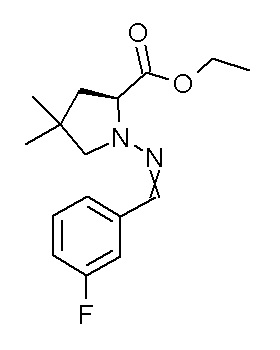
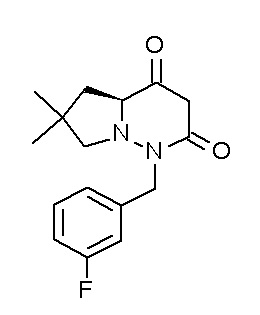
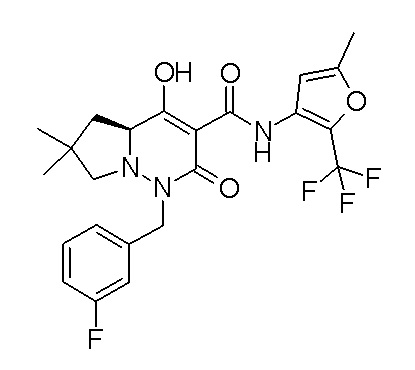
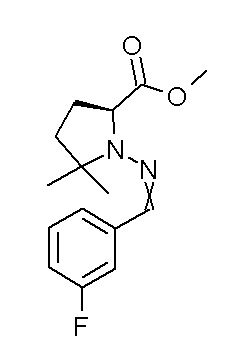
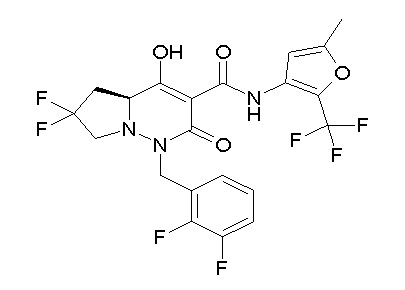
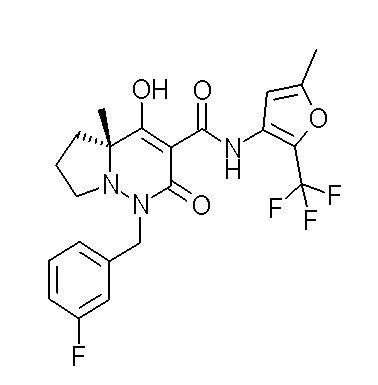
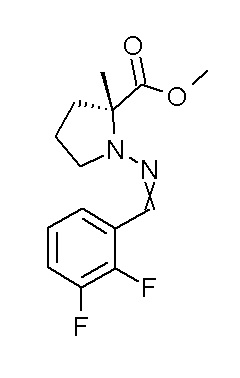
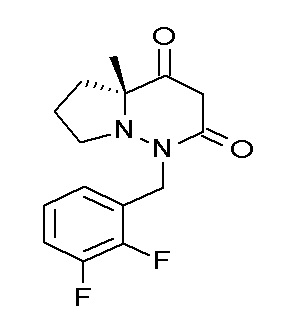
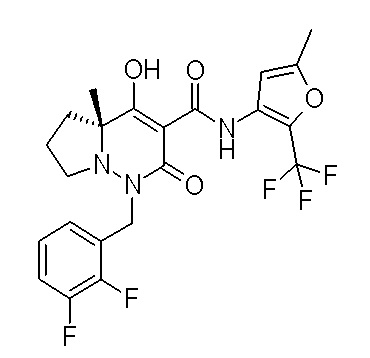
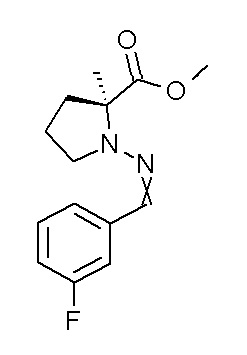
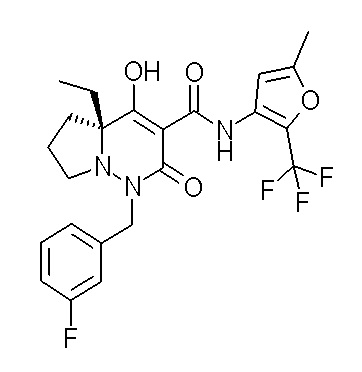
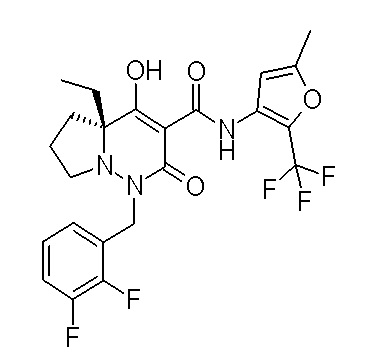
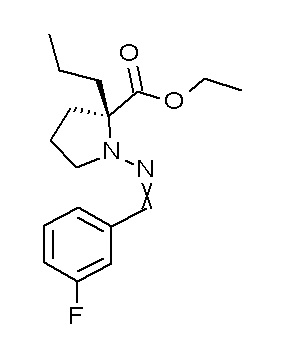
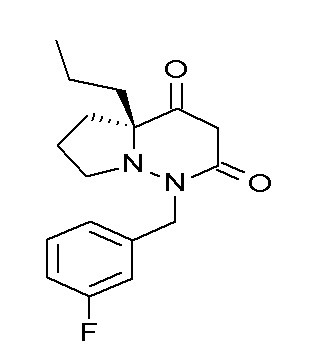
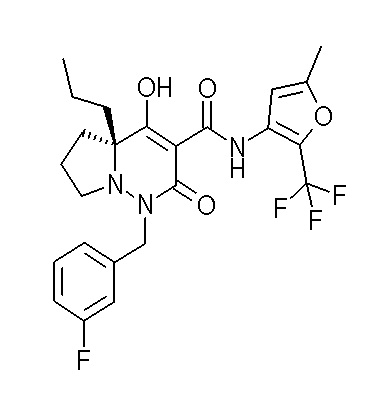
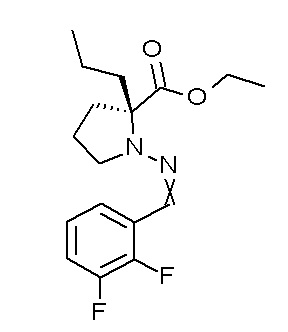
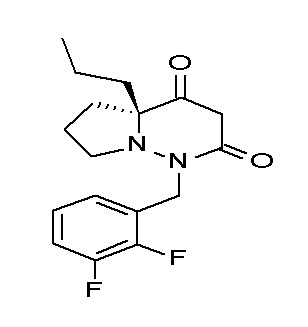
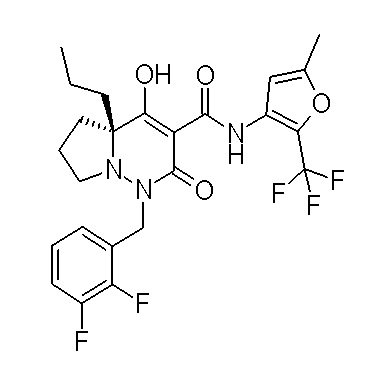

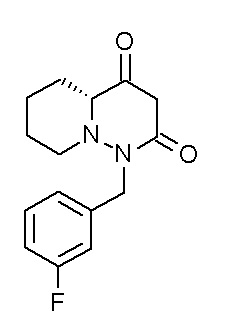
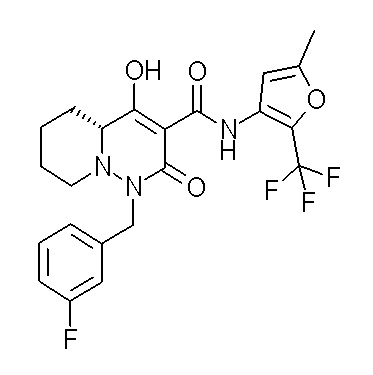
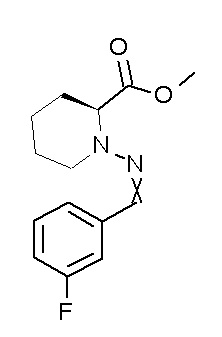
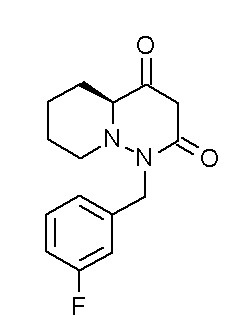
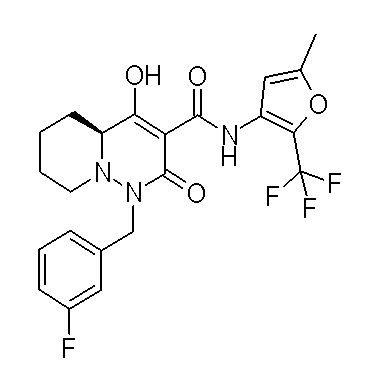
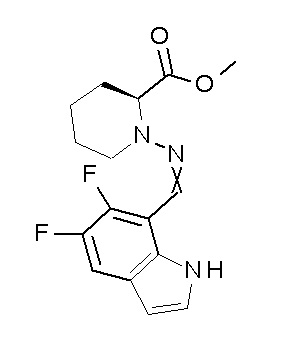
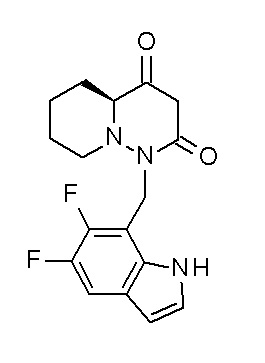
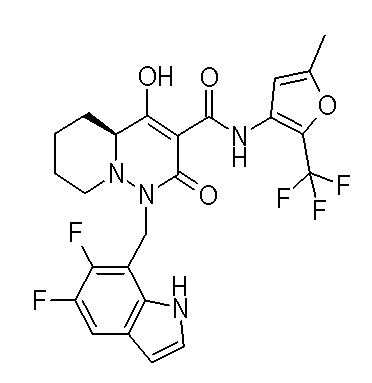
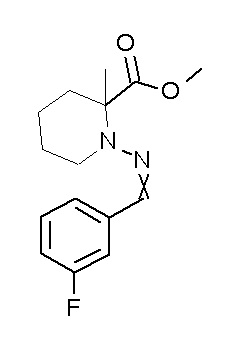

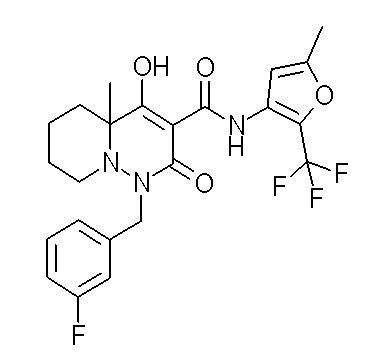
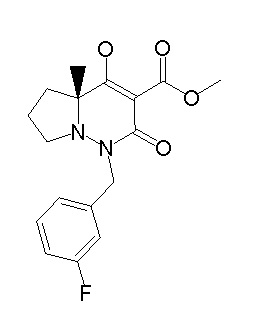
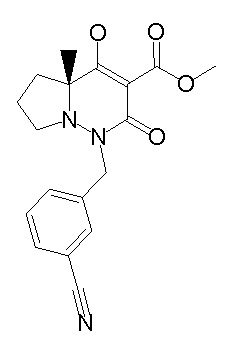
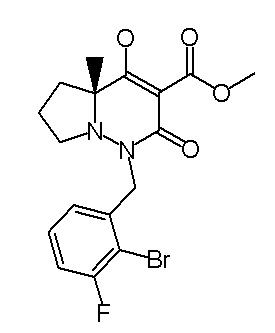
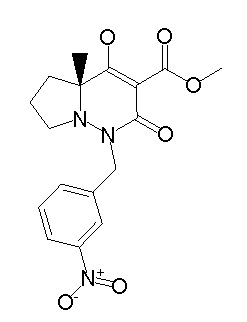
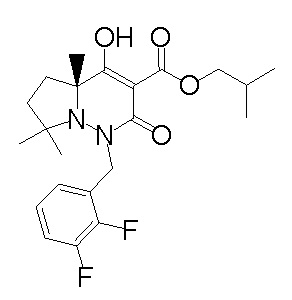
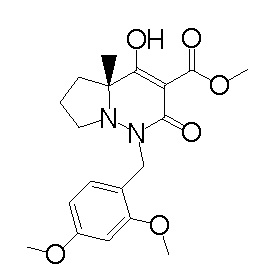
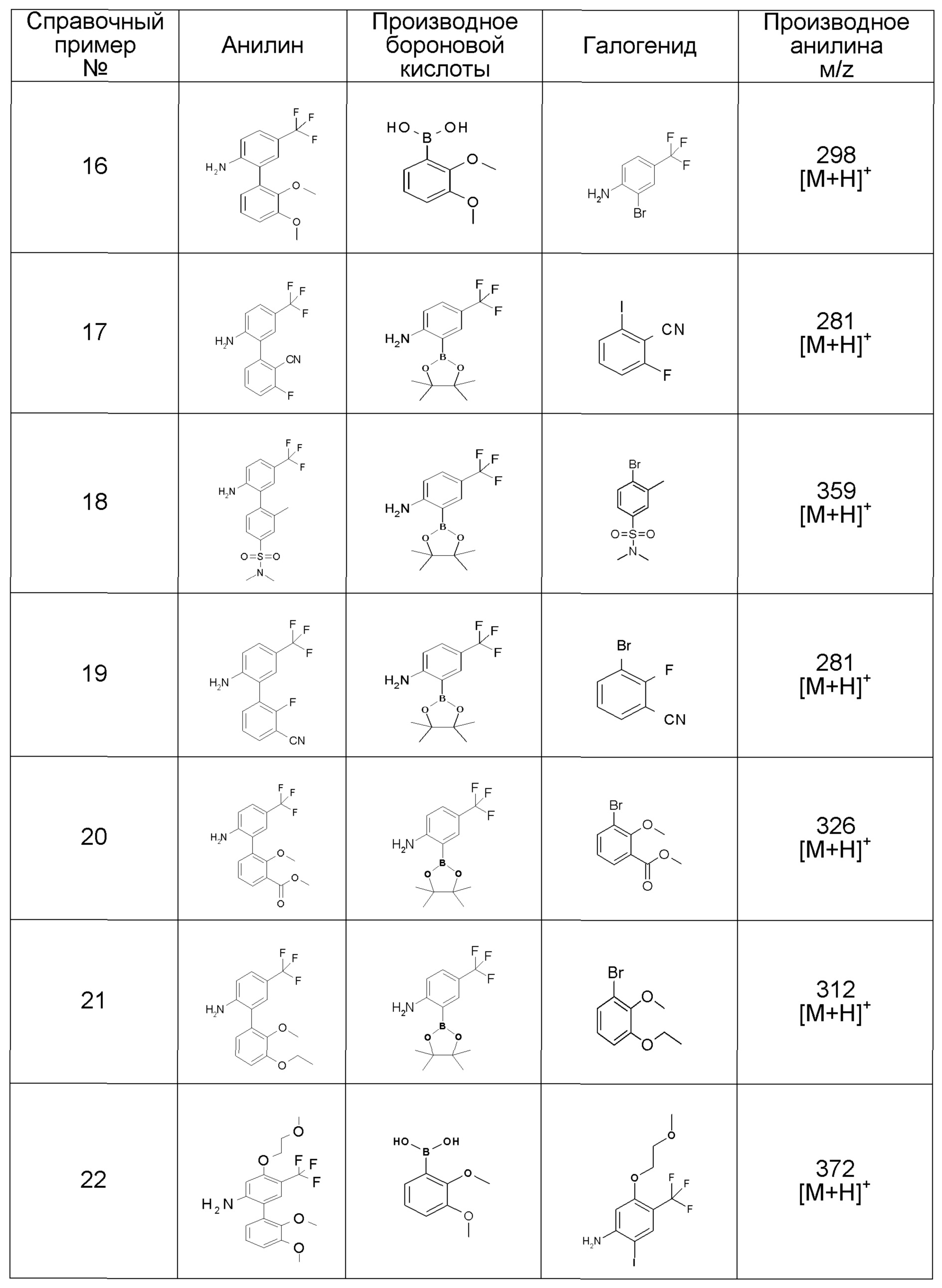
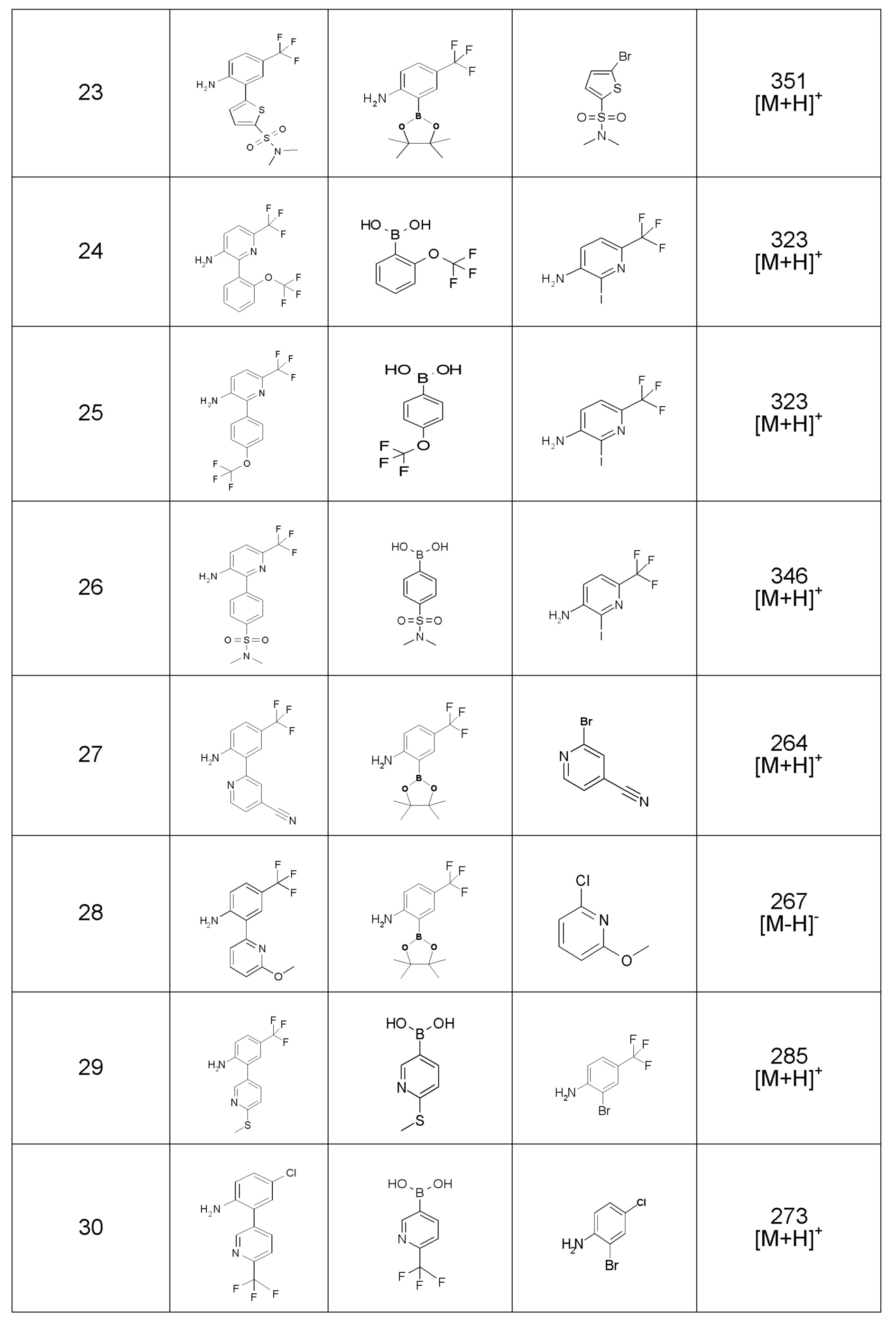
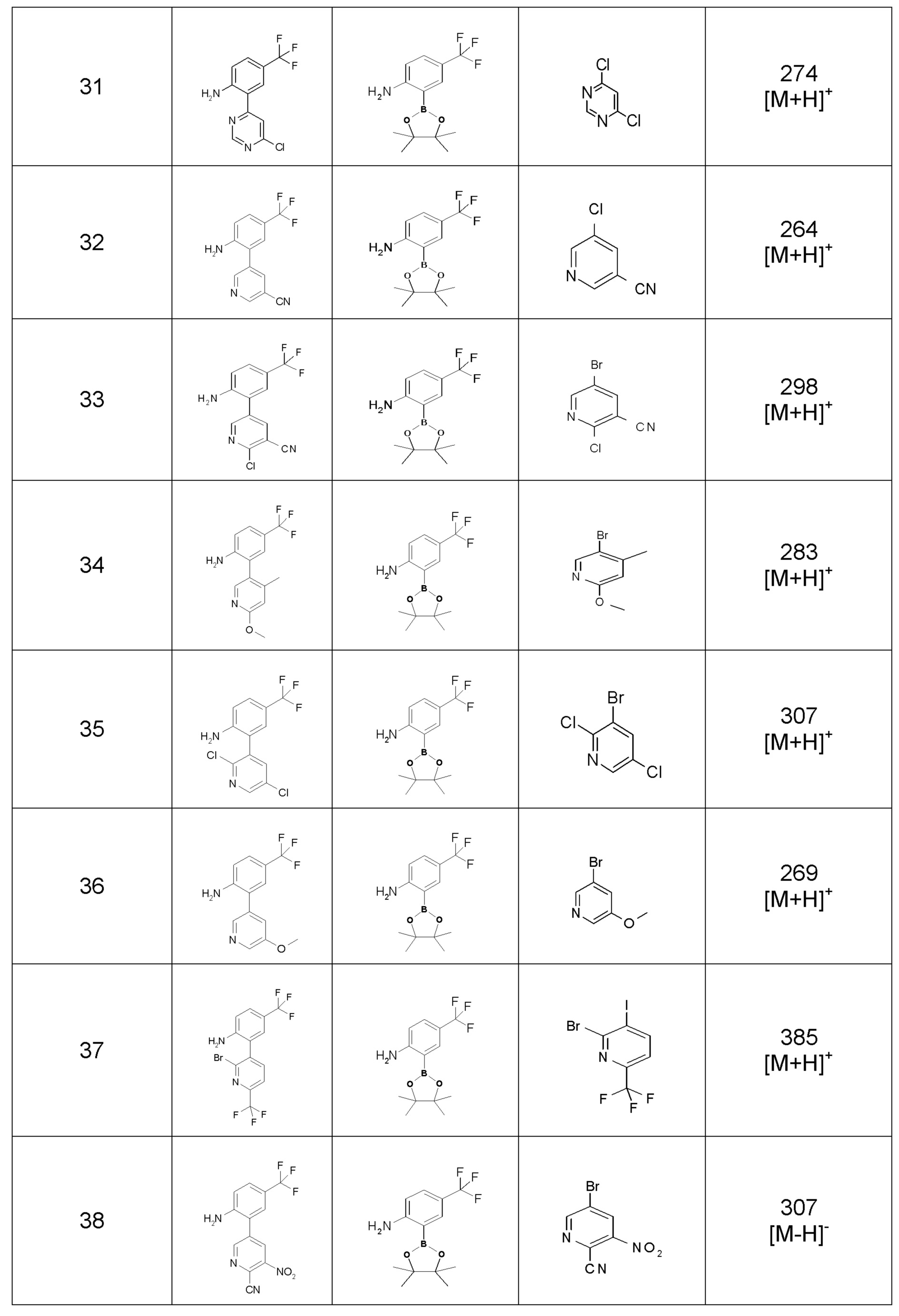
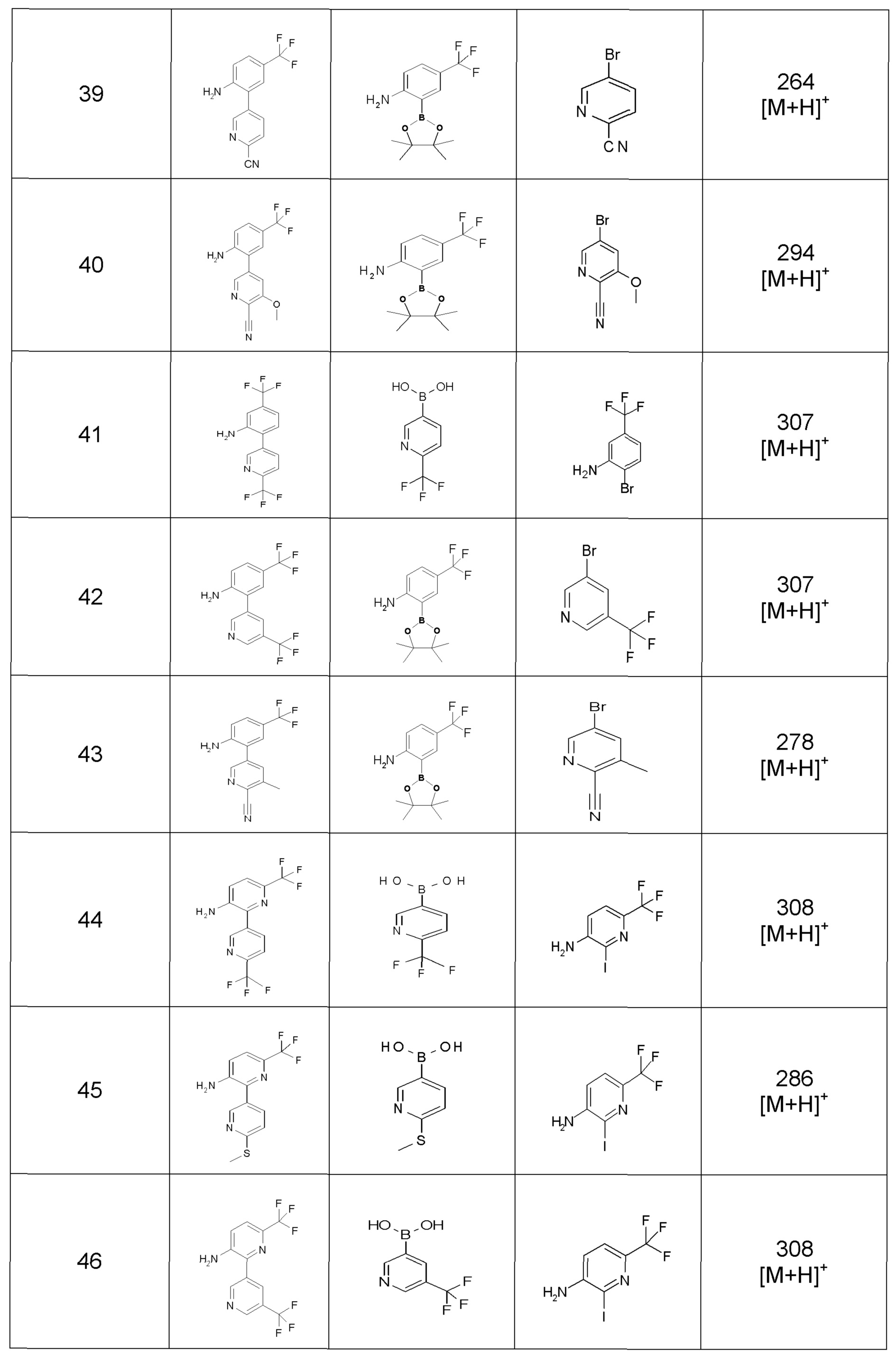
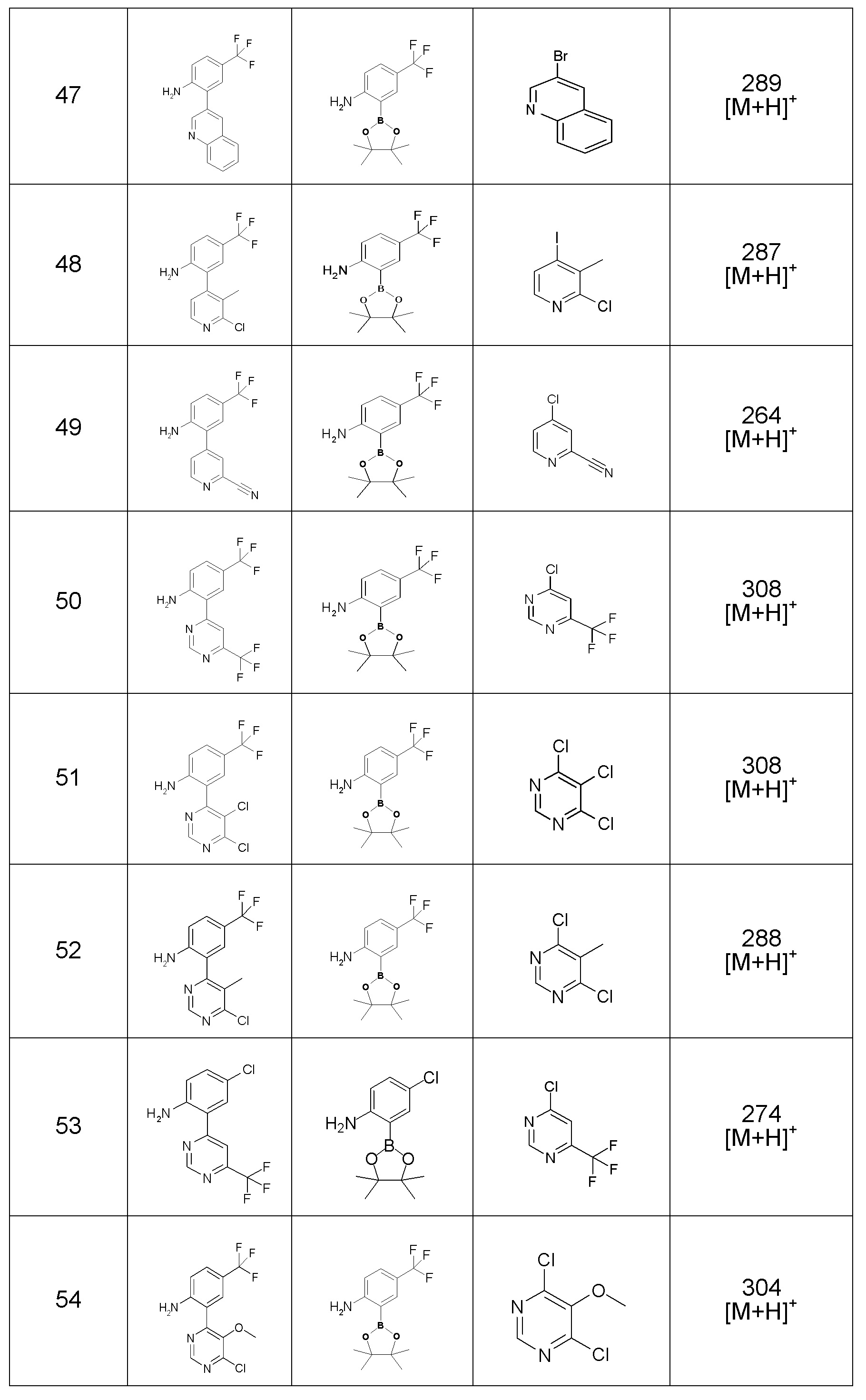
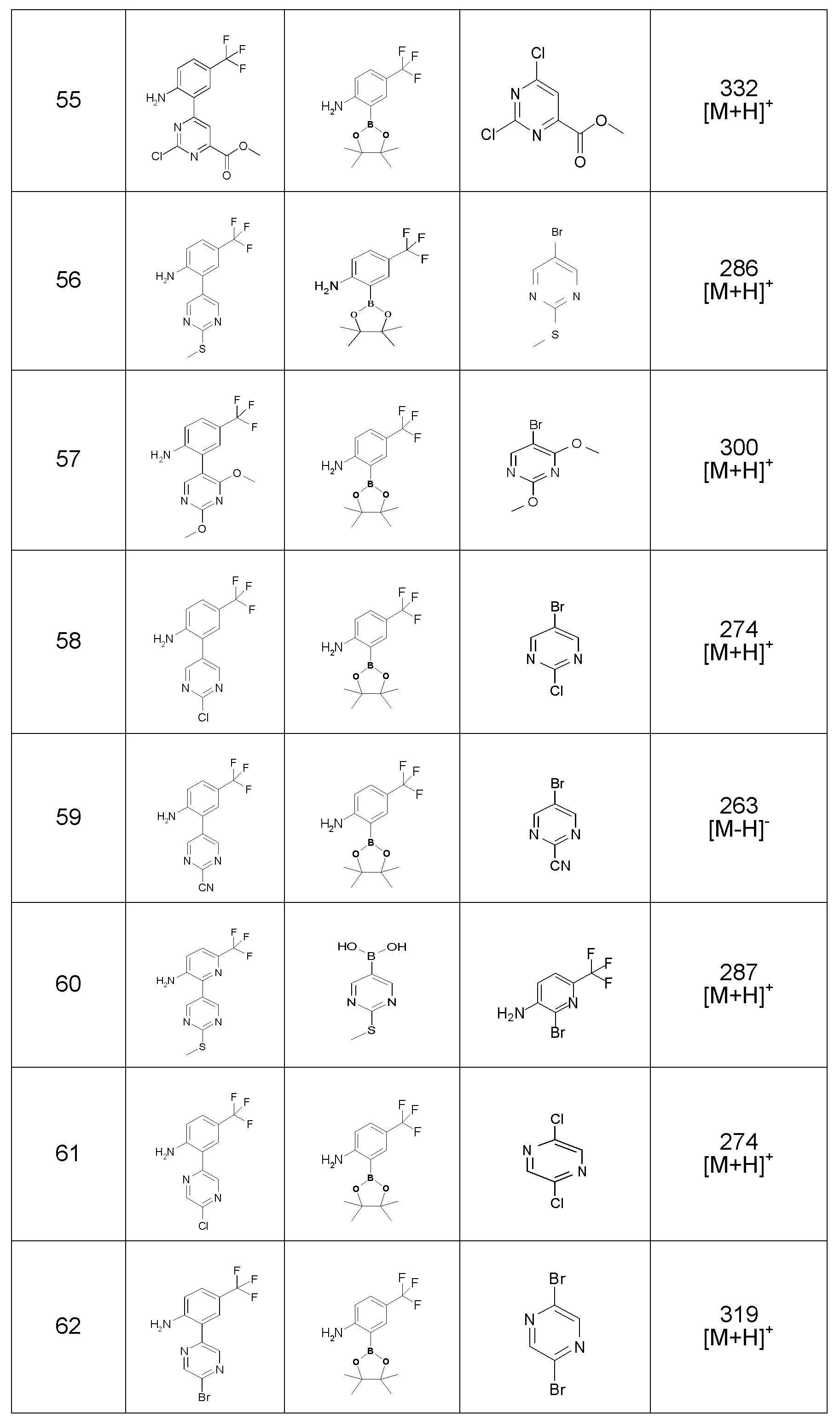
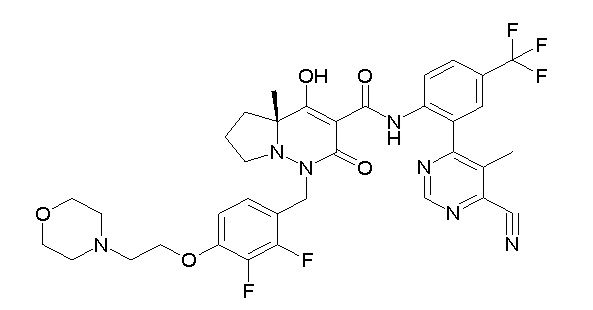
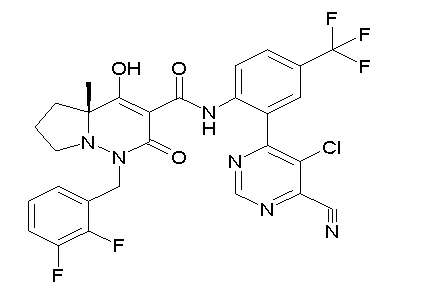
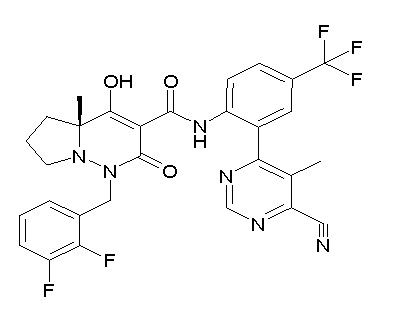
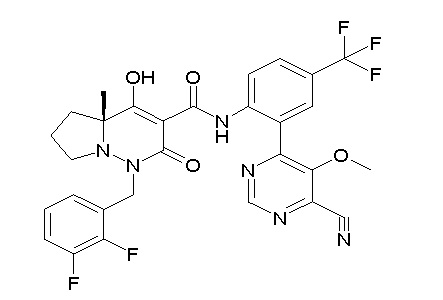
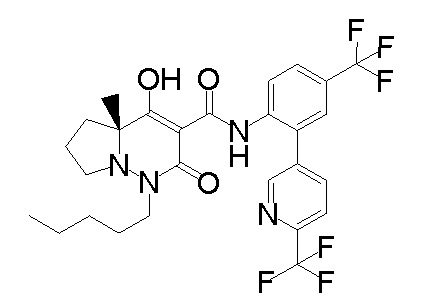

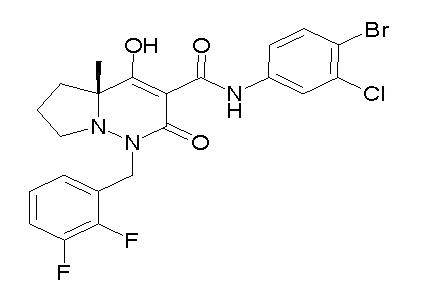
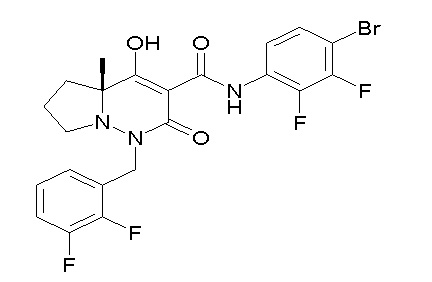
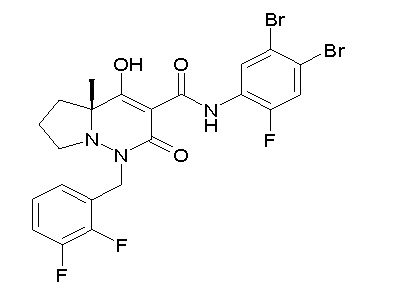
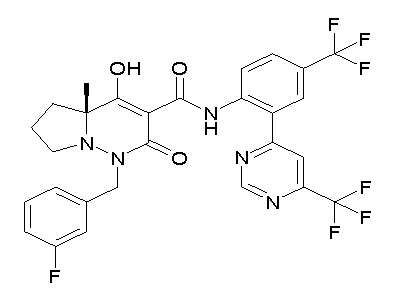
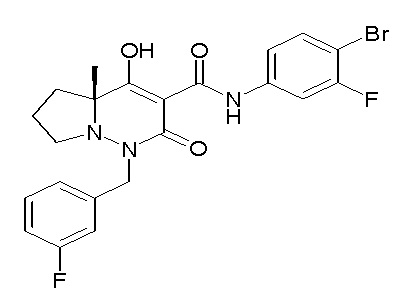

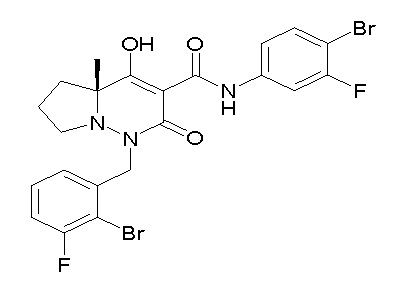
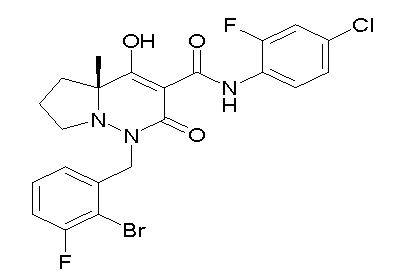
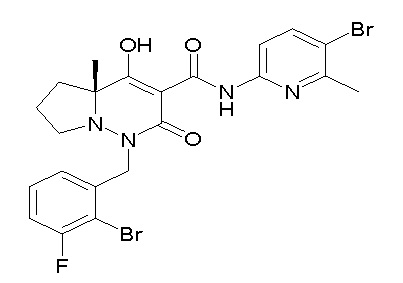
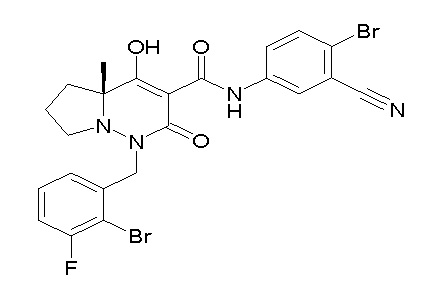
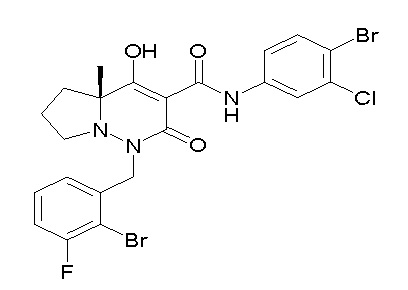
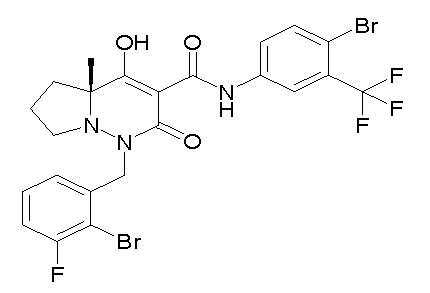
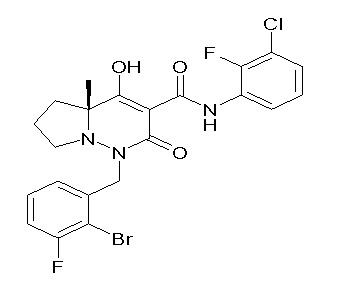
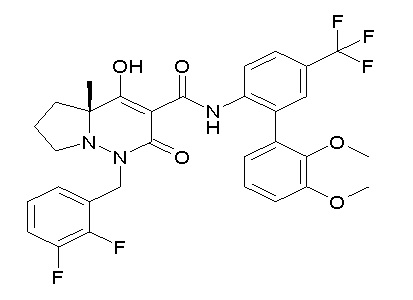
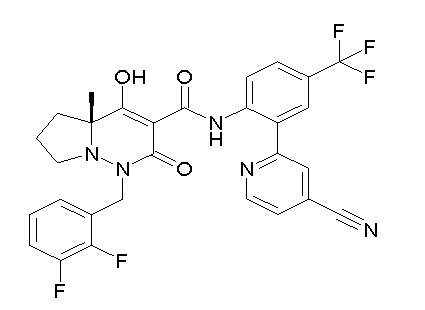
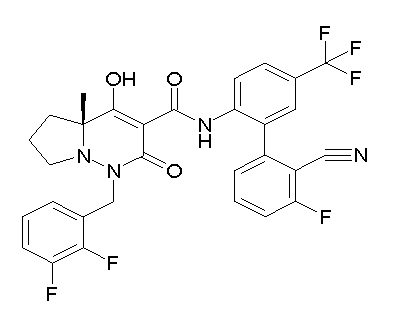
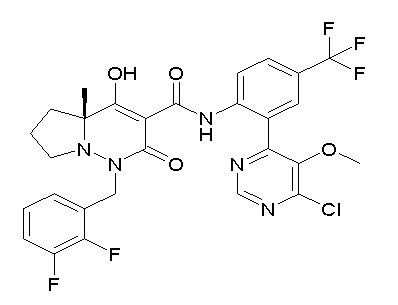
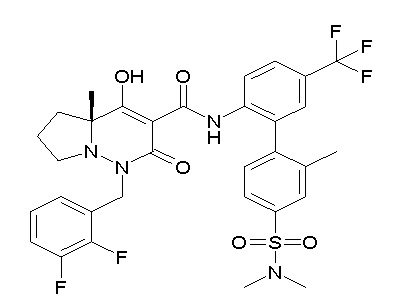
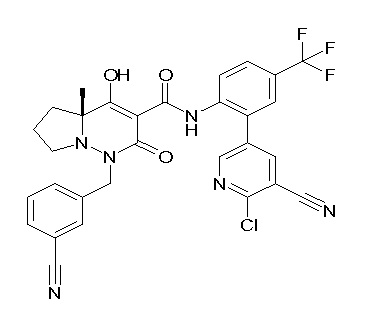
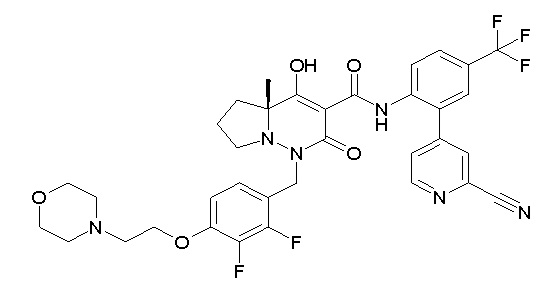
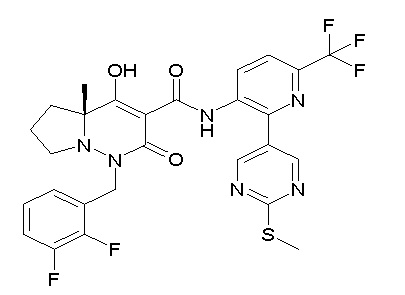
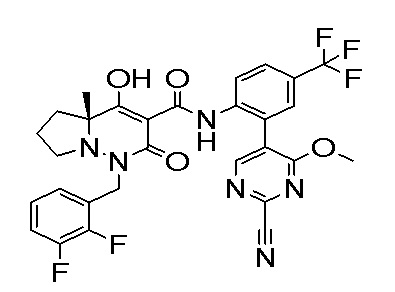
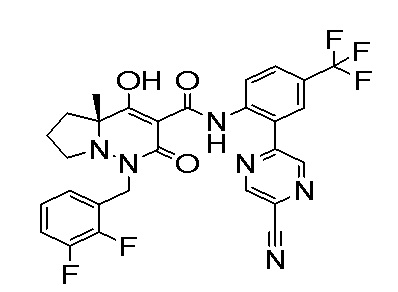
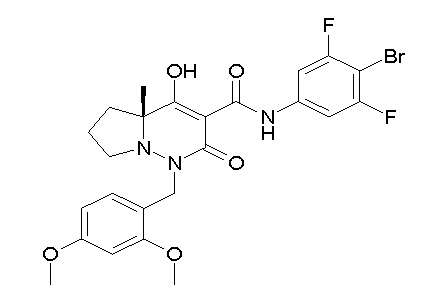
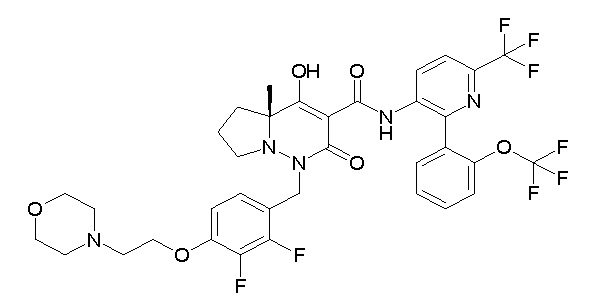

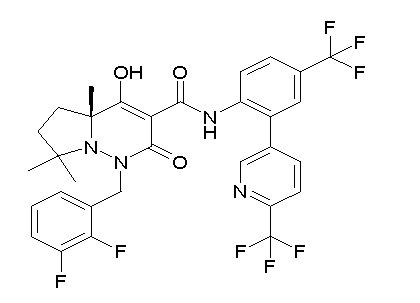
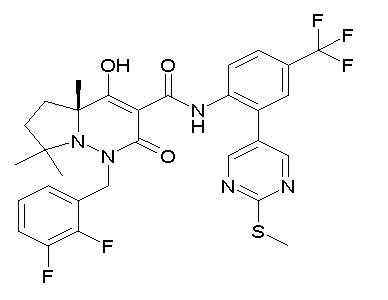
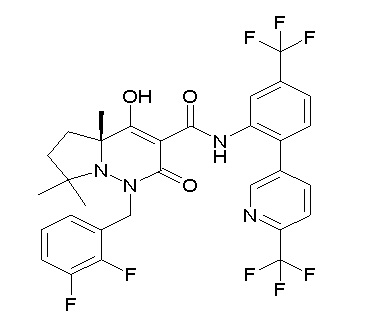
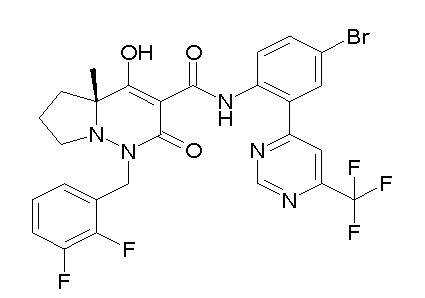
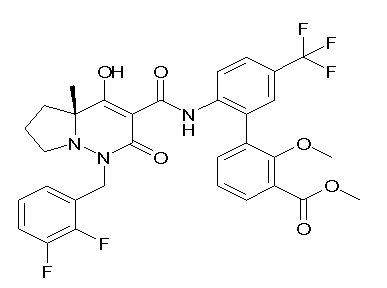
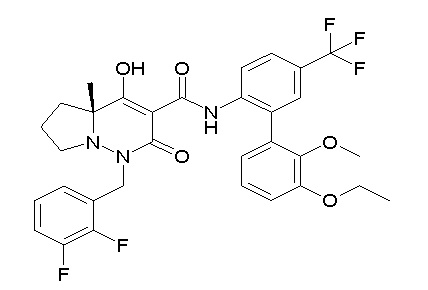
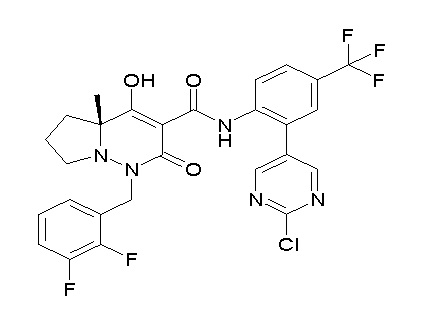
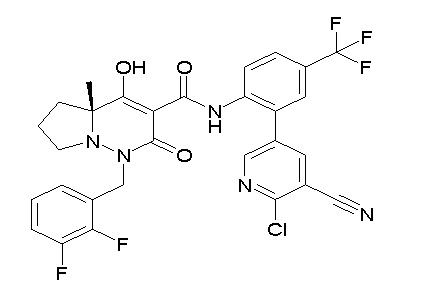
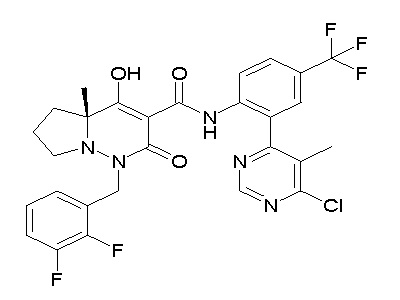
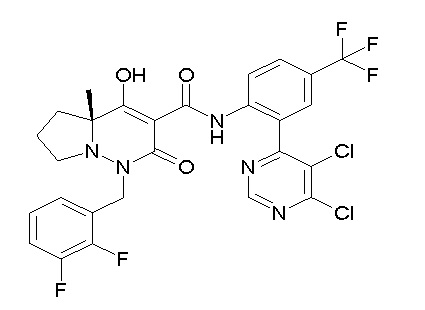
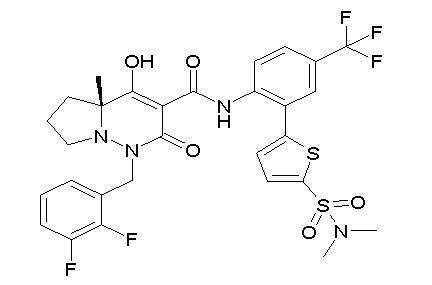
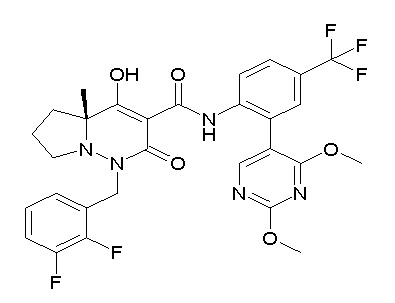
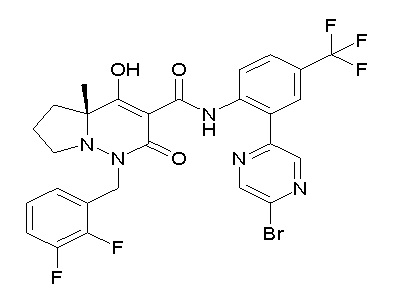
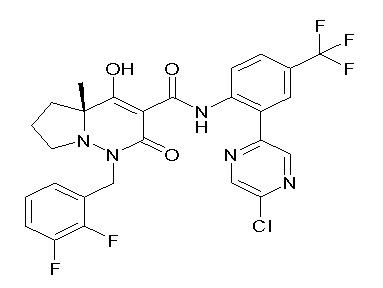
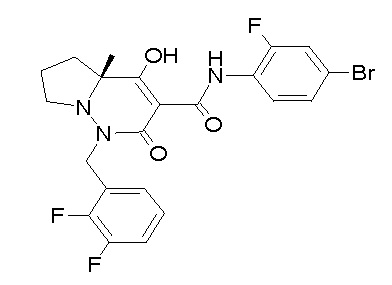
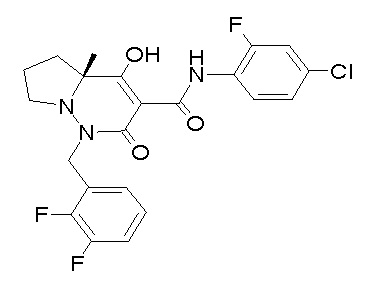
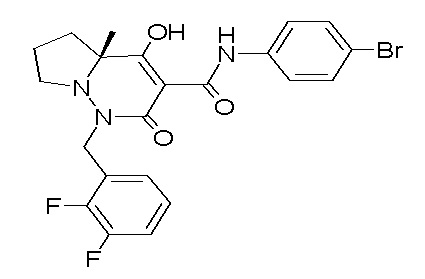

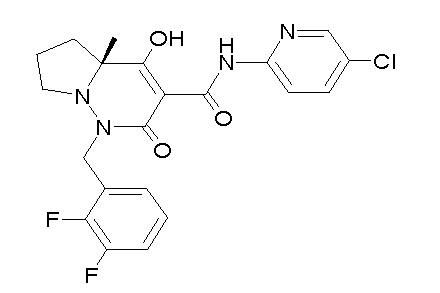
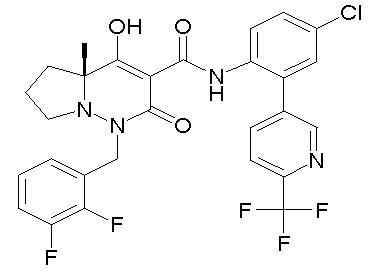
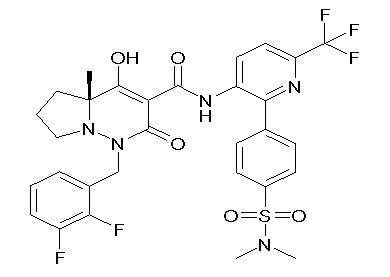
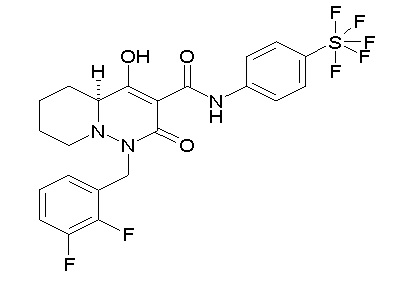
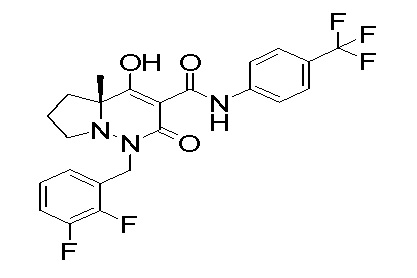
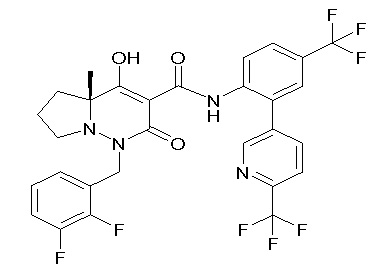
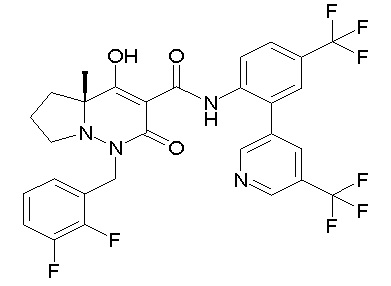
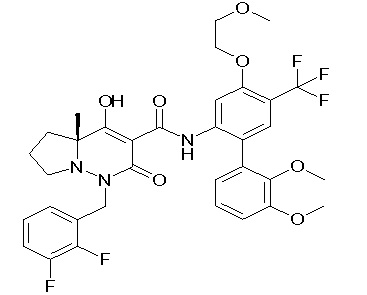
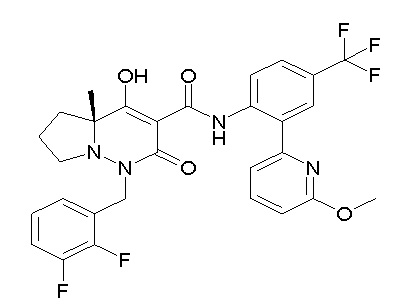
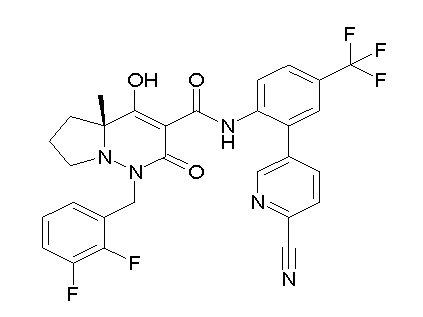
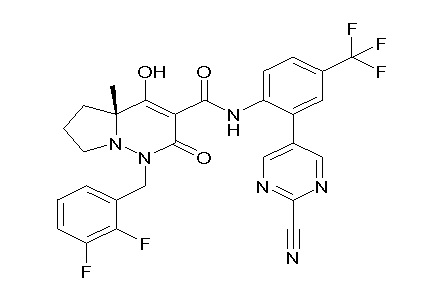
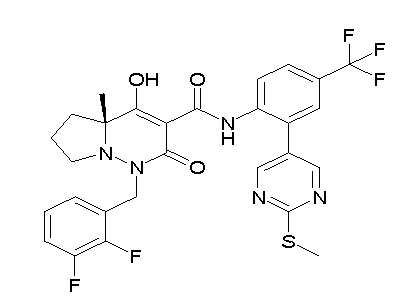
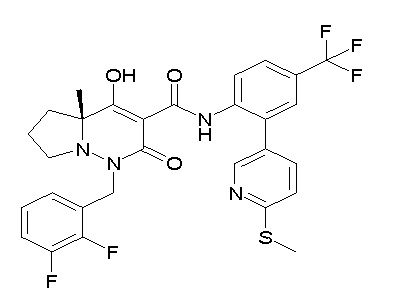
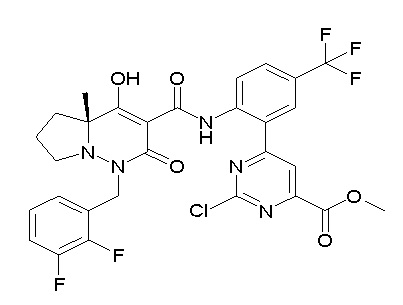
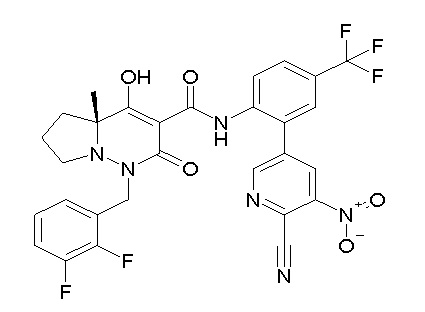
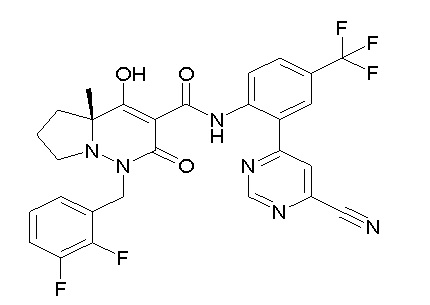
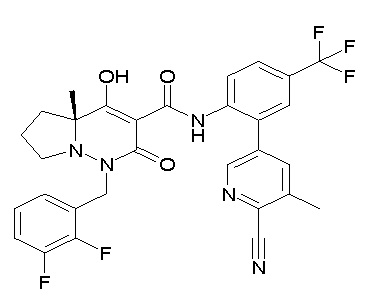
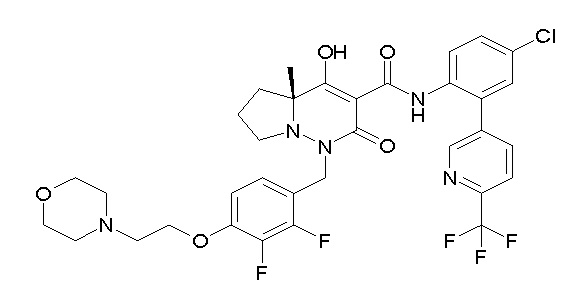
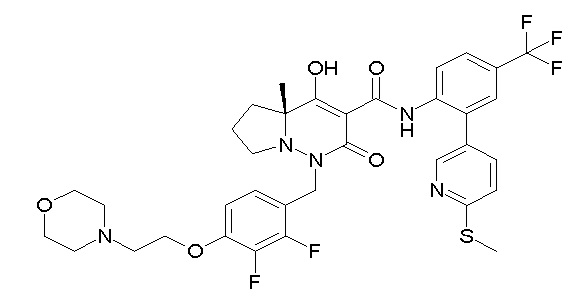
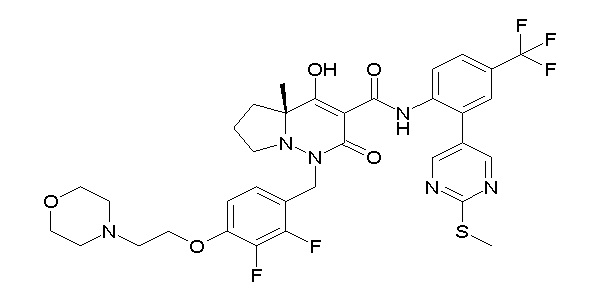
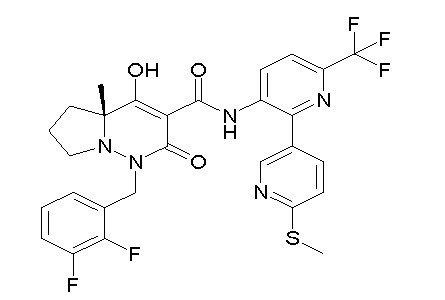
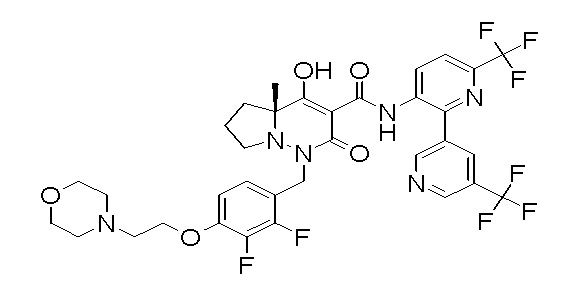
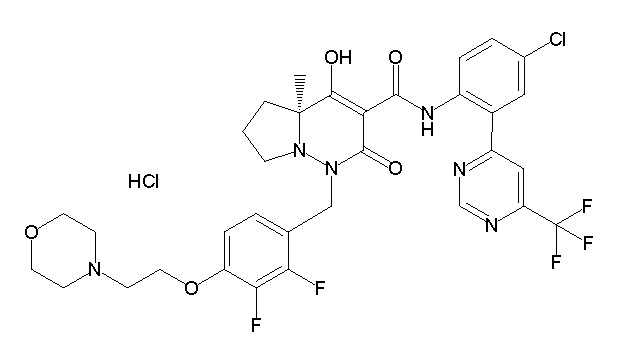
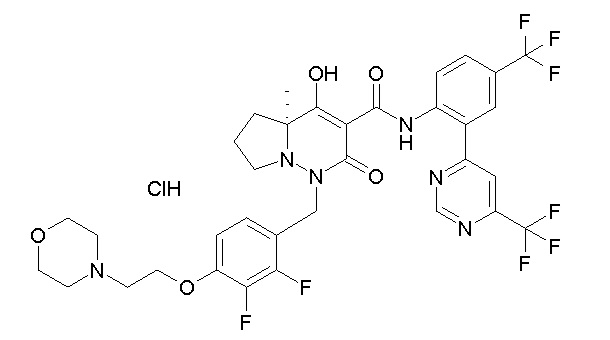
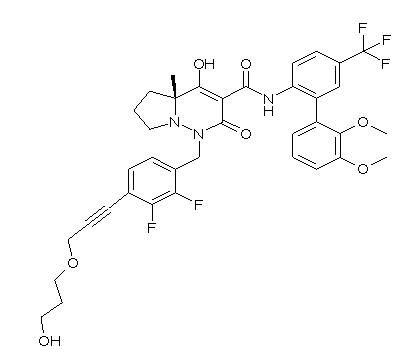
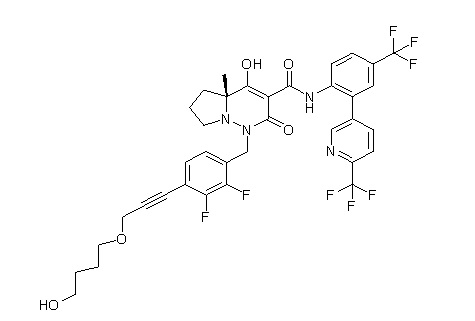
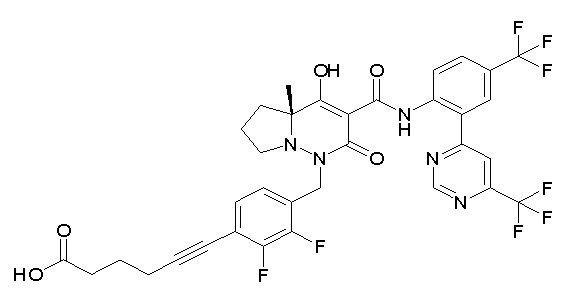
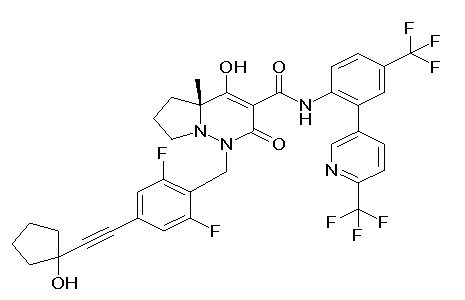
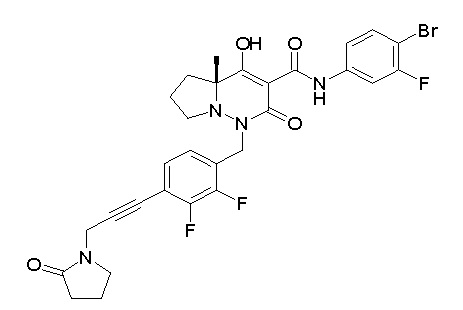
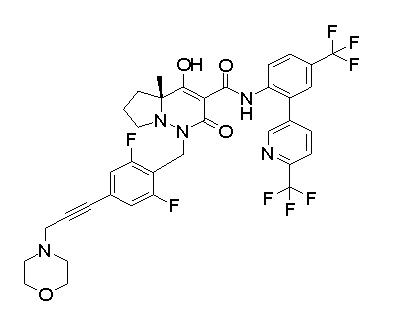
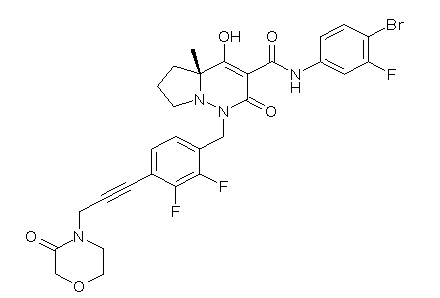
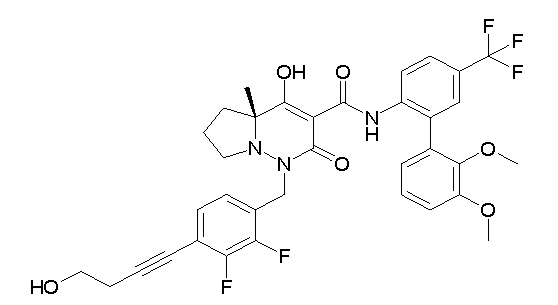
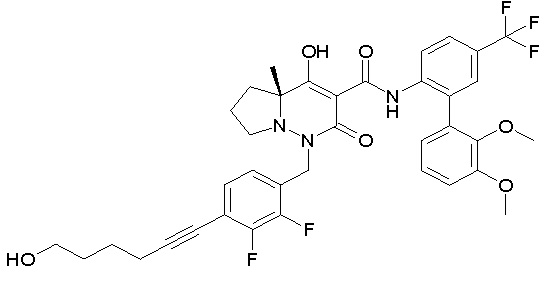
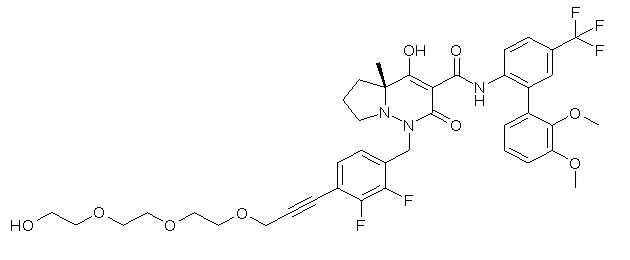
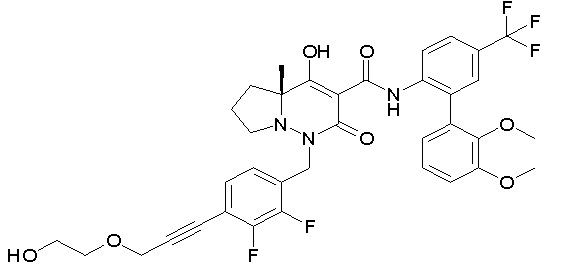
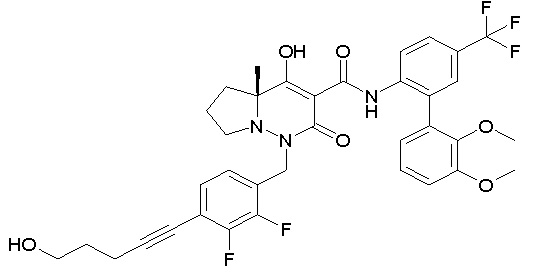
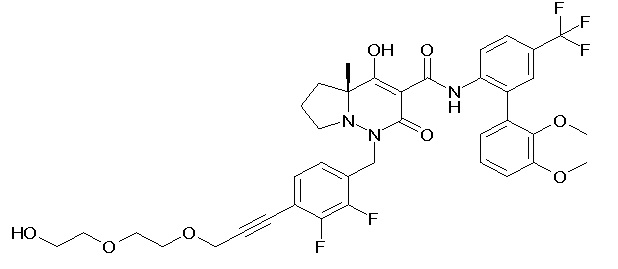
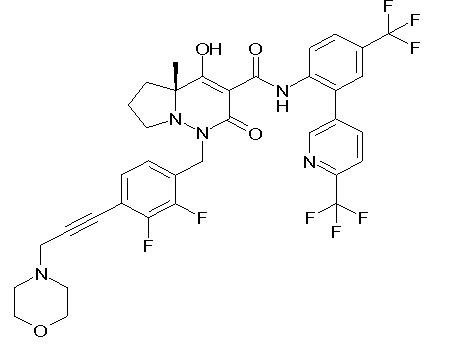

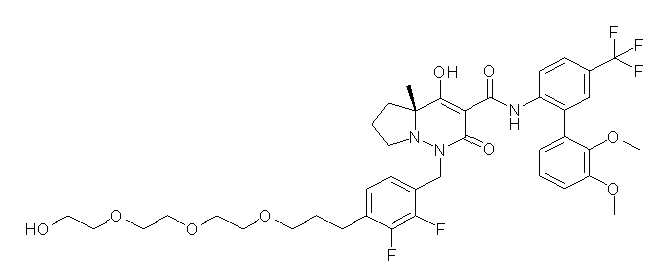
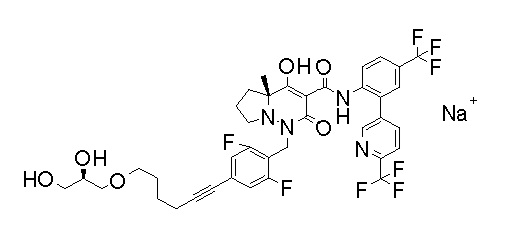
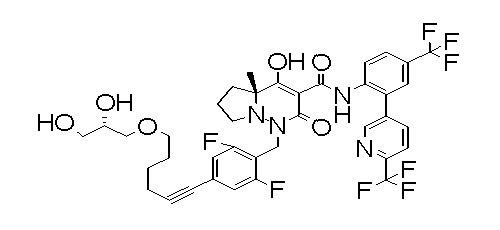
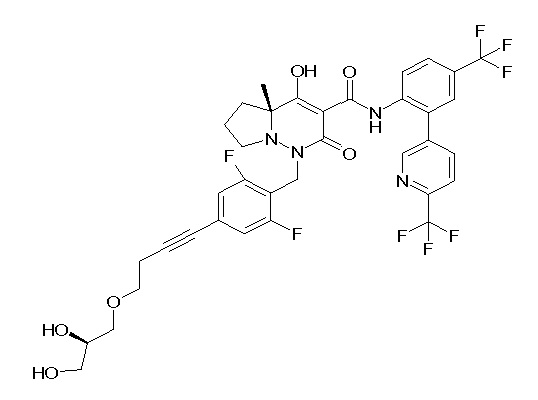
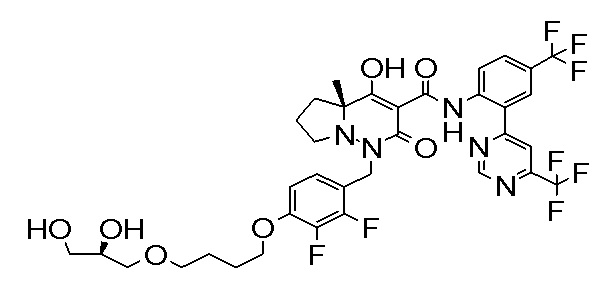
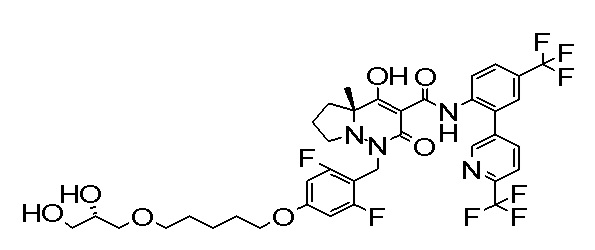
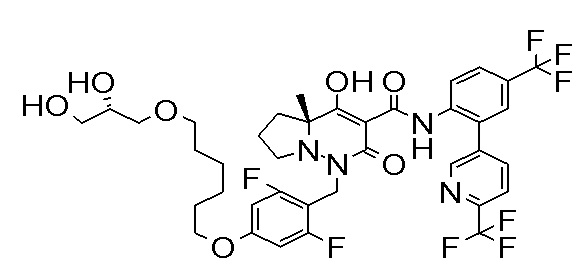
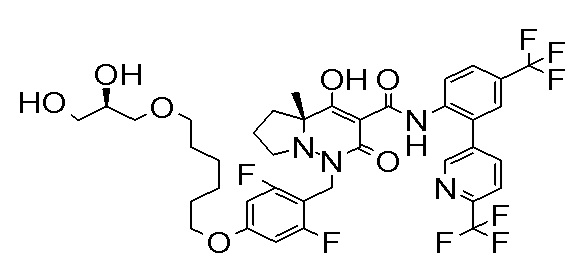
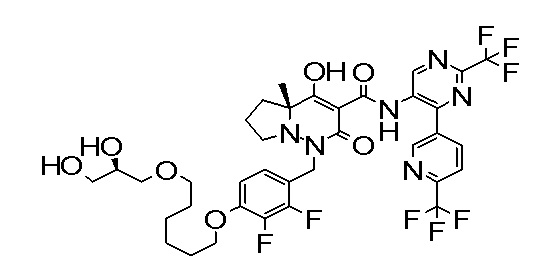
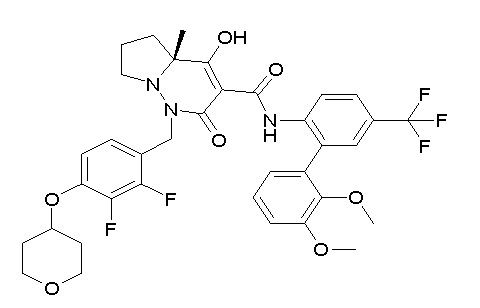
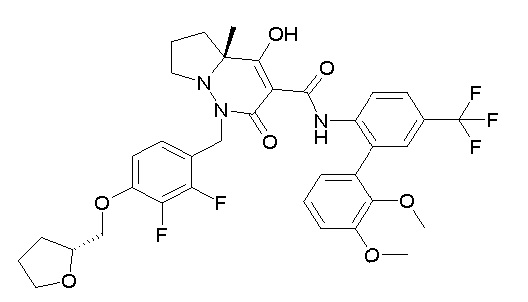
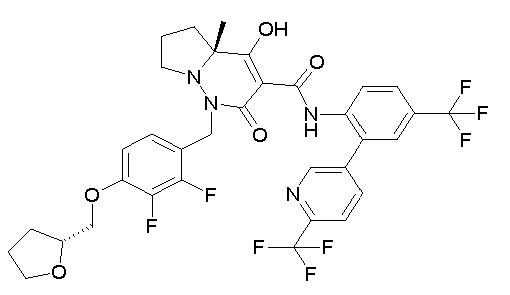
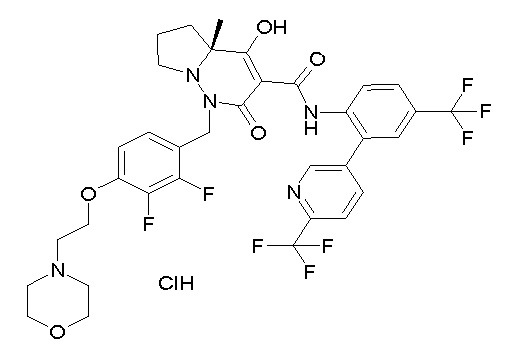
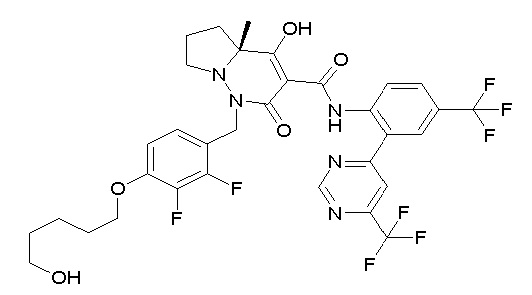
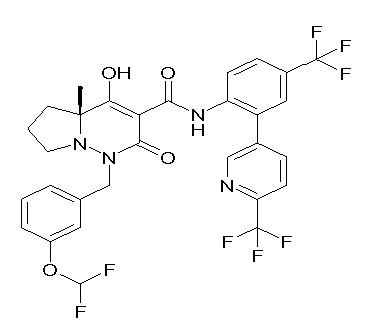
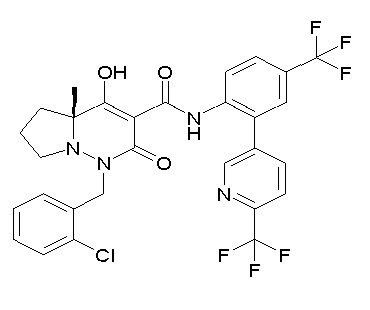

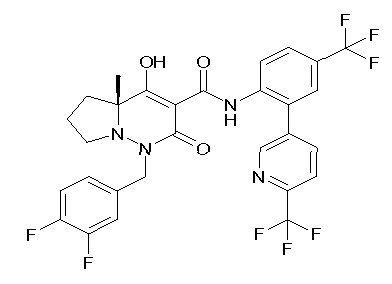
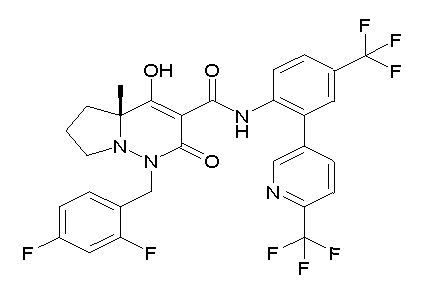
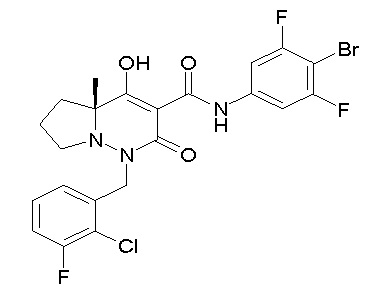
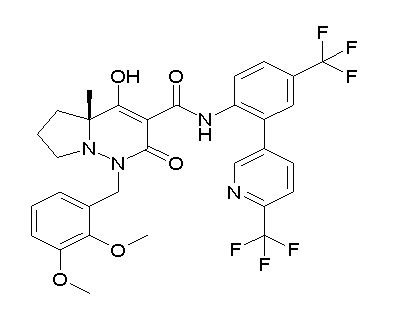
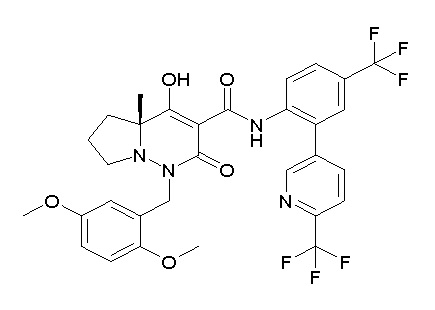
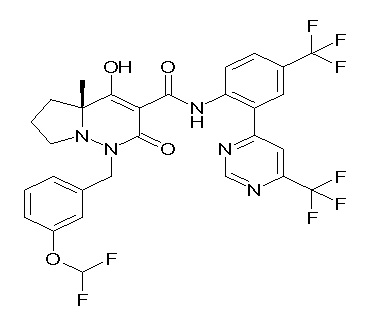
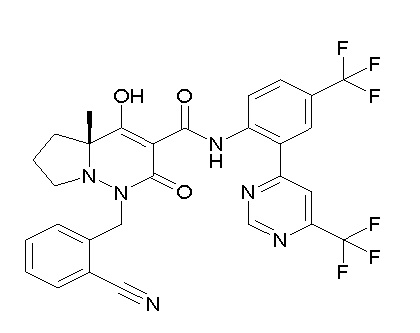
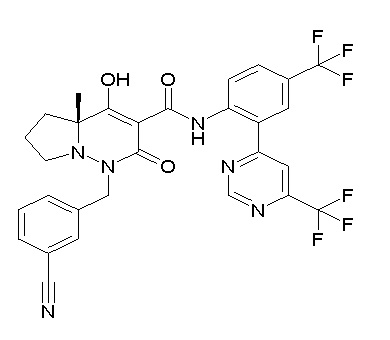
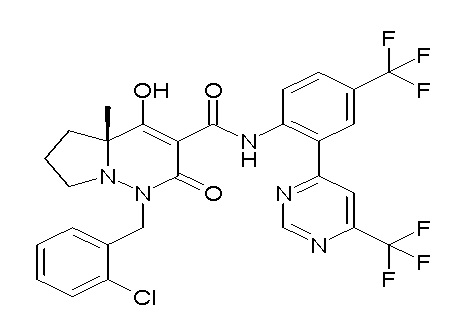
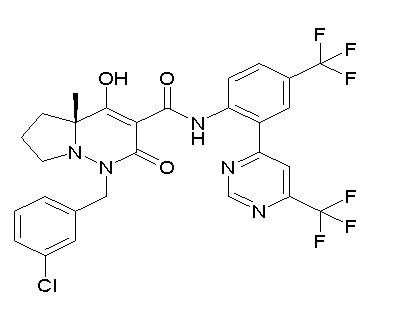
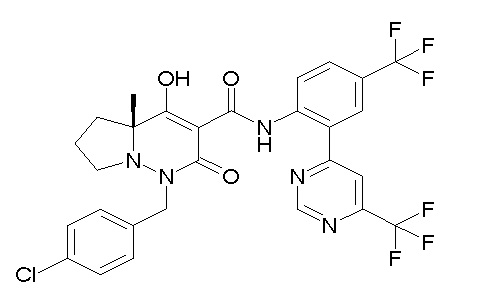
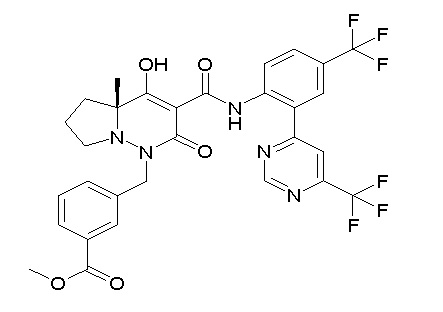
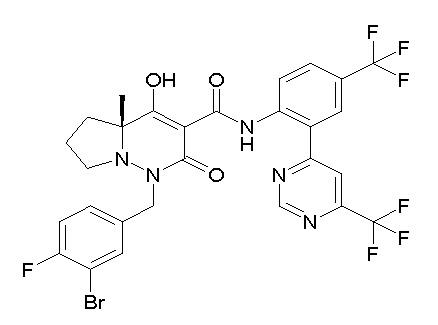
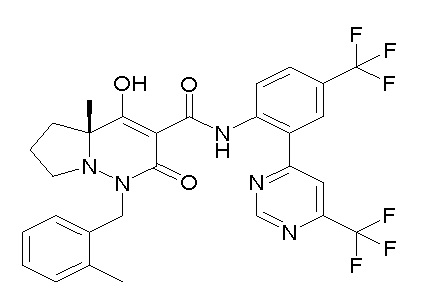
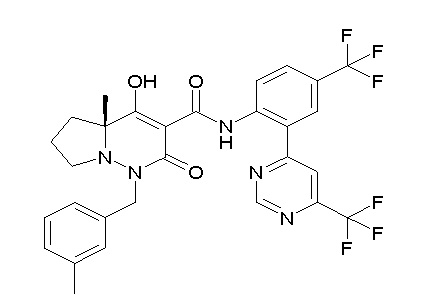
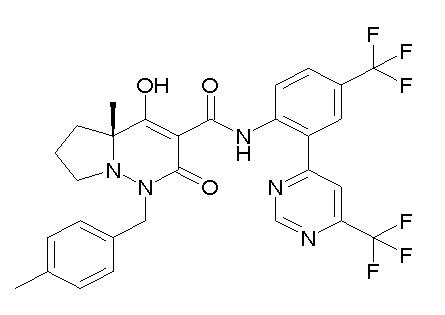
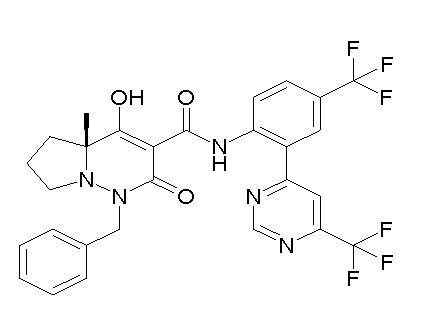
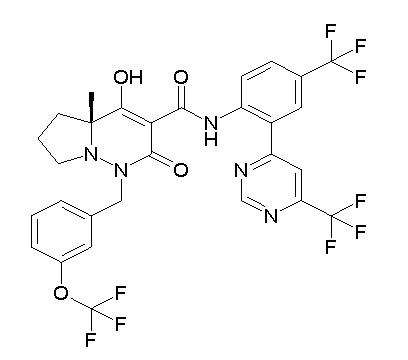
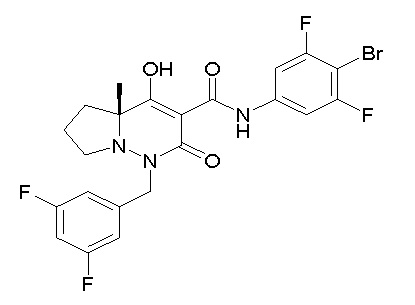
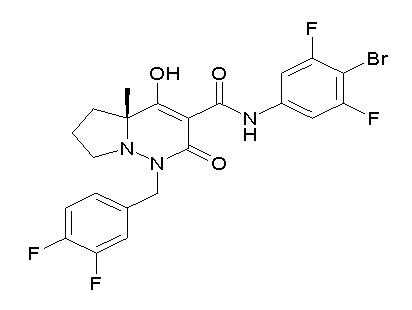
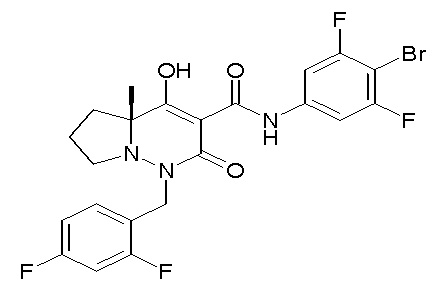
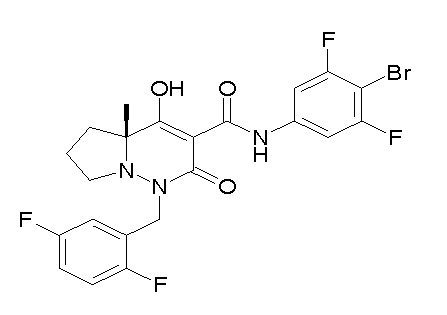
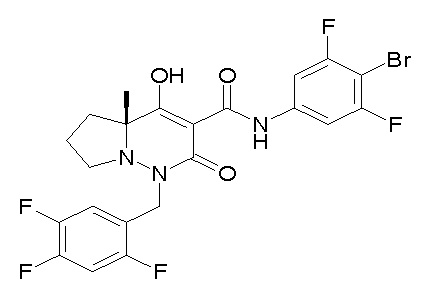
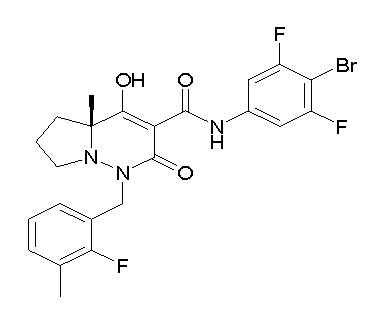
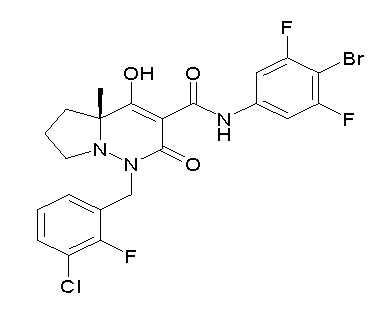
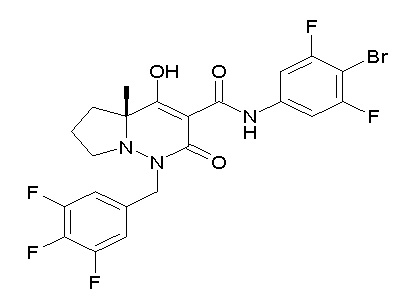
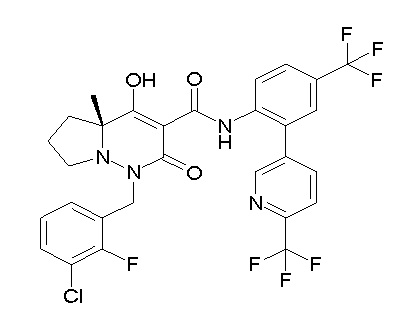
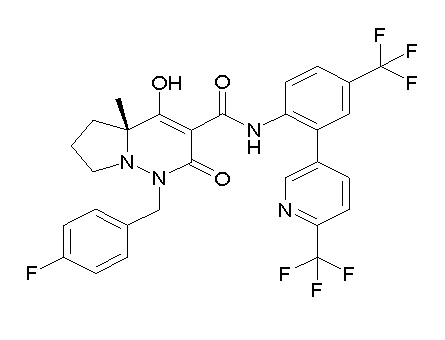
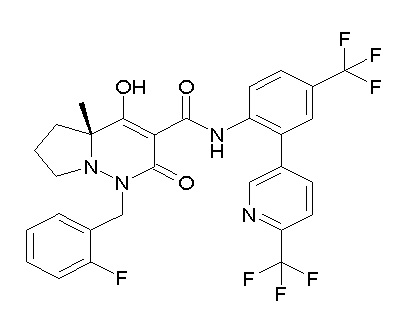
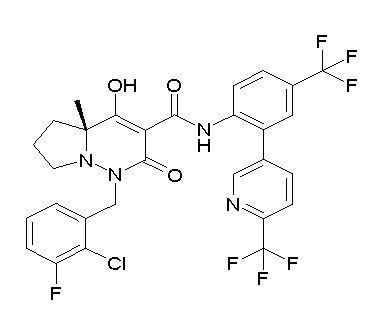
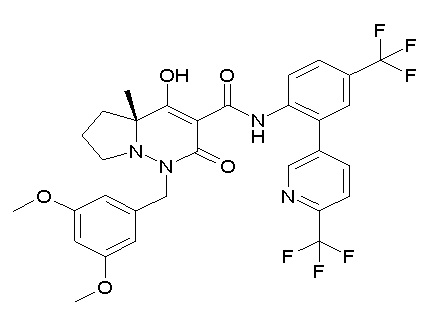
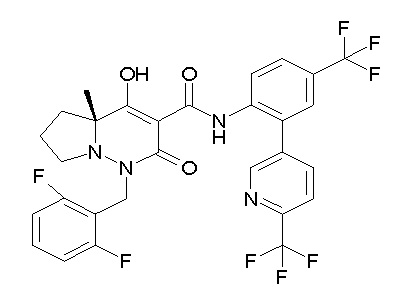
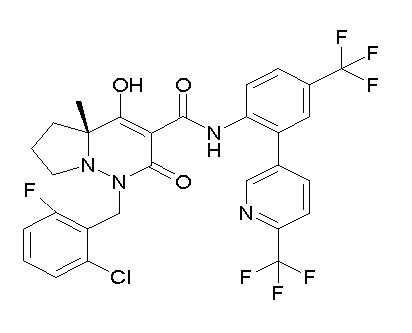
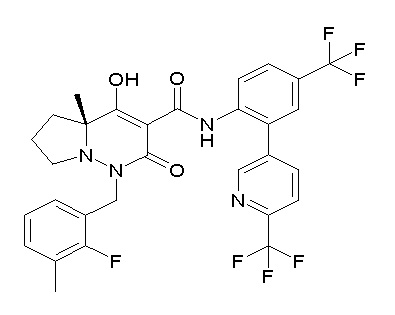
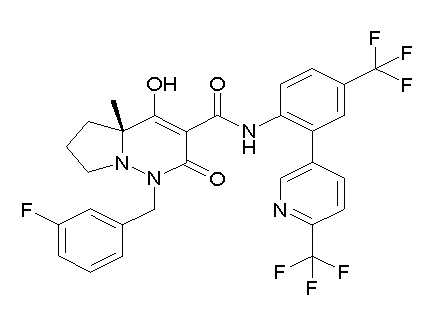
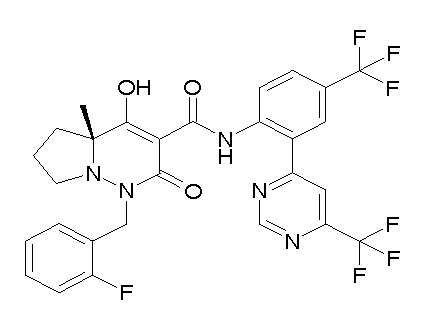
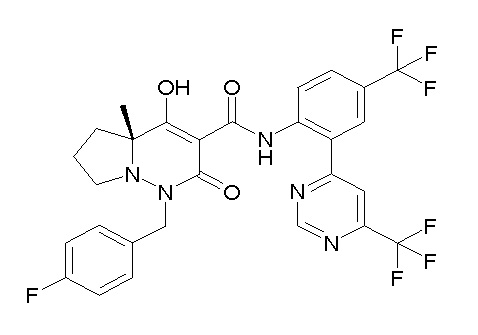
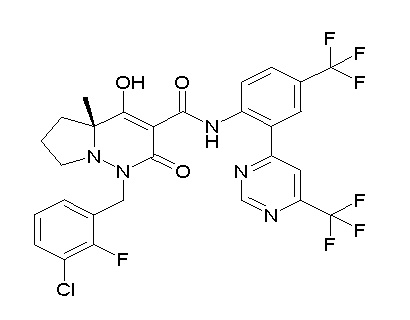
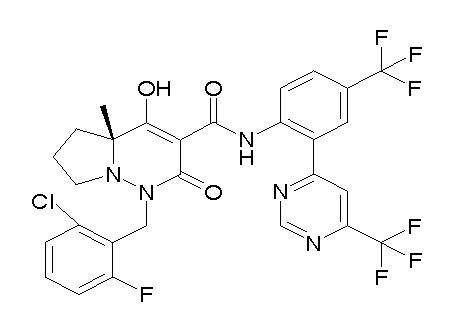
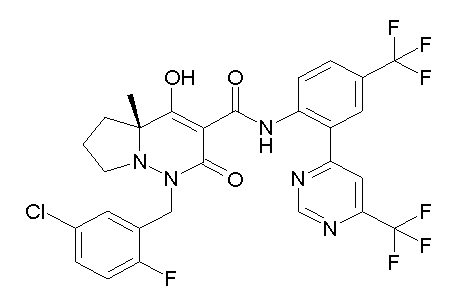
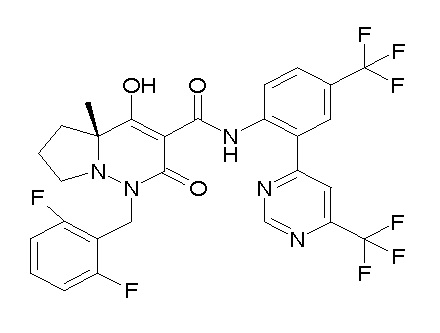
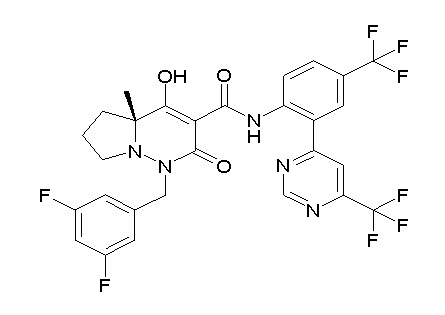
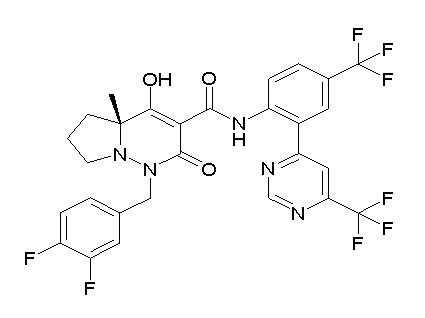
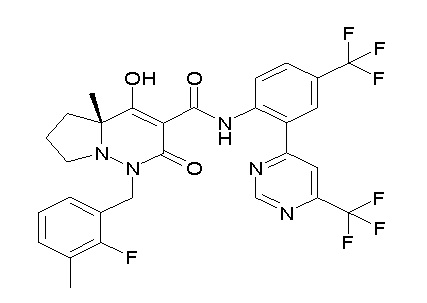
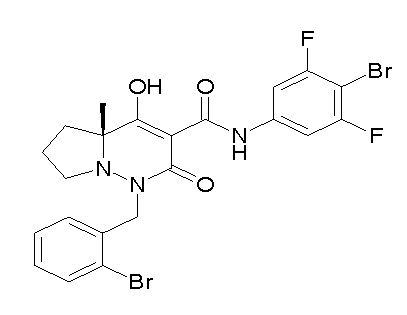
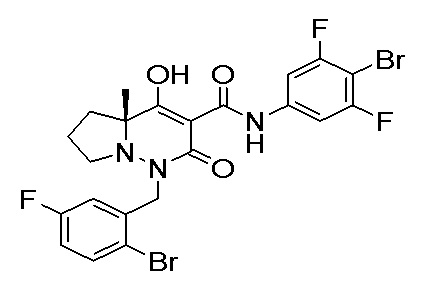
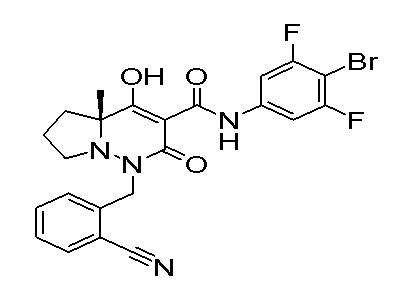
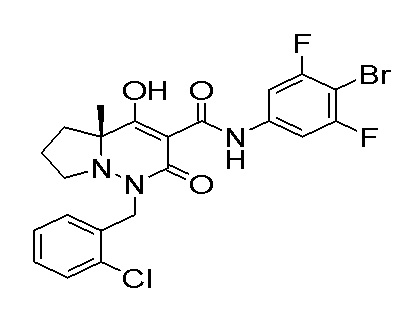
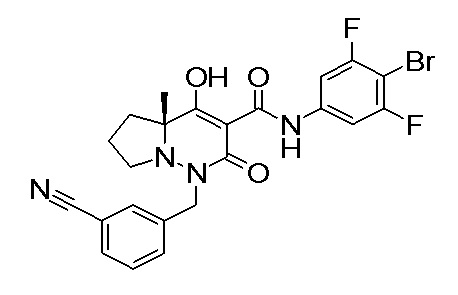
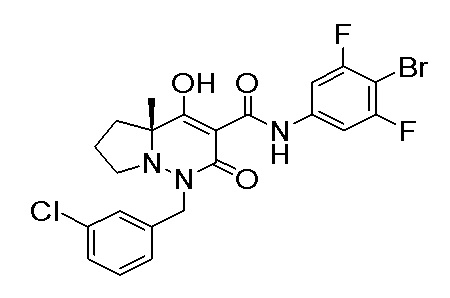
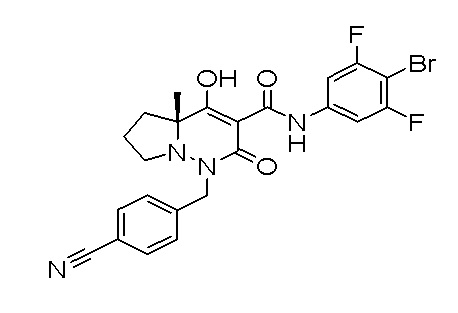
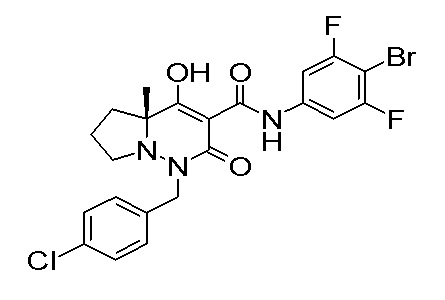
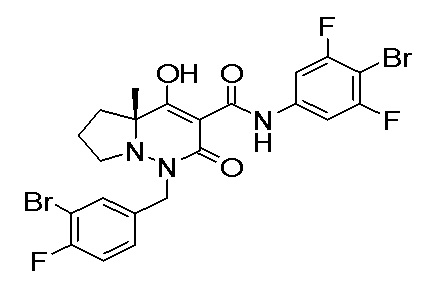
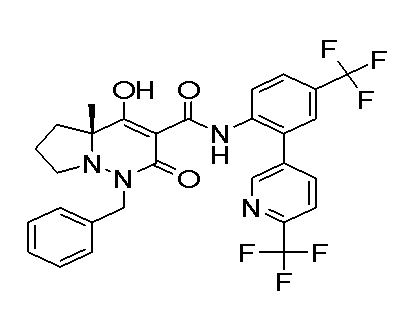
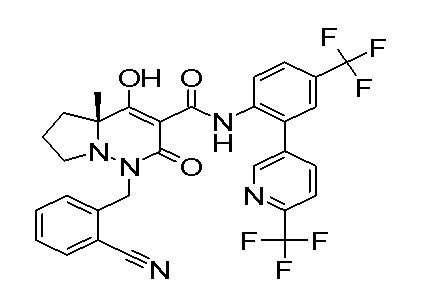
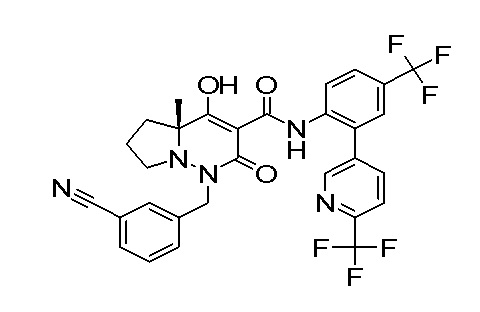
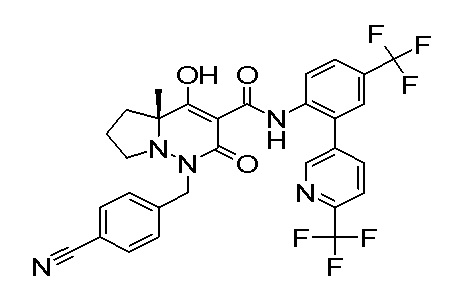
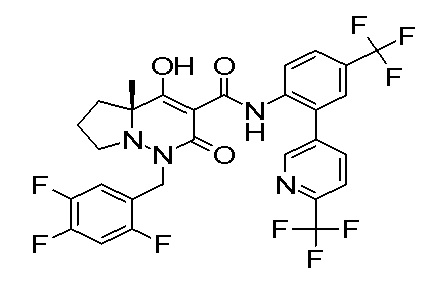
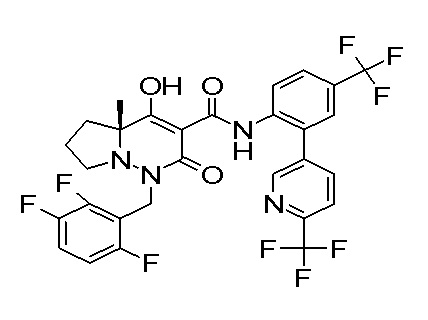
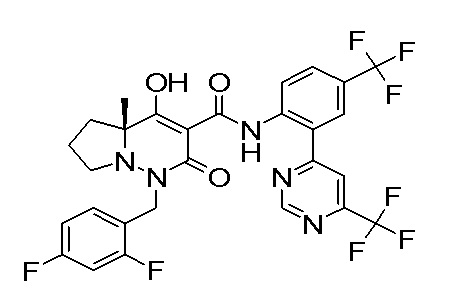
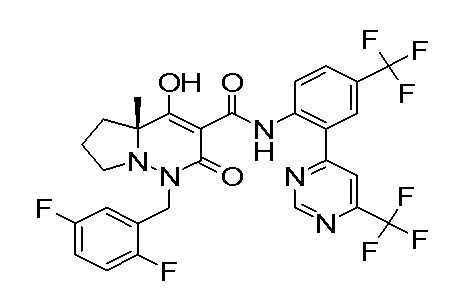
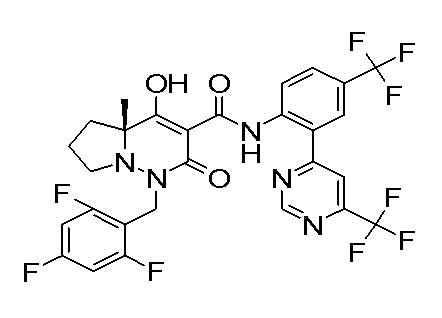
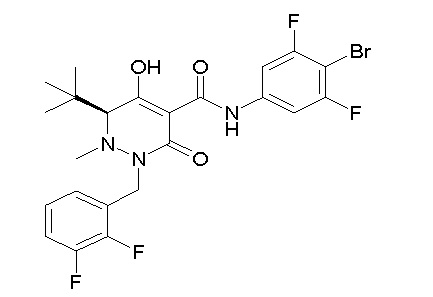
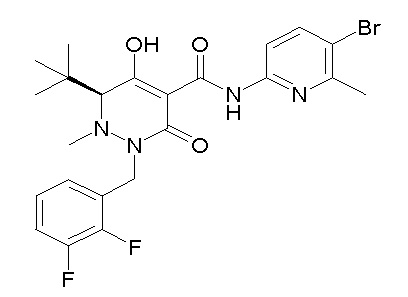
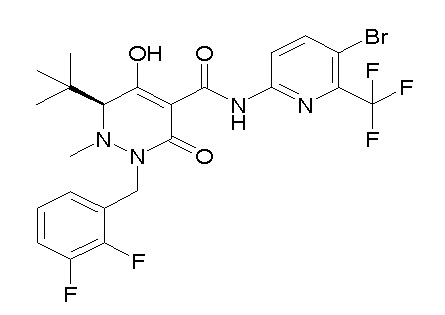

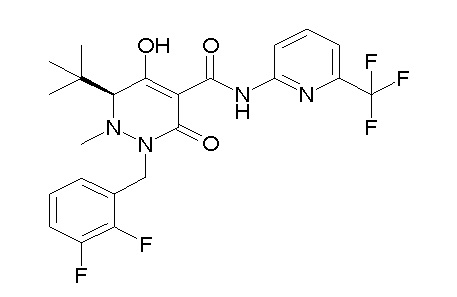
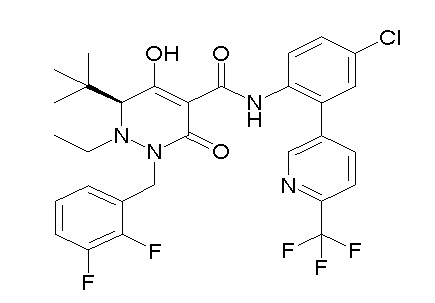
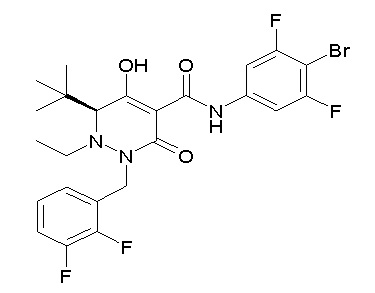
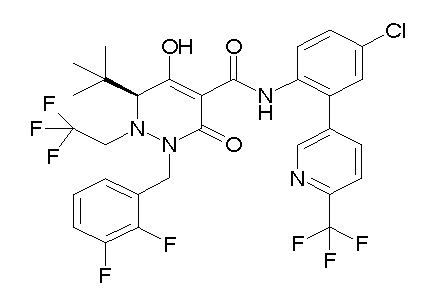
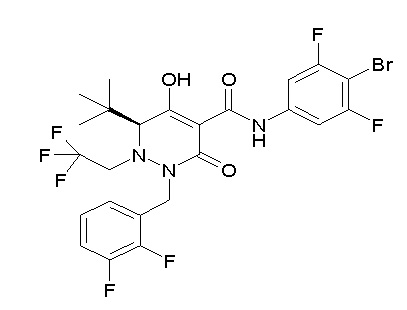
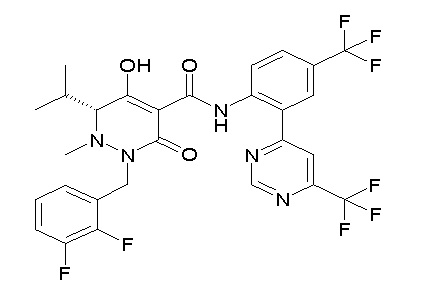
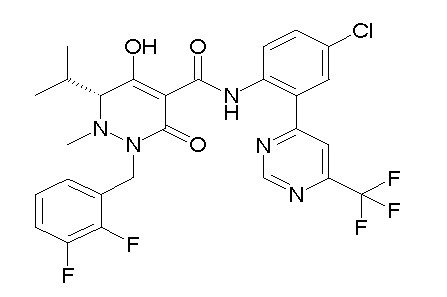
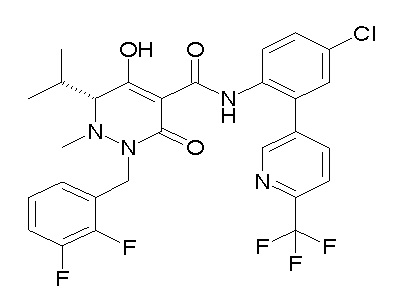
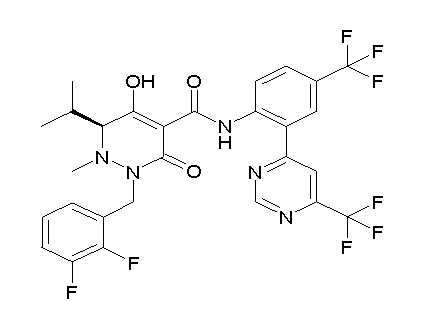
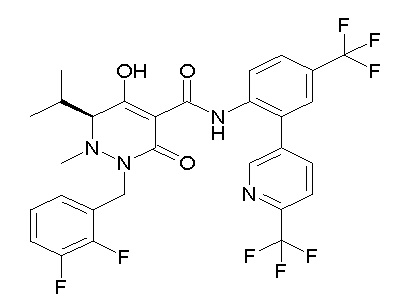
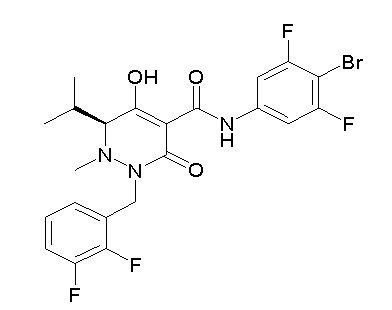
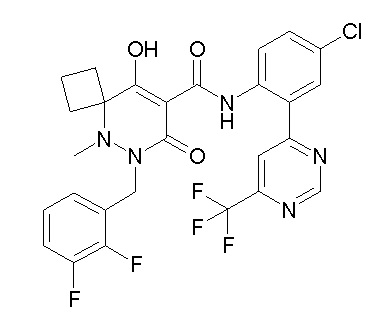
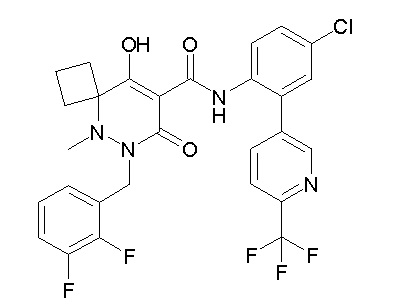
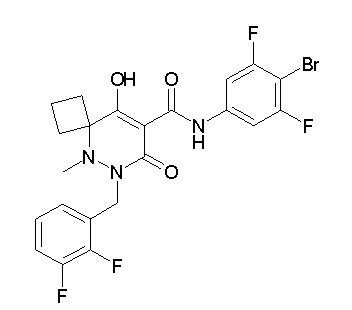
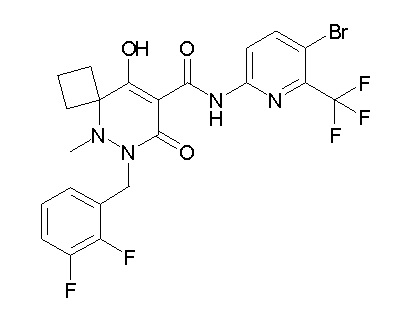
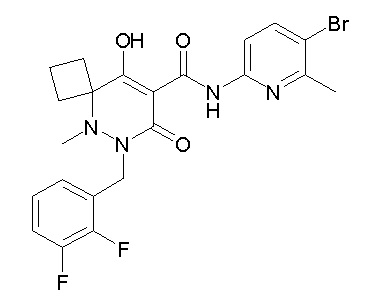
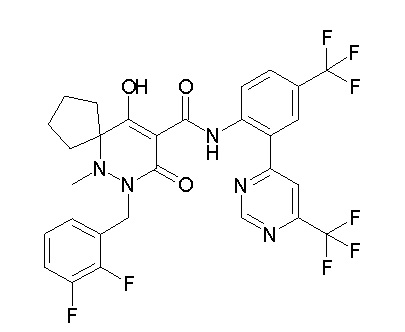
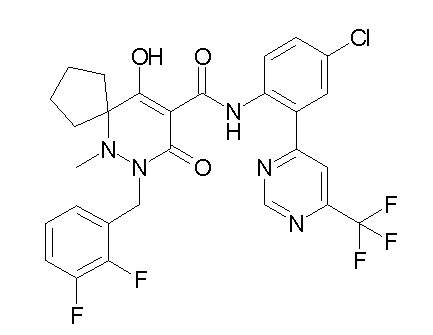
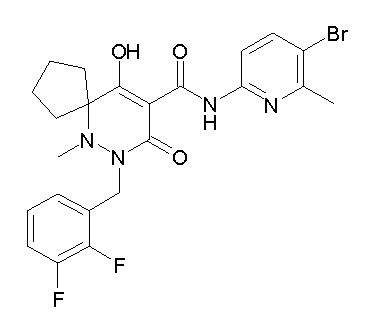
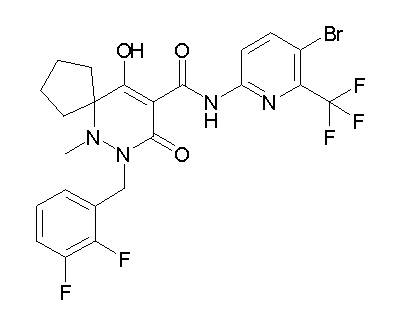
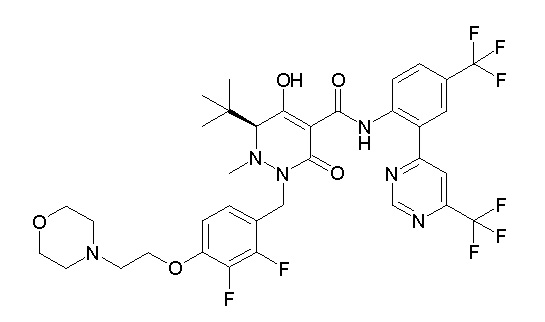
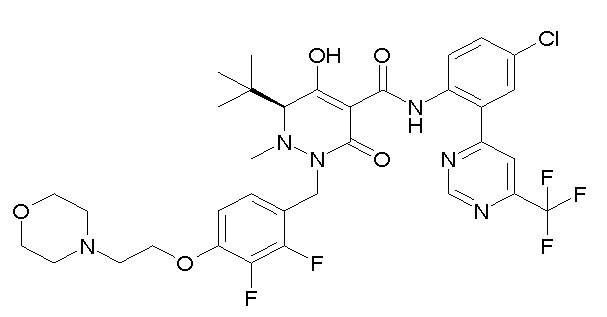
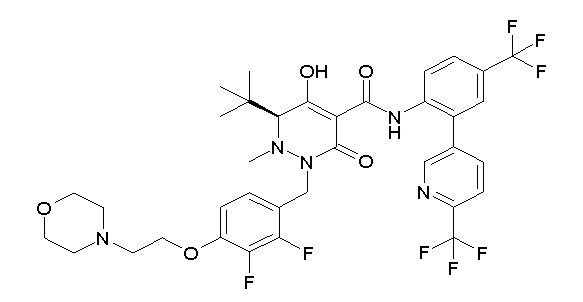
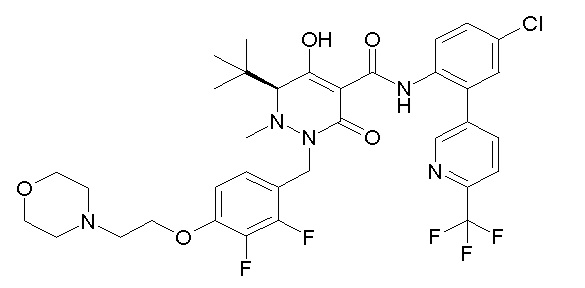
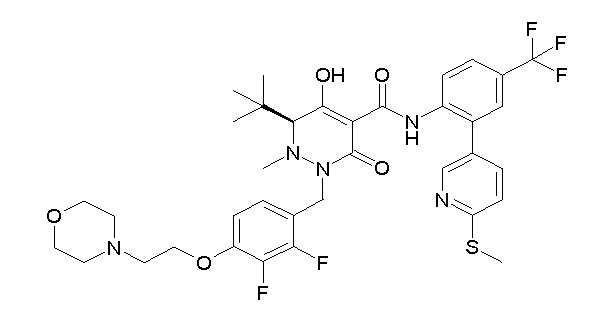
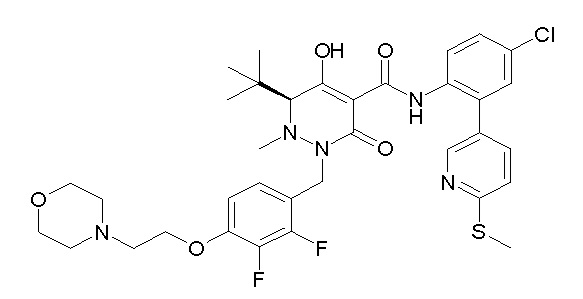

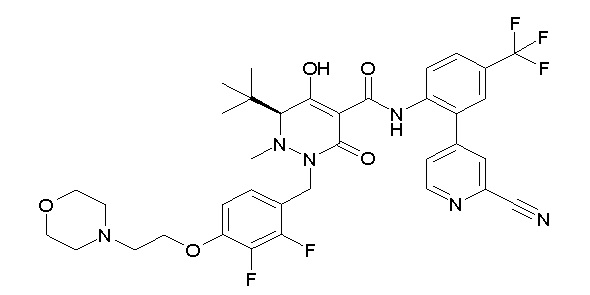
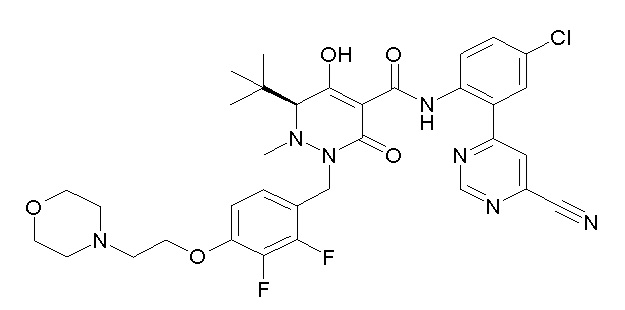
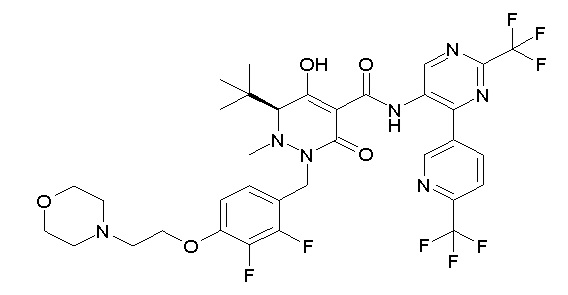
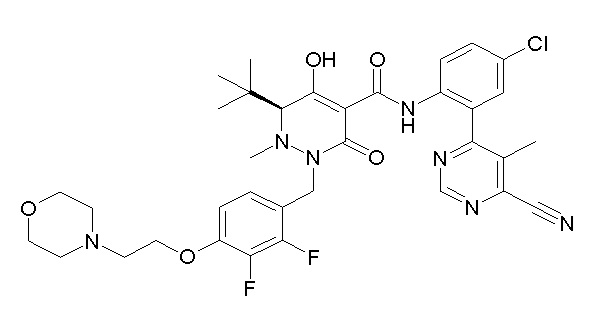
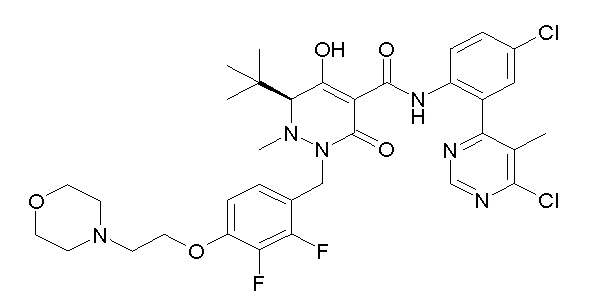
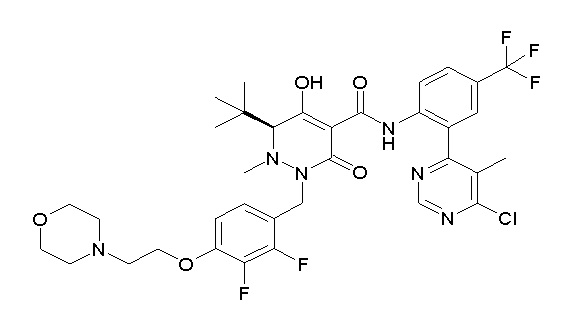
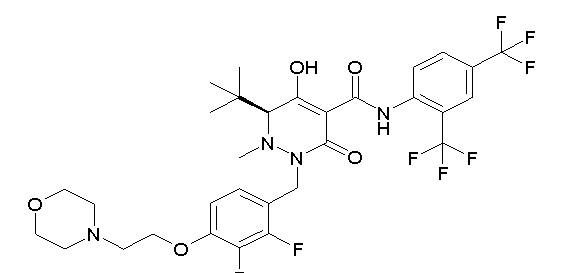
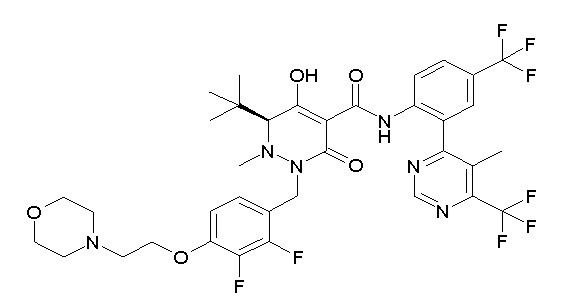
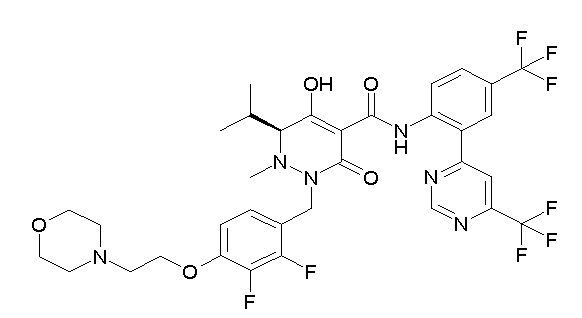
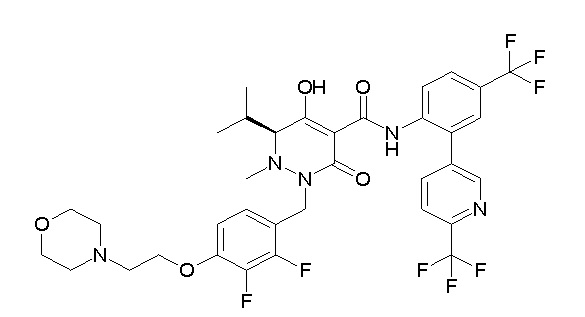
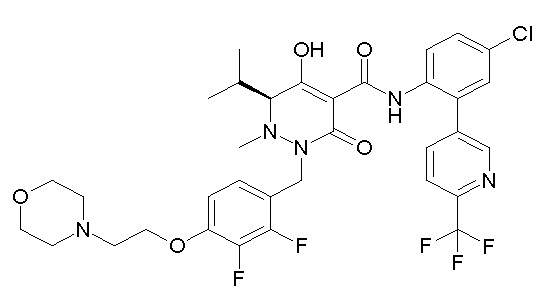
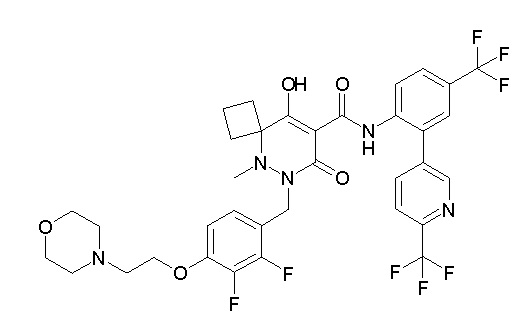
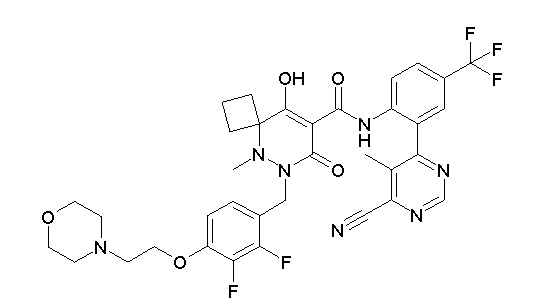
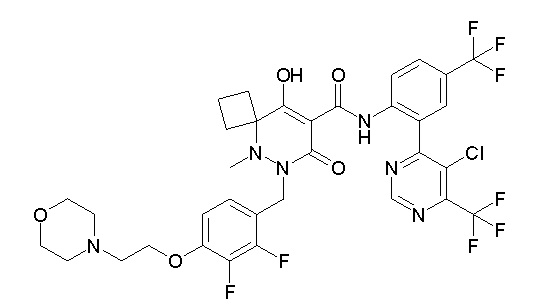
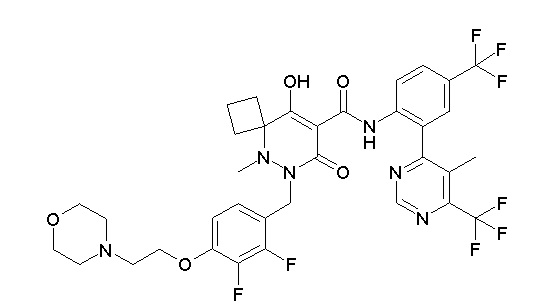
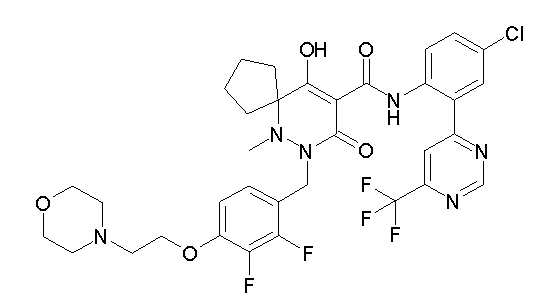
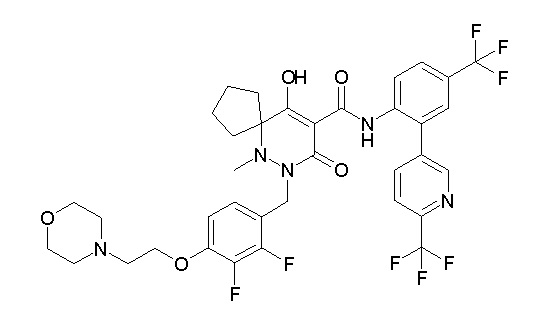
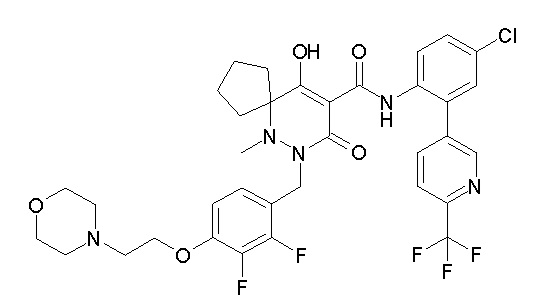
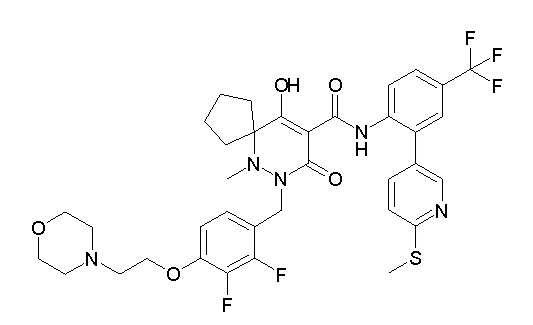
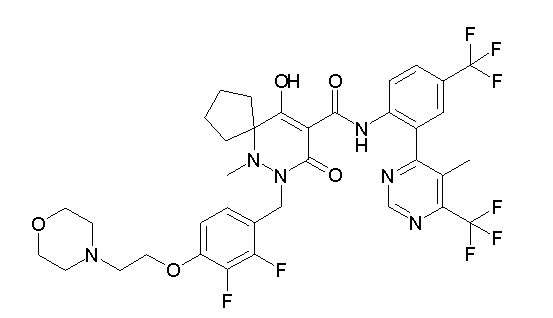
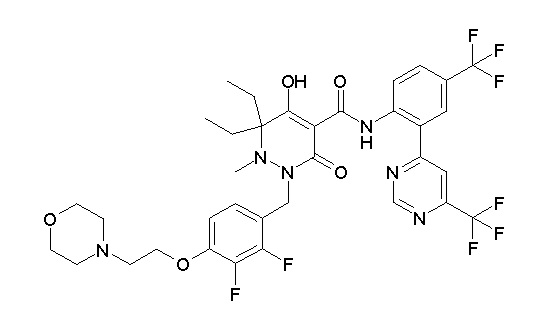
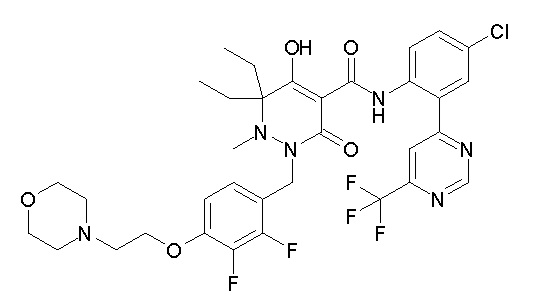
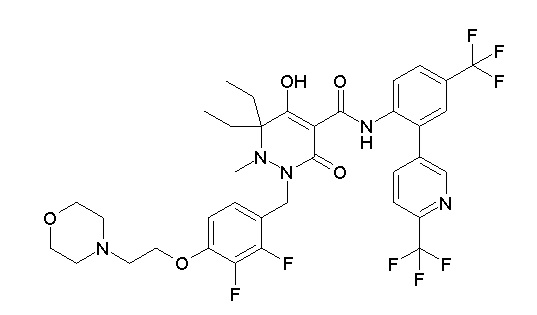
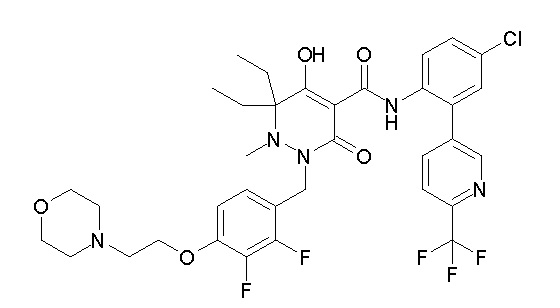
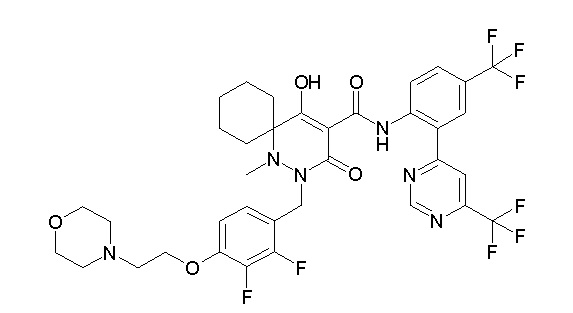
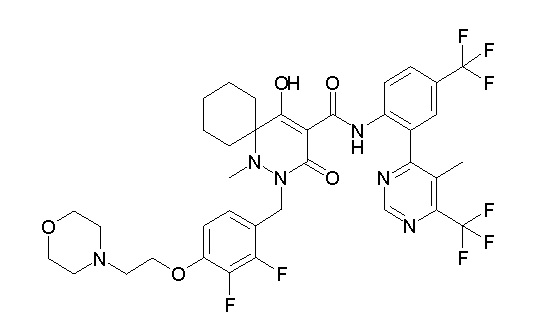
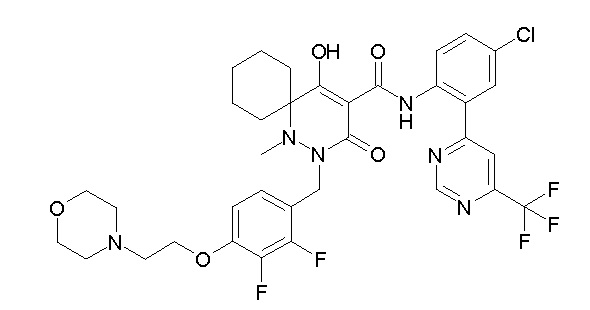
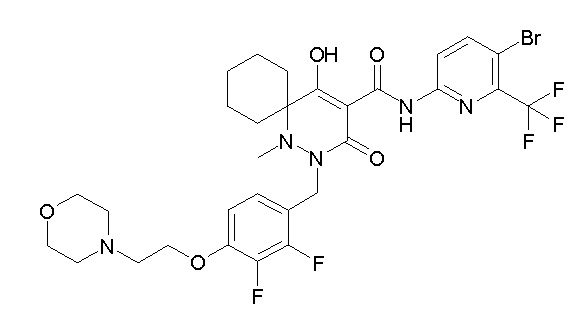
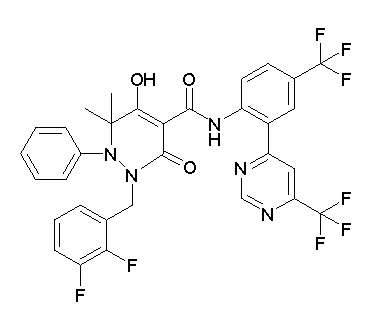
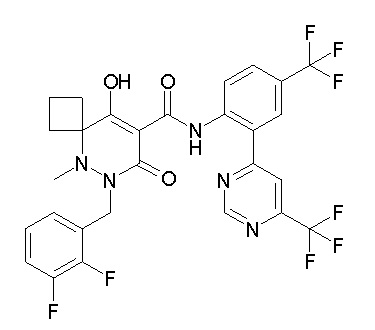
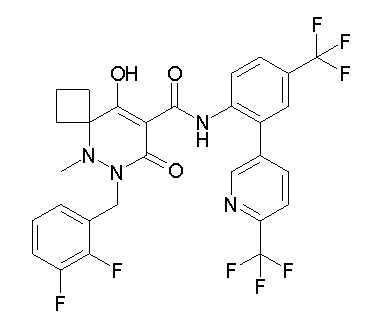
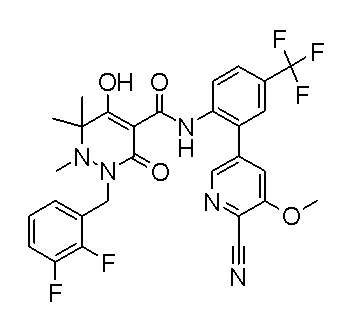
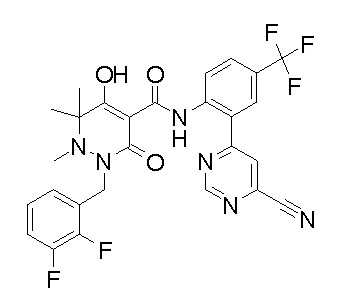
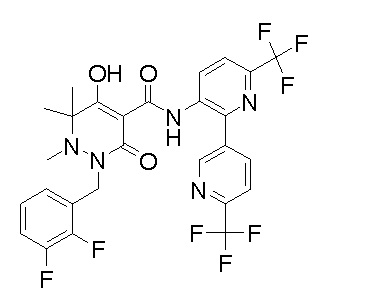
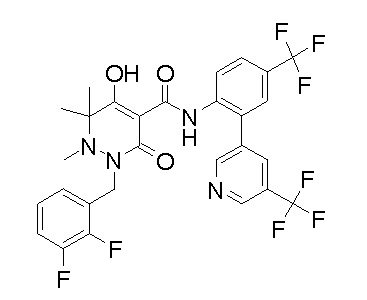
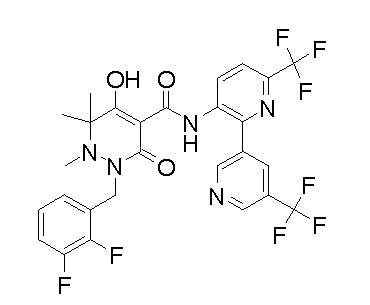
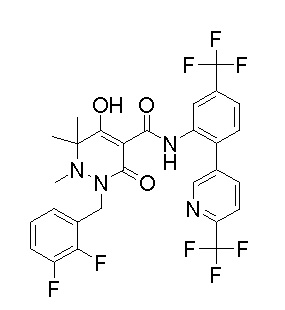
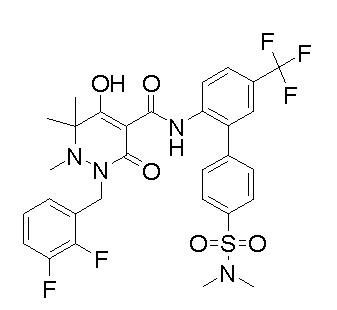
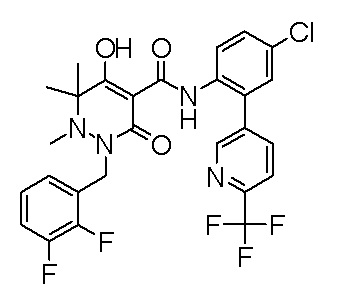
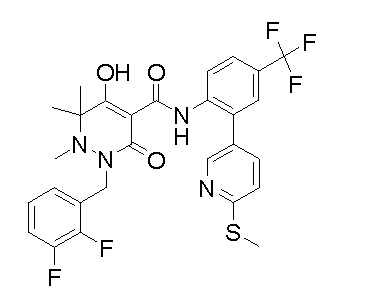
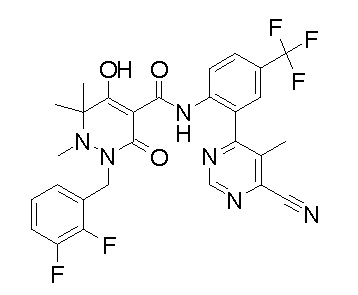
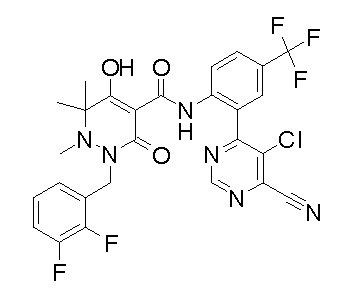
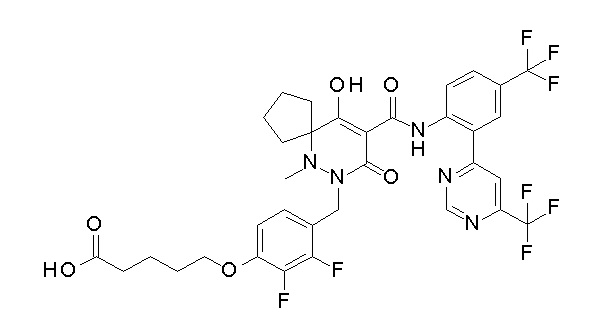
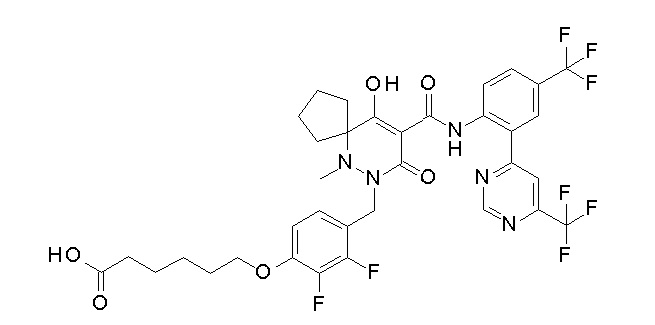
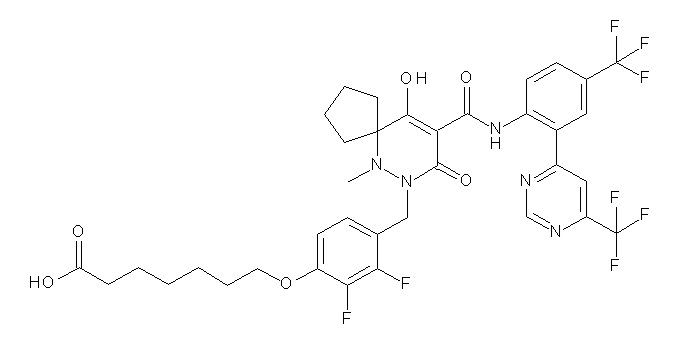


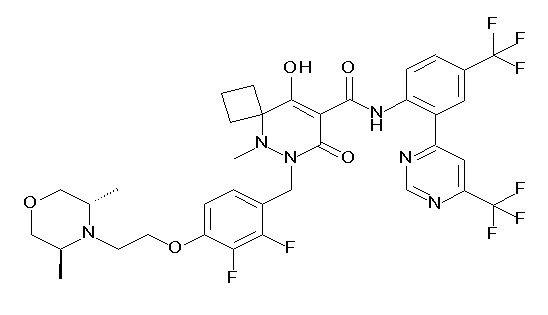
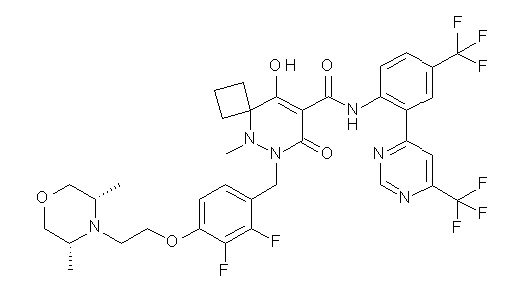
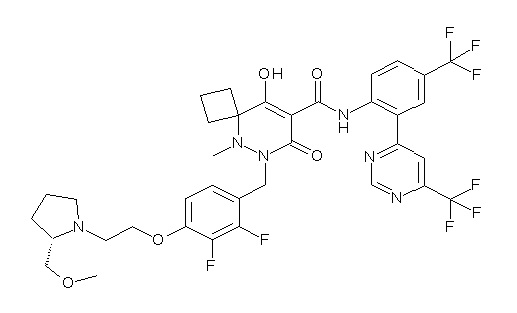
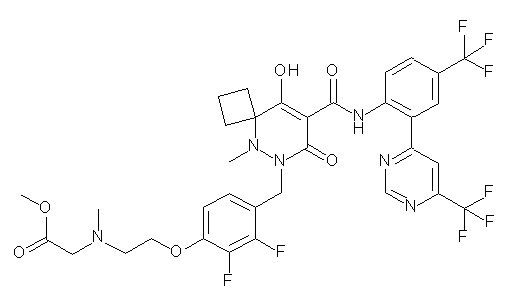
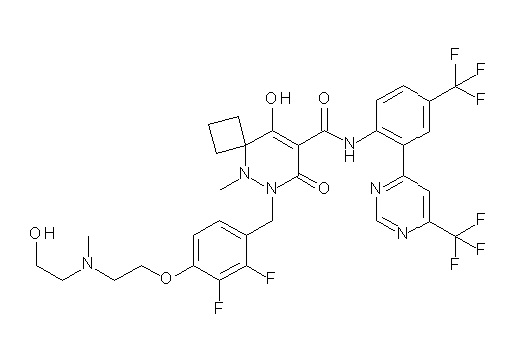
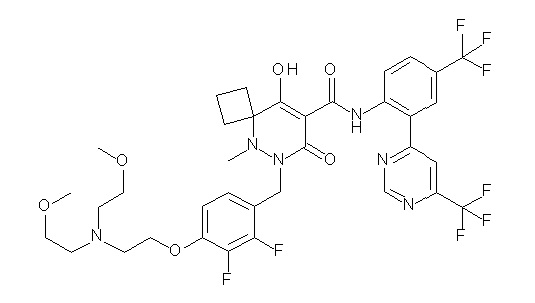
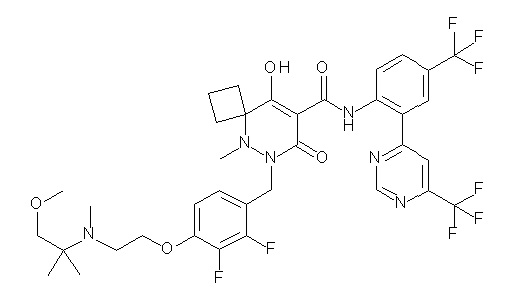
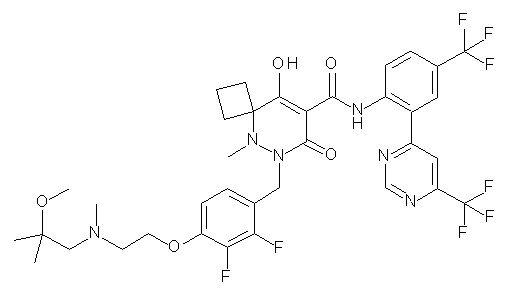
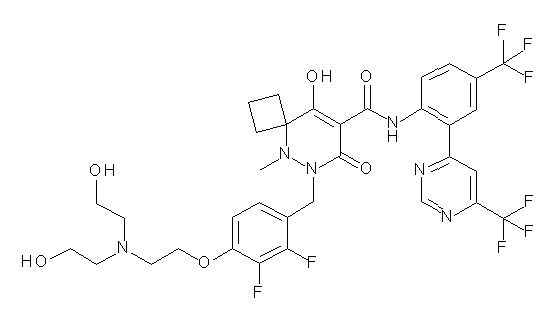
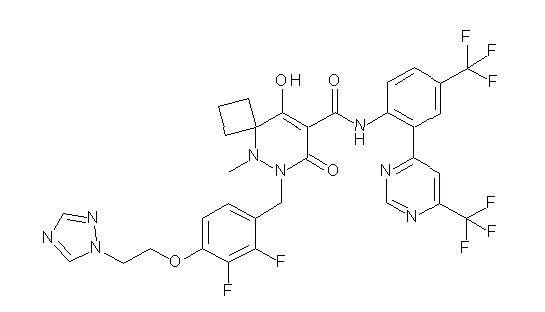
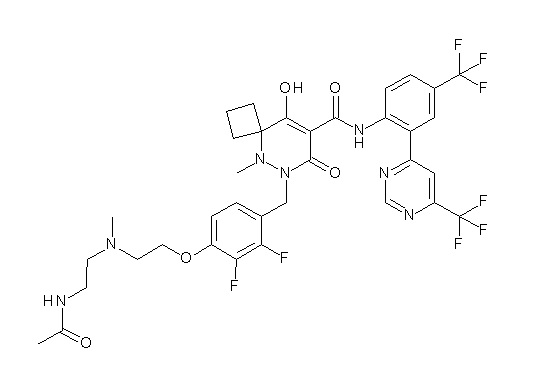
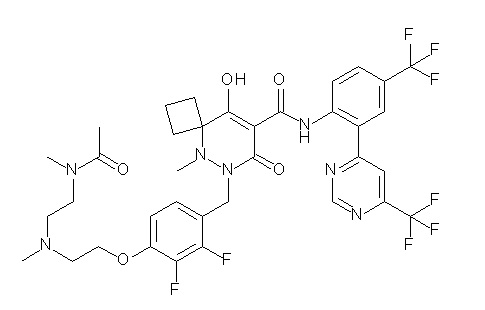
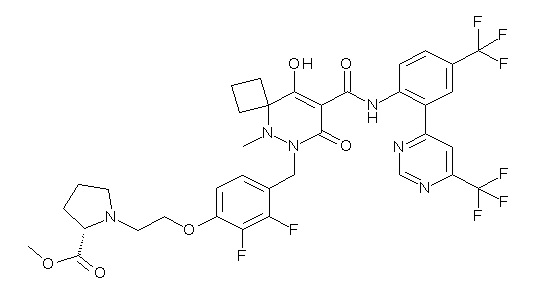
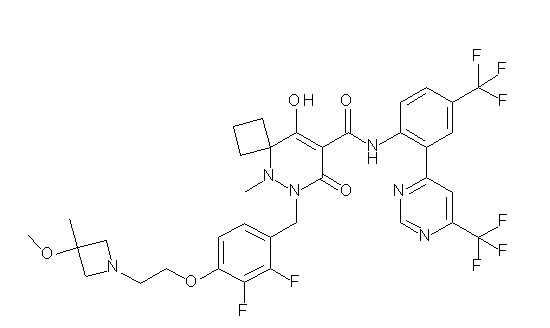
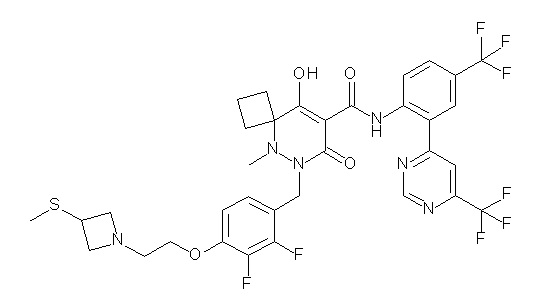
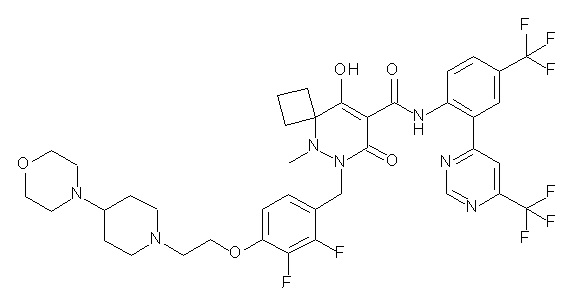
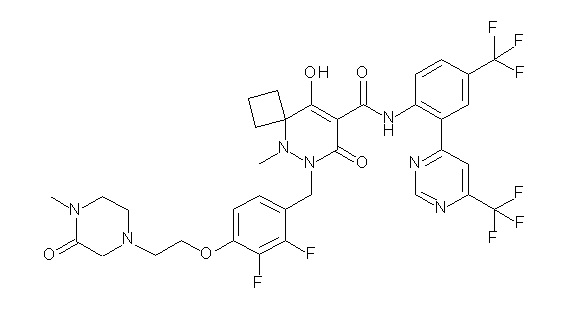
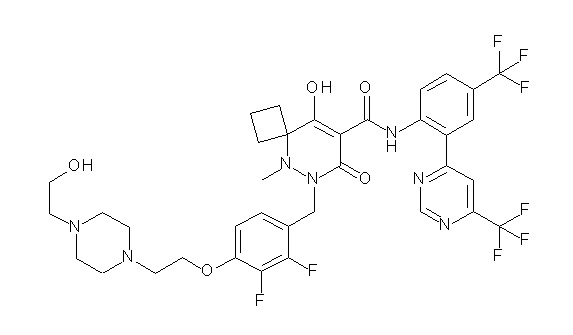
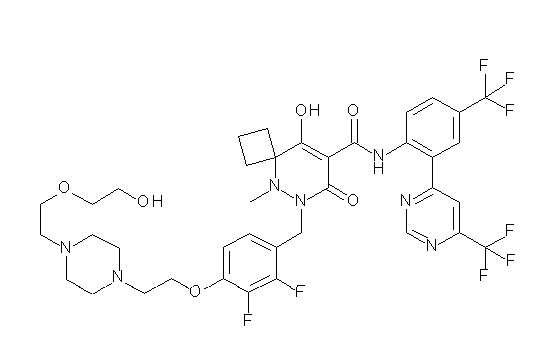
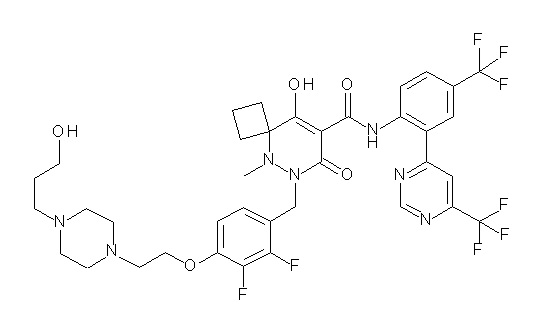
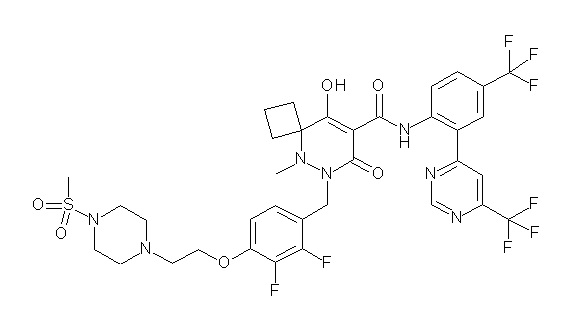
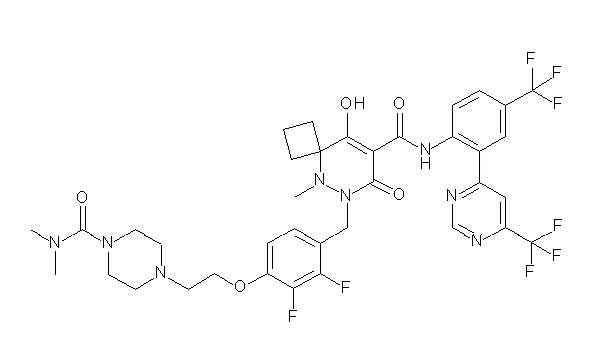
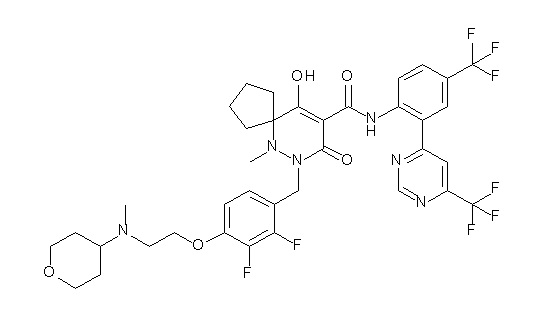
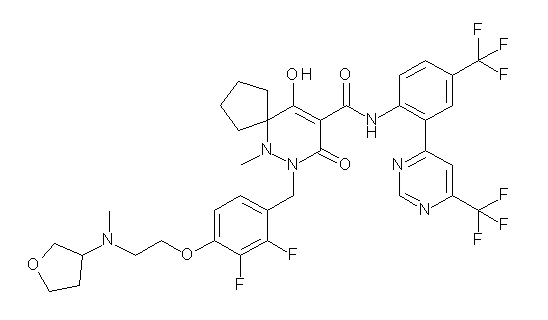
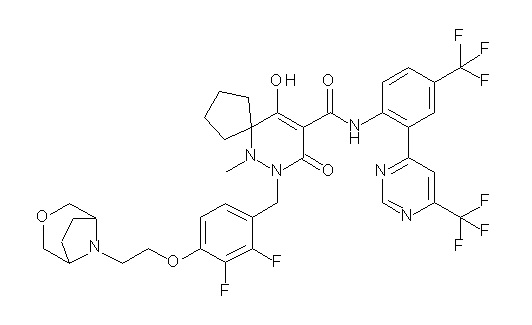
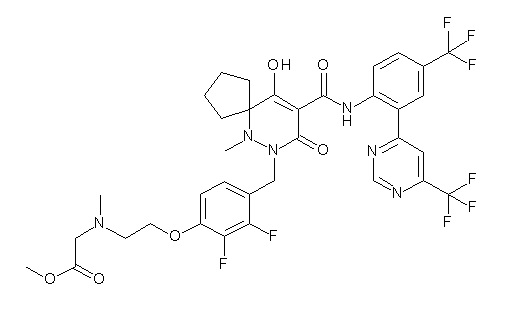
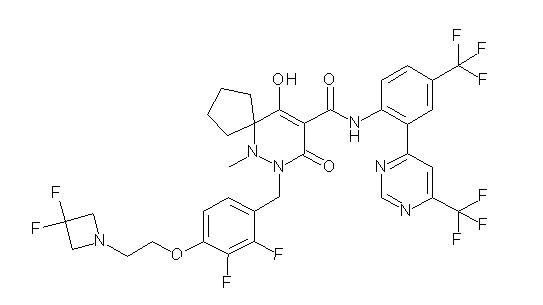
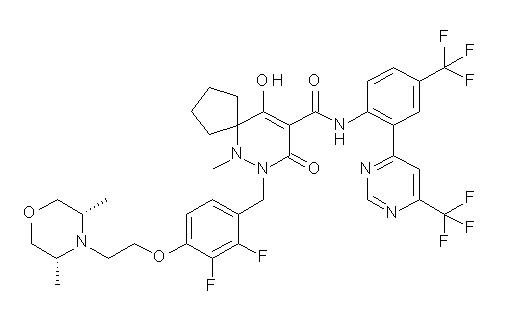
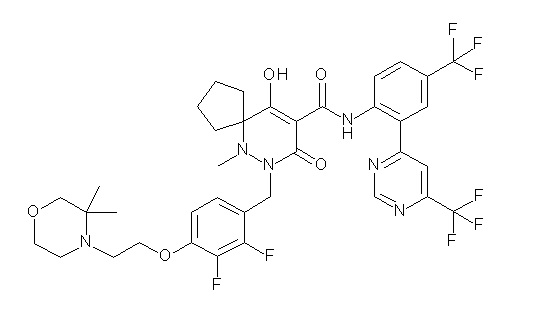
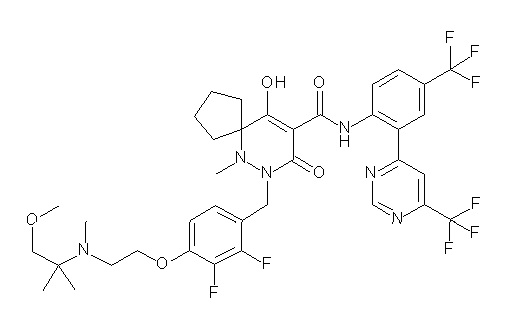
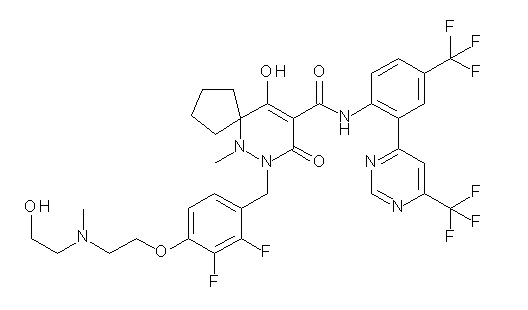
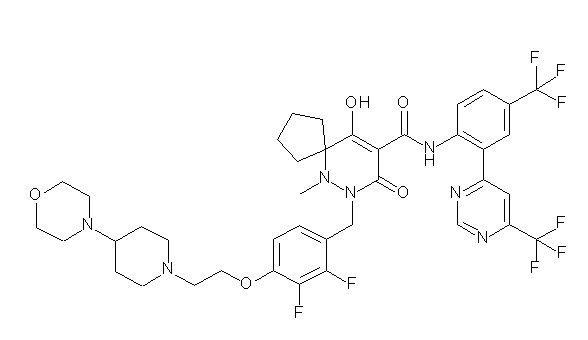
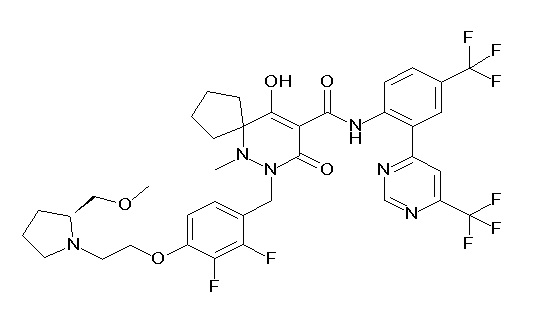
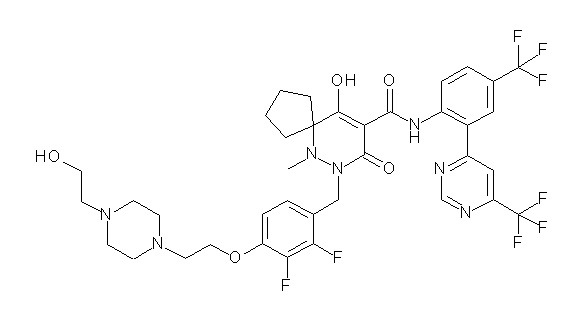
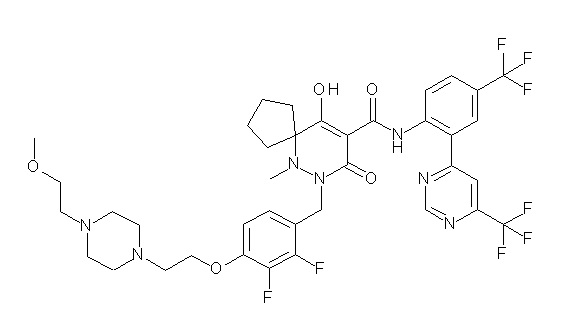
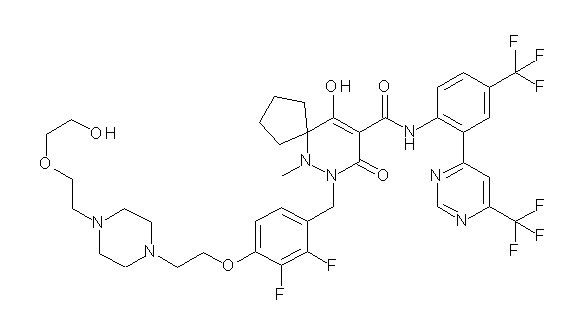
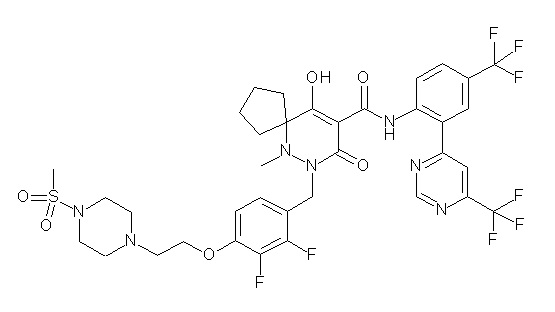
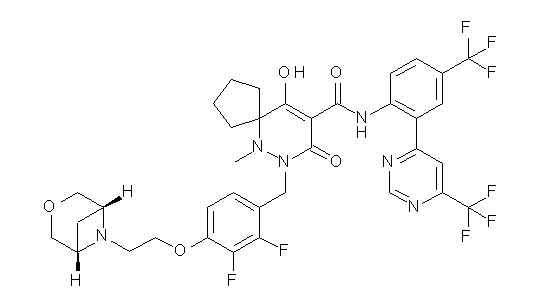
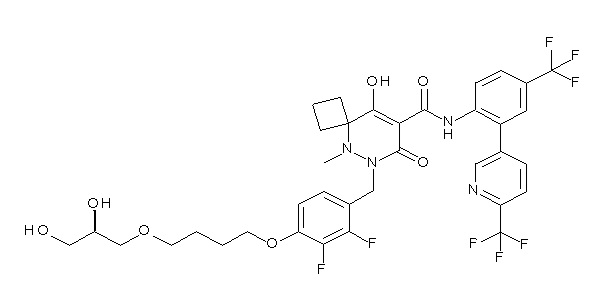
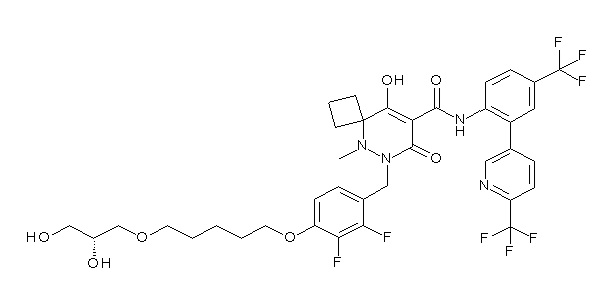
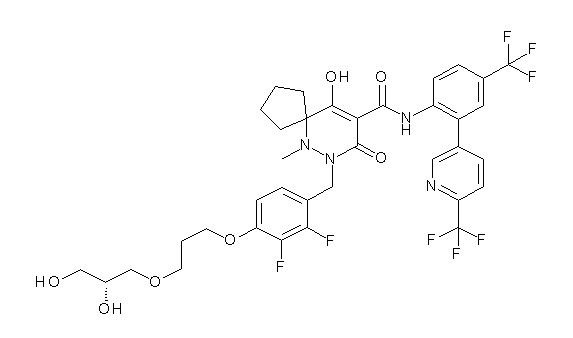
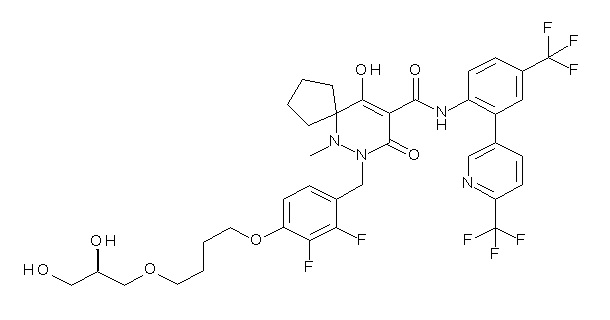
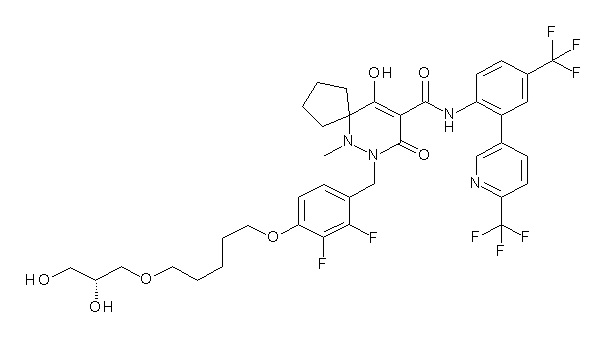
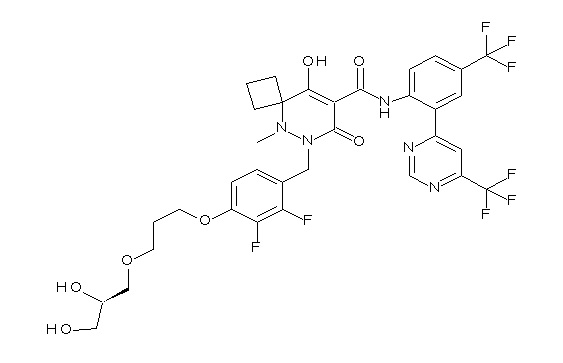
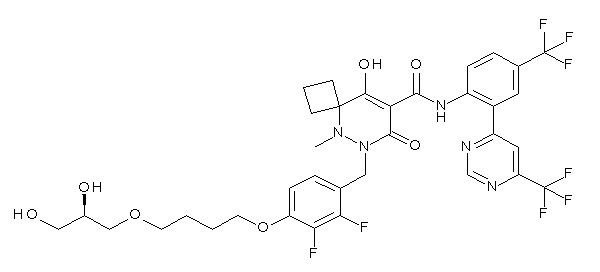
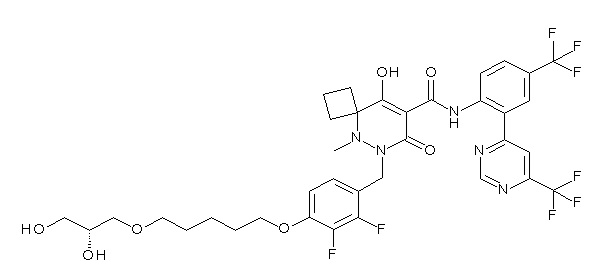
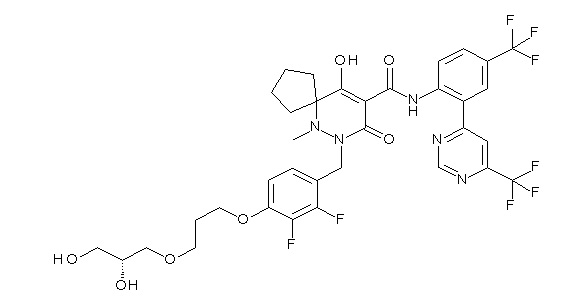
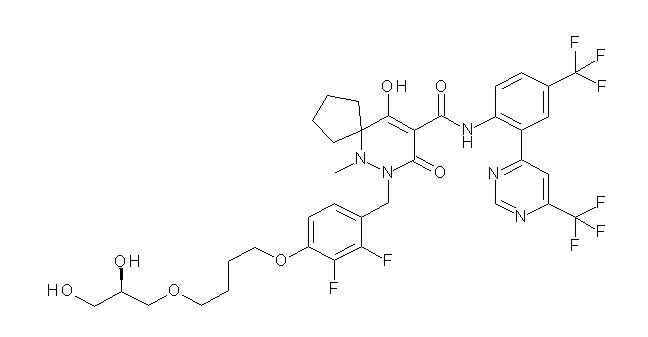
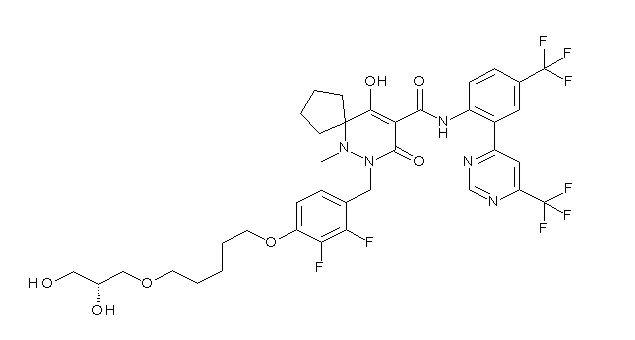
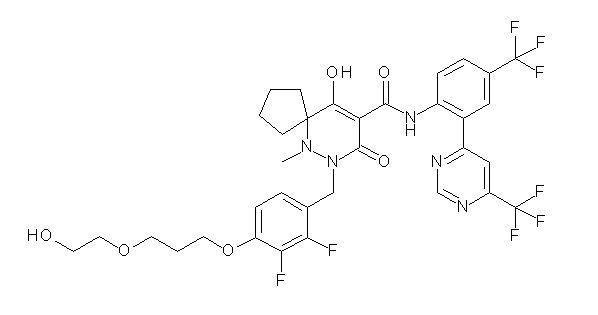
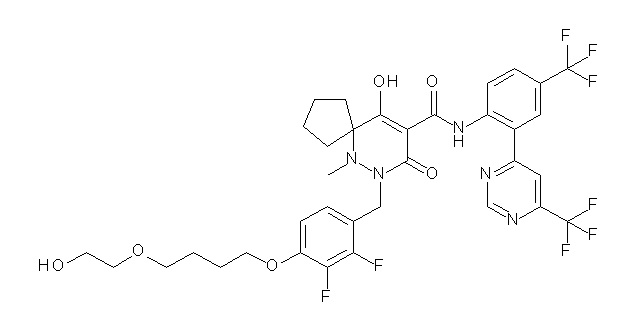
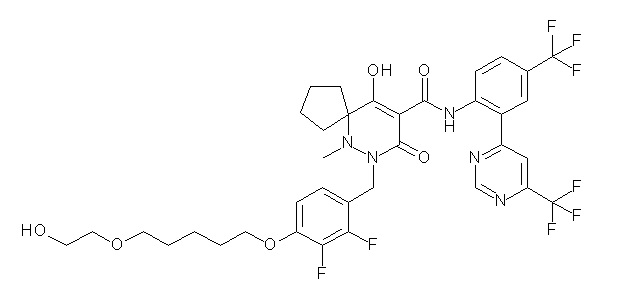
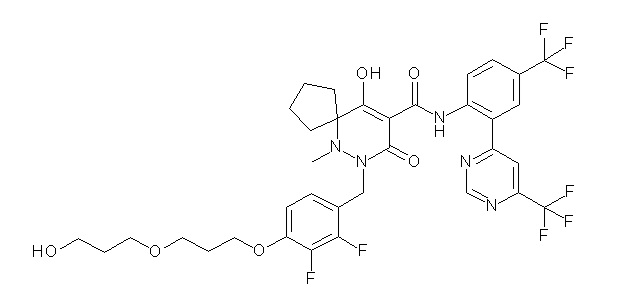
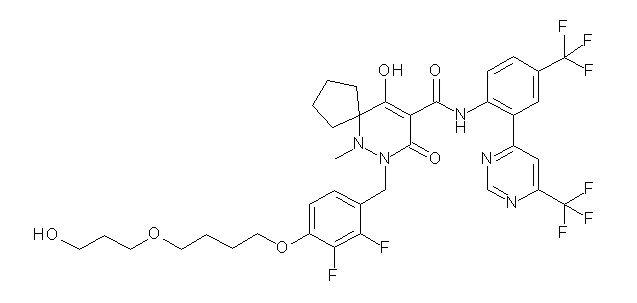
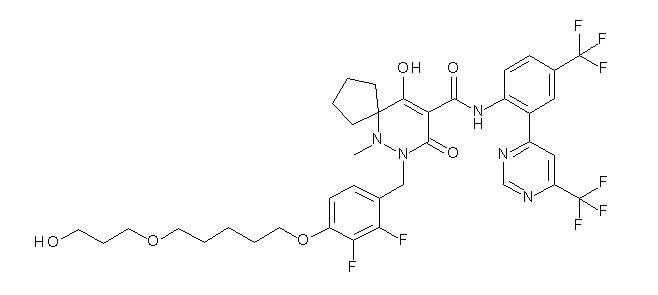
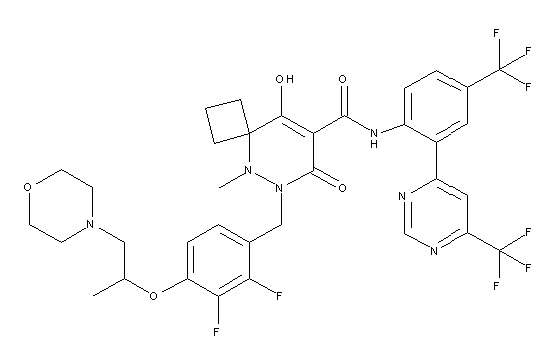
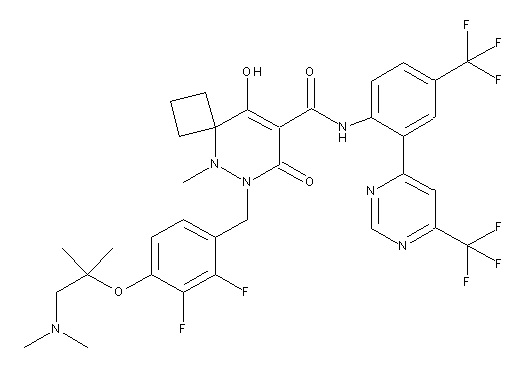
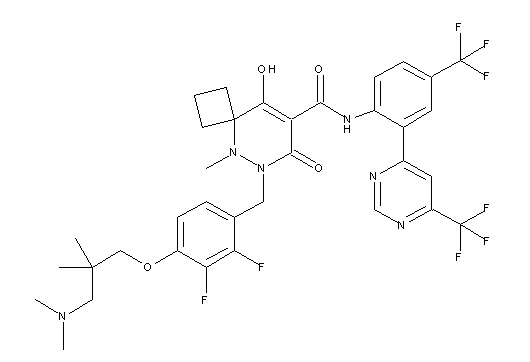

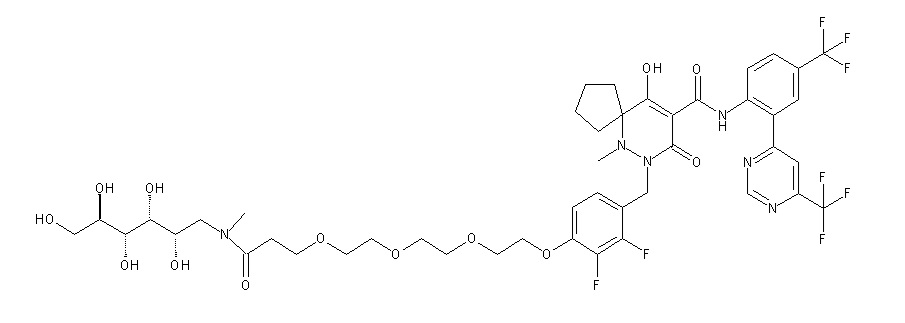
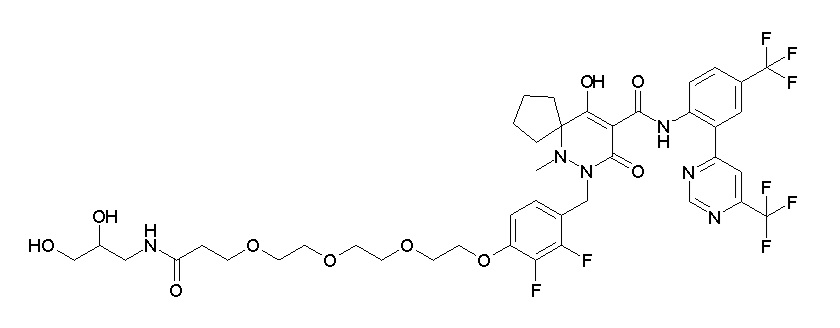
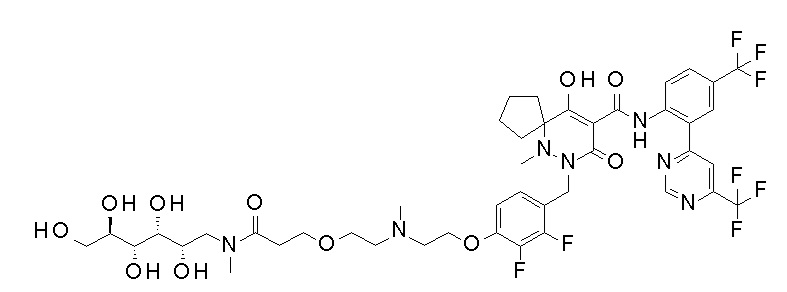
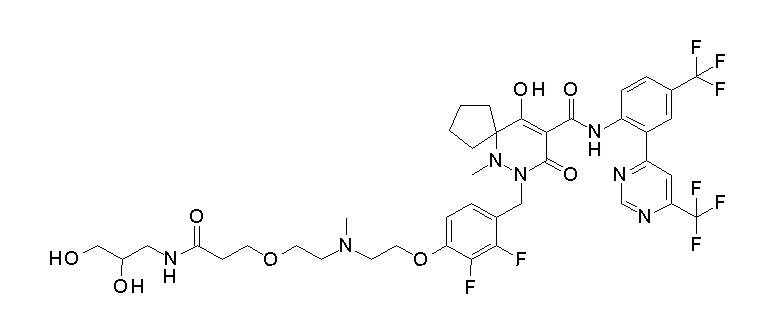
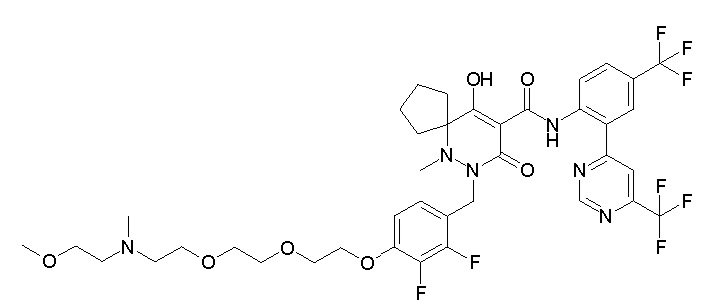
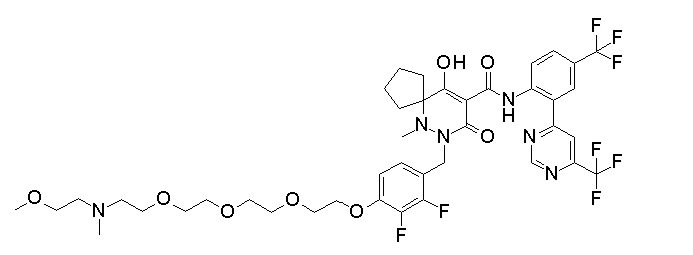
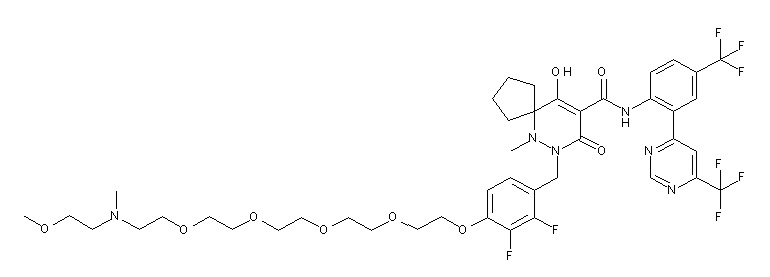
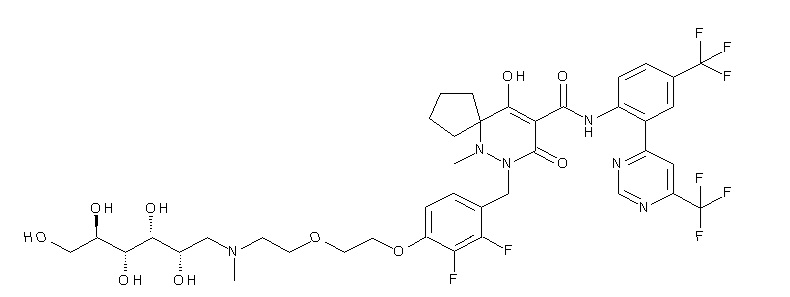

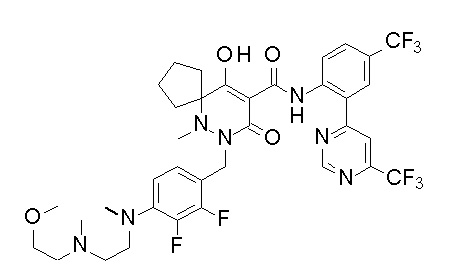
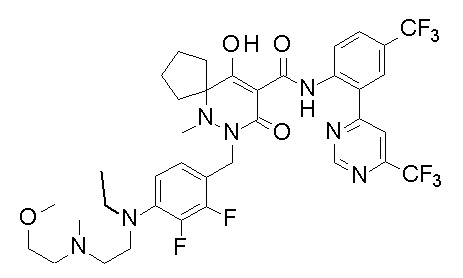
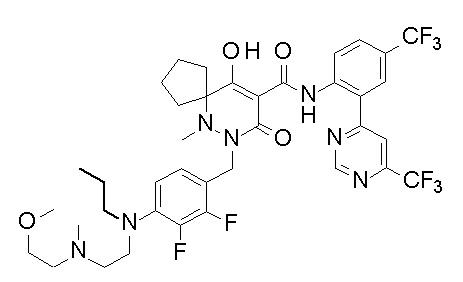
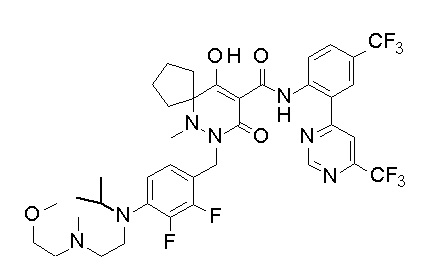
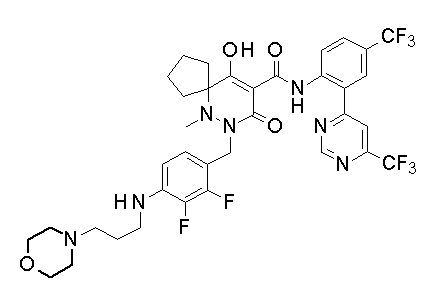
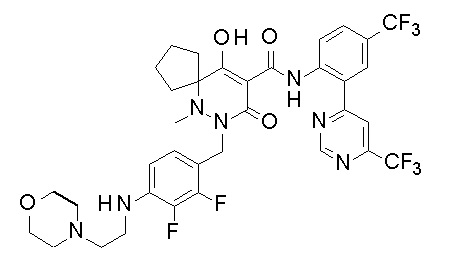
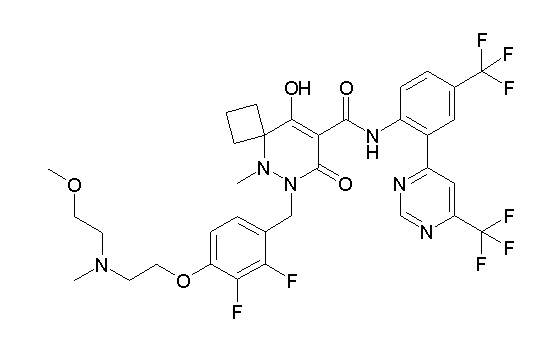

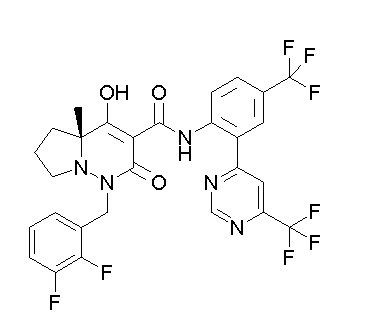
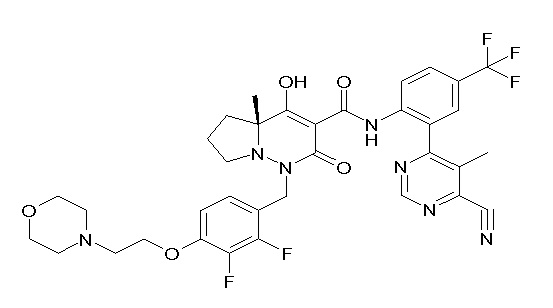
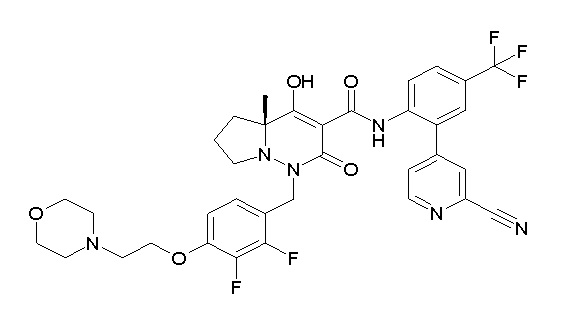
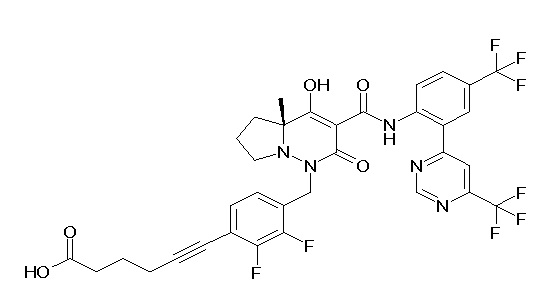
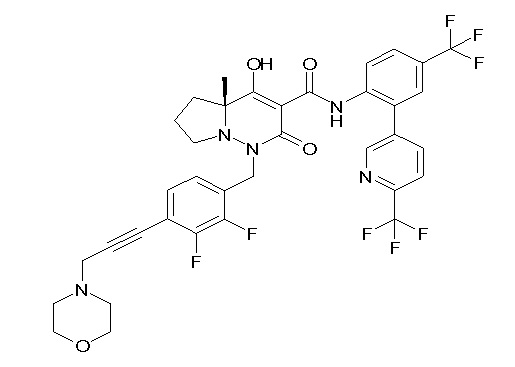
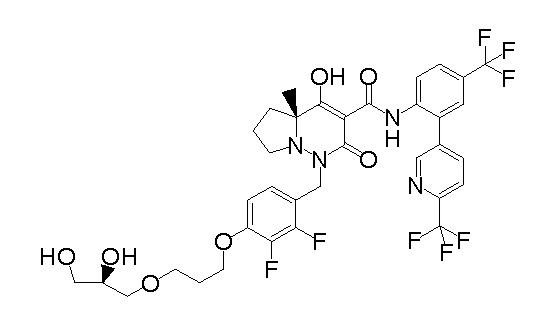
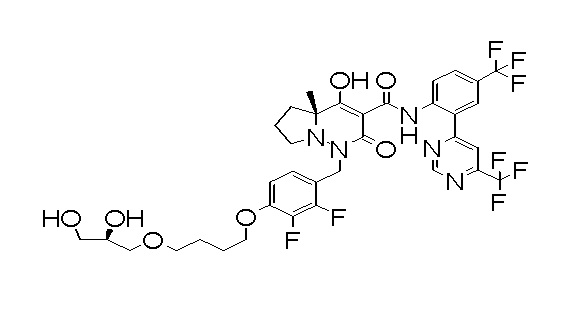
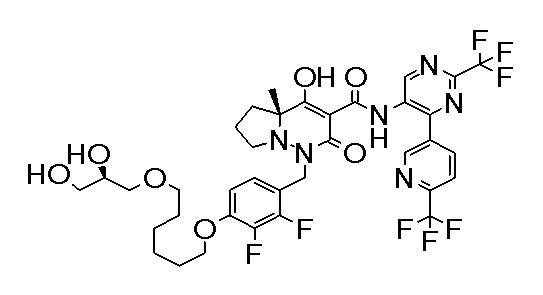
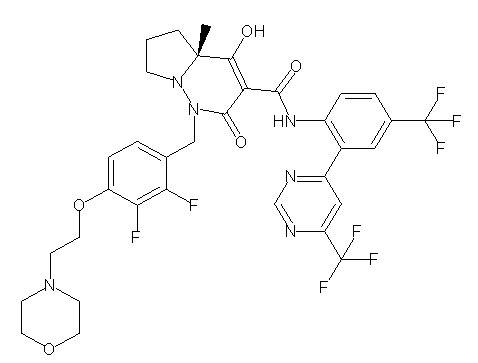
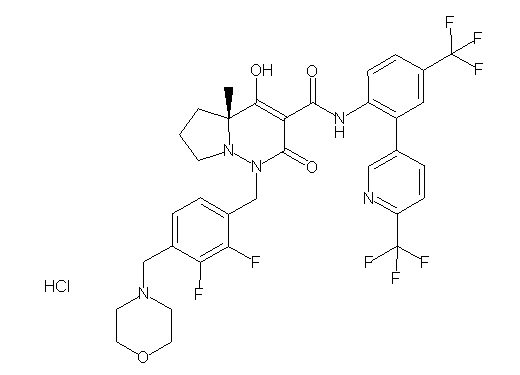
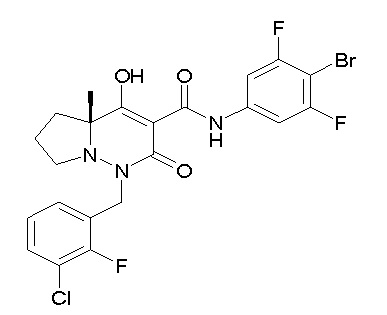
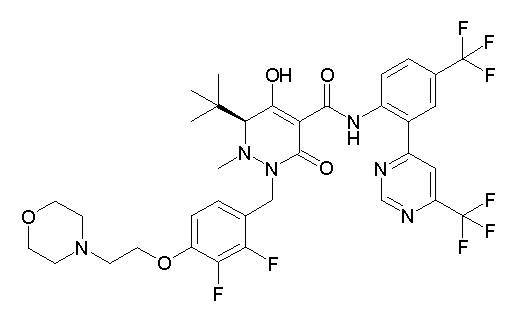
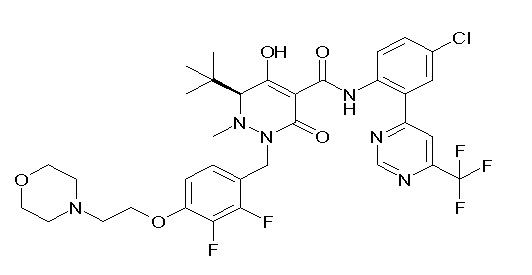
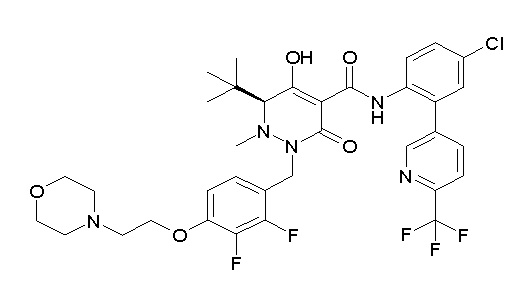
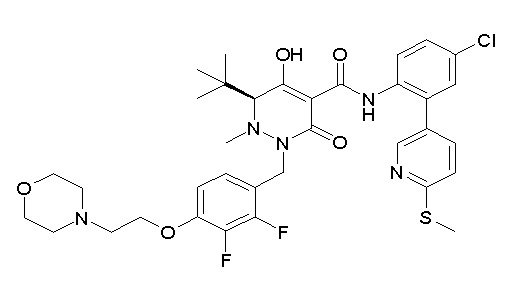
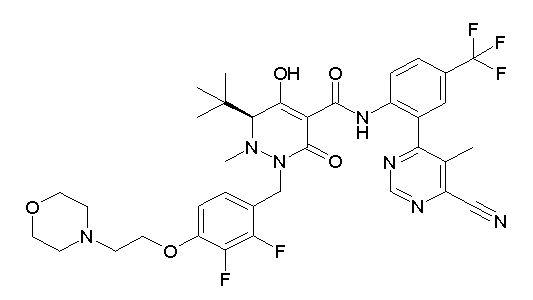
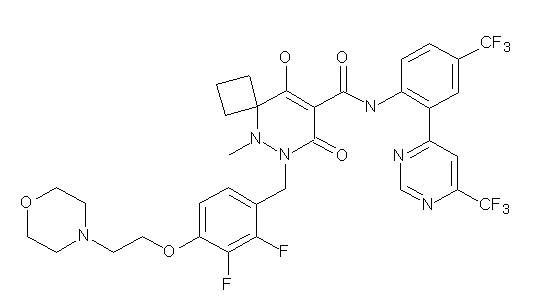
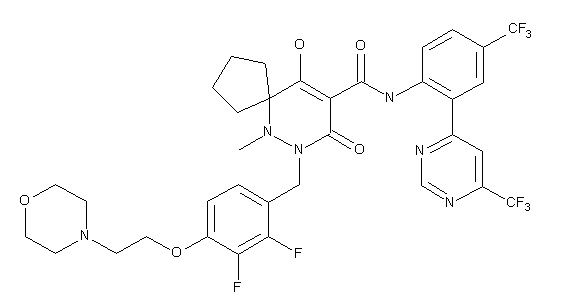
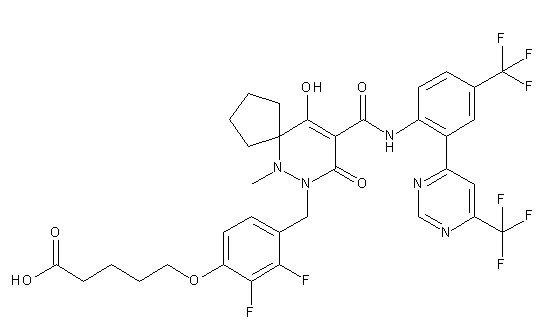
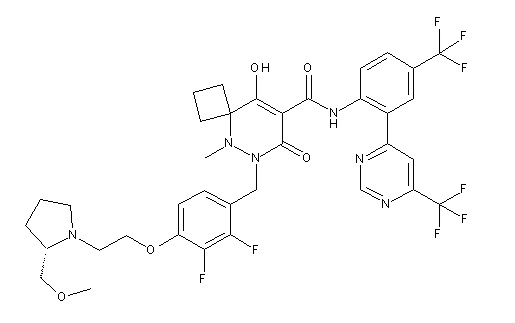
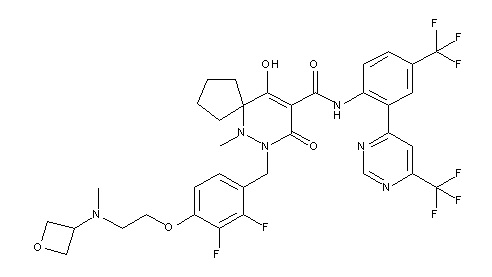
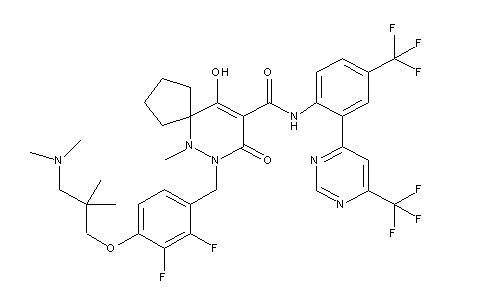
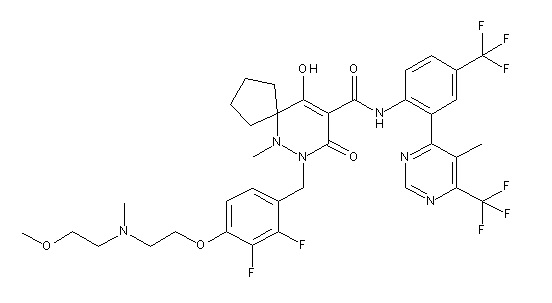

Комментарии