Производные ди(диазониадиспиро[5.2.5.2]гексадекан)-5-нитропиримидина и их применение для лечения коронавирусных инфекций, в частности вызванных вирусом sars-cov-2 - RU2761950C1
Код документа: RU2761950C1
Описание
Изобретение относится к применению производных ди(диазониадиспиро[5.2.5.2]гексадекан)-5-нитропиримидина, обладающих активностью в отношении коронавирусов, для профилактики и лечения коронавирусных инфекций человека и животных, в частности вызванных SARS-Cov-2 штаммом.
Описание
Несмотря на многочисленные исследования в области вирусологии проблемы вирусных респираторных инфекций, в особенности, ассоциированных с различными коронавирусами, приобрели в последнее время особою значимость в связи с эпидемиями SARS и MERS и, особенно, пандемией вызванной вирусом SARS-Cov-2. В структуре инфекционно-вирусных поражений человека коронавирусы занимают 3-е место, уступая лишь гриппу и риновирусам, и составляют в среднем 12 % случаев. Коронавирусные инфекции представляют особую опасность в связи с тем, что они вызывают тяжелые вирусные пневмонии, сопряженные со значительным поражением легких, зачастую не совместимым с жизнью.
Коронавирус человека впервые был выделен в 1965 г. В последующее время коронавирусы привлекли внимание исследователей, когда в Китае в 2002-2003 гг. была зафиксирована вспышка атипичной пневмонии, или тяжёлого острого респираторного синдрома (ТОРС, SARS). Заболевание было вызвано вирусом SARS-CoV. Болезнь распространилась на другие страны, всего заболело 8273 человека, 775 умерло (летальность составила 9,6 %).
Вирус MERS-CoV стал возбудителем ближневосточного респираторного синдрома (MERS), первые случаи которого были зарегистрированы в 2012 г. В 2015 г.в Южной Корее произошла вспышка ближневосточного респираторного синдрома, в ходе которой заболело 183 человека, умерло -33.
В декабре 2019 г. в Китае началась вспышка пневмонии, вызванная вирусом SARS-Cov-2, которая в 2020 г. переросла в пандемию, охватившую все страны Земного шара. Значительное число людей погибло от вызванной этим коронавирусом пневмонии. Очевидно, что пандемии респираторных вирусных инфекций, вызванных коронавирусами, преследовали человечество в прошлом и нет никаких оснований полагать, что этого не будет происходить в будущем.
Биология коронавирусов с неизбежностью обусловливает появление их новых пандемических штаммов, время возникновения, изменчивость генома и антигенные свойства которых предсказать невозможно. То есть эпидемии и пандемии новых респираторных коронавирусных инфекций всегда будут начинаться в отсутствие средств специфической иммунной профилактики и терапии этих инфекций. Последнее предопределяет необходимость заблаговременного изыскания и разработки патогенетических средств и способов профилактики/терапии респираторных вирусных инфекций, исходя из особенностей биологии коронавирусов. Так же известно, что иммунитет после перенесённой болезни, вызванной коронавирусами непродолжительный, и как правило, не защищает от реинфекции, что так же приводит к необходимости создания лекарственных средств широкого противовирусного спектра действия, непосредственно защищающих организм от вирусного поражения.
На сегодняшний день основным средством патогенетической терапии, применяемым для лечения коронавирусных инфекций, служит хлорохин и его некоторые производные. В оригинале хлорохин известен с 1947 г. и показан для профилактики и терапии малярии (Mengesha T., Makonnen E. Comparative efficacy and safety of chloroquine and alternative antimalarial drugs: ameta-analysis from six African countries, East Afr. Med. J. 1999, 76: 314-319; Bello S.O., Chika A., Bello A.Y. Is chloroquine better than artemisin in combination therapy as first line treatment in adult Nigerians with un complicated malaria? A cost effectiveness analysis, Afr. J. Infect. Dis. 2010: 29-42; Waqar T., Khushdil A., Haque K. Efficacy of chloroquine as a first line agent in the treatment of uncomplicated malaria due to Plasmodium Vivax in children and treatment practices in Pakistan: a pilot study. J. Pak. Med. Assoc., 2016, 66: 30-33), при лечении проказы (Bezerra E.L., Vilar M.J., da Trindado Neto P.B., Sato E.I. Double-blind, randomized, controlled clinical trial of clofazimine compared with chloroquine in patients with systemic lupus erythematosus. Arthritis Rheum., 2005, 52(1): 3073-3078; Gordon C., Amissah-Arthur M.B., Gayed M. et al. The British Society for Rheumatology guideline for the management of systemic lupus erythematosus in adults. Rheumatology, 2018,57(1): e1-e45), как противовоспалительное средство при лечении ревматоидного артрита (Schrezenmeier E., Dorner T. Mechanisms of action of hydroxychloroquine and chloroquine: implications for rheumatology. Nat. Rev. Rheumatol., 2020. 16(3): 155-166), в качестве средства терапии антифосфолипидного синдрома (Tektonidou M.G., Andreoli L., Limper M. etal. EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann. Rheun. Dis., 2019, 78: 1296-1304), при лечении синдрома Шегрена (Lee H.J., Shin S., Yoon S.G. et al. The effect of chloroquine on the development of dry eye in Sjogren syndrome animal model. Invest. Ophthalmol. Vis. Sci., 2019, 60: 3708-3716) и ряда других заболеваний.
Способность хлорохина ингибировать ацидификацию эндосом, содержащих вирусы респираторных инфекций, и, таким образом, блокировать выделение их РНК-геномов и последующую репликацию, трудно принять в качестве удовлетворительного объяснения его противовирусной активности. Показано, что, что хлорохин проявляет высокую противовирусную активность не только относительно вирусов гриппа типа А (интернализация в составе эндосом), но и относительно коронавирусов (De Wilde A.H., Jochmans D., PosthumaC.C. etal. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture, Antimicrob. Agents Chemother., 2014, 58: 4875-4884;Kearney J. Chloroquine as a potential treatment and prevention measure for the 2019 novel coronavirus: a review, Preprints. 2020. Art. 2020030275), интернализация которых, практически исключительно, осуществляется посредством слияния мембран, т.е. без стадии образования эндосом (Matsuyama S., Ujike M., Morikawa S. etal. Protease-mediated enhancement of severe acute respiratory syndrome coronavirus infection. PNAS USA, 2005, 102: 12543-12547).
Среди трех типов биологических апериодических полимеров (нуклеиновые кислоты, полипептиды, углеводы) наибольшей информационной емкостью, в силу их структурных особенностей, обладают апериодические полимеры углеводов (гликаны, олигосахариды). Это обеспечивает высокую специфичность лиганд-рецепторных взаимодействий конъюгатов олигосахаридов. Предполагают структура гликанов закодирована в геноме эукариот не прямо, а опосредованно. Синтез олигосахаридов происходит в цистернах аппарата Гольджи при участии вторичных белковых матриц, формирующих функциональные гетерогенные ассоциации гликозилтрансфераз (Чепур С.В., Плужников Н.Н., Сайганов С.А. и соавт. Гипотеза матричного синтеза апериодических полисахаридов, Усп. соврем. биол., 2019. 139 (6): 583-593). Естественно, пространственная структура таких матричных белковых молекул, а следовательно, и их аффинитет к ферментам синтеза гликанов, могут быстро и существенно измениться под влиянием динамики значений величины рН и показателя окислительно-восстановительного потенциала среды цистерн аппарата Гольджи. Следует учитывать, что все участники взаимодействия клеток организма человека с коронавирусами (гликопротеины, гликолипиды) обильно декорированы гликанами с терминальными сиаловыми кислотами, распознаваемыми вирусными частицами как специфические рецепторы.
Вопросы участия гликанов в вирусной адгезии и репликации крайне важны, вследствие этого эти знания могут быть использованы для дизайна и разработки противовирусного препарата широкого спектра действия в отношении как известных, так и не известных на сегодняшний день вирусов. Такие лекарственные препараты могут стать резервными средствами для патогенетической терапии новых коронавирусных инфекций, которые могут возникнуть в будущем. Следует отметить, что целый ряд патогенных для человека вирусов (Schmidtke M., Karger A., Meerbach A., Egerer R., Stelzner A., Makarov V. Binding of a N,N'-bisheteryl derivative of dispirotripiperazine to heparan sulfate residues on the cell surface specifically prevents infection of viruses from different families.Virology, 2003, 311: 134-143), в том числе вирусы герпеса 1 и 2 типа (Schmidtke M., Riabova O., Dahse H.-M., Stelzner A., Makarov V. Synthesis, Cytotoxicity and Antiviral Activity of N,N'-bis-5-nitropyrimidyl Derivatives of Dispirotripiperazine.Antiviral Res., 2002, 55: 117-127), вирус папилломы человека (Selinka H., Florin L., Patel H.D., Freitag K., Schmidtke M., Makarov V.A., Sapp M. Inhibition of transfer to secondary receptors by heparan sulfate-binding drug or antibody induces noninfectious uptake of human papillomavirus. J. of Virology,2007, 81: 10970-10980), цитомегаловируса (Paeschke R., Woskobojnik I., Makarov V., Schmidtke M., Bogner E. DSTP-27 prevents entry of human cytomegalovirus. Antimicrob Agents Chemother.2014, 58(4):1963-1971), некоторые разновидности ВИЧ, респираторный синцитиальный вирус, а так же коронавирусы (MilewskaA., ZarebskiM., NowakP. etal.Human coronavirus NL63 utilizes heparan sulfate proteoglycans for attachment to target cells. J. Virol., 2014, 88, 13221–1323; Milewska A., Nowak P., Owczarek K. et al. Entry of Human Coronavirus NL63 into the Cell. J. Virol., 2018, 92: e01933-17; Szczepanski A., Owczarek K., Bzowska M. et al. Canine Respiratory Coronavirus, Bovine Coronavirus, and Human Coronavirus OC43: Receptors and Attachment Factors, Viruses, 2019, 11: 328), используют общий гепарансульфат-зависимый механизм присоединения к клеточной стеке хозяина. В силу этого блокаторы коммуникации вирусов с клетками организма могут иметь важное значение в терапии вызванных ими заболеваний.
Цель настоящего изобретения состоит в обосновании возможности применения ди(диспиротрипиперазино)-пиримидинов формулы 1 для лечения заболеваний человека и животных, вызванных коронавирусами, в том числе SARS-Cov-2.
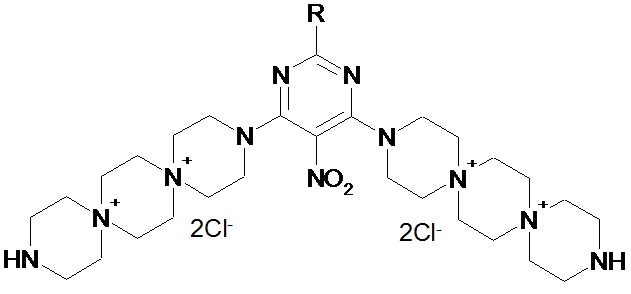
1
где R означает водород или метил.
Соединения по формуле 1 могут быть представлены в виде оснований, а также в виде фармацевтически приемлемых солей, в частности гидрохлоридов. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединения формулы 1 или приготовлены специально.
Соединения могут быть получены и использованы в кристаллическом виде. Соединения по формуле 1 в твердом виде могут быть представлены как в виде кристаллогидратов, так и в виде субстанций, не содержащих кристаллизационную воду.
Активность соединений общей формулы I и их фармацевтически приемлемых кислотно- или основно-аддитивные солей исследована в отношении коронавирусов и позволяет использовать их для получения лекарственных средств на их основе для лечения или профилактики заболеваний, вызванных указанными вирусами.
Перспективным направлением в поиске новых противовирусных соединений считают узкую специфичность воздействия на компоненты жизненного цикла вируса. Один из уникальных механизмов воздействия на процесс инвазии вируса в клетку-хозяина основан на блокировании адсорбции вируса к клетке-мишени за счет специфического блокирования гепарансульфатных протеогиканов.
Производные ди(диспиротрипиперазино)-пиримидинов формулы 1, обнаруженные в результате работ по мишень-направленному поиску новых лекарственных препаратов, обладают способностью специфически блокировать гепарансульфатные протеогликаны, находящиеся на клеточной стенке хозяина и, таким образом, предотвращать специфическую адсорбцию вирусов, в том числе коронавирусов, к клеткам хозяина. Этот процесс можно описать как блокирование адгезии вируса к клетке хозяина, при этом лекарственный препарат на основе ди(диспиротрипиперазино)-пиримидинов формулы 1 взаимодействует именно протеогликанами клетки хозяина, что обеспечивает широту и универсальность его противовирусного действия (Cagno V., Tseligka E.D., Jones S.T., Tapparel C., Heparan Sulfate Proteoglycans and Viral Attachment: True Receptors or Adaptation Bias? Viruses, 2019, 11(7), 596).
Механизм действия производных ди(диспиротрипиперазино)-пиримидинов формулы 1, по-видимому (Schmidtke M., Wutzler P., Makarov V. Novel opportunities to study and block interactions between viruses and cell surface heparan sulfates. Lett. Drug Design Discov., 2004, 1: 35-44)связан со специфическим свойством соединений связываться с гепарансульфатными протеогликанами, что приводит к драматическому уменьшению числа репликаций вируса. Показано, что присоединение исследуемых веществ антагонизируется гепарином. Мишень диазониадиспиро[5.2.5.2]гексадеканов представлена двумя сульфатными группами расположенными в соседних сахаридных остатках, так например для GlcA2S-GlcNS6S, GlcA2S-GlcNS3S, IdoA2S-GlcNAc6S,IdoA2S-GlcNH23SS6S, IdoA2S-GlcNS6S и IdoA2SGlcNS3S показано хорошее электростатическое взаимодействие между отрицательным зарядом на сульфатной группе и положительно заряженными атомами азотади(диспиротрипиперазино)-пиримидинов. Так же показано, что аналогичного рода взаимодействие может происходить и с карбонильной группой октасахарида ΔUA-GlcNSIdoUA2S-GlcNAc-UA2S-GlcNS-IdoUA2S-GlcNH23S, представляющим собой необходимый участок гепарансульфатов для проникновения коронавирусов в клетку хозяина. Таким образом, ди(диспиротрипиперазино)-пиримидины формулы 1 блокируют ключевые функциональные группы гепарансульфатных протеогликанов, предотвращая репликацию вируса и обеспечивая высокую противовирусную активность. Лекарственных препаратов, использующих такой механизм действия, в настоящее время в мире не существует.
Так же имеется информация, что производные диспиротрипиперазиния обладают умеренным иммуносупрессорным эффектом, что может положительно сказаться на блокировании цитокинового шторма, вызванного коронавирусной инфекцией (Markland, W. / McQuaid, T. / Kwong, A. D. Antiviral Efficacy of VX-497, a Novel IMPDH Inhibitor, or Ribavirin in Combination with Interferon in Encephalomyocarditis Virus (EMCV) Infected L929 Cells, Antiviral research, 1999, 41(2), 65; Benenson, E. V.; Timina, O. B. Prospidine versus methotrexate pulse in highly active rheumatoid arthritis: A controlled 6-month clinical trial, Clinical Rheumatology. 1994, 13(1), 54-59).
Производные ди(диспиротрипиперазино)-пиримидинов формулы 1 легко растворимы в воде и поэтому могут быть использованы в различных лекарственных формах как для местного, аэрозольного или для системного применения.
Задача настоящего изобретения состояла в изыскании нового лекарственного средства для лечения коронавирусной инфекции, в том числе выpванной вирусом SARS-Cov-2. Результатом решения данной задачи стало обнаружение высокой противовирусной активности ди(диспиротрипиперазино)-пиримидинов формулы 1.
Осуществление изобретения
Соединения ди(диспиротрипиперазино)-пиримидинов формулы 1 могут быть получены в соответствии со следующей схемой синтеза.
Пример 1. 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-2-метил-5-нитропиримидин тетрахлорид дигидрохлорид (1)
1. Получение 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида.
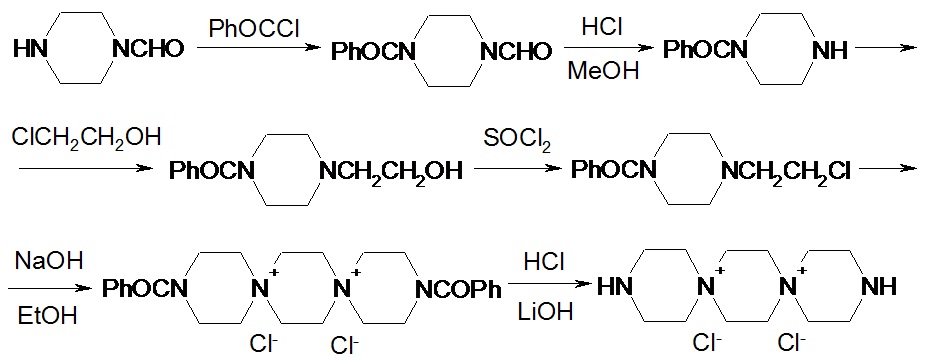
К раствору 15.2 г (0.133 М) 1-формилпиперазина 3 в 267 мл хлороформа добавляют 12.26 г (0.146 М) бикарбоната натрия. Смесь охлаждают водой до 10°С и в течение 0.5 ч прикапывают раствор 17 мл (0.146 М) бензоилхлорида в 27 мл хлороформа. Перемешивают при комнатной температуре 16 ч (оставляют на ночь). Затем реакционную массу промывают водой 2 раза по 150 мл, органический слой высушивают над сульфатом натрия при перемешивании в течение 0.5 ч. Хлороформ упаривают, к остатку добавляют 200 мл гексана, перемешивают при охлаждении до 4ºС, гексан декантируют. Операцию повторяют еще раз. После добавления 3-ей порции гексана смесь перемешивают 0.5 ч. Образовавшийся осадок отфильтровывают, промывают 20 мл гексана и 20 мл эфира. Сушат на воздухе. Получают 22.4 г (77 %) 4-бензоилпиперазин-1-карбальдегида, т. пл. 87ºС.
Растворяют 10.9 г (0.05 М) 4-бензоилпиперазин-1-карбальдегида в 60 мл смеси МеОН и конц. HCl (соотношение HCl и МеОН 1:11) и перемешивают при комнатной температуре 24 ч. Выпавший осадок отфильтровывают, промывают 2×5 мл метанола и 2×10 мл ацетона. Сушат в сушильном шкафу при 90°С 4 ч. Получают 7.55 г (63 %) гидрохлорида 1-бензоилпиперазина, т. пл. 315 ºС.
К раствору 5.34 г (0.0954 М) KOH в 55 мл этанола добавляют 18 г (0.0795 М) гидрохлорида бензоилпиперазина и перемешивают 0.5 ч при 20-22ºС. Затем вносят 13.3 мл (0.199 М) этиленхлоргидрина и в течение 1 ч прикапывают раствор 11.6 г (0.207 М) KOH в 98 мл этанола (ректификата), не допуская увеличения температуры в массе выше 20°С. Через 20 ч образующийся KCl отфильтровывают, промывают 25 мл абс. этанола. Фильтрат охлаждают до 10°С и медленно приливают 58 мл 12 % HCl/EtOH (контроль рН 2-3), перемешивают 1 ч при 5°С, затем оставляют на ночь в холодильнике. Осадок отфильтровывают, промывают 2×10 мл абсолютного этанола, сушат или на воздухе в течение 2 сут или в сушильном шкафу при 50-55°С 4-5 ч. Получают 15.6 г (73 %) гидрохлорида 1-бензоил-4-(β-оксиэтил)пиперазина, т. пл. 215ºС.
К суспензии 13.5 г (0.05 М) гидрохлорида 1-бензоил-4-(β-оксиэтил)пиперазина в 96 мл хлороформа прикапывают при перемешивании в течение 0.5 ч 8 мл SOCl2 при этом повышая температуру реакционной массы до 45°С нагреванием на масляной бане. Выдерживают при этой температуре 0.5 ч, затем нагревают до 55°С, выдерживают 0.5 ч, затем нагревают до 70°С и перемешивают 3 ч. После этого реакционную массу охлаждают до 20°С и оставляют в холодильнике на 16 ч. Осадок отфильтровывают, промывают 2×30 мл хлороформа и сушат 3 ч при 40-45°С в сушильном шкафу. Получают 11.7 г (81 %) гидрохлорида 1-бензоил-4-(β-хлорэтил)пиперазина, т. пл. 230ºС.
К суспензии 7.35 г (0.0254 М) гидрохлорида 1-бензоил-4-(β-хлорэтил)пиперазина в 15 мл этанола (ректификата) приливают раствор 1.12 г (0.028 М) NaOH в 19 мл 96 % этанола и перемешивают при 20-25°С 1.5 ч. Затем NaCl отфильтровывают, промывают 2×5 мл абс. этанола. Фильтрат кипятят при перемешивании 1 ч, а затем упаривают на роторном испарителе при 80°С в бане досуха. Остаток нагревают при 120°С 16 ч. Охлаждают, добавляют 15 мл дистиллированной воды и перемешивают при кипении до полного растворения. К раствору прибавляют 0.7 г активированного угля, кипятят 10 мин. Уголь отфильтровывают и промывают 2×5 мл горячей воды. Маточный раствор охлаждают и оставляют на 16 ч в холодильнике. Выпавший осадок отфильтровывают, промывают водой (2×5 мл) и спиртом (2×5 мл). Сушат 2 ч при 100 ºС. Получают 3.1 г (45 %) дихлорида N,N”-дибензоил-N’,N”-диспиротрипиперазиния в виде дигидрата, т. пл. >360°С (с. разл.).
Смесь 3.1 г (0.0057 М) дихлорида N,N”-дибензоил-N’,N”-диспиротрипиперазиния в виде дигидрата и 20 мл 10 % соляной кислоты, полученной смешением 7 мл концентрированной соляной кислоты и 13 мл дистиллированной воды, кипятят при перемешивании 4 ч. Реакционную смесь охлаждают в бане со льдом до 10-15ºС, выпавшую бензойную кислоту отфильтровывают и промывают водой. Фильтрат упаривают досуха на роторном испарителе. Твердый остаток перемешивают с 10 мл метанола, осадок отфильтровывают и промывают 5 мл метанола. Сушат 2 ч при 100°С. Получают 1.9 г (82 %) дихлорида N’,N”-диспиротрипиперазиния дигидрохлорид дигидрат, т. пл. >330°С (с разл.).
К раствору 1.9 г (0.0047 М) дихлорида N’,N”-диспиротрипиперазиния дигидрохлорид дигидрат в 3.2 мл воды добавляют небольшими порциями 0.26 г (0.0108 М) LiOH при перемешивании и 20°С (рН 9). Затем добавляют 0.17 г активированного угля, перемешивают 0.5 ч, уголь отфильтровывают и промывают 2×1 мл воды. Маточный раствор разбавляют 30 мл метанола и оставляют на 16 ч при 5°С в холодильнике. Выпавший осадок отфильтровывают и промывают на фильтре 5 мл метанола. Сушат при 100°С 2 ч. Получают 1.1 г (79 %) 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида, т. пл. 350°С (с разл.)
2. Получение 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-2-метил-5-нитропиримидин тетрахлорид дигидрохлоридагексагидрата по формуле 1.

К раствору 4,6-дихлоро-2-метил-5-нитропиримидина (0,12 М) в 940 мл этилового спирта добавляют раствор 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида (0,24 М) в 220 мл воды при интенсивном перемешивании. Суспензию нагревают 4 ч при 70°С. Охлаждают до комнатной температуры, осадок отфильтровывают, промывают этиловым спиртом. Сушат при 110°С 18 ч и затем выдерживают на воздухе 4 сут. Выход 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-2-метил-5-нитропиримидин тетрахлорида дигидрохлорида гексагидрата 87 %.
Тпл.=216-220°С с разложением.
MS (m/z): 694.1622 (M+-Cl-) С29H53Cl3N11O2
Микроэлементный анализ %. Рассчитано: С29H67Cl6N11O8: C, 38.25; H, 7.42; Cl 23.36; N, 16.92. Найдено: C, 38.44; H, 7.38; Cl 22.98; N, 16.78.
Анализ воды по Фишеру. Найдено: 13.6 %.
Пример 2. 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-2-метил-5-нитропиримидин тетрахлорид дигидрохлорид (2)
Кристаллический 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гекса-декан-1-ил)-2-метил-5-нитропиримидин тетрахлорид дигидрохлоридтетрагидрат (4,0 г) был подвергнут сушке в сушильном шкафу при температуре 120°С в течение 16 ч до прекращения изменения веса субстанции. Выход 3,58 г (99 %) сухого 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-2-метил-5-нитропиримидин тетрахлорида дигидрохлорида.
Тпл.=216-220°С с разложением.
ES (m/z): 694.1622 (M+-Cl-) С29H53Cl3N11O2
Микроэлементный анализ %. Рассчитано: С29H55Cl6N11O2: C, 43.40; H, 6.91; Cl26.51; N, 19.02.Найдено:C, 43.42; H, 7.03; Cl 26.48; N, 19.09.
Анализ воды по Фишеру. Найдено: 0.4 %.
Пример 3. 4,6-Ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-2-метил-5-нитропиримидин тетрахлорид (3)
К раствору 4,6-дихлоро-2-метил-5-нитропиримидина (0,12 М) в 940 мл этилового спирта добавляют раствор 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида (0,24 М) в 220 мл воды при интенсивном перемешивании. Суспензию нагревают 4 ч при 70°С и добавляют 0,24 М триэтиламина. Реакционную массу дополнительно выдерживают в течение 1 ч при 50оС, охлаждают до комнатной температуры, осадок отфильтровывают, промывают этиловым спиртом. Полученное твердое вещество очищают переосаждением из водного раствора смесью ацетон/метанол 1:1. Продукт сушат при 110°С в течение 5 ч. Выход 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-2-метил-5-нитропиримидин тетрахлорида 83%.
Тпл.=196-201°С с разложением.
ES (m/z): 694.1622 (M+-Cl-) С29H53Cl3N11O2
Микроэлементный анализ %. Рассчитано: С29H53Cl4N11O2: C, 47.74; H, 7.32; Cl19.44; N, 21.12. Найдено:C, 47.67; H, 7.26; Cl 19.56; N, 21.23.
Пример 4. 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-5-нитропиримидин тетрахлорид (4)
К раствору 4,6-дихлоро-5-нитропиримидина (0,12 М) в 940 мл этилового спирта добавляют раствор 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида (0,24 М) в 220 мл воды при интенсивном перемешивании. Суспензию нагревают 4 ч при 70°С и добавляют 0,24 М триэтиламина. Реакционную массу дополнительно выдерживают в течение 1 ч при 50оС, охлаждают до комнатной температуры, осадок отфильтровывают, промывают этиловым спиртом. Полученное твердое вещество очищают переосаждением из водного раствора смесью ацетон/метанол 1:1. Продукт сушат при 110°С в течение 5 ч. Выход 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-5-нитропиримидин тетрахлорида81 %.
Тпл.= 226-230°С с разложением.
ES (m/z): 680.1356 (M+-Cl-) С28H51Cl3N11O2
Микроэлементный анализ %. Рассчитано: С28H51Cl4N11O2: C, 47.00; H, 7.18; Cl19.82; N, 21.53. Найдено:C, 47.07; H, 7.08; Cl 19.92; N, 21.37.
Пример 5. Противовирусная активность соединений по формуле 1 in vitro в отношении SARS-Cov-2 на U2-OS Ace2 клетках.
Эксперимент проведен в соответствии с описанием в EMBO J. 2020 Oct 13:e106267. doi: 10.15252/embj.2020106267. Экспериментальные вещества были предварительно растворены в воде в концентрации 25 μМ. 100 мкл раствора экспериментального соединения были добавлены к клеткам U2-OS Ace2 в среде (8x103 клеток в ячейке) для выращивания (DMEM 10% FCS 1% PS) и инкубировали 45-60 мин при 37°C. Затем добавляли 10 мкл вируса на лунку (конечный MOI 0,1). Клетки инкубировали при 37°C в течение 20 часов, фиксировали 8% PFA в течение 30 минут при комнатной температуре и промывали PBS. Для окрашивания ядер клеток и измерения их жизнеспособности добавляли 100 мкл раствора Hoechst. Планшеты считываются с помощью автоматического конфокального микроскопа (Opera Phoenix), который измеряет количество инфицированных клеток (сигнал GFP) и выживаемость (сигнал Hoechst). Полученные данные представлены в таблице 1.
Таблица 1. Противовирусная активность соединений по формуле 1 in vitro в отношении SARS-Cov-2 на U2-OS Ace2 клетках
ИС - индекс селективности
Пример 6. Противовирусная активность соединений по формуле 1 в отношении SARS-Cov-2 in vitro.
Использовали перевиваемую культуру клеток почек зеленых мартышек Vero (Американская коллекция клеточных культур и вирусов). Клетки культивировали в среде роста, представляющей собой среду ДМЕМ (Минимальная среда ИГЛА, «ПанЭко, Россия) с добавлением 10 % инактивированной нагреванием эмбриональной телячьей сыворотки (ЭТС, «ПанЭко, Россия), 2 мМL-глутамина (Sigma, USA) и антибиотиков (100 Ед/мл пенициллина и 100 мкг/мл стрептомицина). Среда поддержки содержала все указанные выше ингредиенты и 2 % ЭТС. Клетки инкубировали 20 ч в термостате в атмосфере 5 % СО2 при температуре +37°С.
В опытах использовали транспортную среду, содержащую вирус SARS-Cov-2, полученный от больного. Наличие РНК вируса подтверждали SARS-Cov-2 РНК-скрин (Генериум, Владимирская область). Из транспортной среды с подтвержденной активностью готовили разведения для проведения эксперимента. ТЦД50вирус-содержащего материала оценивали по стандартной методике микрометодом в 96-луночных культуральных планшетах с использованием культуры клеток, посевная доза 2×104 клеток на лунку. Культуры клеток инкубировали с вирусной нагрузкой на протяжении 24 ч.
За ТЦД50 вируса принимали минимальное разведение вирус-содержащего изолята клинического материала, вызывающего 50 % поражение клеточного монослоя при отсутствии дегенерации клеточного монослоя в контроле без инфицирования (50 % тканевая цитопатическая доза вируса). Эффективность PDSТP в виде раствора 0,1 мг/мл оценивали визуально с помощью инвертированного микроскопа ЛОМО по сохранению сформированного монослоя клеток.
В параллельных пробах оценивали ТЦД50 вируса при добавлении в среду соединения по формуле 1 в разных концентрациях.
Результаты противовирусной активности соединений по формуле 1 представлены в таблице 2.
Таблица 2. Противовирусная активность in vitro соединений по формуле 1
Таким образом, соединения (1) и (4) по формуле 1 защищают эпителиальные клетки Vero от цитопатического действия SARS-Cov-2.
Пример 7. Защита клеток легкого соединениями по формуле 1 от адгезии к ним вируса SARS-Cov-2.
Для исследования выделяли легкие двух самцов морских свинок. После вскрытия грудной клетки в неё немедленно засыпали гранулированный лед и извлекали легкие, которые немедленно укладывали на замораживающий столик при температуре t=+4°С. Дезинтеграцию тканей осуществляли стандартным способом. Готовили следующие среды для выполнения градиентного центрифугирования и выделения субклеточных структур с учетом адаптированных методических рекомендаций (Гуреев А.П., Кокина А.В., Сыромятников М.Ю., Попов В.Н. Оптимизация методов выделения митохондрий из разных тканей мыши. Вестн. ВГУ, Серия: Химия. Биология. Фармация, 2015, № 4: 61-65; Егорова М.В., Афанасьев С.А. Выделение митохондрий из клеток и тканей животных и человека: современные методические приемы. Сиб. мед. журн., 2011, т. 26, № 1(1):22-28).
1. Среда для выделения содержала 220 мМ маннитола, 100 мМ сахарозы, 1 мМ ЭДТА, 20 мМ HEPES, БСА (свободного от жирных кислот) в концентрации 2 мг/мл. Все компоненты были растворены в деионизированной воде с конечным pH 7.4.
2. Среда для промывки содержала 220 мМ маннитола, 100 мМ сахарозы, 1 мМ ЭДТА, 20 мМ HEPES. Все компоненты были растворены в деионизированной воде с конечным pH 7.4.
3. В 100 % Перколл добавляли 220 мМ маннитола, 100 мМ сахарозы, 1 мМ ЭДТА; 20 мМ HEPES с конечным pH 7.4. 23 % раствор Перколла был приготовлен из 100 % Перколла путем его растворения в среде для промывки.
Ткань легкого промывали в среде выделения и гомогенизировали в стеклянном гомогенизаторе при температуре +4°С. Гомогенат переносили в центрифужные пробирки и доводили до нужного объема средой. Гомогенат центрифугировали в течение 5 мин при 600 g. Полученный супернатант переносили в чистые пробирки и доводили до нужного объема средой для промывки. При повторном центрифугировании осаждение фракций свободных митохондрий и липосом осуществляли при помощи центрифугирования в течение 10 мин при 14000 g. Полученный супернатант удаляли, а осадок ресуспендировали в среде для промывки. После этого осадок от из нескольких пробирок собирали в одну и аккуратно наносили на 23 % раствор Перколла. Центрифугирование в градиенте Перколла проводили в течение 15 мин при 23000 g. После центрифугирования получали разделение трех фаз. Аккуратно удаляли верхний и плотный средний слои. Нижний слой ресуспендировали и добавляли среду промывки. Следующую промывку осуществляли путем центрифугирования в течение 10 мин при 18000 g. Супернатант удаляли, осадок ресуспендировали, объединяли в одну пробирку и центрифугировали при 14000 g 5 мин. Супернатант удаляли, а осадок ресуспендировали в среде для промывки.
В результате были получены мембранные везикулы диаметром 6-15 мкм с пиком распределения 12 мкм (до 72 %), содержащие рецепторные структуры для связывания с вирусом. Его добавление вызывает агломерацию структур и изменение мутности раствора, измеряемой нефелометром. Соответственно введение в среду водорастворимого соединения по формуле 1 препятствовало нарастанию мутности раствора. Количество сайтов связывания тест-системы с избытком превосходило вносимое количество вирусных частиц.
Вирус-содержащие транспортные среды получали при обследовании больных с SARS-Cov-2, наличие вирусной РНК доказывали зарегистрированными тест-системами ПЦР-РВ. Каждую транспортную среду разводили в 1-1000 раз для оценки взаимодействия с биоматериалом, пробу вводили в тест-систему дозатором в количестве 100 мкл. На одном биологическом материале тестировали разведения транспортных сред от 5 больных. Ввиду отсутствия возможности приготовления стандартных растворов и культур вируса вычисляли относительные показатели по каждой пробе в долях, после чего полученные значения усредняли. Результаты исследований представлены в таблице 3.
Таблица 3. Изменения мутности (ед.) биологической тест-системы для оценки связывания с вирусом SARS-Cov-2 с рецепторами клеток легких
На втором этапе проводили центрифугирование получаемой смеси при 14000 g 5 мин, что позволяло осадить везикулы и, соответственно, связанные с ними вирусы, а наличие в растворе несвязанных, в том числе благодаря действию препарата, специфических РНК-структур определяли ПЦР-РВ.
Таблица 4. Качественное выявление несвязанных с рецепторами клеток легких РНК вируса SARS-Cov-2 в супернатанте после центрифугирования, методом ПЦР-РВ
Таким образом, соединения (1) и (4) по формуле 1 дозозависимо связываются с аффинными структурами биологической тест-системы легкого и препятствует адгезии вирусных частиц SARS-Cov-2.
Пример 8. Эффективность препарата по формуле 1 в экспериментах in vivo.
Для оценки эффективности PDSTP воспроизводили модель инфекционного процесса SARS-CoV-2 на сирийских хомяках. Вирус титровали в культуре клеток Vero-B по количеству бляшкообразующих единиц и вводили животным интраназально в количестве 26 мкл/хомяка в дозе 4×104 ТЦИД50. Формировали несколько групп животных одного помета. I группа – интактные животные, составлявшие негативный контроль. II группа – животные, зараженные SARS-CoV-2, составлявшие позитивный контроль. III группа – животные, получавшие PDSTP в дозе 15 мг/кг ежедневно внутрибрюшинно в течение 5 дней до заражения, составлявшие группу профилактики. IV группа - животные, получавшие PDSTP в дозе 15 мг/кг ежедневно внутрибрюшинно в течение 5 дней после заражения с 3 по 7 сут инфекционного процесса на фоне его манифестных признаков, составлявшие группу лечения.
Во время наблюдения за зараженными животными оценивали проявления симптоматики заболевания (чихание, выделение из носа), частота которых достоверно не различалась у зараженных животных. Зараженные животные теряли в массе. Животных выводили из опыта на 7 сутки эксперимента. При вскрытии извлекали лёгкие и селезенку, проводили их взвешивание и рассчитывали удельную массу в процентах от массы тела. Правое лёгкое помещали в чашки Петри с физиологическим раствором и подвергали диафаноскопии для подсчета количества уплотнений ткани и очагов гиперемии с кровоизлияниями в паренхиму лёгкого.
Установлено, что применение препарата PDSTP в профилактической и лечебной схемах препятствует потере массы тела животных, показатели которых достоверно отличались от группы инфицированного контроля. В легких зараженных животных развивалась вирусная пневмония с множественными очагами неравномерного уплотнения с нечеткими границами различной величины, но обычно не очень крупными и имеющими тенденцию к слиянию, особенно в нижних отделах легких. Пятна на поверхности лёгких различного цвета: от светло-серых и серо-розовых до светло-красных и бурых. Участки лёгких с измененным цветом на разрезе имели зернистую поверхность и слегка выбухали над окружающей тканью. В группе позитивного контроля практически не обнаружены участки нормальной ткани легкого светло-розового цвета (рисунок 1). Лёгкие выглядят уплотненными, туго-эластичными, отечными. Поверхность разреза лёгкого пестрая неравномерного кровенаполнения. Из уплотненных участков при разрезе жидкость практически не выдавливается. Согласно гравиметрическим показателям органа (таблица 1) PDSTP существенно не влиял на формирование вирусной пневмонии и удельная масса лёгких зараженных животных разных групп достоверно не различалась, при этом сохраняя существенные отличия от интактных животных.
Прослежено, что у зараженных животных снижалась удельная масса селезенки, по-видимому, отражая формирующееся иммунодефицитное состояние. Профилактическое введение PDSTP усугубляло этот процесс, тогда как лечебное применение препарата позволяло сохранить показатели органа на уровне интактных значений.
В таблице 5 приведена характеристика биометрических показателей (Me [Q25÷Q75]) самок сирийских хомяков на 7 сут инфекции SARS-CoV-2. Заражение интраназальное 26 мкл/хомяк заражение SARS-CoV-2, 4×104 ТЦИД50. Проводились наблюдения лёгких при аутопсии животных. В таблице 6 отражены количественные показатели диафаноскопии. Прослежено, что PDSTP как при профилактическом, так и при лечебном применении снижает количество уплотнений в ткани лёгкого и количество очагов гиперемий и кровоизлияний. В группе животных, получавших лечение препаратом этот эффект виден при визуальном наблюдении и подтверждается результатами подсчета. В этой группе ткань лёгкого представлена единичными очагами уплотнения с достаточно четкими границами различной величины, но обычно не очень крупными и без слияния. Участки легких с измененным цветом на разрезе имеют зернистую поверхность и не выбухают над окружающей тканью. Большая часть поверхности имеет вид нормальной ткани легкого светло-розового и светло-красного цвета. Лёгкие выглядят несколько уплотненными, рыхло-эластичными, незначительно отечными. Поверхность разреза легкого равномерного цвета и кровенаполнения. При разрезе жидкость практически не выдавливается.
Таким образом, в результате проведенных экспериментов показано, что при инфекции SARS-CoV-2 предпочтительно лечебное применение PDSTP, обеспечивающее снижение выраженности застойно-геморрагических поражений лёгких с потенциальным исходом в фиброзирование и предотвращающее дефицит лимфоцитов селезенки, формирующийся при заражении.
Таблица 5. Характеристика биометрических показателей (Me [Q25÷Q75]) самок сирийских хомяков на 7 сут инфекции SARS-CoV-2. Заражение интраназальное 26 мкл/хомяк заражение SARS-CoV-2, 4×104 ТЦИД50
Таблица 6. Характеристика морфометрических показателей (Me [Q25÷Q75]) правого лёгкого самок сирийских хомяков на 7 сут инфекции SARS-CoV-2 при диафаноскопии. Интраназальное 26 мкл/хомяк заражение SARS-CoV-2, 4×104 ТЦИД50
Пример 9. Ингаляционная аппликация препарата по формуле 1
Для оценки ингаляционной токсичности использовали ингаляционную камеру объемом 3 л, в которую ингалировали соединение (1) по формуле 1 при помощи порошкового ингалятора и компрессора с объемной скоростью потока 80 л/мин. Масс-медианный аэродинамический диаметр частиц аэрозоля составил 1,3±0,24 мкм, степень полидисперсности 1,4±0,15.
Для исследований был выбран временной отрезок между 5 мин и 10 мин после начала ингаляции, когда средняя концентрация препарата по формуле 1 в камере выравнивалась. Расчет поглощенной дозы проводили по формуле:

где D - поглощенная доза, мг/кг; МОД - минутный объем дыхания крысы, л/кг×мин; С - средняя концентрация препарата в камере за период ингаляции, мг/л; ΔT - период ингаляции, мин. При ингаляции прототипа или заявляемой композиции в течение 5 мин в данных условиях поглощенная доза препарата составила 1,14 мг/кг.
В результате ранее проведенных исследований LD50 соединения (1) по формуле 1 при однократном внутривенном введении крысам составило 139,5 (116,7 - 166,6) мг/кг для самцов и 155,8 (132,8 - 182,7) мг/кг для самок. Расчетные терапевтические доза должны составлять не более 1/20LD50. Полученная поглощенная доза составляет почти 1/100 от LD50, т.е. гарантированно безопасна и может кратно применяться для достижения защитного эффекта.
Реферат
Изобретение относится к области медицины, а именно направлено на лечение или предупреждение коронавирусной инфекции у человека или животного, вызванного вирусом SARS-Cov-2, путем применения соединения общей формулы 1, где R представляет собой CH3, или его гидрохлоридной соли, дигидрохлоридной соли или дигидрохлорид гексагидрата. Технический результат: высокая противовирусная активность в отношении коронавирусной инфекции у человека или животного, вызванного вирусом SARS-Cov-2. 3 з.п. ф-лы, 6 табл., 9 пр.

Формула


Комментарии