Производные 6,7-дигидро-3н-оксазоло[3,4-α]пиразин-5,8-диона - RU2581831C2
Код документа: RU2581831C2
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ. К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В настоящем изобретении описаны серии производных 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона, их смеси, их фармацевтически приемлемые соли, фармацевтические композиции, их содержащие, способы их получения, способ ингибирования ферментов фосфодиэстераз, их применение в качестве ингибитора ферментов фосфодиэстераз и их применение в качестве ингибитора фермента фосфодиэстеразы 5 типа (PDE-5). В частности, производное (R)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-дион, его энантиомер (S)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3] оксазоло[3,4-α]пиразин-5,8-дион и/или их смеси (в любом соотношении).
Кроме того, в настоящем изобретении описан способ лечения эректильной дисфункции, нарушений и/или состояний, поддающихся лечению релаксацией тканей, и нарушений, поддающихся лечению ингибитором PDE-5, с использованием производных 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона, их смесей (в любом соотношении) и/или их фармацевтически приемлемых солей. В частности, производного (R)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-диона, его энантиомера (S)-3-(l,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α] пиразин-5,8-диона и/или их смесей (в любом соотношении).
УРОВЕНЬ ТЕХНИКИ
До появления пероральных средств лечение сексуальной дисфункции у мужчин проводили интракавернозными инъекциями и другими способами, что было обусловлено, в частности, сомнениями, связанными с неблагоприятными реакциями, которые пероральное введение могло вызвать у человека. Папаверин и пентоксифиллин, например, применяли для лечения эректильной дисфункции методом интракавернозных инъекций. Другими средствами лечения, менее эффективными, являлись, например, психотерапия и хирургические имплантаты.
Пероральное лечение является самым приемлемым для человека, и это было выявлено в результате клинического исследования с использованием ингибиторов cGMP-PDE, а именно PDE-5. Предшественником этих соединений является 5-[2-этокси-5-(4-метилпиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7H- пиразоло[4,3-d]пиримидин-7-он, или силденафил, обладающий сосудорасширяющими свойствами и усиливающий эффекты оксида азота. Силденафил является активным ингредиентом лекарственного препарата Viagra®.
Позднее были разработаны другие соединения ингибиторов PDE-5, которые имеются в многочисленных публикациях в технической литературе, а также в патентных публикациях, такие как варденафил, активный ингредиент лекарственного препарата Levitra®, и тадалафил, активный ингредиент препарата Cialis®.
Соединения настоящего изобретения, производные 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона, также представляют собой ингибиторы фермента фосфодиэтеразы 5 типа (PDE-5).
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Таким образом, целью настоящего изобретения является обеспечение новых соединений производных 6,7-дигидро-3Н-оксазоло[3,4-α]пиразин-5,8-диона, их смесей (в любом соотношении), их фармацевтически приемлемых солей, фармацевтических композиций, их содержащих, которые являются эффективными для лечения эректильной дисфункции, при этом указанные соединения представляют собой релаксанты тканей и/или ингибиторы ферментов фосфодиэстераз, обладающие сосудорасширяющими свойствами и эффектами релаксации, в особенности ингибиторы PDE-5. В частности, производное (R)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-д]пиразин-5,8-дион, его энантиомер (S)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-дион и/или их смеси (в любом соотношении).
Кроме того, целью настоящего изобретения является обеспечение способов получения соединений производных 6,7-дигидро-3Н-оксазоло[3,4-α]пиразин-5,8-диона и их смесей. В частности, производного (R)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-диона, его энантиомера (S)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3] оксазоло[3,4-α]пиразин-5,8-диона и/или их смесей (в любом соотношении).
Более того, целью настоящего изобретения является обеспечение фармацевтических композиций, содержащих эффективное количество одного из производных 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона или их смесей (в любом соотношении) или их фармацевтически приемлемых солей и фармацевтически приемлемые вспомогательные вещества. В частности, фармацевтических композиций, содержащих производное (α)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-дион, его энантиомер (S)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-дион и/или их смеси (в любом соотношении).
Еще одной целью настоящего изобретения является обеспечение лекарственного средства, содержащего терапевтически эффективное количество одного из производных 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона или их смесей (в любом соотношении), или их фармацевтически приемлемых солей. В частности, лекарственных средств, содержащих производное (R)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-дион, его энантиомер (S)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α] пиразин-5,8-дион и/или их смеси (в любом соотношении).
Другой целью настоящего изобретения является применение одного из производных 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона или их смесей (в любом соотношении), или их фармацевтически приемлемых солей для лечения и/или профилактики эректильной дисфункции, нарушений и/или состояний, поддающихся лечению релаксацией тканей, и нарушений, поддающихся лечению ингибитором PDE-5, у млекопитающего. В частности, производного (R)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-диона, его энантиомера (S)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро [1,3]оксазоло[3,4-α]пиразин-5,8-диона и/или их смесей (в любом соотношении).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 показаны релаксационные эффекты соединения 2 (BL 106) на ткань мочеточника человека. Фигура 1 представляет собой кривую зависимости концентрация-эффект для BL 106 в мочеточнике человека. Данные представляют собой среднее ±SEM (стандартная ошибка среднего), n=3 эксперимента.
Фигура 2 показывает релаксационные эффекты соединения 2 (BL 106) на ткань легочной артерии кролика. Фигура 2 представляет собой кривую зависимости концентрация-эффект для BL 106 в легочной артерии кролика.
Фигура 3 показывает релаксационные эффекты соединения 2 (BL 106) на ткань кавернозного тела человека (Фигура 3 A) и ткань кавернозного тела кролика (Фигура 3 В). Фигура 3 представляет собой кривую зависимости концентрация-эффект для BL 106 в кавернозном теле человека (А) и кролика (В). Данные представляют собой среднее ±SEM(стандартная ошибка среднего), n=3 эксперимента.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении описаны производные 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона со структурами, представленными в формуле (I):

и их соли, и сольваты (например, гидраты), в которых:
R1 представляет собой ароматическую группу, конденсированную или не конденсированную группу (необязательно замещенную RB в одном или более положениях), гетероароматическую группу, содержащую один или более гетероатомов, или индольные группы (необязательно замещенные RBB в одном или более положениях), Ci-б алкенилкарбонил (необязательно замещенный R3 в одном или более положениях), бициклическую ароматическую группу (необязательно замещенную RB в одном или более положениях) или бициклическую гетероароматическую группу, содержащую один или более гетероатомов (необязательно замещенную RB в одном или более положениях);
RB представляет собой галоген, гидроксил, азот, циано, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C1-6 галогеналкил, C3-8 циклоалкил, C3-8-циклоалкил-C1-3-алкил, арил-C1-3-алкил или гетероарил-C1-3-алкил;
R2 представляет собой ароматическую группу, содержащую один или более гетероатомов, или гетероароматическую группу, содержащую один или более гетероатомов, или бициклическую ароматическую группу, содержащую один или более гетероатомов, или метилен-3,4-диоксифенильную группу;
R3 представляет собой водород, галоген, C1-6 галогеналкил, C1-3 гетероалкил или C1-3 алкил;
R4 представляет собой водород, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C1-6 галогеналкил, C3-8 циклоалкил, C3-8-циклоалкил-C1-3-алкил, арил-C1-3-алкил или гетероарил-C1-3-алкил.
В одном аспекте «C2-6 алкенилкарбонил» R1 представляет собой одну или более алкенильных групп, содержащих от 2 до 6 атомов углерода, конъюгированных или не конъюгированных с карбонильной группой.
В одном аспекте «арил» RB и R4, например арил-С1-3-алкил, представляет собой фенильную группу или фенилзамещенную один или более раз (например, 1, 2 или 3) галогеном, C1-6 алкилом, C1-6 алкоксилом или метилендиоксилом. В другом аспекте «гетероарил» RB и R4, например гетероарил-C1-6-алкил, представляет собой фурильную группу или пиридил, необязательно замещенный один или более раз галогеном, C1-6 алкилом или C1-6 алкоксилом. В другом аспекте «C3-8 циклоалкил» RB и R4, например C3-8-циклоалкил-С1-3-алкил, представляет собой моноциклическое кольцо, содержащее от 3 до 8 атомов углерода. Примеры циклоалкильных колец включают C3-6 циклоалкильные кольца: циклопропил, циклобутил, циклопентил и циклогексил.
Термин «алкил» может представлять собой алкильную цепь или разветвленную алкильную цепь. Например, C1-4 алкильная группа может представлять собой метил, этил, н-пропил, изопропил, н-бутил, втор-бутил и трет-бутил. Термин «алкенил» включает алкенильные группы с прямыми или разветвленными цепями, например, винильную и аллильную группы. Термин «алкинил» включает алкинильные группы с прямыми и разветвленными цепями, например, ацетилен. Термин «галоген» может представлять собой атомы фтора, хлора, брома или йода. Термин «галоген- C1-6-алкил» может представлять собой алкильную группу, содержащую от одного до шести атомов углерода, замещенных одним или более (например, 1, 2 или 3) атомами галогена.
Соединения формулы (I) могут содержать один или более асимметрических центров, таким образом, существовать в форме энантиомеров и/или диастереомеров. Например, в формуле (I) хиральный центр обозначен звездочкой. Соответственно, изобретение включает один или более энантиомеров и их смеси (в любом соотношении).
Соединения формулы (I) могут существовать в различных таутомерных формах, и изобретение включает одну или более таутомерных форм и их смеси (в любом соотношении).
Фармацевтически приемлемые соли соединений формулы (I), которые имеют основной центр, образованы путем присоединения фармацевтически приемлемых кислот. Некоторые примеры солей включают хлоргидрат, бромгидрат, сульфат или бисульфат, фосфат или гидрофосфат, ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат, глюконат, метансульфонат, бензолсульфонат и п-толуолсульфонат. Соединения формулы (I) могут применяться в виде фармацевтически приемлемых солей металлов, в частности, солей щелочных металлов с основаниями. Например, соли натрия и калия.
В одном варианте соединения данного изобретения имеют структуру, представленную формулой (I), в которой R1 представляет собой индольную группу, R2представляет собой 3,4-метилендиоксифенильную группу, R3 представляет собой водород и R4 представляет собой метальную группу. В предпочтительном варианте соединения данного изобретения представляют собой (R)-3-(бензо[d][1,3]диоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-дион и/или его энантиомер (S)-3-(бензо[d][1,3]диоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро-3Н-оксазоло[3,4-α]пиразин-5,8-дион.
Соединение (R,S)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-дион (2) согласно настоящему изобретению может быть получено в результате реакции соединения 1, в присутствии метиламина с использованием этанола в качестве растворителя согласно Схеме 1:

Альтернативным способом получения соединения 2 является реакция 3 с кислотой в этаноле согласно Схеме 2:

Соединение 1 может быть получено согласно Схеме 3:

Соединение 4 обрабатывают кислотой в изопропаноле. После нейтрализации бикарбонатом натрия добавляют 3,4-(метилендиокси)бензальдегид. Последней стадией этого способа является добавление хлорацетилхлорида.
Альтернативно, соединение 1, может быть получено согласно Схеме 4:

В этом способе соединение 5 обрабатывают кислотой в этаноле. После нейтрализации бикарбонатом натрия добавляют хлорацетилхлорид. Соединение 1 также может быть получено согласно Схеме 5:

В этом способе соединение 6 обрабатывают кислотой в диоксане. После нейтрализации бикарбонатом натрия реакция окисления протекает с использованием пиридинхлорхромата (РСС), что приводит к образованию промежуточного соединения 4, которое обрабатывают кислотой в изопропаноле. После нейтрализации бикарбонатом натрия добавляют 3,4-(метилендиокси)бензальдегид. Последней стадией этого способа является добавление хлорацетилхлорида.
Другой способ получения соединения 1, показан на Схеме 6:

В этом способе реакция 7 и 8 в присутствии оксида алюминия (Al2O3) в дихлорметане приводит к образованию промежуточного соединения 9, которое реагирует с 10 в присутствии оксида кальция (СаО).
Соединение 3 может быть получено согласно Схеме 7:

В этом способе промежуточное соединение 9 взаимодействует с соединением 11 с использованием жидкого аммиака в качестве растворителя.
Альтернативно, соединение 3 может быть получено согласно Схеме 8:

В этом способе в присутствии оксида кальция (СаО) промежуточное соединение 9 взаимодействует с соединением 12.
Соединение 4 может быть получено согласно Схеме 9:

В этом способе соединение 13 обрабатывают (2,3)-дихлор-5,6-дициано-1,4-бензохиноном (DDQ) с использованием смеси тетрагидрофуран:вода в качестве растворителя для реакции.
Другой способ получения соединения 4 показан на Схеме 10:
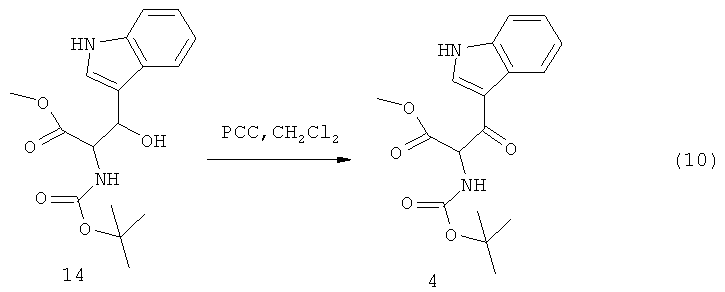
В этом способе соединение 14 обрабатывают хлоридом пиридинхлорхромата (РСС) с использованием метиленхлорида в качестве растворителя для реакции. Соединение 5 может быть получено согласно Схеме 11:

В этом способе в присутствии оксида кальция (СаО) промежуточное соединение 9 взаимодействует с соединением 15.
Альтернативно, соединение 5 может быть получено согласно Схеме 12:

В этом способе промежуточное соединение 9 взаимодействует с соединением 16 с использованием жидкого аммиака в качестве растворителя. Соединение 6 может быть получено согласно Схеме 13:

В этом способе соединение 13 обрабатывают гексаметилдисилазидом лития (LIHDMS). Последней стадией этого способа является добавление йода (I2). Соединение 14 может быть получено согласно Схеме 14:
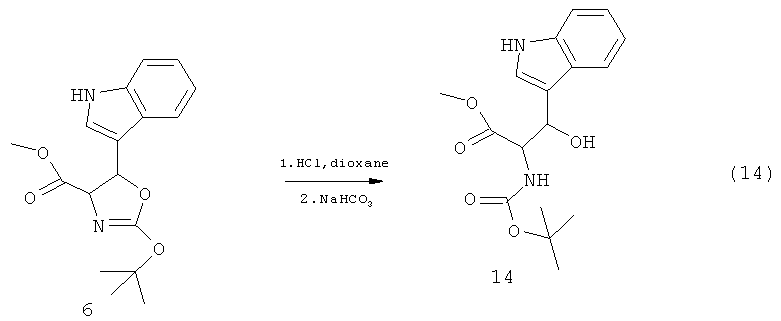
В этом способе соединение 6 обрабатывают кислотой в диоксане. Все соединения, содержащие карбоксиметильную группу, в частности 1, 3, 5 и 7, могут быть приготовлены из (их) производных, содержащих нитрильную группу,
например, согласно Схеме 15.

Например, соединение 17 обрабатывают кислотой в метаноле. Этот способ также может быть использован индивидуально в отношении соединений 18,19 и 20 для получения промежуточных соединений 3, 5 и 1, соответственно.
Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, например подходящую лекарственную форму, при этом указанная композиция содержит эффективное количество одного или нескольких соединений формулы (1) или его фармацевтически приемлемой соли, и фармацевтически приемлемое вспомогательное вещество.
В одном варианте фармацевтическая композиция дополнительно содержит другие ингибиторы PDE-5, такие как силденафил, варденафил и тадалафил; или их фармацевтически приемлемые соли. В другом варианте фармацевтическая композиция дополнительно содержит одно или несколько соединений, которые лечат эректильную дисфункцию или нарушения, поддающиеся лечению ингибитором PDE-5.
В одном варианте фармацевтическую композицию вводят со второй фармацевтической композицией, содержащей другие ингибиторы PDE-5, например силденафил, варденафил и тадалафил; или их фармацевтически приемлемые соли. В другом варианте указанная вторая фармацевтическая композиция содержит одно или несколько соединений, которые лечат эректильную дисфункцию или нарушения, поддающиеся лечению ингибитором PDE-5. Введение может быть совместным введением или последовательным введением.
Фармацевтические композиции могут быть приготовлены способами, хорошо известными в данной области техники. Соответственно, Remingtons Pharmaceutical Sciences или аналогичные источники информации могут быть использованы для приготовления подходящего препарата согласно изобретению.
Фармацевтические композиции для перорального введения могут быть представлены в виде дискретных единиц, таких как капсулы, таблетки, шипучие таблетки, жевательные таблетки, пилюли, порошки, гранулы и гели, или аналогичные фармацевтические формы. Другие лекарственные формы для перорального введения включают суспензии или эмульсии в водном или неводном носителе.
В твердых лекарственных формах соединения формулы (I) могут быть смешаны с фармацевтически приемлемым носителем, содержащим, по меньшей мере, один компонент, выбранный из группы, состоящей из разбавителей, связующих веществ, дезинтегрирующих агентов, лубрикантов, красителей и ароматизаторов. Примерами инертных разбавителей являются карбонат кальция, двузамещенный фосфат кальция, трехзамещенный фосфат кальция, сульфат кальция, микрокристаллическая целлюлоза, порошкообразная целлюлоза, декстраты, декстрины, циклодекстрины, декстрозный наполнитель, фруктоза, каолин, лактитол, лактоза, маннит, сорбит, крахмал, предварительно желатинированный крахмал, сахароза, прессуемый сахар и сахарная глазурь. В качестве связующих может быть использовано одно или несколько веществ, например метилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, желатин, аравийская камедь, этилцеллюлоза, поливиниловый спирт, пуллулан, предварительно желатинированный крахмал, агар, трагант, альгинат натрия, пропиленгликоль и альгинат.В качестве дезинтегрирующих агентов может быть использовано одно или несколько веществ, выбранных из гидроксипропилцеллюлозы с низкой степенью замещения, карбоксиметилцеллюлозы, кальций-карбоксиметилцеллюлозы, натрий-карбоксиметилцеллюлозы, кроскармеллозы натрия, крахмала, кристаллической целлюлозы, оксипропилированного крахмала и частично предварительно желатинированного крахмала. Примерами лубрикантов являются стеариновая кислота, стеарат магния, стеарат кальция, тальк, гидрогенизированное касторовое масло и сахараза.
В случае капсул, таблеток, шипучих таблеток и пилюль лекарственные формы могут также содержать буферные агенты. Могут быть приготовлены мягкие желатиновые капсулы, содержащие смесь соединений формулы (I) и растительного масла. Твердые желатиновые капсулы могут содержать гранулы соединений формулы (I) в комбинации с твердым, порошковым носителем, таким как лактоза, сахароза, сорбит, маннит, картофельный крахмал, кукурузный крахмал, амилопектин, желатин производных целлюлозы. Дополнительно, таблетки и пилюли могут быть приготовлены с энтеросолюбильными покрытиями.
В одном варианте лекарственные формы имеют контролируемый/задержанный/модулированный тип высвобождения на основе носителей или матриц, включая, но без ограничения, биосовместимые полимеры, фармацевтически приемлемые полимерные матрицы, липосомы, PEG-липосомы или циклодекстрин, или матрицу на основе производного циклодекстрина.
Фармацевтические композиции можно вводить различными способами, включая, но без ограничения, пероральный, внутрикарвенозную инъекцию, местное введение и трансдермальную доставку через кожу в различные участки или парентеральные способы. Конкретный выбранный способ введения будет зависеть от соединений, присутствующих в композиции, тяжести эректильной дисфункции, нарушений и/или состояний, поддающихся лечению релаксацией тканей, или нарушения, поддающегося лечению ингибитором PDE-5, и дозы, требуемой для терапевтической эффективности. Предпочтительно, чтобы композиции изобретения находились в форме для перорального введения из соображений удобства для пациента и режима дозирования.
Тканевые релаксанты использовали для способствования расслаблению различных тканей для лечения или в качестве вспомогательного вещества при лечении, процедуре или оперативном вмешательстве по поводу литиаза (Korkes, F. et al, J Bras Nefrol. (2009) 31(1): 55), увеличения предстательной железы (например, доброкачественной гиперплазии предстательной железы, простатита) (WO 9911279) и сужения мочеточника (Van der werf et al., BJU International (2002) 90:588). Другие нарушения и/или состояния, поддающиеся лечению релаксацией тканей, известны и описаны в данной области техники.
Ингибиторы PDE-5 использовали для блокирования разложения cGMP для продления эффектов оксида азота (NO) на различные ткани, например, для поддержания NO-индуцированной релаксации дыхательных путей и сосудов (Bames, Р. J., et al., (1995) и для поддержания NO-индуцированной защиты ткани (Duffin, R., et. al., Br J Phannacol. (2008) 153(4): 623). Такие воздействия на ткани оказались благоприятными для лечения некоторых нарушений - в настоящем изобретении нарушений, поддающихся лечению ингибитором PDE-5 - включая легочную гипертензию (лечение которой обычно проводят силденафила цитратом); бронхит, хроническую астму, гипертензию (ЕР 758653, US 7569572); феномен Рейно (Ghofrani Н.А., et. al., Nat Rev Drug Discov. 2006, 5:689); начальную стадию сердечной недостаточности правого отдела сердца (Ghofrani et al. (2003) AJRCCM 167(8): 1139); нейрогенез и восстановление функций после инсульта (Zhang et al. (2002) Stroke 33:2675-2680); релаксацию коронарных артерий (Halcox et al. (2002) J Am Coll Cardiol 40:1232); нарушение полового возбуждения у женщин (Nehra et al. (2001) World J Urol. 19(1): 115); стенокардию и застойную сердечную недостаточность (Reffelmann et al., Circ. (2003) 108(2): 239). Другие нарушения, поддающиеся лечению ингибитором PDE-5, известны и описаны в данной области техники.
Терапевтически эффективное количество для лечения эректильной дисфункции представляет собой количество, которое является достаточным для достижения улучшения эректильной функции, или частичного снятия симптомов эректильной дисфункции, или даже восстановления эректильной способности. Терапевтически эффективное количество для лечения нарушений, поддающихся лечению ингибитором PDE-5, представляет собой количество, которое является достаточным для достижения улучшения указанного нарушения или частичного снятия симптомов указанного нарушения. Эффективные количества будут зависеть от конкретного состояния, по поводу которого проходит лечение, и его тяжести; индивидуальных характеристик пациента, включая возраст, физическое состояние, размер и массу тела; сопутствующего лечения; и способа введения. Эти факторы хорошо известны опытным в данной области специалистам и могут быть определены без проведения экспериментов. В целом, дозы соединений формулы (I) будут изменяться от примерно 0.01 мг/кг массы тела в сутки до 100 мг/кг массы тела в сутки, предпочтительно от 0.1 мг/кг массы тела в сутки до 10 мг/кг массы тела в сутки. Многократный прием в сутки может рассматриваться для достижения соответствующих системных уровней активных ингредиентов, присутствующих в композиции изобретения.
Настоящее изобретение более подробно описано с помощью следующих Примеров. Следует отметить, что изобретение не ограничивается следующим описанием.
ПРИМЕР 1
Приготовление Соединения 2,(R,S)-3-(1,3-6ензолиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α]пиразин-5,8-диона.
Приготовление промежуточного соединения 4
В раствор DDQ (228.0 г; 1.0 моль) в смеси 1000 мл THF:H2O (9:1) добавляли метил 2-[(трет-бутоксикарбонил)амино]-3-(1H-индол-3-ил)пропаноат (80.0 г; 0.251 моль). Реакционную смесь перемешивали в течение 3 часов. Дополнительные аликвоты DDQ добавляли до израсходования всего исходного материала (по данным ТСХ). После этого реакционную смесь промывали насыщенным раствором NaHCO3 и продукт экстрагировали метиленхлоридом. Органические фазы объединяли и сушили MgSO4. Растворитель частично удаляли и в эту смесь добавляли 3 г активированного угля. Эту смесь перемешивали в течение 30 минут и после отстаивания до комнатной температуры фильтровали. Растворитель удаляли на ротационном испарителе до сухого остатка. Полученное масло растворяли в ацетоне при нагревании (70.0 мл). Раствор охлаждали и помещали в ледяную ванну, что вызывало осаждение метил 2-[(трет-бутоксикарбонил)амино]-3-(1H-ндол-3-ил)-3-оксопропаноата, который фильтровали и сушили в нагревателе при 60°C.
Приготовление промежуточного соединения 1
В суспензию метил 2-[(трет-бутоксикарбонил)амино]-3-(1H-индол-3-ил)-3-оксопропаноата (6.23 г; 19.0 ммоль) 4 в 200 мл изопропанола добавляли 2.0 мл 36% НСl. Реакционную смесь перемешивали в течение 3 часов. Дополнительные аликвоты 36% НСl добавляли до израсходования всего исходного материала. После завершения реакции реакционную смесь охлаждали до комнатной температуры. Добавляли аликвоты NaHCO2 для нейтрализации раствора. Затем в раствор добавляли 3,4-(метилендиокси)бензальдегид (2.86 г; 19 ммоль) и полученную реакционную смесь перемешивали на магнитной мешалке в течение 24 часов, что вызывало осаждение метил 2-[(Е)-(1,3-бензодиоксол-5-илметилиден)амино]-3-(1H-индол-3-ил)-3-оксопропаноата, который фильтровали и сушили в нагревателе при 60°C.
Метил 2-[(E)-(1,3-бензодиоксол-5-илметилиден)амино]-3-(1H-индол-3-ил)-3-оксопропаноат (5.46 г; 15.0 ммоль) добавляли в раствор пиридина (10 мл) в 50 мл сухого метиленхлорида. Эту суспензию перемешивали в течение 30 минут на магнитной мешалке с осушительной трубкой, наполненной CaCO3. Хлорацетилхлорид (2.3 мл; 30.0 ммоль) растворяли в 2.5 мл сухого метиленхлорида. Этот раствор добавляли по каплям в реакционную смесь в течение 30 минут. Еще через 3 часа в реакционную смесь добавляли 100 мл насыщенного водного раствора CuSO4. Органическую фазу экстрагировали в делительной воронке и изолировали. Водную фазу промывали 50 мл метиленхлорида, и органическую фазу изолировали. Органические фазы объединяли. Этот процесс промывания повторяли еще два раза. Органическую фазу промывали насыщенным водным раствором NaCl. Органическую фазу изолировали и сушили MgSO4. Растворитель удаляли на ротационном испарителе, что вызывало выделение метил 3-(хлорацетил)-5-(1H-индол-3-ил)-2-фенил-2,3-дигидро-1,3-оксазол-4-карбоксилата 1.
Приготовление соединения 2
В раствор метил 3-(хлорацетил)-5-(1H-индол-3-ил)-2-фенил-2,3-дигидро-1,3-оксазол-4-карбоксилата (5.46 г; 12.4 ммоль) 1 в 100 мл этанола добавляли 10 мл водного раствора 40% метиламина. Эту реакционную смесь перемешивали на магнитной мешалке в течение 24 часов, что вызывало осаждение (R,S)-3-(1,3-бензодиоксол-5-ил)-1-(1H-индол-3-ил)-7-метил-6,7-дигидро[1,3]оксазоло[3,4-α] пиразин-5,8-диона 2. Полученный продукт имеет следующие характеристики: Т.пл. 279-281°C. МС высокого разрешения (EI): расчетное m/z для [С22Н18N3O5] 404, 1246; обнаруженное: 404, 1239. IV (KBr): 3322, 1647, 1613, 1467 cm-1. ЯМР1Н (300 МГц, DMSO-d6): δ=11.87 (s, 1H); 9.00 (s, 1H); 7.87 (d, 1H, J=9.0 Гц); 7.48 (d, 1H, J=9.0 Гц); 7.14 (m, 5H); 7.00 (d, 1H, J"=9.0 Гц); 6.06 (s, 2H); 4.20 (s, 2H); 2.94 (s, 3H). ЯМР13С (125 МГц, DMSO-d6): δ=158.3; 156.7; 148.2; 147.5; 147.3; 135.7; 130.9; 130.7; 125.1; 122.0; 121.2; 120.4; 120.2; 112.0; 108.1; 106.4; 104.7; 102.2; 101.3; 90.1; 52.7; 32.2.
ПРИМЕР 2
Эффект Соединения 2 на кавернозное тело и мочеточник человека и кавернозное тело и легочную артерию кролика
Ткань
Кавернозное тело и мочеточник человека получали из тканей, извлеченных в результате оперативных вмешательств, которые помещали ледяной раствор Кребса для быстрой доставки в лабораторию.
Самцов кроликов новозеландских белых (2-2.5 кг) использовали для получения тканей полового члена и легочной артерии, которые удаляли и переносили в ледяной раствор Кребса. Две полоски и четыре кольца были получены от каждого кавернозного тела (СС) и легочной артерии соответственно. Запись изометрического напряжения
Кавернозные полоски, легочная артерия и мочеточник погружали в камеры для органов емкостью 10 мл, содержащие раствор Кребса при 37°C, рН 7.4, который находился в условиях постоянного барботирования смесью 95% O2 и 5% CO2. Ткани растягивали под действием силы покоя, равной 5 мН, и оставляли для уравновешивания на 60 мин. Изменения изометрической силы записывали с использованием системы регистрации данных Power-Lab 4/30 (Chart software, версия 7.0; ADInstruments, Colorado Springs, CO). Кумулятивные кривые зависимости концентрация-эффект для соединения 2 (обозначенного как BL 106 на Фигурах 1, 2 и 3) (0.001-10 мкМ) получали для кавернозных пластинок, колец легочной артерии и мочеточника, сокращенных под действием норадреналина (NOR 10 мкМ) (Sigma, St. Louis, MO). Кривые зависимости концентрация-эффект для соединения 2 (обозначенного как BL 106 на Фигурах 1, 2 и 3) были построены для каждого образца. Для легочной артерии кривые зависимости концентрация-эффект для соединения 2 также были построены в присутствии или в отсутствие ингибитора растворимой формы гуанилатциклазы, 1H-[1,2,4]оксадиазоло[4,3-α] хиноксалин-1-она (ODQ 10 мкМ) (Sigma, St. Louis, МО). Контрольные кольца (обработанные 40 мМ DMSO) также обрабатывали параллельно с экспериментальными полосками и кольцами.
Релаксация мочеточника человека
Норадреналин вызвал стойкое сокращение в тканях мочеточника человека. Соединение 2 (BL 106) (0.0001-1 мкМ) вызвало зависимую от концентрации релаксацию в тканях мочеточника (pEC50: 6.29 и Emax 49%, n=3) (Фигура 1).
Релаксация легочной артерии кролика
Норадреналин (3 или 10 мкМ) вызвал стойкое сокращение легочной артерии кролика (17.4 мН). Соединение 2 (BL 106) (0.001-10 мкМ) вызвало зависимые от концентрации релаксации колец легочной артерии (рЕС50: 6.23 [588 нМ] и Emax 62%, n=3) (Фигура 2).
Релаксация кавернозного тела человека
Норадреналин вызвал стойкое сокращение кавернозного тела человека. Соединение 2 (BL 106) (0.0001-1 мкМ) вызвало зависимые от концентрации релаксации кавернозного тела (pEC50: 7.65 и Emax 71%, n=3) (Фигура 3А). Релаксация кавернозного тела кролика
Норадреналин (3 или 10 мкМ) вызвал стойкое сокращение кавернозного тела кролика (13.8 мН). Соединение 2 (BL 106) вызвало зависимые от концентрации релаксации в кавернозном теле (pEC50: 5.92 [1.2 мкМ] и Emax: 91%, n=3) (Фигура 3В)
Реферат
Изобретение относится к производным 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона формулы (I), где Rпредставляет собой индольную группу, Rпредставляет собой метилен-3,4-диоксифенильную группу, Rпредставляет собой водород, галоген, Сгалогеналкил, Сгетероалкил или Салкил и Rпредставляет собой водород, Салкил, Салкенил, Салкинил, Сгалогеналкил, Сциклоалкил или С-циклоалкил-С-алкил, и их фармацевтически приемлемым солям. Также изобретение относится к фармацевтической композиции, содержащей соединения формулы (I), и способу получения соединения формулы (II). Технический результат - производные 6,7-дигидро-3H-оксазоло[3,4-α]пиразин-5,8-диона формулы (I) в качестве ингибиторов фермента фосфодиэстеразы 5 типа (PDE-5). 3 н. и 5 з.п. ф-лы, 3 ил., 2 пр.
Формула

или его фармацевтически приемлемые соли, в котором:
R1 представляет собой индольную группу;
R2 представляет собой метилен-3,4-диоксифенильную группу;
R3 представляет собой водород, галоген, С1-6 галогеналкил, С1-3 гетероалкил или С1-3 алкил; и
R4 представляет собой водород, С1-6 алкил, С2-6 алкенил, С2-6 алкинил, С1-6 галогеналкил, С3-8 циклоалкил или С3-8-циклоалкил-С1-3-алкил.





Комментарии