Способ получения соединения для укрепления степени сцепленности комплексного вещества trpv4-kca2.3 - RU2718913C9
Код документа: RU2718913C9
Чертежи
Описание
1. Техническая область
Настоящее изобретение относится к области технологий медикаментов для лечения гипертонии, в частности относится к применению соединений, укрепляющих степень сцепленности комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3 в контроле гипертонии.
2. Уровень техники
В опубликованном на китайском информационном сайте об интеллектуальной собственности www.chyxx.com «Отчете о результатах исследования функционирования, мониторинга и перспектив развития китайского рынка лекарственных препаратов против гипертонии за 2014-2019» было отмечено: Гипертония - это пожизненное заболевания, больные которой обычно должны принимать лекарства каждый день до конца жизни. Разработка лекарств от гипертонии длится уже несколько десятилетий. В 60-е были предложены диуретики, в 70-е - β-блокаторы рецепторов, в 80-е - блокаторы кальциевых каналов и ингибиторы ангиотензинпревращающего фермента (иАПФ), в 90-е были разработаны более специфичные антагонисты рецепторов ангиотензина II (сартаны), после чего множество однокомпонентных и многокомпонентных препаратов один за другим были утверждены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США и поступили на рынок, став лекарствами первой линии в лечении гипертонии.
Противогипертонические однокомпонентные лекарства развиты достаточно зрело и в соответствии с механизмом их можно разделить на пять классов:
(1) Диуретики: гидрохлоротиазид, буметанид, индапамид и комплексные диуретики;
(2) Антагонисты кальция: нифедипин, амлодипин, дилтиазем, верапамил;
(3) Бета-блокаторы: пропранолол, атенолол, метопролол, лабетолол;
(4) ингибиторы ангиотензинпревращающего фермента; каптоприл, эналаприл, беназеприл, лизиноприл;
(5) антагонисты рецепторов ангиотензина II: лозартан, валсартан, тельмисартан, олмесартан.
Из-за отличия в целевых точках воздействия препараты от гипертонии с разными механизмами обладают разными преимуществами. В процессе лечение необходимо выбрать подходящее пациенту лекарство, и для большинства пациентов после того, как одно лекарства не оказывает терапевтического эффекта, назначается комбинированное лечение.
Ваниллоид 4 с транзиторным рецепторным потенциалом (transient receptor potential vanilloid 4, TRPV4) - это член группы ваниллоидов ионного канала TRP, неизбирательный катионный канал. Канал TRPV4 имеет шесть трансмембранных альфа-спиральных участков, а именно S1-S6, при этом между S5 и S6 имеется регулирующее проход ионов кольцевое пространство, оба конца N и C которого находятся внутри клетки. Чтобы иметь эффект, под действием трансдукции канал TRPV4 должен образовывать функциональные гомополимеризированные или гетерополимеризорованные тетрамеры. На конце N канала TRPV4 находится по крайней мере три связующих участка анкирина, и анкирин может взаимодействовать с каналом TRPV4, что позволяет сдерживать рецептор IP3, тем самым регулируя выделение Ca2+ в клетке. Канал TRPV4 обладает чрезвычайно высокой проницаемостью Ca2+ и наиболее выражен в васкулярных эндотелиальных клетках, и, как канал Ca2+, он участвует в трансдукции сигнала эндотелиальных клеток.
Активированные кальцием калиевые каналы низкой проводимости SKca разделяются на три класса: KCa2.1, KCa2.2 и KCa2.3, при этом: KCa2.3 наиболее выражен в нейронах и спонгиоцитах, а также гладкомышечных клетках сосудов и эндотелиальных клетках; KCa2.3 играет важную роль в физиологической деятельности организма человека, особенно в процессе релаксации гладких мышц. Непрерывная активация KCa2.3 приводит к непрерывной гиперполяризации мембранного потенциала васкулярных эндотелиальных клеток, после чего происходит присоединение к близлежащим гладким мышцам. Прерывание или подавление KCa2.3 может кардинально увеличить сопротивление кровеносных сосудов, образовав периферическое сосудистое сопротивление, что повышает кровяное давление.
Исследования показывают, что в васкулярных эндотелиальных клетках TRPV4 и KCa2.3 вступают в физическое взаимодействие, а Ca2+ по каналу TRP поступает в клетку и активирует эти калий-ионные каналы, после чего происходит расширение сосудов. Однако его точная точка взаимодействия еще недостаточно исследована и посредством поиска точки его взаимодействия было обнаружено, что оказывающие действие на эту точку соединения обладают чрезвычайно важным значением для разработок лекарств от гипертонии.
Суть изобретения
Для решения описанной выше проблемы существующих технологий заявитель предлагает применение для контроля гипертонии соединения, укрепляющего степень сцепленности пространства комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3. Посредством поиска структурной области точки взаимодействия комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3 в рамках настоящего патента было приготовлено специфическое соединение, способное одновременно воздействовать на две точки воздействия, и было обнаружено, что это соединение способно укреплять степень сцепленности пространства комплексного вещества TRPV4-KCa2.3 и что оно обладает чрезвычайно важным значением в разработке лекарств от гипертонии.
Техническое решение, используемое в настоящем изобретении, состоит в следующем.
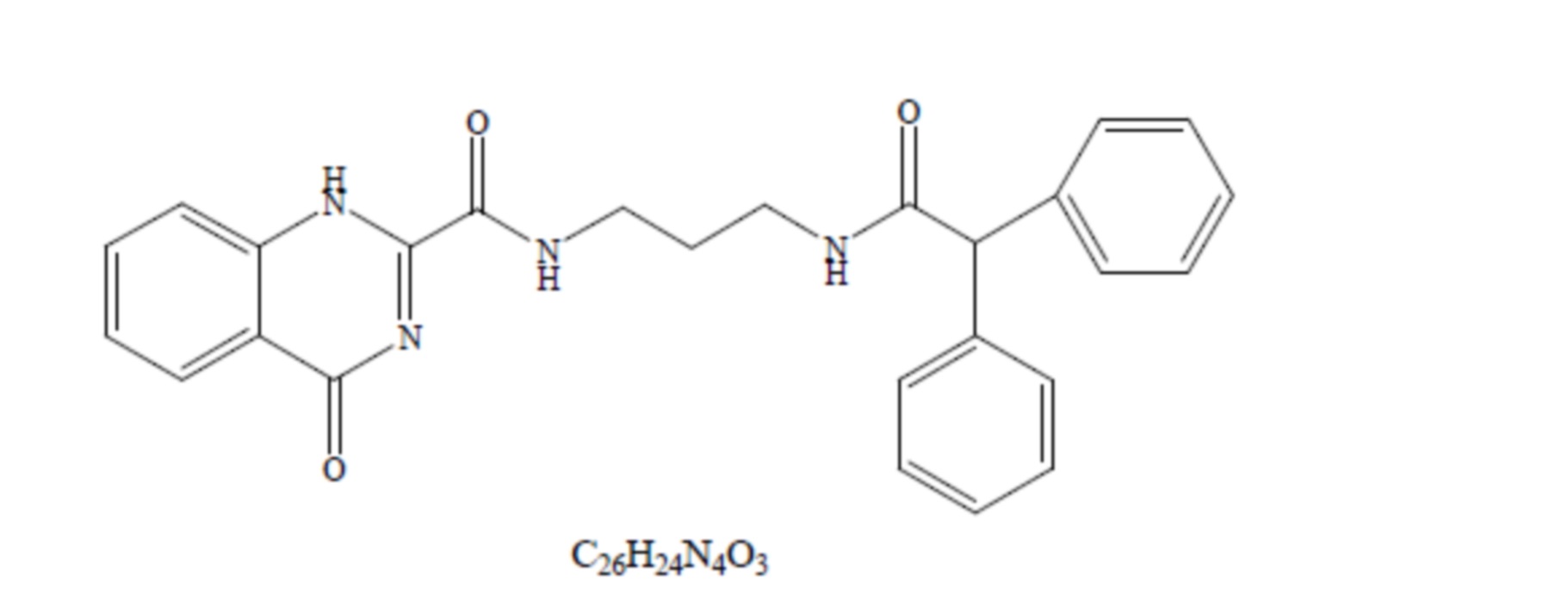
Заявитель раскрывает соединение, укрепляющее степень сцепленности пространства комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3, при этом структурная область точки взаимодействия вышеупомянутого комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3 является структурной областью AR2 белка TRPV4 и структурной областью 17С белка KCa2.3, а вышеупомянутое соединение является соединением, выраженным общей формулой (1) с регистрационным номером JNc-440:

Общая формула (1)
Конкретные шаги по приготовлению вышеупомянутого соединения, укрепляющего степень сцепленности пространства комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3, приведены ниже:
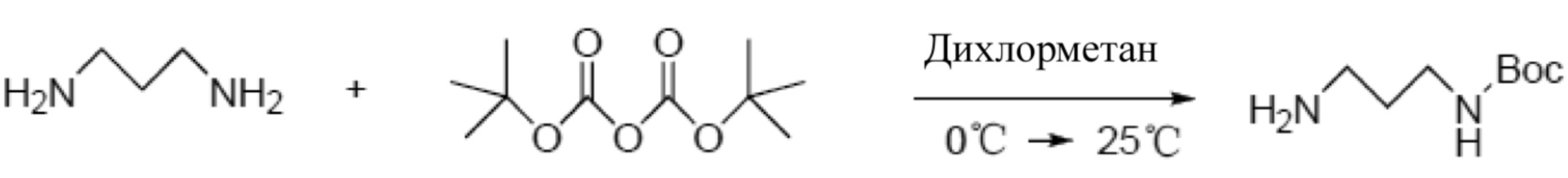
(1) Сначала пропилендиамин проходит трет-бутилоксикарбонил для защиты отдельной аминогруппы:

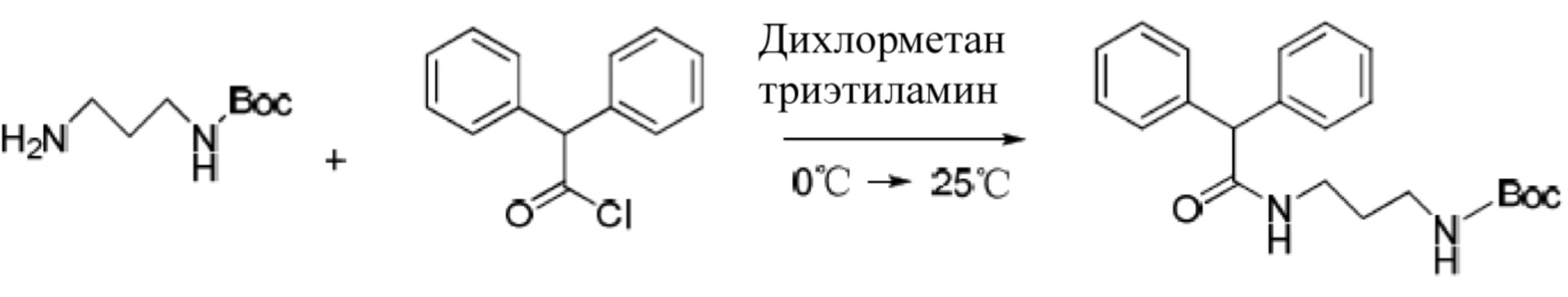
(2) Другая наружная аминогруппа с дифенилацетилхлоридом образует амид:
(3) В кислотных условиях продукты амида сбрасывают трет-бутилоксикарбонильную защиту:

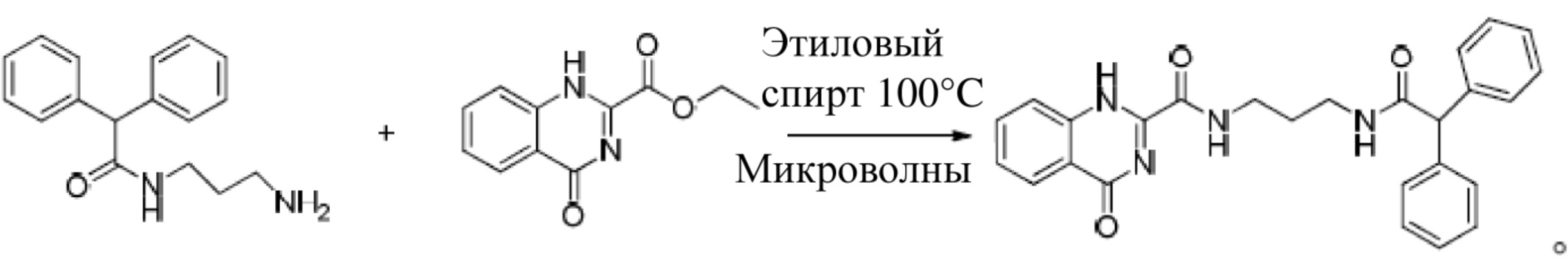
(4) Соединение, сбросившее карбонильную защиту, опять вступает в амино-эфирный обмен с 4-хиназолон-2-этилформиатом, образуя целевое соединение:

Заявитель также раскрывает применение вышеупомянутого соединения: вышеупомянутое соединение может воздействовать на структурные области точки взаимодействия TRPV4 и KCa2.3, таким образом, упрочняя степень сцепленности пространства TRPV4-KCa2.3. Заявитель также раскрывает еще одно применение вышеупомянутого соединения: вышеупомянутое соединение может сдерживать гипертонию.
Заявитель также раскрывает применение в сдерживании гипертонии структурной области AR2 белка TRPV4 и структурной области 17С белка KCa2.3 точки взаимодействия вышеупомянутого комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3.
Технический результат настоящего изобретения состоит в следующем:
В настоящем изобретении сначала с помощью точечной мутации был осуществлен поиск структурной области точки взаимодействия белка TRPV4 и белка KCa2.3, после чего было отобрано соединение, способное укрепить степень сцепленности пространства комплексного вещества TRPV4-KCa2.3, был разработан новый способ приготовления данного соединения, после чего данное соединение было использовано на модели мыши с высоким кровяным давлением и был выявлен терапевтический эффект по отношению к высокому кровяному давлению.
В результате исследований изобретатель обнаружил, что структурная область AR2 вещества TRPV4 и структурная область 17С вещества KCa2.3 является их точкой взаимодействия, а в результате приготовления соединения, одновременно воздействующего на две эти точки воздействия, посредством модели мыши с высоким кровяным давлением было обнаружено, что путем усиления степени сцепленности пространства комплексного вещества TRPV4-KCa2.3, это соединение обеспечивает эффект сдерживания гипертонии. Настоящее изобретение обладает важным значением для разработки лекарственных препаратов от гипертонии.
Описание изображений
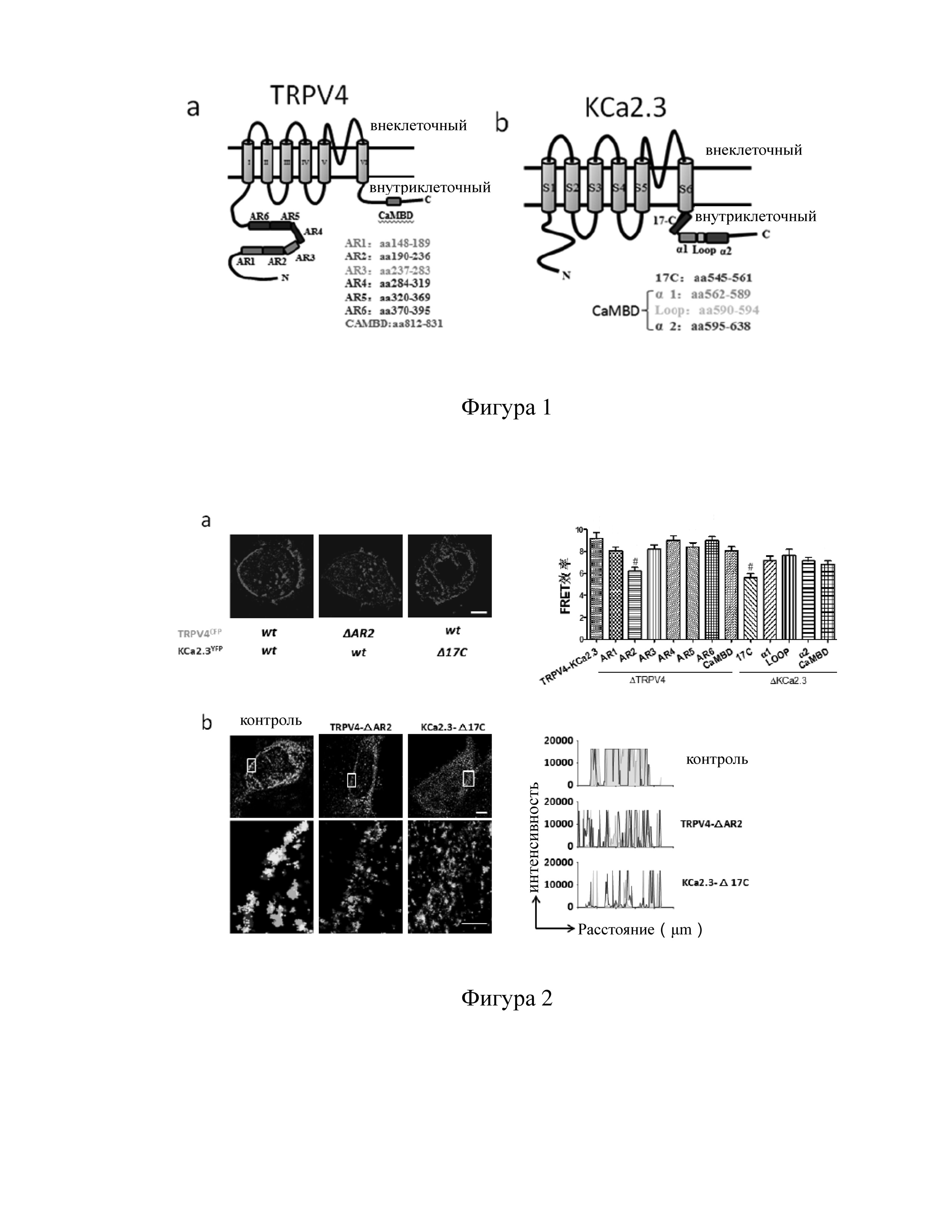
Фигура 1 представляет собой упрощенную схему трехмерной структуры белка TRPV4 и белка KCa2.3 и их функциональной зоны.
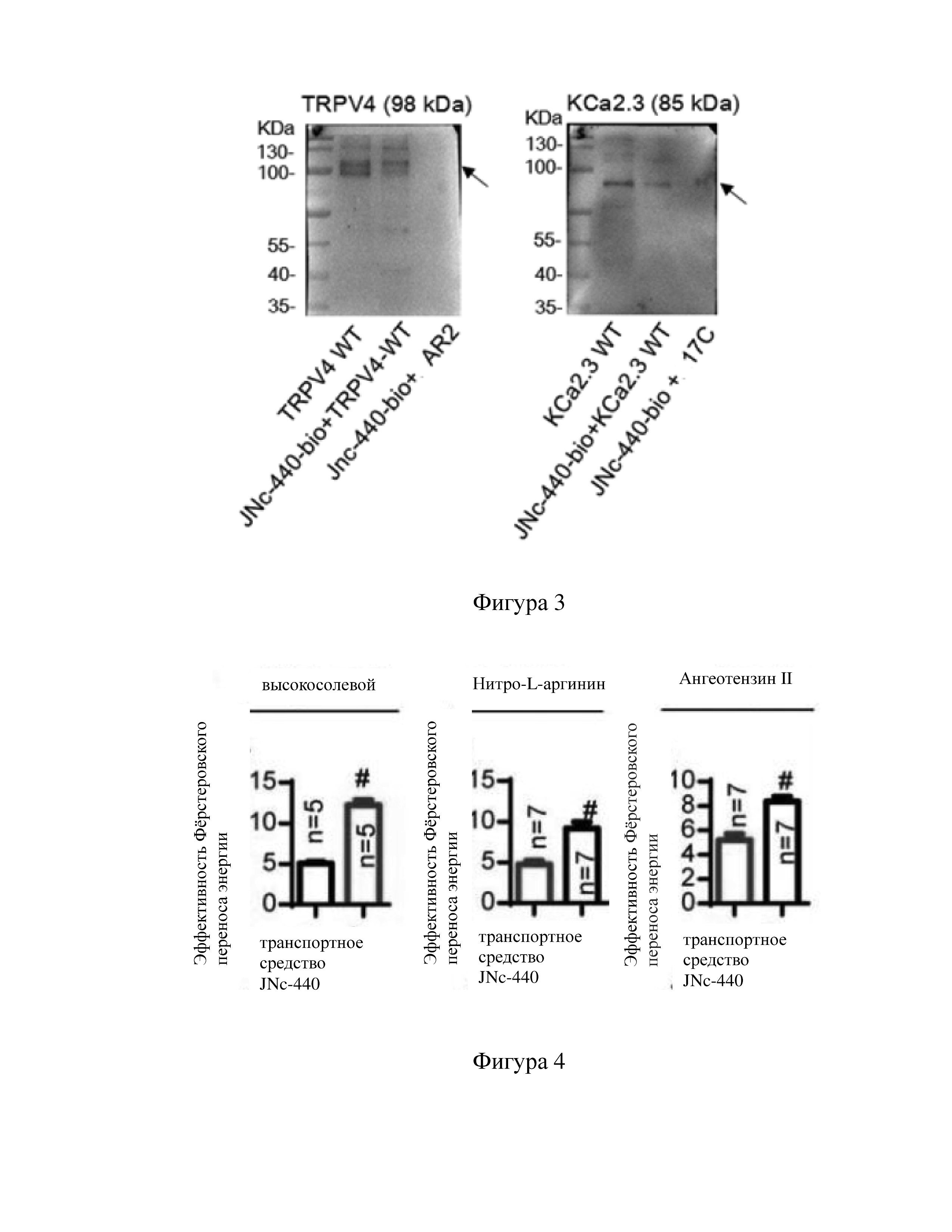
Фигура 2 представляет собой изображение результата поиска точки взаимодействия белка TRPV4 и белка KCa2.3 с помощью микротехнологий переноса флуоресцентной резонансной энергии и микроскопии стохастической оптической реконструкции по варианту осуществления 2 настоящего изобретения.
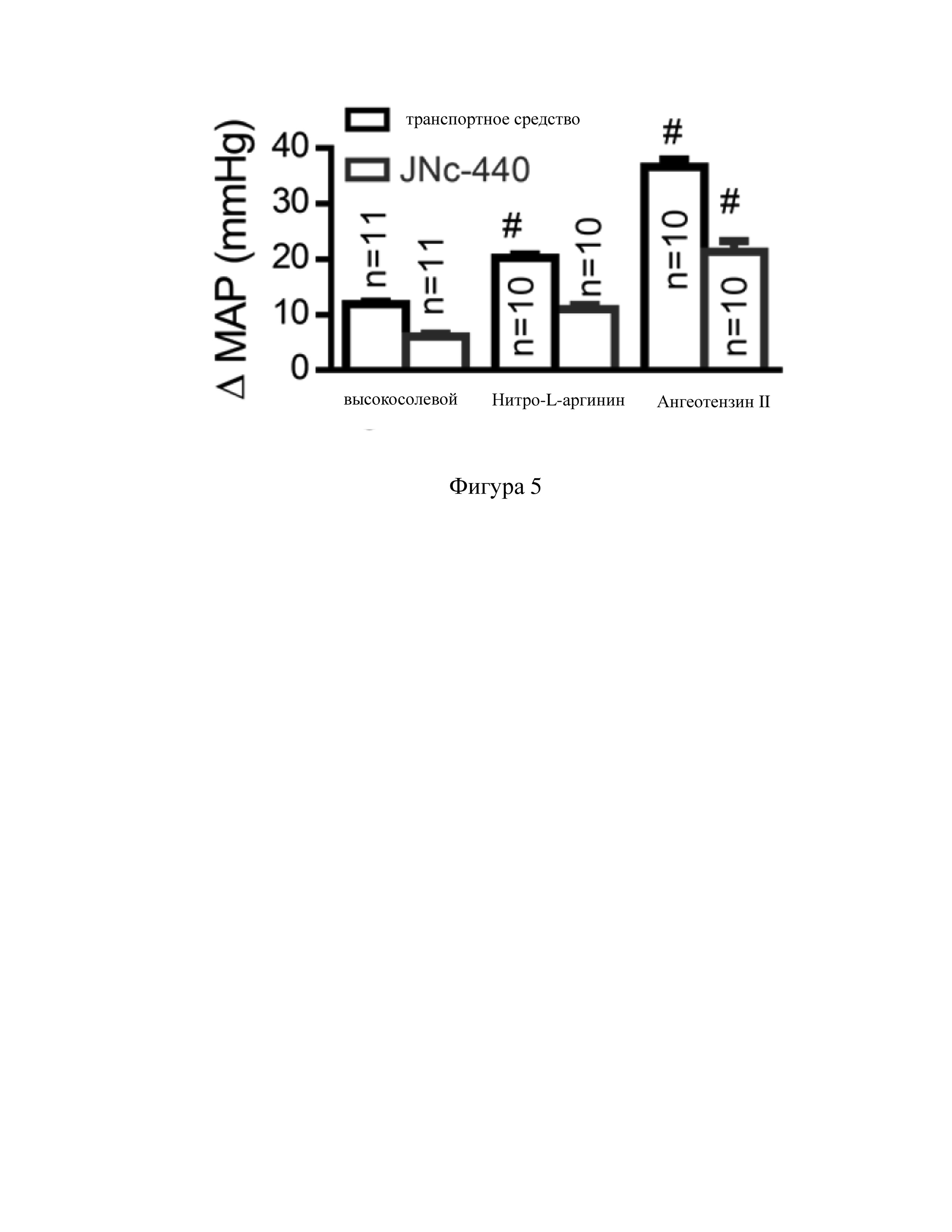
Фигура 3 представляет собой изображение результата со-иммунопреципитации с двумя целевыми точками соединения, приготовленного по варианту осуществления 1.
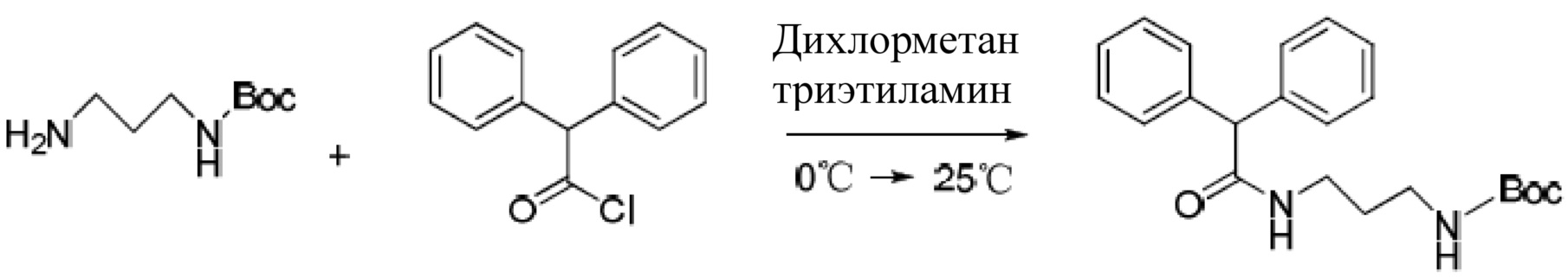
Фигура 4 представляет собой изображение результата изменения степени сцепленности комплексного вещества TRPV4-KCa2.3 после воздействия соединения, приготовленного по варианту осуществления 1, на модель мыши с высоким кровяным давлением, полученное с помощью технологий переноса флуоресцентной резонансной энергии.
Фигура 5 представляет собой изображение результата изменения измеренного кровяного давления после воздействия соединения, приготовленного по варианту осуществления 1, на три модели мыши с высоким кровяным давлением.
Конкретные варианты осуществления
Далее следует более подробное описание настоящего изобретения, сопровождающееся изображениями и вариантами осуществления.
В следующем варианте осуществления были использованы следующие экспериментальные материалы:
Линия клеток: клетки HEK293, приобретенные в Шанхайском банке клеток Академии наук КНР.
Лабораторные животные: самцы мыши C57BL/6J возрастом 8 недель, класс SPF, приобретенные у ООО «Лабораторные животные Чанчжоу Кавэньсы».
Плазмид и праймер: плазмидная матрица, содержащая полный геном CFP-TRPV4 или полный геном YFP-KCa2.3, предоставленная Институтом биомедицины Ло Куай-чхёна Китайского университета Гонконга; праймер приобретен у ООО «Биоинженерия Шанхай Шэнгун».
Олигопептид:
AR2:YGRKKRRQRRRTGKTCLPKALLNLSNGRNDTIPVLLDIAERTGNMREFINSPFRDIYY;
17C: YGRKKRRQRRRRKLELTKAEKHVHNFMM, оба приобретены у ООО «Биоинженерия Шанхай Шэнгун».
Реактивы: первичные антитела goatanti-TRPV4(sc-47527), приобретены у компании SantaCrnz; первичные антитела rabbitanti-KCa2.3(APC-025), приобретены у компании Alomone; вторичные антитела AlexaFluor647 и AlexaFluor488 приобретены у компании Invitrogen.
Набор реактивов точечной мутации QuickChangeTM приобретен у компании Stratagene; набор реактивов для продуктов очистки ДНК и набор активов для экстракции плазмида приобретены у ООО «Биохимическая наука и техника Пекин Тяньгэнь»; компетентные клетки DH5α приобретены у ООО «Биохимическая наука и техника Пекин Тяньгэнь»;
Далее приведена последовательность шагов для синтеза биотинилированного JNc-440:
(1) Под действием хлорокиси фосфора соединение JNc-440 получает продукты хлорирования карбонильной группы:
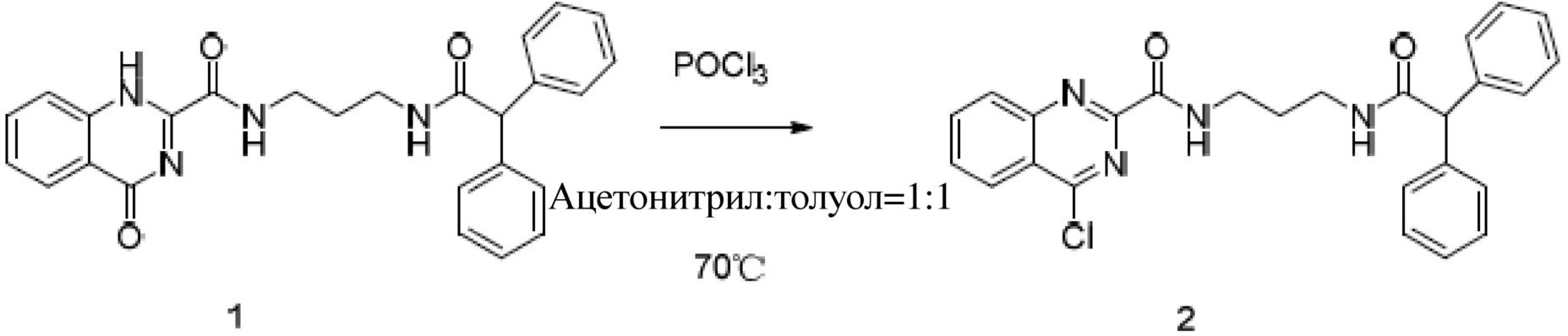
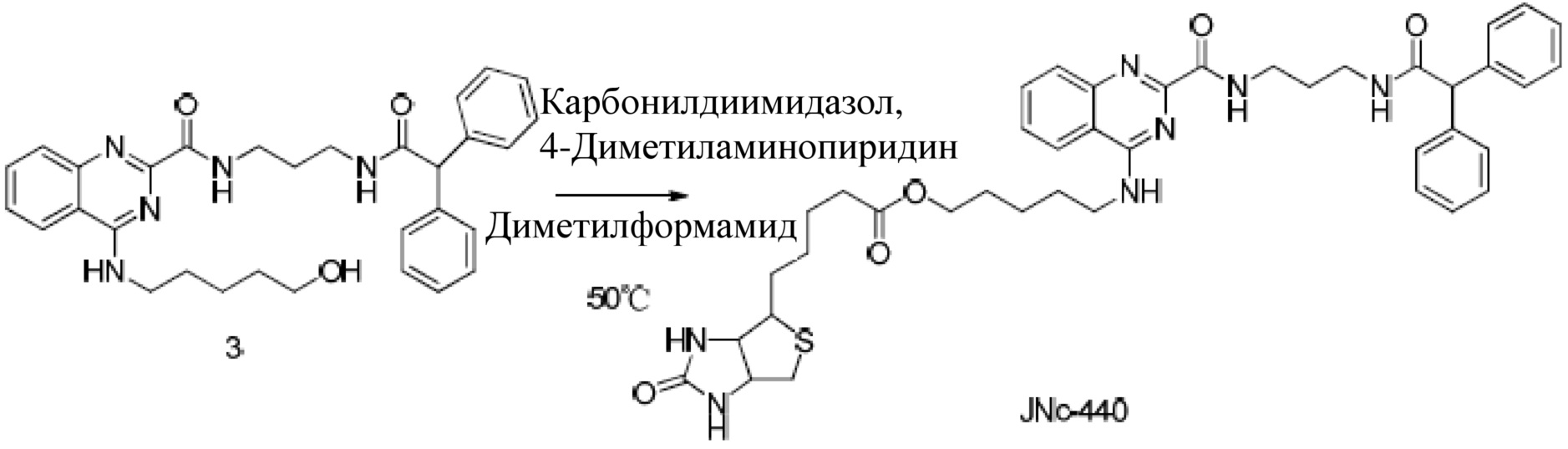
(2) Продукты хлорирования и 5-амино-1-пентанол вступают в реакцию нуклеофильного замещения:

(3) В результате реакции этерификации биотина и полученных на предыдущем этапе продуктов получается биотинилированный JNc-440:
8% высокосолевой корм (TP6032-S8) приобретен у ООО «Кормовая наука и техника Наньтун Тэлофэй»; L-NAME(Nitro-L-arginine) (N5501-5G) приобретен у компании Sigma; ангиотензин 2(ANG-2)(A107852) приобретен у ООО «Биохимическая наука и техника Шанхай Алладин»;
Все остальные химические реактивы приобретены у ООО «Химические реактивы» Группы Синофарм.
Лабораторная аппаратура: прибор для измерения давления крыс и мышей (BP98A) приобретен у компании SINSI; OSMOTICPUMPS (имплантационный насос осмотического давления с желатиновыми капсулами) приобретен у компании ALZET; гелевая система формирования изображений приобретена у компании GENE; лазерный конфокальный микроскоп приобретен у компании Leica;
Вариант осуществления 1: способ приготовления соединения
(1) Соединение 1-пропилен-диамин (30 г, 405 ммоль, 1 экв.) растворяется в 150 мл дихлорметана и перемешивается в ледяной ванне; 2-тертбутил-бикарбонат натрия (16,1 г, 73 ммоль, 0,18 экв.) растворяется в 50 мл дихлорметана; соединение медленно вливается в колбу и перемешивается при комнатной температуре в течение 3 часов; после завершения реакции проводится измерение с помощью метода тонкослойной хроматографии (TLC), разбавляется 50 мл метилхлорида и несколько раз промывается водой, затем еще раз промывается насыщенным раствором NaCl, после чего осуществляется сушка с помощью безводной Na2SO4 и после концентрации получается соединение 2 (19 г, 27%);
(2) соединение 2 (10 г, 57 ммоль, 1 экв.)и триетиламин (TEA) (8,7 г, 86 ммоль, 1,5 экв.) растворяется в 100 мл метиленхлорида и перемешивается в ледяной ванне; дифенил-ацетилхлорид (13,1 г, 57 ммоль, 1 экв.) растворяется в 30 мл метиленхлорида, медленно вливается в колбу и перемешивается при комнатной температуре в течение 2,5 часов; После завершения реакции происходит измерение с помощью TLC и осуществляется сгущение заготовки; После изолирования колоночной хроматографией (20:1 метиленхлорид/метанол) получается соединение 3 (13,2 г, 63%);
(3) Соединение 3 (8 г, 22 ммоль, 1 экв.) растворяется в смешанном растворителе (40 мл: метиленхлорид: трифторуксусная кислота = 4:1), смесь нагревается на масляной бане до 35°C, 1 час; после завершения реакции происходит измерение с помощью TLC, с помощью системы контроля аммиачной воды значение pH доводится до 8-9, вплоть до того, что образованные твердые частицы выпадают в осадок; после фильтрации и сушки образуется соединение 4 (5,3 г, 90%);
(4) Соединение 4 (2 г, 7 ммоль, 2 экв.) и 4-хиназолон-2-этилформиат (0,8 г, 3,5 ммоль, 1 экв.) растворяются в 6 мл этилового спирта и помещаются в микроволновый реактор при температуре 100°C на 45 минут; после завершения реакции осуществляется TLC измерение, в естественно охлажденном растворе образуется белый осадок, а после фильтрации и сушки получается соединение 5. Это соединение 5 и есть соединением, воздействующим на гипертонию и описанным в настоящем изобретении.
Вариант осуществления 2: поиск точки взаимодействия белка TRPV4 и белка KCa2.3
Метод эксперимента: в соответствии с трехмерной структурой белка TRPV4 и KCa2.3 и особенностями их функций выбирается возможная точка соединения (как показано на Фиг. 1), выбранные структурные области главным образом используются для регулировки связи белок-белок и представляют собой платформу для взаимодействия белков. Выбранная для мутации точка соединения приводит к нехватке точек соединения; используемый праймер показан в Таблице 1.
Таблица 1

Используется следующая реакторная система PCR: матрица (полный геном CFP-TRPV4 или полный геном YFP-KCa2.3) 0,5 мкл, Prim Star HS 25 мкл, каждый уровень праймера по 0,5 мкл, добавлено H2O до 50 мкл. Последовательность PCR реакции: предденатурация при 95°C 2 мин, денатурация при 95°C 30 сек., отжиг при 55°C 30 сек, растягивание при 68°C 5 мин, цикл 30 раз, полное растягивание при 68°C 10 мин. После завершения PCR осуществляется очистка с помощью набора реактивов очистки продуктов PCR, очищенные продукты подвергаются ферментному перевариванию с помощью DpnI фермента, при этом система реакции ферментного переваривания представляет собой следующее: фермент DpnI 0,4 мкл, очищенные продукты PCR реакции 5 мкл, 10×buffer 2 мкл, ddH2O 12,6 мкл. Условия ферментного переваривания: 37°C, 1 ч, условия деактивации 80°C, 20 мин. Продукты ферментного переваривания превращаются в компетентные клетки DH5α, после увеличения и выращивания из отобранных отдельных клонированных клеток с помощью набора реактивов для извлечения плазмида извлекается плазмид, а при отправке образца осуществляется последовательность расположения генов.
Происходит трансфекция плазмида с мутацией в клетки HEK293, подвергшиеся трансфекции клетки покрываются конфокальными капсулами, а через 24 часа с помощью лазерного конфокального микроскопа в режиме FRET AB осуществляется измерение сцепленности двух белков до и после мутации.
Согласно приведенному выше способу генной мутации строится плазмид TRPV4- AR2 Δ H и KCa2.3 17 Δ C, а после трансфекции в клетку HEK293 через 24 часа содержание в клетке более 3% параформальдегида и 0,1% PBS раствора глутаральдегида закрепляется, после чего осуществляется очистка с помощью разбавленного PBS 0,1% борогидрата натрия. Клетки в ограничивающей жидкости (в PBS добавлено 3% BSA и 0,2% Triton X-100) подвергаются ограничению и фильтрации и после выдерживания с помощью первичных антител в течение ночи при 4 градусах и трехразового промывания выдерживаются с помощью вторичных антител при комнатной температуре в течение 45 минут. В качестве первичных антител используются goat anti-TRPV4 и rabbit anti-KCa2.3, а в качестве вторичных - Alexa Fluor 647 и Alexa Fluor 488. В то же время с помощью технологий микроскопии стохастической оптической реконструкции (STORM) осуществляется колокализация двух белков, таким образом, еще раз подтверждая точность результата FRET. В приготовленные вышеуказанным способом образцы в центральном месте чистой конфокальной капсулы вводится примерно 4 мкл буферного раствора для формирования изображения, при этом в буферном растворе содержится 5% (w/v) глюкозы, 100 мМ цистеина, 0,8 мг/мл нотатина и 40 мкг/мл каталазы, растворенные в Tris-HCL со значением pH 7,5 или 8. В этом буферном растворе для формирования изображения STORM появляется спектрально различное изображение одной молекулы.
Результат эксперимента: как показано на Фиг. 2а, по сравнению с другими точками мутации, в структурной области AR2 с мутацией TRPV4 или структурной области 17С с мутацией KCa2.3, явление FRET значительно снижается. На Фиг. 2b это еще раз подтверждается экспериментом с получением изображения сверхвысокого разрешения. Это показывает, что структурная область AR2 с TRPV4 и структурная область 17С с KCa2.3 являются точками соединения двух белков.
На Фиг. 2а в порядке синий-зеленый-желтый-красный, эффективность FRET последовательно повышается.
На Фиг. 2b красным обозначено белок TRPV4, зеленым - белок KCa2.3, желтым - перекрытие зеленого и красного.
Вариант осуществления 3: структурная область AR2 с TRPV4 и структурная область 17С с KCa2.3 соединения, приготовленного варианту осуществления 1, являются целевыми точками.
Метод эксперимента:
Первичные эндотелиальные клетки мезентерия мышей с изолированным C57BL/6J, помещаются в клеточный инкубатор с постоянной температурой для культивирования, вводится биотинилированный JNc-440(10 мкМ/л) или олигопептид и биотинилированный JNc-440(10 мкМ/л) и происходит совместное культивирование клеток в течение 96 часов. В результате расщепления с помощью RIPA получается клеточный белок, в супернатант белка вводится 10 мл стрептавидиновых магнитных шариков и происходит выдерживание в течение ночи при 4°C. Полученная в результате выдерживания суспензия адсорбируется с помощью магнитной решетки и получается комплексное вещество авадин-магнитный шарик-биотинилированный JNc-440-белок. С помощью 50 мкл 1xLoadingbuffer перерастворенного вещества в кипящей водяной бане происходит кипячение в течение 5 минут. Образец проходит изолирование с помощью SDS-PAGE, осуществляется перенос белка в мембрану PVDF, герметизация 5% BSA при комнатной температуре в течение 4 часов, выдерживание первичных антигенов в течение ночи при температуре 4 градуса, выдерживание вторичных антигенов при комнатной температуре в течение двух часов, добавляется проявитель цвета ECL и с помощью системы формирования изображения белков осуществляется измерение и анализ.
Результат эксперимента
Результат эксперимента показан на Фиг. 3., биотинилированный JNc-440 может соединяться с белками TrpV4 и KCa2.3; после введения олигопептида AR2 способность биотинилированного JNc-440 соединяться с белком TRPV4 значительно снижается. С другой стороны, по сравнению с контрольной группой, после введения олигопептида 17С способность биотинилированного JNc-440 соединяться с белком KCa2.3 значительно снижается. Результаты показывают, что биотинилированный JNc-440 может соединяться с TRPV4 и KCa2.3, а зонами соединения являются AR2 и 17C.
Вариант осуществления 4: соединение, приготовленное по варианту осуществления 1, может укреплять степень сцепленности пространства комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3.
Метод эксперимента
Были выбраны самцы мышей C57BL/6J возрастом 8 недель. После недельной преадаптации, во время которой они свободно ели и пили, они были разделены на 4 группы: группа с высоким 8% содержанием соли, группа L-NAME, группа ANG-2 и контрольная группа. Сначала у 4 групп мышей было измерено кровяное давление и определена базовая линия давления. Условия в контрольной группе не изменились, каждый день происходило измерение давления; группу с высоким содержанием соли кормили 8% кормом с высоким содержанием соли и каждый день измеряли давление; группу L-NAME кормили 5% раствором L-NAME и каждый день измеряли давление; группа ANG-2 сначала была подвергнута анестезии с помощью 4% хлоргидрата, затем была проведена операция, в ходе которой в спину мышей вживили насосы, каждый насос впрыскивал 2,88 мг/мл раствора ANG-2 объемом 200 мл, были наложены швы, и через 3 дня после заживления опять началось измерение давления и оно продолжало измеряться примерно 4 недели. Кровяное давление в группе с высоким содержанием соли стабилизировалось на 120 мм рт.ст., а в группах L-NAME и ANG-2 давление стабилизировалось примерно на 130 мм рт.ст. и в течение недели больше не повышалось, поэтому моделирование можно считать успешным.
Первичные изолированные эндотелиальные клетки мезентерия моделей мышей с высоким кровяным давлением, помещаются в клеточный инкубатор с постоянной температурой для культивирования, вводится биотинилированный JNc-440 (10 мкМ) и осуществляется совместное культивирование клеток в течение 96 часов. Осуществляется окрашивание в соответствии со способом иммунного окрашивания, описанном в варианте осуществления 2, после чего с помощью лазерного конфокального микроскопа в режиме FRET AB происходит измерение сцепленности двух белков до и после мутации.
Результат эксперимента: как показано на Фиг. 4, после воздействия соединения на эндотелиальные клетки трех разных моделей мышей с высоким кровяным давлением произошло значительное повышение степени сцепленности пространства белков TRPV4 и KCa2.3. Это свидетельствует о том, что данное соединение способно укреплять степень сцепленности пространства комплексного вещества с ионным каналом эндотелиальной клетки TRPV4-KCa2.3.
Вариант осуществления 5: влияние соединения, приготовленного по варианту осуществления 1, на три модели мыши с высоким кровяным давлением.
Метод эксперимента: в соответствии с вариантом осуществления 4 сформированы 3 вида моделей мышей с высоким давлением. После удачного моделирования через хвостовую вену вводится JNc-440 (1 мг/кг), после чего осуществляется измерение и наблюдение за кровяным давлением мышей.
Результат эксперимента: Как показано на Фиг. 5, после воздействия соединения на эндотелиальные клетки трех разных моделей мышей с высоким кровяным давлением их кровяное давление значительно снизилось, что свидетельствует о том, что данное соединение обладает значительным эффектом по снижению давления в данных моделях с высоким кровяным давлением.
Реферат
Изобретение относится к способу получения соединения формулы (1). Способ осуществляют путем взаимодействия пропандиамина с трет-бутоксикарбонилом в дихлорметане при температуре от 0 до 25°С, затем полученное соединение взаимодействует с дифенилацетилхлоридом с получением соответствующего амида. В кислотных условиях с полученного амида удаляют защитную трет-бутоксикарбонильную группу, установленную на первой стадии процесса. Далее полученное производное амина вступает в амино-эфирный обмен со сложным эфиром 4-хиназолон-2-карбоновой кислоты с образованием целевого соединения формулы (1). Технический результат - способ получения соединения формулы (1), укрепляющего степень сцепленности комплексного вещества TRPV4-KCa2.3. 1 табл., 5 ил.(1)
Формула

Документы, цитированные в отчёте о поиске
Гетероциклическое амидное соединение и его применение

Комментарии