Производные 1,2-ди(цикло)замещенного бензола - RU2340602C2
Код документа: RU2340602C2
Описание
Настоящее изобретение относится к производным 1,2-ди(цикло)замещенного бензола, а также к их солям и гидратам, которые могут использоваться в качестве ингибиторов клеточной адгезии или ингибиторов клеточной инфильтрации.
Настоящее изобретение относится к производным 1,2-ди(цикло)замещенного бензола, а также к их солям и гидратам, которые могут использоваться в качестве терапевтических или профилактических средств при воспалительных заболеваниях и аутоиммунных заболеваниях.
Настоящее изобретение также относится к производным 1,2-ди(цикло)замещенного бензола, а также к их солям и гидратам, которые могут использоваться в качестве терапевтических или профилактических средств при различных заболеваниях, сопровождающихся лейкоцитарной адгезией и инфильтрацией, таких как воспалительное заболевание кишечника (в частности, язвенный колит или болезнь Крона), синдром раздраженной кишки, ревматоидный артрит, псориаз, рассеянный склероз, астма и атопический дерматит.
Воспалительная реакция сопровождается инфильтрацией лейкоцитов, обычно нейтрофилов и лимфоцитов, в очаги воспаления.
Инфильтрация лейкоцитов характеризуется миграцией лейкоцитов, таких как нейтрофилы и лимфоциты, из сосудов в окружающие ткани вследствие инициации и активации цитокинами, хемокинами, липидами и комплементом взаимодействия, называемого «качение» или «прикрепление», с эндотелиальными клетками сосудов, которые активированы цитокинами, такими как IL-1 или TNFα, и последующей их адгезией к эндотелиальным клеткам сосудов.
Как указано выше, были опубликованы данные о взаимосвязи между лейкоцитарной адгезией или инфильтрацией и различными воспалительными заболеваниями и аутоиммунными заболеваниями. В этих сообщениях выдвигалось предположение о том, что, вероятно, соединения, обладающие ингибиторной активностью в отношении адгезии или ингибиторной активностью в отношении клеточной инфильтрации, могут использоваться в качестве терапевтических или профилактических средств при таких заболеваниях.
(1) Терапевтические или профилактические средства при воспалительном заболевании кишечника (язвенный колит, болезнь Крона и тому подобное) (смотри непатентные документы 1, 2 и 3)
(2) Терапевтические или профилактические средства при синдроме раздраженной кишки (смотри непатентный документ 4)
(3) Терапевтические или профилактические средства при ревматоидном артрите (смотри непатентный документ 5)
(4) Терапевтические или профилактические средства при псориазе (смотри непатентный документ 6)
(5) Терапевтические или профилактические средства при рассеянном склерозе (смотри непатентный документ 7)
(6) Терапевтические или профилактические средства при астме (смотри непатентный документ 8)
(7) Терапевтические или профилактические средства при атопическом дерматите (смотри непатентный документ 9)
Таким образом, можно предположить, что вещества, которые ингибируют клеточную адгезию или инфильтацию, могут использоваться в качестве терапевтических или профилактических средств при воспалительных заболеваниях и аутоиммунных заболеваниях и в качестве терапевтических или профилактических средств при различных заболеваниях, сопровождающихся адгезией и инфильтрацией лейкоцитов, таких как воспалительное заболевание кишечника (в частности, язвенный колит или болезнь Крона), синдром раздраженной кишки, ревматоидный артрит, псориаз, рассеянный склероз, астма и атопический дерматит.
Также известны соединения, которые обладают противовоспалительным действием, основанным на ингибировании адгезии лейкоцитов и эндотелиальных клеток сосудов, или противовоспалительным действием, основанным на ингибировании лейкоцитарной инфильтрации (эти соединения здесь называются ингибиторами клеточной адгезии и инфильтрации, соответственно), такие как соединения, представленные приведенной ниже формулой:

(Смотри патентный документ 1).
Однако, соединения, представленные общей формулой (1), в соответствии с настоящим изобретением характеризуются тем, что содержат в своей химической структуре пиперазиновую или пиперидиновую группу в ортоположении бензольного кольца, связанного с алифатической карбоциклической группой, такой как циклогексил, отличаясь, таким образом, по своей структуре от вышеуказанных ингибиторов клеточной адгезии или ингибиторов клеточной инфильтрации.
Известным соединением, содержащим в своей химической структуре пиперазиновую или пиперидиновую группу в ортоположении бензольного кольца, связанного с алифатической карбоциклической группой, такой как циклогексил, в качестве признака химической структуры соединения, представленного общей формулой (1) в соответствии с настоящим изобретением, является соединение, представленное следующей формулой:

(Смотри патентный документ 2).
Однако в данной патентной заявке описано только его применение в качестве средства против ожирения и лечение сахарного диабета, основанного на агонистической активности соединения в отношении меланокортинового рецептора, при этом не описано и не высказано предположений о возможности его использования в качестве противовоспалительного средства, чье действие основано на ингибирующей активности в отношении адгезии лейкоцитов или инфильтации.
Известно соединение, отличающееся от вышеуказанного, соединение, представленное следующей формулой:

(Смотри непатентный документ 10, соединение номер 45).
[Патентный документ 1] WO 2002/018320
[Патентный документ 2] WO 2002/059108
[Непатентный документ 1] Inflammatory Bowel Disease (N. Engl. J. Med., 347:417-429(2002))
[Непатентный документ 2] Natalizumab for active Crohn's disease (N. Engl. J. Med., 348:24-32(2003))
[Непатентный документ 3] Granulocyte adsorption therapy in active period of ulcerative colitis (Japanese Journal of Apheresis 18:117-131(1999))
[Непатентный документ 4] A role for inflammation in irritable bowel syndrome (Gut., 51: i41-i44 (2002))
[Непатентный документ 5] Rheumatoid arthritis (Int. J. Biochem. Cell Biol., 36:372-378(2004))
[Непатентный документ 6] Psoriasis (Lancet, 361:1197-1204(2003))
[Непатентный документ 7] New и emerging treatment options for multiple sclerosis (Lancet Neurology, 2:563-566(2003))
[Непатентный документ 8] The role of T lymphocytes in the pathogenesis of asthma (J. Allergy Clin. Immunol., 111:450-463(2003)
[Непатентный документ 9] The molecular basis of lymphocyte recruitment to the skin (J. Invest. Dermatol., 121:951-962(2003))
[Непатентный документ 10] Discovery of 2-(4-pyridin-2-ylpiperazin-1-ylmethyl)-1H-benzimidazole (ABT-724), a dopaminergic agent with a novel mode of action for the potential treatment of erectile dysfunction (J. Med. Chem., 47: 3853-3864 (2004))
Описание изобретения
Объектом настоящего изобретения являются новые соединения, обладающие превосходной ингибирующей активностью в отношение клеточной адгезии и клеточной инфильтрации, которые могут быть использованы в качестве терапевтических или профилактических средств при различных воспалительных заболеваниях и аутоиммунных заболеваниях, связанных с адгезией и инфильтрацией лейкоцитов, таких как воспалительное заболевание кишечника (в частности, язвенный колит или болезнь Крона), синдром раздраженной кишки, ревматоидный артрит, псориаз, рассеянный склероз, астма и атопический дерматит.
В результате интенсивных исследований, авторы настоящего изобретения обнаружили, что 1,2-ди(цикло)замещенные бензольные соединения, имеющие новую химическую структуру, описанную здесь, обладают превосходной ингибирующей активностью в отношении клеточной адгезии и клеточной инфильтрации, и могут быть использованы в качестве терапевтических или профилактических средств при различных воспалительных заболеваниях и аутоиммунных заболеваниях, связанных с адгезией и инфильтрацией лейкоцитов, таких как воспалительное заболевание кишечника (в частности, язвенный колит или болезнь Крона), синдром раздраженной кишки, ревматоидный артрит, псориаз, рассеянный склероз, астма и атопический дерматит, и настоящее изобретение было создано на основе этого открытия.
Конкретно, изобретение относится к соединению, имеющему следующую общую формулу (1) или (100), его соли или их гидрату:

Также, изобретение относится к лекарственному препарату, содержащему соединение, имеющее указанную выше общую формулу (1) или (100), его соли или их гидрату.
Далее, изобретение относится к ингибитору клеточной адгезии и ингибитору клеточной инфильтрации, содержащим соединение, имеющее указанную выше общую формулу (1) или (100), его соль или их гидрат.
Еще далее, изобретение относится к терапевтическому или профилактическому средству при воспалительных заболеваниях или аутоимунных заболеваниях, содержащему соединение, имеющее указанную выше общую формулу (1) или (100), его соль или их гидрат.
В частности, изобретение относится к терапевтическому или профилактическому средству при воспалительном заболевании кишечника (в частности, язвенный колит или болезнь Крона), синдроме раздраженной кишки, ревматоидном артрите, псориазе, множественном склерозе, астме, атопическом дерматите и тому подобное, содержащему соединение, имеющее указанную выше общую формулу (1) или (100), его соль или их гидрат.
Кроме того, в частности, изобретение относится к применению соединения, имеющего указанную выше общую формулу (1) или (100), его соли или их гидрата при получении лекарственного препарата.
В формулах (1) и (100), представленных выше,
R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный заместителем, выбранным из группы A1, или 5-10-членный циклоалкенил, необязательно замещенный заместителем, выбранным из группы A1,
R20, R21, R22 и R23 могут быть одинаковыми или различными и каждый представляет собой водород, гидроксил, галоген, циано, C2-7 алкилкарбонил, нитро, амино, моно(C1-6 алкил)амино, ди(C1-6 алкил)амино, C1-6 алкил, необязательно замещенный заместителем, выбранным из группы B1, C1-6 алкокси, необязательно замещенный заместителем, выбранным из группы B1, 4-8-членную гетероциклическую группу, необязательно замещенную заместителем, выбранным из группы C1, или 5-10-членную гетероарильную кольцевую группу, необязательно замещенную заместителем, выбранным из группы C1,
R30, R31 и R32 могут быть одинаковыми или различными и каждый представляет собой водород, гидроксил, галоген, циано, карбоксил, C1-6 алкил, C1-6 алкокси или C2-7 алкоксикарбонил, или
два из R30, R31 и R32 соединены вместе с образованием оксо (=O) или метилена (-CH2-), и оставшийся представляет собой водород, гидроксил, галоген, циано, карбоксил, C1-6 алкил, C1-6 алкокси или C2-7 алкоксикарбонил,
R40 представляет собой C1-10 алкил, необязательно замещенный заместителем, выбранным из группы D1, 3-8-членный циклоалкил, необязательно замещенный заместителем, выбранным из группы E1, 4-8-членную гетероциклическую группу, необязательно замещенную заместителем, выбранным из группы E1, C2-7 алкенил, необязательно замещенный заместителем, выбранным из группы F1, C2-7 алкинил, необязательно замещенный заместителем, выбранным из группы F1, C2-7 алкилкарбонил, необязательно замещенный заместителем, выбранным из группы G1, моно(C1-6 алкил)аминокарбонил, 4-8-членный гетероциклический карбонил, C2-7 алкоксикарбонил или C1-6 алкилсульфонил,
n представляет собой целое число 0, 1 или 2, и
X1 представляет собой CH или азот,
группа A1 представляет собой группу, включающую гидроксил, галоген, циано, C1-6 алкокси, фенил, необязательно замещенный заместителем, выбранным из группы C1, C1-6 алкила, C1-6 галогеналкила и C2-7 алкилена, где значение C2-7 алкилена возможно только в случае образования спиро звена вместе с замещенным 5-10-членным циклоалкилом или замещенным 5-10-членным циклоалкенилом,
группа B1 представляет собой группу, включающую галоген, C2-7 алкоксикарбонил и карбоксил,
группа C1 представляет собой группу, включающую циано, галоген, C1-6 алкил и C1-6 алкокси,
группа D1 представляет собой группу, включающую гидроксил, галоген, циано, C1-6 алкокси, C1-6 алкилтио, C1-6 алкилсульфонил, C1-6 алкилсульфинил, моно(C1-6 алкил)амино, ди(C1-6 алкил)амино, C2-7 алкилкарбониламино, 3-8-членный циклоалкил, необязательно замещенный заместителем, выбранным из группы H1, C2-7 алкоксикарбонил, карбоксил, 4-8-членную гетероциклическую группу, 5-10-членную гетероарильную кольцевую группу, 6-10-членную арильную кольцевую группу, C2-7 алкилкарбонил, 6-10-членную арильную кольцевую карбонильную группу, аминокарбонил, моно(C1-6 алкил)аминокарбонил, необязательно замещенный галогеном, моно(3-8-членный циклоалкил)аминокарбонил, моно(C2-7 алкоксиалкил)аминокарбонил, ди(C1-6 алкил)аминокарбонил, моно(5-10-членное гетероарильное кольцо)аминокарбонил, 4-8-членный гетероциклический карбонил, необязательно замещенный C1-6 алкилом, и 5-10-членный гетероарильный кольцевой карбонил,
группа E1 представляет собой группу, включающую галоген, C1-6 алкокси, оксо (=O) и C1-6 алкил,
группа F1 представляет собой группу, включающую галоген и C1-6 алкокси,
группа G1 представляет собой группу, включающую 3-8-членный циклоалкил, и
группа H1 представляет собой группу, включающую гидроксил, C1-6 галогеналкил, C1-6 алкил, C2-7 алкоксиалкил, моно(C1-6 алкил)аминокарбонил, ди(C1-6 алкил)аминокарбонил, C2-7 алкоксикарбонил, карбоксил и C2-7 цианоалкил.
Соединение, представленное формулой

исключено из соединений, представленных формулой (1).
В качестве примеров "циклоалкила" в выражении "циклоалкил, необязательно замещенный заместителем, выбранным из группы A1," для R10, указанного выше, могут быть указаны циклопентил, циклогексил, циклогептил, циклооктил, циклононил или циклодецил, из них циклопентил, циклогексил, циклогептил или циклооктил являются предпочтительными, и циклогексил является особенно предпочтительным.
"Циклоалкенил" в выражении "циклоалкенил, необязательно замещенный заместителем, выбранным из группы A1," для R10, указанного выше, может содержать несколько двойных связей, и в качестве примеров могут быть указаны циклопентенил (1-циклопентенил, 2-циклопентенил или 3-циклопентенил), циклогексенил (1-циклогексенил, 2-циклогексенил или 3-циклогексенил), циклогептенил (1-циклогептенил, 2-циклогептенил, 3-циклогептенил или 4-циклогептенил), циклооктенил (1-циклооктенил, 2-циклооктенил, 3-циклооктенил или 4-циклооктенил), циклононенил (1-циклононенил, 2-циклононенил, 3-циклононенил, 4-циклононенил или 5-циклононенил) или циклодеценил (1-циклодеценил, 2-циклодеценил, 3-циклодеценил, 4-циклодеценил или 5-циклодеценил), из них циклопентенил, циклогексенил, циклогептенил или циклооктенил являются предпочтительными, циклогексенил является более предпочтительным, и 1-циклогексенил является наиболее предпочтительным.
В качестве примеров "галогена" для R20, R21, R22 и R23, указанных выше, могут быть указаны фтор, хлор, бром или йод, из них бром, фтор или хлор являются предпочтительными.
"C2-7 Алкилкарбонил" для R20, R21, R22 и R23, указанных выше, представляет собой карбонильную группу, содержащую присоединенный к ней "C1-6 алкил", описанный далее, и в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как ацетил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил, трет-бутилкарбонил, пентилкарбонил, изопентилкарбонил, 2-метилбутилкарбонил, неопентилкарбонил, 1-этилпропилкарбонил, гексилкарбонил, изогексилкарбонил, 4-метилпентилкарбонил, 3-метилпентилкарбонил, 2-метилпентилкарбонил, 1-метилпентилкарбонил, 3,3-диметилбутилкарбонил, 2,2-диметилбутилкарбонил, 1,1-диметилбутилкарбонил, 1,2-диметилбутилкарбонил, 1,3-диметилбутилкарбонил, 2,3-диметилбутилкарбонил, 1-этилбутилкарбонил или 2-этилбутилкарбонил, из них C2-5 группы являются предпочтительными, и ацетил или этилкарбонил являются особенно предпочтительными.
В качестве примеров "моно(C1-6 алкил)амино" для R20, R21, R22 и R23, указанных выше, могут быть указаны группы с прямой цепью или разветвленной цепью, такие как метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, втор-бутиламино, трет-бутиламино, пентиламино, изопентиламино, 2-метилбутиламино, неопентиламино, 1-этилпропиламино, гексиламино, изогексиламино, 4-метилпентиламино, 3-метилпентиламино, 2-метилпентиламино, 1-метилпентиламино, 3,3-диметилбутиламино, 2,2-диметилбутиламино, 1,1-диметилбутиламино, 1,2-диметилбутиламино, 1,3-диметилбутиламино, 2,3-диметилбутиламино, 1-этилбутиламино или 2-этилбутиламино, из них метиламино или этиламино являются предпочтительными, и метиламино является особенно предпочтительным.
"Ди(C1-6 алкил)амино" для R20, R21, R22 и R23, указанных выше, могут быть либо симметричными, либо асимметричными, и в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как диметиламино, метилэтиламино, диэтиламино, метилпропиламино, этилпропиламино, дипропиламино, диизопропиламино, дибутиламино, диизобутиламино, ди(втор-бутил)амино, ди(трет-бутил)амино, метилпентиламино, дипентиламино, диизопентиламино, ди(2-метилбутил)амино, ди(неопентил)амино, ди(1-этилпропил)амино, дигексиламино, метилизогексиламино, диизогексиламино, ди(4-метилпентил)амино, ди(3-метилпентил)амино, ди(2-метилпентил)амино, ди(1-метилпентил)амино, ди(3,3-диметилбутил)амино, ди(2,2-диметилбутил)амино, ди(1,1-диметилбутил)амино, ди(1,2-диметилбутил)амино, ди(1,3-диметилбутил)амино, ди(2,3-диметилбутил)амино, ди(1-этилбутил)амино или ди(2-этилбутил)амино, из них диметиламино, метилэтиламино или диэтиламино являются предпочтительными, и диметиламино является особенно предпочтительным.
В качестве примеров "C1-6 алкила" в выражении "C1-6 алкил, необязательно замещенный заместителем, выбранным из группы B1," для R20, R21, R22 и R23, указанных выше, могут быть указаны группы с прямой цепью или разветвленной цепью, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, втор-пентил, трет-пентил, 2-метилбутил, 1-метилбутил, 2-метилбутил, неопентил, 1,1-диметилпропил, 1,2-диметилпропил, 1-этилпропил, н-гексил, изогексил, 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, 3,3-диметилбутил, 2,2-диметилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил или 1-этил-2-метилпропил, из них C1-4 группы являются предпочтительными, метил, этил или трет-бутил являются более предпочтительными, и метил является наиболее предпочтительным.
В качестве примеров "C1-6 алкокси" в выражении "C1-6 алкокси, необязательно замещенный заместителем, выбранным из группы B1," для R20, R21, R22 и R23, указанных выше, могут быть указаны группы с прямой цепью или разветвленной цепью, такие как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентокси, изопентокси, 2-метилбутокси, неопентокси, гексилокси, 4-метилпентокси, 3-метилпентокси, 2-метилпентокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси или 2,3-диметилбутокси, из них метокси, этокси, пропокси или изопропокси являются предпочтительными, метокси или этокси являются более предпочтительными, и метокси является наиболее предпочтительным.
"4-8-членная гетероциклическая группа" в выражении "4-8-членная гетероциклическая группа, необязательно замещенная заместителем, выбранным из группы C1," для R20, R21, R22 и R23, указанных выше, представляет собой моновалентную группу, полученную при удалении одного атома водорода из любого желаемого положения "4-8-членного гетероцикла", как описано далее.
"4-8-членный гетероцикл" представляет собой неароматическое кольцо (либо полностью насыщенное, либо частично ненасыщенное), содержащее 4-8 атомов, образующих кольцо, и имеющее среди атомов, образующих кольцо, один или несколько гетероатомов, и в качестве примеров могут быть указаны азетидиновое кольцо, пирролидиновое кольцо, пиперидиновое кольцо, азепановое кольцо, азокановое кольцо, тетрагидрофурановое кольцо, тетрагидропирановое кольцо, тетрагидротиопирановое кольцо, морфолиновое кольцо, тиоморфолиновое кольцо, пиперазиновое кольцо, диазепановое кольцо, тиазолидиновое кольцо, изоксазолидиновое кольцо, имидазолидиновое кольцо, пиразолидиновое кольцо, диоксановое кольцо, 1,3-диоксолановое кольцо, оксатиановое кольцо, дитиановое кольцо, пирановое кольцо, дигидропирановое кольцо, пирролиновое кольцо, пиразолиновое кольцо, оксазолиновое кольцо, имидазолиновое кольцо или тиазолиновое кольцо. Предпочтительными "4-8-членными гетероциклическими группами" являются полностью насыщенные 4-8-членные гетероциклические группы, при этом полностью насыщенные 4-8-членные гетероциклические группы, полученные при элиминировании атома водорода, присоединенного к атому азота, образующего кольцо, являются более предпочтительными, особенно предпочтительными являются пирролидин-1-ил, азетидин-1-ил, тиоморфолин-4-ил, пиперидин-1-ил или морфолин-4-ил, и наиболее предпочтительными являются пирролидин-1-ил, пиперидин-1-ил или морфолин-4-ил.
"5-10-членная гетероарильная кольцевая группа" в выражении "5-10-членная гетероарильная кольцевая группа, необязательно замещенная заместителем, выбранным из группы C1," для R20, R21, R22 и R23, указанных выше, обозначает моновалентную группу, полученную при удалении одного атома водорода из любого желаемого положения "5-10-членного гетероарильного кольца", как описано далее.
"5-10-членное гетероарильное кольцо" представляет собой ароматическое кольцо, включающее 5-10 образующих кольцо атомов и содержащее среди атомов, образующих кольцо, один или несколько гетероатомов (что касается конденсированных колец, то по меньшей мере одно из колец является ароматическим), и в качестве примеров могут быть указаны пиридиновое кольцо, тиофеновое кольцо, фурановое кольцо, пиррольное кольцо, оксазольное кольцо, изоксазольное кольцо, тиазольное кольцо, тиадиазольное кольцо, изотиазольное кольцо, имидазольное кольцо, триазольное кольцо, тетразольное кольцо, пиразольное кольцо, фуразановое кольцо, тиадиазольное кольцо, оксадиазольное кольцо, пиридазиновое кольцо, пиримидиновое кольцо, пиразиновое кольцо, триазиновое кольцо, индольное кольцо, изоиндольное кольцо, индазольное кольцо, хинолиновое кольцо, изохинолиновое кольцо, циннолиновое кольцо, хиназолиновое кольцо, хиноксалиновое кольцо, нафтилидиновое кольцо, фталазиновое кольцо, пуриновое кольцо, птеридиновое кольцо, тиенофурановое кольцо, имидазотиазольное кольцо, бензофурановое кольцо, бензотиофеновое кольцо, бензоксазольное кольцо, бензотиазольное кольцо, бензотиадиазольное кольцо, бензимидазольное кольцо, имидазопиридиновое кольцо, пирролопиридиновое кольцо, пирролопиримидиновое кольцо, пиридопиримидиновое кольцо, кумарановое кольцо, хроменовое кольцо, хромановое кольцо, изохромановое кольцо, индолиновое кольцо или изоиндолиновое кольцо. Предпочтительными "5-10-членными гетероарильными кольцевыми группами" являются 5-6-членные группы, более предпочтительными являются изоксазольная кольцевая группа, оксадиазольная кольцевая группа, тетразольная кольцевая группа, пиридиновая кольцевая группа, тиазольная кольцевая группа или тиофеновая кольцевая группа, и особенно предпочтительными являются пиридиновая кольцевая группа, тиазольная кольцевая группа, тиофеновая кольцевая группа или тетразольная кольцевая группа.
В качестве "галогенов" для R30, R31 и R32, указанных выше, могут быть указаны те же, что перечислены выше, из них фтор или хлор являются предпочтительными.
В качестве примеров "C1-6 алкилов" для R30, R31 и R32, указанных выше, могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метил является особенно предпочтительным.
В качестве примеров "C1-6 алкокси" для R30, R31 и R32, указанных выше, могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метокси является особенно предпочтительным.
"C2-7 алкоксикарбонил" для R30, R31 и R32, указанных выше, представляет собой карбонильную группу, содержащую присоединенный к ней вышеуказанный "C1-6 алкокси", и в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентоксикарбонил, изопентоксикарбонил, 2-метилбутоксикарбонил, neoпентоксикарбонил, гексилоксикарбонил, 4-метилпентоксикарбонил, 3-метилпентоксикарбонил, 2-метилпентоксикарбонил, 3,3-диметилбутоксикарбонил, 2,2-диметилбутоксикарбонил, 1,1-диметилбутоксикарбонил, 1,2-диметилбутоксикарбонил, 1,3-диметилбутоксикарбонил или 2,3-диметилбутоксикарбонил, из них метоксикарбонил или этоксикарбонил являются предпочтительными.
В качестве примеров "C1-10 алкила" в выражении "C1-10 алкил, необязательно замещенный заместителем, выбранным из группы D1," для R40, указанного выше, могут быть указаны, в дополнение к вышеуказанному C1-6 алкилу, C7-C10 алкильные группы с прямой цепью или разветвленной цепью, такие как гептил, 3-метилгексил, октил, нонил или децил, из них C1-6 алкильные группы являются предпочтительными, и метил, этил, пропил, изопропил, изобутил, бутил или пентил являются особенно предпочтительными.
В качестве примеров "3-8-членного циклоалкила" в выражении "3-8-членный циклоалкил, необязательно замещенный заместителем, выбранным из группы E1," для R40, указанного выше, могут быть указаны циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, из них циклопропил, циклобутил, циклопентил, циклогексил или циклогептил являются предпочтительными, и циклобутил, циклопентил или циклогексил являются особенно предпочтительными.
В качестве примеров "4-8-членной гетероциклической группы" в выражении "4-8-членная гетероциклическая группа, необязательно замещенный заместителем, выбранным из группы E1," для R40, указанного выше, могут быть указаны те же, что перечислены выше, из них пирролидиновая кольцевая группа, пиперидиновая кольцевая группа, тетрагидротиопирановая кольцевая группа или тетрагидропирановая кольцевая группа являются предпочтительными.
"C2-7 Алкенил" в выражении "C2-7 алкенил, необязательно замещенный заместителем, выбранным из группы F1," для R40, указанного выше, представляет собой алкенильные группы с прямой цепью или разветвленной цепью, состоящие из от 2 до 7 атомов углерода, которые могут содержать 1 или 2 двойные связи, и в качестве примеров могут быть указаны этенил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-метил-1-пропенил, 2-метил-2-пропенил, 1-пентенил, 1-гексенил, 1,6-гексадиенил или 1-гептенил, из них C2-5 группы являются предпочтительными, и 2-пропенил или 2-метил-2-пропенил являются особенно предпочтительными.
"C2-7 Алкинил" в выражении "C2-7 алкинил, необязательно замещенный заместителем, выбранным из группы F1," для R40, указанного выше, представляет собой алкинильные группы с прямой цепью или разветвленной цепью, состоящие из от 2 до 7 атомов углерода, которые могут содержать 1 или 2 тройные связи, и в качестве примеров могут быть указаны этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутенил, 1-пентинил, 1-гексинил, 1,6-гексадиинил или 1-гептинил, из них C2-5 группы являются предпочтительными, и 2-бутинил или 2-пропинил являются особенно предпочтительными.
В качестве примеров "C2-7 алкилкарбонила" в выражении "C2-7 алкилкарбонил, необязательно замещенный заместителем, выбранным из группы G1," для R40, указанного выше, могут быть указаны те же, что перечислены выше, из них C2-5 группы являются предпочтительными, и ацетил или пропилкарбонил являются особенно предпочтительными.
"Моно(C1-6 алкил)аминокарбонил" для R40, указанного выше, представляет собой карбонильную группу, содержащую присоединенный к ней вышеуказанный "моно(C1-6 алкил)амино", и в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил, изопропиламинокарбонил, бутиламинокарбонил, изобутиламинокарбонил, втор-бутиламинокарбонил, трет-бутиламинокарбонил, пентиламинокарбонил, изопентиламинокарбонил, 2-метилбутиламинокарбонил, неопентиламинокарбонил, 1-этилпропиламинокарбонил, гексиламинокарбонил, изогексиламинокарбонил, 4-метилпентиламинокарбонил, 3-метилпентиламинокарбонил, 2-метилпентиламинокарбонил, 1-метилпентиламинокарбонил, 3,3-диметилбутиламинокарбонил, 2,2-диметилбутиламинокарбонил, 1,1-диметилбутиламинокарбонил, 1,2-диметилбутиламинокарбонил, 1,3-диметилбутиламинокарбонил, 2,3-диметилбутиламинокарбонил, 1-этилбутиламинокарбонил или 2-этилбутиламинокарбонил, из них C2-5 группы (общее число атомов углерода) являются предпочтительными и этиламинокарбонил является особенно предпочтительным.
"4-8-членный гетероциклический карбонил" для R40, указанного выше, представляет собой карбонильную группу, содержащую присоединенную к ней указанную выше "4-8-членную гетероциклическую группу", из них пиперидин-1-илкарбонил или морфолин-4-илкарбонил является предпочтительным.
В качестве примеров "C2-7 алкоксикарбонила" для R40, указанного выше, могут быть указаны те же, что перечислены выше, из них метоксикарбонил или этоксикарбонил являются предпочтительными.
"C1-6 Алкилсульфонил" для R40, указанного выше, представляет собой сульфонильную группу, содержащую присоединенный к ней вышеуказанный "C1-6 алкил", в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил, пентилсульфонил, изопентилсульфонил, 2-метилбутилсульфонил, неопентилсульфонил, 1-этилпропилсульфонил, гексилсульфонил, изогексилсульфонил, 4-метилпентилсульфонил, 3-метилпентилсульфонил, 2-метилпентилсульфонил, 1-метилпентилсульфонил, 3,3-диметилбутилсульфонил, 2,2-диметилбутилсульфонил, 1,1-диметилбутилсульфонил, 1,2-диметилбутилсульфонил, 1,3-диметилбутилсульфонил, 2,3-диметилбутилсульфонил, 1-этилбутилсульфонил или 2-этилбутилсульфонил, из них пропилсульфонил является предпочтительным.
В качестве примеров "галогена" для группы A1 могут быть указаны те же, что перечислены выше, из них бром, фтор или хлор являются предпочтительными.
В качестве примеров "C1-6 алкокси" для группы A1 могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метокси является особенно предпочтительным.
В качестве примеров "C1-6 алкила" для группы A1 и группы A2, могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метил, этил, н-бутил или трет-бутил является особенно предпочтительным.
"C1-6 Галогеналкил" для группы A1 и группы A2 представляет собой вышеуказанный "C1-6 алкил", содержащий от 1 до 6 присоединенных к нему вышеуказанных "галогенов", в качестве примеров могут быть указаны алкильные группы с прямой цепью или разветвленной цепью, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, 2-метилбутил, неопентил, 1-этилпропил, гексил, изогексил, 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, 3,3-диметилбутил, 2,2-диметилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 1-этилбутил или 2-этилбутил, содержащие присоединенный к ним атом фтора или атом хлора, из них C1-4 алкил, содержащий присоединенный к нему от 1 до 3 атомов фтора или хлора, является предпочтительным, и трифторметил является особенно предпочтительным.
В качестве примеров "C2-7 алкилена", где C2-7 алкилен является возможным только в случае, когда спирогруппа образована вместе с замещенным 5-10-членным циклоалкилом или замещенным 5-10-членным циклоалкенилом, для группы A1 и группы A2, могут быть указаны группы с прямой цепью или разветвленной цепью, такие как 1,2-этилен, триметилен, пропилен, этилэтилен, тетраметилен, пентаметилен, гексаметилен или гептаметилен, из них 1,2-этилен, тетраметилен или пентаметилен являются предпочтительными.
В качестве примеров "галогена" для группы B1 могут быть указаны те же, что перечислены выше, из них фтор или хлор являются предпочтительными.
В качестве примеров "C2-7 алкоксикарбонила" для группы B1, могут быть указаны те же, что перечислены выше, из них метоксикарбонил или этоксикарбонил являются предпочтительными.
В качестве примеров "галогена" для группы C1, могут быть указаны те же, что перечислены выше, из них бром, фтор или хлор являются предпочтительными.
В качестве примеров "C1-6 алкила" для группы C1 и группы C2, могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метил является особенно предпочтительным.
В качестве примеров "C1-6 алкокси" для группы C1 и группы C2, могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метокси, этокси или изопропокси являются особенно предпочтительными.
В качестве примеров "галогена" для группы D1 и группы D2, могут быть указаны те же, что перечислены выше, из них фтор или хлор являются предпочтительными.
В качестве примеров "C1-6 алкокси" для группы D1 и группы D2, могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метокси или этокси являются особенно предпочтительными.
"C1-6 Алкилтио" для группы D1 представляет собой тио группу, содержащую присоединенный к ней вышеуказанный "C1-6 алкил", и в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, изопентилтио, 2-метилбутилтио, неопентилтио, 1-этилпропилтио, гексилтио, изогексилтио, 4-метилпентилтио, 3-метилпентилтио, 2-метилпентилтио, 1-метилпентилтио, 3,3-диметилбутилтио, 2,2-диметилбутилтио, 1,1-диметилбутилтио, 1,2-диметилбутилтио, 1,3-диметилбутилтио, 2,3-диметилбутилтио, 1-этилбутилтио или 2-этилбутилтио, из них C1-4 группы являются предпочтительными, и метилтио или этилтио являются особенно предпочтительными.
В качестве примеров "C1-6 алкилсульфонил" для группы D1 могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метилсульфонил или этилсульфонил являются особенно предпочтительными.
"C1-6 алкил сульфинил" для группы D1 представляет собой сульфинильную группу, содержащую присоединенный к ней вышеуказанный "C1-6 алкил", в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, бутилсульфинил, изобутилсульфинил, втор-бутилсульфинил, трет-бутилсульфинил, пентилсульфинил, изопентилсульфинил, 2-метилбутилсульфинил, неопентилсульфинил, 1-этилпропилсульфинил, гексилсульфинил, изогексилсульфинил, 4-метилпентилсульфинил, 3-метилпентилсульфинил, 2-метилпентилсульфинил, 1-метилпентилсульфинил, 3,3-диметилбутилсульфинил, 2,2-диметилбутилсульфинил, 1,1-диметилбутилсульфинил, 1,2-диметилбутилсульфинил, 1,3-диметилбутилсульфинил, 2,3-диметилбутилсульфинил, 1-этилбутилсульфинил или 2-этилбутилсульфинил, из них C1-4 группы являются предпочтительными, и метилсульфинил или этилсульфинил являются особенно предпочтительными.
В качестве примеров "моно(C1-6 алкил)амино" для группы D1 могут быть указаны те же, что перечислены выше, из них метиламино или этиламино являются предпочтительными, и метиламино является особенно предпочтительным.
В качестве примеров "ди(C1-6 алкил)амино" для группы D1 могут быть указаны те же, что перечислены выше, из них диметиламино, метилэтиламино или диэтиламино являются предпочтительными, и диметиламино является особенно предпочтительным.
"C2-7 Алкилкарбониламино" для группы D1 представляет собой аминогруппу, содержащую присоединенный к ней вышеуказанный "C2-7 алкилкарбонил", и в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как ацетиламино, этилкарбониламино, н-пропилкарбониламино, изопропилкарбониламино, н-бутилкарбониламино, изобутилкарбониламино, втор-бутилкарбониламино, трет-бутилкарбониламино, пентилкарбониламино, изопентилкарбониламино, 2-метилбутилкарбониламино, неопентилкарбониламино, 1-этилпропилкарбониламино, гексилкарбониламино, изогексилкарбониламино, 4-метилпентилкарбониламино, 3-метилпентилкарбониламино, 2-метилпентилкарбониламино, 1-метилпентилкарбониламино, 3,3-диметилбутилкарбониламино, 2,2-диметилбутилкарбониламино, 1,1-диметилбутилкарбониламино, 1,2-диметилбутилкарбониламино, 1,3-диметилбутилкарбониламино, 2,3-диметилбутилкарбониламино, 1-этилбутилкарбониламино или 2-этилбутилкарбониламино, из них аминогруппы, содержащие присоединенный к ним C2-5 алкилкарбонил, являются предпочтительными, и ацетиламино или этилкарбониламино являются особенно предпочтительными.
В качестве примеров "3-8-членного циклоалкила" для "3-8-членного циклоалкила, необязательно замещенного заместителем, выбранным из группы H1," для группы D1 и "3-8-членного циклоалкила" для группы D2, могут быть указаны те же, что перечислены выше, из них циклопропил, циклобутил, циклопентил или циклогексил являются предпочтительными, циклопропил или циклобутил являются более предпочтительными, и циклопропил является наиболее предпочтительным.
В качестве примеров "C2-7 алкоксикарбонил" для группы D1 могут быть указаны те же, что перечислены выше, из них метоксикарбонил или этоксикарбонил являются предпочтительными.
В качестве примеров "4-8-членной гетероциклической группы" для группы D1 и группы D2, могут быть указаны те же, что перечислены выше, из них тетрагидропирановая кольцевая группа или тетрагидрофурановая кольцевая группа являются предпочтительными, и тетрагидропиран-4-ил является особенно предпочтительным.
В качестве примеров "5-10-членной гетероарильной кольцевой группы" для группы D1, могут быть указаны те же, что перечислены выше, из них фурил, тиенил, пиридил, пиразил, пиримидинил или пиридазинил являются предпочтительными, и фурил, тиенил или пиридил являются особенно предпочтительными.
"6-10-членная арильная кольцевая группа" для группы D1 представляет собой ароматическую углеводородную кольцевую группу, состоящую из от 6 до 10 атомов углерода (что касается конденсированных колец, то по меньшей мере одно из колец является ароматическим), в качестве примеров могут быть указаны фенил, 1-нафтил, 2-нафтил, инденил, инданил, азуленил или гепталенил, из них фенил, 1-нафтил или 2-нафтил являются предпочтительными, и фенил является особенно предпочтительным.
В качестве примеров "C2-7 алкилкарбонила" для группы D1 и группы D2, могут быть указаны те же, что перечислены выше, из них C2-5 группы являются предпочтительными, и ацетил или этилкарбонил является особенно предпочтительными.
"6-10-членная арильная кольцевая карбонильная группа" для группы D1 представляет собой карбонильную группу, содержащую присоединенную к ней указанную выше "6-10-членную арильную кольцевую группу", и в качестве примеров могут быть указаны бензоил, 1-нафтоил, 2-нафтоил, инденилкарбонил, инданилкарбонил, азуленилкарбонил или гепталенилкарбонил, из них бензоил, 1-нафтоил или 2-нафтоил являются предпочтительными, и бензоил является особенно предпочтительным.
В качестве примеров "моно(C1-6 алкил)аминокарбонила" в выражении "моно(C1-6 алкил)аминокарбонил, необязательно замещенный галогеном," для группы D1 и "моно(C1-6 алкил)аминокарбонила" для группы D2 могут быть указаны те же, что перечислены выше, из них C2-5 группы являются предпочтительными, метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил, изопропиламинокарбонил или бутиламинокарбонил являются более предпочтительными, и метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил или изопропиламинокарбонил являются наиболее предпочтительными.
В качестве примеров "моно(3-8-членный циклоалкил)аминокарбонила" для группы D1 могут быть указаны циклопропиламинокарбонил, циклобутиламинокарбонил, циклопентил-аминокарбонил, циклогексиламинокарбонил, циклогептиламинокарбонил или циклооктиламинокарбонил, из них циклопропиламинокарбонил, циклобутиламинокарбонил, циклопентиламинокарбонил или циклогексиламинокарбонил являются предпочтительными, и циклопропиламинокарбонил является особенно предпочтительным.
"Моно(C2-7 алкоксиалкил)аминокарбонил" для группы D1 представляет собой аминокарбонильную группу, содержащую присоединенный к ней "C2-7 алкоксиалкил", где "C2-7 алкоксиалкил" представляет собой вышеуказанный "C1-6 алкил", содержащий присоединенный к ней в области C2-7 вышеуказанный "C1-6 алкокси". В качестве примеров "моно(C2-7 алкоксиалкил)аминокарбонила" могут быть указаны метоксиметиламинокарбонил, метоксиэтиламинокарбонил, этоксиэтил-аминокарбонил, метоксипропиламинокарбонил или пропоксиэтиламинокарбонил, из них метоксиэтиламинокарбонил является предпочтительным.
"Ди(C1-6 алкил)аминокарбонил" для группы D1 и группы D2 представляет собой карбонильную группу, содержащую присоединенный к ней вышеуказанный "ди(C1-6 алкил)амино", и в качестве примеров могут быть указаны группы с прямой цепью или разветвленной цепью, такие как диметиламинокарбонил, метилэтиламинокарбонил, диэтиламинокарбонил, метилпропиламино-карбонил, этилпропиламинокарбонил, дипропиламинокарбонил, диизопропиламинокарбонил, дибутиламинокарбонил, диизобутиламино-карбонил, ди(втор-бутил)аминокарбонил, ди(трет-бутил)-аминокарбонил, метилпентиламинокарбонил, дипентиламинокарбонил, диизопентиламинокарбонил, ди(2-метилбутил)аминокарбонил, ди(неопентил)аминокарбонил, ди(1-этилпропил)аминокарбонил, дигексиламинокарбонил, метилизогексиламинокарбонил, диизогексил-аминокарбонил, ди(4-метилпентил)аминокарбонил, ди(3-метилпентил)аминокарбонил, ди(2-метилпентил)аминокарбонил, ди(1-метилпентил)аминокарбонил, ди(3,3-диметилбутил)аминокарбонил, ди(2,2-диметилбутил)аминокарбонил, ди(1,1-диметилбутил)амино-карбонил, ди(1,2-диметилбутил)аминокарбонил, ди(1,3-диметилбутил)аминокарбонил, ди(2,3-диметилбутил)аминокарбонил, ди(1-этилбутил)аминокарбонил или ди(2-этилбутил)аминокарбонил, из них диметиламинокарбонил, метилэтиламинокарбонил или диэтиламинокарбонил является предпочтительным, и диметиламинокарбонил являются особенно предпочтительными.
"Моно(5-10-членный гетероарильный кольцевой)аминокарбонил" для группы D1 представляет собой группу, полученную замещением одного атома водорода аминокарбонила (карбамоила) вышеуказанной "5-10-членной гетероарильной кольцевой" группой, где в качестве примеров "5-10-членного гетероарильного кольца" могут быть указаны пиридиновое кольцо, тиофеновое кольцо, фурановое кольцо, пиррольное кольцо, оксазольное кольцо, изоксазольное кольцо, тиазольное кольцо, тиадиазольное кольцо, изотиазольное кольцо, имидазольное кольцо, триазольное кольцо, тетразольное кольцо, пиразольное кольцо, фуразановое кольцо, тиадиазольное кольцо, оксадиазольное кольцо, пиридазиновое кольцо, пиримидиновое кольцо, пиразиновое кольцо, триазиновое кольцо, индольное кольцо, изоиндольное кольцо, индазольное кольцо, хинолиновое кольцо, изохинолиновое кольцо, циннолиновое кольцо, хиназолиновое кольцо, хиноксалиновое кольцо, нафтилидиновое кольцо, фталазиновое кольцо, пуриновое кольцо, птеридиновое кольцо, тиенофурановое кольцо, имидазотиазольное кольцо, бензофурановое кольцо, бензотиофеновое кольцо, бензоксазольное кольцо, бензотиазольное кольцо, бензотиадиазольное кольцо, бензимидазольное кольцо, имидазопиридиновое кольцо, пирролопиридиновое кольцо, пирролопиримидиновое кольцо, пиридопиримидиновое кольцо, кумарановое кольцо, хроменовое кольцо, хромановое кольцо, изохромановое кольцо, индолиновое кольцо или изоиндолиновое кольцо. Предпочтительным моно(5-10-членным гетероарильным кольцевым)аминокарбонилом является пиридин-2-иламинокарбонил.
В качестве примеров "4-8-членного гетероциклического карбонила" в выражении "4-8-членный гетероциклический карбонил, необязательно замещенный C1-6 алкилом," для группы D1 и "4-8-членного гетероциклического карбонила" для группы D2, могут быть указаны те же, что перечислены выше, из них пирролидин-1-илкарбонил, азепан-1-илкарбонил, азокан-1-илкарбонил, пиперидин-1-илкарбонил или морфолин-4-илкарбонил являются предпочтительными, и пирролидин-1-илкарбонил, пиперидин-1-илкарбонил или морфолин-4-илкарбонил являются особенно предпочтительными.
"5-10-членный гетероарильный кольцевой карбонил" для группы D1 представляет собой карбонильную группу, содержащую присоединенную к ней указанную выше "5-10-членную гетероарильную кольцевую группу".
"5-членная гетероарильная кольцевая группа" для группы D2 представляет собой группу, где число атомов, образующих кольцо, равно 5 в вышеуказанной "5-10-членной гетероарильной кольцевой группе", в качестве примеров могут быть указаны тиенил, фурил, пирролил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, имидазолил, триазолил, пиразолил, фуразинил или оксадиазолил, из них тиенил или фурил являются предпочтительными.
В качестве примеров "галогена" для группы E1 могут быть указаны те же, что перечислены выше, из них бром, фтор или хлор являются предпочтительными.
В качестве примеров "C1-6 алкокси" для группы E1 могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метокси является особенно предпочтительным.
В качестве примеров "C1-6 алкила" для группы E1 могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метил является особенно предпочтительным.
В качестве примеров "галогена" для группы F1 могут быть указаны те же, что перечислены выше, из них фтор или хлор являются предпочтительными.
В качестве примеров "C1-6 алкокси" для группы F1 могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метокси является особенно предпочтительным.
В качестве примеров "3-8-членный циклоалкила" для группы G1 могут быть указаны те же, что перечислены выше, из них циклогексил или циклопропил являются предпочтительными.
В качестве примеров "C1-6 галогеналкила" для группы H1 могут быть указаны те же, что перечислены выше, из них хлорметил или фторметил являются особенно предпочтительными.
В качестве примеров "C1-6 алкила" для группы H1 могут быть указаны те же, что перечислены выше, из них C1-4 группы являются предпочтительными, и метил является особенно предпочтительным.
В качестве примеров "C2-7 алкоксиалкил" для группы H1 могут быть указаны те же, что перечислены выше, из них метоксиметил является предпочтительным.
В качестве примеров "моно(C1-6 алкил)аминокарбонила" для группы H1 могут быть указаны те же, что перечислены выше, из них метиламинокарбонил является предпочтительным.
В качестве примеров "ди(C1-6 алкил)аминокарбонила" для группы H1 могут быть указаны те же, что перечислены выше, из них диметиламинокарбонил или диэтиламинокарбонил являются предпочтительными, и диметиламинокарбонил является особенно предпочтительным.
В качестве примеров "C2-7 алкоксикарбонила" для группы H1 могут быть указаны те же, что перечислены выше, из них метоксикарбонил или этоксикарбонил являются предпочтительными.
"C2-7 цианоалкил" для H1 представляет собой вышеуказанный "C1-6 алкил", содержащий присоединенную к ней циано группу, в качестве примеров могут быть указаны алкильные группы с прямой цепью или разветвленной цепью, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, 2-метилбутил, неопентил, 1-этилпропил, гексил, изогексил, 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, 3,3-диметилбутил, 2,2-диметилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 1-этилбутил или 2-этилбутил, содержащие присоединенную к ним циано группу, из них C1-4 алкил, содержащий присоединенную к нему циано группу, является предпочтительным, и цианометил является особенно предпочтительным.
Используемый в данной заявке термин "необязательно замещенный заместителем" имеет то же значение, что и "необязательно замещенный 1-6 заместителями 1, или 2, или более видов в любой желаемой комбинации в возможных для замещения положениях", при условии, что число и вид заместителей специально не ограничены.
Некоторые структурные формулы соединений в настоящем описании для удобства представлены только одной изомерной формой, однако изобретение охватывает любой и все геометрические изомеры, а также оптические изомеры на основе асимметрических атомов углерода, стереоизомеров и таутомеров и смесей этих изомеров, которые выражены структурами этих соединений, не будучи ограниченными для любой из приведенных для удобства формул. Таким образом, соединения по изобретению включают все соединения, которые содержат асимметрические атомы углерода и находятся в оптически активной или рацемической форме, без конкретных ограничений изобретения. Также нет ограничений в присутствии полиморфных кристаллических форм, и соединения могут быть в одной кристаллической форме или смеси различных кристаллических форм, при этом также охвачиваются ангидриды и гидраты соединений по изобретению. Также в область изобретения включены метаболиты соединений (1) и (100) по изобретению, полученные путем разложения соединений in vivo. Кроме того, изобретение также включает соединения, которые являются метаболизированными in vivo путем окисления, восстановления, гидролиза, конъюгации или тому подобное, с получением соединений (1) и (100) по изобретению (то есть, "пролекарств").
Используемый в данной заявке термин "соль" конкретно не ограничивается в том случае, когда соль образована из соединения по изобретению и является фармакологически приемлемой, и в качестве примеров могут быть указаны соли неорганических кислот, соли органических кислот, соли неорганических оснований, соли органических оснований и соли кислотные или основные аминокислот.
В качестве предпочтительных примеров солей неорганических кислот могут быть указаны гидрохлорид, гидробромид, сульфат, нитрат и фосфат, и в качестве предпочтительных примеров солей органических кислот могут быть указаны ацетат, сукцинат, фумарат, малеат, тартарат, цитрат, лактат, стеарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат и п-толуолсульфонат.
В качестве предпочтительных примеров солей неорганических оснований могут быть указаны соли щелочных металлов, такие как соли натрия и соли калия, соли щелочноземельных металлов, такие как соли кальция и соли магния, и соли алюминия или аммония, и в качестве предпочтительных примеров солей органических оснований могут быть указаны соли диэтиламина, соли диэтаноламина, соли меглумина и соли N,N'-дибензилэтилендиамина.
В качестве предпочтительных примеров кислотных солей аминокислот могут быть указаны аспартат и глутамат, и в качестве предпочтительных примеров основных солей аминокислот могут быть указаны соли аргинина, соли лизина и соли орнитина.
Предпочтительные соединения по изобретению включают следующие соединения.
(2) соединение, его соль или их гидрат, где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный заместителем, выбранным из группы A2, или 5-10-членный циклоалкенил, необязательно замещенный заместителем, выбранным из группы A2,
где группа A2 состоит из гидроксила, фенила, C1-6 алкила, C1-6 галогеналкила и C2-7 алкилена, где C2-7 алкилен является допустимым только в случае, когда спирогруппа образована вместе с замещенным 5-10-членным циклоалкилом или замещенным 5-10-членным циклоалкенилом.
(3) соединение, его соль или их гидрат, где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный гидроксилом, фенилом, C1-6 алкилом, C1-6 галогеналкилом, 1,2-этиленом, триметиленом, тетраметиленом или пентаметиленом, или 5-10-членный циклоалкенил, необязательно замещенный гидроксилом, фенилом, C1-6 алкилом, C1-6 галогеналкилом, 1,2-этиленом, триметиленом, тетраметиленом или пентаметиленом, где 1,2-этилен, триметилен, тетраметилен или пентаметилен является допустимым только в случае, когда спирогруппа образована вместе с замещенным 5-10-членным циклоалкилом или замещенным 5-10-членным циклоалкенилом.
(4) соединение, его соль или их гидрат, где R10 представляет собой циклогексил, 4-трет-бутилциклогексил, 4,4-диметилциклогексил, 4,4-диэтилциклогексил, 3,3,5,5-тетраметилциклогексил, 3,5-диметилциклогексил, 4-фенилциклогексил, 4-трифторметилциклогексил, 4-н-бутилциклогексил, циклопентил, 3,3,4,4-тетраметилциклопентил, циклогептил, циклооктил или группу представленную формулой:
_
где s представляет собой целое число, равное 0, 1, 2 или 3.
(4-1) соединение, его соль или их гидрат, где R10 представляет собой циклогексил.
(4-2) соединение, его соль или их гидрат, где R10 представляет собой 4-трет-бутилциклогексил.
(4-3) соединение, его соль или их гидрат, где R10 представляет собой 4,4-диметилциклогексил.
(4-4) соединение, его соль или их гидрат, где R10 представляет собой 4,4-диэтилциклогексил.
(4-5) соединение, его соль или их гидрат, где R10 представляет собой 3,3,5,5-тетраметилциклогексил.
(4-6) соединение, его соль или их гидрат, где R10 представляет собой 3,5-диметилциклогексил.
(4-7) соединение, его соль или их гидрат, где R10 представляет собой 4-фенилциклогексил.
(4-8) соединение, его соль или их гидрат, где R10 представляет собой 4-трифторметилциклогексил.
(4-9) соединение, его соль или их гидрат, где R10 представляет собой 4-н-бутилциклогексил.
(4-10) соединение, его соль или их гидрат, где R10 представляет собой циклопентил.
(4-11) соединение, его соль или их гидрат, где R10 представляет собой 3,3,4,4-тетраметилциклопентил.
(4-12) соединение, его соль или их гидрат, где R10 представляет собой циклогептил.
(4-13) соединение, его соль или их гидрат, где R10 представляет собой циклооктил.
(4-14) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

где s представляет собой целое число, равное 0, 1, 2 или 3;
(4-15) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-16) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-17) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:
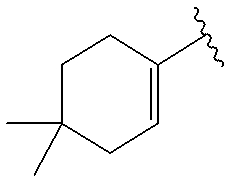
(4-18) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-19) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-20) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-21) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

где s представляет собой целое число, равное 0, 1, 2 или 3.
(4-22) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-23) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-24) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-25) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(4-26) соединение, его соль или их гидрат, где R10 представляет собой группу, представленную следующей формулой:

(5) соединение, его соль или их гидрат, где R20, R21, R22 и R23 могут быть одинаковыми или различными, и каждый представляет собой водород, гидроксил, галоген, циано, C2-7 алкилкарбонил, нитро, амино, моно(C1-6 алкил)амино, ди(C1-6 алкил)амино, C1-6 алкил, необязательно замещенный заместителем, выбранным из группы B1, C1-6 алкокси, необязательно замещенный заместителем, выбранным из группы B1, 4-8-членную гетероциклическую группу, необязательно замещенную заместителем, выбранным из группы C1 или 5-6-членную гетероарильную кольцевую группу, необязательно замещенную заместителем, выбранным из группы C1.
(6) соединение, его соль или их гидрат, где R20, R21, R22 и R23 могут быть одинаковыми или различными, и каждый представляет собой водород, гидроксил, галоген, циано, ацетил, нитро, амино, монометиламино, моноэтиламино, диметиламино, C1-6 алкил, необязательно замещенный заместителем, выбранным из группы B1, C1-6 алкокси, необязательно замещенный заместителем, выбранным из группы B1, 4-8-членную гетероциклическую группу, необязательно замещенную заместителем, выбранным из группы C1, где 4-8-членная гетероциклическая группа получена путем удаления водорода, присоединенного к азоту 4-8-членного гетероцикла, или 5-6-членную гетероарильную кольцевую группу, необязательно замещенную заместителем, выбранным из группы C2,
где группа C2 состоит из C1-6 алкокси и C1-6 алкила.
(7) соединение, его соль или их гидрат, где R20, R21, R22 и R23 могут быть одинаковыми или различными, и каждый представляет собой водород, галоген, циано, ацетил, монометиламино, моноэтиламино, диметиламино, метил, метокси, этокси, морфолин-4-ил, необязательно замещенный заместителем, выбранным из группы C2, пиперидин-1-ил, необязательно замещенный заместителем, выбранным из группы C2, пирролидин-1-ил, необязательно замещенный заместителем, выбранным из группы C2, азетидин-1-ил, пиридин-2-ил или пиридин-3-ил.
(8) соединение, его соль или их гидрат, где по меньшей мере два из R20, R21, R22 и R23 представляют собой водород, и остальные группы, которые могут быть одинаковыми или различными, представляют собой водород, галоген, циано, ацетил, монометиламино, моноэтиламино, диметиламино, метил, метокси, этокси, морфолин-4-ил, необязательно замещенный заместителем, выбранным из группы C2, пиперидин-1-ил, необязательно замещенный заместителем, выбранным из группы C2, пирролидин-1-ил, необязательно замещенный заместителем, выбранным из группы C2, азетидин-1-ил, пиридин-2-ил или пиридин-3-ил.
(9) соединение, его соль или их гидрат, где три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой водород, фтор, циано, диметиламино, метил, метокси, морфолин-4-ил, необязательно замещенный заместителем, выбранным из группы C3, пиперидин-1-ил, необязательно замещенный заместителем, выбранным из группы C3, или пирролидин-1-ил, необязательно замещенный заместителем, выбранным из группы C3,
где группа C3 состоит из метокси, этокси и метила.
(9-1) соединение, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой фтор.
(9-2) соединение, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой циано.
(9-3) соединение, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой диметиламино.
(9-4) соединение, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой метил.
(9-5) соединение, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой метокси.
(9-6) соединение, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой морфолин-4-ил, необязательно замещенный заместителем, выбранным из группы C2.
(9-7) соединение, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой пиперидин-1-ил, необязательно замещенный заместителем, выбранным из группы C2.
(9-8) соединение, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой пирролидин-1-ил, необязательно замещенный заместителем, выбранным из группы C2.
(9-9) соединение, его соль или их гидрат, где все из R20, R21, R22 и R23 представляют собой водород.
(10) соединение, его соль или их гидрат, где R30, R31 и R32 могут быть одинаковыми или различными, и каждый представляет собой водород или C1-6 алкил, или R30 и R31 соединены вместе с образованием оксо (=O), и R32 представляет собой водород или C1-6 алкил.
(11) соединение, его соль или их гидрат, где R30, R31 и R32 могут быть одинаковыми или различными, и каждый представляет собой водород или метил, или R30 и R31 соединены вместе с образованием оксо (=O), и R32 представляет собой водород или метил.
(12) соединение, его соль или их гидрат, где все из R30, R31 и R32 представляют собой водород.
(13) соединение, его соль или их гидрат, где R40 представляет собой C1-6 алкил, необязательно замещенный заместителем, выбранным из группы D1, 3-8-членный циклоалкил, необязательно замещенный заместителем, выбранным из группы E1, C2-7 алкенила, C2-7 алкинила или C2-7 алкилкарбонила.
(14) соединение, его соль или их гидрат, где R40 представляет собой C1-6 алкил, необязательно замещенный заместителем, выбранным из группы D2,
где группа D2 состоит из гидроксила, галогена, циано, C1-6 алкокси, 3-8-членного циклоалкила, 4-8-членной гетероциклической группы, моно(C1-6 алкил)аминокарбонила, ди(C1-6 алкил)аминокарбонила, C2-7 алкилкарбонила, 5-членной гетероарильной кольцевой группы, 4-8-членного гетероциклического карбонила или фенила.
(15) соединение, его соль или их гидрат, где R40 представляет собой н-пропил, н-бутил, н-пентил, изобутил, этилкарбонилметил, метоксиэтил, этоксиэтил, циклопропилметил или тетрагидропиран-4-илметил.
(15-1) соединение, его соль или их гидрат, где R40 представляет собой н-пропил.
(15-2) соединение, его соль или их гидрат, где R40 представляет собой н-бутил.
(15-3) соединение, его соль или их гидрат, где R40 представляет собой н-пентил.
(15-4) соединение, его соль или их гидрат, где R40 представляет собой изобутил.
(15-5) соединение, его соль или их гидрат, где R40 представляет собой этилкарбонилметил.
(15-6) соединение, его соль или их гидрат, где R40 представляет собой метоксиэтил.
(15-7) соединение, его соль или их гидрат, где R40 представляет собой этоксиэтил.
(15-8) соединение, его соль или их гидрат, где R40 представляет собой циклопропилметил.
(15-9) соединение, его соль или их гидрат, где R40 представляет собой тетрагидропиран-4-илметил;
(16) соединение, его соль или их гидрат, где n представляет собой целое число, равное 1.
(17) соединение, его соль или их гидрат, где X1 представляет собой азот (только в случае, когда соединение представлено формулой (1)).
Также предпочтительным является соединение, его соль или их гидрат, которое получено сочетанием:
R10, выбранного из (2)-(4) и вышеуказанных (4-1)-(4-26),
R20, R21, R22 и R23, выбранных из (5)-(9) и вышеуказанных (9-1)-(9-9),
R30, R31 и R32, выбранного из вышеуказанных (10)-(12),
R40, выбранного из (14)-(15) и вышеуказанных (15-1)-(15-9),
n, выбранного из (16), и
X1, выбранного из вышеуказанного (17).
В качестве предпочтительного соединения по изобретению могут быть указаны:
1-[2-(4,4-диметилциклогексил)-5-метоксифенил]-4-пентилпиперазин,
1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин,
1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин,
1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин,
2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-этилацетамид,
цис-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрил,
транс-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрил,
1-бутил-4-(2-циклогексилфенил)пиперазин,
1-бутил-4-[2-(4-трет-бутилциклогексил)фенил]пиперазин,
1-{4-[2-(4,4-диметилциклогексил)фенил]пиперазин-1-ил}бутан-2-он,
4-[3-(4-трет-бутилциклогекс-1-енил)-4-(4-бутилпиперазин-1-ил)фенил]морфолин,
1-[2-(4-трет-бутилциклогексил)фенил]-4-(2-метоксиэтил)пиперазин,
1-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-циклопропилметилпиперазин,
1-(тетрагидропиран-4-илметил)-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин,
4-[4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолин,
1-{4-[2-(4,4-диэтилциклогекс-1-енил)-4-морфолин-4-илфенил]пиперазин-1-ил}бутан-2-он,
1-пропил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин,
1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин,
1-бутил-4-[2-(3,5-диметилциклогексил)фенил]пиперазин,
1-[2-(4,4-диэтилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазин,
4-[4-(4-бутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолин,
4-[4-(4-бутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]морфолин,
1-[4-(4-этоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазин,
цис-4-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]-2,6-диметилморфолин,
4-{4-(4-пентилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил}морфолин,
1-[3-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазин,
1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридин,
1-бутил-4-{2-(3,3,4,4-тетраметилциклопентил)фенил}пиперазин,
1-бутил-4-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]пиперазин,
1-бутил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин,
1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин,
1-{4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-2-он,
1-(2-метоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин,
1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-он,
1-(2-метоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин,
4-[4-(4-бутилпиперазин-1-ил)-5-(4,4-диэтилциклогексил)-2-метоксифенил]морфолин,
1-бутил-4-(2-спиро[4,5]дец-8-илфенил)пиперазин,
1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-изобутилпиперазин,
1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин,
4-[3-(4,4-диметилциклогексил)-4-(4-изобутилпиперазин-1-ил)фенил]морфолин,
{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}ацетонитрил,
1-(2-этоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин,
(R)-1-бутил-4-[2-(4,4-диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазин,
1-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазин,
1-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазин,
1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидин,
1-изобутил-4-[2-(3,3,4,4-тетраметилциклопент-1-енил)фенил]пиперазин, и
1-[2-(4-циклопропилметилпиперазин-1-ил)фенил]-3,3,5,5-тетраметилциклогексанол.
В дополнение к вышеуказанным соединениям, следующие соединения также являются предпочтительными соединениями. Определения терминов в следующих соединениях являются такими же, как определения, данные выше.
<101> Соединение, представленное следующей общей формулой, его соль или их гидрат

где R10 представляет собой циклогексил, необязательно замещенный заместителем, выбранным из группы A1', или циклогексенил, необязательно замещенный заместителем, выбранным из группы A1',
R20, R21, R22 и R23 могут быть одинаковыми или различными, и каждый представляет собой водород, гидроксил, галоген, циано, нитро, амино, моно(C1-6 алкил)амино, ди(C1-6 алкил)амино, C1-6 алкил, необязательно замещенный заместителем, выбранным из группы B1', C1-6 алкокси, необязательно замещенный заместителем, выбранным из группы B1', 4-8-членную гетероциклическую группу, необязательно замещенную заместителем, выбранным из группы C1', или 5-10-членную гетероарильную кольцевую группу, необязательно замещенную заместителем, выбранным из группы C1',
R30, R31 и R32 могут быть одинаковыми или различными, и каждый представляет собой водород, гидроксил, галоген, циано, карбоксил, C1-6 алкил, C1-6 алкокси или C2-7 алкоксикарбонил, или
два из R30, R31 и R32 соединены вместе с образованием оксо (=O),
R40 представляет собой C1-10 алкил, необязательно замещенный заместителем, выбранным из группы D1', или 3-8-членный циклоалкил,
n представляет собой целое число, равное 1 или 2, и
X1 представляет собой CH или азот,
где группа A1' состоит из галогена, C1-6 алкила и C2-7 алкилена, где C2-7 алкилен является допустимым только в том случае, когда спирогруппа образована вместе с циклогексилом или циклогексенилом,
группа B1' состоит из галогена,
группа C1' состоит из циано, галогена, C1-6 алкила и C1-6 алкокси, и
группа D1' состоит из гидроксила, галогена, циано, C1-6 алкокси, 3-8-членного циклоалкила, 4-8-членной гетероциклической группы, 5-10-членной гетероарильной кольцевой группы, C2-7 алкилкарбонила, моно(C1-6 алкил)аминокарбонила, ди(C1-6 алкил)аминокарбонила, 4-8-членного гетероциклического карбонила и 5-10-членного гетероарильного кольцевого карбонила.
<102> Соединение в соответствии с <101>, его соль или их гидрат, где R10 представляет собой циклогексил, необязательно замещенный заместителем, выбранным из группы A2', или циклогексенил, необязательно замещенный заместителем, выбранным из группы A2', где группа A2' состоит из C1-6 алкила и C2-7 алкилена, где C2-7 алкилен является допустимым только в том случае, когда спирогруппа образована вместе с циклогексилом или циклогексенилом.
<103> Соединение в соответствии с <101>, его соль или их гидрат, где R10 представляет собой циклогексил, необязательно замещенный C1-6 алкилом, 1,2-этиленом, триметиленом, тетраметиленом или пентаметиленом, или циклогексенил, необязательно замещенный C1-6 алкилом, 1,2-этиленом, триметиленом, тетраметиленом или пентаметиленом,
где 1,2-этилен, триметилен, тетраметилен или пентаметилен является допустимым только в том случае, когда спирогруппа образована вместе с циклогексилом или циклогексенилом.
<104> Соединение в соответствии с <101>, его соль или их гидрат, где R10 представляет собой циклогексил, 4-(трет-бутил)циклогексил, 4,4-диметилциклогексил, 4,4-диэтилциклогексил, 3,3,5,5-тетраметилциклогексил, или группу, представленную формулой:
_
где s представляет собой целое число, равное 0-3.
<105> Соединение в соответствии с любым из <101> - <104>, его соль или их гидрат, где R20, R21, R22 и R23 могут быть одинаковыми или различными, и каждый представляет собой водород, галоген, циано, амино, моно(C1-6 алкил)амино, ди(C1-6 алкил)амино, C1-6 алкил, необязательно замещенный фтором, C1-6 алкокси, необязательно замещенный фтором, или 4-8-членную гетероциклическую группу, необязательно замещенную заместителем, выбранным из группы C2', где группа C2' состоит из C1-6 алкокси и C1-6 алкила.
<106> Соединение в соответствии с любым из <101> - <104>, его соль или их гидрат, где R20, R21, R22 и R23 могут быть одинаковыми или различными, и каждый представляет собой водород, галоген, циано, амино, монометиламино, диметиламино, метил, метокси, морфолино, необязательно замещенный заместителем, выбранным из группы C2', или пиперидино, необязательно замещенный заместителем, выбранным из группы C2', где группа C2' состоит из C1-6 алкокси и C1-6 алкила.
<107> Соединение в соответствии с любым из <101> - <104>, его соль или их гидрат, где по меньшей мере три из R20, R21, R22 и R23 представляют собой водород, и оставшаяся группа представляет собой водород, галоген, метокси или циано.
<108> Соединение в соответствии с любым из <101> - <107>, его соль или их гидрат, где R30, R31 и R32 могут быть одинаковыми или различными, и каждый представляет собой водород или C1-6 алкил, или R30 и R31 соединены вместе с образованием оксо (=O), и R32 представляет собой водород или C1-6 алкил.
<109> Соединение в соответствии с любым из <101> - <107>, его соль или их гидрат, где R30, R31 и R32 могут быть одинаковыми или различными, и каждый представляет собой водород или метил, или R30 и R31 соединены вместе с образованием оксо (=O), и R32 представляет собой водород или метил.
<110> Соединение в соответствии с любым из <101> - <107>, его соль или их гидрат, где все из R30, R31 и R32 представляют собой водород.
<111> Соединение в соответствии с любым из <101> - <110>, его соль или их гидрат, где R40 представляет собой C1-6 алкил, необязательно замещенный заместителем, выбранным из группы D2', где группа D2' состоит из C1-6 алкокси, 3-8-членного циклоалкила, 4-8-членной гетероциклической группы, циано, моно(C1-6 алкил)аминокарбонила, C2-7 алкилкарбонила и 4-8-членного гетероциклического карбонила.
<112> Соединение в соответствии с любым из <101> - <110>, его соль или их гидрат, где R40 представляет собой C1-6 алкил, необязательно замещенный заместителем, выбранным из группы D3', где группа D3' состоит из метокси, этокси, циклопропила, циано, этиламинокарбонила, н-пропиламинокарбонила, этилкарбонила, пиперидинокарбонила и 4-тетрагидропиранила.
<113> Соединение в соответствии с любым из <101> - <110>, его соль или их гидрат, где R40 представляет собой н-пропил, н-бутил, н-пентил, этилкарбонилметил, метоксиэтил, этоксиэтил, циклопропилметил или 4-тетрагидропиранилметил.
<114> Соединение в соответствии с любым из <101> - <113>, его соль или их гидрат, где n представляет собой целое число, равное 1.
<115> Соединение в соответствии с любым из <101> - <114>, его соль или их гидрат, где X1 представляет собой азот.
<117> Лекарственный препарат, содержащий соединение в соответствии с <101>, его соль или их гидрат.
<118> Ингибитор клеточной адгезии или ингибитор клеточной инфильтрации, содержащий соединение в соответствии с <101>, его соль или их гидрат.
<119> Терапевтическое или профилактическое средство при воспалительном заболевании кишечника, ревматоидном артрите, псориазе, рассеянном склерозе, астме или атопическом дерматите, содержащее соединение в соответствии с <101>, его соль или их гидрат.
<120> Терапевтическое или профилактическое средство при воспалительном заболевании кишечника, содержащее соединение в соответствии с <101>, его соль или их гидрат.
<121> Терапевтическое или профилактическое средство при язвенном колите или болезни Крона, содержащее соединение в соответствии с <101>, его соль или их гидрат.
Соединения по изобретению обладают превосходной ингибирующей активностью в отношении клеточной адгезии или клеточной инфильтрации и могут быть использованы в качестве терапевтических или профилактических средств при различных воспалительных заболеваниях и аутоиммунных заболеваниях, связанных с адгезией и инфильтрацией лейкоцитов, таких как воспалительное заболевание кишечника (в частности, язвенный колит или болезнь Крона), синдром раздраженной кишки, ревматоидный артрит, псориаз, рассеянный склероз, астма и атопический дерматит.
Лучший способ осуществления изобретения
Соединения (1) и (100) по изобретению могут быть получены способами, описанными далее. Однако следует учесть, что способы получения соединений по изобретению не ограничиваются описанными далее.
Соединение (1) по изобретению может быть получено следующими способами: способ A, способ B, способ C, способ D, способ E, способ N, способ P или способ V.
Соединение (1A), соединение (1) по изобретению, где X1 представляет собой азот, может быть получено следующими способами: способ F, способ G, способ H, способ K, способ M, способ Q или способ R.
Соединение (1B), соединение (1) по изобретению, где X1 представляет собой группу формулы CH, и соединение (100) по изобретению могут быть получены следующими способами: способ A, способ B, способ C, способ D, способ E, способ K, способ M, способ S, способ T или способ U.
Каждый из этих способов объяснен более подробно далее.
_
Способ A представляет собой способ получения соединения (1) по изобретению путем взаимодействия соединения (2) с алкилирующим агентом (3), карбонилирующим агентом (3) или сульфонилирующим агентом (3) в инертном растворителе, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, и, необязательно, с удалением любых защитных групп в полученном соединении, или способ получения соединения (100) по изобретению путем взаимодействия соединения (200) аналогичным способом.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, X1 и n имеют те же значения, что указаны выше, R10a, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что и соответствующие группы R10, R20, R21, R22, R23, R30, R31, R32 и R40, или представляют собой соответствующие группы R10, R20, R21, R22, R23, R30, R31, R32 и R40 с соответствующими заместителями на защищенных группах, и W1 является удаляемой группой, которая представляет собой хлор, бром или йод, алкилсульфонилокси, такой как метансульфонилокси или этансульфонилокси, галогеналкансульфонилокси, такой как трифторметансульфонилокси или нонафторбутансульфонилокси, или арилсульфонилокси, такой как бензолсульфонилокси или п-толуолсульфонилокси, из них хлор, бром, йод, метансульфонилокси, п-толуолсульфонилокси, нонафторбутансульфонилокси или трифторметансульфонилокси являются предпочтительными.
(Алкилирование)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, нитрилы, такие как ацетонитрил и изобутиронитрил, ароматические углеводороды, такие как толуол, бензол и ксилол, эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, или сульфоксиды, такие как диметилсульфоксид, а также смеси этих растворителей, из них диметилформамид, ацетонитрил, толуол или тетрагидрофуран являются предпочтительными.
Для используемого основания нет конкретных ограничений, в том случае, если оно может приводить к получению целевого соединения и не дает нежелательных побочных продуктов, и в данном случае конкретно могут быть указаны органические основания, такие как триэтиламин и пиридин, или неорганические основания, такие как карбонат калия, карбонат натрия, калий гидрокарбонат, гидрокарбонат натрия и карбонат цезия, из них карбонат калия или триэтиламин являются предпочтительными.
Если необходимо, для ускорения реакции в качестве добавки используется йодид натрия или йодид калия.
Температура реакции различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -30°C и 180°C, и, предпочтительно, между 0°C и 120°C.
Время реакции различается в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно равно от 0,5 до 100 часов, и, предпочтительно, составляет от 0,5 до 24 часов.
(Карбонилирование или сульфонилирование)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода, эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, органические основания, такие как пиридин, или вода, а также смеси этих растворителей, из них дихлорметан, тетрагидрофуран, диоксан, диметилформамид, пиридин или вода, или их смеси являются предпочтительными.
Для используемого основания нет конкретных ограничений в том случае, если оно может приводить к образованию целевого соединения и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны органические основания, такие как триэтиламин и пиридин, или неорганические основания, такие как карбонат калия, карбонат натрия, гидрокарбонат калия, гидрокарбонат натрия, карбонат цезия и гидроксид натрия, из них карбонат калия или триэтиламин являются предпочтительными.
В качестве добавки для ускорения взаимодействия, если необходимо, используется 4-диметиламинопиридин.
Температура реакции различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -70°C и 120°C, и, предпочтительно, между -70°C и 60°C.
Время реакции различно, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,5 до 48 часов, и, предпочтительно, от 0,5 до 12 часов.
Соединения (1) и (100) по изобретению могут быть выделены или очищены из полученной выше реакционной смеси описанным далее способом.
Когда R10 полученных соединений (1) и (100) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию с получением соединения по изобретению (1) или (1B) (соединение (1), где X1 представляет собой CH), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
Когда R10 полученного соединения (100) представляет собой необязательно замещенный 5-10-членный циклоалкил, соединение может быть подвергнуто гидрированию с получением соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH).
Гидрирование может быть выполнено следующим способом.
Конкретно, реакция гидрирования может проводиться с использованием катализатора на основе металла в инертном растворителе в атмосфере водорода или в присутствии водород-донорного реагента, в присутствии или в отсутствие кислоты.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны вода, спирты, такие как метанол и этанол, эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат, амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир, или органические кислоты, такие как уксусная кислота, или смеси этих растворителей, из них метанол, этанол, этилацетат, тетрагидрофуран, смешанный растворитель из метанола и тетрагидрофурана, или смешанный растворитель из этанола и тетрагидрофурана являются предпочтительными.
Не существует специальных ограничений в отношении используемого металлического катализатора, если он может обеспечивать получения целевого соединения и приводит к получению неотделяемых побочных продуктов, и конкретно могут быть указаны гетерогенные катализаторы на основе редких металлов, такие как палладий, гидроксид палладия, платина, оксид платины, родий, рутений и никель (предпочтительно, на носителе, таком как активированный уголь, оксид алюминия, оксид кремния или цеолит), и гомогенные комплексные катализаторы на основе металлов, такие как хлортрис(трифенилфосфин)родий(I) (комплекс Вилкенсона), из них гетерогенные катализаторы на основе редких металлов (особенно 5-10% палладий-активированный уголь или оксид платины, необязательно увлажненные водой) являются предпочтительными.
Число эквивалентов используемых катализаторов на основе металлов (включая носитель) будут разными, в зависимости от исходных продуктов, растворителя и реагентов, но обычно будут находиться в пропорции 0,05-10 и, предпочтительно, 0,05-3, выраженной в массовом соотношении по отношению к исходному продукту.
Для используемой кислоты нет конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны органические кислоты, такие как метансульфоновая кислота, трифторметансульфоновая кислота, уксусная кислота и трифторуксусная кислота, или неорганические кислоты, такие как хлористоводородная кислота и бромистоводородная кислота.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -10°C и 80°C, и, предпочтительно, между 0°C и 50°C.
Реакционное давление водорода будет также различным, в зависимости от исходных продуктов, растворителя и реагентов, но обычно составляет между 1 и 100 атмосфер, и, предпочтительно, составляет между 1 и 5 атмосфер.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,5 до 200 часов, и, предпочтительно, составляет от 0,5 до 100 часов.
При преобразовании полученного соединения в соль кислоты, преобразование может выполняться обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.

Способ B представляет собой способ получения соединения по изобретению (1) путем взаимодействия соединения (2) с ангидридом кислоты (4) в инертном растворителе, в присутствии или в отсутствие основания, и необязательно, с удалением любых защитных групп с полученного соединения, или способ получения соединения по изобретению (100) путем взаимодействия соединения (200) аналогичным образом.
На данной схеме R10, R20, R21, R22, R23, R30, R31, R32, R40, X1, n, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше. Также, R40b представляет собой группу, содержащую карбонил или сульфонил, которая является подходящей для получения R40 и может образовывать ангидрид кислоты. Заместители на R40b могут также быть защищены.
Этот способ также может быть осуществлен подобным образом на стадии карбонилирования или сульфонилирования описанного выше способа A.
Соединения по изобретению (1) и (100) могут быть выделены или очищены из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученных соединений (1) и (100) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1) или соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
Когда R10 полученного соединения (100) представляет собой необязательно замещенный 5-10-членный циклоалкил, соединение может быть подвергнуто гидрированию с получением соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH).
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
_

Способ C представляет собой способ получения соединения по изобретению (1) путем взаимодействия соединения (2) с альдегидом (5) или кетоном (5) в инертном растворителе, в присутствии восстановительного агента, в присутствии или в отсутствие кислоты, в присутствии или в отсутствие добавки, и, необязательно, с удалением любых защитных групп у полученного соединения, или способ получения соединения по изобретению (100) аналогичным образом путем взаимодействия соединения (200).
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, X1, n, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше. Также, A1 и A2 представляют собой группы, подходящие для получения R40. Заместители на A1 или A2 также могут быть защищены.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлопентан и тетрахлорид углерода, нитрилы, такие как ацетонитрил и изобутиронитрил, ароматические углеводороды, такие как толуол, бензол и хлорбензол, или спирты, такие как метанол и этанол, из них простые эфиры (в частности, тетрагидрофуран) и галогенированные углеводороды (в частности, дихлорпентан) являются предпочтительными.
Для используемого восстановительного агента нет конкретных ограничений, в том случае, если он может привести к получению целевого соединения и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны восстанавливающие агенты на основе бора, такие как триацетоксиборгидрид натрия, цианоборгидрид натрия и бор-пиридин, и катализатор на основе металла-газообразный водород, из них триацетоксиборгидрид натрия является предпочтительным.
Для используемой кислоты нет конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны органические кислоты, такие как уксусная кислота и трифторуксусная кислота, или кислоты Льюиса, такие как тетраизопропоксид титана и хлорид цинка, из них органические кислоты (в частности, уксусная кислота) являются предпочтительными.
Для используемой кислоты нет конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны молекулярные сита или сульфат магния, из них молекулярные сита 4Å являются предпочтительными.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -70°C и 120°C, и, предпочтительно, между 0°C и 50°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,1 до 200 часов, и, предпочтительно, от 0,1 до 24 часов.
В качестве дополнительной литературы, используемой в качестве ссылки, по осуществлению этого способа, может быть указана, но этим не ограничивается, статья Ahmed F. Abdel-Magid et al., J. Org. Chem.(1996), 61, 3849.
Соединения по изобретению (1) и (100) могут быть выделены или очищены из полученной выше реакционной смеси описанным далее способом.
Когда R10 полученного соединения (1) и (100) представляет собой необязательно замещенный 5-10-членный циклоалкенил, оно может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1) или соединения (1B) (соединение (1) где X1 представляет собой CH), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
Когда R10 полученного соединения (100) представляет собой необязательно замещенный 5-10-членный циклоалкил, соединение может быть подвергнуто гидрированию, с получением соединения (1B) (соединение (1) где X1 представляет собой CH) по изобретению.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования в различной последовательности.
Способ D представляет собой способ получения соединения по изобретению (1) путем взаимодействия соединения (2) с сопряженным карбонильным соединением (6) путем реакции Майкла в инертном растворителе, и, необязательно, с удалением защитных групп у полученного соединения, или способ получения соединения по изобретению (100) аналогичным образом путем взаимодействия соединения (200).
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, X1, n, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше. Также, Z1, Z2, Z3 и Z4 представляют собой группы, подходящие для получения R40. Заместители на Z1, Z2, Z3 и Z4 также могут быть защищены.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль и глицерин, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлопентан и тетрахлорид углерода, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, и ароматические углеводороды, такие как бензол, толуол и ксилол, из них галогенированные углеводороды (в частности, хлороформ) или простые эфиры (в частности, тетрагидрофуран) являются предпочтительными.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -30°C и 150°C, и, предпочтительно, между 0°C и 120°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,5 до 48 часов, и, предпочтительно, от 0,5 до 24 часов.
Соединения (1) и (100) по изобретению могут быть выделены или очищены из полученной выше реакционной смеси описанным далее способом.
Когда R10 полученных соединений (1) и (100) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1) или соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
Когда R10 полученного соединения (100) представляет собой необязательно замещенный 5-10-членный циклоалкил, соединение может быть подвергнуто гидрированию с получением соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH).
При преобразовании полученного соединения в соль кислоты, преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования в различной последовательности.
(Способ E)

Способ E представляет собой способ получения соединения по изобретению (1) путем взаимодействия соединения (2) с изоцианатным соединением (7) или замещенным аминокарбонилхлоридным соединением (7) в инертном растворителе, в присутствии или в отсутствие основания, и, необязательно, с удалением защитных групп в полученном соединении, или способ получения соединения по изобретению (100) путем взаимодействия соединения (200) аналогичным способом.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, X1, n, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше. Также, A3, A4 и A5 представляют собой группы, подходящие для получения R40. Заместители на A3, A4 и A5 могут также быть защищены.
Не существует специальных ограничений в отношении используемого растворителя, если он в большей или меньшей степени растворяет исходное соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлопентан и тетрахлорид углерода, ароматические углеводороды, такие как бензол, толуол и хлорбензол, и простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, из них дихлорметан или тетрагидрофуран являются предпочтительными.
Для используемого основания нет конкретных ограничений, в том случае, если он может привести к получению целевого соединения и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны органические основания, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4,3,0]нон-5-ен (DBN), 1,4-диазабицикло[2,2,2]октан (DABCO) и 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU), из них триэтиламин или пиридин являются предпочтительными.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -70°C и 100°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 1 до 24 часов.
Соединения по изобретению (1) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученных соединений (1) и (100) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1) или соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
Когда R10 полученного соединения (100) представляет собой необязательно замещенный 5-10-членный циклоалкил, соединение может быть подвергнуто гидрированию с получением соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH).
При преобразовании полученного соединения в соль кислоты, преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.

Способ F представляет собой способ получения соединения по изобретению (1A) (вышеуказанное соединение формулы (1), где X1 представляет собой азот) путем взаимодействия соединения (8) с соединением (9) (аминирование или амидирование) в инертном растворителе, в присутствии катализатора на основе палладия(0) или катализатора на основе меди, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, в атмосфере инертного газа или без него, и, необязательно, с удалением защитных групп у полученного соединения.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше. Также, W1a представляет собой хлор, бром или йод, или трифторметансульфонилокси группу.
(Реакция в присутствии катализатора на основе палладия(0))
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны амиды, такие как диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, ароматические углеводороды, такие как толуол, бензол, ксилол и мезитилен, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол и циклогексанол, нитрилы, такие как ацетонитрил и изобутиронитрил, или смеси этих растворителей, из них диметилформамид, толуол, ксилол, тетрагидрофуран, диоксан или диметоксиэтан являются предпочтительными.
Для используемого катализатора на основе палладия(0) нет конкретных ограничений, в том случае, если он может давать требуемое соединение и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)-дипалладий, бис(дибензилиденацетон)палладий, бис(три-трет-бутилфосфин)палладий и палладиевая чернь, или катализаторы на основе палладия(0), полученные в реакционной системе путем комбинирования палладиевых комплексов, которыми могут быть палладиевые(0) предшественники, указанные ниже, и различных лигандов, указанных ниже.
Для используемых различных палладиевых комплексов, которые могут использоваться в качестве палладиевых(0) предшественников, нет конкретных ограничений, в том случае, если они могут давать требуемое соединение и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны ацетат палладия, 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладий, дихлорбис(три-o-толилфосфин)палладий, дихлорбис-(трисциклогексилфосфин)палладий, и тому подобное.
Для используемых лигандов нет конкретных ограничений, в том случае, если они могут давать целевое соединение, и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP), 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (Xantphos), три-трет-бутилфосфин, три(4-метилфенил)фосфин, три-2-фурилфосфин, 2-(ди-трет-бутилфосфино)бифенил, 2-(дициклогексилфосфино)бифенил, трициклогексилфосфин, 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил, 1,1'-бис(дифенилфосфино)ферроцен, ди-трет-бутилфосфоний тетрафторборат и 1,3-бис(2,4,6-триметилфенил)имидазол-2-илиден.
Для используемого основания нет конкретных ограничений, в том случае, если оно может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны неорганические основания, такие как трет-бутоксид натрия, трет-бутоксид калия, трикалий фосфат, тринатрий фосфат, карбонат цезия, карбонат калия, карбонат натрия, бикарбонат цезия, гидрокарбонат калия, гидрокарбонат натрия, ацетат натрия, ацетат калия, ацетат цезия, фторид калия, фторид цезия, гидроксид натрия и гидроксид калия, или органические основания, такие как триэтиламин, 1,8-бис(диметиламино)нафталин, 1,4-диазабицикло[2,2,2]октан (DABCO) и 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU).
Для используемой добавки нет конкретных ограничений, в том случае, если она может привести к получению целевого соединения и не дает нежелаемых побочных продуктов, и, в данном случае, конкретно, могут быть указаны фторид лития, фторид натрия, хлорид лития, хлорид натрия, бромид лития, бромид натрия, 1,4,7,10,13,16-гексаоксациклооктадекан (18-Краун-6), 1,4,7,10,13-пентаоксациклопентадекан (15-Краун-5), тетрабутиламмоний фторид и тетрабутиламмоний бромид.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между 0°C и 150°C, и, предпочтительно, между 20°C и 110°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,1 до 100 часов, и составляет, предпочтительно, от 0,5 до 48 часов.
Когда реакцию осуществляют в атмосфере инертного газа, для используемого инертного газа нет конкретных ограничений в том случае, если он не ингибирует реакции на этой стадии, и, конкретно, им может быть газ аргон или азот.
В качестве дополнительной литературы, используемой в качестве ссылки, по осуществлению этого способа, может быть указана, но этим не ограничивается, статья D. Prim et al., Tetrahedron (2002), 58, 2041 и L. Buchwald et al., J. Organomet. Chem. (1999), 576, 125.
(Реакция в присутствии медного катализатора)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, ароматические углеводороды, такие как толуол, бензол, ксилол, мезитилен и нитробензол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв, или смеси этих растворителей, из них изопропанол, N-метилпирролидон, толуол и диметилформамид являются предпочтительными.
Для используемого медного катализатора нет конкретных ограничений, в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны медь (порошок), хлорид меди (I), хлорид меди (II), йодид меди (I), оксид меди (I), оксид меди (II), ацетат меди (II), пентагидрат сульфата меди (II), ацетилацетонат меди (II), тиоцианат меди (I) и тому подобное, из них медь (порошок) и хлорид меди (I) являются предпочтительными.
Для используемых лигандов нет конкретных ограничений, в том случае, если они могут давать целевое соединение и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны этиленгликоль, диэтиленгликоль, крезол, 2,6-диметилфенол, 1-нафтол, 2-нафтол, этилендиамин, N,N'-диметилэтилендиамин и диизопропиламин, из них этиленгликоль и этилендиамин являются предпочтительными.
Для используемого основания нет конкретных ограничений, в том случае, если оно может давать целевое соединение, и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны неорганические основания, такие как трет-бутоксид натрия, трет-бутоксид калия, трикалий фосфат, тринатрий фосфат, карбонат цезия, карбонат калия, карбонат натрия и гидрид натрия, или органические основания, такие как бис(триметилсилил)амид калия, из них карбонат калия и трикалий фосфат являются предпочтительными.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между 0°C и 250°C, и находится предпочтительно в области между 80°C и 150°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,1 до 100 часов, и составляет, предпочтительно, от 0,5 до 48 часов. Когда реакцию осуществляют в атмосфере инертного газа, для используемого инертного газа нет конкретных ограничений в том случае, если он не ингибирует реакции на этой стадии, и, конкретно, им может быть газ аргон или азот.
В качестве дополнительной литературы, используемой в качестве ссылки, по осуществлению этого способа, может быть указана, но этим не ограничивается, статья L. Buchwald et al., Org. Lett. (2002), 4, 581.
Соединение (1A) по изобретению может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1A) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения (1A) по изобретению, где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты, преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.

Способ G представляет собой способ получения соединения по изобретению (1A) (вышеуказанное соединения формулы (1), где X1 представляет собой азот) путем взаимодействия соединения (8) с соединением (10) в инертном растворителе, в присутствии катализатора на основе меди, в присутствии основания, в присутствии или в отсутствие кислорода, и, необязательно, с удалением защитных групп у полученного соединения.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, R10a, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше. M1a представляет собой группу, представленную формулой -B(OH)2.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода, ароматические углеводороды, такие как толуол, бензол и ксилол, или простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, или смеси этих растворителей, из них галогенированные углеводороды (в частности, дихлорметан) являются предпочтительными.
Для используемого катализатора на основе меди нет конкретных ограничений, в том случае, если он может давать требуемое соединение и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны ацетат меди(II), ацетат меди(I), трифторметансульфонат меди(II) и изобутират меди(II), из них ацетат меди(II) является предпочтительным.
Для используемого основания нет конкретных ограничений, в том случае, если оно может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны органические основания, такие как триэтиламин, пиридин, 2,6-лутидин, N-метилморфолин и 1,8-диазабицикло[5,4,0]ундец-7-ен, из них триэтиламин или пиридин являются предпочтительными.
Для используемой добавки для ускорения реакции нет конкретных ограничений, в том случае, если она может давать целевое соединение, и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны молекулярные сита, пиридин-N-оксид и 2,2,6,6-тетраметилпиперидиноокси, из них молекулярные сита (в частности, 4Å) являются предпочтительными.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между 0°C и 80°C, и, предпочтительно, между 10°C и 50°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 1 до 100 часов, и, предпочтительно, от 24 до 48 часов.
Соединения по изобретению (1A) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1A) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1A), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты, преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
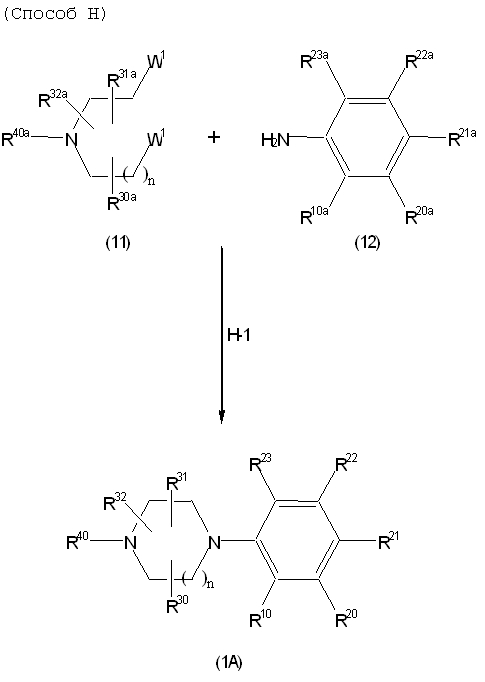
Способ H представляет собой способ получения соединения по изобретению (1A) (соединение вышеуказанной формулы (1), где X1 представляет собой азот) путем взаимодействия соединения (11) с соединением (12) в инертном растворителе или в отсутствие растворителя, в атмосфере инертного газа или без него, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, и, необязательно, с удалением защитных групп у полученного соединения.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, W1, R10a, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв, ароматические углеводороды, такие как бензол, хлорбензол, 1,2-дихлорбензол, толуол и ксилол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, и амиды, такие как диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, из них бутанол, 1,2-дихлорбензол, толуол, ксилол, тетрагидрофуран, диоксан, диметилформамид или гексаметилфосфортриамид являются предпочтительными.
Когда растворитель не используется, реакцию осуществляют с помощью микроволнового реактора или с окисью алюминия или силикагелем в качестве носителя.
Когда реакцию осуществляют в атмосфере инертного газа, для используемого инертного газа нет конкретных ограничений в том случае, если он не ингибирует реакции на этой стадии, и, конкретно, им может быть газ аргон или азот.
Для используемого основания нет конкретных ограничений, в том случае, если оно может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны органические основания, такие как триэтиламин, пиридин, диизопропилэтиламин, 4-диметиламинопиридин, DBU и DABCO, или неорганические основания, такие как карбонат калия, карбонат натрия и гидрокарбонат натрия.
Для используемой для ускорения взаимодействия добавки нет конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны йодиды щелочных металлов, такие как йодид натрия и йодид калия.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между 0°C и 270°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,5 до 100 часов.
Соединения по изобретению (1A) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1A) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1A), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
_

Способ K представляет собой способ получения соединения по изобретению (1A) (соединение формулы (1), где X1 представляет собой азот) путем взаимодействия соединения (13) с реагентом на основе металлического бора (14) или реагентом на основе металлического олова (14) (реакция Suzuki или реакция Stille) в инертном растворителе, в присутствии палладиевого(0) катализатора, в атмосфере инертного газа или без него, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, и, необязательно, с удалением защитных групп у полученного соединения, или способ получения соединения по изобретению (100) путем взаимодействия соединения (190) подобным образом.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, W1a, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше. R10b представляет собой необязательно замещенный 5-10-членный циклоалкенил, где заместитель может быть защищен и имеет те же значения, что и заместитель в выражении "необязательно замещенный 5-10-членный циклоалкенил" для R10.
Также, M1b представляет собой группу B(OE10c)2 или Sn(E10b)3, где E10c представляет собой C1-6 алкил или два из E10c соединены вместе с образованием C2-3 алкилена, необязательно замещенного метилом, и E10b представляет собой C1-6 алкил.
Этот способ будет различаться в зависимости от природы M1b.
(Реакция конденсации Suzuki)
Этот способ представляет собой способ получения соединения по изобретению (1A) (соединение формулы (1), где X1 представляет собой азот) путем взаимодействия соединения (13) с соединением (14) в инертном растворителе, в присутствии палладиевого(0) катализатора, в присутствии основания, в присутствии или в отсутствие добавки, в атмосфере инертного газа или без него, и, необязательно, с удалением защитных групп у полученного соединения, или способ получения соединения (100) по изобретению путем взаимодействия соединения (190) подобным образом.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, ароматические углеводороды, такие как толуол, бензол, ксилол и мезитилен, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв, нитрилы, такие как ацетонитрил и изобутиронитрил, сульфоксиды, такие как диметилсульфоксид и сульфолан, или воду, или смеси этих растворителей, из них диметилформамид, толуол, ксилол, тетрагидрофуран, диоксан, диметоксиэтан или воду, или смеси этих растворителей, являются предпочтительными.
Для используемого катализатора на основе палладия(0) нет конкретных ограничений, в том случае, если он может давать требуемое соединение, и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)-дипалладий, бис(дибензилиденацетон)палладий, бис(три-трет-бутилфосфин)палладий, палладиевая чернь и тому подобное, или палладиевые(0) катализаторы, полученные в реакционной системе путем комбинирования палладиевых комплексов, которыми могут быть палладиевые(0) предшественники, указанные ниже, и различных лигандов, указанных ниже.
Для используемых различных палладиевых комплексов, которые могут использоваться в качестве палладиевых(0) предшественников, нет конкретных ограничений, в том случае, если они могут давать требуемое соединение, и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны ацетат палладия, 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладий, дихлорбис(три-o-толилфосфин)палладий, дихлорбис(трисциклогексилфосфин)палладий и тому подобное.
Для используемых лигандов нет конкретных ограничений, в том случае, если они могут давать целевое соединение, и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны трифенилфосфин, три-трет-бутилфосфин, три(4-метилфенил)фосфин, 2-(ди-трет-бутилфосфино)бифенил, 2-(дициклогексилфосфино)бифенил, трициклогексилфосфин, 1,1'-бис(дифенилфосфино)ферроцен и ди-трет-бутилфосфоний тетрафторборат.
Для используемого основания нет конкретных ограничений, в том случае, если оно может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны неорганические основания, такие как трикалий фосфат, тринатрий фосфат, карбонат цезия, карбонат калия, карбонат натрия, бикарбонат цезия, гидрокарбонат калия, гидрокарбонат натрия, ацетат натрия, гидроксид бария, гидроксид калия, фторид калия и фторид цезия, алкоксиды металлов, такие как этоксид натрия и натрий-трет-бутоксид, ацетаты щелочных металлов, такие как ацетат натрия или ацетат калия, или органические основания, такие как триэтиламин.
Для используемой добавки нет конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны хлорид лития, хлорид натрия, бромид лития, бромид натрия и тетрабутиламмоний бромид.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между 0°C и 150°C, и находится, предпочтительно, между 20°C и 120°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,5 до 100 часов, и, предпочтительно, от 0,5 до 48 часов. Когда реакцию осуществляют в атмосфере инертного газа, для используемого инертного газа нет конкретных ограничений в том случае, если он не ингибирует реакции на этой стадии, и, конкретно, им может быть газ аргон или азот.
В качестве дополнительной литературы, используемой в качестве ссылки, по осуществлению этого способа, могут быть указаны, но этим не ограничиваются, статьи S.P. Stanforth, Tetrahedron (1998), 54, 263, и N. Miyaura, A. Suzuki, Chem. Rev. (1995), 95, 2457.
(Реакция конденсации Stille)
Этот способ представляет собой способ получения соединения по изобретению (1A) (соединение формулы (1), где X1 представляет собой азот) путем взаимодействия соединения (13) с соединением (14) в инертном растворителе, в присутствии палладиевого(0) катализатора, в присутствии или в отсутствие добавки, в атмосфере инертного газа или без него, и, необязательно, с удалением защитных групп у полученного соединения, или способ получения соединения по изобретению (100) путем взаимодействия соединения (190) подобным же образом.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны амиды, такие как диметилформамид, диметилацетамид, гексаметилфосфортриамид и N-метилпирролидон, ароматические углеводороды, такие как толуол, бензол, ксилол и мезитилен, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, или смеси этих растворителей, из них диметилформамид, толуол, ксилол, тетрагидрофуран, диоксан и диметоксиэтан являются предпочтительными.
Для используемого катализатора на основе палладия(0) нет конкретных ограничений, в том случае, если он может давать требуемое соединение и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)-дипалладий, бис(дибензилиденацетон)палладий, бис(три-трет-бутилфосфин)палладий, палладиевая чернь и тому подобное, или палладиевые(0) катализаторы, полученные в реакционной системе путем комбинирования палладиевых комплексов, которыми могут быть палладиевые(0) предшественники, указанные ниже, и различных лигандов, указанных ниже.
Для используемых различных палладиевых комплексов, которые могут использоваться в качестве палладиевых(0) исходных продуктов, нет конкретных ограничений, в том случае, если они могут давать требуемое соединение и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны ацетат палладия, 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладий, дихлорбис(три-o-толилфосфин)палладий, дихлорбис(ацетонитрил)палладий и дихлорбис-(трисциклогексилфосфин)палладий.
Для используемых лигандов нет конкретных ограничений, в том случае, если они могут давать целевое соединение и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны трифенилфосфин, три-трет-бутилфосфин, три(4-метилфенил)фосфин, 2-(ди-трет-бутилфосфино)бифенил, 2-(дициклогексилфосфино)бифенил, трициклогексилфосфин, три-2-фурилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, ди-трет-бутилфосфоний тетрафторборат и трифениларсин.
Для используемой добавки нет конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны фторид цезия, фторид калия, хлорид лития, бромид лития, бромид натрия, тетрабутиламмоний фторид, йодид меди, оксид меди и хлорид цинка.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между 0°C и 150°C, и составляет, предпочтительно, между 20°C и 110°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,1 до 100 часов, и, предпочтительно, от 0,5 до 48 часов.
Когда реакцию осуществляют в атмосфере инертного газа, для используемого инертного газа нет конкретных ограничений в том случае, если он не ингибирует реакции на этой стадии, и, конкретно, им может быть газ аргон или азот.
В качестве дополнительной литературы, используемой в качестве ссылки, по осуществлению этого способа, может быть указана, но этим не ограничивается, статьи S.P. Stanforth, Tetrahedron (1998), 54, 263, и J.K. Stille, Angew. Chem. Int. Ed. Engl. (1986), 25, 508.
Соединения по изобретению (1A) и (100) могут быть выделены или очищены из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученных соединений (1A) и (100) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединения могут быть подвергнуты гидрированию, как описано выше в способе A, с получением соединения по изобретению (1A) или соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
Когда R10 полученного соединения (100) представляет собой необязательно замещенный 5-10-членный циклоалкил, соединение может быть подвергнуто гидрированию с получением соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH).
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.

Способ M представляет собой способ получения соединения по изобретению (1A) (соединение формулы (1), где X1 представляет собой азот) путем взаимодействия соединения (16) с реагентом на основе металлического бора (15) или реагентом на основе металлического олова (15) (реакция Suzuki или реакция Stille) в инертном растворителе, в присутствии палладиевого(0) катализатора, в атмосфере инертного газа или без него, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, и, необязательно, с удалением защитных групп у полученного соединения, или способ получения соединения по изобретению (100) путем взаимодействия соединения (180) подобным образом.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, W1a, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше. R10b также имеет значения, определенные выше.
M1 представляет собой группу B(OE10a)2 или Sn(E10b)3, где E10a представляет собой водород, C1-6 алкил или два из E10a соединены вместе с образованием C2-3 алкилена, необязательно замещенного метилом, и E10b представляет собой C1-6 алкил.
Этот способ может быть осуществлен методом, подобным способу K, описанному выше.
Соединения по изобретению (1A) и (100) могут быть выделены или очищены из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1A) и (100) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1A) или соединение по изобретению (1B) (соединение (1), где X1 представляет собой CH), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
Когда R10 полученного соединения (100) представляет собой необязательно замещенный 5-10-членный циклоалкил, соединение может быть подвергнуто гидрированию, с получением соединения по изобретению (1B) (соединение (1), где X1 представляет собой CH).
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.

Способ N представляет собой способ получения соединения по изобретению (1) путем взаимодействия соединения (17) с галогенирующим агентом в инертном растворителе, в присутствии или в отсутствие добавки, в присутствии или в отсутствие инертного газа, с получением соединения, галогенированного в бензольном кольце, к которому присоединен R10a (стадия N-1-1), и, необязательно, с удалением защитных групп у полученного соединения.
Альтернативно, (стадия N-1-1) может следовать после взаимодействия галогенированного соединения с соединением, которое может ввести желаемый заместитель, или его реакционно активным производным, в присутствии катализатора на основе переходного металла, в инертном растворителе, в присутствии или в отсутствие добавки, в присутствии или в отсутствие инертного газа (стадия N-1-2), и, необязательно, с удалением любой защитной группы у полученного соединения, с получением соединения по изобретению (1).
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, X1, R10a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше. Также, по меньшей мере один из R20b, R21b, R22b и R23b представляет собой водород, и остальные группы представляют собой группы, соответствующие R20a, R21a, R22a и R23a, соответственно.
(Стадия N-1-1)
Эта стадия представляет собой стадию галогенирования.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв, алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир, простые эфиры, такие как диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлопентан и тетрахлорид углерода, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид, и органические кислоты, такие как уксусная кислота, из них спирты (в частности, метанол) являются предпочтительными.
Для используемого галогенирующего агента нет конкретных ограничений, в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны хлор (Cl2), бром (Br2), йод (I2), N-хлорсукцинимид, N-бромсукцинимид, N-йодсукцинимид, йод монохлорид и тионилхлорид, из них хлор, бром и йод являются предпочтительными.
В качестве используемых добавок могут быть указаны ацетат щелочного металла, такой как ацетат натрия и ацетат калия, из них ацетат натрия является предпочтительным.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -20°C и 100°C, и, предпочтительно, между 20°C и 50°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,25 до 48 часов, и, предпочтительно, от 12 до 24 часов.
Соединение по изобретению (1) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1) представляет собой необязательно замещенный 5-10-членный циклоалкенил, гидрирование, как описано выше в способе A, может быть осуществлено с подбором реакционных условий для того, чтобы избежать восстановления введенного галогена, с получением соединения по изобретению (1), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
(Стадия N-1-2)
На этой стадии, галогенированное соединение, полученное на стадии N-1-1, преобразуют в соединение, имеющее желаемый заместитель, в присутствии катализатора на основе переходного металла, и защитные группы у полученного соединения необязательно удаляют способом, описанным далее, с получением соединения по изобретению (1).
Арилгалогенидное соединение, полученное на стадии N-1-1, может быть затем подвергнуто реакции поперечного связывания с соединением, которое позволяет ввести желаемый заместитель, или его реакционно активным производным, в присутствии переходного металла, такого как палладий, медь, никель, цинк или цирконий, или катализатора, содержащего комбинацию любых этих металлов с лигандом. Типом реакции образования связи может быть образование связи углерод-углерод, образование связи углерод-азот или образование связи углерод-кислород. Способ F и способ K представляют собой примеры таких реакций, и в качестве дополнительной литературы, используемой в качестве ссылки, по проведению этой стадии, могут быть указаны, но этим не ограничиваются, статьи John F. Hartwig, Angew. Chem. Int. Ed., (1998), 37, 2046; Steven P. Nolan, et al., Org. Lett. (2001), 3, 10, 1511; Stephen L. Buchwald and Gregory C. Fu, et al., Org. Lett. (2000), 2, 12, 1729; Stepfen P. Stanforth, Tetrahedron (1998), 54, 263; Karen, E. et. al., J.A.C.S. (2001), 123, 10770; Stephen L. Buchwald, et al., J.A.C.S. (1999), 121, 4369; D.M. Tschaen and R. Desmond, et al., Synth. Comm. (1994), 24, 6, 887; John F. Hartwig, et al., J.A.C.S. (2001), 123, 8410; Gregory C. Fu, et al., Org. Lett. (2001), 3, 26, 4295; Damien Prim, et al., Tetrahedron (2002), 58, 2041.
Например, введение морфолина в качестве заместителя в процессе реакции образования связи углерод-азот может быть выполнено следующим способом.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны ароматические углеводороды, такие как бензол, толуол и ксилол, простые эфиры, такие как диоксан, диметоксиэтан и тетрагидрофуран, и амиды, такие как диметилформамид, из них ксилол является предпочтительным.
Для используемой добавки нет конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и добавка может быть, соответственно, выбрана среди палладиевых катализаторов, таких как ацетат паладия(II), оснований, таких как трет-бутоксид калия, трет-бутоксид натрия и карбонат цезия, и фосфинов, таких как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил и три-трет-бутилфосфоний тетрафторборат, из них комбинация ацетат паладия(II), трет-бутоксид натрия и тетрафторборат три-трет-бутилфосфония являются предпочтительными.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между 50°C и 200°C, и, предпочтительно, между 70°C и 150°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,5 до 72 часов, и, предпочтительно, от 2 до 24 часов.
Соединения по изобретению (1) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
(Способ Р)
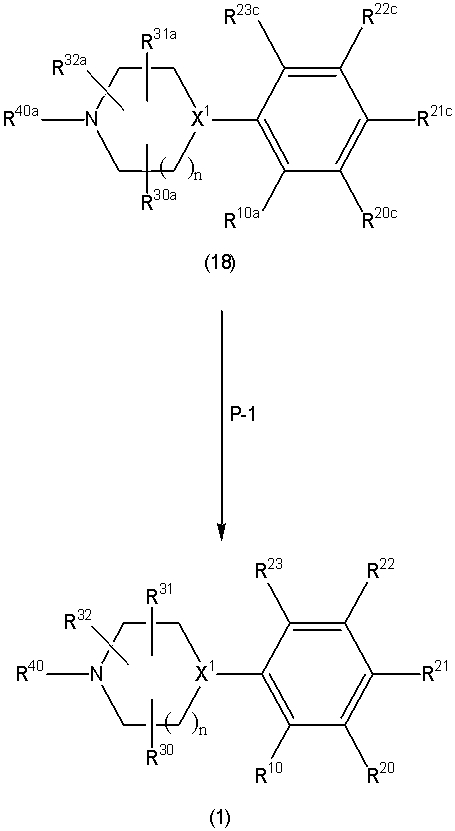
Способ P представляет собой способ получения соединения по изобретению (1) путем взаимодействия соединения (18) с трифторметансульфонилирующим агентом, в инертном растворителе, с получением соединения, где фенольный гидроксил был трифторметансульфонилирован (стадия P-1-1), и, необязательно, с удалением защитных групп у полученного соединения, или, альтернативно, после (стадии P-1-1) может следовать взаимодействие с соединением, которое может вводить желаемый заместитель в фенилтрифлатное соединение, или с его реакционноспособным производным (стадия P-1-2), и, необязательно, удаление защитных групп у полученного соединения с получением соединения по изобретению (1).
Этот способ может быть осуществлен, если в бензольном кольце, к которому присоединен R10a, имеется фенольная гидроксильная группа.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, X1, R10a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше. Кроме того, один из R20c, R21c, R22c и R23c представляет собой фенольную гидроксильную группу, тогда как остальные группы представляют собой R20a, R21a, R22a и R23a, соответственно.
(Стадия P-1-1)
Эта стадия может быть проведена способом, аналогичным способу сульфонилирования, описанного выше в способе A или способе B. Трифторметансульфонилирование может быть заменено на нонафторбутансульфонилирование или толуолсульфонилирование.
Соединение по изобретению (1) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
(Стадия P-1-2)
Это стадия преобразования трифторметансульфонилокси группы у соединения, полученного на стадии P-1-1, в желаемый заместитель.
Эта стадия может быть проведена способом, аналогичным описанному выше способу N-1-2. В качестве дополнительной литературы, используемой в качестве ссылки, по проведению этой стадии, может быть указана, но этим не ограничивается, статья Kurt Ritter, Synthesis, (1993), 735.
Соединение по изобретению (1) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты, преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
(Способ Q)
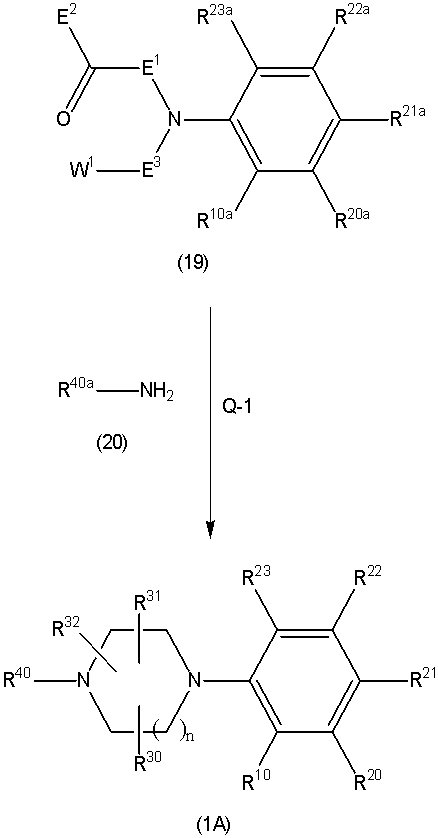
Способ Q представляет собой способ получения соединения (1A) по изобретению (соединение формулы (1), где X1 представляет собой азот), путем взаимодействия соединения (19) и соединения (20) в инертном растворителе, в присутствии восстановительного агента, в присутствии или в отсутствие кислоты, в присутствии добавки, и, необязательно, с удалением защитных групп у полученного соединения.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, W1, R10a, R20a, R21a, R22a, R23a и R40a имеют те же значения, что указаны выше. Также, E1, E2 и E3 представляют собой группы, подходящие для получения желаемой группы формулы:

Заместители у E1, E2 или E3 могут необязательно быть замещены.
Этот способ может быть выполнен способом, аналогичным описанному выше способу C.
Соединение по изобретению (1A) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1A) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1A), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
(Способ R)

Способ R представляет собой способ получения соединения (1A) по изобретению (соединение формулы (1), где X1 представляет собой азот) путем взаимодействия соединения (21) с основанием в инертном растворителе, и, необязательно, с удалением защитных групп у полученного соединения.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, W1, R10a, R20a, R21a, R22a, R23a и R40a имеют те же значения, что указаны выше. Кроме того, E4, E5 и E6 представляют собой группы, подходящие для получения желаемой группы формулы:

Заместители у E4, E5 или E6 могут, необязательно, быть замещены.
Этот способ может быть выполнен способом, аналогичным описанному выше способу A.
Соединения по изобретению (1A) может быть выделено или очищено из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1A) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1A), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
(Способ S)

Способ S представляет собой способ получения соединения по изобретению (1B) (соединение формулы (1), где X1 представляет собой CH) путем осуществления взаимодействия катализатора на основе палладия(0), соединения (22) и соединения (9) в инертном растворителе, затем гидрирования продукта и, необязательно, удаления защитных групп соединения (способ S-1), или способ получения соединения по изобретению (100) путем осуществления взаимодействия соединений (22) и (9) аналогичным способом, и, необязательно, удаления защитных групп полученного соединения (способ S-2), и, если необходимо, последующего преобразования в соединение по изобретению (1B) с помощью гидрирования (способ S-3).
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, W1a, M1b, R10a, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше.
Этот способ может быть выполнен аналогично способу K, описанному выше, с проведением последующей реакции гидрирования аналогично вышеуказанному способу A.
Соединения по изобретению (1B) и (100) могут быть выделены или очищены из полученной выше реакционной смеси способом, описанным далее.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, после взаимодействия между соединением (22) и соединением (9) могут быть осуществлены стадия получения соли и стадия гидрирования, в различной последовательности.
(Способ T)

Способ T представляет собой способ получения соединения по изобретению (1B) (соединение формулы (1), где X1 представляет собой CH) путем взаимодействия соединения (24) и соединения (25) в инертном растворителе, в присутствии катализатора на основе палладия(0), и затем гидрирования продукта и, необязательно, удаления защитных групп у полученного соединения (способ T-1), или способ получения соединения по изобретению (100) путем взаимодействия аналогичным способом соединений (24) и (25) и, необязательно, удаления защитных групп полученного соединения (способ T-2), и, если необходимо, последующего преобразования в соединение по изобретению (1B) с помощью гидрирования (способ T-3).
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, W1a, M1, R10b, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше.
Этот способ может быть выполнен аналогично способу K, указанному выше, с проведением последующей реакции гидрирования аналогично вышеуказанному способу A.
Соединения по изобретению (1B) и (100) могут быть выделены или очищены из полученной выше реакционной смеси способом, описанным далее.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, после взаимодействия между соединением (24) и соединением (25) могут быть осуществлены стадия получения соли и стадия гидрирования, в различной последовательности.
(Способ U)

Способ U представляет собой способ получения соединения по изобретению (1B) (соединение формулы (1), где X1 представляет собой CH) путем взаимодействия соединения (26) с соединением (27) (то есть, литиевым реагентом или реагентом Гриньяра) в инертном растворителе, с получением аддукта (170) (стадия U-1-1), и последующего восстановления гидроксила в бензольном кольце полученного аддукта (170) (стадия U-1-2), и, необязательно, удаления защитных групп, или способ получения соединения по изобретению (100) путем взаимодействия аналогичным способом с получением аддукта (170) (стадия U-1-1), последующей дегидратации гидроксила аддукта (170) в присутствии или в отсутствие кислоты (стадия U-1-3), и, если необходимо, дополнительного удаления защитных групп.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, n, R10b, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше. M2 представляет собой литий или галогенид магния.
(Стадия U-1-1)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, из них тетрагидрофуран является предпочтительным.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -80°C и 30°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,25 до 6 часов.
(Стадия U-1-2)
Эта стадия может быть проведена с помощью восстановления, аналогично гидрированию, описанному в способе A выше, или с помощью восстановления, используя описанный здесь гидрид триалкилсилила, хотя нет ограничений для этих способов.
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в случае использования восстановительной реакции, могут быть указаны гидрид триалкилсилила, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода (в частности, дихлорметан).
Для используемых восстанавливающих агентов нет конкретных ограничений, в том случае, если они могут давать целевое соединение и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны триалкилсилилгидриды, такие как триэтилсилилгидрид и триизопропилсилилгидрид, из них триэтилсилилгидрид является предпочтительным.
Для используемых добавок нет конкретных ограничений, в том случае, если они могут давать целевое соединение и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны галогензамещенные уксусные кислоты, такие как трифторуксусная кислота, и кислоты Льюиса, такие как трифторид бора.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -70°C и 50°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,5 до 48 часов.
(Стадия U-1-3)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакции на этой стадии, и, конкретно, в данном случае могут быть указаны простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, ароматические углеводороды, такие как толуол, бензол и ксилол, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода, вода, и смешанные растворители, или без растворителя.
Для используемых восстанавливающих агентов нет конкретных ограничений, в том случае, если они могут давать целевое соединение и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны триалкилсилилгидриды, такие как гидрид триэтилсилилгидрид и триизопропилсилилгидрид, из них триэтилсилилгидрид является предпочтительным, и тетрагидрофуран, толуол, дихлорметан, хлороформ или вода являются предпочтительными.
Для используемых кислотных добавок нет конкретных ограничений, в том случае, если они могут давать целевое соединение и не дают нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны галогензамещенные уксусные кислоты, такие как трифторуксусная кислота, кислоты Льюиса, такие как трифторид бора, органические сульфоновые кислоты, такие как толуолсульфоновая кислота и камфорсульфоновая кислота, и неорганические кислоты, такие как хлористоводородная кислота и бромид водорода.
Температура реакции будет различна, в зависимости от исходных продуктов, растворителя и реагентов, но обычно находится в области между -80°C и 180°C.
Время реакции будет различным, в зависимости от исходных продуктов, растворителя, реагентов и температуры реакции, но обычно составляет от 0,25 до 24 часов.
Соединения по изобретению (1B) и (100) могут быть выделены или очищены из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1B) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1B), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
(Способ V)
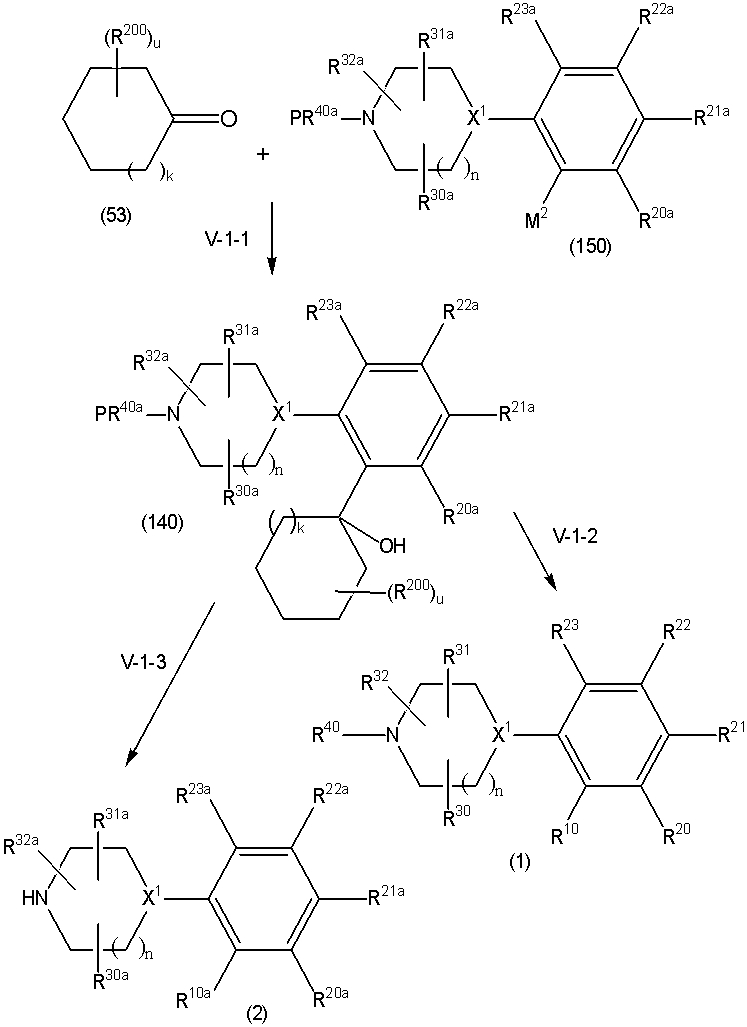
Способ V представляет собой способ получения соединения по изобретению (1) путем взаимодействия соединения (53) с соединением (150) (то есть, литиевым реагентом или реагентом Гриньяра) в инертном растворителе, с получением аддукта (140) (стадия V-1-1), и затем, если необходимо, восстановления или дегидратации гидроксила в бензольном кольце полученного аддукта (140) (стадия V-1-2), и, необязательно, удаления защитных групп, или способ получения соединения (2) путем осуществления взаимодействия аналогичным способом, с получением аддукта (140) (стадия V-1-1), далее, если необходимо, восстановления или дегидратации гидроксила в бензольном кольце полученного аддукта (140) (стадия V-1-3), и последующего удаления защитных групп.
На данной схеме, R10, R20, R21, R22, R23, R30, R31, R32, R40, X1, n, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше. M2 представляет собой литий или галогенид магния. R200 имеет те же значения, что и заместители, входящие в указанную выше группу A1, или представляет собой заместители, и заместители, которые защищены. u равно целому числу 0, 1, 2, 3, 4 или 5. k равно целому числу 0, 1, 2, 3, 4 или 5. PR40a имеет те же значения, что и вышеуказанный R40a, или представляет собой защитную группу для амино (предпочтительно, трет-бутоксикарбонил или бензил).
Этот способ может быть выполнен аналогично вышеуказанному способу U, с проведением последующей реакции гидрирования, описанной в способе A.
Соединение по изобретению (1) и соединение (2) могут быть выделены или очищены из полученной выше реакционной смеси способом, описанным далее.
Когда R10 полученного соединения (1) представляет собой необязательно замещенный 5-10-членный циклоалкенил, соединение может быть подвергнуто гидрированию, как описано выше в способе A, с получением соединения по изобретению (1), где R10 представляет собой 5-10-членный циклоалкил, необязательно замещенный соответствующим заместителем.
При преобразовании полученного соединения в соль кислоты преобразование может быть осуществлено обычным способом. Если необходимо, могут быть осуществлены стадии получения соли и стадии гидрирования, в различной последовательности.
Удаление защитной(ых) группы(групп) будет зависеть от их типа, и удаление может быть выполнено следующим способом, в соответствии с методами, хорошо известными в области органической синтетической химии, такими как метод, описанный, например, в статьях T.W. Greene (Protective Groups in Organic Synthesis) или John Wiley & Sons: J.F.W. McOmis, (Protective Groups in Organic Chemistry), Plenum Press.
Когда аминозащитная группа представляет собой необязательно замещенную силильную группу, такую как триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил или трет-бутилдифенилсилил, она обычно может быть удалена путем обработки соединением, образующим анион фторида, таким как фторид тетрабутиламмония, фтористоводородная кислота, фтористоводородная кислота-пиридин или фторид калия.
Для используемого инертного растворителя нет конкретных ограничений, в том случае, если он не ингибирует реакцию, и, например, предпочтительными являются простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля.
Для температуры реакции и времени реакции нет конкретных ограничений, однако обычно температура реакции находиться в области между 0°C и 50°C, и время реакции находиться в области между от 10 до 18 часов.
Когда аминозащитная группа представляет собой необязательно замещенную алифатическую ацильную группу, необязательно замещенную ароматическую ацильную группу, необязательно замещенную алкоксикарбонильную группу или замещенную метиленовую группу, которая образует основание Шиффа, она может быть удалена обработкой кислотой или основанием в присутствии водного растворителя.
Для используемой кислоты в данной реакции нет конкретных ограничений в том случае, если она представляет собой кислоту, которую обычно используют для удаления аминозащитной группы, и например, представляет собой неорганическую кислоту, такую как бромистоводородная кислота, хлористоводородная кислота, серная кислота, перхлорная кислота, фосфорная кислота или азотная кислота, или органическую кислоту, такую как трифторуксусная кислота и трифторметансульфоновая кислота, из них хлористоводородная кислота или трифторуксусная кислота являются предпочтительными.
Для используемого основания в данной реакции нет конкретных ограничений в том случае, если оно представляет собой основание, которое обычно используют для удаления аминозащитной группы, однако существуют предпочтительно используемые соли щелочных металлов карбоновой кислоты, такие как карбонат лития, карбонат натрия и карбонат калия; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды металлов, такие как метоксид лития, метоксид натрия, этоксид натрия и калий-трет-бутоксид; и аммиачные смеси, такие как водный раствор аммиака и концентрированный аммиак-метанол.
Используемым в реакции растворителем может быть, например, спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; вода; или смесь воды и любого из вышеуказанных растворителей, из них спирты (наиболее предпочтительно этанол) являются предпочтительными.
Температура реакции и время реакции будут меняться, в зависимости от используемого исходного соединения, растворителя и кислоты или основания, и не являются конкретно ограниченными, однако для ингибирования побочных продуктов температура реакции будет обычно находиться в области 0°C и 150°C, и время реакции будет обычно находиться в области от 1 до 10 часов.
Когда аминозащитная группа представляет собой необязательно замещенную аралкильную группу или необязательно замещенную аралкилоксикарбонильную группу, способ взаимодействия с восстанавливающим агентом в инертном растворителе (предпочтительно, каталитическое восстановление при обычной температуре в присутствии катализатора) или способ удаления путем окисления является обычно предпочтительным.
Для инертного растворителя, используемого для удаления способом каталитического восстановления, нет конкретных ограничений в том случае, если он является инертным по отношению к реакции, и например, он представляет собой алифатический углеводород, такой как гексан, гептан, лигроин или петролейный эфир; ароматический углеводород, такой как толуол, бензол или ксилол; простой эфир, такой как метилацетат, этилацетат, пропилацетат, бутилацетат или диэтилкарбонат; простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; органическую кислоту, такую как уксусная кислота; воду; или смесь любых этих растворителей с водой, из них спирты, простые эфиры, органические кислоты и вода (наиболее предпочтительно, спирты и органические кислоты) являются предпочтительными.
Используемый для удаления путем каталитического восстановления катализатор представляет собой, предпочтительно, палладий-углерод, никель Ренея, оксид платины, платиновую чернь, оксид родия-алюминий, трифенилфосфинхлорид-родий или сульфат палладия-барий.
Для величины давления нет конкретных ограничений, однако оно обычно находиться в области от 1 до 10 атмосфер.
Температура реакции и время реакции будут зависеть от исходных продуктов, катализатора и вводимого растворителя, однако, обычно температура реакции будет находиться в области между 0°C и 100°C, и время реакции будет находиться в области между 5 минутами и 72 часами.
Для инертного растворителя, используемого для удаления окислением, нет конкретных ограничений, при условии, что он не участвует в реакции, однако содержащие воду органические растворители являются предпочтительными. Такие органические растворители включают, например, галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода; нитрилы, такие как ацетонитрил; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; и сульфоксиды, такие как диметилсульфоксид и сульфолан, из них галогенированные углеводороды, простые эфиры или сульфоксиды (наиболее предпочтительно, галогенированные углеводороды и сульфоксиды) являются предпочтительными.
Для окислительного агента, используемого в этой реакции, нет конкретных ограничений в том случае, если он является окислительным агентом, используемым для удаления аминозащитной группы, однако, предпочтительно, он представляет собой персульфат калия, персульфат натрия, аммоний церий нитрат (CAN) или 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ).
Температура реакции и время реакции будут меняться, в зависимости от исходных соединений, окислительного агента и растворителя, но обычно температура реакции будет находиться в области между 0°C и 150°C, и время реакции будет находиться в области между 10 минутами и 24 часами.
Когда аминозащитная группа представляет собой необязательно замещенную аралкильную группу, защитная группа может быть удалена с использованием кислоты или основания.
Для кислоты, используемой в этой реакции, нет конкретных ограничений в том случае, если она является кислотой, используемой для удаления необязательно замещенной аралкильной группы, такой как аминозащитная группа, и, например, кислота может представлять собой кислоту Брэнстда, например, неорганическую кислоту, такую как хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или органическую кислоту, такую как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота; кислоту Льюиса, например, хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора или трибромид бора; или кислотную ионообменную смолу, из них предпочтительными являются неорганические кислоты и органические кислоты (наиболее предпочтительно, хлористоводородная кислота, уксусная кислота и трифторуксусная кислота) являются предпочтительными.
Для используемого в данной реакции основания нет конкретных ограничений в том случае, если оно представляет собой основание, которое обычно используют для удаления необязательно замещенной аралкильной группы, такой как аминозащитная группа, однако основание, предпочтительно, представляет собой карбонат щелочного металла, такой как карбонат лития, карбонат натрия или карбонат калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; алкоксид металла, такой как метоксид лития, метоксид натрия, этоксид натрия или калий-трет-бутоксид; или аммиачную смесь, такую как водный раствор аммиака или концентрированный аммиак-метанол.
Для используемого на первой стадии реакции инертного растворителя нет конкретных ограничений в том случае, если он является инертным по отношению к реакции, и, в данном случае, в качестве примеров могут быть указаны алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода; эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; вода; и смеси вышеуказанных растворителей, из них простые эфиры, спирты и вода (наиболее предпочтительно, диоксан, тетрагидрофуран, этанол или вода) являются предпочтительными.
Температура реакции будет изменяться в зависимости от исходных соединений и используемых кислоты и растворителя, однако обычно будет находиться в области между -20°C и температурой кипения (предпочтительно, между 0°C и 100°C).
Время реакции будет изменяться в зависимости от используемых исходных соединений, кислоты и инертного растворителя, и температура реакции, однако, обычно будет находиться в области между 15 минутами и 48 часами (предпочтительно, между 30 минутами и 20 часами).
Когда аминозащитная группа представляет собой необязательно замещенную алкенилоксикарбонильную группу, обычно удаление может быть осуществлено путем обработки кислотой или основанием в тех же условиях, что и при реакции удаления, когда аминозащитная группа представляет собой необязательно замещенную алифатическую ацильную группу, необязательно замещенную ароматическую ацильную группу, необязательно замещенную алкоксикарбонильную группу или замещенную метиленовую группу, которая образует основание Шиффа.
В случае аллилоксикарбонильной группы, особенно удобным является использование способа удаления с помощью палладия и трифенилфосфина или никель-тетракарбонила, так как удаление может быть осуществлено с получением незначительного количества побочных продуктов.
Когда аминозащитная группа представляет собой необязательно замещенную алкильную группу, необязательно замещенную алкенильную группу или необязательно замещенную сульфонильную группу, обычно удаление может быть осуществлено с помощью обработки кислотой или основанием в тех же условиях, что и при реакции удаления, когда аминозащитная группа представляет собой, алифатическую ацильную группу, ароматическую ацильную группу, алкоксикарбонильную группу или замещенную метиленовую группу, которая образует основание Шиффа.
Когда гидроксилзащитная группа представляет собой, например, необязательно замещенную силильную группу, такую как триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил или трет-бутилдифенилсилил, она обычно может быть удалена путем обработки соединением, образующего анион фторида, таким как фторид тетрабутиламмония, фтористоводородная кислота, фтористоводородная кислота-пиридин или фторид калия, или неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или органической кислотой, такой как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота.
Для удаления с помощью фторид аниона, для ускорения реакции может быть добавлена органическая кислота, такая как муравьиная кислота, уксусная кислота или пропионовая кислота.
Для используемого в реакции инертного растворителя нет конкретных ограничений в том случае, если он является инертным по отношению к реакции, но, предпочтительно, растворитель представляет собой простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; нитрил, такой как ацетонитрил или изобутиронитрил; органическую кислоту, такую как уксусная кислота; воду; или смесь этих растворителей.
Температура реакции и время реакции будут меняться в зависимости от используемых исходных соединений, катализатора и инертного растворителя, но обычно температура реакции будет находиться в области между 0°C и 100°C (предпочтительно, между 10°C и 50°C), и время реакции будет находиться в области от 1 до 24 часов.
Когда гидроксилзащитная группа представляет собой необязательно замещенную аралкильную группу или необязательно замещенную аралкилоксикарбонильную группу, способ взаимодействия с восстанавливающим агентом в инертном растворителе (предпочтительно, каталитическое восстановление при обычной температуре в присутствии катализатора) или способ удаления, используя окислительный агент, являются, в основном, предпочтительными.
Для инертного растворителя, используемого для удаления каталитическим восстановлением, нет конкретных ограничений в том случае, если он не участвует в реакции, и в качестве примеров в данном случае могут быть указаны алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как толуол, бензол и ксилол; эфиры, такие как этилацетат и пропилацетат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид, N-метил-2-пирролидон и гексаметилфосфор триамид; алифатические кислоты, такие как муравьиная кислота и уксусная кислота; вода; и смеси этих растворителей, из них спирты (наиболее предпочтительно метанол и этанол) являются предпочтительными.
Для катализатора, используемого для удаления каталитическим восстановлением, нет конкретных ограничений в том случае, если он обычно используется для удаления гидроксилзащитной группы путем каталитического восстановления, и в качестве примеров в данном случае могут быть указаны палладий-углерод, палладиевая чернь, никель Ренея, оксид платины, платиновая чернь, родий-оксид алюминия, трифенилфосфин-родий хлорид или палладий-барий сульфат, из них палладий-углерод является предпочтительным.
Для величины давления нет конкретных ограничений, однако оно, обычно, будет находиться в пределах от 1 до 10 атмосфер.
Температура реакции и время реакции будут меняться в зависимости от исходных соединений, катализатора и вводимого растворителя, но обычно температура реакции будет находиться в области между 0°C и 100°C (предпочтительно, между 20°C и 70°C), и время реакции будет находиться в области между 5 минутами и 48 часами (предпочтительно, между 1 часом и 24 часами).
Для инертного растворителя, используемого для удаления путем окисления, нет конкретных ограничений в том случае, если он не участвует в реакции, однако он, предпочтительно, представляет собой содержащий воду растворитель, и, в данном случае, могут быть указаны в качестве примеров кетоны, такие как ацетон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и тетрахлорид углерода; нитрилы, такие как ацетонитрил; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан; амиды, такие как диметилформамид, диметилацетамид и гексаметилфосфортриамид; и сульфоксиды, такие как диметилсульфоксид.
Для используемого в данной реакции окислительного агента нет конкретных ограничений в том случае, если он представляет собой окислительный агент, используемый для удаления гидроксилзащитной группы, однако он представляет собой, предпочтительно, персульфат калия, персульфат натрия, аммонийцерийнитрат (CAN) или 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ).
Температура реакции и время реакции будут меняться в зависимости от исходных соединений, окислительного агента и инертного растворителя, но обычно температура реакции будет находиться в области между 0°C и 150°C, и время реакции будет находиться в области между 10 минутами и 24 часами.
Удаление может также быть выполнено путем реакции с щелочным металлом, таким как металлический литий или металлический натрий, в жидком аммиаке или спирте, таком как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв при температуре, находящейся в области между -78°C и 0°C.
Удаление может также быть выполнено с применением алюминий хлорида-йодида натрия или йодида алкилсилила, такого как йодид триметилсилила, в инертном растворителе.
Для используемого в данной реакции инертного растворителя нет конкретных ограничений в том случае, если он не участвует в реакции, однако, он представляет собой, предпочтительно, галогенированный углеводород, такой как метиленхлорид, хлороформ или тетрахлорид углерода; нитрил, такой как ацетонитрил; или смесь этих растворителей.
Температура реакции и время реакции будут изменяться в зависимости от исходных соединений и инертного растворителя, но обычно температура реакции будет находиться в области между 0°C и 50°C, и время реакции будет находиться в области между 5 минутами и 72 часами.
Когда гидроксилзащитная группа представляет собой алифатическую ацильную группу, ароматическую ацильную группу или необязательно замещенную алкоксикарбонильную группу, она может быть удалена обработкой основанием в инертном растворителе.
Для используемого основания в данной реакции нет конкретных ограничений в том случае, если оно представляет собой основание, которое обычно используют для удаления гидроксилзащитной группы, и, например, оно может представлять собой соль щелочного металла угольной кислоты, такую как карбонат лития, карбонат натрия или карбонат калия; гидрокарбонат щелочного металла, такой как гидрокарбонат лития, гидрокарбонат натрия или гидрокарбонат калия; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; алкоксид металла, такой как метоксид лития, метоксид натрия, этоксид натрия или калий-трет-бутоксид; или аммиачную смесь, такую как водный раствор аммиака или смесь концентрированный аммиак-метанол, из них гидроксиды щелочных металлов, алкоксиды металлов и аммиачные смеси (наиболее предпочтительно, гидроксиды щелочных металлов и алкоксиды металлов) являются предпочтительными.
Для используемого в данной реакции инертного растворителя нет конкретных ограничений в том случае, если он обычно используется для реакции гидролиза, однако, он представляет собой, предпочтительно, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; спирт, такой как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; воду; или смесь этих растворителей.
Температура реакции и время реакции будут изменяться в зависимости от используемых исходных соединений и основания и инертного растворителя, однако для ингибирования побочных продуктов температура реакции будет обычно находиться в области -20°C и 150°C, и время реакции будет обычно находиться в области 1-10 часов.
Когда гидроксилзащитная группа представляет собой необязательно замещенный алкоксиметил, необязательно замещенный алкилтиометил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрофуранил, тетрагидротиофуранил или необязательно замещенный этил, такой как 1-этоксиэтил, обычно она может быть удалена обработкой кислотой в инертном растворителе.
Для используемой кислоты в данной реакции нет конкретных ограничений в том случае, если она представляет собой кислоту, которую обычно используют для удаления гидроксилзащитной группы, однако обычно могут быть указаны соединения, используемые в качестве кислот Брэнстда или кислот Льюиса, и, предпочтительно, представляют собой кислоты Брэнстда, включающие хлорид водорода; неорганические кислоты, такие как хлористоводородная кислота, серная кислота и азотная кислота; и органические кислоты, такие как уксусная кислота, трифторуксусная кислота, метансульфоновая кислота и п-толуолсульфоновая кислота; или Кислоты Льюиса, такие как трифторид бора, между тем также могут использоваться сильнокислотные катионобменные смолы, такие как DOWEX 50W.
Для используемого в данной реакции инертного растворителя нет конкретных ограничений в том случае, если он обычно является инертным по отношению к реакции, и, например, в данном случае могут быть указаны алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлопентан, хлорбензол и дихлорбензол; эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; вода; и смеси этих растворителей, из них простые эфиры и спирты (наиболее предпочтительно, тетрагидрофуран и метанол) являются предпочтительными.
Температура реакции и время реакции будут меняться в зависимости от используемого исходного соединения и кислоты и инертного растворителя, но обычно температура реакции будет находиться в области между -10°C и 200°C (предпочтительно, между 0°C и 150°C), и время реакции будет находиться в области между 5 минутами и 48 часами (предпочтительно, между 30 минутами и 10 часами).
Когда гидроксилзащитная группа представляет собой необязательно замещенную алкенилоксикарбонильную группу или необязательно замещенную сульфонильную группу, обычно удаление может быть выполнено обработкой основанием, в тех же условиях, что и при реакции удаления, когда гидроксилзащитная группа представляет собой указанную выше необязательно замещенную алифатическую ацильную группу, необязательно замещенную ароматическую ацильную группу или необязательно замещенную алкоксикарбонильную группу.
В случае аллилоксикарбонильной группы особенно удобным является применение способа удаления с использованием палладия и трифенилфосфина или гексафторфосфата бис(метилдифенилфосфин)(1,5-циклооктадиен)иридия (I), так как удаление может быть осуществлено с получением незначительного количества побочных продуктов.
Когда карбоксилзащитная группа представляет собой низшую алкильную группу, низшую алкенильную группу или низшую алкинильную группу или необязательно замещенную силильную группу или если соединение было преобразовывало в ортоэфир в целях защиты, тогда способы удаления путем обработки кислотой или основанием, или, используя фермент, являются предпочтительными.
Для используемой в этой реакции кислоты нет конкретных ограничений в том случае, если она используется для удаления карбоксилзащитной группы, и например, она может представлять собой хлористоводородную кислоту, серную кислоту, фосфорную кислоту или бромистоводородную кислоту.
Для используемого в данной реакции основания нет конкретных ограничений в том случае, если оно используется для удаления карбоксилзащитной группы, и, например, это может быть карбонат щелочного металла, такой как карбонат натрия или карбонат калия; гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; или концентрированный раствор аммиак-метанол, из них гидроксид натрия является предпочтительным.
Изомеризация может происходить при гидролизе с использованием основания.
Для используемого в данной реакции фермента нет конкретных ограничений в том случае, если он представляет собой фермент, используемый для удаления карбоксилзащитной группы, и, например, он может представлять собой липазу или эстеразу.
Используемым в данной реакции растворителем может быть, например, вода, спирт, такой как метанол, этанол или н-пропанол; простой эфир, такой как тетрагидрофуран или диоксан; или смесь любых этих растворителей с водой, из них спирт (наиболее предпочтительно, метанол) является предпочтительным.
Температура реакции и время реакции будут меняться в зависимости от используемых исходных соединений, растворителя и реагентов и не являются конкретно ограниченными, однако для ингибирования побочных продуктов температура реакции будет обычно находиться в области от 0°C до 220°C, и время реакции будет обычно находиться в области от 30 минут до 10 часов.
Когда карбоксилзащитная группа представляет собой необязательно замещенную аралкильную группу или низшую галогеналкильную группу, обычно она может быть удалена восстановлением в растворителе.
Способ восстановления, предпочтительно, представляет собой способ химического восстановления в системе цинк-уксусная кислота, когда карбоксилзащитная группа представляет собой низшую галогеналкильную группу, и, когда она представляет собой необязательно замещенную аралкильную группу, способ может представлять собой один из способов каталитического восстановления, в котором используется катализатор, такой как палладий-углерод или платина, или способ каталитического восстановления, в котором используется сульфид щелочного металла, такой как сульфид калия или сульфид натрия.
Для используемого растворителя нет конкретных ограничений в том случае, если он не участвует в реакции, однако, в данном случае, являются предпочтительными спирты, такие как метанол и этанол; простые эфиры, такие как тетрагидрофуран и диоксан; алифатические кислоты, такие как уксусная кислота; и смеси этих растворителей с водой.
Температура реакции и время реакции будут меняться в зависимости от используемых исходных соединений, растворителя и способа восстановления, но обычно температура реакции будет находиться в области между 0°C и приблизительно комнатной температурой, и время реакции будет находиться в области между 5 минутами и 12 часами.
Если карбонильная группа защищена преобразованием в циклический или ациклический кеталь, образованный путем использования, например, спирта, такого как метанол, изопропанол или диэтиленгликоль, или тиола, такого как метантиол, этантиол или пропандитиол, для обратного преобразования в карбонильную группу может быть использована кислота.
Для используемой в данной реакции кислоты нет конкретных ограничений в том случае, если она представляет собой кислоту, обычно используемую для обратного преобразования в карбонильную группу из циклического или ациклического кеталя, образованного в целях защиты карбонильной группы, и, например, кислота может представлять собой кислоту Брэнстда, например, неорганическую кислоту, такую как хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или органическую кислоту, такую как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота; кислоту Льюиса, такую как хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора или трибромид бора; или кислотную ионообменную смолу, из них неорганические кислоты и органические кислоты (наиболее предпочтительно, хлористоводородная кислота и п-толуолсульфоновая кислота) являются предпочтительными.
Для используемого на первой стадии данной реакции инертного растворителя нет конкретных ограничений в том случае, если он является инертным по отношению к реакции, и, в качестве примеров, в данном случае могут быть указаны алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлопентан и тетрахлорид углерода; эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид; вода; и смеси этих растворителей, из них простые эфиры, спирты и вода (наиболее предпочтительно, ацетон, тетрагидрофуран и вода) являются предпочтительными.
Температура реакции будет изменяться в зависимости от используемых исходных соединений и кислоты и растворителя, но, обычно, она будет находиться в области между -20°C и точкой кипения (предпочтительно, между 0°C и 100°C).
Время реакции будет изменяться в зависимости от используемых исходных соединений, кислоты и инертного растворителя и температуры реакции, но обычно оно будет находиться в области между 5 минутами и 48 часами, (предпочтительно, между 10 минутами и 24 часами).
В случае циклического или ациклического кеталя образованного с использованием тиола, особенно удобным является применение способа удаления с использованием вещества, такого как никель Ренея или нитрат серебра.
В случае преобразования в циклический кеталь с использованием, например, формалина или ацетона в качестве защиты диола, для обратного преобразования в диол можно использовать кислоту.
Для используемой в данной реакции кислоты нет конкретных ограничений в том случае, если она представляет собой обычно используемую кислоту для обратного преобразования в диол из циклического или ациклического кеталя, образованного с целью защиты диола, и например, она может представлять собой кислоту Брэнстда, например, неорганическую кислоту, такую как хлористоводородная кислота, бромистоводородная кислота, серная кислота, перхлорная кислота или фосфорная кислота, или органическую кислоту, такую как уксусная кислота, муравьиная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, трифторуксусная кислота или трифторметансульфоновая кислота; кислоту Льюиса, такую как хлорид цинка, тетрахлорид олова, трихлорид бора, трифторид бора или трибромид бора; или кислотную ионообменную смолу, из них неорганические кислоты и органические кислоты (наиболее предпочтительно, хлористоводородная кислота и п-толуолсульфоновая кислота) являются предпочтительными.
Для используемого на первой стадии данной реакции инертного растворителя нет конкретных ограничений, в том случае, если он является инертным по отношению к реакции, и, в качестве примеров, в данном случае, могут быть указаны алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода; эфиры, такие как метилацетат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфор триамид; вода; и смеси этих растворителей, из них простые эфиры, спирты и вода (наиболее предпочтительно ацетон, тетрагидрофуран и вода) являются предпочтительными.
Температура реакции будет изменяться в зависимости от используемых исходных соединений и кислоты и растворителя, но обычно она будет находиться в области между -20°C и точкой кипения (предпочтительно, между 0°C и 100°C).
Время реакции будет изменяться в зависимости от используемых исходных соединений, кислоты и инертного растворителя и температуры реакции, но обычно оно будет находиться в области между 5 минутами и 48 часами (предпочтительно, между 10 минутами и 24 часами).
Для желаемой реакции удаления удаление защитных групп у аминовых, гидроксильных, карбонильных и/или карбоксильных групп или диола может быть осуществлено в соответствующем порядке.
После завершения реакций в каждом из описанных выше способов и стадий целевое соединение каждой стадии может быть выделено из реакционной смеси обычными способами.
Например, когда реакционная смесь полностью представляет собой жидкость, ее можно охладить до комнатной температуры, если необходимо, или охладить на льду, затем, если необходимо, обработать кислотой или щелочью для нейтрализации, окислительным агентом или восстанавливающим агентом, и далее может быть добавлена вода и органический растворитель, такой как этилацетат, который не смешивается с водой и который не взаимодействует с целевым соединением, и отделить слой, содержащий целевое соединение. Далее может быть добавлен растворитель, который не смешивается с полученным слоем и который не взаимодействует с целевым соединением, и слой, содержащий целевое соединение может быть промыт и отделен. Если указанный слой представляет собой органический слой, он может быть высушен с применением осушителя, такого как безводный сульфат магния или безводный сульфат натрия, растворитель может быть отогнан до получения целевого соединения. Если слой представляет собой водный слой, он может быть обессолен с помощью электричества и затем лиофилизован до получения целевого соединения.
Когда реакционная смесь полностью представляет собой жидкость, если возможно, вещества, не являющиеся целевым соединением (например, растворители, реагенты и так далее), могут быть легко отогнаны при атмосферном давлении или при пониженном давлении с получением целевого соединения.
Когда только целевое соединение осаждается в виде твердого вещества или когда реакционная смесь полностью представляет собой жидкость и только целевое соединение осаждается в виде твердого вещества в процессе способа выделения, целевое соединение может быть сначала отфильтровано с помощью фильтрации и целевое соединение на фильтре может быть промыто подходящим органическим или неорганическим растворителем и высушено, что позволяет обработать маточную жидкость аналогичным способом, что и в случае, когда реакционная смесь полностью представляет собой жидкость, для получения целевого соединения.
Когда только реагент или катализатор представлен в твердой форме или когда реакционная смесь полностью представляет собой жидкость и только реагент или катализатор осаждается в виде твердого вещества в процессе способа выделения, сначала, вместе с целевым соединением, растворенным в растворе, реагент или катализатор могут быть отфильтрованы способом фильтрации, и реагент или катализатор на фильтре могут быть промыты подходящим органическим или неорганическим растворителем, и затем полученные промывочные жидкости объединены в виде маточной жидкости, и полученная смесь обработана тем же способом, как в том случае, когда реакционная смесь полностью представляет собой жидкость, для выделения целевого соединения.
В частности, когда вещества в реакционной смеси, не являющиеся целевым соединением, не ингибируют реакцию на следующей стадии, реакционную смесь можно использовать непосредственно на следующей стадии без выделения целевого соединения.
Чистота целевого соединения, выделенного описанным выше способом, может быть повышена использованием соответствующего способа перекристаллизации, хроматографического способа или способа перегонки.
Когда полученное целевое соединение представляет собой твердое вещество, чистоту целевого соединения обычно можно повысить путем перекристаллизации. Для перекристаллизации можно использовать отдельный растворитель или смешанные растворители, которые не взаимодействуют с целевым соединением. Конкретно, целевое соединение сначала растворяют в одном или нескольких растворителях, которые не взаимодействуют с ними, либо при комнатной температуре, либо при нагревании. Полученный раствор либо охлаждают на льду, либо выдерживают при комнатной температуре с целью кристаллизации целевого соединения из смеси.
Когда выделенное целевое соединение представляет собой жидкость или твердое вещество, чистота целевого соединения может быть повышена любым из различных методов хроматографии. В большинстве случаев могут использоваться слабокислотный силикагель, такой как Silica Gel 60 (340-400 меш) от компании Merck Co. или BW-300 (300 меш) от компании Fuji Silysia Chemical Ltd. Когда целевое соединение представляет собой основание, и адсорбция на вышеуказанных силикагелях достаточно сильна, могут использоваться Propylamine Coating Silica Gel (200-300 mesh) от компании Fuji Silysia Chemical Ltd. или тому подобное. Когда целевое соединение диполярно или должно быть элюировано полярным растворителем, таким как метанол, могут использоваться NAM-200H или NAM-300H от компании Nam Research Co. Эти силикагели могут использоваться для элюирования целевого соединения с помощью одного или нескольких растворителей, которые не взаимодействуют с целевым соединением, с последующей отгонкой растворителя и получением целевого соединение повышенной чистоты.
Когда полученное целевое соединение представляет собой жидкость, ее чистота может быть повышена способом дистилляции. Для дистилляции целевое соединение подвергают воздействию пониженного давления при комнатной температуре или нагреванию для отгонки целевого соединения.
Характерные примеры способов получения соединений по настоящему изобретению (1) и (100) описаны выше, однако исходные соединения и реагенты, используемые для получения соединений по изобретению, также могут образовывать соли, гидраты или сольваты, которые могут быть различными в зависимости от используемых исходных продуктов и растворителей и никак конкретно не ограничиваются в том случае, если они не ингибируют реакцию. Используемые растворители также различаются в зависимости от исходных продуктов и реагентов, однако, несомненно, они никак не ограничиваются в том случае, если они растворяют исходные материалы до некоторой степени и не ингибируют реакцию. Когда соединения по изобретению (1) и (100) получают в свободном виде, с использованием обычных методов они могут быть преобразованы в такие соль или гидраты, которые могут образовывать соединения (1) и (100).
Когда соединения по изобретению (1) и (100) получены в виде соли соединений (1) и (100) или гидрата соединений (1) и (100), они могут быть преобразованы в свободные формы соединений (1) и (100), используя обычные способы.
Кроме того, различные изомеры, полученные для соединений (1) и (100) по изобретению (например, геометрические изомеры, оптические изомеры на основе асимметричных атомов углерода, изомеры вращения, стереоизомеры и таутомеры и так далее), могут быть очищены и выделены, используя обычные методы выделения, такие как перекристаллизация, методы с использованием диастереомерных солей, методы ферментативного фракционирования и различные хроматографические методы (например, тонкослойная хроматография, колоночная хроматография, газовая хроматография и тому подобное).
Исходными соединениями для способа A, способа B, способа C, способа D, способа E, способа F, способа G, способа H, способа K, способа M, способа N, способа P, способа Q, способа R, способа S, способа T, способа U и способа V, как описано выше, могут быть коммерчески доступные соединения, или они могут быть легко получены из коммерчески доступных соединений способами, которые хорошо известны в данной области. Они также могут быть получены следующими способами.
Способ получения соединения (2A) (способ 1-1)

Этот способ представляет собой способ получения соединения (2A) (вышеуказанное соединение (2), где X1 представляет собой азот) путем взаимодействия соединения (28) с соединением (9) (аминирование или амидирование) в инертном растворителе, в присутствии катализатора на основе палладия(0) или катализатора на основе меди, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, в атмосфере инертного газа или без него, и с последующим удалением защитной группы Pro1.
На данной схеме, n, W1a, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше. Также, Pro1 представляет собой аминозащитную группу, и, например, это может быть, необязательно, замещенная силильная группа, такая как триметилсилил, триэтилсилил или трет-бутилдифенилсилил, необязательно замещенная алифатическая ацильная группа, такая как формил или ацетил, необязательно замещенная ароматическая ацильная группа, такая как бензоил, необязательно замещенная алкоксикарбонильная группа, такая как этоксикарбонил или трет-бутоксикарбонил, замещенная метиленовая группа, которая образует основание Шиффа, необязательно замещенная аралкильная группа, такая как бензил, 4-метоксибензил или 4-нитробензил, необязательно замещенная аралкилоксикарбонильная группа, такая как бензилоксикарбонил, 4-метоксибензилоксикарбонил или 4-нитробензилоксикарбонил, необязательно замещенная алкенилоксикарбонильная группа, такая как винилоксикарбонил или аллилоксикарбонил, необязательно замещенная алкильная группа, необязательно замещенная алкенильная группа или необязательно замещенная сульфонильная группа, предпочтительно, низшая алкоксикарбонильная группа, такая как метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил или изобутоксикарбонил, низшая алкоксикарбонильная группа, замещенная галогеном или три низшим алкилсилилом, такая как 2,2,2-трихлорэтоксикарбонил или 2-триметилсилилэтоксикарбонил, алкенилоксикарбонильная группа, такая как винилоксикарбонил или аллилоксикарбонил, необязательно замещенная аралкилоксикарбонильная группа, такая как бензилоксикарбонил, 4-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 2-нитробензилоксикарбонил или 4-нитробензилоксикарбонил, или необязательно замещенная аралкильная группа, такая как бензил, 4-метоксибензил, 3,4-диметоксибензил, 2-нитробензил или 4-нитробензил, и, более предпочтительно, бензил, 4-метоксибензил, 4-нитробензил, этоксикарбонил, трет-бутоксикарбонил или бензилоксикарбонил.
Способ может быть осуществлен подобно тому, как осуществлен описанный выше способ F.
Способ получения соединения (2A) (способ 1-2)

Этот способ представляет собой способ получения соединения (2A) (вышеуказанное соединение (2), где X1 представляет собой азот) путем взаимодействия соединения (29) с соединением (12) в инертном растворителе или без растворителя, в атмосфере инертного газа или без него, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, с получением соединения (2A) и с последующим удалением защитной группы Pro1.
На данной схеме, n, W1, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше.
HPro1 представляет собой водород или имеет те же значения, что указаны для группы Pro1 выше.
Способ может быть осуществлен подобно тому, как осуществлен описанный выше способ H.
Способ получения соединения (2C) (способ 1-3)

Этот способ представляет собой способ получения соединения (2C) (вышеуказанное соединение (2), где R10 представляет собой R10b) путем взаимодействия соединения (30) с соединением (14) в инертном растворителе, в присутствии катализатора на основе палладия(0), в атмосфере инертного газа или без него, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, и с последующим удалением защитной группы Pro1.
На данной схеме, X1, n, W1a, M1b, Pro1, R10b, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше.
Этот способ может быть осуществлен подобно тому, как осуществлен описанный выше способ K.
Способ получения соединения (2C) (способ 1-4)

Этот способ представляет собой способ получения соединения (2c) (вышеуказанное соединение (2), где R10 представляет собой R10b) путем взаимодействия соединения (31) с соединением (16) в инертном растворителе, в присутствии катализатора на основе палладия(0), в атмосфере инертного газа или без него, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, и с последующим удалением защитной группы Pro1.
На данной схеме, X1, n, W1a, M1, Pro1, R10b, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше.
Этот способ может быть выполнен подобно тому, как осуществлен описанный выше способ K.
Способ получения соединения (2A) (способ 1-5)

Этот способ представляет собой способ получения соединения (2A) (вышеуказанное соединение (2), где X1 представляет собой азот) путем взаимодействия соединения (19) и соединения (33) в инертном растворителе, в присутствии восстановительного агента, в присутствии или в отсутствие кислоты, в присутствии или в отсутствие добавки, с получением соединения (2A), и с последующим удалением защитной группы Pro1a описанным выше способом.
На данной схеме, n, W1, E1, E2, E3, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше.
Также, HPro1a представляет собой водород или группу, представленную Pro1a ниже.
Группа Pro1a представляет собой необязательно замещенную аралкильную группу, такую как бензил, 4-метоксибензил, 3,4-диметоксибензил, 2-нитробензил или 4-нитробензил, и, предпочтительно, бензил.
Этот способ может быть выполнен подобно тому, как осуществлен описанный выше способ C.
Способ получения соединения (2A) (способ 1-6)

Этот способ представляет собой способ получения соединения (2A) (вышеуказанное соединение (2), где X1 представляет собой азот) путем взаимодействия основания с соединением (34) в инертном растворителе, и с последующим удалением защитной группы Pro1 способом, описанным выше.
На данной схеме, n, W1, Pro1, E4, E5, E6, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше.
Этот способ может быть выполнен подобно тому, как осуществлен описанный выше способ A.
Способ получения соединения (2B) и (200) (способ 1-7)

Этот способ представляет собой способ получения соединения (2B) (вышеуказанное соединение (2), где X1 представляет собой CH) путем взаимодействия соединения (35) с соединением (9) в инертном растворителе, в присутствии катализатора на основе палладия(0), гидрирования и последующего удаления защитной группы Pro1 (способ 1-7-1), или способ получения соединения (200) путем взаимодействия аналогичным образом соединения (35) с соединением (9), с последующим удалением защитной группы Pro1 (способ 1-7-2).
На данной схеме, n, W1a, M1, Pro1, R10a, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше.
Этот способ осуществлен подобно тому, как осуществлен описанный выше способ K, с последующим гидрированием подобно тому, как и в описанном выше способе A.
Способ получения соединения (2B) и (200C) (способ 1-8)

Этот способ представляет собой способ получения соединения (2B) (вышеуказанное соединение (2), где X1 представляет собой CH) путем взаимодействия соединения (36) с соединением (25) в инертном растворителе, в присутствии катализатора на основе палладия(0), гидрирования и последующего удаления защитной группы Pro1 (способ 1-8-1), или способ получения соединения (200C) (вышеуказанное соединение (200), где R10 представляет собой R10b) путем взаимодействия аналогичным образом соединения (36) с соединением (25), с последующим удалением защитной группы Pro1 (способ 1-8-2).
На данной схеме, n, W1a, M1, Pro1, R10a, R10b, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше.
Этот способ осуществлен подобно тому, как осуществлен описанный выше способ K, с последующим проведением реакции гидрирования подобно тому, как в описанном выше способе A.
Способ получения соединения (2B) и (200C) (способ 1-9)

Этот способ представляет собой способ получения соединения (2B) (вышеуказанное соединение (2), где X1 представляет собой CH) путем взаимодействия соединения (37) с соединением (27) (то есть, литиевый реагент или реагент Гриньяра) в инертном растворителе, в присутствии инертного газа, с получением аддукта (160) (стадия 1-9-1), и с последующим восстановлением гидроксила в бензольном кольце полученного аддукта (160) (стадия 1-9-2), и удалением защитной группы Pro1, или способ получения соединения (200C) (вышеуказанное соединение (200), где R10 представляет собой R10b) путем осуществления взаимодействия аналогичным образом с получением аддукта (160) (стадия 1-9-1), последующей дегидратации гидроксила в бензольном кольце полученного аддукта (160) в присутствии или в отсутствие кислоты (стадия 1-9-3), и далее удалением защитной группы Pro1.
На данной схеме, n, M2, Pro1, R10a, R10b, R20a, R21a, R22a, R23a, R30a, R31a и R32a имеют те же значения, что указаны выше.
Этот способ осуществлен подобно тому, как осуществлен описанный выше способ U.
Способ получения соединения (19) (способ 2)
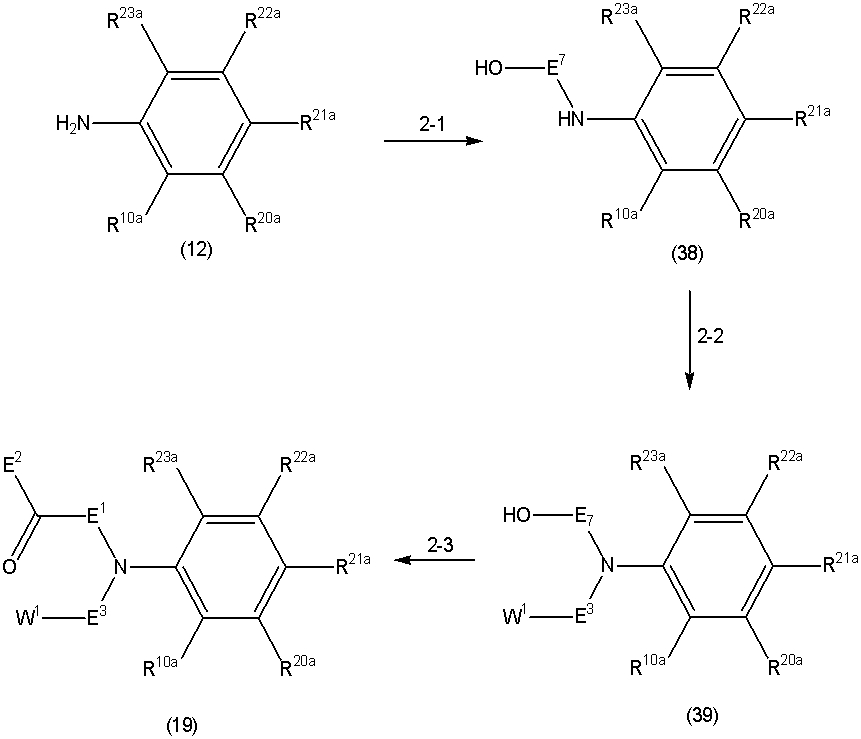
Этот способ представляет собой способ получения соединения (19) путем взаимодействия N-алкилирующего агента с соединением (12) в инертном растворителе с получением соединения (38) (стадия 2-1) и затем взаимодействием N-алкилирующего агента или N-карбонилирующего агента с соединением (38), с получением соединения (39) (стадия 2-2), и взаимодействия окислительного агента с соединением (39) в присутствии или в отсутствие добавки (стадия 2-3).
На данной схеме, W1, E1, E2, E3, R10a, R20a, R21a, R22a и R23a имеют те же значения, что указаны выше. Кроме того, E7 представляет собой группу, подходящую для получения желаемой группы формулы E2(CO)E1-.
Стадия 2-1 и стадия 2-2 могут быть осуществлены методом, подобным методу А, описанному выше.
(Стадия 2-3)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлопентан и тетрахлорид углерода, и нитрилы, такие как ацетонитрил и изобутиронитрил, из них галогенированные углеводороды (в частности дихлорметан) являются предпочтительными.
Для используемого окислительного агента нет конкретных ограничений, в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны хромовые кислоты, такие как пиридинийхлорхромат (PCC) и пиридинийдихромат (PDC), реагент Десс-Мартина (Dess D. B., Martin J. C., J. Am. Chem. Soc., (1991), 113, 7277), или каталитическое количество диметилсульфоксидных окислительных агентов, таких как тетрапропиламмонийперрутенат (VII) (TPAP; Ley S. V. et al., Synthesis, (1994), 639) и диметилсульфоксид-оксалилхлорид (окислительный реагент Сверна; D. Swern et al., Synthesis, (1981), 165), в присутствии N-метилморфолин-N-оксида (NMO) в качестве вспомогательного окислительного агента, из них диметилсульфоксид-оксалилхлорид (окислительный реагент Сверна) является предпочтительным.
Для используемой добавки нет конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны целит и молекулярные сита, из них молекулярные сита являются предпочтительными.
Температура реакции будут меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, однако будет обычно находиться в области -80°C и 60°C, и, предпочтительно, между -80°C и 40°C.
Время реакции будут меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но обычно находиться в области от 0,1 до 100 часов, и, предпочтительно, от 1 до 12 часов.
Соединение (38), соединение (39) или соединение (19) могут быть выделены или очищены из полученных выше реакционных смесей описанными выше способами.
Способ получения соединения (21) и соединения (34) (способ 3)

Этот способ представляет собой способ получения соединения (21) или соединения (34) путем взаимодействия N-алкилирующего агента или N-карбонилирующего агента с соединением (40) в инертном растворителе, с получением соединения (41) (стадия 3-1) и с последующим окислением соединения (41) с получением соединения (42) (стадия 3-2), и взаимодействия соединения (42) с соединением (12) (стадия 3-3).
На данной схеме, W1, E4, E5, E6, R10a, R20a, R21a, R22a и R23a имеют те же значения, что указаны выше. Кроме того, E8 представляет собой группу, подходящую для получения желаемой группы формулы E4(CO)E5. PR40a имеет те же значения, что и у вышеуказанного R40a, или представляет собой аминозащитную группу (предпочтительно, трет-бутоксикарбонил или бензил).
Стадия 3-1 в данном способе может быть проведена аналогичным вышеописанному способу A образом, стадия 3-2 может быть проведена аналогичным вышеописанному способу 2 образом (стадия 2-3), и стадия 3-3 может быть проведена аналогичным вышеописанному способу C образом.
Способ получения соединения (24A), соединения (36A), соединения (22), соединения (35), соединения (24B) и соединения (36B) (способ 4)

Этот способ представляет собой способ введения трифторметансульфонильной группы в соединение (43) в инертном растворителе в атмосфере инертного газа, с получением соединения (24A) или соединения (36A) (стадия 4-1), и с последующим взаимодействием соединения (24A) или соединения (36A) с реагентом на основе металлического бора или реагентом на основе металлического олова в присутствии катализатора на основе палладия(0), с получением соединения (22) или соединения (35) (стадия 4-2), и взаимодействием соединения (22) или соединения (35) с галогенирующим реагентом в присутствии или в отсутствие основания с получением соединения (24B) или соединения (36B) (стадия 4-3). Соединение (43) может также напрямую взаимодействовать с галогенирующим реагентом с получением соединения (24B) или соединения (36B) (стадия 4-4).
На данной схеме, n, R30a, R31a, R32a и PR40a имеют те же значения, что указаны выше.
Также, Hal представляет собой хлор, бром или йод.
M1b представляет собой группу формулы B(OE10c)2 или Sn(E10b)3 (где E10c представляет собой C1-6 алкил, или два из E10c соединены вместе с образованием C2-3 алкилена, необязательно замещенного метилом, и E10b представляет собой C1-6 алкил).
Tf представляет собой трифторметансульфонил.
(Стадия 4-1)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан, из них тетрагидрофуран является предпочтительным.
Эта стадия предпочтительно проводится в атмосфере сухого инертного газа. Инертный газ, предпочтительно, представляет собой аргон или азот.
Для используемого основания нет конкретных ограничений, в том случае, если оно может приводить к получению целевого соединения и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны амиды щелочных металлов, такие как бис(триметилсилил)амид лития, бис(триметилсилил)амид натрия и диизопропиламид лития, из них бис(триметилсилил)амид лития или (диизопропиламид) лития является предпочтительным.
Для используемого трифторметансульфонилирующего реагента нет конкретных ограничений в том случае, если он может приводить к получению целевого соединения и не дает нежелательных побочных продуктов, однако, предпочтительно, он представляет собой N-фенил бис(трифторметансульфонимид).
Температура реакции образования енола будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, однако обычно находится в области между -100 и 20°C, и, предпочтительно, в области между -80 и -30°C.
Температура реакции преобразования в удаляемую группу будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, однако будет обычно находиться в области между -100°C и 50°C, и, предпочтительно, в области между -80°C и 30°C.
Время реакции образования енола будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но обычно будет находиться в пределах от 0,1 до 5 часов, и, предпочтительно, от 0,1 до 3 часов.
Время реакции преобразования в удаляемую группу будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, однако будет обычно находиться в области от 0,1 до 24 часов, и, предпочтительно, от 0,5 до 12 часов.
Дополнительно к описанному выше способу, соединение (44) может быть получено взаимодействием производного кетона (43) с ангидридом трифторметансульфоновой кислоты в инертном растворителе, таком как дихлорметан, в присутствии органического основания, такого как 2,6-ди-трет-бутил-4-метилпиридин, как описано, например, в статье David Crich et al., Synthesis, (2001), 2, 323.
(Стадия 4-2)
(Способ получения соединения (22) и соединения (35) в виде боронатных производных)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид, или сульфоксиды, такие как диметилсульфоксид и сульфолан, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, и ароматические углеводороды, такие как бензол, толуол и ксилол, из них диметилсульфоксид и диоксан являются предпочтительными.
Для используемого катализатора на основе металла нет конкретных ограничений, в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и в данном случае, конкретно, могут быть указаны соединения двухвалентного палладия, такие как хлорид [1,1'-бис(дифенилфосфино)трифенилфосфин]палладия(II) и соединения 0-валентного палладия, такие как тетракис(трифенилфосфин)палладий, из них [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) является предпочтительным.
В качестве используемых оснований в данном случае могут быть указаны феноксид калия, триэтиламин, фосфат калия, карбонат калия и ацетаты калия, из них ацетат калия является предпочтительным.
Используемым катализатором может быть трифениларсин.
Температура реакции будут меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но обычно будет находиться в области 50°C и 80°C.
Время реакции будут меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но обычно будет находиться в области от 1 до 6 часов, и предпочтительно от 2 до 3 часов.
(Способ получения соединения (22) и соединения (35) в виде производных олова)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфор триамид, и простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, из них простые эфиры (в частности, тетрагидрофуран) являются предпочтительными.
Для используемого катализатора на основе металла нет конкретных ограничений, в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны соединения 0-валентного палладия, такие как тетракис(трифенилфосфин)палладий(0) и трис(дибензилиденацетон)дипалладий(0).
В качестве используемых реагентов олова в данном случае могут быть указаны гексаметилдиолово (IV), гексабутилдиолово (IV) и гексафенилдиолово (IV), из них гексаметилдиолово (IV) является предпочтительным.
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области -70°C и 80°C, и предпочтительно между 50°C и 80°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но обычно находится в области от 1 до 8 часов, и предпочтительно от 2 до 4 часов.
В качестве дополнительной литературы, используемой в качестве ссылки, по осуществлению этого способа может быть указана статья Kurt Ritter et al., Synthesis 1993; 735-762.
(Стадия 4-3)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлопентан и тетрахлорид углерода, и простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, из них дихлорметан, тетрахлорид углерода, диэтиловый эфир и тетрагидрофуран являются предпочтительными.
Для используемого галогенирующего реагента нет конкретных ограничений, в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны хлор, бром, йод, N-хлорсукцинимид, N-бромсукцинимид, N-йодсукцинимид и хлорид меди, из них хлор, бром и йод являются предпочтительными.
При использовании основания, в данном случае могут быть указаны гидроксид натрия, пиридин и натрий метоксид.
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области между -78°C и 25°C, и предпочтительно в области между 0°C и 25°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области от 1 до 24 часов, и предпочтительно от 1 до 6 часов.
(Стадия 4-4)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны галогенированные углеводороды, такие как хлороформ, дихлорметан, 1,2-дихлопентан и тетрахлорид углерода, и ароматические углеводороды, такие как бензол, толуол и ксилол, из них хлороформ, дихлорметан и тетрахлорид углерода являются предпочтительными.
Для используемого галогенирующего реагента нет конкретных ограничений, в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны галогенирующие агенты, такие как хлор, оксалилхлорид, тионилхлорид, оксихлорид фосфора, трихлорид фосфора, пентахлорид фосфора, бром, оксалилбромид, тионилбромид, трибромид фосфора, 2,2,2-трибром-1,3,2-бензодиоксафосфол, йод и трийодид фосфора, из них трихлорид фосфора, трибромид фосфора, 2,2,2-трибром-1,3,2-бензодиоксафосфол и трийодид фосфора являются предпочтительными.
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области между 0°C и 70°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области от 1 до 24 часов.
Способ получения соединения (25), соединения (27) и соединения (9A) (способ 5)

В этом способе соединение (45) подвергают взаимодействию с соединением (14) в инертном растворителе в присутствии катализатора на основе палладия(0), с получением соединения (9A) (стадия 5-1), и затем соединение (9A) подвергают взаимодействию с литирующим агентом или реагентом Гриньяра - агентом, позволяющим получить соединение (27) (стадия 5-2), и соединение (27) подвергают взаимодействию с реагентом на основе металлического бора или реагентом на основе металлического олова с получением соединения (25) (стадия 5-3).
На данной схеме, M1, M1b, M2, R10b, R20a, R21a, R22a и R23a имеют те же значения, что указаны выше.
Hal1 представляет собой хлор или бром, и Hal2 представляет собой йод, когда Hal1 представляет собой бром, и бром или йод, когда Hal1 представляет собой хлор.
Стадия 5-1 этого способа может быть осуществлена аналогичным образом, как описано выше в способе K.
(Стадия 5-2)
Эта стадия будут меняться в зависимости от природы M2.
(Стадия получения реагента Гриньяра)
На этой стадии соединение (9A) напрямую подвергают взаимодействию с магнием в инертном растворителе (прямой способ) или осуществляют реакцию обмена магний-галоген проводят между соединением (9A) и другим реагентом Гриньяра (непрямой способ) с получением соединения (27) (то есть, реагент Гриньяра).
(1) Прямой способ
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, и фосфорные амиды, такие как гексаметилфосфортриамид, из них простые эфиры (в частности, диэтиловый эфир и тетрагидрофуран) являются предпочтительными.
Способ взаимодействия может быть проведен в соответствии с обычным способом, и, конкретно, магний суспендируют в растворителе в атмосфере инертного газа, такого как азот или аргон, в присутствии или в отсутствие каталитического количества йода или дибромэтана в качестве активирующего агента, и к реакционной системе медленно добавляют соединение (9A). По завершению реакции соединение (27) получают в супернатанте и его обычно используют в следующей стадия без выделения в чистом виде.
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, однако будет обычно находиться в области между -20°C и 150°C, и предпочтительно в области между 0°C и 100°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области от 1 до 10 часов.
(2) Непрямой способ
Используемый растворитель, температура реакции и время реакции являются такими же, как и для прямого способа.
Способ взаимодействия может быть выполнен в соответствии с обычным способом, но соединение (27) (то есть, соединение органического магния) может также быть получено путем взаимодействия соединения галогена (9A) с бромидом изопропилмагния, или тому подобное, в атмосфере инертного газа, такого как азот или аргон. Полученное соединение (27) обычно используют на следующей стадии без выделения в чистом виде.
(Стадия литирования)
На этой стадии реакция обмена литий-галоген выполняется между соединением галогена (9A) и другим алкиллитиевым реагентом в инертном растворителе, в атмосфере инертного газа, таком как азот или аргон, с получением ариллитиевого реагента (27).
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, и фосфорные амиды, такие как триамид гексаметилфосфора, из них простые эфиры (в частности, диэтиловый эфир и тетрагидрофуран) являются предпочтительными.
Для используемого алкиллитиевого реагента нет конкретных ограничений в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны соединения алкиллития, такие как н-бутиллитий, втор-бутиллитий и трет-бутиллитий, из них н-бутиллитий является предпочтительным.
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области -100°C и 0°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области между 10 минутами и 2 часами.
Полученное соединение (27) обычно используют в следующей стадии без выделения в чистом виде.
(Стадия 5-3)
Данная стадия будет меняться в зависимости от природы M1.
(Стадия получения реагента бороновой кислоты)
На этой стадии, литиевый агент или реагент Гриньяра (27), полученный на стадии 5-2, подвергают взаимодействию с указанным далее реагентом бора, с получением реагента бороновой кислоты соединения (25).
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, и фосфорные амиды, такие как триамид гексаметилфосфора, из них простые эфиры (в частности, диэтиловый эфир и тетрагидрофуран) являются предпочтительными.
Для используемого боратного реагента нет конкретных ограничений в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны триалкилбораты, такие как триизопропилборат и триметилборат, из них триизопропилборат являются предпочтительными.
Полученный триалкилборат может быть легко гидролизирован в воде или водном хлориде аммония, с получением реагента бороновой кислоты соединения (25).
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области -80°C и 50°C, и предпочтительно между -80°C и 30°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области от 1 до 10 часов, и предпочтительно от 2 до 6 часов.
(Стадия получения реагента олова)
На этой стадии, литиевый реагент или реагент Гриньяра (27), полученный на стадии 5-2, подвергают взаимодействию с указанным ниже реагентом галогенированного триалкилолова с получением соединения реагента олова (25).
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, и фосфорные амиды, такие как гексаметилфосфортриамид, из них простые эфиры (в частности, диэтиловый эфир и тетрагидрофуран) являются предпочтительными.
Для используемого реагента галогенированного триалкилолова нет конкретных ограничений в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны соединения галогенированного триалкилолова, такие как хлорид трибутилолова и триметилоловохлорид, из них трибутилоловохлорид является предпочтительным.
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области -80°C и 50°C, и составляет, предпочтительно, между -80°C и 30°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области от 1 до 10 часов, и предпочтительно от 1 до 6 часов.
Способ получения соединения (9B) (способ 6)

На этой стадии, соединение (46) подвергают взаимодействию с соединением (14) в инертном растворителе в присутствии катализатора на основе палладия(0) с получением соединения (47) (стадия 6-1) и затем соединение (47) подвергают взаимодействию с деалкилирующим агентом или деаралкилирующим агентом с получением соединения (48) (стадия 6-2), и в фенольную гидроксильную группу соединения (48) вводят трифторметансульфонильную группу с получением соединения (9B) (стадия 6-3).
На данной схеме Tf, M1b, Hal, R10a, R10b, R20a, R21a, R22a и R23a имеют те же значения, что указаны выше. Кроме того, R100 представляет собой C1-6 алкил или необязательно замещенный аралкил, и, предпочтительно, метил или бензил.
Стадия 6-1 этого способа может быть выполнена подобно тому, как осуществлен описанный выше способ K.
(Стадия 6-2)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны спирты, такие как метанол, этанол и изопропанол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля, ароматические углеводороды, такие как бензол, толуол и ксилол, органические кислоты, такие как дисульфид углерода, уксусная кислота и бромид водорода, в растворе уксусной кислоты, органические основания, такие как хинолин и пиридин, и вода. Эти соединения могут быть выбраны как соединения, подходящие для используемого деалкилирующего агента или деаралкилирующего агента.
Для используемого деалкилирующего агента или деаралкилирующего агента нет конкретных ограничений в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны кислоты Льюиса, такие как трибромид бора, трихлорид бора, трийодид бора и алюминий хлорид, кислоты Брэнстда, такие как бромистоводородная кислота, хлористоводородная кислота и бромид водорода в растворе уксусной кислоты, соли металла, такие как йодид лития, и галогенированные силаны, такие как йодид триметилсилана.
Температура реакции будут меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области -80°C и 250°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области от 0,1 до 100 часов.
Когда R100 представляет собой необязательно замещенную аралкильную группу, стадия деаралкилирования может быть проведена в соответствии со способом гидрирования как описано выше для способа A.
Для того, чтобы сделать возможным выборочное снятие защитных групп, эти условия могут быть выбраны в качестве соответствующих исходным материалам.
В качестве дополнительной литературы, используемой в качестве ссылки, по осуществлению этого способа, может быть указана статья M. Vivekananda Bhatt, Surendra U. Kulkarni et al., "Cleavage of Ethers" Synthesis (1983), 249 и T.W. Greene, (Protective Groups in Organic Synthesis), John Wiley & Sons: J.F.W. McOmis, (Protective Groups in Organic Chemistry), Plenum Press.
Стадия 6-3 может быть выполнена аналогичным образом, как описано выше в способе A или способе B.
Способ получения соединения (25A) (способ 7)

В этом способе соединение (9C) подвергают взаимодействию с реагентом на основе металлического бора или реагента на основе металлического олова в инертном растворителе в присутствии катализатора на основе палладия(0) с получением соединения (25A).
На данной схеме M1b, Hal, R10a, R20a, R21a, R22a и R23a имеют те же значения, что указаны выше.
Этот способ может быть выполнен аналогичным образом, как описано для стадии 4-2 способа 4.
Способ получения соединения (13A) (способ 8)

В этом способе соединение (49) подвергают взаимодействию с соединением (8) (аминирование или амидирование) в инертном растворителе в присутствии катализатора на основе палладия(0) или катализатора на основе меди, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, в атмосфере инертного газа или без него, с получением соединения (50) (стадия 8-1), и затем соединение (50) подвергают взаимодействию с деалкилирующим агентом или деаралкилирующим агентом с получением соединения (51) (стадия 8-2) и трифторметансульфонильную группу вводят в фенольный гидроксил соединения (51) с получением соединения (13A) (стадия 8-3).
На данной схеме, Tf, n, R20a, R21a, R22a, R23a, R30a, R31a, R32a, R40a, R100 имеют те же значения, что указаны выше. Кроме того, MW1a имеет те же значения, что и вышеуказанные M1a или W1a.
Стадия 8-1 данного способа может быть проведена аналогичным образом, как описано выше в способе F или способе G, стадия 8-2 может быть выполнена аналогичным образом, как описано выше для стадии 6-2, и стадия 8-3 может быть выполнена аналогичным образом, как описано выше в способе A или способе B.
Способ получения соединения (15) и соединения (13B) (способ 9)

В этом способе соединение (77) подвергают взаимодействию с соединением (8) в инертном растворителе, в присутствии катализатора на основе палладия(0) или катализатора на основе меди, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки, в атмосфере инертного газа или без него, с получением соединения (13B) (стадия 9-1), и затем соединение (13B) подвергают взаимодействию с реагентом на основе металла с получением соединения (15) (стадия 9-2).
На данной схеме, n, M1, R20a, R21a, R22a, R23a, R30a, R31a, R32a и R40a имеют те же значения, что указаны выше.
Hal4 представляет собой хлор или бром, и Hal3 представляет собой йод, когда Hal4 представляет собой бром, и бром или йод, когда Hal4 представляет собой хлор.
Стадия 9-1 данного способа может быть выполнена аналогичным образом, как описано выше в способе F, и стадия 9-2 может быть выполнена аналогичным образом, как описано для стадии 5-2 и стадии 5-3, или как описано выше в способе 7.
Способ получения соединения (16A), соединения (14) и соединения (16B) (способ 10)

В этом способе удаляемую группу вводят в соединение (53) в инертном растворителе в атмосфере инертного газа или без него с получением соединения (16A) (стадия 10-1), и затем соединение (16A) подвергают взаимодействию с реагентом на основе металлического бора или реагентом основе металлического олова в присутствии катализатора на основе палладия(0) с получением соединения (14) (стадия 10-2), и соединение (14) подвергают взаимодействию с галогенирующим реагентом с получением соединения (16B) (стадия 10-3).
Альтернативно, соединение (53) подвергают взаимодействию непосредственно с галогенирующим агентом с получением соединения (16B) (стадия 10-4).
На данной схеме, Tf, R10b, M1b и Hal имеют те же значения, что указаны выше. Кроме того, R200 имеет те же значения, что и заместители в вышеуказанной группе заместителей A, или представляют собой заместители, которые были затем защищены. u равно целому числу 0, 1, 2, 3, 4 или 5. k равно целому числу 0, 1, 2, 3, 4 или 5.
Стадия 10-1 этого способа может быть выполнена аналогичным образом, как описано выше в способе 4-1, стадия 10-2 может быть выполнена аналогичным образом, как описано выше на стадии 4-2, и стадия 10-3 может быть выполнена аналогичным образом, как описано выше на стадии 4-3. Стадия 10-4 может быть выполнена аналогичным образом, как описано выше на стадии 4-4.
Способ получения соединения (12) (способ 11)

На этой стадии соединение (54) подвергают взаимодействию с нитрующим агентом с получением соединения (55) (стадия 11-1), и затем для восстановления соединения (55) с получением соединения (12) используют металл или соль металла в присутствии кислоты (стадия 11-2).
На данной схеме R10a, R20a, R21a, R22a и R23a имеют те же значения, что указаны выше.
(Стадия 11-1)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указана смесь серной кислоты и азотной кислоты или смесь уксусной кислоты и азотной кислоты, где растворитель азотная кислота реагирует в качестве нитрирующего агента.
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области между -20°C и 150°C, и предпочтительно в области между 0°C и 80°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области от 0,5 до 48 часов, и предпочтительно от 1 до 12 часов.
(Стадия 11-2)
Для используемого растворителя нет конкретных ограничений, в том случае, если он растворяет исходное соединение до некоторой степени и не ингибирует реакцию на этой стадии, и, конкретно, в данном случае могут быть указаны вода, спирты, такие как метанол и этанол, амиды, такие как формамид, диметилформамид, диметилацетамид и гексаметилфосфортриамид, органические кислоты, такие как уксусная кислота, и смеси этих растворителей, из них смешанный растворитель, состоящий из этанола и воды, смешанный растворитель, состоящий из этанола, диметилформамида и воды, или уксусная кислота являются предпочтительными.
Для используемого металла или соли металла нет конкретных ограничений в том случае, если он может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны металлы, такие как порошкообразное железо, порошкообразное олово и порошкообразный цинк, и соли металлов, такие как хлорид олова (II), из них металл (в частности, порошкообразное железо) являются предпочтительными.
Для используемой кислоты конкретных ограничений, в том случае, если она может давать целевое соединение и не дает нежелательных побочных продуктов, и, в данном случае, конкретно, могут быть указаны органические кислоты, такие как уксусная кислота, и неорганические кислоты, такие как хлористоводородная кислота, и хлорид аммония, из них хлорид аммония является предпочтительным.
Эквивалентное количество используемого металла или соли металла будет меняться в зависимости от исходных продуктов, растворителя и реагентов, но, обычно, находится в соотношении 2-15 и, предпочтительно, 3-6, в единицах мольного отношения относительно исходного продукта.
Температура реакции будет меняться в зависимости от используемых исходных продуктов, растворителя и реагентов, но, обычно, будет находиться в области 0°C и 150°C, и, предпочтительно, между 0°C и 100°C.
Время реакции будет меняться в зависимости от используемых исходных продуктов, растворителя, реагентов и температуры реакции, но, обычно, будет находиться в области от 0,5 до 48 часов, и, предпочтительно, от 1 до 12 часов.
Соединение (55) или соединение (12) могут быть выделены или очищены из полученной выше реакционной смеси описанным выше способом.
Способ получения соединения (55A) (способ 12)

В этом способе соединение (56) подвергают взаимодействию с описанным выше соединением (16) с получением соединения (55A) (способ 12-1), или соединение (57) подвергают взаимодействию с описанным выше соединением (14) с получением соединения (55A) (способ 12-2), в инертном растворителе, в присутствии катализатора на основе палладия(0), в атмосфере инертного газа или без него, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки.
На данной схеме, W1a, M1, M1b, R10b, R20a, R21a, R22a и R23a имеют те же значения, что указаны выше.
Стадия 12-1 данного способа может быть осуществлена аналогичным образом, как описано выше в способе K, и стадия 12-2 может быть осуществлена аналогичным образом, как описано выше в способе K.
При использовании соединения по настоящему изобретению в качестве лекарственного средства, это соединение, как правило, смешивают с подходящими добавками для использования в качестве препарата. Однако, это не исключает использование соединения по изобретению самостоятельно в качестве лекарственного средства.
Такие добавки могут включать наполнители, связывающие вещества, смазывающие вещества, разрыхлители, окрашивающие агенты, придающие вкус добавки, эмульгаторы, поверхностно-активные вещества, способствующие растворению вещества, суспендирующие агенты, изотонирующие агенты, буферирующие агенты, антисептики, антиоксиданты, стабилизаторы, ускорители абсорбции и тому подобное, которые обычно используются в фармацевтических препаратах, и, если необходимо, они могут быть добавлены в соответствующих сочетаниях.
В качестве примеров таких наполнителей в данном случае могут быть указаны лактоза, белый мягкий сахар, глюкоза, кукурузный крахмал, маннит, сорбит, крахмал, альфа крахмал, декстрин, кристаллическая целлюлоза, мягкий кремневый ангидрид, силикат алюминия, силикат кальция, алюмометасиликат магния, гидрофосфат кальция и тому подобное.
В качестве примеров связующих веществ в данном случае могут быть указаны поливиниловый спирт, метилцеллюлоза, этилцеллюлоза, аравийская камедь, трагакант, желатин, шеллак, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, натрий карбоксиметилцеллюлоза, поливинилпирролидон, макролголо и тому подобное.
В качестве примеров смазывающих веществ в данном случае могут быть указаны стеарат магния, стеарат кальция, натрий стеарилфумарат, тальк, полиэтиленгликоль, коллоидный оксид кремния и тому подобное.
В качестве примеров разрыхлителей в данном случае могут быть указаны кристаллическая целлюлоза, агар, желатин, карбонат кальция, гидрокарбонат натрия, цитрат кальция, декстрин, пектин, гидроксипропилцеллюлоза низкого замещения, карбоксиметилцеллюлоза, кальций карбоксиметилцеллюлоза, натрий кросскармеллоза, карбоксиметил крахмал и карбоксиметил крахмал натрий, и тому подобное.
В качестве примеров окрашивающих агентов, в данном случае, могут быть указаны вещества, разрешенные для добавления в лекарственные препараты, такие как сесквиоксид железа, сесквиоксид желтого железа, кармин, карамель, β-каротин, оксид титана, тальк, рибофлавин натрий фосфат, желтый алюминиевый краситель и тому подобное.
В качестве примеров придающих вкус агентов в данном случае могут быть указаны порошок какао, ментол, ароматические порошки, масло мяты, борнеол, порошкообразная корица и тому подобное.
В качестве примеров эмульгирующих агентов или поверхностно-активных веществ в данном случае могут быть указаны стеарил триэтаноламин, натрий лаурилсульфат, лаурил аминопропионовая кислота, лецитин, глицерин моностеарат, эфиры жирных кислот и сахарозы, эфиры жирных кислот и глицерина и тому подобное.
В качестве примеров, способствующих растворению вспомогательных веществ, в данном случае могут быть указаны полиэтиленгликоль, пропиленгликоль, бензилбензоат, этанол, холестерин, триэтаноламин, карбонат натрия, натрий цитрат, полисорбат 80, никотинамид и тому подобное.
В качестве примеров суспендирующих агентов в данном случае могут быть указаны поверхностно-активные вещества, упомянутые выше, гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и тому подобное.
В качестве примеров изотонирующих агентов в данном случае могут быть указаны глюкоза, хлорид натрия, маннит, сорбит и тому подобное.
В качестве примеров буферирующих агентов в данном случае могут быть указаны растворы, обладающие буферирующим действием, такие как фосфат, ацетат, карбонат, цитрат и тому подобное.
В качестве примеров антисептиков в данном случае могут быть указаны метилпарабен, пропилпарабен, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусная кислота, сорбиновая кислота и тому подобное.
В качестве примеров антиоксидантов в данном случае могут быть указаны сульфит, аскорбиновая кислота, α-токоферол и тому подобное.
В качестве примеров стабилизаторов в данном случае могут быть указаны стабилизаторы, которые обычно используются в лекарственных препаратах.
В качестве примеров ускорителей абсорбции также могут быть указаны ускорители абсорбции, которые обычно используются в лекарственных препаратах.
Препараты могут быть представлены в виде пероральных форм, таких как таблетки, порошки, гранулы, капсулы, сиропы, пастилки или ингаляторы, в виде форм для наружного применения, таких как суппозиторий, мазь, глазная мазь, пластырь, глазные капли, капли для носа, ушные капли, паста или лосьон, или в виде инъекции.
Пероральный препарат готовят, используя соответствующие сочетания добавок из числа указанных выше. Если необходимо, его поверхность может быть покрыта оболочкой.
Лекарственный препарат для наружного применения готовят, используя соответствующие сочетания добавок из числа указанных выше, и, в частности, наполнители, связывающие вещества, придающие вкус агенты, эмульгирующие агенты, поверхностно-активные агенты, способствующие растворению вспомогательные агенты, суспендирующие агенты, изотонирующие агенты, буферирующие агенты, антисептики, антиоксиданты, стабилизаторы и ускорители абсорбции.
Лекарственный препарат в виде инъекции готовят используя соответствующие сочетания добавок из числа указанных выше, и, в частности, эмульгирующие агенты, поверхностно-активные агенты, способствующие растворению вспомогательные агенты, суспендирующие агенты, изотонирующие агенты, буферирующие агенты, антисептики, антиоксиданты, стабилизаторы, и ускорители абсорбции.
Когда соединение по изобретению используется в виде лекарственного препарата, его доза будет меняться в зависимости от состояния и возраста пациента, но, обычно, будет находиться в области от 0,15 до 5000 мг (предпочтительно, от 0,5 до 1500 мг) в случае перорального препарата, от 0,5 до 1500 мг (предпочтительно, от 1,5 до 500 мг) в случае препарата для наружного применения и от 0,3 до 5000 мг (предпочтительно, от 1 до 500 мг) в случае препарата для инъекции, в день, вводимая однократно или разделено 2-6 раза. Для перорального препарата или инъекции это представляет собой фактически вводимую дозу, тогда как при наружном применении это представляет собой фактически абсорбируемую дозу.
Соединения по изобретению (1) и (100) могут быть получены конкретными способами, описанными в следующих примерах. Следует учесть, однако, что эти примеры служат только в качестве иллюстрации и не предназначены для ограничения соединений по изобретению при любых условиях.
[Примеры]
Используемый в следующих примерах силикагель представляет собой силикагель 60 (Merck & Co., Inc) или BW300 (Fuji Silysia Chemical Ltd.), если не указано иного, и используемый силикагель NH представляет собой силикагель Chromatorex-NH (Fuji Silysia Chemical Ltd.), покрытый пропиламином.
(Пример 1)
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-5-метоксифенил]-4-пентилпиперазина

4,4-Диметилциклогексанон

Ссылка: Bruce H. Lipshutz, John Keith, Patrick Papa, and Randall Vivian, Tetrahedron Lett., 1998, 39, 4627.
(1a)
4,4-Диметилциклогекс-1-ениловый эфир трифторметансульфоновой кислоты

Смесь литий бис(триметилсилил)амида (1M раствор в тетрагидрофуране, 172 мл, 172 ммоль) и безводного тетрагидрофурана (400 мл) перемешивали и затем охлаждали до температуры ниже -70°C на бане сухой лед-ацетон в атмосфере азота. К раствору по каплям в течение 30 минут добавляли раствор 4,4-диметилциклогексанона (18 г, 143 ммоль) в безводном тетрагидрофуране (100 мл). После перемешивания в аналогичных условиях в течение 2 часов и 10 минут к реакционной смеси добавляли N-фенил бис(трифторметансульфонимид) (54 г, 150 ммоль) и перемешивание продолжали в течение 16 часов при медленном нагревании до комнатной температуры.
Для гашения реакции к реакционной смеси добавляли насыщенный водный раствор хлорида аммония. К смеси добавляли гексан и воду, и органический слой и водный слой разделяли. Органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом магния. Водный слой вновь экстрагировали гексаном и обрабатывали способом, которым обрабатывали органический слой. Оба органических слоя объединяли, осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 26,8 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,97 (с, 6H), 1,54 (т, J= 6,4Гц, 2H), 1,96-1,98 (м, 2H), 2,31-2,36 (м, 2H), 5,66-5,69 (м, 1H).
(1b)
2-(4,4-Диметилциклогекс-1-енил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан

К смеси 4,4-диметилциклогекс-1-енилового эфира трифторметансульфоновой кислоты (19 г, 73,4 ммоль), полученного в примере (1a), бис(пинаколато)дибора (21,5 г, 84,6 ммоль), 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладий(II) дихлорметанового комплекса (3 г, 3,68 ммоль) и ацетата калия (21,7 г, 221 ммоль) добавляли диоксан (200 мл) и смесь перемешивали в атмосфере азота при внешней температуре, равной 80°C, в течение 17 часов.
После охлаждения воздухом реакционной смеси до комнатной температуры нерастворившиеся продукты отфильтровывали через целит. Полученный фильтрат концентрировали при пониженном давлении, к остатку добавляли этилацетат и воду и органический слой отделяли. Органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 12,5 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,88 (с, 6H), 1,26 (с, 12H), 1,32 (т, J= 6,4Гц, 2H), 1,85-1,87 (м, 2H), 2,10-2,15 (м, 2H), 6,49-6,51 (м, 1H).
(1c)
1-(4,4-Диметилциклогекс-1-енил)-4-метокси-2-нитробензол

К смеси 4-бром-3-нитроанизола (3,3 г, 14,1 ммоль), 2-(4,4-диметилциклогекс-1-енил)-4,4,5,5-тетраметил-1,3,2]диоксаборолана (4,0 г, 16,9 ммоль), полученного в примере (1b), трикалий фосфата (4,5 г, 21,3 ммоль) и 1,2-диметоксиэтана (30 мл) при перемешивании при комнатной температуре в атмосфере азота добавляли тетракис(трифенилфосфин)палладий(0) (0,82 г, 0,71 ммоль). Затем смесь перемешивали при внешней температуре, равной 80°C, в течение 24 часов.
После охлаждения реакционной смеси до комнатной температуры добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния, осушитель отфильтровывали и затем фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 3,5 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,99 (с, 3H), 1,26 (с, 3H), 1,49 (т, J= 6,4Гц, 2H), 1,78-1,90 (м, 2H), 2,20-2,26 (м, 2H), 3,84 (с, 3H), 5,49-5,54 (м, 1H), 7,04 (дд, J= 8,4, 2,8Гц, 1H), 7,16 (д, J= 8,4Гц, 1H), 7,29 (д, J= 2,8Гц, 1H).
(1d)
2-(4,4-Диметилциклогекс-1-енил)-5-метоксифениламин

К раствору 1-(4,4-диметилциклогекс-1-енил)-4-метокси-2-нитробензола (3,5 г, 13,4 ммоль), полученного в примере (1c), в этаноле (30 мл) добавляли (5 мл) водный раствор хлорида аммония (2,9 г, 54 ммоль) и порошкоообразное железо (1,5 г, 26,8 ммоль) и смесь перемешивали при внешней температуре, равной 90°C, в течение 1 часа и 30 минут. Реакционную смесь пропускали через целит, к фильтрату добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния и осушитель отфильтровывали. Фильтрат концентрировали при пониженном давлении с получением 3,35 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,99 (с, 3H), 1,26 (с, 3H), 1,50 (т, J= 6,4Гц, 2H), 1,94-1,98 (м, 2H), 2,20-2,28 (м, 2H), 3,75 (с, 3H), 5,62-5,66 (м, 1H), 6,24 (д, J= 2,8Гц, 1H), 6,29 (дд, J= 8,4, 2,8Гц, 1H), 6,88 (д, J= 8,4Гц, 1H).
2Н NH2 не могли быть идентифицированы.
(1e)
1-[2-(4,4-Диметилциклогекс-1-енил)-5-метоксифенил]пиперазин

Раствор 2-(4,4-диметилциклогекс-1-енил)-5-метоксифениламина (3,35 г, 14,5 ммоль), полученного в примере (1d), и гидрохлорид бис(2-хлорэтил)амина (3,1 г, 17,4 ммоль) в 1,2-дихлорбензоле (10 мл) перемешивали при 210°C в течение 30 минут. Для удаления в реакторе избытка газообразного хлористого водорода в реактор несколько раз в процессе проведения реакции вдували газообразный азот. Реакционную смесь охлаждали до комнатной температуры, добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 2,1 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,97 (с, 6H), 1,44 (т, J= 6,4Гц, 2H), 1,90-1,98 (м, 2H), 2,34-2,48 (м, 2H), 2,94-3,32 (м, 8H), 3,78 (с, 3H), 5,58-5,66 (м, 1H), 6,48 (дд, J= 8,4, 2,8Гц, 1H), 6,50 (д, J= 2,8Гц,1H), 6,99 (д, J= 8,4Гц, 1H).
1Н NH2 не могли быть идентифицированы.
MS m/e (ESI) 301(MH+).
(1f)
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]-4-пентилпиперазина

К раствору 1-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]пиперазина (90 мг, 0,29 ммоль), полученного в примере (1e), в тетрагидрофуране (10 мл) добавляли альдегид валериановой кислоты (31 мг, 0,36 ммоль), триацетоксиборгидрид натрия (95 мг, 0,59 ммоль) и уксусную кислоту (35 мг, 0,59 ммоль), в указанном порядке, и смесь перемешивали в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния, осушитель отфильтровывали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 110 мг 1-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]-4-пентилпиперазина в виде светло-желтого масла.
MS m/e (ESI) 371(MH+).
Полученное соединение растворяли в этилацетате, добавляли 4н. раствор хлористого водорода в этилацетате и смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель отгоняли при пониженном давлении и затем к остатку добавляли диэтиловый эфир, и смесь фильтровали с получением 50 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CD3OD)
δ: 0,97 (с, 3H), 0,97 (т, J= 7,2Гц, 3H), 1,00 (с, 3H), 1,34-1,50 (м, 8H), 1,72-1,85 (м, 4H), 2,94-3,40 (м, 6H), 3,45-3,88 (м, 4H), 3,76 (с, 3H), 5,62-5,68 (м, 1H), 6,48-6,64 (м, 3H).
MS m/e (ESI) 371(MH+).
(1g)
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-5-метоксифенил]-4-пентилпиперазина
К раствору гидрохлорида 1-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]-4-пентилпиперазина (44 мг), полученного в примере (1f), в метаноле (5 мл) добавляли 10% палладий на угле (100 мг, влажный) и смесь перемешивали в течение 17 часов в атмосфере водорода при атмосферном давлении и комнатной температуре. Реакционную смесь пропускали через целит и фильтрат концентрировали при пониженном давлении. К остатку добавляли диэтиловый эфир и смесь фильтровали с получением 17 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CD3OD)
δ: 0,97 (с, 3H), 0,96 (т, J= 7,2Гц, 3H), 1,04 (с, 3H), 1,36-1,86 (м, 14H), 2,8-2,95 (м, 1H), 3,06-3,40 (м, 10H), 3,77 (с, 3H), 6,70 (д, J= 2,8Гц, 1H), 6,74 (дд, J= 8,4, 2,8Гц, 1H), 7,22 (д, J= 8,4Гц, 1H).
MS m/e (ESI) 373(MH+).
(Пример 2)
Гидрохлорид 4-бутил-1-[2-(4-трет-бутилциклогексил)фенил]пиперазин-2-она

(2a)
4-Трет-бутилциклогекс-1-ениловый эфир трифторметансульфоновой кислоты

Раствор диизопропиламина (22 мл, 0,157 моль) в безводном тетрагидрофуране (500 мл) охлаждали до температуры ниже -70°C на бане сухой лед-ацетон в атмосфере азота. К перемешиваемому раствору в течение 15 минут медленно по каплям добавляли н-бутиллитий (1,56 M раствор в гексане, 100 мл, 0,156 моль). Затем реакционную смесь нагревали до -10°C и далее вновь охлаждали до температуры ниже -70°C. После перемешивания в течение 10 минут к реакционной смеси постепенно по каплям в течение 15 минут добавляли раствор 4-трет-бутилциклогексанона (20,05 г, 0,13 моль) в безводном тетрагидрофуране (100 мл). После перемешивания в течение 30 минут к реакционной смеси постепенно по каплям в течение 15 минут добавляли раствор N-фенил бис(трифторметансульфонимид) (51,09 г, 0,143 моль) в безводном тетрагидрофуране (200 мл) и смесь перемешивали в течение 30 минут. Затем баню с сухим льдом меняли на ледяную баню и перемешивание продолжали в течение 30 минут и далее в течение еще 30 минут при комнатной температуре.
К реакционной смеси добавляли этилацетат и насыщенный солевой раствор и смесь экстрагировали этилацетатом. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 33,1 г указанного в заголовке соединения в виде светло-желтого масла, в рацемической форме по положению трет-бутила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,90 (с, 9H), 1,24-1,44 (м, 2H), 1,90-2,00 (м, 2H), 2,16-2,25 (м, 1H), 2,32-2,46 (м, 2H), 5,72-5,76 (м, 1H).
(2b)
1-(4-Трет-бутилциклогекс-1-енил)-2-нитробензол

Смесь 4-трет-бутилциклогекс-1-енилового эфира трифторметансульфоновой кислоты (7,16 г, 25 ммоль), полученного в примере (2a), 2-нитрофенилбороновой кислоты (5 г, 30 ммоль), 2н. водного карбоната натрия (25 мл), толуола (70 мл) и этанола (35 мл) перемешивали при комнатной температуре в атмосфере азота. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (1,5 г, 1,3 ммоль). Затем смесь перемешивали при внешней температуре, равной 90°C, в течение 1 часа и 30 минут.
К реакционной смеси добавляли этилацетат, воду и насыщенный солевой раствор и смесь экстрагировали этилацетатом. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 4,89 г указанного в заголовке соединения в виде желтовато-коричневого масла, в рацемической форме по положению трет-бутила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,90 (с, 9H), 1,32-1,44 (м, 2H), 1,86-1,97 (м, 2H), 2,14-2,28 (м, 2H), 2,28-2,40 (м, 1H), 5,62-5,66 (м, 1H), 7,26 (дд, J= 7,6, 1,2Гц, 1H), 7,34 (ддд, J= 8,0, 7,6, 1,2Гц, 1H), 7,49 (тд, J= 7,6, 1,2Гц, 1H), 7,77 (дд, J= 8,0, 1,2Гц, 1H).
(2c)
2-(4-Трет-бутилциклогексил)фениламин

Смесь 1-(4-трет-бутилциклогекс-1-енил)-2-нитробензола (4,89 г, 18,86 ммоль), полученного в примере (2b), 10% палладия на угле (1,5 г, влажный) и этилацетата (25 мл) перемешивали в течение 4 часов в атмосфере водорода при атмосферном давлении и комнатной температуре.
Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 3,34 г указанного в заголовке соединения в виде светло-коричневого масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,86 (с, 9H x 0,6), 0,89 (с, 9H x 0,4), 1,08-1,50 (м, 4H), 1,60-2,14 (м, 5H), 2,36-2,46 (м, 1H x 0,4), 2,90-2,96 (м, 1H x 0,6), 3,63 (ушир.с, 2H), 6,64-6,69 (м, 1H), 6,73-6,79 (м, 1H), 6,98-7,04 (м, 1H), 7,10 (дд, J= 7,6, 1,2Гц, 1H x 0,4), 7,34 (дд, J= 7,6, 1,2Гц, 1H x 0,6).
(2d)
2-[2-(4-Трет-бутилциклогексил)фениламино]этанол

Смесь 2-(4-трет-бутилциклогексил)фениламина (1,2 г, 5,19 ммоль), полученного в примере (2c), 2-бромэтанола (0,76 мл, 10,72 ммоль), триэтиламина (1,12 мл, 8,04 ммоль) и толуола (20 мл) кипятили с обратным холодильником в течение 16 часов и 20 минут в атмосфере азота.
К реакционной смеси добавляли этилацетат и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 538 мг указанного в заголовке соединения в виде светлого красного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,86 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 1,08-1,50 (м, 4H), 1,60-2,12 (м, 5H), 2,36-2,45 (м, 1H x 0,4), 2,91-2,96 (м, 1H x 0,6), 3,33-3,38 (м, 2H), 3,85-3,92 (м, 2H), 6,67 (дд, J= 8,0, 1,2Гц, 1H x 0,6), 6,68 (дд, J= 8,0, 1,2Гц, 1H x 0,4), 6,75 (тд, J= 8,0, 1,2Гц, 1H x 0,6), 6,76 (тд, J= 8,0, 1,2Гц, 1H x 0,4), 7,08-7,15 (м, 1H+1H x 0,4), 7,37 (дд, J= 8,0, 1,2Гц, 1H x 0,6).
Каждый 1H NH и OH не мог быть идентифицирован.
(2e)
N-[2-(4-Трет-бутилциклогексил)фенил]-2-хлор-N-(2-гидроксиэтил)ацетамид

Раствор 2-[2-(4-трет-бутилциклогексил)фениламино]этанола (248 мг, 0,9 ммоль), полученного в примере (2d), в безводном тетрагидрофуране (5 мл) охлаждали на бане с ледяной водой в атмосфере азота. Добавляли хлорацетилхлорид (0,08 мл, 1 ммоль) и смесь перемешивали в течение 40 минут.
К реакционной смеси добавляли этилацетат, насыщенный водный раствор гидрокарбоната натрия и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 258 мг указанного в заголовке соединения в виде бесцветного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,88 (с, 9H x 0,4), 0,92 (с, 9H x 0,6), 1,08-1,20 (м, 1H), 1,21-1,32 (м, 2H), 1,42-1,94 (м, 6H), 2,54 (тт, J= 12,0, 3,2Гц, 1H x 0,4), 2,74-2,85 (м, 1H), 2,90-2,98 (м, 1H x 0,6), 3,22 (дд, J= 4,8, 4,0Гц, 1H x 0,4), 3,25 (дд, J= 4,8, 4,0Гц, 1H x 0,6), 3,69-3,90 (м, 4H), 4,38-4,47 (м, 1H), 7,21 (д, J= 7,6Гц, 1H x 0,6), 7,21 (д, J= 7,6Гц, 1H x 0,4), 7,23-7,29 (м, 1H), 7,37-7,43 (м, 1H+1H x 0,4), 7,58 (дд, J= 7,6, 1,2Гц, 1H x 0,6).
(2f)
N-[2-(4-Трет-бутилциклогексил)фенил]-2-хлор-N-(2-оксоэтил)ацетамид

Раствор оксалилхлорида (0,24 мл, 2,75 ммоль) в безводном дихлорметане (5 мл) охлаждали до температуры ниже -65°C на бане сухой лед-ацетон в атмосфере азота. Постепенно по каплям в течение 8 минут добавляли раствор безводного диметилсульфоксида (0,38 мл, 5,35 ммоль) в безводном дихлорметане (5 мл). Потом реакционную смесь нагревали до -20°C и далее вновь охлаждали до температуры ниже -65°C. К реакционной смеси постепенно по каплям в течение 11 минут добавляли раствор N-[2-(4-трет-бутилциклогексил)фенил]-2-хлор-N-(2-гидроксиэтил)ацетамида (256 мг, 0,727 ммоль), полученного в примере (2e), в безводном дихлорметане (5 мл). После перемешивания в течение 30 минут добавляли триэтиламин (0,96 мл, 6,89 ммоль) и реакционную смесь постепенно нагревали до комнатной температуры.
К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, этилацетат и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным водным раствором лимонной кислоты, водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 303 мг сырого продукта, указанного в заголовке соединения в виде светло-желтого масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила. Его использовали без дополнительной очистки в следующей реакции.
(2g)
Гидрохлорид 4-бутил-1-[2-(4-трет-бутилциклогексил)фенил]пиперазин-2-она

Раствор сырого продукта N-[2-(4-трет-бутилциклогексил)фенил]-2-хлор-N-(2-оксоэтил)ацетамида (301 мг), полученного в примере (2f), в 1,2-дихлопентане (7 мл) охлаждали на бане с ледяной водой в атмосфере азота. Добавляли молекулярные сита 4Å (150 мг), н-бутиламин (0,091 мл, 0,921 ммоль) и триацетоксиборгидрид натрия (187 мг, 0,882 ммоль), в указанном порядке, и перемешивание продолжали в течение 20 часов с медленным нагреванием до комнатной температуры.
Нерастворившиеся продукты отфильтровывали и затем к фильтрату добавляли насыщенный водный раствор хлорида аммония, этилацетат и воду и фильтрат экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 163 мг 4-бутил-1-[2-(4-трет-бутилциклогексил)фенил]пиперазин-2-она в виде светло-желтого масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,88 (с, 9H x 0,4), 0,89 (с, 9H x 0,6), 0,95 (т, J= 7,2Гц, 3H), 1,03-2,00 (м, 13H), 2,40-2,51 (м, 2H+1H x 0,4), 2,64-2,77 (м, 1H), 2,86-3,00 (м, 1H+1H x 0,6), 3,16 (д, J= 16,4Гц, 1H x 0,6), 3,24 (д, J= 16,4Гц, 1H x 0,4), 3,37-3,45 (м, 2H), 3,62-3,73 (м, 1H), 7,12 (дд, J= 7,6, 1,2Гц, 1H), 7,21-7,36 (м, 2H+1H x 0,4), 7,56 (дд, J= 7,6, 1,2Гц, 1H x 0,6).
Полученное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали при пониженном давлении и к полученному остатку для образования осадка добавляли диэтиловый эфир. Твердое вещество измельчали с помощью ультразвука, фильтровали и затем высушивали при пониженном давлении с получением 102 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
MS m/e (ESI) 371(MH+).
(Пример 3)
Гидрохлорид 4-[3-(4,4-диметилциклогексил)-4-(4-изобутилпиперазин-1-ил)фенил]морфолина
(3a)
1-(4,4-Диметилциклогекс-1-енил)-2-нитробензол

К раствору 2-нитрофенилбороновой кислоты (14,2 г, 85,19 ммоль) в смеси толуол (250 мл)-этанол (125 мл) добавляли 4,4-диметилциклогекс-1-ениловый эфир трифторметансульфоновой кислоты (20 г, 77,44 ммоль), полученный в примере (1a), тетракис(трифенилфосфин)палладий(0) (4,5 г, 3,87 ммоль) и 2н. водный карбонат натрия (128 мл, 256 ммоль). Смесь перемешивали при внешней температуре, равной 100°C, в течение 1 часа и 45 минут в атмосфере азота.
После охлаждения воздухом реакционной смеси до комнатной температуры ее пропускали через целит и нерастворившиеся продукты отфильтровывали. К полученному фильтрату добавляли этилацетат и воду и фильтрат экстрагировали этилацетатом. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 16,3 г указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,00 (с, 6H), 1,51 (т, J= 6,4Гц, 2H), 1,92-1,94 (м, 2H), 2,24-2,29 (м, 2H), 5,55-5,57 (м, 1H), 7,27 (дд, J= 7,6, 1,6Гц, 1H), 7,34 (ддд, J= 7,6, 7,6, 1,6Гц, 1H), 7,50 (ддд, J= 7,6, 7,6, 1,6Гц, 1H), 7,77 (дд, J= 7,6, 1,6Гц, 1H).
(3b)
2-(4,4-Диметилциклогексил)фениламин

Смесь 1-(4,4-диметилциклогекс-1-енил)-2-нитробензола (16,3 г, 70,5 ммоль), полученного в примере (3a), 10% палладия на угле (1 г, влажный) и этилацетата (100 мл) перемешивали в течение 14 часов и 30 минут в атмосфере водорода при атмосферном давлении и комнатной температуре.
Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Смесь полученного остатка, 10% палладия на угле (3 г, влажный) и этилового спирта (200 мл) перемешивали в течение 30 часов и 30 минут в атмосфере водорода при атмосферном давлении и комнатной температуре.
После завершения реакции реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 11,79 г указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,97 (с, 3H), 0,99 (с, 3H), 1,36 (тд, J= 13,2, 4,0Гц, 2H), 1,47-1,73 (м, 6H), 2,38 (тт, J= 11,6, 3,6Гц, 1H), 3,63 (ушир.с, 2H), 6,68 (дд, J= 7,6, 1,6Гц, 1H), 6,77 (ддд, J= 7,6, 7,6, 1,6Гц, 1H), 7,01 (ддд, J= 7,6, 7,6, 1,6Гц, 1H), 7,14 (дд, J= 7,6, 1,6Гц, 1H).
(3c)
1-[2-(4,4-Диметилциклогексил)фенил]пиперазин

К раствору 2-(4,4-диметилциклогексил)фениламина (11,79 г, 57,98 ммоль), полученного в примере (3b), в 1,2-дихлорбензоле (30 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (12,42 г, 69,58 ммоль) и смесь перемешивали при внешней температуре, равной 200°C, в течение 2 часов и 30 минут в атмосфере азота. В процессе проведения реакции для удаления газообразного хлористого водорода через реактор несколько раз пропускали азот.
После охлаждения воздухом реакционной смеси до комнатной температуры добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 12,15 г указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,97 (с, 3H), 1,01 (с, 3H), 1,34 (тд, J= 12,8, 4,4Гц, 2H), 1,48-1,68 (м, 6H), 2,82-2,84 (м, 4H), 2,95-3,03 (м, 5H), 7,05-7,27(м, 4H).
1H у NH не мог быть идентифицирован.
(3d)
Трет-бутиловый эфир 4-[2-(4,4-диметилциклогексил)фенил]пиперазин-1-карбоновой кислоты

Смесь 1-[2-(4,4-диметилциклогексил)фенил]пиперазина (11 г, 40,4 ммоль), полученного в примере (3c), триэтиламина (6,2 мл, 44,4 ммоль), 4-диметиламинопиридина (247 мг, 2,02 ммоль) и дихлорметана (180 мл) перемешивали при внешней температуре, равной 0°C, в атмосфере азота. Добавляли смесь дикарбоната ди-трет-бутила (9,7 г, 44,4 ммоль) и дихлорметана (20 мл).
К реакционной смеси после перемешивания в течение 2 часов и 50 минут в аналогичных условиях, добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали дихлорметаном. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 14,89 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,96 (с, 3H), 1,01 (с, 3H), 1,31 (тд, J= 12,8, 4,4Гц, 2H), 1,49 (с, 9H), 1,49-1,69 (м, 6H), 2,81 (ушир.с, 4H), 2,95-3,02 (м, 1H), 3,57 (ушир.с, 4H), 7,06 (дд, J= 7,6, 1,6Гц, 1H), 7,10 (ддд, J= 7,6, 7,6, 1,6Гц, 1H), 7,16 (ддд, J= 7,6, 7,6, 2,0Гц, 1H), 7,28 (дд, J= 7,6, 2,0Гц, 1H).
(3e)
Трет-бутиловый эфир 4-[4-бром-2-(4,4-диметилциклогексил)фенил]пиперазин-1-карбоновой кислоты

Смесь трет-бутилового эфира 4-[2-(4,4-диметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (8 г, 21,5 ммоль), полученного в примере (3d), ацетата натрия (17,6 г, 215 ммоль) и метанола (300 мл) перемешивали при внешней температуре, равной комнатной в атмосфере азота. В течение 20 минут по каплям добавляли бром (1,1 мл, 21,5 ммоль) и смесь перемешивали в течение 17 часов в аналогичных условиях. Добавляли ацетат натрия (8,8 г, 107,5 ммоль) и потом по каплям добавляли бром (0,4 мл, 7,8 ммоль) и смесь перемешивали в течение 1 часа в аналогичных условиях.
К реакционной смеси добавляли насыщенный водный раствор сульфита натрия и смесь экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 7,97 г указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,96 (с, 3H), 1,01 (с, 3H), 1,24-1,34 (м, 2H), 1,41-1,64 (м, 6H), 1,49 (с, 9H), 2,77 (ушир.с, 4H), 2,89-2,97 (м, 1H), 3,55 (ушир.с, 4H), 6,92 (д, J= 8,4Гц, 1H), 7,25 (дд, J= 8,4, 2,4Гц, 1H), 7,35 (д, J= 2,4Гц, 1H).
(3f)
Трет-бутиловый эфир 4-[2-(4,4-диметилциклогексил)-4-морфолин-4-илфенил]пиперазин-1-карбоновой кислоты

Смесь трет-бутилового эфира 4-[4-бром-2-(4,4-диметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (1 г, 2,22 ммоль), полученного в примере (3e), морфолина (290 мг, 3,32 ммоль), трет-бутоксида натрия (533 мг, 5,55 ммоль), палладий(II)ацетата (50 мг, 0,222 ммоль), три-трет-бутилфосфоний тетрафторбората (193 мг, 0,666 ммоль) и ксилола (10 мл) перемешивали при внешней температуре, равной 100°C, в течение 1 часа и 15 минут в атмосфере азота.
После охлаждения воздухом реакционной смеси до комнатной температуры смесь пропускали через целит и нерастворившиеся продукты отфильтровывали и затем полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 864 мг указанного в заголовке соединения в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,96 (с, 3H), 1,01 (с, 3H), 1,23-1,66 (м, 8H), 1,48 (с, 9H), 2,75 (с, 4H), 2,93-3,01 (м, 1H), 3,12 (м, 4H), 3,49 (ушир.с, 4H), 3,86 (м, 4H), 6,70 (дд, J= 8,8, 2,8Гц, 1H), 6,83 (д, J= 2,8Гц, 1H), 7,01 (д, J= 8,8Гц, 1H).
(3g)
4-[3-(4,4-Диметилциклогексил)-4-пиперазин-1-илфенил]морфолин

Раствор трет-бутилового эфира 4-[2-(4,4-диметилциклогексил)-4-морфолин-4-илфенил]пиперазин-1-карбоновой кислоты (864 мг, 1,89 ммоль), полученного в примере (3f), в смеси этилацетат (15 мл)-дихлорметан (2 мл) перемешивали при комнатной температуре в атмосфере азота. По каплям добавляли 4н. раствор хлористого водорода в этилацетате (15 мл, 60 ммоль) и смесь перемешивали 12 часов в аналогичных условиях.
После завершения реакции, для подщелачивания смеси, к реакционной смеси добавляли насыщенный водный раствор карбоната натрия. Добавляли хлороформ и воду и смесь экстрагировали хлороформом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 621 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,97 (с, 3H), 1,01 (с, 3H), 1,31-1,64 (м, 8H), 2,77-2,93 (м, 4H), 2,96-3,01 (м, 5H), 3,11-3,14 (м, 4H), 3,85-3,87 (м, 4H), 6,72 (дд, J= 8,8, 2,8Гц, 1H), 6,84 (д, J= 2,8Гц, 1H), 7,07 (д, J= 8,8Гц, 1H).
1H у NH не мог быть идентифицирован.
(3h)
Гидрохлорид 4-[3-(4,4-Диметилциклогексил)-4-(4-изобутилпиперазин-1-ил)фенил]морфолина

К смеси 4-[3-(4,4-диметилциклогексил)-4-пиперазин-1-илфенил]морфолина (100 мг, 0,28 ммоль), полученного в примере (3 г), изобутиральдегида (40 мг, 0,559 ммоль) и тетрагидрофурана (2 мл) добавляли триацетоксиборгидрид натрия (119 мг, 0,559 ммоль) при комнатной температуре в атмосфере азота.
После перемешивания в течение 2 часов и 50 минут к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан) с получением 114 мг 4-[3-(4,4-диметилциклогексил)-4-(4-изобутилпиперазин-1-ил)фенил]морфолина в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,93 (д, J= 6,4Гц, 6H), 0,97 (с, 3H), 1,01 (с, 3H), 1,34 (тд, J = 12,8, 4,8 Гц, 2H), 1,43-1,62 (м, 6H), 1,83 (dq, J= 7,2, 6,4Гц, 1H), 2,16 (д, J= 7,2Гц, 2H), 2,53 (ушир.с, 4H), 2,82-2,85 (м, 4H), 2,93-3,01 (м, 1H), 3,11-3,13 (м, 4H), 3,85-3,87 (м, 4H), 6,71 (дд, J= 8,8, 2,8Гц, 1H), 6,83 (д, J= 2,8Гц, 1H), 7,09 (д, J= 8,8Гц, 1H).
Данный продукт растворяли в смешанном растворителе, включающем этилацетат и дихлорметан, и затем добавляли 4н. раствор хлористого водорода в этилацетате. Полученный гидрохлорид фильтровали с получением 127 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 414(MH+).
(Пример 4)
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин

(4a)
3,3,5,5-Тетраметилциклогекс-1-ениловый эфир трифторметансульфоновой кислоты

Раствор 3,3,5,5-тетраметилциклогексанона (12,8 г, 82,98 ммоль) в безводном тетрагидрофуране (300 мл) охлаждали до температуры ниже -70°C на бане сухой лед-ацетон в атмосфере азота. К перемешиваемому раствору постепенно по каплям добавляли литий бис(триметилсилил)амид (1M раствор в тетрагидрофуране, 100 мл, 100 ммоль) в течение 15 минут. После перемешивания в течение 40 минут в аналогичных условиях к реакционной смеси добавляли раствор N-фенил бис(трифторметансульфонимида) (32,51 г, 91 ммоль) в безводном тетрагидрофуране (150 мл) и перемешивание продолжали в течение 13 часов и 30 минут с медленным нагреванием до комнатной температуры.
К реакционной смеси добавляли этилацетат и насыщенный солевой раствор и смесь экстрагировали этилацетатом. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 23,65 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,04 (с, 6H), 1,09 (с, 6H), 1,35 (с, 2H), 2,08 (с, 2H), 5,51 (с, 1H).
(4b)
4,4,5,5-Тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)-[1,3,2]диоксаборолан

К раствору 3,3,5,5-тетраметилциклогекс-1-енилового эфира трифторметансульфоновой кислоты (45,94 г, 0,16 моль), полученного в примере (4a), в диоксане (500 мл) добавляли бис(пинаколато)дибор (44,9 г, 0,177 моль), 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладий(II) дихлорметановый комплекс (4 г, 4,9 ммоль) и ацетат калия (47,3 г, 0,482 моль), смесь перемешивали при внешней температуре, равной 80°C, в течение 16 часов и 30 минут.
К реакционной смеси добавляли этилацетат, воду и насыщенный солевой раствор, и смесь экстрагировали этилацетатом. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 39,27 г указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,92 (с, 6H), 1,01 (с, 6H), 1,27 (с, 12H), 1,31 (с, 2H), 1,84 (д, J= 1,6Гц, 2H), 6,26 (т, J= 1,6Гц, 1H).
(4c)
Трет-бутиловый эфир 4-(2-гидроксифенил)пиперазин-1-карбоновой кислоты
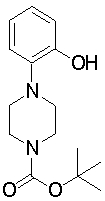
Суспензию 2-(1-пиперазино)фенола (3,56 г, 20 ммоль) в ацетонитриле (15 мл) перемешивали при комнатной температуре. Добавляли раствор ди-трет-бутил дикарбоната (4,8 г, 22 ммоль) в ацетонитриле (15 мл).
После перемешивания в течение 1 часа нерастворившиеся продукты отфильтровывали и фильтрат концентрировали. Перед обработкой ультразвуком к остатку добавляли гексан. Полученное твердое вещество фильтровали и высушивали при пониженном давлении с получением сырого продукта, указанного в заголовке соединения (5,35 г) в виде светло-коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,49 (с, 9H), 2,82 (т, J= 4,8Гц, 4H), 3,59 (т, J= 4,8Гц, 4H), 6,87 (тд, J= 7,6, 1,2Гц, 1H), 6,96 (дд, J= 8,0, 1,2Гц, 1H), 7,07-7,14 (м, 2H).
1H у OH не мог быть идентифицирован.
(4d)
Трет-бутиловый эфир 4-(2-трифторметансульфонилоксифенил)пиперазин-1-карбоновой кислоты

Смесь трет-бутилового эфира 4-(2-гидроксифенил)пиперазин-1-карбоновой кислоты (4,61 г, 16,56 ммоль), полученного в примере (4c), триэтиламина (11,5 мл, 82,5 ммоль) и дихлорметана (100 мл) охлаждали на ледяной бане в атмосфере азота. Постепенно по каплям в течение 40 минут при перемешивании смеси добавляли трифторметансульфоновый ангидрид (4 мл, 23,78 ммоль).
После перемешивания в течение 17 минут, в аналогичных условиях, к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, этилацетат и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали дважды насыщенным водным раствором хлорида аммония, потом промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 5,54 г указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,48 (с, 9H), 2,95 (т, J= 4,8Гц, 4H), 3,62 (т, J= 4,8Гц, 4H), 7,10-7,16 (м, 2H), 7,18 (дд, J= 8,0, 1,6Гц, 1H), 7,33 (ддд, J= 7,2, 7,2, 1,6Гц, 1H).
(4e)
Трет-бутиловый эфир 4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты

Смесь трет-бутилового эфира 4-(2-трифторметансульфонилоксифенил)пиперазин-1-карбоновой кислоты (6,16 г, 15 ммоль), полученного в примере (4d), 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)-[1,3,2]диоксаборолана (4,6 г, 17,41 ммоль), полученного в примере (4b), фосфата трикалия (3,2 г, 15 ммоль), 1,2-диметоксиэтана (60 мл) и воды (3 мл) перемешивали при комнатной температуре в атмосфере азота. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (1,74 г, 1,5 ммоль). Затем смесь перемешивали при внешней температуре, равной 85°C, в течение 2 часов и 20 минут.
К реакционной смеси добавляли этилацетат и воду и затем пропускали через целит и фильтровали. Органический экстракт из фильтрата высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 5,78 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,02 (с, 6H), 1,07 (с, 6H), 1,40 (с, 2H), 1,48 (с, 9H), 2,16 (д, J= 1,6Гц, 2H), 2,91 (т, J= 5,2Гц, 4H), 3,51 (т, J= 5,2Гц, 4H), 5,50 (т, J= 1,6Гц, 1H), 6,97 (дд, J= 8,0, 1,2Гц, 1H), 7,01 (ддд, J= 8,0, 8,0, 1,2Гц, 1H), 7,09 (дд, J= 8,0, 1,6Гц, 1H), 7,20 (ддд, J= 8,0, 8,0, 1,6Гц, 1H).
(4f)
1-[2-(3,3,5,5-Тетраметилциклогекс-1-енил)фенил]пиперазин

Смесь трет-бутилового эфира 4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты (1,78 г, 4,47 ммоль), полученного в примере (4e), трифторуксусной кислоты (5 мл, 64,9 ммоль) и дихлорметана (15 мл) перемешивали при комнатной температуре в течение 8 часов и 20 минут.
Реакционную смесь подщелачивали 5н. водным гидроксидом натрия, при охлаждении на бане с ледяной водой. Затем добавляли этилацетат и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением сырого продукта, указанного в заголовке соединения (1,62 г) в виде светло-коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,03 (с, 6H), 1,07 (с, 6H), 1,41 (с, 2H), 2,12 (д, J= 1,6Гц, 2H), 3,14 (т, J= 6,0 Гц, 4H), 3,19 (т, J= 6,0Гц, 4H), 5,49 (т, J= 1,6Гц, 1H), 7,01-7,11 (м, 3H), 7,22 (ддд, J= 8,0, 7,2, 2,0Гц, 1H).
1H у NH не мог быть идентифицирован.
(4g)
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина

К смеси 1-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина (150 мг, 0,503 ммоль), полученного в примере (4f), бутиральдегида (0,09 мл, 1,011 ммоль) и тетрагидрофурана (7 мл) добавляли триацетоксиборгидрид натрия (270 мг, 1,274 ммоль) и уксусную кислоту (0,03 мл, 0,524 ммоль), в указанном порядке, при комнатной температуре.
После перемешивания в течение 30 минут к реакционной смеси добавляли этилацетат, насыщенный водный гидрокарбонат натрия и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 120 мг 1-бутил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,93 (т, J= 7,2Гц, 3H), 1,02 (с, 6H), 1,07 (с, 6H), 1,34 (кв., J= 7,2Гц, 2H), 1,40 (с, 2H), 1,48-1,55 (м, 2H), 2,17 (д, J= 1,6Гц, 2H), 2,35-2,39 (м, 2H), 2,55 (ушир.с, 4H), 3,02 (ушир.с, 4H), 5,51 (т, J= 1,6Гц, 1H), 6,96-7,02 (м, 2H), 7,07 (дд, J= 7,2, 1,6Гц, 1H), 7,19 (ддд, J= 8,0, 7,2, 1,6Гц, 1H).
Продукт растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали, к полученному остатку добавляли диэтиловый эфир и гексан и кристаллы фильтровали. Затем данный продукт высушивали с помощью вакуумного насоса, с получением 124 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 355(MH+).
(Пример 5)
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина

К смеси 1-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина (40 мг, 0,134 ммоль), полученного в примере (4f), циклопропанкарбальдегида (0,014 мл, 0,187 ммоль) и тетрагидрофурана (3 мл) добавляли триацетоксиборгидрид натрия (34 мг, 0,16 ммоль) и уксусную кислоту (0,008 мл, 0,140 ммоль), в указанном порядке, при комнатной температуре.
После перемешивания в течение 1 часа к реакционной смеси добавляли этилацетат, насыщенный водный раствор гидрокарбоната натрия и воду и смесь экстрагировали этилацетатом. Отделенный органический слой концентрировали при пониженном давлении и полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан) с получением 38 мг 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина. Строение целевого соединения подтверждали с помощью ТСХ и соединение подвергали следующей обработке.
Соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали и к полученному остатку для кристаллизации добавляли диэтиловый эфир. Добавляли гексан и удаляли супернатант раствор смеси диэтиловый эфир-гексан. Полученный твердый остаток высушивали при пониженном давлении с получением 35 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 353(MH+).
(Пример 6)
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-5-метоксифенил]-4-(тетрагидропиран-4-илметил)пиперазина

4,4-Диэтил-2-циклогексенон

Ссылка: Michael E. Flaugh, Thomas A. Crowell, and Diane S. Farlow, J. Org. Chem., 1980, 45, 5399.
(6a)
4,4-Диэтилциклогексанон
Смесь 4,4-диэтил-2-циклогексенона (1 г, 6,57 ммоль), 10% палладия на угле (60 мг, влажный) и этилацетата (15 мл) перемешивали в течение 26 часов в атмосфере водорода при атмосферном давлении и комнатной температуре.
Реакционную смесь фильтровали и затем фильтрат концентрировали при пониженном давлении с получением сырого продукта, указанного в заголовке соединения (720 мг) в виде коричневого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,85 (т, J= 7,6Гц, 6H), 1,43 (кв, J= 7,6Гц, 4H), 1,65 (дд, J= 7,2, 7,2Гц, 4H), 2,31 (дд, J= 7,2, 7,2Гц, 4H).
(6b)
4,4-Диэтилциклогекс-1-ениловый эфир трифторметансульфоновой кислоты

Раствор 4,4-диэтилциклогексанона (720 мг, 4,67 ммоль), полученного в примере (6a), в безводном тетрагидрофуране (20 мл) охлаждали до температуры ниже -70°C на бане сухой лед-ацетон в атмосфере азота и затем перемешивали. К данному раствору постепенно по каплям добавляли литий бис(триметилсилил)амид (1M раствор в тетрагидрофуране, 5,6 мл, 5,6 ммоль). После перемешивания в течение 60 минут в аналогичных условиях к реакционной смеси добавляли N-фенил бис(трифторметансульфонимид) (1,75 г, 4,9 ммоль) и перемешивание продолжали в течение 27 часов медленно нагревая до комнатной температуры.
К реакционной смеси добавляли насыщенный водный раствор хлорида аммония. Затем к реакционной смеси добавляли этилацетат и насыщенный солевой раствор и отделяли органический слой. После промывания органического слоя разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия, в указанном порядке, его высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 710 мг указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,80 (т, J= 7,6Гц, 6H), 1,21-1,40 (м, 4H), 1,55 (т, J= 6,6Гц, 2H), 1,95 (дт, J= 4,0, 2,8Гц, 2H), 2,25-2,30 (м, 2H), 5,63-5,66 (м, 1H).
(6c)
2-(4,4-Диэтилциклогекс-1-енил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан

К раствору 4,4-диэтилциклогекс-1-енилового эфира трифторметансульфоновой кислоты (5,11 г, 17,8 ммоль), полученного в примере (6b), в диоксане (60 мл) добавляли бис(пинаколато)дибор (5,2 г, 20,5 ммоль), 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладий(II) дихлорметановый комплекс (580 мг, 0,71 ммоль) и ацетат калия (5,3 г, 53,5 ммоль) и смесь перемешивали при внешней температуре, равной 90°C, в течение 4 часов. Реакционную смесь охлаждали воздухом до комнатной температуры и нерастворившиеся продукты отфильтровывали. К полученному фильтрату добавляли этилацетат и воду и органический слой отделяли. Органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 4,16 г указанного в заголовке соединения в виде белых кристаллов.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,76 (т, J= 7,6Гц, 6H), 1,13-1,37 (м, 18H), 1,84-1,86 (м, 2H), 2,05-2,10 (м, 2H), 6,48-6,50 (м, 1H).
(6d)
1-(4,4-Диэтилциклогекс-1-енил)-4-метокси-2-нитробензол

Смесь 4-бром-3-нитроанизола (2 г, 8,62 ммоль), 2-(4,4-диэтилциклогекс-1-енил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана (2,7 г, 10,3 ммоль), полученного в примере (6c), трикалий фосфата (2,7 г, 13,0 ммоль) и 1,2-диметоксиэтана (20 мл) перемешивали при комнатной температуре в атмосфере азота и затем добавляли тетракис(трифенилфосфин)палладий(0) (0,5 г, 0,43 ммоль). Потом смесь перемешивали при внешней температуре, равной 80°C в течение 26 часов.
После охлаждения реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 2,4 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,82 (т, J= 7,2Гц, 6H), 1,22-1,54 (м, 6H), 1,87-1,94 (м, 2H), 2,14-2,20 (м, 2H), 3,84 (с, 3H), 5,48-5,54 (м, 1H), 7,04 (дд, J= 8,4, 2,8Гц, 1H), 7,16 (д, J= 8,4Гц, 1H), 7,29 (д, J= 2,8 Гц, 1H).
(6e)
2-(4,4-Диэтилциклогекс-1-енил)-5-метоксифениламин

К раствору 1-(4,4-диэтилциклогекс-1-енил)-4-метокси-2-нитробензола (2,4 г, 8,3 ммоль), полученного в примере (6d), в этаноле (20 мл), добавляли водный раствор (5 мл) хлорида аммония (2,2 г, 41 ммоль) и порошкоообразное железо (1,2 г, 20,7 ммоль), и смесь перемешивали при внешней температуре, равной 90°C в течение 1 часа. Для фильтрования реакционную смесь пропускали через целит и затем добавляли насыщенный солевой раствор к фильтрату и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния, осушитель отфильтровывали и затем фильтрат концентрировали при пониженном давлении с получением 2,6 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,82 (т, J= 7,2 Гц, 6H), 1,21-1,56 (м, 6H), 1,92-1,96 (м, 2H), 2,16-2,22 (м, 2H), 3,75 (с, 3H), 5,61-5,65 (м, 1H), 6,24 (д, J= 2,8Гц, 1H), 6,29 (дд, J= 8,4, 2,8Гц, 1H), 6,87 (д, J= 8,4Гц, 1H).
2Н у NH2 не могли быть идентифицированы.
(6f)
1-[2-(4,4-Диэтилциклогекс-1-енил)-5-метоксифенил]пиперазин

Раствор 2-(4,4-диэтилциклогекс-1-енил)-5-метоксифениламина (2,6 г, 10 ммоль), полученного в примере (6e), и гидрохлорида бис(2-хлорэтил)амина (2,2 г, 12 ммоль) в 1,2-дихлорбензоле (10 мл) перемешивали при внешней температуре, равной 210°C. В реактор в процессе проведения реакции для удаления избытка газообразного хлористого водорода в реакторе несколько раз вдували газообразный азот. Через 1 час реакционную смесь охлаждали до комнатной температуры и затем добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1,4 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,82 (т, J= 7,2Гц, 6H), 1,22-1,52 (м, 6H), 1,90-1,96 (м, 2H), 2,38-2,46 (м, 2H), 2,78-3,04 (м, 8H), 3,79 (с, 3H), 5,61-5,66 (м, 1H), 6,50 (дд, J= 8,4, 2,8Гц, 1H), 6,52 (д, J= 2,8Гц,1H), 6,99 (д, J= 8,4Гц, 1H).
1H у NH не мог быть идентифицирован.
MS m/e (ESI) 329(MH+).
(6g)
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]-4-(тетрагидропиран-4-илметил)пиперазина

К раствору 1-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]пиперазина (90 мг, 0,27 ммоль), полученного в примере (6f), в тетрагидрофуране (10 мл) добавляли тетрагидропиран-4-карбальдегид (37 мг, 0,32 ммоль), триацетоксиборгидрид натрия (87 мг, 0,41 ммоль) и уксусную кислоту (32 мг, 0,57 ммоль), в указанном порядке и смесь перемешивали при комнатной температуре в течение 1 часа и 30 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан) с получением 50 мг 1-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]-4-(тетрагидропиран-4-илметил)пиперазина в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,82 (т, J= 7,2Гц, 6H), 1,40-1,94 (м, 13H), 2,22 (д, J= 7,2Гц, 2H), 2,35-2,58 (м, 6H), 2,94-3,18 (м, 4H), 3,38 (тд, J= 12, 2,0Гц, 2H), 3,77 (с, 3H), 3,90-4,00 (м, 2H), 5,59-5,64 (м, 1H), 6,47 (дд, J= 8,4, 2,8Гц, 1H), 6,51 (д, J= 2,8Гц, 1H), 6,97 (д, J= 8,4Гц, 1H).
Полученное соединение растворяли в этилацетате и затем добавляли 4н. раствор хлористого водорода в этилацетате, и смесь перемешивали при комнатной температуре в течение 15 минут. Растворитель отгоняли при пониженном давлении и твердый остаток промывали диэтиловым эфиром. Затем его фильтровали с получением 50 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e (ESI) 427(MH+).
(6h)
1-[2-(4,4-Диэтилциклогексил)-5-метоксифенил]-4-(тетрагидропиран-4-илметил)пиперазин гидрохлорид

К раствору гидрохлорида 1-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]-4-(тетрагидропиран-4-илметил)пиперазина (34 мг), полученного в примере (6g), в метаноле (5 мл) добавляли десяти процентный палладий на угле (100 мг, влажный) и смесь перемешивали в течение 13 часов в атмосфере водорода при атмосферном давлении и комнатной температуре. Реакционную смесь пропускали через целит для фильтрования и фильтрат концентрировали при пониженном давлении. Твердый остаток промывали диэтиловым эфиром. Затем его фильтровали с получением 34 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CD3OD)
δ: 0,82 (т, J= 7,2Гц, 3H), 0,83 (т, J= 7,2Гц, 3H), 1,20-1,82 (м, 17H), 2,16-2,28 (м, 2H), 2,86-2,96 (м, 1H), 3,10-3,36 (м, 6H), 3,48 (тд, J= 12, 2,0Гц, 2H), 3,68 (д, J= 7,2Гц, 2H), 3,77 (с, 3H), 3,98 (дд, J= 7,2, 4,0Гц, 2H), 6,72 (д, J= 2,8Гц, 1H), 6,74 (дд, J= 8,4, 2,8Гц, 1H), 7,20 (д, J= 8,4Гц, 1H).
MS m/e (ESI) 429(MH+).
(Пример 7)
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина

(7a)
Гидрохлорид 4-метоксипиперидина

К перемешиваемому раствору безводного тетрагидрофурана (100 мл) и диметилформамида (40 мл) добавляли трет-бутиловый эфир 4-гидроксипиперидин-1-карбоновой кислоты (25,5 г, 127 ммоль). Раствор охлаждали до 0°C на ледяной бане при перемешивании. Гидрид натрия (60% дисперсия в масле, 7,6 г, 190 ммоль) постепенно добавляли в течение 3 минут. Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 70 минут и вновь охлаждали до 0°C. К реакционной смеси постепенно в течение 20 минут добавляли раствор метилйодида (9,5 мл, 152 ммоль) в безводной смеси тетрагидрофуран(20 мл)-диметилформамид (5 мл). Ледяную баню убирали и реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа.
После завершения реакции к реакционной смеси добавляли воду и диэтиловый эфир и органический слой отделяли. Органический слой промывали 3 раза водой и затем один раз насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении.
К остатку добавляли этилацетат (200 мл) и смесь охлаждали до 0°C и перемешивали. Затем постепенно в течение 10 минут добавляли 4н. раствор хлористого водорода в этилацетате (100 мл), и температура медленно поднималась до значения комнатной.
После перемешивания в течение 13 часов реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в небольшом количестве дихлорметана. Потом добавляли избыточное количество этилацетата и выпавшее в осадок твердое вещество отфильтровывали и высушивали при пониженном давлении с получением 17,0 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,95-2,02 (м, 2H), 2,05-2,15 (м, 2H), 3,14-3,30 (м, 4H), 3,32 (с, 3H), 3,52-3,57 (м, 1H).
1H у NH не мог быть идентифицирован.
(7b)
5-(4-Метоксипиперидин-1-ил)-2-нитрофенол

Смесь гидрохлорида 4-метоксипиперидина (9,10 г, 60,01 ммоль), полученного в примере (7a), 5-фтор-2-нитрофенола (6,91 г, 43,98 ммоль) и диметилформамида (12 мл) перемешивали в атмосфере азота. К реакционной смеси добавляли триэтиламин (15,24 мл, 109,95 ммоль) и смесь перемешивали при внешней температуре, равной 80°C, в течение 3 часов и 30 минут.
После завершения реакции к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и смешанный растворитель, содержащий этилацетат и диэтиловый эфир. Органический слой отделяли и водный слой экстрагировали диэтиловым эфиром. Полученные органические слои объединяли и высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 37,36 г указанного в заголовке соединения оранжевых кристаллов.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,60-1,68 (м, 2H), 1,83-1,90 (м, 2H), 3,26 (ддд, J= 13,2, 8,0, 3,6Гц, 2H), 3,32 (с, 3H), 3,42-3,47(м, 1H), 3,62 (ддд, J= 13,2, 7,6, 3,6Гц, 2H), 6,24 (д, J= 2,8Гц, 1H), 6,36 (дд, J= 10,0, 2,8Гц, 1H), 7,87 (д, J= 10,0Гц, 1H).
1H у OH не мог быть идентифицирован.
(7c)
5-(4-Метоксипиперидин-1-ил)-2-нитрофениловый эфир трифторметансульфоновой кислоты

Смесь 5-(4-метоксипиперидин-1-ил)-2-нитрофенола (2,35 г, 8,16 ммоль), полученного в примере (7b), триэтиламина (5,7 мл, 40,9 ммоль) и дихлорметана (50 мл) перемешивали на бане с ледяной водой и затем постепенно в течение 15 минут по каплям добавляли трифторметансульфоновый ангидрид (2 мл, 12,24 ммоль), и смесь перемешивали в течение 10 минут в аналогичных условиях.
К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и затем добавляли этилацетат и воду и органический слой отделяли. Органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 3,276 г указанного в заголовке соединения в виде оранжевого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,66-1,74 (м, 2H), 1,84-1,92 (м, 2H), 3,27 (ддд, J= 13,2, 7,6, 3,6Гц, 2H), 3,23 (с, 3H), 3,47 (м, 1H), 3,58 (ддд, J= 12, 8,0, 3,6Гц, 2H), 6,54 (д, J= 2,8Гц, 1H), 6,72 (дд, J= 9,6, 2,8Гц, 1H), 8,07 (д, J= 9,6Гц, 1H).
(7d)
2-(4-Трет-бутилциклогекс-1-енил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан

К 4-трет-бутилциклогекс-1-ениловому эфиру трифторметансульфоновой кислоты (55,0 г, 192,1 ммоль), полученного в примере (2a), добавляли бис(пинаколато)дибор (56,1 г, 220,9 ммоль), 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладий(II) дихлорметановый комплекс (4,88 г, 5,98 ммоль), ацетат калия (56,6 г, 576,3 ммоль) и диоксан (400 мл) и смесь перемешивали при внешней температуре, равной 80°C, в течение 16 часов.
После завершения реакции реакционную смесь охлаждали воздухом до комнатной температуры, к реакционной смеси добавляли этилацетат и воду и органический слой отделяли. Полученный органический слой вновь промывали водой и высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 38,97 г указанного в заголовке соединения в виде светло-желтого твердого вещества, в рацемической форме по положению трет-бутила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,85 (с, 9H), 1,00-1,43 (м, 14H), 1,78-1,90 (м, 2H), 1,98-2,17 (м, 2H), 2,24-2,32 (м, 1H), 6,59 (дд, J= 2,0Гц, 1H).
(7e)
1-[3-(4-Трет-бутилциклогекс-1-енил)-4-нитрофенил]-4-метоксипиперидин

К раствору 5-(4-метоксипиперидин-1-ил)-2-нитрофенилового эфира трифторметансульфоновой кислоты (3,276 г, 8,52 ммоль), полученного в примере (7c), в 1,2-диметоксиэтане (80 мл) добавляли 2-(4-трет-бутилциклогекс-1-енил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан (2,478 г, 9,38 ммоль), полученный в примере (7d), тетракис(трифенилфосфин)палладий(0) (492 мг, 0,426 ммоль) и трикалий фосфат (2,714 г, 12,79 ммоль), и смесь перемешивали при внешней температуре, равной 90°C в течение 2 часов и 30 минут в атмосфере азота.
После завершения реакции к реакционной смеси добавляли насыщенный солевой раствор и этилацетат. Органический слой отделяли и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 1,87 г указанного в заголовке соединения оранжевых кристаллов, в рацемической форме по положению трет-бутила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,90 (с, 9H), 1,38-1,43 (м, 2H), 1,64-1,74 (м, 2H), 1,86-2,00(м, 3H), 2,13-2,33 (м, 4H), 3,21 (ддд, J= 12,4, 8,4, 3,6Гц, 2H), 3,38 (с, 3H), 3,46 (м, 1H), 3,67 (ддд, J= 11,2, 7,2, 3,6Гц, 2H), 5,57(т, J=2,4Гц, 1H), 6,54 (д, J= 2,8Гц, 1H), 6,72 (дд, J= 9,6, 2,8Гц, 1H), 8,07 (д, J= 9,6Гц, 1H).
(7f)
2-(4-Трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фениламин

По очереди добавляли 1-[3-(4-трет-бутилциклогекс-1-енил)-4-нитрофенил]-4-метоксипиперидин (1,87 г, 5,02 ммоль), полученный в примере (7e), хлорид аммония (93,6 мг, 1,75 ммоль), смешанный раствор, состоящий из этанола (30 мл) и воды (10 мл), и порошкоообразное железо (981 мг, 17,57 ммоль) и смесь перемешивали при внешней температуре, равной 90°C, в течение 2 часов в атмосфере азота.
К реакционной смеси добавляли хлорид аммония (30 мг, 0,56 ммоль) и порошкоообразное железо (300 мг, 5,37 ммоль) и смесь перемешивали в течение 3 часов и 15 минут в аналогичных условиях. Нерастворившиеся продукты реакционной смеси фильтровали и к фильтрату затем добавляли этилацетат и насыщенный солевой раствор. Органический слой отделяли и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1,155 г указанного в заголовке соединения в виде светло-желтого твердого вещества, в рацемической форме по положению трет-бутила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,90 (с, 9H), 1,24-1,42 (м, 2H), 1,66-1,76 (м, 2H), 1,90-2,06 (м, 4H), 2,14-2,24 (м, 1H), 2,28-2,32 (м, 2H), 2,72-2,80(м, 2H), 3,26-3,37 (м, 3H), 3,37 (с, 3H), 5,75 (ушир.с, 1H), 6,63 (д, J= 8,4Гц, 1H), 6,67 (с, 1H), 6,71 (д, J= 8,4Гц, 1H).
2Н у NH2 не могли быть идентифицированы.
(7g)
1-[2-(4-Трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин

К раствору 2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фениламина (1,155 г, 3,37 ммоль), полученного в примере (7f), в 1,2-дихлорбензоле (15 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (722 мг, 4,04 ммоль), и смесь перемешивали при внешней температуре, равной 200°C в атмосфере азота.
Удаляли избыток газообразного хлористого водорода в реакторе, используя несколько раз в процессе проведения реакции струю азота.
Через 6 часов реакционную смесь охлаждали до комнатной температуры. Для подщелачивания водного слоя к реакционной смеси добавляли водный карбонат калия и затем этилацетат и добавляли небольшое количество метанола. Органический слой отделяли и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан) с получением 660 мг указанного в заголовке соединения в виде светло-желтого твердого вещества, в рацемической форме по положению трет-бутила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,84 (с, 9H), 1,12-1,32 (м, 2H), 1,58-1,66 (м, 2H), 1,80-1,98 (м, 4H), 2,08-2,16 (м, 1H), 2,28-2,40 (м, 1H), 2,59-2,62 (м, 1H), 2,76 (тд, J= 12,0, 2,8Гц, 4H), 2,83-2,91 (м, 6H), 3,22-3,28 (м, 1H), 3,31 (с, 3H), 3,36-3,42 (м, 2H), 5,63 (т, J= 2,4Гц, 1H), 6,67 (д, J= 3,2Гц, 1H), 6,70 (дд, J= 8,4, 3,2Гц, 1H), 6,81 (д, J= 8,4Гц, 1H).
1H у NH не мог быть идентифицирован.
(7h)
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина

К раствору 1-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина (100 мг, 0,243 ммоль), полученного в примере (7g), в тетрагидрофуране (3 мл) добавляли бутиральдегид (0,0281 мл, 0,316 ммоль), триацетоксиборгидрид натрия (87,1 мг, 0,316 ммоль) и уксусную кислоту (0,0267 мл, 0,466 ммоль) и смесь перемешивали при комнатной температуре в течение 4 часов и 30 минут.
После завершения реакции к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали 3 раза этилацетатом. Полученные органические слои объединяли и высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 103 мг 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина в виде бесцветного твердого вещества, в рацемической форме по положению трет-бутила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,89-0,96 (м, 12H), 1,18-1,39 (м, 4H), 1,48-1,60 (м, 2H), 1,64-1,74 (м, 2H), 1,86-2,06 (м, 4H), 2,14-2,23 (м, 1H), 2,30-2,42 (м, 3H), 2,47-2,60 (м, 4H), 2,66-2,74 (м, 1H), 2,78-2,86 (м, 2H), 2,89-3,06 (м, 4H), 3,28-3,35 (м, 1H), 3,37 (с, 3H), 3,41-3,48 (м, 2H), 5,69 (ушир.с, 1H), 6,73 (с, 1H), 6,76 (д, J= 8,4Гц, 1H), 6,89 (д, J= 8,4Гц, 1H).
Продукт растворяли в этилацетате (3 мл) и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,11 мл, 0,44 ммоль).
Реакционный растворитель удаляли при пониженном давлении, добавляли диэтиловый эфир и полученное твердое вещество фильтровали с получением 83 мг указанного в заголовке соединения в виде бесцветного твердого вещества, в рацемической форме по положению трет-бутила.
MS m/e (ESI) 468(MH+).
(Пример 8)
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

(8a)
Трет-бутиловый эфир 4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты
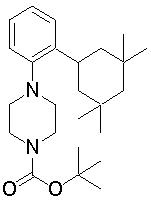
Смесь трет-бутилового эфира 4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты (3,87 г, 9,71 ммоль), полученного в примере (4e), 10% палладия на угле (2,3 г, влажный), метанола (25 мл) и тетрагидрофурана (25 мл) перемешивали в течение 22 часов и 30 минут в атмосфере водорода при атмосферном давлении и комнатной температуре.
После фильтрования реакционной смеси фильтрат концентрировали. К остатку добавляли этилацетат, смесь вновь фильтровали и фильтрат концентрировали при пониженном давлении с получением сырого продукта, указанного в заголовке соединения (3,83 г) в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,92 (с, 6H), 1,12 (с, 6H), 1,12-1,47 (м, 6H), 1,49 (с, 9H), 2,83 (ушир.с, 4H), 3,59 (тт, J= 12,4, 2,8Гц, 1H), 7,07 (тд, J= 7,6, 1,2Гц, 1H), 7,10 (дд, J= 7,6, 1,2Гц, 1H), 7,16 (тд, J= 7,6, 2,0Гц, 1H), 7,24 (дд, J= 7,6, 2,0Гц, 1H).
4Н у пиперазинового кольца не могли быть идентифицированы.
MS m/e (ESI) 401(MH+).
(8b)
1-[2-(3,3,5,5-Тетраметилциклогексил)фенил]пиперазин
Смесь трет-бутилового эфира 4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (9,79 г, 24,44 ммоль), полученного в примере (8a), трифторуксусной кислоты (25 мл, 346 ммоль) и дихлорметана (50 мл) перемешивали при комнатной температуре в течение 1 часа и 30 минут.
После завершения реакции реакционную смесь охлаждали на бане с ледяной водой и подщелачивали 5н. водным гидроксидом натрия. Затем добавляли этилацетат и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Для осаждения кристаллов к полученному остатку добавляли гексан и кристаллы фильтровали и высушивали с помощью вакуумного насоса, с получением 4,94 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) для части продукта массой около 4,94 г:
δ: 0,94 (с, 6H), 1,11 (с, 6H), 1,13-1,44 (м, 6H), 3,17 (ушир.с, 4H), 3,35 (ушир.с, 4H), 3,47 (тт, J= 12,4, 2,8Гц, 1H), 7,10-7,30 (м, 4H).
1H у NH не мог быть идентифицирован.
После концентрирования полученной маточной жидкости фильтрованием получали 4,94 г указанного в заголовке соединения, полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 2,23 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3) для части продукта массой около 2,23 г:
δ: 0,92 (с, 6H), 1,13 (с, 6H), 1,17-1,35 (м, 4H), 1,41-1,46 (м, 2H), 2,84-2,86 (м, 4H), 3,01-3,03 (м, 4H), 3,59 (тт, J= 12,8, 2,8Гц, 1H), 7,04-7,16 (м, 3H), 7,21 (дд, J= 7,6, 1,6Гц, 1H).
1H у NH не мог быть идентифицирован.
(8c)
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К раствору 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (300 мг, 1,00 ммоль), полученного в примере (8b), в тетрагидрофуране (20 мл) добавляли бутиральдегид (107 мг, 1,49 ммоль), триацетоксиборгидрид натрия (420 мг, 1,99 ммоль) и уксусную кислоту (60 мг, 0,99 ммоль), в указанном порядке, смесь перемешивали при комнатной температуре в течение 13 часов и 30 минут. После завершения реакции к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния и затем осушитель фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан) с получением 270 мг 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,92 (с, 6H), 0,94 (т, J= 7,2 Гц, 3H), 1,12 (с, 6H), 1,20-1,60 (м, 10H), 2,37-2,41 (м, 2H), 2,40-2,62 (ушир.с, 4H), 2,92(т, J=4,8Гц, 4H), 3,57 (тт, J= 12,4, 2,8 Гц, 1H), 7,03-7,08 (м, 1H), 7,09-7,16 (м, 2H), 7,19-7,22 (м, 1H).
Продукт растворяли в дихлорметане (5 мл) и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,21 мл, 0,83 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель реакционной смеси отгоняли при пониженном давлении с получением сырого продукта, указанного в заголовке соединения (290 мг) в виде светло-желтого твердого вещества. К полученному сырому продукту (290 мг) добавляли этилацетат (30 мл) и смесь перемешивали при внешней температуре, равной 100°C, в течение 2 часов до завершения растворения. Затем ее медленно охлаждали воздухом до комнатной температуры и перемешивали в течение 21 часов. Осажденный гидрохлорид фильтровали с получением 235 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CD3OD)
δ: 0,96 (с, 6H), 1,03 (т, J= 7,2Гц, 3H), 1,18 (с, 6H), 1,18-1,52 (м, 10H), 1,72-1,81 (м, 2H), 3,10-3,75 (м, 8H), 3,56(тт, J= 12,4, 2,8Гц, 1H), 7,13-7,20 (м, 3H), 7,26-7,29 (м, 1H).
MS m/e (ESI) 357(MH+).
(Пример 9)
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К раствору 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (200 мг, 0,666 ммоль), полученного в примере (8b), в тетрагидрофуране (4 мл) добавляли циклопропанкарбальдегид (70 мг, 0,999 ммоль) и смесь перемешивали при комнатной температуре в течение 5 минут. К реакционной смеси добавляли триацетоксиборгидрид натрия (282 мг, 1,33 ммоль) и после перемешивания в течение 5 минут добавляли уксусную кислоту (0,038 мл, 0,666 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов.
После завершения реакции к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 182 мг 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-пиперазина в виде бесцветных кристаллов.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,12-0,16 (м, 2H), 0,52-0,56 (м, 2H), 0,88-0,96(м, 1H), 0,92 (с, 6H), 1,12 (с, 6H), 1,13-1,45 (м, 6H), 2,32 (д, J = 6,4Гц, 2H), 2,70 (ушир.с, 4H), 2,95 (т, J = 4,4Гц, 4H), 3,60 (тт, J = 12,4, 2,8Гц, 1H), 7,04-7,08 (м, 1H), 7,11-7,14 (м, 2H), 7,20-7,22 (м, 1H).
Полученное соединение (147 мг, 0,415 ммоль) растворяли в дихлорметане (3 мл), и затем к смеси в атмосфере азота добавляли 4н. раствор хлористого водорода в этилацетате (0,11 мл, 0,456 ммоль). После перемешивания в течение 15 минут при комнатной температуре, растворитель отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат (13 мл) и смесь перемешивали при внешней температуре, равной 100°C, в течение 1 часа до завершения растворения. Затем раствор охлаждали воздухом до комнатной температуры и перемешивали в течение 19 часов и 45 минут. Осажденный гидрохлорид фильтровали с получением 134 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 355(MH+).
(Пример 10)
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-этилацетамида

(10a)
1-[2-(4-Трет-бутилциклогексил)фенил]пиперазин
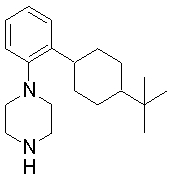
К смеси 2-(4-трет-бутилциклогексил)фениламина (810 мг, 3,5 ммоль), полученного в примере (2c), и 1,2-дихлорбензола (5 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (750 мг, 4,2 ммоль) и смесь кипятили с обратным холодильником в течение 1 часа и 30 минут.
Реакционную смесь охлаждали до комнатной температуры, добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали смешанным растворителем, включающим этилацетат и тетрагидрофуран. Отделенный органический слой высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/метанол), с получением 420 мг указанного в заголовке соединения в виде светло-желтого твердого вещества, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
MS m/e (ESI) 301(MH+).
(10b)
Гидрохлорид 2-{4-[2-(4-Трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-этилацетамида

Смесь 1-[2-(4-трет-бутилциклогексил)фенил]пиперазина (400 мг, 1,33 ммоль), полученного в примере (10a), 2-хлор-N-этилацетамида (200 мг, 1,65 ммоль), карбоната калия (400 мг, 2,89 ммоль) и диметилформамида (15 мл) перемешивали при внешней температуре, равной 115°C, в течение 2 часов.
После завершения реакции к реакционной смеси добавляли этилацетат и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали дважды водой и затем насыщенным солевым раствором, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан) с получением 506 мг 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-этилацетамида в виде бесцветного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,88 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 1,10-1,21 (м, 6H), 1,35-1,48 (м, 2H), 1,68-1,98 (м, 4H), 2,67 (ушир.с, 4H), 2,87-2,92 (м, 4H), 3,06 (с, 2H x 0,6), 3,09 (с, 2H x 0,4), 3,30-3,40 (м, 4H), 7,05-7,22 (м, 3H+1H x 0,4), 7,44 (д, J= 8,0Гц, 1H x 0,6).
Продукт растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали при пониженном давлении, к полученному остатку добавляли диэтиловый эфир и осажденные кристаллы фильтровали. Затем кристаллы высушивали при пониженном давлении с получением 476 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положению трет-бутилциклогексила.
MS m/e (ESI) 386(MH+).
(Пример 11)
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-(пиперидин-1-ил)этанона
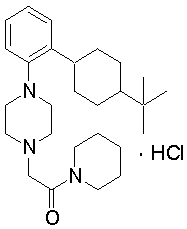
Смесь 1-[2-(4-трет-бутилциклогексил)фенил]пиперазина (50 мг, 0,166 ммоль), полученного в примере (10a), 1-(2-хлорацетил)пиперидина (33 мг, 0,204 ммоль), карбоната калия (60 мг, 0,434 ммоль) и диметилформамида (5 мл) перемешивали при внешней температуре, равной 115°C, в течение 2 часов.
К реакционной смеси добавляли этилацетат, насыщенный водный раствор хлорида аммония и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали дважды насыщенным солевым раствором и затем насыщенным солевым раствором, и потом высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 51 мг 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-(пиперидин-1-ил)этанона в виде бесцветного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,88 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 1,10-1,27 (м, 2H), 1,35-1,46 (м, 2H), 1,54-1,98 (м, 10H), 2,65 (ушир.с, 4H), 2,85-2,92 (м, 4H), 2,94-3,04 (м, 1H x 0,4), 3,24 (с, 2H x 0,6), 3,26 (с, 2H x 0,4), 3,35-3,47 (м, 1H+1H x 0,6), 3,50-3,58 (м, 4H), 7,05-7,28 (м, 3H+1H x 0,4), 7,40 (д, J= 8,0Гц, 1H x 0,6).
Продукт растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали, к полученному остатку добавляли этилацетат и смесь дополнительно концентрировали. К полученному остатку добавляли диэтиловый эфир и осажденные кристаллы фильтровали и высушивали при пониженном давлении с получением 37 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положению трет-бутилциклогексила.
MS m/e (ESI) 426(MH+).
(Пример 12)
Гидрохлорид цис-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрила
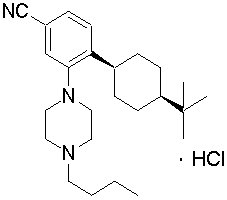
(12a)
1-(4-Трет-бутилциклогекс-1-енил)-4-метокси-2-нитробензол

Смесь 2-(4-трет-бутилциклогекс-1-енил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана (3,17 г, 12 ммоль), полученного в примере (7d), 1-бром-4-метокси-2-нитробензола (2,32 г, 10 ммоль), трикалий фосфата (4,8 г, 15 ммоль), 1,2-диметоксиэтана (30 мл) и воды (5 мл) перемешивали при комнатной температуре в атмосфере азота. К данной реакционной смеси добавляли тетракис(трифенилфосфин)палладий(0) (578 мг, 0,5 ммоль). Смесь перемешивали при внешней температуре, равной 70°C, в течение 18 часов и 30 минут.
К реакционной смеси добавляли этилацетат и воду и затем для фильтрования пропускали через целит. Фильтрат разделяли на масло и воду и полученный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 2,89 г указанного в заголовке соединения в виде желтого твердого вещества, в рацемической форме по положению трет-бутила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,89 (с, 9H), 1,31-1,43 (м, 2H), 1,86-1,95 (м, 2H), 2,13-2,34 (м, 3H), 3,85 (с, 3H), 5,59-5,61 (м, 1H), 7,05 (дд, J = 8,8, 2,4 Гц, 1H), 7,17 (д, J = 8,8 Гц, 1H), 7,31 (д, J = 2,4 Гц, 1H).
(12b)
2-(4-Трет-бутилциклогексил)-5-метоксифениламин

Смесь 1-(4-трет-бутилциклогекс-1-енил)-4-метокси-2-нитробензола (2,89 г, 10,0 ммоль), полученного в примере (12a), 10% палладия на угле (1,0 г, влажный), метанола (15 мл) и тетрагидрофурана (15 мл) перемешивали в течение 12 часов в атмосфере водорода при атмосферном давлении и комнатной температуре.
Реакционную смесь пропускали через целит для фильтрования и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат), с получением 2,56 г указанного в заголовке соединения в виде желтого твердого вещества, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,86 (с, 9H x 0,65), 0,89 (с, 9H x 0,35), 1,05-1,46 (м, 4H), 1,58-1,66 (м, 2H x 0,65), 1,70-1,81 (м, 2H x 0,65), 1,88-1,98 (м, 4H x 0,35), 2,03-2,10 (м, 1H), 2,34 (тт, J= 11,6, 3,2Гц, 1H x 0,35), 2,84-2,89 (м, 1H x 0,65), 3,65 (ушир.с, 2H), 3,74 (с, 3H x 0,35), 3,75 (с, 3H x 0,65), 6,25-6,26 (м, 1H), 6,32-6,36 (м, 1H), 7,00 (д, J= 8,4 Гц, 1H x 0,35), 7,24 (д, J= 8,4Гц, 1H x 0,65).
(12c)
1-[2-(4-Трет-бутилциклогексил)-5-метоксифенил]пиперазин

К раствору 2-(4-трет-бутилциклогексил)-5-метоксифениламина (2,56 г, 9,79 ммоль), полученного в примере (12b), в 1,2-дихлорбензоле (10 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (2,10 г, 11,75 ммоль), смесь перемешивали в атмосфере азота при внешней температуре, равной 200°C.
Для удаления газообразного хлористого водорода в реакторе, в процессе проведения реакции, в реактор вдували струю азота. Данную процедуру повторяли несколько раз.
Через 1 час и 30 минут смесь охлаждали воздухом до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат и смесь перемешивали, после чего нерастворившиеся продукты в реакционной смеси фильтровали через целит. Фильтрат экстрагировали этилацетатом, полученный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1,77 г указанного в заголовке соединения в виде коричневого масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,88 (с, 9H x 0,65), 0,89 (с, 9H x 0,35), 1,09-1,21 (м, 4H), 1,36-1,45 (м, 1H), 1,56-1,63 (м, 1H), 1,68-1,97 (м, 4H), 2,77-2,83 (м, 4H), 2,91 (тт, J= 12,4, 3,2Гц, 1H x 0,35), 2,98-3,03 (м, 4H), 3,32 (тт, J= 5,2Гц, 1H x 0,65), 3,77 (с, 3H x 0,35), 3,783 (с, 3H x 0,65), 6,61-6,67 (м, 1H x 0,65 +2H x 0,35), 6,73 (д, J = 2,4Гц, 1H x 0,65), 7,13 (д, J = 8,8Гц, 1H x 0,35), 7,34 (д, J= 8,4Гц, 1H x 0,65).
(12d)
4-(4-Трет-бутилциклогексил)-3-пиперазин-1-илфенол
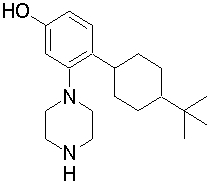
Смесь 1-[2-(4-трет-бутилциклогексил)-5-метоксифенил]пиперазина (1,77 г, 5,36 ммоль), полученного в примере (12c), 48% бромистоводородной кислоты (50 мл) и уксусной кислоты (30 мл) перемешивали при внешней температуре, равной 130°C, в течение 8 часов и 30 минут в атмосфере азота.
Затем реакционную смесь охлаждали на бане с ледяной водой и перемешивали. pH реакционной смеси доводили до значения 8-9 с помощью 5н. водного раствора гидроксида натрия. Выпавшее в осадок твердое вещество фильтровали и промывали водой, и затем к твердому веществу добавляли смешанный растворитель, включающий метанол и этилацетат (соотношение компонентов (объем/объем) = 1/5). Нерастворившиеся продукты отфильтровывали и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли диэтиловый эфир, и затем смесь диспергировали ультразвуком и полученное твердое вещество фильтровали. Твердое вещество высушивали при пониженном давлении с получением 1,43 г указанного в заголовке соединения в виде светло-коричневого твердого вещества, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, DMSO-d6)
δ: 0,85 (с, 9H x 0,65), 0,86 (с, 9H x 0,35), 1,00-1,90 (м, 9H), 2,17 (ушир.с, 1H), 2,59-2,68 (м, 1H x 0,35 + 4H), 2,75-2,83 (м, 4H), 3,20-3,25 (м, 1H x 0,65), 6,40-6,46 (м, 1H x 0,35 + 1H), 6,52 (д, J= 2,8Гц, 1H x 0,65), 6,95 (д, J= 8,4Гц, 1H x 0,35), 7,12 (д, J= 8,4Гц, 1H x 0,65), 9,03 (ушир.с, 1H x 0,35), 9,05 (ушир.с, 1H x 0,65).
(12e)
4-(4-Трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенол

В безводном тетрагидрофуране (10 мл) растворяли 4-(4-трет-бутилциклогексил)-3-пиперазин-1-илфенол (1 г, 3,16 ммоль), полученный в примере (12d), и раствор охлаждали на бане с ледяной водой в атмосфере азота. К реакционной смеси добавляли бутиральдегид (0,31 мл, 3,48 ммоль), триацетоксиборгидрид натрия (1 г, 4,74 ммоль) и уксусную кислоту (0,18 мл, 3,16 ммоль), в указанном порядке и смесь нагревали до комнатной температуры при перемешивании.
Затем смесь перемешивали в течение 4 часов и 30 минут и для гашения реакции к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия. Дополнительно добавляли этилацетат и воду, и полученную реакционную смесь помещали в делительную воронку и интенсивно встряхивали, и затем оставляли отстаиваться. Отделенный водный слой удаляли и органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 886 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,88 (с, 9H x 0,7), 0,89 (с, 9H x 0,3), 0,94 (т, J= 7,6Гц, 3H), 1,01-1,96 (м, 13H), 2,42-2,92 (м, 1H x 0,3 + 10H), 3,28 (тт, J= 5,2, 5,2Гц, 1H x 0,7), 6,53-6,59 (м, 1H), 6,65 (д, J= 2,8Гц, 1H x 0,3), 6,71(д, J= 2,8Гц, 1H x 0,7), 7,06 (д, J= 8,4Гц, 1H x 0,3), 7,27 (д, J= 8,4Гц, 1H x 0,7).
1H у OH не мог быть идентифицирован.
(12f)
Цис-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фениловый эфир трифторметансульфоновой кислоты
и
Транс-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фениловый эфир трифторметансульфоновой кислоты
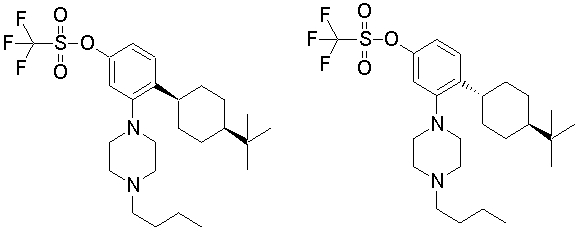
Раствор 4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенола (1,6 г, 4,29 ммоль), полученный в примере (12e), и триэтиламин (3,1 мл, 22,24 ммоль) в безводном дихлорметане (30 мл) охлаждали на бане лед-этанол. Постепенно по каплям к раствору в течение 30 минут при перемешивании добавляли трифторметансульфоновый ангидрид (1,1 мл, 6,54 ммоль).
После перемешивания в течение 30 минут к реакционной смеси добавляли этилацетат, насыщенный водный раствор хлорида аммония и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 946 мг цис-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенилового эфира трифторметансульфоновой кислоты, 110 мг транс-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенилового эфира трифторметансульфоновой кислоты и 946 мг цис/транс смеси, каждый в виде бесцветного масла. Цис/транс смесь дополнительно очищали с помощью хроматографии на колонке с силикагелем (этилацетат/гексан), с получением 214 мг цис-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенилового эфира трифторметансульфоновой кислоты, 82 мг транс-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенилового эфира трифторметансульфоновой кислоты и 434 мг цис/транс смеси, каждый в виде бесцветного масла.
цис форма:
1H-ЯМР (400 МГц, CDCl3)
δ: 0,89 (с, 9H), 0,94 (т, J= 7,2 Гц, 3H), 1,15-1,45 (м, 6H), 1,47-1,67 (м, 3H), 1,67-1,80 (м, 2H), 1,86-1,95 (м, 2H), 2,37-2,44 (м, 2H), 2,59 (ушир.с, 4H), 2,88 (т, J= 4,8Гц, 4H), 3,35 (тт, J= 5,2, 5,2Гц, 1H), 6,97 (дд, J= 8,4, 2,8Гц, 1H), 7,00 (д, J= 2,8Гц, 1H), 7,45 (д, J= 8,4Гц, 1H).
транс форма:
1H-ЯМР (400 МГц, CDCl3)
δ: 0,90 (с, 9H), 0,95 (т, J = 7,2Гц, 3H), 1,08-1,20 (м, 2H), 1,32-1,46 (м, 4H), 1,48-1,62 (м, 3H), 1,78-1,94 (м, 4H), 2,40-2,46 (м, 2H), 2,62 (ушир.с, 4H), 2,89 (т, J= 4,8Гц, 4H), 2,94 (тт, J= 12,0, 3,6Гц, 1H), 6,94 (д, J= 2,4Гц, 1H), 6,95 (дд, J= 9,2, 2,4Гц, 1H), 7,24 (д, J= 9,2Гц, 1H).
(12g)
Гидрохлорид цис-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрила

Смесь цис-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенилового эфира трифторметансульфоновой кислоты (1,16 г, 2,3 ммоль), полученного в примере (12f), цианида цинка (2,7 г, 23 ммоль) и диметилформамида (30 мл) перемешивали при комнатной температуре в атмосфере азота. К этой смеси добавляли тетракис(трифенилфосфин)палладий(0) (370 мг, 0,32 ммоль). Затем смесь перемешивали при внешней температуре, равной 100°C, в течение 19 часов и 10 минут.
К реакционной смеси добавляли этилацетат, разбавленный водный раствор аммиака и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали разбавленным водным раствором аммиака, водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 880 мг цис-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрила в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,88 (с, 9H), 0,94 (т, J = 7,2Гц, 3H), 1,15-1,44 (м, 6H), 1,48-1,67 (м, 3H), 1,70-1,80 (м, 2H), 1,88-1,96 (м, 2H), 2,38-2,44 (м, 2H), 2,59 (ушир.с, 4H), 2,88 (т, J= 4,8Гц, 4H), 3,38 (тт, J= 5,6, 5,6Гц, 1H), 7,34 (дд, J= 7,6, 2,0Гц, 1H), 7,35 (д, J= 2,0Гц, 1H), 7,47 (д, J= 7,6Гц, 1H).
Продукт растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали, к полученному остатку добавляли диэтиловый эфир и гексан, и осажденные кристаллы фильтровали. Затем кристаллы высушивали при пониженном давлении с получением 892 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 382(MH+).
(Пример 13)
Гидрохлорид транс-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрила

Смесь транс-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенилового эфира трифторметансульфоновой кислоты (30 мг, 0,0594 ммоль), полученного в примере (12f), цианида цинка (8 мг, 0,0681 ммоль) и диметилформамида (1 мл) перемешивали при комнатной температуре в атмосфере азота. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (6 мг, 0,0052 ммоль). Затем смесь перемешивали при внешней температуре, равной 100°C, в течение 9 часов. Дополнительно к реакционной смеси добавляли цианид цинка (70 мг, 0,596 ммоль) и тетракис(трифенилфосфин)палладий(0) (20 мг, 0,0173 ммоль), затем эту смесь перемешивали при внешней температуре, равной 100°C, в течение 14 часов и 10 минут.
После завершения реакции к реакционной смеси добавляли этилацетат, разбавленный водный раствор аммиака и воду и смесь экстрагировали этилацетатом. Отделенный органический слой промывали разбавленным водным раствором аммиака, водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 10 мг транс-4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрила в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,90 (с, 9H), 0,95 (т, J= 7,2Гц, 3H), 1,09-1,20 (м, 2H), 1,31-1,46 (м, 4H), 1,49-1,58 (м, 3H), 1,77-1,96 (м, 4H), 2,40-2,46 (м, 2H), 2,62 (ушир.с, 4H), 2,89 (т, J= 5,2Гц, 4H), 2,99 (тт, J= 12,0, 3,2Гц, 1H), 7,27 (д, J= 7,6Гц, 1H), 7,30 (д, J= 1,6Гц, 1H), 7,32 (дд, J= 7,6, 1,6Гц, 1H).
Продукт растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали, к полученному остатку для образования осадка добавляли диэтиловый эфир и гексан и затем его измельчали с помощью ультразвука. После удаления супернатанта полученный твердый остаток высушивали при пониженном давлении с получением 7 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 382(MH+).
(Пример 14)
Гидрохлорид 1-бутил-4-(2-циклогексилфенил)пиперазин

Циклогекс-1-ениловый эфир трифторметансульфоновой кислоты
Ссылка: Crich, D.; Smith, M.; Yao, Q.; Picione, J.; Synthesis 2001, (2), 323-326.
(14a)
2-(Циклогекс-1-енил)нитробензол

При осуществлении взаимодействия способом, аналогичным описанному в примере (2b), и аналогичным способом обработки, в качестве исходного продукта вместо 4-трет-бутилциклогекс-1-енилового эфира трифторметансульфоновой кислоты использовали циклогекс-1-ениловый эфир трифторметансульфоновой кислоты (1,0 г, 5,9 ммоль) с получением 0,56 г указанного в заголовке соединения в виде красного масла.
(14b)
2-Циклогексилфениламин

Полученный в примере (14a) 2-(циклогекс-1-енил)нитробензол (0,56 г, 2,75 ммоль) подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (2c), с получением 0,51 г указанного в заголовке соединения в виде светло-желтого масла.
(14c)
1-(2-Циклогексилфенил)пиперазин

Полученный в примере (14b) 2-циклогексилфениламин (0,48 г, 2,75 ммоль) подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (3c), с получением 0,25 г указанного в заголовке соединения в виде светло-желтого масла.
(14d)
Гидрохлорид 1-бутил-4-(2-циклогексилфенил)пиперазин

При осуществлении взаимодействия и обработки способом, аналогичным описанному в примере (6g), в качестве исходного продукта использовали полученный в примере (14c) 1-(2-циклогексилфенил)пиперазин (0,25 г, 1,02 ммоль), и вместо тетрагидропиран-4-карбальдегида использовали бутиральдегид, с получением 195 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e (ESI) 301(MH+).
(Пример 15)
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (10a) 1-[2-(4-трет-бутилциклогексил)фенил]пиперазин (160 мг, 0,53 ммоль).
Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (6g), используя бутиральдегид вместо тетрагидропиран-4-карбальдегида, с получением 65 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положению трет-бутилциклогексила.
MS m/e (ESI) 357(MH+).
(Пример 16)
Гидрохлорид 4-бутил-1-[2-(4-трет-бутилциклогексил)фенил]-3-метилпиперазин-2-она

(16a)
N-[2-(4-трет-Бутилциклогексил)фенил]-2-хлор-N-(2-гидроксиэтил)пропионамид

В качестве исходного продукта использовали полученный в примере (2d) 2-[2-(4-трет-бутилциклогексил)фениламино]этанол (271 мг, 0,984 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (2e), и обработки аналогичным способом, вместо хлорацетил хлорида использовали 2-хлорпропионилхлорид, с получением 136 мг указанного в заголовке соединения в виде бесцветного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила и метила.
(16b)
N-[2-(4-Трет-бутилциклогексил)фенил]-2-хлор-N-(2-оксоэтил)пропионамид

В качестве исходного продукта использовали полученный в примере (16a) N-[2-(4-трет-бутилциклогексил)фенил]-2-хлор-N-(2-гидроксиэтил)пропионамид (134 мг, 0,366 ммоль).
Его подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (2f), с получением сырого продукта, указанного в заголовке соединения (166 мг) в виде светло-желтого масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила и метила.
(16c)
Гидрохлорид 4-бутил-1-[2-(4-трет-бутилциклогексил)фенил]-3-метилпиперазин-2-она

В качестве исходного продукта использовали полученный в примере (16b) N-[2-(4-трет-бутилциклогексил)фенил]-2-хлор-N-(2-оксоэтил)пропионамид (165 мг).
Его подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (2g), с получением 80 мг 4-бутил-1-[2-(4-трет-бутилциклогексил)фенил]-3-метилпиперазин-2-она в виде светло-желтого масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила и метила.
Продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (2g), с получением 51 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила и метила.
MS m/e (ESI) 385(MH+).
(Пример 17)
Гидрохлорид 1-{4-[2-(4,4-диметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она

В качестве исходного продукта использовали полученный в примере (3c) 1-[2-(4,4-диметилциклогексил)фенил]пиперазин (420 мг, 1,54 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (10b), и обработки аналогичным способом, вместо 2-хлор-N-этилацетамида использовали 1-бром-2-бутанон и вместо диметилформамида использовали ацетонитрил, с получением 488 мг 1-{4-[2-(4,4-диметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,97 (с, 3H), 1,01 (с, 3H), 1,10 (т, J= 7,2Гц, 3H), 1,29-1,36 (м, 2H), 1,46-1,68 (м, 6H), 2,51 (кв., J= 7,2Гц, 2H), 2,58-2,72 (ушир., 4H), 2,90-3,00 (м, 5H), 3,28 (с, 2H), 7,06-7,18 (м, 3H), 7,25-7,28 (м, 1H).
Масло растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор разбавляли гексаном и концентрировали при пониженном давлении. К полученному твердому остатку добавляли смесь на основе диэтилового эфира и гексана, его измельчали с помощью ультразвука и затем фильтровали с получением 496 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 343(MH+).
(Пример 18)
Гидрохлорид 4-[3-(4-трет-бутилциклогекс-1-енил)-4-(4-бутилпиперазин-1-ил)фенил]морфолина

(18a)
5-Морфолин-4-ил-2-нитрофениловый эфир трифторметансульфоновой кислоты

Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (7c), используя в качестве исходного продукта 5-морфолин-4-ил-2-нитрофенол (12 г, 53,5 ммоль) вместо 5-(4-метоксипиперидин-1-ил)-2-нитрофенола, и, используя пиридин вместо растворителя на основе смеси дихлорметан-триэтиламин, с получением 17,24 г указанного в заголовке соединения в виде желтых кристаллов.
(18b)
4-[3-(4-Трет-бутилциклогекс-1-енил)-4-нитрофенил]морфолин

При осуществлении взаимодействия способом, аналогичным описанному в примере (7e), и обработки аналогичным способом, в качестве исходного продукта использовали полученный в примере (18a) 5-морфолин-4-ил-2-нитрофениловый эфир трифторметансульфоновой кислоты (3,08 г, 8,64 ммоль). Соответственно, получали 2,68 г указанного в заголовке соединения в виде желтых кристаллов в рацемической форме по положению трет-бутила.
(18c)
2-(4-Трет-бутилциклогекс-1-енил)-4-морфолин-4-ил)фениламин

При осуществлении взаимодействия способом, аналогичным описанному в примере (6e), и обработки аналогичным способом, в качестве исходного продукта использовали полученный в примере (18b) 4-[3-(4-трет-бутилциклогекс-1-енил)-4-нитрофенил]морфолин (2,68 г, 7,77 ммоль). Соответствеено, получали 2,19 г указанного в заголовке соединения в виде светло-коричневых кристаллов, в рацемической форме по положению трет-бутила.
(18d)
4-[3-(4-Трет-бутилциклогекс-1-енил)-4-пиперазин-1-илфенил]морфолин

Взаимодействие проводили способом, аналогичным описанному в примере (7g), при 200°C в течение 18 часов, используя в качестве исходного продукта 2-(4-трет-бутилциклогекс-1-енил)-4-морфолин-4-ил)фениламин (2,19 г, 6,96 ммоль), полученный в примере (18c), и затем обработку выполняли аналогичным способом. В качестве результата получали 1,84 г указанного в заголовке соединения в виде светло-коричневых кристаллов, в рацемической форме по положению трет-бутила.
(18e)
Гидрохлорид 4-[3-(4-трет-бутилциклогекс-1-енил)-4-(4-бутилпиперазин-1-ил)фенил]морфолин

Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (7h), используя в качестве исходного продукта полученный в примере (18d) 4-[3-(4-трет-бутилциклогекс-1-енил)-4-пиперазин-1-илфенил]морфолин (0,32 г, 0,834 ммоль). Таким образом получали 350 мг указанного в заголовке соединения в виде бесцветных кристаллов, в рацемической форме по положению трет-бутила.
MS m/e (ESI) 440(MH+).
(Пример 19)
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-(2-метоксиэтил)пиперазина

В качестве исходного продукта использовали полученный в примере (10a) 1-[2-(4-трет-бутилциклогексил)фенил]пиперазин (100 мг, 0,333 ммоль). Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (10b), используя 2-бромэтилметиловый эфир вместо 2-хлор-N-этилацетамида и ацетонитрил вместо диметилформамида, с получением 115 мг 1-[2-(4-трет-бутилциклогексил)фенил]-4-(2-метоксиэтил)пиперазина в виде бесцветного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила. Масло преобразовывали в гидрохлорид способом, аналогичным описанному в примере (10b), с получением 124 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положению трет-бутилциклогексила.
MS m/e (ESI) 359(MH+).
(Пример 20)
Гидрохлорид 1-[2-(4-Трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-циклопропилметилпиперазина

В качестве исходного продукта при осуществлении взаимодействия способом, аналогичным описанному в примере (9), и обработки аналогичным способом использовали 1-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин (100 мг, 0,243 ммоль), полученный в примере (7g), с получением 104 мг 1-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-циклопропилметилпиперазина в виде бесцветного твердого вещества, в рацемической форме по положению трет-бутилциклогексила. Продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (9), с получением 79 мг указанного в заголовке соединения в виде светло-желтого твердого вещества, в рацемической форме по положению трет-бутила.
MS m/e (ESI) 466(MH+).
(Пример 21)
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]пиперазина

(21a)
Гидрохлорид 4-этоксипиперидина

В качестве исходного продукта использовали трет-бутиловый эфир 4-гидроксипиперидин-1-карбоновой кислоты (2,2 г, 10,9 ммоль). Для проведения взаимодействия способом, аналогичным описанному в примере (7a), вместо метилйодида использовали этилйодид и обработку проводили аналогичным способом, с получением 1,3 г указанного в заголовке соединения в виде светло-желтых кристаллов.
(21b)
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (3c) 1-[2-(4,4-диметилциклогексил)фенил]пиперазин (65 мг, 0,239 ммоль). Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (8c), с получением 82 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 329(MH+).
(21c)
1-[4-Бром-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазин

В качестве исходного продукта использовали полученный в примере (21b) гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)фенил]пиперазина (64 мг, 0,175 ммоль). Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (3e), исключая из используемых реагентов ацетат натрия, с получением 71 мг указанного в заголовке соединения в виде светло-желтого масла.
(21d)
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]пиперазина
В качестве исходных продуктов использовали полученный в примере (21c) 1-[4-бром-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазин (20 мг, 0,0491 ммоль) и полученный в примере (21a) гидрохлорид 4-этоксипиперидина (11 мг, 0,0638 ммоль).
Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (3f), с дополнительным добавлением натрий трет-бутоксида в эквивалентном количестве по отношению к 4-этоксипиперидин гидрохлориду, с получением 1-бутил-4-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]пиперазина в виде бесцветного масла. Полученное масло растворяли в этилацетате (3 мл) и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,0082 мл). Смесь дополнительно разбавляли гексаном (5 мл) и концентрировали при пониженном давлении. Осажденный сырой кристаллический продукт промывали гексаноми, затем высушивали, с получением 16 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 456(MH+).
(Пример 22)
Гидрохлорид 1-(тетрагидропиран-4-илметил)-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (4f) 1-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин (120 мг, 0,402 ммоль). При осуществлении взаимодействия способом, аналогичным описанному в примере (4g), и обработки аналогичным способом, вместо бутиральдегида использовали тетрагидропиран-4-карбальдегид, с получением 131 мг 1-(тетрагидропиран-4-илметил)-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 1,02 (с, 6H), 1,07 (с, 6H), 1,23-1,34 (м, 2H), 1,39 (с, 2H), 1,67-1,83 (м, 3H), 2,17 (д, J= 1,6Гц, 2H), 2,22 (д, J= 6,8Гц, 2H), 2,51 (ушир.с, 4H), 2,99 (ушир.с, 4H), 3,39 (тд, J= 12,0, 2,0Гц, 2H), 3,95-3,99 (м, 2H), 5,50 (с, 1H), 6,96-7,00 (м, 2H), 7,07 (дд, J= 7,6, 1,6Гц, 1H), 7,18 (ддд, J= 8,0, 8,0, 2,0Гц, 1H).
Данный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 113 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 397(MH+).
(Пример 23)
Гидрохлорид 1-{4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-2-она
В качестве исходного продукта использовали полученный в примере (4f) 1-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин (40 мг, 0,134 ммоль). При осуществлении взаимодействия способом, аналогичным описанному в примере (10b), и обработки аналогичным способом, вместо 2-хлор-N-этилацетамида использовали 1-бром-2-бутанон и вместо диметилформамида использовали ацетонитрил, с получением 31 мг 1-{4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-2-она в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,02 (с, 6H), 1,06 (с, 6H), 1,08 (т, J= 7,6Гц, 3H), 1,39 (с, 2H), 2,16 (д, J= 1,6Гц, 2H), 2,49 (кв., J= 7,6Гц, 2H), 2,59 (ушир.с, 4H), 3,05(т, J=4,8Гц, 4H), 3,23 (с, 2H), 5,50 (т, J= 1,6Гц, 1H), 6,97-7,02 (м, 2H), 7,07 (дд, J= 8,0, 1,6Гц, 1H), 7,19 (ддд, J= 8,0, 8,0, 1,6Гц, 1H).
Данный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 38 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
MS m/e (ESI) 369(MH+).
(Пример 24)
Гидрохлорид 1-(2-метоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (4f) 1-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин (40 мг, 0,134 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (10b), и обработки аналогичным способом, вместо 2-хлор-N-этилацетамида использовали 2-бромэтилметиловый эфир и вместо диметилформамида использовали ацетонитрил, с получением 31 мг 1-(2-метоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 1,02 (с, 6H), 1,07 (с, 6H), 1,39 (с, 2H), 2,17 (д, J= 1,2Гц, 2H), 2,61 (ушир.с, 4H), 2,62 (т, J= 5,6Гц, 2H), 3,03(т, J=4,4Гц, 4H), 3,37 (с, 3H), 3,55 (т, J= 5,6Гц, 2H), 5,50 (т, J= 1,6Гц, 1H), 6,96-7,02 (м, 2H), 7,07 (дд, J= 7,6, 2,0Гц, 1H), 7,18 (ддд, J= 8,0, 8,0, 2,0Гц, 1H).
Данный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 31 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 357(MH+).
(Пример 25)
Гидрохлорид 1-{4-[2-(3,3,5,5-Тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она

В качестве исходного продукта использовали полученный в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин (40 мг, 0,133 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (10b), и обработки аналогичным способом, вместо 2-хлор-N-этилацетамида использовали 1-бром-2-бутанон и вместо диметилформамида использовали ацетонитрил, с получением 33 мг 1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,92 (с, 6H), 1,09 (т, J= 7,2Гц, 3H), 1,11 (с, 6H), 1,17-1,34 (м, 4H), 1,40-1,44 (м, 2H), 2,50 (кв., J= 7,2Гц, 2H), 2,66 (ушир.с, 4H), 2,96 (т, J=4,4Гц, 4H), 3,27 (с, 2H), 3,55 (тт, J= 12,8, 2,8Гц, 1H), 7,06-7,11 (м, 1H), 7,13-7,17 (м, 2H), 7,22 (дд, J= 8,0, 1,6Гц, 1H).
Данный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 33 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
MS m/e (ESI) 371(MH+).
(Пример 26)
Гидрохлорид 1-(2-метоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин (40 мг, 0,133 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (10b), и обработки аналогичным способом, вместо 2-хлор-N-этилацетамида использовали 2-бромэтилметиловый эфир и вместо диметилформамида использовали ацетонитрил с получением 37 мг 1-(2-метоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400 МГц, CDCl3)
δ: 0,92 (с, 6H), 1,12 (с, 6H), 1,17-1,34 (м, 4H), 1,41-1,45 (м, 2H), 2,65 (т, J= 5,6Гц, 2H), 2,66 (ушир.с, 4H), 2,95 (т, J=4,4Гц, 4H), 3,37 (с, 3H), 3,51-3,62 (м, 3H), 7,05-7,11 (м, 1H), 7,12-7,17 (м, 2H), 7,22 (дд, J= 7,6, 1,6Гц, 1H).
Данный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 38 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 359(MH+).
(Пример 27)
Гидрохлорид 1-бутил-4-[5-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
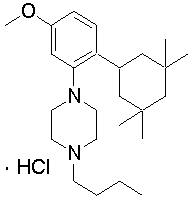
(27a)
4-Метокси-2-нитро-1-(3,3,5,5-тетраметилциклогекс-1-енил)бензол
При осуществлении взаимодействия способом, аналогичным описанному в примере (6d), и обработки аналогичным способом, вместо 2-(4,4-диэтилциклогекс-1-енил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана использовали полученный в примере (4b) 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)-[1,3,2]диоксаборолан (2,7 г, 10,3 ммоль), с получением 2,5 г указанного в заголовке соединения в виде желтого масла.
(27b)
5-Метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фениламин

Полученный в примере (27a) 4-метокси-2-нитро-1-(3,3,5,5-тетраметилциклогекс-1-енил)бензол (2,5 г, 8,6 ммоль) подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (6e), с получением 2,2 г указанного в заголовке соединения в виде желтого масла.
(27c)
1-[5-Метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин

Полученный в примере (27b) 5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фениламин (2,2 г, 8,6 ммоль) подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (6f), с получением 2,0 г указанного в заголовке соединения в виде желтого твердого вещества.
(27d)
Гидрохлорид 1-бутил-4-[5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина

Полученный в примере (27c) 1-[5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин (115 мг, 0,35 ммоль) подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (6g), используя бутиральдегид вместо тетрагидропиран-4-карбальдегида, с получением 80 мг указанного в заголовке соединения в виде светло-желтого масла.
(27e)
Гидрохлорид 1-бутил-4-[5-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Полученный в примере (27d) гидрохлорид 1-бутил-4-[5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина (70 мг, 0,16 ммоль) подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (6h), с получением 5 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e (ESI) 387(MH+).
(Пример 28)
Гидрохлорид 4-[4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина

(28a)
5-Морфолин-4-ил-2-нитрофенол

В качестве исходного продукта использовали коммерчески доступный 5-фтор-2-нитрофенол (10 г, 63,65 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (7b), вместо 4-метоксипиперидин гидрохлорида использовали морфолин. К реакционной смеси добавляли воду и затем осажденные кристаллы фильтровали, промывали водой и гексаном и высушивали воздухом, с получением 14,04 г указанного в заголовке соединения в виде желтых кристаллов.
(28b)
5-Морфолин-4-ил-2-нитрофениловый эфир трифторметансульфоновой кислоты

В качестве исходного продукта использовали полученный в примере (28a) 5-морфолин-4-ил-2-нитрофенол (14,04 г, 62,63 ммоль).
Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (7c), с получением 21,46 г указанного в заголовке соединения в виде желтых кристаллов.
(28c)
4-[4-Нитро-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолин

В качестве исходного продукта использовали полученный в примере (28b) 5-морфолин-4-ил-2-нитрофениловый эфир трифторметансульфоновой кислоты (2 г, 5,6 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (7e), и обработки аналогичным способом, вместо 2-(4-трет-бутилциклогекс-1-енил)-(4,4,5,5-тетраметил)-[1,3,2]диоксаборолана использовали полученный в примере (4b) 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)-[1,3,2]диоксаборолан, и в качестве растворителя использовали смешанный растворитель, состоящий из 1,2-диметоксиэтана и воды, с получением 1,7 г указанного в заголовке соединения в виде желтого масла.
(28d)
4-Морфолин-4-ил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фениламин

В качестве исходного продукта использовали полученный в примере (28c) 4-[4-нитро-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолин (1 г, 2,9 ммоль).
Для проведения взаимодействия аналогичным способом и обработки способом, аналогичным описанному в примере (6e), время реакции изменяли на 15 часов и 40 минут, с получением 912 мг указанного в заголовке соединения в виде желтого масла.
(28e)
4-[4-Пиперазин-1-ил-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолин

В качестве исходного продукта использовали полученный в примере (28d) 4-морфолин-4-ил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фениламин (910 мг, 2,89 ммоль).
Данный продукт подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (7g), с получением 820 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
(28f)
Гидрохлорид 4-[4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина

В качестве исходного продукта использовали полученный в примере (28e) 4-[4-пиперазин-1-ил-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолин (120 мг, 0,313 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (4g), и обработки аналогичным способом, вместо бутиральдегида использовали пропиональдегид, с получением 119 мг 4-[4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина в виде белого твердого вещества.
Данный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 135 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 426(MH+).
(Пример 29)
Гидрохлорид 4-[3-(4,4-диэтилциклогекс-1-енил)-4-(4-пентилпиперазин-1-ил)фенил]морфолина

(29a)
4-[3-(4,4-Диэтилциклогекс-1-енил)-4-нитрофенил]морфолин

В качестве исходного продукта использовали полученный в примере (28b) 5-морфолин-4-ил-2-нитрофениловый эфир трифторметансульфоновой кислоты (3 г, 8,42 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (7e), и обработки аналогичным способом, вместо 2-(4-трет-бутил-1-циклогекс-1-енил)-(4,4,5,5-тетраметил)[1,3,2]диоксаборолана использовали полученный в примере (6c) 2-(4,4-диэтилциклогекс-1-енил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан и в качестве растворителя использовали смешанный растворитель, включающий 1,2-диметоксиэтан и воду, с получением 3,11 г указанного в заголовке соединения в виде желтого масла.
(29b)
2-(4,4-Диэтилциклогекс-1-енил)-4-морфолин-4-илфениламин

В качестве исходного продукта использовали полученный в примере (29a) 4-[3-(4,4-диэтилциклогекс-1-енил)-4-нитрофенил]морфолин (3,11 г, 9,03 ммоль).
Данный продукт подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (6e), с получением 2,55 г указанного в заголовке соединения в виде коричневого масла.
(29c)
4-[3-(4,4-Диэтилциклогекс-1-енил)-4-пиперазин-1-илфенил]морфолин

В качестве исходного продукта использовали полученный в примере (29b) 2-(4,4-диэтилциклогекс-1-енил)-4-морфолин-4-илфениламин (2,55 г, 8,11 ммоль).
Данный продукт подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (7g), с получением 2,01 г указанного в заголовке соединения в виде светло-коричневого твердого вещества.
(29d)
Гидрохлорид 4-[3-(4,4-диэтилциклогекс-1-енил)-4-(4-пентилпиперазин-1-ил)фенил]морфолина
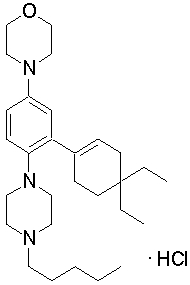
В качестве исходного продукта использовали полученный в примере (29c) 4-[3-(4,4-диэтилциклогекс-1-енил)-4-пиперазин-1-илфенил]морфолин (30 мг, 0,0782 ммоль).
Данный продукт подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (1f). Затем продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (1f), с получением 38,9 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 454 (MH+).
(Пример 30)
Гидрохлорид 1-{4-[2-(4,4-диэтилциклогекс-1-енил)-4-морфолин-4-илфенил]пиперазин-1-ил}бутан-2-она
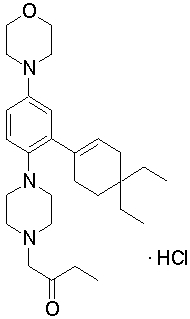
В качестве исходного продукта использовали полученный в примере (29c) 4-[3-(4,4-диэтилциклогекс-1-енил)-4-пиперазин-1-илфенил]морфолин (250 мг, 0,652 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (10b), и обработки аналогичным способом, вместо 2-хлор-N-этилацетамида использовали 1-бром-2-бутанон. Продукт дополнительно преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4 г), с получением 320 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 454(MH+).
(Пример 31)
Гидрохлорид 1-пропил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин (120 мг, 0,399 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (4g), и обработки аналогичным способом, вместо бутиральдегида использовали пропиональдегид, с получением 104 мг 1-пропил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 0,93 (т, J= 7,2Гц, 3H), 1,13 (с, 6H), 1,16-1,35 (м, 4H), 1,40-1,46 (м, 2H), 1,51-1,60 (м, 2H), 2,35-2,39 (м, 2H), 2,61 (ушир.с, 4H), 2,93(т, J=4,8Гц, 4H), 3,57 (тт, J= 12,8, 2,8Гц, 1H), 7,05-7,09 (м, 1H), 7,11-7,17 (м, 2H), 7,22 (дд, J= 7,6, 1,2Гц, 1H).
Продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 92 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 343(MH+).
(Пример 32)
Гидрохлорид 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

(32a)
4-Метокси-1-[4-нитро-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидин

В качестве исходного продукта использовали полученный в примере (7c) 5-(4-метоксипиперидин-1-ил)-2-нитрофениловый эфир трифторметансульфоновой кислоты (3 г, 7,81 ммоль). При осуществлении взаимодействия способом, аналогичным описанному в примере (7e), и обработки аналогичным способом, вместо 4-трет-бутилциклогекс-1-енил-(4,4,5,5-тетраметил)-[1,3,2]диоксаборолана использовали 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)-[1,3,2]диоксаборолан, полученный в примере (4b), и в качестве растворителя использовали смешанный растворитель, состоящий из 1,2-диметоксиэтана и воды, с получением 2,89 г указанного в заголовке соединения в виде желтого масла.
(32b)
4-(4-Метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фениламин

В качестве исходного продукта использовали полученный в примере (32a) 4-метокси-1-[4-нитро-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидин (1 г, 2,68 ммоль).
Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (2c), используя вместо этилацетата смешанный растворитель, состоящий из метанола и тетрагидрофурана, и изменяя время взаимодействия на 18 часов и 40 минут, с получением 845 мг указанного в заголовке соединения в виде светло-коричневого масла.
(32c)
1-[4-(4-Метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин

В качестве исходного продукта использовали полученный в примере (32b) 4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фениламин (843 мг, 2,45 ммоль).
Данный продукт подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (7g), с получением 596 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
(32d)
Гидрохлорид 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (32c) 1-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин (120 мг, 0,29 ммоль).
Данный продукт подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (4g), с получением 130 мг 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде светло-желтого твердого вещества.
Продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 143 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
MS m/e (ESI) 470(MH+).
(Пример 33)
Гидрохлорид 1-бутил-4-(2-спиро[4,5]дец-8-илфенил)пиперазина

(33a)
Спиро[4,5]дец-6-ен-8-он

К раствору циклопентанкарбальдегида (10 г, 100 ммоль) в толуоле (100 мл) добавляли метилвинилкетон (7,8 г, 110 ммоль) и п-толуолсульфоновую кислоту (1,9 г, 10 ммоль) и смесь перемешивали при 120°C в течение 3 часов, используя для удаления воды аппарат Дина-Старка. Реакционную смесь охлаждали воздухом до комнатной температуры, затем добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 6,0 г указанного в заголовке соединения в виде красного масла.
(33b)
Спиро[4,5]декан-8-он

При осуществлении взаимодействия способом, аналогичным описанному в примере (6a), и обработки аналогичным способом, использовали полученный в примере (33a) спиро[4,5]дец-6-ен-8-он (6,0 г, 40 ммоль), с получением 6,0 г указанного в заголовке соединения в виде красного масла.
(33c)
Спиро[4,5]дец-7-ен-8-иловый эфир трифторметансульфоновой кислоты

При осуществлении взаимодействия способом, аналогичным описанному в примере (6b), и обработки аналогичным способом, использовали полученный в примере (33b) спиро[4,5]декан-8-он (7,0 г, 46 ммоль), с получением 3,7 г указанного в заголовке соединения в виде желтого масла.
(33d)
4,4,5,5-Тетраметил-2-спиро[4,5]дец-7-ен-8-ил-[1,3,2]диоксаборолан

При осуществлении взаимодействия и обработки способом, аналогичным описанному в примере (6c), использовали полученный в примере (33c) спиро[4,5]дец-7-ен-8-иловый эфир трифторметансульфоновой кислоты (3,7 г, 40 ммоль), с получением 3,3 г указанного в заголовке соединения в виде светло-желтого масла.
(33e)
Трет-бутиловый эфир 4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазин-1-карбоновой кислоты
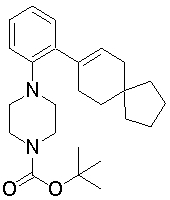
При осуществлении взаимодействия способом, аналогичным описанному в примере (4e), и обработки аналогичным способом, использовали полученный в примере (33d) 4,4,5,5-тетраметил-2-спиро[4,5]дец-7-ен-8-ил-[1,3,2]диоксаборолан (1,3 г, 4,95 ммоль), с получением 1,0 г указанного в заголовке соединения в виде светло-желтого масла.
(33f)
1-(2-Спиро[4,5]дец-7-ен-8-илфенил)пиперазин

При осуществлении взаимодействия способом, аналогичным описанному в примере (4f), и обработки аналогичным способом, использовали полученный в примере (33e) трет-бутиловый эфир 4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазин-1-карбоновой кислоты (1,0 г, 2,5 ммоль), с получением 0,6 г указанного в заголовке соединения в виде желтого масла.
(33g)
Гидрохлорид 1-бутил-4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазина

При осуществлении взаимодействия способом, аналогичным описанному в примере (4g), и обработки аналогичным способом, использовали полученный в примере (33f) 1-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазин (140 мг, 0,47 ммоль), с получением 125 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e(ESI) 353(MH+).
(33h)
Гидрохлорид 1-бутил-4-(2-спиро[4,5]дец-8-илфенил)пиперазина

При осуществлении взаимодействия способом, аналогичным описанному в примере (6h), и обработки аналогичным способом, использовали полученный в примере (33g) гидрохлорид 1-бутил-4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазина (40 мг, 0,10 ммоль), с получением 33 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e(ESI) 355(MH+).
(Пример 34)
Гидрохлорид 1-изобутил-4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазина

(34a)
Спиро[2,5]окт-5-ен-6-иловый эфир трифторметансульфоновой кислоты

При осуществлении взаимодействия способом, аналогичным описанному в примере (6b), и обработки аналогичным способом, в качестве исходного продукта вместо 4,4-диэтилциклогексанона использовали спиро[2,5]октан-2-он (1,71 г, 13,77 ммоль), с получением 3,35 г указанного в заголовке соединения в виде коричневого масла.
(34b)
4,4,5,5-Тетраметил-2-спиро[2,5]окт-5-ен-6-ил-[1,3,2]диоксаборолан

При осуществлении взаимодействия способом, аналогичным описанному в примере (6c), и обработки аналогичным способом, в качестве исходного продукта вместо 4,4-диэтилциклогекс-1-енилового эфира трифторметансульфоновой кислоты использовали полученный в примере (34a) спиро[2,5]окт-5-ен-6-иловый эфир трифторметансульфоновой кислоты (3,34 г, 13,03 ммоль), с получением 2,35 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,25-0,30 (м, 4H), 1,27 (с, 12H), 1,34-1,37 (м, 2H), 1,97-1,99 (м, 2H), 2,19-2,23 (м, 2H), 6,55-6,60 (м, 1H).
(34c)
Трет-бутиловый эфир 4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазин-1-карбоновой кислоты

В качестве исходного продукта использовали полученный в примере (4d) трет-бутиловый эфир 4-(2-трифторметансульфонилоксифенил)пиперазин-1-карбоновой кислоты (4,12 г, 10,03 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (4e), и обработки аналогичным способом, вместо 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолана использовали полученный в примере (34b) 4,4,5,5-тетраметил-2-спиро[2,5]окт-5-ен-6-ил-[1,3,2]диоксаборолан (2,35 г, 10,03 ммоль), с получением 3,09 г указанного в заголовке соединения в виде светло-желтого твердого вещества.
(34d)
1-(2-Спиро[2,5]окт-5-ен-6-илфенил)пиперазин

При осуществлении взаимодействия способом, аналогичным описанному в примере (4f), и обработки аналогичным способом, в качестве исходного продукта использовали полученный в примере (34c) трет-бутиловый эфир 4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазин-1-карбоновой кислоты (0,380 г, 1,03 ммоль), с получением 249 мг указанного в заголовке соединения в виде светло-коричневого масла.
(34e)
Гидрохлорид 1-изобутил-4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазина
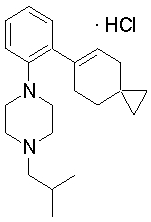
В качестве исходного продукта использовали полученный в примере (34d) 1-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазин (66 мг, 0,246 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (6g), и обработки аналогичным способом, вместо тетрагидропиран-4-карбальдегида использовали изобутиральдегид, с получением 76 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 325(MH+).
(Пример 35)
Гидрохлорид 1-(2-спиро[2,5]окт-5-ен-6-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина

В качестве исходного продукта использовали полученный в примере (34d) 1-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазин (20 мг, 0,0745 ммоль).
Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (6g), с получением 24,3 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 367(MH+).
(Пример 36)
Гидрохлорид 1-изобутил-4-(2-спиро[2,5]окт-6-илфенил)пиперазина

В качестве исходного продукта использовали полученный в примере (34e) гидрохлорид 1-изобутил-4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазина (20 мг, 0,0554 ммоль).
Взаимодействие выполняли способом, аналогичным описанному в примере (6h), и перемешивание продолжали в течение 6 часов, обработку выполняли аналогичным способом, с получением 19 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 327(MH+).
[0240]
(Пример 37)
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-изобутилпиперазина

(37a)
Трет-бутиловый эфир 4-[2-(4,4-диметилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты

В качестве исходного продукта использовали полученный в примере (4d) трет-бутиловый эфир 4-(2-трифторметансульфонилоксифенил)пиперазин-1-карбоновой кислоты (4,1 г, 10 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (4e), и обработки аналогичным способом, вместо 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолана использовали полученный в примере (1b) 2-(4,4-диметилциклогекс-1-енил)-4,4,5,5-тетраметил[1,3,2]диоксаборолан (2,83 г, 12 ммоль), с получением 3,29 г указанного в заголовке соединения в виде бесцветного твердого вещества.
(37b)
1-[2-(4,4-Диметилциклогекс-1-енил)фенил]пиперазин

В качестве исходного продукта использовали полученный в примере (37a) трет-бутиловый эфир 4-[2-(4,4-диметилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты (3,17 г, 8,56 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (3g) и обработки аналогичным способом, вместо смешанного растворителя, состоящего из этилацетата и дихлорметана, использовали дихлорметан, с получением 1,82 г указанного в заголовке соединения в виде светло-зеленого твердого вещества.
(37c)
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-изобутилпиперазина

В качестве исходного продукта использовали полученный в примере (37b) 1-[2-(4,4-диметилциклогекс-1-енил)фенил]пиперазин (200 мг, 0,740 ммоль).
Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (3h), с получением 230 мг 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-изобутилпиперазина в виде светло-желтого масла.
Продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (3h), с получением 255 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 327(MH+).
(Пример 38)
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
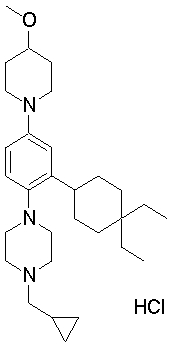
(38a)
Трет-бутиловый эфир 4-[2-(4,4-диэтилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты

В качестве исходного продукта использовали полученный в примере (4d) трет-бутиловый эфир 4-(2-трифторметансульфонилоксифенил)пиперазин-1-карбоновой кислоты (4,71 г, 11,5 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (4e), и обработки аналогичным способом, вместо 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолана использовали полученный в примере (6c) 2-(4,4-диэтилциклогекс-1-енил)-4,4,5,5-тетраметил[1,3,2]диоксаборолан (3,7 г, 14,0 ммоль), с получением 3,94 г указанного в заголовке соединения в виде коричневого масла.
(38b)
Трет-бутиловый эфир 4-[2-(4,4-диэтилциклогексил)фенил]пиперазин-1-карбоновой кислоты

В качестве исходного продукта использовали полученный в примере (38a) трет-бутиловый эфир 4-[2-(4,4-диэтилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты (3,96 г, 9,93 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (8a), и обработки аналогичным способом, вместо смешанного растворителя, состоящего из смеси тетрагидрофурана и метанола, в качестве растворителя использовали только один метанол. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 3,79 г указанного в заголовке соединения в виде желтого масла.
(38c)
Трет-бутиловый эфир 4-[4-бром-2-(4,4-диэтилциклогексил)фенил]пиперазин-1-карбоновой кислоты

В качестве исходного продукта использовали полученный в примере (38b) трет-бутиловый эфир 4-[2-(4,4-диэтилциклогексил)фенил]пиперазин-1-карбоновой кислоты (3,79 г, 9,46 ммоль).
Данный продукт подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (3e), с получением 2,75 г указанного в заголовке соединения в виде белого твердого вещества.
(38d)
Трет-бутиловый эфир 4-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин-1-карбоновой кислоты

Полученный в примере (38c) трет-бутиловый эфир 4-[4-бром-2-(4,4-диэтилциклогексил)фенил]пиперазин-1-карбоновой кислоты (900 мг, 1,88 ммоль) растворяли в ксилоле (10 мл). К смешанному раствору добавляли полученный в примере (7a) гидрохлорид 4-метоксипиперидина (430 мг, 2,84 ммоль), трет-бутоксид натрия (810 мг, 8,43 ммоль), три-трет-бутилфосфоний тетрафторборат (340 мг, 1,17 ммоль) и палладий(II)ацетат (105 мг, 0,47 ммоль), и смесь перемешивали при внешней температуре, равной 100°C, в течение 1 часа в атмосфере азота.
Затем выполняли обработку способом, аналогичным описанному в примере (3f), с получением 413 мг указанного в заголовке соединения в виде светло-красного твердого вещества.
(38e)
1-[2-(4,4-Диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин
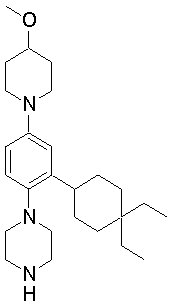
В качестве исходного продукта использовали полученный в примере (38d) трет-бутиловый эфир 4-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин-1-карбоновой кислоты (413 мг, 0,80 ммоль).
Его подвергали взаимодействию способом, аналогичным описанному в примере (8b), и обрабатывали аналогичным способом, вместо 5н. водного гидроксида натрия, используя карбонат калия, с получением 283 мг указанного в заголовке соединения в виде белого твердого вещества.
(38f)
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (38e) 1-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин (50 мг, 0,121 ммоль).
Данный продукт подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (9). Затем продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (9), с получением 60 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 468 (MH+).
(Пример 39)
1-Бутил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-ил-фенил]пиперазин

(39a)
Спиро[5,5]ундец-2-ен-3-иловый эфир трифторметансульфоновой кислоты

При осуществлении взаимодействия способом, аналогичным описанному в примере (6b), и обработки аналогичным способом, в качестве исходного продукта вместо 4,4-диэтилциклогексанона использовали спиро[5,5]ундекан-3-он (15 г, 90,2 ммоль), с получением 20,9 г указанного в заголовке соединения в виде коричневого масла.
(39b)
4,4,5,5-Тетраметил-2-спиро[5,5]ундец-2-ен-3-ил-[1,3,2]диоксаборолан

При осуществлении взаимодействия способом, аналогичным описанному в примере (6c), и обработки аналогичным способом, в качестве исходного продукта вместо 4,4-диэтилциклогекс-1-енилового эфира трифторметансульфоновой кислоты использовали полученный в примере (39a) спиро[5,5]ундец-2-ен-3-иловый эфир трифторметансульфоновой кислоты (10 г, 33,5 ммоль), с получением 7,64 г указанного в заголовке соединения в виде желтого твердого вещества.
(39c)
4-Метокси-1-(4-нитро-3-спиро[5,5]ундец-2-ен-3-ил-фенил)пиперидин

В качестве исходного продукта использовали полученный в примере (7c) 5-(4-метоксипиперидин-1-ил)-2-нитрофениловый эфир трифторметансульфоновой кислоты (2,0 г, 5,43 ммоль). При осуществлении взаимодействия способом, аналогичным описанному в примере (7e), и обработки аналогичным способом, вместо 4-трет-бутилциклогекс-1-енил-(4,4,5,5-тетраметил)-[1,3,2]диоксаборолана использовали полученный в примере (39b) 4,4,5,5-тетраметил-2-спиро[5,5]ундец-2-ен-3-ил-[1,3,2]диоксаборолан (1,65 г, 5,97 ммоль), с получением 2,331 г указанного в заголовке соединения в виде оранжевого масла.
(39d)
4-(4-Метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-ил)фениламин

При осуществлении взаимодействия способом, аналогичным описанному в примере (6e), и обработки аналогичным способом, в качестве исходного продукта использовали полученный в примере (39c) 4-метокси-1-(4-нитро-3-спиро[5,5]ундец-2-ен-3-ил-фенил)пиперидин (2,331 г, 6,06 ммоль), с получением 1,79 г указанного в заголовке соединения в виде желтого масла.
(39e)
1-[4-(4-Метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-ил-фенил]пиперазин
При осуществлении взаимодействия способом, аналогичным описанному в примере (7g), и обработки аналогичным способом, в качестве исходного продукта использовали полученный в примере (39d) 4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-ил)фениламин (1,79 г, 5,03 ммоль), с получением 1,071 г указанного в заголовке соединения в виде светло-желтого твердого вещества.
(39f)
Трет-бутиловый эфир 4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил]пиперазин-1-карбоновой кислоты

При осуществлении взаимодействия способом, аналогичным описанному в примере (3d), и обработки аналогичным способом, в качестве исходного продукта использовали полученный в примере (39e) 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-ил-фенил]пиперазин (450 мг, 1,062 ммоль), с получением 524 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
(39g)
Трет-бутиловый эфир 4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил]пиперазин-1-карбоновой кислоты

В качестве исходного продукта использовали полученный в примере (39f) трет-бутиловый эфир 4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил]пиперазин-1-карбоновой кислоты (524 мг, 1,0 ммоль). При осуществлении взаимодействия способом, аналогичным описанному в примере (8a), и обработки аналогичным способом, вместо смешанного растворителя, состоящего из метанола и тетрагидрофурана, использовали смешанный раствор метанола, тетрагидрофурана и этилацетата, с получением 517 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
(39h)
1-[4-(4-Метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил]пиперазин
При осуществлении взаимодействия способом, аналогичным описанному в примере (8b), и обработки аналогичным способом, в качестве исходного продукта использовали полученный в примере (39g) трет-бутиловый эфир 4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил]пиперазин-1-карбоновой кислоты (517 мг, 0,983 ммоль), с получением 367 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
(39i)
Гидрохлорид 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил]пиперазина

При осуществлении взаимодействия способом, аналогичным описанному в примере (7h), и обработки аналогичным способом, в качестве исходного продукта использовали полученный в примере (39h) 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил]пиперазин (50 мг, 0,117 ммоль), с получением 23 мг 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил]пиперазина в виде бесцветного твердого вещества.
Продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (7h), с получением 28 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 482(MH+).
(Пример 40)
Гидрохлорид {4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}ацетонитрила

В качестве исходного продукта использовали полученный в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин (40 мг, 0,133 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (10b), и обработки аналогичным способом, вместо 2-хлор-N-этилацетамида использовали бромацетонитрил.
Затем полученный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (10b), с получением 28 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 340(MH+).
(Пример 41)
Гидрохлорид 1-(2-этоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

В качестве исходного продукта использовали полученный в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин (40 мг, 0,133 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (10b), и обработки аналогичным способом, вместо 2-хлор-N-этилацетамида использовали этиловый эфир 2-бромэтила.
Затем полученный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (10b), с получением 34 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 373(MH+).
(Пример 42)
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазина

(42a)
Трет-бутиловый эфир 4-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазин-1-карбоновой кислоты

В качестве исходного продукта использовали полученный в примере (3e) трет-бутиловый эфир 4-[4-Бром-2-(4,4-диметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (800 мг, 1,77 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (3f), и обработки аналогичным способом, вместо морфолина использовали пиперидин, с получением 597 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
(42b)
1-[2-(4,4-Диметилциклогексил)-4-пиперидин-1-илфенил]пиперазин

В качестве исходного продукта использовали полученный в примере (42a) трет-бутиловый эфир 4-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазин-1-карбоновой кислоты (597 мг, 1,31 ммоль).
Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (3g), с получением 419 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
(42c)
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазина

В качестве исходного продукта использовали полученный в примере (42b) 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазин (50 мг, 0,141 ммоль).
При осуществлении взаимодействия способом, аналогичным описанному в примере (3h), и обработки аналогичным способом, вместо изобутиральдегида использовали циклопропанкарбальдегид.
Затем полученный продукт преобразовывали в гидрохлорид способом, аналогичным описанному в примере (3h), с получением 65 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 410(MH+).
(Пример 43)
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-5-(4,4-диэтилциклогексил)-2-метоксифенил]морфолина
(43a)
Трет-бутиловый эфир 4-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]пиперазин-1-карбоновой кислоты

При осуществлении взаимодействия способом, аналогичным описанному в примере (3d), и обработки аналогичным способом, использовали полученный в примере (6f) 1-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]пиперазин (0,9 г, 2,7 ммоль), используя в соответствии с примером (3d) в качестве растворителя тетрагидрофуран вместо дихлорметана, с получением 0,96 г указанного в заголовке соединения в виде светло-желтого масла.
(43b)
Трет-бутиловый эфир 1-[2-(4,4-диэтилциклогексил)-5-метоксифенил]пиперазин-1-карбоновой кислоты

При осуществлении взаимодействия способом, аналогичным описанному в примере (8a), и обработки аналогичным способом, использовали полученный в примере (43a) трет-бутиловый эфир 4-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]пиперазин-1-карбоновой кислоты (0,96 г, 2,2 ммоль), используя метанол вместо смешанного растворителя, состоящего из метанола и тетрагидрофурана, с получением 0,95 г указанного в заголовке соединения в виде светло-желтого масла.
(43c)
Трет-бутиловый эфир 4-[4-бром-2-(4,4-диэтилциклогексил)-5-метоксифенил]пиперазин-1-карбоновой кислоты

Взаимодействие проводили способом, аналогичным описанному в примере (3e), используя в качестве исходного продукта полученный в примере (43b) трет-бутиловый эфир 1-[2-(4,4-диэтилциклогексил)-5-метоксифенил]пиперазин-1-карбоновой кислоты (0,9 г, 2,08 ммоль) в соответствии с примером (3e) и используя ацетонитрил вместо метанола и N-бромсукцинимид вместо бромина. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом, после чего обработку выполняли аналогичным способом, с получением 0,41 г указанного в заголовке соединения в виде светло-желтого масла.
(43d)
Трет-бутиловый эфир 4-[2-(4,4-диэтилциклогексил)-4-морфолино-5-метоксифенил]пиперазин-1-карбоновой кислоты

Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (3f), используя в качестве исходного продукта полученный в примере (43c) трет-бутиловый эфир 4-[4-бром-2-(4,4-диэтилциклогексил)-5-метоксифенил]пиперазин-1-карбоновой кислоты (200 мг, 0,39 ммоль) и используя три-трет-бутилфосфин вместо три-трет-бутилфосфоний тетрафторбората, с получением 80 мг указанного в заголовке соединения в виде желтого масла.
(43e)
4-[5-(4,4-Диэтилциклогексил)-2-метокси-4-пиперазин-1-илфенил]морфолин

Взаимодействие и обработку выполняли способом, аналогичным описанному в примере (8b), используя полученный в примере (43d) трет-бутиловый эфир 4-[2-(4,4-диэтилциклогексил)-4-морфолино-5-метоксифенил]пиперазин-1-карбоновой кислоты (80 мг, 0,2 ммоль), с получением 40 мг указанного в заголовке соединения в виде желтого твердого вещества.
(43f)
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-5-(4,4-диэтилциклогексил)-2-метоксифенил]морфолина

Полученный в примере (43e) 4-[5-(4,4-диэтилциклогексил)-2-метокси-4-пиперазин-1-илфенил]морфолин (20 мг, 0,048 ммоль) подвергали взаимодействию и обрабатывали способом, аналогичным описанному в примере (6g), используя бутиральдегид вместо тетрагидропиран-4-карбальдегида, с получением 11 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e (ESI) 472(MH+).
(Пример 44)
Гидрохлорид 1-бутил-4-(2-циклогептилфенил)пиперазина

(44a)
1-(2-Нитрофенил)циклогептен

Смесь циклопент-1-енилового эфира трифторметансульфоновой кислоты (2,50 г, 10,2 ммоль), 2-нитрофенилбороновой кислоты (2,04 г, 12,2 ммоль), тетракис(трифенилфосфин)палладий(0) (612 мг, 0,53 ммоль), 2н. водного раствора карбоната натрия (10,2 мл), толуола (32 мл) и этанола (16 мл) перемешивали в течение 2 часов и 30 минут при внешней температуре, равной 90°C, в атмосфере азота.
К реакционной смеси добавляли этилацетат и насыщенный солевой раствор и экстрагирование выполняли дважды этилацетатом. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 1,937 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,55-1,67 (м, 4H), 1,78-1,84 (м, 2H), 2,25-2,29 (м, 2H), 2,42-2,44 (м, 2H), 5,83 (т, J= 6,4Гц, 1H), 7,28 (дд, J= 7,6, 1,2Гц, 1H), 7,34 (ддд, J= 8,0, 7,6, 1,2Гц, 1H), 7,49 (ддд, J= 7,6, 7,6, 1,2Гц, 1H), 7,81 (дд, J= 8,0, 1,2Гц, 1H).
(44b)
2-Циклогептилфениламин

Смесь полученного в примере (44a) 1-(2-нитрофенил)циклогептена (1,00 г, 4,61 ммоль), 10% палладия на угле (300 мг, влажный) и метанола (130 мл) перемешивали в течение 21 часов при атмосферном давлении и комнатной температуре в атмосфере водорода. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 539 мг указанного в заголовке соединения в виде светло-оранжевого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,49-1,78 (м, 8H), 1,80-1,87 (м, 2H), 1,91-1,96 (м, 2H), 2,60-2,70 (м, 1H), 3,61 (ушир.с, 2H), 6,67 (дд, J= 7,6, 1,2Гц, 1H), 6,76 (дд, J= 7,6, 7,6Гц, 1H), 6,99 (ддд, J= 7,6, 7,6, 1,2Гц, 1H), 7,11 (д, J= 7,6Гц, 1H).
(44c)
1-(2-Циклогептилфенил)пиперазин

К раствору полученного в примере (44b) 2-циклогептилфениламина (539 мг, 2,85 ммоль) в 1,2-дихлорбензоле (7 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (610 мг, 3,42 ммоль) и смесь перемешивали при внешней температуре, равной 200°C в атмосфере азота. Во время проведения взаимодействия, для удаления в реакторе газообразного хлористого водорода в реактор вдували струю азота. Эту процедуру повторяли несколько раз. Через 8 часов смесь охлаждали воздухом до комнатной температуры. К реакционной смеси добавляли водный раствор карбоната калия, этилацетат и метанол и экстрагирование выполняли три раза этилацетатом. Полученные органические слои высушивали над безводным сульфатом натрия и затем осушитель отфильтровывали, и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 540 мг указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,50-1,84 (м, 12H), 2,82-2,84 (м, 4H), 3,01-3,03 (м, 4H), 3,28 (тт, J= 10,0, 2,8Гц, 1H), 7,03-7,07 (м, 2H), 7,12 (ддд, J= 8,4, 6,8, 1,6Гц, 1H), 7,20 (дд, J= 7,6, 1,6Гц, 1H).
1H у NH не мог быть идентифицирован.
(44d)
Гидрохлорид 1-бутил-4-(2-циклогептилфенил)пиперазина

К смеси полученного в примере (44c) 1-(2-циклогептилфенил)пиперазина (25 мг, 0,0967 ммоль) и тетрагидрофурана (1 мл) добавляли бутиральдегид (0,011 мл, 0,126 ммоль), триацетоксиборгидрид натрия (26,6 мг, 0,126 ммоль) и уксусную кислоту (0,011 мл, 0,183 ммоль) и смесь перемешивали в течение 19 часов и 30 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли три раза этилацетатом. Полученные органические слои концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 26,7 мг 1-бутил-4-(2-циклогептилфенил)пиперазин в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,95 (т, J= 7,2Гц, 3H), 1,32-1,41 (м, 2H), 1,49-1,84 (м, 14H), 2,39-2,43 (м, 2H), 2,61 (ушир.с, 4H), 2,89-2,92 (м, 4H), 3,27 (тт, J= 10,0, 3,2Гц, 1H), 7,03-7,15 (м, 3H), 7,21 (дд, J= 7,6, 1,6Гц, 1H).
Это соединение растворяли в дихлорметане (1 мл) и добавляли 4н. раствор хлористого водорода в этилацетате (0,0425 мл, 0,17 ммоль). Данный раствор концентрировали при пониженном давлении и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Это твердое вещество фильтровали и затем высушивали при пониженном давлении с получением 28,5 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 315(MH+).
(Пример 45)
Гидрохлорид 1-бутил-4-(2-циклогепт-1-енилфенил)пиперазина

(45a)
1-(2-Циклогепт-1-енилфенил)пиперазин

К раствору 2-циклогепт-1-енилфениламина (617 мг, 3,29 ммоль) в 1,2-дихлорбензоле (8 мл) добавляли бис(2-хлорэтил)амин гидрохлорид (705 мг, 3,95 ммоль) и смесь перемешивали при внешней температуре, равной 200°C, в атмосфере азота. Во время проведения взаимодействия, для удаления в реакторе газообразного хлористого водорода в реактор вдували струю азота. Эту процедуру повторяли несколько раз. Через 5 часов реакционную смесь охлаждали воздухом до комнатной температуры и затем к реакционной смеси добавляли водный раствор карбонат калия, этилацетат и метанол, и экстрагирование выполняли три раза этилацетатом. Полученные органические слои высушивали над безводным сульфатом натрия и затем осушитель отфильтровывали, и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 387 мг указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,54-1,63 (м, 4H), 1,78-1,84 (м, 2H), 2,23-2,27 (м, 2H), 2,55-2,58 (м, 2H), 2,92-3,01 (м, 8H), 5,85 (т, J= 6,4Гц, 1H), 6,94-6,98 (м, 2H), 7,09 (ддд, J= 7,6, 1,6, 1,6Гц, 1H), 7,20 (ддд, J= 8,0, 7,6, 1,6Гц, 1H).
1H у NH не мог быть идентифицирован.
(45b)
Гидрохлорид 1-бутил-4-(2-циклогепт-1-енилфенил)пиперазина

К раствору полученного в примере (45a) 1-(2-циклогепт-1-енилфенил)пиперазина (20 мг, 0,0780 ммоль) в тетрагидрофуране (1 мл) добавляли бутиральдегид (0,009 мл, 0,1014 ммоль), триацетоксиборгидрид натрия (21,5 мг, 0,1014 ммоль) и уксусную кислоту (0,009 мл, 0,1482 ммоль) и смесь перемешивали в течение 23 часов и 10 минут при комнатной температуре.
К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли три раза этилацетатом. Органические слои концентрировали с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 19 мг 1-бутил-4-(2-циклогепт-1-енилфенил)пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (т, J= 7,2Гц, 3H), 1,35 (т кв, J= 7,2, 7,2Гц, 2H), 1,48-1,61 (м, 8H), 1,78-1,84 (м, 2H), 2,23-2,27 (м, 2H), 2,37-2,40 (м, 2H), 2,54-2,57 (м, 4H), 3,03 (ушир.с, 4H), 5,85 (т, J= 6,4Гц, 1H), 6,93-6,99 (м, 2H), 7,08 (дд, J= 7,6, 1,6Гц, 1H), 7,19 (ддд, J= 8,8, 7,2, 1,6Гц, 1H).
Это соединение растворяли в дихлорметане (1 мл) и добавляли 4н. раствор хлористого водорода в этилацетате (0,0304 мл, 0,1216 ммоль).
Полученный раствор концентрировали в токе азота и затем к полученному остатку добавляли диэтиловый эфир с получением твердого вещества. Твердое вещество измельчали с помощью ультразвука и удаляли раствор супернатантного диэтилового эфира. Затем высушивали при пониженном давлении с получением 20,3 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 313 (MH+).
(Пример 46)
Гидрохлорид 1-(2-циклооктилфенил)-4-изобутилпиперазина
(46a)
1-(2-Циклоокт-1-енилфенил)пиперазин

К раствору 2-циклоокт-1-енилфениламина (140 мг, 0,695 ммоль) в 1,2-дихлорбензоле (2 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (149 мг, 0,835 ммоль) и смесь перемешивали при внешней температуре, равной 200°C, в атмосфере азота. Во время проведения взаимодействия в реактор для удаления газообразного хлористого водорода в реакторе вдували струю азота. Эту процедуру повторяли несколько раз. Через 9 часов, смесь охлаждали воздухом до комнатной температуры. К реакционной смеси добавляли водный раствор карбонат калия, этилацетат и метанол и экстрагирование выполняли три раза этилацетатом. Полученные органические слои высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 100 мг указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,35-1,77 (м, 8H), 2,23-2,28 (м, 2H), 2,74-2,77 (м, 2H), 2,94-3,02 (м, 8H), 5,63 (т, J= 8,0Гц, 1H), 6,93-6,97 (м, 2H), 7,08 (дд, J= 7,6, 2,0Гц, 1H), 7,21 (ддд, J= 7,6, 7,6, 2,0Гц, 1H).
1H у NH не мог быть идентифицирован.
(46b)
Трет-бутиловый эфир 4-(2-циклоокт-1-енилфенил)пиперазин-1-карбоновой кислоты

К полученному в примере (46a) 1-(2-циклоокт-1-енилфенил)пиперазину (100 мг, 0,37 ммоль), растворенном в дихлорметане (2,3 мл), добавляли ди-трет-бутил дикарбонат (96,9 мг, 0,444 ммоль) и триэтиламин (0,0645 мл, 0,463 ммоль) и смесь перемешивали в течение 13 часов при комнатной температуре. Затем добавляли еще ди-трет-бутил дикарбонат (15 мг, 0,0687 ммоль) и 4-диметиламинопиридин (10 мг, 0,0819 ммоль) и далее перемешивали в течение 30 минут при комнатной температуре.
К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование выполняли дважды дихлорметаном. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 128 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,35-1,70 (м, 17H), 2,23-2,28 (м, 2H), 2,71-2,74 (м, 2H), 2,95-2,98 (м, 4H), 3,47-3,50 (м, 4H), 5,62 (т, J= 8,0Гц, 1H), 6,91 (дд, J= 7,6, 1,6Гц, 1H), 6,96 (ддд, J= 7,6, 7,6, 1,6Гц, 1H), 7,08 (дд, J= 7,6, 1,6Гц, 1H), 7,21 (ддд, J= 7,6, 7,6, 1,6Гц, 1H).
(46c)
Трет-бутиловый эфир 4-(2-циклооктилфенил)пиперазин-1-карбоновой кислоты

Смесь полученного в примере (46b) трет-бутилового эфира 4-(2-циклоокт-1-енилфенил)пиперазин-1-карбоновой кислоты (128 мг, 0,345 ммоль), 10% палладия на угле (50 мг, влажный) и метанола (8 мл) перемешивали в течение 3 часов при атмосферном давлении и комнатной температуре в атмосфере водорода.
Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли смесь 10% палладия на угле (130 мг, влажный) и метанол (5 мл)-тетрагидрофуран (3 мл), затем перемешивали в течение 1 часа и 30 минут при комнатной температуре в атмосфере водорода при 4-5 атм.
Реакционную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении с получением сырого продукта, указанного в заголовке соединения в виде светло-желтого масла. Этот продукт использовали в следующей реакции без дополнительной очистки.
(46d)
1-(2-Циклооктилфенил)пиперазин

К смеси полученного в примере (46c) сырого продукта трет-бутилового эфира 4-(2-циклооктилфенил)пиперазин-1-карбоновой кислоты, 1,2-дихлорэтана (2 мл) и воды (0,2 мл) добавляли трифторуксусную кислоту (0,500 мл, 6,490 ммоль), затем перемешивали в течение 5 часов и 30 минут при комнатной температуре. К смеси, для ее подщелачивания, добавляли водный раствор карбонат калия. Затем добавляли этилацетат и экстрагирование выполняли три раза этилацетатом. Органические слои высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 75 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,55-1,72 (м, 14H), 2,83-2,85 (м, 4H), 3,02-3,05 (м, 4H), 3,48-3,54 (м, 1H), 7,03-7,14 (м, 3H), 7,19 (дд, J= 7,6, 4,4Гц, 1H).
1H у NH не мог быть идентифицирован.
(46e)
Гидрохлорид 1-(2-циклооктилфенил)-4-изобутилпиперазина
К раствору полученного в примере (46d) 1-(2-циклооктилфенил)пиперазина (7 мг, 0,0257 ммоль) в тетрагидрофуране (1 мл) добавляли изобутиральдегид (2,4 мг, 0,0334 ммоль), триацетоксиборгидрид натрия (7,1 мг, 0,0334 ммоль) и уксусную кислоту (0,0028 мл, 0,0448 ммоль), затем перемешивали в течение 17 часов и 10 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата три раза. Органические слои концентрировали, с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 4,3 мг 1-(2-циклооктилфенил)-4-изобутилпиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (д, J= 6,8Гц, 6H), 1,46-1,88 (м, 15H), 2,16 (д, J= 7,2 Гц, 2H), 2,55 (ушир.с, 4H), 2,88-2,90 (м, 4H), 3,46-3,52 (м, 1H), 7,02-7,13 (м, 3H), 7,18 (дд, J= 7,2, 1,6Гц, 1H).
Данное соединение растворяли в дихлорметане (1 мл) и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,0066 мл, 0,0262 ммоль). Смесь концентрировали при пониженном давлении и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученный твердый остаток высушивали при пониженном давлении с получением 4,4 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 329 (MH+).
(Пример 47)
Гидрохлорид 1-бутил-4-(2-циклоокт-1-енилфенил)пиперазина

К раствору полученного в примере (46a) 1-(2-циклоокт-1-енилфенил)пиперазина (11 мг, 0,0407 ммоль) в тетрагидрофуране (1 мл) добавляли бутиральдегид (0,0047 мл, 0,0529 ммоль), триацетоксиборгидрид натрия (11,2 мг, 0,0529 ммоль) и уксусную кислоту (0,0044 мл, 0,0773 ммоль), затем перемешивали в течение 14 часов и 20 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли три раза этилацетатом. Органический слой концентрировали, с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 9,9 мг 1-бутил-4-(2-циклоокт-1-енилфенил)пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (т, J= 7,6Гц, 3H), 1,30-1,62 (м, 12H), 2,23-2,28 (м, 2H), 2,35-2,39 (м, 2H), 2,54 (ушир.с, 4H), 2,73-2,76(м, 2H), 3,07 (ушир.с, 4H), 5,63 (т, J= 8,4Гц, 1H), 6,92-6,96 (м, 2H), 7,07 (дд, J= 7,6, 2,0Гц, 1H), 7,20 (ддд, J= 8,8, 7,6, 2,0Гц, 1H).
Данное соединение растворяли в дихлорметане (1 мл) и добавляли 4н. раствор хлористого водорода в этилацетате (0,015 мл, 0,0606 ммоль).
Раствор концентрировали при пониженном давлении и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученный твердый остаток высушивали при пониженном давлении с получением 10,9 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
MS m/e (ESI) 327 (MH+).
(Пример 48)
Гидрохлорид 1-(2-метоксиэтил)-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил]пиперазина

Смесь полученного в примере (39e) 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-ил-фенил]пиперазина (20 мг, 0,0472 ммоль), 2-бромэтилметилового эфира (0,0049 мл, 0,0519 ммоль), карбоната калия (11,1 мг, 0,0803 ммоль) и ацетонитрила (1 мл) перемешивали в течение 5 часов при внешней температуре, равной 80°C. К реакционной смеси добавляли этилацетат и насыщенный солевой раствор и экстрагирование выполняли три раза этилацетатом. Отделенные органические слои концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1-(2-метоксиэтил)-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 1,33-1,56 (м, 10H), 1,61-1,75 (м, 4H), 1,94-2,05 (м, 4H), 2,42-2,48 (м, 2H), 2,56 (ушир.с, 4H), 2,60 (т, J= 5,6Гц, 2H), 2,82 (ддд, J= 12,8, 10,0, 2,8Гц, 2H), 2,95 (ушир.с, 4H), 3,27-3,35 (м, 1H), 3,36 (с, 3H), 3,37 (с, 3H), 3,40-3,47 (м, 2H), 3,53 (т, J= 5,6Гц, 2H), 5,58 (т, J= 1,6Гц, 1H), 6,70 (д, J= 3,2Гц, 1H), 6,75 (дд, J= 8,8, 3,2Гц, 1H), 6,89 (д, J= 8,8Гц, 1H).
Данное соединение растворяли в дихлорметане (1 мл) и добавляли 4н. раствор хлористого водорода в этилацетате (0,0236 мл, 0,0944 ммоль). Раствор концентрировали и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученный твердый остаток высушивали при пониженном давлении с получением 16,8 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e (ESI) 482(MH+).
(Пример 49)
Гидрохлорид (R)-1-бутил-4-[2-(4,4-диметилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазина

(49a)
Гидрохлорид (R)-3-метоксипиперидина

Смесь (R)-3-гидроксипиперидина (2,709 г, 19,7 ммоль), ди-трет-бутил дикарбоната (4,04 г, 31,5 ммоль), дихлорметана (8 мл), триэтиламина (5,76 мл, 41,34 ммоль) и 4-диметиламинопиридина (241 мг, 1,97 ммоль) перемешивали в течение 4 часов и 20 минут при комнатной температуре. К реакционной смеси дополнительно добавляли ди-трет-бутил дикарбонат (1,516 г, 11,82 ммоль), триэтиламин (1,91 мл, 11,82 ммоль) и 4-диметиламинопиридин (120 мг, 0,985 ммоль), затем перемешивали в течение 4 дней при комнатной температуре. К реакционной смеси добавляли водный раствор хлорида аммония и экстрагирование выполняли дважды диэтиловым эфиром. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением сырого продукта трет-бутилового эфира (R)-3-гидроксипиперидин-1-карбоновой кислоты.
Затем часть смешанного растворителя, состоящего из смеси безводного тетрагидрофурана (82 мл) и диметилформамида (33 мл), добавляли к 60% суспензии гидрида натрия в масле (1,18 г, 29,55 ммоль) и смесь охлаждали до значения внешней температуры, равной 0°C, и перемешивали в атмосфере азота. Сырой продукт (R)-3-трет-бутилового эфира метоксипиперидин-1-карбоновой кислоты растворяли в остатке вышеуказанного смешанного растворителя, состоящего из смеси безводного тетрагидрофурана и диметилформамида, и затем медленно добавляли к вышеуказанной смеси. После перемешивания в течение 30 минут в аналогичных условиях, к реакционной смеси добавляли метилйодид (1,84 мл, 27,55 ммоль). Затем ее медленно нагревали до комнатной температуры и перемешивали еще в течение 13 часов. К реакционной смеси добавляли лед и насыщенный водный раствор хлорида аммония и экстрагирование осуществляли с помощью диэтилового эфира. Органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением сырого продукта трет-бутилового эфира (R)-3-метоксипиперидин-1-карбоновой кислоты. К сырому продукту добавляли этилацетат (30 мл) и смесь охлаждали до значения внешней температуры, равного 0°C, и перемешивали. Потом постепенно добавляли 4н. раствор хлористого водорода в этилацетате (147,8 мл, 591 ммоль) и температуру поднимали до комнатной температуры. После перемешивания в течение 4 часов смесь концентрировали и высушивали при пониженном давлении с получением 4,311 г сырого продукта указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,63-1,75 (м, 1H), 1,79-1,98 (м, 2H), 2,00-2,11 (м, 1H), 2,99-3,22 (м, 3H), 3,28-3,36 (м, 1H), 3,41 (с, 3H), 3,62-3,65 (м, 1H).
1H у NH не мог быть идентифицирован.
(49b)
Гидрохлорид (R)-1-бутил-4-[2-(4,4-диметилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазина

Смесь полученного в примере (21c) 1-[4-бром-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазина (37,4 мг, 0,0918 ммоль), полученного в примере (49a) гидрохлорида (R)-3-метоксипиперидина (16,7 мг, 0,110 ммоль), трикалий фосфата (170 мг, 0,801 ммоль), ацетата палладия(II) (8,2 мг, 0,0365 ммоль), тетрафторбората три-трет-бутилфосфония (32 мг, 0,110 ммоль) и ксилола (1,5 мл) перемешивали в течение 4 часов и 30 минут в атмосфере азота при внешней температуре, равной 100°C. Смесь охлаждали воздухом до комнатной температуры и затем очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 24 мг (R)-1-бутил-4-[2-(4,4-диметилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (т, J= 7,6Гц, 3H), 0,97 (с, 3H), 1,01 (с, 3H), 1,22-1,72 (м, 14H), 1,82-1,86 (м, 1H), 2,02-2,30 (м, 1H), 2,39-2,43 (м, 2H), 2,58 (ушир.с, 4H), 2,66 (дд, J= 11,6, 8,4Гц, 1H), 2,74 (ддд, J= 11,2, 11,2, 2,8Гц, 1H), 2,82-2,88 (м, 4H), 2,90-3,00 (м, 1H), 3,31-3,38 (м, 1H), 3,39-3,46 (м, 4H), 3,60 (дд, J= 11,6, 3,6Гц, 1H), 6,74 (дд, J= 8,8, 2,8Гц, 1H), 6,86 (д, J= 2,8Гц, 1H), 7,06 (д, J= 8,8Гц, 1H).
Данное соединение растворяли в дихлорметане (1 мл) и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,0273 мл, 0,109 ммоль).
Данный раствор концентрировали, с получением остатка, который осаждали с помощью добавления диэтилового эфира и затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученное твердое вещество высушивали при пониженном давлении с получением 24,2 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e 442(ESI) (MH+).
(Пример 50)
Гидрохлорид (S)-1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазина

(50a)
Гидрохлорид (S)-3-метоксипиперидина

Взаимодействие проводили в условиях и способами, аналогичными тем, которые описаны в примере (49a), используя в качестве исходного материала (S)-3-гидроксипиперидин (2 г, 14,5 ммоль). Также проводили аналогичную обработку, с получением 3,237 г сырого продукта, указанного в заголовке соединения в виде оранжевого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,63-1,77 (м, 1H), 1,78-1,96 (м, 2H), 1,98-2,09 (м, 1H), 2,99-3,22 (м, 3H), 3,26-3,34 (м, 1H), 3,41 (с, 3H), 3,62-3,65 (м, 1H).
1H у NH не мог быть идентифицирован.
(50b)
Трет-бутиловый эфир (S)-4-[2-(4,4-диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного в примере (38c) трет-бутилового эфира 4-[4-бром-2-(4,4-диэтилциклогексил)фенил]пиперазин-1-карбоновой кислоты (153 мг, 0,32 ммоль), полученный в примере (50a) гидрохлорида (S)-3-метоксипиперидина (72,8 мг, 0,48 ммоль), трет-бутоксида натрия (200 мг, 2,08 ммоль), ацетата палладия(II) (14,4 мг, 0,064 ммоль), тетрафторбората три-трет-бутилфосфония (57,7 мг, 0,192 ммоль) и ксилола (4 мл) перемешивали в течение 6 часов и 10 минут в атмосфере азота при внешней температуре, равной 100°C. К реакционной смеси дополнительно добавляли трет-бутоксид натрия (100 мг, 1,04 ммоль), ацетат паладия(II) (7,2 мг, 0,032 ммоль) и тетрафторборат три-трет-бутилфосфония (27,9 мг, 0,096 ммоль), затем перемешивали в течение 1 часа при внешней температуре, равной 100°C, в атмосфере азота. Реакционную смесь охлаждали воздухом до комнатной температуры и затем очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 59 мг указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,79 (т, J= 7,2Гц, 3H), 0,81 (т, J= 7,2Гц, 3H), 1,14-1,71 (м, 23H), 1,83-1,92 (м, 1H), 2,03-2,10 (м, 1H), 2,65-2,82 (м, 10H), 2,92-3,01 (м, 1H), 3,33-3,47 (м, 5H), 3,57-3,62 (м, 1H), 6,74 (дд, J= 8,8, 3,2Гц, 1H), 6,85 (д, J= 3,2Гц, 1H), 6,99 (д, J= 8,8Гц, 1H).
(50c)
(S)-1-[2-(4,4-Диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазин
Полученный в примере (50b) трет-бутиловый эфир (S)-4-[2-(4,4-Диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазин-1-карбоновой кислоты (59 мг, 0,1148 ммоль) растворяли в смешанном растворителе, состоящем из смеси дихлорметана (0,7 мл) и воды (1 капля). Добавляли трифторуксусную кислоту (0,177 мл, 2,296 ммоль), потом перемешивали в течение 15 часов и 20 минут в аналогичных условиях. Для подщелачивания смеси к реакционной смеси добавляли водный раствор карбонат калия. Затем смесь экстрагировали этилацетатом. Отделенный органический слой концентрировали при пониженном давлении с получением сырого продукта (S)-1-[2-(4,4-диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазина в виде коричневого масла. Этот продукт использовали в следующей реакции без дополнительной очистки.
(50d)
Гидрохлорид (S)-1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазина
К раствору полученного в примере (50c) сырого продукта (S)-1-[2-(4,4-диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазина в тетрагидрофуране (1 мл) добавляли циклопропанкарбальдегид (0,0056 мл, 0,07462 ммоль), триацетоксиборгидрид натрия (16 мг, 0,07462 ммоль) и уксусную кислоту (0,0062 мл, 0,1091 ммоль), затем перемешивали в течение 5 часов при комнатной температуре.
После завершения реакции к реакционной смеси добавляли насыщенный водный раствор гидрокарбонат натрия и экстрагирование выполняли три раза этилацетатом. Отделенные органические слои концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением (S)-1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,23-0,27 (м, 2H), 0,52-0,57 (м, 2H), 0,79 (т, J= 7,6Гц, 3H), 0,81 (т, J= 7,6Гц, 3H), 0,86-0,97 (м, 1H), 1,14-1,72 (м, 14H), 1,84-1,91 (м, 1H), 2,04-2,10 (м, 1H), 2,33 (д, J= 6,8Гц, 2H), 2,63-2,77 (м, 6H), 2,84-2,99 (м, 5H), 3,33-3,45 (м, 5H), 3,58-3,62 (м, 1H), 6,74 (дд, J= 8,4, 2,8Гц, 1H), 6,85 (д, J= 2,8Гц, 1H), 7,08 (д, J= 8,4Гц, 1H).
Это соединение растворяли в дихлорметане (1 мл) и добавляли 4н. раствор хлористого водорода в этилацетате (0,0287 мл, 0,1148 ммоль). Данный раствор концентрировали, с получением остатка, который осаждали с помощью добавления диэтилового эфира и затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученное твердое вещество высушивали при пониженном давлении с получением 17,5 мг указанного в заголовке соединения в виде коричневого твердого вещества.
MS m/e 468(ESI) (MH+).
(Пример 51)
Гидрохлорид 1-циклопентил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (25 мг, 0,0832 ммоль), циклопентанона (9,1 мг, 0,108 ммоль), триацетоксиборгидрида натрия (33,5 мг, 0,158 ммоль) и уксусной кислоты (0,009 мл, 0,158 ммоль) перемешивали в течение 1 часа и 40 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата три раза. Органический слой концентрировали, с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1-циклопентил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного масла.
δ: 0,92 (с, 6H), 1,13 (с, 6H), 1,16-1,36 (м, 6H), 1,39-1,51 (м, 4H), 1,66-1,76 (м, 2H), 1,86-1,96 (м, 2H), 2,48-2,58 (м, 1H), 2,67 (ушир.с, 4H), 2,89-2,98 (м, 4H), 3,52-3,61 (м, 1H), 7,04-7,14 (м, 3H), 7,21 (д, J= 8,8Гц, 1H).
Данное соединение растворяли в дихлорметане (1 мл), и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,0416 мл, 0,166 ммоль). Раствор концентрировали и затем к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученное твердое вещество высушивали при пониженном давлении с получением 24,3 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e 369(ESI) (MH+).
(Пример 52)
Гидрохлорид 1-(2-метилсульфанилэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (100 мг, 0,333 ммоль), 2-хлорэтилметилсульфида (38,7 мг, 0,349 ммоль), карбоната калия (78,2 мг, 0,566 ммоль) и ацетонитрила (2 мл) перемешивали в течение 8 часов и 30 минут при внешней температуре, равной 80°C. Реакционную смесь концентрировали и полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 88 мг 1-(2-метилсульфанилэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,12-1,46 (м, 12H), 2,14-2,18 (м, 2H), 2,55-2,75 (м, 9H), 2,93 (т, J=4,8Гц, 4H), 3,48-3,60 (м, 1H), 7,05-7,17 (м, 3H), 7,23 (дд, J= 7,6, 2,8Гц, 1H).
После растворения 1-(2-метилсульфанилэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (22 мг, 0,0588 ммоль) в дихлорметане (1,5 мл), добавляли 4н. раствор хлористого водорода в этилацетате (0,0294 мл, 0,1175 ммоль). Раствор концентрировали, к полученному остатку добавляли диэтиловый эфир с получением твердого вещества и супернатантный раствор диэтилового эфира удаляли. Полученное твердое вещество высушивали при пониженном давлении с получением 14 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 375(MH+).
(Пример 53)
Гидрохлорид 1-(2-циклопропилэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К раствору циклопропилацетальдегида в 1,2-дихлорэтане (0,29 M, 5 мл) добавляли полученный в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин (25 мг, 0,0832 ммоль), триацетоксиборгидрид натрия (22,9 мг, 0,108 ммоль) и уксусную кислоту (0,009 мл, 0,158 ммоль), затем перемешивали в течение 20 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли дважды этилацетатом. Органический слой концентрировали и полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 20,9 мг 1-(2-циклопропилэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,05-0,08 (м, 2H), 0,42-0,46 (м, 2H), 0,63-0,73 (м, 1H), 0,93 (с, 6H), 1,10-1,48 (м, 14H), 2,50-2,53 (м, 2H), 2,61 (ушир.с, 4H), 2,92 (дд, J= 4,4, 4,4Гц, 4H), 3,52-3,63 (м, 1H), 7,05-7,17 (м, 3H), 7,22 (дд, J= 7,2, 1,2Гц, 1H).
Данное соединение растворяли в дихлорметане (1 мл) и добавляли 4н. раствор хлористого водорода в этилацетате (0,0283 мл, 0,113 ммоль). Раствор концентрировали и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученное твердое вещество высушивали при пониженном давлении с получением 15,6 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e 369(ESI) (MH+).
(Пример 54)
Гидрохлорид 1-изобутил-4-[2-(3,3,4,4-тетраметилциклопент-1-енил)фенил]пиперазина

(54a)
3,3,4,4-Тетраметилциклопент-1-ениловый эфир трифторметансульфоновой кислоты

Раствор 3,3,4,4-тетраметилциклопентанона (860 мг, 6,12 ммоль) в безводном тетрагидрофуране (10 мл) охлаждали до значения внутренней температуры, равного -72°C, в атмосфере азота. К данному перемешиваемому раствору медленно по каплям в течение 30 минут добавляли бис(триметилсилил)амид литий (1M раствор в тетрагидрофуране, 7,34 мл, 7,34 ммоль). После перемешивания в течение 30 минут в аналогичных условиях к реакционной смеси добавляли раствор N-фенилбис(трифторметансульфонимид) (2,41 г, 6,73 ммоль) в безводном тетрагидрофуране (18 мл) и перемешивание продолжали в течение 16 часов и 30 минут при постепенном нагревании до комнатной температуры. К реакционной смеси добавляли этилацетат и 5н. хлористоводородную кислоту, и экстрагирование выполняли три раза этилацетатом. Отделенные органические слои объединяли и промывали 3 раза 5н. хлористоводородной кислотой. Полученный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 992 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,97 (с, 3H), 0,98 (с, 3H), 1,017 (с, 3H), 1,023 (с, 3H), 2,39 (д, J= 1,6Гц, 2H), 5,39 (т, J= 1,6Гц, 1H).
(54b)
1-Нитро-2-(3,3,4,4-тетраметилциклопент-1-енил)бензол

Смесь полученного в примере (54a) 3,3,4,4-тетраметилциклопент-1-енилового эфира трифторметансульфоновой кислоты (992 мг, 3,64 ммоль), 2-нитрофенилбороновой кислоты (729 мг, 4,37 ммоль), тетракис(трифенилфосфин)палладия(0) (219 мг, 0,189 ммоль), 2н. водного раствора карбоната натрия (3,64 мл), толуола (12,5 мл) и этанола (6,3 мл) перемешивали в течение 6 часов при внешней температуре, равной 90°C, в атмосфере азота. Реакционную смесь охлаждали воздухом до комнатной температуры и затем добавляли этилацетат и насыщенный солевой раствор, и экстрагирование выполняли дважды этилацетатом. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 891 мг указанного в заголовке соединения в виде светло-коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,98 (с, 6H), 1,02 (с, 6H), 2,40 (д, J= 1,6Гц, 2H), 5,59 (т, J= 1,6Гц, 1H), 7,25-7,34 (м, 2H), 7,47 (ддд, J= 8,0, 7,2, 1,2Гц, 1H), 7,70 (дд, J= 8,0, 1,2Гц, 1H).
(54c)
2-(3,3,4,4-Тетраметилциклопент-1-енил)фениламин

К смеси полученного в примере (54b) 1-нитро-2-(3,3,4,4-тетраметилциклопент-1-енил)бензола (441 мг, 1,8 ммоль), этанола (10 мл) и воды (3,3 мл) добавляли хлорид аммония (48,1 мг, 0,899 ммоль) и порошкоообразное железо (352 мг, 6,3 ммоль), затем перемешивали в течение 5 часов при внешней температуре, равной 90°C. После дополнительного добавления к реакционной смеси хлорида аммония (9,63 мг, 0,18 ммоль) и железного порошка (100 мг, 1,8 ммоль), перемешивание продолжали в течение 12 часов при внешней температуре, равной 75°C. Реакционную смесь охлаждали до комнатной температуры и затем фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 331 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,99 (с, 6H), 1,02 (с, 6H), 2,54(д, J= 1,2Гц, 2H), 3,93 (ушир.с, 2H), 5,74 (т, J= 1,2Гц, 1H), 6,68-6,74 (м, 2H), 6,99-7,06 (м, 2H).
(54d)
1-[2-(3,3,4,4-Тетраметилциклопент-1-енил)фенил]пиперазин

Смесь полученного в примере (54c) 2-(3,3,4,4-тетраметилциклопент-1-енил)фениламина (331 мг, 1,54 ммоль), 1,2-дихлорбензола (4,7 мл) и гидрохлорида бис(2-хлорэтил)амина (330 мг, 1,85 ммоль) перемешивали в атмосфере азота в течение 9 часов при внешней температуре, равной 200°C. Для удаления газообразного хлористого водорода в реакторе во время проведения взаимодействия в реактор несколько раз вдували струю азота. Реакционную смесь охлаждали воздухом до комнатной температуры и затем добавляли водный раствор карбонат калия, этилацетат и метанол, и экстрагирование выполняли три раза этилацетатом. Полученные органические слои высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 223 мг указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,97 (с, 6H), 1,00 (с, 6H), 2,60 (д, J= 1,4Гц, 2H), 2,90-2,96 (м, 4H), 2,98-3,02 (м, 4H), 6,00 (т, J= 1,4Гц, 1H), 6,94-6,99 (м, 2H), 7,15-7,19 (м, 2H).
1H у NH не мог быть идентифицирован.
(54e)
Гидрохлорид 1-изобутил-4-[2-(3,3,4,4-тетраметилциклопент-1-енил)фенил]пиперазина

К раствору полученного в примере (54d) 1-[2-(3,3,4,4-тетраметилциклопент-1-енил)фенил]пиперазина (20 мг, 0,0703 ммоль) в тетрагидрофуране (1 мл) добавляли изобутиральдегид (6,6 мг, 0,0914 ммоль), триацетоксиборгидрид натрия (19,4 мг, 0,0914 ммоль) и уксусную кислоту (0,0076 мл, 0,134 ммоль), затем перемешивали в течение 4 часов при комнатной температуре. После дополнительного добавления к смеси изобутиральдегида (6,6 мг, 0,0914 ммоль), триацетоксиборгидрид натрия (19,4 мг, 0,0914 ммоль) и уксусной кислоты (0,0076 мл, 0,134 ммоль) перемешивание продолжали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбонат натрия и экстрагирование выполняли три раза этилацетатом. Полученные органические слои концентрировали и полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 4,3 мг 1-изобутил-4-[2-(3,3,4,4-тетраметилциклопент-1-енил)фенил]пиперазин в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (д, J= 6,4Гц, 6H), 0,97 (с, 6H), 1,00 (с, 6H), 1,76-1,86 (м, 1H), 2,14 (д, J= 7,6Гц, 2H), 2,52 (ушир.с, 4H), 2,59 (д, J= 1,6Гц, 2H), 2,98 (ушир.с, 4H), 5,98 (т, J= 1,6Гц, 1H), 6,92-7,00 (м, 2H), 7,14-7,18 (м, 2H).
Данное соединение растворяли в дихлорметане (1 мл) и добавляли 4н. раствор хлористого водорода в этилацетате (0,0063 мл, 0,0253 ммоль). Раствор концентрировали при пониженном давлении и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Удаляли супернатантный раствор диэтилового эфира и полученное твердое вещество высушивали при пониженном давлении с получением 4,8 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 341 (MH+).
(Пример 55)
Гидрохлорид 1-пропил-4-[2-(3,3,4,4-тетраметилциклопентил)фенил]пиперазина

(55a)
2-(3,3,4,4-Тетраметилциклопентил)фениламин

Смесь полученного в примере (54b) 1-нитро-2-(3,3,4,4-тетраметилциклопент-1-енил)бензола (450 мг, 1,83 ммоль), 10% палладия на угле (200 мг, влажный) и метанола (40 мл) перемешивали в течение 3 часов и 30 минут при атмосферном давлении и комнатной температуре в атмосфере водорода. Реакционную смесь фильтровали и к фильтрату добавляли 10% палладий на угле (200 мг, влажный) и 4н. раствор хлористого водорода в этилацетате (0,915 мл, 3,66 ммоль), затем перемешивание продолжали в течение 13 часов и 30 минут при комнатной температуре и атмосферном давлении в атмосфере водорода. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 295 мг указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,96 (с, 6H), 0,97 (с, 6H), 1,80 (дд, J= 13,2, 8,8Гц, 2H), 2,01 (дд, J= 13,2, 9,2Гц, 2H), 3,15-3,36 (м, 3H), 6,67 (дд, J= 7,6, 1,2Гц, 1H), 6,76 (ддд, J= 7,6, 7,6, 1,2 Гц, 1H), 7,00 (ддд, J= 7,6, 7,6, 1,2Гц, 1H), 7,23 (д, J= 7,6Гц, 1H).
(55b)
1-[2-(3,3,4,4-Тетраметилциклопентил)фенил]пиперазин

Смесь полученного в примере (55a) 2-(3,3,4,4-тетраметилциклопентилфенил)амина (295 мг, 1,36 ммоль), 1,2-дихлорбензола (3,84 мл) и гидрохлорида бис(2-хлорэтил)амина (291 мг, 1,63 ммоль) перемешивали в течение 5 часов и 30 минут в атмосфере азота при внешней температуре, равной 200°C. Во время проведения взаимодействия вдували струю азота в реактор для удаления газообразного хлористого водорода в реакторе. Реакционную смесь охлаждали до комнатной температуры и затем добавляли водный раствор карбонат калия, этилацетат и метанол, и экстрагирование выполняли три раза этилацетатом. Полученные органические слои высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 207 мг указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,98 (с, 6H), 1,01 (с, 6H), 1,68 (дд, J= 13,2, 9,2Гц, 2H), 1,96 (дд, J= 13,2, 9,2Гц, 2H), 2,80-2,87 (м, 4H), 2,98-3,04 (м, 4H), 3,94 (тт, J= 9,2, 9,2Гц, 1H), 7,05-7,16 (м, 3H), 7,37 (дд, J= 7,2, 1,6Гц, 1H).
1H у NH не мог быть идентифицирован.
(55c)
Гидрохлорид 1-пропил-4-[2-(3,3,4,4-тетраметилциклопентил)фенил]пиперазина

К раствору полученного в примере (55b) 1-[2-(3,3,4,4-тетраметилциклопентил)фенил]пиперазина (20 мг, 0,0698 ммоль) в тетрагидрофуране (1 мл) добавляли пропиональдегид (0,0065 мл, 0,0908 ммоль), триацетоксиборгидрид натрия (19,2 мг, 0,0908 ммоль) и уксусную кислоту (0,0076 мл, 0,133 ммоль), затем перемешивали в течение 3 часов при комнатной температуре. После дополнительного добавления к реакционной смеси пропиональдегида (0,0065 мл, 0,0908 ммоль), триацетоксиборгидрид натрия (19,2 мг, 0,0908 ммоль) и 1,2-дихлорэтана (1 мл) перемешивание продолжали в течение 18 часов и 30 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли три раза этилацетатом. Полученные органические слои концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1,2 мг 1-пропил-4-[2-(3,3,4,4-тетраметилциклопентил)фенил]пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (т, J= 7,2Гц, 3H), 0,98 (с, 6H), 1,01 (с, 6H), 1,50-1,59 (м, 2H), 1,68 (дд, J= 13,2, 9,6Гц, 2H), 1,96 (дд, J= 13,2, 9,6Гц, 2H), 2,36-2,40 (м, 2H), 2,61 (ушир.с, 4H), 2,91-2,93 (м, 4H), 3,92 (тт, J= 9,6, 9,6Гц, 1H), 7,06-7,15 (м, 3H), 7,36 (д, J= 7,2Гц, 1H).
Данное соединение растворяли в дихлорметане (1 мл) и добавляли 4н. раствор хлористого водорода в этилацетате (0,0018 мл, 0,0730 ммоль). Данный раствор концентрировали при пониженном давлении и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Твердое вещество фильтровали и затем высушивали при пониженном давлении с получением 1,7 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 329 (MH+).
(Пример 56)
Гидрохлорид 4-[4-(4-пентилпиперазин-1-ил)-3-спиро[2,5]окт-5-ен-6-илфенил]морфолина

(56a)
Трет-бутиловый эфир 4-(4-морфолин-4-ил-2-спиро[2,5]окт-5-ен-6-илфенил)пиперазин-1-карбоновой кислоты

Смесь трет-бутилового эфира 4-(4-морфолин-4-ил-2-трифторметансульфонилоксифенил)пиперазин-1-карбоновой кислоты (1,49 г, 3,01 ммоль), 1,2-диметоксиэтана (15 мл), воды (1 мл), полученного в примере (34b) 4,4,5,5-тетраметил-2-спиро[2,5]окт-5-ен-6-ил-[1,3,2]диоксаборолана (1,13 г, 4,82 ммоль), тетракис(трифенилфосфин)палладия(0) (278 мг, 0,241 ммоль) и трикалий фосфата (1,23 г, 5,78 ммоль) перемешивали в течение 13 часов и 20 минут в атмосфере азота при внешней температуре, равной 80-90°C. К реакционной смеси добавляли этилацетат и насыщенный солевой раствор и экстрагирование выполняли три раза этилацетатом. Органический слой высушивали над безводным сульфатом натрия, осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1,23 г указанного в заголовке соединения в виде бесцветного твердого вещества.
(56b)
4-(4-Пиперазин-1-ил-3-спиро[2,5]окт-5-ен-6-илфенил)морфолин
Взаимодействие проводили способом, аналогичным описанному в примере (4f), используя в качестве исходного материала полученный в примере (56a) трет-бутиловый эфир 4-(4-морфолин-4-ил-2-спиро[2,5]окт-5-ен-6-илфенил)пиперазин-1-карбоновой кислоты (1,23 г, 2,71 ммоль), и затем обработку выполняли аналогичным способом, с получением 1,30 г указанного в заголовке соединения в виде светло-коричневого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,32-0,40 (м, 4H), 1,50 (т, J= 6,4Гц, 2H), 2,02-2,06 (м, 2H), 2,53 (д, J= 1,6Гц, 2H), 3,05-3,18 (м, 12H), 3,85 (т, J= 4,8Гц, 4H), 5,69-5,73 (м, 1H), 6,74 (д, J= 2,4Гц, 1H), 6,78 (дд, J= 9,6, 2,4Гц, 1H), 6,94 (д, J= 9,6Гц, 1H).
1H у NH не мог быть идентифицирован.
(56c)
Гидрохлорид 4-[4-(4-пентилпиперазин-1-ил)-3-спиро[2,5]окт-5-ен-6-илфенил]морфолина

К раствору полученного в примере (56b) 4-(4-пиперазин-1-ил-3-спиро[2,5]окт-5-ен-6-илфенил)морфолина (330 мг, 0,933 ммоль) в тетрагидрофуране (10 мл) добавляли валериановый альдегид (104,5 мг, 1,214 ммоль), триацетоксиборгидрид натрия (257,2 мг, 1,214 ммоль) и уксусную кислоту (0,1015 мл, 1,774 ммоль), затем перемешивали в течение 1 часа и 30 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли три раза этилацетатом. Полученный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 269 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,33-0,38 (м, 4H), 0,91 (т, J= 6,8Гц, 3H), 1,24-1,38 (м, 4H), 1,48-1,55 (м, 4H), 2,02-2,05 (м, 2H), 2,34-2,38 (м, 2H), 2,47-2,62 (м, 6H), 2,99 (ушир.с, 4H), 3,10-3,12 (м, 4H), 3,84-3,86 (м, 4H), 5,69-5,73 (м, 1H), 6,73-6,77 (м, 2H), 6,93 (д, J= 8,4Гц, 1H).
После растворения 125 мг данного соединения в дихлорметане (4 мл) добавляли 4н. раствор хлористого водорода в этилацетате (0,147 мл, 0,590 ммоль). Раствор концентрировали при пониженном давлении и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Твердое вещество фильтровали и высушивали при пониженном давлении с получением 120 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 424 (MH+).
(Пример 57)
1-[4-Бром-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазин

(57a)
1-[4-Бром-2-(4,4-диметилциклогексил)фенил]пиперазин

Смесь полученного в примере (3e) трет-бутилового эфира 4-[4-бром-2-(4,4-диметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (1,5 г, 3,32 ммоль), трифторуксусной кислоты (3 мл, 38,7 ммоль) и дихлорметана (6 мл) перемешивали в течение 2 часов и 30 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор карбонат натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток высушивали при пониженном давлении с получением 1,21 г сырого продукта указанного в заголовке соединения в виде коричневого масла.
(57b)
1-[4-Бром-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазин

К смеси полученного в примере (57a) сырого продукта 1-[4-бром-2-(4,4-диметилциклогексил)фенил]пиперазина (1,21 г), бутиральдегида (0,35 мл, 3,98 ммоль), уксусной кислоты (0,1 мл, 3,32 ммоль) и тетрагидрофурана (8 мл) добавляли триацетоксиборгидрид натрия (1,1 г, 4,98 ммоль), затем перемешивали в течение 2 часов и 10 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 901 мг указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (т, J= 7,2Гц, 3H), 0,97 (с, 3H), 1,01 (с, 3H), 1,24-1,60 (м, 12H), 2,38-2,44 (м, 2H), 2,59 (ушир.с, 4H), 2,82-2,97 (м, 5H), 6,97 (д, J= 8,8Гц, 1H), 7,24 (дд, J= 8,8, 2,4Гц, 1H), 7,33 (д, J= 2,4Гц, 1H).
(Пример 58)
Гидрохлорид 1-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]пиперидин-4-карбонитрила

Смесь полученного в примере (57b) 1-[4-бром-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазина (50 мг, 0,123 ммоль), гидрохлорида пиперидин-4-карбонитрила (27 мг, 0,185 ммоль), трет-бутоксида натрия (47 мг, 0,492 ммоль), ацетата паладия(II) (3 мг, 0,0123 ммоль), три-трет-бутилфосфоний тетрафторбората (11 мг, 0,0369 ммоль) и ксилола (1 мл) перемешивали в течение 1 часа при внешней температуре, равной 100°C.
Реакционную смесь очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 32 мг 1-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]пиперидин-4-карбонитрила в виде бесцветного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (т, J= 7,6Гц, 3H), 0,97 (с, 3H), 1,01 (с, 3H), 1,24-1,64 (м, 12H), 1,95-2,13 (м, 4H), 2,36-2,46 (м, 2H), 2,59 (ушир.с, 4H), 2,72-2,79 (м, 1H), 2,86 (ушир.с, 4H), 2,91-3,05 (м, 3H), 3,31-3,41 (м, 2H), 6,72 (дд, J= 8,8, 2,8Гц, 1H), 6,84 (д, J= 2,8Гц, 1H), 7,07 (д, J= 8,8Гц, 1H).
Данное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Смесь концентрировали при пониженном давлении. К остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и твердое вещество высушивали, с получением 25 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 437(MH+).
(Пример 59)
Гидрохлорид 1-[4-азетидин-1-ил-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазина

Смесь полученного в примере (57b) 1-[4-бром-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазина (50 мг, 0,123 ммоль), гидрохлорида азетидина (17 мг, 0,185 ммоль), трет-бутоксида натрия (47 мг, 0,492 ммоль), ацетата паладия(II) (3 мг, 0,0123 ммоль), три-трет-бутилфосфоний тетрафторбората (11 мг, 0,0369 ммоль) и ксилола (1 мл) перемешивали в течение 3 часов при внешней температуре, равной 100°C. К реакционной смеси добавляли воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой фильтровали через целит. Растворитель из фильтрата отгоняли в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1-[4-азетидин-1-ил-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазина в виде бесцветного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (т, J= 7,6Гц, 3H), 0,96 (с, 3H), 1,00 (с, 3H), 1,25-1,66 (м, 12H), 2,32 (quintet, J= 7,2Гц, 2H), 2,37-2,42 (м, 2H), 2,56 (ушир.с, 4H), 2,84 (ушир.с, 4H), 2,90-3,00 (м, 1H), 3,85 (т, J= 7,2Гц, 4H), 6,27 (дд, J= 8,4, 2,8Гц, 1H), 6,32 (д, J= 2,8Гц, 1H), 7,06 (д, J= 8,4Гц, 1H).
Данное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Затем смесь концентрировали при пониженном давлении. К остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и полученное твердое вещество высушивали, с получением 20 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 384(MH+).
(Пример 60)
Гидрохлорид 1-[4-(4-Бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]азепана

Смесь полученного в примере (57b) 1-[4-бром-2-(4,4-диметилциклогексил)фенил]-4-бутилпиперазина (50 мг, 0,123 ммоль), гексаметиленимина (18 мг, 0,185 ммоль), трет-бутоксида натрия (30 мг, 0,308 ммоль), ацетат паладия(II) (3 мг, 0,0123 ммоль), три-трет-бутилфосфоний тетрафторбората (11 мг, 0,0369 ммоль) и ксилола (1 мл) перемешивали в течение 3 часов при внешней температуре, равной 100°C. К реакционной смеси добавляли воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой фильтровали через целит. Растворитель отгоняли из фильтрата в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]азепана в виде желтого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (т, J= 7,6Гц, 3H), 0,97 (с, 3H), 1,01 (с, 3H), 1,28-1,85 (м, 20H), 2,36-2,44 (м, 2H), 2,58 (ушир.с, 4H), 2,77-3,02 (м, 5H), 3,35-3,46 (м, 4H), 6,50 (дд, J= 8,8, 3,2Гц, 1H), 6,55 (д, J= 3,2Гц, 1H), 7,06 (д, J= 8,8Гц, 1H).
Данное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Смесь концентрировали при пониженном давлении. К остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и полученное твердое вещество высушивали, с получением 36 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 426(MH+).
(Пример 61)
Гидрохлорид цис-4-[4-(4-циклобутилметилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]-2,6-диметилморфолина
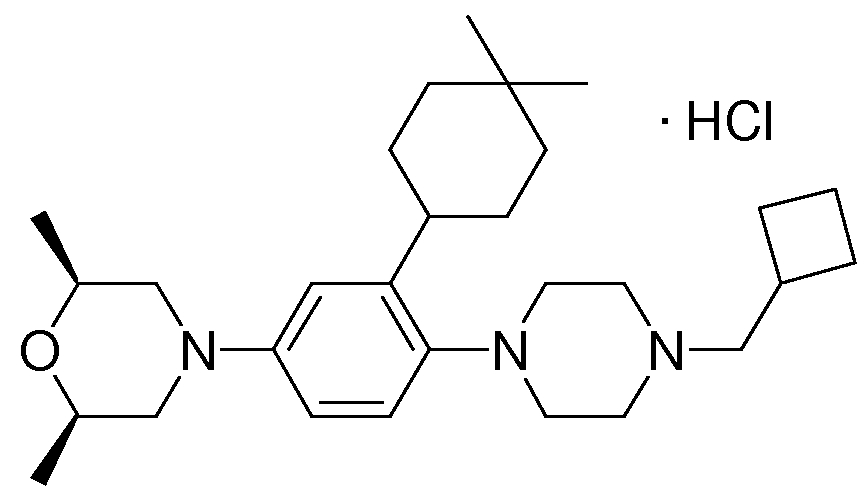
(61a)
Трет-бутиловый эфир цис-4-[2-(4,4-диметилциклогексил)-4-(2,6-диметилморфолин-4-ил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного в примере (3e) трет-бутилового эфира 4-[4-бром-2-(4,4-диметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (700 мг, 1,55 ммоль), цис-2,6-диметилморфолина (268 мг, 2,33 ммоль), трет-бутоксида натрия (372 мг, 3,88 ммоль), ацетат паладия(II) (35 мг, 0,155 ммоль), три-трет-бутилфосфоний тетрафторбората (135 мг, 0,465 ммоль) и ксилола (7 мл) перемешивали в течение 2 часов в атмосфере азота при внешней температуре, равной 100°C. Реакционную смесь охлаждали воздухом до комнатной температуры и затем нерастворившиеся продукты отфильтровывали, к полученному фильтрату добавляли воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 648 мг указанного в заголовке соединения в виде желтых кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,97 (с, 3H), 1,02 (с, 3H), 1,25 (с, 3H), 1,27 (с, 3H), 1,28-1,70 (м, 17H), 2,39 (дд, J= 12,0, 10,4Гц, 2H), 2,65-2,85 (м, 4H), 2,93-3,04 (м, 1H), 3,38 (д, J= 10,4, 2H), 3,49 (ушир.с, 4H), 3,75-3,88 (м, 2H), 6,70 (дд, J= 8,8, 2,8Гц, 1H), 6,82 (д, J= 2,8Гц, 1H), 7,01 (д, J= 8,8Гц, 1H).
(61b)
Цис-4-[3-(4,4-диметилциклогексил)-4-пиперазин-1-илфенил]-2,6-диметилморфолин

К полученному в примере (61a) трет-бутиловому эфиру цис-4-[2-(4,4-диметилциклогексил)-4-(2,6-диметилморфолин-4-ил)фенил]пиперазин-1-карбоновой кислоты (648 мг, 1,33 ммоль) добавляли смешанный растворитель, состоящий из смеси этилацетата (5 мл) и дихлорметана (1 мл), затем перемешивали при комнатной температуре в атмосфере азота. По каплям добавляли 4н. раствор хлористого водорода в этилацетате (5 мл, 20 ммоль), затем перемешивали в течение 17 часов в аналогичных условиях. Для подщелачивания смеси к реакционной смеси добавляли насыщенный водный раствор карбонат натрия. Добавляли дихлорметан и воду и экстрагирование выполняли дихлорметаном. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 451 мг указанного в заголовке соединения в виде свело-желтых кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,97 (с, 3H), 1,03 (с, 3H), 1,25 (с, 3H), 1,27 (с, 3H), 1,40-1,70 (м, 8H), 2,39 (дд, J= 11,6, 10,4Гц, 2H), 2,72-2,83 (м, 4H), 2,91-3,04 (м, 5H), 3,38 (д, J= 10,4, 2H), 3,75-3,88 (м, 2H), 6,71 (дд, J= 8,4, 2,8Гц, 1H), 6,82 (д, J= 2,8Гц, 1H), 7,06 (д, J= 8,4Гц, 1H).
1H у NH не мог быть идентифицирован.
(61c)
Гидрохлорид цис-4-[4-(4-Циклобутилметилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]-2,6-диметилморфолина

Смесь полученного в примере (61b) цис-4-[3-(4,4-диметилциклогексил)-4-пиперазин-1-илфенил]-2,6-диметилморфолина (30 мг, 0,0778 ммоль), бромметилциклобутана (23 мг, 0,156 ммоль), карбоната калия (22 мг, 0,156 ммоль) и диметилформамида (1 мл) перемешивали в течение 1 часа при внешней температуре, равной 80°C. Потом, еще добавляли бромметилциклобутан (23 мг, 0,156 ммоль) и перемешивание продолжали в течение 2 часов в аналогичных условиях. К реакционной смеси добавляли насыщенный водный раствор гидрокарбонат натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем растворитель отгоняли в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением цис-4-[4-(4-циклобутилметилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]-2,6-диметилморфолина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,98 (с, 3H), 1,02 (с, 3H), 1,15-2,15 (м, 20H), 2,39 (дд, J= 11,6, 10,4Гц, 2H), 2,43-3,03 (м, 12H), 3,37 (д, J= 10,4, 2H), 3,75-3,88 (м, 2H), 6,70 (дд, J= 8,8, 2,8Гц, 1H), 6,81 (д, J= 2,8Гц, 1H), 7,07 (д, J= 8,8Гц, 1H).
Данное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Смесь концентрировали при пониженном давлении. К остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и полученное твердое вещество высушивали, с получением 38 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 454(MH+).
(Пример 62)
Этиловый эфир 4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного в примере (10a) 1-[2-(4-трет-бутилциклогексил)фенил]пиперазина (92 мг, 0,306 ммоль), триэтиламина (0,085 мл, 0,612 ммоль) и дихлорметана (2 мл) охлаждали на ледяной бане и перемешивали. К смеси добавляли этил хлорформиат (0,032 мл, 0,337 ммоль), затем перемешивали в течение 2 часов в аналогичных условиях. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 100 мг указанного в заголовке соединения в виде бесцветного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400МГц, CDCl3)
δ: 0,88 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 1,10-2,00 (м, 12H), 2,72-2,93 (м, 4H), 2,97-3,08 (м, 1H x 0,4), 3,39-3,75 (м, 4H + 1H x 0,6), 4,17 (кв., J= 7,2Гц, 2H), 7,05-7,25 (м, 3H + 1H x 0,4), 7,45 (дд, J= 8,0, 1,6Гц, 1H x 0,6).
MS m/e (ESI) 373(MH+).
(Пример 63)
4-[4-[2-(4-Трет-бутилциклогексил)фенил]пиперазин-1-ил]бутан-2-он
Смесь полученного в примере (10a) 1-[2-(4-трет-бутилциклогексил)фенил]пиперазина (30 мг, 0,0998 ммоль) и хлороформа (0,5 мл) охлаждали на ледяной бане и перемешивали. К смеси добавляли метилвинилкетон (0,017 мл, 0,200 ммоль), затем перемешивали в течение 2 часов в аналогичных условиях. Реакционную смесь очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 30 мг указанного в заголовке соединения в виде бесцветного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400МГц, CDCl3)
δ: 0,88 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 1,10-1,99 (м, 9H), 2,20 (с, 3H), 2,40-3,10 (м, 12H + 1H x 0,4), 3,34-3,43 (м, 1H x 0,6), 7,03-7,23 (м, 3H + 1H x 0,4), 7,42 (д, J= 7,6Гц, 1H x 0,6).
(Пример 64)
Гидрохлорид 4-[4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил]бутан-2-ола

К смеси боргидрида натрия (3 мг, 0,0675 ммоль) и метанола (0,5 мл) добавляли смесь полученного в примере 63 4-[4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил]бутан-2-она (25 мг, 0,0675 ммоль) в метаноле (0,5 мл), затем перемешивали в течение 4 часов при комнатной температуре.
К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 23 мг указанного в заголовке соединения в виде бесцветного масла, представляющего собой смесь диастереомеров по положениям трет-бутилциклогексила и гидроксила. Данное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Выпавшее в осадок твердое вещество фильтровали с получением 22 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положениям трет-бутилциклогексила и гидроксила.
MS m/e (ESI) 373(MH+).
(Пример 65)
Метиловый эфир 3-[4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил]пропионовой кислоты
К смеси полученного в примере (10a) 1-[2-(4-трет-бутилциклогексил)фенил]пиперазина (530 мг, 1,76 ммоль) и тетрагидрофурана (2 мл) добавляли метил акрилат (0,24 мл, 2,65 ммоль), затем перемешивали в течение 12 часов при внешней температуре, равной 45°C. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 643 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400МГц, CDCl3)
δ: 0,88 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 1,08-1,99 (м, 9H), 2,25-3,05 (м, 12H + 1H x 0,4), 3,35-3,42 (м, 1H x 0,6), 3,70 (с, 3H), 7,03-7,23 (м, 3H + 1H x 0,4), 7,42 (д, J= 7,6Гц, 1H x 0,6).
MS m/e (ESI) 387(MH+).
(Пример 66)
3-[4-[2-(4-Трет-бутилциклогексил)фенил]пиперазин-1-ил]пропионовая кислота

Смесь полученного в примере 65 метилового эфира 3-[4-[2-(4-трет-бутил-циклогексил)фенил]пиперазин-1-ил]пропионовой кислоты (600 мг, 1,55 ммоль), 2н. водного раствора гидроксида натрия (5 мл, 10 ммоль), метанола (2 мл), тетрагидрофурана (2 мл) и воды (1 мл) перемешивали в течение 12 часов и 40 минут при комнатной температуре. Затем, для доведения pH смеси до значения 6-7, к реакционной смеси добавляли 5н. хлористоводородную кислоту. Смесь концентрировали при пониженном давлении. Потом добавляли метанол, нерастворившиеся продукты отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем NAM (метанол/хлороформ), с получением коричневого масла. Добавляли гексан и выпавшее в осадок твердое вещество фильтровали с получением 414 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400МГц, CDCl3)
δ: 0,89 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 1,06-1,99 (м, 9H), 2,50-3,30 (м, 12H + 1H x 0,4), 3,32-3,39 (м, 1H x 0,6), 7,07-7,24 (м, 3H + 1H x 0,4), 7,44 (дд, J= 8,0, 2,0Гц, 1H x 0,6).
1H у карбоновой кислоты не мог быть идентифицирован.
MS m/e (ESI) 373(MH+).
(Пример 67)
Гидрохлорид 3-[4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил]-N-этилпропионамида

Смесь полученной в примере 66 3-[4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил]пропионовой кислоты (50 мг, 0,134 ммоль), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (77 мг, 0,403 ммоль), моногидрата 1-гидроксибензотриазола (62 мг, 0,403 ммоль), гидрохлорида этиламина (55 мг, 0,671 ммоль), триэтиламина (0,09 мл, 0,671 ммоль) и диметилформамида (1 мл) перемешивали в течение 24 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 53 мг 3-[4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил]-N-этилпропионамида в виде бесцветного масла, представляющего собой смесь диастереомеров по положению трет-бутилциклогексила.
1H-ЯМР (400МГц, CDCl3)
δ: 0,89 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 1,08-1,99 (м, 12H), 2,35-3,04 (м, 12H + 1H x 0,4), 3,24-3,42 (м, 2H + 1H x 0,6), 7,07-7,25 (м, 3H + 1H x 0,4), 7,44 (дд, J= 7,6, 1,6Гц, 1H x 0,6).
1H у NH не мог быть идентифицирован.
MS m/e (ESI) 400(MH+).
Данное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате. Выпавшее в осадок твердое вещество фильтровали с получением 49 мг указанного в заголовке соединения в виде бесцветных кристаллов, представляющих собой смесь диастереомеров по положению трет-бутилциклогексила.
(Пример 68)
Гидрохлорид 1-[2-(4,4-диметилциклогексил)фенил]-4-фуран-2-илметилпиперазина

К смеси полученного в примере (3c )1-[2-(4,4-диметилциклогексил)фенил]пиперазина (30 мг, 0,11 ммоль), фуран-2-карбальдегида (21 мг, 0,22 ммоль) и тетрагидрофурана (2 мл) добавляли триацетоксиборгидрид натрия (119 мг, 0,559 ммоль), затем перемешивали в течение 1 часа и 50 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой фильтровали через целит. Растворитель отгоняли из фильтрата в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-[2-(4,4-диметилциклогексил)фенил]-4-фуран-2-илметилпиперазина. Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и полученное твердое вещество высушивали, с получением 38 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 353(MH+).
(Пример 69)
Гидрохлорид 1-[2-(4,4-диметилциклогексил)фенил]-4-фуран-3-илметилпиперазина

К смеси полученного в примере (3c) 1-[2-(4,4-диметилциклогексил)фенил]пиперазина (30 мг, 0,11 ммоль), фуран-3-карбальдегида (21 мг, 0,22 ммоль) и тетрагидрофурана (2 мл) добавляли триацетоксиборгидрид натрия (119 мг, 0,559 ммоль), затем перемешивали при комнатной температуре в течение 1 часа и 50 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбонат натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой фильтровали через целит. Растворитель отгоняли из фильтрата в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-[2-(4,4-диметилциклогексил)фенил]-4-фуран-3-илметилпиперазина. Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и полученное твердое вещество высушивали, с получением 31 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 353(MH+).
[0333]
(Пример 70)
Гидрохлорид 1-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина

(70a)
Трет-бутиловый эфир 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного в примере (99a) трет-бутилового эфира 4-[4-бром-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (200 мг, 0,417 ммоль), карбоната цезия (408 мг, 1,25 ммоль), тетракис(трифенилфосфин)палладия(0) (50 мг, 0,0417 ммоль) и диметилформамида (4 мл) перемешивали при комнатной температуре в атмосфере азота. К смеси добавляли триметилбороксин (0,06 мл, 0,417 ммоль) и перемешивание продолжали в течение 9 часов при внешней температуре, равной 100°C. К реакционной смеси добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 124 мг указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,11 (с, 6H), 1,13-1,44 (м, 6H), 1,48 (с, 9H), 2,30 (с, 3H), 2,79 (ушир.с, 4H), 3,57 (тт, J= 12,4, 2,8Гц, 1H), 6,94-6,97 (м, 2H), 7,03 (ушир.с, 1H).
4H у пиперазинового кольца не могли быть идентифицированы.
(70b)
1-[4-Метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин

Смесь полученного в примере (70a) трет-бутилового эфира 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (124 мг, 0,299 ммоль), трифторуксусной кислоты (1 мл, 12,9 ммоль) и дихлорметана (2 мл) перемешивали в течение 2 часов и 30 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 85 мг указанного в заголовке соединения в виде желтых кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,12 (с, 6H), 1,13-1,48(м, 6H), 2,30 (с, 3H), 2,82 (т, J= 4,8Гц, 4H), 3,02 (т, J= 4,8Гц, 4H), 3,59 (тт, J= 12,4, 2,8Гц, 1H), 6,97 (ддд, J= 8,4, 2,0, 0,8Гц, 1H), 6,99-7,05 (м, 2H).
1H у NH не мог быть идентифицирован.
(70c)
Гидрохлорид 1-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина

К смеси полученного в примере (70b) 1-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (55 мг, 0,175 ммоль), пропиональдегида (20 мг, 0,350 ммоль) и тетрагидрофурана (2 мл) добавляли триацетоксиборгидрид натрия (75 мг, 0,350 ммоль), затем перемешивали в течение 1 часа и 15 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали, и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 56 мг 1-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина в виде бесцветного твердого вещества.
Данное соединение растворяли в дихлорметане и затем добавляли 4н. раствор хлористого водорода в этилацетате, и смесь концентрировали при пониженном давлении. К полученному остатку добавляли смесь диэтилового эфира и гексана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гексана, удаляли, и полученное твердое вещество высушивали, с получением 54 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,91-0,95 (м, 9H), 1,12 (с, 6H), 1,13-1,60 (м, 8H), 2,29 (с, 3H), 2,34-2,38 (м, 2H), 2,59 (ушир.с, 4H), 2,88-2,2,90 (м, 4H), 3,56 (тт, J= 12,4, 2,8Гц, 1H), 6,93-6,95 (м, 1H), 7,01-7,03 (м, 2H).
MS m/e (ESI) 357(MH+).
(Пример 71)
Гидрохлорид 1-[3-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина

(71a)
1-Метил-3-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензол

Смесь полученного в примере (4b) 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолана (3,96 г, 15 ммоль), 2-бром-3-нитротолуола (2,48 г, 11,5 ммоль), тетракис(трифенилфосфин)палладия(0) (1,33 г, 1,15 ммоль), трикалий фосфата (3,66 г, 17,3 ммоль), 1,2-диметоксиэтана (30 мл) и воды (10 мл) перемешивали в атмосфере азота в течение 10 часов и 20 минут при внешней температуре, равной 80°C. К реакционной смеси добавляли этилацетат и воду и эту смесь фильтровали через целит. Затем фильтрат экстрагировали этилацетатом. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (гексан), с получением 3,14 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,01 (с, 3H), 1,06 (с, 3H), 1,07 (с, 3H), 1,10 (с, 3H), 1,37-1,46 (м, 2H), 1,90 (д, J= 17,2Гц, 1H), 2,14 (дд, J= 17,2, 2,0Гц, 1H), 2,33 (с, 3H), 5,23 (т, J= 2,0Гц, 1H), 7,24 (дд, J= 8,0, 7,6Гц, 1H), 7,36 (д, J= 7,6Гц, 1H), 7,53 (д, J= 8,0Гц, 1H).
(71b)
3-Метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фениламин

Смесь полученного в примере (71a) 1-метил-3-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензола (1 г, 3,66 ммоль), железного порошка (631 мг, 11,0 ммоль), хлорида аммония (783 мг, 14,6 ммоль), этанола (15 мл), воды (6 мл) и диметилформамида (1 мл) перемешивали в атмосфере азота в течение 3 часов и 30 минут при внешней температуре, равной 90°C. К реакционной смеси добавляли этилацетат и воду и эту смесь фильтровали через целит. Затем фильтрат экстрагировали этилацетатом. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 663 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,074 (с, 3H), 1,076 (с, 3H), 1,098 (с, 3H), 1,101 (с, 3H), 1,45 (с, 2H), 1,85 (дд, J= 17,2, 1,2Гц, 1H), 1,95 (дд, J= 17,2, 1,2Гц, 1H), 2,18 (с, 3H), 3,65 (ушир.с, 2H), 5,38 (ушир.с, 1H), 6,55 (д, J= 7,6Гц, 1H), 6,61 (д, J= 7,2Гц, 1H), 6,94 (дд, J= 7,6, 7,2Гц, 1H).
(71c)
1-[3-Метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин

К смеси полученного в примере (71b) 3-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фениламина (663 мг, 2,72 ммоль) и 1,2-дихлорбензола (3 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (632 мг, 3,54 ммоль), затем перемешивали в течение 5 часов и 50 минут при внешней температуре, равной 200°C, в атмосфере азота. Во время проведения взаимодействия через реактор несколько раз пропускали поток азота. Реакционную смесь охлаждали до комнатной температуры, добавляли хлороформ и насыщенный раствор гидрокарбоната натрия и полученный фильтрованием через целит фильтрат экстрагировали хлороформом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 625 мг указанного в заголовке соединения в виде желтого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 1,05 (с, 6H), 1,11 (с, 6H), 1,43 (с, 2H), 1,65 (д, J= 16,8Гц, 1H), 2,23 (с, 3H), 2,38 (д, J= 16,8Гц, 1H), 2,59-2,70 (м, 2H), 2,84-2,93 (м, 2H), 2,95-3,03 (м, 2H), 3,08-3,16 (м, 2H), 5,17 (с, 1H), 6,94 (д, J= 7,2Гц, 1H), 6,96 (д, J= 8,0Гц, 1H), 7,11 (дд, J= 8,0, 7,2Гц, 1H).
1H у NH не мог быть идентифицирован.
(71d)
Гидрохлорид 1-[3-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина

К смеси полученного в примере (71c) 1-[3-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина (115 мг, 0,368 ммоль), пропиональдегида (0,079 мл, 1,1 ммоль) и тетрагидрофурана (2 мл) добавляли триацетоксиборгидрид натрия (246 мг, 1,1 ммоль), затем перемешивали при комнатной температуре в течение 1 часа и 30 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 124 мг 1-[3-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина в виде бесцветных кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (т, J= 7,6Гц, 3H), 1,05 (с, 6H), 1,10 (с, 3H), 1,11 (с, 3H), 1,43 (с, 2H), 1,48-1,57 (м, 2H), 1,64 (д, J= 17,2Гц, 1H), 2,23 (с, 3H), 2,31-2,35 (м, 2H), 2,38 (д, J= 17,2Гц, 1H), 2,42-2,66 (м, 4H), 2,67-2,78 (м, 2H), 3,18-3,28 (м, 2H), 5,18 (с, 1H), 6,94 (д, J= 7,2Гц, 1H), 6,99 (д, J= 7,6Гц, 1H), 7,11 (дд, J= 7,6, 7,2Гц, 1H).
Данное соединение растворяли в дихлорметане и затем добавляли 4н. раствор хлористого водорода в этилацетате, и смесь концентрировали при пониженном давлении. К полученному остатку добавляли смесь диэтилового эфира и гексана, с получением твердого вещества, которое измельчали с помощью ультразвука. Затем его фильтровали и высушивали, с получением 134 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 355(MH+).
(Пример 72)
Гидрохлорид 1-[5-метокси-4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина

(72a)
Трет-бутиловый эфир 4-[5-метокси-4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного методом синтеза, аналогичного описанному в примере (43c), трет-бутилового эфира 4-[4-бром-5-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (509 мг, 1 ммоль), пиперидина (128 мг, 1,5 ммоль), трет-бутоксида натрия (240 мг, 2,5 ммоль), ацетата паладия(II) (22 мг, 0,1 ммоль), тетрафторбората три-трет-бутилфосфония (87 мг, 0,3 ммоль) и ксилола (3 мл) перемешивали в течение 20 часов при внешней температуре, равной 100°C, в атмосфере азота, и затем дополнительно перемешивали в течение 12 часов при внешней температуре, равной 120°C. К реакционной смеси добавляли этилацетат и воду, которую затем пропускали через целит для удаления нерастворимых веществ. Полученный фильтрат экстрагировали этилацетатом. Отделенный органический слой промывали водой и насыщенный солевой раствор и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 88 мг указанного в заголовке соединения в виде красных кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 1,10 (с, 6H), 1,14-1,65 (м, 17H), 1,74 (ушир.с, 4H), 2,80 (ушир.с, 4H), 2,95 (ушир.с, 4H), 3,54 (т, J= 12,4Гц, 1H), 3,81 (с, 3H), 6,59 (с, 1H), 6,77 (с, 1H).
4H не могли быть обнаружены.
(72b)
1-[5-Метокси-4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин

Смесь полученного в примере (72a) трет-бутилового эфира 4-[5-метокси-4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (88 мг, 0,17 ммоль), трифторуксусной кислоты (0,25 мл, 3,2 ммоль) и дихлорметана (0,5 мл) перемешивали при комнатной температуре в течение 1 часа и 10 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 56 мг указанного в заголовке соединения в виде красного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,12 (с, 6H), 1,14-1,65 (м, 8H), 1,71-1,77 (м, 4H), 2,81-2,83 (м, 4H), 2,95 (т, J= 5,2Гц, 4H), 2,99-3,02 (м, 4H), 3,56 (тт, J= 12,4, 2,8Гц, 1H), 3,83 (с, 3H), 6,66 (с, 1H), 6,77 (с, 1H).
1H у NH не мог быть идентифицирован.
(72c)
Гидрохлорид 1-[5-метокси-4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина

К смеси полученного в примере (72b) 1-[5-метокси-4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (5 мг, 0,0121 ммоль), пропиональдегида (1,4 мг, 0,0242 ммоль) и тетрагидрофурана (0,3 мл) добавляли триацетоксиборгидрид натрия (5 мг, 0,0242 ммоль), затем перемешивали при комнатной температуре в течение 1 часа и 10 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Растворитель отгоняли в токе азота до отделения органического слоя. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1-[5-метокси-4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина. Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли гептан, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гептана удаляли и полученное твердое вещество высушивали, с получением 6,1 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,055 (т, J= 7,6Гц, 3H), 1,06 (с, 6H), 1,18-2,08 (м, 12H), 2,66-2,80 (м, 2H), 2,87-3,08 (м, 4H), 3,21-3,31 (м, 2H), 3,44-3,91 (м, 9H), 3,94 (с, 3H), 6,80 (с, 1H), 8,56 (с, 1H).
MS m/e (ESI) 456(MH+).
(Пример 73)
Гидрохлорид 1-(2-Фторэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль), 1-бром-2-фторэтана (16,2 мг, 0,125 ммоль), йодида натрия (1,5 мг, 0,01 ммоль), карбоната калия (20,8 мг, 0,15 ммоль) и диметилформамида (1 мл) перемешивали в течение 2 часов при внешней температуре, равной 80°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью диэтилового эфира. Растворитель отгоняли в токе азота до отделения органического слоя. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-(2-фторэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,13 (с, 6H), 1,15 (д, J= 13,6Гц, 1H), 1,23 (дд, J= 12,4, 12,4Гц, 2H), 1,33 (дт, J= 13,6, 2,0Гц, 1H), 1,40-1,48 (м, 2H), 2,71 (ушир.с, 4H), 2,77 (дт, J= 28,4, 4,8Гц, 2H), 2,95 (т, J= 4,8Гц, 4H), 3,57 (тт, J= 12,4, 2,8Гц, 1H), 4,57 (дт, J= 47,6, 4,8Гц, 2H), 7,05-7,18 (м, 3H), 7,23 (дд, J= 7,6, 1,6Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 27,5 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 347(MH+).
(Пример 74)
Гидрохлорид 1-(2,2-дифторэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль), 2-бром-1,1-дифторэтана (18,1 мг, 0,125 ммоль), йодида натрия (1,5 мг, 0,01 ммоль), карбоната калия (20,8 мг, 0,15 ммоль) и диметилформамида (1 мл) перемешивали в течение 2 часов при внешней температуре, равной 80°C. После дополнительного добавления к реакционной смеси 2-бром-1,1-дифторэтана (18,1 мг, 0,125 ммоль) смесь далее перемешивали в течение 6 часов и 30 минут при внешней температуре, равной 80°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью диэтилового эфира. Растворитель отгоняли в токе азота до отделения органического слоя. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-(2,2-дифторэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,12 (с, 6H), 1,17 (д, J= 14,0Гц, 1H), 1,23 (дд, J= 12,8, 12,8Гц, 2H), 1,33 (дт, J= 13,6, 2,0Гц, 1H), 1,38-1,46 (м, 2H), 2,75 (ушир.с, 4H), 2,81 (тд, J= 14,8, 4,4Гц, 2H), 2,93 (т, J= 4,8Гц, 4H), 3,55 (тт, J= 12,8, 2,8Гц, 1H), 5,93 (тт, J= 56,0, 4,4Гц, 1H), 7,05-7,18 (м, 3H), 7,23 (дд, J= 7,6, 1,6Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 15,3 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 365(MH+).
(Пример 75)
Гидрохлорид 1-(3-фторпропил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль), 1-бром-3-фторпропана (18,0 мг, 0,125 ммоль), йодида натрия (1,5 мг, 0,01 ммоль), карбоната калия (20,8 мг, 0,15 ммоль) и диметилформамида (1 мл) перемешивали в течение 2 часов при внешней температуре, равной 80°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью диэтилового эфира. Растворитель отгоняли в токе азота до отделения органического слоя. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-(3-фторпропил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,12 (с, 6H), 1,15 (д, J= 14,0Гц, 1H), 1,23 (дд, J= 12,8, 12,8Гц, 2H), 1,33 (дт, J= 13,6, 2,0Гц, 1H), 1,38-1,47 (м, 2H), 1,86-2,01 (м, 2H), 2,53-2,57 (м, 2H), 2,61 (ушир.с, 4H), 2,92 (т, J= 4,8Гц, 4H), 3,57 (тт, J= 12,8, 2,8Гц, 1H), 4,56 (дт, J= 47,2, 6,0Гц, 2H), 7,04-7,18 (м, 3H), 7,25 (дд, J= 7,2, 2,0Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 27,8 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 361(MH+).
(Пример 76)
Гидрохлорид 1-(4-фторбутил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль), 1-бром-4-фторбутана (19,8 мг, 0,125 ммоль), йодида натрия (1,5 мг, 0,01 ммоль), карбоната калия (20,8 мг, 0,15 ммоль) и диметилформамида (1 мл) перемешивали в течение 2 часов при внешней температуре, равной 80°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью диэтилового эфира. Растворитель отгоняли в токе азота до отделения органического слоя. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-(4-фторбутил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,12 (с, 6H), 1,15 (д, J= 14,0Гц, 1H), 1,23 (дд, J= 12,4, 12,4Гц, 2H), 1,32 (дт, J= 13,6, 2,0Гц, 1H), 1,39-1,48 (м, 2H), 1,60-1,84 (м, 4H), 2,43-2,46 (м, 2H), 2,61 (ушир.с, 4H), 2,92 (т, J= 4,8Гц, 4H), 3,57 (тт, J= 12,8, 2,8Гц, 1H), 4,49 (дт, J= 47,2, 6,0Гц, 2H), 7,04-7,18 (м, 3H), 7,22 (дд, J= 7,6, 1,6Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 27,3 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 375(MH+).
(Пример 77)
Гидрохлорид 1-аллил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль), аллилбромида (14,8 мг, 0,12 ммоль), карбоната калия (20,8 мг, 0,15 ммоль) и диметилформамида (1 мл) перемешивали в течение 4 часов и 20 минут при внешней температуре, равной 80°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли смесью этилацетата и дихлорметана. Отделенный органический слой промывали водой и затем растворитель отгоняли в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-аллил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,13 (с, 6H), 1,15-1,28 (м, 3H), 1,33 (дт, J= 13,6, 2,0Гц, 1H), 1,38-1,48 (м, 2H), 2,60 (ушир.с, 4H), 2,93 (т, J= 4,8Гц, 4H), 3,07 (ддд, J= 6,8, 1,2, 1,2Гц, 2H), 3,57 (тт, J= 12,4, 2,8Гц, 1H), 5,16-5,19 (м, 1H), 5,21-5,26 (м, 1H), 5,20 (ddt, J= 17,2, 10,0, 6,8Гц, 1H), 7,04-7,18 (м, 3H), 7,20-7,25 (м, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 17,7 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 341(MH+).
(Пример 78)
Гидрохлорид 1-проп-2-инил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль), пропаргилбромида (14,3 мг, 0,12 ммоль), карбоната калия (20,8 мг, 0,15 ммоль) и диметилформамида (1 мл) перемешивали в течение 4 часов и 20 минут при внешней температуре, равной 80°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли смесью этилацета и дихлорметана. Отделенный органический слой промывали водой и затем растворитель отгоняли в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-проп-2-инил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,13 (с, 6H), 1,14-1,36 (м, 4H), 1,40-1,48 (м, 2H), 2,27 (т, J= 2,4Гц, 1H), 2,75 (ушир.с, 4H), 2,96 (т, J= 4,8Гц, 4H), 3,37 (д, J= 2,4Гц, 2H), 3,56 (тт, J= 12,4, 2,8Гц, 1H), 7,05-7,18 (м, 3H), 7,23 (дд, J= 8,0, 1,6Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 6,6 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 339(MH+).
(Пример 79)
Гидрохлорид 1-бут-2-инил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль), 1-бром-2-бутина (16,1 мг, 0,12 ммоль), карбоната калия (20,8 мг, 0,15 ммоль) и диметилформамида (1 мл) перемешивали в течение 4 часов и 20 минут при внешней температуре, равной 80°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью диэтилового эфира. Отделенный органический слой промывали водой и затем растворитель отгоняли в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-бут-2-инил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,14 (с, 6H), 1,14-1,36 (м, 4H), 1,40-1,48 (м, 2H), 1,84 (т, J= 2,4Гц, 3H), 2,73 (ушир.с, 4H), 2,96 (т, J= 4,8Гц, 4H), 3,28 (кв., J= 2,4Гц, 2H), 3,57 (тт, J= 12,8, 2,8Гц, 1H), 7,05-7,18 (м, 3H), 7,22 (дд, J= 7,6, 1,6Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 11,2 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 353(MH+).
(Пример 80)
Гидрохлорид 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(4,4,4-трифторбутил)пиперазина

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль), 1-бром-4,4,4-трифторбутана (24,4 мг, 0,125 ммоль), йодида натрия (1,5 мг, 0,01 ммоль), карбоната калия (20,8 мг, 0,15 ммоль) и диметилформамида (1 мл) перемешивали в течение 2 часов и 30 минут при внешней температуре, равной 60°C. К реакционной смеси добавляли водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью диэтилового эфира. Растворитель отгоняли в токе азота до отделения органического слоя. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(4,4,4-трифторбутил)пиперазина.
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 27,5 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
1H-ЯМР (400МГц, CD3OD)
δ: 0,95 (с, 6H), 1,17 (с, 6H), 1,19-1,42 (м, 6H), 1,98-2,09 (м, 2H), 2,28-2,40 (м, 2H), 3,15 (с, 4H), 3,20-3,90 (м, 7H), 7,12-7,20 (м, 3H), 7,26-7,30 (м, 1H).
MS m/e (ESI) 411(MH+).
(Пример 81)
Гидрохлорид 4-[3-(4-бутилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]морфолина

(81a)
3-Пиперазин-1-ил-4-(3,3,5,5-тетраметилциклогексил)фенол

Для проведения Н-бутилоксикарбонилирования и гидрирования с помощью обычных способов, в качестве исходного материала использовали полученный в примере (27c) 1-[5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин. Смесь полученного путем взаимодействия трет-бутилового эфира 4-[5-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (3,41 г, 7,92 ммоль), уксусной кислоты (18 мл, 314 ммоль) и 48% бромистоводородной кислоты (36 мл, 318 ммоль) перемешивали в течение 8 часов и 20 минут при внешней температуре, равной 130°C. Реакционную смесь охлаждали на бане с ледяной водой и перемешивали, и затем, для доведения pH смеси до значения 8-9, по каплям добавляли 5н. водный раствор гидроксида натрия. Полученное твердое вещество фильтровали с получением 2,98 г сырого продукта указанного в заголовке соединения в виде светло-красного твердого вещества.
1H-ЯМР (400МГц, CD3OD)
δ: 0,94 (с, 6H), 1,54 (с, 6H), 1,17-1,40 (м, 6H), 3,05 (т, J= 4,8Гц, 4H), 3,42 (тт, J= 12,8, 2,8Гц, 1H), 6,55-6,61 (м, 2H), 7,05 (д, J= 8,0Гц, 1H).
4H у пиперазинового кольца и 2H у NH и OH не могли быть идентифицированы.
(81b)
Трет-бутиловый эфир 4-[5-гидрокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты
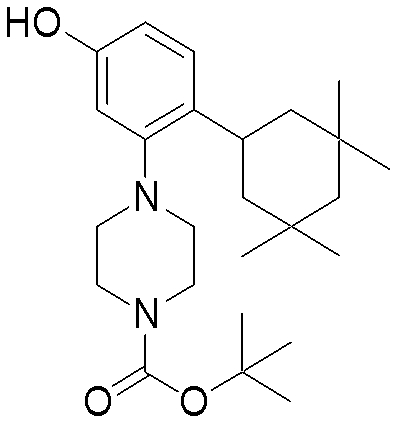
Смесь сырого продукта полученного в примере (81a) 3-пиперазин-1-ил-4-(3,3,5,5-тетраметилциклогексил)фенола (2,98 г) и смешанного растворителя, состоящего из смеси хлороформа и метанола (100 мл), перемешивали при внешней температуре, равной 0°C. По каплям добавляли раствор ди-трет-бутил дикарбоната (1,81 г, 8,32 ммоль) в хлороформе. После перемешивания в течение 2 часов и 30 минут, реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор карбоната натрия и этилацетата, и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали, и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 2,95 г указанного в заголовке соединения в виде светло-красного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,91 (с, 6H), 1,10 (с, 6H), 1,11-1,43 (м, 6H), 1,49 (с, 9H), 2,80 (ушир.с, 4H), 3,43 (тт, J= 12,4, 2,8Гц, 1H), 3,52 (ушир.с, 4H), 6,55-6,57 (м, 2H), 7,06 (дд, J= 7,2, 1,6Гц, 1H).
1H у OH не мог быть идентифицирован.
(81c)
Трет-бутиловый эфир 4-[5-(нонафторбутан-1-сульфонилокси)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного в примере (81b) трет-бутилового эфира 4-[5-гидрокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (1,5 г, 3,60 ммоль), 4-диметиламинопиридина (22,2 мг, 0,18 ммоль), диизопропилэтиламина (0,758 мл, 4,32 ммоль) и дихлорметана (10 мл) охлаждали на бане с ледяной водой и перемешивали в атмосфере азота. Затем по каплям добавляли фторид перфторбутансульфонила (0,773 мл, 3,96 ммоль). После перемешивания в течение 1 часа и 20 минут в аналогичных условиях, перемешивание продолжали в течение 16 часов при комнатной температуре. К реакционной смеси добавляли воду, и экстрагирование выполняли дихлорметаном. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали, и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 2,41 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,11 (с, 6H), 1,13-1,46 (м, 6H), 1,49 (с, 9H), 2,82 (ушир.с, 4H), 3,51 (тт, J= 12,4, 2,8Гц, 1H), 3,57 (ушир.с, 4H), 6,91 (д, J= 2,4Гц, 1H), 6,99 (дд, J= 8,8, 2,4Гц, 1H), 7,27 (д, J= 8,4Гц, 1H).
(81d)
Трет-бутиловый эфир 4-[5-морфолин-4-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного в примере (81c) трет-бутилового эфира 4-[5-(нонафторбутан-1-сульфонилокси)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (200 мг, 0,286 ммоль), морфолина (37,8 мг, 0,429 ммоль), трет-бутоксида натрия (56,7 мг, 0,572 ммоль), трис(дибензилиденацетон)дипалладия(0) (13,1 мг, 0,0143 ммоль), 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенила (11,5 мг, 0,0286 ммоль) и ксилола (3 мл) перемешивали в течение 13 часов и 30 минут при внешней температуре, равной 100°C, в атмосфере азота. Для удаления нерастворимых веществ реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 103 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,91 (с, 6H), 1,10 (с, 6H), 1,11-1,44 (м, 6H), 1,48 (с, 9H), 2,82 (ушир.с, 4H), 3,10-3,12 (м, 4H), 3,45 (тт, J= 12,8, 2,8Гц, 1H), 3,83-3,85 (м, 4H), 6,62-6,68 (м, 2H), 7,12 (д, J= 8,0Гц, 1H).
4H у пиперазинового кольца не могли быть идентифицированы.
(81e)
4-[3-Пиперазин-1-ил-4-(3,3,5,5-тетраметилциклогексил)фенил]морфолин

Смесь полученного в примере (81d) трет-бутилового эфира 4-[5-морфолин-4-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (103 мг, 0,212 ммоль), трифторуксусной кислоты (1 мл, 13,0 ммоль) и дихлорметана (2 мл) перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 42 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,91 (с, 6H), 1,11 (с, 6H), 1,12-1,45 (м, 6H), 2,80-2,90 (м, 4H), 3,00-3,03 (м, 4H), 3,11-3,13 (м, 4H), 3,45 (тт, J= 12,8, 2,8Гц, 1H), 3,80-3,90 (м, 4H), 6,63 (дд, J= 8,4, 2,8Гц, 1H), 6,68 (д, J= 2,8Гц, 1H), 7,11 (д, J= 8,4Гц, 1H).
1H у NH не мог быть идентифицирован.
(81f)
Гидрохлорид 4-[3-(4-бутилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]морфолина

К смеси полученного в примере (81e) 4-[3-пиперазин-1-ил-4-(3,3,5,5-тетраметилциклогексил)фенил]морфолина (14 мг, 0,0363 ммоль), бутиральдегида (0,0097 мл, 0,109 ммоль) и тетрагидрофурана (0,5 мл) добавляли триацетоксиборгидрид натрия (23 мг, 0,109 ммоль), затем перемешивали в течение 1 часа и 30 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Растворитель отгоняли в токе азота до отделения органического слоя. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 4-[3-(4-бутилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]морфолин.
1H-ЯМР (400МГц, CDCl3)
δ: 0,91 (с, 6H), 0,94 (т, J= 7,2Гц, 3H), 1,11 (с, 6H), 1,13-1,54 (м, 10H), 2,39 (т, J= 7,6Гц, 2H), 2,59 (ушир.с, 4H), 2,92 (с, 4H), 3,10 (с, 4H), 3,43 (т, J= 12,4Гц, 1H), 3,84 (с, 4H), 6,63 (д, J= 8,0Гц, 1H), 6,70 (с, 1H), 7,10 (д, J= 8,0Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гексана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гексана, удаляли и полученное твердое вещество высушивали, с получением 17,2 мг указанного в заголовке соединения в виде светло-красного твердого вещества.
MS m/e (ESI) 442(MH+).
(Пример 82)
Гидрохлорид 1-[3-(4-пропилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]этанона

(82a)
Трет-бутиловый эфир 4-[5-ацетил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного в примере (81c) трет-бутилового эфира 4-[5-(нонафторбутан-1-сульфонилокси)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (267 мг, 0,382 ммоль), трибутил(1-этоксивинил)тина (0,16 мл, 0,458 ммоль), дихлорбис(трифенилфосфин)палладия(II) (41 мг, 0,0573 ммоль), хлорида лития (48,6 мг, 1,15 ммоль) и диметилформамида (3 мл) перемешивали в течение 6 часов и 10 минут при внешней температуре, равной 90°C в атмосфере азота. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетата. Смесь фильтровали через целит и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 163 мг указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,12 (с, 6H), 1,14-1,46 (м, 6H), 1,49 (с, 9H), 2,56 (с, 3H), 2,76-2,92 (м, 4H), 3,61 (тт, J= 12,4, 2,8Гц, 1H), 7,31 (д, J= 7,6Гц, 1H), 7,64-7,68 (м, 2H).
4H у пиперазинового кольца не могли быть идентифицированы.
(82b)
1-[3-Пиперазин-1-ил-4-(3,3,5,5-тетраметилциклогексил)фенил]этанон
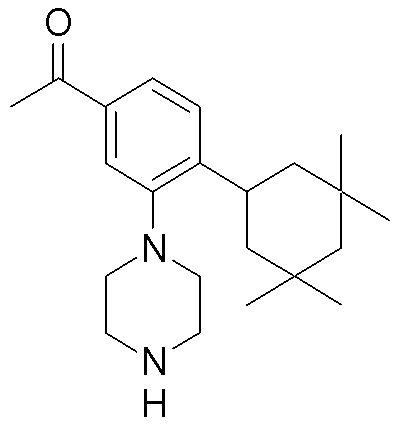
Смесь полученного в примере (82a) трет-бутилового эфира 4-[5-ацетил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (163 мг, 0,368 ммоль), диэтилового эфира (2 мл) и гептана (2 мл) перемешивали при комнатной температуре. Добавляли 4н. раствор хлористого водорода в этилацетате (2 мл, 8 ммоль) и смесь перемешивали в течение 18 часов и 30 минут. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью диэтилового эфира. Отделенный органический слой промывали водой и насыщенным солевым раствором в указанном порядке. Смесь затем фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 58 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,13 (с, 6H), 1,14-1,46 (м, 6H), 2,57 (с, 3H), 2,82-2,91 (м, 4H), 2,99-3,17 (м, 4H), 3,62 (тт, J= 12,4, 2,8Гц, 1H), 7,29 (д, J= 8,0Гц, 1H), 7,64 (дд, J= 8,0, 2,0Гц, 1H), 7,69 (д, J= 2,0Гц, 1H).
1H у NH не мог быть идентифицирован.
(82c)
Гидрохлорид 1-[3-(4-пропилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]этанона

К смеси полученного в примере (82b) 1-[3-пиперазин-1-ил-4-(3,3,5,5-тетраметилциклогексил)фенил]этанона (19 мг, 0,0555 ммоль), пропиональдегида (0,0119 мл, 0,166 ммоль) и тетрагидрофурана (0,3 мл) добавляли триацетоксиборгидрид натрия (35 мг, 0,166 ммоль), затем перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью диэтилового эфира. Растворитель отгоняли в токе азота до отделения органического слоя. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-[3-(4-пропилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]этанона.
1H-ЯМР (400МГц, CDCl3)
δ: 0,90-0,97 (м, 9H), 1,13 (с, 6H), 1,14-1,45 (м, 8H), 2,34-2,40 (м, 2H), 2,56 (с, 3H), 2,60 (ушир.с, 4H), 2,90-3,00 (м, 4H), 3,59 (тт, J= 12,4, 2,8Гц, 1H), 7,29 (д, J= 8,0Гц, 1H), 7,64 (дд, J= 8,0, 2,0Гц, 1H), 7,70 (д, J= 2,0Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли смесь диэтилового эфира и гептана, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор, состоящий из диэтилового эфира и гептана, удаляли и полученное твердое вещество высушивали, с получением 15,5 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 385(MH+).
(Пример 83)
1-[4-[2-(4,4-Диэтилциклогексил)фенил]пиперазин-1-ил]бутан-1-он

(83a)
1-[2-(4,4-Диэтилциклогексил)фенил]пиперазин

Смесь полученного в примере (38b) трет-бутилового эфира 4-[2-(4,4-диэтилциклогексил)фенил]пиперазин-1-карбоновой кислоты (1,12 г, 2,80 ммоль), трифторуксусной кислоты (10 мл, 130 ммоль) и дихлорметана (10 мл) перемешивали в течение 10 минут при внешней температуре, равной 0°C, и температуру поднимали до значения комнатной, потом перемешивали в течение 30 минут. Затем для подщелачивания смеси постепенно к реакционной смеси добавляли карбонат калия. Потом добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Осушитель отфильтровывали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол), с получением 912 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 301(MH+).
(83b)
1-[4-[2-(4,4-Диэтилциклогексил)фенил]пиперазин-1-ил]бутан-1-он

К раствору полученного в примере (83a) 1-[2-(4,4-диэтилциклогексил)фенил]пиперазина (30 мг, 0,10 ммоль) в тетрагидрофуране (1 мл) добавляли триэтиламин (15 мг, 0,15 ммоль), затем перемешивали при внешней температуре, равной 0°C. К реакционной смеси при перемешивании добавляли бутирилхлорид (0,015 мл, 0,14 ммоль) и перемешивание продолжали в течение 9 часов и 30 минут при внешней температуре, равной 0°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Органический слой промывали водой и фильтровали через целит, и фильтрат концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 27 мг указанного в заголовке соединения в виде желтого твердого вещества.
MS m/e (ESI) 371(MH+).
(Пример 84)
Гидрохлорид 1-{4-[2-(4,4-диэтилциклогексил)-4-морфолин-4-илфенил]пиперазин-1-ил}бутан-2-она

(84a)
Трет-бутиловый эфир 4-[2-(4,4-диэтилциклогексил)-4-морфолин-4-ил)фенил]пиперазин-1-карбоновой кислоты

К раствору полученного в примере (38c) трет-бутилового эфира 4-[4-бром-2-(4,4-диэтилциклогексил)фенил]пиперазин-1-карбоновой кислоты (500 мг, 1,0 ммоль) в ксилоле (10 мл) добавляли морфолин (245 мг, 2,82 ммоль), трет-бутоксид натрия (450 мг, 4,68 ммоль), тетрафторборат три-трет-бутилфосфония (340 мг, 1,17 ммоль) и ацетат палладия(II) (105 мг, 0,47 ммоль), затем перемешивали в течение 1 часа при внешней температуре, равной 100°C, в атмосфере азота. Реакционную смесь охлаждали воздухом до комнатной температуры и затем фильтровали через целит. Полученный фильтрат концентрировали при пониженном давлении и остаток распределяли между этилацетатом и водой. Полученный органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Осушитель отфильтровывали и полученный фильтрат отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 573 мг указанного в заголовке соединения в виде белого твердого вещества.
(84b)
4-[3-(4,4-Диэтилциклогексил)-4-пиперазин-1-илфенил]морфолин

Смесь полученного в примере (84a) трет-бутилового эфира 4-[2-(4,4-диэтилциклогексил)-4-морфолин-4-ил]фенил]пиперазин-1-карбоновой кислоты (573 мг, 1,18 ммоль), трифторуксусной кислоты (10 мл, 130 ммоль) и дихлорметана (10 мл) перемешивали в течение 10 минут при внешней температуре, равной 0°C, и затем перемешивание продолжали в течение 30 минут при комнатной температуре. Реакционную смесь охлаждали в воде со льдом, и для подщелачивания смеси добавляли карбонат калия. Затем добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Осушитель отфильтровывали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 354 мг указанного в заголовке соединения в виде белого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,75-0,85 (м, 6H), 1,16-1,68 (м, 13H), 2,76-2,79 (м, 4H), 2,98-3,00(м, 4H), 3,11-3,13 (м, 4H), 3,85-3,87 (м, 4H), 6,70 (дд, J= 8,8, 2,8 Гц, 1H), 6,81 (д, J =2,8 Гц, 1H), 7,05 (д, J= 8,8 Гц, 1H).
1H у NH не мог быть идентифицирован.
(84c)
Гидрохлорид 1-[4-[2-(4,4-диэтилциклогексил)-4-морфолин-4-илфенил]пиперазин-1-ил]бутан-2-она

К раствору полученного в примере (84b) 4-[3-(4,4-диэтилциклогексил)-4-пиперазин-1-илфенил]морфолина (20 мг, 0,052 ммоль) в диметилформамиде (1 мл) добавляли карбонат калия (11 мг, 0,078 ммоль) и 1-бром-2-бутанон (9,4 мг, 0,063 ммоль), затем перемешивали в течение 2 часов и 5 минут при внешней температуре, равной 80°C. После охлаждения воздухом к реакционной смеси добавляли воду и экстрагирование осуществляли с помощью этилацетата. Органический слой промывали водой и затем фильтровали через целит и фильтрат концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-[4-[2-(4,4-диэтилциклогексил)-4-морфолин-4-илфенил]пиперазин-1-ил]бутан-2-она. Данное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате (0,020 мл, 0,080 ммоль). Раствор концентрировали при пониженном давлении и затем к полученному остатку добавляли гексан с получением твердого вещества. Твердое вещество измельчали с помощью ультразвука и удаляли супернатантный раствор гексана. Полученный твердый остаток высушивали при пониженном давлении с получением 25 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 493(MH+).
(Пример 85)
Гидрохлорид 1-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина

(85a)
4-Метокси-1-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензол

К раствору 3-йод-4-нитроанизола (4,21 г, 15,1 ммоль) в 1,2-диметоксиэтане (50 мл) добавляли полученный в примере (4b) 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолан (4,78 г, 18,1 ммоль), фосфат трикалия (4,81 г, 22,7 ммоль) и воду (3 мл). Затем к смеси при комнатной температуре в атмосфере азота при перемешивании добавляли тетракис(трифенилфосфин)палладий(0) (870 мг, 0,755 ммоль). Затем смесь еще перемешивали в течение 13 часов при внешней температуре, равной 70°C. К реакционной смеси добавляли тетракис(трифенилфосфин)палладий(0) (870 мг, 0,755 ммоль) и воду (3 мл), далее перемешивали в течение 26 часов при внешней температуре, равной 100°C. Реакционную смесь охлаждали и затем добавляли этилацетат и смесь фильтровали через целит. Фильтрат концентрировали, с получением остатка, который экстрагировали этилацетатом, и органический слой промывали насыщенным солевым раствором. Органический слой высушивали над безводным сульфатом магния и потом осушитель отфильтровывали, и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 1,5 г указанного в заголовке соединения в виде желтого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 1,05 (с, 6H), 1,07 (с, 6H), 1,41 (с, 2H), 1,99 (д, J= 1,6Гц, 2H), 3,88 (с, 3H), 5,35 (м, 1H), 6,68 (д, J= 2,4Гц, 1H), 6,81 (дд, J= 9,2, 2,4Гц, 1H), 7,91 (д, J= 9,2Гц, 1H).
(85b)
4-Метокси-2-(3,3,5,5-тетраметилциклогексил)фениламин

Смесь полученного в примере (85a) 4-метокси-1-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензола (1,0 г, 3,46 ммоль), 10% палладия на угле (500 мг, влажный), метанола (8 мл) и тетрагидрофурана (2 мл) перемешивали в течение ночи при комнатной температуре и атмосферном давлении в атмосфере водорода. Для удаления катализатора смесь фильтровали через целит и фильтрат концентрировали. Получали сырой продукт указанного в заголовке соединения в виде коричневого масла. Сырой продукт использовали без дополнительной очистки в следующей реакции.
(85c)
1-[4-Метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин

Смесь полученного в примере (85b) сырого продукта 4-метокси-2-(3,3,5,5-тетраметилциклогексил)фениламина, гидрохлорида бис(2-хлорэтил)амина (770 мг, 4,33 ммоль) и 1,2-дихлорбензола (10 мл) перемешивали в течение 2 часов при внешней температуре, равной 220°C. Во время проведения взаимодействия в реакторе с помощью газообразного азота несколько раз удаляли избыток газообразного хлористого водорода. Затем добавляли гидрохлорид бис(2-хлорэтил)амина (180 мг, 1,01 ммоль) и смесь перемешивали в течение 1 часа в аналогичных условиях. Реакционную смесь охлаждали до комнатной температуры, добавляли насыщенный водный раствор гидрокарбонат натрия и экстрагирование выполняли хлороформом. Водный слой вновь экстрагировали хлороформом и органические слои объединяли, промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 660 мг указанного в заголовке соединения в виде коричневого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 1,12 (с, 6H), 1,15-1,34 (м, 4H), 1,42-1,45 (м, 2H), 2,78-2,81 (м, 4H), 2,99-3,02 (м, 4H), 3,63 (тт, J= 13, 2,8Гц, 1H), 3,78 (с, 3H), 6,69 (дд, J= 8,8, 2,8Гц, 1H), 6,77 (д, J= 2,8Гц, 1H), 7,07 (д, J= 8,8Гц, 1H).
(85d)
Гидрохлорид 1-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
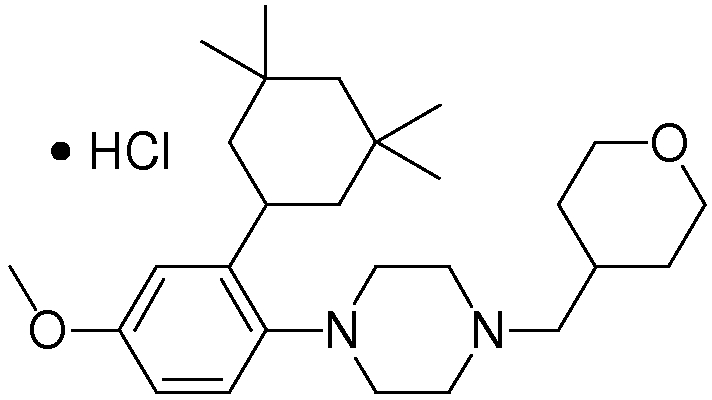
К раствору полученного в примере (85c) 1-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (10 мг, 0,030 ммоль) в тетрагидрофуране (1 мл) добавляли тетрагидропиранил-4-карбальдегид (5,2 мг, 0,045 ммоль), триацетоксиборгидрид натрия (13 мг, 0,061 ммоль) и уксусную кислоту (1,8 мг, 0,030 ммоль), в указанном порядке, затем перемешивали в течение 60 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагирование осуществляли с помощью этилацетата и органический слой концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 1,12 (с, 6H), 1,15-1,35 (м, 6H), 1,41-1,48 (м, 2H), 1,68-1,72 (м, 2H), 1,74-1,85 (м, 1H), 2,25 (д, J= 7,2Гц, 2H), 2,55 (ушир.с, 4H), 2,84 (ушир.с, 4H), 3,39 (ддд, J= 12, 12, 2,0Гц, 2H), 3,60 (тт, J= 12, 2,8Гц, 1H), 3,78 (с, 3H), 3,97 (ддд, J= 12, 2,4, 2,0Гц, 2H), 6,68 (дд, J= 8,8, 2,8Гц, 1H), 6,77 (д, J= 2,8Гц, 1H), 7,07 (д, J= 8,8Гц, 1H).
Полученное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате (0,010 мл, 0,040 ммоль). Раствор концентрировали и к полученному остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и твердый остаток высушивали при пониженном давлении с получением 13,6 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 429(MH+).
(Пример 86)
Гидрохлорид 1-бутил-4-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К раствору полученного в примере (85c) 1-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (10 мг, 0,030 ммоль) в тетрагидрофуране (1 мл) добавляли бутиральдегид (3,3 мг, 0,045 ммоль), триацетоксиборгидрид натрия (13 мг, 0,061 ммоль) и уксусную кислоту (1,8 мг, 0,030 ммоль), в указанном порядке, затем перемешивали в течение 60 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагирование осуществляли с помощью этилацетата и органический слой концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-бутил-4-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 0,94 (т, J= 7,2Гц, 3H), 1,12 (с, 6H), 1,15-1,54 (м, 10H), 2,34-2,40 (м, 2H), 2,57 (ушир., 4H), 2,87 (ушир., 4H), 3,59 (тт, J= 12, 2,8Гц, 1H), 3,77 (с, 3H), 6,67 (дд, J= 8,8, 3,2Гц, 1H), 6,75 (д, J= 3,2Гц, 1H), 7,08 (д, J= 8,8Гц, 1H).
Полученное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате (0,010 мл, 0,040 ммоль). Раствор концентрировали и к полученному остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и твердый остаток высушивали при пониженном давлении с получением 8,6 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 387(MH+).
(Пример 87)
Гидрохлорид 1-[4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-изобутилпиперазина

(87a)
1-Бром-4,5-диметокси-2-нитробензол
Смесь концентрированной азотной кислоты (14 мл) и уксусной кислоты (42 мл) охлаждали при перемешивании до 10°C и затем к перемешанной смеси постепенно добавляли 4-бром-1,2-диметоксибензол (2 г, 9,21 ммоль). Реакционную смесь нагревали до 15°C и перемешивание продолжали в течение 60 минут. Реакционную смесь охлаждали до 0°C и перемешивали при добавлении воды со льдом, и затем экстрагирование осуществляли с помощью эфира. Полученный органический слой нейтрализовали насыщенным водным раствором гидрокарбоната натрия и карбонатом калия и затем промывали водой. После сушки органического слоя над безводным сульфатом магния осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный сырой продукт перекристаллизовывали из этанола с получением 2,09 г указанного в заголовке соединения в виде свело-желтых кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 3,94 (с, 3H), 3,97 (с, 3H), 7,12 (с, 1H), 7,57 (с, 1H).
[0380]
(87b)
4,5-Диметокси-1-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензол

К раствору полученного в примере (87a) 1-бром-4,5-диметокси-2-нитробензола (1,06 г, 4,04 ммоль) в 1,2-диметоксиэтане (30 мл) добавляли полученный в примере (4b) 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолан (1,28 г, 4,85 ммоль), трикалий фосфат (1,29 г, 6,06 ммоль) и воду (1,5 мл). Затем, к смеси при перемешивании при комнатной температуре в атмосфере азота добавляли тетракис(трифенилфосфин)палладий (230 мг, 0,20 ммоль). Потом смесь перемешивали в течение 13 часов при внешней температуре, равной 70°C, и перемешивание продолжали в течение 3 часов при внешней температуре, равной 100°C. К реакционной смеси добавляли тетракис(трифенилфосфин)палладий(0) (230 мг, 0,20 ммоль) и воду (2 мл) и смесь перемешивали еще в течение 9 часов при внешней температуре, равной 100°C, и затем в течение 11 часов при внешней температуре, равной 70°C. После охлаждения реакционной смеси добавляли этилацетат и смесь фильтровали через целит. Фильтрат концентрировали и экстрагировали этилацетатом и полученный органический слой промывали насыщенным солевым раствором. Затем органический слой высушивали над безводным сульфатом магния, осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 1,1 г указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,06 (с, 6H), 1,07 (с, 6H), 1,42 (с, 2H), 1,99 (д, J= 1,6Гц, 2H), 3,93 (с, 3H), 3,96 (с, 3H), 5,32 (м, 1H), 6,60 (с, 1H), 7,47 (с, 1H).
(87c)
4,5-Диметокси-2-(3,3,5,5-тетраметилциклогексил)фениламин

Смесь полученного в примере (87b) 4,5-диметокси-1-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензола (1,0 г, 3,13 ммоль), 10% палладия на угле (500 мг, влажный), метанола (8 мл) и тетрагидрофурана (2 мл) перемешивали в течение 13 часов при комнатной температуре и атмосферном давлении в атмосфере водорода. Для удаления катализатора смесь фильтровали через целит и фильтрат концентрировали. Получали сырой продукт указанного в заголовке соединения в виде желтого масла. Этот сырой продукт использовали без дополнительной очистки в следующей реакции.
(87d)
1-[4,5-Диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин

Смесь сырого продукта полученного в примере (87c) 4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фениламина, гидрохлорида бис(2-хлорэтил)амина (700 мг, 3,91 ммоль) и 1,2-дихлорбензола (10 мл) перемешивали в течение 2 часов при внешней температуре, равной 220°C. Во время проведения взаимодействия, для удаления избытка газообразного хлористого водорода из реактора несколько раз вдували газзобразный азот. Реакционную смесь охлаждали до комнатной температуры, добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли хлороформом. Водный слой вновь экстрагировали хлороформом и органические слои объединяли, промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 490 мг указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,13 (с, 6H), 1,15-1,43 (м, 6H), 2,80-2,83 (м, 4H), 3,00-3,03 (м, 4H), 3,63 (тт, J= 13, 2,8Гц, 1H), 3,85 (с, 3H), 3,87 (с, 3H), 6,72 (с, 1H), 6,73 (с, 1H).
(87e)
Гидрохлорид 1-[4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-изобутилпиперазина

К раствору полученного в примере (87d) 1-[4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (10 мг, 0,028 ммоль) в тетрагидрофуране (1 мл) добавляли изобутиральдегид (3,0 мг, 0,042 ммоль), триацетоксиборгидрид натрия (12 мг, 0,057 ммоль) и уксусную кислоту (1,7 мг, 0,028 ммоль), в указанном порядке, затем перемешивали в течение 60 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагирование осуществляли с помощью этилацетата и органический слой концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-[4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-изобутилпиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,86-1,44 (м, 6H), 0,93 (с, 6H), 0,93 (д, J= 6,8Гц, 6H), 1,12 (с, 6H), 1,82 (м, 1H), 2,15 (д, J= 7,6Гц, 2H), 2,55 (ушир., 4H), 2,87 (ушир., 4H), 3,61 (тт, J= 13, 2,8Гц, 1H), 3,84 (с, 3H), 3,87 (с, 3H), 6,71 (с, 1H), 6,76 (с, 1H).
Полученное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате (0,010 мл, 0,040 ммоль). Раствор концентрировали и к полученному остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и твердый остаток высушивали при пониженном давлении с получением 10,3 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 417(MH+).
(Пример 88)
Гидрохлорид 1-бутил-4-[4-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина

(88a)
Трет-бутиловый эфир 4-(2-хлор-4-нитрофенил)пиперазин-1-карбоновой кислоты
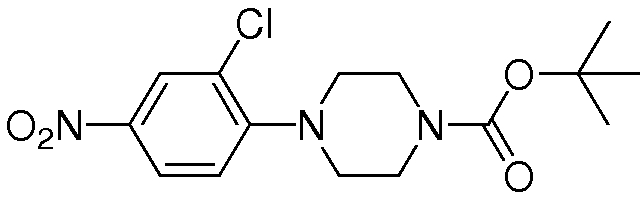
Смесь 3-хлор-4-фторнитробензола (5 г, 27,1 ммоль), трет-бутилового эфира 1-пиперазинкарбоновой кислоты (5 г, 26,8 ммоль) и диметилформамида (10 мл) перемешивали в течение 3 часов и 30 минут при внешней температуре, равной 130°C. После добавления воды к охлажденной воздухом реакционной смеси экстрагирование выполняли 3 раза хлороформом. Органические слои промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 5,93 г указанного в заголовке соединения в виде желтого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 1,49 (с, 9H), 3,15 (дд, J= 5,2, 4,8Гц, 4H), 3,63 (дд, J= 5,2, 4,8Гц, 4H), 7,04 (д, J= 8,8Гц, 1H), 8,11 (дд, J= 8,8, 2,8Гц, 1H), 8,27 (д, J= 2,8Гц, 1H).
(88b)
Трет-бутиловый эфир 4-[4-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты

К раствору полученного в примере (88a) трет-бутилового эфира 4-(2-хлор-4-нитрофенил)пиперазин-1-карбоновой кислоты (5,93 г, 17,3 ммоль) в 1,2-диметоксиэтане (70 мл) добавляли полученный в примере (4b) 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолан (5,5 г, 20,8 ммоль), трикалий фосфат (5,51 г, 26 ммоль) и воду (3 мл). К смеси при перемешивании при комнатной температуре в атмосфере азота добавляли тетракис(трифенилфосфин)палладий(0) (1,0 г, 0,865 ммоль). Затем смесь перемешивали в течение 3 часов при внешней температуре, равной 80°C, и затем в течение 7 часов при внешней температуре, равной 100°C. К реакционной смеси добавляли тетракис(трифенилфосфин)палладий(0) (830 мг, 0,718 ммоль) и перемешивание продолжали в течение 22 часов и 30 минут. К реакционной смеси добавляли этилацетат, который затем фильтровали через целит. Фильтрат концентрировали и полученный остаток экстрагировали этилацетатом, и полученный органический слой промывали водой и насыщенным солевым раствором. Органический слой высушивали над безводным сульфатом магния и затем осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 1,08 г указанного в заголовке соединения в виде оранжевого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,03 (с, 6H), 1,10 (с, 6H), 1,42 (с, 2H), 1,49 (с, 9H), 2,11 (с, 2H), 3,07-3,10 (м, 4H), 3,53-3,56 (м, 4H), 5,67 (с, 1H), 6,94 (д, J= 8,8Гц, 1H), 7,93 (д, J= 2,8Гц, 1H), 8,06 (дд, J= 8,8, 2,8Гц, 1H).
(88c)
1-[4-Нитро-2-(3,3,5,5,-тетраметилциклогекс-1-енил)фенил]пиперазин

Раствор полученного в примере (88b) трет-бутилового эфира 4-[4-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты (300 мг, 0,676 ммоль) в дихлорметане (3 мл) перемешивали при внешней температуре, равной 0°C. Постепенно по каплям добавляли трифторуксусную кислоту (1 мл) в течение 15 минут. Реакционную смесь оставляли нагреваться до комнатной температуры при перемешивании в течение 90 минут. Для подщелачивания смеси, при охлаждении на ледяной бане, к смеси добавляли насыщенный водный раствор гидрокарбоната натрия. Экстрагирование осуществляли с помощью этилацетата и отделенный органический слой промывали водой и затем высушивали над безводным сульфатом магния. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 180 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
(88d)
Гидрохлорид 1-бутил-4-[4-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
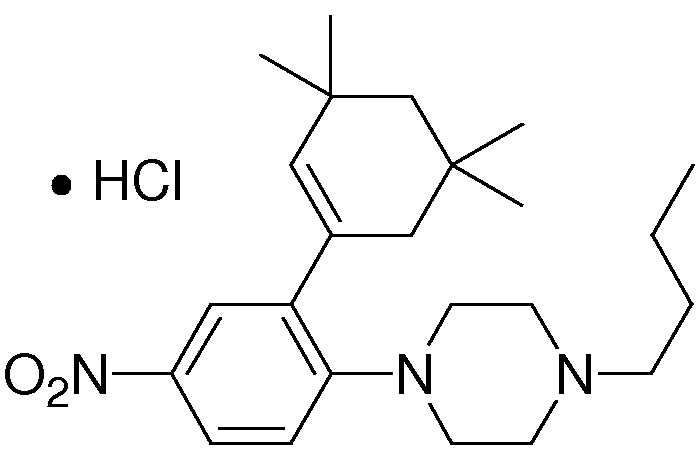
К раствору полученного в примере (88c) 1-[4-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина (10 мг, 0,029 ммоль) в тетрагидрофуране (1 мл) добавляли бутиральдегид (3,2 мг, 0,044 ммоль), триацетоксиборгидрид натрия (12 мг, 0,058 ммоль) и уксусную кислоту (2 мг, 0,029 ммоль), в указанном порядке, затем перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли воду, экстрагирование осуществляли с помощью этилацетата и органический слой концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-бутил-4-[4-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (т, J= 7,2Гц, 3H), 1,03 (с, 6H), 1,10 (с, 6H), 1,25 (м, 1H), 1,32-1,38 (м, 2H), 1,43-1,53 (м, 2H), 1,65 (м, 1H), 2,11 (д, J= 1,6Гц, 2H), 2,36-2,40 (м, 2H), 2,56 (ушир., 4H), 3,19 (ушир., 4H), 5,67 (т, J= 1,6Гц, 1H), 6,94 (д, J= 9,2Гц, 1H), 7,92 (д, J= 2,8Гц, 1H), 8,04 (дд, J= 9,2, 2,8Гц, 1H).
Полученное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате (0,010 мл, 0,040 ммоль). Раствор концентрировали и к полученному остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и остаток концентрировали, с получением 6,3 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 400(MH+).
(Пример 89)
Гидрохлорид 1-циклобутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К раствору полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (20 мг, 0,067 ммоль) в тетрагидрофуране (1 мл) добавляли циклобутанон (7,0 мг, 0,1 ммоль), триацетоксиборгидрид натрия (28 мг, 0,13 ммоль) и уксусную кислоту (4 мг, 0,067 ммоль), в указанном порядке, затем перемешивали в течение 30 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагирование осуществляли с помощью этилацетата и органический слой концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-циклобутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина. Полученное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате (0,025 мл, 0,100 ммоль). Раствор концентрировали и к полученному остатку добавляли гексан с получением твердого вещества. Твердое вещество измельчали с помощью ультразвука и супернатантный раствор гексана удаляли. Твердый остаток высушивали при пониженном давлении с получением 17,6 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 355(MH+).
(Пример 90)
Гидрохлорид 1-циклопропил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К раствору полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (30 мг, 0,1 ммоль) в метаноле (3 мл) добавляли [(1-этоксициклопропил)окси]триметилсилан (105 мг, 0,6 ммоль), цианотригидроборат натрия (28,3 мг, 0,45 ммоль), уксусную кислоту (60,1 мг, 1 ммоль) и молекулярные сита 3Å (50 мг), в указанном порядке, затем перемешивали в течение 5 часов и 30 минут при внешней температуре, равной 80°C. К реакционной смеси добавляли этилацетат, который фильтровали через целит, и фильтрат концентрировали. Затем к остатку добавляли воду, экстрагирование осуществляли с помощью этилацетата и органический слой промывали 2н. водным раствором гидроксида натрия и насыщенным солевым раствором. Органический слой высушивали над сульфатом магния, осушитель отфильтровывали и потом фильтрат концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 1-циклопропил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде белого твердого вещества. Полученное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате (0,040 мл, 0,160 ммоль). Раствор концентрировали и к полученному остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор гексана удаляли и полученный твердый остаток высушивали при пониженном давлении с получением 37,7 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 341(MH+).
(Пример 91)
Гидрохлорид этилового эфира 2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропанкарбоновой кислоты

В качестве исходного материала использовали полученный в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин (2,1 г, 7 ммоль). Взаимодействие проводили способом, аналогичным описанному в примере (4g), используя этиловый эфир 2-формил-1-циклопропанкарбоновой кислоты (цис/транс смесь, в основном транс) вместо бутиральдегида, и выполняли аналогичную обработку, с получением 2,4 г этилового эфира 2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропанкарбоновой кислоты в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,77-0,81 (м, 1H), 0,92 (с, 6H), 1,12 (с, 6H), 1,25-1,36 (м, 9H), 1,37-1,50 (м, 3H), 2,33-2,84 (м, 6H), 2,94 (т, J= 4,8Гц, 4H), 3,56(тт, J= 12,8, 2,8Гц, 1H), 4,10-4,19 (м, 2H), 7,04-7,18 (м, 3H), 7,22 (д, J= 7,6Гц, 1H).
Часть данного соединения, равную 48 мг, преобразовывали в гидрохлорид способом, аналогичным описанному в примере (4g), с получением 52 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 427(MH+).
(Пример 92)
Гидрохлорид транс-1-(2-Метоксиметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

(92a)
Цис-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)метанол
и
Транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)метанол

Литийалюминийгидрид (178 мг, 4,68 ммоль) суспендировали в безводном тетрагидрофуране (15 мл) и суспензию перемешивали при комнатной температуре в атмосфере азота. К суспензии добавляли раствор полученного в примере (91) этилового эфира 2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропанкарбоновой кислоты (1 г, 2,34 ммоль) в безводном тетрагидрофуране (15 мл), затем перемешивали в течение 1 часа и 30 минут при комнатной температуре. К реакционной смеси добавляли фторид натрия (1 г) и при одновременном продувании азотом постепенно добавляли воду (0,4 мл). После перемешивания в течение 1 часа нерастворившиеся продукты отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан). Данный способ давал 173 мг цис-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)метанола в виде бесцветных кристаллов, и 596 мг транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)метанола в виде бесцветного масла.
цис:1H-ЯМР (400МГц, CDCl3)
δ: 0,26 (кв., J= 4,8H, 1H), 0,83-0,88 (м, 1H), 0,92 (с, 6H), 1,12 (с, 6H), 1,15-1,46 (м, 8H), 2,24 (дд, J= 13,2, 13,2Гц, 1H), 2,60 (ушир., 4H), 2,75 (дд, J= 13,2, 5,2Гц, 1H), 2,87-3,00 (м, 4H), 3,12 (дд, J= 13,2, 13,2Гц, 1H), 3,55 (тт, J= 12,8, 2,8Гц, 1H), 4,02 (дд, J= 13,2, 5,2Гц, 1H), 7,04-7,16 (м, 3H), 7,21 (дд, J= 7,6, 1,6Гц, 1H).
1H у OH не мог быть идентифицирован.
транс:1H-ЯМР (400МГц, CDCl3)
δ: 0,41-0,47 (м, 1H), 0,49-0,55 (м, 1H), 0,90 (с, 6H), 1,12 (с, 6H), 1,15-1,47 (м, 8H), 2,30 (дд, J= 12,8, 7,2Гц, 1H), 2,44 (дд, J= 12,8, 6,4Гц, 1H), 2,70 (ушир., 4H), 2,94 (т, J= 4,8Гц, 4H), 3,45-3,60 (м, 3H), 7,04-7,17 (м, 3H), 7,21 (дд, J= 7,2, 1,6Гц, 1H).
1H у OH не мог быть идентифицирован.
(92b)
Гидрохлорид транс-1-(2-метоксиметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
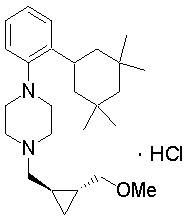
Гидрид натрия (60%, в масле) (31 мг, 0,78 ммоль) суспендировали в диметилформамиде (3 мл) и суспензию перемешивали при комнатной температуре в атмосфере азота. К суспензии добавляли раствор полученного в примере (91a) транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)метанола (60 мг, 0,156 ммоль) в диметилформамиде (3 мл) и смесь перемешивали в течение 30 минут в аналогичных условиях. Реакционную смесь охлаждали в воде со льдом и затем добавляли йодметан (0,015 мл, 0,241 ммоль). Потом реакционную смесь перемешивали в течение 3 часов и 30 минут с одновременным повышением температуры до величины комнатной температуры. Реакционную смесь охлаждали при внешней температуре, равной 0°C, и при одновременном продувании азотом осторожно добавляли воду. Затем добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали дважды водой и затем один раз насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 28 мг транс-1-(2-метоксиметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,42-0,48 (м, 1H), 0,49-0,55 (м, 1H), 0,80-0,96 (м, 2H), 0,92 (с, 6H), 1,12 (с, 6H), 1,13-1,35 (м, 4H), 1,40-1,48 (м, 2H), 2,36 (дд, J= 12,8, 6,8Гц, 1H), 2,39 (дд, J= 12,8, 6,8Гц, 1H), 2,66 (ушир., 4H), 2,94 (т, J= 5,2Гц, 4H), 3,22 (дд, J= 10,0, 7,2Гц, 1H), 3,32 (дд, J= 10,0, 6,4Гц, 1H), 3,34 (с, 3H), 3,57 (тт, J= 12,8, 2,8Гц, 1H), 7,04-7,17 (м, 3H), 7,21 (дд, J= 7,2, 1,2Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Для удаления растворителя раствор продували азотом. К полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученный твердый остаток высушивали с помощью продувки током азота, с получением 13 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 399(MH+).
(Пример 93)
Гидрохлорид танс-1-(2-Фторметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К раствору полученного в примере (92a) транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)метанола (60 мг, 0,156 ммоль) в дихлорметане (5 мл) добавляли трифторид диэтиламиносеры (DAST) (0,052 мл, 0,394 ммоль), затем перемешивали в течение 2 часов при комнатной температуре в атмосфере азота. Реакционную смесь охлаждали при внешней температуре, равной 0°C, добавляли насыщенный водный раствор гидрокарбонат натрия и смесь перемешивали. Затем добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 17 мг транс-1-(2-фторметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,50-0,64 (м, 2H), 0,92 (с, 6H), 0,93-1,03 (м, 1H), 1,05-1,47 (м, 13H), 2,32 (дд, J= 12,8, 6,8Гц, 1H), 2,45 (дд, J= 12,8, 6,0Гц, 1H), 2,69 (ушир., 4H), 2,94 (т, J= 4,8Гц, 4H), 3,56 (тт, J= 12,8, 2,8Гц, 1H), 4,21 (ддд, J= 48,8, 9,6, 7,2Гц, 1H), 4,34 (ддд, J= 48,8, 9,6, 7,2Гц, 1H), 7,04-7,17 (м, 3H), 7,21 (д, J= 7,2, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Для удаления растворителя раствор продували азотом. К полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученный твердый остаток высушивали с помощью продувки током азота, с получением 16 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 387(MH+).
(Пример 94)
Гидрохлорид транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)ацетонитрила

(94a)
Транс-(2-{4-[2-(3,3,5,5-Тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)ацетонитрил
и
Транс-1-(2-Хлорметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин

Раствор полученного в примере (92a) транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)метанола (60 мг, 0,156 ммоль) в дихлорметане (5 мл) перемешивали при внешней температуре, равной 0°C, в атмосфере азота. К смеси добавляли триэтиламин (0,065 мл, 0,468 ммоль) и хлорид метансульфонила (0,018 мл, 0,233 ммоль), в указанном порядке, затем перемешивали в течение 30 минут в аналогичных условиях. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, который затем промывали этилацетатом и водой, и экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток вновь растворяли в диметилсульфоксиде (3 мл) и затем добавляли йодид тетрабутиламмония (12 мг, 0,032 ммоль) и цианид калия (34 мг, 0,522 ммоль) и смесь перемешивали в течение 2 часов при внешней температуре, равной 70°C. К реакционной смеси добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали дважды водой и затем один раз насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 8 мг транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)ацетонитрила в виде бесцветного масла, и 19 мг транс-1-(2-хлорметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного масла.
Транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)ацетонитрил:
1H-ЯМР (400МГц, CDCl3)
δ: 0,53-0,65 (м, 2H), 0,87-1,00 (м, 8H), 1,12 (с, 6H), 1,22-1,47 (м, 6H), 2,30-2,50 (м, 4H), 2,67 (ушир., 4H), 2,94 (т, J= 4,8Гц, 4H), 3,56 (тт, J= 12,8, 2,8Гц, 1H), 7,04-7,17 (м, 3H), 7,21 (дд, J= 7,2, 1,6Гц, 1H).
Транс-1-(2-хлорметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин:
1H-ЯМР (400МГц, CDCl3)
δ: 0,55-0,66 (м, 2H), 0,92 (с, 6H), 0,94-1,11 (м, 2H), 1,12 (с, 6H), 1,13-1,46 (м, 6H), 2,33 (дд, J= 12,8, 6,8Гц, 1H), 2,45 (дд, J= 12,4, 6,4Гц, 1H), 2,68 (ушир., 4H), 2,94 (т, J= 4,8Гц, 4H), 3,47 (дд, J= 11,2, 7,6Гц, 1H), 3,50 (дд, J= 11,2, 7,6Гц, 1H), 3,56 (тт, J= 12,8, 2,8Гц, 1H), 7,04-7,17 (м, 3H), 7,21 (дд, J= 7,6, 1,2Гц, 1H).
(94b)
Гидрохлорид транс-(2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)ацетонитрила

К полученному в примере (94a) транс-(2-{4-[2-(3,3,5,5-Тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропил)ацетонитрилу (8 мг), растворенному в дихлорметане, добавляли 4н. раствор хлористого водорода в этилацетате. Затем для удаления растворителя раствор продували азотом. К полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученный твердый остаток высушивали с помощью продувки током азота, с получением 8 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
MS m/e (ESI) 394(MH+).
(Пример 95)
Гидрохлорид транс-1-(2-хлорметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К полученному в примере (94a) транс-1-(2-хлорметилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазину (19 мг), растворенному в дихлорметане, добавляли 4н. раствор хлористого водорода в этилацетате. Затем для удаления растворителя раствор продували азотом. К полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученный твердый остаток высушивали с помощью продувки током азота, с получением 22 мг указанного в заголовке соединения в виде светло-красного твердого вещества.
MS m/e (ESI) 403(MH+).
(Пример 96)
Гидрохлорид 1-(2-метилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

(96a)
2-Метил-1-циклопропанкарбальдегид

Раствор оксалилхлорида (0,916 мл, 10,5 ммоль) в безводном дихлорметане (10 мл) охлаждали в атмосфере азота до внутренней температуры, равной меньше -65°C. В течение 15 минут по каплям добавляли безводный диметилсульфоксид (1,49 мл, 21 ммоль). После нагревания реакционной смеси до -20°C ее вновь охлаждали до температуры меньше -65°C. В течение 10 минут к реакционной смеси по каплям добавляли раствор 2-метилциклопропанметанола (258 мг, 3 ммоль) в безводном дихлорметане (5 мл). После перемешивания в течение 30 минут в аналогичных условиях к смеси добавляли триэтиламин (4,18 мл, 30 ммоль), температуру постепенно поднимали до величины комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, диэтиловый эфир и воду и экстрагирование осуществляли с помощью диэтилового эфира. Отделенный органический слой промывали дважды насыщенным водным раствором лимонной кислоты и затем насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, в указанном порядке, после чего его высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 730 мг сырого продукта указанного в заголовке соединения в виде светло-желтого масла как смесь цис/транс по положению циклопропан кольцо. Этот продукт использовали в следующей реакции без дополнительной очистки.
(96b)
Гидрохлорид 1-(2-метилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К смеси полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (300 мг, 1 ммоль), полученного в примере (96a) сырого продукта 2-метил-1-циклопропанкарбальдегида (365 мг) и тетрагидрофурана (10 мл) добавляли триацетоксиборгидрид натрия (424 мг, 2 ммоль) и уксусную кислоту (0,057 мл, 1 ммоль), в указанном порядке, затем перемешивали в течение 15 часов и 30 минут при комнатной температуре. К реакционной смеси добавляли этилацетат, насыщенный водный раствор гидрокарбоната натрия и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 163 мг 1-(2-метилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного масла, как смесь цис/транс по положению циклопропанового кольца.
1H-ЯМР (400МГц, CDCl3)
δ: 0,24-0,32 (м, 2H), 0,50-0,55 (м, 2H), 0,92 (с, 6H), 1,06 (д, J= 6,0Гц, 3H), 1,12 (с, 6H), 1,16-1,48 (м, 6H), 2,18 (дд, J= 12,4, 7,2Гц, 1H x 0,85), 2,33 (дд, J= 12,0, 6,4Гц, 1H x 0,15), 2,50 (дд, J= 12,4, 6,4Гц, 1H x 0,85), 2,56 (дд, J= 12,4, 6,4Гц, 1H x 0,15), 2,67 (ушир., 4H), 2,95 (т, J= 4,8Гц, 4H), 3,58 (тт, J= 12,8, 2,8Гц, 1H), 7,05-7,18 (м, 3H), 7,22 (дд, J= 7,2, 1,2Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Этот раствор концентрировали при пониженном давлении и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое фильтровали. Затем продукт высушивали при пониженном давлении с получением 156 мг указанного в заголовке соединения в виде белого твердого вещества, как смесь цис/транс по положению циклопропанового кольца.
MS m/e (ESI) 369(MH+).
(Пример 97)
Гидрохлорид 1-[3-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина

(97a)
2-Фтор-6-нитрофениловый эфир трифторметансульфоновой кислоты

Смесь 2-фтор-6-нитрофенола (5 г, 31,83 ммоль), триэтиламина (22 мл, 157,84 ммоль) и дихлорметана (100 мл) охлаждали, используя баню со льдом и метанолом в атмосфере азота. К данной смеси по каплям в течение 20 минут добавляли трифторметансульфоновый ангидрид (8 мл, 47,55 ммоль), затем перемешивали в течение 50 минут в аналогичных условиях. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 8,02 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 7,52-7,63 (м, 2H), 7,98 (дт, J= 8,0, 2,0Гц, 1H).
(97b)
1-Фтор-3-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензол

К смеси полученного в примере (97a) 2-фтор-6-нитрофенилового эфира трифторметансульфоновой кислоты (2,89 г, 10 ммоль), полученного в примере (4b) 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолана (3,17 г, 12 ммоль), толуола (30 мл) и этанола (15 мл) добавляли карбонат натрия (1,6 г, 15,1 ммоль), очищенную воду (0,9 мл) и тетракис(трифенилфосфин)палладий(0) (1,15 г, 1 ммоль), затем перемешивали в течение 2 часов при внешней температуре, равной 100°C, в атмосфере азота. К реакционной смеси добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 2,25 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,04 (с, 6H), 1,07 (с, 6H), 1,42 (с, 2H), 2,07 (с, 2H), 5,34 (т, J= 2,0Гц, 1H), 7,23-7,29 (м, 1H), 7,33 (ддд, J= 8,0, 8,0, 5,2Гц, 1H), 7,54 (ддд, J= 8,0, 2,0, 1,2Гц, 1H).
(97c)
3-Фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фениламин

К раствору полученного в примере (97b) 1-фтор-3-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензола (2,25 г, 8,11 ммоль) в этаноле (45 мл) добавляли хлорид аммония (150 мг, 2,8 ммоль), воду (15 мл) и порошкоообразное железо (1,6 г, 28,65 ммоль), затем перемешивали в течение 2 часов при внешней температуре, равной 90°C. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 632 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,06 (с, 6H), 1,09 (с, 6H), 1,44 (с, 2H), 1,96 (с, 2H), 3,86 (ушир.с, 2H), 5,51 (т, J= 1,6Гц, 1H), 6,43 (ддд, J= 8,4, 8,0, 1,2Гц, 1H), 6,46 (ддд, J= 8,0, 1,2, 0,8Гц, 1H), 6,96 (ддд, J= 8,4, 8,0, 6,4Гц, 1H).
(97d)
1-[3-Фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин

К раствору полученного в примере (97c) 3-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фениламина (623 мг, 2,52 ммоль) в 1,2-дихлорбензоле (7 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (560 мг, 3,14 ммоль), затем нагревали с обратным холодильником в течение 5 часов при внешней температуре, равной 200°C, в атмосфере азота. Во время проведения взаимодействия, для удаления газообразного хлористого водорода через реактор несколько раз пропускалои поток азота. После охлаждения реакционной смеси до комнатной температуры, для разделения между маслом и водой, добавляли этилацетат, тетрагидрофуран, метанол, насыщенный водный раствор карбоната натрия и воду. Водный слой дополнительно экстрагировали этилацетатом и объединенный органический слой высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 214 мг указанного в заголовке соединения в виде светло-коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,05 (с, 6H), 1,08 (с, 6H), 1,42 (с, 2H), 2,06 (с, 2H), 2,95 (ушир.с, 8H), 5,43 (с, 1H), 6,74 (ддд, J= 8,4, 8,0, 0,8Гц, 1H), 6,79 (д, J= 8,4Гц, 1H), 7,12 (ддд, J= 8,0, 8,0, 6,4Гц, 1H).
1H у NH не мог быть идентифицирован.
(97e)
Гидрохлорид 1-[3-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина

К смеси полученного в примере (97d) 1-[3-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина (115 мг, 0,363 ммоль), тетрагидропиран-4-карбальдегида (62 мг, 0,543 ммоль) и тетрагидрофурана (7 мл) добавляли триацетоксиборгидрид натрия (154 мг, 0,726 ммоль) и уксусную кислоту (0,021 мл, 0,363 ммоль), в указанном порядке, затем перемешивали в течение 1 часа и 30 минут при комнатной температуре. К реакционной смеси добавляли этилацетат, насыщенный водный раствор гидрокарбоната натрия и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 108 мг 1-[3-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,06 (с, 6H), 1,08 (с, 6H), 1,23-1,28 (м, 2H), 1,65-1,83 (м, 3H), 1,42 (с, 2H), 2,06 (с, 2H), 2,21 (д, J= 7,2Гц, 2H), 2,48 (ушир.с, 4H), 2,99 (ушир.с, 4H), 3,38 (тд, J= 12, 2,4Гц, 2H), 3,94-4,00 (м, 2H), 5,42 (с, 1H), 6,72 (ддд, J= 8,0, 8,0, 0,8Гц, 1H), 6,77 (д, J= 8,0Гц, 1H), 7,10 (ддд, J= 8,0, 8,0, 6,4Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем фильтровали. Твердое вещество высушивали при пониженном давлении с получением 97 мг указанного в заголовке соединения в виде белого твердого вещества.
MS m/e (ESI) 415(MH+).
(Пример 98)
Гидрохлорид (R)-1-бутил-4-[2-(4,4-диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазина

(98a)
Трет-бутиловый эфир (R)-[2-(4,4-диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазин-1-карбоновой кислоты

Смесь полученного в примере (38c) трет-бутилового эфира 4-[4-бром-2-(4,4-диэтилциклогексил)фенил]пиперазин-1-карбоновой кислоты (454 мг, 0,947 ммоль), толуола (10 мл), гидрохлорида (R)-3-метоксипирролидина (196 мг, 1,42 ммоль), трет-бутоксида натрия (380 мг, 3,95 ммоль), тетрафторбората три-трет-бутилфосфония (84 мг, 0,29 ммоль) и палладий(II)ацетата (32 мг, 0,14 ммоль) перемешивали в течение 5 часов при внешней температуре, равной 90°C, в атмосфере азота. Нерастворившиеся продукты реакционной смеси отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) с получением 193 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,82 (т, J= 7,6Гц, 6H), 1,16-1,29 (м, 4H), 1,47 (с, 9H), 1,48-1,68 (м, 8H), 2,07-2,14 (м, 2H), 2,74 (ушир.с, 4H), 2,93-3,03 (м, 1H), 3,13 (ушир., 4H), 3,28-3,51 (м, 7H), 4,05-4,11 (м, 1H), 6,38 (дд, J= 8,8, 2,8Гц, 1H), 6,43 (д, J= 2,8Гц, 1H), 7,01 (д, J= 8,8Гц, 1H).
(98b)
(R)-1-[2-(4,4-Диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазин

Смесь полученного в примере (98a) трет-бутилового эфира (R)-[2-(4,4-диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазин-1-карбоновой кислоты (193 мг, 0,386 ммоль), трифторуксусной кислоты (0,5 мл, 6,49 ммоль) и дихлорметана (3 мл) перемешивали в течение 14 часов и 30 минут при комнатной температуре. Для подщелачивания смеси к реакционной смеси добавляли охлажденный на бане с ледяной водой 5н. водный раствор гидроксида натрия. Затем добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 160 мг сырого продукта указанного в заголовке соединения в виде светло-коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,80 (т, J= 7,6Гц, 6H), 1,15-1,30 (м, 4H), 1,42-1,66 (м, 8H), 2,07-2,14 (м, 2H), 2,79 (т, J= 4,8Гц, 4H), 3,02 (т, J= 4,8Гц, 4H), 2,92-3,00 (м, 1H), 3,28-3,51 (м, 7H), 4,05-4,11 (м, 1H), 6,39 (дд, J= 8,4, 2,8Гц, 1H), 6,43 (д, J= 2,8Гц, 1H), 7,07 (д, J= 8,4Гц, 1H).
1H у NH не мог быть идентифицирован.
(98c)
Гидрохлорид (R)-1-бутил-4-[2-(4,4-диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазина

К смеси сырого продукта, полученного в примере (98b), (R)-1-[2-(4,4-диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазина (160 мг), бутиральдегида (0,052 мл, 0,584 ммоль) и тетрагидрофурана (7 мл) добавляли триацетоксиборгидрид натрия (164 мг, 0,774 ммоль) и уксусную кислоту (0,022 мл, 0,384 ммоль), в указанном порядке, затем перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 170 мг (R)-1-бутил-4-[2-(4,4-диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазина в виде светло-коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,80 (т, J= 7,6Гц, 6H), 0,94 (т, J= 7,2Гц, 3H), 1,15-1,40 (м, 6H), 1,45-1,70 (м, 10H), 2,06-2,14 (м, 2H), 2,36-2,43 (м, 2H), 2,57 (ушир., 4H), 2,84 (ушир.с, 4H), 2,90-3,00 (м, 1H), 3,27-3,50 (м, 7H), 4,05-4,10 (м, 1H), 6,37 (дд, J= 8,8, 2,8Гц, 1H), 6,42 (д, J= 2,8Гц, 1H), 7,08 (д, J= 8,8Гц, 1H).
Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое затем измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и твердый остаток высушивали при пониженном давлении с получением 161 мг указанного в заголовке соединения в виде светло-коричневого твердого вещества.
MS m/e (ESI) 456(MH+).
(Пример 99)
Дигидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)-4-тиазол-2-илфенил]пиперазина

(99a)
Трет-бутиловый эфир 4-[4-бром-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты

К смеси полученного в примере (8a) трет-бутилового эфира 4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (2,93 г, 7,31 ммоль), ацетата натрия (6 г, 73,14 ммоль) и метанола (50 мл) добавляли бром (0,37 мл, 7,22 ммоль), затем перемешивали в течение 20 минут при комнатной температуре в атмосфере азота. К реакционной смеси добавляли насыщенный водный раствор тиосульфата натрия, этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 2,67 г указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,10 (с, 6H), 1,12-1,45 (м, 6H), 1,49 (с, 9H), 2,79 (ушир.с, 4H), 3,48 (ушир., 4H), 3,54 (тт, J= 12,4, 2,8Гц, 1H), 6,93 (д, J= 8,4Гц, 1H), 7,25 (дд, J= 8,4, 2,4Гц, 1H), 7,32 (д, J= 2,4Гц, 1H).
(99b)
Трет-бутиловый эфир 4-[2-(3,3,5,5-тетраметилциклогексил)-4-тиазол-2-илфенил]пиперазин-1-карбоновой кислоты

К смеси полученного в примере (99a) трет-бутилового эфира 4-[4-бром-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (150 мг, 0,313 ммоль), 2-(трибутилолово)тиазола (0,16 мл), фторида цезия (107 мг, 0,704 ммоль) и диоксана (8 мл) добавляли тетракис(трифенилфосфин)палладий(0) (40 мг, 0,035 ммоль), затем перемешивали в течение 3 часов в атмосфере азота при внешней температуре, равной 100°C. К реакционной смеси добавляли этилацетат, нерастворившиеся продукты отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан) с получением 115 мг указанного в заголовке соединения в виде свело-желтых кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,12 (с, 6H), 1,15-1,46 (м, 6H), 1,50 (с, 9H), 2,87 (ушир.с, 4H), 3,56 (тт, J= 12,4, 3,2Гц, 1H), 3,59 (ушир., 4H), 7,09 (д, J= 8,4Гц, 1H), 7,28 (д, J= 3,2Гц, 1H), 7,69 (дд, J= 8,4, 2,4Гц, 1H), 7,84 (д, J= 3,2Гц, 1H), 7,88 (д, J= 2,4Гц, 1H).
(99c)
1-[2-(3,3,5,5-Тетраметилциклогексил)-4-тиазол-2-илфенил]пиперазин

Смесь полученного в примере (99b) трет-бутилового эфира 4-[2-(3,3,5,5-тетраметилциклогексил)-4-тиазол-2-илфенил]пиперазин-1-карбоновой кислоты (113 мг, 0,234 ммоль), трифторуксусной кислоты (0,3 мл, 3,89 ммоль) и дихлорметана (2 мл) перемешивали в течение 1 часа и 50 минут при комнатной температуре. Реакционную смесь охлаждали на бане с ледяной водой, и затем, для подщелачивания смеси, добавляли 5н. водный раствор гидроксида натрия. Далее добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали водой и насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 91 мг сырого продукта указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,13 (с, 6H), 1,16-1,50 (м, 6H), 2,90 (т, J= 4,8Гц, 4H), 3,05 (т, J= 4,8Гц, 4H), 3,56(тт, J= 12,8, 2,8Гц, 1H), 7,10 (д, J= 8,4Гц, 1H), 7,26 (д, J= 3,2Гц, 1H), 7,68 (дд, J= 8,4, 2,4Гц, 1H), 7,82 (д, J= 3,2Гц, 1H), 7,86 (д, J= 2,4Гц, 1H).
1H у NH не мог быть идентифицирован.
(99d)
Дигидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)-4-тиазол-2-илфенил]пиперазина

К смеси полученного в примере (99c) 1-[2-(3,3,5,5-тетраметилциклогексил)-4-тиазол-2-илфенил]пиперазина (15 мг, 0,039 ммоль), циклопропанкарбальдегида (0,006 мл, 0,080 ммоль) и тетрагидрофурана (2 мл) добавляли триацетоксиборгидрид натрия (21 мг, 0,099 ммоль) и уксусную кислоту (0,003 мл, 0,052 ммоль), в указанном порядке, затем перемешивали в течение 1 часа и 40 минут при комнатной температуре. К реакционной смеси добавляли этилацетат, насыщенный водный раствор гидрокарбоната натрия и воду, и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой концентрировали с помощью продувки током азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)-4-тиазол-2-илфенил]пиперазина. Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали с помощью продувки током азота и затем к полученному остатку добавляли диэтиловый эфир с получением твердого вещества, которое далее измельчали с помощью ультразвука. Супернатантный раствор диэтилового эфира удаляли и полученный твердый остаток высушивали с помощью продувки током азота, с получением 16 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e (ESI) 438(MH+).
(Пример 100)
Дигидрохлорид 1-циклопропилметил-4-[4-пиридин-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

(100a)
Трет-бутиловый эфир 4-[4-пиридин-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты
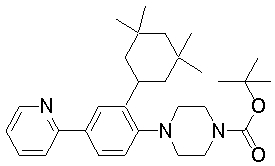
К смеси полученного в примере (99a) трет-бутилового эфира 4-[4-бром-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (100 мг, 0,209 ммоль), 2-(трибутилолово)пиридина (0,08 мл, 0,25 ммоль), фторида цезия (68 мг, 0,448 ммоль) и диоксана (15 мл) добавляли тетракис(трифенилфосфин)палладий(0) (25 мг, 0,022 ммоль), затем перемешивали в течение 3 часов при внешней температуре, равной 90°C, в атмосфере азота. К реакционной смеси добавляли этилацетат, нерастворившиеся продукты отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан), с получением 43 мг указанного в заголовке соединения в виде свело-желтых кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,13 (с, 6H), 1,16-1,49 (м, 6H), 1,50 (с, 9H), 2,88 (ушир.с, 4H), 3,59 (ушир., 4H), 3,61 (тт, J= 12,8, 3,2Гц, 1H), 7,15 (д, J= 8,4Гц, 1H), 7,19 (ддд, J= 7,2, 4,8, 2,0Гц, 1H), 7,68-7,76 (м, 3H), 7,89 (д, J= 2,4Гц, 1H), 8,68 (ддд, J= 4,8, 1,6, 0,8Гц, 1H).
(100b)
1-[4-Пиридин-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин

Смесь полученного в примере (100a) трет-бутилового эфира 4-[4-пиридин-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-карбоновой кислоты (42 мг, 0,088 ммоль), трифторуксусной кислоты (0,1 мл, 1,30 ммоль) и дихлорметана (1 мл) перемешивали в течение 17 часов и 50 минут при комнатной температуре. Реакционную смесь охлаждали на бане с ледяной водой, и потом, для подщелачивания смеси добавляли 5н. водный раствор гидроксида натрия. Затем добавляли этилацетат и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 30 мг сырого продукта указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,14 (с, 6H), 1,17-1,52 (м, 6H), 2,90 (т, J= 4,4Гц, 4H), 3,05 (т, J= 4,8Гц, 4H), 3,61 (тт, J= 12,8, 3,2Гц, 1H), 7,14-7,18 (м, 2H), 7,66-7,75 (м, 3H), 7,87 (д, J= 2,0Гц, 1H), 8,66 (ддд, J= 5,2, 1,6, 0,8Гц, 1H).
1H у NH не мог быть идентифицирован.
(100c)
Дигидрохлорид 1-циклопропилметил-4-[4-пиридин-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

К смеси полученного в примере (100b) 1-[4-пиридин-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (10 мг, 0,026 ммоль), циклопропанкарбальдегида (0,004 мл, 0,054 ммоль) и тетрагидрофурана (2 мл) добавляли триацетоксиборгидрид натрия (14 мг, 0,066 ммоль) и уксусную кислоту (0,002 мл, 0,035 ммоль), в указанном порядке, затем перемешивали в течение 40 минут при комнатной температуре. К реакционной смеси добавляли этилацетат, насыщенный водный раствор гидрокарбоната натрия и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой концентрировали с помощью продувки током азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1-циклопропилметил-4-[4-пиридин-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина. Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Раствор концентрировали путем продувки газообразным азотом и к полученному остатку добавляли диэтиловый эфир с получением твердого вещества. После растирания твердого вещества в порошок обработкой ультразвуком супернатантный раствор диэтилового эфира удаляли. Твердый остаток высушивали с помощью продувки током азота, с получением 3 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e (ESI) 432(MH+).
(Пример 101)
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-(1H-тетразол-5-ил)фенил]пиперазина

(101a)
[4-(4-Трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]метанол

Литийаллюминийгидрид (29 мг, 0,764 ммоль) суспендировали в безводном тетрагидрофуране (5 мл). К суспензии добавляли раствор метилового эфира 4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензойной кислоты (308 мг, 0,743 ммоль) в безводном тетрагидрофуране (5 мл) при комнатной температуре в атмосфере азота, затем перемешивали в течение 55 минут. К реакционной смеси добавляли фторид натрия (262 мг) и постепенно добавляли воду (0,11 мл) при одновременном продувании азотом. После перемешивания в течение 1 часа и 35 минут нерастворившиеся продукты отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в этилацетате и для высушивания добавляли безводный сульфат натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 295 мг сырого продукта указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,88 (с, 9H x 0,6), 0,90 (с, 9H x 0,4), 0,94 (т, J= 7,2Гц, 3H x 0,6), 0,95 (т, J= 7,2Гц, 3H x 0,4), 1,08-1,98 (м, 13H), 2,38-2,44 (м, 2H), 2,59 (ушир.с, 4H), 2,89 (т, J= 4,8Гц, 4H x 0,6), 2,90 (т, J= 4,8Гц, 4H x 0,4), 2,97 (тт, J= 12,4, 2,4Гц, 1H x 0,4), 3,37 (тт, J= 5,2, 5,2Гц, 1H x 0,6), 4,63 (с, 2H), 7,04-7,08 (м, 1H), 7,11 (д, J= 1,6Гц, 1H x 0,4), 7,17 (д, J= 1,6Гц, 1H x 0,6), 7,20 (д, J= 8,0Гц, 1H x 0,4), 7,40 (д, J= 8,0Гц, 1H x 0,6).
1H у OH не мог быть идентифицирован.
(101b)
4-(4-Трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензальдегид

Смесь сырого продукта, полученного в примере (101a), [4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]метанола (294 мг), оксида марганца(IV) (1,3 г, 14,95 ммоль) и хлороформа (15 мл) нагревали с обратным холодильником в течение 40 минут. Реакционную смесь фильтровали и нерастворившиеся продукты отфильтровывали. Фильтрат концентрировали при пониженном давлении с получением 249 мг сырого продукта указанного в заголовке соединения в виде светло-желтого масла. Этот продукт использовали в следующей реакции без дополнительной очистки.
(101c)
4-(4-Трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензальдегидоксим

К смеси сырого продукта, полученного в примере (101b), 4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензальдегида (247 мг), гидроксилхлорида аммония (134 мг, 1,93 ммоль) и этанола (10 мл) добавляли ацетат натрия (193 мг, 2,35 ммоль) и воду (1,5 мл), затем перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь выливали в воду со льдом и затем добавляли этилацетат и насыщенный водный раствор хлорида аммония, и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали, и фильтрат концентрировали при пониженном давлении с получением 271 мг сырого продукта указанного в заголовке соединения в виде светло-желтого твердого вещества. Этот продукт использовали в следующей реакции без дополнительной очистки.
(101d)
4-(4-Трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрил

Смесь сырого продукта, полученного в примере (101c), 4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензальдегидоксима (269 мг), хлорида бензолсульфонила (0,11 мл, 0,862 ммоль), пиридина (0,11 мл, 1,36 ммоль) и тетрагидрофурана (15 мл) нагревали с обратным холодильником в течение 4 часов и 30 минут. После частичной отгонки тетрагидрофурана в реакционную смесь при пониженном давлении добавляли хлороформ и смесь дополнительно нагревали с обратным холодильником в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, полученный остаток выливали в воду со льдом и затем добавляли этилацетат и насыщенный водный раствор хлорида аммония, и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали дважды насыщенным водным раствором хлорида аммония и один раз насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан, затем этилацетат/метанол), с получением 192 мг указанного в заголовке соединения в виде светло-желтого масла.
(101e)
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-(1H-тетразол-5-ил)фенил]пиперазина
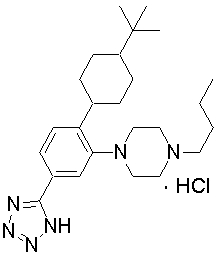
Смесь полученного в примере (101d) 4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрила (146 мг, 0,383 ммоль), азида триметилолова (160 мг, 0,777 ммоль) и толуола (10 мл) перемешивали в течение 14 часов и 20 минут при внешней температуре, равной около 130°C. Реакционную смесь концентрировали при пониженном давлении и затем к остатку добавляли метанол (6 мл) и 1н. хлористоводородную кислоту (6 мл), и смесь перемешивали в течение 2 часов и 10 минут при комнатной температуре. Реакционную смесь охлаждали на бане с ледяной водой и затем для подщелачивания смеси добавляли 2н. водный раствор гидроксида натрия, после чего смесь нейтрализовали вновь насыщенным водным раствором хлорида аммония. Добавляли этилацетат, тетрагидрофуран и воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Смесь затем концентрировали при пониженном давлении и для кристаллизации к полученному остатку добавляли диэтиловый эфир. Кристаллы фильтровали и высушивали при пониженном давлении с получением 133 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 425(MH+).
(Пример 102)
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина

(102a)
2-(3,3,5,5-Тетраметилциклогекс-1-енил)фенол

К смеси 2-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенола(3,5 г, 15,9 ммоль), полученного в примере (4a) 3,3,5,5-тетраметилциклогекс-1-енилового эфира трифторметансульфоновой кислоты (5 г, 17,4 ммоль) и 1,2-диметоксиэтана (20 мл) добавляли тетракис(трифенилфосфин)палладий(0) (0,92 г, 0,79 ммоль) и 2н. водный раствор карбоната натрия (23,9 мл, 47,7 ммоль), затем перемешивали в течение 1 часа в атмосфере азота при внешней температуре, равной 90°C. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и затем растворитель отгоняли при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 3,7 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,06 (с, 6H), 1,11(с, 6H), 1,45 (с, 2H),2,04 (д, J= 1,6Гц, 2H), 5,59 (с, 1H), 5,61 (т, J= 1,6Гц, 1H), 6,87 (тд, J= 7,6, 1,2Гц, 1H), 6,90 (дд, J= 7,6, 1,2Гц, 1H), 7,03 (дд, J= 7,6, 1,2Гц, 1H), 7,12 (тд, J= 7,6, 1,2Гц, 1H).
(102b)
2-(3,3,5,5-Тетраметилциклогексил)фенол
К раствору полученного в примере (102a) 2-(3,3,5,5-тетраметилциклогекс-1-енил)фенола (1,7 г, 7,4 ммоль) в метаноле (30 мл) добавляли 10% палладий на угле (0,5 г, влажный), затем перемешивали в течение 27 часов при комнатной температуре и атмосферном давлении в атмосфере водорода. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением 1,7 г сырого продукта указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,12 (с, 6H), 1,14-1,35 (м, 6H), 3,22 (тт, J=12,8, 2,8Гц, 1H), 4,67 (с, 1H), 6,74 (дд, J=7,6, 1,2Гц, 1H), 6,89 (тд, J=7,6, 1,2Гц, 1H), 7,05 (тд, J=7,6, 1,2Гц, 1H), 7,17 (дд, J=7,6, 1,2Гц, 1H).
(102c)
2-(3,3,5,5-Тетраметилциклогексил)фениловый эфир трифторметансульфоновой кислоты

К раствору полученного в примере (102b) 2-(3,3,5,5-тетраметилциклогексил)фенола (530 мг, 2,28 ммоль) в дихлорметане (20 мл) добавляли триэтиламин (1,3 мл, 4,09 ммоль) и трифторметансульфоновый ангидрид (0,56 мл, 3,33 ммоль), в указанном порядке, при охлаждении на ледяной бане, затем перемешивали в течение 14 часов при нагревании до комнатной температуры. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью диэтилового эфира. Органический слой высушивали над безводным сульфатом магния и затем фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 0,83 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,12 (с, 6H), 1,14-1,38 (м, 6H), 3,31 (тт, J=12,8, 2,8Гц, 1H), 7,22-7,42 (м, 4H).
(102d)
Трет-бутиловый эфир 4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты

К смеси полученного в примере (102c) 2-(3,3,5,5-тетраметилциклогексил)фенилового эфира трифторметансульфоновой кислоты (830 мг, 2,55 ммоль), трет-бутилового эфира 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (631 мг, 2,04 ммоль) (Paul R. Eastwood, Tetrahedron Lett., 2000, 41, 3705) и 1,2-диметоксиэтана (20 мл) добавляли тетракис(трифенилфосфин)палладий (147 мг, 0,13 ммоль) и 2н. водный раствор карбоната натрия (3,8 мл, 7,6 ммоль), затем перемешивали в течение 8 часов при внешней температуре, равной 90°C, в атмосфере азота. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 570 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,03 (с, 6H), 1,12 (с, 6H), 1,16-1,48(м, 6H), 1,49 (с, 9H), 2,32 (ушир.с, 2H), 3,22 (тт, J=12,8, 2,8Гц, 1H), 3,64 (ушир.с, 2H), 4,02 (ушир.с, 2H), 5,52 (ушир.с, 1H), 6,74 (дд, J=7,6, 1,2Гц, 1H), 6,89 (тд, J=7,6, 1,2Гц, 1H), 7,05 (тд, J=7,6, 1,2Гц, 1H), 7,17 (дд, J=7,6, 1,2Гц, 1H).
(102e)
4-[2-(3,3,5,5-Тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридин

К раствору полученного в примере (102d) трет-бутилового эфира 4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (570 мг, 1,43 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (5 мл), затем перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 430 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 1,05 (с, 6H), 1,10-1,52 (м, 6H), 2,35 (ушир.с, 2H), 3,07 (тт, J=12,8, 2,8Гц, 1H), 3,21 (т, J=5,6Гц, 2H), 3,57-3,62 (м, 2H), 5,56-5,61 (м, 1H), 7,00 (дд, J=7,6, 1,2Гц, 1H), 7,12 (тд, 7,6, 1,2Гц, 1H), 7,22-7,27 (м, 1H), 7,36 (тд, J=7,6, 1,2Гц, 1H).
1H у NH не мог быть идентифицирован.
MS m/e (ESI) 298(MH+).
(102f)
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
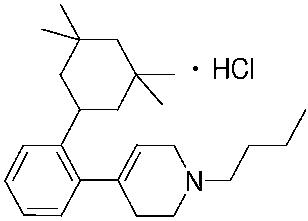
К раствору полученного в примере (102e) 4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина (130 мг, 0,44 ммоль) в тетрагидрофуране (2 мл) добавляли бутиральдегид (37,8 мг, 0,52 ммоль), триацетоксиборгидрид натрия (139 мг, 0,66 ммоль) и уксусную кислоту (52,5 мг, 0,87 ммоль), затем перемешивали в течение 13 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 70 мг 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,91 (с, 6H), 0,94 (т, J=7,2Гц, 3H), 1,05 (с, 6H), 1,12-1,46 (м, 10H), 2,33-2,40 (м, 2H), 2,46 (т, J=7,2Гц, 2H), 2,69 (т, J=5,6Гц, 2H), 3,06-3,12 (м, 3H), 5,49-5,54 (м, 1H), 7,17-7,32 (м, 4H).
Полученное соединение растворяли в этилацетате и затем добавляли 4н. раствор хлористого водорода в этилацетате и смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и к полученному остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Твердое вещество фильтровали и высушивали при пониженном давлении с получением 68 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
MS m/e (ESI) 354(MH+).
(Пример 103)
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина

К раствору полученного в примере (102f) гидрохлорида 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина (48 мг, 0,12 ммоль) в метаноле (3 мл) добавляли 10% палладий на угле (100 мг, влажный), затем перемешивали в течение 4 часов при комнатной температуре и атмосферном давлении в атмосфере водорода. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли простой эфир и гексан, с получением твердого вещества, которое затем измельчали с помощью ультразвука. Твердое вещество фильтровали и высушивали при пониженном давлении с получением 9 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400МГц, CD3OD)
δ: 0,97 (с, 6H), 1,03 (т, J=7,2Гц, 3H), 1,19 (с, 6H), 1,30-1,52(м, 8H), 1,74-1,84 (м, 2H), 1,96-2,17 (м, 4H), 3,02-3,30 (м, 6H), 3,68-3,77 (м, 2H), 7,14-7,30 (м, 4H).
MS m/e (ESI) 356(MH+).
(Пример 104)
Гидрохлорид 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропил-1,2,3,6-тетрагидропиридина

(104a)
1-Метокси-4-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензол

К смеси 2-метокси-5-метилфенилбороновой кислоты (1 г, 6,02 ммоль), полученного в примере (4a) 3,3,5,5-тетраметилциклогекс-1-енилового эфира трифторметансульфоновой кислоты (1,9 г, 6,62 ммоль) и 1,2-диметоксиэтана (30 мл) добавляли тетракис(трифенилфосфин)палладий(0) (0,35 г, 0,30 ммоль) и 2н. водный раствор карбоната натрия (9,0 мл, 18,0 ммоль), затем перемешивали в течение 3 часов в атмосфере азота при внешней температуре, равной 90°C. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтровали, полученный фильтрат концентрировали при пониженном давлении с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 1,0 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,01 (с, 6H), 1,07 (с, 6H), 1,39 (с, 2H), 2,07 (д, J=1,6Гц, 2H), 2,28 (с, 3H), 3,75 (с, 3H), 5,42 (с, 1H), 6,73 (д, J=8,4Гц, 1H), 6,91 (д, J=2,0Гц, 1H), 6,97 (дд, J=8,4, 2,0Гц, 1H).
(104b)
1-Метокси-4-метил-2-(3,3,5,5-тетраметилциклогексил)бензол

К раствору полученного в примере (104a) 1-метокси-4-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензола (1,0 г, 3,87 ммоль) в метаноле (30 мл) добавляли 10% палладий на угле (0,6 г, влажный), затем перемешивали в течение 12 часов при комнатной температуре и атмосферном давлении в атмосфере водорода. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением 1,0 г сырого продукта указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 1,05 (с, 6H), 1,10-1,52 (м, 6H), 2,80 (с, 3H), 3,33 (тт, J=12,8, 2,8Гц, 1H), 3,79 (с, 3H), 6,75 (д, J=8,4Гц, 1H), 6,94 (д, J=2,0Гц, 1H), 6,99 (дд, J=8,4, 2,0Гц, 1H).
(104c)
4-Метил-2-(3,3,5,5-тетраметилциклогексил)фенол

К раствору полученного в примере (104b) 1-метокси-4-метил-2-(3,3,5,5-тетраметилциклогексил)бензола (1,0 г, 3,84 ммоль) в уксусной кислоте (5 мл) добавляли 48% бромистоводородную кислоту (10 мл, 59,3 ммоль), затем нагревали с обратным холодильником в течение 12 часов. К охлажденной реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 450 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,12 (с, 6H), 1,16-1,60 (м, 6H), 2,26 (с, 3H), 3,18 (тт, J= 12,8, 2,8Гц, 1H), 4,47 (с, 1H), 6,64 (д, J= 8,4Гц, 1H), 6,84 (дд, J= 8,4, 2,0Гц, 1H), 6,96 (д, J= 2,0Гц, 1H).
(104d)
4-Метил-2-(3,3,5,5-тетраметилциклогексил)фениловый эфир трифторметансульфоновой кислоты

К раствору полученного в примере (104c) 4-метил-2-(3,3,5,5-тетраметилциклогексил)фенола (0,45 г, 1,83 ммоль) в дихлорметане (30 мл), охлажденного на ледяной бане, добавляли триэтиламин (1,0 мл, 7,32 ммоль) и трифторметансульфоновый ангидрид (0,46 мл, 2,75 ммоль), в указанном порядке, затем перемешивали в течение 2 часов при внешней температуре, равной 0°C. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 0,43 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,94 (с, 6H), 1,11 (с, 6H), 1,08-1,54 (м, 6H), 2,35 (с, 3H), 3,26 (тт, J=12,8, 2,8Гц, 1H), 7,02(дд, J=8,4, 2,0Гц, 1H), 7,09 (д, J=8,4Гц, 1H), 7,14 (д, J=2,0Гц, 1H).
(104e)
Трет-бутиловый эфир 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты

К смеси полученного в примере (104d) 4-метил-2-(3,3,5,5-тетраметилциклогексил)фенилового эфира трифторметансульфоновой кислоты (430 мг, 1,14 ммоль), трет-бутилового эфира 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (421 мг, 1,36 ммоль) (Paul R. Eastwood, Tetrahedron Lett., 2000, 41, 3705) и 1,2-диметоксиэтана (20 мл) добавляли тетракис(трифенилфосфин)палладий(0) (65 мг, 0,06 ммоль) и 2н. водный раствор карбоната натрия (1,72 мл, 3,41 ммоль), затем перемешивали в течение 8 часов в атмосфере азота при внешней температуре, равной 90°C. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали, с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 297 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,91 (с, 6H), 1,02 (с, 6H), 1,09-1,44 (м, 6H), 1,48 (с, 9H), 2,30 (ушир.с,2H), 2,33 (с, 3H), 3,04 (тт, J=12,8, 2,8Гц, 1H), 3,63 (ушир.с, 2H), 4,01 (ушир.с, 2H), 5,49 (ушир.с, 1H), 6,94 (с, 2H), 7,04 (с, 1H).
(104f)
4-[4-Метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридин

К раствору полученного в примере (104e) трет-бутилового эфира 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (297 мг, 0,72 ммоль) в дихлорметане (3 мл) добавляли трифторуксусную кислоту (3 мл), затем перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и затем к остатку добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали с помощью осушителя и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 280 мг сырого продукта, указанного в заголовке соединения, в виде светло-желтого масла.
MS m/e (ESI) 312(MH+).
(104 r)
Гидрохлорид 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропил-1,2,3,6-тетрагидропиридина
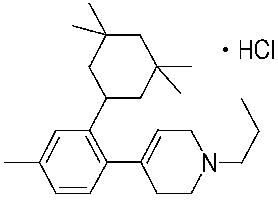
К раствору полученного в примере (104f) 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина (70 мг, 0,23 ммоль) в тетрагидрофуране (2 мл) добавляли пропиональдегид (15,7 мг, 0,27 ммоль), триацетоксиборгидрид натрия (72 мг, 0,34 ммоль) и уксусную кислоту (27 мг, 0,45 ммоль), затем перемешивали в течение 12 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали, с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 63 мг 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропил-1,2,3,6-тетрагидропиридина в виде светло-желтого масла.
MS m/e (ESI) 354(MH+).
Полученное соединение растворяли в этилацетате и добавляли 4н. раствор хлористого водорода в этилацетате и смесь перемешивали в течение 30 минут при комнатной температуре. Раствор концентрировали при пониженном давлении и затем к остатку добавляли гексан с получением твердого вещества, которое измельчали с помощью ультразвука. Твердое вещество фильтровали и высушивали при пониженном давлении с получением 60 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400МГц, CD3OD)
δ: 0,95 (с, 6H), 1,06 (т, J= 7,2Гц, 3H), 1,11 (с, 6H), 1,16-1,46 (м, 8H), 1,77-1,89 (м, 2H), 2,31 (с, 3H), 2,56-2,68 (м, 2H), 3,01 (тт, J= 12,8, 2,8Гц, 1H), 3,12-3,24 (м, 2H), 3,76-3,92 (м, 2H), 5,58 (ушир.с, 1H), 6,96 (с, 2H), 7,11 (с, 1H).
MS m/e (ESI) 354(MH+).
(Пример 105)
Гидрохлорид 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропилпиперидина

К раствору полученного в примере (104g) гидрохлорида 4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропил-1,2,3,6-тетрагидропиридина (50 мг, 0,13 ммоль) в метаноле (10 мл) добавляли 10% палладий на угле (50 мг, влажный), затем перемешивали в течение 2 часов при атмосферном давлении и комнатной температуре в атмосфере водорода. Реакционную смесь фильтровали через целит и полученный фильтрат концентрировали при пониженном давлении. К остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Твердое вещество фильтровали и высушивали при пониженном давлении с получением 16 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400МГц, CD3OD)
δ: 0,97 (с, 6H), 1,05 (т, 3H), 1,18 (с, 6H), 1,18-1,46 (м, 6H), 1,74-1,86 (м, 2H), 1,95-2,08 (м, 4H), 2,29 (с, 3H), 3,00-3,34 (м, 6H), 3,62-3,72 (м, 2H), 6,99 (дд, J= 8,4, 2,0Гц, 1H), 7,08 (д, J= 2,0Гц, 1H), 7,11(д, J= 8,4Гц, 1H).
MS m/e (ESI) 356(MH+).
(Пример 106)
Гидрохлорид 1-бутил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина

(106a)
Трет-бутиловый эфир 4-(5-фтор-2-метоксифенил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты

К смеси 5-фтор-2-метоксифенилбороновой кислоты (1 г, 5,88 ммоль), трет-бутилового эфира 4-трифторметансульфонилокси-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (4,22 г, 7,64 ммоль) (David J. Wustrow, Lawrence D. Wise, Synthesis, 1991, 993) и 1,2-диметоксиэтана (30 мл) добавляли тетракис(трифенилфосфин)палладий(0) (0,34 г, 0,29 ммоль) и 2н. водный раствор карбоната натрия (8,82 мл, 17,6 ммоль), затем перемешивали в течение 2 часов в атмосфере азота при внешней температуре, равной 90°C. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали, с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 2,3 г указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,49 (с, 9H), 2,47 (ушир.с, 2H), 3,58 (т, J= 5,6Гц, 2H), 3,78 (с, 3H), 4,01-4,06 (м, 2H), 5,78 (ушир.с, 1H), 6,77 (дд, J= 8,4, 4,4Гц, 1H), 6,88 (тд, J= 9,2, 3,2Гц, 1H), 6,91 (дд, J=8,8, 3,2Гц, 1H).
(106b)
Трет-бутиловый эфир 4-(5-фтор-2-метоксифенил)пиперидин-1-карбоновой кислоты

К раствору полученного в примере (106a) трет-бутилового эфира 4-(5-фтор-2-метоксифенил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (2,0 г, 6,5 ммоль) в метаноле (30 мл) добавляли 10% палладий на угле (0,99 г, влажный), смесь перемешивали в течение 17 часов при атмосферном давлении и комнатной температуре в атмосфере водорода. Реакционную смесь фильтровали через целит и полученный фильтрат концентрировали при пониженном давлении с получением 2,0 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,48 (с, 9H), 1,50-1,82 (м, 4H), 3,06 (тт, J= 12,8, 2,8Гц, 1H), 3,55-3,62 (м, 2H), 3,78 (с, 3H), 4,01-4,06 (м, 2H), 6,77 (дд, J= 8,8, 4,8Гц, 1H), 6,81-6,93 (м, 2H).
(106c)
4-Фтор-2-пиперидин-4-илфенол

К раствору полученного в примере (106b) трет-бутилового эфира 4-(5-фтор-2-метоксифенил)пиперидин-1-карбоновой кислоты (2,0 г, 6,46 ммоль) в дихлорметане (50 мл) добавляли трибромид бора (1M раствор в тетрагидрофуране, 19,4 мл, 19,4 ммоль), затем перемешивали в течение 4 часов при внешней температуре, равной 60°C. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование выполняли дихлорметаном. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении с получением 840 мг сырого продукта указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,80-2,00 (м, 4H), 2,80-3,16 (м, 4H), 3,44-3,54 (м, 2H), 6,59 (дд, J= 9,2, 3,2Гц, 1H), 6,64 (дд, J= 8,8, 4,4Гц, 1H), 6,75 (тд, J= 8,0, 3,2Гц, 1H).
1H не обнаружен.
MS m/e (ESI) 195(MH+).
(106d)
Трет-бутиловый эфир 4-(5-фтор-2-гидроксифенил)пиперидин-1-карбоновой кислоты

К раствору полученного в примере (106c) 4-фтор-2-пиперидин-4-илфенола (840 мг, 4,30 ммоль) в тетрагидрофуране (20 мл) добавляли триэтиламин (0,78 мл, 5,59 ммоль) и ди-трет-бутил дикарбонат (1,03 г, 4,73 ммоль), в указанном порядке, затем перемешивали в течение 1 часа и 30 минут при комнатной температуре. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния, и затем фильтрат концентрировали при пониженном давлении с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 360 мг указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,48 (с, 9H), 1,50-1,62 (м, 2H), 1,77-1,85 (м, 2H), 2,70-2,90 (м, 2H), 3,00 (тт, J= 12,8, 2,8Гц, 1H), 4,16-4,32 (м, 2H),5,21 (ушир.с, 1H), 6,67 (дд, J= 8,4, 4,4Гц, 1H), 6,75 (тд, J= 8,4, 3,6Гц, 1H), 6,81 (дд, J=8,4, 3,2Гц, 1H).
(106e)
Трет-бутиловый эфир 4-(5-фтор-2-трифторметансульфонилоксифенил)пиперидин-1-карбоновой кислоты

К раствору полученного в примере (106d) трет-бутилового эфира 4-(5-фтор-2-гидроксифенил)пиперидин-1-карбоновой кислоты (360 мг, 1,22 ммоль) в тетрагидрофуране (10 мл), при охлаждении на ледяной бане, добавляли гидрид натрия (60% в масле, 58,6 мг, 1,46 ммоль), смесь перемешивали в течение 10 минут. К смеси добавляли N-фенилбис(трифторметансульфонимид) (479 мг, 1,34 ммоль), затем перемешивали в течение 18 часов при комнатной температуре. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 523 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,25 (с, 9H), 1,40-1,90 (м, 4H), 2,70-2,92 (м, 2H),3,00 (тт, J= 12,8, 2,8Гц, 1H), 4,16-4,34 (м, 2H), 6,88-6,96 (м, 2H), 7,01 (дд, J= 8,8, 4,8Гц, 1H).
(106f)
Трет-бутиловый эфир 4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидин-1-карбоновой кислоты

К смеси полученного в примере (106e) трет-бутилового эфира 4-(5-фтор-2-трифторметансульфонилоксифенил)пиперидин-1-карбоновой кислоты (523 мг, 1,22 ммоль), полученного в примере (4b) 4,4,5,5-тетраметил-2-(3,3,5,5-тетраметилциклогекс-1-енил)[1,3,2]диоксаборолана (387 мг, 1,46 ммоль) и 1,2-диметоксиэтана (10 мл) добавляли тетракис(трифенилфосфин)палладий(0) (71 мг, 0,06 ммоль) и 2н. водный раствор карбоната натрия (1,83 мл, 3,66 ммоль), затем перемешивали в течение 1 часа и 30 минут в атмосфере азота при внешней температуре, равной 90°C. К реакционной смеси добавляли насыщенный солевой раствор и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении с получением остатка, который очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 245 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 1,01 (с, 6H), 1,24 (с, 9H), 1,42 (с, 2H), 1,50-1,72 (м, 4H), 1,85 (с, 2H), 2,58-2,98 (м, 3H), 4,10-4,32 (м, 2H), 5,25 (с, 1H), 6,76-6,88 (м, 2H), 6,97 (дд, J= 8,4, 2,4Гц, 1H).
(106 r)
4-[5-Фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидин

К раствору полученного в примере (106f) трет-бутилового эфира 4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидин-1-карбоновой кислоты (245 мг, 0,59 ммоль) в дихлорметане (3 мл) добавляли трифторуксусную кислоту (3 мл), затем перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и затем к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия, и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении с получением 220 мг сырого продукта указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,92 (с, 6H), 1,01 (с, 6H), 1,42 (с, 2H), 1,74-2,40 (м, 6H), 2,76-3,04 (м, 3H), 3,44-3,52 (м, 2H), 5,22 (с, 1H), 6,71 (дд, J= 10,4, 2,4Гц, 1H), 6,84 (тд, J= 8,4, 2,8Гц, 1H), 6,97 (дд, J= 8,4, 2,0Гц, 1H).
1H у NH не мог быть идентифицирован.
MS m/e (ESI) 316(MH+).
(106h)
Гидрохлорид 1-бутил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина

К раствору полученного в примере (106 г) 4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина (70 мг, 0,22 ммоль) в тетрагидрофуране (2 мл) добавляли бутиральдегид (19,2 мг, 0,27 ммоль), триацетоксиборгидрид натрия (71 мг, 0,33 ммоль) и уксусную кислоту (27 мг, 0,44 ммоль), затем перемешивали в течение 15 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Органический слой высушивали над безводным сульфатом магния и фильтрат концентрировали при пониженном давлении с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 55 мг 1-бутил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина в виде светло-желтого масла.
MS m/e (ESI) 372(MH+).
Полученное соединение растворяли в этилацетате и затем добавляли 4н. раствор хлористого водорода в этилацетате, и смесь перемешивали в течение 30 минут при комнатной температуре. Смешанный раствор концентрировали при пониженном давлении и затем к остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Твердое вещество фильтровали и высушивали при пониженном давлении с получением 47 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400МГц, CD3OD)
δ: 1,02 (т, J= 7,2Гц, 3H), 1,10 (с, 6H), 1,12 (с, 6H), 1,40-1,52 (м, 4H), 1,68-1,80 (м, 2H), 1,92-2,06 (м, 6H), 2,82-3,22 (м, 5H), 3,60-3,72 (м, 2H), 5,30 (т, J= 1,6Гц, 1H), 6,93 (тд, J= 8,4, 2,8Гц, 1H), 6,99 (дд, J= 8,0, 2,4Гц, 1H), 7,05 (дд, J= 8,4, 6,0Гц, 1H).
MS m/e (ESI) 372(MH+).
(Пример 107)
Гидрохлорид 1-бутил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина

К раствору полученного в примере (106h) гидрохлорида 1-бутил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина (47 мг, 0,12 ммоль) в метаноле (3 мл) добавляли 10% палладий на угле (100 мг, влажный), затем перемешивали в течение 4 часов при атмосферном давлении и комнатной температуре в атмосфере водорода. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. К остатку добавляли гексан с получением твердого вещества, которое затем измельчали с помощью ультразвука. Твердое вещество фильтровали и высушивали при пониженном давлении с получением 19 мг указанного в заголовке соединения в виде светло-желтого твердого вещества.
1H-ЯМР (400МГц, CD3OD)
δ: 0,97 (с, 6H), 1,03 (т, J= 7,2Гц, 3H), 1,08-1,16 (м, 2H), 1,19 (с, 6H), 1,18-1,52 (м, 6H), 1,72-1,84 (м, 2H), 1,94-2,10 (м, 4H), 3,06-3,26 (м, 6H), 3,68-3,80 (м, 2H), 6,88-7,02 (м, 2H), 7,30 (дд, J= 8,8, 6,0Гц, 1H).
MS m/e (ESI) 374(MH+).
(Пример 108)
1-[2-(4-Циклопропилметилпиперазин-1-ил)фенил]-3,3,5,5-тетраметилциклогексанол

(108a)
1-(2-Бромфенил)-4-циклопропилметилпиперазин

К раствору 1-(2-бромфенил)пиперазина (3,0 г, 12,4 ммоль) в тетрагидрофуране (30 мл) добавляли уксусную кислоту (0,71 мл, 12,4 ммоль), циклопропанкарбальдегид (1,39 мл, 18,66 ммоль) и триацетоксиборгидрид натрия (4,22 г, 19,9 ммоль), затем перемешивали в течение 88 часов при комнатной температуре. К реакционной смеси добавляли водный раствор карбонат калия, экстрагирование осуществляли с помощью этилацетата и органический слой концентрировали. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 3,773 г указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,13-0,16 (м, 2H), 0,52-0,57 (м, 2H), 0,87-0,95 (м, 1H), 2,34 (д, J= 6,4Гц, 2H), 2,60-2,85 (ушир., 4H), 3,03-3,17 (ушир., 4H), 6,88-7,55 (м, 4H).
(108b)
1-[2-(4-Циклопропилметилпиперазин-1-ил)фенил]-3,3,5,5-тетраметилциклогексанол

К раствору полученного в примере (108a) 1-(2-бромфенил)-4-циклопропилметилпиперазина (700 мг, 2,37 ммоль) в безводном тетрагидрофуране (7 мл) по каплям добавляли н-бутиллитий (1,60 M раствор в гексане, 1,63 мл, 2,61 ммоль) в течение 3 минут при внешней температуре, равной -70°C. После перемешивания в течение 45 минут в аналогичных условиях к реакционной смеси по каплям при внешней температуре, равной -70°C, в течение 4 минут добавляли 3,3,5,5-тетраметилциклогексанон (0,49 мл, 2,85 ммоль). Перемешивание продолжали в течение 15 минут в аналогичных условиях и затем в течение 18 часов и 30 минут при нагревании до тех пор, пока внешняя температура не достигнет значения комнатной температуре. К реакционной смеси добавляли воду и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой промывали насыщенным солевым раствором и затем высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 765 мг указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,12-0,17 (м, 2H), 0,53-0,57 (м, 2H), 0,85-0,95 (м, 1H), 0,93 (с, 6H), 1,13-1,79 (м, 6H), 1,38 (с, 6H), 2,26-2,33 (м, 2H), 2,34 (д, J= 6,4Гц, 2H), 3,00-3,04 (м, 2H), 3,09-3,14 (м, 4H), 7,15 (ддд, J= 7,8, 7,8, 1,4Гц, 1H), 7,22 (ддд, J= 7,8, 7,8, 1,4Гц, 1H), 7,31 (дд, J= 7,8, 1,4Гц, 1H), 7,36 (дд, J= 7,8, 1,4Гц, 1H), 8,11 (ушир.с, 1H).
MS m/e (ESI) 371 (MH+).
[0458]
(Пример 109)
1-Циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин

Смесь полученного в примере (108b) 1-[2-(4-циклопропилметилпиперазин-1-ил)фенил]-3,3,5,5-тетраметилциклогексанола (250 мг, 0,675 ммоль), воды (0,12 мл) и трифторуксусной кислоты (1,04 мл, 13,5 ммоль) перемешивали в течение 21 часа при внешней температуре, равной комнатной температуре. К реакционной смеси добавляли водный раствор карбонат калия и затем экстрагирование осуществляли с помощью этилацетата. Органический слой концентрировали при пониженном давлении с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 218 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,11-0,15 (м, 2H), 0,51-0,56 (м, 2H), 0,85-0,95 (м, 1H), 1,02 (с, 6H), 1,07 (с, 6H), 1,39 (с, 2H), 2,17 (д, J= 1,4Гц, 2H), 2,29 (д, J= 6,4Гц, 2H), 2,50-2,75 (ушир., 4H), 2,95-3,10 (ушир., 4H), 5,50 (т, J= 1,4Гц, 1H), 6,95-7,08 (м, 3H), 7,16-7,20 (м, 1H).
[0459]
(Пример 110)
4-[4-[2-(3,3,5,5-Тетраметилциклогексил)фенил]пиперазин-1-ил]бутан-2-он

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (160 мг, 0,532 ммоль), метилвинилкетона (0,058 мл, 0,692 ммоль) и хлороформа (0,7 мл) перемешивали в течение 21 часа и 30 минут при внешней температуре, равной комнатной температуре. Реакционную смесь разбавляли этилацетатом и затем промывали водным раствором гидрокарбоната натрия. Отделенный органический слой концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гептан), с получением 155 мг указанного в заголовке соединения в виде светло-коричневого масла.
MS m/e (ESI) 371(MH+).
[0460]
(Пример 111)
Гидрохлорид 4-[4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил]бутан-2-ола
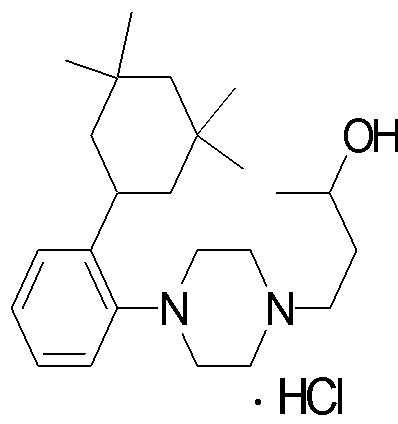
К смеси полученного в примере 110 4-[4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил]бутан-2-она (138 мг, 0,372 ммоль) и метанола (1,5 мл) постепенно добавляли боргидрид натрия (14,1 мг, 0,372 ммоль) при внешней температуре, равной комнатной температуре, затем перемешивали в течение 2 часов в аналогичных условиях. К реакционной смеси добавляли водный раствор хлорида аммония и перемешивание продолжали в течение 20 минут. После подщелачивания смеси водным раствором карбоната калия экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой концентрировали при пониженном давлении с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 136 мг свободной формы указанного в заголовке соединения в виде бесцветного масла. Свободную форму указанного в заголовке соединения (19 мг, 0,051 ммоль) растворяли в смешанном растворителе, состоящем из этилового спирта и этилацетата, и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,014 мл, 0,056 ммоль). Смешанный раствор концентрировали при пониженном давлении и полученный твердый остаток промывали смешанным растворителем, состоящем из смеси диэтилового эфира и гептана, и затем высушивали при пониженном давлении с получением 21 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 373(MH+).
[0461]
(Пример 112)
Гидрохлорид 1-(3-фторбутил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
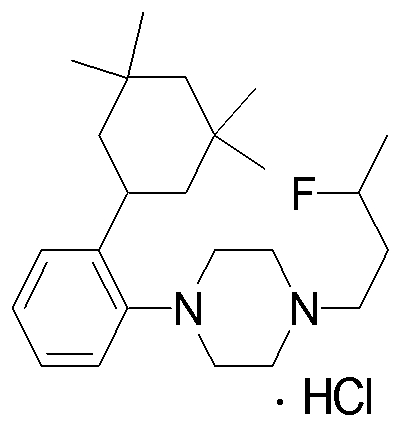
К раствору полученного в качестве промежуточного соединения в примере 111 4-[4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил]бутан-2-ола (40 мг, 0,107 ммоль) в дихлорметане (1 мл) добавляли трифторид диэтиламиносеры (DAST) (0,017 мл, 0,128 ммоль) при внешней температуре, равной -70°C. Затем смесь перемешивали в течение 15 часов при нагревании до тех пор, пока внешняя температура не достигнет значения комнатной. Затем реакционную смесь охлаждали до внешней температуры, равной 0°C, добавляли водный раствор карбоната калия и смесь перемешивали. Смесь экстрагировали этилацетатом с получением органического слоя, который высушивали над безводным сульфатом натрия. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан) с получением 2,8 мг 1-(3-фторбутил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина в виде бесцветного масла. Данное соединение растворяли в смеси этилацетата и этанола и добавляли 4н. раствор хлористого водорода в этилацетате (0,002 мл). Реакционную смесь концентрировали при пониженном давлении и полученный твердый остаток промывали смешанным растворителем, состоящим из смеси диэтилового эфира и гептана, и затем высушивали при пониженном давлении с получением 2,7 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 375(MH+).
(Пример 113)
Гидрохлорид 1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}гексан-2-ола

Смесь полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (120 мг, 0,399 ммоль), 1,2-эпоксигексана (240 мг, 2,39 ммоль) и 2-пропанола (0,8 мл) перемешивали в течение 18 часов при внешней температуре, равной 80°C. Реакционную смесь концентрировали при пониженном давлении с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 116 мг 1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}гексан-2-ола в виде светло-желтого твердого вещества. Данное соединение (12 мг, 0,030 ммоль) растворяли в диэтиловом эфире и добавляли 4н. раствор хлористого водорода в этилацетате (0,0083 мл, 0,033 ммоль). Смешанный раствор концентрировали при пониженном давлении и полученный твердый остаток промывали смешанным растворителем, состоящего из смеси диэтилового эфира и гептана, и затем высушивали при пониженном давлении с получением 10 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 401(MH+).
(Пример 114)
Гидрохлорид 1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-ола

К смеси полученного в качестве промежуточного соединения в примере 25 1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она (298 мг, 0,802 ммоль) и метанола (3 мл) при внешней температуре, равной комнатной температуре постепенно добавляли боргидрид натрия (36,4 мг, 0,962 ммоль), затем перемешивали в течение 1 часа в аналогичных условиях. К реакционной смеси добавляли водный раствор хлорида аммония и смесь перемешивали в течение ночи, и смесь подщелачивали водным раствором карбоната калия, и экстрагирование осуществляли с помощью этилацетата. Отделенный органический слой концентрировали при пониженном давлении с получением остатка, который очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 269 мг свободной формы указанного в заголовке соединения в виде бесцветного твердого вещества. Свободную форму указанного в заголовке соединения (20 мг, 0,054 ммоль) растворяли в смешанном растворителе, состоящем из смеси этанола и этилацетата, и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,015 мл, 0,059 ммоль). Смешанный раствор концентрировали при пониженном давлении и полученный твердый остаток промывали смешанным растворителем, состоящем из смеси диэтилового эфира и гептана, и затем высушивали при пониженном давлении с получением 20 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 373(MH+).
(Пример 115)
Гидрохлорид 2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}бутиронитрила
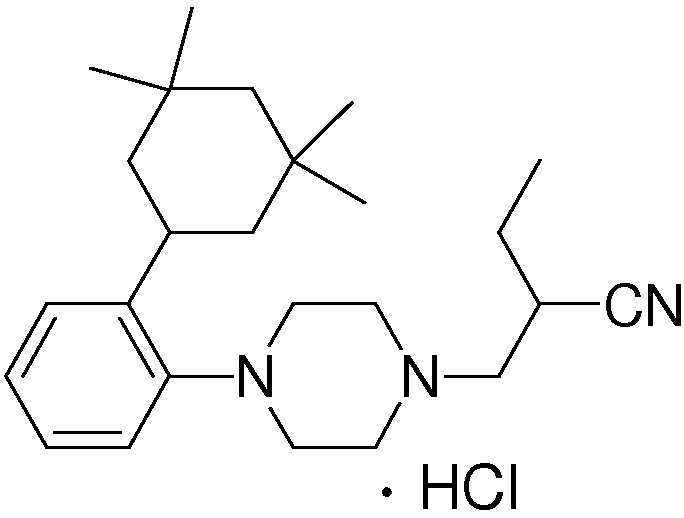
К смеси полученного в качестве промежуточного соединения в примере 25 1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она (80 мг, 0,216 ммоль), 1,2-диметоксиэтана (2,5 мл) и трет-бутанола (0,1 мл) добавляли изоцианид п-толуолсульфонилметила (TosMIC) (46,4 мг, 0,238 ммоль) и трет-бутоксид калия (34 мг, 0,302 ммоль) при внешней температуре, равной 0°C, затем перемешивали в течение 90 минут в аналогичных условиях. Затем внешняя температура поднималась до значения комнатной, и перемешивание продолжали в течение 30 минут. К реакционной смеси добавляли насыщенный солевой раствор, экстрагирование осуществляли с помощью этилацетата и полученный органический слой высушивали над безводным сульфатом натрия. После удаления осушителя фильтрацией фильтрат концентрировали при пониженном давлении с получением остатка, который затем очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гептан), с получением 66 мг свободной формы указанного в заголовке соединения в виде бесцветного масла. Данное соединение (66 мг, 0,173 ммоль) растворяли в смеси дихлорметана и этилацетата и затем добавляли 4н. раствор хлористого водорода в этилацетате (0,046 мл, 0,18 ммоль). Смешанный раствор концентрировали при пониженном давлении и полученный твердый остаток промывали смешанным растворителем, состоящем из смеси диэтилового эфира и гептана, и затем высушивали при пониженном давлении с получением 65 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
MS m/e (ESI) 382(MH+).
[0465]
(Пример 116)
Гидрохлорид 1-фуран-3-илметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
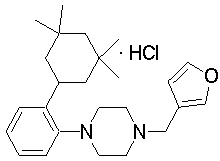
К смеси полученного в примере (8b) 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (50 мг, 0,166 ммоль), фуран-3-карбальдегида (0,02 мл, 0,231 ммоль) и тетрагидрофурана (3 мл) добавляли триацетоксиборгидрид натрия (43 мг, 0,203 ммоль), затем перемешивали в течение 20 минут при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагирование осуществляли с помощью этилацетата. Растворитель отгоняли в токе азота. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан), с получением 1-фуран-3-илметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина. Данное соединение растворяли в дихлорметане и добавляли 4н. раствор хлористого водорода в этилацетате. Растворитель отгоняли в токе азота. К полученному остатку добавляли диэтиловый эфир с получением твердого вещества, и, после дополнительного добавления гексана, твердое вещество измельчали с помощью ультразвука. Супернатантный раствор удаляли и полученное твердое вещество высушивали, с получением 33 мг указанного в заголовке соединения в виде бесцветных кристаллов.
MS m/e (ESI) 381(MH+).
[0466]
(Пример 117)
Метансульфонат 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

(117a)
3,3,5,5-Тетраметилциклогекс-1-ениловый эфир трифторметансульфоновой кислоты

3,3,5,5-Тетраметилциклогексанон (100,0 г, 648,3 ммоль) растворяли в безводном тетрагидрофуране (750 мл) в атмосфере азота и смесь охлаждали и перемешивали при внешней температуре, равной ниже -70°C. К смеси в течение 30 минут в аналогичных условиях по каплям добавляли бис(триметилсилил)амид лития (1 M раствор в тетрагидрофуране, 778 мл, 778 ммоль), затем перемешивали в течение 70 минут в аналогичных условиях. Затем к реакционной смеси в течение 35 минут по каплям добавляли раствор N-фенилбис(трифторметансульфонимида) (254,8 г, 713 ммоль) в безводном тетрагидрофуране (1 л). После перемешивания смеси в течение 20 минут в аналогичных условиях, смесь перемешивали в течение 15 часов при постепенном нагревании до внешней температуры, равной комнатной. Реакцию повторяли еще два раза в том же масштабе, как выше, тем же способом, в тех же условиях. Три реакционные смеси объединяли и подвергали следующей обработке.
К объединенной реакционной смеси добавляли этилацетат (1,5 л) и затем при перемешивании добавляли раствор концентрированной хлористоводородной кислоты (450 мл) в воде со льдом (5 л). После перемешивания в течение некоторого времени отделенный органический слой промывали насыщенным солевым раствором (1,5 л), насыщенным водным раствором гидрокарбоната натрия (1,5 л) и насыщенным солевым раствором (1,5 л). Полученный органический слой высушивали над безводным сульфатом магния (1,5 кг) в течение 30 минут при перемешивании. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан) и затем высушивали при пониженном давлении с получением 520,94 г указанного в заголовке соединения в виде светло-желтого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 1,05 (с, 6H), 1,10 (с, 6H), 1,35 (с, 2H), 2,09 (д, J= 1,2Гц, 2H), 5,51 (т, J= 1,2Гц, 1H).
(117b)
1-Нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензол

К смеси 3,3,5,5-тетраметилциклогекс-1-енилового эфира трифторметансульфоновой кислоты (160,0 г, 558,8 ммоль), 2-нитрофенилбороновой кислоты (97,9 г, 586,8 ммоль) и 1,2-диметоксиэтана (920 мл) добавляли карбонат натрия (118,5 г, 1,12 моль) и очищенную воду (230 мл) при перемешивании при комнатной температуре. Затем к смеси при комнатной температуре (в масляной бане при комнатной температуре) добавляли тетракис(трифенилфосфин)палладий(0) (29,1 г, 25,1 ммоль) и внутреннее пространство колбы заполняли газообразным азотом. Затем смесь перемешивали в течение 4 часов и 30 минут при внешней температуре, равной комнатной температуре (в масляной бане при комнатной температуре).
Ту же реакцию затем осуществляли еще два раза тем же способом в тех же реакционных условиях, но с 170,0 г (593,7 ммоль) 3,3,5,5-тетраметилциклогекс-1-енилового эфира трифторметансульфоновой кислоты и исходный продукт и количества других реагентов изменяли на соответствующие эквиваленты. Три реакционные смеси объединяли и подвергали следующей обработке.
К объединенной реакционной смеси добавляли этилацетат (1,5 л) и воду (4 л), затем эту смесь перемешивали в течение 5 минут. Смесь фильтровали через целит для удаления нерастворимых веществ. После перемешивания полученного фильтрата в течение некоторого времени, органический слой отделяли и водный слой экстрагировали этилацетатом (1 л). Органические слои объединяли и затем высушивали над безводным сульфатом магния (1 кг) в течение 20 минут при перемешивании. Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан) и затем высушивали при пониженном давлении с получением 407,30 г указанного в заголовке соединения в виде желтого твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 1,046 (с, 6H), 1,053 (с, 6H), 1,41 (с, 2H), 2,02 (д, J= 1,6Гц, 2H), 5,37 (т, J= 1,6Гц, 1H), 7,26 (дд, J= 7,6, 1,6Гц, 1H), 7,33 (ддд, J= 8,0, 7,6, 1,6Гц, 1H), 7,49 (ддд, J= 7,6, 7,6, 1,2Гц, 1H), 7,74 (дд, J= 8,0, 1,2Гц, 1H).
(117c)
2-(3,3,5,5-Тетраметилциклогексил)фениламин
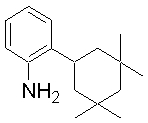
Смесь 1-нитро-2-(3,3,5,5-тетраметилциклогекс-1-енил)бензола (130,0 г, 501,3 ммоль), 10% палладия на угле (13,0 г, влажный) и этилового спирта (1820 мл) помещали в колбу, затем внутреннее пространство заполняли водородом и смесь перемешивали в течение 78 часов при комнатной температуре в атмосфере водорода при атмосферном давлении. Реакцию повторяли еще два раза в том же масштабе, как выше, тем же способом, в тех же условиях. Три реакционные смеси объединяли и подвергали следующей обработке.
Объединеннную реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток разбавляли этилацетатом (700 мл) и гексаном (200 мл) и затем высушивали над безводным сульфатом натрия (200 г) в течение 20 минут при перемешивании. Осушитель отфильтровывали, используя фильтр с микроволокном из стекла, и затем фильтрат концентрировали и высушивали при пониженном давлении с получением 345,76 г указанного в заголовке соединения в виде светло-коричневого масла.
1H-ЯМР (400МГц, CDCl3)
δ: 0,95 (с, 6H), 1,13 (с, 6H), 1,08-1,36 (м, 4H), 1,59-1,62 (м, 2H), 2,86 (тт, J= 12,4, 2,8Гц, 1H), 3,63 (ушир.с, 2H), 6,70 (дд, J= 7,6, 1,2Гц, 1H), 6,78 (ддд, J= 7,6, 7,6, 1,2Гц, 1H), 7,02 (ддд, J= 7,6, 7,6, 1,2Гц, 1H), 7,12 (дд, J= 7,6, 1,2Гц, 1H).
(117d)
1-[2-(3,3,5,5-Тетраметилциклогексил)фенил]пиперазин

К смеси 2-(3,3,5,5-тетраметилциклогексил)фениламина (168,0 г, 726,1 ммоль) и 1,2-дихлорбензола (1200 мл) добавляли гидрохлорид бис(2-хлорэтил)амина (155,5 г, 871,3 ммоль). Смесь перемешивали в течение 7 часов при внешней температуре, равной 190°C, в атмосфере азота. Во время проведения взаимодействия, для удаления образовавшегося газообразного хлористого водорода, через реактор несколько раз пропускали поток азота. Реакцию повторяли еще один раз в том же масштабе, как выше, тем же способом, в тех же условиях. Две реакционные смеси объединяли и подвергали следующей обработке.
После охлаждения до комнатной температуры объединеннную реакционную смесь разбавляли этилацетатом (6 л) и водой (1 л). Затем смесь добавляли к смеси карбоната калия (1,3 кг) и воды (5 л) при перемешивании. Смесь перемешивали и оставляли для отстаивания, и органический слой отделяли. Водный слой вновь экстрагировали этилацетатом (2 л). Объединенные органические слои промывали насыщенным солевым раствором (3 л) и затем высушивали над безводным сульфатом натрия (3,5 кг). Осушитель отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан) и затем высушивали при пониженном давлении с получением 241,67 г указанного в заголовке соединения в виде светло-розового твердого вещества.
Кроме того, вышеуказанная очистка с помощью хроматографии на колонке с NH силикагелем также давала 126,2 г масла в виде смеси требуемого соединения и примесей. К маслу добавляли гексан (150 мл) и смесь перемешивали в течение 2 часов при 0°C. Полученный осадок собирали фильтрованием с отсасыванием и затем высушивали при пониженном давлении с получением 42,74 г указанного в заголовке соединения в виде светло-розового твердого вещества. В общей сложности получали 284,41 г указанного в заголовке соединения в виде светло-розового твердого вещества.
1H-ЯМР (400МГц, CDCl3)
δ: 0,93 (с, 6H), 1,13 (с, 6H), 1,17-1,35 (м, 4H), 1,42-1,46 (м, 2H), 2,84-2,87 (м, 4H), 3,02-3,04 (м, 4H), 3,60 (тт, J= 12,8, 2,8Гц, 1H), 7,06-7,18(м, 3H), 7,23 (дд, J= 7,6, 1,6Гц, 1H).
1H у NH не мог быть идентифицирован.
(117f)
1-Циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин

К смеси 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (241,67 г, 804,3 ммоль), уксусной кислоты (46,0 мл, 804,3 ммоль) и тетрагидрофурана (3300 мл) добавляли смешанный раствор циклопропанкарбальдегида (64,8 г, 924,9 ммоль) и тетрагидрофурана (200 мл) при перемешивании при внешней температуре, равной комнатной температуре. После перемешивания в течение 10 минут к реакционной смеси в течение 8 минут добавляли порциями триацетоксиборгидрид натрия (238,6 г, 1126 ммоль). Затем смесь перемешивали в течение 3 часов при внешней температуре, равной комнатной температуре.
Реакционную смесь разбавляли гексаном (2 л) и водой (1 л). Затем эту смесь добавляли к смеси карбоната калия (667 г) и воды (3,5 л) при перемешивании. После перемешивания в течение некоторого времени и отстаивании смеси отделенный органический слой промывали, последовательно, водой (2 л) и насыщенным солевым раствором (1,5 л). Затем органический слой высушивали над безводным сульфатом натрия (1,5 кг), осушитель отфильтровывали и полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NH силикагелем (этилацетат/гексан) и затем концентрировали при пониженном давлении с получением масла. Это масло растворяли вновь в этилацетате (1L) и для удаления нерастворимых веществ смесь фильтровали через фильтр из стеклянного микроволокна. Полученный фильтрат концентрировали при пониженном давлении, и затем для высушивания при пониженном давлении в течение 2 часов при внешней температуре, равной 50°C, использовали вакуумный насос, с получением 280,7 г указанного в заголовке соединения в виде кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,12-0,16 (м, 2H), 0,52-0,56 (м, 2H), 0,88-0,96(м, 1H), 0,92 (с, 6H), 1,12 (с, 6H), 1,13-1,34 (м, 4H), 1,41-1,47 (м, 2H), 2,32 (д, J= 6,4Гц, 2H), 2,40-2,98 (ушир., 4H), 2,94-2,96 (м, 4H), 3,58 (тт, J = 12,6, 2,8Гц, 1H), 7,05-7,18 (м, 3H), 7,22-7,24 (м, 1H).
(117 g)
Метансульфонат 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина

Смесь 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина (277,0 г, 781,2 ммоль) и метилэтилкетона (2493 мл) перемешивали при нагревании при внешней температуре, равной 81°C. Затем по каплям в течение 3 минут добавляли метансульфоновую кислоту (76,58 г, 796,8 ммоль), до перехода в полностью растворенное состояние. После нагревания и перемешивания в течение 7 минут при внешней температуре, равной 81°C, внешнюю температуру постепенно понижали и перемешивание продолжали до тех пор, пока внутренняя температура не достигнет 37°C. Реакционную суспензию, содержащую полученный осадок, помещали в другую колбу, используя метилэтилкетон (100 мл). Суспензию затем концентрировали при пониженном давлении в течение 1 часа и 20 минут при внешней температуре, равной 21°C. Затем ее высушивали при пониженном давлении в течение 30 минут при внешней температуре, равной 40°C, для затвердевания содержимого колбы, с получением сырого твердого продукта указанного в заголовке соединения. После добавления смешанного растворителя, состоящего из смеси этилацетата (1662 мл) и гептана (1108 мл), к данному сырому твердому продукту, полученную суспензию перемешивали в течение 1 часа при внешней температуре, равной 65°C. Затем суспензию дополнительно перемешивали с постепенным понижением внешней температуры, и после достижения внешней температуры 45°C, перемешивание продолжали в течение 14 часов при внешней температуре, равной комнатной температуре. Полученную суспензию фильтровали и выпавшее в осадок твердое вещество собирали. Твердое вещество промывали смешанным растворителем, состоящим из смеси этилацетата (330 мл) и гептана (220 мл), и высушивали на воздухе с отсасыванием в течение 4 часов при комнатной температуре. Полученные кристаллы высушивали в течение 6 часов при 70°C в сушилке с нагретым воздухом с получением 335,9 г указанного в заголовке соединения в виде бесцветных (белых) порошкообразных кристаллов.
1H-ЯМР (400МГц, CDCl3)
δ: 0,47-0,51 (м, 2H), 0,81-0,85 (м, 2H), 0,94 (с, 6H), 1,10 (с, 6H), 1,15-1,43 (м, 7H), 2,85 (с, 3H), 2,95-3,11 (м, 6H), 3,43 (тт, J= 12,6, 3,0Гц, 1H), 3,52-3,61 (м, 2H), 3,80 (ушир. д, J= 11,2Гц, 2H), 7,13-7,26 (м, 4H), 11,11 (ушир.с, 1H).
[0473]
(Пример 118)
Следующие соединения получали в соответствии с обычными способами получения, описанными выше, способами, описанными в примерах, или их комбинациями с хорошо известными способами.
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-пропилацетамида
MS m/e (ESI) 400(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N,N-диметилацетамида
MS m/e (ESI) 386(MH+).
Гидрохлорид 4-бензил-1-[2-(4-трет-бутилциклогексил)фенил]пиперазин-2-она
MS m/e (ESI) 405(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогекс-1-енил)фенил]пиперазин-1-ил}-N-этилацетамида
MS m/e (ESI) 384(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-циклопропилметилпиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-метилпиперазина
MS m/e (ESI) 313(MH+).
Гидрохлорид 1-фуран-3-илметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 381(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-морфолин-4-илэтанона
MS m/e (ESI) 428(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-пирролидин-1-илэтанона
MS m/e (ESI) 412(MH+).
Гидрохлорид 1-азепан-1-ил-2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}этанона
MS m/e (ESI) 440(MH+).
Гидрохлорид 3-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)бензонитрила
MS m/e (ESI) 382(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-пиридин-2-илфенил]пиперазина
MS m/e (ESI) 434(MH+).
Гидрохлорид 4-(4-трет-бутилциклогекс-1-енил)-3-(4-бутилпиперазин-1-ил)фениламина
MS m/e (ESI) 370(MH+).
Гидрохлорид [4-(4-трет-бутилциклогекс-1-енил)-3-(4-бутилпиперазин-1-ил)фенил]диметиламина
MS m/e (ESI) 398(MH+).
Гидрохлорид [4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]диметиламина
MS m/e (ESI) 400(MH+).
Гидрохлорид 1-[4-(4-Метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пентилпиперазина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил]-4-пентилпиперазина
MS m/e (ESI) 494(MH+).
Гидрохлорид 1-[4-(2-спиро[5,5]ундец-3-илфенил)пиперазин-1-ил]бутан-2-она
MS m/e (ESI) 383(MH+).
Гидрохлорид 1-бутил-4-[2-(4-бутилциклогексил)фенил]пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид метилового эфира [4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]уксусной кислоты
MS m/e (ESI) 429(MH+).
Гидрохлорид [5-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)-2-метоксифенил]диметиламина
MS m/e (ESI) 430(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]пиперазина
MS m/e (ESI) 383(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-5-метоксифенил]пиперазина
MS m/e (ESI) 385(MH+).
Гидрохлорид 1-[2-(4,4-Диэтилциклогекс-1-енил)-5-метоксифенил]-4-пропилпиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид [4-(4-бутилпиперазин-1-ил)-5-(4,4-диэтилциклогексил)-2-метоксифенил]диметиламина
MS m/e (ESI) 430(MH+).
Гидрохлорид 1-пропил-4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазина
MS m/e (ESI) 339(MH+).
Гидрохлорид 1-пропил-4-(2-спиро[4,5]дец-8-илфенил)пиперазина
MS m/e (ESI) 341(MH+).
Гидрохлорид 1-(2-спиро[4,5]дец-8-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 397(MH+).
Гидрохлорид [4-(4-бутилпиперазин-1-ил)-2-метокси-5-(3,3,5,5-тетраметилциклогексил)фенил]диметиламина
MS m/e (ESI) 430(MH+).
Гидрохлорид 4-[4-(4-пентилпиперазин-1-ил)-3-спиро[4,5]дец-7-ен-8-илфенил]морфолина
MS m/e (ESI) 452(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-метоксифенил]пиперазина
MS m/e (ESI) 387(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-метоксифенил]пиперазина
MS m/e (ESI) 387(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)-4-метоксифенил]пиперазин-1-ил}-N,N-диметилацетамида
MS m/e (ESI) 416(MH+).
Метиловый эфир 3-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}пропионовой кислоты
MS m/e (ESI) 387(MH+).
Гидрохлорид 4-[4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид 1-[4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]этанона
MS m/e (ESI) 399(MH+).
Гидрохлорид 4-[3-(4,4-диметилциклогекс-1-енил)-4-(4-изобутилпиперазин-1-ил)-фенил]морфолина
MS m/e (ESI) 412(MH+).
Гидрохлорид цис-4-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 412(MH+).
Гидрохлорид 4-[3-(4,4-диметилциклогекс-1-енил)-4-(4-пропилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 398(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 327(MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 442(MH+).
Этиловый эфир 4-[2-(4,4-диметилциклогексил)фенил]пиперазин-1-карбоновой кислоты
MS m/e (ESI) 345(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]морфолина
MS m/e (ESI) 414(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 399(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 381(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 381(MH+).
Гидрохлорид 1-{4-[2-(4,4-диметилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 341(MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогекс-1-енил)-4-(4-пентилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-бутил-4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазина
MS m/e (ESI) 325(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диэтилциклогексил)фенил]морфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-спиро[5,5]ундец-3-илфенил]морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 343(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)фенил]пиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пентилпиперазина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-{4-[2-(4,4-диэтилциклогексил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диэтилциклогексил)фенил]пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 4-[3-(4,4-диэтилциклогекс-1-енил)-4-(4-пропилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 426(MH+).
Гидрохлорид 4-{3-(4,4-диэтилциклогекс-1-енил)-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-{2-(4-трет-бутилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил}-4-пропилпиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид 1-{2-(4-трет-бутилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил}-4-циклопропилметилпиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-пропил-4-(2-спиро[5,5]ундец-2-ен-3-илфенил)пиперазина
MS m/e (ESI) 353(MH+).
Гидрохлорид 1-циклопропилметил-4-(2-спиро[5,5]ундец-2-ен-3-илфенил)пиперазина
MS m/e (ESI) 365(MH+).
Гидрохлорид 4-{4-(4-бутилпиперазин-1-ил)-3-спиро[5,5]ундец-2-ен-3-илфенил}морфолина
MS m/e (ESI) 452(MH+).
Гидрохлорид 4-{4-(4-пропилпиперазин-1-ил)-3-спиро[5,5]ундец-2-ен-3-илфенил}морфолина
MS m/e (ESI) 438(MH+).
Гидрохлорид 4-{4-(4-циклопропилметилпиперазин-1-ил)-3-спиро[5,5]ундец-2-ен-3-илфенил}морфолина
MS m/e (ESI) 450(MH+).
Гидрохлорид 4-[4-{4-(3-метилбутил)пиперазин-1-ил}-3-спиро[5,5]ундец-2-ен-3-илфенил]морфолина
MS m/e (ESI) 466(MH+).
Гидрохлорид 4-[3-спиро[5,5]ундец-2-ен-3-ил-4-{4-(тетрагидропиран-4-илметил)пиперазин-1-ил}фенил]морфолина
MS m/e (ESI) 494(MH+).
Гидрохлорид 4-{4-(4-пентилпиперазин-1-ил)-3-спиро[5,5]ундец-2-ен-3-илфенил}морфолина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-(2-метоксиэтил)-4-(2-спиро[5,5]ундец-2-ен-3-илфенил)пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-{4-(2-спиро[5,5]ундец-2-ен-3-илфенил)пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 381(MH+).
Гидрохлорид 1-пропил-4-(2-спиро[5,5]ундец-3-илфенил)пиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-циклопропилметил-4-(2-спиро[5,5]ундец-3-илфенил)пиперазина
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-(3-метилбутил)-4-(2-спиро[5,5]ундец-3-илфенил)пиперазина
MS m/e (ESI) 383(MH+).
Гидрохлорид 1-бутил-4-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил}пиперазина
MS m/e (ESI) 480(MH+).
Гидрохлорид 4-[4-{4-(3-метилбутил)пиперазин-1-ил}-3-спиро[5,5]ундец-3-илфенил]морфолина
MS m/e (ESI) 468(MH+).
Гидрохлорид 4-[3-спиро[5,5]ундец-3-ил-4-{4-(тетрагидропиран-4-илметил)пиперазин-1-ил}фенил]морфолина
MS m/e (ESI) 496(MH+).
Гидрохлорид 1-{4-(4-морфолин-4-ил-2-спиро[5,5]ундец-3-илфенил)пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-(2-метоксиэтил)-4-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил}пиперазина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-бутил-4-{4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-5-ен-6-илфенил}пиперазина
MS m/e (ESI) 438(MH+).
Гидрохлорид 1-{4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-5-ен-6-илфенил}-4-пентилпиперазина
MS m/e (ESI) 452(MH+).
Гидрохлорид 4-{4-(4-изобутилпиперазин-1-ил)-3-спиро[2,5]окт-5-ен-6-илфенил}морфолина
MS m/e (ESI) 410(MH+).
Гидрохлорид 4-{4-(4-изобутилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил}морфолина
MS m/e (ESI) 412(MH+).
Гидрохлорид 4-{4-(4-пентилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил}морфолина
MS m/e (ESI) 426(MH+).
Гидрохлорид (S)-1-бутил-4-{2-(4,4-диметилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил}пиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид (R)-1-циклопропилметил-4-{2-(4,4-диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил}пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-изопропил-4-{2-(3,3,5,5-тетраметилциклогексил)фенил}пиперазина
MS m/e (ESI) 343(MH+).
Гидрохлорид 1-циклопентил-4-{2-(3,3,5,5-тетраметилциклогексил)фенил}пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-(2-циклогептилфенил)-4-пропилпиперазина
MS m/e (ESI) 301(MH+).
Гидрохлорид 1-(2-циклогептилфенил)-4-циклопропилметилпиперазина
MS m/e (ESI) 313(MH+).
Гидрохлорид 1-(2-циклогептилфенил)-4-изобутилпиперазина
MS m/e (ESI) 315(MH+).
Гидрохлорид 1-(2-циклогептилфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 1-(2-циклогепт-1-енилфенил)-4-пропилпиперазина
MS m/e (ESI) 299(MH+).
Гидрохлорид 1-(2-циклогепт-1-енилфенил)-4-циклопропилметилпиперазина
MS m/e (ESI) 311(MH+).
Гидрохлорид 1-(2-циклогепт-1-енилфенил)-4-изобутилпиперазина
MS m/e (ESI) 313(MH+).
Гидрохлорид 1-(2-циклогепт-1-енилфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-(2-циклоокт-1-енилфенил)-4-циклопропилметилпиперазина
MS m/e (ESI) 325(MH+).
Гидрохлорид 1-(2-циклооктилфенил)-4-циклопропилметилпиперазина
MS m/e (ESI) 327(MH+).
Гидрохлорид 1-циклопропилметил-4-{2-(3,3,4,4-тетраметилциклопент-1-енил)фенил}пиперазина
MS m/e (ESI) 339(MH+).
Гидрохлорид 1-бутил-4-{2-(3,3,4,4-тетраметилциклопентил)фенил}пиперазина
MS m/e (ESI) 343(MH+).
Гидрохлорид 1-циклопропилметил-4-{2-(3,3,4,4-тетраметилциклопентил)фенил}пиперазина
MS m/e (ESI) 341(MH+).
Гидрохлорид 1-пропил-4-{2-(3,3,4,4-тетраметил-циклопент-1-енил)фенил}пиперазина
MS m/e (ESI) 327(MH+).
Гидрохлорид 1-{2-(4-трет-бутилциклогексил)фенил}-4-(4,4,4-трифторбутил)пиперазина
MS m/e (ESI) 411(MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)фенил}тиоморфолина
MS m/e (ESI) 458(MH+).
Гидрохлорид 1-бутил-4-{2-(4-трет-бутилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил}пиперазина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-фуран-2-илметил-4-(2-спиро[5,5]ундец-2-ен-3-илфенил)пиперазина
MS m/e (ESI) 391(MH+).
Гидрохлорид 1-(2-спиро[5,5]ундец-2-ен-3-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 409(MH+).
Гидрохлорид 1-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил}-4-пропилпиперазина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-циклопропилметил-4-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил}пиперазина
MS m/e (ESI) 478(MH+).
Гидрохлорид 1-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил}-4-(3-метилбутил)пиперазина
MS m/e (ESI) 494(MH+).
Гидрохлорид 1-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил}-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 522(MH+).
Гидрохлорид 1-циклопентил-4-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-2-ен-3-илфенил}пиперазина
MS m/e (ESI) 492(MH+).
Гидрохлорид 4-{4-(4-Фуран-2-илметилпиперазин-1-ил)-3-спиро[5,5]ундец-2-ен-3-илфенил}морфолина
MS m/e (ESI) 476(MH+).
Гидрохлорид 1-(2-спиро[5,5]ундец-3-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 411(MH+).
Гидрохлорид 1-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил}-4-(3-метилбутил)пиперазина
MS m/e (ESI) 496(MH+).
Гидрохлорид 1-{4-(4-метоксипиперидин-1-ил)-2-спиро[5,5]ундец-3-илфенил}-4-пентилпиперазина
MS m/e (ESI) 496(MH+).
Гидрохлорид 4-{4-(4-изобутилпиперазин-1-ил)-3-спиро[5,5]ундец-3-илфенил}морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид 4-{4-(4-фуран-3-илметилпиперазин-1-ил)-3-спиро[5,5]ундец-3-илфенил}морфолина
MS m/e (ESI) 478(MH+).
Гидрохлорид 1-{4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-5-ен-6-илфенил}-4-пропилпиперазина
MS m/e (ESI) 424(MH+).
Гидрохлорид 1-циклопропилметил-4-{4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-5-ен-6-илфенил}пиперазина
MS m/e (ESI) 436(MH+).
Гидрохлорид 1-изобутил-4-{4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-5-ен-6-илфенил}пиперазина
MS m/e (ESI) 438(MH+).
Гидрохлорид 4-{4-(4-бутилпиперазин-1-ил)-3-спиро[2,5]окт-5-ен-6-илфенил}морфолина
MS m/e (ESI) 410(MH+).
Гидрохлорид 1-бутил-4-{2-(4,4-диметилциклогексил)-4-(4-изопропоксипиперидин-1-ил)фенил}пиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 4-[3-спиро[2,5]окт-6-ил-4-{4-(тетрагидропиран-4-илметил)пиперазин-1-ил}фенил]морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид (S)-1-{2-(4,4-диэтилциклогексил)-4-(3-метоксипиперидин-1-ил)фенил}-4-пентилпиперазина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-циклогексил-4-{2-(3,3,5,5-тетраметилциклогексил)фенил}пиперазина
MS m/e (ESI) 383(MH+).
Гидрохлорид 1-изобутил-4-{2-(3,3,4,4-тетраметилциклопентил)фенил}пиперазина
MS m/e (ESI) 343(MH+).
1-Бутил-4-[2-(4-трет-бутилциклогексил)-5-пиридин-3-ил-фенил]пиперазин
MS m/e (ESI) 434(MH+).
Гидрохлорид 4-[4-(4-трет-бутилциклогексил)-3-(4-пентилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид 4-{4-(4-трет-бутилциклогексил)-3-[4-(3-метилбутил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид [4-(4-трет-бутилциклогекс-1-енил)-3-(4-бутилпиперазин-1-ил)фенил]этиламина
MS m/e (ESI) 398(MH+).
Гидрохлорид 4-[3-(4,4-диметилциклогекс-1-енил)-4-(4-пентилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 426(MH+).
Гидрохлорид 4-{3-(4,4-диметилциклогекс-1-енил)-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 426(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пентилпиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-{4-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 454(MH+).
Гидрохлорид 4-[3-(4,4-диметилциклогекс-1-енил)-4-(4-фуран-3-илметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 436(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 464(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-пентилпиперазина
MS m/e (ESI) 341(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 325(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 351(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 351(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 329(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)фенил]-4-пентилпиперазина
MS m/e (ESI) 343(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогексил)фенил]пиперазина
MS m/e (ESI) 327(MH+).
Гидрохлорид 4-[3-(4,4-диметилциклогексил)-4-(4-пентилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 428(MH+).
Гидрохлорид 4-[3-(4,4-диметилциклогексил)-4-(4-фуран-2-илметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 438(MH+).
Гидрохлорид 4-[3-(4,4-диметилциклогексил)-4-(4-фуран-3-илметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 438(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пентилпиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-{4-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 456(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 329(MH+).
Гидрохлорид 1-циклобутилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид {4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-ил}ацетонитрила
MS m/e (ESI) 338(MH+).
Гидрохлорид 1-(2-Этоксиэтил)-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-циклобутилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 367(MH+).
Гидрохлорид цис-4-[3-(4,4-диметилциклогексил)-4-(4-пропилпиперазин-1-ил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 428(MH+).
Гидрохлорид цис-4-[3-(4,4-диметилциклогексил)-4-(4-пентилпиперазин-1-ил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид цис-4-{3-(4,4-диметилциклогексил)-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 484(MH+).
Гидрохлорид цис-4-[3-(4,4-диметилциклогексил)-4-(4-фуран-3-илметилпиперазин-1-ил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 466(MH+).
Гидрохлорид цис-1-{4-[2-(4,4-диметилциклогексил)-4-(2,6-диметилморфолин-4-ил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 456(MH+).
Гидрохлорид цис-4-{3-(4,4-диметилциклогексил)-4-[4-(2-метоксиэтил)пиперазин-1-ил]фенил}-2,6-диметилморфолина
MS m/e (ESI) 444(MH+).
Гидрохлорид цис-4-{3-(4,4-диметилциклогексил)-4-[4-(2-этоксиэтил)пиперазин-1-ил]фенил}-2,6-диметилморфолина
MS m/e (ESI) 458(MH+).
Гидрохлорид цис-4-[4-(4-циклобутилметилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]пиперазина
MS m/e (ESI) 398(MH+).
Гидрохлорид 1-[3-(4,4-диметилциклогексил)-4-(4-пентилпиперазин-1-ил)фенил]пиперидин-4-карбонитрила
MS m/e (ESI) 451(MH+).
Гидрохлорид 1-[3-(4,4-диметилциклогексил)-4-(4-изобутилпиперазин-1-ил)фенил]пиперидин-4-карбонитрила
MS m/e (ESI) 437(MH+).
Гидрохлорид 4-[4-(4-циклобутилметилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]морфолина
MS m/e (ESI) 426(MH+).
Гидрохлорид 1-циклобутилметил-4-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-пропилпиперазина
MS m/e (ESI) 398(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-{4-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 426(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 414(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-(2-этоксиэтил)пиперазина
MS m/e (ESI) 428(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]-4-пропилпиперазина
MS m/e (ESI) 384(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]пиперазина
MS m/e (ESI) 396(MH+).
Гидрохлорид 1-{4-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 412(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 400(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]-4-(2-этоксиэтил)пиперазина
MS m/e (ESI) 414(MH+).
Гидрохлорид 1-[4-(4-циклобутилметилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]пиперидин-4-карбонитрила
MS m/e (ESI) 449(MH+).
Гидрохлорид N-(2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}этил)ацетамида
MS m/e (ESI) 386(MH+).
1-Бутил-4-[2-(4-трет-бутилциклогексил)-5-(3,5-диметилизоксазол-4-ил)фенил]пиперазин
MS m/e (ESI) 452(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-метилфенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 4-[4-(4-трет-бутилциклогексил)-3-(4-пропилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 428(MH+).
Гидрохлорид 4-[4-(4-трет-бутилциклогексил)-3-(4-циклопропилметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид 4-{4-(4-трет-бутилциклогексил)-3-[4-(2-метоксиэтил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 444(MH+).
Гидрохлорид [4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]этиламина
MS m/e (ESI) 400(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-пиперидин-1-илфенил]пиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид 4-[4-(4-циклопропилметилпиперазин-1-ил)-3-(4,4-диметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 410(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 438(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид 4-[3-(4,4-диметилциклогекс-1-енил)-4-(4-фуран-2-илметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 436(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 464(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-ил)пиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)фенил]-4-(тетрагидропиран-4-ил)пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 4-{3-(4,4-диметилциклогексил)-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид 1-{4-[2-(4,4-диметилциклогексил)-4-морфолин-4-илфенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 428(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 428(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид цис-4-[3-(4,4-диметилциклогексил)-4-(4-изобутилпиперазин-1-ил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид цис-4-[4-(4-циклопропилметилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид цис-4-[3-(4,4-диметилциклогексил)-4-(4-фуран-2-илметилпиперазин-1-ил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 466(MH+).
Гидрохлорид цис-{4-[2-(4,4-диметилциклогексил)-4-(2,6-диметилморфолин-4-ил)фенил]пиперазин-1-ил}ацетонитрила
MS m/e (ESI) 425(MH+).
Гидрохлорид 1-[3-(4,4-диметилциклогексил)-4-(4-пропилпиперазин-1-ил)фенил]пиперидин-4-карбонитрила
MS m/e (ESI) 423(MH+).
Гидрохлорид 1-[4-(4-циклопропилметилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]пиперидин-4-карбонитрила
MS m/e (ESI) 435(MH+).
Гидрохлорид 1-[3-(4,4-диметилциклогексил)-4-(4-фуран-3-илметилпиперазин-1-ил)фенил]пиперидин-4-карбонитрила
MS m/e (ESI) 461(MH+).
Гидрохлорид 4-{3-(4,4-диметилциклогексил)-4-[4-(2-этоксиэтил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 430(MH+).
Гидрохлорид {4-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин-1-ил}ацетонитрила
MS m/e (ESI) 425(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-пентилпиперазина
MS m/e (ESI) 426(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-изобутилпиперазина
MS m/e (ESI) 412(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 436(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 436(MH+).
Гидрохлорид {4-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазин-1-ил}ацетонитрила
MS m/e (ESI) 395(MH+).
Гидрохлорид 1-циклобутилметил-4-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазина
MS m/e (ESI) 424(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]-4-пентилпиперазина
MS m/e (ESI) 412(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]-4-изобутилпиперазина
MS m/e (ESI) 398(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 422(MH+).
Гидрохлорид {4-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]пиперазин-1-ил}ацетонитрила
MS m/e (ESI) 381(MH+).
Гидрохлорид 1-циклобутилметил-4-[2-(4,4-диметилциклогексил)-4-пирролидин-1-илфенил]пиперазина
MS m/e (ESI) 410(MH+).
Гидрохлорид 1-бутил-4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-[2-метил-6-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 1-бутил-4-[2-метил-6-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-метил-6-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-[2-метил-6-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-бутил-4-[2-метил-6-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-метил-6-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-бутил-4-[5-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-[5-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-бутил-4-[3-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-циклопропилметил-4-[3-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-метокси-4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[5-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-бутил-4-[5-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-[4-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-бутил-4-[4-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-метил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-[5-фуран-3-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 409(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-фуран-3-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 421(MH+).
Гидрохлорид 1-[5-фуран-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 409(MH+).
Гидрохлорид 4-[3-(4-пропилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 428(MH+).
Гидрохлорид 4-[3-(4-циклопропилметилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид диметил[3-(4-пропилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]амина
MS m/e (ESI) 386(MH+).
Гидрохлорид [3-(4-бутилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]диметиламина
MS m/e (ESI) 400(MH+).
Гидрохлорид [3-(4-циклопропилметилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]диметиламина
MS m/e (ESI) 398(MH+).
Гидрохлорид 1-[3-(4-бутилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]этанона
MS m/e (ESI) 399(MH+).
Гидрохлорид 1-[3-(4-циклопропилметилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенил]этанона
MS m/e (ESI) 397(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-пентилпиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диэтилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-бутил-4-(2-спиро[5,5]ундец-2-ен-3-илфенил)пиперазина
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-бутил-4-(2-спиро[5,5]ундец-3-илфенил)пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 341(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)фенил]-4-(3-метилбутил)пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 353(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 357(MH+).
1-{4-[2-(4,4-Диэтилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-1-он
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-{4-[2-(4,4-диэтилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 359(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 397(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 399(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диэтилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид 4-[4-(4-циклопропилметилпиперазин-1-ил)-3-(4,4-диэтилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 438(MH+).
Гидрохлорид 4-{3-(4,4-диэтилциклогекс-1-енил)-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 482(MH+).
Гидрохлорид 4-{3-(4,4-диэтилциклогекс-1-енил)-4-[4-(2-метоксиэтил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид 4-[3-(4,4-диэтилциклогексил)-4-(4-пропилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 428(MH+).
Гидрохлорид 4-[3-(4,4-диэтилциклогексил)-4-(4-изобутилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид 4-[3-(4,4-диэтилциклогексил)-4-(4-пентилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид 4-[4-(4-циклопропилметилпиперазин-1-ил)-3-(4,4-диэтилциклогексил)фенил]морфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид 4-{3-(4,4-диэтилциклогексил)-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пентилпиперазина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 510(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 512(MH+).
Гидрохлорид 1-{4-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-{4-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 472(MH+).
Гидрохлорид 4-[3-(4,4-диэтилциклогекс-1-енил)-4-(4-фуран-2-илметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 464(MH+).
Гидрохлорид 4-[3-(4,4-диэтилциклогекс-1-енил)-4-(4-фуран-3-илметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 464(MH+).
Гидрохлорид 4-[3-(4,4-диэтилциклогексил)-4-(4-фуран-2-илметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 466(MH+).
Гидрохлорид 4-[3-(4,4-диэтилциклогексил)-4-(4-фуран-3-илметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 492(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 492(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 494(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 494(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 379(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)фенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 379(MH+).
{4-[2-(4,4-Диэтилциклогекс-1-енил)фенил]пиперазин-1-ил}морфолин-4-илметанон
MS m/e (ESI) 412(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 381(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)фенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 381(MH+).
{4-[2-(4,4-Диэтилциклогекс-1-енил)фенил]пиперазин-1-ил}пиперидин-1-илметанон
MS m/e (ESI) 410(MH+).
{4-[2-(4,4-Диэтилциклогексил)фенил]пиперазин-1-ил}пиперидин-1-илметанон
MS m/e (ESI) 412(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)фенил]-4-пентилпиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид цис-4-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диэтилциклогексил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 470(MH+).
Гидрохлорид цис-4-[3-(4,4-диэтилциклогексил)-4-(4-пентилпиперазин-1-ил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 484(MH+).
Гидрохлорид цис-4-[4-(4-циклопропилметилпиперазин-1-ил)-3-(4,4-диэтилциклогексил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид 1-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пентилпиперазина
MS m/e (ESI) 401(MH+).
Гидрохлорид 1-изобутил-4-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 387(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 385(MH+).
Гидрохлорид 1-[4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 403(MH+).
Гидрохлорид 1-бутил-4-[4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 417(MH+).
Гидрохлорид 1-[4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пентилпиперазина
MS m/e (ESI) 431(MH+).
Гидрохлорид 1-[4,5-диметокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 459(MH+).
Гидрохлорид 1-циклогептил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 397(MH+).
Гидрохлорид 1-(4-метилциклогексил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 397(MH+).
Гидрохлорид 1-(1-Этилпропил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-(тетрагидротиопиран-4-ил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 401(MH+).
Гидрохлорид цис-4-[3-(4,4-диэтилциклогексил)-4-(4-пропилпиперазин-1-ил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид 4-[5-(4,4-диэтилциклогексил)-2-метокси-4-(4-пентилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 486(MH+).
Гидрохлорид 4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)бензонитрила
MS m/e (ESI) 368(MH+).
Гидрохлорид 1-[3-Фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 359(MH+).
Гидрохлорид диметиламида транс-2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропанкарбоновой кислоты
MS m/e (ESI) 426(MH+).
Гидрохлорид 1-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}бутан-2-ола
MS m/e (ESI) 373(MH+).
Гидрохлорид транс-4-бутил-1-[2-(4-трет-бутилциклогексил)фенил]пиперазин-2-она
MS m/e (ESI) 371(MH+).
Гидрохлорид цис-4-бутил-1-[2-(4-трет-бутилциклогексил)фенил]пиперазин-2-она
MS m/e (ESI) 371(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}ацетамида
MS m/e (ESI) 358(MH+).
Гидрохлорид 4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)бензонитрила
MS m/e (ESI) 382(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-циклопропилацетамида
MS m/e (ESI) 398(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-пиперидин-1-илпропан-1-она
MS m/e (ESI) 440(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-метилацетамида
MS m/e (ESI) 372(MH+).
Гидрохлорид 3-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}пирролидин-2-она
MS m/e (ESI) 384(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-изопропилацетамида
MS m/e (ESI) 400(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-этил-N-метилацетамида
MS m/e (ESI) 400(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N,N-диэтилацетамида
MS m/e (ESI) 414(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-(2-метоксиэтил)ацетамида
MS m/e (ESI) 416(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-метилпиперазина
MS m/e (ESI) 315(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-этилпиперазина
MS m/e (ESI) 329(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-этилпиперазина
MS m/e (ESI) 327(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-циклопропилметилпиперазина
MS m/e (ESI) 353(MH+).
Гидрохлорид N-бутил-2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}ацетамида
MS m/e (ESI) 414(MH+).
Гидрохлорид 1-азокан-1-ил-2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}этанона
MS m/e (ESI) 454(MH+).
Гидрохлорид [3-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)фенил]метиламина
MS m/e (ESI) 386(MH+).
Гидрохлорид [3-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)фенил]диметиламина
MS m/e (ESI) 400(MH+).
Дигидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-пиридин-3-илфенил]пиперазин
MS m/e (ESI) 434(MH+).
Гидрохлорид [3-(4-трет-бутилциклогекс-1-енил)-4-(4-бутилпиперазин-1-ил)фенил]диметиламина
MS m/e (ESI) 398(MH+).
Гидрохлорид 1-пропил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 341(MH+).
Гидрохлорид 1-(тетрагидропиран-4-илметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 399(MH+).
Гидрохлорид 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 510(MH+).
Гидрохлорид 1-фуран-3-илметил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 492(MH+).
Гидрохлорид 1-{4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-(2-метоксиэтил)-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 512(MH+).
Гидрохлорид 1-{4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-(2-метоксиэтил)-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 472(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид 4-[4-(4-пентилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид 4-[4-(4-циклопропилметилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 438(MH+).
Гидрохлорид 4-{4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил}морфолина
MS m/e (ESI) 482(MH+).
Гидрохлорид 4-[4-(4-фуран-3-илметилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 464(MH+).
Гидрохлорид 1-{4-[4-морфолин-4-ил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 454(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид 4-[4-(4-пентилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид 4-[4-(4-циклопропилметилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид 4-{4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]-3-(3,3,5,5-тетраметилциклогексил)фенил}морфолина
MS m/e (ESI) 484(MH+).
Гидрохлорид 4-[4-(4-фуран-3-илметилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-{4-[4-морфолин-4-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 456(MH+).
Гидрохлорид 4-{4-[4-(2-метоксиэтил)пиперазин-1-ил]-3-(3,3,5,5-тетраметилциклогексил)фенил}морфолина
MS m/e (ESI) 444(MH+).
Гидрохлорид 1-[4-(4-Этоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-{4-[4-(4-Этоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 498(MH+).
Гидрохлорид 2-{4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}-N-метилацетамида
MS m/e (ESI) 485(MH+).
Гидрохлорид (R)-1-[4-(3-метоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид (R)-1-бутил-4-[4-(3-метоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид (R)-1-циклопропилметил-4-[4-(3-метоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид цис-2,6-диметил-4-[4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид цис-4-[4-(4-циклопропилметилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[4-(4-бутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]пиперидин-4-карбонитрила
MS m/e (ESI) 465(MH+).
Гидрохлорид (S)-1-[4-(3-метоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид (S)-1-бутил-4-[4-(3-метоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид (S)-1-циклопропилметил-4-[4-(3-метоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диэтилциклогексил)-4-пиперидин-1-илфенил]пиперазина
MS m/e (ESI) 438(MH+).
Гидрохлорид (R)-1-[2-(4,4-диэтилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид (R)-1-бутил-4-[2-(4,4-диметилциклогексил)-4-(3-метоксипирролидин-1-ил)фенил]пиперазина
MS m/e (ESI) 428(MH+).
Гидрохлорид (R)-1-[4-(3-этоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид (R)-1-циклопропилметил-4-[4-(3-этоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[4-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 359(MH+).
Гидрохлорид 1-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 361(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 373(MH+).
Дигидрохлорид 1-пропил-4-[4-пиридин-2-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 420(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид 4-(4-циклопропилметилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)бензонитрила
MS m/e (ESI) 380(MH+).
Гидрохлорид 1-циклопропилметил-4-[3-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 2-бутил-5-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-2,5-диазабицикло[2,2,1]гептана
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-(1-метилбутил)пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-(1-метилбутил)пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-N-циклогексилацетамида
MS m/e (ESI) 440(MH+).
Этиламид 4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-карбоновой кислоты
MS m/e (ESI) 372(MH+).
Гидрохлорид 3-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-метилпирролидин-2-она
MS m/e (ESI) 398(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-(3,3-диметилпиперидин-1-ил)этанона
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-тиофен-2-илфенил]пиперазина
MS m/e (ESI) 439(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-метилфенил]пиперазина
MS m/e (ESI) 371(MH+).
Дигидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-тиазол-2-илфенил]пиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-4-фторфенил]пиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-фторфенил]пиперазина
MS m/e (ESI) 375(MH+).
Гидрохлорид 1-пентил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-изобутил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-пентил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-изобутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 1-фуран-3-илметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 379(MH+).
Гидрохлорид 1-изобутил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пентилпиперазина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-изобутил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-фуран-3-илметил-4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 494(MH+).
Гидрохлорид 4-[4-(4-изобутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид 4-[4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 428(MH+).
Гидрохлорид 4-[4-(4-изобутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид 1-бутил-4-[4-(4-этоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-{4-[4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-[4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 426(MH+).
Гидрохлорид 1-бутил-4-[4-пиперидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид 1-[4-(4-циклопропилметилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]азепана
MS m/e (ESI) 452(MH+).
Гидрохлорид цис-4-[4-(4-бутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]-2,6-диметилморфолина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-[4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]пиперидин-4-карбонитрила
MS m/e (ESI) 451(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диэтилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-4-пиперидин-1-илфенил]-4-пропилпиперазина
MS m/e (ESI) 426(MH+).
Гидрохлорид (R)-1-бутил-4-[4-(3-этоксипирролидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-бутил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-[4-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 415(MH+).
Гидрохлорид 1-бутил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 375(MH+).
Гидрохлорид 1-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 417(MH+).
Гидрохлорид 1-[5-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 361(MH+).
Гидрохлорид 1-бутил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 375(MH+).
Гидрохлорид 1-[5-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 417(MH+).
Гидрохлорид 4-(4-бутилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)бензонитрила
MS m/e (ESI) 382(MH+).
Гидрохлорид 4-[4-(Тетрагидропиран-4-илметил)пиперазин-1-ил]-3-(3,3,5,5-тетраметилциклогексил)бензонитрила
MS m/e (ESI) 424(MH+).
Дигидрохлорид 1-(тетрагидропиран-4-илметил)-4-[2-(3,3,5,5-тетраметилциклогексил)-4-тиазол-2-илфенил]пиперазина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-бутил-4-[3-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид метиламида 2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропанкарбоновой кислоты
MS m/e (ESI) 412(MH+).
Гидрохлориддиметиламида цис-2-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропанкарбоновой кислоты
MS m/e (ESI) 426(MH+).
Гидрохлорид 1-(1-метилциклопропилметил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 343(MH+).
Гидрохлорид 1-бутил-4-[2-(3,5-диметилциклогексил)фенил]пиперазина
MS m/e (ESI) 329(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трифторметилциклогексил)фенил]пиперазина
MS m/e (ESI) 369(MH+).
1-{4-[2-(4-Трет-бутилциклогексил)фенил]пиперазин-1-ил}бутан-1-он
MS m/e (ESI) 393(MNa+).
Гидрохлорид 1-бутил-4-[2-(4-фенилциклогексил)фенил]пиперазина
MS m/e (ESI) 377(MH+).
Гидрохлорид метилового эфира 3-[4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]пропионовой кислоты
MS m/e (ESI) 443(MH+).
Гидрохлорид этилового эфира [4-(4-трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенокси]уксусной кислоты
MS m/e (ESI) 459(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)-4-пиперидин-1-илфенил]-4-циклопропилметилпиперазина
MS m/e (ESI) 438(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)-4-пиперидин-1-илфенил]-4-пропилпиперазина
MS m/e (ESI) 426(MH+).
Гидрохлорид 4-[4-(4-трет-бутилциклогексил)-5-(4-бутилпиперазин-1-ил)-2-метоксифенил]морфолина
MS m/e (ESI) 472(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-метокси-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 500(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-(4-этоксипиперидин-1-ил)-5-метоксифенил]пиперазина
MS m/e (ESI) 514(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)-5-метокси-4-(4-метоксипиперидин-1-ил)фенил]-4-циклопропилметилпиперазина
MS m/e (ESI) 498(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]пиперазина
MS m/e (ESI) 385(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диэтилциклогексил)-5-метоксифенил]пиперазина
MS m/e (ESI) 387(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогексил)-5-метоксифенил]-4-пропилпиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид 1-бутил-4-[5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 385(MH+).
Гидрохлорид 1-[5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-[5-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид 4-[5-(4,4-диэтилциклогексил)-2-метокси-4-(4-пропилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 458(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)-5-метоксифенил]пиперазина
MS m/e (ESI) 359(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]-4-пропилпиперазина
MS m/e (ESI) 343(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-5-метоксифенил]-4-пропилпиперазина
MS m/e (ESI) 345(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]пиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогексил)-5-метоксифенил]пиперазина
MS m/e (ESI) 357(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 399(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-5-метоксифенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 401(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]-4-пентилпиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 383(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 385(MH+).
Гидрохлорид 1-бутил-4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазина
MS m/e (ESI) 353(MH+).
Гидрохлорид 1-циклопропилметил-4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазина
MS m/e (ESI) 351(MH+).
Гидрохлорид 1-циклопропилметил-4-(2-спиро[4,5]дец-8-илфенил)пиперазина
MS m/e (ESI) 353(MH+).
Гидрохлорид 1-(2-спиро[4,5]дец-7-ен-8-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 395(MH+).
Гидрохлорид 1-[4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазин-1-ил]бутан-2-она
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-[4-(2-спиро[4,5]дец-8-илфенил)пиперазин-1-ил]бутан-2-она
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-{4-[2-(4,4-диметилциклогекс-1-енил)-5-метоксифенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 371(MH+).
Гидрохлорид [2-метокси-4-(4-пропилпиперазин-1-ил)-5-(3,3,5,5-тетраметилциклогексил)фенил]диметиламина
MS m/e (ESI) 416(MH+).
Гидрохлорид 4-[4-(4-пропилпиперазин-1-ил)-3-спиро[4,5]дец-7-ен-8-илфенил]морфолина
MS m/e (ESI) 424(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-спиро[4,5]дец-7-ен-8-илфенил]морфолина
MS m/e (ESI) 438(MH+).
Гидрохлорид 4-[4-(4-циклопропилметилпиперазин-1-ил)-3-спиро[4,5]дец-7-ен-8-илфенил]морфолина
MS m/e (ESI) 436(MH+).
Гидрохлорид 4-{3-спиро[4,5]дец-7-ен-8-ил-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 480(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-спиро[4,5]дец-8-илфенил]морфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид 4-[4-(4-циклопропилметилпиперазин-1-ил)-3-спиро[4,5]дец-8-илфенил]морфолина
MS m/e (ESI) 438(MH+).
Гидрохлорид 4-{3-спиро[4,5]дец-8-ил-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-[4-(4-морфолин-4-ил-2-спиро[4,5]дец-8-илфенил)пиперазин-1-ил]бутан-2-она
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-7-ен-8-илфенил]-4-пропилпиперазина
MS m/e (ESI) 452(MH+).
Гидрохлорид 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-7-ен-8-илфенил]пиперазина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-7-ен-8-илфенил]-4-пентилпиперазина
MS m/e (ESI) 480(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-7-ен-8-илфенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 508(MH+).
Гидрохлорид 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-8-илфенил]пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-8-илфенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 510(MH+).
Гидрохлорид 1-{4-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-8-илфенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 482(MH+).
Гидрохлорид [2-метокси-4-(4-пентилпиперазин-1-ил)-5-(3,3,5,5-тетраметилциклогексил)фенил]диметиламина
MS m/e (ESI) 444(MH+).
Гидрохлорид [4-(4-циклопропилметилпиперазин-1-ил)-2-метокси-5-(3,3,5,5-тетраметилциклогексил)фенил]диметиламина
MS m/e (ESI) 428(MH+).
Гидрохлорид [2-метокси-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]-5-(3,3,5,5-тетраметилциклогексил)фенил]диметиламина
MS m/e (ESI) 472(MH+).
Гидрохлорид 1-циклопропилметил-4-(4-пиперидин-1-ил-2-спиро[4,5]дец-8-илфенил)пиперазина
MS m/e (ESI) 436(MH+).
Гидрохлорид 1-пропил-4-(4-пирролидин-1-ил-2-спиро[4,5]дец-8-илфенил)пиперазина
MS m/e (ESI) 410(MH+).
Гидрохлорид 1-циклопропилметил-4-(4-пирролидин-1-ил-2-спиро[4,5]дец-8-илфенил)пиперазина
MS m/e (ESI) 422(MH+).
Гидрохлорид 1-[5-метокси-4-пирролидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид цис-2,6-диметил-4-[4-(4-пропилпиперазин-1-ил)-3-спиро[4,5]дец-8-илфенил]морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид цис-4-[4-(4-бутилпиперазин-1-ил)-3-спиро[4,5]дец-8-илфенил]-2,6-диметилморфолина
MS m/e (ESI) 468(MH+).
Гидрохлорид цис-4-[4-(4-циклопропилметилпиперазин-1-ил)-3-спиро[4,5]дец-8-илфенил]-2,6-диметилморфолина
MS m/e (ESI) 466(MH+).
Гидрохлорид 4-[2-Этокси-4-(4-пентилпиперазин-1-ил)-5-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 498(MH+).
Гидрохлорид 4-[2-Этокси-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]-5-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]морфолина
MS m/e (ESI) 526(MH+).
Гидрохлорид 4-[2-этокси-4-(4-пропилпиперазин-1-ил)-5-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 472(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 352(MH+).
Гидрохлорид 1-пропил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 342(MH+).
Гидрохлорид 1-пропил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина
MS m/e (ESI) 340(MH+).
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина
MS m/e (ESI) 354(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина
MS m/e (ESI) 352(MH+).
Гидрохлорид 1-(2-фторэтил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 346(MH+).
Гидрохлорид 1-(3-фторпропил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 360(MH+).
Гидрохлорид 1-(4-фторбутил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 374(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 366(MH+).
Гидрохлорид 1-бутил-4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 370(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 368(MH+).
Гидрохлорид 4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропил-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 358(MH+).
Гидрохлорид 1-бутил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 372(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 370(MH+).
Гидрохлорид 4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропилпиперидина
MS m/e (ESI) 360(MH+).
Гидрохлорид 1-бутил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 374(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 372(MH+).
Гидрохлорид 1-пропил-3-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пирролидина
MS m/e (ESI) 326(MH+).
Гидрохлорид 1-бутил-3-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пирролидина
MS m/e (ESI) 340(MH+).
Гидрохлорид 1-циклопропилметил-3-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пирролидина
MS m/e (ESI) 338(MH+).
Гидрохлорид 1-пропил-3-[2-(3,3,5,5-тетраметилциклогексил)фенил]пирролидина
MS m/e (ESI) 328(MH+).
Гидрохлорид 1-бутил-3-[2-(3,3,5,5-тетраметилциклогексил)фенил]пирролидина
MS m/e (ESI) 342(MH+).
Гидрохлорид 1-циклопропилметил-3-[2-(3,3,5,5-тетраметилциклогексил)фенил]пирролидина
MS m/e (ESI) 340(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперидина
MS m/e (ESI) 370(MH+).
Гидрохлорид 4-[5-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропилпиперидина
MS m/e (ESI) 360(MH+).
Гидрохлорид 1-циклопропилметил-4-[5-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 372(MH+).
Гидрохлорид 1-пропил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]азепана
MS m/e (ESI) 354(MH+).
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]азепана
MS m/e (ESI) 368(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]азепана
MS m/e (ESI) 366(MH+).
Гидрохлорид 1-пропил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]азепана
MS m/e (ESI) 356(MH+).
Гидрохлорид 1-бутил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]азепана
MS m/e (ESI) 370(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]азепана
MS m/e (ESI) 368(MH+).
Гидрохлорид 4-[3-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропил-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 358(MH+).
Гидрохлорид 1-циклопропилметил-4-[3-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]1,2,3,6-тетрагидропиридина
MS m/e (ESI) 370(MH+).
Гидрохлорид 4-[3-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-1-пропилпиперидина
MS m/e (ESI) 360(MH+).
Гидрохлорид 1-бутил-4-[3-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 374(MH+).
Гидрохлорид 1-циклопропилметил-4-[3-фтор-2-(3,3,5,5-тетраметилциклогексил)фенилпиперидина
MS m/e (ESI) 372(MH+).
Гидрохлорид 1-бутил-4-[2-фтор-6-(3,3,5,5-тетраметилциклогексил)фенил)пиперидина
MS m/e (ESI) 374(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 355(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-5-фторфенил]пиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-трифторметилфенил]пиперазина
MS m/e (ESI) 425(MH+).
Гидрохлорид 1-бутил-4-[5-трет-бутил-2-(4-трет-бутилциклогексил)фенил]пиперазина
MS m/e (ESI) 413(MH+).
[4-(4-Трет-бутилциклогексил)-3-(4-бутилпиперазин-1-ил)фенил]уксусная кислота
MS m/e (ESI) 413(M-).
1-[4-[2-(4-Трет-бутилциклогекс-1-енил)фенил]пиперазин-1-ил]бутан-1-он
MS m/e (ESI) 391(MNa+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогекс-1-енил)фенил]пиперазин-1-ил}-N,N-диметилацетамида
MS m/e (ESI) 384(MH+).
1-[2-(4-Трет-бутилциклогексил)фенил]-4-(пропан-1-сульфонил)пиперазин
MS m/e (ESI) 429(MNa+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-фенилэтанона
MS m/e (ESI) 419(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-4-пиперидин-1-илфенил]пиперазина
MS m/e (ESI) 438(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4-пиперидин-1-илфенил]пиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-метокси-4-пиперидин-1-илфенил]пиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 4-[5-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)-2-метоксифенил]-2,6-цис-диметилморфолина
MS m/e (ESI) 500(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)-4-(пиперидин-1-ил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 482(MH+).
1-{4-[2-(4-Трет-бутилциклогексил)-5-метокси-4-(4-метоксипиперидин-1-ил)фенил]пиперазин-1-ил}бутан-1-он
MS m/e (ESI) 514(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)-5-метокси-4-(4-метоксипиперидин-1-ил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 542(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)-5-метокси-4-(4-метоксипиперидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 486(MH+).
Гидрохлорид 1-[2-(4,4-диэтилциклогекс-1-енил)-5-метоксифенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 427(MH+).
Гидрохлорид [5-(4,4-диэтилциклогексил)-2-метокси-4-(4-пропилпиперазин-1-ил)фенил]диметиламина
MS m/e (ESI) 416(MH+).
Гидрохлорид 1-[5-метокси-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пентилпиперазина
MS m/e (ESI) 399(MH+).
Гидрохлорид 1-[5-метокси-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пентилпиперазина
MS m/e (ESI) 401(MH+).
Гидрохлорид 1-пентил-4-(2-спиро[4,5]дец-7-ен-8-илфенил)пиперазина
MS m/e (ESI) 367(MH+).
Гидрохлорид 1-пентил-4-(2-спиро[4,5]дец-8-илфенил)пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-{4-[2-(4,4-диметилциклогексил)-5-метоксифенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 373(MH+).
Гидрохлорид 1-[4-(4-морфолин-4-ил-2-спиро[4,5]дец-7-ен-8-илфенил)пиперазин-1-ил]бутан-2-она
MS m/e (ESI) 452(MH+).
Гидрохлорид 4-[4-(4-пропилпиперазин-1-ил)-3-спиро[4,5]дец-8-илфенил]морфолина
MS m/e (ESI) 426(MH+).
Гидрохлорид 4-[4-(4-пентилпиперазин-1-ил)-3-спиро[4,5]дец-8-илфенил]морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-7-ен-8-илфенил]пиперазина
MS m/e (ESI) 464(MH+).
Гидрохлорид 1-{4-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-7-ен-8-илфенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 480(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-8-илфенил]-4-пентилпиперазина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[4,5]дец-8-илфенил]пиперазина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-бутил-4-(4-пиперидин-1-ил-2-спиро[4,5]дец-8-илфенил)пиперазина
MS m/e (ESI) 438(MH+).
Гидрохлорид 1-(4-пиперидин-1-ил-2-спиро[4,5]дец-8-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 480(MH+).
Гидрохлорид 1-(4-пирролидин-1-ил-2-спиро[4,5]дец-8-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 466(MH+).
Гидрохлорид 1-бутил-4-[5-метокси-4-пирролидин-1-ил-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид цис-2,6-диметил-4-{3-спиро[4,5]дец-8-ил-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 510(MH+).
Гидрохлорид 4-[2-Этокси-4-(4-пентилпиперазин-1-ил)-5-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 500(MH+).
Гидрохлорид 4-[4-(4-циклопропилметилпиперазин-1-ил)-2-этокси-5-(3,3,5,5-тетраметилциклогексил)фенил]морфолина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-пропил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)-5-трифторметилфенил]пиперазина
MS m/e (ESI) 409(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)-5-трифторметилфенил]пиперазина
MS m/e (ESI) 421(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)-5-трифторметилфенил]пиперазина
MS m/e (ESI) 423(MH+).
Гидрохлорид 1-пропил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 340(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперидина
MS m/e (ESI) 354(MH+).
Гидрохлорид 1-бутил-4-[4-метил-2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 368(MH+).
Гидрохлорид 4-[5-фтор-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-1-пропилпиперидина
MS m/e (ESI) 358(MH+).
Гидрохлорид 1-бутил-4-[3-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 372(MH+).
Гидрохлорид 1-бутил-4-[2-фтор-6-(3,3,5,5-тетраметилциклогексил)фенил]-1,2,3,6-тетрагидропиридина
MS m/e (ESI) 372(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-4,5-диметоксифенил]пиперазина
MS m/e (ESI) 417(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-6-метоксифенил]пиперазина
MS m/e (ESI) 387(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-5-метоксифенил]пиперазина
MS m/e (ESI) 385(MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-этоксифенил]пиперазина
MS m/e (ESI) 401(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 313(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)фенил]пиперазина
MS m/e (ESI) 329(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 315(MH+).
1-{4-[2-(4,4-Диметилциклогексил)фенил]пиперазин-1-ил}бутан-1-он
MS m/e (ESI) 343(MH+).
Гидрохлорид 1-бутил-4-(2-циклогекс-1-енилфенил)пиперазина
MS m/e (ESI) 299(MH+).
Гидрохлорид {4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}ацетонитрила
MS m/e (ESI) 340(MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогекс-1-енил)-4-морфолин-4-илфенил]пиперазин-1-ил}-N-этилацетамида
MS m/e (ESI) 469(MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-(4-пентилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогекс-1-енил)-4-(4-пропилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 426(MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-(4-пропилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 428(MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогексил)-4-[4-(3-метилбутил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 456(MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогексил)-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 484(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-(2-этоксиэтил)пиперазина
MS m/e (ESI) 373(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-(2-этоксиэтил)пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогекс-1-енил)-4-[4-(3-метилбутил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогекс-1-енил)-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-(тетрагидрофуран-3-илметил)пиперазина
MS m/e (ESI) 385(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 397(MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]пиперазина
MS m/e (ESI) 412(MH+).
Гидрохлорид [4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]диметиламина
MS m/e (ESI) 372(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 371(MH+).
Гидрохлорид 1-пропил-4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазина
MS m/e (ESI) 311(MH+).
Гидрохлорид 1-циклопропилметил-4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазина
MS m/e (ESI) 323(MH+).
Гидрохлорид 1-пропил-4-(2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 313(MH+).
Гидрохлорид 1-циклопропилметил-4-(2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 325(MH+).
Гидрохлорид 1-(2-спиро[2,5]окт-6-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 369(MH+).
Гидрохлорид 1-бутил-4-(2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 327(MH+).
Гидрохлорид 1-[4-(2-спиро[2,5]окт-6-илфенил)пиперазин-1-ил]бутан-2-она
MS m/e (ESI) 341(MH+).
Гидрохлорид 1-пентил-4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазина
MS m/e (ESI) 339(MH+).
Гидрохлорид 1-пентил-4-(2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 341(MH+).
Гидрохлорид 1-бутил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-6-илфенил]пиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид 1-бутил-4-[4-(4-этоксипиперидин-1-ил)-2-спиро[2,5]окт-6-илфенил]пиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-бутил-4-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 410(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]-4-пентилпиперазина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]-4-пропилпиперазина
MS m/e (ESI) 442(MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 498(MH+).
Гидрохлорид 1-бутил-4-(4-пирролидин-1-ил-2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 396(MH+).
Гидрохлорид 1-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)-4-пропилпиперазина
MS m/e (ESI) 396(MH+).
Гидрохлорид 1-циклопропилметил-4-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 408(MH+).
Гидрохлорид 1-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 452(MH+).
Гидрохлорид 1-(2-Этоксиэтил)-4-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 426(MH+).
Гидрохлорид 1-(2-метоксиэтил)-4-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 412(MH+).
Гидрохлорид 1-циклобутилметил-4-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 468(MH+).
Гидрохлорид цис-2,6-диметил-4-[4-(4-пентилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил]морфолина
MS m/e (ESI) 454(MH+).
Гидрохлорид цис-4-[4-(4-бутилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил]-2,6-диметилморфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид цис-4-[4-(4-циклопропилметилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил]-2,6-диметилморфолина
MS m/e (ESI) 438(MH+).
Гидрохлорид цис-2,6-диметил-4-{3-спиро[2,5]окт-6-ил-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 482(MH+).
Гидрохлорид 1-[4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-6-илфенил]-4-пентилпиперазина
MS m/e (ESI) 454(MH+).
Гидрохлорид 1-бутил-4-(2-циклопент-1-енилфенил)пиперазина
MS m/e (ESI) 285(MH+).
Гидрохлорид 2-метил-1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил}пропан-2-ола
MS m/e (ESI) 373(MH+).
Этиловый эфир 4-[2-(4,4-диметилциклогекс-1-енил)фенил]пиперазин-1-карбоновой кислоты
MS m/e (ESI) 343(MH+).
1-{4-[2-(4,4-Диметилциклогекс-1-енил)фенил]пиперазин-1-ил}бутан-1-он
MS m/e (ESI) 341(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-циклогекс-1-енилфенил]морфолина
MS m/e (ESI) 384(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 331(MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогексил)-4-[4-(4,4,4-трифторбутил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 496(MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогекс-1-енил)-4-[4-(4,4,4-трифторбутил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 494(MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-(4-изобутилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 442(MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-(4-циклогексилметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 482(MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогексил)-4-[4-(2-этилбутил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 470(MH+).
Гидрохлорид 1-[4-(2-спиро[2,5]окт-5-ен-6-илфенил)пиперазин-1-ил]бутан-2-она
MS m/e (ESI) 339(MH+).
Гидрохлорид 4-[4-(4-бутилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил]морфолина
MS m/e (ESI) 412(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]-4-изобутилпиперазина
MS m/e (ESI) 456(MH+).
Гидрохлорид 1-пентил-4-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 424(MH+).
Гидрохлорид 1-изобутил-4-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 410(MH+).
Гидрохлорид 1-циклобутилметил-4-(4-пиперидин-1-ил-2-спиро[2,5]окт-6-илфенил)пиперазина
MS m/e (ESI) 422(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]-4-(2-этоксиэтил)пиперазина
MS m/e (ESI) 472(MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-(4-этоксипиперидин-1-ил)фенил]-4-(2-метоксиэтил)пиперазина
MS m/e (ESI) 458(MH+).
Гидрохлорид цис-2,6-диметил-4-[4-(4-пропилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил]морфолина
MS m/e (ESI) 426(MH+).
Гидрохлорид цис-4-[4-(4-изобутилпиперазин-1-ил)-3-спиро[2,5]окт-6-илфенил]-2,6-диметилморфолина
MS m/e (ESI) 440(MH+).
Гидрохлорид 1-изобутил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-6-илфенил]пиперазина
MS m/e (ESI) 440(MH+).
Гидрохлорид 1-циклопропилметил-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-6-илфенил]пиперазина
MS m/e (ESI) 438(MH+).
Гидрохлорид 1-4-[4-(4-метоксипиперидин-1-ил)-2-спиро[2,5]окт-6-илфенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 482(MH+).
1-(4-Бром-2-спиро[2,5]окт-6-илфенил)-4-бутилпиперазин
MS m/e (ESI) 405(MH+).
Гидрохлорид 1-бутил-4-(2-циклопентилфенил)пиперазина
MS m/e (ESI) 287(MH+).
Гидрохлорид 1-(2-циклопентилфенил)-4-пропилпиперазина
MS m/e (ESI) 273(MH+).
Гидрохлорид 1-(2-циклопентилфенил)-4-циклопропилметилпиперазина
MS m/e (ESI) 285(MH+).
1-[4-{2-(4-Трет-бутилциклогексил)фенил}пиперазин-1-ил]-2-циклогексилэтанон
MS m/e (ESI) 425(MH+).
Гидрохлорид 2-[4-{2-(4,4-диметилциклогексил)фенил}пиперазин-1-ил]циклогексанона
MS m/e (ESI) 369(MH+).
Гидрохлорид 3-[4-{2-(4-трет-бутилциклогексил)фенил}пиперазин-1-ил]пиперидин-2-она
MS m/e (ESI) 398(MH+).
Гидрохлорид 2-[4-{2-(4-трет-бутилциклогексил)фенил}пиперазин-1-ил]-N-(2-фторэтил)ацетамида
MS m/e (ESI) 404 (MH+).
Гидрохлорид 4-{3-(4-трет-бутилциклогексил)-4-[4-(2-метоксиэтил)пиперазин-1-ил]фенил}морфолина
MS m/e (ESI) 444 (MH+).
Гидрохлорид 2-{4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил}-1-фенилэтанола
MS m/e (ESI) 421 (MH+).
Гидрохлорид 1-{4-[2-(4-трет-бутилциклогекс-1-енил)-4-морфолин-4-илфенил]пиперазин-1-ил}бутан-2-она
MS m/e (ESI) 454 (MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогекс-1-енил)-4-(4-циклопропилметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 438 (MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-4-(2,5-диметилпиррол-1-ил)фенил]пиперазина
MS m/e (ESI) 448 (MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-[4-[2-(тетрагидропиран-4-ил)этил]пиперазин-1-ил]фенил]морфолина
MS m/e (ESI) 498 (MH+).
Гидрохлорид 1-[4-бром-2-(4-трет-бутилциклогексил)фенил]-4-бутилпиперазина
MS m/e (ESI) 435 (MH+).
Гидрохлорид 4-[5-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)-2-метоксифенил]морфолина
MS m/e (ESI) 472 (MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-[4-(2-этилбутил)пиперазин-1-ил]фенил]морфолина
MS m/e (ESI) 470 (MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогекс-1-енил)-4-(4-изобутилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 440 (MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-(3-метилбутил)пиперазина
MS m/e (ESI) 371 (MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 399 (MH+).
Гидрохлорид 1-{2-(4-трет-бутилциклогексил)фенил}-4-(3-метилсульфанилпропил)пиперазина
MS m/e (ESI) 389 (MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-тиофен-3-илметилпиперазина
MS m/e (ESI) 397 (MH+).
Гидрохлорид 4-[5-(4-трет-бутилциклогексил)-2-метокси-4-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил]морфолина
MS m/e (ESI) 514 (MH+).
Дигидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-(4-бутилпиперазин-1-ил)фенил]-1-метилпиперазина
MS m/e (ESI) 455 (MH+).
Гидрохлорид 4-[4-(4-трет-бутилциклогексил)-3-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]фенил]морфолина
MS m/e (ESI) 484 (MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогексил)-4-(4-циклопентилметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 468 (MH+).
Гидрохлорид 4-[3-(4-трет-бутилциклогекс-1-енил)-4-(4-циклопентилметилпиперазин-1-ил)фенил]морфолина
MS m/e (ESI) 466 (MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогексил)фенил]-4-циклопентилметилпиперазина
MS m/e (ESI) 383 (MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)-4-(4-метилпиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 426 (MH+).
Гидрохлорид 1-[2-(4-трет-бутилциклогекс-1-енил)фенил]-4-пентилпиперазина
MS m/e (ESI) 369 (MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогекс-1-енил)-5-пирролидин-1-илфенил]пиперазина
MS m/e (ESI) 424 (MH+).
Гидрохлорид 1-бутил-4-[2-(4-трет-бутилциклогексил)-5-пирролидин-1-илфенил]пиперазина
MS m/e (ESI) 426 (MH+).
Гидрохлорид 1-бутил-4-[2-(4,4-диметилциклогексил)-4-(3,3-диметилпиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 440 (MH+).
Гидрохлорид 1-(2-спиро[5,5]ундец-2-ен-3-илфенил)-4-(тетрагидропиран-4-илметил)пиперазина
MS m/e (ESI) 409 (MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]пиперазина
MS m/e (ESI) 438 (MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогекс-1-енил)-4-(4-метоксипиперидин-1-ил)фенил]-4-фуран-2-илметилпиперазина
MS m/e (ESI) 464 (MH+).
Гидрохлорид N-этил-2-[4-[4-(4-метоксипиперидин-1-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-ил]ацетамида
MS m/e (ESI) 499 (MH+).
[4-[2-(4,4-Диэтилциклогексил)фенил]пиперазин-1-ил]морфолин-4-илметанон
MS m/e (ESI) 414 (MH+).
Гидрохлорид 1-[4-(4-пропилпиперазин-1-ил)-3-(3,3,5,5-тетраметилциклогексил)фенил]азепана
MS m/e (ESI) 440 (MH+).
Гидрохлорид 1-[4-(4-бутилпиперазин-1-ил)-3-(4,4-диметилциклогексил)фенил]азокана
MS m/e (ESI) 440 (MH+).
Гидрохлорид 1-[2-(4,4-диметилциклогексил)-4-пиперидин-1-илфенил]-4-фуран-3-илметилпиперазина
MS m/e (ESI) 436 (MH+).
Гидрохлорид 1-[4-{2-(4-этилциклогекс-3-енил)-4-морфолин-4-илфенил}пиперазин-1-ил]бутан-2-она
MS m/e (ESI) 426 (MH+).
Гидрохлорид 1-[4-(4-бромпиперидин-1-ил)-2-(4,4-диэтилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 504 (MH+).
Гидрохлорид 1-циклопропилметил-4-[4-фтор-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 373 (MH+).
Гидрохлорид 1-циклопропилметил-4-[4-[1,3,4]оксадиазол-2-ил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]пиперазина
MS m/e (ESI) 421 (MH+).
Гидрохлорид 1-циклогексилметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 397 (MH+).
Гидрохлорид 1-(2-этилбутил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 385 (MH+).
Гидрохлорид 1-[5-[1,3,4]оксадиазол-2-ил-2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-4-пропилпиперазина
MS m/e (ESI) 409 (MH+).
Гидрохлорид 1-метил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 315 (MH+).
Гидрохлорид 1-этил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 329 (MH+).
Гидрохлорид 1-пиридин-4-илметил-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 392 (MH+).
Гидрохлорид 3-(4-пропилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенола
MS m/e (ESI) 359 (MH+).
Гидрохлорид 3-(4-бутилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенола
MS m/e (ESI) 373 (MH+).
Гидрохлорид 3-(4-циклопропилметилпиперазин-1-ил)-4-(3,3,5,5-тетраметилциклогексил)фенола
MS m/e (ESI) 371 (MH+).
Дигидрохлорид 1-циклопропилметил-4-[4-(6-метоксипиридин-2-ил)-2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 462 (MH+).
Гидрохлорид 2-[4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил]циклопропанкарбоновой кислоты
MS m/e (ESI) 399 (MH+).
Гидрохлорид 1-(2-метансульфонилэтил)-4-{2-(3,3,5,5-тетраметилциклогексил)фенил}пиперазина
MS m/e (ESI) 407 (MH+).
Гидрохлорид 1-циклопропилметил-4-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-[1,4]диазепана
MS m/e (ESI) 367 (MH+).
Гидрохлорид 1-[2-(3,3,5,5-тетраметилциклогексил)фенил]-4-(3,3,3-трифторпропил)пиперазина
MS m/e (ESI) 397 (MH+).
Дигидрохлорид метил-[2-[4-{2-(3,3,5,5-тетраметилциклогексил)фенил}пиперазин-1-ил]этил]амина
MS m/e (ESI) 358 (MH+).
Дигидрохлорид диметил-{2-[4-{2-(3,3,5,5-тетраметилциклогексил)фенил}пиперазин-1-ил]этил}амина
MS m/e (ESI) 372 (MH+).
Гидрохлорид 2-пропил-5-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-2,5-диазабицикло[2,2,1]гептан
MS m/e (ESI) 353 (MH+).
Гидрохлорид 2-циклопропилметил-5-[2-(3,3,5,5-тетраметилциклогекс-1-енил)фенил]-2,5-диазабицикло[2,2,1]гептана
MS m/e (ESI) 365 (MH+).
Гидрохлорид 1-{4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазин-1-илметил}циклопропанола
MS m/e (ESI) 371 (MH+).
Гидрохлорид 1-(тетрагидропиран-4-ил)-4-[2-(3,3,5,5-тетраметилциклогексил)фенил]пиперазина
MS m/e (ESI) 385 (MH+).
Гидрохлорид 1-[4-фторметил-2-(3,3,5,5-тетраметилциклогексил)фенил]-4-пропилпиперазина
MS m/e (ESI) 375 (MH+).
Гидрохлорид 1-(тетрагидропиран-4-илметил)-4-[2-(3,3,4,4-тетраметилциклопент-1-енил)фенил]пиперазина
MS m/e (ESI) 383 (MH+).
Дигидрохлорид 2-[4-[2-(4-трет-бутилциклогексил)фенил]пиперазин-1-ил]-N-пиридин-2-илацетамида
MS m/e (ESI) 435 (MH+).
[0474]
(Тестовый пример 1) Оценка соединений в системе адгезии клеток Jurkat
<Иммобилизация человеческого фибронектина в 96-луночной плашке>
Человеческий фибронектин (Becton Dickinson Biosciences) разбавляли физиологическим раствором, забуференным фосфатом (здесь сокращенно PBS; Sigma) до 0,1-0,01 мкг/мл, и разбавленный раствор добавляли в 96-луночную плашку (Becton Dickinson) в количестве 50 мкл/лунка, и оставляли на ночь при 4°C. На следующий день из плашки удаляли супернатант и затем добавляли PBS, содержащий 1% альбумин бычьей сыворотки (здесь сокращенно BSA; Sigma) в количестве 100 мкл/лунка и проводили инкубацию при 37°C в течение 2 часов в CO2-инкубаторе (Hirasawa).
<Анализ адгезии>
Супернатант удаляли из каждой плашки и клетки Jurkat, суспендированные в RPMI-1640 (Sigma), содержащем 1 мг/мл BSA, добавляли в количестве 80 мкл/лунка с расчетом 2,5 x 105 клеток/лунка. Соединение, разбавленное до различных концентраций в RPMI-1640, содержащем 1 мг/мл BSA, добавляли непосредственно в количестве 10 мкл/лунка и затем добавляли 100 нМ форбол миристатацетата (здесь сокращенно PMA; Sigma) в RPMI-1640, содержащем 1 мг/мл BSA в количетстве 10 мкл/лунка и плашку инкубировали в CO2 инкубаторе при 37°C в течение 45-60 минут. Супернатант удаляли из плашки и каждую лунку промывали несколько раз с помощью 100 мкл/лунка RPMI-1640, после чего 50 мМ цитратного буфера (pH 5,0), содержащего 3,75 мМ п-нитрофенол-N-ацетил-β-D-глюкозаминида (Sigma) и 0,25% Triton X-100 (Sigma), добавляли в количестве 60 мкл/лунка и смесь помещали в CO2-инкубатор и инкубировали при 37°C в течение 45 минут. После инкубирования добавляли 50 мМ буфера глицина (pH 10,4), содержащего 5 мМ EDTA, в количестве 90 мкл/лунка, и абсорбцию при 405 нм измеряли с помощью автоматического планшет-ридера EL340 (BIO-TEK) для определения количества адгезированных клеток. Концентрацию каждого соединения, при которой происходило увеличение числа адгезированных клеток путем PMA-стимуляция на 50%, записывали как IC50 (мкМ).
(Тестовый пример 2) Оценка соединений в системе адгезии нейтрофилов периферической крови человека
<Получение нейтрофилов периферической крови человека >
В пластиковые пробирки для центрифугирования, содержащие 100 единиц гепарина натрия (Shimizu Pharmaceutical), добавляли 25 мл свежей крови взятой у здорового человека. После добавления 8 мл физиологического раствора (Otsuka Pharmaceutical), содержащего 6% декстран (Nacalai) и смешивания смесь оставляли при комнатной температуре в течение 45 минут для осаждения эритроцитов. Полученный супернатант переносили в другую пластиковую пробирку для центрифугирования и объединяли с эквивалентным объемом физиологического раствора, забуференного фосфатом (здесь приводится аббревиатура PBS; Sigma), и затем центрифугировали при 1600 об/мин в течение 7 минут при комнатной температуре. Полученную гематоцитарную фракцию суспендировали в 4 мл PBS и суспензию наслаивали на 4 мл Filcoll-PaqueTM PLUS (Amersham Biosciences). Полученную двуслойную жидкость центрифугировали при 2000 об/мин в течение 30 минут при комнатной температуре, после чего супернатант удаляли, и осадок суспендировали в 10 мл PBS и центрифугировали при 1200 об/мин в течение 7 минут и супернатант удаляли. Полученный осадок снова суспендировали в 0,5 мл PBS и затем добавляли 10 мл дистиллированной воды (Otsuka Pharmaceutical), немедленно добавляли 0,5 мл водного раствора, содержащего 3M NaCl, для поддержания изотоничности, смесь центрифугировали при 1200 об/мин в течение 7 минут и полученный осадок снова суспендировали в PBS, содержащем 1 мг/мл альбумина бычей сыворотки (здесь приводится аббревиатура BSA; Sigma), и перед использованием в эксперименте хранили во льду.
<Флуоресцентное мечение нейтрофилов периферической крови>
Полученные нейтрофилы суспендировали в PBS, содержащем 1 мг/мл BSA при 2 x 107 клеток/мл. Добавляли BCECF-AM (Dojin) до конечной концентрации 5 мкМ и смесь инкубировали при 37°C в течение 45 минут. Смесь затем дважды промывали, центрифугируя с PBS, содержащем 1 мг/мл BSA, вновь суспендировали в PBS, содержащем 1 мг/мл BSA, в количестве 5 x 107 клетки/мл, и перед использованием хранили на льду.
<Получение плашек с иммобилизованными HUVEC>
Эндотелиальные клетки пупочной вены человека (здесь приводится аббревиатура HUVEC) суспендировали в среде MCDB131 (Chlorella Industries), содержащей 10% фетальной телячьей сыворотки и 30 мкг/мл добавки для роста эндотелальных клеток (Becton Dickinson Bioscience). К 96-луночной плашке (Iwaki) с иммобилизованным коллагеном типа I добавляли суспензию в количестве 7,5 x 103 клеток/лунку и культивировали в течение 3 дней в CO2-инкубаторе (Hirasawa). После явного слияния клеток супернатант удаляли, плашку дважды промывали PBS, а затем добавляли PBS, содержащий 0,1% глютаральдегида (Kanto Kagaku), в количестве 100 мкл/лунку и HUVEC иммобилизовали в течение 5 минут. Супернатант удаляли и плашку дважды промывали PBS, а затем добавляли PBS в количестве 100 мкл/лунку и перед использованием смесь хранили при 4°C.
<Анализ адгезии>
К 6,5 мл среды RPMI-1640 (Sigma), содержащей 1 мг/мл BSA, добавляли 0,5 мл суспензии BCECF-AM меченных нейтрофилов в количестве 5 x 107/мл, хранящейся на льду, которую перемешивали, и смесь добавляли в количестве 80 мкл/лунку к плашке с иммобилизованными HUVEC. В эту плашку немедленно добавляли раствор соединения, разбавленного до различных концентраций RPMI-1640, содержащим 1 мг/мл BSA, в количестве 10 мкл/лунку, и 100 нМ форбол миристатацетата (здесь приводится аббревиатура PMA; Sigma) в RPMI-1640, содержащем 1 мг/мл BSA, в количестве 10 мкл/лунку, и смесь инкубировали в CO2-инкубаторе при 37°C в течение 45 минут. Из плашки удаляли супернатант затем промывали несколько раз RPMI-1640 в количестве 100 мкл/лунка, и затем добавляли PBS, содержащий 0,1% NP-40 (Calbiochem), в количестве 100 мкл/лунку, и интенсивность флуоресценции измеряли с помощью счетчика мультиметок ARVOTMSX 1420 (Wallac) для определения числа адгезированных клеток. Концентрацию каждого соединения при которой происходило увеличение числа адгезированных клеток путем PMA-стимуляция на 50% записывали как IC50 (мкМ).
(Тестовый пример 3) Оценка соединений на модели с инфильтрацией прямой кишки нейтрофилами, вызванной введением оксазолона
<Сенсибилизация оксазолоном>
Самцам мышей Balb/c в возрасте пять-шесть недель (Charles River Japan) сбривали шерсть на животе на участке площадью приблизительно 2 квадратных сантиметра. Каждой мыши на живот наносили 100% раствор этанола, содержащий 3% 4-этоксиметилен-2-фенил-2-оксазолин-5-он (здесь приводится сокращение оксазолон; Sigma) в количестве 150 мкл.
<Получение эмульсии, содержащей оксазолон>
Дистиллированную воду (Otsuka Pharmaceutical) добавляли в эквивалентный объем 100% арахисового масла (Kanto Kagaku), содержащего 1% оксазолон, и компоненты интенсивно перемешивали с помощью стеклянного шприца (Top Co.) с получением эмульсии, содержащей 0,5% оксазолона.
<Введение оксазолона>
На третий день после сенсибилизации оксазолоном мышам не давали корм, а на четвертый день под анастезией вводили инъекцией 100 мл эмульсии, содержащей 0,5% оксазолона, полученной способом, описанным выше, интраректально в область, находящуюся приблизительно в 3 см от ануса.
<Анализ инфильтрации нейтрафилами прямой кишки>
Каждый соединение суспендировали или разбавляли в водном растворе, содержащем 0,5% метилцеллюлозы (Wako), и перорально вводили в количестве 30 мг/кг за 30 минут до интраректальной инъекции эмульсии оксазолона. Через четыре часа после интраректальной инъекции оксазолона мышей умерщвляли смещением шейных позвонков, и прямую кишку удаляли, анатомируя в продольном направлении, промывали физиологическим раствором и переносили в охлажденные на льду пластиковые пробирки для центрифугирования. После добавления в пробирку 1 мл 50 мМ калий-фосфатного буфера (здесь приводится аббревиатура KPB) (pH 6,0), и ткань гомогенизировали в PHYSCOTRON (Microtec Nition Co., Ltd.), добавляли 2 мл 50 мМ KPB (pH 6,0), и смесь центрифугировали при 3000 об/мин при 4°C в течение 10 минут и супернатант удаляли. К полученному осадку добавляли 1 мл 50 мМ KPB (pH 6,0), содержащему 0,5% гексадецилтриметил-аммоний бромид (Sigma), и замораживали-оттаивали 3-5 раз, используя жидкий азот и горячую воду, центрифугировали при 3000 об/мин при 4°C в течение 10 минут с получением супернатанта. Активность фермента миелопероксидазы в супернатанте анализировали следующим образом. Конкретно, к 10 мкл полученного супернатанта добавляли 200 мкл 50 мМ KPB (pH6,0), содержащего 0,017% o-дианизидина (Sigma) и 0,0005% перекиси водорода (Wako), инкубировали при 37°C и измерение поглащения при 450 нм постоянно измеряли в течение 1 минуты, используя автоматический планшет-ридер EL340 (BIO-TEK) динамическом режиме. Единицами была скорость изменения абсорбции в минуту (mO.D./мин). Что касается эффекта каждого соединения, то уровень ингибирования (%) относительно контрольной группы окзазолона, то есть группы, которой вводили оксазолон и не вводили соединение, представлен в таблице 3.
(Экспериментальный пример 4) Оценка соединения на модели с колитом, вызыванным DSS
1-3% раствор декстрана сульфата натрия (здесь приведено сокращение DSS; ICN) в очищенной воде (Otsuka Pharmaceutical) добавляли в пищу для свободного доступа самцам мышей Balb/c в возрасте 6-7-недель (Charles River Japan) в течение 5-7 дней для индукции колита. Определяли индекс активности заболевания (здесь приводится аббревиатура DAI) на основании твердости кала, содержания крови в кале и изменения массы тела, количество нейтрофилов, инфильтрирующих прямую кишку, и длину прямой кишки использовали в качестве индексов для оценки соединений. Каждое соединение суспендировали или растворяли в водном растворе, содержащем 0,5% метилцеллюлозы (Wako), и вводили перорально в количестве 30 мг/кг один раз в день в течение 5-7 последовательных дней. Соединения примеров 1, 7, 8, 9, 10, 12, 13, 14, 15, 17, 18, 19, 20, 22, 28, 30, 31, 32 и 34 были особенно эффективны по сравнению с контрольной группой DSS, то есть с группой, которой вводили водный раствор DSS и не вводили соединение.
Промышленная применимость
Соединения по изобретению обладают превосходной ингибирующей активностью в отношении клеточной адгезии или клеточной инфильтрации, и поэтому могут использоваться в качестве лекарственных препаратов, которые применяются в виде терапевтического или профилактического средства различных воспалительных заболеваний и аутоимунных заболеваний, связанных с адгезией и инфильтрацией лейкоцитов, таких как воспалительное заболевание кишечника (в частности, язвенный колит или болезнь Крона), синдром раздраженной кишки, ревматоидный артрит, псориаз, рассеянный склероз, астма и атопический дерматит.
Реферат
Настоящее изобретение относится к производным 1,2-ди(цикло)замещенного бензола общей формулы 1, их солям или гидратам

где R10 - 5-10-членный циклоалкил, необязательно замещенный, или 5-10-членный циклоалкенил, необязательно замещенный;
n=0, 1 или 2; X1 представляет собой СН или азот. Соединения обладают ингибирующей активностью в отношении клеточной адгезии или клеточной инфильтрации и могут найти применение в качестве терапевтического или профилактического средства при воспалительных и аутоиммунных заболеваниях, связанных с адгезией и инфильтрацией лейкоцитов. Описаны также лекарственные средства на основе соединений 1. 9 н. и 13 з.п. ф-лы, 3 табл.
Формула
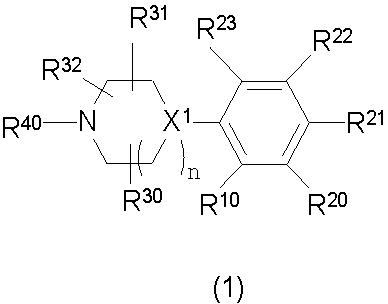













Комментарии