Производные хинолинсульфонамидов и их применение для модулирования пкм2 активности - RU2561132C2
Код документа: RU2561132C2
Чертежи































































Описание
ЗАЯВКА ОБ УСТАНОВЛЕНИИ ПРИОРИТЕТА
Настоящая заявка претендует на приоритет по заявкам U.S.S.N. 61/221,430, поданной 29 июня 2009 года и U.S.S.N. 61/292,360 поданной 5 января 2010 года, каждая из которых включена в настоящую заявку во всей полноте посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Раковые клетки зависят прежде всего от гликолиза, необходимого для выработки клеточной энергии, и от биохимических посредников, необходимых для биосинтеза липидов и нуклеотидов, тогда как большинство «нормальных» клеток тканей у взрослых используют аэробное дыхание. Это принципиальное различие в метаболизме раковых и нормальных клеток, названное эффектом Варбурга, было использовано для целей диагностики, однако до сих пор не применялось в терапии.
Пируваткиназа (ПК) является метаболическим ферментом, превращающим во время гликолиза фосфоенолпируват в пируват. У млекопитающих существует четыре изоформы ПК: L и R изоформы экспрессируются в печени и эритроцитах, изоформа M1 экспрессируется в большинстве тканей взрослого, а изоформа М2 является сплайс-вариантом M1, экспрессируемым во время эмбрионального развития. Все опухолевые клетки экспрессируют исключительно эмбриональную изоформу М2. Хорошо известное отличие изоформ M1 и М2 состоит в том, что М2 является низкоактивным энзимом, зависящим от аллостерической активации гликолитическим посредником, фруктозой-1,6-дифосфатом (ФДФ), тогда как M1 является конститутивно активным ферментом.
Все опухолевые клетки экспрессируют исключительно эмбриональную изоформу М2 пируваткиназы, что наводит на предположение о ПКМ2 как о возможно целевом лечении рака. ПКМ2 также экспрессируется жировой тканью и активированными Т-клетками. Таким образом, модуляция (например, ингибирование или активация) ПКМ2 может быть эффективной при лечении, например, ожирения, сахарного диабета, аутоиммунных состояний и пролиферативных заболеваний, в частности, доброкачественной гиперплазии предстательной железы (ДГПЖ). Существующие ингибиторы пируваткиназы неизбирательны, что затрудняет лечение заболеваний, связанных с функцией пируваткиназы.
Кроме того, связывание фосфотирозинпептида с ПКМ2 приводит к отделению ФДФ от ПКМ2 и конформационным изменениям ПКМ2 из активной тетраметрической формы в неактивную. Соединения, связывающие ПКМ2 и блокирующие фермент в активной конформации, приведут к потере аллостерического контроля ПКМ2, необходимого для сброса биохимических посредников от процесса гликолиза к процессу биосинтеза нуклеотидов и липидов. Таким образом, активация ПКМ2 (то есть активаторы ПКМ2) также может ингибировать рост и пролиферацию раковых клеток, активированных иммунных клеток и жировых клеток.
Имеет место непрекращающаяся необходимость в новых способах лечения таких заболеваний, как рак, сахарный диабет, ожирение, аутоиммунные нарушения, пролиферативные заболевания (например, ДГПЖ) и других заболеваний, имеющих отношение к функции пируваткиназы (например, ПКМ2).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе описаны соединения, модулирующие пируваткиназу М2 (ПКМ2), а также их фармацевтически приемлемые соли, сольваты и гидраты, например, соединения, активирующие ПКМ2. Также представлены фармацевтические композиции, включающие предложенные в изобретении соединения, и применение таких композиций в составе способов лечения заболеваний и состояний, опосредованных функцией пируваткиназы (например, функцией ПКМ2), включая злокачественные заболевания, сахарный диабет, ожирение, аутоиммунные нарушения и доброкачественную гиперплазию предстательной железы (ДГПЖ).
В одном из вариантов осуществления настоящего изобретения приводится фармацевтическая композиция, включающая соединение или фармацевтически приемлемую соль формулы (I):

где:
W, X, Y и Z - каждый независимо выбран из СН или N;
D и D1 - независимо выбран из связи или NRb;
А является необязательно замещенным арилом или необязательно замещенным гетероарилом;
L является связью, -С(O)-, -(CRcRc)m-, -ОС(O)-, -(CRcRc)m-OC(O)-, -(CRcRc)m-C(O)-, -NRbC(S)- или -NRbC(O)- (где место связи с R1 находится на левой стороне);
R1 выбран из алкила, циклоалкила, арила, гетероарила и гетероциклила;
каждый из которых замещен 0-5 вхождением Rd;
каждый R3 независимо выбран из гало, галоалкила, алкила, гидроксила и -ORa, или два соседних R3, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный гетероцикл; каждый Raнезависимо выбран из алкила, ацила, гидроксиалкила и галоалкила;
каждый Rb независимо выбран из водорода и алкила;
каждый Rc независимо выбран из водорода, гало, алкила, алкокси и галоалкокси; или два Rc, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный циклоалкил;
каждый Rd независимо выбран из гало, галоалкила, галоалкокси, алкила, алкинила, нитро, циано, гидроксил, -C(O)Ra, -ОС(O)Ra, -С(O)ORa, -SRa, -NRaRb и -ORa, или два Rd, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный гетероциклил;
n равно 0, 1 или 2;
m равно 1, 2 или 3;
h равно 0, 1, 2; и
g равно 0, 1 или 2.
В другом варианте осуществления настоящего изобретения приводится способ лечения или профилактики заболевания, состояния или нарушения (например, лечение), как описано в настоящем документе, включая применение представленного здесь соединения, его фармацевтически приемлемой соли или его фармацевтической композиции.
В других вариантах осуществления настоящего изобретения приводится способ модулирования (например, повышения или снижения) уровня активности ПКМ2 и/или гликолиза (например, модулирование эндогенной способности клетки пациента подавлять ПКМ2) у пациентов, нуждающихся в этом. Способ включает этап применения эффективной дозы соединения, описанного в настоящем документе, у нуждающегося в нем пациента, модулируя, таким образом, (например, повышая или понижая) уровень активности ПКМ2 и/или гликолиза у пациента. В некоторых вариантах соединение или фармацевтическая композиция, описанные в настоящем документе, используют для поддержания ПКМ2 в активной конформации или для активирования пируваткиназы в размножающихся клетках, как способ направления метаболитов глюкозы у пациента в катаболические, а не анаболические процессы.
В другом варианте осуществления настоящего изобретения приводится способ подавления клеточной пролиферации у пациента, нуждающегося в этом. Способ включает этап применения эффективной дозы соединения, описанного в настоящем документе, у нуждающегося в этом пациента, ингибируя, таким образом, пролиферацию клеток у пациента. Например, с помощью этого способа можно ингибировать рост трансформированной клетки, например, раковой клетки, или в общем подавлять рост ПКМ2-зависимой клетки, претерпевающей аэробный гликолиз.
В другом варианте осуществления настоящего изобретения приводится способ лечения нуждающихся в этом пациентов, страдающих от или восприимчивых к заболеваниям или нарушениям, ассоциированным с функцией ПКМ2. Способ включает этап применения эффективной дозы соединения, описанного в настоящем документе, у пациента, нуждающегося в этом, осуществляя, таким образом, лечение, профилактику или улучшая течение заболевания или нарушения у пациента. В определенном варианте осуществления изобретения модулятор представлен в составе фармацевтической композиции. В определенном варианте осуществления способ включает идентификацию или выбор пациента, который получит пользу от модулирования (например, активации) ПКМ2. Например, для лечения рака, ассоциированного с функцией ПКМ2, пациент может быть установлен на основании уровня активности ПКМ2 в его клетках. В другом варианте осуществления настоящего изобретения выбранный пациент страдает или восприимчив к нарушениям или заболеваниям, установленным в настоящем документе, таким как нарушения, характеризующиеся нежелательным клеточным ростом или пролиферацией, например, рак, ожирение, сахарный диабет, атеросклероз, рестеноз и аутоиммунные заболевания.
В другом варианте осуществления настоящего изобретения соединение, описанное в настоящем документе, применяется в дозировке и с частотой, достаточной для усиления продукции лактата или окислительного фосфорилирования.
КРАТКОЕ ОПИСАНИЕ ФИГУР
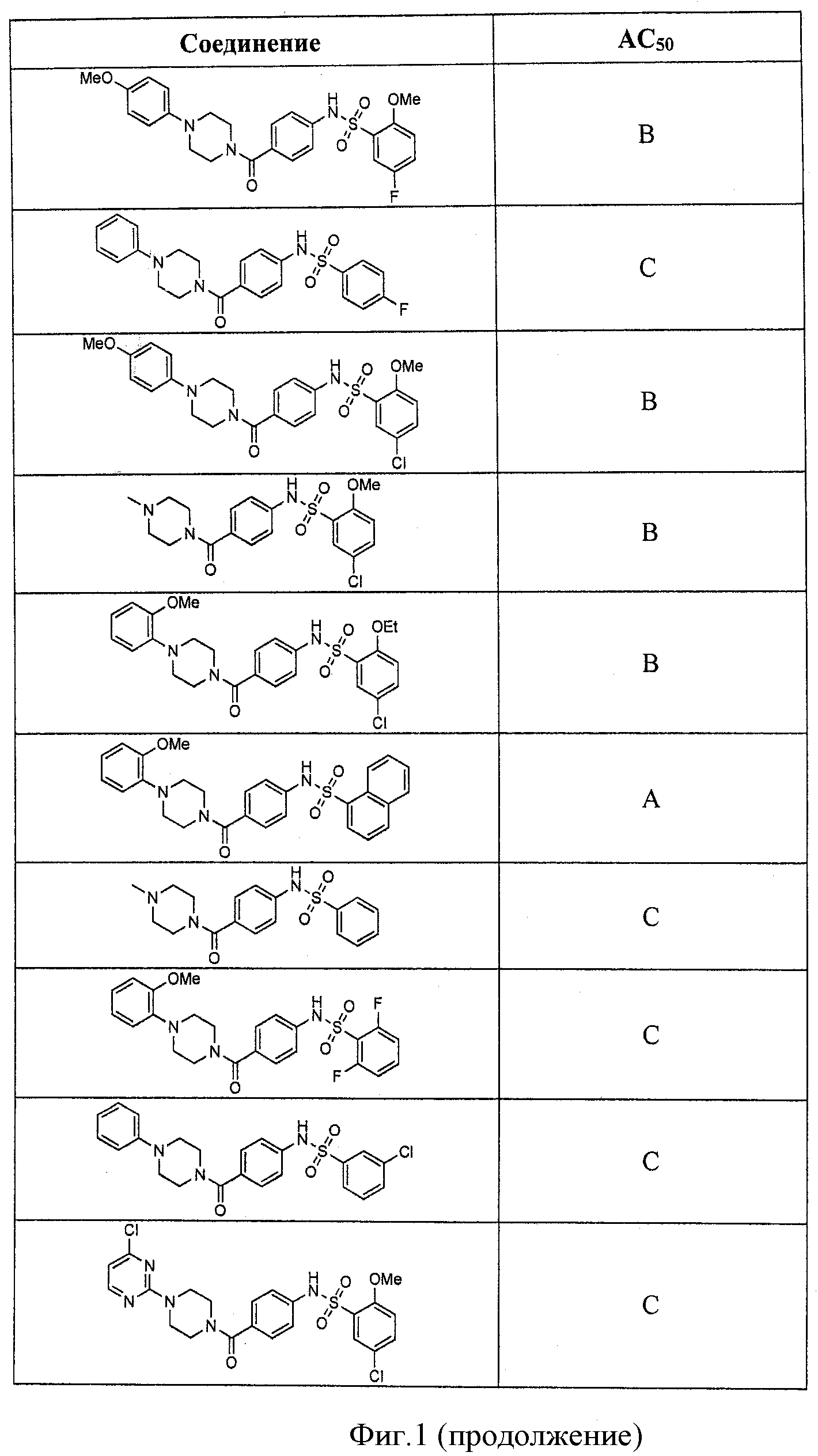
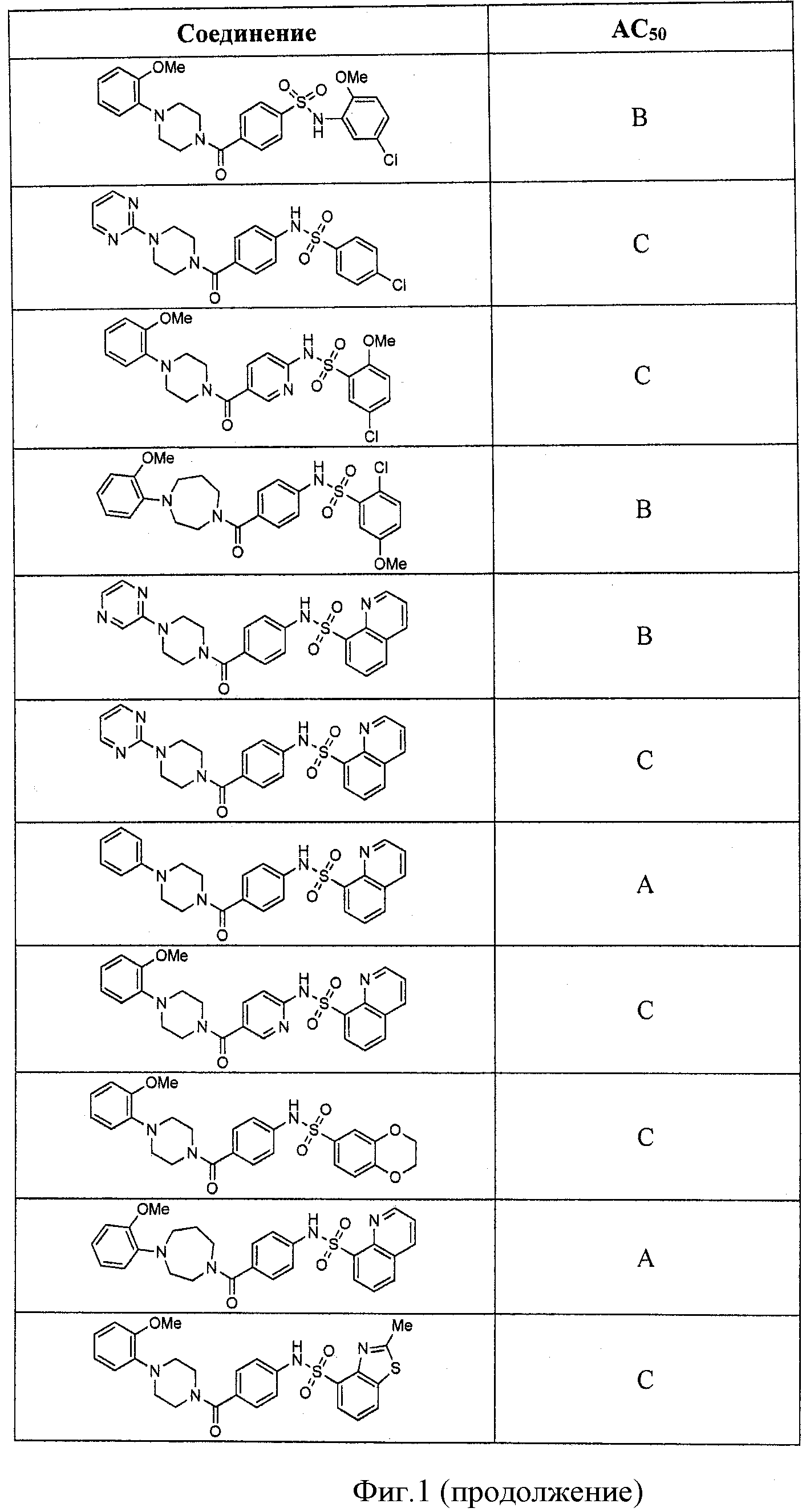
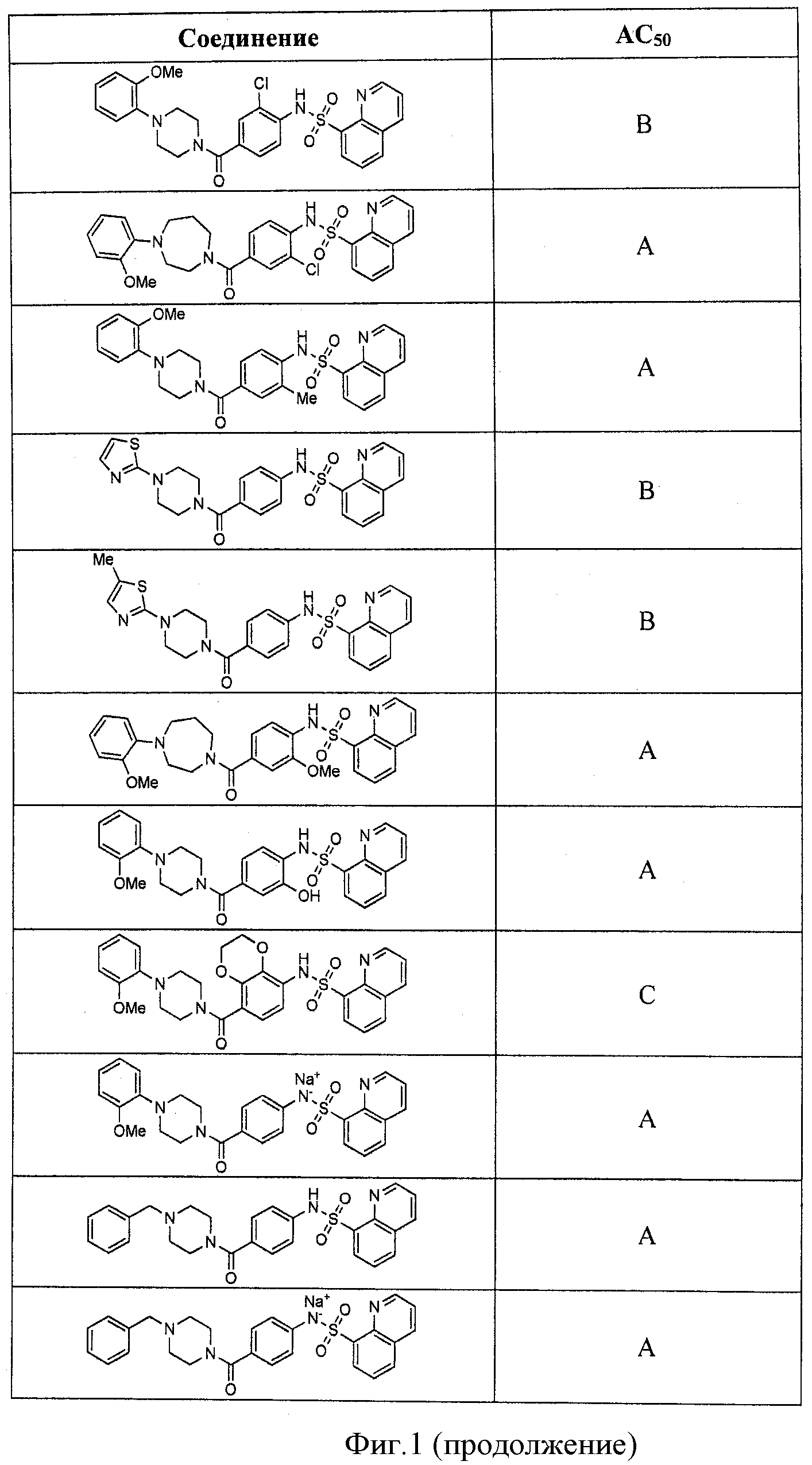
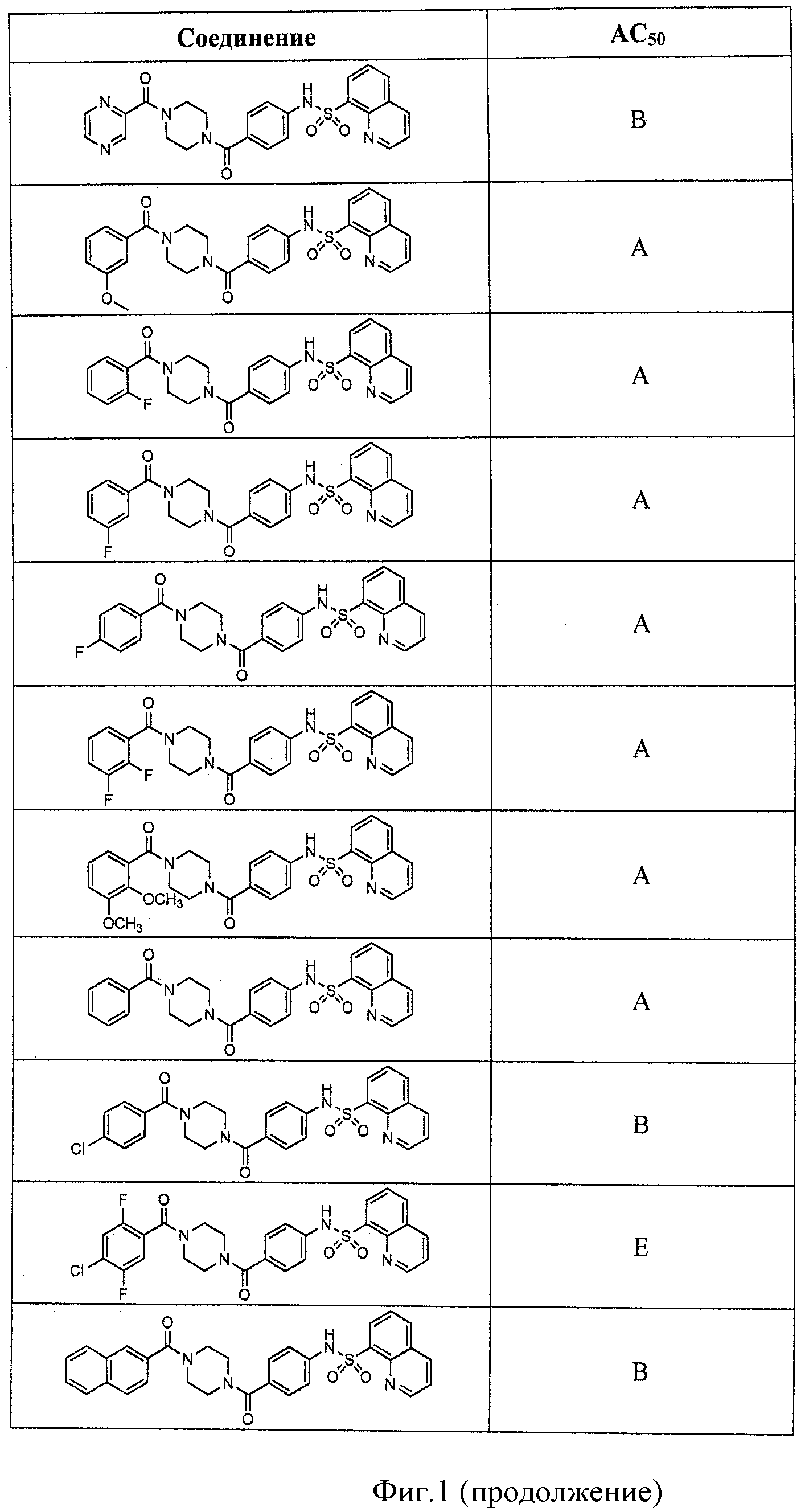
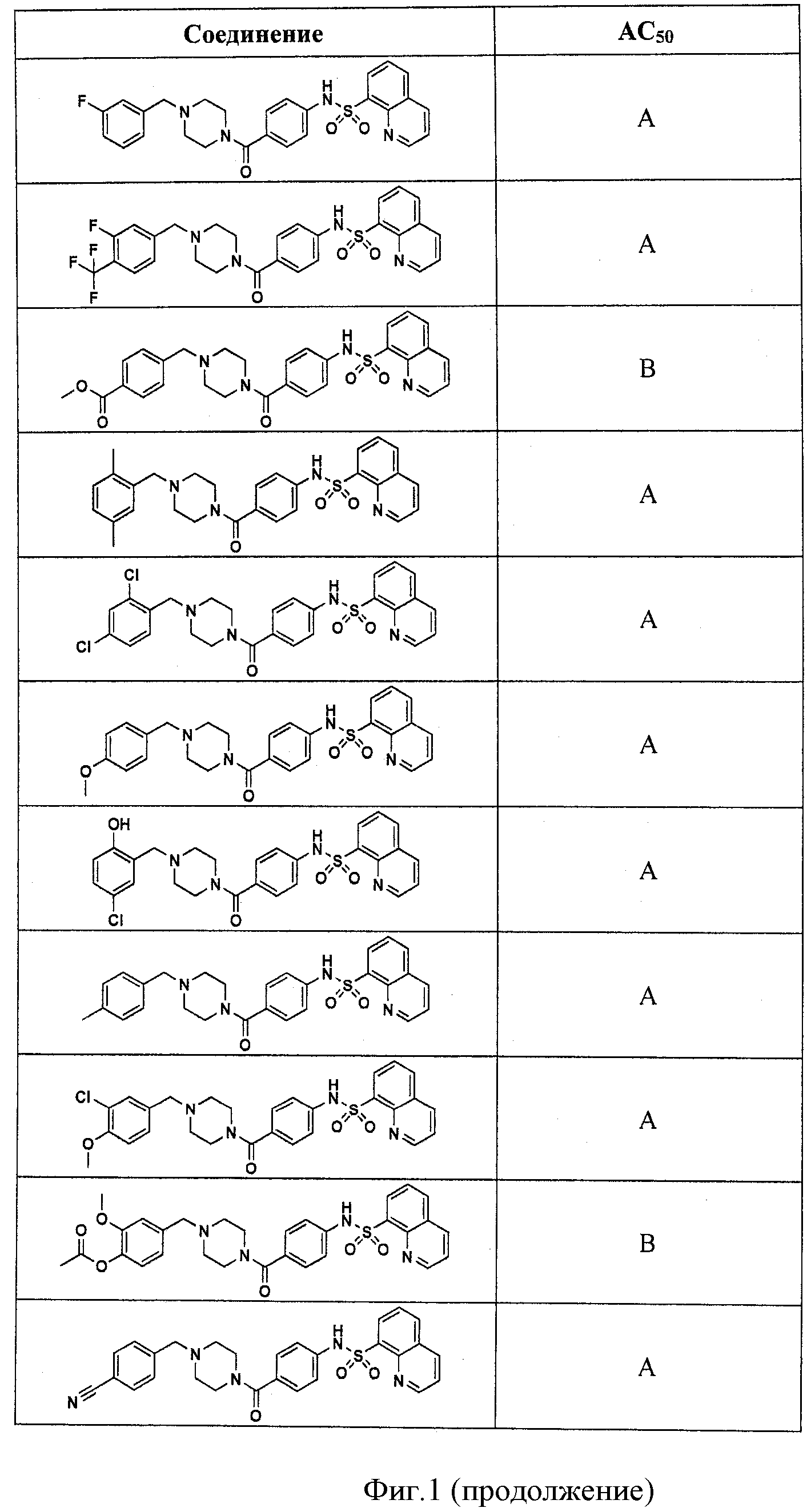
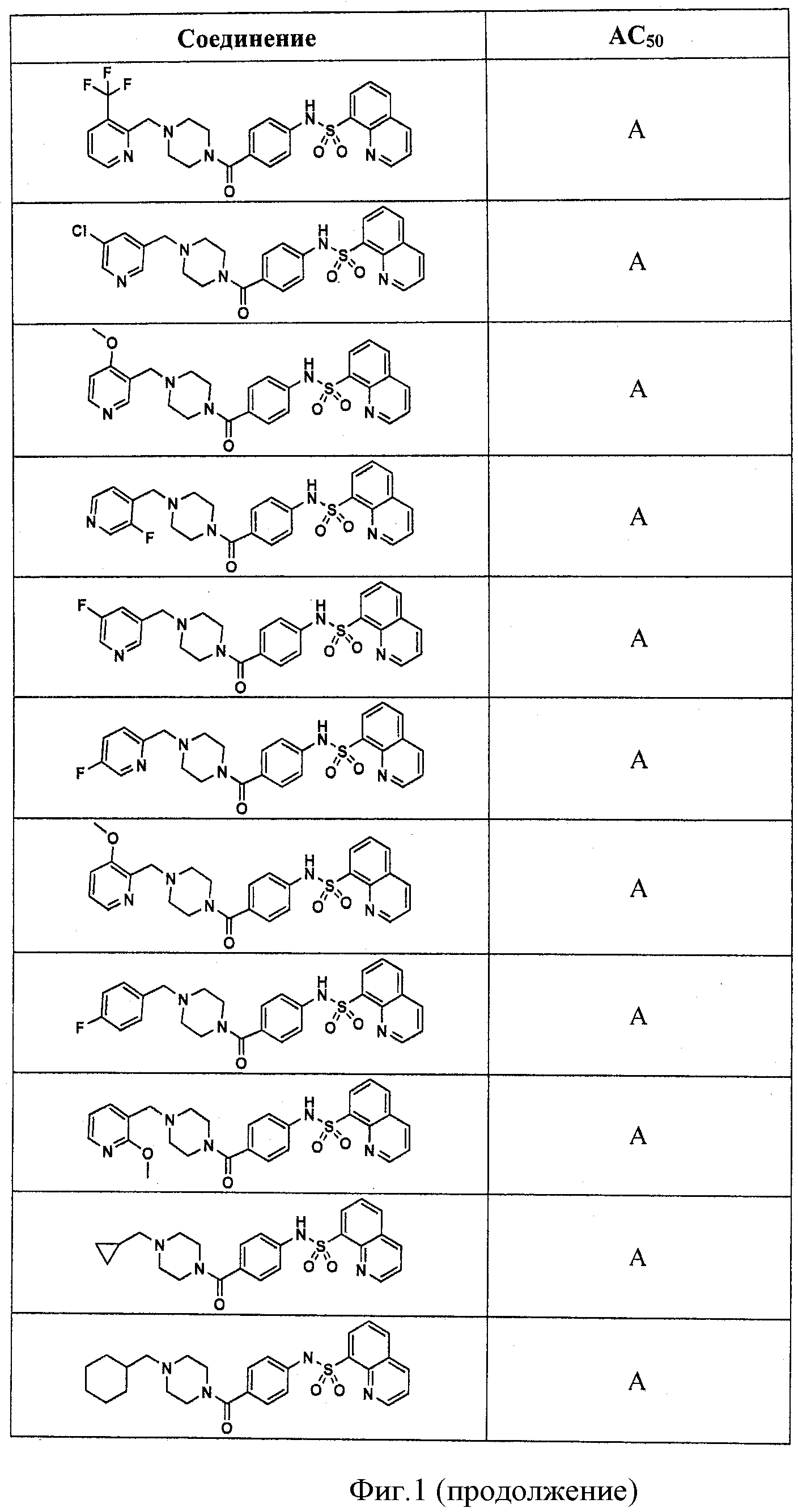
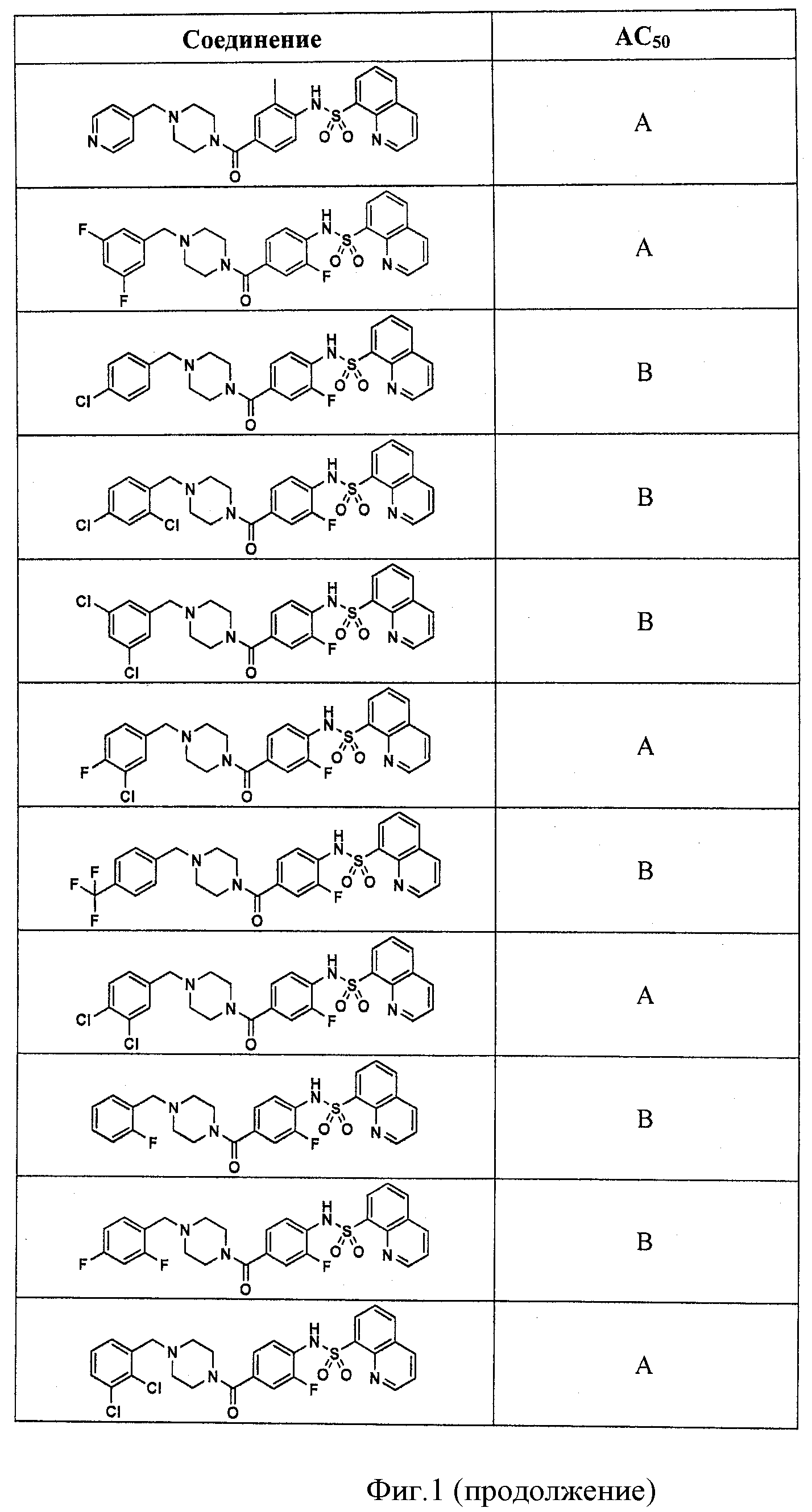
На фигуре в таблице представлены данные о типичных соединениях и соответствующей активности соединения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Подробная информация о составляющих и расположении компонентов, изложенная в следующем далее описании или проиллюстрированная на фигурах, не является ограничивающей. Варианты осуществления настоящего изобретения могут осуществляться на практике или выполняться различными способами. К тому же, используемые в настоящем документе формулировки и терминология имеют целью описание и не должны рассматриваться как ограничивающие. Использование слов «включать», «заключать в себе» или «иметь», «содержать», «вовлекать» и их вариаций в настоящем документе подразумевает охват перечисленных далее пунктов и эквивалентов таковых, а также дополнительных пунктов.
Соединения
Описанные в настоящем документе соединения и композиции модулируют ПКМ2, в частности, активируют ПКМ2. Соединения, модулирующие ПКМ2, например, активирующие ПКМ2, могут быть использованы для лечения таких нарушений, как новообразования (например, рак) или нарушений со стороны жировой клетчатки (например, ожирение).
В одном из вариантов осуществления настоящего изобретения приводится соединение формулы (I) или его фармацевтически приемлемая соль, или фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемая соль:

где:
W, X, Y и Z - каждый независимо выбран из СН или N;
D и D1 - независимо выбраны из связи или NRb;
А является необязательно замещенным арилом или необязательно замещенным гетероарилом;
L является связью, -С(O)-, -(CRcRc)m-, -OC(O)-, -(CRcRc)m-OC(O)-, -(CRcRc)m-C(O)-, -NRbC(S)- или -NRbC(O)- (где точка соединения с R1 находится на левой стороне);
R1 выбран из алкила, циклоалкила, арила, гетероарила и гетероциклила;
каждый из которых замещен 0-5 вхождением Rd;
каждый R3 независимо выбран из гало, галоалкила, алкила, гидроксила и -ORa или два соседних R3, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный гетероцикл;
каждый Ra независимо выбран из алкила, ацила, гидроксиалкила и галоалкила;
каждый Rb независимо выбран из водорода и алкила;
каждый Rc независимо выбран из водорода, гало, алкила, алкокси и галоалкокси или два Rc, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный циклоалкил;
каждый Rd независимо выбран из гало, галоалкила, галоалкокси, алкила, алкинила, нитро, циано, гидроксил, -C(O)Ra, -OC(O)Ra, -C(O)ORa, -SRa, -NRaRb и -ORa, или два Rd, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный гетероциклил;
n равно 0, 1 или 2;
m равно 1, 2 или 3;
h равно 0, 1, 2; и
g равно 0, 1 или 2. В определенных вариантах осуществления настоящего изобретения приводится соединение формулы (I) или его фармацевтически приемлемая соль:

где:
W, X, Y и Z - каждый независимо выбран из СН или N;
D и D1 - независимо выбраны из связи или NRb;
А является необязательно замещенным бициклическим гетероарилом;
L является связью, -С(O)-, -(CRcRc)m-, -OC(O)-, -(CRcRc)m-OC(O)-, -(CRcRc)m-C(O)-, -NRbC(S)- или -NRbC(O)-;
R1 выбран из алкила, циклоалкила, арила, гетероарила и гетероциклила;
каждый из которых замещен 0-5 вхождением Rd;
каждый R3 независимо выбран из гало, галоалкила, алкила, гидроксила и -ORa или два соседних R3, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный гетероцикл; каждый Raнезависимо выбран из алкила, ацила, гидроксиалкила и галоалкила;
каждый Rb независимо выбран из водорода и алкила;
каждый Rc независимо выбран из водорода, гало, алкила, алкокси и галоалкокси или два Rc, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный циклоалкил;
каждый Rd независимо выбран из гало, галоалкила, галоалкокси, алкила, алкинила, нитро, циано, гилроксил, -C(O)Ra, -OC(O)Ra, -C(O)ORa, -SRa, -NRaRb и -ORa, или два Rd, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный гетероциклил;
n равно 0, 1 или 2;
m равно 1, 2 или 3;
h равно 0, 1, 2; и
g равно 0, 1 или 2. В некоторых вариантах осуществления настоящего изобретения h равно 1. В некоторых вариантах осуществления настоящего изобретения h равно 2.
В некоторых вариантах осуществления настоящего изобретения g равно 1. В некоторых вариантах осуществления настоящего изобретения g равно 2.
В некоторых вариантах осуществления настоящего изобретения и h, и g равны 1. В некоторых вариантах осуществления настоящего изобретения h равно 1, а g равно 2. В некоторых вариантах осуществления настоящего изобретения g равно 1, а h равно 2.
В некоторых вариантах осуществления настоящего изобретения W, X, Y и Z являются СН. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере, один из W, X, Y и Z является N. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере, два из W, X, Y и Z являются N. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере, три из W, X, Y и Z являются N.
В некоторых вариантах осуществления W, X, Y, Z и атомы углерода, к которым они присоединены, формируют кольцо пиридила. В некоторых вариантах осуществления настоящего изобретения W, X, Y, Z и атомы углерода, к которым они присоединены, формируют кольцо пиримидила. В некоторых вариантах осуществления настоящего изобретения W, X, Y, Z и атомы углерода, к которым они присоединены, формируют кольцо пиридазина.
В некоторых вариантах осуществления настоящего изобретения W, Х и Y являются СН, a Z является N.
В некоторых вариантах осуществления настоящего изобретения X, Y и Z являются СН, а W является N.
В некоторых вариантах осуществления настоящего изобретения D является NRb, а D1 является связью. В некоторых вариантах осуществления настоящего изобретения D является связью, а D1 является NRb. В некоторых вариантах осуществления настоящего изобретения и D, и D1 является NRb. В некоторых вариантах осуществления настоящего изобретения Rb является алкилом (например, метилом или этилом). В некоторых вариантах осуществления настоящего изобретения Rb является водородом (Н).
В некоторых вариантах осуществления настоящего изобретения А является 9-10-членным бициклическим гетероалкилом (например, хиназолинил, хиноксалинил, циннолинил, изохинолил, индолил, бензоксазолил, пирролопиридил, пирролопиримидил, бензимидозалил, бензтиазолил или бензоксазолил). В некоторых вариантах осуществления настоящего изобретения А является N-содержащим 9-10-членным бициклическим гетероарилом. В некоторых вариантах А является необязательно замещенным хиназолинилом (например, 8-хиназолинил или 4-хиназолинил), необязательно замещенным хиноксалинилом (например, 5-хиноксалинил), необязательно замещенным хинолинилом (например, 4-хинолинил или 8-хинолинил), необязательно замещенным циннолинилом (например, 8-циннолинил), необязательно замещенным изохинолинилом, необязательно замещенным индолилом (7-индолил), необязательно замещенным бензоксазолилом (например, 7-банзоксазолил), необязательно замещенным пирролопиридилом (например, 4-пирролопиридил), необязательно замещенным бензимидазолилом (например, 7-бензимидазолил), необязательно замещенным бензтиазолилом (например, 4-бензтиазолил, 2-метил-4-бензтиазолил или 7-бензтиазолил) или необязательно замещенным бензоксазолилом (например, 4-бензоксазолил). В некоторых вариантах осуществления настоящего изобретения А необязательно замещен на галоген. В некоторых вариантах А является



В некоторых вариантах А является

В некоторых вариантах осуществления настоящего изобретения L является связью.
В некоторых вариантах осуществления настоящего изобретения L является -(CRcRc)m- и m равен 1. В некоторых аспектах этих вариантов каждый Rc является водородом. В некоторых аспектах этих вариантов один Rc является алкилом (например, метилом или этилом), а другой Rc является водородом. В некоторых аспектах этих вариантов один Rc является галогеном (например, фтором), а один Rc является водородом. В некоторых аспектах этих вариантов оба Rc являются галогенами (например, фтором). В некоторых аспектах этих вариантов один Rc является алкокси (например, метокси или этокси), а один Rc является водородом. В некоторых аспектах этих вариантов оба Rc являются алкокси (например, метокси или этокси). В некоторых аспектах этих вариантов два Rc, взятые вместе с углеродом, с которым они связаны, формируют циклоалкил (например, циклопропил).
В некоторых вариантах осуществления настоящего изобретения L является -(CRcRc)m-, и m равно 2. В некоторых аспектах этих вариантов каждый Rc является водородом. В некоторых аспектах этих вариантов один Rc является алкилом (например, метилом или этилом), а каждый другой Rc является водородом. В некоторых аспектах этих вариантов два Rc взятые вместе с углеродом, с которым они связаны, формируют циклоалкил (например, циклопропил), а каждые из других двух Rc являются водородом.
В некоторых вариантах осуществления настоящего изобретения L является -(CRcRc)m-, и m равно 3. В некоторых аспектах этих вариантов каждый Rc является водородом.
В некоторых вариантах осуществления настоящего изобретения L является -С(O)-.
В некоторых вариантах L является -О-С(О)-.
В некоторых вариантах L является NRbC(O)-, a Rb является водородом. В некоторых вариантах L является NRbC(S)-, a Rb является водородом.
В некоторых вариантах L является -(CRcRc)m-С(О)-, а m равно 1. В некоторых аспектах этих вариантов каждый Rc является водородом. В некоторых аспектах этих вариантов один Rc является алкилом (например, метилом или этилом), а один Rc является водородом. В некоторых аспектах этих вариантов оба Rc являются алкилами (например, метил или этил).
В некоторых вариантах осуществления настоящего изобретения L является -(CRcRc)m-C(O)-, a m равно 2. В некоторых аспектах этих вариантов каждый Rcявляется водородом.
В некоторых вариантах осуществления настоящего изобретения L является -(CRcRc)m-С(О)-, а m равно 3. В некоторых аспектах этих вариантов каждый Rc является водородом.
В некоторых вариантах осуществления настоящего изобретения R1является алкилом, замещенным 0-5 проявлениями Rd (например, метил, этил, n-пропил, i-пропил или n-бутил). В некоторых вариантах осуществления настоящего изобретения R1 является метилом, этилом, n-пропилом, i-пропилом или n-бутилом. В некоторых вариантах осуществления настоящего изобретения R1 является этилом или пропилом (n-пропил или i-пропил). В некоторых аспектах этих вариантов L является связью, -СН2-, -С(O)- или -О(СО)-. В некоторых аспектах этих вариантов L является -О(СО)-.
В некоторых вариантах осуществления настоящего изобретения R1является алкилом, замещенным одним Rd (например, метил, этил, n-пропил, i-пропил или n-бутил). В некоторых вариантах осуществления настоящего изобретения R1 является метилом, этилом или n-пропилом, замещенным одним Rd. В некоторых аспектах этих вариантов Rd является гало (например, фтор или хлор). В некоторых аспектах этих вариантов Rd является -C(O)ORa. В некоторых аспектах этих вариантов Ra является алкилом (например, метилом или этилом). В некоторых аспектах этих вариантов L является -NHC(O)-.
В некоторых вариантах осуществления настоящего изобретения R1 является алкилом, замещенным двумя Rd (например, метил, этил, n-пропил, i-пропил или n-бутил). В некоторых вариантах осуществления настоящего изобретения R1 является метилом, этилом, n-пропилом, замещенным двумя Rd. В некоторых вариантах R1 является n-пропилом, замещенным двумя Rd. В некоторых аспектах этих вариантов один Rd является циано, а другой Rd является -NRaRa. В некоторых аспектах. Ra и Rb являются водородом. В некотрых аспектах L является -СН2-.
В некоторых вариантах осуществления настоящего изобретения R1является гетероарилом, замещенным 0-5 вхождением Rd (например, S-содержащий моноциклический гетероарил, N-содержащий моноциклический гетероарил или N-содержащий бициклический гетероарил). В некоторых вариантах осуществления настоящего изобретения R1 является пиридилом, замещенным 0-5 вхождением Rd (например, 2-пиридил, 3-пиридил или 4-пиридил), пиримидилом, замещенным 0-5 вхождением Rd (например, 2-пиримидил или 5-пиримидил) или пиразинилом, замещенным 0-5 вхождением Rd (например, 2-пиразинил). В некоторых вариантах осуществления настоящего изобретения R1 является тиазолилом, замещенным 0-5 вхождением Rd(например, 2-тиазолил или 5-тиазолил). В некоторых вариантах осуществления настоящего изобретения R1 является пиримидилом, замещенным 0-5 вхождением Rd (например, 2-пиримидил). В некоторых вариантах осуществления настоящего изобретения R1 является тиадиазолилом, замещенным 0-5 вхождением Rd (например, 4-тиадиазолил). В некоторых вариантах осуществления настоящего изобретения R1 является пирролилом, замещенным 0-5 вхождением Rd (например, 2-пирролил). В некоторых аспектах этих вариантов L является связью, -СН2-, -С(O)- или -О(СО)-. В некоторых аспектах этих вариантов R1 является пиридилом (например, 2-пиридил, 3-пиридил или 4-пиридил).
В некоторых вариантах осуществления настоящего изобретения R1 является пиридилом (например, 2-пиридил, 3-пиридил или 4-пиридил), замещенным одним Rd. В некоторых аспектах этих вариантов Rd является -OC(O)Ra. В некоторых аспектах этих вариантов Rd является -ORa. В некоторых аспектах этих вариантов Rd является -C(O)ORa. В некоторых аспектах этих вариантов Rd является алкилом (например, метилом или этилом). В некоторых аспектах этих вариантов Rd является галоалкилом (например, трифторметил). В некоторых аспектах этих вариантов Rd является гало (например, фтор или хлор). В некоторых аспектах этих вариантов Ra является алкилом (например, метил или этил). В некоторых аспектах этих вариантов L является -СН2-. В некоторых вариантах осуществления настоящего изобретения R1 является пиридилом (например, 2-пиридил, 3-пиридил или 4-пириидил), замещенным двумя Rd. В некоторых аспектах этих вариантов один Rd является -С(O)ORa, а другой Rd является ORa. В некоторых аспектах этих вариантов Ra является алкилом (например, метил или этил). В некоторых аспектах этих вариантов оба Rd являются галогенами (например, фтор или хлор). В некоторых аспектах этих вариантов L является -СН2-.
В некоторых вариантах осуществления настоящего изобретения R1является пиримидилом (например, 2-пиримидил или 5-пиримидил). В некоторых аспектах этих вариантов L является связью.
В некоторых вариантах осуществления настоящего изобретения R1является пиримидилом (например, 2-пиримидил или 5-пиримидил), замещенным одним Rd. В некоторых аспектах этих вариантов Rd является галогеном (например, фтором или хлором).
В некоторых вариантах осуществления настоящего изобретения R1является пиразинилом (например, 2-пиразинил). В некоторых аспектах этих вариантов L является связью.
В некоторых вариантах осуществления настоящего изобретения R1 является тиазолилом (например, 2-тиазолил, 4-тиазолил или 5-тиазолил). В некоторых аспектах этих вариантов L является -С(O)-.
В некоторых вариантах осуществления настоящего изобретения R1является тиазолилом (например, 2-тиазолил, 4-тиазолил или 5-тиазолил), замещенным одним Rd. В некоторых аспектах этих вариантов Rd является алкилом (например, метил или этил). В некоторых аспектах этих вариантов L является -С(O)-.
В некоторых вариантах осуществления настоящего изобретения R1является тиофенилом, замещенным 0-5 вхождением Rd (например, 2-тиофенил). В некоторых вариантах осуществления настоящего изобретения R1 является тиофенилом.
В некоторых вариантах осуществления настоящего изобретения R1является тиадиазолилом (например, 4-тиадиазолил).
В некоторых вариантах осуществления настоящего изобретения R1является пирролилом (например, 2-пирролил).
В некоторых вариантах осуществления настоящего изобретения R1является циклоалкилом, замещенным 0-5 вхождением Rd (например, циклопропил, циклопентил или циклогексил). В некоторых вариантах R1является циклопроилом. В некоторых вариантах R1 является циклогексилом. В некоторых вариантах R1 является циклопентилом. В некоторых аспектах этих вариантов L является -СН2-С(O)-. В некоторых вариантах R1 является арилом, замещенным 0-5 вхождением Rd.
В некоторых аспектах этих вариантов L является связью, -СН2-, -С(O)- или -О(СО)-.
В некоторых вариантах осуществления настоящего изобретения R1является арилом (например, фенилом). В некоторых вариантах осуществления настоящего изобретения R1 является фенилом. В некоторых аспектах этих вариантов L является связью, -СН2-, -С(O)- или -О(СО)-.
В некоторых вариантах осуществления настоящего изобретения R1является фенилом, замещенным одним Rd. В некоторых аспектах этих вариантов Rd является орто-замещенным. В некоторых аспектах этих вариантов Rd является мета-замещенным. В некоторых аспектах этих вариантов Rd является пара-замещенным. В некоторых аспектах этих вариантов Rd является галогеном (например, фтор, бром или хлор). В некоторых аспектах этих вариантов Rd является алкилом (например, метил, этил, изопропил, t-бутил, n-бутил или n-пентил). В некоторых аспектах этих вариантов Rd является галоалкилом (например, трифторметил). В некоторых аспектах этих вариантов Rd является -ORa. В некоторых аспектах этих вариантов Rd является -C(O)Ra. В некоторых аспектах этих вариантов Rd является -SRa. В некоторых аспектах этих вариантов Rd является -C(O)ORa. В некоторых аспектах этих вариантов Rdявляется цианогруппой. В некоторых аспектах этих вариантов Rd является -NRaRb. В некоторых аспектах этих вариантов Rd является галоалкокси (например, дифторметокси или трифторметокси). В некоторых аспектах этих вариантов Rd является гидроксилом. В некоторых аспектах этих вариантов Rdявляется -OC(O)Ra. В некоторых аспектах этих вариантов Rd является алкинилом (например, 1-гексинил). В некоторых аспектах этих вариантов Rdявляется галоалкильной группой (например, трифторметил). В некоторых аспектах этих вариантов Ra является алкилом (например, метил, этил, n-пропил, изопропил, n-бутил, изобутил, t-бутил или n-пентил). В некоторых аспектах этих вариантов Ra является гидроксиалкилом (например, 2-гидроксилэтил). В некоторых аспектах этих вариантов Ra и Rb являются алкильными группами (например, метильной или этильной). В некоторых аспектах этих вариантов Raявляется ацильной группой (например, ацетил), а Rb является водородом. В некоторых аспектах этих вариантов L является связью, -СН2-, -С(O)- или -O(СО)-.
В некоторых вариантах осуществления настоящего изобретения R1является фенилом, замещенным двумя Rd. В некоторых аспектах этих вариантов оба Rd являются галогенами (например, фтор или хлор). В некоторых аспектах этих вариантов оба Rd являются алкильными группами (например, метальной или этильной). В некоторых аспектах этих вариантов один Rdявляется алкилом (например, метилом или этилом), а другой является -ORa. В некоторых аспектах этих вариантов один Rd является галогеном (например, фтором или хлором), а другой Rd является -ORa. В некоторых аспектах этих вариантов оба Rd являются -ORa. В некоторых аспектах этих вариантов один Rd является галогеном (например, фтором или хлором), а другой Rd является гидроксилом. В некоторых аспектах этих вариантов один Rd является галогеном (например, фтором или хлором), а другой является галоалкилом (например, трифторметил). В некоторых аспектах этих вариантов один Rd является -ORa, a другой Rd является -C(O)ORa. В некоторых аспектах этих вариантов один R является -ORa, а другой Rd является гидроксилом. В некоторых аспектах этих вариантов один Rd является алкилом (например, метил или этил), а другой Rd является гидроксилом. В некоторых аспектах этих вариантов оба Rd являются гидроксильными группами. В некоторых аспектах этих вариантов один Rdявляется галогеном (например, фтором), а другой Rd является галоалкилом (например, трифторметил). В некоторых аспектах этих вариантов оба Rdявляются гидроксильными группами. В некоторых аспектах этих вариантов один Rd является галоалкилом (например, трифторметил), а другой Rd является алкилом (например, метил). В некоторых аспектах этих вариантов два Rdвместе с атомами углерода, с которыми они связаны, формируют необязательно замещенный гетероцикл. В некоторых аспектах этих вариантов два Rd вместе с атомами углерода, с которыми они связаны, формируют необязательно замещенный 5-7-членный гетероцикл. В некоторых аспектах этих вариантов Rdвместе с фенильным кольцом, с которым они связаны, формируют следующую структуру:
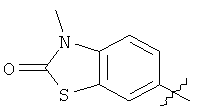
В некоторых аспектах этих вариантов Ra представлен алкильной группой (метальной или этильной). В некоторых аспектах этих вариантов L является связью, -СН2-, -С(O)- или -О(СО)-.
В некоторых вариантах осуществления настоящего изобретения R1является фенилом, замещенным тремя Rd. В некоторых аспектах этих вариантов три Rd являются галогенами (например, фтором или хлором). В некоторых аспектах этих вариантов два Rd являются галогенами (например, фтором или хлором), а один Rd является гидроксилом. В некоторых аспектах этих вариантов один Rd является галогеном (например, фтором или хлором), один Rd является алкилом (например, метилом), а один Rd является гидроксилом. В некоторых аспектах этих вариантов три Rd являются алкилами (например, метилом или этилом). В некоторых аспектах этих вариантов два Rd являются алкилами (например, метилом или этилом), а один Rd является гидроксилом. В некоторых аспектах этих вариантов два Rd являются галогенами (например, фтором или хлором), а один Rd является -ORa. В некоторых аспектах этих вариантов Ra является алкилом (например, метил или этил). В некоторых аспектах этих вариантов один Rd является гидроксилом, а два Rd являются -ORa. В некоторых аспектах этих вариантов Rd является алкилом (например, метил или этил). В некоторых аспектах этих вариантов три Rd являются -ORa. В некоторых аспектах этих вариантов три Rd являются галогенами (например, фтором или хлором). В некоторых аспектах этих вариантов Ra является алкилом (например, метилом или этилом). В некоторых аспектах этих вариантов L является связью, -СН2-, -С(O)- или -О(СО)-.
В некоторых вариантах осуществления настоящего изобретения R1является фенилом, замещенным четырьмя Rd. В некоторых аспектах этих вариантов один Rd является гидроксилом, один Rd является алкилом (например, метил или этил), а два Rd являются -ORa. В некоторых аспектах этих вариантов Ra является алкилом (например, метил или этил). В некоторых аспектах этих вариантов L является связью, -СН2-, -С(O)- или -О(СО)-.
В некоторых вариантах осуществления настоящего изобретения R1является гетероциклом, замещенным 0-5 вхождением Rd.
В некоторых вариантах осуществления настоящего изобретения R1является тетрагидрофуранилом, замещенным 0-5 вхождением Rd (например, 2-тетрагидрофуранил или 3-тетрагидрофуранил). В некоторых аспектах этих вариантов R1 является тетрагидрофуранилом (например, 2-тетрагидрофуранилом или 3-тетрагидрофуранилом). В некоторых аспектах этих вариантов L является -С(O)-.
В некоторых вариантах осуществления настоящего изобретения R1 является азетидинилом, замещенным 0-5 вхождением Rd (например, 3-азетидинил). В некоторых вариантах R1 является азетидинилом (например, 3-азетидинилом). В некоторых вариантах R1 является азетидинилом (например, 3-азетидинилом), замещенным одним Rd. В некоторых аспектах этих вариантов Rd является алкилом (например, метилом или этилом). В некоторых аспектах этих вариантов L является -С(O)-.
В некоторых вариантах осуществления настоящего изобретения R1 является 10-14-членным бициклическим арилом, замещенным 0-5 вхождением Rd. В некоторых вариантах R1 является нафтилом, замещенным 0-5 вхождением Rd. В некоторых вариантах R1 является нафтилом.
В некоторых вариантах L является связью, -(CRcRc)m-, - NRbC(O)-,-(CRcRc)mC(O)-, -С(O)-или -О(СО)-.
В некоторых вариантах осуществления настоящего изобретения L является связью, а R1 является алкилом, арилом или гетероарилом, замещенным 0-5 вхождением Rd. В некоторых аспектах этих вариантов алкил, арил или гетероарил R1 соответствует описанию в любом из вариантов и аспектов выше.
В некоторых вариантах L является -(CRcRc)m-, a R1 является циклоалкилом, арилом, гетероарилом или гетероциклилом, замещенным 0-5 вхождением Rd. В некоторых аспектах этих вариантов циклоалкил, арил, гетероарил или гетероциклил R1 соответствует описанию в любом из вариантов и аспектов выше.
В некоторых вариантах L является -NRbC(О)-, а Rb является водородом, а R1 является арилом, замещенным 0-5 вхождением Rd. В некоторых аспектах этих вариантов арил R1 соответствует описанию в любом из вариантов и аспектов выше.
В некоторых аспектах этих вариантов L является -(CRcRc)m-С(О)-, а R1является циклоалкилом, арилом или гетероарилом, замещенным 0-5 вхождением Rd. В некоторых аспектах этих вариантов циклоалкил, арил или гетероарил R1 соответствует описанию в любом из вариантов и аспектов выше.
В некоторых вариантах L является -С(O)-, а R1 является арилом, алкилом или гетероарилом, замещенным 0-5 вхождением Rd. В некоторых аспектах этих вариантов арил, алкил или гетероарил R1 соответствует описанию в любом из вариантов и аспектов выше.
В некоторых вариантах L является -ОС(O)-, а R1 является алкилом, арилом или гетероциклилом, замещенным 0-5 вхождением Rd. В некоторых аспектах этих вариантов алкил, арил или гетероциклил R1 соответствует описанию в любом из вариантов и аспектов выше.
В некоторых вариантах L является -(CRcRc)m-С(О)-, а R1 является гетероциклилом или циклоалкилом, замещенным 0-5 вхождением Rd. В некоторых аспектах этих вариантов гетероциклил или циклоалкил R1соответствует описанию в любом из вариантов и аспектов выше.
В некоторых вариантах n равно 0. В некоторых вариантах п равно 1.
В некоторых вариантах R3 является алкилом (например, метилом или этилом). В некоторых вариантах R3 является -ORa. В некоторых вариантах Raявляется алкилом (например, метилом или этилом). В некоторых вариантах R3является галогеном (например, фтором или хлором). В некоторых вариантах R3является гидроксилом. В некоторых вариантах R3 является галоалкилом (например, трифторметилом).
В некоторых вариантах n равно 2.
В некоторых вариантах два смежных R3, взятые вместе с атомами углерода, с которыми они связаны, формируют кольцо гетероцикла. В некоторых вариантах оба R3 являются -ORa. В некоторых вариантах два смежных R3, взятые вместе с атомами углерода, с которыми они связаны, формируют

В определенных вариантах соединение имеет формулу (II) или фармацевтически приемлемую соль таковой:

где L, R1, R3, Ra, Rb, Rc, Rd, Y, Z, m, h и g соответствуют определенным выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе.
В определенных вариантах А является арилом (например, фенилом или нафтилом), необязательно замещенным одним или двумя R2, где каждый R2 независимо выбран из галогена, галоалкила, арила, гетероарила, алкила, -ORa, -COORc или -CONRcRc; a D, D1, L, R1, R3, Ra, Rb, Rc, Rd, X, Y, Z, W, n, m, h и g соответствуют определенным выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе. В некоторых аспектах этих вариантов D и D1 являются N. В некоторых аспектах этих вариантов, по меньшей мере, один из W, X, Y и Z является N. В некоторых аспектах этих вариантов один из W, Y и Z является N; h равен 1 и g равен 1.
В определенных вариантах А является гетероарилом (например, N-содержащим моноциклическим гетероарилом или N-содержащим бициклическим гетероарилом), а D, D1, L, R1, R3, Ra, Rb, Rc, Rd, X, Y, Z, W, n, m, h и g соответствуют определенным выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе. В некоторых вариантах А является 5-8-членным моноциклическим гетероарилом (например, пиридилом, пиримидилом или пиразилом), а D, D1, L, R1, R3, Ra, Rb, Rc, Rd, X, Y, Z, W, n, m, h и g соответствуют определенным выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе. В некоторых вариантах А является 5-8-членным N-содержащим моноциклическим гетероарилом, а D, D1, L, R1, R3, Ra, Rb, Rc, Rd, X, Y, Z, W, n, m, h и g соответствуют определенным выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе. В некоторых вариантах А является необязательно замещенным пиридилом (например, 2-пиридил, 3-пиридил или 4-пиридил), необязательно замещенным пиримидилом (например, 2-пиримидил или 5-пиримидил) или необязательно замещенным пиразилом (например, 2-пиразил), a L, R1, R3, Ra, Rb, Rc, Rd, Y, Z, m, h и g соответствуют определенным выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе.
В некоторых вариантах осуществления настоящего изобретения А замещен одним R2, a D, D1, L, R1, R3, Ra, Rb, Rc, Rd, X, Y, Z, W, n, m, h и g соответствуют определенным выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе. В некоторых аспектах этих вариантов R2 является алкилом (например, метилом или этилом). В некоторых аспектах этих вариантов R2 является галогеном. В некоторых аспектах этих вариантов R2 является фтором (F). В некоторых аспектах этих вариантов R2является бромом (Br). В некоторых аспектах этих вариантов R2 является хлором (Cl). В некоторых аспектах этих вариантов R2 является -ORa. В некоторых аспектах этих вариантов Rd является алкилом (например, метилом).
В некоторых вариантах осуществления настоящего изобретения А замещен двумя R2, a D, D1, L, R1, R3, Ra, Rb, Rc, Rd, X, Y, Z, W, n, m, h и g соответствуют определенным выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе. В некоторых аспектах этих вариантов оба R2 являются алкилами (например, метилом). В некоторых аспектах этих вариантов оба R2 являются -ORa. В некоторых аспектах этих вариантов один R2 является галогеном, а другой является -ORa. В некоторых аспектах этих вариантов один R2 является бромом (Br), а другой является -ORa. В некоторых аспектах этих вариантов один R2 является хлором (Cl), а другой является -ORa. В некоторых аспектах этих вариантов один R2 является фтором (F), а другой является -ORa. В некоторых аспектах этих вариантов Rd является алкилом (например, метилом или этилом). В некоторых аспектах этих вариантов оба R2 являются -ORa. В некоторых аспектах этих вариантов два -ORa, взятые вместе с атомами углерода, с которыми они связаны, формируют гетероцикл. В некоторых вариантах А является


где:
W, X, Y и Z - каждый независимо выбран из СН или N;
D и D1 - независимо выбраны из связи или NRb;
А необязательно замещен арилом или необязательно замещен гетероарилом;
L является связью, -С(O)-, -(CRcRc)m-, -OC(O)-, -C(O)NRb-;
R1 независимо выбран из алкила, циклоалкила, арила, гетероарила и гетероциклила; каждый из которых замещен 0-3 Rd;
каждый R3 независимо выбран из гало, галоалкила, алкила, гидроксила и -ORa; или два соседние R3, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный циклил;
каждый Ra независимо выбран из алкила и галоалкила;
каждый Rb независимо выбран из водорода и алкила;
каждый Rc независимо выбран из водорода, гало, алкила, алкокси и галоалкокси, или два Rc, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный циклоалкил;
каждый Rd независимо выбран из гало, галоалкила, алкила, нитро, циано и -ORa, или два Rd, взятые вместе с атомами углерода, к которым они присоединены, формируют необязательно замещенный гетероциклил;
n равно 0, 1 или 2;
m равно 1, 2 или 3;
h равно 0, 1, 2; и
g равно 0, 1 или 2. В некоторых аспектах этих вариантов A, D, D1, L, R1, R3, Ra, Rb, Rc, Rd, X, Y, Z, W, n, m, h и g соответствуют определению в любом из вариантов или аспектов, описанных в настоящем документе.
В другом варианте осуществления настоящего изобретения представлено соединение формулы (I) или его фармацевтически приемлемая соль, или фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль:

где:
W, X, Y и Z - каждый независимо выбран из СН или N;
D и D1 - независимо выбраны из связи или NRc;
А необязательно замещен арилом или необязательно замещен гетероарилом;
R1 независимо выбран из алкила, необязательно замещенного арила и необязательно замещенного гетероарила;
каждый R3 независимо выбран из гало, галоалкила, алкила и -ORa;
каждый Ra независимо выбран из алкила, галоалкила и необязательно замещенного гетероарила;
каждый Rb независимо является алкилом;
каждый Rc независимо выбран из водорода или алкила;
n равно 0, 1 или 2;
h равно 0, 1, 2; и
g равно 0, 1 или 2. В некоторых аспектах этих вариантов А, D, D1, L, R1, R3, Ra, Rb, Rc, Rd, X, Y, Z, W, n, m, h и g соответствуют определению в любом из вариантов или аспектов, описанных в настоящем документе.
В другом варианте осуществления настоящего изобретения представлено соединение или фармацевтически приемлемая соль формулы (Ib), или фармацевтическую композицию, включающую соединение или фармацевтически приемлемую соль формулы (Ib):

где A, L, R1, R3, Ra, Rb, Rc, Rd, W, X, Z, m, h и g соответствуют определению, данному выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе.
В некоторых вариантах X, W и Z являются СН. В некоторых вариантах один из X, W и Z является N, а другие два из X, W и Z являются СН.
В другом варианте представлена фармацевтическая композиция, включающая соединение или его фармацевтически приемлемую соль формулы (Ic) или фармацевтическая композиция, включающая соединение или его фармацевтически приемлемую соль формулы (Ic):

где A, L, R1, R3, Ra, Rb, Rc, Rd, W, X, Y, m, h и g соответствуют определению, данному выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе.
В некоторых вариантах X, Y и W являются СН. В некоторых вариантах один из X, Y и W является N, а другие два из X, Y и W являются СН.
В другом варианте представлено соединение или фармацевтически приемлемая соль формулы (Id) или фармацевтическая композиция, включающая соединение или его фармацевтически приемлемую соль формулы (Id):
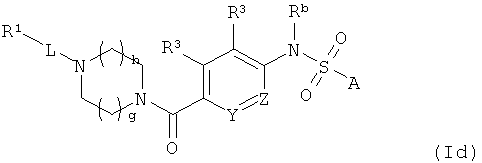
где A, L, R1, R3, Ra, Rb, Rc, Rd, Y, Z, m, h и g соответствуют определению, данному выше в формуле (I) или любому из вариантов или аспектов, описанных в настоящем документе.
В некоторых вариантах Y и Z являются СН. В некоторых вариантах один из Y и Z является N, а один из Y и Z является СН.
В другом варианте представлено соединение или его фармацевтически приемлемая соль формулы (Ie) или фармацевтическая композиция, включающая соединение или его фармацевтически приемлемую соль формулы (Ie):

где А, L, R1, R3, Ra, Rb, Rc, Rd, W, X, Y, Z, m, h и g соответствуют определению, данному выше в формуле (I), или любому из вариантов или аспектов, описанных в настоящем документе.
В определенных вариантах типичные соединения формулы I включают соединения, описанные на фигуре 1 и в примерах. В некоторых вариантах соединение, описанное в настоящем документе, модулирует ПКМ2 посредством взаимодействия (например, связывания) с ФДФ-связывающим карманом. Например, соединение, описанное в настоящем документе, может соревноваться с ФДФ, связывающим ПКМ2.
В некоторых вариантах соединение, описанное в настоящем документе, обладает одним или более свойствами, описанными в настоящем документе, в частности, одним или более следующих свойств: является аллостерическим модулятором (в частности, активатором); модулирует выброс ФДФ (в частности, активирует); является модулятором (в частности, агонистом) ФДФ, например, агонистом, образующим связь с более низкой, приблизительно такой же или более высокой аффинностью, чем ФДФ; модулирует (в частности, активирует) растворение тетраметрической ПКМ2; модулирует (в частности, активирует) сборку тетраметрической ПКМ2; селективно модулирует (в частности, активирует) ПКМ2, по меньшей мере, больше одной другой изоформы ПК, например, избирателен для ПКМ2, больше чем для ПКК, ПКМ1 или IIKL; обладает аффинностью к ПКМ2, превышающей аффинность по меньшей мере к одной из других изоформ ПК, например, ПКК, ПКМ1 или ITKL.
В другом варианте активатор ПКМ2, используемый в способах и композициях, описанных в настоящем документе, действует с помощью или обладает одним или более из приведенных далее механизмов или свойств:
а. является аллостерическим активатором ПКМ2;
б. модулирует (в частности, стабилизирует) связывание ФДФ со связывающим пакетом ПКМ2;
в. модулирует (в частности, активирует) выброс ФДФ из связывающего кармана ПКМ2;
г. является модулятором (в частности, агонистом), например, аналогом ФДФ, например, агонистом, связывающим ПКМ2 с более низкой, примерно одинаковой или более высокой аффинностью, чем ФДФ;
д. модулирует (в частности, активирует) растворение тетраметрической ПКМ2;
е. модулирует (в частности, активирует) сборку тетраметрической ПКМ2;
ж. модулирует (в частности, стабилизирует)тетраметрическую конформацию ПКМ2;
з. модулирует (в частности, активирует) связывание фосфотирозина, содержащего полипептид, с ПКМ2;
и. модулирует (в частности, активирует) способность фосфотирозина, содержащего полипептид, индуцировать выброс ФДФ из ПКМ2, например, путем индуцирования изменения конформации ПКМ2, в частности, в позиции Lys 433, таким образом, препятствуя выбросу ФДФ;
к. связывает или меняет позицию Lys 433 по отношению к связывающему карману ФДФ;
л. избирательно модулирует (в частности, активирует) ПКМ2 более, по меньшей мере, одной другой изоформы ПК, например, избирателен для ПКМ2 более чем для одной или более ПКК, ПКМ1 или ПКЬ;
м. обладает аффинностью к ПКМ2, превышающей аффинность, по меньшей мере, к одной другой изоформе ПК, например, UKR, ПКМ1 или ПKL.
Способность соединения, описанного в настоящем документе, активировать ПКМ2 может быть испытана. Для простоты интенсивность активации этих соединений представлена как АС50 на фигуре 1 и по всей заявке. Типовые соединения представлены на фигуре 1. Как показано на фигуре 1, «А» соответствует активатору ПКМ2 с ЕС50<100 нмоль. «В» соответствует активатору ПКМ2 с EC50 от 100 нмоль до 500 нмоль. «С» соответствует активатору ПКМ2 с ЕС50 от 500 нмоль до 1000 нмоль. «D» соответствует активатору ПКМ2 с ЕС50 от 1 мкМ до 10 мкМ. Данные для «Е» отсутствуют.
Соединения, описанные в настоящем документе, могут быть получены при помощи разнообразных способов синтеза.
Схема 1.

Представленная выше схема 1 является типовой схемой, изображающей типичный синтез определенных соединений, описанных в настоящем документе. Сульфонилхлорид 1 взаимодействует с амином 2 при стандартных условиях сочетания с образованием эфира 3. Гидролиз эфира 3 при использовании гидроксида лития приводит к образованию карбоновой кислоты 4. Пиперазин (5) с соответствующим бромидом при стандартных условиях сочетания в присутствии палладия дает соединение 7. На карбоновую кислоту 4 затем действует производное пиперазина 7 с образованием конечного соединения 8.
Как может быть оценено специалистом, способы синтеза соединений с формулами, приведенными в настоящем документе, ясны специалистам в данной области. Кроме того, различные этапы синтеза могут быть выполнены в альтернативной последовательности или порядке получения желаемых соединений. Химические изменения при синтезе и способологии защитных групп (защита и снятие защиты), используемые при синтезе соединений, описанных в настоящем документе, известны специалистам и включают, в частности, таковые, описанные в работах Р.Ларок «Всеобщие органические превращения», ВСХ Паблишере (1989); Т.У.Грин и Р.Дж.М.Уутс «Защитные группы в органическом синтезе», 2-е изд., Джон Уилей и сыновья (1991); Л.Физер и М.Физер «Физер и реагенты Физера для органического синтеза», Джон Уилей и сыновья (1994) и Л.Пакетт, изд. «Энциклопедия реагентов для органического синтеза», Джон Уилей и сыновья (1995) и последующие издания таковых.
Соединения, представленные в настоящем документе, могут содержать один или больше асимметричных центров и, таким образом, появляться в качестве рацематов и рацемических смесей, одиночных энантиомеров, отдельных диастереомеров и диастереомических смесей. Все такие изомерные формы этих соединений безоговорочно включены в область действия. Если не указано особо, если соединению дается название или изображается структура без уточнения стереохимии и соединение имеет один или больше хиральных центров, подразумевается представление всех возможных стереоизомеров соединения. Соединения, представленные в настоящем документе, также могут содержать связи (например, углерод-углеродные связи) или группы заместителей, которые могут ограничивать вращение связей, в частности, ограничение в результате наличия кольца или двойной связи. Соответственно, все цис/транс и E/Z изомеры безоговорочно включены.
Соединения, представленные в настоящем документе (например, формула I) также могут содержать одно и больше изотопных замещений. Например, Н может находиться в любой изотопной форме, включая1Н,2H (D или дейтерий) и3Н (Т или тритий); С может находиться в любой изотопной форме, включая12С,13С и14C; О находиться в любой изотопной форме, включая16О и18O; и так далее. Соединения, представленные в настоящем документе, также могут быть представлены во множественных таутомерных формах, в таких случаях безоговорочно включаются все таутомерные формы соединений, описанных в настоящем документе, даже если может быть представлена только единственная таутомерная форма (например, алкилирование кольца может привести к алкилированию в нескольких местах; все продукты реакции безоговорочно включаются). Все такие изомерные формы соединений безоговорочно включаются. Все кристаллические формы соединений, описанных в настоящем документе, безоговорочно включены.
Соединения, представленные в настоящем документе, включают сами соединения, а также, если применимо, их соли и их пролекарства. Соль, например, может быть сформирована между анионом и положительно заряженным заместителем (например, аминогруппа) соединения, описанного в настоящем документе. Подходящими анионами являются хлорид, бромид, йодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат и ацетат. Аналогично соль может быть сформированамежду катионом и отрицательно заряженным заместителем (например, карбоксилат) соединения, описанного в настоящем документе. Подходящими катионами являются ион натрия, ион калия, ион магния, ион кальция и катион аммония, такой как ион тетраметиламмония. К примерам пролекарств относятся эфиры и другие фармацевтически приемлемые производные, которые, при применении у субъекта, в состоянии предоставить активные соединения.
Соединения, представленные в настоящем документе, могут быть модифицированы с помощью дополнения соответствующих функциональностей для усиления выбранных биологических свойств, например, нацеленность на определенную ткань. Такие модификации известны специалистам и включают те, которые увеличивают биологическое проникновение в заданные биологические пространства (например, кровь, лимфатическая система, центральная нервная система), увеличивают пероральную доступность, увеличивают растворимость для возможности инъекционного применения, меняют метаболизм и меняют скорость выведения.
В альтернативном варианте осуществления соединения, описанные в настоящем документе, могут быть использованы как платформы или площадки, которые могут быть использованы в способах комбинаторной химии для получения производных и/или химических библиотек соединений. Такие производные и библиотеки соединений обладают биологической активностью и пригодны для определения и разработки соединений, обладающих специфической активностью. Способах комбинаторной химии пригодные для использования соединений, описанных в настоящем документе, известны специалистам, что следует из издания Обрехт, Д. и Виллалгродо, Дж.М. «Комбинаторный с твердой подложкой и параллельный синтез библиотек соединений с маленькой молекулярной массой», Пергамон-Элсевьер Сайнс Лимитед (1998), и включают такие способы как "смешение-разделение" или техники «параллельного» синтеза, способы синтеза с твердой подложкой и синтеза в жидкой среде и способы кодирования (например, Цзарник, А.У., Общ. Мнен. Хим. Био., (1997) 1,60. Таким образом, один вариант связан с способом использования соединений, описанных в настоящем документе, для разработки производных или химических библиотек, включающих: 1) обеспечение основы, охватывающей множество лунок; 2) обеспечение одного или более соединений, идентифицированных по способам, описанных в настоящем документе в каждой лунке; 3) обеспечение одного или больше дополнительного химического продукта в каждой лунке; 4) изолирование одного и более конечного продукта из каждой лунки. Альтернативный вариант связан с способом использования соединений, описанных в настоящем документе, для получения производных или химических библиотек, включающих: 1) обеспечение одного и более соединений, описанных в настоящем документе, связанных с твердой подложкой; 2) обработку одного и более соединений, индентифицированных способами, описанными в настоящим документе, связанных с твердой подложкой, одним и более дополнительными химическими соединениями; 3) изолирование одного и более конечного продукта от твердой подложки. В способах, описанных выше, «метки», или идентификатор, или маркирующие агенты могут быть присоединены к и/или отсоединены от соединений, описанных в настоящем документе, или их производных для облегчения слежения, определения подлинности или изоляции желаемых продуктов или их промежуточных продуктов. Такие химические соединения известны специалистам. Химические соединения, используемые в вышеуказанных способах, могут включать, в частности, растворители, реагенты, катализаторы, реагенты защитной группы и реагенты группы снятия защиты и тому подобное. Примеры таких химических соединений существуют в различных текстах, посвященных химии синтетических и защитных групп, а также в монографиях, упоминаемых в настоящем документе.
Определения
Термин «гало» или «галоген» соответствует любому радикалу фтора, хлора, брома или йода.
Термин «алкил» соответствует углеводородной цепочке, которая может быть прямой или разветвленной, содержащей указанное число атомов углерода. Например, алкил C1-C12 указывает, что группа может содержать от 1 до 12 (включительно) атомов углерода. Термин «галоалкил» соответствует алкилу, в котором один или более атомов водорода замещены галогеном, и включает алкильные молекулы, в которых все атомы водорода были замещены галогенами (например, перфторалкил). Термины «арилалкил» или «аралкил» соответствует алкильной молекуле, в которой алкильный атом водорода замещен на арильную группу. Аралкил включает группы, в которых более чем один атом водорода был замещен на арильную группу. К примерам «арилалкила» или «аралкила» включают бензильную, 2-фенилэтильную, 3-фенилпропильную, 9-фторенильную, бензгидрильную и тритильную группы.
Термин «алкилен» соответствует бивалентному алкилу, например -СН2-, -СН2СН2- и -СН2СН2СН2-.
Термин «алкенил» соответствует прямой или разветвленной углеводородной цепочке, содержащей 2-12 атомов углерода и имеющей одну или более двойных связей. Примеры алкенильных групп включают, но не ограничиваются ими, аллильную, пропенильную, 2-бутенильную, 3-гексенильную и 3-октенильную группы. Одна из двойных углеродных связей может необязательно быть местом связывания алкенильного заместителя. Термин «алкенил» соответствует прямой или разветвленной углеводородной цепочке, содержащей 2-12 атомов углерода и имеющей одну или более тройных связей. Примеры алкинильных групп включают, но не ограничиваются ими, этинильную, пропаргиловую и 3-гексинильную группу. Одна из тройных связей может необязательно быть местом связывания алкинильного заместителя.
Термины «алкиламино» и «диалкиламино» соответствуют радикалам -NH(алкил) и -NH(алкил)2 соответственно. Термин «аралкиламино» соответствует радикалу -NH(аралкил). Термин алкиламиноалкил соответствует радикалу (алкил)NH-алкил-; термин диалкиламиноалкил соответствует радикалу (алкил)2N-алкил-. Термин «алкокси» соответствует радикалу O-алкил. Термин «меркапто» соответствует радикалу SH. Термин «тиоалкокси» соответствует -S-алкильному радикалу. Термин тиоарилокси соответствует -S-арильному радикалу.
Термин «арил» соответствует моноциклическому, бициклическому или трициклическому ароматическому углеводородному кольцу, в котором любой атом кольца способный к замещению, может быть замещен (например, одним или более заместителем). Примеры арильных молекул включают фенил, нафтил и антраценил, но не ограничиваются ими.
Термин «циклоалкил», примененный в настоящем документе, включает циклические, бициклические, трициклические или полициклические неароматические углеводородные группы, имеющие от 3 до 12 атомов углерода. Любой замещаемый атом кольца может быть замещен (например, одним и более заместителем). Циклоалкильные группы могут содержать сочлененные или соединенные одним общим атомом кольца. Сочлененные кольца - это кольца, делящие общий атом углерода. Примеры циклоалкильных молекул включают циклопропил, циклогексил, метилциклогексил, адамантил и норборнил, но не ограничиваются ими.
Термин «гетероциклил» или «гетероциклическая группа» соответствует 3-14-членным неароматическим кольцам (например, 3-14-членные кольца, преимущественно 3-7-членные кольца), структура колец которых включает от одного до четырех гетероатомов, независимо выбранных из О, N или S. Гетероцикл или гетероциклическая группа может содержать сочлененные или соединенные одним общим атомом кольца. Гетероциклы также могут являться полициклами, при этом каждая группа имеет, например, 5-7 атомов в гетероцикле. Термин «гетероциклил» или «гетероциклическая группа» включает предельные или частично насыщенные гетероцикличные структуры. Термин «гетероарил» соответствует 5-14-членному (например, 5-8-членному моноциклическому, 8-12 членному бициклическому или 11-14-членному трициклическому) ароматическому кольцу, обладающему 1-3 гетероатомами в моноциклическом кольце, 1-6 гетероатомами в бициклическом кольце или 1-9 гетероатомами в трициклическом кольце, указанные гетероатомы кольца независимо выбраны из О, N и S (например, 1-3, 1-6 или 1-9 гетероатомов моноциклического, бициклического и трициклического кольца соответственно). Любой замещаемый атом кольца может быть замещен (например, одним или более заместителем). Гетероциклические и гетероарильные группы включают, в частности, тиофен, тиантрен, фуран, пиран, изобензофуран, хромен, ксантен, феноксантин, пиррол, имидазол, пиразол, изотиазол, изоксазол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, птеридин, карбазол, карболин, фенантридин, акридин, пиримидин, фенантролин, феназин, фенарсазин, фенотиазин, фуразан, феноксазин, пирролидин, оксолан, тиолан, оксазол, пиперидин, пиперазин, морфолин, лактоны, лактамы, такие как азетидиноны и пирролидиноны, сультамы, сультоны и тому подобные. Гетероциклическое или гетероарильное кольцо может быть замещено в одной или более позициях такими заместителями, описанными в настоящем документе, как галоген, алкил, аралкил, алкенил, алкил, циклоалкил, гидроксил, амино, нитро, сульфгидрил, имино, амидо, фосфат, фосфонат, фосфинат, карбонил, карбоксил, силил, алкилтио, сульфонил, кетон, альдегид, эфир, гетероцикл, ароматическая или гетероароматическая молекула, -CF3, -CN или тому подобное.
Термин «гетероциклилалкил», использованный в настоящем документе, соответствует алкильной группе, замещенной гетероциклической группой.
Термин «циклоалкенил» соответствует частично ненасыщенным неароматическим моноциклическим, бициклическим или трициклическим углеводородным группам, имеющим от 5 до 12 атомов углерода, преимущественно от 5 до 8. Ненасыщенный углерод может необязательно быть местом связи с циклоалкенильным заместителем. Любой замещаемый атом кольца может быть замещен (например, одним или более заместителем). Циклоалкенильные группы могут содержать сочлененные или соединенные одним общим атомом кольца. Сочлененные кольца - это кольца, делящие общий атом углерода. Примеры циклоалкенильных молекул включают циклогексенил, циклогексадиенил или норборненил, но не ограничиваются ими.
Термин «гетероциклоалкенил» соответствует частично насыщенному неароматическому 5-10-членному моноциклическому, 8-12-членному бициклическому или 11-14-членному трициклическому кольцу, обладающему 1-3 гетероатомами в моноцикле, 1-6 гетероатомами в бицикле или 1-9 гетероатомами в трицикле, указанные гетероатомы выбраны независимо из О, N и S (например, 1-3, 1-6 или 1-9 гетероатомов N, О или S в моноциклическом, бициклическом или трициклическом кольце соответственно). Ненасыщенный углерод или гетероатом могут необязательно быть точкой связи с гетероциклоалкенильным заместителем. Любой замещаемый атом кольца может быть замещен (например, одним и более заместителями). Гетероциклоалкенильные группы могут содержать сочлененные кольца. Сочлененные кольца - это кольца, делящие общий атом углерода. Примеры гетероциклоалкенильных молекул включают тетрагидропиридил и дигидропиранил, но не ограничиваются ими.
Термины «гетаралкил и «гетероаралкил», использованные в настоящем документе, соответствуют алкильной группе, замещенной гетероарильной группой. Гетероатомы кольца соединений, представленных в настоящем документе, включают N-O, S(O) и S(O)2.
Термин «оксо» соответствует атому кислорода, образующему карбонил при присоединении к углероду, N-оксид при присоединении к азоту и сульфоксид или сульфон при присоединении к сере.
Термин «ацил» соответствует алкилкарбонильному, циклоалкилкарбонильному, арилкарбонильному, гетероциклилкарбонильному или гетероарилкарбонильному заместителю, любой из которых может быть также замещен (например, одним или более заместителем).
Термин «заместители» относится к группе, «замещенной» на алкильной, циклоалкильной, алкенильной, алкинильной, гетероциклической, гетероциклоалкенильной, циклоалкенильной, арильной или гетероарильной группе на замещаемом атоме группы. Любой замещаемый атом может быть замещен. Если не указано иначе, к таким заместителям относятся, без ограничений, алкил (например, С1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12 прямые или разветвленные цепи алкила), циклоалкил, галоалкил (например, такой перфторалкил как CF3), арил, гетероарил, аралкил, гетероаралкил, гетероциклил, алкенил, алкинил, циклоалкенил, гетероциклоалкенил, алкокси, галоалкокси (например, перфторалкокси OCF3), гало, гидрокси, карбокси, карбоксилат, циано, нитро, амино, алкиламино, SO3H, сульфат, фосфат, метилендиокси (-O-СН2-O-, в котором атомы кислорода соединены с вициальными атомами), этилендиокси, оксо (не является заместителем на гетероариле), тиоксо (например, C=S) (не является заместителем на гетероариле), имино (алкил, арил, аралкил), S(O)nалкил (где n равно 0-2), S(O)nарил (где n равно 0-2), S(O)n гетероарил (где n равно 0-2), S(O)nгетероциклил (где n равно 0-2), амин (моно-, ди-, алкил, циклоалкил, аралкил, гетероаралкил, арил, гетероарил и их комбинации), эфир (ажил, аралкил, гетероаралкил, арил, гетероарил), амид (моно-, ди-, алкил, аралкил, гетероаралкил, арил, гетероарил и их комбинации), сульфонамид (моно-, ди-, алкил, аралкил, гетероаралкил и их комбинации). С одной стороны, заместители на группе являются независимо любым одиночным или любой подгруппой вышеупомянутых заместителей. С другой стороны, заместитель может сам быть замещенным любым из приведенных выше заместителей.
Термин «избирательно» означает, по меньшей мере, в 2, 3, 4, 5, 6 или 10 раз большую модуляцию (например, активацию) ПКМ2, чем ПКМ1.
Термин «активатор», используемый в настоящем документе, означает вещество, который (измеримо) увеличивает активность пируваткиназы (например, ПКМ2) или является причиной повышения активности пируваткиназы (например, ПКМ2) до уровня, превышающего исходные уровни активности ПКМ2. Например, активатор может имитировать эффект, вызванный естественным лигандом (например, ФДФ). Активирующее действие, вызванное соединением, представленным в настоящем документе, может быть таким же, более выраженным или менее выраженным, чем активирующее действие естественного лиганда, но тип действия тот же. Соединение, представленное в настоящем документе, может быть исследовано для определения, является ли оно активатором, путем прямого или непрямого измерения активности пируваткиназы при воздействии указанного соединения. Активность соединения, представленного в настоящем документе, может быть измерена, в частности, в сравнении с контрольным веществом. В ряде случаев измеренная активность испытываемого соединения, имеется для активации ПКМ2. Активность ПКМ2 может быть измерена, например, путем мониторинга концентрации таких веществ как АТФ или НАДН.
Аббревиатуры Me, Et, Ph, Tf, Nf, Ts, Ms обозначают метил, этил, фенил, трифторметансульфонил, нонафторбутансульфонил, p-толуенсульфонил и метансульфонил соответственно. Более полный список аббревиатур, используемый специалистами химиками-органиками, приводится в первом выпуске каждого тома Журнала органической химии; этот список, как правило, представлен в таблице, озаглавленной Стандартный список аббревиатур. Аббревиатуры, входящие в указанный список, а также все аббревиатуры, используемые специалистами химиками-органиками, включены в данный документ ссылкой на них.
Способы опенки соединений
Способность соединений, описанных в настоящем документе, модулировать ПКМ2 (например, активировать ПКМ2) может быть исследована известными специалистам способами. В некоторых вариантах воплощения настоящего изобретения способность описанных соединений модулировать ПКМ2 (например, активировать ПКМ2) оценивают в условиях нехватки серина. В некоторых вариантах типичные способы учитывают включение соединения в клеточный анализ, который позволяет оценить способность модулировать (например, активировать) ПКМ2. В частности, при контакте вероятного соединения с клеткой производится измерение потребления кислорода или производства лактата. Изменение клеточного фосфоенолпирувата, изменение глицерин-фосфата, изменение рибозы или дезоксирибозы, изменение синтеза липидов, или изменение в преобразовании глюкозы в липиды, нуклеиновые кислоты, аминокислоты или белки может также использоваться для оценки способности соединения модулировать ПКМ2 (например, активировать ПКМ2). Оценка может также включать измерение изменения пирувата или определение изменения потенциала митохондриальной мембраны, например, по измерениям с помощью флуоресцентных потенциометрических красителей.
Активность фермента ПКМ2, исследуемая при скрининге/испытании, может быть измерена, в частности, путем мониторинга концентрации субстрата (например, АТФ или НАДН), присутствующего в реакционной смеси. Пируват, являющийся продуктом ферментативной активности пируваткиназы, превращается в лактат при помощи лактатдегидрогеназы, которая требует потребления НАДН (НАДН→НАД+). Таким образом, активность ПКМ2 может быть косвенно измерена путем мониторинга потребления НАДН, например, посредством флуоресцентного анализа. Таким образом, активность фермента ПКМ2 может напрямую отслеживаться измерением выработки АТФ, так как АТФ образуется при преобразовании фосфоенолпирувата в пируват. Способы мониторинга количества субстрата в реакционной смеси включают, в частности, измерение абсорбции, флуоресценции, комбинационное рассеяние света, измерение фосфоресценции, люминесценции, измерение анализ люциферазы и радиоактивности.
Процедура скрининга требует наличия определенных компонентов в реакционной смеси. Компоненты, используемые в анализе, включают, в частности, нуклеозид дифосфат (например, АДФ), фосфоенолпируват, НАДН, лактатдегидрогеназу, ФДФ, восстановитель (например, дитиотреитол), детергент (например, Бридж 35), глицерин и растворитель (например, ДМСО). Условия типовых реакций представлены в таблице 1.
В некоторых вариантах осуществления настоящего изобретения, соединение, описанное в настоящем документе, может быть оценено при клеточном анализе/анализе вне организма (ex vivo). Например, клетку обрабатывают соединением, описанным в настоящем документе (то есть, активатором пируваткиназы - М2), и соединение оценивается, например, по способности проникать в клетку и связывать ПКМ2, приводя к формированию активированной конформации ПКМ2. Избыток несвязанного соединения может быть вымыт с помощью фосфатно-солевого буферного раствора, а клетки лизированы, например, путем быстрого замораживания на сухом льду, с последующим добавлением детергент-содержащего лизирующего буфера. Лизат, в котором активированная ПКМ2 остается интактной, может быть затем удален и добавлен в химическую смесь, включающую вещества, необходимые для измерения активности пируваткиназы. Анализ может быть совмещен с другим анализом, таким как анализ, совмещенный с ферментом лактатдегидрогеназой-А. Величина измеренной активности пируваткиназы может быть нормализована по общему содержанию белка в лизате и соотнесена с концентрацией добавленного в клетку активатора ПКМ2. Это позволяет получить значение АС50 (концентрация, при которой ПКМ2 активируется на 50%). Также может быть рассчитано общее кратное увеличение активности по сравнению с клетками, обработанными имитатором соединения, а "максимальный уровень активации" может быть использован для распознавания соединений, полностью активирующих ПКМ2, и соединений, которые могут лишь частично активировать ПКМ2. В случае измерения активности ПКМ2 в ткани (например, в клеточной опухоли), соединение можно дозировать животным с представляющей интерес тканью/опухолью. По истечении определенного периода времени, за которое было достигнуто воздействие на представляющую интерес ткань/опухоль-мишень, ткань/ опухоль может быть забрана у животного, подвергнута быстрому замораживанию, а затем лизирована и гомогенизирована. В данном лизате может быть произведено количественное определение активности пируваткиназы как описано выше.
ПКМ1 и ПКМ2 для использования при способах скрининга/испытании, описанных в настоящем документе, могут быть получены любым известным способом для экспрессии рекомбинантных белков. Например, нуклеиновые кислоты, кодирующие желаемый полипептид, могут быть введены в различные типы клеток и бесклеточные системы для экспрессии. Могут быть созданы эукариотические (например, линии клеток COS, HEK293T, СНО и NIH) и прокариотические (например, кишечная палочка) экспрессирующие системы, в которых последовательность для ПКМ вводится в плазмид или другой вектор, используемый затем для преобразования живых клеток. Конструкции, в которых кДНК ПКМ содержит полную открытую рамку считывания или биологически активные фрагменты таковой, вставляют в правильной ориентации в экспрессирующий плазмид и могут быть использованы для экспрессии белка. Прокариотические и эукариотические экспрессирующие системы допускают экспрессию и восстановление рекомбинационных белков, в которых белок ПКМ ковалентно связан с аминоконцевой или карбокисконцевой стороной меченой молекулы, что облегчает идентификацию и/или очистку. К примерам меток, которые могут быть использованы, относятся гексагистидин, НА, FLAG, и с-myc эпитопные метки. Ферментативный или химический участок рестрикции может быть создан между белком ПКМ и меченой молекулой таким образом, чтобы метка могла быть удалена после очистки.
Соединения, служащие в качестве активаторов ПКМ2, демонстрируют специфичность и активацию фермента ПКМ2 при отсутствии ФДФ на уровне превышающем на 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 99 или 100% таковой в присутствии ФДФ. Более того, соединения могут быть оценены в присутствии или отсутствии пептида фосфотирозина. Связывание пептида фосфотирозина с ПКМ2 приводит к отделению ФДФ от ПКМ2 и конформационным изменениям ПКМ2 из активной тетрамерной формы в неактивную. Соединения, связывающие ПКМ2 и блокирующие фермент с активной конфирмацией даже в присутствии пептида фосфотирозина, приводят к потере аллостерического контроля над ПКМ2, необходимого для сброса биохимических промежуточных продуктов из процесса гликолиза в процесс биосинтеза других промежуточных продуктов. Это, в свою очередь, приведет к подавлению роста раковых клеток, активированных иммунных клеток и жировых клеток.
Способы лечения
В одном из вариантов воплощения настоящего изобретения предоставлен способ лечения или профилактики заболевания, патологического состояния или нарушения, как описано в настоящем документе (например, лечения), включающий применение соединения, фармацевтически приемлемых солей соединения или фармацевтической композиции, включающей соединение, описанное в настоящем документе (например, соединение формулы (I), (I-а), (II) или на фигуре 1).
Соединения и композиции, описанные в настоящем документе, могут быть применены в культурах клеток, например in vitro (в пробирке) или ex vivo (вне организма) или у субъекта для лечения, профилактики и/или диагностики ряда нарушений, включая описанные ниже.
Термин «лечить» или «лечение», использованный в настоящем документе, означает наружное применение или введение соединения, одного или в комбинации со вторым соединением субъекту, например, пациенту, или наружное применение или введение соединения в изолированную ткань или клетку, например, клеточную линию, полученную от субъекта, например, пациента с заболеванием (например, заболевание, описанное в настоящем документе), симптомом заболевания, или предрасположенностью к заболеванию с целью лечения, исцеления, облегчения, ослабления, изменения, устранения, улучшения, корректирования или воздействия на заболевание, один или более симптомов заболевания или предрасположенность к заболеванию (например, для предупреждения, по меньшей мере, одного симптома заболевания или отсрочки начала, по меньшей мере, одного симптома заболевания).
Эффективная доза соединения для лечения нарушения, согласно настоящему документу, или «терапевтически эффективное количество» соответствует количеству соединения, эффективного при применении в однократной или многократных дозах у субъекта, при воздействии на клетку или в лечении, облегчении, устранении или улучшении состояния субъекта с заболеванием, превосходя ожидания при отсутствии такого лечения.
Доза соединения, эффективная в профилактике заболевания, согласно настоящему документу, или «профилактически эффективное количество» соединения соответствует количеству, эффективному при однократном или многократном применении у субъекта с целью профилактики или отсрочки начала проявления или рецидива заболевания или симптома заболевания.
Используемый в настоящем документе термин «субъект» соответствует человеку или животному. К типичным людям-субъектам относятся люди-пациенты страдающие заболеванием, например, заболеванием, описанным в настоящем документе, или здоровые субъекты. Термин «животные» включает в себя всех позвоночных, например, не млекопитающих (таких как куры, земноводные, пресмыкающиеся) и млекопитающих, таких как приматы кроме человека, животные, используемые в домашнем и/или сельском хозяйстве, например, овцы, собаки, кошки, коровы, свиньи и так далее.
Опухолевые заболевания
Соединение или композиция, описанные в настоящем документе, могут использоваться с целью лечения опухолевых заболеваний. «Опухолевое заболевание» - это заболевание или нарушение, характеризующееся наличием клеток, способных к автономному росту и размножению, например, патологическое состояние, характеризующееся пролиферативным клеточным ростом. Примером опухолевых заболеваний могут служить карцинома, саркома, метастатические заболевания (например, опухоли простаты, толстой кишки, легких, молочной железы и печени), опухолевые заболевания органов кроветворения, в частности, лейкозы, метастатические опухоли. Широко распространенные виды рака включают в себя: рак молочной железы, простаты, толстой кишки, легких, печени и поджелудочной железы. Лечение соединением может проводиться в дозе, эффективной для улучшения, по меньшей мере, одного из симптомов новообразования, в частности, уменьшения клеточной пролиферации, снижения массы опухоли и т.д.
Описанные способы эффективны при профилактике и лечении злокачественных заболеваний, включая, в частности, солидные опухоли, опухоли мягких тканей и метастазы. Приведенные способы эффективны также при лечении несолидных опухолей. К солидным опухолям относятся злокачественные новообразования (например, саркомы, аденокарпиномы и карциномы) различных систем органов, например, легких, молочной железы, лимфоидной системы, желудочно-кишечного тракта (например, толстой кишки) и мочеполовых (например, почек, уротелиальные опухоли или опухоли яичка) путей, глотки, простаты и яичников. Примерами аденокарциномы могут служить колоректальный рак, почечно-клеточный рак, рак печени, немелкоклеточный рак легкого и рак тонкой кишки.
Другие примеры рака включают острый лимфобластный лейкоз у взрослых, острый лимфобластный лейкоз у детей, острый миелоидный лейкоз у взрослых; рак коры надпочечников; рак коры надпочечников у детей; СПИД-ассоциированная лимфома, СПИД-ассоциированные злокачественные новообразования; рак анального канала; астроцитома мозжечка у детей; астроцитома головного мозга у детей; рак внепеченочных желчных протоков; рак мочевого пузыря, рак мочевого пузыря у детей; рак костей, остеосаркома/злокачественная фиброзная гистиоцитома; глиома ствола головного мозга у детей, опухоль головного мозга у взрослых; опухоли головного мозга, глиома ствола головного мозга у детей; опухоль головного мозга, астроцитома мозжечка у детей, опухоль головного мозга, астроцитома головного мозга/злокачественная глиома у детей, опухоль головного мозга, эпендимома у детей; опухоль головного мозга, медуллобластома у детей; опухоль головного мозга, супратенториальные примитивные нейроэктодермальные опухоли у детей; опухоль головного мозга, глиома зрительных путей и гипоталамическая глиома у детей, опухоли головного мозга у детей (другие); рак молочной железы, рак молочной железы и беременность; рак молочной железы у детей, рак молочной железы у мужчин; бронхиальные аденомы/карциноиды у детей; карциноидная опухоль у детей; карциноидная опухоль желудочно-кишечного тракта; рак коры надпочечников; карцинома островковых клеток; карцинома неизвестного происхождения; лимфома центральной нервной системы, первичная; астроцитома мозжечка у детей; церебральная астроцитома/злокачественная глиома у детей; рак шейки матки; карциномы детского возраста; хронический лимфолейкоз; хронический миелолейкоз; хронические миелопролиферативные заболевания; светлоклеточная саркома сухожильного влагалища, рак толстой кишки, колоректальный рак у детей; Т-клеточная лимфома кожи, рак эндометрия; эпендимома у детей; эпителиальный рак яичников, рака пищевода, рак пищевода у детей; опухоли Юинга; экстракраниальные герминогенноклеточные опухоли у детей; экстрагонадные герминогенные опухоли; рак внепеченочных желчных протоков; рак глаз, внутриглазная меланома; рак глаз, ретинобластома; рак желчного пузыря; рак желудка, рак желудка у детей; карциноидная опухоль желудочно-кишечного тракта; герминогенные экстракраниальные опухоли у детей; герминогенные внегонадные опухоли; герминогенные опухоли яичников; гестационные трофобластические опухоли; глиома ствола мозга у детей; глиома зрительных путей и гипоталамуса у детей; ворсинчатоклеточная лейкемия; рак головы и шеи; гепатоцеллюлярный рак (печени) у взрослых (первичный); гепатоцеллюлярный рак (печени) у детей (первичный); лимфома Ходжкина у взрослых, лимфома Ходжкина у детей; лимфома Ходжкина во время беременности; поглоточный рак; глиома гипоталамуса и глиома зрительных путей у детей; внутриглазная меланома; карцинома островковых клеток (эндокринная часть поджелудочной железы); саркома Капоши, рак почек, рак гортани, рак гортани у детей; острый лимфобластный лейкоз у взрослых; острый лимфобластный лейкоз у детей; острый миелобластный лейкоз у взрослых; острый миелобластный лейкоз у детей; хронический лимфолейкоз, хронический миелобластный лейкоз; ворсинчатоклеточная лейкемия; рак губ и полости рта, рак печени у взрослых (первичный), рак печени у детей (первичный), немелкоклеточный рак легкого, мелкоклеточный рак легких; острый лимфобластный лейкоз у взрослых; острый лимфобластный лейкоз у детей; хронический лимфолейкоз; СПИД-ассоциированная лимфома; лимфома центральной нервной системы (первичная); Т-клеточная лимфома кожи; лимфома Ходжкина у взрослых; лимфома Ходжкина у детей; лимфома Ходжкина во время беременности; неходжкинская лимфома у взрослых, неходжкинская лимфома у детей; неходжкинская лимфома во время беременности; лимфома первичная центральной нервной системы; макроглобулинемия Вальденстрема; рак молочной железы у мужчин; злокачественная мезотелиома у взрослых; злокачественная мезотелиома у детей; злокачественная тимома; медуллобластома у детей; меланома; внутриглазная меланома; меркелиома; злокачественная мезотелиома; метастатический сквамозный рак шеи с неизвестным первичным происхождением; синдром множественных эндокринных неоплазий у детей; множественная миелома/плазмацитома; грибовидный микоз; миелодиспластические синдромы; хронический миелогенный лейкоз; острый миелоидный лейкоз у детей; множественная миелома; хронические миелопролиферативные нарушения; рак носовой полости и околоносовой пазухи; назофарингеальный рак; назофарингеальный рак в детском возрасте; нейробластома; неходжкинская лимфома у взрослых; неходжкинская лимфома у детей; неходжкинская лимфома во время беременности; немелкоклеточный рак легкого; рак полости рта у детей; рак полости рта и губы; ротоглоточный рак; остеосаркома/злокачественная фиброзная гистиоцитоксантома кости; рак яичников у детей; эпителиальный рак яичников; гоноцитома яичников; пограничная опухоль яичника; рак поджелудочной железы; рак поджелудочной железы у детей; рак поджелудочной железы, инсулоцитов; рак околоносовой пазухи и носовой полости; рак паращитовидной железы; рак полового члена; феохромоцитома; пинеальные и супратенториальные примитивные нейроэктодермальные опухоли у детей; опухоль гипофиза; плазмоцитома/множественная миелома; плевролегочная бластома; рак молочной железы и беременность; лимфома Ходжкина во время беременности; неходжкинская лимфома во время беременности; первичная лимфома центральной нервной системы; первичный рак печени у взрослых; первичный рак печени у детей; рак предстательной железы; рак прямой кишки; почечноклеточный рак (почки); почечноклеточный рак (почки) у детей; переходноклеточный рак почечной лоханки и мочеточника; ретинобластома; рабдомиосаркома у детей; рак слюнной железы; рак слюнной железы у детей; саркома Юинга; саркома Капоши; саркома (остеогенная саркома)/злокачественная фиброзная гистиоцитоксантома кости; саркома, рабдомиосаркома у детей; саркома мягких тканей у взрослых; саркома мягких тканей у детей; синдром Сезари; рак кожи; рак кожи у детей; рак кожи (меланома); рак кожи из клеток Меркеля; мелкоклеточный рак легких; рак тонкой кишки; саркома мягких тканей у взрослых; саркома мягких тканей у детей; первичный метастатический сквамозный рак шеи неизвестного происхождения; рак желудка; рак желудка у детей; супратенториальная примитивная нейроэктодермальная опухоль у детей; Т-клеточная лимфома кожи; рак яичка; тимома у детей; злокачественная тимома; рак щитовидной железы; рак щитовидной железы у детей; переходноклеточный рак почечной лоханки и мочеточника; гестационная трофобластическая болезнь; рак неизвестной первичной локализации у детей; редкие формы рака у детей; переходноклеточный рак почечной лоханки и мочеточника; рак уретры; саркома матки; рак влагалища; глиома зрительных путей и глиома гипоталамуса у детей; рак вульвы; макроглобулинемия Вальденстрема; опухоль Вильмса. Метастазы вышеупомянутых раков также могут подвергаться лечению или могут быть предотвращены в соответствии с способами, описанными в настоящем документе.
Комбинированное лечение рака
В некоторых вариантах осуществления настоящего изобретения соединение, описанное в настоящем документе, применяется с одним или более дополнительными способами лечения злокачественных заболеваний. Типичное лечение злокачественных заболеваний включает, например: химиотерапию, целевую терапию, такую как терапия антителами, иммунотерапию и гормональную терапию. Примеры каждого из этих способов лечения приведены ниже.
Химиотерапия
В некоторых вариантах соединение, описанное в настоящем документе, применяется с одной или более химиотерапией. Химиотерапия является способом лечения злокачественного новообразования лекарственными препаратами, разрушающими раковые клетки. «Химиотерапия», в отличие от целевой терапии, как правило, проводится цитотоксическими средствами, которые в большинстве случаев воздействуют на быстро делящиеся клетки. Химиотерапевтические препараты нарушают деление клеток различными возможными способами, например, путем дупликации ДНК или сепарации вновь образованных хромосом. Большинство видов химиотерапии нацелены на все быстро делящиеся клетки и не специфичны для раковых клеток, хотя некоторая степень специфичности может исходить из неспособности многих раковых клеток восстанавливать повреждения ДНК, в то время как нормальные клетки в большинстве случаев могут.
Примерами химиотерапевтических агентов, используемых в терапии рака, являются антиметаболиты (например, фолиевая кислота, пурин и производные пиримидина) и алкилирующие средства (например, препараты хлорметина, нитрозомочевины, платины, соли алкилсульфокислоты, гидразины, триазены, азиридины, веретенный яд, цитотоксические средства, ингибиторы топоизомеразы и другие). Типичными средствами являются акларубицин, актиномицин, алитретиноин, альтретамин, аминоптерин, аминолевулиновая кислота, амрубицин, амсакрин, анагрелид, окись мышьяка, аспарагиназа, атразентан, белотекан, бексаротен, бендамустин, блеомицин, бортезомиб, бусульфан, камптотецин, капецитабин, карбоплатин, карбоквон, кармофур, кармустин, целекоксиб, хлорамбуцил, хлорметин, цисплатин, кладрибин, клофарабин, кризантаспаз, циклофосфамид, цитарабин, дакарбазин, дактиномицин, дауномицин, децитабин, демеколцин, доцетаксел, доксорубицин, эфапроксирал, элескломол, элзамитруцин, эноцитабин, эпирубицин, эстрамустин, этоглюцид, этопозид, флоксуридин, флударабин, 5-фторурацил, фотемустин, гемцитабин, имплантанты Глиадела, гидроксикарбамид, гидроксимочевина, идарубицин, ифосфамид, иринотекан, ирофульвен, иксабепилон, ларотаксил, лейковорин, липосомальный доксорубицин, липосомальный дауномицин, лонидамин, ломустин, лукантон, манносульфан, мазопрокол, мелфалан, меркаптопурин, месна, метотрексат, метил-аминолевулинат, митобронитол, митогуазон, митотан, митомицин, митоксантрон, недаплатин, нимустин, облимерсен, омацетаксин, ортатаксел, оксалиплатин, паклитаксел, пегаспаргаза, пеметрексед, пентостатин, пирарубицин, пиксантрон, пликамицин, порфимер натрия, преднимустин, прокарбазин, ралтитрексед, ранимустин, рубитекан, сапацитабин, семустин, ситимаген цераденовек, сатраплатин, стрептозоцин, талапорфин, тегафур-урацил, темопорфин, темодал, тенипозид, тезетаксел, тестолактон, тетранитрат, тиотепа, тиазофурин, тиогуанин, типифарниб, топотекан, трабектедин, триациквон, триэтеленмеламин, триплатин, третиноин, треосульфан, трофосфамид, урамустин, валрубицин, вертепорфин, винбластин, винкристин, виндезин, винфлунин, винорелбин, вориностат, зорубицин и другие цитостатики или цитотоксические средства, описанные в настоящем документе.
В связи с тем, что некоторые лекарственные препараты эффективнее при совместном применении, нежели при монотерапии, одновременно часто применяются два или более препаратов. Зачастую два или более химиотерапевтических средства используют в качестве сочетанной химиотерапии. В некоторых вариантах химиотерапевтические средства (включая сочетанную химиотерапию) могут быть использованы в комбинации с веществом, описанным в настоящем документе.
Целевая терапия
В некоторых вариантах осуществления настоящего изобретения соединение, описанное в настоящем документе, применяют с одной или несколькими видами целевой терапии. Целевая терапия представляет собой использование средств, специфичных для разрегулированных белков раковых клеток. Низкомолекулярные прицельные лекарственные препараты в большинстве случаев являются ингибиторами ферментативных доменов мутированных, сверхэкспрессированных или иначе критических белков раковой клетки. Выраженными примерами являются ингибиторы тирозинкиназы, такие как акситиниб, босутиниб, цедираниб, дазатиниб, эрлотиниб, иматиниб, гефитиниб, лапатиниб, лестортиниб, нилотиниб, семаксаниб, сорафениб, сунитиниб и вандетаниб, а так же ингибиторы циклинзависимой киназы, такие как алвоцидиб и селициклиб. Терапия моноклональными антителами является другим способом, в котором терапевтическое средство - это антитело, специфически связывающее белок на поверхности раковых клеток. Примерами являются антитела к HER2/neu трастузумаб (ГЕРЦЕПТИН®), обычно применяемые при раке молочной железы, и анти-CD20 антитела ритуксимаб и тозитумомаб, обычно применяемые при В-клеточном лейкозе. К другим типичным антителам относят цетуксимаб, панитумумаб, трастузумаб, алемтузумаб, бевацизумаб, эдреколомаб и гемтузумаб. Типичные гибридные белки включают афлиберцепт и денилейкин дифтитокс. В некоторых вариантах целевая терапия может быть использована в сочетании с соединением, описанным в настоящем документе.
Целевая терапия так же может включать малые пептиды в качестве «устройств самонаведения», которые могут связывать рецепторы поверхности клетки или затронутого внеклеточного матрикса, окружающего опухоль. Радионуклиды, присоединенные к этим пептидам (напр., RGD), уничтожают раковую клетку, если нуклид распадается рядом с клеткой. Примером такой терапии является БЕКСКСАР®.
Иммунотерапия
В некоторых вариантах осуществления настоящего изобретения, соединение, описанное в настоящем документе, применяется с одной или несколькими видами иммунотерапии. Иммунотерапия рака включает разнообразные терапевтические стратегии, разработанные для индуцирования борьбы с опухолью собственной иммунной системы пациента. Современные способы выработки иммунного ответа против опухолей включают внутрипузырную БЦЖ-иммунотерапию при поверхностном раке мочевого пузыря, и использование интерферонов и других цитокинов для индуцирования иммунного ответа у пациентов с почечноклеточной карциномой и меланомой.
Аллогенная трансплантация стволовых кроветворных клеток может быть рассмотрена как форма иммунотерапии, поскольку иммунные клетки донора часто атакуют опухоль при эффекте транплантат против хозяина. В некоторых вариантах иммунотерапевтические средства могут быть использованы в сочетании с веществом, описанным в настоящем документе.
Гормональная терапия
В некоторых вариантах осуществления настоящего изобретения, соединение, описанное в настоящем документе, применяется с одной или несколькими видами гормональной терапии. Рост некоторых злокачественных новобразований можно ингибировать, вводя или блокируя определенные гормоны. Распространенными примерами гормонально-чувствительных опухолей являются определенные типы рака молочной железы и рака предстательной железы. Удаление или блокирование эстрогена или тестостерона часто является важным дополнительным лечением. При определенных злокачественных новообразованиях применение агонистов гормонов, таких как прогестогены, может иметь терапевтически эффект. В некоторых вариантах гормональная терапия может применяться в сочетании с соединением, описанным в настоящем документе.
Ожирение и нарушения жирового обмена
Соединение или композиция, описанные в настоящем документе, могут быть использованы для лечения или профилактики ожирения, например, у человека, в частности, ребенка или взрослого. «Ожирение» соответствует к состоянию, при котором индекс массы тела субъекта превышает или равен 30. Многие соединения, описанные в настоящем документе, могут быть использованы для лечения или профилактики состояний с избыточной массой тела. «Избыточная масса тела» соответствует состоянию, при котором индекс массы тела пациента превышает или равен 25,0. Индекс массы тела (ИМТ) и другие определения указаны согласно " Клиническому руководству Национального института здоровья по идентификации, клиническому обследованию и лечению избыточной массы тела и ожирения у взрослых " (1998).
Лечение соединением может проводиться в дозе, эффективной для изменения массы тела субъекта, по меньшей мере, на 2, 5, 7, 10, 12, 15, 20, 25, 30, 25, 40, 45, 50 или 55%. Лечение соединением может проводиться в дозе, эффективной для снижения индекса массы тела субъекта, менее 30, 28, 27, 25, 22, 20 или 18. Соединения могут быть использованы для лечения или предотвращения неправильной или неадекватной прибавки массы тела, скорости метаболизма или жироотложения, например, анорексии, булимии, ожирения, сахарного диабета или гиперлипидемии (в частности, повышение уровня триглицеридов и/или холестерина), а так же нарушений жирового обмена или обмена липидов.
Соединение или композиция, описанные в настоящем документе, могут применяться для лечения ожирения, ассоциированного с синдромом Прадера-Вилли (СПВ). СПВ является генетическим нарушением, ассоциированным с ожирением (в частности, патологическое ожирение).
Соединение или композиция, описанные в настоящем документе, могут применяться для сокращения жировой ткани организма, предотвращения увеличения жировой ткани в организме, снижения уровня холестерина (например, общего холестерина и/или соотношение общего холестерина к холестерину липопротеинов высокой плотности), и/или понижения аппетита у людей, страдающих синдромом Прадера-Вилли, ассоциированным с ожирением, и/или облегчения сопутствующих заболеваний, таких как сахарный диабет, сердечно-сосудистые заболевания и инсульт.
Композиции и способы применения
Описанные в настоящем документе композиции включают соединения, описанные в настоящем документе (например, соединение, определенное в настоящем документе), а также дополнительные фармакологические средства, если таковые присутствуют, в количествах, эффективных для модулирования болезни или ее симптомов, включая описанные в настоящем документе.
Термин "фармацевтически приемлемый носитель или вспомогательное вещество" соответствует носителям или вспомогательным веществам, которые можно применять у пациента вместе с представленным соединением, и которые не нарушают фармакологическую активность такового и не являются токсичными при применении в дозах, достаточных для доставки терапевтической дозы соединения.
Фармацевтически приемлемые носители, вспомогательные соединения и наполнители, которые можно использовать в представленных в настоящем документе фармацевтических композициях, включают, не ограничиваясь следующим, ионообменные вещества, алюминия оксид, алюминия стеарат, лецитин, самоэмульгирующиеся системы доставки лекарственного препарата (SEDDS), такие как d-α-токоферол полиэтиленгликоль 1000 сукцинат, сурфактанты, используемые в фармацевтических лекарственных формах, например, в твинах или других подобных полимерных матрицах доставки, сывороточный белок, например, альбумин человеческой сыворотки, буферные вещества, например, фосфаты, глицин, сорбиновая кислота, сорбат калия, неполные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, например, протаминсульфат, динатрийфосфат водорода, дикалийфосфат водорода, натрия хлорид, соли цинка, коллоидную кремнекислоту, магния трисиликат, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, воски, полиэтилен поликсипропилен-блок-полимеры, полиэтиленгликоль и ланолин. Циклодекстрины, такие как α-, β-, и γ-циклодекстрин, или химически модифицированные производные, такие как гидроксиалкилциклодекстрины, включая 2- и 3-гидроксипропил-β-циклодекстрины, или другие солюбилизированные производные можно также успешно использовать для улучшения доставки соединений данной формулы.
Фармацевтические композиции, представленные в настоящем документе, можно применять перорально, парентерально, в составе ингаляционных спреев, местно, ректально, назально, буккально, вагинально или с помощью имплантированного депо, предпочтительно пероральное или инъекционное применение. Фармацевтические композиции, представленные в настоящем документе, могут содержать какие-либо стандартные нетоксичные фармацевтически приемлемые носители, адъюванты или наполнители. Необязательно, рН фармацевтического состава может корректироваться фармацевтически приемлемыми кислотами, основаниями или буферами для повышения стабильности разработанного соединения или его формы доставки. Термин «парентеральный», используемый в настоящем документе, включает подкожные, внутрикожные, внутривенные, внутримышечные, внутрисуставные, внутриартериальные, внутрисиновиальные, интрастернальные, интракраниальные инъекции или инфузии, а также введение внутрь пораженных тканей.
Фармацевтические композиции могут быть в виде стерильной инъекционной формы, например, стерильной инъекционной водной или масляной суспензии. Суспензия может быть разработана в соответствии с известными техниками с использованием подходящих диспергирующих или увлажняющих веществ (таких как, например, твин 80) и суспендирующих веществ. Стерильной инъекционной формой также может быть стерильный инъекционный раствор или суспензия в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, раствор в 1,3-бутандиоле. К приемлемым наполнителям и растворителям, которые можно использовать, относятся маннитол, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используются в качестве растворителя или суспендирующей среды. С этой целью можно использовать любые легкие нелетучие масла, включая синтетические моно- или диглицериды. Жирные кислоты, такие как, олеиновая кислота и ее глицеридные производные, пригодны в приготовлении инъекционных лекарственных форм, поскольку являются натуральными фармацевтически приемлемыми жирами, как в частности оливковое масло или касторовое масло, особенно в полиоксиэтилированных формах. Эти масляные растворы или суспензии могут также содержать длинноцепочечные спиртовые разбавители или диспергирующие вещества, или карбоксиметилцеллюлозу или подобные диспергирующие вещества, которые часто используются в разработке фармацевтически приемлемых лекарственных форм, например, эмульсий или суспензий. Для этих целей могут также использоваться другие распространенные сурфактанты, например, твины или спаны и/или другие подобные эмульгирующие вещества или усилители биодоступности, которые часто используются в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм.
Фармацевтические композиции, представленные в настоящем документе, можно применять перорально в любой пероральной приемлемой лекарственной форме, включая, но не ограничиваясь следующим: капсулы, таблетки, эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток для перорального применения к наиболее часто используемым носителям относятся лактоза и кукурузный крахмал. Обычно добавляются смазывающие вещества, например, стеарат магния. При пероральном применении капсул пригодны такие разбавители как лактоза и высушенный кукурузный крахмал. При пероральном применении водных суспензий и/или эмульсий, действующее вещество, которое можно суспендировать или растворить в масляной фазе, сочетается с эмульгирующими веществами и/или суспендирующими веществами. При желании, можно добавить какие-либо подсластители и/или усилители вкуса и/или красители.
Фармацевтические композиции, представленные в настоящем документе, можно также применять в форме ректальных суппозиториев. Эти композиции могут быть приготовлены путем смешивания соединение, представленного в настоящем документе, с подходящим нераздражающим наполнителем, который является твердым веществом при комнатной температуре, но жидким при ректальной температуре и, таким образом, растает в прямой кишке и высвободит активные компоненты. В эту группу входят, не ограничиваясь упомянутым, следующие вещества: кокосовое масло, пчелиный воск и полиэтиленгликоли.
Местное применение фармацевтических композиций, представленных в настоящем документе, пригодно, когда желаемому лечению подвергаются области или органы, легкодоступные при местном применении. Для местного применения на коже фармацевтическая композиция должна быть составлена с подходящей мазью, содержащей действующие вещества, суспендированные или растворенные в носителе. К носителям для местного применения соединений, представленных в настоящем документе, относятся, не ограничиваясь упомянутыми, минеральные масла, нафталанская нефть, белый вазелин, пропиленгликоль, полиоксиэтиленовые полиоксипропиленовые соединения, неионный эмульгированный воск и вода. В качестве альтернативного варианта, фармацевтическая композиция может быть составлена с подходящим лосьоном или кремом, содержащим действующее вещество, суспендированное или растворенное в носителе с подходящими эмульгирующими веществами. К подходящим носителям относятся, не ограничиваясь упомянутыми, минеральные масла, сорбитанмоностеарат, полисорбат 60, цетиловые восковые эфиры, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и вода. Фармацевтические композиции, представленные в настоящем документе, можно также применять топически в нижних отделах кишечника при помощи ректальных суппозиториев или с помощью клизмы. Также сюда относятся топические трансдермальные пластыри.
Фармацевтические композиции, представленные в настоящем документе, можно вводить с помощью назальных аэрозолей или путем ингаляций. Такие композиции готовятся в соответствии с хорошо известными технологиями приготовления лекарственных форм, они могут быть приготовлены как растворы в физиологическом растворе, с использованием бензилового спирта или других подходящих консервантов, усилителей всасывания для усиления биодоступности, фтороуглеродов, и/или других известных солюбилизирующих или диспергирущих веществ.
Когда композиции, представленные в настоящем документе, включают комбинацию соединения описанной здесь формулы и одного или более дополнительных лекарственных или профилактических веществ, и соединение, и вспомогательное вещество должны входить в дозе приблизительно от 1 до 100%, а предпочтительнее от 5 до 95% от обычно применяемой дозы при монотерапии. Вспомогательные вещества можно применять отдельно от соединений, представленных в настоящем документе, как часть режима многократных доз. Альтернативно, эти вещества могут входить в состав одной лекарственной формы, смешанной с соединениями, представленными в настоящем документе, в одной композиции.
Описанные в настоящем документе композиции можно применять инъекционно, внутривенно, внутриартериально, подкожно, интраперитонеально, внутримышечно или подкожно; или перорально, буккально, назально, трансмукозальным способом, местно, в глазных лекарственных формах или путем ингаляций, в дозе от 0,5 до 100 мг/кг массы тела, или в дозах от 1 мг до 1000 мг/дозу каждые 4-120 часов, или в соответствии с требованиями применения конкретного препарата. Данные способы подразумевают применение эффективной дозы соединения или композиции для достижения желаемого или указанного эффекта. Как правило, фармацевтические композиции, представленные в настоящем документе, следует применять от 1 до 6 раз в день или способом непрерывного вливания. Такое применение можно использовать в качестве хронической или острой терапии. Количество действующего вещества, которое можно комбинировать с носителями для приготовления одной лекарственной формы, будет варьировать в зависимости от получающего лечение реципиента и определенного способа введения. Типичный препарат будет содержать от 5% до 95% активного соединения (весовое соотношение). Как вариант, такие препараты содержат от 20% до 80% активного соединения.
Могут потребоваться более низкие или высокие дозы по сравнению с вышеупомянутыми. Конкретные режимы доз и лечения для любого конкретного пациента будут зависеть от ряда факторов, включая активность определенного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, скорость выведения, сочетание с другими препаратами, степень тяжести и течение болезни, состояние или симптомов, предрасположенность пациента к болезни, состоянию или симптомам, а также от мнения лечащего врача.
После улучшения состояния пациента при необходимости можно вводить поддерживающую дозу соединения, композиции или комбинации, представленных в настоящем документе. Со временем дозу или частоту введения, или и то, и другое в зависимости от симптомов можно сократить до уровня, при котором улучшение состояния сохраняется, а симптомы облегчены до желаемого уровня. Однако пациентам может понадобиться долгосрочное периодическое лечение при рецидиве симптомов болезни.
Отбор и мониторинг пациентов
Соединение, описанное в настоящем документе, может модулировать ПКМ2. Соответственно, пациент и/или субъект может быть отобран для лечения соединением, описанным в настоящем документе, после исходного обследования пациента и/или субъекта с целью определения, нуждается ли он в модуляции ПКМ2, и, в случае если обследование показывает, что субъект нуждается в модуляции ПКМ2, с последующим применением у субъекта соединения, описанного в настоящем документе.
Обследование субъекта на предмет необходимости модулирования ПКМ2 может быть проведено с использованием известных способов, например, путем измерения наличия и/или активности ПКМ2 в организме пациента. В некоторых вариантах активность и/или уровень ПКМ2 оценивается в новообразовании.
Мониторинг пациента, получающего соединение, описанное в настоящем документе, может выполняться, например, с целью определения улучшения состояния и/или нежелательных эффектов. Улучшение состояния пациента можно оценивать, наблюдая за ростом, отсутствием роста или регрессией раковой опухоли. В некоторых вариантах проводится рентгенологического обследование пациента или оценка гемолитических параметров.
ПРИМЕРЫ
Пример 1. Количественное определение ПКМ2.
Процедура:
• Маточный ферментный раствор ПКМ2 развели в рабочем буферном растворе.
• В каждую лунку добавили 2 мкл препарата, после чего ввели 180 мкл реакционной смеси.
• Инкубировали реакционные смеси (без АДФ) на протяжении 30 минут при температуре 4°С.
• Пластинки повторно уравновесили до комнатной температуры, после чего добавили 20 мкл АДФ с целью инициации реакции.
• Течение реакции измеряли по изменениям абсорбции при длине волны 340 нм при комнатной температуре (25°С)
Реакционная смесь: ПКМ2 (50 нг/лунка), АДФ (0,7 ммоль), фосфоенолпируват (0,15 ммоль), НАДН (180 мкм), ЛДГ (2 единицы) в рабочем буферном растворе.
Рабочий буферный раствор: 100 ммоль KCl, 50 ммоль трис рН 7.5, 5 ммоль MgCl2, 1 ммоль ДТТ, 0.03% бычий сывороточный альбумин.
Пример 2: Соединения и их приготовление
Схема 2:

Общая процедура получения соединения 1: к раствору 4-бромфенола (5,0, 0,0289 моль, 1 эквивалент) с ДМФ (50 мл) после добавлением йодистого этила (4,70 мл, 0, 0578 моль, 2 эквивалента) добавили углекислый калий (9,970 г, 0,0722 моль, 2,5 эквивалента) и перемешивали всю ночь. Течение реакции отслеживали при помощи тонкослойной хроматографии. После окончания действий с исходным материалом реакционную смесь охлаждали водой (25 мл) и экстрагировали этилацетатом (2×50 мл). Промывание комбинированных органических слоев осуществлялось соляным (40 мл) раствором. Этилацетатный слой сушили над Na2SO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали посредством колоночной хроматографии (9:1, этилацетат/гексан) для получения соединения 1 (5,0 г, 86,2%). Масс-спектрометрия (201,06) 202,1 (M+1).
Общая процедура для соединения 2: Соединение 1 поместили в колбу с двумя горлышками (2,00 г, 0,0099 моль, 1 эквивалент). Хлорсульфоновую кислоту (25 мл, 0,358 моль, 36 эквивалентов) добавили медленно в течение 10 минут при температуре -10°С. Полученную смесь перемешивали при той же температуре на протяжении 10 минут. По завершении реакционную смесь помещали в ледяную воду (100 мл) и проводили экстракцию этилацетатом. Слой органического вещества промывали Н2О, сушили над Na2SO4 и концентрировали при пониженном давлении. Желаемое соединение 2 было получено при помощи очистки колоночной хроматографией (силикагель 60-120 меш, 5% этилацетат-гексан) в виде твердого вещества (3 г, 43,3%).
Общая процедура для соединения 3: К раствору этил-4-аминобензоната (300 мг, 1,81 ммоль, 1 эквивалент) в смеси 1:1 ДХМ (дихлорметан)/пиридин (5 мл/5 мл) был добавлен раствор 5-бром-2-этоксибезол-1-сульфонилхлорида (соединение 2, 654 мг, 2,17 ммоль, 1,2 эквивалента) в ДХМ (5 мл/5 мл) при температуре 0°С. Реакционную смесь перемешивали на протяжении ночи при комнатной температуре. По завершении реакции реакционную смесь развели ДХМ и промыли водой, высушили над натрия сульфатом и сконцентрировали при пониженном давлении. Неочищенный продукт промыли диэтиловым эфиром, а затем n-гексаном и высушили до выхода соединения 3 в виде беловатого цвета твердого вещества (0,600 г, 77%).
1H NMR (200 MHz, ДМСО-d6) 1,30 (t, 3H), 1,58 (t, 3H), 4,20-4,40 (m, 4H), 6,82 (d, 1H), 7,10-7,20 (m, 2H), 7,56-7,60 (dd, 1H), 7,90-8,00 (m, 3H).
Общая процедура для соединения 4: этил 4-(5-бромо-2-этоксифенил сульфонамид)бензоат (соединение 3, 600 мг, 0,0014 моль, 1 эквивалент) внесли в ТГФ-Н2О (ТГФ - тетрагидрофуран или тетрагидрофолат) (1:1, 30 мл/30 мл). Затем к вышеуказанной реакционной смеси добавили LiOH.H2O (0,293 г, 0,007 моль, 5 эквивалентов) и перемешивали на протяжении ночи в колбе с обратным холодильником. После обработки исходного вещества, растворитель удалили при пониженном давлении для получения неочищенного продукта. Неочищенный продукт промыли этилацетатом. Водный слой подкислили лимонной кислотой (рН=4) и повторно экстрагировали этилацетатом (2×25 мл). Комбинированный слой органического вещества высушили над Na2SO4 и сконцентрировали при пониженном давлении. Полученную кислоту на последующем этапе промыли гексаном для получения чистого соединения 4 (0,500 г, 89%).
Масс-спектрометрия (400.24) 397.9 (М-2 пик, режим определения отрицательных ионов);1H NMR (200 MHz, ДМСО-d6) 1.20 (t, 3Н), 4.18 (q, 2H), 7.10 (d, 1H), 7.10-7.20 (d, 3Н), 7.60-8.0 (m, 4H), 10.6 (s, 1H), 12.6 (bs, 1H).
Общая процедура для соединения 7: к раствору 4-(5-бромо-2-этоксифенил сульфонамид) бензойной кислоты (соединение 4, 0,300 г, 0,00074 моль, 1 эквивалент) в ДМФ (25 мл) при температуре 0°С добавили 1-(3-диметиламино-пропил)-3-этилкарбодиимид гидрохлорид (EDCI) (0,157 г, 0,00082 моль, 1,1 эквивалент), HOBt (0,126 г, 0,00082 моль, 1,1 эквивалент) и ДИПЭА (0,48 мл, 0,0026 моль, 3,5 эквивалент) и перемешивали на протяжении 15 минут. Затем при температуре 0°С был добавлен раствор 1-2-(метоксифенил) пиперазина (соединение 6, 0,171 г, 0,00074 моль, 1 эквивалент), после чего полученную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции была добавлена вода (30 мл) и проведено экстрагирование этилацетатом (2×30 мл). Комбинированный слой органического вещества высушили над безводным Na2SO4 и сконцентрировали в условиях пониженного давления. Неочищенный продукт растворили в этилацетате (EtOAc) и добавили к пентану для получения соединения 7, представляющего собой твердое вещество белого цвета, которое отфильтровали и высушили (200 мг, выход 46,5%).

1H NMR (500 MHz, ДМСО-d6) 1.30 (t, 3H), 2.80-3.0 (bs, 4H), 3.30-3.60 (bm, 4H), 3.78 (s, 3H), 4.20 (q, 2H), 6.80-7.00 (m, 4H), 7.10-7.20 (m, 3H), 7.30-7.34 (d, 2H), 7.70-7.75 (dd, 1H), 7.80 (d, 1H), 10.35 (s, 1H); Масс-спектрометрия 574.0; Ширина пика при масс-спектрометрии 574.0; чистота ВЭЖХ 97.80%.
Синтез соединения 6:
Схема 3:

Общая процедура для соединения 5: в круглодонную колбу с двумя горлышками поместили трет-бутил пиперазин-1-карбоксилат (4,97 г, 0,0267 моль, 1 эквивалент), 2-бромоанизол (5,0 г, 0,0267 моль, 1 эквивалент) и CS2CO3 (21,7 g, 0,0668 моль, 2,5 эквивалента) в дегазированном 1,4-диоксане (100 мл) при атмосфере N2. Затем к реакционной смеси были добавлены 2,2'-бис-дифенил-фосфино-1,1'-бинафтил (BINAP) (1,49 г, 0,00240 моль, 0,09 эквивалента) и Pd(OAc)2 (0,96 г, 0,00042 моль, 0,016 эквивалента) в условиях атмосферы N2, после чего осуществлялось перемешивание при 80°С на протяжении ночи. Мониторинг течения реакции проводили при помощи способа тонкослойной хроматографии. По окончании избыточный растворитель отогнали при пониженном давлении, а остаток развели водой и экстрагировали этилацетатом. Слой органического вещества отделили, высушили над Na2SO4 и сконцентрировали в условиях пониженного давления. Неочищенный продукт очищали колонковой хроматографией (силикагель 60-120 меш, 5-6%, этилацетат/гексан) для выхода целевого соединения 5, являющего в виде вязкого масла (2,8 г, 36%).
1H NMR (500 MHz, CDCl3): 1.42 (s, 9H), 3.0 (m, 4H), 3.60 (m, 4H), 3.84 (s, 3H), 6.80-7.00 (m, 4H); Масс-спектрометрия 293,1 (М+1 пик).
Общая процедура для соединения 6: в круглодонной колбе с двумя горлышками трет-бутил-4-(2-метоксифенил)пиперазин-1-карбоксилат (соединение 5, 0,600 г, 0,00205 моль, 1 эквивалент) обработали эфиром-HCl (10 мл). Полученную смесь перемешивали в течение ночи. После завершения обработки исходного материала, согласно ТСХ, эфир удалили при пониженном давлении и получили твердый материал. Твердый материал промыли этилацетатом и высушили для получения аминосоединения 6 в виде твердого вещества белого цвета (0,425 г, 90,08%).
Следующие аналоги были приготовлены с использованием вышеуказанной процедуры с различными сульфонилхлоридами вместо соединения 2.
5-хлор-2-метокси-N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил) бензолсульфамид (8)
Соединение 8 было приготовлено из имеющегося в продаже 2-метокси-5-хлоробензенсульфонилхлорида, как показано на схеме 2.
1H NMR (500 MHz, ДМСО-d6) 2.8-3.0 (bm, 4Н), 3.40-3.78 (m, 4H), 3.80 (s, 3H), 3.84 (s, 3H), 6.80-7.00 (m, 4H), 7.12 (d, 2H), 7.21 (d, 1H), 7.30 (d, 2H), 7.65 (dd, 1H), 7.74 (d, 1H); Основной пик при масс-спектрометрии составляет 516 (отношение массы к заряду); чистота ВЭЖХ: 94.33%
5-бром-2-метокси-N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)бензолсульфамид (9)

Соответствующий сульфонилхлорид был получен из 4-бромофенола. O-метилирование 4-бромофенола с последующей реакцией с хлорсульфоновой кислотой позволило получить 2-метокси-5-бромобензилсульфонилхлорид, использованный для получения соединения 9, как показано на схеме 2.
1H NMR (500 MHz, ДМСО-d6) 2.90-3.00 (bm, 4H), 3.40-3.78 (m, 4H), 3.80 (s, 3H), 3.84 (s, 3H), 6.80-7.00 (m, 4H), 7.10-7.18 (m, 3H), 7.30 (d, 2H), 7.70 (dd, 1H), 7.74 (d, 1H); Основной пик при масс-спектрометрии составляет 562.0; чистота ВЭЖХ: 94.36%
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)нафталин-2-сульфонамид (10)

Имеющийся в продаже нафтален-2-сульфонилхлорид использовали вместо соединения 2 для получения соединения 10.1H NMR (500 MHz, ДМСО-d6) 2.80-3.00 (bm, 4H), 3.40-3.78 (m, 4H), 3.80 (s, 3H), 6.80-7.00 (m, 4H), 7.10-7.30 (m, 4H), 7.60-7.80 (m, 3H), 8.00-8.20 (m, 3H), 8.50 (s, 1H), 10.7 (s, 1H); Основной пик при масс-спектрометрии составляет 504.2; Чистота ВЭЖХ: 93.65% (СЭЖХ)
5-хлор-2-этокси-N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)бензол-сульфонамид (11)

Соответствующий сульфонилхлорид был получен из 4-хлорофенола. O-этилирование 4-хлорофенола с последующей реакцией с хлорсульфоновой кислотой в рамках при соответствующих условиях позволило получить 2-этокси-5-хлоробензен сульфонилхлорид, использованный для получения соединения 11, как показано на схеме 2.
1H NMR (500 MHz, ДМСО-d6) 1.30 (t, 3H), 2.80-3.0 (bs, 4H), 3.40-3.78 (bm, 4H), 3.80 (s, 3H), 4.20 (q, 2H), 6.80-7.00 (m, 4H), 7.16 (d, 2H), 7.20 (d, 1H), 7.38 (d, 2H), 7.60 (d, 1H), 7.80 (s, 1H), 10.20 (s, 1H); Основной пик при масс-спектрометрии составляет 530.1; Чистота ВЭЖХ: 97.48%
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)бензен-сульфонамид (12)

Соединение 12 было получено по схеме 2 с использованием бензенсульфонилхлорида.1H NMR (500 MHz, ДМСО-d6) 2.90-3.00 (bs, 4H), 3.40-3.78 (bm, 4H), 3.80 (s, 3H), 6.84-6.98 (m, 4H), 7.15 (d, 2H), 7.30 (d, 2H), 7.56-7.64 (m, 3H), 7.80 (d, 2H), 10.6 (s, 1H); Основной пик при масс-спектрометрии составляет 452.6; Чистота ВЭЖХ: 96.90%.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)нафталин-1-сульфонамид (13)

Соединение 13 получено по схеме 2 с использованием имеющегося в продаже нафтален-1-сульфонилхлорида.
1H NMR (500 MHz, ДМСО-d6) 2.90-3.00 (bs, 4H), 3.40-3.78 (bm, 4H), 3.80 (s, 3H), 6.84-6.98 (m, 4H), 7.10 (d, 2H), 7.24 (d, 2H), 7.62-7.78 (m, 3H), 8.08 (d, 1H), 8.23 (d, 1H), 8.28 (d, 1H), 8.72 (d, 1H), 10.98 (s, 1H); Основной пик при масс-спектрометрии составляет 502.1; Чистота ВЭЖХ: 96.59%.
2,6-дифторо-N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)бензен-1-сульфонамид(14)

Соединение 14 получено по схеме 2 с использованием имеющегося в продаже 2,6-дифторобензенсульфонилхлорида.
1H NMR (500 MHz, ДМСО-d6) 2.90-3.00 (bs, 4H), 3.40-3.78 (bm, 4H), 3.80 (s, 3H), 6.84-7.00 (m, 4H), 7.20 (d, 2H), 7.30 (t, 2H), 7.38 (d, 2H), 7.68-7.74 (m, 1H), 11.2 (s, 1H); Основной пик при масс-спектрометрии составляет 488.1; Чистота ВЭЖХ: 97.16%.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (15)

Соединение 15 получено по схеме 2 с использованием имеющегося в продаже хинолин-8-сульфонилхлорида.
1H NMR (500 MHz, ДМСО-d6) 2.90-3.00 (bs, 4H), 3.40-3.78 (bm, 4H), 3.80 (s, 3Н), 6.82 (d, 2H), 6.90-7.00 (m, 2H), 7.15-7.20 (2 дублета, 4H), 7.70-7.78 (m, 2H), 8.24 (d, 1H), 8.40 (d, 1H), 8.50 (d, 1H), 9.15 (bs, 1H), 10.42 (s, 1H); Основной пик при масс-спектрометрии составляет 503.2; Чистота ВЭЖХ: 97.11%.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)бензо[d]тиазол-5-сульфонамид (17)

Соединение 17 получено из имеющегося в продаже бензтиазол-6-сульфонил хлорида в соответствии со схемой 2 протокола.
1H NMR (500 MHz, ДМСО-d6) 2.90-3.00 (bs, 4H), 3.40-3.78 (bm, 4H), 3.80 (s, 3H), 6.82-7.00 (m, 4H), 7.20 (d, 2H), 7.38 (d, 2H), 7.90 (d, 1H), 8.22 (d, 1H), 8.78 (s, 1H), 9.60 (s, 1H), 10.70 (s, 1H); Основной пик при масс-спектрометрии составляет 509.1; Чистота ВЭЖХ: 97.29%
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)-3,5-диметилбензен-сульфонамид (18)
Соединение 18 получено из имеющегося в продаже 3,5-диметилбензенсульфонилхлорида в соответствии с протоколом, представленным на схеме 2.
1H NMR (500 MHz, ДМСО-d6) 2.35 (s, 6H), 2.80-2.90 (m, 4H), 3.42-3.78 (bm, 4H), 3.80 (s, 3H), 6.88 (bs, 2H), 6.92-7.00 (m, 2H), 7.15 (d, 2H), 7.26 (s, 1H), 7.33 (d, 2H), 7.42 (s, 2H), 10.5 (s, 1H); Основной пик при масс-спектрометрии составляет 480.3; Чистота ВЭЖХ: 98.56%.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)2,3-дигидробензо[b][1,4]диоксин-6-сульфонамид (19)
Соединение 19 получено из имеющегося в продаже 2,3-дигидробензодиоксо-6-сульфонил хлорида в соответствии с протоколом, представленным на схеме 2.
1H NMR (500 MHz, ДМСО-d6) 2.80-3.00 (m, 4H), 3.42-3.78 (bm, 4H), 3.80 (s, 3H), 4.25 (m, 4H), 6.86-6.88 (m, 2H), 6.92-6.98 (m, 2H), 7.00 (d, 1H), 7.15 (d, 2H), 7.24 (s, 1H), 7.26-7.30 (dd, 1H), 7.34 (d, 2H),10.5 (s, 1H); Основной пик при масс-спектрометрии составляет 510.3; Чистота ВЭЖХ: 97.02%.
5-хлоро-2-метокси-N-(4-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)фенил)бензен-сульфонамид (19а)

Соединение 19а получено согласно схеме 2. N-Boc-гомопиперазин использовали вместо N-Boc-пиперазина для получения промежуточного соединения N-2-метоксифенил-гомопиперазина через реакцию Бухвальда, как показано на схеме 3.
1H NMR (500 MHz, ДМСО-d6) 1.70 (s, 1H), 1.90 (s, 1H), 3.10-3.40 (m, 9H), 3.60-3.80 (m, 2H), 3.82 (s, 3H), 6.70-6.82 (m, 4H), 6.96-7.30 (m, 5H), 7.66 (t, 1H), 7.74 (s, 1H), 10.40 (d, 1H); Основной пик при масс-спектрометрии составляет 530.1; Чистота ВЭЖХ: 95.89%.
N-(4-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (19b)

1H NMR (500 MHz, ДМСО-d6) 1.70 (s, 1H), 1.90 (s, 1H), 3.10-3.40 (m, 8H), 3.58-3.80 (m, 3H), 6.58 (d, 1H), 6.70-7.20 (m, 7H), 7.80 (m, 2H), 8.30 (t, 1H), 8.40 (d, 1H), 8.56 (t, 1H), 9.18 (s, 1H), 10.40 (d, 1H); Основной пик при масс-спектрометрии составляет 517.2; Чистота ВЭЖХ: 97.60%.
N-(4-(4-(2-метоксифенил)-пиперазин-1-карбонил)фенил)2-метилбензо[d]тиазол-4-сульфонамид (35)

2-метилбензотиазол-4-сульфонил хлорид приготовлен в соответствии с Патентом США 4,643,759. Соединение 35 приготовлено согласно общей процедуре, описанной в схеме 2.
1H NMR (500 MHz, ДМСО-d6) 2.80 (s, 3H), 3.00 (bs, 4H), 3.40-3.78 (m, 4H), 3.80 (s, 3H), 6.90 (s, 2H), 6.90-7.0 (m, 2H), 7.18 (d, 2H), 7.30 (d, 2H), 7.82 (d, 1H), 8.04 (d, 1H), 8.60 (s, 1H), 10.6 (1H); Основной пик при масс-спектрометрии составляет 523.4; чистота ЖХМС: 97.38%
N-(4-(4-(2-метоксифенил)-пиперазин-1-карбонил)фенил)тиофен-2-сульфонамид (36)

Соединение 36 получено из имеющегося в продаже тиофен-2-сульфонил хлорида в соответствии с общей процедурой, обозначенной на схеме 2.
1H NMR (500 MHz, ДМСО-d6) 2.90-3.00 (bs, 4Н), 3.30-3.78 (bm, 4H), 3.80 (s, 3H), 6.80-6.90 (m, 2H), 6.90-7.0 (m, 2H), 7.18 (d, 1H), 7.20 (d, 2H), 7.40 (d, 2H), 7.60 (s, 1H), 7.94 (d, 1H), 10.70 (s, 1H); Основной пик при масс-спектрометрии составляет 458.2; Чистота ВЭЖХ 95.02%. Синтез аналогов фенила:
Схема

Процедура синтеза соединения 20: к раствору 2-метокси-5-хлорбензенсульфонил хлорида (878 мг, 0,00362 моль, 1,5 эквивалента) в дихлорметане добавили раствор этил-4-аминобензоата (400 мг, 0,00242 моль, 1 эквивалент) в смеси 1:1 пиридина и ДХМ (5 мл/5 мл) в условиях атмосферы с азотом при температуре 0°С. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Течение реакции отслеживали по ТСХ. По завершении реакционную смесь разбавили ДХМ, дважды промыли водой и высушили над безводным натрия сульфатом. Слой органического вещества сконцентрировали, высушили, промыли эфиром, а затем n-гексаном, и высушили для получения соединения 20 в виде твердого вещества желтовато-белого цвета, (0,8 г, выход 89%).
1H NMR (500 MHz, CDCl3) 1.34 (t, 3H), 4.0 (s, 3H), 4.22-4.32 (q, 2H), 6.90 (d, 1H), 7.16 (d, 2H), 7.20 (s, 1H), 7.84 (s, 1H), 7.92 (d, 2H).
Процедура синтеза соединения 21: LiOH (226 мг, 0,0049 моль, 4 эквивалента) добавили к перемешиваемому раствору соединения 20 (500 мг, 0,0013 моль, 1 эквивалент) в смеси ТГФ-H2O (соотношение 1:1, 30 мл/30 мл), и нагревали на протяжении ночи в колбе с обратным холодильником. Течение реакции наблюдали по ТСХ. По завершении реакционную смесь подкислили лимонной кислотой до рН 4 и экстрагировали этилацетатом. Этилацетатный слой промыли водой, высушили над сернокислым натрием и отогнали. Полученное твердое вещество 21 высушили и использовали без очищения на следующем этапе (400 мг, выход 87%).
1H NMR (500 MHz, ДМСО-d6) 3.82 (s, 3H), 7.10-7.22 (m, 3H), 7.62 (d, 1H), 7.88-7.92 (m, 3H), 10.64 (s, 1H), 12.70 (s, 1H).
Процедура синтеза соединения 22: синтез соединения 22 осуществлялся согласно той же процедуре, что и синтез соединения 5 с использованием бромбензена вместо 2-бромоанизола. Масс-спектрометрия 263 (М+1 пик).
Процедура синтеза соединения 23: соединение 22 (500 мг) растворили в 30 мл эфира/HCl и перемешивали на протяжении 2 часов при комнатной температуре в условиях атмосферы азота. Реакционную смесь отогнали при пониженном давлении для удаления эфира, промыли пентаном и высушили над сернокислым натрием для получения соединения 23 (300 мг, выход 97%).
1H NMR (500 MHz, ДМСО-d6) 3.10-3.20 (m, 4Н), 3.40-3.42 (m, 4H), 6.80 (t, 1H), 7.00 (d, 2H), 7.22 (t, 2H), 9.0 (bs, 1H), 9.40 (bs, 2H).
Процедура синтеза соединения 24: к перемешиваемому раствору соединения 21 (100 мг, 0,00029 моль, 1 эквивалент) в ДМФ (10 мл) добавили 1-этил-3(3-диметиламино-пропил)-3-этилкарбодиимид гидрохлорид (EDCI) (62 мг, 0,00032 моль, 1,1 эквивалент), HOBt (50 мг, 0,00032 моль, 1,1 эквивалент) и ДИПЭА (0,16 мл, 0,00088 моль, 3 эквивалента) при температуре 0°С в условиях атмосферы с азотом. Реакционную смесь перемешивали на протяжении 5 минут при температуре 0°С, а затем при комнатной температуре на протяжении 30 минут. Раствор соединения 23 (59 мг, 0,00029 моль, 1 эквивалент), растворенный в ДМФ и половинном эквиваленте ДИПЭА, постепенно добавляли к вышеуказанной реакционной смеси при температуре 0°С, после чего перемешивали при комнатной температуре на протяжении ночи. Течение реакции отслеживали по ТСХ. После завершения реакционную смесь промыли водой и экстрагировали этилацетатом. Слой органического вещества высушили над сернокислым натрием и сконцентрировали под воздействием вакуума. Неочищенный продукт очищали путем кристаллизации со смесью растворителей этилацетат/ гексан для получения соединения 24 с выходом 24,6% (35 мг).

1H NMR (500 MHz, ДМСО-d6) 3.10-3.20 (bs, 4Н), 3.40-3.78 (bm, 4H), 3.82 (s, 3H), 6.80 (t, 1H), 6.90 (d, 2H), 7.14 (d, 2H), 7.20 (t, 3H), 7.30 (d, 2H), 7.62-7.66 (dd, 1H), 7.74 (d, 1H), 10.40 (s, 1H); Основной пик при масс-спектрометрии составляет 486.0; Чистота ВЭЖХ: 97.34%.
** Соединения с 25 по 30 приготовлены в соответствии с протоколом, аналогичным протоколу, описанному в схеме 4.
N-(4-(4-фенилпиперазин-1-карбонил)фенил)бензенсульфонамид (25)

Соединение 25 получено при использовании бензенсульфонилхлорида в соответствии с протоколом, аналогичным описанному в схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.10-3.20 (bs, 4H), 3.40-3.78 (bm, 4H), 6.80 (t, 1H), 6.92 (d, 2H), 7.10-7.35 (m, 6H), 7.50-7.70 (m, 3H), 7.80 (d, 2H), 10.60 (s, 1H); Основной пик при масс-спектрометрии составляет 422.0; Чистота ЖХВД: 97,92%.
4-фтор-N-(4-(4-фенилпиперазин-1-карбонил)фенил)бензенсульфонамид(26)
Соединение 26 получено при использовании 4-фторобензенсульфонилхлорида в соответствии с процедурой, аналогичной описанной на схеме 4.1H NMR (500 MHz, ДМСО-d6) 3.10-3.20 (bs, 4H), 3.40-3.80 (bm, 4H), 6.80 (t, 1H), 6.94 (d, 2H), 7.14 (d, 2H), 7.20 (t, 2H), 7.32 (d, 2H), 7.35 (t, 2H), 7.80-7.90 (m, 2H), 10.6 (s, 1H); Основной пик при масс-спектрометрии составляет 440.1; Чистота ВЭЖХ: 96.72%.
3-хлор-N-(4-(4-фенилпиперазин-1-карбонил)фенил)бензенсульфонамид (27)

Соединение 27 получено при использовании 3-хлорбензенсульфонилхлорида в соответствии с процедурой, аналогичной представленной на схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.10-3.20 (bs, 4H), 3.40-3.80 (bm, 4H), 6.80 (t, 1H), 7.00 (d, 2H), 7.18-7.22 (m, 4H), 7.38 (d, 2H), 7.60 (t, 1H), 7.70-7.80 (m, 3H), 10.6 (s, 1H); Основной пик при масс-спектрометрии составляет 456.2; Чистота ВЭЖХ: 97.25%.
3-метокси-N-(4-(4-фенилпиперазин-1-карбонил)фенил)бензенсульфонамид (28)
Соединение 28 получено при использовании 3-метоксибензенсульфонилхлорида в соответствии с общей процедурой, представленной в схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.10-3.20 (bs, 4H), 3.40-3.78 (bm, 4H), 3.80 (s, 3H), 6.80 (t, 1H), 6.95 (d, 2H), 7.14-7.24 (m, 5H), 7.28 (bs, 1H), 7.32-7.40 (m, 3H), 7.50 (t, 1H), 10.6 (s, 1H); Основной пик при масс-спектрометрии составляет 452.2; Чистота ВЭЖХ: 93.60%.
2-хлор-N-(4-(4-фенилпиперазин-1-карбонил)фенил)бензенсульфонамид (29)

Соединение 29 получено при использовании имеющегося в продаже 2-хлоробензенсульфонилхлорида в соответствии с общей процедурой, представленной на схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.10-3.20 (bs, 4H), 3.40-3.78 (bm, 4H), 6.80 (t, 1H), 6.95 (d, 2H), 7.16-7.38 (m, 6H), 7.58 (t, 1H), 7.64 (d, 2H), 8.10 (d, 1H), 10.90 (s, 1H); Основной пик при масс-спектрометрии составляет 456.2; Чистота ВЭЖХ: 99.21%.
N-(4-(4-фенилпиперазин-1-карбонил)фенил)нафталин-1-сульфонамид (30)
Соединение 30 получено при использовании имеющегося в продаже нафтален-1-сульфонил хлорида в соответствии с общей процедурой, представленной на схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.10-3.20 (bs, 4H), 3.40-3.78 (bm, 4H), 6.80 (t, 1H), 6.95 (d, 2H), 7.08 (d, 2H), 7.10-7.30 (m, 4H), 7.70-7.80 (m, 3H), 8.10 (d, 1H), 8.20-8.30 (m, 2H), 8.76 (d, 1H), 11.0 (s, 1H); Основной пик при масс-спектрометрии составляет 472.3; Чистота ВЭЖХ: 99,14%.
N-(4-(4-фенилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (30а)

1H NMR (500 MHz, ДМСО-d6) 3.00-3.20 (bm, 4H), 3.30-3.70 (bs, 4H), 6.80 (t, 1H), 6.90 (d, 2H), 7.10-7.22 (m, 6H), 7.70-7.80 (m, 2H), 8.30 (d, 1H). 8.44 (d, 1H), 8.56 (d, 1H), 9.18 (d, 1H), 10.42 (s, 1H); Основной пик при масс-спектрометрии составляет 473.2; Чистота ВЭЖХ: 98.50%.
Синтез аналогов 4-метоксифенила
Схема 5:

Синтез соединения 31:
Раствор 4-бромоанизола (2,0 г, 0,0106 моль, 1 эквивалент) в 1,4-диоксане (30 мл) продували азотом в течение 30 минут при комнатной температуре, с последующим добавлением Cs2CO3 (7,64 г, 0,023 моль, 2,2 эквивалента), BINAP (598 мг, 0,00096 моль, 0,09 эквивалента), Pd(OAc)2 (38 мг, 0,00017 моль, 0,016 эквивалента) и тетрабутиламмония йодида (15 мг). Реакционную смесь повторно продували азотом на протяжении 15 минут, с последующим добавлением N-Boc-пиперазина (2,38 г, 0,0128 моль, 1,2 эквивалент). Реакционную смесь нагревали в течение ночи при температуре 80°С; мониторинг проводили по ТСХ. Избыточный растворитель отогнали при пониженном давлении, а остаток развели водой и экстрагировали этилацетатом. Слой органического вещества отделили, повторно промыли водой, высушили над сернокислым натрием и сконцентрировали. Неочищенный продукт очищали посредством колонковой хроматографии с использованием силикагеля 60-120 меш (15%, этилацетат/гексан) для получения 1,5 г (выход 48.3%) соединения 31.
Синтез соединения 32: Соединение 31 перемешивали при комнатной температуре на протяжении 2 часов в 60 мл эфира/HCl. Избыток растворителя удалили при пониженном давлении, а полученное твердое вещество промыли n-гексаном и высушили для получения 780 мг (выход 99,7%) соединения 32.
5-хлор-2-метокси-N-(4-(4-(4-метоксифенил)пиперазин-1-карбонил)фенил)бензен-сульфонамид (33)

Соединение 33 получено согласно протоколу, описанному для соединения 24 на схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.00 (bs, 4Н), 3.40-3.70 (m, 7H), 3.80 (s, 3H), 6.80-6.90 (dd, 4Н), 7.14 (d, 2H), 7.22 (d, 1H), 7.30 (d, 2H), 7.62-7.66 (dd, 1H), 7.74 (d, 1H), 10.4 (s, 1H); Основной пик при масс-спектрометрии составляет 557.1; Чистота ВЭЖХ: 94.14%.
5-фтор-2-метокси-N-(4-(4-(4-метоксифенил)пиперазин-1-карбонил)фенил)бензен-сульфонамид (34)

Соединение 34 получено согласно общему протоколу, представленному на схеме 4, начиная с 2-метокси-4-фторбензенсульфонилхлорида.
1H NMR (500 MHz, ДМСО-d6) 3.00 (bs, 4Н), 3.40-3.70 (m, 7H), 3.82 (s, 3H), 6.80-6.90 (dd, 4Н), 7.14 (d, 2H), 7.20 (dd, 1H), 7.30 (d, 2H), 7.46-7.49 (m, 1H), 7.60 (dd, 1H), 10.4 (s, 1H); Основной пик при масс-спектрометрии составляет 500.2; Чистота ВЭЖХ: 95.48%.
Синтез аналогов 4-хлорпиримидина:
Схема 6:
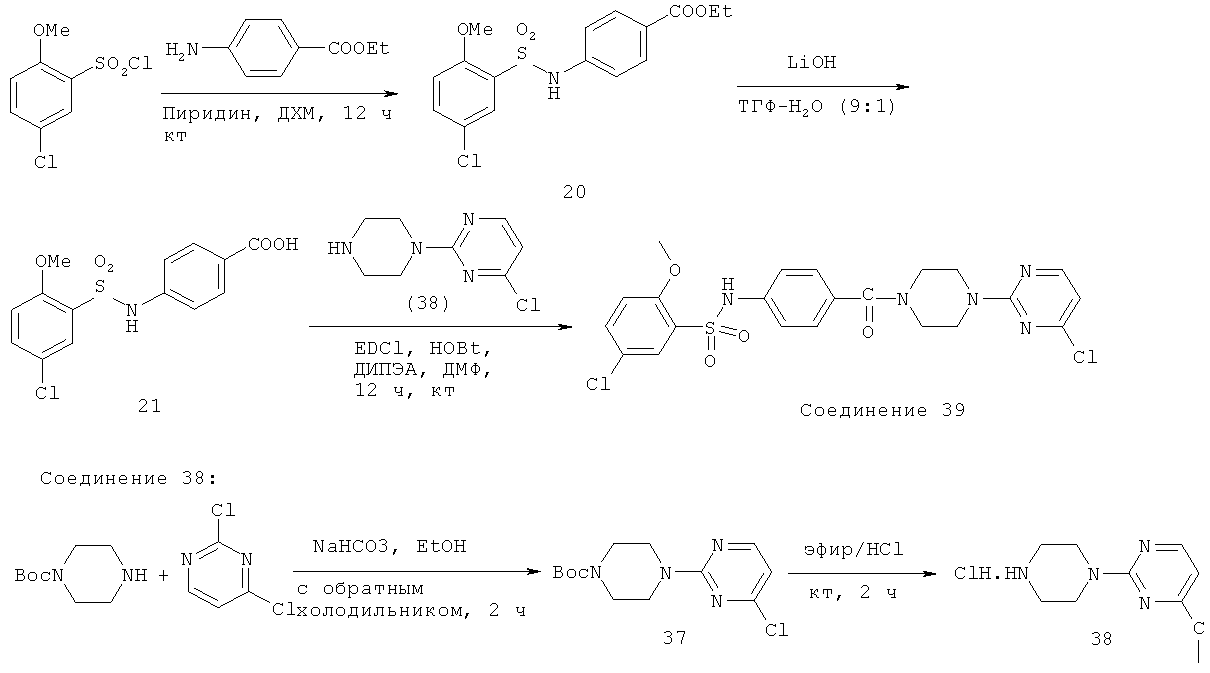
Приготовление соединения 37: 2,4-дихлорпиримидин (801 мг, 0,0053 моль, 1 эквивалент), N-Boc-пиперазин (1,0 г, 0,0053 моль, 1 эквивалент) и бикарбонат натрия (903 мг, 0,0107 моль, 2 эквивалента) растворили в этаноле (50 мл) и перемешивали в течение 1 часа в колбе с обратным холодильником. Течение реакции отслеживали по ТСХ. Избыток растворителя был удален, растворен в воде и экстрагирован дихлорметаном (ДХМ). Слой органического вещества промыли водой, высушили над сернокислым натрием и сконцентрировали в условиях пониженного давления. Неочищенный продукт очистили на силикагеле (60-120 меш) с использованием 15%, этилацетата/гексана для получения сопряженного соединения 37 (230 мг).
1H NMR (500 MHz, CDCl3) 1.5 (s, 9H), 3.5 (m, 4H), 3.80 (m, 4H), 6.80 (d, 1H), 8.20 (d, 1H).
Приготовление соединения 38: раствор соединения 37 в 20 мл эфира/HCl перемешивали на протяжении часа при комнатной температуре в условиях атмосферы азота. Избыток растворителя отогнали при пониженном давлении, а неочищенный материал промыли в n-пентане и высушили до количественного выхода 180 мг соединения 38.
Приготовление соединения 39: к перешиваемому раствору соединения 21 (109 мг, 0,31 ммоль, 1,0 эквивалент) в ДМФ (15 мл) добавили 1-(3-диметиламино- пропил)-3-этилкарбодиимид гидрохлорид (EDCI) (67 мг, 0,35 ммоль, 1,1 эквивалент), HOBt (53,7 мг, 0,35 моль, 1,1 эквивалент) и ДИПЭА (2,0 эквивалента) при температуре 0°С в условиях атмосферы азота. Реакционную смесь перемешивали на протяжении 30 минут при комнатной температуре. Раствор соединения 38 (75 мг, 0,319 ммоль, 1 эквивалент) с 5 мл ДМФ и 1,5 эквивалента ДИПЭА медленно добавили в реакционную смесь при температуре 0°С и перемешивали при комнатной температуре на протяжении 12 часов. Течение реакции отслеживали по ТСХ. По завершении реакционную смесь охладили водой и экстрагировали этилацетатом. Слой органического вещества был отделен, высушен над сернокислым натрием и сконцентрирован в условиях пониженного давления. Неочищенный продукт очистили силикагелем (60-120 меш) с использованием 2% метилового спирта-дихлорметана (МеОН-ДХМ) для получения 30 мг соединения 39 с выходом 18%.
5-Хлор-N-(4-(4-(4-Хлоропиримидин-2-ил)пиперазин-1-карбонил)фенил)-2-метокси бензенсульфонамид (39)

1H NMR (500 MHz, ДМСО-d6) 3.35-3.60 (bs, 4Н), 3.70-3.78 (bm, 4H), 3.80 (s, 3H), 6.78 (d, 1H), 7.16 (d, 2H), 7.22 (d, 1H), 7.36 (d, 2H), 7.66 (d, 1H), 7.80 (s, 1H), 8.18 (s, 1H), 10.50 (s, 1H); Основной пик при масс-спектрометрии составляет 522.1; Чистота ВЭЖХ: 96.50%.
N-(4-(4-(4-Хлоропиримидин-2-ил)пиперазин-1-карбонил)фенил)-4-фторо бензенсульфонамид (40)

Соединение 40 было частично получено согласно протоколам, установленным для соединения 38 сопряженного с пиримидином, как указано на схеме 6, и далее согласно общим процедурам, описанным на схеме 4, начиная с 4- фторбензенсульфонилхлорида.
1H NMR (500 MHz, ДМСО-d6) 3.35-3.60 (bs, 4H), 3.70-3.78 (bm, 4H), 6.78 (d, 1H), 7.18 (d, 2H), 7.38 (d, 2H), 7.42 (d, 2H), 7.82 (d, 2H), 8.38 (d, 1H), 10.60 (s, 1H); Основной пик при масс-спектрометрии составляет 476.2; Чистота ВЭЖХ: 97.89%.
Синтез аналогов 2-приримидина
Схема 7:

Приготовление соединения 41: к раствору 2-бромпиримидина (500 мг, 0,003144 моль, 1 эквивалент) в этаноле (50 мл) добавили бикарбонат натрия (528 мг, 0,0062 моль, 2 эквивалента) и N-Boc-пиперазин (585 мг, 0,0031 моль, 1,0 эквивалент). Реакционную смесь перемешивали в колбе с обратным холодильником в течение 1 часа и отслеживали по ТСХ. По завершении избыток растворителя удалили при пониженном давлении. Неочищенный материал разбавили водой и экстрагировали этилацетатом. Слой органического вещества высушили над сернокислым натрием и сконцентрировали. Неочищенный продукт промыли гексаном и высушили для получения 400 мг соединения 41 (выход 48%).
Приготовление соединения 42: раствор соединения 41 (400 мг) в эфире/HCl (30 мл) перемешивали при комнатной температуре на протяжении 2 часов и отслеживали по ТСХ. Через 2 часа реакционную смесь сконцентрировали в условиях пониженного давления для получения соединения 42 (300 мг, выход 98%), которое промыли гексаном и использовали без очистки.
Приготовление соединения 43: к раствору соединения 21 (100 мг, 0,00029 моль, 1 эквивалент) в ДМФ (15 мл) добавили 1-(3-диметиламино- пропил)-3-этилкарбодиимид гидрохлорид (EDCI) (61,5 мг, 0,00032 моль, 1,1 эквивалент), HOBt (49,28 мг, 0,00032 моль, 1,1 эквивалент) и 1,5 эквивалента ДИПЭА при температуре 0°С, после чего перемешивали при комнатной температуре на протяжении 30 минут. К данной смеси при температуре 0°С добавили раствор соединения 42 в ДМФ (5 мл) и 2 эквивалента ДИПЭА и перемешивали в течение ночи при комнатной температуре. Реактивную смесь охладили водой и экстрагировали этилацетатом. Слой органического вещества промыли водой, высушили над сернокислым натрием и сконцентрировали в условиях пониженного давления для получения неочищенного продукта. Неочищенный материал очищали силикагелем (230-400 меш) с 3% МеОН-ДХМ для получения соединения 43 с выходом 31.6% (45 мг).
5-Хлор-2-метокси-N-(4-(4-(пиримидин-2-ил)пиперазин-1-карбонил)фенил)бензен-сульфонамид(43)

1H NMR (500 MHz, ДМСО-d6) 3.35-3.70 (bm, 4H), 3.70-3.80 (bm, 4H), 3.82 (s, 3H), 6.62 (d, 1H), 7.15 (d, 2H), 7.22 (d, 1H), 7.34 (d, 2H), 7.62-7.66 (dd, 1H), 7.75 (d, 1H), 8.40 (s, 2H), 10.5 (s, 1H); Основной пик при масс-спектрометрии составляет 488.3; Чистота ВЭЖХ: 97.47%.
4-Хлор-N-(4-(4-(пиримидин-2-ил)пиперазин-1-карбонил)фенил)бензен-сульфонамид (44)

Соединение 44 получено из 4-хлорбензенсульфонилхлорида в соответствии с протоколом, представленным на схеме 7 с использованием общей процедуры, описанной на схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.35-3.70 (bm, 4H), 3.70-3.80 (bm, 4H), 6.62 (t, 1H), 7.18 (d, 2H), 7.38 (d, 2H), 7.62 (d, 2H), 7.80 (d, 2H), 8.40 (d, 2H), 10.62 (s, 1H); Основной пик при масс-спектрометрии составляет 458.2; Чистота ВЭЖХ: 98.41%.
N-(4-(4-(пиримидин-2-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (45)

Соединение 45 получено из 4-хлорбензенсульфонил хлорида в соответствии с протоколом, представленным на схеме 7 с использованием общей процедуры, описанной на схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.30-3.80 (bm, 8Н), 6.62 (t, 1H), 7.18 (d, 2H), 7.22 (d, 2H), 7.64-7.80 (m, 2H), 8.30 (d, 1H), 8.38 (d, 2H), 8.42 (d, 1H), 8.58 (d, 1H), 9.18 (d, 1H), 10.42 (s, 1H); Основной пик при масс-спектрометрии составляет 475.2; Чистота ВЭЖХ: 99.52%.
Синтез аналогов пиразина:
Схема 8:

Приготовление соединения 46: к раствору 2-хлорпиразина (500 мг, 0,0027 моль, 1 эквивалент) в ДМФ (20 мл) добавили цезия карбонат (1,7 г, 0,0052 моль, 2 эквивалента), а затем N-Boc-пиперазин (506,8 мг, 0,0027 моль, 1,0 эквивалент). Реакционную смесь нагревали при 100°С на протяжении 12 часов и отслеживали по ТСХ. По завершении избыток растворителя удалили при пониженном давлении, а неочищенный материал разбавили водой и экстрагировали этилацетатом. Слой органического вещества был высушен над сернокислым натрием и сконцентрирован. Неочищенный материал промыли, очистили силикагелем (60-120 меш) с использованием 30% этилацетат-гексана с целью получения 400 мг соединения 46 (выход 44,1%).
Приготовление соединения 47: раствор соединения 46 (250 мг) с эфиром/HCl (30 мл) перемешивали при комнатной температуре на протяжении 1 часа и отслеживали по ТСХ. Через 1 час реакционная смесь была сконцентрирована при пониженном давлении с целью получения соединения 47 (200 мг, выход 98%), которое промыли гексаном и использовали без дальнейшей очистки.
Приготовление соединения 48: к раствору соединения 21 (100 мг, 0,00029 моль, 1 эквивалент) в ДМФ (15 мл) добавили 1-(3-диметиламино-пропил)-3-этилкарбодиимид гидрохлорид (EDCI) (61,5 мг, 0,00032 моль, 1,1 эквивалент), HOBt (49,28 мг, 0,00032 моль, 1,1 эквивалент) и 1,5 эквивалента ДИПЭА.
ДИПЭА при температуре 0°С и перемешивали при комнатной температуре на протяжении 30 минут. К данной смеси при температуре 0°С добавили раствор соединения 47 (58,7 мг, 0,00029 моль, 1 эквивалент) в ДМФ (5 мл) и 3 эквивалента ДИПЭА, после чего перемешивали при комнатной температуре на протяжении 12 часов. Реакционную смесь охладили водой и экстрагировали этилацетатом. Слой органического вещества промыли водой, высушили над сернокислым натрием и сконцентрировали в условиях пониженного давления для получения неочищенного продукта. Неочищенный материал очищали на силикагеле (60-120 меш) с этилацетатом до получения соединения 48 с выходом 31.6% (45 мг).
5-Хлор-2-метокси-N-(4-(4-(пиразин-2-ил)пиперазин-1-карбонил)фенил)бензен-сульфонамид(48)

1H NMR (500 MHz, ДМСО-d6) 3.35-3.70 (bm, 8Н), 3.82 (s, 3H), 7.14 (d, 2H), 7.22 (d, 1H), 7.33 (d, 2H), 7.62-7.68 (dd, 1H), 7.74 (d, 1H), 7.86 (d, 1H), 8.10 (bs, 1H), 8.30 (s, 1H), 10.56 (s, 1H); Основной пик при масс-спектрометрии составляет 488.2; Чистота ВЭЖХ: 92.55%.
N-(4-(4-(пиразин-2-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (49)

Соединение 49 получено из хинолин-8-сульфонил хлорида как описано на схеме 8 с использованием общей процедуры, представленной на схеме 4.
1H NMR (500 MHz, ДМСО-d6) 3.35-3.70 (bm, 8Н), 7.12 (d, 2H), 7.22 (d, 2H), 7.68-7.78 (m, 2H), 7.84 (s, 1H), 8.08 (s, 1H), 8.24 (d, 2H), 8.42 (d, 1H), 8.52 (d, 1H), 9.19 (s, 1H), 10.50 (s, 1H); Основной пик при масс-спектрометрии составляет 475.2; Чистота ВЭЖХ: 98.10%.
Синтез аналогов пиридина
Схема 9:

Приготовление соединения 50: к суспензии NaH (94 мг, 3,94 ммоль, 2 эквивалента) в ДМФ (20 мл) добавили метил-2-амино-пиридин-5-карбоксилат (300 мг, 1,97 ммоль, 1 эквивалент) и перемешивали при комнатной температуре на протяжении 30 минут. Раствор 5-хлор-2-метоксибензенсульфонилхлорида (570 мг, 2,36 ммоль, 1,2 эквивалента) медленно добавляли при комнатной температуре и перемешивали дополнительные 2 часа. Реакцию отслеживали по ТСХ, показавшей остаток 50% исходного материала, продолжение реакции улучшения не дало. Реакционную смесь охладили водой и экстрагировали этилацетатом. Слой органического вещества отделили, высушили над сернокислым натрием и сконцентрировали в условиях пониженного давления. Неочищенный продукт 50, содержащий 50% начального исходного эфира, использовали на следующем этапе без дальнейшей очистки.
Приготовление соединения 51: к раствору соединения 50 (270 мг) в ТГФ/Н2О добавили гидроксид лития (0,160 г, 5 эквивалентов, 3,786 ммоль). Полученную реакционную смесь нагревали в колбе с обратным холодильником и перемешивали на протяжении 4 часов. По завершении реакционную смесь развели водой и экстрагировали этилацетатом. Водный слой подкислили лимонной кислотой и экстрагировали этилацетатом. Слой органического вещества отделили, высушили над сернокислым натрием и сконцентрировали при пониженном давлении. Неочищенную кислоту 51 (90 мг, выход 36%) использовали на следующем этапе без дальнейшей очистки.
Приготовление соединения 52: к раствору соединения 51 (90 мг, 0,263 ммоль, 1 эквивалент) в (15 мл) добавили гексафторфосфат бензотриазол-1-илокситрипирролидинфосфония (РуВОР) (205 мг, 0,395 ммоль, 1,5 эквивалент) при температуре 0°С и перемешивали на протяжении 5 минут. К данной смеси добавили раствор соединения 6 (60,2 мг, 0,2635 ммоль, 1 эквивалент) в 5 мл ДМФ и 3 эквивалента ДИПЭА при температуре 0°С и перемешивали при комнатной температуре на протяжении ночи. По окончании избыток растворителя удалили под вакуумом, а остаток развели водой и экстрагировали этилацетатом. Слой органического вещества отделили, промыли водой, высушили над сернокислым натрием и сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством колонковой хроматографии на силикагеле (60-120 меш) с использованием 1-2% МеОН-ДХМ для получения соединения 52 с выходом 33% (45 мг).
5-Хлоро-2-метокси-N-(5-(4-(2-метоксифенил)пиперазин-1-карбонил)пиридин-2-ил)бензенсульфонамид (52)
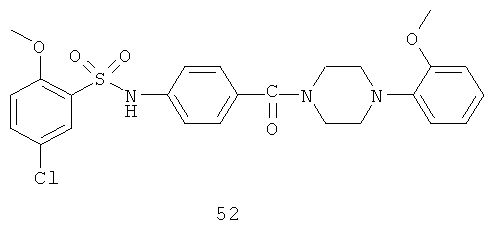
1H NMR (500 MHz, ДМСО-d6) 3.00 (bs, 4Н), 3.40-3.78 (bm, 4H), 3.9 (s, 6H), 6.90 (s, 2H), 6.92-7.00 (m, 2H), 7.20 (d, 1H), 7.60-7.62 (m, 1H), 7.80-7.82 (m, 2H), 8.18 (s, 1H), 11.4 (bs, 1H); Основной пик при масс-спектрометрии составляет 517.2; Чистота ВЭЖХ: 97.65%.
N-(5-(4-(2-метоксифенил)пиперазин-1-карбонил)пиридин-2-ил)хинолин-8-сульфонамид (53)

1H NMR (500 MHz, ДМСО-d6) 2.90 (bs, 4H), 3.40-3.70 (bm, 4H), 3.80 (s, 3H), 6.80-7.20 (m, 5H), 7.60-7.80 (m, 3H), 8.10 (s, 1H), 8.30 (d, 1H), 8.50 (d, 2H), 9.0 (s, 1Н); Основной пик при масс-спектрометрии составляет 504.2; Чистота ВЭЖХ: 98.92%.
Синтез аналогов бензила
Схема 10

Схема 11

Приготовление соединения 55:

К раствору этил-4-аминобензоата (16 г, 96,85 ммоль) в смеси (1:1) ДХМ и пиридина при комнатной температуре в атмосфере
N2 добавили сульфонилхлорид 54 (27,56 г, 121,07 ммоль). Полученную смесь перемешивали в течение 16 ч. После завершения реакции неочищенную смесь разбавили ДХМ, промыли водой, а затем добавили 1Н HCl. Полученный органический слой высушили над Na2SO4 и выпарили при пониженном давлении для получения продукта 55 с 98% выходом (34 г).
Приготовление соединения 56:

К раствору сульфонамида 55 (34 г, 95,5 ммоль) в ТГФ и воде (1:1) добавили LiOH (20 г, 47,66 ммоль). Полученную смесь перемешивали на протяжении ночи при температуре 80°С. После завершения реакции неочищенную смесь промыли этилацетатом (EtOAc). Водный слой подкислили лимонной кислотой и профильтровали. Полученный твердый остаток промыли с этиловым эфиром (Et2O) и азеотропировали при помощи толуола при отрицательном давлении до окисления продукта 56 (30 г, выход 95,8%).
Общая процедура для соединения 57b-57f (Схема II): К раствору N-Вос-пиперазина в ДМФ был добавлен соответствующий бромид R-Br (R=20-23, см. Таблицу 1), а затем K2CO3. Полученная смесь перемешивалась при температуре 80°С в течение 3 дней. После завершения реакции ДМФ удалили при пониженном давлении, полученный остаток разбавили водой и экстрагировали в присутствии EtOAc. Органический слой промыли водой, высушили над Na2SO4 и сконцентрировали. Остаток очистили способом колоночной хроматографии для получения хорошего выхода продуктов 57b-57f.
Приготовление соединения 57g (Схема 2): Соединение 57 g синтезировали из 2-пиколиновой кислоты (1,0 г, 8,12 ммоль), следуя процедуре, описанной для приготовления соединения 58 на схеме 10 с использованием амина n-boc пиперазина для получения 76,10% выхода (1,80 г) продукта 57 g.
Приготовление соединения 58:

К раствору кислоты 56 (2,0 г, 6,09 ммоль) в ДМФ добавили при температуре 0°С РуВоР (Бензотриазол-1-ил-окси-трис-(диметиламино)-фосфоний гексафторофосфат) (4,75 г, 9,14 ммоль) и оставили перемешиваться в течение 5 минут. Затем добавили амин 57а (1,13 г, 6,09 ммоль) при температуре 0°С в атмосфере N2 и перемешивали в течение ночи при комнатной температуре. После завершения реакции полученную смесь разбавили водой и экстрагировали с EtOAc. Органический слой промыли водой, высушили над Na2SO4, и выпарили при отрицательном давлении. Остаток очистили способом колоночной хроматографии (силикагель, 60-120 меш; МеОН-ДХМ, 2:8) для получения 66% выхода (2,0 г) продукта 58.
Приготовление соединения 6:
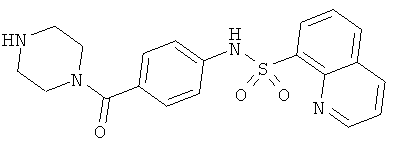
К раствору МеОН-HCl добавили Вос-защищенный амин 5 (2 г, 4,03 ммоль), полученную смесь перемешивали в течение 1 ч. После завершения реакции растворитель удалили при отрицательном давлении, промыли водой, добавили NaHCO3 и экстрагировали с ДХМ. Органический слой высушили над Na2SO4 и выпарили при отрицательном давлении для получения продукта 6 (1,5 г, выход 94,30%).
Приготовление соединения 60:

К раствору амина 59 (0,1 г, 0.25 ммоль) и альдегида 60а (0,04 г, 0.27 ммоль) в ДХМ при комнатной температуре добавили уксусную кислоту (0,2 мл), полученную смесь перемешивали в течение 30 мин. Затем добавили триацетоксиборогидрид натрия (STAB) (0,26 г, 1,26 ммоль), и полученную смесь перемешивали в течение 1 ч при температуре 50°С. После завершения реакции необработанную смесь разбавили ДХМ, промыли водой, высушили над Na2SO4 и сконцентрировали при отрицательном давлении. Остаток очистили способом колоночной хроматографии (силикагель, 60-120 меш; МеОН-ДХМ, 2:8) для получения продукта 60 (0,05 г, выход 38,40%).1H NMR (400 MHz, CDCl3) δ 2.40 (br d, 4H), 3.38 (br s, 2H), 3.48 (s, 2H), 3.68 (br s, 2H), 3.80 (s, 3H), 6.79 (d, 1H), 6.84 (s, 2H), 7.04 (d, 2H), 7.18 (d, 2H), 7.20-7.28 (m, 2H), 7.59-7.64 (m, 2H), 8.03 (d, 1H), 8.28 (d, 1H), 8.36 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS:517 (М+1 пик).
Приготовление соединения 61:

Соединение 61 синтезировали из соединения 59 (0,10 г, 0,25 ммоль) согласно процедуре, описанной для соединения 60 с использованием альдегида 61а для получения продукта 61 с 30,40% выходом (0,040 г).1H NMR (400 MHz, CDCl3) δ 2.40 (br d, 4H), 3.38 (br s, 2H), 3.56 (s, 2H), 3.68 (br s, 2H), 7.06 (d, 2H), 7.18 (d, 3H), 7.25 (d, 4H), 7.42 (d, 2H), 7.59-7.66 (m, 2H), 8.03 (d, 1H), 8.27 (d, 1H), 8.35 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 521 (M+1 пик).
Приготовление соединения 62:

Синтез соединения 62 проводили с применением соединения 59 (0,08 г, 0,20 ммоль) согласно процедуре, описанной для соединения 60 с использованием альдегида 62а для получения продукта 62 с 35,00% выходом (0,040 г).1H NMR (400 MHz, CDCl3) δ 2.40 (br d, 4H), 3.39 (br s, 2H), 3.43 (s, 2H), 3.67 (br s, 2H), 7.02 (d, 2H), 7.15-7.21 (m, 2H), 7.48-7.63 (m, 2H), 8.03 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 567 (M+2 пика).
Приготовление соединения 63:

Синтез соединения 63 проводили согласно процедуре, описанной для соединения 60 с использованием альдегида 63а для получения продукта 63 с 59,00% выходом (0,06 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.40 (br d, 4H), 3.39 (br s, 2H), 3.43 (s, 2H), 3.67 (br s, 2H), 7.02 (t, 2H), 7.05 (d, 2H), 7.19 (d, 2H), 7.21 (s, 2H), 7.49-7.63 (m, 2H), 7.51-7.66 (m, 5H), 8.03 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 505 (M+1 пик).
Приготовление соединения 64:

Синтез соединения 64 проводили согласно процедуре, описанной для соединения 60 с использованием альдегида 64а для получения продукта 64 с 48,54% выходом (0,05 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.40 (br s, 4H), 3.39 (br s, 2H), 3.58 (s, 2H), 3.71 (br s, 2H), 7.08 (d, 2H), 7.16 (d, 2H), 7.43 (d, 1H), 7.51 (d, 1H), 7.59-7.68 (m, 4H), 8.04 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 512 (M+1 пик).
Приготовление соединения 65:

Синтез соединения 65 проводили согласно процедуре, описанной для соединения 60 с использованием альдегида 65а для получения продукта 65 с 28,00% выходом (0,03 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.39 (br d, 4H), 2.58 (s, 3H), 3.29 (br s, 2H), 3.59 (s, 2H), 3.76 (br s, 2H), 7.06 (d, 2H), 7.21 (d, 2H), 7.51-7.68 (m, 2H), 7.80 (d, 2H), 8.03 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 529 (M+1 пик).
Приготовление соединения 66:

Соединение 66 синтезировали согласно процедуре, описанной для соединения 60 с использованием альдегида 66а для получения продукта с 38,80% выходом (0,04 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.40 (br s, 4H), 3.39 (br s, 2H), 3.53 (s, 2H), 3.71 (br s, 2H), 7.06 (d, 2H), 7.15 (d, 2H), 7.43 (t, 1H), 7.51-7.66 (m, 5H), 8.03 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 512 (M+1 пик).
Приготовление соединения 67:

Соединение 67 синтезировали согласно процедуре, описанной для соединения 60 с использованием альдегида 67а для получения продукта с 38% выходом (0,04 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.42 (br d, 4H), 3.38 (br s, 2H), 3.56 (s, 2H), 3.68 (br s, 2H), 7.06 (d, 2H), 7.18 (D, 2H), 7.42 (d, 2H), 7.49 (d, 1H), 7.59-7.68 (m, 4H), 8.03 (d, 1H), 8.27 (d, 1H), 8.35 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 521 (M+1 пик).
Приготовление соединения 68:
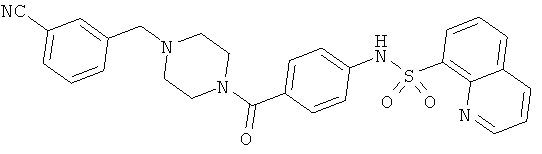
Соединение 68 синтезировали согласно процедуре, описанной для соединения 60 с использованием альдегида 68а для получения требуемого продукта с 38% выходом (0,04 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.43 (br d, 4H), 3.41 (br s, 2H), 3.68 (br s, 4H), 7.06 (d, 2H), 7.15 (d, 2H), 7.35-7.42 (m, 1H), 7.50-7.69 (m, 5H), 8.03 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 512 (M+1 пик).
Приготовление соединения 69:
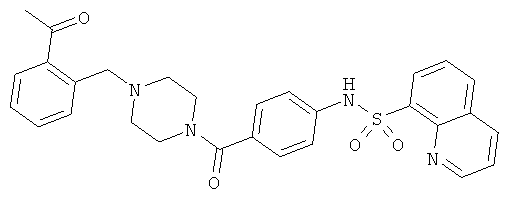
Соединение 69 синтезировали согласно процедуре, описанной для соединения 60 с использованием альдегида 69а для получения требуемого продукта с 37,70% выходом (0,04 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.39 (br s, 4H), 2.52 (s, 3H), 3.26 (br s, 2H), 3.61 (br s, 2H), 3.65 (s, 2H), 7.06 (d, 2H), 7.15 (d, 2H), 7.29-7.39 (m, 3H), 7.58-7.63 (m, 2H), 7.80 (d, 1H), 8.03 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 529 (M+1 пик).
Приготовление соединения 70:

Соединение 70 синтезировали согласно процедуре, описанной для соединения 60 с использованием альдегида 70а для получения продукта с 28,50% выходом (0,03 г) из соединения 6 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.42 (br d, 4H), 3.35 (br s, 2H), 3.60 (s, 2H), 3.68 (br s, 2H), 7.03 (d, 2H), 7.08-7.26 (m, 4H), 7.32 (d, 1H), 7.39 (d, 1H), 7.54-7.60 (m, 2H), 8.03 (d, 1H), 8.28 (d, 1H), 8.37 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 521 (M+1 пик).
Приготовление соединения 71:

Соединение 71 синтезировали согласно процедуре, описанной для соединения 60 с использованием альдегида 71а для получения требуемого продукта с 57,00% выходом (0,06 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3) δ 2.39 (br d, 4H), 3.38 (br s, 2H), 3.43 (s, 2H), 3.63 (br s, 2H), 7.06 (d, 2H), 7.17 (d, 2H), 7.21-7.29 (m, 2H), 7.58-7.63 (m, 3H), 8.03 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 522 (M+пик).
Синтез соединения 72:

Соединение 72 синтезировали согласно процедуре, описанной для соединения 7а с использованием альдегида 72а для получения продукта с 38,80% выходом (0,04 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3): δ 2.45 (br s, 4H), 3.41 (br s, 2H), 3.60 (s, 2H), 3.68 (br s, 2H), 7.06 (d, 2H), 7.15 (d, 2H), 7.21-7.29 (m, 1H), 7.58-7.63 (m, 2H), 7.80 (d, 1H), 8.03 (d, 1H), 8.31 (d, 2H), 8.39 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 522 (M+пик).
Приготовление соединения 73:

Соединение 73 синтезировали согласно процедуре, описанной для соединения 58 на схеме 10 используя амин 57b для получения продукта 73 с 73,27% выходом (0,08 г) из соединения 56 (0,08 г, 0,24 ммоль).).1H NMR (400 MHz, CDCl3): δ 3.44 (br s, 4H), 3.62 (s, 2H), 3.76 (br s, 4H), 6.84 (d, 1H), 7.12 (d, 2H), 7.21 (d, 2H), 7.37 (d, 1H), 7.60-7.66 (m, 2H), 8.04 (d, 1H), 8.32 (d, 1H), 8.39 (d, 1H), 9.18 (d, 1H); MS: 480 (M+1 пик).
Приготовление соединения 74:

Соединение 74 синтезировали согласно процедуре, описанной для соединения 58 на схеме 10 с использованием амина 57 с для получения продукта 74 с 33,45% выходом (0,09 г) из соединения 56 (0,18 г, 0,54 ммоль1H NMR (400 MHz, ДМСО-d6): δ 2.45 (s, 3H), 2.99 (br s, 4H), 3.55 (br s, 4H), 6.78 (s, 1H), 7.14 (dd, 4H), 7.66-7.75 (m, 2H), 8.26 (d, 1H), 8.41 (d, 1H), 8.50 (d, 1H), 9.16 (d, 1H); MS: 480 (M+1 пик).
Приготовление соединения 75:

Соединение 75 синтезировали согласно процедуре, описанной для соединения 58 на схеме 10 с использованием амина 57d для получения продукта 75 с 43,85% выходом (0,10 г) из соединения 56 (0,15 г, 0,47 ммоль).1H NMR (400 MHz, CDl3): δ 2.40 (br d, 4H), 3.38 (br s, 2H), 3.52 (s, 2H), 3.73 (br s, 2H), 7.07 (d, 2H),7.18 (d, 2H), 7.22-7.38 (m, 8H), 7.59-7.63 (m, 2H), 8.02 (d, 1H), 8.32 (d, 1H), 8.39 (d, 1H), 9.18 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); MS: 487 (M+1 пик).
Приготовление соединения 76:

Соединение 76 синтезировали согласно процедуре, описанной для соединения 58 на схеме 10 с использованием амина 57е для получения продукта 76 с 26,31% выходом (0,06 г) из соединения 56 (0,23 г, 0,70 ммоль1H NMR (400 MHz, CDCl3): δ 3.15 (br s, 4H), 3.82 (br s, 4H), 4.21 (s, 2H), 7.12 (dd, 4H), 7.41 (t, 1H), 7.52-7.67 (m, 3 Н), 7.82 (t, 1H), 8.04 (d, 1H), 8.31 (d, 1H), 8.39 (d, 1H), 8.63 (d, 2H), 9.16 (d, 1H); MS: 480 (M+1 peak); MS: 488 (M+1 пик).
Приготовление соединения 77:

Соединение 77 синтезировали согласно процедуре, описанной для соединения 58 на схеме 10 с использованием амина 57f для получения продукта 77 с 21,14% выходом (0,07 г) из соединения 56 (0,17 г, 0,51 ммоль).1H NMR (400 MHz, CDCl3): δ 1.71 (br s, 1H), 1.80 (br s, 1H), 2.53 (br d, 2H), 2.71 (br d, 2H), 3.38 (br s, 2H), 3.57-3.69 (m, 4H), 7.02 (t, 2H), 7.16 (t, 2H), 7.59-7.63 (m, 2H), 8.01 (d, 1H), 8.31 (d, 1H), 8.39 (d, 1H), 8.48 (s, 1H), 9.16 (d, 1H); MS: 480 (M+1 пик); MS: 501 (M+1 пик).
Приготовление соединения 78:

Соединение 78 синтезировали согласно процедуре, описанной для соединения 60 на схеме 10 с использованием альдегида 24 для получения требуемого продукта с 48,61% выходом (0,035 г) из соединения 59 (0,07 г, 0,16 ммоль).1H NMR (400 MHz, CDCl3): δ 0.04 (d, 2H), 0.54 (d, 2H), 0.80-0.90 (m 1H), 2.24 (d, 2H), 2.48 (br d, 4H), 3.39 (br s, 2H), 3.78 (br s, 2H), 7.12 (dd, 4H), 7.49-7.64 (m, 2H), 8.04 (d, 1H), 8.31 (d, 1H), 8.39 (d, 1H), 8.58 (s, 1H), 9.16 (d, 1H); MS: 480 (M+1 пик); MS: 451 (M+1 пик).
Приготовление соединения 81:

Соединение 81 синтезировали согласно процедуре, описанной для соединения 60 на схеме 10 с использованием альдегида 81а для получения продукта 81 с 43,26% выходом (0,045 г) из соединения 6 (0,1 г, 0,23 ммоль).1H NMR (400 MHz, CDCl3): δ 0.91 (t, 3H), 1.25-1.39 (m, 2H), 1.40-1.49 (m, 2H), 2.30 (t, 2H), 2.42 (br s, 4H), 3.39 (br s, 2H), 3.70 (br s, 2H), 7.05 (d, 2H), 7.16 (d, 2H), 7.59-7.64 (m, 2H), 8.02 (d, 1H), 8.32 (d, 1H), 8.38 (d, 1H), 8.58 (br s, 1H), 9.16 (d, 1H); MS: 480 (M+1 пик); MS: 453 (M+1 пик).
Приготовление соединения 82:

Соединение 82 синтезировали согласно процедуре, описанной для соединения 60 на схеме 10 с использованием альдегида 82а для получения продукта с 48,73% выходом (0,06 г) из соединения 59 (0,08 г, 0,20 ммоль).1H NMR (400 MHz, CDCl3): δ 2.39 (br s, 2H), 2.56 (br s, 2H), 3.39 (br s, 2H), 3.59 (s, 2H), 3.75 (br s, 2H), 3.81 (s, 3H), 6.85 (d, 1H), 6.92 (t, 1H), 7.08 (d, 2H), 7.17 (d, 2H), 7.24-7.31 (m, 2H), 8.02(d, 1H), 8.32 (d, 1H), 8.38 (d, 1H), 8.58 (br s, 1H), 9.17 (d, 1H); MS: 480 (M+1 пик); MS: 517 (M+1 пик).
Приготовление соединения 83:

Соединение 83 синтезировали согласно процедуре, описанной для соединения 58 на схеме 10 с использованием амина 57g для получения продукта с 22,72% выходом (0,05 г) из соединения 56 (0,14 г, 0,43 ммоль).1H NMR (400 MHz, CDCl3): δ 3.62 (br s, 8H), 7.05 (d, 2H), 7.19 (d, 2H), 7.38 (t, 1H), 7.59-7.64 (m, 2H), 7.69 (d, 1H), 7.80 (t, 1H), 8.02 (d, 1H), 8.32 (d, 1H), 8.38 (d, 1H), 8.58 (br s, 1H), 9.17 (d, 1H); MS: 480 (M+1 пик); MS: 502 (M+1 пик).
Приготовление натриевой соли 76:
К раствору сульфонамида 75 (0,05 г, 0,10 ммоль) в метаноле, при комнатной температуре добавили NaOH (0,04 г, 0,10 ммоль), полученную смесь перемешивали в течение 2 часов. После завершения реакции соответствующий растворитель удалили при отрицательном давлении. После чего добавили Et2O (5 мл) и затем удалили его. Et2O добавляли и удаляли несколько раз для получения желаемого продукта в твердом виде с 84,61% выходом (0,04 г1H NMR (400 MHz, ДМСО-d6): δ 3.40 (br s, 2H), 3.59 (br s, 8H), 6.77 (d, 1H), 6.89 (d, 1H), 7.18-7.29 (m, 2H), 7.50-7.60 (m, 2H), 7.99 (d, 1H), 8.25-8.32 (m, 2H), 8.98 (d, 1H); MS: 509 (M+1 пик).
Приготовление мезилатной соли 77:
К раствору сульфонамида 75 (0,05 г, 0,10 ммоль) в ДХМ при комнатной температуре добавили CH3SO3H (0,10 г, 0,10 ммоль), полученную смесь перемешивали в течение 2 часов. После завершения реакции соответствующий растворитель удалили при отрицательном давлении, затем добавили Et2O (5 мл) и удалили его. Et2O добавляли и удаляли несколько раз (3×5 мл) для получения требуемого продукта с 59,32% выходом (0,035 г).1H NMR (400 MHz, CDCl3): δ 3.02 (br s, 3H), 3.25 (br s, 3H), 4.23 (s, 2H), 7.17 (dd, 4H), 7.62-7.69 (m, 2H), 8.22 (d, 1H), 8.32 (d, 1H), 8.38 (d, 1H), 9.10 (d, 1H); MS: 487 (M+пик).
Синтез аналогов -N4-арил/гетероарил пиперазина
Схема 12

Общая процедура для соединения 86: Азот очистили через перемешиваемый раствор арилбромида (84, 2,15 ммоль) в 1,4-диоксане (20 мл) при комнатной температуре в течение 30 мин. К реакционной смеси добавили 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP) (0,134 г, 0,215 ммоль), ацетат палладия (0,0096 г, 0,043 ммоль) и карбонат цезия (1,40 г, 4,3 ммоль), и продолжили очищать азот еще 20 мин. В заключение добавили N-Boc пиперазин (85, 0,4 г, 2,15 ммоль) и перемешивали при температуре 100°С в течение ночи в атмосфере азота. После завершения реакции (контроль способом ТСХ), реакционную смесь сконцентрировали в вакууме. Остаток растворили в воде, удаленной посредством этил ацетата (3×50 мл). Комбинированные органические экстракты промыли соляным раствором (20 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали при отрицательном давлении. Необработанный продукт очистили способом колоночной хроматографии (60-120 силикагель) с использованием 10% этил ацетат-гексана для получения соединения 86 (40-60%).
Общая процедура для соединения 87: N1-Вос-N4-арилпиперазин (86, 1,075 ммоль) поместили в круглодонную колбу и добавили метанольную-HCl (20 мл, 20%), которая привела к образованию однородного раствора, и перемешивали в течение 1 часа при комнатной температуре. После завершения реакции (контроль способом ТСХ), растворитель удалили в вакууме. Необработанный продукт несколько раз промыли этил ацетатом, а затем хорошо просушили для получения соединения 87 (90%) в виде белого твердого вещества.
Процедура приготовления этил 4-(хинолин-8-сульфонамидо) бензоата 90: К раствору этил-4-амино бензоата (88, 5,0 г, 30,16 ммоль) в 1:1 смеси ДХМ-пиридина (50:50 мл) добавили хинолин-8-сульфонил хлорид (89, 8,24 г, 36,19 ммоль) в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение ночи. После завершения реакции (контроль способом ТСХ) реакционную смесь разбавили дихлорметаном (150 мл), промыли водой (3×50 мл), раствором 1N HCl (3×50 мл) и соляным раствором (50 мл). Комбинированные органические экстракты сушили над безводным сульфатом натрия, профильтровали и сконцентрировали в вакууме. Необработанный продукт дистиллировали с толуолом, чтобы удалить остатки пиридина и высушили для получения сульфонамида 90 (11,58 г, 90%) в виде практически белого твердого вещества и использовали в таком виде на следующем этапе без последующей очистки.
Аналитические данные соединения 90:1H NMR (500 MHz, CDCl3) δ: 1.20 (3H, t), 4.19 (2H, q), 7.20 (2H, m), 7.60-7.80 (4H, m), 8.30 (1H, m), 8.40-8.50 (2H, m), 9.10 (1H, m), 10.8 (1H, s); MS: m/z 357,4 (M+1)+.
Процедура приготовления 4-(хинолин-8-сульфонамидо) бензойной кислоты 91: Этил 4-(хинолин-8-сульфонамидо)бензоат (90, 10 г, 28,08 ммоль) растворили в смеси ТГФ-воды (100:100 мл) и оставили при комнатной температуре. К раствору добавили LiOH (5,89 г, 14,0 ммоль), и полученный раствор кипятили в течение ночи. Затем реакционную смесь промыли этил ацетатом (3×50 мл) и окислили разбавленной HCl. Полученную суспензию отфильтровали, и остаток дистиллировали толуолом. Затем продукт высушили в вакууме для получения карбоксильной кислоты 91 (8,28 г, 90%) в виде практически белого твердого вещества.
Аналитические данные соединения 91:1H NMR (500 MHz, CDCl3) δ: 7.10 (2H, m), 7.60-7.80 (4H, m), 8.25 (1H, m), 8.40-8.60 (2H, m), 9.10 (1H, m), 10.7 (1H, bs), 12.6 (1H, bs); MS: m/z 329,3 (M+1)+.
Общая процедура для соединения 92: К перемешиваемому раствору карбоксильной кислоты (91, 0,61 ммоль) в ДМФ при температуре 0°С в атмосфере азота добавили EDCI (0,129 г, 0,671 ммоль), HOBt (0,91 г, 0,671 ммоль) и ДИПЭА (0,31 мл, 1,83 ммоль), полученный раствор перемешивали при комнатной температуре в течение 30 мин. Затем при температуре 0°С добавили амино гидрохлорид (87, 0,61 ммоль) и перемешивали в течение ночи при комнатной температуре. После завершения реакции (контроль способом ТСХ), реакционную смесь вылили в 1,0 M HCl и экстрагировали с EtOAc. Органический слой промыли с насыщенным раствором NaHCO3, высушили над NaSO4 и отфильтровали. Растворитель удалили в роторном испарителе, затем продукт выделили хроматографией на силикагеле (60-120 силикагель, 2% МеОН-ДХМ) или препаративная ВЭЖХ для получения амида (92a-as) (40-60%) в виде практически белого твердого вещества.
Общая процедура для соединения (92at, 92au и 92av): К раствору аналога N4-арилпиперазина (0,39 ммоль) в смеси метанол-ДХМ (для соли натрия) или ДХМ (для соли мезилата) добавили гидроксид натрия в метаноле (0,39 ммоль) или метансульфонилхлорид (0,39 ммоль). Реакционную смесь перемешивали в течение ночи и выпарили растворитель при отрицательном давлении. Затем необработанную смесь последовательно промыли в эфире и n-пентане для получения требуемой соли в виде белого твердого вещества.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92а):

1H NMR (500 MHz, ДМСО-d6) δ: 10.42 (s, 1H), 9.15 (bs, 1H), 8.50 (d, 1H), 8.40 (d, 1H), 8.24 (d, 1H), 7.70-7.80 (m, 2H), 7.15-7.20 (dd, 4H), 6.90-7.00 (m, 2H),6.82 (d, 2H), 3.80 (s, 3H), 3.40-3.78 (bm, 4H), 2.80-3.00 (bs, 4H); чистота по ВЭЖХ: 97,11%; MS, m/z 503,2 (М+1)+.
N-(4-(4-фенилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92b):
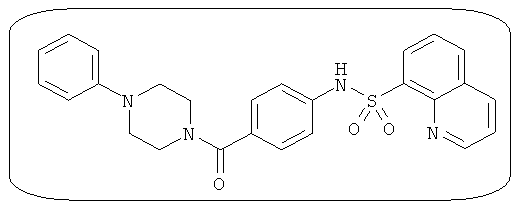
1H NMR (500 MHz, ДМСО-d6) δ: 10.42 (s, 1H), 9.18 (d, 1H), 8.56 (d, 1H), 8.44 (d, 1H), 8.30 (d, 1H), 7.70-7.80 (m, 2H), 7.10-7.22 (m, 6H), 6.90 (d, 2H), 6.80 (t, 1H), 3.30-3.70 (bs, 4H), 3.00-3.20 (bm, 4H); Чистота по ВЭЖХ 98,50%: MS, m/z 473,2 (M+1)+.
N-(4-(4-(3-этоксифенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92с):

1H NMR (400 MHz, CDCl3) δ: 9.18 (d, 1H), 8.60 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.10 (d, 1H), 7.65 (m, 2H), 7.05-7.20 (m, 5H), 6.50 (m, 3H), 4.00 (q, 2H), 3.40-3.90 (bs, 4H), 3.00-3.20 (bm, 4H), 1.40 (t, 3H); чистота по ВЭЖХ 99,74%: MS, m/z 517,40 (M+1)+.
N-(4-(4-(4-этоксифенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92d):

1H NMR (400 MHz, CDCl3) δ: 9.18 (d, 1H), 8.60 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (d, 2H), 7.10 (d, 2H), 6.85 (m, 4H), 4.00 (q, 2H), 3.40-3.90 (bm, 4H), 3.00 (bm, 4H), 1.4 (t, 3H); чистота по ВЭЖХ 99,36%: MS, m/z 517,40 (М+1)+.
Этил 3-(4-(4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-ил)бензоат (92е):

1H NMR (400 MHz, CDCl3) δ: 9.20 (d, 1H), 8.60 (s, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 4H), 7.30 (m, 1H), 7.20 (d, 2H), 7.10 (m, 3H), 4.40 (q, 2H), 3.40-3.90 (bm, 4H), 3.20 (bm, 4H), 1.4 (t, 3H); чистота по ВЭЖХ 99,65%: MS, m/z 545,35 (M+1)+.
N-(4-(4-(2-фторофенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92f):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.60 (s, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (m, 3H), 7.10 (d, 2H), 6.65 (d, 1H), 6.55 (m, 2H), 3.40-3.80 (bm, 4H), 3.15 (bm, 4H); чистота по ВЭЖХ 99,16%: MS, m/z 491,35 (M+1)+.
N-(4-(4-(3-изопропоксифенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92g):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.60 (s, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (m, 2H), 7.15 (m, 1H), 7.10 (d, 2H), 6.45 (m, 3Н), 3.40-3.80 (bm, 4H), 3.15 (bm, 4H); чистота по ВЭЖХ 99,45%: MS, m/z 531,40 (M+1)+.
N-(4-(4-(2,5-дифторофенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92h):
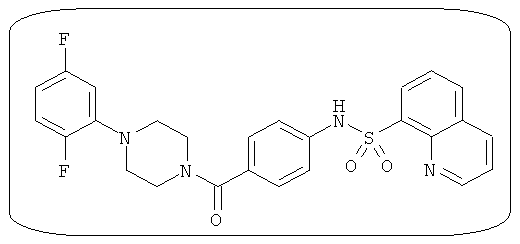
1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.60 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (m, 2H), 7.10 (d, 2H), 6.95 (m, 1H), 6.60 (m, 2H), 3.45-3.90 (bm, 4H), 3.00 (bm, 4H); чистота по ВЭЖХ 99,94%: MS, m/z 509,30 (M+1)+.
N-(4-(4-(3-(метилтио)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92i):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.60 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (m, 3Н), 7.10 (d, 2H), 6.80 (m, 2H), 6.65 (d, 1H), 3.45-3.90 (bm, 4H), 3.10 (bm, 4H), 2.45 (s, 3Н); чистота по ВЭЖХ 99,98%: MS, m/z 519,30 (M+1)+.
N-(4-(4-(3-(трифторометил)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92j):
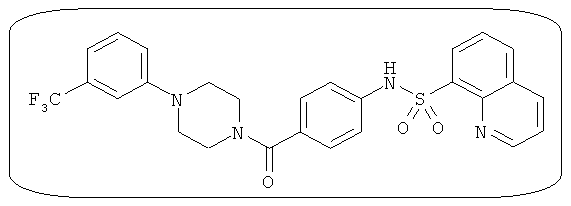
1Н NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.60 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.50 (d, 2H), 7.20 (m, 2H), 7.10 (d, 2H), 6.90 (d, 2H), 3.45-3.90 (bm, 4H), 3.10 (bm, 4H); чистота по ВЭЖХ 99,63%: MS, m/z 541,25 (М+1)+.
N-(4-(4-(2-(трифторометокси)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфон-амид (92k):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (m, 4H), 6.95-7.15 (m, 4H), 3.45-3.90 (bm, 4H), 3.10 (bm, 4H); чистота по ВЭЖХ 99,89%: MS, m/z 557,35 (M+1)+.
N-(4-(4-(4-(этилтио)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (921):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.3 (d, 2H), 7.20 (d, 2H), 7.10 (d, 2H), 6.80 (d, 2H), 3.45-3.90 (bm, 4H), 3.10 (bm, 4H), 2.90 (q, 2H), 1.15 (t, 3Н); чистота по ВЭЖХ 98,53%: MS, m/z 533,35 (M+1)+.
N-(4-(4-(4-(метилтио)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92m):

1H NMR (400 MHz, ДМСО-d6) δ: 10.40 (s, 1H), 9.15 (s, 1H), 8.50 (d, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 7.70 (m, 2H), 7.20 (m, 6H), 6.85 (d, 2H), 3.20-3.70 (bm, 4H), 3.05 (bm, 4H), 2.35 (s, 3Н); чистота по ВЭЖХ 91,00%: MS, m/z 518,50 (M+1)+.
N-(4-(4-(3-(метокси)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92n):

1H NMR (400 MHz, ДМСО-d6) δ: 10.45 (s, 1H), 9.05 (d, 1H), 8.50 (d, 1H), 8.45 (d, 1H), 8.30 (d, 1H), 7.70 (m, 2H), 7.00-7.20 (m, 5H), 6.50 (d, 1H), 6.40 (s, 1H), 6.35 (d, 1H), 3.65 (s, 3H), 3.20-3.70 (bm, 4H), 3.05 (bm, 4H); чистота по ЖХМС 100,00%: MS, m/z 503,35 (M+1)+.
N-(4-(4-(3-(хлоро)фенил)пиперазин4-карбонил)фенил)хинолин-8-сульфонамид (92о):

1H NMR (400 MHz, CDCl3) δ: 9.15 (s, 1H), 8.60 (s, 1H), 8.35 (d, 1H), 8.30 (d. 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.10 - 7.20 (m, 5H), 6.85 (m, 2H), 6.75 (d, 1H), 3.40-3.85 (bm, 4H), 3.10 (bm, 4H); чистота по ЖХМС 97,15%: MS, m/z 507,30 (M+1)+.
N-(4-(4-(3-(метил)-5-(трифторометил)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92р):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20-7.30 (m, 4H), 7.15 (s, 1H), 7.10 (d, 2H), 3.40-3.85 (bm, 4H), 2.85 (bm, 4H), 2.35 (s, 3H); чистота по ЖХМС 99,65%: MS, m/z 555,35 (M+1)+.
N-(4-(4-(3,4-(дихлоро)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92q):

1H NMR (400 MHz, ДМСО-d6) δ: 10.45 (s, 1H),9.15(s, 1H),8.50 (d, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 7.75 (m, 2H). 7.4 (d, 1H), 7.10-7.20 (m, 5H), 6.90 (d, 1H), 3.20-3.65 (bm, 4H), 3.10 (bs, 4H); чистота по ВЭЖХ 93,48%: MS, m/z 542,35 (M+1)+.
N-(4-(4-(3-(трифторометокси)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфон-амид (92r):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (d, 2H), 7.10 (m, 4H), 6.85 (d, 2H), 3.40-3.90 (bm, 4H), 3.10 (bs, 4H); чистота no ВЭЖХ 90,37%: MS, m/z 557,50 (M+1)+.
N-(4-(4-(4-(N,N-диэтиламино)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфон-амид (92s):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (d, 2H), 7.10 (d, 2H), 6.85 (d, 2H), 6.65 (d, 2H), 3.40-3.90 (bm, 4H), 3.3 (q, 4H), 2.80-3.10 (bm, 4H), 1.1 (t, 6H); чистота по ВЭЖХ 97,59%: MS, m/z 544,50 (M+1)+.
N-(4-(4-(3,4-(дифторо)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92t):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (d, 2H), 7.10 (d, 2H), 7.05 (m, 1H), 6.65 (m, 1H), 6.55 (d, 1H), 3.40-3.90 (bm, 4H), 3.00 (bs, 4H); чистота по ВЭЖХ 99,73%: MS, m/z 509,55 (M+1)+.
N-(4-(4-(4-(фторо)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92u):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (d, 2H), 7.10 (d, 2H), 6.95 (m, 2H), 6.85 (m, 2H), 3.40-3.90 (bm, 4H), 3.00 (bs, 4H); чистота по ВЭЖХ 97,39%: MS, m/z 491,25 (M+1)+.
N-(4-(4-(2-(этил)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92v):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.05-7.30 (m, 7H), 7.00 (d, 1H), 3.40-3.90 (bm, 4H), 2.80 (bm, 4H), 2.7 (q, 2H), 1.20 (t, 3H); чистота по ВЭЖХ 98,85%: MS, m/z 501,05 (M+1)+.
N-(4-(4-(4-(хлоро)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92w):

1Н NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (m, 4H), 7.10 (d, 2H), 6.80 (d, 2H), 3.40-3.90 (bm, 4H), 3.10 (bm, 4H); чистота по ЖХМС 99,88%: MS, m/z 507,25 (M+1)+.
N-(4-(4-(3-(этил)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92х):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.20 (m, 3H), 7.10 (d, 2H), 6.75 (m, 3H), 3.40-3.90 (bm, 4H), 3.10 (bm, 4H), 2.6 (q, 2H), 1.2 (t, 3H); чистота по ЖХМС 96,79%: MS, m/z 501,30 (M+1)+.
N-(4-(4-(3-(трифторометил)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92у):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.55 (s, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.50 (m, 2H), 7.25 (m, 2H), 7.20 (m, 2H), 7.10 (d, 2H) 3.40-3.90 (bm, 4H), 2.90 (bm, 4H); чистота по ВЖЭХ 99,65%: MS, m/z 541,15 (M+1)+.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)-N-метилхинолин-8-сульфонамид(92z):

1H NMR (500 MHz, ДМСО-d6) δ: 9.05 (s, 1H), 8.55 (m, 1H), 8.3 (m, 2H), 7.7 (m, 2H), 7.25 (m, 4H), 6.95 (m, 2H), 6.85 (m, 2H), 3.78 (s, 3H), 3.6 (s, 3H), 3.30-3.80 (bm, 4H), 2.80-3.00 (bm, 4H); чистота по ВЖЭХ 97,68%: MS, m/z 517,3 (M+1)+.
Этил 2-(4-(4-(N-метилхинолин-8-сульфонамидо)бензоил)пиперазин-1-ил)бензоат (92аа):

1H NMR (400 MHz, ДМСО-d6) δ: 10.43 (s, 1H), 9.18 (s, 1H), 8.55 (d, 1H), 8.41 (d, 1H), 8.23 (d, 1H), 7.7 (m, 2H), 7.55 (m, 1H), 7.41 (m, 1H), 7.25 (m, 6H), 4.22 (q, 2H), 3.30-3.80 (bm, 4H), 2.80-3.00 (bm, 4H), 1.25 (t, 3Н); чистота по ЖХМС 97,43%: MS, m/z 545,1 (M+1)+, 567,1 (M+23).
N-(4-(4-(3-(диметиламино)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид(92ab):

1H NMR (400 MHz, ДМСО-d6) δ: 9.11-9.16 (d, 1H), 8.54 (bs, 1H), 8.22-8.55 (d, 2H), 8.02-8.06 (d, 1H), 7.55-7.64 (m, 2H), 7.02-7.32 (m, 6H), 6.20-6.54 (m, 2H), 3.20-3.94 (m, 4H), 3.00-3.22 (bs, 4H), 2.84-2.94 (s, 6H); чистота по ЖХМС 98,33%: MS, m/z 516,3 (M+1)+, 538,3 (M+23).
N-(4-(4-(3-фторофенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92ас):

1H NMR (400 MHz, ДМСО-d6) δ: 9.10-9.15 (d, 1H), 8.22-8.40 (m, 2H), 7.98-8.11 (d, 1H), 7.52-7.66 (m, 2H), 7.02-7.28 (m, 6H), 6.42-6.64 (m, 3H), 3.42-3.84 (bd, 4H), 3.00-3.22 (m, 4H); чистота по ЖХМС 93,74%: MS, m/z 491,3 (M+1)+.
N-(4-(4-(5-изопропил-2-метилфенил)пиперазин-l-карбонил)фенил)хинолин-8-сульфонамид (92ad):

1Н NMR (400 MHz, ДМСО-d6) δ: 9.18 (d, 1H), 8.54 (bs, 1H), 8.24-8.38 (dd, 2H), 8.00-8.15 (d, 1H), 7.54-7.66 (m, 2H), 7.18-7.26 (m, 2H), 7.02-7.14 (m, 3H), 6.86-6.94 (m, 2H), 3.42-3.92 (bd, 4H), 2.80-2.98 (m, 2H), 2.22 (s, 3Н), 1.14-1.24 (d, 6H), 0.80-0..92 (m, 1H); чистота по ВЖЭХ 98,76%:
N-(4-(4-(4-(трифторометокси)фенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфон-амид (92ае):
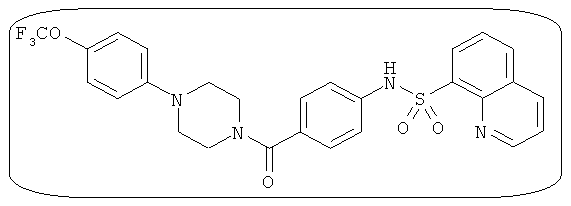
1H NMR (400 MHz, ДМСО-d6) δ: 9.18 (d, 1H), 8.58 (bs, 1H), 8.23-8.38 (dd, 2H), 8.00-8.15 (d, 1H), 7.52-7.68 (m, 2H), 7.14-7.24 (m, 6H), 6.80-6.89 (d, 2H), 3.42-3.92 (bd, 4H), 3.00-3.18 (bs, 4H); чистота по ВЖЭХ 98,77%:
N-(4-(4-(4-метоксифенил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92af):

1H NMR (400 MHz, ДМСО-d6) δ: 10.41 (s, 1H), 9.17 (s, 1H), 8.21-8.45 (ddd, 3Н), 7.63-7.78 (m, 2H), 7.12-7.24 (m, 4H), 6.78-6.94 (d, 4H), 3.82 (s, 3Н), 3.22-3.54 (m, 4H), 2.84-3.08 (m, 4H); чистота по ЖХМС=93,70%: MS, m/z 503,1 (M+1)+.
5-(4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-ил)пиридин-3-ил пропионат (92ag):
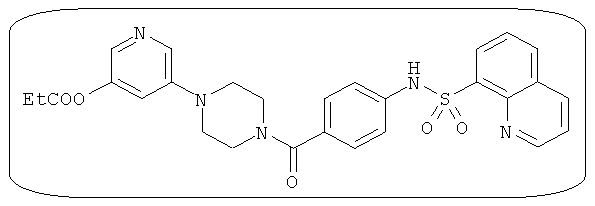
1H NMR (400 MHz, CDCl3) δ: 10.42 (s, 1H), 9.15 (s, 1H), 8.40-8.54 (dt, 2H), 8.24-8.28 (d, 1H), 7.60-7.72 (m, 3Н), 7.05-7.22 (m, 4H), 4.21-4.38 (q, 2H), 3.3-3.8 (m, 8H), 1.25 (t, 3Н); чистота по ЖХМС: 98,85%; MS, m/z 546,3 (M+1)+.
N-(4-(4-(тиазол-2-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92ah):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.60 (m, 2H), 7.35 (d, 1H), 7.20 (d, 2H), 7.10 (d, 2H), 6.7 (d, 1H), 3.3-3.8 (m, 8H); чистота по ВЖЭХ: 99,79%; MS, m/z 480,2 (M+1)+.
N-(4-(4-(2-метилтиазол-5-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92ai):

1H NMR (400 MHz, CDCl3) δ: 10.42 (s, 1H),9.15(d, 1H), 8.45 (d, 1H), 8.40 (d, 1H), 8.15 (d, 1H), 7.70 (m, 2H), 7.20 (d, 2H), 7.15 (d, 2H), 6.8 (s, 1H), 3.5 (bm, 4H), 2.95 (bm, 4H), 2.4 (s, 3H); чистота по ВЖЭХ: 95,78%; MS, m/z 494,3 (M+1)+.
N-(4-(4-(пиразин-2-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92aj):

1H NMR (500 MHz, ДМСО-d6) δ: 10.42 (s, 1H), 9.15 (s, 1H), 8.52 (d, 1H), 8.44 (d, 1H), 8.3 (m, 2H), 8.1 (s, 1H), 7.86 (s, 1H), 7.74 (m, 2H), 7.23 (d, 2H), 7.14 (d, 2H), 3.3-3.7 (m, 8H); чистота по ВЭЖХ: 98,10%; MS, m/z 475,2 (M+1)+.
N-(4-(4-(пиримидин-2-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92ak):

1Н NMR (500 MHz, ДМСО-d6) δ: 10.42 (s, 1H), 9.15 (s, 1H), 8.52 (d, 1H), 8.45 (d, 1H), 8.35 (d, 2H), 8.30 (d, 1H), 7.75 (m, 2H), 7.20 (d, 2H), 7.15 (d, 2H), 7.80 (t, 1H), 3.3-3.8 (m, 8H); чистота по ВЭЖХ: 99,52%; MS, m/z 475,2 (M+1)+.
N-(4-(4-(2-метоксипиридин-3-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92а1):

1H NMR (500 MHz, ДМСО-d6) 2.80-3.00 (4Н, m), 3.40-3.85 (4H, m), 3.85 (3H, s), 6.91 (1H, m), 7.11-7.20 (5H, m), 7.70-7.75 (3H, m), 8.27-8.29 (1H, m), 8.41-8.53 (2H, m),9.12 (1Н, m), 10.44 (1H, s). MS 504,1 (M+1)+.
N-(4-(4-(4-метоксипиидин-3-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92am):
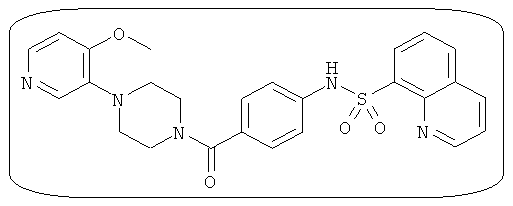
1H NMR (400 MHz, CDCl3) δ: 9.18 (d, 1H), 8.60 (bs, 1H), 8.25-8.40 (m, 3H), 8.05 (d, 1H), 7.65 (m, 2H), 7.20 (d, 2H), 7.15 (d, 2H), 7.10 (d, 1H), 4.10 (s, 3H), 3.40-3.80 (bm, 4H), 3.10 (bm, 4H); чистота по ВЭЖХ: 97,14%; ЖХМС, m/z 504,35 (M+1)+.
N-(4-(4-(5-(этоксикарбонил)пиридин-3-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфон-амид (92an):

1H NMR (400 MHz, ДМСО-d6) δ: 10.45 (s, 1H), 9.15 (d, 1H), 8.55 (m, 3H), 8.45 (d, 1H), 8.30 (d, 1H), 7.70 (m, 2H), 7.65 (s, 1H), 7.20 (d, 2H), 7.10 (d, 2H), 4.30 (q, 2H), 3.4-3.8 (bm, 4H), 3.1 (bm, 4H), 1.3 (t, 3H); чистота по ЖХМС: 98,85%; MS, m/z 546,35 (M+1)+.
N-(4-(4-(5-(метоксикарбонил)-6-метокси)пиридин-3-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92ао):

1H NMR (400 MHz, CDCl3) δ: 9.18 (d, 1H), 8.60 (bs, 1H), 8.35 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.95 (d, 1H), 7.80 (d, 1H), 7.60 (m, 2H), 7.20 (d, 2H), 7.10 (d, 2H), 4.00 (s, 3H), 3.9 (s, 3H), 3.4-3.8 (bm, 4H), 3.1 (bm, 4H); чистота по ВЭЖХ: 94,72%; MS, m/z 562,18 (M+1)+.
N-(4-(4-(пиридин-4-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92ар):

1H NMR (400 MHz, CDCl3) δ: 9.2(s, 1H), 8.22-8.40 (m, 4H), 8.00-8.04 (m, 1H), 7.54-7.62 (m, 2H), 7.05-7.22 (dd, 4H), 6.60-6.68 (d, 1H), 3.2-3.8 (m, 8H); чистота по ЖХМС: 97,37%; ЖХМС, m/z 474,05 (M+1)+.
N-(4-(4-(3-метоксипиридин-2-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92aq):

1H NMR (400 MHz, CDCl3) δ: 10.22 (s, 1H), 9.14 (d, 1H), 8.22-8.50 (ddd, 3H), 7.62-7.78 (m, 3H), 7.11-7.22 (m, 5H), 6.82-6.86 (d, 1H), 3.7 (s, 3H), 3.2-3.8 (m, 8H); чистота по ЖХМС: 97,96%; ЖХМС, m/z 504,3 (М+1)+.
N-(4-(4-(2-метоксипиридин-3-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92ar):

1Н NMR (400 MHz, CDCl3) δ:10.21 (s, 1H), 9.12-9.13 (d, 1H), 8.27-8.53 (ddd, 3H), 7.70-7.75 (m, 3H), 7.13-7.20 (m, 5H), 6.87-6.90 (dd, 1H), 3.85 (s, 3H), 3.29-3.50 (m, 4H), 2.92 (bm, 4H); чистота по ЖХМС 97,11%; ЖХМС, m/z 504,3 (М+1)+.
N-(4-(4-(изохинолин-4-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (92as):

1H NMR (400 MHz, ДМСО-d6) δ: 9.18 (d, 1H), 9.01 (s, 1H), 8.52-8.58 (s, 1H), 8.25-8.41 (dd, 2H), 7.98-8.18 (m, 4H). 7.54-7.78 (m, 4H), 7.22-7.28 (d, 2H), 7.02-7.16 (d, 2H), 3.82-3.98 (m, 4H), 2.94-3.22 (bs, 4H); чистота по ВЖЭХ 94,23%; MS m/z 524,25 (M+1)+.
Натрий (4-(4-(2-метоксифенил)пиперазин-1-карбонил)фенил)(хинолин-8-илсульфонил)амид (92at):

1H NMR (400 MHz, ДМСО-d6) δ: 9.00 (s, 1H), 8.40 (m, 2H), 8.00 (d, 1H), 7.60 (m, 2H), 6.90-7.00 (m, 4H), 6.80 (m, 4H), 3.75 (s, 3H), 3.55 (bs, 4H), 2.90 (bs, 4H); чистота по ЖХМС: 95,17%; MS, m/z 503,25 (M-Na+1)+.
Натрий (4-(4-(пиразин-2-ил)пиперазин-1-карбонил)фенил)(хинолин-8-илсульфонил)амид (92au):

1Н NMR (400 MHz, ДМСО-d6) δ: 9.05 (s, 1H), 8.40 (m, 2H), 8.30 (s, 1H), 8.10 (m, 2H), 7.85 (s, 1H), 7.60 (m, 2H), 7.05 (d, 2H), 6.85 (d, 2H), 3.50 (bs, 8H); чистота по ЖХМС: 98,60%; MS m/z 475,15 (M-Na+1)+.
N-(4-(4-(пиразин-2-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфониламид метан-сульфонат (92av):

1H NMR (400 MHz, ДМСО-d6) δ: 10.45 (s, 1H), 9.05 (d, 1H), 8.52 (d, 1H), 8.40 (d, 1H), 8.30 (m, 2H), 8.10 (s, 1H), 7.85 (s, 1H), 7.70 (m, 2H), 7.20 (d, 2H), 7.10 (d, 2H), 3.50 (bm, 8H), 2.4 (s, 3Н); чистота по ЖХМС: 98,41%; MS, m/z 475,15 (M-MsSO3H+1)+.
Синтез аналогов N4-арил/гетероарил пиперазина с замещенным фенильным центральным кольцом
Схема 13

Общий алгоритм синтеза соединения 94: азот продували через перемешиваемый раствор арилбромида (93, 2,15 ммоль) в 1,4-диоксане (20 мл) при комнатной температуре в течение 30 мин. В реакционную смесь ввели BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) (0,134 г, 0,215 ммоль), ацетат палладия (0,0096 г, 0,043 ммоль) и карбонат цезия (1,40 г, 4,3 ммоль) и продолжили продувку азота в течение следующих 20 минут, в заключение добавили N-трет-бутоксикарбонил пиперазин (85, 0,4 г, 2,15 ммоль) и перемешивали при температуре 100°С в атмосфере азота в течение ночи. По завершении реакции (контролировали посредством ТСХ) реакционную смесь сконцентрировали в вакууме. Остаток растворили в воде и экстрагировали этилацетатом (3×50 мл). Объединенные органические экстракты промыли соляным раствором (20 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали при пониженном давлении. Затем неочищенный продукт очистили колоночной хроматографией (60-120 силикагель), используя 10%-й этилацетат-гексан для получения соединения (94) (40-60%).
Общий алгоритм синтеза соединения (95): в круглодонную колбу поместили N1-трет-бутоксикарбонил-N4-арилпиперазин (94,1,075 ммоль) и добавили метанольный раствор хлористоводородной кислоты (20 мл, 20%), что привело к образованию гомогенного раствора, перемешивали в течение 1 часа при комнатной температуре. По завершении реакции (контролировали посредством ТСХ) растворитель удалили в вакууме. Неочищенный продукт многократно промыли этилацетатом, затем хорошо просушили для получения соли гидрохлорида (95) (90%) в виде твердого вещества белого цвета.
Общий алгоритм синтеза соединения 97: к раствору амина (96, 30,16 ммоль) в 1:1 смеси ДХМ (дихлорометан)-пиридин (50:50 мл) добавили хинолин-8-сульфонил хлорид (89, 8,24 г, 36,19 ммоль) в атмосфере азота. Полученный раствор перемешивали в течение ночи при комнатной температуре. По окончании реакции (контролировали посредством ТСХ) реакционную смесь разбавили дихлорметаном (150 мл), промыли водой (3×50 мл), раствором 1N HCl (3×50 мл), а также соляным раствором (50 мл). Объединенные органические экстракты высушили над безводным сульфатом натрия, профильтровали и выпарили в вакууме. Неочищенный продукт перегнали с толуолом для удаления остатков пиридина, высушили для извлечения сульфонамида (97) (70-90%) в виде твердого вещества грязно-белого цвета, и использовали его на следующем этапе без дальнейшей очистки.
Общий алгоритм синтеза соединения 98а-l: к перемешиваемому раствору карбоновой кислоты (97, 0,61 ммоль) в ДМФ при 0°С в атмосфере азота добавляли ЭДКИ (1-этил-3-(3-диметиламинопропил)карбодиимид) (0,129 г, 0,671 ммоль), HOBt (0,91 г, 0,671 ммоль) и ДИПЭА (0,31 мл, 1,83 ммоль), полученный раствор перемешивали при комнатной температуре в течение 30 мин. Затем при температуре 0°С добавили амингидрохлорид (95, 0,61 ммоль) и перемешивали в течение ночи при комнатной температуре. После завершения реакции (контролировали по ТСХ), реакционную смесь влили в 1,0 М HCl и экстрагировали EtOAc (этилацетатом). Органический слой промыли насыщенным раствором NaHCO3, высушили над NaSO4 и профильтровали. Растворитель удалили роторным испарением, а продукт изолировали хроматографией на силикагеле (60-120 силикагель, 2% МеОН (метанол)-ДХМ) или препаративной ВЭЖХ, чтобы извлечь амид (98а-1) (40-60%) в виде твердого вещества грязно-белого цвета.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (98а):

1H NMR (400 MHz, ДМСО-d6) δ: 10.30 (s, 1H), 9.10 (d, 1H), 8.52 (d, 1H), 8.45 (d, 1H), 8.30 (d, 1H), 7.72 (m, 2H), 6.95 (m, 5H), 6.80 (s, 1H), 6.65 (d, 1H), 3.80 (s, 3H), 3.65 (bs, 2H), 3.60 (s, 3H), 3.10 (bs, 2H), 2.95 (bs, 2H), 2.80 (bs, 2H);
ВЭЖХ чистота 99,73%; показатель m/z (масс-спектрометрия) 533,30 (M+1)+.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)-3-хлорфенил)хинолин-8-сульфонамид (98b):

1H NMR (400 MHz, ДМСО-d6) δ: 10.60 (s, 1H), 9.10 (d, 1H), 8.55 (d, 1H), 8.45 (d, 1H), 8.30 (d, 1H), 7.75 (m, 2H), 7.20 (m, 3H), 6.95 (m, 4H), 3.80 (s, 3H), 3.70 (bs, 2H), 3.10 (bs, 2H), 2.95 (bs, 2H), 2.80 (bs, 2H); ВЭЖХ чистота 94,42%; показатель m/z (масс-спектрометрия) 537,25 (М+1)+.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)-2-хлорфенил)хинолин-8-сульфонамид (98с):

1H NMR (400 MHz, ДМСО-d6) δ: 10.50 (bs, 1H), 9.10 (d, 1H), 8.58 (d, 1H), 8.35 (m, 2H), 7.75 (m, 2H), 7.50 (d, 1H), 7.40 (s, 1H), 7.30 (d, 1H), 6.95 (m, 3H), 6.85 (m, 1H), 3.80 (s, 3H), 3.30-3.75 (bm, 4H), 2.95 (bm, 4H); ЖХМС чистота 97,99%; MC, показатель m/z (масс-спектрометрия) 537,20 (M+1)+.
N-(4-(4-(2-метоксифени)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (98d):

1H NMR (400 MHz, ДМСО-d6) δ: 9.40 (s, 1H), 9.14 (d, 1H), 8.56 (d, 1H), 8.30 (d, 1H), 8.25 (d, 1H), 7.70 (m, 2H), 7.15 (s, 1H), 6.90-7.10 (m, 4H), 6.83 (m, 2H), 3.75 (s, 3H), 3.30-3.75 (bm, 4H), 2.95 (bm, 4H), 2.05 (s, 3H); ВЭЖХ чистота 99,11%; MS, показатель m/z (масс-спектрометрия) 517,14 (M+1)+.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)-2-гидроксифенил)хинолин-8-сульфонамид (98е):

1H NMR (400 MHz, ДМСО-d6) δ: 10.2 (s, 1H), 9.98 (s, 1H), 9.15 (d, 1H), 8.52 (d, 1H), 8.40 (d. 1H), 8.30 (d, 1H), 7.70 (m, 2H), 6.80-6.98 (m, 5H), 6.70 (s, 1H), 6.55 (d, 1H), 3.75 (s, 3H), 3.30-3.60 (bm, 4H), 2.85 (bm, 4H); ВЭЖХ чистота 95,25%; MC, показатель m/z (масс-спектрометрия) 519,14 (M+1)+.
N-(4-(4-(2-метоксифенил)пиперазин-1-карбонил)-2-фторофенил)хинолин-8-сульфонамид (98f):

1H NMR (400 MHz, CDCl3) δ: 9.15 (d, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.80 (t, 1H), 7.60 (m, 2H), 7.13-7.25 (m, 3H), 7.10 (d, 1H), 6.95 (m, 3H), 3.90 (s, 3H), 3.65-4.05 (bm, 4H), 3.30 (bm, 4H); ЖХМС чистота 99,50%; показатель m/z (масс-спектрометрия) 521,10 (М+1)+.
N-(4-(4-(2-метоксипиридин-3-ил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (98g):
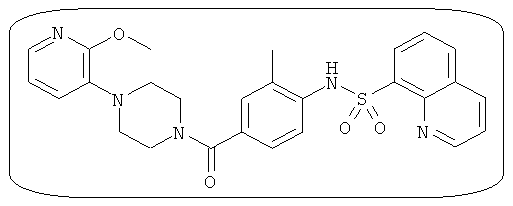
1H NMR (400 MHz, ДМСО-d6) δ: 9.16 (s, 1H), 8.40-8.51 (d, 1H), 8.20-8.38 (m, 2H), 8.02-8.11 (d, 1H), 7.82-8.88 (d, 1H), 7.56-7.66 (m, 2H), 7.34-7.38 (m, 2H), 7.02-7.18 (d, 2H), 6.84-6.88 (d, 1H), 4.02 (s, 3H), 3.78-3.96 (bs, 2H), 3.58-3.62 (bs, 2H), 2.84-3.12 (bs, 4H), 2.22 (s, 3H); ВЭЖХ чистота 90,41%; показатель m/z (масс-спектрометрия) 518,20 (M+1)+.
N-(4-(4-(3-метоксипиридин-2-ил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (98h):
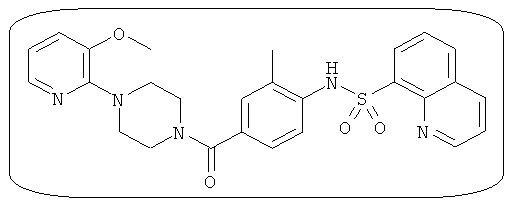
1H NMR (400 MHz, ДМСО-d6) δ: 9.16 (d, 1H), 8.40-8.51 (d, 1H), 8.23-8.31 (d, 1H), 8.19 (s, 1H), 8.02-8.11 (d, 1H), 7.82-8.84 (m, 1H), 7.52-7.64 (m, 2H), 7.28-7.32 (m, 1H), 7.11-7.18 (s, 1H), 6.98-7.02 (t, 1H), 6.82-6.88 (m, 1H), 3.88 (s, 3H), 3.78-3.84 (bs, 2H), 3.26-3.64 (bs, 6H), 2.24 (s, 3H); ЖХМС чистота 96,68%, показатель m/z ЖХМС - 518.2 (M+1)+.
N-(2-фторо-4-(4-(3-метоксипиридин-2-ил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (98i):

1H NMR (400 MHz, ДМСО-d6) δ: 9.18 (d, 1H), 8.88 (s, 1H), 8.38-8.42 (d, 1H), 8.20-8.28 (m, 2H), 8.02-8.13 (d, 2H), 7.72-7.80 (t, 1H), 7.56-7.62 (m, 2H), 6.84-2.12 (dd, 2H), 6.70-6.78 (d, 1H), 3.92 (s, 3Н), 3.48-3.82 (bs, 4H), 3.00-3.18 (bs, 4H); ЖХМС чистота 96,76%,, показатель m/z ЖХМС - 522.2 (M+1)+.
N-(4-(4-(пиридин-4-ил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (98j):

1H NMR (400 MHz, CDCl3) δ: 9.10 (d, 1H), 8.45 (d, 1H), 8.30 (m, 4H), 8.15 (d, 1H), 7.60 (m, 2H), 7.35 (d, 1H), 7.15 (d, 1H), 7.05 (d, 1H), 6.65 (d, 2H), 3.45-3.90 (bm, 4H), 3.30 (bm, 4H), 2.22 (s, 3Н); ЖХМС чистота 100,00%; показатель m/z МС - 488,30 (M+1)+.
N-(4-(4-(2-метоксипиридин-3-ил)пиперазин-1-карбонил)-2-фторофенил)хинолин-8-сульфонамид (98k):

1H NMR (400 MHz, CDCl3) δ: 9.10 (d, 1H), 8.40 (d, 1H), 8.30 (m, 3Н), 8.05 (d, 1H), 7.80 (m, 1H), 7.60 (m, 2H), 7.05 (d, 1H), 6.95 (d, 1H), 6.80 (d, 2H), 3.45-3.90 (bm, 4H), 3.30 (bm, 4H); ЖХМС чистота 99,81%; показатель m/z МС - 492,30 (М+1)+.
N-(4-(4-(2-метоксипиридин-3-ил)пиперазин-1-карбонил)-2-фторофенил)хинолин-8-сульфонамид (98l):

1H NMR (400 MHz, CDCl3) δ: 9.18 (d, 1H), 8.90 (bs, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 8.05 (d, 1H), 7.85 (m, 1H), 7.75 (m, 1H), 7.60 (m, 2H), 7.05 (m, 1H), 6.95 (d, 1H), 6.80 (m, 1H), 4.00 (s, 3Н), 3.45-3.90 (bm, 4H), 3.00 (bm, 4H); ВЭЖХ чистота 96,60%; показатель m/z МС - 522.25 (М+1)+.
Синтез аналогов N-4-арил/гетероарил гомопиперазина.
Схема 14

Общий алгоритм синтеза соединения (100): через перемешиваемый раствор арилбромида (84, 2,15 ммоль) в 1,4-диоксане (20 мл) при комнатной температуре в течение 30 минут продували азот. В реакционную смесь добавили BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) (0,134 г, 0,215 ммоль), ацетат палладия (0,0096 г, 0,043 ммоль) и карбонат цезия (1,40 г, 4,3 ммоль) и продолжали продувку азота в течение следующих 20 мин.; в заключение добавили N-трет-бутоксикарбонил гомопиперазин (99, 0,428 г, 2,15 ммоль) и перемешивали при температуре 100°С в атмосфере азота в течение всей ночи. По окончании реакции (контролировали по ТСХ), реакционную смесь сконцентрировали в вакууме. Остаток растворили в воде, экстрагировали этилацетатом (3×50 мл). Объединенные органические экстракты промыли соляным раствором (20 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали при пониженном давлении. Затем неочищенный продукт прошел очистку колоночной хроматографией (60-120 силикагель) с использованием 10% этилацетат-гексана для получения соединение (100) (40-50%).
Общий алгоритм синтеза соединения (101): в круглодонную колбу поместили N1-трет-бутоксикарбонил-N4-арилгомопиперазин (100, 1,070 ммоль) и добавили метанольный раствор HCl (20 мл, 20%), что привело к образованию гомогенного раствора, перемешивали в течение 1 часа при комнатной температуре. По окончании реакции (контролировали по ТСХ) растворитель удалили в вакууме. Неочищенный продукт многократно промыли этилацетатом, хорошо высушили для получения соединения (101) (90%) в виде твердого вещества белого цвета.
Общий алгоритм синтеза соединения 103: к раствору амина (102, 30,16 ммоль) в 1:1 смеси ДХМ (дихлорметан)-пиридин (50:50 мл) в атмосфере азота добавили хинолин-8-сульфонил хлорид (89, 8,24 г, 36,19 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи. По окончании реакции (контролировали по ТСХ), реакционную смесь разбавили дихлорметаном (150 мл), промыли водой (3×50 мл), раствором 1N HCl (3×50 мл) и соляным раствором (50 мл). Объединенные органические экстракты высушили над безводным сульфатом натрия, профильтровали и выпарили в вакууме. Неочищенный продукт перегнали с толуолом для удаления остатков пиридина и высушили для получения сульфонамида (103) (70-90%) в виде твердого вещества грязно-белого цвета, который использовали в полученном виде на следующем этапе без дальнейшей очистки.
Способ приготовления 4-(хинолин-8-сульфонамидо)бензойной кислоты (104): эфир (103, 5 г, 14,04 ммоль) растворили в смеси ТГФ (тетрагидрофуран) - вода (100:100 мл) и оставили при комнатной температуре. К раствору добавили LiOH (3,0 г, 7,0 ммоль), полученный раствор нагревали в колбе с обратным холодильником в течение ночи. Затем реакционную смесь промыли этилацетатом (3×50 мл), подкислили разбавленной HCl. Полученную суспензию профильтровали, остаток перегнали с толуолом. Затем продукт высушили в вакууме для получения карбоновой кислоты (104) (80-90%) в виде твердого вещества грязно-белого цвета.
Общий алгоритм синтеза соединения 105a-g: к перемешиваемому раствору карбоновой кислоты (104, 0,61 ммоль) в ДМФ при 0°С в атмосфере азота добавили ЭДКИ (1-этил-3-(3-диметиламинопропил)карбодиимид) (0,129 г, 0,671 ммоль), ГОБТ (Гидроксибензотриазол) (0,91 г, 0,671 ммоль) и ДИПЭА (0,31 мл, 1,83 ммоль), полученный раствор перемешивали при комнатной температуре в течение 30 мин. Затем при 0°С добавили амингидрохлорид (101, 0,61 ммоль) и перемешивали в течение ночи при комнатной температуре. По завершении реакции (контролировали по ТСХ) реакционную смесь влили в 1,0 М HCl и экстрагировали EtOAc (этилацетатом). Органический слой промыли насыщенным раствором NaHCO3, высушили над NaSO4 и профильтровали. Растворитель удалили роторным испарением, а продукт изолировали хроматографией на силикагеле (60-120 силикагель, 2% МеОН(метанол)-ДХМ (дихлорметан)) или препаративной ВЭЖХ для получения амида (105a-g) (40-60%) в виде твердого вещества грязно-белого цвета.
N-(4-(4-фенил-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (105а):
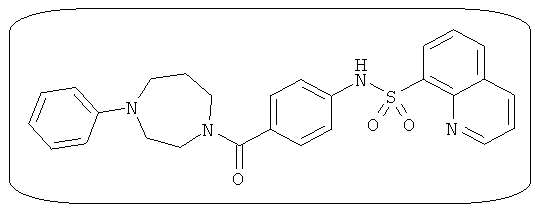
1H NMR (400 MHz, ДМСО-d6) δ: 10.20 (s, 1Н), 9.10 (s, 1H), 8.52 (d, 1H), 8.40 (d, 1H), 8.30 (d, 1H), 7.70 (m, 2H), 6.85-7.20 (m, 5H), 6.40-6.75 (m. 4H), 3.10-3.70 (m, 8H), 1.82 (bm, 2H); ВЭЖХ чистота: 95,19%; показатель m/z MC - 487,30 (M+1)+.
N-(6-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)пиридин-3-ил)хинолин-8-сульфонамид (105b):

1H NMR (400 MHz, ДМСО-d6) δ: 9.15-9.19 (m, 1H), 8.32-8.42 (m, 2H), 8.20-8.26 (d, 1H), 8.10-8.16 (m, 1H), 7.58-7.74 (m, 5H), 7.20-7.28 (m, 1H), 6.92-7-18 (m, 2H), 4.15-4.20 (m, 4H), 3.81-3.88 (m, 4H), 3.82 (s, 3H), 2.42-2.58 (m, 2H); ЖХМС чистота 99,92%; показатель m/z MC - 518,5 (M+1)+.
N-(2-хлоро-4-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (105с):

1H NMR (400 MHz, ДМСО-d6) δ: 9.15 (d, 1Н), 8080-8.92 (m, 1H), 8.40-8.52 (m, 1H), 8.20-8.26 (d, 1H), 8.02-8.06 (d, 1H), 7.68-7.82 (dd, 1H), 7.54-7.62 (m, 2H), 6.84-7.05 (m, 5H), 6.66-6.68 (d, 1H), 3.82 (s, 3H), 3.74-3.78 (m, 2H), 3.41-3.54 (m, 2H), 3.21-3.36 (m, 3H), 3.16-3.19 (bs, 3H), 2.00-2.11 (bs, 1H), 1.82-1.98 (bs, 1H); ЖХМС чистота: 97,10%;, показатель m/z ЖХМС - 551,4 (M+1)+.
N-(3-хлоро-4-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (105d):

1H NMR (400 MHz, ДМСО-d6) δ: 9.15 (s, 1H), 8.32-8.44 (m, 3H), 8.05-8.10 (m, 1H), 7.60-7.72 (m, 2H), 7.22-7.32 (m, 2H), 7.12(s, 1H), 6.88-7.05 (m, 3H), 6.80-6.84 (m, 1H), 3.74-3.91(m, 2H), 3.41 (s, 3H), 3.14-3.42 (m, 6H), 1.82-1.86 (m, 2H); ЖХМС чистота: 99,47%; показатель m/z МС - 551.4 (M+1)+.
N-(2-фторо-4-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (105е):

1Н NMR (400 MHz, ДМСО-d6) δ: 9.15 (s, 1H), 8.32-8.44 (d, 2H), 8.02-8.07 (t, 1H), 7.70-7.84 (m, 1H), 7.51-7.62 (m, 3H), 7.37-7-40(m, 2H), 6.82-7.10 (m, 4H), 3.91-4.15(m, 2H), 3.78-3.88 (m, 2H), 3.82 (s, 3H), 3.62-3.70 (m, 2H), 3.52-3.58 (m, 2H), 2.35-42 (m, 2H); ЖХМС чистота: 99,01%;, показатель m/z МС - 535,5 (M+1)+.
N-(4-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (105f):

1H NMR (400 MHz, ДМСО-d6) δ: 9.25 (s, 1H), 9.10 (d, 1H), 8.54-8.58 (d, 1H), 8.22-8.30(dd, 2H), 7.68-7.76 (m, 2H), 6.78-7.18 (m, 7H), 3.81 (s, 3H), 3.20-3.64 (m, 8H), 2.15 (s, 3H), 1.82 (bm, 2H); ЖХМС чистота: 99,67%; показатель m/z MC - 531,4 (M+1)+.
N-(2-метокси-4-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (105g):

1H NMR (400 MHz, ДМСО-d6) δ: 9.17 (d, 1H), 8.44 (s, 1H), 8.34-8.58 (dd, 2H), 8.02-8.10(d, 1H), 7.56-7.64 (t, 2H), 6.82-6.94 (m, 4H), 6.66-6.68 (m, 1H), 6.24-6.38 (m, 1H), 3.81 (s, 3H), 3.64 (s, 3H), 3.58-3.60 (m, 2H), 3.24-3.40 (m, 4H), 3.04-3.22 (m, 2H), 1.82 (bm, 2H); ЖХМС чистота: 94,21%; показатель m/z MC -547,3 (M+1)+.
Синтез обратных сульфонамидных аналогов N4-арил/гетероарил пиперазина/гомопиперазина.
Схема 15

Общий алгоритм синтеза соединения (108): азот пропускали через перемешиваемый раствор арилбромида (106, 0.4 г, 2,15 ммоль) в 1,4-диоксане (20 мл) при комнатной температуре в течение 30 мин. К реакционной смеси добавили BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) (0,134 г, 0,215 ммоль), ацетат палладия (0,0096 г, 0,043 ммоль) и карбонат цезия (1,40 г, 4,3 ммоль) и продолжили продувку азота в течение последующих 20 мин; в заключение добавили N-трет-бутоксикарбонил амин (107, 2,15 ммоль) и перемешивали при 100°С в атмосфере азота в течение ночи. По окончании реакции (контролировали по ТСХ) реакционную смесь выпарили в вакууме. Остаток растворили в воде, экстрагировали этилацетатом (3×50 мл). Объединенные органические экстракты промыли соляным раствором (20 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали при пониженном давлении. Затем неочищенный продукт очищали колоночной хроматографией (60-120 силикагель), используя 10% этилацетат-гексан для получения соединения (108) (выход 40-60%).
Общий алгоритм синтеза соединения (109): в круглодонную колбу поместили соединение 108 (1,075 ммоль) и добавили метанольный раствор HCl (20 мл, 20%), получив гомогенный раствор, перемешивали его при комнатной температуре в течение часа. По окончании реакции (контролировали по ТСХ) растворитель удалили в вакууме. Неочищенный продукт многократно промыли этилацетатом, а затем хорошо высушили для получения соединения (109) (90%) в виде твердого вещества белого цвета.
Общий алгоритм синтеза соединения 112: К раствору (4-хлоросульфонил)бензойной кислоты (110, 1,6 г, 7,27 ммоль) в 1:1 смеси ДХМ-пиридин (50:50 мл) добавили 8-аминохинолин (111,1,15 г, 8,0 ммоль) в атмосфере азота. Полученный раствор перемешивали в течение ночи при комнатной температуре. По окончании реакции (контролировали по ТСХ), реакционную смесь разбавили дихлорметаном (150 мл), промыли водой (3×50 мл), раствором 1N HCl (3×50 мл) и солевым раствором (50 мл). Объединенные органические экстракты высушили над безводным сульфатом натрия, профильтровали и сконцентрировали в вакууме. Неочищенный продукт перегнали с толуолом для удаления остатков пиридина и высушили для получения сульфонамида (112) (1,9 г, 80%) в виде твердого вещества грязно-белого цвета, которое использовали на следующем этапе без дальнейшей очистки.
Общий алгоритм синтеза соединения 113/114: к перемешиваемому раствору карбоновой кислоты (112, 0,61 ммоль) в ДМФ при 0°С в атмосфере азота добавили ЭДКИ (1-этил-3-(3-диметиламинопропил)карбодиимид) (0,129 г, 0,671 ммоль), HOBt (0,91 г, 0,671 ммоль) и ДИПЭА (0,31 мл, 1,83 ммоль); полученный раствор перемешивали в течение 30 мин при комнатной температуре. Амингидрохлорид (109, 0,61 ммоль) добавили при 0°С и перемешивали в течение ночи при комнатной температуре. По окончании реакции (контролировали по ТСХ), реакционную смесь влили в 1,0 М HCl и экстрагировали EtOAc (этилацетатом). Органический слой промыли насыщенным раствором NaHCO3, высушили над NaSO4 и профильтровали. Растворитель удалили роторным испарением, а продукт изолировали путем хроматографии на силикагеле (60-120 силикагель, 2% МеОН(метанол)-ДХМ) или препаративной ВЭЖХ для получения амида (113/114) (50-60%) в виде твердого вещества грязно-белого цвета.
4-(4-(2-метоксифенил)пиперазин-1-карбонил)-N-(хинолин-8-ил)бензолсульфонамид (113):
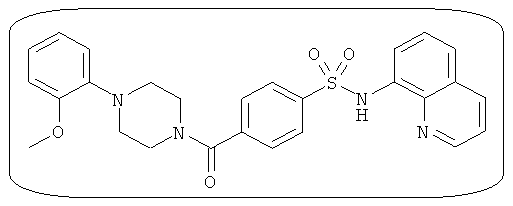
1H NMR (400 MHz, ДМСО-d6) δ: 10.18(s, 1Н), 8.92 (s, 1H), 8.54-8.56 (d, 1H), 7.89-7.93 (d, 2H), 7.66-7.94 (m, 2H), 7.44-7.57 (m, 4H), 6.94-6.98 (m, 2H), 6.83-6.86 (m, 2H), 3.78 (s, 3H), 3.61-3.69 (m, 2H), 3.20-3.54 (m, 2H), 2.91-2.94 (bs, 2H), 1.82-1.86 (bs, 2H); ВЭЖХ чистота: 99,01%;, показатель m/z MC - 503,3 (M+1)+.
4-(4-(2-метоксифенил)-1,4-диазепан-1-карбонил)-N-(хинолин-8-ил)бензолсульфонамид (114):

1H NMR (400 MHz, ДМСО-d6) δ: 9.25 (s, 1H), 8.78 (s, 1H), 8.15 (d, 1H), 7.80-7.99 (m, 3H), 7.38-7.59(m, 4H), 7.15-7.27 (m, 2H), 6.80-7.00 (m, 3H), 3.74-3.91(m, 2H), 3.41 (s, 3H), 3.14-3.42 (m, 6H), 1.82-1.86 (m, 2H); ЖХМС чистота: 99.97%;, показатель m/z MC - 517,3 (M+1)+.
Синтез соединений на основе пиперазина с замещенными фенильными кольцами
Схема 16

Этил 4-(хинолин-8-сульфонамидо)бензоат (90): к перемешиваемому раствору этил 4-аминобензоата (5 г, 30,3 ммоль) в атмосфере азота добавили пиридин (50 мл) при 0°С и размешали в течение 10 мин. Затем при той же температуре к реакционной смеси добавили хинолин-8-сульфонилхлорид 89 (8,94 г, 39,4 ммоль). Полученную смесь размешивали в течение 16 часов при комнатной температуре. По окончании реакции растворитель удалили при пониженном давлении. Следы пиридина удалили перегонкой с толуолом. К полученному остатку добавили диэтиловый эфир, а твердый продукт отфильтровывали и высушивали на воздухе. Полученный неочищенный продукт (8,0 г, 74%) использовали на следующей стадии без дальнейшей очистки.
4-(Хинолин-8-сульфонамидо)бензойная кислота (91): к перемешиваемому раствору этил 4-(хинолин-8-сульфонамидо)бензоата 90 (8 г, 22,4 ммоль) в ТГФ (тетрагидрофуран):H2O (1:1) в атмосфере азота при комнатной температуре добавили твердый LiOH (9,4 г, 224 ммоль). Затем раствор нагревали в колбе с обратным холодильником в течение 6 часов. По окончании реакции реакционную смесь промыли этилацетатом (2×100 мл) для удаления неполярных примесей. Водный слой подкислили (рН 4) раствором лимонной кислоты. Полученный преципитат отфильтровывали и высушили на воздухе. Следы воды удалили перегонкой с толуолом. Полученное твердое вещество грязно-белого цвета (5,9 г, 80%) использовали на следующей стадии без дальнейшей очистки.
N-(4-(пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (115): к перемешиваемому раствору кислоты 91 (6,5 г, 19,8 ммоль) в безводном ДМФ добавили ЭДКИ (1-этил-3-(3-диметиламинопропил)карбодиимид) (3,8 г, 19,8 ммоль) и HOBt (2,67 г, 19,8 ммоль). Температуру смеси снизили до 0°С, при этом добавляли ДИПЭА (11 мл, 59,45 ммоль) в атмосфере азота, полученный раствор (или суспензию) перемешивали при комнатной температуре в течение 30 мин. Затем при 0°С добавили трет-бутоксикарбонил-пиперазин (3,68 г, 19,8 ммоль). Далее реакционную смесь при комнатной температуре перемешивали в течение ночи. По окончании реакции реакционную смесь разбавили водой и экстрагировали этилацетатом (3×70 мл). Органический слой промыли водой (3×50 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали на роторном испарителе для получения неочищенного продукта. Полученный продукт очистили посредством колоночной хроматографии (60-120 силикагель, 2% МеОН(метанол)-ДХМ) для получения чистого продукта, трет-бутоксикарбонила-115 (8,0 г, 82%), в виде твердого вещества грязно-белого цвета, которое подвергли обработке метанольным раствором HCl (100 мл) в течение 2 часов при комнатной температуре. После полного отщепления трет-бутоксикарбонильной группы растворитель удалили при пониженном давлении для получения неочищенного продукта в виде соли HCl. Водный раствор соли промыли диэтиловым эфиром и подщелачили NaHCO3 (pH 10). Затем целевой продукт разделили на этилацетат, высушили над безводным Na2SO4 и удалили растворитель при пониженном давлении с целью получения свободного амина 115 в виде твердого вещества грязно-белого цвета (6,0 г, 95%).
Общий алгоритм синтеза амидов 116а-bg: к перемешиваемому раствору Ar-СООН (0,2525 ммоль) в безводном ДМФ добавили ЭДКИ (1-этил-3-(3-диметиламинопропил)карбодиимид) (48 мг, 0,2525 ммоль) и HOBt (34 мг, 0,2525 ммоль). Температуру смеси понизили до 0°С, при этом в атмосфере азота добавили ДИПЭА (139 мкл, 0,7575 ммоль), полученный раствор (или суспензию) перемешивали при комнатной температуре в течение 30 мин. Затем при температуре 0°С добавили амин 115 (100 мг, 0,2525 ммоль). Реакционную смесь довели до комнатной температуры и перемешивали в течение ночи. После завершения реакции реакционную смесь разбавили водой и экстрагировали этилацетатом (3×15 мл). Органический слой промыли водой (3×10 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали на роторном испарителе для получения неочищенного продукта. Неочищенный продукт очищали либо колоночной хроматографией, либо препаративной ВЭЖХ для получения чистых продуктов с выходами 55-69%.
N-(4-(4-пиколиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116а):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.4-7.6 (m, 2H), 7.7 (m, 2H), 7.9 (m, 1H), 8.3 (m, 1H), 8.4-8.6 (m, 3H), 9.1 (d, 1H), 10.2-10.4 (s, 1H); ВЭЖХ чистота: 95.7%; показатель m/z ЖХМС - 502.1 (M+1)+.
N-(4-(4-никотиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116b):
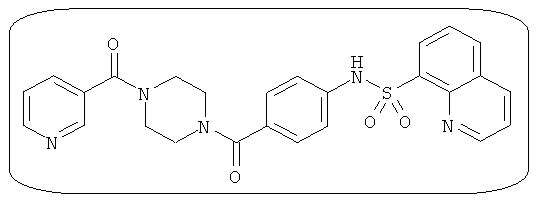
1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.4 (m, 1H), 7.6-7.8 (m, 3Н), 8.0 (m, 1H), 8.3 (m, 2H), 8.4-8.6 (m, 3H), 9.1 (d, 1H), 10.2-10.4 (s, 1H); ВЭЖХ чистота: 96.7%;, показатель m/z ЖХМС - 502,2 (M+1)+.
N-(4-(4-изоникотиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116с):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.6 (m, 3Н), 9.1 (m, 2H), 10.2-10.4 (s, 1H); ВЭЖХ чистота: 98,8%;, показатель m/z ЖХМС - 502,1 (M+1)+.
N-(4-(4-(2-метилникотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116d):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2 (s, 3Н), 3.3-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.4 (m, 1H), 7.6-7.9 (m, 3Н), 8.2 (m, 1H), 8.4-8.6 (m, 3Н), 9.1 (m, 1H), 10.4 (s, 1H); ВЭЖХ чистота: 99,2%; показатель m/z ЖХМС - 516,4 (M+1)+.
N-(4-(4-(2,6-дихлороникотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116е):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2 (s, 3H), 3.3-3.8 (m, 8H), 7.0-7.4 (m, 4H), 7.6 (m, 3H), 8.0 (m, 1H), 8.2 (m, 2H), 8.6 (m, 1H), 9.1 (m, 1H), 10.4 (s, 1H); ВЭЖХ чистота: 98,8%; показатель m/z ЖХМС - 570,3 (M+1)+.
N-(4-(4-(6-метилпиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116f):

1H NMR (400 MHz, ДМСО-d6) δ: 2.5 (s, 3H), 3.3-3.8 (m, 8H), 7.0-7.3 (m, 5H), 7.4 (m, 1H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 1H), 8.6 (m, 1H), 10.4 (s, 1H); ВЭЖХ чистота: 99,9%;, показатель m/z ЖХМС - 516.1 (M+1)+.
N-(4-(4-(пиразин-2-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116g):

1Н NMR (400 MHz, CDCl3) δ: 3.3-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.2-8.4 (m, 1H), 8.6 (m, 2H), 9.0 (s, 1H), 9.2(m, 1H); ВЭЖХ чистота: 97,5%; показатель m/z ЖХМС 503,2 (M+1)+.
N-(4-(4-(3-метоксибензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116h):

1H NMR (400 MHz, ДМСО-d6) δ: 3.3-3.8 (m, 8H), 3.9 (s, 3H), 6.9-7.0 (m, 3H), 7.2(m, 4H), 7.4 (m, 1H), 7.9 (m, 2H), 8.2 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (s, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 97,3%; показатель m/z ЖХМС - 531,3 (М+1)+.
N-(4-(4-(2-фторобензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116i):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2 (m, 4H), 3.4 (m, 2H), 3.6 (m, 2H) 7.0-7.5 (m, 8H), 7.7 (m, 2H), 8.2 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 97,3%; показатель m/z ЖХМС - 519,3 (M+1)+.
N-(4-(4-(3-фторобензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116j):
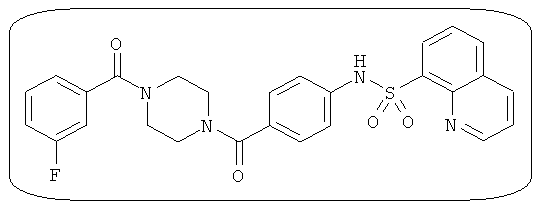
1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 6H), 7.4(m, 2H), 7.8 (m, 2H), 8.2-8.5 (m, 3H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 97,3%; показатель m/z ЖХМС - 519,3 (M+1)+.
N-(4-(4-(4-фторобензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116k):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 6H), 7.4 (m, 2H), 7.8 (m, 2H), 8.2-8.5 (m, 3H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 97,3%; показатель m/z ЖХМС - 519,3 (M+1)+.
N-(4-(4-(2,3-дифторобензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116l):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2 (m, 4H), 3.6 (m, 4H), 7.0-7.4 (m, 6H), 7.5-7.8 (m, 3H), 8.2 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 94,3%; показатель m/z ЖХМС - 537,3 (M+1)+.
N-(4-(4-(2,3-диметоксибензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116m):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2 (m, 4H), 3.6 (m, 4H), 3.7 (s, 3H), 3.8 (s, 3Н), 6.8 (m, 1H), 7.0-7.2 (m, 6H), 7.6-7.8 (m, 2H), 8.2 (m, 1H), 8.4-8.6 (m, 2H) 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 97,2%; показатель m/z ЖХМС - 561,1 (M+1)+.
N-(4-(4-бензоилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116n):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (s, 8H), 6.8 (m, 1H), 7.0-7.2 (m, 6H), 7.6-7.8 (m, 2H), 8.2 (m, 2H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 98,2%; показатель m/z ЖХМС - 501,2 (M+1)+.
N-(4-(4-(4-хлоробензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116о):
1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.2-7.6 (m, 4H), 7.6-7.8 (m, 2H), 8.2-8.6 (m, 3Н), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99.7%; показатель m/z ЖХМС - 53 5,0 (М+1)+.
N-(4-(4-(4-хлоро-2,5-дифторобензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116р):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 4H), 8.2-8.6 (m, 3Н), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,7%; показатель m/z ЖХМС - 555,4 (M+1)+.
N-(4-(4-(2-нафтоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116r):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.4-7.6 (m, 5H), 7.8 (m, 4H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 98,4%; показатель m/z ЖХМС - 551,4 (M+1)+.
N-(4-(4-(2-(4-фторофенил)-2-метилпропаноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116s):

1H NMR (400 MHz, ДМСО-d6) δ: 1.2 (s, 6Н), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 8H), 7.6-7.8 (m, 2H), 8.2-8.6 (m, 3Н), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 98,4%; показатель m/z ЖХМС - 561,4 (М+1)+.
N-(4-(4-(2-метил-2-фенилпропаноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116t):

1H NMR (400 MHz, CD3OD) δ: 3.2-3.8 (m, 8H), 3.9 (s, 2H), 7.2-7.4 (m, 9H), 7.6-7.8 (m, 2H), 8.2 (m, 1H), 8.4 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,4%; показатель m/z ЖХМС - 515,3 (M+1)+.
N-(4-(4-(3-(тиофен-2-ил)пропаноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116u):

1H NMR (400 MHz, ДМСО-d6) δ: 2.4-2.6 (m, 3H), 2.7 (m, 2H), 3.0 (m, 2H), 3.2-3.6 (m, 5H), 6.9 (m, 2H), 7.0-7.2 (m, 4H), 7.4 (m, 1H), 7.8 (m, 2H), 8.2-8.6 (m, 3H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 98,0%; показатель m/z ЖХМС - 535,1 (M+1)+.
N-(4-(4-(2-циклопропилацетил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116v):

1H NMR (400 MHz, CDCl3) δ: 0.2 (m, 2H), 0.6 (m, 2H), 1.0 (m, 1H), 3.3-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6 (m, 2H), 8.0(m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,9%; показатель m/z ЖХМС - 479,4 (M+1)+.
N-(4-(4-(тиазол-4-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116w):

1H NMR (400 MHz, CDCl3) δ: 3.3-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.0-8.2 (m, 2H), 8.4-8.6 (m, 2H), 9.1 (m, 2H), 10.5 (s, 1H); ВЭЖХ чистота: 98,2%; показатель m/z ЖХМС - 508,1 (M+1)+.
N-(4-(4-(1,2,3-тиадиазол-4-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116х):

1H NMR (400 MHz, ДМСО-d6) δ: 3.3-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.2-8.6 (m, 3Н), 9.1 (m, 1H), 9.6 (s,1H), 10.5 (s, 1H); ВЭЖХ чистота: 98,2%; показатель m/z ЖХМС - 508,1 (M+1)+.
N-(4-(4-(1Н-пиррол-2-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116у):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 6.0 (m, 1H), 6.4 (m, 1H), 6.8 (m, 1H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.2 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H), 11.4 (s, 1H); ВЭЖХ чистота: 99,2%; показатель m/z ЖХМС - 490,3 (M+1)+.
N-(4-(4-(2-метилтиазол-5-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116z):

1H NMR (400 MHz, CDCl3) δ: 2.3 (s, 3H), 3.6-3.8 (m, 8H), 7.0-7.2 (m, 5H), 7.6 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1H); ВЭЖХ чистота: 99,7%; показатель m/z ЖХМС - 521,6 (M+1)+.
N-(4-(4-(циклопропанкарбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116аа):

1H NMR (400 MHz, ДМСО-d6) δ: 0.6-0.8 (m, 2H), 2.0 (m, 1H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.2 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,0%; показатель m/z ЖХМС - 465,35 (M+1)+.
N-(4-(4-(циклогексанкарбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116ab):

1H NMR (400 MHz, ДМСО-d6) δ: 1.0-1.2 (m, 5H), 1.6-1.8 (m, 5H), 2.5 (m, 1H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.2 (m, 1Н), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 93,0%; показатель m/z ЖХМС - 507,15 (M+1)+.
N-фенил-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116ас):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 6H),7.4 (m, 2H), 7.6 (m, 2H), 8.2 (m, 2H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,4%;, показатель m/z ЖХМС - 516,4 (M+1)+.
N-(3-метоксифенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116ad):

1H NMR (400 MHz, ДМСО-d6) δ: 3.8 (m 8H), 3.9 (s, 3Н), 6.48 (s, 1H), 7.23 (m, 7H), 7.9 (m, 2H), 8.3 (s, 1H), 8.4-8.6 (d, 2H), 8.72 (s, 1H), 9.24 (s, 1H), 10.53 (s, 1H); ВЭЖХ чистота: 95,27%; показатель m/z MC - 546,16 (М+1)+.
N-(2-метоксифенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116ае):

1H NMR (400 MHz, ДМСО-d6) δ: 3.8 (m 8H), 3.9 (s, 3H), 6.8 (d 2H), 6.98 (d, 2H), 7.23 (m, 4H), 7.9 (m, 4H), 8.42 (d, 1H), 8.6 (d, 1H), 8.72 (d, 1H), 9.24 (s, 1H). 10.53 (s, 1H); ВЭЖХ чистота: 97,73%; показатель m/z MC - 546,14 (M+1)+.
N-(4-метоксифенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116af):

1H NMR (400 MHz, ДМСО-d6) δ: 3.8 (m 8H), 3.9 (s, 3H), 5.9 (S 1H), 6.8 (d 2H), 6.98 (d, 2H), 7.23 (m, 6H), 7.9 (m, 2H), 8.2-8.6 (m, 4H), 9.24 (s, 1H), 10.53 (s, 1H); ВЭЖХ чистота: 98,22%; показатель m/z MC - 546,17 (M+1)+.
N-(2,4-дифторофенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116ag):

1H NMR (400 MHz, ДМСО-d6) δ: 3.4 (m 8H), 7.9 (m 7H), 7.5 (m, 2H), 8.2-8.5 (d, 3H), 9.24 (s, 1H); ВЭЖХ чистота: 95,79%; показатель m/z MC - 552,19 (M+1)+.
N-(2-фторофенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116ah):

1H NMR (400 MHz, ДМСО-d6) δ: 3.8 (m 8H), 7.2 (m, 7H), 7.6 (S, 1H), 7.9 (d, 2H), 8.2-8.6 (d, 4H), 9.24 (s, 1H), 10.53 (s, 1H); ВЭЖХ чистота: 95,38%; показатель m/z MC - 534,22 (М+1)+.
N-(4-фторофенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116ai):

1H NMR (400 MHz, ДМСО-d6) δ: 3.8 (m 8H), 7.2 (m, 5H), 7.42 (d, 2H), 7.6 (d, 2H), 8.2-8.6 (d, 4H), 10.53 (s, 1H), 9.24 (s, 1H); ВЭЖХ чистота: 98,92%; показатель m/z MC - 532,42 (M+1)+.
N-(4-цианофенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116aj):

1H NMR (400 MHz, ДМСО-d6) δ: 3.8 (m 8H), 7.23 (d, 4H), 7.9 (m, 6H), 8.42 (d, 1H), 8.2 (d, 1H), 8.15 (d, 1H), 9.23 (S 1H),), 9.1 (s, 1H), 10.53 (s, 1H); ВЭЖХ чистота: 97,97%; показатель m/z MC - 541,30 (M+1)+.
N-(2-хлорофенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116ak):

1Н NMR (400 MHz, ДМСО-d6) δ: 3.3 (m 8H), 7.2 (m, 6H), 7.3 (d, 4H), 7.9 (m, 2H), 8.42 (d, 2H), 8.5 (d, 1H), 8.52 (d, 1H), 9.24 (s, 1H), 10.53 (s, 1H); ВЭЖХ чистота: 97,73%; показатель m/z MC - 546,14 (M+1)+.
4-(4-(хинолин-8-сульфонамидо)бензоил)-N-(п-толил)пиперазин-1-карбоксамид (116al):

1H NMR (400 MHz, ДМСО-d6) δ: 2.2 (S 3Н), 3.8 (m 8H), 7.1-7.3 (m, 7H), 7.9 (m, 2H), 8.23-8.4 (d, 4H), 9.1 (s, 1H), 10.53 (s, 1H); ВЭЖХ чистота: 98,27%; показатель m/z MC - 530,19 (M+1)+.
N-(4-хлорофенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116am):

1H NMR (400 MHz, ДМСО-d6) δ: 3.3 (m 8H), 7.2 (m, 6H), 7.4 (d, 2H), 7.9 (m, 2H), 8.42 (d, 2H), 8.5 (d, 1H), 8.62 (d, 1H), 9.24 (s, 1H), 10.43 (s, 1H); ВЭЖХ чистота: 97,92%; показатель m/z MC - 550,14 (M+1)+.
4-(4-(хинолин-8-сульфонамидо)бензоил)-N-(4-(трифторометил)фенил)пиперазин-1-карбоксамид (116an):

1H NMR (400 MHz, ДМСО-d6) δ: 3.3 (m 8H), 7.4 (m, 6H), 7.5 (d, 2H), 8.0 (m, 2H), 8.6 (d, 2H), 8.7 (d, 1H), 8.8 (d, 1H), 9.24 (s, 1H), 10.43 (s, 1H); ВЭЖХ чистота: 97,90%; показатель m/z MC - 584,05 (M+1)+.
N-(2-хлоро-5-(трифторометил)фенил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карботиоамид (116ао):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 5H), 8.2 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 9.4 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 96,1%; показатель m/z ЖХМС - 634,17 (M+1)+.
Этил 4-(4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамидо)бутаноат (116ар):

1H NMR (400 MHz, CDCl3) δ: 1.2 (t, 3H), 1.8 (q, 2H), 2.4 (t, 2H), 3.2-3.8 (m, 8H), 3.6 (m, 2H), 4.1 (m, 2H), 5.0 (m, 1H), 7.0-7.2 (m, 4H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 2H), 8.6 (m, 1H), 9.1 (m, 1H); ВЭЖХ чистота: 98,7%; показатель m/z ЖХМС-554,19 (М+1)+.
Этил 3-(4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамидо)пропаноат (116aq):

1H NMR (400 MHz, CD3OD) δ: 1.2 (t, 3H), 2.5 (t, 2H), 3.2-3.8 (m, 8H), 3.6 (m, 2H), 4.1 (m, 2H), 7.2 (m, 4H), 7.6 (m, 2H), 8.2 (m, 1H), 8.4 (m, 2H), 9.1 (m, 1H); ВЭЖХ чистота: 99,3%; показатель m/z ЖХМС - 540,1 (M+1)+.
N-(3-хлоропропил)-4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксамид (116ar):

1H NMR (400 MHz, CD3OD) δ: 2.5 (m, 2H), 3.6 (t, 2H), 3.8 (t, 3H), 3.2-3.8 (m, 8H), 7.2 (m, 4H),7.6 (m, 2H), 8.2 (m, 1H), 8.4 (m, 2H), 9.1 (m, 1H); ВЭЖХ чистота: 98,3%; показатель m/z ЖХМС - 517,1 (M+1)+.
N-(4-(4-(3-(4-(трифторометил)фенил)пропаноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (116as):

1H NMR (400 MHz, ДМСО-d6) δ: 2.7 (t, 2H), 2.9 (t, 2H), 3.2-3.8 (m, 8H), 7.2 (m, 4H), 7.5 (m, 2H), 7.6-7.8 (m, 4H), 8.3 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,0%; показатель m/z ЖХМС - 597,45 (М+1)+.
Изобутил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116at):

1H NMR (400 MHz, ДМСО-d6) δ: 0.8-0.91 (t, 6H), 1.90 (m, 1Н), 3.4-3.6 (m, 8H), 3.8 (d, 2H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.2 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,91%; показатель m/z ЖХМС - 497,18 (М+1)+.
Этил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116au):

1Н NMR (400 MHz, ДМСО-d6) δ: 1.3 (t, 3H), 3.4-3.6 (m, 8H), 4.1 (q, 2H), 7.2 (m, 4H), 7.7-7.8 (m, 2H), 8.2 (m, 1H), 8.5-8.6 (m, 2H), 9.2 (m, 1H), 10.4(s, 1H); ВЭЖХ чистота: 99,65%; показатель m/z ЖХМС - 469,10 (M+1)+.
Изопропил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116av):
1Н NMR (400 MHz, ДМСО-d6) δ: 1.02-1-21. (m, 6H), 4.81-4.9 (m, 1H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.2 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 94,12%; показатель m/z ЖХМС - 481,51 (M-1)+.
Фенил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116aw):

1H NMR (400 MHz, ДМСО-d6) δ: 3.4-3.8 (m, 8H), 7.0-7.2 (m, 7H), 7.4-7.6 (m, 2H), 7.8.-7.85 (m, 2H), 8.2-8.6 (m, 3H), 9.1(m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,71%; показатель m/z ЖХМС 517,25 (M+1)+.
3-фторофенил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116ах):

1H NMR (400 MHz, ДМСО-d6) δ: 3.4-3.8. (m, 8H), 7.0-7.2 (m, 7H), 7.4-7.6 (m, 1H), 7.8.-7.85 (m, 2H), 8.2-8.6 (m, 3H), 9.1(m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 95,75%; показатель m/z ЖХМС 535,25 (M+1)+.
4-фторофенил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116ау):
1H NMR (400 MHz, ДМСО-d6) δ: 3,4-3.8 (m, 8H), 7.0-7.2 (m, 8H), 7.8-7.85 (m, 2H), 8.2-8.6 (m, 3H), 9.1 (m, 1H), 10.5(s, 1H); ВЭЖХ чистота: 95,05%; показатель m/z ЖХМС - 535,27 (M+1)+.
4-хлорофенил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116az):

1H NMR (400 MHz, ДМСО-d6) δ: 3.4-3.8 (m, 8H), 7.0-7.2 (m, 6H), 7.4 (d, 2H), 7.7 (m, 2H), 8.3-8.5 (m, 3H), 9.2 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,41%; показатель m/z ЖХМС - 549,56 (М)+.
n-Толил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116ba):

1Н NMR (400 MHz, ДМСО-d6) δ: 2.2 (s, 3H), 3.2-3.8 (m, 8H), 7.0 (m, 2H), 7.2 (m, 6H), 7.6-7.8 (m, 2H), 8.3 (m, 1H), 8.4-8.6 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); ВЭЖХ чистота: 99,5%; показатель m/z ЖХМС - 531,58 (M+1)+.
3-хлорофенил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116bb):
1Н NMR (400 MHz, ДМСО-d6) δ: 3.4-3.8 (m, 8H), 7.0-7.2 (m, 8H), 7.6-7.8 (m, 2H). 8.2-8.6 (m, 3H), 9.1 (m, 1H), ВЭЖХ чистота: 99,79%; показатель m/z ЖХМС 549,58 (М)+.
м-Толил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116bc):
1Н NMR (400 MHz, ДМСО-d6) δ: 2.23-2.4 (t, 3H), 3.4-3.8. (t, 8H), 6.82-6.98 (m, 6H), 7.0-7.2 (m, 6H), 7.6-7.8 (m, 2H), 8.2-8.6 (m, 3H), 9.1 (m, 1H); ВЭЖХ чистота: 99,26%; показатель m/z ЖХМС - 531,16 (M+1)+. (S)-Тетрагидрофуран-3-ил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116bd):
1H NMR (400 MHz, ДМСО-d6) δ: 2.23-2.4 (m, 2H), 2.6-2.98 (m, 4H), 3.4-3.8 (t, 8H), 3.8-3.95 (m, 4H), 5.23-5.35 (m, 1H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.0-8.1 (d, 2H), 8.32-8.45 (dd, 2H), 9.1 (m, H); ВЭЖХ чистота: 96,89%; показатель m/z ЖХМС - 533,05 (М+23)+.
(Тетрагидрофуран-2-ил)метил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116be):

1Н NMR (400 MHz, ДМСО-d6) δ: 2.23-2.4 (m, 3H), 3.4-3.8 (t, 8H), 3.8-3.95 (m, 4H), 7.0-7.2 (m, 4H), 7.6-7.8 (m,2H), 8.0-8.1 (d, 2H), 8.32-8.45 (dd, 3H), 9.1 (m, 1H); ВЭЖХ чистота: 99,84%; показатель m/z ЖХМС - 525,10 (M+1)+.
2-циклопентилэтил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116bf):

1H NMR (400 MHz, ДМСО-d6) δ: 1.2-1.32 (d, 4H), 2.0-2.12 (m, 8H), 3.4-3.8 (t, 8H), 4.62-4.72 (m, 1H), 7.0-7.2 (m, 6H), 7.6-7.8 (m, 2H), 8.0-8.1 (d, 2H), 8.32-8.45 (dd, 3Н), 9,1 (m, 1H); ВЭЖХ чистота: 99,89%; показатель m/z ЖХМС - 537,10 (М+1)+.
2-циклогексилэтил 4-(4-(хинолин-8-сульфонамидо)бензоил)пиперазин-1-карбоксилат (116bg):

1Н NMR (400 MHz, CDCl3) δ: 1.0 (m, 2H). 1.2 (m, 7H), 1.5 (m, 1H), 1,6 (m, 5H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.6-7.8 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.6 (m, 2H), 9.1 (m, 1H); ВЭЖХ чистота: 99,6%; показатель m/z ЖХМС - 551,45 (M+1)+.
Синтез производных пиперазина с 3-метил, 2-метил, 3-фтор, 3-хлор, 3-гидрокси или 3-метокси замещенными фенильными кольцами
Схема 17

Общий алгоритм синтеза сульфонамида 118: к размешанному раствору амина 7 (30,3 ммоль) в атмосфере азота при температуре 0°С добавили пиридин (50 мл) и размешивали в течение 10 мин. Затем в реакционную смесь при той же температуре добавили хинолин-8-сульфонил хлорид 89 (8,94 г, 39,4 ммоль). Полученную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения реакции растворитель удалили при низком давлении. Следы пиридина удалили путем перегонки с толуолом. К полученному остатку добавили диэтиловый эфир, твердый продукт отфильтровали и высушили на воздухе. Полученный неочищенный продукт (8,0 г, 74%) использовали на следующем этапе без дальнейшей очистки.
Общий алгоритм синтеза сульфонамида 119: ЭДКИ (1-этил-3-(3-диметиламинопропил) карбодиимид) (3,8 г, 19,8 ммоль) и HOBt (2,67 г, 19,8 ммоль) добавили к размешанному раствору кислоты 118 (19,8 ммоль) в безводном ДМФ. Температуру смеси понизили до 0°С, при этом в атмосфере азота добавили ДИПЭА (11 мл, 59,45 ммоль), и полученный раствор (или суспензию) перемешивали при комнатной температуре в течение 30 мин. Затем при 0°С в него добавили трет-бутоксикарбонил пиперазин (3,68 г, 19,8 ммоль). Реакционную смесь при комнатной температуре размешивали в течение ночи. По завершении реакции реакционную смесь разбавили водой и экстрагировали этилацетатом (3×70 мл). Слой органического вещества промыли водой (3×50 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали в ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очищали колоночной хроматографией (60-120 силикагель, 2% МеОН-ДХМ) для получения чистого продукта, трет-бутоксикарбонила-119 (81%), в виде твердого вещества грязно-белого цвета, который подвергли обработке метанольным раствором HCl (100 мл) в течение 2 часов при комнатной температуре. После полного отщепления группы трет-бутоксикарбонила растворитель удалили при пониженном давлении для получения неочищенного продукта в виде соли HCl. Водный раствор соли промыли диэтиловым эфиром и ощелачили NaHCO3 (pH 10). Затем целевой продукт разделили на этилацетат, высушили безводным Na2SO4, растворитель удалили при пониженном давлении для получения свободного амина 119 в виде твердого вещества грязно-белого цвета (95%).
Общий алгоритм синтеза амидов 120а-cu: ЭДКИ (48 мг, 0,2525 ммоль) и HOBt (34 мг, 0,2525 ммоль) добавили к размешанному раствору Ar-СООН (0,2525 ммоль) в безводном ДМФ. Температуру смеси понизили до 0°С, при этом в атмосфере азота добавили ДИПЭА (139 мкл, 0,7575 ммоль), полученный раствор (или суспензию) размешивали при комнатной температуре в течение 30 мин. Затем при температуре 0°С добавили амин 119 (100 мг, 0,2525 ммоль). Далее реакционную смесь при комнатной температуре размешивали в течение ночи. По завершении реакции реакционную смесь разбавили водой и экстрагировали этилацетатом (3×15 мл). Слой органического вещества промыли водой (3×10 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали в ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очищали либо посредством колоночной хроматографией на силикагеле, либо посредством препаративной ВЭЖХ для получения очищенных продуктов с выходом 52-68%.
N-(2-метил-4-(4-пиколиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120а):

1H NMR (400 MHz, CD3OD) δ: 2.1 (s, 3Н), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 3H), 7.6-7.8 (m, 4H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.6 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 97,9%; показатель m/z ЖХМС (жидкостная хромато-масс-спектрометрия) - 516,1 (М+1)+.
N-(2-метил-4-(4-никотиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120b):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0-7.2 (m. 3H), 7.6-7.8 (m, 4H), 8.2 (m, 1H), 8.6 (m, 2H), 8.9 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); чистота ВЭЖХ: 99,3%; показатель m/z ЖХМС - 516,1 (M+1)+.
N-(2-метил-4-(4-(6-метилпиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120с):

1Н NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 2.3 (s, 3H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 3H), 7.6-7.8 (m, 4H), 8.2 (m, 1H), 8.6 (m, 1H), 8.9 (m, 2H), 9.1 (m, 1H), 10.5 (s, 1H); чистота ВЭЖХ: 95,5%; показатель m/z ЖХМС - 530,2 (M+1)+.
N-(2-метил-4-(4-(3-(трифторметил)пиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120d):

1Н NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 2H), 7,4-7.6 (m, 4H), 8.2 (m, 2H), 8.4 (m, 2H), 8.6-8.8 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 97,2%; показатель m/z ЖХМС - 584,1 (M+1)+.
N-(4-(4-(3-фторпиколиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120е):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 2H), 7.4-7.6 (m, 5H). 8.2 (m, 1H), 8.4 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 99,6%; показатель m/z ЖХМС - 534,1 (M+1)+.
N-(4-(4-(4-хлорпиколиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120f):

1Н NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 2H), 7.4 (m, 1H), 7.5-7.8 (m, 4H), 8.0 (m, 1H), 8.2 (m, 2H), 8.6 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 93,4%;, показатель m/z ЖХМС - 550,1 (M+1)+.
N-(4-(4-(4-фторпиколиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120g):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0 (m, 2H), 7.4 (m, 1H), 7.5-7.8 (m, 4H), 8.0 (m, 1H), 8.2-8.4 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 99,2%; показатель m/z ЖХМС - 534,1 (M+1)+.
N-(2-метил-4-(4-(4-(трифторметил)никотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120h):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0 (m, 2H), 7.4 (m, 1H), 7.5-7.6 (m, 3H), 8.4 (m, 3H), 8.7 (s, 1H), 8.8 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 95,0%; показатель m/z ЖХМС - 584,1 (M+1)+.
N-(4-(4-(5-хлор-никотиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120i):

1Н NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0 (m, 3H), 7.4 (m, 1H), 7.6-7.8 (m, 2H), 8.1 (m, 1H), 8.2 (m, 2H), 8.8 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 98,1%; показатель m/z ЖХМС - 550,1 (М+1)+.
N-(4-(4-(5-фтор-никотиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120j):

1Н NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0 (m, 2H), 7.2-7.4 (m, 2H), 7.6-7.8 (m, 2H), 8.0-8.6 (m, 5H), 9.1 (m, 1H); чистота ВЭЖХ: 99,1%; показатель m/z ЖХМС - 534,3 (M+1)+.
N-(4-(4-(3-фтор-изоникотиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120k):

1Н NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0 (m, 2H), 7.2-7.4 (m, 2H), 7.6-7.8 (m, 2H), 8.0 (m, 1H), 8.2-8.6 (m, 4H), 9.1 (m, 1H); чистота ВЭЖХ: 95,3%; показатель m/z ЖХМС - 534,1 (M+1)+.
N-(4-(4-(3-хлор-изоникотиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120l);

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0 (m, 1H), 7.2-7.4 (m, 4Н), 7,6-7.8 (m, 2H), 8.0 (m, 1H), 8.2-8.6 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 99,8%; показатель m/z ЖХМС - 550,3 (М+1)+.
N-(4-(4-(2-метокси-никотиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120m):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8Н), 7.2-7.4 (m, 4Н), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.6 (m, 3H), 9.1 (m, 1Н); чистота ВЭЖХ: 99,3%; показатель m/z ЖХМС - 546,3 (M+1)+.
N-(4-(4-(2-метокси-изоникотиноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120n):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 6.7-7.0 (m, 4Н), 7.2 (m, 1H), 7.6 (m, 2H), 8.0 (m, 1H), 8.2-8.6 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 98,8%; показатель m/z ЖХМС - 546,3 (М+1)+.
N-(2-метил-4-(4-(5-(трифторметил)пиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120о):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3Н), 3.2-3.8 (m, 8H), 7.0 (m, 2H), 7.2 (m, 1H), 7.6 (m, 2H), 7.8 (m, 1H), 8.0 (m, 2H), 8.3-8.5 (m. 2H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 91,8%; показатель m/z ЖХМС - 584.4 (M+1)+.
N-(2-метил-4-(4-(2-(трифторметил)никотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120р):

1Н NMR (400 MHz, CDCl3) δ: 2.1 (s, 3Н), 3.2-3.8 (m, 8H), 7.0 (m, 3H), 7.4 (m, 1H), 7.6 (m, 4H), 8.0 (m, 1H), 8.3-8.5 (m, 1H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,2%; показатель m/z ЖХМС - 584,3 (М+1)+.
N-(4-(4-изоникотиноил-пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120q):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3Н), 3.2-3.8 (m, 8H), 7.0 (m, 3Н), 7.4 (m, 2H), 7.6 (m, 2H). 8.3 (m, 2H), 8.5 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 94,5%; показатель m/z ЖХМС - 516,34 (M+1)+.
N-(2-метил-4-(4-(пиразин-2-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120r):

1Н NMR (400 MHz, CDCl3) δ: 2.1 (s, 3Н), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 2H), 7.4 (m, 1H), 7.6 (m, 2H), 8.0 (m, 1H), 8.3 (m, 2H), 8.6 (m, 1H), 8.8 (m, 1H), 9.0 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,4%; показатель m/z ЖХМС - 517,15(М+1)+.
N-(4-(4-(2,3-дифторбензоил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120s):

1Н NMR (400 MHz, CD3OD) δ: 2.1(s, 3Н), 3.2-3.8 (m, 8H), 7.0 (m, 1H), 7.2 (m, 4H), 7.4 (m, 1H), 8.7 (m, 2H), 8.2-8.5 (m, 3Н). 9.1 (m, 1H); чистота ВЭЖХ: 98,6%; показатель m/z ЖХМС - 551,35 (M+1)+.
N-(4-(4-(2,6-дифторбензоил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120t):

1H NMR (400 MHz, CD3OD) δ: 2.1 (s, 3Н), 3.2-3.8 (m, 8H), 7,0-7.2 (m, 5H), 7.5 (m, 2H), 7.7 (m, 2H), 8.2-8.5 (m, 3Н), 9,1 (m, 1Н); чистота ВЭЖХ: 96,4%; показатель m/z ЖХМС - 551,35 (M+1)+.
N-(4-(4-(3,4-дифторбензоил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120u):

1Н NMR (400 MHz, CD3OD) δ: 2.1 (s, 3Н), 3.2-3.8 (m, 8H), 7.0 (m, 2H), 7.2-7.5 (m, 5H), 7.7 (m, 2H), 8.2-8.5 (m, 3Н), 9.1 (m, 1Н); чистота ВЭЖХ: 97,9%;, показатель m/z ЖХМС - 551,35 (M+1)+.
N-(4-(4-(2-фторбензоил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120v):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 4H), 7.2-7.5 (m, 3H), 7.7 (m, 2H), 8.0-8.5 (m, 3H), 9.1 (m, 1Н); чистота ВЭЖХ: 93,6%; показатель m/z - 533,27 (M+1)+.
N-метил-4-(4-(2-фенилацетил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120w):

1H NMR (400 MHz, CDCl3) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 3.9 (m, 2H), 7.0 (m, 1H), 7.2-7.5 (m, 7H), 7.7 (m, 2H), 8.2-8.5 (m, 4H), 9.1 (m,1H); чистота ВЭЖХ: 94.6%; показатель m/z ЖХМС - 529,35 (М+1)+.
N-(4-(4-(2-(4-фторфенил)ацетил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120х):

1Н NMR (400 MHz, CD3OD) δ: 2.1 (s. 3H), 3.2-3.8 (m, 8H), 7.0-7.5 (m, 7H), 7.7 (m, 2H), 8.2-8.5 (m, 3H), 9.1 (m, 1Н); чистота ВЭЖХ: 95,1%; показатель m/z ЖХМС - 547,0 (M+1)+.
N-(4-(4-(2-(4-фторфенил)-2-метилпропаноил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120у):

1H NMR (400 MHz, CDCl3) δ: 1.6 (s, 6H), 2.1 (s, 3H), 3.2-3.8 (m, 8H), 6.9-7.0 (m, 3H), 7.2-7.5 (m, 3H), 7.7 (m, 2H), 8.2-8.5 (m, 4H), 9.1 (m, 1Н); чистота ВЭЖХ: 99,1%; показатель m/z ЖХМС - 575,1 (М+1)+.
N-(2-метил-4-(4-(гиазол-4-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120r):

1Н NMR (400 MHz, CD3OD) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 3H), 7.6-7.8 (m, 2H), 8.1-8.5 (m, 4H), 9.1 (m, 2H); чистота ВЭЖХ: 98,6%; показатель m/z ЖХМС - 522,05 (М+1)+.
N-(4-(4-(1,2,3-тиадиазол-4-карбонил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (120аа):

1Н NMR (400 MHz, ДМСО-d6) δ: 2.1 (s, 3H), 3.2-3.8 (m, 8H), 7.0-7.2 (m. 3H), 7.4-7.6 (m, 2H), 7.7 (m, 2H), 8.2-8.5 (m, 3H), 9.1 (m,1H), 9.4 (s, 1H), 9.6 (s. 1H); чистота ВЭЖХ: 99,1%; показатель m/z ЖХМС - 523,15 (М+1)+.
Циклопентил 4-(3-метил-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120ab):

1H NMR (400 MHz, CDCl3) δ: 1.4-1.9 (m, 8H), 2.1 (s, 3H), 3.2-3.8 (m, 8H), 5.1 (s, 1H), 7.0-7.2 (m, 1H), 7.4 (m, 3H), 7.7 (m, 1H), 8.2 (m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1Н); чистота ВЭЖХ: 97,4%; показатель m/z ЖХМС - 523,30 (M+1)+.
Циклогексил 4-(3-метил-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120ас):

1H NMR (400 MHz, CDCl3) δ: 0.9 (m, 1H), 1.2-1.7 (m, 10Н), 2.1 (s, 3Н), 3.2-3.8 (m, 8H), 5.1 (s, 1H), 7.0-7.4 (m, 3Н), 7.6 (m, 2H), 8.1 (m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1Н); чистота ВЭЖХ: 99,0%; показатель m/z ЖХМС - 537,19 (M+1)+.
Азетидин-3-ил 4-(3-метил-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120ad):

1H NMR (400 MHz, ДМСО-d6) δ: 0.9(m, 1H), 1.2-1.7 (m, 4H), 2,1 (s, 3Н), 3.2-3.8 (m, 8H), 5.1 (s, 1H), 7.0-7.4 (m, 3Н), 7.6 (m, 2H), 8.3 (m, 2H), 8.6 (m, 1H), 9.1 (m, 1Н); чистота ВЭЖХ: 92,9%; показатель m/z ЖХМС - 510,31 (M+1)+.
1-метилазетидин-3-ил4-(3-метил-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120ае):

1Н NMR (400 MHz, ДМСО-d6) δ: 2.0 (s, 3Н), 2.1 (s, 3Н), 2.9 (m, 4H), 3.2-3.8 (m, 8H), 5.1 (s, 1H), 7.0-7.4 (m, 3Н), 7.8 (m, 2H), 8.3 (m, 2H), 8.6 (m, 1H), 9.1 (m, 1H), 9.4 (s, 1H); чистота ВЭЖХ: 92,0%; показатель m/z ЖХМС - 524,05 (M+1)+.
(Тетрагидрофуран-2-ил)метил 4-(3-метил-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120af):

1H NMR (400 MHz, CDCl3) δ: 1.1 (m, 2H), 1.8-2.0 (m, 4H), 2.1 (s, 3H), 2.9 (m, 4H), 3.2-3.8 (m, 8H), 5.1 (s, 1H), 7,0-7.2 (m, 2H), 7,2-7.4 (m, 1H), 7.6 (m, 2 H), 8.0-8.4 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 99,40%; показатель m/z ЖХМС - 539,15 (M+1)+.
2-циклопентил-этил 4-(3-метил-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120ag):

1H NMR (400 MHz, CDCl3) δ: 1.2 (m, 4H), 1.4-1.6 (m, 8H), 2.0 (m, 1H), 2.1 (s, 3H), 3.2-3.8 (m, 8H), 5.1 (s, 1H), 7.0-7.2 (m, 2H), 7.2-7.4 (m, 1H), 7.6 (m, 2 H), 8.0-8.4 (m, 3H), 9.1 (m, 1Н); чистота ВЭЖХ: 99,50%; показатель m/z ЖХМС - 551,1 (M+1)+.
Тетрагидрофуран-3-ил 4-(3-метил-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120ah):
1H NMR (400 MHz, CDCl3) δ: 2.0 (m, 2H), 2.2 (s, 3H), 2.5 (s, 1H), 3.2-3.8 (m, 8H), 4.0 (m, 4H), 5.1 (s, 1H), 7.0-7.2 (m, 1H), 7.2-7.4 (m, 2H), 7.6 (m, 2H), 8.0-8.4 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 99,50%; показатель m/z ЖХМС - 525,05 (M+1)+.
2-циклогексил-этил4-(3-метил-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120ai):

1H NMR (400 MHz, CDCl3) δ: 2.0 (m, 2H), 2.2 (s, 3H), 2.5 (s, 1H), 3.2-3.8 (m, 8H), 4.0 (m, 4H), 5.1 (s, 1H), 7.0-7.2 (m, 1H), 7.2-7.4 (m, 2H), 7.6 (m, 2H), 8.0-8.4 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 99,50%; показатель m/z ЖХМС - 525,05 (M+1)+.
N-(2-фтор-4-(4-пиколиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120aj):

1H NMR (400 MHz, CDCl3) δ: 1.1 (m, 7H), 1.6-1.8 (m, 5H), 2.1 (s, 3H), 3.2-3.8 (m, 8H), 4.7 (m, 1H). 7.0-7.2 (m, 2H), 7.4-7.6 (m, 3H), 8.0-8.4 (m, 3H), 9.1 (m, 1Н); чистота ВЭЖХ: 99,60%; показатель m/z ЖХМС - 565,45(M+1)+.
N-(2-фтор-4-(4-никотиноил-пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120ak):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 2H), 7.4-7.6 (m, 3H), 8.0-8.4 (m, 3H), 8.7 (m, 3H), 8.9 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 94,6%; показатель m/z ЖХМС - 520,25 (M+1)+.
N-(2-фтор-4-(4-изоникотиноил-пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120аl):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 2H), 7.4-7.6 (m, 3Н), 8.0-8.4 (m, 3Н), 8.7 (m, 3Н), 8.9 (m, 1H), 9.1 (m, 1H), 10.5 (s 1H); чистота ВЭЖХ: 93,8%; показатель m/z ЖХМС - 518,46 (M+1)+.
N-(2-фтор-4-(4-(пиразин-2-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120am):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.4 (m, 3Н), 7.6-7.8 (m, 2H), 8.0-8.4 (m, 2H), 8.7 (m, 3Н), 9.1 (m, 1H), 10.0 (s 1H); чистота ВЭЖХ: 99,8%; показатель m/z ЖХМС - 521,24 (M+1)+.
N-(4-(4-(2,6-дифторбензоил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (120an):
1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.4 (m, 3Н), 7.6-7.8 (m, 5H), 8.0-8.4 (m, 3Н), 9.1 (m, 1H), 10.0 (s, 1H); чистота ВЭЖХ: 99,8%; показатель m/z ЖХМС-555,21 (M+1)+.
N-(4-(4-(3,4-дифторбензоил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (120ао):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.4 (m, 4H), 7.6-7.8 (m, 4H), 8.0-8.4 (m, 2H), 8.7 (m, 1H). 9.1 (m, 1H), 10.0 (s 1H); чистота ВЭЖХ: 97,9%; показатель m/z ЖХМС - 555,14 (M+1)+.
N-(2-фтор-4-(4-(2-фторбензоил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120ар):108

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H). 7.0-7.2 (m, 3H), 7.2-7.4 (m, 4H), 7.6-7.8 (m, 2H), 8.0-8.4 (m, 2H), 8.9 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 97,8%; показатель m/z ЖХМС - 537,21 (M+1)+.
N-(2-фтор-4-(4-(2-фенилацетил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120aq):

1H NMR (400 MHz, CDCl3) δ: 2.4 (s, 2H), 7.0-7.2 (m, 3H), 7.2-7.4 (m, 4H), 7.6-7.8 (m, 4H), 8.0-8.4 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 98,4%; показатель m/z ЖХМС - 533,26 (M+1)+.
N-(2-фтор-4-(4-(2-(4-фторфенил)ацетил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120ar):

1H NMR (400 MHz, CD3OD) δ: 3.2-3.8 (m, 8H), 3.9 (s, 2H), 7.0-7.2(m, 4H), 7.2-7.4(m, 2H), 7.6-7.8 (m, 3H), 8.2 (m, 1H), 8.4 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 93,1%; показатель m/z ЖХМС - 551,23 (M+1)+.
N-(2-фтор-4-(4-(2-(4-фторфенил)-2-метилпропаноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120as):

1H NMR (400 MHz, CDCl3) δ: 1.3 (s, 6H), 3.2-3.8 (m, 8H), 7.0-7.2 (m, 3H), 7.2-7.4 (m, 2H), 7.6-7.8 (m, 3H), 8.2 (m, 1H), 8.4 (m, 2H), 8.9 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 98,3%; показатель m/z ЖХМС - 579.22 (M+1)+.
N-(2-фтор-4-(4-(Тиазол-4-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120at):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 3H), 7.2-7.4 (m, 2H), 7.6-7.8 (m, 3H), 8.2 (m, 1H), 8.9 (m, 2H), 9.0 (s,1H), 9.5 (d, 1H); чистота ВЭЖХ: 91,6%; показатель m/z ЖХМС - 526,19 (M+1)+.
N-(4-(4-(1,2,3-тиадиазол-4-карбонил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (120au):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 3H), 7.6-7.8 (m, 2H), 8.2-8.4 (m, 3H), 9.0 (m, 1H), 9.5 (s,1H); чистота ВЭЖХ: 91,6%; показатель m/z ЖХМС - 526,19 (M+1)+.
Циклогексил 4-(3-фтор-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120av):

1H NMR (400 MHz, ДМСО-d6) δ: 1.2-1.8 (m, 10Н), 3.2-3.8 (m, 8H), 4.8 (m, 1H), 7.0-7.2 (m, 2H), 7.6-7.8 (m, 3Н), 8.2 (m, 1H), 8.2-8.4 (m, 2H), 8.9 (m, 1H), 9.0 (s, 1H), 9.5 (d, 1H); чистота ВЭЖХ: 91,6%; показатель m/z ЖХМС - 526,19 (M+1)+.
N-(2-хлор-4-(4-пиколиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120aw):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 7.0-7.2 (m, 2H), 7.6-7.8 (m, 3Н), 8.2 (m, 3Н), 8.2-8.4 (m, 2H), 8.9 (m, 1H), 9.0 (s,1H), 10.5 (s, 1H); чистота ВЭЖХ: 99,1%; показатель m/z ЖХМС - 537,1 (М+1)+.
N-(2-гидрокси-4-(4-пиколиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120ах):
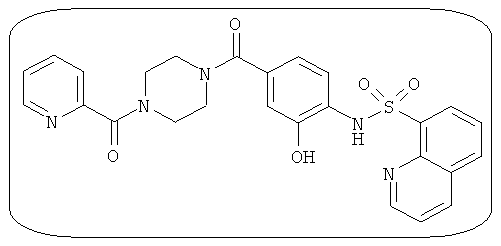
1H NMR (400 MHz. ДМСО-d6) δ: 3.2-3.8 (m, 8H), 4.8 (s, 1H), 7.0-7.2 (m, 2H), 7.6-7.8 (m, 3Н), 8.2 (m, 3Н), 8.2-8.4 (m, 2H), 8.9 (m, 1H), 9.0 (s, 1H), 10.5 (s, 1H); чистота ВЭЖХ: 98,1%; показатель m/z ЖХМС - 518,2 (M+1)+.
N-(4-(4-изоникотиноилпиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120ау):

1H NMR (400 MHz, ДМСО-d6) δ: 3.2-3.8 (m, 8H), 6.4 (m, 1H), 7.0-7.2 (m, 2H), 7.6-7.8 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 3H), 8.8 (s, 1H), 8.9 (s, 1H), 9.0 (s, 1H); чистота ВЭЖХ: 95,0%; показатель m/z ЖХМС - 532,2 (M+1)+.
N-(3-метокси-4-(4-(6-метилпиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120az):

1H NMR (400 MHz, CD3OD) δ: 2.2 (s, 3H), 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.7 (m, 3H), 7.2 (m, 2H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 9.0 (s,1H); чистота ВЭЖХ: 98,8%; показатель m/z ЖХМС - 546,2 (M+1)+.
N-(4-(4-(3-фторпиколиноил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120ba):

1Н NMR (400 MHz, ДМСО-d6)) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.7-7,0 (m, 3H), 7.2 (m, 2H), 7.6-7.8 (m, 3H), 8.1 (s, 1H), 8.4 (m, 2H), 9.0 (s, 1H); чистота ВЭЖХ: 98,8%; показатель m/z ЖХМС - 550,2 (M+1)+.
N-(4-(4-(5-фторпиколиноил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bb):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.7-7.0 (m, 3H), 7.2 (m, 2H), 7.6-7.8 (m, 3H), 8.1 (s, 1H), 8.4 (m, 1H), 9.0 (s, 1H), 9.3 (s, 1H), 10.5 (s, 1H); чистота ВЭЖХ: 98,9%; показатель m/z ЖХМС - 550,2 (M+1)+.
N-(3-метокси-4-(4-(5-(трифторметил)пиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bc):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.6-6.9 (m, 3H), 7.2 (m, 2H), 7.6-7.8 (m, 3H), 8.2-8.4 (m, 2H), 8.9 (m,1Н), 9.0 (s, 1H); чистота ВЭЖХ: 99.2%; показатель m/z ЖХМС - 600,3 (M+1)+.
N-(4-(4-(5-фтор-никотиноил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bd):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.6 (m, 3H), 8.0 (m, 1H), 8.2-8.6 (m, 4H), 9.1 (m, 1H); чистота ВЭЖХ: 99,5%; показатель m/z ЖХМС - 550,3 (M+1)+.
N-(4-(4-(3-хлор-изоникотиноил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120be):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.6 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.6-8.8 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 98,2%; показатель m/z ЖХМС - 566,25 (M+1)+.
N-(4-(4-(3-фтор-изоникотиноил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bf):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6,4 (m, 1H), 7.0 (m, 2H), 7.6 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.6-8.8 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 98,9%; показатель m/z ЖХМС - 550,35 (M+1)+.
N-(4-(4-(5-хлорникотиноил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bg):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.3 (m, 2H), 7.6 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.6-8.8 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 98,5%; показатель m/z ЖХМС - 566,3 (M+1)+.
N-(3-метокси-4-(4-(4-(трифторметил)никотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bh):
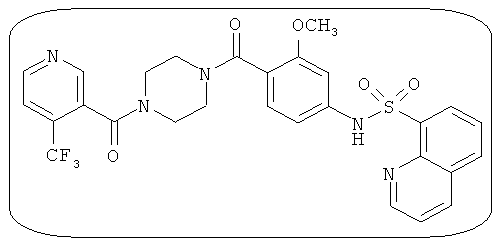
1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.6 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.4-8.6 (m, 2H), 8.9 (m, 1H), 9.1 (m, 1H); Чистота ВЭЖХ: 90,6%; показатель m/z ЖХМС - 600,35 (M+1)+.
N-(3-метокси-4-(4-никотиноилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bi):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6,4 (m, 1H), 7.0 (m, 2H), 7.2-7.6 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.6-8.6 (m, 2H), 8.9 (m, 1H), 9.1 (m, 1H); Чистота ВЭЖХ:96,5%; показатель m/z ЖХМС - 532,35 (M+1)+.
N-(4-(4-(5-хлорпиколиноил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bj):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.6-7.8 (m, 4H), 8.0 (m, 1H), 8.2-8.4 (m, 3H), 9.1 (m, 1H); Чистота ВЭЖХ: 92,08%; показатель m/z ЖХМС - 566,3 (M+1)+.
N-(3-метокси-4-(4-(3-(трифторметил)пиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bk):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.8 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 92,08%; показатель m/z ЖХМС - 566,3 (M+1)+.
N-(3-метокси-4-(4-(2-(трифторметил)никотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bl):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.6-7.8 (m, 4H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.8 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 96,5%; показатель m/z ЖХМС - 600,3 (M+1)+.
N-(3-метокси-4-(4-(3-метоксиизоникотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bm):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 3H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.8 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 93,2%; показатель m/z ЖХМС - 562,3 (M+1)+.
N-(3-метокси-4-(4-(2-метоксиизоникотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bn):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 3H), 7.6-7.8 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 3H), 8.8 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 98,5%; показатель m/z ЖХМС - 562,4 (M+1)+.
N-(3-метокси-4-(4-(пиразин-2-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bo):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.6-7.8 (m, 2H), 8.0 (m, 1H), 8,2-8.4 (m, 4H), 9.1 (s, 1H), 9.2 (s, 1H); чистота ВЭЖХ: 98,9%; показатель m/z ЖХМС - 533,1 (M+1)+.
N-(4-(4-(2-фтор-3-метоксибензоил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bp):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 4.0 (s, 3H), 6.4 (m, 1H), 7.0 (m, 3H), 7.2 (m, 2H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 2H), 9.1 (s, 1H); чистота ВЭЖХ: 99,3%;, показатель m/z ЖХМС - 579,2 (M+1)+.
N-(4-(4-(2-фторбензоил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bq):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.2-7.4 (m, 6H), 8.8 (m, 1H), 8.0 (m, 3H), 8.6 (s, 1H), 9.1 (s, 1H); чистота ВЭЖХ: 99,5%; показатель m/z ЖХМС - 549,2 (M+1)+.
N-(4-(4-(2,3-дифторбензоил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120br):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0-7.4 (m, 5H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 2H), 8.6 (s, 1H), 9.1 (s, 1H); чистота ВЭЖХ: 96,1%; показатель m/z ЖХМС - 567,1 (M+1)+.
N-(4-(4-(3,4-дифторбензоил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bs):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0-7.4 (m, 5H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 2H), 8.6 (s, 1H), 9.1 (s, 1H); чистота ВЭЖХ: 98,9%; показатель m/z ЖХМС - 567,1 (M+1)+.
N-(4-(4-(2,6-дифторбензоил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bt):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H). 6.4 (m, 1H), 7.0-7.4 (m, 4H), 7.6 (m, 3H), 8.0 (m, 1H), 8.4 (m, 2H), 9.1 (s, 1H); чистота ВЭЖХ: 98,4%; показатель m/z ЖХМС - 567,0 (M+1)+.
N-(3-метокси-4-(4-(2-фенилацетил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bu):
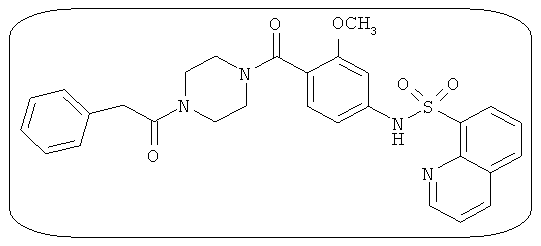
1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 2H), 7.2-7.4 (m, 5H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 2H), 9.1 (s, 1H); чистота ВЭЖХ: 99,7%; показатель m/z ЖХМС - 545,2 (M+1)+.
N-(3-метокси-4-(4-(2-(4-(трифторметил)фенил)ацетил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bv):
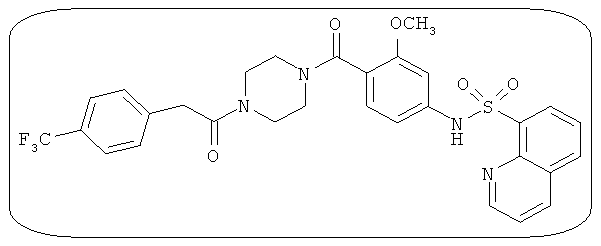
1H NMR (400 MHz, CDCl3) δ; 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 7.0 (m, 3H), 7.2-7.4 (m, 2H), 7.6 (m, 3H), 8.0 (m, 1H), 8.4 (m, 2H), 8.6 (s, 1H), 9.1 (s, 1H); чистота ВЭЖХ: 99,1%; показатель m/z ЖХМС - 613,1 (M+1)+.
N-(3-метокси-4-(4-(2-метил-2-фенилпропаноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bw):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 6.9-7.0 (m, 2H), 7.2-7.4 (m, 4H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 2H), 8.6 (s, 1H), 9.1 (s, 1H); чистота ВЭЖХ: 95,3%; показатель m/z ЖХМС - 573,45 (M+1)+.
N-(4-(4-(2-(4-фторфенил)-2-метил-пропаноил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120bx):
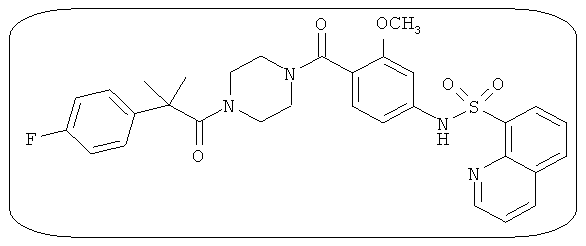
N-(4-(4-(1,2,3-тиадиазол-4-карбонил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (120by):
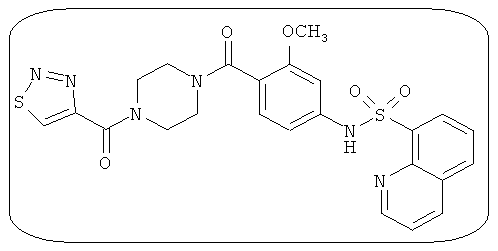
1H NMR (400 MHz, CDCl3) δ: 3,2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 6.9-7.2 (m, 2H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 2H), 8.6(s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,0%; показатель m/z ЖХМС - 539,3 (M+1)+.
N-(3-метокси-4-(4-(тиазол-4-карбонил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120bz):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.4 (m, 1H), 6.9-7.2 (m, 2H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 1H), 8.6 (s, 1H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,6%; показатель m/z ЖХМС - 538,3 (M+1)+.
2-циклопентил-этил 4-(2-метокси-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120са):
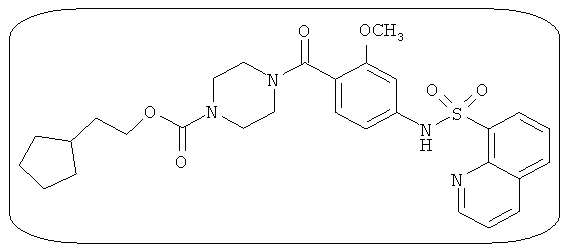
1H NMR (400 MHz, CDCl3) δ: 1.2 (m, 4H), 1.6 (m, 8 H), 3.2-3.8 (m, 8H), 3.9 (s, 3H), 4.7 (m, 1H), 6.4 (m, 1H), 6.9-7.2 (m, 2H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 1H), 8.6 (s, 1H), 8.8 (s. 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,8%; показатель m/z ЖХМС-567,1 (M+1)+.
Тетрагидрофуран-3-ил4-(2-метокси-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120cb):

1H NMR (400 MHz, CDCl3) δ: 2.0 (m, 2H), 2.2(m, 1H), 3.0-3.6 (m, 4 H), 3.2-3.8 (m, 8H), 3.9 (s, 3Н), 5.2 (s, 1H), 6.4 (m, 1H), 6.9-7.2 (m, 2H), 7.6 (m, 2H), 8.0 (m, 1H), 8.4 (m, 1H), 8.6 (s, 1H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 96,2%; показатель m/z ЖХМС - 541,05 (M+1)+.
2-циклогексил-этил 4-(2-метокси-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120сс):
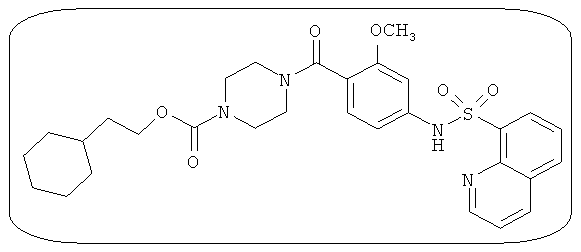
1H NMR (400 MHz, CDCl3) δ: 1.2 (m, 10Н), 1.6-1.8(m, 4H), 3.2-3.8 (m, 8H), 3.9 (s, 3Н), 4.7 (s. 1H), 6.4 (m, 1H), 6.9-7.0 (m, 2H), 7.6 (m, 2H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.6 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 97,7%; показатель m/z ЖХМС-581.4 (М+1)+.
N-(2-метокси-4-(4-(6-метилпиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120cd):
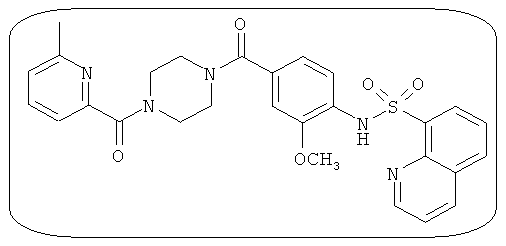
1H NMR (400 MHz, CDCl3) δ: 2.1(s, 3Н), 3.2-3.8 (m, 8H), 3.9 (s, 3Н), 6.7 (s, 1H), 6.9 (m, 1H), 7.2(m, 1H), 7.4-7.8 (m, 5H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,6%; показатель m/z ЖХМС - 546,3 (M+1)+.
N-(2-метокси-4-(4-(3-(трифторметил)пиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120се):
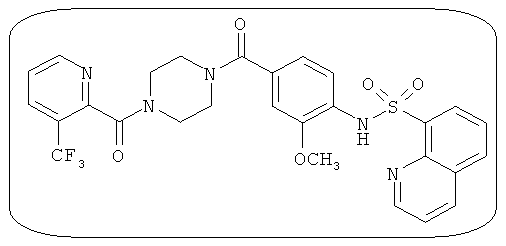
1H NMR (400 MHz, CDCl3) δ: 3.2-3,8 (m, 8H), 3.9 (s, 3H), 6,7 (s, 1H), 6.9 (m, 1H), 7.4-7.7 (m, 4H), 8.0 (m, 2H), 8.2-8.4 (m, 2H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,9%; показатель m/z ЖХМС - 600,3 (М+1)+.
N-(4-(4-(3-фторпиколиноил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (120cf):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9 (m, 2H), 7.4-7.7 (m, 5H), 8.0 (m, 2H), 8.2-8.4 (m, 2H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,8%; показатель m/z ЖХМС - 550,3 (M+1)+.
N-(2-метокси-4-(4-(5-(трифторметил)пиколиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120cg):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9 (m, 2H), 7.6-7.8 (m, 4H), 8.0 (m, 2H), 8.2-8.4 (m, 2H), 8.8 (s, 1H), 8.9 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,6%; показатель m/z ЖХМС - 600,3 (M+1)+.
N-(4-(4-(5-хлорпиколиноил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (120ch):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9 (m, 2H), 7.6-7.8 (m, 5H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.8 (s, 1H), 8.9 (m, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,3%; показатель m/z ЖХМС - 566,3 (М+1)+.
N-(4-(4-(5-фторпиколиноил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (120ci):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9 (m, 2H), 7.6-7.8 (m, 5H), 8.0 (m, 1H), 8.2-8.4 (m, 3H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,4%; показатель m/z ЖХМС - 550,3 (M+1)+.
N-(2-метокси-4-(4-(4-(трифторметил)никотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120cj):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9 (m, 2H), 7.6-7.8 (m, 4H), 8.2-8.4 (m, 2H), 8.6 (s, 1H), 8.8 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 99,9%; показатель m/z ЖХМС - 600,3 (M+1)+.
N-(4-(4-(5-хлор-никотиноил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (120ck):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3,9 (s, 3H), 6.9 (m, 2H), 7.6-7.8 (m, 4H), 8.0 (m, 1H), 8.4-8.6 (m, 2H), 8.7 (s, 1H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 95,7%; показатель m/z ЖХМС - 566,3 (M+1)+.
N-(4-(4-(5-фтор-никотиноил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (120cl):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9 (m, 2H), 7.6-7.8 (m, 4H), 8.0 (m, 1H), 8.4-8.6 (m, 2H), 8.7 (s, 1H), 8.8 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 89,4%; показатель m/z ЖХМС - 550,3 (M+1)+.
N-(4-(4-(3-хлор-изоникотиноил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (120cm):

1H NMR (400 MHz. CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9 (m, 2H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.4-8.6 (m, 4H), 8.9 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 98,5%; показатель m/z ЖХМС - 566,3 (M+1)+.
N-(4-(4-(3-фтор-изоникотиноил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (120cn):
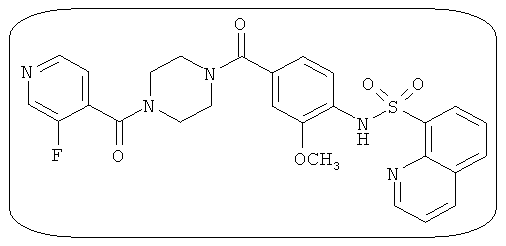
1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9 (m, 2H), 7.6-7.8 (m, 4H), 8.0 (m, 1H), 8.4-8.6 (m, 3H), 8.9 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 94,9%; показатель m/z ЖХМС - 550,3 (M+1)+.
N-(2-метокси-4-(4-(2-метокси-изоникотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120со):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.8 (s, 3H), 3.9 (s, 3H), 6.6-6.9 (m, 4H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 3H), 8.9 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 97,3%; показатель m/z ЖХМС - 562,3 (M+1)+.
N-(2-метокси-4-(4-(2-(трифторметил)пикотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120ср):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.6 (s, 1H), 6.9 (m, 1H), 7.6-7.8 (m, 5H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 8.9 (s. 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,7%; показатель m/z ЖХМС - 600,3 (M+1)+.
N-(2-метокси-4-(4-(2-метокси-никотиноил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (120cq):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.8 (s, 3H), 3.9 (s, 3H), 6.6 (s, 1H), 6.9 (m, 1H), 7.6-7.8 (m, 4H), 8.0 (m, 1H), 8.2-8.4 (m, 3H), 8.9 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 99,8%; показатель m/z ЖХМС - 562,4 (M+1)+.
Тетрагидрофуран-3-ил4-(3-метокси-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120cr):

1H NMR (400 MHz, CDCl3) δ: 2.2 (m, 2H), 3.2-3.8 (m, 8H), 3.9 (s, 3H), 4.0(m, 2Н), 5.0 (m, 1H), 6.9 (m, 2H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ; 98,1%; показатель m/z ЖХМС - 541,0 (M+1)+.
(Тетрагидрофуран-2-ил)метил 4-(3-метокси-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120cs):

1H NMR (400 MHz, CDCl3) δ: 1.2 (m, 2Н), 1.2 (m, 2Н), 1.6 (m, 1Н), 2.0 (m, 2H), 3.2-3.8 (m, 8H), 3.9 (s, 3H), 4.0(m, 2H), 6.9-7.0 (m, 2H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 99,0%; показатель m/z ЖХМС-555,1 (M+1)+.
2-циклопентил-этил4-(3-метокси-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120ct):

1Н NMR (400 MHz, CDCl3) δ: 1,2 (m, 6H), 1.6 (m, 12H), 2,0 (m, 2H), 3.2-3.8 (m, 8H), 3.9 (s, 3H), 4.0(m, 2H), 6.9-7.0 (m, 2H), 7.6-7.8 (m, 3H), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 99,0%; показатель m/z ЖХМС - 589,1 (M+1)+.
2-циклогексил-этил4-(3-метокси-4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилат (120cu):
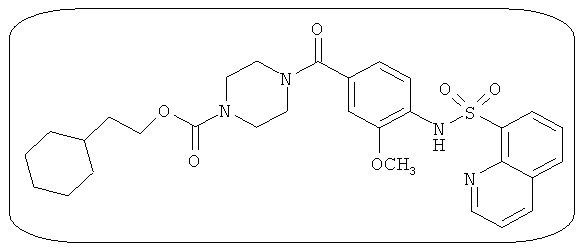
1H NMR (400 MHz, CDCl3) δ: 1.0 (m, 2H), 1.2 (m, 6H), 1.6 (m, 6H), 3.2-3.8 (m, 8H), 3.9 (s, 3H), 4.6(m, 1H), 6.9-7.0 (m, 2H). 7.6-7.8 (m, 3Н), 8.0 (m, 1H), 8.2-8.4 (m, 2H), 9.1 (m, 1H); чистота ВЭЖХ: 98,3%; показатель m/z ЖХМС - 581,4 (M+1)+.
Синтез производных пиперазина с 3-трифторметил или 3-трифторометокси замещенными фенильными кольцами
Схема 18

Общий алгоритм синтеза сульфонамида 122; В размешанный раствор амина 121 (30,3 ммоль) в ДМФ (20 мл на грамм) в атмосфере азота добавили порциями гидрид натрия (90,9 ммоль) при температуре 0°С и размешивали в течение 10 мин при комнатной температуре. Затем в реакционную смесь добавили хинолин-8-сульфонилхлорид 89 (8,94 г, 39,4 ммоль) при температуре 0°С.Полученную смесь размешивали в течение 30 мин при комнатной температуре. После завершения реакции большую часть растворителя удалили при низком давлении. Остаток растворили в смеси ледяной воды и EtOAc, а рН довели до 7,0 при помощи насыщенного раствора NaH2PO4. Затем продукт экстрагировали EtOAc, промыли водой и соляным раствором, высушили над сульфатом натрия, растворитель удалили при низком давлении. Затем полученный неочищенный продукт (80%) использовали в следующем этапе без дальнейшей очистки.
Общий алгоритм синтеза продукта гидролиза 123: в размешанный раствор сульфонамида 122 (22,4 ммоль) в ТГФ (тетрагидрофуране):H2O (1:1) в атмосфере азота добавили твердый LiOH (9,4 г, 224 ммоль) при комнатной температуре. Раствор нагревали в колбе с обратным холодильником в течение 6 часов. После завершения реакции реакционную смесь промыли этилацетатом (2×100 мл) для извлечения неполярных примесей. Водный слой подкислили (рН 4) раствором лимонной кислоты. Полученный преципитат отфильтровали и высушили на воздухе. Следы влаги удалили путем совместной перегонки с толуолом. Полученное твердое вещество грязно-белого цвета (80%) использовали на следующем этапе без дальнейшей очистки,
Общий алгоритм синтеза сульфонамида 124: ЭДКИ (EDCI) (1-этил-3-(3-диметиламинопропил) карбодиимид) (3,8 г, 19,8 ммоль) и HOBt (2,67 г, 19,8 ммоль) добавили в размешанный раствор кислоты 123 (19,8 ммоль) в безводном ДМФ. Температуру смеси понизили до 0°С, в это же время добавили ДИПЭА (11 мл, 59,45 ммоль) в атмосфере азота, а полученный раствор (или суспензию) размешивали при комнатной температуре в течение 30 мин. Затем при температуре 0°С добавили трет-бутоксикарбонил (Вос)-пиперазин (3,68 г, 19,8 ммоль). Реакционную смесь поместили при комнатной температуре и размешивали в течение ночи. После завершения реакции, реакционную смесь развели водой и экстрагировали этилацетатом (3×70 мл). Органический слой промыли водой (3×50 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали в ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очищали путем колоночной хроматографии (60-120 силикагель, 2% МеОН-ДХ) для получения очищенного продукта трет-бутоксикарбонила-125 (8.0 г, 82%) в виде твердого вещества грязно-белого цвета, который подвергли обработке метанольной HCl (100 мл) в течение 2 часов при комнатной температуре. После полного отщепления группы трет-бутоксикарбонила растворитель удалили при низком давлении для получения неочищенного продукта в виде соли HCl. Водный раствор соли промыли диэтиловым эфиром и ощелачили NaHCO3 (pH 10). Затем целевой продукт разделили на этилацетат, высушенный над безводным Na2SO4, растворитель удалили при низком давлении для получения свободного амина 125 в виде твердого вещества грязно-белого цвета (6,0 г, 95%).
Общий алгоритм синтеза амидов 125a-g: ЭДКИ (48 мг, 0,2525 ммоль) и HOBt (34 мг, 0,2525 ммоль) добавили к размешанному раствору Ar-СООН (0,2525 ммоль) в безводном ДМФ. Температуру смеси снизили до 0°С, в это время добавили ДИПЭА (139 мкл, 0,7575 ммоль) в атмосфере азота, полученный раствор (или суспензию) перемешивали при комнатной температуре в течение 30 мин. Затем добавили амин 124 (100 мг, 0,2525 ммоль) при температуре 0°С.Затем реакционную смесь при комнатной температуре перемешивали в течение ночи. После завершения реакции реакционную смесь растворили в воде и экстрагировали этилацетатом (3×15 мл). Органический слой промыли водой (3×10 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали в ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очищали либо посредством колоночной хроматографии с силикагелем, либо путем препаративной ВЭЖХ (высокоэффективной жидкостной хроматографии) для получения очищенных продуктов с выходом 52-70%.
N-(4-(4-изоникотиноилпиперазин-1-карбонил)-2-(трифторметил)фенил)хинолин-8-сульфонамид (125а):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.2 (m, 2H), 7.4-7.7 (m. 4H), 8,0 (m. 2H), 8.4-8.8 (m, 4H), 9,1 (m, 1H); чистота ВЭЖХ; 99.0%; ЖХМС (жидкостная хромато-масс-спектрометрия), m/z найдено 570.1 (M+1)+.
N-(4-(4-никотиноилпиперазин-1-карбонил)-2-(трифторметил)фенил)хинолин-8-сульфонамид (125b):
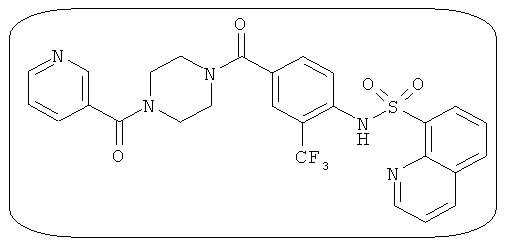
1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.2 (m, 2H), 7.4-7.9 (m, 5H), 8.0-8.4 (m, 2H), 8.4-8.8 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 98.4%; ЖХМС, m/z найдено 570.1 (М+1)+.
N-(4-(4-(пиразин-2-карбонил)пиперазин-1-карбонил)-2-(трифторметил)фенил)хинолин-8-сульфонамид (125с):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.4-7.9 (m, 5H), 8.0-8.4 (m, 2H), 8.4-8.8 (m, 3H), 9.1 (m, 2H); чистота ВЭЖХ: 90.0%; ЖХМС, m/z найдено 571.1 (M+1)+.
N-(4-(4-(2,6-дифторбензоил)пиперазин-1-карбонил)-2-(трифторметил)фенил)хинолин-8-сульфонамид (125d):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.0 (m, 1H), 7.2-7.9 (m, 6H), 8.2-8.8 (m, 3H), 9.1 (m, 2H); чистота ВЭЖХ: 90.0%; ЖХМС, m/z найдено 571.1 (M+1)+.
N-(4-(4-(2-фтор-3-метоксибензоил)пиперазин-1-карбонил)-2-(трифторметил)фенил)хинолин-8-сульфонамид (125е):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 3.9 (s, 3H), 6.9-7.2 (m, 2H), 7.4-7.9 (m, 5H), 8.0-8.6 (m, 3H), 9.1 (m, 2H); чистота ВЭЖХ: 99.0%; ЖХМС, m/z найдено 617,1 (М+1)+.
N-(4-(4-(1,2,3-триадизол-4-карбонил)пиперазин-1-карбонил)-2-(трифторметил)фенил)хинолин-8-сульфонамид (125f):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.4-7.9 (m, 4H), 8.1-8.6 (m, 3H), 9.0 (m, 2H), 9.2 (s, 1H); чистота ВЭЖХ: 99.0%; ЖХМС, m/z найдено 557.1 (M+1)+.
N-(4-(4-(тиазол-4-карбонил)пиперазин-1-карбонил)-2-(трифторметил)фенил)хинолин-8-сульфонамид (125g):

1H NMR (400 MHz, CDCl3) δ: 3.2-3.8 (m, 8H), 7.4-7.9 (m, 3H), 8.1-8.6 (m, 4H), 8.8 (s, 1H), 9.0 (m, 1H); чистота ВЭЖХ: 99.3%; ЖХМС, m/z найдено 576.1 (M+1)+.
Синтез соединений гомопиперазина
Схема 19

Общий алгоритм синтеза сульфонамида 127: в размешанный раствор амина 126 (30,3 ммоль) в атмосфере азота при температуре 0°С добавили пиридин (50 мл) и размешивали в течение 10 мин. Затем в реакционную смесь добавили хинолин-8-сульфонилхлорид 89 (8,94 г, 39,4 ммоль) при той же температуре. Полученную смесь размешивали в течение 16 часов при комнатной температуре. После завершения реакции растворитель удалили при низком давлении. Следы пиридина удалили посредством совместной перегонки с толуолом. В полученный остаток добавили диэтиловый эфир, твердый продукт отфильтровали и высушили на воздухе. Полученный неочищенный продукт (8,0 г, 74%) использовали в следующем этапе без дальнейшей очистки.
Общий алгоритм синтеза кислоты 128: в размешанный раствор сульфонамида 127 (22,4 ммоль) в ТГФ:H2O (1:1) в атмосфере азота добавили твердый LiOH (9,4 г, 224 ммоль) при комнатной температуре. Раствор дефлегмировали в течение 6 часов. После завершения реакции реакционную смесь промыли этилацетатом (2×100 мл) для удаления неполярных примесей. Водный слой подкислили (рН 4) раствором лимонной кислоты. Полученный преципитат отфильтровали и высушили на воздухе. Следы влаги удалили путем совместной перегонки с толуолом. Полученное твердое вещество грязно-белого цвета (80%) использовали в следующем этапе без дальнейшей очистки.
Общий алгоритм синтеза амина 129: ЭДКИ (3,8 г, 19,8 ммоль) и HOBt (2,67 г, 19,8 ммоль) добавили в размешанный раствор кислоты 128 (19,8 ммоль) в
безводном ДМФ. Температуру смеси уменьшили до 0°С, в это время добавили ДИПЭА (11 мл, 59,45 ммоль) в атмосфере азота, полученный раствор (или суспензию) размешивали при комнатной температуре в течение 30 мин. Затем при температуре 0°С добавили трет-бутоксикарбонил-гомопиперазин (19,8 ммоль). Реакционную смесь размешивали при комнатной температуре в течение ночи. После завершения реакции реакционную смесь растворили в воде и извлекли этилацетатом (3×70 мл). Органический слой промыли водой (3×50 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали в ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очистили путем колоночной хроматографии (60-120 силикагель, 2% МеОН-ДХМ) для получения очищенного продукта, трет-бутоксикарбонила-129 (85%) в виде твердого вещества грязно-белого цвета, который подвергли обработке метанольной HCl (100 мл) в течение 2 часов при комнатной температуре. После полного расщепления группы трет-бутоксикарбонила растворитель удалили при низком давлении для получения неочищенного продукта в виде соли HCl. Водный раствор соли промыли диэтиловым эфиром и ощелачили NaHCO3 (рН 10). Затем целевой продукт разделили на этилацетат, высушенный безводным Na2SO4, растворитель удалили при низком давлении для получения свободного амина 129 в виде твердого вещества грязно-белого цвета (92%).
Общий алгоритм синтеза амидов 130а-r: ЭДКИ (48 мг, 0,2525 ммоль) HOBt (34 mg, 0,2525 ммоль) добавили в размешанный раствор Ar-СООН (0,2525 ммоль) в безводном ДМФ. Температуру смеси уменьшили до 0°С, в это время добавили ДИПЭА (139 мкл, 0.7575 ммоль) в атмосфере азота, полученный раствор (или суспензию) размешивали при комнатной температуре в течение 30 мин. Затем при температуре 0°С добавили амин 129 (0,2525 ммоль). Далее реакционную смесь размешивали при комнатной температуре в течение ночи. После завершения реакции реакционную смесь растворили в воде и извлекли этилацетатом (3×15 мл). Органический слой промыли водой (3×10 мл), высушили безводным сульфатом натрия, профильтровали и сконцентрировали в ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очищали либо путем колоночной хроматографии с силикагелем, либо путем препаративной ВЭЖХ для получения очищенных продуктов с выходом 54-72%.
N-(4-(4-(2-(2-фторфенил)ацетил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130а):

1H NMR (400 MHz, ДМСОd6) δ: 3.0-3.8 (m, 10Н), 7.0-7.4 (m, 8H), 7.5-7.8 (m. 2H), 8.0-8.4 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 98.1%; ЖХМС, m/z найдено 547.4 (M+1)+.
N-(4-(4-(2-(5-фторпиридин-2-ил)-2-метилпропаноил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130b):

1H NMR (400 MHz, ДМСОd6) δ: 1.4 (s, 6H), 3.0-3.8 (m, ЮН), 7.0-7.2 (m, 6H), 7.6-7.8 (m, 2H), 8.0-8.4 (m, 3H), 9.1 (m, 1H); чистота ВЭЖХ: 98.6%; ЖХМС, m/z найдено 575.4 (M+1)+.
N-(4-(4-(2-фтор-3-метоксибензоил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130с):

1H NMR (400 MHz, ДМСОd6) δ: 3.0-3.8 (m, 10Н), 3.9 (s, 3H), 6.9-7.2 (m, 7H), 7.6-7.8 (m, 2H), 8.2-8.4 (m, 3H), 9,1 (m, 1H); чистота ВЭЖХ: 98.2%; ЖХМС, m/z найдено 561.5 (M+1)+.
N-(4-(4-пиколиноил-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130d):

1H NMR (400 MHz, ДМСОd6) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 5H), 9.1 (m, 1H); чистота ВЭЖХ: 99.4%; ЖХМС, m/z найдено 516.0 (М+1)+.
N-(4-(4-(2,6-дифторбензоил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130е):

1H NMR (400 MHz, ДМСОd6) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 4H), 9.1 (m, 1H); чистота ВЭЖХ: 98.7%; ЖХМС, m/z найдено 551.3 (M+1)+.
N-(4-(4-(2-(4-фторфенил)ацетил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130f):

1H NMR (400 MHz, ДМСОd6) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 5H), 9.1 (m, 1H); чистота ВЭЖХ: 99.6%; ЖХМС, m/z найдено 547.2 (M+1)+.
N-(4-(4-(4-хлорбензоил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130g):
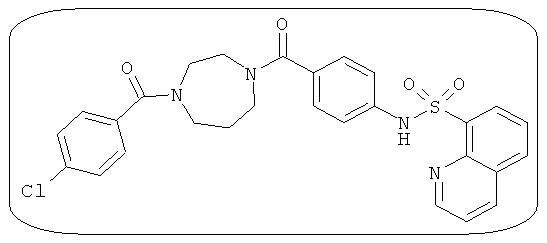
1H NMR (400 MHz, ДМСОd6) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 5H), 9.1 (m, 1H); чистота ВЭЖХ: 99.4%; ЖХМС, m/z найдено 549.3 (M+1)+.
N-(4-(4-(2-(4-(трифторметил)фенил)ацетил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130h):
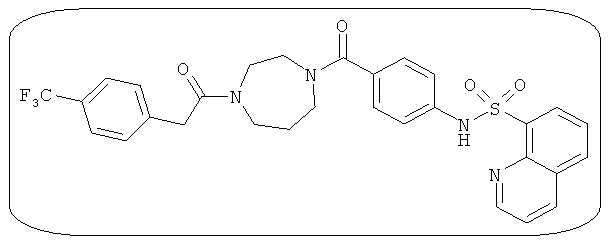
1H NMR (400 MHz, ДМСОd6) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 5H), 9.1 (m, 1H); чистота ВЭЖХ: 99.2%; ЖХМС, m/z найдено 597.2 (M+1)+.
N-(4-(4-(2,4-дихлорбензоил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид 2,2,2-трифторацетат (130i):

1H NMR (400 MHz, ДМСОd6) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 3Н), 8,5 (s, 1H), 9.1 (m, 1H); чистота ВЭЖХ: 94.4%; ЖХМС, m/z найдено 5 82.47 (М+1)+.
N-(4-(4-(2,3-дифторбензоил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130j):

1H NMR (400 MHz, CD3OD) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 4H), 9.1 (m, 1H); чистота ВЭЖХ: 98.6%; ЖХМС, m/z найдено 549.5 (M-1)+.
N-(4-(4-(3,4-дифторбензоил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид 2,2,2-трифторацетат (130k):

1H NMR (400 MHz, CD3OD) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7,0-8.0 (m, 8H), 8.2-8.4 (m, 4H), 9.1 (m, 1H); чистота ВЭЖХ: 99.4%; ЖХМС, m/z найдено 549.3 (M-1)+.
N-(4-(4-(2-метилникотиноил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130l):

lH NMR (400 MHz, CD3OD) δ: 1.4-1.6 (m, 2H), 2.1 (s, 3H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 4H), 9.1 (m, 1H); чистота ВЭЖХ: 98.0%; ЖХМС, m/z найдено 530.4 (М+1)+.
N-(4-(4-(2-фенилацетил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид 2,2,2-трифторацетат (130m):

lH NMR (400 MHz, CD3OD) δ: 1.4-1.6 (m, 2H), 1.6-2.0 (s, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 6H), 9.1 (m, 1H); чистота ВЭЖХ: 98.8%; ЖХМС, m/z найдено 529.1 (M+1)+.
N-(4-(4-(1,2,3-триадизол-4-карбонил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид 2,2,2-трифторацетат (130n):

1H NMR (400 MHz, CD3OD) δ: 1.4-1.6 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 6H), 8.2-8.4 (m, 4H), 9.1 (s, 1H); чистота ВЭЖХ: 98.5%; ЖХМС, m/z найдено 523.1 (M+1)+.
N-(4-(4-(3-фенилпропаноил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130о):

1H NMR (400 MHz, CD3OD) δ: 1.4-1.6 (m, 2H), 1.7 (t, 2H), 1.8 (t, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 6H), 9.1 (s, 1H); чистота ВЭЖХ: 98.2%; ЖХМС, m/z найдено 543.1 (M+1)+.
N-(4-(4-(2-фенилпропаноил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130р):

1H NMR (400 MHz, ДМСОd6) δ: 1.2 (s, 3H), 1.3 (m, 2H), 3.0-3.8 (m, 8H), 4.0 (m, 1H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 6H), 9.1 (s, 1H); чистота ВЭЖХ: 97.1%; ЖХМС, m/z найдено 543.1 (М+1)+.
N-(2-метил-4-(4-пиколиноил-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130q):

1H NMR (400 MHz, ДМСOd6) δ: 1.2 (s, 3H), 1.3 (m, 2H), 3.0-3.8 (m, 8H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 4Н), 9.1 (s, 1H); чистота ВЭЖХ: 96.3%; ЖХМС, m/z найдено 530.1 (M+1)+.
N-(2-гидрокси-4-(4-пиколиноил-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (130r):

1H NMR (400 MHz, ДМСОd6) δ: 1.3-1.8 (m, 2H), 3.0-3.8 (m, 8H), 5.8 (s, 1H), 7.0-8.0 (m, 8H), 8.2-8.4 (m, 4Н), 9.1 (s, 1H); 10.2 (s, 1H), чистота ВЭЖХ: 98.0%; ЖХМС, m/z найдено 532.2 (M+1)+.
Синтез обратных сульфонамидов на основе пиперазина
Схема 20

Общий алгоритм синтеза сульфонамида 133: в размешанный раствор хинолин-8-амина 131 (30,3 ммоль) в атмосфере азота при температуре 0°С добавили пиридин (50 мл) и размешивали в течение 10 мин. Затем в реакционную смесь при той же температуре добавили 4-(хлорсульфонил) бензойную кислоту (132, 30,3 ммоль). Полученную смесь размешивали в течение 16 часов при комнатной температуре. После завершения реакции растворитель удалили при пониженном давлении. Следы пиридина удалили посредством совместной перегонки с толуолом. В полученный остаток добавили диэтиловый эфир, твердый продукт отфильтровали и высушили на воздухе. Полученный неочищенный продукт (74%) использовали в следующем этапе без дальнейшей очистки.
Общий алгоритм синтеза сульфонамида 135: ЭДКИ (3,8 г, 19,8 ммоль) и HOBt (2,67 г, 19,8 ммоль) добавили в раствор кислоты 133 (19,8 ммоль) в безводном ДМФ. Температуру смеси довели до 0°С, в это время в атмосфере азота добавили ДИПЭА (11 мл, 59,45 ммоль), полученный раствор (или суспензию) размешивали при комнатной температуре в течение 30 мин. Затем при температуре 0°С добавили вторичный амин 134 (19,8 ммоль). Далее реакционную смесь при комнатной температуре размешивали в течение ночи. После завершения реакции реакционную смесь растворили в воде и экстрагировали этилацетатом (3×70 мл). Органический слой промыли водой (3×50 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали в ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очищали посредством колоночной хроматографии (60-120 силикагель, 2% МеОН-ДХМ) для получения очищенного продукта, трет-бутоксикарбонила-135 (83%) в виде твердого вещества грязно-белого цвета, который подвергли обработке метанольной HCl (100 мл) в течение 2 часов при комнатной температуре. После полного отщепления группы трет-бутоксикарбонила растворитель удалили при пониженном давлении для получения неочищенного продукта в виде соли HCl. Водный раствор соли промыли диэтиловым эфиром и ощелачили NaHCO3 (pH 10). Затем целевой продукт разделили на этилацетат, высушили безводным Na2SO4, растворитель удалили при пониженном давлении для получения свободного амина 135 в виде твердого вещества грязно-белого цвета (95%).
Общая процедура синтеза амидов 136а-с: ЭДКИ (48 мг, 0,2525 ммоль) и HOBt (34 мг, 0,2525 ммоль) добавили в размешанный раствор пиколиновой кислоты (0,2525 ммоль) в безводном ДМФ. Температуру смеси уменьшили до 0°С, в это время добавили ДИПЭА (139 мкл, 0,7575 ммоль) в атмосфере азота, полученный раствор (или суспензию) размешивали при комнатной температуре в течение 30 мин. Затем добавили амин 135 (100 мг, 0,2525 ммоль) при температуре 0°С. Затем реакционную смесь размешивали при комнатной температуре в течение ночи. После завершения реакции реакционную смесь развели водой и извлекли этилацетатом (3×15 мл). Органический слой промыли водой (3×10 мл), высушили над безводным сульфатом натрия, профильтровали и сконцентрировали в ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очищали либо путем колоночной хроматографии с силикагелем, либо путем препаративной ВЭЖХ для получения очищенных продуктов с выходом 55-76%.
4-(4-пиколиноилпиперазин-1-карбонил)-N-(хинолин-8-ил)бензолсульфонамид (136а):

1H NMR (400 MHz, ДМСОd6) δ: 1.4-1.6 (m, 2H), 3.2-3.8 (m, 8H), 7.0-8.0 (m, 10Н), 8,2 (m, 1H), 8.5 (d, 2H), 8.8 (d, 2H), 10.2 (s, 1H); чистота ВЭЖХ: 99.4%; ЖХМС, m/z найдено 502.1 (M+1)+.
4-(4-пиколиноил-1,4-диазепан-1-карбонил)-N-(хинолин-8-ил)бензолсульфонамид (136b):

1H NMR (400 MHz, ДМСОd6) δ: 3.2 (m, 2H), 3.5 (m, 2H). 3.8 (m, 6H), 7.0-7.4 (m, 6H), 7.6-8.0 (m, 4H), 8.2-9.0 (m, 4H), 10.2 (s, 1H); чистота ВЭЖХ: 97.8%; ЖХМС, m/z найдено 516.2 (M+1)+.
Синтез бензильного ряда - соединений на основе пиперазина с замещенными фенильными кольцами
Схема 21

Синтез этил 4-(хинолин-8-сульфонамид)бензоата (90):

В раствор амина 88 (16 г, 96,85 ммоль) в смеси (1:1) ДХМ и пиридина при комнатной температуре в атмосфере N2 добавили сульфохлорид 89 (27,56 г, 121,07 ммоль). Полученную смесь размешивали в течение 16 часов. После завершения реакции неочищенную смесь развели ДХМ, промыли водой, а затем 1N HCl. Далее органический слой высушили над Na2SO4 и сконцентрировали при пониженном давлении для обеспечения 98% (34 г) выхода продукта 90.
Синтез 4-(хинолин-8-сульфонамид)бензойной кислоты (91):

К раствору сульфонамида 90 (34 г, 95,5 ммоль) в ТГФ и воде (1:1) добавили LiOH (20 г, 47,66 ммоль), полученную смесь перемешивали при температуре 80°С в течение ночи. После завершения реакции, неочищенную смесь промыли EtOAc. Водный слой подкислили лимонной кислотой и профильтровали. Полученное таким образом твердое вещество промыли Et2O и азеотропировали толуолом при пониженном давлении для получения кислоты 91 (30 г, выход 95,8%), которую использовали в следующем этапе без дальнейшей очистки.
Синтез трет-бутил 4-(4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-карбоксилата (138):

В раствор кислоты 91 (2 г, 6,09 ммоль) в ДМФ добавили РуВоР (бензотриазол-1-ил-окси-трис-(диметиламино)-фосфоний гексафторфосфат) (4,75 г, 9,14 ммоль) при температуре 0°С и размешивали в течение 5 минут. Затем трет-бутоксикарбонил-защищенный пиперазин/гомопипер 137 (1,13 г, 6,09 ммоль) добавили в реакционную смесь при той же температуре в атмосфере N2 и размешивали в течение ночи при комнатной температуре. После завершения реакции смесь развели водой и экстрагировали EtOAc. Органический слой промыли водой, высушили над Na2SO4, и выпарили при пониженном давлении. Остаток очистили посредством колоночной хроматографии (силикагель, 60-120 меш; МеОН-ДХМ, 2:8) для обеспечения выхода продукта 138 66% (2 г).
Синтез N-(4-(пиперазин-1-карбонил)фенил)хинолин-8-сульфонамида (139):
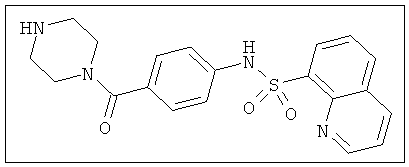
В раствор МеОН·HCl добавили трет-бутоксикарбонил-защищенный амин 138 (2 г, 4,03 ммоль), полученную смесь размешивали в течение 1 часа. После завершения реакции растворитель удалили при пониженном давлении, промыли водой с последующим добавлением NaHCO3 и экстрагировали ДХМ. Органический слой высушили над Na2SO4 и выпарили при уменьшенном давлении для получения продукта 139 (1,5 г, выход 94,30%).
Общая процедура синтеза соединения (VIII-1)-(VIII-216):
В раствор амина 139 (0,25 ммоль) и соответствующего альдегида (0,27 ммоль) в ДХМ при комнатной температуре добавили уксусную кислоту (0,2 мл), полученную смесь размешивали в течение 30 мин. Затем в реакционную смесь добавили триацетоксиборогидрид натрия (STAB) (0,26 г, 1,26 ммоль), полученную смесь размешивали при температуре 50°С в течение 1 часа. После завершения реакции неочищенную смесь развели ДХМ, промыли водой, высушили над Na2SO4 и сконцентрировали при уменьшенном давлении. Остаток очищали посредством колоночной хроматографии (силикагель, 60-120 меш; МеОН-ДХМ, 2:8) для обеспечения выхода продукта 32-45% (VIII-1)-(VIII-216).
N-(4-(4-бензилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-1):

1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H), 7.59-7.64 (m, 2H), 8.03-8.28 (m, 2H), 9.18 (s, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 98.7%; ЖХМС: 487 (М+1).
N-(4-(4-(2-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-2):

1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H), 7.59-8.1 (m, 4H), 9.18 (s, 1H); чистота ВЭЖХ: 99.2%; ЖХМС: 512.3 (М+1).
N-(4-(4-(4-ацетилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-3):

1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.6 (s, 3H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H), 7.60-7.71 (m, 2H), 8.01-8.28 (m, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 97.8%; ЖХМС: 529.2 (М+1).
N-(4-(4-(4-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-4):

1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H), 7.59-7.64 (m, 2H), 8.03-8.28 (m, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 97.8%; ЖХМС: 512.3 (М+1).
N-(4-(4-(4-бромбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-5):
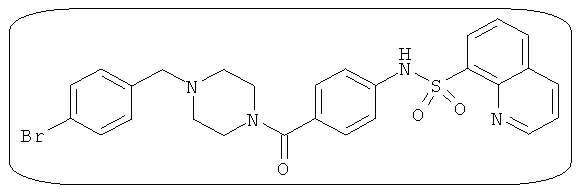
1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H), 7.59-7.64 (m, 2H), 8.03-8.28 (m, 2H), 10.4 (s, 1H); чистота ВЭЖХ: 98.3%; ЖХМС: 566.1 (М+1).
N-(4-(4-(3-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-6):
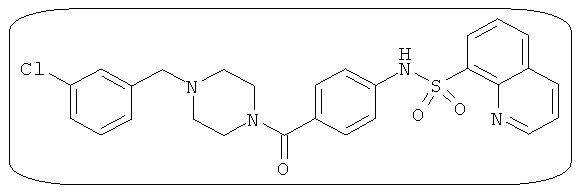
1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.8-7.04 (m, 4H), 7.1-7.2 (m, 3H), 7.59-7.64 (m, 4H), 8.0-8.6 (m, 3H), 10.4 (s, 1H); чистота ВЭЖХ: 96.5%; ЖХМС: 522.1 (М+1).
N-(4-(4-(3-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-7):

1H NMR (400 MHz, CDCl3) δ: 2.40 (s, 2H), 3.9 (s, 3H), 3.68 (br s, 4H), 3.4-3.6 (m. 4H), 7.06 (m, 4H), 7.18 (m, 3H), 7.25 (m, 2H), 7.42 (m, 2H), 8.58 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 97.8%; ЖХМС: 517.1 (М+1).
N-(4-(4-(циклопропилметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-8):

1H NMR (400 MHz, ДМСО-d6) δ: 1.2 (t, 2H), 1.3 (t, 2H), 1.31-1.35 (m, 1H), 2.40 (s, 2H), 3.68 (br s, 4H). 3.4-3.6 (m, 4H), 7.06 (m, 6H), 7.25-7.42 (m, 3H), 9.18 (s, 1H) 10.4 (s, 1H); чистота ВЭЖХ: 97.81%; ЖХМС: 451.3 (М+1).
N-(4-(4-бутилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-9):

1H NMR (400 MHz, ДМСО-d6) δ: 1.25-1.3 (m, 2H), 1.38-1.35 (m, 2H), 1.5 (t, 3H), 2.40 (s, 2H), 3.68 (br s, 4H), 3.4-3.6 (m, 4H), 7.06 (m, 6H), 7.25-7.42 (m, 3H), 9.18 (s, 1H) 10.4 (s, 1H); чистота ВЭЖХ: 99.7%; ЖХМС: 453.2 (М+1).
N-(4-(4-(пиридин-2-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-10):

1H NMR (400 MHz, ДМСО-d6) δ: 2.5 (s, 2H), 3.68 (br s, 4H), 3.4-3.6 (m, 4H), 7.0-7.4 (m, 8H), 7.3-7.4 (m, 3H), 9.18 (s. 1H), 10.4 (s, 1H); чистота ВЭЖХ: 95.8%; ЖХМС:488.1(М+1).
N-(4-(4-(2-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-11):

1H NMR (400 MHz, ДМСО-d6) δ: 2.5 (s, 2H), 3.68 (br s, 4H), 3.4-3.6 (m, 4H), 7.0-7.4 (m, 6H), 7.3-7.4 (m, 4H), 8.0-8.35 (m, 3H), 9.18 (s, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 98.8%; ЖХМС: 522.1 (М+1).
N-(4-(4-(2-ацетилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-12):

1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.6 (s, 3H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 7.0-7.4 (m, 6H), 7.45-7.7(m, 4H), 8.0-8.4 (m, 3H), 9.18 (s, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 98.3%; ЖХМС: 529.2 (М+1).
N-(4-(4-(3-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-13):

1Н NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H), 7.59-8.1 (m, 4H), 10.35 (s, 1H); чистота ВЭЖХ: 99.2%; MS: 512.3 (M+1).
N-(4-(4-(4-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-14):

1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.40 (br d. 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H). 7.59-7.64 (m, 2H). 8.03-8.28 (m, 2H), 10.4 (s, 1H); чистота ВЭЖХ: 98.3%; ЖХМС: 522.3 (М+1).
N-(4-(4-(2-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-15):

1H NMR (400 MHz, ДМСOd6) δ: 2.5 (s, 2H), 3.68 (br s, 4H), 3.4-3.6(m, 4H), 7.0-7.4 (m, 6H), 7.3-7.4 (m, 4H). 8.0-8.35 (m, 3H), 9.18 (s, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 99.1%; ЖХМС: 512.3 (М+1).
N-(4-(4-(4-ацетилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-16):

1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.6 (s, 3H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d, 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H), 7.6-7.7 (m, 2H), 8.0-8.28 (m, 2H), 10.3 (s, 1H); чистота ВЭЖХ: 97.8%; ЖХМС: 529.2 (М+1).
N-(4-(4-(4-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-17):

1H NMR (400 MHz, CDCl3) δ: 1.8 (s, 2H), 2.40 (br d, 4H), 3.38 (br d, 2H), 3.48 (d. 2H), 6.79-7.04 (m, 6H), 7.1-7.2 (m, 4H), 7.59-7.64 (m, 2H), 8.03-8.28 (m, 2H), 10.3 (s, 1H); чистота ВЭЖХ: 97.8%; ЖХМС: 512.3 (М+1).
N-(4-(4-(4-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-18):

1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 3.31 (br s, 2H), 3.41 (s, 2H), 3.64 (br s, 2H), 6.94 (t, 2H), 7.02 (d, 2H), 7.17 (d, 2H), 7.20-7.26 (m, 2H), 7.56-7.64 (m, 2H), 8.03 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 97.62%; ЖХМС: 505 (М++1).
N-(4-(4-(4-бромбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-19):

1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 3.31 (br s, 2H), 3.41 (s, 2H), 3.64 (br s, 2H), 6.94 (d, 2H), 7.06 (t, 4H), 7.40 (d, 2H), 7.56-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ; 94.21%; ЖХМС: 567 (M+).
N-(4-(4-(3-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-20):

1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 3.31 (br s, 2H), 3.41 (s, 2H), 3.64 (br s, 2H), 7.01 (d, 2H), 7.16 (t, 3H), 7.21-7.28 (m, 5H), 7.56-7.62 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.41%; ЖХМС: 567 (М++2).
N-(4-(4-(3-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-21):

1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 3.38 (br s, 2H), 3.46 (s, 2H), 3.72 (br s, 2H), 3.82 (s, 3H), 6.79 (d, 1H), 6.82 (s, 2H), 7.10 (q, 4H), 7.21-7.29 (m, 2H), 7.59-7.66 (m, 2H), 8.01 (d, 1H), 8,28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 98.26%; ЖХМС: 539 (М++23).
N-(4-(4-(3-хлор-4-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-22):

1H NMR (400 MHz, CDCl3) δ: 3.10 (br s, 4H), 3.84 (br s, 4H), 4.19 (s, 2H), 7.16 (d, 2H), 7.21 (d, 2H), 7.28-7.34 (m, 1H), 7,44 (d, 1H), 7.60-7.68 (m, 2H), 8.10 (d, 1H), 8.36 (d, 1H), 8.41 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 96.82%; ЖХМС: 539 (M+).
N-(4-(4-(4-метокси-2-метилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-23):

1H NMR (400 MHz, CDCl3) δ: 2.38 (s, 3H), 2.80 (br s, 4H), 3.80 (s, 3H), 3.88 (br s, 4H), 4.20 (s, 2H), 6.78 (d, 2H), 7.10 (d, 2H), 7.20 (d, 2H), 7.25 (d, 2H), 7,60-7.65 (m, 2H), 8.03 (d, 1H), 8.32 (d, 1H), 8.38 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 96.98%; ЖХМС: 531 (M++1).
N-(4-(4-(2-хлор-3-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-24):

1H NMR (400 MHz, CDCl3) δ: 2.41 (brs, 4H), 3.18 (brs, 4H), 3.81 (brs,3H), 3.98 (s, 2H), 7.02 (d, 1H), 7.13 (d, 2H), 7.18-7.22 (m, 2H), 7.30 (t, 1H), 7.60-7.67 (m, 2H), 8.04 (d, 1H), 8.36 (d, 1H), 8.38 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 99.46%;
ЖХМС:551(M+).
N-(4-(4-(4-хлор-3-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-25):

1H NMR (400 MHz, CDCl3) δ:3.15 (br s, 4H), 3.84 (br s, 4H), 4.19 (s, 2H), 7.13-7.24 (m, 6H), 7.48 (t, 1H), 7.61-7.68 (m, 2H), 8.10 (d, 1H), 8.34 (d, 1H). 8.41 (d, 1H), 9.18 (d, 1H); Чистота ВЭЖХ: 99.24%; ЖХМС: 539 (M+).
N-(4-(4-(2-хлор-4-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-26):

1H NMR (400 MHz, CDCl3) δ: 2.37 (s, 4H), 3.21 (br s, 2H), 3.78 (br s, 2H), 4.39 (s, 2H), 7.18 (d, 2H), 7.21 (d, 2H), 7.61-7.65 (m, 2H), 8.05 (d, 1H), 8.36 (d, 1H), 8.41 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 99.56%; ЖХМС: 539 (M+).
N-(4-(4-(2,6-дифторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-27):

1H NMR (400 MHz, CDCl3) δ: 3.07 (br s, 4H), 3.81 (s, 4H), 4.38 (s, 2H), 7.06 (t, 2H), 7.12 (d, 2H), 7.18 (d, 2H), 7.54 (s, 1H), 7.60-7.64 (m, 2H), 8.01 (d, 1H), 8.36 (d, 1H), 8.38 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 98.26%; ЖХМС: 523 (М++1).
N-(4-(4-(2,3-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-28):
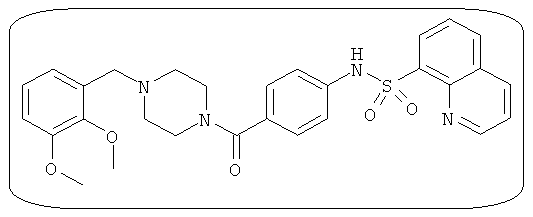
1H NMR (400 MHz, CDCl3) δ: 2.63 (br s, 4H), 3.57 (br s, 4H), 3.90 (d, 6H), 4.18 (s, 2H), 6.98 (d, 2H), 7.00 (d, 1H), 7.14-7.19 (m, 6H), 7.58-7.64 (m, 2H), 8,06 (d, 1H), 8.38 (d, 1H), 8.40 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 99.41%; ЖХМС: 547 (M++1).
N-(4-(4-(3,4-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-29):

1H NMR (400 MHz, CDCl3) δ: 2.63 (br s, 4H), 3.57 (br s, 4H), 3.90 (d, 6H), 4.18 (s, 2H), 6.83 (s, 2H), 7.00 (s, 1H), 7.14 (d, 2H), 7.21 (d, 2H), 7.62-7.68 (m, 2H), 8.04 (d, 1H), 8.38 (d, 1H), 8.40 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 92.46%; ЖХМС: 547 (M++1).
N-(4-(4-(3-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-30):

1H NMR (400 MHz, CDCl3) δ: 3.09 (br s, 4H), 3.85 (s, 4H), 4.19 (s, 2H), 6.94 (d, 2H), 7.06-7.21 (m, 6H), 7.40-7.44 (m, 1H), 7.62-7.68 (m, 2H), 8.08 (d, 1H), 8.38 (d, 1H), 8.40 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 98.92%; ЖХМС: 505 (M++1).
N-(4-(4-(2-этилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-31):

1H NMR (400 MHz, CDCl3) δ: 1.22 (t, 3H), 2.41 (br s, 4H), 2.68 (q, 2H), 3.64 (br s, 4H), 7.06 (d, 2H), 7.20 (d, 2H), 7.22-7.26 (m, 2H), 7.40 (d, 2H), 7.61-7.68 (m, 2H), 8.01 (d, 1H), 8.32 (d, 1H), 8.41 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 99.22%; ЖХМС: 515 (M++1).
N-(4-(4-(4-(трифторметил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-32):

1H NMR (400 MHz, CDCl3) δ: 3.18 (br s, 4H), 3.83 (br s, 4H), 4.25 (s, 2H), 7.06 (d, 2H). 7.22 (d, 2H), 7.56 (d, 2H), 7.60-7.78 (m, 4H), 8.07 (d, 1H), 8.36 (d, 1H), 8.40 (d, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 96.72%; ЖХМС: 555 (M++1).
N-(4-(4-(пиридин-4-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-33):
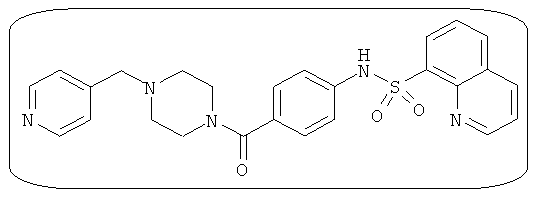
1H NMR (400 MHz, CDCl3) δ: 2.40 (br s, 4H), 3.33 (br s, 2H), 3.41 (s, 2H), 3.64 (br s, 2H), 7.06 (d, 2H), 7.18 (d, 2H), 7.26 (d, 3H), 7.58-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.79 (br s, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 97.4%; ЖХМС: 488.3 (М++7).
N-(4-(4-(пиридин-3-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-34):

1H NMR (400 MHz, CDCl3) δ: 2.40 (br s, 4H), 3.33 (br s, 2H), 3.41 (s, 2H), 3.64 (br s, 2H), 7.06 (d, 2H), 7.18 (d, 2H), 7.26 (d, 3H), 7.58-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.51-8.59 (m, 2H), 9.18 (s, 1H); чистота ВЭЖХ; 98.50%; ЖХМС: 488.0 (M++1).
N-(4-(4-(2-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-35):

1H NMR (400 MHz, CDCl3) δ: 2,42 (br d, 4H), 3.38 (br s, 2H), 3.58 (s, 2H), 3.70 (br s, 2H), 3.80 (s, 3H), 6.83-6.93 (m, 2H), 7.06 (d, 2H), 7.18 (d, 2H), 7.20-7.26 (m, 2H), 7.58-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.51-8.59 (m, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 98.9%; ЖХМС: 517.1 (M++1).
N-(4-(4-((2-хлорпиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-36):

1H NMR (400 MHz, CDCl3) δ: 2.44 (br s, 4H), 3.41 (br s, 2H), 3.60 (s, 2H), 3.74 (br s, 2H), 7.06 (d, 2H), 7.20 (d, 2H), 7.22-7.28 (m, 2H), 7.59-7.66 (m, 2H), 7.81 (d, 1H), 8.01 (d, 1H), 8.35 (d, 2H), 8.39 (d, 1H), 8.59 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 98.6%; ЖХМС: 522 (M+).
N-(4-(4-((6-хлорпиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-37):

1H NMR (400 MHz, CDCl3) δ: 2.44 (br s, 4H). 3.41 (br s, 2H), 3.54 (s, 2H), 3.74 (br s, 2H), 7.06 (d, 2H), 7.20 (d, 2H), 7.22-7.28 (m, 2H), 7.59-7.66 (m, 3H), 8.01 (d, 1H), 8.35 (d, 2H), 8.39 (d, 1H), 8.59 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.22%; ЖХМС: 522 (M+).
N-(4-(4-(2-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-38):

1H NMR (400 MHz, CDCl3) δ: 2.44 (br d, 4H), 3.41 (br s, 2H), 3.61 (s, 2H), 3.74 (br s, 2H), 7.06 (d, 2H), 7.08-7.24 (m, 4H), 7.32 (d, 1H), 7.39 (d, 1H), 7.59-7.7.65 (m, 2H), 8.01 (d, 1H), 8.35 (d, 1H), 8.39 (d. 1H), 8.58 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 94.42%; ЖХМС: 521 (М+).
N-(4-(4-(2-ацетилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-39):

1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 2.58 (s, 3Н), 3.31 (br s, 2H), 3.60 (s, 2H), 3.64 (br s, 2H), 7.03 (d, 2H), 7.15 (d, 2H), 7.30-7.41 (m, 3H), 7.43 (d, 1H), 7.59-7.64 (m, 2H), 8.01 (d, 1H), 8.30 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 96.32%; ЖХМС: 529 (M++1).
N-(4-(4-(3-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-40):

1H NMR (400 MHz, CDCl3) δ: 2.43 (br d, 4H), 3.38 (br s, 2H), 3.68 (s, 4H), 7.08 (d, 2H), 7.18 (d, 2H), 7.40 (t, 1H), 7.45-7.70 (m, 5H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 98.2%; ЖХМС: 512 (M++1).
N-(4-(4-(4-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-41):
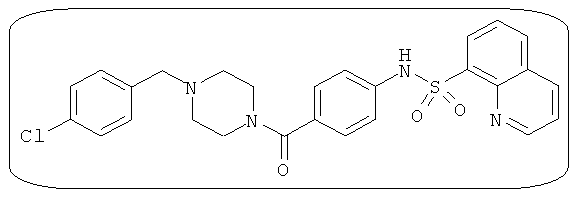
1H NMR (400 MHz, CDCl3) δ: 2.39 (br d, 4H), 3.39 (br s, 2H), 3.50 (s, 2H), 3.64 (br s, 2H), 7.06 (d, 2H), 7.17 (d, 2H), 7.40 (d, 2H), 7.44 (d, 1H), 7.56-7.63 (m, 4H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 96.9%; ЖХМС: 521 (M++1).
N-(4-(4-(2-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-42):
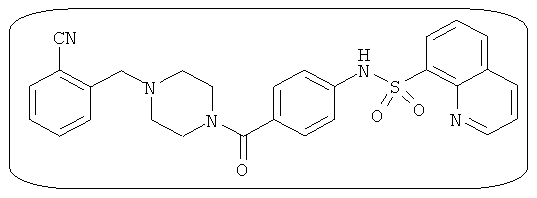
1H NMR (400 MHz, CDCl3) δ: 2.39 (br s, 4H), 3.38 (br s, 2H), 3.50(s, 2H), 3.68 (br s, 2H), 7.03 (d, 2H), 7.18 (d, 2H), 7.40 (t, 1H), 7.51-7.64 (m, 4H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 97.70%; МССЭ (масс-спектрометрия с электрораспылением): 512 (М++1).
N-(4-(4-(4-ацетилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-43):
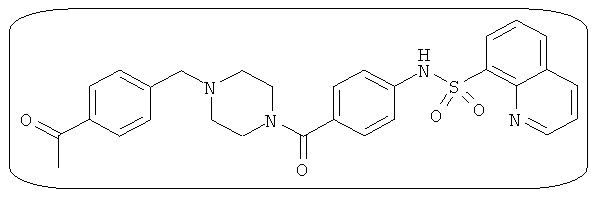
1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 2.58 (s, 3H), 3.34 (br s, 2H), 3.58 (s, 2H), 3.68 (br s, 2H), 7.03 (d, 2H), 7.15 (d, 2H), 7.40 (d, 2H), 7.43 (d, 1H), 7.59-7.64 (m, 2H), 7.91 (d, 2H), 8.01 (d, 1H), 8.30 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 92.23%; МССЭ: 529 (M++1).
N-(4-(4-(4-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-44):

1H NMR (400 MHz, CDCl3) δ: 2.39 (br s, 4H), 3.38 (br s, 2H), 3.52 (s, 2H), 3.68 (br s, 2H), 7.03 (d, 2H), 7.18 (d, 2H), 7.40 (d, 1H), 7.59-7.64 (m, 4H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 98.71%; ЖХМС: 512 (М++7).
N-(4-(4-(4-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-45):

1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 3.35 (br s, 2H), 3.46 (s, 2H), 3.64 (br s, 2H), 6.94 (t, 2H), 7.06 (t, 2H), 7.18 (d, 2H), 7.24-7.28 (m, 2H), 7.56-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 94.7%; ЖХМС: 505 (M++1).
N-(4-(4-(4-бромбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-46):

1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 3.31 (br s, 2H), 3.41 (s, 2H), 3.64 (br s, 2H), 7.06 (d, 2H), 7.18 (t, 3H), 7.40 (d, 2H), 7.56-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.7%; ЖХМС: 567 (М++2).
N-(4-(4-(3-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-47):

1H NMR (400 MHz, CDCl3) δ: 2.39 (br d, 4H), 3.39 (br s, 2H), 3.48 (s, 2H), 3.64 (br s, 2H), 7.06 (d, 2H), 7.17 (d, 2H), 7.40 (d, 2H), 7.44 (d, 1H), 7.58-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 98.98%; МССЭ: 521 (M++1).
N-(4-(4-(2,4-дихлор-5-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-49):

1H NMR (400 MHz, ДМСО-d6) δ: 2.39 (br s, 4H), 3.48 (br s, 4H), 3.70 (s, 2H), 6.98 (s, 1H), 7.01 (s, 1H), 7.10-7.20 (m, 4H), 7.70-7.79 (m, 2H), 8,28 (d, 1H), 8.43 (d, 1H), 8.55 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 95.42%; ЖХМС: 571 (M+).
N-(4-(4-(2-фтор-6-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-50):

1H NMR (400 MHz, ДМСО-d6) δ: 2.39 (s, 4H), 3.42 (br s, 4H), 3.63 (s. 3H), 6.56-6.62 (m, 2H), 7.10-7.19 (m, 4H), 7,70-7.79 (m, 2H), 8.28 (d, 1H), 8.43 (d, 1H), 8.55 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 99.89%; ЖХМС: 521 (M++1).
N-(4-(4-(2-(метилтио)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-51):

1H NMR (400 MHz, ДМСО-d6) δ: 2.35 (br s, 4H), 2.39 (s, 3H), 3.43 (s, 4H), 3.61 (s, 2H), 7.10-7.19 (m, 4H), 7.26 (s, 3H), 7.30 (q, 1H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.43 (d, 1H), 8.55 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 91.14%; ЖХМС: 533 (M++1).
N-(4-(4-(2-фтор-6-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-52):
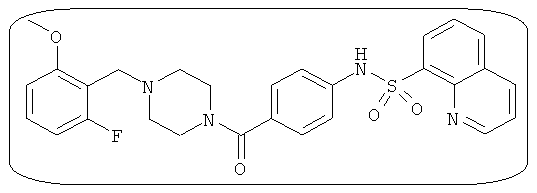
1H NMR (400 MHz, ДМСО-d6) δ: 2.32 (br s, 4H), 3.55 (s, 3H), 3.62 (br s, 4H), 3.80 (s, 2H), 6.78 (t, 1H), 6.84 (d, 1H), 7.13 (s, 4H), 7.30 (q, 1H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.43 (d, 1H), 8.55 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 98.18%; ЖХМС: 535 (M++1).
N-(4-(4-(2-(трет-бутилтио)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-53):
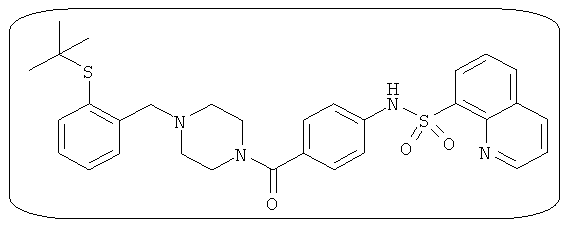
1H NMR (400 MHz, ДМСО-d6) δ: 1.24 (s, 9H), 2.37 (br s, 4H), 3.30 (br s, 4H), 3.78 (s, 2H), 7.08-7.18 (m, 4H), 7.25 (t, 1H), 7.41 (t, 1H), 7.50-7.59 (m, 2H), 7.70-7.79 (m, 2H), 8.29 (d, 1H), 8.43 (d, 1H), 8.48 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 97.92%; ЖХМС: 575 (M++1).
N-(4-(4-(3-хлор-4-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-54):

1H NMR (400 MHz, ДМСО-d6) δ: 2.29 (br s, 4H), 3.43 (s, 4H), 3.62 (s, 2H), 7.06-7.18 (m, 4H), 7.25-7.39 (m, 2H), 7.46 (d, 1H), 7.70-7.79 (m, 2H), 8.29 (d, 1H), 8.43 (d, 1H), 8.48 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 96.47%; ЖХМС: 539 (М+).
N-(4-(4-(2,6-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-55):

1H NMR (400 MHz, ДМСО-d6) δ: 2.32 (br s, 4H), 3.50 (br s, 4H), 3.76 (s, 6H), 3.81 (s, 2H), 6.60 (d, 2H), 7.10 (s, 3Н), 7.22 (t, 1H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.43 (d, 1H), 8.54 (d, 1H), 9.18 (s, 1H), 10.41 (br s, 1H); чистота ВЭЖХ: 94.09%; ЖХМС: 547 (M++1).
N-(4-(4-(3,5-дифторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-56):

1H NMR (400 MHz, ДМСО-d6) δ: 2.30 (br s, 4H), 3.45 (s, 3Н), 7.01 (d, 2H), 7.10-7.21 (m, 4H), 7.70-7.79 (m, 2H), 8.29 (d, 1H), 8.43 (d, 1H), 8.48 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 96.47%; ЖХМС: 523 (M++1).
N-(4-(4-(3-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-57):

1H NMR (400 MHz, ДМСО-d6) δ: 2.36 (br s, 4H), 3.41 (br s, 2H), 3.59 (s, 2H), 7.10-7.21 (m, 6H), 7.37-7.40 (m, 1H), 7.70-7.79 (m, 2H), 8.31 (d, 1H), 8.43 (d, 1H), 8.48 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 94.31%; ЖХМС: 505 (M++1).
N-(4-(4-(3-фтор-4-(трифторметил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-58):

1H NMR (400 MHz, ДМСО-d6) δ: 2.36 (br s, 4H), 3.42 (br s, 4H), 3.59 (s, 3H), 7.10-7.21 (m, 4H), 7.39(d, 1H), 7.42 (d, 1H), 7.70-7.79 (m, 2H), 8.32 (d, 1H), 8.43 (d, 1H), 8.48 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 96.69%; ЖХМС: 595 (М++23).
метил 4-((4-(4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-ил)метил)бензоат (VIII-59):

1H NMR (400 MHz, ДМСО-d6) δ: 2.36 (br s, 4H), 3.43 (br s, 4H), 3.59 (s, 2H), 3.83 (s, 3H), 7.10-7.21 (m, 4H), 7.46(d, 2H), 7.70-7.79 (m, 2H), 7.95 (d, 2H), 8.32 (d, 1H), 8.43 (d, 1H), 8.48 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 97.92%; ЖХМС: 545 (M++1)
N-(4-(4-(2,5-диметилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-60):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (s, 6H), 2.41 (br s, 4H), 3.41 (br s, 4H), 6.97-7.02 (m, 2H), 7.10-7.21 (m, 3H), 7.31 (s, 1H), 7.70-7.79 (m, 2H), 8.29 (d, 1H), 8.43 (d, 1H), 8.56 (d, 1H), 9.18 (s, 1H), 10.41 (br s, 1H); чистота ВЭЖХ: 99.73%; ЖХМС:515 (М++1).
N-(4-(4-(2,4-дихлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-61):

1H NMR (400 MHz, ДМСО-d6) δ 2.38 (br s, 4H), 3.41 (br s, 4H), 3.59 (s, 2H), 7.10 (q, 4H), 7.39(d, 1H), 7.43 (d, 1H), 7.59 (s, 1H), 7.70-7.79 (m, 2H), 8.29 (d, 1H), 8,43 (d, 1H), 8.56 (d, 1H), 9.18 (s, 1H), 10.41 (br s, 1H); чистота ВЭЖХ: 99.34%; ЖХМС: 555 (M+).
N-(4-(4-(4-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-62):
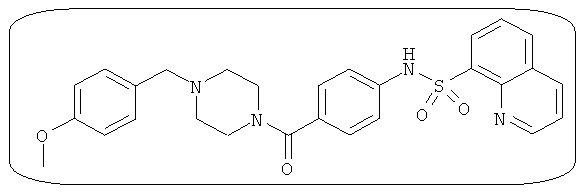
1H NMR (400 MHz, ДМСО-d6) δ: 2.32 (br s, 4H), 3.52 (br s, 4H), 3.79 (s, 2H), 6.81 (d, 2H), 7.10-7.21 (m, 5H), 7.31 (s, 1H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.43 (d, 1H), 8.56 (d, 1H), 9.18 (s, 1H), 10,41 (br s, 1H); чистота ВЭЖХ: 96.49%; ЖХМС: 539 (М++23).
N-(4-(4-(5-хлор-2-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-63):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.59 (s, 4H), 3.62 (s, 2H), 6.79 (d, 2H), 7.06-7.21 (m, 6H), 7.70-7.81 (m, 2H), 8.31 (d, 1H), 8.28 (d, 1H), 8.38 (d. 1H). 8.56 (s, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 97.02%; ЖХМС: 537 (M+).
N-(4-(4-(4-метилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-64):

1H NMR (400 MHz, ДМСО-d6) δ: 2.30 (s, 4H), 3.42 (s, 4H), 3.46 (s, 2H), 7.06-7.20 (m, 8H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.43 (d, 1H), 8.56 (d, 1H), 9.18 (s, 1H), 10.41 (br s, 1H); чистота ВЭЖХ: 98.59%; ЖХМС: 501 (M++1).
N-(4-(4-(3-хлор-4-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-65):

1H NMR (400 MHz, ДМСО-d6) δ: 2.30 (br s, 4H), 3.45 (br s, 6H), 3.81 (s, 3H), 7.04-7.21 (m, 6H), 7.31(s, 1H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.43 (d, 1H), 8.56 (d, 1H), 9.18 (s, 1H), 10.41 (brs, 1H); чистота ВЭЖХ: 99.70%; ЖХМС; 551 (M+).
2-метокси-4-((4-(4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-ил)метил)фенил ацетат (VIII-66):

1Н NMR (400 MHz, ДМСО-d6) δ: 2.22 (s, 3H), 2.38 (br s, 4H), 3.31 (br s, 2H), 3.51 (s, 4H), 3.80 (s, 3H), 6.89 (d, 1H), 7.04 (d, 2H), 7.10-7.23 (m, 4H), 7.71-7.79 (m, 2H), 8.31 (d, 1H), 8.45 (d, 1H), 8,56 (d, 1H), 9.18 (d, 1H), 10,42 (s, 1H); чистота ВЭЖХ: 91.90%; ЖХМС: 575 (М++1).
N-(4-(4-(4-цианобензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-67):

1H NMR (400 MHz, ДМСО-d6) δ: 2.23 (br s, 4H), 3.41 (br s, 2H), 3.54 (s, 2H), 7.06 (q, 4H), 7.22 (s, 2H), 7.62-7.76 (m, 4H), 8.22 (d, 1H), 8.38 (d, 1H), 8.44 (d, 1H), 9.08 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.87%; MS: 512 (M++1).
N-(4-(4-(3,5-дихлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-68):
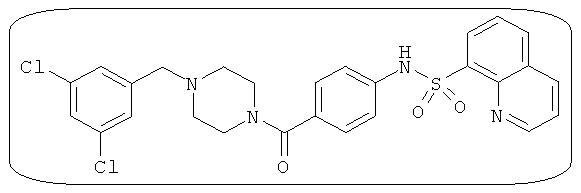
1H NMR (400 MHz, ДМСО-d6) δ: 2.24 (br s, 4H), 3.41 (br s, 4H), 3.44 (s, 2H), 7.08 (q, 3H), 7.30 (2H), 7.41 (s, 1H), 7.60-7.66 (m, 2H), 8.21 (d, 1H), 8.38 (d, 1H), 8.44 (d, 1H), 9.08 (s, 1H), 10.38 (s, 1H); чистота ВЭЖХ: 99.83%; ЖХМС: 555 (M+).
N-(4-(4-(2,5-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-69):

1H NMR (400 MHz, ДМСО-d6) δ: 2.23 (br s, 4H), 3.40 (s, 4H), 3.61 (d, 6H), 3.72 (s, 2H), 6.82 (d, 3H), 7.02-7.10 (m, 4H), 7.60-7.68 (m, 2H), 8.22 (d, 1H), 8.38 (d, 1H), 8.44 (d, 1H), 9.08 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 98.63%; ЖХМС: 547 (M++1).
N-(4-(4-(2-гидрокси-6-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-70):
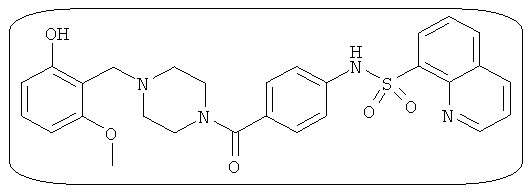
1H NMR (400 MHz, ДМСО-d6) δ: 2.36 (br s, 4H), 3.54 (s, 4H), 3.61 (s, 2H), 3,64 (s, 3H), 6.36 (d, 1H), 7.00-7.10 (m, 5H), 7.60-7.68 (m, 2H), 8.20 (d, 1H), 8.38 (d, 1H), 8.44 (d, 1H), 9.08 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 98.03%; ЖХМС: 533 (M++1).
N-(4-(4-(5-хлор-2-гидрокси-4-метилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-71):

1H NMR (400 MHz, ДМСО-d6) δ: 2.18 (s, 3H), 2.30 (br s, 4H), 3.41 (s, 4H), 3.46 (s, 2H), 6.68 (s, 1H), 7.10-7,19 (m, 4H), 7.65-7.78 (m, 2H), 8.24 (d, 1H), 8.41 (d, 1H), 8.51 (d, 1H), 9.12 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ; 96.25%; ЖХМС: 551 (M+).
N-(4-(4-(4-(гекс-1-инил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-72):

1H NMR (400 MHz, ДМСО-d6) δ: 0.93 (t, 3H), 1.38-1.41 (m, 4H), 2.22 (br s, 6H), 2.38 (t, 2H), 2.80 (s, 3H), 3.44 (s, 2H), 6.22 (d, 1H), 7.00-7.12 (m, 4H), 7.22 (dd, 2H), 7.62-7.70 (m, 2H), 8.24 (d, 1H), 8.38 (d, 1H), 8.44 (d, 1H), 9.08 (s, 1H), 9.60 (br s, 1H), 10.36 (s, 1H); чистота ВЭЖХ: 99.84%; ЖХМС: 567 (M++1).
N-(4-(4-(2-этилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-73):

1H NMR (400 MHz, ДМСО-d6) δ: 1.12 (t, 3H), 2.23 (br s, 4H), 2.62 (q, 2H), 3.40 (s, 2H), 3.43 (br s, 4H), 7.04-7.20 (m, 5H), 7.65-7.70 (m, 2H), 8.25 (d, 1H), 8.41 (d, 1H), 8.50 (d, 1H), 9.10 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 98.83%; ЖХМС: 515 (M++1).
N-(4-(4-(4-(диметилатшо)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-74):
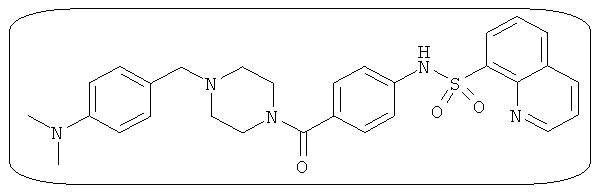
1H NMR (400 MHz, ДМСО-d6) δ: 2.21 (br s, 4H), 2.81 (s, 6H), 3,41 (br s, 6H), 6.61 (d, 2H), 7.01-7.11 (m, 6H), 7.48 (d, 2H), 7.63-7.70 (m, 2H), 8.22 (d, 1H), 8.38 (d, 1H), 8.45 (d, 1H), 9.08 (s, 1H), 10.40 (br s, 1H); чистота ВЭЖХ: 96.86%; ЖХМС: 552 (M++23).
N-(4-(4-(2-гидрокси-3-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-75):

1H NMR (400 MHz, ДМСО-d6) δ: 2.30 (br s, 4H), 3.41 (br s, 4H), 3.54 (s, 2H), 3.75 (s, 3Н), 6.66 (s, 2H), 6.80 (d, 1H), 7.20 (q, 4H), 7.48 (d, 2H), 7.62-7.70 (m, 2H), 8.24 (d, 1H), 8.38 (d, 1H), 8.48 (d, 1H), 9.10 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.76%; ЖХМС: 555 (M++23).
N-(4-(4-(3,4-дихлорбензил)пиперазин4-карбонил)фенил)хинолин-8-сульфонамид (VIII-76):

1H NMR (400 MHz, ДМСО-d6) δ: 2.24 (br s, 4H), 3.41 (s, 4H), 3,45 (s, 2H), 7.05 (q, 4H), 7.24 (d, 1H), 7.52-7.58 (m, 2H), 7.66-7.74 (m, 4H), 8.24 (d, 1H), 8.38 (d, 1H), 8.48 (d, 1H), 9.10 (s, 1H), 10.40 (br s, 1H); чистота ВЭЖХ: 97.35%; ЖХМС: 555 (M+).
N-(4-(4-(3-(2-гидроксиэтокси)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-77):

1H NMR (400 MHz, ДМСО-d6) δ: 2.23 (br s, 4H), 3.40 (s, 4H), 3.69 (q, 2H), 3.98 (t, 2H), 4.78 (s, 2H), 6.79-7.01 (m, 3H), 7.12 (q, 4H), 7.18 (t, 1H), 7.62-7.70 (m, 2H), 8.26 (d, 1H), 8.38 (d, 1H), 8.46 (s, 1H), 9.10 (s, 1H), 10.38 (s, 1H); чистота ВЭЖХ: 97.11%; ЖХМС: 547(M++1).
N-(4-(4-(4-(трифторметил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-78):

1H NMR (400 MHz, ДМСО-d6) δ: 2.24 (br s, 4H), 3.46 (br s, 4H), 3.55 (s, 2H), 7.08 (q, 4H), 7.48 (d, 2H), 7.60-7.70 (m, 4H), 8.24 (d, 1H), 8.38 (d, 1H), 8.48 (d, 1H), 9.10 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.28%; ЖХМС: 555 (М++1).
N-(4-(4-(2,4,5-триметилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-79):
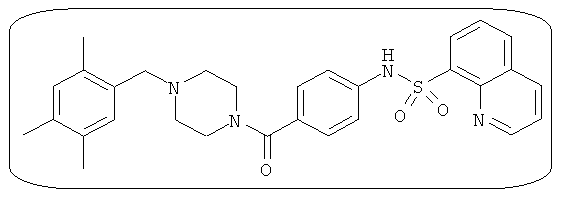
1H NMR (400 MHz, ДМСО-d6) δ: 2.12 (s, 6H), 2.20 (s, 3H), 2.23 (br s, 4H), 3.41 (br s, 4H), 3.46 (s, 2H), 6.88 (d, 2H), 7.08 (q, 4H), 7.62-7.70 (m, 2H), 8.28 (d, 1H), 8.40 (d, 1H), 8.48 (d, 1H), 9.10 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.58%; ЖХМС: 529 (M++1).
N-(4-(4-(4-(пентилокси)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-80):

1H NMR (400 MHz, ДМСО-d6) δ: 0.85 (t, 3H), 1.25-1.39 (m, 4H), 1.65 (pentet, 2H), 2.22 (br s, 4H), 3.38 (s, 4H), 3.41 (s, 2H), 3.90 (t, 2H), 6.80 (d, 2H), 7.08-7.14 (m, 6H), 7.68-7.75 (m, 2H), 8.28 (d, 1H), 8.40 (d, 1H), 8.50 (s, 1H), 9.10 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.80%; ЖХМС: 573 (M++1).
N-(4-(4-(2-метилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-81):

1H NMR (400 MHz, ДМСО-d6) δ: 2.24 (s, 3H), 2.36 (br s, 4H), 3.38 (s, 4H), 3.40 (s, 2H), 7.05-7.20 (m, 6H), 7.65-7.74 (m, 2H), 8.26 (d, 1H), 8.39 (d, 1H), 8.46 (s, 1H), 9.10 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 98.75%; ЖХМС: 501 (M++1).
N-(4-(4-(4-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-82):

1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 3.31 (br s, 2H), 3.41 (s, 2H), 3.64 (br s, 2H), 6.94 (d, 2H), 7.06 (t, 4H). 7.40 (d, 2H), 7.56-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (m, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 97.61%; ЖХМС: 522.0 (M+).
N-(4-(4-(3-пропоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-83):

1H NMR (400 MHz, ДМСО-d6) δ: 0.97 (t, 3H), 1.70 (q, 2H), 2.32 (s, 4H), 3.41 (br s, 4H), 3.90 (t, 2H), 4.22 (br s, 2H), 6.99 (d, 2H), 7.17 (dd, 4H), 7.36 (t, 1H), 7.68-7.74 (m, 2H), 8.28 (d, 1H), 8.39 (d, 1H), 8.50 (d, 1H), 9.16 (s, 1H), 10.50 (s, 1H); чистота ВЭЖХ: 99.57%; ЖХМС: 545 (M++1).
N-(4-(4-(2-пропоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-84):

1H NMR (400 MHz, ДМСО-d6) δ: 0.97 (t, 3H), 1.70 (q, 2H), 2.36 (br s, 4H), 3.42 (br s, 4H), 3.90 (t, 2H), 4.22 (br s, 2H), 6.99 (d, 2H), 7.17 (dd, 4H), 7.40 (br s, 1H), 7.68-7.74 (m, 2H), 8.28 (d, 1H), 8.39 (d, 1H), 8.50 (d, 1H), 9.16 (s, 1H), 10.50 (s, 1H); чистота ВЭЖХ: 99.12%; ЖХМС: 545 (M++1).
N-(4-(4-(2-изопропоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-85):
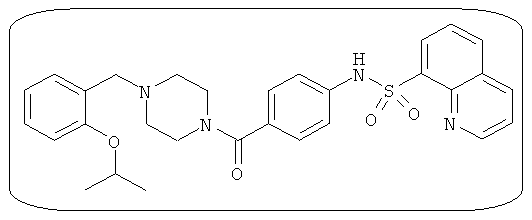
1H NMR (400 MHz, ДМСО-d6) δ: 1.37 (d, 6H), 3.12 (br s, 3H), 4,25 (br s, 2H), 4.71-4.75 (m, 1H), 7.01 (t, 2H), 7.17 (d, 2H), 7.22 (d, 2H), 7.42 (br s, 2H), 7.70-7.79 (m, 2H), 8.30 (d, 1H), 8.42 (d, 1H), 8.51 (d, 1H), 9.14 (s, 1H), 9.50 (br s, 1H), 10.55 (s, 1H); чистота ВЭЖХ: 99.17%; ЖХМС: 545 (M++1).
N-(4-(4-(3-изопропоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-86):

1H NMR (400 MHz, ДМСО-d6) δ: 1.29 (d, 6H), 2.36 (br s, 4H), 3.02 (br s, 4H), 4.25 (s, 2H), 4.62 (sextet, 1H), 6.99-7.09 (m, 3H), 7.20 (dd, 4H), 7.39 (t, 1H), 7.70-7.79 (m, 2H), 8.30 (d, 1H), 8.42 (d, 1H), 8.51 (d, 1H), 9.14 (s, 1H), 9.79 (br s, 1H), 10.57 (s, 1H); чистота ВЭЖХ: 99.11%; ЖХМС: 545 (M++1).
N-(4-(4-(3-бутоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-87):

1H NMR (400 MHz, ДМСО-d6) δ: 0.90 (t, 3H), 1.21 (sextet, 2H), 1.64 (pentet, 2H), 2.31 (br s, 4H), 3.36 (br s, 4H), 3.92 (t, 2H), 4.23 (s, 2H), 6.93-7.01 (m, 2H), 7.17 (q, 4H), 7.31 (s, 2H), 7.63-7.74 (m, 2H), 8.28 (d, 1H), 8.40 (d, 1H), 8.51 (d, 1H), 9.10 (s, 1H), 9.50 (br s, 1H), 10.55 (s, 1H); чистота ВЭЖХ: 99.06%; ЖХМС: 559 (М++1).
N-(4-(4-(2-изопропилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-88):

1H NMR (400 MHz, ДМСО-d6) δ: 1.17 (d, 6H), 3.10 (br s, 4H), 3.21 (br s, 4H), 4.35 (s, 2H), 4.62 (sextate, 1H), 7.18 (dd, 4H), 7.17 (d, 2H), 7.21 (br s, 1H), 7.20 (s, 2H), 7.68-7.74 (m, 2H), 8.28 (d, 1H), 8.40 (d, 1H), 8.51 (d, 1H), 9.14 (s, 1H), 9.50 (brs, 1H), 10.55 (s, 1H); чистота ВЭЖХ: 99.16%; ЖХМС: 529 (M++1).
N-(4-(4-(4-изобутоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-89):

1H NMR (400 MHz, ДМСО-d6) δ: 0.96 (d, 6H), 2.00 (septet, 1H), 2.99 (br s, 2H), 3.18 (br s, 2H), 3.22 (br s, 2H), 3.70 (d, 2H), 4.20 (s, 2H), 6.99 (d, 2H), 7.18 (dd, 4H), 7.35 (d, 2H), 7.65-7.73 (m, 2H), 8.28 (d, 1H), 8.40 (d, 1H), 8.51 (d, 1H), 9.10 (s, 1H), 9.50 (br s, 1H), 10.55 (s, 1H); чистота ВЭЖХ: 99.06%; ЖХМС: 559 (M++1).
N-(4-(4-(2-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-90):

1H NMR (400 MHz, ДМСО-d6) δ: 1.21 (d, 3H), 2.99 (br s, 3H), 3.21 (br s, 2H), 7.17 (d, 4H), 7.21-7.35 (m, 4H), 7.63-7.74 (m, 2H), 8.28 (d, 1H), 8.40 (d, 1H), 8.51 (d, 1H), 9.10 (s, 1H), 9.24 (brs, 1H), 10.55 (s, 1H); чистота ВЭЖХ: 99.88%; ЖХМС: 515 (M++1).
N-(4-(4-(4-метокси-3-метилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-91):

1H NMR (400 MHz, ДМСО-d6) δ: 2.19 (s, 3H), 3.02 (br s, 2H), 3.20 (br s, 2H), 3.30 (br s, 4H), 3.80 (s, 3H), 4.21 (s, 2H), 7.01 (d, 1H), 7.16-7.29 (m, 4H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.44 (d, 1H), 8.57 (d, 1H), 9.14 (s, 1H), 9.78 (br s, 1H), 10.55 (s, 1H); чистота ВЭЖХ: 99.86%; ЖХМС: 531 (M++1).
N-(4-(4-(4-изопропилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-92):

1H NMR (400 MHz, ДМСО-d6) δ: 1.20 (d, 6H), 2.31 (br s, 4H), 2,95 (pentet, 1H), 3.42 (br s, 4H), 4.22 (br s, 2H), 7.20 (dd, 4H), 7.39 (q, 4H), 7,70-7.78 (m, 2H), 8.28 (d, 1H), 8.46 (d, 1H), 8.53 (d, 1H), 9.14 (s, 1H), 9.60 (br s, 1H), 10.58 (s, 1H); чистота ВЭЖХ: 97.92%; ЖХМС: 529 (M++1).
N-(4-(4-(2,6-дифторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид соединение (VIII-93):

1H NMR (400 MHz, ДМСО-d6) δ: 2.31 (br s, 4H), 3.44 (br s, 4H), 3.61 (s, 2H), 7.02-7.26 (m. 5H), 7.56 (br s, 1H), 7.70-7.78 (m, 2H), 8.28 (d, 1H), 8.43 (d, 1H), 8.50 (d, 1H), 9.14 (s, 1H), 10.42 (s, 1H); чистота ВЭЖХ: 99.64%; ЖХМС: 523 (M++1).
N-(4-(4-(4-бутилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-94):

1H NMR (400 MHz, ДМСО-d6) δ: 0.85 (t, 3H), 1.25 (sextet, 2H), 1.32 (pentet, 2H), 2.59 (t, 2H). 3.01 (br s, 4H), 3.12 (br s, 2H), 3.22 (br s, 2H), 4.21 (s, (2H), 7.11 (d, 2H), 7.21 (d, 2H), 7.25 (d, 2H), 7.30 (d, 2H), 7.63-7.71 (m, 2H), 8.28 (d, 1H), 8.40 (d, 1H), 8.51 (d, 1H), 9.10 (s, 1H), 9.78 (br s, 1H), 10.50 (s, 1H); чистота ВЭЖХ: 99.98%; ЖХМС: 543 (M++1).
N-(4-(4-(2,6-диметилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-95):

1H NMR (400 MHz, ДМСО-d6) δ: 2.25 (s, 6H), 2.41 (br s, 4H), 3.02 (br s, 2H), 3.20 (br s, 2H), 4.21 (br s, 2H), 7.05 (d, 3H), 7.17 (d, 2H), 7.24 (d, 2H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.44 (d, 1H), 8.57 (d, 1H), 9.14 (s, 1H), 9.78 (br s, 1H), 10.55 (s, 1H); чистота ВЭЖХ: 98.76%; ЖХМС: 515 (М++1).
N-(4-(4-(3,5-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-96):
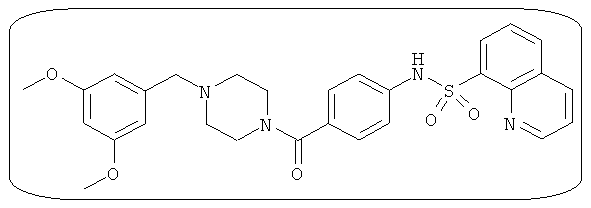
1H NMR (400 MHz, ДМСО-d6) δ: 2.32 (br s, 4H), 3.44 (br s, 4H), 3.72 (d, 6H), 4.19 (s, 2H), 6.59 (d, 1H), 7.18 (dd, 4H), 7.69-7.75 (m, 2H), 8.28 (d, 1H), 8.42 (d, 1H), 8.50 (d, 1H), 9.14 (s, 1H), 9.78 (br s, 1H), 10.51 (s, 1H); Чистота ВЭЖХ: 93.00%; ЖХМС: 547 (M++1).
N-(4-(4-(4-хлор-2-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-97):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.46 (br s, 4H), 3.77 (s, 3H), 4.40 (s, 2H), 7.22 (q, 4H), 7.34-7.44 (m, 2H), 7.55 (t, 1H), 7.63-7.70 (m, 2H), 8.20 (d, 1H), 8.42 (d, 2H), 9.14 (s, 1H); чистота ВЭЖХ: 98.85%; ЖХМС: 539 (M+).
N-(4-(4-(4-этоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-98):

1H NMR (400 MHz, ДМСО-d6) δ: 1.23 (t, 2H), 4.00 (q, 2H), 4.20 (s, 2H), 6.97 (d, 2H), 7.17 (dd, 4H), 7.36 (d, 1H), 7.69-7.75 (m, 2H), 8.28 (d, 1H), 8.41 (d, 1H), 8.51 (d, 1H), 9.10 (s, 1H), 9.50 (br s, 1H), 10.50 (s, 1H); чистота ВЭЖХ: 96.83%; ЖХМС: 531 (M++1).
N-(4-(4-(4-хлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-99):
1H NMR (400 MHz, CD3OD) δ: 2.34 (br s, 4H), 3.23 (br s, 2H), 3.62 (br s, 2H), 4.30 (s, 2H), 7.16-7.20 (m, 4H), 7.37-7.57 (m, 4H), 7.79-7.84 (m, 2H), 8.15 (d, 1H), 8.40 (d, 1H), 9.10 (s, 1H), 9.50 (br s, 1H); чистота ВЭЖХ: 99.75%; ЖХМС: 521 (M+).
N-(4-(4-(2,3-дихлорбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-100):

1H NMR (400 MHz, CD3OD) δ: 2.32 (br s, 4H), 3.62 (br s, 4H), 3.81 (s, 2H), 7.21 (q, 4H), 7.42 (t, 2H), 7.58 (d, 2H), 7.61-7.72 (m, 2H), 8.18 (d, 1H), 8.41 (d, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.15%; ЖХМС: 555 (М++1).
N-(4-(4-(2-гидрокси-5-метилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-101):

1H NMR (400 MHz, CD3OD-d6) δ: 2.08 (s, 3H), 2.22 (s, 4H), 3.32 (s, 4H), 3.72 (s, 2H), 4.21 (s, 1H), 6.80 (d, 1H), 7.10 (s, 2H), 7.18-7.25 (m, 3H), 7.61-7.68 (m, 2H), 8.18 (d, 1H), 8.40 (d, 2H), 9.14 (s, 1H); чистота ВЭЖХ: 98.02%; ЖХМС: 517 (М++1).
N-(4-(4-(5-фтор-2-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-102):
1H NMR (400 MHz, ДMCOd6) δ: 2.30 (br s, 4H), 3.31 (br s, 4H), 3.72 (s, 2H), 6.90-6.95 (m, 3H), 7.04-7.18 (m, 2H), 7.20-7.25 (m, 3H), 7.60-7.65 (m, 2H), 8.41 (d, 2H), 9.10 (s, 1H); чистота ВЭЖХ: 98.95%; ЖХМС: 521 (М++).
N-(4-(4-(2,4-дифторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (103):

1H NMR (400 MHz, ДМСОd6) δ: 2.36 (br s, 4H), 3.3 (br s, 4H), 3.7 (s, 2H), 7.05-7.22 (m, 5H), 7.55 (d, 2H), 7.60-7.65 (m, 2H), 8.18 (d, 1H), 8.40 (d, 2H), 9.10 (s, 1H); чистота ВЭЖХ: 99.24%; ЖХМС: 523.1 (М++1).
N-(4-(4-(3,5-дихлор-2-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-104):

1H NMR (400 MHz, ДMCOd6) δ: 2.37 (br s, 4H), 3.32 (br s, 4H), 3.71 (s, 2H), 4.2 (s, 1H), 7.19-7.23 (m, 4H), 7.39 (s, 1H), 7.56 (s, 1H), 7.62-7.68 (m, 2H), 8.18 (d, 2H), 8.40 (d, 1H), 9.13 (s, 1H); чистота ВЭЖХ: 99.95%; ЖХМС: 572.3 (M++1).
N-(4-(4-(2,3-дигидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-105):

1H NMR (400 MHz, ДМСО-d6) δ: 2.30 (br s, 4H), 3.32 (br s, 4H), 3.76 (s, 2H), 4.2 (br s, 2H), 7.19-7.23 (m, 4H), 7.39 (s, 1H), 7.56 (s, 1H), 7.62-7.68 (m, 3H), 8.18 (d, 2H), 8.40 (d, 1H), 9.13 (s, 1H); чистота ВЭЖХ: 91.9%; ЖХМС: 519.1 (М++1).
N-(4-(4-(3-гидрокси-4-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-106):

1H NMR (400 MHz, ДМСОd6) δ: 3.19 (br s, 4H), 3.3-3.6 (m, 4H), 3.7 (s, 2H), 3.81 (s, 3Н), 6.85 (d, 2H), 6.97 (d, 1H), 7.18-7.24 (m, 5H), 7,60-7.66 (m, 2H), 8.18 (d, 1H), 8.41 (d, 1H), 9.13 (s, 1H); чистота ВЭЖХ: 97.5%; ЖХМС: 533.1 (M++1).
N-(4-(4-(2-(дифторметокси)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-107):

1H NMR (400 MHz, ДМСOd6) δ: 2.7 (s, 1H), 3.19 (br s, 4H), 3,3-3.6 (m, 4H), 3.7 (s, 2H), 6.97-7.0 (m, 4H), 7.18-7.24 (m, 5H), 7.60-7.66 (m, 2H), 8.18 (d, 1H), 8.41 (d, 1H), 9.13 (s, 1H); чистота ВЭЖХ: 99.4%; ЖХМС: 553.1 (M++1).
N-(4-(4-(2-этоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-108):

1H NMR (400 MHz, ДМСOd6) δ: 1.89 (t, 3Н), 3.19 (br s, 4H), 3.3-3.6 (m, 4H), 3.7 (s, 2H), 3.91 (q, 2H), 6.97-7.0 (m, 4H), 7.18-7.24 (m, 5H), 7.60-7.66 (m, 2H), 8.18 (d, 1H), 8.41 (d, 1H), 9.13 (s, 1H); чистота ВЭЖХ: 96.2%; ЖХМС: 553.1 (М++1).
N-(4-(4-(4-гидрокси-3,5-диметилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-109):

1H NMR (400 MHz, ДМСОd6) δ: 2.2 (s, 6H), 3.19 (br s, 4H), 3.3-3.6 (m, 4H), 3.7 (s, 2H), 6.97-7.0 (m, 4H), 7.18-7.24 (m, 3H), 7.60-7.66 (m, 2H), 8.18 (d, 1H), 8.41 (d, 1H), 9.13 (s, 1H); чистота ВЭЖХ: 98.4%; ЖХМС: 531.1 (М++1).
N-(4-(4-(3-этокси-4-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-110):

1H NMR (400 MHz, CDCl3) δ: 1.41 (t, 3H), 2.42 (br s, 4H), 3.25-3.95 (m, 4H), 3.42 (q, 2H), 3.60 (br s, 2H), 4.21 (s, 1H), 6.75 (s, 2H), 6.90 (s, 1H), 7.19 (s, 4H), 7.62-7.67 (m, 2H), 8.18 (d, 1H), 8.40 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 99.29%; ЖХМС: 546.1 (М++1).
N-(4-(4-(4-(терт-бутил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-111):

1H NMR (400 MHz, CD3OD) δ: 1.30 (s, 9H), 2.56 (br s, 4H), 3.30 (br s, 4H), 3.68 (s, 2H), 7.20 (dd, 4H), 7.45 (dd, 4H), 7.70-7.80 (m, 2H), 8.45 (d, 2H), 8.55 (d, 1H), 9.18 (s, 1H), 10.54 (s, 1H); чистота ВЭЖХ: 98.47%; ЖХМС: 543.0 (М++1).
N-(4-(4-(5-фтор-2-(трифторметил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-112):
1H NMR (400 MHz, CDCl3) δ: 2.45 (br s, 4H), 3.2-3.6 (m, 4H), 3.70 (s, 2H), 7.20 (s, 4H), 7.59-7.74 (m, 4H), 8.18 (d, 2H), 8.40 (m, 2H), 9.16 (s, 1H); чистота ВЭЖХ: 99.35%; ЖХМС: 573.1 (M++1).
N-(4-(4-(4-хлор-2-фтор-5-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-113):

1H NMR (400 MHz, CD3OD) δ: 2.91 (br s, 4H), 3.77 (br s, 4H), 3.92 (s, 2H), 4.01 (s, 3Н), 7.20-7.25 (m, 4H), 7.40 (d, 1H), 7.62-7.68 (m, 3Н), 8.18 (d, 1H), 8.41 (d, 2H), 9.13 (s, 1H); чистота ВЭЖХ: 99.42%; ЖХМС: 569 (M++1).
N-(4-((4-(4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-ил)метил)фенил)ацетамид (VIII-114):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 3.01 (br s, 4H), 3.20 (br s, 2H), 3.30 (br s, 2H), 4.24 (s, 2H), 7.20 (dd, 4H), 7.40 (d, 2H), 7.65 (d, 2H), 7.70-7.80 (m, 2H). 8.30 (d, 1H), 8.45 (d, 1H), 8.52 (d, 1H), 9.18 (s, 1H), 10.60 (s, 1H); чистота ВЭЖХ: 95.84%; ЖХМС: 544.1 (М++1).
N-(4-(4-(2-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-115):
1H NMR (400 MHz, CD3OD-d6) δ: 3.01 (br s, 4H), 3.20 (br s, 2H), 3.30 (br s, 2H), 3.82 (s, 2H), 7.02-7.20 (m, 5H), 7.24-7.41 (m, 2H), 7.61-7.67 (m, 2H), 8.18 (d, 1H), 8.41 (t, 2H), 9.12 (s, 1H); чистота ВЭЖХ: 99.03%; ЖХМС: 505 (M++1).
N-(4-(4-(2,3-дифторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-116):

1H NMR (400 MHz, CD3OD-d6) δ: 3.01 (br s, 4H), 3.20 (br s, 2H), 3.30 (br s, 2H), 4.24 (s, 2H), 7.16-7.34 (m, 6H). 7.39-7.47 (m, 2H), 7.61-7.67 (m, 2H), 8.18 (d, 1H), 8.41 (d, 1H), 9.12 (s, 1H); чистота ВЭЖХ; 97.11%; ЖХМС: 523.2 (M++1).
N-(4-(4-(2-гидрокси-4,6-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-117):

1H NMR (400 MHz, CDCl3) δ: 3.15 (br s, 2H), 3.2-3.6 (br s, 6H), 3.39 (br s, 2H), 3.78 (s, 3H), 3.81 (s, 3H), 6.17 (d, 2H), 7.22 (q, 4H), 7.62-7.68 (m, 2H), 8,18 (d, 1H), 8.41 (d. 1H), 9.17 (s, 1H); чистота ВЭЖХ: 97,92%; ЖХМС: 563 (M+).
N-(4-(4-(3,5-дихлор-4-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-118):

1H NMR (400 MHz, ДМСО-d6) δ: 3.04 (br s, 2H), 3.30 (br s, 4H), 4.12 (s, 4H), 4.2 (s, 1H), 7.21 (dd, 4H), 7.27 (s, 1H), 7,50 (s, 2H), 7.69-7.78 (m, 2H), 8.30 (d, 1H), 8.50 (d, 2H), 10.59 (s, 1H); ЧИСТОТА ВЭЖХ: 93.26%; ЖХМС: 571.3 (M+).
N-(4-(4-(2,6-диметилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-119):

1H NMR (400 MHz, ДМСО-d6) δ: 2.44 (s, 6H), 3.34 (s, 6H), 3.39 (br s, 2H), 4.45 (s, 2H), 7.19-7.30 (m, 6H), 7.63-7.70 (m, 3H), 8.20 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 98.10%; ЖХМС: 515 (М++1).
N-(4-(4-(3,4-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-120):

1H NMR (400 MHz, CD3OD) δ: 3.4-3.6 (br s, 2H), 3.85 (d, 6H), 4.1 (s, 6H), 4.29 (s, 2H), 7.02 (d, 3H), 7.21-7.27 (m, 4H), 7.63-7.72 (m, 2H), 8.20 (d, 1H), 8.42 (d, 1H), 9.14 (s, 1H); чистота ВЭЖХ: 99.44%; ЖХМС: 547 (М++1).
N-(4-(4-(3-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-121):
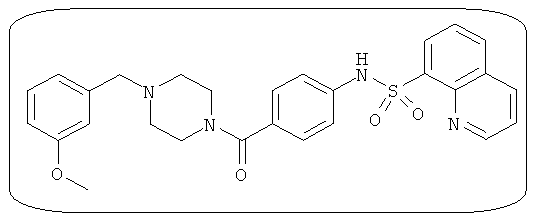
1H NMR (400 MHz, CD3OD) δ: 2.81 (br s, 4H), 3.20 (br s, 4H), 3.78 (s, 3H), 4.25 (s, 2H), 7.01 (t, 2H), 7.20 (t. 3H), 7.39 (t, 1H), 7.61-7.67 (m, 2H), 8.18 (d, 1H), 8.41 (d, 2H), 9.14 (s, 1H); чистота ВЭЖХ: 97.82%; ЖХМС: 517 (M++1).
N-(4-(4-(4-пропоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-122):

1H NMR (400 MHz, CD3OD) δ: 1.01 (t, 3H), 1.78 (sextet, 2H), 3.2-3.85 (br s, 4H), 3.9-4.0 (br s, 4H), 3.92 (t, 2H), 4.22 (s, 2H), 6.97 (d, 2H), 7.21 (q, 4H), 7.38 (d, 2H), 7.61-7.67 (m, 2H), 8.18 (d, 1H), 8.40 (d, 2H), 9.10 (s, 1H); чистота ВЭЖХ: 98.67%; ЖХМС: 545 (M++1).
N-(4-(4-фенэтилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-123):

1H NMR (400 MHz,,ДМСО-d6) δ: 2.01 (t, 2H), 2.20 (t, 2H), 2.8 (br s, 2H), 3.2-3.89 (m, 6H), 7.04-7.32 (m, 4H), 7.59-7.63 (m, 6H), 8.01 (d, 1H), 8.25 (dd, 2H), 8.41 (d, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.43%; ЖХМС: 501 (М++1).
N-(4-(4-(2,3,4-триметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-124):
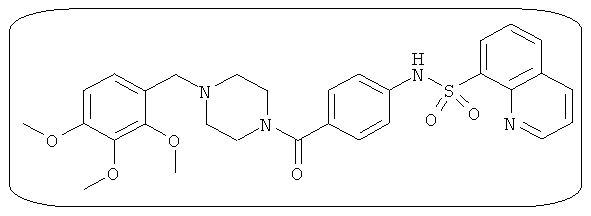
1H NMR (400 MHz, ДМСО-d6) δ: 3.01 (br s, 2H), 3.32-3.71 (m, 6H), 3.78 (s, 3H), 3.84 (s, 3H), 3.86 (s, 3H), 4.22 (br s, 2H), 6.89 (d, 1H), 7.18 (d, 3H), 7.25 (d, 2H), 7.72-7.80 (m, 2H), 8.30 (d, 1H), 8.45 (d, 1H), 8.55 (d, 1H), 9.18 (d, 1H), 10.59 (s, 1H); чистота ВЭЖХ: 99.84%; ЖХМС: 577 (M++1).
N-(4-(4-(4-гидрокси-3,5-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-125):
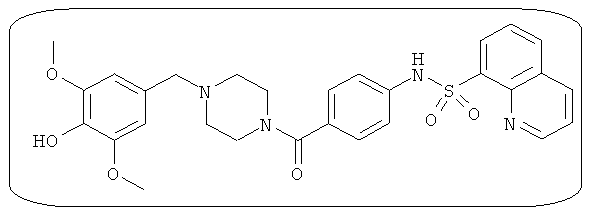
1H NMR (400 MHz, ДМСО-d6) δ: 3.01 (br s, 2H), 3.21 (br s, 2H), 3,3-3.7 (m, 6H), 3.79 (s, 6H), 6.75 (s, 2H), 7.20 (dd, 4H), 7.70-7.80 (m, 2H), 8.31 (d, 1H), 8.46 (d, 2H), 8.55 (d, 1H), 10.59 (s, 1H); чистота ВЭЖХ: 99.21%; ЖХМС: 563 (М++1).
N-(4-(4-(2-гидрокси-3,4-диметокси-6-метилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-126):
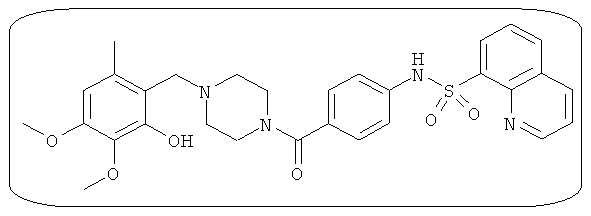
1H NMR (400 MHz, ДМСО-d6) δ: 2.11 (s, 3H), 3.18 (br s, 4H), 3.30 (br s, 4H), 3.66 (s, 3H), 3.75 (s, 3H), 4.18 (s, 2H), 6.48 (s, 1H), 7.20 (dd, 4H), 7.70-7.80 (m, 2H), 8.31 (d, 1H), 8.44 (d, 2H), 8.52 (d, 1H), 8.78 (br s, 1H), 9.10 (br s, 1H), 9.19 (s, 1H), 9.60 (br s, 1H), 10.53 (s, 1H); чистота ВЭЖХ: 97.01%; ЖХМС: 577 (M++1).
N-(4-(4-(4-бутоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-127):
1H NMR (400 MHz, ДМСО-d6) δ: 0.92 (t, 3H), 1.41 (sextet, 2H), 1.68 (pentate, 2H), 3.00 (br s, 2H), 3.15 (br s, 2H), 3.25 (br s, 4H), 3.92 (t, 2H), 4.22 (s, 2H), 6.97 (d, 2H), 7.20 (dd, 4H), 7.38 (d, 2H), 7.70-7.79 (m, 2H), 8.44 (d, 1H), 8.50 (d, 1H). 9.12 (s, 1H), 9.64 (br s, 1H), 10.50 (s, 1H); чистота ВЭЖХ: 98.86%; ЖХМС: 559 (М++1).
N-(4-(4-(3-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-128):
1H NMR (400 MHz, ДМСО-d6) δ: 2.81 (br s, 2H), 3.00 (br s, 6H), 4.20 (br s, 2H), 6.80 (s, 2H), 7.20 (dd, 4H), 7.70-7.80 (m, 2H), 8.31 (d, 1H), 8.46 (d, 2H), 8.55 (d, 1H), 9.17 (s, 1H), 9.70 (br s, 1H), 10.56 (s, 1H); чистота ВЭЖХ: 99.28%; ЖХМС: 503 (M++1).
4-((4-(4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-ил)метил)фенил бутират (VIII-129):

1H NMR (400 MHz, ДМСО-d6) δ: 0.99 (t, 3H), 1.61 (sextet, 2H), 2.56 (t, 2H), 3.03 (br s, 4H), 3.61 (br s, 4H), 4.24 (br s, 2H), 7.10-7,20 (m, 5H), 7.45 (d, 2H), 7.65-7.72 (m, 2H), 8.23 (d, 1H), 8.41 (d, 2H), 8.51 (d, 1H), 9.10 (s, 1H), 9.78 (br s, 1H), 10.50 (s, 1H); чистота ВЭЖХ: 99.17%; ЖХМС: 573 (M++1).
4-((4-(4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-ил)метил)фенил ацетат (VIII-130):

1H NMR (400 MHz, ДМСО-d6) δ 2.24 (s, 3H), 2.38 (br s, 4H), 3.42 (br s, 4H), 3.78 (s, 2H), 7.10 (d, 2H), 7.20 (d, 2H), 7.44 (d, 2H), 7.63-7.71 (m, 2H), 8.25 (d, 1H), 8.41 (d, 2H), 8.45 (d, 1H), 9.10 (s, 1H), 9.70 (br s, 1H), 10.50 (s, 1H); чистота ВЭЖХ: 95.24%; ЖХМС: 545 (M++1).
N-(4-(4-(3,4,5-триметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-131):

1H NMR (400 MHz, ДМСО-d6) δ: 3.75 (s, 3H), 3.81 (s, 6H), 4.22 (s, 2H), 6.78 (s, 2H), 7.21 (q, 4H), 7.63-7.68 (m, 2H), 8.16 (d, 1H), 8,40 (d, 2H), 9,10 (s, 1H); чистота ВЭЖХ: 98.81%; ЖХМС: 577 (M++1).
N-(4-(4-(3-изобутоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-132):

1H NMR (400 MHz, ДМСО-d6) δ: 1.00 (d, 6H), 2.02 (septet, 1H), 3.05 (br s, 4H), 3.30 (br s, 4H), 3.80 (d, 2H), 3.91 (d, 2H), 7.00-7.08 (m, 2H), 7,20 (dd, 4H), 7.39 (t, 1H), 7.71-7.80 (m, 2H), 8.30 (d, 1H), 8.45 (d, 1H), 8.58 (d, 1H), 9.15 (s. 1H), 9.90 (br s, 1H), 10.58 (s, 1H); чистота ВЭЖХ: 99.17%; ЖХМС: 559 (M++1).
N-(4-(4-(2,3-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-133):

1H NMR (400 MHz, ДМСО-d6) δ: 2.25 (br s, 4H), 3.41 (br s, 4H), 3.64 (s, 3H), 3.72 (s, 2H), 3.78 (s, 3H), 6.80-7.05 (m, 6H), 7.21 (q, 1H), 7.59-7.70 (m, 2H), 8.14 (d, 1H), 8.38-8.42 (m, 2H), 9.01 (s, 1H); чистота ВЭЖХ: 98.50%; ЖХМС: 547 (М++1).
N-(4-(4-(3-фтор-4-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-134):
1H NMR (400 MHz, ДМСО-d6) δ: 2.81 (br s, 2H), 3.01 (br s, 2H), 3.25 (br s, 4H), 3.82 (s, 2H), 3.90 (s, 3H), 7.17 (d, 2H), 7.21 (d, 3Н), 7.35 (1Н), 7.70-7.78 (m, 2H), 8.30 (d, 1Н), 8.43 (d, 2H), 8.55 (d, 1Н), 9.12 (br s, 1Н), 10.58 (s, 1Н); чистота ВЭЖХ: 95.38%; ЖХМС: 535 (M++1).
N-(4-(4-(3-фтор-2-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-135):
1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.43 (br s, 4H), 3.62 (s, 2H), 4.38 (s, 1Н), 6.90 (q, 1Н), 7.10-7.28 (m, 6H), 7.62 (d, 2H), 8.18 (d, 1Н). 8.40 (d, 2H), 9.10 (s, 1Н); чистота ВЭЖХ: 98.81%; ЖХМС: 521 (M++1).
N-(4-(4-(2,4-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-136):

1H NMR (400 MHz, ДМСО-d6) δ: 2.52 (br s, 4H), 3.30 (br s, 4H), 3.70-3.98 (m, 8H), 6.58-6.64 (m, 2H), 7.16 (d, 2H), 7.22 (d, 2H), 7.33 (d, 1H), 7.70-7.79 (m, 2H), 8.28 (d, 1Н), 8.44 (d, 2H), 8.55 (d, 1Н), 9.10 (s, 1Н), 9.50 (br s, 1H), 10.51 (s, 1Н); чистота ВЭЖХ: 92.62%; ЖХМС: 547 (M++1).
N-(4-(4-(3,4-диметилбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-137):

1H NMR (400 MHz, ДМСО-d6) δ: 2.20 (s, 3H). 2.25 (br s, 4H), 2.50 (s. 3H), 3.42 (br s, 4H), 3.81 (s, 2H), 6.96-7.20 (m, 7H), 7.68-7,76 (m, 2H), 8.26 (d, 1H), 8.40 (d, 2H), 8.54 (d, 1H), 9.13 (s, 1H), 10.40 (br s, 1H); чистота ВЭЖХ: 96.74%; ЖХМС:515(M++1).
N-(4-(4-(3-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-138):
1H NMR (400 MHz, ДМСО-d6) δ: 1.70 (t, 2H), 2.24 (br s, 4H), 2.48-2.60 (m, 4H), 3.44 (br s, 4H), 7.18-7.24 (m, 8H), 7,70-7.79 (m, 2H), 8.30 (d, 1H), 8.42 (d, 1H), 8.58 (d, 1H), 9.16 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 93.22%; ЖХМС: 515 (M++1).
3-((4-(4-(хинолин-8-сульфонамид)бензоил)пиперазин-1-ил)метил)фенил ацетат (VIII-139):

1H NMR (400 MHz, ДМСО-d6) δ: 2.24 (s, 4H), 2.30 (br s, 2H), 3.40 (br s, 4H), 3.52 (s, 2H), 7.01-7.21 (m, 6H), 7.38 (t, 1H), 7.70-7.79 (m, 2H), 8.29 (d, 1H), 8.42 (d, 1H), 8.58 (d, 1H), 9.15 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 93.39%; ЖХМС; 545 (M++1).
N-(4-(4-(1-фенилэтил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-140):

1H NMR (400 MHz, ДМСО-d6) δ 1.22 (d, 3Н), 2.20 (br s, 2H), 2.24 (br s, 2H), 3.42 (br s, 4H), 3.68 (s, 2H), 7.04 (s, 3Н), 7.17-7.26 (m, 4H), 7.66-7.74 (m, 2H), 8.24 (d, 1H), 8.39 (d, 1H), 8.50 (d, 1H), 9.16 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.27%; ЖХМС: 501 (М++1).
N-(4-(4-((1-фенилциклопропил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-141):

1H NMR (400 MHz, ДМСО-d6) δ: 1.03 (d, 4H), 2.38 (br s, 2H). 2.61 (s, 2H), 3.50 (br s, 4H), 7.19 (s, 4H), 7.25 (t, 1H), 7.36 (t, 2H), 7.42 (d, 2H), 7.60-7.65 (m, 2H), 8.18 (d, 1H), 8.40 (d, 1H), 9.12 (s, 1H); чистота ВЭЖХ: 94.05%; ЖХМС: 527 (М++1).
N-(4-(4-(2-гидрокси-3,4-диметоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-142):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (brs, 4H), 3.06 (br s, 4H), 3.65 (s, 2H), 3.70 (s, 3Н), 3.80 (s, 3Н), 4.18 (s, 1H), 6.59 (d, 1H), 7.00 (d, 1H), 7.18 (dd, 4H), 7.68-7.77 (m, 2H), 8.26 (d, 1H), 8.48 (d, 3Н), 8.53 (d, 1H), 9.18 (s, 1H), 9.42 (br s, 1H), 9.61 (s, 1H), 10.51 (s, 1H); чистота ВЭЖХ: 93.10%; ЖХМС: 563 (M++1).
N-(4-(4-(2-фтор-4-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-143):

1H NMR (400 MHz, ДМСО-d6) δ: 2.39 (br s, 4H), 3.20 (br s, 4H), 3.72 (s, 2H), 3.80 (s, 3H), 6.79 (s, 1H), 6.90-7.01 (m, 2H), 7.18-7.24 (m, 2H), 7.44 (br s, 1H), 7.71-7.80 (m, 2H), 8.30 (d, 1H), 8.49 (d, 1H), 8.57 (d, 1H), 9.18 (s, 1H), 9.82 (br s, 1H), 10.48 (s, 1H); чистота ВЭЖХ: 96.28%; ЖХМС: 435 (М++1).
N-(4-(4-(4-гидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-144):

1H NMR (400 MHz, ДМСО-d6) δ: 2.42 (br s, 4H), 3.20 (br s, 4H), 3.71 (s, 2H), 6.77 (d, 1H), 6.84 (d, 2H), 7.18-7.24 (m, 5H), 7.61-7.67 (m, 2H), 8.17 (d, 1H), 8.40 (d, 2H), 9.10 (s, 1H); чистота ВЭЖХ: 92.29%; ЖХМС: 503 (M++1).
N-(4-(4-(2,5-дигидроксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-145):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.38 (br s, 4H), 3.50 (s, 2H), 6.45-6.59 (m, 3H), 7.04-7.18 (m, 4H), 7.65-7.77 (m, 2H), 8.24 (d, 1H), 8.40 (d, 1H), 8.50 (d, 1H), 8.61 (s, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 98.19%; ЖХМС:519 (M++1).
N-(4-(4-(пиридин-3-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-146):

1H NMR (400 MHz, ДМСО-d6) δ: 2.25 (br s, 4H). 3.30 (br s, 4H), 3.59 (s, 2H), 7.06-7.18 (s, 3H), 7.35-7.40 (m, 1H), 7.65-7.77 (m, 2H), 8.26 (d, 1H), 8.40-8.56 (m, 3H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 99.48%; ЖХМС: 488 (M++1).
N-(4-(4-(циклопропилметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-147):

1H NMR (400 MHz, ДМСО-d6) δ: 0.03 (s, 2H), 0.43 (s, 2H), 0.78-0.84 (m, 1H), 2.18 (d, 2H), 2.39 (br s, 4H), 3.25 (br s. 2H), 3.46 (br s, 2H), 7.10-7.19 (m, 3H), 7.76-7.80 (m, 2H), 8.26 (d, 1H), 8.43 (d, 1H), 8.58 (d, 1H), 9.17 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 98.98%; ЖХМС: 451 (М++1).
N-(4-(4-((3-фторпиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-148):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.21 (br s, 2H), 3.46 (br s, 4H), 3.62 (s, 2H), 7.06-7.11 (m, 3H), 7.40 (t, 1H), 7.62-7.77 (m, 2H), 8.21 (d, 1H), 8.25 (dd, 2H), 8.50 (d, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 98.83%; ЖХМС: 506 (M++1).
N-(4-(4-((4-(трифторметил)пиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-149):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.31 (br s, 4H), 3.62 (s, 2H), 7.06-7.17 (m, 3Н), 7.62-7.77 (m, 2H), 8.21 (d, 1H), 8.38 (d, 1H), 8.50 (d, 1H), 8.72 (s, 1H), 8.90 (s, 1H), 9.10 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.86%; ЖХМС: 556 (М++1).
N-(4-(4-((3-(трифторметил)пиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-150):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.21 (br s, 2H), 3.46 (br s, 2H), 3.70 (s, 2H), 7.06-7.11 (m, 4H), 7.50 (t, 1H), 7.68-7.77 (m. 2H), 8.15 (d, 1H), 8.25 (d, 1H), 8.40 (d, 1H), 8.50 (d, 1H), 8.76 (s, 1H), 9.18 (s, 1H). 10.41 (s, 1H); чистота ВЭЖХ: 98.67%; ЖХМС: 556 (М++1).
N-(4-(4-((5-хлорпиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-151):
1H NMR (400 MHz, ДМСО-d6) δ: 2.31 (br s, 4H), 5 3.38 (br s, 4H), 3.72 (s, 2H), 6.91-7.06 (m, 4H), 7.40 (d, 2H), 7.56-7.63 (m, 2H), 8.0-8.3 (m, 4H), 9.18 (s, 1H); чистота ВЭЖХ: 98.2%; ЖХМС: 523,2 (М++1).
N-(4-(4-((4-метоксипиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-152):

1H NMR (400 MHz, ДМСОd6) δ: 2.38 (br s, 4H), 3.51 (br s, 4H), 3.61 (s, 2H), 7.21-7.81 (m, 6H), 7.40 (m, 2H), 7.56-7.63 (m, 2H), 8.01 (m, 1H), 8.56 (m, 1H), 9.18 (s. 1H); чистота ВЭЖХ: 98.2%; ЖХМС: 518.1 (M++1).
N-(4-(4-((3-фторпиридин-4-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-153):

1H NMR (400 MHz, CDCl3) δ: 2.38 (s, 4H), 3.31 (br s, 4H), 3.64 (m, 2H), 7.0-7.6 (m, 6H), 7.40 (m, 2H), 7.0 -7.6 (m, 2H), 8.56 (m, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 96.5% ЖХМС: 506.1 (М++1).
N-(4-(4-((5-фторпиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-154):
1H NMR (400 MHz, ДМСОd6) δ: 2.38 (s, 2H), 3.31 (m, 2H), 3.41 (m, 2H), 3.64 (m, 2H), 7.0-7.6 (m, 6H), 7.40 (m, 2H), 7.0 -7.6 (d, 2H). 8.56 (d, 2H), 9.18 (m, 1H), 10.3 (m, 1H); чистота ВЭЖХ: 98.5%; ЖХМС: 506.1 (М++1).
N-(4-(4-((5-фторпиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-155):
1H NMR (400 MHz, ДМСОd6) δ: 2.38 (s, 4H), 3.32 (br s, 2H), 3.52 (br s, 2H), 3.8 (s, 2H), 7.0-7.6 (m, 6H), 7.40 (m, 2H), 7.0-7.6 (d, 2H), 8.56 (d, 2H), 9.18 (m, 1H); чистота ВЭЖХ: 99.3%; ЖХМС: 506.1 (M++1).
N-(4-(4-((3-метоксипиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-156):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (s, 4H), 3.41 (m, 4H), 3.8 (m, 2H), 3.91 (s, 3Н), 7.0-7.7 (m, 8H), 8.0-8.51 (m, 4H), 9.12 (m, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 97.3%; ЖХМС: 518.3 (М++1).
N-(4-(4-(4-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-157):

1H NMR (400 MHz, ДМСО-d6) δ: 2.41 (br s, 4H), 3.21 (m, 4H), 3.3-3.8 (m, 2H), 7.05-7.71 (m, 8H), 8.22-8.62 (m, 5H), 9.12 (m, 1H), 10.4 (s,lH); чистота ВЭЖХ: 99.3%; ЖХМС: 505.2 (М++1).
N-(4-(4-((2-метоксипиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-158):

1H NMR (400 MHz, ДМСО-d6) δ: 2.41 (br s, 4H), 3.21 (s, 4H), 3.3-3.8 (br s, 2H), 7.05-7.72 (m, 10H), 8.22-8.61 (m, 3Н), 9.12 (m. 1H), 10.41 (s, 1H); чистота ВЭЖХ: 98.6%; ЖХМС: 505.2 (M++1).
N-(4-(4-(циклопропилметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-159):

1H NMR (400 MHz, ДМСО-d6) δ: 0.04-0.45 (m, 2H), 0.61-0.66 (m, 2H), 1.4-1.6 (m, 1H), 2.21-2.38 (m, 4H), 2.61 (d, 2H), 3.31-3.61 (br s, 4H), 6.94-7.06 (m, 4H), 7.40 (d, 2H), 7.56-7.63 (m, 2H), 8.28 (d, 1H), 9,18 (s, 1H), 10.4 (s, 1H); чистота ВЭЖХ:99.6%; ЖХМС: 451.3 (M++1).
N-(4-(4-(циклогексилметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-160):

1H NMR (400 MHz, ДМСО-d6) δ: 0.8 (m, 2H), 1.2 (m, 4H), 1.4 (s, 1H), 1.7 (m, 4H), 2.32 (m, 4H), 2.62 (br s, 2H), 3.42 (br s, 4H), 7.0-7,4 (m, 4H), 7.5-7.7 (m, 2H), 8.3-8.6 (m, 3H), 9.1 (d, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 99.3%; MS: 493.3 (M++1).
N-(4-(4-(4-хлор-3-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-161):

1H NMR (400 MHz, ДМСО-d6) δ: 2.22-2.41 (m, 4H), 3.21-3.81 (m, 6H). 7.02-7.51 (m, 7H), 7.61-7.72 (m, 2H), 8.31-8.62 (m, 3H), 9.12 (d, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 96.8%; ЖХМС: 539.0 (М++1).
N-(4-(4-(циклопентилметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-162):

1H NMR (400 MHz, ДМСО-d6) δ: 1.10 (sextet, 2H), 1.40-1.53 (m, 4H), 1.60 (br s, 2H), 1.99 (pentate, 1H), 2.20 (d, 4H), 2.43 (br s, 2H), 3.32 (br s, 4H), 7.10 (t, 4H), 7.62-7.69 (m, 5H), 8.25 (d, 1H), 8.40 (d, 1H), 8.47 (d, 1H), 9.10 (d, 1H), 10.28 (s, 1H); чистота ВЭЖХ: 98.26%; ЖХМС: 479 (М++1).
N-(4-(4-((тетрагидрофуран-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-163):

1H NMR (400 MHz, ДМСО-d6) δ 1.42 (sextet, 1H), 1.6-1.8 (m, 2H), 2.20-2.40 (m, 4H), 3.42-3.52 (m, 4H), 3.61-3,75 (m, 4H), 3.80-4.05 (m, 2H), 7.04-7.14 (m, 4H), 7.62-7.69 (m, 2H), 8.25 (d, 1H), 8.40 (d, 1H), 8.47 (d, 1H), 9.10 (d, 1H); чистота ВЭЖХ: 98.26%; ЖХМС: 479 (М++1).
N-(4-(4-((3-хлорпиридин-4-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-164):

1H NMR (400 MHz, ДМСО-d6) δ 2.37 (br s, 4H), 3.42 (br s, 4H), 3.59 (s, 2H), 7.10 (q, 4H), 7,50 (s, 1H), 7.62-7.69 (m, 2H), 8.25 (d, 1H), 8.42 (d, 1H), 8.46-8.52 (m, 2H), 8.58 (s, 1H), 9.10 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 96.59%.; ЖХМС: 522 (M+).
N-(4-(4-((тетрагидрофуран-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-165):

1H NMR (400 MHz, ДМСО-d6) δ 1.62 (sextet, 1H), 1.72-1.92 (m, 2H), 2.20-2.40 (m, 4H), 3.41-3.52 (m, 4H), 3.62-3.75 (m, 4H), 3.82-4.05 (m, 2H), 7.04-7.14 (m, 4H), 7.62-7.69 (m, 2H), 8.25 (d, 1H), 8.40 (d, 1H), 8.47 (d, 1H), 9.10 (d, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 99.2%; ЖХМС: 479 (М++1).
N-(4-(4-((5-(трифторметил)пиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-166):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.5-3.7 (m, 4H), 3.7-4.0 (m, 2H), 7.1-7.3 (m, 6H), 7.50-7.62 (m, 4H), 8.0-8.3 (m, 2H). 9.10 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 96.59%; ЖХМС: 522 (M+).
N-(4-(4-бензил-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-167):

1H NMR (400 MHz, ДМСО-d6) δ: 1.72 (dd, 2H), 2.41-2.72 (m, 2H), 3.22-3.42 (m, 4H), 3,5-3.7 (m, 4H), 7.0-7.4 (m, 5H), 7.5-7.8 (m, 4H), 8.0-8.6 (m, 3H), 9.1 (d, 1H), 10.4 (s, 1H); чистота ВЭЖХ: 98.59%; ЖХМС: 501.2 (М++1).
N-(4-(4-(2-метоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-168):

1H NMR (400 MHz, CDCl3) δ: 2.06 (br s, 2H), 2.42 (br s. 4H), 3.62 (s, 4H), 3.72 (br s, 3H), 3.80 (d, 2H), 6.82-6.97 (m, 2H), 7.06 (t, 2H), 7.18 (t, 2H), 7.22-7.39 (m, 2H), 7.58-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (m, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 98.10%; ЖХМС: 531 (M++1).
N-(4-(4-(4-пропоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-169):

1H NMR (400 MHz, CD3OD) δ: 1.04 (t, 3H), 1.80 (q, 2H), 2.06 (br s, 2H), 3.55 (br s, 4H), 3.99 (t, 4H), 4.35 (s, 2H), 7.00-7.10 (m, 2H), 7.19-7.28 (m, 3H), 7.66-7.70 (m, 2H), 8.19 (d, 1H), 8.42 (d, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 98.74%; ЖХМС: 559 (М++7).
N-(4-(4-(2-пропоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-170):

1H NMR (400 MHz, CD3OD) δ: 1.04(t,3H), 1.84 (brs, 2H), 2.16 (brs, 2H), 3.58 (br s, 4H), 4.08 (br s, 2H), 4.25 (br d, 1H), 4.40 (s, 2H), 7.04 (t, 1H), 7.19 (d, 1H), 7.20-7.28 (m, 4H), 7.44 (d, 1H), 7.53 (t, 1H), 7.68-7.72 (m, 2H), 8.21 (d, 1H), 8.42 (d, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 97.74%; ЖХМС: 559 (М++1).
N-(4-(4-(2-изопропоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-171):

1H NMR (400 MHz, CD3OD) δ: 1.38 (s, 6H), 2.16 (br s, 2H), 3.55 (br s, 3Н), 4.18 (br d, 1H), 4.38 (s, 2H), 4.79 (s, 1H), 7.04 (t, 1H), 7.19 (d, 1H), 7.21-7.34 (m, 4H), 7.40-
7.52 (m, 2H), 7.53 (t, 1H), 7.67-7.72 (m, 2H), 8.21 (d, 1H), 8.44 (d, 2H), 9.18 (s, 1H); ЖХМС: 559 (M++1); чистота ВЭЖХ: 98.99%.
N-(4-(4-(3-изопропоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-172):
lH NMR (400 MHz, CD3OD) δ: 1.38(d,6H), 1.4(m, 1H), 2.08 (brs, 2H), 3.18 (br s, 2H), 3.56 (br s, 4H), 4.38 (s, 2H), 4.68 (m, 2H), 6.99-7.10 (m, 2H), 7.20-7.30 (m, 5H), 7.40 (t, 1H), 7.65-7.70 (m, 2H), 8.20 (d, 1H), 8.43 (d, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 99.68%; ЖХМС: 559 (M++1).
N-(4-(4-(3-бутоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-173):

1H NMR (400 MHz, CD3OD) δ: 1.01 (t, 3H), 1.50 (sextet, 2H), 1.79 (pentate, 2H), 2.06 (br s, 2H), 3.58 (br s, 4H), 3.6-3.9 (m, 4H), 4.03 (t, 2H), 4.38 (s, 2H), 7.00-7.08 (m, 3Н), 7.19-7.26 (m, 4H), 7.41 (t, 1H), 7.63-7.69 (m, 2H), 8.19 (d. 1H), 8.42 (d, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 99.75%; ЖХМС: 573 (М++1).
N-(4-(4-(2-гидрокси-3,4-диметоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-174):

1H NMR (400 MHz, CD3OD) δ: 2.18 (br s, 2H), 3.18 (br s, 2H), 3.56 (br s, 4H), 3.80 (s, 3Н), 3.84 (s, 3Н), 4.18 (br s, 2H), 4.30 (s, 2H), 6.61 (d, 2H), 7.03 (d, 2H), 7.19-7.27 (m, 2H), 7.61-7.66 (m, 2H), 8.19 (d, 1H), 8.42 (d, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 97.61%; ЖХМС: 577 (М++1).
N-(4-(4-(2-изопропилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-175):

1H NMR (400 MHz, CD3OD) δ: 1.22 (d, 6H), 2.05 (br s, 1H), 3.56 (br s, 8H), 4.50 (s, 4H), 7.20-7.39 (m, 5H), 7.40-7.56 (m, 3Н), 7.64-7.69 (m, 2H), 8.20 (d, 1H), 8.42 (d, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 98.73%; ЖХМС: 543 (М++1).
N-(4-(4-(4-изобутоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-176):
1H NMR (400 MHz, CD3OD) δ: 1.04 (d, 6H), 2.02-2.17 (m, 3H), 3.15 (br d, 2H). 3.56 (br d, 4H), 3.79 (d, 2H), 4.20 (br d, 2H), 4.35 (s, 2H), 7.02 (d, 2H), 7.24 (t, 3H), 7.41(d, 2H), 7.68-7.74 (m, 2H), 8.21 (d, 2H), 8.42 (d, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 98.56%; ЖХМС: 573 (М++1).
N-(4-(4-(2-гидрокси-3-метоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-177):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2,60 (br s, 4H), 2.70 (br s, 2H), 3.58 (br s, 2H), 3.78 (s, 2H), 3.9 (s, 3H), 6.63 (d, 3H), 6.80 (br s, 1H), 7.12 (d, 2H), 7.77 (br s. 2H), 8.28 (s, 1H), 8.42 (d, 2H), 8.58 (s, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 98.72%; ЖХМС: 547 (М++1).
N-(4-(4-(2-(терт-бутилтио)бензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-178):

lH NMR (400 MHz, ДМСО-d6) δ: 1,20 (d, 9H), 1.61 (brs, 1H), 1.77 (brs, 1H), 2.60 (br s, 1H), 2.70 (br s, 1H), 3,25 (br s, 2H), 3.58 (br s, 4H), 3.83 (d, 2H), 7.10 (d, 3H), 7.20 (br s. 2H), 7.49 (br s, 1H), 7.77 (br s. 4H), 8.28 (s, 1H), 8.42 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 91.52%; ЖХМС: 589 (M++1).
N-(4-(4-(2-фтор-6-метоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-179);

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.60 (br s, 2H), 3.10 (br s, 2H), 3.45-3.55 (m, 4H), 3.64 (s, 3H), 3.81 (s, 2H), 6.77-6.87 (m, 2H), 7.08-7.20 (m, 4H), 7.30 (br s, 1H), 7,77-7.20 (m, 2H), 8.28 (d, 1H), 8.42 (d, 1H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.88%; ЖХМС: 549 (M++1).
N-(4-(4-(2-(метилтио)бензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-180):
1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.38 (d, 4H), 2.60 (br s, 2H), 3.25 (br s, 2H), 3.58 (s, 2H), 3.6(s. 3H), 7.00-7.18 (m, 5H), 7.24 (d, 2H), 7.77-7.80 (d, 2H), 8.28 (d, 1H), 8.42 (d, 2H), 8.58 (s, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.77%; ЖХМС: 547 (М++1).
N-(4-(4-(5-хлор-2-гидрокси-4-метилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-181):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.25 (s, 4H), 2.78 (br s, 2H), 3.50-3.78 (m, 4H), 6.78 (d, 1H), 7.10-7.20 (m, 4H), 7.77-7.80 (m. 2H), 8.28 (s, 1H). 8.42 (d, 2H), 8.58 (s, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.85%; ЖХМС; 565 (М++1).
N-(4-(4-(3-фенилпропил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-182):
1H NMR (400 MHz, ДМСО-d6) δ: 1.32 (m, 2H), 1.61 (br s, 2H), 1.77 (br s, 2H),2.1 (t, 2H), 2.38 (d, 2H), 2.60 (br s, 1H), 3.28 (br s, 3H), 3.58 (br s, 2H), 7.05-7.31 (m, 7H), 7.77-7.80 (m, 3H), 8.28 (d, 1H), 8.42 (d, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.73%; ЖХМС: 529 (M++1).
N-(4-(4-(3-хлор-4-метоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-183):
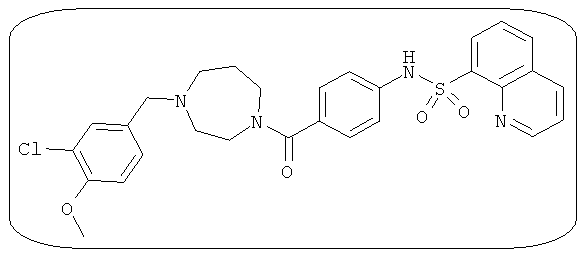
1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.60 (br s, 2H), 3.22 (br s, 2H), 3.57 (s, 4H), 3.82 (s, 2H), 7.01-7.38 (m, 6H), 7.77 (br s. 2H), 8.28 (s, 1H), 8.42 (d, 1H), 8.58 (s, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.50%; ЖХМС: 565 (М++1).
3-((4-(4-(хинолин-8-сульфонамид)бензоил)-1,4-диазепан-1-ил)метил)фенил ацетат (VIII-184):
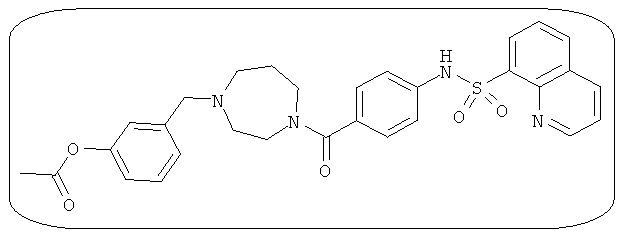
1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.60 (br s, 4H), 2.70 (br s, 2H), 3.58 (br s, 2H), 3.78 (s, 2H), 6.63 (d, 2H), 6.80 (br s, 2H), 7.12 (d, 2H), 7.77 (br s. 2H), 8.28 (s, 1H), 8.42 (d, 2H), 8.58 (s. 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 98.72%; ЖХМС: 547 (М++1).
N-(4-(4-(4-метилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-185):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.26 (s, 3H), 2.39-2.62 (m, 4H), 3.10 (br s, 2H), 3.50 (br s, 4H), 7.01-7.20 (m, 7H), 7.77-7.80 (m, 2H), 8.28 (br s, 1H), 8.42 (d, 1H), 8.58 (d, 2H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ; 97.70%; ЖХМС: 515 (М++1).
N-(4-(4-(2,4-дихлорбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-186):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (brs, 1H), 1.77 (brs, 1H), 2.50-2.76 (m, 2H), 3.45-3.70 (m, 4H), 3.7-3.9 (m, 4H), 7.05-7.20 (m, 2H), 7.36-7.60 (m, 4H), 7.77-7.80 (m, 2H), 8.28 (d, 1H), 8.42 (d, 1H), 8.58 (d, 2H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 99.76%; ЖХМС: 569 (М++1).
N-(4-(4-(4-(трифторметил)бензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-187):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.50-2.60 (m, 2H), 3.10 (br s, 2H), 3.50 (br s, 4H), 3.55-3.9 (m, 2H), 7.10 (s, 4H), 7.20-7.38 (m, 3H), 7.77-7.80 (m, 2H), 8.28 (br s, 1H), 8.42 (d, 1H), 8.58 (d, 2H), 9.18 (s, 1H), 10.41 (s, 1H); MS: 569 (M++1); чистота ВЭЖХ: 99.47%; ЖХМС: 569 (М++1).
N-(4-(4-(2-фенилпропил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-188):

1H NMR (400 MHz, CD3OD) δ: 1.0(q, 1H), 1.36 (d, 3H), 2.04 (brs, 2H), 3.10 (br s, 2H), 3.44 (br s, 4H), 3.56 (br s, 2H), 4.09 (br s, 2H), 7.10 (s, 4H), 7.24-7.40 (m, 4H), 7.62-7.68 (m, 3H), 8.18 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 99.86%; ЖХМС: 529 (М++1).
N-(4-(4-фенэтил-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-189):

1H NMR (400 MHz, CD3OD) δ: 2.10 (br s, 2H), 3.06 (br s, 2H), 3.40 (br s, 4H), 3.62 (br s, 2H), 3.79 (t, 2H), 4.09 (br s, 2H), 7.20-7.39 (m, 8H), 7.62-7.68 (m, 2H), 8.18 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 97.56%; ЖХМС: 515 (М++1).
N-(4-(4-(4-бутилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-190):

1H NMR (400 MHz, CD3OD) δ: 0.92 (t, 3Н), 1.37 (sextet, 2H), 1.58 (sextet, 2H), 2.03 (br s, 2H), 2.62 (t, 2H), 3.16 (br s, 2H), 3.50 (br s, 4H), 4.19 (br s, 2H), 4.24 (s, 2H), 7.17-7.23 (m, 4H), 7.25-7.38 (m, 4H), 7.61-7.65 (m, 2H), 8.18 (d, 1H), 8.41 (d, 2H), 9.16 (s, 1H); чистота ВЭЖХ: 99.72%; ЖХМС: 557 (M++1).
N-(4-(4-(3,5-диметилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-191):

1H NMR (400 MHz, CD3OD) δ: 2.01 (br s, 2H), 2.28 (s, 6H), 3.10 (br s, 2H), 3.44 (br s, 4H), 3.18 (br s, 1H), 4.12 (s, 2H), 7.02 (s, 2H), 7.10 (s, 1H), 7.14-7.22 (m, 4H),7.60-7.65 (m, 2H), 8.18 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 99.81%; ЖХМС: 529 (M++1).
N-(4-(4-(2-гидрокси-3,4-диметокси-6-метилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид(VIII-192):

1H NMR (400 MHz, CD3OD) δ: 2.12 (br s, 2H), 2.38 (s, 3Н), 3,58 (br s, 5H), 3.79 (s, 3Н), 3.83 (s, 3Н), 3.85-3.9 (m, 2H), 4.21 (br s, 1H), 4.38 (s, 2H), 6.50 (s, 1H), 7.20-7.30 (m, 4H), 7.62-7.68 (m, 2H), 8.18 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ; 98.77%; ЖХМС: 591 (M++1).
N-(4-(4-(3,5-диметоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-193):

1H NMR (400 MHz, CD3OD) δ: 2.02 (br s, 2H), 3.51 (br s, 3H), 3.2-3.7 (m, 3H), 3.79 (s, 2H), 3.81 (s, 6H), 4.28 (s, 2H). 6.63 (d, 2H), 7.20-7.27 (m, 5H), 7.62-7.68 (m, 2H), 8.18 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 94.85%; ЖХМС:561 (M++1).
N-(4-(4-(4-хлор-2-фторбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-193):

1H NMR (400 MHz, CD3OD) δ 2.03 (br s, 2H), 3.40 (br s, 4H), 3.61 (br s, 2H), 4.38 (s, 2H), 6.63 (d, 2H), 7.15-7.27 (m, 4H), 7.32-7.38 (m, 2H), 7.52 (t, 1H), 7.60-7.65 (m, 2H), 8.18 (d, 1H), 8.41 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 99.99%; ЖХМС: 553 (М+).
N-(4-(4-(4-этоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-194):

1H NMR (400 MHz, CD3OD) δ: 1.39 (t, 3H), 2.03 (br s, 2H), 3.10 (br s, 1H), 3.57 (br s, 5H), 3.71 (br s, 2H), 4.06 (q, 2H), 4.19 (br s, 1H), 4.30 (s, 1H), 6.63 (d, 2H), 7.00 (d, 2H), 7.18-7.27 (m, 2H), 7.38 (d, 2H), 7.62-7.68 (m, 2H), 8.18 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 98.87%; ЖХМС: 545.0 (М++1).
N-(4-(4-(3-гидроксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-195):
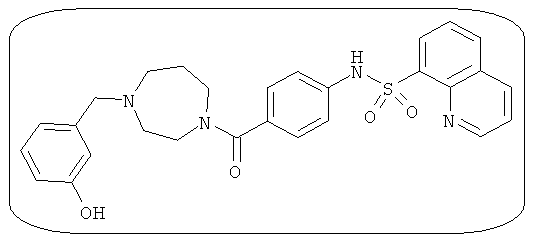
1H NMR (400 MHz, CD3OD) δ: 2.02 (br s, 2H), 3.18 (br s, 2H), 3.59 (s, 4H), 4.20 (br s, 2H), 4.31 (s, 2H), 6.90 (d, 3Н), 7.19-7.32 (m, 5H), 7.62-7.68 (m, 2H), 8.18 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H); чистота ВЭЖХ: 96.26%; ЖХМС: 517.2 (M++1).
N-(4-(4-(2,3-дихлорбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-196):

1H NMR (400 MHz, CD3OD) δ: 2.12 (br s, 2H), 3.53 (br s, 6H), 3.73 (br s, 2H), 4.59 (s, 2H), 6.63 (d, 2H), 7.20-7.30 (m, 3Н), 7.44 (t, 1H), 7.59 (s, 1H). 7.63-7.68 (m, 2H), 7.78 (d, 1H), 8.18 (d, 1H), 8.42 (d, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.29%; ЖХМС: 569 (М++1).
N-(4-(4-(3,4-дихлорбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-197):

1H NMR (400 MHz, ДМС-d6) δ: 1.60 (br s, 1H), 1.78 (br s, 1H), 2.60 (br s, 2H), 2.62 (br s. 2H), 3.23 (br s, 2H), 3.58 (br s, 2H), 3.50-3.62 (m, 2H), 7.07-7.18 (m, 3H). 7.24 (dd, 1H), 7.43-7.60 (m, 2H), 7.70-7.79 (m, 2H), 8.24 (d, 1H), 8.42 (d, 2H), 8.55 (d, 1H), 9.18 (s, 1H), 10.42 (s, 1H); чистота ВЭЖХ: 99.76%; ЖХМС: 569.1 (М++1).
N-(4-(4-(3,5-дифторбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-198):
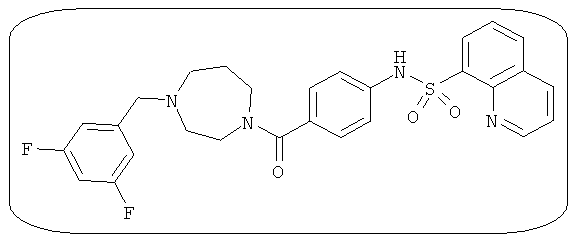
1H NMR (400 MHz, ДMCOd6) δ: 1.60 (brs, 1H), 1.78 (brs, 1H), 2.60 (brs, 2H), 2.62 (br s, 2H), 3.23 (br s, 4H), 3.50-3.62 (m, 2H), 6.95-7.20 (m, 6H), 7.74 (s. 2H),8.24 (d, 1H), 8.42 (d, 2H), 8.55 (d, 1H), 9.18 (s, 1H), 10.42 (s, 1H); чистота ВЭЖХ: 98.49%; ЖХМС: 559.1 (М++23).
N-(4-(4-(2,6-диметоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-199):

1H NMR (400 MHz, ДМСО-d6) δ: 1.60 (br s, 1H), 1.71 (br s, 1H), 2.62 (br s, 3H), 3.21 (br s, 2H), 3.50 (s, 3H), 3.59 (s, 3H), 3.79 (s, 2H), 6.58 (d, 1H), 6.61 (d, 2H), 7.02-7.21 (m, 4H), 7.62-7.68 (m, 2H), 8.18 (d, 1H), 8.42 (d, 2H), 9.18 (s, 1H), 10.39 (s, 1H); чистота ВЭЖХ: 99.26%; ЖХМС: 561 (M++1).
N-(4-(4-(3-хлор-4-фторбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-200):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.80 (br s, 1H), 3.42 (dd, 6H), 7.08-7.18 (m, 3H), 7.20-7.55 (m, 3H), 7.70-7.80 (m, 2H), 8.28 (d, 1H), 8.42 (d, 2H), 8.58 (d, 1H), 9.18 (s, 1H). 10.40 (s, 1H); чистота ВЭЖХ; 99.54%; ЖХМС: 561 (M+).
N-(4-(4-(4-(1-амино-2-цианопропил)бензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-201):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.7 (s, 1H), 1.80 (br s, 1H), 2.70 (t, 2H), 2.93 (s, 3H), 3.23 (br s, 2H), 3.40-3.59 (m, 4H), 3.64 (t, 1H), 6.68 (t, 2H), 7.01-7.18 (m, 5H), 7.70 (br s, 2H), 8.28 (t, 1H), 8.42 (d. 2H), 8.58 (t, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 96.64%; ЖХМС: 605 (М++23).
N-(4-(4-(2-этилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-202):

1H NMR (400 MHz, ДМСО-d6) δ: 1.0-1.17 (m, 2H), 1,2 (t, 3H), 1,59 (br s, 1H), 1.74 (br s, 1H), 2.1 (m, 2H), 2.42-2.75 (m, 5H), 3.2-3.6 (m, 3H), 7.01-7.22 (m, 7H), 7.75 (s, 2H), 8.28 (d, 1H), 8.42 (d, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.16%; ЖХМС: 529 (M++1).
N-(4-(4-(4-(гекс-1-ин-1-ил)бензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-203):

1H NMR (400 MHz, ДМСО-d6) δ: 0.92 (t, 3H), 1.40-1.60 (m, 5H), 1.77 (br s, 2H), 3.20 (br s, 4H), 3.50 (br s, 6H), 7.03-7.38 (m, 7H), 7.78 (br s, 2H), 8.28 (br s, 1H), 8.42 (d, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.77%; ЖХМС: 581 (M++1).
N-(4-(4-(2-фтор-6-гидроксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-204):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (brs, 1H), 1.77 (brs, 1H), 2.60 (brs, 2H), 2.78 (br s, 1H), 3.20-3.42 (m, 3H), 3.58 (d, 2H), 3.79 (d, 2H), 4.1 (s, 1H), 6.59 (br s, 2H), 7.10-7.20 (m, 4H), 7.71-7.80 (m. 2H), 8.28 (d, 1H), 8.42 (d, 1H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.78%; ЖХМС: 535 (М++1).
N-(4-(4-(2,4-дихлор-6-гидроксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-205):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.58-2.80 (m, 3H), 3.20-3.68 (m, 5H), 3.79 (d, 2H), 6.78 (d, 1H), 6.99 (d, 1H), 7.09-7.20 (m, 4H), 7.71-7.80 (m. 2H), 8.28 (d, 1H), 8.42 (d, 1H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.58%. ЖХМС: 585 (М++1).
N-(4-(4-(-гидрокси-6-метоксибензил)1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-206):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.60 (br s, 2H), 3.21 (br s, 2H), 3.42-3.58 (m, 2H), 3.53 (s, 2H), 3.68 (d, 2H), 6.26-6,45 (m, 2H), 7.03-7.20 (m, 3H), 7.71-7,80 (m, 2H), 8.28 (s, 2H). 8.42 (d, 2H), 8.58 (s, 1H), 9.18 (s, 1H), 10.41 (s, 1H); чистота ВЭЖХ: 99.89%; ЖХМС: 547 (М++1).
N-(4-(4-(4-цианобензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-207):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (brs, 1H), 1,77 (brs, 1H), 2.60 (brs, 2H), 3.21 (br s, 2H), 3.42-3.58 (m, 2H), 3.53 (s, 2H), 3.68 (d, 2H), 7.10-7.20 (m, 3H), 7.41-7.58 (m, 2H), 7.71-7.81 (m. 3H), 8.28 (d, 1H), 8.42 (d, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 97.75%; ЖХМС: 526.2 (M++1).
N-(4-(4-(5-хлор-2-гидроксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-208):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.60-2.78 (m, 2H), 3.21 (br s, 2H), 3.42-3.58 (m, 2H), 3.50-3.71 (m, 4H), 6.74-6.80 (m, 1H), 7.08-7.20 (m, 5H), 7.71-7.80 (m. 2H), 8.28 (br s, 1H), 8.42 (d, 2H), 8.58 (br s, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.40%; ЖХМС: 551.1 (M+).
N-(4-(4-(4-метоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-208):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.40 (br s, 1H), 2.60 (br s, 1H), 3.21 (br s, 2H), 3.42-3.58 (m, 4H), 3.77 (s, 2H), 6.80-6.91 (m, 2H), 7.06-7.20 (m, 4H), 7.71-7.79 (m. 2H), 8.28 (br s, 1H), 8.42 (d, 2H), 8.58 (br s, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.04%; ЖХМС: 531 (М++1).
N-(4-(4-(2,5-диметилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-209):

1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.10-2.25 (m, 2H), 2.24 (s, 2H), 2.60-2.67 (m, 2H), 2.60 (br s, 2H), 3.20-3.60 (m, 2H), 6.90-7.20 (m, 5H), 7.71-7.80 (m. 2H), 8.28 (d, 1H), 8.42 (d, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 98.86%; ЖХМС: 529 (М++1).
N-(4-(4-(3,5-дихлорбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-210):
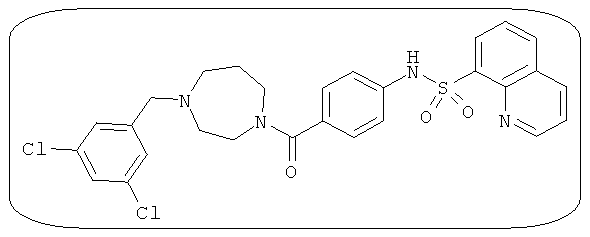
1H NMR (400 MHz, ДМСО-d6) δ:1.61 (br s, 1H), 1.77 (br s. 1H), 2.24 (s, 2H), 2.60-2.67 (m, 2H), 3.20-3.60 (br s, 2H), 3.8-3.9 (m, 4H), 7.09-7.20 (m, 3H), 7.25-7.50 (m, 3H), 7.71-7.80 (m. 2H), 8.28 (d, 1H), 8.42 (d, 1H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.29%; ЖХМС: 569 (M++1).
N-(4-(4-(3-фтор-4-(трифторметил)бензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-211):
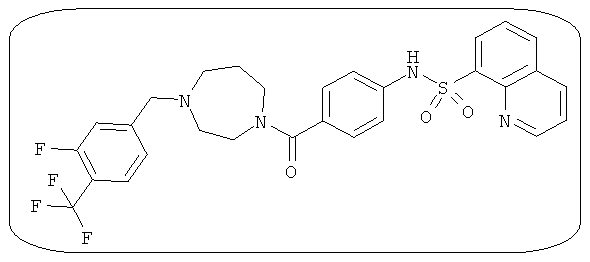
1H NMR (400 MHz, ДМСО-d6) δ: 1.61 (br s, 1H), 1.77 (br s, 1H), 2.24 (s, 2H), 2.40-2.60 (m, 2H), 3.20 (br s, 2H), 3.59 (br s, 2H), 3.58 (d, 2H), 7.10-7.20 (m, 3H), 7.25-7.42 (m, 2H), 7.71-7.80 (m. 2H), 8.28 (d, 1H), 8.42 (d, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ; 99.71%; ЖХМС: 587 (M++1).
N-(4-(4-(2,4,5-триметилбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-212):

1H NMR (400 MHz, ДМСО-d6) δ: 2.10 (s, 3H), 2.18 (s, 6H), 2.24 (s, 2H), 2.40-2.60 (m, 4H), 3.20 (br s, 2H), 3.59 (br s, 2H), 3.58 (d, 2H), 6.80-6.99 (m, 2H), 7.04-7.18 (m, 2H), 7.71-7.80 (m, 2H), 8.28 (d, 1H), 8.42 (d, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.80%; ЖХМС; 543 (M++1).
N-(4-(4-(4-хлорбензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-213):

1H NMR (400 MHz, ДМСО-d6) δ: 1.59(s, 1H), 1.78(s, 1H),2.41 (s, 1H),2.52-2.64 (m, 2H), 3.25 (br s, 2H), 3.55 (s, 2H), 3.59 (s, 2H), 7.08-7.17 (m, 3H), 7.20-7.40 (m, 4H), 7.68-7.75 (m, 2H), 8.28 (d, 1H), 8.42 (d, 1H), 8.53 (d, 1H), 9.18 (s, 1H), 10.39 (s, 1H); чистота ВЭЖХ: 97.45%; ЖХМС: 535.1 (М+).
N-(4-(4-(2,5-диметоксибензил)-1,4-диазепан-1-карбонил)фенил)хинолин-8-сульфонамид (VIII-214):

1H NMR (400 MHz, ДМТО-d6) δ: 1.63 (br s, 1H), 1.78 (br s, 1H), 2.2 (br s, 2H), 2.62 (br s, 2H), 3.24 (br s, 2H), 3.48-3.66 (m, 4H), 3.7-3.86 (s, 6H), 6.71- 6.81 (m, 1H), 6.82-6.99 (m, 2H), 7.05-7.17 (m, 3H), 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.42 (d, 1H), 8.56 (d, 1H), 9.18 (s, 1H), 10.39 (s, 1H); чистота ВЭЖХ: 98.43%; ЖХМС: 561 (М++1).
Синтез соответствующих солей:
Общая процедура образования солей:
В раствор N-(4-(4-бензилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамида (0,25 ммоль) в метаноле (5 мл) добавили гидроксид натрия/ метансульфокислоту (0,25 ммоль, 1,0 экв.), реакционную смесь размешивали в течение 3 часов при комнатной температуре. Растворитель удалили при уменьшенном давлении и азеотропировали пентаном для получения солей в виде твердого вещества бледно-желтого цвета.
Натрий (4-(4-бензилпиперазин-1-карбонил)фенил)(хинолин-8-илсульфонил)амид (VIII-215);

1H NMR (400 MHz, CDCl3) δ: 2.38 (brd, 4H),3.31 (brs, 2H), 3.41 (s. 2H), 3.64 (br s, 2H), 6.94 (d, 2H), 7.06 (t, 4H), 7.40 (d, 2H), 7.56-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); ЖХМС: 508.5 (M++23).
8-(N-(4-(4-бензилпиперазин-1-карбонил)фенил)сульфамоил)хинолин-1-иум метансульфонат (VIII-216):
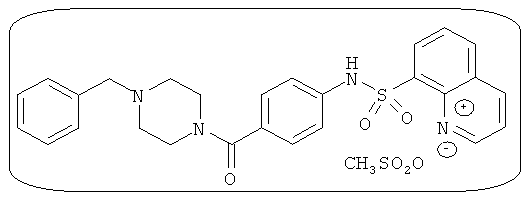
1H NMR (400 MHz, CDCl3) δ: 2.38 (br d, 4H), 3.31 (br s, 2H), 3.41 (s, 2H), 3.64 (br s, 2H), 6.94 (d, 2H), 7.06 (t, 4H), 7.40 (d, 2H), 7.56-7.63 (m, 2H), 8.01 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 8.56 (s, 1H), 9.18 (s, 1H); ЖХМС: 487.0 (M++1).
Синтез производных бензила на основе пиперазина с 3-метил, 2-метил, 3-фтор, 3-хлор, 3-метокси и 2-метокси замещенными фенильными кольцами
Схема 22

Синтез соединений 140-145 и соединения формулы (XIV) выполнили, начиная с анилина 140 (0,25 ммоль) следуя процедурам, указанным на схеме 21 для соединений формулы (VIII) с соответствующими основными этапами, такими как образование сульфонамида, гидролиз эфира, образование амидной связи и восстановительное аминирование.
N-(4-(4-бензилпиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-1):

1H NMR (400 MHz, CDCl3) δ: 2.22 (s, 3H), 2.65 (br s, 4H), 3.50 (br s, 4H), 4.20 (s, 2H), 7.01 (d, 1H), 7.12 (s, 1H), 7.39 (t, 2H), 7.48 (q, 2H), 7.60-7.68 (m, 2H), 8.18 (d, 1H), 8.28 (d, 1H), 8.43 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 98.75%; ЖХМС: 501 (М++1).
N-(4-(4-бензилпиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-2):

1H NMR (400 MHz, CDCl3) δ: 2.62 (br s, 4H), 3.80 (br s, 4H), 4.20 (s, 2H), 6,99 (d, 1H), 7.03 (d, 1H), 7.39 (d, 2H), 7.40-7.48 (m, 3H), 7.60-7.68 (m, 2H), 7.80 (t, 1H), 8.18 (d, 1H), 8.26 (d, 1H), 8.43 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 97.86%; ЖХМС: 505 (M++1).
N-(4-(4-бензилпиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-3):
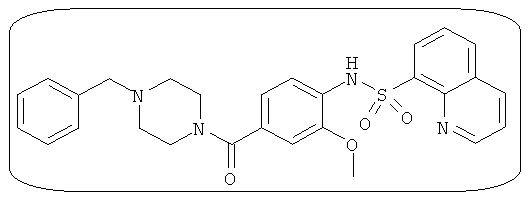
1H NMR (400 MHz, CDCl3) δ: 2.46 (br s, 4H), 3.50 (br s, 4H), 3.66 (s, 3H), 4.20 (br s, 2H), 6.40 (br s, 1H), 6.94 (br s, 1H), 7.39 (d, 2H), 7.42-7.48 (m, 3H), 7.61-7.66 (m, 2H), 8.18 (d, 1H). 8.36 (d, 1H), 8.41 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 99.99%; ЖХМС: 517 (M++1).
N-(4-(4-бензилпиперазин-1-карбонил)-3-хлорфенил)хинолин-8-сульфонамид (XIV-4):
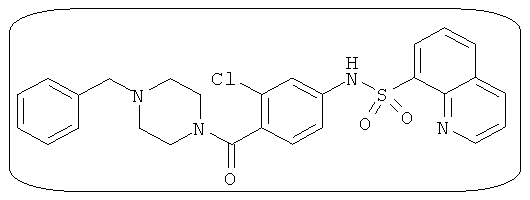
1H NMR (400 MHz, CDCl3) δ: 2.32 (br s, 4H), 3.42 (br s, 4H), 4.38 (s, 2H), 7.16 (q, 2H), 7.30 (s, 1H), 7.49 (s, 4H), 7.64-7.73 (m, 2H), 8.21 (d, 1H). 8.42 (t, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 96.62% ЖХМС: 521 (M+).
N-(4-(4-(4-хлорбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-5):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.41 (br s. 4H), 3.50 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.39 (dd, 2H), 7.54 (s, 1H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 3H), 8.52 (d, 1H), 9.18 (s, 1H), 9.34 (s, 1H); чистота ВЭЖХ: 97.97%; ЖХМС: 535 (M+).
N-(4-(4-(2,4-дихлорбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-6):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.37 (br s, 4H), 3.42 (br s, 4H), 3.50 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.39 (dd, 2H), 7.54 (s, 1H), 7.62-7.77 (m. 2H), 8.21-8.30 (m, 2H), 8.52 (d, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 97.97%; ЖХМС: 569 (M+).
N-(2-метил-4-(4-(4-(трифторметил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-7):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.37 (br s, 4H), 3.41 (br s, 4H), 3.53 (s, 2H), 6.97 (s, 2H), 7,06 (s, 1H), 7.46 (d, 2H), 7.62-7,77 (m, 4H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s. 1H), 9.21 (br s, 1H); чистота ВЭЖХ: 96.00%; ЖХМС: 569 (M++1).
N-(4-(4-(3,5-дихлорбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-8):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.37 (br s, 4H), 3.46 (s, 4H), 6.97 (s, 2H), 7.06 (s, 1H), 7.31 (s, 2H), 7.46 (s, 1H), 7.62-7.77 (m, 3Н), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99,45%; ЖХМС: 569 (M+)
N-(4-(4-(3-фторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-9):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.30 (br s, 4H), 3.41 (br s, 4H), 3.47 (s, 2H), 6.97 (s, 2H), 6.99-7.16 (m, 4H), 7.25-7.34 (m, 1H) 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 97.71%; ЖХМС: 519 (M++1).
N-(4-(4-(3,4-дихлорбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-10):

1H NMR (400 MHz, ДМСО-d6) δ 2.01 (s, 3Н), 2.25 (br s, 4H), 3.45 (s, 4H), 6.97 (s, 2H), 7.06 (m, 1H), 7.25 (d, 1H) 7.58 (t, 2H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 94.90%; ЖХМС: 569 (M+).
N-(4-(4-(3,5-дифторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-11):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.25 (br s, 4H), 3.45 (s, 4H), 3.52 (s, 2H), 6.97-7.10 (m, 5H), 7.62-7.77 (m, 3Н), 8.21-8.30 (m, 2H), 8.57 (d, 1H). 9.18 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 97.84%; ЖХМС: 536 (M++23).
N-(4-(4-(3-хлор-4-фторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-12):
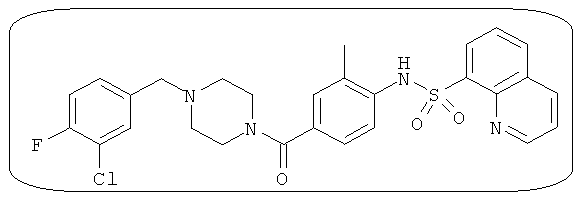
1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.25 (br s, 4H), 3.43 (s, 4H), 3.46 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.21-7.35 (m, 2H), 7.42 (d, 1H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.53 (d, 1H), 9.18 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 94.61%; ЖХМС: 553 (M+).
N-(4-(4-(4-хлор-2-фторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-13):
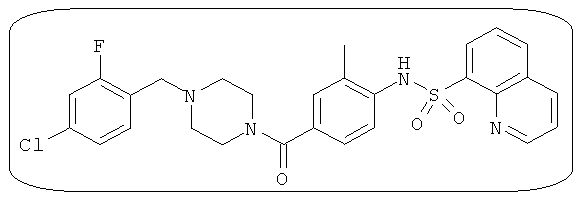
1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.25 (br s, 4H), 3,20 (br s, 2H), 3.45 (s, 4H), 6.97 (s, 2H), 7.06 (s, 1H), 7.21 (d, 1H), 7.31-7.39 (m. 2H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.21 (s, 1H); Чистота ВЭЖХ: 96.23%; ЖХМС: 553 (M+).
N-(4-(4-(2,4-дифторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-14):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.25 (br s, 4H), 3.20 (br s, 2H), 3.45 (s, 4H), 6.97-7.06 (m, 4H), 7.20 (t, 1H), 7.31-7.39 (m, 1H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 99.12%; ЖХМС: 537 (M++1).
N-(4-(4-(2,3-дихлорбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-15):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.25 (br s, 4H), 3.37 (s, 4H), 3.45 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.25 (t, 1H) 7.42 (d, 1H), 7.50 (d, 1H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s. 1H), 9,21 (s, 1H); чистота ВЭЖХ: 98.43%; ЖХМС: 569 (M+).
N-(4-(4-(2-фторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-16):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.30 (br s, 4H), 3.25 (s, 4H), 3.47 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.10-7.20 (m, 2H), 7.24-7.38 (m, 2H) 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 98.71%; ЖХМС: 519 (M++1).
N-(4-(4-(3-хлорбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-17):

1H NMR (400 MHz, ДМСО-d6) δ 2.01 (s, 3Н), 2.37 (br s, 4H), 3.37 (br s, 4H), 3.44 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.20-7.29 (m, 4H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.56 (d, 1H), 9.18 (s, 1H), 9.34 (s, 1H); чистота ВЭЖХ: 99.25%; ЖХМС: 535 (M+).
N-(4-(4-(2,3-дифторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-18):

1H NMR (400 MHz, ДМСО-d6) δ 2.01 (s, 3Н), 2.25 (br s, 4H), 3.46 (br s, 4H), 3.59 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.25-7.36 (m, 2H), 7.63-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 96.79%; ЖХМС: 537 (M++1).
N-(4-(4-(циклопропилметил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-19):

1H NMR (400 MHz, ДМСО-d6) δ: 0.03-0.05 (m, 2H), 0.30-0.31 (m, 2H), 0.45-0.47 (m, 1H), 2.01 (s, 3Н), 2.17 (d, 2H), 2.25 (br s, 4H), 3.22 (br s, 4H), 3.59 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.63-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.21 (s, 1H); Чистота ВЭЖХ: 98.31%; ЖХМС: 465 (M++1).
N-(2-метил-4-(4-(пиридин-4-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-20):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.25 (br s, 4H), 3.46 (br s, 4H), 3.50 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.31 (m, 2H), 7.63-7.77 (m, 3H), 8.21-8.30 (m, 2H). 8.54 (d, 1H), 8.58 (d, 1H), 9.18 (s, 1H), 9.21 (br s, 1H); чистота ВЭЖХ: 94.88%; ЖХМС: 502 (M++1).
N-(4-(4-(3,5-дифторбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-21):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.52 (br s, 4H), 3.58 (s, 2H), 7.01-7,18 (m, 4H), 7.38 (t, 1H), 7.71-7.82 (m, 3H), 8.32 (t, 2H), 8,60 (d, 1H), 9.12 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 98.93%; ЖХМС: 541 (M++1).
N-(4-(4-(4-хлорбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-22):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.28 (br s, 4H), 3.55 (br s, 2H), 7.08 (t, 2H), 7.35-7.40 (m, 4H), 7.71-7.80 (m, 3H), 8.32 (t, 2H), 8.60 (d, 1H), 9.18 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 98.58%; ЖХМС: 539 (M+).
N-(4-(4-(2,4-дихлорбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-23):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 3H), 3.46 (br s, 4H), 3.58 (s, 2H), 7.08 (t, 2H), 7.35 (t, 1H), 7.40 (d, 1H), 7.50 (d, 1H), 7.60 (s, 1H), 7.71-7.79 (m, 2H), 8.32 (t, 2H), 8.60 (d, 1H), 9.18 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 98.58%; ЖХМС: 573 (M+).
N-(4-(4-(3,5-дихлорбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-24):
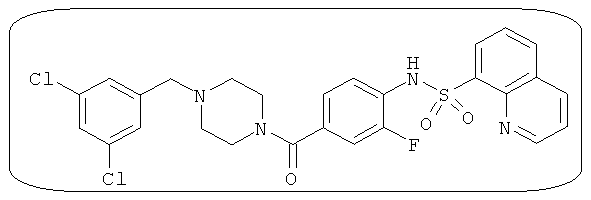
1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.28 (br s, 4H), 3.55 (br s, 2H), 7.10 (t, 2H), 7.30-7.38 (m, 3Н), 7.50 (s, 1Н), 7.71-7.80 (m, 2H), 8.32 (t, 2H), 8.58 (d, 1Н), 9.18 (s, 1Н), 9.98 (s, 1Н); чистота ВЭЖХ: 97.63%; ЖХМС: 573 (M+).
N-(4-(4-(3-хлор-4-фторбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-25):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (brs, 3Н), 3.28 (brs, 4H), 3.55 (s, 2H), 7.10 (t, 2H), 7.29-7.40 (m, 3Н), 7.50 (d, 1Н), 7.71-7.80 (m, 2H), 8.30 (t, 2H), 8.60 (d, 1Н), 9.18 (s, 1Н), 9.98 (s, 1Н); чистота ВЭЖХ: 96.66%; ЖХМС: 557 (M+).
N-(2-фтор-4-(4-(4-(трифторметил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-26):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.46 (br s, 4H), 3.60 (s, 2H), 7.10 (t, 2H), 7.35 (t, 1Н), 7.59 (d, 2H), 7.63-7.78 (m, 4H), 8.32 (t, 2H), 8.60 (d, 1Н), 9.18 (s, 1Н), 9.98 (s, 1Н); чистота ВЭЖХ: 99.96%; ЖХМС: 573 (M++1).
N-(4-(4-(3,4-дихлорбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-27):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 3H), 3.28 (br s, 4H), 3.55 (s, 2H), 7.10 (t, 2H), 7.28-7.40 (m, 2H), 7.58 (t, 2H), 7.70-7.79 (m, 2H), 8.32 (t, 2H), 8.60 (d, 1H), 9.18 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 98.23%; ЖХМС: 573 (M+).
N-(2-фтор-4-(4-(2-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-28):
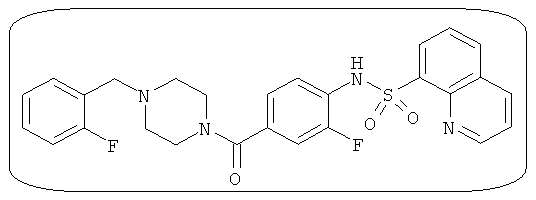
1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.48 (br s, 4H), 3.58 (s, 2H), 7.05-7.20 (m, 3H), 7.28-7.40 (m, 2H), 7.70-7.79 (m, 2H), 8.32 (t, 2H), 8.60 (d, 1H), 9.18 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 96.54%; ЖХМС: 523 (М+).
N-(4-(4-(2,4-дифторбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-29):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.22 (br s, 4H), 3.58 (s, 2H), 7.03-7.20 (m, 3H), 7.20 (t, 1H), 7.38 (t, 1H), 7.44 (q, 1H), 7.70-7.79 (m, 2H), 8.32 (t, 2H), 8.60 (d, 1H), 9.18 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 99.52%; ЖХМС: 541 (M++1).
N-(4-(4-(2,3-дихлорбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-30):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.22 (br s, 4H), 3.58 (s, 2H), 7.12 (m, 3H), 7.31-7.40 (m, 1H), 7.44 (d, 1H), 7.60 (d, 1H), 7,70-7.79 (m, 2H), 8.32 (t, 2H), 8.60 (d, 1H), 9.12 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 97.43%; ЖХМС: 573 (M+).
N-(4-(4-(4-хлор-2-фторбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-31):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 3Н), 3.22 (br s, 4H), 3.58 (s, 2H), 7.10 (t, 2H), 7.23-7.46 (m, 4H), 7.70-7.79 (m, 2H), 8.32 (t, 2H), 8.60 (d, 1H), 9.18 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 99.89%; ЖХМС: 557 (М+).
N-(4-(4-(2,3-дифторбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-32):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 3H), 3.26 (br s, 4H), 3.58 (s, 2H), 7.03-7.25 (m, 4H), 7.38 (t, 2H), 7.70-7.79 (m, 2H). 8.32 (t, 2H), 8.60 (d, 1H), 9.12 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 99.04%; ЖХМС: 541 (M++1).
N-(4-(4-(циклопропилметил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-33):

1H NMR (400 MHz, ДМСО-d6) δ: 0.03-0.035 (m, 2H), 0.64-0.66 (m, 2H), 0.81-0.83 (m, 1H), 2.20 (s, 2H), 2.38 (br s, 4H), 3.52 (br s, 4H), 7.10 (m, 2H), 7.38 (t, 1H), 7.70-7.79 (m, 2H), 8.32 (t, 2H), 8.60 (d, 1H), 9.12 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 97.67%; ЖХМС: 469 (M++1).
N-(2-фтор-4-(4-(пиридин-4-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-34):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.48 (br s, 4H), 3.59 (s, 2H), 7.12 (t, 2H), 7.38 (s, 3H), 7.70-7.79 (m, 2H), 8.32 (t, 2H), 8.57 (d, 2H), 8.60 (d, 1H), 9.10 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 97.70%; ЖХМС: 506 (M++1).
N-(2-фтор-4-(4-(пиридин-2-илметил)пиперазин-l-карбонил)фенил)хинолин-8-сульфонамид (XIV-35):

1H NMR (400 MHz, ДМСО-d6) δ: 2.38 (br s, 4H), 3.22 (br s, 4H), 3.62 (s, 2H), 7.13 (t, 2H), 7.22-7.38 (m, 2H), 7.42 (d, 1H), 7.70-7.79 (m, 3H), 8.32 (t, 2H), 8.50 (s, 1H), 8.60 (d, 1H), 9.18 (s, 1H), 9.98 (s, 1H); чистота ВЭЖХ: 99.74%; ЖХМС: 506 (M++1).
N-(2-метил-4-(4-(пиридин-2-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-36):
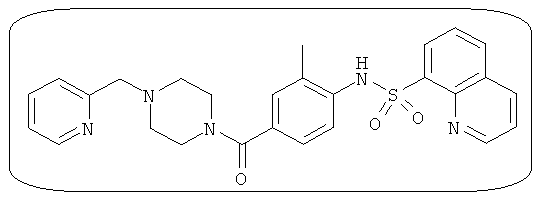
1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.38 (br s, 4H), 3.52 (br s, 4H), 3.60 (s, 2H), 6,97 (s, 2H), 7.03 (s, 1H). 7.23 (t, 1H), 7.40 (d, 1H), 7.64-7.78 (m, 4H), 8.25 (dd, 2H), 8.46 (d, 1H), 8.58 (d, 1H), 9.08 (s, 1H); чистота ВЭЖХ: 98.36%; ЖХМС: 502 (M++1).
N-(2-метил-4-(4-(1-фенилэтил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-37):
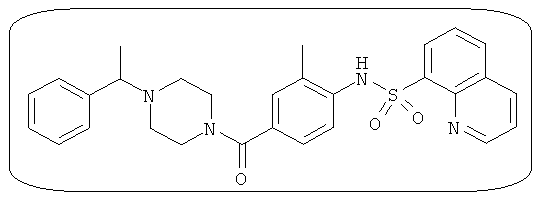
1H NMR (400 MHz, ДМСО-d6) δ: 1.21 (d, 3H), 2.01 (s, 3H), 2.18-2.40 (m, 4H), 3.42 (br s, 4H), 3.46 (q, 1H), 6.90 (s, 2H), 7.01 (s, 1H), 7.18-7.34 (m, 5H), 7.64-7.78 (m, 2H), 8.25 (dd, 2H), 8.38 (d, 1H). 9.18 (s, 1H), 9.31 (s, 1H); чистота ВЭЖХ: 99.85%; ЖХМС: 515 (M++1).
N-(2-метил-4-(4-(2-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-38):

1H NMR (400 MHz, ДМСО-d6) δ: 1.15 (d, 3H), 2.01 (s, 3H), 2.20-2.38 (m, 6Н), 3.48 (br s, 4H), 3.85 (q, 1H), 6.97 (s, 2H), 7.01 (s, 1H), 7.05-7.30 (m, 5H), 7.62-7.76 (m, 2H), 8.25 (dd, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 9.31 (br s, 1H); чистота ВЭЖХ: 95.95%; ЖХМС: 529 (М++1).
N-(2-метил-4-(4-(3-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-39):

1H NMR (400 MHz, ДМСО-d6) δ: 1.62 (m, 2H), 2.01 (s, 3H), 2.18-2.40 (m, 6H), 2.56 (br s, 2H), 3.43-3.56 (m, 4H), 6.97 (s, 2H), 7.01 (s, 1H), 7.13-7.28 (m, 5H), 7.64-7.78 (m, 2H), 8.25 (dd, 2H), 8,56 (d, 1H), 9.10 (s, 1H), 9.31 (s, 1H); чистота ВЭЖХ: 98.98%; ЖХМС: 529 (M++1).
N-(2-метил-4-(4-фенэтилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-40):

1H NMR (400 MHz, CDCl3) δ 2.01 (s, 3H), 2.38 (br s, 4H), 2.58 (t, 2H), 2.65 (t, 2H), 3.50 (br s, 4H), 6.97 (s, 2H), 7.01 (s, 1H), 7.15-7.28 (m, 5H), 7.62-7.78 (m, 2H), 8.25 (dd, 2H), 8.38 (d, 1H), 9.18 (s, 1H), 9.31 (brs, 1H); ЖХМС: 515 (M++1); чистота ВЭЖХ: 97.07%.
N-(3-метокси-4-(4-фенэтилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-41):

1H NMR (400 MHz, ДМСО-d6) δ 2.21-2.58 (m, 6H), 2.73-2.79 (m, 2H), 3.18 (d, 2H), 3.66 (s, 3H), 6.38 (d, 1H), 6.87 (d, 2H), 7.19-7,30 (m, 4H), 7.59-7.62 (m, 2H), 8.02 (d, 1H), 8.25 (d, 2H), 8.35 (d, 1H), 8.42 (s, 2H), 9.18 (d, 1H); чистота ВЭЖХ: 99.42%; ЖХМС: 531 (M++1).
N-(3-метокси-4-(4-(1-фенилэтил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-42):
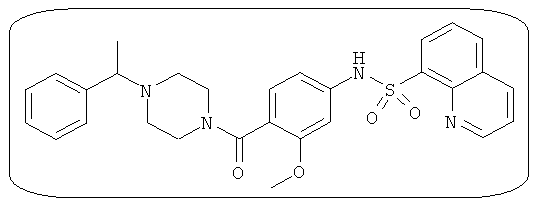
1H NMR (400 MHz, CDCl3) δ: 1.34 (d, 3H), 2.15-2.40 (m, 4H), 3.20 (br s, 4H), 3.35 (q, 1H), 3.62 (s, 3H), 6.35 (d, 1H), 6.82 (d, 2H), 7.18-7.28 (m, 3H), 7.58-7.62 (m, 2H), 8.02 (d, 1H), 8,28 (d, 1H), 8.35 (d, 1H), 8.41 (s, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 97.00%; ЖХМС: 531 (M++1).
N-(3-метокси-4-(4-(2-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-43):

1H NMR (400 MHz, CDCl3) δ: 1.21 (d, 3Н), 2.12-2.45 (m, 6H), 2,84-2.93 (m, 1H), 3.10 (br s, 4H), 3.62 (s, 3Н), 6.37 (d, 1H), 6.82 (d, 2H), 7.18 (d, 2H), 7.28 (d, 2H), 7.58-7.62 (m, 2H), 8.02 (d, 1H), 8.28 (d, 1H), 8.35 (d, 1H), 8.41 (s, 1H), 9.18 (d. 1H); чистота ВЭЖХ: 99.00%; ЖХМС: 545 (М++1).
N-(3-метокси-4-(4-(3-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-44):

1H NMR (400 MHz, CDCl3) δ: 1.78 (pentate, 2H), 2.20 (br s, 2H), 2.35 (t, 4H), 2.60 (t, 2H), 3.15 (m, 4H), 3.62 (s, 3Н), 6.35 (d, 1H), 6.84 (d, 2H), 7,10-7.28 (m, 4H), 7.58-7.62 (m, 2H), 8.02 (d, 1H), 8.28 (d, 1H), 8.35 (d, 1H), 8.41 (s, 1H), 9.18 (d, 1H); Чистота ВЭЖХ: 99.00%; ЖХМС: 545 (M++1).
N-(2-фтор-4-(4-фенэтилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-45):

1H NMR (400 MHz, CDCl3) δ: 2.44 (m, 4H), 2.59 (br s, 2H), 2.76 (d, 2H), 3.40 (br s, 2H), 3.62 (br s, 2H), 6.90 (d, 1H), 7.01 (d, 1H), 7.12-7.30 (m, 4H), 7.58-7.62 (m, 2H), 7.70 (t, 1H), 8.02 (d, 1H), 8.28 (d, 1H), 8.37 (d, 1H), 8.81 (br s, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 96.00%; ЖХМС: 519 (M++1).
N-(2-фтор-4-(4-(1-фенилэтил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-46):

1H NMR (400 MHz, CDCl3) δ: 1.31 (d, 3Н), 2.38 (br s, 4H), 3.36 (q, 3Н), 3.58 (br s, 2H), 6.82 (d, 1H), 7.00 (d, 1H), 7.18-7.30 (d, 5H), 7,58-7.62 (m, 2H), 7.70 (t, 1H), 8.02 (d, 1H), 8.28 (d, 1H), 8.35 (d, 1H), 8.41 (s, 1H), 8.80 (br s, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 99.00%; ЖХМС: 519 (M++).
N-(2-фтор-4-(4-(2-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-47):

1H NMR (400 MHz, CDCl3) δ: 1.21 (d, 3Н), 2.20-2.55 (m, 6H), 2.84 (m, 1H), 3.35 (br s, 2H), 3.58 (br s, 2H), 6.82 (d, 1H), 7.01 (d, 1H), 7.12-7.28 (m, 4H), 7.58-7.62 (m, 3Н), 7.70 (t, 1H), 8.02 (d, 1H), 8.28 (d, 1H), 8.35 (d, 1H), 8.80 (br s, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 97.00%; ЖХМС: 533 (M++1).
N-(2-фтор-4-(4-(3-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-48):

1H NMR (400 MHz, CDCl3) δ: 1.77 (pentate, 2H), 2.20-2.42 (m, 6H), 2,62 (t, 2H), 3.40 (br s, 2H), 3.60 (br s, 2H), 6.90 (d, 1H), 7.01 (d, 1H), 7.12-7.30 (m, 4H), 7.58-7.62 (m, 2H), 7.70 (t. 1H), 8.02 (d, 1H), 8.28 (d, 1H), 8.37 (d, 1H), 8.81 (br s, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 98.00%; ЖХМС: 533 (M++1).
N-(2-метил-4-(4-((3-(трифторметил)пиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-49):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.14 (br s, 2H), 3.46 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.51 (t, 1H), 7.62-7.77 (m, 2H), 8.17 (d, 1H), 8.25 (dd, 2H), 8.58 (d, lH),8.78(s, lH),9.18(s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 97.97%; ЖХМС: 592 (M++23).
N-(2-метил-4-(4-((4-(трифторметил)пиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-50):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.46 (br s, 4H), 3.64 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.62-7.77 (m, 3H), 8.20-8.30 (m, 2H), 8.56 (d, 1H), 8.78 (s, 1H), 8.90 (s. 1H), 9.18 (s, 1H), 9.39 (br s, 1H); чистота ВЭЖХ: 98,71%; ЖХМС: 570 (М++1).
N-(4-(4-((5-хлорпиридин-3-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-51):

1H NMR (400 MHz, ДМСО-d6) δ: 2,01 (s, 3H), 2.37 (br s, 4H), 3.26 (br s, 4H), 3.51 (s, 2H), 6.98 (s, 2H), 7.06 (s, 1H), 7.62-7.77 (m, 2H), 7.81 (s, 1H), 8.25 (dd, 2H), 8.41 (s, 1H), 8.50 (s, 1H), 8.58 (d, 1H), 9.11 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.11%; ЖХМС: 536 (M+).
N-(4-(4-((3-фторпиридин-2-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-52):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.21 (br s, 2H), 3.46 (br s, 2H), 3.64 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.37-7.41 (m, 1H), 7.62-7.77 (m, 3H), 8.22 (d, 1H), 8.27 (d, 1H), 8.36 (s, 1H), 8.58 (d, 1H), 9.10 (s, 1H), 9.38 (s, 1H); чистота ВЭЖХ: 99.15%; ЖХМС: 520 (M++1).
N-(4-(4-(циклогексилметил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-53):
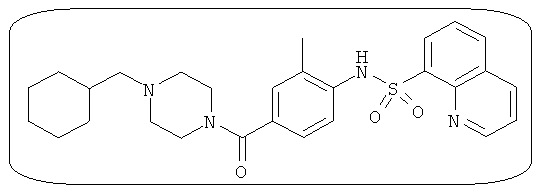
1H NMR (400 MHz, ДМСО-d6) δ: 0.72-0.90 (m, 2H), 1.05-1.21 (m, 4H), 1.41 (br s, 1H), 1.56-1.74 (m, 4H), 2.01 (s, 3H), 2.25 (br s, 5H), 3.20 (br s, 2H), 3.46 (br s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.62-7.77 (m, 2H), 8.25 (dd, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 9.39 (br s, 1H); чистота ВЭЖХ: 94.98%; ЖХМС; 507 (M++1).
N-(2-метил-4-(4-(пиридин-3-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-54):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.30 (br s, 4H), 3.41 (br s, 4H), 3.46 (s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.31 (t, 1H), 7.62-7.77 (m, 2H), 8.25 (dd, 2H), 8.42 (s, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); Чистота ВЭЖХ: 96.73%; ЖХМС: 502 (M++1).
N-(2-метил-4-(4-((1-фенилциклопропил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-55):

1H NMR (400 MHz, ДМСО-d6) δ: 0.65 (s, 2H), 0.78 (s, 2H), 2.01 (s, 3Н), 2.36 (br s, 4H), 2.63 (br s, 2H), 3.41 (br s, 4H), 6.97 (s, 2H), 7.06 (s, 1H), 7.12 (t, 1H), 7.20-7.28 (m, 4H), 7.62-7.77 (m, 2H), 8.25 (dd, 2H), 8.58 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); Чистота ВЭЖХ: 96.19%; ЖХМС: 541 (M++1).
N-(2-фтор-4-(4-(3-фторбензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-56):

1H NMR (400 MHz, ДМСО-d6) δ: 2.45 (s, 4H), 3.56 (br s, 4H), 3.66 (s, 2H), 7.06-7.26 (m, 4H), 7.28-7.39 (m, 2H), 7.62-7,79 (m, 3Н), 8.21-8.36 (m, 2H), 8.57 (d. 1H), 9.18 (s, 1H), 9..85 (s, 1H); Чистота ВЭЖХ: 93.25%; ЖХМС: 522.57 (M+).
N-(4-(4-(3-хлорбензил)пиперазин-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-57):

1H NMR (400 MHz, ДМСО-d6) δ: 2.25 (s, 4H), 3.41 (br s, 4H), 3.47 (s, 2H), 7.01-7.09 (m, 2H), 7.22-7.36 (m, 5H), 7.61-7.78 (m, 2H), 8.21-8.38 (m, 2H), 8.55-8.60 (m, 1H), 9.01 (s, 1H), 9.9 (s, 1H) Чистота ВЭЖХ; 97.30%; ЖХМС: 539 (M+).
N-(4-(4-(2,4-дихлорбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-58):

1H NMR (400 MHz, ДМСО-d6) δ: 2.20-2.39 (m, 4H), 3.41 (br s, 4H), 3.46 (s, 2H), 3.56 (s, 3H), 6.61-6.81 (m, 3H), 7.36-7.60 (m, 3H), 7.62-7,67 (m, 2H), 8.25 (d, 1H), 8.41-8.58 (m, 2H), 9.18 (s, lH),10.25(s, 1H); чистота ВЭЖХ: 98.16%; ЖХМС; 585.50 (M+).
N-(4-(4-(3,5-дихлорбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-59):

1H NMR (400 MHz, ДМСО-d6) δ: 2.20-2.39 (m, 4H), 3.26 (br s, 4H), 3.46 (s, 2H), 3.56 (s, 3H) 6.61-6.85 (m, 3H), 7.26 (s, 2H), 7.45 (s, 1H), 7.63-7.78 (m, 2H), 8.20-8.60 (m, 3H), 9.18 (s, 1H), 10.25 (s, 1H); чистота ВЭЖХ: 97.92%; ЖХМС: 584.1 (M+).
N-(4-(4-(3-хлор-4-фторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-60):

1H NMR (400 MHz, ДМСО-d6) δ: 2.20-2.39 (m, 4H), 3.26 (br s, 4H), 3.46 (s, 2H), 3.56 (s, 3H), 6.61-6.85 (m, 3H), 7.21-7.55 (m, 3H), 7.62-7.75 (m, 2H), 8.21-8.60(m, 3H), 9.18 (s, 1H),10.25 (s, 1H); чистота ВЭЖХ: 98.4%; ЖХМС: 569 (M+).
N-(3-метокси-4-(4-(4-(трифторметил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-61):

1H NMR (400 MHz, ДМСО-d6) δ: 2.20-2.39 (m, 4H), 2.97 (br s, 4H), 3.46 (s, 2H), 3.56 (s, 3H), 6.61-6.85 (m, 3H), 7.42-7.58 (m, 2H), 7.61-7.78 (m, 4H), 8.21-8.60 (m, 3H), 9.18 (s, 1H), 10.25 (s, 1H); чистота ВЭЖХ: 99.24%; ЖХМС: 584.6 (M+).
N-(4-(4-(3,4-дихлорбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-62):

1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 2.97 (br s, 4H), 3.46 (s, 2H), 3.56 (s, 3H), 6.61-6.85 (m, 3H), 7.25 (d, 1H), 7.45-7.60 (m, 2H), 7,63-7.80 (m, 2H), 7.62-7.77 (m, 3H), 8.21-8,60(m, 3H), 9.18 (s, 1H), 10.25 (s, 1H), чистота ВЭЖХ: 98.45%; ЖХМС: 585.50 (M+).
N-(4-(4-(2-фторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-63):

1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 2.97 (br s, 4H), 3.46 (s, 2H), 3.56 (s, 3H), 6.61-6.85 (m, 3H), 7.06-7,45 (m, 4H), 7.71 (s, 2H), 8.21-8.60 (m, 3H), 9.18 (s, 1H), 10.25 (s, 1H) чистота ВЭЖХ: 98.29%; ЖХМС: 534.8 (M+).
N-(4-(4-(2,4-дифторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-64):

1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 2.97 (br s, 4H), 3.46 (s, 2H), 3.56 (s, 3H), 6.61-6.85 (m, 3H), 7.01-7.21 (m, 2H), 7.35-7.42 (m, 1H), 7.62-7.78 (m, 2H), 8.21-8.60 (m, 3H), 9.18 (s, 1H), 10.25 (s, 1H) чистота ВЭЖХ: 99.00%; ЖХМС: 552.59 (M+).
N-(4-(4-(2,3-дихлорбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-65):

1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 3.21 (br s, 4H), 3.46 (s, 2H), 3.61 (s, 3H), 6.61-6.85 (m, 3H), 7.35-7.59 (m, 3H), 7.63-7.75 (m, 2H), 8.21-8.60 (m, 3H), 9.18 (s, 1H), 10.25 (s, 1H); чистота ВЭЖХ: 99.17%; ЖХМС: 585,50 (M+).
N-(4-(4-(4-хлор-2-фторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-66):

1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 3.25 (br s, 4H), 3.46 (s, 2H), 3.61 (s, 3Н), 6.61-6.85 (m, 3Н), 7.22-7.42 (m, 3Н), 7.65-7.75 (m, 2H), 8.21-8.60 (m, 3Н), 9.18 (s, 1H), 10.25 (s, 1H); чистота ВЭЖХ: 91.3%; ЖХМС: 569 (M+).
N-(4-(4-(2,3-дифторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-67):
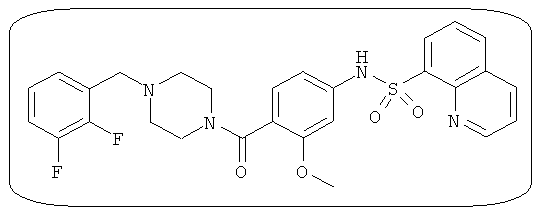
1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 3.21 (br s, 4H), 3.46 (s, 2H), 3.61 (s, 3Н), 6.61-6.85 (m, 3Н), 7.12-7.40 (m, 3Н), 7.65-7.75 (m, 2H), 8.21-8.62 (m, 3Н), 9.18 (s, 1H), 10.25 (s, 1H); чистота ВЭЖХ: 98.39%; ЖХМС: 552.5 (M+).
N-(4-(4-(циклопропилметил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-68):

1Н NMR (400 MHz, ДМСО-d6) δ: 0.10-0.15 (m, 2H), 0.70-0.82 (m, 1H), 1.20-1.30 (m, 2H), 2.02-2.42 (m, 6H), 2.90-3.05 (m, 4H), 3.63 (s, 3Н), 6.61-6.85 (m, 3H), 7.65-7.75 (m, 2H), 8.21-8.60 (m, 3Н), 9.18 (s, 1H), 10.25 (s, 1H), чистота ВЭЖХ: 98%; ЖХМС: 480.5 (М+).
N-(4-(4-((5-хлорпиридин-3-ил)метил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид(XIV-69):
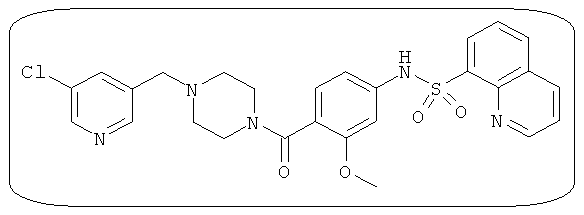
1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 3.21 (br s, 4H), 3.46 (s, 2H), 3.61 (s, 3Н), 6.61-6.85 (m, 3Н), 7.62-7.83 (m, 3Н), 8.21-8.60 (m, 5H), 9.18 (s, 1H), 10.25 (s, 1H); чистота ВЭЖХ: 96.1%; ЖХМС: 551 (M+).
N-(4-(4-((3-фторпиридин-2-ил)метил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-70):

1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 3.21 (br s, 4H), 3.46 (s, 2H), 3.61 (s, 3Н), 6.61-6.85 (m, 3Н), 7.38-4.42 (m, 1H), 7.61-7.78 (m, 3Н), 8.21-8.60 (m, 4H), 9.18 (s, 1H).10.25 (s,lH); чистота ВЭЖХ: 99.54%; ЖХМС: 535.5 (M+).
N-(3-метокси-4-(4-((4-(трифторметил)пиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-71):
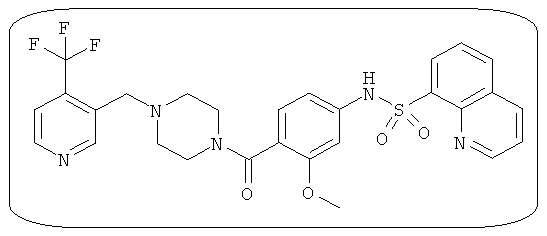
1H NMR (400 MHz, ДМСО-d6) δ: 2.08-2.39 (m, 4H), 3.15 (br s, 4H), 3.46 (s, 2H), 3.61 (s, 3Н), 6.61-6.85 (m, 3Н), 7.62-7.77 (m, 3Н), 8.21-8.60 (m, 3Н), 8.70-8,90 (m, 2H),9.18 (s, 1H),10.25(s, 1H); чистота ВЭЖХ: 98.48%; ЖХМС: 585.6 (M+).
N-(3-метокси-4-(4-((3-(трифторметил)пиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-72):

1H NMR (400 MHz, ДМСО-d6) δ: 2.25 (br s, 4H), 2.85 (br s, 2H), 3.42 (br s, 2H), 3.58 (s, 3H), 3.76 (br s, 2H), 6.60 (d, 1H), 6.78 (s, 1H), 6.92 (d, 1H), 7.46 (t, 1H), 7.63-7.70 (m, 2H), 8.18 (d, 1H), 8.22 (d, 1H), 8.37-8.45 (dd, 2H), 8.78 (d, 1H), 9.18 (s, 1H), 10.29 (s, 1H); чистота ВЭЖХ: 95.85%; ЖХМС: 586.1 (M++1).
N-(4-(4-((3-метоксипиридин-2-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-73):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.39 (br s, 4H), 3.46 (s, 4H), 3.61 (s, 2H), 3.79 (s, 3H), 6.97 (s, 2H), 7.06 (s, 1H), 7.22-7.32 (s, 1H), 7.39 (d, 1H), 7.64-7.81 (m, 2H), 8.12 (d, 1H), 8.21-8.36 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.29%; ЖХМС: 532 (М+).
N-(4-(4-((4-метоксипиридин-3-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-74):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.46 (br s, 6H), 3.79 (s, 3H), 6.97-7.06 (m, 3H), 7.10 (s, 1H), 7.66-7.79 (m, 2H), 8.21-8.38 (m, 4H), 8.57 (d, 1H), 9.16 (s, 1H), 9,39 (s, 1H); чистота ВЭЖХ: 98.22%; ЖХМС: 532 (M++1).
N-4-(4-((5-фторпиридин-3-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-75):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.25 (s, 4H). 3.58 (s, 2H), 6.96 (s, 2H), 7.06 (s, 1H), 7.60-7.79 (m, 3H), 8.21-8.30 (m, 3H), 8.43 (s, 1H), 8.57 (d, 1H), 9.16 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 94.48%; ЖХМС: 520.3 (М++1.
N-(4-(4-((5-фторпиридин-3-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-76):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.25 (s, 4H), 3.58 (s, 2H), 6.96 (s, 2H), 7.06 (s, 1H), 7.42 (t, 1H), 7.60-7.79 (m, 2H), 8.21-8.30 (m, 3H), 8.46 (s, 1H), 8.57 (d, 1H), 9.16 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.87%; ЖХМС: 520.3 (M++1).
N-(4-(4-(2-фтор-4-метоксибензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-77):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.25 (br s, 4H). 3.58 (s, 2H), 3.76 (s, 3H), 6.65-6.78 (m, 2H), 6.96 (s, 2H), 7.06 (s, 1H), 7.21 (t, 1H), 7.61-7.79 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.16 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.37%; ЖХМС: 549.3 (M++1).
N-(4-(4-((3-хлорпиридин-4-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-78):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.24 (br s, 4H), 3.59 (br s, 2H), 6.97 (s, 2H), 7.06 (s, 1H), 7.46 (d, 1H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.44 (d, 1H), 8.52-8.60 (m, 2H), 9.16 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.46%; ЖХМС: 536 (M+).
N-(4-(4-(3-фтор-4-метоксибензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-79):
1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.25 (s, 4H), 3.58 (s, 2H), 3.79 (s, 3H), 6.96-7.18 (m, 6H), 7.60-7.78 (m, 2H), 8.21-8.36 (m, 2H), 8.57 (d, 1H), 9,16 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.01%; ЖХМС: 549.3 (М++1).
N-(4-(4-(2,4-дифторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-80):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.31 (s, 6H), 3.56 (s, 3H), 6.75 (s, 1H), 6.81 (d, 1H), 7.05 (t, 1H), 7.20 (t, 1H), 7.37-7.42 (m, 2H), 7.66-7.79 (m, 2H), 8.25 (d, 2H), 8.57 (d, 1H), 9.13 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 99.51%; ЖХМС: 553 (M+).
N-(4-(4-(2,3-дифторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-81):
1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.31 (br s, 6H), 3.58 (s, 3H), 6.75 (s, 1H), 6.81 (d, 1H), 7.05-7.12 (m, 1H), 7.22-7.38 (m, 1H), 7.41 (d, 1H), 7.66-7.79 (m, 2H), 8.25 (d, 2H), 8.57 (d, 1H), 9.13 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 96.99%; ЖХМС: 553 (M+).
N-(4-(4-(4-хлор-2-фторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-82):
1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.31 (s, 6H), 3.58 (s, 3H), 6.75 (s, 1H), 6.81 (d, 1H), 7.21 (d, 1H), 7.33-7.44 (m, 3H), 7.66-7,79 (m, 2H), 8.25 (d, 2H), 8.57 (d, 1H), 9.13 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 97.45%; ЖХМС: 553 (M+).
N-(4-(4-(3,4-дихлорбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-83):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.31 (br s, 6H), 3.55 (s, 3H), 6.75 (s, 1H), 6.81 (d, 1H), 7.23 (d, 1H), 7.42 (d, 1H), 7.55-7.61 (m, 2H), 7.66-7.79 (m, 2H), 8.25 (d, 2H), 8.57 (d, 1H), 9.13 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 99.49%; ЖХМС: 585 (M+).
N-(4-(4-(3,5-дихлорбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-84):

1H NMR (400 MHz, ДМСО-d6) δ 2.37 (br s, 4H), 3,31 (br s, 6H), 3.55 (s, 3H), 6.75 (s, 1H), 6.81 (d, 1H), 7.38 (s, 1H), 7.42-7.50 (m, 3H), 7.66-7.79 (m, 2H), 8.25 (d, 2H), 8.59 (d, 1H), 9.13 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 99.43%; ЖХМС: 585 (М+).
N-(4-(4-(2,4-дихлорбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-85):

lH NMR (400 MHz, ДМСО-d6) δ 2.37(brs,4H),3.31 (brs, 4H), 3.41 (s, 2H), 3.57 (s, 3H), 6.75 (s, 1H), 6.81 (d, 1H), 7.38-7.59 (m, 4H), 7,64-7.79 (m, 2H), 8.25 (d, 2H), 8.59 (d, 1H), 9.13 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 99.87%; ЖХМС: 585 (М+).
N-(2-метокси-4-(4-(2-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-86):

1H NMR (400 MHz, ДМСО-d6) δ: 1.18 (d, 3H), 2.37 (brs, 4H), 2.41 (m, 1H), 2.46 (br s, 4H), 3.36 (br s, 2H), 3.41 (s, 3H), 6.75 (s, 1H), 6.81 (d, 1H), 7.16-7.36 (m, 5H), 7.41 (d, 1H), 7.62-7.77 (m, 2H), 8.24 (d, 2H). 8.57 (d, 1H), 9.18 (s, 1H). 9.39 (s, 1H); чистота ВЭЖХ: 99.41%; ЖХМС: 545 (M+).
N-(2-метокси-4-(4-(3-фенилпропил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-87):
1H NMR (400 MHz, ДМСО-d6) δ: 1.65 (t, 2H), 2.27-2.38 (m, 6H), 2.52-2.58 (m, 2H), 3.36 (br s, 6H), 3.41 (br s, 5H), 6.75 (s, 1H), 6.81 (d, 1H), 7.16-7.32 (m, 5H), 7.41 (d, 1H), 7.62-7.77 (m, 2H), 8.24 (d, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99,69%; ЖХМС: 545 (M+).
N-(2-метокси-4-(4-фенэтилпиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-88):
1H NMR (400 MHz, ДМСО-d6) δ: 2.39 (s, 4H), 2.61-2.72 (m, 2H), 3.36 (br s, 6H), 3,41 (s, 3H), 6.75 (s, 1H), 6.81 (d, 1H), 7.16-7.32 (m, 5H), 7.41 (d, 1H), 7.62-7.77 (m, 2H), 8.24 (d, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.41%; ЖХМС: 545 (M++1).
N-(4-(4-((5-фторпиридин-2-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-89):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.39 (br s, 4H), 3.31 (br s, 4H), 3.61 (s, 2H), 6.98-7.08 (m, 3H), 7.44-7.56 (m, 2H), 7.62-7.79 (m, 3H), 8,21-8.32 (m, 2H). 8.41 (s, 1H), 8.56-8.60 (m, 1H), 9.16 (s, 1H), 9.38 (s, 1H); чистота ВЭЖХ: 99.82%; ЖХМС: 520 (M++1).
N-(4-(4-(2,4-диметоксибензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-90):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.31 (br s, 4H), 3.42 (s, 2H), 3.76 (s, 6H), 6.42 (d, 1H), 6.52 (s, 1H), 6.97-7.18 (m, 4H), 7.64-7.79 (m, 2H), 8.21-8.36 (m, 2H), 8.59 (d, 1H), 9.16 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 94.33%; ЖХМС: 561 (М++1).
N-(4-(4-(2-фторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-91):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.42 (s, 2H), 3.56 (s, 3H), 6.79 (s, 1H), 6.82 (d, 1H), 7.15-7.19 (m, 4H), 7.21-7.44 (m, 3H), 8.24 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 97.44%; ЖХМС: 535 (М+).
N-(4-(4-(3-хлор-4-фторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-92):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.42 (s, 2H), 3.56 (s, 3H), 6.79 (s, 1H), 6.82 (d, 1H), 7.21-7.45 (m, 4H), 7.62-7.78 (m, 2H), 8.24 (d, 2H), 8.57 (d, 1H), 9.16 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 99.19%; ЖХМС: 569 (M+).
N-(4-(4-(2,3-дихлорбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-93):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.42 (s, 2H), 3.59 (s, 3H), 6.79 (s, 1H), 6.82 (d, 1H), 7.24-7.58 (m, 4H), 7.62-7.78 (m, 2H), 8.24 (d, 2H), 8.57 (d, 1H), 9.16 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 99,80%; ЖХМС: 585 (M+).
N-(2-метокси-4-(4-(пиридин-3-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-94):
1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.32 (s, 4H), 3.42 (s, 3H), 3.56 (s. 2H). 6.79 (s, 1H), 6.82 (d, 1H), 7.30-7.46 (m, 2H), 7.62-7.79 (m, 3H), 8.24 (d, 2H), 8.40-8.59 (m, 2H), 9.10 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 98.45%; ЖХМС: 518(M++1).
N-(4-(4-(3-хлорбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-95):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.42 (s, 3H), 3.59 (s, 2H), 6.79 (s, 1H), 6.82 (d, 1H), 7.21-7.44 (m, 5H), 7.62-7.78 (m, 2H), 8.24 (d, 2H), 8.57 (d, 1H), 9.16 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 98.92%; ЖХМС: 551 (М+).
N-(4-(4-(циклопентилметил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-96):

1H NMR (400 MHz, ДМСО-d6) δ: 1.15-1.19 (m, 2H), 1.40-1.71 (m, 6H), 2.01-2.05 (m, 1H), 2.30-2.37 (br s, 6H), 3.36 (s, 4H), 3.42 (s, 3H), 6.79 (s, 1H), 6.82 (d, 1H), 7.41 (d, 1H), 7.62-7.78 (m, 2H), 8.24 (d, 2H), 8.57 (d, 1H), 9.12 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 99.58%; ЖХМС: 509 (M++1).
N-(4-(4-(2,4-диметоксибензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-97):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (br s, 6H), 3.42 (s, 3H), 3.78 (s, 6H), 6.42-6.51 (m, 2H), 6.79 (s, 1H), 6.82 (d, 1H), 7.41 (d, 1H), 7.62-7.78 (m, 2H), 8.24 (d, 2H), 8.57 (d, 1H), 9.12 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 96.10%; ЖХМС: 577 (M++1).
N-(4-(4-(3,5-дифторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-98):
1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3H), 3.52 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 6.97-7.16 (m, 3H), 7.41 (d, 1H), 7.62-7.80 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.08 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.30%; ЖХМС: 553 (М++1).
N-(2-метокси-4-(4-((4-(трифторметил)пиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-99):
1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3H), 3.62 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 6.97-7.16 (m, 3H), 7.41 (d, 1H), 7.64-7.80 (m, 3H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 8.76 (d, 1H), 8.84 (s, 1H), 9.08 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 96.90%; ЖХМС: 586 (M++1).
N-(4-(4-((5-фторпиридин-2-ил)метил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-100):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3H), 3.59 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 7.41-7.52 (m, 2H), 7.64-7.80 (m, 3H), 8.21-8.30 (m, 2H), 8.41 (s, 2H), 8.57 (d, 2H), 9.08 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 98.81%; ЖХМС: 536 (M++1).
N-(2-метокси-4-(4-((3-метоксипиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-101):

1H NMR (400 MHz, ДМСО-d6) δ: 2.39 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3H), 3.59 (s, 2H), 3.79 (s, 3H), 6.78 (s, 1H), 6.81 (d, 1H), 7.21-7.43 (m, 3H), 7.64-7.80 (m, 2H), 8.05 (s, 1H), 8.24-8.30 (m, 2H), 8.57 (d, 1H), 9.08 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.08%; ЖХМС: 548 (M++1).
N-(2-метокси-4-(4-((4-метоксипиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-102):

1H NMR (400 MHz, ДМСО-d6) δ: 2.39 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3H), 3.55 (s, 2H), 3.81 (s, 3H), 6.78 (s, 1H), 6.81 (d, 1H), 7.01 (s, 1H). 7.41 (s, 1H), 7.64-7.80 (m, 2H), 8.24-8.39 (m, 4H), 8.59 (d, 1H), 9.08 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 97.31%; ЖХМС: 548 (M++1).
N-(4-(4-(циклопентилметил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-103):

1H NMR (400 MHz, ДМСО-d6) δ: 0.81-.84 (m, 1H), 1.1-1.32 (m, 3H), 1.4-1.75 (m, 5H), 2.1 (s, 3H), 2.12-2.4 (br s, 6H), 3.18-3.62 (br s, 4H), 6.9-7.14 (s, 3H), 7.62-7.77 (m, 2H), 8.21-8.35 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.55%; ЖХМС: 493.3 (M++1).
N-(4-(4-(4-фторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-104):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.2-2.37 (br s, 4H), 3.18-3.34 (br s, 2H), 3.42-3.59 (br s, 4H), 6.96 (s, 2H), 7.06-7.16 (m, 3H), 7.31 (t, 2H), 7.61-7.79 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.16 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 99.31%; ЖХМС: 519.3 (M++1).
N-(4-(4-(4-меток:сибензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-105):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н), 2.37 (br s, 4H), 3.18-3.28 (br s, 4H), 3.46 (s, 2H), 3.71 (s, 3Н), 6.82 (d, 2H), 6.96 (d, 2H), 7.06 (s, 1H), 7.19 (d, 2H), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s. 1H), 9.39 (s, 1H); чистота ВЭЖХ: 94.41%. ЖХМС: 531.15 (М++1).
N-(2-метил-4-(4-((6-метилпиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-106):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3Н). 2.34 (br s, 4H), 2.39 (s, 3Н), 3.21(br s, 4H), 3.58 (s, 2H), 6.97-7.16 (m, 4H), 7.21 (d, 2H), 7.62-7.77 (m, 3Н), 8.21-8.34 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 95.18%; ЖХМС: 516.35 (M++1).
N-(2-метил-4-(4-((тетрагидрофуран-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-107):

1H NMR (400 MHz, ДМСО-d6) δ: 0.82-.84 (m, 1H), 1.22 (s, 2H), 1,42-1.58 (br s, 1H), 1.82-1.96 (m, 1H), 2.04 (s, 3Н), 2.21-2.31 (m, 5H), 3.16-3.51 (br s, 5H), 3.72-3.85 (m, 2H), 6.97-7.04 (m, 3Н), 7.62-7.77 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.18 (s, 1H), 9.39 (s, 1H); чистота ВЭЖХ: 98.714%; ЖХМС: 495.35 (M++1).
N-(4-(4-(циклопропилметил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-108):

1H NMR (400 MHz, ДМСО-d6) δ: 0.21 (s, 2H), 0.41 (s, 2H), 0.91 (br s, 1H), 2.12 (s, 2H), 2.39 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3Н), 6.78 (s, 1H). 6.81 (d, 1H), 7.41 (d, 1H), 7.62-7.82 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.08 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 99.74%; ЖХМС: 481 (M++1).
N-(4-(4-(4-хлорбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-109):
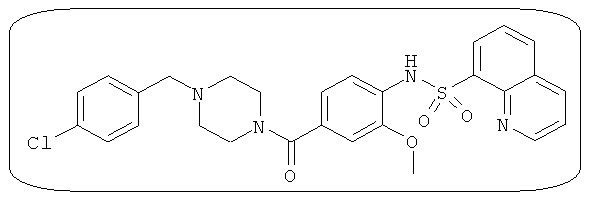
1H NMR (400 MHz, ДМСО-d6) δ: 2.31 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3Н), 3.44 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 7.21-7.43 (m, 5H), 7.62-7.78 (m, 2H), 8.21-8.30 (m, 2H), 8.55 (d, 1H), 9.08 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 94.85%; ЖХМС:551(M+).
N-(2-метокси-4-(4-(4-(трифторметил)бензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-110):
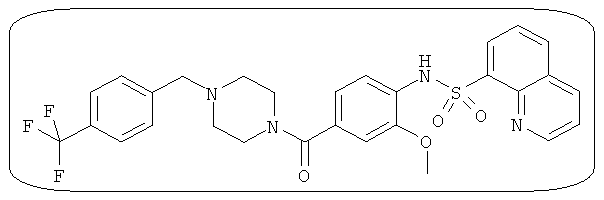
1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3Н), 3.59 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 7.41-7.56 (m, 3Н), 7.62-7.78 (m, 4H), 8.21-8.30 (m, 2H), 8.58 (d, 1H), 9.08 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 98.62%; ЖХМС: 585 (M++1).
N-(2-метокси-4-(4-(4-метоксибензил)пиперазин-1-карбоиил)фенил)хинолин-8-сульфонамид (XIV-111):

1H NMR (400 MHz, ДМСО-d6) δ: 2.35 (br s, 4H), 3.36 (s, 4H), 3.41 (s, 3H), 3.43 (s, 2H), 3.66 (s, 3H), 6.76-6.90 (m, 4H), 7.19 (d, 2H), 7.41 (s, 1H), 7.62-7.78 (m, 2H), 8.21-8.30 (m, 2H), 8.58 (d, 1H), 9.05 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 97.73%; ЖХМС: 547 (М++1).
N-(4-(4-((5-хлорпиридин-3-ил)метил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-112):

1H NMR (400 MHz, ДМСО-d6) δ:2.31 (brs, 4H), 3.37 (s, 4H), 3.41 (s, 3H), 3.55 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 7.41 (d, 1H), 7.62-7.82 (m, 3H), 8.21-8.30 (m, 2H), 8.41-8.61 (m, 3H), 9.05 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 99.46%; ЖХМС: 553 (M++1).
N-(4-(4-((3-фторпиридин-2-ил)метил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-113):

1H NMR (400 MHz, ДМСО-d6) δ 2.39 (br s, 4H), 3.37 (s, 4H), 3.41 (s, 3H), 3.61 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 7.41-7.45 (m, 2H), 7.62-7.80 (m, 4H), 8.21. 8.39 (m, 3Н), 8.59 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 96.15%; ЖХМС: 536 (M+).
N-(2-метокси-4-(4-((3-(трифторметил)пиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-114):

1H NMR (400 MHz, ДМСО-d6) δ: 2.39 (br s, 4H), 3.37 (s, 4H), 3.43 (s, 3Н), 3.70 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 7.41-7.59 (m, 2H), 7.64-7.80 (m, 2H), 8.18 (d, 1H), 8.24-8.29 (m, 2H), 8.59 (d, 1H), 8.79 (d, 1H), 9.08 (s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 99.41%; ЖХМС: 586 (M++1).
N-(4-(4-((3-фторпиридин-4-ил)метил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-115):

1H NMR (400 MHz, ДМСО-d6) δ: 2.45 (s, 4H), 3.47 (s, 4H), 3.56 (s, 3H), 3.61 (s, 2H), 6.72-6.85 (m, 2H), 7.38-7.42 (m, 2H), 7.62-7.81 (m, 2H), 8.21-8.40 (m, 3H), 8.57 (d, 2H), 9.08 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 99.2%; ЖХМС: 535 (M+).
N-(4-(4-((5-фторпиридин-3-ил)метил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-116):

1H NMR (400 MHz, ДМСО-d6) δ: 2.45 (s, 4H), 3.47 (s, 4H), 3.56 (s, 3H), 3.61 (s, 2H), 6.72-6.85 (m, 2H), 7.42 (d, 1H), 7.58-7.81 (m, 3H), 8.21-8.40 (m, 3H), 8.57 (d, 2H), 9.08 (s, 1H), 9.21 (s, 1H); чистота ВЭЖХ: 99.8%; ЖХМС: 535 (M+).
N-(4-(4-(циклогексилметил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-117):

1H NMR (400 MHz, ДМСО-d6) δ: 0.70-0.84 (m, 2H), 1.01-1.21 (m, 3H), 1.35-1.42 (m, 1H), 1.61-1.74 (m, 5H), 2.02 (d, 2H), 2.25 (br s, 4H), 3.47 (s, 2H), 3.56 (s, 3H), 3.61 (s, 2H), 6.65-6.82 (m, 2H), 7.42 (d, 1H), 7.65-7.80 (m, 2H), 8.35 (d, 2H), 8.60 (d, 1H), 9.08(s, 1H),9.19 (d, 1H); чистота ВЭЖХ: 99.7%; ЖХМС: 522 (M+).
N-(4-(4-((2-метоксипиридин-3-ил)метил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-118):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.37 (br s, 4H), 3.46 (s, 4H), 3.56 (s, 2H), 3.86 (s, 3H), 6.96-7.02 (m, 3H), 7.61-7.79 (m, 3H), 8.0 (d, 1H), 8.22-8.35 (m, 2H). 8.58 (d, 1H), 9.15 (s, 1H), 9.35 (s, 1H); чистота ВЭЖХ: 97.2%; ЖХМС: 531(M+).
N-(3-метокси-4-(4-(пиридин-3-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-119):

1H NMR (400 MHz, ДМСО-d6) δ: 2.01-2.38 (s, 4H), 2.97 (br s, 2H), 3.46 (s, 4H), 3.56 (s, 3H), 6.65-6.97 (m, 3H), 7.36 (m, 1H), 7.61-7.78 (m, 3H), 8.20-8.58 (m, 5H), 9.18 (s, 1H), 10.25 (s, 1H); чистота ВЭЖХ: 99.09%; ЖХМС: 517.6 (М+).
N-(4-(4-(3,5-дифторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-120):

1H NMR (400 MHz, ДМСО-d6) δ: 2.31 (br s, 4H), 3.02 (br s, 2H), 3.46 (br s. 4H). 3.59 (s, 3H), 6.81 (d, 1H), 6.78 (s, 1H), 6.85 (d, 1H), 7.06-7.18 (m, 3H), 7.71-7.76 (m, 2H), 8.24 (d, 1H), 8.42-8.58 (m, 2H), 9.18 (s, 1H), 10.28 (s, 1H); чистота ВЭЖХ: 99.20%; ЖХМС: 553 (M++1).
N-(4-(4-(4-хлорбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-121):

1H NMR (400 MHz, ДМСО-d6) δ: 2.36 (br s, 4H), 3.37 (s, 4H), 3.42 (s, 3H), 3.46 (s, 2H), 6.78 (s, 1H), 6.81 (d, 1H), 7.24-7.43 (m, 5H), 7.62-7.78 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.08 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 95.65%; ЖХМС: 551 (M+).
N-(4-(4-((5-фторпиридин-3-ил)метил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-122):

1H NMR (400 MHz, ДМСО-d6) δ: 2.19 (s, 2H), 2.25 (br s, 2H), 2.95 (br s, 2H), 3.52 (d, 5H), 6.61 (d, 1H), 6.78 (s, 1H), 6.83 (d, 1H), 7.60 (d, 1H), 7.70-7.79 (m. 2H), 8.28 (d, 1H), 8.34 (s, 1H), 8.39-8.48 (m, 3H), 9.16 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 99.58%; ЖХМС: 536 (M++1).
N-(4-(4-((3-фторпиридин-4-ил)метил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-123):

1H NMR (400 MHz, ДМСО-d6) δ: 2.21 (br s, 2H), 2.30 (br s, 2H), 3.00 (br s, 2H), 3.58 (d, 5H), 6.61 (d, 1H), 6.78 (s, 1H), 6.84 (d, 1H), 7.44 (t, 1H). 7.70-7.79 (m, 2H), 8.28 (d, 1H), 8.40 (d, 1H), 8.44 (d, 2H), 8.51 (s, 2H), 9.16 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 90.34%; ЖХМС: 536 (M++1).
N-(4-(4-((5-фторпиридин-2-ил)метил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-124):

1H NMR (400 MHz, ДМСО-d6) δ: 2.19 (br s, 2H), 2.25 (br s, 2H), 2,95 (br s, 2H), 3.41 (br s, 2H), 3,58 (s, 3H), 6.61 (d, 1H), 6.78 (s, 1H), 6.83 (d, 1H), 7.47 (t, 1H), 7.60-7.78 (m, 2H), 8.24 (d, 1H), 8.39-8.48 (m, 3H), 9.16 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 99.57%; ЖХМС: 536 (М++1).
N-(4-(4-(3-фторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-125):

1H NMR (400 MHz, ДМСО-d6) δ: 2.19 (br s, 2H), 2.25 (br s, 2H), 2.95 (br s, 2H), 3.42 (s, 2H), 3.52 (s, 3H), 6.60 (d, 1H), 6.78 (s, 1H), 6.82 (d, 1H), 7.00-7.16 (m, 3H), 7.30 (q. 1H), 7.64-7.71 (m, 2H), 8.28 (d, 1H), 8.34 (s, 1H), 8.38 (d, 1H), 9.16 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 99.82%; ЖХМС: 535 (M++1).
N-(4-(4-(3-хлорбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-126):
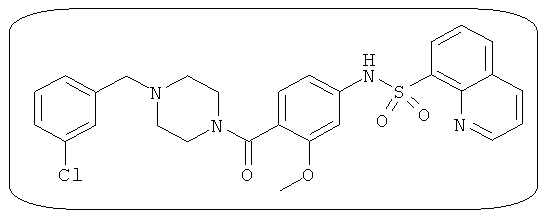
1H NMR (400 MHz, ДМСО-d6) δ: 2.19 (br s, 2H), 2.25 (br s, 2H), 2.97 (br s, 2H), 3.42 (s, 2H), 3.52 (s, 3H), 6.61 (d, 1H), 6.78 (s, 1H), 6.82 (d, 1H), 7.24 (d, 1H), 7.28-7.37 (m, 2H), 8.28 (d, 1H), 8.39 (s, 1H), 8.50 (d, 1H), 9.16 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ; 99.53%; ЖХМС: 551 (M+).
N-(3-метокси-4-(4-(4-метоксибензил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-127):

1H NMR (400 MHz, ДМСО-d6) δ: 2.19 (br s, 2H), 2.25 (br s, 2H), 2.97 (br s, 2H), 3.31 (br s, 2H), 3.59 (s, 2H), 3.63 (s, 3H), 6.61 (d, 1H), 6.78 (s, 1H), 6.82 (d, 3H), 7.12-7.21 (m, 2H), 7.62-7.70 (m, 2H), 8.28 (d, 1H), 8.39 (s, 1H), 8.50 (d, 1H), 9.16 (d, 1H), 10.26 (s, 1H); чистота ВЭЖХ: 90.80%; ЖХМС: 546 (M++1).
N-(4-(4-(2,4-диметоксибензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-128):

1H NMR (400 MHz, ДМСО-d6) δ: 2.25 (br s, 2H), 2.97 (br s, 2H), 3.42 (br s, 4H), 3.59 (s, 2H), 3.63 (s, 3H), 3.73 (s, 6H), 6.45 (d, 1H), 6.50 (s, 1H), 6.64 (d, 1H), 6.78 (s, 1H), 6.82 (d, 1H), 7.12 (d, 1H), 7.65-7.72 (m, 2H), 8.28 (d, 1H), 8.40 (s, 1H), 8.50 (d, 1H), 9.16 (d, 1H), 10.26 (s, 1H); чистота ВЭЖХ: 99.78%; ЖХМС: 577 (M++1).
N-(4-(4-(циклогексилметил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-129):

1H NMR (400 MHz, ДМСО-d6) δ: 0.78 (q, 2H), 1.11 (d, 2H), 1.40 (brs, 1H), 1.54-1.71 (m, 2H), 1.99-2.30 (m, 8H), 2.90 (br s, 4H), 3.45 (d, 1H), 3.59 (s, 3Н), 3.70 (s, 1H), 6.61 (d, 1H), 6.76 (s, 1H), 6.82 (d, 3Н), 7.62-7.70 (m, 2H), 8.28 (d, 1H), 8.40 (s, 1H), 8.47 (m, 1H), 9.10(d, 1H), 10.26 (s, 1H); чистота ВЭЖХ: 98.50%; ЖХМС: 546 (M++1).
N-(3-метокси-4-(4-((3-метоксипиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-130):

1H NMR (400 MHz, ДМСО-d6) δ: 2.22 (br s, 2H), 2.38 (br s, 2H), 2.87 (br s, 4H), 3.41 (s, 3Н), 3.59 (br s, 5H), 3.73 (s, 2H), 6.76 (s, 1H), 6.82 (d, 1H), 7.21 (s, 1H), 7.40 (d, 1H), 7.62-7.69 (m, 2H), 8.03 (s, 1H), 8.27 (d, 1H), 8.39 (s, 1H), 8.50 (m, 1H), 9.10 (d, 1H), 10.23 (s, 1H); чистота ВЭЖХ: 99.86%; ЖХМС: 548 (M++1).
N-(3-метокси-4-(4-((4-метоксипиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-131):

1H NMR (400 MHz, ДМСО-d6) δ: 2.22 (br s, 2H), 2,38 (br s. 2H), 2.90 (br s, 4H), 3.41 (s, 3H), 3.55 (s, 3H), 3.80 (s, 2H), 6.60 (d, 1H), 6.72 (s, 1H), 6.82 (d, 1H), 7.00 (d, 1H), 7.62-7.69 (m, 2H), 8.29 (s, 2H), 8.35 (d, 1H), 8.39 (s, 1H), 8.50 (m, 1H), 9.10 (d, 1H); чистота ВЭЖХ: 92.10%; ЖХМС: 548 (M++1).
N-(4-(4-(4-фторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-132):

1H NMR (400 MHz, ДМСО-d6) δ: 2.19 (br s, 2H), 2.25 (br s, 2H), 2.95 (br s, 4H), 3.42 (s, 2H), 3.52 (s, 3H), 6.60 (d, 1H), 6.78 (s, 1H), 6.82 (d, 1H), 7.10 (t, 2H), 7.23 (t, 2H), 7.63-7.71 (m, 2H), 8.25 (d, 1H), 8.40 (d, 1H), 8.48 (d. 1H), 9.16 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 99.62%; ЖХМС: 535 (М++1).
N-(4-(4-((3-хлорпиридин-4-ил)метил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-133):

1H NMR (400 MHz, ДМСО-d6) δ: 2.24 (br s, 2H), 2.25 (br s, 2H), 2.95 (br s, 4H), 3.58 (s, 5H), 6.61 (d, 1H), 6.74 (s, 1H), 6.83 (d, 1H), 7.47 (d, 1H), 7.63-7.72 (m, 2H), 8.23 (d, 1H), 8.39-8.49 (m, 3H), 8.54 (s, 1H), 9.16 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 98.63%; ЖХМС: 552 (M+).
N-(3-метокси-4-(4-((тетрагидрофуран-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-134):

1H NMR (400 MHz, ДМСО-d6) δ: 1.42 (m, 2H), 1.83 (m, 2H), 2.19 (d, 2H), 2.24-2.39 (m, 4H), 2.95 (br s, 4H), 3.48 (d, 1H), 3.56 (s, 3H), 3.63 (q, 2H), 6.60 (d, 1H), 6.76 (s, 1H), 6.81 (d, 1H), 7.63-7.70 (m, 2H), 8.24 (d, 1H), 8.40 (d, 1H), 8.50 (d, 1H), 9.10 (d, 1H), 10.26 (s, 1H); чистота ВЭЖХ: 98.40%; ЖХМС: 511 (М++1).
N-(3-метокси-4-(4-((2-метоксипиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-135):
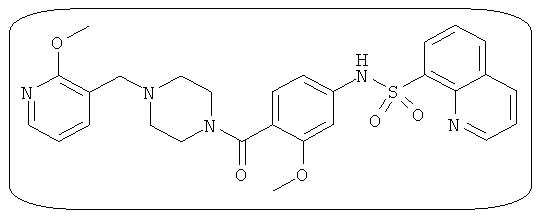
1H NMR (400 MHz, ДМСО-d6) δ: 2.22 (br s, 2H), 2.38 (br s, 4H), 2.90 (br s, 4H), 3.41 (s, 3Н), 3.55 (s, 3Н), 3.80 (s, 2H), 6.61 (d, 1H), 6.75 (s, 1H), 6.82 (d, 1H), 6.97 (t. 1H), 7.60-7.73 (m, 3Н), 8.02 (s, 1H), 8.27 (d, 1H), 8.39 (s, 1H), 8.50 (m, 1H), 9.10 (d, 1H), 10.28 (s, 1H); чистота ВЭЖХ: 99.85%; ЖХМС: 548 (M++1).
N-(3-метокси-4-(4-((5-(трифторметил)пиридин-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-136):

1H NMR (400 MHz, ДМСО-d6) δ 2.22 (br s, 2H), 2.38 (br s, 2H), 2.99 (br s, 4H), 3.58 (s, 3Н), 3.67 (s, 2H), 6.61 (d, 1H), 6,74 (s, 1H), 6.82 (d, 1H), 7.62-7.73 (m, 3Н), 8.19 (d, 1H), 8.26 (d, 1H), 8,d, 1H), 8.50 (m, 1H), 8.82 (s, 1H), 9.10 (d, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 94.67%; ЖХМС: 586 (M++1).
N-(4-(4-(циклопентилметил)пиперазин-1-к:арбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-137):

1H NMR (400 MHz, ДМСО-d6) δ: 1.10 (sextet, 2H), 1.38-1.50 (m, 3Н), 1.55-1.61 (m, 3Н), 1.99 (pentet, 1H), 2.07 (d, 2H), 2.30 (br s, 4H), 2.90 (br s, 4H), 3.59 (s, 3Н), 6.60 (d, 1H), 6.72 (s, 1H), 6.82 (d, 1H), 7,62-7.69 (m, 2H), 8.25 (s, 1H), 8.40 (d, 1Н), 8.47 (d, 1H), 9.10 (d, 1H), 10.24 (s, 1H); чистота ВЭЖХ: 99.86%; ЖХМС: 509 (M++1).
N-(4-(4-(2-фтор-4-метоксибензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-138):

1H NMR (400 MHz, ДМСО-d6) δ: 2.20 (br s, 2H), 2.35 (br s, 2H), 2.90 (br s, 4H), 3.41 (s, 3H), 3.60 (s, 3H), 3.78 (s, 2H), 6.61 (d, 1H), 6.70-6.80 (m, 2H), 6.84 (d, 1H), 7.22 (t, 1H), 7.70-7.80 (m, 2H), 8.26 (d, 1H), 8.42 (d, 1H), 8.50 (d, 1H), 9.16 (s, 1H), 10. 28 (s, 1H); чистота ВЭЖХ: 90.48%; ЖХМС: 565 (M++1).
N-(4-(4-(3-фтор-4-метоксибензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-139):
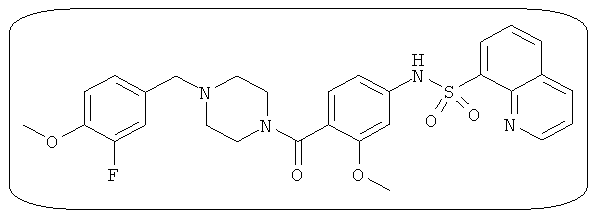
1H NMR (400 MHz, ДМСО-d6) δ: 2.20 (br s, 2H), 2.35 (br s, 2H), 2.97 (br s, 4H), 3.42 (s, 3H), 3.59 (s, 3H), 3.82 (s, 2H), 6.61 (d, 1H), 6.80 (s, 1H), 6.84 (d, 1H), 7.02-7.18 (m, 3H), 7.70-7.80 (m, 2H), 8.26 (d, 1H), 8.42 (d, 1H), 8.50 (d, 1H), 9.16 (s, 1H), 10, 28 (s, 1H); чистота ВЭЖХ: 99.65%; ЖХМС: 565 (M++1).
N-(4-(4-(4-фторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-140):

1H NMR (400 MHz, ДМСО-d6) δ: 2.24 (br s, 4H), 3.20-3.45 (m, 6H), 3.61 (s, 3Н), 6.77 (s, 1H), 6.82 (d, 1H), 7.21 (t, 2H), 7.28 (t, 2H), 7.40 (d, 1H), 7.65-7.77 (m, 2H), 8.26 (d, 2H), 8.56 (d, 1H), 9.07 (s, 1H), 9. 20 (s, 1H); чистота ВЭЖХ: 95.43%; ЖХМС: 535 (M++1).
N-(2-метокси-4-(4-((тетрагидрофуран-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-141):

1H NMR (400 MHz, ДМСО-d6) δ: 1.45 (m, 2H), 1.86 (m, 2H), 2.20 (d, 2H), 2.24-2.39 (m, 4H), 2.95 (br s, 4H), 3.48 (d, 1H), 3.56 (s, 3Н), 3.63 (q, 2H), 6.79 (s, 1H), 6.83 (d, 1H), 7,42 (d, 1H), 7.70-7.80 (m, 2H), 8.42 (d, 2H), 8.59 (d, 1H), 9.04 (br s, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 98.88%; ЖХМС: 511 (M++1).
N-(4-(4-(4-хлор-3-фторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-142):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3.42 (s, 3H), 3.56 (s, 2H), 6.78 (s, 1H), 6.84 (d, 1H), 7.18 (s, 1H), 7.31-7.56 (m, 3Н), 7.63-7.81 (m, 2H), 8.24-8.30 (m, 2H), 8.57 (d, 1H), 9.08 (s, 1H), 9.19 (d, 1H); чистота ВЭЖХ: 97.47%; ЖХМС: 569 (M+).
N-(4-(4-((3-хлорпиридин-4-ил)метил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-143):

1H NMR (400 MHz, ДМСО-d6) δ: 2.41 (br s, 4H), 3.36 (s, 4H), 3.44 (s, 3H), 3.60 (s, 2H), 6.78 (s, 1H), 6.82 (d, 1H), 7.41-7.51 (m, 2H), 7.65-7.80 (m, 2H), 8,22-8.30 (m, 2H), 8.42-8.58 (m, 3H), 9.08 (s, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 99.17%; ЖХМС: 552 (M+).
N-(4-(4-(3-фторбензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-144):

1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3,42 (s, 3H), 3.56 (s, 2H), 6.78 (s, 1H), 6.84 (d, 1H), 7.18 (s, 1H), 7.31-7.56 (m. 3H), 7.63-7.81 (m, 2H), 8.24-8.30 (m, 2H), 8.57 (d, 1H), 9.08 (s, 1H), 9.19 (d, 1H); чистота ВЭЖХ: 97.47%; ЖХМС: 535 (M+).
N-(2-метокси-4-(4-((2-метоксипиридин-3-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-145):
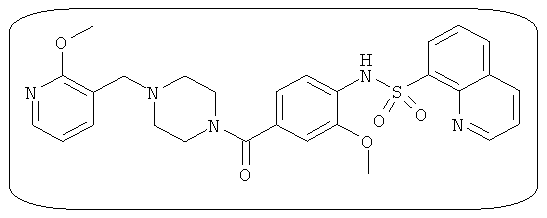
1H NMR (400 MHz, ДМСО-d6) δ: 2.37 (br s, 4H), 3.36 (s, 4H), 3,41 (s, 3H), 3.46 (s, 2H), 3.81 (s, 3H), 6.78 (s, 1H), 6.81 (d, 1H), 6.97-7.01 (m, 1H), 7.41 (d, 1H), 7.62-7.78 (m, 3H), 8.01 (d, 1H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.08 (s, 1H), 9.19 (d, 1H); чистота ВЭЖХ: 99.95%; ЖХМС: 548 (M+).
N-(2-метокси-4-(4-(1-фенилэтил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-146):

1H NMR (400 MHz, ДМСО-d6) δ: 1.21 (d, 3Н), 2.37 (brs, 4H), 3.36-3.41 (m, 8H), 6.71 (s, 1H), 6.78 (d, 1H), 7.11-7.29 (m, 5H), 7.36 (d, 1H), 7.60-7.76 (m, 2H), 8.21-8.30 (m, 2H), 8.48 (d, 1H), 9.01 (s, 1H), 9.12 (s, 1H); чистота ВЭЖХ: 95.62%; ЖХМС: 531 (M++1).
N-(2-метокси-4-(4-((1-фенилциклопропил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-147):

1H NMR (400 MHz, ДМСО-d6) δ: 0.06 (s, 2H), 0.08 (s, 2H), 2.37 (br s, 4H), 3.16 (s, 4H), 3.41 (br s, 5H), 6.78 (s, 1H), 6.81 (s, 1H), 7.12 (s, 2H), 7.19-7.26 (m, 4H), 7.42 (d, 1H), 7.65-7.80 (m, 2H), 8.25-8.31 (m, 2H), 8.58 (d, 1H), 9.10 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 99.97%; ЖХМС: 557 (М++1).
N-(4-(4-(3-фтор-4-метоксибензил)пиперазин-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-148):

1H NMR (400 MHz, ДМСО-d6) δ: 2.31 (brs, 4H), 3.32 (s, 4H), 3.41 (s, 2H), 3.43 (s, 3Н), 3.80 (s, 3Н), 6.78 (s, 1H), 6.82 (d, 1H), 6.98-7.18 (m, 3Н), 7.21 (d, 1H), 7.31 (s, 2H), 7.64-7.80 (m, 2H), 8.21-8.30 (m, 2H), 8.57 (d, 1H), 9.08 (s, 1H), 9.19 (s, 1H); чистота ВЭЖХ: 92.22%; ЖХМС; 565 (M++1).
N-(2-метокси-4-(4-(пиридин-4-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-149):

1H NMR (400 MHz, ДМСО-d6) δ: 2.32 (br s, 4H), 3.41 (s, 3H), 3.50 (s, 4H), 3.62 (s, 2H), 6.75 (s, 1H), 6.82 (d, 1H), 7.28 (d, 2H), 7.41 (d, 1H), 7.66-7.80 (d, 2H), 8.30 (s, 2H), 8.50 (d, 2H), 8.59 (d, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 97.52%; ЖХМС:518 (M++1).
N-(2-метокси-4-(4-((тетрагидрофуран-2-ил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-150):
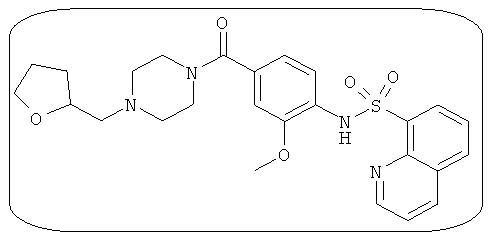
1H NMR (400 MHz, ДМСО-d6) δ: 1.45 (pentet, 2H), 1.78 (pentet, 2H), 1.90 (sextet, 1H), 2.30-2.41 (m, 7H), 3.41 (s, 3H), 3.60 (q, 2H), 3.70 (q, 2H), 3.95 (pentet, 1H), 6.78 (s, 1H), 6.82 (d, 1H), 7.42 (d, 1H), 7.70-7.81 (m, 2H), 8.30 (d, 1H), 8.60 (d, 1H), 9.10 (s, 1H), 9.20 (s, 1H); чистота ВЭЖХ: 99.24%; ЖХМС: 511 (М++1).
N-(4-(4-(4-хлор-3-фторбензил)пиперазин-1-карбонил)-3-метоксифенил)хинолин-8-сульфонамид (XIV-151):

1H NMR (400 MHz, ДМСО-d6) δ: 2.19 (br s, 2H), 2.28 (br s, 2H), 2.97 (br s, 4H), 3.44 (s, 3H), 3.58 (s, 2H), 6.61 (d, 1H), 6.78 (s, 1H), 6.83 (d, 1H), 7.15 (1H), 7.30 (d, 1H), 7.49 (d, 1H), 7.70-7.78 (m, 2H), 8.24 (d, 1H), 8.42 (d, 1H), 8.50 (d, 1H), 9.10 (s, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 98.63%; ЖХМС: 569 (M+).
N-(3-метокси-4-(4-((1-фенилциклопропил)метил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-152):

1H NMR (400 MHz, ДМСО-d6) δ: 0.64 (s, 2H), 0.78 (s. 2H), 2.18 (br s, 4H), 2.39 (s, 2H), 2.81 (br s, 4H), 3.41 (s, 3H), 6.61 (d, 1H), 6,78 (s, 1H), 6.82 (d, 1H), 7.10 (q, 1H), 7.12 (t, 1H), 7.20-7.28 (m, 4H), 7.70-7.80 (m, 2H), 8.23 (d, 1H), 8.41 (d, 1H), 8.50 (d, 1H), 9.13 (s, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 99.99%; ЖХМС; 557(M++1).
N-(3-метокси-4-(4-(пиридин-2-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-153):

1H NMR (400 MHz, ДМСО-d6) δ: 2.22 (br s, 2H), 2.39 (br s, 2H), 2.98 (br s, 2H), 3.57 (br s, 2H), 3.60 (s, 5H), 6.62 (d, 1H), 6.78 (s, 1H), 6.82 (d, 1H), 7.20 (s, 1H), 7.40 (d, 1H), 7.66-7.79 (m, 3H), 8.21-8.30 (m, 2H), 8.40-8.50 (m, 2H), 9.16 (s, 1H), 10.30 (s, 1H); чистота ВЭЖХ: 98.14%; ЖХМС: 518 (М++1).
N-(3-метокси-4-(4-(пиридин-4-илметил)пиперазин-1-карбонил)фенил)хинолин-8-сульфонамид (XIV-154):

1H NMR (400 MHz, ДМСО-d6) δ: 2:20 (br s, 2H), 2.30 (br s, 2H), 2.98 (br s, 4H), 3.50 (s, 3H). 3.58 (s, 2H), 6.62 (d, 1H), 6.78 (s, 1H), 6.82 (d, 1H). 7.24 (s, 2H), 7.65-7.73 (m, 2H), 8.21-8.30 (m, 2H), 8.40 (d, 1H), 8.43-8.50 (:m, 2H), 9.10 (s, 1H), 10.23 (brs, 1H); чистота ВЭЖХ: 99.69%; ЖХМС: 518 (M++1).
N-(4-(4-(4-хлор-3-фторбензил)пиперазин-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-155):
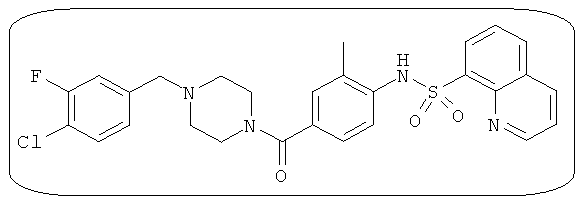
1H NMR (400 MHz, ДМСО-d6) δ: 2.01 (s, 3H), 2.38 (br s, 4H), 3,50 (s, 4H), 3.56 (s, 2H), 7.00 (s, 2H), 7.06 (s, 1H), 7.18 (d, 1H), 7.35 (d, 1H), 7.52 (t, 1H), 7.70-7.80 (m, 2H), 8.29 (q, 2H), 8.59 (d, 1H), 9.15 (s, 1H), 9.38 (s, 1H); чистота ВЭЖХ: 99.25%; ЖХМС: 553 (M+).
N-(4-(4-бензил-1,4-диазепан-1-карбонил)-2-метоксифенил)хинолин-8-сульфонамид (XIV-156):

1H NMR (400 MHz, ДМСО-d6) δ: 2.22 (br s, 2H), 3.01 (br s, 2H), 3.52-3.58 (m, 9H), 4.39 (br s, 2H), 6.66 (d, 1H), 6.80 (s, 1H), 7.50 (br s, 4H), 7.74-7.79 (m, 2H), 8.30 (d, 1H), 8.47 (d, 2H), 8.59 (d, 1H), 9.18 (d, 1H), 10.40 (s, 1H); чистота ВЭЖХ: 99.00%; ЖХМС: 531 (M++1).
N-(4-(4-бензил-1,4-диазепан-1-карбонил)-2-метилфенил)хинолин-8-сульфонамид (XIV-157):

1H NMR (400 MHz, CD3OD) δ: 2.06 (s, 3Н), 2.14 (br s, 2H), 2.22 (s, 4H), 3.58 (br s, 4H), 4.40 (s, 2H), 7.10 (br s, 1H), 7.22 (d, 2H), 7.50 (s, 4H), 7.68-7.77 (m, 2H), 8.21 (d, 1H), 8.38 (d, 1H), 8.51(d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 99.04%; ЖХМС:515 (M++1).
N-(4-(4-бензил-1,4-диазепан-1-карбонил)-2-фторфенил)хинолин-8-сульфонамид (XIV-158):

1H NMR (400 MHz, CDCl3) δ: 2.21 (br s, 6H), 3.43 (br s, 4H), 4.21 (s, 2H), 6.97 (d, 1H), 7.08 (br s, 1H), 7.42 (t, 4H), 7.63-7.68 (m, 2H), 7.79 (t, 1H), 8,09 (d, 1H), 8.28 (d, 1H), 8.38 (d, 1H), 9.18 (d, 1H); чистота ВЭЖХ: 96.67%; ЖХМС: 519 (М++1).
N-(4-(4-бензил-1,4-диазепан-1-карбонил)-3-хлорфенил)хинолин-8-сульфонамид (XIV-159):

1H NMR (400 MHz, CDCl3) δ: 2.12 (br s, 1H), 2.50 (br s, 1H), 3.09 (br s, 2H), 3.29 (br s, 1H), 3.58 (br s, 2H), 3.67 (br s, 2H), 4.20 (s, 2H), 4.41 (br s, 1H), 6.99 (d, 2H), 7.28-7.39 (m, 4H), 7.66 (t, 2H), 8.21 (d, 1H), 8.38 (d, 1H), 8.42 (d, 1H), 9.18 (s, 1H); чистота ВЭЖХ: 95.33%; ЖХМС: 535 (М+).
Синтез бензильных и алкильных производных обратного сульфонамида
Схема 23

Синтез соединения 151 выполняли из анилина 131 (0,25 ммоль) посредством следования процедурам, аналогичным описанным на схеме 21, для соединений формулы (VIII) с такими соответствующими основными этапами, как гидролиз эфира, образование амидной связи в присутствии РуВор вслед за восстановительным анимированием в присутствии триацетоксиборогидрида натрия.
4-(4-бензилпиперазин-1-карбонил)-N-(хинолин-8-ил)бензолсульфонамид (151а):

1H NMR (400 MHz, ДМСО-d6) δ: 2.24 (br s, 2H), 2.40 (br s, 2H), 3.10 (br s, 2H), 3.55 (s, 2H), 3.59 (s, 2H), 7.21-7.39 (m, 4H), 7.42 (d, 2H), 7,58 (d, 2H), 7.91 (d. 2H), 8.37 (d, 1H), 8.81 (s, 1H), 10.15 (br s, 1H); HPLC: 99.26%; ЖХМС; 487 (M++1).
4-(4-бензил-1,4-диазепан-1-карбонил)-N-(хинолин-8-ил)бензолсульфонамид (151b):

1H NMR (400 MHz, ДМСО-d6) δ: 1.55 (s, 1H), 1.75 (s, 1H), 2.41 (s, 2H), 2.52-2.64 (m, 2H), 3.05 (d, 2H), 3.58-3.62 (m, 4H), 7.19-7.32 (m, 3H), 7.36-7.47 (m, 2H), 7.58 (d, 1H), 7.63-7.77 (m, 2H), 7.81-7.89 (m, 2H), 8.30 (dd, 1H), 8.78 (dd, 1H), 10.05 (s, 1H); Чистота ВЭЖХ: 99.89%; ЖХМС: 501 (M++1).
Таким образом, при рассмотрении некоторых аспектов нескольких вариантов осуществления настоящего изобретения, специалистам в данной области следует понимать, что возможны различные изменения, модификации и усовершенствования. Предполагается, что подобные изменения, модификации и усовершенствования являются частью данного раскрытия и находятся в рамках сущности и объема изобретения. Соответственно последующее описание и чертежи являются только примерами.
Реферат
Изобретение относится к области органической химии, а именно к гетероциклическим соединениям общей формулы (I) и к его фармацевтически приемлемым солям, где каждый W, X, Y и Z представляет CH; каждый W, X и Y представляет CH и Z представляет N или каждый W, X и Z представляет CH и Y представляет N; D и Dнезависимо выбраны из связи или NR; A представляет хинолинил; L является связью, -C(O)-, -(CRR)-, -OC(O)-, -(CRR)-OC(O)-, -(CRR)-C(O)-, -NRC(S)- или -NRC(O)- (где точка присоединения к Rнаходится на левой стороне); Rвыбран из C-Cалкила, C-Cциклоалкила, арила (где арил представляет фенил или нафтил), гетероарила (где гетероарил представляет 5-10-членное моно- или бициклическое ароматическое кольцо с 1-3 гетероатомами, выбранными из азота и серы) и гетероциклила (где гетероциклил представляет тетрагидрофуранил или азетидинил), каждый из которых замещен 0-5 заместителями R; каждый Rнезависимо выбран из гало, гало-C-алкила, C-Cалкила, гидроксила и -OR; каждый Rнезависимо выбран из C-Cалкила и ацила (где ацил представляет -C(O)CH), гидрокси-C-Cалкила; каждый Rнезависимо выбран из водорода и C-Cалкила; каждый Rнезависимо выбран из водорода, C-Cалкила или два R, взятые вместе с атомами углерода, к которым они присоединены, образуют C-циклоалкил; каждый Rнезависимо выбран из гало, гало-C-алкила, гало-C-алкокси, C-Cалкила, C-Cалкинила, циано, гидроксила, -C(O)R, -OC(O)R, -C(O)OR, -SR, -NRRи -OR; n равно 0 или 1; m равно 1, 2 или 3; h равно 1 или 2 и g равно 1. Также изобретение относится к конкретным соединениям, фармацевтической композиции на основе соединения формулы (I) и способу модулирования активности ПКМ2. Технический результат: получены новые гетероциклические соединения, полезные для модулирования активности ПКМ2. 5 н. и 41 з.п. ф-лы,
Формула
где
каждый W, X, Y и Z представляет CH; каждый W, X и Y представляет CH и Z представляет N; или каждый W, X и Z представляет CH и Y представляет N;
D и D1 независимо выбраны из связи или NRb;
A представляет хинолинил;
L является связью, -C(O)-, -(CRcRc)m-, -OC(O)-, -(CRcRc)m-OC(O)-, -(CRcRc)m-C(O)-, -NRbC(S)- или -NRbC(O)- (где точка присоединения к R1 находится на левой стороне);
R1 выбран из C1-C6 алкила, C3-C6 циклоалкила, арила (где арил представляет фенил или нафтил), гетероарила (где гетероарил представляет 5-10-членное моно- или бициклическое ароматическое кольцо с 1-3 гетероатомами, выбранными из азота и серы) и гетероциклила (где гетероциклил представляет тетрагидрофуранил или азетидинил), каждый из которых замещен 0-5 заместителями Rd;
каждый R3 независимо выбран из гало, гало-C1-алкила, C1-C6 алкила, гидроксила и -ORa;
каждый Ra независимо выбран из C1-C6 алкила и ацила (где ацил представляет -C(O)CH3), гидрокси-C1-C2 алкила;
каждый Rb независимо выбран из водорода и C1-C6 алкила;
каждый Rc независимо выбран из водорода, C1-C6 алкила или два Rc, взятые вместе с атомами углерода, к которым они присоединены, образуют C3-циклоалкил;
каждый Rd независимо выбран из гало, гало-C1-алкила, гало-C1-алкокси, C1-C6 алкила, C2-C6 алкинила, циано, гидроксила, -C(O)Ra, -OC(O)Ra, -C(O)ORa, -SRa, -NRaRb и -ORa;
n равно 0 или 1;
m равно 1, 2 или 3;
h равно 1 или 2 и
g равно 1.
где A представляет хинолинил.

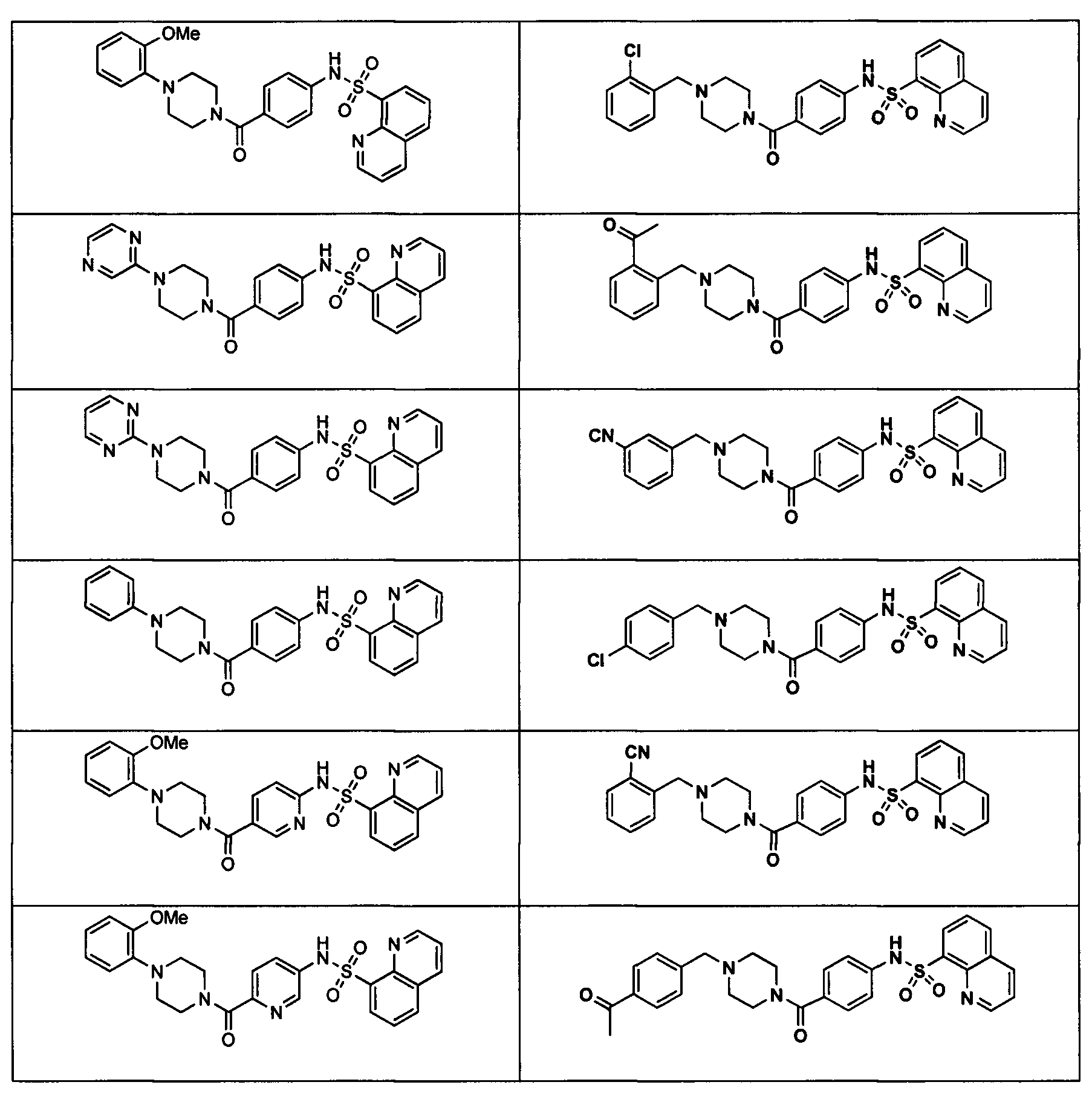
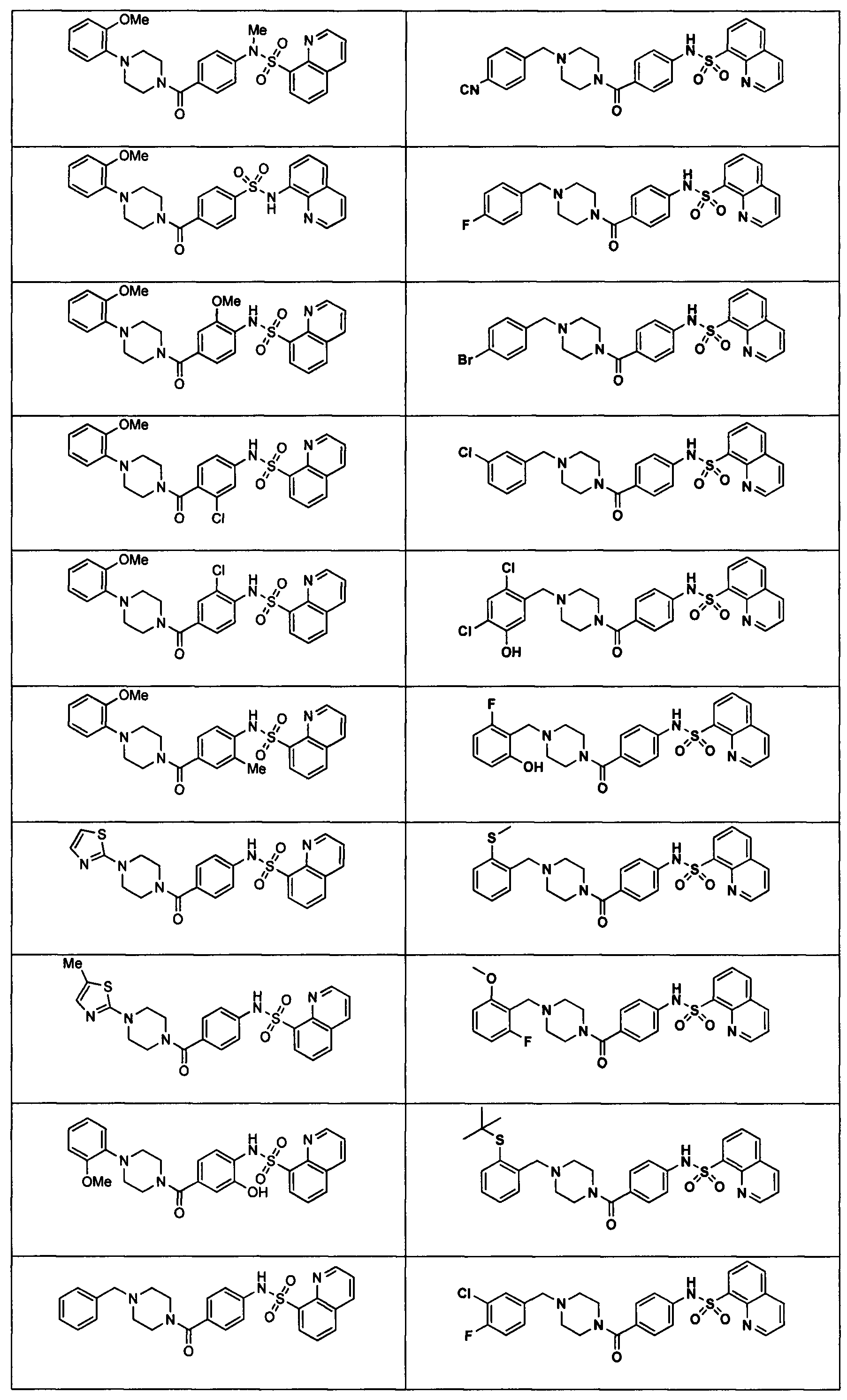




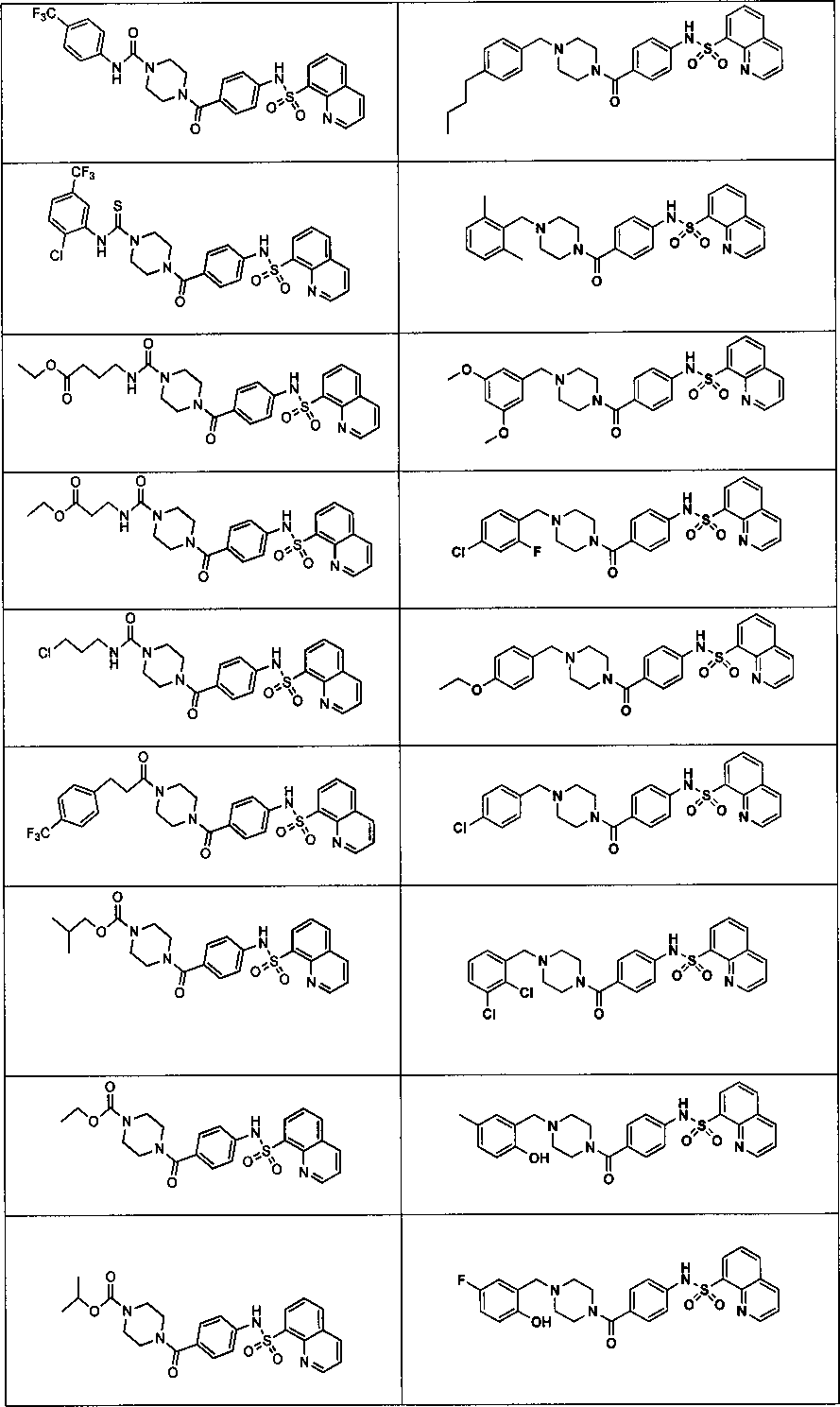



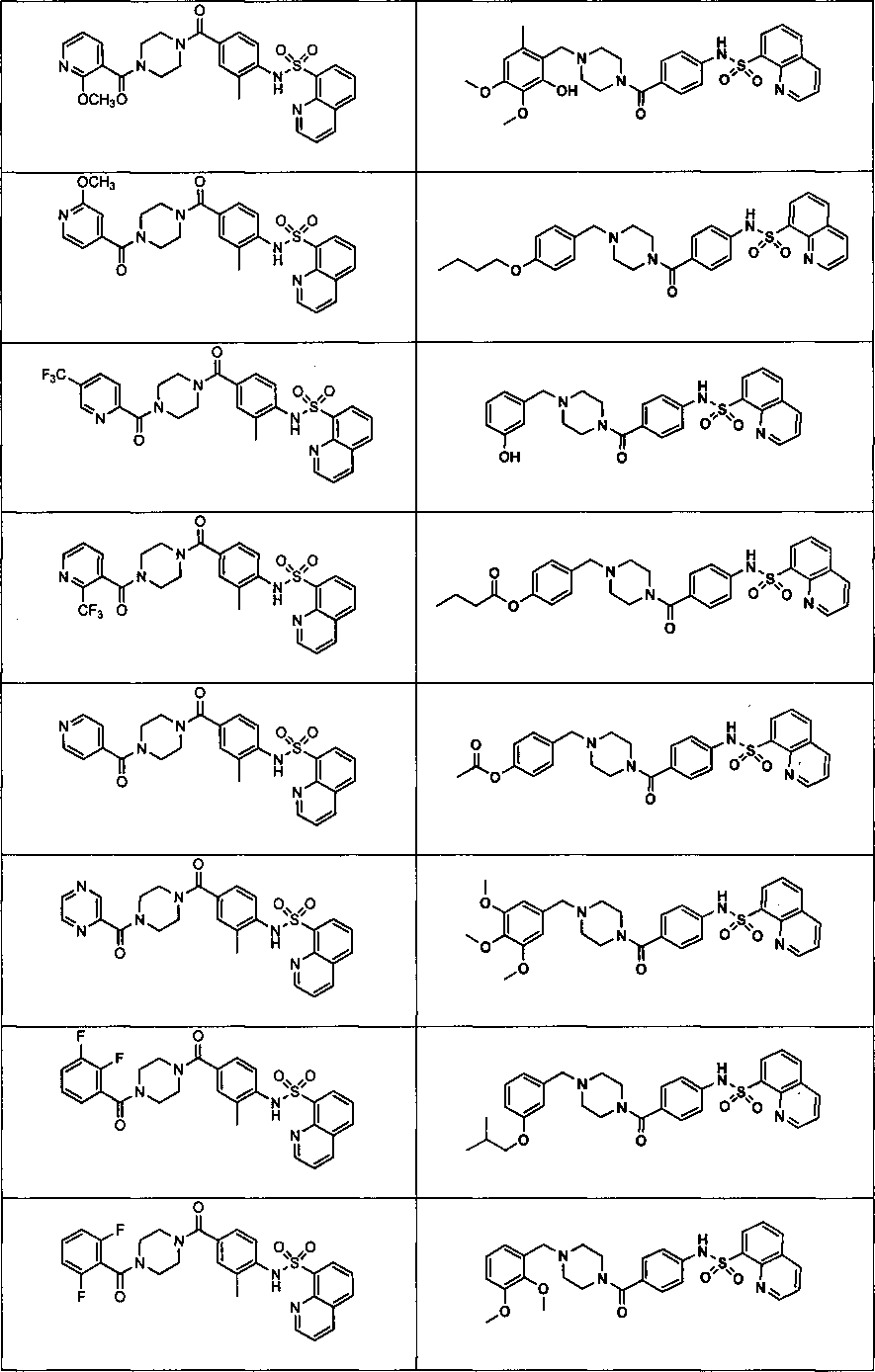









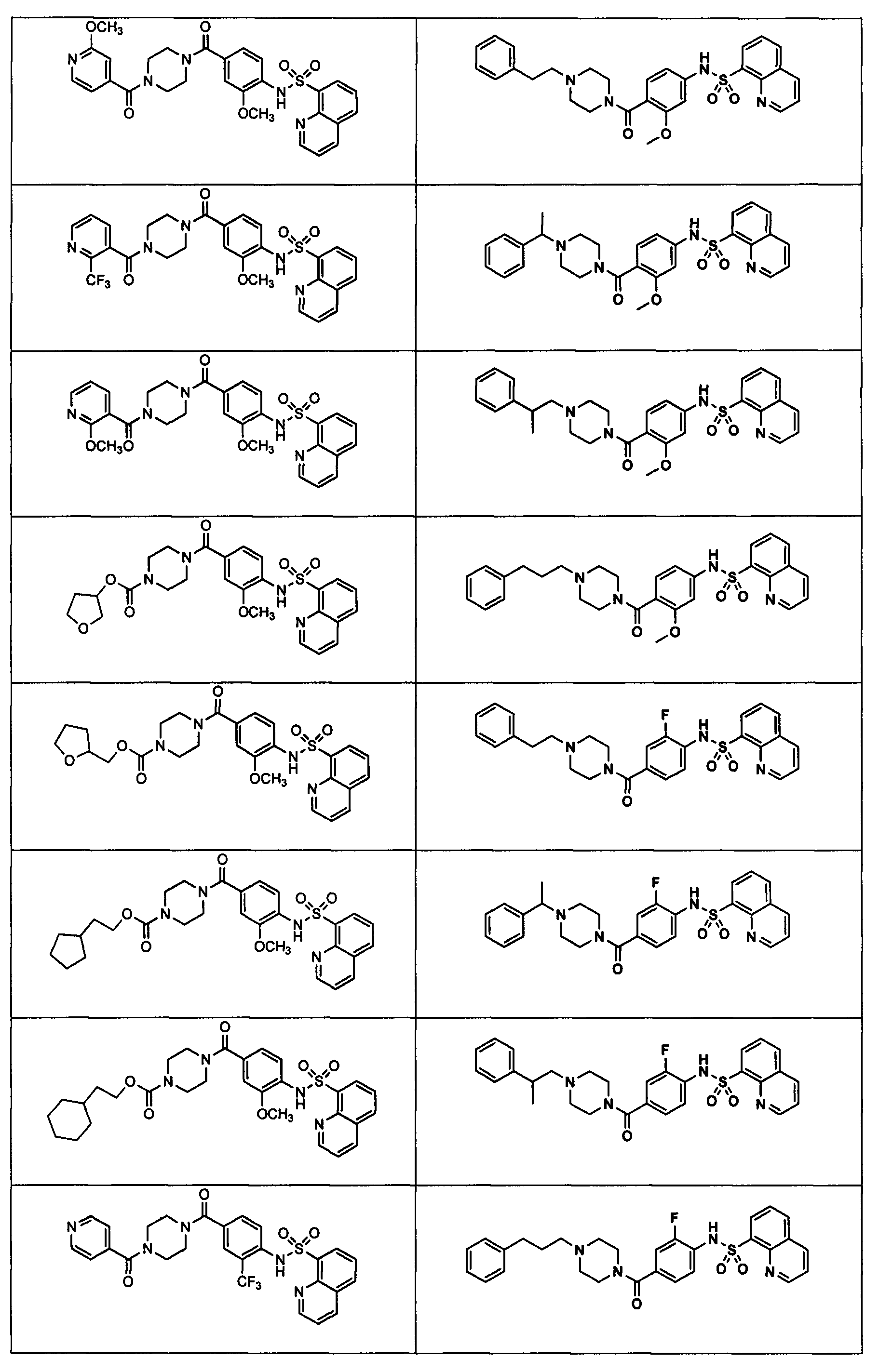
















или его фармацевтически приемлемая соль.

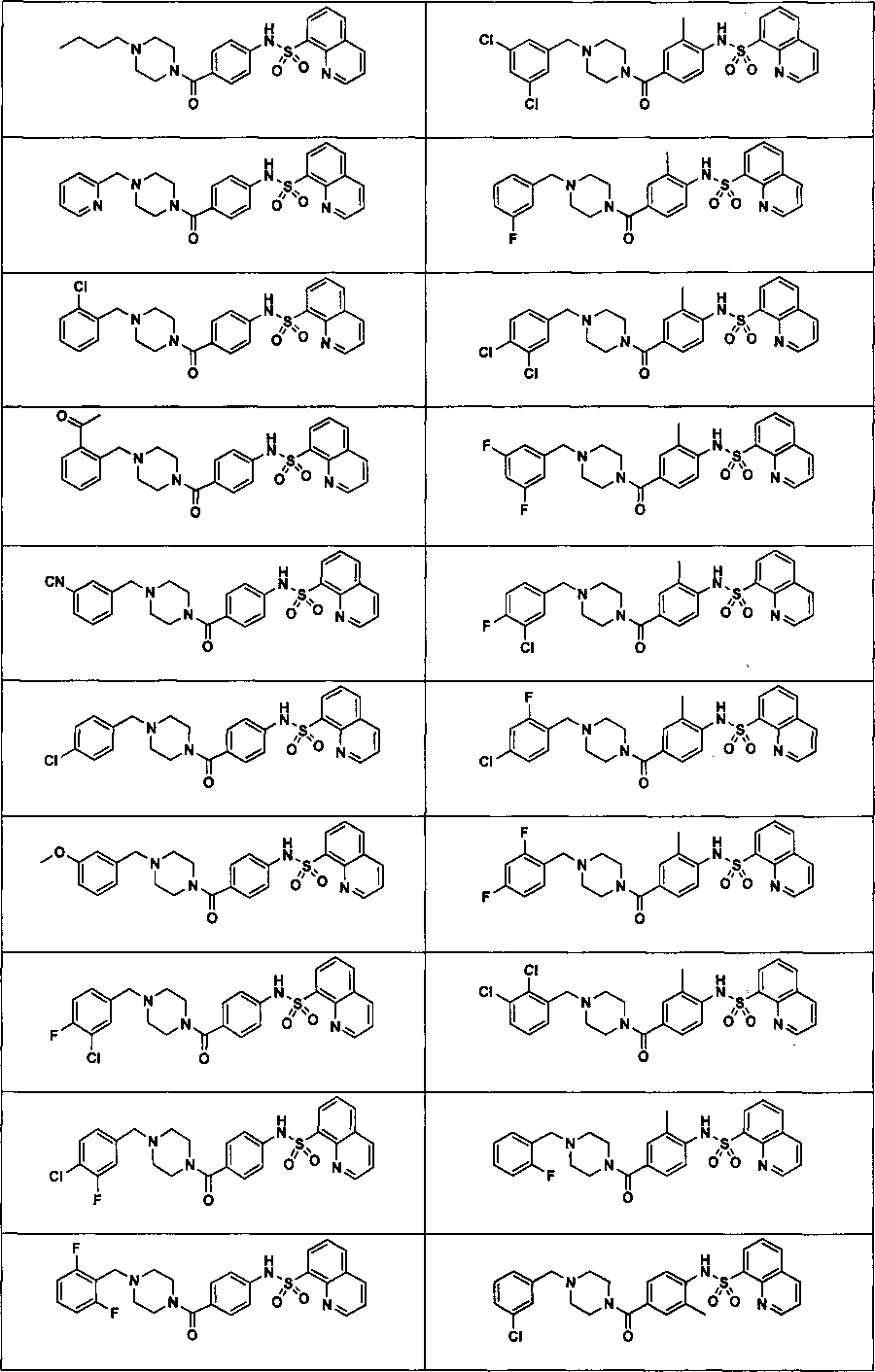

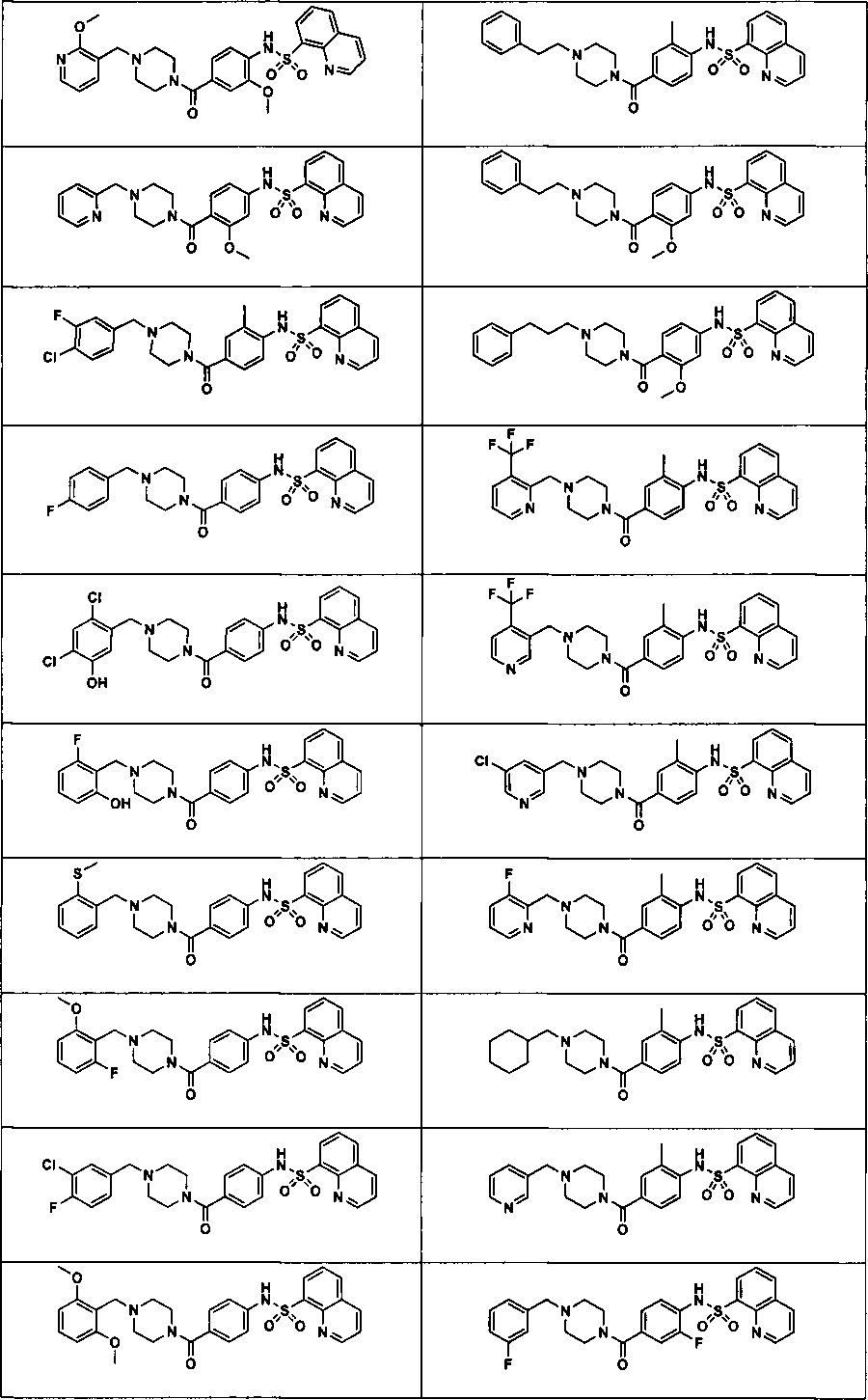


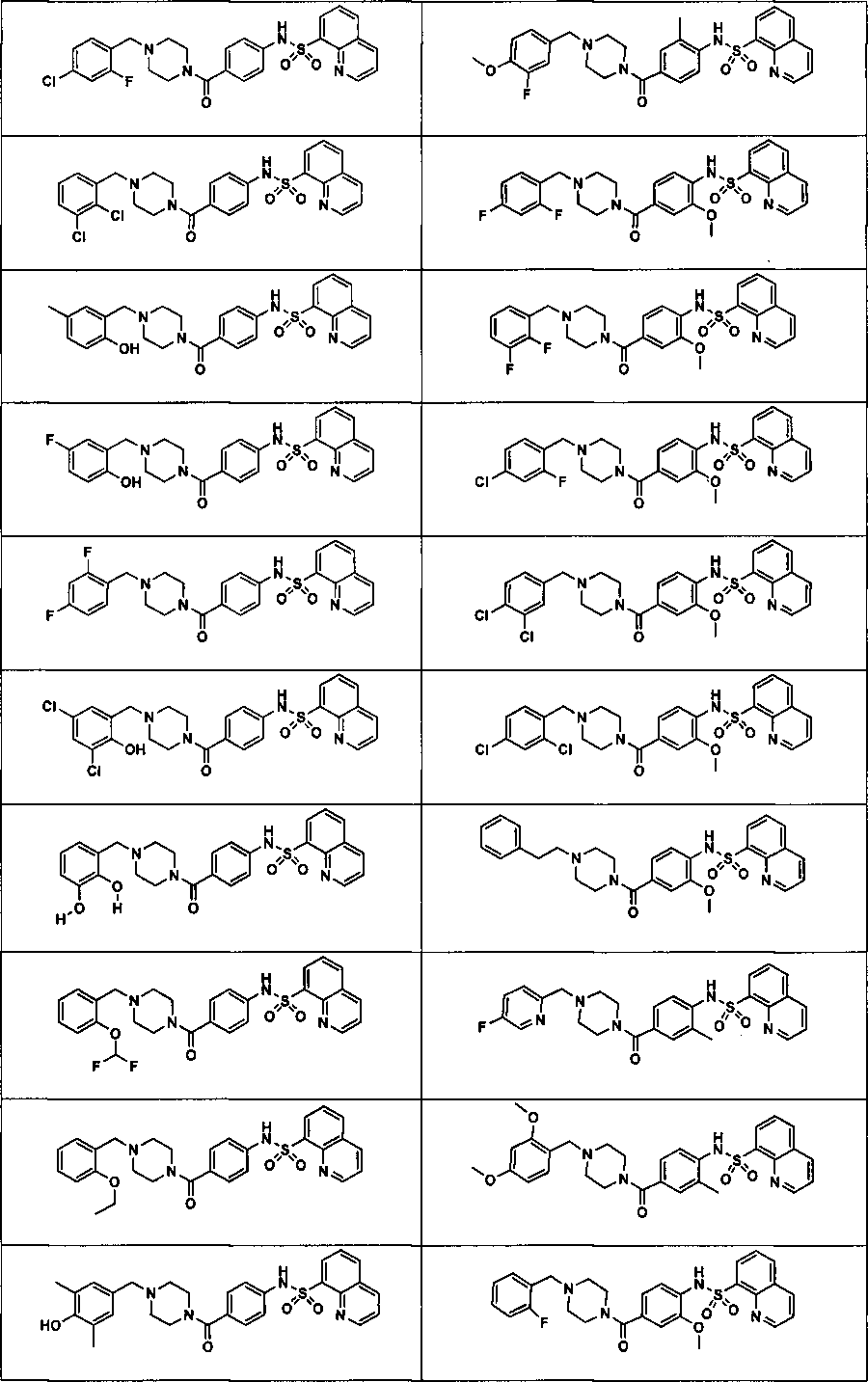




или его фармацевтически приемлемая соль.





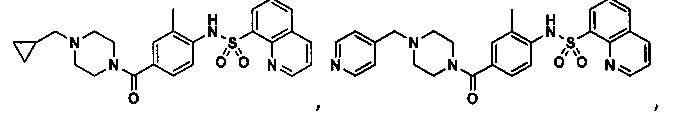
















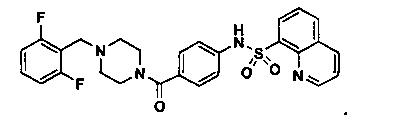



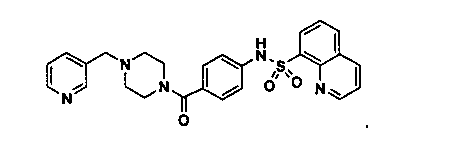


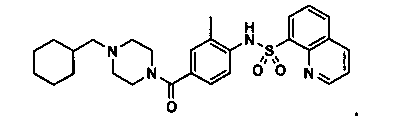

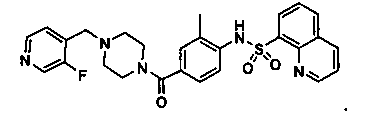




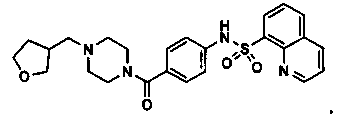

где
каждый W, X, Y и Z представляет CH; каждый W, X и Y представляет XH и Z представляет N; или каждый W, X и Z представляет CH и Y представляет N;
D и D1 независимо выбраны из связи или NRb;
А представляет хинолинил;
L является связью, -C(O)-, -(CRcRc)m-, -OC(O)-, -(CRcRc)m-OC(O)-, -(CRcRc)m-C(O)-, -NRbC(S)- или -NRbC(O)- (где точка присоединения к R1 находится на левой стороне);
R1 выбран из C1-C6 алкила, C3-C6 циклоалкила, арила (где арил представляет фенил или нафтил), гетероарила (где гетероарил представляет 5-10-членное моно- или бициклическое ароматическое кольцо с 1-3 гетероатомами, выбранными из азота и серы) и гетероциклила (где гетероциклил представляет тетрагидрофуранил или азетидинил), каждый из которых замещен 0-5 заместителями Rd;
каждый R3 независимо выбран из гало, гало-C1-алкила, C1-C6 алкила, гидроксила и -ORa;
каждый Ra независимо выбран из C1-C6 алкила и ацила (где ацил представляет -C(O)CH3), гидрокси-C1-C2 алкила и гало-C1-алкила;
каждый Rb независимо выбран из водорода и C1-C6 алкила;
каждый Rc независимо выбран из водорода или C1-C6 алкила или два Rc, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный C3-циклоалкил;
каждый Rd независимо выбран из гало, гало-C1-алкила, гало-C1-алкокси, C1-C6 алкила, C2-C6 алкинила, циано, гидроксила, -C(O)Ra, -OC(O)Ra, -C(O)ORa, -SRa, -NRaRb и -ORa;
n равно 0 или 1;
m равно 1, 2 или 3;
h равно 1 или 2 и
g равно 1.
Документы, цитированные в отчёте о поиске
Производные пиперазина и фармацевтическая композиция на их основе


















Комментарии