Чрескожное введение соединений пиперазинил-2 (3н)-бензоксазолона посредством электрофореза - RU2371179C2
Код документа: RU2371179C2
Чертежи






Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к чрескожному введению посредством электрофореза фармацевтических соединений общей формулы
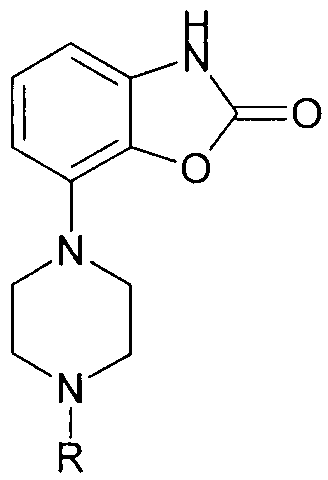
где R представляет собой метил, этил, этил, замещенный одним и более атомами фтора, или цикло-(C3-7)-алкилметил, необязательно замещенный одним и более атомами фтора, или бензил, 2-пиридилметил, 3-пиридилметил или 4-пиридилметил, необязательно замещенные одним и более заместителями из группы, состоящей из галогена, гидроксила, циано, амино, моно- или ди-C1-3-алкиламино, C1-3-алкокси, CF3, OCF3, SCF3, C1-4-алкила, C1-3-алкилсульфониламино, фенила, фуранила и тиенила, и где указанные заместители фенил, фуранил и тиенил необязательно дополнительно замещены 1-3 остатками из группы гидроксила, галогена, C1-4-алкокси, C1-4-алкила, циано, аминокарбонила, моно- или ди-C1-4-алкиламинокарбонила; и его фармацевтически приемлемых солей и пролекарств.
Конкретнее, изобретение относится к чрескожному введению посредством электрофореза фармацевтических соединений общей формулы (I), где R представляет собой метил, этил, этил, замещенный одним и более атомами фтора, или цикло-(C3-7)-алкилметил, необязательно замещенный одним и более атомами фтора, или радикал бензил, 2-пиридилметил, 3-пиридилметил или 4-пиридилметил, причем данные группы могут быть замещены одним и более заместителями из группы, состоящей из галогена, гидроксила, циано, амино, моно- или ди-C1-3-алкиламино, C1-3-алкокси, CF3, OCF3, SCF3, C1-4-алкила, C1-3-алкилсульфониламино.
Конкретнее, изобретение относится к чрескожному введению посредством электрофореза фармацевтических соединений общей формулы (I), где R представляет собой метил или бензил, необязательно замещенный 1-3 заместителями из группы гидроксила и галогена. Большинство предпочтительных соединений в настоящем изобретении являются соединениями, где R представляет собой метил или бензил.
Еще более конкретно, изобретение относится к применению по меньшей мере одного соединения общей формулы I, которая определена выше, или их смесей для изготовления электрофоретического устройства для лечения болевых расстройств, особенно синдрома беспокойных ног, и расстройств ЦНС, особенно болезни Паркинсона.
Настоящее изобретение также относится к применению соединений общей формулы (1) для изготовления (a) раствора для применения в устройстве для чрескожного введения путем электрофореза или в наборах, содержащих картриджи, которые содержат соединение, готовое к применению в указанном устройстве, (b) устройства, подходящего для чрескожного введения путем электрофореза, где указанное чрескожное устройство имеет резервуар, содержащий соединение формулы I или его композицию, и необязательно фармацевтически приемлемый электролит, причем данное устройство может использоваться в способе контролирования профиля введения фармацевтических соединений общей формулы (I) и их композиций, и применении указанных контролируемых профилей введения в лечении болевых расстройств, особенно синдрома беспокойных ног, и расстройств ЦНС, особенно болезни Паркинсона.
УРОВЕНЬ ТЕХНИКИ
Соединения общей формулы I, которые определены выше, известны из WO00/29397 и WO01/85725. Данные соединения демонстрируют непостоянную активность либо частичных агонистов, либо агонистов D2 дофаминовых рецепторов, а также являются агонистами 5HT1 A рецептора. Данные сочетания активностей делают соединения ценными для лечения болезней центральной нервной системы, вызванных нарушениями либо в дофаминергической, либо серотонинергической системах, например болезни Паркинсона и синдрома беспокойных ног.
В определенных случаях, например, когда пероральное введение или инъекция конкретного фармацевтически активного соединения (также называемого лекарственным средством) могут быть неэффективными или недопустимыми из-за плохого всасывания в желудочно-кишечном тракте, сильного влияния первого прохождения, боли и дискомфорта пациента, или других побочных эффектов или недостатков, чрескожное введение может обеспечить выгодный способ введения данного соединения. Это является актуальным, например, при болезни Паркинсона, где имеется необходимость вводить средство для лечения больным, которые спят, находятся в коме или под анестезией. Кроме того, накапливается все больше сведений о том, что непрерывная дофаминовая стимуляция позволяет избежать развития проблем, связанных с прерывистым дозированием, и в которых было показано, что непрерывное введение лекарственного средства снижает частоту периодов «выключения» (P. Niall and W.H. Oertel, Congress Report of 7th International Congress of Parkinson's Disease and Movement Disorders, Miami, Florida, November 10-14, 2002). В общем, чрескожное введение тоже имеет свои проблемы, так как не всегда легко заставить лекарственные средства проникнуть сквозь кожу.
Электрофоретическое чрескожное введение относится к введению ионов или растворимых солей фармацевтически активных соединений в ткани организма под влиянием приложенного электрического поля.
Особенности и выгоды электрофоретических чрескожных систем введения по сравнению с пассивными чрескожными системами, так же как с другими средствами введения фармацевтических соединений в кровоток, были, например, рассмотрены в O.Wong, «Iontophoresis: Fundamentals», in Drugs Pharm. Sci. (1994), 62 (Drug Permeation Enhancement), 219-46 (1994); P.Singh et al., «Iontophoresis in Drug Delivery: Basic Principles and Applications», Critical Reviews in Therapeutic Drug Carrier Systems, 11 (2 & 3): 161-213 (1994); and Ajay K. Banga, Electrically Assisted Transdermal and Topical Drug Delivery, Taylor and Francis Group Ltd., London UK, 1998, ISBN 0-7484-0687-5.
В определенных случаях, например, когда чрескожное введение посредством пластырей представляется неэффективным или недопустимым из-за низкого проникновения через кожу, что приводит к очень крупным пластырям, электрофоретическое чрескожное введение может предоставить выгодный способ введения такого соединения. Кроме того, электрофоретическое чрескожное введение обладает тем главным преимуществом, что введенное количество можно точно регулировать, и может использоваться, чтобы легко титровать у пациентов введение до определенного уровня в течение нескольких недель.
Несмотря на эти преимущества, электрофоретические способы кажутся ограниченными, поскольку профиль введения препарата конкретным способом сильно зависит от конкретного вводимого лекарственного средства. Хотя было проведено много экспериментов с введением посредством электрофореза различных активных веществ, конкретная информация, позволяющая специалисту в данной области техники приспосабливать профиль введения определенного лекарственного средства, не всегда доступна.
Поскольку казалось, что очень трудно разработать чрескожные пластыри с приемлемым размером для соединений с общей формулой (I), существует потребность в электрофоретическом способе введения указанных соединений, который делает возможным введение указанных соединений с различной скоростью, приспособленной к конкретному лечению.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к электрофоретической чрескожной технологии, которая обеспечивает введение соединений общей формулы (I) и их композиций через кожу человека.
Конкретнее, задача настоящего изобретения заключается в том, чтобы предложить применение соединения общей формулы (I) и его фармацевтически приемлемых солей и пролекарств для приготовления композиции, подходящей для применения в устройстве для чрескожного введения путем электрофореза, где указанная композиция содержит соединение формулы I и необязательно фармацевтически приемлемый электролит. Приготовленная композиция подходит для применения в устройстве для чрескожного введения путем электрофореза для лечения болезни Паркинсона и синдрома беспокойных ног.
Еще конкретнее задача данного изобретения заключается в том, чтобы предложить применение соединений общей формулы (I) и их фармацевтически приемлемых солей и пролекарств для изготовления устройства, подходящего для чрескожного введения путем электрофореза для лечения болезни Паркинсона и синдрома беспокойных ног, где указанное чрескожное устройство имеет резервуар, содержащий соединение формулы I или его композицию, и необязательно фармацевтически приемлемый электролит. Когда данное устройство накладывается на кожу живого организма и через кожу заставляют течь электрический ток, соединения общей формулы (I) и их фармацевтически приемлемые соли, и пролекарства электрофоретически вводятся через кожу.
Другая задача изобретения заключается в том, чтобы предложить систему для электрофореза для введения соединений общей формулы (I) и их композиций через кожу, где система включает устройство для чрескожного введения, которое можно прикрепить к коже, устройство, включающее первый электрод и второй электрод, и резервуар для содержания фармацевтически приемлемого электролита и соединений общей формулы (I) и их композиций в электрической связи с первыми и вторыми электродами; и электрический источник энергии, соединенный с первыми и вторыми электродами; где резервуар содержит соединения общей формулы (I) и их композиции, и необязательно фармацевтически приемлемый электролит.
Также задача изобретения заключается в том, чтобы предложить набор, содержащий систему для электрофореза, соединенную с одним и более картриджами, содержащими соединение общей формулы (I), или набор, содержащий один и более картриджей, содержащих соединение общей формулы (I), которые используются, чтобы наполнять резервуар системы для электрофореза. Количество картриджей в наборах предпочтительно составляет от 2 до 91, более предпочтительно от 7 до 28 и наиболее предпочтительно от 14 до 28.
Кожа, через которую должно осуществляться введение, является кожей животных, например кожей человека.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлен график потока 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона через роговой слой человека в виде функции концентрации активного соединения в зависимости от времени.
На фиг.2 представлен график потока 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона через роговой слой человека в виде функции концентрации электролита в зависимости от времени.
На фиг.3 представлен график потока 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона через роговой слой человека в виде функции концентрации активного компонента в зависимости от времени в присутствии 4 г/л NaCl.
На фиг.4 представлен график потока 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона мезилата через кожу крысы, лишенную волос, в виде функции концентрации активного компонента в зависимости от времени в присутствии 30 миллимоль (мМ) NaCl.
На фиг.5 представлен график потока 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона мезилата через кожу крысы, лишенную волос, в виде функции плотности тока в присутствии 30 миллимоль NaCl.
На фиг.6 изображена схема электрофоретического устройства для тестов с 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолоном.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Электрофоретическая чрескожная система введения может содержать первый (донорский) электрод, содержащий электролитически доступное активное соединение в подходящем растворителе или носителе и необязательно вещество, способствующее проникновению; противоэлектрод и источник энергии; первый и второй электроды находятся в электропроводной связи с источником энергии. Первый и второй электроды могут быть приспособлены к разделенному пространством физическому контакту с кожей, посредством чего в ответ на ток, созданный источником энергии через электроды, терапевтическое количество активного соединения вводится через кожу пациента.
Неожиданно было обнаружено, что введением посредством электрофореза (дозой и профилем), которым конкретное активное соединение общей формулы (I) вводится больному, можно управлять, используя подходящую комбинацию начальной концентрации лекарственного средства и электролита и прикладываемого тока (постоянного/переменного) в системе для электрофореза. Например, обнаружено, что комбинация плотности тока (постоянного/переменного) и начального количества электролита может привести к электрофоретическому устройству с очень умеренным размером, который делает возможным регулировать профиль введения лекарственного средства. Способность регулировать профиль введения лекарственного средства при электрофорезе может обеспечить усиленный контроль над влиянием лекарственного средства на пользователя. Кроме того, способность регулировать профиль введения лекарственного средства при электрофорезе может сделать введение посредством электрофореза соединений формулы (I) более фактически эффективным способом введения.
Используемый в данном документе термин «профиль проникновения» означает график потока активного соединения в зависимости от времени в течение заданного периода введения.
Используемый в данном документе термин «картридж» означает контейнер, содержащий активное соединение, который используется для хранения активного соединения до его введения устройством. По меньшей мере, в одном варианте осуществления настоящего изобретения, картридж может быть отобран по его удобству для пользователя. «Картриджем» можно считать любые способы упаковки активного соединения отдельно от электрофоретического устройства. Например, для подачи активного компонента в устройство можно использовать съемные и заменимые резервуары.
Электролиты, используемые в способах по настоящему изобретению, могут включать одновалентные или двухвалентные ионы, например. Примеры электролитов, используемых в способе, включают все соединения, отдающие Cl-, которые растворимы в воде, такие как HCl, NaCl, KCl, CaCl2, MgCl2, триэтиламмония хлорид и трибутиламмония хлорид. В предпочтительном варианте осуществления электролит содержит NaCl. Необходимое количество электролита может зависеть от факторов, таких как транспортная область устройства, объем растворителя или носителя, концентрация активного соединения, плотность тока, продолжительность электрофореза и эффективность транспорта. Электролит может присутствовать в количествах, например, по меньшей мере приблизительно 0,005 ммоль, по меньшей мере приблизительно 0,01 ммоль или по меньшей мере приблизительно 0,05 ммоль. Электролит может присутствовать в количествах, например, не более приблизительно 2 ммоль, не более приблизительно 1,0 ммоль или не более приблизительно 0,3 ммоль. Начальное количество электролита может быть выражено как концентрация, например, по меньшей мере приблизительно 0,005 М, по меньшей мере приблизительно 0,01 М или по меньшей мере приблизительно 0,03 М. Начальное количество электролита может быть выражено как концентрация, например, не более приблизительно 2 М, не более приблизительно 0,2 М или не более приблизительно 0,2 М.
Соединения, которые могут вводиться по настоящему изобретению, были уже определены выше. Пролекарства упомянутых выше соединений находятся в пределах объема настоящего изобретения. Пролекарства являются терапевтическими средствами, которые неактивны per se, но превращаются в один и более активный метаболит. Пролекарства являются биообратимыми производными молекул лекарственного средства, используемыми, чтобы преодолеть некоторые барьеры к полезности молекулы исходного лекарственного средства. Данные барьеры включают без ограничения перечисленными: растворимость, проницаемость, стабильность, пресистемный метаболизм и ограничения направленной доставки (Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, Ed.: F. D. King, p. 215; J. Stella, «Prodrugs as therapeutics», Expert Opin. Ther. Patents, 14(3), 277-280, 2004; P. Ettmayer et al., «Lessons learned from marketed and investigational prodrugs», J.Med.Chem., 47, 2393-2404, 2004). Пролекарства, то есть соединения, которые при введении людям любым известным путем метаболизируются до соединений, имеющих формулу (I), которые принадлежат данному изобретению. В особенности это относится к соединениям с первичной или вторичной амино- или гидроксигруппой. Такие соединения могут реагировать с органическими кислотами, чтобы производить соединения, имеющие формулу (I), в которых присутствует дополнительная группа, которая легко удаляется после введения, например, но без ограничения, амидин, енамин, основание Манниха, гидроксилметиленовое производное, О-(ациклометиленкарбаматное) производное, карбамат, сложный эфир, амид или енаминон.
Как указано выше, соединения формулы I могу использоваться в форме фармацевтически приемлемых солей, полученных из неорганических или органических кислот. Соли пролекарств тоже находятся в пределах объема данного изобретения. Фраза «фармацевтически приемлемая соль» означает те соли, которые в рамках разумного медицинского суждения подходят для применения в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражения, аллергической реакции и т.п. и соответствуют обоснованному соотношению выгоды/риска. Фармацевтически приемлемые соли известны в технике. Например, S. М. Berge и др. подробно описали фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66: 1 et seq. Соли могут быть приготовлены in situ во время заключительного выделения и очистки соединений по изобретению или отдельно путем реакции функции свободного основания с подходящей органической кислотой. Характерные аддитивные соли кислоты включают, без ограничения, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат (изотионат), лактат, малеат, мезилат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмитат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат. Примеры кислот, которые могут использоваться для образования фармацевтически приемлемых аддитивных солей кислоты, включают такие неорганические кислоты, как хлористоводородная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как щавелевая кислота, малеиновая кислота, янтарная кислота и лимонная кислота.
Активные лекарственные средства, которые могут быть введены способом, описанным в данном документе, включают, но не ограничены такими соединения, как 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолон или его солью - моногидрохлоридом (SLV308, см. Drugs of the Future 2001, 26, 128-32), и 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолоном или его солью - мономезилатом (SLV318).
7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолон или его соль - моногидрохлорид и 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолон или его соль - мономезилат подходят для лечения синдрома беспокойных ног или болезни Паркинсона.
Согласно изобретению могут вводиться соединения формулы (I), пролекарства, фармацевтически приемлемые соли любого из вышеприведенных и смеси двух или больше из вышеприведенных.
pH раствора в резервуаре для лекарственного средства может составлять по меньшей мере приблизительно 3,0 в некоторых вариантах осуществления. В других вариантах осуществления pH может быть меньше 7,5 или приблизительно равным 7,5. Еще в других вариантах осуществления pH может составлять от приблизительно 4,0 до приблизительно 6,5. pH может поддерживаться на постоянном уровне посредством буфера, такого как цитратный буфер или фосфатный буфер.
Для 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона или его соли моногидрохлорида применимый pH колеблется от приблизительно 5,0 до приблизительно 6,0. Другой возможный pH для упомянутого соединения равняется приблизительно 5,5. Для 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона или его соли мономезилата pH может колебаться, например, от приблизительно 3,5 до приблизительно 6,0. Другой применимый pH для указанного соединения равняется приблизительно 4,0.
Во время периода введения ток можно заставить течь, приложив постоянное или переменное, такое как импульсное или переменное напряжение/ток. Альтернативно во время периода введения ток можно увеличить, чтобы титровать повышающуюся концентрацию соединения формулы (I).
Напряжение, создаваемое на стадии приложения электрического тока, выбирается из диапазона напряжений, которые не повреждают кожу живого организма и не наносят ущерба скорости чрескожного всасывания активного соединения. Напряжение может составлять, например, по меньшей мере приблизительно 0,1 В, или по меньшей мере приблизительно 0,5 В, или по меньшей мере приблизительно 1 В. Напряжение также может составлять, например, менее приблизительно 40 В, или менее приблизительно 20 В, или менее приблизительно 10 В.
Импульсное или переменное напряжение может иметь частоту, например, по меньшей мере приблизительно 0,01 Гц, или по меньшей мере приблизительно 100 Гц, или по меньшей мере приблизительно 5 кГц. Импульсное или переменное напряжение может иметь частоту, например, не более приблизительно 200 кГц, или не более приблизительно 100 кГц, или не более приблизительно 80 кГц. Импульсное или переменное напряжение может использовать, по существу, колебания любой формы, включая, например, синусоидную, квадратную, треугольную, пилообразную, прямоугольную и т.д. Кроме того, импульсное или переменное напряжение может прилагаться в рабочем цикле менее 100%.
Плотность тока может составлять, например, по меньшей мере приблизительно 0,001 мА/см2, или по меньшей мере приблизительно 0,005 мА/см2, или по меньшей мере приблизительно 0,025 мА/см2. Плотность тока также может составлять, например, не более приблизительно 1,0 мА/см2, не более приблизительно 0,8 мА/см2 или не более приблизительно 0,5 мА/см2.
Резервуар с лекарственным средством содержит лекарственное средство и необязательно электролит вместе с водным раствором или (гидро)гелем в качестве растворителя или носителя. Гель резервуара может состоять из водорастворимых полимеров или гидрогелей. В принципе, может использоваться любой гель. Гели могут быть выбраны с тем, чтобы они не оказывали неблагоприятного воздействия на кожу (разъедания и раздражения). Гели могут проявлять подходящие свойства, такие как хороший контакт с кожей (липкость) и свойство электропроводности. Неограничивающие примеры включают агар, агарозу, поливиниловый спирт и поперечно сшитые гидрогели, такие как гидроксипропилметилцеллюлоза (HPMC), метилцеллюлоза (MC), гидроксиэтилцеллюлоза (HEC), карбоксиметилцеллюлоза (CMC), и поливинилпирролидон (PVP), и фталат поливинилацетата (PVAP).
Подходящие вещества, способствующие проникновению через кожу, включают известные в технике, например C2-C4 спирты, такие как этанол и изопропанол; поверхностно-активные вещества, например анионные поверхностно-активные вещества, такие как соли жирных кислот с 5-30 атомами углерода, например лаурилсульфат натрия и другие сульфатные соли жирных кислот, катионные поверхностно-активные вещества, такие как алкиламины с 8-22 атомами углерода, например олеиламин, и неионогенные поверхностно-активные вещества, такие как полисорбаты и полиоксамеры; алифатические одноатомные спирты с 8-22 атомами углерода, такие как деканол, лауриловый спирт, миристиловый спирт, пальмитиловый спирт, линолениловый спирт и олеиловый спирт; жирные кислоты с 5-30 атомами углерода, такие как олеиновая кислота, стеариновая кислота, линолевая кислота, пальмитиновая кислота, миристиновая кислота, лауриновая кислота и каприновая кислота и их сложные эфиры, такие как этилкаприлат, изопропилмиристат, гексаметиленпальмитат, глицерилмонолаурат, полипропиленгликольмонолаурат и полиэтиленгликольмонолаурат; салициловую кислоту и ее производные; алкилметилсульфоксиды, такие как децилметилсульфоксид и диметилсульфоксид; азациклоалкан-2-оны, замещенные по 1-му положению, такие как 1-додецилазациклогептан-2-он (AZONE®); амиды, такие как октиламид, амид олеиновой кислоты, гексаметиленлаурамид, диэтаноламид лауриловой кислоты, полиэтиленгликоль-3-лаурамид, N,N-диэтил-м-толуамид и кротамитон; и любые другие соединения, совместимые с соединениями общей формулы (I) и устройствами и имеющие действие, увеличивающее чрескожную проницаемость.
В альтернативном варианте осуществления носитель или растворитель отделены от кожи мембраной. Данная мембрана может быть выбрана с тем, чтобы, например, иметь низкое сопротивление электрическому току, и/или, по существу, избегать увеличения барьера против транспорта активного соединения, и/или удерживать носитель внутри устройства во время хранения и транспортировки. Низкое сопротивление электрическому току в одном варианте осуществления можно определить как 20% устойчивости кожи. Барьер против транспорта активного соединения, по существу, не увеличивается мембраной, когда поток активного соединения в устройстве, содержащем мембрану, например, превышает 75% по сравнению с устройством, не содержащим мембрану. Примеры мембран, которые могут использоваться, составляют, например, мембраны, имеющие низкое электрическое сопротивление, которые раскрыты в D.F. Stamiatialis et al., J. Controlled Release 2002, 81. 335-345, такие как мембраны CT-10 кДа, CT-20 кДа, PES-30 кДа и PSf-100 кДа от Sartorius, Dialysis-5 кДа от Diachema, CA-10 кДа, CA-25 кДа, CA-50 kD and CA-100 кДа от Amika и NF-PES-10 и NF-CA-30 от Nadir Filtration.
Системы для электрофореза, применяемые для осуществления данного изобретения, могут включать устройства и/или компоненты, выбранные из широкого разнообразия имеющихся в продаже устройств или компонентов и/или из широкого диапазона способов и материалов, таких как сообщаемые, например, в патентах и публикациях, относящимся к таким системам для электрофореза. В частности, электрофоретическая чрескожная система может содержать электрофоретическое устройство, такое как то, которое можно приобрести в корпорации Alza из Mountain View, Калифорния, США (E-trans® Transdermal Technology), Birch Point Medical Inc. из St. Paul, Миннесота, США (например, IontoPatch™, работающий в соответствии с технологией Wearable Electronic Disposable Delivery (WEDD™)), Iomed из Солт-Лейк-Сити, США (например, устройство IOMED™ Phoresor, в котором применяются IOGEL®, TransQ®Flex, TransQ®E, TransQ®1&2 или Numby Stuff® электроды и среда, удерживающая GelSponge®), или устройство, такое как производимое Vyteris из Fair Lawn, Нью-Джерси, США (Active Transdermal system), или устройство, такое как производимое Empi из St Paul, Миннесота (например Empi DUPEL™), или устройство, известное как LECTRO™ Patch, которое производится General Medical Device Corp. из Лос-Анджелеса, Калифорния.
Электроды могут быть выполнены в виде реакционно-способных или нереакционно-способных электродов. Примерами реакционно-способных электродов служат электроды, сделанные из солей металлов, таких как хлорид серебра, или материалов, описанных в US 4752285. Электроды из хлорида серебра можно создать, основываясь на знаниях специалиста в данной области техники, данные электроды также можно получить в Iomed. Альтернативные реакционно-способные электроды могут быть сделаны из комбинации ионообменных смол, что подтверждается примером электродов, которые можно получить в Empi. Примерами нереакционно-способных электродов служат электроды, сделанные от металлов, таких как золото или платина, или из частиц углерода, рассеянных в полимерных матрицах, таких как применяемые в LECTRO™ Patch. Адгезивы, используемые, чтобы зафиксировать электрофоретическое устройство на коже, могут включать адгезивы, чувствительные к надавливанию, используемые в системах для пассивного чрескожного введения, таких как получаемые из силиконовых или акриловых полимеров, или получаемых из резин, таких как полиизобутилен. Также может использоваться комбинация адгезивов, чувствительных к надавливанию, и проводящих адгезивов, такие как описанные в EPA 0542294.
В резервуаре с лекарственным средством концентрация лекарственного средства может составлять, например, по меньшей мере приблизительно 0,1 мг/мл. Концентрация лекарственного средства в резервуаре с лекарственным средством может составлять, например, не более приблизительно 90 мг/мл. В некоторых вариантах осуществления концентрация 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона или его соли моногидрохлорида составляет, например, от приблизительно 10 до приблизительно 75 мг/мл. В других вариантах осуществления данные концентрации варьируют от приблизительно 20 до приблизительно 55 мг/мл. Еще в других вариантах осуществления концентрация 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона или его мономезилата составляет, например, от приблизительно 1 до приблизительно 30 мг/мл. В других вариантах осуществления данная концентрация может варьировать от приблизительно 5 до приблизительно 10 мг/мл.
Кроме того, резервуар с лекарственным средством системы для электрофореза может содержать дополнительные добавки. Такие добавки могут быть выбраны из тех, которые известны и общеприняты в технике электрофореза. Такие добавки включают, например, антимикробные средства, консерванты, антиоксиданты, вещества, способствующие проникновению, и буферы.
Пример однократной дозы, которую можно ввести в течение одного периода введения, может меняться по величине. Например, однократная доза в одном варианте осуществления может составлять по меньшей мере приблизительно 0,05 мг. Однократная доза в другом варианте осуществления может составлять, например, не более приблизительно 100 мг. Однократная доза для 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона или его моногидрохлорида в некоторых вариантах осуществления может варьировать от приблизительно 0,05 до приблизительно 60 мг. В других вариантах осуществления данная концентрация может колебаться от приблизительно 0,05 до приблизительно 30 мг.
Однократную дозу для введения можно определить на основе одного или широкого диапазона факторов, включая, например, определенное соединение, состояние, возраст, массу тела, клиренс и т.д.
Скорость введения через кожу по меньшей мере одного соединения формулы I может составлять, например, по меньшей мере приблизительно 50 мкг в час. В других вариантах осуществления скорость введения через кожу может составлять, например, не более приблизительно 4000 мкг в час.
В некоторых вариантах осуществления настоящего изобретения способ введения посредством электрофореза фармацевтических соединений включает протокол лечения введением лекарственного средства, который включает периодическое наложение электрофоретического чрескожного устройства с интервалами, которые могут быть такими частыми, как дважды в сутки, или такие редкими, как один раз в неделю или один раз в месяц. То, что в данном документе называется одной стадией лечения, включает наложение устройства, электрофоретическое введение лекарственного средства и удаление устройства после этого. Хотя абсолютное количество введенного лекарственного средства может в значительной степени меняться, определенная в данном документе однократная доза составляет такое количество лекарственного средства, как угодно большое или малое, которое вводится в течение одной стадии лечения путем наложения одного устройства на отдельный участок.
Во время одной стадии лечения лекарственное средство можно вводить постоянно или в течение определенных интервалов. Интервалы могут колебаться, например, от приблизительно 10 минут до 24 или 48 часов. В некоторых случаях может быть выгодно пропустить введение в течение части цикла дня и ночи, например ночью в течение 6, 7 или 8 часов.
В начале введения лекарственного средства может быть желательно иметь линейное или пошаговое увеличение лекарственного средства за определенное время, начиная с низкого количества лекарственного средства до нормальной поддерживающей дозы, данное время также упоминается как время титрования. Период для титрования может составлять, например, по меньшей мере 3 суток или не более 42 суток. Период титрования в некоторых вариантах осуществления может варьировать от 7 до 21 суток, а в других вариантах осуществления составлять приблизительно 14 дней. Способ введения посредством электрофореза по настоящему изобретению может быть применимым для такого линейного или пошагового увеличения введения лекарственного средства, поскольку введенное количество лекарственного средства может регулироваться линейным или пошаговым увеличением плотности тока.
В некоторых вариантах осуществления система для электрофореза содержит
(a) устройство для чрескожного введения, которое можно прикрепить к коже, при этом устройство содержит первый электрод и второй электрод, и резервуар, способный содержать соединение формулы I, как сформулировано выше, и необязательно фармацевтически приемлемый электролит в электрической связи с первыми и вторыми электродами, и
(b) средства для соединения источника электрической энергии с первым и вторым электродами.
Источник электрической энергии может представлять собой любой подходящий источник, такой как, например, батарея, аккумулятор или электроэнергия, поступающая через электрическую розетку. Устройства для соединения источника электрической энергии могут содержать любой подходящий проводник, кабельный канал или носитель электрической энергии. Устройства могут содержать, например, электропроводку, адаптер мощности, контроллер мощности, монитор мощности или комбинацию двух и более из упомянутых. Система для электрофореза может включать еще и другие способы и материалы, такие как описанные в WO 92/17239, EPA 0547482 и US 4 764 164, содержание которых полностью включено в данный документ посредством ссылки.
В некоторых вариантах осуществления транспортная область устройства может составлять по меньшей мере приблизительно 1,0 см2. В других вариантах осуществления транспортная область может не превышать приблизительно 30 см2. В других вариантах осуществления транспортная область может составлять от приблизительно 2 до приблизительно 15 см2 и в следующих вариантах осуществления от приблизительно 5 до приблизительно 10 см2.
В другом варианте осуществления изобретения резервуар с лекарственным средством системы для электрофореза доставляют пользователю пустым и резервуар заполняют непосредственно перед или после наложения системы на кожу. При применении данного варианта осуществления система для электрофореза объединяется с одним и более картриджами, содержащими соединение общей формулы I, как определено выше, включая его соль, или пролекарство, или композицию двух и более из них, и необязательно, фармацевтически приемлемый электролит. Данная комбинация системы для электрофореза и одного и более картриджей может быть определена как начальный набор. Количество картриджей в одном наборе может варьировать, например, от 7 до 91, а в других вариантах осуществления от 14 до 28. Соединение и необязательный электролит могут находиться в форме твердого кристаллического, аморфного или лиофилизированного вещества, причем данный материал должен быть растворен в воде перед заполнением резервуара электрофоретического устройства или находиться в форме раствора, готового к употреблению. Система для электрофореза может быть перезаправлена новым раствором, например, каждые 3-48 часов или, например, однократно каждые 24 часа. В другом варианте осуществления, например, набор, который предназначается для более чем одной стадии лечения, до тех пор, пока электрофоретическая система работает должным образом, содержит только один или больше картриджей, содержащих соединение общей формулы I, как определено выше, включая его соль, или пролекарство, или его композицию, и необязательно может присутствовать фармацевтически приемлемый электролит.
Используемый в данном документе термин «приблизительно», которой изменяет значение, указывает на вариабельность, свойственную данному значению, которую мог бы понять средний специалист в данной области техники. Например, «приблизительно» указывает, что значащие цифры, ошибки округления и т.п. создают диапазон значений около изложенного числа, который попадает в объем раскрытия данного числа.
Следующие примеры предназначаются только для того, чтобы дополнительно иллюстрировать изобретение более подробно, и поэтому не предполагается, что данные примеры каким-либо образом ограничивают объем изобретения.
ПРИМЕРЫ
Пример 1. Общие способы.
Выделение рогового слоя кожи человека
Роговой слой кожи человека (РСКЧ) был получен из здоровой кожи человека, взятой с помощью дерматома. В пределах 24 часов после хирургического удаления кожи человека (с живота или грудной клетки) удаляли остатки подкожного жира. Чтобы избежать мешающего воздействия контаминирующего подкожного жира, поверхность кожи осторожно протирали папиросной бумагой, пропитанной 70% этанолом. Дерматом срезал кожу толщиной примерно 300 мкм; использовали Padgett Electro Dermatome Model B (Kansas City, США). Затем ее инкубировали со стороны дермы на ватмане, пропитанном раствором 0,1% трипсина в фосфатно-солевом буферном растворе в течение ночи при 4°C, а затем 1 час при 37°C. После этого РСКЧ отделяли от подлежащего эпидермиса и дермы. Остаточную активность трипсина блокировали путем промывания РСКЧ в 0,1% растворе ингибитора трипсина в фосфатно-солевом буферном растворе, pH 7,4. РСКЧ несколько раз промывали в воде и хранили в эксикаторе, содержащем силикагель, в атмосфере N2, чтобы подавить окисление липидов.
Выделение кожи безволосых крыс
Безволосых крыс умерщвляли ингаляцией углекислого газа, используя затравочную камеру, предназначенную для такого применения, за полчаса до начала эксперимента. Кожу с живота тщательно удаляли, убеждаясь в том, что на коже не осталось прикрепленных мышц или жира. Затем кожу разрезали на небольшие квадраты, соответствующие набору для диффузии Franz (Membrane Transport System, PermeGear, U.S.A), и помещали до вставки в рамку в 0,1 М буфер фосфата калия.
Синтез активного соединения
Соль 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона и хлористоводородной кислоты синтезировали, как описано в WO00/29397 и Drugs of the Future 2001, 26,128-32. 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона мезилат получали, как описано в WO01/85725 и WO02/066449.
Растворы в экспериментах по электрофорезу
7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолон в виде соли HCl растворяли в 10 мМ растворе цитрата натрия. pH был приведен к pH 5,5 10 мМ лимонной кислотой.
7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолон в виде соли - мезилата растворяли в 0,1 Μ калиевом фосфатном буфере. pH приводили к pH 4,0, используя oртофосфорную кислоту.
Эксперименты по электрофорезу 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона
Эксперименты по электрофорезу 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона проводили, используя 9-канальный источник питания с компьютерным управлением, который подавал постоянный ток (Electronics Department, Gorlaeus Laboratories, Leiden University, Нидерланды). Альтернативно можно использовать имеющийся в продаже источник питания PCT-MK1 от Moor Instruments, Великобритания. В качестве анода использовали серебряный пластинчатый электрод (например, серебряная фольга чистоты > 99,99% толщиной 1,0 мм (продукт Aldrich № 36943-8), 5 см длиной, 3 мм шириной), а в качестве катода использовали электрод из серебра/хлорида серебра (полученный путем повторного (двух- или трехкратного) погружения серебряного провода (чистота > 99,99%, ⌀ 1,0 мм (продукт Aldrich № 26559-4)), согнутого на конце так, чтобы образовался небольшой выступ (примерно 3 мм) под прямым углом к вертикальному стержню электрода, в расплавленный порошок хлорида серебра (чистота >99,999%, продукт Aldrich № 20438-2) (Альтернативно серебряную пластинку и электроды из серебра/хлорида серебра можно подготовить согласно главе 3.4.3. из Ajay K. Banga, Electrically Assisted Transdermal and Topical Drug Delivery, Taylor and Francis Group Ltd., London UK, 1998, ISBN 0-7484-0687-5, или приобрести у коммерческого поставщика, такого как Iomed).
Все эксперименты по диффузии проводили при постоянной плотности тока 0,5 мА/см2, используя три камеры с непрерывным потоком через диффузионные ячейки, при комнатной температуре. Устройство для диффузии состояло из перистальтического насоса, сборщика фракций и 8 диффузионных ячеек (диффузионную ячейку см. на фиг.4). Для всех исследований диффузии использовали роговой слой. Роговой слой человека перед установкой в ячейки гидратировали в течение двух часов в фосфатно-солевом буфере с pH 7,4. Два кусочка рогового слоя помещали между анодной и акцепторной стороной и между акцепторной и катодной стороной, причем апикальная сторона была направлена в сторону анодного и катодного отсеков. В качестве поддерживающей мембраны для рогового слоя использовали мембрану для диализа (пороговое значение 5000 Да). Добавляли парафиновые кольца, чтобы сделать соединения между отсеками герметичными. Температура акцепторной камеры равнялась 37°C. Во время эксперимента поток фосфатно-солевого буфера через акцепторную камеру для каждой ячейки поддерживали приблизительно одинаковым - 6-8 мл в час. После шести часов пассивной диффузии включали ток. Ток выключали, когда t = 15 ч. В следующие 5 часов (период после электрофореза) выполняли пассивную диффузию после электрофореза. Во время электрофореза плотность тока составляла 0,5 мА/см2. Во время эксперимента полное сопротивление листков рогового слоя мониторировали с помощью двух дополнительных серебряных электродов. Очень низкое сопротивление указывало на негерметичность рогового слоя в ячейке. Когда это наблюдалось, данные по диффузии отбрасывались. Все условия повторяли по меньшей мере 3 раза. Число доноров кожи для каждого условия равнялось по меньшей мере 3.
Эксперименты по электрофорезу 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона. Эксперименты по электрофорезу 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона проводили, используя вертикальные диффузионные ячейки Franz (Membrane Transport System, PermeGear, США), подключенные к измерителю источника Keithley 2400, и ток мониторировали с помощью мультиметра. На донорскую половину ячейки воздействовала комнатная температура (25°C), в то время как в рецепторной половине поддерживали 37°C. Рецепторный отсек непрерывно перемешивали. Кожу безволосых крыс, недавно иссеченную, устанавливали в вертикальную диффузионную ячейку, затем рецепторный отсек заполняли подходящей рецепторной средой, которая могла поддерживать условие погружения. Состав рецепторной среды был таким же, как у донорского раствора без лекарственного средства, так что могло поддерживаться условие погружения. Лекарственный препарат помещали в донорский отсек. В доноре в качестве анода использовали серебряный провод, а в рецепторе в качестве катода использовали провод из серебра/хлорида серебра. Ток включали на 3 часа, используя источник питания, дающий постоянный ток. Однако отбор проб продолжали до 24 ч, чтобы посмотреть, остановится ли усиленное введение при отключении тока. Пробы брали из рецептора через заранее определенные интервалы времени и анализировали ВЭЖХ, как описано ниже. Пробы замещали свежей рецепторной средой, что учитывали при расчетах.
Анализ с помощью ВЭЖХ
7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолон анализировали, используя ВЭЖХ с УФ-детектированием (Waters Chromatography, Etten Leur, Нидерланды). Использовали колонку Chromsep SS (250*3 мм L*i.d.), термостатируемую при 30°C. Подвижная фаза состояла из ацетонитрила/метанола/буфера с 0,7 г/л аммония ацетата с pH 5,6 (12/6/82 об./об.) и подавалась со скоростью 0,5 мл/мин. Длина волны детектирования равнялась 215 нм. В хроматограммах проб растворов не наблюдалось продуктов окисления или разложения данного соединения.
7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолон анализировали, используя ВЭЖХ с УФ-детектированием (система Waters Alliance). Использовали колонку Chromsep SS (250*3 мм L*i.d.) с размером частиц 5 мкм, термостатируемую при 40°C. Подвижную фазу получали, используя 1,54 г ацетата аммония в 460 мл воды (pH приводили к 4,6, используя уксусную кислоту) и 540 мл метанола, и дегазировали. Скорость потока составила 0,5 мл/мин. Длина волны обнаружения равнялась 243 нм. Объем инъекции составлял 10 мкл.
Пример 2. Электрофорез 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорида при меняющейся концентрации активного вещества
Готовили раствор 75 мг/мл 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорида в цитратном буфере (Это составляет 85% от максимальной растворимости 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорид в цитратном буфере при pH 5,5). Из данного раствора были сделаны дополнительно разведения в цитратном буфере pH 5,5. Исследуемые концентрации составили 20 мг/мл, 35 мг/мл, 55 мг/мл и 75 мг/мл.
Как можно видеть на фиг.1, после включения тока возник крутой подъем потока 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона. В течение периода электрофореза наблюдаемые потоки 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона были чрезвычайно высокими. Средний транспорт в течение электрофоретического периода составил 394 ± 26, 383 ± 42 459 ± 59, 418 ± 31 мкг/час/см2 для донорских концентраций 20, 35, 55, 75 мг/мл соответственно. Между данными значениями не было значимого различия, что проверено однофакторным дисперсионным анализом (значение р между всеми группами > 0,05).
Во время эксперимента pH донорского раствора менялся не более чем на 0,2 единицы pH.
Пример 3. Электрофорез 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорида при меняющейся концентрации активного электролита
7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорид растворяли в 10 мМ растворе цитрата натрия. pH был приведен к pH 5,5 10 мМ лимонной кислотой. Добавляли хлорид натрия, что в результате дало растворы либо 0,2, либо 4 мг/мл NaCl. Концентрацию 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорида поддерживали постоянными, а именно 35 мг/мл. При 4 мг/мл NaCl выбранная концентрация 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорида составила 80% его максимальной растворимости. Растворимость 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорид с уменьшением концентрации NaCl увеличивается.
Фиг.2 показывает, что после включения тока возник крутой подъем потока 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона. Во время периода электрофореза наблюдаемые потоки 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона были чрезвычайно высоки. Средний транспорт в течение электрофоретического периода составил 471 ± 65, 377 ± 37 и 424 ± 50 мкг/ч/см2 (среднее ± стандартная ошибка среднего) для концентраций поваренной соли 0,2, 4 мг/мл соответственно. Между этими величинами не было значимой разницы, что проверено однофакторным дисперсионным анализом (значение p между всеми группами> 0,05). pH донорского раствора в течение эксперимента менялся не более чем на 0,2 единицы pH. Сильное увеличение и уменьшение во время включения и выключения тока показывают, что с помощью электрофореза можно достичь большого изменения транспорта.
Пример 4. Электрофорез 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорида при меняющейся концентрации активного вещества в присутствии 4 г/л NaCl.
Готовили раствор 55 мг/мл 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорид в цитратном буфере (Это составляет 85% от максимальной растворимости 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорида в цитратном буфере при pH 5,5 в присутствии 4 г/л NaCl). Из данного раствора делали дополнительно разведения в цитратном буфере с pH 5,5. Исследованные концентрации составляли 20 мг/мл, 35 мг/мл, 55 мг/мл, и NaCl был добавлен в количестве, чтобы создать концентрацию 4 г/л.
Фиг.3 показывает, что в присутствии NaCl электрофоретический поток 7-(4-метил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорид слегка зависел от его потока концентрации. Потоки составляли 409 ± 47, 467 ± 74 и 580 ± 87 мкг/ч/см2 для донорских концентраций 20, 35 и 55 мг/мл соответственно (среднее ± стандартная ошибка среднего). Однако тенденция оказалась статистически незначимой, что проверено однофакторным дисперсионным анализом (значение p между всеми группами> 0,05).
pH донорского раствора в течение эксперимента менялся не более чем на 0,2 единицы pH.
Пример 5. Электрофорез 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона при меняющеейся концентрации активного вещества в присутствии 30 мМ NaCl.
Готовили раствор 10 г/мл 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона мезилата в фосфатном буфере (Это примерно максимальная растворимость 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона моногидрохлорида в фосфатном буфере при pH 4,0 в присутствии 30 мМ NaCl). Из данного раствора делали дальнейшие разведения в фосфатном буфере с pH 4,0. Исследованные концентрации составили 1 мг/мл, 5 мг/мл и 10 мг/мл, и NaCl был добавлен в количестве, чтобы создать концентрацию 30 мМ. Фиг.4 показывает, что имеется увеличение электрофоретического потока с увеличением концентрации активного вещества с 1 мг/мл до 5 мг/мл и что нет увеличения электрофоретического потока при дополнительном увеличении концентрации активного вещества до 10 мг/мл.
Пример 6. Электрофорез 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона в концентрации 5 мг/мл, переменная плотность тока в присутствии 30 мМ NaCl.
Раствор 5 г/мл 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона мезилата в фосфатном буфере, который был приготовлен в примере 5, использовали, чтобы изучить влияние плотности тока. Потоки были измерены при плотности тока 0, 0,1, 0,3 и 0,5 мА. Фиг.5 показывает, что электрофорез значительно увеличивает проникновение 7-(4-бензил-1-пиперазинил)-2(3H)-бензоксазолона по сравнению с пассивным введением. Дополнительно показано, что существует линейная взаимосвязь между потоком и плотностью тока.
Реферат
Изобретение относится к области фармацевтики и медицины и касается применения по меньшей мере одного соединения общей формулы (I), где R представляет собой метил или бензил, и его фармацевтически приемлемых солей или их смесей для изготовления электрофоретического устройства для лечения болезни Паркинсона и синдрома беспокойных ног, систем для электрофореза и картриджей и наборов, содержащих соединение формулы I. Изобретение обеспечивает высокую эффективность лечения. 6 н. и 17 з.п. ф-лы.
Формула
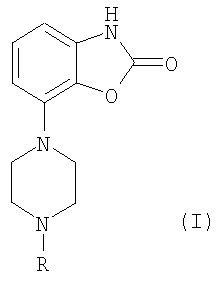
где R представляет собой метил или бензил;
и его фармацевтически приемлемых солей, или смеси любого из вышеупомянутых, и необязательно фармацевтически приемлемого электролита, при изготовлении электрофоретического устройства, которое может быть использовано для введения посредством электрофореза указанного соединения или смеси соединений для лечения болезни Паркинсона и синдрома беспокойных ног.
соединение формулы I представляет собой 7-(4-метил-1-пиперазинил)-2(3Н)-бензоксазолон или его фармацевтически приемлемую соль;
концентрация указанного соединения составляет от 0,1 до 90 мг/мл;
электролит, отдающий Cl-, присутствует в начальном количестве от 0,005 до 2 ммоль;
напряжение, создаваемое на стадии приложения электрического тока, составляет от 0,1 до 40 В;
плотность тока, создаваемая на стадии приложения электрического тока, составляет от 0,001 до 1 мА/см2;
рН составляет от 3,0 до 7,5.
соединение формулы I представляет собой 7-(4-метил-1-пиперазинил)-2(3Н)-бензоксазолон или его моногидрохлорид;
концентрация указанного соединения составляет от 1 до 75 мг/мл;
рН составляет от 5,0 до 6,0.
соединение формулы I представляет собой 7-(4-бензил-1-пиперазинил)-2(3Н)-бензоксазолон или его фармацевтически приемлемую соль;
концентрация указанного соединения составляет от 0,1 до 90 мг/мл;
электролит, отдающий Cl-, присутствует в начальном количестве от 0,005 до 2 ммоль;
напряжение, создаваемое на стадии приложения электрического тока, составляет от 0,1 до 40 В;
плотность тока, создаваемая на стадии приложения электрического тока, составляет от 0,001 до 1 мА/см2;
значение рН составляет от 3,0 до 7,5.
соединение формулы I представляет собой 7-(4-бензил-1-пиперазинил)-2(3Н)-бензоксазолон или его мономезилат;
концентрация указанного соединения составляет от 1 до 30 мг/мл;
рН составляет от 3,5 до 6,0.
(1) электрофоретическую систему для введения соединения через кожу, включающую (а) устройство для чрезкожного введения, присоединяемое к коже, причем устройство имеет в своем составе первый электрод и второй электрод, и резервуар, способный содержать композицию активного соединения, и (b) средства для соединения источника электрической энергии с первым и вторым электродами, и (с) необязательно мембрану, закрывающую резервуар во время транспортировки, хранения и/или использования;
(2) один и более картриджей по пп.16-21.

Комментарии