Производные полимиксина и их применение - RU2675819C1
Код документа: RU2675819C1
Чертежи





Описание
Область техники
Настоящее изобретение относится к производным полимиксина и к их применению при лечении инфекций, вызываемых грамотрицательными бактериями.
Предшествующий уровень техники
Ежегодно от септических инфекций погибают более 215000 граждан Соединенных Штатов. По оценкам, 750000 американцев инфицированы тяжелым сепсисом, и 29% из них умирают от него каждый год. Смертность от сепсиса составляет 9% всех смертельных случаев в США. От сепсиса погибают столько же американцев, сколько от миокардиальных инфекций, и даже больше, чем от дорожно-транспортных происшествий.
От двух до трех миллионов американцев ежегодно заражаются внутрибольничной инфекцией, и 10% этих инфекций развиваются до сепсиса. Более 90000 таких пациентов умирают от сепсиса, полученного в больницах.
Escherichia coli и Klebsiella pneumoniae, обе являющиеся грамотрицательными бактериями, вызывают почти 40% всех внебольничных септических инфекций и приблизительно треть всех внутрибольничных септических инфекций. Из всех грамотрицательных септических инфекций они вызывают приблизительно 60-75%. К другим грамотрицательным возбудителям септических инфекций относятся Acinetobacter baumannii и Pseudomonas aeruginosa. В общей сложности, грамотрицательные бактерии вызывают более 40% всех септических инфекций, причем многие из этих бактерий являются чрезвычайно полирезистентными.
Полимиксины представляют собой группу близкородственных антибиотических веществ, продуцируемых штаммами Paenibacillus polymyxa и родственными микроорганизмами. Эти катионные лекарственные средства являются относительно простыми пептидами с молекулярными массами приблизительно 1000. Полимиксины, такие как полимиксин В, представляют собой декапептидные антибиотикии, то есть они состоят из десяти (10) аминоацильных остатков. Они обладают бактерицидной активностью и особенно эффективны в отношении грамотрицательных бактерий, таких как Е. coli и другие виды Enterobacteriaceae, Pseudomonas, A. baumannii и пр. Однако полимиксины обладают серьезными побочными действиями, включая нефротоксичность и нейротоксичность. Вследствие этого данные лекарственные средства имеют ограниченное применение в качестве терапевтических агентов из-за высокой системной токсичности.
Пандемия грамотрицательных бактерий с высоким уровнем полирезистентности заставила клиницистов возобновить применение полимиксинов в качестве терапии последней линии в случае тяжелых инфекций, даже несмотря на их известную нефротоксичность. Нефротоксичность полимиксинов может осложнить терапию или даже потребовать ее прекращения. Соответственно, риск нефротоксичности следует сопоставлять с положительным влиянием на выживаемость пациентов. Согласно недавним исследованиям, степень нефротоксичности полимиксина В и колистина (высвобождающегося из метансульфоната колистина) варьируется от 10% до 30%, но в отдельных материалах степень токсичности в случае колистина может достигать 43-48%, а в случае полимиксина В - 55%. Соответственно, индивидуальная изменчивость является высокой (Vaara, М. 2013, New derivatives of polymyxins (Новые производные полимиксинов), Journal of Antimicrobial Chemotherapy 2013, 68: 1213-9). Ситуация оказывается еще более неблагополучной, если учитывать современные данные, свидетельствующие о том, что у больных в критическом состоянии применяемые в настоящее режимы приема препаратов оказываются неоптимальными и приводят к недостаточным концентрациям в сыворотке крови. В связи с этим клиницистам рекомендуют увеличивать дозы, однако это приводит к еще большему повышению нефротоксичности.
Краткое описание сущности изобретения
Таким образом, объектом настоящего изобретения является создание производного полимиксина, эффективного в отношении грамотрицательных бактерий и обладающего пониженной нефротоксичностью. Объекты изобретения обеспечиваются с помощью производного полимиксина и его фармацевтически приемлемых солей и посредством их применения, характеризующихся тем, что указано в независимых пунктах формулы изобретения. Предпочтительные варианты осуществления изобретения раскрыты в зависимых пунктах формулы изобретения.
Краткое описание графических материалов
Далее изобретение будет описано более подробно при помощи предпочтительных вариантов осуществления со ссылкой на прилагаемые [сопровождающие] графические материалы, на которых:
на Фиг. 1 показан S-BUN (от англ. serum blood urea nitrogen - содержание азота мочевины в крови) (мг/дл) до (день -7/-8) и во время (дни со 2 по 8) лечения полимиксином В (англ. РМВ), NAB739 или NAB815 (3 животных в группе, в/в (англ. IV, intravenous - внутривенно), три раза в день (англ. TID, three times a day));
на Фиг. 2 показан S-Crea (от англ. serum creatinine - содержание креатинина в крови) (мг/дл) до (день -7/-8) и во время (дни со 2 по 8) лечения полимиксином В (РМВ), NAB739 или NAB815 (3 животных в группе, в/в, три раза в день);
на Фиг. 3 показано соотношение U-NAG (от англ. urine N-acetyl-β-D-glucosaminidase - содержание N-ацетил-D-глюкозаминидазы в моче) (ед./л)/U-Crea (мг/дл)×10 до (день -7/-8) и во время (дни со 2 по 8) лечения полимиксином В (РМВ), NAB739 или NAB815 (3 животных в группе, в/в, три раза в день);
на Фиг. 4 показано соотношение U-GGT (от англ. urine gamma glutamyltransferase - содержание гамма-глютамилтрансферазы в моче) (ед./л)/U-Crea (мг/дл) до (день -7/-8) и во время (дни со 2 по 8) лечения полимиксином В (РМВ), NAB739 или NAB815 (3 животных в группе, в/в, три раза в день).
Подробное описание изобретения
За последние годы был сделано несколько попыток разработать лучше переносимые производные полимиксинов. Ранее нами было показано, что соединения, раскрытые в патентном документе PCT/FI 2007/050441 (содержание и раскрытие которого полностью включены в настоящий документ посредством ссылки), обладают заметной антибактериальной активностью и могут применяться при лечении инфекций, вызываемых грамотрицательными бактериями. Кроме того, было высказано предположение, что такие соединения, каждый из которых несет только три (3) положительных заряда, являются менее нефротоксичными, чем соединения, несущие пять (5) положительных зарядов, а также были представлены предварительные доказательства этого (Vaara М. с соавт. Novel polymixin derivatives carrying only three positive charges are effective antibacterial agents (Новые производные полимиксина, несущие только три положительных заряда, являются эффективными антибактериальными агентами). Antimicrob Agents Chemother 2008, 52: 3229-36; Vaara M., Vaara Т. Polymixin derivatives and uses thereof (Производные полимиксина и их применение). 2010. Патент США 7807637; Vaara М. Polymixins and their novel derivatives (Полимиксины и их новые производные). Curr Opin Microbiol 2010; 13: 574-81; Mingeot-Leclercq M.-P. Novel polymixin derivatives are less cytotoxic than polymixin В to renal proximal tubular cells (Новые производные полимиксина менее цитотоксичны, чем полимиксин В, для клеток проксимальных почечных канальцев). Peptides 2012; 35: 248-52; Vaara М., Vaara Т. The novel polymixin derivative NAB739 is remarkably less cytotoxic than polymixin В and colistin to human kidney proximal tubular cells (Новое производное полимиксина NAB739 заметно менее цитотоксично, чем полимиксин В и колистин, для клеток проксимальных почечных канальцев человека). Int J Antimicrob Chemother 2013, 41:292-3; Vaara, M. 2013, New derivatives of polymixins (Новые производные полимиксинов), Journal of Antimicrobial Chemotherapy 2013, 68: 1213-9).
Хотя эти соединения, такие как NAB739, обладают хорошей антибактериальной активностью в отношении грамотрицательных бактерий, желательно попытаться создать производные, которые бы обладали еще лучшей переносимостью, с помощью надежного и целенаправленного способа.
В данной работе было неожиданно установлено, что конкретное производное полимиксина, такое как определено далее, проявляет требуемое высокое антибактериальное действие в отношении грамотрицательных бактерий без неприемлемой нефротоксичности.
Разработка СВ-182804, молекулы, в остальном идентичной полимиксину В, но несущей 2-хлор-фениламинокарбонил в качестве жирноацильной группы, соединенной с N-концом, в соответствии с Заявкой на патент США 2006004185 (см. также Quale J. с соавт., Activity of polymixin В and the novel polymixin analogue CB-182,804 against contemporary Gram-negative pathogens in New York City (Активность полимиксина В и нового аналога полимиксина СВ-182804 в отношении современных патогенных микроорганизмов в Нью-Йорке), Microb Drug Resist 2012, 13: 574-81) была прекращена в 2010 г. Аналог полимиксина Dap-3 незначительно отличался от полимиксина В в исследованиях нефротоксичности у собак (Magee T.V. с соавт., Discovery of Dap-3 Polymixin Analogues for the Treatment of Multidrug-Resistant Gram-Negative Nosocomial Infections (Выявление аналогов полимиксина Dap-3 для лечения полирезистентных грамотрицательных внутрибольничных инфекций), J. Med. Chem. 2013, 56: 5079-5093). Обе программы включали только соединения с пятью положительными зарядами. К попыткам таже относятся работы Kern с коллегами (Keirstead N, Early prediction of polymixin-induced nephrotoxicity with next generation urinary kidney injury biomarkers (Раннее прогнозирование вызванной полимиксином нефротоксичности с мочевыми биомаркерами повреждения почки нового поколения, Toxicol Sci 2014, 137: 278-91); никаких подробностей или каких-либо дальнейших достижений опубликовано не было.
В Заявке на патент WO/2013/072695 описано более 30 нонапептидов полимиксина, каждый из которых несет по меньшей мере четыре положительных заряда. Некоторые из них были менее цитотоксичными, чем полимиксин В и колистин, для линии НК-2 эпителиальных клеток проксимальных почечных канальцев человека (hRPTEC, от англ. - human Renal Proximal Tubule Epithelial Cell). Кроме того, в ходе 7-дневного исследования на крысах у трех из них повысились уровни цистатина С, альбумина и N-ацетил-D-глюкозаминидазы (NAG) в моче в меньшей степени, чем в случае эквивалентной дозы колистина.
В Заявке на патент WO/2014/188178 продолжена работа, описанная в патентном документе WO/2013/072695. Как явствует из заголовка "Производные полимиксина и их применение в комбинированной терапии вместе с различными антибиотиками", основной упор сделан на потенцирование активности других антибиотиков, таких как рифампин, производными полимиксина из более ранней заявки на патент, а также некоторыми новыми производными. Некоторые из новых производных (примеры производных 44, 46 и 48) несут DSer в R3 (нумерация аминоацильных остатков в соответствии со схемой, обычно используемой для полимиксинов, то есть первый остаток от N-терминального конца полимиксина В нумеруют как R1). Одно из них (производное 46) несет только три положительных заряда. Это аналог NAB739, в остальном идентичный ему, но несет в качестве концевого фрагмента 2-циклогексил-2-гидроксиэтаноил (также известный как 2-циклогексил-2-гидроксиацетил), тогда как NAB739 несет октаноил. В общей сложности, в заявке описано около 100 производных, которые, за исключением описанного выше производного примера 46, несут по 4-6 положительных зарядов. Все производные имели свою циклическую гептапептидную часть, идентичную полимиксину В, за исключением производных примеров 19, 30, 31, и 32, имевших циклическую гептапептидную часть, идентичную гептапептидной части полимиксина Е, и производного примера 50, имевшего циклическую гептапептидную часть, идентичную таковой у полимиксина S. многие из производных были менее токсичными, чем полимиксин В и колистин, для линии НК-2 эпителиальных клеток проксимальных почечных канальцев человека (hRPTEC). Кроме того, в ходе 7-дневного исследования на крысах было показано, что три из них (производные примеров 1, 4 и 10) повышают уровни цистатина, альбумина и NAG в моче в меньшей степени, чем эквивалентная доза колистина. В заявке высказано предположение, что присутствие аминофункциональной группы в составе N-концевой группы может снизить нефротоксичность. Однако в пресловутых нефротоксичных полимиксине В и колистине в R1 имеется свободная аминогруппа. В заявке также предполагается, что гидоксильная группа и/или гетероциклильная группа на N-конце могут иметь аналогичный эффект, снижающий токсичность.
Поиск клинически значимой модели нефротоксичности представляет собой сложную задачу. Magee T.V. с соавт., 2013 (см. выше), показали, что производное полимиксина 5х, где R3 является диаминопропионилом (вместо диаминобутирила) и присутствует относительно полярный 6-оксо-1-фенил-1,6-дигидропиридин-3-карбонил в качестве жирноацильного заместителя, было значительно менее токсичным для эпителиальных клеток проксимальных почечных канальцев человека (hRPTEC), чем полимиксин В. Кроме того, в ходе 7-дневного исследования на крысах 5х оказался менее нефротоксичным, чем полимиксин В. Ободренные этими результатами, авторы провели 7-дневное исследование на собаках. В этом исследовании результаты нефротоксичности оказались лишь незначительно в пользу 5х. Авторы пришли к выводу, что применительно к почечному поражению 5х лучше переносится крысами, чем полимиксин В, однако это преимущество исчезает у собак, что указывает на неэффективность анализа hRPTEC для прогнозирования нефротоксичности у этих видов.
В другом исследовании той же лаборатории (Burt D. et. al. Application of emerging biomarkers of acute kidney injury in development of kidney-sparing polypeptide-based antibiotics (Применение новых биомаркеров острого почечного повреждения на стадии разработки щадящих антибиотиков для почек на основе полипептидов). Drug Chem Toxicol. 2014; 37:204-12) полимиксин В вызывал быстрое появление реакций S-Crea и BUN (анг. Blood Urea Nitrogen - содержание азота мочевины в крови) у собак и обезьян, но не у крыс. Авторы пришли к выводу, что отсутствие реакции у крыс может быть связано с видоспецифичными реакциями на полимиксин В и различиями в физиологии почек. Соединение 5х не было включено в это исследование. Поскольку S-Crea и BUN являются очень достоверными маркерами нефротоксичности в клинической терапии, можно ожидать, что для прогнозирования нефротоксичности у человека модель на животном, таком как собака или обезьяна, будет значительно более надежной, чем модели на грызунах.
Таким образом, анализы in vitro hRPTEC и исследования in vivo на крысах, столь привлекательные в других случаях, могут вводить в заблуждение многообещающими результатами, которые не могут быть продублированы в ходе исследований на животных, более близких к человеку.
NAB815 и его описанное ранее эталонное соединение NAB739 относятся к категории полимиксинов, несущих только три (3) положительных заряда. Как показано здесь, оба они определенно менее нефротоксичны, чем полимиксин В, для макак-крабоедов. При этом NAB815 является менее нефротоксичным, чем NAB739. Его переносили все животные. Клиническое значение имеет и разнородность реакции у пациентов на полимиксин В и колистин, поскольку некоторые пациенты оказываются более уязвимыми к нефротоксическому действию, чем другие. Гистопатологическое сравнение морфологических изменений, вызванных одинаково высокими дозами (36 мг/кг/дозу) NAB739 и NAB815, демонстрирует менее серьезные нефропатические изменения в случае NAB815. Соответственно, NAB815 имеет явное преимущество перед NAB739. Без ограничения какой-либо теорией отметим, что это может являться следствием различия в распределении зарядов. В то время как NAB739 несет все свои три положительных заряда в гептапептидном кольце, NAB815 в гептапептидном кольце имеет только два положительных заряда. Таким образом, гептапептидное кольцо NAB815 не напоминает ни один из известных полимиксинов.
В предыдущей заявке на патент тех же авторов (PCT/FI 2007/050441), а также в публикациях (Vaara М. et. Al. 2008. Novel Polymyxin Derivatives Carrying Only Three Positive Charges Are Effective Antibacterial Agents (Новые производные полимиксина, несущие только три положительных заряда, являются эффективными антибактериальными агентами). Antimicrob Agents Chemother 52:3229-3236; Vaara, M., Т. Vaara. 2010. Structure-activity studies on novel polymyxin derivatives that carry only three positive charges (Изучение зависимости структура-активность новых производных полимиксина, несущих только три положительных заряда). Peptides 31:2318-2321), все молекулы, имеющие два положительных заряда в кольцевой части и один положительный заряд в хвостовой части (NAB715, NAB716, и NAB717), были вариациями одной темы. Один положительный заряд в хвостовой части находился в положении R3, а два положительных заряда в циклической части были смещены между тремя потенциальными положениями в R5, R8 и R9. Из трех комбинаций (положительные заряды в положениях R5&R8, R5&R9 и R8&R9) лишь одна (R5&R9) показала активность, которая, однако, была значительно ниже, чем активность наиболее оптимальных соединений (NAB739 и NAB737), в которых все три положительных заряда находились в циклической части (в R5&R8&R9).
При создании соединения по настоящей заявке на патент (NAB815) был применен совершенно иной подход. В хвостовой части сохранили две гидроксильные группы (обусловленные Thr и DThr в R2 и R3, соответственно), и положительный заряд поместили в положение R1 (а не в R3). В качестве неожиданного результата могла быть сохранена высокая антибактериальная активность, при этом один из трех положительных зарядов располагался в хвостовой части. В более ранней заявке на патент и последующих публикациях не было раскрыто никаких соединений, имеющих полноразмерный хвост (R1, R2 и R3) с одним положительным зарядом на нем.
Совершенно удивительно, что, как также показано здесь, у макак-крабоедов NAB815 выделяется в мочу в очень значительной степени, в то время как выделение полимиксина В практически равно нулю. Это может представлять интерес для лечения тяжелых инфекций, происходящих из мочевых путей.
Соответственно, настоящее изобретение предлагает соединение, имеющее формулу (I):

где
R1 представляет собой Dab,
R2 представляет собой Thr,
R3 представляет собой DThr,
R4 представляет собой Dab,
R5 представляет собой Dab,
R6 представляет собой DPhe,
R7 представляет собой Leu,
R8 представляет собой Abu,
R9 представляет собой Dab;
R10 представляет собой Thr; а
R(FA) является октаноилом;
и его фармацевтически приемлемые соли.
Соединение по настоящему изобретению содержит циклическую пептидную часть R4-R10 и боковую цепь, связанную с N-концевым аминоацильным остатком R4. Боковая цепь состоит из остатка R(FA)-трипептид(R1-R3). R(FA) представляет собой октаноильный остаток (OA), связанный с α-аминогруппой N-концевого аминокислотного остатка трипептидной боковой цепи.
В частности, R1-R10 представляет собой аминокислотную последовательность Dab-Thr-DThr-cy[Dab-Dab-DPhe-Leu-Abu-Dab-Thr-], то есть SEQ ID NO. 1. Таким образом, соединение в соответствии с настоящим изобретением представляет собой OA-Dab-Thr-DThr-cy[Dab-Dab-DPhe-Leu-Abu-Dab-Thr-], то есть OA-SEQ ID NO. 1, или его фармацевтически приемлемую соль.
Соединения формулы (I) обнаруживают высокую антибактериальную активность и при введении демонстрируют лишь незначительное нежелательное нефротоксическое действие либо его отсутствие, как будет показано при помощи результатов иллюстративных фармакологических тестов, обсуждаемых ниже.
Сокращения, использованные в данном контексте: Dab означает α,γ-диамино-н-бутирил, то есть 2,4-диаминобутирил; Abu означает 2-аминобутирил; Thr означает L-треонин; DThr означает D-треонин; DPhe означает D-фенилаланин; Leu означает L-лейцин; и OA означает октаноил.
Выражение "фармацевтически приемлемый" означает пригодный для приготовления фармацевтической композиции, то есть безопасный, нетоксичный и не являющийся ни биологически, ни иным образом нежелательным, и предусматривает возможность применения для животных и человека.
Термин "фармацевтически приемлемая соль" означает соли с кислотами и основаниями, считающимися нетоксичными и обычно использующимися в фармацевтической литературе. Примерами таких солей являются соли присоединения кислот, образованные с фармацевтически приемлемыми нетоксичными кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, лимонная кислота, аскорбиновая кислота, малеиновая кислота, бензойная кислота, винная кислота, угольная кислота и тому подобное. Кислотой, обычно используемой для образования фармацевтически приемлемой соли, является серная кислота.
"Включает" или "включающий" при использовании в данном контексте означает, что описанный набор впоследствии может, но не обязательно должен включать в себя другие элементы.
Соединения по настоящему изобретению могут ингибировать рост или сенсибилизировать клинически важные грамотрицательные бактерии к действию антибактериальных агентов. Указанные грамотрицательные бактерии могут быть бактериями рода Acinetobacter, Aeromonas, Alcaligenes, Bordetella, Branhamella, Campylobacter, Citrobacter, Enterobacter, Escherichia, Francisella, Fusobacterium, Haemophilus, Helicobacter, Klebsiella, Legionella, Moraxella, Pasteurella, Plesiomonas, Pseudomonas, Salmonella, Serratia, Shigella и Yersinia species. Бактерии могут быть, например, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Enterobacter cloacae, Enterobacter aerogenes, другими видами Enterobacter, Citrobacter freundii, Pseudomonas aeruginosa, другими видами Pseudomonas, Acinetobacter baumannii, a также многими другими видами неферментирующих грамотрицательных бактерий. Бактерии также включают Helicobacter pylori и другие клинически важные грамотрицательные бактерии. В частности, указанные грамотрицательные бактерии выбраны из группы, состоящей из: Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Enterobacter cloacae, Citrobacter freundii, Pseudomonas aeruginosa и Acinetobacter baumannii, предпочтительно, указанные грамотрицательные бактерии выбраны из группы, состоящей из: Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa и Acinetobacter baumannii.
Бактериальные инфекции, подлежащие лечению с помощью соединений по настоящему изобретению, включают, например, бактериемию, септицемию, инфекцию кожи и мягких тканей, пневмонию, менингит, инфекции в пельвиоперитонеальной области, инфекцию инородного тела, лихорадку у пациентов гематологического профиля, инфекцию, вызванную внутривенным или другим катетером, канюлей и/или устройством, инфекцию в желудочно-кишечном тракте, глазную или ушную инфекцию, поверхностную кожную инфекцию и колонизацию желудочно-кишечного тракта, слизистых оболочек и/или кожи потенциально токсичными бактериями.
Соединения по настоящему изобретению могут применяться для лечения бактериальной инфекции и/или бактериальных инфекционных заболеваний, в частности, заболеваний, вызываемых грамотрицательными бактериями. Примеры воспалительных заболеваний и состояний включают, не ограничиваясь перечнем, тяжелые внутрибольничные инфекции, инфекции пациентов с иммунной недостаточностью, инфекции пациентов после трансплантации органов, инфекции в отделениях интенсивной терапии (ОИТ, англ. ICU -intensive care units), тяжелые инфекции ожоговых ран, тяжелые внебольничные инфекции, инфекции пациентов с кистозным фиброзом, а также инфекции, вызываемые полирезистентными грамотрицательными бактериями.
Соответственно, настоящее изобретение предлагает способ лечения бактериальной инфекции, в частности, инфекций, вызываемых грамотрицательными бактериями, включающий введение соединения, такого как определено в данном контексте, или фармацевтической композиции, такой как определена в данном контексте, пациенту, нуждающемуся в таком лечении.
Соединения по настоящему изобретению можно вводить в эффективном количестве в пределах суточного диапазона доз приблизительно от 1 мг/кг до 300 мг/кг, предпочтительно, от 3 мг/кг до 100 мг/кг массы тела. Соединения по настоящему изобретению можно вводить в виде однократной суточной дозы или же общесуточную дозу можно вводить раздельными дозами два, три или четыре раза в день.
"Эффективное количество" означает количество соединения, оказывающее терапевтический эффект на получающего лечение субъекта. Терапевтический эффект может быть объективным (то есть поддающимся измерению при помощи какого-либо теста или маркера) либо субъективным (то есть субъект описывает или ощущает эффект). Такое лечение не обязательно должно полностью улучшать состояние при заболевании. Кроме того, такое лечение или предупреждение может применяться в сочетании с другими традиционными способами лечения для облегчения состояния, известными специалистам в данной области.
Соединения по настоящему изобретению наиболее предпочтительно применяют по отдельности или с другими действующими веществами, в частности, с другими антибактериальными агентами. Указанные другие действующие вещества могут вводиться одновременно или последовательно в любом порядке с соединениями по настоящему изобретению. Указанные антибактериальные агенты могут быть выбраны из группы, состоящей из кларитромицина, азитромицина, эритромицина и других макролидов, кетолидов, фторкетолидов, клиндамицина и других линкозаминов, стрептограминов, рифампина, рифабутина, рифалазила и других рифамицинов, фузидовой кислоты, мупироцина, оксазолидинонов, ванкомицина, далбаванцина, телаванцина, оритаванцина и других гликопептидных антибиотиков, фторхинолинов, бацитрацина, производных тетрациклина и фторциклина, бета-лактамных антибиотиков, новобиоцина, плевромутилинов, ингибиторов синтеза фолатов, ингибиторов деформилазы и ингибиторов эффлюксных насосов бактериальной клетки. В частности, указанные антибактериальные агенты могут быть выбраны из группы, состоящей из: кларитромицина, азитромицина, эритромицина, телитромицина, солитромицина, клиндамицина, комбинации стрептограминов - хинупристина и дальфопристина, эравациклина, миноциклина, омадациклина, рифампина, рифабутина, рифалазила, фузидовой кислоты, мупироцина, оксазолидинонов - тедизолида и линезолида, ванкомицина, далбаванцина, оритаванцина, телаванцина, фторхинолинов моксифлоксацина, делафлоксацина и аварофлоксацина и ингибитора синтеза фолатов - триметоприма.
Соединения по настоящему изобретению можно вводить различными способами, например, парэнтерально, подкожно, внутривенно, внутрисуставно, внутриоболочечно (интратекально), внутримышечно, внутрибрюшинно и с помощью подкожных инъекций, а также трансдермально, ректально, буккально, оромукозально, назально, через глаза, ингаляционным путем и при посредстве импланта.
Фармацевтические композиции, содержащие соединение по настоящему изобретению в качестве действующего вещества, могут также включать фармацевтически приемлемые добавки, такие как фармацевтически приемлемый носитель (носители) и/или вспомогательное вещество (вспомогательные вещества), способствующие обработке активных соединений с получением препаратов, которые можно применять для фармацевтических целей. Подходящая фармацевтическая композиция может содержать соединение по настоящему изобретению в сочетании с одним или более другим действующим веществом(ами), в частности, с антибактериальным агентом, таким, как описан выше. Соединения могут быть приготовлены в виде подходящей композиции; приемлемые формы для введения включают, например, растворы, дисперсии, суспензии, порошки, капсулы, таблетки, пилюли, капсулы с контролируемым высвобождением, таблетки с контролируемым высвобождением и пилюли с контролируемым высвобождением.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Общие способы получения
Соединения по настоящему изобретению могут быть получены с помощью известных способов. Следующий пример иллюстрирует получение соединения формулы (I).
Пример 1
Синтез NAB815
NAB815, имеющий структурную формулу октаноил-αDab-Thr-DThr-[цикло-α,γDab-αDab-DPhe-Leu-Abu-αDab-Thr], где карбокситерминальный Thr в R10 связан через посредство его карбоксильной группы с 4-аминогруппой остатка 2,4-диаминомасляной кислоты (Dab) в R4, и имеющий относительную молекулярную массу 1175,44, может быть синтезирован, например, традиционными методами твердофазной химии, используя методику, описанную ранее для других производных полимиксина, таких как NAB739 (патент США 7807637). Аминокислота на С-конце коммерчески доступна в виде предварительно присоединенной к твердой фазе и при отщеплении от смолы кислотой образует С-концевую карбоновую кислоту.
Стратегия при защите заключается в использовании трех уровней ортогональной защиты, временной Fmoc-защиты альфа-аминофункциональных групп, защиты γ-аминогруппы остатка Dab, участвующего в циклизации, группами, которые удаляются на стадии кислотного расщепления, и полупостоянной защиты для закрытия реакционноспособных функциональных групп боковой цепи во время протекания реакции циклизации. После отщепления пептида от смолы С-концевая карбоновая кислота реагирует с γ-аминогруппой остатка диаминомасляной кислоты (Dab) в R4 с образованием циклического пептида. После стадии циклизации полупостоянные защитные группы удаляют с получением NAB пептида.
Соответственно, альфа-аминогруппу аминокислоты защищали с помощью флуоренилметоксикарбонильной группы (Fmoc), и Fmoc удаляли 20% раствором пиперидина в диметилформамиде (ДМФА, англ. DMF) в каждом цикле. Аминокислоту, участвующую в циклизации, то есть Dab в R4, защищали с помощью трет-бутоксикарбонильной группы (tBoc), кислотно-неустойчивой группы, которую удаляли на стадии отщепления. Аминокислоты, имеющие функциональные группы в боковой цепи, защищали с помощью группы, устойчивой к стадии кислотного разложения, то есть бензилоксикарбонильной группой (Z). Аминокислоты D-фенилаланин и лейцин по своей природе не нуждаются в защите боковой цепи. Аминоконец остается незащищенным; это обеспечивает прямую реакцию при ацилировании.
Стадии синтеза проводили в имеющемся в продаже автоматическом синтезаторе, используя в качестве активатора гексафторфосфат O-(6-хлорбензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HCTU).
Ацилирование осуществляли при использовании четырехкратного молярного избытка каждой аминокислоты или жирной кислоты, четырехкратного молярного избытка активатора HCTU (см. выше) и восьмикратного молярного избытка N-метилморфолина. Время реакции составляло 30 мин.
Аминокислоты покупали в уже защищенном виде у стандартных поставщиков. Пептид отделяли от смолы взаимодействием с раствором 95% трифторуксусной кислоты и 5% воды в течение 2 часов при комнатной температуре с получением частично защищенного продукта. Полученный в результате пептид осаждали диэтиловым эфиром.
Смесь, сспользуемая для циклизации, представляла собой гексафторфосфат бензотриазол-1-илокси-трис-пирролидинофосфония (РуВор), N-гидроксибензотриазол (HoBt) и N-метилморфолин (NMM) при молярном избытке 2, 2 и 4, соответственно. Пептид растворяли в диметилформамиде, добавляли смесь для циклизации и оставляли для реакции в течение 2 часов. Циклизованный защищенный пептид осаждали добавлением холодного диэтилового эфира. Весь остаточный РуВор удаляли промыванием пептида водой.
Остальные защитные группы боковой цепи (Z) удаляли путем каталитического дегидрирования. Пептид растворяли в смеси уксусной кислоты, метанола и воды (5:4:1) в атмосфере водорода и в присутствии катализатора палладия на угле.
Пептид очищали хроматографией с обращенной фазой, используя общепринятые градиенты ацетонитрила : воды : трифторуксусной кислоты. Продукт сушили лиофилизацией.
NAB815 превращали в его сульфат. Продукт представлял собой лиофилизат белого цвета. Его раствор (1 мг/мл в воде) был прозрачным и бесцветным. При идентификации методом масс-спектрометрии с электрораспылительной ионизацией (англ. ESI-MS, electrospray ionization mass spectrometry), m составляло 1175,4 ед. (средняя масса).
Фармакологические испытания
Следующие примеры предназначены для иллюстрации настоящего изобретения, и их не следует рассматривать, как ограничивающие объем изобретения. Концентрации соединений в анализах также приведены в качестве примера, и их не следует рассматривать как ограничивающие. Специалист в данной области может определить фармацевтически значимые концентрации с помощью известных способов. Все опыты с животными проводили в соответствии со стандартами этических принципов проведения исследований и соответствующей установленной политики в отношении ухода и использования животных.
Пример 2
Антибактериальная активность NAB815 и его препаратов сравнения
Источник химических реактивов: сульфат NAB815 (серия 1051607; чистота 98,8% методом высокоэффективной жидкостной хроматографии (ВЭЖХ, англ. HPLC) и сульфат NAB739, имеющий структурную формулу октаноил-Thr-DSer-[цикло-α,γDab-αDab-DPhe-Leu-αDab-αDab-Thr], то есть OA-SEQ ID 2 (серия 1049851, чистота 97,3% методом ВЭЖХ). Сульфат полимиксина В получали из компании Sigma-Aldrich, Сент-Луис, Миссури, США (номер в каталоге Р0972, серия BCBF8382V; чистота 89,3%).
Количественное определение минимальной ингибирующей концентрации (МИК, англ. MIC) выполняли в трех параллельных опытах, руководствуясь стандартной методологией CLSI (англ. The Clinical and Laboratory Standards Institute - Институт клинических и лабораторных стандартов) и используя бульон Мюллера-Хинтона согласно описанию Института клинических и лабораторных стандартов, 2012 (Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically (Методы разведений для анализа антимикробной чувствительности бактерий, растущих в аэробных условиях)). Утвержденные стандарты, девятое издание. Документ CLSI М07-А9. Институт клинических и лабораторных стандартов, Уэйн, Пенсильвания). Исходный инокулят (5×105 КОЕ/мл) готовили из ночных культур на триптиказо-соевом агаре, содержащем 5% баранью кровь. Микротитрационные планшеты инкубировали при температуре 35°С в течение 20 часов, после чего их визуально считывали. Изучение синергии осуществляли, используя производные полимиксина в сочетании с рифампином, модельным соединением для таких антибактериальных агентов, для которого неповрежденная внешняя мембрана грамотрицательных бактерий является барьером проницаемости.
В Таблице 1 показаны величины МИК (минимальная ингибирующая концентрация) (мкг/мл), то есть антибактериальная активность, полимиксина В, эталонного соединения (NAB739) и соединения в соответствии с настоящим изобретением (NAB815) по отдельности и в сочетании с фиксированной концентрацией рифампина (0,25 мкг/мл)*; включая чувствительные и невосприимчивые к полимиксину штаммы.
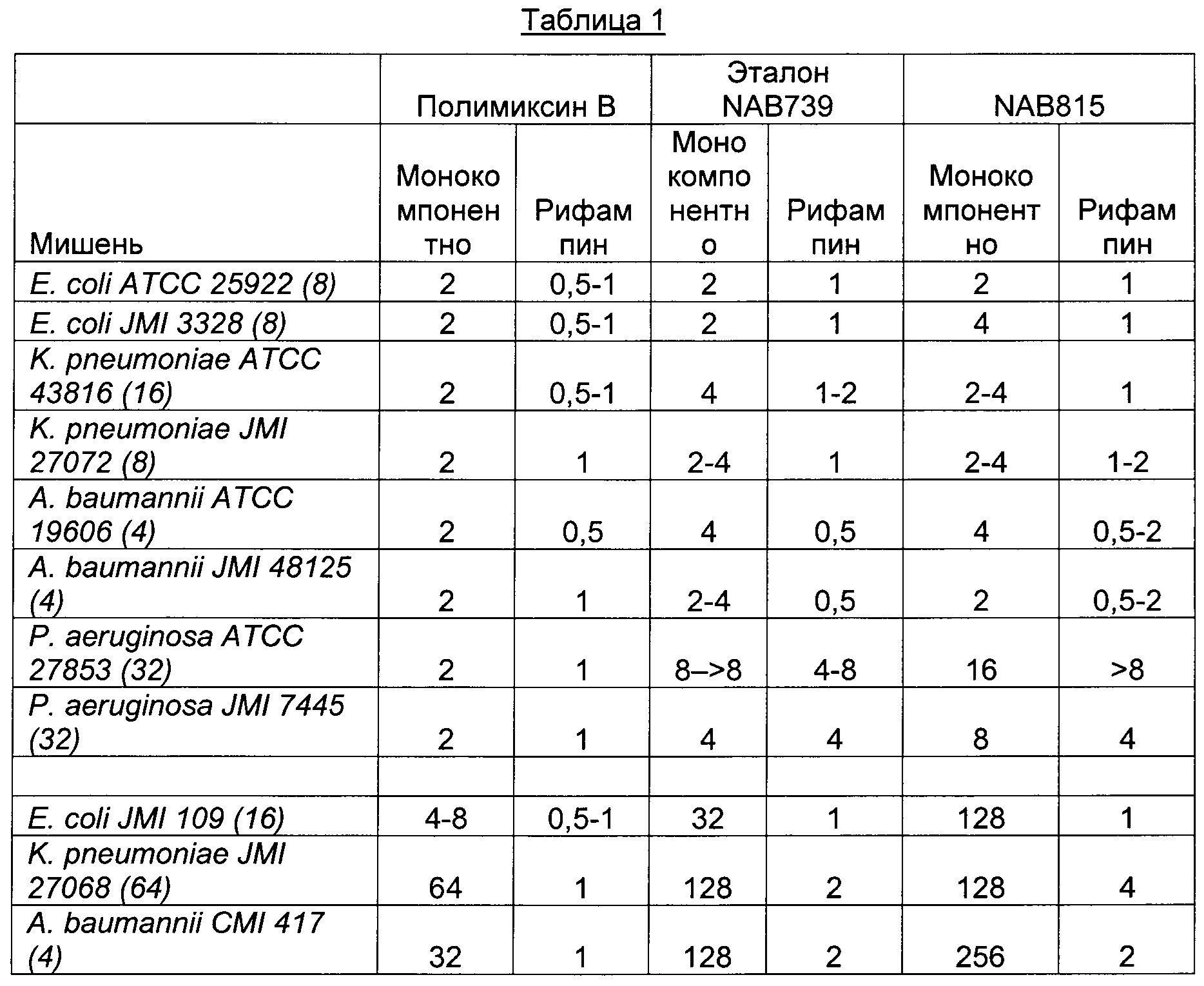
* Величины МИК в отсутствии рифампина представляют собой краткую характеристику наиболее вероятных (модальных) величин МИК из трех повторений и величин МИК из двух анализов методом "шахматной доски". Величины МИК в присутствии рифампина (0,25 мкг/мл) взяты из двух анализов методом "шахматной доски". Модальные величины МИК (мкг/мл) рифампина для каждого целевого штамма (из трех повторений) показаны в скобках после названия целевого бактериального штамма.
Величины МИК NAB815 для чувствительных к полимиксину штаммов Е. coli, К. pneumoniae и Acinetobacter были идентичными или очень близкими к таковым для NAB739 полимиксина В. Полимиксин В показал лучшую активность, чем NAB815 и NAB739 в отношении Pseudomonas aeruginosa и в отношении двух (К. pneumoniae JM109 и A. baumannii CMI417) из трех штаммов, которые проявили пониженную чувствительность к полимиксину В.
Субингибирующие концентрации всех трех пептидов заметно потенцировали активность рифампина (Таблица 1). При концентрации 1 мкг/мл NAB815 снижал МИК рифампина в отношении К. pneumoniae АТСС 43816 с 16 мкг/мл до 0,25 мкг/мл (то есть в 64 раза) и для Е. coli АТСС 25922 и Е. coli JMI3328 с 8 мкг/мл до 0,25 мкг/мл (то есть в 32 раза). Весьма важно также, что штаммы, показавшие пониженную чувствительность к полимиксинам, оказались чувствительными к комбинированной активности NAB815 и рифампина. Очень похожие результаты были получены в случае NAB739. В отношении P. aeruginosa ни NAB815, ни NAB739 не показали какой-либо заметной синергиической активности с рифампином.
В заключение, антибактериальная активность NAB815 и NAB739 была одинаковой или очень близкой не только по отдельности (монокомпонентно), также и в присутствии рифампина.
Пример 3
Токсикологические и токсикокинетические исследования
In vivo токсические и токсикокинетические исследования проводили с использованием макак-крабоедов. Лаборатория, в которой проводили исследования на животных, аккредитована Ассоциацией по оценке и аккредитации условий содержания лабораторных животных (англ. AAALAC - Association for Assessment and Accreditation of Laboratory Animal Care), имеет соответствие требованиям содержания животных, выданное Управлением защиты лабораторных животных (англ. OLAW - Office of Laboratory Animal Welfare), зарегистрирована в Министерстве сельского хозяйства США (англ. USDA - United States Department of Agriculture) и имеет Институциональный комитет по содержанию и использованию лабораторных животных (англ. IACUC - Institutional Animal Care and Use Committee), в обязанности которого входит соблюдение применяемых законов и правил, касающихся гуманного ухода и использования лабораторных животных.
Не подвергавшихся ранее лечению самок макак-крабоедов акклиматизировали в учебном помещении в течение 28 дней, в этот период каждому животному был имплантирован постоянный бедренный катетер, позволяющий осуществлять непрерывные внутривенные инфузии. Животным был предоставлен восстановительный послеоперационный период в течение по меньшей мере 2 недель перед началом дозирования.
Источник химических реактивов был следующим: сульфат NAB815 (серия 1051607; чистота 98,8% методом ВЭЖХ и серия 1054308; чистота 98,4% методом ВЭЖХ) и сульфат NAB739 (серия 1049851, чистота 97,3 методом ВЭЖХ). Сульфат полимиксина В получали из Sigma-Aldrich (номер в каталоге Р0972, серия номер BCBF8382V). В каждый день использования соответствующие количества NAB739, NAB815 или полимиксина В взвешивали и растворяли в соответствующих объемах стерильного физиологического раствора для приготовления базового раствора для каждого тестируемого препарата и положительного контроля. При приготовлении базового раствора использовали поправочный коэффициент для учета чистоты и содержания сульфатов в каждом тестируемом препарате. Соответственно, доза (такая как 36 мг/кг/дозу) относится к дозе чистого пептида в форме его свободного основания, а не к его сульфатной соли.
Дозы были следующими: полимиксин В 18 мг/кг/дозу (Группа 1), полимиксин В 24 мг/кг/дозу (Группа 2), NAB739 24 мг/кг/дозу (Группа 3), NAB739 36 мг/кг/дозу (Группа 4), NAB815 24 мг/кг/дозу (Группа 5), NAB815 36 мг/кг/дозу (Группа 6). Каждая исследуемая группа включала трех животных.
В течение семи дней животным вводили с помощью внутривенной (англ. IV) инфузии трижды в день (англ. TID) дозу в объеме 10 мл/кг в течение 1 часа (плюс/минус 10 минут), с интервалом 8 плюс/минус 0,5 ч. День введения начальной дозы был обозначен как День исследования 1, последующие дни нумеровали по порядку. Дни перед введением начальной дозы были пронумерованы по порядку с последним днем акклиматизации, обозначенным как День -1.
Оценивали следующие параметры через определенные интервалы времени: клинические наблюдения, массы тела, клиническую патологию (общий анализ крови, коагуляцию, биохимический анализ сыворотки, анализ мочи, включая осадки мочи и биохимический анализ мочи), изучение токсикокинетики (плазмы и мочи) и патологическую анатомию (почки). В случаях внепланового умерщвления животных образцы брали в день умерщвления
В день вскрытия животных усыпляли с помощью кетамина, взвешивали и анестезировали путем внутривенной инъекции коммерческого раствора пентобарбитала и фенитоина с последующим обескровливанием.
Вскрытие в конце исследования выживших животных проводили на 8 день. Незапланированное вскрытие в группах с полимиксином В проводили на 4 день для одного животного, получавшего 18 мг/кг/дозу (Группа 1), и для двух животных, получавших 24 мг/кг/дозу (Группа 2), и на 5 день - для двух животных, получавших 18 мг/кг/дозу (Группа 1). Кроме того, на 5 день проводили незапланированное вскрытие для одного животного из группы с NAB739, получавшего 36 мг/кг/дозу (Группа 4).
При вскрытии фиксировали общие наблюдения, регистрировали массы органов и собирали определенные ткани. Гистопатологию выполняли на участках почек, окрашенных гематоксилином и эозином (Н&Е).
Концентрации плазмы и мочи для токсикокинетических (ТК) исследований определяли с помощью жидкостного хроматографа, соединенного с масс-спектрометром, после осаждения белков. Образец (100 мкл) смешивали с внутренним стандартным раствором вода:муравьиная кислота (99:1 об./об.; 50 мл). Затем добавляли 600 мкл раствора ацетонитрил : муравьиная кислота, 100:1. Планшеты центрифугировали при 3200 об./мин в течение 5 минут. С помощью пипеточного дозатора Tomtec Quadra96 переносили аликвоту 450 мкл в новый 96-луночный планшет и сушили в атмосфере азота при температуре 40°С. Затем добавляли 200 мкл смеси вода : метанол : муравьиная кислота (85:15:1 1 об./об.), планшет закрывали для ввода пробы в ЖХ-МС/МС (англ. LC-MS/MS). Система ЖХ-МС (англ. LC-MS) состояла из жидкостного хроматографа Waters Acquity, сопряженного с тройным квадрупольным масс-спектрометром TSQ Quantitative компании Thermo Scientific с ионизацией в режиме определения положительных ионов. Каждый образец (20 мкл) вводили в колонку Acquity ВЕН Shield RP18 (2,1×50 мм; 1,7 мкм) компании Waters, уравновешенную при температуре 50°С. Подвижной фазой А был раствор вода : метанол : муравьиная кислота, 85:15:1 об./об. Подвижной фазой В был раствор ацетонитрил : метанол : муравьиная кислота, 50:50:1 об./об.
Градиенты, подходящие для количественного определения всех соединений, показаны в Таблице 2.

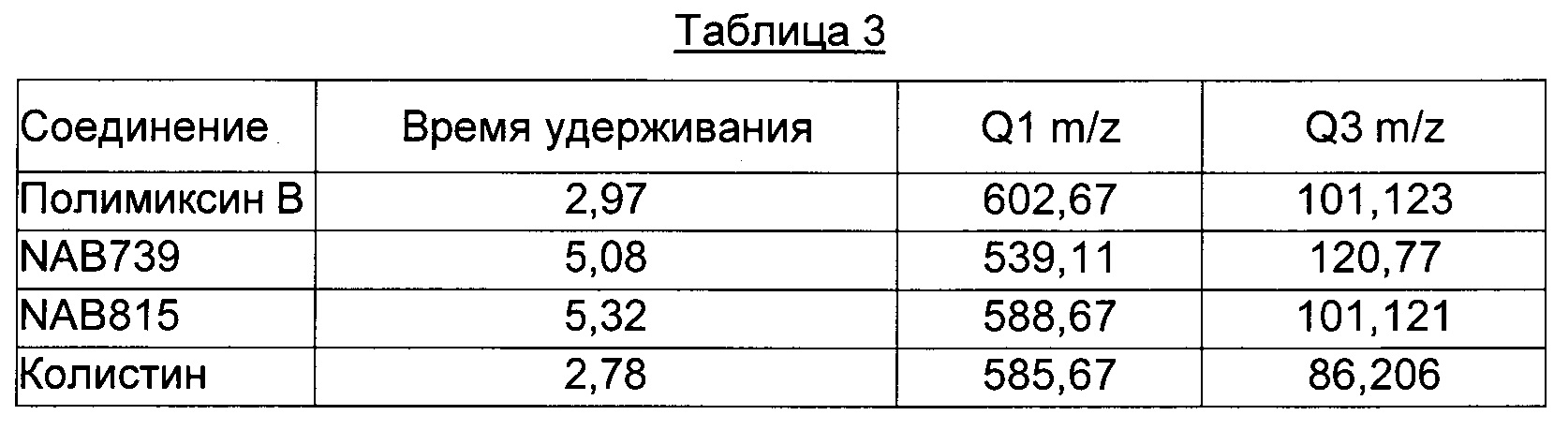
Массопереносы и времена удерживания для каждого из соединений представлены в Таблице 3.
Для полимиксина В соотношения площадей пиков из показаний для калибровочного стандарта пересчитывали, используя (1/концентрация2) линейную аппроксимацию с колистином в качестве внутреннего стандарта. Для NAB739 и NAB815 площади пиков из показаний для калибровочного стандарта пересчитывали, используя (1/концентрация2) квадратичную аппроксимацию (без внутреннего стандарта).
Регрессионные модели выбирали, исходя из поведения анализируемых веществ в диапазоне концентраций, используемых при разработке.
Токсикокинетический анализ осуществляли с использованием программного обеспечения WinNonlin Phoenix версии 6.3 (Pharsight, Сагу, NC). Для ТК плазмы использовали некомпартментную модель внутривенной инфузии.
На рисунках показаны уровни азота мочевины крови (англ. S-BUN; Фиг. 1) и креатинина крови (англ. S-Crea; Фиг. 2), тот и другой являются маркерами крови при повреждении почек, у животных до лечения и у тех же животных, получавших впоследствии полимиксин В, NAB739 или NAB815. На рисунках также показано соотношение N-ацетил-β-D-глюкозаминидаза мочи/креатинин мочи (англ. U-NAG/Crea; Фиг. 3) и соотношение гамма-глутамилтрансфераза мочи/креатинин мочи (англ. U-GGT/Crea; Фиг. 4), оба являются биомаркерами мочи при повреждении почек, у этих животных. S-Crea и U-Crea измеряли с помощью анализатора Olympus Analyzer (OA) и модифицированного метода Яффе, S-BUN - с помощью OA и уреаза/L-глутаматдегидрогеназы. U-NAG измеряли с помощью ферментного анализатора OA/enzymatic, a U-GGT - с помощью OA и глутамилкарбокси-р-нитроанилида, IFCC. На Фиг. с 1 по 4 "*" означают, что животное подлежало эвтаназии из-за тяжелых нефротоксических эффектов.
Можно сделать вывод, что NAB815 переносится значительно лучше, чем NAB739. Одно животное, получавшее по 36 мг/кг/дозу NAB739, подлежало эвтаназии из-за тяжелых нефротоксических эффектов. У этого животного все четыре маркера были существенно увеличены. У другого животного, получавшего по 36 мг/кг/дозу NAB739, заметно увеличены были оба биомаркера мочи. Напротив, животные, получавшие NAB815, показали лишь незначительные, при наличии таковых, увеличения четырех параметров и не подвергались досрочному вскрытию.
При дозе 24 мг/кг/дозу одно животное, получавшее NAB739, показало значительное увеличение S-Crea. Ни один из параметров не был увеличен у животных, получавщих эквивалентную дозу NAB815.
Как и ожидалось, полимиксин В был заметно токсичен. Два животных, получавших полимиксин В в дозе 24 мг/кг/дозу, и все три животных, получавших полимиксин В в дозе 18 мг/кг/дозу, подлежали эвтаназии. У всех шести животных S-BUN, S-Crea и U-GGT/Crea были значительно увеличены. U-NAG/Crea заметно увеличилось у пяти животных.
Гистопатологическое сравнение морфологических изменений, вызванных одинаково высокими дозами (36 мг/кг/дозу) NAB739 и NAB815, показало менее тяжелые нефропатические изменения в случае NAB815. У каждого из животных было зарегистрировано наличие следующих нефропатологических параметров: базофилия канальцев (регенерация), дегенерация канальцев/некроз, инфильтрация (мононуклеарными и/или смешанными воспалительными клетками), дилатация канальцев и мочевые цилиндры. Каждый параметр оценивали следующим образом: коды уровней = 0: незначительные проявления; 1: минимальные; 2: средние; 3: умеренные; 4: заметные. Заметные проявления были зарегистрированы только у эвтаназированных животных, обработанных NAB739, и были следующими: заметная дегенерация канальцев/некроз, а также заметное присутствие мочевых цилиндров. Животные, обработанные NAB739, выжившие после лечения, имели умеренные проявления, оба по двум параметрах. Двое из обработанных NAB815 животных имели средние проявления, оба только по одному параметру. Третье животное, обработанное NAB815, имело лишь минимальные или умеренные проявления. Соответственно, животные, обработанные NAB815, имели менее выраженные изменения тканей по сравнению с теми, которые наблюдались у животных, обработанных NAB739.
Площадь под кривой концентрация-время от 0 ч до 8 ч (англ. Area Under the Curve (AUC) 0-8 ч, ч*мкг/мл) NAB815 после инфузии 8 мг/кг составляла 102 (Среднеквадратическое отклонение (СО) равно 5) при определении в первый (1) день и 110 (СО равно 12) при определении на 7 день. После эквивалентной дозы (8 мг/кг) NAB739 соответствующие величины были 108 (СО равно 2) и 137 (СО равно 2). После эквивалентной дозы полимиксина В (8 мг/мл) при определении в 1 день эта величина составила 112 (СО равно 5). Соответственно, величины AUC были очень близки друг к другу.
Достаточно удивительно, что значительная часть дозы NAB815 выделялась в мочу в течение 8 часов после инфузии (выведение 0-8 ч). После инфузии 8 мг/кг NAB815 выведение 0-8 ч составляло до 38%, 55% и 88% дозы (проценты приведены для каждого животного). Соответствующие скорости выведения в случае NAB739 составили до 20%, 91% и 92% и в случае полимиксина В - 1%, 2% и 2%. Полученные концентрации NAB815 и NAB739 в моче были очень высокими. После инфузии 8 мг/кг NAB815 концентрации вплоть до 175, 225 и 260 мкг/мл были обнаружены либо в образце 0-4 ч, либо в образце 4-8 ч (концентрации приведены для каждого животного). Соответствующие концентрации в случае NAB739 составляли 80, 140 и 155 мкг/мл и в случае полимиксина В - 7, 9 и 15 мкг/мл.
В заключение, NAB815 был значительно менее нефротоксичным, чем NAB739. AUC для обоих соединений были очень близки друг к другу. Оба соединения в значительной степени выделялись в мочу, что давало очень высокие концентрации в моче.
Пример 4
Дополнительные фармакокинетические данные
Данные получены из исследований макак-крабоедов, описанных в Примере 3, где пептиды вводили в виде 1-часовой внутривенной инфузии трижды в день. Уровни пептидов в плазме и моче определяли, как описано в Примере 3.
При дозировании пептидов 36 мг/кг/дозу AUC (ч*мкг/мл) NAB815 составляли 153 (СО, 32) и 205 (СО, 56) в 1 и 7 день, соответственно. Соответствующие величины для NAB739 составляли 239 (СО, 9) и 302 (без СО, количество животных 2). При такой дозировке выведение с мочой (0-8 ч сбор мочи) NAB815 составляло 14,3%, 20,9% и 36,3% для трех животных в 1 день и 33,9%, 40,5% и 41,9% на день 7, соответственно. Соответствующие величины в случае NAB739 составляли 15,4%, 20,4% и 26,4% в 1 день и 30,6% и 55,8% на 7 день (только два животных). Кроме того, концентрации в моче (мкг/мл, в 0-8 ч сбор мочи) NAB815 составляли 114, 173 и 265 для трех животных в 1 день и 17, 62 и 149 на 7 день, соответственно. Соответствующие величины для NAB739 были 33, 82 и 92 в 1 день и 268 и 348 на 7 день (только два животных)
Пример 5
Сравнительная эффективность NAB815 и полимиксина В при инфекции мочевых путей у мышей
Для исследований использовались 64 аутбредные самки OF-1 мышей (Charles River, France) весом от 28 до 32 г и Escherichia coli С175-94 (серотип O8:К48:Н4), клинический изолят, продуцирующий фимбрии 1 типа. Пептидами были NAB815 (серия 1054308) и полимиксин В (Sigma-Aldrich, серия BCBF8382V). Исследование выполнялось Государственным институтом сывороток, Копенгаген, Дания.
За три дня до начала исследования и во время исследования мыши имели свободный доступ к 5% раствору глюкозы в качестве питьевой воды.
В 0 день мочу удаляли из мочевого пузыря, осторожно надавливая на брюшко, после чего мышь анестезировали с помощью приблизительно 0,15 мл смеси золетила подкожно. Шприц с катетером из полиэтилена (Becton Dickison), содержащий бактериальную суспензию, вставляли через мочеиспускательный канал в мочевой пузырь, и 50 мкл бактериального инокулята медленно вводили в мочевой пузырь. В дальнейшем мышь оставалась в клетке. Мышей содержали в тепловом шкафу и оставляли под наблюдением до полного пробуждения.
После измерения колониеобразующих единиц (КОЕ, англ. КОЕ) было определено, что инокулят содержит 9,38 log10 КОЕ/мл, что соответствует 8,08 log10 КОЕ/мышь.
В 1 день и 2 день после заражения мышей обрабатывали подкожно растворами (0,2 мл), содержащими NAB815, полимиксин В или носитель (0,9% NaCl), дважды в день. Группы лечения (по шесть мышей в каждой) были следующими: контрольная группа, получающая носитель; NAB815, 0,25 мг/кг/дозу; NAB815, 0,5 мг/кг/дозу; NAB815, 1 мг/кг/дозу; NAB815, 2 мг/кг/дозу; полимиксин В, 0,25 мг/кг/дозу; полимиксин В, 0,5 мг/кг/дозу; полимиксин В, 1 мг/кг/дозу; и полимиксин В, 2 мг/кг/дозу. Кроме того, одна группа выполняла роль контроля перед лечением, помогая оценить протекание инфекции до начала лечения в 1 день после заражения.
В 1, 2 и 3 день отбирали пробы постинфекционной мочи для подсчета колоний. В 1 день после заражения (группа контроля перед лечением) и на день 3 после заражения (все другие группы) после отбора образца мочи мышей умерщвляли цервикальной дислокацией, и в стерильных условиях удаляли мочевой пузырь и почки. Мочевой пузырь и почки хранили при температуре -80°С и затем гомогенизировали в 0,5 и 1 мл солевого раствора, соответственно.
КОЕ в моче определяли сразу же через 2-3 часа после отбора образца. Замороженные органы оттаивали и гомогенизировали стальными шариками на гомогенизаторов Tissue Lyser. Все образцы, мочу, почки и мочевой пузырь разводили 10 кратно в солевом растворе, и капельные пробы 20 мкл наносили на планшеты с кровяным агаром в двух параллелях. Кроме того, неразбавленные образцы мочи (2-100 мкл в зависимости от количества мочи) наносили на отдельную агаровую пластинку для определения наименьшего возможного уровня обнаружения количества колоний. Все агаровые пластинки инкубировали в течение 18-22 часов при температуре 35°С в атмосферном воздухе.
Лечение с использованием 1 и 2 мг/кг/дозу NAB815 приводило к значительному снижению уровней КОЕ в моче, когда уровни в группе контроля перед лечением в 1 день после заражения сравнивали с уровнями через два дня после начала лечения на 3 день (** р<0,01 и * р<0,05, соответственно (критерий множественного сравнения ANNOVA Dunnett)). Напротив, никаких существенных различий между соответствующими уровнями не было обнаружено в контрольной группе, получающей носитель, в группах NAB815, получающих 0,25 и 0,5 мг/кг/дозу, и в любых группах с полимиксином В.
Лечение с использованием NAB815 показало тенденцию дозозависимого эффекта КОЕ в мочевом пузыре и в почках, тогда как лечение полимиксином В не проявляло никакой тенденции к дозозависимому эффекту.
Из всех 24 мышей, получавших 0,25-2 мг/кг/дозу NAB815, бактериальные уровни были ниже предела обнаружения в моче 8 мышей и в почках 20 мышей, тогда как соответствующее количество мышей, получавших полимиксин В, составляло 1 и 10, соответственно.
Специалисту в данной области будет очевидно, что по мере усовершенствования технологии концепция изобретения может быть осуществлена различными способами. Изобретение и варианты его осуществления не ограничиваются описанными выше примерами, но могут варьироваться в пределах объема формулы изобретения.
Реферат
Изобретение относится к соединению формулы (I), где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и R(FA) имеют значения, указанные в п.1 формулы изобретения, или его фармацевтически приемлемой соли. Изобретение также относится к фармацевтической композиции, обладающей антибактериальной активностью, содержащей указанное выше соединение, и к способу лечения бактериальной инфекции посредством его применения. Технический результат – получение нового производного полимиксина, эффективного в отношении грамотрицательных бактерий и обладающего пониженной нефротоксичностью. 3 н. и 9 з.п. ф-лы, 4 ил., 3 табл., 5 пр.
Формула

Документы, цитированные в отчёте о поиске
Производные полимиксина с короткоцепочечным жирнокислотным хвостом и их применение
Пептидные антибиотики и способы их получения

Комментарии