Комбинированная терапия на основе антитела к cd20 в сочетании с ингибитором bcl-2 и ингибитором mdm2 - RU2727196C2
Код документа: RU2727196C2
Чертежи



Описание
Настоящее изобретение относится к комбинированной терапии на основе антитела к CD20 в сочетании с ингибитором Bcl-2 и ингибитором MDM2, предназначенная для лечения рака.
Предпосылки создания изобретения
Афукозилированные антитела
Опосредованные клеткой эффекторные функции моноклональных антител можно усиливать путем конструирования их олигосахаридного компонента согласно методу, описанному у



Shields R.L. и др., J. Biol. Chem. 276, 2001, cc. 6591-6604; Shields R.L. и др., J. Biol. Chem. 277, 2002, cc. 26733-26740; Simmons L.C. и др., J. Immunol. Methods 263, 2002, cc. 133-147).
Опубликованы исследования, в которых обсуждается активность афукозилированных и фукозилированных антител, включая антитела к CD20 (см., например, Iida S. и др., Clin. Cancer Res. 12, 2006, сс. 2879-2887; Natsumc A. и др., J. Immunol. Methods 306, 2005, сс. 93-103; Satoh М. и др., Expert Opin. Biol. Ther. 6, 2006, cc. 1161-1173; Kanda Y., и др., Biotechnol. Bioeng. 94, 2006, cc. 680-688; Davies J. и др., Biotechnol. Bioeng. 74, 2001, cc. 288-294).
CD20 и антитела к CD20
Молекула CD20 (которую называют также эволюционно консервативным дифференцировочным антигеном человеческих В-лимфоцитов или Вр35) представляет собой широко известный гидрофобный трансмембранный белок, локализованный на пре-В и зрелых В-лимфоцитах (Valentine М.А. и др., J. Biol. Chem. 264, 1989, сс. 11282-11287; и Einfeld D.A. и др., EMBO J. 7, 1988, сс. 711-717; Tedder Т.Е. и др., Proc. Natl. Acad. Sci. U.S.A. 85, 1988, cc. 208-212; Stamenkovic I. и др., J. Exp.Med. 167, 1988, cc. 1975-1980; Tedder Т.Е. и др., J. Immunol. 142, 1989, cc. 2560-2568). При неходжкинских лимфомах (НХЛ) CD20 экспрессируется на поверхности более 90% В-клеток (Anderson K.С.и др., Blood 63, 1984, сс. 1424-1433), но он не выявлен на гематопоэтических стволовых клетках, про-В-клетках, здоровых плазматических клетках или в других здоровых тканях (Tedder Т.Е. и др., J. Immunol. 135, 1985, сс. 973-979).
Существуют два различных тина антител к CD20, которые существенно отличаются механизмом связывания CD20 и биологической активностью (Cragg M.S. и др., Blood 103, 2004, сс. 2738-2743; и Cragg M.S. и др., Blood, 101, 2003, сс. 1045-1052). Антитела типа I, такие, например, как ритуксимаб (неафукозилированное антитело с содержанием фукозы 85% или более), офатумумаб, велтузумаб, окрелизумаб, обладают сильной опосредуемой комплементом цитотоксичностыо.
Антитела типа II, такие, например, как тозитумомаб (B1), 11В8, АТ80 или гуманизированные антитела B-Ly1, эффективно инициируют гибель клеток-мишеней посредством независимой от каспазы клеточной гибели при сопутствующем воздействии фосфатидилсерина.
MDM2
р53 представляет собой белок-супрессор опухоли, который играет центральную роль в защите от развития рака. Он охраняет целостность клеток и препятствует размножению необратимо поврежденных клонов клеток посредством индукции прекращения клеточного роста или апоптоза. На молекулярном уровне р53 представляет собой фактор транскрипции, который может активировать панель генов, участвующих в регуляции клеточного цикла и апоптоза. р53 является мощным ингибитором клеточного цикла, который строго регулируется MDM2 на клеточном уровне. MDM2 и р53 образуют систему управления с обратной связью. MDM2 может связываться с р53 и ингибировать его способность осуществлять трансактивацию регулируемых р53 генов. Кроме того, MDM2 опосредует убиквитин-зависимое расщепление р53. р53 может активировать экспрессию гена MDM2, повышая тем самым уровень белка MDM2 в клетке. Указанная система управления с обратной связью гарантирует, что содержание и MDM2, и р53, будет находиться на низком уровне в здоровых пролиферирующих клетках. MDM2 является также кофактором для E2F, который играет центральную роль в регуляции клеточного цикла.
Регуляция соотношения MDM2 и р53 (E2F) нарушается при многих типах рака. Например, было продемонстрировано, что часто встречающиеся молекулярные дефекты в локусе p16INK4/p19ARF влияют на расщепление белка MDM2. Ингибирование взаимодействия MDM2-p53 в опухолевых клетках, несущих р53 дикого типа, приводит к накоплению р53, прекращению клеточного цикла и/или апоптозу. Следовательно, антагонисты MDM2 могут представлять собой новый подход в терапии рака при их применении, как в качестве индивидуальных агентов, так и в комбинации с широким спектром других противоопухолевых терапий. Осуществимость такой стратегии была продемонстрирована путем применения различных макромолекулярных «инструментов» для ингибирования взаимодействия MDM2-p53 (например, антител, антисмысловых олигонуклеотидов, пептидов). MDM2 также связывается с E2F посредством консервативной связывающей области, как и р53, и активирует E2F-зависимую транскрипцию циклина А, это позволяет предположить, что антагонисты MDM2 могут оказывать воздействия на несущие мутантный р53 клетки.
Bcl-2 и ингибиторы Bcl-2
Белки Bcl-2 играют роль при многих заболеваниях, в частности, при раке, лейкозе, иммунных и аутоиммунных заболеваниях. Считается, что белки Bcl-2 участвуют в раке мочевого пузыря, раке головного мозга, раке молочной железы, раке костного мозга, раке шейки матки, хроническом лимфоцитарном лейкозе, колоректальном раке, раке пищевода, печеночно-клеточном раке, лимфобластном лейкозе, фолликулярной лимфоме, лимфоидных злокачественных заболеваниях Т-клеточного или В-клеточного происхождения, меланоме, миелогенном лейкозе, миеломе, раке ротовой полости, немелкоклеточном раке легкого, раке предстательной железы, раке яичника, мелкоклеточном раке легкого, раке селезенки. Сверхэкспрессия белков Bcl-2 коррелирует с резистентностью к химиотерапии, клиническим исходом, прогрессированием заболевания, общим прогнозом или их комбинацией при различных типах рака и нарушениях иммунной системы.
Краткое изложение сущности изобретения
При создании изобретения было установлено, что комбинация антитела к CD20 типа I или афукозилированного антитела к CD20 типа II с ингибитором Bcl-2 и ингибитором MDM2 обладала значительно повышенными антипролиферативными действиями. При создании изобретения неожиданно было установлено, что указанная комбинация обладала действием, превышающим аддитивное, т.е. высоким синергетическим действием.
Одним из объектов изобретении является афукозилированное антитело к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для лечения рака в комбинации с ингибитором Bcl-2 и ингибитором MDM2.
Другим объектом изобретении является применение афукозилированного антитела к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для приготовления лекарственного средства для лечения рака в комбинации с ингибитором Bcl-2 и ингибитором MDM2.
Другим объектом изобретения является способ лечения пациента, страдающего раком, заключающийся в том, что вводят афукозилированное антитело к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, в комбинации с ингибитором Bcl-2 и ингибитором MDM2 пациенту, который нуждается в таком лечении.
Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297. Согласно другому варианту осуществления изобретения содержание фукозы составляет 0% от общего количества олигосахаридов (сахаров) на Asn297.
В одном из вариантов осуществления изобретения антитело к CD20 типа I представляет собой ритуксимаб. В одном из вариантов осуществления изобретения афукозилированное антитело к CD20 представляет собой антитело изотипа IgG1. В другом варианте осуществления изобретения указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз. В одном из вариантов осуществления изобретения указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1. В другом варианте осуществления изобретения указанное афукозилированное антитело представляет собой антитело к CD20 типа II. В предпочтительном варианте осуществления изобретения указанное афукозилированное антитело представляет собой обинутузумаб.
В одном из вариантов осуществления изобретения указанный ингибитор Bcl-2 представляет собой соединение, выбранное из соединений, описанных в WO 2010/138588. В WO 2010/138588 описаны также методы получения указанных ингибиторов Bcl-2.
Наиболее предпочтительно ингибитор Bcl-2 представляет собой 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид, имеющий представленную ниже формулу, или его соль, сложный эфир или полиморф. В примере 5 WO 2010/138588 описаны методы получения указанного соединения.
Указанный ингибитор Bcl-2 описывается также следующей формулой:

Указанное соединение обозначают также как АВТ-199 (GDC-0199 или венетоклакс).
В одном из вариантов осуществления изобретения указанный ингибитор MDM2 представляет собой соединение, выбранное из соединений, описанных в WO 2011/098398. В WO 2011/098398 описаны также методы получения указанных ингибиторов MDM2.
Наиболее предпочтительно ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту, имеющую представленную ниже формулу, или ее соль, сложный эфир или полиморф. В примере 448 WO 2011/098398 описан метод получения указанного соединения.

В одном из вариантов осуществления изобретения указанное антитело к CD20 типа I представляет собой ритуксимаб, указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1, предпочтительно обинутузумаб, и применяют ингибитор Bcl-2, где ингибитор Bcl-2 выбирают из соединений, описанных в WO 2010/138588, и ингибитор MDM2 выбирают из соединений, описанных в WO 2011/098398. Указанный ингибитор MDM2 предпочтительно представляет собой соединение формулы 1 или формулы I-1, указанной выше в настоящем описании. Предпочтительно ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту или ее соль, и указанный рак представляет собой рак, при котором происходит экспрессия CD20, в одном из вариантов осуществления изобретения он представляет собой лимфому или лимфоцитарный лейкоз.
В одном из вариантов осуществления изобретения связывание афукозилированного антитела к CD20 с CD20 характеризуется величиной KD, составляющей от 10-8 М до 10-13 М.
Одним из вариантов осуществления изобретения является фармацевтическая композиция, содержащая комбинацию антитела к CD20 типа I (в одном из вариантов осуществления изобретения ритуксимаба) или афукозилированного антитела к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 (в одном из вариантов осуществления изобретения афукозированное гуманизированное антитело B-Ly1 или предпочтительно обинутузумаб) и ингибитора Bcl-2, где ингибитор Bcl-2 выбирают из соединений, описанных в WO 2010/138588, и ингибитор MDM2, где ингибитор MDM2 выбирают из соединений, описанных в WO2011/098398. Указанный ингибитор MDM2 предпочтительно представляет собой соединение формулы I или формулы 1-1, приведенной выше в настоящем описании. Предпочтительно ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту или ее соль и предназначен для лечения рака.
Описание чертежей
На чертежах показано:
на фиг. 1 - изменение объема опухоли в течение периода времени вплоть до дня 29 и величины IQR (пример 1);
на фиг. 2 - изменение объема опухоли в течение периода времени вплоть до дня 32 и величины TGI (пример 2);
на фиг. 3 - результаты анализа времени до события в течение периода времени вплоть до дня 125 (пример 2).
Подробное описание изобретения
В изобретении предложено антитело к CD20 типа I или афукозилированное антитело к CD20 IgG1- или IgG3-изотипа, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для лечения рака в комбинации с ингибитором Bcl-2 и ингибитором MDM2.
В изобретении предложено применение антитела к CD20 типа I или афукозилированного антитела к CD20 IgG1 - или IgG3-изотипа, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для приготовления лекарственного средства, предназначенного для лечения рака в комбинации с ингибитором Bcl-2 и ингибитором MDM2.
Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
Понятие «антитело» относится к различным формам антител, включая (но, не ограничиваясь только ими) полные антитела, человеческие антитела, гуманизированные антитела и созданные с помощью генной инженерии антитела, такие как моноклональные антитела, химерные антитела или рекомбинантные антитела, а также фрагменты указанных антител, если они сохраняют отличительные признаки антител, предлагаемых в изобретении. Понятия «моноклональное антитело» или «композиция моноклонального антитела» в контексте настоящего описания относятся к препарату, содержащему молекулы антитела, которые имеют одинаковый аминокислотный состав. Соответственно понятие «человеческое моноклональное антитело» относится к антителам, обладающим одинаковой специфичностью связывания, которые имеют вариабельную и константную области, полученные из последовательностей иммуноглобулина человеческой зародышевой линии. Согласно одному из вариантов осуществления изобретения человеческие моноклональные антитела получают с помощью гибридомы, которая включает В-клетку, полученную из трансгенного животного кроме человека, например, трансгенной мыши, имеющей геном, который содержит трансген человеческой тяжелой цепи и трансген человеческой легкой цепи, слитые с иммортализованной клеткой.
Понятие «химерное антитело» относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, происходящую из одного источника или вида, и но меньшей мере часть константной области, полученную из другого источника или вида, которое, как правило, получают методами рекомбинантной ДНК. Наиболее предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Такие мышиные/человеческие химерные антитела являются продуктом экспрессируемых генов иммуноглобулина, содержащих сегменты ДНК, которые кодируют мышиные вариабельные области иммуноглобулина, и сегменты ДНК, которые кодируют человеческие константные области иммуноглобулина. Другими формами «химерных антител», подпадающих под объем настоящего изобретения, являются антитела, в которых класс или подкласс модифицирован или изменен но сравнению с исходным антителом. Такие «химерные» антитела называют также «антителами переключенного класса». Методы получения химерных антител основаны на общепринятых методиках рекомбинантной ДНК и генной трансфекции, и в настоящее время являются хорошо известными в данной области (см., например, Morrison S.L. и др., Proc. Natl. Acad Sci. USA 81, 1984, cc. 6851-6855; US 5202238 и US 5204244).
Понятие «гуманизированное антитело» относится к антителам, в которых каркасный участок или «определяющие комплементарность участки» (CDR) модифицированы таким образом, что они содержат CDR иммуноглобулина другой специфичности по сравнению с родительским иммуноглобулином. В предпочтительном варианте осуществления изобретения мышиный CDR трансплантируют в каркасный участок человеческого антитела, в результате чего образуется «гуманизированное антитело» (см., например, Riechmann L. и др., Nature 332, 1988, сс. 323-327; и Neuberger M.S. и др., Nature 314, 1985, сс. 268-270). Наиболее предпочтительные CDR соответствуют участкам, которые представлены последовательностями, которые распознают антигены, указанные выше для химерных и би- или мультиспецифических антител.
Подразумевается, что в контексте настоящего описания понятие «человеческое антитело» включает антитела, имеющие вариабельную и константную области, происходящие из последовательностей иммуноглобулина человеческой зародышевой линии. Человеческие антитела хорошо известны в данной области (van Dijk М.А. и van de Winkel J.G., Curr. Opin. Chem. Biol. 5, 2001, cc. 368-374). На основе указанной технологии можно получать человеческие антитела к широкому разнообразию мишеней. Примеры человеческих антител описаны у Kellermann S.A. и др., Curr Opin Biotcchnol. 13, 2002, сс. 593-597.
Подразумевается, что понятие «рекомбинантное человеческое антитело» в контексте настоящего описания включает все человеческие антитела, которые получают, экспрессируют, создают или выделяют методами рекомбинации, такие как антитела, выделенные из клетки-хозяина, такой как NS0- или CHO-клетка, или из животного (например, из мыши), которое является трансгенным по генам человеческого иммуноглобулина, или антитела, экспрессируемые с помощью рекомбинантного экспрсссионного вектора, которым трансфектируют клетку-хозяина. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области, происходящие из последовательностей иммуноглобулина человеческой зародышевой линии, в преобразованной форме. Рекомбинантные человеческие антитела, предлагаемые в изобретении, подвергали in vivo соматической гипермутации. Так, аминокислотные последовательности VН- и VL-областей рекомбинантного антитела представляют собой последовательности, которые, хотя и происходят из последовательностей VН- и VL-областей человеческой зародышевой линии и являются родственными им, но могут не встречаться в существующем в естественных условиях in vivo спектре зародышевых линий человеческого антитела.
В контексте настоящего описания понятие «би- или мультиспецифическое антитело» относится к моноклональным антителам, которые имеют специфичности, связывающиеся по меньшей мере с двумя различными сайтами. В некоторых вариантах осуществления изобретения одна специфичность связывается с CD20, а другая с любым другим антигеном. В некоторых вариантах осуществления изобретения биспецифические антитела могут связываться с двумя различными эпитопами CD20. Биспецифические антитела можно применять также для локализации цитотоксических агентов в клетках, которые экспрессируют CD20. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
В контексте настоящего описания понятие «связывается (связывание)» или «специфически связывается (специфическое связывание)» относится к связыванию антитела с эпигоном опухолевого антигена но данным анализа in vitro, предпочтительно по данным анализа методом (поверхностного) плазмонного резонанса (BIAcore, фирма GE-Healthcare, Унисала, Швеция) при использовании очищенного антигена дикого типа. Аффинность связывания определяют в понятиях ka (константа скорости ассоциации антитела при образовании комплекса антитело/антиген), kD (константа диссоциации) и KD (kD/ka). Считается, что имеет место связывание или специфическое связывание, если аффинность связывания (KD) составляет 10-8 М или менее, предпочтительно от 10-8 М до 10-13 М (в одном из вариантов осуществления изобретения от 10-9 М до 10-13М). Таким образом, афукозилированное антитело, предлагаемое в изобретении, специфически связывается с опухолевым антигеном, что характеризуется аффинностью связывания (KD), составляющей 10-8 моля/л, предпочтительно от 10-8 М до 10-13 М (в одном из вариантов осуществления изобретения от 10-9 М до 10-13 М).
Подразумевается, что понятие «молекула нуклеиновой кислоты» в контексте настоящего описания относится к молекулам ДНК и молекулам РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно она представляет собой двухцепочечную ДНК.
«Константные домены» не участвуют непосредственно в связывании антитела с антигеном, но они участвуют в эффекторных функциях (ADCC, связывание комплемента и CDC).
Понятия «вариабельная область» (вариабельная область легкой цепи (VL), вариабельная область тяжелой цепи (VH)) в контексте настоящего описания обозначают области каждой из пары легких и тяжелых цепей, которые принимают непосредственное участие в связывании антитела с антигеном. Вариабельные домены человеческих легкой и тяжелой цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасных участка (FR), последовательности которых в значительной степени являются консервативными, соединенные тремя «гипервариабельными участками» (или определяющими комплементарность участками, CDR). Каркасные участки адоптированы к β-складчатой конформации, и CDR могут образовывать петли, соединяющие β-складчатую структуру. CDR в каждой цепи поддерживают их трехмерную структуру с помощью каркасных участков и образуют вместе с CDR из другой цепи антигенсвязывающий центр.
Понятие «гипервариабельный участок» в контексте настоящего описания относятся к аминокислотным остаткам антитела, которые ответственны за связывание с антигеном. Гипервариабельный участок содержит аминокислотные остатки из «определяющих комплементарность участков» или «CDR». «Каркасные» или «FR»-участки представляют собой участки вариабельной области, отличные от остатков гипервариабельного участка, как он определен в настоящем описании. Таким образом, легкая и тяжелая цепи антитела содержат в направлении от N- к С-концу следующие домены: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR3 тяжелой цепи представляет собой участок, который вносит основной вклад в связывание с антигеном. CDR- и FR-участки определяют согласно стандартной номенклатуре Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991) и/или как участки из «гипервариабельной петли».
Понятие «афукозилированное антитело» относится к антителу изотииа IgG1 или IgG3 (предпочтительно изотипа IgG1) с измененной схемой гликозилирования в Fc-области в положении Asn297, которое имеет пониженное количество остатков фукозы. Гликозилирование человеческих IgG1 или IgG3 имеет место в положении Asn297, оно обусловлено присутствием корового фукозилированного биантенного сложного олигосахарида в сайте гликозилирования, имеющего на конце вплоть до 2 остатков Gal. Эти структуры обозначают как G0-, G1- (α 1,6 или α 1,3) или G2-гликановые остатки в зависимости от количества концевых остатков Gal (Raju T.S., BioProccss Int. 1, 2003, cc. 44-53). СНО-тип гликозилирования Fc-областей антител описан, например, у Routier F.H., Glycoconjugate J. 14, 1997, сс. 201-207. Антитела, полученные в результате рекомбинантной экспрессии в клетках-хозяевах CHO, не имеющих модификации гликозилирования (гликомодификация), как правило, имеют уровень фукозилирования в положении Asn297, составляющий по меньшей мере 85%. Очевидно, что в контексте настоящего описания понятие афукозилированное антитело включает также и антитела, у которых в их схеме гликозилирования фукоза отсутствует. Хорошо известно, что обычное положение гликозилированного остатка в антителе соответствует аспарагину в положении 297 согласно системе нумерации EU («Asn297»).
«Систему нумерации EU» или «EU-индекс», как правило, применяют для обозначения положения остатка в константной области тяжелой цепи иммуноглобулина (например, EU-индекс описан у Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991, публикация полностью включена в настоящее описание в качестве ссылки).
Таким образом, афукозилированное антитело, предлагаемое в настоящем изобретении, представляет собой антитело изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 (это означает, что по меньшей мере 40% или более олигосахаридов на Asn297 в Fc-области являются афукозилированными). В одном из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от количества олигосахаридов на Asn297 в Fc-области. В другом варианте осуществления изобретения содержание фукозы составляет 50% или менее, а в следующем варианте осуществления изобретения содержание фукозы составляет 30% или менее от количества олигосахаридов на Asn297 в Fc-области. Согласно изобретению «доля (количество) фукозы» означает количество указанного олигосахарида (фукозы) в олигосахаридной (сахарной) цени на Asn297 относительно суммы всех олигосахаридов (сахаров), присоединенных к Asn297 (например, сложных, гибридных и имеющих высокое содержание маннозы структур) по данным MALDI-TOF-масс-спектрометрии и рассчитанное в виде среднего значения (подробный метод определения количества фукозы описан, например, в WO 2008/077546). Согласно одному из вариантов осуществления изобретения олигосахариды Fc-области являются бисекционными. Афукозилированное антитело, предлагаемое в изобретении, можно эксирессировать в гликомодифицированной клетке-хозяине, сконструированной с целью экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, который обладает GnTIII-активностыо, в количестве, достаточном для частичного фукозилирования олигосахаридов в Fc-области. Согласно одному из вариантов осуществления изобретения, полипептид, обладающий GnTIII-активностыо, представляет собой слитый полипептид. В альтернативном варианте α 1,6-фукозилтрансферазную активность клетки-хозяина можно снижать или элиминировать согласно методу, описанному в US 6946292, с получением гликомодифицированных клеток-хозяев. Уровень фукозилирования антитела можно предопределять, например, либо путем изменения условий ферментации (например, продолжительности ферментации), либо путем объединения по меньшей мере двух антител с различным уровнем фукозилирования. Указанные афукозилированные антитела и соответствующие методы гликоконструирования (конструирование схемы гликозилирования, гликоинженерия) описаны в WO 2005/044859, WO 2004/065540, WO 2007/031875, Umana Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180, WO 99/154342, WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2005/011735, WO 2005/027966, WO 97/028267, US 2006/0134709, US 2005/0054048, US 2005/0152894, WO 2003/035835, WO 2000/061739. Указанные антитела, полученные с помощью методов гликоинженерии, обладают повышенной ADCC. Другие методы гликоинженерии, которые позволяют получать афукозилированные антитела, предлагаемые в изобретении, описаны, например, у Niwa R. и др., J. Immunol. Methods 306, 2005, сс. 151-160; Shinkawa Т. и др., J. Biol. Chem. 278, 2003, сс. 3466-3473; WO 03/055993 или US 2005/0249722.
Таким образом, одним из объектов изобретения является антитело к CD20 типа I или афукозилированное антитело к CD20 IgG1 - или IgG3-изотипа (предпочтительно IgG1-изотипа), специфически связывающееся с CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для лечения рака в комбинации с ингибитором Bcl-2 и ингибитором MDM2. Другим объектом изобретения является применение афукозилированного антитела к CD20 IgG1-или IgG3-изотипа (предпочтительно IgG1-изотипа), специфически связывающегося с CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для приготовления лекарственного средства, предназначенного для лечения рака в комбинации с ингибитором Bcl-2 и ингибитором MDM2. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 60% до 20% от общего количества олигосахаридов (сахаров) на Asn297. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 60% до 40% от общего количества олигосахаридов (сахаров) на Asn297. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет 0% от общего количества олигосахаридов (сахаров) на Asn297.
CD20 (который называют также В-лимфоцитарным антигеном CD20, В-лимфоцитарным поверхностным антигеном B1, Leu-16, Вр35, ВМ5 и LF5; последовательность представлена в базе данных SwissProt под номером Р11836) представляет собой гидрофобный трансмембранный белок с молекулярной массой примерно 35 кДа, локализованный на пре-В и зрелых В-лимфоцитах (Valentine М.А. и др., J. Biol. Chem. 264, 1989, сс. 11282-11287; Tedder T.F. и др., Proc. Natl. Acad. Sci. U.S.A. 85, 1988, cc. 208-212; Stamenkovic I. и др., J. Exp.Med. 167, 1988, cc. 1975-1980; Einfeld D.A. и др., EMBO J. 7, 1988, cc. 711-717; Tedder T.F. и др., J. Immunol. 142, 1989, cc. 2560-2568). Соответствующий человеческий ген представляет собой имеющий 4 трансмембранных домена представитель 1 подсемейства А, известный также как MS4A1. Этот ген кодирует представителя семейства трансмембранных генов 4А. Представители этого нового семейства белков отличаются общими структурными особенностями и сходными интрон/экзонными сочленениями (границы сплайсинга) и отличаются уникальными схемами экспрессии для гематопоэтических клеток и нелимфоидных тканей. Этот ген кодирует поверхностную молекулу В-лимфоцитов, которая играет роль в развитии и дифференцировке В-клеток в плазматические клетки. Этот представитель семейства локализован на 11q12 в кластере представителей семейства. Альтернативный сплайсинг этого гена приводит к образованию двух транскрипционных вариантов, которые кодируют один и тот же белок.
Понятия «CD20» и «антиген CD20» в контексте настоящего описания используют взаимозаменяемо, и они включают любые варианты, изоформы и видовые гомологи человеческого CD20, которые в естественных условиях экспрессируются клетками или экспрессируются на клетках, трансфектированных геном CD20. Связывание антитела, предлагаемого в изобретении, с антигеном CD20 опосредует цитолиз клеток, экспрессирующих CD20 (например, опухолевой клетки), путем инактивации CD20. Цитолиз клеток, экспрессирующих CD20, может происходить посредством одного или нескольких из следующих механизмов: индукция клеточной гибели/апоптоза. ADCC и CDC.
Синонимами CD20, принятыми в данной области, являются антиген CD20 В-лимфоцитов, поверхностный антиген В-лимфоцитов B1, Leu-16, Вр35, ВМ5 и LF5.
Понятие «антитело к CD20», предлагаемое в изобретении, относится к антителу, которое специфически связывается с антигеном CD20. В зависимости от характеристик связывания и биологической активности антитела к CD20 в отношении антигена CD20 можно различать два типа антител к CD20 (антитела к CD20 типа I и типа II) согласно Cragg M.S. и др., Blood 103, 2004, сс. 2738-2743; и Cragg M.S. и др., Blood 101, 2003, сс. 1045-1052 (см. таблицу 1).

Примерами антител к CD20 типа II являются, например, гуманизированное антитело B-Ly1 изотипа IgG1 (химерное гуманизированное антитело изотипа IgG1, описанное в WO 2005/044859), 11В8 IgG1 (описанное в WO 2004/035607) и АТ80 IgG1. Как правило, антитела к CD20 типа II изотипа IgG1 обладают характерными CDC-свойствами. Антитела к CD20 типа II обладают пониженной CDC (если они относятся к изотипу IgG1) но сравнению с антителами типа I изотипа IgG1.
Примерами антител к CD20 тина I являются, например, ритуксимаб, III47 IgG3 (ЕСАСС, гибридома), 2С6 IgG1 (описанное в WO 2005/103081), 2F2 IgG1 (описанное в WO 2004/035607 и WO 2005/103081) и 2117 IgG1 (описанное в WO 2004/056312).
Согласно одному из вариантов осуществления изобретения афукозилированные антитела к CD20, предлагаемые в изобретении, представляют собой антитело к CD20 типа II, а согласно другому варианту осуществления изобретения представляют собой афукозилированное гуманизированное антитело B-Ly1.
Афукозилированные антитела к CD20, предлагаемые в изобретении, обладают повышенной антитело-обусловленной клеточнозависимой цитотоксичностыо (ADCC) по сравнению с антителами к CD20, у которых не снижено содержание фукозы.
Под «афукозилированным антителом к CD20 с повышенной антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC)» подразумевается афукозилированное антитело к CD20, как оно определено в настоящем описании, обладающее повышенной ADCC, для определения которой используют любой приемлемый метод, известный обычным специалистам в данной области. Один из приемлемых методов анализа in vitro ADCC предусматривает, что:
1) в анализе используют клетки-мишени, для которых известно, что они экспрессируют антиген-мишень, распознаваемый антигенсвязывающей областью антитела;
2) в качестве эффекторных клеток в анализе используют мононуклеарные клетки периферической крови человека (РВМС), выделенные из крови произвольно выбранного здорового донора;
3) анализ осуществляют согласно следующему протоколу:
I) выделяют РВМС с помощью стандартных процессов центрифугирования в градиенте плотности и суспендируют из расчета 5×106 клеток/мл в RPMI-среде для культивирования клеток;
II) выращивают клетки-мишени с помощью стандартных методов культивирования тканей, собирают клетки на экспоненциальной фазе роста, жизнеспособность которых превышает 90%, промывают в RPMI-среде для культивирования клеток, метят51Cr (100 мкКи), промывают дважды в среде для культивирования клеток и ресуспендируют в среде для культивирования клеток с плотностью 105 клеток/мл;
III) осуществляют трансфекцию, используя по 100 мкл указанной выше конечной суспензии клеток-мишеней на каждую лунку 96-луночного титрационного микропланшета;
IV) осуществляют серийное разведение антитела от 4000 до 0,04 нг/мл в среде для культивирования клеток и добавляют по 50 мкл образовавшихся растворов антитела к клеткам-мишеням в 96-луночном титрационном микропланшете, оценивают в трех иовторностях антитело в различных концентрациях, охватывающих весь диапазон указанных выше концентраций;
V) для контроля максимального высвобождения (MR) в 3 дополнительные лунки в планшете, содержащие меченые клетки-мишени, вносят по 50 мкл 2%-ного (VN) водного раствора неионогенного поверхностно-активного вещества (Nonidet, фирма Sigma, Сент-Луис) вместо раствора антитела (пункт IV, выше);
VI) для контроля спонтанного высвобождения (SR) в 3 дополнительные лунки в планшете, содержащие меченые клетки-мишени, вносят по 50 мкл RPMI-среды для культивирования клеток вместо раствора антитела (пункт IV, выше);
VII) затем 96-луночный титрационный микропланшет центрифугируют при 50 × g в течение 1 мин и инкубируют в течение 1 ч при 4°С;
VIII) добавляют по 50 мкл суспензии РВМС (пункт I, выше) в каждую лунку для обеспечения соотношения эффекторная клетка:клетка-мишень 25:1, и планшеты помещают в инкубатор в атмосферу, содержащую 5% СО2, на 4 ч при 37°С;
IX) собирают бесклеточный супернатант из каждой лунки и количественно оценивают высвободившуюся в эксперименте радиоактивность (ER) с помощью гамма-счетчика;
X) рассчитывают процент удельного лизиса для каждой концентрации антитела с помощью формулы (ER-MR)/(MR-SR) × 100, где ER представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для указанной концентрации антитела, MR представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для MR-контролей (см. пункт V, выше), a SR представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для SR-контролей (см. пункт VI, выше);
4) считают, что имеет место «повышенный уровень ADCC», если установлено: или повышение максимального процента удельного лизиса, обнаруженного в указанном выше диапазоне концентраций антитела, и/или снижение концентрации антитела, требуемой для достижения половины от максимального процента специфического лизиса, обнаруженного в указанном выше диапазоне концентраций антитела. Повышение уровня ADCC определяют относительно уровня ADCC, измеренного с помощью описанного выше анализа, опосредуемого таким же антителом, полученным с использованием такого же типа клеток-хозяев, с использованием таких же стандартных методов очистки, приготовления форм и хранения, которые хорошо известны специалистам в данной области, но которое не получено с использованием клеток-хозяев, сконструированных так, что они сверхэкспрессируют GnTIII.
Указанную «повышенную (повышенный уровень) ADCC» можно получать с помощью модификации указанных антител методами гликоинженерии, что означает повышение встречающихся в естественных условиях опосредуемых клеткой эффекторных функций моноклональных антител путем конструирования их олигосахаридного компонента согласно методу, описанному у Umana, Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180 и в US 6602684.
Понятие «комплементзависимая цитотоксичность (CDC)» относится к лизису человеческих опухолевых клеток-мишеней антителом, предлагаемым в изобретении, в присутствии комплемента. CDC предпочтительно оценивают путем обработки препарата экспрессирующих CD20 клеток антителом к CD20, предлагаемым в изобретении, в присутствии комплемента. Считается, что имеет место CDC, если антитело при его использовании в концентрации 100 нМ индуцирует лизис (гибель клеток) 20% или большего количества опухолевых клеток в течение 4 ч. Анализ предпочтительно осуществляют с помощью меченных51С2 или Eu опухолевых клеток и оценивают высвобождение51С2 или Eu. В качестве контроля опухолевые клетки-мишени инкубируют с комплементом без антитела.
Антитело «ритуксимаб» (являющееся примером антитела к CD20 типа I) представляет собой созданное с помощью генетической инженерии химерное человеческое/мышиное содержащее человеческую гамма-1 константную область моноклональное антитело к человеческому антигену CD20.
Антитело «ритуксимаб» (являющееся примером антитела к CD20 типа I) представляет собой созданное с помощью генетической инженерии химерное человеческое/мышиное содержащее человеческую гамма-1 константную область моноклональное антитело к человеческому антигену CD20. Указанное химерное антитело содержит человеческие гамма-1 константные области и идентифицировано под названием «С2В8» в US 5736137 (Anderson K.С.и др.), выданном 17 апреля 1998 г. на имя фирмы IDEC Pharmaceuticals Corporation. Ритуксимаб разрешен для лечения пациентов, страдающих рецидивирующей или рефрактерной, низкой степени злокачественности или фолликулярной, CD20-позитивной, В-клеточной неходжкинской лимфомой. Изучение механизма действия в опытах in vitro продемонстрировало, что ритуксимаб обладает зависимой от человеческого комплемента цитотоксичностыо (CDC) (Reff М.Е. и др., Blood 83(2), 1994, сс. 435-445). Кроме того, он обладает выраженной активностью в анализах по оценке антитело-обусловленной клеточнозависимой цитотоксичности (ADCC). Ритуксимаб является неафукозилированным.

Понятие «гуманизированное антитело B-Ly1» относится к гуманизированному антителу B-Ly1, описанному в WO 2005/044859 и WO 2007/031875, которое получали из мышиного моноклоналыюго антитела к CD20 B-Ly1 (вариабельная область мышиной тяжелой цепи (VH): SEQ ID NO: 1; вариабельная область мышиной легкой цепи (VL): SEQ ID NO: 2 - см. Poppеma S. и Visser L., Biotest Bulletin 3, 1987, cc. 131-139) путем химеризации с использованием человеческой константной области из IgG1 и последующей гуманизации (см. WO 2005/044859 и WO 2007/031875). Эти «гуманизированные антитела B-Ly1» описаны подробно в WO 2005/044859 и WO 2007/031 875.
Согласно одному из вариантов осуществления изобретения «гуманизированное антитело B-Ly1» имеет вариабельную область тяжелой цепи (VH), выбранную из SEQ ID NO: 3 - SEQ ID NO: 20 (B-HH2 - B-HH9 и B-HL8 -B-HL17, которые описаны в WO 2005/044859 и WO 2007/031875). В одном из конкретных вариантов осуществления изобретения такой вариабельный домен выбирают из группы, состоящей из SEQ ID NO: 3, 4, 7, 9, 11, 13 и 15 (B-HH2, В-HH3, B-HH6, B-HH8, B-HL8, B-HL11 и B-HL13, которые описаны в WO 2005/044859 и WO 2007/031875). В одном из конкретных вариантов осуществления изобретения «гуманизированное антитело B-Ly1» имеет вариабельную область легкой (VL), которая представлена в SEQ ID NO: 20 (В-KV1 в WO 2005/044859 и WO 2007/031875). В одном из конкретных вариантов осуществления изобретения «гуманизированное антитело B-Ly1 » имеет вариабельную область тяжелой цепи (VH), которая представлена в SEQ ID NO: 7 (B-HH6 в WO 2005/044859 и WO 2007/031875), и имеет вариабельную область легкой цепи (VL), которая представлена в SEQ ID NO: 20 (B-KV1 в WO 2005/044859 и WO 2007/031875). Кроме того, гуманизированное антитело B-Ly1 предпочтительно представляет собой антитело изотипа IgG1. Указанные афукозилированные гуманизированные антитела B-Ly1, предлагаемые в изобретении, созданы с помощью гликоинженерии (GE) в Fс-области согласно методам, описанным в WO 2005/044859, WO 2004/065540, WO 2007/031875, у Umana Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180 и WO 99/154342. Согласно одному из вариантов осуществления изобретения афукозилированное созданное с помощью гликоинженерии гуманизированное антитело B-Ly1 представляет собой B-HH6-B-KV1 GE. В одном из вариантов осуществления изобретения антитело к CD20 представляет собой обинутузумаб (рекомендованное международное непатентованное название (INN), WHO Drug Information, т. 26, №4, 2012, с. 453). В контексте настоящего описания обинутузумаб является синонимом GA101. Торговое название - GAZYVA. Информационный документ ВОЗ, касающийся лекарственных средств (WHO Drug Information document) заменяет все предыдущие версии (например, т. 25, №. 1, 2011, сс. 75-76), и его ранее известное название афутузумаб (рекомендованное INN, WHO Drug Information, т. 23, №2, 2009, с. 176; т. 22, №2, 2008, с. 124).
Понятие «ингибитор MDM2» согласно изобретению относится к агентам, которые препятствуют проявлению активности MDM2, что характеризуется величиной IC50, составляющей от 0,001 мкМ до примерно 2 мкМ, в одном из вариантов осуществления изобретения от 0,002 мкМ до примерно 2 мкМ.
В другом варианте осуществления изобретения ингибиторы MDM2 представляют собой низкомолекулярные соединения с молекулярной массой (ММ) менее 1500 Дальтон (Да).
В одном из вариантов осуществления изобретения указанный ингибитор MDM2 представляет собой соединение, выбранное из соединений, описанных в WO 2011/098398. В WO 2011/098398 описаны также методы получения указанного ингибитора MDM2. Указанный ингибитор MDM2 предпочтительно представляет собой соединение формулы I или формулы Ia, приведенной в настоящем описании (формула II или формула IIa WO 2011/098398).

в которой
X выбран из группы, состоящей из H, F, Cl, Br, I, цианогруппы, нитрогруппы, этинила, циклопропила, метила, этила, изопропила, винила и метоксигруппы,
Y представляет собой от одной до четырех групп, независимо выбранных из группы, состоящей из Н, F, Cl, Br, I, CN, ОН, нитрогруппы, (низш.)алкила, циклоалкила, (низш.)алкоксигруппы, (низш.)алкенила, циклоалкенила, (низш.)алкинила, арила, гетероарила, гетероцикла, COOR', OCOR', CONR'R'', NR'COR'', NR''SO2R', SO2NR'R'' и NR'R'', где
R' и R'' независимо выбраны из Н, (низш.)алкила, замещенного (низш.)алкила, (низш.)циклоалкила, замещенного (низш.)циклоалкила, (низш.)алкенила, замещенного (низш.)алкенила, (низш.)циклоалкенила, замещенного (низш.)циклоалкенила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероцикла или замещенного гетероцикла,
и где R' и R'' независимо могут быть связаны с образованием циклической структуры, выбранной из замещенного или незамещенного циклоалкила, замещенного или незамещенного циклоалкенила, замещенного или незамещенного гетероарила или замещенного или незамещенного гетероцикла,
R1 выбран из группы, состоящей из (низш.)алкила, замещенного (низш.)алкила, (низш.)алкенила, замещенного (низш.)алкенила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероцикла, замещенного гетероцикла, циклоалкила, замещенного циклоалкила, циклоалкенила и замещенного циклоалкенила,
R2 обозначает водород или (низш.)алкил,
R3 обозначает H или (низш.)алкил,
R5 выбран из группы, состоящей из (низш.)алкила, замещенного (низш.)алкила, (низш.)алкенила, замещенного (низш.)алкенила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероцикла, замещенного гетероцикла, циклоалкила, замещенного циклоалкила, циклоалкенила и замещенного циклоалкенила,
R4 обозначает водород,
R6 и R7 независимо выбраны из группы, состоящей из (CH2)n-R' (CH2)n-NR'R'', (CH2)n-NR'COR'', (CH2)n-NR'SO2R'', (CH2)n-COOH, (CH2)n-COOR', (CH2)n-CONR'R'', (CH2)n-OR', (CH2)n-SR', (CH2)n-SOR' (CH2)n-SO2R' (CH2)n-COR', (CH2)n-SO3H, (CH2)n-SONR'R'', (CH2)n-SO2NR'R'', (CH2CH2O)m-(CH2)n-R', (CH2CH2O)m-(CH2)n-OH, (CH2CH2O)m-(CH2)n-OR', (CH2CH2O)m-(CH2)n-NR'R-'', (CH2CH2O)m-(CH2)n-NR'COR'', (CH2CH2O)m-(CH2)n-NR'SO2R'', (CH2CH2O)m-(CH2)n-COOH, (CH2CH2O)m-(CH2)n-COOR', (CH2CH2O)m-(CH2)n-CONR'R'', (CH2CH2O)m-(CH2)n-SO2R', (CH2CH2O)m-(CH2)n-COR', (CH2CH2O)m-(CH2)n-SONR'R'', (CH2CH2O)m-(CH2)n-SO2NR'R'', (CH2)p-(CH2CH2O)m-(CH2)n-R', (CH2)p-(CH2CH2O)m-(CH2)n-OH, (CH2)p-(CH2CH2O)m-(CH2)n-OR', (CH2)p-(CH2CH2O)m-(CH2)n-NR'R'', (CH2)p-(CH2CH2O)m-(CH2)n-NR'COR'', (CH2)p-(CH2CH2O)m-(CH2)nNR'SO2R'', (CH2)p-(CH2CH2O)m-(CH2)n-COOH, (CH2)p-(CH2CH2O)m-(CH2)n-COOR', (CH2)p-(CH2CH2O)m-(CH2)n-CONR'R'', (CH2)p-(CH2CH2O)m-(CH2)n-SO2R', (CH2)p-(CH2CH2O)m-(CH2)n-COR', (CH2)p-(CH2CH2O)m-(CH2)n-SONR'R'', (CH2)p-(CH2CH2O)m-(CH2)n-SO2NR'R'', -COR', -SOR' и SO2R'
где R' и R'' имеют указанные выше значения,
m, n и р независимо обозначают числа от 0 до 6,
и его фармацевтически приемлемые соли и сложные эфиры.
Наиболее предпочтительными являются соединения формулы I, в которой
X обозначает F, Cl или Br,
Y обозначает от одной до двух групп, независимо выбранных из группы, состоящей из Н, F, Cl, Br, I, CN, OH, нитрогруппы, (низш.)алкила, циклоалкила, (низш.)алкоксигруппы, (низш.)алкенила, (низш.)циклоалкенила и (низш.)алкинила,
R1 выбран из группы, состоящей из (низш.)алкила, замещенного (низш.)алкила, (низш.)алкенила, замещенного (низш.)алкенила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероцикла, замещенного гетероцикла, циклоалкила, замещенного циклоалкила, циклоалкенила и замещенного циклоалкенила,
R2 обозначает водород,
R3 обозначает H,
R5 выбран из группы, состоящей из арила, замещенного арила, гетероарила и замещенного гетероарила,
R4 обозначает водород,
R6 и R7 независимо выбраны из группы, состоящей из (CH2)n-R' (CH2)n-NR'R'', (CH2)n-NR'COR'', (CH2)n-NR'SO2R'', (CH2)n-COOH, (CH2)n-COOR' (CH2)n-CONR'R'', (CH2)n-OR' (CH2)n-SR' (CH2)n-SOR', (CH2)n-SO2R' (CH2)n-COR', (CH2)n-SO3H, (CH2)n-SONR'R'', (CH2)n-SO2NR'R'', (CH2CH2O)m-(CH2)n-R', (CH2CH2O)m-(CH2)n-OH, (CH2CH2O)m-(CH2)n-OR', (CH2CH2O)m-(CH2)n-NR'R'', (CH2CH2O)m-(CH2)n-NR'COR'', (CH2CH2O)m-(CH2)n-NR'SO2R'', (CH2CH2O)m-(CH2)n-COOH, (CH2CH2O)m-(CH2)n-COOR', (CH2CH2O)m-(CH2)n-CONR'R'', (CH2CH2O)m-(CH2)n-SO2R', (CH2CH2O)m-(CH2)n-COR', (CH2CH2O)m-(CH2)n-SONR'R'', (CH2CH2O)m-(CH2)n-SO2NR'R'', (CH2)p-(CH2CH2O)m-(CH2)n-R', (CH2)p-(CH2CH2O)m-(CH2)n-OH, (CH2)p-(CH2CH2O)m-(CH2)n-OR', (CH2)p-(CH2CH2O)m-(CH2)n-NR'R'', (CH2)p-(CH2CH2O)m-(CH2)n-NR'COR'', (CH2)p-(CH2CH2O)m-(CH2)n-NR'SO2R'', (CH2)p-(CH2CH2O)m-(CH2)n-COOH, (CH2)p-(CH2CH2O)m-(CH2)n-COOR', (CH2)p-(CH2CH2O)m-(CH2)n-CONR'R'', (CH2)p-(CH2CH2O)m-(CH2)n-SO2R',
(CH2)p-(CH2CH2O)m-(CH2)n-COR', (CH2)p-(CH2CH2O)m-(CH2)n-SONR'R'', (CH2)p-(CH2CH2O)m-(CH2)n-SO2NR'R'', -COR', -SOR' и SO2R', где
R' и R'' независимо выбраны из H, (низш.)алкила, замещенного (низш.)алкила, (низш.)циклоалкила, замещенного (низш.)циклоалкила, (низш.)алкенила, замещенного (низш.)алкенила, (низш.)циклоалкила, замещенного (низш.)диклоалкенила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероцикла или замещенного гетероцикла, и где R' и R'' независимо могут связываться с образованием циклической структуры, выбранной из замещенного или незамещенного циклоалкила, замещенного или незамещенного циклоалкенила, замещенного или незамещенного гетероарила или замещенного или незамещенного гетероцикла,
m, n и р независимо обозначают числа от 0 до 6,
и его фармацевтически приемлемые соли и сложные эфиры.
Другими предпочтительными соединениями являются соединения формулы I, в которой:
X обозначает F, Cl или Br,
Y обозначает однозамещенную группу, выбранную из H или F, и R1 выбран из группы, состоящей из (низш.)алкила, замещенного (низш.) алкила, (низш.)алкенила, замещенного (низш.)алкенила, гетероцикла, замещенного гетероцикла, циклоалкила, замещенного циклоалкила, циклоалкенила и замещенного циклоалкенила.
Другой предпочтительный R1 обозначает замещенный (низш.)алкил, выбранный из:

где R8, R9 оба обозначают метил или связаны друг с другом с образованием циклопропильной, циклобутильной, циклопентильной или циклогексильной группы,
R10 обозначает (CH2)m-R11,
m обозначает 0, 1 или 2,
R11 выбран из водорода, гидроксила, (низш.)алкила, (низш.)алкоксигруппы, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероцикла или замещенного гетероцикла,
R2 обозначает Н,
R3 обозначает Н,
R5 обозначает замещенный фенил, выбранный из:


W обозначает F, Cl или Br,
V обозначает Н или F,
R4 обозначает водород,
один из R6 и R7 обозначает водород, а другой обозначает (CH2)n-R'
n обозначает 0 или 1 и
R' выбран из арила, замещенного арила, гетероарила, замещенного гетероарила, гетероцикла или замещенного гетероцикла.
Еще один вариант осуществления настоящего изобретения относится к соединениям формулы Ia

в которой R6 и все переменные и заместители, указанные в определениях R6, имеют значения, указанные выше для формулы I.
Еще один вариант осуществления настоящего изобретения относится к соединениям формулы Ia, в которой R6 обозначает -(CH2)n-R' и
R' обозначает циклогексил или 5-10-членный моно- или бициклический ароматический углеводород, в котором 1 или 2 атома углерода могут быть замещены N, S или О, и где любой из указанного выше циклогексила или ароматического углеводорода может быть замещен одной или двумя группами, независимо выбранными из (низш.)алкила, (низш.)алкенила, (низш.)алкинила, диоксо-(низш.)алкилена (с образованием, например, бенздиоксилыюй группы), галогена, гидроксигруппы, CN, СF3, NH2, N(H, (низш.)алкила), N((низш.)алкила)2, аминокарбонила, карбоксигруппы, NO2, (низш.)алкоксигруппы, тио-(низш.)алкоксигруппы, (низш.)алкилсульфонила, аминосульфонила, (низш.)алкилкарбонила, (низш.)алкилкарбонилоксигруппы, (низш.)алкоксикарбонила, (низш.)алкилкарбонил-NH, фтор-(низш.)алкила, фтор-(низш.)алкоксигрупиы, (низш.)алкоксикарбонил-(низш.)алкоксигруппы, карбокси-(низш.)алкоксигруипы, карбамоил-(низш.)алкоксигруппы, гидрокси-(низш.)алкоксигруппы, NH2-(низш.)алкоксигруппы, N(H, (низш.)алкил)-(низш.)алкоксигруппы, N((низш.)алкил)2-(низш.)алкоксигруппы, (низш.)алкил-1-оксиранил-(низш.)алкокси-(низш.)алкила, 2-оксопирролидин-1-ила, (1,1-диоксо)-2-изотиазолидина, 3-(низш.)алкилсульфинила, замещенного или незамещенного гетероциклического кольца, замещенного или незамещенного арильного кольца, замещенного или незамещенного гетероарильного кольца, трифтор-(низш.)алкилсульфониламиноарила, (низш.)алкилсульфониламинокарбонила, (низш.)алкилсульфониламинокарбониларила, гидроксикарбамоилфенила, бензилокси-(низш.)алкоксигруппы, моно- или ди-(низш.)алкила, замещенного аминосульфонила и (низш.)алкила, который необязательно может быть замещен галогеном, гидроксигруппой, NH2, N(H, (низш.)алкилом) или N((низш.)алкилом)2; и
n обозначает 0 или 1.
Еще один предпочтительный вариант осуществления изобретения относится к соединениям формулы Ia, в которой
R6 обозначает -(CH2)n-R', и
R' обозначает фенил, пиридинил, пиразинил или пиримидинил, который каждый может быть замещен одним или двумя заместителями, независимо выбранными из галогена, C1-С6алкоксигруппы, C1-С6алкила, гидроксикарбонила, карбоксигруппы, карбокси C1-С6алкоксигруппы, оксогруппы и CN;
n обозначает собой 0.
Наиболее предпочтительными являются соединения формулы Ia, выбранные из следующих соединений
метиловый эфир рац-4-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)циклогексанкарбоновой кислоты,
рац-4-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)циклогексанкарбоновая кислота,
метиловый эфир рац-4-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)-2-метоксибензойной кислоты,
рац-4-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)-2-метоксибензойная кислота,
метиловый эфир рац-4-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)-2-фторбензойной кислоты,
рац-4-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)-2-фторбензойная кислота,
метиловый эфир хиральной 5-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)пиридин-2-карбоновой кислоты,
хиральная 5-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)пиридин-2-карбоновая кислота,
метиловый эфир хиральной 6-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)никотиновой кислоты,
хиральная 6-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)никотиновая кислота,
рац-4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2-этоксибензойная кислота,
(4-гидразинкарбонилфенил)амид хиральной (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
трет-бутиловый эфир хиральной [2-(4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}фенил)этил]карбаминовой кислоты,
[4-(2-аминоэтил)фенил]амид хиральной (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
хиральная 5-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}пиразин-2-карбоновая кислота,
хиральная 4-(((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)метил)-2-метоксибензойная кислота,
хиральная-4-({[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}метил)-2-метоксибензойная кислота,
хиральный метил-3-(4-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)фенил)пропаноат,
хиральная 3-(4-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)фенил)пропановая кислота,
хиральная 4-(((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)метил)-2-фторбензойная кислота,
хиральная 4-(((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)метил)-2-фторбензойная кислота,
хиральный (2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-N-(2-морфолинопиримидин-5-ил)-5-неопентилпирролидин-2-карбоксамид,
хиральный (2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентил-N-(пиримидин-5-ил)пирролидин-2-карбоксамид,
(4-диметиламинометилфенил)амид хиральной (2S,3R,4S,5R)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидип-2-карбоновой кислоты,
(4-диметиламинометил-фенил)амид (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
хиральный метил-5-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)-1Н-бензо[d]имидазол-2-карбоксилат,
хиральная-5-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)-1H-бензо[d]имидазол-2-карбоновая кислота,
хиральный метил-5-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)бензофуран-2-карбоксилат,
хиральная 5-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)бензофуран-2-карбоновая кислота,
хиральный метил-4-(4-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)фенил)бутаноат,
хиральная 4-(4-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)фенил)бутановая кислота,
хиральный метил-5-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)бензо[d]оксазол-2-карбоксилат,
хиральная 5-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)бензо[d]оксазол-2-карбоновая кислота,
хиральный (2R,3S,4R,5S)-N-(бензо[d]оксазол-5-ил)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамид,
трет-бутиловый эфир рац-(4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}бензил)карбаминовой кислоты,
(4-аминометилфенил)амид рац-(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
[4-(метансульфониламино-метил)фенил]амид (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
этиловый эфир 1-(4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}фенил)пиперидин-4-карбоновой кислоты,
1-(4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}фенил)пиперидин-4-карбоновая кислота,
(4-диметиламинометилфенил)амид рац-(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
рац-5-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2-пирролидин-1-илбензойная кислота,
трет-бутиловый эфир рац-4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фтopфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-4-метилпиперидин-1-карбоновой кислоты,
(4-метилпиперидин-4-ил)амид рац-(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
(1-метансульфонил-4-метилпиперидин-4-ил)амид рац-(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
метил-1-(4-((2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)фенил)пирролидин-2-карбоксилат,
1-(4-(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-неопентилпирролидин-2-карбоксамидо)фенил)пирролидин-2-карбоновая кислота,
хиральная 5-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]-амино}-1H-пиррол-2-карбоновая кислота,
этиловый эфир хиральной 5-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-1Н-пиррол-2-карбоновой кислоты,
хиральная (R)-2-(4-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}фенил)масляная кислота,
хиральная (S)-2-(4-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}фенил)масляная кислота,
метиловый эфир хиральной (S)-2-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-тиазол-4-ил-пропионовой кислоты,
метиловый эфир хиральной (S)-2-{[(2R,3S,4R,5R)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-тиазол-4-ил-пропионовой кислоты,
хиральная (S)-2-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-тиазол-4-ил-пропионовая кислота,
хиральная (S)-2-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-тиазол-4-ил-пропионовая кислота,
хиральная 4-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-1H-индол-2-карбоновая кислота,
(5-йодпиридин-2-ил)амид рац-(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
2-хлор-4-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}бензойная кислота,
6-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}никотиновая кислота,
пиридин-2-иламид (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
пиридин-4-иламид (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
5-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}пиридине-2-карбоновая кислота,
пиридин-3-иламид (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
(4-йод-3,5диметилфенил)амид (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
трет-бутиловый эфир 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2 фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2-фторбензойной кислоты,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2-фторбензойная кислота,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-фторбензойная кислота,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2-трифторметилбензойная кислота,
(4-йод-2-трифторметоксифенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
метиловый эфир 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-трифторметоксибензойной кислоты,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-трифторметоксибензойная кислота,
6-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}никотиновая кислота,
метиловый эфир 6-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино} никотиновой кислоты,
(6-йодпиридин-3-ил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
метиловый эфир 5-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}пиридин-2-карбоновой кислоты,
метиловый эфир 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойной кислоты,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойная кислота,
(6-карбамоилнафталин-2-ил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
(4-карбамоил-3-хлорфенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
(4-карбамоил-3-трифторметилфенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
5-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}пиридин-2-карбоновая кислота,
метиловый эфир 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-фторбензойной кислоты,
метиловый эфир 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-хлорбензойной кислоты,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-хлорбензойная кислота,
(4-карбамоил-2-фторфенил)амид (2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
(4-карбамоил-2-метоксифенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
метиловый эфир 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2,5-дифторбензойной кислоты,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-диан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2,5-дифторбензойная кислота,
(3,5-дифтор4-йодфенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2,6-дифторбензойная кислота,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-диан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-гидроксибензойная кислота,
(4-карбамоил-3-метоксифенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
(4-карбамоил-3-трифторметоксифенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
(4-карбамоил-3-фторфенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
(4-карбамоил-2-хлорфенил)амид(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилиропил)пирролидин-2-карбононой кислоты,
метиловый эфир 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2-фтор-5-метоксибензойной кислоты,
4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-2-фтор-5-метоксибензойная кислота,
2-(4-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}фенил)-4-метилиентановая кислота,
метиловый эфир хиральной 2-(4-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]-амино}фенил)-2-метилпропионовой кислоты,
хиральная 2-(4-{[(2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}фенил)-2-метилпропионовая кислота,
[4-(1-метил-1-метилкарбамоилэтил)фенил] амид хиральной (2S,3R,4S,5R)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты,
{4-[1-(3-гидроксипропилкарбамоил)-1-метилэтил]фенил}амид хиральной (2R,3S,4R,5S)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты и
[4-(1-карбамоил-1-метилэтил)фенил]амид хиральной (2S,3R,4S,5R)-3-(3-хлор-2-фторфенил)-4-(4-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбоновой кислоты.
В указанных в описании случаях различные группы могут быть замещены 1-5 или предпочтительно 1-3 заместителями, независимо выбранными из группы, состоящей из (низш.)алкила, (низш.)алкенила, (низш.)алкинила, диоксо-(низш.)алкилена (с образованием, например, бенздиоксильной группы), галогена, гидроксигруппы, CN, CF3, NH2, N(H, (низш.)алкила), N((низш.)алкила)2, аминокарбонила, карбоксигруппы, NO2, (низш.)алкоксигруппы, тио-(низш.)алкоксигруппы, (низш.)алкилсульфонила, аминосульфонила, (низш.)алкилкарбонила, (низш.)алкилкарбонилоксигруииы, (низш.)алкоксикарбонила, (низш.)алкилкарбонил-NН, фтор-(низш.)алкила, фтор-(низш.)алкоксигруппы, (низш.)алкоксикарбонил-(низш.)алкоксигруппы, карбокси-(низш.)алкоксигруппы, карбамоил-(низш.)алкоксигруппы, гидрокси-(низш.)алкоксигруппы, NH2-(низш.)алкоксигруппы, N(H, (низш.)алкил-(низш.)алкоксигруппы, N((низш.)алкил)2-(низш.)алкоксигрунпы, (низш.)алкил-1-оксиранил-(низш.)алкокси-(низш.)алкила, 2-оксопирролидин-1-ила, (1,1-диоксо)-2-изотиазолидина, 3-(низш.)алкилсульфинила, замещенного или незамещенного гетероциклического кольца, замещенного или незамещенного арильного кольца, замещенного или незамещенного гетероарильного кольца, трифтор-(низш.)алкилсульфониламиноарила, (низш.)алкилсульфониламинокарбонила, (низш.)алкилсульфониламинокарбониларила, гидроксикарбамоилфенила, бензилокси-(низш.)алкоксигруппы, моно- или дизамещенного (низш.)алкилом аминосульфонила и (низш.)алкила, который необязательно может быть замещен галогеном, гидроксигруппой, NH2, N(H, (низш.)алкилом) или N(низш.)алкилом)2. Предпочтительными заместителями для циклоалкильного, циклоалкенильного, арильного, гетероарильного и гетероциклического колец являются галоген, (низш.)алкоксигруппа, (низш.)алкил, гидроксикарбонил, карбоксигруппа, карбокси-(низш.)алкоксигруппа, оксогруппа и CN. Предпочтительными заместителями для алкила являются алкоксигруппа и N((низш.)алкил)2.
Понятие «алкил» относится к насыщенным углеводородным группам с прямой или разветвленной цепью, имеющим от 1 до примерно 20 атомов углерода, включая группы, имеющие от 1 до примерно 7 атомов углерода. В некоторых вариантах осуществления изобретения алкильные заместители могут представлять собой (низш.)алкильные заместители. Понятие «(низш.)алкил» относится к алкильным группам, имеющим от 1 до 6 атомов углерода, и в некоторых вариантах осуществления изобретения от 1 до 4 атомов углерода. Примеры алкильных групп включают (но, не ограничиваясь только ими) метил, этил, н-пропил, изопронил, н-бутил, втор-бутил, трет-бутил, н-пентил и втор-пентил.
В контексте настоящего описания подразумевается, что понятие «циклоалкил» относится к любой стабильной моноциклической или полициклической системе, которая состоит только из атомов углерода, любое кольцо которой является насыщенным, а понятие «циклоалкенил» относится к любой стабильной моноциклической или иолициклической системе, которая состоит только из атомов углерода, в которой по меньшей мерс одно кольцо является частично ненасыщенным. Примеры циклоалкилов включают (но, не ограничиваясь только ими) циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, бициклоалкилы, включая биниклооктаны, такие как [2.2.2]бициклооктан или [3.3.0]бициклооктан, бициклононаны, такие как [4.3.0]бициклононан, и бициклодеканы, такие как [4.4.0]бициклодекан (декалин), или спиро-соединения. Примеры циклоалкснилов включают (но, не ограничиваясь только ими) циклопентенил или циклогексснил.
В контексте настоящего описания понятие «алкенил» обозначает ненасыщенную алифатическую углеводородную группу с прямой или разветвленной цепью, содержащую одну двойную связь и имеющую 2-6, предпочтительно 2-4 атома углерода. Примерами такой «алкепильной группы» являются винил (этенил), аллил, изопропенил, 1-проненил, 2-метил-1-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-этил-1-бутенил, 3-метил-2-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 4-метил-3-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил и 5-гексенил.
В контексте настоящего описания понятие «алкинил» обозначает ненасыщенную алифатическую углеводородную группу с прямой или разветвленной цепью, содержащую одну тройную связь и имеющую 2-6, предпочтительно 2-4 атома углерода. Примерами такой «алкинильной группы» являются этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил.
В контексте настоящего описания понятие «галоген» обозначает фтор, хлор, бром или йод, предпочтительно фтор и хлор.
Понятие «арил» обозначает одновалентный моноциклический или бициклический ароматический карбоциклический углеводородный радикал, предпочтительно 6-10-членную ароматическую кольцевую систему. Предпочтительные арильные группы включают (но, не ограничиваясь только ими) фенил, нафтил, толил и ксилил. В случае бициклической арильной группы предпочтительной группой является 1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-ильная группа.
Понятие «гетероарил» обозначает ароматическую гетероциклическую кольцевую систему, содержащую вплоть до двух колец. Предпочтительные гетероарильные группы включают (но, не ограничиваясь только ими) тиенил, фурил, индолил, пирролил, пиридинил, пиразинил, оксазолил, тиаксолил, хинолинил, пиримидинил, имидазол, замещенный или незамещенный триазолил и замещенный или незамещенный тетразолил.
В том случае, когда арил или гетероарил являются бициклическими, следует понимать, что одно кольцо может представлять собой арил, в то время как другое представляет собой гетероарил, при этом оба кольца являются замещенными или незамещенными.
Понятие «гетероцикл» или «гетероциклическое кольцо» обозначает замещенный или незамещенный 5-8-членный моно- или бициклический неароматический углеводород, в котором 1-3 атома углерода замещены гетероатомом, выбранным из атома азота, кислорода или серы. Примеры включают пирролидин-2-ил; пирролидин-3-ил; пиперидинил; морфолин-4-ил и т.п., которые в свою очередь могут быть замещены. Понятие «гетероатом» обозначает атом, выбранный из N, О и S.
Понятие «алкоксигруппа, алкоксил или (низш.)алкоксигруппа» относится к любой из указанных выше (низш.)алкильных групп, присоединенных к атому кислорода. Типичные (низш.)алкоксигруппы включают метоксигруппу, этоксигруппу, изопропоксигруппу или пропоксигруппу, бутилоксигруппу и т.п. Кроме того, под понятие «алкоксигруппа» подпадают группы в виде нескольких боковых алкокси-цепей, например, этоксиэпоксигруппа, метоксиэтоксигруппа, метоксиэтоксиэтоксигруппа и т.п., и замещенные боковые алкокси-цепи, например, диметиламиноэтоксигруппа, диэтиламиноэтоксигруппа, диметоксифосфорилметоксигруппа и т.п.
«Фармацевтически приемлемый», например, фармацевтически приемлемый носитель, эксципиент и т.д. обозначает соединение, фармакологически приемлемое и практически нетоксичное для индивидуума, которому вводят конкретное соединение.
Понятие «фармацевтически приемлемая соль» относится к общепринятым кислотно-аддитивным солям или солям присоединения оснований, которые сохраняют биологическую эффективность и свойства соединений, предлагаемых в настоящем изобретении, и которые получают из приемлемых нетоксичных органических или неорганических кислот или органических или неорганических оснований. Примеры кислотно-аддитивных солей включают соли, полученные из неорганических кислот, таких как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, сульфамовая кислота, фосфорная кислота и азотная кислота, и соли, полученные из органических кислот, таких как пара-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота, трифторуксусная кислота и т.п. Примеры солей присоединения оснований включают соли, полученные из гидроксидов аммония, калия, натрия и четвертичного аммония, такие, например, как гидроксид тетраметиламмония. Химическая модификация фармацевтического соединения (т.е. лекарственного средства) с образованием соли представляет собой метод, хорошо известный специалистам в области фармацевтической химии, предназначенный для улучшения физической и химической стабильности, гигроскопичности, текучести и растворимости соединений (см., например, Ansel и др., Pharmaceutical Dosage Forms and Drug Delivery Systems (6-ое изд. 1995) cc. 196 и 1456-1457).
Соединения формулы I или Ia, а также их соли, которые имеют по меньшей один асимметричный атом углерода, могут присутствовать в виде рацемических смесей или различных стереоизомеров. Различные изомеры можно выделять с помощью известных методов разделения, например, с помощью хроматографии.
Соединения, указанные в настоящем описании и подпадающие под указанную выше формулу I или Ia, могут характеризоваться таутомерией или структурной изомерией. Подразумевается, что под обтаем изобретения подпадает любая таутомерная или структурная изомерная форма этих соединений или смеси указанных форм, и изобретение не ограничено какой либо одной таутомерной или структурной изомерной формой, указанной в приведенных выше формулах.
Наиболее предпочтительно ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту, имеющую указанную ниже формулу, или ее соль, эфир или полиморф. В примере 448 WO 2011/098398 описан метод получения указанного соединения. Указанное соединение обозначают как MDM2(4) или RO7388, или RG5503781 и в контексте настоящего описания их используют в качестве синонимов.

Получение ингибитора MDM2, предлагаемого в изобретении, осуществляют согласно методу, описанному в WO 2011/098398.
Понятие «соль» относится к солям соединений, таким как фармацевтически приемлемая соль. Примерами указанных солей могут являться соли со щелочными металлами (калий, натрий и т.н.), соли щелочноземельных металлов (кальций, магний и т.п.), аммониевая соль, соли с фармацевтически приемлемыми органическими аминами (тетраметиламмоний, триэтиламин, метиламин, диметиламин, циклопентиламин, бензиламин, фенэтиламин, пиперидин, моноэтаноламин, диэтаноламин, трис(гидроксиметил)аминометан, лизин, аргинин, N-метил-D-глюкамин и т.п.), и кислотно-аддитивные соли (соли неорганических кислот (гидрохлорид, гидробромид, гидройодид, сульфат, фосфат, нитрат и т.п.) и соли органических кислот (ацетат, трифторацетат, лактат, тартрат, оксалат, фумарат, малеат, бензоат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, толуолсульфанат, изотионат, глюкуронат, глюконат и т.п.)).
Понятие «IC50» относится к концентрации конкретного соединения, требуемой для ингибирования на 50% конкретной измеряемой активности.
Олигосахаридный компонент может оказывать существенное влияние на свойства, имеющие отношение к эффективности терапевтического гликопротеина, включая его физическую стабильность, устойчивость к воздействию протеаз, взаимодействия с иммунной системой, фармакокинетические параметры и специфическую биологическую активность. Указанные свойства могут зависеть не только от присутствия или отсутствия олигосахаридов, но также от их специфических структур. Можно сделать определенные обобщения, касающиеся зависимости структуры олигосахарида и функции гликопротеина. Например, некоторые структуры олигосахарида опосредуют быстрый клиренс гликопротеина из кровотока в результате взаимодействий со специфическими связывающими углеводы белками, а другие могут связываться антителами и запускать нежелательные иммунные реакции (Jenkins N. и др., Nature Biotechnol. 14, 1996, сс. 975-981).
Клетки млекопитающих являются предпочтительными хозяевами для производства терапевтических гликопротеинов благодаря их способности гликозилировать белки с образованием наиболее приемлемой для применения для человека формы (Cumming D.A. и др., Glycobiology 1, 1991, сс. 115-130; Jenkins N. и др., Nature Biotechnol. 14, 1996, сс. 975-981). Бактерии очень редко гликозилируют белки, и подобно другим типам обычных хозяев, таким как клетки дрожжей, нитчатых грибов, насекомых и растений, обеспечивают схемы гликозилирования, ассоциированные с быстрым клиренсом из кровотока, нежелательными иммунными взаимодействиями и в некоторых конкретных случаях пониженной биологической активностью. Среди клеток млекопитающих клетки яичника китайского хомячка (СНО) нашли наиболее широкое применение в течение двух последних десятилетий. Помимо обеспечения приемлемых схем гликозилирования эти клетки позволяют устойчиво получать генетически стабильные, высокопродуктивные клональные клеточные линии. Их можно культивировать, достигая высокой плотности, в простых биореакторах с использованием бессывороточных сред, и на их основе можно разрабатывать безопасные и воспроизводимые биопроцессы. Другими обычно применяемыми клетками животных являются клетки почки детеныша хомяка (ВHK), клетки мышиной миеломы NS0 и SP2/0. В последние годы изучали также возможность их производства в организме трансгенных животных (Jenkins N. и др., Nature Biotechnol. 14, 1996, сс. 975-981).
Все антитела содержат углеводные структуры в консервативных положениях в константных областях тяжелой цепи, при этом каждый изогни характеризуется различной организацией N-связанных углеводных структур, которые оказывают различное действие на сборку, секрецию и функциональную активность белка (Wright А. и Monison S.L., Trends Biotech. 15, 1997, сс. 26-32). Структура присоединенного N-связанного углевода значительно варьируется в зависимости от степени процессирования и может включать имеющие высокое содержание маннозы, множество разветвлений, а также биантенные сложные олигосахариды (Wright А. и Morrison S.L., Trends Biotech. 15, 1997, сс. 26-32). Как правило, имеет место гетерогенный процессинг коровых олигосахаридных структур, присоединенных в конкретном сайте гликозилирования, в результате чего даже моноклональные антитела существует в виде нескольких гликоформ. Было установлено также, что имеют место большие различия в гликозилировании антител между клеточными линиями, и даже при выращивании данной клеточной линии в других условиях культивирования имеют место небольшие различия (Lifely M.R. и др., Glycobiology 5(8), 1995, сс. 813-822).
Одним из путей достижения значительного повышения эффективности при сохранении простого процесса производства и возможности избегать значительных нежелательных побочных действий является усиление природных опосредуемых клеткой эффекторных функций моноклональных антител путем конструирования их олигосахаридного компонента согласно методу, описанному у Umana Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180 и в US 6602684. Антитела IgG1-типа, представляющие собой антитела, наиболее часто используемые в иммунотерапии рака, являются гликопротеинами, которые имеют консервативный N-связанный сайт гликозилирования в положении Asn297 в каждом СН2-домене. Два сложных биантенных олигосахарида, которые присоединены к Asn297, размещаются между СН2-доменами, образуя обширные контакты с каркасом полипептида, и их наличие является существенным для способности антитела опосредовать эффекторные функции, такие как антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) (Lifely M.R. и др., Glycobiology, 5, 1995, сс. 813-822; Jefferis R. и др., Immunol. Rev., 163, 1998, сс. 59-76; Wright А. и Morrison S.L., Trends Biotechnol., 15, 1997, cc. 26-32).
Ранее было установлено, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), гликозилтрансферазы, катализирующей образование бисекционных олигосахаридов, существенно повышает ADCC-активность in vitro антинейробластомного химерного моноклонального антитела (chCE7), продуцируемого сконструированными клетками СНО (см. Umafia Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180; и WO 1999/54342, полное содержание указанных документов включено в настоящее описание в качестве ссылки). Антитело chCE7 относится к большому классу неконъюгированных моноклональных антител, которые обладают высокой аффинностью и специфичностью в отношении опухолей, но имеют слишком низкую эффективность для клинического применения при их получении в стандартных применяемых в промышленности клеточных линиях, в которых отсутствует фермент GnTIII (Umana Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180). Это исследование было первым, в котором установлено, что существенных повышений ADCC-активности можно достигать путем конструирования продуцирующих антитело клеток, экспрессирующих GnTIII, что приводит также к повышению относительного содержания ассоциированных с константной областью (Fc) бисекционных олигосахаридов, включая бисекционные нефукозилированные олигосахариды, по сравнению с уровнями, характерными для встречающихся в естественных условиях антител.
Понятие «рак» в контексте настоящего описания относится к таким видам рака, как лимфомы, лимфолейкозы, рак легкого, немелкоклеточный рак легкого (NSCL), бронхоальвеолярно-клеточный рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожная или внутриглазная меланома, рак матки, рак яичника, ректальный рак, рак анальной области, рак желудка, гастральный рак, рак ободочной кишки, рак молочной железы, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркома мягкой ткани, рак мочеиспускательного канала, рак пениса, рак предстательной железы, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, карцинома почечных лоханок, мезотелиома, печеночно-клеточный рак, билиарный рак, неоплазмы центральной нервной системы (ЦHС), опухоль позвоночника, глиома ствола головного мозга, мультиформная глиобластома, астроцитомы, шванномы, эпендимомы, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденома гипофиза, в том числе устойчивые варианты любого из указанных выше видов рака или комбинации одного или нескольких из указанных выше видов рака. Согласно одному из вариантов осуществления изобретения понятие рак относится к раку, при котором происходит экспрессия CD20.
Подразумевается, что понятие «экспрессия антигена CD20» относится к значительному уровню экспрессии антигена CD20 в клетке, предпочтительно на клеточной поверхности Т- или В-клетки, более предпочтительно В-клетки, входящей в опухоль или рак соответственно, предпочтительно опухоль, которая не относится к солидным опухолям. Пациентов, которые имеют «рак, при котором происходит экспрессия CD20», можно выявлять с помощью стандартных анализов, известных в данной области. Например, экспрессию антигена CD20 можно оценивать иммуногистохимическим (ИГХ) методом, FACS или путем выявления соответствующей мРНК с помощью ПЦР.
Понятие «рак, при котором происходит экспрессия CD20» в контексте настоящего описания относится ко всем видам рака, при которых раковые клетки экспрессируют антиген CD20. В контексте настоящего описания рак, при котором происходит экспрессия CD20, предпочтительно относится к лимфомам (предпочтительно В-клеточным неходжкинским лимфомам (НХЛ)) и лимфолейкозам. Указанные лимфомы и лимфолейкозы включают, например, а) фолликулярные лимфомы, б) мелкоклеточые с нерасщепленными ядрами лимфомы/лимфому Беркитта (включая эндемическую лимфому Беркитта, спорадическую лимфому Беркитта и не-беркиттовскую лимфому), в) лимфомы маргинальной зоны (включая экстранодальную В-клеточную лимфому маргинальной зоны (лимфомы лимфоидной ткани слизистых оболочек, MALT), нодальную В-клеточную лимфому марганальной зоны и лимфому маргинальной зоны селезенки), г) лимфому из клеток зоны мантии (MCL), д) крупноклеточную лимфому (включая В-клеточную диффузную крупноклеточную лимфому (DLCL), диффузную смешанно-клеточную лимфому, иммунобластную лимфому, первичную медиастинальную В-клеточную лимфому, ангиоцентрическую лимфому-легочную В-клеточную лимфому), е) волосатоклеточный лейкоз, ж) лимфоцитарную лимфому, макроглобулинемию Вальденстрема, з) острый лимфобластный лейкоз (ALL), хронический лимфолейкоз (CLL)/мелкоклеточный лимфолейкоз (SLL), В-клеточный пролимфоцитарный лейкоз, и) неоплазмы из плазматических клеток, миеломы из плазматических клеток, множественную миелому, плазмацитому, к) болезнь Ходжкина.
Согласно одному из вариантов осуществления изобретения рак, при котором происходит экспрессия CD20, представляет собой В-клеточные неходжкинские лимфомы (НХЛ)). Согласно другому варианту осуществления изобретения рак, при котором происходит экспрессия CD20, представляет собой лимфому из клеток зоны мантии (MCL), острый лимфобластный лейкоз (ALL), хронический лимфолейкоз (CLL), В-клеточную диффузную крупноклеточную лимфому (DLCL), лимфому Беркитта, волосатоклеточный лейкоз, фолликулярную лимфому, множественную миелому, лимфому маргинальной зоны, пост-трансплантационное лимфопролиферативное нарушение (PTLD), ассоциированную с ВИЧ лимфому, макроглобулинемию Вальденстрема или первичную лимфому ЦНС.
Понятие «метод лечения», «метод обработки» или его эквивалент применительно, например, к раку, относится к процедуре или курсу лечения, которую/который разрабатывают с целью снижения или устранения некоторого количества раковых клеток в организме пациента или для облегчения симптомов рака. «Метод лечения» рака или другого пролиферативного нарушения не обязательно подразумевает, что раковые клетки или другие нарушения должны быть фактически элиминированы, что количество клеток или уровень нарушения фактически должны быть снижены, или что другие симптомы рака или другого нарушения фактически должны быть облегчены. Часто метод лечения рака можно осуществлять даже с небольшой вероятностью успеха, но если с учетом истории болезни пациента и оцененной перспективы хирургического вмешательства предполагается, что он, тем не менее, может оказывать общее благоприятное воздействие.
Понятия «комбинация», «совместное введение» или «совместное применение» относится к применению указанного антитела к CD20 типа I или указанного афукозилированного антитела к CD20 и указанного ингибитора Bcl-2 и указанного ингибитора MDM2 в виде двух различных препаративных форм (или в виде одной препаративной формы). Совместное применение может быть одновременным или последовательным в любом порядке, при этом предпочтительно существует период времени, в течение которого оба действующих вещества (или все действующие вещества) одновременно проявляют свое биологическое действие. Указанное антитело к CD20 типа I или указанное афукозилированное антитело к CD20 и указанный ингибитор Bcl-2 и указанный ингибитор MDM2 применяют совместно либо одновременно, либо последовательно (например, внутривенно (i.v.) посредством непрерывной инфузии (одна для антитела к CD20 и затем одна для указанного ингибитора Bcl-2 и указанного ингибитора MDM2; или например, антитело к CD20 вводят внутривенно (i.v.) посредством непрерывной инфузии, а указанный ингибитор Bcl-2 и указанный ингибитор MDM2 вводят орально). Когда оба терапевтических агента совместно вводят последовательно, то вводимую дозу применяют либо в один и тот же день в виде двух различных введений, либо один из агентов вводят в день 1, а второй совместно применяемый агент вводят в день 2-7, предпочтительно день 2-4. Таким образом, в одном из вариантов осуществления изобретения понятие «последовательно» означает в пределах 7 дней после введения дозы первого компонента (антитела к CD20 или ингибитора Bcl-2 и ингибитора MDM2), предпочтительно в пределах 4 дней после введения дозы первого компонента; а понятие «одновременно» означает в одно и то же время. Понятие «совместное применение» касательно поддерживающих доз указанного антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора Bcl-2 и указанного ингибитора MDM2 означает, что поддерживающие дозы можно совместно вводить одновременно, если цикл лечения обоих лекарственных средств пригоден для этого, например, каждую неделю. Или указанный ингибитор Bcl-2 и указанный ингибитор MDM2 вводят, например, каждый первый-третий день, а указанное афукозилированное антитело вводят каждую неделю. Или поддерживающие дозы применяют совместно последовательно либо в один день, либо в пределах нескольких дней.
Очевидно, что антитела вводят пациенту в «терапевтически эффективном количестве» (или просто в «эффективном количестве»), которое представляет собой количество соответствующего соединения или комбинации, вызывающее биологический или медицинский ответ ткани, системы, животного или человека, ожидаемый исследователем, ветеринаром, лечащим врачом или другим клиницистом.
Количество, применяемое для совместного введения указанного антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора Bcl-2 и указанного ингибитор MDM2, и время совместного введения должны зависеть от типа (вид, пол, возраст, вес и т.д.) и состояния подлежащего лечению пациента и серьезности заболевания или состояния, подлежащего лечению. Указанное антитело к CD20 типа I или афукозилированное антитело к CD20 и указанный ингибитор Bcl-2 и указанный ингибитор MDM2 можно применять для совместного введения пациенту одновременно или в виде серий обработок, например, в один и тот же день или на следующий день.
Если введение является внутривенным, то продолжительность начальной инфузии указанного антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора Bcl-2 и указанного ингибитор MDM2 может быть длиннее, чем продолжительность последующих инфузий, например, составлять примерно 90 мин для начальной инфузии и примерно 30 мин для последующих инфузий (если начальная инфузия хорошо переносилась).
В зависимости от типа и серьезности заболевания начальная возможная доза при совместном введении обоих лекарственных средств пациенту может составлять примерно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) для указанного антитела к CD20 типа I или афукозилированного антитела к CD20; и от 1 мкг /кг до 50 мг/кг (например, 0,1-20 мг/кг) для указанного ингибитора Bcl-2 и указанного ингибитора MDM2. Согласно одному из вариантов осуществления изобретения предпочтительная доза указанного афукозилированного антитела к CD20 (предпочтительно афукозилированного гуманизированного антитела B-Ly1, более предпочтительно обинутузумаба) должна составлять от примерно 0,05 до примерно 30 мг/кг. Так, для совместного введения пациенту можно использовать одну или несколько из следующих доз: примерно 0,5, 2,0, 4,0, 10 или 30 мг/кг (или любую их комбинацию).
В одном из вариантов осуществления изобретения предпочтительная доза указанного ингибитора Bcl-2 (предпочтительно 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2H-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамида или его соли или полиморфа) должна составлять от примерно 0,05 до примерно 30 мг/кг. Так, для совместного введения пациенту можно использовать одну или несколько из следующих доз: примерно 0,5, 2,0, 4,0, 10 или 30 мг/кг (или любую их комбинацию).
В одном из вариантов осуществления изобретения предпочтительная доза указанного ингибитора MDM2 (предпочтительно 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойной кислоты или ее соли или полиморфа) должна составлять от примерно 0,05 до примерно 30 мг/кг. Так, для совместного введения пациенту можно использовать одну или несколько из следующих доз: примерно 0,5, 2,0, 4,0, 10 или 30 мг/кг (или любую их комбинацию).
В зависимости от типа (вид, пол, возраст, вес и т.д.) и состояния пациента и от антитела к CD20 типа I, предпочтительно ритуксимаба, или типа афукозилированного антитела к CD20, дозу и схему введения указанного афукозилированного антитела, предпочтительно афукозилированного гуманизированного антитела B-Ly1, более предпочтительно обинутузумаба, доза и схема введения указанного антитела к CD20 типа I или указанного афукозилированного антитела к CD20 может отличаться от применяемых для указанного ингибитора. Например, антитело к CD20 типа I или указанное афукозилированное антитело к CD20 можно вводить, например, каждую 1-3 недели, а указанный ингибитор ингибитора Bcl-2 и указанный ингибитор MDM2 можно вводить ежедневно или каждые 2-10 дней. Можно применять также начальную более высокую ударную дозу, после которой можно вводить одну или несколько более низких доз.
Согласно одному из вариантов осуществления изобретения предпочтительная доза антитела к CD20 типа I (предпочтительно ритуксимаба) может составлять от примерно 100 до примерно 1000 мг/м2 в день 1, 8, 15, 22, 29, 36, 43, 50, 57 при осуществлении 8-недельного цикла дозирования.
Согласно одному из вариантов осуществления изобретения предпочтительная доза указанного афукозилированного антитела к CD20 (предпочтительно афукозилированного гуманизированного антитела B-Ly1, более предпочтительно обинутузумаба) может составлять от 800 до 1600 мг (в одном из вариантов осуществления от 800 до 1200 мг) в день 1, 8, 15 при осуществлении 3-6-недельного цикла дозирования, а затем доза может составлять от 400 до 1200 (в одном из вариантов осуществления от 800 до 1200 мг) в день 1 при осуществлении вплоть до девяти 3-4-недельных циклов дозирования.
В одном из вариантов осуществления изобретения доза указанного ингибитора Bcl-2, когда ингибитор Bcl-2 выбирают из группы, состоящей из ингибиторов Bcl-2, указанных выше, и предпочтительно он представляет собой 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2H-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид, соответствует указанной ниже. Указанная доза согласно изобретению составляет от 10 до 70 мг/кг, предпочтительно от 20 до 55 мг/кг, один раз в день или через день в виде орального введения
В одном из вариантов осуществления изобретения доза указанного ингибитора MDM2, когда ингибитор MDM2 выбирают из группы, состоящей из ингибиторов MDM2, указанных выше, и предпочтительно он представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту, соответствует указанной ниже. Указанная доза согласно изобретению составляет от 10 до 70 мг/кг, предпочтительно от 20 до 55 мг/кг, один раз в день или через день в виде орального введения.
Рекомендованная доза может варьироваться в зависимости от дополнительного совместного введения химиотерапевтического средства и в зависимости от типа химиотерапевтического средства.
В одном из вариантов осуществления указанное изобретение можно применять для предупреждения или снижения метастазов или дальнейшего их распространения у пациента, страдающего раком, предпочтительно раком, при котором происходит экспрессия CD20. Указанное изобретение можно применять для удлинения продолжительности жизни указанного пациента, удлинения продолжительности жизни без прогрессирования заболевания у указанного пациента, удлинения продолжительности ответа, что приводит к статистически значимому и клинически заметному улучшению состояния подвергнутого лечению пациента при оценке по продолжительности жизни, продолжительности жизни без прогрессирования заболевания, уровню ответа или продолжительности ответа. В предпочтительном варианте осуществления изобретения указанное изобретение можно применять для повышения уровня ответа у группы пациентов.
В контексте настоящего описания для лечения рака можно применять дополнительные другие цитотоксические, химиотерапевтические или противораковые средства, или соединения или ионизирующее излучение, что повышает эффективность указанных средств (например, цитокины), в комбинации с антителом к CD20 типа I или афукозилированным антителом к CD20 и указанным ингибитором Bcl-2 и ингибитором MDM2 для лечения рака. Указанные молекулы должны присутствовать в комбинации в количествах, эффективных для поставленных целей. Согласно одному из вариантов осуществления изобретения комбинированное лечение с использованием указанного антитела к CD20 типа I, предпочтительно ритуксимаба, или указанного афукозилированного антитела к CD20, предпочтительно афукозилированного гуманизированного антитела B-Ly1, более предпочтительно обинутузумаба, и указанного ингибитора Bcl-2 и ингибитора MDM2 применяют без указанных дополнительных цитотоксических, химиотерапевтических или противораковых средств или соединений, повышающих эффективность указанных дополнительных средств.
Указанные дополнительные средства представляют собой, например, алкилирующие агенты или агенты, обладающие алкилирующей активностью, такие как циклофосфамид (СТХ; например, cytoxan®), хлорамбуцил (CHL; например, leukeran®), цисплатин (CisP; например, platinol®), бусульфан (например, myleran®), мелфалан, кармустин (BCNU), стрептозотоцин, триэтиленмеламин (ТЕМ), митомицин С, и т.п.; антиметаболиты, такие как метотрексат (МТХ), этопозид (VP16; например, vepesid®), 6-меркаптопурин (6МР), 6-тиогуанин (6TG), цитарабин (Ara-С), 5-фторурацил (5-FU), капецитабин (например, Xeloda®), дакарбазин (DTIC) и т.п.; антибиотики, такие как актиномицин D, доксорубицин (DXR; например, adriamycin®), даунорубицин (дауномицин), блеомицин, митрамицин и т.п.; алкалоиды, такие как алкалоиды барвинка, такие как винкристин (VCR), винбластин и т.п.; и другие противоопухолевые агенты, такие как паклитаксел (например, taxol®) и производные паклитаксела, цитостатические агенты, глюкокортикоиды, такие как дексаметазон (DEX; например decadron®) и кортикостероиды, такие как преднизон, ингибиторы нуклеозидных ферментов, такие как гидроксимочевина, истощающие аминокислоты ферменты, такие как аспарагиназа, лейковорин и другие производные фолиевой кислоты, и аналогичные другие противоопухолевые агенты. В качестве дополнительных средств можно применять также следующие агенты: арнифостин (например, ethyol®), дактиномицин, мехлоретамин (азотный аналог горчичного газа), стрептозоцин, циклофосфамид, ломустин (CCNU), доксорубицин липо (например, doxil®), гемцитабин (например, gemzar®), даунорубицин липо (например, daunoxome®), прокарбазин, митомицин, доцетаксел (например, taxotere®), альдеслейкин, карбоплатин, оксалиплатин, кладрибин, камитотецин, СРТ 11 (иринотекан), 10-гидрокси-7-этилкамптотецин (SN38), флоксуридин, флударабин, ифосфамид, идарубицин, месну, интерферон бета, интерферон альфа, митоксантроп, топотекан, леупролид, мегестрол, мелфалан, меркаптоиурин, пликамицин, митотан, пэгасиаргазу, пентостатин, пипоброман, пликамицин, тамоксифен, тенипозид, тестолактон, тиогуанин, тиотепу, урациловый аналог горчичного газа, винорелбин, хлорамбуцил. В одном из вариантов осуществления изобретения комбинированную терапию на основе афукозилированного антитела к CD20 и указанного ингибитора Bcl-2 и указанного ингибитора MDM2 применяют без указанных дополнительных средств.
Применение цитотоксических и противораковых средств, описанных выше, а также антипролиферативных мишеньспецифических противораковых лекарственных средств типа ингибиторов протеинкиназ, в химиотерапевтических схемах, как правило, хорошо охарактеризовано в области лечения рака, и предусмотрено в контексте настоящего описания, и при их применении следует учитывать аналогичные положения касательно мониторинга толерантности и эффективности и контроля путей введения и доз с определенными корректировками. Например, фактические дозы цитотоксических агентов можно изменять в зависимости от ответа культивируемых клеток пациента, определенного с использованием методов на основе гистокультур. Как правило, дозы должны быть ниже по сравнению с количеством средства, в котором его применяют в отсутствии других дополнительных агентов.
Типичные дозы эффективного цитотоксического средства могут находиться в диапазонах, рекомендованных производителем, и с учетом ответов in vitro или ответов, полученных на созданных на животных моделях, их концентрацию или количество можно снижать на величину, составляющую примерно вплоть до одного порядка. Так, фактическая доза должна зависеть от рекомендаций лечащего врача, состояния пациента и эффективности терапевтического метода, определенного на основе чувствительности in vitro первичных культур злокачественных клеток или образца ткани из гистокультуры, или ответов, обнаруженных на соответствующих созданных на животных моделях.
В контексте настоящего изобретения в дополнение к комбинированному лечению рака, при котором происходит экспрессия CD20, на основе антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора Bcl-2 и указанного ингибитора MDM2 можно применять в эффективном количестве (дозе) ионизирующее излучение и/или радиофармацевтические средства. Источник излучения может быть внутренним или внешним относительно пациента, подлежащего лечению. Когда источник является внешним относительно пациента, то терапию называют наружной лучевой терапией (EBRT). Когда источник излучения является внутренним относительно пациента, то лечение обозначают как брахитерапия (ВТ). Радиоактивные атомы, которые можно применять согласно настоящему изобретению, можно выбирать из группы, включающей (но, не ограничиваясь только ими) радий, цезий-137, иридий-192, америций-241, золото-198, кобальт-57, медь-67, технеций-99, йод-123, йод-131 и индий-111. Можно также метить антитело соответствующими радиоактивными изотопами. В одном из вариантов осуществления изобретения комбинированную терапию на основе антитела к CD20 типа I или афукозилированного антитела к CD20 и указанного ингибитора Bcl-2 и указанного ингибитора MDM2 применяют без ионизирующего излучения.
Лучевая терапия является стандартным средством лечения для контроля нерезектабельных или неоперабельных опухолей и/или метастазов опухолей. Улучшенные результаты были получены, когда лучевую терапию объединяли с химиотерапией. Лучевая терапия основана на принципе, что высокая доза излучения, поставляемая к области-мишени, может приводить к гибели репродуктивных клеток, как в опухоли, так и в здоровых тканях. Схему введения излучения, как правило, определяют в понятиях абсорбированной дозы излучения (Гр), времени и фракционирования, и ее должен тщательно подбирать онколог. Количество излучения, полученное пациентом, должно зависеть от различных обстоятельств, но двумя наиболее важными являются локализация опухоли относительно других имеющих решающее значение структур или органов в организме и степень распространения опухоли. Типичный курс лечения пациента, подвергающегося лучевой терапии, представляет собой схему лечения в течение периода времени, составляющего от 1 до 6 недель, при этом общую дозу от 10 до 80 Гр вводят пациенту в виде однократной суточной фракционированной дозы, составляющей от 1,8 до 2,0 Гр, 5 дней в неделю. В предпочтительном варианте осуществления настоящего изобретения имеет место синергизм, когда опухоли у больных людей подвергают комбинированной терапии, предлагаемой в изобретении, и излучению. Другими словами, ингибирование роста опухолей с помощью агентов, входящих в комбинацию, предлагаемую в изобретении, повышается при объединении с излучением, необязательно в сочетании с дополнительными химиотерапевтическими или противораковыми средствами. Параметры вспомогательной лучевой терапии описаны, например, в WO 99/60023.
Антитело к CD20 типа I или афукозилированные антитела к CD20 вводят пациенту с помощью известных методов с использованием внутривенного введения в виде болюса или непрерывной инфузии в течение определенного периода времени, с помощью внутримышечного, внутрибрюшинного, спинномозгового, подкожного, внутрисуставного, интрасиновиального или подоболочечного пути введения. В одном из вариантов осуществления изобретения антитело вводят внутривенно или подкожно.
Ингибитор Bcl-2 и ингибитор MDM2 вводят пациенту с помощью известных методов с использованием внутривенного введения в виде болюса или непрерывной инфузии в течение определенного периода времени, с помощью орального, внутримышечного, внутрибрюшинного, спинномозгового, подкожного, внутрисуставного, интрасиновиального или подоболочечного пути введения. В одном из вариантов осуществления изобретения указанный ингибитор Bcl-2 и указанный ингибитор MDM2 вводят внутривенно или орально.
В контексте настоящего описания понятие «фармацевтически приемлемый носитель» включает любой и все материалы, пригодные для фармацевтического введения, включая растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, придающие изотоничность и замедляющие абсорбцию агенты и другие материалы и соединения, которые являются пригодными для фармацевтического введения. За исключением случая, когда они являются несовместимыми с действующим веществом, в композициях, предлагаемых в изобретении, можно применять любые общепринятые среды или агенты. В композиции можно включать также дополнительные действующие вещества.
Фармацевтические композиции:
Фармацевтические композиции можно получать обработкой предлагаемого в изобретении антитела к CD20 и/или ингибитора Bcl-2 и ингибитора MDM2 с фармацевтически приемлемыми неорганическими или органическими носителями. В качестве носителей, например, для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул, можно применять лактозу, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и т.п. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Однако в зависимости от природы действующего вещества, как правило, для мягких желатиновых капсул носители не требуются. Приемлемыми носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и т.п. Приемлемыми носителями для суппозиториев являются, например, встречающиеся в естественных условиях или гидрогенизированные масла, воски, жиры, полутвердые или жидкие полиолы и т.п.
Кроме того, в состав фармацевтических композиций могут входить консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для изменения осмотического давления, буферы, маскирующие вещества или антиоксиданты. Они могут содержать также и другие терапевтически эффективные субстанции.
Одним из вариантов осуществления изобретения является композиция, содержащая как указанное антитело к CD20 типа I (предпочтительно ритуксимаб) или указанное афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело B-Ly1, более предпочтительно обинутузумаб), так и указанный ингибитор Bcl-2 и указанный ингибитор MDM2, для применения при лечении рака, в частности рака, при котором происходит экспрессия CD20 (предпочтительно лимфомы или лимфоцитарного лейкоза, более предпочтительно В-клеточной неходжкинской лимфомы (НХЛ)), лимфомы из клеток зоны мантии (MCL), острого лимфобластного лейкоза (ALL), хронического лимфолейкоза (CLL), В-клеточной диффузной крупноклеточной лимфомы (DLCL), лимфомы Беркитта, волосатоклеточного лейкоза, фолликулярной лимфомы, множественной миеломы, лимфомы из маргинальной зоны, пост-трансплантационного лимфопролиферативного нарушения (PTLD), ассоциированной с ВИЧ лимфомы, макроглобулинемии Вальденстрема или первичной лимфомы ЦНС).
Указанная фармацевтическая композиция может содержать также один или несколько фармацевтически приемлемых носителей.
Настоящее изобретение относится также к фармацевтической композиции, которую применяют, в частности, при раке, содержащей (I) в качестве первого агента антитело к CD20 типа I (предпочтительно ритуксимаб) или афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело В-Lyl), в эффективном количестве и (II) в качестве второго агента ингибитор Bcl-2 и ингибитор MDM2 в эффективном количестве. Указанная композиция необязательно содержит фармацевтически приемлемые носители и/или эксципиенты.
Фармацевтические композиции, содержащие только антитело к CD20 типа I или афукозилированное антитело к CD20, которые применяют согласно настоящему изобретению, приготавливают для хранения путем смешения антитела, имеющего требуемую степень чистоты, необязательно в сочетании с фармацевтически приемлемыми носителями, экципиентами или стабилизаторами (
Фармацевтические композиции ингибитора Bcl-2 и ингибитора MDM2 могут быть сходными с описанными для антитела к CD20 типа I или афукозилированного антитела к CD20.
Фармацевтические композиции низкомолекулярного ингибитора Bcl-2 и ингибитора MDM2 включают композиции, пригодные для орального, назального, местного (включая трансбуккальное и подъязычное), ректального, вагинального и/или парентерального введения. Удобно, когда композиции представляют собой стандартные дозы лекарственного средства и их можно получать методами, хорошо известными в области фармации. Количество действующего вещества, которое можно объединять с носителем для получения единичной лекарственной формы, может варьироваться в зависимости от хозяина, подлежащего лечению, а также от конкретного пути введения. Количество действующего вещества, которое можно объединять с носителем для получения единичной лекарственной формы, должно, как правило, представлять собой количество ингибитора Bcl-2 и ингибитора MDM2, которое обеспечивает терапевтическое действие. Как правило, в том случае, когда оно не составляет 100%, это количество должно составлять от примерно 1% до примерно 99% действующего вещества, предпочтительно от примерно 5% до примерено 70%, наиболее предпочтительно от примерно 10% до примерно 30%. Методы получения указанных композиций включают стадию, на которой приводят в контакт ингибитор Bcl-2 и ингибитор MDM2 с носителем и необязательно одним или несколькими вспомогательными ингредиентами. Как правило, фармацевтические композиции ингибитора Bcl-2 и ингибитора MDM2 получают путем осуществления однородного и тесного контакта ингибитора Bcl-2 и ингибитора MDM2 с жидким носителем или тонкоизмельченными твердыми носителями, или с обоими типа носителей, а затем при необходимости придания формы продукту. Фармацевтические композиции, пригодные для орального введения, могут иметь форму капсул, крахмальных облаток, саше, пилюль, таблеток, лепешек (полученных с применением корригентной основы, как правило, сахарозы и гуммиарабика или трагаканта), порошков, гранул или находиться в виде раствора или суспензии в водной или неводной жидкости, или находиться в виде жидкой эмульсии типа масло-в-воде или вода-в-масле, или находиться в виде эликсира или сиропа или пастилок (полученных с использованием инертной основы, такой как желатин и глицерин, или сахарозы и гуммиарабика), и/или жидкости для полоскания рта и т.п., при этом каждая форма содержит в качестве действующего вещества ингибитор Bcl-2 и ингибитор MDM2 в предварительно определенном количестве. Ингибитор Вcl-2 и ингибитор MDM2 можно применять также и в виде болюса, электуария или пасты.
В одном из дополнительных вариантов осуществления изобретения антитело к CD20 типа I или афукозилированное антитело к CD20 и ингибитор Bcl-2 и ингибитор MDM2 приготавливают в виде двух различных фармацевтических композиций.
Действующие вещества можно включать в микрокапсулы, полученные, например, методом коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы для введения лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Указанные методы описаны в

Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобные полимеров, содержащих антитело, указанные матрицы имеют форму изделий определенной конфигурации, например, пленок или микрокапсул. Примерами матриц с замедленным высвобождением являются сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (US 3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразложимый этиленвинилацетат, разложимые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и леупролидацетата), и поли-D-(-)-3-гидроксимасляная кислота.
Препаративные формы, предназначенные для введения in vivo, должны быть стерильными. Для этой цели можно применять фильтрацию через стерильные фильтрующие мембраны.
Предпочтительно указанное антитело к CD20 типа I представляет собой ритуксимаб или указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1 и указанный ингибитор Bcl-2 представляет собой 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид или его соль или полиморф, а указанный ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту или ее соль или полиморф, и указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз.
Одним из вариантов осуществления изобретения является фармацевтическая композиция, содержащая комбинацию антитела к CD20 типа I или гуманизированного антитела B-Ly1, которое является афукозилированным с содержанием фукозы, составляющим 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, и 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино|-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид или его соль или полиморф, и 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту или ее соль или полиморф, предназначенная для лечения рака, где указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз.
Настоящее изобретение относится также в способу лечения рака, заключающемуся в том, что вводят пациенту, который нуждается в таком лечении, (I) в качестве первого агента в эффективном количестве антитело к CD20 типа I или афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело B-Ly1), и (II) в качестве второго агента в эффективном количестве ингибитор Bcl-2 и ингибитор MDM2.
В одном из вариантов осуществления изобретение фукоза присутствует в количестве от 40% до 60%.
Предпочтительно рак представляет собой рак, при котором происходит экспрессия CD20.
Предпочтительно рак, при котором происходит экспрессия CD20, представляет собой лимфому или лимфоцитарный лейкоз.
Предпочтительно антитело к CD20 типа I представляет собой ритуксимаб.
Предпочтительно указанное афукозилированное антитело к CD20 представляет собой антитело к CD20 типа II.
Предпочтительно указанное антитело представляет собой гуманизированное антитело B-Ly1, представленное в настоящем описании.
Предпочтительно указанное антитело представляет собой обинутузумаб.
Предпочтительно указанный ингибитор Bcl-2 представляет собой 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид или его соль или полиморф.
Предпочтительно указанный ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойиую кислоту или ее соль или полиморф.
Предпочтительно указанное антитело к CD20 типа I представляет собой ритуксимаб или указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1 и указанный ингибитор Bcl-2 представляет собой 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид или его соль или полиморф, и указанный ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кисло ту или ее соль или полиморф, и указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз.
В контексте настоящего описания понятие «пациент» предпочтительно относится к человеку, который нуждается в лечении с использованием антитела к CD20 типа I или афукозилированного антитела к CD20 (например, к пациенту, страдающему раком, при котором происходит экспрессия CD20), для любой цели, и наиболее предпочтительно к человеку, который нуждается в указанном лечении рака или предракового состояния или повреждения. Однако понятие «пациент» можно относить также к животным кроме человека, предпочтительно млекопитающим, среди прочего, к таким как собаки, кошки, лошади, коровы, свиньи, овцы и приматы кроме человека.
Настоящее изобретение относится также к антителу к CD20 типа I или афукозилированному антителу к CD20 с содержанием фукозы, составляющим 60% или менее, и ингибитору Bcl-2 и ингибитору MDM2, предназначенным для применения для лечения рака.
Предпочтительно указанное антитело к CD20 типа I представляет собой ритуксимаб.
Предпочтительно указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1.
Предпочтительно указанное афукозилированное гуманизированное антитело B-Ly1 представляет собой обинутузумаб.
Предпочтительно указанный ингибитор Bcl-2 представляет собой 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид или его соль или полиморф и указанный ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту или ее соль или полиморф.
Предпочтительно указанное антитело к CD20 типа I представляет собой ритуксимаб или указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1, более предпочтительно обинутузумаб, и указанный ингибитор Bcl-2 представляет собой 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид или его соль или полиморф, и указанный ингибитор MDM2 представляет собой 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту или ее соль или полиморф, и указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз.
Приведенные ниже примеры, перечень последовательностей и чертежи представлены с целью пояснения настоящего изобретения, истинный объем которого представлен в прилагаемой формуле изобретения. Очевидно, что в представленные процедуры можно вносить модификации без отклонения от сущности изобретения.
Перечень последовательностей:
SEQ ID NO: 1 - аминокислотная последовательность вариабельной области тяжелой цепи (VH) мышиного моноклонального антитела к CD20 B-Ly1.
SEQ ID NO: 2 - аминокислотная последовательность вариабельной области легкой цепи (VL) мышиного моноклонального антитела к CD20 B-Ly1.
SEQ ID NO: 3-19 - аминокислотные последовательности вариабельной области тяжелой цепи (VH) гуманизированных антител B-Ly1 (В-НН2 - В-НН9, B-HL8 и B-HL10 - B-HL17).
SEQ ID NO: 20 - аминокислотные последовательности вариабельной области легкой цепи (VL) гуманизированного антитела B-Ly1 B-KV1.
Экспериментальные процедуры
Пример 1:
Пример
Противоопухолевая эффективность in vivo
Проводили оценку противоопухолевой эффективности in vivo специфического в отношении CD20 антитела обинутузумаба в комбинации с ингибитором Bcl-2 GDC-0199 и ингибитором MDM2 RG7388 в отношении ксенотрансплантатов DOHH2 DLBCL (CD20 +, p53wt). В контексте настоящего описания название обинутузумаб является синонимом названиям RO5072759 и B-HH6-B-KV1 GE. В контексте настоящего описания указанный ингибитор Bcl-2 GDC-0199 представляет собой следующее химическое соединение: 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид или его соль или полиморфную форму. В контексте настоящего описания указанный ингибитор MDM2 RG7388 представляет собой следующее химическое соединение 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойную кислоту или ее соль или полиморфную форму.
Тестируемые агенты
Антитело к CD20 обинутузумаб получали в виде маточного раствора от фирмы Roche, Базель, Швейцария. Буфер для антитела включал гистидин. Маточный раствор антитела разводили соответствующим образом буфером перед осуществлением инъекций. Ингибитор MDM2(4) получали в виде SDP-формы от фирмы Roche, Базель, Швейцария и ресуспендировали перед применением. Ингибитор Bcl-2 GDC-0199 получали от фирмы GNE, SSF, США и приготавливали соответствующую форму перед применением.
Клеточная линия и условия культивирования
Исходную линию клеток человеческой В-клеточной НХЛ DOHH-2 (DLBCL) создавали на фирме NCI и получали от АТСС (Манассас, шт. Вирджиния, США). Размножение опухолевых клеток для трансплантации осуществляли с помощью системы TAP CompacT CellBase Cell Culture Roboter согласно протоколу. Опухолевые клетки культивировали стандартным образом в среде RPMI 1640, содержащей 10% FCS и 3 мМ L-глутамин, при 37°С в насыщенной водяными парами атмосфере, содержащей 5% СО2. Пересев культуры осуществляли путем 1-кратного расщепления тринсином/ЭДТА дважды в неделю, и для трансплантации использовали пассаж 2.
Животные
Самок мышей линии с тяжелым комбинированным иммунодефицитом с врожденным отсутствием естественных клеток-киллеров (SCID beige-мыши) возрастом 6-7 недель в момент поступления содержали в свободных от специфических патогенов условиях при суточных циклах 12 ч свет/12 ч темноты, согласно прилагаемым руководствам. Протокол экспериментального исследования был рассмотрен и утвержден местным органом управления. После доставки животных их выдерживали в виварии в течение 1 недели, давая пройти акклиматизацию к новым условиям окружающей среды, и для обследования. Постоянный мониторинг состояния здоровья проводили на регулярной основе. Животные имели свободный доступ к диетическому корму и автоклавированной воде.
Мониторинг
У животных ежедневно контролировали клинические симптомы и выявляли побочные действия. Для мониторинга на протяжении эксперимента регистрировали вес тела животных.
Обработка животных
Обработку животных начинали после рандомизации, когда медианный размер опухоли составлял примерно 200 мм3. Антитело к CD20 обинутузумаб вводили индивидуально или в комбинации в дозе 10 мг/кг ip один раз в неделю в дни 13, 21 и 27. Соответствующий наполнитель вводили в те же самые дни. Ингибитор MDM2(4) RG7388 вводили орально в дозе 30 мг/кг индивидуально и в комбинации в дни 13-17, 20-24 и 27-29. И, наконец, ингибитор Bcl-2 GDC-0199 вводили орально в дозе 100 мг/кг в дни 13-29 индивидуально и в комбинации.
Противоопухолевая эффективность
Клетки человеческой диффузной крупноклеточной В-клеточной лимфомы линии DOHH-2 (DLBCL) (CD20+, p53wt) инокулировали s.c. с матригелем самкам SCID beige-мышей. Несущих опухоли мышей произвольно разделяли па группы через 13 дней на подопытные группы и начинали обработку соединением. Несущих опухоли животных обрабатывали применяемым в качестве контроля наполнителем, ингибитором MDM2(4) RO5503781 (RG7388) в дозе 30 мг/кг, антителом к CD20 обинутузумабом в дозе 10 мг/кг или ингибитором Bcl-2 GDC-0199 (100 мг/кг) в качестве индивидуального агента. Кроме того, одна подопытная группа получали тройную комбинацию, включающую ингибитор MDM2 RG7388, антитело к CD20 обинутузумаб и ингибитор Bcl-2 GDC-0199. В результате установлено, что все соединения, применяемые в виде индивидуальных агентов, обладали выраженной противоопухолевой эффективностью в отношении ксенотрансилантатов DOHH-2. Так, обработка ингибитором MDM2(4) RO5503781 (RG7388) приводила к ингибированию роста опухолей ксенотранслантатов p53wt DOHH2 на 56% по сравнению с контролем. Сходная эффективность обнаружена после обработки ингибитором Bcl-2 GDC-0199 (60% TGI), в то время как наиболее высокая эффективность при применении в качестве индивидуального агента достигалась после обработки антителом к CD20 обинутузумабом, при применении которого практически достигался стаз опухолей (TGI 90%). Однако наиболее высокая эффективность обнаружена в группе, обработанной тройной комбинацией, включающей ингибитор MDM2 RG7388 плюс антитело к CD20 обинутузумаб плюс ингибитор Bcl-2 GDC-0199. Таким образом, подход, основанный на применении тройной комбинации, практически индуцировал быстрый регресс опухолей, составляющий в конце опыта 90% с полной ремиссией 30% опухолей. Уровень эффективности в варианте с тройной комбинацией синергетически превышал варианты с индивидуальным применением соответствующего агента.

Пример 2
Специфическое в отношении CD20 антитело обинутузумаб в комбинации с ингибитором Bcl-2 GDC-0199 и ингибитором MDM2 RG7388
В этом примере также применяли СО20-специфическое антитело обинутузумаб в комбинации с ингибитором Bcl-2 GDC-0199 и ингибитором MDM2 RG7388. В контексте настоящего описания в качестве синонима обинутузумаба применяют обозначения RO5072759 и B-HH6-B-KV1 GE. В контексте настоящего описания указанный ингибитор Bcl-2 GDC-0199 представляет собой следующее химическое соединение: 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид или его соль или полиморфную форму. В контексте настоящего описания указанный ингибитор MDM2 RG7388 представляет собой следующее химическое соединение 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]-амино}-3-метоксибензойную кислоту или ее соль или полиморфную форму.
Противоопухолевая активность комбинированного лечения антителом к CD20 типа II RO5072759 (B-HH6-B-KV1 GE), Bcl-2-специфичсским ингибитором GDC-0199 (Abt-199, RG7601) и антагонистом MDM2 RG7388 (RO5503781).
Тестируемые агенты
Антитело к CD20 типа II B-HH6-B-KV1 GE (т.е. гуманизированное B-Ly1, созданное с помощью гликоинженерии B-HH6-B-KV1, см. WO 2005/044859 и WO 2007/031875) получали в виде маточного раствора (с=9,4 мг/мл) от фирмы GlycArt, Шлирен, Швейцария в буфере, содержащем гистидин, трегалозу и полисорбат 20. Антитело разводили в ЗФР перед применением in vivo.
Ингибитор Bcl-2 GDC-0199 получали от фирмы Genentech Inc., шт. Калифорния, США.
Антагонист MDM2(4) RG7388 (RO5503781) получали от отделения Small Molecule Process Research and Development фирмы Hoffmann-La Roche, Базель, Швейцария.
Клеточные линии и условия культивирования
Человеческую клеточную линию лимфомы из клеток зоны мантии Z138 культивировали в среде DMEM, дополненной 10% фетальной бычьей сыворотки (фирма РАА Laboratories, Австрия) и 2 мМ L-глутамином, при 37°С в насыщенной водяным паром атмосфере с 5% СО2. Для экспериментов по ксенотранслантации in vivo клетки инъецировали совместно с матригелем.
Самок мышей линии SCID beige, возраст которых в момент доставки составлял 4-5 недель (покупали у фирмы Charles River, Сульцфельд, Германия), содержали в карантинном отсеке вивария в течения 1 недели и затем в среде, в которой отсутствовали специфические патогены, с суточным циклом 12 ч света/12 ч темноты, согласно прилагаемым руководствам (GV-Solas; Fclasa; TierschG). Протокол экспериментального исследования был проверен и утвержден на фирме и местным регулирующим органом (Regierung von Oberbayern; регистрация №55.2-1-54-2531.2-26-09). Животные имели свободный доступ к диетическому корму (KLIBA NAFAG 3807) и воде (фильтрованной)
Мониторинг
Осуществляли ежедневный мониторинг животных в отношении клинических симптомов и выявления побочных действий. Во время эксперимента вес тела животных определяли два раза в неделю и измеряли размер опухолей с помощью кронциркуля.
Обработка животных
Обработку животных начинали в день произвольного разделения на группы, т.е. через 18 дней после инокуляции опухолевых клеток. Гуманизированное антитело к CD20 типа II RO5072759 B-НН6-B-KV1 GF (обинутузумаб) вводили в качестве индивидуального агента i.p. q7d один раз в неделю (день 18, 25, 32) в течение 3 недель в дозе 0,5 мг/кг. Ингибитор Bcl-2 GDC-0199 давали р.о. один раз в день (со дня 18 по день 36) в течение 19 дней в дозе 100 мг/кг. Антагонист MDM2 RG7388 (RO5503781) давали р.о. один раз в день в течение 5 дней в дозе 100 мг/кг (в пересчете на действующее вещество) со дня 18 по день 22 и вводили в течение 12 дней в дозе 80 мг/кг (в пересчете на действующее вещество) со дня 25 по день 36. Не осуществляли обработку в день 23 и 24. Группам, которые обрабатывали комбинацией, вводили RO5072759 В-НН6-B-KV1 GE, MDM2(4) и GDC-0199 в таких же дозах и в те же дни. В эти же дни осуществляли обработку соответствующим наполнителем.
Ингибирование роста опухолей (TGI) в день 32
Монотерапия с использованием RO5072759, GDC-0199 или RG7388 (RO5503781) приводила к ингибированию роста опухолей на 47%, 53% или 67% соответственно. Комбинация RO5072759 с GDC-0199 или RG7388 (RO5503781) обеспечивала ингибирование роста опухолей на 85% или 86% соответственно. Комбинация RG7388 (RO5503781) с GDC-0199 и тройная комбинация обеспечивала регресс опухолей (TGI>100%) в день 32 после инокуляции опухолевых клеток.
Для изучения длительности воздействий различных обработок осуществляли анализ времени до наступления события вплоть до дня 125 после инокуляции опухолей. Тройная комбинация обеспечивала полную ремиссию опухолей у всех животных вплоть до дня 125 (окончание опыта). Комбинация RG7388 (RO5503781) и RO5072759 приводила к элиминации опухолей у 5 животных (5 из 10). Монотерапия с использованием RO5072759 в субоптимальной дозе 0,5 мг/кг приводила к элиминации опухолей у 2 животных в конце опыта.
Параметр «медианное время до наступления события» для каждой группы представлен в таблице 3.


* Медианное время до наступления события представляет собой время (количество дней), в течение которого у половины животных имело место событие
Как указано в настоящем описании, а также в прилагаемом перечне последовательностей, следующие последовательности являются частью настоящего изобретения:
Последовательности
SEQ ID NO: 1
Аминокислотная последовательность вариабельной области тяжелой цепи (VII) мышиного моноклонального антитела к CD20 B-Ly1

SEQ ID NO: 2
Аминокислотная последовательность вариабельной области легкой цепи (VL) мышиного моноклонального антитела к CD20 B-Ly1

SEQ ID NO: 3
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН2)


SEQ ID NO: 4
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HH3)

SEQ ID NO: 5
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН4)


SEQ ID NO: 6
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН5)

SEQ ID NO: 7
Аминокислотная последовательность вариабельной области тяжелой цепи (VII) гуманизированного антитела B-Ly1 (B-HH6)

SEQ ID NO: 8
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HH7)


SEQ ID NO: 9
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HH8)

SEQ ID NO: 10
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (В-НН9)


SEQ ID NO: 11
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL8)

SEQ ID NO: 12
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL10)

SEQ ID NO: 13
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL11)


SEQ ID NO: 14
Аминокислотная последовательность вариабельной области тяжелой цени (VH) гуманизированного антитела B-Ly1 (B-HL12)

SEQ ID NO: 15
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL13)


SEQ ID NO: 16
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL14)

SEQ ID NO: 17
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL15)

SEQ ID NO: 18
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL16)


SEQ ID NO: 19
Аминокислотная последовательность вариабельной области тяжелой цепи (VH) гуманизированного антитела B-Ly1 (B-HL17)

SEQ ID NO: 20
Аминокислотная последовательность вариабельной области легкой цепи (VL) гуманизированного антитела B-Ly1 B-KV1
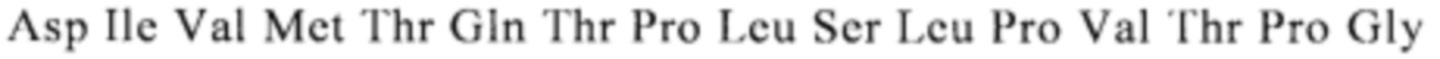

Реферат
Изобретение относится к комбинированной терапии для лечения рака. Раскрыто применение фармацевтической комбинации гуманизированного антитела B-Ly1, которое является афукозилированным и в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, и 4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-l-ил)-N-({3-нитро-4-[(тетрагидро-2H-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-пирроло[2,3-b]пиридин-5-илокси)бензамид, и 4-1[{(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циан-5-(2,2-диметилпропил)пирролидин-2-карбонил]амино}-3-метоксибензойной кислоты или их соли для лечения рака. Изобретение обеспечивает повышенное антипролиферативное действие. 4 з.п. ф-лы, 3 ил., 4 табл., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Сочетанная терапия афукозилированным антителом к cd20 и ингибитором mdm2

Комментарии