Производные гетероарилалкилпиперазина и фармацевтическая композиция на их основе - RU2243970C1
Код документа: RU2243970C1
Описание
Описание
Предпосылки изобретения
1. Область техники
Настоящее изобретение относится к производным пиперазина, дозированным лекарственным формам, содержащим одно или несколько указанных производных, и способам лечения млекопитающих, в частности человека, включающим защиту скелетных мышц от повреждений вследствие травмы, защиту скелетных мышц от последствий мышечных или системных заболеваний, таких как перемежающаяся хромота, лечение шоковых состояний, предохранение донорских тканей и органов, используемых в качестве трансплантатов, и лечение сердечно-сосудистых заболеваний, включая предсердную и желудочковую экстрасистолию, стенокардию Принцметала (изменчивую), постоянную стенокардию и стенокардию физической нагрузки, застойную сердечную недостаточность и инфаркт миокарда.
2. Уровень техники
В патенте США №4567264, который включен в данное описание изобретения в качестве ссылки, описан класс соединений замещенного пиперазина, который включает соединение, известное как ранолазин, (±)-N-(2, 6-диметилфенил)-4-[2-гидрокси-3-(2-метоксифенокси)пропил]-1-пиперазинацетамид, и его фармацевтически приемлемые соли, а также применение указанных веществ для лечения сердечно-сосудистых заболеваний, включая аритмию, изменчивую стенокардию, стенокардию физической нагрузки и инфаркт миокарда.
В патенте США №5506229, который включен в данное описание изобретения в качестве ссылки, описано применение ранолазина, его фармацевтически приемлемых солей и сложных эфиров для лечения тканей, подвергшихся физическому или химическому поражению, включая кардиоплегию, гипоксию или реперфузию сердечных или скелетных мышц или тканей головного мозга, и для использования в трансплантатах. В частности, ранолазин особенно полезен для лечения аритмии, изменчивой стенокардии, стенокардии физической нагрузки и инфаркта миокарда благодаря частичному ингибированию окисления жирных кислот в тканях сердца. В указанном патенте рассмотрены препараты ранолазина для перорального и парентерального введения, включая препараты пролонгированного действия. Например, в примере 7D патента США №5506229 описан препарат пролонгированного действия в капсулах, содержащих микросферы ранолазина и микрокристаллической целлюлозы, покрытые полимерами, регулирующими высвобождение активного вещества.
Несмотря на важное открытие того, что ранолазин является очень полезным средством для лечения заболеваний сердца, по-прежнему существует потребность в соединениях, являющихся частичными ингибиторами окисления жирных кислот, которые характеризуются более продолжительным периодом полувыведения по сравнению с ранолазином и обладают по крайней мере такой же активностью, что и ранолазин.
Краткое изложение существа изобретения
Настоящее изобретение относится к новым производным гетероарилалкилпиперазина, которые являются частичными ингибиторами окисления жирных кислот с длительным периодом полувыведения.
Данное изобретение относится также к новым соединениям замещенного пиперазина, которые можно вводить млекопитающему для защиты скелетных мышц от повреждений вследствие травмы, для защиты скелетных мышц от последствий мышечных или системных заболеваний, таких как перемежающаяся хромота, для лечения шоковых состояний, для предохранения донорских тканей и органов, используемых в качестве трансплантатов, и для лечения сердечно-сосудистых заболеваний, включая предсердную и желудочковую экстрасистолию, стенокардию Принцметала (изменчивую), постоянную стенокардию и стенокардию физической нагрузки, застойную сердечную недостаточность и инфаркт миокарда.
Данное изобретение относится к классу соединений замещенного пиперазина формулы

где m равно 1, 2 или 3;
q означает NH, O или S;
R1, R2, R3, R4 и R5 независимо выбирают из группы, включающей водород, галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22, SO2R22, SO2N(R20)2, NR20CO2R22, NR20CON(R20)2, COR20, CO2R20, CON(R20)2, NR20SO2R22, C1-15 алкил, С2-15 алкенил, С2-15 алкинил, гетероциклил, арил и гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22 и SO2R22, либо R1 и R2, или R2 и R3, или R3 и R4, или R4 и R5 вместе с атомами углерода, к которым они присоединены, могут образовывать 6-членное ароматическое кольцо, которое необязательно замещено алкилом, трифторалкилом, алкокси или галогеном;
R6, R7 и R8 независимо выбирают из группы, включающей водород или С1-3 алкил;
R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбирают из группы, включающей водород, СO2R20, CON(R20)2, C1-4 алкил или арил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, CF3, CN, OR20, N(R20)2, CO2R20, CON(R20)2 или арил, либо R9 и R10 могут вместе взятые образовывать карбонил, R11 и R12 могут вместе взятые образовывать карбонил, R13 и R14 могут вместе взятые образовывать карбонил или R15 и R16 могут вместе взятые образовывать карбонил, R11 и R13, или R9 и R15, или R9 и R11, или R11 и R15, или R9 и R13 могут вместе взятые образовывать кольцо, имеющее от 1 до 3 атомов углерода;
R17 означает гетероарил, необязательно замещенный 1-3 заместителями, выбираемыми из группы, включающей водород, галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22, SO2R22, SO2 N(R20)2, NR20CO2R22, NR20CON(R20)2, COR20, CO2R20, CON(R20)2, NR20SO2R22, C1-15 алкил, С2-15 алкенил, С2-15 алкинил, гетероциклил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22 или SO2R22;
R20 выбирают из группы, включающей Н, С1-15 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, алкил, моно- или диалкиламино, алкил-CN, -О-С1-6 алкил или CF3; и
R22 выбирают из группы, включающей С1-15 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, алкил, моноалкиламино, диалкиламино, алкиламид, ариламид, гетероариламид, CN, О-С1-6 алкил, CF3 или гетероарил.
Другой вариант осуществления настоящего изобретения относится к соединению замещенного пиперизина, выбираемому из группы, включающей
N-(2, 6-диметилфенил)-2-(4-{2-гидрокси-3-[2-(3-трифторметилфенил)-бензоксазол-5-илокси]пропил}пиперазин-1-ил)ацетамид,
2-{4-[3-(бензотиазол-2-илокси)-2-гидроксипропил]пиперазин-1-ил}-N-(2, 6-диметилфенил)-ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазин-1-ил}ацетамид, амид
4-(3-{4-[(2, 6-диметилфенилкарбамоил)метил]пиперазин-1-ил}-2-гидроксипропокси)-1Н-индол-2-карбоновой кислоты,
2-{4-[3-(бензотиазол-6-илокси)-2-гидроксипропил]пиперазин-1-ил}-N-(2, 6-диметилфенил)ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-6-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3,5-диметилпиперазин-1-ил}ацетамид, 2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазин-1-ил}-N-(4-гидроксифенил)ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензоксазол-5-илокси)пропил)пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензотиазол-7-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метил-бензотиазол-5-илокси)пропил]-2-оксопиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензоксазол-5-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-(4-{2-гидрокси-3-[2-(4-трифторметилфенил)бензоксазол-5-илокси]пропил}пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-(гидрокси-3-(хиноксалин-2-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(пиридин-3-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(хинолин-4-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(изохинолин-5-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(хинолин-6-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилхинолин-7-ил-окси)пропил]пиперазин-1-ил}ацетамид,
2-{4-[3-(бензотиазол-2-иламино)-2-гидроксипропил]пиперазинил}-N-(2, 6-диметилфенил)ацетамид,
2-{4-[3-(бензоксазол-2-иламино)-2-гидроксипропил]пиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2,5-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2R)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3,3-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{(2R)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2R)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил](1,4-диазапергидроэпинил)}-N-(2,6-диметилфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(4-гидроксифенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(4-карбоксамидофенил)ацетамид,
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2R)-2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2, 6-диметил-4-гидроксифенил)ацетамид,
2-{5-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2,5-диазабицикло[2.2.1]гепт-2-ил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(4-сульфамоилфенил)ацетамид,
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-фенил-бензоксазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-нафтилацетамид,
N-[4-хлор-3-(трифторметил)фенил]-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-фенилацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,4,5-трихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(4-метоксифенил)-пропил]пиперазинил}-N-(3,4,5-трихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2-хлор-4-метилфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,4, 5-трихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,5-дихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,4-дихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-[3-метокси-5-(трифторметил)фенил]ацетамид,
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-[3, 5-дихлорфенил]-ацетамид и
2-{4-[2-гидрокси-3-(2-((1Е)бута-1,3-диенил)-бензотиазол-5-илокси)пропил]пиперазинил}-N-[4-хлор-2-метокси-5-метилфенил]ацетамид.
Еще один вариант осуществления настоящего изобретения относится к способу введения млекопитающему одной или нескольких композиций по данному изобретению для защиты скелетных мышц от повреждений вследствие травмы, для защиты скелетных мышц от последствий мышечных или системных заболеваний, таких как перемежающаяся хромота, для лечения шоковых состояний, для предохранения донорских тканей и органов, используемых в качестве трансплантатов, и для лечения сердечно-сосудистых заболеваний, включая предсердную и желудочковую экстрасистолию, стенокардию Принцметала (изменчивую), постоянную стенокардию и стенокардию физической нагрузки, застойную сердечную недостаточность или инфаркт миокарда.
Подробное описание изобретения
Класс соединений замещенного пиперазина формулы

где m равно 1, 2 или 3;
q означает NH, O или S;
R1, R2, R3, R4 и R5 независимо выбирают из группы, включающей водород, галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22, SO2R22, SO2N(R20)2, NR20CO2R22, NR20CON(R20)2, COR20, CO2R20, CON(R20)2, NR20SO2R22, C1-15 алкил, С2-15 алкенил, С2-15 алкинил, гетероциклил, арил и гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22 и SO2R22, либо R2 и R3, или R3 и R4, или R4 и R5 вместе с атомами углерода, к которым они присоединены, могут образовывать 6-членное ароматическое кольцо, которое необязательно замещено алкилом, трифторалкилом, алкокси или галогеном;
R6, R7 и R8 независимо выбирают из группы, включающей водород или С1-3 алкил;
R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбирают из группы, включающей водород, СO2R20, CON(R20)2, C1-4 алкил или арил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, CF3, CN, OR20, N(R20)2, CO2R20, CON(R20)2 или арил, либо R9 и R10 могут вместе взятые образовывать карбонил, R11 и R12 могут вместе взятые образовывать карбонил, R13 и R14 могут вместе взятые образовывать карбонил или R15 и R16 могут вместе взятые образовывать карбонил, R11 и R13, или R9 и R15, или R9 и R11, или R11 и R15, или R9 и R13 могут вместе взятые образовывать кольцо, имеющее от 1 до 3 атомов углерода;
R17 означает гетероарил, необязательно замещенный 1-3 заместителями, выбираемыми из группы, включающей водород, галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22, SO2R22, SO2 N(R20)2, NR20CO2R22, NR20CON(R20)2, COR20, CO2R20, CON(R20)2, NR20SO2R22, C1-15 алкил, С2-15 алкенил, С2-15 алкинил, гетероциклил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22 или SO2R22;
R20 выбирают из группы, включающей Н, С1-15 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, алкил, моно- или диалкиламино, алкил-CN, -О-С1-6 алкил или CF3; и
R22 выбирают из группы, включающей С1-15 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, алкил, моноалкиламино, диалкиламино, алкиламид, ариламид, гетероариламид, CN, О-С1-6 алкил, CF3 или гетероарил.
В предпочтительном варианте осуществления изобретения q означает NH или О.
В предпочтительном варианте осуществления изобретения R1, R2, R3, R4 и R5 независимо выбирают из группы, включающей водород, галоген, CF3, CN, OR20, SR20, N(R20)2, SO2N(R20)2, CO2R20, CON(R20)2, C1-8 алкил, С2-8 алкенил, С2-8 алкинил, гетероциклил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22 или SO2R22. В другом предпочтительном варианте осуществления изобретения R1, R2, R3, R4 и R5 независимо выбирают из группы, включающей водород, галоген, CF3, OR20, C1-5 алкил, С2-5 алкенил или С2-5 алкинил, где алкильный заместитель необязательно замещен CF3. В другом предпочтительном варианте осуществления изобретения R1, R2, R3, R4 и R5 независимо выбирают из группы, включающей водород, галоген, CF3 , OR20 или С1-3 алкил, где алкильный заместитель необязательно замещен CF3. Более предпочтительно R1, R2, R3, R4 и R5 независимо выбирают из группы, включающей водород, CF3, OR20 или С1-2 алкил, причем более предпочтительными являются водород, OR20 или метил и наиболее предпочтительными являются водород или метил.
В альтернативном предпочтительном варианте осуществления изобретения любые элементы R1 и R2, или R2 и R3, или R3 и R4, или R4 и R5 вместе с атомами углерода, к которым они присоединены, могут образовывать 6-членное ароматическое кольцо, которое необязательно замещено алкилом, трифторалкилом, алкокси или галогеном и в котором остальные заместители имеют значения, указанные в приведенном выше абзаце. В данном варианте осуществления изобретения наиболее предпочтительно, если R2 и R3 вместе с атомами углерода, к которым они присоединены, образуют 6-членное ароматическое кольцо.
В предпочтительном варианте осуществления изобретения R6, R7 и R8 независимо выбирают из группы, включающей водород или С1-3 алкил и наиболее предпочтительно водород или метил.
В предпочтительном варианте осуществления изобретения R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбирают из группы, включающей водород, CON(R20)2, С1-4 алкил, либо R9 и R10 могут вместе взятые образовывать карбонил, R11 и R12 могут вместе взятые образовывать карбонил, R13 и R14 могут вместе взятые образовывать карбонил или R15 и R16 могут вместе взятые образовывать карбонил. В другом варианте осуществления изобретения R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбирают из группы, включающей водород или С1-2 алкил, либо R9 и R10 могут вместе взятые образовывать карбонил, R11 и R12 могут вместе взятые образовывать карбонил, R13 и R14 могут вместе взятые образовывать карбонил или R15 и R16 могут вместе взятые образовывать карбонил. В более предпочтительном варианте осуществления изобретения R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбирают из группы, включающей водород или метил, либо R9 и R10 могут вместе взятые образовывать карбонил, R11 и R12 могут вместе взятые образовывать карбонил, R13 и R14 могут вместе взятые образовывать карбонил или R15 и R16 могут вместе взятые образовывать карбонил. В другом варианте осуществления изобретения R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбирают из группы, включающей водород или C1-2 алкил, где алкильный заместитель необязательно замещен 1 заместителем, выбираемым из группы, включающей N(R20)2 или арил, либо R9 и R10 могут вместе взятые образовывать карбонил. В другом предпочтительном варианте осуществления изобретения R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбирают из группы, включающей водород или С1-2 алкил, либо R9 и R10 могут вместе взятые образовывать карбонил. В другом предпочтительном варианте осуществления изобретения R11 и R15 выбирают из группы, включающей водород или метил, R9, R10, R12, R13, R14 и R16 означают водород и R9 и R10 могут вместе взятые образовывать карбонил. В другом предпочтительном варианте осуществления изобретения все элементы R9, R10, R11, R12, R13, R14, R15 и R16 означают водород.
В одном предпочтительном варианте осуществления изобретения R17 означает гетероарил, необязательно замещенный 1-2 заместителями, выбираемыми из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, C1-3 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, независимо выбираемым из группы, включающей галоген, CF3, OR20 или N(R20)2. В другом варианте осуществления изобретения R17 означает гетероарил, представляющий конденсированную 6, 5-членную кольцевую систему, имеющую от 1 до 5 гетероатомов, выбираемых из группы, включающей N, O или S, которая необязательно замещена 1-3 заместителями, выбираемыми из группы, включающей водород, галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22, SO2R22, SO2N(R20)2, NR20CO2R22, NR20CON(R20)2, COR20, CO2R20, CON(R20)2, NR20 SO2R22, C1-15 алкил, С2-15 алкенил, С2-15 алкинил, гетероциклил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, независимо выбираемым из группы, включающей галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22 или SO2R22. В данном варианте осуществления изобретения R17 предпочтительно означает гетероарил, представляющий конденсированную 6,5-членную кольцевую систему, имеющую от 1 до 3 гетероатомов, выбираемых из группы, включающей N, O или S, которая необязательно замещена 1-2 заместителями, выбираемыми из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, C1-8 алкил, С2-8 алкенил, С2-8 алкинил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, независимо выбираемым из группы, включающей галоген, CF3, OR20 или N(R20)2. Более предпочтительно R17 означает гетероарил, представляющий конденсированную 6,5-членную кольцевую систему, имеющую от 1 до 2 гетероатомов, выбираемых из группы, включающей N, O или S, которая необязательно замещена 1-2 заместителями, выбираемыми из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, C1-3 алкил, арил или гетероарил, где алкильные и арильные заместители необяательно замещены 1 заместителем, выбираемым из группы, включающей галоген, CF3 или OR20. Еще предпочтительнее в данном варианте осуществления изобретения R17 означает гетероарил, представляющий конденсированную 6,5-членную кольцевую систему, выбираемую из группы, включающей индол, бензотиазол и бензоксазол, которая необязательно замещена 1-2 заместителями, выбираемыми из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, С1-3 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, CF3 или OR20. В данном предпочтительном варианте осуществления изобретения R17 предпочтительно означает бензотиазол, необязательно замещенный 1 заместителем, выбираемым из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, C1-3 алкил или арил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген или CF3. Более предпочтительно R17 означает бензотиазол, необязательно замещенный в положении 2 одним заместителем, выбираемым из группы, включающей водород, метил или фенил. В альтернативном предпочтительном варианте осуществления изобретения R17 означает 5-замещенный бензотиазол, который необязательно замещен 1 заместителем, выбираемым из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, C1-3 алкил или арил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген или CF3. 5-Замещенный бензотиазол предпочтительно замещен в положении 2 одним заместителем, выбираемым из группы, включающей водород, метил или фенил.
В другом предпочтительном варианте осуществления изобретения R17 означает гетероарил, представляющий конденсированную 6,6-членную кольцевую систему, имеющую от 1 до 4 атомов азота, которая необязательно замещена 1-3 заместителями, выбираемыми из группы, включающей водород, галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22, SO2R22, SO2N(R20)2, NR20CO2R22, NR20CON(R20)2, COR20, CO2R20, CON(R20)2, NR20 SO2R22, C1-15 алкил, С2-15 алкенил, С2-15 алкинил, гетероциклил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, независимо выбираемым из группы, включающей галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22 или SO2R22. Более предпочтительно R17 означает гетероарил, представляющий конденсированную 6,6-членную кольцевую систему, имеющую от 1 до 3 атомов азота, которая необязательно замещена 1-2 заместителями, выбираемыми из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, С1-8 алкил, С2-8 алкенил, С2-8 алкинил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, независимо выбираемым из группы, включающей галоген, CF3, OR20 или N(R20)2. Наиболее предпочтительно R17 означает гетероарил, представляющий конденсированную 6,6-членную кольцевую систему, имеющую от 1 до 2 атомов азота, которая необязательно замещена метилом.
В другом предпочтительном варианте осуществления изобретения R17 означает 5- или 6-членное кольцо, имеющее от 1 до 3 гетероатомов, выбираемых из группы, включающей N, S или О, которое необязательно замещено 1-3 заместителями, выбираемыми из группы, включающей водород, галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22, SO2R22, SO2N(R20)2, NR20CO2R22, NR20CON(R20)2, COR20, CO2R20, CON(R20)2, NR20SO2R22, C1-15 алкил, С2-15 алкенил, С2-15 алкинил, гетероциклил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, необязательно выбираемым из группы, включающей галоген, NO2, CF3, CN, OR20, SR20, N(R20)2, S(O)R22 или SO2R22. Более предпочтительно R17 означает 5- или 6-членное кольцо, имеющее от 1 до 3 гетероатомов, выбираемых из N, S или О, которое необязательно замещено 1-2 заместителями, выбираемыми из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, C1-8 алкил, С2-8 алкенил, С2-8 алкинил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, независимо выбираемым из группы, включающей галоген, CF3, OR20 или N(R20)2. Более предпочтительно R17 означает 6-членное кольцо, имеющее от 1 до 2 атомов азота, которое необязательно замещено 1-2 заместителями, выбираемыми из группы, включающей водород, галоген, CF3, OR20, N(R20)2, CON(R20)2, C1-8 алкил, С2-8алкенил, С2-8 алкинил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, независимо выбираемым из группы, включающей галоген, CF3, ОR20 или N(R20)2. Наиболее предпочтительно в данном варианте осуществления изобретения R17 означает 6-членное кольцо, имеющее от 1 до 2 атомов азота, которое необязательно замещено метилом.
В другом предпочтительном варианте осуществления изобретения R17 означает гетероарил, представляющий конденсированную 6,5-членную кольцевую систему, выбираемую из группы, включающей бензотиазол и бензоксазол, которая необязательно замещена 1 заместителем, выбираемым из группы, включающей водород, CF2, OR20, С1-3 алкил или арил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген или CF3, и предпочтительно необязательно замещены метилом.
В предпочтительном варианте осуществления изобретения R20 выбирают из группы, включающей Н, С1-15 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, алкил, моноалкиламино, диалкиламино, алкилциано, -О-С1-6 алкил или CF3. R20 выбирают из группы, включающей Н, С1-5 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, -ОМе или CF3. В более предпочтительном варианте осуществления изобретения R20 выбирают из группы, включающей Н, С1-3 алкил или арил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, -ОМе и CF3. Наиболее предпочтительно R20 выбирают из группы, включающей Н или С1-3 алкил и особенно предпочтительно Н или метил.
В предпочтительном варианте осуществления изобретения R22 выбирают из группы, включающей С1-15 алкил, арил или гетероарил, где алкильные и арильные заместители необязательно замещены 1 заместителем, выбираемым из группы, включающей галоген, алкил, моноалкиламино, диалкиламино, алкиламид, ариламид, гетероариламид, CN, O-C1-6 алкил, CF3 или гетероарил.
Наиболее предпочтительный вариант осуществления данного изобретения относится к соединению замещенного пиперазина, выбираемому из группы, включающей
N-(2,6-диметилфенил)-2-(4-{2-гидрокси-3-[2-(3-трифторметилфенил)бензоксазол-5-илокси]пропил}пиперазин-1-ил)ацетамид,
2-{4-[3-(бензотиазол-2-илокси)-2-гидроксипропил]пиперазин-1-ил}-N-(2,6-диметилфенил)ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазин-1-ил}ацетамид,
амид 4-(3-{4-[(2, 6-диметилфенилкарбамоил)метил]пиперазин-1-ил}-2-гидроксипропокси)-1Н-индол-2-карбоновой кислоты,
2-{4-[3-(бензотиазол-6-илокси)-2-гидроксипропил]пиперазин-1-ил}-N-(2, 6-диметилфенил)ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-6-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3,5-диметилпиперазин-1-ил}ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазин-1-ил}-N-(4-гидроксифенил)ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензоксазол-5-илокси)пропил)пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензотиазол-7-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2-оксопиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензоксазол-5-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-(4-{2-гидрокси-3-[2-(4-трифторметилфенил)бензоксазол-5-илокси]пропил}пиперазин-1-ил)ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-(гидрокси-3-(хиноксалин-2-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(пиридин-3-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(хинолин-4-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2, 6-диметилфенил)-2-{4-[2-гидрокси-3-(изохинолин-5-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(хинолин-6-илокси)пропил]пиперазин-1-ил}ацетамид,
N-(2,6-диметилфенил)-2-{4-[2-гидрокси-3-(2-метилхинолин-7-илокси)пропил]пиперазин-1-ил}ацетамид,
2-{4-[3-(бензотиазол-2-иламино)-2-гидроксипропил]пиперазинил}-N-(2, 6-диметилфенил)ацетамид,
2-{4-[3-(бензоксазол-2-иламино)-2-гидроксипропил]пиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2,5-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2R)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3,3-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{(2R)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2R)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил](1,4-диазапергидроэпинил)}-N-(2,6-диметилфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(4-гидроксифенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(4-карбоксамидофенил)ацетамид,
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2R)-2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2,6-диметил-4-гидроксифенил)ацетамид,
2-{5-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 5-диазабицикло-[2.2.1]гепт-2-ил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(4-сульфамоилфенил)ацетамид,
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-фенилбензоксазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-нафтилацетамид,
N-[4-хлор-3-(трифторметил)фенил]-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-фенилацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,4,5-трихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(4-метоксифенил)пропил]пиперазинил}-N-(3,4,5-трихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2-хлор-4-метилфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-пиперазинил}-N-(3,4, 5-трихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,5-дихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,4-дихлорфенил)ацетамид,
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-[3-метокси-5-(трифторметил)фенил]ацетамид,
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-[3,5-дихлорфенил]ацетамид и
2-{4-[2-гидрокси-3-(2-((1Е)бута-1, 3-диенил)бензотиазол-5-илокси)пропил]пиперазинил}-N-[4-хлор-2-метокси-5-метилфенил]ацетамид.
Ниже приведены определения терминов, используемых в данном описании изобретения.
“Галоген”, используемый отдельно или в сочетании, означает все галогены, то есть хлор (Cl), фтор (F), бром (Br), иод (I).
“Гидроксил” означает группу -ОН.
“Тиол” или “меркапто” означает группу -SH.
“Алкил”, используемый отдельно или в сочетании, означает полученный из алкана радикал, имеющий 1-20, предпочтительно 1-15 атомов углерода (за исключением особо оговоренных случаев). Указанный термин представляет алкил с прямой цепью, алкил с разветвленной цепью или циклоалкил. Алкильными группами с прямой или разветвленной цепью, предпочтительно имеющими 1-15 атомов углерода, более предпочтительно 1-8 атомов углерода, еще предпочтительнее 1-6 атомов углерода, особенно предпочтительно 1-4 атома углерода и наиболее предпочтительно 1-2 атома углерода, являются такие группы, как метил, этил, пропил, изопропил, бутил, трет-бутил и тому подобные. Термин “низший алкил” использован для описания вышеуказанных алкильных групп с прямой цепью. Циклоалкильные группы предпочтительно представляют моноциклические, бициклические или трициклические кольцевые системы, имеющие 3-8, более предпочтительно 3-6 членов в одном кольце, такие как циклопропил, циклобутил, циклопентил, циклогексил, адамантил и тому подобные. Алкил также представляет алкильную группу с прямой или разветвленной цепью, которая содержит циклоалкильную часть или разобщена указанной частью. Алкильная группа с прямой или разветвленной цепью может быть присоединена на любом активном участке с образованием устойчивого соединения. Примеры подобных групп включают, не ограничиваясь ими, 4-(изопропил)циклогексилэтил или 2-метилциклопропилпентил. Замещенный алкил представляет вышеуказанную алкильную группу с прямой цепью, алкильную группу с разветвленной цепью или циклоалкильную группу, которая независимо замещена 1-3 группами или заместителями, включающими галоген, гидрокси, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, ацилокси, арилокси, гетероарилокси, аминогруппу, необязательно моно- или дизамещенную алкильными, арильными или гетероарильными группами, амидино, мочевину, необязательно замещенную алкильными, арильными, гетероарильными или гетероциклильными группами, аминосульфонил, необязательно N-моно- или N,N-дизамещенный алкильными, арильными или гетероарильными группами, алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино или тому подобные.
“Алкенил”, используемый отдельно или в сочетании, означает углеводородную группу с прямой или разветвленной цепью либо циклическую углеводородную группу, имеющую 2-20 атомов углерода, предпочтительно 2-17 атомов углерода, более предпочтительно 2-10 атомов углерода, еще предпочтительнее 2-8 атомов углерода, наиболее предпочтительно 2-4 атома углерода, имеющих по крайней мере одну, предпочтительно 1-3, более предпочтительно 1-2 и наиболее предпочтительно одну углерод-углеродную двойную связь. В случае циклоалкильной группы сопряжение нескольких углерод-углеродных двойных связей не делает кольцо ароматическим. Углерод-углеродные двойные связи могут находиться в циклоалкильной части за исключением циклопропила или в части с прямой или разветвленной цепью. Примеры алкенильных групп включают этенил, пропенил, изопропенил, бутенил, циклогексенил, циклогексенилалкил и тому подобные. Замещенный алкенил представляет вышеуказанную алкенильную группу с прямой цепью, алкенильную группу с разветвленной цепью или циклоалкенильную группу, независимо замещенную 1-3 группами или заместителями, включающими галоген, гидрокси, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, ацилокси, арилокси, гетероарилокси, аминогруппу, необязательно моно- или дизамещенную алкильными, арильными или гетероарильными группами, амидино, мочевину, необязательно замещенную алкильными, арильными, гетероарильными или гетероциклильными группами, аминосульфонил, необязательно N-моно- или N,N-дизамещенный алкильными, арильными или гетероарильными группами, алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино, карбокси, алкоксикарбонил, арилоксикарбонил, гетероарилоксикарбонил или тому подобные, присоединенные на любом активном участке с образованием устойчивого соединения.
“Алкинил”, используемый отдельно и в сочетании, означает углеводородную группу с прямой или разветвленной цепью, содержащую 2-20 атомов углерода, предпочтительно 2-17 атомов углерода, более предпочтительно 2-10 атомов углерода, еще предпочтительнее 2-8 атомов углерода, наиболее предпочтительно 2-4 атома углерода, имеющих по крайней мере одну, предпочтительно одну углерод-углеродную тройную связь. Примеры алкинильных групп включают этинил, пропинил, бутинил и тому подобные. Замещенный алкинил представляет вышеуказанный алкинил с прямой цепью или алкинил с разветвленной цепью, независимо замещенный 1-3 группами или заместителями, включающими галоген, гидрокси, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, ацилокси, арилокси, гетероарилокси, аминогруппу, необязательно моно- или дизамещенную алкильными, арильными или гетероарильными группами, амидино, мочевину, необязательно замещенную алкильными, арильными, гетероарильными или гетероциклильными группами, аминосульфонил, необязательно N-моно- или N,N-дизамещенный алкильными, арильными или гетероарильными группами, алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино или тому подобные, присоединенные на любом активном участке с образованием устойчивого соединения.
“Алкилалкенил” означает группу -R-CR’=CR’’’R’’’’, где R представляет низший алкил или замещенный низший алкил, R’, R’’’, R’’’’ могут независимо представлять водород, галоген, низший алкил, замещенный низший алкил, ацил, арил, замещенный арил, гетарил или замещенный гетарил, указанный ниже.
“Алкилалкинил” означает группу -RC≡CR’, где R представляет низший алкил или замещенный низший алкил, R’ представляет водород, низший алкил, замещенный низший алкил, ацил, арил, замещенный арил, гетарил или замещенный гетарил, указанный ниже.
“Алкокси” означает группу -OR, где R означает низший алкил, замещенный низший алкил, ацил, арил, замещенный арил, аралкил, замещенный аралкил, гетероалкил, гетероарилалкил, циклоалкил, замещенный циклоалкил, циклогетероалкил или замещенный циклогетероалкил, указанный ниже.
“Алкилтио” означает группу -SR, -S(O)n=1-2-R, где R представляет низший алкил, замещенный низший алкил, арил, замещенный арил, аралкил или замещенный аралкил, указанный ниже.
“Ацил” означает группу -С(О)R, где R представляет водород, низший алкил, замещенный низший алкил, арил, замещенный арил и подобные группы, указанные ниже.
“Арилокси” означает группу -OAr, где Ar представляет арил, замещенный арил, гетероарил или замещенный гетероарил, указанный ниже.
“Амино” означает группу NRR’, где R и R’ могут независимо представлять водород, низший алкил, замещенный низший алкил, арил, замещенный арил, гетарил и замещенный гетарил, указанный ниже, или ацил.
“Амидо” означает группу -C(O)NRR’, где R и R’ могут независимо представлять водород, низший алкил, замещенный низший алкил, арил, замещенный арил, гетарил и замещенный гетарил, указанный ниже.
“Карбоксил” означает группу -С(О)ОR, где R представляет водород, низший алкил, замещенный низший алкил, арил, замещенный арил, гетарил и замещенный гетарил, указанный ниже.
“Арил”, используемый отдельно или в сочетании, означает фенил или нафтил, необязательно карбоциклически конденсированный с циклоалкилом, который предпочтительно имеет 5-7, более предпочтительно 5-6 членов в кольце и/или необязательно замещен 1-3 группами или заместителями, включающими галоген, гидрокси, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, ацилокси, арилокси, гетероарилокси, аминогруппу, необязательно моно- или дизамещенную алкильными, арильными или гетероарильными группами, амидино, мочевину, необязательно замещенную алкильными, арильными, гетероарильными или гетероциклильными группами, аминосульфонил, необязательно N-моно- или N,N-дизамещенный алкильными, арильными или гетероарильными группами, алкильсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино или тому подобные.
“Замещенный арил” означает арил, необязательно замещенный одной или несколькими функциональными группами, такими как галоген, низший алкил, низший алкокси, алкилтио, ацетилен, амино, амидо, карбоксил, гидроксил, арил, арилокси, гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Гетероцикл” означает насыщенную, ненасыщенную или ароматическую карбоциклическую группу, имеющую одно кольцо (например, морфолино, пиридил или фурил) или несколько конденсированных колец (например, нафтпиридил, хиноксалил, хинолинил, индолизинил или бензо[b]тиенил) и по крайней мере один гетероатом, такой как N, O или S, в кольце, которое может быть не замещено или замещено такими группами, как галоген, низший алкил, низший алкокси, алкилтио, ацетилен, амино, амидо, карбоксил, гидроксил, арил, арилокси, гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Гетероарил”, используемый отдельно или в сочетании, означает моноциклическое ароматическое кольцо, имеющее 5 или 6 атомов в кольце, или бициклическую ароматическую группу, имеющую 8-10 атомов и содержащую один или несколько гетероатомов, предпочтительно 1-4 гетероатома, более предпочтительно 1-3 гетероатома, еще предпочтительнее 1-2 гетероатома, независимо выбираемых из О, S и N, которая необязательно замещена 1-3 группами или заместителями, включающими галоген, гидрокси, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, ацилокси, арилокси, гетероарилокси, аминогруппу, необязательно моно- или дизамещенную алкильными, арильными или гетероарильными группами, амидино, мочевину, необязательно замещенную алкильными, арильными, гетероарильными или гетероциклильными группами, аминосульфонил, необязательно N-моно- или N,N-дизамещенный алкильными, арильными или гетероарильными группами, алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино или тому подобные. Гетероарил включает также оксиды S или N, такие как сульфинил, сульфонил и N-оксид третичного атома азота в кольце. Атом углерода или азота представляет место присоединения гетероарильного кольца с сохранением устойчивого ароматического кольца. Примерами гетероарильных групп являются пиридинил, пиридазинил, пиразинил, хиназолинил, пуринил, хинолинил, изохинолинил, пиримидинил, пирролил, оксазолил, тиазолил, тиенил, изоксазолил, оксатиадиазолил, изотиазолил, тетразолил, имидазолил, триазинил, фуранил, бензофурил, индолил, бензотиазолил, бензоксазолил и тому подобные. Замещенный гетероарил имеет заместитель, присоединенный у активного атома углерода или азота с образованием устойчивого соединения.
“Гетероциклил”, используемый отдельно или в сочетании, означает неароматическую циклоалкильную группу, имеющую 5-10 атомов, из которых 1-3 атома углерода в кольце заменены гетероатомами O, S или N и которые представляют необязательно бензоконденсированный или конденсированный гетероарил с 5-6 членами в кольце и/или необязательно замещены, как, например, в случае циклоалкила. Гетероциклил включает также оксиды S или N, такие как сульфинил, сульфонил и N-оксид третичного атома азота в кольце. Место присоединения соответствует положению атома углерода или азота. Примерами гетероциклильных групп являются тетрагидрофуранил, дигидропиридинил, пиперидинил, пирролидинил, пиперазинил, дигидробензофурил, дигидроиндолил и тому подобные. Замещенный гетероциклил содержит замещающий азот, присоединенный к активному атому углерода или азота с образованием устойчивого соединения.
“Замещенный гетероарил” означает гетероцикл, необязательно моно- или полизамещенный одной или несколькими функциональными группами, например, такими как галоген, низший алкил, низший алкокси, алкилтио, ацетилен, амино, амидо, карбоксил, гидроксил, арил, арилокси, гетероцикл, замещенный гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Аралкил” означает группу -R-Ar, в которой Ar представляет арильную группу и R представляет низшую алкильную или замещенную низшую алкильную группу. Арильные группы могут быть не замещены или замещены такими группами, как галоген, низший алкил, алкокси, алкилтио, ацетилен, амино, амидо, карбоксил, гидроксил, арил, арилокси, гетероцикл, замещенный гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Гетероалкил” означает группу -R-Het, в которой Het представляет гетероциклическую группу и R представляет низшую алкильную группу. Гетероалкильные группы могут быть не замещены или замещены такими группами, как галоген, низший алкил, низший алкокси, алкилтио, ацетилен, амино, амидо, карбоксил, арил, арилокси, гетероцикл, замещенный гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Гетероарилалкил” означает группу -R-HetAr, в которой HetAr представляет гетероарильную группу и R представляет низший алкил или замещенный низший алкил. Гетероарилалкильные группы могут быть не замещены или замещены, например, такими группами, как галоген, низший алкил, замещенный низший алкил, алкокси, алкилтио, ацетилен, арил, арилокси, гетероцикл, замещенный гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Циклоалкил” означает двухвалентную циклическую или полициклическую алкильную группу, имеющую 3-15 атомов углерода.
“Замещенный циклоалкил” означает циклоалкильную группу, имеющую один или несколько заместителей, например, таких как галоген, низший алкил, замещенный низший алкил, алкокси, алкилтио, ацетилен, арил, арилокси, гетероцикл, замещенный гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Циклогетероалкил” означает циклоалкильную группу, в которой один или несколько атомов углерода в кольце заменены гетероатомами (например, N, O, S или Р).
“Замещенный циклогетероалкил” означает указанную циклогетероалкильную группу, которая имеет один или несколько заместителей, таких как галоген, низший алкил, низший алкокси, алкилтио, ацетилен, амино, амидо, карбоксил, гидроксил, арил, арилокси, гетероцикл, замещенный гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Алкилциклоалкил” означает группу -R-циклоалкил, в которой циклоалкил представляет циклоалкильную группу и R представляет низший алкил или замещенный низший алкил. Циклоалкильные группы могут быть не замещены или замещены, например, такими группами, как галоген, низший алкил, низший алкокси, алкилтио, ацетилен, амино, амидо, карбоксил, гидроксил, арил, арилокси, гетероцикл, замещенный гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Алкилциклогетероалкил” означает группу -R-циклогетероалкил, в которой R представляет низший алкил или замещенный низший алкил. Циклогетероалкильные группы могут быть не замещены или замещены, например, такими группами, как галоген, низший алкил, низший алкокси, алкилтио, амино, амидо, карбоксил, ацетилен, гидроксил, арил, арилокси, гетероцикл, замещенный гетероцикл, гетарил, замещенный гетарил, нитро, циано, тиол, сульфамидо и тому подобные.
“Необязательный” и “необязательно” означает, что описываемое событие или явление может произойти или не произойти и что данное описание включает все случаи, когда указанное событие или явление происходит, и все случаи, когда указанное событие не происходит. Например, термин “необязательные фармацевтические наполнители” означает, что описываемый препарат может содержать или не содержать любые фармацевтические наполнители помимо специально указанных и что для описываемого препарата действительны все случаи, когда необязательные наполнители присутствуют, и все случаи, когда они отсутствуют.
Термин “лечение” означает любое терапевтическое воздействие, оказываемое на млекопитающего, в частности человека, которое включает:
(i) профилактику заболевания у субъекта, предрасположенного к возникновению заболевания, которое еще не диагностировано;
(ii) подавление заболевания, то есть прекращение его развития; или
(iii) ослабление заболевания, то есть достижение регрессии заболевания.
Все вышеуказанные варианты осуществления изобретения относятся к фармацевтически приемлемым кислотно-аддитивным солям, в частности к моно- или дигидрохлоридам и их смесям.
Соединения общей формулы Ia (q = O) или Ic (q = S) можно получить в соответствии со схемами 1-5. Общий синтез соединений по данному изобретению показан на схеме 1. Соединение IV можно получить N-ацилированием замещенного анилина II 2-замещенным хлорацетилхлоридом III. Соединение II можно приобрести коммерческим путем или легко получить, восстанавливая соответствующее производное нитробензола (кислота/SnCl2 или каталитическое гидрирование, см. Advanced Organic Chemistry, Ed. J. March, (1992) A. Wiley-Interscience). Некоторые примеры коммерчески производимых замещенных анилинов, соответствующих общей формуле II, включают 2,6-диметиланилин, 2,3-диметиланилин, 2-метиланилин, 4-метиланилин, 4-метиланилин, 2,4-дихлоранилин, 3,4-дихлоранилин, 2,5-дихлоранилин, 2,4-дихлоранилин, 2-хлоранилин, 3-хлоранилин, 2,6-дифторанилин, 2,5-дифторанилин, 3,4-дифторанилин, 2-фторанилин, 4-фторанилин, 3-фторанилин, 2-фтор-6-хлоранилин, 4-фтор-3-хлоранилин, 4-ацетоксианилин.
Схема 1

Соединение VI можно получить взаимодействием соединения IV с N-защищенным замещенным пиперазином V при нагревании в приемлемом растворителе (например, ДМФ, EtOH). Следует защитить атом азота в соединении V, только если необходимо контролировать региоселективность присоединения соединения V к соединению IV. В некоторых случаях соединение V можно приобрести коммерческим путем. Примеры коммерчески производимых соединений, соответствующих общей формуле V, включают 2-метилпиперазин, 2,5-диметилпиперазин, 2,6-диметилпиперазин, 2,3,5,6-тетраметилпиперазин, пиперазин-2-карбоновую кислоту, пергидрохиноксалин, 2-аминометил-6-метилпиперазин, 2-аминометилпиперазин, 2-(о-хлорфенил)пиперазин и 2-(м-хлорфенил)пиперазин. Снятие защиты с соединения VI можно произвести в стандартных условиях (например, Вос-группу удаляют при помощи ТФУ, CBZ и бензил удаляют гидрированием). Соединение Ia или Ic можно получить, взаимодействием соединения VII с эпоксидом VIII при нагревании в соответствующем растворителе (этанол, ДМФ, CHCl2, ТГФ) или при перемешивании при комнатной температуре в присутствии лантанида (III), являющегося кислотой Льюиса (Chini, M et al., Tetrahedron Lett., 35:433-36 (1994).
Схема 2

Эпоксид VIII (где m = 1, 2 или 3) можно получить в соответствии со схемой 2. Нагревая замещенный фенол или тиофенол IX с эпихлоргидрином или эпибромгидрином, 4-бром-1,2-эпоксибутан и карбонат калия в ацетоне или гидрид натрия в ДМФ, можно получить эпоксид VIII. Соединение IX можно приобрести коммерчески путем. Примеры коммерчески производимых соединений, соответствующих формуле XI, включают 2-метил-5-гидроксибензотиазол, 2-гидроксибензотиазол, 8-гидроксихинолидин, 6-гидроксихинолин, 4-гидроксихинолин, 5-гидроксиизохинолин, 3-гидроксипиридин, 2-хиноксалинол и 4-(имидазол-1-ил)фенол. В некоторых случаях соединение VIII можно приобрести коммерческим путем. Примеры коммерчески производимых соединений, соответствующих общей формуле VIII, включают 4-глицидилокси-2-индолкарбоксамид.
Соединение IX можно в свою очередь получить, снимая защиту у соответствующего метилового или бензилового эфира (Х) при помощи кислот Льюиса, показанных на схеме 3 (BBr3, BF3 и т.д., см. Advanced Organic Chemistry, Ed. J. March (1992) A. Wiley Intersciences, p. 434). У бензиловых эфиров можно также снять защиту, нагревая указанные эфиры с обратным холодильником вместе с гидроксидом палладия в этаноле/циклогексене (см. Catalytic hydrogenation over platinum metals., P.N. Rylander, Academic Press, New York, NY, (1976), p. 464). Коммерчески производимые метиловые эфиры включают 6-метокси-2-метилбензотиазол.
Схема 3

Соединение IX можно также получить диазотированием соответствующих аминосоединений (XI) в соответствии со схемой 4 (Boggust, W.A. and Cocker, W. J., Chem. Soc. 1949, 355). Коммерчески производимые амины включают 6-аминобензотиазол.
Схема 4

6,5-Конденсированную кольцевую систему соединения Х можно получить циклизацией коммерчески производимых простых эфиров 2-аминофенолов, 2-аминотиофенолов или 2-аминоанилинов (XII) со сложными ортоэфирами (XIII) (Musser, J. H. et al., J. Med. Chem. 1985, 28, 1255-1259) или имидатами (XIV) (Gregory, G. I. Et al., J. Chem. Soc. Perkin Trans.1, 1973, 47-51) в соответствии со схемами 5 и 6. Коммерчески производимые простые эфиры аминофенолов включают 4-метокси-2-аминофенол, сложные ортоэфиры включают триметилортоформиат и триметилортоацетат, имидаты включают гидрохлорид этилацетимидата и гидрохлорид этилбензимидата.
Схема 5

Схема 6

Аналог тиофенола соединения XII можно получить из коммерчески производимого соединения XV, взаимодействием с гидратом дисульфида натрия и последующим восстановлением оловом и хлористоводородной кислотой (Dannley, R;L. and Zazaris, D. A.; Can. J. Chem. 1965, 43, 2610-2612) в соответствии со схемой 7. Коммерчески производимые нитросоединения включают 3-нитро-4-хлоранизол.
Схема 7
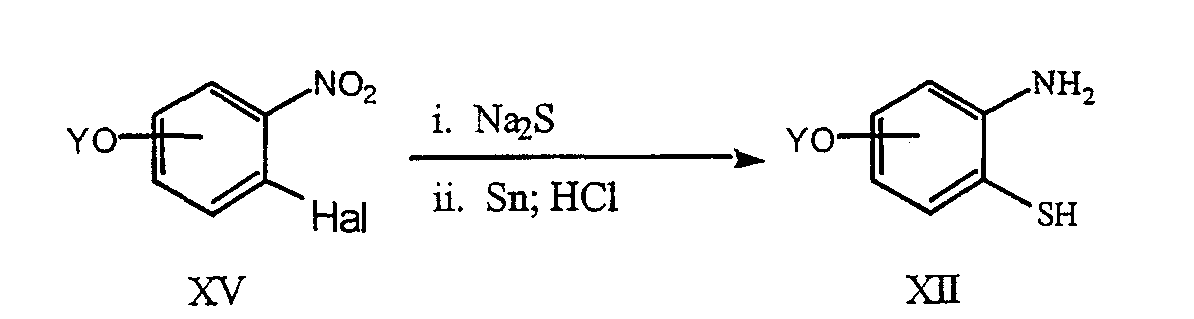
Hal=Cl, Br, I; Y=Me, бензил
Имидат XIV можно получить, барботируя газообразный HCl через спиртовой раствор коммерчески производимых нитрилов XVI в соответствии со схемой 8. Коммерчески производимые нитрилы включают бензонитрил, 4-трифторметилбензонитрил и 3-трифторметилбензонитрил.
Схема 8
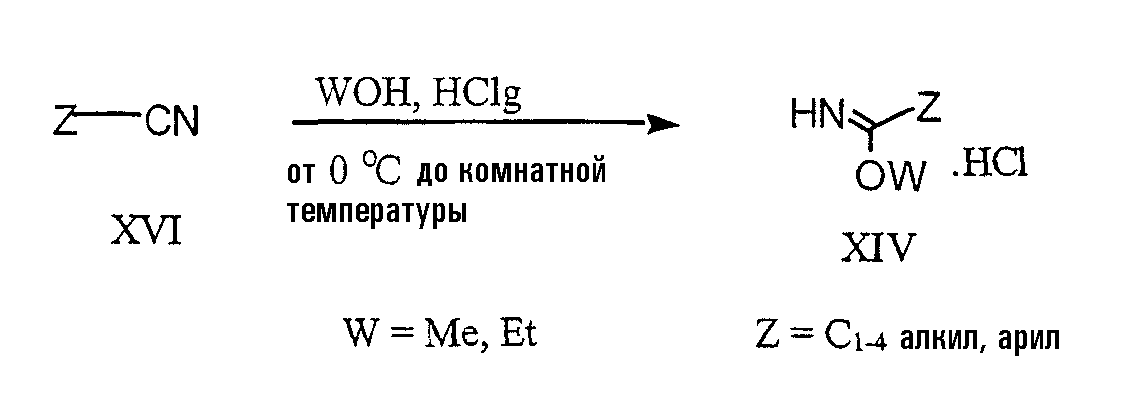
Серусодержащую 6,5-конденсированную кольцевую систему соединения Х можно также получить из коммерчески производимых простых эфиров анилинов XVII (Stevens, M.F.G. et al., J. Med. Chem. 1994, 37, 1689-1695) в соответствии со схемой 9. Тиоамид ХХ можно получить взаимодействием реагента Лавессона с амидом XIX, который в свою очередь можно получить в результате взаимодействия соединения XVII с соединением XVIII. Соединение XXI получают циклизацией соединения ХХ с ферроцианидом калия в основных условиях. Коммерчески производимые простые эфиры анилинов включают бензилоксианилины и анизидины.
Схема 9

Общий синтез соединения XXV по данному изобретению показан на схеме 10. Соединение XXIV можно получить, снимая защиту у соединения XXIII в стандартных условиях (например, ВОС-группу удаляют при помощи ТФУ, CBZ и бензил удаляют гидрированием). Соединение XXIII в свою очередь можно получить взаимодействием коммерчески производимого аналога защищенного монокетопиперазина формулы XXII с соединением IV и гидридом натрия в приемлемом растворителе (ДМФ, ТГФ). Пример коммерчески производимых монокетопиперазинов включает 4-бензилоксикарбонилпиперазин-2-он.
Схема 10

Общий синтез соединения Ib (q=NH) по данному изобретению показан на схемах 11 и 12. Соединение XXVII можно получить, нагревая с обратным холодильником соединение VII вместе с эпоксидом XXVI в приемлемом растворителе (этанол, ТГФ). Снятие защиты у соединения XXVII можно произвести в стандартных условиях (например, ВОС-группу удаляют при помощи ТФУ; CBZ удаляют гидрированием или Pd(OH)2). Соединение Ib можно получить, нагревая с обратным холодильником соединение XXVIII вместе с соединением XXIX в приемлемом растворителе (этанол, ТГФ). Коммерчески производимое соединение XXIX включает 2-хлорбензотиазол, 2-хлорбензоксазол, 2-хлорпиридин, 2-хлорпиримидин, 2-хлор-4-(трифторметил)пиримидин и хлорпиразин.
Схема 11

Эпоксид XXVI в свою очередь можно получить в соответствии со схемой 12. Коммерчески производимое соединение ХХХ можно защитить в стандартных условиях (защиту ВОС-группой осуществляют при помощи ВОС-ангидрида; защиту CBZ-группой осуществляют при помощи CBZ-Cl). Соединение XXV можно получить взаимодействием соединения XXXI с м-хлорпербензойной кислотой в приемлемом растворителе (например, дихлорметане). Пример коммерчески производимого соединения ХХХ включает, не ограничиваясь им, аллиламин.
Схема 12

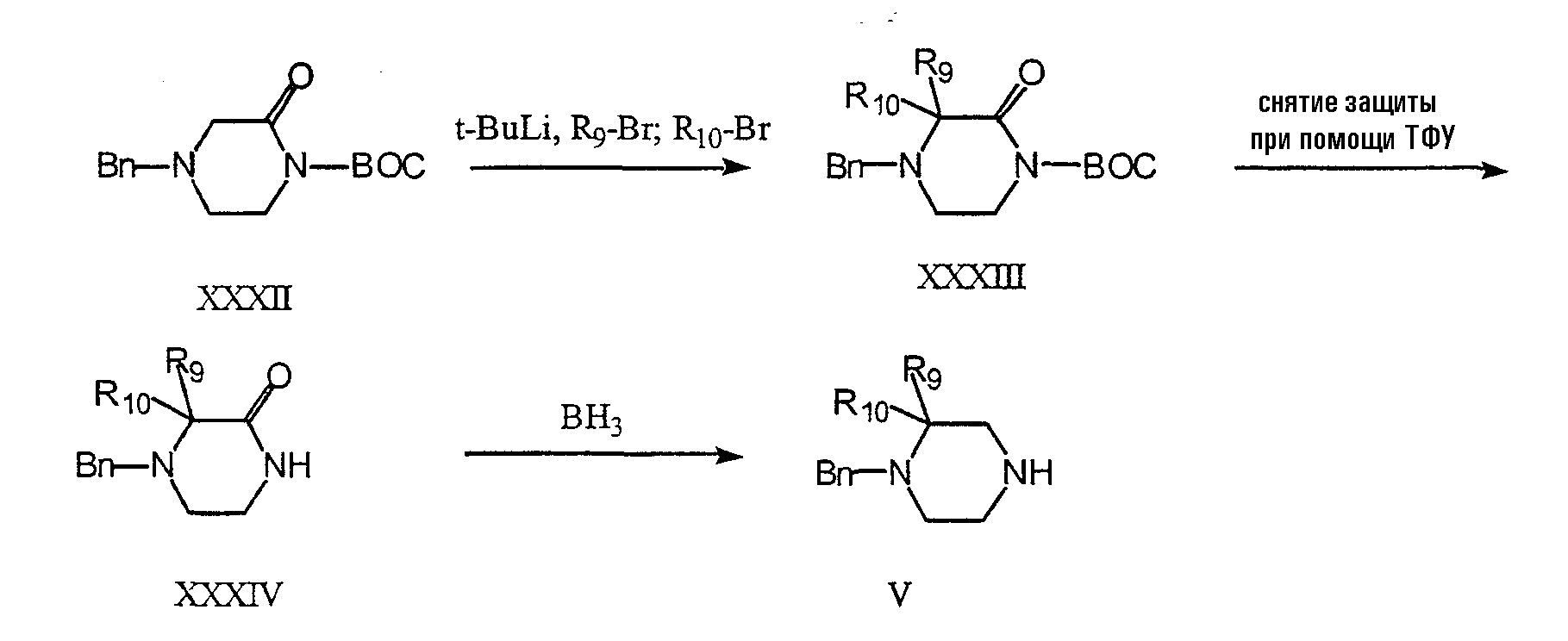
Соединение V можно получить в соответствии со схемой 13. Соединение XXXIII получают методом Полмана и др. (Pohlman et al., J. Org. Chem., 1997, 62, 1016-1022), алкилируя соединение XXXII алкилгалогенидами с использованием трет-BuLi в качестве основания. Восстанавливая соединение XXXIV дибораном, можно получить N-бензилзащищенный вариант соединения V после удаления N-Вос-защитной группы при помощи трифторуксусной кислоты (ТФУ) (метод восстановления дибораном описан в статье Jacobson et al., J. Med. Chem. 1999, 42, 1123-1144).
Схема 13
Соединение V можно также получить, выполняя обычную реакцию сочетания (например, EDC или PyBroP) D- или L-аминокислот и обычную реакцию снятия защиты, показанную на схеме 14 (Cledera, P. et al., Tetrahеdron, 1998, p. 12349-12360; Smith, R.A. et al. Bioorg. Med. Chem. Lett. 1998, p. 2369-2374). Восстанавливая дикетопиперазин XXXVII дибораном, можно получить N-бензилзащищенный вариант соединения V.
Схема 14

Соединение V можно также получить в соответствии со схемой 15. Имин XLI можно получить бромированием альдегидов XXXVIII с последующим взаимодействием с этилендиамином. Соединение V можно получить, подвергая соединение XLI каталитическому гидрированию (Bogeso, K. P., et al., J. Med. Chem., 1995, 38, p. 4380-4392). Коммерчески производимые альдегиды включают изомасляный альдегид.
Схема 15

Соединение V включает также бициклические гомологи пиперазина: (1S,4S)-(+)-2,5-диазабицикло[2.2.1]гептан 83, 3, 8-диазабицикло[3.2.1]октан 84 и 2,5-диазабицикло[2.2.2]октан 85.

Коммерчески производимые бициклические аналоги включают (1S,4S)-(+)-2,5-диазабицикло[2.2.1]гептан 83. Соединения 84, 85 и (1R,4R)-изомер соединения 83 можно получить методами, описанными в научной литературе (получение соединений 84 и 85 описано в статье Sturm, P.A. et al., J. Med. Chem., 1974, 17, 481-487; получение соединения 83 описано в статье Barnish, T. F. and Fox, D.E, J. Org. Chem., 1990, 55, 1684-1687).
Типичные примеры получения соединений, показанных на приведенных выше общих схемах, представлены на схемах 16-29, которые далее иллюстрируют альтернативные способы получения соединений по настоящему изобретению. В частности, 2,6-метиланилин ацилируют 2-хлорацетилхлоридом 2, используя насыщенный бикарбонат и диэтиловый эфир (1:1) в качестве основания и сорастворителя, и получают производное хлорацетамида 3. Соединение 5 получают, взаимодействием соединения 3 с пиперазином при нагревании в этаноле. Производное пиперазина 7 получают взаимодействием соединения 5 с эпоксидом 6 при кипячении обоих компонентов в этаноле с обратным холодильником, как показано на схеме 16. Соединение 6 получают, нагревая эпихлоргидрид с фенолом 8 в ацетоне в присутствии К2СО3, как показано на схеме 17.
Схема 16
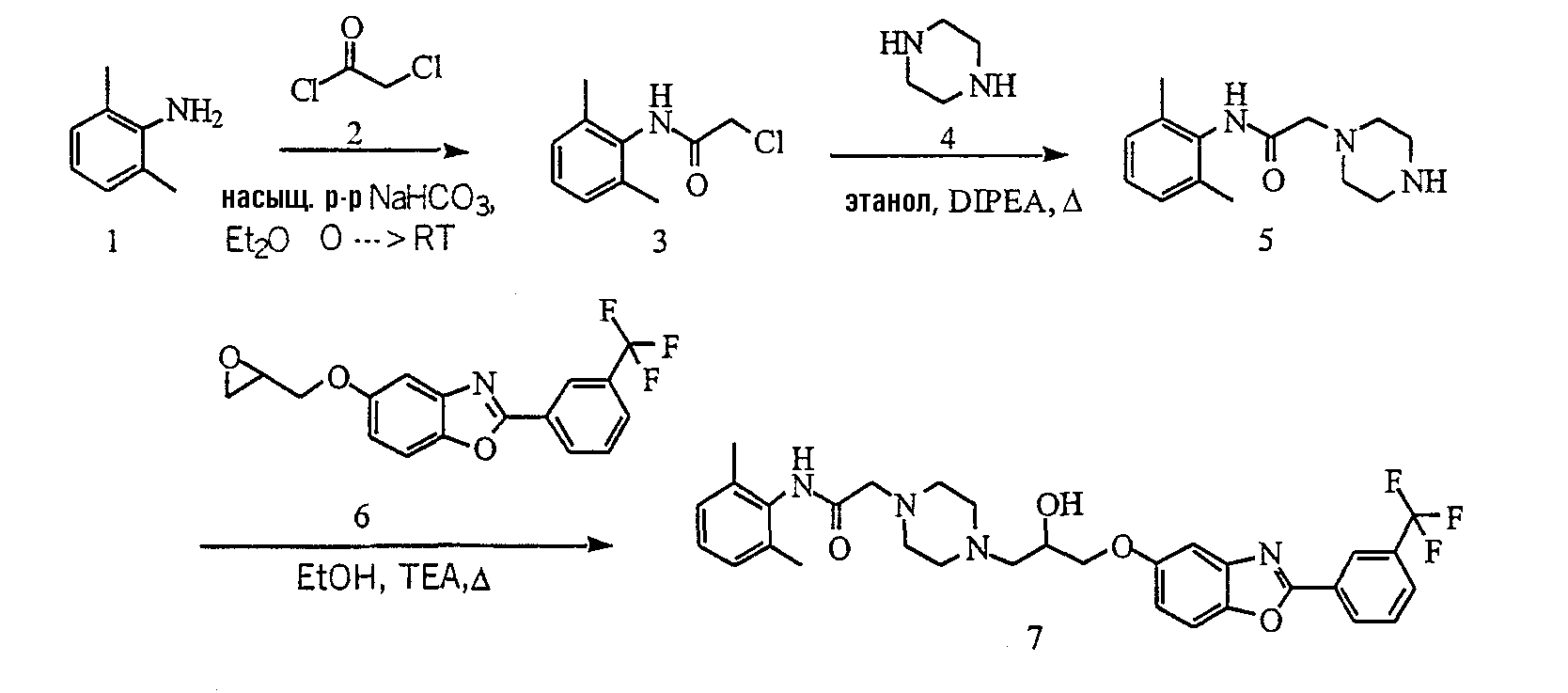
Схема 17

Производное бензоксазола 8 получают, снимая защиту у соединения 13 в соответствии со схемой 18. Соединение 10 получают конденсацией 2-амино-4-метоксифенола 12. Соединение 12 получают каталитическим гидрированием коммерчески производимого 4-метокси-2-нитрофенола 11 и производного бензимидата 13 в соответствии со схемой 19. Соединение 13 получают из 3-трифторметилбензонитрила 14, выполняя реакцию Пиннера (этанол/безводный HCl).
Схема 18
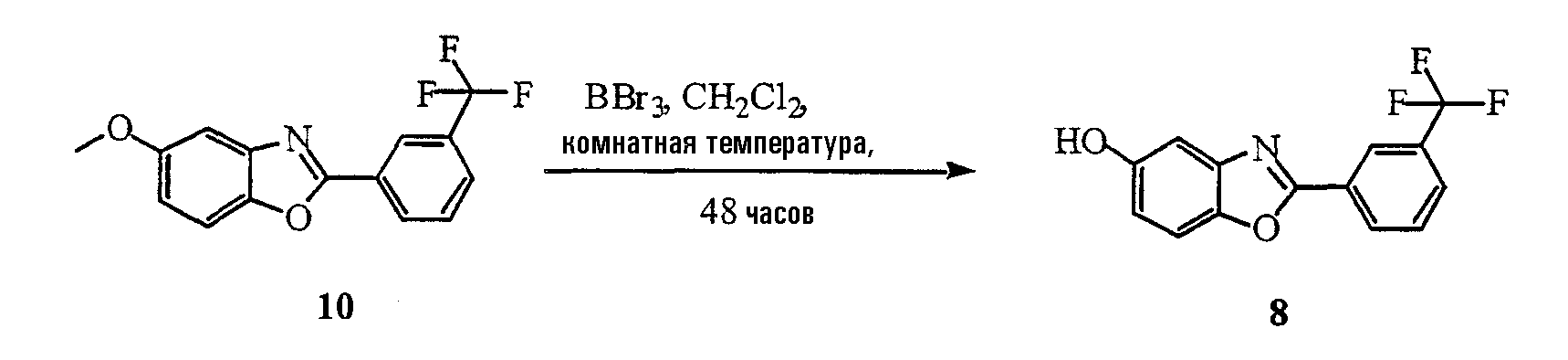
Схема 19
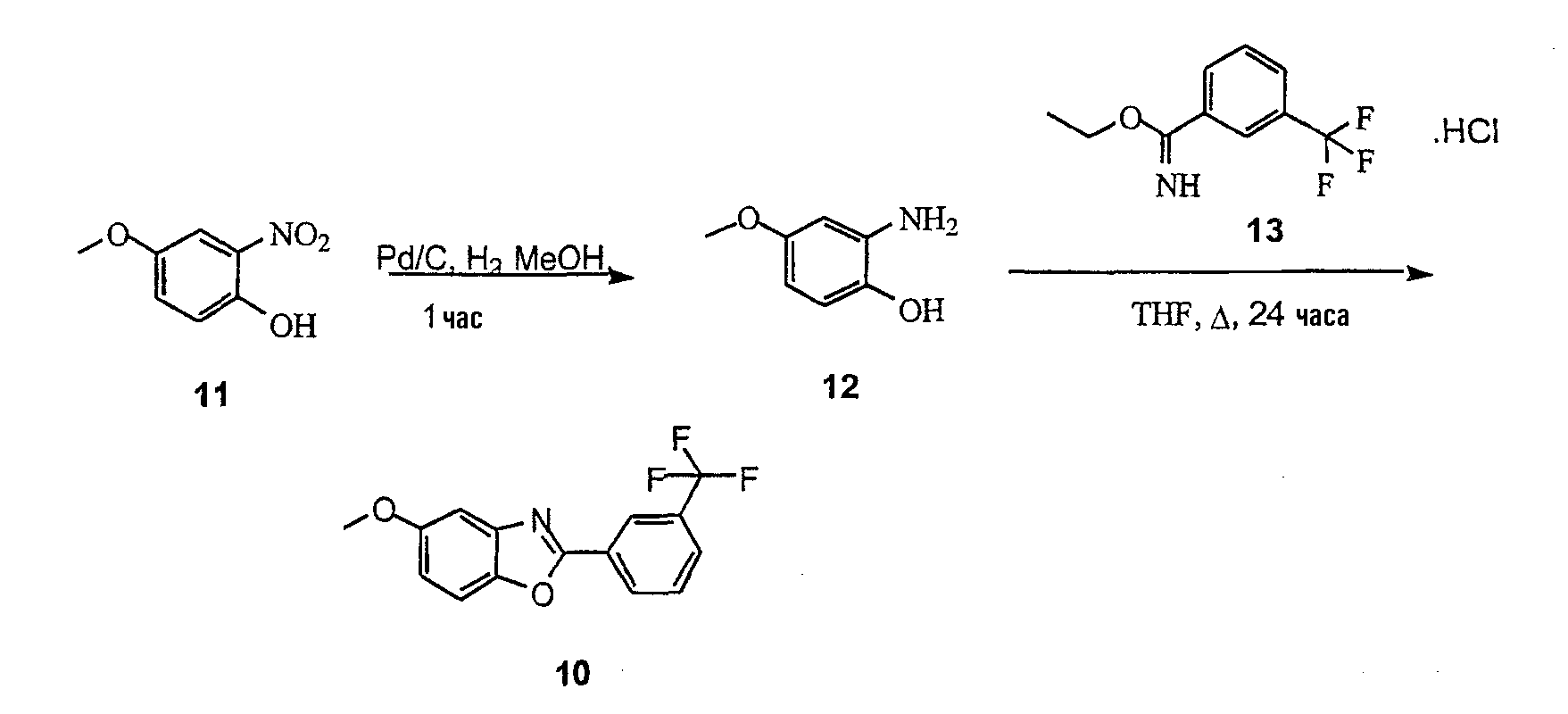
Схема 20

Синтез основных промежуточных соединений, используемых при получении соединений по настоящему изобретению, показан на схемах 21-25. Соединение 16 получают диазотированием коммерчески производимого 6-аминобензотиазола в соответствии со схемой 21.
Схема 21

Соединение 19 получают конденсацией соединения 12 с триметилортоацетатом 18, как показано на схеме 22.
Схема 22
Соединение 22 можно получить, восстанавливая соединение 21 оловом и хлористоводородной кислотой в соответствии со схемой 23. Соединение 21 синтезируют взаимодействием соединения 20 с гидратом дисульфида натрия.
Схема 23

Соединение 26 получают взаимодействием соединения 25 с реагентом Лавессона в соответствии со схемой 24. Соединение 25 получают взаимодействием анилина 23 с бензоилхлоридом 24. Выполняя циклизацию тиоамида 26 с ферроцианидом калия в водном растворе гидроксида натрия, получают смесь соединений 27 и 28. Соединения 27 и 28 разделяют колоночной хроматографией.
Схема 24

Соединение 27 дебензилируют в соответствии со схемой 25, осуществляя обменный гидрогенолиз с использованием катализатора Перлманна в этаноле/циклогексене.
Схема 25

Синтез соединения 34 по данному изобретению показан на схеме 26. Амид 3 получают в соответствии со схемой 16. Соединение 31 получают, подвергая соединение 3 взаимодействию с анионом монокетопиперазина 30, полученным в результате обработки гидридом натрия в ДМФ. Соединение 34 получают, нагревая соединение 32 с эпоксидом 33 в этаноле. Соединение 32 получают, снимая защиту у соединения 31 каталитическим дегидрированием. Эпоксид 33 получают аналогично способу получения соединения 6, показанному на схеме 17.
Схема 26

Синтез типичного соединения 39 по данному изобретению показан на схеме 27. Синтез соединения 5 показан выше (схема 16). Соединение 36 получают, нагревая с обратным холодильником соединение 5 вместе с эпоксидом 35. У соединения 36 снимают защиту, производя обработку гидроксидом палладия в этаноле/циклогексене в условиях нагревания с обратным холодильником, и получают амин 37. Конечное соединение 39 получают взаимодействием соединения 37 с 2-хлорбензотиазолом в этаноле и триэтиламине.
Схема 27

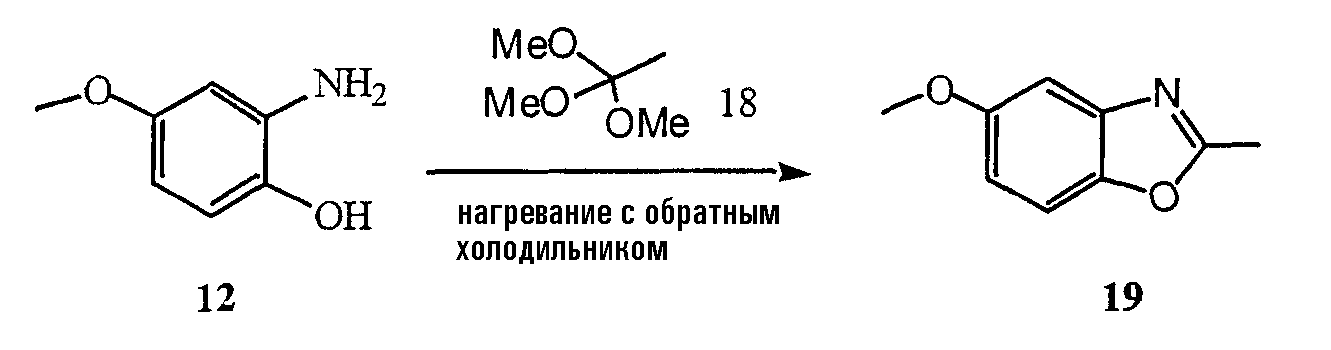
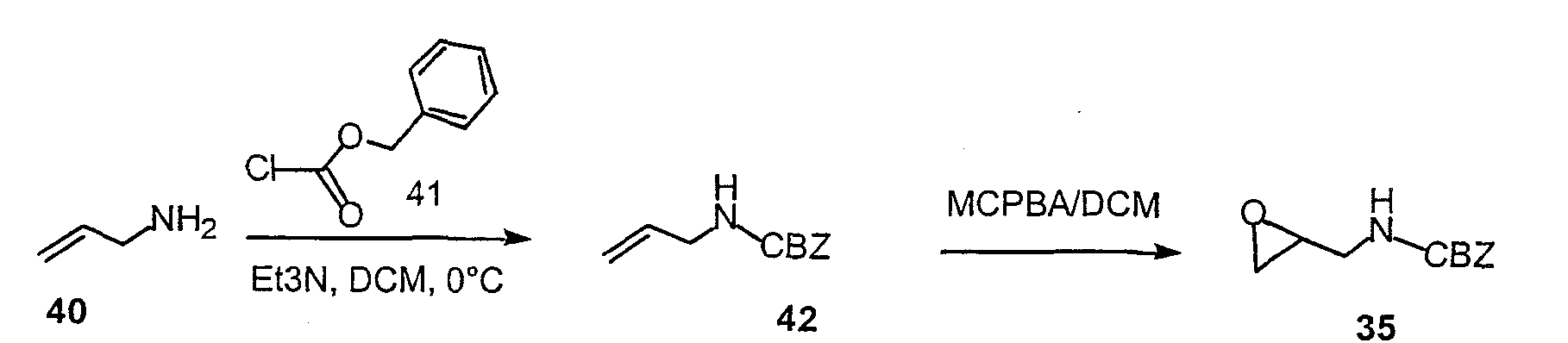
Эпоксид 35 синтезируют в соответствии со схемой 28. Аллиламин 40 подвергают взаимодействию с бензилхлорформиатом в дихлорметане, получая при этом соединение 42. Эпоксид 35 получают в результате взаимодействия м-хлорпербензойной кислоты с соединением 42.
Схема 28
Кислотно-аддитивные соли соединений по настоящему изобретению можно превратить в соответствующее свободное основание обработкой приемлемым основанием, таким как карбонат калия или гидроксид натрия, обычно в присутствии водного растворителя и при температуре от около 0 до 100°С. Свободное основание выделяют обычными способами, такими как экстракция органическим растворителем.
Соли соединений по данному изобретению можно взаимозаменять, используя преимущества разных степеней растворимости и летучести или производя обработку ионообменной смолой в соответствующей форме. Указанное превращение производят при температуре от около 0°С до температуры кипения растворителя, используемого в качестве среды при выполнении данной реакции. Описанные активные соединения и соли можно вводить любыми приемлемыми способами введения лекарственных средств. Такие способы включают пероральный, парентеральный, чрескожный, подкожный и другие способы системного введения. Предпочтительным способом введения является пероральный за исключением тех случаев, когда субъект не способен самостоятельно проглотить любое лекарственное средство. В таких случаях композицию необходимо вводить парентерально.
В зависимости от предлагаемого способа введения композиции могут иметь форму твердых, полутвердых или жидких единичных дозированных форм, например, такую как таблетки, суппозитории, пилюли, капсулы, порошки, жидкости, суспензии и тому подобные, причем единичные дозированные формы предпочтительно должны быть предназначены для однократного введения точных доз. Композиции могут содержать один или несколько обычно используемых фармацевтически приемлемых наполнителей и по крайней мере одно активное соединение по данному изобретению или его фармацевтически приемлемую соль, а также другие лекарственные средства, фармацевтические вещества, носители, адъюванты, разбавители и т.д.
Количество вводимого активного соединения зависит от массы тела нуждающегося в лечении субъекта, серьезности заболевания, способа введения и предписаний лечащего врача. Однако эффективная доза обычно составляет 0,1-30 мг/кг/сутки, предпочтительно 0,5-20 мг/кг/сутки. Для среднестатистического человека с массой тела 70 кг эффективная доза составляет 7-2100 мг/сутки или предпочтительно 35-1400 мг/сутки. Так как описанные соединения характеризуются одинаковым механизмом воздействия (частичное ингибирование окисления жирных кислот), дозы (или формы введения), используемые для лечения указанных заболеваний (защита скелетных мышц от повреждения вследствие травмы; защита скелетных мышц от последствий мышечных или системных заболеваний, таких как перемежающаяся хромота; лечение шоковых состояний; предохранение донорских тканей и органов, используемых в качестве трансплантатов; и лечение сердечно-сосудистых заболеваний, включая предсердную и желудочковую экстрасистолию, стенокардию Принцметала (изменчивую), постоянную стенокардию и стенокардию физической нагрузки, застойную сердечную недостаточность или инфаркт миокарда), обычно находятся в одинаковых общих и предпочтительных пределах.
В твердых композициях обычно используют нетоксичные твердые вещества, которые включают, например, фармацевтические сорта маннита, лактозы, крахмала, стеарата магния, натриевой соли сахарина, талька, целлюлозы, глюкозы, сахарозы, карбоната магния и подобных веществ. Вышеуказанное активное соединение может входить в состав суппозиториев, содержащих в качестве носителя полиалкиленгликоли, например пропиленгликоль. Жидкие фармацевтические композиции можно получить, растворяя, диспергируя и т.д. активное соединение и необязательные фармацевтические адъюванты в наполнителе, таком как, например, вода, физиологический раствор, водный раствор декстрозы, глицерин, этанол и тому подобные, с образованием раствора или суспензии. Вводимая фармацевтическая композиция может при желании также содержать небольшие количества нетоксичных вспомогательных веществ, таких как смачивающие вещества или эмульгаторы, рН-регулирующие буферные вещества и тому подобные, например ацетат натрия, монолаурат сорбита, натрий-ацетат триэтаноламина, олеат триэтаноламина и т.д. Способы получения таких дозированных лекарственных форм хорошо известны или должны быть очевидны специалистам в данной области; см., например, Remington’s Pharmaceutical Sciences, Mack Publishing Company, Easton, Pennsylvania, 15th Edition, 1975. Предназначенные для введения композиции или препараты в любом случае должны содержать терапевтически эффективное количество одного или нескольких активных соединений, то есть количество, позволяющее эффективно ослаблять симптомы заболевания у нуждающегося в лечении субъекта. Предназначенную для перорального введения фармацевтически приемлемую нетоксичную композицию получают, используя любые обычно применяемые наполнители, такие как, например, фармацевтически сорта маннита, лактозы, крахмала, стеарата магния, натрий-сахарина, талька, целлюлозы, глюкозы, сахарозы, карбоната магния и подобных веществ. Такие композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, порошков, препаратов пролонгированного действия и тому подобных. Указанные композиции могут содержать 10%-95% активного ингредиента, предпочтительно 1-70%.
Парентеральное введение обычно осуществляют в виде подкожных, внутримышечных или внутривенных инъекций. Инъекционные препараты можно получить в виде жидких растворов или суспензий, в виде твердых веществ, предназначенных для растворения или суспендирования в жидкости непосредственно перед инъекцией, или в виде эмульсий. Приемлемыми наполнителями являются, например, вода, физиологический раствор, декстроза, глицерин, этанол или тому подобные. Кроме того, предназначенные для введения фармацевтические композиции при желании могут также содержать небольшие количества нетоксичных вспомогательных веществ, таких как смачивающие вещества или эмульгаторы, рН-регулирующие буферные вещества и тому подобные, например ацетат натрия, монолаурат сорбита, олеат триэтаноламина и т.д.
Недавно предложенный способ парентерального введения представляет имплантацию системы с медленным или пролонгированным высвобождением активного вещества, благодаря чему в организме сохраняется постоянный уровень вводимой дозы. См., например, патент США №3710795, который включен в данное описание изобретения в качестве ссылки. Другой новый способ предполагает пероральное введение композиций по данному изобретению в дозированной лекарственной форме пролонгированного действия с использованием композиций и/или способов, описанных в заявке на патент США №09/321522, поданной 27 мая 1999 г, которая включена в данное описание изобретения в качестве ссылки.
В объем настоящего изобретения входят также другие способы введения млекопитающему, предпочтительно человеку, одного или нескольких соединений по данному изобретению, которые включают, не ограничиваясь ими, болюсы, внутривенное, чрескожное и подкожное введение, ингаляцию и любые другие способы введения лекарственных средств, известные специалистам в данной области.
Нижеследующие примеры лишь иллюстрируют данное изобретение, не ограничивая объем формулы изобретения.
Пример 1
N-(2,6-Диметилфенил)-2-(4-{2-гидрокси-3-[2-(3-трифторметилфенил)бензоксазол-5-илокси]пропил}пиперазин-1-ил)ацетамид (7)

Часть А
Синтез N-(2,6-диметилфенил)-2-хлорацетамида (3)
2,6-Диметиланилин (9,8 г, 81,2 ммоль) растворяют в диэтиловом эфире (100 мл) и насыщенном водном растворе NaHCO3 (100 мл) и реакционную смесь охлаждают на бане со смесью воды со льдом. К холодному раствору по каплям добавляют хлорацетилхлорид 2 (9,17 г, 81,2 ммоль) в течение 2 часов. Смесь оставляют нагреваться до комнатной температуры в течение 14 часов. Затем смесь экстрагируют этилацетатом (3×50). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют. Остаток растирают в диэтиловом эфире и фильтруют, получая соединение 3 в виде белого твердого вещества.
Часть В
Синтез N-(2,6-диметилфенил)пиперазин-1-илацетамида (5)
К раствору соединения 3 (5 г, 25,2 ммоль) в этаноле (100 мл) добавляют пиперазин 4 (2,1 г, 25,0 ммоль) и N,N-диизопропилэтиламин (3,2 г, 25,2 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 24 часов. Затем смесь концентрируют в вакууме и остаток очищают колоночной хроматографией (DCM:MeOH, 10:1), получая соединение 5.
Часть С
Синтез 5-(оксиран-2-илметокси)-2-[(3-трифторметил)фенил]бензоксазола (6)
1. Синтез 2-амино-4-метоксифенола (12)
Раствор 4-метокси-2-нитрофенола 11 (10 г, 59,1 ммоль) и Pd/C (1,0 г) в метаноле (100 мл) помещают в аппарат Парра в атмосфере Н2 (3,5 атм (50 фунтов/кв.дюйм)) на 60 минут. Реакционную смесь фильтруют через целит 521 и отфильтрованный осадок промывают МеОН. Фильтрат упаривают (в вакууме), получая соединение 12 в виде желтовато-коричневого твердого вещества.
2. Синтез гидрохлорида этилового эфира 3-трифторметилбензимидокислоты (13)
В раствор α,α,α -трифторметил-м-толунитрила 14 (1 г, 5,84 ммоль) в EtOH (10 мл, безводный) барботируют HCl (газообразный, безводный) в течение 10 минут и перемешивают раствор в течение ночи. Растворитель выпаривают, получая соединение 13 в виде белого твердого вещества. Полученное твердое вещество используют на следующей стадии без очистки.
3. Синтез 5-метокси-2-(3-трифторметилфенил)бензоксазола (10)
Раствор соединения 13 и соединения 12 (850 мг, 6,13 ммоль) в ТГФ (10 мл) нагревают до температуры кипения с обратным холодильником и перемешивают в течение ночи. Реакционную смесь оставляют охлаждаться и выпаривают ТГФ (в вакууме). Остаток растворяют в этилацетате и промывают водой. Органический слой сушат над MgSO4 и обрабатывают активированным углем Norit A. Смесь фильтруют через целит 521, упаривают (в вакууме) и остаток очищают колоночной хроматографией (20% этилацетата/ гексаны), получая соединение 10 в виде светло-желтого твердого вещества.
4. Синтез 2-[(3-трифторметил)фенил]бензоксазол-5-ола (8)
К раствору соединения 10 (200 мг, 0,68 ммоль) в CН2Cl2 (5 мл) по каплям добавляют BBr3 (1 М раствор в CН2Cl2, 1 мл, 1 ммоль). Полученный раствор перемешивают в течение 48 часов. Растворитель удаляют выпариванием (в вакууме), остаток растворяют в этилацетате и промывают насыщенным раствором NaHCO3. Органический слой сушат над MgSO4 и упаривают (в вакууме). Остаток очищают колоночной хроматографией (30% этилацетата/гексаны), получая соединение 8 в виде белого твердого вещества.
5. Синтез 5-(оксиран-2-илметокси)-2-[(3-трифторметил)фенил]бензоксазола (6)
К суспензии NaH (7 мг, 60% дисперсия в масле, 0,18 ммоль) в ДМФ (2 мл, безводный) по каплям добавляют раствор соединения 8 (54 мг, 0,19 ммоль) в ДМФ (2 мл, безводный). Раствор перемешивают в течение 15 минут. К вышеуказанному раствору добавляют эпихлоргидрин (50 мкл, 0,63 ммоль) и полученный раствор перемешивают в течение ночи. Растворитель выпаривают (в вакууме), остаток растворяют в воде и экстрагируют этилацетатом. Органические слои объединяют, сушат над MgSO4 и упаривают, получая соединение 6 в виде прозрачного масла.
Часть D
Синтез N-(2, 6-диметилфенил)-2-(4-{2-гидрокси-3-[2-(3-трифторметилфенил)бензоксазол-5-илокси]пропил}пиперазин-1-ил)ацетамида (7)
Раствор соединения 5 (183 мг, 0,73 ммоль) и соединения 6 в EtOH (2 мл) и триэтиламине (0,2 мл) нагревают до 90°С и перемешивают в течение ночи. Реакционную смесь оставляют охлаждаться и выпаривают растворитель (в вакууме) с образованием масла. Масло очищают препаративной ТСХ (МеОН/NH4OH/CН2Cl2, 5:0,5:94,5), получая соединение 7 в виде белого твердого вещества. Масс-спектр (МН+) = 583,4.
Пример 2
2-{4-[3-(Бензотиазол-2-илокси)-2-гидроксипропил]пиперазин-1-ил}-N-(2,6-диметилфенил)ацетамид (43)

Синтез 2-(оксиран-2-илметокси)бензотиазола (44)

Соединение 44 получают аналогично способу получения соединения 6, заменяя соединение 8 2-гидроксибензотиазолом в части С-5 примера 1.
Соединение 43 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 44 в части D синтеза соединения 7. Масс-спектр (МН+)=455,3.
Пример 3
N-(2, 6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазин-1-ил}ацетамид (45)
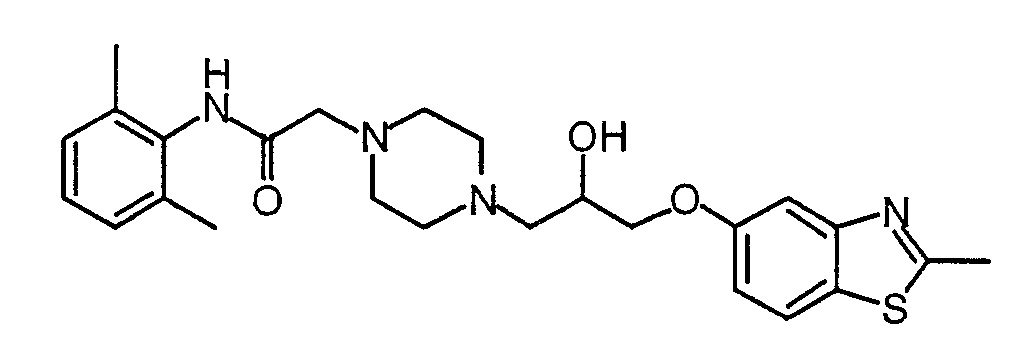
Синтез 2-метил-5-(оксиран-2-илметокси)бензотиазола (33)
Соединение 33 получают аналогично способу получения соединения 6, заменяя соединение 8 2-метилбензотиазол-5-олом в части С-5 примера 1.
Соединение 45 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 33 в части D синтеза соединения 7. Масс-спектр (МН+)=469,3.
Пример 4
Амид 4-(3-{4-[(2, 6-диметилфенилкарбамоил)метил]пиперазин-1-ил}-2-гидроксипропокси)-1Н-индол-2-карбоновой кислоты (46)

Соединение 19 получают аналогично способу получения соединения 7, заменяя соединение 6 коммерчески производимым 4-глицидилокси-2-индолкарбоксамидом в части D синтеза соединения 7. Масс-спектр (МН+)=480,4.
Пример 5
2-{4-[3-(Бензотиазол-6-илокси)-2-гидроксипропил]пиперазин-1-ил}-N-(2,6-диметилфенил)ацетамид (47)

Синтез бензотиазол-6-ола (16)

К раствору 6-аминобензотиазола (1,0 г, 6,66 ммоль) в воде (22 мл) и H2SO4 (16 мл) при 5°С добавляют раствор нитрита натрия (460 мг, 6,72 ммоль) в воде (13 мл), поддерживая температуру ниже 5°С. Полученный раствор перемешивают в течение 15 минут. Реакционную смесь нагревают до 160°С и медленно добавляют раствор H2SO4 (50 мл) и воду (38 мл). Полученную смесь перемешивают в течение 1 часа. Смесь оставляют охлаждаться и добавляют водный раствор 50% гидроксида натрия до достижения рН 7. Смесь экстрагируют этилацетатом и промывают насыщенным раствором соли. Объединенную органическую часть сушат над MgSO4 и упаривают с образованием полутвердого вещества. Полутвердое вещество очищают колоночной хроматографией (40% этилацетата/гексаны), получая бензотиазол-6-ол 16 в виде не совсем белого твердого вещества.
Синтез 6-(оксиран-2-илметокси)бензотиазола (48)

Соединение 48 получают аналогично способу получения соединения 6, заменяя соединение 8 соединением 16 в части С-5 примера 1.
Соединение 47 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 48 в части D синтеза соединения 7. Масс-спектр (МН+)=455,3.
Пример 6
N-(2, 6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-6-илокси)пропил]пиперазин-1-ил}ацетамид (49)

Синтез 2-метилбензотиазол-6-ола (50)

Соединение 50 получают из коммерчески производимого 6-метокси-2-метилбензотиазола аналогично способу получения, описанному в части С-4 примера 1.
Синтез 2-метил-6-(оксиран-2-илметокси)бензотиазола (51)

Соединение 51 получают аналогично способу получения соединения 6, заменяя соединение 8 соединением 50 в части С-5 примера 1.
Соединение 49 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 51 в части D синтеза соединения 7. Масс-спектр (МН+)=469,3.
Пример 7
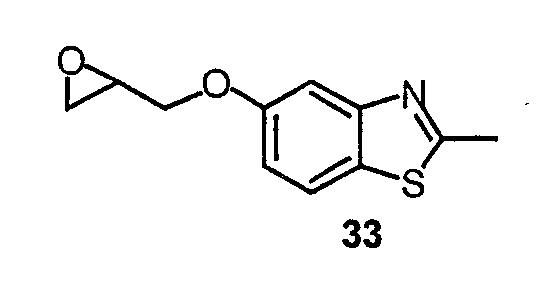
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3,5-диметилпиперазин-1-ил}ацетамид (52)
Синтез N-(2,6-диметилфенил)-2-(3,5-диметилпиперазин-1-ил)ацетамида (53)

Соединение 53 получают аналогично способу получения соединения 3, заменяя пиперазин 2,6-диметилпиперазином в части А примера 1.
Соединение 52 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 33 и соединение 5 соединением 53 в части D синтеза соединения 7. Масс-спектр (МН+)=497,4.
Пример 8
2-{4-[2-Гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазин-1-ил}-N-(4-гидроксифенил)ацетамид (54)

Синтез 4-аминофенилацетата (55)
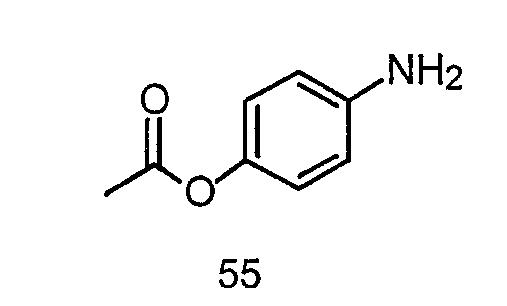
Соединение 55 получают аналогично способу получения соединения 12, заменяя соединение 11 4-нитрофенилацетатом в части С-1 примера 1.
Синтез 4-(2-хлорацетиламино)фенилацетата (56)

Соединение 56 получают аналогично способу получения соединения 3, заменяя соединение 1 соединением 55 в части А примера 1.
Синтез 4-(2-пиперазинилацетиламино)фенилацетата (57)

Соединение 57 получают аналогично способу получения, описанному в части В примера 1, заменяя соединение 3 соединением 56.
Соединение 54 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 33 и соединение 5 соединением 57 в части D синтеза соединения 7. Масс-спектр (МН+)=457,5.
Пример 9
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазин-1-ил}ацетамид (58)
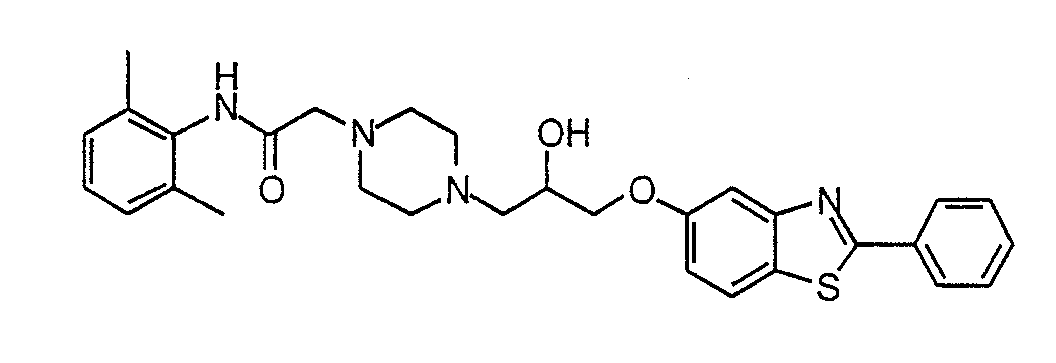
Синтез фенил-N-[3-(фенилметокси)фенил]карбоксамида (25)

К раствору 3-бензилоксианилина 23 (1,0 г, 5,0 ммоль) и TEA (0,74 мл, 5,3 ммоль) в CН2Cl2 по каплям добавляют бензоилхлорид (0,61 мл, 5,26 ммоль) и смесь перемешивают в течение ночи. Реакционную смесь разбавляют водой и полученное твердое вещество отфильтровывают в вакууме. Твердое вещество сушат на воздухе, получая соединение 25 в виде белого твердого вещества.
Синтез фенил{[(3-фенилметокси)фенил]амино}метан-1-тиона (26)

Раствор соединения 25 (455 мг, 1,5 ммоль) и реагента Лавессона (0,6 мол. экв.) в хлорбензоле (15 мл) нагревают до 120°С и перемешивают в течение 1,5 часов. Реакционную смесь оставляют охлаждаться и выпаривают растворитель (в вакууме). Остаток очищают колоночной хроматографией (этилацетат/гексан, 1:9), получая соединение 26 в виде желтого твердого вещества.
Синтез 2-фенил-5-(фенилметокси)бензотиазола (27)
К раствору соединения 26 (960 мг, 3 ммоль) в этаноле (5 мл) добавляют водный раствор гидроксида натрия (30%, 8 мол. экв.). Смесь разбавляют водой (6 мл) и получают конечный 10% водный раствор гидроксида натрия. Полученный раствор добавляют аликвотами (1 мл) к перемешиваемому раствору феррицианида калия (4 мол. экв.) в воде при 90°С и полученную смесь нагревают в течение 30 минут. Реакционную смесь оставляют охлаждаться и экстрагируют продукт этилацетатом. Органический слой сушат и упаривают. Остаток, смесь соединений 27 и 28, очищают на колонке (этилацетат/гексан, 1:99), получая соединение 27 в виде белого твердого вещества.
Синтез 2-фенилбензотиазол-5-ола (29)
Гидроксид палладия (100 мг) добавляют к раствору соединения 27 (260 мг, 0,8 ммоль) в этаноле/циклогексене (5 мл/2 мл) и кипятят с обратным холодильником в течение 16 часов. Реакционную смесь охлаждают и катализатор удаляют фильтрованием (через целит). Растворитель выпаривают, получая соединение 29 в виде белого твердого вещества.
Синтез 5-(оксиран-2-илметокси)-2-фенилбензотиазола (59)

Соединение 59 получают аналогично способу получения соединения 6, заменяя соединение 8 соединением 29 в части С-5 примера 1.
Соединение 58 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 59 в части D синтеза соединения 7. Масс-спектр (МН+) = 531,6.
Пример 10
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензоксазол-5-илокси)пропил]пиперазин-1-ил}ацетамид (60)

Синтез 5-(оксиран-2-илметокси)-2-фенилбензоксазола (61)

Соединение 61 получают аналогично способу получения соединения 6, заменяя соединение 13 гидрохлоридом этилбензимидата в части С1-5 примера 1.
Соединение 60 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 61 в части D синтеза соединения 7. Масс-спектр (МН+)=515,3.
Пример 11
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-фенилбензотиазол-7-илокси)пропил]пиперазин-1-ил}ацетамид (62)

Синтез 7-(оксиран-2-илметокси)-2-фенилбензотиазола (63)
Соединение 63 получают аналогично способу получения соединения 59, заменяя соединение 29 соединением 28 со снятой защитой в примере 9.
Соединение 62 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 63 в части D синтеза соединения 7. Масс-спектр (МН+)=531,3.
Пример 12
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2-оксопиперазин-1-ил}ацетамид (64)

Синтез фенилметил-4-{[N-(2,6-диметилфенил)карбамоил]метил}-3-оксопиперазинкарбоксилата (31)
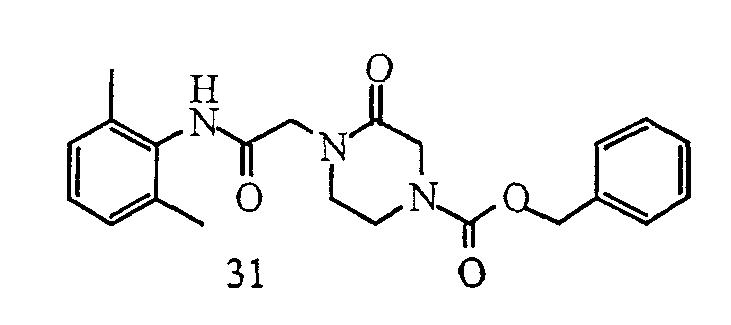
К раствору соединения 30 (252 мг, 1,3 ммоль) в ТГФ (13 мл) и NaH (62 мг, 1,6 ммоль) добавляют соединение 3 (300 мг, 1,3 ммоль). Раствор перемешивают в атмосфере азота в течение ночи. Реакционную смесь гасят водой (0,1 мл) и сушат над Na2SO4. Раствор концентрируют и очищают колоночной хроматографией, получая соединение 31 в виде твердого вещества.
Синтез N-(2,6-диметилфенил)-2-(2-оксопиперазинил)ацетамида (32)

К раствору соединения 31 в метаноле (10 мл) добавляют 10% палладий на угле. В реактор вводят водород (2,8 атм (40 фунтов/кв.дюйм)) и реакционную смесь перемешивают в течение 4 часов. Катализатор удаляют фильтрованием, фильтрат концентрируют и очищают колоночной хроматографией (МеОН:DCM, 1:15), получая соединение 32 в виде полутвердого соединения.
Соединение 64 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 33 и соединение 5 соединением 32 в части D синтеза соединения 7. Масс-спектр (МН+)=483,3.
Пример 13
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-метилбензоксазол-5-илокси)пропил]пиперазин-1-ил}ацетамид (65)

Синтез 5-метокси-2-метилбензоксазола (19)

Раствор 2-амино-4-метоксифенола 17 (8 г, 57,4 ммоль) в триметилортоацетате 18 (50 мл) нагревают до температуры кипения с обратным холодильником и перемешивают в течение 24 часов. Реакционную смесь оставляют охлаждаться и избыток растворителя 18 выпаривают (в вакууме). Остаток растворяют в этилацетате и промывают водой. Органический слой сушат над MgSO4 и обрабатывают активированный углем Norit A. Полученный раствор фильтруют через целит 521 и упаривают с образованием масла. Масло хроматографируют на силикагеле (20% этилацетата/гексаны), получая соединение 19 в виде светло-желтого твердого вещества.
Синтез 2-метил-5-оксиран-2-илметоксибензоксазола (67)

Соединение 67 получают аналогично способу получения соединения 6, заменяя соединение 8 6-гидрокси-2-метилбензоксазолом 66 в части С-5 примера 1.
Соединение 66 в свою очередь получают, снимая защиту у соединения 19, как описано в части С-4 примера 1.
Соединение 65 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 67 в части D синтеза соединения 7. Масс-спектр (МН+)=543,4.
Пример 14
N-(2,6-Диметилфенил)-2-(4-{2-гидрокси-3-[2-(4-трифторметилфенил)-бензоксазол-5-илокси]пропил}пиперазин-1-ил)ацетамид (68)
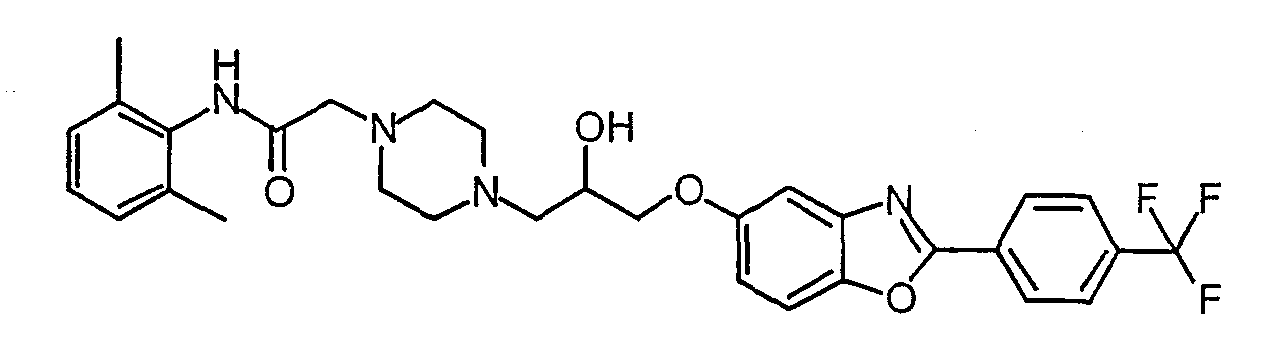
Синтез 5-(оксиран-2-илметокси)-2-(4-трифторметилфенил)бензоксазола (69)

Соединение 69 получают аналогично способу получения соединения 6, заменяя соединение 13 гидрохлоридом этилового эфира 4-трифторметил-бензимидокислоты в части С1-5 примера 1.
Соединение 68 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 69 в части D синтеза соединения 7. Масс-спектр (МН+)=583,4.
Пример 15
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(хиноксалин-2-илокси)пропил]пиперазин-1-ил}ацетамид (70)

Синтез 2-(оксиран-2-илметокси)хиноксалина (71)

Соединение 71 получают аналогично способу получения соединения 6, заменяя соединение 8 хиноксалин-2-олом в части С-5 примера 1.
Соединение 70 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 71 в части D синтеза соединения 7. Масс-спектр (МН+)=450,9.
Пример 16
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(пиридин-3-илокси)пропил]пиперазин-1-ил}ацетамид (72)
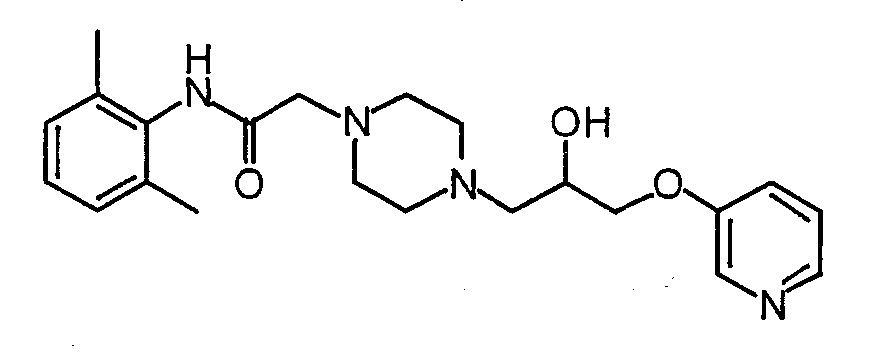
Синтез 3-(оксиран-2-илметокси)пиридина (73)
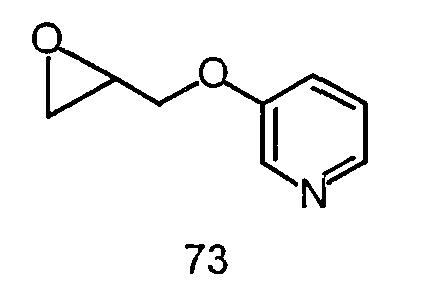
Соединение 73 получают аналогично способу получения соединения 6, заменяя соединение 8 3-гидроксипиридином в части С-5 примера 1.
Соединение 72 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 73 в части D синтеза соединения 7. Масс-спектр (МН+)=399,4.
Пример 17
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(хинолин-4-илокси)пропил]пиперазин-1-ил}ацетамид (74)

Синтез 4-(оксиран-2-илметокси)хинолина (75)

Соединение 75 получают аналогично способу получения соединения 6, заменяя соединение 8 4-гидроксихинолином в части С-5 примера 1.
Соединение 74 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 75 в части D синтеза соединения 7. Масс-спектр (МН+)=449,4.
Пример 18
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(изохинолин-5-илокси)пропил]пиперазин-1-ил}ацетамид (76)
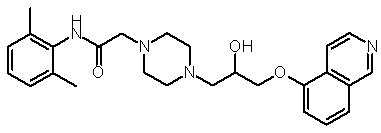
Синтез 5-(оксиран-2-илметокси)изохинолина (77)
Соединение 77 получают аналогично способу получения соединения 6, заменяя соединение 8 5-гидроксиизохинолином в части С-5 примера 1.
Соединение 76 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 77 в части D синтеза соединения 7. Масс-спектр (МН+)=449,4.
Пример 19
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(хинолин-6-илокси)пропил]пиперазин-1-ил}ацетамид (78)

Синтез 6-(оксиран-2-илметокси)хинолина (79)

Соединение 79 получают аналогично способу получения соединения 6, заменяя соединение 8 6-гидроксихинолином в части С-5 примера 1.
Соединение 78 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 79 в части D синтеза соединения 7. Масс-спектр (МН+)=449,4.
Пример 20
N-(2,6-Диметилфенил)-2-{4-[2-гидрокси-3-(2-метилхинолин-7-илокси)пропил]пиперазин-1-ил}ацетамид (80)

Синтез 2-метил-7-(оксиран-2-илметокси)хинолина (81)

Соединение 81 получают аналогично способу получения соединения 6, заменяя соединение 8 7-гидрокси-2-метилхинолином в части С-5 примера 1.
Соединение 80 получают аналогично способу получения соединения 7, заменяя соединение 6 соединением 81 в части D синтеза соединения 7. Масс-спектр (МН+)=463,5.
Пример 21
2-{4-[3-(Бензотиазол-2-иламино)-2-гидроксипропил]пиперазинил}-N-(2,6-диметилфенил)ацетамид (39)

Синтез (фенилметокси)-N-проп-2-енилкарбоксамида (42)

К раствору аллиламина (3,34 г, 5,85 ммоль) в дихлорметане (100 мл) и триэтиламине (16 мл) добавляют бензилхлорформиат (8,25 мл, 5,78 ммоль) при 0°С. Смесь перемешивают при 0°С в течение 2 часов и еще 90 минут при комнатной температуре. Растворитель удаляют выпариванием и остаток очищают флэш-колоночной хроматографией (30% EtOAc/гексаны), получая соединение 42 в виде прозрачного масла.
Синтез N-(оксиран-2-илметокси)(фенилметокси)карбоксамида (35)

Соединение 42 (5,0 г, 2,61 ммоль) обрабатывают м-хлорпербензойной кислотой (11,71 г, 9,1 ммоль) в дихлорметане (110 мл) при комнатной температуре в течение 18 часов. Дихлорметан выпаривают с образованием вязкого масла, которое очищают колоночной флэш-хроматографией (30% EtOAc/ гексаны), получая соединение 35 в виде прозрачного масла.
Синтез N-(2,6-диметилфенил)-2-(4-{2-гидрокси-3-[фенилметокси]карбониламино]пропил}пиперазинил)ацетамида (36)
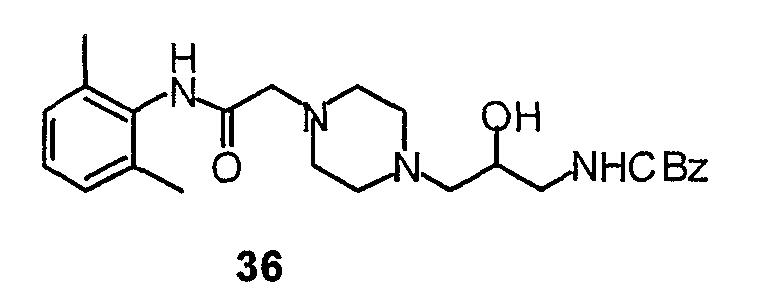
Раствор соединения 42 (2,5 г, 1,2 ммоль) и соединения 5 (5,94 г, 2,4 ммоль) в этаноле (100 мл) и триэтиламине (3,34 мл) нагревают с обратным холодильником в течение 18 часов. Растворители удаляют и остаток очищают колоночной флэш-хроматографией (этилацетат), получая соединение 36 в виде белого твердого вещества.
Синтез 2-[4-(3-амино-2-гидроксипропил)пиперазинил]-N-(2,6-диметилфенил)ацетамида (37)
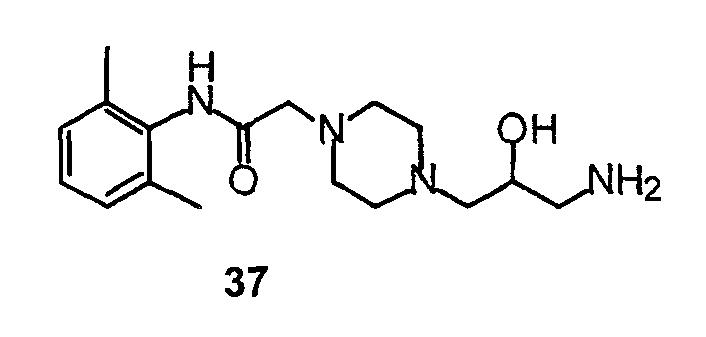
Раствор соединения 36 (3,0 г, 0,66 ммоль) в метаноле (70 мл) в присутствии 10% палладия на угле (0,337 г) перемешивают в атмосфере водорода в течение 16 часов. Катализатор отфильтровывают и реакционную смесь концентрируют, получая соединение 37 в виде липкого твердого вещества.
К раствору соединения 37 (75 мг) в этаноле (2 мл) добавляют триэтиламин (0,13 мл) и 2-хлорбензтиазол (87 мг) и нагревают при температуре кипения с обратным холодильником в течение 16 часов. Реакционную смесь концентрируют и очищают препаративной ТСХ (5% МеОН/дихлорметан), получая соединение 39 в виде белого твердого вещества. Масс-спектр (МН+)=454,4.
Пример 22
2-{4-[3-(Бензоксазол-2-иламино)-2-гидроксипропил]пиперазинил}-N-(2, 6-диметилфенил)ацетамид (82)

Соединение 82 получают аналогично способу получения соединения 39, заменяя 2-хлорбензотиазол, используемый в примере 21, 2-хлорбензоксазолом. Масс-спектр (МН+)=438,4.
Нижеследующие соединения получают способами, описанными в примерах 1-21. Все указанные соединения характеризуются удовлетворительными масс-спектроскопическими данными (МН+).
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2,5-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[(2R)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3,3-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{(2R)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[(2R)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил](1,4-диазапергидроэпинил)}-N-(2,6-диметилфенил)ацетамид
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(4-гидроксифенил)ацетамид
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2, 6-диметилпиперазинил}-N-(4-карбоксамидофенил)ацетамид
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[(2R)-2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2, 6-диметил-4-гидроксифенил)ацетамид
2-{5-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]-2,5-диазабицикло[2.2.1]гепт-2-ил}-N-(2,6-диметилфенил)ацетамид
2-{4-[(2S)-2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(4-сульфамоилфенил)ацетамид
2-{(3S)-4-[(2S)-2-гидрокси-3-(2-фенилбензоксазол-5-илокси)пропил]-3-метилпиперазинил}-N-(2,6-диметилфенил)ацетамид
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-нафтилацетамид
N-[4-хлор-3-(трифторметил)фенил]-2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}ацетамид
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-фенилацетамид
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,4, 5-трихлорфенил)ацетамид
2-{4-[2-гидрокси-3-(4-метоксифенил)пропил]пиперазинил}-N-(3,4,5-трихлорфенил)ацетамид
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(2-хлор-4-метилфенил)ацетамид
2-{4-[2-гидрокси-3-(2-метилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,4, 5-трихлорфенил)ацетамид
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,5-дихлорфенил)ацетамид
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-(3,4-дихлорфенил)ацетамид
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-[3-метокси-5-(трифторметил)фенил]ацетамид
2-{4-[2-гидрокси-3-(2-фенилбензотиазол-5-илокси)пропил]пиперазинил}-N-[3, 5-дихлорфенил]ацетамид
2-{4-[2-гидрокси-3-(2-((1Е)бута-1,3-диенил)бензотиазол-5-илокси)пропил]пиперазинил}-N-[4-хлор-2-метокси-5-метилфенил]ацетамид
Пример 23
Митохондриальные анализы
Митохондрии из сердца крыс выделяют методом Недергарда и Кэннона (Methods in Enzymol., 55, 3, 1979).
Окисление пальмитоил-СоА. Окисление пальмитоил-СоА проводят при общем объеме 100 мкл, с содержанием следующих веществ: 110 мМ KCl, 33 мМ трис-буфера с рН 8, 2 мМ KPi, 2 мМ MgCl2, 0,1 мМ EDTA, 14,7 мкМ обезжиренного бычьего сывороточного альбумина (BSA), 0,5 мМ яблочной кислоты, 13 мМ карнитина, 1 мМ ADP, 52 мкг митохондриального белка и 16 мкМ пальмитоил-СоА, меченного по положению 1 радиоактивным изотопом С14 (удельная активность 60 мСi/ммоль; 20 мкCi/мл с использованием 5 мкл в одном анализе). Соединения по данному изобретению добавляют в раствор ДМСО в следующих концентрациях: 100 мкМ и 50 мкМ. В каждом анализе используют контрольный образец, содержащий только ДМСО. Смесь инкубируют при 30°С в течение 15 минут, после чего продукт ферментативной реакции центрифугируют (при ускорении 20000 g в течение 1 минуты) и 70 мкл супернатанта вводят в активированную колонку с кремниевой кислотой для хроматографии с обращенной фазой (примерно 0,5 мл кремниевой кислоты). Колонку элюируют 2 мл воды и 0,5 мл элюента используют для сцинтилляционного подсчета с целью определения количества С14, улавливаемого в виде бикарбонатного иона С14.
В таблице 1 приведено ингибирование окисления жирной кислоты митохондрий с использованием пальмитоил-СоА в качестве субстрата -% содержание испытуемого вещества в 2-х концентрациях и IC50
Таблица 1
Пример 25
Метаболическая устойчивость. Для измерения метаболической устойчивости соединения по данному изобретению инкубируют с микросомными фракциями S-9 печени человека. Реакционную смесь инкубируют при 37°С в течение 30 минут и при помощи ЖХ – масс-спектроскопии определяют оставшееся количество исходного лекарственного вещества. Параметры ответа на каждое соединение определяют путем построения стандартной кривой и использования внутреннего эталона при выполнении анализа образцов. Процентное содержание ранолазина по истечении 30 минут, представляющее среднее значение для пяти экспериментов, составляет 57%. Соединения по данному изобретению анализируют в соответствии с приведенной ниже методикой и процентное содержание оставшегося исходного лекарственного вещества делят на среднее %-ное содержание оставшегося ранолазина (57%), определяя таким образом коэффициент метаболической устойчивости. Соединение, имеющее коэффициент устойчивости выше 1,2, характеризуется лучшей устойчивостью, чем ранолазин при выполнении анализа S-9 печени. Соединение, имеющее коэффициент устойчивости от 1,2 до 0,8, характеризуется эквивалентной устойчивостью при выполнении анализа S-9 печени. Соединение, имеющее коэффициент устойчивости менее 0,8, характеризуется меньшей устойчивостью, чем ранолазин при выполнении анализа S-9 печени.
Целью данного эксперимента является сравнение процентного содержания оставшихся соединений по настоящему изобретению с процентным содержанием оставшегося ранолазина после инкубации фракций S9 печени человека в течение 30 минут.
Реагенты
При выполнении анализа используют нижеследующие реагенты: фосфат калия, 0,5 М раствор, рН 7,4 (буфер для инкубации), находящийся при комнатной температуре; 0,05 М раствор MgCl2, находящийся при 4°С; тетранатриевую соль восстановленного β-никотинамидадениндинуклеотидфосфата (NADPH), 0,02 М раствор в воде (~16,6 мг/мл) фирмы Sigma, партия №79Н7044, полученная в день использования. 1 мМ ранолазина или соединений 43, 45, 47, 52, 70, 74, 76, 78 и 80 в АCN разводят до 100 мкМ в 10% АCN; исходный раствор S9 человека: 20 мг/мл фирмы Gentest.
Методика выполнения анализа
Инкубируемые смеси получают следующим образом.
Все компоненты (табл.2) объединяют с буфером для инкубации и пипеткой вводят в пробирку 200 мкл смеси + 25 мкл испытуемого соединения вместе с 25 мкл S-9.
Смесь предварительно инкубируют при 37°С в течение 5 минут, затем через 0 и 30 минут после начала реакции удаляют 50 мкл аликвоту инкубируемой смеси и добавляют к 100 мкл смеси ацетонитрил : метанол (9:1), содержащей внутренний эталон.
Смесь центрифугируют и 100 мкл аликвоту супернатанта разводят в 1 мл растворителя С (0,1% муравьиной кислоты в воде). Образцы анализируют при помощи ЖХ/МС (введение 10 мкл) для определения изменения соотношения между испытуемым соединением и внутренним эталоном в периоды времени, соответствующие 0 и 30 минутам.
Анализ и расчет данных
Образцы анализируют для выявления исходных соединений и возможных метаболитов при помощи ЖХ/МС с использованием внутреннего эталона и колонки ODS-C18 при объемном расходе 0,25 мл/мин. В соответствии с описанной выше методикой получают приведенные в таблице 3 коэффициенты относительной устойчивости для соединений по данному изобретению по сравнению с ранолазином.
Реферат
Настоящее изобретение относится к производным гетероарилалкилпиперазина общей формулы (I):

где m равно 1, 2 или 3; q означает NH или O; R1, R2, R3, R4 и R5 независимо выбирают из группы, включающей водород, C1-15 алкил, OR20, R20 представляет водород; R6, R7 и R8 представляют водород; R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбирают из группы, включающей водород, C1-4 алкил, или R9 и R10 вместе с атомом углорода, к которому они присоединены, образуют карбонил; R17 означает гетероарил, который выбирают из группы, включающей индолил, бензоксазолил, бензотиазолил, хинолинил, изохинолинил, пиридил, бензопиразинил, необязательно замещенный 1-2 заместителями, выбираемыми из группы, включающей водород, CF3, C1-8 алкил, фенил, CON(R20)2. Соединения обладают свойством частичного ингибитора окисления жирных кислот и могут быть использованы для применения в терапии для защиты скелетных мышц от последствий мышечных или системных заболеваний. Описана также фармацевтическая композиция на основе заявленных соединений. 3 c. и 36 з.п.ф-лы, 3 табл.
Формула


Комментарии