Кристаллы производных 6,7-ненасыщенного-7-карбамоилморфинана и способ их получения - RU2607084C2
Код документа: RU2607084C2
Чертежи

















Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к кристаллам производных морфинана и к способу их получения. Более подробно настоящее изобретение относится к кристаллам производных 6,7-ненасыщенного-7-карбамоилморфинана, его солей присоединения кислоты и/или сольватов, и к способу их получения.
УРОВЕНЬ ТЕХНИКИ
[0002] Для доставки лекарственных средств желательны кристаллические формы, обладающие превосходными химическими и/или физическими свойствами.
В патентном документе 1 раскрыто, что производное 6,7-ненасыщенного-7-карбамоилморфинана, представленное следующей формулой:

можно использовать в качестве терапевтического и/или профилактического агента для лечения рвоты и/или запора. Хотя следующее соединение (I-284):

раскрыто в форме свободной соли, в примерах указанного патента конкретно не раскрыты соли присоединения кислот и/или сольваты. Далее, в патенте вовсе отсутствует описание его кристаллической формы.
В качестве способа получения производного 6,7-ненасыщенного-7-карбамоилморфинана, раскрыт только способ синтеза соответствующего производного 7-карбамоила из 7-карбоксипроизводного, как представлено следующей формулой:

ДОКУМЕНТ УРОВНЯ ТЕХНИКИ
[0003] [Патентные документы]
[Патентный документ 1] Международная патентная публикация заявки WO 2006/126637
[Патентный документ 2] Международная патентная публикация заявки WO 2001/002375
[0004] [Непатентные документы]
[Непатентный документ 1] Chemical Communications, 1998, vol.23, 2575-2576
[Непатентный документ 2] Synthesis, 1989, vol.2, 131-132
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, КОТОРЫЕ ДОЛЖНО РЕШИТЬ ИЗОБРЕТЕНИЕ
[0005] Активные ингредиенты лекарственных средств могут иметь существенно отличающиеся физические свойства, зависящие от каждой твердой формы. Различия в таких физических свойствах в указанных активных ингредиентах могут влиять, например, на способы получения или способы введения активных ингредиентов лекарственных средств или фармацевтических композиций, включающих указанные активные ингредиенты.
Несмотря на то, что сами производные 6,7-ненасыщенного-7-карбамоилморфинана уже были описаны, было желательно раскрыть подходящие соли и/или стабильные кристаллические формы и более подходящие способы их получения для использования в лекарственных средствах или для промышленного производства лекарственных средств.
СРЕДСТВА РЕШЕНИЯ УКАЗАННЫХ ПРОБЛЕМ
[0006] В результате интенсивных исследований авторы настоящего изобретения обнаружили, что стабильные кристаллы получают из соединений, представленных следующей формулой (IA):

их солей присоединения кислот и/или сольватов, и осуществили следующее изобретение.
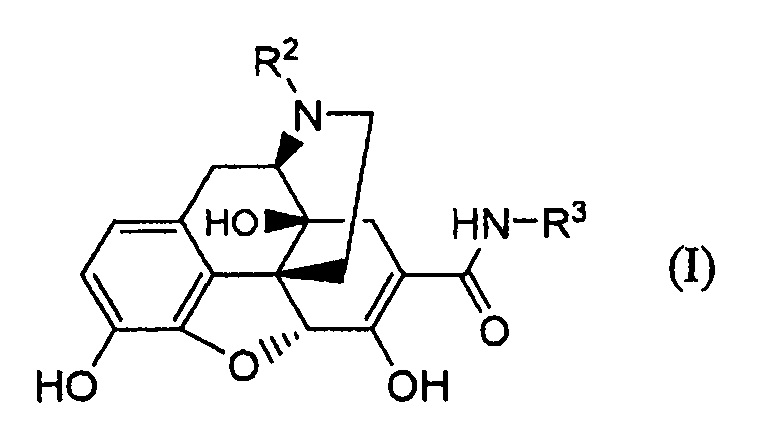
Далее авторы обнаружили, что соединение следующей формулы (I):
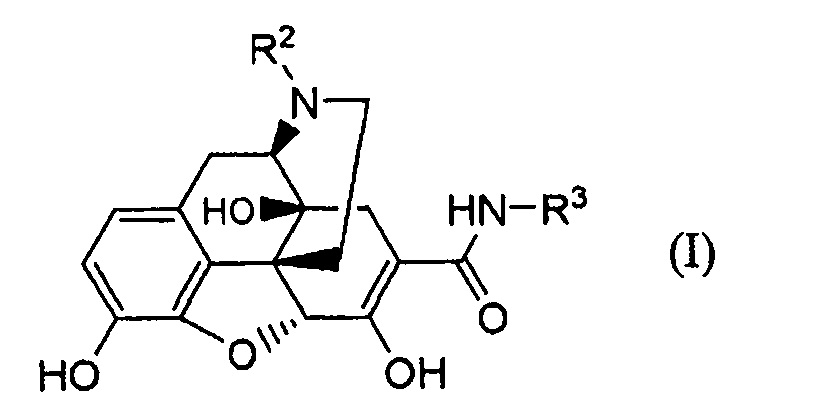
где R2 представляет собой необязательно замещенный низший алкил и R3 представляет собой необязательно замещенный низший алкил, необязательно замещенный циклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил, получают, осуществляя взаимодействие карбаматного производного следующей формулы (II):

где R1 представляет собой водород или защитную группу для гидроксила, и R2 и R3 имеют указанные выше значения; в присутствии основания, и удаляя защитную группу R1, тем самым осуществляя настоящее изобретение в отношении нового способа получения производного 6,7-ненасыщенного-7-карбамоилморфинана.
[0007] В настоящем изобретении предложено следующее.
(1) Соль п-толуолсульфоновой кислоты, соль уксусной кислоты или соль хлористоводородной кислоты соединения следующей формулы (IA):
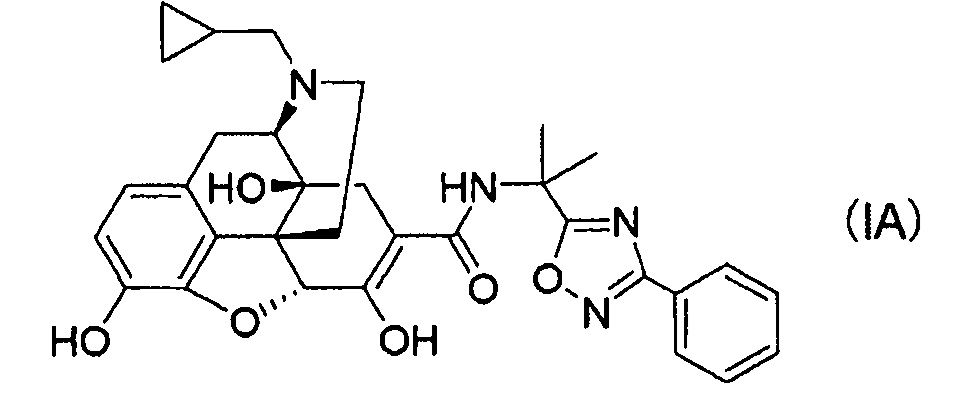
или сольват указанного соединения, или его соль присоединения кислоты.
[0008]
(2) Кристаллы соли п-толуолсульфоновой кислоты соединения следующей формулы (IA):

или кристаллы сольвата его соли присоединения кислоты.
[0009]
(3) Кристаллы соли п-толуолсульфоновой кислоты по п. (2), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 7,8°±0,2°, 10,6°±0,2°, 15,6°±0,2°, 17,8°±0,2° и 21,5°±0,2°.
(4) Кристаллы соли п-толуолсульфоновой кислоты по п. (2), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 7,8°±0,2°, 10,6°±0,2°, 15,6°±0,2°, 17,8°±0,2°, 18,6°±0,2°, 20,4°±0,2°, 21,5°±0,2°, 21,9°±0,2°, 23,6°±0,2° и 25,5°±0,2°.
(5) Кристаллы соли п-толуолсульфоновой кислоты по п. (2), отличающиеся рентгеновским дифракционным спектром порошка, который практически идентичен спектру, представленному на ФИГ. 1.
[0010]
(6) Форма I кристаллической формы гидрата соли п-толуолсульфоновой кислоты по п. 2, где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 12,9°±0,2°, 17,6°±0,2°, 22,4°±0,2°, 25,4°±0,2° и 28,7°±0,2°.
(7) Форма I кристаллической формы гидрата соли п-толуолсульфоновой кислоты по п. (2), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 6,6°±0,2°, 8,9°±0,2°, 11,4°±0,2°, 12,9°±0,2°, 14,0°±0,2°, 15,0°±0,2°, 17,6°±0,2°, 18,2°±0,2°, 22,4°±0,2°, 25,4°±0,2° и 28,7°±0,2°.
(8) Форма I кристаллической формы гидрата соли п-толуолсульфоновой кислоты по п. (2), отличающаяся рентгеновским дифракционным спектром порошка, который практически идентичен спектру, представленному на ФИГ. 2.
[0011]
(9) Форма II кристаллической формы гидрата соли п-толуолсульфоновой кислоты по п. (2), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 8,8°±0,2°, 17,5°±0,2°, 21,9°±0,2°, 23,7°±0,2° и 26,1°±0,2°.
(10) Форма II кристаллической формы гидрата соли п-толуолсульфоновой кислоты по п. (2), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 7,1°±0,2°, 8,8°±0,2°, 17,5°±0,2°, 19,2°±0,2°, 19,7°±0,2°, 21,2°±0,2°, 21,9°±0,2°, 23,7°±0,2°, 24,5°±0,2° и 26,1°±0,2°.
(11) Форма II кристаллической формы гидрата соли п-толуолсульфоновой кислоты по п. (2), отличающаяся рентгеновским дифракционным спектром порошка, который практически идентичен спектру, представленному на ФИГ. 3.
[0012]
(12) Кристаллы соли уксусной кислоты соединения формулы (IA):

или кристаллы сольвата его соли присоединения кислоты.
(13) Кристаллы соли уксусной кислоты по п. (12), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 5,6°±0,2°, 10,3°±0,2°, 12,0°±0,2°, 14,6°±0,2° и 26,0°±0,2°.
(14) Кристаллы соли уксусной кислоты по п. (12), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 5,6°±0,2°, 8,3°±0,2°, 9,1°±0,2°, 10,3°±0,2°, 12,0°±0,2°, 13,5°±0,2°, 14,6°±0,2°, 16,3°±0,2° и 26,0°±0,2°.
(15) Кристаллы соли уксусной кислоты по п. (12), отличающиеся рентгеновским дифракционным спектром, который практически идентичен спектру, представленному на ФИГ. 4.
[0013]
(16) Кристаллы соли хлористоводородной кислоты соединения формулы (IA):

или кристаллы сольвата соли присоединения кислоты.
(17) Кристаллы соли хлористоводородной кислоты по п. (16), где указанные кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 8,5°±0,2°, 12,7°±0,2°, 15,6°±0,2°, 17,3°±0,2° и 23,9°±0,2°.
(18) Кристаллы соли хлористоводородной кислоты по п. (16), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 8,5°±0,2°, 10,8°±0,2°, 11,3°±0,2°, 12,7°±0,2°, 13,9°±0,2°, 15,6°±0,2°, 17,3°±0,2°, 19,2°±0,2°, 20,1°±0,2° и 23,9°±0,2°.
(19) Кристаллы соли хлористоводородной кислоты по п. (16), отличающиеся рентгеновским дифракционным спектром порошка, который практически идентичен спектру, представленному на ФИГ. 5.
[0014]
(20) Кристаллы соединения формулы (IA):
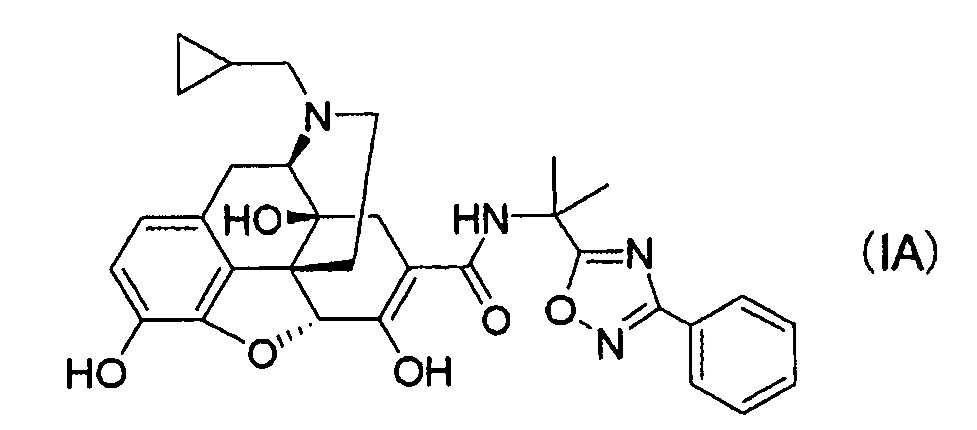
или кристаллы его сольвата.
(21) Кристаллы соединения формулы (IA) по п. (20), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 13,5°±0,2°, 21,6°±0,2°, 22,1°±0,2°, 23,4°±0,2° и 26,7°±0,2°.
(22) Кристаллы соединения формулы (IA) по п. (20), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 6,8°±0,2°, 11,7°±0,2°, 13,5°±0,2°, 15,6°±0,2°, 16,7°±0,2°, 21,6°±0,2°, 22,1°±0,2°, 23,4°±0,2°, 26,7°±0,2° и 30,1°±0,2°.
(23) Кристаллы соединения формулы (IA) по п. (20), отличающиеся рентгеновским дифракционным спектром порошка, который практически идентичен спектру, представленному на ФИГ. 7.
[0015]
(24) Кристаллы этанольного сольвата по п. (20), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 11,0°±0,2°, 16,5°±0,2°, 20,5°±0,2°, 21,8°±0,2° и 22,6°±0,2°.
(25) Кристаллы этанольного сольвата по п. (20), где кристаллы характеризуются пиками в рентгеновском дифракционном спектре порошка, соответствующими дифракционным углам (2θ): 6,9°±0,2°, 11,0°±0,2°, 12,9°±0,2°, 13,4°±0,2°, 16,5°±0,2°, 20,5°±0,2°, 21,3°±0,2°, 21,8°±0,2°, 22,6°±0,2° и 25,1°±0,2°.
(26) Кристаллы этанольного сольвата по п. (20), отличающиеся рентгеновским дифракционным спектром, который практически идентичен спектру, представленному на фиг. 6.
(27) Фармацевтическая композиция, включающая кристаллы по любому одному из пп. (2)-(26).
(27A) Антагонист опиоидного рецептора, включающий кристаллы по любому одному из пп. (2)-(26).
(27B) Терапевтический и/или профилактический агент для лечения тошноты, рвоты и/или запора, где указанный агент включает кристаллы по любому одному из пп. (2)-(26).
(27C) Ослабляющий действие и/или профилактический агент для лечения побочных эффектов, вызванных соединением, обладающим агонистической активностью в отношении опиоидного рецептора, где указанный агент включает кристаллы по любому одному из пп. (2)-(26).
(27D) Терапевтический и/или профилактический агент по п. (27C), где побочными эффектами являются тошнота, рвота и/или запор.
(27E) Терапевтический и/или профилактический агент по п. (27C) или (27D), где указанным соединением, обладающим агонистической активностью в отношении опиоидного рецептора, является морфин, оксикодон, гидрокодон, трамадол, или их фармацевтически приемлемые соли или сольваты.
(27F) Использование кристаллов по любому одному из пп. (2)-(26) для получения терапевтического и/или профилактического агента для лечения тошноты, рвоты и/или запора.
(27G) Использование кристаллов по любому одному из пп. (2)-(26) для получения ослабляющего действие и/или профилактического агента для лечения побочных эффектов, вызванных соединением, обладающим агонистической активностью в отношении опиоидного рецептора.
(27H) Терапевтический и/или профилактический способ лечения тошноты, рвоты и/или запора, отличающийся введением фармацевтической композиции, включающей кристаллы по любому одному из пп. (2)-(26).
(27I) Способ, ослабляющий действие и/или профилактический, для лечения побочных эффектов, вызванных соединением, обладающим агонистической активностью в отношении опиоидного рецептора, включающий стадию введения кристаллов по любому одному из пп. (2)-(26).
(27J) Фармацевтическая композиция, включающая кристаллы по любому одному из пп. (2)-(26), для лечения и/или профилактики тошноты, рвоты и/или запора.
(27K) Фармацевтическая композиция, включающая кристаллы по любому одному из пп. (2)-(26), для ослабления и/или профилактики побочных эффектов, вызванных соединением, обладающим агонистической активностью в отношении опиоидного рецептора.
(27L) Анальгетики, включающие комбинацию соединений, обладающих агонистической активностью в отношении опиоидного рецептора, с эффективным количеством кристаллов по любому одному из пп. (2)-(26) для ослабления и/или профилактики побочных эффектов, вызванных соединением, обладающим агонистической активностью в отношении опиоидного рецептора.
(27M) Анальгетики, включающие комбинацию соединений, обладающих агонистической активностью в отношении опиоидного рецептора, с эффективным количеством кристаллов по любому одному из пп. (2)-(26) для лечения и/или профилактики тошноты, рвоты и/или запора, вызванного соединением, обладающим агонистической активностью в отношении опиоидного рецептора.
(27N) Анальгетики по п. (27L) или (27M), где соединением, обладающим агонистической активностью в отношении опиоидного рецептора, является морфин, оксикодон, гидрокодон, трамадон или их фармацевтически приемлемые соли или сольваты.
[0016]
(28) Способ получения кристаллов соли присоединения кислоты соединения формулы (IA):

или кристаллов сольвата указанной соли присоединения кислоты по любому одному из пп. (2)-(19), отличающийся стадиями добавления кислоты к соединению формулы (IA), и последующей кристаллизации соли присоединения кислоты или ее сольвата из растворителя, при необходимости.
(29) Способ получения кристаллов по п. (2), отличающийся стадиями:
обработки основанием соединения формулы (IID):

где R1 представляет собой водород или гидроксил-защищающую группу,
добавления п-толуолсульфоновой кислоты после удаления защитной группы R1, при необходимости, и
кристаллизации соли присоединения кислоты или ее сольвата из растворителя, при необходимости.
(30) Способ по п. (29), отличающийся стадиями:
обработки основанием соединение формулы (IIE):
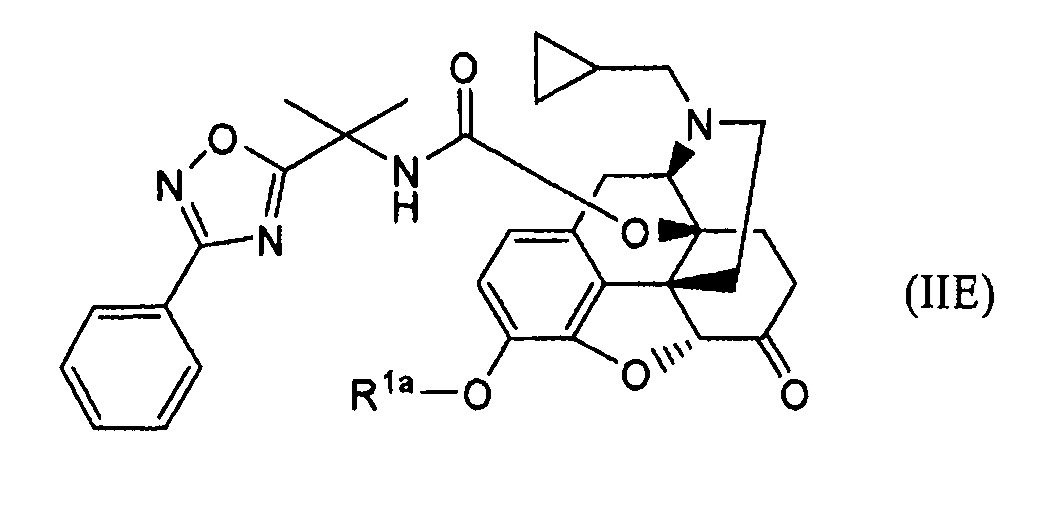
где Rla представляет собой атом водорода или гидрокси-защищающую группу, удаляемую основанием,
с последующим добавлением к полученному п-толуолсульфоновой кислоты, и
кристаллизации соли присоединения кислоты или ее сольвата из растворителя, при необходимости.
(31) Способ получения соединение формулы (II):

где Rlb представляет собой гидрокси-защищающую группу, R2 представляет собой необязательно замещенный низший алкил, R3 представляет собой необязательно замещенный низший алкил, необязательно замещенный циклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
отличающийся осуществлением взаимодействия соединения формулы (III):
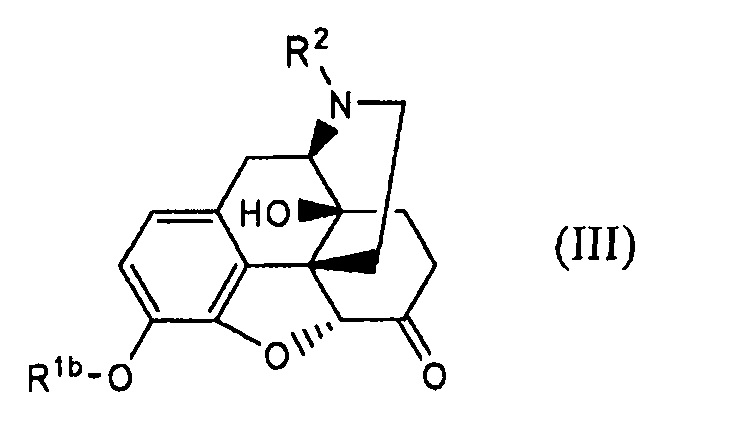
где Rlb и R2 имеют указанные выше значения; с соединением формулы: R3-N=C=О, где R3 имеет указанные выше значения; или с соединением формулы: R3-NH-C(=О)-X, где R3 имеет указанные выше значения и X представляет собой уходящую группу; в присутствии или в отсутствие кислоты.
(32) Способ по п. (31), отличающийся тем, что получают соединение формулы (III):

где Rlb и R2имеют указанные в п. (31) значения;
осуществляя защиту гидроксигруппы соединения формулы (IV);
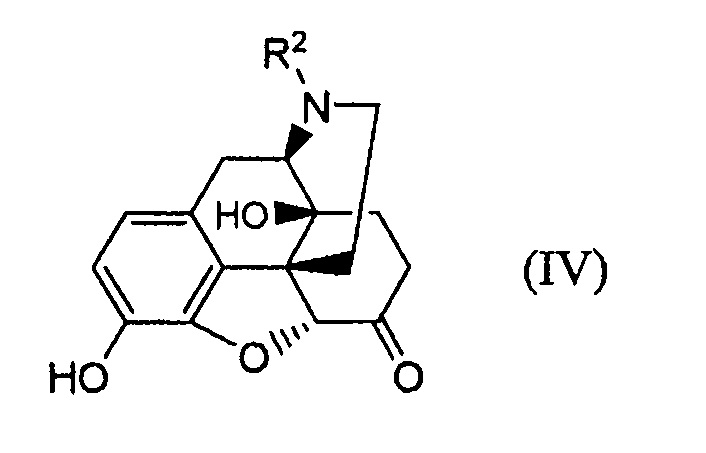
где R2 имеет указанные в п. (31) значения.
(33) Способ по п. (32), где последовательно осуществляют стадии получения соединения формулы (III):

где Rlb и R2 имеют указанные в п. (31) значения;
защиты гидроксильной группы соединения формулы (IV):

где R2 имеет указанные в п. (31) значения;
и осуществляют взаимодействие соединения формулы (III) с соединением формулы:
R3-N=C=О,
где R3 имеет указанные в п. (31) значения; или
с соединением формулы: R3-NH-C(=О)-X, где R3 имеет указанные выше значения и X представляет собой уходящую группу;
в присутствии или в отсутствие кислоты.
Где выражение "последовательно осуществляют" означает тот факт, что реакцию следующей стадии осуществляют без выделения соединения, полученного на предшествующей стадии.
Например, осуществляют две стадии в одном реакторе.
(34) Способ по любому одному из пп. (31)-(33), где реакцию осуществляют в присутствии кислоты.
(35) Способ по п. (34), где кислота является кислотой Льюиса.
(36) Способ по п. (35), где кислота Льюиса представляет собой CuCl, CuCl2, CuBr, CuI, CuBr, CuSO4, Cu, Zn(OAc)2, ZnBr2 или ZnCl2.
(37) Способ по любому одному из пп. (31)-(36), отличающийся тем, что реакцию осуществляют в присутствии кислоты в количестве около 0,00005-1,0 эквивалента в отношении к соединению формулы (III).
(38) Способ по любому одному из пп. (31)-(37), где Rlb представляет собой гидросил-защищающую группу, удаляемую основанием.
(39) Способ получения соединения формулы (I):

где R2 и R3 имеют указанные в п. (31) значения; путем обработки основанием соединения формулы (IIA):

где R2 и R3 имеют указанные выше значения.
(40) Способ получения соединения формулы (I):

где R2 и R3 имеют указанные в п. (31) значения;
отличающийся тем, что обрабатывают основанием соединение формулы (IIC):

где R1cпредставляет собой гидрокси-защитную группу, удаляемую основанием, и R2 и R3 имеют указанные выше значения.
(41) Способ получения соединения формулы (IB):

где R1dпредставляет собой гидрокси-защитную группу, не удаляемую основанием, и R2 и R3 имеют указанные в п.(31) значения;
отличающийся тем, что обрабатывают основанием соединение формулы (IIB):
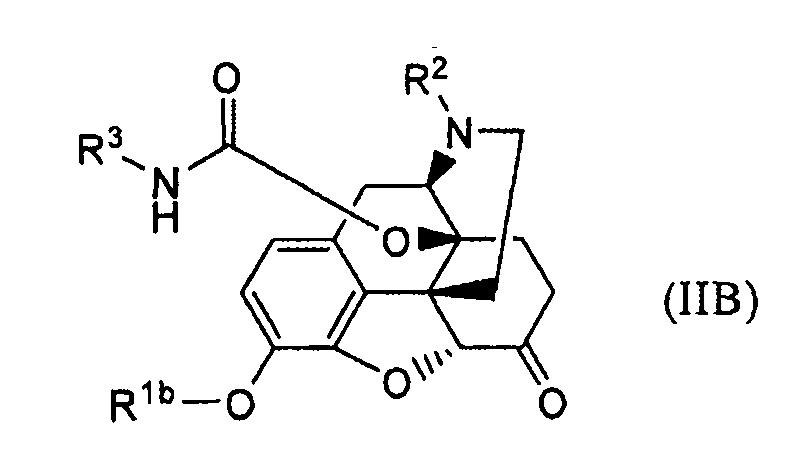
где R1bпредставляет собой гидрокси-защитную группу, и R2 и R3 имеют указанные выше значения.
(42) Способ по любому одному из пп. (39)-(41), где
основанием является неорганическое основание.
(43) Способ по любому одному из пп. (39)-(41), где указанное основание представляет собой гидроксид калия, гидроксид натрия, гидроксид лития или гидроксид цезия.
(44) Способ по любому одному из пп. (39)-(43), где температура реакции составляет 30°C-100°C.
(45) Способ получения соединения формулы (IX):
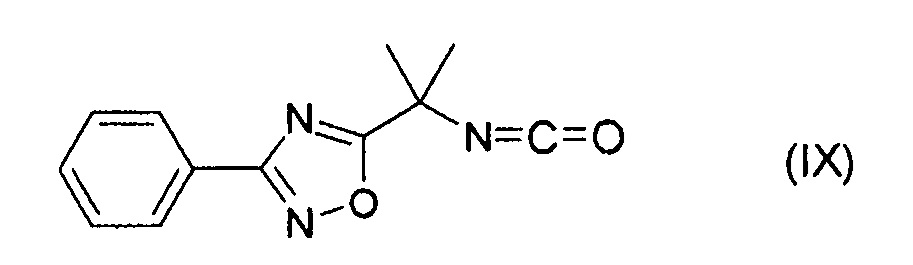
путем осуществления реакции соединения формулы (VIIIa):
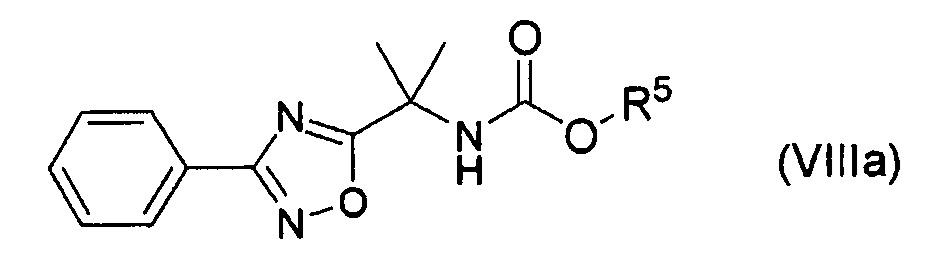
где R5 представляет собой низший алкил; в присутствии кислоты Льюиса и основания.
(46) Способ по п. (45), отличающийся тем, что осуществляют взаимодействие соединения формулы (X):

где R5 представляет собой низший алкил; с соединением формулы (XI):

получая указанное соединение формулы (VIIIa).
(47) Способ по любому одному из пп. (45) или (46), где кислота Льюиса представляет собой AlCl3 или TiCl4.
(48) Способ получения соли присоединения кислоты соединения формулы (I),
включающий стадии:
осуществления взаимодействия соединение формулы (IIIA):

где Rlc представляет собой гидрокси-защитную группу, удаляемую основанием, и R2 имеет указанные в п. (31) значения:
с соединением формулы: R3-N=C=О, где R3 имеет указанные в п.(31) значения; или
с соединением формулы: R3-NH-C(=О)-X, где R3 имеет указанные выше значения, и X представляет собой уходящую группу;
в присутствии или в отсутствие катализатора - кислоты Льюиса до получения соединения формулы (IIC):

где Rlc, R2 и R3 имеют указанные выше значения; затем
обработки соединения формулы (IIC) основанием до получения соединения формулы (I):
где R2 и R3 имеют указанные выше значения; и
добавления кислоты к соединению формулы (I) до получения соли присоединения кислоты.
Соли присоединения кислоты также получают, охлаждая реакционный раствор после того, как соль присоединения кислоты образуется в результате добавления кислоты.
Где далее приводятся примеры вариантов настоящего изобретения получения соединения формулы (IIC), включающие стадии:
осуществления взаимодействия соединения формулы (IIIA) с соединением формулы: R3-N=C=О, где R3 имеет указанные выше значения, в присутствии катализатора - кислоты Льюиса;
осуществления взаимодействие соединения формулы (IIIA) с соединением формулы: R3-N=C=О, где R3 имеет указанные выше значения, в отсутствие катализатора - кислоты Льюиса; или осуществления взаимодействия соединения формулы (IIIA) с соединением формулы: R3-NH-C(=О)-X, где R3 и X имеют указанные выше значения, в отсутствие катализатора - кислоты Льюиса.
(49) Способ по п. (48), где соль присоединения кислоты указанного соединения формулы (I) представляет собой соль п-толуолсульфоновой кислоты, соль уксусной кислоты, соль хлористоводородной кислоты или их сольваты.
(50) Способ по п. (49), где соль п-толуолсульфоновой кислоты, соль уксусной кислоты или соль хлористоводородной кислоты или их сольваты представляют собой кристаллы.
(51) Соединение формулы (IID):

где R1 представляет собой водород или гидроксил-защищающую группу.
(52) Соединение формулы (VII):

где R6 представляет собой группу, представленную -N=C=О или -NH-C(=О)-X, где X представляет собой уходящую группу.
В соединениях, представленных вышеуказанными формулой (II), формулой (IIA), формулой (IIB), формулой (IIC), формулой (IID) и формулой (IIE), водород в "-NH-" группе "-О-C(=О)-NH-", присоединенной к боковой цепи в 7-положении скелета морфинана, можно заменить амино-защитной группой.
[0017] В рассматриваемом описании термин "галоген" включает фтор, хлор, бром и йод. Содержащие термин галоген фрагменты, такие как "замещенный галогеном низший алкил", "замещенный галогеном низший алкокси" и "замещенный галогеном низший алкилтио" также аналогичны.
Термин "низший алкил" включает неразветвленный или разветвленный алкил, содержащий 1-10 атомов углерода, предпочтительно 1-6, или более предпочтительно 1-3, и например, метил, этил, н-пропил, изопропил, n-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, гексил, изогексил, н-гептил, изогептил, н-октил, изооктил, н-нонил и н-децил. Предпочтительны метил, этил, изопропил, н-бутил, втор-бутил, трет-бутил и 1-этилпропил и т.д.
[0018] В качестве примеров "необязательно замещенного низшего алкила", можно привести галоген, гидрокси, низший алкокси, замещенный галогеном низший алкокси, гидрокси низший алкокси, низший алкилтио, низший алкиламино, ациламино, ацил, ацилокси, циано, карбокси, низший алкоксикарбонил, карбамоил, низший алкилкарбамоил, цианокарбамоил, низший алкилсульфонилкарбамоил, арилсульфонилкарбамоил, сульфамоил, низший алкилсульфамоил, низший алкилсульфонил, циклоалкил, необязательно замещенный одной или более группами, выбранными из группы заместителей (группа заместителей включает галоген, гидроксил, низший алкил, замещенный галогеном низший алкил, гидрокси низший алкил, низший алкокси низший алкил, карбокси низший алкил, низший алкоксикарбонил низший алкил, амино низший алкил, низший алкиламино низший алкил, ациламино низший алкил, циано низший алкил, низший алкокси, замещенный галогеном низший алкокси, гидрокси низший алкокси, низший алкилтио, замещенный галогеном низший алкилтио, ацил, ацилокси, амино, низший алкиламино, ациламино, циано, карбокси, низший алкоксикарбонил, карбамоил, низший алкил карбамоил, арилкарбамоил, цианокарбамоил, низший алкил сульфонилкарбамоил, сульфамоил, низший алкилсульфамоил, низший алкилсульфонил, арил и гетероциклическая группа необязательно замещены низшим алкилендиокси, циклоалкенил, необязательно замещенный одной или более группами, выбранными из группы заместителей α, арил необязательно замещенный одной или более группами, выбранными из группы заместителей α, арилокси, необязательно замещенный одной или более группами, выбранными из группы заместителей α, арилтио, необязательно замещенный одной или более группами, выбранными из группы заместителей α, гетероциклическая группа, необязательно замещенная одной или более группами, выбранными из группы заместителей α, и гетероциклокси, необязательно замещенный одной или более группами, выбранными из группы заместителей α.
[0019] Низший алкильный фрагмент в выражении "замещенный галогеном низший алкил", "гидрокси низший алкил", "амино низший алкил", "ациламино низший алкил", "ацилокси низший алкил", "циклоалкил низший алкил", "низший алкокси", "замещенный галогеном низший алкокси", "гидрокси низший алкокси", "низший алкокси низший алкил", "низший алкоксикарбонил", "карбокси низший алкил", "низший алкоксикарбонил низший алкил", "низший алкилтио", " замещенный галогеном низший алкилтио", "низший алкиламино", "низший алкиламино низший алкил", "низший алкилкарбамоил", "низший алкилсульфамоил", "низший алкилсульфонил", "арил низший алкил", "три низший алкилсилил", "низший алкилдиарилсилил", "триарил низший алкилсилил", "низший алкокси низший алкокси низший алкил", "низший алкилтио низший алкил", "арил низший алкокси низший алкил", "низший алкилсульфонил", "низший алкилсульфонилкарбамоил", "низший алкилкарбонил", "циано низший алкил", "низший алкоксикарбониламино", "низший алкилендиокси" и "замещенный гетероциклом низший алкил" имеют те же значения, что и приведенные выше для выражения "низший алкил".
Заместители в выражениях "необязательно замещенный низший алкокси", "необязательно замещенный низший алкилтио" и "необязательно замещенный низший алкилсульфонил" имеют те же значения, что и приведенные выше для выражения "низший алкил, необязательно замещенный".
[0020] Термин "низший алкенил" включает неразветвленный или разветвленный алкенил, содержащий 2-10 атомов углерода, предпочтительно 2-8, более предпочтительно 3-6 атомов углерода, который содержит одну или более из двойных связей в произвольных положениях. Более конкретно, он включает винил, аллил, пропенил, изопропенил, бутенил, изобутенил, пренил, бутадиенил, пентенил, изопентенил, пентадиенил, гексенил, изогексенил, гексадиенил, гептенил, октенил, ноненил и деценил и т.д.
Заместители в выражении "необязательно замещенный низший алкенил " имеют те же самые значения, что и для выражения "необязательно замещенный низший алкил".
Термин "низший алкинил" включает неразветвленный или разветвленный алкинил, содержащий 2-10 атомов углерода, предпочтительно 2-8, более предпочтительно 3-6, который содержит одну или более из тройных связей в произвольных положениях. Более конкретно, включены этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил и т.д. Они могут содержать двойную связь в еще более произвольных положениях.
[0021] Заместители в выражении "необязательно замещенный низший алкинил" имеют те же значения, что и в приведенном выше выражении "необязательно замещенный низший алкил".
В качестве примеров заместителей "необязательно замещенного амино" можно привести низший алкил, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, циклоалкил, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, ацил, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, амино, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, арил, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, сульфамоил, низший алкилсульфамоил, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, арилсульфамоил необязательно замещенный одной или более из групп, выбранных из группы заместителей α, низший алкилсульфонил, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, арилсульфонил, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, ариламино, необязательно замещенный одной или более из групп, выбранных из группы заместителей α, и гетероциклическая группа, необязательно замещенная одной или более из групп, выбранных из группы заместителей α.
[0022] Заместители в выражении "необязательно замещенный карбамоил" имеют те же самые значения, что и для приведенного выше выражения "необязательно замещенный амино".
"Циклоалкил" представляет собой карбоциклическую группу, содержащую 3-10 атомов углерода, предпочтительно 3-8, более предпочтительно 4-8 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил и т.д. Кроме того, они могут быть конденсированы с указанными далее "арильной" или "гетероциклической группами" в произвольных положениях.
Циклоалкильный фрагмент в выражениях "циклоалкил низший алкил" и "циклоалкилкарбонил" имеет те же самые значения, что и приведенные выше для термина "циклоалкил".
[0023] Одна или более из групп, выбранных из раскрытой выше группы заместителей α, служат примерами заместителей в выражении "необязательно замещенный циклоалкил". Заместители могут находиться в любом из положений и могут находиться у атома углерода с циклоалкильной связью.
Термин "циклоалкенил " включает вышеперечисленные значения для циклоалкила, содержащего одну или более из двойных связей в любом положении кольца, и конкретно включает циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклогексадиенил и т.д.
Циклоалкенильный фрагмент "циклоалкенилкарбонила" имеет те же значения, что и указанные выше для "циклоалкенила".
[0024] Заместители в выражении "необязательно замещенный циклоалкенил" имеют те же значения, что и указанные выше для выражения "циклоалкил, необязательно замещенный".
Термин "арил" включает фенил, нафтил, антрил, фенантрил и особенно предпочтительно фенил.
Арильные фрагменты в "арилокси", "арилтио", "арил низший алкил", "низший алкилдиарилсилил", "триарил низший алкилсилил", "арил низший алкилокси низший алкил", "арилсульфонил", "арилсульфамоил", "ариламино", "арилкарбамоил" и "арилсульфонилкарбамоил" имеют указанные выше значения для термина "арил".
[0025] Примерами заместителей для терминов "необязательно замещенный арил", "необязательно замещенный фенил" и "необязательно замещенный арилсульфонил" приведенной выше группы заместителей α служат фенил, замещенный одной или более из групп, выбранных из заместителей группы α, фенокси, замещенный одной или более из групп, выбранных из группы заместителей α, или низший алкилендиокси и т.д.
Термин "гетероциклическая группа" включает гетероциклические группы, содержащие в кольце один или более из гетероатомов, необязательно выбранных из O, S и N, и конкретно включены гетероарилы, содержащие 5-6 членов, такие как пирролил, имидазолил, пиразолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазорил, триадинил, тетразолил, изоксазолил, оксазолил, оксадиазолил, изотиазолил, тиазолил, тиадиазолил, фурил и тиенил и т.д.;
бициклические конденсировано-гетероциклические группы, такие как индолил, изоиндолил, индазолил, индридинил, индринил, изоиндринил, хинолил, изохинолил, циннолинил, фталазинил, хиазолинил, нафтиридинил, хиноксалинил, пуринил, птеридинил, бензопиранил, бензимидазолил, бензизоксазолил, бензоксазолил, бензоксадиазолил, бензоизотиазолил, бензотиазолил, бензотиадиазолил, бензофурил, изобензофурил, бензотиенил, бензотриазорил, имидазопиридил, триазолопиридил,имидазотиазолил, пиразинопиридазинил, хиназолинил, хинолил, изохинолил, нафтиридинил, дигидропиридил, тетрагидрохинолил и тетрагидробензотиенил;
трициклические конденсировано-гетероциклические группы, такие как карбазолил, акридинил, ксантенил, фенотиазинил, феноксатиинил, феноксазинил, дибензофурил;
неароматические гетероциклические группы, такие как диоксанил, тииранил, тиоланил, тиетанил, оксиланил, оксетанил, оксатиоланил, азетидинил, тианил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперазинил, морфолинил, морфолино, тиоморфолинил, тиоморфолино, дигидропиридил, дигидрофурил, тетрагидрофурил, тетрагидропиранил, тетрагидротиазолил и тетрагидроизотиазолил.
Предпочтительны гетероарил или неароматические гетероциклические группы, содержащие 5-6 членов.
[0026] Гетероциклический фрагмент терминов "гетероциклический окси" и "гетероциклический низший алкил" имеет те же самые значения, что и указанные выше для "гетероциклической группы".
Одна или более из групп, выбранных из группы, состоящей из приведенной выше группы заместителей α и оксо, являются примерами заместителей в "необязательно замещенной гетероциклической группе" и "необязательно замещенной гетероциклокси".
Заместители могут находиться в любом положении и могут быть заместителями у атома углерода или атома азота, имеющими связь гетероциклической группы.
[0027] Термин "ацил" включает неразветвленный или разветвленный линейный алифатический ацил, содержащий 1-10 атомов углерода, предпочтительно 1-6, более предпочтительно 1-4, и циклический алифатический ацил, ароил и гетероциклический карбонил, содержащий 4-9 атомов углерода, предпочтительно 4-7.
Термин "линейный алифатический" включает вышеприведенные "низший алкил", "низший алкенил" и "низший алкинил". Термин "циклический алифатический" включает вышеприведенные "циклоалкил" и "циклоалкенил". Гетероциклический фрагмент гетероциклического карбонила тот же самый, что для вышеуказанной "гетероциклической группы". Примеры включают ацил, формил, ацетил, пропионил, бутирил, изобутирил, валерил, пивалоил, гексаноил, акрилоил, пропиолоил, метакрилоил, кротоноил, циклопропилкарбонил, циклогексилкарбонил, циклооктилкарбонил, бензоил, пиридинкарбонил, пиперидинкарбонил, пиперазинкарбонил, морфолинокарбонил и т.д.
Ацильные фрагменты "ацилокси", "ациламино", "ациламино низший алкил" и "ацилокси низший алкила" те же самые, что и для вышеприведенного "ацила".
Заместители для "необязательно замещенного ацила" или "необязательно замещенного ацилокси" те же самые, что и заместители для вышеуказанного "необязательно замещенного низшего алкила", если "ацил" представляет собой линейный алифатический ацил, и если "ацил" представляет собой циклический алифатический ацил, ароил и гетероциклический карбонил, заместителем является одна или более из групп, выбранных из вышеприведенной группы заместителей α.
[0028] Термин "сольват " включает сольваты с органическими растворителями (этанолом, 2-пропанолом, метилацетатом, этилацетатом, н-пропилацетатом, 1,2-диметоксиэтаном, метилизобутилкетоном, ацетонитрилом и т.д.) и например, гидраты. Если образуется гидрат, соединение может быть координировано с любым количеством молекул воды.
Примерами "защищающих гидроксил групп" являются бензил, п-метоксифенилбензил, ацетил, формил, бензоил, хлорацетил, пивалоил, метилкарбонат, изобутилкарбонат, бензилкарбонат, винилкарбонат, фенилкарбамат, мезил, тозил, триметилсилил, триэтилсилил, трет-бутилдиметилсилил, метоксиметил, бензилоксиметил, метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, пропенил, фенацил и тетрагидропиранил и т.д.
Примерами "защищающих гидроксил групп, удаляемых основанием" являются ацетил, формил, бензоил, хлорацетил, пивалоил, метилкарбонат, изобутилкарбонат, бензилкарбонат, винилкарбонат, фенилкарбамат, мезил, тозил и т.д. В одном аспекте примерами служат ацетил, формил, бензоил, хлорацетил и пивалоил. В другом аспекте примером служит ацетил.
Примерами "защищающих гидроксил групп, не удаляемых основанием", служат бензил, п-метоксифенилбензил, триметилсилил, триэтилсилил, трет-бутилдиметилсилил, метоксиметил, бензилоксиметил, метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, пропенил, фенацил и тетрагидропиранил и т.д.
Примерами "уходящих групп" являются необязательно замещенный фенокси (например, фенокси, п-нитрофенокси и o-нитрофенокси), гетероциклические группы (например, 1-имидазолил и 1-пиразолил), необязательно замещенный гетероциклокси (например, пиридилокси) и т.д.
Примерами "солей присоединения кислоты соединения формулы (I)" и "солей присоединения кислоты соединения формулы (IA)" являются соли неорганических оснований (например, хлористоводородной кислоты, серной кислоты, азотной кислоты, карбоновой кислоты, бромистоводородной кислоты, фосфорной кислоты, иодистоводородной кислоты и т.д.), или соли органических кислот (например, муравьиной кислоты, уксусной кислоты, пропионовой кислоты, трифторуксусной кислоты, лимонной кислоты, молочной кислоты, винной кислоты, щавелевой кислоты, малеиновой кислоты, фумаровой кислоты, миндальной кислоты, глутаровой кислоты, яблочной кислоты, бензойной кислоты, фталевой кислоты, аскорбиновой кислоты, бензолсульфоновой кислоты, п-толуолсульфоновой кислоты, метансульфоновой кислоты, этансульфоновой кислоты и т.д.). Например, в качестве соли присоединения кислоты "соли присоединения кислоты соединения формулы (I)" и соли присоединения кислоты "соли присоединения кислоты соединения формулы (IA)", можно указать соль п-толуолсульфоновой кислоты, соль уксусной кислоты и соль хлористоводородной кислоты.
Примерами "амино-защитной группы" являются трет-бутилдиметилсилил, трет-бутоксикарбонил, аллил, 9-флуоренилметилоксикарбонил, бензил, п-метоксибензил, метоксиметил, бензилоксиметил, бензгидрил и тритил.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0029] В настоящем изобретении предложены производные 6,7-ненасыщенного-7-карбамоилморфинана, их соли присоединения кислоты и/или кристаллы их сольватов. Указанные кристаллы обладают хорошей стабильностью и их можно использовать в качестве ингредиентов для получения лекарственных средств. Новый способ получения может внести вклад в сокращение стадий получения, в повышение выходов и т.д.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0030]
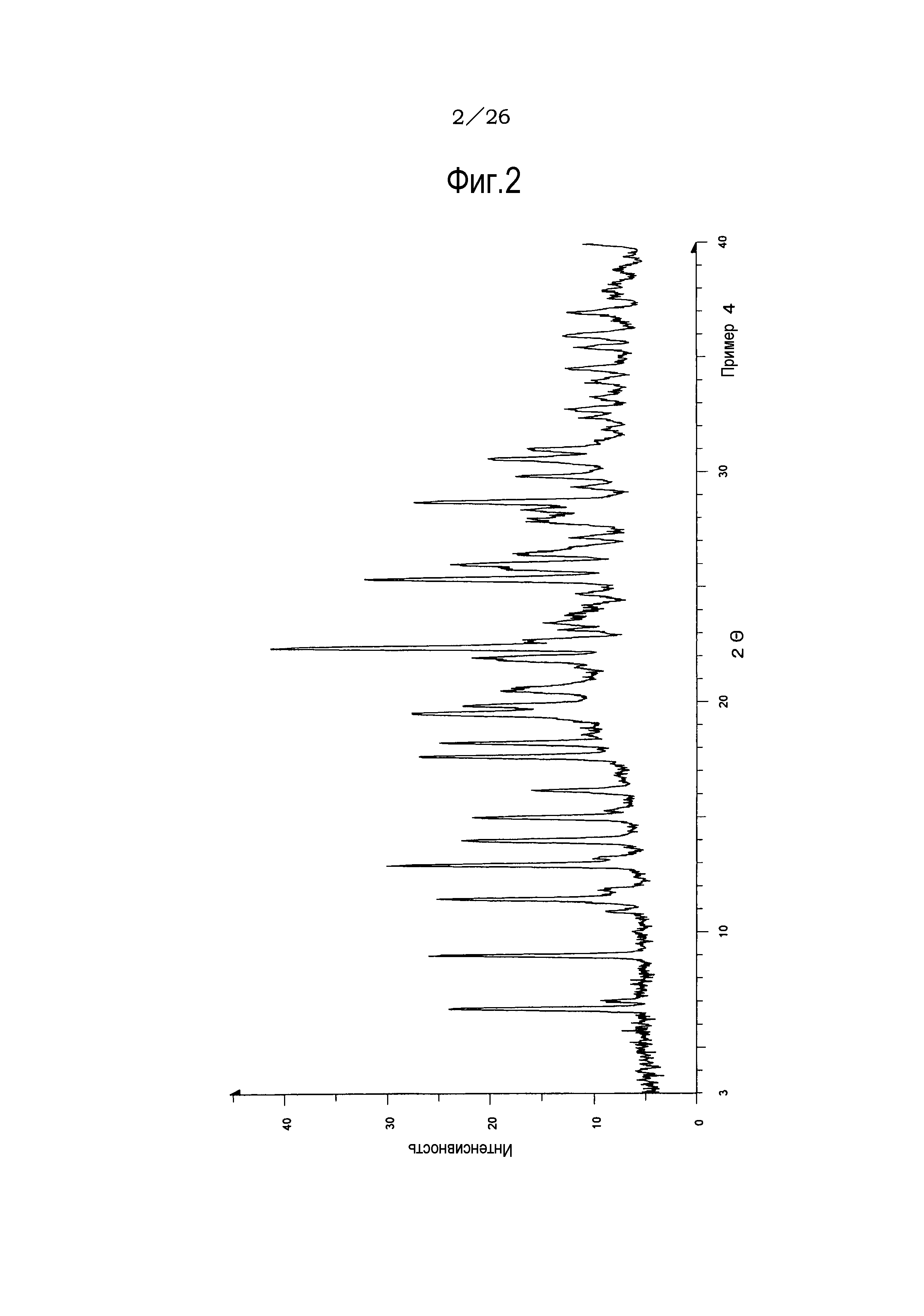
Фиг. 1 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов (не сольват) соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 2 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов (форма I) гидрата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
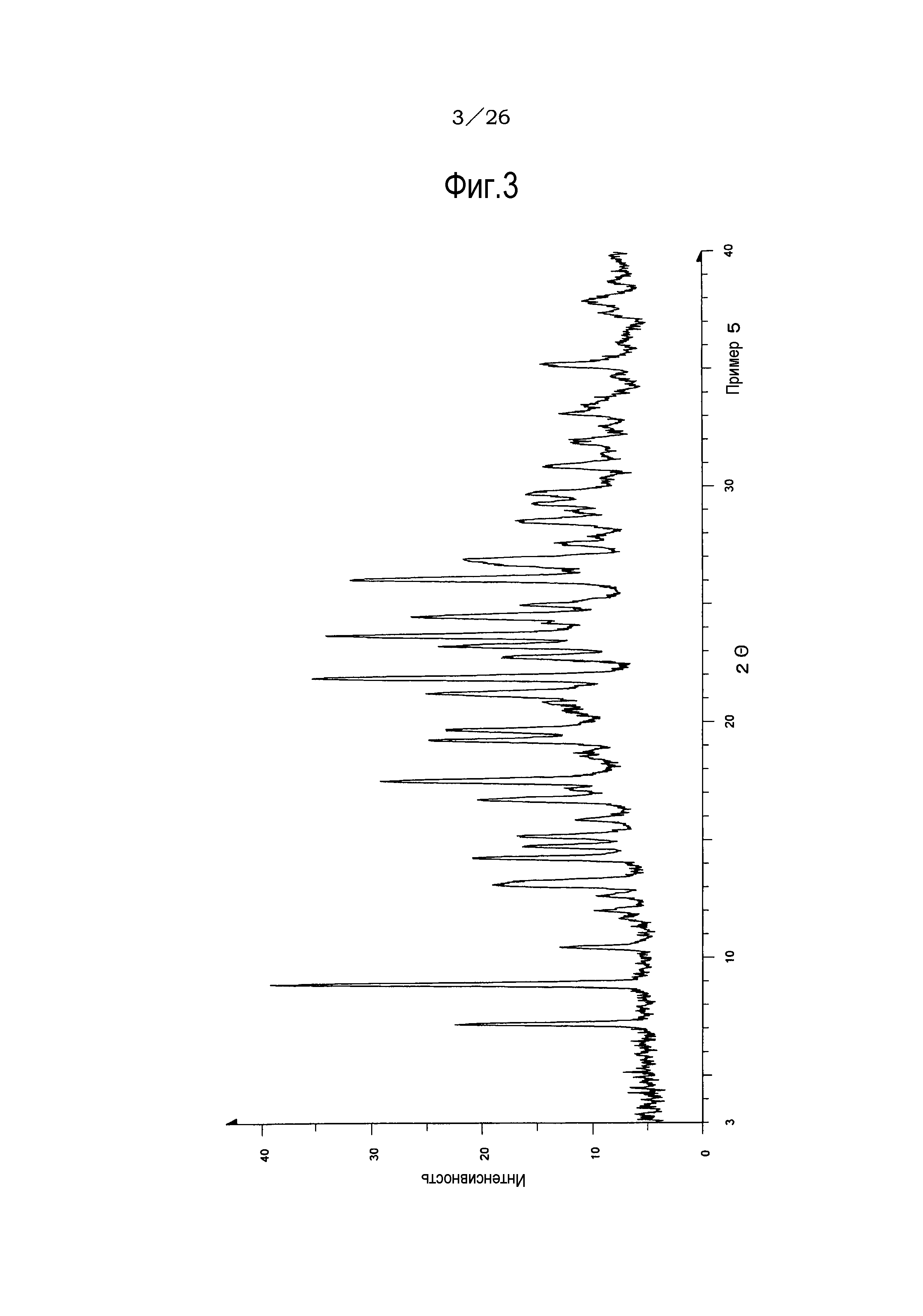
Фиг. 3 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов (форма II) гидрата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 4 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов соли уксусной кислоты соединения (IA) настоящего изобретения.
Фиг. 5 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов соли хлористоводородной кислоты указанного соединения (IA) настоящего изобретения.
Фиг. 6 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов этанольного сольвата соединения (IA) настоящего изобретения.
Фиг. 7 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов свободного соединения (IA) настоящего изобретения.
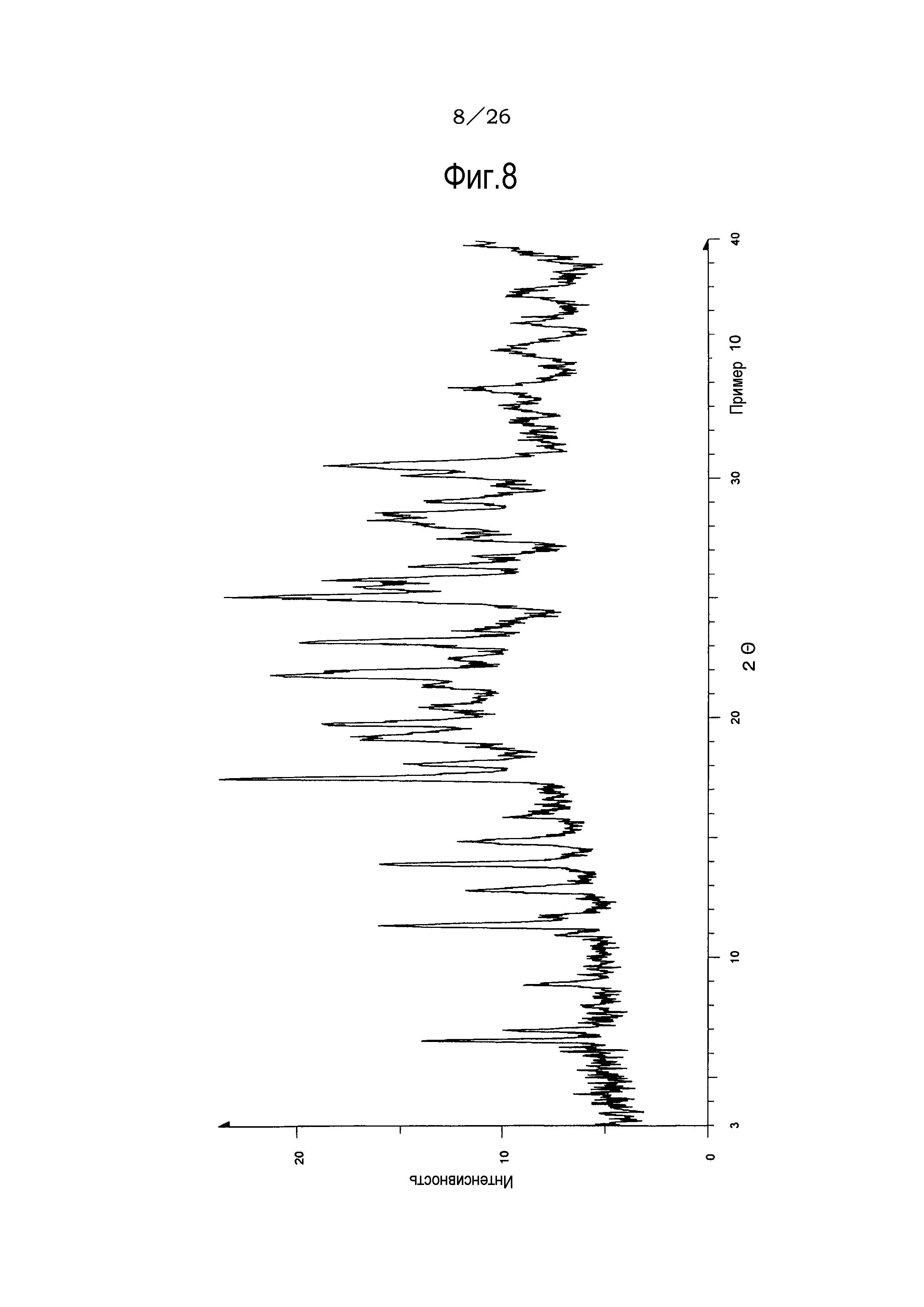
Фиг. 8 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов метилацетатного сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
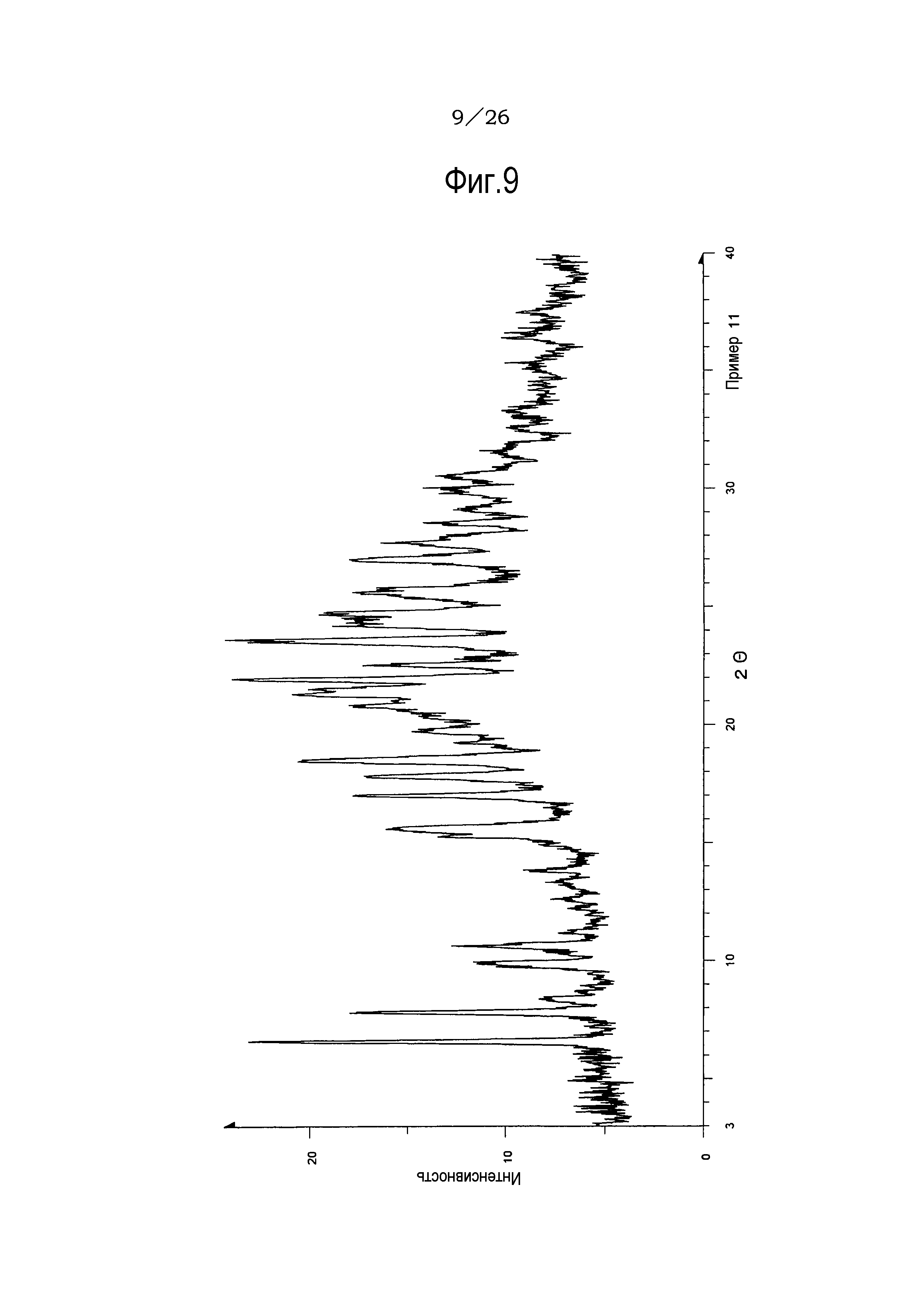
Фиг. 9 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов сольвата (этилацетат и 2-пропанол) соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
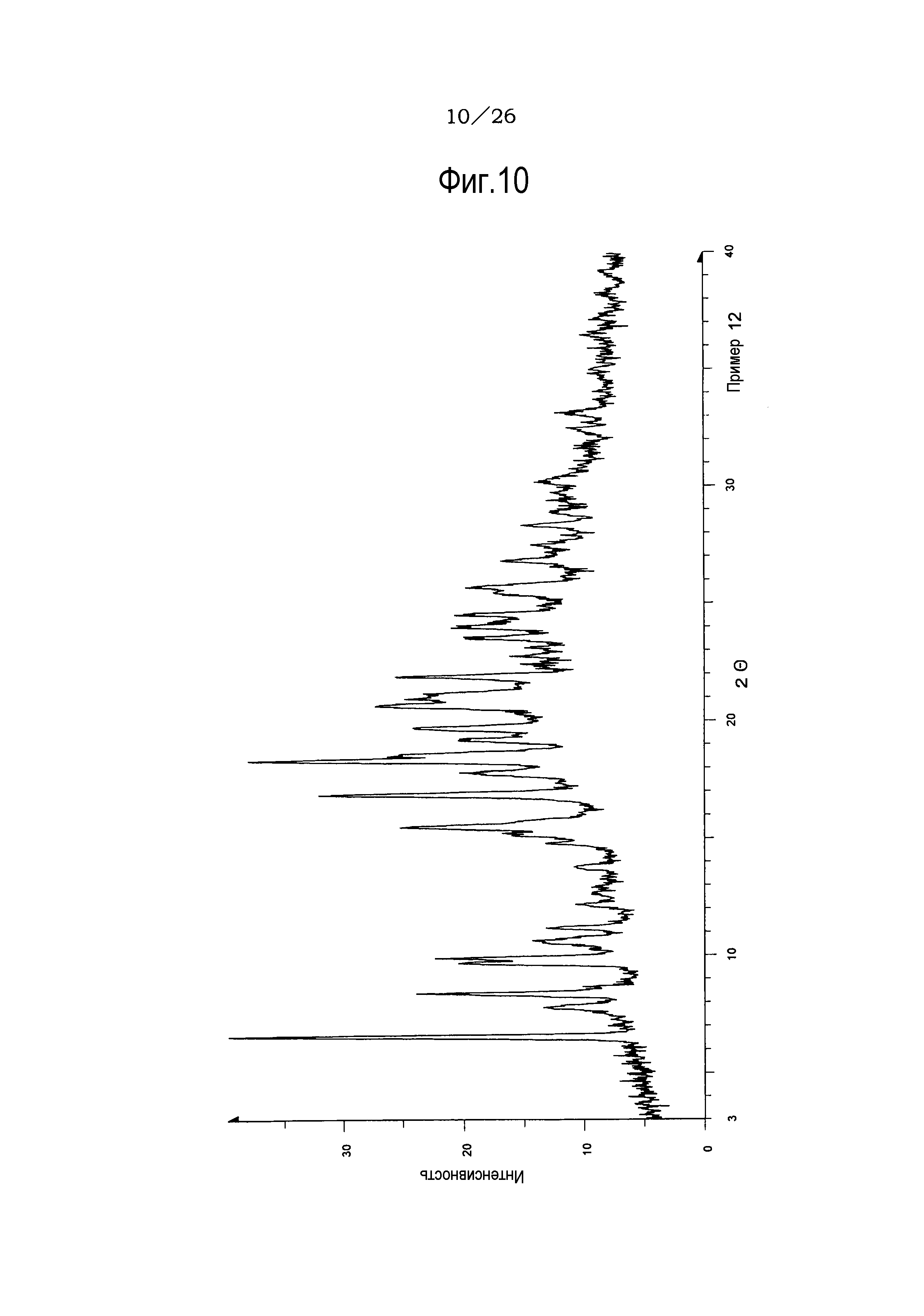
Фиг. 10 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов сольвата (н-пропилацетат/2-пропанол) соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 11 демонстрирует рентгеновскую дифракционную картину от порошка ацетонитрильного сольвата кристаллов соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 12 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов 1,2-диэтоксиэтанового сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
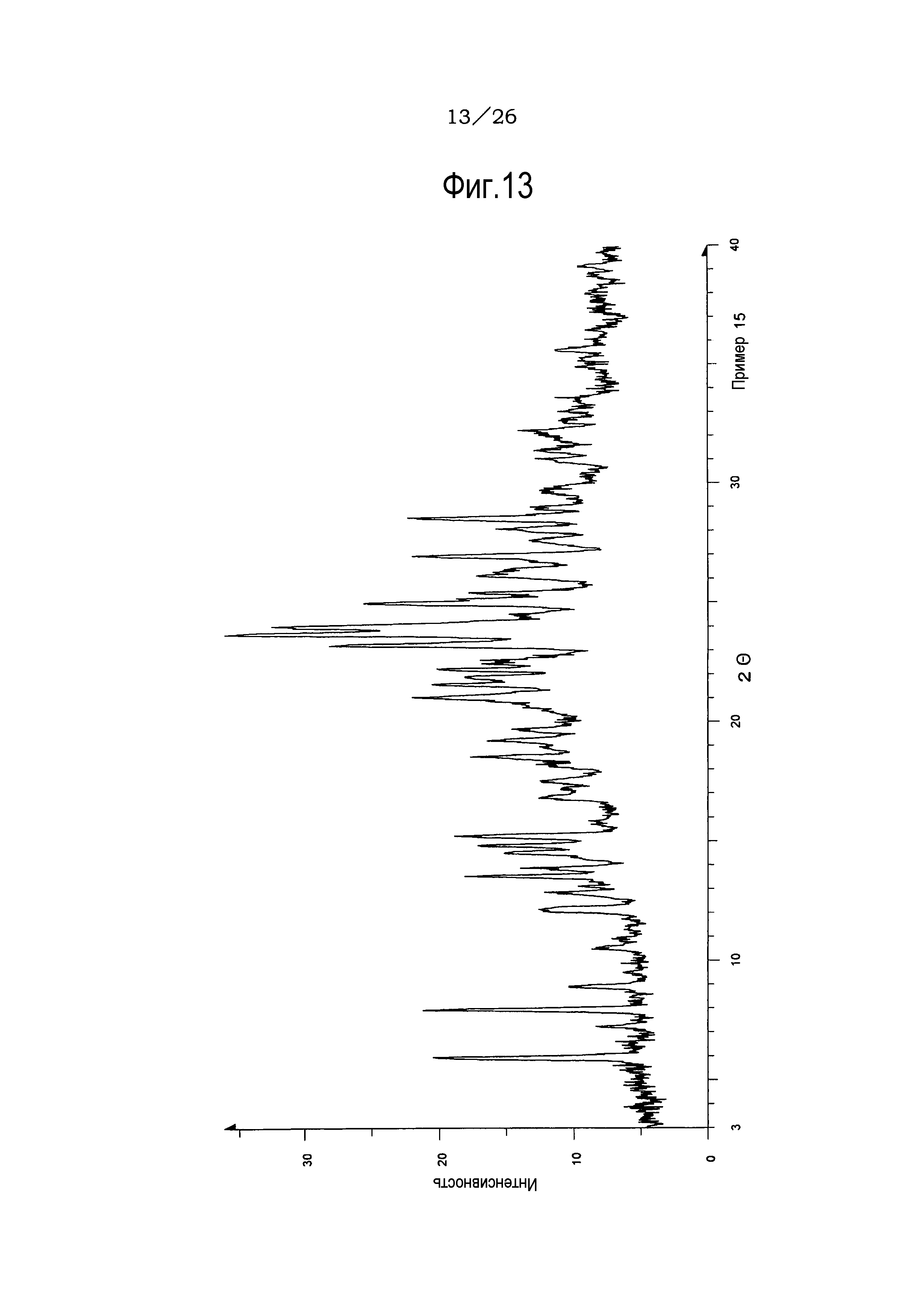
Фиг. 13 демонстрирует рентгеновскую дифракционную картину от порошка кристаллов метилизобутилкетонового сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 14 демонстрирует результаты TG/DTA анализов кристаллов (не сольват) соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 15 демонстрирует результаты TG/DTA анализов кристаллов (форма I) гидрата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
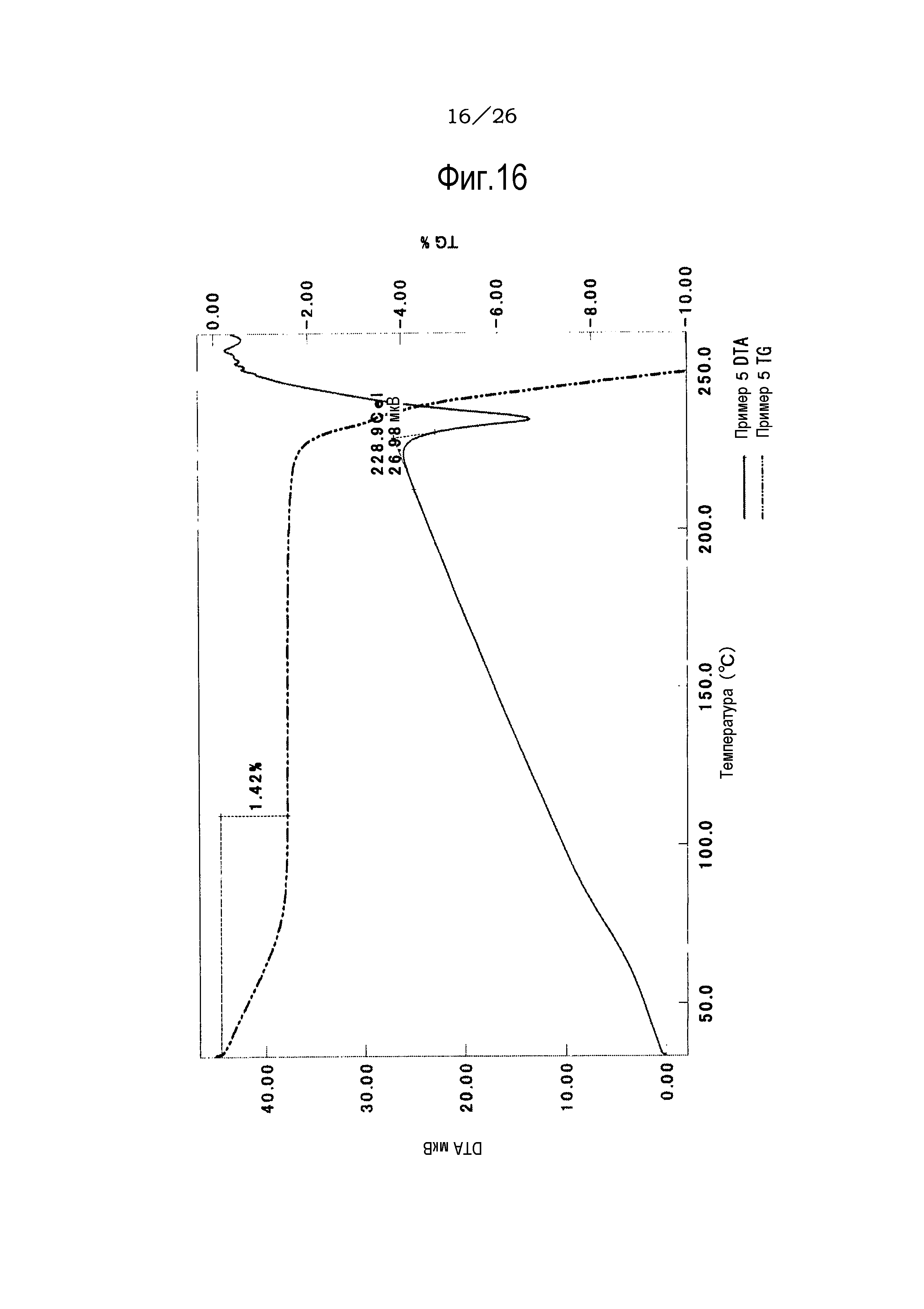
Фиг. 16 демонстрирует результаты TG/DTA анализов кристаллов (форма II) гидрата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
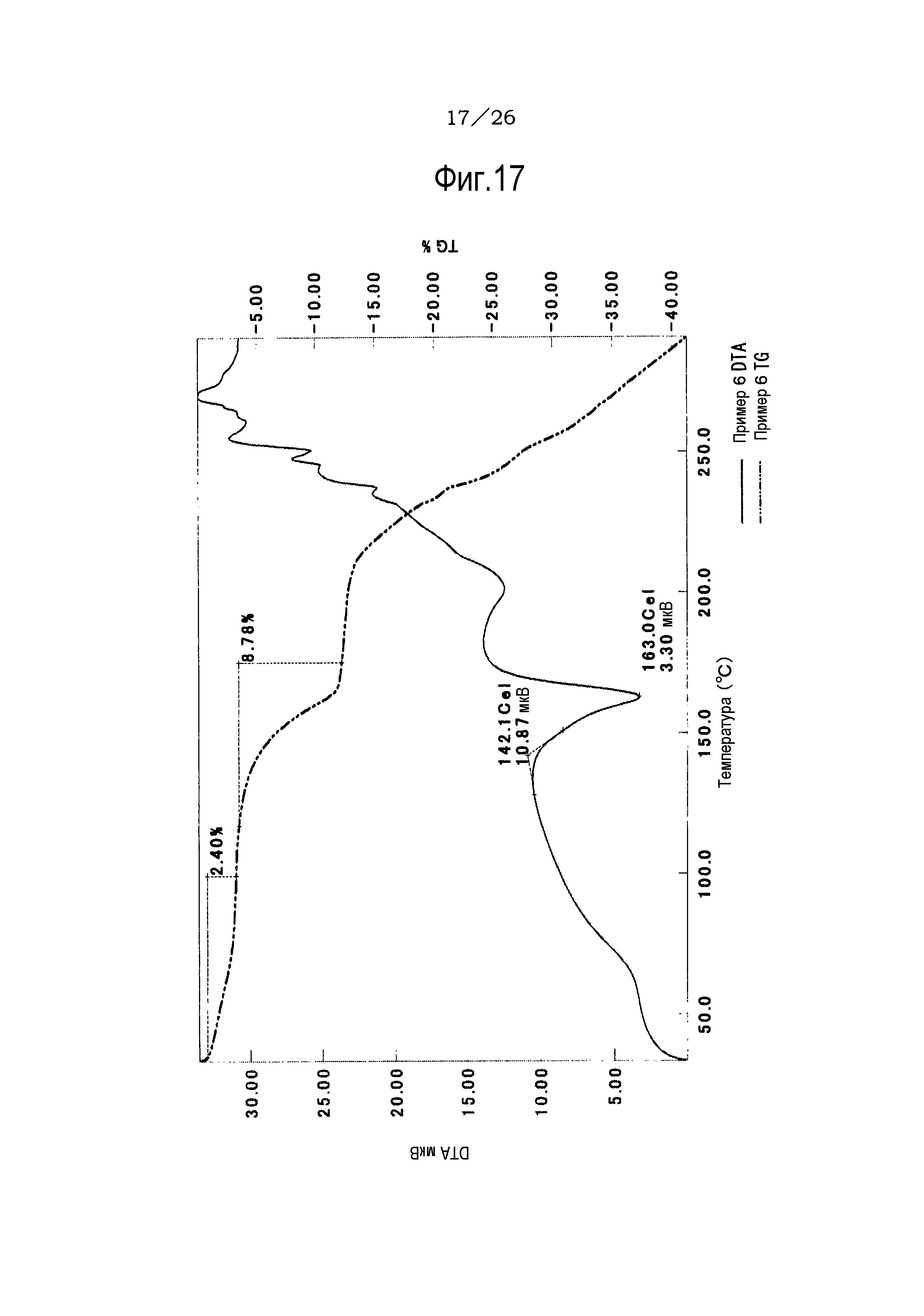
Фиг. 17 демонстрирует результаты TG/DTA анализов соли уксусной кислоты соединения (IA) настоящего изобретения.
Фиг. 18 демонстрирует результаты TG/DTA анализов соли хлористоводородной кислоты соединения (IA) настоящего изобретения.
Фиг. 19 демонстрирует результаты TG/DTA анализов этанольного сольвата соединения (IA) настоящего изобретения.
Фиг. 20 демонстрирует результаты TG/DTA анализов свободной формы соединения (IA) настоящего изобретения.
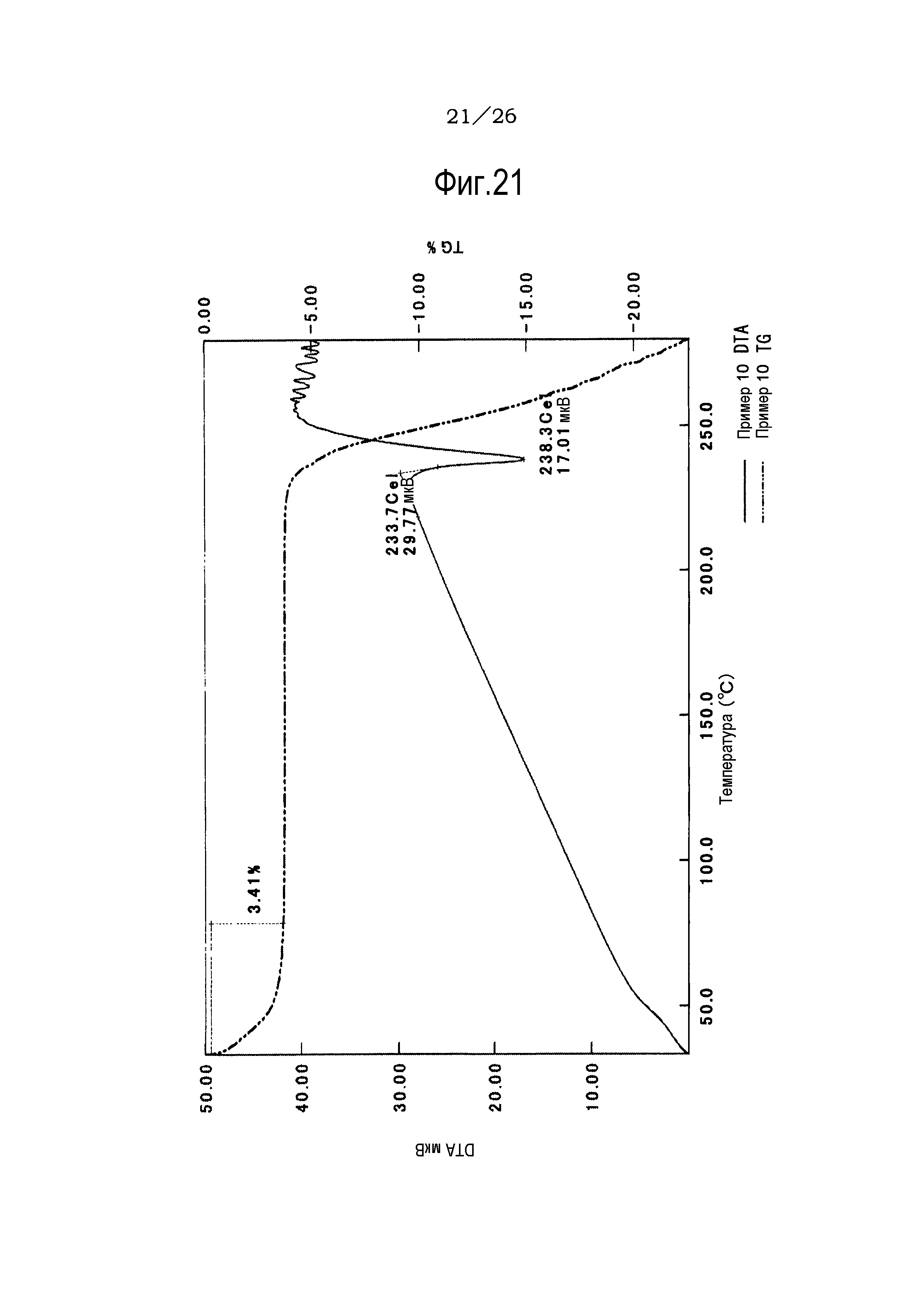
Фиг. 21 демонстрирует результаты TG/DTA анализов метилацетатного сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 22 демонстрирует результаты TG/DTA анализов этилацетат/2-пропанольного сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 23 демонстрирует результаты TG/DTA анализов этилацетат/2-пропанольного сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 24 демонстрирует результаты TG/DTA анализов ацетонитрильного сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 25 демонстрирует результаты TG/DTA анализов 1,2-диметоксиэтанового сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
Фиг. 26 демонстрирует результаты TG/DTA анализов метилизобутилкетонового сольвата соли п-толуолсульфоновой кислоты соединения (IA) настоящего изобретения.
ПРЕДПОЧТИТЕЛЬНЫЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0031] Кристаллы настоящего изобретения получают в виде соли присоединения кислоты соединения, представленного формулой (I), или сольвата указанной соли присоединения кислоты. Примерами используемых в изобретении кислот служат п-толуолсульфоновая кислота, уксусная кислота или хлористоводородная кислота. Считают, что кристаллы п-толуолсульфоновой кислоты не должны быть гигроскопичными и должны обладать превосходной стабильностью. В качестве примеров растворителей для образования сольватов используют воду, этанол, 2-пропанол, метилацетат, этилацетат, н-пропилацетат, 1,2-диметоксиэтан, метилизобутилкетон, ацетонитрил и т.д.
Кристаллы соли присоединения кислоты кристаллизуются после добавления 1,0-10,0 эквивалентов кислоты в раствор указанного соединения формулы (I) при температуре от 0°C до комнатной температуры или при нагревании при температуре ниже температуры кипения растворителя, необязательно охлаждая или конденсируя указанный растворитель.
Получение сольватированных кристаллов осуществляют, растворяя соль присоединения кислоты соединения формулы (I) в солюбилизирующем растворителе, содержащем растворитель, подлежащий сольватированию, по меньшей мере при комнатной температуре или при температуре ниже температуры кипения растворителя путем нагревания, добавляя растворитель подлежащий сольватированию, и перемешивая или оставляя раствор выстаивается при температуре от 0°C до комнатной в течение от нескольких часов до одного дня. Кристаллы можно отделить от растворителя, используя обычные способы выделения, такие как выделение фильтрованием или центрифугированием, и выделить, используя обычные способы очистки, такие как промывка и сушка.
Сольваты соединений, представленных формулой (I), также включены в термин кристаллы настоящего изобретения. Примерами растворителей служат вода, этанол и т.д. Сольват соединения, представленного формулой (I), можно получить тем же способом, что и сольват вышеуказанной соли присоединения кислоты.
В случае соединения (IA), в качестве примеров кристаллов настоящего изобретения можно привести соль п-толуолсульфоновой кислоты (не сольват), гидрат соли п-толуолсульфоновой кислоты, метилацетатный сольват соли п-толуолсульфоновой кислоты, этилацетат/2-пропанольный сольват соли п-толуолсульфоновой кислоты, н-пропилацетат/2-пропанольный сольват соли п-толуолсульфоновой кислоты, ацетонитрильный сольват соли п-толуолсульфоновой кислоты, 1,2-диметоксиэтановый сольват соли п-толуолсульфоновой кислоты, метилизобутилкетоновый сольват соли п-толуолсульфоновой кислоты, гидрохлоридный, ацетатный, этанольный сольват свободной формы и т.д.
Например, соль п-толуолсульфоновой кислоты (не сольват) соединения, представленного формулой (IA), получают следующим образом: 2-пропанол и н-пропилацетат добавляют к органическому слою, содержащему соединение (IA), и полученный раствор конденсируют. К концентрату по каплям добавляют 2-пропанольный раствор, содержащий 1-10,0 эквивалентов п-толуолсульфоновой кислоты при температуре 50-70°C, и происходит кристаллизация. Полученное сырое твердое вещество растворяют в метаноле и н-пропилацетате снова путем нагревания, нерастворимые материалы отфильтровывают, и кристаллизацию осуществляют путем концентрирования фильтрата в вакууме. Полученные кристаллы сушат при температуре 50-70°C в течение 2-5 часов в вакууме, получая целевую соль п-толуолсульфоновой кислоты (не сольват).
[0032] Конкретные способы получения кристаллов настоящего изобретения проиллюстрированы далее.
Если нет конкретных указаний, численные значения в описании и формуле изобретения представляют собой почти ближайшие значения. Численные отклонения происходят за счет неточностей калибровки приборов, приборных ошибок, степени чистоты вещества, размеров кристаллов, размеров образцов и других факторов.
[0033] Термин "кристаллы", использованный в описании, означает вещество, молекулярная структура которого обладает упорядоченностью дальнего порядка. Степень кристалличности кристаллов можно определить, используя множество методик, включая, например, рентгеновскую дифракцию порошка, адсорбцию воды, дифференциальный или калориметрический анализы, хромоскопию в растворе, и используя характеристики растворимости.
[0034] Обычно кристаллические органические соединения состоят из большого числа атомов, организованных периодически в трехмерном пространстве. Характер периодичности структуры обычно обуславливает физические свойства, которые можно определить, используя большинство спектрофотометрических методов (например, дифракцию рентгеновских лучей, инфракрасную спектроскопию, Раман-спектроскопию и твердотельный ЯМР).
Среди них наиболее высокочувствительным аналитическим способом для определения кристалличности твердых веществ является метод дифракции рентгеновских лучей на порошке (XRPD). Когда кристаллы облучают рентгеновскими лучами, они отражаются от кристаллической решетки, интерферируют и усиливаются только дифракционные пики, которые отвечают условиям правила Брэгга. Другие дифракционные пики не наблюдаются.
С другой стороны, высокоорганизованные дифракционные пики в широком интервале не наблюдаются для аморфных твердых веществ. Обычно дальний порядок, основанный на повторяющейся кристаллической решетке, отсутствует в аморфных твердых телах, и тогда наблюдается размытая XRPD картина, называемая ореолом.
[0035] Кристаллические формы производных 6,7-ненасыщенного-7-карбамоилморфинана, его солей присоединения кислоты и/или их сольватов, раскрытых в рассматриваемом описании, имеют, предпочтительно, отличительные картины рентгеновской дифракции на порошках. В случае солей п-толуолсульфоновой кислоты соединения (IA), возможно точно определить каждые из кристаллов по наличию характеристических дифракционных пиков и отличить одни кристаллы от других. Характеристические дифракционные пики, использованные в описании, представляют собой пики, выбранные из наблюдаемой дифракционной картины. Предпочтительно, характеристические пики можно выбрать из примерно 20 пиков, более предпочтительно из около десяти пиков, наиболее предпочтительно, из около пяти пиков соответствующей дифракционной картины.
[0036] Необходимо понимать, что величина угла дифракции (2θ) включает ошибку приблизительно в ±0,2°, так как ошибка может возникнуть обычно в пределах ±0,2° в определении угла дифракции в XRPD. Поэтому не только кристаллы, имеющие идентичные значения углов дифракции в XRPD, но также и кристаллы, имеющие значения в интервале ±0,2°, включены в настоящее изобретение.
[0037] Хорошо известно, что относительные интенсивности пиков, представленные далее в таблицах и на чертежах, могут меняться под действием множества факторов, таких как, например, ориентационный эффект кристаллов по отношению к пучку рентгеновских лучей, степень чистоты анализируемого вещества или кристалличность образца. Кроме того, могут наблюдаться смещения пиков из-за изменения высоты образца. Кроме того, могут наблюдаться различные сдвиги в соответствии с уравнением Брэгга (n A= 2dsinθ), если образец исследуют, используя отличающуюся длину волны, но и другая картина XRPD, полученная при использовании такой другой длины волны, также включена в объем настоящего изобретения.
[0038] Кристаллы соли п-толуолсульфоновой кислоты (не сольват), гидрата соли п-толуолсульфоновой кислоты (формы I), и гидрата соли п-толуолсульфоновой кислоты (формы II) соединения (IA) в настоящем изобретении демонстрируют рентгеновский дифракционный спектр порошка, как представлено на фиг. 1-3. Все кристаллы демонстрируют характеристические пики, как представлено в таблице 1.

[0039] Кристаллы настоящего изобретения можно также охарактеризовать, используя термический анализ.
TG/DTA (термогравиметрический/дифференциальный термический анализ) представляет собой один из основных способов термического анализа и представляет собой способ измерения массы и термических характеристик вещества как агрегата атомов и молекул.
TG/DTA представляет собой измерение изменений массы и количества тепла в зависимости от температуры или времени для активного фармацевтического ингредиента, и получают TG (термогравиметрия) и DTA (дифференциальный термический анализ) кривую, строя график зависимости полученных результатов от температуры или от времени. Из TG/DTA кривой можно получить информацию о массе, о разложении активного фармацевтичского ингредиента, о дегидратации, об окислении, о восстановлении, о сублимации и испарении и о количестве теплообмена.
В TG/DTA "точка плавления" означает наступление температуры.
Известно, что наблюдаемые изменения температуры и массы могут зависеть от скорости нагревания, способа получения исследуемого образца, конкретного устройства прибора TG/DTA. Для авторизации идентичности кристаллов важны все пики, и результаты могут изменяться до некоторой степени в зависимости от условий измерения.
[0040] Что касается кристаллов соли п-толуолсульфоновой кислоты, гидрата (формы (I) соли п-толуолсульфоновой кислоты, гидрата (формы II) соли п-толуолсульфоновой кислоты, ацетата и гидрохлорида, то результаты TG/DTA анализов представлены на фиг. 14-18.
[0041] Кристаллы соединения формулы (IA), его соли присоединения кислоты и/или их сольваты обладают антагонистической активностью в отношении опиоидных рецепторов (особенно опиоидных рецепторов δ и μ). Соответственно, они могут быть эффективны при лечении и/или для профилактики тошноты, рвоты, запоров, также как острых проблем пищеварения, острого алкоголизма, пищевых отравлений, простуды, язвы желудка, язвы двенадцатиперстной кишки, рака желудка, заворота кишок, аппендицита, перитонита, холецистита, гепатита, воспаления печени, энцефалита, менингита, мозговой гипертензии, черепно-мозговых травм, морской болезни, рвоты беременных, побочных эффектов химиотерапии, побочных эффектов радиационной терапии, побочных эффектов противораковых агентов, задержек желудочно-кишечного транзита, вызванного давлением или стенозом желудочно-кишечного тракта, или послеоперационных спаек кишок, тошноты или рвоты, вызванных повышением мозгового давления из-за опухоли мозга, мозгового кровотечения, менингита, последствий облучения опухоли мозга, острого запора, вызванного илеусом, язвы двенадцатиперстной кишки или аппендицита и т.д., нейропатии, недостатка питания, слабости, авитаминоза, ишемии, атонического запора, вызванного гипочувствительностью или недостатком механического стимула, спастического запора, вызванного стрессом и т.д., которые вызваны соединениями, обладающими агонистической активностью в отношении опиоидного рецептора.
[0042] Кристаллы соединения, представленного формулой (IA), его соли присоединения кислоты и/или их сольваты в настоящем изобретении отличаются слабым транзитом в мозг и обладают превосходным эффектом в отношении снижения побочных эффектов, таких как тошнота, рвота и запор и т.д., вызванных агонистами опиоидных рецепторов, без ингибирования анальгезирующего эффекта агонистов, которые вводят пациенту с заболеваниями, связанными с болью, такой как боль при раке (костные метастазы; сдавливании нервов; при повышенном внутричерепном давлении; при повреждениях мягких тканей; при запоре, или с болью при мышечных спазмах; с болью внутренних органов, мышц и поясницы или суставной сумки плеча; с послеоперационной хронической болью и при AIDS и т.д.
Кроме того, кристаллы настоящего изобретения обладают чистой антагонистической активностью в отношении опиоидных рецепторов, их ингибирующее действие в отношении hERG (ген-специфические калиевые каналы сердца) каналов слабо, и отсутствует связь с кардиотоксичностью. Все вышеуказанное обуславливает преимущества в аспекте безопасности. Кроме того, кристаллы настоящего изобретения отличаются выгодными характеристиками с точки зрения способов введения, такими как великолепная абсорбционная способность при пероральном введении, высокая стабильность в плазме человека и высокая биодоступность, и поэтому они очень эффективны в качестве лекарственных средств.
[0043] Если прием кристаллов настоящего изобретения или их фармацевтических композиций прописан пациентам против тошноты, рвоты и запора, которые вызваны соединением, обладающим агонистической активностью в отношении опиоидного рецептора, их можно вводить до введения, после введения или одновременно с введением соединения, обладающего агонистической активностью в отношении опиоидного рецептора. Интервалы между введением указанных двух типов лекарственных средств конкретно не ограничены.
Например, если фармацевтическую композицию, включающую кристаллы настоящего изобретения, вводят после введения соединения, обладающего агонистической активностью в отношении опиоидного рецептора, эффективным будет введение указанной композиции немедленно после или с промежутком менее 3 дней после введения агониста опиоидного рецептора, или немедленно после или с промежутком менее 1 дня после введения. Если указанную композицию вводят до введения агониста опиоидного рецептора, эффективным будет введение композиции непосредственно перед или менее чем за один день до введения агониста опиоидного рецептора, или непосредственно перед или менее чем за примерно 12 часов до введения.
Если фармацевтическую композицию, включающую кристаллы настоящего изобретения, или сами кристаллы прописывают для лечения и/или профилактики тошноты, рвоты или запора, другие агенты для лечения и/или профилактики тошноты, рвоты или запора можно использовать в комбинации. Например, возможно введение соединения настоящего изобретения с другими агентами, такими как гидрохлорид ондансетрона, адренокортикостероиды (метилпреднизолон, преднизолон, дексаметазон и т.д.), прохлорперазин, галоперидол, тимиперон, перфеназин, метоклопрамид, домперидон, скополамин, гидрохлорид хлорпромазина, дроперидол, стимулирующие слабительные (сеннозид, пикосульфат натрия и т.д.), осмотические слабительные (лактулоза), слабительные соли (окись магния и т.д.) и т.д.
Кроме того, при необходимости, к кристаллам или фармацевтическим композициям, включающим кристаллы настоящего изобретения, для получения комбинированных агентов могут быть добавлены соединения, обладающие агонистической активностью в отношении опиоидного рецептора, и/или другие агенты для лечения и/или профилактики тошноты, рвоты или запора, и также другие фармацевтические добавки.
[0044] Кристаллы настоящего изобретения можно вводить пациенту непосредственно или в виде фармацевтической композиции, в которой кристаллы настоящего изобретения смешаны с фармацевтическим носителем или эксципиентом. Подробную информацию относительно лекарственных форм и способов введения можно найти в "Remington's Pharmacological Sciences" Mack Publishing Co., Easton, and PA., последнее издание.
[0045] Хотя подходящий способ введения не ограничен, он может включать пероральное, интраректальное, через слизистую, энтеральное, внутримышечное, подкожное, интраспинальное, интратекальное, прямое интравентрикулярное, внутривенное, внутрибрюшинное, интраназальное интраокулярное введение, и инъекции. Предпочтительны пероральный и парентеральный способы введения. Фармацевтическую композицию настоящего изобретения можно получить способами, которые хорошо известны специалистам, такими как обычное смешивание, растворение, гранулирование, нанесение сахарной оболочки, измельчение в порошок, эмульгирование, инкапсулирование, упаковка и лиофилизация.
[0046] Фармацевтические композиции, используемые в настоящем изобретении, можно приготовить с помощью известных способов, используя один или более из фармацевтически приемлемых носителей, включая эксципиенты и добавки, которые облегчают приготовление фармацевтически приемлемых лекарственных композиций, включающих кристаллы настоящего изобретения. Конкретные формы лекарственных композиций зависят от способов введения.
[0047] Если введение осуществляют путем инъекций, кристаллы настоящего изобретения можно вводить после их растворения в водном растворе, предпочтительно, растворе Рингера или в буферном растворе, таком как физиологический солевой раствор, которые физиологически приемлемы. В случае введения через слизистую оболочку можно использовать усиливающий проницаемость агент, подходящий для соответствующего целевого барьера. Можно использовать усиливающие проницаемость агенты, которые обычно используют в указанной области техники.
[0048] Если используют пероральный способ введения, кристаллы настоящего изобретения можно вводить в комбинации с фармацевтически приемлемыми носителями, которые хорошо известны специалистам. Для перорального введения пациенту можно использовать такие фармацевтические формы, как таблетки, пилюли, леденцы, таблетки с сахарной оболочкой, капсулы, жидкости, гели, сиропы, взвеси и суспензии. Фармацевтические композиции для перорального введения можно получить, смешивая твердый эксципиент и другие подходящие добавки, при необходимости, гранулируя смесь и обрабатывая полученные гранулы до получения таблеток или ядер для нанесения сахарной оболочки.
Примеры эксципиентов включают увеличивающие объем агенты - сахара, такие как лактоза, сахароза, маннит или сорбит; специально обработанную целлюлозу, такую как кукурузный крахмал, пшеничный крахмал, рисовый крахмал и картофельный крахмал; и смолу трагаканта, метилцеллюлозу, гидроксипропилметилцеллюлозу и/или натрийкарбоксиметилцеллюлозу и т.д.
При необходимости можно добавлять разрыхляющие агенты, такие как агар и альгиновая кислота. Можно использовать соли, такие как альгинат натрия.
[0049] Фармацевтические композиции для перорального введения включают твердые капсулы, полученные из желатина с пластификаторами, такими как желатин, глицерин или сорбит. Твердые капсулы могут содержать кристаллы настоящего изобретения вместе с увеличивающими объем агентами, такими как лактоза, связующими, такими как крахмал, смазывающими агентами, такими как тальк или стеарат магния, и стабилизирующими агентами, при необходимости. В случае мягких капсул кристаллы настоящего изобретения можно растворить или суспендировать в подходящей жидкости, такой как жирные масла, жидкий парафин или жидкий полиэтиленгликоль. К лекарственной композиции может быть добавлен стабилизирующий агент.
[0050] Фармацевтическая композиция может также содержать подходящий носитель или эксципиент в твердой или в жидкой фазе. Примеры носителей или эксципиентов включают карбонат кальция, фосфат кальция, различные типы сахаров, крахмал, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоль и т.д.
[0051] Эффективное количество кристаллов в фармацевтических композициях, включающих кристаллы настоящего изобретения, для лечения можно оценить, используя вначале анализ культуры. Затем вводимое количество можно увеличить для экспериментов на животных таким образом, чтобы диапазон концентраций для циркуляции составлял величину IC50 (а именно концентрации кристаллов или их фармацевтических композиций обеспечивали бы половину максимального ингибирования PK активности), определенной в анализе клеточных культур. Затем эффективное количество для людей можно более точно определить, используя такую информацию.
[0052] Токсичность и терапевтический эффект кристаллов или фармацевтических композиций, включающих кристаллы настоящего изобретения, можно измерить, определяя значение IC50 кристаллов или фармацевтических композиций, включающих указанные кристаллы, используя стандартные медицинские процедуры в клеточной культуре или на лабораторных животных. Результаты, полученные в анализе клеточных культур и в экспериментах на животных, можно использовать для предварительного определения интервала величин доз, используемых для людей. Величины доз для людей меняются в зависимости от состава лекарственного средства и способа введения. С учетом состояния пациентов, каждый практикующий врач может выбрать конкретные композиции лекарственных средств и дозы (например, со ссылкой на Fingl et al., 1975, in "The Pharmacological Basis of Therapeutics", и Ch.1, p. 1).
При пероральном введении взрослым пациентам доза обычно составляет 0,1 мкг - 1 г/в день, предпочтительно, составляет 0,01-200 мг/день, и в случае парентерального введения доза обычно составляет 1 мкг - 10 г/день, предпочтительно 0,1-10 мг/день, хотя эта величина зависит от типа заболевания, способа введения и возраста и массы тела пациента.
[0053] Далее разъясняется способ получения соединения (I) настоящего изобретения.
Способ получения соединение (I) в настоящем изобретении проиллюстрирован на схеме 1:
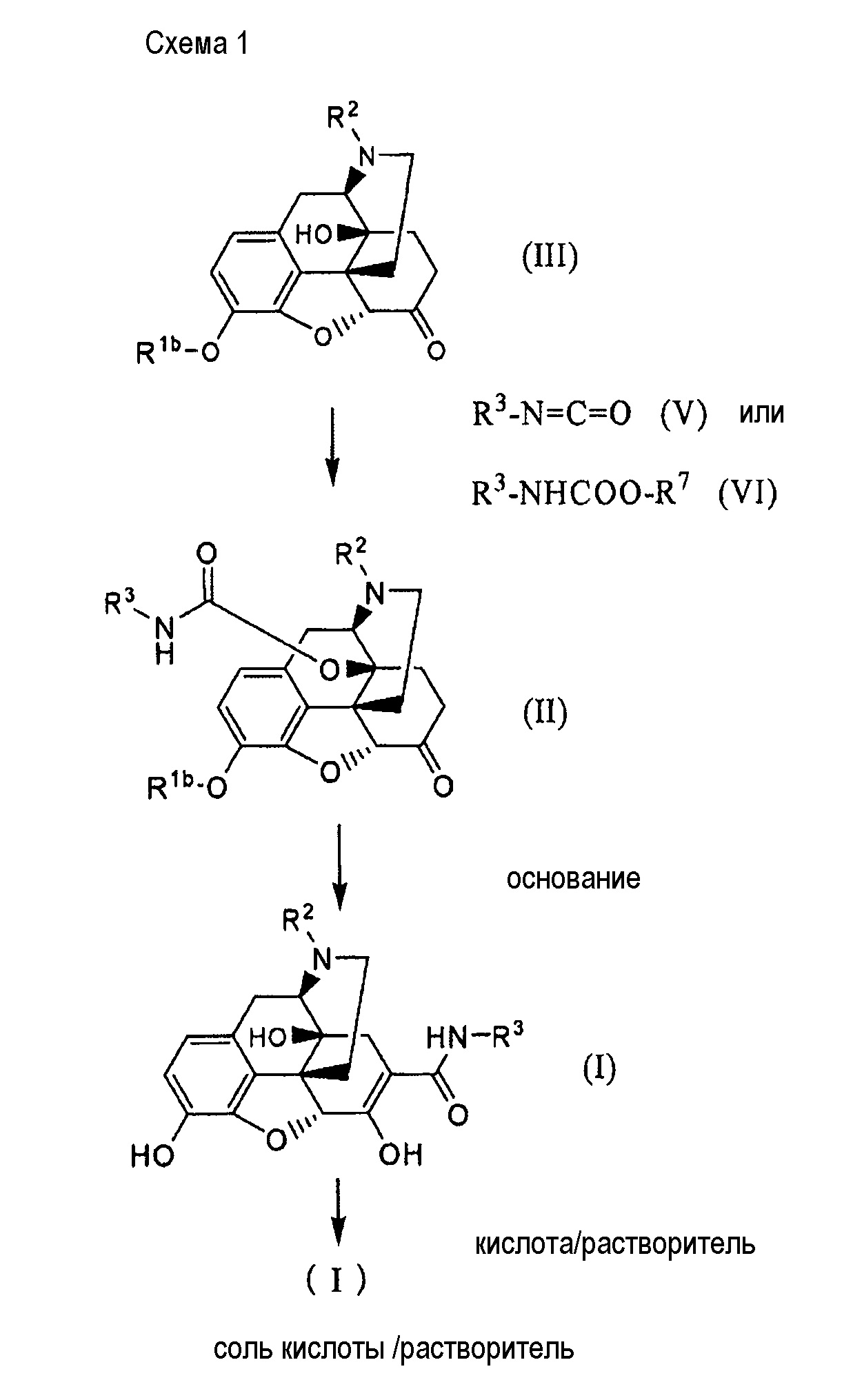
где Rlb представляет собой гидроксил-защищающую группу; R2 представляет собой необязательно замещенный алкил; R3представляет собой необязательно замещенный алкил, необязательно замещенный циклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил; и R7 представляет собой необязательно замещенный фенил.
В соответствии с настоящим изобретением соединение (I) можно получить, добавляя основание к производному карбамата (II) и осуществляя их взаимодействие при температуре в интервале от комнатной до температуры ниже температуры кипения растворителя в течение от 1 до 10 часов. В качестве оснований предпочтительны неорганические основания, такие как гидроксид лития, гидроксид натрия, гидроксид калия и гидроксид цезия, и предпочтительно, добавление водного раствора, содержащего 1-10 эквивалентов щелочи к производному карбамата (II). Осуществляют реакцию производного карбамата, предпочтительно, растворяя его в гидрофильном растворителе, таком как метанол, этанол, 2-пропанол и ДМСО и т.д., и добавляя водный раствор вышеуказанный щелочи.
Хотя гидроксил-защищающая группа в R1b в производном карбамата (II) конкретно не ограничена, возможно непосредственно получить соединение (I), если адаптировать защитную группу, которую можно удалить под действием основания, такую как ацетильная группа. В случае защитной группы, которую нельзя удалить основанием, удаление защитной группы можно осуществить до или после обработки вышеуказанным основанием.
Производное карбамата (II) получают, осуществляя взаимодействие изоцианатного производного (V) с соединением (III). Реакцию осуществляют, добавляя раствор, содержащий от 0,5 до 5 эквивалентов, предпочтительно, от 1,0 до 1,2 эквивалентов изоцианатного производного (IV) относительно соединения (III), к раствору соединения (III), и осуществляя их взаимодействие при температуре от комнатной до температуры ниже температуры кипения растворителя в течение от 1 до 10 часов. Предпочтительно добавлять катализатор - кислоту Льюиса, такую как, например, CuCl2, в количестве от 0,00005 до 1 эквивалента, предпочтительно, от 0,0001 до 0,1 эквивалента, более предпочтительно от 0,0001 до 0,01 эквивалента. Этилацетат, ацетонитрил, ацетон, толуол и т.д. можно использовать в качестве реакционного растворителя, хотя нет конкретных ограничений.
Вышеуказанное изоцианатное производное (V) можно получить, осуществляя взаимодействие предшественника карбамата (VIII), где R5 представляет собой низший алкил, в присутствии кислоты Льюиса и основания в соответствии со следующей схемой:

Производное карбамата (II) можно также получить, используя активный эфир (VI) карбаминовой кислоты, где R7 представляет собой необязательно замещенный фенил, вместо изоцианатного производного. Активный эфир можно получить, осуществляя взаимодействие хлорформиата соответствующего фенола с аминопроизводным: R3-NH2:

В указанной реакции предпочтителен R7, в котором OR7 группа функционирует как уходящая группа X, и особенно предпочтительны фенильная группа, п-нитрофенильная группа, п-хлорфенильная группа и т.д.
ПРИМЕРЫ
[0054] Далее настоящее изобретение разъясняется более подробно с привлечением примеров, но указанные примеры не ограничивают настоящего изобретение. Хотя предпринимались попытки гарантировать точность, приближающуюся к численным значениям (например, количества, температуры и т.д.), следует принять во внимание некоторые ошибки и отклонения. Если конкретно не указано, % представляет собой массовый % компонента, и массовый % представляет собой массовый % от полной массы композиции. Давление является атмосферным давлением или приближающимся к нему давлением. В рассматриваемом описании приняты следующие сокращения: г (g) представляет собой грамм, L представляет собой литр, мг (mg) представляет собой миллиграмм, мл (mL) представляет собой миллилитр, Boc представляет собой трет-бутоксикарбонильную группу, Ac представляет собой ацетил, Me представляет собой метильную группу, Et представляет собой этильную группу, и Pr представляет собой пропильную группу.
(Получение дифракционного спектра рентгеновских лучей)
Рентгеновские дифракционные спектры кристаллов, полученных в каждом из примеров, осуществляют в следующих условиях измерения в соответствии со способами получения дифракционных спектров рентгеновских лучей, раскрытыми в General Test Procedures of the Japanese pharmacopoeia (фармакопеи Японии).
(Прибор)
D-8 Discover (Bruker)
(Методика получения)
Что касается образцов, то применяют следующие условия измерений.
Способ измерения: Способ отражения
Тип источника излучения: Cu трубка
Рабочая длина волны: CuK α излучение
Ток в трубке: 40 мА
Напряжение на трубке: 40 кВ
Подложка для образца: Стекло
Интервал углов тестирования: 3°-40°
[0055]
(Получение результатов TG/DTA) (TG/DTA = Комплекс дифференциальнотермического и термогравиметрического анализа)
Отмеряют около 5 мг каждого из кристаллов, полученных в каждом примере, помещают в алюминиевый контейнер и измеряют в открытой системе. Условия измерений следующие.
(Условия измерений)
Прибор: TG/DTA 6300 от SEIKO
Интервал температур при измерениях: 25-300°C
Скорость нагревания: 10°C/мин
[0056]
[Пример 1-1]
Получение соли п-толуолсульфоновой кислоты [соединение (9)] соединения (IA)

[0057] Стадия 1: Синтез соединения (3)
Диизопропилэтиламин (17,5 г, 135,4 ммоль) добавляют к раствору трет-бутоксикарбониламиноизомасляной кислоты (1) (25,0 г, 123 ммоль) в н-пропилацетате (150 мл) при 0°C. К смеси по каплям добавляют изобутилхлорформиат (17,6 г, 128,9 ммоль) при той же температуре и перемешивают в течение часа. К полученному добавляют раствор бензамидоксима (2) (17,6 г, 129,3 ммоль) в н-пропилацетате (100 мл) и перемешивают при 0°C в течение 1 часа и затем при 95°C в течение 5 часов. Добавляют кислотный водный раствор, и выделяют органический слой, промывают гидрокарбонатом натрия и водой и концентрируют в вакууме. К реакционному раствору добавляют хлористоводородную кислоту, перемешивают в течение 2,5 часа, и выпавшие в осадок кристаллы собирают фильтрованием, промывают и сушат, получая соединение (3) (27,34 г, 92,7%).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,80 (6Н, с), 7,59-7,64 (3Н, м), 8,01-8,05 (2Н, м), 9,26 (3Н, уш.).
[0058] Стадия 2: Синтез соединения (4)
К суспензии соединения (3) (19,0 г, 79,2 ммоль) в толуоле (150 мл) при 25°C добавляют щелочную воду и перемешивают. Добавляют метилхлорформиат (8,3 г, 88,0 ммоль) при 50°C, перемешивают в течение часа, органический слой выделяют, промывают последовательно водным раствором хлористоводородной кислоты, водным раствором бикарбоната натрия и водой и концентрируют в вакууме.
К полученному добавляют раствор треххлористого бора (1,0 моль/л, 7,3 мл) в толуоле, по каплям добавляют триэтиламин при 50°C и перемешивают в течение 2 часов. Реакционный раствор концентрируют, получая раствор соединения (4).
[0059] Стадия 3: Синтез соединения (6)
Триэтиламин (11,3 г, 111,7 ммоль) и уксусный ангидрид (5,7 г, 55,8 ммоль) добавляют к раствору коммерческого гидрохлорида налтрексона (5) (20,0 г, 52,9 ммоль) в этилацетате (160 мл) и перемешивают при 40°C в течение 2 часов. Реакционный раствор охлаждают, промывают водой и концентрируют, получая раствор соединения (6).
1H ЯМР (300 МГц, ДМСО-d6) δ 0,14 (2H, д, J=4,8 Гц), 0,49 (2H, д, J=7,8 Гц), 0,88 (1H, м), 1,29 (1H, д, J=9,9 Гц), 1,46 (1H, тд, J=14,1, 3,3 Гц), 1,79 (1H, дт, J=12,0, 3,3 Гц), 1,90-2,00 (1H, м), 2,11 (1H, дт, J=14,4, 3,3 Гц), 2,26 (3H, с), 2,30-2,46 (3H, м), 2,52-2,72 (2H, м), 2,92 (1H, тд, J=14,1, 4,8 Гц), 3,07 (1H, д, J=18,9 Гц), 3,17 (1H, д, J=5,7 Гц), 4,91 (1H, с), 5,18 (1H, с), 6,71 (1H, д, J=8,1 Гц), 6,83 (1H, д, J=8,1 Гц).
[0060] Стадия 4: Синтез соединения (7)
Реакционный раствор соединения (4) и этилацетат добавляют к раствору соединения (6), к полученному добавляют водный раствор хлорида меди (II) и перемешивают при 25°C в течение 4 часов. К реакционному раствору добавляют гептан и осуществляют кристаллизацию. Фильтруют, промывают и сушат, получая в результате соединение (7) (89,2%).
1H ЯМР (300 МГц, ДМСО-d6) δ 0,20-0,40 (2H, м), 0,60-0,90 (1H, м), 1,20-1,50 (2H, м), 1,67 (3H, с), 1,74 (3H, с), 1,90-2,10 (2H, м), 2,10-2,20 (2H, м), 2,26 (3H, с), 2,30-2,55 (2H, м), 2,58-2,80 (4H, м), 3,03 (2H, м), 4,31 (1H, с), 4,81 (1H, с), 6,71 (1H, д, J=8,1 Гц), 6,85 (1H, d, J=7,8 Гц), 7,50-7,70 (3H, м), 7,92-8,01 (2H, м), 8,11 (1H, с).
[0061] Стадия 5: Синтез соединения (8)
Водный раствор гидроксида калия по каплям добавляют к суспензии соединения (7) (5,5 г, 9,0 ммоль) в 2-пропаноле (22 мл) и перемешивают при 80°C в течение 5 часов. Реакционный раствор промывают толуолом, величину pH доводят до 7,0-8,0 и экстрагируют н-пропилацетатом. Органический слой промывают водой, добавляют 2-пропанол и н-пропилацетат и концентрируют. Добавляют раствор п-толуолсульфоновой кислоты (1,5 г, 8,l ммоль) в 2-пропаноле для осуществления кристаллизации. После охлаждения выпавший осадок собирают фильтрованием, получая влажный продукт (8) (н-пропилацетат/2-пропанольный сольват соли п-толуолсульфоновой кислоты).
Результаты рентгеновского дифракционного и TG/DTA анализов влажного продукта (8) (н-пропилацетат/2-пропанольный сольват соли п-толуолсульфоновой кислоты) представлены в следующем сравнительном примере 3.
[0062] Стадия 6: Синтез соединения (9)
Влажный продукт (8) растворяют в метаноле и н-пропилацетате путем нагревания, и полученный раствор фильтруют, промывают и концентрируют в вакууме. Выпавший осадок собирают фильтрованием, промывают, получая сырой продукт, который сушат при температуре 60°C в течение 3 часов в вакууме, получая кристаллы соединения (9) (не сольват: 66,3%).
1H ЯМР (300 МГц, ДМСО-d6) δ 13,37 (1H, с), 9,44 (1H, с), 8,95 (1H, уш.с), 8,12 (1H, с), 7,99-7,96 (2H, м), 7,60-7,53 (3H, м), 7,49-7,45 (2H, м), 7,11 (2H, д, J=8,4 Гц), 6,69 (2H, ABq,), 6,56 (1H, с), 4,94 (1H, с), 3,95 (1H, д, J=5,1 Гц), 3,50-3,25 (2H, м), 3,07 (2H, уш.д, J=12 Гц), 3,00-2,90 (1H, м), 2,75-2,60 (1H, м), 2,60-2,40 (2H, м), 2,29 (3H, с), 2,10 (1H, д, J=14,7 Гц), 1,70 (6H, с), 1,75-1,60 (1H, м), 1,15-0,95 (1H, м), 0,80-0,55 (2H, м), 0,55-0,35 (2H, м).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг.1 и в таблице 2.

В рентгеновском дифракционном спектре порошка наблюдаются пики, соответствующие дифракционным углам (2θ): 7,8°±0,2°, 10,6°±0,2°, 15,6°±0,2°, 17,8°±0,2°, 18,6±0,2°, 20,4°±0,2°, 21,5°±0,2°, 21,9°±0,2°, 23,6°±0,2° и 25,5°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 14.
[0063] [Пример 1-2]
Получение соли п-толуолсульфоновой кислоты [соединение (9)] соединения (IA)
(альтернативный способ A)

[0064] Стадия 1: Синтез соединения (11)
CDI (карбонилдиимидазол, 5,28 г, 31,1 ммоль) и ацетонитрил (5 мл) добавляют к суспензии метоксикарбонил-2-метилаланина (10) (5,00 г, 31,0 ммоль) в ацетонитриле (25 мл) при 0°C и перемешивают в течение 1,5 часа. Бензамидоксим (2) (4,65 г, 34,2 ммоль) и ацетонитрил (20 мл) добавляют при той же температуре и перемешивают в течение 2 часов. К полученному сразу добавляют водный раствор карбоната калия [0,10 эквивалента в отношении к соединению (10): 0,43 г] в воде (15 мл) и осуществляют реакцию при температуре ниже, чем температура кипения растворителя, в течение 1-5 часов. После концентрирования в вакууме добавляют воду, и выпавший в осадок сырой продукт собирают фильтрованием и промывают. Влажный продукт сушат, получая соединение (11) (7,43 г, выход 91,7%).
1H ЯМР (300 МГц, CDCl3) δ: 1,81 (6H, с), 3,65 (3H, с), 5,46 (1H, с), 7,49-7,50 (3H, м), 8,05-8,08 (2H, м).
[0065] Стадия 2: Синтез соединения (4)
Триэтиламин (7,55 г, 74,63 ммоль) по каплям добавляют к раствору соединения (11) (15,12 г, 57,41 ммоль) и треххлористого алюминия (9,19 г, 68,89 ммоль) в толуоле при 50°C и перемешивают при той же температуре в течение 2,5 часа. Органический слой выделяют и концентрируют, получая реакционный раствор соединения (4).
1H ЯМР (300 МГц, CDCl3) δ: 1,84 (6H, c), 7,31-7,55 (3H, м), 8,05-8,13 (2H, м).
13C-ЯМР (75 МГц, CDCl3) δ: 29,85, 55,71, 126,16, 127,44, 128,78, 131,35, 168,23, 180,88.
IR (cm-1): 1446, 1478, 1570, 1638, 2256, 2986, 3337.
[0066] Стадия 3-6: Синтез соединения (9)
Соединение (9) (не сольват) синтезируют из соединения (5), используя стадии примера 1-1.
[0067] [Пример 1-3]
Получение соли п-толуолсульфоновой кислоты [соединение (9)] соединения (IA)
(Альтернативный способ B)
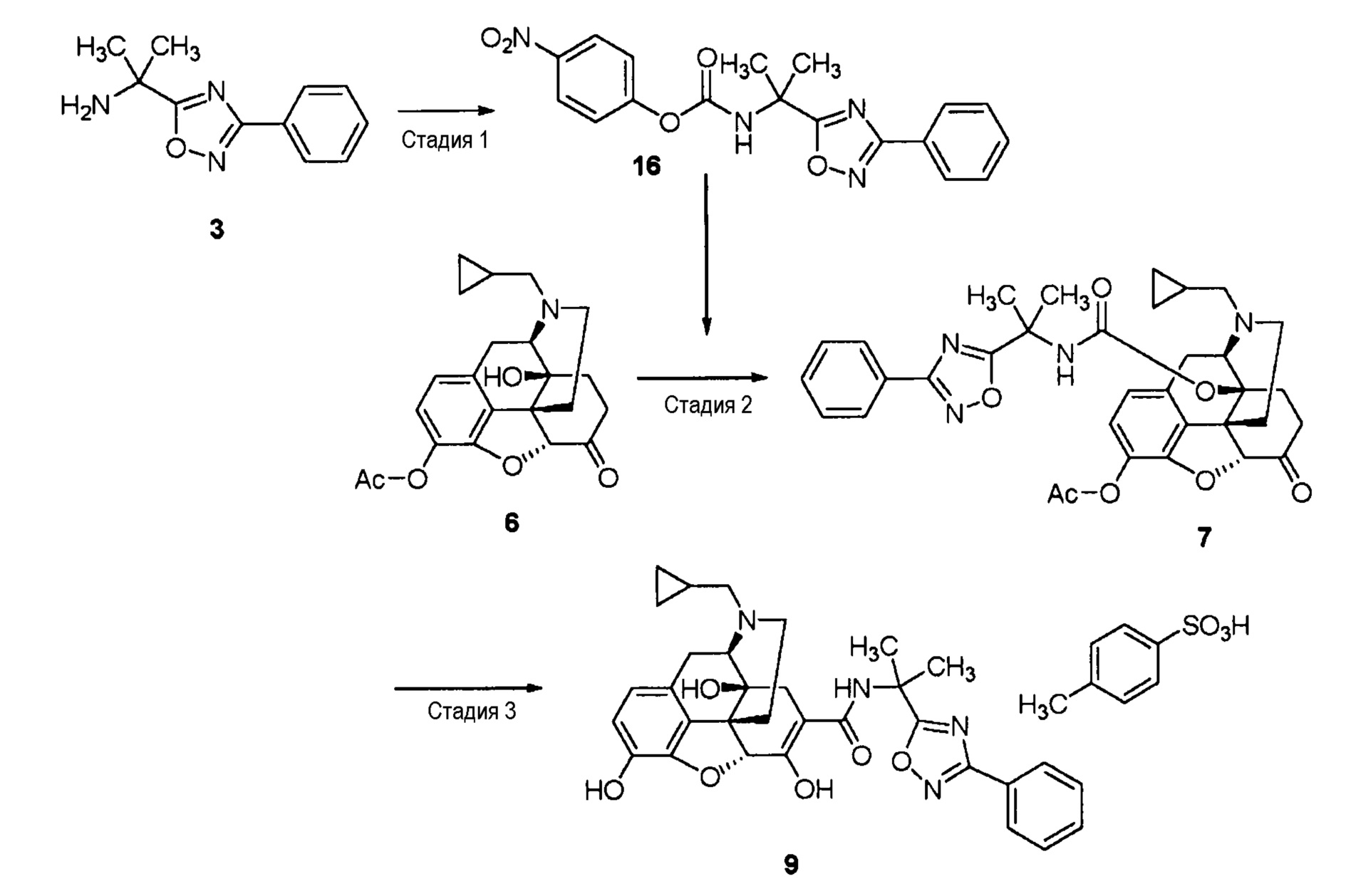
[0068] Стадия 1
Соединение (3) (2,03 г, 10,0 ммоль), полученное тем же способом, что и способ стадии 1 примера 1-1, растворяют в ацетонитриле (20 мл), добавляют пиридин (0,89 мл, 11,0 ммоль) и 4-нитрофенилхлорформиат (2,22 г, 11,0 ммоль) при охлаждении льдом, и перемешивают при комнатной температуре в течение 1,5 часа. Реакционный раствор выливают в ледяную воду, содержащую 2 моль/л хлористоводородной кислоты, и дважды экстрагируют этилацетатом. Полученный экстракт промывают солевым раствором, сушат над безводным сульфатом натрия, фильтруют и концентрируют. Гексан (примерно 20 мл) добавляют к полученному маслу бледно-желтого цвета (4,88 г), которое отверждается при охлаждении льдом. Полученный твердый продукт собирают фильтрованием, промывают гексаном, получая нужное соединение (16) (3,74 г) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3) δ 8,24 (2H, д, J=9,3 Гц), 8,09 (2H, м), 7,53-7,45 (3H, м), 7,33 (2H, уш.д, J=8,7 Гц), 5,99 (1H, уш.с), 1,92 (6H, с).
[0069] Стадия 2
Соединение (6) (3,28 г, 8,56 ммоль), синтезированное тем же способом, что и способ стадии 3 примера 1-1, и соединение (16) (3,79 г, 10,3 ммоль) растворяют в ацетонитриле (10 мл) и кипятят с обратным холодильником в течение 22 часов. Реакционный раствор охлаждают до комнатной температуры, выливают в ледяную воду и дважды экстрагируют этилацетатом. Полученный экстракт дважды промывают 0,1 моль/л водным раствором гидроксида натрия и один раз солевым раствором, сушат над безводным сульфатом магния, фильтруют и концентрируют. Полученное аморфное соединение (7) (5,46 г) используют на следующей стадии без дополнительной очистки.
1H ЯМР (ДМСО-d6) δ 8,0-7,9 (2H, м), 7,6-7,5 (3H, м), 6,9-6,7 (2H, Abq,), 4,32 (1H, с), 3,2-1,2 (12H, м), 2,26 (3H, с), 1,71 (1Н, д, J=21,6 Гц), 1,61 (6H, с), 0,95-0,65 (1H, м), 0,55-0,2 (2H, м), 0,2-0,5 (2H, м).
[0070] Стадия 3
Соединение (7) (500 мг) растворяют в диметилсульфоксиде (2 мл), добавляют 2 моль/л водный раствор гидроксида калия (2 мл) и перемешивают при 80°C в течение 6 часов. Реакционный раствор охлаждают до комнатной температуры, нейтрализуют, используя 2 моль/л хлористоводородную кислоту, и экстрагируют этилацетатом. Полученный экстракт промывают последовательно 0,1 моль/л водным раствором гидроксида натрия и солевым раствором, сушат над безводным сульфатом натрия, фильтруют и концентрируют. Полученное твердое аморфное вещество бледно-желтого цвета (412 мг) растворяют в метаноле (2 мл), добавляют гидрат п-толуолсульфоновой кислоты (165 мг) и оставляют выстаиваться в течение 30 минут. Затем добавляют ацетонитрил (20 мл), и оставляют выстаиваться при температуре 5°C в течение ночи. Выпавший осадок собирают фильтрованием и сушат в вакууме, получая соль п-толуолсульфоновой кислоты (9) (не сольват: 282 мг) в виде кристаллов (выход из соединения (6): 48%).
1H ЯМР (ДМСО-d6) δ 13,37 (1H, с), 9,44 (1H, с), 8,95 (1H, уш.с), 8,12 (1H, с), 7,99-7,96 (2H, м), 7,60-7,53 (3H, м), 7,49-7,45 (2H, м), 7,11 (2H, д, J=8,4 Гц), 6,69 (2H, ABq,), 6,56 (1H, с), 4,94 (1H, с), 3,95 (1H, d, J=5,1 Гц), 3,50-3,25 (2H, м), 3,07 (2H, уш.д, J=12 Гц), 3,00-2,90 (1H, м), 2,75-2,60 (1H, м), 2,60-2,40 (2H, м), 2,29 (3H, с), 2,10 (1H, д, J=14,7 Гц), 1,70 (6H, с), 1,75-1,60 (1H, м), 1,15-0,95 (1H, м), 0,80-0,55 (2H, м), 0,55-0,35 (2H, м).
[0071] [Пример 1-4]
Получение соли п-толуолсульфоновой кислоты [соединение (9)] соединения (IA)
(Альтернативный способ C)
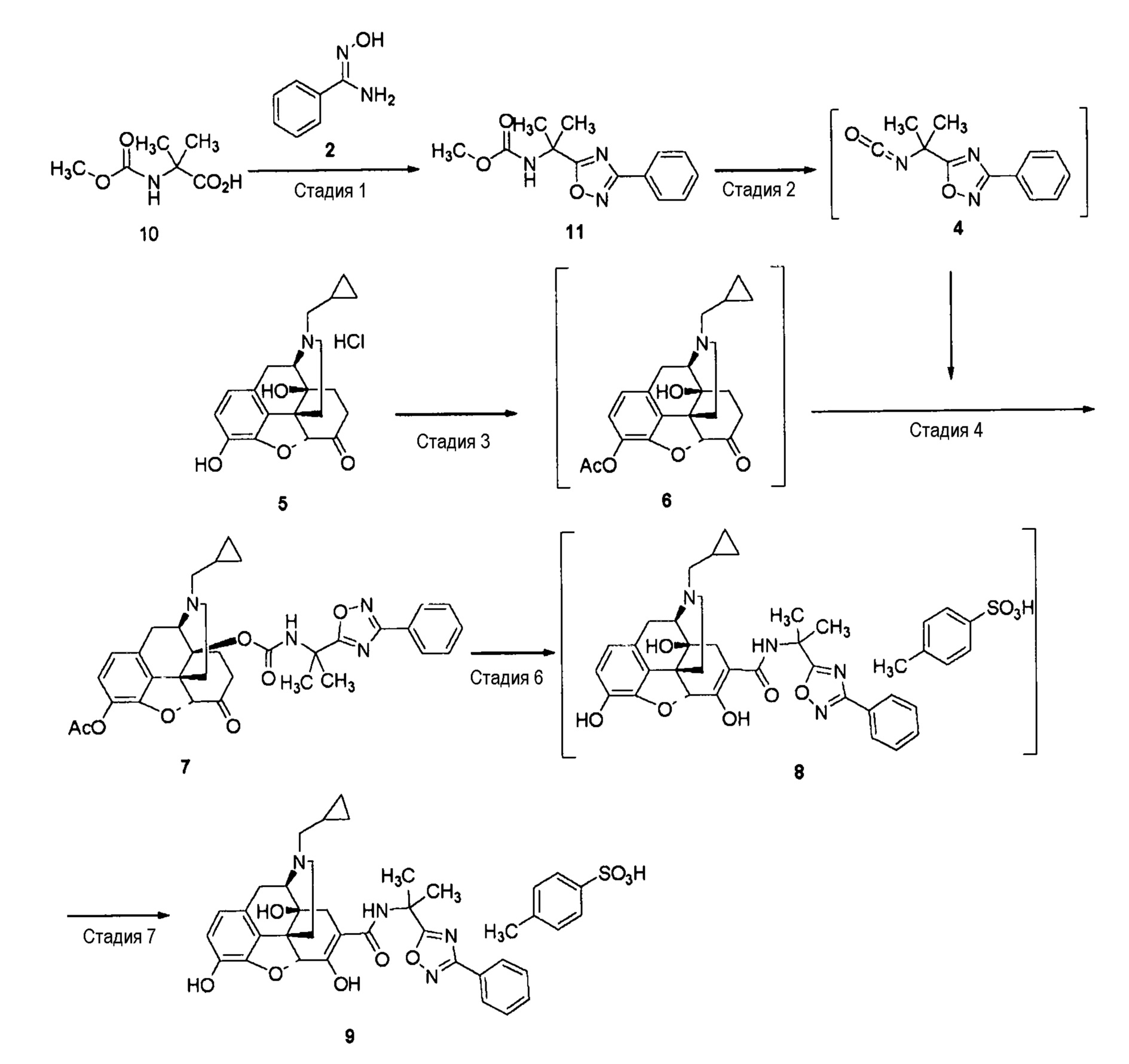
[0072] Стадия 1: Синтез соединения (4)
Толуол добавляют к соединению (11) (0,5 г, 1,91 ммоль), полученному тем же способом, что и способ стадии 1 примера 1-2. К полученному добавляют TiCl4 (2,30 ммоль), и смесь нагревают до 50°C. К реакционному раствору добавляют триэтиламин (2,30 ммоль) и перемешивают при той же температуре в течение 2 часов, получая реакционный раствор соединения (4).
Стадия 2-7: Синтез соединения (9)
Соединение (9) (не сольват) синтезируют из соединения (5), используя те же стадии, что и стадии примера 1-1.
[0073] [Пример 2]
Синтез соединения (20)

[0074] Стадия 1
Соединение (17) (4,51 г, 36 ммоль) растворяют в ацетонитриле (45 мл), и добавляют пиридин (3,20 мл, 39,6 ммоль) и фенилхлорформиат (5,00 мл, 39,6 ммоль) при охлаждении льдом. Добавляют диметилформамид (9 мл) и ацетонитрил (30 мл) и перемешивают при комнатной температуре в течение 45 минут. Выпавший из реакционного раствора осадок собирают фильтрованием, промывают холодным метанолом и водой и сушат в вакууме, получая целевое соединение (18) (7,02 г) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3) δ 8,61 (1H, с), 7,43 (2H, т, J=7,8 Гц), 7,41 (1H, с), 7,29 (1H, т, J=7,8 Гц), 7,21 (2H, д, J=7,8 Гц), 3,97 (3H, с).
[0075] Стадия 2
Соединение (6) (1,92 г, 5,00 ммоль), полученное тем же способом, что и способ стадии 3 примера 1-1, и соединение (18) (1,84 г, 7,50 ммоль) растворяют в диметилформамиде (10 мл) и перемешивают при температуре 120°C в течение 4 часов. Реакционный раствор охлаждают снова до комнатной температуры, добавляют ацетонитрил (50 мл) и выпавший осадок отфильтровывают. Полученный фильтрат концентрируют при температуре 60°C в вакууме, и выпаривают диметилформамид. К полученному остатку добавляют ацетонитрил (100 мл) и перемешивают при охлаждении льдом в течение 30 минут. Выпавшие в осадок кристаллы собирают фильтрованием, промывают холодным ацетонитрилом и сушат в вакууме, получая первую порцию кристаллов (1,66 г) соединения (19). Далее маточный раствор концентрируют, к остатку добавляют диэтиловый эфир и перемешивают при комнатной температуре, получая вторую порцию кристаллов (306 мг) и третью порцию кристаллов (71 мг).
1H ЯМР (ДМСО-d6) δ 10,58 (1H, уш.с), 8,52 (1H, с), 7,19 (1H, с), 6,83 (2H, Abq,), 4,78 (1H, с), 4,44 (1H, д, J=5,4 Гц), 3,90 (3H, с), 3,12 (1H, д, J=18,6 Гц), 2,9-2,55 (4Н, м), 2,35 (1Н, дд, J=6,3 Гц, 12,6 Гц), 2,27 (3H, с), 2,25-2,12 (3H, м), 2,1-1,9 (1H, м), 1,62-1,48 (1H, м), 1,28-1,20 (1H, м), 0,75-0,62 (1H, м), 0,35 (2H, д, J=7,5 Гц), 0,1-0,5 (2H, м).
[0076] Стадия 3
Соединение (19) (2,02 мг, 3,78 ммоль) растворяют в метаноле (9,5 мл), добавляют 2 моль/л водный раствор гидроксида калия (9,5 мл) и перемешивают при 60°C в течение 2,5 часа. Реакционный раствор охлаждают снова до комнатной температуры, нейтрализуют, используя 2 моль/л хлористоводородную кислоту при охлаждении льдом, и выпаривают метанол. Выпавший осадок сырых кристаллов собирают фильтрованием, перекристаллизовывают из смеси этилацетата и метанола (1:1), получая целевое соединение (20) (1,44 г, выход 77%) в виде кристаллов.
1H ЯМР (ДМСО-d6) δ 14,2 (1H, уш.с), 9,19 (1H, с), 8,8 (1H, уш.с), 8,32 (1H, с), 7,49 (1H, с), 6,56 (2H, ABq.), 6,1 (1H, уш.с), 4,53 (1H, уш.с), 3,82 (3H, с), 3,5-2,3 (9H, м), 1,82 (1H, д, J=15,6 Гц), 1,53 (1H, уш.д, J=13,5 Гц), 1,15-0,95 (1H, м), 0,75-0,5 (2H, м), 0,5-0,3 (2H, м).
[0077] [Пример 3-1]
Синтез соединения (7) (способ 1)

[0078] Соединение (6) (соответствующее гидрохлориду налтрексона 5,00 г), синтезированное по способу стадии 3 примера 1-1, растворяют в этилацетате, добавляют уксусную кислоту (0,1 эквивалента) и нагревают до 50°C. К полученному добавляют раствор соединения (4), синтезированного по способу стадий 1 и 2 примера 1-1, и перемешивают при той же температуре в течение 6,5 часа. К реакционному раствору добавляют гептан, выпавший в осадок твердый продукт собирают фильтрованием, промывают и сушат, получая соединение (7) (6,92 г, 85,3%).
[0079] [Пример 3-2]
Синтез соединения (7) (способ 2)
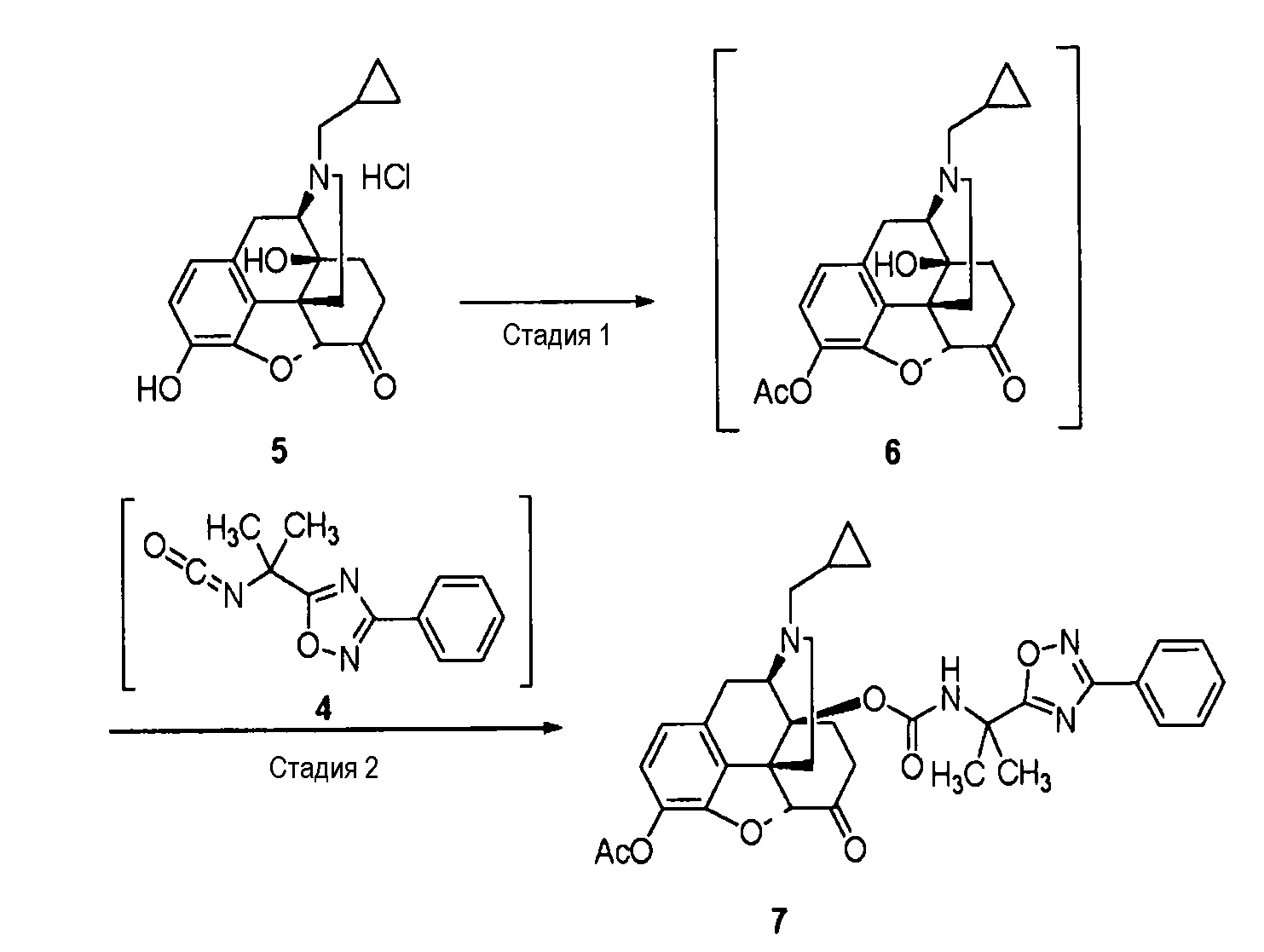
Соединение (6), синтезированное по способу стадии 3 примера 1-1, растворяют в этилацетате, к полученному добавляют соединение (4) (1,5 эквивалента) и толуол и перемешивают при 70°C в течение 8 часов, получая соединение (7).
[0080] [Пример 4]
Получение гидрата кристаллов соли п-толуолсульфоновой кислоты (форма I) соединения (IA)
Смесь 2-пропанола (25 мл) и воды (2,5 мл) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 5,00 г), полученной по способу представленного выше примера 1-1, и растворяют путем нагревания. Добавляют ацетонитрил (50 мл) и перемешивают при комнатной температуре в течение 4 часов. Выпавшие в осадок кристаллы собирают фильтрованием, сушат при 85°C в вакууме в течение 4 часов, получая кристаллы (4,68 г).
Элементный анализ:
Рассчитано: C, 60,28; H, 5,94; N, 7,21; S, 4,13 (рассчитано как 1,9 H2O)
Найдено: C, 60,5; H, 6,17; N, 7,21; S, 3,83
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 2 и в таблице 3.

В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 6,6°±0,2°, 8,9°±0,2°, 11,4°±0,2°, 12,9°±0,2°, 14,0°±0,2°, 15,0°±0,2°, 17,6°±0,2°, 18,2°±0,2°, 22,4°±0,2°, 25,4°±0,2° и 28,7°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 15. Если процент потерь массы рассчитывают на основании представленных результатов, эта величина составляет 2,42%. Поэтому оказывается, что содержание воды в кристаллах соответствует 1 молю воды. На основании представленных выше измерений можно сделать вывод о том, что содержание воды в форме-I соответствует 1-2 молям воды.
[0081] [Пример 5]
Получение кристаллов (формы II) гидрата соли п-толуолсульфоновой кислоты соединения (IA)
Тетрагидрофуран (12,5 мл) добавляют к соли п-толуолсульфоновой кислоты (не сольват, 5,00 г), синтезированной по способу вышеприведенного примера 1-1, и полученную соль растворяют. Добавляют н-пропилацетат (50 мл) и перемешивают при комнатной температуре в течение 4 часов. Выпавшие в осадок кристаллы собирают фильтрованием, сушат при 85°C в течение 4 часов в вакууме, получая кристаллы (4,77 г).
Элементный анализ:
Рассчитано: C, 61,56; H, 5,83; N, 7,36; S, 4,21 (рассчитано как 1,0 H2O)
Найдено: C, 61,68; H, 5,78; N, 7,39; S, 4,07
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 3 и в таблице 4.

В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 7,1°±0,2°, 8,8°±0,2°, 17,5°±0,2°, 19,2°±0,2°, 19,7°±0,2°, 21,2°±0,2°, 21,9°±0,2°, 23,7°±0,2°, 24,5°±0,2° и 26,1°±0,2°
Результаты TG/DTA анализа представлены на фиг. 16. Если процент потерь массы рассчитывают на основании представленных результатов, эта величина составляет 1,42%. Поэтому оказывается, что содержание воды в кристаллах соответствует 0,5 моля воды. На основании представленных выше измерений можно сделать вывод, что содержание воды в форме II соответствует 0,5-1 молям воды.
[0082] [Пример 6]
Получение ацетата соединения (IA)
Этилацетат (100 мл) и водный раствор (50 мл) карбоната натрия (3,18 г; 1,1 эквивалента относительно соли п-толуолсульфоновой кислоты) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 20,0 г), полученной по способу вышеприведенного примера 1-1, и органический слой выделяют. Этилацетатный слой промывают 1% водным раствором карбоната натрия (50 мл) и насыщенным солевым раствором (50 мл), и каждый водный слой экстрагируют этилацетатом. Этилацетатный слой сушат над безводным сульфатом натрия и концентрируют до около 30 г. Добавляют ацетонитрил (200 мл) и уксусную кислоту (4,6 мл; 3 эквивалента относительно соли п-толуолсульфоновой кислоты), и перемешивают при комнатной температуре. После появления выпавших в осадок кристаллов смесь оставляют выстаиваться при комнатной температуре в течение дня. Выпавший осадок собирают фильтрованием, получая кристаллы (16,17 г).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 4 и в таблице 5.

В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 5,6°±0,2°, 8,3°±0,2°, 9,1°±0,2°, 10,3°±0,2°, 12,0°±0,2°, 13,5°±0,2°, 14,6°±0,2°, 16,3°±0,2° и 26,0°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 17.
[0083] [Пример 7]
Получение гидрохлорида соли соединения (IA)
Этилацетат (100 мл) и водный раствор (50 мл) карбоната натрия (3,18 г; 1,1 эквивалента относительно соли п-толуолсульфоновой кислоты) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 20,0 г), полученной по способу вышеприведенного примера 1-1, и органический слой выделяют. Этилацетатный слой дважды промывают водой (50 мл), и каждый водный слой экстрагируют этилацетатом. Этилацетатный слой сушат над безводным сульфатом натрия, добавляют ацетонитрил (200 мл) и 4 моль/л смеси хлористоводородная кислота-этилацетат (10 мл; 1,5 эквивалента относительно соли п-толуолсульфоновой кислоты) и концентрируют до около 50 г. К концентрированному раствору добавляют ацетонитрил (200 мл) и перемешивают при комнатной температуре в течение одного часа. Выпавший осадок собирают фильтрованием, получая кристаллы (10,01 г).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 5 и в таблице 6.

В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 8,5°±0,2°, 10,8°±0,2°, 11,3°±0,2°, 12,7°±0,2°, 13,9°±0,2°, 15,6°±0,2°, 17,3°±0,2°, 19,2°±0,2°, 20,1°±0,2° и 23,9°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 18.
[0084] [Пример 8]
Получение этанольного сольвата соединения (IA)
Этилацетат (100 мл) и водный раствор (50 мл) карбоната натрия (3,18 г; 1,1 эквивалента относительно соли п-толуолсульфоновой кислоты) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 20,0 г), полученной по способу вышеприведенного примера 1-1, и органический слой выделяют. Этилацетатный слой промывают 1% водным раствором карбоната натрия (50 мл) и насыщенным солевым раствором (50 мл), и каждый водный слой экстрагируют этилацетатом (50 мл).
Этилацетатный слой сушат над безводным сульфатом натрия и концентрируют до около 30 г. Добавляют этанол (100 мл) и разбавляют изопропиловым эфиром до такой степени, сразу после которой раствор мутнеет. Полученную смесь перемешивают при комнатной температуре, и смесь оставляют выстаиваться при комнатной температуре в течение дня, после того, как начинают выпадать в осадок кристаллы. Осадок собирают фильтрованием, получая кристаллы (9,57 г).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 6 и в таблице 7.
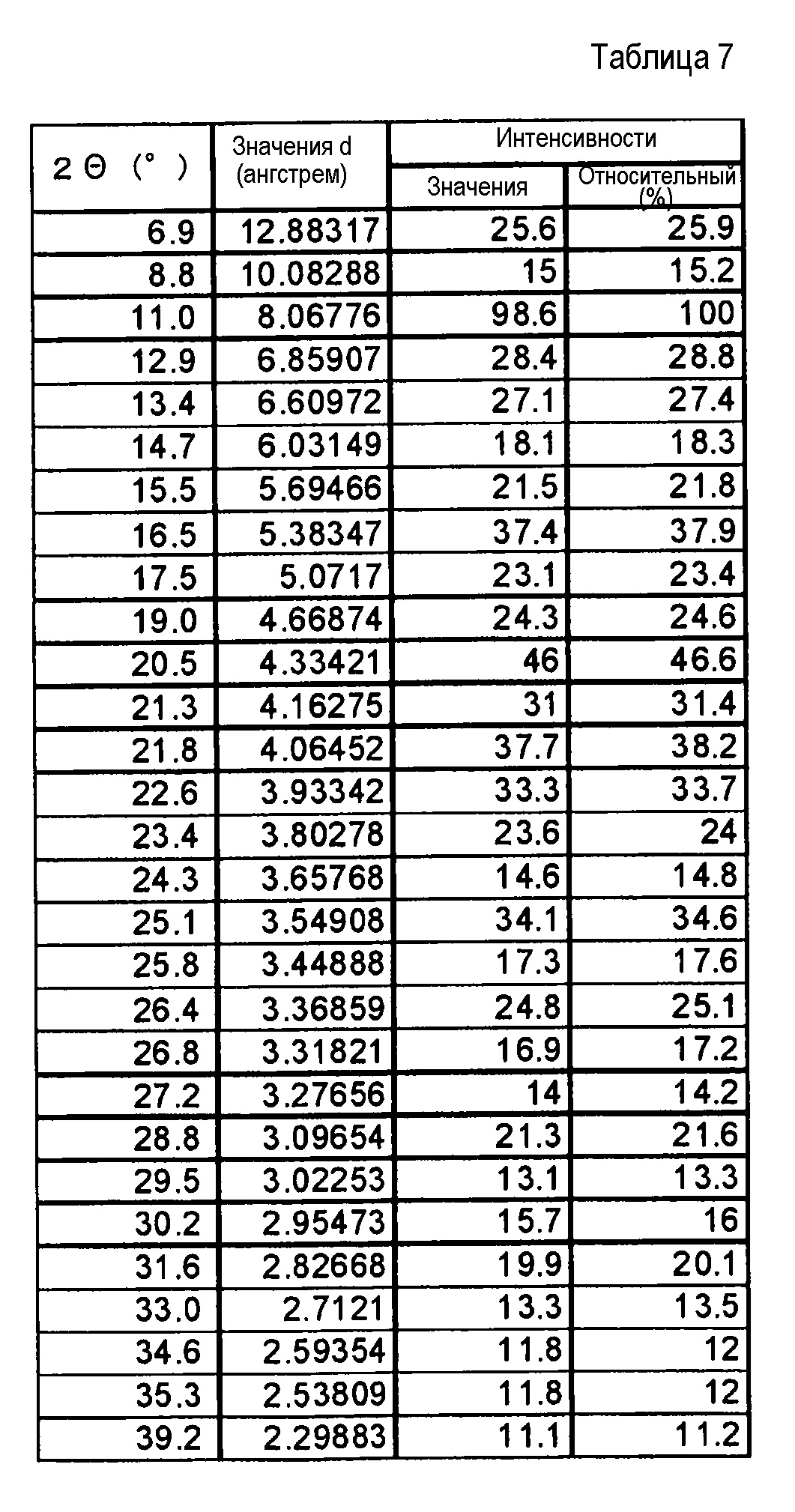
В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 6,9°±0,2°, 11,0°±0,2°, 12,9°±0,2°, 13,4°±0,2°, 16,5°±0,2°, 20,5°±0,2°, 21,3°±0,2°, 21,8°±0,2°, 22,6°±0,2° и 25,1°±0,2°
Результаты TG/DTA анализа представлены на фиг. 19.
[0085] [Пример 9]
Получение свободной формы соединения (IA)
Этанольный сольват соединения примера 8 сушат при 120°C в течение 10 часов в вакууме, и данные ЯМР подтверждают тот факт, что этанол не остается в кристаллах.
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 7 и в таблице 8.
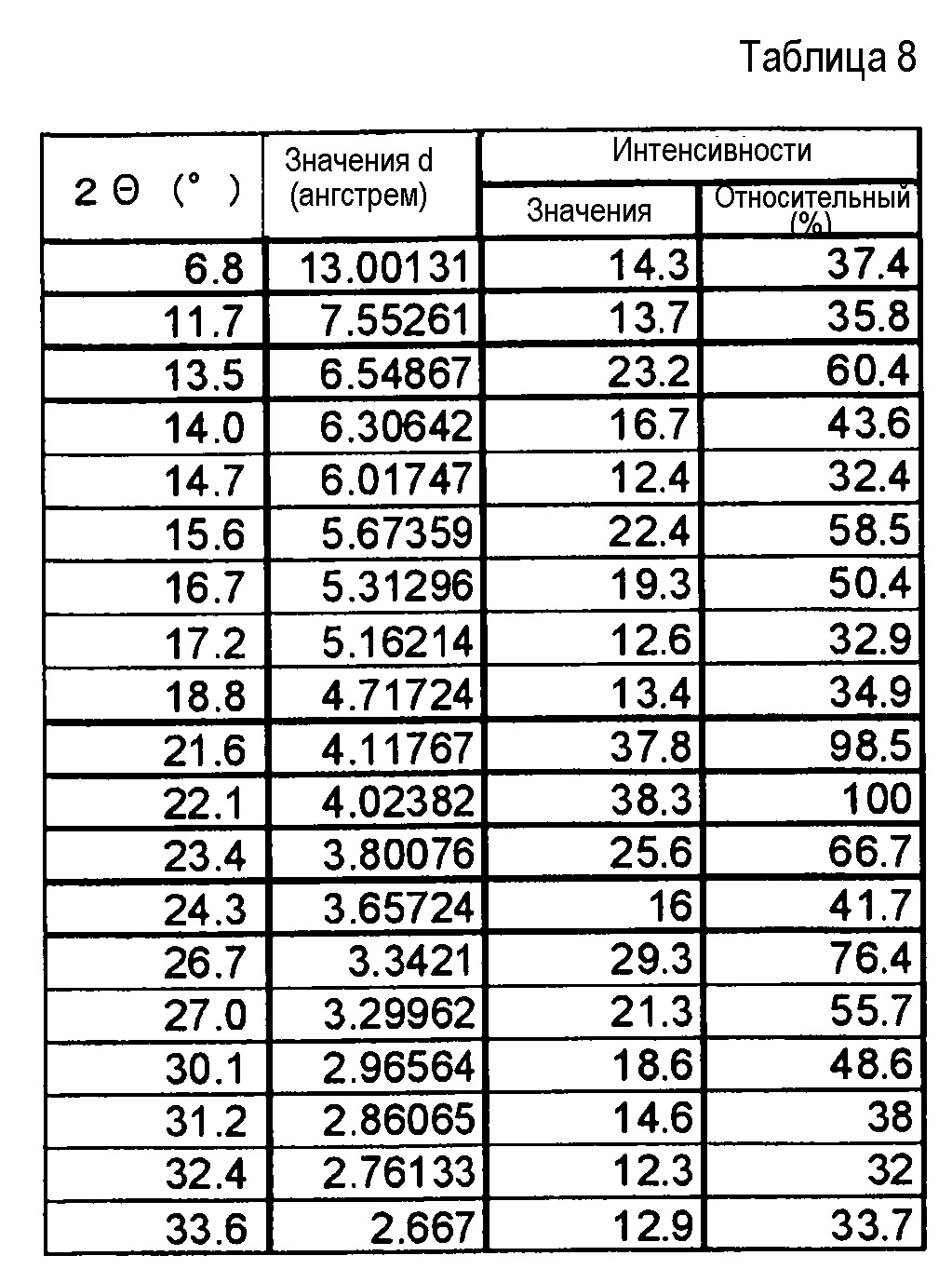
В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 6,8°±0,2°, 11,7±0,2°, 13,5°±0,2°, 15,6°±0,2°, 16,7°±0,2°, 21,6°±0,2°, 22,1°±0,2°, 23,4°±0,2°, 26,7°±0,2° и 30,1°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 20.
[0086] [Пример 10]
Получение метилацетатного сольвата соли п-толуолсульфоновой кислоты соединения (IA)
Смесь 2-пропанола (5 мл) и воды (0,5 мл) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 1,0 г), полученному по способу вышеприведенного примера 1-1, и растворяют его путем нагревания. Метилацетат (20 мл) добавляют и перемешивают при комнатной температуре в течение 4 часов. Выпавший осадок собирают фильтрованием, получая кристаллы (0,98 г).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 8 и в таблице 9.
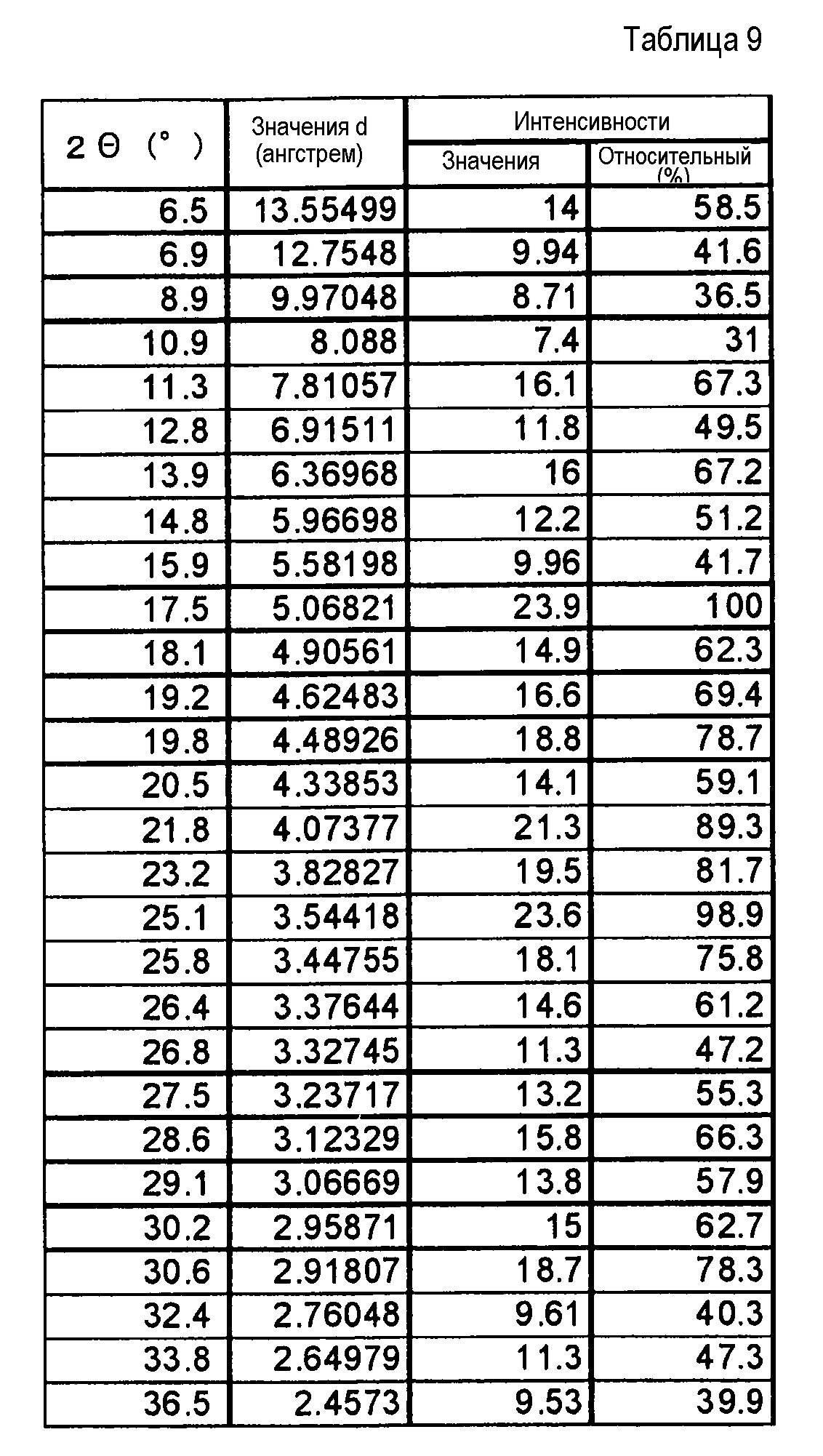
В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 17,5°±0,2°, 21,8°±0,2°, 23,2°±0,2°, 25,1°±0,2° и 30,6°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 21.
[0087] [Пример 11]
Получение этилацетат/2-пропанольного сольвата соли п-толуолсульфоновой кислоты соединения (IA)
Смесь 2-пропанола (5 мл) и воды (0,5 мл) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 1,0 г), полученной по способу вышеприведенного примера 1-1, и растворяют путем нагревания. Добавляют этилацетат (20 мл) и перемешивают при комнатной температуре в течение 4 часов. Выпавший осадок собирают фильтрованием, получая кристаллы (0,96 г).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 9 и в таблице 10.

В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 6,6°±0,2°, 7,8°±0,2°, 17,0°±0,2°, 17,8°±0,2°, 18,5°±0,2°, 21,9°±0,2° и 23,6°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 22.
[0088] [Пример 12]
Получение н-пропилацетат/2-пропанолльного сольвата соли п-толуолсульфоновой кислоты соединения (IA)
Результаты рентгеновского дифракционного спектра влажного порошка продукта (8), полученного на стадии 5 вышеприведенного примера 1-1, представлены на фиг. 10 и в таблице 11.

В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 6,5°±0,2°, 8,3°±0,2°, 15,5°±0,2°, 16,8°±0,2° и 18,3°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 23.
[0013] [Пример 13]
Получение ацетонитрильного сольвата соли п-толуолсульфоновой кислоты соединения (IA)
Смесь 2-пропанола (5 мл) и воды (0,5 мл) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 1,0 г), полученной по способу вышеприведенного примера 1-1, и растворяют путем нагревания. Добавляют ацетонитрил (15 мл) и перемешивают при комнатной температуре в течение 4 часов. Выпавший осадок собирают фильтрованием, получая кристаллы (1,02 г).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 11 и в таблице 12.

В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 11,3°±0,2°, 17,6°±0,2°, 21,7°±0,2°, 22,3°±0,2° и 28,5°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 24.
[0090] [Пример 14]
Получение 1,2-диметоксиэтанового сольвата соли п-толуолсульфоновой кислоты соединения (IA)
Тетрагидрофуран (5 мл) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 1,0 г), полученной по способу вышеприведенного примера 1-1, и растворяют путем нагревания. Добавляют 1,2-диметоксиэтан (20 мл) и перемешивают при комнатной температуре в течение 4 часов. Выпавший осадок собирают фильтрованием, получая кристаллы (1,05 г).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 12 и в таблице 13.
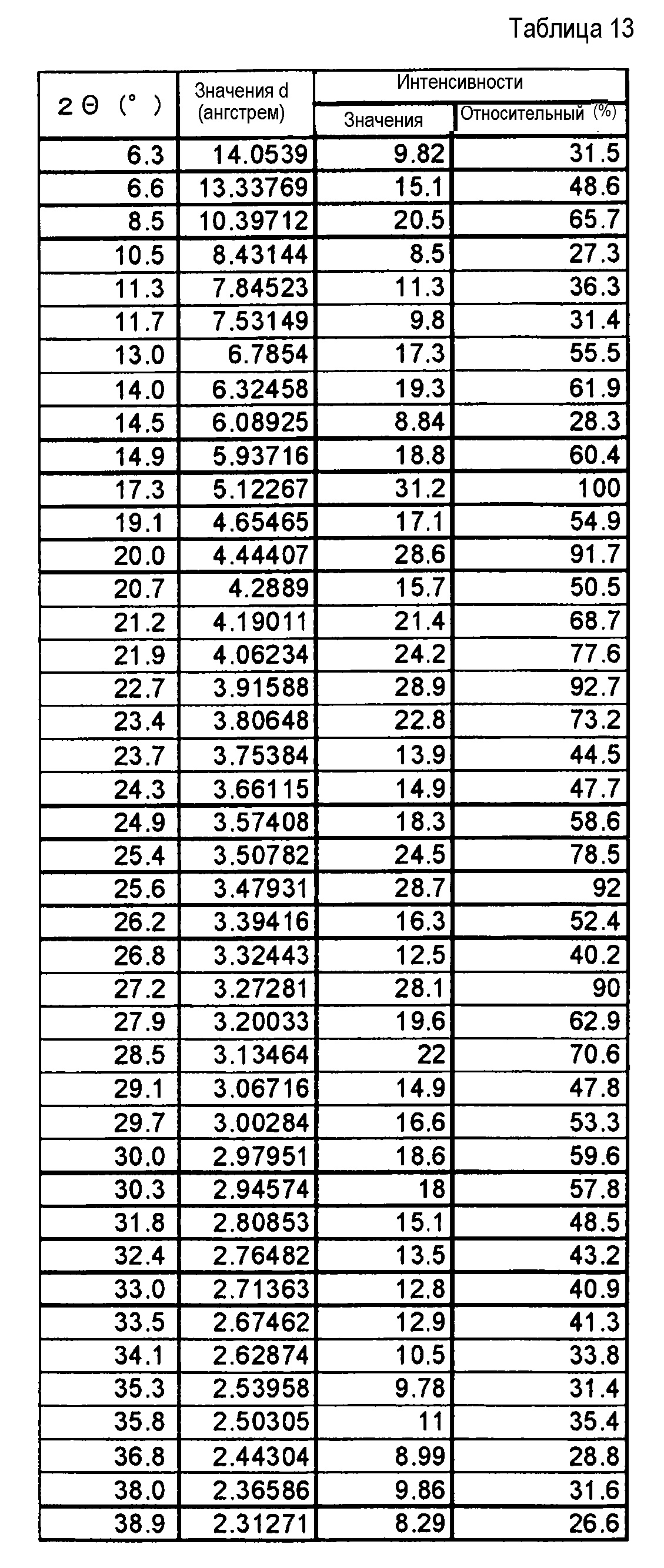
В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 8,5°±0,2°, 13,0°±0,2°, 14,0°±0,2°, 14,9°±0,2°, 17,3°±0,2°, 20,0°±0,2°, 21,9°±0,2°, 22,7°±0,2°, 25,6°±0,2° и 27,2°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 25.
[0091] [Пример 15]
Получение метилизобутилкетонного сольвата соли п-толуолсульфоновой кислоты соединения (IA)
Тетрагидрофуран (5 мл) добавляют к соли п-толуолсульфоновой кислоты (не сольват; 1,0 г), полученной по способу вышеприведенного примера 1-1, и растворяют путем нагревания. Добавляют метилизобутилкетон (20 мл) и перемешивают при комнатной температуре в течение 4 часов. Выпавший осадок собирают фильтрованием, получая кристаллы (1,02 г).
Результаты рентгеноструктурного дифракционного анализа порошка представлены на фиг. 13 и в таблице 14.

В рентгеновском дифракционном спектре порошка наблюдаются пики при углах дифракции (2θ): 5,9°±0,2°, 7,9°±0,2°, 13,5°±0,2°, 15,2°±0,2°, 23,2°±0,2°, 23,7°±0,2°, 24,0°±0,2°, 25,0°±0,2°, 27,0°±0,2° и 28,5°±0,2°.
Результаты TG/DTA анализа представлены на фиг. 26.
[0092] Тестовый пример 1
Стабильность твердости тестируемых кристаллов
Около 10 мг кристаллов тщательно взвешивают в 2-мл стеклянном контейнере с полиэтиленовой пробкой.
После того как закрывают стеклянный контейнер, его запечатывают парафином и хранят в течение двух или четырех недель при температуре 40°C или 60°C. Образец, хранившийся при 40°C, называют как 40°C с плотной воздухонепроницаемой пробкой, и хранившийся при 60°C называют как 60°C с плотной воздухонепроницаемой пробкой.
Кроме того, образцы хранят в стеклянном контейнере, который открывают при температуре 40°C, относительной влажности 89%, или 60°C, в течение двух недель или четырех недель. Образец, хранившийся при 40°C и относительной влажности 89% называют 40°C R.H.89%, и образец, хранившийся при 60°C, называют 60°C открытый.
Используя образцы, хранившиеся с герметичной пробкой при -40°C в качестве стандарта, их содержимое измеряют, используя способ абсолютной калибровки, используя ВЭЖХ способ в следующих условиях:
В таблице 16 представлены оставшиеся кристаллы и результаты наблюдений, касающихся изменений внешнего вида соли п-толуолсульфоновой кислоты (не сольвата) соединения (IA).
В таблице 17 представлены оставшиеся кристаллы и результаты наблюдений, касающихся изменений внешнего вида гидрата соли п-толуолсульфоновой кислоты (форма I) соединения (IA).
В таблице 19 представлены оставшиеся кристаллы и результаты наблюдений, касающихся изменений внешнего вида гидрата соли п-толуолсульфоновой кислоты (форма II) соединения (IA).
Кроме того, если не происходит изменения внешнего вида кристаллов, оценка обозначается как (-), и если происходят незначительные изменения, оценка обозначается как (±).
Не происходит никаких изменений во внешнем виде соли п-толуолсульфоновой кислоты (не сольват), гидрата соли п-толуолсульфоновой кислоты (формы I) или гидрата соли п-толуолсульфоновой кислоты (формы II), уменьшения массы каждого из типов кристаллов не наблюдается и все кристаллы оказались стабильными.
Условия ВЭЖХ
Колонка: CAPCELL PAK C18 AQ (3 мкм 3,0×150 мм)
Температура колонки: 50°C
Длина волны УФ детектирования: 231 нм
Подвижная фаза: Градиентное элюирование осуществляют в условиях, представленных в таблице 15.
[A] Смешанный раствор, содержащий формиат аммония (10 ммоль/л) и хлорид магния (10 ммоль/л)
[B] Ацетонитрил



[0093] Тестовый пример 2
Тест, подтверждающий гигроскопичность кристаллов.
Около 10 мг соли п-толуолсульфоновой кислоты (не сольват) формулы (IA) помещают в контейнер для образцов автоматического прибора для определения сорбции водяных паров, и сушат при 25°C в атмосфере сухого азота. После завершения процесса сушки относительную влажность непрерывно изменяют с интервалами 5% в диапазоне от 0% до 95%, и количество адсорбированного и десорбированного образцом водяного пара измеряют с помощью автоматического прибора для определения сорбции водяных паров: DVS Advantage (Surface Measurement Systems).
Результаты представлены в таблице 19. Максимальное количество влаги, поглощенной кристаллами соли п-толуолсульфоновой кислоты (не сольват) формулы (IA) в диапазоне значений относительной влажности от 0% до 95% при 25°C составляет меньше 1,2%, и наблюдается слабая гигроскопичность кристаллов.
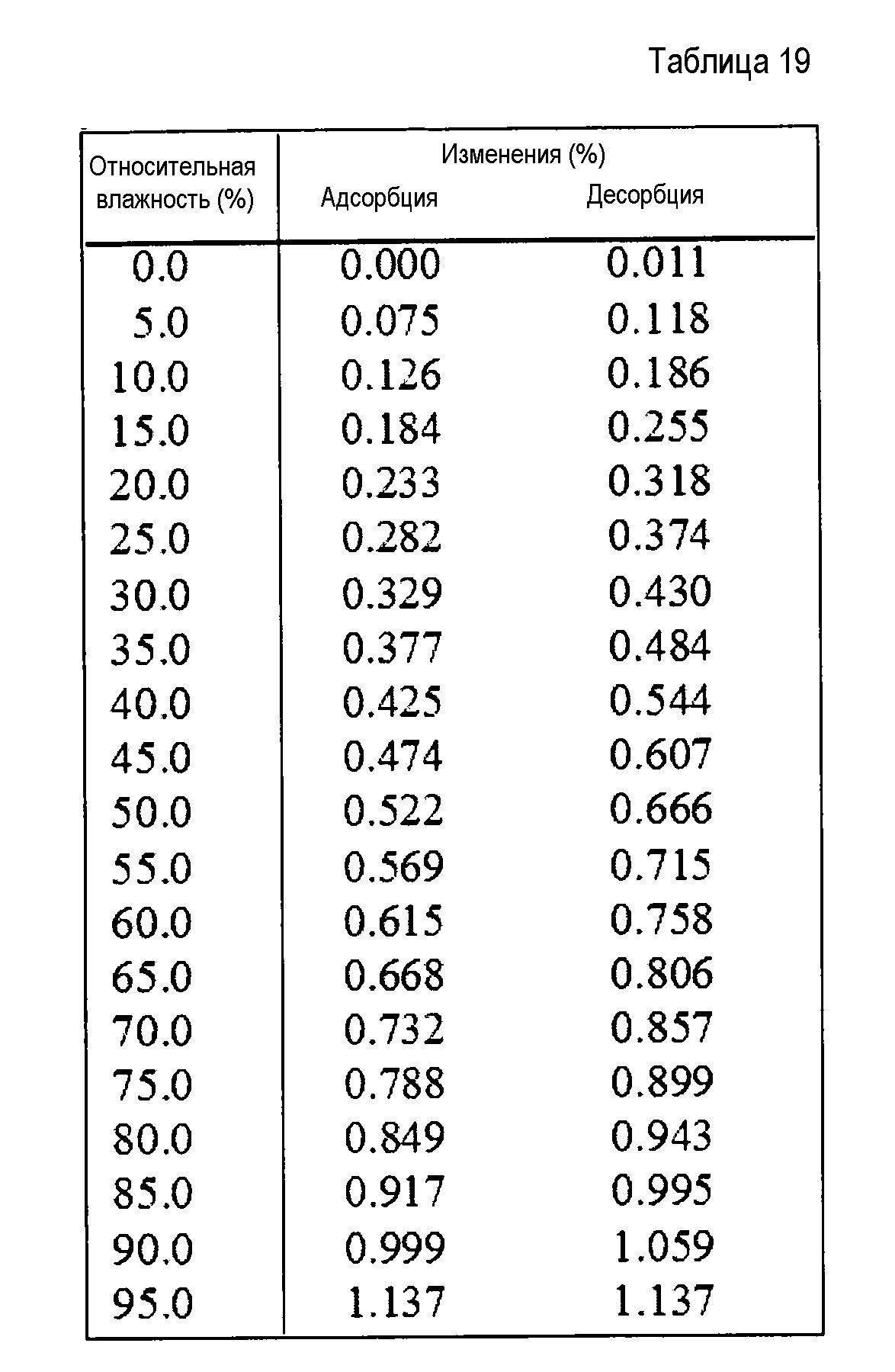
[0094] Пример композиции 1
Получают гранулы, содержащие следующие компоненты.
Термин "соединение, представленное формулой (IA)" включает свободную форму, соль присоединения кислоты и/или их сольваты.
Соединение, представленное формулой (IA), и лактозу пропускают через сито 60 меш. Кукурузный крахмал пропускают через сито 120 меш. Все это смешивают в V-образном роторном миксере. Водный раствор HPC-L (гидроксипропилцеллюлоза низкой вязкости) добавляют к порошку смеси, и смесь месят, гранулируют и сушат. Полученные сухие гранулы фильтруют, используя вибрационный сетчатый фильтр (12/60 меш), получая гранулированную композицию.
[0095] Пример композиции 2
Приготавливают гранулы для инкапсулирования, содержащие следующие ингредиенты.
Термин "соединение, представленное формулой (IA)", включает свободную форму, соль присоединения кислоты и/или их сольваты.
Соединение, представленное формулой (IA), и лактозу пропускают через сито 60 меш. Кукурузный крахмал пропускают через сито 120 меш. Все это смешивают и к порошку смеси добавляют водный раствор HPC-L (гидроксипропилцеллюлоза низкой вязкости), и смесь месят, гранулируют и сушат. Регулируют размер частиц полученных высушенных гранул, и желатиновые капсулы № 4 заполняют 150 мг гранул.
[0096] Пример композиции 3
Получают таблетки, содержащие следующие ингредиенты.
Термин "соединение, представленное формулой (IA)" включает свободную форму, соль присоединения кислоты и/или их сольваты.
Соединение, представленное формулой (IA), лактозу, микрокристаллическую целлюлозу и CMC-Na (натрийкарбоксиметилцеллюлозу) пропускают через сито 60 меш и смешивают. С порошком смеси смешивают стеарат магния, и получают смесь порошка для таблеток. Полученный порошок таблетируют, получая таблетки по 150 мг.
[0097] Пример композиции 4
Следующие ингредиенты смешивают при нагревании и стерилизуют, получая раствор для инъекций.
"Соединение, представленное вышеприведенной формулой (IA)", включает свободную форму, соль присоединения кислоты и/или ее сольват.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0098] В настоящем изобретении предложены производные 6,7-ненасыщенного-7-карбамоилморфинана, их соли присоединения кислоты, сольваты и/или их стабильные кристаллы, которые можно использовать в качестве материала для получения лекарственных средств.
В настоящем изобретении также предложены производные 6,7-ненасыщенного-7-карбамоилморфинана, соли присоединения кислоты, сольваты и/или их стабильные кристаллы, которые можно использовать для лечения и/или профилактики тошноты, рвоты и/или запора, вызванных соединениями, обладающими агонистической активностью в отношении опиоидного рецептора, и новый способ получения их кристаллов.
Реферат
Изобретение относится к соли п-толуолсульфоновой кислоты соединения формулы (IA) или ее гидрату, включая их кристаллические формы. Изобретение относится к форме I кристаллов гидрата соли п-толуолсульфоновой кислоты соединения формулы (IA), где в рентгеновском дифракционном спектре порошка кристаллической формы присутствуют пики, соответствующие дифракционным углам (2θ): 12,9°±0,2°, 17,6°±0,2°, 22,4°±0,2°, 25,4°±0,2° и 28,7°±0,2°. Также изобретение относится к форме II кристаллов гидрата соли п-толуолсульфоновой кислоты соединения формулы (IA), где в рентгеновском дифракционном спектре порошка кристаллической формы присутствуют пики, соответствующие дифракционным углам (2θ): 8,8°±0,2°, 17,5°±0,2°, 21,9°±0,2°, 23,7°±0,2° и 26,1°±0,2°. Кристаллические формы соли п-толуолсульфоновой кислоты соединения формулы (IA) и ее гидраты предназначены для изготовления фармацевтической композиции, проявляющей агонистическую активность в отношении опиоидного рецептора. Кристаллическую форму соли п-толуолсульфоновой кислоты соединения формулы (IA) или кристаллические формы гидрата указанной соли п-толуолсульфоновой кислоты получают путем добавления п-толуолсульфоновой кислоты к соединению формулы (IA) и кристаллизацией соли п-толуолсульфоновой кислоты или ее гидрата в растворителе. Способ получения кристаллической формы или кристаллической формы гидратов указанной соли п-толуолсульфоновой кислоты формулы (IA) также может быть осуществлен путем следующих стадий: 1) обработка основанием соединения формулы (IIE), где Rпредставляет собой водород или защищающую гидроксил группу, которую можно удалить основанием, выбранную из группы, состоящей из ацетила, формила, бензоила, хлорацетила, пивалоила, метилкарбоната, изобутилкарбоната,
Формула
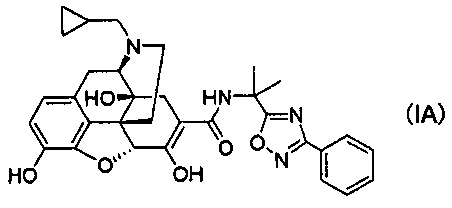
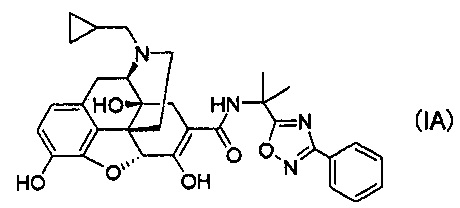

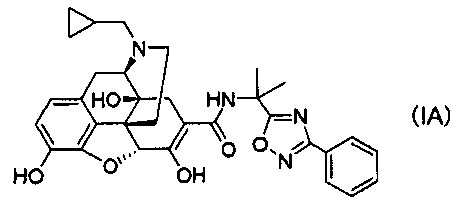

Документы, цитированные в отчёте о поиске
Способ получения производных бензоатных эфиров 3-оксиморфинанов

Комментарии