Композиции для лечения артрита - RU2563360C2
Код документа: RU2563360C2
Чертежи






Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к области лечения артрита. Изобретение, в частности, относится к способам лечения артрита и заболеваний, связанных с артритом, с помощью лекарственного средства, содержащего Trl-клетки человека, которые направлены против суставного антигена.
Уровень техники
Приблизительно 46 миллионов американцев и 100 миллионов европейцев страдают от артрита и это число растет с каждым годом.
Ревматоидный артрит (РА) характеризуется дисбалансом иммунной системы, который вызывает сверхпродукцию провоспалительных цитокинов, например фактора некроза опухоли альфа (TNFα), интерлейкина 1 (IL-1), и недостаток противовоспалительных цитокинов, например, IL-10, IL-11. РА характеризуется воспалением синовиальной сумки, которое прогрессирует до деструкции хряща, эрозии костей и последующей деформации суставов. Первыми симптомами РА являются воспаление суставов, опухание, затруднение в движении и боль. В процесс воспаления вовлечены полиморфонуклеарные клетки, макрофаги и лимфоциты. Активированные Т-лимфоциты продуцируют цитотоксины и провоспалительные цитокины, тогда как макрофаги стимулируют высвобождение простагландинов и цитотоксинов. Вазоактивные вещества (гистамин, кинины и простагландины) высвобождаются в очаге воспаления и вызывают отек, повышение температуры, покраснение и боль, связанные с воспаленными суставами. В поздней стадии РА, ферменты, продуцируемые воспаленными клетками, могут разложить кость и сустав. Многолетние повреждения приводят к хронической боли, потере функционирования, деформации, потере работоспособности суставов и даже к сокращению продолжительности жизни. Распространение РА во всем мире составляет 1,0% общей популяции.
Юношеский идиопатический артрит (ЮИА), ранее известный как ювенильный ревматоидный артрит (ЮРА), является самой распространенной формой персистирующего артрита у детей. ЮИА иногда относят к ювенальному хроническому артриту (ЮХА), означая, что это не совсем ЮИА, не охватывает все формы хронического детского артрита. ЮИА является артритом, который вызывает воспаление суставов и неподвижность более чем 6 недель у детей младше 16 лет. 3 основных типа ЮИА включают олигоартикулярный ЮИА, полиартикулярный ЮИА и системный ЮИА. Олигоартикулярный (или pauciarticular) ЮИА вовлекает 5 или менее суставов в первые 6 месяцев заболевания. Полиартикулярный ЮИА вовлекает 5 или более суставов в первые 6 месяцев заболевания. Этот подтип может включать вовлечение шейных и челюстных, а также небольших суставов, обычно вовлекаемых. Системный ЮИА (болезнь Стилла) характеризуется артритом, температурой и розовой сыпью. Системный ЮИА может быть сложным для диагностики, поскольку температура и сыпь возникают и проходят. Системный ЮИА может поражать внутренние органы и приводить к серозиту (например, перикардиту).
Анкилозирующий спондилит (АС; также известный как болезнь Бехтерева/синдром Бехтерева/болезнь Штрюмпелля-Мари/синдром Штрюмпелля-Мари/Спондилартрит) является хроническим, болезненным, дегенеративным воспалительным артритом, в первую очередь поражающим позвоночные и крестцово-повздошные суставы, вызывая в конце сращение позвоночника; это член группы аутоиммунной спондилоартропатии с возможно генетической предрасположенностью. Полное сращение приводит к полной ригидности позвоночника, состояние известное как "bamboo spine".
Псориатический артрит (также артропатический псориаз или псориатическая артропатия) представляет собой тип воспалительного артрита, который поражает около 5-7% людей, страдающих от хронического кожного псориаза. Лечение псориатического артрита аналогично лечению ревматоидного артрита. Более 80% пациентов с псориатическим артритом будут иметь псориатические поражения ногтей, характеризующиеся рубцеванием ногтей, или более экстремально, потерю ногтей самих по себе (онихолизис).
Большинство традиционных методов лечения артрита направлено на коррекцию иммунного отклонения, которое возможно запускает пролиферацию синовиальных клеток и эрозию хрящей. Современное лечение артрита включает лекарственные средства первой линии для контроля боли и воспаления, классифицируемые как нестероидные противовоспалительные лекарственные средства (НПЛС), например аспирин, ибупрофен, напроксен, и др. Лекарственные средства второй линии включают кортикостероиды и модифицирующие заболевание антиревматические лекарства (DMARD), например пеницилинамин, циклофосфамид, соли золота, азатиоприн, левамизол, метотрексат, лефлуномид, циклоспорин, этанерцепт и сульфасалазин и др.
Контролирование боли является важной частью лечения артрита. Анальгетики могут только обеспечить временное купирование боли. Они не уменьшают воспаление, не останавливают прогрессирование заболевания. Ацетаминофен (тиленол) является наиболее широко распространенным анальгетиком. Наркотические анальгетики также можно прописывать при более сильной боли.
Кортикостероиды тесно связаны с кортизолом, гормоном, образующимся в коре надпочечников. Лечение ревматоидного артрита кортикостероидами остается спорным в отношении взаимовлияния польза/вред. Доказано, что кортикостероиды очень значимые лекарственные средства из-за их способности быстро снижать опухание и воспаление.
Однако, хорошо известно, что кортикостероиды могут оказывать серьезные и длительные побочные эффекты. Следовательно, они могут использоваться только в некоторых ситуациях системно или локально для конкретного сустава для купирования боли, постоянно при более низкой эффективной дозе в течение короткого периода с постепенным отказом от их приема или сокращением дозировки с течением времени.
НПЛС отличаются от кортикостероидов. НПЛС в низких дозах снижают боль и при высоких дозах ослабляют воспаление. Большинство НПЛС представляют собой ингибиторы фермента циклооксигеназы, ингибируя неселективно обе: циклооксигеназу-1 (СОХ-1) и циклооксигеназу-2 (СОХ-2). Циклооксигеназа является ферментом, лимитирующим скорость катализа образования простагландинов и тромбоксана из арахидоновой кислоты. Простагландины среди прочего функционируют как молекулы-мессенжеры в процессе воспаления. СОХ-1 является ферментом, постоянно экспрессирующимся с функцией "домашнего хозяйства" для регулирования многих нормальных физиологических процессов. Побочные эффекты НПЛС главным образом связаны с их ингибированием СОХ-1 в почках и желудочно-кишечном тракте, где простагландины играют защитную роль. СОХ-2 является ферментом с низкой или неопределяемой экспрессией в большинстве тканей, но может быть быстро индуцирована в ответ на активацию клеток цитокинами, факторами роста и опухолевыми промоторами. Терапевтические эффекты НПЛС имеют значимость благодаря их ингибирующему действию на СОХ-2. Хотя селективные СОХ-2-ингибиторы, коксибы (целекоксиб, рофекоксиб, вальдекоксиб, парекоксиб и эторикоксиб), имеют противовоспалительное действие без разрушения желудочно-кишечных простагландинов, при клиническом применении наблюдали повышенный риск развития сердечно-сосудистых заболеваний, что привело к отзыву по всему миру некоторых коксибов (рофекоксиб и вальдекоксиб).
В то время как НПЛС снижают воспаление изо дня в день, более сильные лекарства, DMARD, обычно требуются пациентам с персистирующим воспалением в нескольких суставах, вследствие воспалительного артрита, длящегося более шести недель. DMARD замедляют биологические процессы, которые запускают персистирующее воспаление. DMARD являются антиревматическими лекарственными средствами замедленного действия. Самым быстродействующим DMARD является метотрексат, видимая польза от приема которого наступает через четыре-шесть недель после приема. Остальные DMARD могут оказать эффект через три-шесть месяцев или через более длительное время. В связи с тем, что DMARD подавляют иммунную систему, то через длительное время после применения могут возникнуть побочные эффекты. Метотрексат выступает как эффективное средство для лечения РА либо как самостоятельный агент, либо в комбинации с другими DMARD. Профиль токсичности метотрексата хорошо изучен и включает серьезные и иногда даже фатальные заболевания печени, пневмонии и цитопении.
Наиболее значимый прогресс в последние годы в лечении РА связан с развитием биологических DMARD. Озвучивание ключевой роли TNF-α в патогенезе РА привело к развитию направленных лекарственных средств, блокирующих активность этого цитокина. В дополнении к анти-TNF терапии был разработан ряд других биологических DMARD, специфичных против молекул (IL-1) или клеток (В-клеток и Т-клеток), вовлеченных в процесс заболеваний, связанных с нарушением иммунной системы. Возможные преимущества биологических DMARD над традиционными DMARD включают высокую специфичность блокады молекул-мишеней, критически вовлеченных в патогенез, быстрое начало клинического действия, снижение неспецифичной токсичности, длительный интервал между приемами доз (каждую неделю подкожно или каждый месяц внутривенно), возможные длительные иммуномодуляторные эффекты, и улучшенное качество жизни пациента. Биологические DMARD, используемые для лечения артрита, включают те, что блокируют воспалительные цитокины, специфично истощая В-клетки и селективно ингибируя активацию Т-клеток.
Хотя доступен широкий спектр лекарств, успешное лечение воспалительного артрита все еще остается главной неудовлетворенной медицинской потребностью. Хотя биологические DMARD являются наиболее перспективным путем снижения или даже остановки развития данного заболевания, они работают только для некоторого числа пациентов: даже при наиболее эффективной анти-TNF терапии, по меньшей мере, одна треть пациентов с РА не отвечают на лечение.
В настоящем изобретении заявитель имеет цель обеспечить альтернативное лечение артрита, основанное на применении Trl-клеток, направленных против суставного антигена.
Раскрытие изобретения
Изобретение относится к композиции, содержащей, по меньшей мере, одну популяцию Trl-клеток человека, направленных против суставного антигена, причем указанный антиген не является HSP, кератином, пируватдегидрогеназой, топоизомеразой I, кардиолипином или коллагеном типа IV. В предпочтительном воплощении указанная популяция Trl-клеток человека является кленовой популяцией Trl-клеток человека.
Для целей изобретения указанный суставной антиген выбирают из группы, содержащей цитруллин-замещенные циклические и линейные филагрины, коллагены типа II, гликопротеин 39 (HCgp39) человеческого хряща, гетерогенный ядерный рибонуклеопротеин (hnRNP) A2, hnRNP B1, htiRNP D, Ro60/52, BiP, виментин, фибриноген, коллаген типа I, III и V, аннексии V, глюкозо-6-фосфатизомеразу (GPI), ацетил-кальпастатин, альдолазу, snRNP, PARP, Scl-70, Scl-100, фосфолипидный антиген, включая анионный фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матричную металлопротеиназу, фибриллин, аггреккан и их фрагменты, варианты и смеси.
В предпочтительном воплощении указанный суставной антиген является коллагеном типа II и его фрагментами, вариантами и смесями. В другом предпочтительном воплощении указанный суставной антиген представляет собой HCgp39 и его фрагменты, варианты и смеси.
Другим объектом изобретения является лекарственное средство, содержащее, по меньшей мере, одну популяцию Trl-клеток человека, направленных против суставного антигена.
Другим объектом изобретения является фармацевтическая композиция, содержащая, по меньшей мере, одну популяцию Trl-клеток человека, направленных против суставного антигена, в комбинации с одним или более фармацевтически приемлемым носителем.
В предпочтительном воплощении указанная популяция Trl-клеток человека представляет собой клоновую популяцию Trl-клеток человека.
Указанное лекарственное средство или фармацевтическая композиция по изобретению содержит, по меньшей мере, одну Trl-клетку человека, направленную Против суставного антигена, выбранного среди цитруллин-замещенных циклических и линейных филагринов, коллагена типа II, гликопротеина 39 (HCgp39) человеческого хряща, гетерогенного ядерного рибонуклеопротеина (hnRNP) A2, hnRNP B1, htiRNP D, Ro60/52, BiP, виментина, фибриногена, коллагена типа I, III и V, аннексина V, глюкозо-6-фосфатизомеразы (GPI), ацетил-кальпастатина, альдолазы, snRNP, PARP, Scl-70, Scl-100, фосфолипидного антигена, включая анионный фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матричная металлопротеиназа, фибриллина, аггреккана и их фрагментов, вариантов и смесей.
В предпочтительном воплощении указанная Trl-клетка человека направлена против суставного антигена, выбранного среди коллагена типа II, HCgp39 и HSP.
Изобретение относится к применению композиции, содержащей, по меньшей мере, одну популяцию Trl-клеток человека, направленных против суставного антигена, для приготовления лекарственного средства или фармацевтической композиции для лечения артрита.
В одном воплощении изобретения указанный суставной антиген выбирают из группы, содержащей цитруллин-замещенные циклические и линейные филагрины, коллагены типа II, гликопротеин 39 (HCgp39) человеческого хряща, гетерогенный ядерный рибонуклеопротеин (hnRNP) A2, hnRNP B1, htiRNP D, Ro60/52, BiP, виментин, фибриноген, коллаген типа I, III и V, аннексии V, глюкозо-6-фосфатизомеразу (GPI), ацетил-кальпастатин, альдолазу, snRNP, PARP, Scl-70, Scl-100, фосфолипидный антиген, включая анионный фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матричную металлопротеиназу, фибриллин, аггреккан и их фрагменты, варианты и смеси.
В предпочтительном воплощении указанная, по меньшей мере, одна популяция Trl-клеток человека направлена против суставного антигена, выбранного среди коллагена типа II, HCgp39 и HSP.
В предпочтительном воплощении указанный артрит представляет собой ревматоидный артрит.
В другом предпочтительном воплощении указанный артрит представляет собой анкилозирующий спондилит.
В другом предпочтительном воплощении указанный артрит представляет собой ювенильный идиопатический артрит.
В другом предпочтительном воплощении указанный артрит представляет собой псориатический артрит.
В одном воплощении изобретения лекарственное средство или фармацевтическая композиция, которую вводят субъекту, нуждающемуся в ее введении, содержит Trl-клетки человека, аутологичные клеткам указанного субъекта.
В предпочтительном воплощении нуждающемуся субъекту вводят от 104/кг до 107 кг Trl-клеток. В одном воплощении изобретения, введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения осуществляют в комбинации с одним или более терапевтическими агентами, применяемыми для лечения артрита.
В предпочтительном воплощении указанный один или более терапевтических агентов выбирают из группы кортикоидов, анти-TNF, анти-интерлейкинов, анти-В лимфоцитов, анти-костимулирующих молекул, толерогенных агентов, белков антикомплемента, ингибиторов молекул Т-клеточного сигнала, ингибиторов клеточной миграции, метотрексата, лефлуномида, сульфасалазина, гидроксихлорокина, азатиоприна, циклоспорина, миноциклина, D-пеницилламина.
В другом воплощении изобретения лекарственное средство или фармацевтическую композицию изобретения вводят субъекту, который не отвечает адекватно на или маловероятно, что ответит, на один или более терапевтических агентов из группы кортикоидов, анти-TNF, анти-интерлейкинов, анти-В лимфоцитов, анти-костимулирующих молекул, толерогенных агентов, белков антикомплемента, ингибиторов молекул Т-клеточного сигнала, ингибиторов клеточной миграции, метотрексата, лефлуномида, сульфасалазина, гидроксихлорокина, азатиоприна, метотрексата, циклоспорина, миноциклина, D-пеницилламина.
Другим объектом изобретения является способ лечения артрита у субъекта, который нуждается в таком лечении, причем указанный способ включает следующие стадии:
- получение Trl-клеток, направленных на выбранный суставной антиген, при этом указанные Trl-клетки получают из образца крови указанного субъекта,
- клонирование указанных Trl-клеток, направленных на выбранный суставной антиген,
- дополнительное увеличение Trl-клонов, полученных на предыдущей стадии,
- повторное введение полученных Trl-клонов указанному субъекту предпочтительно внутривенным путем.
Краткое описание чертежей
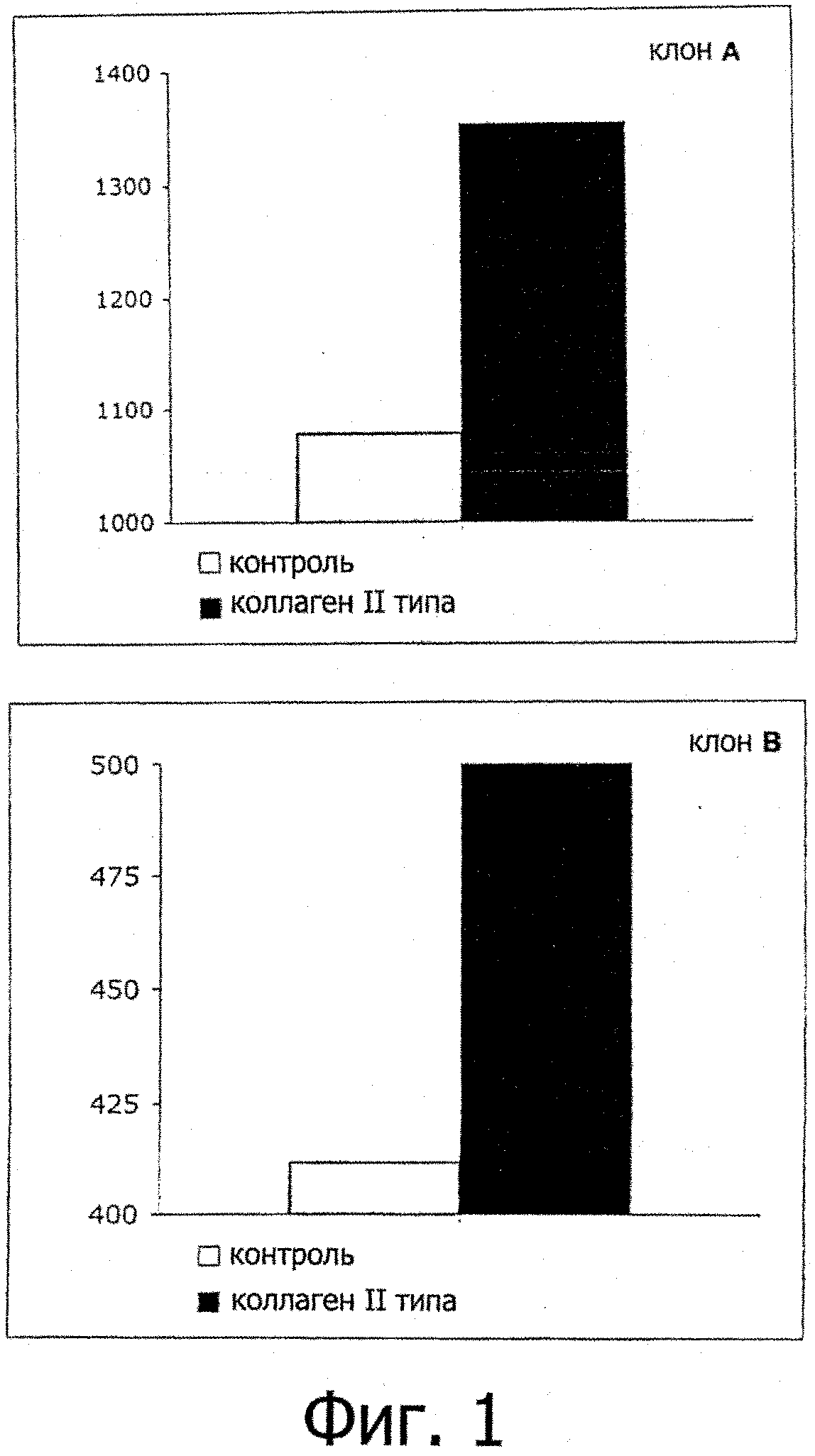
Фигура 1: IL-10-продукция Trl-клонов после специфичной активации коллагеном типа II.
Фигура 1 описывает специфичное повышение продукции IL-10 Т-клеточными клонами в присутствии специфичного антигена типа II коллагена. Клоны активировали с или без коллагена типа II в присутствии облученных аутологичных антиген представляющих клеток. Через 48 ч продукцию IL-10 измеряли с помощью ELISA.
Фигура 2: Профиль цитокиновой секреции Trl-клонов, специфичных к коллагену типа II IL-10, IL-4 и IFNy-секрецию клонами Trl-клеток, специфичных к коллагену типа I, измеряли в 48 ч супернатанте клеток, активированных анти-CD3+анти-СВ28 моноклональными антителами.
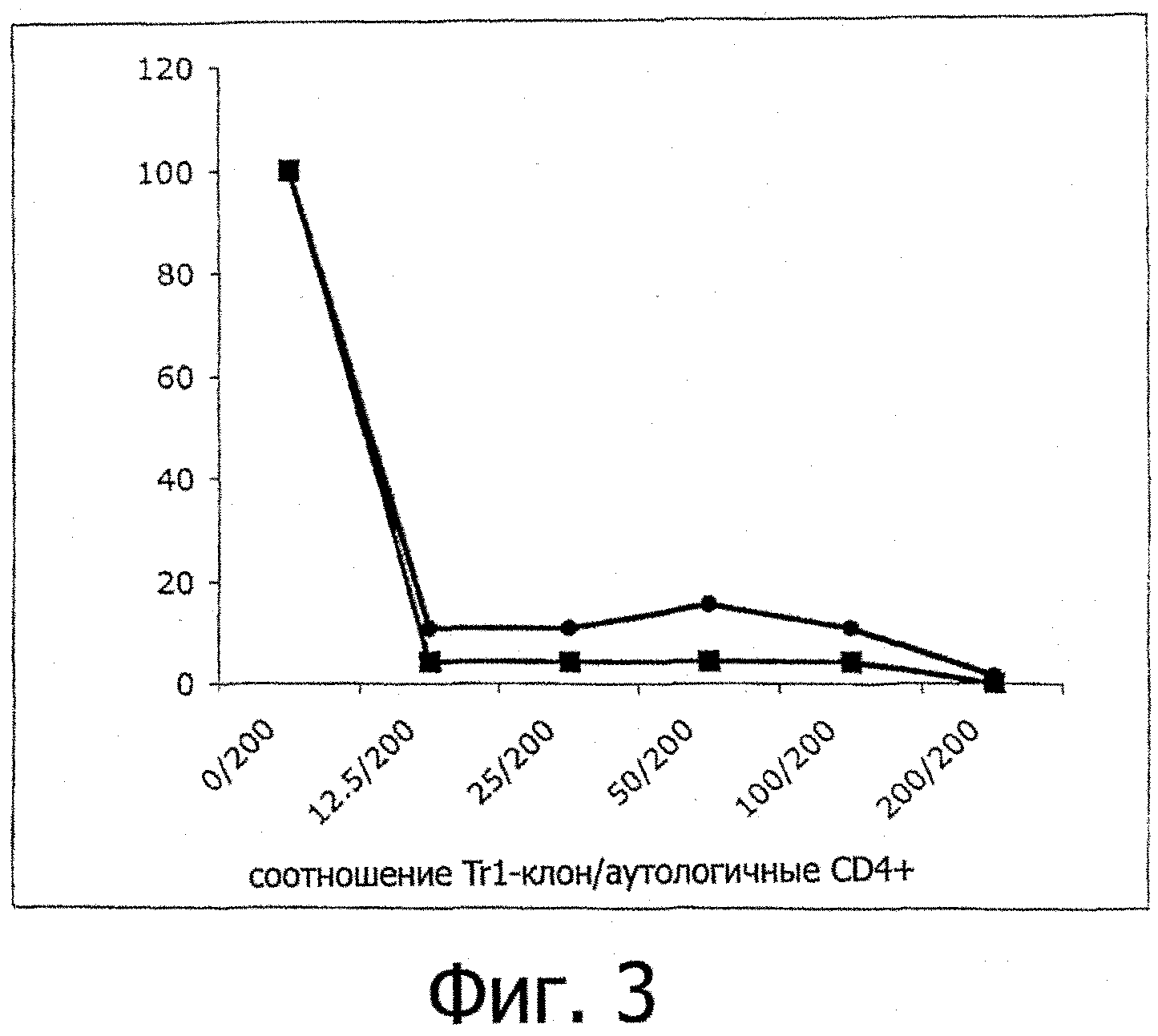
Фигура 3: In vitro подавляющая активность Trl-клонов, специфичных к коллагену типа II.
Подавляющую активность Trl-клонов, специфичных к коллагену типа II, измеряли в экспериментах сокультивирования с аутологичными CD4+Т лимфоцитами. Клеточные популяции культивировали совместно в течение 3 дней, используя анти-CD3+анти-CD28 моноклональные антитела. Затем клеточную пролиферацию аутологичных CD4+Т-клеток оценивали в отсутствии или присутствии разных количеств Trl-клеток. Результаты показывают, что добавление Trl-клеток к CD4+Т-лимфоцитам сильно ингибирует пролиферацию Т-клеток.
Фигура 4: Профиль цитокиновой секреции Trl-клонов, специфичных к коллагену типа II и выделенных от пациентов с ревматоидным артритом.
Фигура 5: In vitro подавляющая активность Trl-клонов, специфичных к коллагену типа II и выделенных от пациентов с ревматоидным артритом.
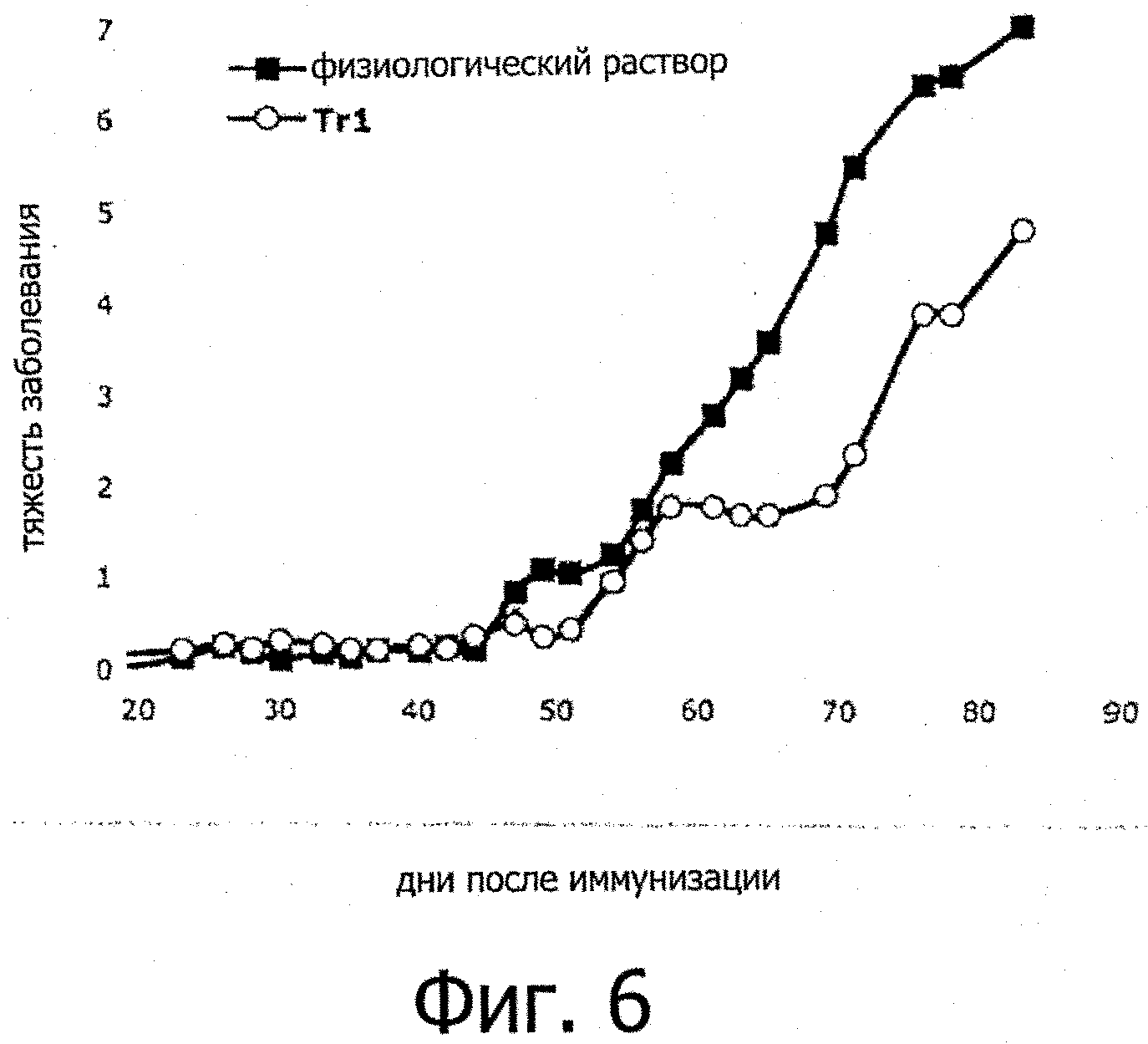
Фигура 6: Trl-клетки, специфичные к коллагену типа II, ингибируют развитие тяжелого артрита в мышиной модели коллаген-индуцированного артрита.
Осуществление изобретения
Определения
Термин "Trl-клетки" в используемом здесь значении относится к клеткам, имеющим следующий фенотип в покое CD4+CD25-FoxP3- и способным при активации секретировать высокие уровни IL-10 и значимые уровни TGF-P. Trl-клетки отличаются, частично, их особым цитокиновым профилем: они продуцируют высокие уровни IL-10, значимые уровни TGF-P и средние уровни IFN-y, и при этом низкие или следовые уровни IL-4 или IL-2. Цитокиновая продукция типично повышается в культурах клеток после активации поликлональными активаторами Т-лимфоцитов, такими как анти-CD3+анти-CD28 антителами или интерлейкином-2, РМА+иономицин. Альтернативно, цитокиновая продукция увеличивается в культурах клеток после активации специфичным Т-клеточным антигеном, представленным антиген-представляющими клетками. Высокие уровни IL-10 соответствуют, по меньшей мере, около 500 пг/мл, обычно более чем около 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, или 20 тысяч пг/мл или более. Значимые уровни TGF-β соответствуют, по меньшей мере, около 100 пг/мл, обычно более чем около 200, 300, 400, 600, 800 или 1000 пг/мл или более. Средние уровни IFN-γ соответствуют концентрациям от 0 пг/мл и, по меньшей мере, 400 пг/мл, обычно более чем около 600, 800, 1000, 1200, 1400, 1600, 1800 или 2000 пг/мл или более. Низкие или следовые уровни IL-4 или IL-2 соответствуют менее чем около 500 пг/мл, предпочтительно менее чем около 250, 100, 75 или 50 пг/мл или менее.
Термин "антиген" в используемом здесь значении относится к белку или пептиду, для которого клетки данного изобретения используются для модуляции, или для применения в любых способах данного изобретения. В одном воплощении термин "антиген" может касаться синтетически полученной молекулы или природной молекулы, которая разделяет гомологию последовательности с представляющим интерес антигеном или структурную гомологию с представляющим интерес антигеном. В одном воплощении антигеном может быть мимеотоп. "Фрагмент" антигена касается любой субпопуляции антигена в качестве короткого пептида. "Вариант" антигена относится к молекуле, практически аналогичной или всему антигену, или его фрагменту. Вариантные антигены можно без труда получить путем направленного химического синтеза вариантного пептида, используя хорошо известные из уровня техники методы.
Термин "субъект" в используемом здесь значении относится к человеку.
Термин "эффективное количество" в используемом здесь значении относится к количеству, достаточному для того, чтобы вызвать лечебный или желаемый клинический результат (например, улучшение клинического состояния).
Термин "клон" или "кленовая популяция" в используемом здесь значении относится к популяции дифференцированных клеток, которые получены из специфической дифференцированной клетки.
Термин "лечение" или "лечить" в используемом здесь значении в целом относится к клиническому вмешательству в попытке изменения естественного развития индивидуума, которого лечат, и может осуществляться в процессе развития клинической патологии. Желаемые эффекты включают, но не ограничиваются, облегчение симптомов, подавление, снижение или ингибирование любых прямых или непрямых осложнений заболевания, замедление скорости прогрессирования заболевания, повышение или облегчение стадии заболевания, и вызывание ремиссии или улучшение прогноза. В контексте изобретения, это относится к любому улучшению течения клинических симптомов воспалительного артрита, а также любому улучшению самочувствия пациентов, в частности улучшению проявления путем, по меньшей мере, одного из следующих: снижение припухлости и болезненности суставов, снижение боли в суставах, замедление разрушения суставов и окружающей ткани, увеличение периода ремиссии между острыми обострениями болезни; снижение времени длительности острого обострения; предотвращение начала тяжелой стадии заболеванияи др.
Термин "артрит" в используемом здесь значении относится к хроническому воспалению (независимо от причины, но обычно вследствие аутоиммунного процесса, который воздействует на суставы) в тканях вокруг суставов, таких как сухожилие, связки и мышцы, а также в других органах организма. Предпочтительно воспалительный артрит, который подвергается лечению, представляет собой ревматоидный артрит (РА), ювенильный (юношеский) идиопатический артрит (ЮИА), анкилозирующий спондилит, псориатический артрит, полихондрит, септический артрит. Предпочтительной целью лечения является ревматоидный артрит.
Настоящее изобретение относится к способу лечения артрита у субъекта, нуждающегося в таком лечении, включающему введение указанному субъекту композиции, содержащей Trl-клетки человека, направленные против суставного антигена.
Согласно изобретению "популяция Trl-клеток человека" соответствует Trl-клеткам, как описано здесь выше в определениях, и не включает CD4+CD25+регуляторные Т-клетки или FoxP3+регуляторные Т-клетки (природные или традиционные Treg), TGF-P секретирующие Th3-клетки или регуляторные NKT-клетки.
Согласно изобретению термин "суставной антиген" относится к иммуногенному пептиду, который присутствует в суставе.
В одном воплощении изобретения указанный иммуногенный пептид может присутствовать в суставе в покое. В другом воплощении указанный иммуногенный пептид может присутствовать в воспаленном суставе.
Примеры суставных антигенов включают, но не ограничиваются, цитруллин-замещенные циклические и линейные филагрины, коллагены типа II, гликопротеин 39 (HCgp39) человеческого хряща, гетерогенный ядерный рибонуклеопротеин (hnRNP) A2, hnRNP B1, htiRNP D, Ro60/52, BiP, виментин, фибриноген, коллаген типа I, III и V, аннексии V, глюкозо-6-фосфатизомеразу (GPI), ацетил-кальпастатин, альдолазу, snRNP, PARP, Scl-70, Scl-100, фосфолипидный антиген, включая анионный фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матричную металлопротеиназу, фибриллин, аггреккан.
В предпочтительном воплощении указанные Trl-клетки человека направлены против суставного антигена, выбранного среди коллагена типа II, HCgp39 и HSP-протеинов.
В более предпочтительном воплощении указанная композиция содержит Trl-клетки человека, направленные против коллагена типа II. Trl-клетки человека, направленные против коллагена типа II, могут быть направлены против эпитопов, присутствующих в 245-273 фрагменте коллагена типа II (IAGAPGFPGPRGPPGPQGATGPLGPKGQT, SEQ ID NO 1), и связаны либо с HLA-DR1, либо с HLA-DR4 субъектами.
В другом более предпочтительном воплощении указанная композиция содержит Trl-клетки человека, направленные против HCgp39. Trl-клетки человека, направленные против Hcgp39, могут быть направлены против следующих эпитопов HCgp39: PTFGRSFTLASSE (SEQ ID NO 2), RSFTLASSETGVG (SEQ ID NO 3), VGYDDQESVKSKV (SEQ ID NO 4), SQRFSKIASNTQSR (SEQ ID NO 5), FGRSFTLAS (SEQ ID NO 6), FTLASSETG (SEQ ID NO 7). YDDQESVKS (SEQ ID NO 8), FSKIASNTQ (SEQ ID NO 9).
В другом более предпочтительном воплощении указанная композиция содержит Trl-клетки человека, направленные против HSP-белков, таких как HSP60, HSP70, HSP90.
Не желая быть связанным какой-либо теорией, заявитель полагает что инъецируемая Trl-клеточная популяция, направленная на суставной антиген, будет активирована in vivo посредством антигена, присутствующего в суставе, и затем будет способна контролировать артрит. Следовательно, отпадает необходимость введения антигена, к которому направлены Trl-клетки, для стимулирования этих клеток.
Настоящее изобретение относится к композиции, содержащей, по меньшей мере, одну популяцию Trl-клеток человека, направленную против суставного антигена, обеспечивая то, что указанная популяция Trl-клеток человека не направлена против HSP, коллагена типа IV, кератина, пируватдегидрогеназы, топоизомеразы I и кардиолипина.
В предпочтительном воплощении указанная композиция содержит популяцию Trl-клеток человека, направленных против суставного антигена, выбранного среди коллагена типа II и HCgp39. В более предпочтительном воплощении указанная композиция содержит популяцию Trl-клеток человека, направленных против коллагена типа II. В другом более предпочтительном воплощении указанная композиция содержит популяцию Trl-клеток человека, направленных против HCgp39.
В одном воплощении изобретения Trl-клетки человека могут быть получены путем:
a) изолирования популяции клеток-предшественников из субъекта;
b) получения популяции дендритных клеток путем культивирования указанной популяции клеток-предшественников в присутствии IL-10;
c) контактирования клеток стадии b) с популяцией CD4+Т-лимфоцитов, выделенной из указанного субъекта в присутствии суставного антигена с обеспечением дифференцировки CD4+Т-клеток, направленных на указанный антиген в Trl-клеточной популяции; и
d) извлечение Trl-клеточной популяции стадии с).
На стадии b) IL-10 присутствует в количестве от 50 до 250 МЕ/мл, предпочтительно при 100 МЕ/мл в культуральной среде. Указанный способ получения Trl-клеток описан в Wakkach et al (Immunity 2003 May; 18 (5): 605-17).
Способ также может выполняться с использованием дексаметазона и витамина D3 или толерогенных или незрелых DC вместо DC стадии b).
В другом воплощении настоящего изобретения Trl-клетки человека могут быть получены путем:
a) культивирования популяции CD4+Т-клеток, направленных на суставной антиген, выделенный из субъекта в среде с подходящим количеством IFN-α; и
b) извлечения Trl-клеточной популяции.
IFN-α предпочтительно присутствует в среде в концентрации 5 нг/мл. На стадии а) среда может дополнительно содержать подходящее количество IL-10 предпочтительно в количестве 100 МЕ/мл.
В стадии b) Trl-клеточную популяцию культивируют в среде, содержащей IL-15 для обеспечения пролиферации, причем IL-15 присутствует в среде предпочтительно в концентрации 5 нг/мл. Указанный способ обеспечения Trl-клетками описан в патенте США №6746670.
В еще другом воплощении изобретения, Trl-клетки человека могут быть получены путем:
a) in vitro активирования популяции CD4+Т-клеток в присутствии суставного антигена, представленного синтетическими антиген представляющими клетками; и
b) извлечения активированных CD4+Т-клеток, содержащих, по меньшей мере, 10% Trl-клеток.
Предпочтительно синтетические антиген представляющие клетки экспрессируют молекулу II класса системы HLA и молекулу типа LFA-3 человека и не экспрессируют костимулированные молекулы В7-1, В7-2, В7-HI, CD40, CD23 и ICAM-I. Указанный процесс получения Trl-клеток описан в заявке WO 02/092793.
В еще одном воплощении изобретения, Trl-клетки человека могут быть получены путем:
a) in vitro активирования популяции CD4+Т-клеток в присутствии суставного антигена и подходящего количества IL-10; и
b) извлечение Trl-клеточной популяции.
Предпочтительно, IL-10 присутствует в среде в количестве 100 МЕ/мл. Указанный способ описан в Groux et al. (Nature 1997, 389 (6652): 737-42).
В другом воплощении изобретения Trl-клетки человека могут быть получены путем:
а) стимулирование популяции лейкоцитов или популяции мононуклеарных клеток периферической крови (РВМС) суставным антигеном;
б) извлечение антиген-специфичной популяции Trl-клеток из стимулированной популяции;
с) при необходимости увеличение указанной антиген-специфичной популяции Trl-клеток.
Лейкоциты охватывают несколько типов клеток, которые характеризуются по их значимости, их расположению, их количеству, их времени жизни и их потенциалу. Эти типы следующие: полинуклеарные или гранулярные лейкоциты, среди которых определяются эозинофилы, нейтрофилы и базофилы, и мононуклеарные клетки или мононуклеарные клетки периферической крови (PBMCs), которые являются большими белыми клетками крови и состоят в основных типах клеток иммунной системы (лимфоциты и моноциты). Лейкоциты или РВМС могут быть отделены от периферической крови любым методом, известным для специалиста в данной области техники. Преимущественно для отделения РВМС можно применять центрифугирование, предпочтительно центрифугирование в градиенте плотности, предпочтительно прерывистое центрифугирование в градиенте плотности. Альтернативой является применение специфичных моноклональных антител. В некоторых воплощениях РВМС типично выделяют из цельной крови с помощью фиколл-гипака, используя стандартные процедуры. В других воплощениях РВМС извлекают с помощью лейкафареза. Указанный метод описан в патентной заявке WO 2007/010406.
В еще одном воплощении Trl-клетки человека могут быть получены путем:
a) культивирования популяции лейкоцитов или популяции мононуклеарных клеток периферической крови (РВМС) вместе с мезенхимальными стволовыми клетками в присутствии суставного антигена;
b) извлечение Trl-клеточной популяции.
Указанный метод также можно осуществлять с нативными или Т-клетками памяти вместо РВМС или лейкоцитов.
Trl-клеточная популяция, полученная таким образом, может дополнительно быть увеличена путем культивирования в присутствии цитокинов, таких как интерлейкин-2 и интерлейкин-4. Альтернативно, интерлейкин-15 и интерлейкин-13 также можно использовать в культурах для увеличения Trl-клеток.
В способах, описанных выше, Trl-клетки человека могут характеризоваться с помощью способа идентификации, описанного в WO 2005/000344. Указанный способ идентификации Trl-клеток основан на определении одновременно присутствия продуктов экспрессии генов, кодирующих молекулу CD4 и молекул из группы, состоящей из CD18 и/или CD11a, и CD49b. Trl-клетки могут быть идентифицированы и/или очищены с помощью анализа Elisa, проточной цитометрии или иммунноаффинного метода с антителами, направленными против указанных маркеров.
Trl-клетки можно также обогащать путем позитивного отбора или негативного отбора, используя проточную цитометрию или магнитные микроносители. Такие методы также описаны в WO 2005/000344.
В другом воплощении настоящего изобретения Trl-клетки, направленные на суставной антиген, могут быть увеличены в количестве с помощью in vitro метода, описанного в WO 2006/108882. Указанный метод включает:
a) культивирование при температуре Т1 ниже 35°С, в среде для культивирования Mf, питающих клеток, таких как питающие клетки насекомых, при этом указанная температура Т1 обеспечивает пролиферацию питающих клеток и эти питающие клетки экспрессируют факторы, которые взаимодействуют со следующими поверхностно-клеточными белками:
- CD3/TCR комплексом, CD28 белком,
- IL-2 рецептором,
- CD2 белком,
- IL-4 рецептором,
b) контактирование питающих клеток, полученных на стадии а), очищенных или нет от их среды для культивирования Mf, с Trl-клеточной популяцией, содержащейся в среде для культивирования Мр, где среда для культивирования Мр изначально не содержит факторы, указанные на стадии а), для получения смеси, содержащей Trl-клеточную популяцию, питающие клетки и среду для культивирования Мр,
c) культивирование смеси, полученной на стадии
b) при температуре Т2, которая составляет, по меньшей мере, 35°С, причем эту температуру выбирают таким образом, чтобы Trl-клеточная популяция пролиферировала, а питающие клетки не пролиферировали,
d) извлечение Trl-клеточной популяции, размноженной таким образом. Примеры факторов, которые взаимодействуют с вышеуказанными поверхностно-клеточными белками включают:
- модифицированное анти-CD3 антитело, в котором анти-CD3 внутрицитоплазматический домен CD3-тяжелой цепи замещен трансмембранным доменом,
- CD80 или CD86 белок,
- IL-2, секретируемый питающими клетками,
- CD58 белок,
- интерлейкин, выбранный из группы, содержащей IL-4 и IL-13.
В предпочтительном воплощении настоящего изобретения указанные Trl-клетки, направленные на суставной антиген, можно клонировать, используя традиционные методы для клонирования Т-клеток. В предпочтительном воплощении настоящего изобретения композиция, содержащая, по меньшей мере, одну популяцию Trl-клеток человека, направленных против суставного антигена, или, по меньшей мере, один клон Trl-клетки человека, направленный против суставного антигена, может быть заморожена для хранения.
В предпочтительном воплощении настоящего изобретения суставной антиген выбирают из группы, содержащей цитруллин-замещенные циклические и линейные филагрины, коллагены типа II, гликопротеин 39 (HCgp39) человеческого хряща, гетерогенный ядерный рибонуклеопротеин (hnRNP) A2, hnRNP B1, htiRNP D, Ro60/52, BiP, виментин, фибриноген, коллаген типа I, III и V, аннексии V, глюкозо-6-фосфатизомеразу (GPI), ацетил-кальпастатин, альдолазу, snRNP, PARP, Scl-70, Scl-100, фосфолипидный антиген, включая анионный фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матричную металлопротеиназу, фибриллин, аггреккан. их фрагменты, варианты и смеси.
Предпочтительно суставной антиген представляет собой рекомбинантный или синтезированный антиген.
Предпочтительно суставной антиген является коллагеном типа II, его фрагментами, вариантами и смесями.
Предпочтительно суставной антиген - это HCgp39, его фрагменты, варианты и смеси.
Термин "вариант" суставного антигена относится здесь к антигену, который почти идентичен природному антигену и который проявляет ту же биологическую активность. Минимальная разница между природным антигеном и его вариантами может заключаться, например, в аминокислотой замене, делеции и/или дополнению. Такие варианты могут содержать, например, консервативные аминокислотные замены, в которых аминокислотные остатки замещены аминокислотными остатками, имеющими сходную боковую цепь. Семейства аминокислотных остатков, имеющих схожие боковые цепи, определены в уровне техники, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
Другой целью настоящего изобретения является обеспечение лекарственного средства, содержащего, по меньшей мере, одну популяцию Trl-клеток человека, направленных против суставного антигена.
Настоящее изобретение также касается обеспечения фармацевтической композиции, содержащей, по меньшей мере, одну популяцию Trl-клеток человека, направленных против суставного антигена, в комбинации с одним или более фармацевтически приемлемым носителем.
Согласно предпочтительному воплощению популяция Trl-клеток человека является клоновой популяцией Trl-клеток человека.
Согласно предпочтительному воплощению суставной антиген выбирают среди цитруллин-замещенных циклических и линейных филагринов, коллагенов типа II, гликопротеина 39 (HCgp39) человеческого хряща, гетерогенного ядерного рибонуклеопротеина (hnRNP) А2, hnRNP B1, htiRNP D, Ro60/52, BiP, виментина, фибриногена, коллагена типа I, III и V, аннексина V, глюкозо-6-фосфатизомеразы (GPI), ацетил-кальпастатина, альдолазы, snRNP, PARP, Scl-70, Scl-100, фосфолипидного антигена, включая анионный фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матричной металлопротеиназы, фибриллина, аггрекканы, и их фрагментов, вариантов и смесей.
Согласно более предпочтительному воплощению лекарственное средство или фармацевтическая композиция изобретения содержит, по меньшей мере, одну популяцию Trl-клеток человека или клон, направленный против суставного антигена, выбранного среди коллагена типа II, HCgp39 и HSP.
Предпочтительно указанная композиция содержит Trl-клетки человека, направленные против коллагена типа II.
Trl-клетки человека, направленные против коллагена типа II, могут быть направлены против эпитопов, присутствующих в 245-273 фрагменте типа II коллагена (IAGAPGFPGPRGPPGPQGATGPLGPKGQT, SEQ ID NO 1), и связаны либо с HLA-DR1, либо с HLA-DR4 субъектами.
В другом более предпочтительном воплощении композиция содержит Trl-клетки человека, направленные против HCgp39. Trl-клетки человека, направленные против Hcgp39, могут быть направлены против следующих эпитопов HCgp39: PTFGRSFTLASSE (SEQ ID NO 2), RSFTLASSETGVG (SEQ ID NO 3), VGYDDQESVKSKV (SEQ ID NO 4), SQRFSKIASNTQSR (SEQ ID NO 5), FGRSFTLAS (SEQ ID NO 6), FTLASSETG (SEQ ID NO 7), YDDQESVKS (SEQ ID NO 8), FSKIASNTQ (SEQ ID NO 9).
В другом более предпочтительном воплощении композиция содержит Trl-клетки человека, направленные против HSP-белков, таких как HSP60, HSP65, HSP70, HSP90.
Фармацевтически пригодные носители, использующиеся здесь, традиционные Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980) описывает композиции и составы, которые подходят для фармацевтической доставки композиции настоящего изобретения. В общем, природа носителя будет зависеть от пути введения, который применяют. Например, парентеральные составы обычно включают инъецируемые жидкости, которые включают фармацевтически и физиологически подходящие жидкости, такие как воду, физиологический раствор, буферные солевые растворы, водную декстрозу, кунжутное масло, глицерин, этанол, их комбинации или подобные им, в качестве носителя. Носитель и композиция могут быть стерильными, и состав обеспечивает путь введения. В дополнение к биологически нейтральным носителям фармацевтические композиции, которые вводят, могут содержать небольшое количество нетоксичных вспомогательных веществ, таких как увлажнители или эмульгирующие агенты, консерванты и регулирующие рН агенты и им подобные, например, натрия ацетат или сорбитанмонолаурат. Композиция может быть жидким раствором, суспензией, эмульсией.
Настоящее изобретение относится к применению композиции, содержащей, по меньшей мере, одну популяцию Trl-клеток человека, направленных против суставного антигена, или получению лекарственного средства или фармацевтической композиции для лечения артрита.
Объектом изобретения является лекарственное средство или фармацевтическая композиция, как описано здесь выше, для лечения артрита или для применения при лечении артрита.
Указанный артрит включает, но не ограничивается, ревматоидный артрит, полихондрит, септический артрит, спондилоартропатии или анкилозирующий спондилит, ювенильный идиопатический артрит (ЮИА), псориатический артрит и заболевания, связанные с артритом, такие как системная красная волчанка, синдром Шегрена, склеродермия, дерматомиозит, полимиозит, ревматическая полимиалгия, фибромиалгия, саркоидоз, васкулит.
Согласно предпочтительному воплощению популяция Trl-клеток человека является клоновой популяцией Trl-клеток человека.
Согласно предпочтительному воплощению одна популяция Trl-клеток человека или клон направлен против суставного антигена, выбранного среди цитруллин-замещенных и линейных филагринов, коллагенов типа II, гликопротеина 39 (HCgp39) человеческого хряща, гетерогенного ядерного рибонуклеопротеина (hnRNP) A2, hnRNP B1, htiRNP D, Ro60/52, BiP, виментина, фибриногена, коллагена типа I, III и V, аннексии V, глюкозо-6-фосфатизомеразу (GPI), ацетил-кальпастатин, альдолазу, snRNP, PARP, Scl-70, Scl-100, фосфолипидный антиген, включая анионный фосфатидилсерин, нейтрально заряженного фосфатидилэтаноламина и фосфатидилхолина, матричной металлопротеиназы, фибриллина, аггреккана, и их фрагментов, вариантов и смесей.
Согласно более предпочтительному воплощению, по меньшей мере, одна популяция Trl-клеток человека или клон направлены против суставного антигена, выбранного среди коллагена типа II, HCgp39 и HSP.
Предпочтительно, Trl-клетки человека или клоны направлены против коллагена типа II. Trl-клетки человека или клоны, направленные против коллагена типа II, могут быть направлены против эпитопов, присутствующих в 245-273 фрагменте коллагена типа II (IAGAPGFPGPRGPPGPQGATGPLGPKGQT, SEQ ID NO 1), и связаны либо с HLA-DR1, либо HLA-DR4 субъектами.
В другом более предпочтительном воплощении Trl-клетки человека или клоны направлены против HCgp39. Trl-клетки человека или клоны, направленные против Hcgp39, могут быть направлены против следующих эпитопов HCgp39: PTFGRSFTLASSE (SEQ ID NO 2), RSFTLASSETGVG (SEQ ID NO 3), VGYDDQESVKSKV (SEQ ID NO 4), SQRFSKIASNTQSR (SEQ ID NO 5), FGRSFTLAS (SEQ ID NO 6), FTLASSETG (SEQ ID NO 7), YDDQESVKS (SEQ ID NO 8), FSKIASNTQ (SEQ ID NO 9).
В другом более предпочтительном воплощении Trl-клетки человека или клоны направлены против HSP белков, таких как HSP60, HSP65, HSP70, HSP90.
В предпочтительном воплощении настоящее изобретение относится к применению композиции, как описано здесь выше, для приготовления лекарственного средства или фармацевтической композиции для лечения ревматоидного артрита.
В другом предпочтительном воплощении настоящее изобретение относится к применению композиции, как описано здесь выше, для приготовления лекарственного средства или фармацевтической композиции для лечения псориатического артрита.
В другом предпочтительном воплощении настоящее изобретение относится к применению композиции, как описано здесь выше, для приготовления лекарственного средства или фармацевтической композиции для лечения анкилозирующего спондилита.
В другом предпочтительном воплощении настоящее изобретение относится к применению композиции, как описано здесь выше/для приготовления лекарственного средства или фармацевтической композиции для лечения ювенального идиопатического артрита.
Объектом настоящего изобретения также является способ лечения артрита, предпочтительно ревматоидного артрита, ювенального идиопатического артрита, псориатического артрита или анкилозирующего спондилита у субъекта, нуждающегося в таком лечении, включающий введение указанному субъекту эффективного количества лекарственного средства, которое описано здесь выше, или фармацевтической композиции, которая описана здесь выше.
Композиция может быть составлена для парентерального, внутримышечного, внутривенного, интраперитонеального введения, интраназальной ингаляции, легочной ингаляции, интрадермального, внутрисуставного, интратекального введения. В одном воплощении изобретения, лекарственное средство или фармацевтическая композиция изобретения может быть введена в сустав, который подвергается лечению.
Предпочтительно лекарственное средство или фармацевтическая композиция изобретения может быть введена внутрисуставным, интраперитонеальным или внутривенным инъецированием или путем прямого инъецирования в лимфатические узлы пациента, предпочтительно внутривенным путем.
Количество Trl-клеток, направленных на суставной антиген, эффективных для лечения артрита, будет зависеть от природы воспаления и может быть определено с использованием стандартных клинических техник. Точная доза вводимого состава также будет зависеть от пути введения и тяжести заболевания или нарушения и будет рассчитываться в соответствии с оценкой лечащего врача и с индивидуальными особенностями. Эффективные дозы можно экстраполировать из кривых зависимости от дозы, полученных из тест-систем in vitro или на экспериментальных моделях.
В одном воплощении настоящего изобретения субъекту вводят от 104/кг до 104/кг клеток. Предпочтительно субъекту вводят от 103/кг до 107/кг клеток и более предпочтительно около 106/кг клеток.
В одном воплощении изобретения субъекту вводят лекарственное средство в период, когда внезапное обострение заболевания продемонстрировано за счет снижения клинического статуса субъекта, или в период, когда воспалительные очаги можно визуализировать, например, посредством радиографии или магнитно-резонансной томографии.
В одном воплощении изобретения субъекту однократно вводят лекарственное средство или фармацевтическую композицию настоящего изобретения.
Во втором воплощении изобретения лекарственное средство или фармацевтическую композицию настоящего изобретения вводят субъекту один раз в месяц.
В третьем воплощении изобретения лекарственное средство или фармацевтическую композицию настоящего изобретения вводят субъекту один раз в квартал.
В четвертом воплощении изобретения лекарственное средство или фармацевтическую композицию настоящего изобретения вводят субъекту один-два раза в год.
В другом воплощении настоящего изобретения лекарственное средство или фармацевтическая композиция, которую вводят нуждающемуся субъекту, содержит Trl-клетки человека, аутологичные клеткам указанного субъекта.
Это означает, что Trl-клетки, которые будут введены субъекту, или что предшественники для продукции Trl-клеток происходят от субъекта, которому вводят Trl-клетки.
Настоящее изобретение относится также к способу лечения артрита у субъекта, нуждающегося в таком лечении, включающем стадии:
- отбор образца крови у субъекта,
- получение Trl-клеток, направленных на выбранный суставной антиген,
- клонирование указанных Trl-клеток, направленных на выбранный суставной антиген,
- дополнительное увеличение числа Trl-клонов, полученных на предыдущей стадии,
- инъецирование Trl-клонов, полученных таким образом, субъекту, предпочтительно внутривенным путем.
Предпочтительно клонирование и увеличение числа Trl-клонов, направленных на выбранный суставной антиген, осуществляют следующим способом:
а) культивирование при температуре Т1 ниже 35°С, в среде для культивирования Mf питающих клеток, таких как питающие клетки насекомых, причем указанная температура Т1 обеспечивает пролиферацию питающих клеток и питающие клетки экспрессируют факторы, которые связаны со следующими поверхностно-клеточными белками:
- CD3/TCR комплексом,
- CD28 белком,;
- IL-2 рецептором,
- CD2 белком,
- IL-4 рецептором,
b) контактирование питающих клеток, полученных на стадии а), очищенных или нет от их среды для культивирования Mf, с Trl-клеточной популяцией, содержащейся в среде для культивирования Мр, причем среда для культивирования Мр изначально не содержит факторы, указанные на стадии а), для получения смеси, содержащей Trl-клеточную популяцию, питающие клетки и среду для культивирования Мр,
c) культивирование смеси, полученной на стадии b), при температуре Т2, которая составляет, по меньшей мере, 35°С, причем температура выбирается так, чтобы Trl-клеточная популяция пролиферировала, а питающие клетки не пролиферировали,
d) извлечение Trl-клеточной популяции, увеличенной таким образом. Примеры факторов, которые взаимодействуют с вышеуказанными поверхностно-клеточными белками, включают:
- модифицированное анти-CD3 антитело, в котором анти-CD3 внутрицитоплазматический домен CD3-тяжелой цепи замещен трансмембранным доменом,
- CD80 или CD86 белок,
- IL-2, секретируемый питающими клетками,
- CD58 белок,
- интерлейкин, выбранный из группы, содержащей IL-4 и IL-13.
В другом воплощении настоящего изобретения способ лечения артрита у субъекта, нуждающегося в таком лечении, включает введение субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения в комбинации с одним или более терапевтическими агентами, применяемыми для лечения артрита.
Настоящее изобретение относится к применению фармацевтической композиции или лекарственного средства изобретения, в котором введение субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения осуществляют в комбинации с одним или более терапевтическими агентами, применяемыми для лечения артрита.
Примеры терапевтических агентов, широко применяемых для лечения артрита, следующие:
- кортикоиды (преднизолон);
- анти-TNF, такие как инфликсимаб, адалимумаб-белок, этанерцепт;
- анти-интерлейкины, такие как анакинра, AMG 108, игуратимод, актемра;
- анти-В лимфоциты, такие как ритуксимаб, эпратузумаб;
- анти-костимулирующие молекулы, такие как абатацепт, белимумаб;
- толерогенные агенты (синтетические молекулы, направленные на поверхностные ДНК рецепторы В-лимфоцитов), такие как LJP 394 или TV-4710;
- белок антикомплемента, такой как экулизумаб;
- ингибиторы молекул системы сигналов Т-клеток, такие как СР690550;
- ингибиторы клеточной миграции, такие как антагонисты хемокиновых рецепторов (маравирок, INCB3284);
- лефлуномид;
- сульфасалазин;
- гидроксихлорокин;
- азатиоприн;
- метотрексат;
- циклоспорин;
- миноциклин;
- D-пеницилламин;
- комбинированная терапия, такая как метотрексат+сульфазолин, метотрексат+гидроксихлорокин, метотрексат+азатиоприн, метотрексат+инфликсимаб, метотрексат+лефлуномид, метотрексат+этанерцепт, циклоспорин+гидроксихлорокин, циклоспорин+метотрексат, метотрексат+сульфасалазин+гидроксихлорокин.
В предпочтительном воплощении настоящего изобретения способ лечения артрита у субъекта, нуждающегося в таком лечении, включает введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения в комбинации с одним или более терапевтическими агентами, выбранными из группы кортикоидов, анти-TNF, анти-интерлейкинов, анти-В-лимфоцитов, анти-костимулирующих молекул, толерогенных агентов, белков антикомплемента, ингибиторов молекул системы сигналов Т-клеток, ингибиторов клеточной миграции, метотрексата, лефлуномида, сульфасалазина, гидроксихлорокина, азатиоприна, метотрексата, циклоспорина, миноциклина, D-пеницилламина.
Настоящее изобретение относится к применению фармацевтической композиции или лекарственного средства изобретения для лечения артрита у субъекта, нуждающегося в таком лечении, в котором введение субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения осуществляют в комбинации с одним или более терапевтическими агентами, выбранными из группы кортикоидов, анти-TNF, анти-интерлейкинов, анти-В-лимфоцитов, анти-костимулирующих молекул, толерогенных агентов, белков антикомплемента, ингибиторов молекул системы сигналов Т-клеток, ингибиторов клеточной миграции, метотрексата, лефлуномида, сульфасалазина, гидроксихлорокина, азатиоприна, метотрексата, циклоспорина, миноциклина, D-пеницилламина.
В другом воплощении настоящее изобретение также относится к способу лечения артрита, в котором лекарственное средство или фармацевтическую композицию изобретения вводят субъекту, нуждающемуся в таком введении, который не отвечает адекватно на или маловероятно, что ответит на лечение, один или более терапевтический агент из группы кортикоидов, анти-TNF, анти-интерлейкинов, анти-В-лимфоцитов, анти-костимулирующих молекул, толерогенных агентов, белков антикомплемента, ингибиторов молекул системы сигналов Т-клеток, ингибиторов клеточной миграции, метотрексата, лефлуномида, сульфасалазина, гидроксихлорокина, азатиоприна, метотрексата, циклоспорина, миноциклина, D-пеницилламина.
Настоящее изобретение относится к применению фармацевтической композиции или лекарственного средства изобретения, при котором субъект не отвечает адекватно на или маловероятно, что ответит на лечение одним или более терапевтическими агентами из группы кортикоидов, анти-TNF, анти-интерлейкинов, анти-В-лимфоцитов, анти-костимулирующих молекул, толерогенных агентов, белков антикомплемента, ингибиторов молекул системы сигналов Т-клеток, ингибиторов клеточной миграции, метотрексата, лефлуномида, сульфасалазина, гидроксихлорокина, азатиоприна, метотрексата, циклоспорина, миноциклина, D-пеницилламина.
"Неадекватный ответ", "не отвечает адекватно" или "маловероятно, что ответит адекватно" относится к действительному или возможному ответу субъекта, который показывает, что терапия или оказалась или способна оказаться неэффективной, токсичной или плохо переносимой, поскольку это касается субъекта.
Примеры
В следующем ниже описании все эксперименты, для которых не представлен подробный протокол, осуществляли согласно стандартному протоколу.
Приведенные примеры включены для демонстрации предпочтительных воплощений изобретения. Специалистам в данной области необходимо понимать, что техники, описанные в примерах, которые раскрыты изобретателем ниже, применимы для практики изобретения и, следовательно, могут быть предпочтительными способами для практики. Однако, специалист в данной области должен в свете настоящего описания понимать, что можно выполнить многие изменения в конкретно раскрытых воплощениях с получением одинаковых или сходных результатов, не выходя за пределы объема и сущности изобретения.
Методики экспериментов
Выделение Trl-клеток
Собирали образцы крови здоровых пациентов или пациентов с тяжелым ревматоидным артритом и отделяли белые клетки с использованием центрифугирования в градиенте плотности. Клетки затем культивировали в присутствии коллагена типа II для индуцирования специфической пролиферации Trl-клеток, направленных против этого антигена. Через 13 дней культивации клеточные популяции клонировали путем ограничения способа разбавления. Клоны затем оценивали по их специфичности к коллагенам типа II и для характеристики профиля продукции цитокинов Trl-клетками.
Анализ цитокинов
Для определения специфичности антигенов осуществляли анализ сэндвич-ELISA 48-часовых супернатантов Т-клеточных клонов, стимулированных в присутствии антиген представляющих клеток (4,105) и в присутствии или отсутствии специфического антигена (коллагена типа II). Для определения профиля цитокиновой продукции клоны Trl-клеток, стимулированные коллагеном типа II, стимулировали анти-СВЗ+анти-СВ28 моноклональными антителами и через 48 ч собирали супернатанты. ELISA осуществляли, используя анти-1b-4 (11В11), анти-IL-10 (2А5), анти-IFN-γ (XGM 1.2), биотин анти-1b-4 (24G2), анти-IL-10 (SXC1), анти-IFN-γ (R4-6А2) (Pharmingen Becton Dickinson).
Изучения супрессии
Для изучения супрессии раздельные количества клонов Trl-клеток, стимулированных коллагеном типа II, совместно культивировали с аутологичными CD4 положительными Т лимфоцитами. Со-культуры стимулировали анти-СО3+анти-СВ28 моноклональными антителами. Альтернативно, супернатанты коллаген II-специфичных клонов добавляли к CD4 положительным Т-лимфоцитам, стимулированным анти-CD3+анти-CD28 моноклональными антителами. Через 3 дня оценивали общую клеточную пролиферацию, используя набор для определения пролиферации WST-I от Roche.
Результаты
Фигура 1 показывает продукцию IL-10 двух разных Trl-клеточных популяций, специфичных к коллагену типа II в присутствии или отсутствии антигена. Результаты показывают, что стимуляция коллагеном типа II вызывает усиление продукции IL-10. Эти результаты демонстрируют специфичность клеточных популяций по отношению к коллагену типа II.
Для дополнительного определения профиля цитокиновой секреции этих Trl-клеточных популяций, специфичных к коллагену типа II, клетки стимулировали в присутствии анти-CD3+анти-CD28 моноклональных антител. Проводили ELISA 48 ч супернатантов для измерения продукции IL-4, IL-10 и IFNγ. Фигура 2 показывает, что профиль цитокиновой секреции, наблюдаемый для последних коллаген типа II-специфичных популяций, соответствуют профилю цитокиновой секреции Trl-клеток, т.е. высокая продукция IL-10, низкая продукция IFNγ и отсутствие продукции IL-4.
Оценивали супрессивную активность этих Trl-популяций, специфичных к коллагену типа II. Trl-клетки культивировали совместно с аутологичными CD4+Т-клетками в присутствии анти-CD3+анти-CD28 моноклональных антител. Через 3 дня стимуляции измеряли клеточную пролиферацию. Фигура 3 показывает результаты для двух Trl-популяций и подтверждает подавляющую активность этих клеток.
Фигура 4 показывает профиль цитокиной продукции коллаген типа II-специфичного клона, стимулированного анти-СВ3+анти-СВ28 антителами in vitro.
Этот клон был получен из периферической крови пациента с ревматоидным артритом, резистентного к традиционным средствам лечения ревматоидного: артрита, включая анти-TNF-альфа антитела.
Высокая продукция IL-10 и продукция IFNraMMa в отсутствии IL-4 характеризует его Trl-клеточную идентичность.
Супернатант этого активированного клона способен подавлять пролиферацию CD4+Т-лимфоцитов in vitro (Фигура 5). Сопутствующая блокада обоих IL-10 и ТОРбета обеспечивали возобновление пролиферации, показывая что подавляющая активность Trl-клона опосредуется этими двумя цитокинами.
Этот эксперимент подтверждает, что Trl-клетки, специфичные к коллагену типа II, могут быть выделены из пациентов, которые резистентны к традиционному лечению ревматоидного артрита, и что эти Trl-клетки способны подавлять CD4+Т-клеточную пролиферацию через IL-1 и TGF-бета. Эффект Trl-клеток, специфичных к коллагену типа II, далее оценивали in vivo на мышиной модели коллаген-индуцированного артрита.
Мышиные спленоциты из трансгенных мышей линии ТВС (экспрессирующих Т-клеточный рецептор, специфичный для коллагена типа II) активировали бычьим коллагеном типа II (5 мкг/мл) в течение 7 дней в присутствии IL-10 (50 нг/мл) и анти-IL-4 (10 мкг/мл).
Артрит индуцировали у мышей DBA-I путем подкожного введения коллагена типа II (100 мкг) в полном адъюванте Фрейнда на 0 день с последующей второй иммунизацией коллагеном типа II (100 мкг), инъецированного также подкожно в неполном адъюванте Фрейнда на 21 день.
Тяжесть заболевания оценивали путем измерения опухшего сустава и воспаленных пальцев. Сингенные Trl-клетки, специфичные к коллагену типа II (1,5 миллиона), вводили внутривенно на 19 день.
Фигура 6 показывает, что внутривенное введение Trl-клеток, специфичных к коллагену типа II, ингибирует развитие тяжелого артрита в мышиной модели коллаген-индуцированного артрит.
Реферат
Изобретение относится к области биотехнологии, конкретно к получению популяции Tr1-клеток, направленных против коллагена типа II, и может быть использовано в медицине. Выделяют популяцию Tr1-клеток, направленных против коллагена типа II и имеющих в покое фенотип CD4CD25FoxP3. Полученную популяцию Tr1-клеток в комбинации с одним или несколькими фармацевтически приемлемыми носителями используют в составе фармацевтической композиции для лечения артрита. Изобретение позволяет получить эффективное средство для лечения артрита. 3 н. и 9 з. п. ф-лы, 6 ил.

Комментарии