Композиция для усиления экспрессии трансгена в эукариотических клетках и способ увеличения продукции целевого белка, кодируемого трансгеном - RU2546249C2
Код документа: RU2546249C2
Чертежи


Описание
Область, к которой относится изобретение
Изобретение относится к областям биотехнологии и медицины, в частности к производству ДНК-векторов со вставкой гена целевого белка, производству рекомбинантных белков в культурах эукариотических клеток, наработке модифицированных клеток для клеточной терапии, клеточной и генной терапии у человека и животных.
Описание предшествующего уровня техники
ДНК-векторы используют в различных областях биологии для доставки в клетки и экспрессии чужеродного генетического материала. Их применяют в качестве молекулярно-биологических инструментов как в исследованиях in vitro, например, для изучения функций каких-либо генов, так и in vivo для переноса генетической информации в клетки организма с целью терапии или вакцинации. Отдельной областью использования ДНК-векторов является модификация с их помощью клеток, которые затем используются как продуценты целевого белка или средства для генной терапии.
Во всех описанных выше случаях использования ДНК-векторов их важной характеристикой является уровень экспрессии целевого гена. Поэтому особой задачей при разработке систем на основе ДНК-векторов является увеличение уровня экспрессии доставляемого в клетки трансгена. От этого зависит уровень продукции трансгена при генетической терапии или уровень иммунной реакции при генетической иммунизации. Кроме того, повышение уровня экспрессии трансгена может позволить снизить дозу вектора, вводимого in vitro или in vivo.
Для повышения уровня экспрессии целевого гена используют два основных подхода. Первый подход заключается во включении в состав экспрессионной кассеты ДНК-векторов различных регуляторных элементов: промоторов, сигналов полиаденилирования, интронов, экзонов, 5'- и 3'-нетранслируемых элементов, таких как PARS, IRES, WPRE [Dorokhov Y.L., Skulachev M.V., Ivanov P.A., Zvereva S.D., Tjulkina L.G., Merits A., Gleba Y.Y., Hohn T., Atabekov J.G. Polypurine (A)-rich sequences promote cross-kingdom conservation of internal ribosome entry // Proc. Natl. Acad. Sci. USA, 2002, v.99, p.5301-5306. Lee Y.B., Glover C.P., Cosgrave A.S., Bienemann A., Uney J.B. Optimizing regulatable gene expression using adenoviral vectors. // Exp Physiol., 2005 Jan; 90(1):33-37. Li Z.L., Tian P.X., Xue W.J., Wu J. Co-expression of sCD40Llg and CTLA4lg mediated by adenovirus prolonged mouse skin allograft survival. - J Zhejiang Univ Sci B, 2006 Jun; 7(6):436-44. US 20080241883 A1 Recombinant expression vector elements (rEVEs) for enhancing expression of recombinant proteins in host cells. WO 2008000445 Expression vector(s) for enhanced expression of a protein of interest in eukaryotic or procariotic host cells].
Второй подход - воздействие на клетки, в которые введен ДНК-вектор, внешними молекулярными агентами, такими, например, как бутират натрия и трихостатин А [Siavoshian S., J-P Segain, M. Kornprobst, C. Bonnet, C. Cherbut, J-P. Galmiche, H.M. Blottierea. Butyrate and trichostatin A effects on the proliferation/differentiation of human intestinal epithelial cells: induction of cyclin D3 and p21 expression. // Gut, 2000; 46:507-514].
Репликативно дефектные ДНК-векторы, например, рекомбинантные псевдовирусные частицы не способны размножаться [US 6019978 Replication-defective adenovirus human type 5 recombinant as a vaccine carrier], поэтому результативность экспрессии целевого трансгена зависит от способности вирусных частиц трансдуцировать клетки и от эффективности дальнейшей наработки целевого белка.
Повышения эффективности in vivo достигают повышением дозы вводимых вирусов [Tutykhina I.L., Sedova E.S., Gribova I.Y., Ivanova T.I., Vasilev L.A., Rutovskaya M.V., Lysenko A.A., Shmarov M.M., Logunov D.Y., Naroditsky B.S., Tillib S.V., Gintsburg A.L. Passive immunization with a recombinant adenovirus expressing an HA (H5)-specific single-domain antibody protects mice from lethal influenza infection. // Antiviral Res., 2013 Mar; 97(3):318-28] или повышением качества вводимых вирусных частиц [RU 2443779 Способ получения препарата рекомбинантного аденовируса, характеризующегося сниженным коэффициентом соотношения физических и инфекционных вирусных частиц, и генно-терапевтический лекарственный препарат, полученный таким способом].
Известно изобретение [US 20080311095 Methods and compositions for increased transgene expression], в котором предложен метод повышения экспрессии трансгена в Т-клетках человека путем их предварительной активации in vitro с помощью антител к CD3/CD28. Это изобретение было выбрано нами в качестве прототипа. Очевидны следующие существенные недостатки прототипа: (1) данное изобретение пригодно только для активации Т-клеток и не может быть применено для активации других типов клеток, потому что рецептор CD3 синтезируется исключительно Т-клетками; (2) предложенный в прототипе тип активации Т-клеток можно проводить только в условиях in vitro; (3) по предлагаемой в прототипе методике активации с помощью антител к CD3/CD28 все Т-клетки будут активно размножаться (поликлональная активация). Такие поликлонально активированные in vitro Т-клетки нельзя вводить в организм животных или человека, поскольку это приведет к тяжелым аутоиммунным, системным воспалительным, лимфопролиферативным процессам и полному нарушению нормальных функций иммунной системы с очень высоким риском смертельного исхода.
Задачей данного изобретения была разработка композиции для усиления экспрессии трансгена в эукариотических клетках и способа увеличения продукции целевого белка, кодируемого трансгеном, а также обеспечение возможности применения композиции и способа как в культуре клеток in vitro, так и in vivo в живом организме, не вызывая опасных явлений для его здоровья и жизни.
Поставленная задача решается за счет того, что создана композиция для интенсивной продукции целевого белка в эукариотических клетках, включающая ДНК-вектор со вставкой гена целевого белка и агонист клеточных рецепторов из класса рецепторов PRR - pattern recognition receptors, выбранный из следующих агонистов: агонистов рецепторов TLR2, или агонистов рецепторов TLR4, или агонистов рецепторов TLR5, или агонистов рецепторов TLR7, или агонистов рецепторов TLR8, или агонистов рецепторов TLR9, или агонистов NOD1- рецепторов, или агонистов NOD2-рецепторов, взятые в оптимальных соотношениях. При этом в качестве агониста рецептора TLR2 используют липотейхоевую кислоту, либо в качестве агониста рецептора TLR2 используют липопептид. В качестве агониста рецептора TLR4 используют бактериальный липополисахарид, либо в качестве агониста рецептора TLR4 используют кислый пептидогликан с молекулярной массой 1200-40000 КД. В качестве агониста рецепторов TLR5 используют флагеллин. В качестве агониста рецептора TLR7 используют имиквомод, либо в качестве агониста рецептора TLR7 используют препарат CL097, являющийся производным имидазохинолина. В качестве агониста рецептора TLR8 используют имиквомод, либо в качестве агониста рецептора TLR8 используют препарат CL097, являющийся производным имидазохинолина. В качестве агониста рецептора TLR9 используют олигонуклеотид CpG ODN 1826, либо в качестве агониста рецептора TLR9 используют олигонуклеотид CpG ODN 2006. В качестве агониста NOD1-рецепторов используют C12-iE-DAP - Lauroyl-g-D-Glu-D-mDAP и Lauroyl-g-D-Glu-L-mDAP - синтетические фрагменты бактериального пептидогликана. В качестве агониста рецепторов NOD2-используют L18-MDP - производное мурамилдипептида, а именно фрагмента бактериального пептидогликана. В качестве агониста рецепторов PRR может быть использован фармацевтический препарат в эффективной дозе. В качестве агониста рецепторов PRR используют фармацевтический препарат «Иммуномакс» - Р N001919/02. В качестве агониста рецепторов PRR может быть также использован фармацевтический препарат «Пирогенал» - Р N003478/0. В качестве агониста рецепторов PRR может быть также использован фармацевтический препарат «Ликопид» - ЛС-001438. В качестве ДНК-вектора используют нереплицирующиеся рекомбинантные аденовирусные наночастицы на основе аденовируса человека 5 серотипа. ДНК-вектор используют со вставкой целевого гена, кодирующего секреторный белок, либо используют ДНК-вектор со вставкой целевого гена, кодирующего цитоплазматический белок. Либо используют ДНК-вектор со вставкой целевого гена, кодирующего мембранный белок.
В способе увеличения продукции целевого белка, кодируемого трансгеном, в эукариотических клетках при их трансдуцировании ДНК-векторами использована заявленная композиция. При этом усиление продукции целевого белка достигается в условиях культуры эукариотических клеток in vitro. Также усиление продукции целевого белка достигается в условиях организма in vivo. При этом эукариотические клетки получены из организма мыши, или эукариотические клетки получены из организма человека.
Также может быть использована композиция для интенсивной продукции целевого белка в эукариотических клетках, включающая ДНК-вектор со вставкой гена целевого белка и агонист клеточных рецепторов из класса рецепторов цитокинов, в оптимальном соотношении. В этом случае в качестве агониста рецепторов цитокинов используется фактор некроза опухоли. Используется способ увеличения продукции целевого белка в эукариотических клетках при их трансдуцировании ДНК-векторами с использованием вышеуказанной композиции.
Таким образом, технический результат - повышение производства целевого трансгенного белка был достигнут путем использования агонистов PRR-рецепторов (от англ. pattern-recognition receptors), а также рецепторов цитокинов.
Отличительной особенностью изобретения является использование агонистов PRR-рецепторов из классов TLR- и NOD-рецепторов, а также цитокиновых рецепторов (рецептор фактора некроза опухоли, ФНО).
Предлагаемое изобретение дает следующие преимущества: (1) эффект достигается как в условиях in vitro, так и in vivo; (2) эффект достигается в любых типах клеток, которые могут экспрессировать ДНК-вектор и которые несут функционально активные PRR-рецепторы; (3) предложенный нами метод усиления экспрессии трансгена не приводит ни к поликлональной пролиферации, ни к каким-либо другим патологическим эффектам, опасным для животных и человека, и для усиления экспрессии трансгена по предложенному нами методу могут быть использованы фармацевтические препараты агонисты PRR-рецепторов.
Сущность изобретения
Данное изобретение предлагает композицию для усиления экспрессии трансгена в эукариотических клетках и способ увеличения продукции целевого белка, кодируемого трансгеном.
Задача, решаемая данным изобретением, состоит в значительном усилении экспрессии целевого трансгена и продукции целевого белка в эукариотических клетках как в условиях культуры клеток in vitro, так и в условиях организма человека и животных.
Известно, что транскрипция генов и продукция белков в эукариотических клетках могут значительно изменяться под влиянием внешних сигналов, которые можно отнести к нескольким принципиальным типам:
а) контакт эукариотической клетки с возбудителями инфекций или компонентами возбудителей инфекций, которые в научной литературе принято именовать PAMP (pathogen associated molecular patterns);
б) контакт эукариотической клетки с поврежденными клетками или их компонентами, которые в научной литературе принято именовать DAMP (damage-associated molecular patterns);
в) цитокины и сигналы опасности (danger signals), представляющие собой химические регуляторные сигналы для коммуникации клеток между собой;
г) контактные взаимодействия эукариотических клеток друг с другом;
д) контакт клетки с полимерами межклеточного матрикса.
В данном изобретении задача усиления экспрессии трансгена и продукции целевого белка решается путем активации трансдуцированных клеток с помощью РАМР, DAMP, действующих на клетки через PRR-рецепторы, или с помощью цитокинов, действующих на клетки через рецепторы цитокинов, или путем имитации таких воздействий с помощью веществ-агонистов, действующих на эукариотические клетки через PRR-рецепторы или рецепторы цитокинов.
В данном изобретении для усиления экспрессии трансгена и продукции целевого белка в эукариотической клетке, которую трансдуцируют ДНК-вектором со вставкой трансгена, используют вещества, активирующие клеточный метаболизм через PRR-рецепторы или через рецепторы цитокинов. Результатом предложенного в данном изобретении сочетания ДНК-векторов с указанными типами активаторов клеточного метаболизма является усиленная в 2-10 раз продукция целевых белков, относящихся к цитоплазматическим, мембранным или секреторным белкам.
В данном описании изобретения доказывается, что в эукариотической клетке, которую трансдуцируют ДНК-вектором со вставкой трансгена, происходит усиление экспрессии трансгена и продукции целевого белка с помощью активаторов, действующих через PRR-рецепторы или рецепторы цитокинов, что одинаково эффективно реализуется на эукариотических клетках in vitro и in vivo, то есть в условиях организма.
Эффект усиления наблюдается как на клетках животных (мышь), так и человека. Усиление наблюдается в тех типах клеток, которые способны трансдуцироваться и экспрессировать данный ДНК-вектор и несут функционально активные PRR-рецепторы.
Предложенные в данном изобретении усилители экспрессии трансгена могут использоваться и в условиях in vivo, что было продемонстрировано на лабораторных животных, также показано, что в качестве агонистов PRR-рецепторов могут быть использованы фармацевтические препараты.
Перечень фигур
Фиг.1А - Ответ клеток HEK-Blue-TLR4 продукцией репортерного белка SEAP, подтверждающий, что кислый пептидогликан активирует NF-kB через рецепторы TLR-4.
Активность NF-кВ измеряли по экспрессии NF-kB-зависимого репортерного гена SEAP в клетках HEK-Blue, не имеющих рецепторов TLR (null), и в клетках, экспрессирующих один из следующих рецепторов TLR 2, 3, 4, 5, 7, 8, или 9. Клетки инкубировали в течение 18 часов в присутствии КПГ - кислого пептидогликана (5 мкг/мл, ■) или без него (негативный контроль, □). В качестве позитивного контроля для каждого типа клеток использовали стандартный агонист (

Результаты даны в виде кратности повышения продукции NF-kB-зависимого репортерного белка SEAP по отношению к контрольным клеткам (без активатора). Представлены средние значения, полученные в трех независимых экспериментах. Вывод - кислый пептидогликан (КПГ, патент RU №2195308) активирует NF-kB через рецепторы TLR4.
Фиг.1В - Зависимость продукции NF-kB-зависимого репортерного белка SEAP клетками HEK-Blue-TLR4 от концентрации кислого пептидогликана.
КПГ индуцирует экспрессию NF-kB-зависимого репортерного гена (SEAP) в клетках HEK-Blue-TLR4. Клетки инкубировали в присутствии указанных концентраций КПГ в течение 18 часов. Интактные клетки HEK-Blue-TLR4, а также клетки HEK-Blue-TLR-null были использованы в качестве негативного контроля. Результаты даны в виде кратности повышения продукции NF-kB-зависимого репортерного белка SEAP по отношению к контрольным клеткам (без активатора). Представлены средние значения, полученные в трех независимых экспериментах.
Фиг.2 (A, B, C, D, E, F, G, H) - Идентификация клеточного рецептора лекарственного препарата «Иммуномакс» (Р N001919/02).
Клетки коллекции НЕК Blue TLR (InvivoGen), экспрессирующие один из TLR-рецепторов (TLR2, 3, 4, 5, 7, 8, или 9), или не имеющие TLR-рецепторов (null), были использованы для идентификации рецептора лекарственного препарата «Иммуномакс» (Р N001919/02). Представлены результаты исследования:
(A) - на клетках TLR-null;
(B) - на клетках с рецепторами TLR2 и корецепторами CD14;
(C) - на клетках с рецепторами TLR3;
(D) - на клетках с рецепторами TLR4 и корецепторами CD14, и MD2;
(E) - на клетках с рецепторами TLR5;
(F) - на клетках с рецепторами TLR7;
(G) - на клетках с рецепторами TLR8;
(H) - на клетках с рецепторами TLR9.
Клетки указанных линий инкубировали в полной культуральной среде in vitro в течение 18 часов при 37°C и 5% CO2 в присутствии препарата «Иммуномакс» (от 0,02 до 15 мкг/мл) или без него.
В качестве позитивного контроля для каждого типа клеток использовали стандартный агонист: ФНО-α (10 нг/мл) для null-клеток (2 A), липопептид (1 мкг/мл) для TLR2-клеток (2 B), поли I:С (10 мкг/мл) для TLR-клеток (2 C), ЛПС (1 мкг/мл) для TLR4-клеток (2 D), флагеллин (1 мкг/мл) для TLR5-клеток (2 E), имиквимод (1 мкг/мл) для TLR7-клеток (2 F), CL097 (1 мкг/мл) для TLR8-клеток (2 G) и ODN 2007 (10 мкг/мл) для TLR9-клеток (2 H). Активацию TLR-рецепторов (ФНОα-рецепторов в случае контрольных клеток TLR-null) оценивали по активации продукции репортерного белка SEAP, ген которого находится под NF-kB-зависимым промотором во всех использованных типах клеток. Результаты даны в виде кратности повышения продукции NF-kB-зависимого репортерного белка SEAP по отношению к контрольным клеткам (без активатора). Представлены средние значения, полученные в трех независимых экспериментах.
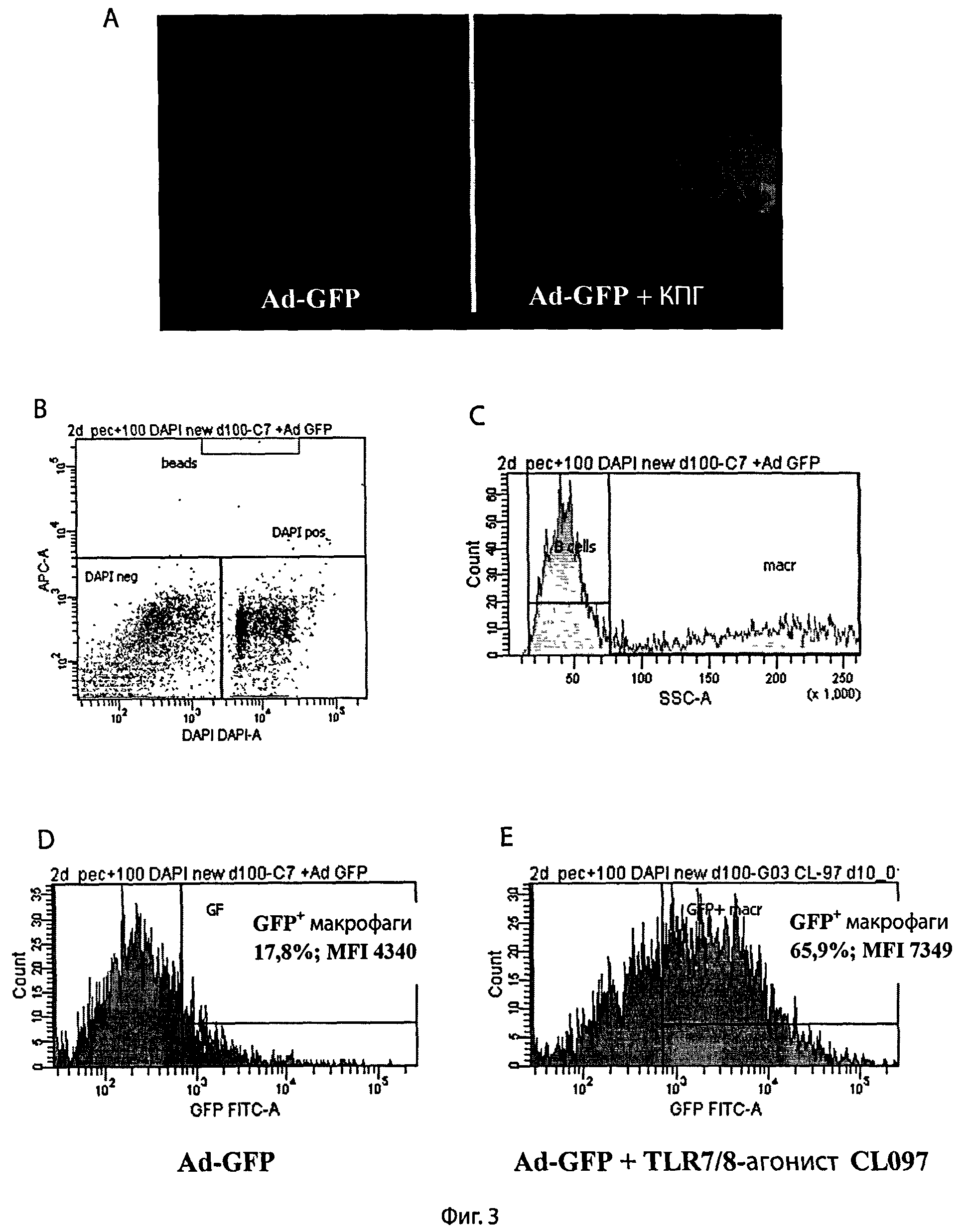
Фиг.3 - Анализ методами конфокальной микроскопии и проточной цитометрии усиления экспрессии трансгена Ad-GFP в перитонеальных макрофагах под влиянием агонистов PRR-рецепторов.
A - перитонеальные макрофаги трансдуцировали Ad-GFP (2×107 БОЕ/мл) в отсутствии (фото слева) или в присутствии агониста TLR4 (КПГ, 10 мкг/мл, фото справа).
B и C - последовательные стадии цитометрического выделения популяции живых макрофагов по светорассеянию и окрашиванию DAPI специфическим красителем ДНК.
D и E - анализ интенсивности GFP-флуоресценции перитонеальных макрофагов, трансдуцированных Ad-GFP (2×107 БОЕ/мл) в отсутствие (D) или в присутствии (E) агониста TLR7/8-рецепторов CL097 (2,5 мкг/мл).
Культуры клеток инкубировали при 37°C и 5% CO2 в течение 4 дней. По окончании инкубации клетки смывали холодным раствором Версена и с помощью проточного цитометра FACS Aria II определяли процент и абсолютное количество клеток, имеющих зеленую флуоресценцию, а также интенсивность флуоресценции клеток. Абсолютное содержание клеток нормировали по калибровочным шарикам с известной концентрацией (CountBright Invitrogen).
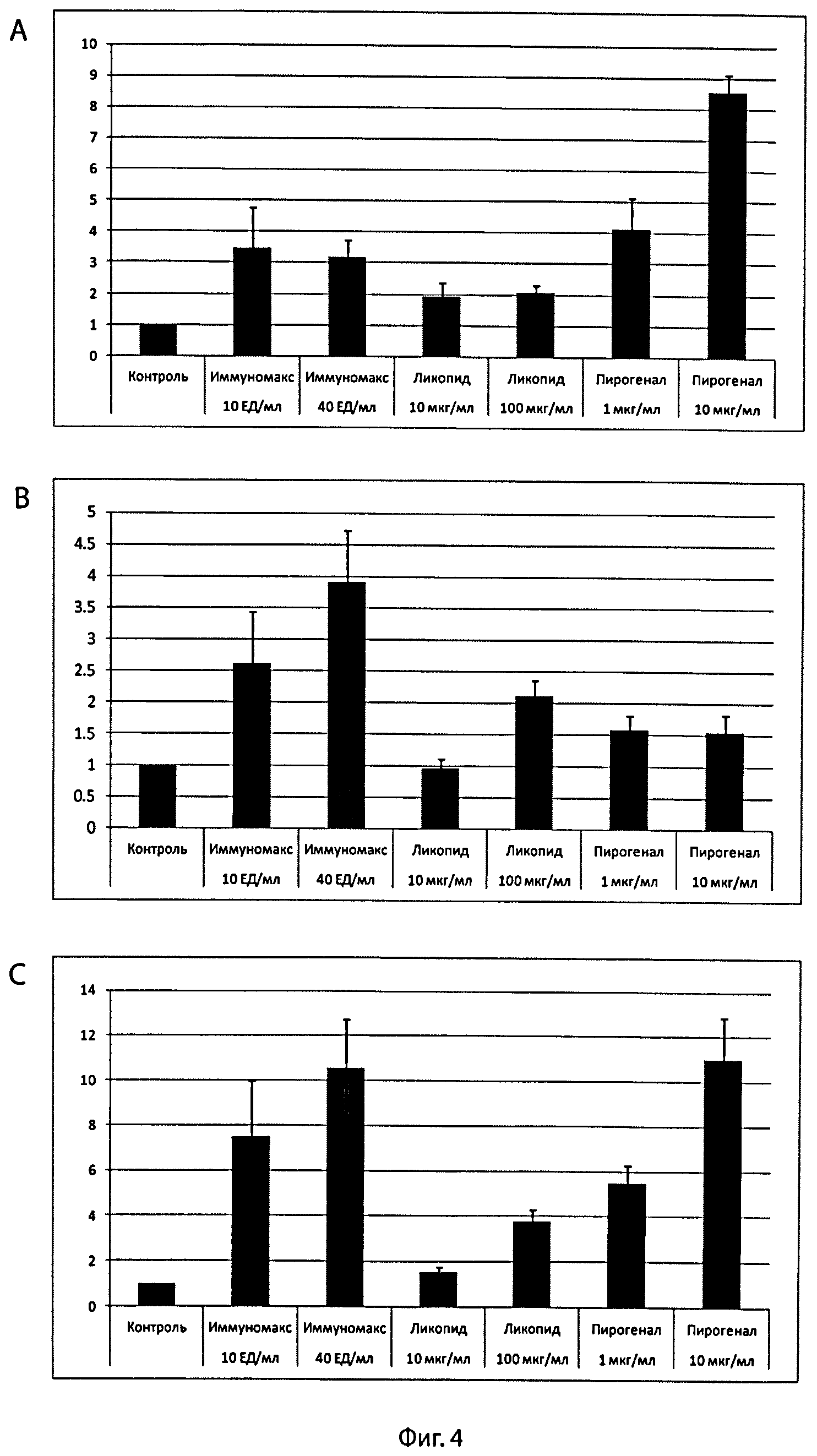
Фиг.4 - Повышение экспрессии целевого цитоплазматического белка GFP в перитонеальных макрофагах in vitro с помощью фармацевтических агонистов PRR-рецепторов.
Перитонеальные макрофаги мыши трансдуцировали Ad-GFP (2×105 БОЕ) без дополнительной активации (контроль) или при активации клеток одним из фармацевтических агонистов PRR-рецепторов, в частности лекарственными препаратами «Иммуномакс» (Рег. №Р N001919/02-171011) или «Пирогенал» (Р N003478/0), или «Ликопид» (ЛС-001438). Клетки инкубировали в полной культуральной среде 37°C и 5% CO2 в течение 2 суток. По окончании инкубации клетки смывали холодным раствором Версена и с помощью проточного цитометра FACS Aria II определяли количество макрофагов, имеющих зеленую флуоресценцию (A), и среднюю интенсивность флуоресценции (B). Интегральную флуоресценцию макрофагов (C) вычисляли как произведение числа флуоресцирующих клеток на среднюю интенсивность флуоресценции клеток. Данные нормированы на значения в контроле (Ad-GFP без дополнительной активации клеток).
Раскрытие изобретения
Задача, решаемая данным изобретением, состоит в значительном усилении экспрессии целевого трансгена и продукции целевого белка в эукариотических клетках как в условиях культуры клеток in vitro, так и в условиях организма человека и животных.
В качестве ДНК-векторов в данном изобретении использовали нереплицирующиеся рекомбинантные аденовирусные наночастицы (НРАН), кодирующие цитоплазматические, мембранные или секретируемые белки. ДНК-вектор экспрессировали в культурах следующих эукариотических клеток: первичные клетки селезенки, костного мозга, перитонеальной полости мышей, клетки костного мозга мыши, дифференцированные в культуре in vitro в присутствии гранулоцитарного-макрофагального колониестимулирующего фактора GM-CSF, фракция мононуклеарных клеток из крови человека. Анализ экспрессии трансгена зависел от использованного вектора. При использовании НРАН со вставкой гена зеленого флуоресцентного белка (Ad-GFP) анализ экспрессии проводили методами флуоресцентной и конфокальной микроскопии, а также проточной цитофлуориметрии. При использовании НРАН со вставкой генов гемагглютинина вирусов гриппа H1N1 (Ad-HA1), H3N2 (Ad-НА3) и В (Ad-HA-B) продукцию целевого белка анализировали методом цитофлуориметрии после окрашивания клеток моноклональным антителом, специфично связывающимся с белком НА. Экспрессию НРАН со вставкой гена секреторной эмбриональной щелочной фосфатазы (Ad-SEAP) определяли по секреции целевого белка SEAP, концентрацию которого измеряли колориметрическим методом по ферментативной активности SEAP.
Усиления экспрессии добивались с помощью агонистов PRR-рецепторов. Современные представления о PRR-рецепторах сводятся к наличию в клетках человека и животных нескольких семейств РАМР- и DAMP-распознающих рецепторов, позволяющих клеткам не только детектировать и реагировать на контакт практически с любым микроорганизмом или его компонентами, но также узнавать о повреждении собственных тканей организма и адекватно реагировать на эти повреждения.
К PRR-рецепторам относятся TLR (toll-like receptors), NLR (NOD-like receptors), RLR (RIG-like receptors) и некоторые другие семейства рецепторов [Mikayla R. Thompson, John J. Kaminski, Evelyn A. Kurt-Jones, and Katherine A. Fitzgerald. Pattern Recognition Receptors and the Innate Immune Response to Viral Infection. // Viruses, 2011 June; 3(6): 920-940. Takeuchi O, Akira S. Pattern recognition receptors and inflammation. // Cell, 2010 Mar 19; 140(6):805-20]. Детально описаны внутриклеточные сигнальные пути, начинающиеся с активации PRR-рецепторов и завершающиеся активацией NF-kB, AP-1, IRF и других транскрипционных факторов, которые управляют экспрессией определенных групп генов и последующей продукцией кодируемых этими генами белков.
В представленных ниже примерах 4, 5, 6, 7, 8, 9 и 10 продемонстрировано, что повышение экспрессии целевого трансгена достигается при воздействии на широкий спектр PRR-рецепторов из класса TLR рецепторов, выбранных из списка: TLR2, TLR4, TLR5, TLR7, TLR8 и TLR9, а также из класса NLR, в частности, NOD1- и NOD2-рецепторов.
Усиления экспрессии целевого белка GFP добивались с помощью следующих естественных агонистов PRR-рецепторов или их синтетических аналогов:
лигандов TLR2 - липотейхоиевой кислоты (ЛТК) и липопептида (Lipopeptide, Lot A11, ЕМС microcollections, GMBH);
лигандов TLR4 - липополисахарида (ЛПС) из E. coli серотип 055: В5 (Sigma L-2880) и кислого пептидогликана с молекулярной массой 1200-40000 КД (КПГ, патент РФ №2195308);
лиганда TLR5 - флагеллина (Invivogen);
лигандов TLR7 и TLR8 - имиквимода и CL097 (производное имидазохинолина, Invivogen);
лигандов TLR9 - CpG-олигонуклеотидов ODN 1826 и ODN 2006 (Invivogen).
В примере 4 продемонстрировано, что повышение экспрессии целевого трансгена достигается при воздействии через класс NOD-рецепторов с помощью:
лиганда NOD1-рецептора C12-iE-DAP (Lauroyl-g-D-Glu-D-mDAP и Lauroyl-g-D-Glu-L-mDAP, являющиеся синтетическими фрагментами бактериального пептидогликана, Invivogen) и
лиганда NOD2-рецептора L18-MDP (производное мурапилдипептида, являющегося синтетическим фрагментом бактериального пептидогликана, Invivogen).
Отличительной особенностью данного изобретения является возможность использования эффекта усиления продукции целевого трансгена in vivo и, что особенно ценно, при использовании фармацевтических агонистов PRR-рецепторов.
В приведенном примере 10 продемонстрировано усиление экспрессии целевого белка с помощью фармацевтических агонистов рецепторов:
TLR4, в частности, лекарственного препарата «Иммуномакс» (Рег. №Р N001919/02-171011, Иммафарма, Россия) и лекарственного препарата «Пирогенал» (Р N003478/0, Медгамал, филиал ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН, Россия), а также агониста рецепторов NOD2 лекарственного препарата «Ликопид» (ЛС-001438, ЗАО ПЕПТЕК, Россия).
Наличие положительного эффекта по усилению экспрессии целевого белка не только при использовании агонистов PRR-рецепторов, но и при использовании цитокинов было продемонстрировано на примере ФНО-α (пример 6).
В примерах 6, 7, 8 продемонстрировано повышение экспрессии секреторного белка, для чего использовали ДНК-вектор со вставкой гена SEAP.
В примере 9 продемонстрировано повышение экспрессии целевых мембранных белков, для чего использовали ДНК-векторы со вставкой гена гемагглютинина вирусов гриппа Н1М1, H3N1, или B.
Реализация изобретения была продемонстрирована на клетках мыши (примеры 4, 5, 6, 7, 8 и 10) и человека (пример 9). В примере 8 продемонстрировано усиление экспрессии трансгена и продукции целевого белка в условиях живого организма, в частности у лабораторных мышей, что не ограничивает распространения изобретения у других животных и человека.
Далее приведены примеры, раскрывающие наиболее предпочтительные воплощения данного изобретения с целью лучшего пояснения его сущности.
Примеры реализации изобретения
Пример 1. Создание плазмидных конструкций, кодирующих цитоплазматический, секретируемый или мембранный белок.
В качестве ДНК-вектора используют НРАН на основе аденовируса человека 5-го серотипа.
Для получения НРАН на первом этапе создают плазмидные конструкции, несущие экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют цитоплазматический белок GFP, секретируемый белок SEAP, мембранные белки HA1, HA3 или HA-B. Таким образом, получают плазмидные конструкции pShuttle-CMV-GFP, pShuttle-CMV-SEAP, pShuttle-CMV-HAI, pShuttle-CMV-HA3, pShuttle-CMV-HA-B.
Для получения плазмидных конструкций pShuttle-CMV-GFP, pShuttle-CMV-SEAP, pShuttle-CMV-HAI, pShuttle-CMV-НА3, pShuttle-CMV-HA-В в качестве вектора используют плазмидную конструкцию pShuttle-CMV с участками генома аденовируса человека 5-го серотипа для получения нереплецирующихся рекомбинантных аденовирусных наночастиц, входящую в набор к системе «AdEasy Adenoviral vector system» («Stratagene» Cat. No 240009). Плазмидную конструкцию pShuttle-CMV гидролизуют по сайту для эндонуклеазы рестрикции EcoRV, а затем осуществляют вставку нуклеотидных последовательностей, которые кодируют белок GFP, SEAP, HA1, HA3 или НА-B, соответственно, получают конструкции pShuttle-CMV-GFP, pShuttle-CMV-SEAP, pShuttle-CMV-HAI, pShuttle-CMV-НА3 или pShuttle-CMV-HA-B. Нуклеотидные последовательности цитоплазматического белка GFP, секретируемого белка SEAP, мембранных белков HA1, HA3 и HA-B для вставки в pShuttle-CMV получают путем гидролиза соответствующих плазмидных конструкций pGREEN (США, Carolina Biological Supply Company), pAL-SEAP, pAL-HA1, pAL-НА3 и pAL-HA-B (химический синтез, Россия, Евроген) по сайтам для эндонуклеазы рестрикции Ase I (pGREEN), EcoRV (pAL-SEAP, pAL-HA1, pAL-НА3 и pAL-HA-B). Наличие генов белков GFP, SEAP, HA1, HA3, НА-B в составе соответствующих плазмидных конструкций pShuttle-CMV-GFP, pShuttle-CMV-SEAP, pShuttle-CMV-HAI, pShuttle-CMV-НА3, pShuttle-CMV-HA-B подтверждают рестрикционным анализом при использовании эндонуклеазы EcoRI, NotI и EcoRV и методом ПЦР.
Таким образом, получают плазмидные конструкции pShuttle-CMV-GFP, pShuttle-CMV-SEAP, pShuttle-CMV-HAI, pShuttle-CMV-НА3, pShuttle-CMV-HA-B, несущие экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют цитоплазматический белок GFP, секретируемый белок SEAP, мембранные белки HA1, HA3 или НА-B, которые в дальнейшем используют для получения НРАН.
Пример 2. Получение и тестирование нереплицирующихся рекомбинантных аденовирусных наночастиц со вставками генов целевых белков GFP, SEAP, HA1, HA3 или НА-B.
Получение нереплицирующихся рекомбинантных аденовирусных наночастиц Ad-GFP, Ad-SEAP, Ad-HA1, Ad-НА3 и Ad-HA-В, несущих экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют цитоплазматический белок GFP, секретируемый белок SEAP, мембранные белки НА1, НА3 или НА-В, соответственно, проводят согласно методике «AdEasy Adenoviral vector system» (Stratagene, Cat. No 240009), в основе которой лежит гомологичная рекомбинация участков генома аденовируса в клетках E. coli. Наличие генов GFP, SEAP, HA1, HA3 и НА-B в составе соответствующих НРАН подтверждают методом ПЦР. Далее определяют титры НРАН Ad-GFP, Ad-SEAP, Ad-HA1, Ad-НА3 и Ad-HA-B методом бляшко-образования на культуре клеток НЕК293 (клетки эмбриональной почки человека) [Graham F.L., Prevec L. Manipulation of adenovirus vectors. // Methods in Mol. Biol., 1991, v.7, p.109-127].
Экспрессию полученных ДНК-векторов и продукцию соответствующих целевых белков проверяли в культуре клеток линии А549. Экспрессию цитоплазматического целевого белка GFP определяли с помощью инвертированного флуоресцентного микроскопа (ICM-405, Leitz) и с помощью метода проточной цитофлуориметрии на приборе FACS Aria II (BD Biosceinces).
Экспрессию секреторного целевого белка SEAP определяли по методу Berger (Berger J., Hauber J., Hauber R., Geiger R., Cullen B.R. Secreted placental alkaline phosphatase: a powerful new quantitative indicator of gene expression in eukaryotic cells. // Gene, 1988 Jun 15; 66 (1):1-10) с незначительными модификациями. Аликвоту тестируемой жидкости осветляли центрифугированием 14000 g в течение 2 мин, прогревали при 65°C в течение 5 мин для ингибирования эндогенных фосфатаз, вносили 20 мкл в лунки 96-луночного планшета в 130 мкл реакционного буфера (0,5 М NaHCO3, 0,5 мМ MgCl2, pH 9,8) и инкубировали при 37°C 10 мин. Затем добавляли 50 мкл 60 мкМ пара-нитрофенил фосфата в реакционном буфере и через фиксированные интервалы времени измеряли оптическую плотность на длине волны 405 нм. Активность SEAP выражали в мЕд/мл из расчета, что 1 мЕд/мл соответствует увеличению оптической плотности 0,04 ед. в 1 минуту.
Экспрессию мембранных целевых белков HA1, HA3 и НА-B определяли с помощью окрашивания клеток моноклональными антителами к HA1, HA3 и НА-B, соответственно, с последующим анализом методом проточной цитофлуориметрии на приборе FACS Aria II (BD Biosceinces).
Таким образом были получены ДНК-векторы - НРАН (Ad-GFP, Ad-SEAP, Ad-HA1, Ad-НА3 и Ad-HA-B), несущие экспрессирующие кассеты, содержащие нуклеотидные последовательности, которые кодируют цитоплазматический белок GFP, секретируемый белок SEAP, мембранные белки HA1, HA3 или НА-B, соответственно, а также подтверждена экспрессия соответствующих белков.
Пример 3. Кислый пептидогликан с молекулярной массой 1200-40000 КД (по патенту РФ №2195308) и фармацевтический препарат «Иммуномакс» (Р N001919/02) являются агонистами TLR4.
Для идентификации рецепторов, с которыми взаимодействуют кислый пептидогликан (патент РФ №2195308) и фармацевтический препарат «Иммуномакс» (Р N001919/02), использовали коллекцию клеточных линий HEK-Blue (InvivoGen), стабильно экспрессирующих один из следующих TLR-рецепторов человека: TLR2, TLR4, TLR5, TLR7, TLR8 или TLR9. Все клеточные линии HEK-Blue имеют индуцибельный репортерный ген SEAP, находящийся под контролем NF-kB-зависимого промотора. Сигнал от TLR-рецептора в этих клеточных линиях приводит к секреции репортерного белка SEAP во внеклеточную среду. Исследование, проведенное с клетками HEK-Blue, экспрессирующими различные TLR, показало, что КПГ (патент РФ №2195308) и фармацевтический препарат «Иммуномакс» являются агонистами рецепторов TLR4. Оба эффектора активировали NF-kB-зависимую продукцию репортерного белка SEAP исключительно в клетках, экспрессирующих рецепторы TLR4 (фиг.1А, фиг.2). Активация TLR4-NF-/CB сигнального пути прямо зависела от концентрации агониста (фиг.1В, фиг.2).
Представленные данные доказывают, что КПГ (патент РФ №2195308) и фармацевтический препарат «Иммуномакс» (Р N001919/02) являются агонистами TLR4.
Пример 4. Повышение экспрессии целевого цитоплазматического белка GFP в перитонеальных макрофагах мыши in vitro с помощью агонистов PRR-рецепторов из классов TLR- и NOD-рецепторов.
Перитонеальные макрофаги мыши (BALB/c самки, питомник «Столбовая») вымывали с помощью физиологического раствора, осаждали центрифугированием 1200 об/мин - 10 мин, суспензировали в концентрации 1 млн клеток в 1 мл полной культуральной среды (ПС, состоит из RMPI-1640 с добавлением 10% эмбриональной телячьей сыворотки, 2 mM L-глютамина, 50 мкМ β-меркаптоэтанола и 10 мкг/мл гентамицина), инкубировали ночь в чашках Петри диаметром 90 мм при 37°C и 5% CO2. На следующий день не прилипшие клетки смывали теплым фосфатным буферным раствором (PBS, pH 7,4), прилипшие макрофаги заливали раствором Версена, выдерживали 60 мин в холодильнике при 4°С, а затем смывали струей раствора Версена из 5 мл пипетки. Макрофаги осаждали центрифугированием 1200 об/мин - 10 мин, суспензировали в ПС и инкубировали в лунках 96-луночного планшета в концентрации 0,1 млн/мл в объеме 200 мкл на лунку в триплетах с добавлением 2×107БОЕ/мл Ad-GFP (полученных как в примере 2) в сочетании с агонистами TLR и NOD рецепторов или без них (контроль). Планшеты с клетками инкубировали в течение 4 дней при 37°C и 5% CO2. В таблице 1 представлены использованные в работе агонисты рецепторов TLR и NOD с указанием их конечной концентрации in vitro.
На фиг.3А приведена фотография макрофагов, полученная при конфокальной микроскопии клеток, трандуцированных Ad-GFP с дополнительной активацией агонистом TLR4 (10 мкг/мл КПГ, правая фотография), в сравнении с контрольными макрофагами, трансдуцированными Ad-GFP без добавления КПГ (левая фотография). Отчетливо видно усиление интенсивности флуоресценции в клетках, дополнительно стимулированных КПГ, что свидетельствует об усилении синтеза целевого белка GFP. Для количественного анализа продукции GFP использовали метод проточной цитометрии, который позволяет определить как абсолютное число клеток, содержащих флуоресцирующий белок GFP, так и содержание флуоресцирующего белка в каждой клетке по интенсивности флуоресценции отдельной клетки. Произведение числа светящихся клеток на интенсивность флуоресценции каждой клетки пропорционально количеству синтезированных молекул GFP.
Как описано выше, перитонеальные макрофаги трансдуцировали Ad-GFP (2×107 БОЕ/мл) в отсутствие или в присутствии одного из указанных агонистов PRR-рецепторов. Культуры клеток инкубировали при 37°C и 5% CO2 в течение 4 дней. По окончании инкубации клетки смывали холодным раствором Версена и с помощью проточного цитометра FACS Aria II определяли процент и абсолютное количество клеток, имеющих зеленую флуоресценцию, а также интенсивность флуоресции клеток. Абсолютное содержание клеток нормировали по калибровочным шарикам с известной концентрацией (CountBright Invitrogen), живые и мертвые клетки разделяли с помощью ДНК-специфического красителя DAPI. На фиг.3B и фиг.3C показаны стадии цитометрического выделения живых клеток и макрофагов. Представлены характерные гистограммы сигнала флуоресценции GFP после трансдукции макрофагов Ad-GFP без дополнительной активации клеток - фиг.3D или с использованием дополнительной активации клеток CL097, агонистом рецепторов TLR7 и TLR8 - фиг.3E.
Количественную оценку усиления экспрессии целевого белка GFP проводили по формуле:
где:
K - кратность усиления экспрессии GFP;
MFI - средняя интенсивность флуоресценции трансдуцированных Ad-GFP клеток при их дополнительной активации агонистом;
MFIcontr - средняя интенсивность флуоресценции трансдуцированных Ad-GFP клеток в контроле без дополнительной активации;
N - число флуоресцирующих клеток после трансдукции Ad-GFP с дополнительной активацией агонистом;
Ncontr - число флуоресцирующих клеток в контроле после трансдукции Ad-GFP без дополнительной активации.
Данные, представленные в таблице 2, показывают, что усиление экспрессии GFP в перитонеальных макрофагах, трансдуцированных Ad-GFP, происходило под влиянием агонистов различных PRR-рецепторов, выбранных из классов TLR- и NOD-рецепторов, в частности, агонистов TLR2 (липопептид, липотейхойевая кислота), TLR4 (КПГ, липополисахарид), TLR5 (флагеллин), TLR7/8 (CL097, имиквимод), TLR9 (CpG 2006, ODN 1826), NOD-1 (C12-iE-DAP) nNOD-2(L18-MDP).
Пример 5. Повышение экспрессии целевого цитоплазматического белка GFP in vitro в дендритных клетках мыши костномозгового происхождения с помощью агониста TLR4.
Клетки костного мозга мыши (BALB/c самки, питомник «Столбовая») вымывали из бедренных и большеберцовых костей с помощью физиологического раствора, эритроциты лизировали с помощью гипотонического шока (15 секунд в дистиллированной воде), осмотичность мгновенно восстанавливали, внося необходимое количество 10-кратного раствора Хэнкса, клетки осаждали центрифугированием 1200 об/мин - 10 мин, суспензировали в ПС в концентрации 1 млн/мл и инкубировали в чашках Петри диаметром 90 мм в присутствии 20 нг/мл ростового фактора GM-CSF. Через 3-4 суток культуральную среду заменяли на свежую ПС, дополненную GM-CSF. Через 7 дней смывали неприлипшие клетки, суспензировали их в ПС и инкубировали в лунках 96-луночного планшета в концентрации 0,1 млн/мл в объеме 200 мкл на лунку в триплетах с добавлением 2×107 БОЕ/мл Ad-GFP, полученных как в примере 2, в сочетании с добавлением 5 мкг/мл КПГ (RU №2195308) или без него. Через 2 суток после внесения Ad-GFP клетки смывали холодным раствором Версена и определяли процент флуоресцирующих клеток с помощью проточного цитометра FACS Aria II. Результаты представлены в таблице 3. Экспрессия целевого белка GFP в костномозговых дендритных клетках усиливалась в 5 раз при их активации КПГ (RU №2195308).
Пример 6. Повышение экспрессии целевого секреторного белка эмбриональной щелочной фосфатазы в перитонеальных макрофагах мыши in vitro с помощью цитокина ФНО-α.
Перитонеальные макрофаги мыши получали и инкубировали, как описано в примере 4. Клетки инкубировали в триплетах с добавлением Ad-SEAP в концентрации 2×107БОЕ на лунку вместе с ФНО-α (10 нг/мл) или КПГ (RU №2195308, 10 мкг/мл). В контрольные лунки вносили Ad-SEAP (2×107 БОЕ) без добавления активаторов. Через 4 суток в культуральной жидкости измеряли активность секретируемой щелочной фосфатазы SEAP, как описано в примере 2. В присутствии ФНО-α экспрессия секреторного целевого белка SEAP усиливалась в 1,8 раза (таблица 4).
Пример 7. Повышение экспрессии целевого секретируемого белка SEAP in vitro в дендритных клетках мыши костномозгового происхождения с помощью агониста TLR4.
Дендритные клетки мыши костномозгового происхождения получали, как описано в примере 5. Суспензию дендритных клеток в ПС инкубировали в лунках 96-луночного планшета в концентрации 0,1 млн/мл в объеме 200 мкл на лунку в триплетах с добавлением 2×107 БОЕ Ad-SEAP, полученных, как в примере 2, в сочетании с КПГ (RU №2195308, 5 мкг/мл) или без него. Через 6 суток в культуральной среде измеряли активность секретируемой фосфатазы SEAP, как описано в примере 2. При активации дендритных клеток агонистом TLR4 (КПГ, Патент РФ №2195308) экспрессия SEAP усиливалась в 6 раз (таблица 5).
Пример 8. Повышение экспрессии трансгена секреторного белка SEAP в организме лабораторных мышей in vivo с помощью фармацевтического агониста TLR4 («Иммуномакс»).
Ad-SEAP получали, как в примере 2, вводили в дозе 108БОЕ на мышь в 200 мкл физиологического раствора в перитонеальную полость мышам BALB/c (самки, 14-16 граммов, питомник РАМН «Столбовая») вместе с 10 мкг лекарственного препарата «Иммуномакс» (Иммафарма, Россия) или без него. Через 3 суток индивидуально у каждой мыши забирали кровь из ретроорбитального синуса, получали сыворотку крови, в которой определяли активность SEAP, как описано в примере 2. Введение «Иммуномакса» усиливало экспрессию SEAP в 7 раз (таблица 6). При этом не было отмечено каких-либо нежелательных (токсических) явлений у животных, получавших лекарственный препарат «Иммуномакс» в сочетании с Ad-SEAP. Этот результат доказывает возможность усиления экспрессии трансгена у животных и человека с помощью фармацевтического агониста рецепторов TLR4 лекарственного препарата «Иммуномакс».
Пример 9. Повышение экспрессии трансгенов целевых мембранных белков HA1, HA3 и НА-B в культуре клеток человека in vitro с помощью агониста TLR4.
Кровь из локтевой вены здоровых доноров забирали в пробирки с KsEDTA BD Vacutainer и выделяли мононуклеарную фракцию, для этого кровь разводили в 2 раза физиологическим раствором и наслаивали на фиколл с плотностью 1,077 г/л (ПанЭко, Россия), центрифугировали 25 мин при 400 g при температуре 20°C. Фракцию, содержащую мононуклеарные клетки, собирали в 15 мл пробирку, клетки отмывали в растворе PBS (с добавлением 0,5% БСА, 1% глюкозы, 10 мМ HEPES, pH 7,4). Клетки суспензировали в концентрации 3 млн в 1 мл ПС, разливали по 0,5 мл в лунки 24-луночного планшета Nunclon в дуплетах. Затем в культуры вносили один из векторов Ad-HA1, Ad-НА3 или Ad-HA-B (по 5×106 БОЕ) вместе с 5 мкг/мл КПГ (RU №2195308) или без него. Планшет инкубировали 2 суток при 37°C в атмосфере 5% CO2. Через 2 суток клетки из лунок собирали раствором Версена, переносили в 15 мл пробирки и осаждали центрифугированием. Клеточный осадок окрашивали с помощью моноклональных антител против гемагглютинитов HA1, HA3 или НА-B (SinoBiological) в течение 20 мин, отмывали раствором PBS (с добавлением 0,5% BSA, 0,01% азида натрия, 0,35 мМ ЭДТА, 10 мМ HEPES, pH 7,4). Связавшиеся с НА антитела выявляли с помощью меченых FITC Fab-фрагментов антител к мышиным IgG. Клетки отмывали раствором PBS (с добавлением 0,5% BSA, 0,01% азида натрия, 0,35 мМ ЭДТА, 10 мМ HEPES, рН 7,4), моноциты окрашивали с помощью антител CD14 PE-Cy7 (BD Biosceinces). На проточном цитофлуориметре FACS Aria II определяли процент клеток, экспрессирующих НА, в популяции CD14-позитивных клеток. При активации клеток КПГ (RU №2195308) экспрессия мембранных целевых белков HA1, HA3 и НА-B усиливалась в 1,75-4,1 раза (таблица 7).
Пример 10. Повышение экспрессии трансгена целевого цитоплазматического белка GFP в перитонеальных макрофагах мыши in vitro с помощью фармацевтических агонистов PRR из классов TLR- и NOD-рецепторов.
Перитонеальные макрофаги мыши получали и инкубировали, как описано в примере 4. Клетки инкубировали в триплетах, трансдуцировали вектором Ad-GFP в концентрации 5×106 БОЕ/мл. Для активации макрофагов в культуры клеток вносили фармацевтические агонисты рецепторов TLR4, в частности лекарственный препарат «Иммуномакс» (Рег. №Р N001919/02-171011, Иммафарма, Россия) или лекарственный препарат «Пирогенал» (Р N003478/0, Медгамал, филиал ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН, Россия), или фармацевтический агонист NOD-рецепторов - лекарственный препарат «Ликопид» (ЛС-001438, ЗАО ПЕПТЕК, Россия). Контролем служили культуры трансдуцированных макрофагов без добавления активаторов. Через 2 суток оценивали экспрессию целевого белка GFP, как описано в примере 4. На рисунке 4 представлены результаты экспериментов. Они доказывают, что все использованные нами лекарственные препараты - фармацевтические агонисты PRR - вызывают значительное усиление экспрессии целевого трансгена. При стимуляции клеток фармацевтическими агонистами PRR продукция целевого белка усиливалась от 2 до 11 раз. Эффект усиления зависел от дозы агониста. Этот результат означает, что усиление экспрессии трансгена можно осуществлять у человека с помощью лекарственных (фармацевтических) препаратов, активирующих трансдуцированные клетки через рецепторы PRR.
Все перечисленные примеры подтверждают, что поставленная техническая задача, а именно разработка композиции для усиления экспрессии трансгена в эукариотических клетках и способа увеличения продукции целевого белка, кодируемого трансгеном, а также обеспечение возможности применения композиции и способа как в культуре клеток in vitro, так и in vivo в живом организме - реализована в данном изобретении.
Список сокращений
PRR (от англ. pattern recognition receptors) - клеточные рецепторы для распознавания молекулярных образов, ассоциированных с микробами, вирусами, клеточным стрессом и повреждением.
TLR (от англ. Toll-like receptors) - Toll-подобные клеточные рецепторы, относящиеся к PRR
NOD-рецепторы (от англ. nucleotide-binding oligomerization domain-containing receptors) - клеточные рецепторы, относящиеся к PRR.
NLR (от англ. NOD-like receptors) - рецепторы, подобные NOD, относятся к PRR
RLR (от англ. RIG-like receptors) - рецепторы, подобные RIG, относятся к PRR
РАМР (от англ. pathogen associated molecular patterns) - молекулярные образы, ассоциированные с микробами и вирусами
DAMP (от англ. damage-associated molecular patterns) - молекулярные образы, ассоциированные с повреждением
НРАН - нереплицирующиеся рекомбинантные аденовирусные наночастицы
GM-CSF - гранулоцитарный-моноцитарный колониестимулирующий фактор
GFP - зеленый флуоресцентный белок
Ad - НРАН на основе аденовируса 5 типа
Ad-GFP - НРАН со вставкой гена GFP
НА1 - гемагглютинин вируса гриппа H1N1
НА3 - гемагглютинин вируса гриппа H3N2
НА-В - гемагглютинин вируса гриппа B
Ad-HA1 - НРАН со вставкой гена HA1
Ad-НА3-НРАН со вставкой гена HA3
Ad-HA-B - НРАН со вставкой гена НА-B
SEAP - секреторная эмбриональная щелочная фосфатаза
Ad-SEAP - НРАН со вставкой гена SEAP
ЛТК - липотейхоиевая кислота, компонента бактериальной стенки
ЛПС - липополисахарид, компонента бактериальной стенки
КПГ - кислый пептидогликан
CL097 - производное имидазохинолина
ODN - олигонуклеотид
C12-iE-DAP - Lauroyl-g-D-Glu-D-mDAP и Lauroyl-g-D-Glu-L-mDAP, синтетические фрагменты бактериального пептидогликана
L18-MDP - производное мурамилдипептида
ПЦР - полимеразная цепная реакция
ПС - полная среда для культивирования клеток
PBS - фосфатный буферный раствор
БОЕ - бляшко-образующие единицы
ФНО - фактор некроза опухоли
БСА - бычий сывороточный альбумин
FITC - изотиоцианат флуоресцеина
ЭДТА - этилендиамин тетраацетат
FACS - проточный цитофлуориметр
Литература
1. Dorokhov Y.L., Skulachev M.V., Ivanov P.A., Zvereva S.D., Tjulkina L.G., Merits A., Gleba Y.Y., Hohn T., Atabekov J.G. Polypurine (A)-rich sequences promote cross-kingdom conservation of internal ribosome entry // Proc. Natl. Acad. Sci. USA, 2002, v.99, p.5301-5306.
2. Lee Y.B., Glover C.P., Cosgrave A.S., Bienemann A., Uney J.B. Optimizing regulatable gene expression using adenoviral vectors. // Exp Physiol., 2005 Jan; 90(1):33-37.
3. Li Z.L., Tian P.X., Xue W.J., Wu J. Co-expression of sCD40Llg and CTLA4lg mediated by adenovirus prolonged mouse skin allograft survival. - J Zhejiang Univ Sci B, 2006 Jun; 7(6):436-44.
4. US 20080241883 A1 Recombinant expression vector elements (rEVEs) for enhancing expression of recombinant proteins in host cells.
5. WO 2008000445 Expression vector(s) for enhanced expression of a protein of interest in eukaryotic or procariotic host cells.
6. Siavoshian S., J-P. Segain, M. Kornprobst, C. Bonnet, C. Cherbut, J-P. Galmiche, H.M. Blottierea. Butyrate and trichostatin A effects on the proliferation/differentiation of human intestinal epithelial cells: induction of cyclin D3 and p21 expression. // Gut, 2000; 46:507-514.
7. RU 2443779 Способ получения препарата рекомбинантного аденовируса, характеризующегося сниженным коэффициентом соотношения физических и инфекционных вирусных частиц, и генно-терапевтический лекарственный препарат, полученный таким способом.
8. US 20080311095 Methods and compositions for increased transgene expression (прототип).
9. Mikayla R. Thompson, John J. Kaminski, Evelyn A. Kurt-Jones, and Katherine A. Fitzgerald. Pattern Recognition Receptors and the Innate Immune Response to Viral Infection. // Viruses, 2011 June; 3(6):920-940.
10. Takeuchi O., Akira S. Pattern recognition receptors and inflammation. // Cell, 2010 Mar 19; 140(6):805-20.
11. Graham F.L., Prevec L. Manipulation of adenovirus vectors. // Methods in Mol. Biol., 1991, v.7, p.109-127.
12. Berger J., Hauber J., Hauber R., Geiger R., Cullen B.R. Secreted placental alkaline phosphatase: a powerful new quantitative indicator of gene expression in eukaryotic cells. // Gene, 1988 Jun 15; 66(1):1-10.
13. US 6019978 Replication-defective adenovirus human type 5 recombinant as a vaccine carrier.
Реферат
Изобретение относится к области биохимии, в частности к композициям для интенсивной продукции целевого белка в эукариотических клетках, включающим ДНК-вектор со вставкой гена целевого белка и агонист клеточных рецепторов. Также изобретение относится к способам увеличения продукции целевого белка, кодируемого трансгеном, в эукариотических клетках с использованием вышеуказанных композиций. Изобретение позволяет эффективно увеличивать продукцию целевого белка в эукариотических клетках. 4 н. и 24 з.п. ф-лы, 4 ил., 7 табл., 10 пр.

Комментарии