Улучшенные композиции на основе t-клеток - RU2719030C2
Код документа: RU2719030C2
Чертежи




Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет в соответствии с § 119(e) раздела 35 Свода федеральных законов США на основании предварительной заявки на патент США № 62/008957, поданной 6 июня 2014 года, которая включена в данный документ посредством ссылки во всей своей полноте.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область техники
Настоящее изобретение относится к улучшенным композициям на основе T-клеток и способам производства T-клеток. Более конкретно, настоящее изобретение относится к способам производства T-клеток, которые приводят к средствам адоптивной T-клеточной иммунотерапии с улучшенным выживанием, размножением и персистенцией in vivo.
Описание предшествующего уровня техники
Адоптивная иммунотерапия представляет собой перенос T-лимфоцитов субъекту для терапии заболевания. Потенциал адоптивной иммунотерапии для лечения широкого спектра заболеваний, таких как рак, инфекционное заболевание, аутоиммунное заболевание, воспалительное заболевание и иммунодефицит, еще не реализован. Однако, для большинства, если не для всех, стратегий адоптивной иммунотерапии необходимы стадии активации и размножения T-клеток для получения клинически эффективной терапевтической дозы Т-клеток. Современные технологии получения терапевтических доз Т-клеток, в том числе разработанных Т-клеток, остаются ограниченными за счет затруднительных производственных процессов для получения T-клеток. Например, для размножения T-клеток зачастую требуются трудоемкое и дорогостоящее клонирование и/или несколько раундов активации/размножения, чтобы достичь терапевтически значимые количества T-клеток. Кроме того, существующие способы активации/размножения T-клеток обычно сочетаются с существенной дифференцировкой T-клеток и обычно приводят к краткосрочным эффектам, в том числе краткосрочному выживанию и отсутствию персистенции и отсутствию in vivo размножения перенесенных T-клеток. Таким образом, в существующих производственных процессах для получения T-клеток производится низкокачественный T-клеточный продукт, который подвержен истощению и потере функций эффекторных иммунных клеток.
До настоящего времени, клиническая эффективность средств адоптивной иммунотерапии на основе разработанных T-клеток ограничена вследствие слабого размножения и персистенции T-клеток после инфузии пациентам. Таким образом, такие средства терапии не подходят для широко распространенного клинического применения. В соответствии с этим, существует постоянная, неудовлетворенная потребность в улучшениях производства T-клеток и терапевтических композиций на основе T-клеток, которые способны выживать, размножаться и персистировать in vivo.
КРАТКОЕ ОПИСАНИЕ
В настоящем изобретении в целом предусмотрены средства адоптивной T-клеточной иммунотерапии, содержащие персистирующие и высокоактивные противоопухолевые композиции на основе T-клеток, и способы их получения.
Настоящее изобретение относится к улучшенным композициям на основе T-клеток и способам производства T-клеток. Более конкретно, настоящее изобретение относится к способам производства T-клеток, которые приводят к улучшенному выживанию, размножению и персистенции in vivo.
В различных вариантах осуществления предусмотрен способ производства T-клеток, включающий: (a) выделение популяции T-клеток, например, проникающих в опухоль цитотоксических T-лимфоцитов (TIL), из субъекта; (b) активацию популяции T-клеток и стимуляцию популяции T-клеток к пролиферации, где стадии активации и стимуляции выполняют в присутствии ингибитора пути AKT/mTOR; (c) культивирование T-клеток для пролиферации; где стадии активации и стимуляции, выполняемые в присутствии ингибитора пути PI3K/AKT/mTOR, приводят к поддержанию пролиферации T-клеток по сравнению с пролиферацией T-клеток, которые подвергались активации и стимуляции в отсутствие ингибитора пути PI3K/AKT/mTOR.
В различных вариантах осуществления предусмотрен способ производства T-клеток, включающий: (a) активацию популяции T-клеток и стимуляцию популяции T-клеток для пролиферации, где стадии активации и стимуляции выполняют в присутствии ингибитора пути AKT/mTOR; (b) трансдукцию T-клеток с помощью вирусного вектора, содержащего разработанный T-клеточный рецептор (TCR) или химерный антигенный рецептор (CAR); (c) культивирование трансдуцированных T-клеток для пролиферации; где стадии активации и стимуляции, выполняемые в присутствии ингибитора пути PI3K/AKT/mTOR, приводят к поддержанию пролиферации трансдуцированных T-клеток по сравнению с пролиферацией трансдуцированных T-клеток, которые подвергались активации и стимуляции в отсутствие ингибитора пути PI3K/AKT/mTOR.
В конкретных вариантах осуществления способы, рассмотренные в данном документе, включают выделение мононуклеарных клеток периферической крови в качестве источника T-клеток.
В определенных вариантах осуществления активация T-клеток включает приведение T-клеток в контакт с антителом к CD3 или его CD3-связывающим фрагментом.
В дополнительных вариантах осуществления стимуляция T-клеток включает приведение T-клеток в контакт с антителом к CD28 или его CD28-связывающим фрагментом, B7-1 или его CD28-связывающим фрагментом или B7-2 или его CD28-связывающим фрагментом.
В некоторых вариантах осуществления клетки трансдуцируют с помощью вирусного вектора до пролиферации T-клеток.
В определенных вариантах осуществления клетки трансдуцируют с помощью вирусного вектора после пролиферации T-клеток.
В конкретных вариантах осуществления вектор представляет собой ретровирусный вектор.
В дополнительных вариантах осуществления вектор представляет собой лентивирусный вектор.
В других конкретных вариантах осуществления клетки содержат химерный антигенный рецептор (CAR).
В конкретных вариантах осуществления CAR содержит внеклеточный домен, который связывает антиген, выбранный из группы, включающей фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, CMV, EBV, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, HPV, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM и VEGFR2; трансмембранный домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD28, CD45, PD-1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD54 (ICAM), CD134 (OX40), CD137 (41BB), CD152 (CTLA4), CD273 (PD-L2), CD274 (PD-L1) и CD278 (ICOS); и домен передачи сигнала CD3ζ.
В дополнительных вариантах осуществления внеклеточный домен содержит антитело или антиген-связывающий фрагмент, которые связывают антиген.
В определенных вариантах осуществления трансмембранный домен получен из CD8α или CD28.
В дополнительных вариантах осуществления один или более доменов передачи костимулирующего сигнала выбраны из группы, включающей CD28, CD134 и CD137.
В дополнительных вариантах осуществления CAR содержит полипептид шарнирной области.
В конкретных вариантах осуществления полипептид шарнирной области содержит шарнирную область IgG1 или CD8α.
В конкретных вариантах осуществления CAR содержит сигнальный пептид.
В некоторых вариантах осуществления сигнальный пептид предусматривает сигнальный полипептид тяжелой цепи IgG1 или сигнальный полипептид CD8α.
В некоторых вариантах осуществления ингибитор пути PI3K/AKT/mTOR выбран из группы, включающей BEZ235, LY294002, GDC-0941, BYL719, GSK2636771, TGX-221, AS25242, CAL-101, IPI-145, MK-2206, GSK690693, GDC-0068, A-674563, CCT128930, AZD8055, INK128, рапамицин, PF-04691502, эверолимус, BI-D1870, H89, PF-4708671, FMK, AT7867, NU7441, PI-103, NU7026, PIK-75, ZSTK474 и PP-121.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой общий ингибитор PI3K, выбранный из группы, включающей BEZ235, LY294002 и GDC-0941.
В других конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой селективный ингибитор PI3K, выбранный из группы, включающей BYL719, GSK2636771, TGX-221, AS25242, CAL-101 и IPI-145.
В других конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой ингибитор PI3K, ZSTK474.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой общий ингибитор AKT, выбранный из группы, включающей MK-2206, GSK690693 и GDC-0068.
В дополнительных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой селективный ингибитор AKT1, A-674563.
В определенных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой селективный ингибитор AKT2, CCT128930.
В определенных вариантах осуществления ингибитор пути PI3K/AKT/mTOR ингибирует активацию AKT под действием DNA-PK.
В дополнительных вариантах осуществления ингибитор пути PI3K/AKT/mTOR ингибирует активацию AKT под действием PDK-1.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR ингибирует активацию AKT под действием mTORC2.
В дополнительных вариантах осуществления ингибитор пути PI3K/AKT/mTOR ингибирует активацию AKT под действием HSP.
В других конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой общий ингибитор mTOR, выбранный из группы, включающей AZD8055, INK128 и рапамицин.
В определенных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой селективный ингибитор mTORC1, выбранный из группы, включающей PF-04691502 и эверолимус.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой ингибитор s6-киназы, выбранный из группы, включающей BI-D1870, H89, PF-4708671, FMK и AT7867.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой ингибитор DNA-PK, выбранный из группы, включающей NU7441, PI-103, NU7026, PIK-75 и PP-121.
В некоторых вариантах осуществления популяция T-клеток, которых активировали и стимулировали в присутствии ингибитора пути PI3K/AKT/mTOR, характеризуется увеличенным количеством T-клеток, экспрессирующих один или более маркеров, выбранных из группы, включающей CD62L, CCR7, CD28, CD27, CD122 и CD127, по сравнению с популяцией T-клеток, которых активировали и стимулировали в отсутствие ингибитора пути PI3K/AKT/mTOR.
В дополнительных вариантах осуществления популяция T-клеток, которых активировали и стимулировали в присутствии ингибитора пути PI3K/AKT/mTOR, не экспрессирует CD57 или KLRG1 или экспрессирует меньшее количество CD57 или KLRG1 по сравнению с популяцией T-клеток, которых активировали и стимулировали в отсутствие ингибитора пути PI3K/AKT/mTOR.
В различных вариантах осуществления предусмотрен способ поддержания пролиферации и снижения дифференцировки повторно стимулированных T-клеток, экспрессирующих разработанный TCR или CAR, включающий (a) приведение всей или части популяции пролиферирующих T-клеток, содержащих разработанный TCR или CAR, в контакт с антителом к CD3 или его CD3-связывающим фрагментом и антителом к CD28 или его CD28-связывающим фрагментом, которое стимулирует вспомогательную молекулу CD28 на поверхности T-клеток, тем самым осуществляя повторную стимуляцию активированных T-клетки к пролиферации; где повторно стимулированные T-клетки характеризуются поддерживаемой пролиферацией и сниженной дифференцировкой по сравнению с пролиферацией T-клеток, которых стимулировали или повторно стимулировали в отсутствие ингибитора пути PI3K/AKT/mTOR.
В конкретных вариантах осуществления клетки содержат разработанный TCR.
В определенных вариантах осуществления клетки содержат CAR.
В других конкретных вариантах осуществления клетки содержат вирусный вектор, кодирующий разработанный TCR или CAR.
В дополнительных вариантах осуществления вектор представляет собой ретровирусный вектор.
В дополнительных вариантах осуществления вектор представляет собой лентивирусный вектор.
В конкретных вариантах осуществления CAR содержит внеклеточный домен, который связывает антиген, выбранный из группы, включающей фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM и VEGFR2; трансмембранный домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD28, CD45, PD-1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD54 (ICAM), CD134 (OX40), CD137 (41BB), CD152 (CTLA4), CD273 (PD-L2), CD274 (PD-L1) и CD278 (ICOS); и домен передачи сигнала CD3ζ.
В некоторых вариантах осуществления внеклеточный домен содержит антитело или антиген-связывающий фрагмент, которые связывают антиген.
В определенных вариантах осуществления трансмембранный домен получен из CD8α или CD28.
В дополнительных вариантах осуществления один или более доменов передачи костимулирующего сигнала выбраны из группы, включающей CD28, CD134 и CD137.
В конкретных вариантах осуществления CAR содержит полипептид шарнирной области.
В дополнительных вариантах осуществления полипептид шарнирной области содержит шарнирную область IgG1 или CD8α.
В дополнительных вариантах осуществления CAR содержит сигнальный пептид.
В других конкретных вариантах осуществления сигнальный пептид предусматривает сигнальный полипептид тяжелой цепи IgG1 или сигнальный полипептид CD8α.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR выбран из группы, включающей BEZ235, LY294002, GDC-0941, BYL719, GSK2636771, TGX-221, AS25242, CAL-101, IPI-145, MK-2206, GSK690693, GDC-0068, A-674563, CCT128930, AZD8055, INK128, рапамицин, PF-04691502, эверолимус, BI-D1870, H89, PF-4708671, FMK, AT7867, NU7441, PI-103, NU7026, PIK-75, ZSTK474 и PP-121.
В дополнительных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой общий ингибитор PI3K, выбранный из группы, включающей BEZ235, LY294002 и GDC-0941.
В других конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой селективный ингибитор PI3K, выбранный из группы, включающей BYL719, GSK2636771, TGX-221, AS25242, CAL-101 и IPI-145.
В других конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой ингибитор PI3K, ZSTK474.
В определенных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой общий ингибитор AKT, выбранный из группы, включающей MK-2206, GSK690693 и GDC-0068.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой селективный ингибитор AKT1, A-674563.
В дополнительных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой селективный ингибитор AKT2, CCT128930.
В некоторых вариантах осуществления ингибитор пути PI3K/AKT/mTOR ингибирует активацию AKT под действием DNA-PK.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR ингибирует активацию AKT под действием PDK-1.
В определенных вариантах осуществления ингибитор пути PI3K/AKT/mTOR ингибирует активацию AKT под действием mTORC2.
В конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR ингибирует активацию AKT под действием HSP.
В дополнительных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой общий ингибитор mTOR, выбранный из группы, включающей AZD8055, INK128 и рапамицин.
В дополнительных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой селективный ингибитор mTORC1, выбранный из группы, включающей PF-04691502 и эверолимус.
В некоторых вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой ингибитор s6-киназы, выбранный из группы, включающей BI-D1870, H89, PF-4708671, FMK и AT7867.
В других конкретных вариантах осуществления ингибитор пути PI3K/AKT/mTOR представляет собой ингибитор DNA-PK, выбранный из группы, включающей NU7441, PI-103, NU7026, PIK-75 и PP-121.
В конкретных вариантах осуществления популяция активированных T-клеток, которых повторно стимулировали в присутствии ингибитора пути PI3K/AKT/mTOR, характеризуется увеличенным количеством T-клеток, экспрессирующих один или более маркеров, выбранных из группы, включающей CD62L, CCR7, CD28, CD27, CD122 и CD127, по сравнению с популяцией T-клеток, которых активировали и стимулировали в отсутствие ингибитора пути PI3K/AKT/mTOR.
В дополнительных вариантах осуществления популяция активированных T-клеток, которых повторно стимулировали в присутствии ингибитора пути PI3K/AKT/mTOR, не экспрессирует CD57 или KLRG1 или экспрессирует меньшее количество CD57 или KLRG1 по сравнению с популяцией T-клеток, которых активировали и стимулировали в отсутствие ингибитора пути PI3K/AKT/mTOR.
В различных вариантах осуществления предусмотрена популяция T-клеток, содержащих вектор, содержащий разработанный TCR или CAR, где клетки были активированы и простимулированы к пролиферации в присутствии ингибитора пути PI3K/AKT/mTOR.
В различных конкретных вариантах осуществления предусмотрена популяция T-клеток, содержащих вектор, содержащий разработанный TCR или CAR, где клетки были активированы и простимулированы к пролиферации в присутствии ингибитора пути PI3K/AKT/mTOR и были повторно простимулированы путем приведения всей или части популяции пролиферирующих иммунных эффекторных клеток в контакт с антителом к CD3 или его CD3-связывающим фрагментом и антителом к CD28 или его CD28-связывающим фрагментом, который стимулирует вспомогательную молекулу CD28 на поверхности иммунных эффекторных клеток.
В определенных вариантах осуществления иммунные эффекторные клетки включают T-клетки.
В одном варианте осуществления иммунные эффекторные клетки представляют собой TIL.
В различных вариантах осуществления предусмотрена композиция, содержащая популяцию иммунных эффекторных клеток, рассмотренных в данном документе, и физиологически приемлемый наполнитель.
В различных определенных вариантах осуществления предусмотрен способ лечения рака у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества композиции на основе T-клеток, рассмотренной в данном документе.
В конкретных вариантах осуществления рак выбран из группы, включающей опухоль Вильмса, саркому Юинга, нейроэндокринную опухоль, глиобластому, нейробластому, меланому, рак кожи, рак молочной железы, рак толстой кишки, рак прямой кишки, рак предстательной железы, рак печени, рак почки, рак поджелудочной железы, рак легкого, рак желчевыводящей системы, рак шейки матки, рак эндометрия, рак пищевода, рак желудка, рак головы и шеи, медуллярную карциному щитовидной железы, рак яичника, глиому, лимфому, лейкоз, миелому, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический лимфолейкоз, хронический миелогенный лейкоз, лимфому Ходжкина, неходжкинскую лимфому и рак мочевого пузыря.
В одном варианте осуществления рак ассоциирован с вирусной инфекцией, e.g., инфекцией, обусловленной CMV, HPV или EBV, или вызван ею.
В дополнительных вариантах осуществления рак представляет собой рак поджелудочной железы, и внеклеточный связывающий домен связывает эпитоп PSCA или MUC1.
В некоторых вариантах осуществления рак представляет собой рак мочевого пузыря, и внеклеточный связывающий домен связывает эпитоп PSCA или MUC1.
В дополнительных вариантах осуществления рак представляет собой мультиформную глиобластому, и внеклеточный связывающий домен связывает эпитоп EPHA2, EGFRvIII или CSPG4.
В конкретных вариантах осуществления рак представляет собой рак легкого, и внеклеточный связывающий домен связывает эпитоп PSCA или GD2.
В определенных вариантах осуществления рак представляет собой рак молочной железы, и внеклеточный связывающий домен связывает эпитоп CSPG4 или HER2.
В дополнительных вариантах осуществления рак представляет собой меланому, и внеклеточный связывающий домен связывает эпитоп CSPG4 или GD2.
В конкретных вариантах осуществления рак представляет собой B-клеточное новообразование, и связывающий домен связывает эпитоп BCMA.
В различных вариантах осуществления предусмотрен способ лечения гемобластоза у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества композиции на основе T-клеток, рассмотренной в данном документе.
В определенных вариантах осуществления гемобластоз представляет собой B-клеточное новообразование, выбранное из группы, включающей множественную миелому (MM), хронический лимфолейкоз (CLL) или неходжкинскую лимфому (NHL).
В конкретных вариантах осуществления MM выбрана из группы, включающей клинически выраженную множественную миелому, вялотекущую множественную миелому, плазмоцитарный лейкоз, несекреторную миелому, IgD-миелому, остеосклеротическую миелому, солитарную плазмацитому кости и экстрамедуллярную плазмацитому.
В определенных вариантах осуществления NHL выбрана из группы, включающей лимфому Беркитта, хронический лимфолейкоз/мелкоклеточную лимфоцитарную лимфому (CLL/SLL), диффузную В-крупноклеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, лимфобластную лимфому из B-клеток-предшественников и лимфому из клеток мантийной зоны.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ АСПЕКТОВ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
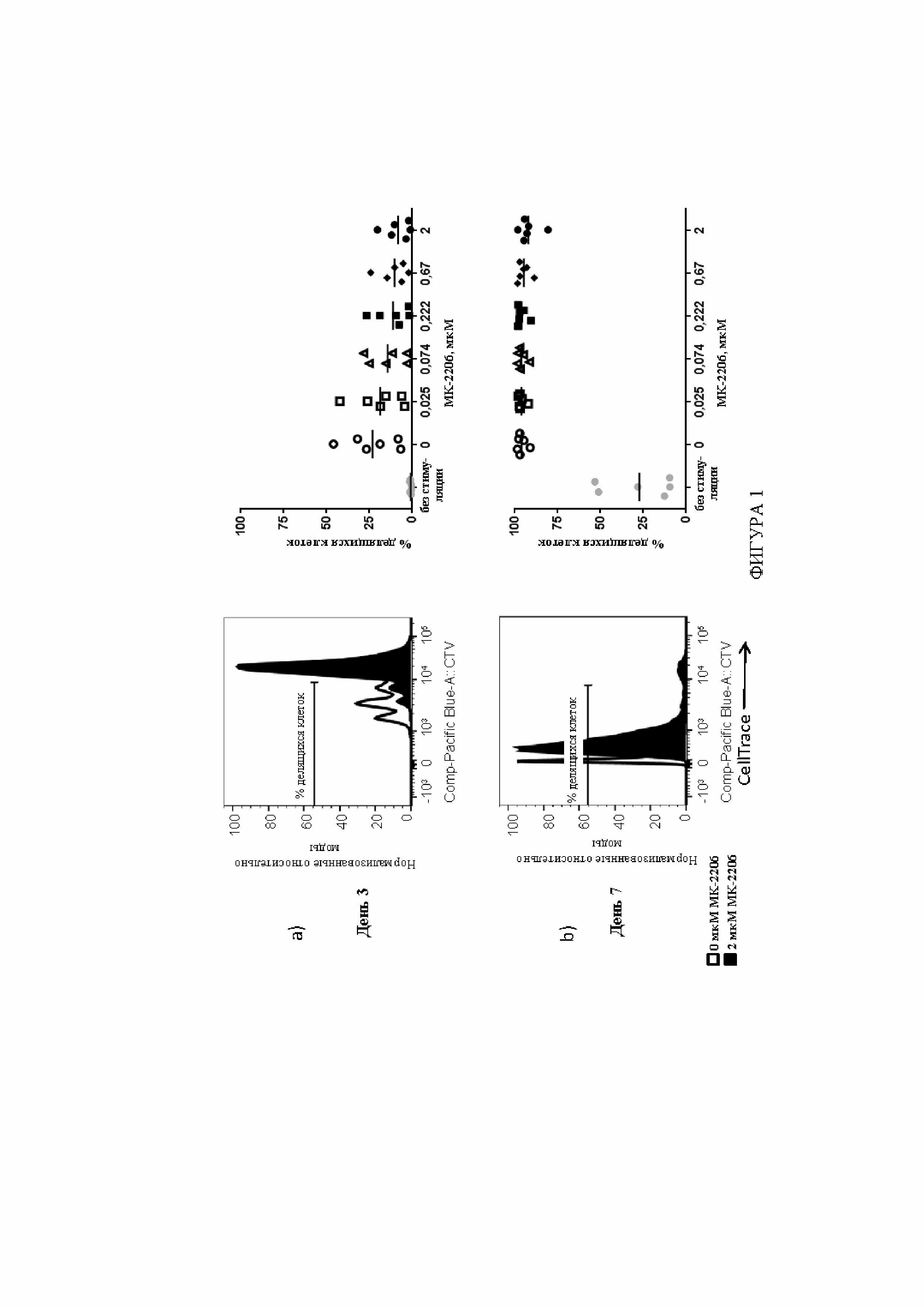
На фигуре 1 показан типичный пример поддержания T-клеточной пролиферации у T-клеток, обработанных ингибитором AKT. T-клетки культивировали с различными концентрациями ингибитора AKT, MK-22067, вплоть до семи дней. На крайних правых панелях показан процент делящихся T-клеток из культур T-клеток, инициированных из шести образцов PBMC нормальных доноров. Каждым символом на крайней правой панели представлена уникальная культура, которую выращивали параллельно с титрованной дозой MK-2206. На крайних левых панелях показан типичный пример из этих экспериментов. A) После трех дней культивирования с MK-2206, пролиферация T-клеток лишь немного снизилась в сравнении с контролем без обработки. B) После 7 дней культивирования с MK-2206, пролиферация T-клеток фактически не отличалась в сравнении с контролем без обработки.
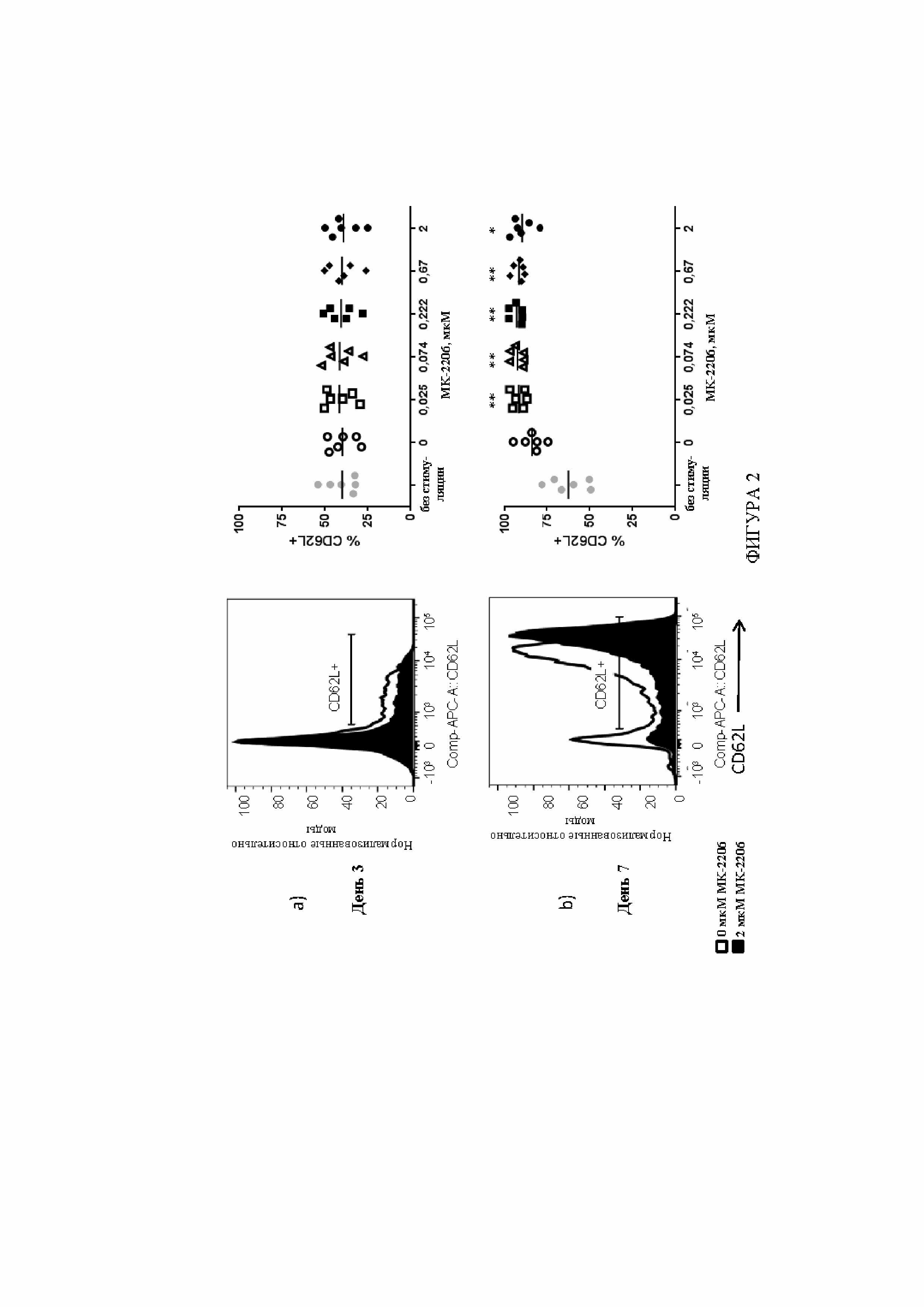
На фигуре 2 показан типичный пример экспрессии CD62L в T-клетках, обработанных с помощью ингибитора AKT. T-клетки культивировали с различными концентрациями ингибитора AKT, MK-22067, вплоть до семи дней. На крайних правых панелях показан процент T-клеток, экспрессирующих CD62L, из культур T-клеток, инициированных из шести образцов PBMC нормальных доноров. Каждым символом на крайней правой панели представлена уникальная культура, которую выращивали параллельно с титрованной дозой MK-2206. На крайних левых панелях показан типичный пример из этих экспериментов. A) После трех дней культивирования с MK-2206, экспрессия CD62L на T-клетках, обработанных с помощью MK-2206, фактически не отличалась в сравнении с контролем без обработки. B) После 7 дней культивирования для T-клеток, обработанных с помощью MK-2206, показаны значительно более высокие уровни экспрессии CD62L в сравнении с контролем без обработки.
На фигуре 3 показана экспрессия CD62L на T-клетках с CAR к BCMA, которую оценивали с помощью проточной цитометрии в конце культивирования с MK-2206, TCN или ZSTK474. Культуры CAR T-клеток, обработанные с помощью MK-2206 и ZSTK474, характеризовались значительно более высоким уровнем экспрессии CD62L в сравнении с культурами CAR T-клеток, обработанных с помощью IL-2 отдельно или с помощью TCN.
На фигуре 4 показан средний объем опухоли для опухолей множественной миеломы у мышей, которых обрабатывали с помощью T-клеток с CAR к BCMA, культивируемых с IL-2, IL-7 и IL-15, MK-2206, ZST747 или TCN. Для T-клеток с CAR к BCMA, культивируемых с IL-7 и IL-15, MK-2206 или ZST747, показаны аналогичные уровни противоопухолевой активности в сравнении с T-клетками с CAR к BCMA, культивируемыми со стандартным IL-2. Для T-клеток с CAR к BCMA, культивируемых с TCN, не был показан противоопухолевый ответ.
На фигуре 5 показана противоопухолевая активность T-клеток с CAR к BCMA, обработанных с помощью IL-2, IL-7/15, MK-2206, TCN или ZSTK474 на модели опухолей Дауди. На прогрессирование опухолей Дауди не влияла последующая обработка с помощью T-клеток с CAR к BCMA, культивируемых с IL-2 или IL7/15. T-клетки с CAR к BCMA, культивируемые либо с MK-2206, либо с ZST474, вызывали полный регресс опухоли.
На фигуре 6 показана персистенция T-клеток с CAR к BCMA, культивируемых с ZSTK474, в животных, которых обрабатывали с помощью T-клеток с CAR к BCMA, культивируемых с IL-2, MK-2206 или ZSTK474, у которых 100 мм3 опухоль RPMI-8226 полностью подверглась регрессу. Животным повторно вводили RPMI-8226 через 13 дней в другой бок. CAR T-клетки, культивируемые с IL-2, которыми обрабатывали животных, не были в состоянии предупредить разрастание опухоли. У животных, которых обрабатывали с помощью T-клеток с CAR к BCMA, культивируемых с ZSTK474, не наблюдалось никаких признаков приживления опухоли.
ПОДРОБНОЕ ОПИСАНИЕ
A. Обзор
Настоящее изобретение в целом относится к улучшенным способам производства композиций на основе Т-клеток. Не желая быть связанным какой-либо конкретной теорией, способы по настоящему изобретению, рассмотренные в данном документе, разобщают пролиферацию и дифференцировку T-клеток для получения T-клеток с более совершенными свойствами, например, повышенным выживанием, размножением и персистенцией in vivo, при сопутствующем снижении дифференцировки по сравнению с существующими композициями на основе T-клеток, известными из уровня техники. Соответственно, композиции на основе T-клеток, рассмотренные в данном документе, содержат высокоактивные T-клетки, которые имеют характеристики молодых или наивных T-клеточных популяций, которые способны к нескольким раундам размножения при ограниченной дифференцировке. Более того, размноженные клетки способны к последующей дифференцировке и обеспечению функций иммунных эффекторных клеток.
В различных вариантах осуществления предусмотрен способ производства T-клеток, который поддерживает или в минимальной степени снижает пролиферацию T-клеток и снижает, уменьшает или уменьшает степень дифференцировки T-клеток во время размножения T-клеток. В конкретных предпочтительных вариантах осуществления композицию на основе T-клеток производят при помощи способов, рассмотренных в данном документе, которые могут дополнительно повышать эффективность средства адоптивной T-клеточной иммунотерапии. Произведенные композиции на основе T-клеток, рассмотренные в данном документе, применимы для лечения или предупреждения множества состояний, в том числе без ограничения рака, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания и иммунодефицита. Не желая быть связанным какой-либо конкретной теорией, автор настоящего изобретения удивительным образом и неожиданно обнаружил, что модуляция путей передачи сигналов в клетке у T-клеток, причем путей, которые в норме ассоциированы с пролиферацией в раковых клетках, приводит к фактическому поддержанию или незначительному снижению пролиферации T-клеток и снижению дифференцировки T-клеток во время размножения T-клеток по сравнению с T-клетками, в которых пути передачи сигнала в клетке не подвергаются модулированию.
В одном варианте осуществления способ производства разработанных T-клеток включает приведение T-клеток в контакт со средством, которое ингибирует путь PI3K/AKT/mTOR в клетках. Клетки можно приводить в контакт перед, во время и/или после активации и размножения. Композиции на основе разработанных T-клеток сохраняют достаточную активность T-клеток, так что они могут подвергаться нескольким раундам размножения без существенного повышения дифференцировки.
Соответственно, способы и композиции, рассмотренные в данном документе, представляют значительное улучшение по сравнению с существующими средствами адоптивной клеточной иммунотерапии.
При осуществлении настоящего изобретения на практике будут использоваться, если не указано иное, традиционные методы химии, биохимии, органической химии, молекулярной биологии, микробиологии, методики рекомбинантной ДНК, генетики, иммунологии и клеточной биологии, находящиеся в пределах компетенции специалистов в данной области, многие из которых описаны ниже с целью иллюстрации. Такие методики в полном объеме объясняются в литературе. См., например, Sambrook, et al., Molecular Cloning: A Laboratory Manual (3rd Edition, 2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Maniatis et al., Molecular Cloning: A Laboratory Manual (1982); Ausubel et al., Current Protocols in Molecular Biology (John Wiley and Sons, дополнено в июле 2008); Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience; Glover, DNA Cloning: A Practical Approach, vol. I & II (IRL Press, Oxford, 1985); Anand, Techniques for the Analysis of Complex Genomes, (Academic Press, New York, 1992); Transcription and Translation (B. Hames & S. Higgins, Eds., 1984); Perbal, A Practical Guide to Molecular Cloning (1984); Harlow and Lane, Antibodies, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1998) Current Protocols in Immunology Q. E. Coligan, A. M. Kruisbeek, D. H. Margulies, E. M. Shevach and W. Strober, eds., 1991); Annual Review of Immunology; а также монографии в журналах, таких как Advances in Immunology.
Все публикации, патенты и патентные заявки, цитируемые в данном документе, тем самым включены посредством ссылки во всей своей полноте.
B. Определения
Если не определено иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое общеизвестно обычным специалистам в области техники, к которой относится настоящее изобретение. Хотя при осуществлении настоящего изобретения на практике или при его тестировании могут быть использованы любые способы и материалы, аналогичные или эквивалентные описанным в данном документе, предпочтительные варианты осуществления композиций, способов и материалов описаны в данном документе. Для целей настоящего изобретения ниже определены следующие термины.
Формы единственного и множественного числа, используемые в данном документе, обозначают один или несколько (т.е. по меньшей мере один) грамматических объектов предмета. В качестве примера, «элемент» означает один элемент или несколько элементов.
Используемый в данном документе термин «приблизительно» или «примерно» относится к количеству, уровню, значению, числу, частоте, процентной доле, измерению, размеру, величине, весу или длине, которые варьируют вплоть до 30, 25, 20, 25, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% относительно эталонного количества, уровня, значения, числа, частоты, процентной доли, измерения, размера, величины, веса или длины. В конкретных вариантах осуществления термины «приблизительно» или «примерно», когда употребляются перед числовым значением, указывают на значение плюс или минус диапазон, составляющий 15%, 10%, 5% или 1%.
Используемый в данном документе термин «значительно» относится к количеству, уровню, значению, числу, частоте, процентной доле, измерению, размеру, величине, весу или длине, которые составляют 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более от эталонного количества, уровня, значения, числа, частоты, процентной доли, измерения, размера, величины, веса или длины. В одном варианте осуществления «практически такой же» относится к количеству, уровню, значению, числу, частоте, процентной доле, измерению, размеру, величине, весу или длине, которые оказывают действие, например, физиологическое действие, которое является примерно таким же, как у эталонного количества, уровня, значения, числа, частоты, процентной доли, измерения, размера, величины, веса или длины.
На протяжении настоящего описания, если контекст не требует иного, слова «содержат», «содержит» и «содержащий» следует понимать как подразумевающий включение указанной стадии, или элемента, или группы стадий или элементов, но не исключение любой другой стадии, или элемента, или группы стадий или элементов. Под «состоящий из» подразумевают включение и ограничение тем, что следует за фразой «состоящий из». Таким образом, фраза «состоящий из» указывает на то, что перечисленные элементы являются необходимыми или обязательными, и что никакие другие элементы не могут присутствовать. Под «по существу состоящий из» подразумевают включение любых элементов, перечисленных после данной фразы, и ограничение другими элементами, которые не препятствуют активности или действиям, указанным в настоящем раскрытии в отношении перечисленных элементов, или способствуют им. Таким образом, фраза «по существу состоящий из» указывает на то, что перечисленные элементы являются необходимыми или обязательными, но другие элементы являются необязательными и могут присутствовать или отсутствовать в зависимости от того, влияют ли они на активность или действие перечисленных элементов.
Ссылка на протяжении настоящего описания на «один вариант осуществления», «вариант осуществления», «конкретный вариант осуществления», «сходный вариант осуществления», «определенный вариант осуществления», «дополнительный вариант осуществления» или «еще один вариант осуществления» или их комбинации означает, что конкретный признак, структура или характеристика, описанные в связи с данным вариантом осуществления, включены по меньшей мере в один из вариантов осуществления настоящего изобретения. Таким образом, появление всех вышеприведенных фраз в различных местах на протяжении настоящего описания не обязательно относится к одному варианту осуществления. Более того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом в одном или более вариантах осуществления.
Используемые в данном документе термины «производство T-клеток», или «способы производства Т-клеток», или аналогичные термины относятся к процессу получения терапевтической композиции на основе Т-клеток, при этом способы производства могут включать одну или более, или все из следующих стадий: сбор, стимуляцию, активацию и размножение.
Термины «Т-клетка» или «T-лимфоцит» приняты в данной области техники и подразумевают включение тимоцитов, наивных Т-лимфоцитов, незрелых T-лимфоцитов, зрелых T-лимфоцитов, покоящихся T-лимфоцитов или активированных T-лимфоцитов. Т-клетка может представлять собой T-хелперную клетку (Th), например, T-хелперную клетку 1 типа (Th1) или T-хелперную клетку 2 типа (Th2). T-клетка может представлять собой хелперную T-клетку (HTL; CD4+ T-клетку) CD4+ T-клетку, цитотоксическую T-клетку (CTL; CD8+ T-клетку), проникающую в опухоль цитотоксическую T-клетку (TIL; CD8+ T-клетку), CD4+CD8+ T-клетку, CD4-CD8- T-клетку или любую другую субпопуляцию T-клеток. Другие иллюстративные популяции Т-клеток, подходящие для применения в конкретных вариантах осуществления, включают наивные Т-клетки и Т-клетки памяти.
«Высокоактивные T-клетки» и «молодые T-клетки» применяются взаимозаменяемо в конкретных вариантах осуществления и обозначают фенотипы T-клеток, при которых T-клетка способна к пролиферации и происходит сопутствующее снижение дифференцировки. В конкретных вариантах осуществления молодая T-клетка имеет фенотип «наивной T-клетки». В различных вариантах осуществления с помощью способов производства, рассмотренных в данном документе, производят молодые T-клетки; клетки, у которых пролиферация T-клеток была разобщена с дифференцировкой T-клеток во время стимуляции, активации и размножения T-клеток. Не желая быть связанным какой-либо конкретной теорией, высокоактивные T-клетки, произведенные с помощью рассматриваемых композиций и способов, обладают большей противоопухолевой эффективностью после адоптивного переноса. В конкретных вариантах осуществления молодые T-клетки содержат один или более или все из следующих биологических маркеров: CD62L, CCR7, CD28, CD27, CD122 и CD127. В одном варианте осуществления молодые T-клетки содержат один или более или все из следующих биологических маркеров: CD62L, CCR7, CD28, CD27, CD122 и CD127 и у них отсутствует экспрессия CD57, CD244, CD160, PD-1, CTLA4, TIM3 и LAG3.
Используемый в данном документе термин «пролиферация» относится к увеличению деления клеток, как симметричного, так и ассиметричного деления клеток. В конкретных вариантах осуществления «пролиферация» относится к симметричному или ассиметричному делению Т-клеток. «Увеличенную пролиферацию» наблюдают, когда происходит увеличение количества клеток в обработанном образце по сравнению с количеством клеток в необработанном образце.
Используемый в данном документе термин «дифференцировка» относится к способу снижения активности или пролиферации клетки или к переходу клетки в состояние ограниченной активности в отношении развития. В конкретных вариантах осуществления дифференцированные T-клетки приобретают функции иммунных эффекторных клеток.
«Иммунная эффекторная клетка» представляет собой любую клетку иммунной системы, которая характеризуется одной или более эффекторными функциями (например, цитолитической активностью цитотоксической клетки, секрецией цитокинов, индукцией ADCC и/или CDC). Иллюстративные иммунные эффекторные клетки, рассмотренные в данном документе, представляют собой T-лимфоциты, в частности, цитотоксические T-клетки (CTL; CD8+ T-клетки), TIL и хелперные T-клетки (HTL; CD4+ T-клетки).
«Модифицированными Т-клетками» называют Т-клетки, которые были модифицированы посредством введения полинуклеотида, кодирующего разработанный TCR или CAR, рассмотренный в данном документе. Модифицированные Т-клетки включают как генетические, так и негенетические модификации (например, эписомные или внехромосомные).
Используемый в данном документе термин «полученный методами генной инженерии» или «генетически модифицированный» относится к добавлению дополнительного генетического материала в форме ДНК или РНК в общий генетический материал клетки.
Термины «генетически модифицированные клетки», «модифицированные клетки» и «перенаправленные клетки» используют взаимозаменяемо.
Используемый в данном документе термин «генная терапия» относится к введению дополнительного генетического материала в форме ДНК или РНК в общий генетический материал клетки, что восстанавливает, корректирует или модифицирует экспрессию гена или служит для экспрессии терапевтического полипептида, например, TCR или CAR, и/или одного или более цитокинов. В конкретных вариантах осуществления Т-клетки модифицируют для экспрессии разработанного TCR или CAR без модификации генома клеток, например, посредством введения эписомного вектора, который экспрессирует TCR или CAR в клетке.
Термин «ex vivo» обычно относится к совершению действий за пределами организма, таким как исследование и измерения, производимым в или на живой ткани в искусственных условиях вне организма, предпочтительно с минимальными отличиями от естественных условий. В конкретных вариантах осуществления в процедурах «ex vivo» задействованы живые клетки или ткани, взятые из организма и культивируемые или модулируемые при помощи лабораторного оборудования, как правило, в стерильных условиях и обычно в течение нескольких часов или до приблизительно 24 часов, но в том числе до 48 или 72 часов, в зависимости от обстоятельств. В определенных вариантах осуществления такие ткани или клетки можно собирать и замораживать, а позднее оттаивать для обработки ex vivo. Эксперименты с культурой ткани или процедуры, длящиеся дольше нескольких дней с применением живых клеток или тканей, как правило, считаются «in vitro», хотя в определенных вариантах осуществления данный термин можно использовать взаимозаменяемо с ex vivo.
Термин «in vivo» относится, как правило, к совершению действий в пределах организма, таким как самообновление клеток и размножение клеток. В одном варианте осуществления термин «размножение in vivo» относится к способности популяции клеток увеличиваться в количестве in vivo.
Термин «стимуляция» относится к первичному ответу, индуцируемому связыванием стимулирующей молекулы (например, комплекса TCR/CD3) с ее когнатным лигандом, с опосредованием тем самым события передачи сигнала, в том числе без ограничений передачи сигнала посредством комплекса TCR/CD3.
«Стимулирующая молекула» относится к молекуле на T-клетке, которая специфически связывается с когнатным стимулирующим лигандом.
Используемый в данном документе «стимулирующий лиганд» означает лиганд, который в случае присутствуя на антиген-презентирующей клетке (например, на aAPC, дендритной клетке, B-клетке и т.п.) может специфически связываться с когнатным партнером по связыванию (называемым в данном документе «стимулирующая молекула») на T-клетке, с опосредованием тем самым первичного ответа T-клетки, в том числе без ограничений активации, инициации иммунного ответа, пролиферации и т.п. Стимулирующие лиганды включают без ограничений лиганды CD3, например, антитело к CD3, и лиганды CD2, например, антитело к CD2, и пептиды, например, пептиды CMV, HPV, EBV.
Термин «активация» относится к состоянию T-клетки, которую в достаточной степени простимулировали для индукции обнаруживаемой клеточной пролиферации. В конкретных вариантах осуществления активация также может быть ассоциирована с индуцированной выработкой цитокинов и обнаруживаемыми эффекторными функциями. Термин «активированные Т-клетки» относится, помимо прочего, к Т-клеткам, которые пролиферируют. Сигналы, генерируемые посредством только TCR, являются недостаточными для полной активации Т-клетки, и необходимы один или более вторичных или костимулирующих сигналов. Таким образом, активация T-клетки предусматривает первичный стимулирующий сигнал посредством комплекса TCR/CD3 и один или более вторичных костимулирующих сигналов. О костимуляции может свидетельствовать пролиферация и/или выработка цитокинов Т-клетками, которые получили сигнал первичной активации, такой как стимуляция посредством комплекса CD3/TCR и посредством CD2.
«Костимулирующий сигнал» относится к сигналу, который в комбинации с первичным сигналом, таким как связывание с TCR/CD3, приводит к пролиферации T-клеток, выработке цитокинов и/или повышению экспрессии или понижению экспрессии определенных молекул (например, CD28).
«Костимулирующий лиганд» относится к молекуле, которая связывает костимулирующую молекулу. Костимулирующий лиганд может быть растворимым или находиться на поверхности. «Костимулирующая молекула» относится к когнатному партнеру по связыванию на T-клетке, который специфически связывается с костимулирующим лигандом (например, антителом к CD28).
«Аутологичные», как используется в данном документе, относится к клеткам от того же субъекта.
«Аллогенные», как используется в данном документе, относится к клеткам того же вида, которые генетически отличны при сравнении с данной клеткой.
«Сингенные», как используется в данном документе, относится к клеткам другого субъекта, которые генетически идентичны при сравнении с данной клеткой.
«Ксеногенные», как используется в данном документе, относится к клеткам другого вида при сравнении с данной клеткой. В предпочтительных вариантах осуществления клетки по настоящему изобретению являются аллогенными.
Используемые в данном документе термины «индивидуум» и «субъект» часто используются взаимозаменяемо и относятся к любому животному, у которого обнаружен симптом рака, который можно подвергать лечению с помощью векторов для генной терапии, терапевтических средств на основе клеток и способов, раскрытых в других частях данного документа. Подходящие субъекты (например, пациенты) включают лабораторных животных (таких как мышь, крыса, кролик или морская свинка), сельскохозяйственных животных и домашних животных или питомцев (таких как кошка или собака). Включены отличные от человека приматы и, предпочтительно, пациенты-люди. Типичными субъектами являются пациенты-люди, у которых есть рак, у которых был диагностирован рак, или которые подвержены риску развития рака.
Используемый в данном документе термин «пациент» относится к субъекту, у которого было диагностировано конкретное показание, которое можно лечить с помощью векторов для генной терапии, терапевтических средств на основе клеток и способов, раскрытых в других частях данного документа.
Используемое в данном документе «лечение» или «осуществление лечения» включает любой положительный или необходимый эффект в отношении симптомов или патологических признаков заболевания или патологического состояния, и может включать даже небольшое уменьшение одного или более измеряемых маркеров заболевания или состояния, подлежащего лечению, например, рака. Лечение может необязательно подразумевать либо уменьшение или ослабление симптомов заболевания или состояния, либо отсрочку прогрессирования заболевания или состояния. «Лечение» необязательно означает полное устранение или излечение заболевания или состояния, или связанных с ними симптомов.
Используемые в данном описании «предупреждать» и аналогичные слова, такие как «предупрежденный», «предупреждение» и т.д., обозначают подход для предупреждения, ингибирования или снижения вероятности возникновения или рецидива заболевания или состояния, например, рака. Он также относится к отсрочке манифестации или рецидива заболевания или состояния или к отсрочке появления или рецидива симптомов заболевания или состояния. Используемые в данном документе «предупреждение» и аналогичные слова также включают снижение интенсивности, эффекта, симптомов и/или бремени заболевания или состояния до манифестации или рецидива заболевания или состояния.
Используемый в данном описании термин «количество» относится к «количеству, эффективному для» или «эффективному количеству» генетически модифицированной терапевтической клетки, например, Т-клетки, для достижения полезного или требуемого профилактического или терапевтического результата, в том числе клинических результатов.
«Профилактически эффективное количество» относится к количеству генетически модифицированной терапевтической клетки, эффективному для достижения требуемого профилактического результата. Обычно, но не обязательно, поскольку профилактическую дозу применяют у субъектов до появления заболевания или на его ранней стадии, профилактически эффективное количество меньше терапевтически эффективного количества.
«Терапевтически эффективное количество» генетически модифицированной терапевтической клетки может меняться в зависимости от таких факторов, как стадия заболевания, возраст, пол и вес индивидуума, а также от способности Т-клеток вызывать требуемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты вируса или трансдуцированных терапевтических клеток перевешиваются терапевтически благоприятными эффектами. Термин «терапевтически эффективное количество» включает количество, которое является эффективным для «лечения» субъекта (например, пациента). Если указано терапевтическое количество, точное количество композиций по настоящему изобретению, которое следует ввести, может определить лечащий врач с учетом индивидуальных различий в возрасте, весе, размере опухоли, степени инфекции или метастазов и состоянии пациента (субъекта).
Используемый в данном документе термин «рак» относится, в целом, к классу заболеваний или состояний, при которых аномальные клетки бесконтрольно делятся и способны инвазировать в близлежащие ткани.
Используемый в данном документе термин «злокачественный» относится к раку, при котором группа опухолевых клеток проявляет одно или более из неконтролируемого роста (т.е. деления сверх пределов нормы), инвазии (т.е. внедрения в прилегающие ткани и их разрушения) и метастазирования (т.е. распространения в другие участки организма посредством лимфы или крови). Используемый в данном документе термин «метастазировать» относится к распространению рака из одной части организма в другую. Опухоль, образованная распространившимися клетками, называется «метастатическая опухоль» или «метастаз». Метастатическая опухоль состоит из клеток, аналогичных клеткам исходной (первичной) опухоли.
Используемый в данном документе термин «доброкачественный» или «незлокачественный» относится к опухолям, которые могут увеличиваться в размере, но не распространяются в другие части организма. Доброкачественные опухоли являются самоограничивающимися и обычно не склонны к инвазии или метастазированию.
«Раковая клетка» или «опухолевая клетка» относится к отдельной клетке раковой опухоли или ткани. Опухолью, в целом, называют вздутие или патологическое изменение, образованное вследствие аномального роста клеток, которое может быть доброкачественным, предраковым или злокачественным. Большинство форм рака образуют опухоли, но некоторые, например, лейкозы, не обязательно образуют опухоли. Для тех форм рака, которые образуют опухоли, термины раковая (клетка) и опухолевая (клетка) используются взаимозаменяемо. Количество опухоли у индивидуума представляет собой «опухолевую нагрузку», которую можно измерить как число, объем или вес опухоли.
«Инфекционное заболевание» относится к заболеванию, которое может передаваться от человека к человеку или от организма к организму, и которое вызывает микробный агент (например, возбудитель инфекции верхних дыхательных путей). Инфекционные заболевания известны из уровня техники и включают, например, гепатит, заболевания, передающиеся половым путем (например, хламидиоз, гонорея), туберкулез, HIV/AIDS, дифтерию, гепатит B, гепатит C, холеру и грипп.
«Аутоиммунное заболевание» относится к заболеванию, при котором в организме развивается иммуногенная реакция (т.е. реакция иммунной системы) в отношении некоторых составляющих его собственной ткани. Другими словами, иммунная система теряет свою способность распознавать какую-то ткань или систему в пределах организма как «свои» и нацеливается и атакует их, как если бы они были чужеродными. Аутоиммунные заболевания можно классифицировать на те, которые воздействуют преимущественно на один орган (например, гемолитическая анемия и аутоиммунный тиреоидит), и на те, при которых патологический процесс аутоиммунного заболевания затрагивает множество тканей (например, системная красная волчанка). Например, рассеянный склероз предположительно вызывают Т-клетки, атакующие оболочки нервных волокон головного мозга и спинного мозга. Это приводит к потере координации, слабости и нечеткости зрения. Аутоиммунные заболевания известны из уровня техники и включают, например, тиреоидит Хашимото, болезнь Грейвса, волчанку, рассеянный склероз, ревматоидный артрит, гемолитическую анемию, аутоиммунный тиреоидит, системную красную волчанку, целиакию, болезнь Крона, колит, диабет, склеродермию, псориаз и т.п.
«Иммунодефицит» означает состояние пациента, иммунная система которого была ослаблена вследствие заболевания или вследствие введения химических веществ. Такое состояние создает системный дефицит количества и типов клеток крови, необходимых для защиты от чужеродных веществ. Иммунодефицитные состояния или заболевания известны из уровня техники и включают, например, AIDS (синдром приобретенного иммунодефицита), SCID (тяжелый комбинированный иммунодефицит), изолированную недостаточность IgA-типа, вариабельный неклассифицируемый иммунодефицит, агаммаглобулинемию, сцепленную с Х-хромосомой, хронический гранулематоз, гипер-IgМ-синдром и диабет.
«Усиливать», или «содействовать», или «увеличивать», или «повышать» в целом называют способность композиции, рассмотренной в данном документе, приводить к, способствовать или вызывать более сильную физиологическую реакцию (т.е. последующие эффекты) по сравнению с реакцией, вызванной либо носителем, либо контрольной молекулой/композицией. Измеряемая физиологическая реакция может включать повышение размножения, активации, персистенции Т-клеток и/или повышение их способности вызывать цитолиз раковых клеток, наряду с прочим, очевидным из понимания в уровне техники и описания в данном документе. «Повышенное» или «увеличенное» количество, как правило, представляет собой «статистически значимое» количество, и может включать повышение, которое в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные знаки между ними, превышающие 1, например, 1,5, 1,6, 1,7, 1,8 и т.д.) превышает реакцию, обусловленную носителем или контрольной композицией.
«Уменьшать», или «понижать», или «облегчать», или «снижать», или «ослаблять» в целом называют способность композиции, рассмотренной в данном документе, продуцировать, способствовать или вызывать более слабую физиологическую реакцию (т. е. последующие эффекты) по сравнению с реакцией, вызванной либо носителем, либо контрольной молекулой/композицией. «Пониженное» или «уменьшенное» количество, как правило, представляет собой «статистически значимое» количество, и может включать уменьшение, которое в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные знаки между ними, превышающие 1, например, 1,5, 1,6, 1,7, 1,8 и т.д.) меньше по сравнению с реакцией (эталонной реакцией), обусловленной носителем, контрольной композицией, или реакцией в конкретной клеточной линии.
«Поддерживать», или «сохранять», или «поддержание», или «без изменений», или «без существенных изменений», или «без существенного снижения» в целом называют способность композиции, рассмотренной в данном документе, продуцировать, способствовать или вызывать более слабую физиологическую реакцию (т. е. последующие эффекты) в клетке по сравнению с реакцией, обусловленной либо носителем, либо контрольной молекулой/композицией, или реакцией в конкретной клеточной линии. Соизмеримая реакция представляет собой реакцию, которая существенно не отличается или измеримо отличается от эталонной реакции.
Термины «аффинность специфического связывания», или «специфически связывает», или «специфически связанный», или «специфическое связывание», или «специфически нацеливает», используемые в данном документе, описывают связывание одной молекулы с другой с большей аффинностью связывания, чем фоновое связывание. Связывающий домен (или CAR, содержащий связывающий домен, или белок слияния, содержащий связывающий домен) «специфически связывается» с целевой молекулой, если он связывается или ассоциируется с целевой молекулой с аффинностью или Ka (т.е. равновесной константой ассоциации конкретного взаимодействия связывания в единицах 1/M), например, большей или равной приблизительно 105 M-1. В определенных вариантах осуществления связывающий домен (или белок слияния на его основе) связывается с мишенью с Ka, большей или равной приблизительно 106 M-1, 107 M-1, 108 M-1, 109 M-1, 1010 M-1, 1011 M-1, 1012 M-1 или 1013 M-1. Связывающими доменами (или одноцепочечными белками слияния на их основе) с «высокой аффинностью» называют связывающие домены с Ka, составляющей по меньшей мере 107 M-1, по меньшей мере 108 M-1, по меньшей мере 109 M-1, по меньшей мере 1010 M-1, по меньшей мере 1011 M-1, по меньшей мере 1012 M-1, по меньшей мере 1013 M-1 или более.
В качестве альтернативы аффинность можно определить как равновесную константу диссоциации (Kd) конкретного взаимодействия связывания в единицах M (например, от 10-5 M до 10-13 M или менее). Аффинность полипептидов связывающего домена и CAR-белков согласно настоящему раскрытию можно легко определить с применением традиционных методик, например, с помощью конкурентного ELISA (твердофазного иммуноферментного анализа), или анализов ассоциации связывания или замещения с применением меченых лигандов, или с применением устройства для поверхностного плазмонного резонанса, такого как Biacore T100, доступного от компании Biacore, Inc., Писктавей, Нью-Джерси, или технологии оптического биосенсора, такой как система EPIC или EnSpire, доступных от компании Corning и Perkin Elmer, соответственно (см. также, например, Scatchard et al. (1949) Ann. N.Y. Acad. Sci. 51:660; патенты США №№ 5283173; 5468614 или аналогичные).
В одном варианте осуществления аффинность специфического связывания приблизительно в 2 раза превышает аффинность фонового связывания, приблизительно в 5 раз превышает аффинность фонового связывания, приблизительно в 10 раз превышает аффинность фонового связывания, приблизительно в 20 раз превышает аффинность фонового связывания, приблизительно в 50 раз превышает аффинность фонового связывания, приблизительно в 100 раз превышает аффинность фонового связывания или приблизительно в 1000 раз превышает аффинность фонового связывания или больше.
«Антиген (Ag)» относится к соединению, композиции или веществу, которое может стимулировать выработку антител или Т-клеточный ответ у животного, в том числе к композициям (таким как композиция, содержащая опухолеспецифический белок), которые инъецируют животному или поглощаются животным. Антиген реагирует с продуктами специфического гуморального или клеточного иммунитета, в том числе с теми, которые были индуцированы под действием гетерологичных антигенов, таких как раскрытые антигены. «Целевой антиген» или «целевой антиген, представляющий интерес» представляет собой антиген, для связывания которого предназначен связывающий домен CAR, рассмотренного в данном документе.
«Эпитоп» или «антигенная детерминанта» относится к области антигена, с которой связывается связывающий агент.
«Выделенный пептид» или «выделенный полипептид» и т.п., используемые в данном документе, относятся к in vitro выделению и/или очистке пептидной или полипептидной молекулы из клеточного окружения, а также от связи с другими компонентами клетки, т.е. она не является в значительной степени связанной с in vivo веществами. Аналогично термин «выделенная клетка» относится к клетке, которая была получена из in vivo ткани или органа и практически не содержит внеклеточного матрикса.
Используемый в данном документе «выделенный полинуклеотид» относится к полинуклеотиду, который был очищен от последовательностей, которые фланкируют его во встречающемся в природе состоянии, например, ДНК-фрагменту, который был освобожден от последовательностей, которые в норме расположены рядом с фрагментом. «Выделенный полинуклеотид» относится также к комплементарной ДНК (кДНК), рекомбинантной ДНК или другому полинуклеотиду, который не существует в природе и который был создан руками человека.
C. Способы производства Т-клеток
T-клетки, произведенные с помощью способов, рассмотренных в данном документе, обеспечивают улучшенные композиции для адоптивной иммунотерапии. Не желая быть связанным какой-либо конкретной теорией, полагают, что композиции на основе T-клеток, произведенные с помощью способов, рассмотренных в данном документе, наделены более совершенными свойствами, в том числе повышенным выживанием, размножением при относительном отсутствии дифференцировки и персистенцией in vivo. В одном варианте осуществления способ производства T-клеток включает приведение клеток в контакт с одним или более средствами, которые модулируют путь передачи сигнала в клетке PI3K/Akt/mTOR. В различных вариантах осуществления T-клетки можно получить из любого источника и привести в контакт со средством во время фаз активации и/или размножения в производственном процессе. Полученные композиции на основе T-клеток обогащены T-клетками с высокой активностью в отношении развития, которые обладают способностью к пролиферации и экспрессии одного или более из следующих биомаркеров: CD62L, CCR7, CD28, CD27, CD122 и CD127.
В одном варианте осуществления производят модифицированные T-клетки, предусматривающие поддерживаемые уровни пролиферации и сниженную дифференцировку. В конкретном варианте осуществления T-клетки производят путем стимуляции T-клеток для их перехода в активированное состояние и к пролиферации в присутствии одного или более стимуляторных сигналов и средств, которое является ингибитором пути передачи сигнала в клетке PI3K/Akt/mTOR.
Затем T-клетки можно модифицировать для экспрессии одного или более разработанных TCR или CAR. В одном варианте осуществления T-клетки модифицируют путем трансдукции T-клеток с помощью вирусного вектора, содержащего разработанный TCR или CAR. В определенном варианте осуществления T-клетки модифицируют перед стимуляцией и активацией в присутствии ингибитора пути передачи сигнала в клетке PI3K/Akt/mTOR. В другом варианте осуществления T-клетки модифицируют после стимуляции и активации в присутствии ингибитора пути передачи сигнала в клетке PI3K/Akt/mTOR. В конкретном варианте осуществления T-клетки модифицируют в пределах 12 часов, 24 часов, 36 часов или 48 часов после стимуляции и активации в присутствии ингибитора пути передачи сигнала в клетке PI3K/Akt/mTOR.
После активации T-клеток клетки культивируют для пролиферации. T-клетки можно культивировать в течение по меньшей мере 1, 2, 3, 4, 5, 6 или 7 дней, по меньшей мере 2 недель, по меньшей мере 1, 2, 3, 4, 5 или 6 месяцев или более с 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более раундами размножения.
В различных вариантах осуществления композиции на основе T-клеток производят в присутствии одного или более ингибиторов пути PI3K/AKT/mTOR. Ингибиторы могут целенаправленно воздействовать на одну или более активностей в пути или на одиночную активность. Не желая быть связанным какой-либо конкретной теорией, предполагается, что обработка или приведение T-клеток в контакт с одним или более ингибиторов пути PI3K/AKT/mTOR во время фаз стимуляции, активации и/или размножения в производственном процессе предпочтительно повышает число молодых T-клеток, с получением тем самым более совершенных терапевтических композиций на основе T-клеток.
В конкретном варианте осуществления предусмотрен способ повышения пролиферации T-клеток, экспрессирующих разработанный T-клеточный рецептор. Такие способы могут включать, например, сбор источника T-клеток из субъекта, стимуляцию и активацию T-клеток в присутствии одного или более ингибиторов пути PI3K/AKT/mTOR, модификацию T-клеток для экспрессии разработанного TCR или CAR, и размножение T-клеток в культуре.
В определенном варианте осуществления предусмотрен способ получения популяций T-клеток, обогащенных в отношении экспрессии одного или более из следующих биомаркеров: CD62L, CCR7, CD28, CD27, CD122 и CD127. В сходном варианте осуществления предусмотрен способ увеличения числа T-клеток, экспрессирующих CD62L, CCR7, CD28, CD27, CD122 и CD127 и не экспрессирующих или экспрессирующих низкие уровни CD57, CD244, CD160, PD-1, CTLA4, TIM3 и LAG3. Как обсуждается в других частях данного документа, уровни экспрессии биомаркеров молодых T-клеток сравнивают с уровнями экспрессии таких маркеров у более дифференцированных T-клеток или популяций иммунных эффекторных клеток.
В одном варианте осуществления мононуклеарные клетки периферической крови (PBMC) применяют в качестве источника T-клеток в способах производства T-клеток, рассмотренных в данном документе. PBMC составляет гетерогенная популяция T-лимфоцитов, которые могут представлять собой CD4+, CD8+ или CD4+ и CD8+, и они могут включать другие мононуклеарные клетки, такие как моноциты, B-клетки, NK-клетки и NKT-клетки. Вектор экспрессии, содержащий полинуклеотид, кодирующий разработанный TCR или CAR, рассмотренные в данном документе, можно вводить в популяцию человеческих донорных T-клеток, NK-клеток или NKT-клеток. Успешно трансдуцированные Т-клетки, которые несут вектор экспрессии, можно отсортировать с применением проточной цитометрии для выделения CD3-позитивных Т-клеток, а затем дополнительно размножить для увеличения количества модифицированных Т-клеток в дополнение к активации клеток с применением антител к CD3 и/или антител к CD28 и IL-2, IL-7 и/или IL-15 или любых других способов, известных из уровня техники, описываемых в других частях данного документа.
Способы производства, рассмотренные в данном документе, могут дополнительно включать криоконсервацию модифицированных T-клеток для хранения и/или получения препарата для применения у субъекта-человека. T-клетки криоконсервируют, так что клетки остаются жизнеспособными после оттаивания. При необходимости криоконсервированные трансформированные иммунные эффекторные клетки можно оттаивать, выращивать и размножать для увеличения количества таких клеток. Используемая в данном документе «криоконсервация» относится к сохранению клеток путем охлаждения до температур ниже нуля, таких как (обычно) 77 K или −196°C (температура кипения жидкого азота). Для того,чтобы предотвратить разрушение сохраняемых клеток в процессе замораживания при низких температурах или в ходе нагревания до комнатной температуры, зачастую используют криопротекторные средства. Криопротекторные средства и оптимальные скорости охлаждения могут защитить клетки от повреждения. Криопротекторные средства, которые можно использовать, включают без ограничений диметилсульфоксид (DMSO) (Lovelock and Bishop, Nature, 1959; 183: 1394-1395; Ashwood-Smith, Nature, 1961; 190: 1204-1205), глицерин, поливинилпирролидин (Rinfret, Ann. N.Y. Acad. Sci., 1960; 85: 576) и полиэтиленгликоль (Sloviter and Ravdin, Nature, 1962; 196: 48). Предпочтительная скорость охлаждения составляет 1-3°C/минута. После по меньшей мере двух часов Т-клетки достигают температуры −80°C и их можно поместить непосредственно в жидкий азот (−196°C) для постоянного хранения, например, в криогенный сосуд для долгосрочного хранения.
1. T-клетки
В настоящем изобретении рассматривается производство улучшенных композиций на основе Т-клеток. T-клетки могут быть аутологичными/аутогенными («своими») или неаутологичными («не своими», например, аллогенными, сингенными или ксеногенными). В предпочтительных вариантах осуществления T-клетки получают из субъекта-млекопитающего. В более предпочтительном варианте осуществления T-клетки получают из субъекта-примата. В наиболее предпочтительном варианте осуществления T-клетки получают из субъекта-человека.
Т-клетки можно получать из различных источников, в том числе без ограничений мононуклеарных клеток периферической крови, костного мозга, ткани лимфатического узла, пуповинной крови, ткани тимуса, ткани из очага инфекции, асцитов, плеврального выпота, ткани селезенки и опухолей. В определенных вариантах осуществления Т-клетки можно получать из дозы крови, собранной у субъекта с применением любой из целого ряда методик, известных специалисту в данной области, например, с помощью осаждения, например, разделения с помощью FICOLL™. В одном варианте осуществления клетки из циркулирующей крови индивидуума получают посредством афереза. Продукт афереза как правило содержит лимфоциты, в том числе Т-клетки, моноциты, гранулоциты, B-клетки, другие ядерные белые кровяные клетки, красные кровяные клетки и тромбоциты. В одном варианте осуществления клетки, собранные посредством афереза, можно промывать для удаления фракции плазмы и для помещения клеток в подходящий буфер или среду для последующей обработки. Клетки можно промывать при помощи PBS или другого подходящего раствора, не содержащего кальций, магний и большинство, если не все прочие двухвалентные катионы. Как будет понятно рядовым специалистам в данной области, стадию промывки можно выполнять при помощи способов, известных специалистам в данной области, таких как с помощью полуавтоматической проточной центрифуги. Например, Cobe 2991 Cell Processor, Baxter CytoMate и т.п. После промывки клетки можно ресуспендировать в различных биосовместимых буферах или других солевых растворах, содержащих или не содержащих буфер. В определенных вариантах осуществления нежелательные компоненты из образца после афереза можно удалять в культуральной среде для непосредственного ресуспендирования клеток.
В конкретных вариантах осуществления популяцию клеток, содержащую Т-клетки, например PBMC, применяют в способах производства, рассмотренных в данном документе. В других вариантах осуществления в способах производства, рассмотренных в данном документе, применяют выделенную или очищенную популяцию Т-клеток. Клетки можно выделить из мононуклеарных клеток периферической крови (PBMC) посредством лизиса эритроцитов и истощения моноцитов, например, путем центрифугирования в градиенте PERCOLLTM. В некоторых вариантах осуществления после выделения PBMC как цитотоксические, так и хелперные Т-лимфоциты можно сортировать на субпопуляции наивных Т-клеток, Т-клеток памяти и эффекторных Т-клеток либо перед, либо после активации, размножения и/или генетической модификации.
Специфические субпопуляции Т-клеток, экспрессирующие один или более следующих маркеров: CD3, CD4, CD8, CD28, CD45RA, CD45RO, CD62, CD127 и HLA-DR, можно в дальнейшем выделять при помощи методик позитивной или негативной селекции. В одном варианте осуществления специфическую субпопуляцию Т-клеток, экспрессирующих один или более маркеров, выбранных из группы, включающей CD62L, CCR7, CD28, CD27, CD122 и CD127, дополнительно выделяют при помощи методик позитивной или негативной селекции. В различных вариантах осуществления композиции на основе произведенных T-клеток не экспрессируют или фактически не экспрессируют один или более из следующих маркеров: CD57, CD244, CD160, PD-1, CTLA4, TIM3 и LAG3.
В одном варианте осуществления экспрессия одного или более маркеров, выбранных из группы, включающей CD62L, CCR7, CD28, CD27, CD122 и CD127, повышена по меньшей мере в 1,5 раза, по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз, по меньшей мере в 10 раз, по меньшей мере в 25 раз или более по сравнению с популяцией T-клеток, которые активировали и размножали без ингибитора PI3K/AKT/mTOR.
В одном варианте осуществления экспрессия одного или более маркеров, выбранных из группы, включающей CD57, CD244, CD160, PD-1, CTLA4, TIM3 и LAG3, снижена по меньшей мере в 1,5 раза, по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз, по меньшей мере в 10 раз, по меньшей мере в 25 раз или более по сравнению с популяцией T-клеток, которые активировали и размножали с ингибитором PI3K/AKT/mTOR.
В одном варианте осуществления способы производства, рассмотренные в данном документе, повышают количество T-клеток, содержащих один или более маркеров наивных T-клеток или T-клеток с высокой активностью в отношении развития. Не желая быть связанным какой-либо конкретной теорией, автор настоящего изобретения полагает, что обработка популяции клеток, содержащей T-клетки, с помощью одного или более ингибиторов PI3K/AKT/mTOR разобщает пролиферацию T-клеток и сигналы дифференцировки, и приводит тем самым к повышению размножения T-клеток с высокой активностью в отношении развития и обеспечивает более надежное и эффективное средство адоптивной иммунотерапии, чем существующие средства T-клеточной терапии.
Иллюстративные примеры маркеров наивных T-клеток или T-клеток с высокой активностью в отношении развития, повышенных в T-клетках, произведенных с применением способов, рассмотренные в данном документе, включают без ограничений CD62L, CCR7, CD28, CD27, CD95, CD122 и CD127. В конкретных вариантах осуществления наивные T-клетки не экспрессируют или фактически не экспрессируют один или более из следующих маркеров: CD57, CD244, CD160, PD-1, BTLA, CD45RA, CTLA4, TIM3 и LAG3.
Что касается T-клеток, популяции T-клеток, полученные с помощью разных методик размножения, рассмотренных в данном документе, могут характеризоваться целым рядом специфических фенотипических свойств, в зависимости от используемых условий. В различных вариантах осуществления популяции размноженных T-клеток содержат один или более из следующих фенотипических маркеров: CCR7, CD3, CD4, CD8, CD27, CD28, CD62L, CD95, CD122, CD127 и HLA-DR.
В одном варианте осуществления такие фенотипические маркеры включают повышенную экспрессию одного или более или всех из CD62L, CCR7, CD28, CD27, CD122 и CD127. В конкретных вариантах осуществления размножают CD8+ T-лимфоциты, характеризующиеся экспрессией фенотипических маркеров наивных T-клеток, в том числе CD62L, CCR7, CD28, CD27, CD122 и CD127.
В конкретных вариантах осуществления размножают T-клетки, характеризующиеся экспрессией фенотипических маркеров центральных T-клеток памяти, в том числе CD45RO, CD62L, CCR7, CD28, CD27, CD122 и CD127, и негативные по гранзиму B. В некоторых вариантах осуществления центральные T-клетки памяти представляют собой CD45RO+, CD62L+, CD8+ T-клетки.
В определенных вариантах осуществления размножают CD4+ T-лимфоциты, характеризующиеся экспрессией фенотипических маркеров наивных CD4+клеток, в том числе CD62L, и негативные по экспрессии CD45RAи/или CD45RO. В некоторых вариантах осуществления CD4+клетки характеризуются экспрессией фенотипических маркеров центральных CD4+ клеток памяти, в том числе CD62L, и CD45RO-позитивных. В некоторых вариантах осуществления эффекторные CD4+ клетки являются CD62L-позитивными и CD45RO-негативными.
В определенных вариантах осуществления T-клетки выделяют из индивидуума и модифицируют без дальнейших манипуляций ex vivo или in vitro. Такие клетки затем можно напрямую повторно вводить индивидууму. В дополнительных вариантах осуществления T-клетки сначала активируют и стимулируют к пролиферации in vitro, перед тем как подвергнуть генетической модификации для экспрессии разработанного TCR или CAR. В связи с этим Т-клетки можно культивировать до и/или после того как их подвергают генетической модификации (т.е. трансдуцируют или трансфицируют для экспрессии разработанного TCR или CAR, рассмотренного в данном документе).
2. Активация и размножение
Для достижения достаточных терапевтических доз композиций на основе T-клеток зачастую проводят один или более раундов стимуляции, активации и/или размножения T-клеток. Как правило, T-клетки можно активировать и размножать с применением способов, описываемых, например, в патентах США 6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514 и 6867041, каждый из которых включен в данный документ посредством ссылки в своей полноте. T-клетки, модифицированные для экспрессии разработанного TCR или CAR, можно активировать и размножать перед модификацией T-клеток и/или после нее. Кроме того, T-клетки можно приводить в контакт с одним или более средствами, которые модулируют путь передачи сигнала в клетке PI3K/AKT/mTOR перед, во время и/или после активации и/или размножения. В одном варианте осуществления T-клетки, произведенные с помощью способов, рассмотренных в данном документе, подвергают одному, двум, трем, четырем или пяти или более раундам активации и размножения, каждый из которых может предусматривать одно или более средств, которые модулируют путь передачи сигнала в клетке PI3K/AKT/mTOR.
В одном варианте осуществления костимулирующий лиганд присутствует на антиген-презентирующей клетке (например, aAPC, дендритной клетке, B-клетке и т.п.), который специфически связывает когнатную костимулирующую молекулу на T-клетке, с обеспечением тем самым сигнала, который, в дополнение к первичному сигналу, обеспечиваемому, к примеру, связыванием комплекса TCR/CD3, опосредует необходимый T-клеточный ответ. Подходящие костимулирующие лиганды включают без ограничений CD7, B7-1 (CD80), B7-2 (CD86), PD-L 1, PD-L2, 4-1BBL, OX40L, индуцируемый костимулирующий лиганд (ICOS-L), молекулу межклеточной адгезии (ICAM), CD30L, CD40, CD70, CD83, HLA-G, MICA, MICB, HVEM, бета-рецептор лимфотоксина, ILT3, ILT4, агонист или антитело, которые связывают Toll-подобный рецептор, и лиганд, который специфически связывается с B7-H3.
В конкретном варианте костимулирующий лиганд включает антитело или его антиген-связывающий фрагмент, которые специфически связываются с костимулирующей молекулой, присутствующей на T-клетке, в том числе без ограничений CD27, CD28, 4-IBB, OX40, CD30, CD40, PD-1, 1COS, лимфоцитарным функциональным антигеном-1 (LFA-1), CD7, LIGHT, NKG2C, B7-H3, и лиганд, который специфически связывается с CD83.
Подходящие костимулирующие лиганды дополнительно включают целевые антигены, которые могут находиться в растворимой форме или экспрессироваться на APC или aAPC, которые связывают разработанные TCR или CAR, экспрессированные на модифицированных T-клетках.
В различных вариантах осуществления способ производства T-клеток, рассмотренных в данном документе, включает активацию популяции клеток, включающей T-клетки, и размножение популяции T-клеток. Активацию T-клеток можно осуществлять путем обеспечения первичного стимулирующего сигнала через T-клеточный комплекс TCR/CD3 или путем стимуляции поверхностного белка CD2 и путем обеспечения вторичного костимулирующего сигнала через вспомогательную молекулу, например, CD28.
Комплекс TCR/CD3 можно стимулировать путем приведения T-клетки в контакт с подходящим CD3-связывающим средством, например, лигандом CD3 или моноклональным антителом к CD3. Иллюстративные примеры антител к CD3 включают без ограничений OKT3, G19-4, BC3 и 64.1.
В другом варианте осуществления можно использовать CD2-связывающее средство для обеспечения первичного стимулирующего сигнала для T-клеток. Иллюстративные примеры CD2-связывающих средств включают без ограничений лиганды CD2 и антитела к CD2, например, антитело T11.3 в комбинации с антителом T11.1 или T11.2 (Meuer, S. C. et al. (1984) Cell 36:897-906) и антитело 9.6 (которое распознает тот же эпитоп, что и TI 1.1) в комбинации с антителом 9-1 (Yang, S. Y. et al. (1986) J. Immunol. 137:1097-1100). Также можно использовать другие антитела, которые связываются с теми же эпитопами, что и любое из вышеописанных антител. Дополнительные антитела или комбинации антител можно подготовить и идентифицировать с помощью стандартных методик, раскрываемых в других частях данного документа.
В дополнение к первичному стимулирующему сигналу, обеспечиваемому через комплекс TCR/CD3 или посредством CD2, для индукции T-клеточных ответов требуется вторичный, костимулирующий сигнал. В конкретных вариантах осуществления для обеспечения костимулирующего сигнала можно использовать CD28-связывающий агент. Иллюстративные примеры CD28-связывающих средств включают без ограничений: природные лиганды CD 28, например, природный лиганд для CD28 (например, представитель семейства белков B7, такой как B7-1(CD80) и B7-2 (CD86); и моноклональное антитело к CD28 или его фрагмент, способные к перекрестной реакции с молекулой CD28, например, моноклональные антитела 9.3, B-T3, XR-CD28, KOLT-2, 15E8, 248.23.2 и EX5.3D10.
В одном варианте осуществления молекула, обеспечивающая первичный стимулирующий сигнал, например, молекула, которая обеспечивает стимуляцию через комплекс TCR/CD3 и CD2, и костимулирующая молекула присоединены к одной и той же поверхности.
В определенных вариантах осуществления связывающие средства, которые обеспечивают стимулирующий и костимулирующий сигналы, локализованы на поверхности клетки. Это можно осуществить посредством трансфекции или трансдукции клетки с помощью нуклеиновой кислоты, кодирующей связывающее средство, в форме, подходящей для их экспрессии на клеточной поверхности, или в качестве альтернативы посредством присоединения связывающего средства к клеточной поверхности.
В другом варианте осуществления молекула, обеспечивающая первичный стимулирующий сигнал, например, молекула, которая обеспечивает стимуляцию через комплекс TCR/CD3 и CD2, и костимулирующая молекула представлены на антиген-презентирующих клетках.
В одном варианте осуществления молекула, обеспечивающая первичный стимулирующий сигнал, например, молекула, которая обеспечивает стимуляцию через комплекс TCR/CD3 и CD2, и костимулирующая молекула находятся на отдельных поверхностях.
В определенном варианте осуществления одно из связывающих средств, которые обеспечивают стимулирующий и костимулирующий сигналы, является растворимым (обеспечивается в виде раствора), а другое средство(а) находится на одной или более поверхностях.
В конкретном варианте осуществления оба связывающие средства, которые обеспечивают стимулирующий и костимулирующий сигналы, находятся в растворимой форме (обеспечивается в виде раствора).
В различных вариантах осуществления способы производства T-клеток, рассмотренные в данном документе, включают активацию T-клеток с помощью антитела к CD3 и антитела к CD28.
Композиции на основе T-клеток, произведенных с помощью способов, рассмотренные в данном документе, содержат T-клетки, активированные и/или размноженные в присутствии одного или более средств, которые ингибируют путь передачи сигнала в клетке PI3K/AKT/mTOR. T-клетки, модифицированные для экспрессии разработанного TCR или CAR, можно активировать и размножать перед модификацией T-клеток и/или после нее. В конкретных вариантах осуществления популяцию T-клеток активируют, модифицируют для экспрессии разработанного TCR или CAR и затем культивируют для размножения.
В одном варианте осуществления T-клетки, произведенные с помощью способов, рассмотренных в данном документе, содержат повышенное количество T-клеток, экспрессирующих маркеры, свидетельствующие о высоком пролиферативном потенциале и способности к самообновлению, но которые не экспрессируют или экспрессируют фактически необнаруживаемые количества маркеров дифференцировки T-клеток. Эти T-клетки можно неоднократно активировать и размножать надежным образом и обеспечивать тем самым улучшенную терапевтическую композицию на основе T-клеток.
В одном варианте осуществления популяция T-клеток, которые активировали и размножали в присутствии одного или более средств, которые ингибировали путь передачи сигнала в клетке PI3K/AKT/mTOR, возрастает по меньшей мере в 1,5 раза, по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз, по меньшей мере в 10 раз, по меньшей мере в 25 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по меньшей мере в 250 раз, по меньшей мере в 500 раз, по меньшей мере в 1000 раз или более в сравнении с популяцией T-клеток, которые активировали и размножали без ингибитора PI3K/AKT/mTOR.
В одном варианте осуществления популяция T-клеток, характеризующихся экспрессией маркеров молодых T-клеток, которые активировали и размножали в присутствии одного или более средств, которые ингибируют путь передачи сигнала в клетке PI3K/AKT/mTOR, возрастает по меньшей мере в 1,5 раза, по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз, по меньшей мере в 10 раз, по меньшей мере в 25 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по меньшей мере в 250 раз, по меньшей мере в 500 раз, по меньшей мере в 1000 раз или более в сравнении с популяцией T-клеток, которые активировали и размножали без ингибитора PI3K/AKT/mTOR.
В одном варианте осуществления размножение T-клеток, активированных с помощью способов, рассмотренных в данном документе, дополнительно включает культивирование популяции клеток, содержащей T-клетки, в течение от нескольких часов (приблизительно 3 часов) до приблизительно 7 дней, до приблизительно 28 дней или любое целое число часов между ними. В другом варианте осуществления композицию на основе T-клеток можно культивировать в течение 14 дней. В конкретном варианте осуществления T-клетки культивируют в течение приблизительно 21 дня. В другом варианте осуществления композиции на основе T-клеток культивируют в течение приблизительно 2-3 дней. Также может потребоваться несколько циклов стимуляции/активации/размножения, так что время культивирования T-клеток может составлять 60 дней или более.
В конкретных вариантах осуществления условия, подходящие для культивирования T-клеток, включают подходящую среду (например, минимальную питательную среду, или среду RPMI 1640, или X-vivo 15 (Lonza)) и один или более факторов, необходимых для пролиферации и жизнеспособности, в том числе без ограничений сыворотку (например, фетальную бычью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, IL-21, GM-CSF, IL- 10, IL- 12, IL-15, TGFβ или TNF-α, или любые другие добавки, требуемые для роста клеток, известные специалисту в данной области.
Дополнительные иллюстративные примеры сред для культивирования клеток включают без ограничений RPMI 1640, среду Клика, AIM-V, DMEM, MEM, a-MEM, F-12, X-Vivo 1 5 и X-Vivo 20, Optimizer, с добавленными аминокислотами, пируватом натрия и витаминами, либо бессывороточные, либо дополненные соответствующим количеством сыворотки (или плазмы) или определенным набором гормонов, и/или количеством цитокина(-ов), достаточным для роста и размножения T-клеток.
Иллюстративные примеры других добавок для размножения T-клеток включают без ограничений поверхностно-активное вещество, Plasmanate, буферы для обеспечения pH, такие как HEPES, и восстанавливающие средства, такие как N-ацетилцистеин и 2-меркаптоэтан.
Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, а не в культуры клеток, которые предназначены для инфузии субъекту. Целевые клетки поддерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, 37°C) и атмосфере (например, воздух с 5% C02).
В конкретных вариантах осуществления PBMC или выделенные Т-клетки приводят в контакт со стимулирующим средством и костимулирующим средством, таким как антитела к CD3 и CD28, как правило, присоединенными к грануле или другой поверхности, в среде для культивирования с соответствующими цитокинами, такими как IL-2, IL-7 и/или IL-15.
В других вариантах осуществления искусственные APC (aAPC) получают путем разработки клеток K562, U937, 721.221, T2 и C1R, которые предназначены для стабильной экспрессии и секреции целого ряда костимулирующих молекул и цитокинов. В конкретном варианте осуществления применяют aAPC в виде K32 или U32, предназначенные для выставления одной или более стимулирующих молекул на основе антитела на клеточной поверхности AAPC. Популяции Т-клеток можно размножать при помощи aAPC, экспрессирующих различные костимулирующие молекулы, в том числе без ограничений CD137L (4-1BBL), CD134L (OX40L) и/или CD80 или CD86. Наконец, aAPC обеспечивают эффективную платформу для размножения генетически модифицированных Т-клеток и для поддержания экспрессии CD28 на CD8 Т-клетках. aAPC, предусмотренные в WO 03/057171 и US2003/0147869, включены тем самым посредством ссылки во всей своей полноте.
3. Средства
В различных вариантах осуществления предусмотрен способ производства T-клеток, в котором размножают недифференцированные или T-клетки с высокой активностью в отношении развития, включающие приведение T-клеток в контакт со средством, которое модулирует путь PI3K/AKT/mTOR в клетках. Клетки можно приводить в контакт перед, во время и/или после активации и размножения. Композиции на основе T-клеток сохраняют достаточную активность T-клеток, так что они могут подвергаться нескольким раундам размножения без существенного повышения дифференцировки.
Используемые в данном документе термины «модулировать», «модулятор» или «модулирующее средство» или аналогичный термин относятся к способности средства вызывать изменение пути передачи сигнала в клетке. Модулятор может повышать или снижать количество, активность компонента пути, или повышать или снижать требуемый эффект или выход пути передачи сигнала в клетке. В одном варианте осуществления модулятор является ингибитором. В другом варианте осуществления модулятор является активатором.
«Средство» относится к соединению, малой молекуле, например, малой органической молекуле, нуклеиновой кислоте, полипептиду или его фрагменту, изоформе, варианту, аналогу или производному, применяемым в модуляции пути PI3K/AKT/mTOR.
«Малая молекула» относится к композиции, которая имеет молекулярную массу менее приблизительно 5 кДа, менее приблизительно 4 кДа, менее приблизительно 3 кДа, менее приблизительно 2 кДа, менее приблизительно 1 кДа или менее приблизительно 0,5 кДа. Малые молекулы могут включать нуклеиновые кислоты, пептиды, полипептиды, пептидомиметики, пептоиды, углеводы, липиды, их компоненты или другие органические или неорганические молекулы. Библиотеки химических и/или биологических смесей, таких как экстракты грибов, бактерий или водорослей, известны из уровня техники и их можно подвергнуть скринингу с помощью любого из анализов по настоящему изобретению. Примеры способов синтеза молекулярных библиотек можно найти в (Carell et al., 1994a; Carell et al., 1994b; Cho et al., 1993; DeWitt et al., 1993; Gallop et al., 1994; Zuckermann et al., 1994).
«Аналог» относится к малому органическому соединению, нуклеотиду, белку или полипептиду, которые обладают аналогичной или идентичной активностью или функцией(-ями), что и соединение, нуклеотид, белок или полипептид, или к соединению с активностью, требуемой согласно настоящему изобретению, необязательно содержащему последовательность или структуру, которые аналогичны или идентичны последовательности или структуре предпочтительного варианта осуществления.
«Производное» относится к любому соединению, белку или полипептиду, которые содержат аминокислотную последовательность исходного белка или полипептида, которая была изменена путем введения замены, делеции или добавления аминокислотного остатка, или нуклеиновой кислоте или нуклеотиду, которые были модифицированы любым введением нуклеотидных замен или делеций, добавлений или мутаций. Производная нуклеиновая кислота, нуклеотид, белок или полипептид обладает аналогичной или идентичной функцией, что и у исходного полипептида.
В различных вариантах осуществления средство, которое модулирует путь PI3K/AKT/mTOR активирует компонент данного пути. «Активатор» или «агонист» относится к средству, которое стимулирует, повышает или индуцирует одну или более активностей молекулы в пути PI3K/AKT/mTOR, в том числе без ограничений молекулы, которая ингибирует одну или более активностей PI3K, Akt или mTOR (или комплекса mTORC1, mTORC2).
В различных вариантах осуществления средство, которое модулирует путь PI3K/AKT/mTOR ингибирует компонент данного пути. «Ингибитор» или «антагонист» относится к средству, которое ингибирует, снижает или уменьшает одну или более активностей молекулы в пути PI3K/AKT/mTOR, в том числе без ограничений PI3K, Akt или mTOR (или комплекса mTORC1, mTORC2). В одном варианте осуществления ингибитор представляет собой ингибитор двух молекул. В одном варианте осуществления ингибитор предотвращает образование белковых комплексов, таких как комплекс mTORCl или сходные комплексы. В конкретном варианте осуществления ингибитор может ингибировать класс молекул, которые имеют одинаковую или фактически аналогичную активность (общий ингибитор), или может специфически ингибировать активность молекулы (селективный или специфический ингибитор). Ингибирование также может быть необратимым или обратимым.
В одном варианте осуществления ингибитор характеризуется IC50, составляющей по меньшей мере 1 нМ, по меньшей мере 2 нМ, по меньшей мере 5 нМ, по меньшей мере 10 нМ, по меньшей мере 50 нМ, по меньшей мере 100 нМ, по меньшей мере 200 нМ, по меньшей мере 500 нМ, по меньшей мере 1 мкМ, по меньшей мере 10 мкМ, по меньшей мере 50 мкМ или по меньшей мере 100 мкМ. Определение IC50 можно проводить с применением любых традиционных методик, известных из уровня техники. Например, IC50 можно определить путем измерения активности данного фермента в присутствии целого ряда концентраций исследуемого ингибитора. Экспериментально полученные значения активности фермента затем наносят на график в зависимости от применяемых концентраций ингибитора. Концентрация ингибитора, при которой проявляется 50% активности фермента (по сравнению с активностью в отсутствие какого-либо ингибитора), принимается как значение «IC50». Аналогично, другие ингибирующие концентрации можно определить путем соответствующего определения активности.
В различных вариантах осуществления T-клетки приводят в контакт, или обрабатывают, или культивируют с одним или более модуляторами пути PI3K/AKT/mTOR при концентрации, составляющей по меньшей мере 1 нМ, по меньшей мере 2 нМ, по меньшей мере 5 нМ, по меньшей мере 10 нМ, по меньшей мере 50 нМ, по меньшей мере 100 нМ, по меньшей мере 200 нМ, по меньшей мере 500 нМ, по меньшей мере 1 мкМ, по меньшей мере 10 мкМ, по меньшей мере 50 мкМ, по меньшей мере 100 мкМ или по меньшей мере 1 М.
В конкретных вариантах осуществления T-клетки можно приводить в контакт, или обрабатывать, или культивировать с одним или более модуляторами пути PI3K/AKT/mTOR в течение по меньшей мере 12 часов, 18 часов, по меньшей мере 1, 2, 3, 4, 5, 6 или 7 дней, по меньшей мере 2 недель, по меньшей мере 1, 2, 3, 4, 5 или 6 месяцев или более с 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более раундами размножения.
a. Путь PI3K/AKT/mTOR
Путь фосфатидил-инозитол-3-киназа/Akt/мишень рапамицина в клетках млекопитающих (PI3K/Akt/mTOR) служит в качестве посредника для интеграции передачи сигналов с помощью факторов роста с пролиферацией, дифференцировкой, метаболизмом и выживанием клетки. PI3K представляют собой семейство высоко консервативных внутриклеточных липидкиназ. PI3K класса IA активируются тирозинкиназами-рецепторами факторов роста (RTK), либо напрямую, либо через взаимодействие с семейством адапторных молекул-субстратов инсулинового рецептора. Данная активность приводит к образованию фосфатидил-инозитол-3,4,5-трифосфата (PIP3) - регулятора серин/треониновой киназы Akt. mTOR действует через канонический путь PI3K посредством 2 различных комплексов, при этом каждый из них характеризуется отличающимися партнерами по связыванию, которые обуславливают различную активность. mTORC1 (mTOR в комплексе с PRAS40, раптором и mLST8/GbL) действует в качестве нижерасположенного эффектора передачи сигнала PI3K/Akt, посредством связывания сигналов факторов роста с трансляцией белков, ростом, пролиферацией и выживанием клеток. mTORC2 (mTOR в комплексе с риктором, mSIN1, протором и mLST8) действуют в качестве вышерасположенного активатора Akt.
После опосредованной факторами роста активации PI3K Akt привлекается к мембране посредством взаимодействия ее плестринового гомологичного домена с PIP3, тем самым открывается ее активационная петля и создается возможность фосфорилирования по треонину 308 (Thr308) под действием конститутивно активной фосфоинозитид-зависимой протеинкиназы 1 (PDK1). Для максимальной активации Akt также фосфорилируется под действием mTORC2 по серину 473 (Ser473) ее C-терминального гидрофобного мотива. Также было показано, что DNA-PK и HSP важны в регуляции активности Akt. Akt активирует mTORC1 посредством ингибирующего фосфорилирования TSC2, который вместе с TSC1, производит отрицательную регуляцию mTORC1 путем ингибирования ГТФазы Rheb, положительного регулятора mTORC1. mTORC1 имеет 2 четко определенных субстрата, p70S6K (называемый ниже в данном документе S6K1) и 4E-BP1, оба из которых крайне важны для регуляции синтеза белков. Таким образом, mTORC1 представляет собой важный нижерасположенный эффектор PI3K, связывающий передачу сигнала с помощью факторов роста с трансляцией белка и пролиферацией клеток.
b. Ингибиторы mTOR
Термины «ингибитор mTOR» или «средство, которое ингибирует mTOR» относятся к нуклеиновой кислоте, пептиду, соединению или малой органической молекуле, которые ингибируют по меньшей мере одну активность белка mTOR, такую как, к примеру, активность серин/треониновой протеинкиназы в отношении по меньшей мере одного из ее субстратов (например, p70S6 киназа 1, 4E-BP1, AKT/PKB и eEF2). Ингибиторы mTOR способны непосредственно связываться и ингибировать mTORC1, mTORC2 или оба mTORC1 и mTORC2.
Ингибирование активности mTORC1 и/или mTORC2 можно обнаружить по снижению передачи сигнала в пути PI3K/Akt/mTOR. Целый ряд показателей можно использовать для определения снижения результата такого пути передачи сигнала. Некоторые неограничивающие примеры показателей включают (1) снижение фосфорилирования Akt по остаткам, в том числе без ограничений 5473 и T308; (2) снижение активации Akt, о чем свидетельствует, например, снижение фосфорилирование субстратов Akt, в том числе без ограничений Fox01/O3a T24/32, GSK3a/β; S21/9 и TSC2 T1462; (3) снижение фосфорилирования молекул передачи сигнала, расположенных ниже mTOR, в том числе без ограничений рибосомальной S6 S240/244, 70S6K T389 и 4EBP1 T37/46; и (4) ингибирование пролиферации раковых клеток.
В одном варианте осуществления ингибиторы mTOR являются ингибиторами активного центра. Они представляют собой ингибиторы mTOR, которые связываются с сайтом связывания АТФ (также называемым АТФ-связывающим карманом) mTOR и ингибируют каталитическую активность обоих mTORC1 и mTORC2. Одним классом ингибиторов активного центра, пригодных для применения в способах производства T-клеток, рассмотренных в данном документе, являются ингибиторы с двойной специфичностью, которые нацеливаются и напрямую ингибируют как PI3K, так и mTOR. Ингибиторы с двойной специфичностью связываются с обоими сайтами связывания АТФ в mTOR и PI3K. Иллюстративные примеры таких ингибиторов включают без ограничений: имидазохиназолины, вортманнин, LY294002, PI-103 (Cayman Chemical), SF1126 (Semafore), BGT226 (Novartis), XL765 (Exelixis) и NVP-BEZ235 (Novartis).
Другой класс ингибиторов активного центра mTOR, пригодных для применения в способах, рассмотренных в данном документе, селективно ингибирует активность mTORC1 и mTORC2 по сравнению с одной или более фосфатидилинозитол 3-киназами I типа, например, PI3-киназой α, β, γ или δ. Эти ингибиторы активного центра связываются с активным центром mTOR, но не PI3K. Иллюстративные примеры таких ингибиторов включают без ограничений: пиразолопиримидины, Torin1 (Guertin and Sabatini), PP242 (2-(4-амино-1-изопропил-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-5-ол), PP30, Ku-0063794, WAY-600 (Wyeth), WAY-687 (Wyeth), WAY-354 (Wyeth) и AZD8055 (Liu et al., Nature Review, 8, 627-644, 2009). I
В одном варианте осуществления селективный ингибитор mTOR относится к средству, которое проявляет 50% ингибирующую концентрацию (IC50) в отношении mTORC1 и/или mTORC2, которая ниже IC50 ингибитора в отношении одной, двух, трех или более PI3-киназ I типа или в отношении всех PI3-киназ I типа по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по меньшей мере в 1000 раз или более.
Другой класс ингибиторов mTOR для применения в настоящем изобретении называются в данном изобретении «рапалоги». Используемый в данном документе термин «рапалоги» относится к соединениям, которые специфически связываются с FRB-доменом mTOR (FKBP-домен связывания рапамицина), они структурно родственны рапамицину и сохраняют свойства ингибирования mTOR. Термин рапалоги исключает рапамицин. Рапалоги включают сложные эфиры, простые эфиры, оксимы, гидразоны и гидроксиламины рапамицина, а также соединения, в которых функциональные группы на основной структуре рапамицина были модифицированы, например, путем восстановления или окисления. Фармацевтически приемлемые соли таких соединений также считаются производными рапамицина. Иллюстративные примеры рапалогов, пригодных для применения в способах, рассмотренных в данном документе, включают без ограничений темсиролимус (CC1779), эверолимус (RAD001), дефоролимус (AP23573), AZD8055 (AstraZeneca) и OSI-027 (OSI).
В одном варианте осуществления средство представляет собой рапамициновый ингибитор mTOR (сиролимус).
В конкретном варианте осуществления примеры ингибиторов mTOR для применения в настоящем изобретении ингибируют один из mTORC1, mTORC2 или оба mTORC1 и mTORC2 с IC50 (концентрация, при которой ингибируется 50% активности), составляющей приблизительно 200 нМ или менее, предпочтительно приблизительно 100 нМ или менее, даже более предпочтительно приблизительно 60 нМ или менее, приблизительно 25 нМ, приблизительно 10 нМ, приблизительно 5 нМ, приблизительно 1 нМ, 100 мкМ, 50 мкМ, 25 мкМ, 10 мкМ, 1 мкМ или менее. В одном аспекте ингибитор mTOR для применения в настоящем изобретении ингибирует один из mTORC1, mTORC2 или оба mTORC1 и mTORC2 с IC50 от приблизительно 2 нМ до приблизительно 100 нМ, более предпочтительно от приблизительно 2 нМ до приблизительно 50 нМ, даже более предпочтительно от приблизительно 2 нМ до приблизительно 15 нМ.
В одном варианте осуществления примеры ингибиторов mTOR ингибируют либо PI3K и mTORC1 или mTORC2, либо оба mTORC1 и mTORC2 и PI3K c IC50 (концентрация, при которой ингибируется 50% активности), составляющей приблизительно 200 нМ или менее, предпочтительно приблизительно 100 нМ или менее, даже более предпочтительно приблизительно 60 нМ или менее, приблизительно 25 нМ, приблизительно 10 нМ, приблизительно 5 нМ, приблизительно 1 нМ, 100 мкМ, 50 мкМ, 25 мкМ, 10 мкМ, 1 мкМ или менее. В одном аспекте ингибитор mTOR для применения в настоящем изобретении ингибирует PI3K и mTORC1 или mTORC2 или оба mTORC1 и mTORC2 и PI3K с IC50 от приблизительно 2 нМ до приблизительно 100 нМ, более предпочтительно от приблизительно 2 нМ до приблизительно 50 нМ, даже более предпочтительно от приблизительно 2 нМ до приблизительно 15 нМ.
Дополнительные иллюстративные примеры ингибиторов mTOR, пригодных для применения в конкретных вариантах осуществления, рассмотренных в данном документе, включают без ограничений AZD8055, INK128, рапамицин, PF-04691502 и эверолимус.
Было показано, что mTOR демонстрирует надежную и специфическую каталитическую активность в отношении физиологических субстратных белков, p70 S6 рибосомальной протеин киназы I (p70S6K1) и eIF4E-связывающего белка 1 (4EBP1), как измеряется с помощью фосфор-специфических антител в вестерн-блоттинге.
В одном варианте осуществления ингибитор пути PI3K/AKT/mTOR представляет собой ингибитор s6-киназы, выбранный из группы, включающей BI-D1870, H89, PF-4708671, FMK и AT7867.
c. Ингибиторы PI3K
Используемый в данном документе термин «ингибитор PI3K» относится к нуклеиновой кислоте, пептиду, соединению или малой органической молекуле, которые связываются с по меньшей мере одной активностью PI3K и ингибируют ее. Белки PI3K можно разделить на три класса, PI3K класса 1, PI3K класса 2 и PI3K класса 3. PI3K класса 1 существуют в виде гетеродимеров, состоящих из одной из четырех каталитических субъединиц p110 (p110α, p110β, p110δ и p110γ) и одной из двух семейств регуляторных субъединиц. Ингибитор PI3K по настоящему изобретению предпочтительно нацеливается на ингибиторы PI3K класса 1. В одном варианте осуществления ингибитор PI3K будет проявлять селективность в отношении одной или более изоформ ингибиторов PI3K класса 1 (т.е. селективность в отношении p110α, p110β, p110δ и p110γ или одной или более из p110α, p110β, p110δ и p110γ). В другом аспекте ингибитор PI3K ингибитор не буде проявлять селективность в отношении изоформы и будет считаться «общим ингибитором PI3K». В одном варианте осуществления ингибитор PI3K будет конкурировать за связывание с АТФ с каталитическим доменом PI3K.
В определенных вариантах осуществления ингибитор PI3K, например, может нацеливаться на PI3K, а также дополнительные белки в пути PI3K-AKT-mTOR. В конкретных вариантах осуществления ингибитор PI3K, который нацеливается на оба mTOR и PI3K, можно относить либо к ингибитору mTOR, либо к ингибитору PI3K. Ингибитор PI3K, который нацеливается только на PI3K, можно относить к селективному ингибитору PI3K. В одном варианте осуществления может подразумеваться, что селективный ингибитор PI3K относится к средству, которое проявляет 50% ингибирующую концентрацию в отношении PI3K, которая ниже IC50 ингибитора в отношении mTOR и/или других белков в пути по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 30 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по меньшей мере в 1000 раз или более.
В конкретном варианте осуществления примеры ингибиторов PI3K ингибируют PI3K с IC50 (концентрация, при которой ингибируется 50% активности), составляющей приблизительно 200 нМ или менее, предпочтительно приблизительно 100 нМ или менее, даже более предпочтительно приблизительно 60 нМ или менее, приблизительно 25 нМ, приблизительно 10 нМ, приблизительно 5 нМ, приблизительно 1 нМ, 100 мкМ, 50 мкМ, 25 мкМ, 10 мкМ, 1 мкМ или менее. В одном варианте осуществления ингибитор PI3K ингибирует PI3K с IC50 от приблизительно 2 нМ до приблизительно 100 нМ, более предпочтительно от приблизительно 2 нМ до приблизительно 50 нМ, даже более предпочтительно от приблизительно 2 нМ до приблизительно 15 нМ.
Иллюстративные примеры ингибиторов PI3K, пригодных для применения в способах производства T-клеток, рассмотренных в данном документе, включают без ограничений BKM120 (ингибитор PI3K класса 1, Novartis), XL147 (ингибитор PI3K класса 1, Exelixis), (общий ингибитор PI3K, GlaxoSmithKline) и PX-866 (ингибитор PI3K класса 1; изоформы p110α, p110β и p110γ, Oncothyreon).
Другие иллюстративные примеры селективных ингибиторов PI3K включают без ограничений BYL719, GSK2636771, TGX-221, AS25242, CAL-101, ZSTK474 и IPI-145.
Дополнительные иллюстративные примеры общих ингибиторов PI3K включают без ограничений BEZ235, LY294002, GSK1059615 и GDC-0941.
d. Ингибиторы AKT
Используемый в данном документе термин «ингибитор AKT» относится к нуклеиновой кислоте, пептиду, соединению или малой органической молекуле, которые ингибируют по меньшей мере одну активность AKT. Ингибиторы AKT можно сгруппировать в несколько классов, в том числе ингибиторы на липидной основе (например, ингибиторы, которые нацеливаются на плекстриновый гомологичный домен AKT, что предотвращает локализацию AKT на плазматических мембранах), АТФ-конкурентные ингибиторы и аллостерические ингибиторы. В одном варианте осуществления ингибиторы AKT действуют путем связывания с каталитическим центром AKT. В конкретном варианте осуществления ингибиторы Akt действуют путем ингибирования фосфорилирования нижерасположенных мишеней AKT, таких как mTOR. В другом варианте осуществления активность AKT ингибируется путем ингибирования входящих сигналов для Akt путем ингибирования, например, активации AKT под действием DNA-PK, активации AKT под действием PDK-1 и/или активации Akt под действием mTORC2.
Ингибиторы AKT могут нацеливаться на все три изоформы AKT, AKT1, AKT2, AKT3, или могут быть селективными в отношении изоформы и нацеливаться только на одну или две из изоформ AKT. В одном варианте осуществления ингибитор AKT может нацеливаться на AKT, а также дополнительные белки в пути PI3K-AKT-mTOR. Ингибитор AKT, который нацеливается только на AKT, можно относить к селективному ингибитору AKT. В одном варианте осуществления может подразумеваться, что селективный ингибитор AKT относится к средству, которое проявляет 50% ингибирующую концентрацию в отношении AKT, которая ниже IC50ингибитора в отношении других белков в пути по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 30 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз, по меньшей мере в 1000 раз или более.
В конкретном варианте осуществления примеры ингибиторов AKT ингибируют AKT с IC50 (концентрация, при которой ингибируется 50% активности), составляющей приблизительно 200 нМ или менее, предпочтительно приблизительно 100 нМ или менее, даже более предпочтительно приблизительно 60 нМ или менее, приблизительно 25 нМ, приблизительно 10 нМ, приблизительно 5 нМ, приблизительно 1 нМ, 100 мкМ, 50 мкМ, 25 мкМ, 10 мкМ, 1 мкМ или менее. В одном варианте осуществления AKT ингибирует AKT с IC50 от приблизительно 2 нМ до приблизительно 100 нМ, более предпочтительно от приблизительно 2 нМ до приблизительно 50 нМ, даже более предпочтительно от приблизительно 2 нМ до приблизительно 15 нМ.
Иллюстративные примеры ингибиторов AKT для применения в комбинации с конъюгатами антитело-лекарственное средство на основе ауристатина включают, например, перифосин (Keryx), MK2206 (Merck), VQD-002 (VioQuest), XL418 (Exelixis), GSK690693, GDC-0068 и PX316 (PROLX Pharmaceuticals).
Иллюстративным неограничивающим примером селективного ингибитора Akt1 является A-674563.
Иллюстративным неограничивающим примером селективного ингибитора Akt2 является CCT128930.
В конкретных вариантах осуществления ингибитор Akt ингибирует активацию Akt под действием DNA-PK, активацию Akt под действием PDK-1, активацию Akt под действием mTORC2 и активацию Akt под действием HSP.
Иллюстративные примеры ингибиторов DNA-PK включают без ограничений NU7441, PI-103, NU7026, PIK-75 и PP-121.
D. Разработанные T-клеточные рецепторы и химерные антигенные рецепторы
Рассмотренные способы производства T-клеток особенно применимы для размножения T-клеток, модифицированных для экспрессии высокоаффинных T-клеточных рецепторов (разработанных TCR) или химерных антигенных рецепторов (CAR) без сопутствующего повышения дифференцировки этих модифицированных T-клеток. В одном варианте осуществления T-клетка является генетически модифицированной для экспрессии одного или более разработанных TCR или CAR. Используемые в данном документе T-клетки, модифицированные для экспрессии разработанных TCR или CAR, рассмотренные в данном документе, могут называться «антиген-специфическими перенаправленными T-клетками».
1. Разработанные TCR
Встречающиеся в природе T-клеточные рецепторы содержат две субъединицы, α-субъединицу и β-субъединицу, каждая из которых представляет собой уникальный белок, образованный за счет акта рекомбинации в геноме каждой T-клетки. Библиотеки TCR можно подвергать скринингу на их селективность в отношении конкретных целевых антигенов. Таким образом, природные TCR, которые характеризуются высокой авидностью и реактивностью в отношении целевых антигенов, можно отбирать, клонировать и затем вводить в популяцию T-клеток, применяемых для адоптивной иммунотерапии.
В одном варианте осуществления T-клетки модифицируют путем введения полинуклеотида, кодирующего субъединицу TCR, которая способна формировать TCR, которые придают T-клеткам специфичность в отношении опухолевых клеток, экспрессирующих целевой антиген. В конкретных вариантах осуществления субъединицы характеризуются одной или более аминокислотными заменами, делециями, вставками или модификациями относительно встречающихся в природе субъединиц, при условии, что субъединицы сохраняют способность формировать TCR, придающие трансфицированным T-клеткам способность наводиться на целевые клетки и принимать участие в иммуногенной передаче цитокиновых сигналов. Разработанные TCR предпочтительно также связывают целевые клетки, на которых находится соответствующий опухолеассоциированный пептид, с высокой авидностью и необязательно опосредуют эффективный цитолиз целевых клеток, на которых присутствует соответствующий пептид in vivo.
Нуклеиновые кислоты, кодирующие разработанные TCR, предпочтительно выделены из их природного контекста в (встречающейся в природе) хромосоме T-клетки и могут быть вставлены в подходящие векторы, как описано в других частях данного документа. Как нуклеиновые кислоты, так и содержащие их векторы можно эффективно переносить в клетку, которая предпочтительно представляет собой T-клетку. Модифицированные T-клетки тогда приобретают способность к экспрессии одной или более цепей TCR (и, предпочтительно, двух цепей), кодируемых трансдуцированной нуклеиновой кислотой или нуклеиновыми кислотами. В предпочтительных вариантах осуществления разработанный TCR представляет собой экзогенный TCR, ввиду того, что его вводят в T-клетки, которые в норме не экспрессируют конкретный TCR. Существенным аспектом разработанных TCR является то, что они характеризуются высокой авидностью в отношении опухолевого антигена, презентируемого молекулой главного комплекса гистосовместимости (MHC) или аналогичным иммунологическим компонентом. В отличие от разработанных TCR CAR разрабатывают для связывания целевых антигенов независимым от MHC способом.
Белок, кодируемый нуклеиновыми кислотами по настоящему изобретению, можно экспрессировать с дополнительными полипептидами, прикрепленными к амино-концевой или карбокси-концевой части α-цепи или β-цепи TCR по настоящему изобретению, при условии что прикрепленный дополнительный полипептид не препятствует способности α-цепи или β-цепи формировать функциональный T-клеточный рецептор и обеспечивать MHC-зависимое распознавание антигена.
Антигены, которые распознаются разработанными TCR, рассмотренными в данном документе, включают без ограничений раковые антигены, в том числе антигены как форм рака системы кроветворения, так и солидных опухолей. Иллюстративные антигены включают без ограничений фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM и VEGFR2.
2. Химерные антигенные рецепторы (CAR)
Способы производства T-клеток, рассмотренные в данном документе, включают модификацию T-клеток для экспрессии одного или более CAR, рассматриваемых в данном документе. В различных вариантах осуществления настоящего изобретения предусмотрены T-клетки, полученные методами генной инженерии с помощью векторов, разработанных для экспрессии CAR, которые перенаправляют цитотоксичность на опухолевые клетки. CAR представляют собой молекулы, в которых объединена специфичность антитела к целевому антигену (например, опухолевому антигену) с внутриклеточным активирующим доменом Т-клеточного рецептора с получением химерного белка, который проявляет специфическую противоопухолевую клеточную иммунную активность. Используемый в данном документе термин «химерный» обозначает составленный из частей различных белков или ДНК из различных источников.
CAR, рассмотренные в данном документе, содержат внеклеточный домен, который связывается со специфическим целевым антигеном (также называемый связывающий домен или антиген-специфический связывающий домен), трансмембранный домен и внутриклеточный домен передачи сигнала. Основной характеристикой CAR является их способность перенаправлять специфичность иммунной эффекторной клетки, запуская тем самым пролиферацию, продукцию цитокинов, фагоцитоз или продукцию молекул, которые могут опосредовать клеточную гибель клетки, экспрессирующей целевой антиген, независимым от главного комплекса гистосовместимости (MHC) способом, с использованием специфических в отношении клетки нацеливающих способностей моноклональных антител, растворимых лигандов или специфических в отношении клетки корецепторов.
В конкретных вариантах осуществления CAR содержит внеклеточный связывающий домен, в том числе без ограничений антитело или его антиген-связывающий фрагмент, связанный лиганд или внеклеточный домен корецептора, который специфически связывает целевой антиген, выбранный из группы, включающей фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM и VEGFR2; один или более шарнирных доменов или спейсерных доменов; трансмембранный домен, в том числе без ограничений трансмембранные домены из CD8α, CD4, CD45, PD-1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, в том числе без ограничений внутриклеточные домены передачи костимулирующего сигнала из CD28, CD54 (ICAM), CD134 (OX40), CD137 (41BB), CD152 (CTLA4), CD273 (PD-L2), CD274 (PD-L1) и CD278 (ICOS); и домены передачи первичного сигнала из CD3ζ или FcRγ.
a. Связывающий домен
В конкретных вариантах осуществления CAR, рассмотренные в данном документе, содержат внеклеточный связывающий домен, который специфически связывается с целевым полипептидом, например, целевым антигеном, экспрессируемым на опухолевой клетке. Используемые в данном документе термины «связывающий домен», «внеклеточный домен», «внеклеточный связывающий домен», «антиген-специфический связывающий домен» и «внеклеточный антиген-специфический связывающий домен» являются взаимозаменяемыми и предусматривают CAR с возможностью специфично связываться с целевым антигеном, представляющим интерес. Связывающий домен может содержать любой белок, полипептид, олигопептид или пептид, который обладает способностью специфически распознавать и связываться с биологической молекулой (например, рецептором клеточной поверхности или опухолевым белком, липидом, полисахаридом или другой целевой молекулой клеточной поверхности или их компонентом). Связывающий домен включает любого встречающегося в природе, синтетического, полусинтетического или полученного рекомбинантным путем партнера по связыванию для биологической молекулы, представляющей интерес.
В конкретных вариантах осуществления внеклеточный связывающий домен CAR содержит антитело или его антиген-связывающий фрагмент. Термин «антитело» относится к связывающему агенту, который представляет собой полипептид, содержащий по меньшей мере вариабельную область легкой цепи или тяжелой цепи иммуноглобулина, которая специфически распознает и связывает эпитоп целевого антигена, такого как пептид, липид, полисахарид или нуклеиновая кислота, содержащий антигенную детерминанту, распознаваемую иммунной клеткой. Антитела включают их антиген-связывающие фрагменты. Термин также включает полученные методами генной инженерии формы, такие как химерные антитела (например, гуманизированные мышиные антитела), гетероконъюгатные антитела (такие как, биспецифические антитела) и их антиген-связывающие фрагменты. См. также Pierce Catalog and Handbook, 1994-1995 (Pierce Chemical Co., Рокфорд, Иллинойс); Kuby, J., Immunology, 3rd Ed., W. H. Freeman & Co., New York, 1997.
В конкретных вариантах осуществления целевой антиген представляет собой эпитоп полипептида фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2.
Вариабельные области легкой и тяжелой цепей содержат «каркасную область», прерываемую гипервариабельными участками, также называемыми «определяющими комплементарность участками» или «CDR». CDR можно определять или идентифицировать с помощью традиционных способов, например, с помощью последовательности по Kabat и др. (Wu, TT and Kabat, E. A., J Exp Med. 132(2):211-50, (1970); Borden, P. and Kabat E. A., PNAS, 84: 2440-2443 (1987); (см. Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, 1991, которая тем самым включена посредством ссылки), или с помощью структуры согласно Chothia и др. (Choithia, C. and Lesk, A.M., J Mol. Biol., 196(4): 901-917 (1987), Choithia, C. et al., Nature, 342: 877 - 883 (1989)).
Последовательности каркасных участков различных легких или тяжелых цепей относительно консервативны в пределах вида, такого как человек. Каркасный участок антитела, который представляет собой объединенные каркасные участки составляющих антитело легкой и тяжелой цепей, служит для регуляции положения и выравнивания CDR в трехмерном пространстве. Прежде всего CDR ответственны за связывание с эпитопом антигена. CDR каждой цепи, как правило, называются CDR1, CDR2 и CDR3, нумеруются последовательно, начиная с N-конца, а также, как правило, идентифицируются с помощью цепи, в которой конкретный CDR находится. Таким образом, CDR, расположенные в вариабельном домене тяжелой цепи антитела, называются CDRH1, CDRH2 и CDRH3, тогда как CDR, расположенные в вариабельном домене легкой цепи антитела, называются CDRL1, CDRL2 и CDRL3. Антитела с различной специфичностью (т.е. различными паратопами для различных антигенов) имеют разные CDR. Несмотря на то, что CDR варьируют от антитела к антителу, только ограниченное количество аминокислотных положений в пределах CDR непосредственно вовлечено в связывание антигена. Такие положения в пределах CDR называют определяющими специфичность остатками (SDR).
Ссылки на «VH» или «VH» относятся к вариабельной области тяжелой цепи иммуноглобулина, в том числе таковой антитела, Fv, ScFv, dsFv, Fab или другого фрагмента антитела, раскрываемого в данном документе. Ссылки на «VL» или «VL» относятся к вариабельной области легкой цепи иммуноглобулина, в том числе таковой антитела, Fv, ScFv, dsFv, Fab или другого фрагмента антитела, раскрываемого в данном документе.
«Моноклональное антитело» представляет собой антитело, вырабатываемое одним клоном В-лимфоцитов или клеткой, в которую были трансфицированы гены легкой и тяжелой цепи одного антитела. Моноклональные антитела получают с помощью способов, известных специалистам в данной области, например, посредством создания образующих антитела гибридных клеток путем слияния клеток миеломы с иммунными клетками селезенки. Моноклональные антитела включают гуманизированные моноклональные антитела.
«Химерное антитело» содержит каркасные остатки от одного вида, такого как человек, и CDR (которые в целом обуславливают связывание антигена) от другого вида, такого как мышь. В конкретных предпочтительных вариантах осуществления CAR, рассмотренный в данном документе, содержит антиген-специфический связывающий домен, который представляет собой химерное антитело или его антиген-связывающий фрагмент.
В некоторых предпочтительных вариантах осуществления антитело представляет собой гуманизированное антитело (такое как гуманизированное моноклональное антитело), которое специфически связывается с поверхностным белком опухолевой клетки. «Гуманизированное» антитело представляет собой иммуноглобулин, включающий человеческий каркасный участок и один или более CDR из не являющегося человеческим иммуноглобулина (например, мышиного, крысиного или синтетического). Гуманизированные антитела могут быть сконструированы при помощи методов генной инженерии (см., например, патент США № 5585089).
В конкретных вариантах осуществления внеклеточный связывающий домен CAR содержит антитело или его антиген-связывающий фрагмент, в том числе без ограничения верблюжий Ig (антитело верблюдовых (VHH)), IgNAR, Fab-фрагменты, Fab'-фрагменты, F(ab)'2-фрагменты, F(ab)'3-фрагменты, Fv, одноцепочечное Fv-антитело («scFv»), бис-scFv, (scFv)2, минитело, диатело, триатело, тетратело, стабилизированный дисульфидными связями Fv-белок («dsFv») и однодоменное антитело (sdAb, нанотело).
«Верблюжий Ig» или «VHH-антитело верблюдовых», используемые в данном документе, относятся к наименьшей известной антиген-связывающей единице из антитела, состоящего только из тяжелых цепей (Koch-Nolte, et al., FASEB J., 21: 3490-3498 (2007)). Термины «антитело, состоящее только из тяжелых цепей» или «антитело верблюдовых» относится к антителу, которое содержит два VH-домена и не содержит легких цепей (Riechmann L. et al, J. Immunol. Methods 231:25–38 (1999); WO94/04678; WO94/25591; патент США № 6005079).
«IgNAR» или «новый иммуноглобулиновый антигенный рецептор» относится к классу антител из иммунного спектра акул, которые состоят из гомодимеров из одного вариабельного домена нового антигенного рецептора (VNAR) и пяти константных доменов нового антигенного рецептора (CNAR).
Расщепление антител папаином дает два идентичных антиген-связывающих фрагмента, называемых «Fab»-фрагменты, каждый с одним антиген-связывающим сайтом, и оставшийся «Fc»-фрагмент, название которого отражает его способность легко кристаллизоваться. Fab-фрагмент содержит вариабельные домены тяжелой и легкой цепи, а также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбокси-конце СН1-домена тяжелой цепи, включающими один или более цистеиновых остатков из шарнирной области антитела. Fab'-SH в данном документе обозначает Fab', в котором цистеиновый остаток(и) константных доменов имеет свободную тиольную группу. F(аb')2-фрагменты антитела первоначально были получены как пары из Fab'-фрагментов, которые имеют общие цистеиновые остатки шарнирной области. Также известны другие средства для химического связывания фрагментов антител.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный антиген-связывающий сайт. В молекуле одноцепочечного Fv (scFv) один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связаны посредством гибкого пептидного линкера, так что легкая и тяжелая цепи могут объединяться в «димерную» структуру, аналогичную таковой у молекулы двуцепочечного Fv.
Термин «диатела» относится к фрагментам антитела с двумя антиген-связывающими сайтами, при этом фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одну полипептидную цепь (VH-VL). Путем использования линкера, который является слишком коротким, чтобы позволить образование пары между двумя доменами одной цепи, домены вынуждены образовывать пару с комплементарными доменами другой цепи и создавать два антиген-связывающих сайта. Диатела могут быть бивалентными или биспецифическими. Более полно диатела описаны, например, в EP 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); и Hollinger et al., PNAS USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в Hudson et al., Nat. Med. 9:129-134 (2003).
«Однодоменное антитело», или «sdAb», или «нанотело» относится к фрагменту антитела, который состоит из вариабельной области тяжелой цепи антитела (VH-домен) или вариабельной области легкой цепи антитела (VL-домен) (Holt, L., et al, Trends in Biotechnology, 21(11): 484-490).
«Одноцепочечные Fv» или «scFv»-фрагменты антитела содержат VH- и VL-домены антитела, где указанные домены присутствуют в одной полипептидной цепи и в любой ориентации (например, VL-VH или VH-VL). Как правило, полипептид scFv дополнительно содержит полипептидный линкер между VH- и VL-доменами, который обеспечивает возможность scFv образовать требуемую структуру для связывания антигена. Обзор scFv см., например, Pluckthün, в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York, 1994), pp. 269-315.
В предпочтительных вариантах осуществления CAR, рассмотренный в данном документе, содержит антиген-специфический связывающий домен, который представляет собой scFv (мышиный, человеческий или гуманизированный scFv), который связывает антиген, экспрессируемый на раковой клетке. В определенном варианте осуществления scFv связывает фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, 'глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM и VEGFR2.
b. Линкеры
В определенных вариантах осуществления CAR, рассмотренные в данном документе, могут содержать линкерные остатки между различными доменами, например, между VH- и VL-доменами, добавленные для соответствующего разделения их в пространстве и обеспечения конформации молекулы. CAR, рассмотренные в данном документе, могут содержать один, два, три, четыре или пять или более линкеров. В конкретных вариантах осуществления длина линкера составляет от приблизительно 1 до приблизительно 25 аминокислот, от приблизительно 5 до приблизительно 20 аминокислот или от приблизительно 10 до приблизительно 20 аминокислот, или любой другой промежуточный отрезок из аминокислот. В некоторых вариантах осуществления линкер имеет длину 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот.
Иллюстративные примеры линкеров включают глициновые полимеры (G)n; глицин-сериновые полимеры (G1-5S1-5)n, где n равняется целому числу, составляющему по меньшей мере один, два, три, четыре или пять; глицин-аланиновые полимеры; аланин-сериновые полимеры и другие гибкие линкеры, известные из уровня техники. Глициновые и глицин-сериновые полимеры являются относительно неструктурированными и, следовательно, могут служить нейтральным связующим между доменами белков слияния, таких как CAR, описанных в данном документе. Глицин обеспечивает значительно большее фи-пси пространство, чем аланин, и является намного менее ограниченным, чем остатки с более длинными цепями (см. Scheraga, Rev. Computational Chem. 11173-142 (1992)). Специалисту в данной области будет понятно, что структура CAR в конкретных вариантах осуществления может включать линкеры, которые являются полностью или частично гибкими, так что линкер может включать гибкий линкер, а также одну или более частей, обуславливающих менее гибкую структуру с обеспечением требуемой структуры CAR.
Другие примеры линкеров включают без ограничений следующие аминокислотные последовательности: GGG; DGGGS (SEQ ID NO: X); TGEKP (SEQ ID NO: X) (см., например, Liu et al., PNAS 5525-5530 (1997)); GGRR (SEQ ID NO: X) (Pomerantz et al. 1995, выше); (GGGGS)n где = 1, 2, 3, 4 или 5 (SEQ ID NO: X) (Kim et al., PNAS 93, 1156-1160 (1996.); EGKSSGSGSESKVD (SEQ ID NO:X) (Chaudhary et al., 1990, Proc. Natl. Acad. Sci. U.S.A. 87:1066-1070); KESGSVSSEQLAQFRSLD (SEQ ID NO:X) (Bird et al., 1988, Science 242:423-426), GGRRGGGS (SEQ ID NO:X); LRQRDGERP (SEQ ID NO:X); LRQKDGGGSERP (SEQ ID NO:X); LRQKd(GGGS)2 ERP (SEQ ID NO:X). В качестве альтернативы гибкие линкеры могут быть разработаны методами рационального дизайна с использованием компьютерной программы, способной моделировать как ДНК-связывающие сайты, так и пептиды сами по себе (Desjarlais & Berg, PNAS 90:2256-2260 (1993), PNAS 91:11099-11103 (1994), или с помощью способов фагового дисплея.
В конкретных вариантах осуществления CAR содержит scFV, который дополнительно содержит линкерную последовательность вариабельной области. «Линкерная последовательность вариабельной области» представляет собой аминокислотную последовательность, которая соединяет вариабельную область тяжелой цепи с вариабельной областью легкой цепи и обеспечивает спейсерную функцию, совместимую с взаимодействием двух связывающих субдоменов, так что полученный полипептид сохраняет специфическую аффинность связывания с той же целевой молекулой, что и антитело, которое содержит такие же вариабельные области легкой и тяжелой цепей. В одном варианте осуществления линкерная последовательность вариабельной области имеет дину 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот. В конкретном варианте осуществления линкерная последовательность вариабельной области содержит глицин-сериновый полимер (G1-5S1-5)n, где n равняется целому числу, составляющему по меньшей мере 1, 2, 3, 4 или 5. В другом варианте осуществления линкерная последовательность вариабельной области содержит аминокислотный линкер (G4S)3.
c. Спейсерный домен
В конкретных вариантах осуществления за связывающим доменом CAR следует один или более «спейсерных доменов», которыми называют область, отодвигающую антиген-связывающий домен от поверхности эффекторной клетки для обеспечения надлежащего контакта клетка/клетка, связывания антигена и активации (Patel et al., Gene Therapy, 1999; 6: 412-419). Спейсерный домен может быть получен из природного, синтетического, полусинтетического или рекомбинантного источника. В определенных вариантах осуществления спейсерный домен представляет собой часть иммуноглобулина, включающую без ограничения одну или более константных областей тяжелой цепи, например, CH2 и CH3. Спейсерный домен может включать аминокислотную последовательность из встречающейся в природе шарнирной области иммуноглобулина или измененной шарнирной области иммуноглобулина.
В одном варианте осуществления спейсерный домен содержит CH2 и CH3 из IgG1.
d. Шарнирный домен
За связывающим доменом CAR, как правило, следует один или более «шарнирных доменов», которые играют роль в регуляции положения антиген-связывающего домена, отодвигая его от поверхности эффекторной клетки для обеспечения надлежащего контакта клетка/клетка, связывания антигена и активации. CAR, как правило, содержит один или более шарнирных доменов между связывающим доменом и трансмембранным доменом (TM). Шарнирный домен может быть получен из природного, синтетического, полусинтетического или рекомбинантного источника. Шарнирный домен может включать аминокислотную последовательность из встречающейся в природе шарнирной области иммуноглобулина или измененной шарнирной области иммуноглобулина.
Иллюстративные шарнирные домены, пригодные для применения в CAR, описанных в данном документе, включают шарнирную область, полученную из внеклеточных областей мембранных белков 1 типа, таких как CD8α, CD4, CD28 и CD7, которые могут представлять собой шарнирные области дикого типа из этих молекул или могут быть измененными. В другом варианте осуществления шарнирный домен содержит шарнирную область CD8α.
e. Трансмембранный домен (TM)
«Трансмембранный домен» представляет собой часть CAR, которая объединяет внеклеточную связывающую часть и внутриклеточный домен передачи сигнала, а также заякоривает CAR в плазматической мембране иммунной эффекторной клетки. TM-домен может быть получен из природного, синтетического, полусинтетического или рекомбинантного источника.
Иллюстративные TM-домены могут быть получены из (т.е. содержат по меньшей мере трансмембранную область(и)) альфа, бета или зета-цепи T-клеточного рецептора, эпсилон-CD3, зета-CD3, CD4, CD5, CD9, CD 16, CD22, CD27, CD28, CD33, CD37, CD45, CD64, CD80, CD86, CD134, CD137, CD152 и CD154.
В одном варианте осуществления CAR, рассмотренный в данном документе, содержит TM-домен, полученный из CD8α. В другом варианте осуществления CAR, рассмотренный в данном документе, содержит TM-домен, полученный из CD8α, и короткий олиго- или полипептидный линкер длиной предпочтительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, который связывает TM-домен и внутриклеточный домен передачи сигнала у CAR. Глицин-сериновый линкер является особенно подходящим линкером.
f. Внутриклеточный домен передачи сигнала
В конкретных вариантах осуществления CAR, рассмотренные в данном документе, содержат внутриклеточный домен передачи сигнала. «Внутриклеточным доменом передачи сигнала» называют часть CAR, которая участвует в передаче сообщения об эффективном связывании CAR с целевым антигеном во внутреннюю часть иммунной эффекторной клетки для запуска эффекторной функции клетки, например, активации, выработки цитокина, пролиферации и цитотоксической активности, в том числе высвобождения цитотоксических факторов в CAR-связанную целевую клетку, или других клеточных ответов, вызываемых связыванием антигена с внеклеточным доменом CAR.
Термин «эффекторная функция» относится к специализированной функции клетки. Эффекторная функция Т-клетки, например, может представлять собой цитолитическую активность, или вспомогательную, или активность, включающую секрецию цитокина. Таким образом, термин «внутриклеточный домен передачи сигнала» относится к части белка, который передает сигнал для запуска эффекторной функции и который обуславливает выполнение клеткой специализированной функции. Несмотря на то, что обычно можно использовать целый внутриклеточный домен передачи сигнала, во многих случаях не является необходимым применение целого домена. В тех случаях, когда применяют усеченную часть внутриклеточного домена передачи сигнала, такую усеченную часть можно применять вместо целого домена, при условии что он передает сигнал для запуска эффекторной функции. Термин внутриклеточный домен передачи сигнала подразумевает включение любой усеченной части внутриклеточного домена передачи сигнала, достаточный для передачи сигнала для запуска эффекторной функции.
Известно, что сигналы, генерируемые посредством только TCR, являются недостаточными для полной активации Т-клетки, и что также требуется повторный или костимулирующий сигнал. Таким образом можно сказать, что активация Т-клетки опосредуется двумя различными классами внутриклеточных доменов передачи сигнала: доменами передачи первичного сигнала, которые инициируют антиген-зависимую первичную активацию посредством TCR (например, комплекса TCR/CD3), и доменами передачи костимулирующего сигнала, которые действуют независимым от антигена образом с обеспечением вторичного или костимулирующего сигнала. В предпочтительных вариантах осуществления CAR, рассмотренный в данном документе, содержит внутриклеточный домен передачи сигнала, который содержит один или более «доменов передачи костимулирующего сигнала» и «домен передачи первичного сигнала».
Домены передачи первичного сигнала реагируют на первичную активацию комплекса TCR либо путем стимуляции, либо путем ингибирования. Домены передачи первичного сигнала, которые действуют стимулирующим образом, могут содержать мотивы передачи сигнала, которые известны как иммунорецепторные тирозиновые активирующие мотивы или ITAM.
Иллюстративные примеры ITAM-содержащих доменов передачи первичного сигнала, которые являются особенно применимыми в настоящем изобретении, включают таковые, полученные из TCRζ, FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD3ζ, CD22, CD79a, CD79b и CD66d. В конкретных предпочтительных вариантах осуществления CAR содержит домен передачи первичного сигнала CD3ζ и один или более доменов передачи костимулирующего сигнала. Внутриклеточные домены передачи первичного сигнала и передачи костимулирующего сигнала могут быть присоединены в любом порядке последовательно к карбоксильному концу трансмембранного домена.
CAR, рассмотренные в данном документе, содержат один или более доменов передачи костимулирующего сигнала для повышения эффективности и размножения Т-клеток, экспрессирующих CAR-рецепторы. Используемый в данном документе термин «домен передачи костимулирующего сигнала» или «домен костимуляции» относится к внутриклеточному домену передачи сигнала от костимулирующей молекулы.
Иллюстративные примеры таких костимулирующих молекул включают CD27, CD28, 4-1BB (CD137), OX40 (CD134), CD30, CD40, PD-1, ICOS (CD278), CTLA4, LFA-1, CD2, CD7, LIGHT, TRIM, LCK3, SLAM, DAP10, LAG3, HVEM и NKD2C, а также CD83. В одном варианте осуществления CAR содержит один или более доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD137 и CD134, а также домен передачи первичного сигнала CD3ζ.
В одном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; трансмембранный домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD45, PD-1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD54, CD134, CD137, CD152, CD273, CD274 и CD278; и домен передачи первичного сигнала CD3ζ.
В другом варианте осуществления CAR содержит scFv, который связывает фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM или VEGFR2; шарнирный домен, выбранный из группы, включающей шарнир/CH2/CH3 IgG1 и CD8α, а также CD8α; трансмембранный домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD45, PD-1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD134 и CD137; а также домен передачи первичного сигнала CD3ζ.
В еще одном варианте осуществления CAR содержит scFv, дополнительно содержащий линкер, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, выбранный из группы, включающей шарнир/CH2/CH3 IgG1 и CD8α, а также CD8α; трансмембранный домен, содержащий TM-домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD45, PD-1 и CD152, а также короткий олиго- или полипептидный линкер длиной предпочтительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, который связывает TM-домен с внутриклеточным доменом передачи сигнала CAR; и один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD134 и CD137; а также домен передачи первичного сигнала CD3ζ.
В конкретном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM и VEGFR2; шарнирный домен, содержащий полипептид CD8α; трансмембранный домен CD8α, содержащий полипептидный линкер, состоящий из приблизительно 3 аминокислот; один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD134 и CD137; а также домен передачи первичного сигнала CD3ζ.
E. Полипептиды
В настоящем изобретении рассмотрены, в частности, полипептиды разработанных TCR и CAR или их фрагменты, клетки и композиции, содержащие таковые, а также векторы, которые экспрессируют полипептиды. «Полипептид», «фрагмент полипептида», «пептид» и «белок» используются взаимозаменяемо, если не указано иное, и в соответствии с общепринятым значением, т.е. последовательность из аминокислот. Полипептиды не ограничены определенной длиной, например, они могут содержать последовательность белка полной длины или фрагмент белка полной длины, и могут включать посттрансляционные модификации полипептида, например, гликозилирования, ацетилирования, фосфорилирования и т.п., а также другие модификации, известные из уровня техники, как встречающиеся, так и не встречающиеся в природе. В различных вариантах осуществления полипептиды, рассмотренные в данном документе, содержат сигнальную (или лидерную) последовательность на N-терминальном конце белка, которая котрансляционно или посттрансляционно управляет переносом белка. Иллюстративные примеры подходящих сигнальных последовательностей, применимых в раскрытом данном документе, включают без ограничения сигнальную последовательность тяжелой цепи IgG1 и сигнальную последовательность CD8α. Полипептиды могут быть получены с помощью любой из множества хорошо известных методик рекомбинации и/или синтеза. Полипептиды, рассмотренные в данном документе, в частности, охватывают CAR по настоящему раскрытию или последовательности, которые имеют делеции, добавления, и/или замены одной или более аминокислот относительно полипептида, рассматриваемого в данном документе.
Полипептиды включают «варианты полипептида». Варианты полипептида могут отличаться от встречающегося в природе полипептида одной или более заменами, делециями, добавлениями и/или вставками. Такие варианты могут быть встречающимися в природе или могут быть получены синтетическим путем, например, посредством модификации одной или более упомянутых выше полипептидных последовательностей. Например, в конкретных вариантах осуществления может быть необходимо улучшать аффинность связывания и/или другие биологические свойства разработанных TCR или CAR посредством введения одной или более замен, делеций, добавлений и/или вставок. Предпочтительно полипептиды по настоящему изобретению включают полипептиды, характеризующиеся по меньшей мере приблизительно 65%, 70%, 75%, 85%, 90%, 95%, 98% или 99% аминокислотной идентичностью с ними.
Полипептиды включают «фрагменты полипептида». Фрагментами полипептида называют полипептид, который может быть мономерным или мультимерным, характеризующийся амино-концевой делецией, карбокси-концевой делецией и/или внутренней делецией или заменой относительно встречающегося в природе или полученного рекомбинантным способом полипептида. В определенных вариантах осуществления фрагмент полипептида может содержать аминокислотную цепь, имеющую длину по меньшей мере от 5 до приблизительно 500 аминокислот. Следует иметь в виду, что в определенных вариантах осуществления фрагменты имеют длину по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 150, 200, 250, 300, 350, 400 или 450 аминокислот.
Полипептид также может быть слит в рамке считывания или конъюгирован с линкерной или другой последовательностью для облегчения синтеза, очистки или идентификации полипептида (например, поли-His), или для улучшения связывания полипептида с твердым носителем.
Как уже отмечалось выше, полипептиды по настоящему изобретению могут быть изменены различными путями, в том числе характеризоваться аминокислотными заменами, делециями, усечениями и вставками. Способы таких манипуляций общеизвестны из уровня техники. Например, варианты аминокислотной последовательности эталонного полипептида могут быть получены посредством мутаций ДНК. Способы мутагенеза и изменений нуклеотидной последовательности хорошо известны из уровня техники. См., например, Kunkel (1985, Proc. Natl. Acad. Sci. USA. 82: 488-492), Kunkel et al., (1987, Methods in Enzymol, 154: 367-382), патент США № 4873192, Watson, J. D. et al., (Molecular Biology of the Gene, Fourth Edition, Benjamin/Cummings, Menlo Park, Calif., 1987) и ссылочные документы, процитированные в них. Рекомендации, касающиеся подходящих аминокислотных замен, которые не влияют на биологическую активность представляющего интерес белка, можно найти в модели Dayhoff et al., (1978) Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Washington, D.C.).
В определенных вариантах осуществления вариант будет содержать консервативные замены. «Консервативной заменой» является та, при которой аминокислота замещена на другую аминокислоту, которая характеризуется аналогичными свойствами, вследствие чего специалист в области техники, связанной с химией пептидов, может ожидать, что вторичная структура и гидропатичная природа полипептида практически не изменятся. В структуре полинуклеотидов и полипептидов по настоящему изобретению можно выполнять модификации и тем не менее получать функциональную молекулу, которая кодирует вариантный или производный полипептид с необходимыми характеристиками.
Варианты полипептида дополнительно включают гликозилированные формы, конъюгаты, образованные путем агрегации с другими молекулами, а также конъюгаты с образованием ковалентной связи с неродственными химическими фрагментами (например, пегилированные молекулы). Варианты с ковалентной связью можно получать путем связывания функциональных групп с группами, которые находятся в аминокислотной цепи, или с N- или C-концевым остатком, как известно из уровня техники. Варианты также включают аллельные варианты, видовые варианты и мутеины. Усечения или делеции областей, которые не влияют на функциональную активность белков, также приводят к образованию вариантов.
В одном варианте осуществления, в котором требуется экспрессия одного или более полипептидов, полинуклеотидные последовательности, кодирующие их, можно разделять с помощью последовательности IRES, как обсуждается в других частях данного документа. В другом варианте осуществления два или более полипептидов могут экспрессироваться как белок слияния, который содержит одну или более саморасщепляющихся полипептидных последовательностей.
Полипептиды по настоящему изобретению включают слитые полипептиды. В предпочтительных вариантах осуществления предусмотрены слитые полипептиды и полинуклеотиды, кодирующие слитые полипептиды. Слитыми полипептидами и белками слияния называют полипептид, который имеет по меньшей мере два, три, четыре, пять, шесть, семь, восемь, девять или десять, или большее количество полипептидных сегментов. Слитые полипептиды, как правило, присоединены C-концом к N-концу, хотя они также могут быть присоединены C-концом к C-концу, N-концом к N-концу или N-концом к C-концу. Полипептиды в белке слияния могут находиться в любом порядке или в определенном порядке. Слитые полипептиды или белки слияния могут также включать консервативно модифицированные варианты, полиморфные варианты, аллели, мутанты, подпоследовательности и межвидовые гомологи, при условии сохранения требуемой транскрипционной активности слитого полипептида. Слитые полипептиды можно получать с помощью способов химического синтеза или с помощью химического связывания двух фрагментов или, как правило, можно получать с помощью других стандартных методик. Лигированные последовательности ДНК, кодирующие слитый полипептид, функционально связаны с подходящими элементами контроля транскрипции или трансляции, как обсуждается в других частях данного документа.
В одном варианте осуществления партнер по слиянию содержит последовательность, которая способствует экспрессии белка (энхансер экспрессии), приводя к более высоким выходам по сравнению с нативным рекомбинантным белком. Другие партнеры по слиянию могут быть выбраны таким образом, чтобы увеличить растворимость белка, или чтобы обеспечить возможность направления белка в требуемые внутриклеточные компартменты, или чтобы облегчить транспорт белка слияния через клеточную мембрану.
Слитые полипептиды могут дополнительно содержать сигнал расщепления полипептида между каждым из полипептидных доменов, описанных в данном документе. Кроме того, сайт расщепления полипептида может быть помещен в последовательность любого линкерного пептида. Примеры сигналов расщепления пептида включают сайты распознавания для расщепления полипептида, такие как сайты расщепления для протеазы, сайты расщепления для нуклеазы (например, сайты распознавания для редкощепящего фермента, сайты распознавания для саморасщепляющихся рибозимов) и саморасщепляющиеся вирусные олигопептиды (см. deFelipe and Ryan, 2004. Traffic, 5(8); 616-26).
Подходящие сайты расщепления для протеазы и саморасщепляющиеся пептиды хорошо известны специалисту в данной области (см., например, в Ryan et al., 1997. J. Gener. Virol. 78, 699-722; Scymczak et al. (2004) Nature Biotech. 5, 589-594). Примеры сайтов расщепления для протеазы включают без ограничения сайты расщепления для NIa-протеаз потивируса (например, протеаз вируса гравировки табака), HC-протеаз потивируса, P1 (P35)-протеаз потивируса, NIa-протеаз бимовируса, RNA-2-кодируемых протеаз бимовируса, L-протеаз афтовируса, 2A-протеаз энтеровируса, 2A-протеаз риновируса, 3C-протеаз пикорнавируса, 24K-протеаз комовируса, 24K-протеаз неповируса, 3C-подобной протеазы RTSV (сферический вирус тунгро риса), 3C-подобной протеазы PYVF (вирус желтой пятнистости пастернака), гепарина, тромбина, фактора Xa и энтерокиназы. В одном варианте осуществления вследствие высокой точности расщепления предпочтительными являются сайты расщепления для протеазы TEV (вирус гравировки табака), например, EXXYXQ(G/S) (SEQ ID NO:), например, ENLYFQG (SEQ ID NO:) и ENLYFQS (SEQ ID NO:), где X представляет собой любую аминокислоту (расщепление посредством TEV происходит между Q и G или Q и S).
В конкретном варианте осуществления саморасщепляющиеся пептиды включают полипептидные последовательности, полученные из 2A-пептидов потивируса и кардиовируса, FMDV (вируса ящура), вируса ринита лошадей типа A, вируса Thosea asigna и тешовируса свиней.
В определенных вариантах осуществления сайт саморасщепляющегося полипептида включает последовательность или домен 2A-сайта или 2A-подобного сайта (Donnelly et al., 2001. J. Gen. Virol. 82:1027-1041).
F. Полинуклеотиды
В конкретных вариантах осуществления предусмотрены полинуклеотиды, кодирующие один или более полипептидов разработанных TCR или CAR, рассмотренных в данном документе. Используемые в данном документе термины «полинуклеотид» или «нуклеиновая кислота» относятся к матричной РНК (мРНК), РНК, геномной РНК (gRNA), плюс-нити РНК (РНК(+)), минус-нити РНК (РНК(-)), геномной ДНК (gDNA), комплементарной ДНК (кДНК) или рекомбинантной ДНК. Полинуклеотиды включают одно- и двухнитевые полинуклеотиды. Предпочтительно полинуклеотиды по настоящему изобретению включают полинуклеотиды или варианты, характеризующиеся по меньшей мере приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с любой из эталонных последовательностей, описанных в данном документе (см., например, Перечень последовательностей), при этом, как правило, вариант сохраняет по меньшей мере одну биологическую активность эталонной последовательности. В различных иллюстративных вариантах осуществления настоящего изобретения предусмотрены, в частности, полинуклеотиды, содержащие векторы экспрессии, вирусные векторы и плазмиды-переносчики, а также композиции и клетки, содержащие их.
В конкретных вариантах осуществления настоящего изобретения предусмотрены полинуклеотиды, которые кодируют по меньшей мере приблизительно 5, 10, 25, 50, 100, 150, 200, 250, 300, 350, 400, 500, 1000, 1250, 1500, 1750 или 2000 или более смежных аминокислотных остатков полипептида по настоящему изобретению, а также все полипептиды промежуточной длины. Нетрудно понять, что «промежуточной длины» в данном контексте означает любую длину между приведенными значениями, например, 6, 7, 8, 9 и т.д., 101, 102, 103 и т. д.; 151, 152, 153 и т.д.; 201, 202, 203 и т.д.
Используемые в данном документе термины «вариант полинуклеотида» и «вариант» и т. п. относятся к полинуклеотидам, проявляющим существенную идентичность последовательности с эталонной полинуклеотидной последовательностью, или к полинуклеотидам, которые гибридизуются с эталонной последовательностью в жестких условиях, которые определены ниже в данном документе. Данные термины включают полинуклеотиды, в которых один или более нуклеотидов были добавлены или удалены, или замещены другими нуклеотидами по сравнению с эталонным полинуклеотидом. При этом из уровня техники хорошо известно, что определенные изменения, в том числе мутации, добавления, делеции и замены, можно выполнять относительно эталонного полинуклеотида, при условии что измененный полинуклеотид сохраняет биологическую функцию или активность эталонного полинуклеотида.
Перечисления «идентичности последовательности» или содержащие, например, «последовательность на 50% идентичная», используемые в данном документе, относятся к степени, в которой данные последовательности являются идентичными при попарном сравнении нуклеотидов или попарном сравнении аминокислот в окне сравнения. Таким образом, «процентное значение идентичности последовательности» можно рассчитать путем сравнения двух последовательностей, подвергнутых оптимальному выравниванию в окне сравнения, определения числа положений, в которых идентичное основание нуклеиновой кислоты (например, A, T, C, G, I) или идентичный аминокислотный остаток (например, Ala, Pro, Ser, Thr, Gly, Val, Leu, Ile, Phe, Tyr, Trp, Lys, Arg, His, Asp, Glu, Asn, Gln, Cys и Met) встречаются в обеих последовательностях, чтобы получить число совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнения (т. е. размер окна) и умножения результата на 100 с получением процентного значения идентичности последовательностей. Предусмотрены нуклеотиды и полинуклеотиды, характеризующиеся по меньшей мере приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с любой из эталонных последовательностей, описанных в данном документе, как правило, при условии что вариант полипептида сохраняет по меньшей мере одну биологическую активность эталонного полипептида.
Термины, используемые для описания взаимосвязи последовательностей двух или более полинуклеотидов или полипептидов, включают следующие: «эталонная последовательность», «окно сравнения», «идентичность последовательности», «процентное значение идентичности последовательности» и «существенная идентичность». Длина «эталонной последовательности» составляет по меньшей мере 12, но чаще 15-18 и зачастую по меньшей мере 25 мономерных единиц, в том числе нуклеотидов и аминокислотных остатков. Поскольку каждый из двух полинуклеотидов может содержать (1) последовательность (т.е. только часть полной полинуклеотидной последовательности), которая сходна в двух полинуклеотидах, и (2) последовательность, которая отлична в двух полинуклеотидах, сравнение последовательности двух (или более) полинуклеотидов, как правило, выполняют путем сравнения последовательностей двух полинуклеотидов в «окне сравнения» для выявления и сравнения локальных областей сходства последовательностей. «Окно сравнения» относится к умозрительному сегменту по меньшей мере из 6 смежных положений, обычно от приблизительно 50 до приблизительно 100, чаще от приблизительно 100 до приблизительно 150, в котором последовательность сравнивают с эталонной последовательностью из того же количества смежных положений после того, как две последовательности подвергли оптимальному выравниванию. Окно сравнения может содержать приблизительно 20% или меньше добавлений или делеций (т.е. гэпов) по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей. Оптимальное выравнивание последовательностей для выравнивания в окне сравнения можно проводить с помощью компьютеризированной реализации алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics версия 7.0, Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин, США) или посредством просмотра наилучшего выравнивания (т. е. приводящего к наиболее высокому процентному значению гомологии в окне сравнения), полученному с помощью любого из различных выбранных способов. Также можно упомянуть семейство программ BLAST, например, раскрытое в Altschul et al., 1997, Nucl. Acids Res. 25:3389. Подробное обсуждение анализа последовательностей можно найти в разделе 19.3 в Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons Inc, 1994-1998, Chapter 15.
Полинуклеотиды по настоящему изобретению, независимо от длины кодирующей последовательности как таковой, можно объединять с другими последовательностями ДНК, такими как промоторы и/или энхансеры, нетранслируемые области (UTR), последовательности Козак, сигналы полиаденилирования, дополнительные сайты для ферментов рестрикции, множественные сайты клонирования, сайты внутренней посадки рибосомы (IRES), сайты распознавания рекомбиназ (например, сайты LoxP, FRT и Att), стоп-кодоны, сигналы терминации транскрипции и полинуклеотиды, кодирующие саморасщепляющиеся полипептиды, эпитопные метки, как описано в других частях данного документа или как известно из уровня техники, так что их общая длина может значительно изменяться. В связи с этим предполагается, что может быть использован полинуклеотидный фрагмент практически любой длины, при этом общая длина предпочтительно ограничивается простотой получения и применения в предполагаемом протоколе рекомбинантной ДНК.
Полинуклеотиды могут быть получены, подвергнуты манипуляциям и/или экспрессированы с помощью любой из множества хорошо отработанных методик, известных и доступных из уровня техники. Чтобы экспрессировать требуемый полипептид, нуклеотидная последовательность, кодирующая данный полипептид, может быть встроена в соответствующий вектор. Примерами векторов являются плазмиды, автономно реплицирующиеся последовательности и мобильные генетические элементы. Дополнительные примеры векторов включают без ограничений плазмиды, фагмиды, космиды, искусственные хромосомы, такие как дрожжевая искусственная хромосома (YAC), бактериальная искусственная хромосома (BAC) или искусственная хромосома, полученная из P1 (PAC), бактериофаги, такие как фаг лямбда или фаг M13, а также вирусы животных. Примеры категорий вирусов животных, применимых в качестве векторов, включают без ограничений ретровирус (в том числе лентивирус), аденовирус, аденоассоциированный вирус, герпесвирус (например, вирус простого герпеса), поксвирус, бакуловирус, папилломавирус и паповавирус (например, SV40). Примерами векторов экспрессии являются векторы pClneo (Promega) для экспрессии в клетках млекопитающих; pLenti4/V5-DEST™, pLenti6/V5-DEST™ и pLenti6.2/V5-GW/lacZ (Invitrogen) для опосредованного лентивирусами переноса генов и экспрессии в клетках млекопитающих. В конкретных вариантах осуществления кодирующие последовательности химерных белков, раскрытые в данном документе, могут быть лигированы в такие векторы экспрессии для экспрессии химерного белка в клетках млекопитающих.
«Элементы контроля» или «регуляторные последовательности», присутствующие в векторе экспрессии, представляют собой такие нетранслируемые области вектора — точку начала репликации, кассеты для отбора, промоторы, энхансеры, сигналы инициации трансляции (последовательность Shine Dalgarno или последовательность Козак), интроны, последовательность полиаденилирования, 5' и 3'-нетранслируемые области, которые взаимодействуют с клеточными белками хозяина для осуществления транскрипции и трансляции. Такие элементы могут различаться по своей силе и специфичности. В зависимости от используемых векторной системы и хозяина можно использовать любое число подходящих элементов транскрипции и трансляции, в том числе универсальные промоторы и индуцируемые промоторы.
В конкретных вариантах осуществления вектор для применения при осуществлении настоящего изобретения на практике, в том числе без ограничения векторы экспрессии и вирусные векторы, будет включать экзогенные, эндогенные или гетерологичные последовательности контроля, такие как промоторы и/или энхансеры. «Эндогенная» последовательность контроля представляет собой последовательность, которая в природных условиях связана с данным геном в геноме. «Экзогенная» последовательность контроля представляет собой последовательность, которая помещена в непосредственное соседство с геном при помощи манипуляции с генами (т.е. методик молекулярной биологии), так что транскрипция данного гена обусловлена связанным энхансером/промотором. «Гетерологичная» последовательность контроля представляет собой экзогенную последовательность, которая происходит от иного вида, чем клетка, подвергаемая генетическим манипуляциям.
Термин «промотор», используемый в данном документе, относится к сайту распознавания полинуклеотида (ДНК или РНК), с которым связывается РНК-полимераза. РНК-полимераза инициирует и транскрибирует полинуклеотиды, функционально связанные с промотором. В конкретных вариантах осуществления промоторы, активные в клетках млекопитающих, содержат AT-богатую область, расположенную примерно на 25-30 оснований выше сайта инициации транскрипции, и/или другую последовательность, расположенную на 70-80 оснований выше начала транскрипции, область CNCAAT, где N может представлять собой любой нуклеотид.
Термин «энхансер» относится к сегменту ДНК, который содержит последовательности, способные обеспечивать усиленную транскрипцию и, в некоторых случаях, способные функционировать независимо от их ориентации относительно другой последовательности контроля. Энхансер может функционировать совместно или аддитивно с промоторами и/или другими энхансерными элементами. Термин «промотор/энхансер» относится к сегменту ДНК, который содержит последовательности, способные обеспечивать как промоторные, так и энхансерные функции.
Термин «функционально связанный» относится к непосредственному соседству, при котором описанные компоненты находятся во взаимосвязи, позволяющей им функционировать надлежащим им образом. В одном варианте осуществления термин относится к функциональной связи между последовательностью контроля экспрессии нуклеиновой кислоты (такой как промотор и/или энхансер) и второй полинуклеотидной последовательностью, например, полинуклеотидом, представляющим интерес, где последовательность контроля экспрессии обеспечивает транскрипцию нуклеиновой кислоты, соответствующей второй последовательности.
Используемый в данном документе термин «последовательность контроля конститутивной экспрессии» относится к промотору, энхансеру или промотору/энхансеру, который непрерывно или постоянно обеспечивает возможность транскрипции функционально связанной последовательности. Последовательность контроля конститутивной экспрессии может представлять собой «универсальный» промотор, энхансер или промотор/энхансер, который обеспечивает возможность экспрессии в самых различных типах клеток и тканей, или «специфический в отношении клетки», «специфический в отношении типа клеток», «специфический в отношении линии клеток» или «специфический в отношении ткани» промотор, энхансер или промотор/энхансер, который обеспечивает возможность экспрессии в ограниченном количестве типов клеток и тканей, соответственно.
Иллюстративные универсальные последовательности контроля экспрессии, подходящие для применения в конкретных вариантах осуществления настоящего изобретения, включают без ограничений немедленно-ранний промотор цитомегаловируса (CMV), вирусный промотор вируса обезьян 40 (SV40) (например, ранний или поздний), LTR-промотор вируса мышиного лейкоза Молони (MoMLV), LTR вирус саркомы Рауса (RSV), промотор вируса простого герпеса (HSV) (тимидинкиназа), H5, P7.5, а также P11-промоторы вируса коровьей оспы, промотор фактора элонгации 1-альфа (EF1a), фактор раннего ростового ответа 1 (EGR1), ферритин H (FerH), ферритин L (FerL), глицеральдегид-3-фосфатдегидрогеназу (GAPDH), фактор инициации трансляции эукариот 4A1 (EIF4A1), 70 кДа белок теплового шока 5 (HSPA5), 90 кДа белок теплового шока бета, представитель 1 (HSP90B1), 70 кДа белок теплового шока (HSP70), β-кинезин (β-KIN), локус ROSA 26 человека (Irions et al., Nature Biotechnology 25, 1477 - 1482 (2007)), промотор убиквитина C (UBC), промотор фосфоглицераткиназы-1 (PGK), промотор из энхансера цитомегаловируса/промотора куриного β-актина (CAG), промотор β-актина и промотор (MND) с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля, с сайтом связывания праймера, замещенным на последовательность из dl587rev (Challita et al., J Virol. 69(2):748-55 (1995)).
В конкретном варианте осуществления может быть необходима экспрессия полинуклеотида, содержащего разработанный TCR или CAR, за счет промотора, который обеспечивает стабильную и долгосрочную экспрессию в Т-клетках и на уровне, достаточном для перенаправления Т-клеток на клетки, экспрессирующие целевой антиген. В предпочтительном варианте осуществления промотор представляет собой промотор EF1α или MND-промотор.
Используемая в данном документе «условная экспрессия» может относиться к любому типу условной экспрессии, в том числе без ограничений индуцируемой экспрессии; репрессируемой экспрессии; экспрессии в клетках или тканях, характеризующихся конкретным физиологическим, биологическим или болезненным состоянием и т. д. Данное определение не предназначено для исключения специфической в отношении типа клеток или ткани экспрессии. В определенных вариантах осуществления настоящего изобретения предусмотрена условная экспрессия полинуклеотида, представляющего интерес, например, экспрессия контролируется путем воздействия на клетку, ткань, организм и т. д., с помощью средства обработки или условия, которые вызывают экспрессию полинуклеотида или которые вызывают повышение или понижение уровня экспрессии полинуклеотида, кодируемого полинуклеотидом, представляющим интерес.
Иллюстративные примеры индуцируемых промоторов/систем включают без ограничений промоторы, индуцируемые стероидами, такие как промоторы генов, кодирующих глюкокортикоидные или эстрогеновые рецепторы (индуцируемые путем обработки соответствующим гормоном), металлотиониновый промотор (индуцируемый путем обработки различными тяжелыми металлами), MX-1-промотор (индуцируемый интерфероном), мифепристон-регулируемая система «GeneSwitch» (Sirin et al., 2003, Gene, 323:67), кумат-индуцируемый генный переключатель (WO 2002/088346), тетрациклин-зависимые регуляторные системы и т.д.
Условную экспрессию также можно обеспечить с помощью сайт-специфической ДНК-рекомбиназы. В соответствии с определенными вариантами осуществления настоящего изобретения вектор содержит по меньшей мере один (как правило два) сайт(-а) для рекомбинации, опосредованной сайт-специфической рекомбиназой. Используемые в данном документе термины «рекомбиназа» или «сайт-специфическая рекомбиназа» включают вырезающие или интегративные белки, ферменты, кофакторы или ассоциированные белки, которые вовлекаются в реакции рекомбинации с участием одного или более сайтов рекомбинации (например, двух, трех, четырех, пяти, семи, десяти, двенадцати, пятнадцати, двадцати, тридцати, пятидесяти и т.д.), которые могут быть белками дикого типа (см. Landy, Current Opinion in Biotechnology 3:699-707 (1993)) или их мутантами, производными (например, белками слияния, содержащими последовательности белка рекомбинации или их фрагменты), фрагментами и вариантами. Иллюстративные примеры рекомбиназ, подходящих для применения в конкретных вариантах осуществления настоящего изобретения, включают без ограничения Cre, Int, IHF, Xis, Flp, Fis, Hin, Gin, ΦC31, Cin, Tn3-резольвазу, TndX, XerC, XerD, TnpX, Hjc, Gin, SpCCE1 и ParA.
G. Вирусные векторы
В конкретных вариантах осуществления клетку (например, T-клетку) трансдуцируют с помощью ретровирусного вектора, например, лентивирусного вектора, кодирующего разработанный TCR или CAR, рассматриваемый в данном документе. Трансдуцированные T-клетки вызывают стабильный, долгосрочный и стойкий T-клеточный ответ.
Используемый в данном документе термин «ретровирус» относится к РНК-вирусу, который обратно транскрибирует свою геномную РНК в линейную двухнитевую ДНК-копию, а затем ковалентно интегрирует свою геномную ДНК в геном хозяина. Иллюстративные ретровирусы, подходящие для применения в конкретных вариантах осуществления, включают без ограничений: вирус мышиного лейкоза Молони (M-MuLV), вирус саркомы мышей Молони (MoMSV), вирус саркомы мышей Харви (HaMuSV), вирус опухоли молочной железы мышей (MuMTV), вирус лейкоза гиббонов (GaLV), вирус лейкоза кошек (FLV), спумавирус, вирус лейкоза мышей Френда, вирус стволовых клеток мышей (MSCV), вирус саркомы Рауса (RSV) и лентивирус.
Используемый в данном документе термин «лентивирус» относится к группе (или роду) сложных ретровирусов. Иллюстративные лентивирусы включают без ограничений: HIV (вирус иммунодефицита человека; в том числе HIV 1 типа и HIV 2 типа); вирус висна-маэди (VMV); вирус артрита-энцефалита коз (CAEV); вирус инфекционной анемии лошадей (EIAV); вирус иммунодефицита кошек (FIV); вирус иммунодефицита крупного рогатого скота (BIV) и вирус иммунодефицита обезьян (SIV). В одном варианте осуществления предпочтительными являются векторные остовы на основе HIV (т. е. цис-действующие элементы последовательности HIV).
Используемый в данном документе термин «вектор» относится к молекуле нуклеиновой кислоты, способной переносить или транспортировать другую молекулу нуклеиновой кислоты. Переносимая нуклеиновая кислота обычно связана с векторной молекулой нуклеиновой кислоты, например, вставлена в нее. Вектор может содержать последовательности, которые управляют автономной репликацией в клетке, или может содержать последовательности, достаточные для обеспечения интеграции в ДНК клетки-хозяина. Применимые векторы включают, например, плазмиды (например, ДНК-плазмиды или РНК-плазмиды), транспозоны, космиды, бактериальные искусственные хромосомы и вирусные векторы. Применимые вирусные векторы включают, например, ретровирусы с дефектной системой репликации и лентивирусы.
Как будет очевидно специалисту в данной области, термин «вирусный вектор» широко используется для обозначения либо молекулы нуклеиновой кислоты (например, плазмиды-переносчика), которая включает элементы, происходящие из нуклеиновой кислоты вируса, которые, как правило, облегчают перенос молекулы нуклеиновой кислоты или ее интеграцию в геном клетки, либо вирусной частицы, которая опосредует перенос нуклеиновой кислоты. Вирусные частицы, как правило, будут включать различные вирусные компоненты и иногда также компоненты клетки-хозяина в дополнение к нуклеиновой кислоте(ам).
Термин «вирусный вектор» может относиться либо к вирусу или вирусной частице, способным переносить нуклеиновую кислоту в клетку, либо к самой переносимой нуклеиновой кислоте. Вирусные векторы и плазмиды-переносчики содержат структурные и/или функциональные генетические элементы, которые происходят преимущественно из вируса. Термин «ретровирусный вектор» относится к вирусному вектору или плазмиде, содержащим структурные или функциональные генетические элементы или их части, которые происходят преимущественно из ретровируса. Термин «лентивирусный вектор» относится к вирусному вектору или плазмиде, содержащим структурные или функциональные генетические элементы или их части, в том числе LTR, которые происходят преимущественно из лентивируса. Термин «гибридный вектор» относится к вектору, LTR или другой нуклеиновой кислоте, содержащим как ретровирусные например, лентивирусные, последовательности, так и вирусные последовательности, не являющиеся лентивирусными. В одном варианте осуществления гибридный вектор относится к вектору или плазмиде-переносчику, содержащим ретровирусные, например, лентивирусные, последовательности для обратной транскрипции, репликации, интеграции и/или упаковки.
В конкретных вариантах осуществления термины «лентивирусный вектор», «лентивирусный вектор экспрессии» могут использоваться в отношении лентивирусных плазмид-переносчиков и/или инфекционных лентивирусных частиц. Если в данном документе ссылаются на элементы, такие как сайты клонирования, промоторы, регуляторные элементы, гетерологичные нуклеиновые кислоты и т.д., следует понимать, что последовательности таких элементов представлены в форме РНК в лентивирусных частицах по настоящему изобретению и представлены в форме ДНК в ДНК-плазмидах по настоящему изобретению.
На каждом конце провируса находятся структуры, называемые «длинными концевыми повторами» или «LTR». Термин «длинный концевой повтор (LTR)» относится к доменам из пар оснований, расположенных на концах ретровирусных ДНК, которые в контексте их природных последовательностей представляют собой прямые повторы и содержат области U3, R и U5. LTR, как правило, обеспечивают функции, существенные для экспрессии ретровирусных генов (например, индукции, инициации и полиаденилирования генных транскриптов) и для репликации вируса. LTR содержит множество регуляторных сигналов, в том числе элементы контроля транскрипции, сигналы полиаденилирования и последовательности, необходимые для репликации и интеграции вирусного генома. Вирусный LTR разделен на три области, называемые U3, R и U5. U3-область содержит энхансерные и промоторные элементы. U5-область представляет собой последовательность между сайтом связывания праймера и R-областью и содержит последовательность полиаденилирования. R (повтор)-область фланкирована U3- и U5-областями. LTR состоит из U3-, R- и U5-областей и встречается на обоих 5'- и 3'-концах вирусного генома. Рядом с 5' LTR находятся последовательности, необходимые для обратной транскрипции генома (сайт связывания праймера тРНК) и для эффективной упаковки вирусной РНК в частицы (Psi-сайт).
Используемый в данном документе термин «сигнал упаковки» или «последовательность упаковки» относится к последовательностям, расположенным в пределах ретровирусного генома, которые необходимы для вставки вирусной РНК в вирусный капсид или частицу, см., например, Clever et al., 1995. J. of Virology, Vol. 69, No. 4; pp. 2101–2109. В некоторых ретровирусных векторах используется минимальный сигнал упаковки (также называемый psi [Ψ]-последовательность), необходимый для заключения вирусного генома в капсид. Таким образом, используемые в данном документе термины «последовательность упаковки», «сигнал упаковки», «psi» и символ «Ψ» применяются в отношении некодирующей последовательности, необходимой для заключения ретровирусных нитей РНК в капсид во время сборки вирусной частицы.
В различных вариантах осуществления векторы содержат модифицированные 5' LTR и/или 3' LTR. Каждый или оба LTR могут содержать одну или более модификаций, в том числе без ограничений одну или более делеций, вставок или замен. Зачастую модификации в 3' LTR осуществляют для повышения безопасности лентивирусных или ретровирусных систем, путем придания вирусам дефектности по репликации. Используемый в данном документе термин «дефектный по репликации» относится к вирусу, который не способен к полноценной, эффективной репликации, так что не происходит образования инфекционных вирионов (например, дефектное по репликации лентивирусное потомство). Термин «компетентный по репликации» относится к вирусу дикого типа или мутантному вирусу, который способен к репликации, так что вирусная репликация вируса приводит к образованию инфекционных вирионов (например, компетентное по репликации лентивирусное потомство).
Термин «самоинактивирующиеся» (SIN) векторы относится к дефектным по репликации векторам, например, ретровирусным или лентивирусным векторам, в которых область энхансер-промотор правого (3') LTR, известная как U3-область, была модифицирована (например, посредством делеции или замены) для предотвращения вирусной транскрипции после первого цикла вирусной репликации. Это происходит потому, что во время вирусной репликации U3-область правого (3') LTR используется как шаблон для U3-области левого (5') LTR, и, таким образом, вирусный транскрипт не может быть получен без энхансера-промотора в U3. В дополнительном варианте осуществления настоящего изобретения модифицируют 3' LTR, так что U5-область замещена, например, идеальной последовательностью поли-(A). Следует отметить, что модификации LTR, такие как модификации 3' LTR, 5' LTR, или как 3', так и 5' LTR, также включены в объем настоящего изобретения.
Дополнительное усиление безопасности обеспечивают замещением U3-области 5' LTR гетерологичным промотором для управления транскрипцией вирусного генома во время образования вирусных частиц. Примеры гетерологичных промоторов, которые могут быть использованы, включают, например, вирусный промотор вируса обезьян 40 (SV40) (например, ранний или поздний), промотор цитомегаловируса (CMV) (например, немедленно-ранний), промотор вируса мышиного лейкоза Молони (MoMLV), промотор вируса саркомы Рауса (RSV) и промотор вируса простого герпеса (HSV) (тимидинкиназа). Типичные промоторы способны обеспечивать высокие уровни транскрипции Tat-независимым образом. Такое замещение снижает возможность рекомбинации с получением компетентных по репликации вирусов, поскольку в системе продукции вируса отсутствует полная последовательность U3. В определенных вариантах осуществления гетерологичный промотор имеет дополнительные преимущества в контроле способа, посредством которого транскрибируется вирусный геном. Например, гетерологичный промотор может быть индуцируемым, так что транскрипция всего или части вирусного генома будет происходить только в присутствии индуцирующих факторов. Индуцирующие факторы включают без ограничений одно или более химических соединений или физиологических условий, таких как температура или pH, при которых культивируются клетки-хозяева.
В некоторых вариантах осуществления вирусные векторы содержат элемент TAR. Термин «TAR» относится к генетическому элементу «трансактивационного ответа», расположенному в R-области лентивирусных (например, HIV) LTR. Данный элемент взаимодействует с лентивирусным трансактиваторным (tat) генетическим элементом для усиления вирусной репликации. Однако данный элемент не является необходимым в вариантах осуществления, где U3-область 5' LTR замещена гетерологичным промотором.
«R-область» относится к области в пределах ретровирусных LTR, начинающейся от начала кэпирующей группы (т.е. точки начала транскрипции) и заканчивающейся непосредственно перед началом поли-А-тракта. R-область также определяют как фланкированную U3- и U5-областями. R-область играет важную роль во время обратной транскрипции, обеспечивая перенос растущей нити ДНК от одного конца генома к другому.
Используемый в данном документе термин «FLAP-элемент» относится к нуклеиновой кислоте, последовательность которой содержит центральный полипуриновый тракт и центральные последовательности терминации (cPPT и CTS) ретровируса, например, HIV-1 или HIV-2. Подходящие FLAP-элементы описаны в патенте США № 6682907 и в Zennou, et al., 2000, Cell, 101:173. Во время обратной транскрипции HIV-1 центральная инициация плюс-нити ДНК в центральном полипуриновом тракте (cPPT) и центральная терминация в центральной последовательности терминации (CTS) приводит к образованию трехнитевой ДНК-структуры: центрального ДНК-флэпа HIV-1. Без желания быть связанными какой-либо теорией, ДНК-флэп может действовать как цис-активная детерминанта ядерного импорта лентивирусного генома и/или может повышать титр вируса. В конкретных вариантах осуществления ретровирусный или лентивирусный векторные остовы содержат один или более FLAP-элементов, расположенных в векторах выше или ниже гетерологичных генов, представляющих интерес. Например, в конкретных вариантах осуществления плазмида-переносчик содержит FLAP-элемент. В одном варианте осуществления вектор по настоящему изобретению содержит FLAP-элемент, выделенный из HIV-1.
В одном варианте осуществления ретровирусные или лентивирусные векторы-переносчики содержат один или более экспортных элементов. Термин «экспортный элемент» относится к цис-действующему посттранскрипционному регуляторному элементу, который регулирует транспорт РНК-транскрипта из ядра в цитоплазму клетки. Примеры РНК-экспортных элементов включают без ограничений элемент rev-ответа (RRE) вируса иммунодефицита человека (HIV) (см., например, Cullen et al., 1991. J. Virol. 65: 1053; и Cullen et al., 1991. Cell 58: 423) и посттранскрипционный регуляторный элемент вируса гепатита В (HPRE). Как правило, РНК-экспортный элемент расположен в пределах 3' UTR гена и может быть встроен в виде одной или множественных копий.
В конкретных вариантах осуществления экспрессию гетерологичных последовательностей в вирусных векторах повышают посредством внедрения в векторы посттранскрипционных регуляторных элементов, эффективных сайтов полиаденилирования и, необязательно, сигналов терминации транскрипции. Разнообразные посттранскрипционные регуляторные элементы могут увеличивать экспрессию гетерологичной нуклеиновой кислоты в белок, например, посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE; Zufferey et al., 1999, J. Virol., 73:2886); посттранскрипционный регуляторный элемент, присутствующий в вирусе гепатита В (HPRE) (Huang et al., Mol. Cell. Biol., 5:3864); и подобные (Liu et al., 1995, Genes Dev., 9:1766). В конкретных вариантах осуществления векторы по настоящему изобретению содержат посттранскрипционный регуляторный элемент, такой как WPRE или HPRE.
В конкретных вариантах осуществления векторы по настоящему изобретению лишены или не содержат посттранскрипционный регуляторный элемент, такой как WPRE или HPRE, поскольку в некоторых случаях такие элементы повышают риск клеточной трансформации и/или не увеличивают в существенной или значительной степени количество мРНК-транскрипта или не повышают стабильность мРНК. Следовательно, в некоторых вариантах осуществления векторы по настоящему изобретению лишены или не содержат WPRE или HPRE в качестве дополнительной меры безопасности.
Элементы, управляющие эффективной терминацией или полиаденилированием транскриптов гетерологичных нуклеиновых кислот, увеличивают экспрессию гетерологичных генов. Сигналы терминации транскрипции, как правило, находятся ниже сигнала полиаденилирования. В конкретных вариантах осуществления векторы содержат последовательность полиаденилирования за 3′-концом полинуклеотида, кодирующего полипептид, подлежащий экспрессии. Используемый в данном документе термин «сайт поли(А)» или «поли(А)-последовательность» описывает последовательность ДНК, которая управляет как терминацией, так и полиаденилированием растущей нити РНК-транскрипта с помощью РНК-полимеразы II. Последовательности полиаденилирования могут повышать стабильность мРНК путем добавления поли(А)-хвоста к 3′-концу кодирующей последовательности, и тем самым содействуя увеличению эффективности трансляции. Эффективное полиаденилирование рекомбинантного транскрипта необходимо, поскольку транскрипты, лишенные поли(А)-хвоста, являются нестабильными и легко подвергаются деградации. Иллюстративные примеры поли(А)-сигналов, которые могут быть использованы в векторе по настоящему изобретению, включают идеальную поли(A)-последовательность (например, AATAAA, ATTAAA, AGTAAA), поли(A)-последовательность бычьего гормона роста (BGHpA), поли(А)-последовательность β-глобина кролика (rβgpA) или другую подходящую гетерологичную или эндогенную поли(А)-последовательность, известную из уровня техники.
В различных вариантах осуществления векторы по настоящему изобретению содержат промотор, функционально связанный с полинуклеотидом, кодирующим полипептид разработанного TCR или CAR. Векторы могут содержать один или более LTR, при этом каждый LTR содержит одну или более модификаций, таких как одна или более нуклеотидных замен, добавлений или делеций. Векторы могут дополнительно содержать один или более вспомогательных элементов для увеличения эффективности трансдукции (например, cPPT/FLAP), упаковки вируса (например, Psi (Ψ) сигнал упаковки, RRE) и/или другие элементы, которые повышают экспрессию терапевтического гена (например, поли(A)-последовательности), и могут необязательно содержать WPRE или HPRE. Специалисту в данной области будет понятно, что многие другие различные варианты осуществления могут быть смоделированы на основе существующих вариантов осуществления настоящего изобретения.
«Клетка-хозяин» включает клетки, подвергнутые трансфекции, инфицированию или трансдукции in vivo, ex vivo или in vitro с помощью рекомбинантного вектора или полинуклеотида по настоящему изобретению. Клетки-хозяева могут включать упаковывающие клетки, продуцирующие клетки и клетки, инфицированные вирусными векторами. В конкретных вариантах осуществления клетки-хозяева, инфицированные вирусным вектором по настоящему изобретению, вводят субъекту, нуждающемуся в терапии. В определенных вариантах осуществления термин «целевая клетка» используется взаимозаменяемо с термином «клетка-хозяин» и относится к клеткам требуемого типа, подвергнутым трансфекции, инфицированию или трансдукции. В предпочтительных вариантах осуществления целевая клетка представляет собой Т-клетку.
Для получения приемлемого титра вируса зачастую необходимо крупномасштабное получение вирусных частиц. Вирусные частицы получают посредством трансфекции вектора-переносчика в упаковывающую клеточную линию, которая содержит вирусные структурные и/или вспомогательные гены, например, гены gag, pol, env, tat, rev, vif, vpr, vpu, vpx или nef или другие ретровирусные гены.
Используемый в данном документе термин «упаковочный вектор» относится к вектору экспрессии или вирусному вектору, который лишен сигнала упаковки, и содержит полинуклеотид, кодирующий один, два, три, четыре или более вирусных структурных и/или вспомогательных генов. Обычно упаковочные векторы включены в упаковывающую клетку, и их вводят в клетку посредством трансфекции, трансдукции и инфекции. Способы трансфекции, трансдукции и инфекции хорошо известны специалистам в данной области Ретровирусный/лентивирусный вектор-переносчик по настоящему изобретению может быть введен в упаковывающую клеточную линию посредством трансфекции, трансдукции и инфекции с получением продуцирующей клетки или клеточной линии. Упаковочные векторы по настоящему изобретению могут быть введены в человеческие клетки или клеточные линии с помощью стандартных способов, в том числе, например, трансфекции с использованием фосфата кальция, липофекции или электропорации. В некоторых вариантах осуществления упаковочные векторы вводят в клетки совместно с доминантным селектируемым маркером, таким как неомицин, гигромицин, пуромицин, бластоцидин, зеоцин, тимидинкиназа, DHFR, глутаминсинтетаза или ADA, с последующей селекцией в присутствии соответствующего лекарственного средства и выделением клонов. Ген селектируемого маркера может быть физически связан с генами, закодированными в упаковочном векторе, например, посредством IRES или саморасщепляющихся вирусных пептидов.
Белки вирусной оболочки (env) определяют диапазон клеток-хозяев, которые в конечном итоге могут быть инфицированы и трансформированы посредством рекомбинантных ретровирусов, полученных из клеточных линий. В случае лентивирусов, таких как HIV-1, HIV-2, SIV, FIV и EIV, белки env включают gp41 и gp120. Предпочтительно вирусные белки env, экспрессируемые упаковывающими клетками по настоящему изобретению, закодированы в отдельном векторе из вирусных генов gag и pol, как было ранее описано.
Иллюстративные примеры происходящих из ретровирусов генов env, которые можно использовать в настоящем изобретении, включают без ограничений гены оболочек MLV, оболочки 10A1, оболочек BAEV, FeLV-B, RD114, SSAV, вируса Эбола, вируса Сэндай, FPV (вируса чумы домашней птицы) и вируса гриппа. Аналогично могут быть использованы гены, кодирующие оболочки РНК-вирусов (например, РНК-вирусов из семейств Picornaviridae, Calciviridae, Astroviridae, Togaviridae, Flaviviridae, Coronaviridae, Paramyxoviridae, Rhabdoviridae, Filoviridae, Orthomyxoviridae, Bunyaviridae, Arenaviridae, Reoviridae, Birnaviridae, Retroviridae), а также ДНК-вирусов (семейства Hepadnaviridae, Circoviridae, Parvoviridae, Papovaviridae, Adenoviridae, Herpesviridae, Poxviridae и Iridoviridae). Типичные примеры включают FeLV, VEE, HFVW, WDSV, SFV, вирус бешенства, ALV, BIV, BLV, EBV, CAEV, SNV, ChTLV, STLV, MPMV, SMRV, RAV, FuSV, MH2, AEV, AMV, CT10 и EIAV.
В других вариантах осуществления белки оболочки для псевдотипирования вируса по настоящему изобретению включают без ограничений белки из любого из следующих вирусов: вируса гриппа A, такого как H1N1, H1N2, H3N2 и H5N1 (птичий грипп), вируса гриппа B, вируса гриппа C, вируса гепатита A, вируса гепатита B, вируса гепатита C, вируса гепатита D, вируса гепатита E, ротавируса, любого вируса из группы норовирусов, кишечных аденовирусов, парвовируса, вируса лихорадки Денге, вируса оспы обезьян, вирусов порядка Mononegavirales, лиссавируса, такого как вирус бешенства, вирус летучих мышей острова Лагос, вирус Мокола, вирус Дювенхага, вирус европейских летучих мышей 1 и 2 типа и вирус австралийских летучих мышей, эфемеровируса, везикуловируса, вируса везикулярного стоматита (VSV), герпесвирусов, таких как вирус простого герпеса 1 и 2 типов, вирус ветряной оспы, цитомегаловирус, вирус Эпштейна-Барр (EBV), вирус герпеса человека (HHV), вирус герпеса человека 6 и 8 типа, вируса иммунодефицита человека (HIV), вируса папилломы, мышиного гаммагерпесвируса, аренавирусов, таких как вирус аргентинской геморрагической лихорадки, вирус боливийской геморрагической лихорадки, вирус Сабиа, ассоциированный с геморрагической лихорадкой, вирус венесуэльской геморрагической лихорадки, вирус лихорадки Ласса, вирус Мачупо, вирус лимфоцитарного хориоменингита (LCMV), Bunyaviridiae, таких как вирус конго-крымской геморрагической лихорадки, хантивирус, вирус, вызывающий геморрагическую лихорадку с почечным синдромом, вирус лихорадки Рифт-Валли, Filoviridae (филовирус), в том числе вируса геморрагической лихорадки Эбола и геморрагической лихорадки Марбург, Flaviviridae, в том числе вирус киасанурской лесной болезни, вирус омской геморрагической лихорадки, вирус, вызывающий клещевой энцефалит, и Paramyxoviridae, таких как вирус Хендра и вирус Нипах, вирусы Variola major и Variola minor (вирусы натуральной оспы), альфавирусов, таких как вирус венесуэльского энцефалита лошадей, вирус восточного энцефалита лошадей, вирус западного энцефалита лошадей, SARS-ассоциированного коронавируса (SARS-CoV), вируса Западного Нила и любого вируса, вызывающего энцефалит.
В одном варианте осуществления настоящего изобретения предусмотрены упаковывающие клетки, которые продуцируют рекомбинантный ретровирус, например, лентивирус, псевдотипированный с помощью гликопротеина VSV-G.
Используемые в данном документе термины «псевдотипировать» или «псевдотипирование» относятся к вирусу, белки оболочки которого были замещены на белки другого вируса, обладающего предпочтительными характеристиками. Например, HIV может быть псевдотипирован с помощью белков оболочки, представляющих собой G-белок вируса везикулярного стоматита (VSV-G), который обеспечивает возможность HIV инфицировать более широкий спектр клеток, поскольку белки оболочки HIV (кодируемые геном env) в норме нацеливают вирус на CD4+ клетки. В предпочтительном варианте осуществления настоящего изобретения белки оболочки лентивируса псевдотипированы с помощью VSV-G. В одном варианте осуществления настоящего изобретения предусмотрены упаковывающие клетки, которые продуцируют рекомбинантный ретровирус, например, лентивирус, псевдотипированный с помощью гликопротеина оболочки VSV-G.
Используемый в данном документе термин «упаковывающие клеточные линии» применяют при ссылке на клеточные линии, которые не содержат сигнал упаковки, но при этом стабильно или транзиентно экспрессируют вирусные структурные белки и ферменты репликации (например, gag, pol и env), которые необходимы для правильной упаковки вирусных частиц. Для получения упаковывающих клеток по настоящему изобретению можно использовать любую подходящую клеточную линию. Как правило, указанные клетки являются клетками млекопитающих. В конкретном варианте осуществления клетки, используемые для получения упаковывающей клеточной линии, являются человеческими клетками. Подходящие клеточные линии, которые можно использовать, включают, например, клетки CHO, клетки BHK, клетки MDCK, клетки C3H 10T1/2, клетки FLY, клетки Psi-2, клетки BOSC 23, клетки PA317, клетки WEHI, клетки COS, клетки BSC 1, клетки BSC 40, клетки BMT 10, клетки VERO, клетки W138, клетки MRC5, клетки A549, клетки HT1080, клетки 293, клетки 293Т, клетки B-50, клетки 3T3, клетки NIH3T3, клетки HepG2, клетки Saos-2, клетки Huh7, клетки HeLa, клетки W163, клетки 211 и клетки 211A. В предпочтительных вариантах осуществления упаковывающие клетки представляют собой клетки 293, клетки 293Т или клетки A549.
Используемый в данном документе термин «продуцирующая клеточная линия» относится к клеточной линии, которая способна продуцировать рекомбинантные ретровирусные частицы, содержащей упаковывающую клеточную линию и конструкцию вектора-переносчика, содержащую сигнал упаковки. Продукцию инфекционных вирусных частиц и исходных растворов вируса можно выполнять с применением традиционных методик. Способы получения исходных растворов вируса известны из уровня техники и проиллюстрированы, например, в Y. Soneoka et al. (1995) Nucl. Acids Res. 23:628-633, и N. R. Landau et al. (1992) J. Virol. 66:5110-5113. Инфекционные вирусные частицы можно собирать из упаковывающих клеток с применением традиционных методик. Например, инфекционные частицы можно собирать при помощи лизиса клеток и сбора супернатанта культуры клеток, как известно из уровня техники. В случае необходимости собранные вирусные частицы необязательно могут быть очищены. Подходящие методики очистки хорошо известны специалистам в данной области.
Доставка гена(-ов) или другой полинуклеотидной последовательности с применением ретровирусного или лентивирусного вектора посредством вирусной инфекции, а не трансфекции, называется «трансдукцией». В одном варианте осуществления ретровирусные векторы трансдуцируют в клетку посредством инфекции и интеграции провируса. В определенных вариантах осуществления целевая клетка, например, Т-клетка, является «трансдуцированной», если она содержит ген или другую полинуклеотидную последовательность, доставленную в клетку посредством инфекции с помощью вирусного или ретровирусного вектора. В конкретных вариантах осуществления трансдуцированная клетка содержит один или более генов или других полинуклеотидных последовательностей, доставленных в клеточный геном с помощью ретровирусного или лентивирусного вектора.
В конкретных вариантах осуществления клетки-хозяева, трансдуцированные вирусным вектором по настоящему изобретению, который экспрессирует один или более полипептидов, вводят субъекту для лечения и/или предупреждения B-клеточного новообразования. Другие способы, связанные с применением вирусных векторов в генной терапии, которые могут быть использованы в соответствии с некоторыми вариантами осуществления настоящего изобретения, описаны, например, в Kay, M. A. (1997) Chest 111(6 Supp.):138S-142S; Ferry, N. and Heard, J. M. (1998) Hum. Gene Ther. 9:1975-81; Shiratory, Y. et al. (1999) Liver 19:265-74; Oka, K. et al. (2000) Curr. Opin. Lipidol. 11:179-86; Thule, P. M. and Liu, J. M. (2000) Gene Ther. 7:1744-52; Yang, N. S. (1992) Crit. Rev. Biotechnol. 12:335-56; Alt, M. (1995) J. Hepatol. 23:746-58; Brody, S. L. and Crystal, R. G. (1994) Ann. N.Y. Acad. Sci. 716:90-101; Strayer, D. S. (1999) Expert Opin. Investig. Drugs 8:2159-2172; Smith-Arica, J. R. and Bartlett, J. S. (2001) Curr. Cardiol. Rep. 3:43-49; и Lee, H. C. et al. (2000) Nature 408:483-8.
H. Композиции и составы
Композиции, рассмотренные в данном документе, могут содержать один или более полипептидов, полинуклеотидов, содержащих их векторов и композиций на основе T-клеток, рассматриваемых в данном документе. Композиции включают без ограничений фармацевтические композиции. «Фармацевтической композицией» называют композицию, составленную в фармацевтически приемлемых или физиологически приемлемых растворах для введения в клетку или животному либо отдельно, либо в комбинации с одним или более иными видами терапии. Следует также иметь в виду, что, при желании, композиции по настоящему изобретению можно также вводить в комбинации с другими средствами, такими как, например, цитокины, факторы роста, гормоны, малые молекулы, химиотерапевтические средства, пролекарства, лекарственные средства, антитела или другие различные фармацевтически активные средства. Для других компонентов, которые также можно включать в композиции, практически не существует ограничений, при условии, что дополнительные средства не оказывают отрицательного влияния на способность композиции доставлять предусмотренное терапевтическое средство.
Фраза «фармацевтически приемлемый» используется в данном документе для обозначения тех соединений, материалов, композиций и/или готовых лекарственных форм, которые, в рамках медицинских показаний, пригодны для применения в контакте с тканями человека и животных, при этом не вызывают чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соизмеримых с приемлемым соотношением польза/риск.
Используемый в настоящем документе «фармацевтически приемлемый носитель, разбавитель или наполнитель» включает без ограничений адъювант, носитель, наполнитель, скользящее средство, подсластитель, разбавитель, консервант, краситель/окрашивающее средство, усилитель вкуса и запаха, поверхностно-активное вещество, смачивающее средство, диспергирующее средство, суспендирующее средство, стабилизатор, изотоническое средство, растворитель, поверхностно-активное вещество или эмульгатор, который был одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств США как пригодный для применения у человека или домашних животных. Примеры фармацевтически приемлемых носителей включают без ограничений сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; трагакант; солод; желатин; тальк; масло какао, воски, животные и растительные жиры, парафины, силиконы, бентониты, кремниевую кислоту, окись цинка; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные средства, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы и любые другие совместимые вещества, используемые в фармацевтических составах.
В конкретных вариантах осуществления композиции по настоящему изобретению содержат некоторое количество модифицированных T-клеток, полученных с помощью способов, рассмотренных в данном документе. В предпочтительных вариантах осуществления фармацевтические композиции на основе T-клеток содержат высокоактивные T-клетки с одним или более или во всеми из следующих маркеров: CD62L, CCR7, CD28, CD27, CD122 и CD127.
В целом можно указать, что фармацевтическую композицию, содержащую T-клетки, произведенные с помощью способов, рассмотренных в данном документе, можно вводить при дозировках 102-1010 клеток/кг массы тела, 105-109 клеток/кг массы тела, 105-108 клеток/кг массы тела, 105-107 клеток/кг массы тела, 107-109 клеток/кг массы тела или 107-108 клеток/кг массы тела, включая все целые значения в пределах этих диапазонов. Количество клеток будет зависеть от способа конечного применения, для которого предназначена данная композиция, а также от типа клеток, включенных в нее. Для способов применений, предусмотренных в данном документе, количество клеток на литр объема или менее, может составлять 500 мл или менее, даже 250 мл или 100 мл или менее. Следовательно, плотность требуемых клеток, как правило, превышает 106 клеток/мл и обычно превышает 107 клеток/мл, как правило, составляет 108 клеток/мл или больше. Клинически значимое количество иммунных клеток можно распределить на несколько инфузий, которые совокупно равны или превышают 105, 106, 107, 108, 109, 1010, 1011 или 1012 клеток. В некоторых аспектах настоящего изобретения, в частности, если все вводимые клетки будут перенаправлены на конкретный целевой антиген (например, BCMA), можно вводить сниженные количества клеток в диапазоне 106/кг (106-1011 на пациента). T-клетки, модифицированные для экспрессии разработанного TCR или CAR, можно вводить несколько раз при дозировках в пределах этих диапазонов. Клетки могут быть аллогенными, сингенными, ксеногенными или аутологичными относительно пациента, проходящего лечение. При необходимости для усиления приживления и функции инфузированных T-клеток лечение может также включать введение митогенов (например, PHA) или лимфокинов, цитокинов и/или хемокинов (например, IFN-γ, IL-2, IL-7, IL-15, IL-12, TNF-альфа, IL-18 и TNF-бета, GM-CSF, IL-4, IL-13, Flt3-L, RANTES, MIP1α и т. д.), описываемых в данном документе.
Как правило, композиции, содержащие клетки, активированные и размноженные, как описано в данном документе, можно использовать в лечении и предупреждении заболеваний, которые возникают у индивидуумов с ослабленным иммунитетом. В частности, композиции, содержащие модифицированные Т-клетки, полученные с помощью способов, рассмотренных в данном документе, применяют в лечении рака. Модифицированные Т-клетки по настоящему изобретению можно вводить либо отдельно, либо в виде фармацевтической композиции в комбинации с носителями, разбавителями, наполнителями и/или с другими компонентами, такими как IL-2, IL-7 и/или IL-15, или другие цитокины или популяции клеток. В конкретных вариантах осуществления фармацевтические композиции, рассмотренные в данном документе, содержат некоторое количество генетически модифицированных Т-клеток в комбинации с одним или более фармацевтически или физиологически приемлемыми носителями, разбавителями или наполнителями.
Фармацевтические композиции, содержащие модифицированные Т-клетки, рассмотренные в данном документе, могут дополнительно содержать буферы, такие как нейтральный забуференный солевой раствор, фосфатный буферный солевой раствор и т.п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие средства, такие как ЭДТА или глутатион; адъюванты (например, гидроксид алюминия) и консерванты. Композиции по настоящему изобретению предпочтительно составлены для парентерального введения, например, внутрисосудистого (внутривенного или внутриартериального), внутрибрюшинного или внутримышечного введения.
Жидкие фармацевтические композиции, будь-то растворы, суспензии или другие аналогичные формы, могут включать одно или более из следующего: стерильные разбавители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический раствор, раствор Рингера, изотонический раствор хлорида натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и средства для регулирования тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть заключен в ампулах, одноразовых шприцах или флаконах с многократными дозами, изготовленных из стекла или пластика. Инъецируемая фармацевтическая композиция предпочтительно является стерильной.
В конкретном варианте осуществления композиции, рассмотренные в данном документе, содержат эффективное количество композиции на основе размноженных модифицированных T-клеток отдельно или в комбинации с одним или более терапевтическими средствами. Таким образом, композиции на основе T-клеток можно вводить отдельно или в комбинации с другими известными способами лечения рака, такими как лучевая терапия, химиотерапия, трансплантация, иммунотерапия, гормональная терапия, фотодинамическая терапия и т.д. Композиции также можно вводить в комбинации с антибиотиками. Такие терапевтические средства могут быть приняты в данной области техники в качестве стандартного лечения конкретного болезненного состояния, описанного в данном документе, такого как конкретная форма рака. Примеры предусмотренных терапевтических средств включают цитокины, факторы роста, стероиды, NSAID, DMARD, противовоспалительные средства, химиотерапевтические средства, радиотерапевтические средства, терапевтические антитела или другие активные и вспомогательные средства.
В определенных вариантах осуществления композиции, содержащие T-клетки, рассмотренные в данном документе, можно вводить в сочетании с любым количеством химиотерапевтических средств. Иллюстративные примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, в том числе алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламиновую смолу; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамин оксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, антрамицин, азасерин, блеомицины, кактиномицин, калихемицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции коры надпочечников, такие как аминоглутетимид, митотан, трилостан; добавку для восполнения фолиевой кислоты, такую как фолиниевая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; амсакрин; бестрабуцил; бисантрен; эдатрексат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиниума ацетат; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2, 2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепу; таксоиды, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Принстон, Нью-Джерси) и доксетаксел (TAXOTERE®., Rhne-Poulenc Rorer, Антони, Франция); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митомицин C; митоксантрон; винкристин; винорелбин; навельбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифторметиломитин (DMFO); производные ретиноевой кислоты, такие как Targretin™ (бексаротен), Panretin™ (алитретиноин); ONTAK™ (денилейкин дифтитокс); эсперамицины; капецитабин; а также фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанного. Также в это определение включены антигормональные средства, которые регулируют или ингибируют действие гормонов на опухоли, такие как антиэстрогены, включающие, например, тамоксифен, ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанного.
Целый ряд других терапевтических средств можно использовать в сочетании с композициями, описанными в данном документе. В одном варианте осуществления композицию, содержащую T-клетки, вводят с противовоспалительным средством. Противовоспалительные средства или препараты включают без ограничений стероиды и глюкокортикоиды (в том числе бетаметазон, будесонид, дексаметазон, гидрокортизона ацетат, гидрокортизон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон), нестероидные противовоспалительные средства (NSAIDS), в том числе аспирин, ибупрофен, напроксен, метотрексат, сульфасалазин, лефлуномид, лекарственные препараты против TNF, циклофосфамид и микофенолат.
Другие примеры NSAID выбраны из группы, включающей ибупрофен, напроксен, напроксен-натрий, ингибиторы Cox-2, такие как VIOXX® (рофекоксиб) и CELEBREX® (целекоксиб) и сиалилаты. Примеры обезболивающих средств выбраны из группы, включающей ацетаминофен, оксикодон, трамадол или пропоксифена гидрохлорид. Примеры глюкокортикоидов выбраны из группы, включающей кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон или преднизон. Примеры модификаторов биологического ответа включают молекулы, направленные против маркеров клеточной поверхности (например, CD4, CD5 и т.д.), ингибиторы цитокинов, такие как антагонисты TNF (например, этанерцепт (ENBREL®), адалимумаб (HUMIRA®) и инфликсимаб (REMICADE®)), ингибиторы хемокинов и ингибиторы молекул адгезии. Модификаторы биологического ответа включают моноклональные антитела, а также рекомбинантные формы молекул. Примеры DMARD включают азатиоприн, циклофосфамид, циклоспорин, метотрексат, пеницилламин, лефлуномид, сульфасалазин, гидроксихлорохин, препарат золота (пероральный (ауранофин) и внутримышечный) и миноциклин.
Иллюстративные примеры терапевтических антител, пригодных для комбинации с CAR-модифицированными Т-клетками, рассмотренными в данном документе, включают без ограничений абаговомаб, адекатумумаб, афутузумаб, алемтузумаб, альтумомаб, аматуксимаб, анатумомаб, арцитумомаб, бавитуксимаб, бектумомаб, бевацизумаб, биватузумаб, блинатумомаб, брентуксимаб, кантузумаб, катумаксомаб, цетуксимаб, цитатузумаб, циксутумумаб, кливатузумаб, конатумумаб, даратумумаб, дрозитумаб, дулиготумаб, дусигитумаб, детумомаб, дацетузумаб, далотузумаб, эркомексимаб, элотузумаб, энситуксимаб, эртумаксомаб, этарацизумаб, фариетузумаб, фиклатузумаб, фигитумумаб, фланвотумаб, футуксимаб, ганитумаб, гемтузумаб, гирентуксимаб, глембатумумаб, ибритумомаб, иговомаб, имгатузумаб, индатуксимаб, инотузумаб, интетумумаб, ипилимумаб, иратумумаб, лабетузумаб, лексатумумаб, линтузумаб, лорвотузумаб, лукатумумаб, мапатумумаб, матузумаб, милатузумаб, минретумомаб, митумомаб, моксетумомаб, нарнатумаб, наптумомаб, нецитумумаб, нимотузумаб, нофетумомаб, окаратузумаб, офатумумаб, оларатумаб, онартузумаб, опортузумаб, ореговомаб, панитумумаб, парсатузумаб, партитумаб, пемтумомаб, пертузумаб, пинтумомаб, притумумаб, ракотумомаб, радретумаб, рилотумумаб, ритуксимаб, робатумумаб, сатумомаб, сибротузумаб, силтуксимаб, симтузумаб, солитомаб, такатузумаб, таплитумомаб, тенатумомаб, тепротумумаб, тигатузумаб, тозитумомаб, трастузумаб, тукотузумаб, ублитуксимаб, велтузумаб, ворсетузумаб, вотумумаб, залутумумаб, CC49 и 3F8.
В определенных вариантах осуществления композиции, описанные в данном документе, вводят в сочетании с цитокином. Под используемым в данном документе «цитокином» подразумевают общий термин, обозначающий белки, высвобождаемые одной популяцией клеток, которые действуют на другую клетку как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины, хемокины и традиционные полипептидные гормоны. В число цитокинов включены гормоны роста, такие как человеческий гормон роста, N-метионил человеческий гормон роста и гормон роста крупного рогатого скота; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-альфа и -бета; мюллерова ингибирующая субстанция; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-бета; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуцирующие факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), такие как макрофагальный-CSF (M-CSF); гранулоцитарно-макрофагальный-CSF (GM-CSF) и гранулоцитарный-CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1 альфа, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; IL-15, фактор некроза опухолей, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, в том числе LIF и kit-лиганд (KL). Используемый в данном документе термин «цитокин» включает белки из природных источников или из культуры рекомбинантных клеток, а также биологически активные эквиваленты цитокинов с нативной последовательностью.
I. Целевые клетки и антигены
В настоящем изобретении предусмотрены, в частности, генетически модифицированные иммунные эффекторные клетки, перенаправленные на целевую клетку, например, на опухолевую или раковую клетку, и которые содержат разработанные T-клеточные рецепторы или CAR со связывающим доменом, который связывается с целевыми антигенами на клетках. Раковые клетки также могут распространяться в другие части организма через кровеносную и лимфатическую системы. Существует несколько основных типов рака. Карцинома представляет собой рак, который начинается в коже или в тканях, выстилающих или покрывающих внутренние органы. Саркома представляет собой рак, который начинается в кости, хряще, жировой ткани, мышечной ткани, кровеносных сосудах или другой соединительной или поддерживающей ткани. Лейкоз представляет собой рак, который начинается в кроветворной ткани, такой как костный мозг, и вызывает появление большого количества аномальных клеток крови и поступление их в кровь. Лимфома и множественная миелома представляют собой формы рака, которые начинаются в клетках иммунной системы. Формы рака центральной нервной системы представляют собой формы рака, которые начинаются в тканях головного и спинного мозга.
В одном варианте осуществления целевая клетка экспрессирует антиген, например, целевой антиген, который практически не встречается на поверхности других нормальных (требуемых) клеток. В одном варианте осуществления целевая клетка представляет собой клетку паренхимы поджелудочной железы, клетку протока поджелудочной железы, клетку печени, клетку миокарда, клетку скелетной мышцы, остеобласт, скелетный миобласт, нейрон, клетку эндотелия сосудов, пигментную клетку, гладкомышечную клетку, глиальную клетку, жировую клетку, остеоцит, хондроцит, клетку панкреатического островка, клетку ЦНС, клетку ПНС, клетку печени, липоцит, клетку почки, клетку легкого, клетку кожи, клетку яичника, фолликулярную клетку, эпителиальную клетку, иммунную клетку или эндотелиальную клетку.
В определенных вариантах осуществления целевая клетка представляет собой часть ткани поджелудочной железы, нервной ткани, ткани сердца, костного мозга, мышечной ткани, костной ткани, кожной ткани, ткани печени, волосяного фолликула, ткани сосудов, жировой ткани, легочной ткани и почечной ткани.
В конкретном варианте осуществления целевая клетка представляет собой опухолевую клетку. В другом конкретном варианте осуществления целевая клетка представляет собой раковую клетку, такую как клетка у пациента с раком. Примеры клеток, которые можно уничтожить при помощи раскрытых способов, включают клетки следующих опухолей: гемобластоза, такого как лейкоз, в том числе острый лейкоз (такой как острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, а также миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный и эритролейкоз), хронические лейкозы (такие как хронический миелоцитарный (гранулоцитарный) лейкоз и хронический лимфоцитарный лейкоз), истинная полицитемия, лимфома, болезнь Ходжкина, неходжкинская лимфома, множественная миелома, макроглобулинемия Вальденстрема, болезнь тяжелых цепей).
В другом варианте осуществления клетка представляет собой клетку солидной опухоли, такой как формы саркомы или карциномы, фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома и другие саркомы, синовиома, мезотелиома, саркома Юинга, лейомиосаркома, рабдомиосаркома, карцинома толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, печеночно-клеточный рак, рак легкого, колоректальный рак, плоскоклеточный рак, базальноклеточный рак, аденокарцинома (например аденокарцинома поджелудочной железы, толстой кишки, яичника, легкого, молочной железы, желудка, предстательной железы, шейки матки или пищевода), карцинома потовых желез, карцинома сальной железы, папиллярная карцинома, папиллярные аденокарциномы, медуллярная карцинома, бронхогенный рак, почечно-клеточный рак, гепатома, карцинома желчного протока, хориокарцинома, опухоль Вильмса, рак шейки матки, опухоль яичка, карцинома мочевого пузыря, опухоли ЦНС (такие как глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, менангиома, меланома, нейробластома и ретинобластома).
В одном варианте осуществления рак выбран из группы, включающей Способ по п. 1, где рак выбран из группы, включающей опухоль Вильмса, саркому Юинга, нейроэндокринную опухоль, глиобластому, нейробластому, меланому, рак кожи, рак молочной железы, рак толстой кишки, рак прямой кишки, рак предстательной железы, рак печени, рак почки, рак поджелудочной железы, рак легкого, рак желчевыводящей системы, рак шейки матки, рак эндометрия, рак пищевода, рак желудка, рак головы и шеи, медуллярную карциному щитовидной железы, рак яичника, глиому, лимфому, лейкоз, миелому, острый лимфобластный лейкоз, острый миеологенный лейкоз, хронический лимфолейкоз, хронический миелогенный лейкоз, лимфому Ходжкина, неходжкинскую лимфому и рак мочевого пузыря.
В одном варианте осуществления целевая клетка представляет собой злокачественную клетку печени, поджелудочной железы, легкого, молочной железы, мочевого пузыря, головной мозга, кости, щитовидной железы, почки, кожи и системы кроветворения. В другом варианте осуществления целевая клетка представляет собой клетку в раке печени, раке поджелудочной железы, раке легкого, раке молочной железы, раке мочевого пузыря, раке головного мозга, раке кости, раке щитовидной железы, раке почки, раке кожи или раке системы кроветворения.
В одном варианте осуществления целевая клетка представляет собой клетку, например, раковую клетку, инфицированную вирусом, в том числе без ограничений CMV, HPV и EBV.
В одном варианте осуществления целевой антиген представляет собой эпитоп фолатного рецептора альфа, 5T4, αvβ6 интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, CMV, EBV, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, HPV, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2.
J. Способы терапии
Модифицированные T-клетки, полученные с помощью способов, рассмотренных в данном документе, обеспечивают улучшенную адоптивную иммунотерапию для применения в лечении различных состояний, в том числе без ограничений рака, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания и иммунодефицита. В конкретных вариантах осуществления специфичность первичной Т-клетки перенаправлена на опухолевые или раковые клетки при помощи генетической модификации первичной Т-клетки с помощью разработанного TCR или CAR, рассмотренного в данном документе. В одном варианте осуществления настоящего изобретения предусмотрен тип клеточной терапии, при которой Т-клетки модифицируют для экспрессии разработанного TCR или CAR, который нацеливается на раковые клетки, экспрессирующие целевой антиген, и модифицированные Т-клетки вводят реципиенту, нуждающемуся в этом. Введенные клетки способны уничтожить опухолевые клетки в реципиенте. В отличие от терапии на основе антител Т-клетки, модифицированные разработанным TCR или CAR, способны реплицироваться in vivo, что приводит к долгосрочной персистенции, которая может обеспечить длительную терапию рака.
В одном варианте осуществления Т-клетки с разработанным TCR и CAR по настоящему изобретению могут подвергаться активному in vivo размножению Т-клеток и могут персистировать в течение длительного периода времени. В другом варианте осуществления Т-клетки с разработанным TCR или CAR по настоящему изобретению превращаются в специфические Т-клетки памяти, которые могут реактивироваться для ингибирования любого дополнительного образования или роста опухоли.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего промотор, функционально связанный с полинуклеотидом, кодирующим CAR, применяют при лечении солидных опухолей или форм рака, в том числе без ограничений рака печени, рака поджелудочной железы, рака легкого, рака молочной железы, рака мочевого пузыря, рака головного мозга, рака кости, рака щитовидной железы, рака почки или рака кожи.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего промотор, функционально связанный с полинуклеотидом, кодирующим разработанный TCR или CAR, который содержит антиген-специфический связывающий домен, который связывает эпитоп PSCA или MUC1, применяют при лечении различных форм рака, в том числе без ограничений поджелудочной железы, мочевого пузыря и легкого.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего промотор, функционально связанный с полинуклеотидом, кодирующим разработанный TCR или CAR, применяют при лечении гемобластозов, в том числе без ограничений лейкоза, в том числе острого лейкоза (например, ALL, AML и миелобластного, промиелоцитарного, миеломоноцитарного, моноцитарного и эритролейкоза), хронических лейкозов (например, CLL, SLL, CML, HCL), истинной полицитемии, лимфомы, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы, макроглобулинемии Вальденстрема и болезни тяжелых цепей.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего промотор, функционально связанный с полинуклеотидом, кодирующим разработанный TCR или CAR, применяют для лечения В-клеточных новообразований, в том числе без ограничений множественной миеломы (MM), неходжкинской лимфомы (NHL) и хронического лимфоцитарного лейкоза (CLL).
Множественная миелома представляет собой B-клеточное новообразование с морфологией зрелых плазматических клеток, характеризующееся злокачественным перерождением одного клона этих типов клеток. Эти плазматические клетки пролиферируют в BM и могут инвазировать в прилегающую кость и иногда кровь. Вариантные формы множественной миеломы включают клинически выраженную множественную миелому, вялотекущую множественную миелому, плазмоцитарный лейкоз, несекреторную миелому, IgD-миелому, остеосклеротическую миелому, солитарную плазмацитому кости и экстрамедуллярную плазмацитому (см., например, Braunwald, et al. (eds), Harrison’s Principles of Internal Medicine, 15th Edition (McGraw-Hill 2001)).
Неходжкинская лимфома охватывает большую группу форм рака лимфоцитов (белых кровяных клеток). Неходжкинские лимфомы могут возникать в любом возрасте и часто характеризуются увеличенными размерами лимфатических узлов, лихорадкой и потерей веса. Существует множество типов неходжкинской лимфомы. Например, неходжкинскую лимфому можно подразделять на агрессивные (быстрорастущие) и вялотекущие (медленнорастущие) типы. Несмотря на то, что неходжкинские лимфомы могут происходить из В-клеток и Т-клеток, используемые в данном документе термины «неходжкинская лимфома» и «В-клеточная неходжкинская лимфома» используются взаимозаменяемо. В-клеточные неходжкинские лимфомы (NHL) включают лимфому Беркитта, хронический лимфолейкоз/мелкоклеточную лимфоцитарную лимфому (CLL/SLL), диффузную В-крупноклеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, лимфобластную лимфому из B-клеток-предшественников и лимфому из клеток мантийной зоны. Лимфомы, возникающие после трансплантации костного мозга или стволовых клеток, как правило, представляют собой В-клеточные неходжкинские лимфомы.
Хронический лимфоцитарный лейкоз (CLL) представляет собой вялотекущий (медленнорастущий) рак, который вызывает медленное увеличение количества незрелых белых кровяных клеток, называемых B-лимфоциты или B-клетки. Раковые клетки распространяются через кровь и костный мозг, а также могут поражать лимфатические узлы или другие органы, такие как печень и селезенка. В конечном итоге CLL вызывает поражение костного мозга. Иногда на более поздних стадиях заболевания данное заболевание называют мелкоклеточная лимфоцитарная лимфома.
В конкретных вариантах осуществления предусмотрены способы, включающие введение терапевтически эффективного количества модифицированных T-клеток, рассмотренных в данном документе, или содержащей их композиции пациенту, нуждающемуся в этом, отдельно или в комбинации с одним или более терапевтическими средствами. В определенных вариантах осуществления клетки по настоящему изобретению применяют при лечении пациентов с риском развития рака. Таким образом, в настоящем изобретении предусмотрены способы лечения или предупреждения рака, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества модифицированных Т-клеток по настоящему изобретению.
В одном варианте осуществления способ лечения рака у субъекта, нуждающегося в этом, включает введение эффективного количества, например терапевтически эффективного количества, композиции, содержащей генетически модифицированные иммунные эффекторные клетки, рассмотренные в данном документе. Количество и частоту введения будут определять в зависимости от таких факторов, как состояние пациента, а также тип и тяжесть заболевания пациента, хотя соответствующие дозировки можно определить при помощи клинических испытаний.
В одном варианте осуществления количество T-клеток в композиции, вводимой субъекту, составляет по меньшей мере 0,1 x 105 клеток, по меньшей мере 0,5 x 105 клеток, по меньшей мере 1 x 105 клеток, по меньшей мере 5 x 105 клеток, по меньшей мере 1 x 106 клеток, по меньшей мере 0,5 x 107 клеток, по меньшей мере 1 x 107 клеток, по меньшей мере 0,5 x 108 клеток, по меньшей мере 1 x 108 клеток, по меньшей мере 0,5 x 109 клеток, по меньшей мере 1 x 109клеток, по меньшей мере 2 x 109 клеток, по меньшей мере 3 x 109 клеток, по меньшей мере 4 x 109 клеток, по меньшей мере 5 x 109 клеток или по меньшей мере 1 x 1010 клеток. В конкретных вариантах осуществления субъекту вводят от приблизительно 1 x 107 CAR T-клеток до приблизительно 1 x 109 CAR T-клеток, от приблизительно 2 x 107 CAR T-клеток до приблизительно 0,9 x 109 CAR T-клеток, от приблизительно 3 x 107 CAR T-клеток до приблизительно 0,8 x 109 CAR T-клеток, от приблизительно 4 x 107 CAR T-клеток до приблизительно 0,7 x 109 CAR T-клеток, от приблизительно 5 x 107 CAR T-клеток до приблизительно 0,6 x 109 CAR T-клеток или от приблизительно 5 x 107 CAR T-клеток до приблизительно 0,5 x 109 CAR T-клеток.
В одном варианте осуществления количество T-клеток в композиции, вводимой субъекту, составляет по меньшей мере 0,1 x 104 клеток/кг массы тела, по меньшей мере 0,5 x 104 клеток/кг массы тела, по меньшей мере 1 x 104клеток/кг массы тела, по меньшей мере 5 x 104 клеток/кг массы тела, по меньшей мере 1 x 105 клеток/кг массы тела, по меньшей мере 0,5 x 106 клеток/кг массы тела, по меньшей мере 1 x 106 клеток/кг массы тела, по меньшей мере 0,5 x 107 клеток/кг массы тела, по меньшей мере 1 x 107 клеток/кг массы тела, по меньшей мере 0,5 x 108 клеток/кг массы тела, по меньшей мере 1 x 108 клеток/кг массы тела, по меньшей мере 2 x 108 клеток/кг массы тела, по меньшей мере 3 x 108 клеток/кг массы тела, по меньшей мере 4 x 108 клеток/кг массы тела, по меньшей мере 5 x 108 клеток/кг массы тела или по меньшей мере 1 x 109 клеток/кг массы тела. В конкретных вариантах осуществления субъекту вводят от приблизительно 1 x 106 CAR T-клеток/кг массы тела до приблизительно 1 x 108 CAR T-клеток/кг массы тела, от приблизительно 2 x 106 CAR T-клеток/кг массы тела до приблизительно 0,9 x 108 CAR T-клеток/кг массы тела, от приблизительно 3 x 106 CAR T-клеток/кг массы тела до приблизительно 0,8 x 108 CAR T-клеток/кг массы тела, от приблизительно 4 x 106 CAR T-клеток/кг массы тела до приблизительно 0,7 x 108 CAR T-клеток/кг массы тела, от приблизительно 5 x 106 CAR T-клеток/кг массы тела до приблизительно 0,6 x 108 CAR T-клеток/кг массы тела или от приблизительно 5 x 106 CAR T-клеток/кг массы тела до приблизительно 0,5 x 108 CAR T-клеток/кг массы тела.
Рядовому специалисту в данной области будет понятно, что для осуществления необходимой терапии могут потребоваться множественные введения композиций по настоящему изобретению. Например, композиция может быть введена 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более раз на протяжении 1 недели, 2 недель, 3 недель, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 1 года, 2 лет, 5 лет, 10 лет или более.
В определенных вариантах осуществления может быть необходимо вводить субъекту активированные Т-клетки, а затем последовательно осуществлять забор крови (или выполнять аферез), активировать полученные из нее Т-клетки в соответствии с настоящим изобретением, и осуществлять реинфузию этих активированных и размноженных Т-клеток пациенту. Этот процесс можно осуществлять множество раз через каждые несколько недель. В определенных вариантах осуществления Т-клетки можно активировать из крови, взятой в количестве от 10 см3 до 400 см3. В определенных вариантах осуществления Т-клетки активируют из крови, взятой в количестве 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3, 100 см3, 150 см3, 200 см3, 250 см3, 300 см3, 350 см3 или 400 см3 или более. Не привязываясь к какой-либо теории, применение такого протокола множественного взятия крови/множественной реинфузии может служить для отбора определенных популяций Т-клеток.
Введение композиций, рассмотренных в данном документе, можно осуществлять любым удобным способом, в том числе путем аэрозольной ингаляции, инъекции, приема внутрь, переливания, имплантации или трансплантации. В предпочтительном варианте осуществления композиции вводят парентерально. Используемые в данном документе фразы «парентеральное введение» и «введенный парентерально» относятся к способам введения, отличным от энтерального и местного введения, которые обычно осуществляют путем инъекции и которые включают без ограничений внутрисосудистую, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, внутриглазничную, внутриопухолевую, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную и внутригрудинную инъекцию и инфузию. В одном варианте осуществления композиции, рассмотренные в данном документе, вводят субъекту путем непосредственной инъекции в опухоль, лимфатический узел или очаг инфекции.
В одном варианте осуществления субъекту, нуждающемуся в этом, вводят эффективное количество композиции для усиления клеточного иммунного ответа на рак у субъекта. Иммунный ответ может включать клеточные иммунные ответы, опосредованные цитотоксическими Т-клетками, способными приводить к цитолизу инфицированных клеток, регуляторными Т-клетками, а также реакции с хелперными Т-клетками. Также могут быть индуцированы гуморальные иммунные ответы, опосредованные в первую очередь хелперными Т-клетками, способными активировать B-клетки, что приводит к выработке антител. Можно использовать целый ряд методик для анализа типа иммунных ответов, индуцируемых композициями по настоящему изобретению, которые хорошо описаны в уровне техники; например, Current Protocols in Immunology, под ред. John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober (2001) John Wiley & Sons, NY, N.Y.
В случае опосредованного T-клетками цитолиза клеток связывание CAR-лиганда инициирует передачу сигнала с помощью CAR в Т-клетку, что приводит к активации целого ряда путей передачи сигнала в Т-клетке, что индуцирует Т-клетку к выработке или высвобождению белков, способных индуцировать апоптоз целевой клетки посредством различных механизмов. Такие опосредованные Т-клетками механизмы включают (без ограничений) перенос внутриклеточных цитотоксических гранул из Т-клетки в целевую клетку, Т-клеточную секрецию противовоспалительных цитокинов, которые могут индуцировать цитолиз клеток непосредственно (или опосредованно путем рекрутинга киллерных эффекторных клеток), и усиление экспрессии лигандов рецепторов смерти (например, FasL) на поверхности Т-клеток, которые индуцируют апоптоз целевой клетки после связывания со своим когнатным рецептором смерти (например, Fas) на целевой клетке.
В одном варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, у которого был диагностирован рак, включающий извлечение иммунных эффекторных клеток из субъекта, генетическую модификацию указанных иммунных эффекторных клеток с помощью вектора, содержащего нуклеиновую кислоту, кодирующую разработанный TCR или CAR, рассматриваемый в данном документе, с получением тем самым популяции модифицированных иммунных эффекторных клеток, и введение модифицированных иммунных эффекторных клеток тому же субъекту. В предпочтительном варианте осуществления иммунные эффекторные клетки включают Т-клетки.
В определенных вариантах осуществления настоящего изобретения также предусмотрены способы стимуляции иммуномодулирующего ответа, опосредованного иммунными эффекторными клетками, в отношении популяции целевых клеток у субъекта, включающие стадии введения субъекту популяции иммунных эффекторных клеток, экспрессирующих конструкцию нуклеиновой кислоты, кодирующую молекулу разработанного TCR или CAR.
Способы введения композиций клеток, описанных в данном документе, включают любой способ, который является эффективным либо для повторного введения ex vivo генетически модифицированных иммунных эффекторных клеток, которые непосредственно экспрессируют разработанный TCR или CAR в субъекте, либо для повторного введения генетически модифицированных предшественников иммунных эффекторных клеток, которые при введении субъекту дифференцируются в зрелые иммунные эффекторные клетки, которые экспрессируют разработанный TCR или CAR. Один способ включает трансдукцию Т-клеток периферической крови ex vivo с помощью конструкции нуклеиновой кислоты в соответствии с настоящим изобретением и возврат трансдуцированных клеток в субъект.
Все публикации, патентные заявки и выданные патенты, цитируемые в настоящем описании, включены в данный документ посредством ссылки, как если бы каждая отдельная публикация, патентная заявка или выданный патент были конкретно и индивидуально указаны как включенные посредством ссылки.
Хотя вышеизложенное изобретение было довольно подробно описано для иллюстрации и примера в целях ясности понимания, среднему специалисту в данной области будет очевидно в свете идей настоящего изобретения, что в него могут быть внесены определенные изменения и модификации без отступления от сущности или объема прилагаемой формулы изобретения. Следующие примеры предусмотрены только в качестве иллюстрации, но не в качестве ограничения. Специалисты в данной области без труда смогут выявить целый ряд второстепенных параметров, которые можно было бы изменить или модифицировать, чтобы получить по существу такие же результаты.
Примеры
Пример 1
Пролиферация T-клеток, культивируемых с ингибитором AKT
Целью данного эксперимента было определение эффекта ингибиторов Akt в отношении пролиферации T-клеток. Воздействие MK-2206 (Selleckchem) на пролиферацию T-клеток оценивали путем измерения деления T-клеток.
Мононуклеарные клетки периферической крови (PBMC) представляют собой гетерогенную популяцию клеток, содержащую T-клетки. PBMC собирали от нормальных доноров и метили с помощью флуоресцентного красителя (CellTrace® Violet, Molecular Probes), интенсивность которого постепенно понижалась в два раза с каждым делением клеток. Меченые PBMC применяли в качестве источника клеток для размножения T-клеток. T-клетки активировали и размножали путем культивирования меченых PBMC с антителом к CD3 и антителом к CD28 (Miltenyi Biotec) в среде, содержащей IL-2 (CellGenix).
Воздействие MK-2206 на деление клеток оценивали путем оценки снижения флуоресценции CellTrace Violet с помощью проточной цитометрии после добавления 0,025 мкМ, 0,074 мкМ, 0,222 мкМ, 0,67 мкМ или 2,0 мкМ MK-2206 к культурам T-клеток в день 0. Свежую среду для культивирования на основе XVIVO-15, содержащую IL-2 и MK-2206, добавляли к культурам T-клеток через каждые два-три дня в течение в общей сложности семи дней для обеспечения разрастания и размножения T-клеток. Обработка с помощью MK-2206 несущественно снижала деление T-клеток через три дня после инициирования культуры (фигура 1A). Кроме того, для T-клеток, культивируемых в присутствии MK-2206 в течение семи дней, не наблюдались статистически значимые отличия в делении T-клеток по сравнению со средой или контролями без обработки (фигура 1B). Парный t-критерий проводили для всех семи дневных культур; (каждую концентрацию MK-2206 сравнивали с 0 мкМ MK-2206: культуры не имели статистически значимого отличия на уровне p≤0,05).
Пример 2
Экспрессия CD62L на T-клетках, обработанных с помощью MK-2206
Целью данного эксперимента было определение эффекта ингибиторов Akt на T-клеточные маркеры, определяющие активность T-клеток. Воздействие MK-2206 (Selleckchem) на активность T-клеток оценивали путем измерения экспрессии CD62L в культурах T-клеток, полученных в примере 1.
На мышиных моделях было показано, что экспрессия CD62L указывает на высокоактивные T-клетки; T-клетки с большей противоопухолевой эффективностью после адоптивного переноса. Однако для T-клеток, культивируемых с IL-2 in vitro, было показано снижение экспрессии CD62L и, с учетом вышесказанного, это коррелирует со сниженной противоопухолевой активностью опухолеспецифических T-клеток. Удивительным образом, автор настоящего обнаружил, что ингибитор AKT, MK-2206, значительно повышает экспрессию CD62L при всех протестированных концентрациях MK-2206 после семи дней культивирования и в присутствии IL-2. Фигура 2. Парный t-критерий проводили для всех семидневных культур; (каждую концентрацию MK-2206 сравнивали с 0 мкМ MK-2206: *p<0,05, **p<0,01).
Пример 3
Экспрессия CD62L на CAR T-клетках, обработанных с помощью Mk-2206 или ZSTK474
CAR T-клетки культивировали либо с MK-2206, либо с трицирибинфосфатом- TCN (ингибиторы AKT) или с ZSTK474 (ингибитор PI3K). CAR T-клетки, специфические в отношении антигена созревания B-клеток (BCMA), применяли в данной серии экспериментов. Культивирование CAR T-клеток проводили с применением системы, напрямую масштабируемой до крупных клинических производственных процессов. Вкратце, мононуклеарные клетки периферической крови (PBMC) культивировали в флаконах для стационарного культивирования в среде, содержащей IL-2 (CellGenix) и антитела, специфические в отношении CD3 и CD28 (Miltenyi Biotec). 2x108 единиц трансдукции лентивируса, кодирующего CAR к BCMA, добавляли через один день после инициирования культуры. T-клетки с CAR к BCMA поддерживали в фазе логарифмического роста путем добавления свежей среды, содержащей IL-2 и оптимизированную дозу ингибитора в течение в общей сложности десяти дней культивирования. В конце культивирования у T-клеток с CAR к BCMA проводили исследование фенотипа.
Экспрессию CD62L на T-клетках с CAR к BCMA оценивали с помощью проточной цитометрии в конце культивирования. T-клетки с CAR к BCMA специфически обнаруживали с применением рекомбинантного человеческого BCMA-Fc IgG, конъюгированного с PE. Экспрессию CD62L определяли с помощью совместного окрашивания с применением антитела, специфического в отношении CD62L. T-клетки с CAR к BCMA от трех нормальных доноров, культивируемые с IL-2 и MK2206, характеризовали значительно более высокой экспрессией CD62L по сравнению c культурами, обработанными только с помощью IL-2. Трансдукция лентивируса для экспрессии CAR к BCMA не приводила к снижению улучшенного фенотипа, обусловленного MK2206. Аналогичное улучшение наблюдали с применением во время культивирования ZST474, но не в случае TCN. (Фигура 3).
Пример 4
CAR T-клетки, обработанные с помощью Mk-2206 или ZSTK474, демонстрируют улучшенную терапевтическую активность
T-клетки с CAR к BCMA, обработанные с помощью MK-2206, TCN или ZSTK474, как описано в примере 3, тестировали для оценки того, была ли повышенная экспрессия CD62L ассоциирована с повышенной противоопухолевой активностью. T-клетки, экспрессирующие CAR к BCMA, получали после культивирования с IL-2 и одним из MK2206, TCN или ZSTK474. Аликвоту CAR T-клеток также культивировали в среде, дополненной IL-7 и IL-15 в дозах, ранее показавших усиление терапевтической эффективности CAR T-клеток. Животным с 100 мм3 подкожными опухолями множественной миеломы (RPMI-8226) вводили путем инфузии эквивалентные дозы CAR T-клеток (1x106 CAR-положительных клеток).
T-клеток с CAR к BCMA, культивируемые с IL-2, было достаточно, чтобы вызвать полный регресс опухоли. Для T-клеток с CAR к BCMA, культивируемых с IL-7 и IL-15, MK-2206 или ZST747, показаны аналогичные уровни противоопухолевой активности в сравнении с T-клетками с CAR к BCMA, культивируемыми со стандартным IL-2, на данной животной модели множественной миеломы. В отличие от этого, T-клетки с CAR к BCMA, культивируемые с TCN, полностью отменяли какие-либо противоопухолевые ответы. Результаты данных экспериментов показаны на фигуре 4.
Пример 5
CAR T-клетки, обработанные с помощью Mk-2206 или ZSTK474, демонстрируют улучшенную терапевтическую активность на модели агрессивной опухоли
Модель более агрессивной и трудноизлечимой опухоли применяли для определения противоопухолевой активности CAR T-клеток, обработанных с помощью IL-2, MK-2206, TCN, ZSTK474, IL7/15 или среды. Клетки опухоли Дауди экспрессируют белок BCMA на низком уровне и их можно эффективно обрабатывать с применением T-клеток с CAR к BCMA. На прогрессирование опухолей Дауди не влияла последующая обработка с помощью T-клеток с CAR к BCMA, культивируемых с IL-2 или IL7/15. Поразительно, T-клетки с CAR к BCMA, культивируемые с одним из MK-2206 или ZST474, вызывали полный регресс опухоли. Результаты данных экспериментов показаны на фигуре 5.
Пример 6
CAR T-клетки, обработанные с помощью Mk-2206 или ZSTK474, демонстрируют улучшенную персистенцию
Клинические данные от пациентов, которых лечили с помощью CAR T-клеток, позволяют предположить, что персистенция ассоциирована с объективным ответом опухоли на лечение. Персистенцию T-клеток с CAR к BCMA оценивали с помощью повторного введения опухолей мышам, которые характеризовались полным регрессом. Животным, которых обрабатывали с помощью T-клеток с CAR к BCMA, культивируемых с IL-2, MK-2206 или ZSTK474, при этом у них полностью подверглись регрессу 100 мм3 опухоли RPMI-8226, через 13 дней повторно вводили RPMI-8226 в другой бок. CAR T-клетки, культивируемые с IL-2, которыми обрабатывали животных, не были в состоянии предупредить разрастание опухоли. В отличие от этого, ни у одного из животных, которых обрабатывали с помощью T-клеток с CAR к BCMA, культивируемых с ZSTK474, не наблюдалось никаких признаков приживления опухоли. Эти данные показывают, что терапевтически активные T-клетки с CAR к BCMA сохраняют в случае T-клеток с CAR к BCMA, культивируемых с ZSTK474. Результаты данных экспериментов показаны на фигуре 6.
В целом в нижеследующей формуле изобретения используемые термины не должны толковаться как ограничивающие формулу изобретения конкретными вариантами осуществления, раскрытыми в настоящем описании и формуле изобретения, но должны быть истолкованы как включающие все возможные варианты осуществления вместе с полным объемом эквивалентов, которые такая формула изобретения охватывает. Соответственно, формула изобретения не ограничивается настоящим раскрытием.
Реферат
Данное изобретение относится к области иммунологии. Предложен способ производства Т-клеток, согласно которому стадии активации, стимуляции, трансдукции с помощью вирусного вектора, содержащего полинуклеотид, кодирующий Т-клеточный рецептор (TCR) или химерный антигенный рецептор (CAR), а также культивирования трансдуцированных Т-клеток для пролиферации выполняют в присутствии ингибитора фосфатидил-инозитол-3-киназы (PI3K). Применение указанного ингибитора повышает экспрессию CD62L. Полученные таким образом Т-клетки могут быть использованы в адоптивной терапии. 20 з.п. ф-лы, 6 ил., 6 пр.

Комментарии