Координационные комплексы на основе металлов в качестве фотодинамических соединений и их применение - RU2682674C2
Код документа: RU2682674C2
Чертежи









Описание
1. ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к координационным комплексам на основе металлов, которые являются подходящими в качестве терапевтических и диагностических агентов. Настоящее изобретение также относится к фотодинамическим соединениям, которые могут быть активированы излучением в области от ультрафиолетовой до инфракрасной (УФ-ИК), особенно вблизи инфракрасного света, и которые являются подходящими в качестве терапевтических и диагностических агентов. В частности, в настоящем изобретении предложены перестраиваемые фотодинамические соединения на основе металлов, которые представляют собой координационные комплексы, полученные из органических лигандов. Указанные фотодинамические соединения могут быть активированы при помощи излучения для обеспечения разрушения нежелательных клеток, например гиперпролиферативных клеток и микробных клеток. Указанные фотодинамические соединения могут быть также активированы при помощи излучения для обеспечения разрушения вирусов.
2. УРОВЕНЬ ТЕХНИКИ
[0002] В настоящее время фотодинамическая терапия (ФДТ) является актуальной областью исследований, проводимых с целью лечения заболеваний, связанных с гиперпролиферативными клетками, таких как рак и незлокачественные нарушения. Разработка новых фотодинамических соединений (ФДС) для фотодинамической терапии (ФДТ) все больше ориентирована на металлосупрамолекулярные комплексы, полученные из металлов, таких как рутений и родий. Причиной продолжения исследования новых фотосенсибилизаторов для ФДТ являются ограничения, связанные с традиционными порфиринами на органической основе, такими как Фотофрин (Photofrin®), которые должны быть активированы относительно короткими длинами волн света и не должны функционировать в условиях недостатка кислорода. Были достигнуты значительные успехи в преодолении этих ограничений путем введения смешанных комплексов металлов, которые обладают низковозбужденными энергетическими уровнями3ММСТ (перенос заряда от металла к металлу, англ.: metal-to-metal charge transfer). Тем не менее, до настоящего времени существует ограниченное количество сведений о фотодинамических соединениях на основе металлов, которые способны обеспечивать фотодинамическую терапию для лечения заболеваний, связанных с гиперпролиферативными клетками, таких как рак и незлокачественные нарушения.
[0003] Существует назревшая потребность в новых фото динамических соединениях (ФДС), являющихся подходящими в качестве фотосенсибилизаторов для ФДТ, которые и изменяют течение заболевания, и эффективны для лечения пациентов с заболеваниями, связанными с гиперпролиферативными клетками, например, такими как рак. Также долгое время существует потребность в новых ФДС, которые являются подходящими в качестве диагностических агентов in vivo. Настоящее изобретение направлено на удовлетворение потребности в разработке новых ФДС, которые являются подходящими в качестве фотосенсибилизаторов для ФДТ, которые и изменяют течение заболевания, и эффективны для лечения пациентов с заболеваниями, связанными с гиперпролиферативными клетками, например раком. Настоящее изобретение также направлено на удовлетворение назревшей потребности в новых ФДС, которые являются подходящими в качестве диагностических агентов in vivo.
[0004] Все ссылки, упоминаемые в настоящем описании, полностью включены в него посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] Настоящее изобретение относится к новым соединениям формулы (I):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы, где:
M в каждом случае независимо выбран из группы, состоящей из осмия, марганца, молибдена, рения, рутения, железа, кобальта, родия, иридия, никеля, платины, палладия, ванадия, хрома, вольфрама, технеция и меди;
X выбран из группы, состоящей из Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2;
n=0, 1, 2, 3, 4 или 5;
q в каждом случае независимо представляет собой 0, 1 или 2;
y в каждом случае независимо представляет собой 0, 1 или 2;
z в каждом случае независимо представляет собой 1, 2 или 3;
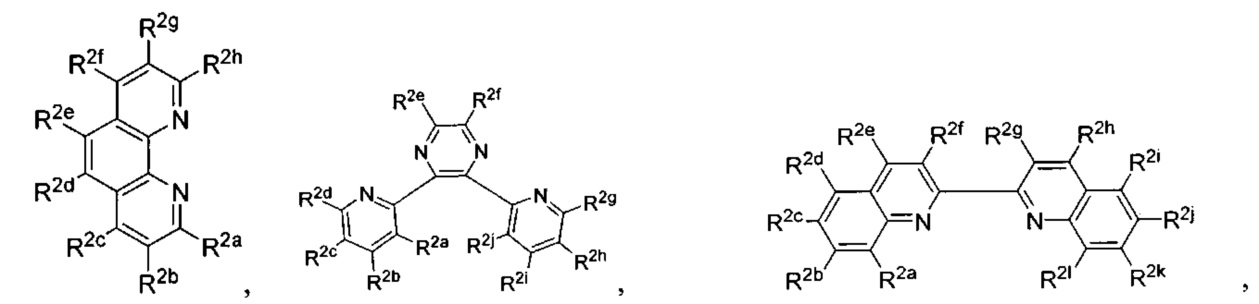
Lig1 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из


Lig2 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из





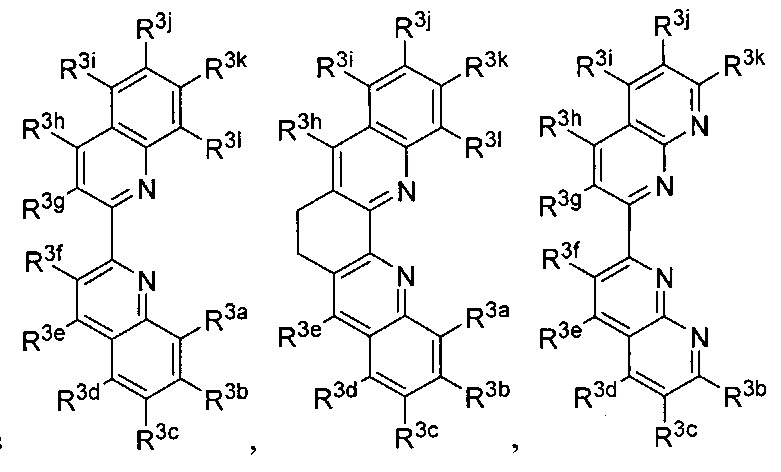
Lig3 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из

[0006] R1 выбран из группы, состоящей из водорода, необязательно замещенного фенила, необязательно замещенного арила, необязательно замещенного гетероарила, 4-пиридила, 3-пиридила, 2-тиазола, 2-пиролила, 2-фуранила,
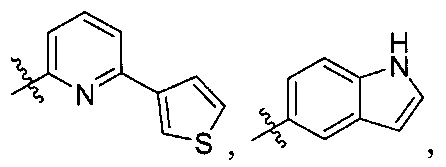






u представляет целое число;
R2a, R2b, R2c, R2d, R2e, R2f, R2g, R2h, R2i, R2j, R2k и R21 в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 обязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкил, С3-7 необязательно замещенного циклоалкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, CO2R5, CONR62, NR72, SO3H, сульфата, сульфоната, необязательно замещенного арила, необязательно замещенного арилокси, необязательно замещенного гетероарила и необязательно замещенного гетероцикла;
R3a, R3b, R3c, R3d, R3e, R3f, R3g, R3h R3i, R3j, R3k и R3l в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, необязательно замещенного фенила и CO2R8;
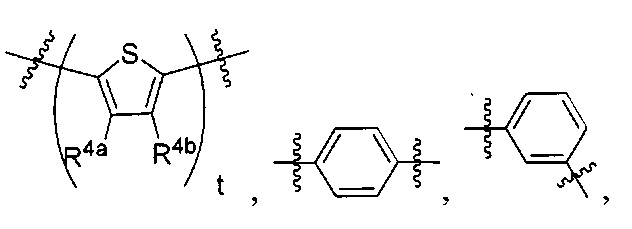
R4a, R4b и R4c в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, C1-6 необязательно замещенного циклоалкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, CO2R5 CONR62, NR72, сульфата, сульфоната, необязательно замещенного арила, необязательно замещенного арилокси, необязательно замещенного гетероарила, и необязательно замещенного гетероцикла;
R4a и R4b, в каждом случае присутствия при тиофеновом кольце, совместно с атомом, к которому они присоединены, образуют необязательно замещенное кольцо, содержащее от 6 атомов в кольце, включая 2 атома кислорода;
R5 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R6 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R7 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R8 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
[0007] Соединения со структурой

[0008] Соединения согласно настоящему изобретению включают соединения, имеющие формулу (II):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0009] Соединения согласно настоящему изобретению включают соединения, имеющие формулу (III):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0010] Соединения согласно настоящему изобретению включают соединения, имеющие формулу (IV):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0011] Настоящее изобретение также относится к новым соединениям формулы (V):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0012] Настоящее изобретение также относится к новым соединениям формулы (VI):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы, где:
[0013] M1 и M2 в каждом случае независимо выбран из группы, состоящей из осмия, марганца, молибдена, рения, рутения, железа, кобальта, родия, иридия, никеля, платины, палладия, ванадия, хрома, вольфрама, технеция и меди;
[0014] p в каждом случае независимо составляет 0, 1 или 2, и в одном случае p должен отличаться от нуля.
[0015] A2 выбран из группы, состоящей из


[0016] Настоящее изобретение также относится к новым соединениям формулы (VII):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0017] Настоящее изобретение также относится к новым соединениям формулы (VIIa):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы, где:
[0018] А выбран из группы, состоящей из



[0019] При этом A3 представляет собой мостиковый лиганд, который связан с M1 как бидентатный лиганд, и A3 связан с M2 как бидентатный лиганд.
[0020] Настоящее изобретение также относится к новым соединениям формулы (VIIb):

включая гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0021] Настоящее изобретение также относится к новым соединениям формулы (VIIc):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0022] Настоящее изобретение также относится к новым соединениям формулы (VIId):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0023] Настоящее изобретение также относится к новым соединениям формулы (VIIe):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0024] Настоящее изобретение также относится к новым соединениям формулы (VIIf):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[0025] Настоящее изобретение также относится к композициям, содержащим:
[0026] эффективное количество одного или более соединений согласно настоящему изобретению и вспомогательное вещество.
[0027] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве агента, связывающего ДНК.
[0028] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве агента, связывающего ДНК.
[0029] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве агента, связывающего нуклеиновую кислоту.
[0030] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве агента, связывающего нуклеиновую кислоту.
[0031] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве агента, связывающего белок.
[0032] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве агента, связывающего белок.
[0033] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве агента для фоторасщепления ДНК.
[0034] Настоящее изобретение также относится к способу, в котором Соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве агента для фоторасщепления ДНК.
[0035] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве агента, конденсирующего ДНК.
[0036] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве агента, конденсирующего ДНК.
[0037] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве агента, дающего эффект переключения ДНК.
[0038] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве агента, дающего эффект переключения ДНК.
[0039] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве фотосенсибилизатора, который может функционировать в фотопроцессе типа I.
[0040] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве фотосенсибилизатора, который может функционировать в фотопроцессе типа I.
[0041] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве фотосенсибилизатора, который может функционировать в фотопроцессе типа II.
[0042] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве фотосенсибилизатора, который может функционировать в фотопроцессе типа II.
[0043] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяются в качестве фотосенсибилизатора, который может функционировать в фотопроцессах типа I и типа II.
[0044] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют в качестве фотосенсибилизатора, который может функционировать в фотопроцессах типа I и типа II.
[0045] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяются для разрушения нежелательных клеток, включая гиперпролиферативные клетки и микробные клетки.
[0046] Настоящее изобретение также относится к способу применения соединений согласно настоящему изобретению для разрушения вирусов.
[0047] Настоящее изобретение также относится к способу применения соединений согласно настоящему изобретению для разрушения нежелательных клеток, включая гиперпролиферативные клетки и микробные клетки с использованием света в качестве активатора.
[0048] Настоящее изобретение также относится к способу применения соединений согласно настоящему изобретению для разрушения вирусов с использованием света в качестве активатора.
[0049] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют для разрушения нежелательных клеток, включая гиперпролиферативные клетки и микробные клетки.
[0050] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют для разрушения вирусов.
[0051] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют для разрушения клеток, включающих клетки бактерий, грибов и простейших.
[0052] Настоящее изобретение также относится к способу применения соединений согласно настоящему изобретению для разрушения клеток, включающих клетки бактерий, грибов и простейших, с использованием света в качестве активатора.
[0053] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют для разрушения клеток, включающих клетки бактерий, грибов и простейших.
[0054] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют для индуцирования апоптоза в клетках, включая гиперпролиферативные клетки.
[0055] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют для индуцирования апоптоза в клетках, включая гиперпролиферативные клетки.
[0056] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют для обеспечения сшивки ДНК в клетках, включая гиперпролиферативные клетки.
[0057] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению и вспомогательное вещество применяют для обеспечения сшивки ДНК в клетках, включая гиперпролиферативные клетки.
[0058] Настоящее изобретение также относится к способу лечения или предотвращения заболеваний, в этиологии которых задействованы гиперпролиферативные клетки, включая, например, рак, где указанный способ включает введение субъекту эффективного количества соединения или композиции согласно настоящему изобретению.
[0059] Кроме того настоящее изобретение также относится к способу лечения или предотвращения заболеваний, в этиологии которых задействованы гиперпролиферативные клетки, включая, например, рак, где указанный способ включает введение субъекту композиции, содержащей эффективное количество одного или более соединений согласно настоящему изобретению и вспомогательное вещество.
[0060] Настоящее изобретение также относится к способу лечения или предотвращения заболеваний, в этиологии которых задействованы гиперпролиферативные клетки, включая, например, рак, где указанный способ включает введение субъекту эффективного количества соединения или композиции согласно настоящему изобретению и внутриклеточного восстанавливающего агента, такого как глутатион.
[0061] Настоящее изобретение также относится к способу лечения или предотвращения заболеваний, в этиологии которых задействованы гиперпролиферативные клетки, включая, например, рак, где указанный способ включает введение субъекту эффективного количества соединения или композиции согласно настоящему изобретению, и вспомогательного вещества, и внутриклеточного восстанавливающего агента, такого как глутатион.
[0062] Настоящее изобретение также относится к способу лечения или предотвращения заболеваний, в этиологии которых задействованы гиперпролиферативные клетки, включая, например, рак, где указанный способ включает введение субъекту эффективного количества соединения или композиций согласно настоящему изобретению и внутриклеточного окисляющего агента, такого как кислород.
[0063] Настоящее изобретение также относится к способу лечения или предотвращения заболеваний, в этиологии которых задействованы гиперпролиферативные клетки, включая, например, рак, где указанный способ включает введение субъекту эффективного количества соединения или композиции согласно настоящему изобретению, и вспомогательного вещества, и внутриклеточного окисляющего агента, такого как кислород.
[0064] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве диагностических агентов in vivo посредством внутриклеточной люминесценции или колориметрическими методами.
[0065] Настоящее изобретение также относится к способу, в котором соединения согласно настоящему изобретению применяют в качестве иммуномодулирующих агентов для опосредования отторжения вторичных опухолей.
[0066] Настоящее изобретение также относится к способу получения соединений согласно настоящему изобретению.
[0067] Эти и другие объекты, признаки и преимущества станут очевидными для специалистов в данной области техники при ознакомлении со следующим подробным описанием и прилагаемой формулой изобретения. Все процентные содержания, соотношения и пропорции в настоящем описании являются массовыми, если не указано иное. Все температуры приведены в градусах Цельсия (°C), если не указано иное. Все упомянутые документы в их соответствующей части включены в настоящее описание посредством ссылки; упоминание любого документа не должно толковаться как допущение того, что он является известным уровнем техники по отношению к настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ ВИДОВ ЧЕРТЕЖЕЙ
[0068] Настоящее изобретение будет описано в сочетании со следующими чертежами на которых одинаковые позиционные обозначения обозначают подобные элементы, где:
[0069] Фигура 1: Иллюстративные примеры соединений согласно настоящему описанию.
[0070] Фигура 2: Поглощение УФ-БИК-излучения приводимыми в качестве примера соединениями согласно настоящему описанию, определенное с применением спектрофотометра Jasco V530 в УФ и видимой области спектра и программного обеспечения Spectra Manager.
[0071] Фигура 3: Влияние интенсивности излучения на эффект ФДТ при помощи 40 мкМ TLDOs14H Cl2 (клетки U87, нормальные кислородные условия (нормоксия)). Клетки облучали с возбуждением 808 нм в течение увеличивающихся промежутком времени с достижением 90, 400 и 600 Дж⋅см-2. Данные выражены в процентах по отношению к контролю (без ФС, без излучения). Эффект ФДТ рассчитывали путем вычитания количества токсических клеток, уничтоженных в темноте, и количества клеток, уничтоженных только облучением, из общего количества клеток, уничтоженных посредством ФДТ.
[0072] Фигура 4: Экспериментальное доказательство высокой стабильности новых ФДС, полученных из координационных комплексов на основе металлов: Фотостабильность, количественно определенную по фотообесцвечиванию, сравнивали с фотостабильностью аминолевулиновой кислоты (АЛК) - агента для клинической ФДТ. Оптические плотности (нормированные на нулевой момент времени) для 13,9 мкМ TLDOs14H Cl2, растворенного в системе ДМСО-вода, показаны для 808 нм (треугольники) и 670 нм (круги). Для сравнения использовали фотообесцвечивание 1,3 мкМ PPIX (фотодинамически активного метаболита стандартного фотосенсибилизатора - АЛК) (ромбы). Фотообесцвечивание фиксировали в течение 60 минут облучения (525 нм, 78 мВт⋅см-2).
[0073] Фигура 5: Экспериментальное доказательство высокой стабильности TLDOs14H Cl2: эффективная ФДТ до и после фотообесцвечивания, представленная для 40 мкМ TLDOs14H Cl2 при двух различных дозах излучения (клетки U87, нормальные кислородные условия). "ИК нормоксические" испытания относятся к клеткам, обработанным TLDOs14H Cl2, облученных светом с длиной волны 808 нм при 400 или 600 Дж⋅см-2 с использованием ранее обесцвеченного (облучение 300 Дж⋅см-2, 808 нм) или необесцвеченного фотосенсибилизатора. Данные выражены в виде процентов уничтоженных клеток по отношению к контролю (без ФС, без облучения светом). Эффект ФДТ (темные линии) рассчитывали путем вычитания количества токсических клеток, уничтоженных в темноте, и количества клеток, уничтоженных только облучением, из общего количества клеток, уничтоженных посредством ФДТ. Испытания "токсичности в темноте" показывают, что уничтожения клеток почти не происходит, и данные для них едва видны на графике.
[0074] Фигура 6: Экспериментальное доказательство ФДТ in vitro в нормальных кислородных условиях (TLDOsH2B Cl2, TLDOsH2IP Cl2 и TLDOs14H Cl2) и при гипоксии (TLDOsh2b Cl2>TLDOs14H Cl2>TLDOsh2IP Cl2). Гипоксические условия относятся к среде, в которой содержится примерно 0,1-0,5% кислорода. Эффекты TLDOs14H Cl2 (40 мкМ), TLDOsH2B Cl2 (160 и 320 мкМ), TLDOshH2IP Cl2 (100 мкМ) и 12,5 мМ АЛК (используют в качестве чувствительного к кислороду положительного контроля) без излучения (серые линии) и при излучении (темные линии) на уничтожение клеток выражены в процентах от контроля (без ФС, без излучения). Доза излучения: 635 нм, 90 Дж⋅см-2.
[0075] Фигура 7: Экспериментальное доказательство получения АФК посредством TLDOsh2IP Cl2 in vitro: уменьшенное уничтожение клеток в линии U87 в присутствии NaN3 (акцептора синглетного кислорода) и диметилтиомочевины (ДМТМ, акцептора гидроксильных радикалов). Эффективность TLDOsh2IP Cl2 (40 мкМ) и АЛК (10 мМ) в отношении уничтожения клеток U87 без излучения (серые линии) и при излучении (темные линии) в присутствии акцепторов гидроксильных радикалов (ДМТМ, 40 мМ) и синглетного кислорода (NaN3, 2 мМ) после облучения при 635 нм, 90 Дж⋅см-2. Результаты выражен в процентах от контроля (без ФС, без излучения), полученных после вычитания количества токсических клеток, уничтоженных в темноте, и количества клеток, уничтоженных только облучением, из общего количества клеток, уничтоженных посредством ФДТ.
[0076] Фигура 8: Подкожные CT26.WT колоректальные опухоли, которые лечили посредством ФДТ (TLDOs2IP Cl2, 808 нм, 600 Дж⋅см2) у белых мышей. Размер опухоли: 5,0×0,5 мм; доза: 3 мг кг-1; объем: 100 мкл и время: 10 мкл/мин. На 52 день после лечения посредством ФДТ опухоль у мышей отсутствовала, и мыши были здоровы.
[0077] Фигура 9: Экспериментальное доказательство увеличения выживаемости животных с использованием противоракового лечения посредством ФДТ: выжившие животные, вылеченные посредством ФС + излучение, все еще находятся под наблюдением. Концентрация TLDOsH2IP составила 3 мг⋅кг-1; доза излучения (808 нм, 600 Дж⋅см-2).
[0078] Фигура 10: Удержание опухоли сильно окрашенным соединением согласно настоящему описанию, которое может быть использовано в качестве колориметрического индикатора для выявления наличия опухолевых клеток в моделях на животных.
[0079] Фигура 11: Профили поглощения в видимой и ближней ИК области для фотосенсибилизаторов общей структуры [Os(biq)2(LL)]Cl2, где biq = 2,2'-бихинолил и LL=1,10-фенантролин (TLDOsH2B Cl2), имидазо[4,5-f][1,10]фенантролин (TLDOsH2IP Cl2) или 2-(2''-тиенил)-имидазо[4,5-f][1,10]фенантролин (TLDOs1H Cl2), полученные с применением спектрофотометра Jasco V530 в УФ и видимой области спектра и программного обеспечения Spectra Manager.
[0080] Фигура 12: Экспериментальное доказательство эффекта независимой от кислорода ФДТ посредством TLDOsH2B Cl2 in vitro: незатронутые уничтоженные клетки в линии U87 в присутствии NaN3 (акцептора синглетного кислорода) и сильно сниженная гибель клеток в присутствии ДМТМ (акцептора гидроксильных радикалов). Эффективности TLDOsh2B Cl2 (90 мкМ) и АЛК (10 мМ) в отношении гибели клеток U87 без излучения (серые линии) и при излучении (черные линии) в присутствии акцепторов гидроксильных радикалов (ДМТМ, 20-40 мМ) и синглетного кислорода (NaN3, 2 мМ) после облучения при 635 нм, 90 Дж⋅см-2. Результат выражен в процентах от контроля (без ФС, без излучения), полученных после вычитания количества токсических клеток, уничтоженных в темноте, и количества клеток, уничтоженных только облучением, из общего количества клеток, уничтоженных посредством ФДТ.
[0081] Фигура 13: Формула для определения констант связывания ДНК для соединений согласно настоящему описанию.
[0082] Фигура 14: Влияние концентрации соединений согласно настоящему описанию (TLDOsH2B Cl2, TLDOsH2IP Cl2, TLDOs1H Cl2, TLDOs10H Cl2, TLDOs14H Cl2) на эффект ФДТ in vitro в отношении клеток HL-60 без излучения (пунктирные линии) и при излучении (сплошные линии). Относительную жизнеспособность клеток оценивали по методу с аламаровым синим в соответствии с инструкциями производителя. Результат выражен в процентах по отношению к необработанным контрольным образцам. Доза излучения: белый свет (400-700 нм), 100 Дж⋅см-2.
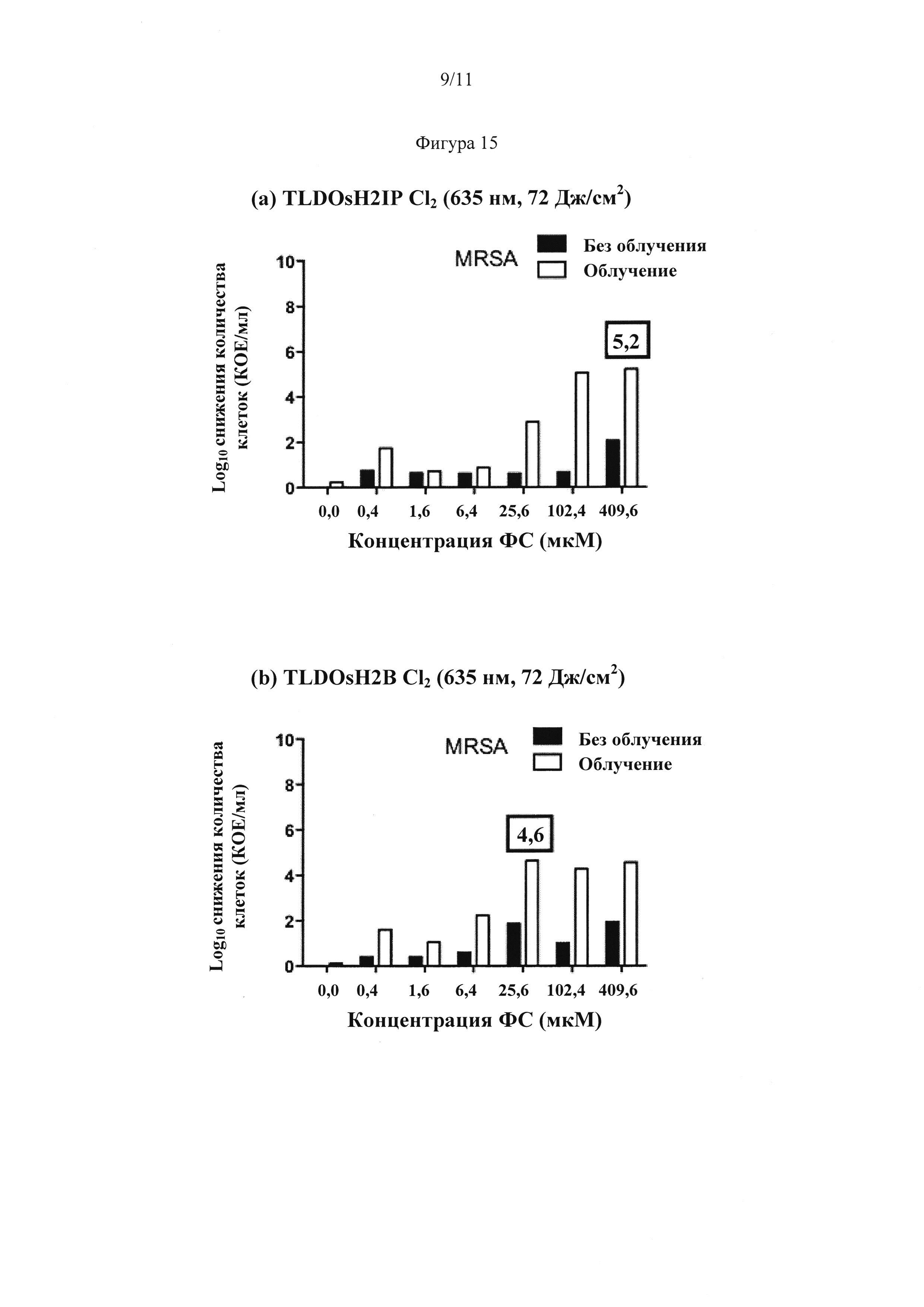
[0083] Фигура 15: Фотодинамическая инактивация (ФДИ) устойчивого к метициллину золотистого стафилококка S. aureus (МУЗС), опосредованная фотосенсибилизаторами TLDOsH2IP Cl2 (a) и TLDOsH2B Cl2 (b). Максимальные логарифмы уничтожения, полученные при помощи источника красного света, составили 5,2 и 4,6 для TLDOsH2IP Cl2 и TLDOsH2B Cl2, соответственно.
[0084] Фигура 16: Кривые выживания Каплана-Мейера для TLDOsH2IP Cl2-опосредованной ФДТ при помощи красного излучения (635 нм, 100 мВт/см2) для модели рака толстой кишки в виде подкожной карциномы у мышей. Животным вводили 3 мг/кг (1/6 MTD50) до ФДТ при 190 Дж/см2 или 266 Дж/см2. Для сравнения приведены контрольные мыши, получающие только светолечение или только фотосенсибилизатор.
[0085] Фигура 17: Эксперимент проведен с Klebsiella pneumoniae (Kp) при помощи фотосенсибилизаторов (ФС) TLDOsH2IP Cl2 и TLDOsH2B Cl2. Максимальный логарифм уничтожения был достигнут для Kp (2IP, 530 нм): 4,8, для Kp (H2B, 530 нм): 8.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0086] В описании, где композиции описаны как имеющие, включающие или содержащие конкретные компоненты или где способы описаны как имеющие, включающие или содержащие конкретные стадии, предполагается, что композиции согласно настоящему описанию также по существу состоят из, или состоят из, перечисленных компонентов, и что способы согласно настоящему описанию также по существу состоят из, или состоят из, перечисленных стадий.
[0087] В настоящей заявке, в том случае когда указано, что элемент или компонент включен в и/или выбран из списка перечисленных элементов или компонентов, должно быть понятно, что указанный элемент или компонент может быть любым из перечисленных элементов или компонентов и может быть выбран из группы, состоящей из двух или более перечисленных элементов или компонентов.
[0088] Применение форм единственного числа в настоящем описании включает применение форм множественного числа (и наоборот), если не указано иное. К тому же, когда перед количественным значением употребляют термин "примерно", настоящее описание также включает само конкретное количественное значение, если не указано иное.
[0089] Следует понимать, что порядок стадий или последовательность выполнения определенных действий не принципиальны до тех пор, пока настоящее описание функционирует. Кроме того, две или более стадий или действий могут быть проведены одновременно.
[0090] В контексте настоящего описания под термином "галоген" понимают хлор, бром, фтор и йод.
[0091] В контексте настоящего описания, если не указано иное, термины "алкил" и "алифатический", отдельно или как часть группы заместителя, относятся к прямым и разветвленным углеродным цепям, содержащим от 1 до 20 атомов углерода или любое количество из этого диапазона, например от 1 до 6 атомов углерода или от 1 до 4 атомов углерода. Указанное количество атомов углерода (например C1-6) будет независимо относиться к количеству атомов углерода в алкильном фрагменте или к алкильной части более крупного алкилсодержащего заместителя. Неограничивающие примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил и т.п. Алкильные группы могут быть необязательно замещены. Неограничивающие примеры замещенных алкильных групп включают гидроксиметил, хлорметил, трифторметил, аминометил, 1-хлорэтил, 2-гидроксиэтил, 1,2-дифторэтил, 3-карбоксипропил и т.п. В группах заместителя с несколькими алкильными группами, таких как (C1-6алкил)2амино, алкильные группы могут быть одинаковыми или различными.
[0092] В контексте настоящего описания термины "алкенильные" и "алкинильные" группы, отдельно или как часть группы заместителя, относятся к прямым и разветвленным углеродным цепям, содержащим 2 или более атомов углерода, предпочтительно от 2 до 20, причем цепь алкенила содержит по меньшей мере одну двойную связь в цепи, а цепь алкинила содержит по меньшей мере одну тройную связь в цепи. Алкенильные и алкинильные группы могут быть необязательно замещены. Неограничивающие примеры алкенильных групп включают этенил, 3-пропенил, 1-пропенил (также известный как 2-метилвинил), изопропенил (также известный как называемый 2-метилэтен-2-ил), бутен-4-ил и т.п. Неограничивающие примеры замещенных алкенильных групп включают 2-хлорэтенил (также известный как 2-хлорвинил), 4-гидроксибутен-1-ил, 7-гидрокси-7-метилокт-4-ен-2-ил, 7-гидрокси-7-метилокт-3,5-диент-2-ил и т.п. Неограничивающие примеры алкинильных групп включают этинил, проп-2-инил (также известный как пропаргил), пропин-1-ил и 2-метилгекс-4-ин-1-ил. Неограничивающие примеры замещенных алкинильных групп включают 5-гидрокси-5-метилгекс-3-инил, 6-гидрокси-6-метилгепт-3-ин-2-ил; 5-гидрокси-5-этилгепт-3-инил и т.п.
[0093] В контексте настоящего описания "циклоалкил", отдельно или как часть другой группы, относится к неароматическому углеродсодержащему кольцу, включающему циклизованные алкильные, алкенильные и алкинильные группы, например, содержащие от 3 до 14 атомов углерода в кольце, предпочтительно от 3 до 7 или от 3 до 6 атомов углерода в кольце или даже от 3 до 4 атомов углерода в кольце, и необязательно содержащий одну или более (например, 1, 2 или 3) двойных или тройных связей. Циклоалкильные группы могут быть моноциклическими (например, циклогексил) или полициклическими (например, содержащими конденсированные, мостиковые и/или спирокольцевые системы), где атомы углерода расположены внутри или снаружи системы колец. Циклоалкильная группа в любом подходящем положении в кольце может быть ковалентно связано с определенной химической структурой. Циклоалкильные кольца могут быть необязательно замещены. Неограничивающие примеры замещенных циклоалкильных групп включают циклопропил, 2-метилциклопропил, циклопр'опенил, циклобутил, 2,3-дигидроксициклобутил, циклобутенил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогептил, циклооктанил, декалинил, 2,5-диметилциклопентил, 3,5-дихлорциклогексил, 4-гидроксициклогексил, 3,3,5-триметилциклогекс-1-ил, октагидропенталенил, октагидро-1H-инденил, 3a,4,5,6,7,7а-гексагидро-3H-инден-4-ил, декагидроазуленил; бицикло[6.2.0]деканил, декагидронафталинил и додекагидро-1H-флуоренил. Термин "циклоалкил" также включает карбоциклические кольца, которые являются бициклическими углеводородными кольцами, неограничивающие примеры которых включают, бицикло-[2.1.1]гексанил, бицикло[2.2.1]гептанил, бицикло [3.1.1]гептанил, 1,3-диметил[2.2.1]гептан-2-ил, бицикло[2.2.2]октанил и бицикло[3.3.3]ундеканил.
[0094] Термин "галогеналкил", как предполагается, включает как разветвленные, так и неразветвленные насыщенные алифатические углеводородные группы, содержащие определенное число атомов углерода, замещенные одним или более атомами галогена. Галогеналкильные группы включают пергалогеналкильные группы, где все атомы водорода алкильной группы заменены атомами галогена (например, -CF3, -CF2CF3). Галогеналкильные группы могут необязательно содержать один или более заместителей в дополнение к галогену. Примеры галогеналкильных групп включают, но не ограничены ими, фторметильные, дихлорэтильные, трифторметильные, трихлорметильные, пентафторэтильные и пентахлорэтильные группы.
[0095] Термин "алкокси" относится к группам -O-алкил, где алкильная группа является такой, как определено выше. Алкоксигруппы могут быть необязательно замещены. Термин C3-C6 циклический алкокси относится к кольцу, содержащему от 3 до 6 атомов углерода и по меньшей мере один атом кислорода (например, тетрагидрофуран, тетрагидро-2Н-пиран). C3-C6 циклические алкоксигруппы необязательно могут быть замещены.
[0096] Термин "арил", применяемый отдельно или как часть другой группы, определен в настоящем описании как ненасыщенное ароматическое моноциклическое кольцо, содержащее 6 углеродных атомов или ненасыщенное ароматическое полициклическое кольцо, содержащее от 10 до 14 углеродных атомов. Арильные кольца могут представлять собой, например, фенильные или нафтильные кольца, каждое из которых необязательно содержит в качестве заместителей один или более фрагментов, способных заменить один или более атомов водорода. Неограничивающие примеры арильных групп включают фенил, нафтилен-1-ил, нафтилен-2-ил, 4-фторфенил, 2-гидроксифенил, 3-метилфенил, 2-амино-4-фторфенил, 2-(N,N-диэтиламино)фенил, 2-цианофенил, 2,6-ди-трет-бутилфенил, 3-метоксифенил, 8-гидроксинафтилен-2-ил 4,5-диметоксинафтилен-1-ил, и 6-циано-нафтилен-1-ил. Арильные группы также включают, например, фенильные или нафтильные кольца, сконденсированные с одним или более насыщенными или частично насыщенными углеродными кольцами (например, бицикло[4.2.0]окта-1,3,5-триенил, инданил), который может быть замещен одним или более атомами углерода ароматического и/или насыщенного или частично насыщенного колец.
[0097] Термин "арилалкил" или "аралкил" относится к группе -алкил-арил, где алкильные и арильные группы являются такими, как определено в настоящем описании. Аралкильные группы согласно настоящему изобретению необязательно замещены. Примеры арилалкильных групп включают, например, бензил, 1-фенилэтил, 2-фенилэтил, 3-фенилпропил, 2-фенилпропил, флуоренилметил и т.п.
[0098] Термины "гетероциклический" и/или "гетероцикл" и/или "гетероцилил", применяемые отдельно или как часть другой группы, определены в настоящем описании как одно или более колец, содержащие от 3 до 20 атомов, где по меньшей мере один атом в по меньшей мере одном кольце представляет собой гетероатом, выбранный из азота (N), кислорода (O) или серы (S), и причем кольцо, содержащее гетероатом, не является ароматическим. В гетероциклических группах, которые включают 2 или более конденсированных кольца, кольцо, не содержащее гетероатом, может представлять собой арил (например, индолинил, тетрагидрохинолинил, хроманил). Иллюстративные гетероциклические группы содержат от 3 до 14 атомов в кольце, из которых от 1 до 5 представляют собой гетероатомы, независимо выбранные из азота (N), кислорода (O) или серы (S). Один или более атомов N или S в гетероциклической группе могут быть окислены. Гетероциклические группы могут быть необязательно замещены.
[0099] Неограничивающие примеры гетероциклических звеньев, содержащие одиночное кольцо, включают: диазиринил, азиридинил, уразолил, азетидинил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолинил, изоксазолил, тиазолидинил, изотиазолил, изотиазолинил, оксатиазолидипоил, оксазолидиноил, гидантоинил, тетрагидрофуранил, пирролидинил, морфолинил, пиперазинил, пиперидинил, дигидропиранил, тетрагидропиранил, пиперидин-2-онил (валеролактам), 2,3,4,5-тетрагидро-1H-азепинил, 2,3-дигидро-1H-индол и 1,2,3,4-тетрагидро-хинолин. Неограничивающие примеры гетероциклических единиц, содержащие 2 или более колец, включают: гексагидро-1H-пирролизинил, 3a,4,5,6,7,7а-гексагидро-1H-бензо[d]имидазолил, 3a,4,5,6,7,7а-гексагидро-1H-индолил, 1,2,3,4-тетрагидрохинолинил, хроманил, изохроманил, индолинил, изоиндолинил и декагидро-1H-циклоокта[b]пирролил.
[00100] Термин "гетероарил", отдельно или как часть другой группы, определен в настоящем описании как одно или более колец, содержащие от 5 до 20 атомов, где по меньшей мере один атом в по меньшей мере одном кольце представляет собой гетероатом, выбранный из азота (N), кислорода (О) или серы (S), и причем по меньшей мере одно из колец, которые содержат гетероатом, является ароматическим. В гетероарильных группах, которые включают 2 или более конденсированных колец, кольцо, не содержащее гетероатом, может представлять собой карбоцикл (например, 6,7-дигидро-5H-циклопентапиримидин) или арил (например, бензофуранил, бензотиофенил, индолил). Иллюстративные гетероарильные группы содержат от 5 до 14 атомов в кольце и содержат от 1 до 5 гетероатомов в кольце, независимо выбранных из азота (N), кислорода (О) или серы (S). Один или более атомов N или S в гетероарильной группе могут быть окислены. Гетероарильные группы могут быть замещены. Неограничивающие примеры гетероарильных колец, содержащих одиночное кольцо, включают: 1,2,3,4-тетразолил, [1,2,3]триазолил, [1,2,4]триазолил, триазинил, тиазолил, 1H-имидазолил, оксазолил, фуранил, тиофенил, пиримидинил, 2-фенил пиримидинил, пиридинил, 3-метил пиридинил и 4-диметиламинопиридинил. Не ограничивающие примеры гетероарильных колец, содержащих 2 или более конденсированных колец, включают: бензофуранил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, циннолинил, нафтиридинил, фенантридинил, 7H-пуринил, 9H-пуринил, 6-амино-9H-пуринил, 5H-пирроло[3,2-d] пиримидинил, 7H-пирроло [2,3-d] пиримидинил, пиридо[2,3-d]пиримидинил, 2-фенилбензо[d]тиазолил, 1H-индолил, 4,5,6,7-тетрагидро-1-H-индолил, хиноксалинил, 5-метил хиноксалинил, хиназолинил, хинолинил, 8-гидрокси-хинолинил и изохинолинил.
[00101] Одним неограничивающим примером гетероарильной группы, описанной выше, является C1-C5 гетероарил, который содержит от 1 до 5 углеродных атомов в кольце и по меньшей мере один дополнительный атом в кольце, который представляет собой гетероатом (предпочтительно от 1 до 4 дополнительных атомов в кольце, которые представляют собой гетероатомы), независимо выбранный из азота (N), кислорода (O) или серы (S). Примеры C1-C5 гетероарила включают, но не ограничены ими, триазинил, тиазол-2-ил, тиазол-4-ил, имидазол-1-ил, 1H-имидазол-2-ил, 1H-имидазол-4-ил, изоксазолин-5-ил, фуран-2-ил, фуран-3-ил, тиофен-2-ил, тиофен-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, пиридин-2-ил, пиридин-3-ил и пиридин-4-ил.
[00102] Если не указано иное, когда два заместителя совместно образуют кольцо, содержащее определенное количество атомов в кольце (например, R2 и R3 совместно с азотом (N), к которому они присоединены, образуют кольцо, содержащее от 3 до 7 членов в кольце), указанное кольцо может содержать атомы углерода и необязательно один или более (например от 1 до 3) дополнительных гетероатомов, независимо выбранных из азота (N), кислорода (О) или серы (S). Кольцо может быть насыщено или частично насыщено и может быть необязательно замещено.
[00103] Для целей настоящего изобретения звенья конденсированного кольца, а также спироциклические кольца, бициклические кольца и т.п., которые содержат одиночный гетероатом, будут считаться принадлежащими к циклической группе, соответствующей кольцу, содержащему гетероатом. Например, 1,2,3,4-тетрагидрохинолин, имеющий формулы:

для целей настоящего изобретения считается гетероциклическим звеном. 6,7-Дигидро-5H-циклопентапиримидин, имеющий формулы:
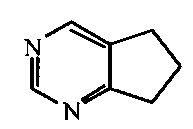
для целей настоящего изобретения считается гетероарильным звеном. В том случае если конденсированное кольцо содержит гетероатомы и в насыщенном, и в арильном кольце, арильное кольцо будет иметь преимущество и определять тип категории, к которой относится кольцо. Например, 1,2,3,4-тетрагидро-[1,8]нафтиридин, имеющий формулу:

для целей настоящего изобретения, считается гетероарильной единицей.
[00104] Каждый раз, когда термин или что-либо одно из его приставки или корней появляются в названии заместителя, полученное название не следует интерпретировать как содержащее эти ограничения, предусмотренные в данном описании. Например, когда термин "алкил", или "арил", или что-либо одно из его приставки или корней появляются в названии заместителя (например, арилалкил, алкиламино), полученное название не следует интерпретировать как содержащее ограничения, приведенные выше для терминов "алкил" и "арил".
[00105] Термин "замещенный" используют во всем описании. Термин "замещенный" определен в настоящем описании как ациклический или циклический фрагмент, в котором один или более атомов водорода заменен заместителем или несколькими (например, от 1 до 10) заместителей, как определено ниже в настоящем описании. Заместители могут заменять один или два атома водорода одного фрагмента одновременно. Кроме того, эти заместители могут заменить два атома водорода при двух соседних атомах углерода с образованием указанного заместителя, нового фрагмента или звена. Например, замещенное звено, которая подразумевает замену одного атома водорода, включает галоген, гидроксил и т.п. Замена двух атомов водорода включает карбонил, оксимино и т.п. Замена двух атомов водорода от соседних атомах углерода включает эпокси и т.п. Термин "замещенный" используют во всем настоящем описании для обозначения того, что во фрагменте один или более атомов водорода заменены заместителем. Когда фрагмент описан как "замещенный", может быть заменено любое количество атомов водорода. Например, дифторметил представляет собой замещенный C1 алкил; трифторметил представляет собой замещенный C1 алкил, 4-гидроксифенил представляет собой замещенное ароматическое кольцо; (N,N-диметил-5-амино)октанил представляет собой замещенный C8 алкил; 3-гуанидинопропил представляет собой замещенный C3 алкил; и 2-карбоксипиридинил представляет собой замещенный гетероарил.
[00106] Переменные группы, определенные в настоящем описаний, например, алкильные, алкенильные, алкинильные, циклоалкильные, алкоксильные, арилоксильные, арильные, гетероциклические и гетероарильные группы, определенные в настоящем описании, применяемые отдельно или как часть другой группы, могут быть необязательно замещены. Необязательно замещенные группы будут отмечены соответствующим образом.
[00107] Ниже приведены неограничивающие примеры заместителей, которые могут заменить атомы водорода во фрагменте: галоген (хлор (Cl), бром (Br), фтор (F) и йод (I)), -CN, -NO2, оксо (=O), -OR9, -SR9, -N(R9)2, -NR9C(O)R9, -SO2R9, -SO2OR9, -SO2N(R9)2, -C(O)R9, -C(O)OR9, -C(O)N(R9)2, C1-6 алкил, C1-6 галогеналкил, C1-6 алкокси, C2-8 алкенил, C2-8 алкинил, C3-14 циклоалкил, арил, гетероцикл или гетероарил, где каждый из групп алкила, галогеналкила, алкенила, алкинила, алкокси, циклоалкила, арила, гетероцикла и гетероарила необязательно замещены 1-10 (например, 1-6 или 1-4) группами, независимо выбранными из галогена, -CN, -NO2, оксо и Rx; где Rx, в каждом случае, независимо представляет собой водород, -OR10, -SR10, -C(O)R10, -C(O)OR10, -C(O)N(R10)2, -SO2R10, -S(O)2OR10, -N(R10)2, -NR10C(O)R10, C1-6 алкил, C1-6 галогеналкил, C2-8 алкенил, C2-8 алкинил, циклоалкил (например, C3-6 циклоалкил), арил, гетероцикл или гетероарил, или два Rx, совместно с атомом(ми), к которому они присоединены, образуют необязательно замещенный карбоцикл или гетероцикл, где указанный карбоцикл или гетероцикл содержит от 3 до 7 атомов в кольце; где R10, в каждом случае, независимо представляет собой водород, С1-6 алкил, C1-6 галогеналкил, С2-8 алкенил, C2-8 алкинил, циклоалкил (например, C3-6 циклоалкил), арил, гетероцикл или гетероарил, или два R10, совместно с атомом(ми), к которому они присоединены, образуют необязательно замещенный карбоцикл или гетероцикл, где указанный карбоцикл или гетероцикл предпочтительно содержит от 3 до 7 атомов в кольце.
[00108] В некоторых вариантах реализации заместители выбраны из
i) -OR11; например -OH, -ОСН3, -ОСН2СН3, -ОСН2СН2СН3;
ii) -C(O)R11; например-СОСН3, -СОСН2СН3, -СОСН2СН2СН3;
iii) -C(O)OR11; например -CO2CH3, -CO2CH2CH3, -CO2CH2CH2CH3;
iv) -C(O)N(R11)2; например -CONH2, -CONHCH3, -CON(CH3)2;
v) -N(R11)2; например -NH2, -NHCH3, -N(CH3)2, -NH(CH2CH3);
vi) галогенов: -F, -Cl, -Br и -I;
vii) -CHeXg; где X представляет собой галоген, m составляет от 0 до 2, e+g=3; например -CH2F, -CHF2, -CF3, -CCl3 или -CBr3
viii) -SO2R11; например -SO2H; -SO2CH3; -SO2C6H5;
ix) C1-C6 линейного, разветвленного или циклического алкила;
x) циано;
xi) нитро;
xii) N(R11)C(O)R11;
xiii) оксо (=O);
xiv) гетероцикла; и
xv) гетероарила.
где каждый R11 независимо представляет собой водород, необязательно замещенного C1-C6 линейного или разветвленного алкила (например, необязательно замещенного C1-C4 линейного или разветвленного алкила), или необязательно замещенного C3-C6 циклоалкила (например, необязательно замещенного C3-C4 циклоалкила); или два R11 могут быть взяты вместе для образования кольца, содержащего 3-7 атомов в кольце. В некоторых аспектах каждый R11 независимо представляет собой водород, C1-C6 линейный или разветвленный алкил, необязательно замещенные галогеном или C3-C6 циклоалкилом или C3-C6 циклоалкилом.
[00109] В нескольких местах в настоящем описании заместители соединений представлены в виде групп или диапазонов. В частности, предполагается, что настоящее описание включает все без исключения отдельные подкомбинации членов таких групп и диапазонов. Например, термин "C1-6 алкил" предназначен для конкретного обозначения в отдельности C1, C2, C3, C4, C5, C6, C1-C6, C1-C5, C1-C4, C1-C3, C1-C2, C2-C6, C2-C5, C2-C4, C2-C3, C3-C6, C3-C5, C3-C4, C4-C6, C4-C5 и C5-C6 алкила.
[00110] Для целей настоящего изобретения термины "соединение", "аналог" и "композиция" остаются вполне тождественными для соединений согласно изобретению, описанных в настоящем описании, вне зависимости от того, являются ли они фотодинамическими или нет, включая все энантиомерные формы, диастереоизомерные формы, соли и т.п., и термины " соединение", " аналог" и "композиция" применяют взаимозаменяемо в данном описании.
[00111] Для целей настоящего изобретения термин "bpy" будет равнозначен 2,2'-бипиридину и [2,2']бипиридину.
[00112] Для целей настоящего изобретения термин "phen" будет равнозначен [1,10]фенантролину и 1,10-фенантролину.
[00113] Для целей настоящего изобретения термин "dmb" будет равнозначен 4,4'-диметил-2,2'-бипиридину.
[00114] Для целей настоящего изобретения термин "biq" будет равнозначен 2,2'-бихинолилу.
[00115] Для целей настоящего изобретения термин "dpq" будет равнозначен
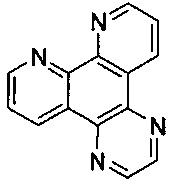
[00116] Для целей настоящего изобретения термин "dppz" будет равнозначен

[00117] Для целей настоящего изобретения термин "dppn" будет равнозначен

[00118] Для целей настоящего изобретения термин "dpqC" будет равнозначен

[00119] Для целей настоящего изобретения термин "dppza" будет равнозначен

[00120] Для целей настоящего изобретения термин "dppzc" будет равнозначен

[00121] Для целей настоящего изобретения термин "dppzs" будет равнозначен

[00122] Для целей настоящего изобретения термин "HAT" будет равнозначен

[00123] Для целей настоящего изобретения термин "TAP" будет равнозначен
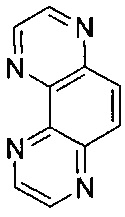
[00124] Для целей настоящего изобретения термин "PHEHAT" будет равнозначен

[00125] Для целей настоящего изобретения термин "tpac" будет равнозначен

[00126] Соединения, приведенные в настоящем описании, могут содержать ассиметричный атом (также именуемый как хиральный центр), а некоторые соединения могут содержать один или более ассиметричных атомов или центров, которые могут, таким образом, позволять получить оптические изомеры (энантиомеров) и диастереомеры. Настоящее описание и соединения, раскрытые в настоящем описании, включают такие энантиомеры и диастереомеров, а также рацемические смеси и разделенные, энантиомерно чистые R и S стереоизомеры, а также другие смеси R и S стереоизомеров и их фармацевтически приемлемых солей. Оптические изомеры могут быть получены в чистом виде посредством стандартных методик, известных специалистам в данной области техники, которые включают, но не ограничиваются ими, образование диастереоизомерной соли, кинетическое разделение и ассиметрический синтез. Настоящее описание также включает цис- и трансизомеры соединений, содержащих алкенильные фрагменты (например, алкены и имины). Также следует понимать, что настоящее описание включает все возможные региоизомеры и их смеси, которые могут быть получены в чистом виде посредством стандартных методик, известных специалистам в данной области техники, которые включают, но не ограничиваются ими, колоночную хроматографию, тонкослойную хроматографию и высокоэффективную жидкостную хроматографию.
[00127] Фармацевтически приемлемые соли соединений согласно настоящему описанию, которые могут содержать кислотный остаток, могут быть получены с использованием органических и неорганических оснований. В настоящем изобретении предусмотрены как моно, так и полианионные соли в зависимости от количества протонов кислоты, способных к депротонированию. Подходящие соли, образованные с участием оснований, включают соли металлов, таких как соли щелочных металлов или щелочноземельных, например натриевые, калиевые или магниевые соли; соли аммония и органические соли амина, такие как соли, образованные при помощи морфолина, тиоморфолина, пиперидина, пирролидина, моно-, ди- или три-низшего алкиламина (например, этил-трет-бутил-, диэтил-, диизопропил-, триэтил-, трибутил- или диметилпропиламина), или моно-, ди- или тригидрокси низшего алкиламина (например, моно-, ди- или триэтаноламина). Конкретные неограничивающие примеры неорганических оснований включают NaHCO3, Na2CO3, KHCO3, K2CO3, Cs2CO3, LiOH, NaOH, KOH, NaH2PO4, Na2HPO4 и Na3PO4. Также могут быть образованы внутримолекулярные соли. Также, если соединение, описанное в настоящем описании, включает щелочной остаток, соли могут быть образованы с использованием органических и неорганических кислот. Например, соли могут быть образованы из следующих кислот: уксусной, пропионовой, молочной, бензолсульфоновой, бензойной, камфорсульфоновой, лимонной, винной, янтарной, дихлоруксусной, этенсульфоновой, муравьиной, фумаровой, глюконовой, глутаминовой, гиппуровой, бромистоводородной, соляной, изэтионовой, молочной, малеиновой, яблочной, малоновой, миндальной, метансульфоновой, слизевой, нафталинсульфоновой, азотной, щавелевой, памоевой, пантотеновой, фосфорной фталевой, пропионовой, янтарной, серной, винной, толуолсульфоновой и камфорсульфоновой, а также другими фармацевтически приемлемыми солями.
[00128] Когда любой переменный параметр встречается более одного раза в любой составной части или в любой формуле, его определение в каждом случае не зависит от его определения в каждом другом случае (например, в N(R6)2, каждый R6 может быть таким же или отличным от других). Комбинации заместителей и/или переменных параметров допустимы, только если такие комбинации приводят к получению стабильных соединений.
[00129] Термины "лечить" и "лечение" и "терапия" в контексте настоящего описания относятся к частичному или полному облегчению, подавлению, уменьшению интенсивности и/или ослаблению состояния, которым предположительно страдает пациент.
[00130] В контексте настоящего описания "терапевтически эффективный" и "эффективная доза" относится к веществу или количеству, которое проявляет желаемую биологическую активность или эффект.
[00131] В контексте настоящего описания термин "фотодинамическая терапия" будет означать лечение для разрушения клеток или модулирования иммунной функции, включая иммунную реакцию, клеток и тканей посредством применения лекарственного средства, которое может быть активировано при помощи излучения с определенной длиной волны и дозой.
[00132] В контексте настоящего описания термин "фотодинамическое соединение" будет означать соединение, которое обеспечивает фотодинамическую терапию.
[00133] Кроме случаев, когда это отмечено, термины "субъект" или "пациент" используются взаимозаменяемо и относятся к млекопитающим, таким как пациенты-люди и приматы, не являющиеся людьми, а также к экспериментальным животным, таким как кролики, крысы и мыши, и другим животным. Соответственно, термин "субъект" или "пациент", используемый в настоящем описании, означает любого пациента или субъекта, являющегося млекопитающим, которому могут быть введены соединения согласно настоящему изобретению. В иллюстративном варианте реализации настоящего изобретения для идентификации пациентов, которых лечили в соответствии со способами согласно настоящему изобретению, используют принятые способы скрининга для определения факторов риска, связанных с заболеванием или состоянием, на которое оказывается нацеленное воздействие или предполагаемым у субъекта заболеванием или состоянием, или для определения состояния существующего заболевания или состояния у субъекта. Эти способы скрининга включают, например, традиционные исследования для определения факторов риска, которые могут быть связаны с заболеванием или состояние, на которое оказывается нацеленное воздействие, или предполагаемым заболеванием или состоянием. Эти и другие рутинные методы позволяют практикующему врачу выбрать пациентов, нуждающихся в терапии с применением способов и соединений согласно настоящему изобретению.
СОЕДИНЕНИЯ
[00134] Соединения согласно настоящему изобретению представляют собой координационные соединения на основе металлов, полученные из органических лигандов, внутрикомплексно циклизованных с металлом, предпочтительно представляют собой перестраиваемые фотодинамические соединения и включают все энантиомерные и диастереомерные формы и их фармацевтически приемлемые соли формулы (I):
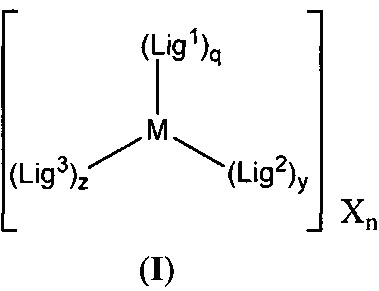
включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы, где:
M в каждом случае независимо выбран из группы, состоящей из состоящей из осмия, марганца, молибдена, рения, рутения, железа, кобальта, родия, иридия, никеля, платины, палладия, ванадия, хрома, вольфрама, технеция и меди;
X выбран из группы, состоящей из Cl, PF6-, Br-, BF4-, ClO4-, CF3SO3- и SO4-2;
n=0, 1, 2, 3, 4 или 5;
q в каждом случае независимо представляет собой 0, 1 или 2;
y в каждом случае независимо представляет собой 0, 1 или 2;
z в каждом случае независимо представляет собой 1, 2 или 3;
Lig1 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из






Lig2 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из






Lig3 представляет собой бидентатный лиганд, который в каждом случае независимо выбран из группы, состоящей из


R1 выбран из группы, состоящей из водорода, необязательно замещенного фенила, необязательно замещенного арила, необязательно замещенного гетероарила, 4-пиридила, 3-пиридила, 2-тиазола, 2-пиролила, 2-фуранила,







u представляет собой целое число;
R2a, R2b, R2c, R2d, R2e, R2f, R2g, R2h, R2i, R2j, R2k и R2l в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 обязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкил, С3-7 необязательно замещенного циклоалкила, С ив необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, CO2R5, CONR62, NR72, сульфата, сульфоната, необязательно замещенного арила, необязательно замещенного арилокси, необязательно замещенного гетероарила и необязательно замещенного гетероцикла;
R3a, R3b, R3c, R3d, R3e, R3f, R3g, R3h R3i, R3j, R3k и R3l в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, необязательно замещенного фенила и CO2R8;
R4a, R4b и R4c в каждом случае независимо выбраны из группы, состоящей из водорода, C1-6 необязательно замещенного алкила, C1-6 необязательно замещенного разветвленного алкила, C1-6 необязательно замещенного циклоалкила, C1-6 необязательно замещенного галогеналкила, C1-6 необязательно замещенного алкокси, CO2R5 CONR62, NR72, сульфата, сульфоната, необязательно замещенного арила, необязательно замещенного арилокси, необязательно замещенного гетероарила, и необязательно замещенного гетероцикла;
R4a и R4b, в каждом случае присутствия при тиофеновом кольце, совместно с атомом, к которому они присоединены, образуют необязательно замещенное кольцо, содержащее от 6 атомов в кольце, включая 2 атома кислорода;
R5 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R6 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R7 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила;
R8 в каждом случае независимо выбран из группы, состоящей из водорода и необязательно замещенного алкила.
[00135] Соединения согласно настоящему изобретению включают соединения, имеющие формулу (II):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00136] Соединения согласно настоящему изобретению включают соединения, имеющие формулу (III):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00137] Соединения согласно настоящему изобретению включают соединения, имеющие формулу (IV):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00138] Настоящее изобретение также относится к новым соединениям формулы (V):
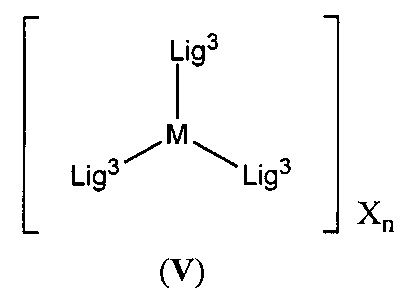
включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00139] Настоящее изобретение также относится к новым соединениям формулы (VI):
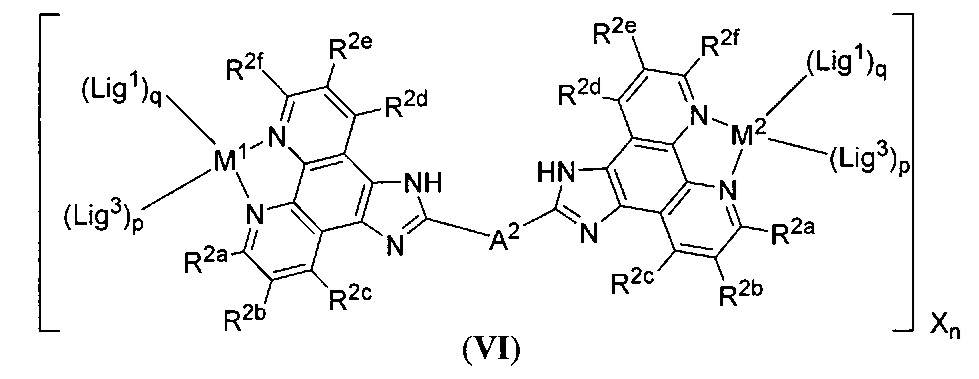
включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы, где:
A2 выбран из группы, состоящей из



t представляет собой целое число.
[00140] Настоящее изобретение также относится к новым соединениям формулы (VIIa):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы, где:
A3 выбран из группы, состоящей из



[00141] При этом A3 представляет собой мостиковый лиганд, связанный с M1 как бидентатный лиганд и A3 связан с M2 как бидентатный лиганд.
[00142] Настоящее изобретение также относится к новым соединениям формулы (VIIb):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00143] Настоящее изобретение также относится к новым соединениям формулы (VIIc):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00144] Настоящее изобретение также относится к новым соединениям формулы (VIId):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00145] Настоящее изобретение также относится к новым соединениям формулы (VIIe):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00146] Настоящее изобретение также относится к новым соединениям формулы (VIIf):

включая их гидраты, сольваты, фармацевтически приемлемые соли, пролекарства и комплексы.
[00147] В некоторых вариантах реализации M представляет собой осмий, марганец, молибден, рений, рутений, железо, кобальт, родий, иридий, никель, платину, палладий, ванадий, хром, вольфрам, технеций или медь.
[00148] В некоторых вариантах реализации M1 представляет собой осмий, марганец, молибден, рений, рутений, железо, кобальт, родий, иридий, никель, платину, палладий, ванадий, хром, вольфрам, технеций или медь.
[00149] В некоторых вариантах реализации M2 представляет собой осмий, марганец, молибден, рений, рутений, железо, кобальт, родий, иридий, никель, платину, палладий, ванадий, хром, вольфрам, технеций или медь.
[00150] В некоторых вариантах реализации X представляет собой Cl-, PF6-, Br-, BF4-, ClO4-, CF3SO3- или SO4-2.
[00151] В некоторых вариантах реализации n составляет 0.
[00152] В некоторых вариантах реализации n составляет 1.
[00153] В некоторых вариантах реализации n составляет 2.
[00154] В некоторых вариантах реализации n составляет 3.
[00155] В некоторых вариантах реализации n составляет 4.
[00156] В некоторых вариантах реализации n составляет 5.
[00157] В некоторых вариантах реализации y составляет 0.
[00158] В некоторых вариантах реализации y составляет 1.
[00159] В некоторых вариантах реализации y составляет 2.
[00160] В некоторых вариантах реализации z составляет 1.
[00161] В некоторых вариантах реализации z составляет 2.
[00162] В некоторых вариантах реализации z составляет 3.
[00163] В некоторых вариантах реализации q составляет 0.
[00164] В некоторых вариантах реализации q составляет 1.
[00165] В некоторых вариантах реализации q составляет 2.
[00166] В некоторых вариантах реализации Lig1 представляет собой
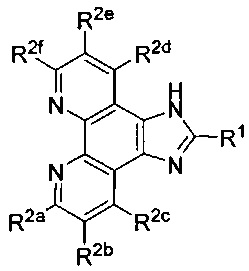
[00167] В некоторых вариантах реализации Lig1 представляет собой

[00168] В некоторых вариантах реализации Lig1 представляет собой

[00169] В некоторых вариантах реализации Lig1 представляет собой

[00170] В некоторых вариантах реализации Lig1 представляет собой

[00171] В некоторых вариантах реализации Lig1 представляет собой

[00172] В некоторых вариантах реализации Lig1 представляет собой

[00173]
[00174] В некоторых вариантах реализации Lig1 представляет собой
[00175] В некоторых вариантах реализации Lig1 представляет собой

[00176] В некоторых вариантах реализации Lig1 представляет собой

[00177] В некоторых вариантах реализации Lig1 представляет собой
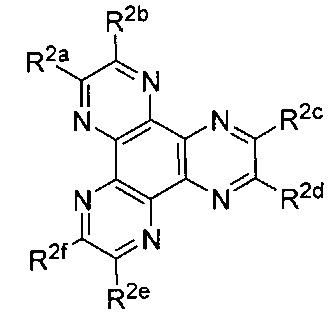
[00178] В некоторых вариантах реализации Lig1 представляет собой

[00179] В некоторых вариантах реализации Lig1 представляет собой

[00180] В некоторых вариантах реализации Lig1 представляет собой

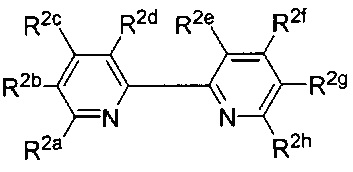
[00181] В некоторых вариантах реализации Lig2 представляет собой

[00182] В некоторых вариантах реализации Lig2 представляет собой
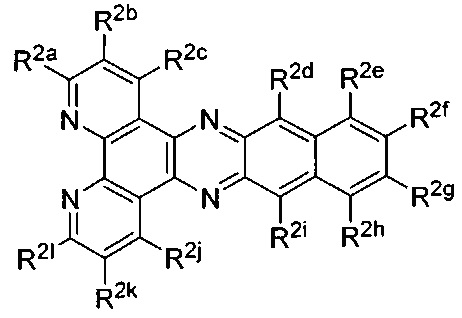
[00183] В некоторых вариантах реализации Lig2 представляет собой

[00184] В некоторых вариантах реализации Lig2 представляет собой

[00185] В некоторых вариантах реализации Lig2 представляет собой

[00186] В некоторых вариантах реализации Lig2 представляет собой

[00187] В некоторых вариантах реализации Lig2 представляет собой

[00188]
[00189] В некоторых вариантах реализации Lig2 представляет собой

[00190] В некоторых вариантах реализации Lig2 представляет собой

[00191] В некоторых вариантах реализации Lig2 представляет собой

[00192] В некоторых вариантах реализации Lig2 представляет собой

[00193] В некоторых вариантах реализации Lig2 представляет собой

[00194] В некоторых вариантах реализации Lig2 представляет собой

[00195] В некоторых вариантах реализации Lig2 представляет собой

[00196] В некоторых вариантах реализации Lig3 представляет собой

[00197] В некоторых вариантах реализации Lig3 представляет собой

[00198] В некоторых вариантах реализации Lig3 представляет собой

[00199] В некоторых вариантах реализации Lig3 представляет собой

[00200] В некоторых вариантах реализации R1 представляет собой водород.
[00201] В некоторых вариантах реализации R1 представляет собой необязательно замещенный фенил.
[00202] В некоторых вариантах реализации R1 представляет собой необязательно замещенный арил.
[00203] В некоторых вариантах реализации R1 представляет собой необязательно замещенный гетероарил.
[00204] В некоторых вариантах реализации R1 представляет собой 2-фуранил.
[00205] В некоторых вариантах реализации R1 представляет собой 3-пиридил.
[00206] В некоторых вариантах реализации R1 представляет собой 4-пиридил.
[00207] В некоторых вариантах реализации R1 представляет собой 2-тиазол.
[00208] В некоторых вариантах реализации R1 представляет собой 2-пиролил.
[00209] В некоторых вариантах реализации R1 представляет собой

[00210] В некоторых вариантах реализации R1 представляет собой

[00211] В некоторых вариантах реализации R1 представляет собой

[00212] В некоторых вариантах реализации R1 представляет собой

[00213] В некоторых вариантах реализации R1 представляет собой

[00214] В некоторых вариантах реализации R1 представляет собой

[00215] В некоторых вариантах реализации R1 представляет собой

[00216] В некоторых вариантах реализации R1 представляет собой

[00217] В некоторых вариантах реализации R1 представляет собой

[00218] В некоторых вариантах реализации R1 представляет собой

[00219] В некоторых вариантах реализации R1 представляет собой

[00220] В некоторых вариантах реализации R1 представляет собой

[00221] В некоторых вариантах реализации R1 представляет собой

[00222] В некоторых вариантах реализации R1 представляет собой

[00223] В некоторых вариантах реализации R1 представляет собой

[00224] В некоторых вариантах реализации R1 представляет собой

[00225] В некоторых вариантах реализации и представляет собой целое число.
[00226] В некоторых вариантах реализации R1 представляет собой

[00227] В некоторых вариантах реализации R1 представляет собой

[00228] В некоторых вариантах реализации R1 представляет собой

[00229] В некоторых вариантах реализации R1 представляет собой

[00230] В некоторых вариантах реализации R1 представляет собой

[00231] В некоторых вариантах реализации R1 представляет собой

[00232] В некоторых вариантах реализации R1 представляет собой

[00233] В некоторых вариантах реализации R1 представляет собой

[00234] В некоторых вариантах реализации R1 представляет собой
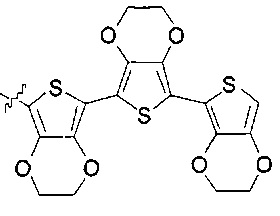
[00235] В некоторых вариантах реализации R1 представляет собой

[00236] В некоторых вариантах реализации R1 представляет собой

[00237] В некоторых вариантах реализации R1 представляет собой

[00238] В некоторых вариантах реализации R1 представляет собой

[00239] В некоторых вариантах реализации R1 представляет собой

[00240] В некоторых вариантах реализации R1 представляет собой

[00241] В некоторых вариантах реализации R1 представляет собой

[00242] В некоторых вариантах реализации R1 представляет собой

[00243] В некоторых вариантах реализации R1 представляет собой

[00244] В некоторых вариантах реализации R2a представляет собой водород.
[00245] В некоторых вариантах реализации R2a представляет собой C1-6 необязательно замещенный алкил.
[00246] В некоторых вариантах реализации R2a представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00247] В некоторых вариантах реализации R2a представляет собой C3-7 необязательно замещенный циклоалкил.
[00248] В некоторых вариантах реализации R2a представляет собой C1-6 необязательно замещенный галогеналкил.
[00249] В некоторых вариантах реализации R2a представляет собой C1-6 необязательно замещенный алкокси.
[00250] В некоторых вариантах реализации R2a представляет собой CO2R5.
[00251] В некоторых вариантах реализации R2a представляет собой CONR62.
[00252] В некоторых вариантах реализации R2a представляет собой NR72.
[00253] В некоторых вариантах реализации R2a представляет собой SO3H.
[00254] В некоторых вариантах реализации R2a представляет собой сульфат.
[00255] В некоторых вариантах реализации R2a представляет собой сульфонат.
[00256] В некоторых вариантах реализации R2a представляет собой необязательно замещенный арил.
[00257] В некоторых вариантах реализации R2a представляет собой необязательно замещенный арилокси.
[00258] В некоторых вариантах реализации R2a представляет собой необязательно замещенный гетероарил.
[00259] В некоторых вариантах реализации R2a представляет собой необязательно замещенный гетероцикл.
[00260] В некоторых вариантах реализации R2b представляет собой водород.
[00261] В некоторых вариантах реализации R2b представляет собой C1-6 необязательно замещенный алкил.
[00262] В некоторых вариантах реализации R2b представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00263] В некоторых вариантах реализации R2b представляет собой C3-7 необязательно замещенный циклоалкил.
[00264] В некоторых вариантах реализации R2b представляет собой C1-6 необязательно замещенного галогеналкил.
[00265] В некоторых вариантах реализации R2b представляет собой C1-6 необязательно замещенный алкокси.
[00266] В некоторых вариантах реализации R2b представляет собой CO2R5.
[00267] В некоторых вариантах реализации R2b представляет собой CONR62.
[00268] В некоторых вариантах реализации R2b представляет собой NR72.
[00269] В некоторых вариантах реализации R2b представляет собой SO3H.
[00270] В некоторых вариантах реализации R2b представляет собой сульфат.
[00271] В некоторых вариантах реализации R2b представляет собой сульфонат.
[00272] В некоторых вариантах реализации R2b представляет собой необязательно замещенный арил.
[00273] В некоторых вариантах реализации R2b представляет собой необязательно замещенный арилокси.
[00274] В некоторых вариантах реализации R2b представляет собой необязательно замещенный гетероарил.
[00275] В некоторых вариантах реализации R2b представляет собой необязательно замещенный гетероцикл.
[00276] В некоторых вариантах реализации R2c представляет собой водород.
[00277] В некоторых вариантах реализации R2c представляет собой C1-6 необязательно замещенный алкил.
[00278] В некоторых вариантах реализации R2c представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00279] В некоторых вариантах реализации R2c представляет собой C3-7 необязательно замещенный циклоалкил.
[00280] В некоторых вариантах реализации R2c представляет собой C1-6 необязательно замещенный галогеналкил.
[00281] В некоторых вариантах реализации R2c представляет собой C1-6 необязательно замещенный алкокси.
[00282] В некоторых вариантах реализации R2c представляет собой CO2R5.
[00283] В некоторых вариантах реализации R2c представляет собой CONR62.
[00284] В некоторых вариантах реализации R2c представляет собой NR72.
[00285] В некоторых вариантах реализации R2c представляет собой SO3H.
[00286] В некоторых вариантах реализации R2c представляет собой сульфат.
[00287] В некоторых вариантах реализации R2c представляет собой сульфонат.
[00288] В некоторых вариантах реализации R2c представляет собой необязательно замещенный арил.
[00289] В некоторых вариантах реализации R2c представляет собой необязательно замещенный арилокси.
[00290] В некоторых вариантах реализации R2c представляет собой необязательно замещенный гетероарил.
[00291] В некоторых вариантах реализации R2c представляет собой необязательно замещенный гетероцикл.
[00292] В некоторых вариантах реализации R2d представляет собой водород.
[00293] В некоторых вариантах реализации R2d представляет собой C1-6 необязательно замещенный алкил.
[00294] В некоторых вариантах реализации R2d представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00295] В некоторых вариантах реализации R2d представляет собой C3-7 необязательно замещенный циклоалкил.
[00296] В некоторых вариантах реализации R2d представляет собой C1-6 необязательно замещенный галогеналкил.
[00297] В некоторых вариантах реализации R2d представляет собой C1-6 необязательно замещенный алкокси.
[00298] В некоторых вариантах реализации R2d представляет собой CO2R5.
[00299] В некоторых вариантах реализации R2d представляет собой CONR62.
[00300] В некоторых вариантах реализации R2d представляет собой NR72.
[00301] В некоторых вариантах реализации R2d представляет собой SO3H.
[00302] В некоторых вариантах реализации R2d представляет собой сульфат.
[00303] В некоторых вариантах реализации R2d представляет собой сульфонат.
[00304] В некоторых вариантах реализации R2d представляет собой необязательно замещенный арил.
[00305] В некоторых вариантах реализации R2d представляет собой необязательно замещенный арилокси.
[00306] В некоторых вариантах реализации R2d представляет собой необязательно замещенный гетероарил.
[00307] В некоторых вариантах реализации R2d представляет собой необязательно замещенный гетероцикл.
[00308] В некоторых вариантах реализации R2e представляет собой водород.
[00309] В некоторых вариантах реализации R2e представляет собой C1-6 необязательно замещенный алкил.
[00310] В некоторых вариантах реализации R2e представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00311] В некоторых вариантах реализации R2e представляет собой C3-7 необязательно замещенный циклоалкил.
[00312] В некоторых вариантах реализации R2e представляет собой C1-6 необязательно замещенный галогеналкил.
[00313] В некоторых вариантах реализации R2e представляет собой C1-6 необязательно замещенный алкокси.
[00314] В некоторых вариантах реализации R2e представляет собой CO2R5.
[00315] В некоторых вариантах реализации R2e представляет собой CONR62.
[00316] В некоторых вариантах реализации R2e представляет собой NR72.
[00317] В некоторых вариантах реализации R2e представляет собой SO3H.
[00318] В некоторых вариантах реализации R2e представляет собой сульфат.
[00319] В некоторых вариантах реализации R2e представляет собой сульфонат.
[00320] В некоторых вариантах реализации R2e is необязательно замещенного арил.
[00321] В некоторых вариантах реализации R2e представляет собой необязательно замещенный арилокси.
[00322] В некоторых вариантах реализации R2e представляет собой необязательно замещенный гетероарил.
[00323] В некоторых вариантах реализации R2e представляет собой необязательно замещенного гетероцикл.
[00324] В некоторых вариантах реализации R2f представляет собой водород.
[00325] В некоторых вариантах реализации R2f представляет собой C1-6 необязательно замещенный алкил.
[00326] В некоторых вариантах реализации R2f представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00327] В некоторых вариантах реализации R2f представляет собой С3-7 необязательно замещенный циклоалкил.
[00328] В некоторых вариантах реализации R2f представляет собой C1-6 необязательно замещенный галогеналкил.
[00329] В некоторых вариантах реализации R2f представляет собой C1-6 необязательно замещенный алкокси.
[00330] В некоторых вариантах реализации R2f представляет собой CO2R5.
[00331] В некоторых вариантах реализации R2f представляет собой CONR62.
[00332] В некоторых вариантах реализации R2f представляет собой NR72.
[00333] В некоторых вариантах реализации R2f представляет собой SO3H.
[00334] В некоторых вариантах реализации R2f представляет собой сульфат.
[00335] В некоторых вариантах реализации R2f представляет собой сульфонат.
[00336] В некоторых вариантах реализации R2f представляет собой необязательно замещенный арил.
[00337] В некоторых вариантах реализации R2f представляет собой необязательно замещенный арилокси.
[00338] В некоторых вариантах реализации R2f представляет собой необязательно замещенный гетероарил.
[00339] В некоторых вариантах реализации R2f представляет собой необязательно замещенный гетероцикл.
[00340] В некоторых вариантах реализации R2g представляет собой водород.
[00341] В некоторых вариантах реализации R2g представляет собой C1-6 необязательно замещенный алкил.
[00342] В некоторых вариантах реализации R2g представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00343] В некоторых вариантах реализации R2g представляет собой C3-7 необязательно замещенный циклоалкил.
[00344] В некоторых вариантах реализации R2g представляет собой C1-6 необязательно замещенный галогеналкила.
[00345] В некоторых вариантах реализации R2g представляет собой C1-6 необязательно замещенный алкокси.
[00346] В некоторых вариантах реализации R2g представляет собой CO2R5.
[00347] В некоторых вариантах реализации R2g представляет собой CONR62.
[00348] В некоторых вариантах реализации R2g представляет собой NR72.
[00349] В некоторых вариантах реализации R2g представляет собой SO3H.
[00350] В некоторых вариантах реализации R2g представляет собой сульфат.
[00351] В некоторых вариантах реализации R2g представляет собой сульфонат.
[00352] В некоторых вариантах реализации R2g представляет собой необязательно замещенный арил.
[00353] В некоторых вариантах реализации R2g представляет собой необязательно замещенный арилокси.
[00354] В некоторых вариантах реализации R2g представляет собой необязательно замещенный гетероарил.
[00355] В некоторых вариантах реализации R2g представляет собой необязательно замещенный гетероцикл.
[00356] В некоторых вариантах реализации R2h представляет собой водород.
[00357] В некоторых вариантах реализации R2h представляет собой C1-6 необязательно замещенный алкил.
[00358] В некоторых вариантах реализации R2h представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00359] В некоторых вариантах реализации R2h представляет собой С3-7 необязательно замещенный циклоалкил.
[00360] В некоторых вариантах реализации R2h представляет собой C1-6 необязательно замещенный галогеналкил.
[00361] В некоторых вариантах реализации R2h представляет собой C1-6 необязательно замещенный алкокси.
[00362] В некоторых вариантах реализации R2h представляет собой CO2R5.
[00363] В некоторых вариантах реализации R2h представляет собой CONR62.
[00364] В некоторых вариантах реализации R2h представляет собой NR72.
[00365] В некоторых вариантах реализации R2h представляет собой SO3H.
[00366] В некоторых вариантах реализации R2h представляет собой сульфат.
[00367] В некоторых вариантах реализации R2h представляет собой сульфонат.
[00368] В некоторых вариантах реализации R2h представляет собой необязательно замещенный арил.
[00369] В некоторых вариантах реализации R2h представляет собой необязательно замещенный арилокси.
[00370] В некоторых вариантах реализации R2h представляет собой необязательно замещенный гетероарил.
[00371] В некоторых вариантах реализации R2h представляет собой необязательно замещенный гетероцикла.
[00372] В некоторых вариантах реализации R2f представляет собой водород.
[00373] В некоторых вариантах реализации R2i представляет собой C1-6 необязательно замещенный алкил.
[00374] В некоторых вариантах реализации R2i представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00375] В некоторых вариантах реализации R2i представляет собой C3-7 необязательно замещенный циклоалкил.
[00376] В некоторых вариантах реализации R2i представляет собой C1-6 необязательно замещенный галогеналкил.
[00377] В некоторых вариантах реализации R2i представляет собой C1-6 необязательно замещенный алкокси.
[00378] В некоторых вариантах реализации R2i представляет собой CO2R5.
[00379] В некоторых вариантах реализации R2i представляет собой CONR62.
[00380] В некоторых вариантах реализации R2i представляет собой NR72.
[00381] В некоторых вариантах реализации R2i представляет собой SO3H.
[00382] В некоторых вариантах реализации R2i представляет собой сульфат.
[00383] В некоторых вариантах реализации R2i представляет собой сульфонат.
[00384] В некоторых вариантах реализации R2i представляет собой необязательно замещенный арил.
[00385] В некоторых вариантах реализации R2i представляет собой необязательно замещенный арилокси.
[00386] В некоторых вариантах реализации R2i представляет собой необязательно замещенный гетероарил.
[00387] В некоторых вариантах реализации R2i представляет собой необязательно замещенный гетероцикл.
[00388] В некоторых вариантах реализации R2j представляет собой водород.
[00389] В некоторых вариантах реализации R2j представляет собой C1-6 необязательно замещенный алкил.
[00390] В некоторых вариантах реализации R2j представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00391] В некоторых вариантах реализации R2j представляет собой C3-7 необязательно замещенный циклоалкил.
[00392] В некоторых вариантах реализации R2j представляет собой C1-6 необязательно замещенный галогеналкил.
[00393] В некоторых вариантах реализации R2j представляет собой C1-6 необязательно замещенный алкокси.
[00394] В некоторых вариантах реализации R2j представляет собой CO2R5.
[00395] В некоторых вариантах реализации R2j представляет собой CONR62.
[00396] В некоторых вариантах реализации R2j представляет собой NR72.
[00397] В некоторых вариантах реализации R2j представляет собой SO3H.
[00398] В некоторых вариантах реализации R2j представляет собой сульфат.
[00399] В некоторых вариантах реализации R2j представляет собой сульфонат.
[00400] В некоторых вариантах реализации R2j представляет собой необязательно замещенный арил.
[00401] В некоторых вариантах реализации R2j представляет собой необязательно замещенный арилокси.
[00402] В некоторых вариантах реализации R2j представляет собой необязательно замещенный гетероарил.
[00403] В некоторых вариантах реализации R2j представляет собой необязательно замещенный гетероцикл.
[00404] В некоторых вариантах реализации R2k представляет собой водород.
[00405] В некоторых вариантах реализации R2k представляет собой C1-6 необязательно замещенный алкил.
[00406] В некоторых вариантах реализации R2k представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00407] В некоторых вариантах реализации R2k представляет собой C3-7 необязательно замещенный циклоалкил.
[00408] В некоторых вариантах реализации R2k представляет собой C1-6 необязательно замещенный галогеналкил.
[00409] В некоторых вариантах реализации R2k представляет собой C1-6 необязательно замещенный алкокси.
[00410] В некоторых вариантах реализации R2k представляет собой CO2R5.
[00411] В некоторых вариантах реализации R2k представляет собой CONR62.
[00412] В некоторых вариантах реализации R2k представляет собой NR72.
[00413] В некоторых вариантах реализации R2k представляет собой SO3H.
[00414] В некоторых вариантах реализации R2k представляет собой сульфат.
[00415] В некоторых вариантах реализации R2k представляет собой сульфонат.
[00416] В некоторых вариантах реализации R2k представляет собой необязательно замещенный арил.
[00417] В некоторых вариантах реализации R2k представляет собой необязательно замещенный арилокси.
[00418] В некоторых вариантах реализации R2k представляет собой необязательно замещенный гетероарил.
[00419] В некоторых вариантах реализации R2k представляет собой необязательно замещенный гетероцикл.
[00420] В некоторых вариантах реализации R2l представляет собой водород.
[00421] В некоторых вариантах реализации R2l представляет собой C1-6 необязательно замещенный алкил.
[00422] В некоторых вариантах реализации R2l представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00423] В некоторых вариантах реализации R2l представляет собой C3-7 необязательно замещенный циклоалкил.
[00424] В некоторых вариантах реализации R2l представляет собой C1-6 необязательно замещенный галогеналкил.
[00425] В некоторых вариантах реализации R2l представляет собой C1-6 необязательно замещенный алкокси.
[00426] В некоторых вариантах реализации R2l представляет собой CO2R5.
[00427] В некоторых вариантах реализации R2l представляет собой CONR62.
[00428] В некоторых вариантах реализации R2l представляет собой NR72.
[00429] В некоторых вариантах реализации R2l представляет собой SO3H.
[00430] В некоторых вариантах реализации R2l представляет собой сульфат.
[00431] В некоторых вариантах реализации R2l представляет собой сульфонат.
[00432] В некоторых вариантах реализации R2l представляет собой необязательно замещенный арил.
[00433] В некоторых вариантах реализации R2l представляет собой необязательно замещенный арилокси.
[00434] В некоторых вариантах реализации R2l представляет собой необязательно замещенный гетероарил.
[00435] В некоторых вариантах реализации R2l представляет собой необязательно замещенный гетероцикл.
[00436] В некоторых вариантах реализации R3a представляет собой водород.
[00437] В некоторых вариантах реализации R3a представляет собой C1-6 необязательно замещенный алкил.
[00438] В некоторых вариантах реализации R3a представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00439] В некоторых вариантах реализации R3a представляет собой C1-6 необязательно замещенный галогеналкил.
[00440] В некоторых вариантах реализации R3a представляет собой C1-6 необязательно замещенный алкокси.
[00441] В некоторых вариантах реализации R3a представляет собой необязательно замещенный фенил.
[00442] В некоторых вариантах реализации R3a представляет собой CO2R8.
[00443] В некоторых вариантах реализации R3b представляет собой водород.
[00444] В некоторых вариантах реализации R3b представляет собой C1-6 необязательно замещенный алкил.
[00445] В некоторых вариантах реализации R3b представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00446] В некоторых вариантах реализации R3b представляет собой C1-6 необязательно замещенный галогеналкил.
[00447] В некоторых вариантах реализации R3b представляет собой C1-6 необязательно замещенный алкокси.
[00448] В некоторых вариантах реализации R3b представляет собой необязательно замещенный фенил.
[00449] В некоторых вариантах реализации R3b представляет собой CO2R8.
[00450] В некоторых вариантах реализации R3c представляет собой водород.
[00451] В некоторых вариантах реализации R3c представляет собой C1-6 необязательно замещенный алкил.
[00452] В некоторых вариантах реализации R3c представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00453] В некоторых вариантах реализации R3c представляет собой C1-6 необязательно замещенный галогеналкил.
[00454] В некоторых вариантах реализации R3c представляет собой C1-6 необязательно замещенный алкокси.
[00455] В некоторых вариантах реализации R3c представляет собой необязательно замещенный фенил.
[00456] В некоторых вариантах реализации R3c представляет собой CO2R8.
[00457] В некоторых вариантах реализации R3d представляет собой водород.
[00458] В некоторых вариантах реализации R3d представляет собой C1-6 необязательно замещенный алкил.
[00459] В некоторых вариантах реализации R3d представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00460] В некоторых вариантах реализации R3d представляет собой C1-6 необязательно замещенного галогеналкил.
[00461] В некоторых вариантах реализации R3d представляет собой C1-6 необязательно замещенный алкокси.
[00462] В некоторых вариантах реализации R3d представляет собой необязательно замещенный фенил.
[00463] В некоторых вариантах реализации R3d представляет собой CO2R8.
[00464] В некоторых вариантах реализации R3e представляет собой водород.
[00465] В некоторых вариантах реализации R3e представляет собой C1-6 необязательно замещенный алкил.
[00466] В некоторых вариантах реализации R3e представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00467] В некоторых вариантах реализации R3e представляет собой C1-6 необязательно замещенный галогеналкил.
[00468] В некоторых вариантах реализации R3e представляет собой C1-6 необязательно замещенный алкокси.
[00469] В некоторых вариантах реализации R3e представляет собой необязательно замещенного фенил.
[00470] В некоторых вариантах реализации R3e представляет собой CO2R8.
[00471] В некоторых вариантах реализации R3f представляет собой водород.
[00472] В некоторых вариантах реализации R3f представляет собой C1-6 необязательно замещенный алкил.
[00473] В некоторых вариантах реализации R3f представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00474] В некоторых вариантах реализации R3f представляет собой C1-6 необязательно замещенный галогеналкил.
[00475] В некоторых вариантах реализации R3f представляет собой C1-6 необязательно замещенный алкокси.
[00476] В некоторых вариантах реализации R3f представляет собой необязательно замещенный фенил.
[00477] В некоторых вариантах реализации R3f представляет собой CO2R8.
[00478] В некоторых вариантах реализации R3g представляет собой водород.
[00479] В некоторых вариантах реализации R3g представляет собой C1-6 необязательно замещенный алкил.
[00480] В некоторых вариантах реализации R3g представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00481] В некоторых вариантах реализации R3g представляет собой C1-6 необязательно замещенный галогеналкил.
[00482] В некоторых вариантах реализации R3g представляет собой C1-6 необязательно замещенный алкокси.
[00483] В некоторых вариантах реализации R3g представляет собой необязательно замещенный фенил.
[00484] В некоторых вариантах реализации R3g представляет собой CO2R8.
[00485] В некоторых вариантах реализации R3h представляет собой водород.
[00486] В некоторых вариантах реализации R3h представляет собой C1-6 необязательно замещенный алкил.
[00487] В некоторых вариантах реализации R3h представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00488] В некоторых вариантах реализации R3h представляет собой C1-6 необязательно замещенный галогеналкил.
[00489] В некоторых вариантах реализации R3h представляет собой C1-6 необязательно замещенный алкокси.
[00490] В некоторых вариантах реализации R3h представляет собой необязательно замещенный фенил.
[00491] В некоторых вариантах реализации R3h представляет собой CO2R8.
[00492] В некоторых вариантах реализации R3i представляет собой водород.
[00493] В некоторых вариантах реализации R3i представляет собой C1-6 необязательно замещенный алкил.
[00494] В некоторых вариантах реализации R3i представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00495] В некоторых вариантах реализации R3i представляет собой C1-6 необязательно замещенный галогеналкил.
[00496] В некоторых вариантах реализации R3i представляет собой C1-6 необязательно замещенный алкокси.
[00497] В некоторых вариантах реализации R3i представляет собой необязательно замещенный фенил.
[00498] В некоторых вариантах реализации R3i представляет собой CO2R8.
[00499] В некоторых вариантах реализации R3j представляет собой водород.
[00500] В некоторых вариантах реализации R3j представляет собой C1-6 необязательно замещенный алкил.
[00501] В некоторых вариантах реализации R3j представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00502] В некоторых вариантах реализации R3j представляет собой C1-6 необязательно замещенный галогеналкил.
[00503] В некоторых вариантах реализации R3j представляет собой C1-6 необязательно замещенный алкокси.
[00504] В некоторых вариантах реализации R3j представляет собой необязательно замещенный фенил.
[00505] В некоторых вариантах реализации R3j представляет собой CO2R8.
[00506] В некоторых вариантах реализации R3k представляет собой водород.
[00507] В некоторых вариантах реализации R3k представляет собой C1-6 необязательно замещенный алкил.
[00508] В некоторых вариантах реализации R3k представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00509] В некоторых вариантах реализации R3k представляет собой C1-6 необязательно замещенный галогеналкила.
[00510] В некоторых вариантах реализации R3k представляет собой C1-6 необязательно замещенный алкокси.
[00511] В некоторых вариантах реализации R3k представляет собой необязательно замещенный фенил.
[00512] В некоторых вариантах реализации R3k представляет собой CO2R8.
[00513] В некоторых вариантах реализации R3l представляет собой водород.
[00514] В некоторых вариантах реализации R3l представляет собой C1-6 необязательно замещенный алкил.
[00515] В некоторых вариантах реализации R3l представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00516] В некоторых вариантах реализации R3l представляет собой C1-6 необязательно замещенный галогеналкил.
[00517] В некоторых вариантах реализации R3l представляет собой C1-6 необязательно замещенный алкокси.
[00518] В некоторых вариантах реализации R3l представляет собой необязательно замещенный фенил.
[00519] В некоторых вариантах реализации R3l представляет собой CO2R8.
[00520] В некоторых вариантах реализации R4a представляет собой водород.
[00521] В некоторых вариантах реализации R4a представляет собой C1-6 необязательно замещенный алкил.
[00522] В некоторых вариантах реализации R4a представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00523] В некоторых вариантах реализации R4a представляет собой C1-6 необязательно замещенного циклоалкил.
[00524] В некоторых вариантах реализации R4a представляет собой C1-6 необязательно замещенный галогеналкил.
[00525] В некоторых вариантах реализации R4a представляет собой C1-6 необязательно замещенный алкокси.
[00526] В некоторых вариантах реализации R4a представляет собой CO2R5.
[00527] В некоторых вариантах реализации R4a представляет собой CONR62.
[00528] В некоторых вариантах реализации R4a представляет собой NR72.
[00529] В некоторых вариантах реализации R4a представляет собой сульфат.
[00530] В некоторых вариантах реализации R4a представляет собой сульфонат.
[00531] В некоторых вариантах реализации R4a представляет собой необязательно замещенный арил.
[00532] В некоторых вариантах реализации R4a представляет собой необязательно замещенный арилокси.
[00533] В некоторых вариантах реализации R4a представляет собой необязательно замещенный гетероарил.
[00534] В некоторых вариантах реализации R4a представляет собой необязательно замещенный гетероцикл.
[00535] В некоторых вариантах реализации R4b представляет собой водород.
[00536] В некоторых вариантах реализации R4b представляет собой C1-6 необязательно замещенный алкил.
[00537] В некоторых вариантах реализации R4b представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00538] В некоторых вариантах реализации R4b представляет собой C1-6 необязательно замещенный циклоалкил.
[00539] В некоторых вариантах реализации R4b представляет собой C1-6 необязательно замещенный галогеналкил.
[00540] В некоторых вариантах реализации R4b представляет собой C1-6 необязательно замещенный алкокси.
[00541] В некоторых вариантах реализации R4b представляет собой CO2R5.
[00542] В некоторых вариантах реализации R4b представляет собой CONR62.
[00543] В некоторых вариантах реализации R4b представляет собой NR72.
[00544] В некоторых вариантах реализации R4b представляет собой сульфат.
[00545] В некоторых вариантах реализации R4b представляет собой сульфонат.
[00546] В некоторых вариантах реализации R4b представляет собой необязательно замещенный арил.
[00547] В некоторых вариантах реализации R4b представляет собой необязательно замещенный арилокси.
[00548] В некоторых вариантах реализации R4b представляет собой необязательно замещенный гетероарил.
[00549] В некоторых вариантах реализации R4b представляет собой необязательно замещенный гетероцикл.
[00550] В некоторых вариантах реализации R4c представляет собой водород.
[00551] В некоторых вариантах реализации R4c представляет собой C1-6 необязательно замещенный алкил.
[00552] В некоторых вариантах реализации R4c представляет собой C1-6 необязательно замещенный разветвленный алкил.
[00553] В некоторых вариантах реализации R4c представляет собой C1-6 необязательно замещенный циклоалкил.
[00554] В некоторых вариантах реализации R4c представляет собой C1-6 необязательно замещенный галогеналкил.
[00555] В некоторых вариантах реализации R4c представляет собой C1-6 необязательно замещенный алкокси.
[00556] В некоторых вариантах реализации R4c представляет собой CO2R5.
[00557] В некоторых вариантах реализации R4c представляет собой CONR62.
[00558] В некоторых вариантах реализации R4c представляет собой NR72.
[00559] В некоторых вариантах реализации R4c представляет собой сульфат.
[00560] В некоторых вариантах реализации R4c представляет собой сульфонат.
[00561] В некоторых вариантах реализации R4c представляет собой необязательно замещенный арил.
[00562] В некоторых вариантах реализации R4c представляет собой необязательно замещенный арилокси.
[00563] В некоторых вариантах реализации R4c представляет собой необязательно замещенный гетероарил.
[00564] В некоторых вариантах реализации R4c представляет собой необязательно замещенный гетероцикл.
[00565] В некоторых вариантах реализации R4a и R4b в совокупности с атомом, к которому они присоединены образуют необязательно замещенное кольцо, содержащее от 6 атомов в кольце, включая 2 атома кислорода.
[00566] В некоторых вариантах реализации R5 представляет собой водород.
[00567] В некоторых вариантах реализации R5 представляет собой необязательно замещенный алкил.
[00568] В некоторых вариантах реализации R6 представляет собой водород.
[00569] В некоторых вариантах реализации R6 представляет собой необязательно замещенный алкил.
[00570] В некоторых вариантах реализации R7 представляет собой водород.
[00571] В некоторых вариантах реализации R7 представляет собой необязательно замещенный алкил.
[00572] В некоторых вариантах реализации R8 представляет собой водород.
[00573] В некоторых вариантах реализации R8 представляет собой необязательно замещенный алкил.
[00574] В некоторых вариантах реализации t представляет собой целое число.
[00575] В некоторых вариантах реализации t составляет 1.
[00576] В некоторых вариантах реализации t составляет 2.
[00577] В некоторых вариантах реализации t составляет 3.
[00578] В некоторых вариантах реализации t составляет 4.
[00579] В некоторых вариантах реализации t составляет 5.
[00580] В некоторых вариантах реализации t составляет 6.
[00581] В некоторых вариантах реализации A2 представляет собой

[00582] В некоторых вариантах реализации A2 представляет собой

[00583] В некоторых вариантах реализации A2 представляет собой

[00584] В некоторых вариантах реализации A2 представляет собой

[00585] В некоторых вариантах реализации A2 представляет собой
[00586] В некоторых вариантах реализации A2 представляет собой

[00587] В некоторых вариантах реализации A2 представляет собой

[00588] В некоторых вариантах реализации A2 представляет собой

[00589] В некоторых вариантах реализации A2 представляет собой

[00590] В некоторых вариантах реализации A2 представляет собой

[00591] В некоторых вариантах реализации A3 представляет собой

[00592] В некоторых вариантах реализации A3 представляет собой

[00593] В некоторых вариантах реализации A3 представляет собой

[00594] В некоторых вариантах реализации A3 представляет собой

[00595] В некоторых вариантах реализации A3 представляет собой

[00596] Иллюстративные варианты реализации включают соединения формулы (VIII) или их фармацевтически приемлемые соли:

где неограничивающие M, z, y, X, n и R1 определены в настоящем описании ниже в таблице 1.




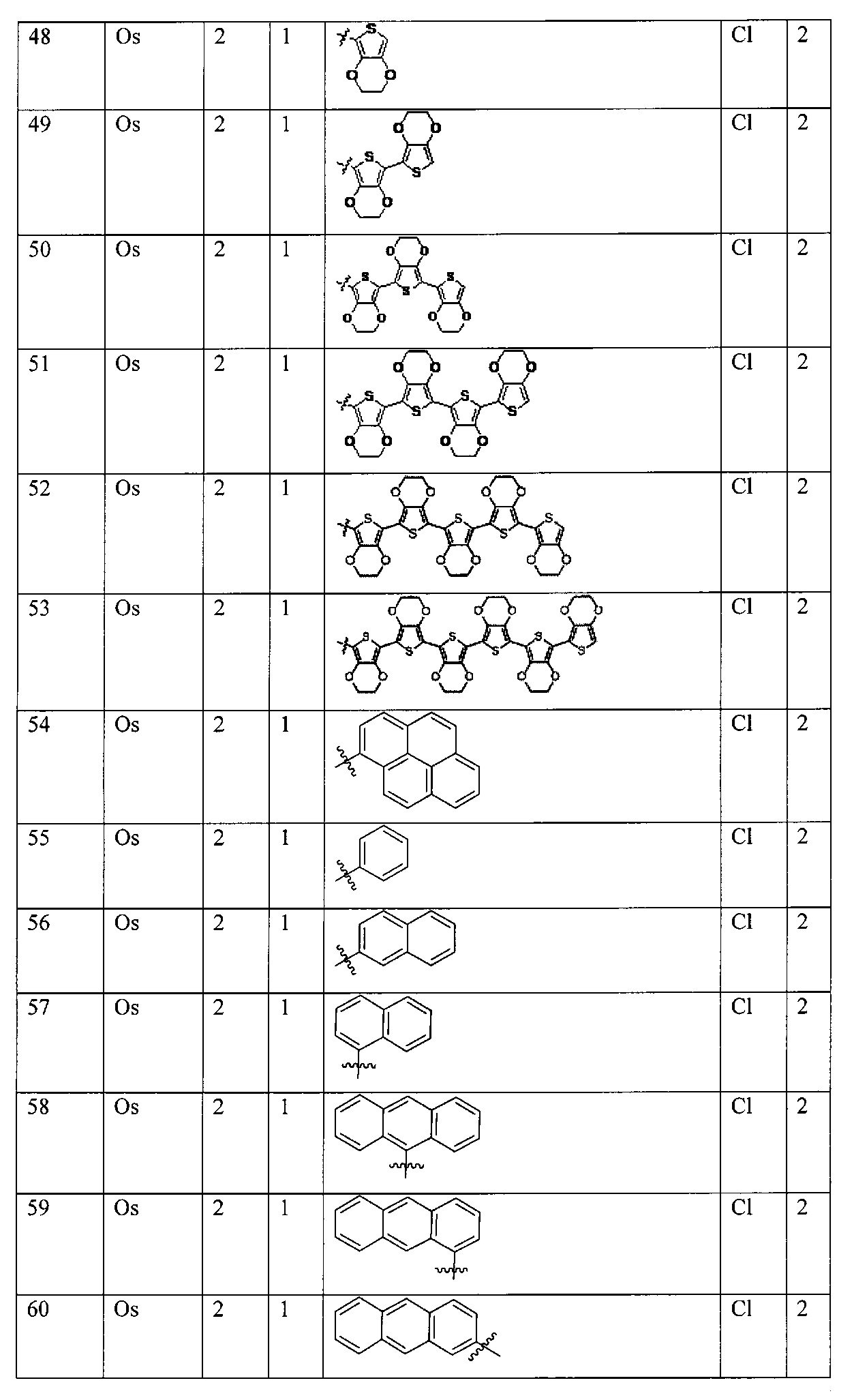

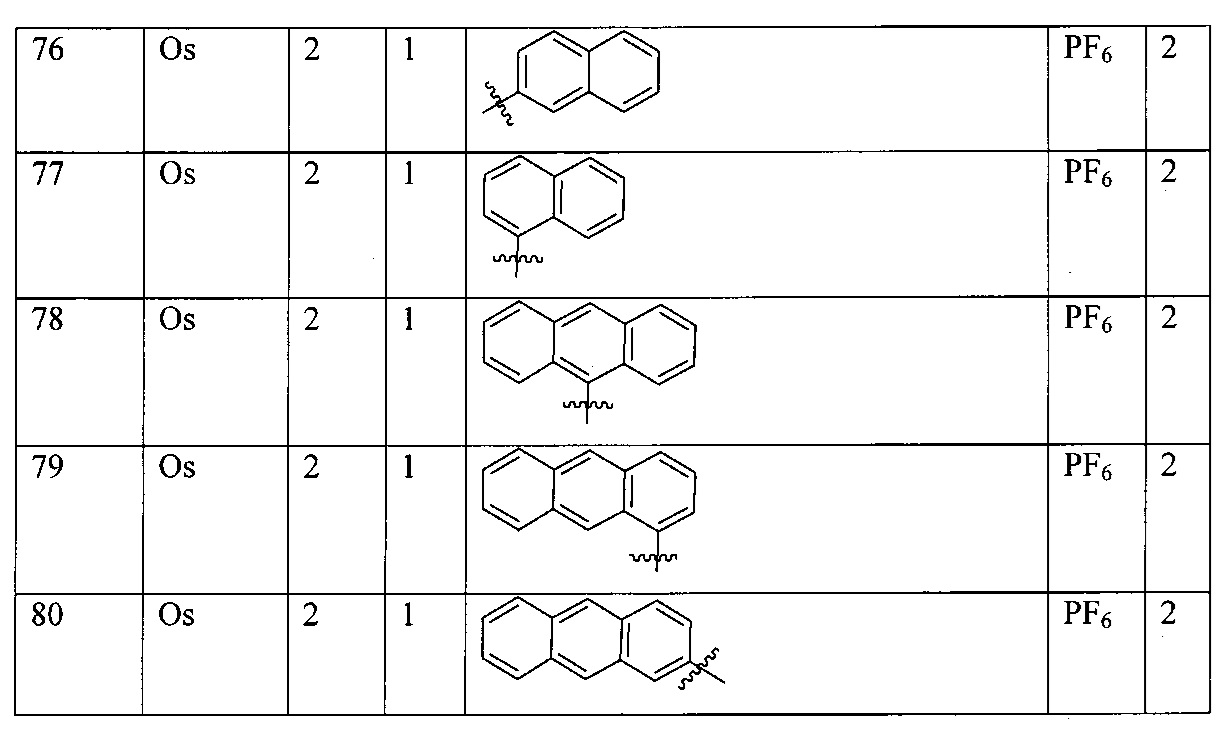
[00597] Иллюстративные варианты реализации включают соединения формулы (IX) или их фармацевтически приемлемые соли:
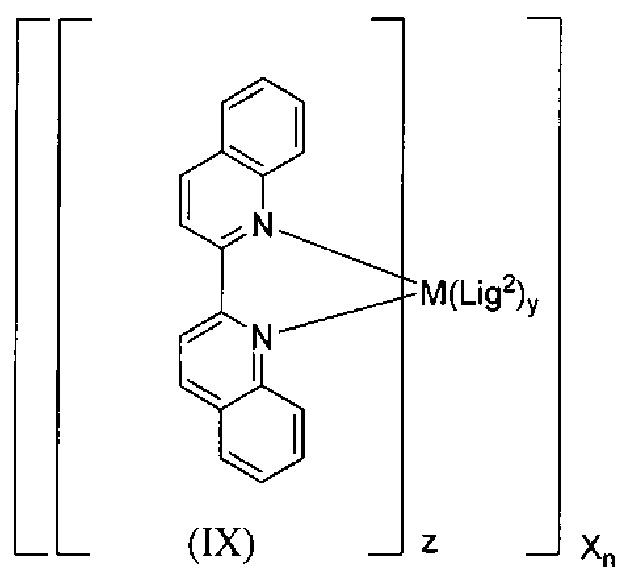
где неограничивающие примеры M, Lig, y, z, X и n определены в настоящем описании ниже в таблице 2.
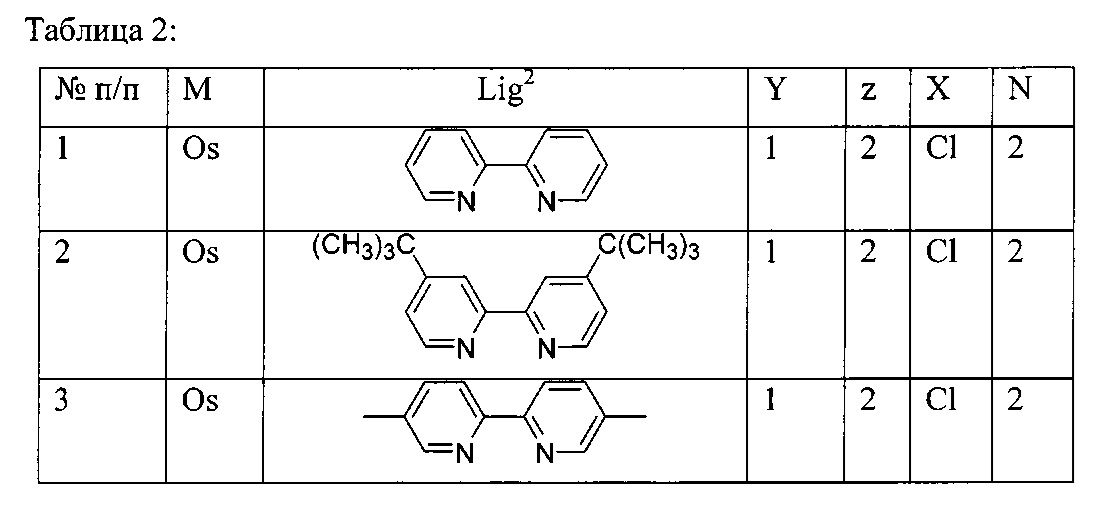





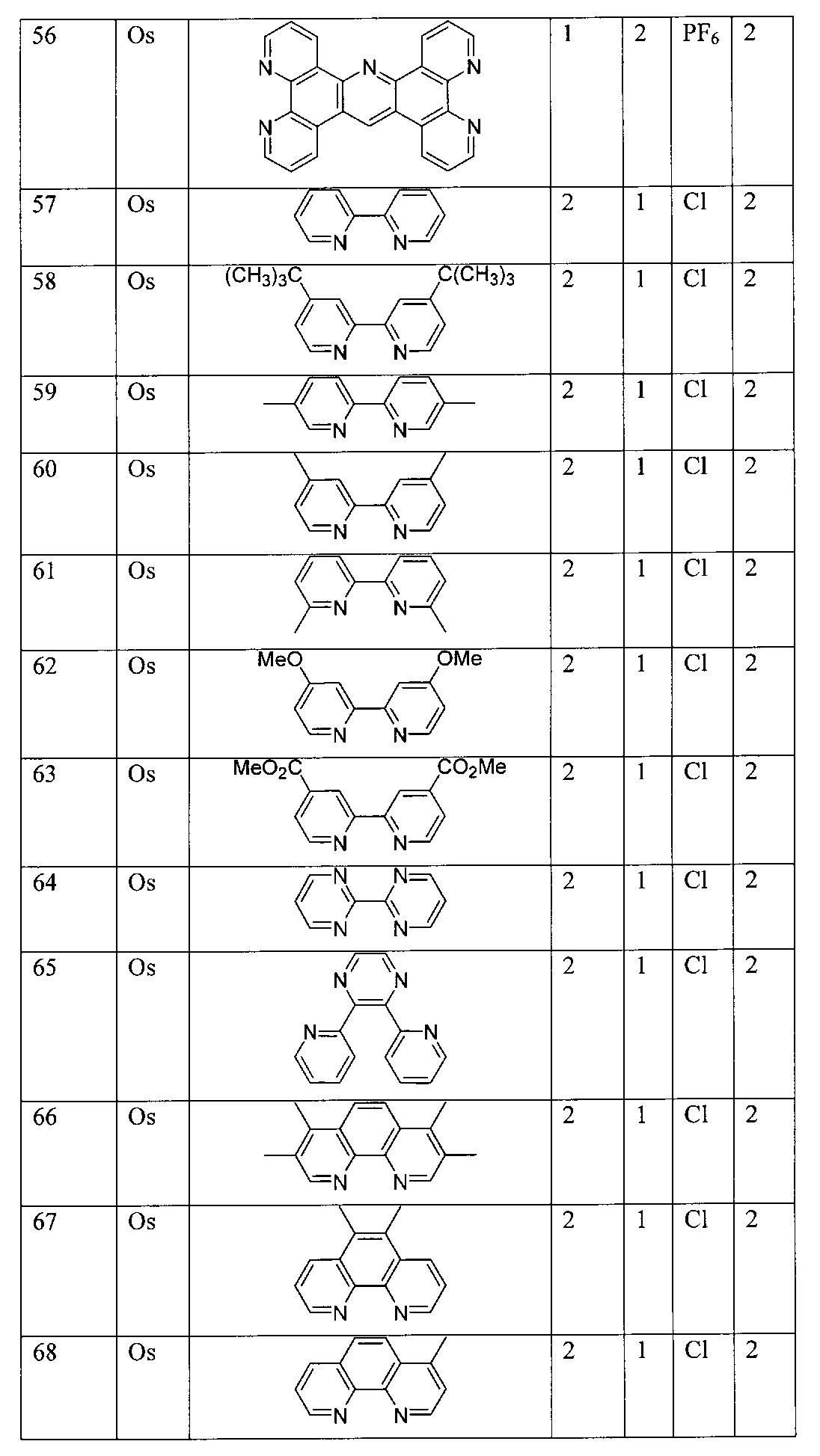



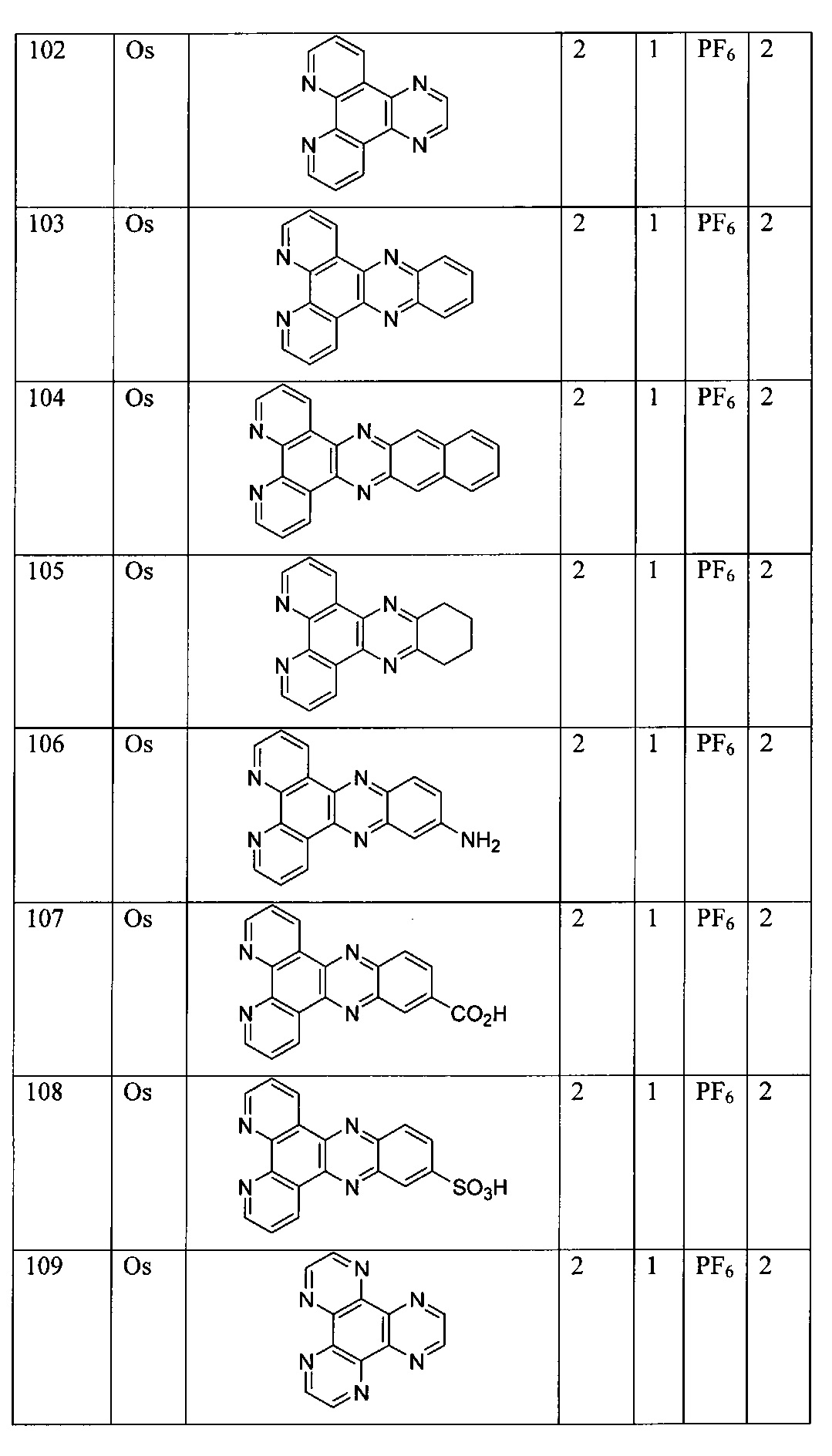
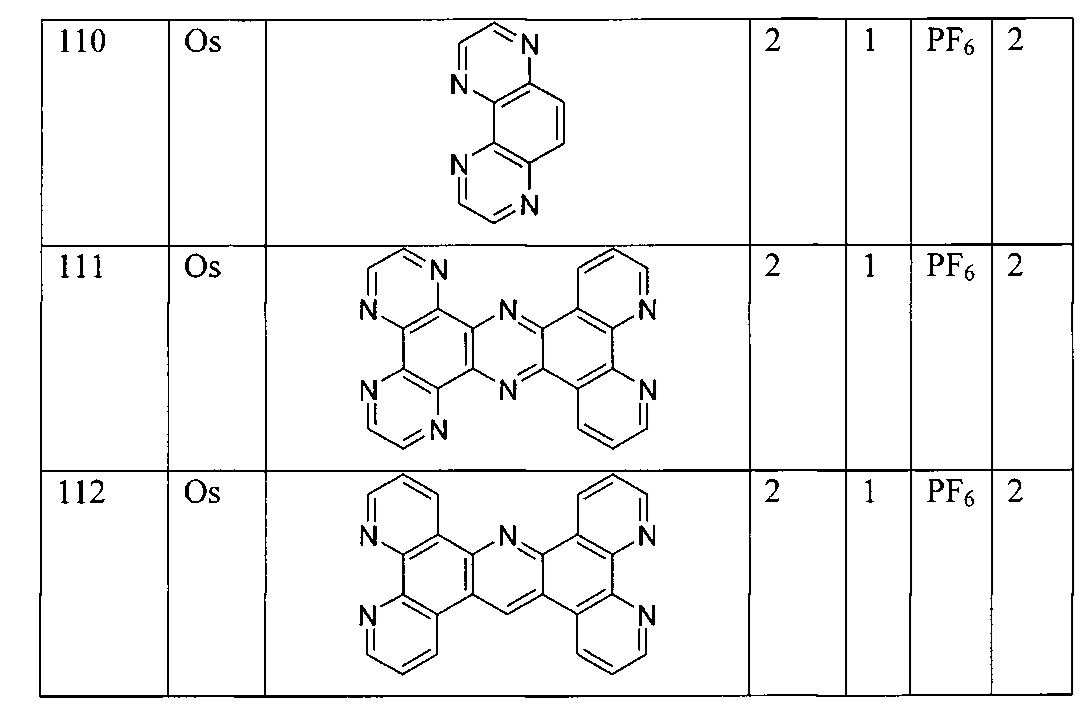
[00598] Иллюстративные варианты реализации включают соединения формулы (X) или их фармацевтически приемлемые соли:

где неограничивающие примеры M, t, X и q определены в настоящем описании ниже в таблице 4.


[00599] Иллюстративные варианты реализации включают соединения формулы (XI) или их фармацевтически приемлемые соли:

где неограничивающие примеры М, Lig, t, X и q определены в настоящем описании ниже в таблице 5.

[00600] Иллюстративные варианты реализации включают соединения формулы (XII) или их фармацевтически приемлемые соли:

где неограничивающие примеры М, Lig, t, X и q определены в настоящем описании ниже в таблице 6.


[00602] Иллюстративные варианты реализации включают соединения формулы (XIII) или их фармацевтически приемлемые соли:

где неограничивающие примеры M1, M2, X и n определены в настоящем описании ниже в таблице 7.

[00604] Иллюстративные варианты реализации включают соединения формулы (XIV) или формулы или их фармацевтически приемлемые соли:

где неограничивающие примеры M1, M2, Lig1, Lig2 X и n определены в настоящем описании ниже в таблице 8.

[00606] Иллюстративные варианты реализации включают соединения формулы (XV) или их фармацевтически приемлемые соли:

где неограничивающие примеры M1, M2, Lig1, Lig2, X и n определены в настоящем описании ниже в таблице 9.

[00607] Иллюстративные варианты реализации включают соединения формулы (XVI) или их фармацевтически приемлемые соли:
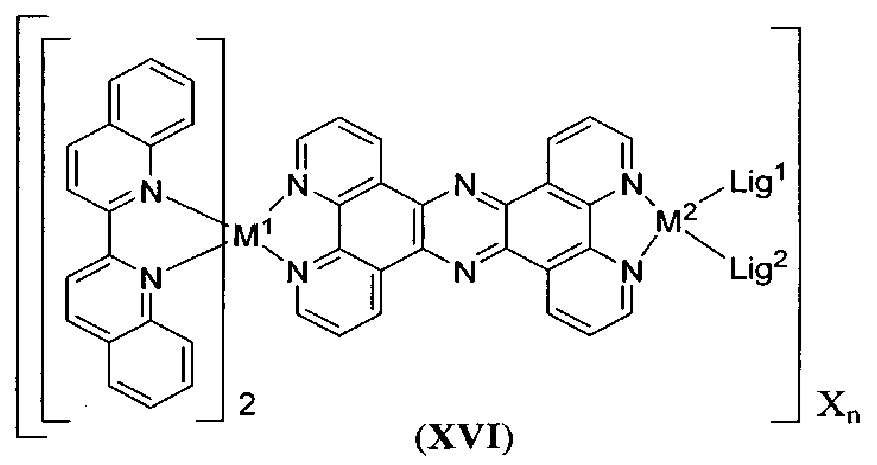
[00608] где неограничивающие примеры M1, M2, Lig1, Lig2, X и n определены в настоящем описании ниже в таблице 10.


[00609] Иллюстративные варианты реализации включают соединения формулы (XVII) или их фармацевтически приемлемые соли:

[00610] где неограничивающие примеры M1, M2, Lig1, Lig2, X и n определены в настоящем описании ниже в таблице 11.


[00611] Для целей настоящего изобретения соединение изображено рацемической формулой, которая равнозначна любому из двух энантиомеров или их смесей или в случае, когда присутствует второй хиральный центр, всем диастереомерам.
[00612] Во всех вариантах реализации, представленных в настоящем описании, примеры подходящих необязательных заместителей не предназначены для ограничения объема заявленного изобретения. Соединения согласно настоящему изобретению могут содержать любой из заместителей или комбинации заместителей, представленных в настоящем описании.
[00613] Свойства соединений согласно настоящему изобретению:
[00614] С момента случайного обнаружения цисдиамминодихлорплатины(II), то есть, цисплатина и его беспрецедентного успеха в качестве противоракового химиотерапевтического препарата, металлофармацевтические средства в качестве противораковых агентов привлекли особое внимание, хотя немногие из них были одобрены для клинического применения. Сообщалось, что комплексы, полученные из золота, железа и рутения, обладают противораковой активностью и два органометаллических комплекса рутения (имидазолий [транс-тетрахлор(1H-имидазол)(S-диметилсульфоксид)рутенат(III)], NAMI-A и индазолий [транс-тетрахлорбис(1H-индазол) рутенат(III)], KP1019) в настоящее время проходят клинические испытания (Alessio, Е.; Mestroni, G.; Bergamo, A.; Sava, G. Current Topics in Medicinal Chemistry 2004, 4, 1525-1535. Hartinger, C.G.; Zorbas-Seifried, S.; Jakupec, M.A.; Kynast, В.; Zorbas, H.; Keppler, B.K. Journal of Inorganic Biochemistry 2006, 100, 891-904.). В отличие от них, металлофармацевтические средства, полученные из переходного металла третьего ряда - осмия - остаются в значительной степени неисследованными ((a) Ni, W.-X.; Man, W.-L.; Cheung, M.T.-W.; Sun, R.W.-Y.; Shu, Y.-L.; Lam, Y.-W.; Che, C.-M.; Lau, T.-C. Chemical Communications 2011, 47, 2140-2142. (b) Kostrhunova, H.; Florian, J.; Novakova, O.; Peacock, A.F.A.; Sadler, P.J.; Brabec, V. Journal of Medicinal Chemistry 2008, 51, 3635-3643.), наиболее вероятно из-за его восприятия как высоко токсичного (например, OsO4) и по существу инертного (Os2+, Os3+) агента. Не так давно металлоорганические комплексы на основе Os(II) аренового фрагмента показали сильные цитотоксические и антиметастатические свойства in vitro, но данная активность не переносилась на противораковую активность in vivo (Bergamo, A.; Masi, A.; Peacock, A.; Habtemariam, А.; Sadler, P.; Sava, G. Journal of Inorganic Biochemistry 2010, 104, 79-86). На сегодняшний день только основании Шиффа с высоковалентным нитридом осмия(VI) перспективны in vivo. При их совместном рассмотрении из этих предварительных исследований, касающихся комплексов на основе Os, можно выделить несколько основных моментов: (i) сильная цитотоксичность in vitro не приводит a priori к противораковой активности in vivo, (ii) существуют некоторые высоковалентные комплексы на основе Os, которые проявляют сильную цитотоксичность in vitro, которая переносится как подавление опухоли in vivo, и (iii) что наиболее важно, не все соединения на основе Os демонстрируют дозолимитирующую токсичность для хозяина. На сегодняшний день не существует примеров фотодинамических соединений (ФДС) на основе координационных комплексов на основе металлов, которые успешно продемонстрировали in vitro или in vivo эффекты при ФДТ. (Ni, W.-X.; Man, W.-L.; Cheung, M.T.-W.; Sun, R.W.-Y.; Shu, Y.-L.; Lam, Y.-W.; Che, C.-M.; Lau, T.-C. Chemical Communications 2011, 47, 2140-2142. Kostrhunova, H.; Florian, J.; Novakova, O.; Peacock, A.F.A.; Sadler, P.J.; Brabec, V. Journal of Medicinal Chemistry 2008, 51, 3635-3643. Bergamo, A.; Masi, A.; Peacock, A.; Habtemariam, A.; Sadler, P.; Sava, G. Journal of Inorganic Biochemistry 2010, 104, 79-86).
[00615] Соединения согласно настоящему описанию, приведенные в настоящем документе, представляют собой первые примеры применения простых координационных комплексов на основе металлов в качестве фотодинамических соединений (ФДС), подходящих для лечения и диагностики стадии заболевания, в частности, для разрушения возбудителей инфекции, гиперпролиферативных клеток и опухолевых клеток. Соединения согласно настоящему описанию (i) представляют собой координационные комплексы на основе металлов, (ii) поглощают ультрафиолетовый (УФ), видимый и инфракрасный (ИК) (в частности, ближний инфракрасный (БИК)) свет и активируются излучением с длинами волн от УФ до ИК, в частности >800 нм, (iii) убивают растущие раковые клетки в культуре и у животных и (iv) разрушают бактерии и устойчивые к антибиотикам бактерии.
[00616] Соединения, в которых использованы органические конструкции, описанные в настоящем документе, а также использованы металлы, такие как осмий, марганец, молибден, рений, рутений, железо, кобальт, родий, иридий, никель, платина, палладий, ванадий, хром, вольфрам, технеций и медь, также способны выступать в качестве агентов для ФДТ, подходят для лечения и диагностики стадии болезненных состояний, в частности для деструкции инфекционных организмов, гиперпролиферативных клеток и опухолевых клеток и содержат соединения согласно настоящему описанию.
[00617] Соединения согласно настоящему описанию представляют собой агенты для ФДТ, растворимые в воде, растворимые в солевом растворе и не растворимые в воде. Растворимость в воде, соли и липофильность указанных соединений может быть отрегулирована путем изменения заместителей. Комплексы со структурами (b) и (c) на фигуре 1 не имеют существенной гидрофобности и, следовательно, являются водорастворимыми, в то же время структуры (a), (d) и (e) не растворимы в воде. Растворимые в воде соединения можно сделать более липофильными, а липофильные соединения можно сделать гидрофильными при помощи структурных модификаций, рационального выбора растворителей, разбавителей, вспомогательных веществ и т.п.
[00618] Соединения согласно настоящему описанию подходят в качестве агентов, оказывающих нацеленное воздействие на опухоль при ФДТ. Гидрофобность, гидрофильность, липофильность и удерживание опухоли соединениями согласно настоящего описания можно регулировать путем изменения заместителей. Включение по меньшей мере одного присоединенного к тиофену имидазо[4,5-f][1,10]фенантролинового лиганда (структура (a) на фигуре 1) приводит к удерживанию опухоли в подкожной модели рака толстой кишки у мышей по меньшей мере на 4 часа. Количество тиофоновых звеньев в имидазо[4,5-f][1,10]фенантролиновом лиганде можно варьировать для регуляции растворимости в воде в зависимости от удерживания опухоли (структуры (a), (e) и (f) на фигуре 1).
[00619] Соединения согласно настоящему описанию поглощают свет УФ-ИК областей спектра, в частности ближней ИК-области спектра (фигура 2) и являются подходящими в качестве агентов для фотодинамической терапии. Дииминовый лиганд 2,2'-бихинолил ("biq") обеспечивает поглощающую способность соединений согласно настоящему описанию в ближней ИК области спектра, при этом остальные лиганды могут быть изменены для регуляции физических и фармакокинетических свойств этого комплекса, а также механизма его действия в качестве агентов для ФДТ согласно настоящему описанию.
[00620] Соединения согласно настоящему описанию не токсичны для клеток, даже при концентрациях, превышающих 100 мкМ. Кроме того, соединения согласно настоящему описанию демонстрируют сильный эффект ФДТ при увеличении дозы излучения (фигура 3), даже при низких эффективных концентрациях, составляющих 0,8 мкМ. По сравнению с клиническим агентом АПК указанные соединения гораздо более стабильны (фигуры 4, 5) и показывают более сильное фотонное поглощение. Соединения согласно настоящему описанию проявляют способность выступать в качестве агентов для ФДТ типа 1 или типа 2 в зависимости от комбинации выбранных лигандов, где фотохимия типа 1 включает образование радикалов, таких как высокотоксичный гидроксильный радикал, а фотохимия типа 2 включает сенсибилизацию синглетного кислорода при помощи агента для ФДТ. Эти противопоставленные друг другу механизмы действия могут быть исследованы путем включения акцепторов соответствующих активных форм кислорода в эксперимент по ФДТ и наблюдения, уменьшается ли или исключается эффект ФДТ; например, исключение ФДТ в присутствии акцептора гидроксильных радикалов свидетельствует о том, что гидроксильный радикал вовлечен в механизм воздействия. Соединения этого класса, описанные в настоящем изобретении, обладают спектром действий, которые варьируются от абсолютного типа 1 до абсолютного типа 2, а также элементами и того, и другого.
[00621] Лиганды соединений согласно настоящему описанию можно менять (i) для получения водорастворимых и водонерастворимых составов, которые легко проникают в клеточные мембраны и (ii) для изменения активности между нормальными кислородными условиями и гипоксией (фигура 6). Соединения согласно настоящему описанию, выступающие в качестве фотосенсибилизаторов, непосредственно связывают ДНК, вызывая конденсацию высоких уровней ДНК и последующий апоптоз, и способны вырабатывать достаточное терапевтическое количество синглетного кислорода и гидроксильных радикалов (активные формы кислорода, АФК, фигура 7), при этом убивая микробные и раковые клетки даже в гипоксической среде.
[00622] Соединения согласно настоящему описанию не токсичны для клеток, но проявляют сильную фотоцитотоксичность по отношению к раковым клеткам и микроорганизмам и могут быть применены для обеспечения эффекта ФДТ (фигуры 8, 9), подходящего для лечения заболевания связанного с гиперпролиферацией клеток, такого как рак, включая, но не ограничиваясь ими, рак молочной железы, рак толстой кишки, рак головного мозга, мелоному, лейкоз и рак мочевого пузыря, а также разрушения микроорганизмов, бактерий, вирусов, простейших и грибов.
[00623] Традиционные клинические агенты для ФДТ характеризуются приемлемыми квантовыми выходами синглетного кислорода, указывающие на высокую вероятность того, что in vivo ФДТ зависит, по меньшей мере частично, от образования синглетного кислорода. Соединения согласно настоящему описанию неожиданно демонстрируют очень низкий квантовый выход синглетного кислорода при всех длинах волн возбуждающего света (таблица 1). Несмотря на то, что не является неожиданным тот факт, что сенсибилизация синглетного кислорода однофотонным поглощением была бы неудачной в фототерапевтическом диапазоне (780-950 нм) в связи с низкой энергией фотонов (Starkey, J.R.; Rebane, А.К.; Drobizhev, M.A.; Meng, F.; Gong, A.; Elliott, A.; Mclnnerney, K.; Spangler, C.W. Clinical Cancer Research 2008, 14, 6564-6573), низкий квантовый выход синглетного кислорода при более коротких длинных волн был неожиданным, учитывая мощную ФДТ, которую наблюдали in vitro и in vivo при применении соединений согласно настоящему описанию. Таким образом, причиной сильного окислительного всплеска АФК могут служить супероксид, пероксид водорода и гидроксильные радикалы, и но вторичные активные формы азота (АФА) могут также играть важную роль (Coleman, J.; Scherz, A., European Urological Review, 2012; 7(2): 106-8). Фототермические эффекты не были исключены.
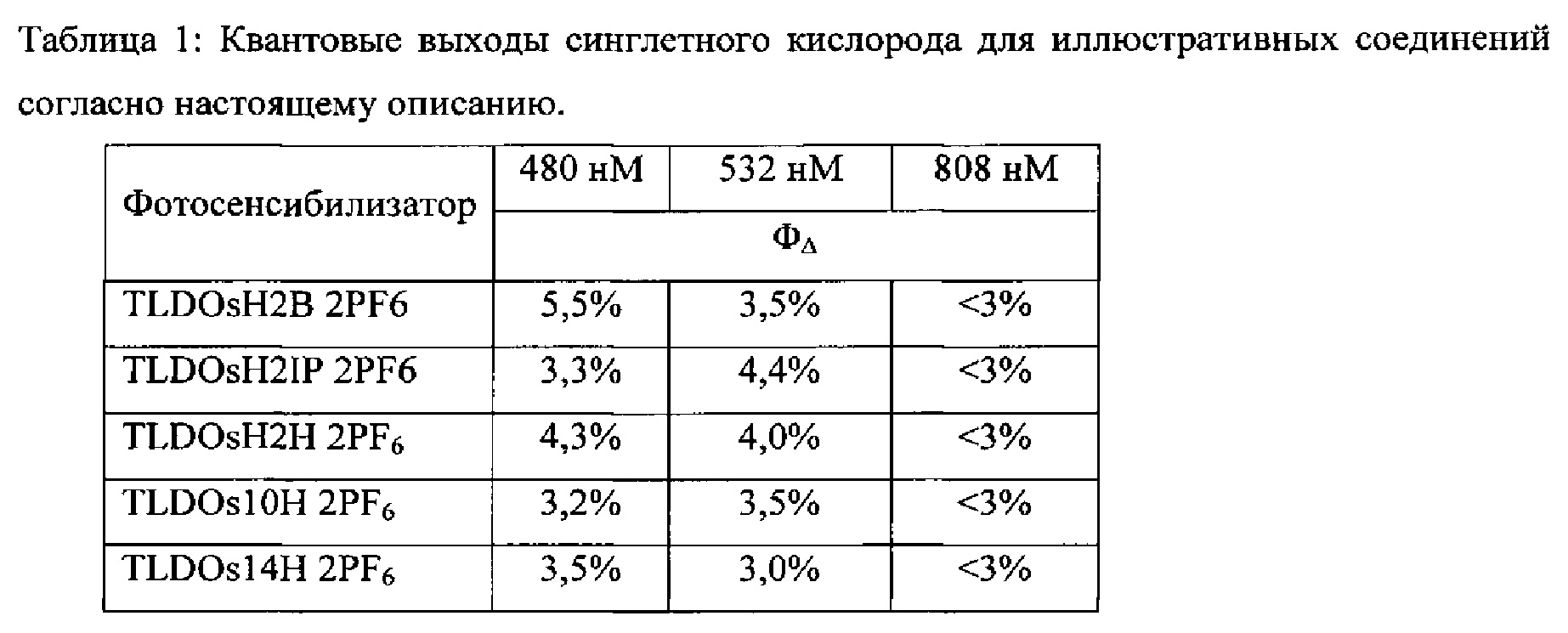
[00624] В вариантах реализации согласно настоящему описанию создают излучение при длинах волн >800 нм, и квантовый выход излучения увеличивается менее чем в два раза в дегазированном или продуваемом аргоном растворе. Эта минимальная кислородная зависимость и длинноволновый выход могут быть подходящими для целей диагностики, в частности для применения в медицине ((a) Starkey, J.R.; Rebane, А.К.; Drobizhev, M.A.; Meng, F.; Gong, A.; Elliott, A.; Mclnnerney, K.; Spangler, C.W. Clinical Рак Research 2008, 14, 6564-6573. (b) Cullander, C. The Journal of Investigative Dermatology. Symposium Proceedings / the Society for Investigative Dermatology, Inc. [and] European Society for Dermatological Research 1998, 3, 166-171). Кроме того, глубоко пигментированные соединения могут подходить в качестве колориметрических индикаторов для раковых клеток и тканей (фигура 10), на что указывает высокое удерживание соединений согласно настоящему описанию раковыми клетками.
[00625] Соединения согласно настоящему описанию обладают способностью собирать фотоны малой энергии, расширяя спектральный ответ в ближней ИК области электромагнитного спектра, не доступный ранее описанным фотосенсибилизаторам, что делает их подходящими для применения в сенсибилизированных красителем фотоэлементах (СКФЭ). Варианты реализации согласно настоящему описанию демонстрируют как панхроматическое поглощение, так и высокую оптическую плотность (фигуры 1 и 11, TLDOsH2B Cl2). 2,2'-Бихинолиновый лиганд соединений согласно настоящему описанию выступает в качестве ароматического π-делокализованного лиганда, который увеличивает силу осцилятора спин-запрещенного перехода в ближней ИК области спектра путем заимствования интенсивности от значительно смещенных в сторону красной области спектра спинразрешенных синглет-синглетных переходов (Kinoshita, Т.; Fujisawa, J.-i.; Nakazaki, J.; Uchida, S.; Kubo, Т.; Segawa, H.J. Phys. Chem. Lett. 2012, 3, 394-398). Дополнительные лиганды включены без значительного изменения поглощения в ближней ИК области спектра модельного соединения TLDOsH2B Cl2. Фигура 11 демонстрирует, что 1,10-фенантролин может быть заменен имидазо[4,5-f[1,10]фенантролином (TLDOsH2IP Cl2) или 2-(2''-триенил)-имидазо[4,5-f][1,10]фенантролином (TLDOs1H Cl2), фотобиологически активными соединениями, подходящими в качестве агентов для ФДТ, которые могут быть активированы источниками света в ближней ИК области.
[00626] Соединения согласно настоящему описанию также способны разрушать микроорганизмы, такие как Staphylococcus aureus (SA) и устойчивый к метицилину S.aureus (УМЗС), при активации светом в диапазоне от УФ до ИК, в частности красным светом видимой области спектра и светом в ближней области ИК спектра. Примером может служить активация TLDOsH2IP Cl2 (уже при 25 мкМ) красным светом, дающим существенную фотодинамическую инактивацию УМЗС, определенную в виде снижения log10 колониеобразующих единиц (КОЕ) на мл бактериального раствора. При пиковых концентрациях было достигнуто уменьшение log10 до 5,2 и 4,6 для TLDOsH2IP Cl2 и TLDOsH2B Cl2, соответственно (фигура 15). Таким образом, фотодинамическая активация (ФДА), опосредованная этим новым классом фотосенсибилизаторов, продемонстрирована для конкретного условно-патогенного патогена, и такой фотодинамический эффект можно применить и к грамположительным, и к грамотрицательным бактериям (устойчивым и неустойчивым) при различных величинах давления кислорода при рациональном выборе фотосенсибилизатора и длины волны для его активации.
[00627] Соединения согласно настоящему описанию также способны увеличивать продолжительность жизни мышей, содержащих опухоли, представляющие собой аденокарциному толстой кишки, при активации облучением при соответствующей длине волны. Иллюстративные результаты для соединений согласно настоящему описанию приведены в фигуре 16. TLDOsH2IP Cl2-опосредованную ФДТ при облучении красным светом (635 нм) при 190 или 266 Дж/см2 проводили на мышах (CT26CL25 иммуногенный тип), содержащих подкожные опухоли, представляющие собой аденокарциному толстой кишки. На фигуре 16 представлены кривые выживаемости Каплана-Мейера, демонстрирующие, что облучение или фотосенсибилизатор отдельно не обеспечивают длительное выживание животных. Однако мыши, которых обработали излучением и фотосенсибилизатором, выживали в течение более длительного периода времени, и это выживание возрастало с увеличением плотности энергии. При активации TLDOsH2IP Cl2 посредством красного света с плотностью энергии 266 Дж/см2, длительное выживание животных проявлялось более чем в 80% популяции. Таким образом, класс соединений, описанных в данном изобретении, перспективен в качестве терапевтического инструмента для лечения рака (и разрушения нежелательных клеток в целом, таких микроорганизмы и вирусы).
[00628] Соединения согласно настоящему описанию обладают иммуномодулирующей функцией, в результате чего лечение in vivo при помощи ФДТ применяют, чтобы обеспечить отторжение вторичных опухолей. ФДТ-обработанных мышей повторно заражали CT26.CL25 (антигенными) клетками, которые экспрессируют антиген опухоли, и в результате опухолей не было. У всех контрольных мышей, которые не получали предшествующего лечения при помощи ФДТ, был отмечен повторный рост опухоли уже на 4 день. Следовательно, ФДТ с применением соединений согласно настоящему изобретению может изменять клеточные иммунные реакции, что приводит к возникновению системного антиген-специфического противоопухолевого иммунитета.
СПОСОБ
[00629] Настоящее изобретение также относится к способу получения соединений согласно настоящему изобретению.
[00630] Соединения согласно настоящему описанию могут быть получены в соответствии с методиками, которые изложены в настоящем описании, из имеющихся в продаже исходных материалов, соединений, известных из литературы, или легко получаемых промежуточных соединений с применением стандартных способов синтеза и методик, известных специалистам в данной области техники. Информацию о стандартных способах синтеза и методиках получения молекул органических соединений и координационных комплексов, а также преобразований и манипуляций с функциональными группами можно легко получить из соответствующей научной литературы или из стандартных учебников в данной области. Следует понимать, что в если указаны типовые или предпочтительные условия проведения процесса (то есть температура реакции, время, мольные соотношения реагентов, растворители, давления и т.д.), также могут быть использованы и другие условия процесса, если не указано иное. Оптимальные условия реакции могут меняться в зависимости от конкретных реагентов или применяемого растворителя, но такие условия могут быть определены специалистами в данной области техники посредством обычных методов оптимизации. Специалисты в области органического и неорганического синтезов придут к выводу, что природу и порядок представленных стадий синтеза можно варьировать с целью оптимизации образования соединений, описанных в настоящем описании.
[00631] Способы, описанные в настоящем документе, можно контролировать в соответствии с любым известным в данной области техники способом. Например, образование продукта можно контролировать методами спектроскопии, такими как спектроскопия ядерного магнитного резонанса (например, 1H или 13C), инфракрасная спектроскопия, спектрофотометрия (например, в УФ-видимой областях спектра), масс-спектрометрия, или посредством хроматографии, такой как высокоэффективная жидкостная хроматография (ВЭЖХ), газовая хроматография (ГХ), гель-проникающая хроматография (ГПХ) или тонкослойная хроматография (ТСХ).
[00632] Получение соединений может включать защиту и снятие защиты с различных химических групп. Необходимость в защите и снятии защиты и в выборе соответствующих защитных групп может быть легко определена специалистом в данной области техники. С химией защитных групп можно ознакомиться, например, по источнику Greene et al., Protective Groups in Organic Synthesis, 2d. Ed. (Wiley & Sons, 1991), полное описание которого включено в настоящее описание посредством ссылки для всех целей.
[00633] Реакции или процессы, описанные в настоящем описании, можно проводить в подходящих растворителях, которые может легко выбрать специалист в области органического и неорганического синтеза. Подходящие растворители, как правило, по существу инертны к веществам, участвующим в реакции, промежуточным соединениям и/или продуктам реакции при температурах, при которых проводят реакции, то есть при температурах, которые могут варьироваться в пределах от температуры замерзания растворителя до температуры кипения растворителя. Заданную реакцию можно проводить в одном растворителе или в смеси из более чем одного растворителя. В зависимости от конкретной стадии реакции можно выбрать подходящие растворители для конкретной стадии реакции.
[00634] Соединения согласно настоящему описанию можно получить посредством способов, известных в области органической и неорганической химии. Реагенты, которые применяют для получения соединений согласно настоящему описанию, могут быть либо приобретены, либо получены стандартными способами, описанными в литературе. Например, соединения согласно настоящему изобретению можно получить в соответствии со способом, представленным в разделе «Общие схемы синтеза…».
ОБЩИЕ СХЕМЫ СИНТЕЗА ДЛЯ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ
[00635] Реагенты, которые применяют для получения соединений согласно настоящему описанию, могут быть либо приобретены, либо получены стандартными способами, описанными в литературе. В соответствии с настоящим изобретением, соединения данного класса можно получить по одной из следующих схем реакций.
[00636] Соединения формулы (5) можно получить в соответствии со способом, представленным в следующих схемах.
Схема 1

[00637] Соответственно, проводят реакцию подходящим образом замещенного соединения формулы (1), известного соединения или соединения, полученного известными способами, с подходящим образом замещенным соединением формулы (2) в присутствии соли аммония, такой как ацетат аммония, формиат аммония, хлорид аммония, бромид аммония, сульфат аммония и т.п., в растворителе, таком как уксусная кислота, муравьиная кислота, пропионовая кислота и т.п., необязательно в присутствии метанола, этанола, N,N-диметилформамида и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения, с получением соединения формулы (3). Далее проводят реакцию соединения формулы (3) с соединением формулы (4) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, смеси вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения, с получением соединения формулы (5). Соединения формулы (5) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
Схема 1а

[00638] В альтернативном варианте проводят реакцию подходящим образом замещенного соединения формулы (1), известного соединения или соединения, полученного известными способами, с подходящим образом замещенным соединением формулы (2a) в присутствии соли аммония, такой как ацетат аммония, формиат аммония, хлорид аммония, бромид аммония, сульфат аммония и т.п., в растворителе, таком как полифосфорная кислота, уксусная кислота, муравьиная кислота, пропионовая кислота и т.п., необязательно в присутствии метанола, этанола, N,N-диметилформамида и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового с получением соединения формулы (3). Далее проводят реакцию соединения формулы (3) с соединением формулы (4) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (5). Соединения формулы (5) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00639] Соединения формулы (7) можно получить в соответствии со способом, представленным на схеме 2.
Схема 2

[00640] Соответственно, проводят реакцию подходящим образом замещенного соединения формулы (3) с соединением формулы (6) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (7). Соединения формулы (7) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00641] Соединения формулы (8) можно получить в соответствии со способом, представленным на схеме 3.
Схема 3

[00642] Соответственно, проводят реакцию подходящим образом замещенного соединения формулы (9), известного соединения или соединения, полученного известными способами, с подходящим образом замещенным соединением формулы (10) в присутствии соли аммония, такой как ацетат аммония, формиат аммония, хлорид аммония, бромид аммония, сульфат аммония и т.п., в растворителе, таком как уксусная кислота, муравьиная кислота, пропионовая кислота и т.п., необязательно в присутствии метанола, этанола, N,N-диметилформамида и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединений формулы (11). Далее проводят реакцию соединения формулы (11) с соединением формулы (12) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (8). Соединения формулы (8) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
Схема 3a
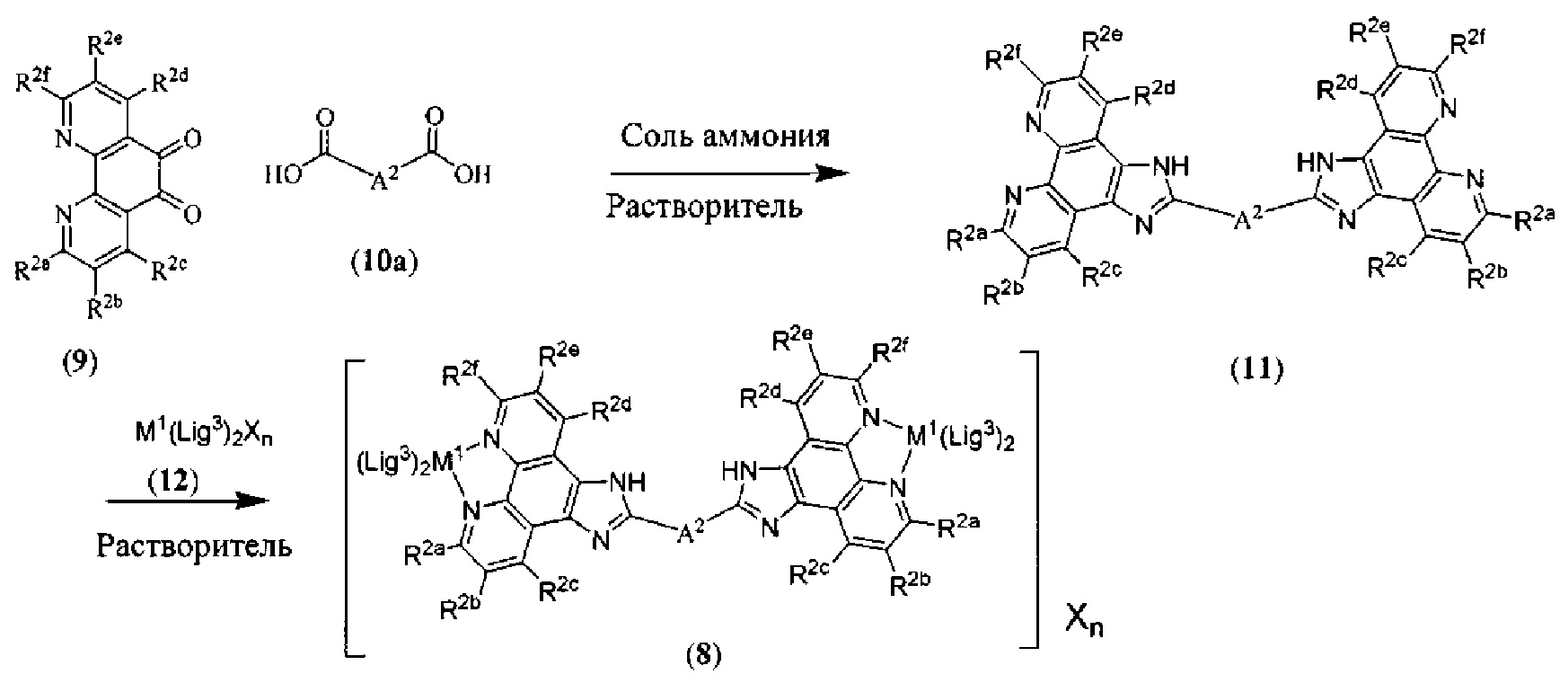
[00643] В альтернативном варианте проводят реакцию подходящим образом замещенного соединения формулы (9), известного соединения или соединения, полученное известными способами, с подходящим образом замещенным соединением формулы (10a) в присутствии соли аммония, такой как ацетат аммония, формиат аммония, хлорид аммония, бромид аммония, сульфат аммония и т.п., в растворителе, таком как полифосфорная кислота, уксусная кислота, муравьиная кислота, пропионовая кислота и т.п., необязательно в присутствии метанола, этанола, N,N-диметилформамида и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (11). Далее проводят реакцию соединения формулы (11) с соединением формулы (12) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (8). Соединения формулы (8) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00644] Соединения формулы (8а) можно получить в соответствии со способом, представленным на следующей схеме 3b.
Схема 3b

[00645] Далее проводят реакцию соединения формулы (11) с соединением формулы (12) в растворителе, таком как метанол, этанол, изопропанол этиленгликоль, глицерин, вода, 1,4-диоксан и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (8а). Далее проводят реакцию соединения формулы (8а) с соединением формулы (12а) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (8b). Соединения формулы (8b) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00646] Соединения формулы (8d) можно получить в соответствии со способом, представленным на следующей схеме 3c.
Схема 3c

[00647] Далее проводят реакцию соединения формулы (11) с соединением формулы (12b) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (8c). Далее проводят реакцию Соединения формулы (8c) с соединением формулы (12а) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (8d). Соединения формулы (8d) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00648] Соединения формулы (8f) можно получить в соответствии со способом, представленным в следующей схеме 3d.
Схема 3d

[00649] Проводят реакцию соединения формулы (11) с соединением формулы (12c) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (8е). Далее проводят реакцию соединения формулы (8е) с соединением формулы (12d) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (8f). Соединения формулы (8f) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00650] Соединения формулы (13) можно получить в соответствии со способом, представленным на следующей схеме 4.
Схема 4

[00651] Соответственно, далее проводят реакцию подходящим образом замещенного соединения формулы (14), известного соединения или соединения, полученного известными способами, с соединением формулы (15), известным соединением или соединением, полученным известными способами, в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединений формулы (13). Соединения формулы (13) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00652] Соединения формулы (16) можно получить в соответствии со способом, представленным на схеме 5.
Схема 5

[00653] Соответственно, проводят реакцию подходящим образом замещенного соединения формулы (17) с соединением формулы (18) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей, и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (16). Соединения формулы (16) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00654] Соединения формулы (19) можно получить в соответствии со способом, представленным на схеме 6.
Схема 6
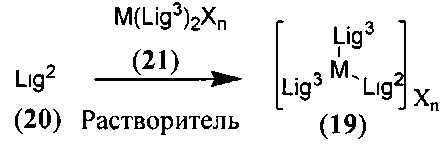
[00655] Соответственно, далее проводят реакцию подходящим образом замещенного соединения формулы (20), известного соединения или соединения, полученного известными способами, с соединением формулы (21), известным соединением или соединением, полученным известными способами, в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (19). Соединения формулы (19) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00656] Соединения формулы (22) можно получить в соответствии со способом, представленным на схеме 7.
Схема 7

[00657] Соответственно, проводят реакцию подходящим образом замещенного соединения формулы (23), известного соединения или соединения, полученного известными способами, с соединением формулы (24), известным соединением или соединением, полученным известными способами, в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (22). Соединения формулы (22) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00658] Соединения формулы (25) можно получить в соответствии со способом, представленным на схеме 8.
Схема 8

[00659] Соответственно, проводят реакцию подходящим образом замещенного соединения формулы (26), известного соединения или соединения, полученного известными способами, и подходящим образом замещенного соединения формулы (27), известного соединения или соединения, полученного известными способами, с соединением формулы (24) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (25). Соединения формулы (25) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
Схема 9

[00660] Кроме того, проводят реакцию подходящим образом замещенного соединения формулы (26), известного соединения или соединения, полученного известными способами, с соединением формулы (30) в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (26а). Далее проводят реакцию соединения формулы (26) с соединением формулы (27), известным соединением или соединением, полученным известными способами, в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (27а). Далее проводят реакцию соединения формулы (27а) с соединением формулы (29), известным соединением или соединением, полученным известными способами, в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (25).
[00661] Соединения формулы (28) можно получить в соответствии со способом, представленным на схеме 10.
Схема 10

[00662] Соответственно, проводят реакцию подходящим образом замещенного соединения формулы (29), известного соединения или соединения, полученного известными способами, с соединением формулы (30), известным соединением или соединением, полученным известными способами, необязательно в присутствии хлористого лития, в растворителе, таком как метанол, этанол, изопропанол, этилен 1,2-диметоксиэтан, гликоль, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединений формулы (28). Соединения формулы (28) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00663] Соединения формулы (31) можно получить в соответствии со способом, представленным на схеме 11.
Схема 11

[00664] Проводят реакцию соединения формулы (27а) с соединением формулы (29а), известным соединением или соединением, полученным известными способами, в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (25а). Далее проводят реакцию соединения формулы (25а) с соединением формулы (27а), известным соединением или соединением, полученным известными способами, в растворителе, таком как метанол, этанол, изопропанол, этиленгликоль, 1,2-диметоксиэтан, глицерин, вода, 1,4-диоксан, диметилформамид, в смесях вышеуказанных растворителей и т.п., необязательно при нагревании, необязательно при нагревании посредством микроволнового излучения с получением соединения формулы (31). Соединения формулы (31) можно преобразовать в альтернативные солевые формы обычными способами, известными специалистам в данной области техники.
[00665] Изобретение будет более подробно пояснено на основании следующих Примеров, но следует понимать, что настоящее изобретение не следует считать ограниченным ими.
[00666] Приведенные ниже примеры представляют собой иллюстративные способы получения некоторых соединений согласно настоящему изобретению. Квалифицированный практик будет знать, как заменить соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области техники для того, чтобы приготовить соединения согласно настоящему изобретениию.
[00667]1H-ЯМР спектры получены на приборе Bruker Avance 300-МГц ЯМР. Масс-спектрометрические данные низкого и высокого разрешения были получены на приборе Bruker Daltonics micrOTOF.
ПРИМЕРЫ

[00668] Получение 2-(2',2'':5'',2'''-тертиофен)-имидазо[4,5-f][1,10]фенантролина (IP-ТТ): 10-Фенантролин-5,6-дион (166,6 мг, 0,800 ммоль), ацетат аммония (616 мг, 8,00 ммоль) и 5-формил-2,2':5',2''-тертиофен (221,12 мг, 0,800 ммоль) смешивали с ледяной уксусной кислотой (4,0 мл) в микроволновой реакционной камере и проводили реакцию посредством 300 Вт при 180°C в течение 10 минут. Цвет раствора менялся от светло-желтого до темно-красного, и раствор охлаждали до комнатной температуры. Раствор нейтрализовывали путем добавления по каплям водного NH4OH (6 мл) до выпадения продукта в осадок в виде желтого/коричневого твердого вещества. Полученное твердое вещество собирали с применением тонко спеченного стеклянного фильтра и промывали Н2О (15 мл). Полученный продукт сушили под вакуумом с получением рыжевато-коричневого порошка (256 мг, 69%). Rf = (2% H2O, 43% CHCl3, 25% ацетон, 30% MeOH + 1% NH4OH).1H ЯМР (ДМСО-d6) 7,14 (dd; 1Н; J=4,37 Гц), 7,33-7,43 (m; 4Н), 7,55 (m; 1H), 7,75-7,79 (m; 3H), 8,82 (d; 2Н; J=8,01 Гц), 8,97 (d; 2Н; J=3,00 Гц).
[00669] Получение 16х: сложный пиниколовый эфир 2,2'-5,2''-тертиофен-5 бороновой кислоты (236,1 мг, 0,780 ммоль), 5-бромо-2-тиофенкарбоксальдегид (57,4 мкл, 0,59 ммоль) и Pd(PPh3)4 (55 мг) смешивали в продуваемой аргоном лампе СВЧ. СВЧ лампу снова продували аргоном и 1,2-диметоксиэтаном (5,66 мл) и затем отдельно шприцом добавляли 2М водный раствор Na2CO3 (0,4 мл). Проводили реакцию в растворе при 200 Вт и 175°C в течение 1 часа. Полученный темно-зеленый раствор фильтровали на тонкой фритте для удаления катализатора и промывали небольшими порциями этилацетата. Фильтрат разбавляли дополнительным количеством этилацетата, переносили в 125 мл сепаратор и промывали насыщенным раствором NaCl (3×50 мл). Органический слой концентрировали при пониженном давлении и сушили под вакуумом с получением неочищенного продукта (130,9 мг, 62%). Очистку проводили на колонке, заполненной силикагелем, элюировали смесью 1:1 дихлорметан:гексан. Медленно перемещающееся пятно, которое положительно окрашивается динитрофенилгидразином, что указывает на наличие альдегида, собирали, концентрировали при пониженном давлении и сушили под вакуумом с получением чистого продукта (14,1 мг, 6,7%). Rf=0,20 (1:1 дихлорметан:гексан).1H ЯМР (CDCl3) 9,86 (s; 1Н), 7,67 (d; 1Н; J=3,96 Гц), 7,21-7,29 (m; 3H), 7,20 (d; 1Н; J=3,54 Гц), 7,11-7,14 (m; 3H), 7,04 (t; 1Н; J=4,89 Гц).
[00670] Получение 16L: 1,10-Фенантролин-5,6-дион (41,6 мг, 0,200 ммоль), ацетат аммония (154 мг, 2,00 ммоль) и 16x (71,7 мг, 0,200 ммоль) смешивали в ледяной уксусной кислоте (1,0 мл) в микроволновой реакционной камере и проводили реакцию при 300 Вт 180°C в течение 10 минут. Раствор оставляли охлаждаться до комнатной температуры с последующей нейтрализацией добавлением по каплям водного NH4OH (2-4 мл) пока продукт не выпадал в осадок в виде коричневого твердого вещества. Твердое вещество собирали при помощи тонко спеченного стеклянного фильтра и промывали Н2О (15 мл). Полученный продукт сушили под вакуумом с получением неочищенного продукта в виде коричневого порошка (105,9 мг, 96%). Проводили очистку перекристаллизацией из горячего MeOH с получением чистого продукта (31,1 мг, 28%).1H ЯМР (ДМСО-d6) 9,04 (br; 2Н), 8,84 (d; 2Н; J=7,35 Гц), 7,86 (br; 2Н), 7,33-7,57 (m; 8Н); 7,11 (br; 1Н). МС (ИЭР+) m/z: 549,0 [М+1Н]+. МСВР (ИЭР+) m/z для C29H17N4S4; расчет. 549,0331; получ. 549,0307.

[00671] Получение 2L: 1,10-Фенантролин-5,6-дион (234,1 мг, 1,11 ммоль), ацетат аммония (1,77 г, 23,0 ммоль) и 2,5-тиофендикарбоксальдегид (77,9 мг, 0,556 ммоль) смешивали в ледяной уксусной кислоте (20 мл) и кипятили с обратным холодильником на воздухе при 135°C в течение 6 часов. Цвет раствора изменился от светло-желтого до темно-красного и продукт выпал в осадок в виде светло-оранжевого вязкого осадка. Реакционную смесь охладили до комнатной температуры. Оранжевый осадок собирали с применением средне спеченного стеклянного фильтра и промывали Н2О (10 мл). Полученный продукт сушили под вакуумом с получением окончательного чистого продукта в виде светло-оранжевого порошка. Очистки не требовалось (90,7 мг, 31,3%). Rf = полоса к 0,60 (2% H2O, 43% CHCl3, 25% ацетон, 30% MeOH + 1% NH4OH).1H ЯМР (300 МГц) [(CD3)2SO]: 9,07 (d; 4Н; J=3,03 Гц), 8,90 (d; 4Н; J=8,22 Гц), 8,04 (s; 2Н), 7,86-7,90 (br; 4Н). МС (ИЭР+) m/z: 521,1 [M+H]+. МСВР (ИЭР+) m/z для C30H17N8S; расчет. 521,1291; получ. 521,1265.

[00672] Получение 3L: 1,10-Фенантролин-5,6-дион (18,9 мг, 0,0900 ммоль), ацетат аммония (138,7 мг, 1,80 ммоль) и 2,2'-битиофен-5,5'-дикарбальдегид (10 мг, 0,0450 ммоль) смешивали в ледяной уксусной кислоте (5 мл) и кипятили с обратным холодильником на воздухе при 135°C в течение 6 часов. Цвет раствора изменился от светло-желтого до темно-красного и продукт выпал в осадок в виде светло-оранжевого выделившегося порошка. Реакционную смесь охладили до комнатной температуры. Раствор нейтрализовывали путем добавления по каплям водного NH4OH (5 мл) до тех пор, пока более целевой продукт прекратил выпадать в осадок в виде оранжевого твердого вещества. Оранжевый осадок собирали с применением тонко спеченного стеклянного фильтра и промывали H2O (10 мл). Полученный продукт сушили под вакуумом с получением оранжевого порошка, который проявил конечный продукт и примеси по данным ЯМР (12,6 мг, 47%). Альтернативный микроволновой синтез также осуществляли с участием 1,10-фенантролин-5,6-диона (18,9 мг, 0,0900 ммоль), ацетата аммония (138,7 мг, 1,80 ммоль) и 2,2'-битиофен-5,5'-дикарбальдегида (10 мг, 0,0450 ммоль), которые смешивали в ледяной уксусной кислоте (1,0 мл) в микроволновой реакционной камере и проводили реакцию при 300 Вт, 180°C в течение 10 минут. Цвет раствора изменился от светло-желтого до темно-красного и остыл при комнатной температуре. Наблюдали продукт в виде оранжевого осадка. Раствор нейтрализовывали путем добавления по каплям водного NH4OH (1 мл) до тех пор, пока более целевой продукт не прекратил выпадать в осадок в виде оранжевого твердого вещества. Твердое вещество собирали с применением тонко спеченного стеклянного фильтра и промывали H2O (10 мл). Полученный продукт сушили под вакуумом с получением оранжевого порошка, который проявил конечный продукт и примеси по данным ЯМР. (25,3 мг, 93%) Rf = полоса к 0,68 (2% H2O, 43% CHCl3, 25% Ацетон, 30% MeOH + 1% NH4OH).1H ЯМР (300 МГц) [(CD3)2SO]: 9,02 (br), 8,85 (br; 4Н), 7,84 (m; 2Н), 7,70 (br).

[00673] Получение имидазо[4,5-f][1,10]фенантролина (IP): [1,10]фенантролин[5,6]дион (525 мг, 2,5 ммоль) смешивали с формальдегидом (0,243 мл 37% масс/об раствора, 3 ммоль) и ацетат аммония (3,85 г, 50 ммоль) в ледяной уксусной кислоте (8 мл). Реакционную смесь нагревали с обратным холодильником до тех пор, пока весь ключевой компонент реакции не израсходуется и охлаждали до комнатной температуры. Разбавление проводили водой с последующей нейтрализацией NH4OH с получением осадка, который отфильтровали и промывали водой и затем диэтиловым эфиром с получением светло-коричневого твердого вещества (504 мг, 91%).1H ЯМР (300 МГц, ДМСО-d6), δ (ppm): 13,75 (s, 1Н), 9,03 (dd, 2Н, J1=4,3 Гц, J2=1,5 Гц), 8,83 (dd, 2Н, J1=8 Гц, J2=1,5 Гц), 8,47 (d, 1Н), 7,83 (dd, 2Н, J1=8 Hz, J2=4,3 Hz).

[00674] Получение 2-(тиенил)имидазо[4,5-f][1,10]фенантролина (IP-T). 1,10-фенантролин-5,6-дион (42 мг, 0,62 ммоль), ацетат аммония (154 мг, 2,0 ммоль) и 2-тиофенкарбоксальдегид (18,3 мл, 0,20 ммоль) смешивали с ледяной уксусной кислотой (1 мл) в микроволновой реакционной камере и проводили реакцию (300 Вт, 180°C) в течение 10 минут. Темно красный раствор охладили до комнатной температуры и нейтрализовывали путем добавления по каплям водного NH4OH до тех пор, пока продукт не выпал в осадок в виде желтовато-коричневого твердого вещества. Твердое вещество собирали с применением тонко спеченного фритта и промывали Н2О. Полученный продукт сушили под вакуумом с получением желтого порошка (36,2 мг, 60%).

[00675] Получение 2-(2',2''-битиофен)имидазо[4,5-f][1,10]фенантролина (IP-BT). 1,10-фенантролин-5,6-дион (100 мг, 0,48 ммоль), ацетат аммония (740 мг, 9,6 ммоль) и 5-формил-2,2'-битиофен (112, 0,58 ммоль) смешивали с ледяной уксусной кислотой (10 мл) в микроволновой реакционной камере и проводили реакцию (300 Вт, 180°C) в течение 10 минут. Темно-красный раствор охладили до комнатной температуры и нейтрализовывали путем добавления по каплям водного NH4OH до тех пор, пока продукт не выпал в осадок в виде желтого/коричневого твердого вещества. Твердое вещество собирали с применением тонко спеченного стеклянного фритта и промывали Н2О. Полученный продукт сушили под вакуумом с получением оранжево-коричневого твердого вещества (125 мг, 68%).

[00676] Получение Os(biq)2Cl2. K2[OsCl6] (1,23 г, 2,5 ммоль) и 2,1 экв. 2,2'-бихинолила (1,28 г, 5 ммоль) растворили в этиленгликоле (15 мл) и перемешивали при нагревании с обратным холодильником до завершения реакции по данным ТСХ. Восстановление Os3+ до Os2+ осуществляли в насыщенном водном Na2S2O4 (3 мл) с образованием осадка, который отфильтровали и промывали водой и затем диэтиловым эфиром с получением темно-зеленого твердого вещества (1,82 г, 91%).
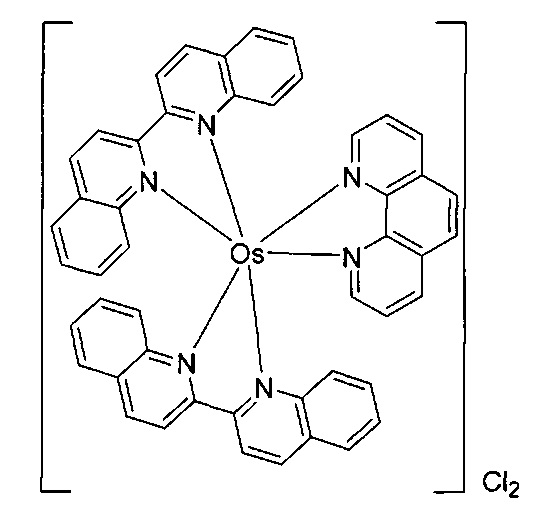
[00677] Получение TLDOsH2B Cl2 и TLDOsH2B 2PF6. Os(biq)2Cl2 (162 мг, 0,2 ммоль) и [1,10]фенантролин моногидрат (48 мг, 0,24 ммоль) смешивали в продутом аргоном этиленгликоле (2,5 мл) и облучали в однокамерном микроволновом реакторе (180°C, 300 Вт) в течение 10 минут. Реакционную смесь охлаждали и разделяли между водой и CH2Cl2. Водную фазу промывали CH2Cl2 для удаления непрореагировавшего лиганда и затем добавляли по каплям водный раствор NH4PF6 до тех пор, когда перестал образовываться осадок. Полученный продукт экстрагировали в CH2Cl2 и концентрировали при пониженном давлении с получением темно-фиолетового твердого вещества (247 мг). Очистка TLDOsH2B 2PF6 проводили на силикагеле, элюированием 7,5-10% H2O:MeCN раствором, содержащим 0,5% KNO3. Фракции, содержащие целевой продукт объединили, выпаривали при пониженном давлении и дополнительно сушили под вакуумом с получением соответствующего комплекса NO3- и избыток KNO3. Для удаления нежелательной соли продукт растворяли в воде с применением ультразвука. Насыщенный водный раствор KPF6 добавляли до тех пор, пока продукт перестал выпадать в осадок. Целевой комплекс PF6- экстрагировали с применением CH2Cl2. Органический слой отделяли, концентрировали при пониженном давлении и сушили под вакуумом с получением конечного чистого продукта в виде темно-фиолетового твердого вещества (105 мг, 45%), который подвергался реакции анионного обмена с образованием соответствующего хлоридного комплекса (87,7 мг, 97% эффективности преобразования) на Amberlite IRA-410.1H ЯМР (300 МГц, CD3CN) δ (ppm): 9,10-8,95 (m, 2Н), 8,90-8,75 (m, 4Н), 8,27-8,15 (m, 4Н), 8,12 (d, J=7,7 Гц, 2H), 7,98 (s, 2Н), 7,86-7,74 (m, 2Н), 7,68 (dq, J=7,8, 4,4, 3,3 Гц, 4H), 7,48 (d, J=4,3 Гц, 2H), 7,26 (d, J=6,4 Гц, 2H), 7,01 (d, J=5,1 Гц, 2H), 6,90 (dd, J=14,7, 6,4 Гц, 4H), 6,79 (d, J=6,6 Гц, 2H). МС (ИЭР+) m/z: 442,1 [М-2PF6]2+, 1027,2 [M-PF6]. МСВР (ИЭР+) m/z для C48H32N6Os; расчет. 442,1146; получ. 442,1132.

[00678] Получение TLDOsH2IP Cl2 и TLDOsH2IP 2PF6: Os(biq)2Cl2 (81 мг, 0,1 ммоль) и имидазо[4,5-f][1,10]фенантролин (22 мг, 0,1 ммоль) смешивали в продутом аргоном этиленгликоле (2,5 мл) и облучали в однокамерном микроволновом реакторе (180°C, 300 Вт) в течение 10 минут. Реакционную смесь охлаждали и разделяли между водой и CH2Cl2. Водную фазу промывали CH2Cl2 для удаления непрореагировавшего лиганда и затем добавляли по каплям водный раствор NH4PF6 до тех пор, когда перестал образовываться осадок. Твердое вещество экстрагировали в CH2Cl2 и концентрировали при пониженном давлении с получением темно-фиолетового твердого вещества TLDOsH2IP 2PF6s (120 мг, 99%) в количественном выходе. Материал применяли без дальнейшей очистки. 100 мг продукта подвергали реакции анионного обмена с образованием соответствующего хлоридного комплекса (61,4 мг, 76% эффективности преобразования) на Amberlite IRA-410.1H ЯМР (300 МГц, CD3CN) δ (ppm) 9,02 (d, J=8,9 Гц, 2Н), 8,83 (d, J=3,6 Гц, 2Н), 8,80 (d, J=3,5 Гц, 2Н), 8,22-8,13 (m, 3H), 8,10 (d, J=8,3 Гц, 2Н), 7,88 (d, J=5,3 Гц, 2Н), 7,84-7,75 (m, 2Н), 7,63 (d, J=7,9 Гц, 2Н), 7,47 (t, J=7,2 Гц, 2Н), 7,22 (t, J=7,2 Гц, 2Н), 7,05-6,95 (m, 2Н), 6,91 (d, J=8,8 Гц, 4Н), 6,80-6,71 (m, 2Н). МС (ИЭР+) m/z: 462,1 [M-2PF6]2+, 1069,2 [M-PF6]. МСВР (ИЭР+) m/z для C49H32N8Os; расчет. 462,1177; получ. 462,1174.

[00679] Получение TLDOs1H Cl2 и TLDOs1H 2PF6. Os(biq)2Cl2 (81 мг, 0,1 ммоль) и 2-(тиенил)имидазо[4,5-f][1,10]фенантролин (30 мг, 0,1 ммоль) смешивали в продутом аргоном этиленгликоле (2,5 мл) и облучали в однокамерном микроволновом реакторе (180°C, 300 Вт) в течение 10 минут. Реакционную смесь охлаждали и разделяли между водой и CH2Cl2. Водную фазу промывали CH2Cl2 для удаления непрореагировавшего лиганда и затем добавляли по каплям водный раствор NH4PF6 до тех пор, когда перестал образовываться осадок. Полученный продукт экстрагировали в CH2Cl2 и концентрировали при пониженном давлении с получением темно-фиолетового твердого вещества (96 мг, 74%). TLDOs1H 2PF6 не требует дальнейшей очистки. Чистый продукт (65 мг) подвергали реакции анионного обмена с образованием соответствующего хлоридного комплекса (47,9 мг, 91% эффективности преобразования) на Amberlite IRA-410.1H ЯМР (300 МГц, CD3CN) δ (ppm): 9,01 (d, J=9,0 Гц, 2H), 8,82 (d, J=9,1 Гц, 4H), 8,51 (s, 2Н), 8,18 (d, J=8,6 Гц, 2H), 8,10 (d, J=8,4 Гц, 2H), 7,88 (d, J=5,3 Гц, 2H), 7,85-7,73 (m, 4Н), 7,64 (d, J=7,6 Гц, 2H), 7,57 (d, J=4,9 Гц, 1H), 7,53-7,44 (m, 2H), 7,29-7,19 (m, 2H), 7,19-7,12 (m, 1H), 7,06-6,96 (m, 3H), 6,91 (d, J=9,2 Гц, 4H), 6,78 (d, J=6,7 Гц, 2H). МС (ИЭР+) m/z: 503,1 [M-2PF6]2+, 1005,2 [M-PF6]. МСВР (ИЭР+) m/z для C53H34N8OsS; расчет. 503,1115; получ. 503,1105.

[00680] Получение TLDOs10H Cl2 и TLDOs10H 2PF6. Os(biq)2Cl2 (81 мг, 0,1 ммоль) и 2-(2',2''-битиофен)имидазо[4,5-f][1,10]фенантролин (38,4 мг, 0,1 ммоль) смешивали в продутом аргоном этиленгликоле (2,5 мл) и облучали в однокамерном микроволновом реакторе (180°C, 300 Вт) в течение 10 минут. Реакционную смесь охлаждали и разделяли между водой и CH2Cl2. Водную фазу промывали CH2Cl2 для удаления непрореагировавшего лиганда и затем добавляли по каплям водный раствор NH4PF6 до тех пор, когда перестал образовываться осадок. Полученный продукт экстрагировали в CH2Cl2 и концентрировали при пониженном давлении с получением темно-фиолетового твердого вещества (135 мг, 98%). TLDOs10H 2PF6 не требует дальнейшей очистки. Чистый продукт (70 мг) подвергали реакции анионного обмена с образованием соответствующего хлоридного комплекса (55.3 мг, 97% эффективности преобразования) на Amberlite IRA-410.1H ЯМР (300 МГц, CD3CN) δ (ppm): 9,01 (d, J=9,0 Гц, 2H), 8,82 (d, J=9,1 Гц, 4Н), 8,51 (s, 2Н), 8,18 (d, J=8,6 Гц, 2Н), 8,10 (d, J=8,4 Гц, 2Н), 7,88 (d, J=5,3 Гц, 2Н), 7,85-7,73 (m, 4Н), 7,64 (d, J=7,6 Гц, 2Н), 7,57 (d, J=4,9 Гц, 1H), 7,53-7,44 (m, 2Н), 7,29-7,19 (m, 2Н), 7,19-7,12 (m, 1H), 7,06-6,96 (m, 3H), 6,91 (d, J=9,2 Гц, 4Н), 6,78 (d, J=6,7 Гц, 2Н). МС (ИЭР+) m/z: 544,1 [M-2PF6]2+. МСВР (ИЭР+) m/z для C57H36N8OsS2; расчет. 544,1054; получ. 544,1046.

[00681] Получение TLDOs14H Cl2 и TLDOs14H 2PF6. Os(biq)2Cl2 (162 мг, 0,2 ммоль) и 2-(2',2'':5'',2'''-тертиофен)-имидазо[4,5-f][1,10]фенантролин (112 мг, 0,24 ммоль) смешивали в продутом аргоном этиленгликоле (2,5 мл) и облучали в однокамерном микроволновом реакторе (180°C, 300 Вт) в течение 10 минут. Реакционную смесь охлаждали и разделяли между водой и CH2Cl2. Водную фазу промывали CH2Cl2 для удаления непрореагировавшего лиганда и затем добавляли по каплям водный раствор NH4PF6 до тех пор, когда перестал образовываться осадок. Полученный продукт экстрагировали в CH2Cl2 и концентрировали при пониженном давлении с получением темно-фиолетового твердого вещества (456 мг). Очистку TLDOs14H PF6 проводили на силикагеле, элюированием с 0-10% H2O:MeCN раствором, содержащим 0,5-2,5% KNO3. Фракции, содержащие целевой продукт, объединяли, выпаривали при пониженном давлении и дополнительно сушили под вакуумом с получением соответствующего комплекса NO3- и избытка KNO3. Для удаления нежелательной соли продукт растворяли в воде с применением ультразвука. Насыщенный раствор KPF6 добавляли до тех пор, пока продукт перестал выпадать в осадок. Целевой комплекс PF6- экстрагировали с применением CH2Cl2. Органический слой отделяли, концентрировали при пониженном давлении и сушили под вакуумом с получением конечного чистого продукта в виде очень темного бурого твердого вещества (84 мг, 29%), который подвергался реакции анионного обмена с образованием соответствующего хлоридного комплекса (68 мг, 99% эффективности преобразования) на Amberlite IRA-410.1H ЯМР (300 МГц, CD3CN-d3) δ 9.01 (d, J=8,8 Гц, 2Н), 8,82 (dd, J=8,7, 2,4 Гц, 4Н), 8,46 (d, J=8,1 Гц, 2Н), 8,19 (d, J=8,8 Гц, 2Н), 8,11 (d, J=8,2 Гц, 2Н), 7,88 (d, J=5,6 Гц, 2Н), 7,85-7,76 (m, 2Н), 7,68-7,60 (m, 3H), 7,48 (t, J=7,4 Гц, 2Н), 7,36 (d, J=5,0 Гц, 1H), 7,31-7,17 (m, 5Н), 7,10-7,02 (m, 1Н), 7,00 (d, J=7,2 Гц, 2Н), 6,93 (d, J=8,5 Гц, 4Н), 6,78 (t, J=7,9 Гц, 2Н). МС (ИЭР+) m/z: 585,1 [M-2PF6]2+. МСВР (ИЭР+) m/z для C61H38N8OsS3; расчет. 585,0993; получ. 585,1012.
СОСТАВЫ
[00682] Настоящее изобретение также относится к композициям или составам, которые содержат соединения согласно настоящему изобретению. В общем, композиции согласно настоящему изобретению содержат эффективное количество одного или более соединений и их солей согласно настоящему изобретению, которые эффективны при проведении фотодинамической терапии; и один или более вспомогательных вещества.
[00683] Для целей настоящего изобретения термин "вспомогательное вещество" и "носитель" используют как взаимозаменяемые по всему описанию настоящего изобретения и указанные термины определены в настоящем описании как «ингредиенты, которые используются в практике разработки рецептур безопасной и эффективной фармацевтической композиции".
[00684] Разработчик рецептур поймет, что вспомогательные вещества применяют в основном для доставки безопасного, стабильного и функционального лекарственного средства, применяемого не только как часть общей несущей среды для доставки, но также и как средство для достижения эффективного всасывания активного ингредиента у реципиента. Вспомогательное вещество может выполнять такую же прямую и простую роль, как если бы оно было инертным наполнителем или вспомогательное вещество, применяемое в настоящем описании, может быть частью pH стабилизирующей системы или покрытия, которое обеспечивает надежную доставку ингредиентов в желудок. Разработчик рецептур может также воспользоваться преимуществом того факта, что соединения согласно настоящему изобретению имеют усовершенствованную клеточную активность, фармакокинетические свойства, а также улучшенную биодоступность при пероральном введении препарата.
[00685] Настоящее описание предлагает фармацевтические композиции, которые включают по меньшей мере одно соединений, описанное в настоящем описании и одно или более фармацевтически приемлемых носителей, вспомогательные вещества или разбавители. Примеры таких носителей хорошо известны специалистам в данной области техники и могут быть получены в соответствии с приемлемыми методиками получения лекарственных средств, такими как, например, описанные в Remington's Pharmaceutical Sciences, 17th edition, ed. Alfonoso R. Gennaro, Mack Publishing Company, Истон, штат Пенсильвания (1985) полное описание которого включено в настоящее описание посредством ссылки во всех. В контексте настоящего описания "фармацевтически приемлемый" относится к веществу, которое приемлемо для применения в фармацевтике с токсикологической точки зрения и не воздействует отрицательно на действующее вещество. Соответственно, фармацевтически приемлемыми носителями являются те, которые совместимы с другими компонентами в составе и are биологически приемлемы. В фармацевтические композиции также могут быть включены дополнительные действующие вещества.
[00686] Соединения согласно настоящему описанию можно вводить перорально или парентерально чистым или в сочетании с обычными фармацевтическими носителями. Подходящие твердые носители могут включать одно или более вещества, который могут также выступать в качестве вкусовых добавок, смазочных веществ, солюбилизаторов, суспендирующих средств, наполнителей, смазывающих веществ, добавок для прессования, связывающих веществ или веществ, улучшающих распадаемость таблеток или инкапсулирующего материала. Соединения настоящего изобретения могут быть приготовлены обычным способом, например, способом, аналогичным тому, который используется для приготовления известных фотодинамических соединений. Пероральные составы, которые содержат соединения согласно настоящему описанию, могут содержать любые традиционно используемые соединения, предназначенные для перорального применения включая таблетки, капсулы, трансбуккальные лекарственные формы, пастилки, таблетки для рассасывания и жидкие лекарственные формы для перорального применения, суспензии или растворы. В порошках носитель может представлять собой тонко измельченное твердое вещество, представляющее собой смесь с тонко измельченным соединением. В таблетках соединение согласно настоящему описанию может быть смешано с носителем, имеющим необходимые компрессионные свойства, в подходящих пропорциях и спрессован в требуемых форме и размере. Порошки и таблетки могут содержать до 99% соединения настоящего изобретения.
[00687] Капсулы могут содержать смеси одного или более соединения(й) согласно настоящему описанию с инертным наполнителем (ми) и/или разбавитель(ли), такие как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный крахмал или крахмал из тапиоки), сахара, искусственные подсластители, порошкообразных целлюлозы (например, кристаллическая и микрокристаллическая целлюлозы), мука, желатины, камеди и т.п.
[00688] Подходящие Составы таблеток можно сделать с помощью обычного прессования, методами мокрой грануляции или сухой грануляции и с использованием фармацевтически приемлемых разбавителей, связывающих веществ, смазывающих веществ, разрыхлителей, веществ, модифицирующих поверхность (включая поверхностно-активные вещества), суспендирующих или стабилизирующих агентов, включая, но не ограничиваясь ими, стеарат магния, стеариновую кислоту, лаурилсульфат натрия, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозы, метилцеллюлозу, микрокристаллическую целлюлозу, натрий карбоксиметил целлюлозу, кальций карбоксиметилцеллюлозу поливинилпирролидон, альгиновую кислоту, камедь акации, ксантановую камедь, цитрат натрия, комплексные силикаты, карбонат кальция, глицин, сахарозу, сорбит, дикальций фосфат, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, низкоплавкие воски и ионообменные смолы. Агенты, модифицирующие поверхность, включают неионные и анионные агенты, модифицирующие поверхность. Характерные примеры агентов, модифицирующих поверхность включают, но не ограничиваясь ими, полоксамер 188, бензалкония хлорид, стеарат кальция, цетостеариловый спирт, цетомакроголевый эмульгированный воск, сложные эфиры сорбита, коллоидный диоксид кремния, фосфаты, лаурилсульфат натрия, алюмосиликат магния и триэтаноламин. Лекарственные формы для перорального применения в настоящем описании могут использовать лекарственные формы со стандартной задержкой или замедленного высвобождения для изменения всасывания соединения(й). Лекарственная рецептура для перорального применения может также состоять из соединения согласно настоящему описанию в воде или фруктовом соке, при необходимости содержащим соответствующие солюбилизаторы или эмульгаторы as needed.
[00689] Жидкие носители можно использовать при приготовлении растворов, суспензий, эмульсий, сиропов, настоек и для ингаляционной доставки. Соединение согласно настоящему описанию можно растворить или суспендировать в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель или их смесь или а фармацевтически приемлемые масла или жиры. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферные растворы, консерванты, подсластители, ароматизаторы, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы и осморегуляторы. Примеры жидких носителей для перорального и парентерального введения включают, но не ограничиваясь ими, воду (в частности, содержащую добавки как описано в настоящем описании, например, производные целлюлозы, такие как раствор натрий карбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например, гликоли) и их производные и масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения, носитель может представлять собой жирный сложный эфир, такой как этил олеат и изопропил миристат. Стерильные жидкие носители применяют в стерильных жидких композициях для парентерального введения. Жидкий носитель для композиций под давлением может представлять собой галогензамещенный углеводород или другие фармацевтически приемлемые пропелленты.
[00690] Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, могут применяться, например, внутримышечно, внутрибрюшинно или подкожно. Стерильные растворы могут также вводить внутривенно. Композиции для перорального приема могут быть либо в жидкой, либо в твердой форме.
[00691] Предпочтительная фармацевтическая композиция представляет собой стандартную лекарственную форму, например, в виде таблеток, капсул, порошков, растворов, суспензий, эмульсий, гранул и суппозиториев. В такой форме, фармацевтическая композиция может быть разделена на стандартную дозу(ы), содержащие соответствующие количества соединения настоящего изобретения. Единичные лекарственные формы могут представлять собой расфасованные композиции, например, упакованные порошки, виалы, ампулы, предварительно заполненные шприцы или саше, содержащие жидкости. Кроме того, единичные лекарственные формы могут представлять собой а капсулы или таблетки или может быть соответствующее количество любых таких композиций в упаковке. Такая единичная лекарственная форма может содержать примерно от 1 мг/кг соединения до примерно 500 мг/кг соединения и может быть представлена как разовая доза или как две или более доз. Такие дозы могут быть введены любым способом, подходящим для введения соединения(й) в кровоток реципиента, в том числе перорально, с помощью имплантатов, парентерально (в том числе внутривенно, внутрибрюшинно и подкожно), ректально, вагинально и трансдермально.
[00692] При введении дозы для лечения или ингибирования конкретного болезненного состояния или расстройства, следует понимать, что эффективная доза может варьироваться в зависимости от конкретного используемого соединения, способа введения и тяжести состояния, подлежащего лечению, а также различных физических факторов, связанных с индивидуумом, проходящим лечение. Для применения в лечебных целях, соединение согласно настоящему описанию может быть обеспечено пациенту, уже страдающему заболеванием в количестве, эффективном для лечения или по меньшей мере частичного улучшения симптомов болезни и ее осложнений. Дозу, которую следует применять при лечении конкретного индивидуума, как правило должен субъективно определять лечащий врач. Участвующие переменные включают специфические условия и их свойства, такие как размер, возраст и модель реакции пациента.
[00693] В некоторых случаях, возможно, что будет желательно вводить соединение непосредственно в дыхательные пути пациента, используя устройства, такие как, но не ограничиваясь ими, дозирующие аэрозольные ингаляторы, управляемые дыханием ингаляторы, многоразовые ингаляторы сухого порошка, помпы, распылительные диспенсеры, приводимые в действие сдавливанием, аэрозольные распылители и аэрозольные ингаляторы. Для введения путем интраназальной или интрабронхиальной ингаляции, одно или более соединения согласно настоящему описанию растворено, частично растворено или суспендировано в одном или более фармацевтически приемлемых растворителях и могут быть введены при помощи, например, а помпы или распылительного диспенсера, приводимого в действие сдавливанием. Растворители могут представлять собой, например, изотонический раствор или бактериостатическую воду. Твердая композиция может представлять собой, в качестве примера, порошкообразный препарат, включающий одно или более соединений согласно настоящему описанию, смешанных с лактозой или другими инертными порошками, которые являются приемлемыми для внутрибронхиального применения и могут быть введены при помощи, например, аэрозольного распылителя или устройства, которое разрушает или прокалывает капсулу, заключающую в себе твердую композицию и переносит твердую композицию для ингаляции. Аэрозольная композиция может включать, в качестве примера, одно или более соединения согласно настоящему описанию, пропелленты, поверхностно-активные вещества и со-растворители и может быть введен при помощи, например, дозирующим устройством. Пропелленты могут представлять собой хлорфторуглерод (ХФУ), а гидрофторалкан (ГФА) или другие пропелленты, которые физиологически и экологически приемлемы.
[00694] Соединения, описанные в настоящем описании, могут быть введены парентерально или внутрибрюшинно. Растворы или суспензии этих соединений или фармацевтически приемлемых солей, гидратов или их сложных эфиров могут быть получены в воде смешением с подходящими поверхностно-активными веществами, такими как гидроксилпропилцеллюлоза. Дисперсии также могут быть получены в глицерине, жидком полиэтиленгликоле и их смесях в маслах. При обычных условиях хранения и применения эти препараты обычно содержат консервант для ингибирования роста микроорганизмов
[00695] Фармацевтические формы, подходящие для введения, могут' включать стерильные водные растворы или дисперсии и стерильные порошки для незапланированного приготовления стерильных инъекционных растворов или дисперсий. В некоторых вариантах реализации фармацевтическая форма может быть стерильной и ее вязкость позволяет ей проходить через шприц. Форма предпочтительно является стабильной при хранения и производстве и может быть защищена от загрязняющего действия микроорганизмов, таких как бактерии, грибов и простейшие. Носитель может представлять собой растворитель или дисперсионную среду содержащую, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительные масла.
[00696] Соединения согласно настоящему описанию могут быть введены трансдермально, то есть введены через поверхность тела и внутренние выстилки телесных путей, включая эпителиальные и слизистые ткани. Такое введение можно проводить с применением соединений согласно настоящему описанию, включая их фармацевтически приемлемые соли, гидраты или сложные эфиры, в виде лосьонов, крем, пен, пластырей, суспензий, растворов и суппозиторий (ректальных и вагинальных).
[00697] Трансдермальное введение может быть осуществлено посредством использования трансдермального пластыря, содержащего соединение, такое как соединение согласно настоящему описанию, и носитель, который может быть инертен к соединению, может быть нетоксичным для кожи и может допускать доставку соединения для системного всасывания в кровоток через кожу. Носитель может принять любое количество форм, таких как кремы и мази, пасты, гели и окклюзирующие устройства. Кремы и мази могут представлять собой вязкие жидкости или полутвердые эмульсии либо типа масло-в-воде либо типа вода-в-масле. Пасты, содержащие абсорбирующие порошки, диспергированные в нефти или гидрофильной нефти, содержащей соединение настоящего изобретения, также могут быть подходящими. Разнообразные окклюзирующие устройства могут быть использованы для выделения соединения в кровоток, такие как полупроницаемая мембрана, покрывающая резервуар, содержащий соединение с или без носителя или матрицу, содержащую соединение. В литературе известны и другие окклюзирующие устройства.
[00698] Соединения согласно настоящему описанию могут быть введены ректально или вагинально в форме обычного суппозитория. Суппозитории могут быть изготовлены из традиционных материалов, включая масло какао, с или без добавления восков для изменения температуры размягчения суппозитория и глицерин. Также могут быть использованы суппозитории на водорастворимых основаниях, таких как полиэтиленгликоли различных молекулярных весов.
[00699] Липидные составы или нанокапсулы могут быть использованы для введения соединений согласно настоящему описанию в клетки-хозяева либо in vitro либо in vivo. Липидные составы и нанокапсулы могут быть получены способами, известными в данной области техники.
[00700] Для повышения эффективности соединений согласно настоящему описанию желательно сочетать соединение с другими эффективными в лечении целевой болезни агентами. Например, другие активные соединения (то есть, другие действующие ингредиенты или агенты), эффективные в лечении целевой болезни, могут быть введены с соединениями согласно настоящему описанию. Другие агенты могут быть введены в тот же момент, что и соединения, описанные в настоящем описании или в другой момент времени.
[00701] Соединения согласно настоящему описанию могут быть подходящими для лечения или ингибирования патологического состояния или заболевания у млекопитающего, например, у обследуемого человека. Настоящее описание, соответственно, предлагает способы лечения или ингибирования патологического состояния или заболевания предоставляя млекопитающему соединение согласно настоящему описанию, включающее фармацевтически приемлемую соль или фармацевтическую композицию, которая включает одно или более соединение согласно настоящему описанию в комбинации или ассоциации с фармацевтически приемлемыми носителями Соединения согласно настоящему описанию можно вводить отдельно или в сочетании с другими терапевтически эффективными соединениями или терапией для лечения или подавления патологического состояния или заболевания.
[00702] Неограничивающие примеры композиций согласно настоящему изобретению включают примерно от 0,001 мг до примерно 1000 мг одного или более соединений согласно настоящему изобретению и одно или более вспомогательных веществ; примерно от 0,01 мг до примерно 100 мг одного или более соединений согласий настоящему изобретению и одно или более вспомогательных веществ; и примерно от 0,1 мг до примерно 10 мг одного или более соединений согласно настоящему изобретению; и одно или более вспомогательных веществ.
МЕТОДИКИ
[00703] Для оценки и выбора соединений в качестве фотодинамических соединений могут быть применены следующие методики.
[00704] Способ определения влияния интенсивности потока света на эффект ФДТ соединениями согласно настоящему описанию:
[00705] Клеточная линия была приобретена в АТСС (Манассас, Вирджиния): U87MG (U87, #HTB-14). Профили коротких тандемных повторов (STR) для всех клеточных линий были верифицированы. Клетки культивировали в среде DMEM с 10% фетальной бычьей сыворотки (FBS) и 1% пенициллина (5000 единиц⋅мл-1) и стрептомицина (5000 мкл⋅мл-1) (все производства Gibco, Invitrogen, Калифорния, США) в культуральных флаконах с поверхностью роста клеток 75 см2 и выдерживали при 37°C в 5% CO2. Клетки пересевали при 80% конфлюэнтности, полную замену среды осуществляли каждые 2-3 дня. Клетки использовали между 6 и 27 пассажами.
[00706] За 24 часа до экспериментов в дублированные 96-луночные планшеты (Falcon, Invitrogen, Калифорния, США) высевали по 15000 клеток на лунку с использованием 200 мкл клеточной суспензии на лунку. На следующий день культуральную среду заменяли средой с TLDOs14H Cl2 в различных концентрациях. Через 4-6 часов после добавления ФС несвязанный ФС удаляли путем полной замены культуральной среды на свежую среду без пирувата натрия с последующим облучением светом в ходе ФДТ.
[00707] Облучение всего 96-луночного планшета проводили с помощью лазерного источника (В & W Tek Inc., Ньюарк, Делавер, США), излучающего на длине волны 808±25 нм. Дозы облучения 90-600 Дж⋅см-2 достигали при плотности потока энергии 0,120-0,190 мВт⋅см-2. В охлаждении необходимости не было.
[00708] Жизнеспособность клеток измеряли в дублированных 96-луночных планшетах через 24 часа после облучения с помощью метода анализа Presto Blue Cell Viability assay (Invitrogen, Калифорния, США) в соответствии с протоколом производителя по показаниям прибора SpectroMax М5 (Molecular Devices, Саннивейл, Калифорния, США). Приведенные в качестве примера результаты представлены на фигуре 3, на которой с использованием TLDOs14HCl2 в качестве репрезентативного случая продемонстрировано, что фотодинамический эффект может быть усилен за счет увеличения дозы света.
[00709] Способ определения фотостабильности соединений согласно настоящему описанию.
[00710] Для измерения фотостабильности соединения согласно настоящему описанию растворяли в дистиллированной деионизированной воде (с использованием концентрированного исходного раствора, приготовленного в ДМСО). ФС облучали при 78 мВт⋅см-2 в общей сложности в течение 60 минут с использованием зеленого светодиодного источника света (525 нм, 78 мВт⋅см-2). Каждые 5 минут измеряли оптическую плотность при 670 нм или 808 нм, и наносили ее на график в зависимости от поглощенных фотонов. Приведенные в качестве примера результаты для TLDOs14H Cl2, показаны на фигуре 4 и демонстрируют высокую фотостабильность соединений согласно настоящему описанию.
[00711] Способ определения стабильности соединений согласно настоящему описанию в условиях фотообесцвечивания:
[00712] Клеточная линия была приобретена в АТСС (Манассас, Вирджиния): U87MG (U87, #НТВ-14). Профили коротких тандемных повторов (STR) для всех клеточных линий были верифицированы. Клетки культивировали в среде DMEM с 10% фетальной бычьей сыворотки и 1% пенициллина (5000 единиц⋅мл-1) и стрептомицина (5000 мкл⋅мл-1) (все производства Gibco, Invitrogen, Калифорния, США) в культуральных флаконах с поверхностью роста клеток 75 см2 и выдерживали при 37°C в 5% CO2. Клетки пересевали при 80% конфлюэнтности, полную замену среды осуществляли каждые 2-3 дня. Клетки использовали между 6 и 27 пассажами.
[00713] За 24 часа до экспериментов в дублированные 96-луночные планшеты (Falcon, Invitrogen, Калифорния, США) высевали по 15000 клеток на лунку с использованием 200 мкл клеточной суспензии на лунку. На следующий день культуральную среду заменяли средой с соединениями согласно настоящему описанию в различных концентрациях. Через 4-6 часов после добавления ФС несвязанный ФС удаляли путем полной замены культуральной среды на свежую среду без пирувата натрия с последующим облучением светом в ходе ФДТ.
[00714] Облучение всего 96-луночного планшета проводили с помощью лазерного источника (В & W Tek Inc., Ньюарк, Делавер, США), излучающего на длине волны 808±25 нм. Дозы облучения 400-600 Дж⋅см-2 достигали при плотности потока энергии 0,120-0,190 мВт⋅см-2. В охлаждении необходимости не было.
[00715] Жизнеспособность клеток измеряли в дублированных 96-луночных планшетах через 24 часа после облучения с помощью метода анализа Presto Blue Cell Viability assay (Invitrogen, Калифорния, США) в соответствии с протоколом производителя по показаниям прибора SpectroMax М5 (Molecular Devices, Саннивейл, Калифорния, США). Приведенные в качестве примера результаты для TLDOs14H Cl2 представлены на фигуре 5 и демонстрируют, что соединения согласно настоящему описанию устойчивы при фотоотбеливающих условиях.
[00716] Способ определения влияния соединений согласно настоящему описанию in vitro при нормоксических и гипоксических условиях.
[00717] Клеточную линию приобрели в АТСС (Манассас, Вирджиния): U87MG (U87, #HTB-14). Профили коротких тандемных повторов (STR) для всех клеточных линий были верифицированы. Клетки культивировали в среде DMEM с 10% фетальной бычьей сыворотки и 1% пенициллина (5000 единиц-мл-1) и стрептомицина (5000 мкл⋅мл-1) (все производства Gibco, Invitrogen, Калифорния, США) в культуральных флаконах с поверхностью роста клеток 75 см2 и выдерживали при 37°C в 5% CO2. Клетки пересевали при 80% конфлюэнтности, полную замену среды осуществляли каждые 2-3 дня. Клетки использовали между 6 и 27 пассажами.
[00718] За 24 часа до экспериментов в дублированные 96-луночные планшеты (Falcon, Invitrogen, Калифорния, США) высевали по 15000 клеток на лунку с использованием 200 мкл клеточной суспензии на лунку. На следующий день культуральную среду заменяли средой с соединениями согласно настоящему описанию в различных концентрациях. Через 4-6 часов после добавления ФС несвязанный ФС удаляли путем полной замены культуральной среды на свежую среду без пирувата натрия с последующим облучением светом в ходе ФДТ.
[00719] Облучение всего 96-луночного планшета проводили с помощью массива красных светодиодов в качестве источника света, излучающего на длине волны в 635±25 нм, предоставленного Theralase Inc. (Торонто, Онтарио, Канада). Дозы облучения 90 Дж⋅см-2 достигали при плотности потока энергии 125 мВт⋅см-2. Плотность потока энергии была однородной в пределах 12% во всех лунках. Активное охлаждение воздуха удерживало средний рост температуры культуры ткани на уровне на 3°C ниже температуры окружающей среды.
[00720] Для гипоксических экспериментов все используемые растворы держали в гипоксических условиях в течение по меньшей мере 24 часов до эксперимента. Для облегчения прикрепления 96-луночные планшеты, содержащие клетки, переносили в гипоксическую камеру (InvivO2 400 Ruskinn Technology Ltd., UK) через 4 часа после посева в нормоксических условиях. Планшеты оставались в гипоксических условиях в течение 24 часов перед облучением светом в ходе ФТД. Гипоксическая камера имела атмосферу из 0,5% O2, 5% CO2 с N2 в качестве баланса при 37°C и 95% влажности. Как и в нормоксических условиях среду с ФС добавляли, а затем заменяли свежей средой через 4-6 часов после добавления фотосенсибилизатора. Клетки держали при 0,1% O2 в течение 2 часов для дальнейшего снижения количества доступного кислорода в экспериментальной лунке. Время диффузии кислорода через ~3 мм столб жидкости гораздо меньше времени экспозиции, составляющего ~7 мин, а значит, реоксигенацию из внешней среды необходимо ограничивать без ущерба для ФДТ-независимой жизнеспособности клеток. После облучения клетки держали при 0,5% O2 в течение 24 часов до проведения измерений жизнеспособности клеток. Для всех процессов, проводимых при нормальных условиях окружающей среды (облучение светом, измерение гибели клеток), планшеты, содержащие клетки, были герметично запечатаны кислородонепроницаемой адгезивной (Evergreen Scientific, США). При возвращении планшетов в гипоксические условия герметизацию удаляли, и заменяли крышки планшета. Это не меняло pO2 в экспериментальных лунках, что было проверено посредством колориметрического анализа (Suflita, J. and Concannon, F.,1995).
[00721] Жизнеспособность клеток измеряли в дублированных 96-луночных планшетах через 24 часа после облучения с помощью метода анализа Presto Blue Cell Viability assay (Invitrogen, Калифорния, США) в соответствии с протоколом производителя по показаниям прибора SpectroMax М5 (Molecular Devices, Саннивейл, Калифорния, США). Приведенные в качестве примера результаты представлены на фигуре 6, на которой показано, что эти соединения способны убивать клетки со световой активацией в концентрациях, при которых темновая токсичность незначительна. На ней также показано, что некоторые из этих соединений проявляют фотодинамический эффект даже при гипоксии, что сигнализирует о фотоактивности типа 1 в некоторых иллюстративных примерах.
[00722] Способ для продукции активных форм кислорода соединениями согласно настоящему описанию:
[00723] Клеточная линия была приобретена в АТСС (Манассас, Вирджиния): U87MG (U87, #HTB-14). Профили коротких тандемных повторов (STR) для всех клеточных линий были верифицированы. Клетки культивировали в среде DMEM с 10% фетальной бычьей сыворотки и 1% пенициллина (5000 единиц⋅мл-1) и стрептомицина (5000 мкл⋅см-1) (все производства Gibco, Invitrogen, Калифорния, США) в культуральных флаконах с поверхностью роста клеток 75 см2 и выдерживали при 37°C в 5% CO2. Клетки пересевали при 80% конфлюэнтности, полную замену среды осуществляли каждые 2-3 дня. Клетки использовали между 6 и 27 пассажами.
[00724] За 24 часа до экспериментов в дублированные 96-луночные планшеты (Falcon, Invitrogen, Калифорния, США) высевали по 15000 клеток на лунку с использованием 200 мкл клеточной суспензии на лунку. На следующий день культуральную среду заменяли средой с TLDOs14H Cl2 в различных концентрациях. Через 4-6 часов после добавления ФС несвязанный ФС удаляли путем полной замены культуральной среды на свежую среду без пирувата натрия с последующим облучением светом в ходе ФДТ.
[00725] Облучение всего 96-луночного планшета проводили с помощью массива красных светодиодов в качестве источника света, излучающего на длине волны в 635±25 нм, предоставленного Theralase Inc. (Торонто, Онтарио, Канада). Дозы облучения 90 Дж⋅см-2 достигали при плотности потока энергии 125 мВт⋅см-2. Плотность потока энергии была однородной в пределах 12% во всех лунках. Активное охлаждение воздуха удерживало средний рост температуры культуры ткани на уровне на 3°C ниже температуры окружающей среды.
[00726] Для выявления вклада гидроксильного радикала и синглетного кислорода в воздействие ФДТ к клеткам добавляли ФС в присутствии либо N,N'-диметилтиомочевины (DMTU) (40 мМ), акцептора гидроксильных радикалов, либо азида натрия (2 мМ), скавенджера синглетного кислорода. Перед ФДТ, после удаления ФС, свежеприготовленные растворы скавенджеров добавляли к клеткам; их удаляли и заменяли свежей средой после ФДТ.
[00727] Жизнеспособность клеток измеряли в дублированных 96-луночных планшетах через 24 часа после облучения с помощью метода анализа Presto Blue Cell Viability assay (Invitrogen, Калифорния, США) в соответствии с протоколом производителя по показаниям прибора SpectroMax М5 (Molecular Devices, Саннивейл, Калифорния, США). Приведенные в качестве примера результаты представлены на фигурах 7 и 12, на которых показано, что TLDOsh2IP Cl2 и TLDOsh2B Cl2 продуцируют активные формы кислорода.
[00728] В случае осуществления TLDOsH2B-опосредованной ФДТ в присутствии скавенджеров гидроксильного радикала влияние ФДТ практически нивелировалось, что предполагает, что это соединение демонстрирует фотоактивность типа 1 в этих раковых клетках. Это предположение дополнительно подкреплено наблюдениями, что акцептор синглетного кислорода (посредник типа 2) не снижает влияния ФДТ в какой-либо значительной степени. Таким образом, гидроксильные радикалы могут играть ключевую роль в ряде биологических явлений, приписываемых этому классу агентов, включая: фотосвязывание с ДНК и другими биомолекулами, активность нуклеаз, фоторасщепление ДНК и цитотоксические фоторедокс-пути.
[00729] Количественное определение ФДТ in vitro в отношении раковых клеток соединениями согласно настоящему изобретению.
[00730] Клетки промиелоцитарного лейкоза человека HL-60 (АТСС CCL-240), находящиеся в логарифмической фазе роста, переносили аликвотами по 50 мкл (приблизительно 40000 клеток) в два 96-луночных микропланшета для культур тканей (Corning Costar, Acton, MA), содержащих 25 мкл теплой культуральной среды (среда RPMI-1640, дополненная 20% FBS), и переносили в инкубатор (37°C, 5% CO2) с водяной рубашкой (Thermo Electron Corp., Forma Series II, Model 3110, HEPA Class 100) для достижения равновесия. Теплые аликвоты по 25 мкл серийно разведенных соединений согласно настоящему описанию, свежеприготовленные в фосфатно-солевом буфере (PBS) (2,68 мМ хлорида калия, 1,47 мМ одноосновного фосфата калия, 0,137 М хлорида натрия и 8,10 мМ двухосновного фосфата натрия, pH 7,4), добавляли к клеткам и инкубировали при 37°C в атмосфере 5% CO2 в течение 15-19 ч. Один из микропланшетов облучали видимым светом (400-700 нм) с помощью проектора 190 Вт (BenQ MS510) в течение 1 ч (0,0278 мВт⋅см-2⋅с-1, общая доза излучения составляла 100 Дж⋅см-2), в то время как другой микропланшет держали в темноте. Оба микропланшета затем инкубировали (37°C в атмосфере 5% CO2) приблизительно в течение 48 ч. Пролиферацию и жизнеспособность клеток определяли с помощью редокс-индикатора Alamar Blue, действие которого основано на способности метаболически активных клеток превращать данный реагент во флуоресцентный индикатор. Вкратце, теплые аликвоты по 10 мкл теплого индикатора Alamar Blue (Life Technologies DAL 1025) добавляли ко всем лункам с образцами и инкубировали микропланшеты в течение 15-16 ч при 37°C в атмосфере 5% CO2. Микропланшеты помещали во флуоресцентный микропланшетный ридер Cytofluor 4000 с фильтром возбуждения, установленным на 530±25 нм, и фильтром эмиссии, установленным на 620±4 нм. После этого данные импортировали в электронную таблицу Microsoft Excel (Microsoft Office 2010) и использовали для анализа. Иллюстративные результаты приведены на фигуре 14, на которой показано, что белый свет широкого спектра может быть использован в дополнение к свету с узким диапазоном длин волн для разрушения клеток млекопитающих с помощью фотодинамического эффекта, и эта активность приводит к устранению микробных клеток, таких как бактерии, грибы, простейшие, и вирусов.
[00731] Фото динамическая инактивация (ФДИ) устойчивого к метициллину S. aureus (MRSA), опосредованная фотосенсибилизаторами TLDOsH2IP Cl2 и TLDOsH2B Cl2
[00732] Культуры выращивали в течение ночи в Колумбийском бульоне (Columbia broth). Бактериальные аликвоты для сравнения готовили путем разведения культивированной в течение ночи культуры свежей средой до оптической плотности 0,3 при длине волны 600 нм, что эквивалентно 108 КОЕ/мл. 2 мМ исходный раствор ФС готовили в высокоочищенной воде (MilliQ, 18,5 мОМ) и серийные разведения готовили в условиях низкой освещенности до достижения финальных концентраций в диапазоне от 409,6 до 0,4 мкМ. Бактериальные аликвоты добавляли в 96-луночный планшет (по 60 мкл на лунку) с последующим добавлением 60 мкл среды, содержащей соответствующее разведение ФС, включая контрольные образцы для каждого штамма SA без ФС. Планшеты готовили в двух экземплярах, таким образом, один из них использовали в качестве темнового контроля и инкубировали в течение 30 минут с ФС в темноте при 37°C. Другой идентичный планшет подвергали воздействию красным светом (общая доза облучения 72 Дж⋅см-2) в течение 10 минут. Количественное определение бактериальных частиц производили путем подсчета вручную; аликвоты по 30 мкл, разведенные в PBS, помещали на чашки с Колумбийским агаром и подсчитывали колонии через 24 часа инкубации при 37°C. Приведенные в качестве примера результаты приведены на фигуре 15, на которой показано, что соединения согласно настоящему описанию способны уничтожать инфекционные агенты, в частности, бактерии и устойчивые к антибиотикам бактерии.
[00733] Фотодинамическая инактивация Klebsiella pneumoniae (Kp) соединениями согласно настоящему описанию:
[00734] Культуры выращивали в течение ночи в Колумбийском бульоне (Columbia broth). Бактериальные аликвоты для сравнения готовили путем разведения культивированной в течение ночи культуры свежей средой до оптической плотности 0,3 при длине волны 600 нм, что эквивалентно 108 КОЕ/мл. 2 мМ исходный раствор ФС готовили в высокоочищенной воде (MilliQ, 18,5 мОМ) и серийные разведения готовили в условиях низкой освещенности до достижения финальных концентраций в диапазоне от 500 до 6,4 мкМ. Бактериальные аликвоты добавляли в 96-луночный планшет (по 40 мкл на лунку) с последующим добавлением 40 мкл среды, содержащей соответствующее разведение ФС, включая контрольные образцы. Планшеты готовили в двух экземплярах, таким образом, один из них использовали в качестве темнового контроля и инкубировали в течение 30 минут с ФС в темноте при 37°C. Другой планшет с идентичными концентрациями ФС и бактерий подвергали воздействию света в течение 10 минут с помощью источника зеленого (530 нм) света (общая доза облучения 66 Дж⋅см-2). Количественное определение бактериальных частиц производили путем подсчета вручную; аликвоты по 10 мкл, разведенные в PBS, помещали на чашки с Колумбийским агаром и подсчитывали колонии через 24 часа инкубации при 37°C. Приведенные в качестве примера результаты приведены на фигуре 17, на которой показано, что соединения согласно настоящему описанию способны уничтожать Klebsiella pneumonia.
[00735] Моделирование in vivo на мышах:
[00736] Все эксперименты на животных проводили в соответствии с протоколами, утвержденными Комитетом по уходу за животными Университета Сети Здравоохранения (Animal Care Committee at the University Health Network), Онтарио, Канада (дата утверждения IACUC 08/03/2012, гарантийный номер А5408-01). Все животные были размещены в виварии с неограниченным доступом к воде и пище при 12-часовом цикле день/ночь. Клеточную линию приобрели в АТСС (Манассас, Верджиния); СТ26 дикого типа (CT26.WT, #CRL-2638). Профили коротких тандемных повторов (STR) для всех клеточных линий были верифицированы Клетки культивировали в среде RPMI 1640 Клетки культивировали в среде DMEM с 10% фетальной бычьей сыворотки и 1% пенициллина (5000 единиц/мл) и стрептомицина (5000 единиц/мкл) (все производства Gibco, Invitrogen, Калифорния, США) в культуральных флаконах с поверхностью роста клеток 75 см2 и выдерживали при 37°C в 5% CO2. Клетки пересевали при 80% конфлюэнтности, полную замену среды осуществляли каждые 2-3 дня. Клетки использовали между 6 и 27 пассажами. Дли инъекций клеток карциномы толстого кишечника мыши CT26.WT мышей линии BALB/c в возрасте 8-10 недель анестезировали изофлуораном (индукция 5%, поддержание 1,5%) и брили одну заднюю ногу. Мышам подкожно вводили от 3 до 3,5×106 клеток каждой в 100 мкл PBS в дорзальную поверхность ноги в течение 30 секунд. Размер опухоли измеряли вручную в двух измерениях калипером Вернье каждые 2-3 дня. Когда размер опухоли достигал 5-6 мм, внутриопухолево (ВО) вводили 3 мг/кг соединений согласно настоящему описанию из расчета 100 мкл на массу тела в 20 г. Контрольным мышам ВО вводили стерильный физиологический раствор. Через 4 часа опухоли облучали, в то время как мыши были под анестезией изофлуораном. Приведенные в качестве примера результаты приведены на фигурах 8, 9 и 10, на которых показано, что соединения согласно настоящему изобретению способны уничтожать опухоли у мышей при активации УФ-ИК светом.
[00737] Соединения согласно настоящему описанию способны увеличивать продлевать срок жизни прошедших ФДТ мышей с раком.
[00738] Все эксперименты на животных проводили в соответствии с протоколами, утвержденными Комитетом по уходу за животными Университета Сети Здравоохранения, (Animal Care Committee at the University Health Network) Онтарио, Канада (дата утверждения IACUC 08/03/2012 гарантийный номер А5408-01). Все животные были размещены в виварии с неограниченным доступом к воде и пище в 12-часовом цикле день/ночь. Дли инъекций клеток карциномы толстого кишечника мыши иммуногенетического типа CT26.CL25 мышей линии BALB/c в возрасте 8-10 недель анестезировали изофлуораном (индукция 5%, поддержание 1,5%) и брили одну заднюю ногу. Мышам подкожно вводили 2,5×106 клеток каждой в 100 мкл PBS в дорзальную поверхность ноги в течение 30 секунд. Размер опухоли измеряли вручную в двух измерениях калипером Вернье каждые 2-3 дня. Когда размер опухоли достигал 5-6 мм, внутриопухолево (ВО) вводили Os2IP из расчета 100 мкл на массу тела в 20 г. Контрольным мышам ВО вводили стерильный физиологический раствор. Через 4 часа опухоли облучали, в то время как мыши были под анестезией изофлуораном, подаваемом в стерильном физиологическом растворе. Через 4 часа опухоли облучали красным светом (635 нм), в то время как мыши были под анестезией изофлуораном. Приведенные в качестве примера результаты для соединений согласно настоящему описанию представлены на фигуре 16, на которой показано увеличение срока жизни в условиях эксперимента.
[00739] Лечение ФДТ предотвращает у мышей повторный рост опухолей клетками CT26.CL25 (антигенными).
[00740] В 0 день мышей с подкожной опухолью 6 мм подвергали лечению посредством ФДТ с TLDOsH2IP Cl2; на 1 день опухоль не была выявлена ни в ходе клинической оценке, ни в ходе измерений калипером. На 20 день тем же животным без опухолей повторно вводили клетки CT26.CL25 (антигенные), которые экспрессируют опухолевый антиген. На 21 день и в последующий период (>4 дней) наблюдение показывает, что прошедшие ФДТ мыши вылечены и являются устойчивыми к повторному заражению. Противоопухолевые эффекты ФДТ были полностью отменены у непрошедших терапию животных, и у всех мышей на 4 день сообщают о росте опухоли.
[00741] Выделение топоизомеразы II из клеток HL60
[00742] Экстракты ядер афинно осаждали, как описано в руководстве 'Small Scale Preparation of Торо I and II Extracts from Tissue Culture Cells (Optimized for HeLa Cells)' на сайте компании TopoGEN (http:www.topogen.com/html/extracts.html). Все операции проводили на льду при 4°C. Вкратце, 10 мл клеток HL-60 в экспоненциальной фазе роста (1×106 клеток/мл) переносили в стерильную 15 мл коническую центрифужную пробирку (Fisher Scientific, Канада) и осаждали в центрифуге Eppendorf 5804R (радиус 16,1 см) на скорости 2100 об/мин в течение 3 мин при 4°C. Клетки отмывали 3 мл ледяного фосфатно-солевого буферного раствора, содержащего 2,68 мМ хлорида калия, 1,47 мМ одноосновного фосфата калия, 0,137 М хлорида натрия и 8,10 мМ двухосновного фосфата натрия, pH 7,4, следующим образом: клеточный осадок ресуспендировали в PBS-буфере (перемешивали пипетированием), центрифугировали на скорости 2100 об/мин (3 мин, 4°C) и осторожно отбирали супернатант.После второй отмывки клетки ресуспендировали в 3 мл холодного гипотонического буфера (10 мМ трис-HCl, pH 7,5, 1 мМ EDTA, 4 мМ MgCl2, 0,5 мМ фенилметилсульфонилфторида (PMSF)) и сгустки разбивали пипетированием. Клетки снова осаждали (2100 об/мин, 3 мин, 4°C), ресуспендировали и диспергировали в 3 мл того же холодного гипотонического буфера и оставляли на льду в течение 10 мин для набухания. Клеточные мембраны разрушали с помощью холодного гомогенизатора Даунса (Pyrex, 15 мл), совершая 6-8 ходов поршня. Лизаты переносили в чистую стерильную микроцентрифужную пробирку вместимостью 1,5 мл (Fisher Scientific, Канада) и центрифугировали (2900 об/мин, 10 мин, 4°C). Осадок, содержащий ядра, дважды отмывали тем же холодным гипотоническим буфером следующим образом: холодный буфер добавляли к осадку и ресуспендировали ядра пипетированием, затем осаждали (2900 об/мин, 10 мин, 4°C), супернатант осторожно удаляли и выбрасывали. После второй отмывки ядра ресуспендировали в объеме холодного гипотонического буфера без MgCl2, равном 4 объемам осадка (приблизительно 500 мкл). Равный объем холодного 1 М NaCl добавляли к ресуспендированному осадку и оставили на льду на 45 мин, после чего осаждали в микроцентрифуге (14000 об/мин, 15 мин, 4°C). Супернатант (ядерный экстракт), суспендированный в 5 мМ трис-HCl (pH 7,5), 0,5 мМ EDTA, 0,25 мМ PMSF, и 0,5 М NaCl, использовали для анализа релаксации ДНК.
[00743] Общую концентрацию белка (эквивалент бычьего сывороточного альбумина (БСА)) в экстракте определяли с помощью набора для определения общего белка Микро-Лоури (набор для определения общего белка, Микро-Лоури, модификация Петеросона), следуя инструкциям производителя для 'Определения белка без преципитации белка'. Вкратце, пять белковых стандартов из BSA приготовили из исходного раствора с концентрацией 400 мкг/мл в чистой воде объемом 200 мкл в стерильных микроцентрифужных пробирках вместимостью 1,5 мл (конечные концентрации BSA составляли 10, 20, 40, 60, 80 мкг). Шестую пробирку, содержащую чистую воду использовали в качестве контрольного образца (blank). Седьмую пробирку, содержащую 50 мкл ядерного экстракта и 150 мкл (разведение выбрано случайным образом), готовили для измерения содержания в ней белка относительно стандартов BSA. Содержимое всех пробирок тщательно перемешивали встряхиванием, затем во все пробирки добавляли 200 мкл раствора реагента Лоури с последующим перемешиванием встряхиванием. Растворы находились при комнатной температуре в течение 20 мин, затем в каждую пробирку добавляли по 100 мкл фенольного реагента Folin Ciocalteu (6х разведение 2 н. исходного раствора) с последующим перемешиванием встряхиванием. Растворы оставляли на 30 мин для проявления окраски. Растворы по одному за раз переносили в кварцевую кювету с длиной оптического пути 1 см и измеряли поглощение стандартов и содержимого пробирок с образцами в сравнении с пустым образцом на длине волны 750 нм. Был построен график (Excel, 2007) значений поглощения стандартов в сравнении с их соответствующей концентрацией белка, и для расчета содержания белка в образце ядерного экстракта использовали линейную регрессию, принимая во внимание 10х разведение. В результате была получена концентрация белка ядерного экстракта в 599 мкг/мл или 279 мкг (BSA эквиваленты).
[00744] Активность экстракта топоизомеразы в анализе релаксации ДНК:
[00745] Релаксационную активность ядерного экстракта, содержащего топоизомеразу I и II, определяли путем детектирования превращения суперспирализованной плазмидной ДНК в ее релаксированную форму в присутствии АТФ. Смесь в реакционных пробирках (объемом 20 мкл) собирали на льду путем последовательного добавления: (i) чистой воды (различное количество, добавляли до объема 20 мкл); (ii) 4 мкл релаксационного буфера (250 мМ трис-HCl, pH 8, 0,75 М NaCl, 50 мМ MgCl2, 2,5 мМ дитиотреитола, 150 мкг БСА/мл и 10 мМ АТФ); (iii) pUC19 суперспирализованной плазмидной ДНК (250 нг или 38,6 мкМ оснований); и (iv) экстракта топоизомеразы (1, 2, 3 или 4 мкл). Реакцию инициировали нагреванием пробирок в инкубаторе при 37°C в течение 30 мин. Реакцию останавливали добавлением 2 мкл раствора 10% SDS (в стерильной воде) и затем ДНК-связанный белок гидролизовали добавлением 2 мкл протеиназы K (исходный раствор с концентрацией 0,50 мг/мл в 10 мМ трис-HCl, 1 мМ EDTA, pH 7,5) и инкубировали при 37°C в течение 15 мин. Затем добавляли 2 мкл загрузочного красителя с фиколлом (0,25% бромфенолового синего, 15% фиколла в 1х ТВЕ-буфера) и затем анализировали образцы ДНК путем электрофореза в 1,5% агарозном геле с использованием 1х ТВЕ-буфера (50 B, 180 мин). Гели окрашивали бромидом этидия (1 мг/мл) в течение 30 мин с последующей отмывкой от красителя в воде и визуализировали УФ-трансиллюминацией (трансиллюминатор UVP) с помощью системы визуализации Gel-Doc-It Imaging system (UVP). Одну единицу активности топоизомеразы II ДНК определили как количество фермента, способного релаксировать 250 нг суперспирализованной ДНК за 30 мин при 37°C (в данном случае одна единица = 2 мкл экстракта). Наличие топо I оценивали путем тестирования на релаксацию плазмиды UC19 (250 нг) в отсутствие АТФ за 30 мин при 37°C. В этих условиях релаксацию плазмиды pUC19 не было обнаружено (указывает на активность топоизомеразы I от низкой до отсутствующей).
[00746] Анализы топоизомеразы II:
[00747] Ингибирование активности топоизомеразы II соединениями согласно настоящему описанию измеряли путем анализа релаксации суперспирализованной ДНК с помощью набора лекарственного скрининга топоизомеразы II (TopoGEN). Вкратце, 0,23 мкг суперспирализованной ДНК плазмиды pUC19 (3,5 мкл 64,5 нг/мкл исходного раствора 10 мМ трис-Cl, pH 8,5) суспендировали в реакционном буфере с pH 8,0 (250 мМ трис-HCl, 0,75 М NaCl, 50 мМ MgCl2, 2,5 мМ дитиотреитола, 150 мкг БСА/мл и 10 мМ АТФ). Добавляли чистую воду (различное количество, добавляли до объема в 20 мкл), затем добавляли 2 мкл аликвоты соединений рутения (серийные разведения 1, 10, 50, 100, 500, 1000 мкМ), что делало финальную концентрацию образца составляющей 0,1, 1,5, 10, 50 и 100 мкМ. Контрольные образцы готовили следующим образом: (i) только плазмида (без ядерного экстракта); (ii) плазмида с ядерным экстрактом; (iii) плазмида с самой высокой концентрацией рутения (без ядерного экстракта) и (iv) плазмида с ядерным экстрактом (без АТФ в буфере). Содержимое пробирок тщательно перемешивают (осторожно встряхивают и откручивают) перед инициацией реакции путем добавления 2 мкл (одной единицы) ядерного экстракта. После 30 мин инкубации при 37°C реакцию останавливали добавлением 2 мкл 10% SDS (в стерильной воде). ДНК-связанный белок гидролизовали добавлением 2 мкл протеиназы K (исходный раствор с концентрацией 0,50 мг/мл в 10 мМ трис-HCl, 1 мМ EDTA, pH 7,5) и инкубировали при 37°C в течение 15 мин без дополнительной экстракции смесью хлороформа и изоамилового спирта (ранее экстракция не показали никакого видимого улучшения результатов). Наконец, добавляли 2 мкл загрузочного красителя с фиколлом (0,25% бромфенолового синего, 15% фиколла в 1x TBE-буфере) и затем анализировали образцы ДНК путем электрофореза в 1,5% агарозном геле с использованием 1x TBE-буфера (50 B, 180 мин). Гели окрашивали бромидом этидия (1 мг/мл) в течение 30 мин с последующей отмывкой от красителя в воде и визуализировали УФ-трансиллюминацией (трансиллюминатор UVP) с помощью системы визуализации Gel-Doc-It Imaging system (UVP).
[00748] Связывание ДНК с помощью УФ-видимого излучения:
[00749] Оптическое титрование проводили на 0,5-2 мл растворах ФДС с возрастающими количествами ДНК из тимуса теленка или спермы сельди для достижения соотношения [основания ДНК]/[ФДС] между 0,1 и 10. ДНК добавляли с шагом в 1-5 мкл к растворам соединения (10 мкМ) в 10 мМ 3-морфолинопропан-1-сульфоновой кислоте (MOPS), 10 мМ MOPS с 50 мМ NaCl, 5 мМ трис-HCl или 5 мМ трис-HCl с 50 мМ NaCl при pH 7,5. Разведение соединений согласно настоящему описанию в конце каждого титрования, даже незначительные, были учтены в анализах констант связывания. Константу связывания ДНК (Kb) получали при подстановке данных титрования в ур. 1 (Фигура 13), где b=1+KbCt+Kb[ДНК]t/2s, Ct и [ДНК]t представляют общие концентрации ФДС и ДНК, соответственно, s представляет собой размер сайта связывания, а также






[00750] Кривые плавления ДНК строили путем измерения поглощения (A260) 2 мл 25 мкМ раствора ДНК (40 мМ MOPS, pH 7,5) как функции температуры (20-100°C) в отсутствие или в присутствии соединения согласно настоящему описанию (5 мкМ). Растворы ДНК и соединения согласно настоящему описанию для экспериментов по плавлению перед измерением оставляли для достижения равновесия на 30 мин при 25°C.Контроллер температуры ETC-505T охлаждали ледяной водой (4°C) с помощью насоса для аквариума и поток аргона подавали в отсек с образцами через впускной газовый клапан для предотвращения конденсации на окошках кювет в экспериментах с изменяемой температурой.
[00751] Титрование фоторасщепления:
[00752] Эксперименты по фоторасщеплению ДНК проводили в соответствии с общим анализом плазмидной ДНК с общим объемом образцов в 20 мкл в микроцентрифужных пробирках вместимостью 0,5 или 1,5 мл, содержащих трансформированную pUC19 плазмиду (200 нг, >95% формы I) в 10 мМ MOPS-буфере и 100 мМ NaCl, pH 7,4. ДНК добавляли в пробирки для анализа в виде раствора в 10 мМ трис-Cl (pH 8,5) и разбавляли MOPS (pH 7,5, финальная концентрация 10 мМ) и NaCl (финальная концентрация 100 мМ). Растворы соединений согласно настоящему описанию добавляли до достижения концентраций от 0 до 500 мкМ и доводили реакционные смеси до финального объема в 20 мкл, если это было необходимо, дистиллированной деионизированной H2O. Первоначально комплексы растворяли в ацетонитриле (2 мкМ исходные растворы) и все последующие разведения осуществляли дистиллированной деионизированной H2O, так что в конечном итоге пробирки для анализа содержали <1% ацетонитрила. Для анализов на основе концентраций образцы (без преинкубационного периода) облучали на воздухе в течение 30 мин светом с длиной волны 420 нм внутри фотореактора (Luzchem LZC-4X). В случае необходимости облучения деоксигенированного образца через образцы пузырьками пропускали аргон в течение 15 мин перед облучением при положительном давлении аргона. Все образцы гасили добавлением загрузочного буфера (gel loading buffer) (4 мкл), загружали в 1% агарозный гель, содержащий бромид (0,75 мкг/мл) и подвергали электрофорезу в течение 30 мин при 8-12 B/см в 1x TAE (40 мМ трис-ацетата, 1 мМ EDTA, pH 8,2). Бэнды визуализировали с помощью УФ-трансиллюминации (трансиллюминатор UVP) и количественно определяли с помощью системы визуализации Gel Doc-It Imaging system (UVP) или программы GNU Image Manipulation Program (GIMP).
[00753] Культура клеток HL-60:
[00754] Линия клеток промиелоцитарного лейкоза человека HL-60 (АТСС CCL-240) культивировали при 37°C в атмосфере 5% CO2 в культуральной среде IMDM Hyclone с 20% FBS и пересевали 3-4 раза в неделю в соответствии со стандартными асептическими процедурами. Культивирование начинали с 200000 клеток⋅мл-1 во флаконах для культивирования тканей с площадью роста клеток 25 см2 и субкультвировали до достижения уровня роста 750000 клеток⋅мл-1 во избежание старения, связанного с продолжительной повышенной плотностью клеток в культуре. Полную среду готовили порциями по 200 мл по мере необходимости путем смешивания IMDM (160 мл), FBS (40 мл, заранее разделенной на аликвоты и инактивированной нагреванием) и сульфата гентомицина (100 мкл исходного раствора концентрации 50 мг⋅мл-1) в вакуумной фильтрационной системе Stericup Millipore (0,22 мкм) объемом 250 мл и фильтровали.
[00755] Анализы цитотоксичности и фотоцитотоксичности
[00756] Клетки линии HL-60, находящиеся в логарифмической фазе роста (приблизительно 8×105) переносили аликвотами по 50 мкл в два 96-луночных микропланшета для культивирования тканей (Corning Costar, Acton, MA), содержащих 100 мкл теплой культуральной среды и помещали в инкубатор с водяной рубашкой при 37°C в атмосферу 5% CO2 (Thermo Electron Corp., Forma Series II, Model 3110, HEPA Class 100) на один час для достижения равновесия. Все пустые лунки микропланшетов заполняли 200 мкл фосфатно-солевого буфера (PBS), содержащего 2,68 мМ хлорида калия, 1,47 мМ одноосновного фосфата калия, 0,137 М хлорид натрия и 8,10 мМ двухосновного фосфата натрия, pH 7,4, чтобы свести к минимуму потерю влаги при испарении. Теплые аликвоты по 50 мкл раствора соединений согласно настоящему описанию (4, 20, 40, 200 мкМ), свежеприготовленного в PBS, добавляли к клетками и инкубировали при 37°C в атмосфере 5% CO2 в течение 4 ч (финальные концентрации составляли 1,5, 10, 50 мкМ). Один из микропланшетов облучали видимым светом (400-700 нм) в фотореакторе Luzchem (флуоресцентные лампы холодного белого света, 21 Вт/м2) в течение 15 мин; другой микропланшет инкубировали в идентичных условиях в темноте. Оба микропланшета затем инкубировали (37°C в атмосфере 5% CO2) в течение 40 ч. Счетчик клеток Cellometer Auto T4 (ESBE Scientific) применяли для определения количества клеток, их жизнеспособности, диаметра и % жизнеспособности клеток. Суспензии клеток (20 мкл) разбавляли в соотношении 1:1 0,2% раствором красителя трипанового синего (Sigma Aldrich, Канада), помещали в камеру слайда для счетчика клеток, и вставляли слайд в автоматический счетчик клеток, осуществляющий подсчет на основании изображения. Концентрации клеток и жизнеспособность клеток были определены автоматически (Cellometer Auto Counter Software) на основании общего числа клеток, фактора разведения и исключения окрашивания трипановым синим. Параметры оптимального типа клеток были установлены путем импорта настроек для клеток линии HL-60, затем данные импортировали в электронную таблицу Microsoft Excel (Microsoft Office 2010) для анализа данных.
[00757] Анализы цитотоксичности и фотоцитотоксичности:
[00758] Клетки линии HL-60, находящиеся в логарифмической фазе роста, переносили (как правило, аликвотами по 25 мкл) в 96-луночные планшеты для культивирования тканей (Corning Costar, Acton, MA), содержащие культуральную среду с различными концентрациями соединений согласно настоящему описанию или без них для достижения финальных объемов в культуральных лунках, составляющих 100 мкл и 10000-20000 клеток. Растворы соединений согласно настоящему описанию в полной среде готовили порциями по 1 мл, где концентрация ацетонитрила из первоначальных исходных растворов соединений согласно настоящему описанию составляла <0,5% об/об, и стерильно фильтровали с помощью шприцев с 0,22 мкм фильтрами Nalgene. Планшеты инкубировали при 37°C в атмосфере 5% CO2 в течение 30 мин перед тем как подвергнуть облучению светом с длиной волны 420 нм в фотореакторе Luzchem в течение 30 мин; темновые контроли инкубировали в идентичных условиях в темноте. Понятие «темновые контролю), или пробы на цитотоксичность (ЦТ), относится к пробам, содержащим соединения согласно настоящему описанию, которые не подвергают воздействию излучения, а понятие «световые контроли» относится к пробам, не содержащим соединения согласно настоящему описанию, которые подвергают воздействию излучения. Пробы на фотоцитотоксичность (ФЦТ) содержали ФДС, и их подвергали воздействию излучения. Подсчет клеток и окрашивание на жизнеспособность проводили немедленно и через ~24 ч после воздействия излучения. Подсчет вручную проводили в смесях в соотношении 1:1 анализируемой культуры и трипанового синего объемом 25 мкл в гемоцитометре Нейбауэра наблюдением в инвертированный световой микроскоп в режиме фазового контраста (объектив 4x, общее увеличение 60x). В этих условиях жизнеспособные клетки выглядели ярко-белыми, а нежизнеспособные клетки были синими. Все эксперименты проводили в трех повторностях, и графические данные представляют собой среднее этих трех повторностей.
[00759] Окрашивание на жизнеспособность:
[00760] Жизнеспособность устанавливали в соответствии с опубликованным протоколом, в соответствии с которым 100х исходный раствор бромида этидия/акридинового оранжевого (БЭ/АО) готовили путем растворения бромида этидия (50 мг) и акридинового оранжевого (15 мг) в 95% этаноле (1 мл) и разбавления в соотношении 1/50 дистиллированной деионизированной Н2О. 100х исходный раствор делили на аликвоты по 1 мл и хранили при -20°C. 1x рабочий раствор готовили путем размораживания 1 мл 100 x исходного раствора и разведения его в соотношении 1/100 фосфатно-солевым буфером. Рабочий раствор хранили в бутылке из темного стекла при 4°C в течение срока до 1 месяца. Для окрашивания на жизнеспособность клеток аликвоту суспензии клеток доводили до концентрации клеток 1-5×106 клеток/мл в забуференной фосфатом среде IMDM. Аликвоты объемом 25 мкл этой клеточной суспензии смешивали с 1x красящим раствором БЭ/АО (25 мкл) в микроцентрифужной пробирке; аликвоту объемом 25 мкл этой суспензии окрашенных клеток переносили в гемоцитометр и рассматривали под инвертированным световым микроскопом Nikon Eclipse TE2000-U в режиме эпи-флуоресценции (объектив 10х или 40x, общее увеличение 150x или 600x). В этих условиях жизнеспособные клетки поглощали AO и исключали БЭ, что приводило только к зеленой флуоресценции при возбуждении УФ-светом. Нежизнеспособные клетки (апоптотические или некротические) усваивали БЭ и светились красным при возбуждении зеленым светом, подавляя какую бы то ни было зеленую флуоресценцию АО. Апоптотические клетки распознавали по формированию более мелких апоптотических тел, светящихся красным.
[00761] Окрашивание ядра для лазерной сканирующей конфокальной микроскопии (LSCM)
[00762] Клетки линии промиелоцитарного лейкоза человека HL-60 (АТСС CCL-240), находящиеся в логарифмической фазе роста, переносили аликвотами по 100 мкл (приблизительно 50000 клеток) в 96-луночный микропланшет для культивирования тканей (Corning Costar, Acton, MA), содержащий 150 мкл теплой культуральной среды (IMDM Hyclone с 20% FBS), и помещали в инкубатор с водяной рубашкой (Thermo Electron Corp., Forma Series II, Model 3110, HEPA Class 100) при 37°C в атмосферу 5% CO2 на один час для достижения равновесия. Затем добавляли 50 мкл 600 мкМ раствора соединений согласно настоящему изобретению (нагретые до 37°C), приготовленные в фосфатно-солевом буфере (PBS), содержащем 2,68 мМ хлорида калия, 1,47 мМ одноосновного фосфата калия, 0,137 М хлорида натрия и 8,10 мМ двухосновного фосфата натрия, pH 7,4. Микропланшет возвращали в инкубатор на 15 мин. Затем образцы объемом 300 мкл переносили в чашку для культивирования со стеклянным дном, покрытую коллагеном (FluoroDish FD35COL, World Precision Instruments Inc.) и возвращали в инкубатор на 10-15 мин, чтобы дать клеткам прикрепиться к покрытой коллагеном чашке. Объем содержимого чашки для культивирования ткани впоследствии доводили до 2 мл теплым PBS для LSCM.
[00763] Несмотря на то, что настоящее изобретение было описано подробно и со ссылками на конкретные примеры, для специалиста в данной области техники будет очевидно, что без отступления от сущности и рамок изобретения могут быть сделаны различные изменения и модификации.
Реферат
Изобретение относится к фотодинамическим соединениям формулы (I):включая его фармацевтически приемлемые соли. М в каждом случае независимо выбран из группы, состоящей из осмия, рутения, железа, кобальта, родия, иридия, никеля и платины; X выбран из группы, состоящей из Cl, PF, Br, BF, ClO, CFSOи SO; n = 0, 1, 2, 3, 4 или 5; q независимо для каждого случая составляет 0, 1 или 2; у независимо для каждого случая составляет 0, 1 или 2; z независимо для каждого случая составляет 1, 2 или 3. Значения Lig, Lig, Ligприведены в формуле изобретения. Также предложены способ лечения заболевания, связанного с гиперпролиферирующими клетками, способ разрушения бактерий и варианты соединений. Указанные фотодинамические соединения могут быть активированы при помощи излучения для обеспечения разрушения нежелательных клеток, таких как гиперпролиферативных клеток и клеток бактерий. 6 н. и 6 з.п. ф-лы, 17 ил., 11 табл.
Формула
















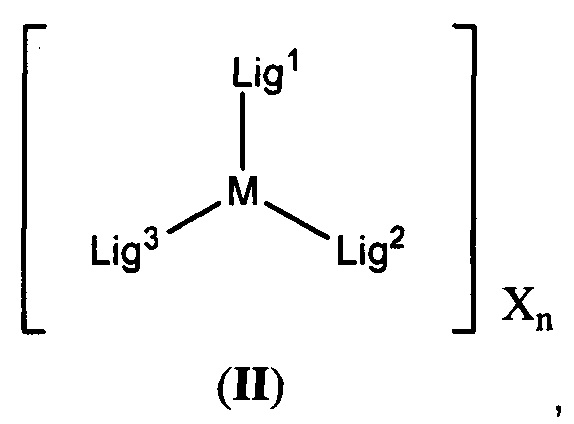


















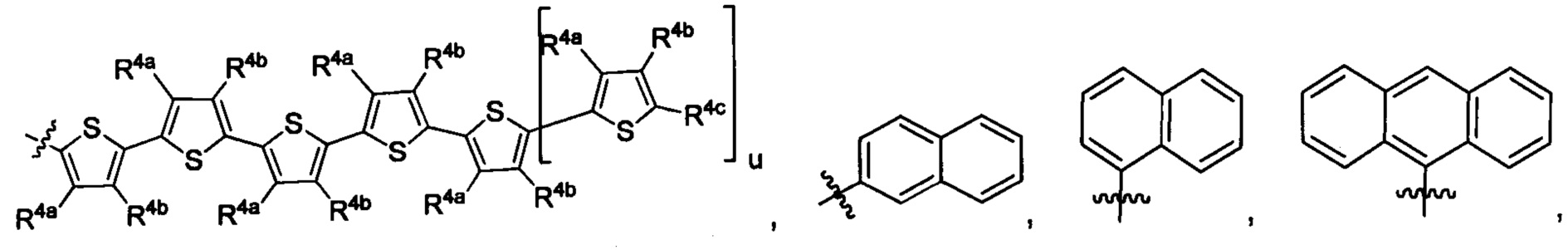






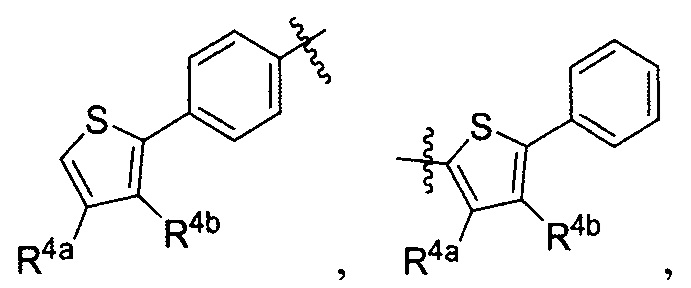

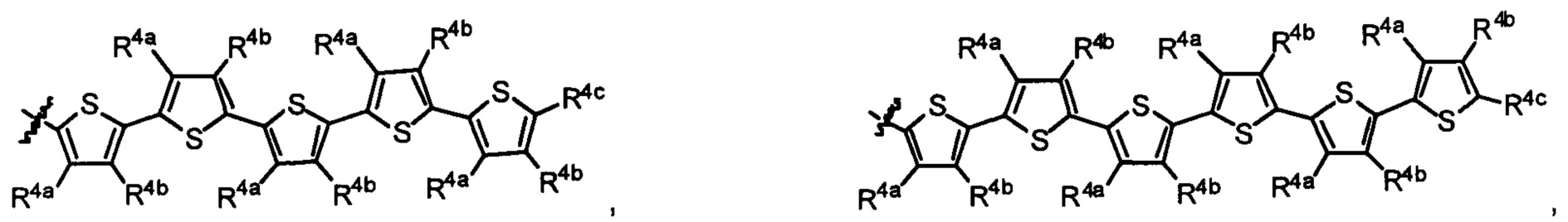



Комментарии