Производные хинолина и хиноксалина, полезные в качестве антагонистов цистеинил-лейкотриена - RU2605929C2
Код документа: RU2605929C2
Чертежи

Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет преимущество заявки на патент Индии № 2109/MUM/2011, поданной 26 июля 2011 г., которая включена в настоящий документ посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым антагонистам цистеинил-лейкотриена (в частности LTD4), в основном к хинолиновым, хиноксалиновым или бенз[c]тиазоловым производным, представленным общей формулой (I), или к их фармацевтически приемлемой соли, способу их получения и к применению соединений при получении фармацевтических композиций для терапевтического лечения расстройства, связанного с цистеинил-лейкотриеном, у млекопитающих, точнее у людей.
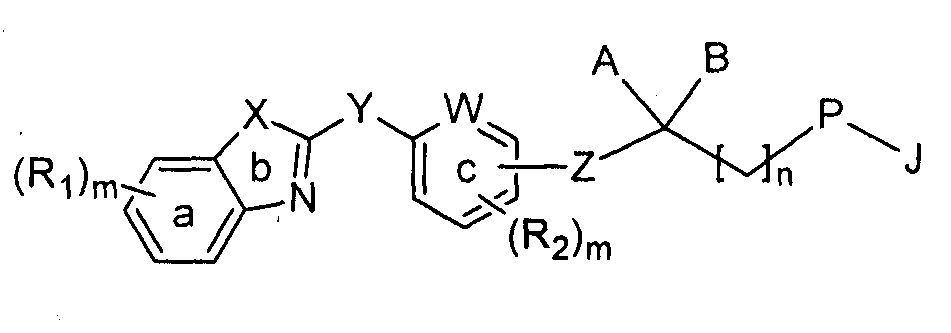
формула (I)
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Цистеинил-лейкотриеновые метаболиты, такие как LTC4, LTD4 и LTE4, походят из мембранной арахидоновой кислоты и представляют собой некоторые из известных медиаторов (Dahlen et al., Nature 288,484, 1980 и Burke et al; J. Pharmacol. and Exp. Therap., 221 , 235, 1983) вызванных аллергией и воспалениями расстройств, таких как аллергический ринит, бронхиальная астма, COPD, атопический дерматит, крапивница, вирусный бронхиолит, кистозный фиброз, эозинофильный гастроэнтерит и т.д. CysLT1 и CysLT2 представляют собой два идентифицированных рецептора, с которыми эти медиаторы связываются, и последующие опосредованные рецепторами неблагоприятные реакции приводят к патологическим состояниям.
В патенте США № 5856322; патенте США №5565473; патенте США № 5266568; патенте США № 5204358; патенте США № 5104882; патенте США № 5059610; патенте США № 5051427; патенте США № 4920133; патенте США № 4920132; европейском патенте № 0315399; европейском патенте № 0318093; европейском патенте № 0399818; WO 1989/004303; WO 2004/043966; Chem. Rev., Article ASAP, DOI: 10.1021/cr100392s, Дата публикации (Web): 28 апреля, 2011г., и т.д. раскрывается ряд антагониста лейкотриенового рецептора.
Селективные антагонисты рецептора CysLT1, такой как монтелукаст (Singular; Merck: Bioorg. Med. Chem. Lett., 1995, 5, 283 и Progress in Medicinal chemistry Vol 38, Chapter 5, Ed, by F.D. King and A.W. Oxford, 249, 2001), зафирлукаст (Accolate: AstraZeneca: J. Med. Chem, 1990, 33, 1781) и пранлукаст (Onon® Ono: J. Med. Chem. , 1988, 31, 84), были выпущены на рынок для лечения сезонного аллергического ринита, лечения астмы от мягкой до умеренной, а сейчас оцениваются для других воспалительных расстройств. Поскольку, представленные на рынке продукты имеют определенные ограничения, например, зафирлукаст характеризуется микросомальным связыванием в печени, приводящим к взаимодействиям лекарственное средство-лекарственное средство, а монтелукаст оценивается по отношению к склонностям к суициду у некоторых субъектов при длительном применении, существует потребность в разработке новых структур, эффективно связывающихся с CysLT1 и демонстрирующих фармакологическую активность с пониженным прифилем побочных эффектов. Также существует потребность в снижении стероидной нагрузки у детей, при этом антагонисты CysLT1 известны своим стероидсберегающим эффектом в лечение астмы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым антагонистам цистеинил-лейкотриена (в частности, LTD4), главным образом хинолиновых, хиноксалиновых или бенз[c]тиазоловых производных, представленным общей формулой (I),

формула (I),
или к их фармацевтически приемлемой соли,
где
кольцо 'a', кольцо 'b' и кольцо 'c' независимо представляют собой арильное или гетероарильное кольцо, необязательно замещенное одним или несколькими идентичными или различными радикалами R1 или R2,
R1 и R2 независимо выбраны из группы, включающей водород, галоген, -OH, -CN, -NO2, -NH2, -C1-10алкил, -C3-10циклоалкил, -О-C1-8алкил (алкокси), -О-C3-8циклоалкил (циклоалкокси), -S-C1-8алкил (тиоалкокси), -C(О)-C1-8алкил, -COOH, -C(О)NH2, -C(О)NH-C1-8алкил, -C(О)N(С1-8алкил)2, -C(О)О-C1-8алкил, -C1-8галогеналкил (галогеналкокси), -C3-8алкенил, -C3-8алкинил, -OC(О)-NH2, -OC(О)-NH(C1-8алкил), -OC(О)-N(C1-8алкил)2, -NH(C1-8алкил), -N(C1-8алкил)2, -NH-SO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -NH-C(О)-(C1-8алкил), -N(C1-8алкил)-C(О)-(C1-8алкил), -NH-C(О)О-C1-8алкил, -N(C1-8алкил)-C(О)О-C1-8алкил, -NH-C(О)-NH2, -NH-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(O)-N(C1-8алкил)2, -NH-C(О)-NH-SO2-C1-8алкил, -N(C1-8алкил)-C(О)-NHSO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -S-C1-8алкил, -S(О)-C1-8алкил, -SO2-C1-8алкил, -S-арил, -S(О)-арил, SO2-арил, -SO2NH2, -SO2NH-(C1-8алкил), -SO2N(C1-8алкил)2;
W представляет собой группу, выбранную из -CH= или -N=;
X представляет собой группу, выбранную из -CH=CH-, -S- или -N=CH-;
Y представляет собой группу, выбранную из -CH=CH- или -C≡C-;
Z представляет собой связь или группу, выбранную из -(CH2)n-, -O-CH2- или -CH=CH-;
A представляет собой группу, выбранную из водорода, -OH, -OR, -SR, -О(CH2)n арил, -О(CH2)nгетероарил, -OCOR, -OCO-арил, -SCOR, -SCO-арил, -NRR', -NRCOR', NRCO-арил, -NRCO-арил-COOR, -NRCH2ArCOOR, -NHCH2(CR,R')OH, -NHCOCH2гетероарил, -NHCOCH2(CR,R')CH2COOR, -NHCOCH2(P)-арил-COOR, -NHCOCH2NRR', -NRSO2R', -NRSO2-арил, -NRCONRR', -NRCONR'-арил, -NRCOCH2-арил-COOR', -NRPO(OR')(OH);
B представляет собой группу, выбранную из водорода, -OR', -SR, -NRR' и -NRCOR';
или A и B вместе могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо, содержащее по меньшей мере два гетероатома, выбранных из кислорода и серы;
или A и B вместе представляют собой группу, включающую C=О, C=S, C=N(OR) или C=NNRR';
P выбран из группы, включающей -О-, -S-, -CH2- и -NR-; или P могут образовывать фрагмент -CH=CH- с соседним атомом углерода;
J представляет собой группу, выбранную из арил-Q, гетероарил-Q или -(CH2)nQ, где Q представляет собой группу, выбранную из водорода, -CH3, -CF3, OR, -COOR, -CONRR', -CR=CR-COOR'; -OCH2-арил-COOR, -CH2О-арил-COOR, -CONHSO2R, -CONHSO2-арил, -OCH2CONRR', -NHSO2R, -NHSO2-арил, -NHSO2NHR, -SO2NHR, -SO2NH-арил, -NHCOR, -NHCO(CRR')-COOR, -C(RR')-COOR, тетразола, -C(RR')OH, -C(RR')CONRR', -CН2NRR' или -OCH2C(RR')OH;
R и R' независимо выбраны из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1-3алкил (циклоалкил), -C3-6алкенил и -C3-6алкинил, или R и R' вместе с атомом, к которому они присоединены, вместе могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо;
'n' представляет собой целое число, выбранное из 1, 2 или 3;
'm' представляет собой целое число, выбранное из 0-4, включительно;
при условии, что, если P представляет собой -CH2-, то оба A и B представляют собой группы, присоединенные к углероду через гетероатом, и если B представляет собой водород, то А представляет собой -NR-.
Один аспект настоящего изобретения относится к соединениям общей формулы (Ia),

формула (Ia),
или к их фармацевтически приемлемой соли,
где
R1, R2 и R3 независимо выбраны из группы, включающей водород, галоген, -OH, -CN, -NO2, -NH2, -С1-10алкил, -C3-10циклоалкил, -О-C1-8алкил, -О-C1-8алкил (алкокси), -O-C3-8циклоалкил (циклоалкокси), -S-C1-8алкил (тиоалкокси), -C(O)-C1-8алкил, -COOH, -C(О)NH2, -C(О)NH-C1-8алкил, -C(О)N(C1-8алкил)2, -C(О)О-C1-8алкил, -C1-8галогеналкил (галогеналкокси), -C3-8алкенил, -C3-8алкинил, -OC(О)-NH2, -OC(О)-NH(C1-8алкил), -OC(О)-N(C1-8алкил)2, -NH(C1-8алкил), -N(C1-8алкил)2, -NH-SO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -NH-C(О)-(C1-8алкил), -N(C1-8алкил)-C(О)-(C1-8алкил), -NH-C(О)О-C1-8алкил, -N(C1-8алкил)-C(О)О-C1-8алкил, -NH-C(О)-NH2, -NH-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-N(C1-8алкил)2, -NH-C(О)-NH-SO2-C1-8алкил, -N(C1-8алкил)-C(О)-NHSO2-C1-8алкил, -N(C1-8алкил)-C(О)-N(C1-8алкил)-SO2-C1-8алкил, -S-C1-8алкил, -S(О)-C1-8алкил, -SO2-C1-8алкил, -S-арил, -S(О)-арил, SO2-арил, -SO2NH2, -SO2NH-(C1-8алкил), -SO2N(C1-8алкил)2;
W представляет собой группу, выбранную из -CH= или -N=;
X представляет собой группу, выбранную из -CH=CH-, -S- или -N=CH-;
Y представляет собой группу, выбранную из -CH=CH- или -C≡C-;
A представляет собой группу, выбранную из водорода, -OH, -OR, -SR, -О(CH2)nарила, -О(CH2)nгетероарила, -OCOR, -OCO-арила, -SCOR, -SCO-арила, -NRR', -NRCOR', -NRCO-арила, -NRCO-арил-COOR, -NRCH2ArCOOR, -NHCH2(CR,R')OH, -NHCOCH2гетероарила, -NHCOCH2(CR,R')CH2COOR, -NHCOCH2(P)-арил-COOR, -NHCOCH2NRR', -NRSO2R', -NRSO2-арила, -NRCONRR', -NRCONR'-арила, -NRCOCH2-арил-COOR', -NRPO(OR'XOH); при условии, что, если A представляет собой -OR или -SR, то P выбран из -О-, -S- или -NR-, и если A представляет собой -NR-, P выбран из -О-, -S-, -NR- или -CН2;
P выбран из группы, включающей -О-, -S-, -CH2- и -NR-; или P может образовывать фрагмент -CH=CH- с соседним атомом углерода;
Q представляет собой группу, выбранную из водорода, -CH3, -CF3, OR, -COOR, -CONRR', -CR=CR-COOR'; -OCH2арил-COOR, -CH2О-арил-COOR, -CONHSO2R, -CONHSO2арил, -OCH2CONRR', -NHSO2R, -NHSO2арил, -NHSO2NHR, -SO2NHR, -SO2NHарила, -NHCOR, -NHCO(CRR')-COOR, -C(RR')-COOR, тетразола, -C(RR')OH, -C(RR')CONRR', -CH2NRR' или -OCH2C(RR')OH;
R и R' независимо выбраны из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1-3алкил (циклоалкил), -C3-6алкенил и -C3-6алкинил, или R и R' вместе с атомом, к которому они присоединены, вместе могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо;
'm' представляет собой целое число, выбранное из 0-4, включительно;
при условии, что, если P представляет собой -CH2-, то А представляет собой -NR-.
Аспект настоящего изобретения относится к соединениям общей формулы (Ib),

формула (Ib),
или к их фармацевтически приемлемой соли,
где
R1, R2 и R3 независимо выбраны из группы, включающей водород, галоген, -OH, -CN, -NO2, -NH2, -C1-10алкил, -C3-10циклоалкил, -O-C1-8алкил, -О-C1-8алкил (алкокси), -О-C3-8циклоалкил (циклоалкокси), -S-C1-8алкил (тиоалкокси), -C(О)-C1-8алкил, -COOH, -C(О)NH2, -C(О)NH-C1-8алкил, -C(О)N(C1-8алкил)2, -C(О)О-C1-8алкил, -C1-8галогеналкил (галогеналкокси), -C3-8алкенил, -C3-8алкинил, -OC(О)-NH2, -OC(О)-NH(C1-8алкил), -OC(О)-N(C1-8алкил)2, -NH(C1-8алкил), -N(C1-8алкил)2, -NH-SO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -NH-C(О)-(C1-8алкил), -N(C1-8алкил)-C(О)-(C1-8алкил), -NH-C(О)О-C1-8алкил, -N(C1-8алкил)-C(О)О-C1-8алкил, -NH-C(О)-NH2, -NH-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-N(C1-8алкил)2, -NH-C(О)-NH-SO2-C1-8алкил, -N(C1-8алкил)-C(O)-NHSO2-C1-8алкил, -N(C1-8алкил)-C(О)-N(C1-8алкил)-SO2-C1-8алкил, -S-C1-8алкил, -S(О)-C1-8алкил, -SO2-C1-8алкил, -S-арил, -S(О)-арил, SO2-арил, -SO2NH2, -SO2NH-(C1-8алкил), -SO2N(C1-8алкил)2;
W представляет собой группу, выбранную из -CH= или -N=;
X представляет собой группу, выбранную из -CH=CH-, -S- или -N=CH-;
Y представляет собой группу, выбранную из -CH=CH- или -C≡C-;
A и B независимо выбраны из -OR', -SR', -NRR' или -NRCOR';
или A и B вместе могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо, содержащее по меньшей мере два гетероатома, выбранных из кислорода и серы;
или A и B вместе представляют собой группу, включающую C=О, C=S, C=N(OR) или C=NNRR';
P выбран из группы, включающей -О-, -S-, -CH2- и -NR-; или P может образовывать -CH=CH- фрагмент с соседним атомом углерода;
Q представляет собой группу, выбранную из водорода, -CH3, -CF3, OR, -COOR, -CONRR', -CR=CR-COOR'; -OCH2арил-COOR, -CH2О-арил-COOR, -CONHSO2R, -CONHSO2арила, -OCH2CONRR', -NHSO2R, -NHSO2арила, -NHSO2NHR, -SO2NHR, -SO2NHарила, -NHCOR, -NHCO(CRR')-COOR, -C(RR'COOR, тетразола, -C(RR')OH, -C(RR')CONRR', -CH2NRR' или -OCH2C(RR')OH;
R и R' независимо выбраны из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1-3алкил (циклоалкил), -C3-6алкенил и -C3-6алкинил, или R и R' вместе с атомом, к которому они присоединены, могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо;
'm' представляет собой целое число, выбранное из 0-4, включительно;
при условии, что, если P представляет собой -CH2-, то оба A и B представляют собой группы, присоединенные к углероду через гетероатом.
Один аспект настоящего изобретения относится к соединениям общей формулы (Ic),

формула (Ic),
или к их фармацевтически приемлемой соли,
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, -OH, -CN, -NO2, -NH2, -C1-10алкил, -C3-10циклоалкил, -О-C1-8алкил (алкокси), -O-C3-8циклоалкил (циклоалкокси), -S-C1-8алкил (тиоалкокси), -C(О)-C1-8алкил, -COOH, -C(О)NH2, -C(О)NH-C1-8алкил, -C(О)N(C1-8алкил)2, -C(О)О-C1-8алкил, -C1-8галогеналкил (галогеналкокси), -C3-8алкенил, -C3-8алкинил, -OC(О)-NH2, -OC(О)-NH(C1-8алкил), -OC(О)-N(C1-8алкил)2, -NH2, -NH(C1-8алкил), -N(C1-8алкил)2, -NH-SO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -NH-C(О)-(C1-8алкил), -N(C1-8алкил)-C(О)-(C1-8алкил), -NH-C(О)О-C1-8алкил, -N(C1-8алкил)-C(О)О-C1-8алкил, -NH-C(О)-NH2, -NH-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(O)-N(C1-8алкил)2, -NH-C(О)-NH-SO2-C1-8алкил, -N(C1-8алкил)-C(О)-NHSO2-C1-8алкил, -N(C1-8алкил)-C(О)-N(C1-8алкил)-SO2-C1-8алкил, -S-C1-8алкил, -S(О)-C1-8алкил, -SO2-C1-8алкил, -S-арил, -S(О)-арил, SO2-арил, -SO2NH2, -SO2NH-(C1-8алкил), -SO2N(C1-8алкил)2;
W представляет собой группу, выбранную из -CH= или -N=;
X представляет собой группу, выбранную из -CH=CH-, -S- или -N=CH-;
Y представляет собой группу, выбранную из -CH=CH- или -C≡C-;
A и B независимо выбраны из водорода, -OR', -SR, -NRR' и -NRCOR'; при условии, что, если B представляет собой водород, P выбран из -О-, -S- или -NR-;
или A и B вместе могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо, содержащее по меньшей мере два гетероатома, выбранных из кислорода и серы;
или A и B вместе представляют собой группу, включающую C=О, C=S, C=N(OR) или C=NNRR';
P выбран из группы, включающей -О-, -S-, -CH2- и -NR-; или P могут образовывать фрагмент -CH=CH- с соседним атомом углерода; при условии, что, если B представляет собой водород, то P выбран из группы, включающей -О-, -S- и -NR-.
Q представляет собой группу, выбранную из водорода, -CH3, -CF3, OR, -COOR, -CONRR', -CR=CR-COOR'; -OCH2арил-COOR, -CH2О-арил-COOR, -CONHSO2R, -CONHSO2арила, -OCH2CONRR', -NHSO2R, -NHSO2арила, -NHSO2NHR, -SO2NHR, -SO2NHарила, -NHCOR, -NHCO(CRR')-COOR, -C(RR')-COOR, тетразола, -C(RR')OH, -C(RR')CONRR', -CH2NRR' или -OCH2C(RR')OH;
R и R' независимо выбраны из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1-3алкил (циклоалкил), -C3-6алкенил и -C3-6алкинил, или R и R' вместе с атомом, к которому они присоединены, могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо;
'n' представляет собой целое число, выбранное из 1, 2 или 3;
'm' представляет собой целое число, выбранное из 0-4, включительно.
Настоящее изобретение также относится к применению соединения формулы (I), (Ia), (Ib) или (Ic) или его соли или N-оксидов для получения фармацевтической композиции, содержащей соединение формулы (I), (Ia), (Ib) или (Ic) или его N-оксид и его фармацевтически приемлемый носитель, разбавитель или наполнитель.
Кроме того, настоящее изобретение также относится к способу лечения расстройства, связанного с цистеинил-лейкотриеном, включающему введение млекопитающему, при необходимости такого лечения, эффективного количества соединения формулы (I), (Ia), (Ib) или (Ic) или его соли, или N-оксидов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым антагонистам цистеинил-лейкотриена (в частности, LTD4), представленным общей формулой (I),

формула (I),
или к их фармацевтически приемлемой соли,
где
кольцо 'a', кольцо 'b' и кольцо 'c' независимо представляют собой арильное или гетероарильное кольцо, необязательно замещенное одним или несколькими идентичными или различными радикалами R1 или R2,
R1 и R2 независимо выбраны из группы, включающей водород, галоген, -OH, -CN, -NO2, -NH2, -C1-10алкил, -C3-10 циклоалкил, -О-C1-8алкил (алкокси), -O-C3-8циклоалкил (циклоалкокси), -S-C1-8алкил (тиоалкокси), -C(О)-C1-8алкил, -COOH, -C(О)NH2, -C(О)NH-C1-8алкил, -C(О)N(C1-8алкил)2, -C(О)О-C1-8алкил, -C1-8галогеналкил (галогеналкокси), -C3-8алкенил, -C3-8алкинил, -OC(О)-NH2, -OC(О)-NH(C1-8алкил), -OC(О)-N(C1-8алкил)2, -NH2, -NH(C1-8алкил), -N(C1-8алкил)2, -NH-SO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -NH-C(О)-(C1-8алкил), -N(C1-8алкил)-C(О)-(C1-8алкил), -NH-C(О)О-C1-8алкил, -N(C1-8алкил)-C(О)О-C1-8алкил, -NH-C(О)-NH2, -NH-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(O)-N(C1-8алкил)2, -NH-C(О)-NH-SO2-C1-8алкил, -N(C1-8алкил)-C(О)-NHSO2-C1-8алкил, -N(C1-8алкил)-C(О)-N(C1-8алкил)-SO2-C1-8алкил, -S-C1-8алкил, -S(О)-C1-8алкил, -SO2-C1-8алкил, -S-арил, -S(О)-арил, SO2-арил, -SO2NH2, -SO2NH-(C1-8алкил), -SO2N(C1-8алкил)2;
W представляет собой группу, выбранную из -CH= или -N=;
X представляет собой группу, выбранную из -CH=CH-, -S- или -N=CH-;
Y представляет собой группу, выбранную из -CH=CH- или -C≡C-;
Z представляет собой связь или группу, выбранную из -(CH2)n-, -О-CH2- или -CH-CH-;
A представляет собой группу, выбранную из водорода, -OH, -OR, -SR, -О(CH2)nарила, -О(CH2)nгетероарила, -OCOR, -OCO-арила, -SCOR, -SCO-арила, -NRR', -NRCOR', -NRCO-арила, -NRCO-арил-COOR, -NRCH2ArCOOR, -NHCH2(CR,R')OH, -NHCOCH2гетероарила, -NHCOCH2(CR,R')CH2COOR, -NHCOCH2(P)-арил-COOR, -NHCOCH2NRR', -NRSO2R', -NRSO2-арила, -NRCONRR', -NRCONR'-арила, -NRCOCH2-арил-COOR', -NRPO(OR')(OH);
B представляет собой группу, выбранную из водорода, -OR', -SR, -NRR' и -NRCOR';
или A и B вместе могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо, содержащее по меньшей мере два гетероатома, выбранных из кислорода и серы;
или A и B вместе представляют собой группу, включающую C=О, C=S, C=N(OR) или C=NNRR';
P выбран из группы, включающей -О-, -S-, -CH2- и -NR-; или P могут образовывать фрагмент -CH=CH- с соседним атомом углерода;
J представляет собой группу, выбранную из арил-Q, гетероарил-Q или -(CH2)nQ, где Q представляет собой группу, выбранную из водорода, -CH3, -CF3, OR, -COOR, -CONRR', -CR=CR-COOR'; -OCH2арил-COOR, -CH2О-арил-COOR, -CONHSO2R, -CONHSO2арила, -OCH2CONRR', -NHSO2R, -NHSO2арила, -NHSO2NHR, -SO2NHR, -SO2NHарила, -NHCOR, -NHCO(CRR')-COOR, -C(RR')-COOR, тетразола, -C(RR')OH, -C(RR')CONRR', -CH2NRR' или -OCH2C(RR')OH;
R и R' независимо выбраны из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1-3алкил (циклоалкил), -C3-6алкенил и -C3-6алкинил, или R и R' вместе с атомом, к которому они присоединены, могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо;
'n' представляет собой целое число, выбранное из 1, 2 или 3;
'm' представляет собой целое число, выбранное из 0-4, включительно;
при условии, что, если P представляет собой -CH2-, то оба A и B представляют собой группы, присоединенные к углероду через гетероатом, и если B представляет собой водород, то А представляет собой -NR-.
Один предпочтительный вариант осуществления относится к соединениям формулы (I), где кольца 'a' и 'b' содержат слитую гетероциклическую ароматическую кольцевую систему, предпочтительно замещенное или незамещенное хинолиновое, тиазольное или хиноксалиновое кольцо.
Еще один вариант осуществления относится к соединениям формулы (I), где паттерн замещения в кольце 'c' является (1, 2); (1, 3) или (1, 4) по отношению к Ύ' и предпочтительно (1, 3), как раскрыто в описании.
Другой предпочтительный вариант осуществления относится к соединениям формулы (I), где W представляет собой -CH=.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (I), где X представляет собой -CH-CH-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (I), где Y представляет собой -CH=CH-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (I), где Y представляет собой -CH=CH- с транс-конфигурацией.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (I), где Z представляет собой связь.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (I), где R1 и R2 выбраны из водорода и галогена.
Еще один вариант осуществления относится к соединению формулы (Ia),

формула (Ia),
или к их фармацевтически приемлемой соли,
где
R1, R2 и R3 независимо выбраны из группы, включающей водород, галоген, -OH, -CN, -NO2, -NH2, -C1-10алкил, -C3-10циклоалкил, -О-C1-8алкил, -О-C1-8алкил (алкокси), -O-C3-8циклоалкил (циклоалкокси), -S-C1-8алкил (тиоалкокси), -C(O)-C1-8алкил, -COOH, -C(О)NH2, -C(О)NH-C1-8алкил, -C(О)N(C1-8алкил)2, -C(О)О-C1-8алкил, -C1-8галогеналкил (галогеналкокси), -C3-8алкенил, -C3-8алкинил, -OC(О)-NH2, -OC(О)-NH(C1-8алкил), -OC(О)-N(C1-8алкил)2, -NH(C1-8алкил), -N(C1-8алкил)2, -NH-SO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -NH-C(О)-(C1-8алкил), -N(C1-8алкил)-C(О)-(C1-8алкил), -NH-C(О)О-C1-8алкил, -N(C1-8алкил)-C(О)О-C1-8алкил, -NH-C(О)-NH2, -NH-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-N(C1-8алкил)2, -NH-C(О)-NH-SO2-C1-8алкил, -N(C1-8алкил)-C(O)-NHSO2-C1-8алкил, -N(C1-8алкил)-C(О)-N(C1-8алкил)-SO2-C1-8алкил, -S-C1-8алкил, -S(О)-C1-8алкил, -SO2-C1-8алкил, -S-арил, -S(О)-арил, -SO2-арил, -SO2NH2, -SO2NH-(C1-8алкил), -SO2N(C1-8алкил)2;
W представляет собой группу, выбранную из -CH= или -N=;
X представляет собой группу, выбранную из -CH=CH-, -S- или -N=CH-;
Y представляет собой группу, выбранную из -CH=CH- или -C≡C-;
A представляет собой группу, выбранную из водорода, -OH, -OR, -SR, -О(CH2)nарила, -О(CH2)nгетероарила, -OCOR, -OCO-арила, -SCOR, -SCO-арила, -NRR', -NRCOR', -NRCO-арила, -NRCO-арил-COOR, -NRCH2ArCOOR, -NHCH2(CR,R')OH, -NHCOCH2гетероарила, -NHCOCH2(CR,R')CH2COOR, -NHCOCH2(P)-арил-COOR, -NHCOCH2NRR', -NRSO2R, -NRSO2-арила, -NRCONRR', -NRCONR'-арила, -NRCOCH2-арил-COOR', -NRPO(OR')(OH); при условии, что, если A представляет собой -OR или -SR, то P выбран из -О-, -S- или -NR-, и если A представляет собой -NR-, то P выбран из -О-, -S-, -NR- или -CH2-;
P выбран из группы, включающей -О-, -S-, -CH2- и -NR-; или P могут образовывать фрагмент -CH=CH- с соседним атомом углерода;
Q представляет собой группу, выбранную из водорода, -CH3, -CF3, OR, -COOR, -CONRR', -CR=CR-COOR; -OCH2арил-COOR, -CH2О-арил-COOR, -CONHSO2R, -CONHSO2арила, -OCH2CONRR', -NHSO2R, -NHSO2арила, -NHSO2NHR, -SO2NHR, -SO2NHарила, -NHCOR, -NHCO(CRR')-COOR, -C(RR')-COOR, тетразола, -C(RR')OH, -C(RR')CONRR', -CH2NRR' или -OCH2C(RR')OH;
R и R' независимо выбраны из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1-3алкил (циклоалкил), -C3-6алкенил и -C3-6алкинил, или R и R' вместе с атомом, к которому они присоединены, могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо;
'm' представляет собой целое число, выбранное из 0-4, включительно;
при условии, что, если P представляет собой -CH2-, то А представляет собой -NR-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ia), где W представляет собой -CH=.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ia), где X представляет собой -CH=CH-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ia), где Y представляет собой -CH=CH-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (I), где Y представляет собой -CH=CH- с транс-конфигурацией.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ia), где Z представляет собой связь.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ia), где R1 и R2 выбраны из водорода и галогена.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ia), где A представляет собой -OR или -SR, и P выбран из -О-, -S- или -NR-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ia), где A представляет собой -NR-, и P выбран из -О-, -S-, -NR- или -CH2-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ia), где Q представляет собой группу, выбранную из водорода, OR, -COOR, -CONRR', -CONHSO2R, -NHCO(CRR')-COOR, -C(RR')OH или -OCH2C(RR')OH, а R и R' определены выше.
Еще один вариант осуществления относится к соединению формулы (Ib),

формула (Ib),
или к их фармацевтически приемлемой соли,
где
R1, R2 и R3 независимо выбраны из группы, включающей водород, галоген, -OH, -CN, -NO2, -NH2, -С1-10алкил, -C3-10циклоалкил, -О-C1-8алкил, -О-C1-8алкил (алкокси), -O-C3-8циклоалкил (циклоалкокси), -S-C1-8алкил (тиоалкокси), -C(O)-C1-8алкил, -COOH, -C(О)NH2, -C(О)NH-C1-8алкил, -C(О)N(C1-8алкил)2, -C(О)О-С1-8алкил, -C1-8галогеналкил (галогеналкокси), -C3-8алкенил, -C3-8алкинил, -OC(О)-NH2, -OC(О)-NH(C1-8алкил), -OC(О)-N(С1-8алкил)2, -NH(C1-8алкил), -N(C1-8алкил)2, -NH-SO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -NH-C(О)-(C1-8алкил), -N(C1-8алкил)-C(О)-(C1-8алкил), -NH-C(О)О-C1-8алкил, -N(C1-8алкил)-C(О)О-C1-8алкил, -NH-C(О)-NH2, -NH-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-N(C1-8алкил)2, -NH-C(О)-NH-SO2-C1-8алкил, -N(C1-8алкил)-C(O)-NHSO2-C1-8алкил, -N(C1-8алкил)-C(О)-N(С1-8алкил)-SO2-C1-8алкил, -S-C1-8алкил, -S(О)-C1-8алкил, -SO2-C1-8алкил, -S-арил, -S(О)-арил, SO2-арил, -SO2NH2, -SO2NH-(C1-8алкил), -SO2N(C1-8алкил)2;
W представляет собой группу, выбранную из -CH= или -N=;
X представляет собой группу, выбранную из -CH=CH-, -S- или -N=CH-;
Y представляет собой группу, выбранную из -CH=CH- или -C≡C-;
A и B независимо выбраны из -OR', -SR, -NRR' или -NRCOR';
или A и B вместе могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо, содержащее по меньшей мере два гетероатома, выбранных из кислорода и серы;
или A и B вместе представляют собой группу, включающую C=О, C=S, C=N(OR) или C=NNRR';
P выбран из группы, включающей -О-, -S-, -CH2- и -NR-; или P могут образовывать фрагмент -CH=CH- с соседним атомом углерода;
Q представляет собой группу, выбранную из водорода, -CH3, -CF3, OR, -COOR, -CONRR', -CR=CR-COOR'; -OCH2арил-COOR, -CH2О-арил-COOR, -CONHSO2R, -CONHSO2арила, -OCH2CONRR', -NHSO2R, -NHSO2арила, -NHSO2NHR, -SO2NHR, -SO2NHарила, -NHCOR, -NHCO(CRR')-COOR, -C(RR')-COOR, тетразола, -C(RR')OH, -C(RR')CONRR', -CH2NRR' или -OCH2C(RR')OH;
R и R' независимо выбраны из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1-3алкил (циклоалкил), -C3-6алкенил и -C3-6алкинил, или R и R' вместе с атомом, к которому они присоединены, могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо;
'm' представляет собой целое число, выбранное из 0-4, включительно;
при условии, что, если P представляет собой -CH2-, то оба A и B представляют собой группы, присоединенные к углероду через гетероатом.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где W представляет собой -CH=.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где X представляет собой -CH=CH-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где Y представляет собой -CH=CH-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (I), где Y представляет собой -CH=CH- с транс-конфигурацией.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где Z представляет собой связь.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где R1 и R2 выбраны из водорода и галогена.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где A и B представляет собой -OR', а R' выбран из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C3-6алкенил или -C3-6алкинил.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где A и B вместе образуют замещенное или незамещенное 5-8-членное циклическое кольцо, содержащее по меньшей мере два гетероатома, выбранных из кислорода и серы.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где A и B вместе представляют собой группу C=N(OR), а R выбран из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C3-6алкенил или -C3-6алкинил.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ib), где Q представляет собой группу, выбранную из водорода, OR, -COOR, -CONRR', -CH2О-арил-COOR, -C(RR')-COOR, -CH2NRR', тетразол, -C(RR')OH или -OCH2C(RR')OH, а R и R' определены выше.
Еще один вариант осуществления относится к соединению формулы (Ic),

формула (Ic),
или к их фармацевтически приемлемой соли,
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, -OH, -CN, -NO2, -NH2, -C1-10алкил, -C3-10циклоалкил, -О-C1-8алкил (алкокси), -O-C3-8циклоалкил (циклоалкокси), -S-C1-8алкил (тиоалкокси), -C(О)-C1-8алкил, -COOH, -C(О)NH2, -C(О)NH-C1-8алкил, -C(О)N(С1-8алкил)2, -C(О)О-C1-8алкил, -C1-8галогеналкил (галогеналкокси), -C3-8алкенил, -C3-8алкинил, -OC(О)-NH2, -OC(О)-NH(C1-8алкил), -OC(О)-N(C1-8алкил)2, -NH2, -NH(C1-8алкил), -N(C1-8алкил)2, -NH-SO2-C1-8алкил, -N(C1-8алкил)-SO2-C1-8алкил, -NH-C(О)-(C1-8алкил), -N(C1-8алкил)-C(О)-(C1-8алкил), -NH-C(О)О-C1-8алкил, -N(C1-8алкил)-C(О)О-C1-8алкил, -NH-C(О)-NH2, -NH-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(О)-NH(C1-8алкил), -N(C1-8алкил)-C(O)-N(C1-8алкил)2, -NH-C(О)-NH-SO2-C1-8алкил, -N(C1-8алкил)-C(О)-NHSO2-C1-8алкил, -N(C1-8алкил)-C(О)-N(C1-8алкил)-SO2-C1-8алкил, -S-C1-8алкил, -S(О)-C1-8алкил, -SO2-C1-8алкил, -S-арил, -S(О)-арил, SO2-арил, -SO2NH2, -SO2NH-(C1-8алкил), -SO2N(C1-8алкил)2;
W представляет собой группу, выбранную из -CH= или -N=;
X представляет собой группу, выбранную из -CH=CH-, -S- или -N=CH-;
Y представляет собой группу, выбранную из -CH=CH- или -C≡C-;
A и B независимо выбраны из водорода, -OR', -SR, -NRR' и -NRCOR'; при условии, что, если B представляет собой водород, то P выбран из -О-, -S- или -NR-;
или A и B вместе могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо, содержащее по меньшей мере два гетероатома, выбранных из кислорода и серы;
или A и B вместе представляют собой группу, включающую C=О, C=S, C=N(OR) или C=NNRR';
P выбран из группы, включающей -О-, -S-, -CH2- и -NR-; или P могут образовывать фрагмент -CH=CH- с соседним атомом углерода; при условии, что, если B представляет собой водород, то P выбран из группы, включающей -О-, -S- и -NR-.
Q представляет собой группу, выбранную из водорода, -CH3, -CF3, OR, -COOR, -CONRR', -CR=CR-COOR'; -OCH2арил-COOR, -CH2О-арил-COOR, -CONHSO2R, -CONHSO2арила, -OCH2CONRR', -NHSO2R, -NHSO2арила, -NHSO2NHR, -SO2NHR, -SO2NHарила, -NHCOR, -NHCO(CRR')-COOR, -C(RR')-COOR, тетразола, -C(RR')OH, -C(RR')CONRR', -CH2NRR' или -OCH2C(RR')OH;
R и R' независимо выбраны из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1-3алкил (циклоалкил), -C3-6алкенил и -C3-6алкинил, или R и R' вместе с атомом, к которому они присоединены, могут образовывать замещенное или незамещенное 5-8-членное циклическое кольцо;
'm' представляет собой целое число, выбранное из 0-4, включительно.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ic), где W представляет собой -CH=.
Другой предпочтительный вариант осуществления относится к соединениям формулы (Ic), где X представляет собой -CH=CH-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ic), где Y представляет собой -CH=CH-.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (I), где Y представляет собой -CH=CH- с транс-конфигурацией.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ic), где Z представляет собой связь.
Еще один предпочтительный вариант осуществления относится к соединениям формулы (Ic), где R1 и R2 выбраны из водорода и галогена.
Дополнительно к вышеприведенному тексту и ко всему раскрытию приведенные выражения имеют следующие значения, если не указано иное.
Далее приведены применяемые в настоящем описании выражения. Представлено начальное определение для группы или выражения, применяемого в настоящем документе к этой группе или выражению во всем настоящем описании, отдельно или как часть другой группы, если не указано иное.
Общие выражения, применяемые выше и ниже, предпочтительно имеют в контексте настоящего раскрытия следующие значения, если не указано иное.
Выражение "алкил" относится радикалу с углеводородной цепью, который включает только атомы углерода и водорода в скелете, либо прямом, либо разветвленном, содержащем от одного до восьми атомов углерода, включительно, и который присоединяется к остальной части молекулы одинарной связью, например, метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил и 1,1-диметилэтил (трет-бутил). Выражение "C1-8алкил" относится к алкильной цепи, линейной или разветвленной, содержащей 1-8 атомов углерод, включительно. Если не установлено или не указано иное, все алкильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Выражение "алкенил" относится к углеводородной цепи, содержащей от 3 до 10 атомов углерода, включительно, и содержащей по меньшей мере одну углерод-углеродную двойную связь, которая не находится в положении 1, и которая может иметь (E) или (Z) конфигурацию. Неограничивающие примеры алкенильных групп включают 2-пропенил (аллил), 2-метил-2-пропенил и (Z)-2-бутенил. Если не установлено или не указано иное, все алкенильные группы, описанные или заявленные в настоящем документе, могут быть с прямой цепью или разветвленными, замещенными или незамещенными.
Выражение "алкинил" относится гидрокарбильному радикалу по меньшей мере с одной углерод-углеродной тройной связью, которая не находится в положении 1, и содержащему от 3 до приблизительно 12 атомов углерода, включительно (при этом радикалы, содержащие от 3 до приблизительно 10 атомов углерода являются предпочтительными).
Неограничивающие примеры алкинильных групп включают 2-пропинил и 3-бутинил. Если не установлено или не указано иное, все алкинильные группы, описанные или заявленные в настоящем документе, могут быть с прямой цепью или разветвленными, замещенными или незамещенными.
Выражение "алкокси" обозначает алкильную группу, присоединенную посредством кислородной связи к остальной части молекулы. Иллюстративными примерами таких групп являются -OCH3 и -OC2H5. Если не установлено или не указано иное, все алкоксигруппы, описанные или заявленные в настоящем документе, могут быть с прямой цепью или разветвленными, замещенными или незамещенными.
Выражения "галоген" означает фтор, хлор, бром или йод.
Подобным образом, "галогеналкил" или "галогеналкокси" относится к алкилу или алкоксигруппе, замещенным одним или несколькими атомами галогена.
Выражение "циклоалкил" означает неароматическую моно- или мультициклическую кольцевую систему от 3 до приблизительно 12 атомов углерода. Моноциклические кольца включают без ограничения циклопропил, циклобутил, циклопентил и циклогексил. Примеры простых мультициклических циклоалкильных групп включают пергидронафтил, пергидроинденил и т.п.; мостиковые мультициклические группы включают адамантил и норборнил и т.п., а также спиромультициклические группы, например, спиро(4,4)нон-2-ил. Если не установлено или не указано иное, все циклоалкильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Выражение "циклоалкилалкил" относится к радикалу, содержащему циклическое кольцо, содержащее от 3 до приблизительно 8 атомов углерода, присоединенных непосредственно к алкильной группе. Циклоалкилалкильная группа может быть присоединена к основной структуре на любом атоме углерода в алкильной группе, что приводит к созданию стабильной структуры. Неограничивающие примеры таких групп включают циклопропилметил, циклобутилэтил и циклопентилэтил. Если не установлено или не указано иное, все циклоалкилалкильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Выражение "циклоалкенил" относится к радикалу, содержащему циклическое кольцо, содержащее от 3 до приблизительно 8 атомов углерода и по меньшей мере одну углерод-углеродную двойную связь, которая не находится в положении 1, такому как циклопропенил, циклобутенил и циклопентенил. Если не установлено или не указано иное, все циклоалкенильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Выражение "арил" относится к ароматическому радикалу с 6-14 атомами углерода, содержащему моноциклические, бициклические и трициклические ароматические системы, такие как фенил, нафтил, тетрагидронафтил, инданил и бифенил. Если не установлено или не указано иное, все арильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Выражение "арилалкил" относится к арильной группе, определенной выше, связанной непосредственно с алкильной группой, определенной выше, например, -CH2C6H5 и -C2H4C6H5. Если не установлено или не указано иное, все арилалкильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Выражение "гетероарил", если не указано иное, относится к замещенным или незамещенным 5-14-членным ароматическим гетероциклическим кольцевым радикалам с одним или несколькими гетероатомами, независимо выбранными из N, O или S. Гетероарилом может быть моно-, би- или трициклическая кольцевая система. Гетероарильный кольцевой радикал может быть присоединен к основной структуре на любом гетероатоме или атоме углерода, что приводит к созданию стабильной структуры. Примеры таких гетероарильных кольцевых радикалов включают без ограничения оксазолил, изоксазолил, имидазолил, фурил, индолил, изоиндолил, пирролил, триазолил, тиазинил, тетразоил, тиенил, тиазолил, изотиазолил, пиридил, пиримидинил, пиразинил, пиридазинил, бензофуранил, бензотиазолил, бензоксазолил, бензимидазолил, бензотиенил, бензопиранил, карбазолил, хинолинил, изохинолинил, хиназолинил, циннолинил, нафтиридинил, птеридинил, пуринил, хиноксалинил, хинолинил, изохинолинил, тиадиазолил, индолизинил, акридинил, феназинил, имидазо[1,2-a]пиридил, имидазо[1,2-a]пиридин и фталазинил. Если не установлено или не указано иное, все гетероарильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Выражение "гетероарилалкил" относится к гетероарильному кольцевому радикалу, связанному непосредственно с алкильной группой. Гетероарилалкильный радикал может быть присоединен к основной структуре на любом атоме углерода в алкильной группе, что приводит к созданию стабильной структуры. Если не установлено или не указано иное, все гетероарилалкильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Если не указано иное, выражение "замещенный", используемое в настоящем документе, относится к группе или фрагменту с одним или несколькими заместителями, присоединенными к структурному скелету группы или фрагмента, в том числе без ограничения к таким заместителям как дейтерий, гидрокси, галоген, карбоксил, циано, нитро, оксо (=О), тио (=S), алкил, галогеналкокси, алкенил, алкинил, арил, арилалкил, циклоалкил, циклоалкилалкил, циклоалкенил, амино, алкиламино, диалкиламино, гетероарил, гетероциклилалкильное кольцо, гетероарилалкил, гетероциклическое кольцо, гуанидин, алкилгуанидин, -COORx, -C(О)Rx, -C(S)Rx, -C(О)NRxRy, -(O)ONRxRy, -NRxCONRyRz, -N(Rx)SORy, -N(Rx)SO2Ry, -(=N-N(Rx)Ry), -NRxC(О)ORy, -NRxRy, -NRxC(О)Ry, -NRxC(S)Ry, -NRxC(S)NRyRz, -SONRxRy, -SO2NRxRy, -ORx, -ORxC(О)NRyRz, -ORxC(О)ORy, -OC(О)RX, -OC(О)NRxRy, -RxNRyC(О)Rz, -RxORy, -RxC(О)ORy, -RxC(О)NRyRz, -RxC(О)Ry, -RxOC(О)Ry, -SRx, -SORx, -SO2Rx и -ONO2, где Rx, Ry и Rz независимо выбраны из водорода, алкила, алкокси, алкенила, алкинила, арила, арилалкила, циклоалкила, циклоалкенила, амино, алкиламино, диалкиламино, арила, гетероарила, гетероциклилалкильного кольца, гетероарилалкила или замещенного или незамещенного гетероциклического кольца.
Вышеупомянутое выражение "гетероциклическое кольцо" или "гетероциклил", если не указано иное, относится к замещенному или незамещенному неароматическому 3-15-членному кольцевому радикалу, который состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из азота, фосфора, кислорода и серы. Гетероциклическим кольцевым радикалом может быть моно-, би- или трициклическая кольцевая система, которая может включать слитые, мостиковые или спиро кольцевые системы, и атомы азота, фосфора, углерода, кислорода или серы в гетероциклическом кольцевом радикале необязательно могут быть окислены до различных степеней окисления. Кроме того, атом азота необязательно может быть кватернизирован; также, если иным образом не ограничено определением, гетероциклическое кольцо или гетероциклил необязательно может содержать одну или несколько этиленовых связей. Примеры таких гетероциклических кольцевых радикалов включают без ограничения азепинил, азетидинил, бензодиоксолил, бензодиоксанил, хроманил, диоксоланил, диоксафосфоланил, декагидроизохинолил, инданил, индолинил, изоиндолинил, изохроманил, изотиазолидинил, изоксазолидинил, морфолинил, оксазолинил, оксазолидинил, оксадиазолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, октагидроиндолил, окстагидроизоиндолил, пергидроазепинил, пиперазинил, 4-пиперидонил, пирролидинил, пиперидинил, фенотиазинил, феноксазинил, хинуклидинил, тетрагидроизохинолил, тетрагидрофурил, тетрагидропиранил, тиазолинил, тиазолидинил, тиаморфолинил, тиаморфолинил сульфоксид и тиаморфолинил сульфон. Гетероциклический кольцевой радикал может быть присоединен к основной структуре на любом гетероатоме или атоме углерода, что приводит к созданию стабильной структуры. Если не установлено или не указано иное, все гетероциклильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Выражение "гетероциклилалкил" относится к гетероциклическому кольцевому радикалу, непосредственно связанному с алкильной группой. Гетероциклилалкильный радикал может быть присоединен к основной структуре на любом атоме углерода в алкильной группе, что приводит к созданию стабильной структуры. Если не установлено или не указано иное, все гетероциклилалкильные группы, описанные или заявленные в настоящем документе, могут быть замещенными или незамещенными.
Соединения согласно настоящему изобретению могут образовывать кислые соли, если в молекуле присутствует аминная или основная функциональная группа. Кислоты могут быть природными или синтетическими и, как правило, могут содержать карбоновую, сульфоновую функциональную группу. В качестве альтернативы, кислые соли могут быть получены из любых минеральных кислот, таких как хлористоводородная кислота, серная кислота, борная кислота и т.д., дающих хлориды, сульфаты, нитраты, фосфаты, бораты и т.д.
Соединения согласно настоящему изобретению также могут образовывать основные соли, если в молекуле присутствуют кислотные функциональные группы, такие как карбоновая, сульфоновая, тетразолильная и ациламиносульфонатные. Основания, необходимые для образования соли, могут быть природными или синтетическими и, как правило, могут содержать замещенную или незамещенную первичную, вторичную, третичную аминную функциональную группу, такую как этиламин, изопропиламин, трет-бутиламин, триалкиламины, меглумин и т.д. В качестве альтернативы, основные соли могут быть получены из гидроксидов какого-либо из щелочного или щелочно-земельного металла или карбонатов, таких как гидроксид натрия, гидроксид магния и т.д.
Как кислые, так и основные соли можно использовать в способах очистки конечных продуктов и промежуточных соединений. Если соединения содержат более одной кислотной функциональной группы, такой как у двухосновной кислоты, соли могут быть образованы из одного или нескольких оснований, соответственно, с сохранения электронейтральности.
Некоторые из соединений, описанных в настоящем документе, относятся к соединениям формулы (I), (Ia), (Ib) или (Ic), содержащим один или несколько хиральных центров и относящимся к рацемической смеси изомеров 'R' и 'S' или любой форме, в зависимости от происхождения или от условий их синтеза. Оптические изомеры могут быть разделены при необходимости. Способ разделения можно наилучшим образом выполнять на стадии промежуточного соединения или на стадии конечного продукта в некоторых случаях.
Некоторые из соединений, описанных в настоящем документе, относятся к соединениям формулы (I), (Ia), (Ib) или (Ic), содержат один или несколько “алкенов” и могут быть представлены либо цис-, либо транс-конфигурационными изомерами, предпочтительно транс-изомером. В случае “оксимов” могут предусматривать син- или анти-конфигурацию или их смесь.
Новые соединения согласно настоящему изобретению могут применяться для указанной цели либо отдельно, либо в комбинации с NSAID, такими как ингибиторы COX-2, антагонисты H1, ингибиторы PDE IV, или даже со стероидами при различных патологических состояниях, таких как мигрень, крапивница, аллергические расстройства, астма или COPD. В качестве альтернативы, эти соединения можно применять как бронходилататоры или даже как ингибиторы липоксиназы.

формула (Ia) (где p = -CH2- ; A = -NRR)
Схема 1
В одном варианте осуществления согласно общей схеме синтеза 1 некоторые из соединений формулы Ia получали из промежуточного соединения-спирта 5. Такой хинолиновый аналог описывается в литературе: M. Labelle et. al., Bio. Org. Med. Chem. Lett., 1994, 4, 463, или M. Labelle et. al., ibid, 1995, 5, 293. В реакции Риттера в присутствии ацетонитрила или хлорацетонитрила и кислоты или кислоты Льюиса промежуточное соединение 5 превращается в ацетамид 6a или хлорацетамид 6b, который при кислотном гидролизе и этерификации дает амин 6c. Кислоты, применяемые в способе с реакцией Риттера, выбирают из сильных кислот, таких как серная кислота, алкилсульфоновые кислоты, галогенсульфоновые кислоты, галогеналкилсульфоновые кислоты, минеральные кислоты, органические кислоты, такие как трифторуксусная кислота или муравьиная кислота и т.д. Также можно использовать кислоты Льюиса/кислые соли, такие как TMS-трифлат, скандия трифлат, висмута трифлат и т.п., также можно использовать комбинацию кислот.
Обработка 6c различными электрофильными реагентами, такими как хлорангидриды/ангидриды кислоты/изоцианаты/карбамоилхлориды/тиокарбомоилхлориды/алкилгалогениды/эпоксиды/сульфонилхлориды и т.п., как показано на фигуре 1, будет давать некоторые соединения, такие как амиды/амидокислоты/карбаматы/мочевины, представленные в Ia.1-Ia.86, приведенных в таблице 1. Хиральные производные амина могут быть получены из хиральной версии спирта 5 или путем разделения рацемической смеси амина 6c с использованием хиральной кислоты, такой как винная кислота/хиральная сульфоновая кислота/миндальная кислота и т.д., в виде диастереомерной соли с последующей нейтрализацией. Некоторые другие производные из таблицы 1 синтезировали путем обработки амина 6c диальдегидами или дигалогенидами с получением гетероциклических производных.

Фигура 1
Реакция нуклеофильного замещения хлорацетамида 6b с выбранными нуклеофилами, такими как фенол/феноксиды/тиофенолы/тиофеноксиды/амины/аминокислотные производные, как показано на фигуре 2, приводила к некоторым из производных, либо непосредственно, или путем последующей стадии гидролиза, как показано в таблице 1.

Фигура 2
Как показано в вышеприведенной схеме 1, многие из кетосоединений 4 получали и применяли в данной работе путем обработки аллиловых спиртов 3 различными гелогенаренами, представленными на фигуре 3, при условиях реакции присоединения Хека. Реакцию Виттига также можно использовать для получения альдегидов 2a.

Фигура 3
Аллиловые спирты 3, необходимые в данной работе, последовательно получали из альдегидов 2a/2b при стандартных условиях реакции Гриньяра с использованием винилмагниевых реагентов. Альдегиды, такие как 2a, можно легко синтезировать конденсацией 2-метил-замещенных хромофоров, полученных из хинолина/хиноксалина/бенз(c)тиазола, представленного как 1a, в присутствии органических ангидридов, таких как уксусный ангидрид/пропионовый ангидрид, с арилдиальдегидами 1b при повышенных температурах либо с растворителем, таким как гексан, гептан, толуол, ксилол и т.д., либо без растворителя. В альтернативных способах этого процесса галогенарены, применяемые для синтеза соединений согласно настоящему изобретению, можно получать непосредственно из коммерческих источников или получать многостадийным синтезом, известным из уровня техники.

Схема 2
В другом варианте осуществления (схема 2) альдегиды, такие как 2a/b, полученные из замещенных или незамещенных хинальдинов/бенз[c]тиазолов/хиноксалинов (M. Labelle et. al., Bio. Org. Med. Chem. Lett., 1994, 4, 463 или M. Labelle et. al., ibid, 1995, 5, 293), обрабатывали триалкилсульфоксониевой солью/триалкилсульфониевыми солями с образованием эпоксидов 7 при условиях Кори-Чайковского (E.J. Corey et. al., J, Am. Chem. Soc., 87, 1353, 1965, и E.J. Corey et. al, Org. synth., 49, 78, 1969).
Ахиральные/хиральные эпоксиды 7 открывали при основном условии с нуклеофилами, полученными из фенолов/тиофенолов (фигура 2), с получением спирта, такого как 8, который в свою очередь превращали в амины, такие как 9c, в несколько стадий, а именно последовательностью галогенирования-азидирования-восстановления как при условии реакции Штаудингера. В качестве альтернативы, некоторые из спиртов превращали в ациламиды при условиях Риттера, как описано ранее. Ахиральные/хиральные эпоксиды 7 также можно открывать при умеренных кислотных условиях/в условиях кислоты Льюиса в присутствии различных спиртов, таких как метанол, этанол, изопропанолфенэтиловый спирт, аллиловый спирт, пропаргиловый спирт, циклогексанол, циклопропилметанол и т.д. (фигура 4), с образованием бета-алкокси-спиртов, таких как 10, которые при реакции Мицунобу (O. Mitsunobu, Synthesis 1981, 1 и S.D. Lepore and Y. He, J. Org. Chem., 68, 8261, 2003) с различными фенолами/тиофенолом (выбранными из фигуры 2) дают соединения, такие как 11. При основном гидролизе некоторые соединения могут давать рацемические или хиральные производные интереса, как показано в формуле (Ia).

Фигура 4
Настоящее изобретение не ограничивается примерами, упомянутыми в следующих таблицах, и предусматривает некоторые замещенные хинальдины, тиазолы и хиноксалиновые хроматофоры, такие как хинальдин, 7-хлорхинальдин, 7-фторхинальдин, 6-фторхинальдин, 7-метокси-хинальдин, 6,7-дихлорхиналидин, 7,8-дихлорхинальдин, 7-хлор-6-фторхинальдин, 6,7-дифторхинальдин, 2-метилбензо[c]тиазол, 6-хлор-2-метилбензо[c]тиазол, 2-метилхиноксалин и 7-хлор-2-метилхиноксалин и т.д.
Оксимы 12 и оксим-эфиры 13 также получали из кетосоединения 4 при обычных реакционных условиях. В еще одном варианте осуществления кетосоединения, такие как 4 или 8a, обрабатывали триалкилортоформиатом в спирте/гликолях/тиогликолях в присутствии каталитической кислоты, такой как минеральная кислота, пара-толуолсульфоновая кислота (PTSA), камфора-сульфоновая кислота (CSA), твердые кислотные катализаторы, такие как amberlyst-H+, другие смоляные кислоты или глины, с получением открытых или циклических кеталей 14 и 15, как показано в схеме 3 (где U и V представляют гетероатомы, такие как -О-, -S- или -NR-). Кроме того, кетали, содержащие сложноэфирные фрагменты, гидролизовали при обычном основном условии с образованием кислоты или ее производных, как показано в формуле (Ib) (см. таблицу 2). Также некоторые из пролекарств из кислот синтезировали и тестировали в отношении желаемой активности.

Схема 3
В дополнение, как в схеме 4, неполные эфиры многоатомного спирта 10 можно обрабатывать алифатическими бромозащищенными сложными эфирами при основных условиях до 16 с последующим сложноэфирным гидролизом с получением некоторых из соединений, представленных формулой (Ic) (показанных в таблице 2).

Схема 4
Альдегиды 2a/2b превращали в кетогалогенид 17 в несколько стадий, а затем обрабатывали различными алифатическими тиоловыми сложными эфирами и из полученной структуры 18 при кетализировании получали кеталь-сложный эфир 19. Гидролиз сложного эфира 19 при обычном основном условии давал некоторые из алифатических соединений интереса, как показано в формуле (Ic). Подобным образом, некоторые из кетальных производных формулы (Ib) получали из халькона 4a, полученного из аллилового спирта 3 путем окисления до 3a и соединения с галогенаренами, показанными на фигуре 3.
Соединения согласно настоящему изобретению могут быть проиллюстрированы следующими неограничивающими примерами.
Таблица 1: соединения формулы (Ia)
l#Масс определяли в режиме CI. Обозначенные конфигурации являются относительными.
Таблица 2: соединения формул (Ib) и (Ic)
Представлены иллюстративные способы синтеза и реакционные условия.
В одном варианте осуществления, изображенном на схеме 5, промежуточное соединение 21 сложного неполного эфира многоатомного спирта синтезировали из известного промежуточного кетосоединения 20, а затем 21 обрабатывали серной кислотой в присутствии ацетонитрила и ледяной уксусной кислоты с получением амида 22 с применением реакции Риттера. Последующий кислотный гидролиз соединения 22 давал промежуточное соединение аминокислоты 23. Обычная этерификация аминокислоты 23 давала промежуточное соединение сложного эфира 24, которое при обработке различными электрофилами, такими как хлорангидриды/ангидриды кислот/изоцианаты/карбамоилхлориды/тиокарбомоилхлориды/алкилгалогениды/эпоксиды/сульфонилхлориды и т.п. (фигура 1), либо при нейтральных, либо при основных условиях способов получения амидов A, B или C давало в результате различные сложные эфир-амиды, гидролизом которых получали некоторые производные, показанные в таблице 1. Например, 23 непосредственно реагирует с некоторыми циклическими ангидридами, такими как янтарный и фталевый ангидриды, с получением производных двухосновных кислот, таких как (Ia.04) и (Ia.07) (таблица 1). В некоторых случаях аминокислотное промежуточное соединение 23 может непосредственно реагировать со смешанными ангидридами, полученными из капроновой кислоты и пиволилхлорида, с получением производного, такого как (Ia.09).
Подобным образом, известное диоловое промежуточное соединение 25 обрабатывали метансульфонилхлоридом с получением моно-мезилированного продукта 26, обработка натрия азидом которого дает азидоспирт 27. Восстановление азидогруппы в трифенилфосфине (TPP), воде-диоксане давало аминоспирт 28. Последующая реакция этого аминола 28 с различными вышеприведенными электрофилами (фигура 1) давала некоторые из соединений, описанных в таблице 1. Например, обработка 28 4,5-дихлорфталевым ангидридом давала (Ia.58). При реакции 28 с хлорацетилхлоридом в результате получалось 28a, которое при дальнейшей обработке тиогликолевой кислотой давало продукт нуклеофильного замещения (Ia.64). Подобным образом, если хлоралкил-амидный сложный эфир 22a обрабатывали морфолином в качестве нуклеофила, последующее воздействие щелочным гидролизом давало (Ia.16), как описано в экспериментальном разделе.
Согласно одной методике эпоксид 30, необходимый в настоящем документе, можно получать путем обработки известного альдегида 29 (JOC, 1989, 54, 3718-3721) в одну стадию с применением реакции Кори-Чайковского. Обработка 30 фенолом 31, полученным из метилсалицилата, как показано на схеме 6, давала в результате оксадиол 32, который в свою очередь обрабатывали согласно схеме (посредством азида) с получением аминоспирта 35. Аминоспирт 35 также можно непосредственно получать обработкой мезилата 33 источником амина, таким как HMTA. Промежуточное соединение 35 применяли для синтеза некоторых из соединений, родственных соединениям формулы (Ia) (см. таблицу 1), таких как (Ia.109).

Схема 5

Схема 6
Некоторые из амидных производных, таких как (Ia.38) и (Ia.75), синтезировали согласно представленной схеме 7.

Схема 7
Если аминокислота 23 была защищена трет-бутоксикарбонильной (boc) функциональной группой и амидирована при обычных условиях до 37, последующее алкилирование при основных условиях давало 39. После снятия защиты с 37 и 39 полученные в результате амин-амиды 38 и 40 обрабатывали циклическим ангидридом, таким как фталевый ангидрид, с получением соединений интереса. Дальнейшей этерификацией (Ia.38) превращали в (Ia.48), или, в другом случае, 38 можно было превращать непосредственно в (Ia 48).
В другом осуществлении настоящего изобретения сложный эфир-амид 22a, полученный реакцией Риттера из 21 с хлорацетонитрилом (согласно схеме 5), обрабатывали нуклеофилами, такими как морфолин, с получением морфолинового сложного эфира, который при гидролизе давал производное, такое как (Ia.16).
Для получения хиральных производных рацемический сложный аминоэфир 24/24a подвергали разделению фракциональной кристаллизацией как диастереомерную соль с использованием любой из хиральных кислот, таких как винная кислота/камфорная сульфокислота/миндальная кислота, или любого другого средства хирального разделения в подходящем растворителе и при подходящей температуре путем одной или нескольких кристаллизаций.
В другом варианте осуществления, показанном на схеме 8, известный сложный кетоэфир 20 при кислотной обработке этиленгликолем/этилортоформиатом в этаноле с получением циклических/ациклических кеталей 41 или 42 при азеотропных условиях/нагревании с обратным холодильником с последующим основным гидролизом давал определенные соединения, представленные формулой Ib, такие как (Ib.04)/(Ib.96). При осуществлении настоящего изобретения кислоты, полученные по схеме 8, превращали в амиды/сложные эфиры выбора согласно описанным ранее способам. Промежуточное кетосоединение 20 обрабатывали гидроксиламином с получением оксима 43, и последующее o-алкилирование и сопутствующий гидролиз давали оксим-кислоты, такие как (Ib.145), описанные в настоящем документе.
Согласно настоящему изобретению кетали и кетоксим-эфиры тестировали с помощью анализов связывания LTD4 и установили, что они представляют особый интерес. Кроме того, настоящее изобретение не ограничивается ими и может распространяться также на их производные, такие как гидразоны.

Схема 8
Ранее описанный эпоксид 30 обрабатывали ледяной уксусной кислотой/BF3-эфиратом в присутствии различных спиртов, таких как циклопропилметанол, как показано на схеме 9, с получением рацемического эфирного спирта 44, который при обработке метилсалицилатом при условии Мицунобу давал сложный эфир 45. Гидролиз 45 давал производное (Ia.96).
При основном условии эпоксид 30 открывали тиосалицилатом, а затем спирт 46 окисляли (по Сверну) с получением промежуточного соединения 47, которое использовали в получении некоторых из производных, таких как (Ib.41). Подобным образом алифатические сложные тиоэфиры могут открывать эпоксид 30 с получением соответствующих алифатических производных (формула Ic).

Схема 9
Кеталь-амид, такой как (Ib.36), можно синтезировать согласно схеме 10. Таким образом, гидроксикислоту 48 лактонизировали при мягких условиях с получением лактона 49. Обработка лактона различными аминами, такими как пирролидин, давала промежуточное соединение амида оксикислоты 50. Окисление 50 при условиях Сверна до 51 с последующей кетализацией при описанном ранее стандартном условии давало (Ib.36).
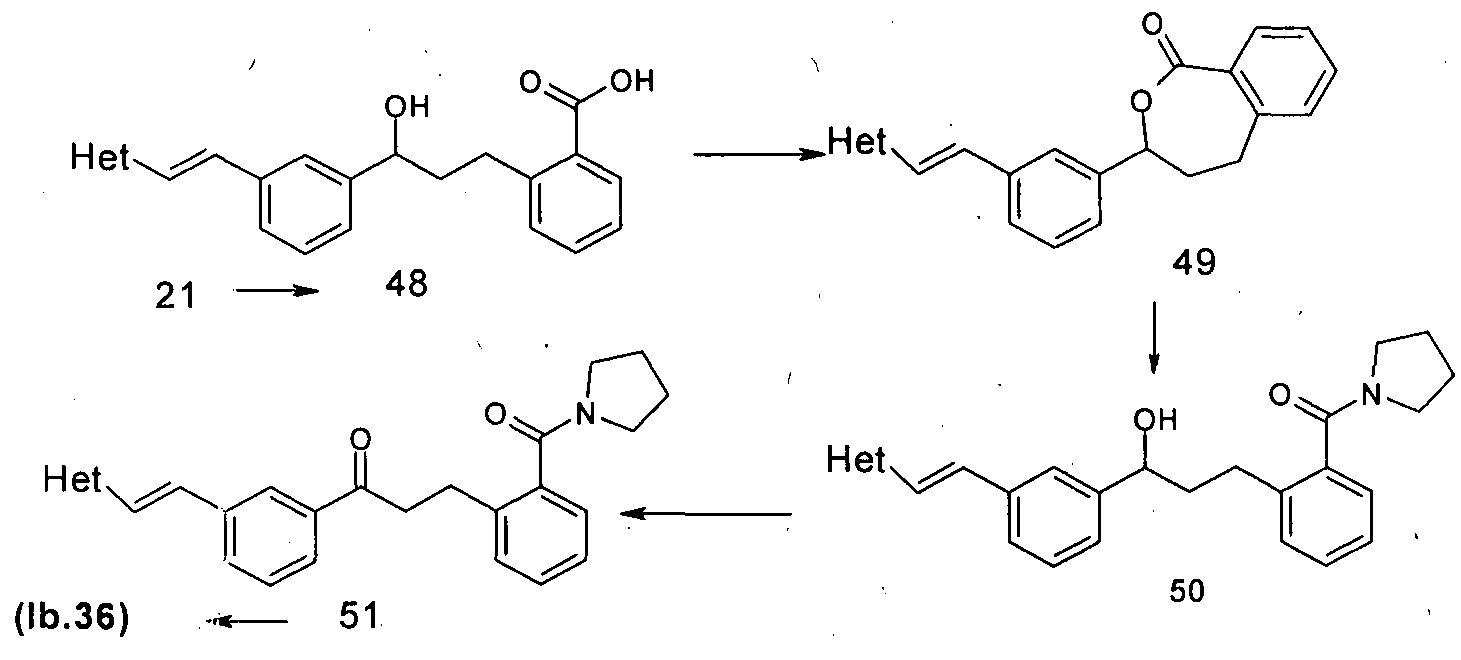
Схема 10

Схема 11
Хиральные производные в соответствии с настоящим изобретением можно синтезировать согласно следующим способам, предусматривающим способы хирального разделения или асимметричный синтез необходимых хиральных спиртов, как описано на схеме 11. В способе A иллюстративная реакция окисления спирта 52 дает замещенную миндальную кислоту, такую как 53, в виде рацемической смеси энантиомеров, которая при химическом разделении дает разделение изомеров (+) и (-) при одном или нескольких способах кристаллизации. Восстановление кислоты обратно дает хиральный спирт 54, который реакцией Мицунобу и гидролизом превращают в соединение, такое как (Ia.166), в виде хирального производного. В способе B альдегид 29 (JOC, 1989, 54, 3718-3721) превращали в метилкетон 57 при условиях окисления Сверна, а затем бромировали с помощью NBS с получением кето-бромида 58. Хиральное восстановление кето-бромсодержащего соединения 58 с (+) DIP хлорид/CBS катализатором с последующей обработкой основанием давало хиральный эпоксид 59. Вышеописанное открытие кольца эпоксида при кислых условиях/с кислотой Льюиса в этаноле 59 давало хиральный спирт 56 с обратимой конфигурацией. Разделение наилучшим образом можно осуществлять на промежуточной стадии, как показано в настоящем документе, или при необходимости на конечных соединениях. В качестве альтернативы, многие из конечных производных можно получать в виде рацемической смеси кислот из рацемических эпоксидов, а разделение изомеров можно выполнять на конечном продукте с помощью хиральной колоночной хроматографии.
В еще одном варианте осуществления, описанном на схеме 12, можно синтезировать соединения в соответствии с настоящим изобретением (формула I), где -Z- представляет собой радикал, представленный группами -C=C- (либо цис, либо транс, и предпочтительно транс) или -О-CH2-.
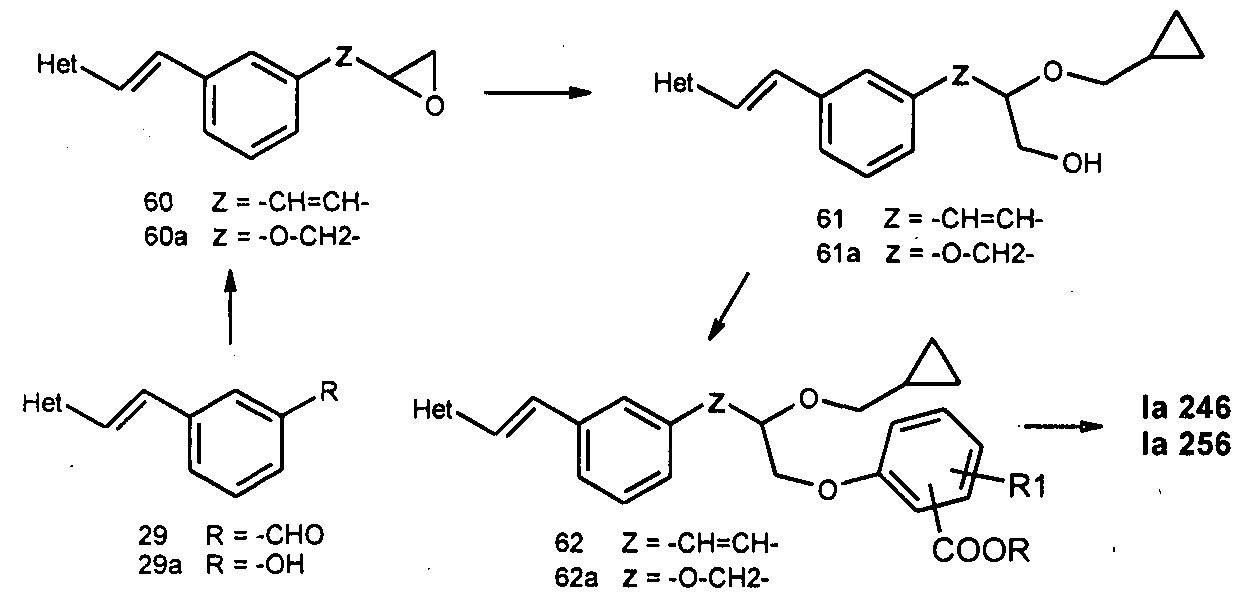
Схема 12
Таким образом, известный альдегид 29 обрабатывали ацетоном в щелочных условиях и затем продукт конденсации бромировали NBS с последующим восстановлением натрия боргидрида, и последующая обработка щелочью давала эпоксидное промежуточное соединение 60. Обычное открытие эпоксида при условиях кислоты Льюиса (BF3-эфират) со спиртом, таким как циклопропилметанол, давало в результате неполный эфир многоатомного спирта 61. Дальнейшая обработка спирта различными замещенными фенолами при описанной ранее реакции Мицунобу и последующий гидролиз давали некоторые из описанных соединений, таких как Ia-246 и Ia-247, при хиральном разделении рацемической смеси.
В другом осуществлении известной методики фенол 29a обрабатывали эпихлоргидрином с превращением в необходимое эпоксидное промежуточное соединение 60a, которое при открытии кислотного кольца давало промежуточное соединение неполного эфира многоатомного спирта 61a. Дальнейшая химическая трансформация согласно данной методике давала в результате соединения Ia-256 и Ia-257. Настоящее изобретение не ограничивается упомянутыми в настоящем документе примерами, но получением такого класса соединений как антагонисты LTD4.
Эксперименты
Большинство соединений, представленных в настоящем документе, аналитически характеризовали с помощью1Н-ЯМР, масс-спектроскопических техник. Выражение «общепринятая обработка» в экспериментальном разделе относится к добавлению органического вещества в несмешивающийся с водой растворитель, промыванию органической фазы водой, солевым раствором с последующей сушкой с сульфатом натрия и концентрированию перед подверганием флеш-хроматографии (FC).
Общие процедуры для амидов формулы Ia
Способ A: К раствору амина (1,0 г) в дихлорметане (20 мл) добавляли триэтиламин (1,5 экв.), а затем хлорангидридный реагент из фигуры 1. Взбалтывали при комнатной температуре, добавляли воду и экстрагировали дихлорметаном, промывали водой, солевым раствором и сушили над сульфатом натрия (общепринятая обработка) и подвергали FC с получением продукта формулы Ia.
Способ B: К раствору амина (1,0 г) в дихлорметане (20 мл) добавляли ангидрид из фигуры 1. Взбалтывали при комнатной температуре, добавляли воде и экстрагировали дихлорметаном, промывали водой, солевым раствором, сушили над сульфатом натрия и подвергали FC с получением продукта формулы Ia.
Способ C: К раствору амина (1 г) в растворителе (20 мл) добавляли раствор смешанного ангидрида, полученный добавлением к кислоте (1,1 экв.), пиволилхлориду (1,1 экв.) и триэтиламину (1,2 экв.) также в одном и том же растворителе (10 мл). Взбалтывали при комнатной температуре добавляли воду и экстрагировали дихлорметаном, промывали водой, солевым раствором, сушили над натрия сульфатом и подвергали FC с получением продукта формулы Ia.
Пример 1: метиловый сложный эфир 2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил-фенил}-3-гидроксипропил)-бензойной кислоты 21
К раствору сложного кетоэфира 20 (10 г, 21,9 ммоль) в (1:2) смеси метанола с дихлорметаном (150 мл) добавляли боргидрид натрия (626 мг, 16,5 ммоль) в азоте. Реакционную смесь взбалтывали при окружающих условиях в течение 1 часа. К вышеуказанной смеси добавляли воду (50 мл) и взбалтывали еще 20 минут. К полученной в результате смеси добавляли дихлорметан (100 мл), органическую фазу отделяли с последующей общепринятой обработкой, концентрацией и FC с получением грязно-белого рацемического твердого вещества 21 (8,0 г, 80%).
Пример 2: метиловый сложный эфир 2-(3-ацетиламино-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил-фенил}-пропил)-бензойной кислоты 22
К взбалтываемому раствору 21 (1,0 г, 2,18 ммоль) в ледяной уксусной кислоте (5 мл) добавляли ацетонитрил (20 мл), раствор конц. серной кислоты (0,58 мл) в ледяной уксусной кислоте (5 мл) при 0°C и взбалтывали в течение 10 минут. Реакционную смесь нагревали до комнатной температуры и выдерживали в течение 24 часов. Реакционную смесь выливали в воду (100 мл), ощелачивали до pH 12 водн. NaOH и экстрагировали этилацетатом с последующей общепринятой обработкой, концентрацией и FC с получением соединения 22 (0,7 г, 64%) в виде грязно-белого твердого вещества.
Пример 3: метиловый сложный эфир 2-(3-ацетиламино-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил-фенил}-пропил)-бензойной кислоты 22a
Согласно процедуре, описанной для соединения 22 с использованием хлорацетонитрила вместо ацетонитрила получали 22a (51%).
Пример 4: 2-(3-амино-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил-фенил}-пропил)-бензойная кислота 23
Взбалтываемый раствор сложного эфира-ацетамида 22 (100 мг, 0,2 ммоль) в 1,4-диоксане (10 мл) обрабатывали 4 M водн. хористоводородной кислотой (10 мл) при температуре флегмы (110°C) в течение ночи. Полученную в результате смесь выливали в воду (100 мл), ощелачивали водн. NaOH до pH 8,0-10,0, нейтрализовали водн. уксусной кислотой и фильтровали. Полученный остаток сушили с получением аминокислоты 23 (30 мг, 34%) в виде белого твердого вещества.
Пример 5: (способ B): 2-(3-(3-карбоксипропиониламино)-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-пропил)-бензойная кислота (Ia.04)
К взбалтываемому раствору аминокислоты 23 (0,5 г, 1,13 ммоль) в дихлорметане добавляли янтарный ангидрид (0,34 г, 3,39 ммоль) в азоте. Реакционную смесь взбалтывали в течение 1,5 часов при комнатной температуре и фильтровали с получением твердого остатка. Остаток промывали дихлорметаном (2 x 5 мл) с последующим промыванием н-гексаном (2 x 10 мл) и сушили под вакуумом с получением продукта двухосновной кислоты (Ia.04) (0,2 г, 31%) в виде грязно-белого твердого вещества.
Пример 6: (Способ C): 2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-гексаноиламинопропил)-бензойная кислота (Ia.09)
К взбалтываемому раствору капроновой кислоты (262 мг, 2,26 ммоль) в дихлорметане (10 мл) добавляли триэтиламин (0,62 мл, 4,52 ммоль) и пиволилхлорид (0,3 мл, 2,48 ммоль) в азоте. Полученную в результате смесь взбалтывали в течение 15 минут, добавляли аминокислоту 23 (500 мг, 1,13 ммоль) в виде раствора в дихлорметане (10 мл) и взбалтывали в течение 24 часов. Реакционную смесь гасили водой (50 мл) и подкисляли до pH 6 с использованием уксусной кислоты. Полученную в результате смесь экстрагировали дихлорметаном с последующей общепринятой обработкой и FC с получением Ia.09 (150 мг, 25%) в виде грязно-белого твердого вещества.
Пример 7: 2-[3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-(2-морфолин-4-ил-ацетиламино)-пропил)-бензойная кислота (Ia.16)
Этап 1: метиловый сложный эфир 2-[3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-(2-морфолин-4-ил-ацетиламино)-пропил)-бензойной кислоты
К взбалтываемому раствору сложному хлорсодержащему эфиру 22a (1,0 г, 0,0019 моль) в THF (25 мл) добавляли морфолин (0,38 мл, 0,0028 моль), тетрабутиламмония йодид (25 мг) и взбалтывали в течение ночи. Полученную в результате смесь концентрировали и подвергали FC с получением сложного морфолин-эфира (0,8 г, 73,39%) в виде бесцветного масла.
Этап 2
К взбалтываемому раствору сложного морфолин-эфира (0,8 г, 0,0014 моль) в диоксане (30 мл) добавляли 10% водн. NaOH (5,5 мл, 0,014 моль). Реакционную смесь нагревали при 100°C в течение 3 часов, охлаждали до температуры окружающих условий с последующим добавлением уксусной кислоты (10 мл). Растворители выпаривали с последующим добавлением этилацетата (100 мл) и воды (35 мл). Органический слой отделяли с последующей общепринятой обработкой. Растворитель полностью выпаривали с получением остатка, который насыщали диэтиловым эфиром и фильтровали с получением кислоты (Ia.16) (0,388 г, 49,74%) в виде твердого вещества.
Пример 8: этил-2-(3-амино-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил)-фенил}-пропилбензоат 24
К взбалтываемому раствору аминокислоты 23 (4,0 г, 9,0 ммоль) в абсолютном этаноле (40 мл) каплями добавляли конц. серную кислоту (2,0 мл). Смесь нагревали с обратным холодильником в течение 3 часов и концентрировали под вакуумом. Полученное остаточное масло растворяли в дихлорметане (100 мл), промывали водн. карбонатом натрия (pH = 8,0), водой и солевым раствором, сушили над сульфатом натрия и концентрировали с получением сложного аминоэфира 24 (5,0 г, 94%) в виде желтого масла.
Пример 9: (способ A): 2-[3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил-фенил}-3-(циклогексанкарбониламино)-пропил]-бензойная кислота (Ia.23)
К взбалтываемому раствору сложного аминоэфира 24 (1,0 г, 2,19 ммоль) в дихлорметане (25 мл) добавляли циклогексанкарбонилхлорид (0,35 мл, 2,63 ммоль). Реакционную смесь взбалтывали в течение 1 часа при комнатной температуре, разбавляли дихлорметаном (100 мл), промывали 10% водн. раствором карбоната натрия (pH = 8-9) и водой, сушили, выпаривали с получением остатка. Остаток насыщали диэтилэфиром (20 мл) с получением неочищенного сложного амидэфира (600 мг, 48%), который при обычном щелочном гидролизе давал (Ia.23) (72%) в виде грязно-белого твердого вещества.
Пример 10: 2-[2-(3-азидо-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-фенил}-пропил)-фенил]-пропан-2-ол 27
К суспензии диола 25 (7,3 г, 21,8 ммоль) в толуоле (30 мл) и ацетонитриле (70 мл) в азоте добавляли DIEA (5,0 мл, 28,4 ммоль) и мезилхлорид (2,0 мл, 26,2 ммоль) при -25°C. Реакционную смесь взбалтывали в течение 3 часов и обеспечивали охлаждение до -60°C. В вышеуказанную смесь добавляли гексан (50 мл) и взбалтывали в течение 1 часа. Полученный в результате неочищенный твердый мезилат 26 фильтровали в азоте и переносили в другую колбу, содержащую DMF (50 мл). Азид натрия (7,0 г, 109 ммоль) добавляли в колбу и содержимое взбалтывали при окружающих условиях в течение 12 часов. Воду (100 мл) добавляли для погашения реакционной массы. Полученную в результате смесь экстрагировали дихлорметаном. Органический слой промывали водой (50 мл), сушили, концентрировали и подвергали FC с получением азида 27 (5,0 г, 63%) в виде желтого твердого вещества.
Пример 11: 2-[2-3-амино-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-фенил}-пропил)-фенил]-пропан-2-ол 28
К раствору азидо-спирта 27 (4,0 г, 8,0 ммоль) в THF (25 мл) добавляли TPP (2,317 г, 8,83 ммоль) и воду (2,0 мл). Реакционную смесь взбалтывали при окружающих условиях в течение 36 часов. К полученной в результате смеси добавляли дихлорметан. Органическую фазу отделяли, концентрировали и подвергали FC с получением аминоспирта 28 (2,5 г, 66%) в виде желтого твердого вещества.
Пример 12: 2-хлор-N-{1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-[2-(1-гидрокси-1-метилэтил)-фенил]-пропил}-ацетамид 28a
К хорошо взболтанному раствору аминоспирта 28 (1,0 г, 2,18 ммоль) в дихлорметане (25 мл) добавляли триэтиламин (0,365 мл, 2,29 ммоль) и хлорацетилхлорид (0,182 мл, 2,62 ммоль) и взбалтывали в течение 12-13 часов. К полученной в результате смеси добавляли 50% раствор водн. натрия бикарбоната (100 мл). Водный слой экстрагировали дихлорметаном (2 x 50 мл) и объединенный органический слой промывали водой (2 x 50 мл), сушили, выпаривали и кристаллизовали из эфира:гексана (50 мл, 75 мл) с получением 28a (0,850 г, 73%) в виде грязно-белого твердого вещества.
Пример 13: 4,5-дихлор-N-{1-{3-[(E)-2-(7-Хлорхинолин-2-ил)-винил]-фенил}-3-[2-(1-гидрокси-1-метилэтил)-фенил]-пропил}-фталамовая кислота (Ia.58)
К взбалтываемому раствору амина 28 (0,2 г, 0,00043 моль) в дихлорметане (1,0 мл) при 25-30°C добавляли 3,4-дихлорфталевый ангидрид (98 мг, 0,00045 моль). Реакционную смесь взбалтывали в течение 3 часов и фильтровали. Остаток промывали и сушили под вакуумом с получением кислоты (Ia 58) (0,2 г, 69%) в виде желтого твердого вещества.
Пример 14: 3-({l-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-[2-(1-гидрокси-1-метилэтил)-фенил]-пропилкарбамоил}-метилсульфонил)-пропионовая кислота (Ia.64)
К взбалтываемому раствору хлорамида 28a (0,5 г, 0,93 ммоль) в тетрагидрофуране (20 мл) выдерживали в азоте, добавляли 2-меркаптоуксусную кислоту (0,130 г, 1,87 ммоль) и калия трет-бутоксид (0,210 г, 1,87 ммоль). Реакционную массу взбалтывали в течение 5 часов, выливали в воду (100 мл) и подкисляли ледяной уксусной кислотой (10 мл) с последующей общепринятой обработкой в этилацетате и выпариванием с получением остатка. Полученный в результате остаток очищали с помощью FC с последующим насыщением гексаном с получением (Ia.64) (0,2 г, 36%) в виде бледно-желтого твердого вещества.
Пример 15: 7-хлор-2-[(E)-2-(3-оксиранил-фенил)-винил]-хинолин 30
К раствору триметилсульфония йодиду (7,66 г, 37,54 ммоль) в сухом DMSO (50 мл) в азоте добавляли 50% гидрида натрия (1,8 г, 37,54 ммоль). Раствор охлаждали до 10°C. Суспензию 3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-бензальдегида 29 (10,0 г, 34,12 ммоль) в THF (50 мл) добавляли к вышеупомянутому раствору одной порцией. Реакционную смесь взбалтывали при окружающих условиях в течение 2 часов и выливали в воду (1,0 л) с последующей общепринятой обработкой этилацетатом и FC с получением эпоксида 30 (7,0 г, 66%) в виде кремового твердого вещества.
Пример 16: 2-(1-гидрокси-1-метилэтил)-фенол 31
К взбалтываемому раствору метилмагния хлорида (134 мл, 3 M в THF), выдержанного в азоте при 0°C, добавляли раствор 2-гидроксиацетофенона (50 г, 367 ммоль) в безводном THF (100 мл). Реакционную смесь взбалтывали. После завершения реакции реакционную смесь обрабатывали 4 M уксусной кислотой (500 мл) с последующей общепринятой обработкой в дихлорметане и FC с получением гидроксифенола 31 (25 г, 45%) в виде бесцветного масла.
Пример 17: 2-[2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-гидрокси-этокси)-фенил]-пропан-2-ол 32
К взбалтываемому раствору эпоксида 30 (10,0 г, 32,57 ммоль) в DMF (30 мл) добавляли спирт 31 (7,425 г, 48,85 ммоль), карбонат калия (8,99 г, 65,14 ммоль). Реакционную смесь взбалтывали в течение ночи при 120-130°C. Полученную в результате смесь обрабатывали 10% водн. уксусной кислотой, далее разбавляли водой с последующей общепринятой обработкой в этилацетате и FC с получением диола 32 (7,0 г, 46%).
Пример 18: 1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-[2-(1-гидрокси-1-метилэтил)-фенил]-пропиловый сложный эфир метансульфоновой кислоты 33
К взбалтываемому раствору диола 32 (1,0 г, 2,17 ммоль) в сухом THF (10 мл) при 0°C добавляли TEA (0,45 мл, 3,26 ммоль) и мезилхлорид (0,18 мл, 2,38 ммоль). Реакционную смесь взбалтывали в течение 2 часов. К полученной в результате смеси добавляли насыщенный раствор натрия бикарбоната (20 мл) и воду (50 мл). Вышеуказанную смесь экстрагировали с использованием дихлорметаном. Дихлорметановый слой концентрировали с получением грязно-белой пены мезилата 33 (1,0 г, 86%), который использовали в следующей стадии без дополнительной очистки.
Пример 19: 2-[2-(2-азидо-2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]фенил}-этокси)-фенил]-пропан-2-ол 34
К взбалтываемому раствору мезилата 33 (1,0 г, 1,85 ммоль) в DMF (10 мл) при окружающих условиях добавляли азид натрия (483 мг, 7,43 ммоль). Реакционную смесь взбалтывали в течение ночи с последующей общепринятой обработкой этилацетатом и FC с получением азида 34 (0,5 г, 55%) в виде желтого твердого вещества.
Пример 20: 2-[2-(3-амино-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-пропил)-фенил]-пропан-2-ол 35
Следующей процедурой, описанной для соединения 28, получали аминоспирт 35 (выход 72%) в виде желтого твердого вещества в течение приблизительно 24 часов.
Пример 21: 2-{1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-[2-(1-гидрокси-1-метилэтил)-фенокси]-этилкарбамоил}-циклопент-1-енкарбоновая кислота (Ia.109)
К взбалтываемому раствору амина 35 (0,2 г, 0,436 ммоль) в дихлорметане (5,0 мл) добавляли 1-циклопентен-1,2-дикарбоновой кислоты ангидрид (0,057 г, 0,436 ммоль). Реакционную смесь взбалтывали в течение 12 часов в умеренном потоке азота. К полученной в результате смеси добавляли гексан (5 мл), взбалтывали в течение 15 минут и фильтровали. Полученный твердый остаток сушили под вакуумом с получением (Ia. 109) (0,150 г, 58%) в виде грязно-белого твердого вещества.
Пример 22: 2-(3-трет-бутоксикарбониламино-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-пропил)-бензойная кислота 36
К взбалтываемому раствору аминокислоты 23 (6,0 г, 0,0136 моль) в ацетонитриле (30 мл) и воде (30 мл) при окружающих условиях добавляли TEA (2,26 мл, 0,0163 моль) и (boc)ангидрид (3,94 мл, 0,0163 моль). Реакционную смесь взбалтывали в течение 30 минут. Добавляли 1 н HCl для нейтрализации реакционной смеси с последующей общепринятой обработкой в дихлорметане и концентрацией с получением boc-защищенного 36 (7,0 г, 95,23%) в виде грязно-белого твердого вещества.
Пример 23: трет-бутиловый сложный эфир [1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-(2-диэтил-карбамоилфенил)-пропил]-карбаминовой кислоты 37
К взбалтываемому раствору N-Boc-кислоты 36 (6,0 г, 0,011 моль) в ацетонитриле (60 мл) при окружающих условиях добавляли триэтиламин (1,85 мл, 0,0133 моль) и пивалоилхлорид (1,5 мл, 0,0122 моль). Реакционную смесь взбалтывали в течение 30 минут, обрабатывали диэтиламином (1,37 мл, 0,0133 моль) и далее взбалтывали при окружающих условиях в течение 3 часов с последующей общепринятой обработкой в дихлорметане и FC с получением амида 37 (2,4 г, 34,3%) в виде грязно-белого твердого вещества.
Пример 24: 2-(3-амино-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-пропил)-N,N-диэтилбензамид 38
После нижеупомянутой для соединения 40 процедуры снятия защитной группы boc получали соединение 38.
Пример 25: N-[1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-(2-диэтил-карбамоилфенил)-пропил]-фталамовая кислота (Ia.38)
К взбалтываемому раствору аминамида 38 (300 мг, 0,00059 моль) в дихлорметане (3 мл) добавляли фталевый ангидрид (96,5 мг, 0,00065 моль). Реакционную смесь взбалтывали при комнатной температуре в течение 1 часа, концентрировали и подвергали FC. Обогащенные продуктом фракции концентрировали и повторно кристаллизовали с использованием толуола с получением амида кислоты (Ia.38) (120 мг, 31,5%) в виде грязно-белого твердого вещества.
Пример 26: метиловый сложный эфир N-[1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-(2-диэтил-карбамоил-фенил)-пропил]-фталамовой кислоты: (Ia.48)
К взбалтываемому раствору метилгидрофталата (150 мг, 0,00083 моль) в ацетонитриле (1,5 мл) добавляли триэтиламин (0,14 мл) и пивалоилхлорид (0,12 мл). Полученную в результате смесь взбалтывали в течение 30 минут при комнатной температуре. Раствор амин-амида 38 (450 мг, 0,00085 моль) в дихлорметане (1,5 мл) добавляли к вышеупомянутому раствору и полученную в результате смесь взбалтывали в течение 1 часа с последующей полной дистилляцией растворителя и FC. Полученный остаток после FC насыщали диэтиловым эфиром, взбалтывали в течение 0,5 часа и фильтровали с получением диамида (Ia.48) (140 мг, 25,6%) в виде грязно-белого твердого вещества.
Пример 27: трет-бутиловый сложный эфир [1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-(2-диэтилкарбамоил-фенил)-пропил]-метил-карбаминовой кислоты 39
К взбалтываемому раствору N-Boc-амида 37 (2,4 г, 0,0038 моль) в смеси THF (24 мл) и DMF (2 мл) добавляли NaH (760 мг, 0,019 моль). Полученную в результате смесь нагревали при 60°C в течение 30 минут. К вышеупомянутой смеси добавляли метилйодид (1,89 мл, 0,030 моль) и взбалтывали в течение 2-3 часов. Реакционную массу нейтрализовали уксусной кислотой и разбавляли водой с последующей общепринятой обработкой дихлорметаном и FC с получением метилированного соединения 39 (500 мг, 20,4%).
Пример 28: 2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-метиламино-пропил)-N,N-диэтилбензамид 40
К взбалтываемому раствору N-boc-амида 39 (400 мг, 0,62 ммоль) в дихлорметане каплями добавляли конц. H2SO4 (1,0 мл). Реакционную смесь взбалтывали при окружающих условиях в течение приблизительно 1 часа. Полученную в результате смесь нейтрализовали триэтиламином и разбавляли водой с последующей общепринятой обработкой с использованием дихлорметана и FC с получением амин-амида 40 (330 мг, 97,6%).
Пример 29: N-[1-{3-[(E(-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-(2-диэтилкарбамоил-фенил)-пропил]-N-метил-фталамовая кислота (Ia.75)
В способе B далее использовали соединение 40 (300 мг). В конце реакции добавляли диэтиловый эфир к реакционной массе с последующей фильтрацией с получением твердого вещества (Ia.75) (300 мг, 69,44%).
Пример 30: метил-2-[2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-[1,3] диоксолан-2-ил)-этил]-бензоат 41
К взбалтываемому раствору безводного PTSA (333 мг, 1,75 ммоль) в сухом толуоле (50 мл) добавляли сложный кетоэфир 20 (1,0 г, 2,2 ммоль), этиленгликоль (0,732 мл, 13,15 ммоль) и дополнительный сухой толуол (25 мл). Реакционную смесь нагревали с обратным холодильником и воду-толуол удаляли аппаратом Dean-Stark. Через 10 часов реакционную смесь выливали в 5% водн. бикарбонат натрия (18,5 мл, 8,77 ммоль). Полученную в результате смесь дважды экстрагировали толуолом и объединенную органическую фазу обрабатывали обычным образом, и подвергали FC с получением сложного кетальэфира 41 (0,7 г, 70%) в виде грязно-белого твердого вещества.
В следующем примере описана общая процедура сложноэфирного гидролиза.
Пример 31: 2-[2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]фенил}-[1,3]диоксолан-2-ил)-этил]-бензойная кислота (Ib. 4)
К взбалтываемому раствору сложного кетальэфира 41 (0,5 г, 1,0 ммоль) в 1,4-диоксане (5,0 мл) добавляли 20% водн. NaOH (0,4 г, 10,0 ммоль). Реакционную смесь нагревали с обратным холодильником при 100°C в течение 12 часов, концентрировали для удаления диоксана, разбавляли водой (25 мл) и подкисляли 4 M уксусной кислотой (3,75 мл, 15 ммоль). Полученные в результате осадки фильтровали, промывали водой и сушили с получением бледно-желтой кеталь-кислоты (Ib. 4) (0,3 г, 61%).
Пример 32: метил-2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3,3-диэтоксипропил)-бензоат 42
К взбалтываемому раствору сложного кетоэфира 20 (1,0 г, 0,0022 ммоль) в этаноле (10,0 мл) добавляли триэтилортоформиат (5,0 мл) и PTSA (0,42 г, 0,002 ммоль) при окружающих условиях. Реакционную смесь нагревали с обратным холодильником в течение 4 часов. Полученную в результате смесь выливали в 2% водн. натрия бикарбонат и экстрагировали в дихлорметане (25 мл) с последующей общепринятой обработкой и FC с получением сложного кеталь-эфира 42 (0,65 г, 56%) в виде грязно-белого твердого вещества.
Пример 33: 2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3,3-диэтокси-пропил)-бензойная кислота (Ib.96)
К взбалтываемому раствору сложного кеталь-эфира 42 (0,65 г, 1,29 ммоль) в 1,4-диоксане (10,0 мл) добавляли раствор натрия гидроксида (0,6 г, 15 ммоль). Реакционную смесь нагревали при 80°C в течение 18 часов. Полученную в результате смесь концентрировали для удаления диоксана, разбавляли водой (25 мл) и подкисляли уксусной кислотой с последующей общепринятой обработкой дихлорметаном и FC с получением (Ib.96) (0,35 г, 55%).
Пример 34: метил-2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил-)-винил]-фенил}-3-гидроксиимино-пропил)-бензоат 43
К взбалтываемому раствору хлористоводородной соли гидроксиламина (3,05 г, 0,044 моль) в воде (40 мл) добавляли натрия ацетат (7,21 г, 0,088 моль) и взбалтывали в течение 5 минут. К вышеуказанному водному раствору добавляли сложный кетоэфир 20 (10 г, 0,022 моль), этанол (200 мл) и нагревали до 75-80°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Твердое вещество отделяли фильтрацией, сушили под вакуумом с получением сложного оксим-эфира 43 (8,5 г) в виде грязно-белого твердого вещества.
Пример 35: 2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил-)-винил]-фенил}-3-гидрокси-имино-пропил)-бензойная кислота (Ib.145)
К взбалтываемой суспензии оксимового сложного эфира 43 (1,45 г, 003 моль) в DMF (30 мл) добавляли натрия гидрид (0,222 г, 0,009 моль) при комнатной температуре, а затем этилбромид (0,46 мл, 0,006). Реакционную смесь взбалтывали в течение 2 часов. Полученную в результате смесь выливали в воду, взбалтывали в течение 15 минут и экстрагировали этилацетатом с последующей общепринятой обработкой и FC. Полученный элюент после FC концентрировали насухо с получением кислоты оксимового эфира (Ib.l45) (0,28 г, 18,8%).
Пример 36: 2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-циклопропил-метоксиэтанол 44
К раствору эпоксида 30 (3,0 г, 0,0098 моль) в дихлорметане (30,0 мл) добавляли циклопропилметанол (60,0 мл) при окружающих условиях и взбалтывали в течение 5 минут. К вышеуказанному раствору медленно добавляли комплекс бор-трифторид-этиловый эфир (3,0 мл, 0,0238 моль) с такой скоростью, чтобы поддерживать температуру реакции от 25°C до 30°C. Реакционную массу взбалтывали при окружающей температуре в течение 18 часов. Осторожно добавляли насыщенный водный раствор карбоната натрия (3,0 г) и полученную в результате смесь экстрагировали дихлорметаном (30 мл). Органическую фазу отделяли с последующей общепринятой обработкой и FC с получением неполного эфира многоатомного спирта 44 (1,5 г, 40,5%).
Пример 37: метиловый сложный эфир 2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-циклопропил-метоксиэтокси)-бензойной кислоты 45
К суспензии неполного эфира многоатомного спирта 44 (0,9 г, 0,0024 моль) в THF (5 мл) добавляли трифенилфосфен (0,93 г, 0,0035 моль) и метилсалицилат (0,54 мл, 0,0036 моль). Полученную в результате смесь взбалтывали при окружающей температуре в течение 5 минут и каплями в смесь добавляли диизопропилазодикарбоксилат (0,71 г, 0,0035 моль). Реакционную смесь взбалтывали при той же температуре в течение семи дней. Дихлорметан (30 мл) добавляли в смесь с последующей сушкой полученного в результате раствора над сульфатом натрия, выпариванием растворителей и FC получали сложный эфир 45 (0,12 г, 9,62%).
Пример 38: 2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-циклопропил-метокси-этокси)-бензойная кислота (Ia.96)
Взбалтываемый раствор сложного эфира 45 (1,0 г, 0,0019 моль) в THF (10,0 мл) обрабатывали 20% водным раствором гидроксида тетра-н-бутиламмония (2,5 мл) при окружающей температуре в течение 15 часов. Растворители выпаривали, полученную в результате смесь разбавляли водной уксусной кислотой и экстрагировали дихлорметаном (30 мл) с последующей общепринятой обработкой и FC с получением (Ia.96) (0,8 г, 79%).
Пример 39: метил-2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-гидрокси-этилсульфонил)-бензоат 46
К взбалтываемому раствору эпоксида 30 (37 г, 0,120 моль) в смеси диметилформамида (140 мл) и ацетонитрила (200 мл) добавляли метил-2-меркаптобензоат (20,0 г, 0,145 моль) с последующим добавлением безводного карбоната калия (19,8 г, 0,145 моль). Реакционную смесь взбалтывали в течение ночи, фильтровали и концентрировали. Полученную в результате смесь выливали в воду (2,0 л), взбалтывали и экстрагировали этилацетатом (1,0 л). Органический слой промывали водой (500 мл) и солевым раствором (500 мл), сушили над безводным сульфатом натрия, выпаривали и подвергали FC (EtOAc/гексаны) с получением продукта в виде бледно-желтого твердого вещества 46 (18,0 г, выход 31%).
Пример 40: метил-2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-оксо-этилсульфонил)-бензоат 47
К взбалтываемому раствору гидроксисоединения 46 (10,0 г, 0,021 моль) в дихлорметане (100 мл) добавляли одной партией хлорхромат пиридиния (13,44 г, 0,035 моль) и обеспечивали взбалтывание при окружающей температуре в течение 2 часов. Полученную в результате смесь фильтровали через прокладку интенсивным потоком. Остаток промывали дихлорметаном (500 мл). Объединенный слой фильтрата выпаривали и подвергали FC с получением бледно-желтого твердого вещества 47 (8,0 г, 80%).
Пример 41 : 2-(2-ацетокси-2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-этилсульфонил)-бензойная кислота (Ia.118)
Этап 1: Соединение 46 (1,0 г) гидролизовали согласно способу, приведенному в примере 25, в диоксане:воде с использованием щелочи с получением спиртокислоты (0,9 г).
Этап 2: К взбалтываемому раствору вышеуказанной спиртокислоты (0,9 г, 0,002 моль) в тетрагидрофуране (2,0 мл) добавляли пиридин (1 мл), уксусный ангидрид (2,0 мл) и взбалтывание продолжали в течение 12 часов при комнатной температуре с последующими выпариванием растворителей, FC и кристаллизацией полученного продукта после FC в диэтиловом эфире (25 мл) и гексане (50 мл) с получением ацилированной кислоты (Ia.118) (0,58 г, 58,76%) в виде желтого твердого вещества.
Пример 42: 2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-[1,3]диоксолан-2-ил-метилсульфонил)-бензойная кислота (Ib.41)
Получали согласно процедуре, описанной в примере 30.
Пример 43: 2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-гидрокси-пропил)-бензойная кислота 48
К взбалтываемому раствору 21 (30,0 г, 65,6 ммоль) в 1,4-диоксане (160 мл) добавляли хлопья гидроксида натрия (7,87 г, 196 ммоль) и воду (70 мл). Реакционную смесь нагревали до температуры флегмы и концентрировали в вакууме. В оставшуюся смесь добавляли воду (1 л) с последующим подкислением ледяной уксусной кислотой до pH 6,0 и взбалтывали в течение 15 минут. Полученную в результате смесь фильтровали и полученный твердый остаток растворяли в этилацетате (400 мл). Полученный в результате раствор сушили над безводным натрия сульфатом, концентрировали досуха. К остатку добавляли гексан (400 мл) и полученную в результате суспензию фильтровали с отделением твердого вещества, которое сушили в вакууме с получением 48 (24,0 г, 82%) в виде бледно-желтого твердого вещества.
Пример 44: 3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-4,5-дигидро-3H-бензо[c]-оксепин-1-он 49
К взбалтываемому раствору гидроксикислоты 48 (24,0 г, 54,06 ммоль) в дихлорметане (500 мл) добавляли 4-диметиламинопиридин (13,23 г, 108 ммоль) и взбалтывали в течение 15 минут. К вышеуказанной смеси добавляли дициклогексилкарбодиимид (14,53 г, 70,2 ммоль) и взбалтывали в течение 24 часов. Осажденный DCU отфильтровывали, а фильтрат концентрировали. Полученный остаток после концентрации суспендировали в THF (150 мл) и фильтровали для удаления какого-либо остаточного DCU с последующим промыванием остатка дополнительным THF (2 х 50 мл). Объединенный фильтрат концентрировали в вакууме и подвергали FC. Полученный остаток после концентрации элюента насыщали гексана (200 мл) и фильтровали с получением твердого лактона 49 (20,0 г, 80%).
Пример 45: [2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-гидрокси-пропил)-фенил]-пирролидин-1-ил-метанон 50
Взбалтываемый раствор лактона 49 (21,0 г, 49,0 ммоль) в пирролидине (20 мл, 241 ммоль) нагревали при 90°C в течение 3 часов. Избыточный пирролидин отгоняли и остаток растворяли в дихлорметане (200 мл) с последующей FC с получением желаемого гидроксипирролидинамида 50 (15,0 г, 61%) в виде бледно-желтого твердого вещества.
Пример 46: 1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-3-[2-(пирролидин-1-карбонил)-фенил]-пропан-1-он 51
К взбалтываемому раствору оксалилхлорида (2,47 мл, 28,7 ммоль) в дихлорметане (33,74 мл) добавляли раствор диметилсульфоксида (4,4 мл, 62,6 ммоль) в дихлорметане (14,2 мл) в течение 5 минутного периода при -60°C. Полученную в результате смесь взбалтывали в течение 30 минут и каплями добавляли раствор гидроксипирролидинамида 50 (13,0 г, 26,1 ммоль) в дихлорметане (40 мл). Реакционную смесь взбалтывали в течение 40 минут и каплями добавляли диизопропилэтиламин (22,3 мл, 130 ммоль) и далее взбалтывали еще 45 минут. Реакционной массе позволяли нагреться до окружающей температуры и взбалтывали в течение 1 часа. В вышеуказанную смесь добавляли воду (200 мл) с последующей экстракцией с использованием дихлорметана (2 x 200 мл), общепринятой обработкой и FC. Выпариванием элюента получали кетоамид 51 (7,0 г, 54%) в виде грязно-белого твердого вещества.
Пример 47: {2-[2-(2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-[1,3]-диоксолан-2-ил)-этил]-фенил}-пирролидин-1-ил-метанон (Ib.36)
Получали согласно процедуре описанной в примере 30.
Пример 48: 2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-этокси-этанол 52
Получали, как описано в примере 36 с использованием этанола, 30 и в присутствии кислоты Льюиса BF3-эфирата.
Пример 49: {3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-этоксиуксусная кислота 53
К взбалтываемому раствору этокси-спирта 52 (30 г, 0,085 моль) в дихлорметане (300 мл) добавляли каталитический TEMPO (0,265 г, 0,0017 моль) и взбалтывали в течение 10 минут. К вышеуказанному раствору добавляли 100 мл водный раствор, содержащий смесь натрия хлорита (23 г, 0,25 моль) и бромида калия (5 г, 0,0425 моль) добавляли и взбалтывали в течение 5 минут. К этой реакционной смеси добавляли водн. уксусную кислоту (5 мл, 20%) и взбалтывание продолжали в течение 12 часов при окружающей температуре. Реакционную смесь фильтровали и твердое вещество промывали деминерализованной водой (500 мл) с последующим промыванием дихлорметаном (200 мл). К полученному твердому веществу добавляли толуол (400 мл) и полученную в результате смесь азеотропно концентрировали до объема смеси 150 мл и охлаждали в ледяной бане. Полученную в результате суспензию фильтровали. Полученное твердое вещество промывали гексаном и сушили в вакууме с получением этоксикислоты 53 (25 г, 80,6%).
Пример 50: (R)-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-этоксиуксусная кислота 54
К взбалтываемой суспензии рацемической этоксикислоты 53 (100 г, 0,27 моль) в смеси ацетона и воды (9:1, 900 мл) каплями добавляли раствор R-(+)-альфа-метилбензиламин (35 мл, 0,27 моль), ацетон:вода (9:1, 100 мл). Полученную в результате смесь взбалтывали в течение 16-17 часов, фильтровали для отделения твердого вещества и нейтрализовали уксусной кислотой. Способ повторяли несколько раз с получением (-)-этоксикислоты 54 (18 г, 98-99% э.и. с помощью HPLC).
Пример 51: (S)-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-этоксиуксусная кислота 55
Применяли S-(-)-альфа-метилбензиламин в вышеуказанной процедуре с получением (+)-этоксикислоты 55.
Пример 52: (R)-2-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-этоксиэтанол 56
Этап 1: К суспензии этоксикислоты 54 (5,3 г, 0,01 моль) в метаноле (100 мл) охлаждали до 5-10°C каплями добавляли тионила хлорид (8,0 мл, 0,13 моль). Реакционную смесь нагревали с обратным холодильником в течение 2 часов и охлаждали до окружающей температуры. Растворитель полностью выпаривали и к остатку добавляли дихлорметан (150 мл) и насыщенный водный раствор бикарбоната натрия (150 мл). Полученную в результате смесь взбалтывали в течение 15 минут и отделяли органический слой, который при общепринятой обработке и полном выпаривании растворителя давал сложный эфир (6,5 г) в виде бесцветного масла, которое использовали на следующей стадии без очистки.
Этап 2: К взбалтываемому раствору вышеуказанного сложного эфира (6,5 г, 0,017 моль) в метаноле, охлажденному до 5-10°C, порциями добавляли боргидрид натрия (2,5 г, 0,068 моль) и взбалтывали в течение 2 часов при окружающей температуре. Растворитель полностью выпаривали и к остатку добавляли дихлорметан (100 мл) и дименирализованную воду (100 мл). Органическую фазу отделяли и промывали 5% водным раствором уксусной кислоты с последующей общепринятой обработкой и полным выпариванием растворителя. К вышеуказанной смеси добавляли толуол (100 мл) и подвергали азеотропной дистилляции до объема смеси приблизительно 25 мл. Концентрированную смесь охлаждали до окружающей температуры, взбалтывали в течение 2 часов и фильтровали для выделения твердого хирального спирта 56 (4,0 г, 66,66%).
Пример 53: l-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-этанон 57
Этап 1: 3 M раствор метилмагния хлорида (12,46 мл, 37,4 ммоль) в THF каплями добавляли к хорошо взбалтываемой суспензии альдегида 29 (10 г, 34 ммоль) в толуоле (80 мл), выдержанной при -10°C в азоте, и взбалтывали в течение 2 часов. К полученной в результате смеси каплями добавляли 10% водн. раствор аммония хлорида (52,65 мл). Реакционную смесь нагревали до комнатной температуры, добавляли воду (27,5 мл) и взбалтывали в течение 30 минут. Полученную в результате суспензию фильтровали, промывали водой (2 x 30 мл) и изопропиловым спиртом (10 мл) и сушили с получением спирта (8,2 г, 78%) в виде грязно-белого твердого вещества.
Этап 2: К охлажденному (-78°C) и взбалтываемому раствору оксалилхлорида (3,08 г, 24,2 ммоль) в безводном THF (44 мл) каплями добавляли раствор диметилсульфоксида (4,42 г, 56,5 ммоль) в THF (6 мл) с поддерживанием температуры в диапазоне -78°C±5°C. Полученную в результате смесь взбалтывали в течение 30 минут и обрабатывали суспензией вышеуказанного спирта (5 г, 16,1 ммоль) в смеси (1:1) дихлорметана и THF (100 мл). Реакционную смесь взбалтывали в течение 45 минут. Каплями добавляли триэтиламин (9,63 г, 95 ммоль) и взбалтывание продолжали в течение 30 минут. Реакционную смесь нагревали до 5°C, добавляли воду (125 мл) и взбалтывали в течение 15 минут. Полученную в результате смесь экстрагировали дихлорметаном (100 мл) с последующей общепринятой обработкой и концентрацией с получением кетона 57 (3,0 г, выход 60%) в виде грязно-белого твердого вещества.
Пример 54: 2-бром-1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-этанон 58
К нагретому (90°C) и взбалтываемому раствору кетона 57 (5 г, 0,016 моль) в смеси 4:1 толуола и ацетонитрила (125 мл) добавляли метансульфоновую кислоту (2,64 мл, 0,041 моль) и взбалтывали в течение 1 часа. Реакционную смесь охлаждали до 68°C, одновременно добавляли NBS (3,19 г, 0,018 моль) и взбалтывали содержимое при 65°C в течение 4 часов с последующим взбалтыванием при комнатной температуре в течение 18 часов. Твердое вещество из реакционной смеси собирали фильтрацией и растворяли в дихлорметане (100 мл), дихлорметановый слой промывали 10% водн. карбонатом натрия и подвергали общепринятой обработке и концентрации с получением альфа-бромкетона 58 (3,0 г, 48%) в виде грязно-белого твердого вещества.
Пример 55: (-)-7-хлор-2-[(E)-2-((S)-3-оксиранилфенил)-винил]-хинолин 59
Этап 1: 2-бром-1-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-этанол
К охлажденной (-25°C) и взбалтываемой суспензии бромкетона 58 (5 г, 0,013 моль) в безводном THF (60 мл) добавляли диизопропилэтиламин (0,83 г, 0,005 моль) с последующим добавлением (+)DIP хлорида (21 мл, 60-65% раствор в гексане) при -25°C. Полученную в результате смесь взбалтывали при -20°С в течение 30 минут с последующим взбалтыванием при -15°C в течение 3 часов. Полученную в результате мутную реакционную смесь взбалтывали при 0°С в течение 1 часа. В смесь добавляли ацетон и взбалтывали при комнатной температуре в течение 18 часов. Вышеуказанную смесь снова охлаждали до 0°C и добавляли добавляли к ней 20% водн. раствор калия-натрия тартрат (110 мл). Полученную в результате смесь взбалтывали и экстрагировали в THF. Органический фазу промывали 90% солевым раствором и THF выпаривали с последующей кристаллизацией неочищенного твердого вещества в этилацетате:гептане (1:2) с получением бромсодержащего спирта (3,9 г, 78%) в виде грязно-белого - бледно-желтого твердого вещества.
Этап 2: К взбалтываемому раствору вышеуказанного бромсодержащего спирта (8 г, 0,021 моль) в 1,4-диоксане (80 мл) добавляли раствор водн. NaOH (1,65 г, 0,04 моль). Реакционную смесь взбалтывали при комнатной температуре в течение 2 часов и разбавляли толуолом (160 мл). Органическую фазу промывали деминерализованной водой и отделяли с последующей общепринятой обработкой и концентрацией с получением эпоксида 59 (5,1 г, 81%) в виде грязно-белого твердого вещества.
Пример 56: 7-хлор-2-{(E)-2-[3-((E)-2-оксиранилвинил)-фенил]-винил}-хинолин 60
Этап 1: К раствору альдегида 29 (15 г, 0,0519 моль) в смеси 200 мл ацетона и THF (1:1) добавляли 10% водн. раствор NaOH и взбалтывали в течение 3 часов. Добавляли разбавленную уксусную кислоту до кислого pH смеси. Реакционную смесь выпаривали до половины объема и выливали в воду (200 мл). Отделенное твердое вещества фильтровали с получением (E)-4-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-бут-3-ен-2-она (13 г, 76,47%) в виде желтого твердого вещества.
Этап 2: К раствору вышеуказанного энона (3 г, 0,009 моль) в 80 мл ацетонитрила:толуола (1:1) добавляли метансульфоновую кислоту (2,16 г, 0,02252 моль) и NBS (1,67 г, 0,00945 моль) и нагревали до 85°C в течение 3 часов. К вышеуказанной смеси добавляли насыщ. NaHCO3 (100 мл) и этилацетат (100 мл). Органический слой отделяли и подвергали очистке колоночной хроматографией с получением бромсодержащего продукта [(E)-1-бром-4-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-бут-3-ен-2-она] (1,2 г, 32,43%) в виде желтого твердого вещества.
Этап 3: К раствору вышеуказанного бромсодержащего продукта (6 г, 0,14556 моль) в смеси 200 мл метанола:дихлорметана (1:1) порциями добавляли натрия боргидрид и взбалтывали в течение 1 часа при окружающей температуре. К вышеуказанной смеси добавляли воду (25 мл) и взбалтывали в течение 15 минут. Органический слой отделяли, промывали деминерализованной водой, солевым раствором и сушили над сульфатом натрия. Растворитель полностью выпаривали с получением 8,0 г коричневого масла [(E)-1-бром-4-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-бут-3-ен-2-она], которое непосредственно применяли на следующей стадии без дополнительной очистки.
Этап 4: К раствору вышеуказанного масла (8,0 г, 0,01932 моль) в 100 мл диоксана добавляли 2 н водн. NaOH (100 мл). Полученную в результате смесь взбалтывали в течение ночи. Органический слой отделяли, промывали деминерализованной водой (100 мл) и сушили над сульфатом натрия. Растворитель полностью выпаривали и полученный остаток насыщали диэтиловым эфиром (25 мл), взбалтывали в течение 15 минут и фильтровали с получением названного эпоксида 60 (3,8 г, 59,37%) в виде грязно-белого твердого вещества.
Пример 57: (E)-4-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-циклопропил-метокси-бут-3-ен-1-ол 61
Получали согласно способу, описанному в примере 30, с получением эфира-спирта 61 (50%) в виде желтого твердого вещества.
Пример 58: метиловый сложный эфир 2-((E)-4-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-циклопропилметокси-бут-3-енилокси)-5-метокси-бензойной кислоты 62
Получали раствор эфира-спирта 61 (2 г, 0,0049 моль) в диоксане (20 мл), взбалтывали в течение 15 минут и добавляли к другому раствору ADDP (2,48 г, 0,0099 моль) и трифенилфосфина (2,58 г, 0,0099 моль) в диоксане (10 мл). Полученную в результате смесь взбалтывали в течение 5 минут. К вышеуказанной смеси добавляли метиловый сложный эфир 2-гидрокси-5-метоксибензойной кислоты и взбалтывали в течение ночи. К полученной в результате смеси добавляли дименирализованную воду (0,1 мл), уксусную кислоту (0,1 мл) и взбалтывали в течение 5 минут. Растворители полностью выпаривали и полученный остаток насыщали диэтиловым эфиром, взбалтывали в течение 15 минут и фильтровали. Фильтрат подвергали FC (гексан:этилацетат) с получением сложного эфира 62 (1,87 г) в виде масла.
Пример 59: 2-((E)-(S)-4-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенил}-2-циклопропилметокси-бут-3-енилокси)-5-метокси-бензойная кислота Ia246 и ее энантиомер Ia247
К взбалтываемому раствору вышеуказанного сложного эфира 62 в этаноле (100 мл) добавляли водн. NaOH (1,22 г в 50 мл) и взбалтывали в течение ночи при окружающей температуре. Растворитель полностью выпаривали из вышеуказанной смеси. К остатку добавляли деминерализованную воду (100 мл) и взбалтывали в течение 15 минут с последующим добавлением разбавленной уксусной кислоты. Полученную в результате смесь экстрагировали в этилацетате (100 мл). Органический слой отделяли и промывали деминерализованной водой, солевым раствором и сушили над сульфатом натрия. Растворитель полностью выпаривали с получением рацемической кислоты (1,2 г, 68,6%) в виде желтого масла, которое затем разделяли на хиральные изомеры Ia246 (190 мг) и Ia247 (120 мг) хиральной хроматографией.
Пример 60: 7-хлор-2-[(E)-2-(3-оксиранилметоксифенил)-винил]-хинолин 60a
К раствору фенола 29a (12 г, 0,043 моль) в диоксане (100 мл) добавляли эпихлоргидрин (33 мл, 0,43 моль), деминерализованную воду (50 мл) и NaOH (2 г, 0,05 моль). Реакционную смесь нагревали при 80°C в течение ночи, охлаждали до окружающей температуры и экстрагировали этилацетатом. Органический слой промывали водой, солевым раствором, сушили над сульфатом натрия и подвергали колоночной хроматографии с получением 60a (8,0 г, 55,70%) в виде желтого твердого вещества.
Пример 61: 3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенокси}-2-циклопропилметоксипропан-1-ол 61a
Как описано в примере 30 с использованием 60a с получением эфир-спирт 61a (41,2%) в виде желтого твердого вещества.
Пример 62: метиловый сложный эфир 2-(3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенокси}-2-циклопропилметоксипропокси)-5-метоксибензойной кислоты 62a
Как описано в примере 52 с использованием 61a с получением сложного эфира 62a (76%) в виде желтого масла.
Пример 67: 2-((S)-3-{3-[(E)-2-(7-хлорхинолин-2-ил)-винил]-фенокси}-2-цикло пропилметоксипропокси)-5-метоксибензойная кислота Ia256 и энантиомер Ia257
Как описано в примере 53 с использованием сложного эфира 62a при гидролизе до рацемической смеси кислот (72,4%), которая при хиральном разделении давала Ia256 и Ia257 в виде бледно-желтых твердых веществ.
Способы биологических анализов
Первичный in-vitro биологический скрининг для соединений выполняли с использованием анализа связывания рецептора с радиолигандом (меченный тритием LTD4 в качестве лиганда) известными способами, описанными в литературе [a). Mong et al. European Journal of Pharmacology (102); 1984 1-11 b). Jones et al; Journal of Physiology & Pharmacology (73); 1994, 191-201 c). MDS Pharma Services: 250460 Leukotriene, Cysteinyl CysLT1]. В связи с этим мембрану легкого морской свинки (100 мкг) инкубировали с 0,2 нМ 3H LTD4 в присутствии эталонного стандарта/объект тестирования/контроль-среда. Неспецифичное связывание определяли путем инкубирования мембраны с 0,2 нМ 3H LTD4 в присутствии 1 мкM немеченого LTD4. Образцы инкубировали при 26°C в течение 30 минут и фильтровали с использованием вакуума на мембране для разделения связанного и несвязанного радиолиганда. Мембрану тестировали жидкостным сцинтилляционным счетчиком для вычисления связанной радиоактивности. Специфичное связывание в наборе, обработанном средой и обработанном эталонным стандартом/объектом тестирования сравнивали для оценивания значений % ингибирования. Некоторые из соединений показали >50% ингибирование при наличии ≤3 наномолярной концентрации соединений в соответствии с настоящим изобретением, как показано в следующей таблице.
Все публикации и патентные заявки, цитированные в настоящей заявке, включены в настоящий документ посредством ссылки в той же степени, как если бы каждая отдельная публикация или патентная заявка специально и индивидуально была включена в настоящий документ посредством ссылки.
Реферат
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (Iа) или к его фармацевтически приемлемой соли, где в каждом случае Rи Rнезависимо выбраны из группы, включающей водород, галоген, -ОН, -Cалкил, -О-Cалкил, -О-Сгалогеналкокси, -N(Cалкил); Rпредставляет собой водород; W представляет собой группу, выбранную из -СН= или -N=; X представляет собой группу, выбранную из -СН=СН- или -N=CH-, где азот из -N=CH- непосредственно связан с кольцом 'а'; Y представляет собой группу, выбранную из -СН=СН- или -С≡С-; Z представляет собой связь или группу, выбранную из -(СН)- и -СН=СН-; А представляет собой группу, выбранную из -OR, -O(СН)фенила, -O(СН)тиофена; Р выбран из группы, включающей -О-; Q представляет собой группу, выбранную из -СООН; где R выбран из группы, включающей водород, -Cалкил, -Cциклоалкил, -Cалкил (Cциклоалкил), -Cалкенил и -Cалкинил; 'n' в каждом случае представляет собой целое число, выбранное из 1, 2 или 3; 'm' в каждом случае представляет собой целое число, выбранное из 0-3 включительно. Кроме того, изобретение относится к соединению формулы (Id), где значения радикалов описаны в формуле изобретения. Технический результат: получены новые гетероциклические соединения, полезные в качестве антагонистов цистеинил-лейкотриена. 2 н. и 7 з.п. ф-лы, 1 ил., 2 табл., 67 пр.
Формула

где
в каждом случае R1 и R3 независимо выбраны из группы, включающей водород, галоген, -ОН, -C1-2алкил, -О-C1-2алкил, -О-С1галогеналкокси, -N(C1алкил)2;
R2 представляет собой водород;
W представляет собой группу, выбранную из -СН= или -N=;
X представляет собой группу, выбранную из -СН=СН- или -N=CH-, где азот из -N=CH- непосредственно связан с кольцом 'а';
Y представляет собой группу, выбранную из -СН=СН- или -С≡С-;
Z представляет собой связь или группу, выбранную из -(СН2)n- и -СН=СН-;
А представляет собой группу, выбранную из -OR, -O(СН2)nфенила, -O(СН2)nтиофена;
Р выбран из группы, включающей -О-;
Q представляет собой группу, выбранную из -СООН; где
R выбран из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1алкил (C3-6циклоалкил), -C3-6алкенил и -C3-6алкинил;
'n' в каждом случае представляет собой целое число, выбранное из 1, 2 или 3;
'm' в каждом случае представляет собой целое число, выбранное из 0-3 включительно.

где
в каждом случае R1 и R3 независимо выбраны из группы, включающей водород, галоген, -C1-2алкил, -O-C1-2алкил, -О-С1галогеналкокси, -N(C1алкил)2;
R2 представляет собой водород;
X представляет собой группу, выбранную из СН и N;
Z представляет собой связь или группу, выбранную из -(СН2)n- и -СН=СН-;
А представляет собой группу, выбранную из -OR, -O(СН2)nфенила, -O(СН2)n тиофена, где R выбран из группы, включающей водород, -C1-6алкил, -C3-6циклоалкил, -C1алкил (C3-6циклоалкил), -C3-6алкенил и -C3-6алкинил;
P выбран из группы, включающей -О-;
'n' в каждом случае представляет собой целое число, выбранное из 1, 2 и 3;
'm' в каждом случае представляет собой целое число, выбранное из 0, 1, 2 и 3.


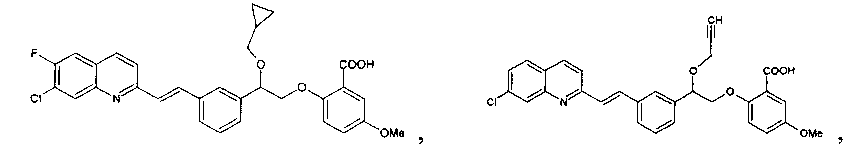


и фармацевтически приемлемую соль любого из них.

Комментарии