Тетрагидрохинолиновые производные - RU2347570C2
Код документа: RU2347570C2
Описание
Настоящее изобретение относится к соединению, обладающему ФСГ-модулирующей активностью, в частности тетрагидрохинолиновому производному, к фармацевтической композиции, содержащей его, а также к применению указанного соединения в терапии.
Гонадотропины выполняют важную роль в многочисленных функциях организма, включая метаболизм, терморегуляцию и репродуктивный процесс. Гонадотропины действуют на специфические типы половых клеток, инициируя дифференциацию клеток яичника и яичек и стероидогенез. Гипофизарный гонадотропин ФСГ (фолликулостимулирующий гормон) играет, например, важную роль в стимуляции развития и созревания фолликул, в ходе которой ЛГ (лютеинизирующий гормон) индуцирует овуляцию (Sharp, R.M. Clin Endocrinol. 33:787-807, 1990; Dorrington and Armstrong, Recent Prog. Horm. Res. 35:301-342, 1979). В настоящее время ФСГ используется клинически в сочетании с ЛГ для стимуляции яичника, например для гиперстимуляции яичника с целью оплодотворения in vitro (IVF) и индукции овуляции у женщин с ановулярным бесплодием (Insler, V., Int. J. Fertility 33:85-97, 1988, Navot and Rosenwaks, J. Vitro Fert. Embryo Transfer 5:3-13, 1988), а также в случае мужского гипогонадизма и мужского бесплодия.
Гонадотропин ФСГ высвобождается из передней доли гипофиза под воздействием гонадотропин-рилизинг гормона и эстрогенов, а также из плаценты во время беременности. У женщин ФСГ действует на яичники, ускоряя развитие фолликул, и представляет собой основной гормон, регулирующий секрецию эстрогенов. У мужчин ФСГ отвечает за целостность семенных канальцев и действует на клетки Сертоли, поддерживая гаметогенез. Очищенный ФСГ используют клинически для лечения бесплодия у женщин и некоторых типов недостаточности сперматогенеза у мужчин. Гонадотропины, предназначенные для терапевтического применения, могут быть выделены из мочи человека и в этом случае характеризуются низкой чистотой (Morse et al., Amer. J. Reproduct. Immunol. and Microbiology 17:143, 1988). Альтернативно, они могут быть получены в виде рекомбинантных гонадотропинов. Рекомбинантный человеческий ФСГ доступен коммерчески и используется в искусственной репродукции (Olijve et al., Mol. Hum. Reprod. 2:371, 1996; Devroey et al., Lancet 339:1170, 1992).
Действие ФСГ гормона опосредовано специфическим рецептором плазматической мембраны, которая является представителем большого семейства рецепторов, связанных с G-белком. Указанные рецепторы состоят из одного полипептида, включающего семь трансмембранных доменов, и способны взаимодействовать с G-белком, что приводит к активации аденилатциклазы.
ФСГ рецептор представляет собой высокоспецифичную мишень в процессе роста фолликул яичника и экспрессируется исключительно в яичнике. Блокирование указанного рецептора или ингибирование сигнального пути, который в норме индуцируется после активации ФСГ-опосредованного рецептора, будет нарушать развитие фолликулы и, таким образом, овуляцию и способность к оплодотворению. В этой связи низкомолекулярные антагонисты ФСГ могут использоваться в качестве основы для создания контрацептивных средств. Такие антагонисты ФСГ могут привести к снижению развития фолликулы (к отсутствию овуляции) со все еще достаточной продукцией эстрогена, что позволит избежать неблагоприятного воздействия, например, на костную массу.
Настоящее изобретение описывает получение низкомолекулярных аналогов гормона, которые оказывают селективное модулирующее воздействие на ФСГ рецептор. Соединения согласно настоящему изобретению могут использоваться как (частичные) агонисты или (частичные) антагонисты ФСГ рецептора.
Таким образом, авторами было обнаружено, что приведенный ниже класс тетрагидрохинолиновых соединений формулы I или их фармацевтически приемлемых солей обладает ФСГ-модулирующей активностью:
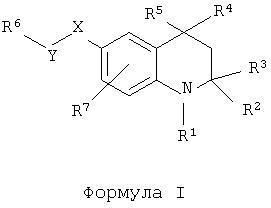
где R1 обозначает формил, (1-6С)алкилкарбонил или (1-6С)алкилсульфонил;
R2 и R3 обозначают H или (1-4С)алкил;
R4 обозначает фенил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей гидрокси, амино, галоген, нитро, трифторметил, циано, (1-4С)алкил, (2-4С)алкенил, (2-4С)алкинил, (1-4С)алкокси, (1-4С)(ди)алкиламино. Предпочтительным для замещения является пара-положение.
R5 обозначает (1-4С)алкил;
Y-X обозначает C(O)-O, S(O)2-O, NHC(O)-O, NHC(S)-O, OC(O)-O, связь-О, C(O)-NH, S(O)2-NH, NHC(O)-NH, NHC(S)-NH, OC(O)-NH, связь-HN, NH-C(O), O-C(O), NH-S(O)2 или O-S(O)2или X-Y обозначает связь;
R6обозначает H, трифторметил, (1-6С)алкил, 1- или 2-адамантил(1-4С)алкил, (2-6С)алкенил, (2-6С)алкинил, (6-10С)арил, (3-9С)гетероарил, (3-6С)циклоалкил, (2-6С)гетероциклоалкил, (1-4С)алкилтио(1-4С)алкил, (6-10С)арил(1-4С)алкил, (3-9С)гетероарил(1-4С)алкил, (3-6С)циклоалкил(1-4С)алкил, (2-6С)гетероциклоалкил(1-4С)алкил, R8,R9-аминокарбонил(1-4С)алкил, R8,R9-амино(1-4С)алкил, R8-оксикарбонил(1-4С)алкил, R8-окси(1-4С)алкил, R8-карбонил(1-4С)алкил.
Если R6 обозначает H, то следует отметить, что X-Y не может представлять собой связь.
Если R6 обозначает фенил, указанный фенил, вдобавок к заместителям для (6-10С)арильных групп, указанным в определении, может быть необязательно замещен (6-10С)арилом, (6-10С)арилокси, (6-10С)арил(1-4С)алкокси, (3-9С)гетероарилом, (3-9С)гетероарилокси, (3-9С)гетероарил(1-4С)алкокси, (1-4С)алкилкарбониламино, (1-4С)алкилкарбонилокси, (3-6С)циклоалкилкарбонилокси, (1-4С)алкоксикарбонил(1-4С)алкилкарбонилокси, (1-4С)алкокси(1-4С)алкилкарбонилокси, (6-10С)арилкарбонилокси, (3-9С)гетероарилкарбонилокси, (1-4С)алкилсульфонилокси, (6-10С)арилсульфонилокси, (3-9С)гетероарилсульфонилокси, (1-4С)(ди)алкилкарбамоилом, (6-10С)(ди)арилкарбамоилом, (2-6С)гетероциклоалкилкарбамоилом, (6-10С)(ди)ариламино, (3-6С)циклоалкилом, (3-6С)циклоалкил(1-4С)алкилом, (2-6С)гетероциклоалкилом, (2-6С)гетероциклоалкил(1-4С)алкилом.
R7 обозначает H, (1-4С)алкил, (1-4С)алкокси, галоген, трифторметил, циано, нитро, гидроксил;
R8 и/или R9 обозначает H, (1-4С)алкил, (2-4С)алкенил, (2-4С)алкинил, (6-10С)арил, (3-9С)гетероарил, (6-10С)арил(1-4С)алкил, (3-9С)гетероарил(1-4С)алкил, (3-6С)циклоалкил(1-4С)алкил, (2-6С)гетероциклоалкил(1-4С)алкил, (1-4С)(ди)алкиламино(1-4С)алкил, (1-4С)алкокси(1-4С)алкил, (1-4С)алкилтио(1-4С)алкил, (1-4С)алкилкарбониламино(1-4С)алкил, (1-4С)алкоксикарбонил(1-4С)алкил, (1-4С)алкоксикарбониламино(1-4С)алкил, (3-6С)циклоалкил, (2-6С)гетероциклоалкил или R8иR9 могут соединяться в (2-6С)гетероциклоалкильное кольцо.
Соединения согласно настоящему изобретению модулируют функции ФСГ рецептора и могут использоваться для тех же клинических целей, что и нативный ФСГ, если они ведут себя как агонисты, с тем преимуществом, что они обладают измененными свойствами стабильности и могут вводиться разными способами. Если они блокируют ФСГ рецептор, то могут использоваться, например, в качестве контрацептивного средства.
Таким образом, модуляторы ФСГ рецептора согласно настоящему изобретению могут использоваться для лечения бесплодия, для контрацепции, для лечения гормонзависимых заболеваний, таких как рак молочной железы, рак предстательной железы и эндометриоз. Предпочтительно соединения согласно настоящему изобретению используются для инактивации ФСГ рецептора.
Термин "(1-4С)алкил" в контексте настоящего описания обозначает разветвленную или неразветвленную алкильную группу, содержащую 1-4 атома углерода, например метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил.
Термин "(1-6С)алкил" в контексте настоящего описания обозначает разветвленную или неразветвленную алкильную группу, содержащую 1-6 атомов углерода, например метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил и гексил. Предпочтительны (1-5С)алкильные группы и наиболее предпочтителен (1-4С)алкил.
Термин "1-или 2-адамантил(1-4С)алкил" обозначает адамантильную группу, присоединенную к положению 1 или 2 алкильной группы, содержащей 1-4 атома углерода, и имеет то же значение, что и указанные выше.
Термин "(2-4С)алкенил" обозначает разветвленную или неразветвленную алкенильную группу, содержащую 2-4 атома углерода, такую как этенил и 2-бутенил.
Термин "(2-6С)алкенил" обозначает разветвленную или неразветвленную алкенильную группу, содержащую 2-6 атомов углерода, такую как этенил, 2-бутенил и н-пентенил.
Термин "(2-4С)алкинил" обозначает разветвленную или неразветвленную алкинильную группу, содержащую 2-4 атома углерода, такую как этинил и пропинил.
Термин "(2-6С)алкинил" обозначает разветвленную или неразветвленную алкинильную группу, содержащую 2-6 атомов углерода, такую как этинил, пропинил и н-пентинил.
Термин "(3-6С)циклоалкил" обозначает циклоалкильную группу, содержащую 3-6 атомов углерода, которая может представлять собой циклопропил, циклобутил, циклопентил и циклогексил.
Термин "(2-6С)гетероциклоалкил" обозначает гетероциклоалкильную группу, содержащую 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, и включающую по меньшей мере один гетероатом, выбранный из N, O и/или S, который может быть присоединен через гетероатом, если это доступно, или атом углерода. Предпочтительные гетероатомы включают N или О. Наиболее предпочтительными являются пиперидин, морфолин и пирролидин.
Термин "(1-4С)алкокси" обозначает алкоксигруппу, содержащую 1-4 атома углерода, алкильный фрагмент, которой имеет указанное выше значение. Предпочтительны (1-2С)алкоксигруппы.
Термин "(6-10С)арил" обозначает ароматическую углеводородную группу, содержащую 6-10 атомов углерода, такую как фенил, нафтил, тетрагидронафтил или инденил, которая может быть необязательно замещена одним или более заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано, (1-4С)алкила, (2-4С)алкенила, (2-4С)алкинила, (1-4С)алкокси, (1-4С)(ди)алкиламино, в которых алкильный фрагмент имеет указанное выше значение. Предпочтительной ароматической углеводородной группой является фенил.
Термин "(3-9С)гетероарил" обозначает замещенную или незамещенную ароматическую группу, содержащую 3-9 атомов углерода, включающую по меньшей мере один гетероатом, выбранный из N, O и/или S, такую как имидазолил, тиадиазолил, пиридил, (бенз)тиенил, (бензо)фурил, хинолил, тетрагидрохинолил, хиноксалил или индолил. Заместители на гетероарильной группе могут быть выбраны из заместителей, перечисленных для арильной группы. Гетероарильная группа может быть присоединена через атом углерода или гетероатом, если он доступен. Предпочтительные гетероарильные группы представляют собой тиенил, фурил и пиридил.
Термин "(6-10С)арилокси" обозначает определенную выше арильную группу, содержащую 6-10 атомов углерода, присоединенную к атому кислорода. (3-9С)гетероарилоксигруппы являются аналогами (6-10С)арилоксигрупп, которые включают по меньшей мере один гетероатом, выбранный из N, O или S.
Термин "(1-4С)алкоксикарбонил(1-4С)алкил" обозначает алкоксикарбонилалкильную группу, в которой алкоксигруппа включает 1-4 атома углерода и имеет указанное выше значение, а алкильная группа содержит 1-4 атома углерода и также имеет указанное выше значение.
Термин "(1-4С)алкокси(1-4С)алкил" обозначает алкоксиалкильную группу, в которой алкоксигруппа включает 1-4 атома углерода и имеет указанное выше значение, а алкильная группа содержит 1-4 атома углерода и также имеет указанное выше значение.
Термин "(3-6С)циклоалкил(1-4С)алкил" обозначает циклоалкильную группу, содержащую 3-6 атомов углерода, присоединенную к алкильной группе, включающей 1-4 атома углерода, в которой циклоалкильная группа представляет собой определенную выше (3-6С)циклоалкильную группу, а алкильная группа представляет собой определенную выше (1-4С)алкильную группу.
Термин "(2-6С)гетероциклоалкил(1-4С)алкил" обозначает гетероциклоалкильную группу, содержащую 2-6 атомов углерода, присоединенную к алкильной группе, включающей 1-4 атома углерода, в которой гетероциклоалкильная группа представляет собой определенную выше (2-6С)гетероциклоалкильную группу, а алкильная группа представляет собой определенную выше (1-4С)алкильную группу.
Термин "(1-4С)(ди)алкиламино" обозначает (ди)алкиламиногруппу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "(6-10С)(ди)ариламино" обозначает (ди)ариламиногруппу, арильные группы которой содержат 6-10 атомов углерода и имеют указанное выше значение.
Термин "(1-4С)(ди)алкиламино(1-4С)алкил" обозначает (ди)алкиламиноалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "(1-4С)алкилтио(1-4С)алкил" обозначает алкилтиоалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "аминокарбонил(1-4С)алкил" в определении R8,R9-аминокарбонил(1-4С)алкила обозначает аминокарбонилалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение. Аминокарбонилметильная группа является предпочтительной аминокарбонилалкильной группой.
Термин "амино(1-4С)алкил" в определении R8,R9-амино(1-4С)алкила обозначает аминоалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "оксикарбонил(1-4С)алкил" в определении R8-оксикарбонил(1-4С)алкила обозначает оксикарбонилалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение. Оксикарбонилметильная группа является предпочтительной оксикарбонилалкильной группой.
Термин "окси(1-4С)алкил" в определении R8-окси(1-4С)алкила обозначает оксиалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "карбонил(1-4С)алкил" в определении R8-карбонил(1-4С)алкила обозначает карбонилалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "(6-10С)арил(1-4С)алкил" обозначает арилалкильную группу, содержащую 7-14 атомов углерода, в которой алкильная группа представляет собой (1-4С)алкильную группу, а арильная группа представляет собой определенный выше (6-10С)арил. Фенил(1-4С)алкильные группы, такие как бензил, являются предпочтительными арилалкильными группами. (3-9С)гетероарил(1-4С)алкильные группы являются аналогами (6-10С)арил(1-4С)алкильных групп, включающими по меньшей мере один гетероатом, выбранный из N, O и/или S, в которых гетероарильная группа может быть присоединена через атом углерода или через гетероатом, если доступно.
Термин "соединенные в (2-6С)гетероциклоалкильное кольцо" в определении NR8R9, где R8 и R9 вместе с атомом азота, к которому они присоединяются с образованием кольца, обозначает кольцо, содержащее атом азота и максимум 2-6 атомов углерода, причем указанное кольцо может содержать один или более дополнительных гетероатомов, выбранных из N, O и/или S. Примеры таких колец включают азетидин, пирролидин, пиперидин, пиперазин и (тио)морфолин.
Термин "галоген" обозначает фтор, хлор, бром или иод.
Термин "(1-6С)алкилкарбонил" обозначает алкилкарбонильную группу, алкильные группы которой содержат 1-6 атомов углерода и имеют указанное выше значение. Предпочтительны (1-4С)алкилкарбонильные группы.
Термин "(1-4С)алкилкарбониламино(1-4С)алкил" обозначает алкилкарбониламиноалкильную группу, алкильные группы которой содержат 1-4 атома углерода и имеют указанное выше значение.
Термин "(6-10С)арил(1-4С)алкокси" обозначает арильную группу, содержащую 6-10 атомов углерода, определенную выше, которая присоединена к (1-4С)алкоксигруппе, определенной ранее. (3-9С)гетероарил(1-4С)алкоксигруппы являются аналогами (6-10С)арил(1-4С)алкоксигрупп и включают по меньшей мере один гетероатом, выбранный из N, O или S, в которых гетероарильная группа может быть присоединена через атом углерода или через гетероатом, если доступно.
Термин "(1-4С)алкилкарбонилокси" обозначает алкилкарбонилоксигруппу, алкильная группа которой содержит 1-4 атома углерода. Термин (3-6С)циклоалкилкарбонилокси обозначает циклоалкилкарбонилоксигруппу, в которой циклоалкильная группа содержит 3-6 атомов углерода, а циклоалкильная группа имеет указанное выше значение.
Термин "(1-4С)алкоксикарбонил(1-4С)алкилкарбонилокси" обозначает (1-4С)алкоксикарбонильную группу, присоединенную к алкилкарбонилоксигруппе, в которой алкильный фрагмент содержит 1-4 атома углерода, а алкоксигруппа имеет указанное выше значение.
Термин "(1-4С)алкокси(1-4С)алкилкарбонилокси" обозначает алкоксигруппу, содержащую 1-4 атома углерода, присоединенную к алкилкарбонилоксигруппе, содержащей 1-4 атома углерода, в которой алкокси и алкильная группы имеют указанные выше значения.
Термин "(1-4С)алкилкарбониламино" обозначает алкилкарбониламиногруппу, алкильная группа которой содержит 1-4 атома углерода.
Термин "(1-4С)алкоксикарбониламино(1-4С)алкил" обозначает алкоксикарбонильную группу, содержащую 1-4 атома углерода, с указанным выше значением, присоединенную к аминоалкильной группе, в которой алкильная группа содержит 1-4 атома углерода и значение которой указано выше.
Термин "(6-10С)арилкарбонилокси" обозначает арилкарбонилоксигруппу, в которой арильная группа содержит 6-10 атомов углерода. Предпочтительной арилкарбонилоксигруппой является фенилкарбонилоксигруппа. (3-9С)гетероарилкарбонилоксигруппы являются аналогами (6-10С)арилкарбонилоксигрупп, которые включают по меньшей мере один гетероатом, выбранный из N, O или S, и могут присоединяться через атом углерода или гетероатом, если доступно.
Термин "(1-4С)алкилсульфонил" обозначает алкилсульфонильную группу, алкильная группа которой содержит 1-4 атома углерода и имеет указанное выше значение.
Термин "(1-6С)алкилсульфонил" обозначает алкилсульфонильную группу, алкильная группа которой содержит 1-6 атомов углерода и имеет указанное выше значение. (1-3С)алкилсульфонильные группы являются предпочтительными.
Термин "(1-4С)алкилсульфонилокси" обозначает алкилсульфонилоксгруппу, алкильная группа которой содержит 1-4 атома углерода и имеет указанное выше значение. (1-3С)алкилсульфонилоксигруппы являются предпочтительными.
Термин "(6-10С)арилсульфонилокси" обозначает арилсульфонилоксигруппу, арильная группа которой содержит 6-10 атомов углерода и имеет указанное выше значение. Фенилсульфонилоксигруппа является предпочтительной. (3-9С)гетероарилсульфонилоксигруппы являются аналогами (6-10С)арилсульфонилоксигрупп и включают по меньшей мере один гетероатом, выбранный из N, O или S, которые могут присоединяться через атом углерода или через гетероатом, если доступно.
Термин "(1-4С)(ди)алкилкарбамоил" обозначает (ди)алкилкарбамоильную группу, алкильная группа которой содержит 1-4 атома углерода и имеет указанное выше значение.
Термин "(6-10С)(ди)арилкарбамоил" обозначает (ди)арилкарбамоильную группу, арильные фрагменты которой содержат 6-10 атомов углерода и имеют указанные выше значения.
Термин "(2-6С)гетероциклоалкилкарбамоил" обозначает гетероциклоалкилкарбамоильную группу, гетероциклоалкильная группа которой содержит 2-6 атомов углерода и имеет указанное выше значение.
Предпочтительными соединениями согласно настоящему изобретению являются соединения формулы I, в которой Y-X обозначает C(O)-NH, OC(O)-NH или C(O)-O. Более предпочтительными являются соединения, в которых Y-X обозначает C(O)-NH.
Предпочтительными соединениями являются также соединения, в которых R1 обозначает (1-4C)алкилкарбонил, предпочтительно ацетил, и/или R2 и/или R3 и R5 обозначают независимо (1-4С)алкил, более предпочтительно метил.
R6 предпочтительно обозначает объемную группу. Предпочтительными соединениями являются такие соединения, в которых R6 обозначает (6-10С)арил, (3-9С)гетероарил, (6-10С)арил(1-4С)алкил или (3-9С)гетероарил(1-4С)алкил. Наиболее предпочтительными являются соединения, в которых R6 обозначает (6-10С)арил, еще более предпочтительным является фенил. Предпочтительные R7 группы обозначают Н, (1-4С)алкил или (1-4С)алкокси. Наиболее предпочтительными являются Н или (1-4С)алкил и еще более предпочтительным является Н или метил. Наиболее предпочтительными являются соединения, в которых R7 обозначает Н.
В наиболее предпочтительных соединениях согласно настоящему изобретению R1 обозначает (1-4С)алкилкарбонил, R2, R3, R5 обозначают независимо (1-4С)алкил, R4 обозначает фенил и Y-X обозначает C(O)-NH и R7 обозначает Н. Еще более предпочтительными являются соединения, в которых R1 обозначает ацетил, R2, R3, R5 обозначают независимо метил, R4 обозначает фенил и Y-X обозначает C(O)-NH и R7 обозначает Н.
В указанных выше предпочтительных соединениях замещения возможны в соответствии с указаниями, данными в определениях групп. Фенил в R6 может быть, кроме того, замещен как указано в определении R6.
Из настоящего изобретения исключаются следующие соединения: 1-ацетил-6-бензоиламино-4-(4-метилфенил)-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин, 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4,6,8-пентаметилхинолин, 1-ацетил-6-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-6-трифторацетиламино-4-(4-метилфенил)-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-6-трифторацетиламино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-4-(4-хлорфенил)-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин и 1-ацетил-4-(4-бромфенил)-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин.
Исключенные соединения раскрыты в Ref. Zh., Khim. Abstr. No. 1Zh311, 1972; Khim. Geterosikl. Soedin. 7:795, 1971; Ambinter Screening Collection, order nrs 28020-A0839/0039328 (CAS 310456-97-4) and -A0705/0032919 (CAS 327981-38-4); ChemDiv. Inc. order nr 8005-9747 (CAS360760-14-1); ChemStar Product list, order nr CHS0065413 (CAS 299418-67-0); Asinex Compound Collection, order nr BAS0068990 (CAS 299970-20-0).
Приемлемые способы получения соединений согласно настоящему изобретению приведены ниже.
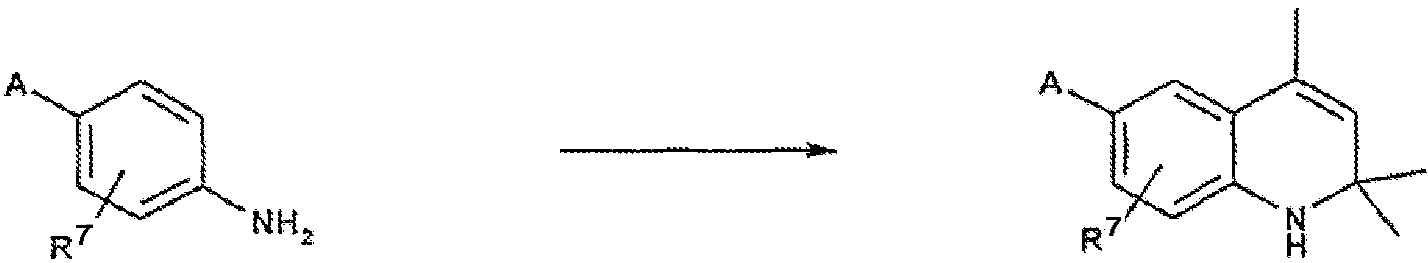
Соединения согласно настоящему изобретению, в которых R2 и R3 обозначают метил, могут быть получены из (защищенных) анилинов общей формулы II-a-e, в которой R7 имеет указанное выше значение, с помощью известной реакции Скраупа, которая дает 1,2-дигидро-2,2,4-триметилхинолиновые производные формулы III-a-e.
Аналогичные реакции циклизации Скраупа описаны в литературе: A. Knoevenagel, Chem. Ber. 54:1726, 1921: R.L. Atkins and D.E. Bliss, J. Org. Chem. 43:1975, 1978; J.V. Johnson, B.S. Rauckman, D.P. Baccanari and B. Roth, J. Med. Chem. 32:1942, 1989: W.C. Lin, S.-T. Huang and S.-T. Lin, J. Chin. Chem. Soc. 43:497, 1996: J.P. Edwards, S.J. West, K.B. Marschke, D.E. Mais, M.M. Gottardis and T.K. Jones, J. Med. Chem. 41:303, 1998.
Обычно указанную выше реакцию проводят при повышенной температуре в ацетоне, мезитилоксиде или этилацетоацетате в присутствии иода или протонной кислоты, такой как хлористоводородная кислота, п-толуолсульфоновая кислота или водный раствор хлористого иода. Альтернативно, 1,2-дигидро-2,2,4-триметилхинолины формулы III-a-e могут быть получены посредством реакции соответствующего анилина формулы II-a-e с ацетоном в присутствии MgSO4, 4-трет-бутилкатехола и иода (L.G. Hamann, R.I. Higuchi, L. Zhi, J.P. Edwards and X.-N. Wang, J. Med. Chem. 41:623, 1998). Исходный материал может быть получен либо непосредственно из коммерческих источников, либо посредством замещения ароматического кольца известными приемами, как, например, описано в литературе (H. Cerfontain, Y. Zou and B.H. Bakker, Recl. Trav. Chim. Pays-Bas, 113:403, 1994; A. Coppock, J. Org. Chem. 22:325, 1957; M. Schlosser, J.H. Choi and Takagishi, Tetrahedron, 46:5633, 1990).
Альтернативно, соединения общей формулы VI-a-e, в которой R2 и R3 обозначают (2-4C)алкил и R7 определен выше, могут быть синтезированы путем циклизации анилина формулы IV-a-e с соответствующим кетоном формулы V.
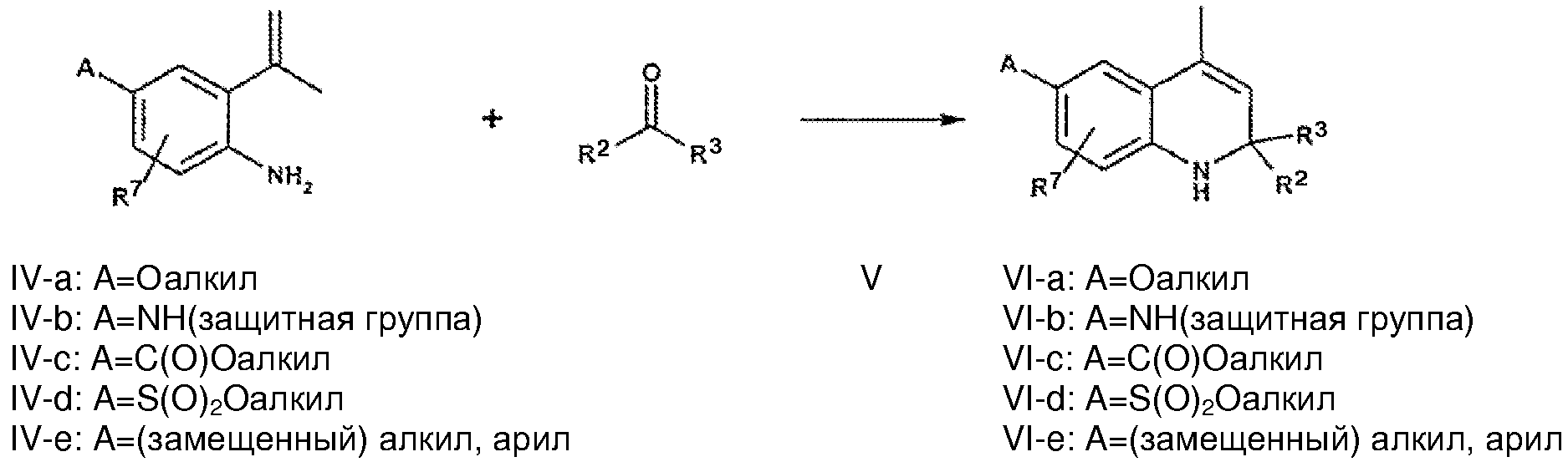
Указанную выше реакцию проводят обычно в инертном растворителе, таком как толуол, при повышенной температуре с использованием протонной кислоты или кислоты Льюиса, такой как, но не ограничиваясь, п-толуолсульфоновая кислота или трифторид бора, для ускорения циклизации (H. Walter, H. Sauter and T. Winkler, Helv. Chim. Acta, 75:1274, 1992; H. Walter, Helv. Chim. Acta, 77:608, 1994; H. Walter and J. Schneider, Heterocycles, 41:1251, 1995; J.P. Edwards, J.D. Ringgenberg and T.K. Jones, Tetrahedron Lett. 39:5139, 1998).
Требуемые для построения молекулы блоки формулы IV-a-e могут быть получены по реакции Виттига кетонов формулы VII-a-e. Введение заместителей А в ароматическое кольцо может быть осуществлено с использованием известных реакций замещения ароматического кольца либо на стадии анилина, либо на стадии 1,2-дигидро-2,2,4-триметилхинолина, как указывалось выше для соединений формулы II.
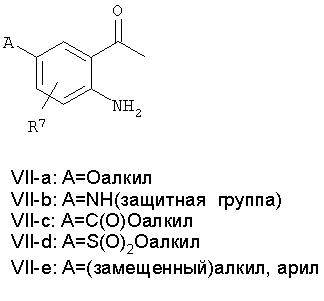
Кроме того, соединения общей формулы VI-a-e, в которой R2 = R3 = Н, могут быть получены из анилинов общей формулы II-a-e посредством реакции с 1-метилстиролом и формальдегидом в ацетонитриле при температуре окружающей среды или при повышенной температуре. Аналогичные реакции циклизации описаны в литературе: J.M. Mellor and G.D. Merriman, Tetrahedron, 51:6115, 1995.
Последующее 1-N-ацилирование или 1-N-сульфонилирование соединений формулы VI, в которой R2, R3 R7 и А определены выше, может быть проведено в стандартных условиях, известных специалистам в данной области. В типичном эксперименте соединения формулы VI подвергают взаимодействию в растворителе, таком как дихлорметан, тетрагидрофуран, толуол или пиридин, с ацилгалогенидом или ангидридом кислоты или сульфонилхлоридом в присутствии основания, такого как, но не ограничиваясь, N,N-диизопропилэтиламин, триэтиламин, пиперидин или гидрид натрия, с получением N-ацилированнного или N-сульфонилированного 1,2-дигидро-4-метилхинолинового производного формул VIII-a и VIII-b, соответственно.
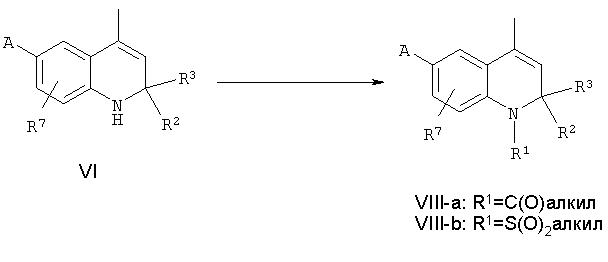
Аналогичные реакции N-ацилирования дигидрохинолинового скелета описаны в литературе: Zh. V. Shmyreva, Kh. S. Shikhaliev and E.B. Shpanig, Izv. Vyssh. Uchebn. Zaved. Khim. Tekhnol. 31:45, 1988; Zh. V. Shmyreva, Kh. S. Shikhaliev, L.P. Zalukaev, Y.A. Ivanov, Y.S. Ryabokobylko and I.E. Pokrovskaya, Zh. Obshch. Khim. 59:1391, 1989.
1-N-формилирование может быть легко проведено посредством реакции дигидрохинолина формулы VI с муравьиной кислотой в присутствии трифторуксусной кислоты при повышенной температуре (см., например, P. Bouyssou, C. Le Goff and J. Chenault, J. Heterocycl. Chem. 29:895, 1992) или с этиловым эфиром муравьиной кислоты в присутствии ацетата натрия, как описано в литературе (например, N. Atanes, S. Perez, E. Guitan, L. Castedo and J.M. Saa, Tetrahedron, 50:11257, 1994).
Введение требуемой фенильной группы в положении 4 дигидрохинолинового скелета может быть осуществлено посредством реакции алкилирования Фриделя-Крафтса (замещенных) производных бензола соединениями общей формулы VIII, в которой R1, R2, R3, R7 и А определены ранее.

Последнюю реакцию обычно проводят при повышенной температуре либо в чистом (замещенном) бензоле, либо в соответствующем инертном растворителе, таком как гептан или гексан, с использованием в качестве реагента (замещенного) бензола, катализируемую кислотой Льюиса (например, AlCl3, AlBr3, FeCl3 или SnCl4). Алкилирование по реакции Фриделя-Крафтса с использованием 1,2-дигидро-2,2,4-триметилхинолина описано в литературе (B.A. Lugovik, L.G. Yudin and A.N. Kost, Dokl. Akad. Nauk. SSSR, 170:340, 1966; B.A. Lugovik, L.G. Yudin, S.M. Vinogradova and A.N. Kost, Khim. Geterosikl. Soedin. 7:795, 1971).
Соединения согласно настоящему изобретению, описываемые формулой XII, в которых R5 Me и R1, R2, R3, R4, R7 и А определены ранее, могут быть синтезированы из тетрагидрохинолиновых кетонов формулы X. Так, реакция Виттига кетонов формулы X с соответствующим реагентом Виттига дает ненасыщенное производное формулы XI, которое, в свою очередь, является исходным материалом для алкилирования по реакции Фриделя-Крафтса (замещенного) бензола в указанном выше способе получения соединений общей формулы IX.
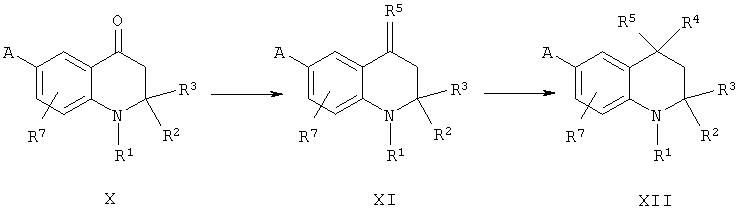
Указанная выше реакция Виттига известна специалистам в данной области.
Требуемый кетон формулы X может быть получен посредством реакции анилина формулы II с 3-хлор-3-метил-1-бутином (XIII) в смеси диэтиловый эфир/вода в присутствии порошка меди и триэтиламина с получением алкина формулы XIV. Водородгалогеновый обмен может осуществляться путем депротонирования соединения формулы XIV в инертном растворителе, таком как тетрагидрофуран, с использованием н-бутиллития при температуре ниже -50°С при добавлении п-толуолсульфонилхлорида с получением хлорида общей формулы XV. И, наконец, катализируемая кислотой циклизация (например, серной кислотой) может быть осуществлена при повышенной температуре в растворителе, таком как полиэтиленгликоль, с получением соединений формулы XVI, которые могут быть ацилированы или сульфонилированы, как было описано выше для производных общей формулы VI.
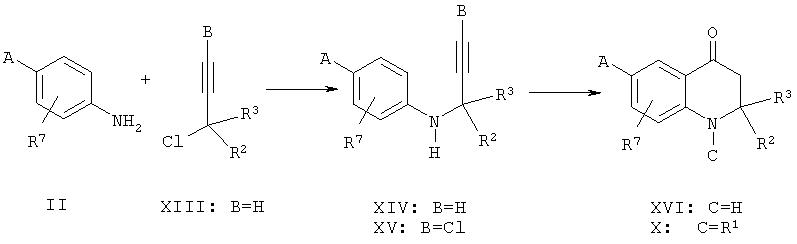
Указанная выше последовательность реакций описана в литературе (P. Barmettler and H.-J. Hansen, Helv. Chim. Acta, 73:1515, 1990 (и содержащиеся в работе ссылки)).
Функционализация положения 6 в тетрагидрохинолинах общей формулы XII может быть осуществлена по известным процедурам снятия защиты-сопряжения:
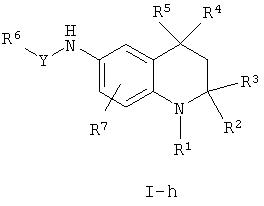
Соединения согласно настоящему изобретению, в которых Х = О и Y = C(O), S(O)2, NHC(O), NHC(S), OC(O) или связь и которые описываются формулой I-a, могут быть получены из тетрагидрохинолина, содержащего 6-метокси, формулы XII-a. Реакция деметилирования известна специалистам в данной области.
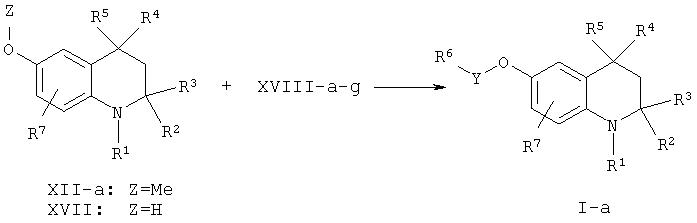
В типичном эксперименте деметилирование осуществляют посредством реакции соединения формулы XII-а с BBr3 в инертном растворителе, таком как, но не ограничиваясь, дихлорметан или тетрагидрофуран, при низкой температуре с получением соединений со снятой защитой общей формулы XVII. Альтернативно, деметилирование может быть достигнуто при проведении реакции соединений формулы XII-a с комплексом BF3.Me2S при температуре окружающей среды в инертном растворителе, как указывалось для деметилирования с использованием BBr3.
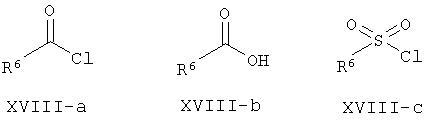
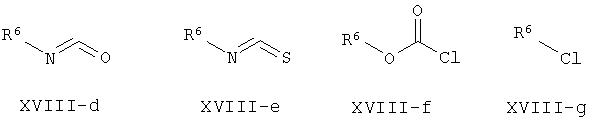
Способы последующей функционализации свободных OH групп в производных формулы XVII также известны специалистам в данной области и могут быть легко осуществлены с использованием реактивов формулы XVIII-a-g.
В случае галогенсодержащих реактивов формулы XVIII указанную выше реакцию проводят обычно при комнатной температуре в подходящем растворителе, например, в апротонном растворителе, таком как N,N-диметилформамид, дихлорметан или тетрагидрофуран, в присутствии основания, такого как, не ограничиваясь приведенными ниже, N,N-диизопропилэтиламин или гидрид натрия. Для ускорения последней реакции могут быть введены добавки, такие как N,N-диметиламинопиридин или иодид тетрабутиламмония. Кроме того, использование изоцианатов или изотиоцианатов формулы XVIII-d и XVIII-e в инертном растворителе при температуре окружающей среды или при повышенной температуре приводит к получению соединений формулы I-а, в которой Y = NHC(O) или NHC(S) соответственно.
Соединения, в которых Y = C(O), могут быть также получены альтернативным способом с использованием карбоновых кислот общей формулы XVIII-b и с помощью связующего реагента, такого как тетрафторборат О-(бензотриазол)-1-ил)-N,N,N',N'-тетраметилурония (TBTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) или гексафторфосфат бромтрипирролидинофосфония (PyBrOP) и третичное основание, например, N,N-диизопропилэтиламин, в растворителе, таком как N,N-диметилформамид или дихлорметан, при температуре окружающей среды или при повышенной температуре.
Соединения, описываемые формулой I-b-c, в которой W = R8,R9N или R8O, соответственно, могут быть синтезированы посредством взаимодействия соединений общей формулы XVII с хлорангидридом формулы XIX в стандартных условиях.
Альтернативно, соединения формулы I-b-c могут быть получены из производных формулы XVII и хлорангидрида формулы XIX, в которых W = OEt, с омылением щелочью (например, NaOH) и последующей конденсацией свободной карбоновой кислоты либо с аминами общей формулы R8,R9NH, либо со спиртами общей формулы R8OH в присутствии связующего реагента, такого как указанные ранее TBTU, HATU или PyBrOP, и третичного основания, такого как N,N-диизопропилэтиламин.
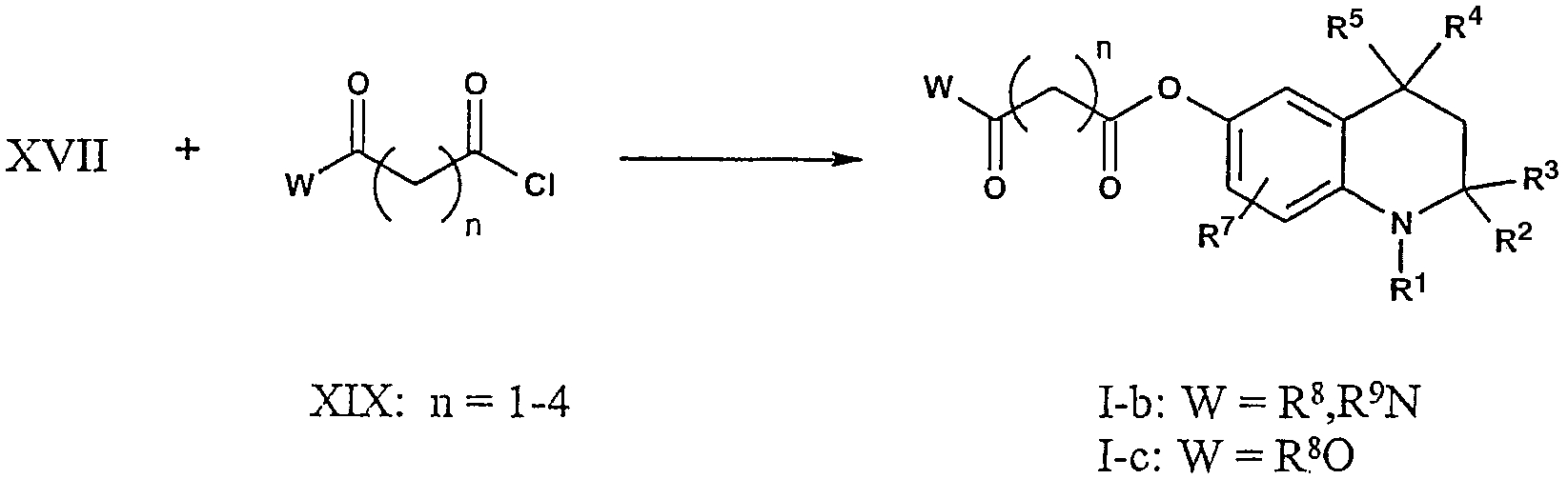
Соединения формулы I-d-e, в которых V = R8,R9N или R8O, соответственно, могут быть получены путем нуклеофильного замещения галогена, такого как Br, присутствующего в соединениях формулы XXI, аминами общей формулы R8,R9NH или спиртами общей формулы R8OH. В свою очередь, требуемый тетрагидрохинолин формулы XXI может быть синтезирован из соединения формулы XVII и бромацилхлорида общей формулы XX с использованием известных процедур синтеза.
Соединения, описываемые формулой I-f-g, в которых U=(замещенное) гетероароматическое соединение или (замещенный) фенил соответственно могут быть получены посредством реакции сопряжения Сузуки (замещенных) иодбензоильных производных формулы XXII бороновыми кислотами общей формулы XXIII-a-b.
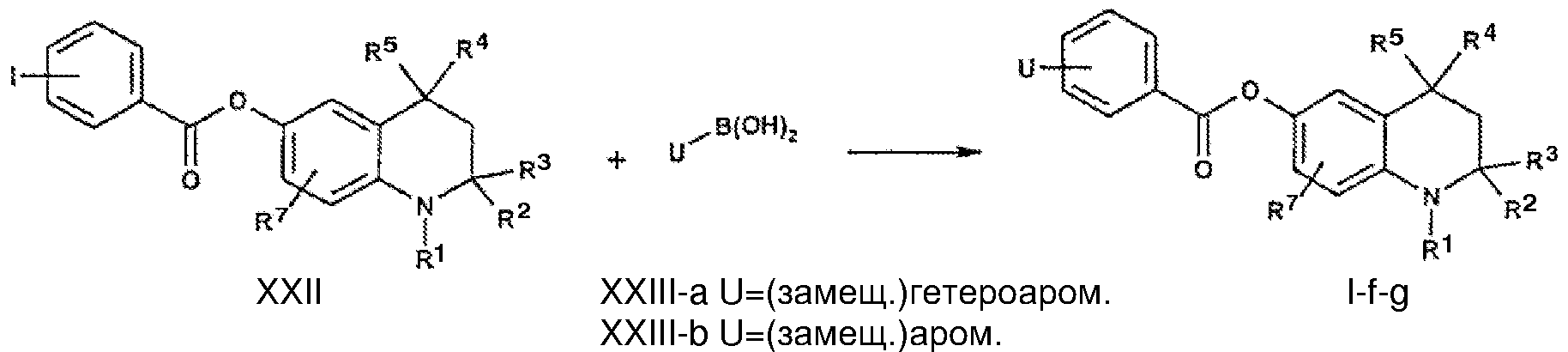
Обычно проводят реакцию иодида формулы XXII с бороновой кислотой формулы XXIII-a-b в смеси растворителей, такой как смесь диметоксиэтан/этанол, с использованием фторида цезия и палладиевого катализатора, такого как палладийтетракистрифенилфосфин или трис(дибензилиденацетон)дипалладий при повышенной температуре в атмосфере азота. Добавление трифенилфосфина может ускорять реакцию и улучшать ее выход. Указанная выше реакция достаточно широко описана в литературе (см., например A. Suzuki, Acc. Chem. Res. 15:178, 1982; N. Miyaura, T. Ishiyama, H. Sasaki, M. Ishikawa, M. Satoh and A. Suzuki, J. Am. Chem. Soc. 111:314, 1989).
Аналогично, соединения, описываемые формулой I-h, в которой X = NH и Y определен выше, могут быть синтезированы с использование способов, описанных выше для соединений общей формулы I-a-g, в которой X = O.
Соединения описываемой формулы I-i-j, в которой X = C(O) или S(O)2 и Y = NH или О соответственно, могут быть получены посредством реакции соответствующих ацил- или сульфонилхлоридов формулы XXV с аминами общей формулы R6NH2 или со спиртами общей формулы R6OH с использованием способа, описанного выше для получения соединений формулы I-a.
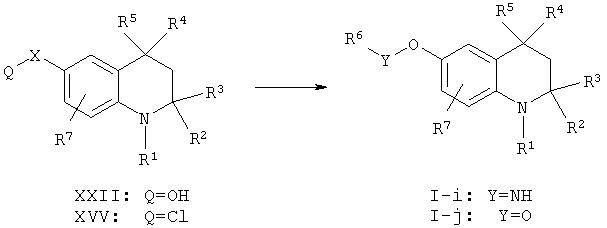
Требуемые ацил- или сульфонилхлориды формулы XXV могут быть получены из соответствующих соединений формулы XXIV при обработке, например, POCl3, PCl5, оксалилхлоридом, фосгеном или SOCl2, в растворителях, таких как толуол, ацетонитрил или N,N-диметилформамид, процедуры которой описаны в литературе. (См., например, M. Bonnat, M. Bradley and J.D. Kilburn, Tetrahedron Lett. 37:5409, 1996; J.G. Montana, G.M. Buckley, N. Cooper, H.J. Dyke and L. Gowers, Bioorg. Med. Chem. Lett, 8:2635, 1998; J. Hayler, P.D. Kane, D. LeGrand, F. Lugrin, K. Menear, R. Price, M. Allen, X. Cockcroft, J. Ambler, K. Butler and K. Durren, Bioorg. Med. Chem. Lett. 10:1567, 2000).
Альтернативно, соединения формулы XXIV, в которой X = C(O), могут использоваться непосредственно в качестве исходных материалов для получения производных формулы I-I-j с использованием связующих реагентов, как указано выше.
В случае соединений, описываемых формулой I-k-p, в которой X=C(O) или S(O)2 и Y=NH или О и n=1-4, могут использоваться известные процедуры синтеза.
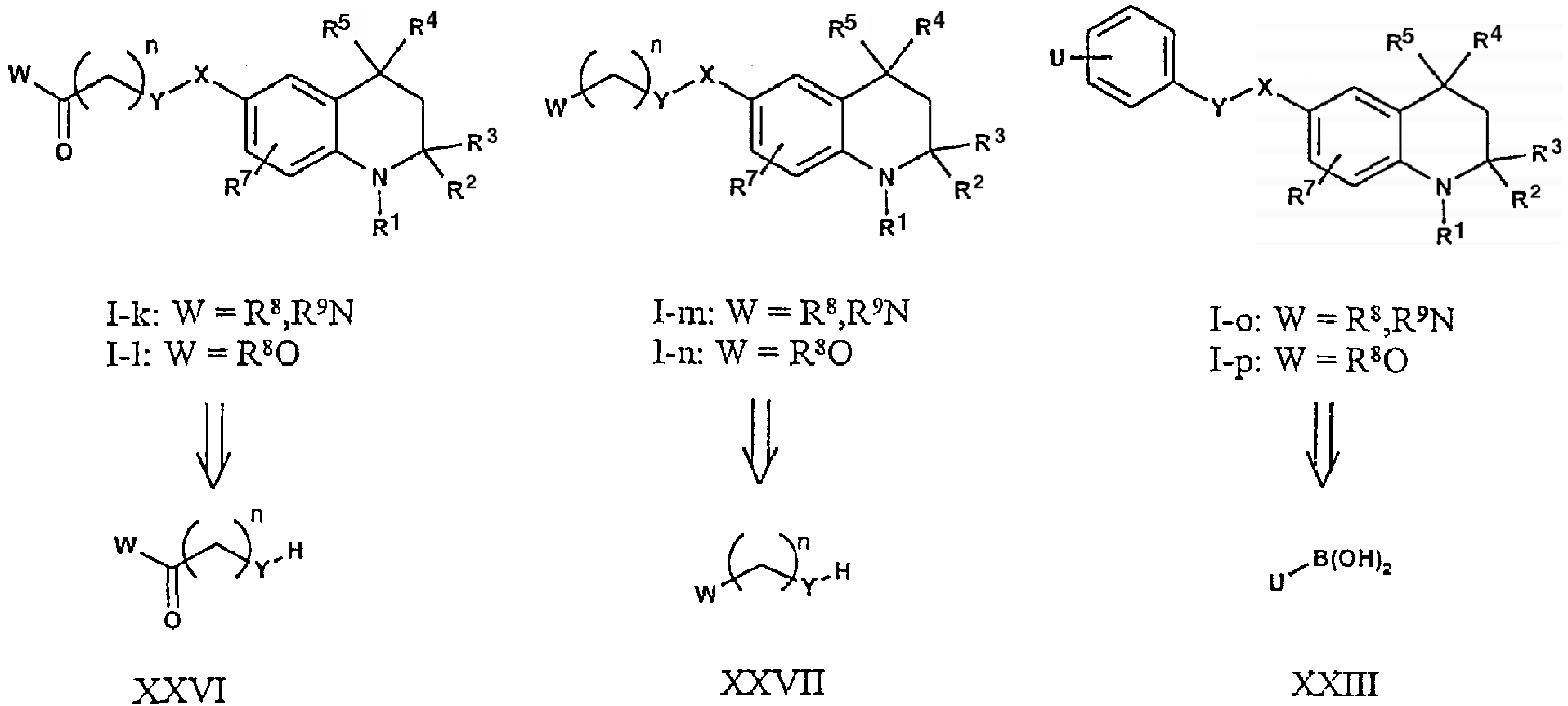
Таким образом, получение тетрагидрохинолинов формулы I-k-l может быть осуществлено при конденсировании амина или спирта, описываемых формулой XXVI (Y = NH или O соответственно) с хлоридами общей формулы XXV в стандартных условиях. В аналогичном случае для получения соединений формулы I-m-n могут использоваться амины или спирты формулы XXVII. И, наконец, использование указанных ранее бороновых кислот формулы XXIII ведет к получению соединений формулы I-o-p посредством указанной выше реакции сопряжения Сузуки.
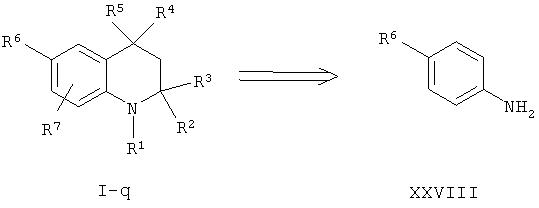
Соединения согласно настоящему изобретению, в которых X-Y обозначает связь и которые описываются формулой I-q, могут быть приобретены непосредственно из коммерческих источников или из легко получаемых анилинов формулы XXVIII с помощью последовательности реакций Скраупа, ацилирования и алкилирования Фриделя-Крафтса.
В аналогичном случае соединения, описываемые формулой I-r, в которой X-Y обозначает связь и U=(замещенное) гетероароматическое соединение или (замещенный) фенил, могут быть получены с помощью реакции конденсации Сузуки соответствующих 6-иодпроизводных тетрагидрохинолина формулы XXIX с бороновыми кислотами общей формулы XXIII, как указано выше.
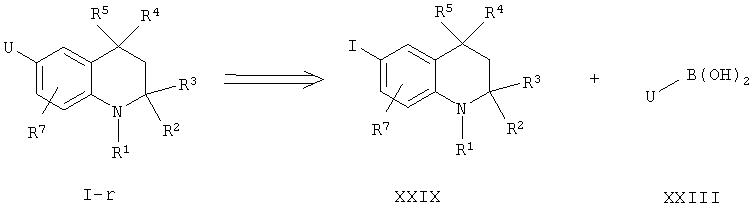
Требуемый иодид формулы XXIX может быть получен из соответствующего амина с помощью известной реакции Сандмейера.
Некоторые соединения согласно настоящему изобретению могут иметь форму свободного основания, а также могут быть выделены из реакционной смеси в виде фармацевтически приемлемой соли. Фармацевтически приемлемые соли могут быть также получены путем обработки свободного основания формулы I органической или неорганической кислотой, такой как хлористоводородная, бромистоводородная, иодистоводородная, серная кислота, фосфорная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота и аскорбиновая кислота.
Соединения согласно настоящему изобретению содержат по меньшей мере один хиральный атом углерода и в этой связи могут быть получены в виде чистых энантиомеров или в виде смеси энантиомеров, или в виде смеси диастереомеров. Способы выделения чистых энантиомеров известны в технике и осуществляются, например, путем кристаллизации солей, которые получают из оптически активных кислот и рацемической смеси, или с помощью хроматографии с использованием хиральных колонок. В случае диастереомеров может использоваться хроматография в колонках с прямой или обращенной фазой.
Соединения согласно настоящему изобретению могут образовывать гидраты или сольваты. Специалистам в данной области известно, что соединения, несущие заряд, образуют гидратированные формы при лиофилизации с использованием воды или образуют сольватированные формы при концентрировании в растворе соответствующего органического растворителя. Соединения согласно настоящему изобретению включают гидраты или сольваты перечисленных соединений.
При выборе активных соединений основываются на результатах их тестирования, которое при использовании концентрации 10-5 М должно приводить к получению активности более чем 20% от максимальной активности с использованием в качестве стандарта ФСГ. Другим критерием может быть величина ЭК50, которая должна быть <10-5 М, предпочтительно <10-7 М.
Специалистам в данной области известно, что желательное значение ЭК50 зависит от природы исследуемых соединений. Так, например, соединения со значением ЭК50 менее чем 10-5 М, в основном, рассматриваются как потенциальные соединения, подлежащие отбору. Предпочтительно данное значение ниже, чем 10-7 М. Однако соединение, которое имеет большее значение ЭК50, но является селективным для определенного рецептора, может стать лучшим кандидатом для отбора согласно настоящему изобретению.
Способы определения связывания рецептора как в тестах in vitro, так и в тестах in vivo для определения биологической активности гонадотропинов известны. В целом, создают условия для контакта экспрессированного рецептора с испытуемым соединением и измеряют параметры его связывания или стимуляцию или ингибирование функционального ответа.
Для измерения функционального ответа в соответствующих хозяйских клетках осуществляют экспрессию выделенной ДНК, кодирующей ген рецептора ФСГ, предпочтительно человеческого рецептора. Такая клетка может представлять собой клетку яичника китайского хомячка, но приемлемы также и другие клетки. Предпочтительно указанные клетки являются клетками млекопитающих (Jia et al, Mol. Endocrin., 5:759-776, 1991).
Способы конструирования клеточных линий, экспрессирующих рекомбинантный ФСГ, известны в технике (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, последнее издание). Экспрессия рецептора достигается путем экспрессии ДНК, кодирующей желательный белок. Методики направленного мутагенеза, лигирование дополнительных последовательностей, ПЦР и конструирование подходящих систем экспрессии в настоящее время известны в технике. Части или полностью вся ДНК, кодирующая желательный белок, могут быть сконструированы с использованием стандартных методик твердофазного синтеза, предпочтительно с включением сайтов рестрикции для облегчения лигирования. Для экспрессии кодирующих последовательностей ДНК могут быть также использованы подходящие контролирующие элементы транскрипции и трансляции включенной кодирующей последовательности. Как известно, в настоящее время имеются системы экспрессии, которые совместимы с множеством хозяйских клеток, включая прокариотические хозяйские клетки, такие как бактерии и эукариотические организмы, такие как дрожжи, растительные клетки, клетки насекомых, клетки млекопитающих, птичьи клетки и т.п.
Далее клетки, экспрессирующие рецептор, приводят в контакт с испытуемым соединением, с тем, чтобы определить наличие связывания или стимуляции или ингибирования функционального ответа.
Альтернативно, для измерения уровня связывания соединения могут использоваться выделенные клеточные мембраны, содержащие экспрессируемый рецептор.
Для измерения уровня связывания могут использоваться радиоактивно меченые или флюоресцентно меченые соединения. В качестве стандартного соединения может использоваться человеческий рекомбинантный ФСГ. В альтернативном варианте могут также проводиться тесты на конкурентное связывание.
Другой тест включает скрининг соединений, обладающих агонистской активностью в отношении рецептора ФСГ путем выявления стимуляции опосредованного рецептором накопления цАМФ. При этом указанный способ включает экспрессию рецептора на клеточной поверхности хозяйской клетки и воздействие на клетку испытуемого соединения. Далее измеряют уровень цАМФ. Уровень цАМФ может быть снижен или повышен в зависимости от природы действия, ингибирующего или стимулирующего, испытуемого соединения в случае связывания его с рецептором.
Кроме прямого измерения, например уровня цАМФ, в экспонированных клетках могут использоваться клеточные линии, которые, вдобавок к трансфекции ДНК, кодирующей рецептор, подверглись также трансфекции второй ДНК, кодирующей репортерный ген, экспрессия которого соответствует уровню цАМФ. Такие репортерные гены могут индуцироваться под действием цАМФ или могут быть конструированы таким образом, чтобы они имели связь с новыми элементами, отвечающими на уровень цАМФ. В целом, экспрессия репортерного гена может контролироваться любым отзывчивым элементом, реагирующим на изменение уровней цАМФ. Подходящие репортерные гены включают, например, LacZ, щелочную фосфатазу, люциферазу светлячков и зеленый флуоресцентный белок. Принципы таких тестов на трансактивацию известны в технике и описаны в литературе (например, Stratowa, Ch., Himmler, A. and Czernilofsky, A.P. (1995) Curr.Opin.Biotechnol. 6:574).
Настоящее изобретение также относится к фармацевтической композиции, включающей тетрагидрохинолиновые производные или их фармацевтически приемлемые соли, имеющие общую формулу I, в смеси с фармацевтически приемлемыми вспомогательными компонентами и необязательно другими терапевтическими средствами. Вспомогательные компоненты должны быть "приемлемы" в смысле совместимости с другими ингредиентами композиции и не должны оказывать вредное воздействие на реципиентов. Фармацевтические композиции могут также включать тетрагидрохинолиновые производные: 1-ацетил-6-бензоиламино-4-(4-метилфенил)-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин, 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4,6,8-пентаметилхинолин, 1-ацетил-6-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-6-трифторацетиламино-4-(4-метилфенил)-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-6-трифторацетиламино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин, 1-ацетил-4-(4-хлорфенил)-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин и 1-ацетил-4-(4-бромфенил)-1,2,3,4-тетрагидро-2,2,4,6-тетраметилхинолин.
Композиции включают, например, композиции, пригодные для перорального, сублингвального, подкожного, внутривенного, внутримышечного, местного или ректального введения и т.п., в стандартных дозированных формах для введения.
В случае перорального введения активный ингредиент может иметь вид дискретных единиц, таких как таблетки, капсулы, порошки, грануляты, растворы, суспензии и т.п.
В случае парентерального введения фармацевтическая композиция согласно настоящему изобретению может быть представлена в виде единичной дозы или контейнеров с множественной дозой, например, в виде жидкостей для инъекций в заданных количествах, например, в запаянных флаконах и ампулах, и может храниться в высушенном при замораживании (в лиофилизированном) состоянии, когда требуется лишь добавление стерильного жидкого носителя, например воды, перед использованием.
Смешанный с фармацевтически приемлемыми вспомогательными компонентами, такими, например, которые описаны в стандартном руководстве (Gennaro, A.R. et al., Remington: The Science and Practice of Pharmacy (20th Edition., Lippincott Williams & Wilkins, 2000, см. в особенности Part 5: Pharmaceutical Manufacturing), активный агент может подвергнуться прессованию для получения твердых дозированных форм, таких как пилюли, таблетки, или может быть представлен в виде капсул или суппозиториев. В случае использования фармацевтически приемлемых жидкостей активный агент может применяться в виде жидкостной композиции, например в виде препарата для инъекций, в виде раствора, суспензии, эмульсии или в виде аэрозоля, например назального аэрозоля.
В изобретении с целью получения стандартных дозированных форм рассматривается использование традиционных добавок, таких как наполнители, красители, полимерные связующие вещества и т.п. В целом, могут использоваться любые фармацевтически приемлемые добавки, которые не мешают функции активных соединений. Соответствующие носители, с которыми активный агент согласно настоящему изобретению может вводиться в виде твердых композиций, включают лактозу, крахмал, производные целлюлозы и т.п. или их смеси, используемые в соответствующих количествах. В случае парентерального введения могут использоваться водные суспензии, изотонические солевые растворы и стерильные растворы для инъекций, содержащие фармацевтически приемлемые средства, способствующие диспергированию, и/или смачивающие агенты, такие как пропиленгликоль или бутиленгликоль.
Настоящее изобретение также относится к описанной выше фармацевтической композиции в сочетании с упаковочным материалом, пригодным для данной композиции, причем указанный упаковочный материал включает инструкции по использовании композиции согласно описанному выше способу.
Тетрагидрохинолиновые производные согласно настоящему изобретению могут также вводиться в виде имплантируемых фармацевтических устройств, состоящих из ядра активного материала, окруженного мембраной, которая регулирует уровень высвобождения активного ингредиента. Такие имплантаты вводятся подкожно или местным способом и высвобождают активный ингредиент с примерно постоянной скоростью в течение относительно продолжительных периодов времени, например, в течение периодов времени от нескольких недель до нескольких лет. Способы получения имплантируемых фармацевтических устройств известны в технике и описаны, например, в европейском патенте 0303306 (AKZO Nobel N.V.).
Точная доза и режим введения активного ингредиента или содержащей его фармацевтической композиции зависят, несомненно, от того терапевтического эффекта, которого необходимо добиться (лечение бесплодия, контрацепция) и может варьировать в зависимости от природы конкретного соединения, способа введения, а также возраста и состояния здоровья конкретного субъекта, которому будет вводиться указанное средство.
В целом, для парентерального введения требуются меньшие дозировки, чем при других способах введения, которые в большей степени зависят от уровня всасывания. При этом предпочтительная дозировка для человека содержит 0,0001-25 мг на килограмм веса тела. Желательная доза может быть представлена в виде одной дозы или множественных поддоз, вводимых с соответствующими интервалами времени в течение дня, или, если реципиентом является женщина, в виде нескольких доз, вводимых с соответствующими интервалами в течение менструального цикла. Дозировка, а также режим введения могут различаться для случаев реципиента-мужчины и реципиента-женщины.
Таким образом, соединения согласно настоящему изобретению могут использоваться при лечении.
Еще один аспект настоящего изобретения относится к использованию тетрагидрохинолинового производного, имеющего общую формулу I, при получении лекарственного средства, используемого для лечения заболеваний, связанных с метаболизмом рецептора ФСГ, предпочтительно для контроля фертильности, более предпочтительно для лечения бесплодия или для предупреждения оплодотворения. Соединения согласно настоящему изобретению могут также использоваться для лечения гормонзависимых заболеваний, таких как рак молочной железы, рак предстательной железы и эндометриоз.
Настоящее изобретение описывается приведенными ниже примерами.
Примеры
Пример 1
1-Ацетил-6-(трет-бутоксикарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 6-(трет-Бутоксикарбонил)амино-1,2-дигидро-2,2,4-триметилхинолин
Смесь N-Boc-1,4-фенилендиамина (5,0 г) и иода (1,3 г) в мезитилоксиде (25 мл) перемешивают в течение 2 часов при 100°С. Реакционную смесь концентрируют в вакууме и остаток хроматографируют на Al2O3 (Alumina B, act. III) в смеси гептан/дихлорметан = 8/2 в качестве элюента.
Выход: 2,9 г MS-ESI: [M+H]+ = 289,2
(b) 1-Ацетил-6-(трет-бутоксикарбонил)амино-1,2-дигидро-2,2,4-триметилхинолин
Добавляют по каплям ацетилхлорид (11,1 мл) и уксусный ангидрид (11,1 мл) к раствору 6-(трет-бутоксикарбонил)амино-1,2-дигидро-2,2,4-триметилхинолина (8,5 г) в пиридине (22 мл) и дихлорметане (212 мл). После перемешивания в течение 18 часов реакционную смесь промывают 2М HCl и водой. Органический слой сушат (MgSO4), фильтруют и концентрируют в вакууме. Остаток хроматографируют на силикагеле в смеси гептан/этилацетат = 8/2 (объем/объем) в качестве элюента.
Выход: 6,7 г MS-ESI: [M+H]+ = 331,2
(с) 1-Ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-(трет-бутоксикарбонил)амино-2,2,4-триметил-1,2-дигидрохинолина (2,4 г) и AlCl3 (9,5 г) в бензоле (150 мл) перемешивают при 70°С в течение 1 часа. Реакционную смесь охлаждают (0°С) и реакцию гасят водой и, кроме того, добавляют раствор 2M NaOH. Органический слой отделяют, сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток хроматографируют на силикагеле в смеси гептан/этилацетат = 8/2 (объем/объем) в качестве элюента.
Выход: 1,6 г. MS-ESI: [M+H]+ = 309,2
(d) 1-Ацетил-6-(трет-бутоксикарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг), (Boc)2O (30 мг) и N,N-диизопропилэтиламина (20 мкл) в тетрагидрофуране (4 мл) перемешивают при 60°С в течение 18 часов. Реакционную смесь концентрируют в вакууме и остаток хроматографируют на силикагеле в смеси дихлорметан/метанол = 1/0 => 95/5 (объем/объем) в качестве элюента.
Выход: 8 мг. MS-ESI: [M+H]+ = 409,2
Пример 2
6-Амино-1-бутирил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 6-(трет-Бутоксикарбонил)амино-1-бутирил-1,2-дигидро-2,2,4-триметилхинолин
К раствору 6-(трет-бутоксикарбонил)амино-1,2-дигидро-2,2,4-триметилхинолина (50 мг) и каталитического количества N,N-диметиламинопиридина в пиридине (4 мл) добавляют по каплям бутирилхлорид (185 мкл). После перемешивания в течение 18 часов реакционную смесь концентрируют в вакууме. Остаток растворяют в этилацетате и промывают водой. Органический слой отделяют, сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 7/3 (объем/объем).
Выход: 47 мг. MS-ESI: [M+H]+ = 359,4
(b) 6-Амино-1-бутирил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-бутирил-6-(трет-бутоксикарбонил)амино-1,2-дигидро-2,2,4-триметилхинолина (47 мг) и AlCl3 (52 мг) в бензоле (2 мл) перемешивают при 60°С в течение 6 часов. Реакционную смесь охлаждают (0°С), реакцию гасят водой и, кроме того, добавляют раствор 2M NaOH. Органический слой отделяют, сушат над MgSO4 и концентрируют в вакууме. Остаток очищают препаративной ВЭЖХ.
Выход: 10 мг. MS-ESI: [M+H]+ = 337,2; ВЭЖХ: Rt=6,97 мин (способ 1)
Пример 3
1-Ацетил-6-амино-4-(4-хлорфенил)-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-(трет-бутоксикарбонил)амино-1,2-дигидро-2,2,4-триметилхинолина (25 мг) и AlCl3 (35 мг) в хлорбензоле (2 мл) перемешивают в течение 1 часа. Реакционную смесь гасят водой и, кроме того, добавляют раствор 2M NaOH и этилацетат. Органический слой отделяют, сушат над MgSO4 и концентрируют в вакууме.
Выход: 20 мг. MS-ESI: [M+H]+ = 343,4; ВЭЖХ: Rt=6,16 мин (способ 1).
Пример 4
1-Ацетил-6-амино-4-(4-фторфенил)-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 3, проводят реакцию алкилирования Фриделя-Крафтса фторбензола (2 мл) 1-ацетил-6-(трет-бутоксикарбонил)амино-1,2-дигидро-2,2,4-триметилхинолином (25 мг) в присутствии AlCl3.
Выход: 15 мг. MS-ESI: [M+H]+ = 327,4; ВЭЖХ: Rt=5,63 мин (способ 1)
Пример 5
1-Ацетил-6-амино-1,2,3,4-тетрагидро-4-(4-толуоил)-2,2,4-триметилхинолин
По способу, описанному в примере 3, проводят реакцию алкилирования Фриделя-Крафтса толуола (2 мл) 1-ацетил-6-(трет-бутоксикарбонил)амино-1,2-дигидро-2,2,4-триметилхинолином (25 мг) в присутствии AlCl3 (35 мг).
Выход: 22 мг. MS-ESI: [M+H]+ = 323,2
Пример 6
1-Ацетил-6-(4-хлорбензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг), 4-хлорбензоилхлорида (11 мг) и N,N-диизопропилэтиламина (22 мкл) в тетрагидрофуране (1 мл) перемешивают в течение 18 часов. Реакционную смесь концентрируют в вакууме, остаток растворяют в этилацетате и промывают 0,5M HCl, водой, 5% водным NaHCO3, водой и насыщенным раствором соли. Органический слой отделяют, сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 0/1 (объем/объем).
Выход: 9,5 мг. MS-ESI: [M+H]+ = 447,4; ВЭЖХ: Rt=10,87 мин (способ 1)
Пример 7
1-Ацетил-6-бензоиламино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) бензоилхлоридом (9,1 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 1,2 мг. MS-ESI: [M+H]+ = 413,4; ВЭЖХ: Rt=10,01 мин (способ 1)
Пример 8
1-Ацетил-4-фенил-1,2,3,4-тетрагидро-6-(4-[трифторметил]бензоил)амино-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 4-трифторметилбензоилхлоридом (14 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 8,9 мг. MS-ESI: [M+H]+ = 481,4; ВЭЖХ: Rt=10,76 мин (способ 1)
Пример 9
1-Ацетил-6-(4-нитробензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 4-нитробензоилхлоридом (12 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 8,2 мг. MS-ESI: [M+H]+ = 458,4; ВЭЖХ: Rt=10,02 мин (способ 1)
Пример 10
1-Ацетил-4-фенил-6-(4-н-пропилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 4-н-пропилбензоилхлоридом (12 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 6,7 мг. MS-ESI: [M+H]+ = 455,4; ВЭЖХ: Rt=11,19 мин (способ 1)
Пример 11
1-Ацетил-6-(3-бром-2,6-диметоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (25 мг), 3-бром-2,6-диметоксибензойной кислоты (23 мг), гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) (68 мг) и N,N-диизопропилэтиламина (32 мкл) в дихлорметане (4 мл) перемешивают в течение 18 часов. Реакционную смесь концентрируют в вакууме, остаток растворяют в этилацетате и промывают 0,5M HCl, водой, 5% водным NaHCO3, водой и насыщенным раствором соли. Органический слой сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат=1/0 => 0/1 (объем/объем).
Выход: 28 мг. MS-ESI: [M+H]+ = 551,4; ВЭЖХ: Rt=3,75 мин (способ 2)
Пример 12
1-Ацетил-4-фенил-6-(4-фенилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (11 мг) 4-бифенилкарбонилхлоридом (16 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 1,0 мг. MS-ESI: [M+H]+ = 489,4; ВЭЖХ: Rt=11,62 мин (способ 1)
Пример 13
1-Ацетил-6-(4-[4-хлорфенил]бензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-(4-иодбензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (300 мг), 4-иодбензоилхлорида (520 мг) и каталитического количества N,N-диметиламинопиридина в пиридине (4 мл) перемешивают в течение 18 часов. Реакционную смесь концентрируют в вакууме, остаток растворяют в этилацетате и промывают насыщенным водным NaHCO3, водой и насыщенным раствором соли. Органический слой сушат (MgSO4) и концентрируют в вакууме.
Выход: 460 мг. MS-ESI: [M+H]+ = 539,4; ВЭЖХ: Rt=10,98 мин (способ 1)
(b) 1-Ацетил-6-(4-[4-хлорфенил]бензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-(4-иодбензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (25 мг), 4-хлорбензолбороновой кислоты (22 мг), фторида цезия (14 мг), трифенилфосфина (5,0 мг) и трис(дибензилиденацетон)дипалладия(0) (4,3 мг) в смеси диметоксиэтан/этанол (4:1) (5 мл) перемешивают в течение 15 минут, пропуская через раствор азот. Через 3 часа реакционную смесь концентрируют при 80°С в вакууме, остаток растворяют в этилацетате и промывают 0,5M HCl, водой, 5% водным NaHCO3, водой и насыщенным раствором соли. Органический слой сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 0/1 (объем/объем).
Выход: 16 мг. MS-ESI: [M+H]+ = 523,4; ВЭЖХ: Rt=4,40 мин (способ 2)
Пример 14
1-Ацетил-4-фенил-6-(4-[3-пиридил]бензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 13, приводят реакцию перекрестного сочетания Сузуки 1-ацетил-6-(4-иодбензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (25 мг), циклического эфира пиридин-3-бороновая кислота-1,3-пропандиола (23 мг), фторида цезия (14 мг), трифенилфосфина (5,0 мг) и трис(дибензилиденацетон)дипалладия(0) (4,3 мг) в смеси диметоксиэтан/этанол (4:1) (объем/объем) (5 мл).
Выход: 17 мг. MS-ESI: [M+H]+ = 490,4; ВЭЖХ: Rt=7,11 мин (способ 1)
Пример 15
1-Ацетил-4-фенил-6-(2-фенил-5-метоксибензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-(2-бром-5-метоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (25 мг) с 2-бром-5-метоксибензойной кислотой (21 мг) с участием HATU (68 мг) и N,N-диизопропилэтиламина (32 мкл) в дихлорметане (4 мл).
Выход: 31 мг. MS-ESI: [M+H]+ = 521,4; ВЭЖХ: Rt=3,74 мин (способ 2)
(b) 1-Ацетил-4-фенил-6-(2-фенил-5-метоксибензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 13, проводят реакцию перекрестного сочетания Сузуки 1-ацетил-4-фенил-6-(2-бром-5-метоксибензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (30 мг), бензолбороновой кислоты (25 мг), фторида цезия (21 мг), трифенилфосфина (7,0 мг) и трис(дибензилиденацетон)дипалладия(0) (6,0 мг) в смеси диметоксиэтан/этанол (4:1) (объем/объем) (5 мл).
Выход: 23 мг. MS-ESI: [M+H]+ = 519,4; ВЭЖХ: Rt=10,87 мин (способ 1)
Пример 16
1-Ацетил-4-фенил-6-(2-фенил-3-метилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-4-фенил-6-(2-бром-3-метилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (25 мг) с 2-бром-3-метилбензойной кислотой (19 мг) с участием HATU (68 мг) и N,N-диизопропилэтиламина (32 мкл) в дихлорметане (4 мл).
Выход: 16,3 мг. MS-ESI: [M+H]+ = 505,2; ВЭЖХ: Rt=3,80 мин (способ 2)
(b) 1-Ацетил-4-фенил-6-(2-фенил-3-метилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 13, проводят реакцию перекрестного сочетания Сузуки 1-ацетил-4-фенил-6-(2-бром-3-метилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (16 мг), бензолбороновой кислоты (25 мг), фторида цезия (21 мг), трифенилфосфина (7,0 мг) и трис(дибензилиденацетон)дипалладия(0) (6,0 мг) в смеси диметоксиэтан/этанол (4:1) (объем/объем) (5 мл).
Выход: 4,9 мг. MS-ESI: [M+H]+ = 503,3; ВЭЖХ: Rt=4,61 мин (способ 2)
Пример 17
1-Ацетил-4-фенил-1,2,3,4-тетрагидро-6-(α-толуолсульфонил)амино-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию сульфонилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) α-толуолсульфонилхлоридом (12 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (25 мл).
Выход: 9,8 мг. MS-ESI: [M+H]+ = 463,4; ВЭЖХ: Rt=9,49 мин (способ 1)
Пример 18
1-Ацетил-4-фенил-6-(фениламинокарбонил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг), фенилизоцианата (8,0 мг) и N,N-диизопропилэтиламина (22 мкл) в тетрагидрофуране (1 мл) перемешивают в течение 18 часов. Реакционную смесь концентрируют в вакууме, остаток растворяют в этилацетате и промывают 0,5M HCl, водой, 5% водным NaHCO3, водой и насыщенным раствором соли. Органический слой сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 0/1 (объем/объем).
Выход: 3,8 мг. MS-ESI: [M+H]+ = 428,4; ВЭЖХ: Rt=10,39 мин (способ 1)
Пример 19
1-Ацетил-6-(трет-бутиламинотиокарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 18, получают тиомочевину из 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с использованием трет-бутилизоцианата (7,5 мг) и N,N-диизопропилэтиламина (22 мкл) в тетрагидрофуране (1 мл).
Выход: 0,50 мг. MS-ESI: [M+H]+ = 424,4; ВЭЖХ: Rt=5,90 мин (способ 1)
Пример 20
Трифторацетат 1-ацетил-6-(4-трет-бутилбензил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина
Смесь 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг), 4-(трет-бутил)бензилхлорида (6,5 мг) и N,N-диизопропилэтиламина (10 мкл) в тетрагидрофуране (1 мл) перемешивают при температуре 50°С в течение 18 часов. Реакционную смесь концентрируют в вакууме, остаток растворяют в этилацетате и промывают 0,5M HCl, водой, 5% водным NaHCO3, водой и насыщенным раствором соли. Органический слой сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 0/1 (объем/объем).
Выход: 3,1 мг. MS-ESI: [M+H]+ = 455,4; ВЭЖХ: Rt=10,00 мин (способ 1)
Пример 21
1-Ацетил-4-фенил-6-(3-фенилпропионил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 3-фенилпропионилхлоридом (11 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 1,2 мг. MS-ESI: [M+H]+ = 441,4; ВЭЖХ: Rt=10,25 мин (способ 1)
Пример 22
1-Ацетил-6-(2-фуроил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 2-фуроилхлоридом (8,5 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 7,7 мг. MS-ESI: [M+H]+ = 403,4; ВЭЖХ: Rt=8,91 мин (способ 1)
Пример 23
1-Ацетил-6-(изовалерил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) изовалерилхлоридом (7,8 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 5,3 мг. MS-ESI: [M+H]+ = 393,4; ВЭЖХ: Rt=9,35 мин (способ 1)
Пример 24
1-Ацетил-6-(3-[адамантан-1-ил]пропионил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с 3-(адамантан-1-ил)пропионовой кислотой (10 мг) с участием HATU (25 мг) и N,N-диизопропилэтиламина (22 мкл) в дихлорметане (1 мл).
Выход: 6,7 мг. MS-ESI: [M+H]+ = 499,4; ВЭЖХ: Rt=12,43 мин (способ 1)
Пример 25
1-Ацетил-6-(этилмалонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (150 мг) этилмалонилхлоридом (147 мг) и N,N-диизопропилэтиламином (314 мкл) в тетрагидрофуране (8 мл).
Выход: 163 мг. MS-ESI: [M+H]+ = 423,2; ВЭЖХ: Rt=8,48 мин (способ 1)
Пример 26
1-Ацетил-6-([4-метоксибензиламино]карбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-(гидроксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Добавляют по каплям 2M раствор NaOH к перемешиваемому раствору 1-ацетил-6-(этилмалонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (161 мг) в смеси диоксан/вода (4:1) (объем/объем) (12 мл) до pH 14. После перемешивания в течение 3,5 часов реакционную смесь выливают в воду и экстрагируют этилацетатом при pH 2. Органический слой промывают водой и насыщенным раствором соли, сушат (MgSO4) и концентрируют в вакууме.
Выход: 163 мг. MS-ESI: [M+H]+ = 395,2; ВЭЖХ: Rt=7,43 мин (способ 1)
(b) 1-Ацетил-6-([4-метоксибензиламино]карбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 4-метоксибензиламина (5,2 мг) с 1-ацетил-6-(гидроксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолином (10 мг) с участием HATU (19 мг) и N,N-диизопропилэтиламина (16 мкл) в тетрагидрофуране (2 мл).
Выход: 7,3 мг. MS-ESI: [M+H]+ = 514,4; ВЭЖХ: Rt=8,80 мин (способ 1)
Пример 27
1-Ацетил-6-([этоксикарбонилметиламино]карбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации этилового эфира глицина·HCl (5,3 мг) с 1-ацетил-6-(гидроксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолином (10 мг) с участием HATU (19 мг) и N,N-диизопропилэтиламина (16 мкл) в тетрагидрофуране (2 мл).
Выход: 4,6 мг. MS-ESI: [M+H]+ = 480,6; ВЭЖХ: Rt=7,94 мин (способ 1)
Пример 28
1-Ацетил-6-([N-этил-N-бензиламино]карбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации N-этилбензиламина (5,2 мг) с 1-ацетил-6-(гидроксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолином (10 мг) с участием HATU (19 мг) и N,N-диизопропилэтиламина (16 мкл) в тетрагидрофуране (2 мл).
Выход: 7,3 мг. MS-ESI: [M+H]+ = 512,6; ВЭЖХ: Rt=9,36 мин (способ 1)
Пример 29
1-Ацетил-6-([2,4-дифторбензиламино]метилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-(бромацетил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (130 мг) бромацетилхлоридом (69 мкл) и N,N-диизопропилэтиламином (121 мкл) в дихлорметане (10 мл).
Выход: 151 мг. MS-ESI: [M+H]+ = 431,2
(b) 1-Ацетил-6-([2,4-дифторбензиламино]метилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-(бромацетил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг), 2,4-дифторбензиламина (6,0 мг) и N,N-диизопропилэтиламина (10 мкл) в диоксане (2 мл) перемешивают при температуре 40°С в течение 18 часов. Реакционную смесь концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси дихлорметан/метанол = 1/0 => 95/5 (объем/объем).
Выход: 5,5 мг. MS-ESI: [M+H]+ = 492,4; ВЭЖХ: Rt=6,74 мин (способ 1)
Пример 30
1-Ацетил-6-([4-{1-фенил}пиперазинил]метилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 29, проводят реакцию N-алкилирования 1-фенилпиперазина (7,0 мкл) 1-ацетил-6-(бромацетил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолином (10 мг) и N,N-диизопропилэтиламином (10 мкл) в диоксане (2 мл).
Выход: 8,4 мг. MS-ESI: [M+H]+ = 511,4; ВЭЖХ: Rt=7,01 мин (способ 1)
Пример 31
1-Ацетил-6-([N-морфолино]метилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 29, проводят реакцию N-алкилирования морфолина (4,0 мкл) 1-ацетил-6-(бромацетил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолином (10 мг) и N,N-диизопропилэтиламином (9,0 мкл) в дихлорметане (2 мл).
Выход: 10 мг. MS-ESI: [M+H]+ = 436,4; ВЭЖХ: Rt=5,64 мин (способ 1)
Пример 32
1-Ацетил-6-(2-тиофенметиламино)карбонил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) Метиловый эфир 1,2-дигидро-2,2,4-триметилхинолин-6-карбоновой кислоты
По способу, описанному в примере 1, проводят реакцию Скраупа метил 4-аминобензоата (5,0 г) и иода (1,7 г) в мезитилоксиде (25 мл).
Выход: 2,3 мг. MS-ESI: [M+H]+ = 232,2.
(b) Метиловый эфир 1-ацетил-1,2-дигидро-2,2,4-триметилхинолин-6-карбоновой кислоты
Смесь метилового эфира 1,2-дигидро-2,2,4-триметилхинолин-6-карбоновой кислоты (2,3 г) и каталитического количества N,N-диметиламинопиридина в уксусном ангидриде (60 мл) перемешивают при температуре 100°С в течение 18 часов. Реакционную смесь концентрируют в вакууме, остаток растворяют в этилацетате и промывают водой и насыщенным раствором соли. Органический слой сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 1/9 (объем/объем).
Выход: 2,3 г.
(с) Метиловый эфир 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин-6-карбоновой кислоты
По способу, описанному в примере 3, проводят реакцию алкилирования Фриделя-Крафтса бензола (60 мл) метиловым эфиром 1-ацетил-1,2-дигидро-2,2,4-триметилхинолин-6-карбоновой кислоты (2,3 г) в присутствии AlCl3 (4,4 г).
Выход: 1,2 мг. MS-ESI: [M+H]+ = 352,4; ВЭЖХ: Rt=9,72 мин (способ 1)
(d) 1-Ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4- триметилхинолин-6-карбоновая кислота
2M раствор NaOH добавляют по каплям к перемешиваемому раствору метилового эфира 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин-6-карбоновой кислоты (1,2 г) в смеси диоксан/вода (4:1) (объем/объем) (50 мл) до pH 12. После перемешивания в течение 18 часов реакционную смесь выливают в воду и экстрагируют этилацетатом при pH 2. Органический слой промывают водой и насыщенным раствором соли, сушат (MgSO4) и концентрируют в вакууме.
Выход: 891 мг. MS-ESI: [M+H]+ = 338,2
(е) 1-Ацетил-6-(2-тиофенметиламино)карбонил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 2-тиофенметиламина (5,0 мг) с 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин-6-карбоновой кислотой (10 мг) с участием HATU (23 мг) и N,N-диизопропилэтиламина (19 мкл) в дихлорметане (2 мл).
Выход: 3,0 мг. MS-ESI: [M+H]+ = 433,4; ВЭЖХ: Rt=9,28 мин (способ 1)
Пример 33
1-Ацетил-6-(2-[4-метоксифенил]этиламино)карбонил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 2-(4-метоксифенил)этиламина (6,1 мг) с 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин-6-карбоновой кислотой (10 мг) с участием HATU (23 мг) и N,N-диизопропилэтиламина (19 мкл) в дихлорметане (2 мл).
Выход: 9,9 мг. MS-ESI: [M+H]+ = 457,4; ВЭЖХ: Rt=9,34 мин (способ 1)
Пример 34
1-Ацетил-6-(3-изопропоксипропиламино)карбонил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 3-изопропоксипропиламино (5,2 мг) с 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин-6-карбоновой кислотой (10 мг) с участием HATU (23 мг) и N,N-диизопропилэтиламина (19 мкл) в дихлорметане (2 мл).
Выход: 8,8 мг. MS-ESI: [M+H]+ = 437,4; ВЭЖХ: Rt=8,80 мин (способ 1)
Пример 35
1-Ацетил-6-(2-[метилтио]этиламино)карбонил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 2-(метилтио)этиламина (4,1 мг) с 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин-6-карбоновой кислотой (10 мг) с участием HATU (23 мг) и N,N-диизопропилэтиламина (19 мкл) в дихлорметане (2 мл).
Выход: 10 мг. MS-ESI: [M+H]+ = 411,4; ВЭЖХ: Rt=3,33 мин (способ 2)
Пример 36
1-Ацетил-6-(4-метоксибензилокси)карбонил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 4-метоксибензилового спирта (6,2 мг) с 1-ацетил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин-6-карбоновой кислотой (10 мг) с участием HATU (23 мг) и N,N-диизопропилэтиламина (19 мкл) в дихлорметане (2 мл).
Выход: 7,2 мг. MS-ESI: [M+H]+ = 458,4; ВЭЖХ: Rt=3,90 мин (способ 2)
Пример 37
1-Ацетил-6-(4-фенилбензоил)окси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1,2-Дигидро-6-метокси-2,2,4-триметилхинолин
По способу, описанному в примере 1, проводят реакцию Скраупа 4-анизидина (5,0 г) и иода (1,7 г) в мезитилоксиде (25 мл).
Выход: 2,3 г. MS-ESI: [M+H]+ = 204,2
(b) 1-Ацетил-1,2-дигидро-6-метокси-2,2,4-триметилхинолин
К охлажденному (0°С) раствору 1,2-дигидро-6-метокси-2,2,4-триметилхинолина (1,7 г) и каталитического количества N,N-диметиламинопиридина в пиридине (60 мл) добавляют по каплям ацетилхлорид (8 мл). После перемешивания в течение 18 часов реакционную смесь концентрируют в вакууме. Остаток растворяют в дихлорметане и промывают 1M HCl, водой, 5% водным NaHCO3, водой и насыщенным раствором соли. Органический слой сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием дихлорметана в качестве элюента.
Выход: 1,8 г. MS-ESI: [M+H]+ = 246,2
(с) 1-Ацетил-6-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 3, проводят реакцию алкилирования Фриделя-Крафтса бензола (25 мл) 1-ацетил-1,2-дигидро-6-метокси-2,2,4-триметилхинолином (1,8 г) в присутствии AlCl3(3,0 г).
Выход: 1,9 г. ВЭЖХ: Rt=9,62 мин (способ 1)
(d) 1-Ацетил-6-гидрокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
К охлажденному (0°С) раствору 1-ацетил-6-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (0,9 г) в дихлорметане (75 мл) добавляют по каплям трибромид бора (1,30 мл). После перемешивания в течение 18 часов реакционную смесь вливают в воду и экстрагируют этилацетатом. Органической слой промывают водой, 5% водным NaHCO3 и водой, сушат (MgSO4) и концентрируют в вакууме.
Выход: 950 мг. MS-ESI: [M+H]+ = 310,2; ВЭЖХ: Rt=8,41 мин (способ 1)
(е) 1-Ацетил-4-фенил-6-(4-фенилбензоил)окси-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-гидрокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 4-бифенилкарбонилхлоридом (14 мг) и N,N-диизопропилэтиламином (28 мкл) в тетрагидрофуране (1 мл).
Выход: 8,2 мг. MS-ESI: [M+H]+ = 490,4; ВЭЖХ: Rt=12,81 мин (способ 1)
Пример 38
1-Ацетил-6-(трет-бутилацетил)окси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-гидрокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) трет-бутилацетилхлоридом (9,0 мкл) и N,N-диизопропилэтиламином (28 мкл) в тетрагидрофуране (1 мл).
Выход: 3,9 мг. MS-ESI: [M+H]+ = 408,4; ВЭЖХ: Rt=11,28 мин (способ 1)
Пример 39
1-Ацетил-6-(циклопропилметил)окси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Смесь 1-ацетил-6-гидрокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг), карбоната цезия (63 мг), бромида тетрабутиламмония (29 мг) и хлорметилциклопропана (8,4 мкл) в ацетонитриле (1 мл) перемешивают при температуре 50°С в течение 18 часов. Реакционную смесь концентрируют в вакууме и остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 6/4 (объем/объем).
Выход: 10 мг. MS-ESI: [M+H]+ = 364,2; ВЭЖХ: Rt=10,73 мин (способ 1)
Пример 40
1-Ацетил-6-(3-пиридилметил)окси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 39, проводят реакцию алкилирования 1-ацетил-6-гидрокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг) 3-пиколилхлоридом·HCl (12 мг), карбонатом цезия (63 мг) и бромидом тетрабутиламмония (30 мг) в ацетонитриле (1 мл).
Выход: 10 мг. MS-ESI: [M+H]+ = 401,2; ВЭЖХ: Rt=8,40 мин (способ 1)
Пример 41
1-Ацетил-6-этил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1,2-Дигидро-6-этил-2,2,4-триметилхинолин
По способу, описанному в примере 1, проводят реакцию Скраупа п-этиланилина (1,0 г) и иода (0,34 г) в мезитилоксиде (5 мл).
Выход: 800 мг. MS-ESI: [M+H]+ = 202,2
(b) 1-Ацетил-6-этил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 37, проводят реакцию ацилирования 1,2-дигидро-6-этил-2,2,4-триметилхинолина (800 мг) ацетилхлоридом (3,5 мл) с использованием каталитического количества N,N-диметиламинопиридина в пиридине (25 мл).
Выход: 410 мг. MS-ESI: [M+H]+ = 244,2
(с) 1-Ацетил-6-этил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 3, проводят реакцию алкилирования Фриделя-Крафтса бензола (10 мл) 1-ацетил-6-этил-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолином (410 мг) в присутствии AlCl3 (710 мг).
Выход: 407 мг. MS-ESI: [M+H]+ = 322,4
Пример 42
1-Ацетил-6-(1,1'-бифенил)-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-иод-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
К охлажденному (0°С) раствору 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (128 мг) и серной кислоты (82 мг) в воде (2 мл) добавляют по каплям раствор нитрита натрия (31 мг). После перемешивания в течение 15 минут при 0°С добавляют раствор иодида калия (105 мг). После перемешивания в течение 18 часов реакционную смесь выливают в дихлорметан. Отделяют органический слой и промывают его 5% водным тиосульфатом натрия и водой, сушат (MgSO4) и концентрируют в вакууме.
Выход: 160 мг. MS-ESI: [M+H]+ = 420,0
(b) 1-Ацетил-6-(1,1'-бифенилил)-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 13, проводят реакцию перекрестного сочетания Сузуки 1-ацетил-6-иод-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг), (1,1'-бифенил-4-ил)бороновой кислоты (28 мг), фторида цезия (15 мг), трифенилфосфина (5 мг) и трис(дибензилиденацетон)дипалладия(0) (4,5 мг) в смеси диметоксиэтан/этанол (4:1) (объем/объем) (5 мл).
Выход: 16 мг. MS-ESI: [M+H]+ = 446,4; ВЭЖХ: Rt=6,84 мин (способ 2)
Пример 43
1-Ацетил-6-(4-хлорфенил)-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 13, проводят реакцию перекрестного сочетания Сузуки 1-ацетил-6-иод-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг), 4-хлорфенилбороновой кислоты (22 мг), фторида цезия (15 мг), трифенилфосфина (5 мг) и трис(дибензилиденацетон)дипалладия(0) (4,5 мг) в смеси диметоксиэтан/этанол (4:1) (объем/объем) (5 мл).
Выход: 8,6 мг. MS-ESI: [M+H]+ = 404,4; ВЭЖХ: Rt=5,94 мин (способ 2)
Пример 44
1-Ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4,7-тетраметилхинолин
(а) 1-Ацетил-6-амино-1,2-дигидро-2,2,4,7-тетраметилхинолин
Смесь N-Boc-2-метил-1,4-фенилендиамина (2,3 г), сульфата магния (6,3 г), 4-трет-бутилкатехола (100 мг) и иода (300 мг) в ацетоне (15 мл) перемешивают при температуре кипения с обратным холодильником в течение 20 часов. Реакционную смесь охлаждают до комнатной температуры и фильтруют. Фильтрат концентрируют в вакууме и остаток хроматографируют на SiO2 с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 3/1 (объем/объем). Продукт, 6-(трет-бутоксикарбонил)амино-1,2-дигидро-2,2,4,7-тетраметилхинолин, ацилируют ацетилхлоридом (1,0 мл) в смеси пиридина (1,0 мл) и толуола (10 мл). После перемешивания в течение 1 часа реакционную смесь промывают 3% водной лимонной кислотой и водой. Органический слой сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 =>3/1 (объем/объем).
Выход: 350 мг. MS-ESI: [M+H]+ = 345,4
(b) 1-Ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4,7-тетраметилхинолин
AlCl3 (266 мг) добавляют к нагретому (70°С) раствору 1-ацетил-6-амино-1,2-дигидро-2,2,4,7-тетраметилхинолина (100 мг) в бензоле (10 мл). Через 3 часа смесь охлаждают и концентрируют в вакууме. Остаток растворяют в этилацетате и промывают водой. Органический слой отделяют, сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 =>3/1 (объем/объем).
Выход: 75 мг. MS-ESI: [M+H]+ = 323,4
Пример 45
1-Ацетил-6-(4-фенилбензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4,7-тетраметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4,7-тетраметилхинолина (20 мг) 4-бифенилкарбонилхлоридом (100 мг) и пиридином (100 мкл) в тетрагидрофуране (5 мл).
Выход: 24 мг. MS-ESI: [M+H]+ = 503,4
Пример 46
1-Ацетил-6-(4-фенилбензоил)амино-8-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-амино-8-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 44, проводят реакцию Скраупа N-Boc-3-метокси-1,4-фенилендиамина (450 мг), сульфата магния (1,0 г), 4-трет-бутилкатахола (10 мг) и иода (20 мг) в ацетоне (10 мл), реакцию ацилирования продукта ацетилхлоридом (250 мкл) и пиридином (250 мкл) в толуоле (10 мл) и затем реакцию алкилирования Фриделя-Крафтса в присутствии AlCl3 (266 мг).
Выход: 71 мг. MS-ESI: [M+H]+ = 339,4
(b) 1-Ацетил-6-(4-фенилбензоил)амино-8-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-8-метокси-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг) 4-бифенилкарбонил-хлоридом (100 мг) и пиридином (100 мкл) в тетрагидрофуране (5 мл).
Выход: 25 мг. MS-ESI: [M+H]+ = 519,4
Пример 47
1-Ацетил-6-(2-фуроил)амино-1,2,3,4-тетрагидро-4-толуоил-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-толуоил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 2-фуроилхлоридом (8,1 мг) и N,N-диизопропилэтиламином (20 мкл) в тетрагидрофуране (1 мл).
Выход: 12 мг. MS-ESI: [M+H]+ = 417,4; ВЭЖХ: Rt=4,90 мин (способ 2)
Пример 48
1-Ацетил-6-(4-фенилбензоил)амино-1,2,3,4-тетрагидро-4-толуоил-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-толуоил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 4-бифенилкарбонилхлоридом (14 мг) и N,N-диизопропилэтиламином (20 мкл) в тетрагидрофуране (1 мл).
Выход: 9,3 мг. MS-ESI: [M+H]+ = 503,4; ВЭЖХ: Rt=6,08 мин (способ 2)
Пример 49
1-Ацетил-6-(этилмалонил)амино-1,2,3,4-тетрагидро-4-толуоил-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-толуоил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) этилмалонилхлоридом (9,4 мг) и N,N-диизопропилэтиламином (20 мкл) в тетрагидрофуране (1 мл).
Выход: 12 мг. MS-ESI: [M+H]+ = 437,4; ВЭЖХ: Rt=4,71 мин (способ 2)
Пример 50
1-Ацетил-6-(3,5-дибромбензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят с использованием HATU реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с 3,5-дибромбензойной кислотой (10 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 15,9 мг. MS-ESI: [M+H]+ = 470,9; ВЭЖХ: Rt=10,11 мин (способ 1)
Пример 51
1-Ацетил-6-(5-бром-2-метиламинобензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят с использованием HATU реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с 5-бром-2-метиламинобензойной кислотой (8,4 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 13,2 мг. MS-ESI: [M+H]+ = 522,1; ВЭЖХ: Rt=8,95 мин (способ 1)
Пример 52
1-Ацетил-6-(3,4,5-триметоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) 3,4,5-триметоксибензоилхлоридом (12 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 14,5 мг. MS-ESI: [M+H]+ = 503,2; ВЭЖХ: Rt=11,26 мин (способ 1)
Пример 53
1-Ацетил-6-(3,5-дихлор-2,6-диметоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят с использованием HATU реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с 3,5-дихлор-2,6-диметоксибензойной кислотой (9,0 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 15,1 мг. MS-ESI: [M+H]+ = 541,1; ВЭЖХ: Rt=10,92 мин (способ 1)
Пример 54
1-Ацетил-6-(2-ацетилоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят с использованием HATU реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с 2-ацетилоксибензойной кислотой (6,0 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 1,1 мг. MS-ESI: [M+H]+ = 471,2; ВЭЖХ: Rt=14,35 мин (способ 1)
Пример 55
1-Ацетил-6-(2-ацетамидо-5-бромбензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят с использованием HATU реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с 2-ацетамидо-5-бромбензойной кислотой (6,0 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 2,3 мг. MS-ESI: [M+H]+ = 530,2; ВЭЖХ: Rt=12,01 мин (способ 1)
Пример 56
1-Ацетил-6-(5-бром-2-N,N-диметилкарбамоилбензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят с использованием HATU реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с 5-бромсалициловой кислотой (8,0 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 3,0 мг. MS-ESI: [M+H]+ = 580,2; ВЭЖХ: Rt=12,53 мин (способ 1)
Пример 57
1-Ацетил-6-(2-[4-толуоилокси]бензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят с использованием HATU реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (10 мг) с 2-[4-толуоилокси]бензойной кислотой (8,0 мг) и N,N-диизопропилэтиламином (22 мкл) в тетрагидрофуране (1 мл).
Выход: 8,0 мг. MS-ESI: [M+H]+ = 519,4; ВЭЖХ: Rt=13,11 мин (способ 1)
Пример 58
1-Ацетил-6-(2-метилсульфонилоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-(2-метоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (0,60 г) 2-метоксибензоилхлоридом (1,0 г) и N,N-диизопропилэтиламином (1,7 мл) в тетрагидрофуране (60 мл).
Выход: 0,65 г. MS-ESI: [M+H]+ = 443,4
(b) 1-Ацетил-6-(2-гидроксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
К раствору 1-ацетил-6-(2-метоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (0,64 г) в дихлорметане (40 мл) добавляют по каплям BBr3 (0,69 мл). После перемешивания в течение 4 часов проведенная ТСХ указывает на полное превращение исходного материала. К реакционной смеси добавляют воду и продолжают перемешивание еще в течение 15 минут. Смесь промывают 5% водным NaHCO3 и водой. Органический слой сушат (MgSO4) и концентрируют в вакууме. Полученный продукт используют без дальнейшей очистки.
Выход: 0,62 мг. MS-ESI: [M+H]+ = 429,4
(с) 1-Ацетил-6-(2-метилсульфонилоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
Проводят реакцию сульфонилирования 1-ацетил-6-(2-гидроксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (12 мг) метилсульфонилхлоридом (6,5 мкл) в пиридине (1 мл). После перемешивания в течение 16 часов проведенная ТСХ указывает на полное превращение в более быстро продвигающийся при хроматографировании продукт. Смесь концентрируют, остаток растворяют в дихлорметане и промывают водой. Органический слой сушат (Na2SO4) и концентрируют в вакууме. Неочищенный продукт очищают хроматографией на колонке с силикагелем. Элюент: смесь гептан/этилацетат=8/2 (объем/объем).
Выход: 8,0 мг. MS-ESI: [M+H]+ = 507,4. ВЭЖХ: Rt=5,03 мин (способ 2)
Пример 59
1-Ацетил-6-(2-[3,5-диметилизоксазол-4-сульфонил]оксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 58, проводят реакцию сульфонилирования 1-ацетил-6-(2-гидроксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг) 3,5-диметилизоксазол-4-сульфонилхлоридом (27 мг) в пиридине (2 мл).
Выход: 14 мг. MS-ESI: [M+H]+ = 588,4. ВЭЖХ: Rt=14,46 мин (способ 1)
Пример 60
1-Ацетил-6-(2-метоксикарбонилэтилкарбонилоксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-(2-гидроксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг) 3-карбометоксипропионилхлоридом (14 мг) и N,N-диизопропилэтиламином (40 мкл) в тетрагидрофуране (2 мл).
Выход: 21,4 мг. MS-ESI: [M+H]+ = 543,6; ВЭЖХ: Rt=6,98 мин (способ 1)
Пример 61
1-Ацетил-6-(2-[5-метилизоксазол-3-карбонил]оксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-(2-гидроксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (15 мг) 5-метилизоксазол-3-карбонилхлоридом (10 мг) и N,N-диизопропилэтиламином (30 мкл) в тетрагидрофуране (1 мл).
Выход: 4,0 мг. MS-ESI: [M+H]+ = 538,4; ВЭЖХ: Rt=9,84 мин (способ 1)
Пример 62
1-Ацетил-6-(2-[2-оксазолидинон-5-метил]оксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 39, проводят реакцию алкилирования 1-ацетил-6-(2-гидроксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (20 мг) 5-хлорметил-2-оксазолидиноном (7 мг), карбонатом цезия (63 мг) и бромидом тетрабутиламмония (30 мг) в ацетонитриле (1 мл).
Выход: 25 мг. MS-ESI: [M+H]+ = 542,4; ВЭЖХ: Rt=8,21 мин (способ 1)
Пример 63
1-Ацетил-6-(2-[морфолино-4-карбонил]оксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-(2-гидроксибензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (15 мг) морфолино-4-карбонилхлоридом (12 мкл) и N,N-диизопропилэтиламином (30 мкл) в тетрагидрофуране (1 мл).
Выход: 5,4 мг. MS-ESI: [M+H]+ = 542,4; ВЭЖХ: Rt=10,02 мин (способ 1)
Пример 64
1-Ацетил-6-(2-фениламинобензоил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят с использованием HATU реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (15 мг) с N-фенилантраниловой кислотой (21 мг) и N,N-диизопропилэтиламином (33 мкл) в тетрагидрофуране (1 мл).
Выход: 5,8 мг. MS-ESI: [M+H]+ = 504,4; ВЭЖХ: Rt=13,42 мин (способ 1)
Пример 65
1-Ацетил-6-(2-пирролидон-N-этилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-акрилоиламино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 6, проводят реакцию ацилирования 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (0,12 г) акрилоилхлоридом (39 мкл) и N,N-диизопропилэтиламином (0,21 мл) в тетрагидрофуране (10 мл).
Выход: 0,13 г. MS-ESI: [M+H]+ = 363,2
(b) 1-Ацетил-6-(2-пирролидон-N-этилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
К смеси 2-пирролидона (19 мг) и NaH (18 мг, 60% в масле) в ТГФ (1 мл) добавляют 1-ацетил-6-акрилоиламино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин (8 мг) в ТГФ (1 мл). Проведенный после перемешивания в течение 18 часов TCX анализ указывает на превращение продукта в более быстро продвигающийся при хроматографировании продукт. Смесь разбавляют этилацетатом и промывают водой, 0,5N HCl и водой. Органический слой сушат (Na2SO4) и концентрируют в вакууме. Очистку проводят хроматографией на колонке с силикагелем с использованием в качестве элюента смеси гептан/этилацетат = 8/2 => 1/1 (объем/объем).
Выход: 4,6 мг. MS-ESI: [M+H]+ = 448,4. ВЭЖХ: Rt=4,51 мин (способ 2)
Пример 66
1-Ацетил-6-(этоксиэтоксиэтилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 65, проводят реакцию Михаэля присоединения 2-этоксиэтанола (19 мг) и 1-ацетил-6-акрилоиламино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (8 мг) в ТГФ (1 мл).
Выход: 1,0 мг. MS-ESI: [M+H]+ = 453,4; ВЭЖХ: Rt=5,03 мин (способ 2)
Пример 67
1-Ацетил-6-(2-пирролидон-N-метоксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации N-гидроксиметил-2-пирролидона (22 мг) и 1-ацетил-6-(гидроксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (15 мг) с участием HATU (29 мг) и N,N-диизопропилэтиламина (33 мкл) в тетрагидрофуране (2 мл).
Выход: 4,6 мг. MS-ESI: [M+H]+ = 478,4; ВЭЖХ: Rt=5,53 мин (способ 2)
Пример 68
1-Ацетил-6-(трет-бутилкарбонил-N-[2-этокси]карбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации трет-бутил-N-(2-гидроксиэтил)карбамата (29 мкл) и 1-ацетил-6-(гидроксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (15 мг) с участием HATU (29 мг) и N,N-диизопропилэтиламина (33 мкл) в тетрагидрофуране (2 мл).
Выход: 11 мг. MS-ESI: [M+H]+ = 538,4; ВЭЖХ: Rt=5,32 мин (способ 2)
Пример 69
1-Ацетил-6-(2-фурилметоксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации фурфурилового спирта (17 мкл) и 1-ацетил-6-(гидроксикарбонилметилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (15 мг) с участием HATU (29 мг) и N,N-диизопропилэтиламина (33 мкл) в тетрагидрофуране (2 мл).
Выход: 7,1 мг. MS-ESI: [M+H]+ = 475,4; ВЭЖХ: Rt=5,30 мин (способ 2)
Пример 70
1-Ацетил-6-([циклопропилметиламинометилкарбонил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 29, проводят реакцию алкилирования циклопропилметиламина (4 мкл) 1-ацетил-6-(бромацетил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолином (10 мг) и N,N-диизопропилэтиламином (13 мкл) в дихлорметане (1 мл).
Выход: 6,8 мг. MS-ESI: [M+H]+ = 535,6; ВЭЖХ: Rt=6,29 мин (способ 2)
Пример 71
1-Ацетил-4-(2-метоксифенил)-6-(4-фенилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
(а) 1-Ацетил-6-(4-фенилбензоил)амино-1,2-дигидро-2,2,4-триметилхинолин
1-Ацетил-6-(трет-бутоксикарбонил)амино-1,2,-дигидро-2,2,4-триметилхинолин (1,0 г) растворяют в смеси трифторуксусная кислота/CH2Cl2 (1/1, объем/объем, 25 мл) и перемешивают в течение 2 часов. Реакционную смесь концентрируют в вакууме, разбавляют этилацетатом и промывают 5% водным NaHCO3. Органический слой отделяют, сушат (MgSO4) и концентрируют. Остаток растворяют в CH2Cl2 (25 мл), добавляют N,N-диизопропилэтиламин (5,2 мл) и 4-фенилбензоилхлорид (2,0 г) и смесь перемешивают в течение 16 часов. Смесь концентрируют и хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат =1/0 => 0/1 (объем/объем).
Выход: 0,63 мг. MS-ESI: [M+H]+ = 411,2
(b) 1-Ацетил-4-(2-метоксифенил)-6-(4-фенилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин и 1-ацетил-4-(4-метоксифенил)-6-(4-фенилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 3, проводят реакцию алкилирования Фриделя-Крафтса анизола (25 мл, хранящегося на молекулярных ситах 3Е) 1-ацетил-6-(4-фенилбензоил)амино-1,2-дигидро-2,2,4-триметилхинолином (0,50 г) в присутствии AlCl3 (0,50 г). Очистка хроматографией на силикагеле (элюент: смесь гептан/этилацетат = 1/0 => 0/1, объем/объем) приводит к получению 2-метоксифенилзамещенного производного в качестве минорного продукта и 4-метоксифенилзамещенного производного в качестве основного продукта.
Выход: 46 мг. MS-ESI: [M+H]+ = 518,0 (2-метоксифенил)
Выход: 0,20 г. MS-ESI: [M+H]+ = 518,1 (4-метоксифенил)
Пример 72
1-Ацетил-4-(4-гидроксифенил)-6-(4-фенилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
К охлажденному (0°С) раствору 1-ацетил-4-(4-метоксифенил)-6-(4-фенилбензоил)амино-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (0,46 г) в CH2Cl2 добавляют BBr3 в атмосфере азота. После перемешивания в течение 3 часов при комнатной температуре достигается полное превращение. Смесь охлаждают, добавляют 1M NaOH до щелочного pH, затем добавляют этилацетат и смесь подкисляют 1M HCl. Органический слой отделяют, сушат (MgSO4) и концентрируют. Остаток хроматографируют на силикагеле с использованием в качестве элюента смеси гептан/этилацетат = 1/0 => 0/1 (объем/объем).
Выход: 0,13 мг. MS-ESI: [M+H]+ = 504,0
Пример 73
1-Ацетил-6-(5-метилникотиноил)амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолин
По способу, описанному в примере 11, проводят реакцию конденсации 1-ацетил-6-амино-4-фенил-1,2,3,4-тетрагидро-2,2,4-триметилхинолина (0,10 г) с 5-метилникотиновой кислотой (0,13 г) с участием HATU (0,18 г) и N,N-диизопропилэтиламина (0,28 мл) в дихлорметане (2 мл).
Выход: 0,12 г. MS-ESI: [M+H]+ = 427,0
Пример 74
Биологическая активность in vitro CHO-ФСГ
ФСГ активность соединений тестируют в клетках яичника китайского хомячка (CHO), стабильно трансфицированных рецептором человеческого ФСГ, и проводят совместную трансфекцию отзывчивым на цАМФ элементом (CRE)/промотором, направленную на экспрессию репортерного гена люциферазы светлячка. Связывание лиганда с Gs-сопряженным рецептором ФСГ приводит к увеличению уровня цАМФ, что, в свою очередь, индуцирует повышенную трансактивацию репортерной конструкции люциферазы. Сигнал люциферазы количественно оценивают с помощью люминесцентного счетчика. Для исследуемых соединений вычисляют значения ЭК50 (концентрацию исследуемого соединения, которая вызывает половинную (50%) стимуляцию от максимального значения). С этой целью используют программное обеспечение GraphPad PRISM, версию 3.0 (GraphPad software Inc., San Diego).
Соединения всех примеров имеют активность (ЭК50) меньше, чем 10-5М. Соединения примеров 1, 6-13, 15, 16, 21-24, 30, 36, 37, 45, 46, 48, 50-53 55, 57, 58, 61, 63 и 64 имеют значение ЭК50 меньше, чем 10-7М.
Реферат
Настоящее изобретение относится к области лекарственных средств, в частности к тетрагидрохинолиновым производным общей формулы (I), где Y-X обозначает С(O)-O, C(O)-NH, S(O)2-NH, NHC(O)-NH, NHC(S)-NH, OC(O)-NH; R6 обозначает Н, (1-6С)алкил, 1- или 2-адамантил(1-4С)алкил, (3-9С)гетероарил, (3-6С)циклоалкил, (2-6С)гетероциклоалкил, алкилтио(1-4С)алкил, фенил(1-4С)алкил, (3-6С)циклоалкил(1-4С)алкил, (2-6С)гетероциклоалкил(1-4С)алкил, R8, R9аминокарбонил(1-4C) алкил, R8, R8,R9-амино (1-4С)алкил, R8-оксикарбонил(l-4C)алкил, R8-окси(l-4C)алкил, R8-карбонил(1-4С)алкил или фенил, необязательно замещенный гидрокси, амино, галогеном, нитро, трифторметилом, (3-9С)гетероарилом, (1-4С)алкилкарбониламино, (1-4С)алкилкарбонилокси, (3-9С)гетероарилкарбонилокси, (3-9С)гетероарилсульфонилокси, (2-6С)гетероциклоалкилкарбамоилом или дифениламино. Кроме того, настоящее изобретение также относится к фармацевтической композиции, обладающей модулирующей активностью в отношении рецептора ФСГ, включающей указанные производные. 2 з. и 15 з.п. ф-лы.
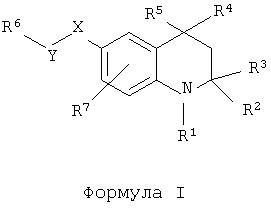
Формула
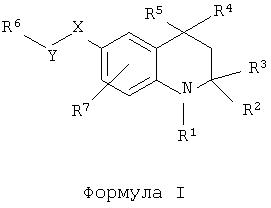

Комментарии