Способ получения модуляторов регулятора трансмембранной проводимости кистозного фиброза - RU2543714C2
Код документа: RU2543714C2
Описание
Заявление об установлении приоритета
Настоящая заявка заявляет приоритет по трем предварительным патентным заявкам США, имеющим серийные номера 61/162148, подана 20 марта 2009 года; 61/246303, подана 28 сентября 2009 года; и 61/248565, подана 5 октября 2009 года. Каждая из вышеуказанных предварительных патентных заявок включена в полном объеме в настоящую заявку посредством ссылки.
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к способу получения модуляторов регулятора трансмембранной проводимости кистозного фиброза ("CFTR").
Предпосылки создания изобретения
Кистозный фиброз (CF) представляет собой рецессивное генетическое заболевание, которое поражает приблизительно 30000 детей и взрослых в США и приблизительно 30000 детей и взрослых в Европе. Несмотря на прогресс в лечении CF, метод его лечения отсутствует.
CF вызывается мутациями в гене регулятора трансмембранной проводимости кистозного фиброза (CFTR), который кодирует эпителиальный хлорный ионный канал, отвечающий за помощь в регуляции солевой и водной абсорбции и секреции в различных тканях. Лекарственные средства на основе малых молекул, известные как потенциирующие средства, которые повышают вероятность открытия CFTR канала, представляют собой одну потенциальную терапевтическую стратегию для лечения CF.
В частности, CFTR представляет собой cAMP/АТФ-опосредованный анионный канал, который экспрессируется в различных типах клеток, включая абсорбтивные и секреторные эпителиальные клетки, где он регулирует приток анионов через мембрану, а также активность других ионных каналов и белков. В эпителиальных клетках, нормальное функционирование CFTR является критическим для поддержания транспорта электролитов в организме, включая респираторную и пищеварительную ткани. CFTR состоит приблизительно из 1480 аминокислот, которые кодируют белок, состоящий из тандемного повтора трансмембранных доменов, каждый из которых содержит шесть трансмембранных двойных спиралей и нуклеотидный связывающийся домен. Эти два трансмембраных домена связаны между собой большим полярным регуляторным (R)-доменом с множественными сайтами фосфорилирования, которые регулируют активность канала и клеточный траффик.
Ген, кодирующий CFTR, был идентифицирован и секвенирован (See Gregory, R. J. et al. (1990) Nature 347:382-386; Rich, D. P. et al. (1990) Nature 347:358-362), (Riordan, J. R. et al. (1989) Science 245:1066-1073). Дефект в этом гене вызывает мутации в CFTR, приводящие к кистозному фиброзу ("CF"), наиболее распространенному фатальному генетическому заболеванию у людей. Кистозный фиброз поражает приблизительно одного из каждых 2500 детей раннего возраста в США. Из населения США в целом, до 10 миллионов людей имеют одну копию дефективного гена без явно выраженных эффектов заболевания. В отличие от этого, субъекты с двумя копиями CF-ассоциированного гена страдают от изнурительных и фатальных эффектов CF, включая хроническое легочное заболевание.
У пациентов с CF, мутации в CFTR эндогенно экспрессируемые в респираторном эпителии, приводят к уменьшенной апикальной анионной секреции, вызывая дисбаланс в транспорте ионов и жидкостей. Полученное в результате снижение анионного транспорта способствует повышенной аккумуляции слизи в легких с сопутствующими микробными инфекциями, которые, в конечном счете, приводят к смерти CF пациентов. Помимо респираторного заболевания, CF пациенты типично страдают от желудочно-кишечных проблем и недостаточной функции поджелудочной железы, что при отсутствии лечения приводит к смерти. Кроме того, большинство мужчин с кистозным фиброзом являются бесплодными, и фертильность снижена у женщин с кистозным фиброзом. В отличие от тяжелых эффектов двух копий CF-ассоциированного гена, субъекты с одной копией CF-ассоциированного гена демонстрируют повышенную резистентность к холере и к обезвоживанию в результате диареи - возможно объясняющую относительно высокую распространенность CF гена среди населения.
Анализ последовательности CFTR гена CF хромосом выявил ряд различных заболеваний, вызывающих мутации (Cutting, G. R. et al. (1990) Nature 346:366-369; Dean, M. et al. (1990) Cell 61:863:870; and Kerem, B-S. et al. (1989) Science 245:1073-1080; Kerem, B-S et al. (1990) Proc. Natl. Acad. Sci. USA 87:8447-8451). В настоящее время идентифицировано более чем 1000 заболеваний, вызывающих мутации в CF гене (http://www.genet.sickkids.on.ca/cftr/app). Наиболее распространенной мутацией является делеция фенилаланина в положении 508 аминокислотной последовательности CFTR, и ее обычно указывают как ΔF508-CFTR. Эта мутация возникает приблизительно в 70% случаев кистозного фиброза, и она ассоциируется с тяжелым заболеванием.
Делеция остатка 508 в ΔF508-CFTR препятствует правильной укладке зарождающегося белка. Это приводит к неспособности мутантного белка выходить из ER и перемещаться к плазматической мембране. В результате, количество каналов, присутствующих в мембране, далеко от определяемого в клетках, экспрессирующих CFTR дикого типа. Помимо нарушенного траффика, такая мутация приводит к дефекту воротного механизма канала. Все вместе, уменьшенное количество каналов в мембране и дефект воротного механизма, приводят к снижению анионного транспорта через эпителий, приводя к нарушенному транспорту ионов и жидкостей. (Quinton, P. M. (1990), FASEB J. 4: 2709-2727). Исследования, однако, показали, что уменьшенные количества ΔF508-CFTR в мембране являются функциональными, хотя меньше чем CFTR дикого типа. (Dalemans et al. (1991), Nature Lond. 354: 526-528; Denning et al., supra; Pasyk and Foskett (1995), J. Cell. Biochem. 270: 12347-50). Помимо ΔF508-CFTR, другое заболевание, вызывающее мутации в CFTR, которое приводит к нарушенному траффику, синтезу и/или воротному механизму канала, можно было бы регулировать либо путем активации, либо даун-регуляции для изменения анионной секреции и модификации прогрессирования и/или тяжести заболевания.
Хотя CFTR транспортирует различные молекулы, помимо анионов, ясно, что эта роль (транспорт анионов) представляет собой один элемент в важном механизме транспорта ионов и воды через эпителий. Другие элементы включают эпителиальный Na+ канал, ENaC, Na+/2Cl-/K+ ко-транспортер, Na+-K+-АТФазный насос и базолатеральные мембранные K+ каналы, которые отвечают за поглощение хлора в клетке.
Эти элементы работают вместе для достижения направленного транспорта через эпителий через их селективную экспрессию и локализацию в клетке. Абсорбция хлора происходит в результате скоординированной активности ENaC и CFTR, присутствующих на апикальной мембране, и Na+-K+-АТФазного насоса и Cl ионных каналов, экспрессируемых на базолатеральной поверхности клетки. Вторичный активный транспорт хлора с люминальной стороны приводит к аккумуляции внутриклеточного хлора, который затем пассивно покидает клетку через Cl-каналы, приводя к векторному транспорту. Расположение Na+/2Cl-/K+ ко-транспортера, Na+-K+-АТФазного насоса и базолатеральных мембранных K+ каналов на базолатеральной поверхности и CFTR на люминальной стороне координирует секрецию хлора через CFTR на люминальной стороне. Поскольку вода, вероятно, никогда сама активно не транспортируется, ее протекание через эпителий зависит от очень малых трансэпителиальных осмотических градиентов, создаваемых объемным потоком натрия и хлора.
Как обсуждалось выше, считается, что делеция остатка 508 в ΔF508-CFTR препятствует правильной укладке зарождающегося белка, что приводит к неспособности мутантного белка выходить из ER и перемещаться к плазматической мембране. В результате, на плазматической мембране присутствуют недостаточные количества зрелого белка, и транспорт хлора в эпителиальных тканях существенно снижен. Действительно, было показано, что этот клеточный феномен дефектного ER процессинга ABC транспортеров при помощи ER механизма лежит в основе не только CF заболевания, но также широкого ряда других отдельных и наследственных заболеваний.
Соответственно, существует потребность в модуляторах CFTR активности и композициях на их основе, которые можно использовать для модулирования активности CFTR в клеточной мембране млекопитающего.
Существует потребность в способах лечения заболеваний, вызванных мутацией в CFTR, с использованием таких модуляторов CFTR активности.
Существует потребность в способах модулирования CFTR активности в ex vivo клеточной мембране млекопитающего.
Существует также потребность в способах для получения соединений, которые модулируют CFTR активность.
Краткое описание изобретения
В общем, изобретение обеспечивает способы получения соединений, полезных в качестве модуляторов CFTR.
В одном аспекте изобретение обеспечивает способ получения соединения формулы 1

включающий конденсацию карбоновой кислоты формулы 2

с анилином формулы 3

в присутствии конденсирующего агента, выбранного из группы, включающей тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, HBTU, HCTU, 2-хлор-4,6-диметокси-1,3,5-триазин, HATU, HOBT/EDC и T3P®.
Каждый R2 и R4 независимо выбран из группы, включающей водород, CN, CF3, галоген, C1-6 алкил с прямой или разветвленной цепью, 3-12-членную циклоалифатическую группу, фенил, C5-10гетероарил или C3-7 гетероциклическую группу, где указанный гетероарил или гетероциклическая группа содержит не более 3 гетероатомов, выбранных из O, S или N, и каждый C1-6 алкил с прямой или разветвленной цепью, 3-12-членная циклоалифатическая группа, фенил, C5-10 гетероарил или C3-7 гетероциклическая группа, независимо и необязательно, содержат не более трех заместителей, выбранных из -OR', -CF3, -OCF3, SR', S(O)R', SO2R', -SCF3, галогена, CN, -COOR', -COR-, -О(CH2)2N(R')(R'), -O(CH2)N(R')(R'), -CON(R')(R'), -(CH2)2OR', -(CH2)OR', CH2CN, необязательно замещенного фенила или фенокси, -N(R')(R'), -NR'C(O)OR', -NR'C(O)R', -(CH2)2N(R')(R') или -(CH2)N(R')(R').
Каждый R5 независимо выбран из группы, включающей водород, -OH, NH2, CN, CHF2, NHR', N(R')2, -NHC(O)R', NHC(O)OR', NHSO2R', -OR', OC(O)OR', OC(O)NHR', OC(О)NR'2, CH2OH, CH2N(R')2, C(O)OR', SO2NHR', SO2N(R')2 или CH2NHC(O)OR'.
Или R4 и R5, взятые вместе, образуют 5-7-членное кольцо, содержащее от 0 до трех гетероатомов, выбранных из N, O или S, где указанное кольцо необязательно содержит не более трех заместителей R3.
Каждый X независимо представляет собой связь или необязательно замещенную C1-6 алкилиденовую цепь, где не более двух метиленовых звеньев группы X необязательно и независимо заменены группой -CO-, -CS-, -COCO-, -CONR'-, -CONR'NR'-, -CO2-, -OCO-, -NR'CO2-, -O-, -NR'CONR'-, -OCONR'-, -NR'NR', -NR'NR'CO-, -NR'CO-, -S-, -SO, -SO2-, -NR'-, -SO2NR'-, NR'SO2- или -NR'SO2NR'-. Каждый Rx независимо представляет собой R', галоген, NO2, CN, CF3 или OCF3.
y представляет собой целое число от 0 до 4.
Каждый R' независимо выбран из группы, включающей водород или необязательно замещенную группу, выбранную из C1-8 алифатической группы, 3-8-членного насыщенного, частично ненасыщенного или полностью ненасыщенного моноциклического кольца, содержащего от 0 до 3 гетероатомов, независимо выбранных из группы, включающей азот, кислород или серу, или 8-12-членной насыщенной, частично ненасыщенной или полностью ненасыщенной бициклической кольцевой системы, содержащей от 0 до 5 гетероатомов, независимо выбранных из группы, включающей азот, кислород или серу; или два присутствующих R', взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, содержащее от 0 до 4 гетероатомов, независимо выбранных из N, O или S.
Каждый R3 независимо представляет собой -C1-C3 алкил, C1-C3 пергалогеналкил, -O(C1-C3 алкил), -CF3, -OCF3, -SCF3, -F, -Cl, -Br, -COOR', -COR', -O(CH2)2N(R')(R'), -О(CH2)N(R')(R'), -CON(R')(R'), -(CH2)2OR', -(CH2)OR', необязательно замещенное моноциклическое или бициклическое ароматическое кольцо, необязательно замещенный арилсульфон, необязательно замещенное 5-членное гетероарильное кольцо, -N(R')(R'), -(CH2)2N(R')(R') или -(CH2)N(R')(R').
Варианты воплощения данного аспекта включают одну или несколько из следующих особенностей. R5 независимо представляет собой -OC(O)OR', -OC(O)NHR' или -OC(О)N(R')2, и R' не является водородом; по меньшей мере один из R4 или R2 независимо представляет собой C1-6 алкил с прямой или разветвленной цепью, который замещен группой -COOR' или -CON(R')(R'), и R' не является водородом. Способ также включает расщепление группы -OC(O)OR', -OC(O)NHR' или -OC(O)N(R')2 с образованием группы -OH. Способ также включает гидролиз каждой из групп -COOR' или -CON(R')2 с образованием группы -COOH. Гидролиз осуществляют путем обработки соединения формулы 1 спиртовым растворителем в присутствии основания, такого как NaOH, KOH или метоксид натрия. Спиртовой растворитель, используемый в реакции гидролиза, представляет собой метанол. Реакцию конденсации соединения формулы 2 и соединения формулы 3 с получением соединения формулы 1 осуществляют в присутствии основания, такого как K2CO3, Et3N, NMM, пиридин или DIEA. Реакцию конденсации соединения формулы 2 и соединения формулы 3 с получением соединения формулы 1 осуществляют в присутствии растворителя, такого как EtOAc, IPAc, ТГФ, MEK, NMP, ацетонитрил, ДМФА или 2-метилтетрагидрофуран. Реакцию конденсации соединения формулы 2 и соединения формулы 3 с получением соединения формулы 1 осуществляют при температуре реакции, которую поддерживают приблизительно в пределах от 10°C до 78°C, такой как приблизительно в пределах от 20°C до 30°C, приблизительно в пределах от 40°C до 50°C и приблизительно в пределах от 42°C до 53°C. Реакцию конденсации осуществляют при перемешивании в течение по меньшей мере 2 часов, например, в течение по меньшей мере 70 часов или в течение по меньшей мере 3 дней.
В некоторых вариантах воплощения, R5 независимо представляет собой -OC(O)OR', -OC(O)NHR' или -OC(O)N(R')2, и R' не является водородом; и каждый из R2 и R4 независимо выбран из группы, включающей водород, CF3, C1-C6 алкил с прямой или разветвленной цепью, 3-12-членную циклоалифатическую группу или фенил.
В некоторых дополнительных вариантах воплощения, R5 независимо представляет собой -OC(O)OR', и R' не является водородом; и каждый из R2 и R4 независимо представляет собой C1-C6 алкил с прямой или разветвленной цепью или 3-12-членную циклоалифатическую группу.
В некоторых вариантах воплощения R2 и R4 представляют собой трет-бутил.
В другом аспекте изобретение обеспечивает способ получения соединения 27,

включающий:
(a) конденсацию соединения 26

с соединением 13

в присутствии EDCI, HOBT и DIEA, с использованием ДМФА в качестве растворителя, где температуру реакции поддерживают приблизительно в пределах от 20°C до 30°C, и реакцию осуществляют в течение, по меньшей мере, 70 часов, с получением соединения 14
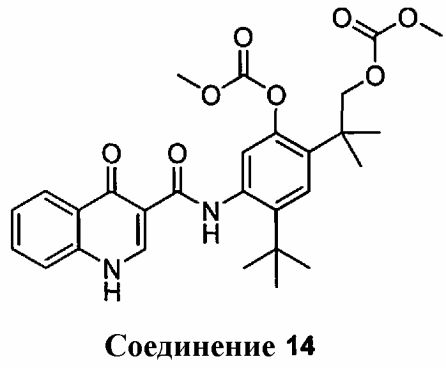
(b) обработку соединения 14 при помощи KOH в метаноле.
Еще в одном аспекте изобретение обеспечивает способ получения соединения 28,

включающий:
(a) конденсацию соединения 26

с соединением 20

в присутствии HATU и DIEA, с использованием ацетонитрила в качестве растворителя, где температуру реакции поддерживают приблизительно в пределах от 40°C до 50°C, и где реакцию осуществляют в течение, по меньшей мере, 3 дней, с получением соединения 21

(b) обработку соединения 21 при помощи NaOH в метаноле.
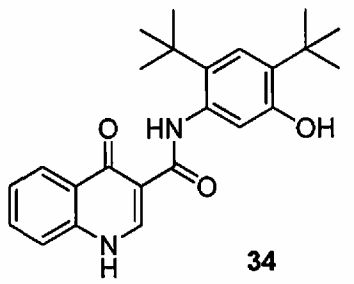
Еще в одном аспекте изобретение обеспечивает способ получения соединения 34,

включающий:
(a) конденсацию соединения 26

с соединением 32

в присутствии T3P® и пиридина, с использованием 2-метилтетрагидрофурана в качестве растворителя, где температуру реакции поддерживают приблизительно в пределах от 42°C до 53°C, и где реакцию осуществляют в течение, по меньшей мере, 2 часов, с получением соединения 33

(b) обработку соединения 33 при помощи смеси NaOMe/MeOH в 2-метилтетрагидрофуране.
В одном варианте воплощения способ дополнительно включает стадию образования суспензии соединения 34 в смеси ацетонитрила и воды, где твердую форму соединения 34 преобразуют в Соединение 34.
Варианты воплощения вышеизложенного аспекта включают одну или несколько из следующих особенностей. Способ также включает растворение Соединения 34 в двухфазном растворе 2-метилтетрагидрофурана и 0,1 н HCl, который перемешивают. Способ также включает выделение органической фазы из двухфазного раствора. Способ также включает фильтрование и удаление твердого вещества из органической фазы. Способ также включает сокращения объема органической фазы приблизительно на 50% с использованием дистилляции. Способ также включает трехкратное выполнение следующей процедуры: добавление MeOAc, EtOAc, PAc, t-BuOAc, тетрагидрофурана (ТГФ), Et2O или метил-трет-бутилового эфира (MTBE) к органической фазе до тех пор, пока объем органической фазы не увеличится на 100%, и уменьшение объема органической фазы на 50% с использованием дистилляции. Способ также включает добавление MeOAc, EtOAc, IPAc, t-BuOAc, тетрагидрофурана (ТГФ), Et2O или метил-трет-бутилового эфира (MTBE) к органической фазе до тех пор, пока объем органической фазы не увеличится на 100%. Способ также включает нагревание органической фазы до температуры кипения с обратным холодильником и поддержание указанной температуры кипения с обратным холодильником в течение периода времени, по меньшей мере, около 5 часов. Способ также включает охлаждение органической фазы до температуры в пределах от -5°C до 5°C в течение периода времени 4,5 часов - 5,5 часов.
Еще в одном аспекте изобретение обеспечивает соединения, полученные при помощи любого из способов, описанных в настоящей заявке.
Еще в одном аспекте изобретение обеспечивает фармацевтическую композицию, включающую соединение, полученное при помощи любого из способов, описанных в настоящей заявке.
Еще в одном аспекте, изобретение обеспечивает способ модулирования CFTR активности в биологическом образце, включающий стадию контактирования указанного биологического образца с соединением, полученным при помощи любого из способов, описанных в настоящей заявке.
В другом аспекте изобретение также обеспечивает способ лечения или ослабления тяжести заболевания у пациента, включающий введение указанному пациенту одной из композиций, определенной в настоящей заявке, и указанное заболевание выбрано из группы, включающей кистозный фиброз, астму, вызванное курением COPD (хроническое обструктивное заболевание легких), хронический бронхит, риносинусит, запор, панкреатит, недостаточность функции поджелудочной железы, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыносящих протоков (CBAVD), неосложненную форма легочного заболевания, идиопатический панкреатит, аллергический бронхолегочный аспергиллез (ABPA), заболевание печени, наследственную эмфизему, наследственный гемохроматоз, коагуляционно-фибринолизные недостаточности, такие как дефицит белка С, наследственный ангионевротический отек типа 1, нарушения липидного процессинга, такие как семейная гиперхолестеринемия, хиломикронемия типа 1, абеталипопротеинемия, лизосомальные болезни накопления, такие как болезнь клеточных включений/болезнь Дери, мукополисахаридоз, болезнь Сандгоффа/Тея-Сакса, болезнь Криглера-Найяра типа II, полиэндокринопатию/гиперинсулемию, сахарный диабет, карликовость Ларона, миелопероксидазную недостаточность, первичный гипопаратиреоз, меланому, гликаноз CDG (врожденные заболевания гликозилирования) типа 1, врожденный тиреотоксикоз, несовершенный остеогенез, наследственную гипофибриногенемию, недостаточное активированное время свертывания крови(АСТ), несахарный диабет (НД), несахарный нейрофизарный диабет, нейрогенный несахарный диабет, мышечную атрофию Шарко-Мари-Тута, болезнь Перлизауса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, атрофия Пика, некоторые полиглутаминовые неврологические расстройства, такие как болезнь Гентингтона, спинально-церебеллярную атаксию типа I, спинальную и бульбарную мышечную атрофию, дентато-рубро-паллидо-льюисова атрофия и миотоническую дистрофию, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (из-за дефекта процессинга прионного белка), болезнь Фабри, синдром Штреусслера-Шейнкера, COPD (хроническое обструктивное заболевание легких), синдром сухих глаз или болезнь Шегрена, остеопороз, остеопению, заживление костей и рост костей (включая восстановление кости, регенерацию костной ткани, снижение резорбции костной ткани и увеличение костных отложений), синдром Горема, хлоридные каналопатии, такие как врожденная миотония (формы Томсона и Бекера), синдром Барттера типа III, болезнь Дента, гиперэкплексию, эпилепсию, гиперэкплексию, лизосомную болезнь накопления, синдром Ангельмана и первичную цилиарную дискинезию (PCD), термин для наследственных нарушений структуры и/или функции реснисчатых структур, включающий PCD с транспозицией внутренних органов (также известный как синдром Картагенера), PCD без транспозиции внутренних органов и цилиарную аплазию.
В некоторых вариантах воплощения заболевание представляет собой кистозный фиброз.
В другом аспекте изобретение обеспечивает набор для использования в измерении активности CFTR или его фрагмента в биологическом образце in vitro или in vivo, включающий:
i. композицию, включающую соединение, полученное любым из способов, описанных в настоящей заявке; и
ii. инструкции для:
a. контактирования композиции с биологическим образцом; и
b. измерения активности указанного CFTR или его фрагмента.
В некоторых вариантах воплощения набор также содержит инструкции для:
i. контактирования дополнительного соединения с биологическим образцом;
ii. измерения активности указанного CFTR или его фрагмента в присутствии указанного дополнительного соединения; и
iii. сравнения активности CFTR в присутствии дополнительного соединения с плотностью CFTR в присутствии композиции формулы 1.
Преимущественно, изобретение обеспечивает способы синтеза соединений, полезных в качестве модуляторов CFTR, с более высоким выходом и с более высокой чистотой по сравнению с известными способами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
Как это используется в настоящей заявке, следующие определения являются применимыми, если не указано иное.
Термин "ABC-транспортер", как он используется в настоящей заявке, означает ABC-транспортерный белок или его фрагмент, содержащий, по меньшей мере, один связывающий домен, где указанный белок или его фрагмент присутствует in vivo или in vitro. Термин "связывающий домен", как он используется в настоящей заявке, означает домен на ABC-транспортере, который может связываться с модулятором. Смотри, например, Hwang, T. C. et al., J. Gen. Physiol. (1998): 111(3), 477-90.
Термин "CFTR", как он используется в настоящей заявке, означает регулятор трансмембранной проводимости кистозного фиброза или его мутацию, обладающую способностью регулятора активности, включая, но не ограничиваясь этим, ΔF508 CFTR и G551D CFTR (смотри, например, http://www.genet.sickkids.on.ca/cftr/, для CFTR мутаций).
Термин "модулирующий", как он используется в настоящей заявке, означает увеличение или уменьшение на количество, которое можно измерить.
Для целей настоящего изобретения, химические элементы обозначаются в соответствии с Периодической Таблицей Элементов, CAS version, Handbook of Chemistry and Physics, 75th Ed. Кроме того, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и в "March's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M. B. and March, J., John Wiley & Sons, New York: 2001, полное содержание которых включено в настоящую заявку посредством ссылки.
Как описано в настоящей заявке, соединения по настоящему изобретению необязательно могут быть замещены одним или несколькими заместителями, такими как в общем виде проиллюстрированные выше или представленные на примере конкретных классов, подклассов и видов по настоящему изобретению. Должно быть понятно, что фраза "необязательно замещенный" используется взаимозаменяемо с фразой "замещенный или незамещенный". Как правило, термин "замещенный", независимо от того, стоит перед ним слово "необязательно" или нет, относится к замещению водородных радикалов в данной структуре радикалом указанного заместителя.
Если не указано иное, необязательно замещенная группа может содержать заместитель в каждом замещаемом положении этой группы, и когда более чем одно положение в какой-либо определенной структуре может быть замещено более чем одним заместителем, выбранным из указанной группы, такие заместители могут быть либо одинаковыми, либо отличными друг от друга в каждом положении. Комбинации заместителей, предусматриваемые настоящим изобретением, предпочтительно представляют собой такие, которые приводят к образованию стабильных или химически достижимых соединений.
Термин "стабильный", как он используется в настоящей заявке, относится к соединениям, которые, по существу, не изменяются, будучи подверженными условиям, которые делают возможным их получение, детекцию и, предпочтительно, их выделение, очистку и использование по одному или нескольким назначениям, раскрытым в настоящей заявке. В некоторых вариантах воплощения стабильное соединение или химически достижимое соединение представляет собой такое, которое, по существу, не изменяется при выдерживании при температуре 40°C или ниже, в отсутствие влаги или в других химически реакционных условиях, в течение, по меньшей мере, недели.
Термин "алифатический" или "алифатическая группа", как он используется в настоящей заявке, означает линейную (т.е. неразветвленную) или разветвленную, замещенную или незамещенную углеводородную цепь, которая является полностью насыщенной или которая содержит одну или несколько единиц ненасыщенности, или моноциклический углеводород или бициклический углеводород, который является полностью насыщенным или который содержит одну или несколько единиц ненасыщенности, но который не является ароматическим (также указанный в настоящей заявке как "карбоцикл", "циклоалифатический" или "циклоалкил"), который имеет одну точку присоединения к остальной части молекулы. Если не указано иное, алифатические группы содержат 1-20 алифатических атомов углерода. В некоторых вариантах воплощения алифатические группы содержат 1-10 алифатических атомов углерода. В других вариантах воплощения, алифатические группы содержат 1-8 алифатических атомов углерода. В следующих вариантах воплощения, алифатические группы содержат 1-6 алифатических атомов углерода, и еще в некоторых вариантах воплощения алифатические группы содержат 1-4 алифатических атомов углерода. В некоторых вариантах воплощения "циклоалифатический" (или "карбоцикл" или "циклоалкил") относится к моноциклическому C3-8 углеводороду или бициклическому или трициклическому C8-14 углеводороду, который является полностью насыщенным или который содержит одну или несколько единиц ненасыщенности, но который не является ароматическим, который имеет одну точку присоединения к остальной части молекулы, где любое отдельное кольцо в указанной бициклической кольцевой системе содержит 3-7 членов. Подходящие алифатические группы включают, но не ограничиваются этим, линейные или разветвленные, замещенные или незамещенные алкильные, алкенильные, алкинильные группы и их гибриды, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил. Подходящие циклоалифатические группы включают циклоалкил, бициклический циклоалкил (например, декалин), связанный мостиковой связью бициклоалкил, такой как норборнил или [2,2,2] бицикло-октил или связанный мостиковой связью трициклическую группу, такую как адамантил.
Термин "гетероалифатический", как он используется в настоящей заявке, означает алифатические группы, где один или два атома углерода независимо заменены одним или несколькими атомами, выбранными из кислорода, серы, азота, фосфора или кремния. Гетероалифатические группы могут быть замещенными или незамещенными, разветвленными или неразветвленными, циклическими или нециклическими и включают "гетероцикл", "гетероциклил", "гетероциклоалифатические" или "гетероциклические" группы.
Термин "гетероцикл", "гетероциклил", "гетероциклоалифатический" или "гетероциклический", как он используется в настоящей заявке, означает неароматические, моноциклические, бициклические или трициклические кольцевые системы, в которых один или несколько кольцевых членов представляет собой независимо выбранный гетероатом. В некоторых вариантах воплощения "гетероцикл", "гетероциклил", "гетероциклоалифатическая" или "гетероциклическая" группа содержит от трех до четырнадцати кольцевых членов, где один или несколько кольцевых членов представляют собой гетероатом, независимо выбранный из группы, включающей кислород, серу, азот или фосфор, и каждое кольцо в системе содержит от 3 до 7 кольцевых членов.
Термин "гетероатом" означает один или несколько атомов, выбранных из кислорода, серы, азота, фосфора или кремния (включая, любую окисленную форму азота, серы, фосфора или кремния; кватернизированную форму любого основного азота или; замещаемый азот гетероциклического кольца, например, N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
Термин "ненасыщенный", как он используется в настоящей заявке, означает, что группа содержит одну или несколько единиц ненасыщенности.
Термин "алкокси" или "тиоалкил", используемый в настоящей заявке, относится к алкильной группе, определенной выше, присоединенной к основной углеродной цепи через атом кислорода ("алкокси") или серы ("тиоалкил").
Термины "галогеналифатический" и "галогеналкокси" означает алифатический или алкокси, в зависимости от конкретного случая, замещенный одним или несколькими атомати галогена. Термин "галоген" или "гало" означает F, Cl, Br или I. Примеры галогеналифатической группы включают -CHF2, -CH2F, -CF3, -CF2 - или пергалогеналкил, такой как, -CF2CF3.
Термин "арил", используемый отдельно или как часть более крупной группы, как в "аралкиле", "аралкокси" или "арилоксиалкиле", относится к моноциклической, бициклической и трициклической кольцой системе, содержащей в целом от пяти до четырнадцати кольцевых членов, где, по меньшей мере, одно кольцо в системе является ароматическим, и где каждое кольцо в системе содержит от 3 до 7 кольцевых членов. Термин "арил" можно использовать взаимозаменяемо с термином "арильное кольцо". Термин "арил" также относится к гетероарильным кольцевым системам, определенным в настоящей заявке ниже.
Термин "гетероарил", используемый отдельно или как часть более крупной группы, как в "гетероаралкиле" или "гетероарилалкокси", относится к моноциклическим, бициклическим и трициклическим кольцевым системам, содержащим в целом от пяти до четырнадцати кольцевых членов, где по меньшей мере одно кольцо в системе является ароматическим, по меньшей мере одно кольцо в системе содержит один или несколько гетероатомов, и где каждое кольц в системе содержит от 3 до 7 кольцевых членов. Термин "гетероарил" можно использовать взаимозаменяемо с термином "гетероарильное кольцо" или термином "гетероароматический".
Арильная (включая аралкил, аралкокси, арилоксиалкил и подобные) или гетероарильная (включая гетероаралкил и гетероарилалкокси и подобные) группа может содержать один или несколько заместителей. Подходящие заместители по ненасыщенному атому углерода арильной или гетероарильной группы выбраны из галогена; -R0; -OR0; -SR0; 1,2-метилен-диокси; 1,2-этилендиокси; фенила (Ph), необязательно замещенного группой R0; -O(Ph), необязательно замещенного группой R0; -(CH2)1-2(Ph), необязательно замещенного группой R0; -CH=CH(Ph), необязательно замещенного группой R0; -NO2; -CN; -N(R0)2; -NR0C(O)R0; -NR0C(O)N(R0)2; -NR0CO2R0; -NR0NR0C(O)R0; -NR0NR0C(O)N(R0)2; -NR0NR0CO2R0; -C(O)C(O)R0; -C(O)CH2C(O)R0; -CO2R0; -C(O)R0; -C(O)N(R0)2; -OC(O)N(R0)2; -S(O)2R0; -SO2N(R0)2; -S(O)R0; -NR0SO2N(R0)2; -NR0SO2R0; -C(=S)N(R0)2; -C(=NH)-N(R0)2; или -(CH2)0-2NHC(O)R0, где в каждом независимом случае R0 выбран из водорода, необязательно замещенной C1-6 алифатической группы, незамещенного 5-6-членного гетероарильного или гетероциклического кольца, фенила, -O(Ph) или -CH2(Ph), или, несмотря на определения выше, две независимо присутствующие группы R0, на одном и том же заместителе или на разных заместителях, взятые вместе с атомом(ами), с которым связана каждая R0 группа, образуют 3-8-членное циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из группы, включающей азот, кислород или серу. Необязательные заместители в алифатической группе R0 выбраны из NH2, NH(C1-4алифатическая группа), N(C1-4алифатическая группа)2, галогена, C1-4 алифатический, OH, О(C1-4алифатическая группа), NO2, CN, CO2H, CO2(C1-4 алифатическая группа), O(галоген C1-4алифатическая группа) или галоген C1-4 алифатической группы, где каждая из перечисленных выше C1-4алифатических групп R0 является незамещенной.
Алифатическая или гетероалифатическая группа или неароматическое гетероциклическое кольцо может содержать один или несколько заместителей. Подходящие заместители по насыщенному углероду алифатической или гетероалифатической группы или неароматического гетероциклического кольца выбраны из перечисленных выше для ненасыщенного углерода арильной или гетероарильной группы и дополнительно включают следующие: =О, =S, =NNHR*, =NN(R*)2, =NNHC(O)R*, =NNHCO2(алкил), =NNHSO2(алкил) или =NR*, где каждый R* независимо выбран из группы, включающей водород или необязательно замещенную C1-6 алифатическую группу. Необязательные заместители в алифатической группе R* выбраны из NH2, NH(C1-4 алифатическая группа), N(C1-4 алифатическая группа)2, галогена, C1-4 алифатической группы, OH, О(C1-4 алифатическая группа), NO2, CN, CO2H, CO2(C1-4 алифатическая группа), O(галоген C1-4 алифатическая группа) или галоген(C1-4 алифатическая группа), где каждая из перечисленных выше C1-4 алифатических групп R* является незамещенной.
Необязательные заместители по азоту неароматического гетероциклического кольца выбраны из -R+, -N(R+)2, -C(O)R+, -CO2R+, -C(O)C(O)R+, -C(O)CH2C(O)R+, -SO2R+, -SO2N(R+)2, -C(=S)N(R+)2, -C(=NH)-N(R+)2 или -NR+SO2R+; где R+ представляет собой водород, необязательно замещенную C1-6 алифатическую группу, необязательно замещенный фенил, необязательно замещенный -O(Ph), необязательно замещенный -CH2(Ph), необязательно замещенный -(CH2)1-2(Ph); необязательно замещенный -CH=CH(Ph); или незамещенное 5-6-членное гетероарильное или гетероциклическое кольцо, содержащее от одного до четырех гетероатомов, независимо выбранных из группы, включающей кислород, азот или серу, или, несмотря на определение выше, две независимо присутствующие группы R+, на одном и том же заместителе или на разных заместителях, взятые вместе с атомом(ами), с которым связана каждая R+ группа, образуют 3-8-членное циклоалкильное, гетероциклильное, арильное или гетероарильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из группы, включающей азот, кислород или серу. Необязательные заместители в алифатической группе или фенильном кольце R+ выбраны из NH2, NH(C1-4 алифатическая группа), N(C1-4 алифатическая группа)2, галогена, C1-4 алифатической группы, OH, О(C1-4 алифатическая группа), NO2, CN, CO2H, CO2(C1-4 алифатическая группа), O(галоген C1-4 алифатическая группа) или галоген(C1-4 алифатическая группа), где каждая из перечисленных выше C1-4 алифатических групп R+ является незамещенной.
Термин "алкилиденовая цепь" относится к прямой или разветвленной углеродной цепи, которая может быть полностью насыщенной или может содержать одну или несколько единиц ненасыщенности, и содержит две точки присоединения к остальной части молекулы. Термин "спироциклоалкилиден" относится к карбоциклическому кольцу, которое может быть полностью насыщенным или может содержать одну или несколько единиц ненасыщенности, и содержит две точки присоединения от одного и того же кольцевого атома углерода к остальной части молекулы.
Термин "суспензия", как он используется в настоящей заявке, определяется как смесь, включающая твердое вещество и жидкость, где твердое вещество является не более чем частично растворимым в жидкости. Термин "суспендировать" или "суспендированный", как он используется в настоящей заявке (пример, "твердый продукт суспендировали в течение 24 часов"), определяется как действие, направленное на образование суспензии, и перемешивание указанной суспензии в течение определенного времени.
Термин "защитная группа" (PG), как он используется в настоящей заявке, означает группы, предназначенные для защиты функциональной группы, такой как, например, спирт, амин, карбоксил, карбонил, и т.п., против нежелательных реакций при осуществлении процедур синтеза. Традиционно используемые защитные группы раскрыты в Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Edition (John Wiley & Sons, New York, 1999), который включен в настоящую заявку посредством ссылки. Примеры азот-защитных групп включают ацильные, ароильные или карбамильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, o-нитрофеноксиацетил, α-хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и хиральные вспомогательные группы, такие как защищенные или незащищенные D, L или D, L-аминокислоты, такие как аланин, лейцин, фенилаланин и подобные; сульфонильные группы, такие как бензолсульфонил, п-толуолсульфонил и подобные; карбаматные группы, такие как бензилоксикарбонил, п-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтоксикарбонил, α,α-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2,-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и подобные, арилалкильные группы, такие как бензил, трифенилметил, бензилоксиметил и подобные, и силильные группы, такие как триметилсилил и подобные. Другим примером N-защитной группы является трет-бутилоксикарбонил (Boc).
Примерами полезных защитных групп для кислот являются замещенные алкиловые сложные эфиры, такие как 9-флуоренилметиловый, метоксиметиловый, метилтиометиловый, тетрагидропираниловый, тетрагидрофураниловый, метоксиэтоксиметиловый, 2-(триметилсилил)этоксиметиловый, бензилоксиметиловый, пивалоилоксиметиловый, фенилацетоксиметиловый, триизопропилсилилметиловый, цианометиловый, ацетоловый, фенациловый, замещенные фенациловые сложные эфиры, 2,2,2-трихлорэтиловый, 2-галогенэтиловый, ω-хлоралкиловый, 2-(триметилсилил)этиловый, 2-метилтиоэтиловый, трет-бутиловый, 3-метил-3-пентиловый, дициклопропилметиловый, циклопентиловый, циклогексиловый, аллиловый, металлиловый, циннамиловый, фениловый, силиловые сложные эфиры, бензиловые и замещенные бензиловые сложные эфиры, 2,6-диалкилфениловые сложные эфиры, такие как пентафторфениловый, 2,6-диалкилфениловый. Другие защитные группы для кислот представляют собой метиловые или этиловые сложные эфиры.
Способы добавления (способ обычно называемый как "защита") и удаления (способ обычно называемый как "удаление защиты") таких защитных групп для амина и кислоты хорошо известны из уровня техники и являются доступными, например, см. P. J. Kocienski, Protecting Groups, Thieme, 1994, который включен в настоящую заявку посредством ссылки во всей полноте, и Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Edition (John Wiley & Sons, New York, 1999).
Примеры подходящих растворителей, которые можно использовать в настоящем изобретении, включают, но не ограничиваются этим, воду, метанол, дихлорметан (ДХМ), ацетонитрил, диметилформамид (ДМФА), метилацетат (MeOAc), этилацетат (EtOAc), изопропилацетат (IPAc), трет-бутилацетат (t-BuOAc), изопропиловый спирт (IPA), тетрагидрофуран (ТГФ), метилэтилкетон (MEK), трет-бутанол, диэтиловый эфир (Et2O), метил-трет-бутиловый эфир (MTBE), 1,4-диоксан и N-метилпирролидон (NMP).
Примеры подходящих связующих агентов, которые можно использовать в настоящем изобретении, включают, но не ограничиваются этим гидрохлорид 1-(3-(диметиламино)пропил)-3-этилкарбодиимида (EDCI), гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU), 1-гидроксибензотриазол (HOBT), гексафторфосфат 2-(1H-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU), тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, 1-H-бензотриазолий-1-[бис(диметиламино)метилен]-5-хлоргексафторфосфат (HCTU), 2-хлор-4,6-диметокси-1,3,5-триазин и 2-пропанфосфоновый ангидрид (T3P®).
Примеры подходящих оснований, которые можно использовать в настоящем изобретении, включают, но не ограничиваются этим, карбонат калия (K2CO3), N-метилморфолин (NMM), триэтиламин (Et3N; TEA), диизопропилэтиламин (i-Pr2EtN; DIEA), пиридин, гидроксид калия (KOH), гидроксид натрия (NaOH) и метоксид натрия (NaOMe; NaOCH3).
В некоторых вариантах воплощения две независимо присутствующие группы R0, показанные в структуре ниже, взяты вместе с атомом(атомами), с которым они связаны, с образованием 3-8-членного циклоалкильного, гетероциклильного, арильного или гетероарильного кольца, содержащего 0-3 гетероатома, независимо выбранных из группы, включающей азот, кислород или серу. Примеры колец, которые образованы двумя независимо присутствующими группами R0, взятыми вместе с атомом(атомами), с которым они связаны, включают, но не ограничиваются этим, следующие: a) две независимо присутствующие группы R0, которые связаны с одним и тем же атомом и взяты вместе с этим атомом с образованием кольца, например, N(R0)2, где обе присутствующие группы R0 взяты вместе с атомом азота с образованием пиперидин-1-ильной, пиперазин-1-ильной или морфолин-4-ильной группа; и b) две независимо присутствующие группы R0, которые связаны с разными атомами и взяты вместе с обоими этими атомами с образованием кольца, например, где фенильная группа замещена двумя независимо присутствующими группами OR0

Эти две независимо присутствующие группы R0 взяты вместе с атомами кислорода, с которыми они связаны, с образованием конденсированного 6-членного кислород-содержащего кольца:

Должно быть понятно, что другие различные кольца могут быть образованы, когда две независимо присутствующие группы R0 взяты вместе с атомом(атомами), с которым каждая переменная связана, и что примеры, подробно описанные выше, не являются ограничивающими.
Заместители в кольцах, например, моно- и полиарильной, алифатической, гетероалифатической кольцевых системах могут быть присоединены в любом положении кольца, присоединение заместителя в которой является химически возможным.
Если не указано иное, предполагается, что структуры, представленные в настоящей заявке, также включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационные)) формы структур; например, R и S конфигурации для каждого асимметрического центра, (Z) и (E) изомеры по двойной связи, и (Z) и (E) конформационные изомеры. Поэтому отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси соединений по настоящему изобретению включены в объем настоящего изобретения. Если не указано иное, все таутомерные формы соединений по настоящему изобретению включены в объем настоящего изобретения. Например, когда Rx-X- в соединении формулы 1 представляет собой водород, указанное соединение формулы 1 может существовать в виде таутомера:

Кроме того, также подразумевается, если не указано иное, что структуры, представленные в настоящей заявке, включают соединения, которые отличаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие представленные структуры, за исключением замещения водорода дейтерием или тритием, или замещения углерода углеродом13C или14C, включены в объем настоящего изобретения. Такие соединения являются полезными, например, в качестве аналитических инструментов, зондов в биологических анализах или в качестве терапевтических средств.
II. СПОСОБЫ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
В общем, изобретение обеспечивает способы синтеза соединений, полезных в качестве модуляторов CFTR.
В некоторых вариантах воплощения изобретение обеспечивает способ получения соединения, имеющего структуру

В некоторых вариантах воплощения изобретение обеспечивает способ получения соединения, имеющего структуру

В некоторых вариантах воплощения изобретение обеспечивает способ получения соединения, имеющего структуру

В одном аспекте, изобретение обеспечивает способ получения соединения формулы 1,

включающий конденсацию карбоновой кислоты формулы 2

с анилином формулы 3

в присутствии конденсирующего агента, выбранного из группы, включающей тетрафторборат 2-хлор-1,3-диметил-2-имидазолия, HBTU, HCTU, 2-хлор-4,6-диметокси-1,3,5-триазин, HATU, HOBT/EDC и T3P®.
Каждый R2 и R4 независимо выбран из группы, включающей водород, CN, CF3, галоген, C1-6 алкил с прямой или разветвленной цепью, 3-12-членную циклоалифатическую группу, фенил, C5-10 гетероарил или C3-7 гетероциклическую группу, где указанный гетероарил или гетероциклическая группа содержит не более 3 гетероатомов, выбранных из O, S или N, и каждый C1-6 алкил с прямой или разветвленной цепью, 3-12-членная циклоалифатическая группа, фенил, C5-10гетероарил или C3-7 гетероциклическая группа независимо и необязательно содержит не более трех заместителей, выбранных из -OR', -CF3, -OCF3, SR', S(O)R', SO2R', -SCF3, галогена, CN, -COOR', -COR-, -О(CH2)2N(R')(R'), -О(CH2)N(R')(R'), -CON(R')(R'), -(CH2)2OR', -(CH2)OR', CH2CN, необязательно замещенного фенила или фенокси, -N(R')(R'), -NR'C(О)0R', -NR'C(O)R', -(CH2)2N(R')(R') или -(CH2)N(R')(R').
Каждый R5 независимо выбран из группы, включающей водород, -OH, NH2, CN, CHF2, NHR', N(R')2, -NHC(O)R', NHC(O)OR', NHSO2R', -OR', OC(O)OR', OC(O)NHR', OC(O)NR'2, CH2OH, CH2N(R')2, C(O)OR', SO2NHR', SO2N(R')2 или CH2NHC(O)OR'.
Или R4 и R5, взятые вместе, образуют 5-7-членное кольцо, содержащее 0-3 гетероатома, выбранных из N, O или S, где указанное кольцо необязательно содержит не более трех заместителей R3.
Каждый X независимо представляет собой связь или необязательно замещенную C1-6 алкилиденовую цепь, где вплоть до двух метиленовых звеньев X необязательно и независимо заменены группой -CO- -CS-, -COCO-, -CONR'-, -CONR'NR'-, -CO2-, -OCO-, -NR'CO2-, -O-, -NR'CONR'-, -OCONR'-, -NR'NR', -NR'NR'CO-, -NR'CO-, -S-, -SO, -SO2-, -NR'-, -SO2NR'-, NR'SO2- или -NR'SO2NR'-.
Каждый Rx независимо представляет собой R', галоген, NO2, CN, CF3 или OCF3, y представляет собой целое число, имеющее значение 0-4. Каждый R' независимо выбран из водорода или необязательно замещенной группы, выбранной из C1-8 алифатической группы, 3-8-членного насыщенного, частично ненасыщенного или полностью ненасыщенного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членной насыщенной, частично ненасыщенной или полностью ненасыщенной бициклической кольцевой системы, содержащей 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы; или две присутствующие группы R', взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из N, O или S.
Каждый R3 независимо представляет собой -C1-3 алкил, C1-3пергалогеналкил, -О(C1-3алкил), -CF3, -OCF3, -SCF3, -F, -Cl, -Br или -COOR', -COR', -O(CH2)2N(R')(R'), -О(CH2)N(R')(R'), -CON(R')(R'), -(CH2)2OR', -(CH2)OR', необязательно замещенное моноциклическое или бициклическое ароматическое кольцо, необязательно замещенный арилсульфон, необязательно замещенное 5-членное гетероарильное кольцо, -N(R')(R'), -(CH2)2N(R')(R') или -(CH2)N(R')(R').
В одном варианте воплощения, R5 независимо представляет собой -OC(O)OR', -OC(O)NHR' или -OC(О)N(R')2, и R' не является водородом. В некоторых случаях R5 представляет собой -OC(O)OR', и R' не является водородом. В других случаях, R5 представляет собой -OC(O)NHR', и R' не является водородом. В некоторых других случаях, R5 представляет собой -OC(О)N(R')2, и R' не является водородом.
В одном варианте воплощения, способ также включает расщепление -OC(O)OR', -OC(O)NHR' или -OC(О)N(R')2 R5 группы с образованием -OH. Расщепление осуществляют путем обработки соединения формулы 1, содержащего -OC(O)OR', -OC(O)NHR' или -OC(O)N(R')2 R5 группу, спиртовым растворителем в присутствии основания, такого как NaOH, KOH или метоксид натрия. Спиртовой растворитель, используемый в реакции расщепления, представляет собой метанол, этанол, изопропиловый спирт или трет-бутанол.
Еще в одном варианте воплощения, по меньшей мере один из R4 или R2 независимо представляет собой C1-6 алкил с прямой или разветвленной цепью, который замещен группой -COOR' или -CON(R')2, и R' не является водородом. В некоторых случаях, один из R4 или R2 представляет собой -COOR', и R' не является водородом. В других случаях, один из R4 или R2 представляет собой -CON(R')2, и R' не является водородом.
В одном варианте воплощения, способ также включает гидролиз группы -COOR' или -CON(R')2, по меньшей мере, по одному из R4 и R2. Гидролиз осуществляют путем обработки соединения формулы 1, содержащего -COOR' или -CON(R')2 группу, по меньшей мере, по одному из R4 и R2 с использованием спиртового растворителя, в присутствии основания, такого как NaOH, KOH или метоксид натрия. Спиртовой растворитель, используемый в гидролизе, представляет собой метанол, этанол, изопропиловый спирт или трет-бутанол.
Еще в одном варианте воплощения, по меньшей мере один из R4 или R2 независимо представляет собой C1-6 алкил с прямой или разветвленной цепью, который замещен группой -COOR' или -CON(R')2, и R5 независимо представляет собой -OC(O)OR', -OC(O)NHR' или -OC(O)N(R')2, и каждый R' не является водородом.
В одном варианте воплощения, способ также включает гидролиз группы -COOR' или -CON(R')2, по меньшей мере, по одному из R4 и R2, и расщепление -OC(O)OR', -OC(O)NHR' или -OC(О)N(R')2 R5 группы. Реакцию гидролиза/расщепления осуществляют путем обработки соединения формулы 1, содержащего -COOR' или -CON(R')2 группу, по меньшей мере, по одной из R4 и R2 и -OC(O)OR', -OC(O)NHR' или -OC(О)N(R')2 R5 группе с использованием спиртового растворителя, в присутствии основания, такого как NaOH, KOH или метоксид натрия. Спиртовой растворитель, используемый в реакции гидролиза/расщепления представляет собой метанол, этанол, изопропиловый спирт или трет-бутанол.
Еще в одном варианте воплощения, сочетание карбоновой кислоты формулы 2 и анилина формулы 3 осуществляют в присутствии основания, такого как K2CO3, Et3N, N-метилморфолин (NMM), пиридин или DIEA.
Еще в одном варианте воплощения, сочетание карбоновой кислоты формулы 2 и анилина формулы 3 осуществляют в присутствии пиридина или DIEA.
В следующем варианте воплощения, сочетание карбоновой кислоты формулы 2 и анилина формулы 3 осуществляют в присутствии растворителя, такого как EtOAc, IPAc, ТГФ, MEK, NMP, ацетонитрил, ДМФА или 2-метилтетрагидрофуран.
В следующих вариантах воплощения, конденсацию карбоновой кислоты формулы 2 и анилина формулы 3 осуществляют при температуре реакции, которую поддерживают в пределах от 10°C до 78°C, такой как приблизительно в пределах от 20°C до 30°C, приблизительно в пределах от 40°C до 50°C и приблизительно в пределах от 42°C до 53°C.
Еще в некоторых вариантах воплощения, реакцию конденсации осуществляют при перемешивании в течение по меньшей мере 2 часов, например в течение по меньшей мере 8 часов, в течение по меньшей мере 70 часов или в течение по меньшей мере 3 дней.
Еще в одном варианте воплощения, y имеет значение 0.
В следующих вариантах воплощения, R2 представляет собой трет-бутил.
В некоторых вариантах воплощения R5 независимо представляет собой -OC(O)OR', -OC(O)NHR' или -OC(O)N(R')2, и R' не является водородом; и каждый из R2 и R4 независимо выбран из водорода, CF3, C1-C6 алкила с прямой или разветвленной цепью, 3-12-членной циклоалифатической группы или фенила.
В некоторых вариантах воплощения R5 независимо представляет собой -OC(O)OR', -OC(O)NHR' или -OC(O)N(R')2, и R' не является водородом; и каждый из R2 и R4 независимо выбран из C1-C6 алкила с прямой или разветвленной цепью.
В некоторых вариантах воплощения R5 независимо представляет собой -OC(O)OR', -OC(O)NHR' или -OC(О)N(R')2, и R' не является водородом; и каждый из R2 и R4 независимо выбран из метила, этила, н-пропила, изопропил, н-бутила, изобутила, трет-бутила, н-пентила или н-гексила.
В некоторых вариантах воплощения R2 и R4 представляют собой трет-бутил.
В одном варианте воплощения, изобретение обеспечивает способ получения соединения формулы 5

путем взаимодействия соединения формулы 6

с реагентом, способным вызывать присоединение защитной группы к фенольному кислороду соединения формулы 6 в присутствии растворителя, с получением, таким образом, соединения формулы 7,

которое подвергают нитрованию с образованием соединения формулы 8

которое затем восстанавливают с получением соединения формулы 5, где PG представляет собой защитную группу, и R4 и R5 имеют значение, определенное выше.
В одном варианте воплощения, растворитель, используемый в преобразовании соединения формулы 6 в соединение формулы 7 представляет собой диэтиловый эфир или метиленхлорид.
Еще в одном варианте воплощения, растворитель, используемый в реакции введения защитной группы представляет собой метиленхлорид.
В следующем варианте воплощения, PG представляет собой пропоксиформил, метансульфонил, 4-нитробензоил, этоксиформил, бутоксиформил, трет-бутоксиформил, изопропоксиформил или метоксиформил.
Еще в одном варианте воплощения, PG представляет собой метоксиформил.
Еще в одном варианте воплощения, соединение формулы 7 подергают нитрованию с использованием смеси серной кислоты, азотной кислоты и метиленхлорида.
В одном варианте воплощения, нитросоединение формулы 8 очищают при помощи кристаллизации.
В следующем варианте воплощения, нитросоединение формулы 8 очищают при помощи кристаллизации с использованием гексана.
Еще в одном варианте воплощения, способ также включает стадию контактирования соединения формулы 4

с водным раствором кислоты с получением соединения формулы 2.
В одном варианте воплощения, соединение формулы 3 представляет собой соединение формулы 40

Еще в одном варианте воплощения, способ также включает стадию контактирования соединения формулы 41

с метилтриметилсилилдиметилкетенацеталем (MTDA)

с получением соединения формулы 42

В следующем варианте воплощения, способ включает стадию восстановления соединения формулы 42 с получением соединения формулы 40.
В одном варианте воплощения, соединение формулы 3 представляет собой соединение формулы 43

В следующем варианте воплощения, способ включает стадию контактирования соединения формулы 44
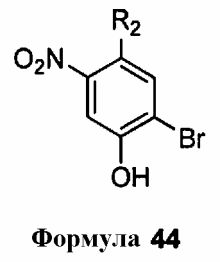
с метилтриметилсилилдиметилкетенацеталем (MTDA)

с получением соединения формулы 45

В следующем варианте воплощения, способ включает стадию восстановления соединения формулы 45 с получением соединения формулы 43.
В другом аспекте, изобретение обеспечивает способ получения соединения формулы 2

включающий контактирования соединения формулы 4

с водным раствором кислоты, где каждый X независимо представляет собой связь или представляет собой необязательно замещенную C1-6 алкилиденовую цепь, где вплоть до двух метиленовых звеньев X необязательно и независимо заменены группой -CO-, -CS-, -COCO- -CONR'-, -CONR'NR'-, -CO2-, -OCO-, -NR'CO2-, -O-, -NR'CONR'-, -OCONR'-, -NR'NR', -NR'NR'CO-, -NR'CO-, -S-, -SO, -SO2-, -NR'-, -SO2NR'-, NR'SO2- или -NR'SO2NR'-;
каждый Rx независимо представляет собой R', галоген, NO2, CN, CF3 или OCF3;
y представляет собой целое число, имеющее значение 0-4; и
каждый R' независимо выбран из группы, включающей водород или необязательно замещенную группу, выбранную из C1-8 алифатической группы, 3-8-членного насыщенного, частично ненасыщенного или полностью ненасыщенного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членной насыщенной, частично ненасыщенной или полностью ненасыщенной бициклической кольцевой системы, содержащей 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы; или две присутствующие группы R', взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из N, O или S.
В одном варианте воплощения этого аспекта, соединение формулы 4

получают путем контактирования соединения формулы 50

с соединением формулы 51
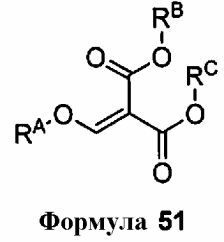
где RA, RB и RC могут представлять собой C1-6 алкил.
В одном варианте воплощения этого аспекта, соединение формулы 50 и соединение формулы 50 подвергают взаимодействию при температуре от около 100°C до около 300°C. Еще в одном варианте воплощения, соединение формулы 50 и соединение формулы 50 подвергают взаимодействию при температуре около 100°C. Еще в одном варианте воплощения, соединение формулы 50 и соединение формулы 50 подвергают взаимодействию при температуре около 250°C. Еще в одном дополнительном варианте воплощения, соединение формулы 50 и соединение формулы 50 подвергают взаимодействию при температуре около 100°C и затем при температуре около 250°C.
Еще в одном дополнительном варианте воплощения этого аспекта, y имеет значение 0.
В другом аспекте, изобретение обеспечивает способ получения соединения формулы 40

включающий стадию контактирования соединения формулы 41

с метилтриметилсилилдиметилкетенацеталем (MTDA)

с получением соединения формулы 42

где каждый R2 независимо выбран из группы, включающей водород, CN, CF3, галоген, C1-6 алкил с прямой или разветвленной цепью, 3-12-членную циклоалифатическую группу, фенил, C5-10 гетероарил или C3-7 гетероциклическую группу, где указанный гетероарил или гетероциклическая группа содержит не более 3 гетероатомов, выбранных из O, S или N, и каждый C1-6 алкил с прямой или разветвленной цепью, 3-12-членная циклоалифатическая группа, фенил, C5-10 гетероарил или C3-7 гетероциклическая группа независимо и необязательно содержит не более трех заместителей, выбранных из -OR', -CF3, -OCF3, SR', S(O)R', SO2R', -SCF3, галогена, CN, -COOR', -COR-, -O(CH2)2N(R')(R'), -O(CH2)N(R')(R'), -CON(R')(R'), -(CH2)2OR', -(CH2)OR', CH2CN, необязательно замещенного фенила или фенокси, -N(R')(R'), -NR'C(О)OR', -NR'C(О)R', -(CH2)2N(R')(R') или -(CH2)N(R')(R');
каждый R5 независимо выбран из водорода, -OH, NH2, CN, CHF2, NHR', N(R')2, -NHC(O)R', NHC(O)OR', NHSO2R', -OR', OC(O)OR', OC(O)NHR', OC(О)NR'2, CH2OH, CH2N(R')2, C(O)OR', SO2NHR', SO2N(R')2 или CH2NHC(O)OR'; и
каждый R' независимо выбран из водорода или необязательно замещенной группы, выбранной из C1-C8 алифатической группы, 3-8-членного насыщенного, частично ненасыщенного или полностью ненасыщенного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членной насыщенной, частично ненасыщенной или полностью ненасыщенной бициклической кольцевой системы, содержащей 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы; или две присутствующих группы R', взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из N, O или S.
В одном варианте воплощения этого аспекта, способ включает стадию восстановления соединения формулы 42 с получением соединения формулы 40.
В другом аспекте, изобретение обеспечивает способ получения соединения формулы 43

включающий стадию контактирования соединения, имеющего формулу 44

с метилтриметилсилилдиметилкетенацеталем (MTDA)

с получением соединения формулы 45
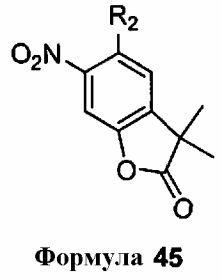
где каждый R2 независимо выбран из группы, включающей водород, CN, CF3, галоген, C1-6 алкил с прямой или разветвленной цепью, 3-12-членную циклоалифатическую группу, фенил, C5-10 гетероарил или C3-7 гетероциклическую группу, где указанный гетероарил или гетероциклическая группа содержит не более 3 гетероатомов, выбранных из O, S или N, и каждый C1-6 алкил с прямой или разветвленной цепью, 3-12-членная циклоалифатическая группа, фенил, C5-10 гетероарил или C3-7 гетероциклическая группа независимо и необязательно содержит не более трех заместителей, выбранных из -OR', -CF3, -OCF3, SR', S(O)R', SO2R', -SCF3, галоген, CN, -COOR', -COR-, -O(CH2)2N(R')(R'), -O(CH2)N(R')(R'), -CON(R')(R'), -(CH2)2OR'-(CH2)OR', CH2CN, необязательно замещенного фенила или фенокси, -N(R')(R'), -NR'C(О)OR', -NR'C(O)R', -(CH2)2N(R')(R') или -(CH2)N(R')(R'); и каждый R' независимо выбран из водорода или необязательно замещенной группы, выбранной из C1-8 алифатической группы, 3-8-членного насыщенного, частично ненасыщенного или полностью ненасыщенного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членной насыщенной, частично ненасыщенной или полностью ненасыщенной бициклической кольцевой системы, содержащей 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы; или две присутствующих группы R', взятые вместе с атомом (атомами), с которым они связаны, образуют необязательно замещенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из N, O или S.
В одном варианте воплощения этого аспекта, способ включает стадию восстановления соединения формулы 45 с получением соединения формулы 43.
В некоторых специфических вариантах воплощения, способ получения соединения 27

включает:
(a) взаимодействие соединения 26

с соединением 13
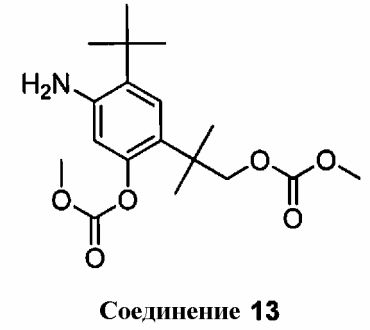
в присутствии EDCI, HOBT и DIEA, с использованием ДМФА в качестве растворителя, где температуру реакции поддерживают приблизительно в пределах от 20°C до 30°C, и реакцию осуществляют в течение, по меньшей мере, 70 часов, с получением соединения 14

(b) обработку соединения 14 при помощи KOH в метаноле.
В другом специфическом варианте воплощения, способ получения соединения 28

включает:
(a) взаимодействие соединения 26

с соединением 20

в присутствии HATU и DIEA, с использованием ацетонитрила в качестве растворителя, где температуру реакции поддерживают приблизительно в пределах от 40°C до 50°C, и где реакцию осуществляют в течение, по меньшей мере, 3 дней, с получением соединения 21

(b) обработку соединения 21 при помощи NaOH в метаноле.
Еще в одном специфическом варианте воплощения, способ получения соединения 34

включает:
(a) взаимодействие соединения 26

с соединением 32

в присутствии T3P® и пиридина, с использованием 2-метилтетрагидрофурана в качестве растворителя, где температуру реакции поддерживают в пределах от около 42°C до около 3°C, и где реакцию осуществляют в течение, по меньшей мере, 2 часов, с получением соединения 33

(b) обработку соединения 33 при помощи NaOMe/MeOH в 2-метилтетрагидрофуране.
Еще в одном варианте воплощения, способ также включает стадию образования суспензии соединения 34 в смеси ацетонитрила и воды, где твердую форму соединения 34 преобразовывают в Соединение 34.
В одном варианте воплощения, отношение ацетонитрила к воде в суспензии составляет около 9:1.
Еще в одном варианте воплощения, суспензию нагревают до температуры приблизительно в пределах от 73°C до 83°C.
Еще в одном варианте воплощения, соединение 34 находится в суспензии в течение, по меньшей мере, около 3 часов.
В следующем варианте воплощения, способ включает гашение реакционной смеси при помощи 1н. раствора HCl; добавление 0,1н. раствора HCl к смеси, создавая тем самым двухфазную смесь; перемешивание двухфазной смеси; выделение органической фазы из указанной двухфазной смеси; фильтрование и удаление твердого вещества из указанной органической фазы; уменьшение объема органической фазы приблизительно на 50% с использованием дистилляции; осуществление в трех повторах следующих стадий: добавление ацетонитрила к органической фазе до тех пор, пока объем указанной органический фазы не увеличится на 100%, и уменьшение объема органической фазы приблизительно на 50%; увеличение объема органической фазы приблизительно на 100% путем добавления ацетонитрила и затем добавления воды, с образованием суспензии, где конечное соотношение растворителя ацетонитрил/вода составляет 9:1; нагревание указанной суспензии до температуры приблизительно в пределах от 73°C до 83°C; перемешивание указанной суспензии в течение, по меньшей мере, 5 часов; и охлаждение указанной суспензии до температуры приблизительно в пределах от -5°C до 5°C.
В альтернативном варианте воплощения, способ включает гашение реакционной смеси при помощи 1,2н. раствора HCl; создавая тем самым двухфазную смесь; перемешивание указанной двухфазной смеси; выделение органической фазы из указанной двухфазной смеси; добавление 0,1н. раствора HCl к органическому слою, создавая тем самым двухфазную смесь; перемешивание указанной двухфазной смеси; выделение органической фазы; фильтрование и удаление твердого вещества из указанной органической фазы; уменьшение объема органической фазы приблизительно на 50% с использованием дистилляции; осуществление в трех повторах следующих стадий: добавление ацетонитрила к органической фазе до тех пор, пока объем указанной органический фазы не увеличится на 100%, и уменьшение объема органической фазы приблизительно на 50%; увеличение объема органической фазы приблизительно на 100% путем добавления ацетонитрила и затем добавления воды, с образованием суспензии, где конечное соотношение растворителя ацетонитрил/вода составляет 9:1; нагревание указанной суспензии до температуры приблизительно в пределах от 73°C до 83°C; перемешивание указанной суспензии в течение, по меньшей мере, 5 часов; и охлаждение указанной суспензии до температуры приблизительно в пределах от 20°C до 25°C; фильтрование и удаление твердого вещества из указанной суспензии; промывка твердого вещества ацетонитрилом, имеющим температуру приблизительно в пределах от 20°C до 25°C четыре раза; и сушка твердого вещества в вакууме при температуре от 45°C до около 55°C.
В одном варианте воплощения, объем 1н. раствора HCl, используемого для гашения реакции, составляет 25% от общего объема исходной реакционной смеси; объем 0,1н. раствора HCl, добавляемого к реакционной смеси, составляет 25% от общего объема исходной реакционной смеси; и стадии дистилляции осуществляют при пониженном давлении, где температура вне реакционного сосуда меньше чем около 45°C, и температура реакционной смеси больше чем около 0°C.
В следующем варианте воплощения, способ включает образование суспензии соединения 34 в изопропилацетате.
В одном варианте воплощения, суспензию нагревают до температуры кипения с обратным холодильником.
Еще в одном варианте воплощения, соединение 34 находится в суспензии в течение, по меньшей мере, около 3 часов.
В некоторых вариантах воплощения, способ получения соединения 34 дополнительно включает растворение соединения 34 в 2-метилтетрагидрофуране; добавление 0,1н. раствора HCl к этому раствору с получением двухфазного раствора, который перемешивают. Еще в одном варианте воплощения, способ также включает отделение органической фазы от двухфазного раствора. Еще в одном варианте воплощения, способ также включает фильтрование и удаление твердого вещества из органической фазы. Еще в одном варианте воплощения, способ также включает уменьшение объема органической фазы приблизительно на 50% с использованием дистилляции. Еще в одном варианте воплощения, способ также включает осуществление в трех повторах следующей процедуры: добавление MeOAc, EtOAc, IPAc, t-BuOAc, тетрагидрофурана (ТГФ), Et2O или метил-трет-бутилового эфира (MTBE) к органической фазе до тех пор, пока объем органической фазы не увеличится на 100%, и уменьшение объема органической фазы на 50% с использованием дистилляции. Еще в одном варианте воплощения, способ также включает добавление MeOAc, EtOAc, IPAc, t-BuOAc, тетрагидрофурана (ТГФ), Et2O или метил-трет-бутилового эфира (MTBE) к органической фазе до тех пор, пока объем органической фазы не увеличится на 100%. Еще в одном варианте воплощения, способ также включает нагревание органической фазы до температуры кипения с обратным холодильником и поддержание указанной температуры кипения с обратным холодильником в течение, по меньшей мере, около 5 часов. Еще в одном варианте воплощения, способ также включает охлаждение органической фазы до температуры в пределах от около -5°C до около 5°C в течение периода времени от 4,5 часов до 5,5 часов.
Еще в одном варианте воплощения, способ получения соединения 34 дополнительно включает кристаллизацию соединения 34, включающую введение затравки в насыщенную реакционную смесь, включающую соединение 34 в растворе, с использованием, по меньшей мере, одного кристалла по существу чистого соединения 34.
Еще в одном варианте воплощения, изобретение обеспечивает способ получения соединения формулы 2

включающий гидролиз соединения формулы 4

В следующем варианте воплощения, соединение формулы 4 гидролизуют с использованием гидролизующего агента в присутствии растворителя.
В некоторых дополнительных вариантах воплощения гидролизующий агент представляет собой HCl, H2SO4, H3PO4, Na2CO3, LiOH, KOH или NaOH.
В некоторых вариантах воплощения растворитель, используемый в гидролизе, представляет собой H2O, метанол, этанол, изопропанол или трет-бутанол.
В следующих вариантах воплощения, изобретение обеспечивает соединение, полученное при помощи любого из способов, описанных в настоящей заявке.
В следующем варианте воплощения, изобретение обеспечивает фармацевтическую композицию, включающую соединение, полученное при помощи любого из способов, описанных в настоящей заявке.
В одном аспекте, изобретение обеспечивает способ получения соединения 27

включающий контактирование соединения 34
с биологической композицией.
В одном варианте воплощения этого аспекта, биологическая композиция включает биологический организм, выбранный из группы, включающей грибы, бактерии и архебактерии.
В одном варианте воплощения, биологическая композиция представляет собой грибы. В следующем варианте воплощения, грибы представляют собой одноклеточные грибы. Еще в одном варианте воплощения, грибы представляют собой многоклеточные грибы.
В следующем варианте воплощения, грибы представляют собой многоклеточные грибы, выбранные из группы, включающей Absidia, Aspergillus, Beauveria, Botrytis, Cunninghamella, Cyathus, Gliocladium, Mortierella, Mucor, Phanerochaete, Stemphylium, Syncephalastrum и Verticillium.
В следующем варианте воплощения, грибы представляют собой многоклеточные грибы, выбранные из группы, включающей Absidia pseudocylindrospora, Aspergillus alliaceus, Aspergillus ochraceus, Beauveria bassiana, Cunninghamella blakesleeana, Cunninghamella echinulata, Mortierella isabellina, Mucor plumbeus, Phanerochaete chrysosporium, Syncephalastrum racemosum и Verticillium theobromae.
Еще в одном варианте воплощения, грибы представляют собой одноклеточные грибы, выбранные из группы, включающей Candida, Debaryomyces, Geotrichum, Pichia, Rhodotorula, Saccharomyces, Sporobolomyces, Williopsis и Yarrowia.
В следующем варианте воплощения, грибы представляют собой одноклеточные грибы, выбранные из группы, включающей Candida paripsilosis, Debaryomyces hansenii, Geotrichum candidum, Pichia methanolica, Pichia subpellicosa, Rhodotorula glutinis, Rhodotorula mucaliginosa, Saccharomyces cerevisiae, Sporobolomyces salmonicolor, Williopsis saturnis и Yarrowia lipolytica.
Еще в одном варианте воплощения, биологический организм представляет собой архебактерии. В следующем варианте воплощения, архебактерии представляют собой Pyrococcus. Еще в одном варианте воплощения, архебактерии представляют собой Pyrococcus furiosus.
Еще в одном варианте воплощения, биологический организм представляет собой бактерии.
В следующем варианте воплощения, бактерии выбраны из группы, включающей Lactobacillus, Pseudomonas, Rhodococcus и Streptomyces.
В следующем варианте воплощения, бактерии выбраны из группы, включающей Lactobacillus reuterii, Pseudomonas methanolica, Rhodococcus erythropolis, Streptomyces griseus, Streptomyces griseolus, Streptomyces platensis и Streptomyces rimosus.
Еще в одном варианте воплощения, биологическая композиция включает Streptomyces rimosus или его фрагмент.
В одном варианте воплощения этого аспекта, биологическая композиция включает растворитель. В следующем варианте воплощения, растворитель включает воду. Еще в одном варианте воплощения, растворитель представляет собой буфер. Еще в одном варианте воплощения, растворитель представляет собой калийфосфатный буфер, имеющий рН около 7.
В одном аспекте, изобретение обеспечивает способ получения соединения 28

включающий взаимодействие соединения 34

с биологической композицией.
В одном варианте воплощения этого аспекта, биологическая композиция включает биологический организм, выбранный из группы, включающей грибы, бактерии и архебактерии.
В одном варианте воплощения, биологическая композиция представляет собой грибы. В следующем варианте воплощения, грибы представляют собой одноклеточные грибы. Еще в одном варианте воплощения, грибы представляют собой многоклеточные грибы.
В следующем варианте воплощения, грибы представляют собой многоклеточные грибы, выбранные из группы, включающей Absidia, Aspergillus, Beauveria, Botrytis, Cunninghatnella, Cyathus, Gliocladium, Mortierella, Mucor, Phanerochaete, Stemphylium, Syncephalastrum и Verticillium.
В следующем варианте воплощения, грибы представляют собой многоклеточные грибы, выбранные из группы, включающей Absidia pseudocylindrospora, Aspergillus alliaceus, Aspergillus ochraceus, Beauveria bassiana, Cunninghatnella blakesleeana, Cunninghamella echinulata, Mortierella isabellina, Mucor plumbeus, Phanerochaete chrysosporium, Syncephalastrum racemosum и Verticillium theobromae.
Еще в одном варианте воплощения, грибы представляют собой одноклеточные грибы, выбранные из группы, включающей Candida, Debaryomyces, Geotrichum, Pichia, Rhodotorula, Saccharomyces, Sporobolomyces, Williopsis и Yarrowia.
В следующем варианте воплощения, грибы представляют собой одноклеточные грибы, выбранные из группы, включающей Candida paripsilosis, Debaryomyces hansenii, Geotrichum candidum, Pichia methanolica, Pichia subpellicosa, Rhodotorula glutinis, Rhodotorula mucaliginosa, Saccharomyces cerevisiae, Sporobolomyces salmonicolor, Williopsis saturnis и Yarrowia lipolytica.
В другом варианте воплощения, биологический организм представляет собой архебактерии. В следующем варианте воплощения, архебактерии представляют собой Pyrococcus. Еще в одном варианте воплощения, архебактерии представляют собой Pyrococcus furiosus.
Еще в одном варианте воплощения, биологический организм представляет собой бактерии.
В следующем варианте воплощения, бактерии выбраны из группы, включающей Lactobacillus, Pseudomonas, Rhodococcus и Streptomyces.
В следующем варианте воплощения, бактерии выбраны из группы, включающей Lactobacillus reuterii, Pseudomonas methanolica, Rhodococcus erythropolis, Streptomyces griseus, Streptomyces griseolus, Streptomyces platensis и Streptomyces rimosus.
В одном варианте воплощения этого аспекта, биологическая композиция включает Streptomyces rimosus или его фрагмент.
В одном варианте воплощения этого аспекта, биологическая композиция включает растворитель. В следующем варианте воплощения, растворитель включает воду. Еще в одном варианте воплощения, растворитель представляет собой буфер. Еще в одном варианте воплощения, растворитель представляет собой калийфосфатный буфер, имеющий рН около 7.
III. ОБЩИЙ СИНТЕЗ
Соединения формулы 1 можно синтезировать в соответствии со Схемой 1.
На Схеме 1, анилины формулы 3, где R2, R4 и R5 необязательно и независимо замещены функциональными группами, определенными выше, и где эти функциональные группы необязательно и независимо имеют присоединенные к ним защитные группы, подвергают взаимодействию с карбоновокислотными промежуточными соединениями формулы 2 в условиях реакции конденсации. Производные формулы 1, которые имеют присоединенные к ним одну или несколько защитных групп, затем можно подвергнуть процедуре удаления защиты с получением незащищенных производных формулы 1.
Реакцию конденсации, показанную на Схеме 1, можно осуществить путем растворения используемых в реакции веществ в подходящем растворителе, обработки полученного раствора подходящим связывающим реагентом, необязательно в присутствии подходящего основания.
Анилины формулы 3, где R4 представляет собой защищенный 1-гидрокси-2-метилпропан-2-ил, можно синтезировать в соответствии со Схемой 2.


Альтернативно, анилины формулы 3, где R4 представляет собой защищенный 1-гидрокси-2-метилпропан-2-ил, можно синтезировать в соответствии со Схемой 3.


Анилины формулы 3, где R4 и R5 вместе с фенильным кольцом, с которым они связаны, образуют 3,3-диметилбензофуран-2(3H)-он, можно синтезировать в соответствии со Схемой 4.


Альтернативно, анилины формулы 3, где R4 и R5 вместе с фенильным кольцом, с которым они связаны, образуют 3,3-диметилбензофуран-2(3H)-он, можно синтезировать в соответствии со Схемой 5.


Анилины формулы 3, где R5 представляет собой защищенный гидроксил, можно синтезировать в соответствии со Схемой 6.

Дигидрохинолинкарбоновые кислоты формулы 2 можно синтезировать в соответствии со Схемой 7, где анилиновое производное подвергают реакции присоединения конъюгата к EtOCH=C(COOEt)2, с последующей термической перегруппировкой и гидролизом.

IV. ПРИМЕНЕНИЯ И СПОСОБЫ ПРИМЕНЕНИЯ
Фармацевтически приемлемые композиции
В одном аспекте настоящего изобретения, обеспечиваются фармацевтически приемлемые композиции, при этом такие композиции включают любое из соединений, описанных в настоящей заявке, и необязательно включают фармацевтически приемлемый носитель, адъювант или наполнитель. В некоторых вариантах воплощения, эти композиции необязательно дополнительно включают одно или несколько дополнительных терапевтических средств.
Также должно быть понятно, что некоторые соединения по настоящему изобретению могут существовать в свободной форме для лечения или, если это является подходящим, в виде фармацевтически приемлемого производного или его пролекарства. В соответствии с настоящим изобретением, фармацевтически приемлемое производное или пролекарство включает, но не ограничивается этим, фармацевтически приемлемые соли, сложные эфиры, соли таких сложных эфиров или любой другой продукт присоединения или производное, которое при введении пациенту, нуждающемуся в этом, способно обеспечивать, непосредственно или опосредованно, соединение, которое описано в настоящей заявке, или его метаболит или остаток.
Используемые в настоящей заявке, термин "фармацевтически приемлемая соль" относится к тем солям, которые, в соответствии со взвешенной медицинской оценкой, являются подходящими для использования в контакте с тканями человека и низших животных, без чрезмерной токсичности, раздражения, аллергических реакций и т.п., и соизмеримы с разумным соотношением польза/риск. "Фармацевтически приемлемая соль" означает любую нетоксичную соль или соль сложного эфира соединения настоящего изобретения, которая при введении реципиенту способна обеспечивать, либо непосредственно или опосредованно, соединение настоящего изобретения или обладающий ингибиторной активностью метаболит или остаток такого соединения.
Фармацевтически приемлемые соли хорошо известны из уровня техники. Например, S. M. Berge, et al. Подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, который включен в настоящую заявку посредством ссылки. Фармацевтически приемлемые соли соединений настоящего изобретения включают соли, полученные из подходящих неорганических и органических кислот и оснований. Примеры фармацевтически приемлемых нетоксичных кислотно-аддитивных солей включают соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с использованием других способов, используемых в данной области техники, таких как ионообмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, эдисилат (этандисульфонат), этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и подобные. Соли, полученные из подходящих оснований, включают соли щелочных металлов, щелочно-земельных металлов, аммония и N+(C1-4алкил)4. Настоящее изобретение также предусматривает кватернизацию любой основной азот-содержащей группы соединений, раскрытых в настоящей заявке. Водо- или масло-растворимые или диспергируемые продукты можно получить при помощи такой кватернизации. Репрезентативные соли щелочных или щелочно-земельных металлов включают соли натрия, лития, калия, кальция, магния и подобные. Кроме того, фармацевтически приемлемые соли включают, если это является подходящим, нетоксичные катионы аммония, четвертичного аммония и амина, образованные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
Как описано выше, фармацевтически приемлемые композиции по настоящему изобретению дополнительно включают фармацевтически приемлемый носитель, адъювант или наполнитель, который, как это используется в настоящей заявке, включает любой и все растворители, разбавители или другие жидкие носители, вещества, способствующие диспергированию или суспензированию, поверхностно-активные вещества, изотонические агенты, загустители или эмульгаторы, консерванты, твердые связующие, смазывающие вещества и подобные, как это является подходящим для конкретной лекарственной формы, которая является желательной. Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) раскрывает различные носители, используемые для формулирования фармацевтически приемлемых композиций, и известные способы их получения. За исключением только тех случаев, когда какая-либо традиционная среда, используемая в качестве носителя, несовместима с соединениями по настоящему изобретению, например, вызывает какой-либо нежелательный биологический эффект или иначе взаимодействует неблагоприятным образом с любым другим компонентом(компонентами) фармацевтически приемлемой композиции, ее использование предусматривается как охватываемое объемом настоящего изобретения. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, вторичный кислый фосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блок-полимеры, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, масло семян хлопчатника; саффлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, вещества, способствующие высвобождению из формы, вещества покрытий, подсластители, отдушки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композиции, в соответствии с тем, как это сочтет нужным специалист, занимающийся формулированием композиции.
Применения соединений и фармацевтически приемлемые композиции
Еще в одном аспекте настоящее изобретение обеспечивает способ лечения или ослабления тяжести состояния, заболевания или расстройства, связанного с CFTR мутацией. В некоторых вариантах воплощения, настоящее изобретение обеспечивает способ лечения состояния, заболевания или расстройства, связанного с дефицитом CFTR активности, при этом способ включает введение композиции, включающей соединение формулы 1, субъекту, предпочтительно млекопитающему, нуждающемуся в этом.
В другом аспекте, изобретение также обеспечивает способ лечения или ослабления тяжести заболевания у пациента, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке, и указанное заболевание выбрано из таких заболеваний, как кистозный фиброз, астма, вызванное курением COPD (хроническое обструктивное заболевание легких), хронический бронхит, риносинусит, запор, панкреатит, недостаточность функции поджелудочной железы, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыносящих протоков (CBAVD), неосложненная форма легочного заболевания, идиопатический панкреатит, аллергический бронхолегочный аспергиллез (ABPA), заболевание печени, наследственная эмфизема, наследственный гемохроматоз, коагуляционно-фибринолизные недостаточности, такие как дефицит белка С, наследственный ангионевротический отек типа 1, нарушения липидного процессинга, такие как семейная гиперхолестеринемия, хиломикронемия типа 1, абеталипопротеинемия, лизосомальные болезни накопления, такие как болезнь клеточных включений/болезнь Дери, мукополисахаридоз, болезнь Сандгоффа/Тея-Сакса, болезнь Криглера-Найяра типа II, полиэндокринопатия/гиперинсулемия, сахарный диабет, карликовость Ларона, миелопероксидазная недостаточность, первичный гипопаратиреоз, меланома, гликаноз CDG (врожденные заболевания гликозилирования) типа 1, врожденный тиреотоксикоз, несовершенный остеогенез, наследственная гипофибриногенемия, недостаточное активированное время свертывания крови, несахарный диабет (НД), несахарный нейрофизарный диабет, нейрогенный несахарный диабет, мышечная атрофия Шарко-Мари-Тута, болезнь Перлизауса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, атрофия Пика, некоторые полиглутаминовые неврологические расстройства, такие как болезнь Гентингтона, спинально-церебеллярная атаксия типа I, спинальная и бульбарная мышечная атрофия, дентато-рубро-паллидо-льюисова атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (из-за дефекта процессинга прионного белка), болезнь Фабри, синдром Штреусслера-Шейнкера, COPD (хроническое обструктивное заболевание легких), синдром сухих глаз или болезнь Шегрена, остеопороз, остеопения, заживление костей и рост костей (включая восстановление кости, регенерацию костной ткани, снижение резорбции костной ткани и увеличение костных отложений), синдром Горема, хлоридные каналопатии, такие как врожденная миотония (формы Томсона и Бекера), синдром Барттера типа III, болезнь Дента, гиперэкплексия, эпилепсия, гиперэкплексия, лизосомная болезнь накопления, синдром Ангельмана и первичная цилиарная дискинезия (PCD), термин для наследственных нарушений структуры и/или функции реснисчатых структур, включая PCD с транспозицией внутренних органов (также известный как синдром Картагенера), PCD без транспозиции внутренних органов и цилиарная аплазия.
В некоторых вариантах воплощения способ включает лечение или ослабление тяжести кистозного фиброза у пациента, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В некоторых вариантах воплощения, у пациента имеются мутантные формы человеческого CFTR. В других вариантах воплощения, у пациента имеется одна или несколько из следующих мутаций ΔF508, R117H и G551D человеческого CFTR. В одном варианте воплощения, способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR на, по меньшей мере, одном аллеле, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR на обоих аллелях, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR на, по меньшей мере, одном аллеле, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает лечение или ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR на обоих аллелях, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке.
В некоторых вариантах воплощения способ включает ослабление тяжести кистозного фиброза у пациента, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В некоторых вариантах воплощения, у пациента имеются мутантные формы человеческого CFTR. В других вариантах воплощения, у пациента имеется одна или несколько из следующих мутаций ΔF508, R117H и G551D человеческого CFTR. В одном варианте воплощения, способ включает ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR на, по меньшей мере, одном аллеле, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает ослабление тяжести кистозного фиброза у пациента, имеющего ΔF508 мутацию человеческого CFTR на обоих аллелях, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR на, по меньшей мере, одном аллеле, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке. В одном варианте воплощения, способ включает ослабление тяжести кистозного фиброза у пациента, имеющего G551D мутацию человеческого CFTR на обоих аллелях, включающий введение указанному пациенту одной из композиций, определенных в настоящей заявке.
В некоторых аспектах, изобретение обеспечивает способ лечения или ослабления тяжести остеопороза у пациента, включающий введение указанному пациенту соединения Формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения способ лечения или ослабления тяжести остеопороза у пациента включает введение указанному пациенту, по существу, аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В следующих вариантах воплощения, способ лечения или ослабления тяжести остеопороза у пациента включает введение указанному пациенту аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения, способ лечения или ослабления тяжести остеопороза у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
В некоторых аспектах, изобретение обеспечивает способ лечения или ослабления тяжести остеопении у пациента, включающий введение указанному пациенту соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения способ лечения или ослабления тяжести остеопении у пациента включает введение указанному пациенту, по существу, аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В следующих вариантах воплощения, способ лечения или ослабления тяжести остеопении у пациента включает введение указанному пациенту аморфного соединения формулы 1.
В некоторых вариантах воплощения, способ лечения или ослабления тяжести остеопении у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
В некоторых аспектах, изобретение обеспечивает способ заживления кости и/или восстановления кости у пациента, включающий введение указанному пациенту соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения способ заживления кости и/или восстановления кости у пациента включает введение указанному пациенту, по существу, аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В следующих вариантах воплощения, способ заживления кости и/или восстановления кости у пациента включает введение указанному пациенту аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения, способ заживления кости и/или восстановления кости у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
В некоторых аспектах, изобретение обеспечивает способ снижения резорбции костной ткани у пациента, включающий введение указанному пациенту соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения способ снижения резорбции костной ткани у пациента включает введение указанному пациенту, по существу, аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В следующих вариантах воплощения, способ снижения резорбции костной ткани у пациента включает введение указанному пациенту аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых аспектах, изобретение обеспечивает способ увеличения костных отложений у пациента, включающий введение указанному пациенту соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения способ увеличения костных отложений у пациента включает введение указанному пациенту, по существу, аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В следующих вариантах воплощения, способ увеличения костных отложений у пациента включает введение указанному пациенту аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения, способ увеличения костных отложений у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
В некоторых аспектах, изобретение обеспечивает способ лечения или ослабления тяжести COPD у пациента, включающий введение указанному пациенту соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения способ лечения или ослабления тяжести COPD у пациента включает введение указанному пациенту, по существу, аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В следующих вариантах воплощения, способ лечения или ослабления тяжести COPD у пациента включает введение указанному пациенту аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения, способ лечения или ослабления тяжести COPD у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
В некоторых аспектах, изобретение обеспечивает способ лечения или ослабления тяжести вызванного курением COPD у пациента, включающий введение указанному пациенту соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения способ лечения или ослабления тяжести вызванного курением COPD у пациента включает введение указанному пациенту, по существу, аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В следующих вариантах воплощения, способ лечения или ослабления тяжести вызванного курением COPD у пациента включает введение указанному пациенту аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения, способ лечения или ослабления тяжести вызванного курением COPD у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
В некоторых аспектах, изобретение обеспечивает способ лечения или ослабления тяжести хронического бронхита у пациента, включающий введение указанному пациенту соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения способ лечения или ослабления тяжести хронического бронхита у пациента включает введение указанному пациенту, по существу, аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В следующих вариантах воплощения, способ лечения или ослабления тяжести хронического бронхита у пациента включает введение указанному пациенту аморфного соединения формулы 1 или его фармацевтически приемлемой соли.
В некоторых вариантах воплощения, способ лечения или ослабления тяжести хронического бронхита у пациента включает введение указанному пациенту фармацевтической композиции, описанной в настоящей заявке.
В соответствии с альтернативным вариантом воплощения, настоящее изобретение обеспечивает способ лечения кистозного фиброза, включающий стадию введения указанному млекопитающему эффективного количества композиции, включающей соединение по настоящему изобретению.
В соответствии с настоящим изобретением "эффективное количество" соединения или фармацевтически приемлемой композиции представляет собой такое количество, которое является эффективным для лечения или ослабления тяжести одного или нескольких заболеваний, расстройств или состояний, указанных выше.
Другой аспект настоящего изобретения обеспечивает способ введения фармацевтической композиции путем перорального введения пациенту, по меньшей мере, один раз в день, композиции, включающей соединение формулы 1. В одном варианте воплощения, способ включает введение фармацевтической композиции, включающей соединение формулы 1, через каждые 24 часа. Еще в одном варианте воплощения, способ включает введение фармацевтической композиции, включающей соединение формулы 1, через каждые 12 часов. В следующем варианте воплощения, способ включает введение фармацевтической композиции, включающей соединение формулы 1, три раза в день. Еще в одном варианте воплощения, способ включает введение фармацевтической композиции, включающей соединение формулы 1, через каждые 4 часа.
Соединения и композиции, в соответствии со способом по настоящему изобретению, можно вводить с использованием любого количества и любого пути введения, эффективного для лечения или ослабления тяжести одного или нескольких из заболеваний, расстройств или состояний, указанных выше.
В некоторых вариантах воплощения, соединения и композиции по настоящему изобретению являются полезными для лечения или ослабления тяжести кистозного фиброза у пациентов, которые демонстрируют остаточную CFTR активность в апикальной мембране ткани респираторного и нереспираторного эпителия. Присутствие остаточной CFTR активности на поверхности эпителия можно легко определить при помощи способов, известных из уровня техники, например, стандартными электрофизиологическими, биохимическими или гистохимическими методами. Такими способами определяют CFTR активность с использованием in vivo или ex vivo электрофизиологических методов, измерения Cl- концентраций в выделениях потных или слюнных желез или с использованием ex vivo биохимических или гистохимических методов для контроля плотности клеточной поверхности. С использованием таких способов можно легко определить остаточную CFTR активность у пациентов гетерозиготных или гомозиготных для различных мутаций, включая пациентов гомозиготных или гетерозиготных для наиболее распространенной мутации ΔF508.
Еще в одном варианте воплощения, соединения и композиции по настоящему изобретению являются полезными для лечения или ослабления тяжести кистозного фиброза у пациентов, которые имеют остаточную CFTR активность, индуцируемую или усиливаемую с использованием фармакологических способов или генной терапии. Такие способы повышают количество CFTR, присутствующего на клеточной поверхности, индуцируя таким образом отсутствующую до этого CFTR активность у пациента или повышая существующий уровень остаточной CFTR активности у пациента.
В одном варианте воплощения, соединения и композиции по настоящему изобретению являются полезными для лечения или ослабления тяжести кистозного фиброза у пациентов в рамках определенных генотипов, демонстрирующих остаточную CFTR активность, например, мутации класса III (нарушение регуляции или воротного механизма), мутации класса IV (изменение проводимости) или мутации класса V (уменьшение синтеза) (Lee R. Choo-Kang, Pamela L., Zeitlin, Type I, II, III, IV and V cystic fibrosis Transmembrane Conductance Regulator Defects and Opportunities of Therapy; Current Opinion in Pulmonary Medicine 6:521 - 529, 2000). Другие генотипы пациентов, которые демонстрируют остаточную CFTR активность, включают пациентов гомозиготных для одного из этих классов или гетерозиготных с любым другим классом мутаций, включая мутации класса I, мутации класса II или мутации, которые не классифицированы.
В одном варианте воплощения, соединения и композиции по настоящему изобретению являются полезными для лечения или ослабления тяжести кистозного фиброза у пациентов в пределах определенных клинических фенотипов, например, от средней тяжести до легкой формы клинического фенотипа, который типично соотносится с количеством остаточной CFTR активности в апикальной мембране эпителиальных тканей. Такие фенотипы включают пациентов, демонстрирующих недостаточность функции поджелудочной железы, или пациентов, у которых диагностирован идиопатический панкреатит и врожденное двустороннее отсутствие семявыносящих протоков или легкая форма легочного заболевания.
Точное количество, которое необходимо, будет разным для разных субъектов, в зависимости от конкретного вида, возраста и общего состояния субъекта, тяжести инфекции, конкретного средства, способа его введения и т.п. Соединения по настоящему изобретению предпочтительно формулируют в лекарственную форму, содержащую стандартные единицы дозирования, для простоты введения и равномерного дозирования. Выражение "стандартные единицы дозирования", используемое в настоящей заявке, относится к физически дискретной единице средства, подходящего для пациента, подлежащего лечению. Однако должно быть понятно, что общий суточный прием соединений и композиций по настоящему изобретению определяет лечащий врач в соответствии с взвешенной медицинской оценкой. Конкретный уровень эффективной дозы для любого конкретного пациента или организма будет зависеть от различных факторов, включая расстройство, подлежащее лечению, и тяжесть этого расстройства; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, пути введения и скорость выведения из организма конкретного используемого соединения; продолжительность лечения; лекарственные средства, используемые в сочетании или случайно с конкретным используемым соединением и подобные факторы, хорошо известные в медицине. Термин "пациент", как он используется в настоящей заявке, означает животное, предпочтительно - млекопитающего, и наиболее предпочтительно - человека.
Фармацевтически приемлемые композиции по настоящему изобретению можно вводить человеку и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местным путем (например, в виде порошков, мазей, капель или пластыря), буккально, в виде перорального или назального спрея или т.п., в зависимости от тяжести инфекции, подлежащей лечению. В некоторых вариантах воплощения, соединения по настоящему изобретению можно вводить перорально или парентерально при дозах на уровне от около 0,01 мг/кг до около 50 мг/кг и предпочтительно от около 0,5 мг/кг до около 25 мг/кг массы тела субъекта в день, один или несколько раз в день, для получения желаемого терапевтического эффекта.
Жидкие лекарственные формы для перорального введения включают, но не ограничиваются этим, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активного соединения, жидкие лекарственные формы могут содержать инертные разбавители, традиционно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, масло семян хлопчатника, арахисовое масло, кукурузное масло, масло из проростков семян, оливковое масло, касторовое масло и кунжутное масло), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана, и их смеси. Помимо инертных разбавителей, пероральные композиции также могут включать адъюванты, такие как смечивающие вещества, эмульгаторы и суспендирующие вещества, подсластители, отдушки и ароматизаторы.
Препараты для инъекций, например, стерильные водные растворы или масляные суспензии для инъекций, можно сформулировать в соответствии с известными из уровня техники способами с использованием подходящих диспергирующих или смечивающих веществ и суспендирующих веществ. Стерильный препарат для инъекций также может представлять собой стерильный раствор, суспензию или эмульсию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Из приемлемых наполнителей и растворителей, которые можно использовать, можно указать воду, раствор Рингера U. S. P. и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла традиционно используют в качестве растворителя или среды для суспендирования. Для этих целей можно использовать любое светлое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в препаратах для инъекций используют жирные кислоты, такие как олеиновая кислота.
Композиции для инъекций можно стерилизовать, например, путем фильтрования через удерживающий бактерии фильтр или путем включения стерилизующих веществ в форме стерильных твердых композиций, которые можно растворить или диспергировать в стерильной воде или другой стерильной среде для инъекций перед использованием.
Для пролонгирования эффекта соединения по настоящему изобретению, часто желательно замедлить абсорбцию соединения из подкожной или интрамышечной инъекции. Это можно осуществить с использованием жидкой суспензии кристаллического или аморфного вещества с плохой водо-растворимостью. Скорость абсорбции соединения в этом случае зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленную абсорбцию парентерально вводимой формы соединения получают путем растворения или суспендирования соединения в масляном наполнителе. Депо формы для инъекций получают путем образования матриц для микроинкапсулирования соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения с полимерами и природы конкретного используемого полимера, можно контролировать скорость высвобождения соединения. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Композиции депо препаратов для инъекций также получают путем заключения соединения в липосомы или микроэмульсии, которые совместимы с тканями организма.
Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые можно получить путем смешивания соединения по настоящему изобретению с подходящими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но являются жидкими при температуре тела, и поэтому плавятся в прямой кишке или вагинальной полости и высвобождают активное соединение.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано с, по меньшей мере, одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или вторичный кислый фосфат кальция и/или a) наполнителями или объемными веществами, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и аравийская камедь, c) увлажнителями, такими как глицерин, d) разрыхлителями, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедляющими растворение веществами, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими веществами, такими как, например, цетиловый спирт и глицеринмоностеарат, h) абсорбентами, такими как каолиновая и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и смесями таких веществ. В случае капсул, таблеток и пилюль, лекарственная форма также может включать буферные вещества.
Твердые композиции подобного типа также можно использовать в качестве наполнителей, заключенных в мягкие и твердые желатиновые капсулы, с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобные. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области фармацевтического формулирования. Они необязательно содержат светонепроницаемые агенты, и также могут иметь такую композицию, которая делает возможным высвобождение активного ингредиента(ингредиентов), только или предпочтительно, в определенной части пищеварительного тракта, необязательно замедленным образом. Примеры композиций инкапсулирующих веществ, которые можно использовать, включают полимерные вещества и воски. Твердые композиции подобного типа также можно использовать в качестве наполнителей, заключенных в мягкие и твердые желатиновые капсулы, с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобные.
Активные соединения также могут быть в микроинкапсулированной форме с одним или несколькими эксципиентами, как указано выше. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, контролирующие высвобождение покрытия и другие покрытия, хорошо известные в области фармацевтического формулирования. В таких твердых лекарственных формах активное соединение может быть смешано с, по меньшей мере, одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы также могут включать, как это имеет место в обычной практике, дополнительные вещества, отличные от инертных разбавителей, например, смазывающие вещества для таблетирования и другие вспомогательные вещества для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, такие лекарственные формы также могут включать буферные вещества. Они необязательно содержат светонепроницаемые агенты, и также могут иметь такую композицию, которая делает возможным высвобождение активного ингредиента(ингредиентов), только или предпочтительно, в определенной части пищеварительного тракта, необязательно замедленным образом. Примеры композиций инкапсулирующих веществ, которые можно использовать, включают полимерные вещества и воски.
Лекарственные формы для введения местным или чрескожным путем соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, препараты для ингаляций или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, которые могут для этого потребоваться. Глазные препараты, ушные капли и глазные капли также предусматриваются как охватываемые объемом настоящего изобретения. Кроме того, настоящее изобретение предусматривает использование чрескожных пластырей, которые имеют дополнительное преимущество, обеспечивая контролируемую доставку соединения в организм. Такие лекарственные формы получают путем растворения или диспергирования соединения в подходящей среде. Также можно использовать усилители абсорбции, используемые для усиления проникновения соединения через кожу. Скорость можно контролировать либо путем обеспечения контролирующей скорость мембраны, либо путем диспергирования соединения в полимерной матрице или геле.
Анализ активности соединения, используемого в настоящем изобретении в качестве модулятора CFTR, можно осуществить в соответствии со способами, в общем описанными в известном уровне техники и в Примерах, представленных в настоящей заявке.
Также должно быть понятно, что соединения и фармацевтически приемлемые композиции по настоящему изобретению можно использовать в комбинированной терапии, то есть соединения и фармацевтически приемлемые композиции можно вводить одновременно с введением, до или после введения одного или нескольких других желательных терапевтических средств или медицинских процедур. Конкретные комбинированные терапии (терапевтические средства или процедуры) для использования в комбинированной схеме лечения должны учитывать совместимость желаемых терапевтических средств и/или процедур и желаемого терапевтического эффекта, достижение которого необходимо. Также должно быть понятно, что используемые терапии могут достигать желаемого эффекта при одном и том же расстройстве (например, соединение по настоящему изобретению можно вводить одновременно с другим средством, используемым для лечения этого же расстройства), или они могут быть предназначены для достижения разных эффектов (например, контроль любых побочных эффектов). Как это используется в настоящей заявке, дополнительные терапевтические средства, которые обычно вводят для лечения или профилактики определенного заболевания или состояния, известны как "подходящие для заболевания или состояния, подлежащего лечению".
В одном варианте воплощения, дополнительное средство выбрано из муколитического средства, бронходилататора, антибиотика, противоинфекционного средства, противоивоспалительного средства, модулятора CFTR, отличного от соединения по настоящему изобретению, или питательного вещества.
В одном варианте воплощения, дополнительное средство представляет собой антибиотик. Примеры антибиотиков, полезных в настоящем изобретении, включают тобрамицин, включая тобрамицин в виде порошка для ингаляции (TIP), азитромицин, азтреонам, включая аэрозольную форму азтреонама, амикацин, включая его липосомальную композицию, ципрофлоксацин, включая его композицию, подходящую для введения путем ингаляции, левофлаксацин, включая его аэрозольную композицию, и сочетания двух антибиотиков, например, фосфомицина и тобрамицина.
Еще в одном варианте воплощения, дополнительное средство представляет собой муколитическое средство. Примеры муколитических средств, полезных в настоящем изобретении, включают Pulmozyme®.
Еще в одном варианте воплощения, дополнительное средство представляет собой бронходилататор. Пример бронходилататоров включают албутерол, метапротенерол сульфат, пирбутерол ацетат, салметерол или тетрабулин сульфат.
Еще в одном варианте воплощения, дополнительное средство является эффективным для восстановления поверхностной жидкости в дыхательных путях в легких. Такие средства улучшают перемещение соли в клетки и из клеток, делая слизь в дыхательных путях в легких более гидратированной, поэтому они более легко выводятся. Примеры таких средств включают гипертонический солевой раствор, денуфозол тетранатрий ([[(3S,5R)-5-(4-амино-2-оксопиримидин-1-ил)-3-гидроксиоксолан-2-ил]метоксигидроксифосфорил][[[(2R,3S,4R,5R)-5-(2,4-диоксопиримидин-1-ил)-3,4-дигидроксиоксолан-2-ил]метоксигидроксифосфорил]оксигидроксифосфорил]гидрофосфат) или бронхитол (препарат для ингаляций на основе маннита).
Еще в одном варианте воплощения, дополнительное средство представляет собой противовоспалительное средство, т.е. средство, которое может уменьшать воспаление в легких. Примеры таких средств, полезных в настоящем изобретении, включают ибупрофен, докозагексановую кислоту (DHA), силденафил, глутатион для ингаляций, пиоглитазон, гидроксихлорохин или симавастатин.
Еще в одном варианте воплощения, дополнительное средство представляет собой модулятор CFTR, отличный от соединения 1, т.е. средство, которое обладает эффектом модулирования CFTR активности. Примеры таких средств включают аталурен ("PTC 124®"; 3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]бензойная кислота), синапултид, ланковутид, депелестат (человеческий рекомбинантный ингибитор эластазы нейтрофилов), кобипростон (7-{(2R,4aR,5R,7aR)-2-[(3S)-1,1-дифтор-3-метилпентил]-2-гидрокси-6-оксооктагидроциклопента[b]пиран-5-ил}гептановая кислота) или (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойная кислота. Еще в одном варианте воплощения, дополнительное средство представляет собой (3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойную кислоту.
Еще в одном варианте воплощения, дополнительное средство представляет собой питательное вещество. Примеры таких веществ включают панкрелипазу (заместитель панкреатических ферментов), включая Pancrease®, Pancreacarb®, Ultrase® или Creon®, Liprotomase® (прежнее название Trizytek®), Aquadeks®, или глутатион для ингаляций. В одном варианте воплощения, дополнительное питательное вещество представляет собой панкрелипазу.
Количество дополнительного терапевтического средства, присутствующего в композиции по настоящему изобретению, не должно превышать количество, являющееся нормально возможным для введения в композици, включающей такое терапевтическое средство в качестве единственного активного вещества. Предпочтительно, количество дополнительного терапевтического средства в композициях, раскрытых в настоящем изобретении, должно находиться в пределах от около 50% до 100% от количества, являющегося нормально возможным для введения в композици, включающей такое терапевтическое средство в качестве единственного активного вещества.
Соединения по настоящему изобретению или содержащие их фармацевтически приемлемые композиции также могут быть включены в композиции для покрытия имплантируемых медицинских устройств, таких как протезы, искусственные клапаны, сосудистые трансплантаты, стенты и катетеры. Соответственно, настоящее изобретение, еще в одном аспекте, включает композицию для покрытия имплантируемого устройства, включающую соединение по настоящему изобретению, описанное в целом выше и в классах и подклассах, описанных в настоящей заявке, и носитель, подходящий для покрытия указанного имплантируемого устройства. Еще в одном аспекте настоящее изобретение включает имплантируемое устройство с покрытием, имеющим композицию, включающую соединение по настоящему изобретению, описанное в целом выше и в классах и подклассах, описанных в настоящей заявке, и носитель, подходящий для покрытия указанного имплантируемого устройства. Подходящие покрытия и общее описание получения имеющих покрытия имплантируемых устройств можно найти в патентах США №№ 6099562; 5886026; и 5304121. Покрытия типично представляют собой биосовместимые полимерные вещества, такие как полимерные гидрогели, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. Покрытия, необязательно, могут быть дополнительно покрыты подходящим верхним слоем из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их сочетаний для придания композиции характеристик контролируемого высвобождения.
Другой аспект настоящего изобретения относится к модулированиию активности CFTR в биологическом образце или у пациента (например, in vitro или in vivo), при этом способ включает введение пациенту или контактирование указанного биологического образца с соединением формулы 1 или композицией, включающей указанное соединение. Термин "биологический образец", используемый в настоящей заявке, включает, без ограничения, клеточные культуры или их экстракты; материал биопсии, полученный от млекопитающего, или его экстракты; и кровь, слюну, мочу, кал, семенную жидкость, слезы или другие жидкости организма, или их экстракты.
Модуляция CFTR в биологическом образце является полезной для различных целей, которые известны специалистам в данной области. Примеры таких целей включают, но не ограничиваются этим, исследование CFTR в биологических и патологических явлениях; и сравнительную оценку новых модуляторов CFTR.
В следующем варианте воплощения, обеспечивается способ модулирования активности анионного канала in vitro или in vivo, включающий стадию контактирования указанного канала с соединением формулы 1. В вариантах воплощения, анионный канал представляет собой хлоридный канал или бикарбонатный канал. В других вариантах воплощения, анионный канал представляет собой хлоридный канал.
В соответствии с альтернативным вариантом воплощения, настоящее изобретение обеспечивает способ увеличения количества функционального CFTR в мембране клетки, включающий стадию контактирования указанной клетки с соединением формулы 1.
В соответствии с другим вариантом воплощения, активность CFTR определяют путем измерения трансмембраного потенциала. Средства для измерения потенциала через мембрану в биологическом образце могут включать любой из способов, известных из уровня техники, такой как оптический анализ мембранного потенциала или другие электрофизиологические методы.
Оптический анализ мембранного потенциала включает использование потенциал-чувствительных FRET сенсоров, описанных Gonzalez и Tsien (см. Gonzalez, J. E. and R. Y. Tsien (1995) "Voltage sensing by fluorescence resonance energy transfer in single cells." Biophys J 69(4): 1272-80 ; Gonzalez, J. E. and R. Y. Tsien (1997); "Improved indicators of cell membrane potential that use fluorescence resonance energy transfer" Chem Biol 4(4): 269-77), в сочетании со средствами измерения изменений флуоресценции, такими как Voltage/Ion Probe Reader (VIPR) (см. Gonzalez, J. E., K. Oades, et al. (1999) "Cell-based assays and instrumentation for screening ion-channel targets" Drug Discov Today 4(9): 431-439).
Эти потенциал-чувствительные анализы основаны на изменении передачи резонансной энергии флуоресценции (FRET) между мембрано-растворимым потенциал-чувствительным красителем, DiSBAC2(3) и флуоресцентным фосфолипидом, CC2-DMPE, который присоединен к внешней створке плазматической мембраны и действует в качестве FRET донора. Изменения мембранного потенциала (Vm) вызывают редистрибуцию отрицательно заряженного DiSBAC2(3) через плазматическую мембрану и количество передаваемой энергии от CC2-DMPE соответственно изменяется. Изменения эмиссии флуоресценции можно отслеживать с использованием VIPR™ II, который представляет собой интегрированное устройство подачи жидкости и детектор флуоресценции, предназначенное для осуществления клеточных скрининговых анализов в 96- или 384-луночных микротитровальных планшетах.
В одном варианте воплощения, настоящее изобретение обеспечивает способ модулирования CFTR активности в биологическом образце, включающий стадию контактирования указанного биологического образца с соединением формулы 1 или его фармацевтически приемлемой солью, где R1, R2, R3, R4 и Y имеют значение, определенное выше.
В одном варианте воплощения, настоящее изобретение обеспечивает способ модулирования CFTR активности в биологическом образце, включающий стадию контактирования указанного биологического образца с соединением, полученным способами, описанными в настоящей заявке, имеющим структуру:

или его фармацевтически приемлемой солью.
В одном варианте воплощения, настоящее изобретение обеспечивает способ модулирования CFTR активности в биологическом образце, включающий стадию контактирования указанного биологического образца с соединением, полученным способами, описанными в настоящей заявке, имеющим структуру:

или его фармацевтически приемлемой солью.
В одном варианте воплощения, настоящее изобретение обеспечивает способ модулирования CFTR активности в биологическом образце, включающий стадию контактирования указанного биологического образца с соединением, полученным способами, описанными в настоящей заявке, имеющим структуру:

или его фармацевтически приемлемой солью.
В одном варианте воплощения, настоящее изобретение обеспечивает способ лечения или ослабления тяжести заболевания у пациента, включающий введение указанному пациенту эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли, где R1, R2, R3, R4 и Y имеют значение, определенное выше, и указанное заболевание выбрано из следующих: кистозный фиброз, астма, вызванное курением COPD (хроническое обструктивное заболевание легких), хронический бронхит, риносинусит, запор, панкреатит, недостаточность функции поджелудочной железы, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыносящих протоков (CBAVD), неосложненная форма легочного заболевания, идиопатический панкреатит, аллергический бронхолегочный аспергиллез (ABPA), заболевание печени, наследственная эмфизема, наследственный гемохроматоз, коагуляционно-фибринолизные недостаточности, такие как дефицит белка С, наследственный ангионевротический отек типа 1, нарушения липидного процессинга, такие как семейная гиперхолестеринемия, хиломикронемия типа 1, абеталипопротеинемия, лизосомальные болезни накопления, такие как болезнь клеточных включений/болезнь Дери, мукополисахаридоз, болезнь Сандгоффа/Тея-Сакса, болезнь Криглера-Найяра типа II, полиэндокринопатия/гиперинсулемия, сахарный диабет, карликовость Ларона, миелопероксидазная недостаточность, первичный гипопаратиреоз, меланома, гликаноз CDG (врожденные заболевания гликозилирования) типа 1, врожденный тиреотоксикоз, несовершенный остеогенез, наследственная гипофибриногенемия, недостаточное активированное время свертывания крови, несахарный диабет (НД), несахарный нейрофизарный диабет, нейрогенный несахарный диабет, мышечная атрофия Шарко-Мари-Тута, болезнь Перлизауса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий супрануклеарный паралич, атрофия Пика, некоторые полиглутаминовые неврологические расстройства, так как болезнь Гентингтона, спинально-церебеллярная атаксия типа I, спинальная и бульбарная мышечная атрофия, дентато-рубро-паллидо-льюисова атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (из-за дефекта процессинга прионного белка), болезнь Фабри, синдром Штреусслера-Шейнкера, COPD (хроническое обструктивное заболевание легких), синдром сухих глаз или болезнь Шегрена.
В одном варианте воплощения, способ включает лечения или ослабления тяжести заболевания у пациента путем введения указанному пациенту эффективного количества соединения, полученного способами, описанными в настоящей заявке, имеющего структуру:

или его фармацевтически приемлемой соли.
В одном варианте воплощения, способ включает лечения или ослабления тяжести заболевания у пациента путем введения указанному пациенту эффективного количества соединения, полученного способами, описанными в настоящей заявке, имеющего структуру:

или его фармацевтически приемлемой соли.
Еще в одном варианте воплощения, способ включает лечения или ослабления тяжести заболевания у пациента путем введения указанному пациенту эффективного количества соединения, полученного способами, описанными в настоящей заявке, имеющего структуру:

или его фармацевтически приемлемой соли.
В другом аспекте настоящее изобретение обеспечивает набор для использования в измерении активности CFTR или его фрагмента в биологическом образце in vitro или in vivo, включающий (i) композицию, включающую соединение формулы 1 или любой из описанных выше вариантов воплощения; и (ii) инструкции для a) контактирования композиции с биологическим образцом, и b) измерения активности указанного CFTR или его фрагмента.
В одном варианте воплощения, набор дополнительно включает инструкции для a) контактирования дополнительной композиции с биологическим образцом; b) измерение активности указанного CFTR или его фрагмента в присутствии указанного дополнительного соединения, и c) сравнение активности CFTR в присутствии дополнительного соединения с плотностью CFTR в присутствии композиции формулы 1.
В вариантах воплощения, набор используют для измерения плотности CFTR.
В одном варианте воплощения, набор включает композицию, включающую соединение, полученное способами, описанными в настоящей заявке, имеющее структуру:

или его фармацевтически приемлемую соль.
В одном варианте воплощения, набор включает композицию, включающую соединение, полученное способами, описанными в настоящей заявке, имеющее структуру:

или его фармацевтически приемлемую соль.
В некоторых вариантах воплощения набор включает композицию, включающую соединение, полученное способами, описанными в настоящей заявке, имеющее структуру:

или его фармацевтически приемлемую соль.
Для более полного раскрытия изобретения, описанного в настоящей заявке, далее представлены следующие примеры. Должно быть понятно, что эти примеры предназначены только для иллюстративных целей и не должны рассматриваться как ограничивающие каким-либо образом настоящее изобретение.
V. ПРИМЕРЫ
Получение 1: Общий синтез 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (26)

Процедура получения этил 4-оксо-1,4-дигидрохинолин-3-карбоксилата (25)

Соединение 23 (4,77 г, 47,7 ммоль) по каплям добавляли к соединению 22 (10 г, 46,3 ммоль) с подповерхностным потоком N2 для вытеснения этанола при температуре ниже 30°C в течение 0,5 часов. Затем раствор нагревали до 100-110°C и перемешивали в течение 2,5 часов. После охлаждения смеси до температуры ниже 60°C добавляли дифениловый эфир. Полученный раствор по каплям добавляли в дифениловый эфир, который был нагрет до 228-232°C, в течение 1,5 часов с подповерхностным потоком N2 для вытеснения этанола. Смесь перемешивали при 228-232°C в течение дополнительных 2 часов, охлаждали до температуры ниже 100°C и затем к осадку продукта добавляли гептан. Полученную суспензию перемешивали при 30°C в течение 0,5 часов. Твердые вещества затем фильтровали и осадок промывали гептаном и сушили в вакууме с получением соединения 25 в виде коричневого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 12,25 (с), δ 8,49 (д), δ 8,10 (м), δ 7,64 (м), δ 7,55 (м), δ 7,34 (м), δ 4,16 (кв), δ 1,23 (т).
Процедура получения 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (26)

Способ 1
Соединение 25 (1,0 экв.) суспендировали в растворе HCl (10,0 экв.) и H2O (11,6 об.). Суспензию нагревали до 85-90°C, хотя альтернативные температуры также подходят для этой стадии гидролиза. Например, гидролиз альтернативно можно осуществлять при температуре от около 75 до около 100°C. В некоторых случаях гидролиз осуществляют при температуре от около 80 до около 95°C. В иных случаях стадию гидролиза осуществляют при температуре от около 82 до около 93°C (например, от около 82,5 до около 92,5°C, или от около 86 до около 89°C). После перемешивания при 85-90°C в течение приблизительно 6,5 часов отбирали пробы реакционной смеси для определения завершения реакции. Перемешивание можно осуществлять при любых температурах, подходящих для реакции гидролиза. Раствор затем охлаждали до 20-25°C и фильтровали. Реактор/осадок промывали при помощи H2O (2 об. ×2). Осадок затем промывали при помощи 2 об. H2O до достижения уровня pH≥3,0. Осадок затем сушили в вакууме при 60°C с получением соединения 26.
Способ 2
Соединение 25 (11,3 г, 52 ммоль) добавляли к смеси 10% NaOH (водный раствор) (10 мл) и этанола (100 мл). Раствор нагревали до температуры кипения с обратным холодильником в течение 16 часов, охлаждали до 20-25°C и затем уровень pH доводили до 2-3 при помощи 8% раствора HCl. Смесь затем перемешивали в течение 0,5 часов и фильтровали. Осадок промывали водой (50 мл) и затем сушили в вакууме с получением соединения 26 в виде коричневого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 15,33 (с), δ 13,39 (с), δ 8,87 (с), δ 8,26 (м), δ 7,87 (м), δ 7,80 (м), δ 7,56 (м).
Пример 1: Общий синтез N-(2-трет-бутил-5-гидрокси-4-(1-гидрокси-2-метилпропан-2-ил)фенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (27)
Общая схема синтеза соединения 27 представлена ниже, с последующими процедурами синтеза каждого промежуточного соединения, полученного в результате синтеза.

Процедура получения 2-гидрокси-5-трет-бутилбензальдегида (2)

К перемешиваемому раствору соединения 1 (700 г, 4,66 моль) в CH3CN (7,0 л) добавляли MgCl2 (887 г, 9,32 моль), пара-формальдегид (1190 г) и TEA (2,5 л, 17,9 моль) в атмосфере N2. Смесь нагревали до температуры кипения с обратным холодильником в течение 5 часов. После охлаждения до комнатной температуры к смеси добавляли 2 л ледяной воды, с последующим добавлением 6 л 3 M раствора HCl (водный раствор). Суспензию оставляли при перемешивании до тех пор, пока раствор не становился прозрачным. Органический слой отделяли и водный слой экстрагировали при помощи MTBE (3 л ×3). Органические слои объединяли и концентрировали досуха. Остаток растворяли в MTBE (4000 мл), промывали водой (1000 мл ×2) и насыщенным солевым раствором (1000 мл), сушили над безводным Na2SO4, фильтровали, затем концентрировали с получением соединения 2 в виде светло-желтого твердого вещества, которое использовали в следующей реакции без дополнительной сушки или очистки.1H ЯМР (CDCl3; 400 МГц) δ 10,86 (с), δ 9,89 (с), δ 7,59 (м), δ 7,51 (д), δ 6,94 (д), δ 10,61 (с).
Процедура получения 2-(бензилокси)-5-трет-бутилбензальдегида (3)

К перемешиваемому раствору соединения 2 (614,5 г, 3,33 моль) в ДМФА (3,5 л) добавляли K2CO3 (953 г, 6,90 моль) и бензилхлорид (480 г, 3,80 моль). Смесь нагревали до 90°C и оставляли при перемешивании в течение 3 часов. Суспензию охлаждали до комнатной температуры, затем добавляли MTBE (2 л), с последующим добавлением воды (12 л). Смесь затем перемешивали в течение 10 минут и водный слой отделяли и экстрагировали при помощи MTBE (2 л ×3). Органические слои объединяли и промывали водой (2 л ×2) и насыщенным солевым раствором (1,5 л × 1) и концентрировали с получением соединения 3 в виде светло-желтого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 10,42 (с), δ 7,71 (м), δ 7,51 (м), δ 7,43 (м), δ 7,35 (м), δ 7,24 (м), δ 5,27 (с), δ 1,26 (с).
Процедура получения 2-(бензилокси)-5-трет-бутилбензилового спирта (4)

К перемешиваемой суспензии соединения 3 (974 г, 3,63 моль) в MeOH (4000 мл) медленно добавляли NaBH4 (121 г, 3,20 моль) при температуре 0-20°C. Раствор оставляли при перемешивании при температуре 15°C в течение 3 часов и затем охлаждали до 0°C. По каплям добавляли 2N раствор HCl (водный раствор) (1300 мл) при температуре ниже 20°C. Раствор затем фильтровали и упаривали досуха и остаток растворяли в MTBE (5 л). Раствор затем промывали водой (2 л ×2) и насыщенным солевым раствором (1,5 л ×1). Выпаривание растворителя давало соединение 4 в виде светло-желтого твердого вещества, которое использовали на следующей стадии реакции без дополнительной очистки.1H ЯМР (DMCO-d6; 400 МГц) δ 7,40 (м), δ 7,32 (м), δ 7,17 (м), δ 6,91 (м), δ 5,09 (с), δ 5,00 (т), δ 4,56 (д), δ 1,26 (с).
Процедура получения 2-(бензилокси)-5-трет-бутилбензилхлорида (5)

К перемешиваемому раствору соединения 4 (963 г, 3,56 моль) в безводном ДХМ (2000 мл) при 0°C медленно добавляли SOCl2 (535 г, 4,5 моль). Смесь перемешивали при 20°C в течение 2 часов, затем концентрировали в вакууме с получением соединения 5 в виде масла, которое использовали в следующей реакции без дополнительной сушки или очистки.
Процедура получения 2-(бензилокси)-5-трет-бутилбензилнитрила (6)

К перемешиваемому раствору соединения 5 (1045 г, 3,54 моль) в безводном ДМФА (1000 мл) добавляли KCN (733 г, 11,3 моль). Смесь перемешивали при 35°C в течение 24 часов, затем выливали в воду (10 л). Добавляли этилацетат (4 л) и смесь перемешивали в течение 30 минут. Органический слой затем отделяли и водный слой экстрагировали этилацетатом (3000 мл ×2). Органические слои объединяли и промывали водой (4 л ×2) и насыщенным солевым раствором (3 л ×1), затем концентрировали в вакууме с получением соединения 6 в виде желтого твердого вещества.1Н ЯМР (DMCO-d6; 400 МГц) δ 7,51 (м), δ 7,37 (м), 7,02 (д), δ 5,17 (с), δ 3,88 (с), 1,26 (с).
Процедура получения 2-(2-(бензилокси)-5-трет-бутилфенил)-2-метилпропаннитрила (7)

К перемешиваемой суспензии NaH (86 г, 2,15 моль, 60% в минеральном масле) в ДМФА (1000 мл) по каплям добавляли раствор соединения 6 (100,0 г, 0,358 моль) в ДМФА (500 мл) при 20°C. После перемешивания в течение 30 минут, по каплям добавляли MeI (205 г, 1,44 моль) в ДМФА (500 мл) при температуре ниже 30°C в течение 2 часов. Суспензию перемешивали в течение 1,5 часов при температуре 25-30°C, затем медленно добавляли лед (100 г) до тех пор, пока не прекращалось выделение газа. Уровень pH доводили до приблизительно 7 путем медленного добавления 2N раствора HCl. Смесь разбавляли водой (4 л) и MTBE (2 л). Органический слой отделяли и водный слой экстрагировали при помощи MTBE (500 мл ×2). Объединенные органические слои промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и затем концентрировали в вакууме с получением соединения 7 в виде белого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 7,56 (м), δ 7,40 (м), δ 7,34 (м), δ 7,10 (д), δ 5,21 (с), δ 1,73 (с), δ 1,27 (с).
Процедура получения 2-(2-(бензилокси)-5-трет-бутилфенил)-2-метилпропаналя (8)

К перемешиваемому раствору соединения 7 (20 г, 0,065 моль) в толуоле (300 мл) по каплям добавляли DIBAH (80 мл, 1 M в толуоле) при температуре от около -60 до -50°C. После перемешивания в течение 2 часов к реакционной смеси добавляли 6 N раствор HCl (300 мл) и перемешивание продолжали в течение 30 минут. Органический слой затем отделяли, промывали 2 N раствором HCl с последующим промыванием раствором NaHCO3, затем насыщенным солевым раствором, сушили над Na2SO4 и концентрировали в вакууме с получением соединения 8 в виде масла. Продукт использовали в следующей реакции без дополнительной очистки.1H ЯМР (CDCl3; 400 МГц) δ 9,61 (с), δ 7,36 (м), δ 7,25 (м), δ 6,87 (м), δ 5,06 (м), δ 1,43 (с), δ 1,33(с).
Процедура получения 2-(2-(бензилокси)-5-трет-бутилфенил)-2-метилпропан-1-ола (9)

К перемешиваемому раствору соединения 8 (9,21 г, 0,030 моль) в MeOH (150 мл) медленно добавляли NaBH4 (2,3 г, 0,061 моль) при 0°C. После смесь перемешивали при 20°C в течение 3 часов, добавляли 12 мл 6 N раствора HCl и смесь перемешивали в течение дополнительных 30 минут. Раствор затем концентрировали до приблизительно одной четвертой исходного объема и экстрагировали при помощи EtOAc. Органический слой отделяли и промывали водой и насыщенным солевым раствором, сушили при помощи Na2SO4, фильтровали и затем концентрировали в вакууме с получением соединения 9 в виде белого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 7,47 (м), δ 7,42 (м), δ 7,34 (м), δ 7,28 (м), δ 7,16 (м), δ 6,94 (м), δ 5,08 (с), δ 4,45 (т), δ 3,64 (д), δ 1,28 (с), δ 1,25 (с).
Процедура получения 2-(2-гидрокси-5-трет-бутилфенил)-2-метилпропан-1-ола (10)

Pd(OH)2 (1 г) и соединение 9 (9,26 г, 0,030 моль) в MeOH (200 мл) перемешивали в атмосфере водорода при давлении 20-30 ф/кв.дюйм (1,406-2,109 кг/см2) в течение 16-18 часов. Смесь затем фильтровали через Celite® и фильтрат концентрировали с получением соединения 10 в виде белого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 9,16 (с), δ 7,16 (д), δ 7,00 (м), δ 6,65 (м), δ 4,71 (т), δ 3,62 (д), δ 1,27 (с), δ 1,22 (с).
Процедура получения 1-((метилкарбокси)окси)-2-(1-((метилкарбокси)окси)-2-метилпропан-2-ил)-4-трет-бутилбензола (11)

К перемешиваемому раствору соединения 10 (23,2 г, 0,10 моль), DMAP (1,44 г) и DIEA (72,8 г, 0,56 моль) в безводном ДХМ (720 мл) по каплям добавляли метилхлорформиат (43,5 г, 0,46 моль) в ДХМ (160 мл) при 0°C. После смесь перемешивали при 20°C в течение 16 часов, смесь промывали водой, 1 N раствором HCl и насыщенным солевым раствором, сушили при помощи MgSO4 и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (смесь 1:20 EtOAc:петролейный эфир) с получением соединения 11 в виде белого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 7,32 (м), δ 7,10 (д), δ 4,26 (с), δ 3,84 (с), δ 3,64 (с), δ 1,31 (с), δ 1,28 (с).
Процедура получения 1-((метилкарбокси)окси)-2-(1-((метилкарбокси)окси)-2-метилпропан-2-ил)-4-трет-бутил-5-нмтробензола (12)

К перемешиваемому раствору соединения 11 (32 г, 0,095 моль) в ДХМ (550 мл) по каплям добавляли 98% H2SO4 (43 г, 0,43 моль) при 0°C. После перемешивания в течение 20 минут при 0°C, 65% HNO3 (16,2 г, 0,17 моль) добавляли к смеси по каплям при 0°C. Смесь затем перемешивали при 1-10°C в течение 4 часов и затем добавляли смесь лед-вода (200 мл). Водный слой отделяли и экстрагировали при помощи ДХМ (200 мл ×3) и объединенные органические слои промывали водой (водный раствор), NaHCO3 и насыщенным солевым раствором, затем сушили при помощи MgSO4 и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (смесь 1:20 EtOAc:петролейный эфир) с получением неочищенного соединения 12 в виде масла.
Процедура получения 2-трет-бутил-5-((метилкарбокси)окси)-4-(1-((метилкарбокси)окси)-2-метилпропан-2-ил)анилина (13)

Pd/C (2,6 г) и соединение 12 (14 г, неочищенное) перемешивали в MeOH (420 мл) при комнатной температуре в атмосфере водорода при давлении 20-30 ф/кв.дюйм (1,406-2,109 кг/см2) в течение 16-18 часов. Затем смесь фильтровали при помощи kieselguhr® и фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (смесь 1:10 EtOAc:петролейный эфир) с получением соединения 13 в виде серого твердого вещества.1H ЯМР (CDCl3; 400 МГц) δ 7,26 (с), δ 7,19 (с), δ 4,26 (с), δ 3,89 (с), δ 3,74 (с), δ 1,40 (с), δ 1,35 (с).
Процедура получения N-(2-трет-бутил-5-((метилкарбокси)окси)-4-(1-((метилкарбокси)окси)-2-метилпропан-2-ил)фенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (14)

К перемешиваемому раствору соединения 26 (5,0 г, 0,026 моль) в безводном ДМФА (120 мл) при 0°C добавляли EDCI (5,6 г, 0,029 моль), HOBT (3,8 г, 0,028 моль) и DIEA (6,6 г, 0,051 моль). После перемешивания в течение 1 часа в смесь по каплям добавляли раствор соединения 13 (3,0 г, 0,008 моль) в ДХМ (30 мл) при 0°C. Смесь перемешивали при 25°C в течение 72 часов и затем концентрировали в вакууме. Остаток растворяли в EtOAc (225 мл) и промывали водой (120 мл ×1), 1N раствором HCl (120 мл) и насыщенным солевым раствором, сушили при помощи Na2SO4 и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (смесь 1:1 EtOAc:петролейный эфир) с получением соединения 14 в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 12,34 (с, 1H), 11,58 (с, 1H), 9,07 (с, 1H), 8,42 (д, 1H), 7,66 (с, 1H), 7,51 (с, 1H), 7,47 (с, 1H), 7,39 (с, 1H), 6,72 (с, 1H), 4,34 (с, 2H), 3,82 (с, 3H), 3,74 (с, 3H), 1,41 (с, 9H), 1,40 (с, 6H).
Процедура получения N-(2-трет-бутил-5-гидрокси-4-(1-гидрокси-2-метилпропан-2-ил)фенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (27)

К перемешиваемому раствору KOH (1,2 г, 0,02 моль) в MeOH (80 мл) при 0°C добавляли соединение 14 (1,9 г, 0,0036 моль). После перемешивания в течение 2-3 часов при температуре 5-15°C смесь концентрировали досуха. Остаток затем растирали в воде (10 мл), фильтровали, промывали при помощи ДХМ и сушили в вакууме в течение 24 часов с получением соединения 27 в виде белого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 12,77 (с), δ 8,86 (с), δ 8,20 (д), δ 7,55 (д), δ 7,42 (т), δ 7,16 (кв), δ 7,02 (с), δ 6,85 (м), δ 3,55 (с), δ 1,55 (с), δ 1,35 (с), δ 1,27 (с). МС найдено (М+H) 409,2.
Пример 2: Альтернативный общий синтез N-(2-трет-бутил-5-гидрокси-4-(1-гидрокси-2-метилпропан-2-ил)фенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (27)


Процедура получения метил 2-(5-трет-бутил-2-гидрокси-4-нитрофенил)-2-метилпропаноата (38):

Смесь 2-бром-4-трет-бутил-5-нитрофенола (15,00 г, 54,72 ммоль), бис(три-трет-бутилфосфин)палладия(0) (1,422 г, 2,783 ммоль), фторида цинка (2,82 г, 27,27 ммоль), метилтриметилсилилдиметилкетенацеталя (MTDA) (19,35 г, 111,0 ммоль) и диметилформамида (150 мл) нагревали при 70°C в течение 18 часов. Смесь охлаждали до комнатной температуры и разбавляли водой. После перемешивания в течение одного часа водную фазу экстрагировали при помощи MTBE. Органический слой сушили в вакууме с получением неочищенного продукта в виде коричневого твердого вещества. Очистку продукта осуществляли путем растирания в порошок в н-гептане.1Н ЯМР (400 МГЦ, DMCO-d6) δ 10,38 (с, 1H); 7,37 (с, 1H); 6,79 (с, 1H); 3,54 (с, 3H); 1,45 (с, 6H); 1,32 (с, 9H).
Процедура получения 4-трет-бутил-2-(1-гидрокси-2-метилпропан-2-ил)-5-нитрофенола (39):

1M раствор алюмогидрида лития в ТГФ (11,80 мл, 11,80 ммоль) добавляли к раствору метил 2-(5-трет-бутил-2-гидрокси-4-нитрофенил)-2-метилпропаноата (5,36 г, 18,15 ммоль) в ТГФ (50 мл). Смесь перемешивали при температуре окружающей среды в течение 3 часов и затем разбавляли метанолом. Смесь подкисляли при помощи 1N раствора HCl (pH 1-2) и водную фазу экстрагировали при помощи MTBE. Органическую фазу сушили в вакууме с получением 4-трет-бутил-2-(1-гидрокси-2-метилпропан-2-ил)-5-нитрофенола, который использовали на следующей стадии без дополнительной очистки.1H-ЯМР (400 МГЦ, DMCO-d6) δ 10,12 (с, 1H); 7,37 (с, 1H); 6,80 (с, 1H); 4,77 (с, 1H); 3,69-3,65 (м, 2H); 1,30 (с, 9H); 1,29 (с, 6H).
Процедура получения 4-трет-бутил-2-(2-метоксикарбонилокси-1,1-диметил-этил)-5-нитро-фенил] метилкарбоната (12)

К раствору 4-трет-бутил-2-(1-гидрокси-2-метилпропан-2-ил)-5-нитрофенола (1,92 г, 7,18 ммоль), триэтиламина (1,745 г, 17,24 ммоль) и диметиламинопиридина (87,74 мг, 0,718 ммоль) в дихлорметане (30 мл) при 0°C медленно загружали метилхлорформиат (2,376 г, 25,14 ммоль), поддерживая температуру ниже 5°C. После добавления смесь оставляли нагреваться до температуры окружающей среды и перемешивали до тех пор, пока ВЭЖХ не показала полную конверсию исходного материала (2-8 часов). Реакционную смесь разбавляли водой и подкисляли при помощи 1N раствора HCl (pH 1-2). Водную фазу экстрагировали при помощи ДХМ и объединенные органические слои сушили в вакууме. Неочищенное полутвердое янтарное вещество перекристаллизовывали из смеси метанола и дихлорметана с получением указанного в заголовке соединения в виде желтого кристаллического твердого вещества.1H-ЯМР (400 МГЦ, DMCO-d6) δ 7,67 (с, 1H); 7,52 (с, 1H); 4,30 (с, 2H); 3,86 (с, 3H); 3,64 (с, 3H); 1,35 (с, 9H); 1,35 (с, 6H).
Процедура получения 5-амино-4-трет-бутил-2-(2-метоксикарбонилокси-1,1-диметил-этил)фенил] метилкарбоната (13):

Смесь [4-трет-бутил-2-(2-метоксикарбонилокси-1,1-диметил-этил)-5-нитро-фенил] метилкарбоната (1,27 г, 3,313 ммоль) и Pd/C (75 мг, 0,035 ммоль) в метаноле (50 мл) продували азотом. После продувки колбы водородом смесь гидрировали в течение 18 часов при температуре и давлении окружающей среды. Раствор фильтровали через Celite® и сушили в вакууме с получением продукта в виде твердого вещества.1H-ЯМР (400 МГЦ, DMCO-d6) δ 6,99 (с, 1H); 6,39 (с, 1H); 4,92(с, 2H); 4,13 (с, 2H); 3,82 (с, 3H); 3,65 (с, 3H); 1,32 (с, 9H); 1,23 (с, 6H).
Процедура получения N-(2-трет-бутил-5-гидрокси-4-(1-гидрокси-2-метилпропан-2-ил)фенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (27):

В смесь [5-амино-4-трет-бутил-2-(2-метоксикарбонилокси-1,1-диметил-этил)фенил] метилкарбоната (103 мг, 0,29 ммоль), 4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (50 мг, 0,26 ммоль) и пиридина (42 мг, 0,53 ммоль) в 2-МеТГФ (3,0 мл) загружали T3P в виде 50 масс.% раствора в 2-МеТГФ (286 мг, 0,45 ммоль). Смесь нагревали до 50°C в течение 18 часов. После охлаждения до температуры окружающей среды смесь разбавляли водой. Органическую фазу отделяли и снова промывали водой. В органическую фазу загружали метоксид натрия (39 мг, 0,72 ммоль) и раствор перемешивали в течение 2 часов. Реакцию гасили при помощи 1 N раствора HCl и после разделения фаз органическую фазу промывали при помощи 0,1 N раствора HCl. Органическую фазу затем сушили в вакууме с получением соединения 27 в виде твердого вещества. Данные1H-ЯМР спектра соответствуют указанному выше.
Пример 3: Общий синтез 2-(5-трет-бутил-2-гидрокси-4-(4-оксо-1,4-дигидрохинолин-3-карбоксамидо)фенил)-2-метилпропановой кислоты (28):

Процедура получения 2-(5-трет-бутил-2-гидроксифенил)-2-метилпропаннитрила (15)

Pd (OH)2/C (2,0 г) и соединение 7 (20,0 г, 0,104 моль) перемешивали в MeOH (150 мл) при комнатной температуре в атмосфере водорода при давлении 10 ф/кв.дюйм(0,703 кг/см2) в течение 16-18 часов. Смесь затем фильтровали через слой Celite® и фильтрат концентрировали с получением соединения 15, которое использовали на следующей стадии реакции без дополнительной очистки.1H ЯМР (DMCO-d6; 400 МГц) δ 9,83 (с), δ 7,24 (с), δ 7,18 (м), δ 6,80 (м), δ 1,71 (с), δ 1,24 (с).
Процедура получения 4-трет-бутил-2-(2-цианопропан-2-ил)фенилметилкарбоната (16)

В перемешиваемую смесь соединения 15 (126,6 г, 0,564 моль), DMAP (6,0 г) и DIEA (188 г, 1,46 моль) в безводном ДХМ (1500 мл) при 0°C в течение 2 часов по каплям добавляли метилхлорформиат (110 г, 1,17 моль) в безводном ДХМ (300 мл). После перемешивания в течение 12 часов при 0°C добавляли смесь лед-вода (1,5 л) и смесь перемешивали при 0°C в течение 30 минут. Органический слой отделяли и промывали 1N раствором HCl, водой и насыщенным солевым раствором. Раствор ДХМ сушили над MgSO4 и концентрировали в вакууме с получением соединения 16 в виде желтого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 7,47 (м), δ 7,39 (д), δ 7,24 (д), δ 3,84 (с), δ 1,71 (с), δ 1,30 (с).
Процедура получения 2-(1-амино-2-метил-1-оксопропан-2-ил)-4-трет-бутил-5-нитрофенилметилкарбоната (17)

В перемешиваемую смесь соединения 16 (10,0 г, 36,3 ммоль) и KNO3 (5,51 г, 54,5 ммоль) в ДХМ (1000 мл) по каплям добавляли 98% раствор H2SO4 (145,4 г, 1,45 моль) при 0°C. Смесь перемешивали при 30°C в течение 4 дней. Слой H2SO4 затем отделяли и вливали в смесь льда с водой (50 г) и затем экстрагировали при помощи ДХМ (100 мл ×3). Объединенные органические слои промывали водой, водным раствором NaHCO3 и насыщенным солевым раствором, затем сушили над MgSO4 и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (смесь петролейный эфир/EtOAc 20:1→10:1→5:1→3:1) с получением соединения 17 в виде желтого твердого вещества.1H ЯМР (CDCl3; 400 МГц) δ 8,05 (с), δ 7,74 (с), δ 7,61 (с), δ 7,32 (с), δ 5,32 (с), δ 3,91 (с), δ 3,92 (с), δ 1,62 (с), δ 1,59 (с), δ 1,42 (с), δ 1,38 (с).
Процедура получения 2-(5-трет-бутил-2-гидрокси-4-нитрофенил)-2-метилпропановой кислоты (18)

К смеси соединения 17 (7,3 г, 21,6 ммоль) в метаноле (180 мл) добавляли воду (18 мл) и NaOH (8,64 г, 216 ммоль). Раствор нагревали и поддерживали при кипячении с обратным холодильником в течение 3 дней. Растворитель выпаривали в вакууме и остаток растворяли в 140 мл воды. Затем раствор подкисляли до pH=2 путем добавления 2N раствора HCl. Водную фазу экстрагировали этилацетатом (100 мл ×3) и объединенные органические фазы промывали водой и насыщенным солевым раствором, сушили над безводным Na2SO4 и затем концентрировали с получением соединения 18 в виде желтого твердого вещества, которое использовали на следующей стадии реакции без дополнительной очистки.
Процедура получения 5-трет-бутил-3,3-диметил-6-нитробензофуран-2(3H)-она (19)

К раствору соединения 18 (7,10 г, 25,2 ммоль) в 710 мл безводного ТГФ добавляли EDCI (14,5 г, 75,6 ммоль). Полученную суспензию оставляли при перемешивании при 30°C в течение ночи. Осадок фильтровали и тщательно промывали при помощи ДХМ. Фильтрат концентрировали досуха и остаток растворяли в ДХМ (100 мл). Раствор промывали водой (50 мл ×2) и насыщенным солевым раствором (50 мл ×1). Слой ДХМ затем сушили над безводным Na2SO4 и концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (смесь петролейный эфир/EtOAc 200:1→100:1→50:1) с получением соединения 19 в виде белого твердого вещества.1H ЯМР (CDCl3; 400 МГц) δ 7,36 (с), δ 7,10 (с), δ 1,53 (с), δ 1,41 (с).
Процедура получения 6-амино-5-трет-бутил-3,3-диметилбензофуран-2(3H)-она (20)

Pd/C (1,50 г) и соединение 19 (3,00 г, 1,14 ммоль) суспендировали в ТГФ (1500 мл) при 25°C в атмосфере водорода при давлении 30 ф/кв.дюйм (2,109 кг/см2) в течение 4 часов. Смесь затем фильтровали через слой Celite® и фильтрат концентрировали в вакууме с получением соединения 20 в виде белого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 7,05 (с), δ 6,49 (с), δ 5,01 (с), δ 1,35 (с), δ 1,33 (с).
Процедура получения N-(5-трет-бутил-3,3-диметил-2-оксо-2,3-дигидробензофуран-6-ил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (21)

Суспензию HATU (17,6 г, 46,3 моль) и соединения 26 (8,36 г, 44,2 ммоль) в безводном ацетонитриле (1 л) перемешивали при комнатной температуре в течение 1 часа. К суспензии добавляли соединение 20 (3,40 г, 14,6 ммоль) и затем по каплям добавляли DIEA (11,5 г, 89,0 ммоль). Смесь перемешивали при 45°C в течение 4 дней. Полученный осадок фильтровали и тщательно промывали при помощи ДХМ. Фильтрат концентрировали досуха и остаток растворяли в ДХМ (200 мл) и промывали при помощи 1N раствора HCl (200 мл ×2) с последующим промыванием 5% водным раствором NaHCO3 (200 мл ×3) и затем насыщенным солевым раствором (200 мл ×1). Смесь затем сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (смесь CH2Cl2/MeOH 100:1→50:1) с получением соединения 21 в виде светло-желтого твердого вещества.1Н-ЯМР (400МГЦ, DMCO-d6) δ 12,96 (д, J 6,4 Гц, 1H); 12,1 (с, 1H); 8,9 (д, J 6,4 Гц, 1H); 8,33 (д, J 8 Гц, 1H); 7,84-7,75 (м, 2H); 7,55-7,48 (м, 3H); 1,47 (с, 6H); 1,45 (с, 9H).
Процедура получения 2-(5-трет-бутил-2-гидрокси-4-(4-оксо-1,4-дигидрохинолин-3-карбоксамидо)фенил)-2-метилпропановой кислоты (28)

К перемешиваемому раствору соединения 21 (0,9 г, 2,45 ммоль) в MeOH (50 мл) при 0°C добавляли NaOH (1,5 г, 37,5 ммоль). После перемешивания в течение 16 часов при 40°C растворитель выпаривали в вакууме, затем остаток растворяли в H2O (50 мл). Осадок фильтровали и фильтрат промывали при помощи ДХМ (100 мл ×1) и этилацетата (100 мл ×1). Водный слой подкисляли при помощи 2N раствора HCl до достижения уровня pH 1-2. Осадок фильтровали и промывали при помощи H2O (80 мл) и гептана (50 мл). Его сушили в вакууме с получением соединения 28 в виде белого твердого вещества.1H ЯМР (DMCO-d6; 400 МГц) δ 12,85 (с), δ 11,84 (с), δ 11,77 (с), δ 9,39 (с), δ 8,86 (с), δ 8,33 (с), δ 7,79 (м), δ 7,52 (м), δ 7,18 (с), δ 7,09 (с), δ 1,44 (с), δ 1,40 (с). МС найдено (М+H) 423,08.
Пример 4: Второй альтернативный синтез N-(2-трет-бутил-5-гидрокси-4-(1-гидрокси-2-метилпропан-2-ил)фенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (27)

3-Горлую круглодонную колбу объемом 50 мл оснащали магнитной мешалкой, барботажным устройством для азота и термопарой. В колбу загружали соединение 21 (514 мг, 1,27 ммоль) и 2-МеТГФ (4 мл). Реакционную смесь перемешивали при комнатной температуре. Добавляли алюмогидрид лития (204 мг, 6,6 ммоль) в виде твердого вещества до тех пор, пока не достигалась 100% конверсия, которую отслеживали, с использованием ВЭЖХ. К реакционной смеси добавляли соль калий натрий 2,3-дигидроксибутандиоат тетрагидрат (50 мл раствора 400 г/л) и MTBE (50 мл). Полученный раствор перемешивали в течение 15 минут и затем давали отстояться в течение 15 минут. Органический слой отделяли и pH водного слоя доводили до pH около 6-7 путем добавления винной кислоты. Водный слой экстрагировали при помощи MTBE. Органический слой концентрировали и сушили под высоким вакуумом с получением указанного в заголовке соединения в виде не совсем белого порошка. Данные1H-ЯМР спектра соответствовали указанному выше.
Пример 5: Альтернативный общий синтез 2-(5-трет-бутил-2-гидрокси-4-(4-оксо-1,4-дигидрохинолин-3-карбоксамидо)фенил)-2-метилпропановой кислоты (28):

Процедура получения 2-бромида угольной кислоты, 4-третбутилфенилового эфира метилового эфира (35)
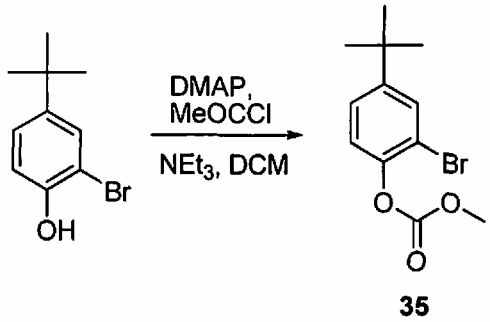
3-Горлую круглодонную колбу объемом 2 л оснащали магнитной мешалкой, барботажным устройством для азота и термопарой. Добавляли 2-бром-4-третбутилфенол (50 г, 211,7 ммоль) с последующим добавлением ДХМ (1,75 л), DMAP (1,29 г, 10,58 ммоль) и Et3N (44,3 мл, 317,6 ммоль). Реакционную смесь охлаждали до 0°C. К реакционной смеси по каплям добавляли метилхлорформиат (19,62 мл, 254 ммоль). Смесь оставляли нагреваться до комнатной температуры при перемешивании в течение ночи. Когда реакция была завершена, смесь фильтровали через воронку из спекшегося стекла. Фильтрат переносили в делительную воронку объемом 1 л. Для гашения реакции к фильтрату добавляли 1N раствор HCl (300 мл) и органический слой отделяли. Органический слой затем промывали смесью 291 мл насыщенного раствора NaHCO3 и 100 мл воды. Слои разделяли и определяли, что водный слой имеет уровень pH около 8. Органический слой концентрировали и сушили под высоким вакуумом в течение приблизительно 16 часов с получением указанного в заголовке соединения в виде прозрачного желтого масла, которое использовали на следующей стадии реакции без дополнительной очистки.1H-ЯМР (400 МГЦ, DMCO-d6) 7,66 (д, J 2,0 Гц, 1H), 7,46 (дд, J 8,4, 2,0 Гц, 1H), 7,32 (д, J 8,4 Гц, 1H), 3,86 (с, 3H), 1,28 (с, 9H).
Процедура получения (2-бром-4-трет-бутил-5-нитро-фенил) метилкарбоната (36)

3-Горлую круглодонную колбу объемом 2 л оснащали магнитной мешалкой, барботажным устройством для азота и термопарой. В колбу загружали соединение 35 (176 г, 612,9 ммоль) и концентрированную серную кислоту (264 мл). Реакционную смесь охлаждали до -5°C-0°C. По каплям добавляли азотную кислоту (28,6 мл, 612,9 ммоль) и реакционную смесь перемешивали при 0°C в течение 2 часов. После завершения перемешивания добавляли воду (264 мл) с последующим добавлением MTBE (264 мл). Раствор перемешивали в течение 15 минут, затем давали отстояться в течение 15 минут. Органический слой отделяли, концентрировали и сушили под высоким вакуумом с получением указанного в заголовке соединения в виде темно-коричневого масла, которое использовали на следующей стадии реакции без дополнительной очистки.1H-ЯМР (400 МГЦ, DMCO-d6) 7,96 (с, 1H), 7,92 (с, 1H), 3,89 (с, 3H), 1,34 (с, 9H).
Процедура получения 2-бром-4-трет-бутил-5-нитро-фенола (37)

(2-Бром-4-трет-бутил-5-нитро-фенил)метилкарбонат (72,9 г, 219,5 ммоль) загружали в реактор и добавляли ДХМ (291,6 мл). Желтый реакционный раствор охлаждали, с использованием бани со льдом. Порциями добавляли метоксид натрия (67,04 г, 69,11 мл 5,4 M раствора, 373,2 ммоль) при температуре 2,2-6,9°C. После завершения добавления реакционную смесь медленно нагревали до температуры окружающей среды. Когда нагревание завершалось, реакционную смесь охлаждали до 0°C и гасили при помощи 1M раствора HCl (373,2 мл, 373,2 ммоль). Двухфазную смесь перемешивали в течение 20 минут и переносили в делительную воронку. Органический слой отделяли и промывали водой (300 мл) с последующим промыванием насыщенным солевым раствором (300 мл). Органический слой концентрировали и неочищенный продукт сушили под высоким вакуумом. Продукт далее очищали при помощи сверхкритической жидкостной хроматографии (SFC) на устройстве Berger MultiGram III (Mettler Toledo AutoChem, Newark DE). Условия для данного способа были следующие: 20% метанол при скорости потока 250 мл/мин на колонке PPU (30*150) от Princeton Chromatography, 100 бар, 35°C, 220 нм. Вводили 3,5 мл раствора 55-70 мг/мл. Данные собирали с использованием программы SFC ProNTo. Очищенный продукт, полученный в результате SFC очистки, являлся метанольным сольватом. Для удаления метанола осуществляли азеотропную дистилляцию. В круглодонную колбу объемом 1 л загружали темно-желтое твердое вещество, 2-бром, 4-третбутил, 5-нитрофенолметанольный сольват, (111,3 г, 59,9 ммоль) с последующей загрузкой гептана (500 мл). Суспензию нагревали до 64°C с получением прозрачного раствора. Растворитель отгоняли при пониженном давлении (649 мбар) в течение 30 минут и затем упаривали досуха. Эту процедуру повторяли три раза до тех пор, пока не определяли отсутствие MeOH при помощи1H-ЯМР. Продукт сушили под высоким вакуумом в течение 16 часов с получением продукта в виде темно-желтого полутвердого вещества.1H-ЯМР (400 МГЦ, DMCO-d6) δ 11,2 (шир.с, OH), 7,69 (с, 1H); 7,03 (с, 1H); 1,30 (с, 9H).
Процедура получения 5-трет-бутил-3,3-диметил-6-нитробензофуран-2(3H)-она (19)

Дифторцинк (6,093 г, 58,92 ммоль) добавляли в круглодонную колбу после ее продувки азотом. Под потоком азота затем добавляли Pd(tBu3P)2 (2 г, 3,835 ммоль). Затем в колбу добавляли 2-бром-4-трет-бутил-5-нитро-фенол (16,15 г, 58,92 ммоль), растворенный в ДМФА (80,75 мл). Реакционная смесь представляла собой оранжевую суспензию. К смеси добавляли (1-метокси-2-метил-проп-1-енокси)триметилсилан (21,61 г, 25,13 мл, 117,8 ммоль) и полученную смесь нагревали до 80°C и перемешивали в течение 16 часов. После завершения реакционную смесь охлаждали до температуры окружающей среды и фильтровали через Celite®. Фильтрованный осадок промывали при помощи MTBE (536,0 мл) и к фильтрату добавляли воду (893,3 мл). Смесь перемешивали в течение 15 минут и отстаивали в течение дополнительных 15 минут. Слои разделяли и к органической фазе добавляли 0,5M раствор HCl (500 мл, 250,0 ммоль). Слои разделяли и органический слой промывали водой (500 мл). Слои разделяли и органический слой промывали при помощи NaCl (500 мл; 8 масс.%). Органический слой отделяли и растворитель удаляли в вакууме. Получали неочищенный продукт в виде коричневого кристаллического твердого вещества и затем очищали через пробку из кремнезема, с использованием в качестве элюента смесь гексан:MTBE 20:1-10:1. Фракции, содержащие продукт, объединяли и растворитель удаляли в вакууме с получением чистого продукта в виде белого кристаллического твердого вещества.1Н-ЯМР (400 МГЦ, DMCO-d6) δ 7,80 (с, 1H); 7,62 (с, 1H); 1,49 (с, 6H); 1,34 (с, 9H).
Процедура получения 6-амино-5-трет-бутил-3,3-диметилбензофуран-2(3H)-она (20)

Палладий на углероде (содержание влаги 5 масс.%) помещали в круглодонную колбу под потоком азота. В сосуд затем добавляли 5-трет-бутил-3,3-диметил-6-нитро-бензофуран-2-он (4,7 г, 17,85 ммоль). В сосуд затем осторожно загружали метанол (120 мл) в атмосфере азота. Сосуд затем продували при помощи N2, откачивали воздух, затем заполняли газообразным водородом. Из сосуда откачивали воздух и повторно заполняли газообразным водородом и затем вводили непрерывный поток газообразного водорода. После завершения введения газа реакционную смесь фильтровали через Celite® и осадок промывали при помощи MeOH (300 мл). Растворитель удаляли в вакууме и продукт сушили под высоким вакуумом с получением белого кристаллического твердого вещества.1H-ЯМР (400 МГЦ, DMCO-d6) δ 7,05 (с, 1H); 6,48 (с, 1H); 5,02 (с, 2H, NH2); 1,34 (с, 6H); 1,30 (с, 9H).
Процедура получения N-(5-трет-бутил-3,3-диметил-2-оксо-2,3-дигидробензофуран-6-ил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (21)

В реакционный сосуд загружали соединение 26 (2,926 г, 15,43 ммоль), соединением 20 (4,32 г, 18,52 ммоль), 2-МеТГФ (35,99 мл) и далее 50% T3P в 2-МеТГФ (13,36 г, 21,00 ммоль). Добавляли пиридин (2,441 г, 2,496 мл, 30,86 ммоль) и суспензию нагревали при температуре 47,5°C±5°C в течение 18 часов. После завершения нагревания реакционную смесь охлаждали до температуры окружающей среды и добавляли 2-МеТГФ (36) и воду (30 мл). Слои разделяли и органический слой промывали 10 масс.% раствором лимонной кислоты (30 мл), водой (30 мл) и дважды NaHCO3 (20 мл). Органический слой промывали насыщенным солевым раствором (50 мл), отделяли и растворитель удаляли в вакууме. Неочищенный продукт растворяли в MTBE (100 мл) и добавляли гексан (200 мл) в качестве анти-растворителя. Твердое вещество осаждали и полученную суспензию перемешивали в течение двух часов. Твердое вещество собирали вакуумным фильтрованием и осадок промывали гексаном. Полученный продукт сушили в вакуумной печи при 55°C с выпуском азота с получением указанного в заголовке соединения в виде бежевого твердого вещества.1H-ЯМР (400 МГЦ, DMCO-d6) δ 12,96 (д, J 6,4 Гц, 1H); 12,1 (с, 1H); 8,9 (д, J 6,4Гц, 1H); 8,33 (д, J 8Гц, 1H); 7,84-7,75 (м, 2H); 7,55-7,48 (м, 3H); 1,47 (с, 6H); 1,45 (с, 9H).
Процедура получения 2-(5-трет-бутил-2-гидрокси-4-(4-оксо-1,4-дигидрохинолин-3-карбоксамидо)фенил)-2-метилпропановой кислоты (28)

Соединение 26 (81,30 мг, 0,4288 ммоль) и Соединение 20 (110 мг, 0,4715 ммоль) загружали в круглодонную колбу. Затем добавляли 2-МеТГФ (1 мл) с последующим добавлением 50% T3P в 2-МеТГФ (371,4 мг, 0,5836 ммоль) и пиридина (67,84 мг, 69,37 мкл, 0,8576 ммоль) в 2-МеТГФ. Суспензию нагревали при 47,5°C±5°C в течение ночи. После завершения нагревания реакционную смесь охлаждали до температуры окружающей среды. Добавляли 2-МеТГФ (1,014 мл) и воду (811,2 мкл). Слои разделяли и органический слой промывали водой (811,2 мкл) и дважды при помощи NaHCO3 (2 мл). Органический слой переносили в круглодонную колбу. Добавляли LiOH (38,6 мг, 0,9 ммоль), растворенный в воде (2 мл), и реакционную смесь нагревали до 45°C. После завершения нагревания слои разделяли и органический слой отбрасывали. Водный слой охлаждали на бане со льдом и к раствору добавляли хлористоводородную кислоту (10,72 мл 1,0 M раствора, 10,72 ммоль) до тех пор, пока уровень pH не достигал значения около 3-4. Водный слой дважды экстрагировали при помощи 2-МеТГФ (5 мл) и органические слои объединяли и промывали насыщенным солевым раствором (5 мл). Органический слой отделяли и растворитель удаляли в вакууме. Полученное твердое вещество сушили в вакуумной печи с выпуском азота при 50°C с получением указанного в заголовке соединения.1Н-ЯМР (400 МГЦ, DMCO-d6) δ 12,89 (д, J 6,8 Гц, 1H); 11,84 (с, 1H); 11,74 (с, 1H); 9,36 (с, 1H); 8,87-8,61 (д, J 6,4 Гц ,1H); 8,34-8,32 (д, J 9,1 Гц 1H); 7,83-7,745 (м, 2H); 7,17-7,09 (м, 1H); 7,17 (с, 1H); 7,09 (с, 1H); 1,43 (с, 6H); 1,40 (с, 9H).
Пример 6: Общий синтез N-(2,4-ди-трет-бутил-5-гидроксифенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (34)


Процедура получения 2,4-ди-трет-бутилфенилметилкарбоната (30)

Способ 1
К раствору 2,4-ди-трет-бутилфенола, соединение 29, (10 г, 48,5 ммоль) в диэтиловом эфире (100 мл) и триэтиламине (10,1 мл, 72,8 ммоль), при 0°C добавляли по каплям метилхлорформиат (7,46 мл, 97 ммоль). Смесь затем оставляли нагреваться до комнатной температуры и перемешивали в течение дополнительных 2 часов. Затем добавляли дополнительные 5 мл триэтиламина и 3,7 мл метилхлорформиата и реакционную смесь перемешивали в течение ночи. Реакционную смесь затем фильтровали, фильтрат охлаждали до 0°C и затем добавляли дополнительные 5 мл триэтиламина и 3,7 мл метилхлорформиата и реакционную смесь оставляли нагреваться до комнатной температуры и затем перемешивали еще в течение 1 часа. На этой стадии реакция была практически завершена и доводилась до завершения при помощи фильтрования, затем промывания водой (×2), с последующим промыванием насыщенным солевым раствором. Раствор затем концентрировали с получением желтого масла и очищали при помощи колоночной хроматографии с получением соединения 30.1H ЯМР (400 МГц, DMCO-d6) δ 7,35 (д, J=2,4 Гц, 1H), 7,29 (дд, J=8,4,2,4 Гц, 1H), 7,06 (д, J=8,4 Гц, 1H), 3,85 (с, 3H), 1,30 (с, 9H), 1,29 (с, 9H).
Способ 2
В реакционный сосуд загружали 4-диметиламинопиридин (DMAP, 3,16 г, 25,7 ммоль) и 2,4-ди-трет-бутилфенол (соединение 29, 103,5 г, 501,6 ммоль), добавляли метиленхлорид (415 г, 313 мл) и раствор перемешивали до растворения всех твердых веществ. Затем добавляли триэтиламин (76 г, 751 ммоль) и раствор охлаждали до температуры 0-5°C. Затем по каплям добавляли метилхлорформиат (52 г, 550,3 ммоль) в течение 2,5-4 часов для поддержания температуры раствора между 0-5°C. Реакционную смесь затем медленно нагревали до температуры 23-28°C и перемешивали в течение 20 часов. Реакционную смесь затем охлаждали до температуры 10-15°C и загружали 150 мл воды. Смесь перемешивали при температуре 15-20°C в течение 35-45 минут и водный слой затем отделяли и экстрагировали при помощи 150 мл метиленхлорида. Органические слои объединяли и нейтрализовали при помощи 2,5% раствора HCl (водный раствор) при температуре 5-20°C с получением конечного уровня pH 5-6. Органический слой затем промывали водой и концентрировали в вакууме при температуре ниже 20°C до 150 мл с получением соединения 30 в метиленхлориде.
Процедура получения 5-нитро-2,4-ди-трет-бутилфенилметилкарбоната (31)

Способ 1
К перемешиваемому раствору соединения 30 (6,77 г, 25,6 ммоль) при 0°C по каплям добавляли 6 мл смеси серной кислоты и азотной кислоты 1:1. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 часа. Продукт очищали, с использованием жидкостной хроматографии (ISCO, 120 г, 0-7% EtOAc/гексан, 38 минут), с получением около 8:1-10:1 смеси региоизомеров соединения 31 в виде белого твердого вещества.1H ЯМР (400 МГц, DMCO-d6) δ 7,63 (с, 1H), 7,56 (с, 1H), 3,87 (с, 3H), 1,36 (с, 9H), 1,32 (с, 9H). ВЭЖХ время удерживания 3,92 минут 10-99% CH3CN, время эксперимента 5 мин.; ESI-MS 310 m/z (MH)+.
Способ 2
К соединению 30 (100 г, 378 ммоль) добавляли ДХМ (540 г, 408 мл). Смесь перемешивали до растворения всех твердых веществ и затем охлаждали до температуры -5-0°C. Затем по каплям добавляли концентрированную серную кислоту (163 г), для поддержания исходной температуры реакции и смесь перемешивали в течение 4,5 часов. Затем по каплям добавляли азотную кислоту (62 г) в течение 2-4 часов при поддержании исходной температуры реакции и затем перемешивали при этой температуре в течение дополнительных 4,5 часов. Реакционную смесь затем медленно добавляли в холодную воду, поддерживая температуру ниже 5°C. Гашеную реакционную смесь затем нагревали до 25°C и водный слой удаляли и экстрагировали метиленхлоридом. Объединенные органические слои промывали водой, сушили, с использованием Na2SO4 и концентрировали до объема 124-155 мл. Добавляли гексан (48 г) и полученную смесь снова концентрировали до объема 124-155 мл. Далее к смеси добавляли дополнительное количество гексана (160 г). Смесь затем перемешивали при температуре 23-27°C в течение 15,5 часов и затем фильтровали. К фильтрованному осадку добавляли гексан (115 г), полученную смесь нагревали до температуры кипения с обратным холодильником и перемешивали в течение 2-2,5 часов. Смесь затем охлаждали до температуры 3-7°C, перемешивали в течение дополнительных 1-1,5 часов и фильтровали с получением соединения 31 в виде бледно-желтого твердого вещества.
Процедура получения 5-амино-2,4-ди-трет-бутилфенилметилкарбоната (32)

2,4-Ди-трет-бутил-5-нитрофенилметилкарбонат (1,00 экв.) загружали в подходящий реактор гидрогенирования, с последующей загрузкой 5% Pd/C (2,50 масс.% сухой, Johnson-Matthey Type 37). В реактор загружали MeOH (15,0 об.) и систему закрывали. Систему продували при помощи N2 (газ) и затем доводили давление до 2,0 Бар при помощи H2 (газ). Реакцию осуществляли при температуре реакции 25°C±5°C. После завершения реакции реакционную смесь фильтровали и реактор/осадок промывали при помощи MeOH (4,00 об.). Полученный фильтрат дистиллировали в вакууме при температуре не выше 50°C до 8,00 об. Добавляли воду (2,00 об.) при температуре 45°C±5°C. Полученную суспензию охлаждали до температуры 0°C±5°С. Суспензию выдерживали при температуре 0°C±5°С в течение не менее 1 часа и фильтровали. Осадок промывали один раз при температуре 0°C±5°С смесью MeOH/H2O (8:2) (2,00 об.). Осадок сушили в вакууме (-0,90 бар и -0,86 бар) при температуре 35°C-40°C с получением соединения 32.1H ЯМР (400 МГц, DMCO-4) δ 7,05 (с, 1H), 6,39 (с, 1H), 4,80 (с, 2H), 3,82 (с, 3H), 1,33 (с, 9H), 1,23 (с, 9H).
После завершения реакции полученную смесь разбавляли от около 5 до 10 объемов MeOH (например, от около 6 до около 9 объемов MeOH, от около 7 до около 8,5 объемов MeOH, от около 7,5 до около 8 объемов MeOH или около 7,7 объемов MeOH), нагревали до температуры около 35±5°C, фильтровали, промывали и сушили, как описано выше.
Получение N-(2,4-ди-трет-бутил-5-гидроксифенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (34).


4-Оксо-1,4-дигидрохинолин-3-карбоновую кислоту, соединение 26, (1,0 экв.) и 5-амино-2,4-ди-трет-бутилфенилметилкарбонат, соединение 32, (1,1 экв.) загружали в реактор. Добавляли 2-МеТГФ (4,0 объема, по отношению к кислоте) с последующим добавлением 50% раствора T3P® в 2-МеТГФ (1,7 экв.). Сосуд, загруженный T3P, промывали при помощи 2-МеТГФ (0,6 об.). Затем добавляли пиридин (2,0 экв.) и полученную суспензию нагревали до температуры 47,5°C±5,0°C и выдерживали при этой температуре в течение 8 часов. Отбирали образец и проверяли на завершение реакции при помощи ВЭЖХ. После завершения полученную смесь охлаждали до температуры 25,0°C±2,5°C. Для разбавления смеси добавляли 2-МеТГФ (12,5 об.). Реакционную смесь 2 раза промывали водой (10,0 об.). Добавляли 2-МеТГФ, чтобы довести общий объем реакционной смеси до 40,0 об. (загружали ~16,5 об.). К этому раствору добавляли смесь NaOMe/MeOH (1,7 эквивалентов) для осуществления реакции метанолиза. Реакционную смесь перемешивали в течение не менее 1,0 часа и завершение реакции контролировали при помощи ВЭЖХ. После завершения реакцию гасили 1N раствором HCl (10,0 об.) и промывали 0,1N раствором HCl (10,0 об.). Органический раствор тщательно фильтровали для удаления каких-либо частиц и помещали во второй реактор. Отфильтрованный раствор концентрировали при температуре не более чем 35°C (температура рубашки реактора) и не менее чем 8,0°C (внутренняя температура реакции) при пониженном давлении до 20 об. Добавляли CH3CN до 40 об. и раствор концентрировали при температуре не выше 35°C (температура рубашки реактора) и не менее чем 8,0°C (внутренняя температура реакции) до 20 об. Добавление CH3CN и цикл концентрирования повторяли еще 2 раза, всего 3 добавления CH3CN и 4 процедуры концентрирования до 20 об. После конечного концентрирования до 20 об. добавляли 16,0 об. CH3CN с последующим добавлением 4,0 об. H2O до достижения конечной концентрации 40 об. 10% H2O/CH3CN относительно исходной кислоты. Эту суспензию нагревали до температуры 78,0°C±5,0°C (температура кипячения с обратным холодильником). Суспензию затем перемешивали в течение не менее чем 5 часов. Суспензию охлаждали до температуры 0,0°C±5°C в течение 5 часов и фильтровали. Осадок промывали при температуре 0,0°C±5,0°С при помощи CH3CN (5 об.) 4 раза. Полученное твердое вещество (соединение 34) сушили в вакуумной печи при температуре 50,0°C±5,0°C.1H ЯМР (400 МГц, DMCO-d6) δ 12,8 (с, 1H), 11,8 (с, 1H), 9,2 (с, 1H), 8,9 (с, 1H), 8,3 (с, 1H), 7,2 (с, 1H), 7,9 (т, 1H), 7,8 (д, 1H), 7,5 (т, 1H), 7,1 (с, 1H), 1,4 (с, 9H), 1,4 (с, 9H).
Альтернативное получение N-(2,4-ди-трет-бутил-5-гидроксифенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (34).

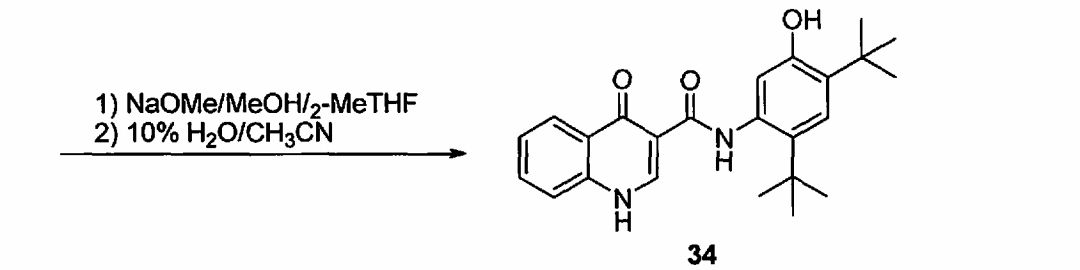
4-Оксо-1,4-дигидрохинолин-3-карбоновую кислоту, соединение 26, (1,0 экв.) и 5-амино-2,4-ди-трет-бутилфенилметилкарбонат, соединение 32, (1,1 экв.) загружали в реактор. Добавляли 2-МеТГФ (4,0 об., по отношению к кислоте) с последующим добавлением 50% раствора T3P® в 2-МеТГФ (1,7 экв.). Сосуд, загруженный T3P, промывали при помощи 2-МеТГФ (0,6 об.). Затем добавляли пиридин (2,0 экв.) и полученную суспензию нагревали до температуры 47,5°C±5,0°C и выдерживали при этой температуре в течение 8 часов. Отбирали образец и проверяли на завершение реакции при помощи ВЭЖХ. После завершения полученную смесь охлаждали до температуры 20°C±5°C. Для разбавления смеси добавляли 2-МеТГФ (12,5 об.). Реакционную смесь 2 раза промывали водой (10,0 об.) и 2-МеТГФ (16,5 объемов) загружали в реактор. К этому раствору добавляли смесь 30% масс/масс NaOMe/MeOH (1,7 эквивалентов) для осуществления реакции метанолиза. Реакционную смесь перемешивали при температуре 25,0°C±5,0°С в течение не менее 1,0 часа и завершение реакции контролировали при помощи ВЭЖХ. После завершения реакцию гасили при помощи 1,2N раствора HCl/Н2О (10,0 об.) и промывали при помощи 0,1N раствором HCl/Н2О (10,0 об.). Органический раствор тщательно фильтровали для удаления каких-либо частиц и помещали во второй реактор.
Отфильтрованный раствор концентрировали при температуре не более чем 35°C (температура рубашки реактора) и не менее чем 8,0°C (внутренняя температура реакции) при пониженном давлении до 20 об. Добавляли CH3CN до 40 об. и раствор концентрировали при температуре не более чем 35°C (температура рубашки реактора) и не менее чем 8,0°C (внутренняя температура реакции) до 20 об. Добавление CH3CN и цикл концентрирования повторяли еще 2 раза, всего 3 добавления CH3CN и 4 процедуры концентрирования до 20 об. После конечного концентрирования до 20 об. добавляли 16,0 об. CH3CN с последующим добавлением 4,0 об. H2O до достижения конечной концентрации 40 об. 10% H2O/CH3CN относительно исходной кислоты. Эту суспензию нагревали до температуры 78,0°C±5,0°C (температура кипячения с обратным холодильником). Суспензию затем перемешивали в течение не менее чем 5 часов. Суспензию охлаждали до температуры 20°C-25°C в течение 5 часов и фильтровали. Осадок промывали при помощи CH3CN (5 об.), нагревали до температуры 20°C-25°С 4 раза. Полученное твердое вещество (соединение 34) сушили в вакуумной печи при температуре 50,0°C±5,0°C.1H ЯМР (400 МГц, DMCO-d6) δ 12,8 (с, 1H), 11,8 (с, 1H), 9,2 (с, 1H), 8,9 (с, 1H), 8,3 (с, 1H), 7,2 (с, 1H), 7,9 (т, 1H), 7,8 (д, 1H), 7,5 (т, 1H), 7,1 (с, 1H), 1,4 (с, 9H), 1,4 (с, 9H).
Пример 7: Процедура биосинтеза N-(2-трет-бутил-5-гидрокси-4-(1-гидрокси-2-метилпропан-2-ил)фенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (27) и 2-(5-трет-бутил-2-гидрокси-4-(4-оксо-1,4-дигидрохинолин-3-карбоксамидо)фенил)-2-метилпропановой кислоты (28)
Streptomyces rimosus (DSM 40260) приобретали у DSMZ в качестве замороженной культуры. Эту культуру использовали для инокуляции скошенных агаров, которые поддерживали и хранили при температуре 4°C. Дрожжевой экстракт-солодовый экстракт-пептон (YMP) среду, содержащую дрожжевой экстракт (4 г/л), солодовый экстракт (10 г/л) и соевую муку (5 г/л), получали и стерилизовали при 130°C в течение 60 минут. Пять колб, содержащих 1 л YMP среды, непосредственно инокулировали S. rimosus из скошенных агаров. Культуре давали расти в течение 2-3 дней при 30°C при осторожном взбалтывании приблизительно при 100 об/мин. В этих условиях наблюдали два типа роста, либо мутный раствор, либо сфероидальные частицы, которые скапливались на дне колбы. Было показано, что этот последний тип роста приводит к более высоким преобразованиям в Соединение 27. Клетки затем центрифугировали, собирали и ресуспендировали в двух колбах, содержащих 1 л 0,1 M калий-фосфатного буфера, pH 7,0. В колбы добавляли 5,0 г соединения 34 в 50 мл N,N-диметилформамида (ДМФА). Реакции осуществляли в течение 24 часов при 30ºC при осторожном взбалтывании при около 100 об/мин, к этому моменту анализ ВЭЖХ показал преобразования 7,59% Соединения 27 и 1,17% Соединения 28.
Содержимое обеих колб объединяли, центрифугировали при 3500 об/мин в течение 10 минут и ресуспендировали в 500 мл метанола. Эту суспензию интенсивно перемешивали в течение 30 минут и затем центрифугировали снова при 6000 об/мин в течение 10 минут. Органический слой собирали и процесс повторяли два раза. Метанольные экстракты концентрировали в вакууме с получением 2,50 г, 1,57 г и 1,11 г твердого вещества, соответственно. Было показано, что твердые вещества из этих экстрактов содержат 74,78-91,96% Соединения 34, 7,66-19,73% Соединения 27 и 0,39-5,49% Соединения 28. Для отбора порции соединения 34 из продуктов биоокисления, твердые вещества из первых двух экстракций объединяли, суспендировали в 250 мл метанола, интенсивно перемешивали в течение 1 часа и фильтровали в вакууме. Хотя Соединения 27 и 28 были обогащенными в фильтрате (22,09 и 6,14%, соответственно), твердые вещества все еще также содержали Соединение 27 (8,96%) и Соединение 28 (0,50%).
Метанольный фильтрат, содержащий приблизительно 2,2 г растворенных твердых веществ, адсорбировали на 4,5 г диоксида кремния и очищали флэш-хроматографией с использованием градиента 100% дихлорметана →88:12 дихлорметан/метанол. Фракции, содержащие Соединение 27, концентрировали в вакууме и далее сушили при помощи сушки замораживанием с получением 130 мг соединения 27 (98,5% чистота по данным ВЭЖХ). Фракцию, содержащую неочищенное Соединение 28, также концентрировали в вакууме с получением менее чем 10 мг твердого вещества.
Клеточный осадок после центрифугирования ресуспендировали в 500 мл метанола и гомогенизировали в BeadBeater для отслоения клеток и выделения какого-либо оставшегося продукта. Органический слой получали путем центрифугирования гомогенизированной суспензии при 6000 об/мин в течение 10 минут. Его добавляли к твердому веществу, полученному из третьей экстракции и отфильтрованных твердых веществ из обогащенной суспензии первых двух экстракций, и суспендировали при температуре кипения с обратным холодильником в течение ночи. Суспензию затем охлаждали и подвергали вакуумной фильтрации с получением 1,99 г твердого вещества. Твердое вещество снова растворяли в 300 мл метанола, затем адсорбировали на приблизительно 5 г диоксида кремния и очищали флэш-хроматографией с использованием градиента 100% дихлорметана →94:6 дихлорметан/метанол с получением 820 мг твердого вещества, содержащего Соединение 34 и Соединение 27, а также другие примеси. Полученное вещество снова подвергали колоночной очистке с использованием более высокого градиента растворителя (100% ДХМ →смесь 6% MeOH/94% ДХМ) с получением дополнительных 89 мг соединения 27. Спектр1H-ЯМР соответствовал указанному выше.
Пример 8: Процедура перекристаллизации N-(2,4-ди-трет-бутил-5-гидроксифенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида (34)

Соединение 34 (1,0 экв.) загружали в реактор. Добавляли 2-МеТГФ (20,0 об.) с последующим добавлением 0,1N раствора HCl (5,0 об.). Двухфазный раствор перемешивали и разделяли и верхнюю органическую фазу промывали два раза дополнительным количеством 0,1 N раствора HCl (5,0 об.). Органический раствор тщательно фильтровали для удаления каких-либо твердых частиц и помещали во второй реактор. Отфильтрованный раствор концентрировали при температуре не выше 35°C (температура рубашки реактора) и не выше 8,0°C (внутренняя температура реакции) при пониженном давлении до 10 об. Добавляли изопропилацетат (IPAc) (10 об.) и раствор концентрировали при температуре не выше 35°C (температура рубашки реактора) и не выше 8,0°C (внутренняя температура реакции) до 10 об. Добавление IPAc и концентрирование повторяли еще 2 раза, всего 3 добавления IPAc и 4 процедуры концентрирования до 10 об. После конечной процедуры концентрирования загружали 10 об. IPAc и суспензию нагревали до температуры кипения с обратным холодильником и поддерживали при этой температуре в течение 5 часов. Суспензию охлаждали до 0,0°C ±5°C в течение 5 часов и фильтровали. Осадок промывали при помощи IPAc (5 об.) один раз. Полученное твердое вещество сушили в вакуумной печи при 50,0°C±5,0°C.
Пример 9: Общая процедура испытания растворимости при pH 7,4
Высокопроизводительный анализ во встряхиваемой колбе использовали для определения растворимости соединений в pH 7,4 буфере. Для расчета концентрации соединений в растворе эксперименты осуществляли с использованием двух условий для каждого соединения: 300 мкМ в 100% DMSO и 200 мкМ в pH 7,4 фосфатном буфере в присутствии 2% DMSO. Каждый образец оставляли для встряхивания в течение ночи, затем вводили в колонку ВЭЖХ-УФ для определения площади пика с использованием следующих условий: колонка Phenomenex 00A-4251-B0 - 30×2,00 мм Luna 3 мкм C18(2) 100A; скорость потока 0,8 мл/мин; объем вводимой пробы 20 мкл; подвижные фазы: стандартная вода для ВЭЖХ с 0,1% муравьиной кислоты и стандартный ацетонитрил для ВЭЖХ с 0,1% муравьиной кислоты; площадь пика определяли при 254 нм. Растворимость в мкМ рассчитывали с использованием следующего уравнения: конц.=(площадь пика pH 7,4)/( площадь пика 300 мкМ DMSO стандартные условия)×300 мкМ концентрация стандартных условий. Представляющие интерес пики определяли в буферных условиях на основании времени удерживания (RT) самой большой площади пика в 300 мкМ DMSO стандартных условиях.
VI. АНАЛИЗЫ АКТИВНОСТИ
Пример 10: Общая процедура для анализов активности
Анализы для детекции и измерения ΔF508-CFTR-потенцирующих свойств соединений
Оптические методы определения мембранного потенциала для анализа ΔF508-CFTR-модулирующих свойств соединений
В анализе используют чувствительные к флуоресцентному потенциалу красители для измерения изменения мембранного потенциала с использованием планшет-ридера для считывания флуоресценции (например, FLIPR III, Molecular Devices, Inc.) для получения данных, показывающих повышение уровня функционального ΔF508-CFTR в клетках NIH 3T3. Движущей силой для ответа является создание градиента хлоридных ионов в связи с активацией канала путем однократного добавления жидкости после того, как клетки были предварительно обработаны соединениями с последующей нагрузкой потенциал-чувствительного красителя.
Идентификация потенцирующих соединений
Для идентификации ΔF508-CFTR-потенциирующих средств был разработан HTS анализ в формате двойного добавления. В этом HTS анализе используют чувствительные к флуоресцентному потенциалу красители для измерения изменения мембранного потенциала на FLIPR III как показателя усиления воротного механизма (проводимости) ΔF508 CFTR в ΔF508 CFTR NIH 3T3 клетках с коррекцией на температуру. Движущей силой для ответа является градиент Cl- ионов в связи с активацией канала форсколином при однократном добавлении жидкости с использованием планшет-ридера для считывания флуоресценции, такого как FLIPR III, после того как клетки были предварительно обработаны потенциирующими соединениями (или DMSO носителем в качестве контроля) с последующей нагрузкой красителя редистрибуции.
Растворы
Раствор в ванночке #1: (в мМ) NaCl 160, KCl 4,5, CaCl2 2, MgCl2 1, HEPES 10, pH 7,4 при помощи NaOH.
Раствор в ванночке без хлора: Хлоридные соли в Растворе в ванночке #1 замещены глюконатными солями.
Клеточная культура Мышиные фибробласты NIH3T3, стабильно экспрессирующие ΔF5O8-CFTR, использовали для оптических измерений мембранного потенциала. Клетки поддерживали при 37°C в 5% CO2 и 90% влажности в модифицированной Дульбекко среде Игла, дополненной 2 мМ глутамин, 10% фетальной бычьей сыворотки, ×1 NEAA, β-ME, ×1 пенициллина/стрептомицина и 25 мМ HEPES в 175 см2 культуральных колбах. Для всех оптических анализов, клетки высевали при плотности ~20000/лунка в 384-луночных матригель-покрытых планшетах и культивировали в течение 2 часов при 37°C, затем культивировали при 27°C в течение 24 часов для анализа потенциирующего средства. Для корректирующих анализов, клетки культивировали при 27°C или 37°C с и без соединения в течение 16-24 часов. Электрофизиологические анализы для определения ΔF508-CFTR-модулирующих свойств соединений.
1. Анализ с использованием камеры Ussing
Эксперименты с использованием камеры Ussing осуществляли на поляризованных эпителиальных клетках дыхательных путей, экспрессирующих ΔF508-CFTR, для дальнейшей характеризации модуляторов ΔF508-CFTR, идентифицированных в оптических анализах. Не-CF и CF эпителии дыхательных путей выделяли из бронхиальной ткани, культивировали, как описано ранее (Galietta, L.J.V., Lantero, S., Gazzolo, A., Sacco, O., Romano, L., Rossi, G.A., & Zegarra-Moran, O. (1998) In Vitro Cell. Dev. Biol. 34, 478-481), и высевали на Costar® Snapwell™ фильтры, которые были предварительно покрыты NIH3T3-кондиционированной средой. Через четыре дня апикальную среду удаляли и клетки выращивали на границе раздела воздух-жидкость в течение >14 дней перед их использованием. Это приводило к образованию монослоя полностью дифференцированных цилиндрических клеток, которые были реснитчатыми, особенность, которая является характерной для эпителия дыхательных путей. Не-CF HBE выделяли у некурящих субъектов, которые не страдали каким-либо известным легочным заболеванием. CF-HBE выделяли у пациентов, гомозиготных для ΔF508-CFTR.
Включения HBE, выращенные на Costar® Snapwell™ клеточной культуре, помещали в камеру Ussing (Physiologic Instruments, Inc., San Diego, CA) и измеряли трансэпителиальное сопротивление и ток короткого замыкания в присутствии базолатерального →апикального градиента Cl- (ISc) с использованием системы фиксации потенциала (Department of Bioengineering, University of Iowa, IA). Вкратце, HBE исследовали в условиях регистрации фиксации потенциала (Vhold=0 мВ) при 37°C. Базолатеральный раствор содержал (в мМ) 145 NaCl, 0,83 K2HPO4, 3,3 KH2PO4, 1,2 MgCl2, 1,2 CaCl2, 10 Глюкозы, 10 HEPES (pH доводили до 7,35 при помощи NaOH), и апикальный раствор содержал (в мМ) 145 NaГлюконата, 1,2 MgCl2, 1,2 CaCl2, 10 глюкозы, 10 HEPES (pH доводили до 7,35 при помощи NaOH).
Идентификация потенцирующих соединений
Типичный протокол включал использование градиента концентрации Cl- на базолатеральной →апикальной мембране. Для установления этого градиента, на базолатеральной мембране использовали нормальные растворы Рингера, тогда как на апикальной NaCl заменяли эквимолярным количеством глюконата натрия (титровали до pH 7,4 при помощи NaOH) с получением высокого градиента концентрации Cl- через эпителий. Форсколин (10 мкМ) и все испытываемые соединения добавляли на апикальной стороне включений клеточной культуры. Эффективность предполагаемых ΔF508-CFTR-потенциирующих средств сравнивали с эффективностью известного потенциирующего средства генистеина.
2. Пэтч-кламп регистрация
Общий Cl- ток в ΔF508-NIH3T3 клетках отслеживали с использованием перфорированного пэтч-кламп метода, как описано ранее (Rae, J., Cooper, K., Gates, P., & Watsky, M. (1991) J. Neurosci. Methods 37, 15-26). Определение фиксации потенциала осуществляли при 22°C с использованием Axopatch 200B пэтч-кламп усилителя (Axon Instruments Inc., Foster City, CA). Раствор в пипетке содержал (в мМ) 150 N-метил-D-глюкамин (NMDG)-Cl, 2 MgCl2, 2 CaCl2, 10 EGTA, 10 HEPES и 240 мкг/мл амфотерицина-B (pH доводили до 7,35 при помощи HCl). Внеклеточная среда содержала (в мМ) 150 NMDG-Cl, 2 MgCl2, 2 CaCl2, 10 HEPES (pH доводили до 7,35 при помощи HCl). Генерирование импульсов, сбор данных и анализ осуществляли с использованием ПК, снабженного Digidata 1320 AJD интерфейсом, в сочетании с Clampex 8 (Axon Instruments Inc.). Для активации ΔF508-CFTR, 10 мкМ форсколина и 20 мкМ генистеина добавляли в ванночку и отношение ток-напряжение контролировали через каждые 30 сек.
Идентификация потенцирующих соединений
Способность ΔF508-CFTR-потенциирующих средств увеличивать макроскопический ΔF508-CFTR Cl- ток (IΔF508) в NIH3T3 клетках, стабильно экспрессирующих ΔF508-CFTR, также исследовали с использованием перфорированного пэтч-кламп метода. Потенциирующие средства, идентифицированные в оптических анализах, вызывали дозо-зависимое повышение IΔF508 с такой же активностью и эффективностью, как наблюдали в оптических анализах. Во всех исследованных клетках потенциал реверсии до и в процессе аппликации потенциирующего средства был около -30 мВ, что представляет собой рассчитанное значение ECl (-28 мВ).
Клеточная культура
Мышиные фибробласты NIH3T3, стабильно экспрессирующие ΔF508-CFTR, использовали для регистрации в конфигурации “целая клетка”. Клетки поддерживали при 37°C в условиях 5% CO2 и 90% влажности в модифицированной Дульбекко среде Игла, дополненной 2 мМ глутамина, 10% фетальной бычьей сыворотки, ×1 NEAA, β-ME, ×1 пенициллина/стрептомицина и 25 мМ HEPES, в 175 см2 колбах для культивирования. Для регистрации в конфигурации “целая клетка”, 2500-5000 клеток высевали на поли-L-лизин-покрытые покровные стекла и культивировали в течение 24-48 часов при 27°C перед их использованием для испытания активности потенциирующих средств; и инкубировали с или без корректирующего соединения при 37°C для измерения активности корректирующих соединений.
3. Анализы одиночных каналов
Воротную активность wt-CFTR и температуру-скорректированного ΔF508-CFTR, экспрессируемого в NIH3T3 клетках, наблюдали с использованием пэтч-регистраций в изолированных участках мембран в конфигурации “внутренняя сторона наружу”, как описано ранее (Dalemans, W., Barbry, P., Champigny, G., Jallat, S., Dott, K., Dreyer, D., Crystal, R.G., Pavirani, A., Lecocq, J-P., Lazdunski, M. (1991) Nature 354, 526-528), с использованием Axopatch 200B пэтч-кламп усилителя (Axon Instruments Inc.). Раствор в пипетке содержал (в мМ): 150 NMDG, 150 аспарагиновой кислоты, 5 CaCl2, 2 MgCl2 и 10 HEPES (pH доводили до 7,35 при помощи Tris основания). Раствор в ванночке содержал (в мМ): 150 NMDG-Cl, 2 MgCl2, 5 EGTA, 10 TES и 14 Tris основания (pH доводили до 7,35 при помощи HCl). После эксцизии, оба wt- и ΔF508-CFTR активировали путем добавления 1 мМ Mg-АТФ, 75 нМ каталитической субъединицы cAMP-зависимой протеинкиназы (PKA; Promega Corp. Madison, WI) и 10 мМ NaF для ингибирования протеинфосфатаз, которые препятствовали прохождению тока. Потенциал в пипетке поддерживали при 80 мВ. Активность каналов анализировали в маленьких изолированных участках мембран, содержащих ≤2 активных канала. Максимальное количество одновременных открытий определяло количество активных каналов в процессе эксперимента. Для определения амплитуды тока одиночного канала данные, зарегистрированные от 120 сек ΔF508-CFTR активности, фильтровали "off-line" при 100 Гц и затем использовали для построения амплитудных гистограмм по всем точкам, которые подгоняли при помощи множества функций Гаусса с использованием программы Bio-Patch Analysis (Bio-Logic Comp. France). Общий микроскопический ток и вероятность раскрытия (P0) определяли из 120 сек активности канала. P0 определяли с использованием программы Bio-Patch или из зависимости P0=I/i(N), где I = означает ток, i = амплитуда тока одиночного канала, и N = количество активных каналов в пэтче.
Клеточная культура
Мышиные фибробласты NIH3T3, стабильно экспрессирующие ΔF508-CFTR, использовали для пэтч-кламп регистраций в изолированных участках мембран. Клетки поддерживали при 37°C в условиях 5% CO2 и 90% влажности в модифицированной Дульбекко среде Игла, дополненной 2 мМ глутамина, 10% фетальной бычьей сыворотки, ×1 NEAA, β-ME, ×1 пенициллина/стрептомицина и 25 мМ HEPES, в 175 см2 колбах для культивирования. Для регистрации одиночных каналов, 2500-5000 клеток высевали на поли-L-лизин-покрытые покровные стекла и культивировали в течение 24-48 часов при 27°C перед их использованием.
Соединения формулы 1 являются полезными в качестве модуляторов АТФ связывающих кассетных транспортеров.
ДРУГИЕ ВАРИАНТЫ ВОПЛОЩЕНИЯ
Все публикации и патенты, на которые имеются ссылки в настоящем раскрытии, включены в настоящую заявку посредством ссылки в той степени, как если бы каждая такая публикация или патентная заявка была конкретно и индивидуально указана как включенная посредством ссылки. В случае, если значения терминов в каком-либо из патентов или публикаций, включенных посредством ссылки, противоречат значению терминов, используемых в настоящем раскрытии, предполагается, что значения терминов в настоящем раскрытии являются определяющими. Кроме того, представленное выше обсуждение раскрывает и описывает только иллюстративные варианты воплощения настоящего изобретения. Специалисты в данной области смогут легко определить, исходя из такого обсуждения и из сопутствующих чертежей и формулы изобретения, что возможны различные изменения, модификации и варианты, без отступления от сути и объема настоящего изобретения, как оно определено в следующей далее формуле изобретения.
Реферат
Изобретение относится к области органической химии, а именно к способу получения соединения формулы 1, включающему конденсацию карбоновой кислоты формулы 2 с анилином формулы 3 в присутствии ТЗР®, где каждый Rи Rнезависимо представляет собой Cалкил с прямой или разветвленной цепью, и каждый Cалкил с прямой или разветвленной цепью независимо и необязательно замещен -OR′; каждый Rпредставляет собой ОС(О)OR′ или Rи R, взятые вместе, образуют группу; y представляет собой 0; каждый R′ представляет собой Cалкильную группу, необязательно замещенную одной или более группами, выбранными из оксо и -O-C-алкильной группы. Также изобретение относится к промежуточным соединениям и способам их получения. Технический результат: разработан новый способ получения соединения формулы 1, который может быть полезен в качестве модулятора регулятора трансмембранной проводимости кистозного фиброза (“CFTR”). 9 н.п. и 43 з.п.ф-лы, 10пр.,,
Формула
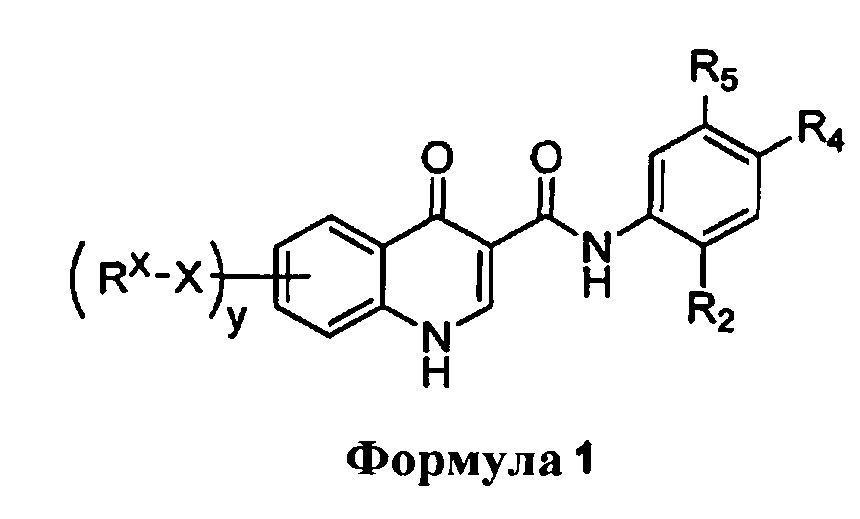
включающий конденсацию карбоновой кислоты формулы 2

с анилином формулы 3

в присутствии Т3Р®, где
каждый R2 и R4 независимо представляет собой C1-6 алкил с прямой или разветвленной цепью, и каждый C1-6 алкил с прямой или разветвленной цепью независимо и необязательно замещен -OR′;
каждый R5 представляет собой ОС(О)OR′ или
R4 и R5, взятые вместе, образуют группу

y представляет собой 0;
каждый R′ представляет собой C1-4 алкильную группу, необязательно замещенную одной или более группами, выбранными из оксо и -O-C1-4-алкильной группы.


с водным раствором кислоты с получением соединения формулы 2.



с метилтриметилсилилдиметилкетенацеталем (MTDA)
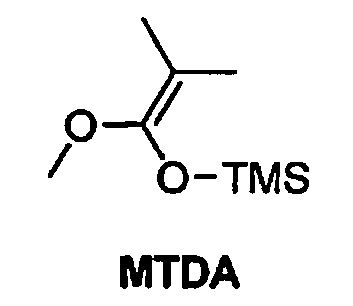
с получением соединения формулы 45


включающий контактирование соединения формулы 4
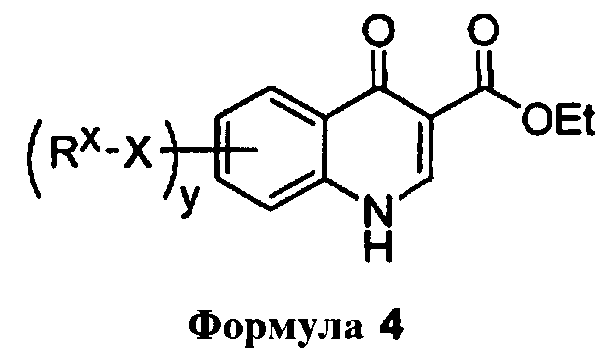
с водным раствором кислоты, где у представляет собой 0;

включающий стадию контактирования соединения формулы 41

с метилтриметилсилилдиметилкетенацеталем (MTDA)

с получением соединения формулы 42

восстановление соединения формулы 42 с помощью LiAlH4 с получением соединения формулы

контактирование полученного соединения с метилхлорформиатом с получением соединения формулы

и восстановление полученного соединения с получением соединения формулы 40.
где каждый R2, независимо представляет собой C1-6алкил с прямой или разветвленной цепью и
каждый R5 независимо представляет собой -ОН или ОС(О)OR′ и
каждый R′ независимо представляет собой C1-4 алкильную группу.

включающий стадию контактирования соединения, имеющего формулу 44

с метилтриметилсилилдиметилкетенацеталем (MTDA)

с получением соединения формулы 45

и восстановление соединения формулы 45 с получением соединения формулы 46,
где каждый R2 представляет собой C1-6алкил с прямой или разветвленной цепью.

включающий:
(а) взаимодействие соединения 26

с соединением 32

в присутствии Т3Р® и пиридина, с использованием 2-метилтетрагидрофурана в качестве растворителя, где температуру реакции поддерживают в пределах около 42°C-53°C, и где реакцию осуществляют в течение, по меньшей мере, 2 часов, с получением соединения 33

(b) обработку соединения 33 при помощи NaOMe/MeOH в 2-метилтетрагидрофуране.

включающий:
(а) взаимодействие соединения 26

с соединением 32

в присутствии ангидрида 2-пропан фосфоновой кислоты и пиридина, с использованием 2-метилтетрагидрофурана в качестве растворителя, где температуру реакции поддерживают в пределах около 42°C-53°C, и где реакцию осуществляют в течение, по меньшей мере, 6 часов, с получением соединения 33

(b) обработку соединения 33 при помощи NaOMe/MeOH в 2-метилтетрагидрофуране;
(c) добавление раствора 1,2н. HCl к реакционной смеси с образованием первой двухфазной смеси;
(d) отделение первой двухфазной смеси;
(e) добавление раствора 0,1н. HCl к органической фазе первой двухфазной смеси с образованием второй двухфазной смеси;
(f) отделение органической фазы от второй двухфазной смеси;
(g) уменьшение количества растворителя в органической фазе второй двухфазной смеси на 50% с использованием дистилляции;
(h) увеличение объема органической фазы второй двухфазной смеси на 100% добавлением ацетонитрила;
(i) выполнение стадий (g)-(h) дополнительно два раза;
(j) добавление воды к органической фазе второй двухфазной смеси с получением суспензии соединения 34 в ацетонитриле и воде, где суспензия имеет соотношение ацетонитрила к воде 9:1;
(k) нагревание суспензии до температуры в пределах около 73°C-83°C в течение 3 часов;
(l) охлаждение суспензии до температуры в пределах 20°C-25°C;
(m) фильтрование и отделение твердого вещества от суспензии.

включающий:
(а) взаимодействие соединения 26

с соединением 32

в присутствии ангидрида пропан фосфоновой кислоты и пиридина, с использованием 2-метилтетрагидрофурана в качестве растворителя, где температуру реакции поддерживают в пределах около 42°C-53°C, и где реакцию осуществляют в течение, по меньшей мере, 2 часов, с получением соединения 33

(b) гидролиз метоксикарбонильной группы при фенольном атоме кислорода соединения 33 путем обработки соединения 33 при помощи NaOMe/MeOH в 2-метилтетрагидрофуране с получение соединения 34;
(c) формирование суспензии соединения 34 в ацетонитриле и воде с получением соединения 34 в чистой форме.
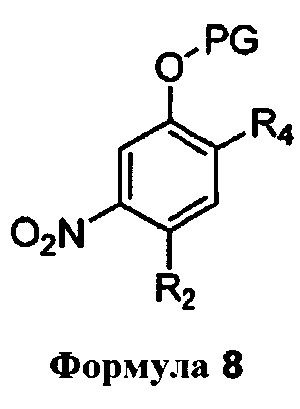
включающий нитрование соединения формулы 7 с использованием смеси серной и азотной кислот в присутствии дихлорметана

где PG представляет собой защитную группу, и каждый из R2 и R4 представляет собой трет-бутил, и где нитросоединение формулы 8 очищают при помощи кристаллизации.

с реагентом, способным вызывать присоединение защитной группы к фенольному кислороду соединения формулы 6 в присутствии растворителя.

путем восстановления соединения формулы 8.
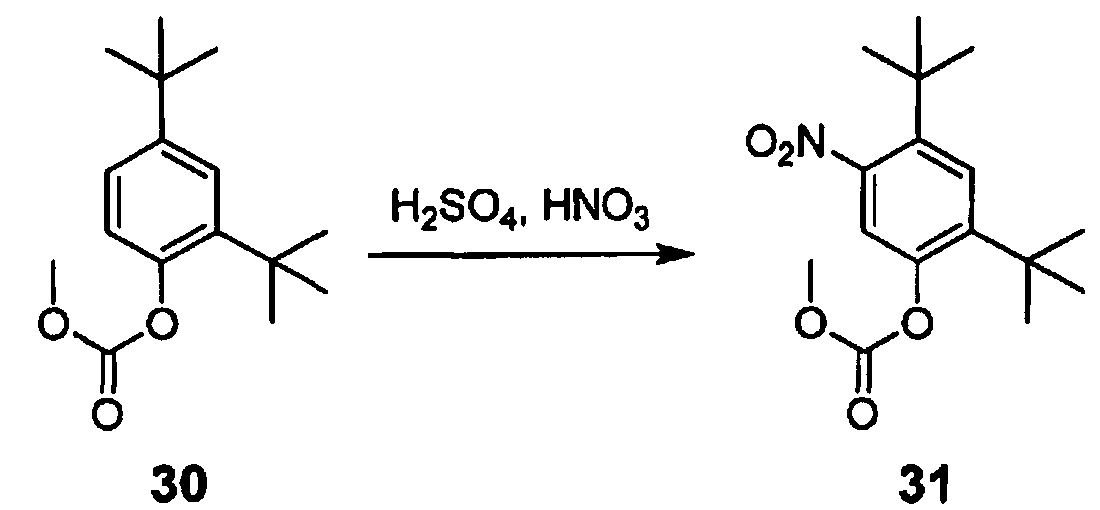

Документы, цитированные в отчёте о поиске
Способ получения анилиновых производных и 3-метил-7-нитро-3н-изобензофуран-1-он

Комментарии