Применение hsp70 в качестве регулятора ферментативной активности - RU2521672C2
Код документа: RU2521672C2
Чертежи



















Описание
Данная заявка является непредварительной заявкой патентной заявки DK PA 2008 00885, поданной 26 июня 2008 года, которая включена в настоящее описание в полном объеме в качестве ссылки. Все патентные и непатентные ссылки, указанные в предварительной заявке или в настоящей заявке, также включены в настоящее описание в полном объеме в качестве ссылки.
Область изобретения
Настоящее изобретение относится к области модуляции ферментативной активности посредством использования взаимодействия между молекулярным шапероном Hsp70 и лизосомальным фосфолипидом бис(моноацилглицеро)фосфатом (BMP, также известным под названием LBPA). Взаимодействие Hsp70-BMP модулирует активность ферментов лизосомального компартмента, взаимодействующих с BMP, и, таким образом, настоящее изобретение предоставляет средства реверсирования патологии лизосомных болезней накопления.
Уровень техники
Молекулярные шапероны обнаруживаются во всех компартментах клетки, где имеют место конформационные перегруппировки белков, хотя синтез белков является главным источником несвернутых пептидов в клетке, проблема клетки, которая возникает из-за высокой температуры или других стимулов, которые могут делать белки структурно лабильными и, таким образом, подверженными несвертыванию и агрегации, сталкивается со специфическим клеточным ответом, вовлекающим продукцию защитных белков. Данный ответ представляет собой явление, которое наблюдают во всех типах клеток от прокариот до эукариот и обозначают как ответ на тепловой шок или стресс. Индуцируемые данным ответом белки известны как белки теплового шока (HSP), среди которых существует несколько семейств.
Основным примером семейства шаперонов являются белки Hsp70. Недавно данное семейство связали с другими аспектами клеточного гомеостаза, помимо функционирования в качестве шаперона, наиболее заметно по причине своих антиапоптотических свойств, своих функций в иммунитете и явной зависимости злокачественных клеток от стимуляции Hsp70. Кроме того, Hsp70 может играть роль в сохранении целостности лизосом. Однако молекулярные механизмы остаются неясными.
Лизосомные болезни накопления являются редкой группой заболеваний, характеризуемой накоплением веществ в лизосомальном компартменте и приводящей к его дестабилизации, что оказывает разрушительное действие на пораженных индивидуумов. Вещества накапливаются в лизосомальном компартменте по причине дефицита ферментов, вовлеченных в их катаболизм.
К настоящему времени не существует доступного лечения большинства лизосомных болезней накопления. Основной причиной данной группы заболеваний является неспособность специфических лизосомальных ферментов эффективно катаболизировать специфические лизосомальные вещества, такие как липиды. Таким образом, для подгруппы данных заболеваний, включающей болезнь Гоше и болезнь Фабри, применяют заместительную терапию ферментами (ERT) посредством предоставления пациенту рекомбинантного фермента. Однако ERT является дорогим видом терапии, что может ограничивать ее применение в некоторых регионах, и эффективным только против специфического типа заболевания, для которого получен рекомбинантный фермент. Целью настоящего изобретения является предоставление новых средств для лечения лизосомных болезней накопления.
Сущность изобретения
В настоящем изобретении молекулярную основу участия Hsp70 в стабильности лизосомальной мембраны описывают посредством объяснения молекулярной основы ассоциации между Hsp70 и клеточными мембранами, в частности, цитоплазматической и лизосомальной мембранами.
Из литературы известно, что Hsp70 может играть роль в сохранении целостности лизосом. Однако молекулярный механизм остается неясным. Кроме того, вопрос, является ли данное свойство специфическим для большинства индуцируемых стрессом Hsp70 (HspA1A/A1Β обозначены как Hsp70 на всем протяжении данного исследования) или обладают ли другие члены семейства Hsp70 теми же характеристиками, также не рассматривался.
Данные оставшиеся без ответа вопросы подсказали одну из главных целей данного изобретения, представляющую собой исследование молекулярной основы лизосомально-протективного действия Hsp70. В связи с этим разрабатывали способ получения рекомбинантного Hsp70 и его мутантов, как и способ субклеточного фракционирования, основанного на ультрацентрифугировании в градиенте йодиксанола. Анализ для прямой оценки целостности лизосомальной мембраны основывается на индуцированной фотоокислением проницаемости лизосом, что делает возможным микроскопический подход к оценке действия Hsp70 и других компонентов в реальном времени в отношении их способности делать чувствительными или защищать лизосомальные мембраны. В различных системах in vitro исследовали взаимодействие рекомбинантного Hsp70 и мутантов с различными липидами, включая измерение рассеяния света липосомами под углом 90°, сдвига флуоресценции триптофана и поверхностного плазмонного резонанса (BIAcore). Моделирование электростатической поверхности Hsp70 in silico помогло в создании концептуальной модели взаимодействия Hsp70-BMP. Для проверки in vivo соответствия наблюдаемого в системах in vitro взаимодействия липидов взаимодействие BMP-Hsp70 метили в отношении обоих компонентов. Для дальнейшей демонстрации возможности применения данного механизма описывали способ гибели клеток, индуцируемой введением цисплатина, и в этой системе гибели клеток метили лизосомальный Hsp70 в линиях опухолевых и нетрансформированных клеток.
Для рассмотрения молекулярной основы вклада Hsp70 в стабильность лизосомальной мембраны авторы стремились установить систему, которая устраняла бы влияние цитозольного Hsp70, т.е. нацеливания Hsp70 непосредственно на лизосомы. На фотографиях электронной микроскопии Nylandsted et al. показано, что Hsp70 может присутствовать внутри лизосом, и, таким образом, решали разрабатывать способ получения рекомбинантного Hsp70 человека (rHsp70) в надежде применять механизм эндоцитоза в качестве способа доставки rHsp70 напрямую в лизосомы. Авторы настоящего изобретения преодолевали, таким образом, необходимость добавления лизосомальных сортировочных сигналов Hsp70, потенциально нарушая функции и избегая осложнений, которые могут появляться вследствие сверхэкспрессии. Кроме того, эндоцитозный подход делает возможным титрование количеств rHsp70 и в длительной перспективе открывает возможности изучения механизма поглощения внеклеточного Hsp70.
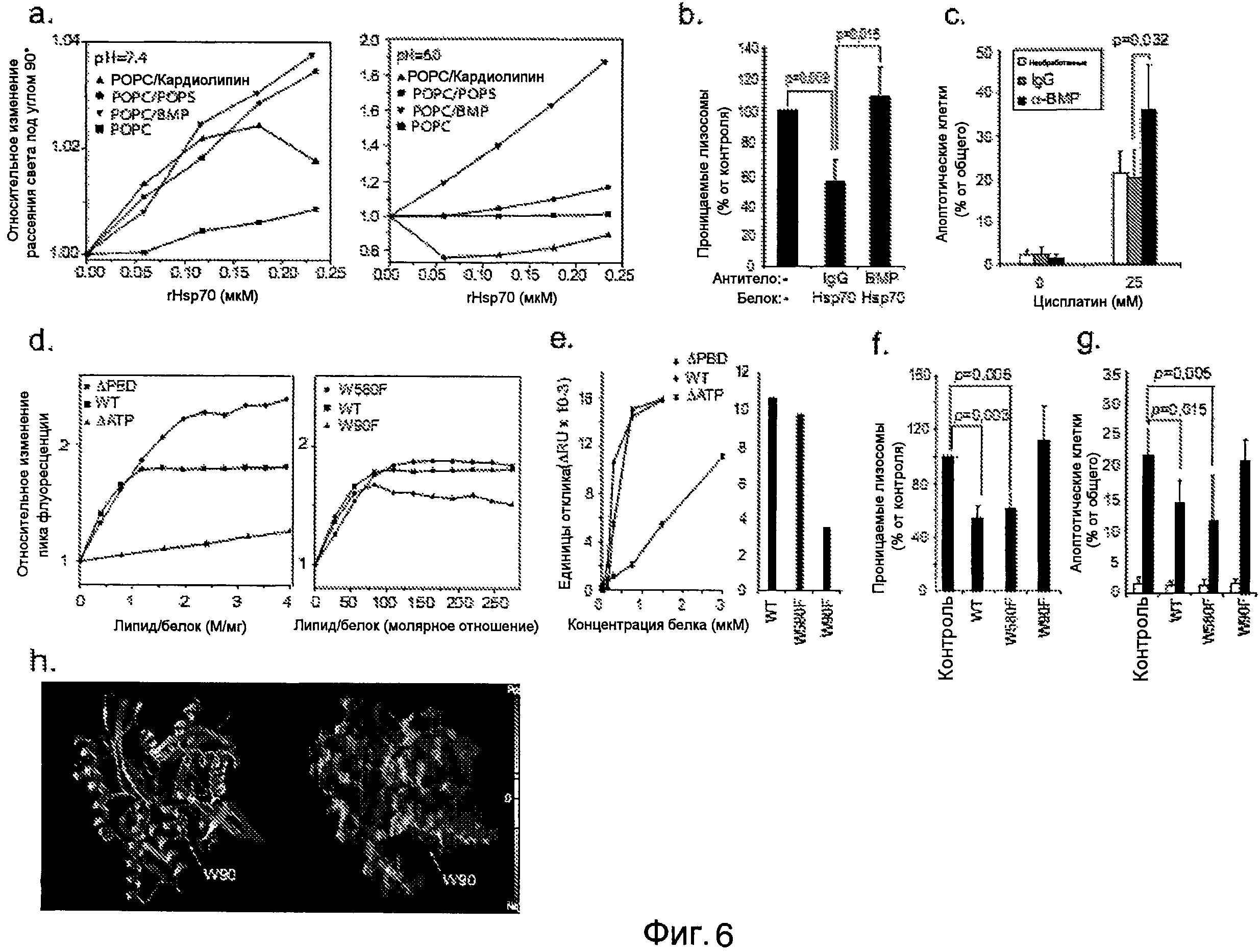
Обладая разработанным способом получения Hsp70, для оценки эндоцитоза его метили флуорофором Alexa Fluor 488 (Hsp70-AF488). С применением конфокальной визуализации показывали, что rHsp70 в действительности, таким образом, нацелен на лизосомы. Затем для оценки влияния на стабильность лизосомальной мембраны авторы разрабатывали способ количественного определения проницаемости лизосомальной мембраны на уровне единичных лизосом и применение данного способа для оценки действия подвергшегося эндоцитозу rHsp70. Данные способы формируют основу для примеров 1 и 2, в которых авторы показывают, что Hsp70 усиливает выживание клетки посредством стабилизации лизосом посредством pH-зависимого высокоаффинного связывания с эндолизосомальным анионным фосфолипидом бис(моноацилглицеро)фосфатом (BMP). Положительно заряженный АТФазный домен Hsp70 отвечает за связывание, но субстрат-связывающий домен также необходим для эффективной стабилизации лизосом. Любопытно, что данное взаимодействие и протективное действие, которое оно оказывает, зависят от триптофана 90, локализованного в положительно заряженном клине АТФазного домена. Важно, что можно достичь цитопротективного действия доставкой rHsp70 посредством эндоцитоза и специфически отменить его посредством внеклеточного введения антител BMP или ингибиторов Hsp70.
В дополнение к этому, авторы также стремились соединить механизм защиты лизосомальных мембран Hsp70 с явлениями образования опухоли и программируемой гибели клеток. Таким образом, авторы характеризовали программу гибели клеток, инициируемую введением общепринятого химиотерапевтического средства цисплатина, и обнаруживали, что она не зависит от каспазы, но для нее характерно лизосомальное высвобождение протеаз. Трансгенный, также как и подвергшийся эндоцитозу, Hsp70 способен усиливать выживание клеток в условиях воздействия цисплатина посредством стабилизации лизосомальных мембран. Любопытно, что авторы показали, что меченый лизосомальный Hsp70 сам по себе или его лизосомальный партнер по взаимодействию бис(моноацилглицеро)фосфат (BMP) делают трансформированные, но не нетрансформированные, линии клеток предстательной железы чувствительными к цисплатину, что служит экспериментальным подтверждением применения взаимодействия BMP-Hsp70 в качестве фармакологической мишени для терапии злокачественных опухолей.
Любопытно, что, несмотря на то, что Hsp70-2 обладает 86% гомологией по последовательности аминокислот с Hsp70, он не способен защищать лизосомальные мембраны напрямую. Однако истощение Hsp70-2 также сказывается на проницаемости лизосомальной мембраны и последующей программируемой гибели клеток. Данное действие не зависит от прямого взаимодействия Hsp70-2 и лизосомального компартмента, а скорее контролируется через подавление фактора роста эпителия хрусталика (LEDGF) в ответ на истощение Hsp70-2.
Способы и результаты данного исследования более подробно рассматриваются в разделе Примеры.
Объясняя в настоящем документе молекулярную основу цитопротективного действия Hsp70 посредством взаимодействия с лизосомальным BMP, способствующего лизосомальной стабилизации, полученные данные предоставляют основу для терапевтического воздействия на лизосомные болезни накопления.
К настоящему моменту продемонстрировано, что, неожиданно, введение рекомбинантного Hsp70 в клетки эффективно реверсирует патологию лизосомных болезней накопления, как показано в настоящем документе для болезни Ниманна-Пика и болезни Фарбера. Кроме того, введение в клетки индуктора Hsp70, бензилового спирта, эффективно реверсирует патологию лизосомных болезней накопления, как показано в настоящем документе для болезни Ниманна-Пика.
Таким образом, настоящее изобретение относится к способу лечения лизосомных болезней накопления посредством увеличения прямо или косвенно внутриклеточной концентрации и/или активности Hsp70 у нуждающихся в этом индивидуумов посредством введения Hsp70, его функционального фрагмента или варианта или посредством введения индуктора или коиндуктора Hsp70.
В одном из аспектов настоящее изобретение относится к биоактивному средству, способному увеличивать внутриклеточную концентрацию и/или активность Hsp70 для применения в качестве лекарственного средства или для применения в лечении лизосомных болезней накопления.
В одном из вариантов осуществления указанное биоактивное средство представляет собой Hsp70 или его функциональный фрагмент или вариант.
В другом варианте осуществления указанное биоактивное средство является индуктором или коиндуктором Hsp70.
Другой аспект настоящего изобретения относится к способу лечения лизосомных болезней накопления, включающему введение биоактивного средства по настоящему изобретению нуждающемуся в этом индивидууму.
В одном из вариантов осуществления указанное лечение является профилактическим, излечивающим или смягчающим.
В одном из вариантов осуществления указанная лизосомная болезнь накопления выбрана из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, сиалидоза, метахроматической лейкодистрофии и дефицита сапозинов.
В другом варианте осуществления указанную лизосомную болезнь накопления характеризуют как имеющую остаточную ферментативную активность дефектного фермента, вовлеченного в патологию.
Настоящее изобретение также относится к способу лечения лизосомной болезни накопления, включающему введение биоактивного средства по настоящему изобретению в сочетании с, по меньшей мере, одним другим способом лечения.
Дополнительный аспект настоящего изобретения относится к способу модуляции ферментативной активности фермента, где указанный фермент взаимодействует с BMP (бис(моноацилглицеро)фосфатом), включающему этапы
i) введения биоактивного средства по настоящему изобретению,
ii) допущения взаимодействия между BMP и Hsp70, и
iii) модуляции ферментативной активности фермента, взаимодействующего с BMP.
В другом аспекте настоящее изобретение относится к Hsp70 или его функциональному фрагменту или варианту для применения в качестве лекарственного средства.
В одном из аспектов настоящее изобретение относится к способу модуляции ферментативной активности фермента, где указанный фермент взаимодействует с BMP, включающему этап введения Hsp70 или его функционального фрагмента или варианта в форме, допускающей взаимодействие между BMP и Hsp70 или указанным его функциональным фрагментом или вариантом, и, таким образом, модуляции ферментативной активности фермента, взаимодействующего с BMP.
Предпочтительно Hsp70 или указанный его функциональный фрагмент или вариант образует ковалентный или нековалентный комплекс с BMP.
Предпочтительно BMP взаимодействует с сапозином.
Предпочтительно указанный сапозин выбран из группы, состоящей из сапозина A, сапозина B, сапозина C и сапозина D.
Предпочтительно указанный фермент выбран из группы, состоящей из сфингомиелиназы, кислой сфингомиелиназы, сиалидазы, альфа-галактозидазы, бета-галактозидазы, бета-галактозилцерамидазы, глюкозилцерамидазы и кислой церамидазы.
Предпочтительно указанная модуляция ферментативной активности является стимуляцией ферментативной активности указанного фермента.
В другом аспекте настоящее изобретение относится к Hsp70 или его функциональному фрагменту или варианту для применения в качестве лекарственного средства. Предпочтительно указанный Hsp70 или его функциональный фрагмент или вариант можно использовать в лечении, облегчении или профилактике лизосомных болезней накопления, таких как болезнь Ниманна-Пика, болезнь Гоше, болезнь Фарбера, болезнь Краббе, болезнь Фабри и сиалидоз.
В другом аспекте изобретение относится к способу увеличения захвата соединения, включающему этап введения указанного соединения вместе с Hsp70 или его функциональным фрагментом или вариантом. В одном из вариантов осуществления указанный Hsp70 или его функциональный фрагмент или вариант ковалентно связан с указанным соединением. В другом варианте осуществления указанный Hsp70 или его функциональный фрагмент или вариант нековалентно связан с указанным соединением.
Вариант осуществления изобретения относится к способу стимуляции ферментативной активности фермента, ассоциированного с лизосомной болезнью накопления, такой как болезнь Ниманна-Пика, болезнь Гоше, болезнь Фарбера, болезнь Краббе, болезнь Фабри и сиалидоз. Предпочтительно указанная лизосомная болезнь накопления является болезнью Ниманна-Пика.
Поскольку лизосомные болезни накопления возникают по причине недостаточной ферментативной активности, целью изобретения является увеличение ферментативной активности для смягчения или лечения нарушения.
Показано, что Hsp70 взаимодействует с BMP. Поскольку BMP действует как кофактор для различных других белков, взаимодействие между Hsp70 и BMP может модулировать функцию этих различных других белков. Например, BMP действует как кофактор для aSMазы. Таким образом, взаимодействие Hsp70 и BMP может увеличивать активность aSMазы. Поскольку болезнь Ниманна-Пика ассоциирована со снижением активности aSMазы, Hsp70 может смягчать или излечивать болезнь Ниманна-Пика посредством увеличения активности aSMазы. Аналогично, BMP действует как кофактор для сапозина A, сапозина B, сапозина C и сапозина D. Данные белки сапозины вовлечены в другие лизосомные болезни накопления, и, таким образом, Hsp70 может смягчать или излечивать другие лизосомные болезни накопления посредством усиления активности сапозина или фермента, ассоциированного с указанным сапозином.
В варианте осуществления изобретения Hsp70 применяют вместе с заместительной терапией ферментом при лечении лизосомной болезни накопления. Таким образом, необходимое количество фермента можно значительно снизить благодаря фермент-активирующему действию Hsp70.
В другом варианте осуществления Hsp70 применяют для облегчения захвата ферментов при заместительной терапии ферментом, таким образом, увеличивая количество фермента, захваченного соответствующими клетками.
Определения и сокращения
aSMaза/ASM: кислая сфингомиелиназа
ADD70: ловушка Hsp70, являющаяся производным AIF
AIF: Апоптоз-индуцирующий фактор
AO: Акридиновый оранжевый
Apaf-1: Апоптотический протеаза-активирующий фактор 1
Bag-1: Bcl-2-ассоциированный атаноген-1
Bcl-2: B-клеточная лимфома/лейкоз 2
Bid: BH3-взаимодействующий агонист домена смерти
BMP: бис(моноацилглицеро)фосфат
CARD: Домен активации каспазы
Каспаза: Цистеинаспартатспецифические протеазы
CHIP: C-конец Hsp70-связывающегося белка
CytC: Цитохром C
DD: Домен смерти
DED: Домен эффектора смерти
дцРНК: Двухцепочечная РНК
eHsp70: Внеклеточный Hsp70
ER: Эндоплазматическая сеть
ERT: Заместительная терапия ферментом
FADD: Fas-ассоциированный белок, содержащий домен смерти
HIP: Hsp70-взаимодействующий белок
HRP: Пероксидаза хрена
HS: Тепловой шок/стресс
HSE: Элемент теплового шока
HSF: Фактор теплового шока
Hsp: Белок теплового шока
HspBP1: Белок 1, связывающий белки теплового шока
IAP: Белок-ингибитор апоптоза
iMEF: Иммортализованные эмбриональные фибробласты мыши
JNK: c-jun NH2-концевая киназа
LAMP-1/-2: Лизосомальный мембранный белок -1/-2
LBPA: Лизобисфосфатидная кислота
LEDGF: Фактор роста эпителия хрусталика
LMP: Проницаемость лизосомальной мембраны
MIC-1: Макрофагальный ингибиторный цитокин 1
MOMP: Проницаемость внешней митохондриальной мембраны
MPR: Рецептор манноза-6-фосфата
MTT: 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2H-тетразолия бромид
NPD: Болезнь Ниманна-Пика
NPDA: Болезнь Ниманна-Пика, тип A
NPDB: Болезнь Ниманна-Пика, тип Β
NPDC: Болезнь Ниманна-Пика, тип C
NPDD: Болезнь Ниманна-Пика, тип D
PCD:: Программируемая гибель клеток
PKC: Протеинкиназа C
POPC: Пальмитоилолеоилфосфатидилхолин
POPS: Пальмитоилолеоилфосфатидилсерин
RNAi: РНК-интерференция
ROS: Активные формы кислорода
SD: Стандартное отклонение
миРНК: Малые интерферирующие РНК
Smac/Diablo: Второй митохондриальный активатор каспазы
tBid: Усеченный Bid
TNF: Фактор некроза опухоли
TNFR: рецептор TNF
TRADD: TNFR-ассоциированный белок, содержащий домен смерти
TRAF: TNFR-ассоциированный фактор
Лизосомные болезни накопления (LSD): термины "лизосомное нарушение накопления" и "лизосомная болезнь накопления" используют в качестве синонимов.
Функциональный фрагмент Hsp70: термин "функциональный фрагмент Hsp70" истолковывают в значении любого фрагмента Hsp70, обладающего желаемой функцией. В отношении модуляции ферментативной активности функциональный фрагмент является фрагментом, способным модулировать ферментативную активность. В отношении увеличения захвата вещества функциональный фрагмент Hsp70 является фрагментом, способным увеличивать захват указанного вещества. Следует понимать, что точный количественный эффект функционального фрагмента может отличаться от действия полноразмерной молекулы. В некоторых случаях функциональный фрагмент в действительности может являться более эффективным, чем полноразмерная молекула. Кроме того, применение фрагментов вместо полноразмерных молекул может быть выгодным с точки зрения меньшего размера фрагментов.
Функциональный вариант Hsp70: термин "функциональный вариант Hsp70" истолковывают в значении любого варианта Hsp70, обладающего желаемой функцией. В отношении модуляции ферментативной активности функциональный вариант является вариантом, способным модулировать ферментативную активность. В отношении увеличения захвата вещества функциональный вариант Hsp70 является фрагментом, способным увеличивать захват указанного вещества. Понятно, что точный количественный эффект функционального варианта может отличаться от действия полноразмерной молекулы. В некоторых случаях функциональный вариант, в действительности, может являться более эффективным, чем полноразмерная молекула.
"Биоактивное средство" (т.е. биологически активное вещество/средство) является любым средством, лекарственным средством, соединением, композицией материалов или смесью, которая обеспечивает некоторое фармакологическое, зачастую полезное, действие, которое можно демонстрировать in vivo или in vitro. В настоящем документе данный термин, кроме того, включает любое физиологически или фармакологически активное вещество, которое оказывает местное или системное действие на индивидуума. Дополнительные примеры биоактивных средств включают в качестве неограничивающих примеров средства, включающие или состоящие из олигосахарида, средства, содержащие или состоящие из полисахарида, средства, необязательно содержащие или состоящие из гликозилированного пептида, средства, необязательно содержащие или состоящие из гликозилированного полипептида, средства, содержащие или состоящие из нуклеиновой кислоты, средства, содержащие или состоящие из олигонуклеотида, средства, содержащие или состоящие из полинуклеотида, средства, содержащие или состоящие из липида, средства, содержащие или состоящие из жирной кислоты, средства, содержащие или состоящие из сложного эфира жирной кислоты, и средства, содержащие или состоящие из вторичного метаболита. Его можно использовать профилактически, терапевтически в связи с лечением индивидуума, такого как человек или любое другое животное. В настоящем документе биоактивное средство является веществом, способным увеличивать внутриклеточную концентрацию и/или активность Hsp70.
Термины "лекарственное средство" или "лекарственный препарат" в настоящем документе включают биологически, физиологически или фармакологически активные вещества, способные местно или системно действовать на тело человека или животного.
Термины "лечение" и "терапия" в настоящем документе равноценно применяют для лечебной терапии, профилактической или превентивной терапии и смягчающей или паллиативной терапии. Термин включает подход получения полезных или желаемых физиологических результатов, которые можно установить клинически. Для целей данного изобретения полезный или желаемый клинический результат включает в качестве неограничивающих примеров снижение симптомов, снижение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние, остановку или замедление прогресса или ухудшения состояния/симптомов, смягчение или облегчение состояния или симптомов и ремиссию (частичную или полную), обнаруживаемую или не обнаруживаемую. В настоящем документе термин "облегчение" и его варианты означают, что степень и/или нежелательные проявления физиологического состояния или симптома уменьшаются и/или ход прогресса замедлен или растянут во времени по сравнению с непринимавшими композиции по настоящему изобретению.
"Эффект лечения" или "терапевтический эффект" проявляется, если появляется изменение в состоянии, подвергшемся лечению, что оценивают по критерию, составляющему определение термина "лечение". Это "изменение" состояния, подвергшегося лечению, существует, если существует, по меньшей мере, 5% улучшение, предпочтительно 10% улучшение, более предпочтительно, по меньшей мере, 25%, даже более предпочтительно, по меньшей мере, 50%, такое как, по меньшей мере, 75%, и наиболее предпочтительно, по меньшей мере, 100% улучшение. Изменение может основываться на улучшениях тяжести подвергшегося лечению состояния индивидуума, или на разнице частоты улучшающихся состояний в популяции индивидуумов с лечением и без лечения биоактивным средством, или с биоактивным средством в сочетании с фармацевтической композицией по настоящему изобретению.
"Фармакологически эффективное количество", "фармацевтически эффективное количество" или "физиологически эффективное количество "биоактивного средства" является таким количеством биоактивного средства, присутствующего в фармацевтической композиции, как описано в настоящем документе, которое необходимо для обеспечения желаемого уровня активного средства в кровотоке или в месте действия у индивидуума (например, в легких, желудочной системе, колоректальной системе, предстательной железе и т.д.) для лечения с целью получения ожидаемого физиологического ответа при введении такой композиции. Точное количество зависит от многих факторов, например активного средства, активности композиции, применяемого средства доставки, физических характеристик композиции, предполагаемого применения пациентом (т.е. количество доз, вводимых в сутки), соблюдения пациентом режима лечения и т.п., и его легко может определить специалист в данной области в зависимости от информации, предоставляемой в настоящем документе. "Эффективное количество" биоактивного средства можно вводить в одно введение или посредством многократного введения количества, составляющего в общей сложности эффективное количество, предпочтительно в течение 24-часового периода. Его можно определить посредством стандартных клинических способов определения подходящих количеств и выбора времени введения. Следует понимать, что "эффективное количество" может являться результатом эмпирического и/или индивидуализированного (для каждого отдельного случая) определения со стороны лечащего медицинского работника и/или индивидуума.
Термины "увеличение" и "улучшение" положительного эффекта и их варианты в настоящем документе относятся к терапевтическому эффекту биоактивного средства по сравнению с плацебо или увеличению терапевтического эффекта медицинского лечения по современному уровню техники сверх достигаемого обычно, когда фармацевтическую композицию вводят без биоактивного средства по данному изобретению. "Увеличение терапевтических эффектов" проявляется, когда имеет место ускорение и/или увеличение интенсивности и/или продолжительности терапевтических эффектов, достигаемых в результате введения биоактивного средства (средств). Это также может включать увеличение продолжительности терапевтических эффектов. Это также может проявляться, когда для достижения таких же эффектов, как при совместном введении с биоактивным средством (средствами), предоставляемым по настоящему изобретению, по сравнению с введением большего количества фармацевтической композиции без биоактивного средства требуется введение меньшего количества фармацевтической композиции. Усиление эффекта предпочтительно, но необязательно, приводит к лечению острых симптомов, для которых фармацевтическая композиция отдельно неэффективна или менее терапевтически эффективна. Усиления достигают, когда имеет место, по меньшей мере, 5% усиление терапевтических эффектов, такое как, по меньшей мере, 10% усиление терапевтических эффектов, когда биоактивное средство по настоящему изобретению вводят совместно с фармацевтической композицией по сравнению с введением фармацевтической композиции отдельно. Предпочтительно увеличение на, по меньшей мере, 25%, более предпочтительно, по меньшей мере, 50%, даже более предпочтительно, по меньшей мере, 75%, наиболее предпочтительно, по меньшей мере, 100%.
"Совместное введение" биоактивного средства (средств) или биоактивных средств и лекарственных средств по современному уровню техники в настоящем документе относится к введению одного или нескольких биоактивных средств по настоящему изобретению или введению одного или нескольких биоактивных средств по настоящему изобретению и фармацевтической композиции по современному уровню техники в некоторый период времени. Предпочтительным является период времени менее чем 72 часа, такой как 48 часов, например менее чем 24 часа, такой как менее чем 12 часов, например менее чем 6 часов, такой как менее чем 3 часа. Однако данные термины также означают, что биоактивное средство и терапевтическую композицию можно вводить совместно.
Термин "индивидуум" относится к позвоночным, в частности к представителям видов класса млекопитающих, предпочтительно приматам, включая людей. В предпочтительном варианте осуществления индивидуум в настоящем документе является человеком, мужчиной или женщиной любого возраста.
"Нуждающийся в этом индивидуум" относится к индивидууму, который может получать пользу от настоящего изобретения. В одном из вариантов осуществления указанный нуждающийся в этом индивидуум является больным индивидуумом, где указанное заболевание является лизосомной болезнью накопления.
Термин "природный нуклеотид" или "нуклеотид" относится к любому из четырех дезоксирибонуклеотидов, dA, dG, dT и dC (элементы ДНК) и четырех рибонуклеотидов, A, G, U и C (элементы РНК), как они существуют в природе. Каждый природный нуклеотид содержит или по существу состоит из остатка сахара (рибозы или дезоксирибозы), остатка фосфата и остатка природного/стандартного основания. Природные нуклеотиды связываются с комплементарными нуклеотидами по широко известным правилам спаривания оснований (Watson и Crick), где аденин (A) спаривается с тимином (T) или урацилом (U); и где гуанин (G) спаривается с цитозином (C), где соответствующие пары нуклеотидов являются частью комплементарных антипараллельных цепей нуклеотидов. Спаривание оснований приводит к специфической гибридизации между заранее определенными и комплементарными нуклеотидами. Спаривание оснований является основой, в соответствии с которой ферменты способны катализировать синтез олигонуклеотида, комплементарного матричному олигонуклеотиду. В этом синтезе строительные блоки (как правило, трифосфаты рибо- или дезоксирибо-производных A, T, U, C или G) направляются матричным олигонуклеотидом для образования комплементарного олигонуклеотида с правильной комплементарной последовательностью. Распознавание последовательности олигонуклеотидов по ее комплементарной последовательности опосредуется соответствующими и взаимодействующими основаниями, которые образуют пары оснований. В природе специфические взаимодействия, приводящие к спариванию оснований, регулируются размером оснований и структурой доноров и акцепторов водородной связи в основаниях. Большое пуриновое основание (A или G) спаривается с небольшим пиримидиновым основанием (T, U или C). Дополнительно распознавание пары оснований между парами находится под влиянием водородных связей, формирующихся между основаниями. В геометрии пары оснований Уотсона-Крика шестичленное кольцо (пиримидин в природных олигонуклеотидах) сопоставляется с кольцевой системой, состоящей из слитого шестичленного кольца и пятичленного кольца (пурин в природных олигонуклеотидах) с водородной связью в середине, связывающей два атома кольца, и водородными связями на любой стороне кольца, соединяющими функциональные группы, присоединенные к каждому кольцу, с донорными группами, спаренными с акцепторными группами.
В настоящем документе "нуклеиновая кислота" или "молекула нуклеиновой кислоты" относится к полинуклеотидам, таким как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК), олигонуклеотидам, фрагментам, полученным посредством полимеразной цепной реакции (ПЦР), и фрагментам, полученным посредством лигирования, расщепления, действия эндонуклеазы или действия экзонуклеазы. Молекулы нуклеиновой кислоты можно составлять из мономеров, которые являются природными нуклеотидами (такими как ДНК и РНК) или аналогами природных нуклеотидов (например, альфа-энантиомерные формы природных нуклеотидов) или их комбинацией. Модифицированные нуклеотиды могут иметь отличия в остатках сахара и/или в остатках пиримидиновых или пуриновых оснований. Модификации сахара, включающие, например, замену одной или нескольких гидроксильных групп галогенами, алкильными группами, аминами и азидными группами, или сахара можно функционализировать как простые эфиры или сложные эфиры. Кроме того, целый остаток можно заменить стерически и электронно-схожими структурами, такими как азасахара и карбоциклические аналоги сахара. Примеры модификации остатков оснований включают алкилированные пурины и пиримидины, ацилированные пурины или пиримидины или другие широко известные гетероциклические заменители. Мономеры нуклеиновой кислоты можно связывать фосфодиэфирными связями или аналогами таких связей. Аналоги фосфодиэфирных связей включают фосфотиоат, фосфодитиоат, фосфоселеноат, фосфодиселеноат, фосфоанилотиоат, фосфоанилидат, фосфоамидат и т.п. Термин "молекула нуклеиновой кислоты" также включает, например, так называемые "пептидные нуклеиновые кислоты", которые содержат природные или модифицированные основания нуклеиновых кислот, прикрепленные к полиамидному остову. Можно применять одноцепочечные или двухцепочечные нуклеиновые кислоты.
Термин "комплементарная молекула нуклеиновой кислоты" относится к молекуле нуклеиновой кислоты, обладающей комплементарной последовательностью нуклеотидов и обратной ориентацией, по сравнению с исходной последовательностью нуклеотидов. Например, последовательность 5' ATGCACGGG 3' комплементарна 5' CCCGTGCAT 3'.
"Выделенная молекула нуклеиновой кислоты" является молекулой нуклеиновой кислоты, которая не встроена в геномную ДНК организма. Например, молекула ДНК, которая кодирует фактор роста и которую отделяли от геномной ДНК клетки, является выделенной молекулой ДНК. Другим примером выделенной молекулы ДНК является химически синтезированная молекула нуклеиновой кислоты, которая не интегрирована в геном организма. Молекула нуклеиновой кислоты, которую выделяли из отдельных видов, меньше, чем полная молекула ДНК хромосомы этого вида.
"Конструкция молекулы нуклеиновой кислоты" является молекулой нуклеиновой кислоты, одно- или двухцепочечной молекулой нуклеиновой кислоты, модифицированной вмешательством человека таким образом, чтобы содержать сегменты нуклеиновой кислоты, комбинированные и сопоставленные в несуществующем в природе порядке.
"Линейная ДНК" означает некольцевую молекулу ДНК, имеющую свободные 5'- и 3'-концы. Линейную ДНК можно получать из закрытых кольцевых молекул ДНК, таких как плазмиды, посредством ферментативного расщепления или физического разрушения.
"Комплементарная ДНК (кДНК)" является одноцепочечной молекулой ДНК, полученной из матричной мРНК с помощью фермента обратная транскриптаза. Как правило, для инициации обратной транскрипции применяют праймер, комплементарный частям мРНК. Специалисты в данной области также применяют термин "кДНК" для обозначения двухцепочечной молекулы ДНК, состоящей из одноцепочечной молекулы ДНК и комплементарной ей цепи ДНК. Термин "кДНК" также относится к клону молекулы кДНК, синтезированной по матрице РНК.
"Гетерологичная ДНК" относится к молекуле ДНК или совокупности молекул ДНК, которые не существуют в природе в определенной клетке-хозяине. Гетерологичные для отдельной клетки-хозяина молекулы ДНК могут содержать ДНК из вида клетки-хозяина (т.е. эндогенная ДНК) при условии, что ДНК хозяина комбинирована с ДНК не-хозяина (т.е. экзогенной ДНК). Например, молекулу ДНК, содержащую сегмент ДНК не-хозяина, кодирующий полипептид, функционально связанный с сегментом ДНК хозяина, содержащим транскрипционный промотор, рассматривают как гетерологичную молекулу ДНК. Наоборот, гетерологичная молекула ДНК может содержать эндогенный ген, функционально связанный с экзогенным промотором. В качестве другой иллюстрации, молекулу ДНК, содержащую ген из клетки дикого типа, рассматривают как гетерологичную ДНК, если данная молекула ДНК встроена в мутантную клетку с недостатком гена дикого типа.
"Полипептид" является полимером аминокислотных остатков, предпочтительно соединенных исключительно пептидными связями, полученных природным или синтетическим путем. Полипептид, полученный посредством экспрессии молекулы ДНК не-хозяина, является "гетерологичным" пептидом или полипептидом. В настоящем документе термин "полипептид" охватывает белки, пептиды и полипептиды, где указанные белки, пептиды или полипептиды можно посттрансляционно модифицировать или не модифицировать. Посттрансляционная модификация может включать фосфорилирование, метилирование и гликозилирование.
Термин "экспрессия" относится к биосинтезу гена или продукту гена.
"Гибридизовать" означает отжиг цепей нуклеиновой кислоты из разных источников, что является образованием пар оснований между комплементарными регионами двух цепей ДНК, которые исходно не спарены. Термин "гибридизация в строгих условиях" определяли по Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor, Laboratory Press (1989), 1101-1104. Предпочтительно гибридизация в строгих условиях означает, что после отмывки в течение 1 часа с однократным SSC и 0,1% SDS при 50°C, предпочтительно при 55°C, более предпочтительно при 62°C и наиболее предпочтительно при 68°C, в частности 1 час в 0,2-кратном SSC и 0,1% SDS при 50°C, предпочтительно при 55°C, более предпочтительно при 62°C и наиболее предпочтительно при 68°C, наблюдают положительный сигнал гибридизации.
Участок "полной гомологии" определяют как совпадение спаренных нуклеотидов по длине последовательности взаимодействующих нуклеотидов; в природной РНК спаривание A с U и G с C.
"Промотор" является последовательностью нуклеотидов, которая направляет транскрипцию структурного гена. Как правило, промотор локализуется в 5'-некодирующей области гена, проксимально к участку начала транскрипции структурного гена. Элементы последовательности внутри промоторов, которые функционируют при инициации транскрипции, часто описывают как консенсусную последовательность нуклеотидов. Если промотор является индуцибельным промотором, то уровень транскрипции повышается в ответ на индуцирующее средство. В отличие от этого уровень транскрипции не регулируется индуцирующим средством, если промотор является конститутивным промотором. Также известны репрессируемые промоторы.
"Регуляторный элемент" является последовательностью нуклеотидов, которая модулирует активность промотора. Например, регуляторный элемент может содержать последовательность нуклеотидов, которая связывается с клеточными факторами, запускающими транскрипцию исключительно или предпочтительно в определенных клетках, тканях или органеллах. Данные типы регуляторных элементов, как правило, ассоциированы с генами, которые экспрессируются "клеточно-специфическим", "ткане-специфическим" или "органелло-специфическим образом".
"Энхансер" является типом регуляторного элемента, который может увеличивать эффективность транскрипции независимо от расстояния или ориентации энхансера относительно участка начала транскрипции.
"Клонирующий вектор" является молекулой нуклеиновой кислоты, такой как плазмида, космида или бактериофаг, которая обладает способностью автономно реплицироваться в клетке-хозяине. Как правило, клонирующие вектора содержат один или небольшое число участков распознавания эндонуклеаз рестрикции, что делает возможным инсерцию молекулы нуклеиновой кислоты определенным образом без потери важной биологической функции вектора, также как и последовательности нуклеотидов, кодирующей маркерный ген, подходящий для применения в идентификации и отборе трансформированных клеток с клонирующим вектором. Как правило, маркерный ген включает гены, обеспечивающие резистентность к тетрациклину и ампициллину.
"Экспрессирующий вектор" является молекулой нуклеиновой кислоты, кодирующей ген, который экспрессируется в клетке-хозяине. Как правило, экспрессирующий вектор содержит транскрипционный промотор, ген и терминатор транскрипции. Как правило, экспрессия гена находится под контролем промотора, и такой ген называют "функционально связанным" с промотором. Аналогично регуляторный элемент и ядерный промотор являются функционально связанными, если регуляторный элемент модулирует активность ядерного промотора. Более простые вектора, называемые "транскрипционными векторами", способны только транскрибироваться, но не транслироваться: они могут реплицироваться в клетке-мишени, но не экспрессироваться, в отличие от экспрессирующих векторов. Транскрипционные вектора применяют для амплификации их вставок.
"Рекомбинантный хозяин" является клеткой, содержащей гетерологичную молекулу нуклеиновой кислоты, такую как клонирующий вектор или экспрессирующий вектор.
Трансфекция описывает введение чужеродного материала в эукариотические клетки. Термин "трансфекция" для невирусных способов чаще всего применяют по отношению к клеткам млекопитающих, в то время как термин "трансформация" является предпочтительным для описания переноса невирусной ДНК в бактерии и эукариотические клетки неживотного происхождения, такие как грибы, водоросли и растения. Для трансфекции можно применять и химические, и физические способы.
"Полипептид" является полимером аминокислотных остатков, предпочтительно соединенных пептидными связями, полученным природным или синтетическим путем. Получаемый посредством экспрессии молекулы ДНК не-хозяина полипептид является "гетерологичным" пептидом или полипептидом. В настоящем документе термин "полипептид" охватывает белки, пептиды и полипептиды, где указанные белки, пептиды и полипептиды можно посттрансляционно модифицировать или не модифицировать. Например, посттрансляционная модификация может включать фосфорилирование, метилирование и гликозилирование.
"Аминокислотный остаток" может быть природным или неприродным аминокислотным остатком, связанным пептидными связями или связями, отличающимися от пептидных связей. Аминокислотные остатки могут иметь D-конфигурацию или L- конфигурацию. Аминокислотный остаток содержит аминоконцевую часть (NH2) и карбоксиконцевую часть (COOH), отделенные центральной частью, содержащей атом углерода или цепь атомов углерода, из которых, по меньшей мере, один атом содержит, по меньшей мере, одну боковую цепь или функциональную группу. NH2 относится к аминогруппе, присутствующей на аминоконце аминокислоты или пептида, и COOH относится к карбоксильной группе, присутствующей на карбоксильном конце аминокислоты или пептида. Универсальный термин аминокислота включает и природные, и неприродные аминокислоты. Природные аминокислоты по стандартной номенклатуре, как приведено в J. Biol. Chem., 243:3552-59 (1969) и утверждено в 37 C.F.R., section 1.822(b)(2), принадлежат к группе аминокислот, приведенных ниже в таблице 1 настоящего документа. Неприродные аминокислоты являются теми, которые не приведены в таблице 1. Примеры неприродных аминокислот являются теми, которые приведены в, например, в 37 C.F.R. section 1.822(b)(4), все из которых включены в настоящий документ в качестве ссылки. Неприродные аминокислотные остатки также включают в качестве неограничивающих примеров модифицированные аминокислотные остатки, L-аминокислотные остатки и стереоизомеры D-аминокислотных остатков.
"Эквивалентный аминокислотный остаток" относится к аминокислотному остатку, способному заменить другой аминокислотный остаток в полипептиде без существенного отличия структуры и/или функции полипептида. Таким образом, эквивалентные аминокислоты обладают сходными свойствами, такими как размер боковой цепи, полярность боковой цепи (полярная или неполярная), гидрофобность (гидрофобная или гидрофильная), pH (кислый, нейтральный или щелочной) и организация углерода боковой цепи (ароматическая/алифатическая). В связи с этим "эквивалентные аминокислотные остатки" можно рассматривать как "консервативные замены аминокислоты".
Классификация эквивалентных аминокислот относится в одном из вариантов осуществления к следующим классам: 1) HRK, 2) DENQ, 3) C, 4) STPAG, 5) MILV и 6) FYW
В настоящем документе в значении термина "эквивалентная замена аминокислоты" одна аминокислота может заменять другую в одном из вариантов осуществления в группах аминокислот, указанных ниже в настоящем документе:
i) Аминокислоты, имеющие полярные боковые цепи (Asp, Glu, Lys, Arg, His, Asn, Gln, Ser, Thr, Tyr и Cys);
ii) Аминокислоты, имеющие неполярные боковые цепи (Gly, Ala, Val, Leu, Ile, Phe, Trp, Pro и Met);
iii) Аминокислоты, имеющие алифатические боковые цепи (Gly, Ala, Val, Leu, Ile);
iv) Аминокислоты, имеющие циклические боковые цепи (Phe, Tyr, Trp, His, Pro);
v) Аминокислоты, имеющие ароматические боковые цепи (Phe, Tyr, Trp);
vi) Аминокислоты, имеющие кислые боковые цепи (Asp, Glu);
vii) Аминокислоты, имеющие щелочные боковые цепи (Lys, Arg, His);
viii) Аминокислоты, имеющие амидные боковые цепи (Asn, Gln);
ix) Аминокислоты, имеющие гидроксильные боковые цепи (Ser, Thr);
x) Аминокислоты, имеющие серосодержащие боковые цепи (Cys, Met);
xi) Нейтральные, слабогидрофобные аминокислоты (Pro, Ala, Gly, Ser, Thr);
xii) Гидрофильные, кислые аминокислоты (Gln, Asn, Glu, Asp), и
xiii) Гидрофобные аминокислоты (Leu, Ile, Val).
Настоящее изобретение также относится к вариантам Hsp70 или его фрагментам, где замены моделируют посредством компьютерного анализа, в котором применяют гомологию последовательностей для прогнозирования влияния замены на функцию белка (например, Pauline C. Ng and Steven Henikoff, Genome Research, Vol. 11, Issue 5, 863-874, May 2001).
По причине неточности стандартных аналитических способов молекулярные массы и длины полимеров рассматривают как приблизительные величины. Когда такую величину выражают как "приблизительно" X или "примерно" X, точность выраженного значения X рассматривают как +/-20%, такую как +/-10%, например +/-5%.
Описание чертежей
Фигура 1
Действие Hsp70 на связывание aSMaзы с BMP и уровнями церамида. (A) Связывание 0,2 мкМ aSMазы с BMP-содержащими липосомами при pH 4,5 как функция предсвязанного Hsp70 (экспериментальный аналог примера 1, смотри более подробно материалы и способы в настоящем документе). Hsp70 позволяли диссоциировать в течение 10 мин, тем самым достигая более низкой асимптоты для диссоциации перед добавлением aSMaзы. (B) Конфокальная микроскопия и количественный анализ уровней церамида в iMEF дикого типа (WT) и трансгенных по Hsp70 (Hsp70-TG) iMEF. Иммунологический анализ проводили с моноклональным антителом мыши против церамида (клон 15b4). Проводили количественный анализ, основываясь на полученных лазерным сканированием микрофотографиях из 6 заранее определенных регионов, после чего количественный анализ проводили с применением программного обеспечения LSM Duo.
Фигура 2
Действие rHsp70 на активность кислой сфингомиелиназы в iMEF-WT (иммортализованных эмбриональных фибробластах мыши дикого типа). В клетки вводили rHsp70 в концентрации 3 нМ, 30 нМ и 300 нМ и измеряли активность aSMазы (A500 является величиной продуцируемого церамида, которая увеличивает плотность). Контрольные клетки обрабатывали BSA (бычьим сывороточным альбумином).
Фигура 3
Активность кислой SMазы в разных фибробластах. NPDA: Болезнь Ниманна-Пика типа A.
Фигура 4
Схема гидролиза главного сфинголипида. Экзогидролитический распад сфинголипидов с короткими гидрофильными головными группами требует неферментативных кофакторов, белков-активаторов сфинголипидов (SAP или сапозины). Наследственные дефициты соответствующего фермента, а также соответствующего белка-активатора вызывают лизосомальное накопление липидов и приводят к развитию различных сфинголипидозов. Из Ferlintz et al., Chem. Phys. Lipids, (102) 35-43, 1999.
Фигура 5
Лизосомальный Hsp70 стабилизирует лизосомальные мембраны. (a) Представленные конфокальные фотографии клеток U-2-OS, которые инкубировали с 300 нМ rHsp70-AF488 (зеленый) в течение 24 часов, фиксировали и окрашивали на наличие лизосомального интегрального мембранного белка-1 (LIMP-1; красный). Для колокализации с маркерами других органелл смотри фиг. 9. (b) Перед количественным анализом rHsp70-AF488 в мембранах (мемб.) и супернатанте (суп.), полученном посредством повторяющихся циклов замораживания-оттаивания и центрифугирования легкой мембранной фракции (LMF), клетки U-2-OS инкубировали с 300 нМ rHsp70-AF488 в течение 24 часов. Иммуноблот лизосомно-ассоциированного мембранного белка 2 (LAMP-2) и катепсина Β (Cat B) демонстрирует применимость способа фракционирования. (c) Представленные фотографии клеток U-2-OS, подвергнутых фотоокислению (акридиновый оранжевый и синий свет). Потерю целостности лизосом визуализировали по потере красного и увеличению зеленого окрашивания. (d и e) Клетки U-2-OS инкубировали с указанными рекомбинантными белками (300 нМ) в течение 24 часов и анализировали целостность лизосом после фотоокисления. Как указано, перед добавлением рекомбинантных белков (е) клетки обрабатывали указанными миРНК в течение 48 часов. Величины представляют значения ± SD для трех (d) или пяти (e) независимых экспериментов. Представленные иммуноблоты указанных белков из клеток U-2-OS оставляли необработанными или обрабатывали контрольными или Hsp70 миРНК, они указаны справа. Масштабная шкала: 20 мкМ (a и c).
Фигура 6
pH-зависимое взаимодействие между Hsp70 и BMP стабилизирует лизосомальные мембраны, (a) Относительные изменения в рассеянии света под углом 90° липосомами после добавления rHsp70 (в 0,12 нМ аликвотах) к липосомам, содержащим указанные липиды (χ=0,2) при pH 7,4 (слева) и pH 6,0 (справа). (b) Клетки U-2-OS оставляли необработанными (-) или инкубировали с 50 мкг/мл анти-BMP или контрольными IgG в течение 7 часов перед добавлением наполнителя (-) или 300 нМ rHsp70 в течение 24 часов и анализировали целостность лизосом после фотоокисления. (c) Клетки U-2-OS оставляли необработанными или инкубировали с 50 мкг/мл анти-BMP или контрольными IgG в течение 7 часов перед добавлением наполнителя (-) или 25 мкМ цисплатина в течение 24 часов и анализировали морфологию апоптотической клетки после окрашивания хехстом 33342. (d) Взаимодействие rHsp70 и его мутантов с липосомами POPC/BMP (χΒΜΡ=0,2) при pH 6,0 оценивали по изменениям в относительной интенсивности пиков флуоресценции. Концентрации белка составляли 0,36 мкМ (rHsp70), 0,5 мкМ (ΔΑΤΡ) и 0,35 мкМ (ΔPBD) (слева) или 0,43 мкМ (справа), и добавляли липосомы в 10 мкМ аликвотах. (e) Анализ взаимодействий BIAcore между rHsp70 дикого типа (WT) и его делецией (ΔΑΤΡ и ΔPBD) и точковой мутацией (W90F и W580F) с иммобилизованными LUV при pH 4,5 (средний диаметр: 100 нм; общая концентрация липидов: 0,1 мМ; композиция: сфингомиелин (χ=0,1), фосфатидилхолин (χ=0,5), холестерин (χ=0,2) и BMP (χ=0,2)). Вносили липосомы до достижения равновесия (100 с) и вносили указанные концентрации (слева) или 300 нМ (справа) рекомбинантных белков в буфере ацетата натрия (50 мМ, pH 4,5) для 200 с при скорости потока 20 мкл/мин с последующим этапом диссоциации в течение 10 мин. ΔRU определяют как разницу между ответным сигналом после достижения равновесия липосом и равновесия белок-липосома. (f и g) Клетки U-2-OS оставляли необработанными (контроль) или инкубировали с указанными рекомбинантными белками Hsp70 (300 нМ) в течение 24 часов и анализировали целостность лизосом после фотоокисления (f), или обрабатывали наполнителем (белые столбцы) или 25 мкМ цисплатина (черные столбцы) в течение 24 часов и анализировали апоптозо-подобную морфологию (g). (h) Ленточная модель и модель молекулярной поверхности АТФазного домена Hsp70. АТФ (представление ван-дер Ваальсовой поверхности) можно визуализировать связанным в АТФ-связывающем кармане. Зеленые и фиолетовые сферы обозначают ван-дер Ваальсову поверхность координированных ионов кальция и натрия соответственно. Отмечена положительно заряженная часть домена снизу и в позиции W90. Величины представляют значения ± SD для минимума из пяти независимых экспериментов (b, c, f и g).
Фигура 7
Hsp70 стимулирует активность ASM, что, в свою очередь, стабилизирует лизосомы. (a) Анализ связывания Biacore 200 нМ rASM с BMP-содержащими липосомами при pH 4,5 как функции предсвязанного rHsp70. Эксперименты проводили, как описано в комментарии к фиг. 6e, с rASM, добавленной в течение 180 сек после 10 мин этапа rHsp70-диссоциации с последующим еще одним 10- минутным этапом диссоциации. (b) Активность ASM в лизатах MEF дикого типа (WT) и трансгенных по Hsp70 (Hsp70) MEF (левая панель) и в WT MEF инкубированных с 300 нМ rHsp70 в течение 24 или 48 часов, как указано. (c и d) Жизнеспособность (снижение MTT; c) и активность цитозольного катепсина (zFRaза; d) в WT и Hsp70 iMEF, обработанных указанными концентрациями дезипрамина в течение 3 часов. (e) Прижизненная отдельно-клеточная визуализация потери целостности лизосом (фотоокисление в WT и Hsp70 MEF, а также Hsp70 MEF, инкубированных в течение 3 часов с 12,5 и 25 мкМ дезипрамина (левая и правая панели соответственно). Потерю красной (левая панель) и увеличение зеленой флуоресценции (правая панель) непрерывно измеряли для получения полных кинетических кривых потери целостности лизосом. 25-60 клеток исследовали pr. эксперимент из заранее определенных регионов), p<0,001 для Hsp70 vs. WT и Hsp70 + дезипрамин vs. Hsp70. Все величины представляют значения ± SD для минимума из 3 независимых экспериментов.
Фигура 8
rHsp70 стимулирует активность ASM, стабилизирует лизосомы и снижает объем лизосом в NPDA фибробластах. (a) Прижизненную отдельно-клеточную визуализацию стабильности лизосом из первичных фибробластов от пациента с NPDA анализировали как на фиг. 3e, p<0,001. (b) Активность ASM NPDA фибробластов, оставшихся необработанными или обработанных 300 нМ rHsp70 в течение 48 часов (левая панель) или 150 нМ rASM отдельно или в сочетании с 300 нМ rHsp70 в течение 24 часов (правая панель). Вычисляли значения p из полученной производительности фермента (DA500/мг белка/мин). Фотография справа демонстрирует поглощение rASM посредством эндоцитоза (зеленый) и его локализацию в лизосомальном компартменте, как визуализировали посредством дополнительного окрашивания Lysotracker Red. (c) Стабильность лизосом NPDA фибробластов, остававшихся необработанными или обработанных в течение 24 часов 300 нМ rHsp70, 150 нМ aSMaзы или комбинацией rHsp70 и aSMaзы, анализировали как на фиг. 3e. p<0,001 для всех обработок по сравнению с необработанными клетками. (d) Количественный анализ лизосомального региона конфокальных площадей поперечного сечения клеток в NPDA фибробластах, остававшихся необработанными или обработанных в течение 24 часов 300 нМ BSA, 300 нМ rHsp70, 150 нМ rASM (150 нМ) или комбинацией rHsp70 и rASM. Фотография справа демонстрирует действие rHsp70 (зеленый) на объем лизосомального компартмента (красный) в NPDA фибробластах. Белыми стрелками отмечают подвергнутый эндоцитозу rHsp70 и уменьшение лизосомального компартмента. Величины представляют значения ± SD для 3 независимых экспериментов. Масштабная шкала=20 мкМ. UT=необработанные.
Фигура 9
Колокализация подвергнутого эндоцитозу rHsp70-AF488 с лизосомами. Представленные конфокальные фотографии клеток U-2-OS, инкубированных с 300 нМ rHsp70-AF488 (зеленый) в течение 24 часов, фиксированных и окрашенных для следующих маркеров органелл (красный): лизосомальный мембранный белок-1 (LAMP-1; лизосомы), LAMP-2 (лизосомы), LBPA/BMP (6C4; эндолизосомальный компартмент), cyt c (митохондрии), SERCA (ER) и гольджин-97 (аппарат Гольджи). Масштабная шкала: 20 мкм (LAMP-1, LAMP-2 и BMP) или 10 мкм (Cyt c, SERCA и Гольджин-97).
Фигура 10
Взаимодействие rASM (рекомбинантной aSMaзы) и BMP в присутствии rHsp70. (a) Взаимодействие rASM с иммобилизованными анионными липосомами (средний диаметр 100 нм, общая концентрация липидов 0,1 мМ, и композиция; 10 мол.% сфингомиелина, 50 мол.% фосфатидилхолина, 20 мол.% холестерина и 20 мол.% BMP) при pH 4,5. Ответные сигналы измеряли после связывания липосом, что определяли как ноль. (b) Действие предсвязанного rHsp70 на последующее связывание rASM. Указанные количества rHsp70 инкубировали с иммобилизованными анионными липосомами идентично с (a). После 10 мин этапа диссоциации rHsp70 добавляли 200 нМ rASM в течение 180 сек с последующей 10 мин диссоциацией.
Фигура 11
Действие низкомолекулярного соединения индуктора Hsp70, бензилового спирта, на фибробласты пациента с болезнью Ниманна-Пика типа A (NPDA). (A) Индукция Hsp70 в NPDA Götz бензиловым спиртом в зависимости от дозировки (экспрессия белка). (B) Увеличивающаяся стабильность лизосом NPDA Götz после обработки клеток NPDA Götz 40 мМ бензиловым спиртом. (C) Снижение патологии в клетках NPDA Götz после обработки 40 мМ бензиловым спиртом, измеряемое по площади поперечного сечения лизосом (способ далее детально описан в примере 2).
Фигура 12
Действие истощения aSMaзы на стабильность лизосом. Малые интерферирующие РНК (миРНК) к кислой сфингомиелиназе (si938, si1257, si1340) и контрольные миРНК (мм) трансфицировали в клетки U-2O-S посредством олигофектамина (Invitrogen) по инструкции производителя. Концентрация миРНК: 50 нМ. После 72 часов снижение подтверждали посредством ОТ-ПЦР (не приводится) и клетки анализировали на предмет стабильности лизосом посредством прижизненной визуализации отдельных клеток с опосредующим фотоокисление акридиновым оранжевым. Увеличение зеленой флуоресценции непрерывно измеряли для получения полных кинетических кривых потери целостности лизосом. Как следует, формирующие диаграмму клетки, обработанные миРНК к aSMaзе, демонстрируют значительное увеличение стабильности лизосом. Дополнительно способ объяснен в примере 2.
Фигура 13
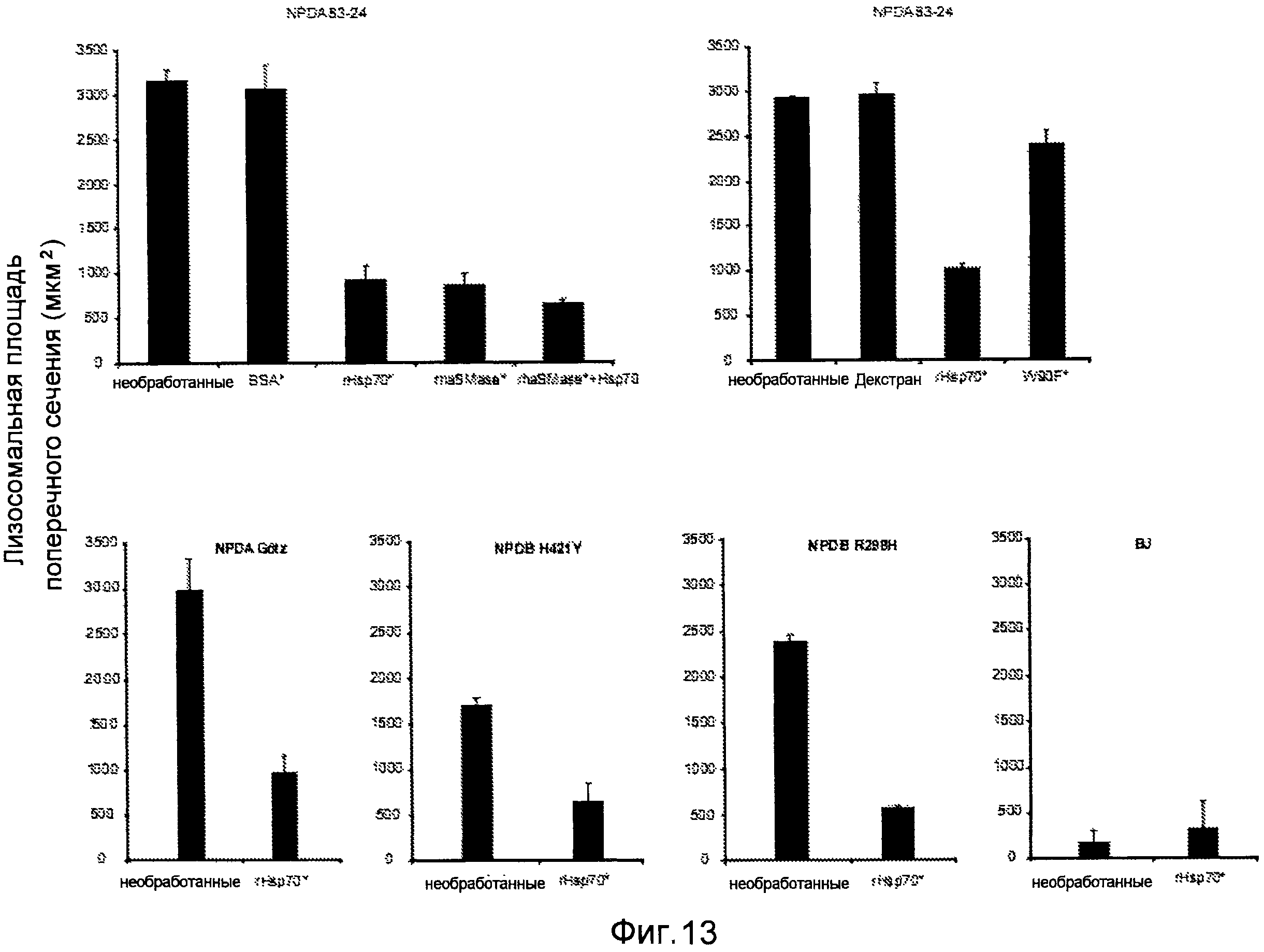
Обработка всех клеточных линий NPDA/B rHsp70 существенно реверсирует лизосомную патологию, т.е. снижает площадь поперечного сечения лизосом. Количественный анализ лизосомального региона конфокальных площадей поперечного сечения клеток фибробластов с болезнью Ниманна-Пика типа A и Β (NPDA/NPDB) и нормальных фибробластов (BJ), остававшихся необработанными или обработанных в течение 24 часов 300 нМ BSA или декстраном в качестве контроля, или обработанных в течение 24 часов 300 нМ rHsp70, 150 нМ rhaSMaзы или их сочетанием. Клетки NPDA, обработанные в течение 24 часов 300 нМ rHsp70-W90F (W90F), невзаимодействующим с BMP мутантом Hsp70, имели эффект, сравнимый с контрольными клетками. Для способов смотри пример 2.
Фигура 14
Увеличение активности aSMазы в трансгенных по Hsp70 фибробластах и фибробластах NPDA, обработанных rHsp70. Масс-спектрометрический анализ липидного спектра (сфингомиелин и церамид, как указано) в иммортализованных эмбриональных фибробластах мыши (iMEF) дикого типа (WT) или трансгенных по Hsp70 (TG) (A и B), а также фибробластах пациентов с болезнью Ниманна-Пика типа A (NPDA 83/24), остававшихся необработанными или обработанных rHsp70 (C). Более низкие уровни сфингомиелина и более высокие уровни церамида указывают на увеличение активности кислой сфингомиелиназы.
Фигура 15
Реверсирование патологии в фибробластах пациента с болезнью Фарбера. Количественный анализ лизосомального региона конфокальных площадей поперечного сечения клеток пациентов с болезнью Фарбера. Фибробласты пациента с болезнью Фарбера (Фарбер 89/73 и Фарбер 89/78) оставляли необработанными или обрабатывали в течение 24 часов 300 нМ BSA или 300 нМ rHsp70, как указано. Как следует из фигур, обработка фибробластов пациента с болезнью Фарбера rHsp70 существенно реверсирует патологию лизосом, т.е. снижает площадь поперечного сечения лизосом. Для описания способов смотри пример 2.
Фигура 16
Hsp70 увеличивает захват других молекул посредством эндоцитоза. Панель A: иммортализованные эмбриональные фибробласты мыши (iMEF) дикого типа (WT) или трансгенные по Hsp70 (TG) инкубировали с 20 мкг/мл меченым Alexa Fluor-488 BSA (BSA*) в течение 24 часов. Захват посредством эндоцитоза определяли посредством флуоресцентной микроскопии (не приводится) (смотри пример 2). Затем клетки собирали и анализировали захват BSA*. Как следует из фигуры, Hsp70-трансгенные iMEF обладают существенно большим захватом BSA*, чем iMEF дикого типа. Панель B: клетки остеосаркомы U-2О-S инкубировали с 20 мкг/мл BSA* в течение 24 часов с 3000 нМ rHsp70 или без, как указано. Поглощение посредством эндоцитоза определяли посредством флуоресцентной микроскопии (не приводится) (смотри пример 2). Затем клетки собирали и анализировали поглощение BSA*. Как следует из фигуры, клетки U-2О-S, в которые совместно добавляли BSA* и rHsp70, обладают существенно большим поглощением BSA*, чем клетки, инкубированные только с BSA*.
Подробное описание изобретения
Как демонстрируют авторы настоящего изобретения, основную часть своего цитопротективного действия Hsp70 оказывает через прямое взаимодействие с эндолизосомальными мембранами; взаимодействием управляет специфический фосфолипид под названием (бис(моноацилглицеро)фосфат). BMP присутствует только в поздних эндосомах и лизосомах. Авторы демонстрируют, что взаимодействие Hsp70-BMP зависит от N-концевого АТФазного домена Hsp70, в особенности триптофана 90, и, кроме того, взаимодействие зависит от pH. Взаимодействие Hsp70 и BMP является существенным для мембрано-стабилизирующего действия Hsp70, т.к. обеспечивает платформу для модуляции стабильности специфической подгруппы лизосомальных ферментов и предотвращает дестабилизацию лизосомальных мембран с последующим высвобождением лизосомальных ферментов. Эти данные формируют основу нового и многообещающего способа терапии лизосомных болезней накопления, как описано в настоящем документе.
Лизосомы
С момента открытия лизосом Duve в 1955 в представлении об этих органеллах доминировала догма о том, что они являются исключительно конечным этапом эндоцитоза в клетках животных - компартментом, вмещающим широкий набор гидролаз, которые в случае высвобождения в цитозоль вызывают некроз и воспаление ткани. Данное представление о лизосомах, как об установке для удаления отходов в лучшем случае и как о неспецифическом средстве самоубийства в худшем случае, резко изменилось в свете недавних открытий, предоставляющих доказательство значительно больших специфических функций лизосом и их содержимого.
Лизосомальные гидролазы
Как главный компартмент внутриклеточной деградации и последующей переработки элементов клетки, лизосомы получают свой гетеро- и аутофагический груз, который в просвете данной органеллы достигает своего пункта назначения. Деградацию осуществляет ряд кислых гидролаз (фосфатазы, нуклеазы, гликозидазы, протеазы, пептидазы, сульфатазы, липазы и т.д.), способных расщепить все главные макромолекулы клетки. Среди наиболее изученных лизосомальных протеаз существует семейство катепсиновых протеаз. Катепсины можно разделять на три подгруппы по аминокислоте в их активном центре, т.е. цистеиновые (B, C, H, F, K, L, O, S, V, W и X/Z), аспартатные (D и E) и сериновые (G) катепсины. Катепсины оптимально функционируют при кислом pH в лизосомах (pH 4-5), хотя они могут функционировать при нейтральном pH вне лизосом, хоть и со снижением стабильности и/или изменением специфичности.
До недавнего времени считали, что функция катепсинов ограничена эндолизосомальным кругооборотом белков и деградацией внеклеточного матрикса при секреции. Однако в течение последних нескольких лет многим катепсинам приписывают более специфические функции, включая роль в ремоделировании костной ткани, презентации антигена, гомеостазе эпидермиса, процессинге прогормонов, защите цитотоксических лимфоцитов от саморазрушения после дегрануляции, защите центральной нервной системы мыши, ангиогенезе, инвазии злокачественных клеток, а также программируемой гибели клеток (PCD).
Помимо расщепления белков, лизосомы и поздние эндосомы также отвечают за метаболизм липидов клетки, таких как гликосфинголипиды, посредством групп эндолизосомальных ферментов и коэнзимов, чья собственная функция зависит от липидного состава эндолизосомальных мембран. Важность метаболизма функциональных эндолизосомальных липидов легко можно оценить, принимая во внимание, что клиническое заболевание выявляют в случае дисфункции на любой стадии метаболизма сфинголипидов, приводящей к таким заболеваниям, как болезнь Тея-Сакса, болезнь Сандхоффа, болезнь Фарбера, болезнь Фабри, болезнь Гоше, болезнь Краббе и болезнь Ниманна-Пика.
Транспорт в лизосомы и из них
Транспорт эндоцитозных мембран играет существенную роль в клетке млекопитающего благодаря доставке компонентов мембран, различных растворенных молекул и связанных с рецептором лигандов в ряд внутриклеточных компартментов. В то время как различные пути эндоцитоза до недавнего времени представлялись простыми, где главные пути сходятся на лизосомах, в которых имеют место деградация и возможная переработка обратно в цитоплазматическую мембрану, недавние доказательства демонстрируют, что данные пути являются более сложными, чем представлялось на первый взгляд.
Путь эндоцитоза
Эндоцитоз является наиболее понятным в терминах рецептор-опосредуемого эндоцитоза молекул посредством формирования покрытых клатрином углублений, хотя идентифицировали ряд путей эндоцитоза, опосредованных не клатрином (например, макропиноцитоз, фагоцитоз, захват посредством формирования кавеол и непокрытых клатрином углублений). Терминология системы эндоцитоза не полностью стандартизована, и общеупотребительный термин "ранняя эндосома" в действительности описывает два отдельных эндосомальных компартмента - сортирующую эндосому и эндоцитозный рециркулирующий компартмент (ERC). В обычном рецептор-опосредуемом пути эндоцитоза рецепторы, такие как рецепторы трансферрина, рецептор липопротеинов низкой плотности и рецептор манноза-6-фосфата (MPR), концентрируются в покрытых клатрином углублениях на поверхности цитоплазматической мембраны посредством взаимодействий между консервативными мотивами в их цитоплазматических хвостах и элементами клатриновой оболочки. После отделения клатриновой облочки новая сформированная эндосома сливается с другими эндосомами и уже существующими сортирующими эндосомами с целью стать сортирующей эндосомой. Как видно из названия, ее первичной задачей является сортировка недавно возникших компонентов по соответствующим локализациям. Три известных пункта назначения включают цитоплазматическую мембрану, поздние эндосомы и ERC. При созревании сортирующей эндосомы она испытывает снижение pH, которое способствует высвобождению связанных с рецептором лигандов в просвет эндосомы. Однако до полного созревания сортирующей эндосомы в позднюю эндосому направленные на переработку молекулы необходимо отсортировать. Полагают, что данный процесс происходит посредством отщепления небольших трубочек, процесс, который способствует сортировке мембранных белков из растворенных молекул, поскольку отношение поверхности к объему у трубочек выше, чем у везикулярной сортирующей эндосомы. Отщепленные трубочки могут передавать мембранные белки прямо обратно в цитоплазматическую мембрану (прямой путь возврата) или в ERC. В основном ERC является скоплением тубулярных органелл, локализация которых варьирует в разных типах клеток. В то время как ERC способна сортировать молекулы в несколько различных пунктов назначения, большинство молекул, проходящих ERC, возвращается в цитоплазматическую мембрану.
Когда сортирующая эндосома созревает, pH в ее просвете непрерывно снижается, в основном посредством действия протонной АТФазы вакуолярного типа (V-АТФаза), в то же время происходит сдвиг в содержании мембранных белков и липидов. Мембранный транспорт из сортирующей эндосомы в позднюю эндосому и затем в лизосому является поводом для некоторой дискуссии. Дискуссия касается того, лучше ли объяснять данный транспорт посредством везикулярного транспорта или посредством созревания сортирующей эндосомы. Обе модели представляют среднее между сортирующей и поздней эндосомой. В то время как модель созревания утверждает, что везикула, которая достигает поздней эндосомы, является тем, что осталось после удаления компонентов из бывшей сортирующей эндосомы, модель предсуществующего компартмента утверждает, что транспорт молекул в поздние эндосомы происходит через эндоцитозную транспортную везикулу (ECV), специфическую транспортную везикулу между предсуществующей сортирующим и поздним эндосомальным компартментом. И сортирующий, и поздний эндосомальный компартмент рассматривают как структурно более сложные и имеющие больше специализированных функций, чем транспортные везикулы. Недавние исследования по визуализации живых клеток урегулировали механистические аспекты обеих моделей, однако то, как везикулы возникают из активной сети ранних эндосом, может подвергаться дискуссии в том, как они теряют малую ГТФазу RAB5 и приобретают RAB7, маркер поздних эндосом. Хотя организация пути эндоцитоза функционально четко определена, терминология может являться нечеткой. Функционально путь эндоцитоза определяют по рецепторам домашнего хозяйства (например, рецептору трансферрина) и другим липидам и белкам, прошедшим через раннюю эндосому/сортирующую эндосому, где имеет место разъединение лиганда с рецептором, но не через позднюю эндосому, где может происходить протеолиз. Однако, помимо данных функциональных критериев, картина становится более запутанной, когда это касается терминологии, не в самую последнюю очередь при условии образования внутрипросветных везикул, начинающегося в ранних эндосомах и становящегося более и более заметного в течение созревания поздних эндосом, приведшего к возникновению термина "мультивезикулярные тельца" (MVB). Данный термин взаимозаменяемо используют для ECV и поздних эндосом, а также для всех эндоцитозных везикул, содержащих мультивезикулярные области или элементы, включая гибридные органеллы, которые образуются, когда лизосомы сливаются с поздними эндосомами (которые содержат мультивезикулярные структуры). Однако поздние эндосомы содержат больше внутрипросветных везикул и, таким образом, часто являются компартментом, описываемым термином "мультивезикулярные тельца".
В конечном итоге, существенное количество путаницы в данной области возникло из-за разделения поздних эндосом и лизосом или его недостатка. Оба компартмента в равной степени имеют кислую среду, и большинство, если не все, белков, присутствующих в лизосомах, также обнаруживают в поздних эндосомах. По модели созревания поздние эндосомы являются предшественниками лизосом, но склонными к ступенчатому развитию, как позволяет предполагать теория, и очень трудно достичь строгой классификации. Однако недавно представили доказательство того, что лизосомы и поздние эндосомы являются отдельными компартментами, которые затем подвергаются "поцелую" (временному слиянию), а также полному слиянию, после которого лизосомы могут преобразовываться из гибридных огранелл.
Биосинтетический путь
Помимо эндоцитоза, поздние эндосомы также получают груз через путь MPR из сети транс-Гольджи (TGN) (биосинтетический путь). Катион-зависимый MPR и катион-независимый рецептор MPR/инсулиноподобного фактора роста-II (IGF-II) делят функцию доставки вновь синтезированных кислых гидролаз из TGN в лизосомы. Распознавание кислых гидролаз MPR требует дополнительных углеводов в эндоплазматической сети и последующей модификации и фосфорилирования углеводных остатков до остатков маннозо-6-фосфата в цис-Гольджи. MPR-связанные гидролазы сначала доставляются в эндосомы, где они диссоциируют от рецепторов по причине снижения pH в полости, таким образом, позволяя рецепторам вернуться обратно в TGN. Белком, в основном ответственным за сортировку MPR в покрытые клатрином углубления на TGN, является адапторный белок-1 (AP-1), хотя также в этом играют роль локализованные в аппарате Гольджи содержащие γ-петлю связывающие фактор АДФ-рибозилирования белки (GGA). В настоящее время известно, что и AP-1, и GGA работают совместно или фактически нацелены на два MPR к разным субклеточным локализациям. AP-1 является частью семейства адапторных белков, состоящего из четырех членов, все из которых являются гетеротетрамерными белками, широко применяемыми в секреторном и эндоцитозном путях. В дополнение к указанной выше роли AP-1 в покрытых клатрином углублениях, образующихся в TGN, AP-1 и AP-2 применяются в покрытых клатрином углублениях в течение эндоцитоза на цитоплазматической мембране, в то время как AP-3 и AP-4 функционируют в транспорте лизосомальных мембранных белков (LAMP).
Путь аутофагии
Аутофагия является третьим хорошо охарактеризованным путем попадания макромолекул в лизосому. Аутофагия является эволюционно консервативным путем, вовлеченным в кругооборот долгоживущих белков и органелл. Как правило, он действует на низком базальном уровне, хотя его можно индуцировать, например, в условиях ограничения питания. В данных условиях макроаутофагия является главным путем, отвечающим за доставку вещества в лизосомы. Макроаутофагия характеризуется плоскими мембранными цистернами вокруг цитоплазматических органелл и/или части цитозоля, таким образом, образующим закрытую двухмембранную связанную вакуоль, аутофагосому. В конечном итоге аутофагосома сливается с лизосомами, образуя аутофаголизосому/аутолизосому, где происходят деградация и переработка поглощенных макромолекул. Происхождение мембраны аутофагосомы до сих пор не ясно. Эндоплазматическая сеть, аппарат Гольджи, малоизученный мембранный компартмент, называемый фагофор, так же как и синтез de novo, рассматривали в качестве источников мембраны аутофагосомы. Недавний прогресс посредством генетики дрожжей и последующего открытия гомологов у млекопитающих быстро улучшает понимание процесса аутофагии, и следует надеяться, что в ближайшее время они прольют свет на источник мембраны аутофагосом.
Также существуют другие пути попадания аутофагического груза в лизосомы. Более беспорядочный процесс, называемый микроаутофагией, характеризуется поглощением цитозоля лизосомами посредством инвагинации лизосомальной мембраны. Помимо макромолекул, которые присутствуют в поглощенном цитозоле, данный процесс также может вовлекать захват органелл, таких как пероксисомы. В конечном итоге шаперон-опосредуемый транспорт белков цитозоля в просвет лизосомы представляет собой более направленную и селективную форму аутофагии. Данный путь зависит от присутствия конститутивно экспрессирующегося члена семейства белков теплового шока 70, Hsc70, на обеих сторонах лизосомальных мембран. Более того, процесс зависит от распознавания LAMP-2a консервативного мотива KDEL на целевом белке.
Перестройка лизосом и лизосомальная секреция
После слияния лизосом с поздними эндосомами или аутофагосомами лизосомы перестраиваются из образующихся гибридных органелл через секвестрацию мембранных белков и конденсацию содержимого просвета. Из мембранных белков, которые необходимо удалить или переработать из гибридной органеллы, наиболее заметными являются MPR, т.к. они по определению отсутствуют в лизосомах. Однако лизосомы нельзя рассматривать как конечную стадию пути эндоцитоза, т.к. они также способны образовывать секреторные лизосомы посредством слияния с секреторными гранулами, Ca2+-зависимого процесса, который впервые обнаружили в секретирующих клетках гемопоэза. Однако также существует доказательство Ca2+-регулируемого мембранно-проксимального лизосомального компартмента, отвечающего за экзоцитоз в несекретирующих клетках. Процесс экзоцитоза зависит от белка Rab27a, члена семейства белков Rab, которое насчитывает более 60 членов. Rab являются малыми ГТФазами, которые играют ключевую регуляторную роль в большинстве этапов мембранного транспорта, включая формирование везикулы, подвижности, соединение и слияние. По меньшей мере, 13 белков Rab применяются в пути эндоцитоза для определения судьбы различных подвергнутых эндоцитозу молекул и их везикул.
Программируемая гибель клеток
Регуляция общего количества клеток, также как и количества клеток, составляющих различные ткани, вместе с потребностью в механизме элиминации нежелательных клеток являются фундаментальной потребностью в многоклеточных организмах. Таким образом, программируемая гибель клеток наделяет многоклеточный организм потенциалом - освобождать себя от нежелательных клеток без потери элементов клетки и, таким образом, избегать воспаления, связанного с некрозом, принципиальной альтернативой программируемой гибели клеток.
Апоптоз
Слово апоптоз применяют в греческом языке для описания "опадания" лепестков цветов или листьев с деревьев, и впервые введено в обращение Currie и соавторами в 1972 для описания общего типа программируемой гибели клеток, которую авторы наблюдали для ряда тканей и типов клеток. Авторы отмечали, что наблюдаемые ими явления обладают значительным морфологическим сходством, которое отличается от морфологических черт, характеризующих клетки, подвергающиеся патологической, некротической смерти, и предполагали, что данные общие морфологические черты могут иметь место из-за идентичного основополагающего процесса.
Когда клетки гибнут посредством апоптоза, они подвергаются серии трансформирующих событий. Среди данных событий существенной для характерного апоптотического фенотипа является активация каспаз - семейства цистеиновых эндопептидаз, которые расщепляют субстраты по специфическим остаткам аспартата, и таким образом получивших свое название. Активация каспаз приводит к протеолитическому процессингу других каспаз, а также множеству других изменений в общей активности белков в клетках, в конечном итоге приводя к характерным морфологическим чертам, связанным с активацией каспаз и, таким образом, по определению, с апоптозом. Классические черты апоптоза включают сжатие клетки и вакуолизацию цитоплазматической мембраны, конденсацию хроматина в правильные геометрические формы, фрагментацию ДНК на ~200 п.н. фрагменты, так называемую нуклеосомную лестницу, отделение клетки от соседних клеток и дезинтеграцию клетки в небольшие замкнутые везикулы, называемые апоптотическими тельцами. В многоклеточном окружении данные апоптотические тельца в конечном итоге подвергаются фагоцитозу макрофагами или соседними клетками, таким образом, завершая удаление нежелательной клетки.
Программируемая гибель клеток
Программируемая гибель клеток (PCD) не является синонимом апоптоза, хотя кто-то может подумать так, основываясь на литературе, в которой данный термин применяют беспорядочно. Постепенно принимают термин PCD, хотя все еще применяют термин апоптоз для описания программы гибели клеток, регулируемой активацией каспаз, в частности каспазы-3. Однако способность некоторых клеток выживать после активации проапоптотических каспаз, также как PCD с полным отсутствием активации каспаз и активация каспаз, приводящая к неапоптотической PCD, свидетельствуют о значительной пластичности программы (программ) гибели клеток, и, таким образом, PCD можно более точно определять как гибель клеток, зависящую от сигналов и активностей внутри умирающей клетки. Предполагают, что PCD можно подразделять на апоптоз, апоптозо-подобную и некрозо-подобную PCD по морфологии ядра умирающих клеток, каждое определение обусловлено различными морфологическими характеристиками, из которых главной является форма конденсации хроматина или ее отсутствие, хотя более предпочтительно различать PCD, основываясь на путях передачи сигнала, лежащих в основе каждого набора состояний, приводящего к PCD. Однако данный способ разделения различных типов PCD еще не применяют, т.к. необходимо классифицировать пути, приводящие к различным типам гибели клеток.
Некроз
Некроз является принципиальной альтернативой PCD и его невозможно предотвратить любым другим способом, кроме как удалением стимулов, вызывающих некроз. Данный тип гибели клеток, как правило, наблюдают при патологических повреждениях организма.
Молекулярный механизм программируемой гибели клеток
Апоптоз
Как указано в предыдущем разделе, апоптоз определяют по активации членов семейства цистеиновых эндопептидаз, известных как каспазы, и морфологии, связанной с их активацией. Каспазы присутствуют в клетках как неактивные зимогены, которые можно быстро активировать протеолитическим процессингом. Процессинг происходит как иерархический каскад, в котором апоптотический стимул активирует инициаторную каспазу (например, каспазу-8 и -9), которая, в свою очередь, активирует следующий уровень в иерархии, эффекторные каспазы (например, каспазы-3, -6 и -7). Последние рассматривают как исполнителей апоптоза, т.к. они расщепляют ряд субстратов, процессинг которых в конечном итоге приводит к фенотипу, ассоциируемому с апоптозом. Программу апоптоза можно активировать различными стимулами, которые приблизительно можно разделить на внеклеточные и внутриклеточные стимулы, последние рассматривают митохондрион в качестве важного участника. Внеклеточные стимулы и последующий ответ, вызывающий апоптоз, также обозначают как внешний путь передачи сигнала, он включает серию событий, начинающуюся с активации одного из различных рецепторов смерти, таких как Fas/Apo-1/CD95, TNFR или TRAIL. После связывания их соответствующих лигандов данные рецепторы задействуют содержащие домен смерти (DD) адапторные молекулы, такие как TRADD (TNFR1-ассоциированный белок, содержащий домен смерти) и FADD (Fas-ассоциированный белок, содержащий домен смерти), посредством взаимодействия с DD, присутствующим в рецепторе. Затем данные адапторные молекулы задействуют в своем рецепторном комплексе каспазу-8, где каспаза активируется, возможно, посредством индуцированного пространственной близостью аутокаталитического процессинга. Затем в некоторых клетках (так называемых клетках I типа) каспаза-8 непосредственно расщепляет и активирует прокаспазу-3, в то время как в клетках II типа субстратом для каспазы-8 является цитоплазматический белок Bid. Расщепление Bid порождает фрагмент (усеченный Bid (tBid)), который индуцирует олигомеризацию, транслокацию и инсерцию двух проапоптотических членов семейства Bcl-2, Bax и Bak, на внешней митохондриальной мембране. Данная инсерция опосредует высвобождение носителя электронов цитохрома c (CytC) из межмембранного пространства митохондрий вместе с множеством других белков, наиболее значительными из которых являются фактор индукции апоптоза (AIF), Smac/DIABLO, который противодействует эффектам белков, известных как белки-ингибиторы апоптоза (IAP), и эндонуклеазы G, ДНКаза. Необходимо отметить, что хотя это и является важнейшим моментом в теориях активации каспаз через митохондрии, в отношении того, как инсерция Bax и Bak облегчает высвобождение цитохрома c, не существует убедительных доказательств. После высвобождения из митохондрий CytC накапливается в цитоплазме, где он связывается с белком Apaf-1 (апоптотический протеаза-активирующий фактор-1), что приводит к конформационным изменениям, которые способствуют олигомеризации Apaf-1. Затем данный олигомер связывается с прокаспазой-9 посредством однотипных взаимодействий между доменами активации каспазы (CARD), что приводит к образованию комплекса, называемого апоптосомой. Образование данного комплекса приводит к значительному усилению ферментативной активности прокаспазы-9, активность которой приводит к протеолитической активации каспазы-3.
Также апоптоз могут запускать внутриклеточные факторы, усиливающие проницаемость внешней митохондриальной мембраны (MOMP), процесс, известный как внутренний путь передачи сигнала. Данные факторы включают вторичные мессенджеры, ассоциируемые с клеточным стрессом, такие как Ca2+, NO и арахидоновая кислота, а также билирубин, соли желчных кислот и стимулы, которые могут вызывать денатурацию белков и повреждение ядерной и митохондриальной ДНК, такие как ионизирующее излучение, тепловой стресс, активные формы кислорода (ROS) и химиотерапевтические средства. В случае повреждения ядерной ДНК его контролируют различные протеинкиназы, которые зависят от формы повреждения ДНК, а также и пагубно его усиливают. Активность данных киназ индуцирует накопление p53, который затем может действовать как фактор транскрипции, вызывая усиление транскрипции проапоптотических генов, таких как Bax, Noxa и PUMA, все из которых могут индуцировать MOMP. На уровне митохондрий p53 индуцирует экспрессию митохондриальных ферментов, которые локально генерируют ROS, а также митохондриальный матричный белок (p53AIP1), сверхэкспрессия которого запускает падение потенциала митохондрий и апоптоз.
Индукция MOMP посредством p53 или посредством действия описанных выше внутренних стимулов является точкой пересечения внутреннего и внешнего путей передачи сигнала, где внутренний путь передачи сигнала следует описанному выше для внешнего пути передачи сигнала с высвобождением цитохрома С, образованием апоптосомы и активацией каспазы-3, составляющими конечные этапы смерти нежелательной клетки.
Альтернативы апоптозу
В течение последнего десятилетия оспаривают исключительную роль каспаз как исполнителей PCD, и возрастающее количество доказательств позволяет предполагать о большем в жизни, и в особенности смерти, клетки, чем можно приписать только каспазам.
Недавно разработанные каспаза-специфические фармакологические ингибиторы, а также инактивация пути передачи сигнала каспазами посредством факторов, таких как истощение энергии, нитративный/оксидативный стресс и члены семейства белков-ингибиторов апоптоза (IAP), не всегда останавливают прогрессирование по направлению к смерти, они инициируют или даже усиливают подгруппу основополагающих каспаза-независимых программ гибели. Данные программы включают инициируемые рецептором смерти пути передачи сигнала, а также пути передачи сигнала, инициируемые противоопухолевыми лекарственными средствами, недостаточностью факторов роста, стауроспорином, Bax-родственными белками и истощением Hsp70. Морфологические черты данных каспаза-независимых программ гибели часто напоминают наблюдаемые при классическом апоптозе, и быстро растут экспериментальные доказательства роли других протеаз, таких как катепсины, калпаины и сериновые протеазы, в качестве существенных кофакторов вышестоящих и нижестоящих каспаз. Этот аргумент усиливается данными о том, что многие некаспазные протеазы способны расщеплять, по меньшей мере, некоторые из классических субстратов каспаз, что может объяснить некоторые сходства, наблюдаемые между каспаза-зависимыми и -независимыми программами гибели.
Хотя можно оспаривать значимость таких программ гибели, т.к. они замаскированы эффективностью каспаз, накапливаются доказательства эволюционно консервативной роли лизосомальных катепсиновых протеаз в программах гибели клеток, инициируемых в ответ на различные стимулы, такие как рецептор смерти из семейства рецепторов фактора некроза опухоли, гипоксия, оксидативный стресс, осмотический стресс, высокая температура и противоопухолевые лекарственные средства.
Вовлечение лизосом в программируемую гибель клеток
В то время как роль лизосом и их гидролаз в очищающей фазе PCD, т.е. поглощении апоптотических клеток и телец соседними клетками или фагоцитами, хорошо изучена, понимание значимости лизосом и лизосомальных гидролаз в промежуточных событиях PCD заняло время. Одной из причин данной задержки может являться то, что метилкетоновые ингибиторы пептидов, общеупотребительные для оценки роли каспаз в PCD (например, zVAD-fmk, Ac-DEVD-fmk, Boc-D-fmk и т.д.), также ингибируют другие цистеиновые протеазы, включая некоторые цистеиновые катепсины. Даже спустя девять лет после обнаружения их перекрестной реакции протективные эффекты этих ингибиторов в концентрациях, способных ингибировать некаспазные протеазы, часто интерпретируют как доказательство каспаза-опосредованного пути гибели и продолжают недооценивать роль других цистеиновых протеаз в PCD. Открытие лизосомальной PCD может дополнительно откладываться по причине того, что ультраструктура лизосом кажется интактной в апоптотических клетках, анализируемых посредством электронной микроскопии. Таким образом, разрушение лизосом до недавнего времени рассматривали как изменение по принципу "все или ничего" на поздних стадиях неконтролируемой некротической гибели клеток и аутолиза ткани. Однако новые способы, позволяющие более точно оценивать целостность лизосомальной мембраны, позволяли выявлять, что лизосомы с нормальной ультраструктурой могут пропускать часть своих ферментов, и данная частичная проницаемость лизосомальных мембран (LMP) не только ранее имела место во многих моделях гибели, но может в действительности запускать апоптоз и апоптоз-подобную PCD.
Проницаемость лизосомальных мембран (LMP) и ее следствия
Исследования с различными соединениями, которые нацелены непосредственно на целостность лизосомальных мембран, такими как H2O2, сложный метиловый эфир L-лейцил-L-лейцина, осмотический стресс, сфингозин, лизосомотропные антибиотики норфлоксацин и ципрофлоксацин и фотоокислительное повреждение лизосом (фотолиз), убедительно доказывают, что умеренная проницаемость лизосом может приводить к PCD. Количественное соотношение между степенью разрушения лизосом и типом гибели клеток позволяет предполагать объяснение широких различий в морфологическом исходе LMP. По данной модели низкая интенсивность стресса запускает ограниченное высвобождение содержимого лизосом в цитоплазму с последующим апоптозом или апоптоз-подобной гибелью клеток, в то время как высокая интенсивность стресса приводит к генерализованному разрушению лизосом и быстрому некрозу клетки. Таким образом, низкая концентрация сфингозина, кислого метаболита церамида, синтезируемого церамидазой, с детергент-подобными свойствами при низком pH, индуцирует частичную LMP и каспаза-опосредованный апоптоз, в то время как высокие концентрации приводят к массивной LMP и каспаза-независимой некротической гибели клетки. В данной модели запускаемую частичной LMP гибель можно ингибировать фармакологическими ингибиторами цистеиновых и аспартатных катепсинов, и увеличение активности цитозольных катепсинов предшествует активации каспаз и изменениям потенциала митохондриальных мембран, позволяя предполагать непосредственную роль цитозольных катепсинов в процессе гибели. Важно, что роль LMP и катепсинов в гибели клеток не ограничивается экспериментальными моделями с применением непосредственных разрушителей лизосом. LMP также участвует в исполнении гибели клетки в ответ на широкий ряд классических апоптотических стимулов, таких как активация рецепторов смерти из семейства рецепторов фактора некроза опухоли (TNF), интерлейкин-1, активация p53, недостаточность факторов роста, стабилизирующие микротрубочки средства, этопозид, активация сигма-2 рецептора, синтетический ретиноид CD437, активация рецептора B-клеток, стауроспорин, осмотический стресс, а также низкомолекулярные соединения, идентифицированные при скрининге для новых противоопухолевых лекарственных средств, которые индуцируют p53-независимый апоптоз.
LMP как пусковой механизм митохондриального пути апоптоза
Цитотоксические эффекты LMP часто зависят, по меньшей мере частично, от активации митохондриального пути гибели. Элегантное исследование посредством микроинъекций демонстрирует, что при локализации в цитозоле отдельная лизосомальная гидролаза, катепсин D, является достаточной для запуска проницаемости внешней митохондриальной мембраны и апоптоза при клеточных дозах, соответствующих половине общей клеточной активности катепсина D. Однако катепсин D недостаточен для запуска PCD во всех моделях гибели клеток, вовлекающих LMP. Другие хорошо изученные медиаторы запускаемой LMP PCD включают цистеиновые катепсины B и L, а также активные формы кислорода. Однако необходимо подчеркнуть, что соответствующим образом не исключена роль других лизосомальных гидролаз, лизосомальных вторичных мессенджеров и LMP-опосредованного закисления цитозоля. Одна из связей между катепсинами и проницаемостью митохондриальной мембраны может являться Bid, проапоптотический исключительно BH3 белок из семейства Bcl-2, которые могут процессировать и активировать некоторые цистеиновые катепсины, но не катепсин D при цитозольном pH. Однако предполагают, что катепсин D активирует и расщепляет Bid в кислой среде эндолизосомального компартмента после интернализации рецептора-1 TNF (TNF-R1). По данной модели эндоцитоз активированного лигандом TNF-R1 приводит к опосредуемому кислой сфингомиелиназой синтезу церамида, который затем связывается с неактивным катепсином D и активирует его посредством аутокаталитического процессинга. Катепсин D также может активировать Bax Bid-зависимым образом, что продемонстрировали на обработанных стауроспорином Т-клетках. Кроме того, в обработанных ципрофлоксацином фибробластах LMP запускает проницаемость митохондриальной мембраны посредством Bid-зависимой активации Bax и Bak. В данной модельной системе активация Bax не зависит от катепсина D, но вместо этого зависит от активных форм кислорода. Необходимо отметить, что индуцируемая ципрофлоксацином проницаемость митохондриальной мембраны не полностью ингибируется в клетках с недостатком Bax и Bak. Альтернативный механизм, соединяющий LMP и проницаемость митохондриальной мембраны, может включать непосредственные эффекты активных форм кислорода и/или липидных медиаторов, таких как арахидоновая кислота, которая может синтезироваться в катепсин B-зависимым образом.
Исследования с применением иммортализованных эмбриональных фибробластов мыши (MEF) от мышей с дефицитом отдельных катепсинов четко выявили то, что в исполнение гибели клеток, зависящей от запускающих LMP стимулов, вовлечены различные катепсины. Иммортализованные MEF от мышей с дефицитом катепсинов B и L, но не от мышей с дефицитом катепсина D, высокорезистивны к TNF, в то время как противоположную картину наблюдают при обработке клеток стауроспорином. Обширные исследования индуцируемых TNF путей гибели клеток, помимо прочего, выявили, что роль отдельных катепсинов в PCD зависит от типа изучаемых клеток. Как указано выше, индуцируемая TNF гибель иммортализованных MEF зависит от цистеиновых катепсинов, но не от катепсина D. Кроме того, истощение катепсина D эффективно защищает клетки рака шейки матки HeLa от индуцируемой TNF и цисплатином цитотоксичности. Данное различие возникает не по причине общих различий между клетками человека и мыши, т.к. катепсин B отдельно и совместно с другими цистеиновыми катепсинами также является ключевым для эффективного индуцируемого TNF уничтожения клеток в линиях клеток рака шейки матки (ME-180) и рака молочной железы (MCF-7). Объяснение данного разнообразия до сих пор не ясно, но в этом могут играть роль различные уровни экспрессии отдельных катепсинов и их ингибиторов в различных клеточных линиях. Таким образом, различная способность различных стимулов гибели регулировать уровни экспрессии отдельных катепсинов или их ингибиторов может дать объяснение различиям в ответе на различные стимулы. Например, известно, что адриамицин и этопозид усиливают экспрессию катепсина D посредством активации p53. Альтернативно, другие пути передачи сигнала, индуцируемые различными стимулами, могут действовать совместно со специфическими катепсинами.
Митохондрион-независимый путь гибели, индуцируемый LMP
Важно, что летальные эффекты LMP и цитозольных катепсинов не ограничиваются активацией внутреннего пути апоптоза. В клетках мелкоклеточного рака легких, обработанных стабилизирующими микротрубочки лекарственными средствами (паклитакселом, эпотилоном Β и дискодермолидом), LMP происходит в процессе гибели клетки, и цистеиновые катепсины опосредуют микронуклеацию и гибель клетки каспаза-независимым образом. В обработанных TNF клеточных линиях карциномы человека LMP происходит вслед за проницаемостью внешней митохондриальной мембраны. Однако ингибирование активности или экспрессии цистеиновых катепсинов дает существенную защиту против индуцируемой TNF гибели клеток без значительного ингибирования активации эффекторных каспаз. Кроме того, катепсин B отвечает за апоптоз-подобные изменения, такие как конденсация хроматина, выход фосфатидилсерина и вакуолизация цитоплазматической мембраны в отсутствие активности каспаз в обработанных TNF клетках фибросаркомы мыши WEHI-S. Кроме того, истощение белка теплового шока 70 (Hsp70) в различных клетках злокачественных опухолей человека, а также сверхоптимальная активация Т-клеток запускает LMP и опосредуемую катепсинами апоптоз-подобную PCD без активации внутреннего пути апоптоза. В соответствии с этими данными катепсин B может индуцировать ядерный апоптоз в изолированных ядрах. Таким образом, катепсины, предположительно, способны действовать и как инициаторные, и как эффекторные протеазы программируемой гибели клетки в зависимости от стимула и контекста клетки. По причине их способности опосредовать PCD в злокачественных клетках, где митохондриальный путь гибели блокирован, например, по причине сверхэкспрессии Bcl-2, усиливается надежда, что способы лечения, индуцирующие LMP, могут доказать свою эффективность в лечении злокачественных опухолей, которые резистентны к индукторам классического апоптоза. Кроме того, данная идея подкреплена данными, демонстрирующими, что иммортализация и трансформация может делать клетки чувствительными к лизосомальной гибели клеток.
Передача сигнала LMP
Как описано выше, LMP, после которой происходит высвобождение содержимого лизосомы, в особенности катепсинов, в цитозоль, считается ключевым этапом активации лизосомального пути гибели. Однако путь передачи сигнала, приводящий к LMP, только начинает проясняться. Одним из наиболее изученных механизмов является передача сигнала от рецептора-1 фактора некроза опухоли, хотя объяснение данного пути передачи сигнала к LMP весьма затруднено из-за сильно отличающегося ответа в разных клетках-мишенях.
Таким образом, TNF может индуцировать какспаза-зависимую и -независимую LMP в зависимости от контекста клетки. Кроме того, относящиеся к TNF лиганды FasL, TRAIL и TWEAK также связаны с каспаза-независимой PCD, и с апоптотической, и с некротической морфологией. Фармакологические и генетические исследования показывают, что каспаза-опосредованный путь, приводящий от TNF к LMP, зависит от каспазы-8 и -9, хотя активация каспазы-9 сильно отличается в клетках человека и мыши. Связь между каспазами и LMP все еще неизвестна, и хотя индуцируемое TNF и опосредованное каспазой-8 расщепление Bid позволяет предполагать участие LMP, эти данные не подтверждаются индуцируемой TNF LMP в iMEF с дефицитом Bid. Кроме того, предполагают, что Bid является мишенью для катепсинов в лизосомальном пути гибели, вовлекающем Bid раньше, нежели позже, LMP.
Также TNF стимулирует расщепление сфингомиелина до фосфорилхолина и церамида посредством активации нейтральной сфингомиелиназы (SMазы) на цитоплазматической мембране и кислой SMазы (aSMазы) в лизосомальном компартменте. Оба события вовлечены в индуцируемые TNF пути гибели клеток, но до настоящего времени только нейтральную SMaзу связывали с LMP через фактор, ассоциированный с нейтральной SMaзой (FAN). Исследования, проводимые на iMEF с дефицитом FAN, а также фибробластах человека, экспрессирующих доминантную негативную форму FAN, показали, что FAN не только опосредует индуцируемую TNF продукцию церамида, но также участвует в процессинге каспазы-8 и гибели клеток. Т.к. индуцируемая TNF LMP в гепатоцитах мыши зависит от каспазы-8, снижение ее процессинга может объяснить снижение LMP в обработанных TNF гепатоцитах, экспрессирующих доминантный негативный FAN. Однако нельзя исключать роль церамида и его метаболитов. Их роль в индуцируемой TNF передаче сигнала гибели подтверждена снижением TNF и индуцируемой Fas гепатотоксичностью у мышей с дефицитом aSMaзы, которая активируется после каспазы-8. В частности, синтезируемый из церамида в реакции, катализируемой лизосомальным ферментом кислой церамидазой, сфингозин является заманчивым кандидатом, т.к. он, в противоположность церамиду, может действовать как детергент, непосредственно дестабилизируя лизосомальную мембрану. Помимо повышения синтеза прекурсора сфингозина, церамида, посредством активации SMase, TNF также регулирует уровни сфингозина посредством опосредованной катепсином B понижающей регуляции сфингозинкиназы-1, фермента, который превращает проапоптотический сфингозин в антиапоптотический сфингозин-1-фосфат. Данная активность катепсина B может приводить к накоплению сфингозина в лизосомах и, таким образом, может, по меньшей мере частично, объяснить вовлечение катепсина B в эффективную LMP в обработанных TNF гепатоцитах.
Кроме того, TNF может запускать LMP и гибель клеток в присутствии ингибиторов каспаз. Данный путь не зависит от каспазы-8, но требует взаимодействия с рецептором, содержащим домен смерти, белок-1 (RIP-1) и вовлекает синтез активных форм кислорода. Совместно с внутрилизосомальным железом оксидативный стресс может генерировать радикалы кислорода посредством реакции Фентона и, таким образом, может вызывать окисление липидов лизосомальной мембраны, приводя к дестабилизации мембраны и высвобождению содержимого лизосом. Молекулярная связь между RIP-1, оксидативным стрессом и LMP до сих пор не выяснена.
Индукция гибели клеток несколькими классическими индукторами апоптоза (т.е. p53, этопозидом и стауроспорином) также вовлекает LMP с последующей катепсин-зависимой проницаемостью митохондриальной мембраны. Однако пути передачи сигнала от данных стимулов к LMP остаются невыясненными.
Механизмы защиты клетки от LMP
Принимая во внимание потенциальный роковой исход LMP, не удивительно, что клетки развили ряд способов противодействовать этому, ингибируя сам LMP или защищая клетки от кислых гидролаз, попадающих в цитозоль вследствие LMP.
Сообщается, что, помимо многих других функций, фосфатидилинозитол-3-киназа (PI3K) защищает лизосомы от дестабилизации. Ингибирование PI3K в клетках эндотелия сосудов человека индуцирует высвобождение катепсина B в цитозоль, что свидетельствует о скорее непосредственной роли PI3K в сохранении целостности лизосомальных мембран. Кроме того, ингибиторы PI3K делают клетки чувствительными к индуцируемым TNF и интерлейкином-1 лизосомальным путям гибели. Измененные функции лизосом и повышенные уровни экспрессии катепсинов в злокачественных клетках могут представлять угрозу в виде снижения стабильности лизосом. Таким образом, PI3K, которая, как правило, активирована в злокачественных клетках человека, также может участвовать в стабильности лизосом в опухолевых клетках и, таким образом, повышать резистивность данных клеток к гибели. В то время как роль PI3K в стабильности лизосом опухолевых клеток только обсуждается, недавние данные свидетельствуют о роли Hsp70 в защите лизосом от разрушающих мембрану стимулов. Данное исследование в основном проводили на опухолевых клетках, которые также часто демонстрируют локализацию Hsp70 на цитоплазматической мембране, а также в эндолизосомальном компартменте.
В явлении высвобождения лизосомальных протеаз в цитозоль после LMP цитозольные ингибиторы протеаз представляют собой защиту от пагубных последствий. В то время как эндогенные ингибиторы катепсина D неизвестны, цистеиновые катепсины можно эффективно ингибировать, по меньшей мере, тремя цитозольными ингибиторами протеаз, т.е. цистатинами A и B и ингибитором сериновых протеаз 2A (Spi2A), недавно обнаружено, что они также обладают потенциальной ингибиторной активностью против некоторых цистеиновых катепсинов (B, H, K, L и V) и катепсина G. Значимость данных ингибиторов в предотвращении PCD в физиологических и патологических условиях демонстрируют посредством мышей с дефицитом цистатина B, которые демонстрируют повышение апоптоза клеток-зерен мозжечка. Кроме того, после обработки TNF экспрессия Spi2A индуцируется через NF-κB и эффективно ингибирует индуцируемую TNF активность цитозольного катепсина B и гибель клеток MEF. Любопытно, что недавно сообщали о том, что в C. Elegans цитозольный ингибитор сериновых протеаз (серпин)-6 может защищать от индукции, а также летальных эффектов от повреждения лизосом, вызванных гипоосмотическим стрессом, а также многообразием других лизосомальных стрессов, демонстрируя, что защита от LMP является эволюционно консервативным механизмом.
Лизосомные болезни накопления
Лизосомные болезни накопления (LSD) являются группой из приблизительно 40 редких наследственных заболеваний обмена веществ, которые являются результатом нарушений функций лизосом. LSD вызываются дисфункцией лизосом, как правило, вследствие дефицита отдельного фермента, необходимого для метаболизма липидов, гликопротеинов или мукополисахаридов. Хотя каждая болезнь является результатом мутаций в разных генах, приводящих к дефициту ферментативной активности, все они обладают общими биохимическими характеристиками - все лизосомные болезни начинаются с аномального накопления веществ внутри лизосомы.
По отдельности LSD возникают с частотой менее 1:100000, однако как группа они возникают с частотой приблизительно 1:5000-1:10000. Большинство из этих болезней являются аутосомно-рецессивными, однако несколько наследуются X-сцепленно, как болезнь Фабри.
В основном лизосомные болезни накопления классифицируют по природе первично накопленного материала, и их можно приблизительно разделять следующим образом:
- болезни накопления липидов (липидозы), в основном сфинголипидозы (включая болезни Гоше и Ниманна-Пика);
º ганглиозидозы (включая болезнь Тея-Сакса);
º лейкодистрофии;
- мукополисахаридозы (включая синдром Хантера и болезнь Гурлера);
- болезни накопления гликопротеинов (гликопротеинозы);
- муколипидозы.
В зависимости от тяжести заболевания пациенты умирают в молодом и непредсказуемом возрасте, многие в течение нескольких месяцев или лет с момента рождения, в то время как другие доживают до раннего взрослого возраста, в конечном итоге погибая от различных патологий их индивидуального заболевания. Симптомы LSD варьируют в зависимости от индивидуального заболевания и могут варьировать от умеренных до тяжелых. Они могут включать задержку развития, нарушение движения, судороги, слабоумие, тугоухость и/или слепоту. У некоторых индивидуумов с LSD увеличена печень (гепатомегалия) и увеличена селезенка (спленомегалия), имеются проблемы с сердечно-сосудистой и дыхательной системами и аномальный рост костей.
Большинство пациентов первоначально подвергаются скринингу посредством набора ферментов, который является наиболее эффективным способом постановки окончательного диагноза. В некоторых семьях, в которых известна вызывающая заболевание мутация (мутации), и в некоторых генетических изолятах можно проводить анализ мутаций. Т.к. здесь возможно несколько различных мутаций, иногда для подтверждения диагноза необходимо секвенирование гена, кодирующего конкретный поврежденный фермент. Пренатальная диагностика может являться полезной, когда известен генетический фактор риска.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения лизосомных болезней накопления.
Гидролиз лизосомальных сфинголипидов
В лизосомальный катаболизм сфинголипидов (или гликосфинголипидов) вовлечено множество ферментов (смотри фигуру 4). Каждый из данных ферментов, или, более конкретно, гидролаз, отвечает за деградацию специфического сфинголипида.
Лизосомальные гидролазы сфинголипидов взаимодействуют с белками-активаторами сфинголипидов (SAP или сапозинами) для стимуляции активности указанных гидролаз. Считается, что SAP способствуют взаимодействию фермент/субстрат между водорастворимыми ферментами и мембраносвязанными субстратами.
Кроме того, липидный состав позднего эндосомального и лизосомального компартментов характеризуется присутствием отрицательно заряженных фосфолипидов, таких как BMP и PI (фосфатидилинозитол), которые также стимулируют активность некоторых гидролаз. BMP-зависимые лизосомальные гидролазы включают сиалидазу, α-галактозидазу A, глюкозилцерамидазу, β-галактозилцерамидазу, арилсульфатазу A, кислую церамидазу и сфингомиелиназу.
Кофакторные сапозины
Сапозины являются небольшими лизосомальными белками, которые служат в качестве активаторов различных лизосомальных разрушающих липиды ферментов. Возможно, они действуют посредством выделения липидного субстрата из мембранного окружения, таким образом, делая его более доступным для растворенных разрушающих ферментов. Все сапозины млекопитающих синтезируются в виде единой молекулы-предшественника (просапозина), которая содержит четыре домена сапозина-B, дающие активные сапозины после протеолитического расщепления, и два домена сапозина-A, которые удаляются в реакции активации. Домены сапозина-B также существуют в других белках, многие из которых действуют при лизисе мембраны.
Просапозин (PSAP) является белком, который у человека кодируется геном PSAP. Данный ген кодирует высококонсервативный гликопротеин, который является предшественником 4 продуктов расщепления: сапозинов A, B, C и D. Сапозин является сокращением от белка-активатора сфинголипидов или SAP. Каждый домен белка-предшественника содержит приблизительно 80 аминокислотных остатков с рядом идентично расположенных остатков цистеина и участками гликозилирования. Сапозины A-D первоначально локализуются в лизосомальном компартменте, где они облегчают катаболизм гликосфинголипидов с короткими олигосахаридными группами. Белок-предшественник существует и как секреторный белок, и как интегральный мембранный белок и обладает нейротрофической активностью. Сапозины A-D необходимы для гидролиза некоторых сфинголипидов специфическими лизосомальными гидролазами.
Сапозины являются важными коактиваторами сиалидазы (SAP-B), α-галактозидазы A (SAP-B), глюкозилцерамидазы (SAP-C), β-галактозилцерамидазы (SAP-C), арилсульфатазы А (SAP-B) и кислой церамидазы (SAP-D). Кислая сфингомиелиназа (aSMaза) не зависит критически от любого из известных белков-активаторов, однако присутствие сапозинов повышает активность данного фермента. Также охарактеризован пятый сапозин GM2-активаторный белок.
BMP
Бис(моноацилглицеро)фосфат (BMP), также известный как лизобисфосфатидная кислота, является главной частью липидного состава позднего эндосомального и лизосомального компартментов. Он является отрицательно заряженным фосфолипидом, более конкретно, глицеринфосфолипидом.
BMP впервые выделяли из легкого кролика, но в настоящее время известно, что он является минорной составляющей тканей всех животных. Его стереохимическая конфигурация отличается от таковой у других глицерофосфолипидов животных тем, что фосфодиэфирный остаток связан с положениями sn-1 и sn-1' глицерина, чаще, чем с положением sn-3. Это остается неясным, являются ли положения sn-3 и 3' или sn-2 и sn-2' в остатках глицерина этерифицированными жирными кислотами. Какими бы ни были положения жирных кислот на молекуле глицерина, их состав можно отличать по часто встречающимся 18:1 (n-9) и 18:2(n-6), 20:4 и 22:6(n-3), хотя это сильно зависит от специфичной ткани, типа клеток или органеллы. Такой отличительный состав позволяет предполагать совершенно специфические функции, некоторые из которых необходимо выявлять.
Как правило, BMP является предпочтительно минорным компонентом тканей животных. Однако он сильно повышен в лизосомах печени и других тканей, где его количество может достигать 15% или более от мембранных фосфолипидов, и в настоящее время его признают маркером данных органелл. Это - поздние эндосомы и лизосомы, содержащие уникальный липид BMP. Несомненно, здесь участвуют внутренние мембраны поздних эндосом, содержащие вплоть до 70% фосфолипидов как BMP.
Если сообщаемое присутствие BMP в некоторых алкалофильных штаммах видов Bacillus можно подтвердить, то это станет единственным известным исключением из правила о том, что данный липид имеет происхождение строго от млекопитающих и не присутствует в прокариотах, дрожжах и высших растениях.
Существует хорошее доказательство того, что BMP синтезируется из фосфатидилглицерина прежде всего в эндосомальной системе. В том, что, вероятно, является основным путем, на первом этапе фосфолипаза A2 удаляет жирную кислоту из положения sn-2 фосфатидилглицерина. На втором этапе лизофосфатидилглицерин ацетилируется по положению sn-2' головной группы остатка глицерина для получения sn-3:sn-1' лизобисфосфатидной кислоты посредством реакции трансацилирования с лизофосфатидилглицерином в качестве и ацильного донора, и ацильного акцептора. Третий этап в достаточной мере все еще необходимо описать, но он должен включать удаление жирной кислоты из положения sn-1 первичного глицеринового звена и перемещение фосфорильного эфира из положения sn-3 в sn-1. Окончательное положение sn-2 первичного глицеринового звена этерифицировано, возможно, посредством реакции трансацилирования с другим фосфолипидом в качестве донора (таким образом, отличаясь составом жирных кислот). Возможны другие пути биосинтеза.
Активно исследуют функцию BMP в лизосомах. Он может играть структурную роль в образовании комплексной системы внутрипросветных мембран, способствуя тенденции не образовывать бислой. Он является конусовидной молекулой и усиливает слияние мембран при pH в эндосомах. Кроме того, его уникальная стереохимия означает, что он устойчив к действию фосфолипаз, таким образом, он препятствует или предотвращает саморасщепление лизосомальных мембран. Составляющие жирные кислоты могут быстро меняться трансацилированием, но глицерофосфатный остов является стабильным. Кроме того, возможно, данный липид может связываться со специфическими белками в мембранных доменах, функционально схожими с рафтами. Это позволяет предполагать, что характерная сеть богатых BMP мембран, содержащихся внутри мультивезикулярной поздней эндосомы, регулирует транспорт холестерина, действуя как точка скопления и перераспределения. Например, когда лизосомальные мембраны инкубировали с антителами к BMP, холестерин имел тенденцию накапливаться. Процесс находится под контролем Alix/AIP1, который является белком, специфически взаимодействующим с BMP и вовлеченным в сортировку в мультивезикулярные эндосомы.
Известно, что BMP значительно стимулирует ферменты, вовлеченные в деградацию глюкозилцерамидов, такие как белки-активаторы сфинголипидов, такие как сапозины. В данном случае он просто может функционировать, обеспечивая подходящее окружение для взаимодействия гликосфинголипидгидролаз и их активаторов. Кроме того, он играет динамическую роль в снабжении арахидоновой кислотой для синтеза эйкозаноидов в альвеолярных макрофагах.
Для BMP-зависимых ферментов степень гидролиза значительно увеличивается, когда BMP присутствует в мембране, для aSMaзы даже без присутствия белка-активатора, такого как сапозин. На фигуре 4 пунктирным кругом обозначали ферменты или заболевание, при котором данный фермент является дефектным, что указывает на зависимость от BMP.
BMP вовлечен в патологию лизосомных болезней накопления, таких как болезнь Ниманна-Пика типа C (накопление холестерина) и некоторые индуцируемые лекарственными средствами липидозы. В данных обстоятельствах его состав имеет тенденцию меняться до благоприятных молекулярных состояний, которые содержат меньше полиненасыщенных компонентов. Он является антигеном, выявляемым в аутоиммунной сыворотке пациентов с редким и плохо изученным заболеванием, известным как антифосфолипидный синдром, таким образом, он является фактором патологической основы данного заболевания.
В одном из вариантов осуществления данное изобретение относится к способу лечения лизосомных болезней накопления посредством применения взаимодействия между Hsp70 и BMP.
Болезни накопления липидов
Болезни накопления липидов (или липидозы) являются подгруппой лизосомных болезней накопления, при которых повреждающие количества липидов накапливаются во внутриклеточном пространстве по причине сниженной экспрессии или функции ферментов, необходимых для метаболизма липидов. Со временем данное избыточное накопление липидов может вызывать постоянное повреждение клеток и тканей, особенно в головном мозге, периферической нервной системе, печени, селезенке и костном мозге.
Липиды являются обширной группой природных молекул, включающей жиры, воски, стерины, жирорастворимые витамины (такие как витамины A, D, Ε и K), моноглицериды, диглицериды, фосфолипиды и другие. Основные биологические функции липидов включают накопление энергии, они являются структурными компонентами клеточных мембран и важными сигнальными молекулами.
Липиды можно приблизительно разделять на гидрофобные или амфифильные низкомолекулярные соединения; амфифильная природа некоторых липидов позволяет им образовывать структуры, такие как везикулы, липосомы или мембраны в водном окружении. Биологические липиды образуются целиком или частично от двух отличающихся типов биологических субъединиц: кетоацильных и изопреновых групп. Применяя данный подход, липиды можно разделять на восемь категорий: жирные ацилы, глицеринипиды, глицерофосфолипиды, сфинголипиды, сахаролипиды и поликетиды (образующиеся при конденсации кетоацильных субъединиц) и стерины и преноловые липиды (образующиеся при конденсации изопреновых субъединиц).
Хотя термин липид иногда применяют как синоним жиров, жиры являются подгруппой липидов, называемой триглицеридами. Липиды также включают молекулы, такие как жирные кислоты и их производные (включая три-, ди- и моноглицериды и фосфолипиды), а также другие стерол-содержащие метаболиты, такие как холестерин.
Описывают некоторые лизосомные болезни накопления, характеризующиеся накоплением липидов (т.е. болезни накопления липидов); они коротко изложены ниже в настоящем документе.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения болезней накопления липидов.
Болезнь Ниманна-Пика
Болезнь Ниманна-Пика (NPD) вызывается дефектом фермента кислой сфингомиелиназы (aSMaзы) с систематическим названием сфингомиелинфосфодиэстераза. Основную массу мембранного сфингомиелина гидролизует лизосомальный фермент aSMaзы для получения церамида (и фосфохолина). Сфингомиелин содержит церамидный мембранный якорь, который связан с коротким фосфорилхолиновым остатком.
Сфингомиелиназа не зависит критически от любых известных белков-активаторов, делая предполагаемый внутримолекулярный активаторный домен aSMaзы и присутствие отрицательно заряженных липидов в лизосоме существенными для кругооборота сфингомиелина. Таким образом, aSMaза не требует присутствия сапозинов в качестве кофакторов; однако присутствие сапозинов в дальнейшем неизменно стимулирует активность данного фермента (Ferlinz et al., 1999). BMP стимулирует активность aSMaзы.
Когда сфингомиелин не может метаболизироваться должным образом, он накапливается внутри клетки, в конечном итоге приводя к гибели клетки и неправильной работе главных систем органов. Симптомы могут включать недостаточность мышечной координации, дегенерацию мозга, проблемы с обучением, потерю мышечного тонуса, повышенную тактильную чувствительность, спастичность, затруднения при кормлении и проглатывании, заторможенность речи и увеличение печени и селезенки. Кроме того, может иметь место помутнение роговицы и характерное вишнево-красное пятно, образующееся вокруг центра сетчатки.
Болезнь Ниманна-Пика (NPD) имеет 4 родственных типа; типы A, B, C и D. Все типы NPD наследуются аутосомно-рецессивным образом и поражают и мужчин, и женщин. При типах A и B недостаточная активность фермента aSMaзы вызывает накопление токсических количеств сфингомиелина. Заболевание возникает, когда обе копии гена aSMaзы у индивидуума (оба аллеля) имеют мутацию.
Болезнь Ниманна-Пика типа A (NPDA) - наиболее распространенный тип, встречается у детей. Он характеризуется желтухой, увеличением печени и глубоким поражением головного мозга. Не существует эффективного лечения для индивидуумов с типом А, и пациенты с типом А умирают в младенчестве, как правило, до достижения 18 месяцев.
Болезнь Ниманна-Пика типа Β (NPDB) включает увеличение печени и селезенки, которое, как правило, происходит у малолетних детей, а также распространены респираторные нарушения. Увеличение органов и респираторные нарушения могут вызывать сердечно-сосудистый стресс и могут приводить к заболеваниям сердца в пожилом возрасте. Как правило, пациенты с NPDB имеют либо небольшие неврологические проблемы, либо не имеют их. Для нескольких пациентов с типом B проводили трансплантацию костного мозга и сообщали смешанные результаты. Будущее развитие заместительной терапии ферментом и генной терапии также может помочь тем, у кого заболевание типа B. Дети с типом B могут жить сравнительно долгое время, но могут требовать кислородной поддержки из-за легочных нарушений.
NPDA и NPDB вызваны одним и тем же дефицитом фермента, и увеличиваются доказательства того, что две формы представляют собой противоположные границы диапазона. Индивидуумы с NPDA, как правило, обладают небольшой продукцией aSMaзы или не обладают ею (менее чем 1% от нормы), в то время как те, у кого NPDB, обладают приблизительно 10% от нормального уровня aSMaзы.
Существует приблизительно 1200 случаев NPA и NPB по всему миру с преобладанием типа Β или промежуточной формы.
NPDA и NPDB диагностируют посредством измерения уровня активности aSMaзы в лейкоцитах из образца крови. Т.к. данный тест идентифицирует индивидуумов с типами A и B, он не очень надежен для определения индивидуумов, которые являются носителями (тех, кто обладает только одной нефункциональной копией гена ASM). Кроме того, тест демонстрирует снижение активности aSMaзы, но он не всегда может предсказать, имеет ли индивидуум тип A, или тип B, или промежуточный вариант заболевания; это требует клинического исследования индивидуума.
В некоторых популяциях специфические мутации являются причиной высокого процента случаев дефицита aSMaзы. Для NPDA мутации R496L, fsP330 и L302P являются причиной более 95% вызывающих заболевание генетических изменений в популяции евреев-ашкенази. Для идентификации носителей применяют непосредственное тестирование индивидуумов в данной популяции на данные 3 мутации. В других популяциях, прежде чем проводить ДНК-анализ носителей среди членов семьи, сначала необходимо идентифицировать мутации у пораженного индивидуума.
Для NPDB мутации aSMaзы H421Y и K576N отвечают за 85% популяции NPDB в Саудовской Аравии; мутации L137P, fsP189 и L549P отвечают за 75% турецкой популяции NPDB; мутации S379P, R441X и R474W отвечают за 55% португальской популяции NPDB; мутация A196P отвечает за 42% английской/шотландской популяции NPDB, и мутации F480L и DeltaR608 выявляли как вызывающие заболевание у пациентов с NPDB.
Болезнь Ниманна-Пика типа C (NPDC) существенно отличается от типа A или B. Пациенты с NPDC не способны соответствующим образом метаболизировать холестерин и другие липиды в клетке и характеризуются дефектом, который нарушает транспорт холестерина между клетками головного мозга. Таким образом, избыточные количества холестерина и других липидов накапливаются в печени, селезенке и головном мозге. NPDC вызывает вторичное снижение активности aSMaзы, что позволяет рассматривать все три типа как формы одного и того же заболевания.
Существует значительное различие симптомов, когда тип C впервые возник и при прогрессировании заболевания. Симптомы могут возникать так рано, как в течение нескольких месяцев жизни, и так поздно, как в зрелом возрасте. Нарушение движения глаз в вертикальной плоскости (неспособность двигать глазами вверх и вниз), увеличение печени или желтуха у маленьких детей являются сильными признаками для подозрения на NPDC. Как правило, на ранних стадиях заболевания появляются только один или два симптома. В большинстве случаев неврологические симптомы начинают появляться в возрасте между 4 и 10 годами. В целом, чем позже начинаются неврологические симптомы, тем медленнее прогрессирует заболевание.
По всему миру диагностировали приблизительно 500 случаев болезни Ниманна-Пика типа C. Однако считается, что число людей, пораженных NPDC, выше, но трудности в диагностике не позволяют точно оценить частоту встречаемости. Изначально NPDC диагностировали как неспособность к обучению, умственную отсталость, неуклюжесть и задержку развития моторных навыков.
В настоящее время болезнь Ниманна-Пика типа D считают вариантом типа C. Как правило, тип D возникает у людей, происходящих из Новой Шотландии. Индивидуумам с типами C и D часто назначают низкохолестериновую диету, но ее клиническое преимущество неубедительно. Продолжительность жизни индивидуумов с типами C и D варьирует, однако заболевание всегда является смертельным. Подавляющее большинство детей умирает до 20 лет.
NPDC является редким и крайне вариабельным состоянием и может не распознаваться некоторыми медицинскими работниками. Для тех специалистов, которые подозревают данный диагноз у пациента, его можно определить посредством взятия биопсии кожи, культивирования фибробластов и исследования их способности транспортировать и накапливать холестерин. Транспорт холестерина в клетки исследуют посредством измерения превращения холестерина из одной формы в другую (этерификации). Накопление холестерина оценивают посредством окрашивания клеток реактивом (филипином), который светится под ультрафиолетовым излучением.
В 1997 году идентифицировали ген NPDC1. Мутации или вызывающие заболевания изменения в данном гене отвечают за приблизительно 95% всех случаев NPDC. С тех пор в данном гене и во втором гене NPDC, NPDC2, идентифицировали более 250 различных генетических мутаций, относящихся к NPDC. Кроме того, в приблизительно 95% случаев возможно идентифицировать генетические изменения, вызывающие заболевание, если диагноз NPDC впервые подтвержден описанным выше тестированием. Однако из-за того, что существует так много уникальных еще неидентифицированных мутаций, неоптимально применять генетическое тестирование в качестве основного диагностического инструмента для NPDC.
Болезнь Ниманна-Пика поражает все сегменты популяции с сообщениями о случаях в Северной Америке, Южной Америке, Европе, Африке, Азии и Австралии. Однако более высокая встречаемость наблюдается в некоторых популяциях:
• популяция евреев-ашкенази (NPDA и NPDB);
• популяция французских канадцев в Новой Шотландии (тип D,- считающийся вариантом NPDC);
• регион Магриба (Тунис, Марокко и Алжир) в Северной Африке (NPDB);
• испано-американская популяция южного Нью-Мексико и Колорадо (NPDC).
В одном из вариантов осуществления настоящее изобретение относится к способу лечения болезни Ниманна-Пика посредством модуляции ферментативной активности кислой сфингомиелиназы (aSMaзы).
Болезнь Фарбера
Болезнь Фарбера вызывается дефектом фермента кислая церамидаза. Кислая церамидаза отвечает за превращение церамида в сфингозин (и жирную кислоту); таким образом, дефект приводит к накоплению церамида. BMP стимулирует ее активность, и она зависит от сапозинов.
Кислая церамидаза также известна как N-ацилсфингозинаминогидролаза, ее кодирует ген ASAH1. Она является гетеродимерным белком, содержащим негликозилированную альфа-субъединицу и гликозилированную бета-субъединицу, которая в зрелом ферменте отщепляется посттрансляционно.
Болезнь Фарбера также известна как липогранулематоз Фарбера, дефицит церамидазы, фиброцитарный дисмукополисахаридоз и липогранулематоз. Это крайне редкое аутосомно-рецессивное заболевание, характеризующееся аномалиями суставов, печени, гортани, тканей и центральной нервной системы. Также могут поражаться печень, сердце и почки. Как правило, симптомы обнаруживают в первые несколько недель жизни, они включают нарушение двигательных и умственных способностей и затруднение глотания. Другие симптомы могут включать артрит, увеличение лимфоузлов и суставов, охриплость, подкожные узелки (и иногда в легких и других частях тела), хроническое сокращение мышц и сухожилий вокруг суставов и рвоту. Пораженные индивидуумы могут нуждаться во введении интубационной трубки. В тяжелых случаях увеличены печень и селезенка.
В настоящее время не существует специфического лечения болезни Фарбера. Кортикостероиды могут помогать снижать боль. Узлы в некоторых случаях можно лечить трансплантацией костного мозга или хирургически уменьшать или удалять. Большинство детей с классической формой болезни Фарбера умирают в возрасте 2 лет, как правило, от заболевания легких. Индивидуумы с умеренной формой заболевания могут доживать до подросткового возраста.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения болезни Фарбера посредством модуляции ферментативной активности кислой церамидазы.
Болезнь Краббе
Болезнь Краббе вызывается дефектом фермента β-галактозилцерамидаза. β-галактозилцерамидаза отвечает за превращение галактозилцерамида в церамид; таким образом, дефект приводит к накоплению галактозилцерамида. BMP стимулирует ее активность, она зависит от сапозинов.
Болезнь Краббе также известна как глобоидно-клеточная лейкодистрофия или галактозилцерамидный липидоз. Это редкое, часто смертельное дегенеративное аутосомно-рецессивное заболевание, которое поражает миелиновую оболочку нервной системы. Оно встречается приблизительно 1 случай на 100000 новорожденных. Более высокую встречаемость, приблизительно 1 на 6000, обнаруживали в арабских общинах в Израиле.
Болезнь Краббе вызывается мутациями в гене GALC, которые вызывают дефицит фермента галактозилцерамидаза. Накопление липидов действует на рост защитной миелиновой оболочки нервов (покрытие, которое изолирует многие нервы) и вызывает тяжелую дегенерацию двигательных навыков.
Дети с болезнью Краббе являются нормальными при рождении. Симптомы появляются между 3 и 6 месяцами и включают раздражительность, лихорадку, тугоподвижность конечностей, судороги, трудности кормления, рвоту и замедление умственного и двигательного развития. На первых стадиях заболевания врачи часто принимают их за симптомы детского церебрального паралича. Другие симптомы включают слабость мышц, спастичность, тугоухость, зрительную атрофию и слепоту, паралич и затруднения глотания. Также может иметь место продолжительная потеря веса. Также существует болезнь Краббе с началом в юношеском и зрелом возрасте, которые обладают схожими симптомами, но более медленным прогрессированием. В целом, у детей данное заболевание является смертельным до 2 лет. Пациенты с поздним началом болезни Краббе имеют тенденцию к более медленному прогрессированию заболевания и живут значительно дольше.
Хотя не существует лечения болезни Краббе, показано, что трансплантация костного мозга улучшает случаи на ранних этапах течения заболевания. В целом, лечение заболевания является симптоматическим и поддерживающим. Физиотерапия может помогать поддерживать или увеличивать тонус мышц и циркуляцию. Недавние исследования сообщают, что трансплантация пуповинной крови успешна в остановке заболевания так долго, как долго ее дают до появления очевидных симптомов.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения болезни Краббе посредством модуляции ферментативной активности β-галактозилцерамидазы.
Болезнь Фабри
Болезнь Фабри вызывается дефектом фермента α-галактозидаза A. α-галактозидаза A отвечает за превращение глоботриаозилцерамида в лактозилцерамид; таким образом, дефект приводит к накоплению глоботриаозилцерамида (также сокращаемого как Gb3, GL-3 или церамидтригексозид). BMP стимулирует ее активность, и она зависит от сапозинов.
Болезнь Фабри также известна как болезнь Андерсона-Фабри, диффузная ангиокератома туловища, синдром Руитера-Помпена-Вейерса, церамидтригексозидоз и болезнь Свили-Клионски. Это X-сцепленное рецессивное (наследственное) заболевание, которое поражает гемизигот мужского пола, а также гетерозигот и гомозигот женского пола; мужчины обладают наиболее тяжелыми клиническими симптомами, в то время как у женщин они варьируют от видимого отсутствия симптомов до таких же серьезных, как у мужчин. Предполагают, что данное многообразие имеет причиной характер инактивации X-хромосомы в течение эмбрионального развития женщин.
Симптомы включают ангидроз (недостаток потоотделения), слабость, ангиокератомы (доброкачественно повреждение капилляров кожи), жгучую боль в конечностях и зрительные нарушения. Ангиокератомы являются мелкими болезненными папулами, появляющимися в любой области тела, но преобладают на бедрах, ягодицах, внизу живота и паху. Внешние зрительные нарушения могут представлять собой cornea verticillata (также известную, как кератопатия vortex). Кератопатия может присутствовать у бессимптомных носителей, и ее нужно дифференцировать от других причин кератопатии vortex (т.е. накопления лекарственных средств в роговице). Другие зрительные показатели, которые можно увидеть, включают аневризму конъюнктивы, задние спицеподобные катаракты, отек зрительного нерва, отек желтого пятна, атрофию зрительного нерва и расширение сосудов сетчатки. Почечные осложнения являются распространенным и серьезным эффектом заболевания; почечная недостаточность может ухудшаться на всем протяжении жизни. Протеинурия часто является первым признаком вовлечения почек. Также имеют место осложнения на сердце; относящиеся к сердцу эффекты могут ухудшаться с возрастом и могут приводить к повышенному риску заболевания сердца. Цереброваскулярные эффекты приводят к повышенному риску инсульта. Другие симптомы включают шум в ушах, головокружение, тошноту и диарею.
Как правило, симптомы впервые возникают в раннем детстве и их тяжело распознавать; редкость болезни Фабри для многих врачей иногда приводит к неправильному диагнозу или игнорированию. Как правило, манифестация заболевания усиливается в количестве и тяжести с возрастом индивидуума.
До недавнего времени лечение болезни Фабри нацеливалось на симптоматические эффекты. Однако недавно ее стали лечить посредством заместительной терапии ферментом (ERT) с применением агалзидазы альфа (реплагал) и агалзидазы бета (фабразим). Стоимость данных лекарственных средств является проблемой (приблизительно $250000 US в год на пациента) и остается барьером для многих пациентов в некоторых странах. Заместительную терапию ферментом (как правило, вводимого каждые две недели) можно проводить у пациента на дому самим пациентом. Заместительная терапия ферментом не приносит излечения и для максимальной пользы его необходимо вводить регулярно.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения болезни Фабри посредством модуляции ферментативной активности α-галактозидазы A.
Болезнь Гоше
Болезнь Гоше вызывается дефектом фермента глюкозилцерамидаза (также известной как глюкоцереброзидаза или кислая β-глюкозидаза); белок весом 55,6 кДа, длиной 497 аминокислоты. Глюкозилцерамидаза отвечает за превращение глюкозилцерамида (или глюкоцереброзида) в церамид; таким образом, дефект приводит к накоплению глюкозилцерамида. BMP стимулирует ее активность, которая зависит от сапозинов.
Болезнь Гоше является наиболее распространенной из лизосомных болезней накопления. Жировой материал может накапливаться в селезенке, печени, почках, легких, головном мозге и костном мозге.
Симптомы могут включать увеличение селезенки и печени, дисфункцию печени, нарушения скелета и повреждение костей, которые могут причинять боль, тяжелые неврологические осложнения, увеличение лимфоузлов и (изредка) расположенных рядом суставов, увеличение живота, коричневатый оттенок кожи, анемию, низкое содержание тромбоцитов в крови и желтые жировые отложения в склере. Пораженные наиболее серьезно индивидуумы могут являться более восприимчивыми к инфекции.
Заболевание является аутосомно-рецессивным и, таким образом, поражает и мужчин, и женщин. Различные мутации глюкозилцерамидазы определяют остаточную активность фермента и, во многом, фенотип. Исследования позволяют предполагать, что гетерозиготы по конкретным мутациям глюкозилцерамидазы обладают повышенным риском болезни Паркинсона и злокачественных новообразований (неходжкинская лимфома, меланома и рак поджелудочной железы).
Глюкозилцерамид является составляющей мембраны эритроцитов и лейкоцитов. Макрофаги, которые удаляют данные клетки, неспособны удалить побочные продукты, которые накапливаются в фибриллах и превращаются в клетки Гоше, которые проявляются при световой микроскопии, напоминая мятую бумагу.
Болезнь Гоше имеет три общепринятых клинических субтипа. Каждый тип связан с конкретными мутациями. Всего известно приблизительно 80 мутаций.
• Тип I (или ненейропатический тип) является наиболее распространенной формой заболевания, встречающейся приблизительно 1 случай на 50000 живорожденных. Он наиболее часто встречается среди евреев-ашкенази, в 100 раз чаще, чем в общей популяции. Симптомы могут проявляться в детстве или в зрелом возрасте и включают увеличение печени и сильное увеличение селезенки (совместно - гепатоспленомегалия); селезенка может разрушаться и вызывать дополнительные осложнения. Слабость скелета и заболевания костей могут являться выраженными. Увеличение селезенки и замещение костного мозга вызывают анемию, тромбоцитопению и лейкопению. Головной мозг не поражен, но могут иметь место нарушения в легких и реже в почках. Как правило, у пациентов в данной группе легко образуются кровоподтеки (из-за низкого уровня тромбоцитов), и они испытывают слабость из-за низкого уровня эритроцитов. В зависимости от начала и тяжести заболевания пациенты с типом 1 могут хорошо доживать до зрелого возраста. Многие пациенты имеют умеренную форму заболевания или могут не демонстрировать симптомы.
• Тип II (или острая инфантильная нейропатическая болезнь Гоше), как правило, начинается в течение 6 месяцев с рождения и имеет частоту встречаемости приблизительно 1 на 100000 живорожденных. Симптомы включают увеличение печени и селезенки, обширное и прогрессирующее повреждение головного мозга, нарушения движения глаз, спастичность, судороги, ригидность конечностей и низкую способность к сосанию и глотанию. Пораженные дети, как правило, умирают в возрасте 2 года.
• Тип III (хроническая нейропатическая форма) может начинаться в любой период детства и встречается приблизительно 1 случай на 100000 живорожденных. Он характеризуется медленно прогрессирующими, но более умеренными, по сравнению с острой формой или типом 2, неврологическими симптомами. Основные симптомы включают увеличение селезенки и/или печени, судороги, плохую координацию, скелетные нарушения, нарушения движения глаз, нарушения крови, включая анемию, и нарушения дыхательной системы. Пациенты часто доживают до раннего подросткового и зрелого возраста.
The National Gaucher Foundation заявляет, что около 1 на 100 человек в общей популяции США является носителем болезни Гоше типа 1, приводя к распространенности 1 на 40000; среди евреев-ашкенази соотношение носителей существенно выше, приблизительно 1 на 15. Болезнь Гоше типа 2 не демонстрирует особого преобладания в любой этнической группе. Болезнь Гоше типа 3 особенно распространена в популяции северной области Швеции Норрботтен, где частота встречаемости заболевания 1 на 50000.
Для пациентов с типом 1 и особенно типом 3 заместительная терапия ферментом с внутривенным введением рекомбинантной глюкозилцерамидазы может уменьшать размер печени и селезенки, снижать аномалии скелета и реверсировать другие проявления. Редкость данного заболевания означает, что затруднительно проводить исследования по поиску дозы, таким образом, существует дискуссия об оптимальной дозе и частоте введения. По причине низкой встречаемости это становится редким лекарственным средством во многих странах. Существующее в настоящее время лечение болезни церезимом (Cerezyme®) (имиглюцераза для инъекций) стоит до $550000 ежегодно для одного пациента, и лечение нужно продолжать всю жизнь. Другим лекарственным средством, одобренным для данного заболевания в 2003 году, является миглустат.
Успешная трансплантация костного мозга излечивает неневрологические проявления заболевания, т.к. она вносит популяцию моноцитов с активной глюкозилцерамидазой. Однако данный способ несет значительный риск и его редко проводят на пациентах с болезнью Гоше. Хирургическая операция для удаления селезенки (спленэктомия) может требоваться в редких случаях, если у пациента анемия или когда увеличенный орган мешает удобству пациента. Переливание крови может приносить пользу некоторым пациентам с анемией. Другим пациентам может требоваться операция по замене сустава для улучшения подвижности и качества жизни. Другие варианты лечения включают антибиотики от инфекций, противоэпилептические средства от судорог, бисфосфонаты для поврежденных костей и трансплантаты печени.
Терапия снижения субстрата может демонстрировать эффективность в остановке заболевания типа 2, т.к. он может проникать через гематоэнцефалический барьер в головной мозг. В настоящее время не существует эффективного лечения тяжелого повреждения мозга, которое может возникнуть у пациентов с болезнью Гоше типа 2 и 3.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения болезни Гоше посредством модуляции ферментативной активности глюкозилцерамидазы.
Сиалидоз
Сиалидоз, или муколипидоз типа I (ML I), вызывается дефектом фермента сиалидаза (или альфа-нейраминидаза). Сиалидаза отвечает за превращение GM3 в лактозилцерамид; таким образом, дефект приводит к накоплению GM3. BMP стимулирует ее активность, и она зависит от сапозинов.
Сиалидоз наследуется аутосомно-рецессивным образом. Симптомы присутствуют при рождении или развиваются в течение первого года жизни. У многих пораженных детей при рождении отмечают обширные отеки по всему телу. Данные дети часто рождаются с грубыми чертами лица, такими как плоская переносица, отекшие веки, увеличенные десны и увеличенный размер языка (макроглоссия). Многие дети также рождаются с деформацией скелета, такой как дислокация бедра. Дети часто проявляют внезапные непроизвольные мышечные сокращения (называемые миоклонусами) и имеют красные пятна в глазах (вишнево-красные макулы). Они часто неспособны координировать произвольные движения (называют атаксией). Также присутствуют тремор, нарушение зрения и судороги. Тесты выявляют аномальное увеличение печени (гепатомегалия) и селезенки (спленомегалия) и крайнюю степень абдоминальных отеков. В целом, у детей недостаток тонуса мышц (гипотония) и умственная отсталость, которая является исходно или прогрессирующе тяжелой. Многие пациенты страдают от задержки в развитии и рецидивирующих респираторных инфекций. Большинство детей с ML I умирают до достижения 1 года жизни.
Сиалидоз можно подразделять по возрасту начала симптомов и типам представленных симптомов. Эффекты заболевания могут варьировать от умеренных до тяжелых.
Сиалидоз является редким заболеванием без расовой предрасположенности. Доступны очень небольшие популяционные данные, но исследование в Нидерландах показало частоту приблизительно 1 случай на 2175000 живорожденных. Однако данное соотношение может не применяться для всех популяций, в некоторых из которых более высокая встречаемость; кроме того, упущенное клиническое распознавание является важным фактором, когда скрининг новорожденных не является предметом выбора.
Варианты лечения сиалидоза остаются ограниченными и непосредственно направленными на поддерживающее лечение и облегчение симптомов.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения сиалидоза посредством модуляции активности сиалидазы.
Метахроматическая лейкодистрофия
Метахроматическая лейкодистрофия (MLD) или дефицит арилсульфатазы A вызывается дефектом фермента арилсульфатаза A (или цереброзидсульфатаза). Арилсульфатаза A отвечает за превращение сульфатида (или цереброзид-3-сульфата) в галактозилцерамид; таким образом, дефект приводит к накоплению сульфатида. BMP стимулирует ее активность, она зависит от сапозинов.
Это - лизосомная болезнь накопления, которую общепринято указывают в семействе лейкодистрофий. Лейкодистрофия действует на рост и/или развитие миелина, жирового покрытия, которое действует как изолятор вокруг нервного волокна в центральной и периферической нервных системах.
Как и у многих других генетических заболеваний, которые действуют на метаболизм липидов, существует несколько форм MLD, которые являются позднеинфантильной, ювенильной и взрослой:
• При позднеинфантильной форме, которая является наиболее распространенной формой MLD, пораженные дети начинают испытывать затруднения при ходьбе после первого года жизни. Симптомы включают атрофию и слабость мышц, ригидность мышц, задержку развития, прогрессирующую потерю зрения, приводящую к слепоте, конвульсии, нарушенное глотание, паралич и слабоумие. Дети могут впадать в кому. Без лечения большинство детей с данной формой MLD умирают к 5 годам, часто гораздо раньше.
• Дети с ювенильной формой MLD (начало в 3-10 лет), как правило, начинают с плохой школьной успеваемости, умственных нарушений и слабоумия, и затем развиваются симптомы, схожие с позднеинфантильной формой, но с более медленным прогрессированием. Возраст смерти варьирует, но, как правило, в течение 10-15 лет с начала симптомов.
• Взрослая форма, как правило, начинается после 16 лет как психическое расстройство или прогрессирующее слабоумие. MLD с началом в зрелом возрасте прогрессирует более медленно, чем позднеинфантильная и ювенильная формы, с затянувшимся течением в десятилетие или более.
В редких случаях организм может компенсировать дефицит, и индивидуум не демонстрирует симптомы.
Не существует излечения MLD и стандартизированного лечения, это смертельное заболевание. Дети с продвинутым ювенильным или зрелым началом и пациенты с позднеинфантильной формой, проявляющие симптомы, получают лечение, ограниченное борьбой с болью и симптомами. Пациенты с пресимптоматической позднеинфантильной MLD, а также с ювенильной и взрослой MLD, которые являются пресимптоматическими или демонстрируют от умеренных до средних симптомов, обладают выбором трансплантации костного мозга (включая трансплантацию стволовых клеток), которая находится на стадии исследования.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения метахроматической лейкодистрофии посредством модуляции ферментативной активности арилсульфатазы A.
Дефицит сапозинов
Дефицит просапозинов/сапозинов приводит к тяжелым неврологическим дефицитам и у людей, и у мышей.
Пациенты с точковыми мутациями в сапозинах A, B и C обладают фенотипами болезни Краббе, метахроматической лейкодистрофии и болезни Гоше, что свидетельствует о том, что их первичными субстратами in vivo являются галактозилцерамид, сульфатид и глюкозилцерамид соответственно.
Атипичная болезнь Краббе вследствие дефицита сапозина A: наследственное биохимическое нарушение, приводящее к неврологической регрессии в течение нескольких месяцев с момента рождения. Как правило, смерть наступает в течение нескольких первых лет жизни. Нарушение схоже с болезнью Краббе, но отличается генетической первопричиной биохимического дефекта. Болезнь Краббе вовлекает дефект в гене галактоцереброзидазы, в то время как атипичная болезнь Краббе вовлекает дефект в гене просапозина, что вызывает дефицит сапозина A.
Сапозин B, ранее известный как SAP-1 и активатор сульфатида, стимулирует гидролиз широкого ряда субстратов, включая цереброзидсульфат, GM1 ганглиозид и глоботриаозилцерамид, для арилсульфатазы А, кислой бета-галактозидазы и альфа-галактозидазы соответственно. Дефицит сапозина B у человека, описываемый как аутосомно-рецессивный признак, приводит к накоплению в ткани цереброзидсульфата и клинической картине, похожей на метахроматическую лейкодистрофию (метахроматическая лейкодистрофия с дефицитом активатора), хотя и с нормальной активностью арилсульфатазы. Дефицит сапозина B является гетерогенным заболеванием со спектром, схожим с метахроматической лейкодистрофией.
Сапозин (SAP-) C требуется для деградации глюкозилцерамида, и его дефицит приводит к различным формам болезни Гоше; ненейропатической болезни Гоше вследствие дефицита SAP-C. У пациентов наблюдают очень высокие уровни активности хитотриозидазы, хемокина CCL18, повышенную концентрацию глюкозилцерамида в плазме и нормальную активность β-глюкозидазы в фибробластах кожи. Идентифицировали миссенс-мутацию p.L349P, локализованную в домене SAP-C, и другую мутацию, p.M1L, локализованную в инициирующем кодоне белка-предшествнника просапозина.
У некоторых пациентов с ненейропатической болезнью Гоше идентифицировали мутации и в сапозине C, и в сапозине D.
Комбинированный дефицит сапозинов C и D у мышей приводит к нейропатическому фенотипу с накоплением глюкозилцерамида и альфа-гидроксицерамида.
У мышей дефицит сапозина D ассоциирован с накоплением церамида, частичной утрате клеток Пуркинье и нарушением функции мочевыделительной системы. Данный фенотип не имитирует эмбриональную смертность, которую демонстрируют мыши с полным дефицитом кислой церамидазы, фермента, связанного с сапозином D.
У людей известны две мутации, которые приводят к полной инактивации всех четырех сапозинов и просапозинов. Общий дефицит сапозинов является разрушительным заболеванием с вовлечением множества органов и множества сфинголипидов. Сообщали о комбинированном дефиците сапозинов (или дефицит просапозинов) в случае тяжелой нейровисцеральной дистрофии, вызывавшей смерть новорожденного. В моче повышались многие сфинголипиды, с наибольшим повышением глоботриаозилцерамида. Идентифицировали новую мутацию в гене PSAP, будучи гомозиготной по мутации акцепторного участка сплайсинга на две пары выше кодона 10. Данная мутация приводит к преждевременному стоп-кодону и образованию низких уровней транскрипта.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения дефицита сапозинов. Указанный дефицит сапозинов можно выбирать из группы, состоящей из дефицита сапозина A, дефицита сапозина B, дефицита сапозина C, дефицита сапозина D и комбинированного дефицита сапозинов (или дефицита просапозинов).
Остаточная ферментативная активность
Лизосомные болезни накопления, как описано выше в настоящем документе, вызываются дефектным ферментом. Указанный дефектный фермент может не иметь остаточной активности или может иметь некоторую остаточную активность.
В настоящем документе остаточная ферментативная активность означает, что хотя фермент и является дефектным, что, например, вызвано мутацией, активность фермента не полностью исчезала, но скорее снижалась до патологического уровня.
В одном из аспектов настоящее изобретение относится к биоактивным средствам для применения в лечении лизосомных болезней накопления и способу лечения индивидуума с лизосомной болезнью накопления.
В одном из вариантов осуществления настоящего изобретения лизосомную болезнь накопления, которую лечат по настоящему изобретению, характеризуют как имеющую остаточную ферментативную активность дефектного фермента, вовлеченного в патологию заболевания.
В одном из вариантов осуществления указанная остаточная ферментативная активность находится в диапазоне от 0,1% до 50%, таком как в диапазоне от 0,1 до 1%, например, от 1 до 2%, таком как от 2 до 3%, например, от 3 до 4%, таком как от 4 до 5%, например, от 5 до 6%, таком как от 6 до 7%, например, от 7 до 8%, таком как от 8 до 9%, например, от 9 до 10%, таком как от 10 до 11%, например, от 11 до 12%, таком как от 12 до 13%, например, от 13 до 14%, таком как от 14 до 15%, например, от 15 до 20%, таком как от 20 до 25%, например, от 25 до 30%, таком как от 30 до 35%, например, от 35 до 40%, таком как от 40 до 45%, например, в диапазоне от 45 до 50% остаточной ферментативной активности.
Современные способы лечения LSD
Не существует излечения от лизосомных болезней накопления, и лечение в большинстве своем является симптоматическим, хотя с некоторым успехом проводили трансплантацию костного мозга и заместительную терапию ферментом (ERT). Кроме того, для ряда данных заболеваний в специализированных центрах проводили трансплантацию пуповинной крови. Однако трансплантационная терапия сопровождается большим числом побочных эффектов и часто вызывает осложнения у пациентов. Кроме того, в настоящее время для некоторых из данных заболеваний рассматривают терапию снижения субстрата, способ, применяемый для снижения накопления материала.
Для большинства лизосомных болезней накопления остается большая неудовлетворенная потребность в обеспечении эффективного способа лечения.
Для ряда лизосомных болезней накопления разрабатывали заместительную терапию ферментом, и для лечения болезни Гоше на рынке в течение нескольких лет существует церезим (Cerezyme®). Дефектный фермент, глюкоцереброзидазу, получали рекомбинантными техниками и вводили посредством внутривенных вливаний в течение нескольких часов. Лечение не является излечением, и пациентам требуется пожизненное лечение для прекращения прогрессирования заболевания. Некоторые симптомы можно улучшить посредством ERT.
Однако для большинства LSD еще не разработали эффективную ERT. Это может происходить по причине того, что получение активного фермента является трудной задачей из-за комплексной субъединичной структуры дефектных ферментов. В действительности ферменты могут при получении неправильно сворачиваться.
Для тех LSD, для которых доступна ERT, существуют препятствия, которые делают данный вид терапии менее желательным. Во-первых, ERT является очень дорогим видом терапии, который является финансовым бременем для общества, что делает его недоступным для некоторых пациентов. Кроме того, ERT специфически нацелена только на одно заболевание. Сообщают о некоторых побочных эффектах церезима (Cerezyme®), включая развитие иммунного ответа, тошноту, рвоту, боль в животе, диарею, сыпь, слабость, головную боль, жар, головокружение, озноб, боль в спине, учащенное сердцебиение, а также симптомы, позволяющие предполагать аллергическую реакцию.
Таким образом, раскрытие настоящего изобретения предоставляет новый и инновационный способ лечения лизосомных болезней накопления. В особенности это относится к тем заболеваниям, для которых не разрабатывали эффективную терапию, для тех, кто может извлечь выгоду из менее дорогого лечения, и тех, кто может извлечь выгоду из комбинированной терапии, включающей биоактивное средство по настоящему изобретению.
В настоящем документе способ по настоящему изобретению относится к способу лечения, проводить который существенно дешевле, чем ERT и который нацелен больше чем на одну лизосомную болезнь накопления.
Молекулярные шапероны, или белки теплового шока, описаны ниже в настоящем документе, т.к. авторы обнаружили, что взаимодействие между белком теплового шока 70 и лизосомальным BMP, как описано выше в настоящем документе, формирует основу для модулирования лизосомальной ферментативной активности и лечения лизосомных болезней накопления по настоящему изобретению.
Молекулярные шапероны
Потратив большое количество энергии сначала на транскрипцию, а затем трансляцию генетического кода ДНК, клетка в конце концов синтезирует полипептид, функция которого, вероятно, требуется на данном этапе жизни клетки. Однако для достижения полного функционального белка необходимо преодолеть некоторые заключительные препятствия - одним из них является правильный фолдинг первичной полипептидной цепи. Эволюционные требования достижения правильного фолдинга являются очевидными - не только громадная трата энергии для синтеза пептида без правильной конформации и, следовательно, функции, но также и агрегация таких белков в просвете клетки могут оказаться вредными для клетки. Данная агрегация в действительности является весьма вероятным исходом, рассматривая внутриклеточное окружение высокой концентрации белка, таким образом, не является неожиданностью то, что сложный и изящный механизм белков существует, чтобы помогать фолдингу белка, позволяя функциональному состоянию белка поддерживаться в данных условиях. Данные белки в совокупности называют молекулярными шаперонами, т.к. как и их аналоги у человека, они предотвращают нежелательные взаимодействия между своими незрелыми клиентами.
Молекулярные шапероны обнаруживают во всех компартментах клетки, где происходят конформационные перестройки белков, и хотя синтез белков является главным источником несвернутых пептидов в клетке, проблема клетки, которая возникает из-за высокой температуры или других стимулов, которые могут делать белки структурно лабильными и, следовательно, склонными к неправильному фолдингу и агрегации, встречается со специфическим ответом клетки, вовлекающим выработку защитных белков. Данный ответ представляет собой явление, наблюдаемое в каждом типе клеток в диапазоне от прокариот до эукариот и обозначаемое как ответ на тепловой шок или стресс. Индуцируемые данным ответом белки известны как белки теплового шока (HSP), существует несколько их семейств. Данные семейства составляли из родственных по последовательности, структуре и функции белков, в то время как шапероны из различных семейств могут значительно отличаться и по структуре, и по функции в клетке. Основным примером семейства шаперонов являются белки Hsp70, которые составляют центральную часть повсеместно распространенной системы шаперонов, присутствующей в большинстве компартментов эукариотических клеток, эубактерий и многих архибактерий. Недавно, помимо выполнения функции шаперона, данное семейство связали с другими аспектами клеточного гомеостаза - наиболее значительно посредством своих антиапоптотических свойств, своей функции в иммунитете и очевидной зависимости злокачественных клеток от положительной регуляции Hsp70.
Семейство белков теплового шока 70
Белки Hsp70 вовлечены в широкий диапазон клеточных процессов, включая фолдинг белков и деградацию нестабильных клеточных белков, а также выполнение циитопротективной функции. Общей функцией Hsp70 в данных процессах, по-видимому, является связывание коротких гидрофобных сегментов в частично свернутые полипептиды, таким образом способствуя правильному фолдингу и предотвращению агрегации. В эукариотах шапероны Hsp70 взаимодействуют in vivo с различными классами белков, которые выполняют функцию регулирования критических этапов их функционального цикла; среди них белок из J-доменного семейства Hsp40. Кроме того, идентифицировали дополнительные белки-партнеры, некоторые из которых связывают Hsp70 с другими системами шаперонов, такими как система Hsp90.
Члены семейства Hsp70 человека
Некоторые из важных функций, приписываемых молекулярным шаперонам, включают импорт белков в компартменты клетки, фолдинг белков в цитозоле, эндоплазматической сети и митохондриях, предотвращение агрегации белков и рефолдинг неправильно свернутых белков. В настоящее время семейство Hsp70 человека включает 10 членов, кодируемых различными генами, и данный раздел направлен на предоставление обзора членов данного семейства в отношении функции, профилей экспрессии и гомологии. Существует некоторая путаница в номенклатуре различных членов семейства Hsp70 человека, хотя система общих ориентиров излагается в Tavaria et al., что предоставляет логическую связь между названиями локусов, генов и белков. Однако т.к. все еще существует некоторая межвидовая путаница, гены и белки Hsp70 описывают в настоящем документе по названию их локусов. Название Hsp70 может относиться к двум индуцибельным членам семейства Hsp70 с названиями локусов HSPA1A и HSPA1Β или к целому семейству Hsp70 в общем, как видно из контекста документа. Однако, как применяется в настоящем изобретении, Hsp70 направлено на обозначение любого из двух индуцибельных членов семейства Hsp70 с названиями локусов HSPA1A и HSPA1B.
HspA1A и Hsp1B
Транскрибируемые из локусов HSPA1A и HSPA1Β гены являются двумя тепловой шок/стресс-индуцибельными генами Hsp70, и большая часть литературных источников относит Hsp70 человека к белкам, кодируемым этими двумя генами. Данные гены дают начало белкам, содержащим 641 аминокислоту, имеющим 99% гомологию друг с другом и являющимся первыми клонированными и охарактеризованными членами семейства Hsp70. Гены связаны в комплекс MHC класса III на 6p21.3, не имеют интронов, имеют промоторные регионы, содержащие HSE, что позволяет им связывать HSF и индуцировать транскрипцию в ответ на множество повреждений клеток.
Белковой последовательностью для белка теплового шока 1A Homo sapiens (HSPA1A) с молекулярным весом 70 кДа является (SEQ ID NO:1) (Образец no. NM_005345.5):
MAKAAAIGIDLGTTYSCVGVFQHGKVEIIANDQGNRTTPSYVAFTDTERLIGDAAKNQVALNPQNTVFDAKRLIGRKFGDPVVQSDMKHWPFQVINDGDKPKVQVSYKGETKAFYPEEISSMVLTKMKEIAEAYLGYPVTNAVITVPAYFNDSQRQATКDАGVIAGLNVLRIINEPTAAAIAYGLDRTGKGERNVLIFDLGGGTFDVSILTIDDGIFEVKATAGDTHLGGEDFDNRLVNHFVEEFKRKHKKDISQNKRAVRRLRTACERAKRTLSSSTQASLEIDSLFEGIDFYTSITRARFEELCSDLFRSTLEPVEKALRDAKLDKAQIHDLVLVGGSTRIPKVQKLLQDFFNGRDLNKSINPDEAVAYGAAVQAAILMGDKSENVQDLLLLDVAPLSLGLETAGGVMTALIKRNSTIPTKQTQIFTTYSDNQPGVLIQVYEGERAMTKDNNLLGRFELSGIPPAPRGVPQIEVTFDIDANGILNVTATDKSTGKANKITITNDKGRLSKEEIERMVQEAEKYKAEDEVQRERVSAKNALESYAFNMKSAVEDEGLKGKISEADKKKVLDKCQEVISWLDANTLAEKDEFEHKRKELEQVCNPIISGLYQGAGGPGPGGFGAQGPKGGSGSGPTIEEVD
Последовательностью нуклеиновой кислоты (ДНК) для белка теплового шока 1A Homo sapiens (HSPA1A) с молекулярным весом 70 кДа является (SEQ ID NO:2) (Образец no. NM_005345.5):
1 ataaaagccc aggggcaagc ggtccggata acggctagcc tgaggagctg ctgcgacagt
61 ccactacctt tttcgagagt gactcccgtt gtcccaaggc ttcccagagc gaacctgtgc
121 ggctgcaggc accggcgcgt cgagtttccg gcgtccggaa ggaccgagct cttctcgcgg
181 atccagtgtt ccgtttccag cccccaatct cagagcggag ccgacagaga gcagggaacc
241 ggcatggcca aagccgcggc gatcggcatc gacctgggca ccacctactc ctgcgtgggg
301 gtgttccaac acggcaaggt ggagatcatc gccaacgacc agggcaaccg caccaccccc
361 agctacgtgg ccttcacgga caccgagcgg ctcatcgggg atgcggccaa gaaccaggtg
421 gcgctgaacc cgcagaacac cgtgtttgac gcgaagcggc tgattggccg caagttcggc
481 gacccggtgg tgcagtcgga catgaagcac tggcctttcc aggtgatcaa cgacggagac
541 aagcccaagg tgcaggtgag ctacaagggg gagaccaagg cattctaccc cgaggagatc
601 tcgtccatgg tgctgaccaa gatgaaggag atcgccgagg cgtacctggg ctacccggtg
661 accaacgcgg tgatcaccgt gccggcctac ttcaacgact cgcagcgcca ggccaccaag
721 gatgcgggtg tgatcgcggg gctcaacgtg ctgcggatca tcaacgagcc cacggccgcc
781 gccatcgcct acggcctgga cagaacgggc aagggggagc gcaacgtgct catctttgac
841 ctgggcgggg gcaccttcga cgtgtccatc ctgacgatcg acgacggcat cttcgaggtg
901 aaggccacgg ccggggacac ccacctgggt ggggaggact ttgacaacag gctggtgaac
961 cacttcgtgg aggagttcaa gagaaaacac aagaaggaca tcagccagaa caagcgagcc
1021 gtgaggcggc tgcgcaccgc ctgcgagagg gccaagagga ccctgtcgtc cagcacccag
1081 gccagcctgg agatcgactc cctgtttgag ggcatcgact tctacacgtc catcaccagg
1141 gcgaggttcg aggagctgtg ctccgacctg ttccgaagca ccctggagcc cgtggagaag
1201 gctctgcgcg acgccaagct ggacaaggcc cagattcacg acctggtcct ggtcgggggc
1261 tccacccgca tccccaaggt gcagaagctg ctgcaggact tcttcaacgg gcgcgacctg
1321 aacaagagca tcaaccccga cgaggctgtg gcctacgggg cggcggtgca ggcggccatc
1381 ctgatggggg acaagtccga gaacgtgcag gacctgctgc tgctggacgt ggctcccctg
1441 tcgctggggc tggagacggc cggaggcgtg atgactgccc tgatcaagcg caactccacc
1501 atccccacca agcagacgca gatcttcacc acctactccg acaaccaacc cggggtgctg
1561 atccaggtgt acgagggcga gagggccatg acgaaagaca acaatctgtt ggggcgcttc
1621 gagctgagcg gcatccctcc ggcccccagg ggcgtgcccc agatcgaggt gaccttcgac
1681 atcgatgcca acggcatcct gaacgtcacg gccacggaca agagcaccgg caaggccaac
1741 aagatcacca tcaccaacga caagggccgc ctgagcaagg aggagatcga gcgcatggtg
1801 caggaggcgg agaagtacaa agcggaggac gaggtgcagc gcgagagggt gtcagccaag
1861 aacgccctgg agtcctacgc cttcaacatg aagagcgccg tggaggatga ggggctcaag
1921 ggcaagatca gcgaggcgga caagaagaag gtgctggaca agtgtcaaga ggtcatctcg
1981 tggctggacg ccaacacctt ggccgagaag gacgagtttg agcacaagag gaaggagctg
2041 gagcaggtgt gtaaccccat catcagcgga ctgtaccagg gtgccggtgg tcccgggcct
2101 gggggcttcg gggctcaggg tcccaaggga gggtctgggt caggccccac cattgaggag
2161 gtagattagg ggcctttcca agattgctgt ttttgttttg gagcttcaag actttgcatt
2221 tcctagtatt tctgtttgtc agttctcaat ttcctgtgtt tgcaatgttg aaattttttg
2281 gtgaagtact gaacttgctt tttttccggt ttctacatgc agagatgaat ttatactgcc
2341 atcttacgac tatttcttct ttttaataca cttaactcag gccatttttt aagttggtta
2401 cttcaaagta aataaacttt aaaattcaaa aaaaaaaaaa aaaaa
Белковой последовательностью для белка теплового шока 1B Homo sapiens (HSPA1B) с молекулярным весом 70 кДа является (SEQ ID N0:3) (Образец no: NM_005346):
MAKAAAIGIDLGTTYSCVGVFQHGKVEIIANDQGNRTTPSYVAFTDTERLIGDAAKNQVALNPQNTVFDAKRLIGRKFGDPVVQSDMKHWPFQVINDGDKPKVQVSYKGETKAFYPEEISSMVLTKMKEIAEAYLGYPVTNAVITVPAYFNDSQRQATКDАGVIAGLNVLRIINEPTAAAIAYGLDRTGKGERNVLIFDLGGGTFDVSILTIDDGIFEVKATAGDTHLGGEDFDNRLVNHFVEEFKRKHKKDISQNKRAVRRLRTACERAKRTLSSSTQASLEIDSLFEGIDFYTSITRARFEELCSDLFRSTLEPVEKALRDAKLDKAQIHDLVLVGGSTRIPKVQKLLQDFFNGRDLNKSINPDEAVAYGAAVQAAILMGDKSENVQDLLLLDVAPLSLGLETAGGVMTALIKRNSTIPTKQTQIFTTYSDNQPGVLIQVYEGERAMTKDNNLLGRFELSGIPPAPRGVPQIEVTFDIDANGILNVTATDKSTGKANKITITNDKGRLSKEEIERMVQEAEKYKAEDEVQRERVSAKNALESYAFNMKSAVEDEGLKGKISEADKKKVLDKCQEVISWLDANTLAEKDEFEHKRKELEQVCNPIISGLYQGAGGPGPGGFGAQGPKGGSGSGPTIEEVD
Последовательностью нуклеиновой кислоты (ДНК) для белка теплового шока 1B Homo sapiens (HSPA1B) с молекулярным весом 70 кДа является (SEQ ID N0:4) (Образец no: NM_005346):
1 ggaaaacggc cagcctgagg agctgctgcg agggtccgct tcgtctttcg agagtgactc
61 ccgcggtccc aaggctttcc agagcgaacc tgtgcggctg caggcaccgg cgtgttgagt
121 ttccggcgtt ccgaaggact gagctcttgt cgcggatccc gtccgccgtt tccagccccc
181 agtctcagag cggagcccac agagcagggc accggcatgg ccaaagccgc ggcgatcggc
241 atcgacctgg gcaccaccta ctcctgcgtg ggggtgttcc aacacggcaa ggtggagatc
301 atcgccaacg accagggcaa ccgcaccacc cccagctacg tggccttcac ggacaccgag
361 cggctcatcg gggatgcggc caagaaccag gtggcgctga acccgcagaa caccgtgttt
421 gacgcgaagc ggctgatcgg ccgcaagttc ggcgacccgg tggtgcagtc ggacatgaag
481 cactggcctt tccaggtgat caacgacgga gacaagccca aggtgcaggt gagctacaag
541 ggggagacca aggcattcta ccccgaggag atctcgtcca tggtgctgac caagatgaag
601 gagatcgccg aggcgtacct gggctacccg gtgaccaacg cggtgatcac cgtgccggcc
661 tacttcaacg actcgcagcg ccaggccacc aaggatgcgg gtgtgatcgc ggggctcaac
721 gtgctgcgga tcatcaacga gcccacggcc gccgccatcg cctacggcct ggacagaacg
781 ggcaaggggg agcgcaacgt gctcatcttt gacctgggcg ggggcacctt cgacgtgtcc
841 atcctgacga tcgacgacgg catcttcgag gtgaaggcca cggccgggga cacccacctg
901 ggtggggagg actttgacaa caggctggtg aaccacttcg tggaggagtt caagagaaaa
961 cacaagaagg acatcagcca gaacaagcga gccgtgaggc ggctgcgcac cgcctgcgag
1021 agggccaaga ggaccctgtc gtccagcacc caggccagcc tggagatcga ctccctgttt
1081 gagggcatcg acttctacac gtccatcacc agggcgaggt tcgaggagct gtgctccgac
1141 ctgttccgaa gcaccctgga gcccgtggag aaggctctgc gcgacgccaa gctggacaag
1201 gcccagattc acgacctggt cctggtcggg ggctccaccc gcatccccaa ggtgcagaag
1261 ctgctgcagg acttcttcaa cgggcgcgac ctgaacaaga gcatcaaccc cgacgaggct
1321 gtggcctacg gggcggcggt gcaggcggcc atcctgatgg gggacaagtc cgagaacgtg
1381 caggacctgc tgctgctgga cgtggctccc ctgtcgctgg ggctggagac ggccggaggc
1441 gtgatgactg ccctgatcaa gcgcaactcc accatcccca ccaagcagac gcagatcttc
1501 accacctact ccgacaacca acccggggtg ctgatccagg tgtacgaggg cgagagggcc
1561 atgacgaaag acaacaatct gttggggcgc ttcgagctga gcggcatccc tccggccccc
1621 aggggcgtgc cccagatcga ggtgaccttc gacatcgatg ccaacggcat cctgaacgtc
1681 acggccacgg acaagagcac cggcaaggcc aacaagatca ccatcaccaa cgacaagggc
1741 cgcctgagca aggaggagat cgagcgcatg gtgcaggagg cggagaagta caaagcggag
1801 gacgaggtgc agcgcgagag ggtgtcagcc aagaacgccc tggagtccta cgccttcaac
1861 atgaagagcg ccgtggagga tgaggggctc aagggcaaga tcagcgaggc ggacaagaag
1921 aaggttctgg acaagtgtca agaggtcatc tcgtggctgg acgccaacac cttggccgag
1981 aaggacgagt ttgagcacaa gaggaaggag ctggagcagg tgtgtaaccc catcatcagc
2041 ggactgtacc agggtgccgg tggtcccggg cctggcggct tcggggctca gggtcccaag
2101 ggagggtctg ggtcaggccc taccattgag gaggtggatt aggggccttt gttctttagt
2161 atgtttgtct ttgaggtgga ctgttgggac tcaaggactt tgctgctgtt ttcctatgtc
2221 atttctgctt cagctctttg ctgcttcact tctttgtaaa gttgtaacct gatggtaatt
2281 agctggcttc attatttttg tagtacaacc gatatgttca ttagaattct ttgcatttaa
2341 tgttgatact gtaagggtgt ttcgttccct ttaaatgaat caacactgcc accttctgta
2401 cgagtttgtt tgtttttttt tttttttttt ttttttgctt ggcgaaaaca ctacaaaggc
2461 tgggaatgta tgtttttata atttgtttat ttaaatatga aaaataaaat gttaaacttt
2521 aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa a
HspAIL и HspA2
Два члена семейства Hsp70 назвали "генами-шовинистами", т.к. мужские половые клетки поддерживают их экспрессию со строгим предубеждением. Ген hspA1L является конститутивно экспрессирующимся безинтронным членом семейства Hsp70, локализованным на 4 т.п.н. в сторону теломеры относительно локуса HSPA1A в том же комплексе MHC класса III на хромосоме 6. Он экспрессируется в небольшом количестве до и после теплового шока, но с профилем экспрессии, способствующим тестам на мышах, крысах и человеке с белком из 641 аминокислоты, который на 90% гомологичен HspA1A. Ген hspA2 впервые выделяли из геномной библиотеки мыши и позднее демонстрировали, что он конститутивно экспрессируется, хоть и на низком уровне, в различных тканях тела человека, включая скелетные мышцы, яичник, тонкий кишечник, толстый кишечник, головной мозг, плаценту и почки, но высоко экспрессируется в яичках. Его экспрессия, а точнее ее недостаток, связан с аномальным сперматогенезом человека, и самцы мыши hspA2(-/-) являются стерильными. Ген локализован на хромосоме 14, дает начало белку из 639 аминокислот с 84% гомологией с HspA1A, хотя точная локализация является предметом обсуждения, т.к. в двух статьях представляют разные положения локусов - 14q24.1 против 14q22.
HspA6 и HspA7
Гены hspA6 и hspA7 являются индуцируемыми тепловым шоком членами семейства Hsp70, для которых нет аналогов у мышей. Они содержат HSE в промоторных участках и являются безинтронными. Они колокализованы на хромосоме 1 и имеют друг с другом 94% гомологию последовательности нуклеотидов. Однако только HspA6 является функциональным, в то время как ген hspA7 содержит однонуклеотидную инсерцию, приводящую к образованию преждевременного стоп-кодона в положении +1324. Белок HspA6 имеет длину 643 аминокислоты и демонстрирует 77% гомологию с HspA1A и HspA1B.
HspA5 и HspA9
Гены hspA5 и hspA9 являются двумя компартмент-специфическими членами семейства Hsp70. Белок HspA5 длиной 655 аминокислот локализован в эндоплазматической сети (ER) и способствует фолдингу и транспорту недавно синтезированных белков в их компартмент. Белок является на 64% гомологичным HspA1A, ген локализован на 9q34. Белок HspA9 длиной 679 аминокислот локализован в митохондриях, где он облегчает фолдинг белков после их транспорта через митохондриальную мембрану. HspA9 локализован на 5q31.1, белок является на 52% гомологичным HspA1A.
HspA8
Похожий член Hsp70, известный как Hsc70, кодируется геном, названным hspA8, на 11q24, давая начало белку из 646 аминокислот с 86% гомологией с HspA1A, и конститутивно экспрессируется во всех тканях и клеточных линиях. Белок является аналогом Hsp70 по своим функциям в клетке, обеспечивая требуемое сопровождение в нормальных обстоятельствах, но ему также приписывают роль в "раздевании" покрытых клатрином везикул, а также в опосредованной шаперонами аутофагии.
HspA3 и HspA4
В настоящем документе не обсуждаются, т.к. существуют сомнения в том, существует ли HSPA3, и наиболее вероятно, что HSPA4 является членом семейства Hsp110 и до настоящего времени о нем ничего неизвестно, кроме того, что он локализован на 5q31.1-2.
Регуляция транскрипции Hsp70
Геномный фут-принтинг промотора Hsp70 человека выявил, что тепловой шок/стресс индуцирует быстрое связывание факторов транскрипции теплового шока (HSF) с областью, охватывающей последовательности nGAAn, названные элементами теплового шока (HSE). В нормальных условиях Hsp70 связывается с HSF, которые находятся в цитозоле, но при стрессе HSF отделяются от Hsp70 и перестраивают гомотримерную конформацию после фосфорилирования PKC или другими сериновой/треониновой киназами. Тримеры HSF попадают в ядро, где они связывают HSE, локализованные в промоторной области генов Hsp70, и затем фосфорилируются киназами HSF.
В данное время у людей описали три HSF (HSF1, HSF2 и HSF4). HSF1 является главным фактором транскрипции, активируемым в большинстве стрессовых условий и отвечающим на широкий диапазон стимулов, которые можно разделить на физиологические (т.е. деление клетки, гормональная стимуляция), патологические (т.е. инфекции, жар, воспаление, злокачественное новообразование) и условия окружения (т.е. тепловой шок, тяжелые металлы, этанол). HSF2 отвечает только на гемин, в то время как HSF4 предпочтительно экспрессируется в сердце человека, поджелудочной железе, головном мозге и скелетных мышцах, не имеет c-концевого гиброфобного повтора, распространенного среди HSF всех позвоночных, и выступает как репрессор экспрессии HSP. Регуляция гена Hsp70, отвечающая за синтез конститутивно экспрессируемого Hsp70 (Hsc70), недостаточно исследована, но, кажется, HSF не вовлечены в нее.
Хотя HSF являются наиболее значительными факторами, регулирующими экспрессию HSP, показано, что другие факторы транскрипции обладают той же способностью. Показано, что специфические факторы, связывающиеся с CCAAT-бокс (CBF), индуцируют транскрипцию Hsp70, опухолевый супрессор p53 может подавлять транскрипцию посредством связывания с промоторной областью Hsp70 и посредством нейтрализации CBF, и белок 1, связывающийся с факторами теплового шока (HSBP1), противодействует HSF и, таким образом, снижает транскрипцию Hsp70.
Структурные и функциональные свойства Hsp70
Структура и функции системы Hsp70 наиболее изучены для Hsp70 эубактерий, DnaK, его Hsp40 кошаперон DnaJ и фактор обмена нуклеотидов GrpE. Однако, как правило, механизм рассматривают как аналогичный у эукариот, хотя доказательства позволяют предполагать о разъединении GrpE. Данный раздел сосредотачивает внимание на системе Hsp70 эукариот, но также включает комментарии по системе эубактерий там, где это уместно.
Hsp70 содержит две функциональные части - N-концевой АТФазный домен и меньший C-концевой пептид-связывающий домен. АТФазный домен содержит два субдомена, разделенных щелью, содержащей участок связывания нуклеотида, который определяет пептид-связывающие свойства C-концевого домена. Когда АТФ связан, пептидный субстрат связывается и диссоциирует быстро, хотя и с низкой аффинностью, в случае, когда ни нуклеотид, ни ADP не связан с N-концевым доменом, соотношение связывания и диссоциации пептида снижается и повышается аффинность. Таким образом, гидролиз АТФ выступает молекулярным переключателем между двумя состояниями Hsp70, цикличность которого регулируют белок J-доменного семейства Hsp40 у эукариот и DnaJ и GrpE у эубактерий. N-концевой J-домен Hsp40 связывается с Hsp70, ускоряя гидролиз АТФ и, таким образом, способствуя захвату пептида, в то время как C-концевая часть Hsp40 функционирует как шаперон посредством распознавания гидрофобных пептидов, в результате чего Hsp70 задействован в первичных полипептидных цепях. Необходимо отметить, что молекулярные шапероны не предоставляют специфическую стерическую информацию для фолдинга связанного белка, но скорее ингибируют непродуктивные взаимодействия, таким образом позволяя белку свернуться в свою нативную структуру более эффективно.
У эубактерий GrpE индуцирует высвобождение ADP из DnaK (бактериального Hsp70), в то время как для эукариотических белков Hsp70 такой фактор, по-видимому, необязателен из-за того, что скорость-лимитирующей стадией в данном цикле АТФазы является не диссоциация связанного ADP, а сам гидролиз АТФ. Однако дополнительные белки служат для регуляции функционирования Hsp70 у эукариот; гомоолигомерный белок Hip (взаимодействующий с Hsp70 белок) выполняет функцию положительного регулятора посредством стабилизации ADP-связанного состояния Hsp70, в то время как белок, связывающийся с карбоксиконцом Hsp70 (CHIP), и ассоциированный с Bcl-2 атаноген 1 (Bag-1) обладают ингибиторным действием - CHIP посредством ингибирования АТФазной активности Hsp70 и Bag-1 посредством противодействия рефолдинговой активности Hsp70. Дальнейшие взаимодействия обеспечены двумя Hsp40 белками человека Hdj1 и Hdj2, для которых показано, что помимо их функционирования как Hsp 40 (описанного выше) они облегчают спаривание Hsp70 и Hsp90 посредством Hop (Hsp-организующего белка), адапторного белка, который физически связывает шапероны через два их домена с тетратрикопептидными повторами (TPR), которые связывают протяженные C-концевые последовательности Hsp70 и Hsp90 соответственно. Недавно показано, что некоторые из указанных выше белков являются регуляторами переноса ненативных или необратимо неправильно свернутых белков от шаперонов в убиквитин-протеосомную систему. Белок CHIP помимо негативной регуляторной роли для Hsp70 способен связываться с Hsp90 через N-концевой TPR домен и нацелен на субстраты Hsp90 для деградации через C-концевой домен убиквитинлигазы, но также способен функционально кооперироваться с BAG-1, который связывается с Hsp70 (а также протеосомой). Эти данные предоставляют связь между механизмами, интегрирующими фолдинг при участии шаперонов, и протеолитической деградацией, двумя главными компонентами контроля качества белков в цитозоле.
Цитопротекция посредством Hsp70
Помимо своих антиапоптотических способностей и, как следствие, функционирования в качестве молекулярного шаперона, т.е. способствуя фолдингу белков в денатурирующих условиях, Hsp70 способен действовать на выживание клеток различными другими способами, включая защиту функционирования митохондрий после повреждения вследствие ишемии-реперфузии, блока активации стрессовой N-концевой c-jun киназы (JNK) после стимуляции первичных фибробластов TNF, и представляется, что комплекс Hsp70/Bag-1 регулирует рост клеток и митогенез в условиях клеточного стресса. Кроме того, способность Hsp70 защищать клетки от гибели клеток, индуцированной рядом стимулов, таких как TNF, TRAIL, оксидативный стресс, УФ-излучение, и противоопухолевыми лекарственными средствами, т.е. доксорубицин, этопозид и таксол, подчеркивает его антиапоптотические свойства. В конечном итоге статьи также предоставляют доказательства более прямого взаимодействия между Hsp70 и механизмом апоптоза, т.к. показано, что Hsp70 противодействует фактору индукции апоптоза (AIF), а также влияет на антиапоптотические функции после каспазы-3.
Недавние доказательства также позволяют предполагать, что потенциальное цитопротективное действие Hsp70 обусловлено стабилизацией лизосомальных мембран. В доказательство этого истощение Hsp70 запускает раннюю проницаемость лизосомальных мембран и опосредованную катепсинами гибель злокачественных клеток, и экзогенный Hsp70 эффективно ингибирует дестабилизацию лизосом, индуцируемую различным стрессом. Кроме того, мыши с дефицитом Hsp70 страдают панкреатитом, вызываемым недостатком лизосомальных протеаз в цитозоле. Все эти явления подчеркивают роль Hsp70 как важного регулятора PCD и, следовательно, фактора выживания клеток.
Hsp70 при злокачественных новообразованиях
Hsp70 часто сверхэкспрессируется в злокачественных опухолях человека, и его экспрессия коррелирует с неблагоприятным прогнозом для опухолей груди и эндометрия. В соответствии с этим Hsp70 повышает канцерогенный потенциал клеток грызунов, имплантированных иммуно-компрометированным или изогенным животным.
Кроме того, роль Hsp70 как важного фактора выживания злокачественных клеток обоснована в статье Wei et al., которые провели первое исследование истощения Hsp70 в злокачественных клетках. Результаты показали, что когда экспрессия Hsp70 в различных линиях злокачественных клеток ингибирована посредством применения антисмысловых олигомеров, индуцируется ингибирование пролиферации клеток и последующий апоптоз. Данная работа подтверждена серией экспериментов, в которых опосредованное аденовирусом истощение Hsp70 запускало специфическую лизосомальную программу гибели злокачественных клеток.
Кроме того, исследования in vivo с применением ортотопических ксенотрансплантатов глиобластомы и карциномы молочной железы, а также подкожных ксенотрансплантатов карциномы толстого кишечника у мышей с иммунодефицитом демонстрируют противозлокачественный потенциал истощения Hsp70, т.к. опухоли мышей, получавших местное воздействие указанной выше аденовирусной конструкции, продемонстрировали массивную апоптозо-подобную гибель клеток и вовлечение макрофагов. Данные исследования четко демонстрируют зависимость некоторых опухолей от присутствия Hsp70, хотя другие исследования свидетельствуют о том, что цитотоксичность, наблюдаемая в культуре клеток после опосредованного аденовирусом истощения Hsp70, обусловлена комбинацией опосредованного вирусом клеточного стресса и негативной регуляции Hsp70. Несмотря на данное противоречие, индуцируемая истощением Hsp70 цитотоксичность в культуре клеток не зависит от каспаз, т.к. ни сверхэкспрессия Bcl-2, ни фармакологическое ингибирование каспаз не может спасти клетки. Скорее, индуцирующими гибель событиями являются запуск LMP и высвобождение катепсинов в цитозоль, т.к. ингибирование цистеиновых катепсинов придает значительную цитопротекцию. Кроме того, у мышей истощение Hsp70 в вышеупомянутых опухолевых ксенотрансплантатах приводит к высвобождению катепсинов и гибели опухолевых клеток.
Как отмечалось ранее, одним из цитопротективных механизмов Hsp70, который можно применять к злокачественным клеткам, является перемещение Hsp70 в эндосомальный компартмент, где он выполняет мембрано-протективную функцию. Данное перемещение может не только направляться необходимостью защитить лизосомальные мембраны, т.к. исследования показывают, что для больше чем 50% опухолей показана локализация Hsp70 на поверхности цитоплазматической мембраны - области, которая непосредственно соединена с эндолизосомальным компартментом посредством эндоцитоза и секреторных событий, как описано выше. Экспонированный на поверхности Hsp70 представляет собой уникальный эпитоп, который может действовать как структура распознавания для естественных киллеров (NK), стимулируя их пролиферацию и цитолитическую активность. Показано, что клетки NK, активируемые данной пептидной последовательностью Hsp70, ингибируют рост опухоли у мышей с тяжелым комбинированным иммунодефицитом (SCID), возможным механизмом этого может являться то, что Hsp70, связанный с поверхностью клетки, опосредует апоптоз посредством специфического связывания и захвата гранзима D независимо от перфорина.
Как описано выше, эндолизосомальные мембраны и цитоплазматические мембраны постоянно взаимозаменяются. Таким образом, присутствие Hsp70 на поверхности злокачественных клеток может являться "неудачным" следствием двух событий, которые способствуют прогрессированию опухоли; секреция катепсинов, которая способствует инвазии и ангиогенезу, и локализация Hsp70 на лизосомальных мембранах, что предотвращает случайное высвобождение цистеиновых катепсинов в цитозоль и последующую гибель клетки.
Внеклеточный Hsp70
Как указано в предыдущих параграфах, внутриклеточные функции Hsp70 являются важными для соответствующего гомеостаза клетки, не в последнюю очередь перед лицом вредных вызовов. Однако интересная роль и у внеклеточного Hsp70 (eHsp70), особенно когда это касается иммунного и воспалительного ответов, которые, кроме того, могут играть важную роль в устранении злокачественных клеток. Кроме того, вовлечение в общую физиологическую адаптацию к стрессу и защита от повреждения клеток также являются развивающимися темами для eHsp70.
Внеклеточный Hsp70 и нейропротекция
Первое доказательство существования eHsp70 появилось в исследованиях на гигантском аксоне кальмара, в которых показали, что повышение температуры индуцирует ряд белков теплового шока в глиальной оболочке, окружающей аксон, которые были перенесены в аксон. Эти данные в скором времени были воспроизведены на культивируемых эмбриональных клетках крысы, и, что важно, на этом этапе существовало доказательство неклассического пути эндоцитоза, отвечающего за высвобождение Hsp70, в то время как ни монензин, ни колхицин, ингибиторы классического пути секреции, не могли блокировать секрецию Hsp70. После данной публикации другие статьи предоставляли примеры высвобождения Hsp глией и захвата нейронами в различных системах животных моделей, таких как лягушки, лангусты и крысы. Поддержку роли клеток глии как источника eHsp70 у людей обеспечило исследование культивируемых клеток глиобластомы человека. Данное исследование показало, что в контролируемых условиях клетки высвобождают ~10 пг Hsp70 на миллион клеток в среде в течение периода времени 24 часа. Это высвобождение возрастало в 2,5-5 раз, когда применяли 20 мин теплового шока в начале периода времени. Важно, что данное исследование также показало, что высвобождение eHsp70 было выше, чем то, что может выявляться при гибели клеток. Эти данные подтверждают первоначально выдвинутую гипотезу, предложенную Tytell et al., о том, что глиальное высвобождение Hsp может являться путем поддержки функционирования нейрона при метаболическом стрессе.
Доказательство in vivo того, что eHsp70 обладает нейропротективной функцией при остром стрессе, появилось во множестве исследований. В исследовании Tidwell et al. обнаруживали, что eHsp70 способен снижать величину гибели клеток моторных нейронов после аксотомии, когда eHsp70 прикладывали посредством гелевой губки после аксотомии. В таком же исследовании усиление выживания сенсорных нейронов ганглия дорсального корешка также наблюдали после введения Hsp70, хотя это зависело от немного более высоких доз Hsp70, чем для моторных нейронов. Кроме того, показано, что eHsp70 защищает моторные нейроны, которым в противном случае суждено умереть в ходе эмбрионального развития цыпленка, а также защищает моторные нейроны, выделенные из спинного мозга цыпленка при отсутствии трофических факторов. Защитную роль eHsp70 in vivo также описывали при световом повреждении сетчатки. В данном исследовании Yu et al. после воздействия индуцирующего повреждение света вводили в стекловидное тело раствор рекомбинантных Hsp70 и Hsc70 в дозе, которую ранее описывали, как вызывающую обширную дегенерацию фоторецепторов. Любопытно, что присутствие смеси eHsp70 в камере стекловидного тела правого глаза приводит к значительно большему выживанию фоторецепторов сетчатки. Кроме того, оценка захвата меченного флуоресцеином Hsc/Hsp70 показывает, что он присутствует в сетчатке через 6 часов после введения. Показано, что внеклеточный Hsp70, введенный интраназально, предотвращает последствия неизбежного стресса у крыс, и недавно описывали, что введенный интраперитонеально рекомбинантный Hsp70 человека эффективен в увеличении продолжительности жизни, задерживая начало симптомов, сохраняя моторную функцию и продляя выживание моторных нейронов на модели бокового амиотрофического склероза мыши. Дополнительная работа in vitro с применением Hsp70 или смеси Hsc/Hsp70 в системах нейронов, кроме того, показала, что eHsp70 может усиливать устойчивость нервной клетки к стрессу и снижать полиглутаминовую токсичность и агрегацию.
Внеклеточный Hsp70 и иммунитет
Помимо роли в цитопротекции установлено, что ассоциированный с цитоплазматической мембраной, а также свободный системный eHsp70, играют роль в иммунитете. Рассматривая одну из главных функций Hsp70 в качестве шаперона внутриклеточных белков, возможно, неудивительно, что он может вовлекаться в связывание иммуногенных пептидов и помогать в их презентации посредством молекул главного комплекса гистосовместимости (MHC) класса I. Кроме того, показано, что выделенный из опухоли eHsp70 действует как шаперон для иммуногенных пептидов и селективно связывается с антигенпрезентирующими клетками (APC). После рецептор-опосредованного эндоцитоза данный комплекс Hsp70-пептид презентируется на молекулах MHC класса I, приводя к цитотоксическому ответу Т-клеток. Кроме того, при действии в качестве шаперона для собственных антигенов Hsp70 также способен связывать микробные пептиды и неметилированные CpG мотивы в ДНК бактерий.
В дополнение к роли в качестве антиген-презентирующего шаперона eHsp70 также вовлекается в стимуляцию врожденного иммунитета. В то время как показано, что ряд типов клеток высвобождает Hsp70, также показано, что eHsp70 связывает ряд рецепторов на различных субпопуляциях лейкоцитов, включая естественные киллеры (NK), макрофаги, моноциты и дендритные клетки. Вовлеченные в распознавание eHsp70 рецепторы в основном включают рецепторы распознавания паттерна (PRR) и состоят из множества рецепторов из различных семейств рецепторов, таких как толл-подобные рецепторы (TLR), скевенджер-рецепторы и лектины типа C. После связывания рецептора eHsp70 способен вызывать обширный цитокиновый ответ, включая высвобождение провоспалительных цитокинов, таких как TNFα, IL-1β, IL-12, IL-6 и GM-CSF, процесс, запускаемый перемещением NF-κB в ядро, что позволяет предполагать действие eHsp70 в качестве цитокина, что также приводит к предложению создать для eHsp70 термин шаперокин для лучшего описания уникальных функций eHsp70 как шаперона, так и цитокина.
Большую часть работ in vivo о роли eHsp70 в иммунитете проводили на моделях грызунов. Например, увеличение концентрации eHsp70 в ответ на шоковое воздействие на хвост ассоциировано со снижением воспаления и более быстрым временем заживления после подкожного введения E.Coli. Кроме того, введение in vivo Hsp70 мыши ускоряет затягивание раны, свойство, вероятно, по причине которого усиливается фагоцитоз макрофагами инородных веществ в ране.
Не хватает доказательства иммуномодуляторной роли Hsp70 у людей, но исследования демонстрирует связь с увеличением eHsp70 и улучшением прогноза/исхода травмы головного мозга, хотя также показано противоположное. Однако также известно, что концентрации eHsp70 снижаются в пожилом возрасте, что может свидетельствовать о возраст-зависимом снижении способности осуществлять полный ответ на стресс, что, помимо прочего, может являться причиной увеличения заболеваемости и смертности, наблюдаемого при старении, хотя это остается исключительно спорным.
Высвобождение Hsp70
Помимо данных, демонстрирующих перенос eHsp70 между соседними клетками, такими как модель глия/аксон, в нескольких статьях подтверждено присутствие свободного eHsp70 в кровотоке. Для присутствующего в данном компартменте Hsp70 является необходимым высвобождение из органа/клетки. Как правило, рассматривают два главных пути достижения этого. Одним является пассивный путь, в котором обнаружение eHsp70 в периферическом кровотоке является следствием высвобождения из внутриклеточной совокупности Hsp70 по причине лизиза или гибели клеток. Альтернативно, или возможно дополнительно, Hsp70 активно высвобождается посредством неклассического пути эндоцитоза.
Предполагают, что Hsp70 вместе с другими белками теплового шока высвобождаются только в патологических условиях, приводящих к некротической гибели, но не при программируемой гибели клеток. Несомненно, тяжелая травма и патологические состояния, приводящие к некрозу, могут приводить к высвобождению Hsp70 в кровоток. Это убедительно подтверждено и логически ожидаемо. Однако недавние исследования показали, что Hsp70 может высвобождаться из интактных клеток посредством активных механизмов и что уровень стимулов определяет способ высвобождения. Убедительное доказательство ненекротического высвобождения Hsp70 также представлено в исследовании индуцируемого упражнениями высвобождения eHsp70 в периферический кровоток. В зависимости от способа упражнения (чем выше физическая нагрузка, тем больше высвобождение) в периферическом кровотоке можно определять существенно повышение eHsp70, и важно, что неизвестны исследования, в которых сообщалось о прямой корреляции между eHsp70 и маркерами повреждения мышц. То, что eHsp70 может высвобождаться независимо от повреждения клеток и тканей, помимо прочего изящно демонстрировали Fleshner с соавторами, которые показали, что психологический стресс, такой как боязнь хищника и электрошок, может вызывать стресс-индуцируемое высвобождение eHsp70, процесс, который, как предполагают, зависит от катехоламиновой передачи сигнала.
Способ, которым Hsp70 покидает клетку, до сих пор непонятен, не в последнюю очередь из-за того, что Hsp70 не содержит какую-либо классическую пептидную лидерную последовательность, которая может направлять его на секрецию. Кроме того, т.к. классическую секрецию обсуждали выше, предполагают, что должен существовать альтернативный механизм секреции eHsp70. Продемонстрировали, что eHsp70 может высвобождаться в везикулах, охарактеризованных как экзосомы, но также представляли доказательства, что eHsp70 может высвобождаться как свободный eHsp70, как в клеточных системах, так и in vivo. Предполагают, что для высвобождения eHsp70 необходимы липидные рафты, хотя это является предметом обсуждения. Кроме того, показано, что функциональный лизосомальный компартмент необходим для высвобождения eHsp70 и что данное высвобождение сопровождается наличием лизосомальных белков-маркеров на поверхности клетки, позволяя предполагать, что секреция зависит от слияния цитоплазматической и лизосомальной мембран. Независимо от того, происходит ли высвобождение посредством экзосом или непосредственно из лизосом, интересно отметить, что, по-видимому, во все способы высвобождения вовлекается некоторый тип секреторных MVB/позднего эндосомального/лизосомального компартмента.
Поскольку катехоламины через α1-адренергический рецептор могут приводить к выходу внутриклеточного кальция и т.к. предполагают, что такой же выход кальция является причиной экзоцитоза экзосом, мультивезикулярных телец и лизосом, то современной гипотезой является то, что в периоды стресса повышение норадреналина, действующего через α1-адренергические рецепторы, приводит к выходу кальция внутри клетки и последующему высвобождению Hsp70 в экзосомах.
Биоактивное средство по настоящему изобретению
В одном из вариантов осуществления настоящее изобретение относится к модуляции ферментативной активности, где указанный фермент взаимодействует с BMP, посредством применения биоактивного средства, способного увеличивать внутриклеточную концентрацию и/или активность Hsp70.
Модуляцию ферментативной активности по настоящему изобретению можно получать посредством предоставления одного из следующих классов соединений и терапии, которые увеличивают внутриклеточную концентрацию и/или активность Hsp70:
- Hsp70 или его функциональный фрагмент или вариант
- Индукторы или коиндукторы Hsp70
▪ Низкомолекулярные лекарственные средства, такие как бимокломол и аримокломол
▪ Флюидизаторы мембраны, такие как бензиловый спирт
▪ Сублетальная тепловая терапия (≤42°C) или гипертермия
▪ Некоторые лекарственные средства из группы противовоспалительных и противоопухолевых лекарственных средств
▪ Клеточный стресс
▪ Активные формы кислорода (ROS)
▪ Адреналин, норадреналин
▪ УФ-излучение
▪ Лучевая терапия
Таким образом, биоактивное средство по настоящему изобретению является любым средством, реагентом или соединением, которое повышает внутриклеточную концентрацию и/или активность Hsp70; и включает сам HSP70 или его функциональный фрагмент или вариант и любой индуктор или коиндуктор Hsp70, известный специалисту в данной области, где указанное биоактивное средство способно модулировать активность фермента, который взаимодействует с BMP.
Отсюда следует, что биоактивное средство может повышать внутриклеточную концентрацию и/или активность Hsp70 прямо или косвенно.
В одном из вариантов осуществления биоактивное средство по настоящему изобретению является Hsp70 или его функциональным фрагментом или вариантом.
В другом варианте осуществления биоактивное средство по настоящему изобретению является индуктором или коиндуктором Hsp70.
В одном из вариантов осуществления биоактивное средство по настоящему изобретению содержит комбинацию Hsp70 или его функционального фрагмента или варианта и индуктора или коиндуктора Hsp70.
Аспектом по настоящему изобретению является предоставление биоактивного средства, способного повышать внутриклеточную концентрацию и/или активность Hsp70, для применения в качестве лекарственного средства.
Дополнительным аспектом настоящего изобретения является предоставление биоактивного средства, способного повышать внутриклеточную концентрацию и/или активность Hsp70, для применения в лечении лизосомных болезней накопления.
Дополнительным аспектом настоящего изобретения является предоставление биоактивного средства, способного повышать внутриклеточную концентрацию и/или активность Hsp70, для применения в качестве лекарственного средства или для применения в лечении лизосомных болезней накопления.
В одном из вариантов осуществления указанное лечение может являться профилактическим, излечивающим или смягчающим. В одном конкретном варианте осуществления указанное лечение является профилактическим. В другом варианте осуществления указанное лечение является излечивающим. В дополнительном варианте осуществления указанное лечение является смягчающим.
В одном из вариантов осуществления указанная лизосомная болезнь накопления выбрана из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, метахроматической лейкодистрофии, сиалидоза и дефицита сапозинов.
В конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Ниманна-Пика типа A или B. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Фарбера. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Краббе. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является метахроматической лейкодистрофией. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является сиалидозом. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Фабри. В очередном конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Гоше. В очередном конкретном варианте осуществления указанная лизосомная болезнь накопления является дефицитом сапозинов.
Также аспектом настоящего изобретения является предоставление биоактивного средства, способного повышать внутриклеточную концентрацию и/или активность Hsp70, для применения в лечении лизосомных болезней накопления, где указанные лизосомные болезни накопления являются одним, такими как двумя, например, тремя, такими как четырьмя, например, пятью, такими как шестью, например, семью нарушениями, выбранными из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, метахроматической лейкодистрофии, сиалидоза и дефицита сапозинов.
Отсюда следует, что биоактивное средство по настоящему изобретению можно использовать для лечения подгруппы лизосомных болезней накопления, выбранных из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, метахроматической лейкодистрофии, сиалидоза и дефицита сапозинов.
В одном конкретном варианте осуществления биоактивное средство по настоящему изобретению можно использовать для лечения болезни Ниманна-Пика типа A и Β и болезни Фарбера.
В одном из вариантов осуществления биоактивное средство по настоящему изобретению содержит комбинацию Hsp70 или его функционального фрагмента или варианта и вещества, которое повышает взаимодействие между Hsp70 и BMP.
Еще одним дополнительным аспектом настоящего изобретения является предоставление применения биоактивного средства, способного повышать внутриклеточную концентрацию и/или активность Hsp70, для производства лекарственного средства для лечения лизосомных болезней накопления.
Биоактивное средство - Hsp70 или его функциональный фрагмент или вариант
В одном из вариантов осуществления настоящее изобретение относится к модуляции ферментативной активности, где указанный фермент взаимодействует с BMP, посредством применения Hsp70 или его функционального фрагмента или варианта.
Аспектом настоящего изобретения является предоставление Hsp70 или его функционального фрагмента или варианта для применения в качестве лекарственного средства.
Дополнительным аспектом настоящего изобретения является предоставление Hsp70 или его функционального фрагмента или варианта для применения в лечении лизосомных болезней накопления.
Еще одним дополнительным аспектом настоящего изобретения является предоставление применения Hsp70 или его функционального фрагмента или варианта для производства лекарственного средства для лечения лизосомных болезней накопления.
В одном из вариантов осуществления указанная лизосомная болезнь накопления выбрана из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, метахроматической лейкодистрофии, сиалидоза и дефицита сапозинов.
Следует понимать, что Hsp70 или его функциональный фрагмент или вариант по настоящему изобретению может являться любым природным или синтетическим продуктом, и его можно получать любым общепринятым способом, известным специалисту в данной области.
В одном из вариантов осуществления Hsp70 или его функциональный фрагмент или вариант является полученным из природного источника. Указанный природный источник может являться любым растением, животным или бактерией, которые экспрессируют или в них можно индуцировать экспрессию Hsp70 в форме, подходящей для введения нуждающемуся в этом индивидууму.
Однако в предпочтительном варианте осуществления Hsp70 или его функциональный фрагмент или вариант получают синтетически. Отсюда следует, что Hsp70 или его функциональный фрагмент или вариант может в одном из предпочтительных вариантов осуществления являться рекомбинантным белком, таким образом, полученным общепринятым способом и обозначенным как rHsp70.
Hsp70 по настоящему изобретению, синтетический или природный, может обладать последовательностью, полученной из любых подходящих видов растений, животных или бактерий. В одном из вариантов осуществления указанный rHsp70 является полученным из млекопитающего. Указанное млекопитающее можно выбирать из группы, состоящей из человека (homo sapiens), мыши (mus musculus), коровы, собаки, крысы, хорька, свиньи, овцы и обезьяны. В другом варианте осуществления указанный rHsp70 получают из бактерий.
Hsp70 частично охарактеризован как имеющий очень высокую степень межвидовой консервативности последовательности, таким образом, возможно, позволяя Hsp70, полученному из одного вида, применяться для других видов без вызова повреждающего иммунного ответа.
В одном конкретном варианте осуществления указанный rHsp70 обладает последовательностью, полученной из Hsp70 человека.
В одном конкретном варианте осуществления указанный rHsp70 обладает последовательностью, полученной из более чем одного вида. Указанный Hsp70 или его функциональный фрагмент или вариант может, таким образом, в одном из вариантов осуществления являться химерой.
Рекомбинантный белок является белком, полученным из рекомбинантной ДНК. Рекомбинантная ДНК является формой ДНК, которая не существует в природе, которую создают комбинированием последовательностей ДНК, которые в норме не существуют совместно. В терминах генетической модификации рекомбинантную ДНК получают посредством добавления соответствующей ДНК в существующую ДНК организма, такую как плазмиды бактерий, для кодирования различных признаков для специфических целей. Это отличается от генетической рекомбинации тем, что это происходит не в результате процессов в клетке, а сконструировано человеком.
В одном из вариантов осуществления Hsp70 по настоящему изобретению обладает 100% гомологией с белком Hsp70 дикого типа. В другом варианте осуществления Hsp70 по настоящему изобретению обладает менее чем 100% гомологией с белком Hsp70 дикого типа, такой как от 99,9 до 95% гомологии, например, от 95 до 90% гомологии, такой как от 90 до 85% гомология, например, от 85 до 80% гомологии, такой как от 80 до 75% гомология, например, от 75 до 60% гомологии с белком дикого типа. Независимо от степени гомологии любой вариант Hsp70, сохраняющий его способность модулировать ферментативную активность фермента, который связывается с BMP, находится в объеме данного изобретения.
В одном из вариантов осуществления биоактивное средство является Hsp70. В одном из вариантов осуществления указанный Hsp70 является полноразмерным Hsp70.
Также вариантом осуществления является предоставление функционального фрагмента или варианта Hsp70. Как определено в настоящем документе, функциональный фрагмент или вариант является любым фрагментом Hsp70, обладающим желаемой функцией, которая в терминах по настоящему изобретению является способностью модулировать ферментативную активность фермента, где указанный фермент взаимодействует с BMP.
В одном из вариантов осуществления биоактивное средство является функциональным фрагментом или вариантом Hsp70.
В одном из вариантов осуществления биоактивное средство является функциональным фрагментом или вариантом Hsp70, в котором Hsp70 модифицируют посредством делеции (делеций), добавления (добавлений) или замены (замен) Hsp70 дикого типа.
Белок Hsp70 дикого типа обладает общей длиной 641 аминокислота. Подразумевается, что фрагмент Hsp70 в одном из вариантов осуществления содержит любой фрагмент с общей длиной менее, чем белок дикого типа в 641 аминокислоту, такой как менее чем 625 аминокислот, например, менее чем 600 аминокислот, такой как менее чем 575 аминокислот, например, менее чем 550 аминокислот, такой как менее чем 525 аминокислот, например, менее чем 500 аминокислот, такой как менее чем 475 аминокислот, например, менее чем 450 аминокислот, такой как менее чем 425 аминокислот, например, менее чем 400 аминокислот, такой как менее чем 375 аминокислот, например, менее чем 350 аминокислот, такой как менее чем 325 аминокислот, например, менее чем 300 аминокислот, такой как менее чем 275 аминокислот, например, менее чем 250 аминокислот, такой как менее чем 225 аминокислот, например, менее чем 200 аминокислот, такой как менее чем 175 аминокислот, например, менее чем 150 аминокислот, такой как менее чем 125 аминокислот, например, менее чем 100 аминокислот, такой как менее чем 75 аминокислот, например, менее чем 50 аминокислот, такой как менее чем 25 аминокислот.
Белок Hsp70 дикого типа обладает общей длиной 641 аминокислота. Подразумевается, что фрагмент Hsp70 в одном из вариантов осуществления содержит любой фрагмент с общей длиной более чем 10 аминокислот, такой как более чем 25 аминокислот, например, более чем 50 аминокислот, такой как более чем 75 аминокислот, например, более чем 100 аминокислот, такой как более чем 125 аминокислот, например, более чем 150 аминокислот, такой как более чем 175 аминокислот, например, более чем 200 аминокислот, такой как более чем 225 аминокислот, например, более чем 250 аминокислот, такой как более чем 275 аминокислот, например, более чем 300 аминокислот, такой как более чем 325 аминокислот, например, более чем 350 аминокислот, такой как более чем 375 аминокислот, например, более чем 400 аминокислот, такой как более чем 425 аминокислот, например, более чем 450 аминокислот, такой как более чем 475 аминокислот, например, более чем 500 аминокислот, такой как более чем 525 аминокислот, например, более чем 550 аминокислот, такой как более чем 575 аминокислот, например, более чем 600 аминокислот, такой как более чем 625 аминокислот.
Отсюда следует, что общая длина фрагмента Hsp70 по настоящему изобретению может в одном из вариантов осуществления находиться в диапазоне от 5 до 25 аминокислот, таком как от 25 до 50 аминокислот, например, от 50 до 75 аминокислот, таком как от 75 до 100 аминокислот, например, от 100 до 125 аминокислот, таком как от 125 до 150 аминокислот, например, от 150 до 175 аминокислот, таком как от 175 до 200 аминокислот, например, от 200 до 225 аминокислот, таком как от 225 до 250 аминокислот, например, от 250 до 275 аминокислот, таком как от 275 до 300 аминокислот, например, от 300 до 325 аминокислот, таком как от 325 до 350 аминокислот, например, от 350 до 375 аминокислот, таком как от 375 до 400 аминокислот, например, от 400 до 425 аминокислот, таком как от 425 до 450 аминокислот, например, от 450 до 475 аминокислот, таком как от 475 до 500 аминокислот, например, от 500 до 525 аминокислот, таком как от 525 до 550 аминокислот, например, от 550 до 575 аминокислот, таком как от 575 до 600 аминокислот, например, от 600 до 625 аминокислот, таком как от 625 до 640 аминокислот.
В одном конкретном варианте осуществления фрагмент или вариант Hsp70 содержит весь или часть АТФазного домена Hsp70. Отсюда следует, что фрагмент или вариант Hsp70 по настоящему изобретению в одном из вариантов осуществления содержит все или часть аминокислот в положении от 30 до 382.
В другом конкретном варианте осуществления фрагмент или вариант Hsp70 содержит триптофан в положении 90 аминокислот АТФазного домена Hsp70.
Фрагмент Hsp70 может являться усеченной версией белка дикого типа, что означает, что он является его более короткой версией. Фрагмент может являться усеченным посредством укорачивания белка с аминоконца и карбоксильного конца, или он может являться усеченным посредством делеции одной или нескольких внутренних областей белка любого размера.
Фрагмент или вариант Hsp70 может в одном из вариантов осуществления обладать 100% гомологией с белком дикого типа. В другом варианте осуществления фрагмент или вариант Hsp70 также может являться вариантом Hsp70, который обладает менее чем 100% гомологией с белком дикого типа, такой как от 99,9 до 95% гомологией, например, от 95 до 90% гомологией, такой как от 90 до 85% гомологией, например, от 85 до 80% гомологией, такой как от 80 до 75% гомологией, например, от 75 до 60% гомологией с белком дикого типа.
Следует понимать, что любой фрагмент или вариант Hsp70, который сохраняет его способность модулировать активность лизосомального фермента, находится в объеме данного изобретения.
Следует понимать, что любой фрагмент или вариант Hsp70, который сохраняет его способность взаимодействовать с BMP, находится в объеме данного изобретения.
Следует понимать, что конкретный количественный эффект функционального фрагмента или варианта может отличаться от эффекта полноразмерной молекулы. В некоторых случаях функциональный фрагмент или вариант в действительности может являться более эффективным, чем полноразмерная молекула. Кроме того, применение фрагментов вместо полноразмерных молекул может иметь преимущество из-за меньшего размера фрагментов.
В одном из вариантов осуществления функциональный фрагмент или вариант Hsp70 может являться вариантом Hsp70, в котором одну или несколько аминокислот заменяют. Указанная замена (замены) может являться эквивалентной или консервативной заменой (заменами), или неэквивалентной или неконсервативной заменой (заменами).
В одном из вариантов осуществления заменяли от 0,1 до 1% аминокислотных остатков Hsp70 дикого типа, такой как от 1 до 2% аминокислотных остатков, например, от 2 до 3% аминокислотных остатков, такой как от 3 до 4% аминокислотных остатков, например, от 4 до 5% аминокислотных остатков, такой как от 5 до 10% аминокислотных остатков, например, от 10 до 15% аминокислотных остатков, такой как от 15 до 20% аминокислотных остатков, например, от 20 до 30% аминокислотных остатков, такой как от 30 до 40% аминокислотных остатков, например, от 40 до 50% аминокислотных остатков, такой как от 50 до 60% аминокислотных остатков, например, от 60 до 70% аминокислотных остатков, такой как от 70 до 80% аминокислотных остатков, например, от 80 до 90% аминокислотных остатков, такой как от 90 до 100% аминокислотных остатков.
В одном из вариантов осуществления заменяли от 1 до 5 аминокислотных остатков Hsp70 дикого типа, такой как от 5 до 10 аминокислотных остатков, например, от 10 до 15 аминокислотных остатков, такой как от 15 до 20 аминокислотных остатков, например, от 20 до 30 аминокислотных остатков, такой как от 30 до 40 аминокислотных остатков, например, от 40 до 50 аминокислотных остатков, такой как от 50 до 75 аминокислотных остатков, например, от 75 до 100 аминокислотных остатков, такой как от 100 до 150 аминокислотных остатков, например, от 150 до 200 аминокислотных остатков, такой как от 200 до 300 аминокислотных остатков, например, от 300 до 400 аминокислотных остатков, такой как от 400 до 500 аминокислотные остатки.
В одном из вариантов осуществления функциональный фрагмент или вариант Hsp70 является слитым белком. В одном из вариантов осуществления указанный функциональный фрагмент или вариант Hsp70 слит с меткой.
Преимущества применения Hsp70 или его функционального фрагмента или варианта
Как описано выше в настоящем документе, не существует излечения от лизосомных болезней накопления, и лечение в основном является симптоматическим, за исключением проведения заместительной терапии ферментом (ERT) для болезни Гоше и болезни Фабри. Как указано, ERT является очень дорогим видом терапии, который эффективен только для одного заболевания.
Как известно авторам, до сих пор не предпринималось удачных попыток предоставления ERT для остальных лизосомных болезней накопления, ассоциированных с накоплением липидов, таким образом, в настоящее время остается большая неудовлетворенная потребность в обеспечении эффективного и специфического способа лечения данных LSD.
Введение нуждающемуся в этом индивидууму Hsp70 или его функционального фрагмента или варианта обладает рядом преимуществ по сравнению с общепринятыми способами лечения лизосомных болезней накопления.
Во-первых, получение рекомбинантного белка, такого как rHsp70 или его функционального фрагмента или варианта, с применением современных технологий является простым и прямым способом получения существенного количества rHsp70 или его функционального фрагмента или варианта. Общепринятые способы получения рекомбинантных ферментов хорошо известны специалисту в данной области.
Кроме того, получение рекомбинантного белка, такого как rHsp70, его функционального фрагмента или варианта, является дешевым способом получения существенного количества rHsp70 или его функционального фрагмента или варианта. По сравнению с получением ферментов для ERT стоимость значительно снижается.
Кроме того, применение Hsp70 или его функционального фрагмента или варианта можно использовать для лечения более чем одной специфической лизосомной болезни накопления. Это также применимо для индукторов и коиндукторов Hsp70 по настоящему изобретению. В действительности биоактивное средство, способное повышать внутриклеточную концентрацию и/или активность Hsp70, можно использовать для лечения любой лизосомной болезни накопления, которую можно реверсировать посредством модуляции ферментативной активности вовлеченного дефектного фермента, где указанный фермент взаимодействует с BMP.
В конечном итоге, т.к. Hsp70 является присутствующей эндогенно молекулой, т.е. молекулой, которая берет начало из организма, ткани или клетки, ожидается, что введение Hsp70 или его функционального фрагмента или варианта не вызывает или вызывает очень низкий иммунный ответ. Это является главным преимуществом, т.к. облегчает лечение и снижает потенциальные побочные эффекты при введении индивидууму.
Эктопическая экспрессия Hsp70
В одном из вариантов осуществления Hsp70 или его функциональный фрагмент или вариант может экспрессироваться посредством вектора. Таким образом, в одном из вариантов осуществления изобретение относится к вектору, кодирующему Hsp70 или его функциональный фрагмент или вариант.
В одном из вариантов осуществления настоящего изобретения Hsp70 или его функциональный фрагмент или вариант можно вводить нуждающемуся в этом индивидууму в виде вектора.
Вектор, применяемый для экспрессирования Hsp70 или его функционального фрагмента или варианта, можно выбирать из группы, состоящей из вирусных векторов (ретровирусных и аденовирусных) или невирусных векторов (плазмид, космид, бактериофагов).
В одном из вариантов осуществления указанный вектор содержит один или более участков начала репликации, маркер селекции и один или более участков распознавания эндонуклеазами рестрикции. В другом варианте осуществления указанный вектор является функционально связанным с регуляторными последовательностями, контролирующими транскрипцию указанного Hsp70 или его функционального фрагмента или варианта в подходящей клетке-хозяине.
В одном из вариантов осуществления настоящее изобретение относится к способу получения Hsp70 или его функционального фрагмента или варианта, как описано в настоящем документе; указанному способу, включающему этапы предоставления вектора, кодирующего указанный Hsp70 или его функциональный фрагмент или вариант, и экспрессирования указанного вектора in vitro или in vivo в подходящем организме-хозяине, и, таким образом, получение Hsp70 или его функционального фрагмента или варианта.
Изобретение дополнительно относится к выделенной рекомбинантной или трансгенной клетке-хозяину, содержащей вектор, кодирующий Hsp70 или его функциональный фрагмент или вариант по настоящему изобретению.
Изобретение также относится к способу получения рекомбинантной или трансгенной клетки-хозяина, включающему этапы предоставления вектора, кодирующего Hsp70 или его функциональный фрагмент или вариант, введения указанного вектора в указанную рекомбинантную или трансгенную клетку-хозяина и также, необязательно, экспрессирования указанного вектора в указанной рекомбинантной или трансгенной клетке-хозяине с получением, таким образом, рекомбинантной или трансгенной клетки-хозяина, продуцирующей указанный Hsp70 или его функциональный фрагмент или вариант.
В другом варианте осуществления настоящее изобретение относится к трансгенному организму млекопитающего, содержащему описанную выше клетку-хозяина.
В дополнительном варианте осуществления трансгенный организм млекопитающего, содержащий рекомбинантную или трансгенную клетку-хозяина по настоящему изобретению, не является принадлежащим человеку.
Трансгенную клетку-хозяина можно выбирать из группы, состоящей из клетки-хозяина млекопитающего, растения, бактерии, дрожжей или грибов.
Для улучшения доставки ДНК в клетку необходимо защищать ДНК от повреждения и облегчать ее вход в клетку. Создавали липоплекс и полиплекс, обладающие способностью защищать ДНК от нежелательной деградации в течение процесса трансфекции. Плазмидную ДНК можно покрывать липидами в организованной структуре, схожей с мицеллой или липосомой. Когда организованная структура образует комплекс с ДНК, это называется липоплекс. Для формирования липосомы можно применять три типа липидов: анионные (отрицательно заряженные), нейтральные или катионные (положительно заряженные). Комплексы полимеров с ДНК называют полиплексами. Большинство полиплексов состоит из катионных полимеров, и их получение регулируется посредством ионных взаимодействий.
В одном из вариантов осуществления вектор, содержащий Hsp70 или его функциональный фрагмент или вариант, можно применять для генной терапии. Генная терапия представляет собой введение гена в клетки и ткани индивидуума для лечения заболевания, такого как наследственное заболевание, при котором удаленный мутантный аллель заменяют функциональным.
В другом варианте осуществления Hsp70 или его функциональный фрагмент или вариант можно вводить как непокрытую ДНК. Это является простейшей формой невирусной трансфекции. Доставку непокрытой ДНК можно проводить посредством электропорации, сонопорации или применением "генной пушки", которая выстреливает покрытой частицами золота ДНК в клетку с помощью газа под высоким давлением.
Биоактивное средство - индукторы и коиндукторы Hsp70
В одном из вариантов осуществления настоящее изобретение относится к модуляции ферментативной активности, где указанный фермент взаимодействует с BMP посредством применения индукторов или коиндукторов Hsp70.
Индуктором Hsp70 является соединение, которое само может усиливать экспрессию гена Hsp70 и экспрессию белка без сопутствующего стресса.
Коиндуктором Hsp70 является соединение, которое не может усиливать экспрессию гена Hsp70 и экспрессию белка без сопутствующего (умеренного) стресса, но стресс-индуцируемое повышение уровней Hsp70 является, кроме того, увеличенным или повышенным их присутствием.
Аспектом по настоящему изобретению является предоставление индуктора или коиндуктора Hsp70 для применения в качестве лекарственного средства.
Дополнительным аспектом настоящего изобретения является предоставление индуктора или коиндуктора Hsp70 для применения в лечении лизосомных болезней накопления.
Еще одним дополнительным аспектом настоящего изобретения является предоставление применения индуктора или коиндуктора Hsp70 для производства лекарственного средства для лечения лизосомных болезней накопления.
В одном из вариантов осуществления указанная лизосомная болезнь накопления выбрана из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, метахроматической лейкодистрофии, сиалидоза и дефицита сапозинов.
В конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Ниманна-Пика типа A или B. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Фарбера. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Краббе. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является метахроматической лейкодистрофией. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является сиалидозом. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Фабри. В еще одном конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Гоше. В еще одном конкретном варианте осуществления указанная лизосомная болезнь накопления является дефицитом сапозина.
В одном из вариантов осуществления биоактивное средство по настоящему изобретению является индуктором или коиндуктором Hsp70. В конкретном варианте осуществления биоактивное средство по настоящему изобретению является индуктором Hsp70. В другом конкретном варианте осуществления биоактивное средство по настоящему изобретению является коиндуктором Hsp70.
Низкомолекулярные лекарственные средства - производные гидроксиламина
В одном из вариантов осуществления биоактивное средство по настоящему изобретению является коиндуктором Hsp70. В дополнительном варианте осуществления указанный коиндуктор Hsp70 является низкомолекулярным лекарственным средством.
В конкретном варианте осуществления коиндуктор Hsp70 по настоящему изобретению является производным гидроксиламина. Указанное производное гидроксиламина в дополнительном варианте осуществления выбирают из группы бимокломола (BRLP-42), аримокломола (BRX-220), BRX-345 и BGP-15.
В конкретном варианте осуществления указанное производное гидроксиламина является аримокломолом (BRX-220).
Бимокломол ([2-гидрокси-3-(1-пиперидинил)пропокси]-3-пиридин-карбоксимидоил-хлорид малеат) является нетоксичным соединением, которое первоначально разрабатывали для лечения осложнений диабета, таких как нейропатии. Показано, что бимокломол улучшает выживание клеток в экспериментальных условиях стресса, частично посредством повышения внутриклеточных белков теплового шока (HSP), включая Hsp70, через активацию HSF-1. Показано, что бимокломол обладает способностью коиндукции Hsp70 в отсутствие несвернутых белков и что бимокломол взаимодействует и повышает текучесть отрицательно заряженных мембранных липидов. BRX-345 является структурным аналогом бимокломола с, до некоторой степени, меньшей способностью индуцировать HSP.
Аримокломол (BRX-220) является аналогом бимокломола, который также взаимодействует и усиливает ответ на тепловой шок. В настоящее время аримокломол проходит клинические испытания для лечения ALS (бокового амиотрофического склероза); прогрессирующего нейродегенеративного нарушения. Аримокломол является объектом собственности CytRx Corporation.
Таким образом, аспектом настоящего изобретения является предоставление коиндуктора Hsp70 производного гидроксиламина для применения в лечении лизосомных болезней накопления.
Еще одним дополнительным аспектом настоящего изобретения является предоставление применения коиндуктора Hsp70 производного гидроксиламина для производства лекарственного средства для лечения лизосомных болезней накопления.
В одном из вариантов осуществления указанная лизосомная болезнь накопления выбрана из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, метахроматической лейкодистрофии, сиалидоза и дефицита сапозинов.
Мембранные флюидизаторы
В одном из вариантов осуществления биоактивное средство по настоящему изобретению является индуктором Hsp70. В дополнительном варианте осуществления указанный индуктор Hsp70 является мембранным флюидизатором.
Лечение мембранным флюидизатором также можно обозначать как липидную терапию.
В конкретном варианте осуществления индуктор Hsp70 по настоящему изобретению является мембранным флюидизатором, выбранным из группы бензилового спирта, гептанола, AL721, докозагексаеновой кислоты, алифатических спиртов, олеилового спирта, диметиламиноэтанола, A2C, фарнезола и анестетиков, таких как лидокаин, ропивакаин, бупивакаин и мепивакаин, а также других известных специалисту в данной области.
Помимо денатурации части белков клетки в течение теплового шока (протеотоксичность) также предполагается, что изменение текучести мембран является клеточным термодатчиком, который инициирует ответ на тепловой шок и индуцирует HSP. В действительности, химически индуцированные перестройки мембраны, аналогичные индуцированному теплом разжижению цитоплазматической мембраны, способны активировать HSP, не вызывая денатурацию белка.
Текучесть мембраны относится к вязкости липидного бислоя клеточной мембраны. Мембранные фосфолипиды объединяют жирные кислоты различной длины и насыщения.
Мембранные флюидизаторы действуют посредством включения между мембранными липидами, таким образом индуцируя эффект разупорядочивания посредством ослабления ван-дер-ваальсовых взаимодействий между ацильными цепями липидов.
Таким образом, аспектом настоящего изобретения является предоставление мембранного флюидизатора, выбранного из группы бензилового спирта, гептанола, AL721, докозагексаеновой кислоты, алифатических спиртов, олеилового спирта, диметиламиноэтанола, A2C, фарнезола и анестетиков, таких как лидокаин, ропивакаин, бупивакаин и мепивакаин, а также других известных специалисту в данной области, для применения в лечении лизосомных болезней накопления.
Еще одним дополнительным аспектом настоящего изобретения является применение мембранного флюидизатора, выбранного из группы бензилового спирта, гептанола, AL721, докозагексаеновой кислоты, алифатических спиртов, олеилового спирта, диметиламиноэтанола, A2C, фарнезола и анестетиков, таких как лидокаин, ропивакаин, бупивакаин и мепивакаин, а также других известных специалисту в данной области, для производства лекарственного средства для лечения лизосомных болезней накопления.
В одном из вариантов осуществления указанная лизосомная болезнь накопления выбрана из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, метахроматической лейкодистрофии, сиалидоза и дефицита сапозинов.
Другие способы индукции Hsp70
Предусмотрено, что любые способы индукции экспрессии Hsp70 включены в объем настоящего изобретения, некоторые из них описаны ниже в настоящем документе.
Повышенная температура индивидуума является потенциальным индуктором HSP, включая Hsp70, и такая сублетальная тепловая терапия является аспектом настоящего изобретения. В одном из вариантов осуществления сублетальная тепловая терапия включает повышенную температуру индивидуума до внутренней температуры приблизительно 38°C, такой как приблизительно 39°C, например, приблизительно 40°C, такой как приблизительно 41°C, например, приблизительно 42°C, такой как приблизительно 43°C.
Таким образом, аспектом настоящего изобретения является предоставление сублетальной тепловой терапии для применения в лечении лизосомных болезней накопления.
Психологический стресс, такой как боязнь хищника и электрошок, может вызывать стресс-индуцируемое высвобождение eHsp70, процесс, предположительно зависящий от катехоламиновой передачи сигнала. Кроме того, адреналин и норадреналин могут вызывать высвобождение Hsp70.
Показано, что следующие соединения индуцируют (или коиндуцируют) HSP, включая Hsp70: мембрано-взаимодействующее соединение алкиллизофосфолипид эдельфозин (ET-18-OCH3 или 1-октадецил-2-метил-рац-глицеро-3-фосфохолин); противовоспалительные лекарственные средства, включая ингибиторы циклооксигеназы 1/2, такие как целекоксиб и рофекоксиб, а также NSAID, такие как ацетилсалициловая кислота, салицилат натрия и индометацин; простагландины PGA1, PGj2 и 2-циклопентен-1-он; агонисты гамма-рецепторов, активируемых пролифератором пероксисом; взаимодействующие с тубулином противораковые средства, включая винкристин и паклитаксел; сенсибилизатор инсулина пиоглитазон; противоопухолевые средства, такие как карбоплатин, доксорубицин, флударабин, ифосфамид и цитарабин; ингибиторы Hsp90 гелданамицин, 17-AAG, 17-DMAG, радицикол, гербимицин-A и арахидоновая кислота; ингибиторы протеосом MG132 и лактацистин; ингибиторы сериновых протеаз DCIC, TLCK и TPCK; противоязвенные лекарственные средства геранилгеранилацетон (GGA), ребамипид, карбеноксолон и полапрецинк (цинк L-карнозин); тяжелые металлы (цинк и олово); противовоспалительное лекарственное средство дексаметазон; кокаин; никотин; спирт; агонисты альфа-адренорецепторов; циклопентеноновые простаноиды; а также растительные лекарственные средства пеонифлорин, глицирризин, целастрол, дигидроцеластрол, дигидроцеластрол диацетат и куркумин.
Таким образом, аспектом настоящего изобретения является предоставление соединения, выбранного из группы эдельфозин (ET-18-OCH3 или 1-октадецил-2-метил-рац-глицеро-3-фосфохолин), целекоксиб, рофекоксиб, ацетилсалициловая кислота, салицилат натрия, индометацин, PGA1, PGj2, 2-циклопентен-1-он, агонисты гамма-рецепторов, активируемых пролифератором пероксисом, винкристин, паклитаксел, пиоглитазон, карбоплатин, доксорубицин, флударабин, ифосфамид, цитарабин, гелданамицин, 17-AAG, 17-DMAG, радицикол, гербимицин-A, арахидоновая кислота, MG132, лактацистин, DCIC, TLCK, TPCK, геранилгеранилацетон (GGA), ребамипид, карбеноксолон, полапрецинк (цинк L-карнозин), дексаметазон, кокаин, никотин, спирт, агонисты альфа-адренорецепторов, циклопентеноновые простаноиды, пеонифлорин, глицирризин, целастрол, дигидроцеластрол, дигидроцеластрол диацетат и куркумин, а также другие индукторы HSP, известные специалисту в данной области, для применения в лечении лизосомных болезней накопления.
Фармацевтическая композиция по настоящему изобретению
Настоящее изобретение относится к модуляции ферментативной активности, где указанный фермент взаимодействует с BMP, посредством применения биоактивного средства, способного повышать концентрацию и/или активность Hsp70, таким образом принося пользу пациентам, страдающим от лизосомных болезней накопления.
Поскольку можно вводить биоактивное средство по настоящему изобретению как неочищенный реагент, предпочтительно предоставлять его в виде фармацевтического состава. Таким образом, настоящее изобретение дополнительно относится к фармацевтической композиции для медицинского применения, которая содержит биоактивное средство по настоящему изобретению или его фармацевтически приемлемые соли, как описано в настоящем документе, и фармацевтически приемлемый носитель.
Аспектом настоящего изобретения является предоставление композиции, такой как фармацевтическая композиция, содержащей биоактивное средство, указанное в настоящем документе, которое можно вводить нуждающемуся в этом индивидууму.
В одном из вариантов осуществления изобретение относится к композиции, содержащей биоактивное средство по настоящему изобретению. Композицию, как описано в настоящем документе, в одном из вариантов осуществления можно составлять в сочетании с физиологически приемлемым носителем. Композицию, как описано в настоящем документе, в одном из вариантов осуществления можно составлять в сочетании с фармацевтически приемлемым носителем.
Фармацевтические композиции, содержащие биоактивное средство по настоящему изобретению, можно получать общепринятыми способами, например, как описано в Remington: The Science и Practice of Pharmacy 1995, edited by E.W. Martin, Mack Publishing Company, 19th edition, Easton, Pa.
Биоактивные средства по настоящему изобретению можно составлять для парентерального введения и можно представлять в виде однократной дозы в ампулах, предварительно набранных шприцах, вливаниях небольшого объема или в упаковках лекарственных средств для многократного приема с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных наполнителях, носители, разбавители или растворители, включая водные растворы минеральных солей или других водорастворимых молекул, пропиленгликоль, полиэтиленгликоль, растительные масла, животные масла, синтетические масла, инъецируемые органические сложные эфиры, и могут содержать вспомогательные вещества, такие как консервирующие, увлажняющие, эмульгирующие или суспендирующие, стабилизирующие и/или диспергирующие средства, красители, буферы, загустители, солюбилизаторы и т.п. Альтернативно активный ингредиент может представлять собой порошок, полученным асептическим выделением из твердого тела или лиофилизацией из раствора для составления перед применением с подходящим средством, например, стерильной, апирогенной водой.
Фармацевтически приемлемые соли биоактивных средств, если их можно получать, также входят в объем настоящего изобретения в качестве специфических гидратных формах соли. Данные соли являются такими, которые являются приемлемыми в области фармацевтического применения. Тем самым, это означает, что соль сохраняет биологическую активность исходного соединения, и соль не обладает неблагоприятными или вредными эффектами при применении и использовании в лечении заболеваний.
Фармацевтически приемлемые соли получают общепринятым способом. Если исходное соединение является основанием, его обрабатывают избытком органической или неорганической кислоты в подходящем растворителе. Если исходное соединение является кислотой, его обрабатывают неорганическим или органическим основанием в подходящем растворителе.
Можно применять любой подходящий состав биоактивного средства по настоящему изобретению, известный специалисту в данной области.
В одном из вариантов осуществления Hsp70 или его функциональный фрагмент, или вариант составляют в биодеградируемой микросфере, такой как липосома.
Введение
Можно применять любой подходящий способ введения для предоставления млекопитающему, предпочтительно человеку, эффективного количества биоактивного средства по настоящему изобретению, где указанное биоактивное средство может являться Hsp70 или его функциональным фрагментом, или вариантом.
Введение нуждающемуся в этом индивидууму биоактивных средств или фармацевтических композиций может происходить через три главных пути доставки: 1) местный (нанесение на поверхности тела, такие как кожа или слизистые оболочки); 2) энтеральный (через желудочно-кишечный или пищеварительный тракт) и 3) парентеральный (иными путями, чем желудочно-кишечный или пищеварительный тракт).
Местное введение включает накожное (нанесение на кожу), ингаляционное, клизму, глазные капли (на конъюнктиву), ушные капли, интраназальный путь и вагинальное введение.
Энтеральное введение является любой формой введения, которая вовлекает любую часть желудочно-кишечного тракта и включает пероральное введение (через рот, например, таблетки, капсулы или капли), внутриректальное (например, суппозитории или клизма) введение, помимо желудочного или дуоденального зонда для кормления.
Парентеральная доставка, такая как инъекция или вливание, является эффективной для доставки биоактивного средства к мишени или введения лекарственного средства в кровоток и включает внутривенное (в вену), внутриартериальное (в артерию), внутримышечное (в мышцу), внутрисердечное (в сердце), подкожное (под кожу), внутрикостное (в костный мозг), внутрикожное (в саму кожу), интратекальное или интраспинальное (в спинномозговой канал), интраперитонеальное (в брюшную полость), трансдермальное (диффузия через интактную кожу), трансмукозальное (диффузия через слизистую оболочку, например, инсуффляция (вдыхание), сублингвальное, буккальное и вагинальные суппозитории), ингаляционное, эпидуральное (в эпидуральное пространство) и введение в стекловидное тело (в глаз). Сублингвальное введение (под язык) также является формой парентерального введения, посредством чего биоактивные средства диффундируют в кровоток через ткань слизистой оболочки под языком. Биоактивное средство по настоящему изобретению можно вводить любым парентеральным путем доставки и, предпочтительно, любым из указанных выше.
Парентеральная доставка обладает преимуществом, позволяя избегать деградации в желудочно-кишечном тракте, связанной с энтеральной доставкой.
Парентеральная доставка обладает дополнительным преимуществом, позволяя избегать пресистемного метаболизма, связанного с энтеральной доставкой, т.к. позволяет соединениям абсорбироваться непосредственно в системном кровотоке.
Пресистемный метаболизм представляет собой явление метаболизма лекарственного средства, в результате которого концентрация лекарственного средства значительно снижается до достижения им системного кровотока. Это является частью лекарственного средства, потерянного в процессе абсорбции, которая, как правило, относится к печени и стенке кишечника.
После проглатывания лекарственного средства оно абсорбируется пищеварительной системой и входит в портальную систему печени, проходит через воротную вену в печень до того, как достигнет остального тела. Печень метаболизирует многие лекарственные средства, иногда до такой степени, что только небольшое количество активного лекарственного средства выходит из печени в остальную систему кровообращения. Таким образом, данное первое прохождение через печень значительно снижает биодоступность лекарственного средства.
Четырьмя первичными системами, которые влияют на эффект первого прохождения лекарственного средства, являются ферменты просвета желудочно-кишечного тракта, ферменты стенки кишечника, бактериальные ферменты и печеночные ферменты.
Подходящие лекарственные формы для такого введения можно получать общепринятыми способами. Подходящие лекарственные формы для введения посредством ингаляции, такие как аэрозольный состав или дозирующий ингалятор, можно получать общепринятыми способами.
В одном из вариантов осуществления конкретный способ введения биоактивного средства по настоящему изобретению является парентеральным введением.
В одном из вариантов осуществления конкретный способ парентерального введения биоактивного средства по настоящему изобретению является внутривенной, подкожной, внутримышечной, внутриартериальной, подкожной или интраперитонеальной инъекцией.
В одном из вариантов осуществления конкретный способ парентерального введения биоактивного средства по настоящему изобретению является ингаляцией.
В одном из вариантов осуществления конкретный способ парентерального введения биоактивного средства по настоящему изобретению является внутривенным вливанием.
Внутривенное вливание по настоящему изобретению в одном из вариантов осуществления может происходить в течение периода времени от 10 минут до 20 минут, такого как от 20 до 30 минут, например, от 30 до 40 минут, такого как от 40 до 50 минут, например, от 50 до 60 минут, такого как от 60 до 90 минут, например, от 90 до 120 минут, такого как от 2 часов до 3 часов, например, от 3 до 4 часов, такого как от 4 до 5 часов, например, от 5 до 6 часов, такого как от 6 до 7 часов, например, от 7 до 8 часов.
В конкретном варианте осуществления способ парентерального введения биоактивного средства по настоящему изобретению является трансмукозальной доставкой. Указанная трансмукозальная доставка является в одном из вариантов осуществления сублингвальной доставкой, в другом варианте осуществления указанная трансмукозальная доставка является буккальной доставкой и в еще одном варианте осуществления указанная трансмукозальная доставка является инсуффляцией или интраназальной доставкой.
Лекарственные формы включают таблетки, пастилки, коллоидные растворы, суспензии, растворы, капсулы, кремы, мази, эмульсии, гели, лосьоны, пасты, аэрозоли или другие формы, известные в данной области.
Эффективная доза применяемого активного ингредиента может варьировать в зависимости от конкретной применяемой композиции, способа введения, подвергнутого лечению состояния и тяжести подвергнутого лечению состояния. Такую дозу легко может установить специалист в данной области.
В одном из вариантов осуществления биоактивное средство по настоящему изобретению вводят в виде суточной дозы приблизительно от 1 микрограмма до приблизительно 100 миллиграмов на килограмм массы тела животного, давая как однократную суточную дозу или как разделенную общую дозу, или в форме замедленного высвобождения. Режим дозирования можно устанавливать в этом диапазоне или даже вне этого диапазона для обеспечения оптимального терапевтического ответа.
В одном из вариантов осуществления биоактивное средство по настоящему изобретению вводят в дозе приблизительно от 1 мкг до приблизительно 10 мкг на кг массы тела, такой как приблизительно от 10 мкг до приблизительно 50 мкг на кг массы тела, например, приблизительно от 50 мкг до приблизительно 100 мкг на кг массы тела, такой как приблизительно от 100 мкг до приблизительно 250 мкг на кг массы тела, например, приблизительно от 250 мкг до приблизительно 500 мкг на кг массы тела, такой как приблизительно от 500 мкг до приблизительно 750 мкг на кг массы тела, например, приблизительно от 750 мкг до приблизительно 1000 мкг на кг массы тела, такой как приблизительно от 1 мг до приблизительно 10 мг на кг массы тела, например, приблизительно от 10 мг до приблизительно 50 мг на кг массы тела, такой как приблизительно от 50 мг до приблизительно 100 мг на кг массы тела.
Указанную дозу можно вводить через определенные временные интервалы и можно выражать в мг на кг массы тела на единицу времени. Указанная единица времени в одном из вариантов осуществления может являться минутой, такой как в час, например, в сутки, такой как в неделю.
Комбинированное лечение
Аспектом настоящего изобретения является предоставление биоактивного средства, способного повышать внутриклеточную концентрацию и/или активность Hsp70, для применения в лечении лизосомных болезней накопления в сочетании с другими способами лечения.
В одном из аспектов настоящее изобретение относится к способу лечения лизосомной болезни накопления, включающему введение биоактивного средства по настоящему изобретению в сочетании с, по меньшей мере, одним другим способом лечения.
Таким образом, в одном из вариантов осуществления биоактивное средство по настоящему изобретению вводят нуждающемуся в этом индивидууму в сочетании с, по меньшей мере, одним другим способом лечения, таким как общепринятые или известные способы лечения LSD.
Следует понимать, что биоактивное средство по настоящему изобретению является Hsp70 или его функциональным фрагментом, или вариантом, или индуктором или коиндуктором Hsp70.
Применение более чем одного способа лечения в комбинации может происходить одновременно или последовательно. Одновременное введение может содержать два соединения в одной и той же композиции или содержать в различных композициях, или может являться одной композицией и одним способом лечения, по существу проводимым в одно и то же время. Последовательное введение означает, что применяют больше одного способа лечения в разные моменты времени, такие как применение одного способа лечения первым и затем применение второго способа лечения. Для достижения оптимального эффекта специалист в данной области может определять интервал времени для применения более чем одного способа лечения, и он может в одном из вариантов осуществления составлять от 30 минут до 72 часов.
Способы лечения в виде химических соединений можно применять совместно или раздельно, каждый в своей наиболее эффективной дозе. Введение более чем одного соединения может обладать синергическим действием, таким образом эффективно снижая необходимую дозу лекарственного средства.
В одном из вариантов осуществления биоактивное средство по настоящему изобретению вводят нуждающемуся в этом индивидууму в сочетании с заместительной терапией ферментом (ERT). Указанную ERT в одном из вариантов осуществления можно выбирать из группы, состоящей из церезима (Cerezyme®) (имиглюцераза для инъекций), миглустата, фабразима (Fabrazyme®) (агалсидаза бета) и реплагала (агалсидаза альфа).
В одном из вариантов осуществления биоактивное средство по настоящему изобретению вводят индивидууму с болезнью Гоше в сочетании с церезимом (Cerezyme®) (имиглюцераза для инъекций) или миглустатом.
В другом варианте осуществления биоактивное средство по настоящему изобретению вводят индивидууму с болезнью Фабри в сочетании с фабразимом (Fabrazyme®) (агалсидаза бета) или реплагалом (агалсидаза альфа).
В другом варианте осуществления биоактивное средство по настоящему изобретению вводят нуждающемуся в этом индивидууму в сочетании с болеутоляющими средствами.
В еще одном варианте осуществления биоактивное средство по настоящему изобретению вводят нуждающемуся в этом индивидууму в сочетании с кортикостероидами.
Биоактивное средство по настоящему изобретению в одном из вариантов осуществления можно вводить нуждающемуся в этом индивидууму в сочетании с трансплантацией, такой как трансплантация костного мозга, трансплантация пуповинной крови или трансплантация стволовых клеток.
Биоактивное средство по настоящему изобретению в другом варианте осуществления можно вводить нуждающемуся в этом индивидууму в сочетании с терапией снижения субстрата.
В другом варианте осуществления биоактивное средство по настоящему изобретению вводят нуждающемуся в этом индивидууму в сочетании с симптоматической и поддерживающей терапией, такой как физиотерапия.
Hsp70 увеличивает захват соединений
Кроме прочего, авторы настоящего изобретения показали, что Hsp70 увеличивает захват других молекул посредством эндоцитоза (фиг. 16). Данный увеличенный захват может происходить независимо от Hsp70 посредством пассивных механизмов, которые позволяют соединению легче захватываться клеткой в присутствии Hsp70, или он может происходить в зависимости от Hsp70 посредством прямого связывания с Hsp70.
Способность Hsp70 увеличивать захват соединений клеткой является преимуществом в том, что он позволяет Hsp70 или его функциональному фрагменту, или варианту вводиться в клетки, чтобы легко подвергнуться захвату клеткой.
Кроме того, способность Hsp70 увеличивать захват соединений клеткой является преимуществом в комбинированных схемах лечения, т.к. присутствие Hsp70 может повышать захват Hsp70 и соединения, вводимого в сочетании с Hsp70.
Что касается комбинированного лечения, где одно соединение является ферментом для ERT и другое является Hsp70 или его функциональным фрагментом, или вариантом, то оно может помогать эффективно снижать количество фермента для ERT, необходимого для достижения эффективных внутриклеточных доз. Это уместно, т.к. ERT является очень дорогой.
В ситуации, в которой биоактивное средство по настоящему изобретению содержит комбинацию Hsp70 или его функционального фрагмента, или варианта и индуктора или коиндуктора Hsp70, присутствие Hsp70 может, таким образом, увеличивать захват указанного индуктора или коиндуктора Hsp70.
Способ модуляции ферментативной активности фермента
Настоящее изобретение относится в одном из аспектов к модуляции ферментативной активности. Указанный фермент может являться ферментом, вовлеченным в катаболизм лизосомальных веществ. И указанная модуляция может проистекать из взаимодействия между Hsp70 и BMP.
Таким образом, авторы настоящего изобретения описывали взаимодействие между Hsp70 и BMP, где Hsp70 взаимодействует или связывается с BMP с определенной аффинностью. Молекула, обладающая "аффинностью" к молекуле X означает в настоящем документе, что молекула с аффинностью к молекуле X связывается с молекулой X в конкретном определяемом количестве в конкретных условиях, но (необязательно определяемо) не связывается с другими, отличающимися молекулами (к которым она не обладает аффинностью) в той же степени в идентичных условиях. Одной из мер описания аффинности молекулы к другой молекуле является константа диссоциации, Kd. Чем меньше Kd, тем сильнее аффинность. Константы диссоциации можно определять хорошо известными в данной области способами, такими как анализ поверхностного плазмонного резонанса. В настоящем документе предпочтительно, чтобы молекула с "аффинностью" к другой молекуле X обладала Kd для указанной молекулы X, которая менее чем 100 мМ, такой как менее чем 10 мМ, например, менее чем 5 мМ, такой как менее чем 1 мМ, например, менее чем 0,1 мМ, такой как менее чем 0,01 мМ, например, менее чем 1 мкМ, такой как менее чем 100 нМ, например, менее чем 10 нМ, такой как менее чем 1 нМ, например, менее чем 100 пМ, такой как менее чем 10 пМ, например, менее чем 1 пМ. Кроме того, в настоящем документе предпочтительно, что молекула, которая "не обладает аффинностью" к молекуле X, обладает константой диссоциации, Kd, в отношении связывания молекулы X, которая является, по меньшей мере, в 10 раз выше, такой как, по меньшей мере, 20 раз выше, например, по меньшей мере, 30 раз выше, такой как, по меньшей мере, 40 раз выше, например, по меньшей мере, 50 раз выше, такой как, по меньшей мере, 60 раз выше, например, по меньшей мере, 70 раз выше, такой как, по меньшей мере, 80 раз выше, например, по меньшей мере, 90 раз выше, такой как, по меньшей мере, 100 раз выше, чем Kd связывания (с молекулой X) молекулы, которая обладает аффинностью к молекуле X. Наиболее предпочтительным является, по меньшей мере, десятикратное отличие Kd между теми молекулами, которые рассматриваются как обладающие аффинностью, и теми, которые подразумеваются как не обладающие аффинностью к молекуле X.
Аспектом настоящего изобретения является предоставление способа модуляции ферментативной активности фермента, где указанный фермент взаимодействует с BMP (бис(моноацилглицеро)фосфатом), указанный способ включает этапы:
i) введения биоактивного средства, способного повышать внутриклеточную концентрацию и/или активность Hsp70;
ii) допущения взаимодействия между BMP и Hsp70, и
iii) модуляции ферментативной активности фермента, взаимодействующего с BMP.
Указанное взаимодействие в одном из вариантов осуществления может являться прямым или указанное взаимодействие в другом варианте осуществления может являться косвенным.
В одном из вариантов осуществления настоящее изобретение относится к способу модуляции ферментативной активности фермента, где указанный фермент взаимодействует с BMP (бис(моноацилглицеро)фосфатом), указанный способ включает этапы:
i) введения биоактивного средства по настоящему изобретению;
ii) допущения взаимодействия между BMP и Hsp70, и
iii) модуляции ферментативной активности фермента, взаимодействующего с BMP.
В одном из вариантов осуществления указанный Hsp70 формирует ковалентный или нековалентный комплекс с BMP.
В одном из вариантов осуществления указанный BMP взаимодействует с сапозином. В дополнительном варианте осуществления указанный сапозин можно выбирать из группы, состоящей из сапозина A, сапозина B, сапозина C и сапозина D.
В дополнительном варианте осуществления указанный фермент выбран из группы, состоящей из сфингомиелиназы, кислой сфингомиелиназы (aSMaзы), кислой церамидазы, бета-галактозилцерамидазы, альфа-галактозидазы, бета-галактозидазы, глюкозилцерамидазы, сиалидазы и арилсульфатазы.
В одном конкретном варианте осуществления модуляция ферментативной активности является повышением ферментативной активности.
В одном из вариантов осуществления указанное повышение ферментативной активности является повышением в диапазоне от 1 до 5%, таким как в диапазоне от 5 до 10%, например, в диапазоне от 10 до 15%, таким как в диапазоне от 15 до 20%, например, в диапазоне от 20 до 25%, таким как в диапазоне от 25 до 30%, например, в диапазоне от 30 до 35%, таким как в диапазоне от 35 до 40%, например, в диапазоне от 40 до 45%, таким как в диапазоне от 45 до 50%, например, в диапазоне от 50 до 60%, таким как в диапазоне от 60 до 70%, например, в диапазоне от 70 до 80%, таким как в диапазоне от 80 до 90%, например, в диапазоне от 90 до 100%, таким как в диапазоне от 100 до 120%, например, в диапазоне от 120 до 140%, таким как в диапазоне от 140 до 160%, например, в диапазоне от 160 до 180%, таким как в диапазоне от 180 до 200%, например, в диапазоне от 200 до 250%, таким как в диапазоне от 250 до 300%, например, в диапазоне от 300 до 400%, таким как в диапазоне от 400 до 500%, например, в диапазоне от 500 до 750%, таким как в диапазоне от 750 до 1000%, например, в диапазоне от 1000 до 1500%, таким как в диапазоне от 1500 до 2000%, например, в диапазоне от 2000 до 5000%.
В другом аспекте настоящее изобретение относится к способу идентификации партнеров по связыванию для комплекса Hsp70-BMP, включающему этапы выделения указанного комплекса Hsp70-BMP и выделения указанных партнеров по связыванию. В одном из вариантов осуществления указанный партнер по связыванию является агонистом. В другом варианте осуществления указанный партнер по связыванию является антагонистом.
В другом аспекте настоящее изобретение относится к комплексу Hsp70-BMP и его применению для лекарственного средства, такого как для лечения лизосомной болезни накопления.
В одном из вариантов осуществления настоящее изобретение относится к антителу, которое специфически распознает комплекс Hsp70-BMP.
Способ лечения
В одном из аспектов настоящее изобретение относится к способу лечения нуждающегося в этом индивидуума.
Таким образом, аспектом настоящего изобретения является предоставление способа лечения лизосомной болезни накопления, содержащего введение биоактивного средства по настоящему изобретению нуждающемуся в этом индивидууму.
Отсюда следует, что в одном из вариантов осуществления указанное лечение может являться профилактическим, излечивающим или смягчающим. В одном конкретном варианте осуществления указанное лечение является профилактическим. В другом варианте осуществления указанное лечение является излечивающим. В дополнительном варианте осуществления указанное лечение является смягчающим.
Биоактивное средство, применяемое по настоящему изобретению, в одном из вариантов осуществления можно составлять как фармацевтическую композицию.
В одном из вариантов осуществления указанная лизосомная болезнь накопления выбрана из группы, состоящей из болезни Ниманна-Пика, болезни Фарбера, болезни Краббе, болезни Фабри, болезни Гоше, метахроматической лейкодистрофии, сиалидоза и дефицита сапозинов.
В конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Ниманна-Пика типа A или B. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Фарбера. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Краббе. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является метахроматической лейкодистрофией. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является сиалидозом. В другом конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Фабри. В еще одном конкретном варианте осуществления указанная лизосомная болезнь накопления является болезнью Гоше. В еще одном конкретном варианте осуществления указанная лизосомная болезнь накопления является дефицитом сапозинов.
В одном из вариантов осуществления указанная лизосомная болезнь характеризуется повышенным внутриклеточным накоплением сфинголипида.
В одном из вариантов осуществления указанное лечение снижает внутриклеточное накопление веществ у нуждающегося в этом индивидуума. Указанное вещество может являться веществом, которое в норме деградирует в лизосомах. В одном из вариантов осуществления указанное вещество является сфинголипидом.
В одном из вариантов осуществления лечение по настоящему изобретению снижает внутриклеточное накопление деградирующего в лизосомах вещества, такого как сфинголипид до менее чем 100% накопленного количества, такого как менее чем 90% накопленного количества, например, менее чем 80% накопленного количества, такого как менее чем 70% накопленного количества, например, менее чем 60% накопленного количества, такого как менее чем 50% накопленного количества, например, менее чем 40% накопленного количества, такого как менее чем 30% накопленного количества, например, менее чем 20% накопленного количества, такого как менее чем 10% накопленного количества, например, менее чем 5% накопленного количества.
В одном из вариантов осуществления лечение по настоящему изобретению снижает внутриклеточное накопление сфинголипида на, по меньшей мере, 5%, такое как, по меньшей мере, 10%, например, по меньшей мере, 15%, такое как, по меньшей мере, 20%, например, по меньшей мере, 25%, такое как, по меньшей мере, 30%, например, по меньшей мере, 35%, такое как, по меньшей мере, 40%, например, по меньшей мере, 45%, такое как, по меньшей мере, 50%, например, по меньшей мере, 55%, такое как, по меньшей мере, 60%, например, по меньшей мере, 65%, такое как, по меньшей мере, 70%, например, по меньшей мере, 75%, такое как, по меньшей мере, 80%, например, по меньшей мере, 85%, такое как, по меньшей мере, 90%, например, по меньшей мере, 95%, такое как, по меньшей мере, 100%.
В одном из вариантов осуществления указанный накопленный сфинголипид выбран из группы, состоящей из сфингомиелина, церамида, галактозилцерамида, глоботриаозилцерамида, глюкозилцерамида, GM3 и сульфатида.
Степень снижения внутриклеточной концентрации деградирующего в лизосомах вещества, такого как сфинголипид, может зависеть от факторов, таких как формы введения, режимы дозирования и т.п.
В одном из вариантов осуществления указанное лечение увеличивает продолжительность жизни указанного нуждающегося в этом индивидуума.
Отсюда следует, что продолжительность жизни в одном из вариантов осуществления может увеличиваться на время от 6 месяцев до 1 года, такое как от 1 года до 2 лет, например, от 2 до 3 лет, такое как от 3 до 4 лет, например, от 4 до 5 лет, такое как от 5 до 6 лет, например, от 6 до 7 лет, такое как от 7 до 8 лет, например, от 8 до 9 лет, такое как от 9 до 10 лет, например, от 10 до 12 лет, такое как от 12 до 14 лет, например, от 14 до 16 лет, такое как от 16 до 18 лет, например, от 18 до 20 лет, такое как от 20 до 25 лет, например, от 25 до 30 лет, такое как от 30 до 40 лет, например, от 40 до 50 лет, такое как от 50 до 60 лет, например, от 60 до 70 лет, такое как от 70 до 80 лет, например, от 80 до 90 лет, такое как от 90 до 100 лет.
В одном из вариантов осуществления продолжительность жизни увеличивается на, по меньшей мере, 6 месяцев, такое как, по меньшей мере, 1 год, такое как, по меньшей мере, 2 года, например, 3 года, такое как, по меньшей мере, 4 года, например, 5 лет, такое как, по меньшей мере, 6 лет, например, 7 лет, такое как, по меньшей мере, 8 лет, например, 9 лет, такое как, по меньшей мере, 10 лет, например, 12 лет, такое как, по меньшей мере, 14 лет, например, 16 лет, такое как, по меньшей мере, 18 лет, например, 20 лет, такое как, по меньшей мере, 25 лет, например, 30 лет, такое как, по меньшей мере, 40 лет, например, 50 лет, такое как, по меньшей мере, 60 лет, например, 70 лет, такое как, по меньшей мере, 80 лет, например, 90 лет, такое как, по меньшей мере, 100 лет.
Также аспектом настоящего изобретения является предоставление способа увеличения продолжительности жизни пациента с лизосомной болезнью накопления, где указанный способ включает введение биоактивного средства по настоящему изобретению нуждающемуся в этом индивидууму.
В одном из вариантов осуществления настоящее изобретение относится к способу увеличения продолжительности жизни пациента с лизосомной болезнью накопления, где указанный способ включает введение биоактивного средства по настоящему изобретению нуждающемуся в этом индивидууму, где указанная продолжительность жизни увеличивается на время от 6 месяцев до 1 года, такое как от 1 года до 2 лет, например, от 2 до 3 лет, такое как от 3 до 4 лет, например, от 4 до 5 лет, такое как от 5 до 6 лет, например, от 6 до 7 лет, такое как от 7 до 8 лет, например, от 8 до 9 лет, такое как от 9 до 10 лет, например, от 10 до 12 лет, такое как от 12 до 14 лет, например, от 14 до 16 лет, такое как от 16 до 18 лет, например, от 18 до 20 лет, такое как от 20 до 25 лет, например, от 25 до 30 лет, такое как от 30 до 40 лет, например, от 40 до 50 лет, такое как от 50 до 60 лет, например, от 60 до 70 лет, такое как от 70 до 80 лет, например, от 80 до 90 лет, такое как от 90 до 100 лет.
В одном из вариантов осуществления настоящее изобретение относится к способу увеличения продолжительности жизни пациента с лизосомной болезнью накопления, где указанный способ включает введение биоактивного средства по настоящему изобретению нуждающемуся в этом индивидууму, где указанная продолжительность жизни увеличивается на, по меньшей мере, 6 месяцев, такое как, по меньшей мере, 1 год, такое как, по меньшей мере, 2 года, например, 3 года, такое как, по меньшей мере, 4 года, например, 5 лет, такое как, по меньшей мере, 6 лет, например, 7 лет, такое как, по меньшей мере, 8 лет, например, 9 лет, такое как, по меньшей мере, 10 лет, например, 12 лет, такое как, по меньшей мере, 14 лет, например, 16 лет, такое как, по меньшей мере, 18 лет, например, 20 лет, такое как, по меньшей мере, 25 лет, например, 30 лет, такое как, по меньшей мере, 40 лет, например, 50 лет, такое как, по меньшей мере, 60 лет, например, 70 лет, такое как, по меньшей мере, 80 лет, например, 90 лет, такое как, по меньшей мере, 100 лет.
ПРИМЕРЫ
Пример 1: Взаимодействие между Hsp70 и бис(моноацилглицеро)фосфатом стабилизирует лизосомы и способствует выживанию клеток
Реферат
Проницаемость лизосомальной мембраны является эволюционно консервативным признаком стресс-индуцируемой гибели клеток. В настоящем документе авторы показывают, что главный стресс-индуцибельный белок теплового шока 70 (Hsp70) усиливает выживание клетки посредством стабилизации лизосом посредством pH-зависимого высокоаффинного связывания с эндолизосомальным анионным фосфолипидом бис(моноацилглицеро)фосфатом (BMP; также обозначаемым как лизобисфосфатидная кислота). Положительно заряженный АТФазный домен Hsp70 отвечает за связывание, но для эффективной стабилизации лизосом также требуется субстрат-связывающий домен. Важно, что можно получать цитопротективное действие посредством доставки эндоцитозом рекомбинантного Hsp70 и специфически реверсировать внеклеточным введением антител к BMP или ингибиторов Hsp70. Таким образом, данное взаимодействие белок-липид открывает волнующие возможности разработки цитопротективных и цитотоксических лизосомо-специфических способов терапии для лечения дегенеративных заболеваний и злокачественных опухолей, соответственно.
Введение
Лизосомы являются высоко динамичными цитозольными органеллами, которые принимают мембранный транспорт от биосинтетического (сеть транс-Гольджи), эндоцитозного, фагоцитозного и аутофагического путей. Они содержат более 50 кислых гидролаз, которые могут перерабатывать все основные макромолекулы клетки до их продуктов деградации, доступных для метаболической реутилизации. Недавно выявили, что помимо их катаболических функций "ведения домашнего хозяйства", лизосомальные протеазы, катепсины, являются важными эффекторами в эволюционно консервативных программах гибели клеток, индуцируемыми, например, рецепторами смерти из семейства рецепторов фактора некроза опухоли, гипоксией, оксидативным стрессом, осмотическим стрессом, теплом и противоопухолевыми лекарственными средствами. Катепсин-зависимую гибель клеток характеризуют ранней проницаемостью лизосомальной мембраны и последующим перемещением катепсинов в цитозоль, где они могут инициировать каспаза-зависимые и -независимые пути гибели клеток. Таким образом, целостность лизосомальной мембраны выступает как важный регулятор выживания клеток в различных условиях стресса. В то время как сообщают, что ингибиторы цитозольных цистеиновых протеаз защищают от индуцируемого катепсинами повреждения клеток в клетках млекопитающих, а также в нематодах Caenorhabditis elegans, механизм, посредством которого клетки регулируют стабильность лизосомальной мембраны, остается в значительной степени неясным. Однако недавнее косвенное доказательство позволяет предполагать, что потенциальное цитопротективное действие основного стресс-индуцибельного Hsp70 имеет место по причине стабилизации лизосомальной мембраны. Истощение Hsp70 запускает раннюю проницаемость лизосомальной мембраны и катепсин-опосредованную гибель злокачественных клеток, и экзогенный Hsp70 эффективно ингибирует лизосомальную дестабилизацию, индуцируемую различным стрессом. Кроме того, мыши с дефицитом Hsp70 страдают от панкреатита, вызванного проникновением лизосомальных протеаз в цитозоль.
Молекулярный механизм, лежащий в основе лизосомально-протективного потенциала Hsp70, остается трудным для понимания, но ключ к данному механизму действия может заключаться в ассоциируемом со стрессом и злокачественной опухолью перемещении небольшой части Hsp70 в эндолизосомальный компартмент. Главной целью данного исследования является определение, является ли в действительности лизосомальная локализация ключевой для цитопротективного действия Hsp70. Примечательно, что приводимые в настоящем документе данные показывают, что Hsp70 с высокой аффинностью связывается с лизосомо-специфическим липидом BMP, и данное взаимодействие белок-липид стабилизирует лизосомы. Важно, что данный цитопротективный механизм можно применять посредством внеклеточного введения самого Hsp70 или соединений, которые противодействуют связыванию Hsp70-BMP или специфическому функционированию Hsp70 в лизосомальном компартменте.
Результаты и обсуждение
Для исследования того, является ли лизосомальная локализация ключевой для цитопротективного действия Hsp70, авторы настоящего изобретения получали рекомбинантный Hsp70 (rHsp70) и использовали преимущество клеточного механизма эндоцитоза для мечения rHsp70 в просвете лизосом. Иммуноцитохимический анализ клеток остеосаркомы U-2-OS, инкубированных с меченным Alexa Fluor 488 rHsp70 выявляли четкую колокализацию подвергнутого эндоцитозу rHsp70 с поздними эндосомальными и лизосомальными белками-маркерами (лизосомно-ассоциированные мембранные белки 1 и 2 и лизосомальный интегральный мембранный белок-1 (LIMP-1)) и эндолизосомо-специфический липид (BMP), в то время как не наблюдали колокализацию с маркерами эндоплазматической сети (Ca2+-АТФаза эндоплазматической сети (SERCA)), аппарата Гольджи (гольджин-97) или митохондрий (цитохром С (cyt c)). Также наблюдали лизосомальную локализацию в живых клетках, где подвергнутый эндоцитозу rHsp70 колокализовался с Lysotracker® Red, но не с Mitotracker® Red. Для определения количества подвергнутого эндоцитозу Hsp70 подсчитывали флуоресцентный сигнал от нагруженных rHsp70* клеток и выявляли, что в среднем 70 нг rHsp70* захватывается 1*105 клетками. Для определения того, локализуется ли rHsp70* только в просвете или он непосредственно связан с эндолизосомальными мембранами, субфракционировали нагруженные rHsp70* клетки U-2-OS и измеряли количество rHsp70*, присутствующего в легкой мембранной фракции (LMF) (клеточные органеллы, включая ранние и поздние эндосомы и лизосомы). Замораживание-скалывание органелл в LMF посредством повторяющихся циклов замораживания/оттаивания в жидком азоте привело к тотальному высвобождению катепсина Β в супернатант, в то время как белок лизосомальной мембраны LAMP-2 оставался в осадочной разрушенной мембранной фракции. С применением количественного анализа подвергнутого эндоцитозу rHsp70* выявляли, что приблизительно 1/3 от общего rHsp70* оставалось в осадке, что убедительно позволяет предполагать, что он связан с эндолизосомальными мембранами. Для оценки того, может ли подвергнутый эндоцитозу rHsp70 стабилизировать лизосомальные мембраны, клетки нагружали акридиновым оранжевым, метахроматическим слабым основанием, которое накапливается в кислом компартменте клетки, т.е. поздних эндосомах и лизосомах, и делает их чувствительными к фотоокислению после воздействия синего света (Brunk et al., 1997; Nylandsted et al., 2004). Фотоокисление приводит к потере лизосомального градиента pH и проникновению акридинового оранжевого в цитозоль. Это легко можно визуализировать и подсчитать, т.к. акридиновый оранжевый демонстрирует красную флуоресценцию, когда концентрируется в кислом компартменте, и зеленую флуоресценцию, когда в более низкой концентрации присутствует в цитозоле. Примечательно, что подвергнутый эндоцитозу rHsp70 защищает лизосомы от индуцируемого синим светом фотоокисления, в то время как в клетках, нагруженных рекомбинантными Hsc70 и Hsp70-2, которые обладают 86% и 84% гомологией аминокислотной последовательности с Hsp70, соответственно, защиту не наблюдали. Кроме того, специфичные к Hsp70 малые интерферирующие РНК (миРНК) делали лизосомы клеток U-2-OS чувствительными к фотоокислению, и данный эффект полностью реверсировался подвергнутым эндоцитозу rHsp70, соответствующим образом демонстрируя, что цитопротективное действие эндогенного Hsp70 опосредуется скорее небольшими фракциями белков, локализованных в просвете лизосом, чем большой совокупностью, присутствующей в цитозоле. Показанный выше эффективный захват Hsp70 посредством эндоцитоза и стабилизация лизосом могут объяснять недавно сообщенные удивительные нейропротективные эффекты внеклеточного Hsp70, вводимого в места повреждения после разнообразных обработок, для которых известно, что они запускают лизосомальный путь гибели клеток, т.е. световое повреждение сетчатки и аксотомии седалищного нерва.
Для исследования того, является ли протективное действие Hsp70 следствием непосредственного связывания Hsp70 с лизосомальными мембранами, авторы исследовали его взаимодействие с пальмитоил-олеоил-фосфатидилхолиновыми (POPC) большими однослойными везикулами (LUV), содержащими разнообразные мембрано-ассоциированные анионные липиды, т.е. пальмитоил-олеоил-фосфатидилсерин (POPS; первично во внутреннем слое цитоплазматической мембраны), кардиолипин (первично митохондриальный) и BMP (первично в поздних эндосомах и лизосомах). Принимая во внимание все более кислое окружение эндолизосомального компармента после созревания лизосом, сравнивали взаимодействия белок-липид в нейтральных (pH 7,4) и кислых (pH 6,0) условиях. При pH 7,4 rHsp70 вызывает небольшое относительное изменение в рассеянии света липосомами POPC под углом 90°, свидетельствующее об очень слабом связывании с бислоем POPC. Как ранее сообщалось для POPS, все отрицательно заряженные липиды повышают связывание rHsp70 с липосомами при нейтральном pH. Данное повышение являлось приблизительно 4-кратным, независимо от отрицательно заряженных липидов или плотности заряда на поверхности липосомы (POPS обладает суммарным зарядом -1, и кардиолипин и BMP обладают суммарным зарядом -2). Примечательно, что снижение pH от 7,4 до 6,0 существенно меняет профиль связывания rHsp70 с липидами. В связи с тем, что связывание с POPS лишь незначительно повышается при закислении, связывание с BMP почти в 20 сильнее при кислом pH по сравнению с нейтральным pH. pH-зависимое высокоаффинное связывание Hsp70 с BMP подтверждено независимым рядом экспериментов BIAcore.
Для исследования того, требуется ли pH-зависимое высокоаффинное взаимодействие между Hsp70 и BMP, наблюдаемое in vitro, опосредуемой Hsp70 стабилизации лизосом в живых клетках, авторы метили клеточный BMP, нагружая эндолизосомальный компартмент клеток U-2-OS антителами к BMP, как указано ранее (Kobayashi et al., 1998). Примечательно, что антитела к BMP эффективно ингибируют способность rHsp70 проявлять защиту против индуцируемой фотоокислением лизосомальной проницаемости. Даже более важно, что антитела к BMP делают клетки остеосаркомы U-2-OS существенно более чувствительными к цисплатину, который индуцирует раннюю проницаемость лизосомальной мембраны в клетках U-2-OS, а также других чувствительных к цисплатину клеточных линиях, применяемых в данном исследовании. Таким образом, клетки карциномы предстательной железы PC-3 и DU-145 также стали существенно более чувствительными к цисплатин-индуцирумой гибели клеток после обработки антителами к BMP.
Подтвердив, что лизосомальное взаимодействие Hsp70-BMP является важным для цитопротективного действия Hsp70, затем авторы исследовали, какая из частей белка Hsp70 отвечает за связывание липида. Для определения этого измеряли сдвиг флуоресценции триптофана (W90 и W580) после стыковки rHsp70 с BMP-содержащими липосомами при pH 6,0. Авторы получали мутантные белки rHsp70 с делециями двух главных функциональных доменов белка, т.е. амино-концевого АТФазного домена (rHsp70-ΔATP; делеция аминокислот 119-426) и карбокси-концевого пептид-связывающего домена (rHsp70-ΔPBD; делеция аминокислот 437-617). Потеря сигнала в относительной интенсивности пика флуоресценции для Hsp70-ΔATP свидетельствовала о том, что АТФазный домен требуется для высокоаффинного связывания Hsp70 с бислоем POPC/BMP. Затем два триптофана в Hsp70 заменяли на фенилаланины (W90F и W580F) для исследования того, какой триптофан отвечает за связывание липида и сдвиг флуоресценции. Снижение сигнала rHsp70-W90F с недостатком триптофана в АТФазном домене (rHsp70-W90F) и неизмененный сигнал rHsp70-W580F с недостатком триптофана в пептид-связывающем домене свидетельствуют о том, что триптофан в положении 90 состыковывается с липидным слоем. Поскольку применяемый выше способ измеряет только относительный сдвиг флуоресценции после вставки триптофана в липофильное окружение, авторы также анализировали связывание липидов rHsp70 и его мутантами более количественным образом с применением системы BIAcore 2000 с иммобилизованными BMP-содержащими LUV на поверхности сенсорного чипа L1 при pH 4,5. И rHsp70, и rHsp70-ΔPBD демонстрируют сильное взаимодействие с BMP, в то время как связывание rHsp70-ΔATP значительно снижается, подтверждая, что Hsp70 взаимодействует с BMP в основном через свой АТФазный домен. Удивительно, что мутанты по триптофану демонстрируют убедительную разницу в своей способности взаимодействовать с BMP. В то время как мутант rHsp70-W580F обладает по существу тем же профилем взаимодействия, как и rHsp70, связывание мутанта rHsp70-W90F значительно снижается. Поскольку rHsp70-W90F соответствующим образом сворачивается, что анализировали посредством кругового дихроизма в ближней и дальней УФ-области, и способен сворачивать люциферазу и гидролизовать АТФ, мутация W90F специфически прекращает взаимодействие между Hsp70 и BMP, таким образом, сохраняя структурные и функциональные аспекты шаперона Hsp70. Таким образом, мутант rHsp70-W90F неожиданно предоставил нам бесценный инструмент для дальнейшего исследования того, наделяет ли непосредственное взаимодействие между Hsp70 и BMP Hsp70 его лизосомально-протективными свойствами. В действительности мутант rHsp70-W90F полностью теряет свою способность защищать лизосомальные мембраны от фотоокисления и клетки от цисплатин-индуцируемой лизосомальной гибели клеток, в то время как мутант rHsp70-W580F демонстрирует ту же эффективность, как и белок дикого типа. Также мутант rHsp70-ΔPBD, который демонстрирует неизмененную способность связывать богатые BMP мембраны, теряет свою способность защищать от фотоокисления и цисплатина. Эти данные демонстрируют, что связывание Hsp70 с BMP требуется, но его недостаточно для защиты лизосомальных мембран. Кроме того, интактный карбокси-концевой пептид-связывающий домен необходим для стабилизации лизосомальных мембран в живых клетках.
Длительное время ингибиторы Hsp70 рассматривали как интересные противоопухолевые лекарственные средства. Однако внимание концентрировали на ингибировании цитозольного Hsp70, и проблемы в отношении доставки лекарственного средства и недостатка специфичности среди членов семейства Hsp70 представляли собой непреодолимые барьеры для разработки подходящих антагонистов Hsp70. Установив, что связывание с BMP и интактным пептид-связывающим доменом требуется для цитопротективного действия Hsp70, и подтвердив потенциал мечения взаимодействия Hsp70-BMP, затем авторы исследовали, могут ли ингибиторы шапероновой активности Hsp70 также противодействовать протективному действию эндолизосомального Hsp70. Это выполняли посредством инкубирования клеток с пептидом-производным фактора индукции апоптоза (ADD70), который ингибирует шапероновую функцию Hsp70 посредством связывания с его пептид-связывающим доменом. Следует отметить, что данный большой пептид (388 аминокислоты) не проникает через цитоплазматическую мембрану, и, таким образом, предоставляет другой инструмент для специфического мечения эндолизосомального Hsp70. В частности, инкубирование клеток с пептидом ADD70 полностью блокирует лизосомально-протективное действие подвергнутого эндоцитозу rHsp70 в клетках U-2-OS. Для исследования того, может ли ADD70 также противодействовать цитопротективному действию Hsp70 самих клеток, авторы исследовали его действие на цисплатин-индуцируемую цитотоксичность в трансгенных по Hsp70 иммортализованных эмбриональных фибробластах мыши (iMEF), в которых трансгенный Hsp70 вызывает почти полную резистентность к цисплатин-индуцируемой гибели клеток. Примечательно, что обработка ADD70 трансгенных по Hsp70 iMEF эффективно отменяет Hsp70-опосредованное протективное действие и делает их такими же чувствительными к цисплатину, как iMEF дикого типа. iMEF дикого типа экспрессируют очень низкие уровни Hsp70, и, таким образом, неспособность ADD70 в дальнейшем делать их чувствительными к цисплатину подтверждает идею о том, что ADD70-опосредованная сенсибилизация в действительности происходит из-за ингибирования Hsp70. Схожая с обработкой против BMP, обработка ADD70 делает клетки карциномы предстательной железы PC-3 и DU-145 чувствительными к цисплатин-индуцируемой цитотоксичности.
Представленные в настоящем документе данные демонстрируют, что Hsp70 взаимодействует непосредственно с эндолизосомальным анионным липидом BMP, и что данное взаимодействие стабилизирует эндолизосомальные мембраны. Т.к. концентрация BMP повышается в эндоцитозных везикулах во время созревания эндосом до формирования мультивезикулярных телец, поздних эндосом и лизосом, регуляция pH может являться способом нацеливания Hsp70 на BMP и лизосомы. Субдомены Hsp70 значительно отличаются по своим уровням значимости, АТФазный домен имеет pl на 1,72 единиц выше, чем пептид-связывающий домен. Данная характеристика позволяет предполагать, что при кислом pH АТФазный домен предпочтительно положительно заряжен, что может облегчать его взаимодействие с анионными липидами. Поскольку во время эндоцитозного созревания pH снижается, нарастает положительный заряд и любое анионное взаимодействие даже больше усиливается. Представленные в настоящем документе данные демонстрируют зависимость взаимодействия Hsp70-BMP от кислого pH, и АТФазный домен подтверждает эту теорию. Кроме того, молекулярное моделирование электростатической поверхности АТФазного домена Hsp70 выявило, что он формирует почти клинообразную структуру с преимущественно положительным зарядом у основания клина даже при pH 7,0. Любопытно, что W90 расположен в этом положительно заряженном домене, который может дать ключ к вопросу, почему мутация Hsp70-W90F обладает таким глубоким влиянием на способность Hsp70 взаимодействовать с BMP и стабилизировать лизосомы. BMP локализуется исключительно на внутренних мембранах эндолизосомального компартмента, где он поддерживает расщепление и выход липидов из липидных везикул посредством кислой сфингомиелиназы и белков-активаторов сфинголипидов, дающих начало метаболитам, таким как церамид и сфингозин-1-фосфат, который вовлечен в дестабилизацию мембран и гибель клеток. Следует отметить, что лизосомальных внутренних мембран можно достигнуть посредством инвагинации внешних мембран на уровне ранних и поздних эндосом, и, таким образом, соответствующие везикулы также, вероятно, содержат Hsp70. Таким образом, Hsp70 противодействует роли BMP как кофактора гидролиза сфинголипидов и, таким образом, изменяет липидный состав лизосом. Для проверки данной гипотезы авторы в настоящий момент разрабатывают основанную на масс-спектрометрии технологию количественного анализа метаболитов лизосомальных сфинголипидов.
Накопленные данные позволяют предполагать, что повышенная экспрессия и измененный транспорт лизосомальных протеаз может образовывать "ахиллесову пяту" опухолевых клеток посредством их сенсибилизации к проницаемости лизосомальной мембраны. Таким образом, взаимодействие BMP-Hsp70 на эндолизосомальных мембранах и получающаяся в результате стабилизация эндолизосомального компартмента предоставляет злокачественным клеткам защиту от этого, в противном случае, прямого пути к гибели клеток. Молекулярный механизм, лежащий в основе данного цитопротективного действия, в настоящее время открывает новые волнующие возможности сенсибилизации злокачественных клеток к средствам, которые индуцируют лизосомальные пути гибели клеток через специфическое ингибирование стабилизирующей лизосомы функции Hsp70. Наоборот, взаимодействие между Hsp70 и BMP может предоставлять новые стратегии лечения, основывающиеся на цитопротекции, вызванной стабилизирующей лизосомы функцией экзогенно введенного Hsp70, для таких отличающихся повреждений, как панкреатит, повреждения двигательного и чувствительного нерва и индуцируемое светом повреждение сетчатки.
Материалы и способы
Культура клеток и реактивы
Клеточные линии остеосаркомы человека U-2-OS культивировали на RPMI 1640 (Invitrogen) с добавлением 6% инактивируемой теплом телячьей сывороткой и пенициллина-стрептомицина. Получали трансгенные по Hsp70 и подходящие контрольные iMEF и поддерживали, как описано ранее (Nylandsted et al., 2004). Все клетки выращивали при 37°C в атмосфере увлажненного воздуха с 5% CO2, неоднократно тестировали и признавали отрицательной на микоплазму.
Если не указано иначе, все реагенты получали от Sigma-Aldrich (Sigma-Aldrich Denmark A/S).
Рекомбинантные белки
Рекомбинантный Hsp70 и его мутанты получали с применением векторной системы pET-16b (Novagen) с индукцией экспрессии белка и последующей Ni2+-аффинной очисткой, оптимизированной по протоколу производителя.
Мечение rHsp70 Alexa Fluor 488 проводили по протоколу производителя (Molecular Probes).
Захват клетками рекомбинантных белков и антител:
Субконфлюэнтные клетки культивировали на RPMI 1640 (Invitrogen) с добавлением 6% инактивируемой теплом телячьей сывороткой и пенициллина-стрептомицина. Рекомбинантные белки или лизаты ретикулоцитов добавляли непосредственно в среду для получения конечной концентрации. Затем клетки выращивали другие 20 часов в присутствии белка/лизата.
Нагрузку клеток антителом против BMP (LBPA) (6C4) проводили с применением техник данной области.
Количественный анализ подвергнутого эндоцитозу rHsp70* проводили посредством выращивания клеток в течение 20 часов в присутствии rHsp70*, после чего клетки собирали, отмывали 3 раза в PBS и подсчитывали. Для полного захвата клетками применяли 1*105 клеток. Клетки лизировали посредством инкубации в течение 30 мин на льду в 100 мкл дигитонина-PBS (200 мкг/мл). Измеряли флуоресценцию на считывающем приборе Spectramax Gemini (Molecular Devices). Для легких мембранных фракций (LMF) собирали в общей сложности 10*106 клеток, отмывали 3 раза в PBS и гомогенизировали в гомогенизаторе Даунса, пока разрушение мембран не достигло 90%, что определяли окрашиванием трипановым синим. Затем клетки подвергали фракционированию мембраны, первыми удаляя цитоплазматическую мембрану, ядро и тяжелые мембранные фракции, после чего собирали LMF посредством центрифугирования при 17000*g в течение 20 мин. Затем LMF разделяли на две - первую брали как "полную" LMF. Вторую фракцию замораживали/оттаивали в течение 5 циклов в жидком азоте для того, чтобы сломать мембраны, и затем центрифугировали при 20000*g в течение 20 мин для отделения мембран от содержимого просвета. Всю клеточную работу после собирания проводили при максимуме 4°C.
Анализ целостности лизосом и жизнеспособности клеток
Субконфлюэнтные клетки U-2-OS, инкубированные с 2 мкг/мл акридинового оранжевого в течение 15 мин при 37°C, отмывали, облучали и анализировали в сбалансированном солевом растворе Хенкса с добавлением 3% FCS. Клетки для визуализации отдельных клеток выбирали из восьми заранее определенных областей в каждой лунке в проходящем свете, после чего те же клетки немедленно визуализировали и подвергали воздействию синего света дуговой ртутной горелки USH102 100 Вт (Ushio electric), установленной в лампу U-ULS100HG (Olympus), на 20 сек. Флуоресцентную микроскопию проводили на инвертированном микроскопе Olympus IX-70 с x20 объективом LCPIanFI с NA=0,40. Утрату лизосомального градиента pH количественно измеряли посредством подсчета утраты интенсивного красного окрашивания.
Апоптоз-подобную гибель клеток определяли окрашиванием клеток 0,05 мкг/мл хехстом 33342 (Molecular Probes) и подсчетом клеток с конденсированными ядрами в инвертированном флуоресцентном микроскопе Olympus IX-70 (Filter U-MWU 330-385 нм). Для каждого эксперимента подсчитывали минимум восемь выбранных случайным образом областей. Жизнеспособность клеток анализировали посредством анализа снижения 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (MTT), как описано ранее67. Некротические клетки подсчитывали посредством проточной цитометрии с окрашиванием клеток в течение 10 мин при 37°C 2,5 мкМ SYTOX Green (Молекулярные зонды) и затем измеряли позитивно окрашенные клетки по интенсивности их флуоресценции в канале FL1 проточного цитометра (FACSCalibur™; Becton Dickinson).
Клетки обрабатывали цисплатином, как указано, цитозольные фракции получали обработкой дигитонином и определяли активность цитозольного цистеинового катепсина (zFRaза) и каспаза-3-подобную (DEVDaза) активность.
РНК-интерференция
Применяемые миРНК включали одну, нацеленную на два гена, кодирующих Hsp70 (HSPA1A и HSPA1B); 5'- GCCAUGACGAAAGACAACAAUCUGU-3' (Invitrogen) и контрольную Hsp70 миРНК, описанную ранее. Олигофектамин (Invitrogen) применяли в качестве трасфицирующего средства.
Иммунологический анализ
Применяемые первичные антитела включали моноклональные антитела мыши против Hsp70 (2H9; любезно предоставленные Boris Margulis, Russian Academy of Sciences, St. Petersburg, Russia), глицеральдегид-3-фосфатдегидрогеназы (GAPDH; Biogenesis), BMP (6C4; (Kobayashi et al., 1998)), LIMP-1 (H5C6; разработанные J. Thomas August и James E.K. Hildreth и полученные из Developmental Studies Hybridoma Bank, разработанные при содействии NICHD и поддерживаемые The University of Iowa, Department of Biological Sciences, Iowa City, USA), cyt c (клон 6H2.B4, BD PharMingen), SERCA (IID8, Calbiochem) и гольджина-97 (CDF4, Molecular Probes). Белки, разделенные в 10% SDS-PAGE и перенесенные на нитроцеллюлозную мембрану, определяли при помощи указанных первичных антител, подходящих конъюгированных с пероксидазой вторичных антител от Dako, реактивов для вестерн-блоттинга ECL (Amersham) и прибора для считывания люминесцентного изображения (LAS-1000Plus, Fujifilm).
Спектры флуоресценции триптофана и рассеяние света под углом 90° липосомами
Спектры флуоресценции триптофана (RFI) и рассеяние света под углом 90° (RSI) анализировали в буфере HEPES (20 мМ HEPES, 0,1 мМ ЭДТА, pH 7,4 или 6,0, как указано) с применением LUV, содержащих указанные липиды, по существу, как указано ранее. Для RFI, LUV добавляли 10 мкМ аликвоты и записывали спектры после 20 мин периода стабилизации. Для RSI рекомбинантные белки добавляли в 0,12 нМ аликвотах.
Поверхностный плазмонный резонанс (BIAcore)
Для получения LUV в органических растворителях растворяли смесь липидов, содержащую 10 мол.% сфингомиелина, 50 мол.% фосфатидилхолина, 20 мол.% холестерина и 20 мол.% BMP, сушили ее под струей аргона и регидратировали в буфере Трис/HCl (pH 7,4) (Kolzer et al., 2004). Смесь замораживали/оттаивали девять раз в жидком азоте и затем в инкубаторе при 37°C. После ультразвуковой отмывки в течение 15 мин смесь 21 раз пропускали через поликарбонатную мембрану с диаметром пор 100 нм. Измерения поверхностного плазмонного резонанса проводили с применением системы BIAcore 2000 при 25°C. LUV (общая концентрация липидов 0,1 мМ) иммобилизовали на поверхности сенсорного чипа L1 (BIAcore) в PBS (нагрузочный буфер). В качестве подвижного буфера применяли буфер ацетата натрия (50 мМ, pH 4,5). В качестве контроля непосредственно на поверхность липосом вводили кислую сфингомиелиназу (0,2 мкМ, 60 мкл в подвижном буфере). Получали единицы отклика между 4100RU-5250RU. Интересующий белок вводили в подвижный буфер при скорости потока 20 мкл/мин при указанных концентрациях. После введения добавляли этап диссоциации 10 мин.
Молекулярное моделирование
Анализ первичной структуры, а также молекулярное моделирование проводили с помощью программного обеспечения, доступного на Expert Protein Analysis System (EXPaSy), протеомного сервера Swiss Institute of Bioinformatics (http://expasy.org/). Молекулярное моделирование проводили на основе кристаллической структуры АТФазного домена Hsp70 человека (код pdb: 1S3X) и субстрат-связывающего домена Hsc70 человека (код pdb: 7HSC) с помощью DeepView-Swiss PDB Viewer. Поверхностные модели основывались на кулоновском взаимодействии при pH 7,0 с применением растворителя с диэлектрической постоянной 80 (H2O).
Статистический анализ
Статистический анализ проводили с применением двустороннего парного t-критерия Стьюдента для оценки нулевой гипотезы. Базовый уровень статистической значимости определяли как 5%, и все группы данных тестировали с применением критерия F на сопоставимость их отклонений. Весь статистический анализ проводили минимум на трех независимых экспериментах.
Обсуждение
В литературе представлено доказательство того, что Hsp70 может присутствовать на цитоплазматических мембранах опухолевых клеток, а также в эндолизосомальной системе. Кроме того, известно, что Hsp70 может высвобождаться в кровоток в течение различных стресс-индуцирующих событий, наиболее типично при лихорадке, травме и интенсивных физических упражнениях, наиболее занимательно при психологическом стрессе, хотя данную работу проводили в основном в области иммунологии. Присутствие видов Hsp70 в эндолизосомальном компартменте также описано для другого члена семейства Hsp70; конститутивно экспрессируемого Hsc70. Функция Hsc70 в данном месте в действительности дала название процессу, известному как шаперон-опосредуемая аутофагия.
Однако из литературы ничего не известно о молекулярной основе ассоциации Hsp70 с цитоплазматической и эндолизосомальной мембранами, которая заставила авторов составить данный проект.
Данные из примера 1 демонстрируют, что Hsp70 способен взаимодействовать с отрицательно заряженными мембранными липидами, такими как фосфатидилсерин (PS), кардиолипин и бис(моноацилглицеро)фосфат (BMP) при нейтральном pH. В результате имитации кислотности, которую можно ожидать в ранней эндолизосомальной системе (pH 6,0), однако профиль взаимодействия значительно изменяется, и аффинность Hsp70 к BMP становится в 20 раз выше чем при нейтральном pH и почти в 9 выше чем для PS. Данное взаимодействие Hsp70-BMP подтверждали в более детально разработанной системе BIAcore, в которой pH в настоящее время установлен на уровень, ожидаемый в поздних эндосомах и лизосомах (pH 4,5), главных участках для большей части клеточного BMP. Любопытно, что известный взаимодействующий с BMP белок, кислая сфингомиелиназа (aSMaза), которая использует BMP как кофактор, демонстрирует только половину аффинности к BMP по сравнению с Hsp70, демонстрируя высокую относительную аффинность Hsp70 к BMP.
Взаимодействие Hsp70 с PS также описывалось другими, как обладающее взаимодействием между Hsp70 мыши и кислыми гликоцерамидами, для которых взаимодействие зависит от N-концевого АТФазного домена и в некоторых случаях также от пептид-связывающего домена (PBD). Однако, в отличие от применяемых в настоящем документе систем, эти данные получали в системах, содержащих по существу только один липид (90-100% и 100% чистого липида, соответственно), вероятно, не похожих на любое минимально комплексное липидное окружение, которое ожидают в эукариотической клетке. Однако важность N-концевой области Hsp70 для связи с кислыми липидами, как показано Harada et al., соответствует данным заявителей о том, что взаимодействие Hsp70 с BMP зависит от его N-концевого АТФазного домена. Кроме того, авторы показали, что триптофан 90 (W90) Hsp70 является критической аминокислотой, т.к. его мутация значительно снижает взаимодействие Hsp70-BMP. Гипотетическая модель свидетельствует о том, что Hsp70 содержит специфические участки связывания гидрофильных и гидрофобных частей кислых гликолипидов в АТФазном, а также в пептид-связывающем домене (PBD).
Хотя данная модель может являться применимой для связывания Hsp70 с кислыми гликолипидами, авторы предпочтительно предлагают другую модель взаимодействия Hsp70-BMP. Основываясь на данных, представленных в настоящем документе: I) способности PBD только на более слабое взаимодействие с BMP; II) важности W90; III) связывающих свойствах АТФазного домена; и IV) молекулярном моделировании поверхностного электростатического потенциала Hsp70, авторы предполагали, что Hsp70 взаимодействует с BMP через электростатически положительно заряженный клинообразный субдомен в основании АТФазной щели. Поскольку консервативная замена W90 на фенилаланин значительно снижает взаимодействие Hsp70-BMP, не действуя на рефолдинговую или АТФазный активности Hsp70, и т.к. данная единичная замена аминокислоты не меняет электростатический профиль, возможно, что более приемлемым для объяснения взаимодействия Hsp70 с более общим анионным липидным мотивом является нечто среднее между двумя моделями. В такой модели положительный поверхностный заряд облегчает электростатические взаимодействия, и конкретные остатки, такие как W90, могут вовлекаться в определение специфичности связывания анионных липидных партнеров по связыванию - в данном случае, BMP. Любопытно, что это может потенциально вовлекать Hsp70 как более общего регулятора липидного гомеостаза в клетке. В поддержку этого существуют данные, демонстрирующие, что липидные мембраны клеток могут выступать первичными датчиками стресса, такого как лихорадка и оксидативный стресс, и, таким образом, исходными индукторами ответа на стресс. В присутствии стресса кто-то может сказать, что липидные мембраны клетки являются ключевыми компартментами, поддерживающими гомеостаз или фактически модифицирующими для запуска специфических явлений передачи сигнала в ответ на вызов клетке. Связывание Hsp70 с липидами, такими как BMP, и последующее повышение стабильности лизосомальных мембран и, возможно, другие клеточные липидные явления могут, таким образом, представлять часть общего клеточного ответа на стресс. В случае злокачественной опухоли такой ответ может послужить концом самой злокачественной опухоли, но также и с позиции более широкой эволюционной перспективы, координированный ответ белок-липид в присутствии клеточного стресса может добиться цели.
Представленные в настоящем документе данные, демонстрирующие, что только Hsp70, но не Hsc70 и Hsp70-2, способен напрямую защищать лизосомальные мембраны, свидетельствуют, что сам основной стресс-индуцируемый Hsp70, но не другие виды Hsp70, может регулировать потенциальный липидный ответ на стресс. Однако также известно, что истощение Hsp70-2 также приводит к проницаемости лизосомальной мембраны и гибели клеток, хотя в этом случае путь является непрямым, т.к. он зависит от LEDGF. Однако механизм действия LEDGF на лизосомальные мембраны остается нерешенным.
Для валидации важности взаимодействия Hsp70-BMP in vivo авторы метили BMP подвергнутыми эндоцитозу антителами и лизосомальный Hsp70 эндоцитозом AIF-производного полипептида ADD70, который в ином случае клетка не пропускает. Это подтверждает, что взаимодействие между Hsp70 и BMP служит для стабилизации лизосомальных мембран, т.к. клетки впоследствии делали значительно чувствительными к эффектам прямых разрушающих лизосомальную мембрану стимулов, также как к LMP-индуцирующему химиотерапевтическому средству цисплатин, профиль программируемой гибели клеток которых характеризуют как часть данного проекта. Ранее показано, что экспрессия ADD70 делает злокачественные клетки чувствительными к множеству смертельных стимулов и снижает и онкогенность карциномы толстой кишки крысы и клеток меланомы мыши в изогенных животных. Основное отличие между данным подходом и подходом, представленным в настоящем документе, состоит в том, что авторы настоящего изобретения стремились специфически метить лизосомальный Hsp70 через эндоцитоз ADD70, в то время как в предыдущих исследованиях для мечения более широко представленного цитоплазматического Hsp70 применяли цитозольную экспрессию ADD70. Успех мечения эндолизосомального взаимодействия Hsp70-BMP также предоставлял конкретный решающий эксперимент для идеи о мечении лизосомальных компартментов посредством эндоцитоза в способах терапии, концепции, которая может иметь широкое терапевтическое применение, т.к. кто-то может представить сенсибилизацию, например, злокачественных клеток к средствам, индуцирующим лизосомальные пути гибели клеток через специфическое ингибирование лизосомо-стабилизирующей функции Hsp70. Наоборот, взаимодействие между Hsp70 и BMP может предоставлять новые стратегии лечения, основанные на цитопротекции, предоставленной лизосомо-стабилизирующей функцией экзогенно введенного Hsp70 для таких разнообразных повреждений, как панкреатит, повреждение двигательного и чувствительного нерва и светоиндуцируемое повреждение сетчатки. В действительности, концепцию применения механизма эндоцитоза для введения специфических цитотоксических соединений уже применяют в качестве доставки посредством эндоцитоза спирали BH3 с углеводородными сшивками, основанной на проапоптотическом BH3-взаимодействующем агонисте домена смерти, Bid, который, как показано, индуцирует апоптоз в лейкозных клетках. Данный процесс зависит от выхода интактной спирали BH3 из эндоцитозного компартмента и активации Bax и Bak для индукции высвобождения цитохрома С и активирует митохондриальную программу апоптоза. Однако механизм выхода из эндоцитозной системы, к сожалению, не рассматривается в данной работе.
Как показано в настоящем документе, взаимодействие между Hsp70 и BMP зависит от АТФазного домена Hsp70. Любопытно, что недавние сообщения о кошапероне Hsp70, Hsp70-связывающем белке 1 (HspBP1) может подчеркнуть значение данной положительно заряженной области Hsp70. Исследование кристаллической структуры HspBP1, образующего комплекс с частью АТФазного домена Hsp70, выявило, что взаимодействие между ними опосредуется изогнутым, полностью α-спиральным слоем в HspBP1, содержащим четыре армадилл-подобных повтора. Вогнутая поверхность данного изогнутого слоя охватывает выступ II АТФазного домена, тот же выступ, который формирует основную часть электростатически положительно заряженного объема АТФазного домена Hsp70, который, как утверждают авторы, опосредует взаимодействие между Hsp70 и BMP. Дальнейшая перспектива этого предоставляется другим исследованием, в котором 14 линий злокачественных клеток характеризовали в отношении их относительных уровней Hsp70/HspBP1. В данном другом исследовании обнаруживали, что клеточные линии с высоким молярным отношением HspBP1/Hsp70 более восприимчивы к противоопухолевым лекарственным средствам, чем линии с низким отношением, а также, что сверхэкспрессия HspBP1 способствует проницаемости лизосомальной мембраны. Основываясь на данных сообщениях и данных, представленных в этом примере, кто-либо может говорить в пользу модели, в которой HspBP1 посредством связывания с положительно заряженной областью АТФазного домена Hsp70 разрушает данное взаимодействие с BMP и, таким образом, его стабилизирующее действие на эндолизосомальные мембраны, приводя к повышению чувствительности LMP-индуцирующим стимулам. По этой причине домен HspBP1 с повторами армадилла потенциально может формировать основу рационального конструирования лекарственного средства, равно как и аргумент в пользу ADD70. Эффективность таких HspBP1-производных молекул легко тестировать в системах, описываемых в настоящем документе, и она представляет собой интересный путь к дальнейшему применению молекулярного механизма, описываемого в настоящем документе.
Как показывают авторы в настоящем документе, Hsp70 связывается с BMP с высокой аффинностью при кислом pH 4,5, даже почти в 2 раза выше, чем в случае "классического" партнера по связыванию BMP кислой сфингомиелиназы (aSMaзы). Любопытно, что BMP служит стимулирующим кофактором для ферментативного гидролиза не только сфингомиелина посредством aSMaзы, но и большей части мембранно-связанных сфинголипидов, т.к. он также функционирует как кофактор для белков-активаторов сфинголипидов (SAP/сапозины) A-D. Таким образом, очевидным вопросом является, изменяет ли каким-либо образом Hsp70 посредством связывания с BMP связывающие свойства aSMaзы и сапозинов, модифицируя этим катаболизм мембранных сфинголипидов и гликосфинголипидов и синтез нижестоящих эффекторных молекул, таких как церамид и его метаболиты, церамид-1-фосфат, сфингозин и сфингозин-1-фосфат, все из которых вовлечены в выживание клетки и гибель. В действительности, авторы обнаруживали, что Hsp70 способен модулировать связывание aSMaзы с содержащими BMP липосомами при pH 4,5 в зависимости от концентрации Hsp70. Как можно видеть, низкие концентрации (3-150 нМ) Hsp70 облегчают взаимодействие aSMaзы с липосомами BMP-Hsp70, в то время как более высокие концентрации Hsp70 (300-1500 нМ) обладают обратным действием. Хотя нашей рабочей концентрацией в среде, когда добавляли Hsp70 для эндоцитоза, являлось 300 нМ, трудно на основе этого оценивать введенную внутрилизосомальную концентрацию, и любые умозаключения о том, какое действие может оказывать Hsp70 на активность aSMase in vivo, остаются теоретическими. Однако окрашивание трансгенных по Hsp70 iMEF (Hsp70-TG) и iMEF дикого типа (WT) с моноклональными антителами против церамида выявило, что Hsp70-трансгенные мыши демонстрируют четкую положительную регуляцию церамида, которая присутствует в характерной структуре "узлы на веревке" на периферии клеток, а также рядом с ядром. Дальнейший анализ церамидного iMEF посредством выделения липидов и последующей масс-спектроскопии подтвердил эти данные, т.к. совокупные уровни церамида от, в среднем, 10,2 нг церамида/мг белка для iMEF-WT до 14,9 нг/мг для трансгенных по Hsp70 iMEF. Кроме того, авторы подтверждают, что данный эффект можно приписывать действию Hsp70, т.к. авторы также профилировали наши нагруженные rHsp70 клетки U-2-OS (т.е. 300 нМ rHsp70 в полной среде в течение 24 часов, аналогично всем другим экспериментам по эндоцитозу Hsp70, представленным в настоящем документе). Количественный анализ церамида в нагруженных Hsp70 клетках U-2-OS демонстрировал повышение совокупных уровней церамида от 2,99 нг церамида/мг белка для контрольных клеток до 5,10 нг/мг для нагруженных Hsp70 клеток (на момент написания эксперимент проводили только один раз). Однако, собранные вместе, все они подтверждают роль Hsp70 в модуляции уровней церамида в клетках, хотя, безусловно, необходима дальнейшая валидация. Кроме того, если эти данные можно подтвердить, само собой возникает ряд вопросов, таких как компартментализация видов церамида, количественный анализ видов церамида (которых существует, по меньшей мере, 50 различных видов молекул), анализ профиля уровней церамида при различных стрессах, статус трансформации клеток и т.д.
Любопытно, что в предыдущем исследовании рассматривали один из данных вопросов, который показал, что тепловой шок (42,5ºC в течение 2 часов) вызывает накопление церамида в лимфоцитах острого лейкоза Molt-4. Данное накопление можно блокировать фармакологическими ингибиторами фумонизин B1 и мириоцин, последний из которых относится к специфическим ингибиторам синтеза церамида de novo, т.к. он блокирует действие сериновой пальмитоилтрансферазы, фермента, который инициирует синтез de novo новых сфинголипидов из серина пальмитоил-КоА. Частный механизм данного повышения синтеза церамида de novo описывали на дрожжах, у которых тепловой стресс индуцирует острый приток серина в ER, что запускает синтез de novo. Интересно тестировать, можно ли модулировать повышение уровней церамида, наблюдаемое после эндоцитоза rHsp70, фармакологическими ингибиторами или наблюдаемое повышение связано с катаболическими путями деградации сфинголипидов и стимуляции этого посредством связывания Hsp70 с BMP. Безусловно, также можно выдвигать гипотезу о составной модели. В данной модели исходный тепловой стресс может приводить к флюидизации мембраны, приток серина быстрой инициации синтеза сфинголипидов de novo. Впоследствии индукция Hsp70 вследствие теплового стресса может приводить к повышению уровней Hsp70 в клетке, взаимодействию Hsp70 с BMP, повышению активности aSMaзы, а также, возможно, активности SAP, приводя к синтезу церамида катаболическим путем. Данный вторичный ответ может дополнять исходную индукцию de novo или, возможно, принимать на себя вместо нее, т.к. продолжающийся ответ de novo зависит от продолжающегося получения серина и пальмитоил-KoA. Однако необходимо тестировать, является ли защита клеток следствием повышения самого церамида или, возможно, ее обеспечивают измененные уровни его вышестоящих и нижестоящих метаболитов.
На данном этапе остается ответить на некоторые основные вопросы: Каким образом Hsp70 заканчивается во внеклеточном окружении и внутри эндолизосомального компартмента? Hsp70 секретируется и затем захватывается посредством эндоцитоза? - или Он присутствует внутри лизосом или более специализированных секреторных лизосом, ожидая высвобождающего сигнала в виде стресса? И возможно, более важно - Какова биологическая значимость присутствия Hsp70 во внеклеточном окружении?
Хотя исследование, представленное в данной работе, неспособно ответить на эти комплексные вопросы, можно делать некоторые умозаключения. Во-первых, Hsp70 может подвергаться эндоцитозу во всех тестируемых в данном проекте клеточных линиях, свидетельствуя об общем пути распознавания внеклеточного Hsp70 (eHsp70). Это соответствует данным, демонстрирующим, что eHsp70 может связываться с рядом рецепторов на разных субпопуляциях лейкоцитов. Вовлеченные в распознавание внеклеточного Hsp70 (eHsp70) рецепторы в основном включают рецепторы распознавания паттерна (PRR) и состоят из множества рецепторов из различных семейств рецепторов, таких как толл-подобные рецепторы (TLR), скевенджер-рецепторы и лектины типа C. Поскольку при работе над данным проектом не рассматривали, по какому исходному механизму Hsp70 подвергается эндоцитозу (рецептор-опосредованный, рафт-зависимый, клатрин-зависимый и т.д.), то нельзя указывать, отвечают ли PRR за наблюдаемый в наших системах эндоцитоз eHsp70. Однако 10-кратный избыток немеченного Hsp70 не может конкурировать с захватом меченного AF488 Hsp70 в клетках U-2-OS и iMEF, и наоборот, эндоцитоз значительно усиливался в присутствии избытка немеченного Hsp70, что, в некоторой степени, свидетельствует против насыщаемого механизма захвата.
Внимание в области иммунологии в основном уделяли цитокиновому ответу и активации врожденной иммунной защиты, вызванной связыванием eHsp70 с PRR и, таким образом, не очень много внимания уделяли действию eHsp70 после связывания рецептора и инициации передачи сигнала.
Механизм высвобождения Hsp70 во внеклеточное окружение и эффекты Hsp70, в некоторой степени, уже рассматривали в настоящем документе, хотя все еще не хватает удовлетворительного молекулярного проникновения в суть этих волнующих механизмов. Тем не менее, существует множество доказательств присутствия Hsp70 в системе кровообращения после стресса, и накапливающиеся данные подтверждают роль eHsp70, стресс-индуцируемого или экзогенно доставленного, в нейропротекции, а также в стимулировании первичной системы иммунной защиты. В отношении высвобождения Hsp70, первое доказательство переноса Hsp70 из одной клетки в другую пришло из исследований на гигантском аксоне кальмара, и при воспроизведении данных результатов на культивируемых эмбриональных клетках крысы представляли доказательство того, что неклассический путь экзоцитоза отвечает за высвобождение Hsp70.
Предполагают, что Hsp70 вместе с другими белками теплового шока высвобождаются только в патологических условиях, приводящих к некротической гибели, но не при программируемой гибели. Однако недавние исследования показали, что Hsp70 может высвобождаться из интактных клеток посредством активных механизмов и что уровень стимулов определяет способ высвобождения. Важно, что нет данных об исследованиях, которые показали прямую корреляцию между eHsp70 и маркерами повреждения мышц, хотя после физических упражнений в периферическом кровотоке можно определять значительное повышение eHsp70. Наиболее убедительными и, возможно, также наиболее интересными являются открытия, демонстрирующие, что психологический стресс, такой как боязнь хищника и электрошок, может вызывать стресс-индуцируемое высвобождение eHsp70, процесс, который, как предполагают, зависит от катехоламиновой передачи сигнала. Это в особенности интересно, т.к. катехоламины через α1-адренергический рецептор могут приводить к внутриклеточному выбросу кальция, а выброс кальция может вызывать экзоцитоз экзосом, мультивезикулярных телец и лизосом. По этой причине в периоды стресса повышение норадреналина, действующего через α1-адренергические рецепторы, может приводить к выбросу кальция внутри клетки с последующим высвобождением Hsp70 в экзосомах. Доказательство данной гипотезы пришло из свидетельств о том, что eHsp70 может высвобождаться в везикулах, характеризуемых как экзосомы, но также представлено доказательство того, что eHsp70 может высвобождаться как свободный eHsp70, в клеточных системах, а также in vivo. Также предполагают, что для высвобождения eHsp70 необходимы липидные рафты, хотя это также оспаривается. Кроме того, показано, что функциональный лизосомальный компартмент необходим для высвобождения eHsp70 и что данное высвобождение сопровождается присутствием на поверхности клетки лизосомальных белков-маркеров, позволяя предполагать, что секреция зависит от слияния цитоплазматической и лизосомальной мембран.
Вне зависимости от того, присутствует ли высвобожденный Hsp70 в экзосомах или как свободный eHsp70, интересно отметить, что, очевидно, некоторые типы секреторного MVB/позднего эндосомального/лизосомального компартмента вовлекаются во все способы высвобождения. Основываясь на этих данных и полученных в настоящем документе результатах, можно сформулировать более комплексную гипотезу о том, как Hsp70 проникает из цитозоля во внеклеточное окружение. Однако высвобождение Hsp70 зависит от повышения внутриклеточного кальция, т.к. он служит сигналом для экзоцитоза эндолизосом. Однако присутствие Hsp70 в данном компартменте зависит от взаимодействия Hsp70 и BMP, как описано в настоящем документе, т.к. Hsp70 эффективно агрегирует на BMP-содержащих внутренних мембранах в поздних эндосомах/MVB/лизосомах. Hsp70 может поступать в поздние эндосомы и лизосомы посредством внеклеточного захвата, такого как эндоцитоз, как также описано в настоящем документе, или посредством инвагинаций внешних мембран ранних и поздних эндосом, а также лизосом, которые захватывают внутриклеточный Hsp70 и BMP вблизи. Кислотность компартмента поддерживает строгое предпочтение локализации Hsp70 на BMP-содержащих мембранах. После экзоцитоза некоторая часть Hsp70 все еще связана с BMP-содержащими экзосомами, но нейтральный pH, встречающийся во внеклеточном окружении, скорее способствует значительному сдвигу равновесия Hsp70-BMP в сторону более несвязанного Hsp70, приводя к свободному, а также связанному с экзосомами Hsp70, который затем может выполнять свои внеклеточные функции.
В конечном итоге, представленные в настоящем документе данные демонстрируют, что Hsp70 прямо и pH-зависимо взаимодействует с эндолизосомальным анионным фосфолипидом BMP. Авторы демонстрируют, что связывание Hsp70 с BMP опосредуется АТФазным доменом Hsp70, вовлекающим триптофан 90 и что данное взаимодействие приводит к стабилизации эндолизосомальных мембран, возможно, посредством влияния на активность других BMP-связывающих белков. Авторы также показывают, что объяснение данного молекулярного механизма открывает новые волнующие возможности сенсибилизации злокачественных клеток к средствам, индуцирующим лизосомальные пути гибели клеток посредством специфического ингибирования лизосомо-стабилизирующей функции Hsp70. Наоборот, взаимодействие между Hsp70 и BMP может предоставлять новые стратегии лечения, основанные на цитопротекции, вызываемой лизосомо-стабилизирующей функцией экзогенно введенного Hsp70.
Пример 2: Взаимодействие между Hsp70 и бис(моноацилглицеро)фосфатом активирует кислую сфингомиелиназу, стабилизирует лизосомальные мембраны и способствует выживанию клеток
Белок теплового шока 70 (Hsp70) является эволюционно высококонсервативным молекулярным шапероном, способствующим выживанию подвергнутых стрессу клеток посредством ингибирования проницаемости лизосомальной мембраны, признака стресс-индуцируемой гибели клеток. Ключи к молекулярному механизму этого могут лежать в недавно описанном, ассоциированном со стрессом и злокачественными опухолями переносе небольших порций Hsp70 в лизосомальный компартмент. В настоящем документе авторы показывают, что Hsp70 стабилизирует лизосомы посредством повышения активности кислой сфингомиелиназы (ASM), лизосомальной липазы, гидролизующей сфингомиелин до церамида и фосфорилхолина. В кислом окружении Hsp70 с высокой аффинностью и специфичностью связывается с эндолизосомальным анионным фосфолипидом бис(моноацилглицеро)фосфатом (BMP), важным кофактором для ASM, таким образом облегчая связывание ASM с BMP и стимулируя активность ASM. Ингибирование взаимодействия Hsp70-BMP антителами к BMP или точковой мутацией (W90A) в Hsp70, а также ингибирование активности ASM дезипрамином, эффективно реверсирует Hsp70-опосредуемую стабилизацию лизосом. Примечательно, что сниженная активность ASM в клетках от пациентов с болезнью Ниманна-Пика A (NPDA), тяжелой лизосомной болезни накопления, вызванной мутациями в гене ASM, также ассоциирована со значительным снижением стабильности лизосом, и данный фенотип можно эффективно корректировать восстановлением активности лизосомальной ASM посредством лечения рекомбинантным Hsp70 или ASM. Взятые вместе, эти данные открывают волнующие возможности лечения лизосомных болезней накопления и злокачественных опухолей не пропускаемыми клеткой соединениями, которые входят в просвет лизосом посредством эндоцитозного пути доставки.
Лизосомальные протеазы, катепсины, являются важными эффекторами в эволюционно консервативных программах гибели клеток, индуцируемых большим разнообразием стрессов. Катепсин-зависимая гибель клеток характеризуется ранней проницаемостью лизосомальной мембраны и последующим перемещением катепсинов в цитозоль, где они могут инициировать каспаза-зависимые и -независимые пути гибели клеток. Для исследования, является ли лизосомальная локализация ключевой для описанной способности Hsp70 стабилизировать лизосомальные мембраны и защищать клетки от стресс-индуцируемой гибели клеток, авторы воспользовались преимуществом клеточного механизма эндоцитоза для мечения рекомбинантного Hsp70 (rHsp70) в лизосомах. Иммуноцитохимический и биохимический анализы клеток остеосаркомы U-2-OS, инкубированных с меченным флуорохромом rHsp70, выявил эффективный захват rHsp70, его специфическую колокализацию с поздними эндосомальными и лизосомальными маркерами и связывание с лизосомальными мембранами (фиг. 5a, b и фиг. 9). Применяя визуализацию в реальном времени для наблюдения за целостностью лизосомальной мембраны (фиг. 5c), авторы показали, что подвергнутый эндоцитозу rHsp70 защищает лизосомы от фотоокисления (фиг. 5d). Кроме того, малые интерферирующие РНК (миРНК), специфичные для Hsp70, делали лизосомы чувствительными к фотоокислению, и данный эффект полностью реверсировался подвергнутым эндоцитозу rHsp70, соответствующим образом демонстрируя, что протективное действие эндогенного Hsp70 опосредуется небольшой фракцией белка в просвете лизосом (фиг. 5e). Несмотря на схожий захват (данные не указаны), не наблюдали стабилизации лизосом с рекомбинантным Hsc70 и Hsp70-2, которые обладают 86% и 84% гомологией аминокислотной последовательности с Hsp70, соответственно (фиг. 5d).
Присутствие Hsp70 в лизосомальных мембранах и его способность выдерживать гидролитическое лизосомальное окружение позволяют предполагать, что он связан с липидами лизосомальной мембраны. Таким образом, авторы исследовали взаимодействие Hsp70 с пальмитоил-олеоил-фосфатидилхолином (POPC) больших однослойных везикул (LUV), содержащих различные мембранно-ассоциированные анионные липиды, т.е. пальмитоил-олеоил-фосфатидилсерин (POPS; первично в цитоплазматической мембране), кардиолипин (первично митохондриальной) и BMP (первично в поздних эндосомах/лизосомах). Принимая во внимание возрастающее кислое окружение эндолизосомального компартмента после созревания лизосом, авторы сравнивали взаимодействие белок-липиды в нейтральных (pH 7,4) и кислых (pH 6,0) условиях (фиг. 6a). При pH 7,4 rHsp70 вызывает небольшое относительное изменение в рассеянии света под углом 90° в POPC липосомах, свидетельствующее об очень слабом связывании. Как сообщалось ранее для POPS, все отрицательно заряженные липиды усиливают связывание rHsp70 с липосомами при нейтральном pH приблизительно в 4 раза, независимо от плотности заряда на поверхности липосомы (в диапазоне от -1 до -2) (фиг. 6a). Примечательно, что связывание с BMP почти в 20 раз сильнее при кислом pH по сравнению с нейтральным pH, в то время как связывание с POPS лишь незначительно повышалось после закисления (фиг. 6a). Связывание Hsp70 с BMP с высокой аффинностью при кислом pH подтверждали в ряде независимых экспериментов BIAcore (фиг. 6e и 7a). Важно, что антитела к BMP, доставленные в эндолизосомальный компартмент посредством эндоцитоза, эффективно ингибируют способность rHsp70 стабилизировать лизосомы в живых клетках (фиг. 6b) и делают клетки чувствительными к цисплатину (фиг. 6c), противоопухолевому лекарственному средству, индуцирующему проницаемость лизосом.
Для исследования того, какая часть Hsp70 отвечает за связывание с BMP, авторы измеряли сдвиг флуоресценции триптофана стыковки rHsp70 и его мутантов в BMP-содержащие липосомы. Потеря сигнала в относительной интенсивности пика флуоресценции для мутанта Hsp70 с недостатком аминокислот 119-426 в амино-концевом АТФазном домене (rHsp70-ΔATP), но не с недостатком аминокислот 437-617 карбокси-концевом пептид-связывающем домене (rHsp70-ΔPBD), свидетельствует о том, что АТФазный домен требуется для высокоаффинного связывания Hsp70 с BMP (фиг. 6d). Затем авторы заменили два триптофана в Hsp70 на фенилаланины (W90F и W580F) и исследовали, какой из триптофанов отвечает за сдвиг флуоресценции, индуцируемый связыванием липида. Снижение сигнала только для rHsp70-W90F свидетельствует о том, что NH2-конец белка стыкуется в липидный слой (фиг. 6d). Более количественный анализ BIAcore взаимодействия BMP-rHsp70 подтвердил, что Hsp70 взаимодействует с BMP в основном через свой АТФазный домен (фиг. 6e). Неожиданно, мутация W90F специфически прекращает взаимодействие между rHsp70 и BMP, в то же время поддерживая структурные (фолдинг, анализированный посредством кругового дихроизма в дальней и ближней УФ-области) и функциональные (сворачивание люциферазы и гидролиз АТФ) аспекты Hsp70 как шаперона (фиг. 6e и данные не указаны). Таким образом, мутант rHsp70-W90F предоставляет авторам бесценный инструмент для дальнейшего исследования того, обеспечивает ли прямое взаимодействие между Hsp70 и BMP лизосомально-протективные свойства. В действительности, мутант rHsp70-W90F полностью теряет свою способность защищать лизосомальные мембраны от фотоокисления и клетки от цисплатин-индуцируемой лизосомальной гибели клеток, в то время как мутант rHsp70-W580F демонстрирует то же протективное действие, как и белок дикого типа (фиг. 6f и g). Важно, что мутантный Hsp70 подвергается эндоцитозу по существу также эффективно, как и Hsp70 дикого типа (данные не указаны). Таким образом, мы делали вывод, что связывание Hsp70 с BMP является существенным для лизосомально-стабилизирующего действия Hsp70.
Поскольку концентрация BMP в эндоцитозных везикулах повышается при созревании эндосом до образования лизосом, регуляция pH может являться путем, которым Hsp70 нацеливается на лизосомы. Вычисления (PROTPARAM, протеомный сервер EXPaSy, Swiss Institute of Bioinformatics) выявили, что АТФазный домен Hsp70 обладает теоретическим pl на 1,72 единицы выше, чем пептид-связывающий домен (6,62 против 4,9). Данная характеристика позволяет предполагать, что при кислом pH АТФазный домен является преимущественно положительно заряженным, что может облегчать его взаимодействие с анионными липидами. Данные, демонстрирующие зависимость взаимодействия Hsp70-BMP от кислого pH и АТФазного домена, поддерживают эту теорию. Кроме того, молекулярное моделирование электростатической поверхности АТФазного домена Hsp70 выявило, что он образует почти клиноподобную структуру с преимущественно положительным зарядом у основания клина, содержащего W90, возможно объясняющего глубокое влияние мутации W90F на способность Hsp70 взаимодействовать с BMP и стабилизировать лизосомы (фиг. 6h).
BMP связывает ASM с высокой аффинностью и стимулирует ее способность гидролизовать сфингомиелин до церамида и фосфорилхолина. Анализ BIAcore выявил, что предобработка BMP-содержащих LUV rHsp70 в субэквимолярных концентрациях облегчает последующее связывание ASM, в то время как более высокие концентрации rHsp70 демонстрируют ингибиторный эффект (фиг. 7a и 10). Примечательно, что трансгенные по Hsp70 эмбриональные фибробласты мыши (Hsp70-MEF), защищенные от стресс-индуцируемого лизосомального повреждения (фиг. 7e), демонстрируют значительно более высокую активность ASM, чем MEF дикого типа (WT-MEF), и обработка WT-MEF rHsp70 в цитопротективной концентрации (300 нМ) повышает активность ASM до уровня, сравнимого с таковым в Hsp70-MEF (фиг. 7b). Для исследования того, отвечает ли ASM за лизосомально-стабилизирующее действие, авторы обрабатывали клетки дезипрамином, хорошо описанным фармакологическим ингибитором ASM. Дезипрамин снижает жизнеспособность MEF в зависимости от дозировки, и гибель клеток ассоциирована с массивной проницаемостью лизосом, как показано посредством поступления катепсинов в цитозоль (фиг. 7c и d). Примечательно, что дезипрамин-индуцируемая гибель клеток и проницаемость лизосом значительно снижены в Hsp70-MEF по сравнению с WT-MEF. Кроме того, ингибирование ASM субтоксическими концентрациями дезипрамина реверсирует устойчивость лизосом к стрессу в Hsp70-MEF до уровня WT-MEF как доказательство ускоренной потери целостности лизосомальной мембраны после фотокисления (фиг. 7e). Кроме того, лизосомо-протективная роль подтверждается данными, демонстрирующими, что лизосомы в фибробластах от пациентов с NPDA, смертельной лизосомной болезнью накопления, вызванной мутациями в гене ASM, демонстрируют крайнюю чувствительность к индуцируемому фотоокислением повреждению (фиг. 8a). Примечательно, что rHsp70 также способен повышать ферментативную активность эндогенной мутантной ASM, а также одновременно нагруженной rASM, в клетках пациента (фиг. 8b). Повышенная активность ASM, получаемая нагружением лизосом rHsp70, rASM или их комбинацией, коррелирует с их способностью стабилизировать лизосомы и нормализовывать объем значительно увеличенного лизосомального компартмента в клетках NPDA (фиг. 8b-d). Следует отметить, что схоже с rHsp70, rASM также локализуется в лизосомах (фиг. 8b).
Собранные вместе эти данные свидетельствуют о том, что взаимодействие Hsp70-BMP стабилизирует лизосомы посредством механизма, вовлекающего скорее регуляцию метаболизма сфингомиелина, чем непосредственную физическую стабилизацию мембраны. Такой непрямое действие подтверждено тем фактом, что BMP локализуется исключительно на внешних мембранах эндолизосомального компартмента, где его основной функцией является поддержание разрушения и выделения липидов или липидных везикул посредством ASM и белков-активаторов сфинголипидов. Любопытно, что ASM-опосредованное повышение лизосомальной концентрации церамида модифицирует стерическую конформацию лизосомальных мембран и, таким образом, облегчает их слияние с другими внутриклеточными везикулами и цитоплазматической мембраной. Таким образом, изменения состава и объема лизосомальных мембран, как результат церамид-индуцированного повышения способности к слиянию, может участвовать в Hsp70-опосредованном повышении стабильности лизосом. С другой стороны, различные апоптотические стимулы индуцируют перемещение ASM в другой слой цитоплазматической мембраны, где церамид может образовывать липидные микродомены, которые функционируют как участки активации мембранно-ассоцированных сигнальных молекул, вовлеченных в апоптотическую передачу сигнала. Таким образом, церамид может оказывать противоположные эффекты на выживание клеток в зависимости от того, продуцируется ли он внутри лизосом или на цитоплазматической мембране. Описанный выше молекулярный механизм, лежащий в основе цитопротективного действия Hsp70, открывает новые волнующие возможности для сенсибилизации злокачественных клеток к средствам, индуцирующим лизосомальные пути гибели клеток посредством специфического ингибирования лизосомо-стабилизирующей функции Hsp70. Наоборот, способность экзогенно введенного rHsp70 в одиночку или в сочетании с rASM может прямо заявлять о новом лечении пациентов с NPD, возможные способы лечения которого ограничены генотерапией и терапией стволовыми клетками.
Краткое изложение способов
WT- и Hsp70-MEF получали, иммортализовывали и поддерживали, как описано в данной области. Фибробласты NPDA человека (83/24) получали из биопсии кожи 5-месячного пациента с гепатоспленомегалией. Рекомбинантные белки получали с применением векторной системы pET-16b Ni2+-аффинной очистки (Novagen) и метили Alexa Fluor 488 по протоколу производителя (Molecular Probes). Для анализа целостности лизосом авторы разрабатывали способ визуализации в реальном времени клеток, окрашенных акридиновым оранжевым, метахроматическим слабым основанием, накапливающимся в кислом компартменте клетки, окрашивая ее красным и делая чувствительной к фотоокислению. Индуцируемую фотоокислением потерю градиента pH и проникновение акридинового оранжевого в цитозоль из отдельных лизосом визуально подсчитывали как "потерю красных точек" в клетках U2-0-S и как снижение красной и повышение зеленой флуоресценции в фибробластах посредством программного обеспечения Zeiss LSM DUO. Общую и цитоплазматическую (вызванную дигитонином) активность катепсинов измеряли в обработанных дигитонином образцах с применением зонда zFR-AFC (Enzyme System Products), как описано в данной области. Спектры флуоресценции триптофана и рассеяние света липосомами под углом 90° анализировали в буфере HEPES (20 мМ HEPES, 0,1 мМ ЭДТА, pH как указано), по существу, как описано в данной области. Измерения поверхностного плазмонного резонанса проводили на иммобилизованных LUV с применением системы BIAcore 2000, как описано в данной области. Hsp70 миРНК (5'-GCCAUGACGAAAGACAACAAUCUGU-3') и контрольные Hsp70 миРНК трансфицировали с олигофектамином (Invitrogen). Иммунологический анализ проводили по стандартным протоколам. Апоптоз-подобную гибель клеток и проницаемость лизосомальной мембраны анализировали, по существу, как описано в данной области. Активность ASM анализировали посредством Amplex Red Sphingomyelinase Assay Kit (A12220) от Molecular Probes с описанными в данной области модификациями. Статистический анализ проводили с применением двустороннего парного t-критерия Стьюдента, и все группы данных тестировали на сопоставимость их отклонений с применением критерия F.
Способы
Культивирование клеток и реактивы. Клетки остеосаркомы человека U-2-OS культивировали на RPMI 1640 (Invitrogen) с добавлением 6% инактивируемой теплом телячьей сыворотки и пенициллина-стрептомицина. Трансгенные по Hsp70 соответствующие контрольные MEF получали и поддерживали, как описано в данной области. Первичные фибробласты NPDA человека выращивали на среде MEF с добавлением 1% пирувата натрия, 1% HEPES, 1% L-глутамина. Все клетки выращивали при 37°C в атмосфере увлажненного воздуха с 5% CO2 и неоднократно тестировали и признавали отрицательной на микоплазму. Если не указано иначе, все реактивы получали от Sigma-Aldrich (Sigma-Aldrich Denmark A/S).
Анализ целостности лизосом. Субконфлюэнтные клетки, инкубированные с 2 мкг/мл акридинового оранжевого в течение 15 мин при 37°C, отмывали, облучали и анализировали в сбалансированном солевом растворе Хенкса с добавлением 3% эмбриональной телячьей сыворотки. Клетки для визуализации отдельных клеток выбирали из восьми заранее определенных областей в каждой лунке в проходящем свете, после чего те же клетки немедленно визуализировали и подвергали воздействию синего света дуговой ртутной горелки USH102 100 Вт (Ushio electric), установленной в лампу U-ULS100HG (Olympus), на 20 сек. Флуоресцентную микроскопию проводили на инвертированном микроскопе Olympus IX-70 с x20 объективом LCPIanFI с NA=0,40. Утрату лизосомального градиента pH количественно измеряли посредством подсчета утраты интенсивного красного окрашивания. Для работы с более большим лизосомальным компартментом различных фибробластов, применяемых в данном исследовании, разрабатывали более усовершенствованный способ. Клетки для визуализации отдельных клеток выбирали из восьми заранее определенных областей в каждой лунке в проходящем свете, после чего те же клетки немедленно визуализировали и подвергали воздействию света 489 нм от 100 МВт диодного лазера, в то же время при лазерном сканировании, делая микрофотографии каждые 330 мс с применением конфокальной системы Zeiss LSM LIVE DUO в двух каналах, разделенных полосовыми фильтрами для 495-555 нм (зеленого) и LP650 нм (красного) света. Впоследствии получившиеся замедленные записи анализировали посредством интегрированного программного обеспечения Zeiss LSM DUO. Общую и цитоплазматическую (вызванную дигитонином) активности катепсинов измеряли в обработанных дигитонином образцах с применением зонда zFR-AFC (Enzyme System Products), как описано в данной области.
Анализ жизнеспособности клеток. Плотность клеток оценивали анализом снижения 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетранатрия бромида (MTT, SIGMA-Aldrich), по существу, как описано в данной области. Апоптоз-подобную гибель клеток оценивали посредством окрашивания клеток 0,05 мкг/мл хехстом 33342 (Molecular Probes) и подсчета клеток с конденсированными ядрами на инвертированном флуоресцентном микроскопе Olympus IX-70 (фильтр U-MWU 330-385 нм). Для каждого эксперимента подсчитывали минимум восемь выбранных случайным образом областей.
Иммунологический анализ и микроскопия. Применяемые первичные антитела включали моноклональные антитела мыши против Hsp70 (2H9; любезно предоставленные Boris Margulis, Russian Academy of Sciences, St. Petersburg, Russia), глицеральдегид-3-фосфатдегидрогеназы (GAPDH; Biogenesis), BMP (6C4), лизосомального интегрального мембранного белка-1 (H5C6; разработанные J. Thomas August и James E.K. Hildreth и полученные из Developmental Studies Hybridoma Bank, разработанные при содействии NICHD и поддерживаемые The University of Iowa, Department of Biological Sciences, Iowa City, USA). Белки, разделенные в 10% SDS-PAGE и перенесенные на нитроцеллюлозную мембрану, определяли при помощи указанных первичных антител, подходящих конъюгированных с пероксидазой вторичных антител от Dako, реактивов для вестерн-блоттинга ECL (Amersham) и прибора для считывания люминесцентного изображения (LAS-1000Plus, Fujifilm). Для иммуноцитохимии применяли конъюгированные с Alexa Fluor®-576 или Alexa Fluor®-488 вторичные антитела. Для визуализации лизосомального компартмента в живых клетках применяли Lysotracker Red®. Флуоресцентные фотографии получали с применением лазерного сканирующего микроскопа Zeiss Axiovert 100M. Количественный анализ Lysotracker и замедленные записи для целостности лизосом проводили с применением системы Zeiss LSM LIVE DUO.
Спектры флуоресценции триптофана и рассеяние липосомами света под углом 90°. Спектры флуоресценции триптофана (RFI) и рассеяние липосомами света под углом 90° (RSI) анализировали в буфере HEPES (20 мМ HEPES, 0,1 мМ ЭДТА, pH 7,4 или 6,0, как указано) с применением LUV, содержащих указанные липиды, по существу, как описано в данной области. Для RFI в 10 мкМ аликвоты добавляли LUV и регистрировали спектры после 20 мин периода стабилизации. Для RSI в 0,12 нМ аликвоты добавляли рекомбинантные белки.
Поверхностный плазмонный резонанс (BIAcore). Для получения LUV смесь липидов, содержащую 10 мол.% сфингомиелина, 50 мол.% фосфатидилхолина, 20 мол.% холестерина и 20 мол.% BMP, растворенную в органических растворителях, сузили в струе аргона и регидратировали в буфере Трис/HCI (pH 7,4). Смесь замораживали-оттаивали девять раз в жидком азоте и затем в инкубаторе при 37°C. После ультразвуковой отмывки в течение 15 мин смесь 21 раз пропускали через поликарбонатную мембрану с диаметром пор 100 нм. Измерения поверхностного плазмонного резонанса проводили с применением системы BIAcore 2000 при 25°C. LUV (общая концентрация липидов 0,1 мМ) иммобилизировали на поверхности сенсорного чипа L1 (BIAcore) в PBS (нагрузочный буфер). В качестве подвижного буфера применяли буфер ацетата натрия (50 мМ, pH 4,5). В качестве контроля непосредственно на поверхность липосом вводили кислую сфингомиелиназу (0,2 мкМ, 60 мкл в подвижном буфере). Получали единицы отклика между 4100RU-5250RU. Интересующий белок вводили в подвижный буфер при скорости потока 20 мкл/мин при указанных концентрациях. В случае, когда после rHsp70 следует rASM, rASM добавляли на 180 сек после 10 мин этапа диссоциации rHsp70 с последующим еще одним 10-мин этапом диссоциации.
Молекулярное моделирование. Анализ первичной структуры, а также молекулярное моделирование, проводили с помощью программного обеспечения, доступного на Expert Protein Analysis System (EXPaSy), протеомного сервера Swiss Institute of Bioinformatics (http://expasy.org/). Молекулярное моделирование проводили на основе кристаллической структуры АТФазного домена Hsp70 человека (код pdb: 1S3X) и субстрат-связывающего домена Hsc70 человека (код pdb: 7HSC) с помощью DeepView-Swiss PDB Viewer. Поверхностные модели основывались на кулоновском взаимодействии при pH 7,0 с применением растворителя с диэлектрической постоянной 80 (H2O).
Статистический анализ. Статистический анализ проводили с применением двустороннего парного t-критерия Стьюдента для оценки нулевой гипотезы. Базовый уровень статистической значимости определяли как 5% и все группы данных тестировали с применением критерия F на сопоставимость их отклонений. Весь статистический анализ проводили минимум на трех независимых экспериментах.
Пример 3: Действие бензилового спирта на лизосомные болезни накопления
В Примерах 2 и 3 показано, что Hsp70 обладают лизосомально-стабилизирующим действием через взаимодействие с BMP. Для оценки того, наблюдается ли данное действие также при обработке клеток химическим индуктором Hsp70, фибробласты пациента с болезнью Ниманна-Пика типа A (NPDA) обрабатывали низкомолекулярным индуктором Hsp70; бензиловым спиртом (BA). Результаты показаны на фиг. 11. Во-первых, клетки NPDA обрабатывали увеличивающимися дозами BA (0, 20, 30, 35, 40, 45 мМ), лизировали и анализировали посредством вестерн-блоттинга. То же количество белка добавляли в каждую лунку. Экспрессию белка Hsp70 оценивали по каждому условию, и показали, что BA индуцирует экспрессию Hsp70 в зависимости от дозировки (первичные антитела: Stressgen SPA-810, специфичные к Hsp70). Затем оценивали стабильность лизосом NPDA Götz после обработки 40 мМ BA с применением тех же способов, как описано в примере 2. Наблюдали повышенную стабильность лизосом в ответ на BA. В конечном итоге, оценивали площадь поперечного сечения лизосом в клетках NPDA Götz после обработки 40 мМ BA с применением тех же способов, как описано в примере 2. Наблюдали снижение патологии.
Реферат
Изобретение относится к области биотехнологии. Настоящее изобретение относится к области модуляции ферментативной активности посредством использования взаимодействия между молекулярным шапероном Hsp70 и лизосомальным фосфолипидом бис(моноацилглицеро)фосфатом (BMP). Взаимодействие Hsp70-BMP модулирует активность ферментов лизосомального компартмента, взаимодействующих с BMP, и, таким образом, настоящее изобретение представляет средства реверсирования патологии лизосомных болезней накопления. Изобретение может быть использовано в медицине. 3 н. и 18 з.п.ф-лы, 16 ил., 2 табл., 3 пр.

Комментарии