Селективные к bcl-2 агенты, вызывающие апоптоз, для лечения рака и иммунных заболеваний - RU2621052C2
Код документа: RU2621052C2
Чертежи


Описание
В данной заявке заявлен приоритет по предварительной заявке Соединенных Штатов № 61/120275, поданной 5 декабря 2008 года, и предварительной заявке Соединенных Штатов № 61/181180, поданной 26 мая 2009 года, которые включены в настоящее описание ссылкой во всей полноте.
Область техники, к которой относится изобретение
Данное изобретение относится к соединениям, которые селективно ингибируют активность антиапоптотических белков семейства Bcl-2, к композициям, содержащим данные соединения, и к способам лечения заболеваний, при которых экспрессируются антиапоптотические белки Bcl-2.
Уровень техники
Антиапоптотические белки семейства Bcl-2 связаны с рядом заболеваний и исследуются в качестве возможных мишеней для терапевтических лекарственных средств. Данные мишени для интервенционного терапевтического лечения включают, например, белки Bcl-2, Bcl-XL и Bcl-w семейства Bcl-2. Недавно в поданных от лица заявителя РСТ/US/2004/36770, опубликованной как WO 2005/049593, и РСТ/US/2004/367911, опубликованной как WO 2005/049594, сообщалось об ингибиторах белков семейства Bcl-2. Несмотря на то что в данной области техники известны ингибиторы, обладающие высокой степенью связывания с белком-мишенью, способность соединения к связыванию является лишь одним из множества параметров, которые необходимо рассматривать. Одна из задач заключается в получении соединений, предпочтительно связывающихся, то есть селективных по отношению к одному белку по сравнению с другим белком. Известно, что для проявления данной селективности соединение должно не только проявлять высокое сродство к связыванию с конкретным белком, но также иметь более низкое сродство к связыванию с другими белками.
Типичной мерой сродства к связыванию ингибитора антиапоптотического белка является равновесие между процессами связывания и диссоциации между белком и ингибитором (Ki). Константа ингибирования (Ki) представляет собой константу диссоциации комплекса фермент-ингибитор или комплекса белок/низкомолекулярное соединение, где низкомолекулярное соединение ингибирует связывание одного белка с другим белком. Таким образом, большое значение Ki указывает на низкое сродство к связыванию, а небольшое значение Ki указывает на высокое сродство к связыванию.
Типичной мерой клеточной активности ингибитора антиапоптотического белка является концентрация, вызывающая 50% клеточный эффект (ЕС50).
Соответственно, авторами изобретения найдено, что хотя соединения, которые известны в данной области техники, используются для лечения различных видов рака и иммунных заболеваний, они неселективны по отношению к антиапоптотическим белкам Bcl-2 по сравнению с антиапоптотическими белками Bcl-XL и, таким образом, приводят к большей вероятности побочных эффектов, характеризуемых ингибированием антиапоптотических белков Bcl-XL, таких, как тромбоцитопения.
Таким образом, данное изобретение включает ряд соединений, проявляющих неожиданные свойства относительно своей селективности к связыванию и ингибированию активности антиапоптотического белка Bcl-2 по сравнению с антиапоптотическим белком Bcl-XL, которое значительно больше, чем селективность к связыванию и ингибирования в случае соединений, представленных в РСТ/US/2004/36770 и РСТ/US/2004/367911.
Сущность изобретения
Следовательно, один из вариантов осуществления данного изобретения относится к соединениям или их терапевтически приемлемым солям, пролекарствам или солям пролекарств, которые применимы в качестве селективных ингибиторов одного или более членов семейства антиапоптотических белков, соединениям, имеющим формулу (I)

где А1 является N или С(А2);
один, или два, или три, или каждый из А2, В1, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NR1C(O)NHR1, NR1C(O)N(R1)2, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CN, CF3, C(O)OH, C(O)NH2 или C(O)OR1A; и
Y1 представляет собой H, CN, NO2, C(O)OH, F, Cl, Br, I, CF3, OCF3, CF2CF3, OCF2CF3, R17, OR17, C(O)R17, C(O)OR17, SR17, NH2, NHR17, N(R17)2, NHC(O)R17, C(O)NH2, C(O)NHR17, C(O)N(R17)2, NHS(O)R17 или NHSO2R17;
или
В1 и Y1, вместе с атомами, с которыми они связаны, образуют имидазол или триазол; и
один, или два, или каждый из А2, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NHC(O)NHR1, N(CH3)C(O)N(CH3)R1, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CF3, C(O)OH, C(O)NH2 или C(O)OR1A;
R1 представляет собой R2, R3, R4 или R5;
R1A представляет собой С1-С6-алкил, С3-С6-алкенил или С3-С6-алкинил;
R2 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R2A; R2A представляет собой циклоалкан или гетероциклоалкан;
R3 представляет собой гетероарил, который не конденсирован или конденсирован с бензолом, гетероареном или R3A; R3A представляет собой циклоалкан или гетероциклоалкан;
R4 представляет собой циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R4A; R4A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R5 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R6, NC(R6A)(R6B), R7, OR7, SR7, S(O)R7, SO2R7, NHR7, N(R7)2, C(O)R7, C(O)NH2, C(O)NHR7, NHC(O)R7, NHSO2R7, NHC(O)OR7, SO2NH2, SO2NHR7, SO2N(R7)2, NHC(O)NH2, NHC(O)NHR7, NHC(O)CH(CH3)NHC(O)CH(CH3)NH2, NHC(O)CH(CH3)NHC(O)CH(CH3)NHR1, OH, (O), C(O)OH, (O), N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R6 представляет собой С2-С5-спироалкил, каждый из которых не замещен или замещен ОН, (O), N3, CN, CF3, CF2CF3, F, Cl, Br, I, NH2, NH(CH3) или N(CH3)2;
R6A и R6B представляют собой независимо выбранный алкил или вместе с N, с которым они связаны, образуют R6C;
R6C представляет собой азиридин-1-ил, азетидин-1-ил, пирролидин-1-ил или пиперидин-1-ил, каждый из которых содержит СН2 фрагмент, незамененный или замененный на О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH;
R7 представляет собой R8, R9, R10 или R11;
R8 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R8A;
R8A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R9 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R9A; R9A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R10 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R10A; R10A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R11 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R12, OR12, NHR12, N(R12)2, C(O)NH2, C(O)NHR12, C(O)N(R12)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R12 представляет собой R13, R14, R15 или R16;
R13 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R13A; R13A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R14 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R14A; R14A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R15 представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R15A; R15A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R16 представляет собой алкил, алкенил или алкинил;
R17 представляет собой R18, R19, R20 или R21;
R18 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R18A; R18A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R19 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R19A; R19A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R20 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R20A; R20A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R21 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R22, OR22, NHR22, N(R22)2, C(O)NH2, C(O)NHR22, C(O)N(R22)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R22 представляет собой R23, R24 или R25;
R23 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R23A; R23A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R24 представляет собой гетероарен, который не конденсирован или конденсирован с ареном, гетероареном или R24A; R24A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R25 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R25A; R25A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
Z1 представляет собой R26 или R27, каждый из которых замещен R28, R29 или R30, каждый из которых замещен F, Cl, Br, I, CH2R37, CH(R31)(R37), C(R31)(R31A)(R37), C(O)R37, OR37, SR37, S(O)R37, SO2R37, NHR37 или N(R32)R37;
R26 представляет собой фенил, который не конденсирован или конденсирован с ареном или гетероареном;
R27 представляет собой фенил, который не конденсирован или конденсирован с ареном или гетероареном;
R28 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R28A; R28A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R29 представляет собой гетероарил или R29A; R29A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R30 представляет собой циклоалкил или циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R30A; R30A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R31 и R31A независимо представляют собой F, Cl, Br или алкил или взяты вместе и образуют С2-С5-спироалкил;
R32 представляет собой R33, C(O)R33 или C(O)OR33;
R33 представляет собой R34 или R35;
R34 представляет собой фенил, который не конденсирован или конденсирован с арилом, гетероарилом или R34A; R34A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R35 представляет собой алкил, который не замещен или замещен R36;
R36 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R36A; R36A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R37 представляет собой R38, R39 или R40, каждый из которых замещен F, Cl, Br, I, R41, OR41, NHR41, N(R41)2, NHC(O)OR41, SR41, S(O)R41 или SO2R41;
R38 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R38A; R38A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R39 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R39A; R39A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R40 представляет собой С3-С8-циклоалкил или С4-С8-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R40A; R40A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R41 представляет собой R42, R43, R44 или R45;
R42 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R42A; R42A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R43 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R43A; R43A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R44 представляет собой С3-С9-циклоалкил или С4-С7-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R44A; R44A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R45 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R46, OR46, NHR46, N(R46)2, C(O)NH2, C(O)NHR46, C(O)N(R46)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R46 представляет собой R47, R48 или R49;
R47 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R47A; R47A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R48 представляет собой гетероарил или R48A; R48A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R49 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R49A; R49A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
где фрагменты, представленные R26 и R27, дополнительно замещены одним, или двумя, или тремя независимо выбранными из R50A, OR50A, SR50A, S(O)R50A, SO2R50A или NHR50A;
R50A представляет собой R51A, R52A, R53A или R54A;
R51A представляет собой фенил, который не конденсирован или конденсирован с бензолом, гетероареном или R51AA,
где R51AA представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52A представляет собой гетероарил;
R53A представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53AA,
где R53AA представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R54A представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55AA, OR55AA, SR55AA, S(O)R55AA, SO2R55AA, NHR55AA, N(R55AA)2, С(O)R55AA, C(O)NH2, C(O)NHR55AA, NHC(О)R55AA, NHSO2R55AA, NHC(О)OR55AA, SO2NH2, SO2NHR55AA, SO2N(R55AA)2, NHC(О)NH2, NHC(О)NHR55AA, OH, (O), C(O)OH, N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55AA представляет собой алкил, алкенил, алкинил, фенил или гетероарил или R56A;
R56A представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N;
где фрагменты, представленные R2, R3, R4, R6, R6C, R8, R8A, R9, R10, R13, R14, R15, R18, R19, R20, R23, R24, R25, R26, R27, R28, R29, R30, R34, R36, R38, R39, R40, R42, R43, R44, R47, R48 и R49, независимо не замещены, дополнительно не замещены, замещены или дополнительно замещены одним, или двумя, или тремя, четырьмя или пятью заместителями, независимо выбранными из R50, OR50, SR50, S(O)R50, SO2R50, С(O)R50, СО(O)R50, ОС(O)R50, ОС(O)OR50, NH2, NHR50, N(R50)2, C(O)NH2, C(O)NHR50, C(O)N(R50)2, C(O)NHOH, C(O)NHOR50, C(O)NHSO2R50, C(O)NR55SO2R50, SO2NH2, SO2NHR50, SO2N(R50)2, CF3, CF2CF3, C(O)H, C(O)OH, C(N)NH2, C(N)NHR50, C(N)N(R50)2, OH, (O), CN, N3, NO2, CF3, CF2CF3, OCF3, OCF2CF3, F, Cl, Br или I;
R50 представляет собой R51, R52, R53 или R54;
R51 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R51B; R51B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52 представляет собой гетероарил;
R53 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53B,
где R53B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R54 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55, OR55, SR55, S(O)R55, SO2R55, NHR55, N(R55)2, С(O)R55, C(O)NH2, C(O)NHR55, NHC(О)R55, NHSO2R55, NHC(О)OR55, SO2NH2, SO2NHR55, SO2N(R55)2, NHC(О)NH2, NHC(О)NHR55, OH, (O), C(O)OH, N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55 представляет собой алкил, алкенил, алкинил, фенил, гетероарил или R56,
где алкил, алкенил, алкинил не замещены или замещены ОСН3; и
R56 представляет собой С3-С8-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N.
Другой вариант осуществления данного изобретения относится к соединениям или их терапевтически приемлемым солям, пролекарствам или солям пролекарств, которые применимы в качестве селективных ингибиторов антиапоптотических белков Bcl-2, соединениям, имеющим формулу (II)

где
R100 такой, как описано в случае заместителей при R26;
n равно 0, 1, 2 или 3;
А1 является N или С(А2);
один, или два, или три, или каждый из А2, В1, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NR1C(O)NHR1, NR1C(O)N(R1)2, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CN, CF3, C(O)OH, C(O)NH2 или C(O)OR1A; и
Y1 представляет собой H, CN, NO2, C(O)OH, F, Cl, Br, I, CF3, OCF3, CF2CF3, OCF2CF3, R17, OR17, C(O)R17, C(O)OR17, SR17, NH2, NHR17, N(R17)2, NHC(O)R17, C(O)NH2, C(O)NHR17, C(O)N(R17)2, NHS(O)R17 или NHSO2R17;
или
В1 и Y1, вместе с атомами, с которыми они связаны, образуют имидазол или триазол; и
один или два или каждый из А2, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NHC(O)NHR1, N(CH3)C(O)N(CH3)R1, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CF3, C(O)OH, C(O)NH2 или C(O)OR1A;
R1 представляет собой R2, R3, R4 или R5;
R1A представляет собой С1-С6-алкил, С3-С6-алкенил или С3-С6-алкинил;
R2 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R2A; R2A представляет собой циклоалкан или гетероциклоалкан;
R3 представляет собой гетероарил, который не конденсирован или конденсирован с бензолом, гетероареном или R3A; R3A представляет собой циклоалкан или гетероциклоалкан;
R4 представляет собой циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R4A; R4A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R5 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R6, NC(R6A)(R6B), R7, OR7, SR7, S(O)R7, SO2R7, NHR7, N(R7)2, C(O)R7, C(O)NH2, C(O)NHR7, NHC(O)R7, NHSO2R7, NHC(O)OR7, SO2NH2, SO2NHR7, SO2N(R7)2, NHC(O)NH2, NHC(O)NHR7, NHC(O)CH(CH3)NHC(O)CH(CH3)NH2, NHC(O)CH(CH3)NHC(O)CH(CH3)NHR1, OH, (O), C(O)OH, (O), N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R6 представляет собой С2-С5-спироалкил, каждый из которых не замещен или замещен ОН, (O), N3, CN, CF3, CF2CF3, F, Cl, Br, I, NH2, NH(CH3) или N(CH3)2;
R6A и R6B представляют собой независимо выбранный алкил или вместе с N, с которым они связаны, образуют R6C;
R6C представляет собой азиридин-1-ил, азетидин-1-ил, пирролидин-1-ил или пиперидин-1-ил, каждый из которых содержит СН2 фрагмент, незамененный или замененный на О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH;
R7 представляет собой R8, R9, R10 или R11;
R8 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R8A;
R8A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R9 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R9A; R9A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R10 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R10A; R10A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R11 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R12, OR12, NHR12, N(R12)2, C(O)NH2, C(O)NHR12, C(O)N(R12)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R12 представляет собой R13, R14, R15 или R16;
R13 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R13A; R13A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R14 представляет собой гетероарил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R14A; R14A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R15 представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R15A; R15A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R16 представляет собой алкил, алкенил или алкинил;
R17 представляет собой R18, R19, R20 или R21;
R18 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R18A; R18A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R19 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R19A; R19A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R20 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R20A; R20A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R21 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R22, OR22, NHR22, N(R22)2, C(O)NH2, C(O)NHR22, C(O)N(R22)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R22 представляет собой R23, R24 или R25;
R23 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R23A; R23A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R24 представляет собой гетероарен, который не конденсирован или конденсирован с ареном, гетероареном или R24A; R24A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R25 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R25A; R25A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R30 представляет собой циклоалкил или циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R30A; R30A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен; каждый из которых замещен F, Cl, Br, I, CH2R37, CH(R31)(R37), C(R31)(R31A)(R37), C(O)R37, OR37, SR37, S(O)R37, SO2R37, NHR37 или N(R32)R37;
R31 и R31A независимо представляют собой F, Cl, Br или алкил или взяты вместе и образуют С2-С5-спироалкил;
R32 представляет собой R33, C(O)R33 или C(O)OR33;
R33 представляет собой R34 или R35;
R34 представляет собой фенил, который не конденсирован или конденсирован с арилом, гетероарилом или R34A; R34A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R35 представляет собой алкил, который не замещен или замещен R36;
R36 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R36A; R36A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R37 представляет собой R38, R39 или R40, каждый из которых замещен F, Cl, Br, I, R41, OR41, NHR41, N(R41)2, NHC(O)OR41, SR41, S(O)R41 или SO2R41;
R38 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R38A; R38A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R39 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R39A; R39A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R40 представляет собой С3-С8-циклоалкил или С4-С8-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R40A; R40A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R41 представляет собой R42, R43, R44 или R45;
R42 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R42A; R42A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R43 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R43A; R43A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R44 представляет собой С3-С9-циклоалкил или С4-С7-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R44A; R44A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R45 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R46, OR46, NHR46, N(R46)2, C(O)NH2, C(O)NHR46, C(O)N(R46)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R46 представляет собой R47, R48 или R49;
R47 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R47A; R47A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R48 представляет собой гетероарил или R48A; R48A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R49 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R49A; R49A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
где фрагменты, представленные R2, R3, R4, R6, R6C, R8, R8A, R9, R10, R13, R14, R15, R18, R19, R20, R23, R24, R25, R26, R27, R28, R29, R30, R34, R36, R38, R39, R40, R42, R43, R44, R47, R48 и R49, независимо не замещены, дополнительно не замещены, замещены или дополнительно замещены одним, или двумя, или тремя, или четырьмя, или пятью заместителями, независимо выбранными из R50, OR50, SR50, S(O)R50, SO2R50, С(O)R50, СО(O)R50, ОС(O)R50, ОС(O)OR50, NH2, NHR50, N(R50)2, C(O)NH2, C(O)NHR50, C(O)N(R50)2, C(O)NHOH, C(O)NHOR50, C(O)NHSO2R50, C(O)NR55SO2R50, SO2NH2, SO2NHR50, SO2N(R50)2, CF3, CF2CF3, C(O)H, C(O)OH, C(N)NH2, C(N)NHR50, C(N)N(R50)2, OH, (O), CN, N3, NO2, CF3, CF2CF3, OCF3, OCF2CF3, F, Cl, Br или I;
R50 представляет собой R51, R52, R53 или R54;
R51 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R51B; R51B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52 представляет собой гетероарил;
R53 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53B;
где R53B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R54 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55, OR55, SR55, S(O)R55, SO2R55, NHR55, N(R55)2, С(O)R55, C(O)NH2, C(O)NHR55, NHC(О)R55, NHSO2R55, NHC(О)OR55, SO2NH2, SO2NHR55, SO2N(R55)2, NHC(О)NH2, NHC(О)NHR55, OH, (O), C(O)OH, N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55 представляет собой алкил, алкенил, алкинил, фенил, гетероарил или R56;
где алкил, алкенил, алкинил не замещены или замещены ОСН3; и
R56 представляет собой С3-С8-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N.
Другой вариант осуществления данного изобретения относится к соединениям или их терапевтически приемлемым солям, пролекарствам или солям пролекарств, которые применимы в качестве селективных ингибиторов антиапоптотических белков Bcl-2, соединениям, имеющим формулу (III)
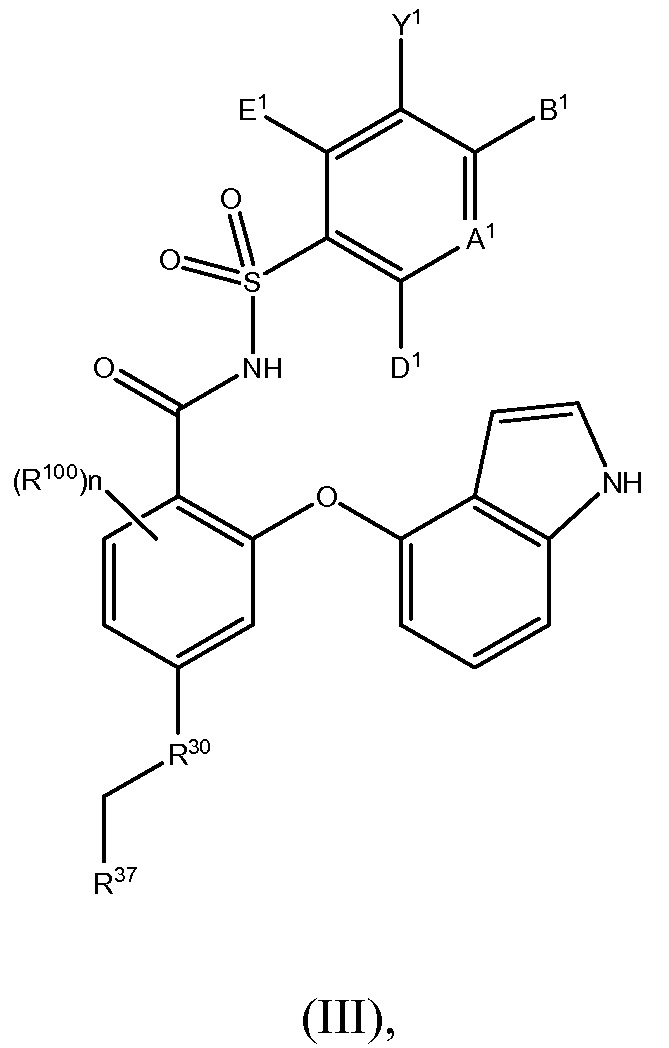
где
R100 такой, как описано в случае заместителей при R26;
n равно 0, 1, 2 или 3;
А1 является N или С(А2);
один, или два, или три, или каждый из А2, В1, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NR1C(O)NHR1, NR1C(O)N(R1)2, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CN, CF3, C(O)OH, C(O)NH2 или C(O)OR1A; и
Y1 представляет собой H, CN, NO2, C(O)OH, F, Cl, Br, I, CF3, OCF3, CF2CF3, OCF2CF3, R17, OR17, C(O)R17, C(O)OR17, SR17, NH2, NHR17, N(R17)2, NHC(O)R17, C(O)NH2, C(O)NHR17, C(O)N(R17)2, NHS(O)R17 или NHSO2R17;
или
В1 и Y1 вместе с атомами, с которыми они связаны, образуют имидазол или триазол; и
один, или два, или каждый из А2, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NHC(O)NHR1, N(CH3)C(O)N(CH3)R1, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CF3, C(O)OH, C(O)NH2 или C(O)OR1A;
R1 представляет собой R2, R3, R4 или R5;
R1A представляет собой С1-С6-алкил, С3-С6-алкенил или С3-С6-алкинил;
R2 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R2A; R2A представляет собой циклоалкан или гетероциклоалкан;
R3 представляет собой гетероарил, который не конденсирован или конденсирован с бензолом, гетероареном или R3A; R3A представляет собой циклоалкан или гетероциклоалкан;
R4 представляет собой циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R4A; R4A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R5 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R6, NC(R6A)(R6B), R7, OR7, SR7, S(O)R7, SO2R7, NHR7, N(R7)2, C(O)R7, C(O)NH2, C(O)NHR7, NHC(O)R7, NHSO2R7, NHC(O)OR7, SO2NH2, SO2NHR7, SO2N(R7)2, NHC(O)NH2, NHC(O)NHR7, NHC(O)CH(CH3)NHC(O)CH(CH3)NH2, NHC(O)CH(CH3)NHC(O)CH(CH3)NHR1, OH, (O), C(O)OH, (O), N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R6 представляет собой С2-С5-спироалкил, каждый из которых не замещен или замещен ОН, (O), N3, CN, CF3, CF2CF3, F, Cl, Br, I, NH2, NH(CH3) или N(CH3)2;
R6A и R6B представляют собой независимо выбранный алкил или вместе с N, с которым они связаны, образуют R6C;
R6C представляет собой азиридин-1-ил, азетидин-1-ил, пирролидин-1-ил или пиперидин-1-ил, каждый из которых содержит СН2 фрагмент, незамененный или замененный на О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH;
R7 представляет собой R8, R9, R10 или R11;
R8 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R8A;
R8A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R9 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R9A; R9A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R10 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R10A; R10A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R11 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R12, OR12, NHR12, N(R12)2, C(O)NH2, C(O)NHR12, C(O)N(R12)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R12 представляет собой R13, R14, R15 или R16;
R13 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R13A; R13A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R14 представляет собой гетероарил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R14A; R14A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R15 представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R15A; R15A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R16 представляет собой алкил, алкенил или алкинил;
R17 представляет собой R18, R19, R20 или R21;
R18 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R18A; R18A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R19 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R19A; R19A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R20 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R20A; R20A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R21 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R22, OR22, NHR22, N(R22)2, C(O)NH2, C(O)NHR22, C(O)N(R22)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R22 представляет собой R23, R24 или R25;
R23 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R23A; R23A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R24 представляет собой гетероарен, который не конденсирован или конденсирован с ареном, гетероареном или R24A; R24A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R25 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R25A; R25A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R30 представляет собой циклоалкил или циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R30A; R30A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен; каждый из которых замещен F, Cl, Br, I, CH2R37, CH(R31)(R37), C(R31)(R31A)(R37), C(O)R37, OR37, SR37, S(O)R37, SO2R37, NHR37 или N(R32)R37;
R31 и R31A независимо представляют собой F, Cl, Br или алкил или взяты вместе и образуют С2-С5-спироалкил;
R32 представляет собой R33, C(O)R33 или C(O)OR33;
R33 представляет собой R34 или R35;
R34 представляет собой фенил, который не конденсирован или конденсирован с арилом, гетероарилом или R34A; R34A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R35 представляет собой алкил, который не замещен или замещен R36;
R36 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R36A; R36A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R37 представляет собой R38, R39 или R40, каждый из которых замещен F, Cl, Br, I, R41, OR41, NHR41, N(R41)2, NHC(O)OR41, SR41, S(O)R41 или SO2R41;
R38 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R38A; R38A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R39 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R39A; R39A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R40 представляет собой С3-С8-циклоалкил или С4-С8-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R40A; R40A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R41 представляет собой R42, R43, R44 или R45;
R42 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R42A; R42A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R43 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R43A; R43A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R44 представляет собой С3-С9-циклоалкил или С4-С7-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R44A; R44A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R45 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R46, OR46, NHR46, N(R46)2, C(O)NH2, C(O)NHR46, C(O)N(R46)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R46 представляет собой R47, R48 или R49;
R47 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R47A; R47A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R48 представляет собой гетероарил или R48A; R48A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R49 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R49A; R49A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
где фрагменты, представленные R2, R3, R4, R6, R6C, R8, R8A, R9, R10, R13, R14, R15, R18, R19, R20, R23, R24, R25, R26, R27, R28, R29, R30, R34, R36, R38, R39, R40, R42, R43, R44, R47, R48 и R49, независимо не замещены, дополнительно не замещены, замещены или дополнительно замещены одним, или двумя, или тремя, или четырьмя, или пятью заместителями, независимо выбранными из R50, OR50, SR50, S(O)R50, SO2R50, С(O)R50, СО(O)R50, ОС(O)R50, ОС(O)OR50, NH2, NHR50, N(R50)2, C(O)NH2, C(O)NHR50, C(O)N(R50)2, C(O)NHOH, C(O)NHOR50, C(O)NHSO2R50, C(O)NR55SO2R50, SO2NH2, SO2NHR50, SO2N(R50)2, CF3, CF2CF3, C(O)H, C(O)OH, C(N)NH2, C(N)NHR50, C(N)N(R50)2, OH, (O), CN, N3, NO2, CF3, CF2CF3, OCF3, OCF2CF3, F, Cl, Br или I;
R50 представляет собой R51, R52, R53 или R54;
R51 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R51B; R51B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52 представляет собой гетероарил;
R53 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53B,
где R53B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R54 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55, OR55, SR55, S(O)R55, SO2R55, NHR55, N(R55)2, С(O)R55, C(O)NH2, C(O)NHR55, NHC(О)R55, NHSO2R55, NHC(О)OR55, SO2NH2, SO2NHR55, SO2N(R55)2, NHC(О)NH2, NHC(О)NHR55, OH, (O), C(O)OH, N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55 представляет собой алкил, алкенил, алкинил, фенил, гетероарил или R56;
где алкил, алкенил, алкинил не замещены или замещены ОСН3; и
R56 представляет собой С3-С8-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N.
Другой вариант осуществления данного изобретения относится к соединениям или их терапевтически приемлемым солям, пролекарствам или солям пролекарств, которые применимы в качестве селективных ингибиторов антиапоптотических белков Bcl-2, соединениям, имеющим формулу (IV)

где
R100 такой, как описано в случае заместителей при R26;
n равно 0, 1, 2 или 3;
А1 является N или С(А2);
один, или два, или три, или каждый из А2, В1, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NR1C(O)NHR1, NR1C(O)N(R1)2, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CN, CF3, C(O)OH, C(O)NH2 или C(O)OR1A; и
Y1 представляет собой H, CN, NO2, C(O)OH, F, Cl, Br, I, CF3, OCF3, CF2CF3, OCF2CF3, R17, OR17, C(O)R17, C(O)OR17, SR17, NH2, NHR17, N(R17)2, NHC(O)R17, C(O)NH2, C(O)NHR17, C(O)N(R17)2, NHS(O)R17 или NHSO2R17;
или
В1 и Y1 вместе с атомами, с которыми они связаны, образуют имидазол или триазол; и
один, или два, или каждый из А2, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NHC(O)NHR1, N(CH3)C(O)N(CH3)R1, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CF3, C(O)OH, C(O)NH2 или C(O)OR1A;
R1 представляет собой R2, R3, R4 или R5;
R1A представляет собой С1-С6-алкил, С3-С6-алкенил или С3-С6-алкинил;
R2 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R2A; R2A представляет собой циклоалкан или гетероциклоалкан;
R3 представляет собой гетероарил, который не конденсирован или конденсирован с бензолом, гетероареном или R3A; R3A представляет собой циклоалкан или гетероциклоалкан;
R4 представляет собой циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R4A; R4A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R5 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R6, NC(R6A)(R6B), R7, OR7, SR7, S(O)R7, SO2R7, NHR7, N(R7)2, C(O)R7, C(O)NH2, C(O)NHR7, NHC(O)R7, NHSO2R7, NHC(O)OR7, SO2NH2, SO2NHR7, SO2N(R7)2, NHC(O)NH2, NHC(O)NHR7, NHC(O)CH(CH3)NHC(O)CH(CH3)NH2, NHC(O)CH(CH3)NHC(O)CH(CH3)NHR1, OH, (O), C(O)OH, (O), N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R6 представляет собой С2-С5-спироалкил, каждый из которых не замещен или замещен ОН, (O), N3, CN, CF3, CF2CF3, F, Cl, Br, I, NH2, NH(CH3) или N(CH3)2;
R6A и R6B представляют собой независимо выбранный алкил или вместе с N, с которым они связаны, образуют R6C;
R6C представляет собой азиридин-1-ил, азетидин-1-ил, пирролидин-1-ил или пиперидин-1-ил, каждый из которых содержит СН2 фрагмент, незамененный или замененный на О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH;
R7 представляет собой R8, R9, R10 или R11;
R8 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R8A;
R8A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R9 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R9A; R9A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R10 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R10A; R10A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R11 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R12, OR12, NHR12, N(R12)2, C(O)NH2, C(O)NHR12, C(O)N(R12)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R12 представляет собой R13, R14, R15 или R16;
R13 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R13A; R13A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R14 представляет собой гетероарил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R14A; R14A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R15 представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R15A; R15A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R16 представляет собой алкил, алкенил или алкинил;
R17 представляет собой R18, R19, R20 или R21;
R18 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R18A; R18A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R19 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R19A; R19A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R20 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R20A; R20A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R21 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R22, OR22, NHR22, N(R22)2, C(O)NH2, C(O)NHR22, C(O)N(R22)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R22 представляет собой R23, R24 или R25;
R23 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R23A; R23A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R24 представляет собой гетероарен, который не конденсирован или конденсирован с ареном, гетероареном или R24A; R24A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R25 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R25A; R25A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R30 представляет собой циклоалкил или циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R30A; R30A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен; каждый из которых замещен F, Cl, Br, I, CH2R37, CH(R31)(R37), C(R31)(R31A)(R37), C(O)R37, OR37, SR37, S(O)R37, SO2R37, NHR37 или N(R32)R37;
R31 и R31A независимо представляют собой F, Cl, Br или алкил или взяты вместе и образуют С2-С5-спироалкил;
R32 представляет собой R33, C(O)R33 или C(O)OR33;
R33 представляет собой R34 или R35;
R34 представляет собой фенил, который не конденсирован или конденсирован с арилом, гетероарилом или R34A; R34A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R35 представляет собой алкил, который не замещен или замещен R36;
R36 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R36A; R36A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R37 представляет собой R38, R39 или R40, каждый из которых замещен F, Cl, Br, I, R41, OR41, NHR41, N(R41)2, NHC(O)OR41, SR41, S(O)R41 или SO2R41;
R38 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R38A; R38A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R39 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R39A; R39A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R40 представляет собой С3-С8-циклоалкил или С4-С8-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R40A; R40A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R41 представляет собой R42, R43, R44 или R45;
R42 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R42A; R42A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R43 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R43A; R43A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R44 представляет собой С3-С9-циклоалкил или С4-С7-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R44A; R44A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R45 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R46, OR46, NHR46, N(R46)2, C(O)NH2, C(O)NHR46, C(O)N(R46)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R46 представляет собой R47, R48 или R49;
R47 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R47A; R47A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R48 представляет собой гетероарил или R48A; R48A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R49 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R49A; R49A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
где фрагменты, представленные R2, R3, R4, R6, R6C, R8, R8A, R9, R10, R13, R14, R15, R18, R19, R20, R23, R24, R25, R26, R27, R28, R29, R30, R34, R36, R38, R39, R40, R42, R43, R44, R47, R48 и R49, независимо не замещены, дополнительно не замещены, замещены или дополнительно замещены одним, или двумя, или тремя, или четырьмя, или пятью заместителями, независимо выбранными из R50, OR50, SR50, S(O)R50, SO2R50, С(O)R50, СО(O)R50, ОС(O)R50, ОС(O)OR50, NH2, NHR50, N(R50)2, C(O)NH2, C(O)NHR50, C(O)N(R50)2, C(O)NHOH, C(O)NHOR50, C(O)NHSO2R50, C(O)NR55SO2R50, SO2NH2, SO2NHR50, SO2N(R50)2, CF3, CF2CF3, C(O)H, C(O)OH, C(N)NH2, C(N)NHR50, C(N)N(R50)2, OH, (O), CN, N3, NO2, CF3, CF2CF3, OCF3, OCF2CF3, F, Cl, Br или I;
R50 представляет собой R51, R52, R53 или R54;
R51 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R51B; R51B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52 представляет собой гетероарил;
R53 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53B,
где R53B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R54 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55, OR55, SR55, S(O)R55, SO2R55, NHR55, N(R55)2, С(O)R55, C(O)NH2, C(O)NHR55, NHC(О)R55, NHSO2R55, NHC(О)OR55, SO2NH2, SO2NHR55, SO2N(R55)2, NHC(О)NH2, NHC(О)NHR55, OH, (O), C(O)OH, N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55 представляет собой алкил, алкенил, алкинил, фенил, гетероарил или R56;
где алкил, алкенил, алкинил не замещены или замещены ОСН3; и
R56 представляет собой С3-С8-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N.
Следующий вариант осуществления данного изобретения относится к соединениям или их терапевтически приемлемым солям, пролекарствам или солям пролекарств, которые применимы в качестве селективных ингибиторов антиапоптотических белков Bcl-2, соединениям, имеющим формулу (V)

где
R100 такой, как описано в случае заместителей при R26;
n равно 0, 1, 2 или 3;
А1 является N или С(А2);
один, или два, или три, или каждый из А2, В1, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NR1C(O)NHR1, NR1C(O)N(R1)2, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CN, CF3, C(O)OH, C(O)NH2 или C(O)OR1A; и
Y1 представляет собой H, CN, NO2, C(O)OH, F, Cl, Br, I, CF3, OCF3, CF2CF3, OCF2CF3, R17, OR17, C(O)R17, C(O)OR17, SR17, NH2, NHR17, N(R17)2, NHC(O)R17, C(O)NH2, C(O)NHR17, C(O)N(R17)2, NHS(O)R17 или NHSO2R17;
или
В1 и Y1 вместе с атомами, с которыми они связаны, образуют имидазол или триазол; и
один, или два, или каждый из А2, D1 и E1 представляют собой независимо выбранный R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NHC(O)NHR1, N(CH3)C(O)N(CH3)R1, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CF3, C(O)OH, C(O)NH2 или C(O)OR1A;
R1 представляет собой R2, R3, R4 или R5;
R1A представляет собой С1-С6-алкил, С3-С6-алкенил или С3-С6-алкинил;
R2 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R2A; R2A представляет собой циклоалкан или гетероциклоалкан;
R3 представляет собой гетероарил, который не конденсирован или конденсирован с бензолом, гетероареном или R3A; R3A представляет собой циклоалкан или гетероциклоалкан;
R4 представляет собой циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R4A; R4A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R5 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R6, NC(R6A)(R6B), R7, OR7, SR7, S(O)R7, SO2R7, NHR7, N(R7)2, C(O)R7, C(O)NH2, C(O)NHR7, NHC(O)R7, NHSO2R7, NHC(O)OR7, SO2NH2, SO2NHR7, SO2N(R7)2, NHC(O)NH2, NHC(O)NHR7, NHC(O)CH(CH3)NHC(O)CH(CH3)NH2, NHC(O)CH(CH3)NHC(O)CH(CH3)NHR1, OH, (O), C(O)OH, (O), N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R6 представляет собой С2-С5-спироалкил, каждый из которых не замещен или замещен ОН, (O), N3, CN, CF3, CF2CF3, F, Cl, Br, I, NH2, NH(CH3) или N(CH3)2;
R6A и R6B представляют собой независимо выбранный алкил или вместе с N, с которым они связаны, образуют R6C;
R6C представляет собой азиридин-1-ил, азетидин-1-ил, пирролидин-1-ил или пиперидин-1-ил, каждый из которых содержит СН2 фрагмент, незамененный или замененный на О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH;
R7 представляет собой R8, R9, R10 или R11;
R8 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R8A;
R8A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R9 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R9A; R9A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R10 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R10A; R10A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R11 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R12, OR12, NHR12, N(R12)2, C(O)NH2, C(O)NHR12, C(O)N(R12)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R12 представляет собой R13, R14, R15 или R16;
R13 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R13A; R13A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R14 представляет собой гетероарил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R14A; R14A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R15 представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R15A; R15A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R16 представляет собой алкил, алкенил или алкинил;
R17 представляет собой R18, R19, R20 или R21;
R18 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R18A; R18A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R19 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R19A; R19A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R20 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R20A; R20A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R21 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R22, OR22, NHR22, N(R22)2, C(O)NH2, C(O)NHR22, C(O)N(R22)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R22 представляет собой R23, R24 или R25;
R23 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R23A; R23A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R24 представляет собой гетероарен, который не конденсирован или конденсирован с ареном, гетероареном или R24A; R24A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R25 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R25A; R25A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R30 представляет собой циклоалкил или циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R30A; R30A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен; каждый из которых замещен F, Cl, Br, I, CH2R37, CH(R31)(R37), C(R31)(R31A)(R37), C(O)R37, OR37, SR37, S(O)R37, SO2R37, NHR37 или N(R32)R37;
R31 и R31A независимо представляют собой F, Cl, Br или алкил или взяты вместе и образуют С2-С5-спироалкил;
R32 представляет собой R33, C(O)R33 или C(O)OR33;
R33 представляет собой R34 или R35;
R34 представляет собой фенил, который не конденсирован или конденсирован с арилом, гетероарилом или R34A; R34A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R35 представляет собой алкил, который не замещен или замещен R36;
R36 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R36A; R36A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R37 представляет собой R38, R39 или R40, каждый из которых замещен F, Cl, Br, I, R41, OR41, NHR41, N(R41)2, NHC(O)OR41, SR41, S(O)R41 или SO2R41;
R38 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R38A; R38A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R39 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R39A; R39A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R40 представляет собой С3-С8-циклоалкил или С4-С8-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R40A; R40A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R41 представляет собой R42, R43, R44 или R45;
R42 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R42A; R42A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R43 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R43A; R43A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R44 представляет собой С3-С9-циклоалкил или С4-С7-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R44A; R44A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R45 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним или двумя заместителями, независимо выбранными из R46, OR46, NHR46, N(R46)2, C(O)NH2, C(O)NHR46, C(O)N(R46)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R46 представляет собой R47, R48 или R49;
R47 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R47A; R47A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R48 представляет собой гетероарил или R48A; R48A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R49 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R49A; R49A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
где фрагменты, представленные R2, R3, R4, R6, R6C, R8, R8A, R9, R10, R13, R14, R15, R18, R19, R20, R23, R24, R25, R26, R27, R28, R29, R30, R34, R36, R38, R39, R40, R42, R43, R44, R47, R48 и R49, независимо не замещены, дополнительно не замещены, замещены или дополнительно замещены одним, или двумя, или тремя, или четырьмя, или пятью заместителями, независимо выбранными из R50, OR50, SR50, S(O)R50, SO2R50, С(O)R50, СО(O)R50, ОС(O)R50, ОС(O)OR50, NH2, NHR50, N(R50)2, C(O)NH2, C(O)NHR50, C(O)N(R50)2, C(O)NHOH, C(O)NHOR50, C(O)NHSO2R50, C(O)NR55SO2R50, SO2NH2, SO2NHR50, SO2N(R50)2, CF3, CF2CF3, C(O)H, C(O)OH, C(N)NH2, C(N)NHR50, C(N)N(R50)2, OH, (O), CN, N3, NO2, CF3, CF2CF3, OCF3, OCF2CF3, F, Cl, Br или I;
R50 представляет собой R51, R52, R53 или R54;
R51 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R51B; R51B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52 представляет собой гетероарил;
R53 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53B,
где R53B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R54 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55, OR55, SR55, S(O)R55, SO2R55, NHR55, N(R55)2, С(O)R55, C(O)NH2, C(O)NHR55, NHC(О)R55, NHSO2R55, NHC(О)OR55, SO2NH2, SO2NHR55, SO2N(R55)2, NHC(О)NH2, NHC(О)NHR55, OH, (O), C(O)OH, N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55 представляет собой алкил, алкенил, алкинил, фенил, гетероарил или R56;
где алкил, алкенил, алкинил не замещены или замещены ОСН3; и
R56 представляет собой С3-С8-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных N.
Следующий вариант осуществления относится к соединениям формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), в которых А1 представляет собой С(А2) и А2 представляет собой Н.
Следующий вариант осуществления относится к соединениям формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), в которых А1 представляет собой С(А2), А2 представляет собой Н и В1 представляет собой NHR1.
Следующий вариант осуществления относится к соединениям формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), в которых А1 представляет собой С(А2), А2 представляет собой Н, В1 представляет собой NHR1 и D1 представляет собой Н.
Следующий вариант осуществления относится к соединениям формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), в которых А1 представляет собой С(А2), А2 представляет собой Н, В1 представляет собой NHR1, D1 представляет собой Н и Е1 представляет собой Н.
Следующий вариант осуществления относится к соединениям формулы (I), формулы (II), формулы (III), формулы (IV) или формулы (V), в которых А1 представляет собой С(А2), А2 представляет собой Н, В1 представляет собой NHR1, D1 представляет собой Н, Е1 представляет собой Н и Y1 представляет собой NO2.
Еще один вариант осуществления относится к соединениям формулы (I), которые представляют собой
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-бензилокси-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(2-фенилэтокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(фенилтио)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(фенилтио)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(фенилтио)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(фенилсульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(фенилсульфинил)бензамид;
2-бензил-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-бензил-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-бензил-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(2-фенилэтил)бензамид;
2-(бензиламино)-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-анилино-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-анилино-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-метокси-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индазол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индазол-5-илокси)-N-((4-((1-метилпиперидин-4-ил))амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензамид;
4-(4-((4’-хлор-4-(пирролидин-1-илметил)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-пирролидин-1-илэтил)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((1-циклопентилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)-3-изобутилпиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(2,4-диоксо-3-азабицикло(3,2,0)гепт-3-ил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(4-метил-6-оксо-1,4,5,6-тетрагидропиридазин-3-ил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(3,3-диметил-2-оксоазетидин-1-ил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(4-нитро-2Н-1,2,3-триазол-2-ил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((2-(2-пиперидин-1-илэтокси)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-((((1-этилпирролидин-2-ил)метил)амино)карбонил)-4-метоксифенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1-нафтилокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2-нафтилокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(2-нафтилокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2-нафтилокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(хинолин-7-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(хинолин-6-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(изохинолин-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(изохинолин-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(хинолин-6-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-6-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(изохинолин-7-илокси)-N-((4-((3-(морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(изохинолин-7-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-метоксифенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-метилфенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-(трифторметил)сульфонил)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-(трифторметил)сульфонил)фенил)сульфонил)бензамид;
N-((3-((хлор(дифтор)метил)сульфонил)-4-((3-(диметиламино)пропил)амино)фенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
2-(1Н-индол-4-илокси)-4-(4-((2-(4-метоксифенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(4-(трифторметил)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(4-(трифторметокси)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(3-(трифторметил)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(3-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
N-((3-((хлор(дифтор)метил)сульфонил)-4-((1-метилпиперидин-4-ил)амино)фенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(феноксиметил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(пиридин-3-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(пиридин-3-илокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(((1R)-3-(диметиламино)-1-((фенилтио)метил)пропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(пиридин-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(пиридин-3-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(пиридин-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((2-(4-метилпиперазин-1-ил)этил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(4-метилпиперазин-1-ил)пропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил(метил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(((1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-циано-4-((3-(диметиламино)пропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-(трифторметил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(изопропил)метил)амино)пропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(3-(диметиламино)пропокси)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((2-(4-метилпиперазин-1-ил)этил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-(4-метилпиперазин-1-ил)пропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-(4-метилпиперазин-1-ил)пропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(3-(диметиламино)пропокси-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((2-(4-метилпиперазин-1-ил)этил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-(((1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-(((1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(3-(диметиламино)пропокси)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-(4-метилпиперазин-1-ил)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((1-(2,2,2-трифторэтил)пиперидин-4-ил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(((4-(диметиламино)-1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2,3-дигидро-1,4-бензодиоксин-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
5-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-1,1’-дифенил-2-карбоксамид;
5-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-1,1’-дифенил-2-карбоксамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(3-пиперидин-1-ил)пропокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(3-(диметиламино)пропокси-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(3-пиперидин-1-илпропокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(3-(диметиламино)пропокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((1-(2,2,2-трифторэтил)пиперидин-4-ил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(2-пирролидин-1-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(2-(диизопропиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2,3-дигидро-1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклоокт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклоокт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((2-(диметиламино)этил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((4-(диметиламино)бутил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((1-(фенилсульфонил)пиперидин-4-ил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((1-(хинолин-8-илсульфонил)пиперидин-4-ил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((1-(фенилсульфонил)пиперидин-4-ил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((1-(хинолин-8-илсульфонил)пиперидин-4-ил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(((1S)-3-(диметиламино)-1-тиен-2-илпропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тиен-2-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(1Н-1,2,3-триазол-1-ил)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(2Н-1,2,3-триазол-2-ил)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(2-нафтилокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(2-оксопиридин-1(2Н)-ил)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(пиридин-2-илокси)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(пиридин-4-ил)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-((трифторметил)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((3-циано-4-((3-(диметиламино)пропил)амино)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((4-метилпиперазин-1-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((1-(4’-хлор-1,1’-дифенил-2-ил)этил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
N-((4-(((4-аминотетрагидро-2Н-пиран-4-ил)метил)амино)-3-нитрофенил)сульфонил)-(4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3S)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3R)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил}сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
N-[(4-{[(3S,4R)-1-бензил-3-гидроксипиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[1-(2-мнтоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2-гидроксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[1-(2-метоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил] бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-[4-({4’-хлор-3-[3-(диметиламино)пропил]-1,1’-дифенил-2-ил}метилпиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-{4-[(4’-хлор-4-морфолин-4-ил-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[(4’-хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил]пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диметиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-[4-({4’-хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил}этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-({[4-(диметиламино)тетрагидро-2Н-пиран-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
N-({4-[(2-аминоциклогексил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-[4-({4’-хлор-4-[3-(диметиламино)проп-1-инил]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[2-(4-гидрокси-1-метилпиперидин-4-ил)этил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-2-ил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-[4-({4’-хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(циклопропилметил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил]амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил]бензамид;
4-(4-{[4’-хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-морфолин-4-илциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-2-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-4-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(2-гидроксиэтил)пиперазин-1-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3S)-1-метилпирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-фторпропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1-гидроксициклогексил)метил]амино}-3-нитрофенил}сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-гидрокси-1-тетрагидро-2Н-пиран-4-илэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-({1-[2-(1Н-пиразол-1-ил)этил]пиперидин-4-ил}амино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(метиламино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(метиламино)-3-нитрофенил]сульфонил}бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-{[4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-морфолин-4-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-[(4-{[(1-аминоциклогексил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксопирролидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-{4-[(1R)-1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[(1S)-1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(циклогексилметиламино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-3-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-иламино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3-метилоксетан-3-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метоксициклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1,1-диоксидотиоморфолин-4-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксопиперидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксоимидазолидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-пиридин-4-илэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-морфолин-4-ил-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(4-метоксипиперидин-1-ил)-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-5-пирролидин-1-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-[4-({4’-хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидротиен-3-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидротиен-3-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-(трифторметил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[2-(1,3-диоксолан-2-ил)этил]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[1-метил-5-оксопирролидин-3-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[1-метил-6-оксопиперидин-3-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид;
4-(4-{[4-(4-хлорфенил)-1-метил-1Н-пиразол-5-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-метилоксетан-3-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1-оксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1,3-тиазол-5-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2-тетрагидро-2Н-пиран-4-илэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[3-(метилсульфонил)пропил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1,1-диоксидотиоморфолин-4-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотетрагидротиен-3-ил)амино]-3-нитрофенил]сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-дифторэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4,4-дифторциклогексил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[4-(4-хлорфенил)-1-изопропил-6-оксо-1,6-дигидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил] бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[3-(метилсульфонил)пропокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[3-(метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[3-(метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-({[(3R)-4-гидрокси-1-адамантил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-({[цис-4-гидрокси-1-адамантил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид;
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидротиен-3-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-(метиламино)-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[4-(4-хлорфенил)-6-изопропоксипиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[6-(тетрагидро-2Н-пиран-4-илметокси)-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(2-метоксиэтил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
N-({4-[(1-ацетилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[1-(метилсульфонил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
N-({4-[(1-ацетилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[1-(метилсульфонил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-([3-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2R)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2S)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-морфолин-4-илэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)окси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[4-(4-хлорфенил)-1-(3-гидроксипропил)-1,2,5,6-тетрагидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
бензил 4-({[4-({[4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензоил]амино}сульфонил)-2-нитрофенил]амино}метил)пиперидин-1-карбоксилат;
N-{[3-(аминокарбонил)-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-метил-1Н-имидазол-5-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-морфолин-4-илсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотиоморфолин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил) бензамид;
N-({5-бром-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[6-[(тетрагидро-2Н-пиран-4-илметил)амино]-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3,3-диметилбутил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1S)-1-(гидроксиметил)-3-метилбутил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(2R)-тетрагидрофуран-2-илметил]амино}фенил)сульфонил] бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1R)-1-(гидроксиметил)-2-метилпропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метоксифенил)амино]-3-нитрофенил}сульфонил)бензамид;
N-[(4-{[2-(1,3-бензодиоксол-5-ил)этил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(2-оксопирролидин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-гидроксифенил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
N-{[4-({2-[4-(аминосульфонил)фенил]этил}амино)-3-нитрофенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1Н-имидазол-1-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1S)-1-фенилэтил]амино}фенил)сульфонил]бензамид;
N-({2-хлор-5-фтор-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(метилсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(метилсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-диметилтетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-[хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)окси]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илбут-2-инил)окси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-этинил-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-гидрокси-4-метоксифенил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(2,3-дигидро-1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(пиридин-3-иламино)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)-2-(пиридин-3-иламино)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)-2-(пиридин-3-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1,2,3,4-тетрагидроизохинолин-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
транс-N-({5-хлор-6-[(4-метоксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(2,2-дифторэтил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино)фенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
N-[(5-хлор-6-{[1-(цианометил)-4-фторпиперидин-4-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидрофуран-3-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
транс-N-({5-хлор-6-[(4-гидроксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил] окси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил]сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил]сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
N-[(5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил]сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил]сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(цианометил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-[2-(2-метоксиэтокси)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1- (N,N-диметилглицил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(цианометил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(3-нитро-4-{[(4-оксетан-3-илморфолин-2-ил)метил]амино}фенил)сульфонил]бензамид;
N-[(5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}окси)пиридин-3-ил]сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопропилпиперидин-4-ил)амино)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино}-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино}-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидрофуран-3-илметил)амино]фенил}сульфонил)бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
N-{[5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}метокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-{[5-хлор-6-{[(3R)-1-[2,2-дифторэтил)пирролидин-3-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-[(4-{[(4- метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
N-{[5-хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[({(2R)-4-[2-(2-метоксиэтокси)этил]морфолин-2-ил}метил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
N-[(4-{[(4-ацетилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил) бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(4-(метилсульфонил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-({4-фтор-1-[2-фтор-1-(фторметил)этил]пиперидин-4-ил}метокси)-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(2-тетрагидрофуран-2-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-цианоциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4,4-дифторциклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
N-({3-хлор-4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-тетрагидро-2Н-пиран-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропаноил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид;
N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропаноил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид;
N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид;
N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид;
4-(4-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}бензил)пиперазин-1-ил]-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид;
4-(4-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил]бензил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил]бензил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифтометил)сульфонил]фенил}сульфонил)бензамид;
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил]бензил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил]бензил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид;
4-(4-{2-[(4R,7S)-2,3,3a,4,7,7a-гексагидро-1Н-4,7-метаноинден-5-ил]бензил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-[4-(2-{5-[(1R,5S)-8-азабицикло[3.2.1]окт-8-илметил]тиен-2-ил}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-[4-(3-{5-[(1R,5S)-8-азабицикло[3.2.1]окт-8-илметил]тиен-2-ил}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
и их терапевтически приемлемым солям, пролекарствам, солям пролекарств и их метаболитам.
Следующий вариант осуществления относится к композиции для лечения рака мочевого пузыря, рака мозга, рака груди, рака костного мозга, рака шейки матки, хронического лимфолейкоза, колоректального рака, рака пищевода, гепатоцеллюлярного рака, лимфобластного лейкоза, фолликулярной лимфомы, злокачественных лимфоидных новообразований Т-клеточной или В-клеточной природы, меланомы, миелогенного лейкоза, миеломы, рака полости рта, рака яичника, немелкоклеточного рака легких, хронического лимфолейкоза, миеломы, рака предстательной железы, мелкоклеточного рака легких или рака селезенки, при этом указанная композиция включает эксципиент и терапевтически эффективное количество соединения формулы (I).
Следующий вариант осуществления относится к способу лечения рака мочевого пузыря, рака мозга, рака груди, рака костного мозга, рака шейки матки, хронического лимфолейкоза, колоректального рака, рака пищевода, гепатоцеллюлярного рака, лимфобластического лейкоза, фолликулярной лимфомы, злокачественных лимфоидных новообразований Т-клеточной или В-клеточной природы, меланомы, миелогенного лейкоза, миеломы, рака полости рта, рака яичника, немелкоклеточного рака легких, хронического лимфолейкоза, миеломы, рака предстательной железы, мелкоклеточного рака легких или рака селезенки у пациента, включающий введение пациенту терапевтически эффективного количества соединения формулы (I).
Следующий вариант осуществления относится к способу лечения рака мочевого пузыря, рака мозга, рака груди, рака костного мозга, рака шейки матки, хронического лейкоза, колоректального рака, рака пищевода, гепатоцеллюлярного рака, лимфобластического лейкоза, фолликулярной лимфомы, злокачественных лимфоидных новообразований Т-клеточной или В-клеточной природы, меланомы, миелогенного лейкоза, миеломы, рака полости рта, рака яичника, немелкоклеточного рака легких, хронического лимфолейкоза, миеломы, рака предстательной железы, мелкоклеточного рака легких или рака селезенки у пациента, включающий введение пациенту терапевтически эффективного количества соединения формулы (I) и терапевтически эффективного количества одного дополнительного терапевтического агента или нескольких дополнительных терапевтических агентов.
Подробное описание изобретения
Переменные группы в настоящем описании представлены идентификаторами (заглавными буквами с числовыми и/или буквенными надстрочными индексами) и могут быть осуществлены конкретно.
Подразумевается, что понятно, что надлежащие валентности сохраняются для всех групп и их комбинаций, что одновалентные группы, содержащие более одного атома, изображаются слева направо и связываются через свои левые концы, и что двухвалентные группы также изображаются слева направо.
Также подразумевается, что понятно, что конкретный вариант осуществления переменной группы в настоящем описании может таким же или отличным от другого конкретного варианта осуществления с тем же идентификатором.
Использованный в настоящем описании термин «алкенил» означает линейную или разветвленную углеводородную цепь, содержащую от 2 до 10 атомов углерода и содержащую, по меньшей мере, одну углерод-углеродную двойную связь. Термин “Cx-Cy алкенил” означает линейную или разветвленную углеводородную цепь, включающую по меньшей мере одну углерод-углеродную двойную связь, содержащую от х до y атомов углерода. Термин «С3-С6 алкенил» означает алкенильную группу, содержащую 3-6 атомов углерода. Представительные примеры алкенила включают, но без ограничения, бута-2,3-диенил, этенил, 2-пропенил, 2-метил-2-пропенил, 3-бутенил, 4-пентенил, 5-гексенил, 2-гептенил, 2-метил-1-гептенил и 3-деценил.
Термин «алкенилен» означает двухвалентную группу, полученную из линейного или разветвленного углеводорода, содержащего от 2 до 4 атомов углерода, и включающую, по меньшей мере, одну углерод-углеродную двойную связь. Термин «Cx-Cy алкенилен» означает двухвалентную группу, полученную из линейного или разветвленного углеводорода, содержащего, по меньшей мере, одну углерод-углеродную двойную связь, и включающую от х до y атомов углерода. Представительные примеры алкенилена включают, но без ограничения, =СН=СН- и -СН2СН=СН-.
Использованный в настоящем описании термин «алкил» означает линейную или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 10 атомов углерода. Термин “Cx-Cy алкил” означает линейный или разветвленный насыщенный углеводород, содержащий от х до y атомов углерода. Например, “C1-C6 алкил” означает линейный или разветвленный насыщенный углеводород, содержащий от 2 до 6 атомов углерода. Представительные примеры алкенилена включают, но без ограничения, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, н-гептил, н-октил, н-нонил и н-децил.
Термин «алкилен» означает двухвалентную группу, полученную из линейной или разветвленной насыщенной углеводородной цепи, содержащей от 1 до 10 атомов углерода, например, от 1 до 4 атомов углерода. Термин “Cx-Cy алкилен” означает двухвалентную группу, полученную из линейной или разветвленной насыщенной углеводородной цепи, содержащей от x до y атомов углерода. Например, “C2-C6 алкилен” означает линейный или разветвленный насыщенный углеводород, содержащий от 2 до 6 атомов углерода. Представительные примеры алкилена включают, но без ограничения, -СН2-, -СН2СН2-, -СН2СН2СН2-, -СН2СН2СН2СН2- и -СН2СН(СН3)СН2-.
Использованный в настоящем описании термин «алкинил» означает линейную или разветвленную углеводородную группу, содержащую от 2 до 10 атомов углерода и включающую, по меньшей мере, одну углерод-углеродную тройную связь. Термин “Cx-Cy алкинил” означает линейную или разветвленную группу, содержащую от х до y атомов углерода. Например, “C3-C6 алкинил” означает линейную или разветвленную углеводородную группу, содержащую от 3 до 6 атомов углерода и включающую, по меньшей мере, одну углерод-углеродную тройную связь. Представительные примеры алкинила включают, но без ограничения, ацетиленил, 1-пропинил, 2-пропинил, 3-бутинил, 2-пентинил и 1-бутинил.
Использованный в настоящем описании термин «алкинилен» означает двухвалентный радикал, полученный из линейной или разветвленной углеводородной группы, содержащей от 2 до 10 атомов углерода, и включающий в себя, по меньшей мере, одну углерод-углеродную тройную связь.
Использованный в настоящем описании термин «арил» означает фенил.
Использованный в настоящем описании термин «циклическая группа» означает бензол, фенил, фенилен, циклоалкан, циклоалкил, циклоалкилен, циклоалкен, циклоалкенил, циклоалкенилен, циклоалкин, циклоалкинил, циклоалкинилен, гетероарен, гетероарил, гетероциклоалкан, гетероциклоалкил, гетероциклоалкен, гетероциклоалкенил и спироалкил.
Использованные в настоящем описании термины «циклоалкилен» или «циклоалкил» или «циклоалкан» означают моноциклическую или мостиковую углеводородную циклическую систему. Моноциклический циклоалкил представляет собой карбоциклическую кольцевую систему, содержащую от трех до десяти атомов углерода, ноль гетероатомов и ноль двойных связей. Примеры моноциклических кольцевых систем включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Моноциклическая кольцевая система может содержать один или два алкиленовых мостика, каждый из которых состоит из одного, двух или трех атомов углерода, каждый из которых связывает два не соседних атома углерода данной циклической системы. Представительные примеры подобных мостиковых циклоалкильных кольцевых систем включают, но без ограничения, бицикло[3.1.1]гептан, бицикло[2.2.1]гептан, бицикло[2.2.2]октан, бицикло[3.2.1]октан, бицикло[3.2.2]нонан, бицикло[3.3.1]нонан, бицикло[4.2.1]нонан, трицикло[3.3.1.03,7]нонан, (октагидро-2,5-метанопентален или норадамантан) и трицикло[3.3.1.13,7]декан (адамантан). Моноциклический и мостиковый циклоалкил может быть связан с исходной молекулярной группой через любой подходящий для замещения атом, содержащийся в данной циклической системе.
Использованные в настоящем описании термины «циклоалкенилен» или «циклоалкенил» или «циклоалкен» означают моноциклическую или мостиковую углеводородную циклическую систему. Моноциклический циклоалкенил включает от четырех до десяти атомов углерода и ноль гетероатомов. Четырехчленные циклические системы содержат одну двойную связь, пяти- или шестичленные циклические системы содержат одну или две двойных связи, семи- или восьмичленные циклические системы содержат одну, две или три двойных связи, а девяти- или десятичленные циклические системы содержат одну, две, три или четыре двойных связи. Представительные примеры моноциклических циклоалкильных циклоалкенильных групп включают, но без ограничения, циклобутенил, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Моноциклическое циклоалкенильное кольцо может содержать один или два алкиленовых мостика, каждый из которых состоит из одного, двух или трех атомов углерода, каждый из которых связывает два не соседних атома углерода данной циклической системы. Представительные примеры подобных мостиковых циклоалкенильных групп включают, но без ограничения, бицикло[2.2.1]гепт-2-ен, 4,5,6,7-тетрагидро-3аН-инден, октагидронафталенил и 1,6-дигидропентален. Моноциклический и мостиковый циклоалкенил может быть связан с исходной молекулярной группой через любой подходящий для замещений атом, содержащийся в данных циклических системах.
Использованный в настоящем описании термин «циклоалкин» или «циклоалкинил» или «циклоалкинилен» означают моноциклическую или мостиковую углеводородную циклическую систему. Моноциклическое циклоалкинильное кольцо включает восемь или более атомов углерода, ноль гетероатомов и одну или более тройных связей. Моноциклическое циклоалкинильное кольцо может содержать один или два алкиленовых мостика, каждый из которых состоит из одного, двух или трех атомов углерода, каждый из которых связывает два не соседних атома углерода данной циклической системы. Моноциклический и мостиковый циклоалкинил может быть связан с исходной молекулярной группой через любой подходящий для замещений атом, содержащийся в данных циклических системах.
Использованные в настоящем описании термины «гетероарен» или «гетероарил» или «гетероарилен» означают пятичленный или шестичленный ароматический цикл, содержащий, по меньшей мере, один атом углерода, и один или более одного независимо выбранного атом азота, кислорода или серы. Гетероарены данного изобретения связаны через любые соседние атомы цикла, при условии сохранения надлежащих валентностей. Представительные примеры гетероарила включают, но без ограничения, фуранил (включая, но без ограничения, фуран-2-ил), имидазолил (включая, но без ограничения, 1Н-имидазол-1-ил), изоксазолил, изотиазолил, оксадиазолил, 1,3-оксазолил, пиридинил (например, пиридин-4-ил, пиридин-2-ил, пиридин-3-ил), пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, 1,3-тиазолил, тиенил (включая, но без ограничения, тиен-2-ил, тиен-3-ил), триазолил и триазинил.
Использованный в настоящем описании термин «гетероциклоалкан», или «гетероциклоалкил», или «гетероциклоалкилен» означает моноциклический или мостиковый трех-, четырех-, пяти-, шести-, семи- или восьмичленный цикл, содержащий, по меньшей мере, один гетероатом, независимо выбранный из группы, включающей O, N и S, и ноль двойных связей. Моноциклический и мостиковый гетероциклоалкан связаны с исходной молекулярной группой через любой подходящий для замещения атом углерода или любой подходящий для замещения атом азота, содержащийся в циклах. Гетероатомы азота и серы в данных гетероциклических кольцах необязательно могут быть окислены, а атомы азота необязательно могут быть кватернизованы. Представительные примеры гетероциклоалкановых групп включают, но без ограничения, 8-азабицикло[3.2.1]октан, 3-азабицикло[3.2.2]нонан, морфолинил, тетрагидропиранил, пирролидинил, пиперидинил, диоксоланил, тетрагидрофуранил, тиоморфолинил, 1,4-диоксанил, тетрагидротиенил, тетрагидротиопиранил, оксетанил, пиперазинил, имидазолидинил, азетидин, азепанил, азиридинил, диазепанил, дитиоланил, дитианил, изоксазолидинил, изотиазолидинил, оксадиазолидинил, оксазолидинил, пиразолидинил, тетрагидротиенил, тиадиазолидинил, тиазолидинил, тиоморфолинил, тритианил и тритианил.
Использованный в настоящем описании термин «гетероциклоалкенилен», или «гетероциклоалкенил», или «гетероциклоалкилен» означает моноциклический или мостиковый трех-, четырех-, пяти-, шести-, семи- или восьмичленный цикл, содержащий, по меньшей мере, один гетероатом, независимо выбранный из группы, включающей O, N и S, и одну или более двойных связей. Моноциклический и мостиковый гетероциклоалкен связаны с исходной молекулярной группой через любой подходящий для замещения атом углерода или любой подходящий для замещения атом азота, содержащийся в циклах. Гетероатомы азота и серы в данных гетероциклических кольцах необязательно могут быть окислены, а атомы азота необязательно могут быть кватернизованы. Представительные примеры гетероциклоалкеновых групп включают, но без ограничения, 1,4,5,6-тетрагидропиридазинил, 1,2,3,6-тетрагидропиридинил, дигидропиранил, имидазолинил, изотиазолинил, оксадиазолинил, изоксазолинил, оксазолинил, пиранил, пиразолинил, пирролинил, тиадиазолинил, тиазолинил и тиопиранил.
Использованный в настоящем описании термин «фенилен» означает двухвалентный радикал, полученный при удалении атома водорода из фенила.
Использованный в настоящем описании термин «спироалкил» означает алкилен, оба конца которого связаны с одним и тем же атомом углерода, и представленный примером С2-спироалкила, С3-спироалкила, С4-спироалкила, С5-спироалкила, С6-спироалкила, С7-спироалкила, С8-спироалкила, С9-спироалкила и т.п.
Использованный в настоящем описании термин «спирогетероалкил» означает спироалкил, содержащий один или два СН2 фрагмента, замененных независимо выбранным O, C(O), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, не замененных или замененных N.
Использованный в настоящем описании термин «спирогетероалкенил» означает спироалкенил, содержащий один или два СН2 фрагмента, замененных независимо выбранным O, C(O), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, не замененных или замененных N, и также означает спироалкенил, содержащий один или два СН2 фрагмента, не замененных или замененных независимо выбранным O, C(O), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, замененых N.
Использованный в настоящем описании термин «спироцикло» означает два заместителя при одном и том же атоме углерода, которые вместе с атомом углерода, с которым они связаны, образуют циклоалкановый, гетероциклоалкановый, циклоалкеновый или гетероциклоалкеновый цикл.
Использованный в настоящем описании термин «С2-С5-спироалкил» означает С2-спироалкил, С3-спироалкил, С4-спироалкил и С5-спироалкил.
Использованный в настоящем описании термин «С2-спироалкил» означает эт-1,2-илен, оба конца которого заменяют атомы водорода одного и того же СН2фрагмента.
Использованный в настоящем описании термин «С3-спироалкил» означает проп-1,3-илен, оба конца которого заменяют атомы водорода одного и того же СН2фрагмента.
Использованный в настоящем описании термин «С4-спироалкил» означает бут-1,4-илен, оба конца которого заменяют атомы водорода одного и того же СН2фрагмента.
Использованный в настоящем описании термин «С5-спироалкил» означает пент-1,5-илен, оба конца которого заменяют атомы водорода одного и того же СН2фрагмента.
Использованный в настоящем описании термин «С6-спироалкил» означает гекс-1,6-илен, оба конца которого заменяют атомы водорода одного и того же СН2фрагмента.
Использованный в настоящем описании термин «NH защищающая группа» означает трихлорэтоксикарбонил, трибромэтоксикарбонил, бензилоксикарбонил, пара-нитробензилкарбонил, орто-бромбензилоксикарбонил, хлорацетил, дихлорацетил, трихлорацетил, трифторацетил, фенилацетил, формил, ацетил, бензоил, трет-амилоксикарбонил, трет-бутоксикарбонил, пара-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 4-(фенилазо)бензилоксикарбонил, 2-фурфурилоксикарбонил, дифенилметоксикарбонил, 1,1-диметилпропоксикарбонил, изопропоксикарбонил, фталоил, сукцинил, аланил, лейцил, 1-адамантилоксикарбонил, 8-хинолилоксикарбонил, бензил, дифенилметил, трифенилметил, 2-нитрофенилтио, метансульфонил, пара-толуолсульфонил, N,N-диметиламинометилен, бензилиден, 2-гидроксибензилиден, 2-гидрокси-5-хлорбензилиден, 2-гидрокси-1-нафтилметилен, 3-гидрокси-4-пиридилметилен, циклогексилиден, 2-этоксикарбонилциклогексилиден, 2-этоксикарбонилциклопентилиден, 2-ацетилциклогексилиден, 3,3-диметил-5-оксициклогексилиден, дифенилфосфорил, дибензилфосфорил, 5-метил-2-оксо-2Н-1,3-диоксол-4-илметил, триметилсилил, триэтилсилил и трифенилсилил.
Использованный в настоящем описании термин «С(О)ОН защищающая группа» означает метил, этил, н-пропил, изопропил, 1.1-диметилпропил, н-бутил, трет-бутил, фенил, нафтил, бензил, дифенилметил, трифенилметил, пара-нитробензил, пара-метоксибензил, бис(пара-метоксифенил)метил, ацетилметил, бензоилметил, 2-тетрагидропиранил, 2-тетрагидрофуранил, 2,2,2-трихлорэтил, 2-(триметилсилил)этил, ацетоксиметил, пропионилоксиметил, пивалоилоксиметил, фталимидометил, сукцинимидометил, циклопропил, циклобутил, циклопентил, циклогексил, метоксиметил, метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, бензилоксиметил, метилтиометил, 2-метилтиоэтил, фенилтиометил, 1,1-диметил-2-пропенил, 3-метил-3-бутенил, аллил, триметилсилил, триэтилсилил, триизопропилсилил, диэтилизопропилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, дифенилметилсилил и трет-бутилметоксифенилсилил.
Использованный в настоящем описании термин «ОН или SH защищающая группа» означает бензилоксикарбонил, 4-нитробензилоксикарбонил, 4-бромбензилоксикарбонил, 4-метоксибензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, 1,1-диметилпропоксикарбонил, изопропоксикарбонил, изобутилоксикарбонил, дифенилметоксикарбонил, 2,2,2-трихлорэтоксикарбонил, 2,2,2-трибромэтоксикарбонил, 2-(триметилсилил)этоксикарбонил, 2-(фенилсульфонил)этоксикарбонил, 2-(трифенилфосфонио)этоксикарбонил, 2-фурфурилоксикарбонил, 1-адамантилоксикарбонил, винилоксикарбонил, аллилоксикарбонил, S-бензилтиокарбонил, 4-этокси-1-нафтилоксикарбонил, 8-хинолилоксикарбонил, ацетил, формил, хлорацетил, дихлорацетил, трихлорацетил, трифторацетил, метоксиацетил, феноксиацетил, пивалоил, бензоил, метил, трет-бутил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 1,1-диметил-2-пропенил, 3-метил-3-бутенил, аллил, бензил(фенилметил), пара-метоксибензил, 3,4-диметоксибензил, дифенилметил, трифенилметил, тетрагидрофурил, тетрагидропиранил, тетрагидротиопиранил, метоксиметил, метилтиометил, бензилоксиметил, 2-метоксиэтоксиметил, 2,2,2-трихлорэтоксиметил, 2-(триметилсилил)этоксиметил, 1-этоксиэтил, метансульфонил, пара-толуолсульфонил, триметилсилил, триэтилсилил, триизопропилсилил, диэтилизопропилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, дифенилметилсилил и трет-бутилметоксифенилсилил.
Соединения
У настоящих соединений могут существовать геометрические изомеры. Соединения данного изобретения могут содержать углерод-углеродные двойные связи или углерод-азотные двойные связи E- или Z-конфигурации, где термин «Е» представляет собой заместители более высокого порядка с противоположных сторон двойной связи углерод-углерод или углерод-азот, а термин «Z» представляет собой заместители более высокого порядка с одной стороны двойной связи углерод-углерод, как определено правилами старшинства Канна-Ингольда-Прелога. Соединения данного изобретения могут существовать также в виде смеси «Е»- и «Z»-изомеров. Заместители вокруг циклоалкила или гетероциклоалкила обозначают как имеющие цис- или транс-конфигурацию. Кроме того, в изобретении рассматриваются различные изомеры и их смеси, образующиеся в результате расположения заместителей в циклической системе адамантана. Два заместителя в одном цикле в циклической системе адамантана определяют как имеющие относительную конфигурацию Е или Z. Например, см. C. D. Jones, M. Kaselj, R. N. Salvatore, W. J. le Noble J. Org. Chem. 1998, 63, 2758-2760 and E. L. Eliel, and S.H. Wilen. (1994) Stereochemistry of Organic Compounds. New York, NY: John Wiley & Sons, Inc.
Соединения данного изобретения содержат асимметрически замещенные атомы углерода в R- или S-конфигурации, в которых термины «R» и «S» определены правилами ИЮПАК 1974 года для секции Е, фундаментальная стереохимия, Pure Appl. Chem. (1976) 45, 13-10. Соединения, имеющие асимметрически замещенные атомы углерода с равным количеством R- и S-конфигураций, являются рацемическими по данным атомам углерода. Атомам с избытком одной конфигурации относительно другой приписывают конфигурацию, присутствующую в большем количестве, предпочительно, при избытке около 85-90%, более предпочительно, при избытке около 95-99%, и еще более предпочительно, при избытке, большем примерно 99%. Соответственно, данное изобретение включает рацемические смеси, относительные и абсолютные стереоизомеры, и смеси относительных и абсолютных стереоизомеров.
Соединения данного изобретения, содержащие NH, C(O)OH, OH или SH группы, могут содержать связанные с ними группы, образующие пролекарства. Группы, образующие пролекарства, удаляются путем метаболических процессов, и высвобождают соединения, содержащие свободный гидроксил, амино или карбоновую кислоту in vivo. Пролекарства применимы для регулирования таких фармакокинетических свойств соединений, как растворимость и/или гидрофобность, абсорбцию в желудочно-кишечном тракте, биодоступность, проникновение в ткани и скорость клиренса.
Соединения, обогащенные изотопом или меченные изотопом
Соединения изобретения могут существовать в форме, меченной или обогащенной изотопом, содержащей один или более атомов с атомной массой или массовым числом, отличающимся от атомной массы или массового числа, наиболее богато представленного в природе. Изотопы могут быть радиоактивными или не радиоактивными изотопами. Изотопы таких атомов, как водород, углерод, фосфор, сера, фтор, хлор и йод включают, но без ограничения,2Н,3Н,13С,14С,15N,18O,32P,35S,18F,36Cl и125I. Соединения, содержащие другие изотопы этих и/или других атомов, входят в рамки данного изобретения.
В другом варианте осуществления меченные изотопом соединения содержат изотопы дейтерия (2Н), трития (3Н) или14С. Меченные изотопом соединения данного соединения можно получить общими способами, которые хорошо известны специалистам в данной области. Такие меченные изотопом соединения можно получить, осуществляя методики, описанные в раскрытых в настоящем описании примерах и схемах, заменяя легко доступный меченный изотопом реагент не меченным реагентом. В некоторых случаях соединения можно обработать меченными изотопом реагентами для обмена нормального атома на его изотоп, например, заменить водород дейтерием можно при действии дейтерийсодержащей кислоты, такой как D2SO4/D2O. В дополнение к сказанному, родственные методики и промежуточные соединения описаны, например, у Lizondo, J et al., Drugs Fut, 21(11), 1116 (1996); Brickner, S. J. et al., J. Med. Chem., 39(3), 673 (1996); Mallesham, B. et al., Org Lett, 5(7), 963 (2003); в публикациях РСТ WO1997010223, WO2005099353, WO1995007271, WO2006008754; патентах США № 7538189, 7534814, 7531685, 7528131, 7521421, 7514068, 7511013 и публикации патентной заявки США № 20090137457, 20090131485, 20090131363, 20090118238, 20090111840, 20090105338, 20090105307, 20090105147, 20090093422, 20090088416 и 20090082471, при этом данные способы включены здесь ссылкой.
Соединения данного изобретения, меченные изотопом, можно использовать в качестве стандартов для определения эффективности ингибиторов Bcl-2 в анализах на связывание. Изотопсодержащие соединения использовали в фармацевтическом исследовании для изучения метаболической судьбы соединений in vivo при помощи оценки механизма действия и пути метаболизма не меченного изотопом исходного соединения (Blake et al. J. Pharm. Sci. 64, 3, 367-391 (1975)). Такие метаболические исследования важны при разработке безопасных эффективных терапевтических лекарственных препаратов либо потому, что пациенту вводят in vivo активное соединение, либо потому, что метаболиты, образующиеся из исходного соединения, оказываются токсичными или канцерогенными (Foster et al., Advances in Drug Research Vol. 14, pp. 2-36, Academic press, London, 1985; Kato et al., J. Labelled Comp. Radiopharmaceut., 36(10):927-932 (1995); Kushner et al., Can. J. Physiol. Pharmacol., 77, 79-88 (1999).
Кроме того, лекарственные препараты, содержащие нерадиоактивный изотоп, такие как дейтерированные лекарственные препараты, называемые «тяжелыми лекарственными препаратами», можно использовать для лечения заболевания и состояний, относящихся к активности Bcl-2. Увеличение количества изотопа, присутствующего в соединении сверх его природного относительного содержания, называется обогащением. Примеры количества обогащения включают от 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 16, 21, 25, 29, 33, 37, 42, 46, 50, 54, 58, 63, 67, 71, 75, 79, 84, 88, 92, 96 до около 100% мол. Замена примерно до 15% нормального атома тяжелым изотопом было эффективным и паоддерживалось в течение от дней до недель у млекопитающих, включая грызунов и собак, при минимальных наблюдаемых неблагоприятных эффектах (Czajka D. M. and Finkel A. J., Ann. N.Y. Acad. Sci. 1960 84: 770; Thomson J. F., Ann. New York Acad. Sci. 1960 84: 736; Czakja D. M. et al., Am. J. Physiol. 1961 201: 357). Было найдено, что значительная степень замещения до 15-23% в жидкостях человеческого тела дейтерием не вызывает токсичности (Blagojevic N et al. in "Dosimetry & Treatment Planning for Neutron Capture Therapy", Zamenhof R, Solares G and Harling О Eds. 1994. Advanced Medical Publishing, Madison Wis. pp. 125-134; Diabetes Metab. 23: 251 (1997)).
Стабильное мечение изотопом лекарственного препарата может изменить его физико-химические свойства, такие как рКа и липидную растворимость. Данные эффекты и изменения могут воздействовать на фармакодинамический ответ молекулы лекарственного средства, если ее изотопное замещение влияет на область, вовлеченную в лиганд-рецепторное взаимодействие. Несмотря на то что некоторые физические свойства молекулы, меченной стабильным изотопом, отличаются от свойств немеченой молекулы, химические и биологические свойства являются одинаковыми, за одним важным исключением: из-за увеличенной массы тяжелого изотопа, любая связь, включающая тяжелый изотоп и другой атом, будет прочнее, чем аналогичная связь между легким изотопом и этим атомом. Соответственно, включения изотопа в сайт метаболизма или ферментного превращения замедлит указанные реакции, потенциально изменяя фармакокинетический профиль или эффекетивность относительно неизотопного соединения.
Амиды, сложные эфиры и пролекарства
Пролекарства представляют собой производные активного лекарственного средства, созданные для улучшения некоторого идентифицированного, нежелательного физического или биологического свойства. Физические свойства обычно связаны с растворимостью (слишком большая или недостаточная липидная или водорастворимость) или стабильностью, хотя проблематичные биологические свойства включают слишком быстрый метаболизм или плохую биодоступность, что само по себе может относиться к физико-химическому свойству.
Пролекарства обычно получают путем а) образования сложного эфира, полуэфиров, карбонатных сложных эфиров, нитратных сложных эфиров, амидов, гидроксамовых кислот, карбаматов, иминов, оснований Манниха и енаминов активного лекарственного средства, b) функционализации лекарственного средства азо, гликозидной, пептидной и эфирной функциональной группой, с) использования полимеров, солей, комплексов, фосфорамидов, ацеталей, полуацеталей и кетальных форм лекарственного средства. Например, см. Andrejus Korolkovas's, "Essentials of Medicinal Chemistry", John Wiley-Interscience Publications, John Wiley and Sons, New York (1988), pp. 97-118, которая включена в настоящее описание ссылкой во всей полноте.
Сложные эфиры можно получить из субстратов формулы (I), содержащих либо гидроксильную группу, либо карбоксигруппу, при помощи общих методов, известных специалистам в данной области. Типичными реакциями данных соединений являются реакции замещения, заменяющие один из гетероатомов на другой атом, например:
Схема 1
Амиды можно получить из субстратов формулы (I), содержащих либо аминогруппу, либо карбоксигруппу похожим образом. Сложные эфиры также взаимодействуют с аминами или аммиаком, образуя амиды.
Схема 2
Другой способ получения амидов из соединений формулы (I) состоит в совместном нагревании карбоновых кислот и аминов.
На приведенных выше схемах 2 и 3 R и R’ независимо представляют собой субстраты формулы (I), алкил или водород.
Подходящие группы для А1, B1, D1, E1, Y1 и Z1 в соединениях формулы (I) выбирают независимо. Описанные варианты осуществления настоящего изобретения можно объединить. Подобная комбинация рассматривается и входит в рамки настоящего изобретения. Например, предполагается, что варианты осуществления для любого из А1, B1, D1, E1, Y1 и Z1 можно объединить с вариантами осуществления, определенными для любого другого из А1, B1, D1, E1, Y1 и Z1.
Следовательно, один из вариантов осуществления данного изобретения относится к соединениям или его терапевтически приемлемым солям, пролекарствам или солям пролекарств, которые применимы в качестве селективных ингибиторов одного или более членов семейства антиапоптотических белков, при этом данные соединения имеют формулу (I)
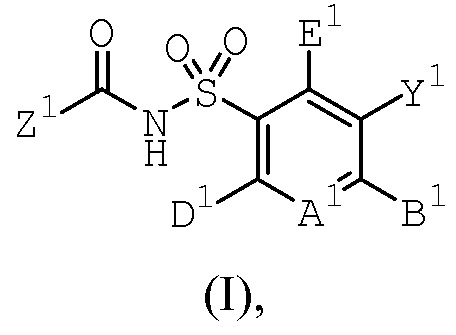
где А1 является N или С(А2);
один, или два, или три, или каждый из А2, В1, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NR1C(O)NHR1, NR1C(O)N(R1)2, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CN, CF3, C(O)OH, C(O)NH2 или C(O)OR1A; и
Y1 представляет собой H, CN, NO2, C(O)OH, F, Cl, Br, I, CF3, OCF3, CF2CF3, OCF2CF3, R17, OR17, C(O)R17, C(O)OR17, SR17, NH2, NHR17, N(R17)2, NHC(O)R17, C(O)NH2, C(O)NHR17, C(O)N(R17)2, NHS(O)R17 или NHSO2R17;
или
В1 и Y1 вместе с атомами, с которыми они связаны, образуют имидазол или триазол; и
один, или два, или каждый из А2, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NHC(O)NHR1, N(CH3)C(O)N(CH3)R1, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CF3, C(O)OH, C(O)NH2 или C(O)OR1A;
R1 представляет собой R2, R3, R4 или R5;
R1A представляет собой С1-С6-алкил, С3-С6-алкенил или С3-С6-алкинил;
R2 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R2A; R2A представляет собой циклоалкан или гетероциклоалкан;
R3 представляет собой гетероарил, который не конденсирован или конденсирован с бензолом, гетероареном или R3A; R3A представляет собой циклоалкан или гетероциклоалкан;
R4 представляет собой циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R4A; R4A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R5 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R6, NC(R6A)(R6B), R7, OR7, SR7, S(O)R7, SO2R7, NHR7, N(R7)2, C(O)R7, C(O)NH2, C(O)NHR7, NHC(O)R7, NHSO2R7, NHC(O)OR7, SO2NH2, SO2NHR7, SO2N(R7)2, NHC(O)NH2, NHC(O)NHR7, NHC(O)CH(CH3)NHC(O)CH(CH3)NH2, NHC(O)CH(CH3)NHC(O)CH(CH3)NHR1, OH, (O), C(O)OH, (O), N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R6 представляет собой С2-С5-спироалкил, каждый из которых не замещен или замещен ОН, (O), N3, CN, CF3, CF2CF3, F, Cl, Br, I, NH2, NH(CH3) или N(CH3)2;
R6A и R6B представляют собой независимо выбранный алкил или вместе с N, с которым они связаны, образуют R6C;
R6C представляет собой азиридин-1-ил, азетидин-1-ил, пирролидин-1-ил или пиперидин-1-ил, каждый из которых содержит один СН2 фрагмент, незамененный или замененный на О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH;
R7 представляет собой R8, R9, R10 или R11;
R8 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R8A;
R8A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R9 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R9A; R9A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R10 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R10A; R10A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;;
R11 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R12, OR12, NHR12, N(R12)2, C(O)NH2, C(O)NHR12, C(O)N(R12)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R12 представляет собой R13, R14, R15 или R16;
R13 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R13A; R13A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R14 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R14A; R14A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R15 представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R15A; R15A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R16 представляет собой алкил, алкенил или алкинил;
R17 представляет собой R18, R19, R20 или R21;
R18 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R18A; R18A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R19 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R19A; R19A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R20 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R20A; R20A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R21 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R22, OR22, NHR22, N(R22)2, C(O)NH2, C(O)NHR22, C(O)N(R22)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R22 представляет собой R23, R24 или R25;
R23 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R23A; R23A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R24 представляет собой гетероарен, который не конденсирован или конденсирован с ареном, гетероареном или R24A; R24A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R25 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R25A; R25A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
Z1 представляет собой R26 или R27, каждый из которых замещен R28, R29 или R30, каждый из которых замещен F, Cl, Br, I, CH2R37, CH(R31)(R37), C(R31)(R31A)(R37), C(O)R37, OR37, SR37, S(O)R37, SO2R37, NHR37 или N(R32)R37;
R26 представляет собой фенил, который не конденсирован или конденсирован с ареном или гетероареном;
R27 представляет собой гетероарен, который не конденсирован или конденсирован с ареном или гетероареном;
R28 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R28A; R28A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R29 представляет собой гетероарил или R29A; R29A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R30 представляет собой циклоалкил или циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R30A; R30A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R31 и R31A независимо представляет собой F, Cl, Br или алкил или взяты вместе и образуют С2-С5-спироалкил;
R32 представляет собой R33, C(O)R33 или C(O)OR33;
R33 представляет собой R34 или R35;
R34 представляет собой фенил, который не конденсирован или конденсирован с арилом, гетероарилом или R34A; R34A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R35 представляет собой алкил, который не замещен или замещен R36;
R36 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R36A; R36A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R37 представляет собой R38, R39 или R40, каждый из которых замещен F, Cl, Br, I, R41, OR41, NHR41, N(R41)2, NHC(O)OR41, SR41, S(O)R41 или SO2R41;
R38 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R38A; R38A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R39 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R39A; R39A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R40 представляет собой С3-С8-циклоалкил или С4-С8-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R40A; R40A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R41 представляет собой R42, R43, R44 или R45;
R42 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R42A; R42A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R43 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R43A; R43A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R44 представляет собой С3-С9-циклоалкил или С4-С7-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R44A; R44A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R45 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним или двумя независимо выбранными заместителями R46, OR46, NHR46, N(R46)2, C(O)NH2, C(O)NHR46, C(O)N(R46)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R46 представляет собой R47, R48 или R49;
R47 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R47A; R47A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R48 представляет собой гетероарил или R48A; R48A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R49 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R49A; R49A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
где фрагменты, представленные R26 и R27, дополнительно замещены одним, или двумя, или тремя независимо выбранными из R50A, OR50A, SR50A, S(O)R50A, SO2R50A или NHR50A;
R50A представляет собой R51A, R52A, R53A или R54A;
R51A представляет собой фенил, который не конденсирован или конденсирован с бензолом, гетероареном или R51AA,
где R51AA представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52A представляет собой гетероарил;
R53A представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53AA,
где R53AA представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
где R54A представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55AA, OR55AA, SR55AA, S(O)R55AA, SO2R55AA, NHR55AA, N(R55AA)2, С(O)R55AA, C(O)NH2, C(O)NHR55AA, NHC(О)R55AA, NHSO2R55AA, NHC(О)OR55AA, SO2NH2, SO2NHR55AA, SO2N(R55AA)2, NHC(О)NH2, NHC(О)NHR55AA, OH, (O), C(O)OH, (О), N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55AA представляет собой алкил, алкенил, алкинил, фенил или гетероарил или R56A;
R56A представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N;
где фрагменты, представленные R2, R3, R4, R6, R6C, R8, R8A, R9, R10, R13, R14, R15, R18, R19, R20, R23, R24, R25, R26, R27, R28, R29, R30, R34, R36, R38, R39, R40, R42, R43, R44, R47, R48 и R49, независимо не замещены, дополнительно не замещены, замещены или дополнительно замещены одним, или двумя, или тремя, или четырьмя, или пятью заместителями, независимо выбранными из R50, OR50, SR50, S(O)R50, SO2R50, С(O)R50, СО(O)R50, ОС(O)R50, ОС(O)OR50, NH2, NHR50, N(R50)2, C(O)NH2, C(O)NHR50, C(O)N(R50)2, C(O)NHOH, C(O)NHOR50, C(O)NHSO2R50, C(O)NR55SO2R50, SO2NH2, SO2NHR50, SO2N(R50)2, CF3, CF2CF3, C(O)H, C(O)OH, C(N)NH2, C(N)NHR50, C(N)N(R50)2, OH, (O), CN, N3, NO2, CF3, CF2CF3, OCF3, OCF2CF3, F, Cl, Br или I;
R50 представляет собой R51, R52, R53 или R54;
R51 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R51B; R51B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52 представляет собой гетероарил;
R53 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53B,
где R53B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R54 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55, OR55, SR55, S(O)R55, SO2R55, NHR55, N(R55)2, С(O)R55, C(O)NH2, C(O)NHR55, NHC(О)R55, NHSO2R55, NHC(О)OR55, SO2NH2, SO2NHR55, SO2N(R55)2, NHC(О)NH2, NHC(О)NHR55, OH, (O), C(O)OH, (О), N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55 представляет собой алкил, алкенил, алкинил, фенил, гетероарил или R56, и
где алкил, алкенил, алкинил не замещены или замещены ОСН3; и
R56 представляет собой С3-С8-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N.
Другой вариант осуществления данного изобретения относится к соединениям формулы (I), где
А1 является N или С(А2);
один, или два, или три, или каждый из А2, В1, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NR1C(O)NHR1, NR1C(O)N(R1)2, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CN, CF3, C(O)OH, C(O)NH2 или C(O)OR1A; и
Y1 представляет собой H, CN, NO2, C(O)OH, F, Cl, Br, I, CF3, OCF3, CF2CF3, OCF2CF3, R17, OR17, C(O)R17, C(O)OR17, SR17, NH2, NHR17, N(R17)2, NHC(O)R17, C(O)NH2, C(O)NHR17, C(O)N(R17)2, NHS(O)R17 или NHSO2R17;
или
В1 и Y1 вместе с атомами, с которыми они связаны, образуют имидазол или триазол; и
один, или два, или каждый из А2, D1 и E1 независимо выбраны из R1, OR1, SR1, S(O)R1, SO2R1, C(O)R1, C(O)OR1, OC(O)R1, NHR1, N(R1)2, C(O)NHR1, C(O)N(R1)2, NHC(O)R1, NHC(O)OR1, NHC(O)NHR1, N(CH3)C(O)N(CH3)R1, SO2NHR1, SO2N(R1)2, NHSO2R1, NHSO2NHR1 или N(CH3)SO2N(CH3)R1, а остальные независимо выбраны из H, F, Cl, Br, I, CF3, C(O)OH, C(O)NH2 или C(O)OR1A;
R1 представляет собой R2, R3, R4 или R5;
R1A представляет собой С1-С6-алкил, С3-С6-алкенил или С3-С6-алкинил;
R2 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R2A; R2A представляет собой циклоалкан или гетероциклоалкан;
R3 представляет собой гетероарил, который не конденсирован или конденсирован с бензолом, гетероареном или R3A; R3A представляет собой циклоалкан или гетероциклоалкан;
R4 представляет собой циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R4A; R4A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R5 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R6, NC(R6A)(R6B), R7, OR7, SR7, S(O)R7, SO2R7, NHR7, N(R7)2, C(O)R7, C(O)NH2, C(O)NHR7, NHC(O)R7, NHSO2R7, NHC(O)OR7, SO2NH2, SO2NHR7, SO2N(R7)2, NHC(O)NH2, NHC(O)NHR7, NHC(O)CH(CH3)NHC(O)CH(CH3)NH2, NHC(O)CH(CH3)NHC(O)CH(CH3)NHR1, OH, (O), C(O)OH, (O), N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R6 представляет собой С2-С5-спироалкил, каждый из которых не замещен или замещен ОН, (O), N3, CN, CF3, CF2CF3, F, Cl, Br, I, NH2, NH(CH3) или N(CH3)2;
R6A и R6B представляют собой независимо выбранный алкил, или, вместе с N, с которым они связаны, образуют R6C;
R6C представляет собой азиридин-1-ил, азетидин-1-ил, пирролидин-1-ил или пиперидин-1-ил, каждый из которых содержит один СН2 фрагмент, незамененный или замененный на О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH;
R7 представляет собой R8, R9, R10 или R11;
R8 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R8A;
R8A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R9 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R9A; R9A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R10 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R10A; R10A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R11 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R12, OR12, NHR12, N(R12)2, C(O)NH2, C(O)NHR12, C(O)N(R12)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R12 представляет собой R13, R14, R15 или R16;
R13 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R13A; R13A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R14 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R14A; R14A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R15 представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен, каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R15A; R15A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R16 представляет собой алкил, алкенил или алкинил;
R17 представляет собой R18, R19, R20 или R21;
R18 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R18A; R18A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R19 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R19A; R19A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R20 представляет собой С3-С10-циклоалкил или С4-С10-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R20A; R20A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R21 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R22, OR22, NHR22, N(R22)2, C(O)NH2, C(O)NHR22, C(O)N(R22)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R22 представляет собой R23, R24 или R25;
R23 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R23A; R23A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R24 представляет собой гетероарен, который не конденсирован или конденсирован с ареном, гетероареном или R24A; R24A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R25 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R25A; R25A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
Z1 представляет собой R26 или R27, каждый из которых замещен R28, R29 или R30, каждый из которых замещен F, Cl, Br, I, CH2R37, CH(R31)(R37), C(R31)(R31A)(R37), C(O)R37, OR37, SR37, S(O)R37, SO2R37, NHR37 или N(R32)R37;
R26 представляет собой фенил, который не конденсирован или конденсирован с ареном или гетероареном;
R27 представляет собой гетероарен, который не конденсирован или конденсирован с ареном или гетероареном;
R28 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R28A; R28A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R29 представляет собой гетероарил или R29A; R29A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R30 представляет собой циклоалкил или циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R30A; R30A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R31 и R31A независимо представляет собой F, Cl, Br или алкил или взяты вместе и образуют С2-С5-спироалкил;
R32 представляет собой R33, C(O)R33 или C(O)OR33;
R33 представляет собой R34 или R35;
R34 представляет собой фенил, который не конденсирован или конденсирован с арилом, гетероарилом или R34A; R34A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R35 представляет собой алкил, который не замещен или замещен R36;
R36 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R36A; R36A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R37 представляет собой R38, R39 или R40, каждый из которых замещен F, Cl, Br, I, R41, OR41, NHR41, N(R41)2, NHC(O)OR41, SR41, S(O)R41 или SO2R41;
R38 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R38A; R38A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R39 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R39A; R39A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R40 представляет собой С3-С8-циклоалкил или С4-С8-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R40A; R40A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R41 представляет собой R42, R43, R44 или R45;
R42 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R42A; R42A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R43 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R43A; R43A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R44 представляет собой С3-С9-циклоалкил или С4-С7-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R44A; R44A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R45 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним или двумя независимо выбранным R46, OR46, NHR46, N(R46)2, C(O)NH2, C(O)NHR46, C(O)N(R46)2, OH, (O), C(O)OH, N3, CN, NH2, CF3, CF2CF3, F, Cl, Br или I;
R46 представляет собой R47, R48 или R49;
R47 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R47A; R47A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R48 представляет собой гетероарил или R48A; R48A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R49 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R49A; R49A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
где фрагменты, представленные R26 и R27, дополнительно замещены OR50A;
R50A представляет собой R51A;
R51A представляет собой фенил, который конденсирован с гетероареном;
где фрагменты, представленные R2, R3, R4, R6, R6C, R8, R8A, R9, R10, R13, R14, R15, R18, R19, R20, R23, R24, R25, R26, R27, R28, R29, R30, R34, R36, R38, R39, R40, R42, R43, R44, R47, R48 и R49, независимо не замещены, дополнительно не замещены, замещены или дополнительно замещены одним, или двумя, или тремя, или четырьмя, или пятью заместителями, независимо выбранными из R50, OR50, SR50, S(O)R50, SO2R50, С(O)R50, СО(O)R50, ОС(O)R50, ОС(O)OR50, NH2, NHR50, N(R50)2, C(O)NH2, C(O)NHR50, C(O)N(R50)2, C(O)NHOH, C(O)NHOR50, C(O)NHSO2R50, C(O)NR55SO2R50, SO2NH2, SO2NHR50, SO2N(R50)2, CF3, CF2CF3, C(O)H, C(O)OH, C(N)NH2, C(N)NHR50, C(N)N(R50)2, OH, (O), CN, N3, NO2, CF3, CF2CF3, OCF3, OCF2CF3, F, Cl, Br или I;
R50 представляет собой R51, R52, R53 или R54;
R51 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R51B; R51B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R52 представляет собой гетероарил;
R53 представляет собой С3-С6-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с ареном, гетероареном или R53B,
где R53B представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R54 представляет собой алкил, алкенил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55, OR55, SR55, S(O)R55, SO2R55, NHR55, N(R55)2, С(O)R55, C(O)NH2, C(O)NHR55, NHC(О)R55, NHSO2R55, NHC(О)OR55, SO2NH2, SO2NHR55, SO2N(R55)2, NHC(О)NH2, NHC(О)NHR55, OH, (O), C(O)OH, (О), N3, CN, NH2, CF3, OCF3, CF2CF3, OCF2CF3, F, Cl, Br или I;
R55 представляет собой алкил, алкенил, алкинил, фенил, гетероарил или R56,
где алкил, алкенил, алкинил не замещены или замещены ОСН3; и
R56 представляет собой С3-С8-циклоалкил или С4-С6-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N.
В одном из вариантов осуществления формулы (I) А1 является N или С(А2);
один, или два, или три, или каждый из А2, В1, D1 и E1 независимо выбраны из R1, OR1, SR1, SO2R1, NHR1, N(R1)2, C(O)NHR1, а остальные независимо выбраны из H, F, Cl, Br или I;
Y1 представляет собой H, CN, NO2, F, Cl, Br, I, CF3, R17, NHC(O)R17 или C(O)NH2;
R1 представляет собой R2, R3, R4 или R5;
R2 представляет собой фенил;
R3 представляет собой гетероарил;
R4 представляет собой циклоалкил, гетероциклоалкил или гетероциклоалкенил, каждый из которых не конденсирован или конденсирован с R4A; R4A представляет собой циклоалкан;
R5 представляет собой алкил или алкинил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R6, R7, OR7, SR7, SO2R7, N(R7)2, OH, CN, CF3, F, Cl, Br или I;
R6 представляет собой С2-С5-спироалкил;
R7 представляет собой R8, R9, R10 или R11;
R8 представляет собой фенил, который не конденсирован или конденсирован с R8A;
R8A представляет собой гетероциклоалкан;
R9 представляет собой гетероарил;
R10 представляет собой С3-С10-циклоалкил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, S(O), SO2 или NH, и один или два СН фрагмента, незамененных или замененных на N;
R11 представляет собой алкил, каждый из которых не замещен или замещен одним, или двумя, или тремя независимо выбранными OR12, F, Cl, Br или I;
R12 представляет собой R16;
R16 представляет собой алкил;
R17 представляет собой R19 или R21;
R19 представляет собой гетероарил, который не конденсирован или конденсирован с ареном, гетероареном или R19A; R19A представляет собой циклоалкан, циклоалкен, гетероциклоалкан или гетероциклоалкен;
R21 представляет собой алкинил;
Z1 представляет собой R26, каждый из которых замещен R30, каждый из которых замещен F, Cl, Br, I, CH2R37 или CH(R31)(R37);
R26 представляет собой фенил;
R30 представляет собой циклоалкил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на NH;
R31 и R31A независимо представляет собой алкил;
R37 представляет собой R38, R39 или R40, каждый из которых замещен F, Cl, Br, I, NHR41 или R41;
R38 представляет собой фенил;
R39 представляет собой гетероарил;
R40 представляет собой С3-С8-циклоалкил или С4-С8-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, С(О), CNOH, CNOCH3, S, S(O), SO2 или NH;
R41 представляет собой R42, R43 или R44;
R42 представляет собой фенил;
R43 представляет собой гетероарил;
R44 представляет собой С3-С9-циклоалкил или С4-С7-циклоалкенил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных независимо выбранным NH, и один или два СН фрагмента, незамененных или замененных на N, и каждый из которых не конденсирован или конденсирован с R44A; R44A представляет собой циклоалкан;
где группа, представленная R26, дополнительно замещена одним, двумя или тремя заместителями, независимо выбранными из R50A, OR50A, SR50A, S(O)R50A, SO2R50A или NHR50A;
R50A представляет собой R51A, R52A или R54A,;
R51A представляет собой фенил, который не конденсирован или конденсирован с бензолом, гетероареном или R51AA;
где R51AA представляет собой гетероциклоалкан;
R52A представляет собой гетероарил;
R54A представляет собой алкил, каждый из которых не замещен или замещен одним, или двумя, или тремя независимо выбранными из R55AA или OR55AA;
R55AA представляет собой фенил;
где фрагменты, представленные R2, R3, R4, R6, R6C, R8, R8A, R9, R10, R13, R14, R15, R18, R19, R20, R23, R24, R25, R26, R27, R28, R29, R30, R34, R36, R38, R39, R40, R42, R43, R44, R47, R48 и R49 независимо не замещены, дополнительно не замещены, замещены или дополнительно замещены одним, или двумя, или тремя, или четырьмя, или пятью заместителями, независимо выбранными из R50, OR50, SR50, S(O)R50, SO2R50, С(O)R50, СО(O)R50, NH2, NHR50, SO2NH2, OH, (O), CN, CF3, OCF3, F, Cl, Br или I;
R50 представляет собой R51, R52 или R54;
R51 представляет собой фенил, который не конденсирован или конденсирован с ареном, гетероареном или R51B; R51B представляет собой гетероциклоалкан;
R52 представляет собой гетероарил;
R53 представляет собой С3-С6-циклоалкил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных на независимо выбранный О, и один или два СН фрагмента, незамененных или замененных на N;
R54 представляет собой алкил, каждый из которых не замещен или замещен одним, или двумя, или тремя заместителями, независимо выбранными из R55, OR55, N(R55)2, OH, CN, F, Cl, Br или I; и
R55 представляет собой алкил или фенил;
где алкил не замещен или замещен ОСН3; и
R56 представляет собой С3-С8-циклоалкил, каждый из которых содержит один или два СН2 фрагмента, незамененных или замененных независимо выбранным NH, и один или два СН фрагмента, незамененных или замененных на N.
В одном из вариантов осуществления формулы (I) А1 является N. В следующем варианте осуществления формулы (I) А1 является С(А2). В следующем варианте осуществления формулы (I) А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (I) В1 является R1, OR1, SR1, SO2R1, NHR1, N(R1)2 или С(O)NHR1. В следующем варианте осуществления формулы (I) В1 является NHR1. В следующем варианте осуществления формулы (I) В1 является NHR1, а А1 является С(А2), а А2 является Н. В следующем варианте осуществления формулы (I) В1 является OR1. В следующем варианте осуществления формулы (I) В1 является OR1, а А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (I) D1 и Е1являются Н. В следующем варианте осуществления формулы (I) В1 является NHR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н. В следующем варианте осуществления формулы (I) В1 является OR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н.
В одном из вариантов осуществления формулы (I) Y1является H, CN, NO2, F, Cl, Br, I, CF3, R17, NHC(O)R17 или C(O)NH2. В следующем варианте осуществления формулы (I) Y1является NO2. В следующем варианте осуществления формулы (I) Y1является Cl. В следующем варианте осуществления формулы (I) В1 является NHR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является NO2. В следующем варианте осуществления формулы (I) В1 является OR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является Cl.
В одном из вариантов осуществления формулы (I) R1 представляет собой R2, R3, R4 или R5. В следующем варианте осуществления формулы (I) R1 является R2, а R2 представляет собой фенил.
В одном из вариантов осуществления формулы (I) R1 является R3, а R3 представляет собой гетероарил. В следующем варианте осуществления формулы (I) R3 представляет собой триазолил.
В одном из вариантов осуществления формулы (I) R1 является R4. В следующем варианте осуществления формулы (I) R1 является R4, а R4 представляет собой циклоалкил. В следующем варианте осуществления формулы (I) R1 является R4, а R4 представляет собой циклогексил. В следующем варианте осуществления формулы (I) R1 является R4, а R4 представляет собой гетероциклоалкил. В следующем варианте осуществления формулы (I) R1 является R4, а R4 представляет собой 8-азабицикло[3.2.1]октан, азетидинил, пиперидинил, пиперазинил, пирролидинил, морфолинил, тетрагидропиранил или тетрагидротиофенил. В следующем варианте осуществления формулы (I) R1 является R4, а R4 представляет собой гетероциклоалкенил. В следующем варианте осуществления формулы (I) R1 является R4, а R4 представляет собой тетрагидропиридазинил.
В одном из вариантов осуществления формулы (I) R1 является R5. В следующем варианте осуществления формулы (I) R1 является R5, а R5 представляет собой алкил или алкинил. В следующем варианте осуществления формулы (I) R1 является R5, а R5 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (I) R1 является R5, а R5 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными из R6, R7, OR7, SR7, SO2R7, N(R7)2, OH, CN, CF3, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (I) R1 является R5, а R5 представляет собой алкил, который замещен R7.
В одном из вариантов осуществления формулы (I) R7 является R8, R9, R10 или R11. В следующем варианте осуществления формулы (I) R7 является R8, а R8 представляет собой фенил, который не конденсирован или конденсирован с R8A, а R8A представляет собой гетероциклоалкан. В следующем варианте осуществления формулы (I) R7 является R8, а R8 представляет собой фенил, который не конденсирован. В следующем варианте осуществления формулы (I) R7 является R9, а R9 представляет собой гетероарил. В следующем варианте осуществления формулы (I) R7 является R9, а R9 представляет собой фуранил, имидазолил, изотиазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, оксазолил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, тетразолил, тиазолил, тиофенил, триазинил или 1,2,3-триазолил. В следующем варианте осуществления формулы (I) R7 является R9, а R9 представляет собой пиридинил, тиазолил, имидазолил и 1,2,3-триазолил. В следующем варианте осуществления формулы (I) R7 является R10, а R10 представляет собой С3-С10-циклоалкил. В следующем варианте осуществления формулы (I) R7 является R10, а R10 представляет собой С6 или С10-циклоалкил. В следующем варианте осуществления формулы (I) R7 является R10, а R10 представляет собой циклогексил или адамантил. В следующем варианте осуществления формулы (I) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пиранил, пиридин-1(Н)-ил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (I) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (I) R7 является R11, а R11 представляет собой алкил, который не замещен или замещен. В следующем варианте осуществления формулы (I) R7 является R11, а R11 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (I) R7 является R11, а R11 представляет собой алкил, который замещен. В следующем варианте осуществления формулы (I) R7 является R11, а R11 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными OR12, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (I) R7 является R11, а R11 представляет собой алкил, который замещен OR12, R12 является R16, а R16 представляет собой алкил.
В одном из вариантов осуществления формулы (I) R17 является R19 или R21. В следующем варианте осуществления формулы (I) R17 является R19, а R19 представляет собой гетероарил. В следующем варианте осуществления формулы (I) R17 является R19, а R19 представляет собой тиазолил. В следующем варианте осуществления формулы (I) R17 является R21, а R21 представляет собой алкинил. В следующем варианте осуществления формулы (I) R17 является R21, а R21 представляет собой этинил.
Другой вариант осуществления относится к соединениям формулы (I), которые представляют собой
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-(бензилокси)-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(2-фенилэтокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(фенилтио)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(фенилтио)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(фенилтио)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(фенилсульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(фенилсульфинил)бензамид;
2-бензил-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-бензил-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-бензил-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(2-фенилэтил)бензамид;
2-(бензиламино)-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-анилино-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
2-анилино-4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-метокси-N-((3-нитро-4-тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индазол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индазол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензамид;
4-(4-((4’-хлор-4-(пирролидин-1-илметил)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-пирролидин-1-илэтил)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((1-циклопентилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)-3-изобутилпиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(2,4-диоксо-3-азабицикло(3.2.0)гепт-3-ил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((4-метил-6-оксо-1,4,5,6-тетрагидропиридазин-3-ил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3,3-диметил-2-оксоазетидин-1-ил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(4-нитро-2Н-1,2,3-триазол-2-ил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((2-(2-пиперидин-1-илэтокси)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-((((1-этилпирролидин-2-ил)метил)амино)карбонил)-4-метоксифенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1-нафтилокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2-нафтилокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(2-нафтилокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2-нафтилокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(хинолин-7-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(хинолин-6-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(изохинолин-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(изохинолин-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(хинолин-6-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-6-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(изохинолин-7-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(изохинолин-7-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-метоксифенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-метилфенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
N-((3-((хлор(дифтор)метил)сульфонил)-4-((3-(диметиламино)пропил)амино)фенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
2-(1Н-индол-4-илокси)-4-(4-((2-(4-метоксифенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(4-(трифторметил)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(4-(трифторметокси)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(3-(трифторметил)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(3-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
N-((3-((хлор(дифтор)метил)сульфонил)-4-((1-метилпиперидин-4-ил)амино)фенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(феноксиметил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(пиридин-3-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(пиридин-3-илокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(((1R)-3-(диметиламино)-1-(фенилтио)метил)пропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-(пиридин-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(пиридин-3-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-(пиридин-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((2-(4-метилпиперазин-1-ил)этил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(4-метилпиперазин-1-ил)пропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)(метил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(((1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-циано-4-((3-(диметиламино)пропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)фенил)-3-(трифторметил)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(изопропил(метил)амино)пропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропокси)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((2-(4-метилпиперазин-1-ил)этил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-(4-метилпиперазин-1-ил)пропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-метилпиперазин-1-ил)пропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(3-(диметиламино)пропокси)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((2-(4-метилпиперазин-1-ил)этил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-(((1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-(((1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(3-(диметиламино)пропокси)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-(4-метилпиперазин-1-ил)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((1-(2,2,2-трифторэтил)пиперидин-4-ил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(((4-(диметиламино)-1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2,3-дигидро-1,4-бензодиоксин-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
5-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-1,1’-дифенил-2-карбоксамид;
5-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-1,1’-дифенил-2-карбоксамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(3-пиперидин-1-илпропокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(3-(диметиламино)пропокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(3-пиперидин-1-илпропокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(3-(диметиламино)пропокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((1-метилпиперидин-4-иламино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((1-(2,2,2-трифторэтил)пиперидин-4-ил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(2-пирролидин-1-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-4-(2-(диизопропиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2,3-дигидро-1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклоокт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклоокт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((2-(диметиламино)этил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((4-(диметиламино)бутил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((1-(фенилсульфонил)пиперидин-4-ил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((1-(хинолин-8-илсульфонил)пиперидин-4-ил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((1-(фенилсульфонил)пиперидин-4-ил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((1-(хинолин-8-илсульфонил)пиперидин-4-ил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(((1S)-3-(диметиламино)-1-(тиен-2-илпропил)амино)-3-нитрофенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тиен-2-илметил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-фенокси-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(1Н-1,2,3-триазол-1-ил)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(2Н-1,2,3-триазол-2-ил)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(2-нафтилокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(2-оксопиридин-1(2Н)-ил)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(пиридин-2-илокси)этил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((2-(пиридин-4-илэтил)амино)фенил)сульфонил)-2-феноксибензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((3-циано-4-((3-(диметиламино)пропил)амино)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((4-метилпиперазин-1-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-(1-(4’-хлор-1,1’-дифенил-2-ил)этил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
N-((4-(((4-аминотетрагидро-2Н-пиран-4-ил)метил)амино)-3-нитрофенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3S)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3R)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
N-[(4-{[(3S,4R)-1-бензил-3-гидроксипиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[1-(2-метоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2-гидроксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[1-(2-метоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-({4’-хлор-3-[3-(диметиламино)пропил]-1,1’-дифенил-2-ил}метил}пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-({4’-хлор-4-морфолин-4-ил-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-({4’-хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диметиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино}-3-нитрофенил}сульфонил)бензамид;
4-(4-({4’-хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-{4-[1-{4’-хлор-1,1’-дифенил-2-ил}этил)пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(диметиламино)тетрагидро-2Н-пиран-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
N-({4-[(2-аминоциклогексил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-[4-({4’-хлор-4-[3-(диметиламино)проп-1-инил]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[2-(4-гидрокси-1-метилпиперидин-4-ил)этил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-2-ил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-[4-({4’-хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(циклопропилметил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил)сульфонил)бензамид;
4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[4’-хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-([4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-([4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-([4-{[(1-морфолин-4-илциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-([3-нитро-4-{[1-(1,3-тиазол-2-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-([3-нитро-4-{[1-(1,3-тиазол-4-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)-бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({4-(2-гидроксиэтил)пиперазин-1-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3S)-1-метилпирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-фторпропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-илметил)амино}-3-нитрофенил)сульфонил]-4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-([4-{[(1-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-гидрокси-1-тетрагидро-2Н-пиран-4-илэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-({1-[2-(1Н-пиразол-1-ил)этил]пиперидин-4-ил}амино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(метиламино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(метиламино)-3-нитрофенил]сульфонил}бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил]этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-морфолин-4-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-([4-{[(1-аминоциклогексил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-{[2-(2-оксопирролидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил]этил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-{4-[(1R)-1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[(1S)-1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(циклогексилметил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-3-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-иламино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3-метилоксетан-3-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метоксициклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1,1-диоксидотиоморфолин-4-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксопиперидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксоимидазолидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2-пиридин-4-илэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-морфолин-4-ил-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(4-метоксипиперидин-1-ил)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-5-пирролидин-1-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-([3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-[4-({4’-хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил]пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-([4-{[(1,1-диоксидотетрагидротиен-3-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотетрагидротиен-3-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-(трифторметил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[2-(1,3-диоксолан-2-ил)этил]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метил-5-оксопирролидин-3-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метил-6-оксопиперидин-3-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид;
4-(4-{[4-(4-хлорфенил)-1-метил-1Н-пиразол-5-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-[(3-метилоксетан-3-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1-оксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1,3-тиазол-5-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2-тетрагидро-2Н-пиран-4-илэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[3-(метилсульфонил)пропил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1,1-диоксидотиоморфолин-4-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотетрагидротиен-3-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-дифторэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4,4-дифторциклогексил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[4-(4-хлорфенил)-1-изопропил-6-оксо-1,6-дигидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[3-(метилсульфонил)пропокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[3-(метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[3-(метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(3R)-4-гидрокси-1-адамантил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[цис-4-гидрокси-1-адамантил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид;
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-([4-{[(1,1-диоксидотетрагидротиен-3-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-(метиламино)-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
N-({5-бром-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[4-(4-хлорфенил)-6-изопропоксипиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({6-(тетрагидро-2Н-пиран-4-илметокси)-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(2-метоксиэтил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
N-({4-[(1-ацетилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-(метилсульфонил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
N-({4-[(1-ацетилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-([4-{[1-(метилсульфонил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил)метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил)метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2R)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2S)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-морфолин-4-илэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)окси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[4-(4-хлорфенил)-1-(3-гидроксипропил)-1,2,5,6-тетрагидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
бензил 4-({[4-({[4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензоил]амино}сульфонил)-2-нитрофенил]амино}метил)пиперидин-1-карбоксилат;
N-({3-(аминокарбонил)-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил)метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-метил-1Н-имидазол-5-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-морфолин-4-илсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотиоморфолин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
N-{[5-бром-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[6-[(тетрагидро-2Н-пиран-4-илметил)амино]-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3,3-диметилбутил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1S)-1-(гидроксиметил)-3-метилбутил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(2R)-тетрагидрофуран-2-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1R)-1-(гидроксиметил)-2-метилпропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метоксифенил)амино]-3-нитрофенил}сульфонил)бензамид;
N-[(4-{[2-(1,3-бензодиоксол-5-ил)этил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(2-оксопирролидин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-гидроксифенил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
N-{[4-({2-[4-(аминосульфонил)фенил]этил}амино)-3-нитрофенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1Н-имидазол-1-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1S)-1-фенилэтил]амино}фенил)сульфонил]бензамид;
N-({2-хлор-5-фтор-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(метилсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(метилсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-диметилтетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-[(4-тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)окси]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илбут-2-инил)окси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-этинил-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-ил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-гидрокси-4-метоксифенил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(2,3-дигидро-1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(пиридин-3-иламино)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)-2-(пиридин-3-иламино)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)-2-(пиридин-3-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1,2,3,4-тетрагидроизохинолин-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
транс-N-({5-хлор-6-[(4-метоксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(2,2-дифторэтил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
N-({5-хлор-6-{[1-(цианометил)-4-фторпиперидин-4-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидрофуран-3-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
транс-N-({5-хлор-6-[(4-гидроксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]окси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
N-({5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(цианометил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-(2-метоксиэтокси)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1- (N,N-диметилглицил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(цианометил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(3-нитро-4-{[(4-оксетан-3-илморфолин-2-ил)метил]амино}фенил)сульфонил]бензамид;
N-({5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}окси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидрофуран-3-илметил)амино]фенил}сульфонил)бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
N-({5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}метокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-({(3R)-1-(2,2-дифторэтил)пирролидин-3-ил}метокси)пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[({(2R)-4-[2-(2-метоксиэтокси)этил]морфолин-2-ил}метил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
N-[(4-{[(4-ацетилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(метилсульфонил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-({4-фтор-1-[2-фтор-1-(фторметил)этил]пиперидин-4-ил}метокси)-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(2-тетрагидрофуран-2-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-цианоциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4,4-дифторциклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил) бензамид;
N-({3-хлор-4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-тетрагидро-2Н-пиран-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1R,5S)- 8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)2-фенокси-4-(4-{(3-фенилпропаноил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид;
N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропаноил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид;
N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид;
N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид;
4-[4-(2-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}бензил)пиперазин-1-ил]-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид;
4-[4-(2-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид;
4-(4-{2-[(4R,7S)-2,3,3а,4,7,7а-гексагидро-1Н-4,7-метаноинден-5-ил]пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-[4-(2-{5-[(1R,5S)-8-азабицикло[3.2.1]окт-8-илметил]тиен-2-ил}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-[4-(2-{5-[(1R,5S)-8-азабицикло[3.2.1]окт-8-илметил]тиен-2-ил}бензилиден)пиперидин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид;
4-[4-(3-{5-[(1R,5S)-8-азабицикло[3.2.1]окт-8-илметил]тиен-2-ил}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты.
В другом аспекте в настоящем изобретении предоставлены соединения формулы (II)
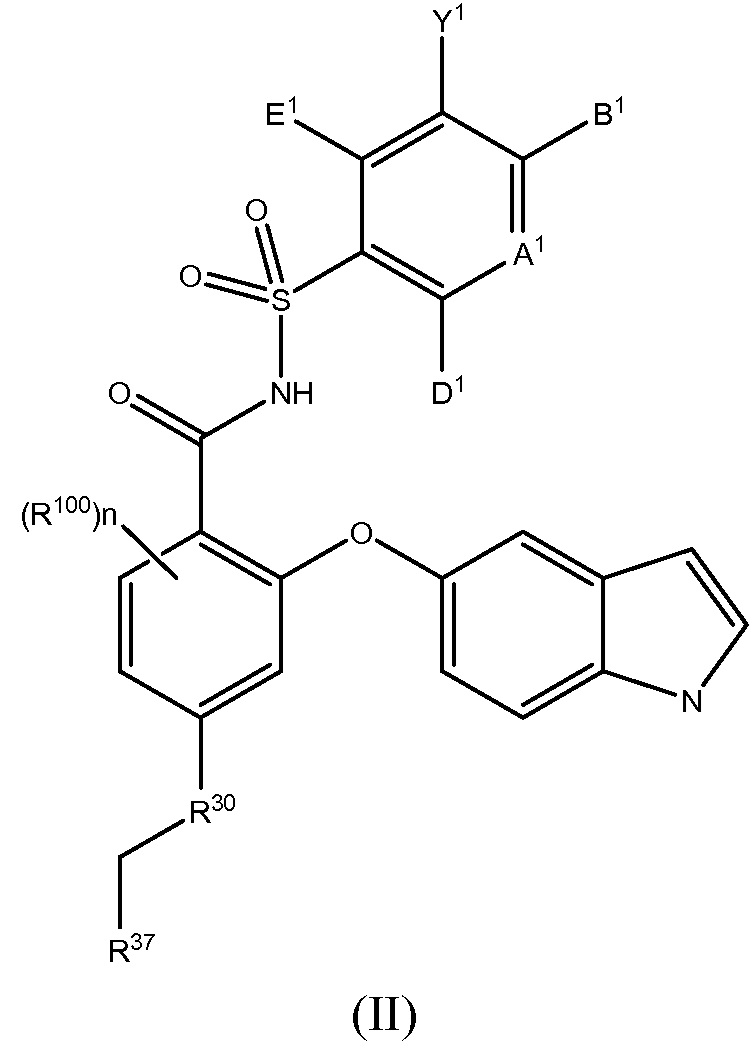
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты,
в которых А1, В1, D1, Е1, Y1, R30 и R37 аналогичны описанным в настоящем описании для формулы (I), n равно 0, 1, 2 или 3; описание числа заместителей при R26 и R100 аналогично описанному для заместителей при R26.
В одном из вариантов осуществления формулы (II) А1 является N. В следующем варианте осуществления формулы (II) А1 является С(А2). В следующем варианте осуществления формулы (II) А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (II) В1 является R1, OR1, SR1, SO2R1, NHR1, N(R1)2 или С(O)NHR1. В следующем варианте осуществления формулы (II) В1 является NHR1. В следующем варианте осуществления формулы (II) В1 является NHR1, а А1 является С(А2), а А2 является Н. В следующем варианте осуществления формулы (II) В1 является OR1. В следующем варианте осуществления формулы (II) В1 является OR1, а А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (II) D1 и Е1являются Н. В следующем варианте осуществления формулы (II) В1 является NHR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н. В следующем варианте осуществления формулы (II) В1 является OR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н.
В одном из вариантов осуществления формулы (II) Y1является H, CN, NO2, F, Cl, Br, I, CF3, R17, NHC(O)R17 или C(O)NH2. В следующем варианте осуществления формулы (II) Y1является NO2. В следующем варианте осуществления формулы (II) В1 является NHR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является NO2. В следующем варианте осуществления формулы (II) Y1является Cl. В следующем варианте осуществления формулы (II) В1 является OR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является Cl.
В одном из вариантов осуществления формулы (II) R1 представляет собой R2, R3, R4 или R5. В следующем варианте осуществления формулы (II) R1 является R2, а R2 представляет собой фенил.
В одном из вариантов осуществления формулы (II) R1 является R3, а R3 представляет собой гетероарил. В следующем варианте осуществления формулы (II) R3 представляет собой триазолил.
В одном из вариантов осуществления формулы (II) R1 является R4. В следующем варианте осуществления формулы (II) R1 является R4, а R4 представляет собой циклоалкил. В следующем варианте осуществления формулы (II) R1 является R4, а R4 представляет собой циклогексил. В следующем варианте осуществления формулы (II) R1 является R4, а R4 представляет собой гетероциклоалкил. В следующем варианте осуществления формулы (II) R1 является R4, а R4 представляет собой 8-азабицикло[3.2.1]октан, азетидинил, пиперидинил, пиперазинил, пирролидинил, морфолинил, тетрагидропиранил или тетрагидротиофенил. В следующем варианте осуществления формулы (II) R1 является R4, а R4 представляет собой гетероциклоалкенил. В следующем варианте осуществления формулы (II) R1 является R4, а R4 представляет собой тетрагидропиридазинил.
В одном из вариантов осуществления формулы (II) R1 является R5. В следующем варианте осуществления формулы (II) R1 является R5, а R5 представляет собой алкил или алкинил. В следующем варианте осуществления формулы (II) R1 является R5, а R5 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (II) R1 является R5, а R5 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными из R6, R7, OR7, SR7, SO2R7, N(R7)2, OH, CN, CF3, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (II) R1 является R5, а R5 представляет собой алкил, который замещен R7.
В одном из вариантов осуществления формулы (II) R7 является R8, R9, R10 или R11. В следующем варианте осуществления формулы (II) R7 является R8, а R8 представляет собой фенил, который не конденсирован или конденсирован с R8A, а R8A представляет собой гетероциклоалкан. В следующем варианте осуществления формулы (II) R7 является R8, а R8 представляет собой фенил, который не конденсирован. В следующем варианте осуществления формулы (II) R7 является R9, а R9 представляет собой гетероарил. В следующем варианте осуществления формулы (II) R7 является R9, а R9 представляет собой фуранил, имидазолил, изотиазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, оксазолил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, тетразолил, тиазолил, тиофенил, триазинил или 1,2,3-триазолил. В следующем варианте осуществления формулы (II) R7 является R9, а R9 представляет собой пиридинил, тиазолил, имидазолил и 1,2,3-триазолил. В следующем варианте осуществления формулы (II) R7 является R10, а R10 представляет собой С3-С10-циклоалкил. В следующем варианте осуществления формулы (II) R7 является R10, а R10 представляет собой С6 или С10-циклоалкил. В следующем варианте осуществления формулы (II) R7 является R10, а R10 представляет собой циклогексил или адамантил. В следующем варианте осуществления формулы (II) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пиранил, пиридин-1(Н)-ил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (II) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (II) R7 является R11, а R11 представляет собой алкил, который не замещен или замещен. В следующем варианте осуществления формулы (II) R7 является R11, а R11 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (II) R7 является R11, а R11 представляет собой алкил, который замещен. В следующем варианте осуществления формулы (II) R7 является R11, а R11 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными OR12, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (II) R7 является R11, R11 представляет собой алкил, который замещен OR12, R12 является R16, а R16 представляет собой алкил.
В одном из вариантов осуществления формулы (II) R17 является R19 или R21. В следующем варианте осуществления формулы (II) R17 является R19, а R19 представляет собой гетероарил. В следующем варианте осуществления формулы (II) R17 является R19, а R19 представляет собой тиазолил. В следующем варианте осуществления формулы (II) R17 является R21, а R21 представляет собой алкинил. В следующем варианте осуществления формулы (II) R17 является R21, а R21 представляет собой этинил.
Другой вариант осуществления относится к соединениям формулы II, которые представляют собой
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((1-циклопентилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
N-((3-((хлор(дифтор)метил)сульфонил)-4-((3-(диметиламино)пропил)амино)фенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
N-((3-((хлор(дифтор)метил)сульфонил)-4-((1-метилпиперидин-4-ил)амино)фенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((2-(4-метилпиперазин-1-ил)этил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((3-(4-метилпиперазин-1-ил)пропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(3-(диметиламино)пропокси)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-(((1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-(4-метилпиперазин-1-ил)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(((4-(диметиламино)-1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-(диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(2,3-дигидро-1Н-индол-5-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-((трифторметил)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((3-циано-4-((3-(диметиламино)пропил)амино)фенил)сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((3-нитро-4-((1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-((4-((4-метилпиперазин-1-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3S)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3R)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
N-[(4-{[(3S,4R)-1-бензил-3-гидроксипиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-(2-метоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-5-фтор-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-5-фтор-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(диметиламино)тетрагидро-2Н-пиран-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
N-({4-[(2-аминоциклогексил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[2-(4-гидрокси-1-метилпиперидин-4-ил)этил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-2-ил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(циклопропилметил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперидин-1-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-морфолин-4-илциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-2-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-4-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(2-гидроксиэтил)пиперазин-1-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3S)-1-метилпирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-фторпропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-гидрокси-1-тетрагидро-2Н-пиран-4-илэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-({1-[2-(1Н-пиразол-1-ил)этил]пиперидин-4-ил}амино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(метиламино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5-морфолин-4-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-[(4-{[(1-аминоциклогексил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксопирролидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{1-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-N-({4-[(циклогексилметил)амино]-3-нитрофенил}сульфонил) 2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-3-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-иламино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3-метилоксетан-3-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метоксициклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1,1-диоксидотиоморфолин-4-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксопиперидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксоимидазолидин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-[(2-пиридин-4-илэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-морфолин-4-ил-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(4-метоксипиперидин-1-ил)-3-нитрофенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-5-пирролидин-1-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидротиен-3-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотетрагидротиен-3-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-(трифторметил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[2-(1,3-диоксолан-2-ил)этил]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метил-5-оксопирролидин-3-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метил-6-оксопиперидин-3-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид;
4-(4-{[4-(4-хлорфенил)-1-метил-1Н-пиразол-5-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-метилоксетан-3-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1-оксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1,3-тиазол-5-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2-тетрагидро-2Н-пиран-4-илэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-дифторэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4,4-дифторциклогексил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[4-(4-хлорфенил)-1-изопропил-6-оксо-1,6-дигидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(3R)-4-гидрокси-1-адамантил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(3R)-4-гидрокси-1-адамантил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-(метиламино)-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
N-{[5-бром-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[4-(4-хлорфенил)-6-изопропоксипиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[6-(тетрагидро-2Н-пиран-4-илметокси)-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(2-метоксиэтил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
N-({4-[(1-ацетилпиперидин-4-ил]амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[1-(метилсульфонил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2R)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2S)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-морфолин-4-илэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)окси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
бензил 4-({[4-({[4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензоил]амино}сульфонил)-2-нитрофенил]амино}метил)пиперидин-1-карбоксилат;
N-{[3-(аминокарбонил)-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[4’-хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-{4-[(5-трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-метил-1Н-имидазол-5-ил)метил]амино}-3-нитрофенил}сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(морфолин-4-илсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотиоморфолин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3,3-диметилбутил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1S)-1-(гидроксиметил)-3-метилбутил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(2R)-тетрагидрофуран-2-илметил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1R)-1-(гидроксиметил)-2-метилпропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метоксифенил)амино]-3-нитрофенил}сульфонил)бензамид;
N-[(4-{[2-(1,3-бензодиоксол-5-ил)этил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(2-оксопирролидин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-гидроксифенил)амино}-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
N-{[4-({2-[4-(аминосульфонил)фенил]этил}амино)-3-нитрофенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1Н-имидазол-1-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1S)-1-фенилэтил]амино}фенил)сульфонил]бензамид;
N-({2-хлор-5-фтор-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(метилсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-диметилтетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)окси]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илбут-2-инил)окси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-гидрокси-4-метоксифенил)амино]-3-нитрофенил)амино]сульфонил)-2-(1Н-индол-5-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино]-3-нитрофенил)сульфонил]бензамид;
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты.
В другом аспекте в настоящем изобретении предоставлены соединения формулы (III)
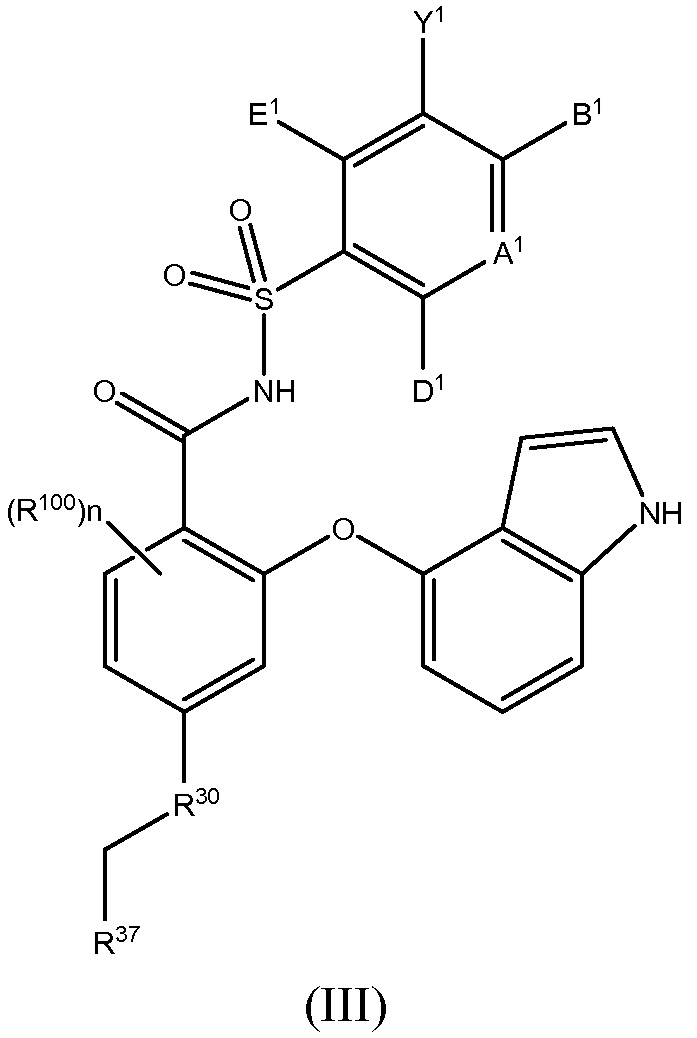
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты,
в которых А1, В1, D1, Е1, Y1, R30 и R37 аналогичны описанным в настоящем описании для формулы (I), n равно 0, 1, 2 или 3; описание числа заместителей при R26 и R100 аналогично описанному для заместителей при R26.
В одном из вариантов осуществления формулы (III) А1 является N. В следующем варианте осуществления формулы (III) А1 является С(А2). В следующем варианте осуществления формулы (III) А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (III) В1 является R1, OR1, SR1, SO2R1, NHR1, N(R1)2 или С(O)NHR1. В следующем варианте осуществления формулы (III) В1 является NHR1. В следующем варианте осуществления формулы (III) В1 является NHR1, а А1 является С(А2), а А2 является Н. В следующем варианте осуществления формулы (III) В1 является OR1. В следующем варианте осуществления формулы (III) В1 является OR1, а А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (III) D1 и Е1являются Н. В следующем варианте осуществления формулы (III) В1 является NHR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н. В следующем варианте осуществления формулы (III) В1 является OR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н.
В одном из вариантов осуществления формулы (III) Y1является H, CN, NO2, F, Cl, Br, I, CF3, R17, NHC(O)R17 или C(O)NH2. В следующем варианте осуществления формулы (III) Y1является NO2. В следующем варианте осуществления формулы (III) В1 является NHR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является NO2. В следующем варианте осуществления формулы (III) Y1является Cl. В следующем варианте осуществления формулы (III) В1 является OR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является Cl.
В одном из вариантов осуществления формулы (III) R1 представляет собой R2, R3, R4 или R5. В следующем варианте осуществления формулы (III) R1 является R2, а R2 представляет собой фенил.
В одном из вариантов осуществления формулы (III) R1 является R3, а R3 представляет собой гетероарил. В следующем варианте осуществления формулы (III) R3 представляет собой триазолил.
В одном из вариантов осуществления формулы (III) R1 является R4. В следующем варианте осуществления формулы (III) R1 является R4, а R4 представляет собой циклоалкил. В следующем варианте осуществления формулы (III) R1 является R4, а R4 представляет собой циклогексил. В следующем варианте осуществления формулы (III) R1 является R4, а R4 представляет собой гетероциклоалкил. В следующем варианте осуществления формулы (III) R1 является R4, а R4 представляет собой 8-азабицикло[3.2.1]октан, азетидинил, пиперидинил, пиперазинил, пирролидинил, морфолинил, тетрагидропиранил или тетрагидротиофенил. В следующем варианте осуществления формулы (III) R1 является R4, а R4 представляет собой гетероциклоалкенил. В следующем варианте осуществления формулы (III) R1 является R4, а R4 представляет собой тетрагидропиридазинил.
В одном из вариантов осуществления формулы (III) R1 является R5. В следующем варианте осуществления формулы (III) R1 является R5, а R5 представляет собой алкил или алкинил. В следующем варианте осуществления формулы (III) R1 является R5, а R5 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (III) R1 является R5, а R5 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными из R6, R7, OR7, SR7, SO2R7, N(R7)2, OH, CN, CF3, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (III) R1 является R5, а R5 представляет собой алкил, который замещен R7.
В одном из вариантов осуществления формулы (III) R7 является R8, R9, R10 или R11. В следующем варианте осуществления формулы (III) R7 является R8, а R8 представляет собой фенил, который не конденсирован или конденсирован с R8A, а R8A представляет собой гетероциклоалкан. В следующем варианте осуществления формулы (III) R7 является R8, а R8 представляет собой фенил, который не конденсирован. В следующем варианте осуществления формулы (III) R7 является R9, а R9 представляет собой гетероарил. В следующем варианте осуществления формулы (III) R7 является R9, а R9 представляет собой фуранил, имидазолил, изотиазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, оксазолил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, тетразолил, тиазолил, тиофенил, триазинил или 1,2,3-триазолил. В следующем варианте осуществления формулы (III) R7 является R9, а R9 представляет собой пиридинил, тиазолил, имидазолил и 1,2,3-триазолил. В следующем варианте осуществления формулы (III) R7 является R10, а R10 представляет собой С3-С10-циклоалкил. В следующем варианте осуществления формулы (III) R7 является R10, а R10 представляет собой С6 или С10-циклоалкил. В следующем варианте осуществления формулы (III) R7 является R10, а R10 представляет собой циклогексил или адамантанил. В следующем варианте осуществления формулы (III) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пиранил, пиридин-1(Н)-ил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (III) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (III) R7 является R11, а R11 представляет собой алкил, который не замещен или замещен. В следующем варианте осуществления формулы (III) R7 является R11, а R11 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (III) R7 является R11, а R11 представляет собой алкил, который замещен. В следующем варианте осуществления формулы (III) R7 является R11, а R11 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными OR12, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (III) R7 является R11, а R11 представляет собой алкил, который замещен OR12, R12 является R16, а R16 представляет собой алкил.
В одном из вариантов осуществления формулы (III) R17 является R19 или R21. В следующем варианте осуществления формулы (III) R17 является R19, а R19 представляет собой гетероарил. В следующем варианте осуществления формулы (III) R17 является R19, а R19 представляет собой тиазолил. В следующем варианте осуществления формулы (III) R17 является R21, а R21 представляет собой алкинил. В следующем варианте осуществления формулы (III) R17 является R21, а R21 представляет собой этинил.
Еще один вариант осуществления относится к соединениям формулы (III), которые представляют собой
4-(4-((4’-хлор-4-(пирролидин-1-илметил)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-пирролидин-1-илэтил)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-((3-(диметиламино)пропил)амино)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((тетрагидро-2Н-пиран-4-илметил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-морфолин-4-илпропил)амино)-3-((трифторметил)сульфонил)фенил)сульфонил)бензамид;
2-(1Н-индол-4-илокси)-4-(4-((2-(4-метоксифенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(4-(трифторметил)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(4-(трифторметокси)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((4,4-диметил-2-(3-(трифторметил)фенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(3-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((3-(4-метилпиперазин-1-ил)пропил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((2-(4-метилпиперазин-1-ил)этил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-(((1-метилпиперидин-4-ил)метил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-((4-(3-диметиламино)пропокси)-3-нитрофенил)сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((1-(2,2,2-трифторэтил)пиперидин-4-ил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-диметиламино)этокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((4’-хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклоокт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((3-пирролидин-1-илпропил)амино)фенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)-4,4-диметилциклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклоокт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогепт-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклопент-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-((2-(4-хлорфенил)циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((4-((1-метилпиперидин-4-ил)амино)-3-нитрофенил)сульфонил)бензамид;
4-(4-(1-(4’-хлор-1,1’-дифенил-2-ил)этил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид;
N-((4-(((4-аминотетрагидро-2Н-пиран-4-ил)метил)амино)-3-нитрофенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2-гидроксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[1-(2-метоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-[4-({[4’-хлор-3-[3-(диметиламино)пропил]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[(4’-хлор-4-морфолин-4-ил-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-[4-({4’-хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диметиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
4-[4-({4’-хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-[4-({4’-хлор-4-[3-(диметиламино)проп-1-инил]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид;
4-(4-{[4’-хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[4’-хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил}сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(метиламино)-3-нитрофенил]сульфонил}бензамид;
4-{4-[1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-{4-[(1R)-1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-{4-[(1S)-1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид;
4-[4-({4’-хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[3-(метилсульфонил)пропил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1,1-диоксидотиоморфолин-4-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотетрагидротиен-3-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтокси)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[3-(метилсульфонил)пропокси]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид;
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидротиен-3-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид;
N-({4-[(1-ацетилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[1-(метилсульфонил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид;
4-(4-{[4-(4-хлорфенил)-1-(3-гидроксипропил)-1,2,5,6-тетрагидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
N-{[5-бром-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[6-(тетрагидро-2Н-пиран-4-илметил)амино]-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(метилсульфонил)фенил]сульфонил}бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-этинил-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индол-4-илокси)бензамид;
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид;
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты.
В другом аспекте в настоящем изобретении предоставлены соединения формулы (IV)
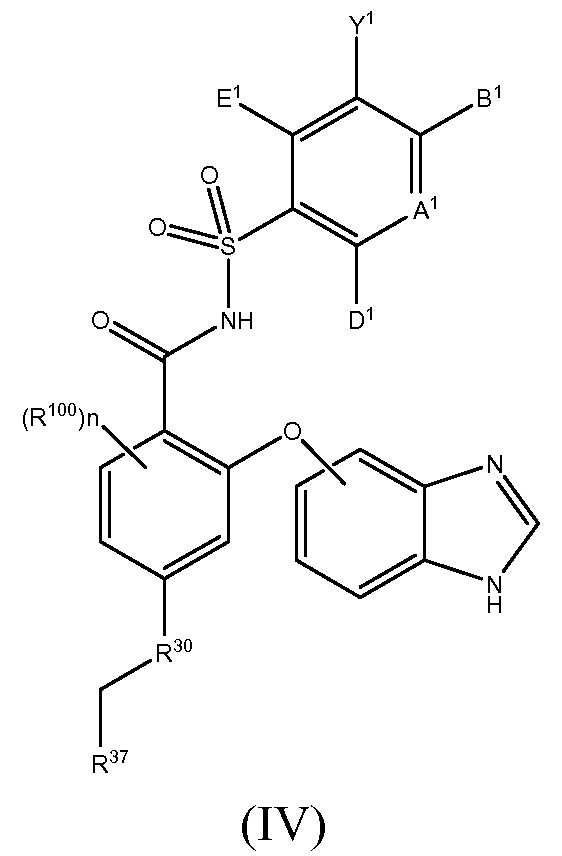
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты,
в которых А1, В1, D1, Е1, Y1, R30 и R37 аналогичны описанным в настоящем описании для формулы (I), n равно 0, 1, 2 или 3; описание числа заместителей при R26 и R100 аналогично описанному для заместителей при R26.
В одном из вариантов осуществления формулы (IV) А1 является N. В следующем варианте осуществления формулы (IV) А1 является С(А2). В следующем варианте осуществления формулы (IV) А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (IV) В1 является R1, OR1, SR1, SO2R1, NHR1, N(R1)2 или С(O)NHR1. В следующем варианте осуществления формулы (IV) В1 является NHR1. В следующем варианте осуществления формулы (IV) В1 является NHR1, а А1 является С(А2), а А2 является Н. В следующем варианте осуществления формулы (IV) В1 является OR1. В следующем варианте осуществления формулы (IV) В1 является OR1, а А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (IV) D1 и Е1являются Н. В следующем варианте осуществления формулы (IV) В1 является NHR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н. В следующем варианте осуществления формулы (IV) В1 является OR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н.
В одном из вариантов осуществления формулы (IV) Y1является H, CN, NO2, F, Cl, Br, I, CF3, R17, NHC(O)R17 или C(O)NH2. В следующем варианте осуществления формулы (IV) Y1является NO2. В следующем варианте осуществления формулы (IV) В1 является NHR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является NO2. В следующем варианте осуществления формулы (IV) Y1является Cl. В следующем варианте осуществления формулы (IV) В1 является OR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является Cl.
В одном из вариантов осуществления формулы (IV) R1 представляет собой R2, R3, R4 или R5. В следующем варианте осуществления формулы (IV) R1 является R2, а R2 представляет собой фенил.
В одном из вариантов осуществления формулы (IV) R1 является R3, а R3 представляет собой гетероарил. В следующем варианте осуществления формулы (IV) R3 представляет собой триазолил.
В одном из вариантов осуществления формулы (IV) R1 является R4. В следующем варианте осуществления формулы (IV) R1 является R4, а R4 представляет собой циклоалкил. В следующем варианте осуществления формулы (IV) R1 является R4, а R4 представляет собой циклогексил. В следующем варианте осуществления формулы (IV) R1 является R4, а R4 представляет собой гетероциклоалкил. В следующем варианте осуществления формулы (IV) R1 является R4, а R4 представляет собой 8-азабицикло[3.2.1]октан, азетидинил, пиперидинил, пиперазинил, пирролидинил, морфолинил, тетрагидропиранил или тетрагидротиофенил. В следующем варианте осуществления формулы (IV) R1 является R4, а R4 представляет собой гетероциклоалкенил. В следующем варианте осуществления формулы (IV) R1 является R4, а R4 представляет собой тетрагидропиридазинил.
В одном из вариантов осуществления формулы (IV) R1 является R5. В следующем варианте осуществления формулы (IV) R1 является R5, а R5 представляет собой алкил или алкинил. В следующем варианте осуществления формулы (IV) R1 является R5, а R5 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (IV) R1 является R5, а R5 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными из R6, R7, OR7, SR7, SO2R7, N(R7)2, OH, CN, CF3, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (IV) R1 является R5, а R5 представляет собой алкил, который замещен R7.
В одном из вариантов осуществления формулы (IV) R7 является R8, R9, R10 или R11. В следующем варианте осуществления формулы (IV) R7 является R8, а R8 представляет собой фенил, который не конденсирован или конденсирован с R8A, а R8A представляет собой гетероциклоалкан. В следующем варианте осуществления формулы (IV) R7 является R8, а R8 представляет собой фенил, который не конденсирован. В следующем варианте осуществления формулы (IV) R7 является R9, а R9 представляет собой гетероарил. В следующем варианте осуществления формулы (IV) R7 является R9, а R9 представляет собой фуранил, имидазолил, изотиазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, оксазолил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, тетразолил, тиазолил, тиофенил, триазинил или 1,2,3-триазолил. В следующем варианте осуществления формулы (IV) R7 является R9, а R9 представляет собой пиридинил, тиазолил, имидазолил и 1,2,3-триазолил. В следующем варианте осуществления формулы (IV) R7 является R10, а R10 представляет собой С3-С10-циклоалкил. В следующем варианте осуществления формулы (IV) R7 является R10, а R10 представляет собой С6 или С10-циклоалкил. В следующем варианте осуществления формулы (IV) R7 является R10, а R10 представляет собой циклогексил или адамантанил. В следующем варианте осуществления формулы (IV) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пиранил, пиридин-1(Н)-ил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (IV) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (IV) R7 является R11, а R11 представляет собой алкил, который не замещен или замещен. В следующем варианте осуществления формулы (IV) R7 является R11, а R11 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (IV) R7 является R11, а R11 представляет собой алкил, который замещен. В следующем варианте осуществления формулы (IV) R7 является R11, а R11 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными OR12, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (IV) R7 является R11, а R11 представляет собой алкил, который замещен OR12, R12 является R16, а R16 представляет собой алкил.
В одном из вариантов осуществления формулы (IV) R17 является R19 или R21. В следующем варианте осуществления формулы (IV) R17 является R19, а R19 представляет собой гетероарил. В следующем варианте осуществления формулы (IV) R17 является R19, а R19 представляет собой тиазолил. В следующем варианте осуществления формулы (IV) R17 является R21, а R21 представляет собой алкинил. В следующем варианте осуществления формулы (IV) R17 является R21, а R21 представляет собой этинил.
Другой вариант осуществления относится к соединениям формулы (IV), которые представляют собой
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(2,2-дифторэтил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(цианометил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-(2-метоксиэтокси)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(N,N-диметилглицил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(цианометил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(3-нитро-4-{[(4-оксетан-3-илморфолин-2-ил)метил]амино}фенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидрофуран-3-илметил)амино]фенил}сульфонил)бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[({(2R)-4-[2-(2-метоксиэтокси)этил]морфолин-2-ил}метил)амино]-3-нитрофенил}сульфонил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
N-[(4-{[(4-ацетилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(метилсульфонил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид;
транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-цианоциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4,4-дифторциклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты.
В другом аспекте в настоящем изобретении предоставлены соединения формулы (V)
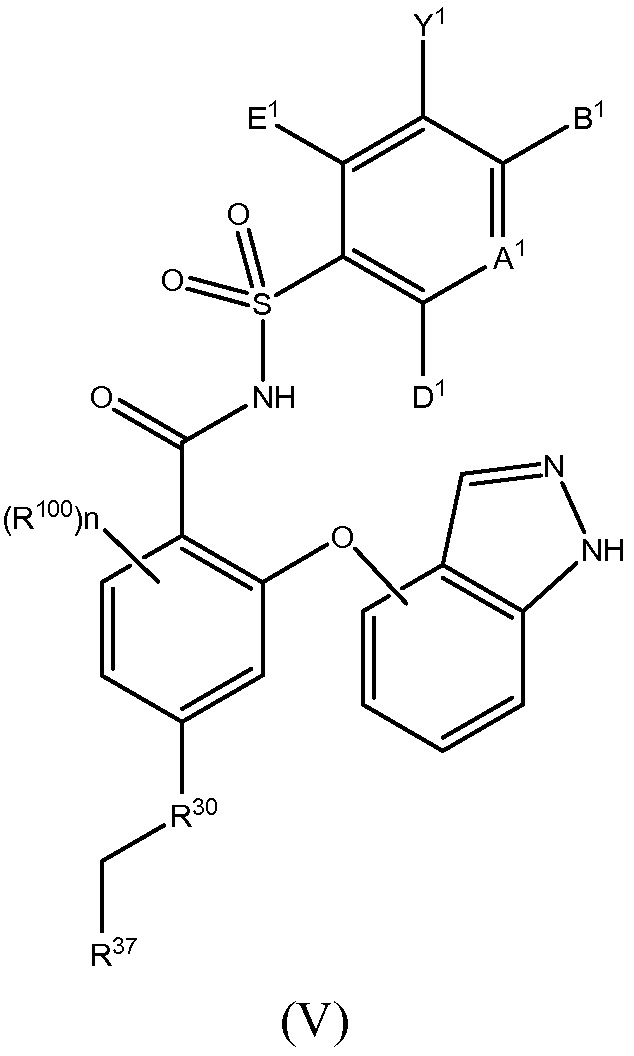
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты,
в которых А1, В1, D1, Е1, Y1, R30 и R37 аналогичны описанным в настоящем описании для формулы (I), n равно 0, 1, 2 или 3; описание числа заместителей при R26 и R100 аналогично описанному для заместителей при R26.
В одном из вариантов осуществления формулы (V) А1 является N. В следующем варианте осуществления формулы (V) А1 является С(А2). В следующем варианте осуществления формулы (V) А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (V) В1 является R1, OR1, SR1, SO2R1, NHR1, N(R1)2 или С(O)NHR1. В следующем варианте осуществления формулы (V) В1 является NHR1. В следующем варианте осуществления формулы (V) В1 является NHR1, а А1 является С(А2), а А2 является Н. В следующем варианте осуществления формулы (V) В1 является OR1. В следующем варианте осуществления формулы (V) В1 является OR1, а А1 является С(А2), а А2 является Н.
В одном из вариантов осуществления формулы (V) D1 и Е1являются Н. В следующем варианте осуществления формулы (V) В1 является NHR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н. В следующем варианте осуществления формулы (V) В1 является OR1, а А1 является С(А2), А2 является Н, а D1 и Е1являются Н.
В одном из вариантов осуществления формулы (V) Y1является H, CN, NO2, F, Cl, Br, I, CF3, R17, NHC(O)R17 или C(O)NH2. В следующем варианте осуществления формулы (V) Y1является NO2. В следующем варианте осуществления формулы (V) В1 является NHR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является NO2. В следующем варианте осуществления формулы (V) Y1является Cl. В следующем варианте осуществления формулы (V) В1 является OR1, а А1 является С(А2), А2 является Н, D1 и Е1являются Н, а Y1является Cl.
В одном из вариантов осуществления формулы (V) R1 представляет собой R2, R3, R4 или R5. В следующем варианте осуществления формулы (V) R1 является R2, а R2 представляет собой фенил.
В одном из вариантов осуществления формулы (V) R1 является R3, а R3 представляет собой гетероарил. В следующем варианте осуществления формулы (V) R3 представляет собой триазолил.
В одном из вариантов осуществления формулы (V) R1 является R4. В следующем варианте осуществления формулы (V) R1 является R4, а R4 представляет собой циклоалкил. В следующем варианте осуществления формулы (V) R1 является R4, а R4 представляет собой циклогексил. В следующем варианте осуществления формулы (V) R1 является R4, а R4 представляет собой гетероциклоалкил. В следующем варианте осуществления формулы (V) R1 является R4, а R4 представляет собой 8-азабицикло[3.2.1]октан, азетидинил, пиперидинил, пиперазинил, пирролидинил, морфолинил, тетрагидропиранил или тетрагидротиофенил. В следующем варианте осуществления формулы (V) R1 является R4, а R4 представляет собой гетероциклоалкенил. В следующем варианте осуществления формулы (V) R1 является R4, а R4 представляет собой тетрагидропиридазинил.
В одном из вариантов осуществления формулы (V) R1 является R5. В следующем варианте осуществления формулы (V) R1 является R5, а R5 представляет собой алкил или алкинил. В следующем варианте осуществления формулы (V) R1 является R5, а R5 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (V) R1 является R5, а R5 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными из R6, R7, OR7, SR7, SO2R7, N(R7)2, OH, CN, CF3, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (V) R1 является R5, а R5 представляет собой алкил, который замещен R7.
В одном из вариантов осуществления формулы (V) R7 является R8, R9, R10 или R11. В следующем варианте осуществления формулы (V) R7 является R8, а R8 представляет собой фенил, который не конденсирован или конденсирован с R8A, а R8A представляет собой гетероциклоалкан. В следующем варианте осуществления формулы (V) R7 является R8, а R8 представляет собой фенил, который не конденсирован. В следующем варианте осуществления формулы (V) R7 является R9, а R9 представляет собой гетероарил. В следующем варианте осуществления формулы (V) R7 является R9, а R9 представляет собой фуранил, имидазолил, изотиазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, оксазолил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, тетразолил, тиазолил, тиофенил, триазинил или 1,2,3-триазолил. В следующем варианте осуществления формулы (V) R7 является R9, а R9 представляет собой пиридинил, тиазолил, имидазолил и 1,2,3-триазолил. В следующем варианте осуществления формулы (V) R7 является R10, а R10 представляет собой С3-С10-циклоалкил. В следующем варианте осуществления формулы (V) R7 является R10, а R10 представляет собой С6 или С10-циклоалкил. В следующем варианте осуществления формулы (V) R7 является R10, а R10 представляет собой циклогексил или адамантанил. В следующем варианте осуществления формулы (V) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пиранил, пиридин-1(Н)-ил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (V) R7 является R10, а R10 представляет собой морфолинил, пиперазинил, пиперидинил, тетрагидро-2Н-пиранил, 1,2-дигидропиридинил, пирролидинил, оксетанил, тиоморфолинил, имидазолидинил, тетрагидротиофенил, диоксоланил, тетрагидротиопиранил, диоксанил или тетрагидрофуранил. В следующем варианте осуществления формулы (V) R7 является R11, а R11 представляет собой алкил, который не замещен или замещен. В следующем варианте осуществления формулы (V) R7 является R11, а R11 представляет собой алкил, который не замещен. В следующем варианте осуществления формулы (V) R7 является R11, а R11 представляет собой алкил, который замещен. В следующем варианте осуществления формулы (V) R7 является R11, а R11 представляет собой алкил, который замещен одним, или двумя, или тремя независимо выбранными OR12, F, Cl, Br или I заместителями. В следующем варианте осуществления формулы (V) R7 является R11, а R11 представляет собой алкил, который замещен OR12, R12 является R16, а R16 представляет собой алкил.
В одном из вариантов осуществления формулы (V) R17 является R19 или R21. В следующем варианте осуществления формулы (V) R17 является R19, а R19 представляет собой гетероарил. В следующем варианте осуществления формулы (V) R17 является R19, а R19 представляет собой тиазолил. В следующем варианте осуществления формулы (V) R17 является R21, а R21 представляет собой алкинил. В следующем варианте осуществления формулы (V) R17 является R21, а R21 представляет собой этинил.
Другой вариант осуществления относится к соединениям формулы (V), которые представляют собой
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
транс-N-({5-хлор-6-[(4-метоксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[1-(цианометил)-4-фторпиперидин-4-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидрофуран-3-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
транс-N-({5-хлор-6-[(4-гидроксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]окси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}окси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид;
N-{[5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}метокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-[(5-хлор-6-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-({4-фтор-1-[2-фтор-1-(фторметил)этил]пиперидин-4-ил}метокси)-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(2-тетрагидрофуран-2-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
N-({3-хлор-4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид;
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-тетрагидро-2Н-пиран-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид;
и их терапевтически приемлемые соли, пролекарства, соли пролекарств и метаболиты.
Фармацевтические композиции, комбинационная терапия, способы лечения и введение
Следующий вариант осуществления включает фармацевтические композиции, содержащие соединение формулы (I) и эксципиент.
Следующий вариант осуществления включает способы лечения рака у млекопитающего, включающие введение ему терапевтически приемлемого количества соединения формулы (I).
Следующий вариант осуществления включает способы лечения аутоиммунного заболевания у млекопитающего, включающие введение ему терапевтически приемлемого количества соединения формулы (I).
Следующий вариант осуществления относится к композициям для лечения заболеваний, в ходе которых экспрессируются антиапоптотические белки Bcl-2, включающим эксципиент и терапевтически эффективное количество соединения формулы (I).
Следующий вариант осуществления относится к способам лечения заболеваний у пациента, при которых экспрессируются антиапоптотические белки Bcl-2, при этом указанные способы включают введение данному пациенту терапевтически эффективного количества соединения формулы (I).
Следующий вариант осуществления относится к композициям для лечения рака мочевого пузыря, рака мозга, рака груди, рака костного мозга, рака шейки матки, хронического лимфолейкоза, колоректального рака, рака пищевода, гепатоцеллюлярного рака, лимфобластного лейкоза, фолликулярной лимфомы, злокачественных лимфоидных новообразований Т-клеточной или В-клеточной природы, меланомы, миелогенного лейкоза, миеломы, рака полости рта, рака яичника, немелкоклеточного рака легких, рака предстательной железы, мелкоклеточного рака легких или рака селезенки, включающим эксципиент и терапевтически эффективное количество соединения формулы (I).
Следующий вариант осуществления относится к способам лечения рака мочевого пузыря, рака мозга, рака груди, рака костного мозга, рака шейки матки, хронического лимфолейкоза, колоректального рака, рака пищевода, гепатоцеллюлярного рака, лимфобластного лейкоза, фолликулярной лимфомы, злокачественных лимфоидных новообразований Т-клеточной или В-клеточной природы, меланомы, миелогенного лейкоза, миеломы, рака полости рта, рака яичника, немелкоклеточного рака легких, рака предстательной железы, мелкоклеточного рака легких или рака селезенки у пациента, при этом указанные способы включают введение данному пациенту терапевтически эффективного количества соединения формулы (I).
Следующий вариант осуществления относится к композициям для лечения заболеваний, в ходе которых экспрессируются антиапоптотические белки Bcl-2, включающие эксципиент и терапевтически эффективное количество соединения формулы (I) и терапевтически эффективное количество одного дополнительного терапевтического агента или нескольких дополнительных терапевтических агентов.
Следующий вариант осуществления относится к способам лечения заболевания у пациента, в ходе которого экспрессируются антиапоптотические белки Bcl-2, при этом указанные способы включают введение данному пациенту терапевтически эффективного количества соединения формулы (I) и терапевтически эффективного количества одного дополнительного терапевтического агента или нескольких дополнительных терапевтических агентов.
Следующий вариант осуществления относится к композициям для лечения рака мочевого пузыря, рака мозга, рака груди, рака костного мозга, рака шейки матки, хронического лимфолейкоза, колоректального рака, рака пищевода, гепатоцеллюлярного рака, лимфобластного лейкоза, фолликулярной лимфомы, злокачественных лимфоидных новообразований Т-клеточной или В-клеточной природы, меланомы, миелогенного лейкоза, миеломы, рака полости рта, рака яичника, немелкоклеточного рака легких, хронического лимфоцитарного лейкоза, миеломы, рака предстательной железы, мелкоклеточного рака легких или рака селезенки у пациента, включающие эксципиент и терапевтически эффективное количество соединения формулы (I) и терапевтически эффективное количество одного дополнительного терапевтического агента или нескольких дополнительных терапевтических агентов.
Следующий вариант осуществления относится к способам лечения рака мочевого пузыря, рака мозга, рака груди, рака костного мозга, рака шейки матки, хронического лимфолейкоза, колоректального рака, рака пищевода, гепатоцеллюлярного рака, лимфобластного лейкоза, фолликулярной лимфомы, злокачественных лимфоидных новообразований Т-клеточной или В-клеточной природы, меланомы, миелогенного лейкоза, миеломы, рака полости рта, рака яичника, немелкоклеточного рака легких, хронического лимфоцитарного лейкоза, миеломы, рака предстательной железы, мелкоклеточного рака легких или рака селезенки у пациента, при этом указанные способы включают введение данному пациенту терапевтически эффективного количества соединения формулы (I) и терапевтически эффективного количества одного дополнительного терапевтического агента или нескольких дополнительных терапевтических агентов.
Метаболиты соединений формулы (I), образующиеся в результате метаболических процессов, протекающих in vitro или in vivo, также могут использоваться для лечения заболеваний, связанных с антиапоптотическим белком Bcl-2.
Некоторые соединения-предшественники, которые могут метаболизироваться in vitro или in vivo с образованием соединений формулы (I), также могут использоваться для лечения заболеваний, связанных с экпрессией антиапоптотического белка Bcl-2.
Соединения формулы (I) могут существовать в виде солей присоединения кислоты, солей присоединения основания или цвиттер-ионов. Соли данных соединений получают в процессе выделения или после очистки соединений. Соли присоединения кислоты данных соединений представляют собой соли, полученные реакций данных соединений с кислотой. Например, ацетатная, адипатная, альгинатная, гидрокарбонатная, цитратная, аспартатная, бензоатная, бензолсульфонатная, гидросульфатная, бутиратная, камфоратная, камфорсульфонатная, диглюконатная, формиатная, фумаратная, глицерофосфатная, глутаматная, гемисульфатная, гептаноатная, гексаноатная, гидрохлоридная, гидробромидная, гидройодидная, лактобионатная, лактатная, малеатная, мезитиленсульфонатная, метансульфонатная, нафталинсульфонатная, никотинатная, оксалатная, памоатная, пектинатная, персульфатная, фосфатная, пикратная, пропионатная, сукцинатная, тартратная, тиоцианатная, трихлорацетатная, трифторацетатная, пара-толуолсульфонатная и ундеканоатная соли данных соединений и их пролекарств рассматриваются как включенные в данное изобретение. Соли присоединения основания данных соединений представляют собой соли, полученные реакцией данных соединений с гидроксидом, карбонатом или гидрокарбонатом таких катионов, как литий, натрий, калий, кальций и магний.
Соединения формулы (I) можно вводить, например, буккально, офтальмологически, перорально, осмотически, парентерально (внутримышечно, внутрибрюшинно, внутристернально, внутривенно, подкожно), ректально, местно, чрескожно или вагинально.
Терапевтически эффективные количества соединений формулы (I) зависят от реципиента, получающего лечение, подлежащего лечению нарушения и его тяжести, композиции, содержащей соединение, времени введения, пути введения, продолжительности лечения, эффективности соединения, скорости его клиренса, и вводится ли совместно с ним другое лекарственное средство или нет. Количество соединения данного изобретения, имеющего формулу (I), используемое для получения композиции, предназначенной для суточного введения пациенту в виде разовой дозы или раздельных доз, составляет от около 0,03 до около 200 мг/кг массы тела. В композициях разовых доз содержатся данные количества или комбинации их делителей.
Соединения формулы (I) можно вводить с эксципиентом или без него. Эксципиенты включают, например, инкапсулирующие вещества или добавки, такие как ускорители абсорбции, антиоксиданты, связывающие вещества, буферные агенты, агенты покрытия, окрашивающие вещества, разбавители, дезинтегрирующие агенты, эмульгаторы, расширители, наполнители, вкусовые вещества, увлажнители, смазывающие вещества, ароматизирующие вещества, консерванты, газы-носители, высвобождающие агенты, стерилизаторы, подсластители, солюбилизаторы, увлажняющие вещества и их смеси.
Эксципиенты для получения композиций, содержащих соединение формулы (I), предназначенных для перорального введения в виде твердой дозированной формы, включают, например, агар, альгиновую кислоту, гидроксид алюминия, бензиловый спирт, бензилбензоат, 1,3-бутиленгликоль, карбомеры, касторовое масло, ацетат целлюлозы, масло какао, кукурузный крахмал, масло семян хлопчатника, кросповидон, диглицериды, этанол, этилцеллюлозу, этиллаурат, этилолеат, сложные эфиры жирных кислот, желатин, масло зародышей пшеницы, глюкозу, глицерин, арахисовое масло, гидроксипропилметилцеллюлозу, изопропанол, изотонический физиологический раствор, лактозу, гидроксид магния, стеарат магния, солод, маннит, моноглицериды, оливковое масло, арахисовое масло, фосфатные соли калия, картофельный крахмал, повидон, пропиленгликоль, раствор Рингера, сафлоровое масло, кунжутное масло, натрий-карбоксиметилцеллюлозу, фосфатные соли натрия, лаурилсульфат натрия, сорбит натрия, соевое масло, стеариновые кислоты, стеарилфумарат, сахарозу, поверхностно-активные вещества, тальк, трагакант, тетрагидрофурфуриловый спирт, триглицериды, воду и их смеси. Эксципиенты для получения композиций, содержащих соединение данного изобретения, имеющее формулу (I), предназначенных для офтальмологического или перорального введения в виде жидких дозированных форм, включают, например, 1,3-бутиленгликоль, касторовое масло, кукурузное масло, масло семян хлопчатника, этанол, сложные эфиры сорбитана и жирных кислот, масло зародышей пшеницы, арахисовое масло, глицерин, изопропанол, оливковое масло, полиэтиленгликоли, пропиленгликоль, кунжутное масло, воду и их смеси. Эксципиенты для получения композиций, содержащих соединение данного изобретения, имеющее формулу (I), предназначенных для осмотического введения, включают например, хлорфторуглеводороды, этанол, воду и их смеси. Эксципиенты для получения композиций, содержащих соединение данного изобретения, имеющее формулу (I), предназначенных для парентерального введения, включают, например, 1,3-бутандиол, касторовое масло, кукурузное масло, масло семян хлопчатника, декстрозу, масло зародышей пшеницы, арахисовое масло (groundnut), липосомы, олеиновую кислоту, оливковое масло, арахисовое масло (peanut), раствор Рингера, сафлоровое масло, соевое масло, U.S.P. или изотонический раствор хлорида натрия, воду и их смеси. Эксципиенты для получения композиций, содержащих соединение данного изобретения, имеющее формулу (I), предназначенных для ректального или вагинального введения, включают например, масло какао, полиэтиленгликоль, воск и их смеси.
Предполагается, что соединения формулы (I) будут применимы при использовании их с алкилирующими агентами, ингибиторами ангиогенеза, антителами, антиметаболитами, антимитотическими агентами, антипролиферативными агентами, противовирусными агентами, ингибиторами aurora-киназы, прочими ингибиторами промоторов апоптоза (например, Bcl-xL, Bcl-w и Bfl-1), активаторами пути рецепторов смерти, ингибиторами Bcr-Abl киназы, BiTE-антителами (Bi-специфичный активатор Т-клеток), конъюгатами антитело-лекарственный препарат, модификаторами биологического ответа, ингибиторами циклинзависимой киназы, ингибиторами клеточного цикла, ингибиторами циклооксигеназы-2, DVD, ингибиторами рецептора гомолога онкогена вируса лейкемии (ErbB2), ингибиторами фактора роста, ингибиторами белков теплового шока (HSP-90), ингибиторами деацетилазы гистонов (HDAC), гормональными видами терапии, иммунологическими препаратами, ингибиторами ингибиторов белков апоптоза (IAP), интеркалирующими антибиотиками, ингибиторами киназы, ингибиторами кинезинов, ингибиторами Jak2, ингибиторами мишени рапамицина у млекопитающих, микро-РНК, ингибиторами митоген-активируемой внеклеточной сигнал-регулируемой киназы, поливалентные связывающие белки, нестероидные противовоспалительные лекарственные средства (NSAID), ингибиторами поли АДФ(аденозиндифосфат)рибоза полимеразы (PARP), платиновые химиотерапевтические препараты, ингибиторами polo-подобной киназы (Plk), ингибиторами фосфоинозитид-3-киназ (PI3K), ингибиторами протеосом, аналогами пурина, аналогами пиримидина, ингибиторами рецепторов тирозинкиназы, растительными алкалоидами ретиноидами/дельтоидами, малыми ингибирующими рибонуклеиновыми кислотами (siРНК), ингибиторами топоизомеразы, ингибиторами убиквитинлигазы и т.п., и в сочетании с одним или более из числа данных агентов.
BiTE антитела представляют собой bi-специфические антитела, направляющие Т-клетки атаковать раковые клетки путем одновременного связывания двух клеток. Затем Т-клетка атакует раковую клетку-мишень. Примеры BiTE антител представляют собой адекатумумаб (Micromet MT201), блинатумомаб (Micromet MT103) и т.п. Не ограничиваясь теорией, один из механизмов, по которому Т-клетки вызывают апоптоз раковой клетки-мишени, заключается в экзоцитозе цитолитических гранулярных компонентов, которые включают перфорин и гранзим В. В этом отношении было показано, что Bcl-2 ослабляет вызывание апоптоза как перфорином, так и гранзимом В. Эти данные позволяют предположить, что ингибирование Bcl-2 могло бы усилить цитотоксические эффекты, вызываемые Т-клетками, нацеленными на раковые клетки (V.R. Sutton, D.L. Vaux and J.A. Trapani, J. of Immunology 1997, 158 (12), 5783).
SiРНК представляют собой молекулы с эндогенными РНК основаниями или химически модифицированные нуклеотиды. Эти модификации не уничтожают клеточную активность, но, напротив, придают повышенную устойчивость и/или повышенную клеточную эффективность. Примеры химических модификаций включают тиофосфатные группы, 2’-дезоксинуклеотид, 2’-ОСН3-содержащие рибонуклеотиды, 2’-F-рибонуклеотиды, 2’-метоксиэтилрибонуклеотиды, их сочетания и т.п. SiРНК могут иметь изменяющиеся длину (например, 10-200 п.о.) и структуры (например, шпильки, единичную/двойную цепи, петли, одноцепочечные разрывы/гэпы, ошибочные спаривания) и обрабатываются в клетках, приводя к сайленсингу активных генов. Двухцепочечная siРНК (dsРНК) может иметь то же количество нуклеотидов в каждой цепи (тупые концы) или асимметрические концы (выступающие). Выступание 1-2 нуклеотидов может иметь место в смысловой и/или антисмысловой цепи, а также находиться в 5’- и/или 3’-концах данной цепи. Например, было показано, что нацеливание siРНК на Mcl-1 повышает активность АВТ-263 (то есть N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино)-3-((трифторметил)сульфонил)бензолсульфонамида) или АВТ-737 (то есть N-(4-(4-((4’-хлор(1,1’-дифенил)-2-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(диметиламино)-1-((фенилсульфонил)метил)пропил)амино)-3-нитробензолсульфонамида) в клеточных линиях множественной опухоли (Tse et al., Cancer Research 2008, 68(9), 3421 и приведенные там ссылки).
Поливалентные связывающие белки представляют собой белки, содержащие два или более антигенсвязывающих сайтов. Поливалентные связывающие белки создают так, чтобы в них имелось три или более антигенсвязывающих сайтов, и, как правило, они на являются существующими в природе антителами. Термин «полиспецифический связывающий белок» означает связывающий белок, способный к связыванию двух или более связанных или не связанных мишеней. Связывающие белки с двойным вариабельным доменом (DVD) представляют собой четырехвалентные или поливалентные связывающие белки, содержащие два или более антигенсвязывающих сайтов. Подобные DVD могут быть моноспецифичными (то есть способными к связыванию одного антигена) или полиспецифичными (то есть способными к связыванию двух или более антигенов). DVD связывающие белки, содержащие два DVD полипептида с тяжелой цепью и два DVD полипептида с легкой цепью, называют DVD Ig. Каждая половина DVD Ig содержит DVD полипептид с тяжелой цепью, DVD полипептид с легкой цепью и два антигенсвязывающих сайта. Каждый антигенсвязывающий сайт включает вариабельный домен с тяжелой цепью и вариабельный домен с легкой цепью, содержащие в сумме 6 CDR, участвующих в связывании антигена, на антигенсвязывающий сайт. Полиспецифические DVD включают DVD связывающие белки, связывающие DLL4 и VEGF или C-met и EFGR или ErbB3 и EGFR.
Алкилирующие агенты включают алтретамин, AMD-473, АР-5280, апазиквон, бендамустин, бросталлицин, бусульфан, карбоквон, кармустин (BCNU), хлорамбуцил, CLORETAZINE® (ларомустин, VNP 40101М), циклофосфамид, декарбазин, эстрамустин, фотемустин, глуфосфамид, ифосфамид, KW-2170, ломустин (CCNU), мафосфамид, мелфалан, митобронитол, митолактол, нимустин, N-оксид азотистого иприта, ранимустин, темозоломид, тиотепа, TREANDA® (бендамустин), треосульфан, рофосфамид и т.п.
Ингибиторы ангиогенеза включают ингибиторы эндотелийспецифичных рецепторных тирозинкиназ (Tie-2), ингибиторы эпидермального фактора роста (EGFR), ингибиторы инсулинового фактора роста (IGFR-2), ингибиторы матриксных металлопротеиназ-2 (ММР-2), ингибиторы матриксных металлопротеиназ-9 (ММР-9), ингибиторы рецептора тромбоцитарного фактора роста (PDGFR), аналоги тромбоспондина, ингибиторы рецепторов тирозинкиназы фактора роста эндотелия сосудов (VEGFR) и т.п.
Антиметаболиты включают ALIMTA® (пеметрексед динатрия, LY231514, МТА), 5-азацитидин, XELODA® (капецитабин), кармофур, LEUSTAT® (кладрибин), клофарабин, цитарабин, окфосфат цитарабина, арабинозид цитозина, децитабин, дефероксамин, доксифлуридин, эфлорнитин, EICAR (5-этинил-1-β-D-рибофуранозилимидазол-4-карбоксамид), эноцитабин, этинилцитидин, флударабин, 5-фторурацил отдельно или в сочетании с лейковорином, GEMZAR® (гемцитабин), гидроксимочевина, ALKERAN® (мелфалан), меркаптопурин, 6-меркаптопуринрибозид, метотрексат, микофенольная кислота, неларабин, нолатрексед, окфосфат, пелитрексол, пентостатин, ралтитрексед, рибавирин, триапин, триметрексат, S-1, тиазофурин, тегафур, TS-1, видарабин, UFT и т.п.
Противовирусные средства включают ритонавир, гидроксихлорокин и т.п.
Ингибиторы Aurora-киназы включают АВТ-348, AZD-1152, MLN-8054, VX-680, ингибиторы, специфичные к Aurora A-киназе, ингибиторы, специфичные к Aurora В-киназе, ингибиторы pan-Aurora-киназы и т.п.
Ингибиторы белков Bcl-2 включают АТ-101 ((-)госсипол), GENASENSE® (G3139 или облимерсен (антисмысловой олигонуклеотид, имеющий мишенью Bcl-2)), IPI-194, IPI-565, N-(4-(4-((4’-хлор(1,1’-дифенил)-2-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(диметиламино)-1-((фенилсульфанил)метил)пропил)амино)-3-нитробензолсульфонамид) (АВТ-737), N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино)-3-((трифторметил)сульфонил)бензолсульфонамид (АВТ-263), GX-070 (обатоклакс) и т.п.
Ингибиторы Bcr-Abl киназы включают DASATINIB® (BMS-354825), GLEEVEC® (иматиниб) и т.п.
Ингибиторы CDK включают AZD-5438, BMI-1040, BMS-032, BMS-387, CVT-2584, флавопиридол, GPC-286199, MCS-5A, PD0332991, PHA-690509, селициклиб (CYC-202, R-росковитин), ZK-304709 и т.п.
Ингибиторы СОХ-2 включают АВТ-963, ARCOXIA® (эторикоксиб), BEXTRA® (валдекоксиб), BMS347070, CELEBREX® (целекоксиб), СОХ-189 (лумиракоксиб), СТ-3, DERAMAXX® (деракоксиб), JTE-522, 4-метил-2-(3,4-диметилфенил)-1-(4-сульфамоилфенил-1Н-пиррол), МК-663 (эторикоксиб), NS-398, парекоксиб, RS-57067, SC-58125, SD-8381, SVT-2016, S-2474, T-614, VIOXX® (рофекоксиб) и т.п.
Ингибиторы EGRF включают ABX-EGF, анти-EGFR иммунолипосомы, EGF-вакцину, EMD-7200, ERBITUX® (цетуксимаб), HR3, антитела IgA, IRESSA® (гефитиниб), TARCEVA® (эрлотиниб или OSI-774), ТР-38, белок слияния EGFR, TYKERB® (лапатиниб) и т.п.
Ингибиторы рецептора ErbB2 включают СР-724-714, CI-1033 (канертиниб), HERCEPTIN® (трастузумаб), TYKERB® (лапатиниб), OMNITARG® (2С4, петузумаб), ТАК-165, GW-572016 (ионафарниб), GW-282974, ЕКВ-569, PI-166, dHER2 (HER2 вакцина), АРС-8024 (HER2 вакцина), диспецифическое анти-HER/2neu антитело, В7.her2IgG3, трифункциональные диспецифические AS HER2 антитела, mAB AR-209, mAB 2B-1 и т.п.
Ингибиторы деацетилазы гистонов включают депсипептид, LAQ-824, MS-275, трапоксин, субероиланилидгидроксамовую кислоту (SAHA), TSA, вальпроевую кислоту и т.п.
Ингибиторы HSP-90 включают 17-AAG-nab, 17-AAG, CNF-101, CNF-1010, CNF-2024, 17-DMAG, гелданамицин, IPI-504, KOS-953, MYCOGRAB® (человеческое рекомбинантное антитело к HSP-90), NCS-683664, PU24FCI, PU-3, радицикол, SNX-2112, STA-9090 VER49009 и т.п.
Ингибиторы ингибиторов белков апоптоза включают HGS1029, GDC-0145, GDC-0152, LCL-161, LBW-242 и т.п.
Конъюгаты антитело-лекарственный препарат включают анти-CD22-MC-MMAF, анти-CD22-MC-MMAE, анти-CD22-MCC-DM1, CR-011-vcMMAE, PSMA-ADC, MEDI-547, SGN-19Am, SGN-35, SGN-75 и т.п.
Активаторы пути рецепторов смерти включают TRAIL, антитела или другие агенты, имеющие мишенью TRAIL или рецепторы смерти (например, DR4 или DR5), такие, как апомаб, конатумумаб, ETR2-ST01, GDC0145 (лексатумумаб), HGS-1029, LBY-135, PRO-1762 и трастузумаб.
Ингибиторы кинезина включают ингибиторы Eg5, такие, как AZD4877, ARRY-520, ингибиторы CENPE, такие, как GSK923295A и т.п.
Ингибиторы JAK-2 включают СЕР-701 (лезауртиниб), XL019 и INCB018424 и т.п.
Ингибиторы МЕК включают ARRY-142886, ARRY-438162, PD-325901, PD-98059 и т.п.
Ингибиторы mTOR включают AP-23573, CCI-779, эверолимус, RAD-001, рапамицин, темзиролимус, АТФ-конкурентные ингибиторы TORC1/TORC2, включая PI-103, PP242, PP30, Torin 1 и т.п.
Нестероидные противовоспалительные лекарственные препараты включают AMIGESIC® (салсалат), DOLOBID® (дифлунизал), MOTRIN® (ибупрофен), ORUDIS® (кетопрофен), RELAFEN® (набуметон), FELDENE® (пироксикам), ибупрофен крем, ALEVE® (напроксен) и NAPROSYN® (напроксен), VOLTAREN® (диклофенак), INDOCIN® (индометацин), CLINORIL® (сулиндак), TOLECTIN® (толметин), LODINE® (этодолак), TORADOL® (кеторолак), DAYPRO® (оксапрозин) и т.п.
Ингибиторы PDGFR включают С-451, СР-673, СР-868596 и т.п. Платиновые химиотерапевтические препараты включают цисплатин, ELOXATIN® (оксалиплатин), эптаплатин, лобаплатин, недаплатин, PARAPLATIN® (карбоплатин), сатраплатин, пикоплатин и т.п.
Ингибиторы Polo-подобной киназы включают BI-2536 и т.п.
Ингибиторы фосфоинозитид-3-киназ (PI3K) включают вортманнин, LY294002, XL-147, CAL-120, ONC-21, AEZS-127, ETP-45658, PX-866, GDC-0941, BGT226, BEZ235, XL765 и т.п.
Аналоги тромбоспондина включают АВТ-510, АВТ-567, АВТ-898, TSP-1 и т.п.
Ингибиторы VEGFR включают AVASTIN® (бевацизумаб), АВТ-869, АЕЕ-788, ANGIOZYME™ (рибозим, ингибирующий ангиогенез (Ribosyme Pharmaceuticals (Boulder, CO.) and Chiron, (Emeryville, CA)), акситиниб (AG-13736), AZD-2171, СР-547632, IM-862, MACUGEN (пегаптамиб), NEXAVAR® (сорафениб, BAY43-9006), пазораниб (GW-786034), ваталаниб (РТК-787, ZK-222584), SUTENT® (сунитиниб, SU-11248), ловушка VEFG, ZACTIMA™ (вандетаниб, ZD-6474), GA101, офатумумаб, АВТ-806 (mAb-806), ErbB3 специфические антитела, BSG2 специфические антитела, DLL4 специфические антитела и С-met специфические антитела и т.п.
Антибиотики включают интеркалирующие антибиотики акларубицин, актиномицин D, амрубицин, аннамицин, адриамицин, BLENOXANE® (блеомицин), даунорубицин, CAELYX® или MYOCET® (липосомальный доксорубицин), элзамитруцин, эпирбуцин, гларбуицин, ZAVEDOS® (идарубицин), митомицин С, неморубицин, неокарциностатин, пепломицин, пирарубицин, ребеккамицин, стималамер, стрептозоцин, VALSTAR® (валрубицин), циностатин и т.п.
Ингибиторы топоизомеразы включают акларубицин, 9-аминокамптотецин, амонафид, амсакрин, бекатекарин, белотекан, BN-80915, CAMPTOSAR® (гидрохлорид иринотекана), камптотецин, CARDIOXANE® (дексразоксин), дифломотекан, эдотекарин, ELLENCE® или PHARMORUBICIN® (эпирубицин), этопозид, экзатекан, 10-гидроксикамптотецин, гиматекан, луртотекан, митоксантрон, оратецин, пирарбуцин, пиксантрон, рубитекан, собузоксан, SN-38, тафлупозид, топотекан и т.п.
Антитела включают AVASTIN® (бевасизумаб), CD40-специфичные антитела, chTNT-1/B, денозумаб, ERBITUX® (цетуксимаб), HUMAX-CD4® (занолимумаб), IGF1R-специфичные антитела, линтузумаб, PANOREX® (эдреколомаб), RENCAREX® (WX G250), RITUXAN® (ритуксимаб), тицилимумаб, трастузимаб, CD20 антитела I и II типа и т.п.
Гормональные типы терапии включают ARIMIDEX® (анастрозол), AROMASIN® (эксеместан), арзоксифен, CASODEX® (бикалутамид), CETROTIDE® (цетрореликс), дегареликс, деслорелин, DESOPAN® (трилостан), дексаметазон, DROGENIL® (флутамид), EVISTA® (ралоксифен), AFEMA™ (фадрозол), FARESTON® (торемифен), FASLODEX® (фулвестрант), FEMARA® (летрозол), форместан, глюкокортикоиды, HECTOROL® (доксеркальциферол), RENAGEL® (севеламеркарбонат), лазофоксифен, лейпролидацетат, MEGACE® (мегестрол), MIFEPREX® (мифепристон), NILANDRON™ (нилутамид), NOLVADEX® (тамоксифенцитрат), PLENAXIS™ (абареликс), преднизон, PROPECIA® (финастерид), рилостан, SUPREFACT® (бузерелин), TRELSTAR® (рилизинг-фактор лютеинезирующего гормона (LHRH)), VANTAS® (имплант гистрелина), VETORYL® (трилостан или модрастан), ZOLADEX® (фосрелин, госерелин) и т.п.
Дельтоиды и ретиноиды включают сеокальцитол (ЕВ1089, СВ1093), лексакальцитрол (КН1060), фенретинид, PANCRETIN® (алиретиноин), ATRAGEN® (липосомальный третиноин), TARGRETIN® (бексаротен), LGD-1550 и т.п.
Ингибиторы PARP включают АВТ-888 (велипариб), олапариб, KU-59436, AZD-2281, AG-014699, BSI-201, BGP-15, INO-1001, ONO-2231 и т.п.
Растительные алкалоиы включают, но не ограничиваются, винкристином, винбластином, виндезином, винорелбином и т.п.
Протеасомальные ингибиторы вклчюают в себя VELCADE® (бортезомид), MG132, NPI-0052, PR-171 и т.п.
Примеры иммунологических препаратов включают интерфероны и другие агенты, повышающие иммунитет. Интерфероны включают интерферон альфа, интерферон альфа-2а, интерферон альфа-2b, интерферон бета, интерферон гамма-1а, ACTIMMUNE® (интерферон гамма-1b) или интерферон гамма-n1, их сочетания и т.п. Другие агенты включают ALFAFERON® (IFN-α), BAM-002 (оксисленный глутатион), BEROMUN® (тазонермин), BEXXAR® (тозитумомаб), CAMPATH® (алемтузумаб), CTLA4 (цитотоксический лимфоцитный антиген 4), декарбазин, данилейкин, эпратузумаб, GRANOCYTE® (ленограстим), лентинан, лейкоцитарный альфа интерферон, имиквимод, MDX-010 (анти-CTLA-4), меланомная вакцина, митумомаб, молграмостин, MYLOTARG® (гемтузумаб озогамицин), NEUPROGEN® (филграстим), OncoVAC-CL, OVAREX® (ореговомаб), пентумомаб (Y-muHMFG1), PROVENGE® (сипулейцель-Т), саргарамостим, сизофилан, тецелейкин, THERACYS® (Bacillus Calmette-Guerin), убенимекс, VIRULIZIN® (иммунотерапевтический препарат, Lorus Pharmaceuticals), Z-100 (Specific Substance of Maruyama (SSM)), WF-10 (тетрахлордекаоксид (TCDO)), PROLEUKIN® (алдеслейкин), ZADAXIN® (тималфазин), ZENAPAX® (даклизумаб), ZEVALIN® (90Y-ибритумомаб тиуксетан) и т.п.
Модификаторы биологического ответа включают агенты, модифицирующие механизмы защиты живых организмов или биологические ответы, такие как выживание, рост или дифференциацию клеток тканей, направляющие их к обладанию противоопухолевой активностью, и включают крестин, лентинан, сизофиран, пицибанил PF-3512676 (CpG-8954), убенимекс и т.п.
Аналогии пиримидина включают цитарабин (ара С или арабинозид С), цитозинарабинозид, доксифлуридин, FLUDARA® (флударабин), 5-FU (5-фторурацил), флоксуридин, GEMZAR® (гемцитабин), TOMUDEX® (ратитрексед), TROXATYL® (триацетилуридинтроксацитабин) и т.п.
Аналоги пурина включают LANVIS® (тиогуанин) и PURI-NETHOL® (меркаптопурин).
Антимитотические агенты включают батабулин, эпотилон D (KOS-862), N-(2-((4-гидроксифенил)амино)пиридин-3-ил)-4-метоксибензолсульфонамид, иксабепилон (BMS-247550), паклитаксель, TAXOTERE® (доцетаксель), PNU100940 (109881), патупилон, XRP-9881 (ларотаксель), винфлунин, ZK-EPO (синтетический эпилон) и т.п.
Ингибиторы убиквитин лигазы включают ингибиторы MDM2, такие, как нутлины, ингибиторы NEDD8, такие, как MLN4924 и т.п.
Соединение настоящего изобретения можно также использовать в качестве радиосенсибилизирующих веществ, повышающих эффективность радиотерапии. Примеры радиотерапии включают внешнюю радиотерапию, дистанционную радиотерапию, близкофокусную радиотерапию и радиотерапию с открытыми и закрытыми источниками излучения и т.п.
Кроме того, соединения формулы (I) можно комбинировать с другими химиотерапевтическими средствами, такими, как ABRAXANE™ (ABI-007), ABT-100 (ингибитор фарнезил трансферазы), ADVEXIN® (вакцина Ad5CMV-p53), ALTOCOR® или MEVACOR® (ловастатин), AMPLIGEN® (поли I: поли C12U, синтетическая РНК), APTOSYN® (эксизулинд), AREDIA® (памидроновая кислота), арглабин, L-аспарагиназа, атаместан (1-метил-3,17-дион-андроста-1,4-диен), AVAGE® (тазаротен), AVE-8062 (производное комбреастатина), ВЕС2 (митумомаб), кахектин или кахексин (фактор некроза опухолей), канваксин (вакцина), CEAVAC® (раковая вакцина), CELEUK® (целмолейкин), CEPLENE® (дигидрохлорид гистамина), CERVARIX® (вакцина против вируса папилломы человека), CHOP® (C: CYTOXAN® (циклофосфамид); H: ADRIAMYCIN® (гидроксидоксорубицин); О: винкристин (ONCOVIN®); P: преднизон), CYPAT™ (ципротеронацетат), комбрестатин А4Р, DAB(389)EGF (каталитический и транслокационный домен дифтерийного токсина, соединенный с человеческим эпилермальным фактором роста через His-Ala линкер) или TransMID-107R™ (дифтерийные токсины), дакарбазин, дактиномицин, 5,6-диметилксантенон-4-уксусная кислота (DMXAA), энилурацил, EVIZON™ (лактат скваламина), DIMERICINE® (T4N5 липосомальный лосьон), дискодермолид, DX-8951f (экзатеканмезилат), энзастаурин, ЕРО906 (эпитилон В), GARDASIL® (квадривалентная рекомбинантная вакцина против вируса папилломы человека (типы 6, 11, 16, 18)), GASTRIMMUNE®, GENASENSE®, GMK (ганглиозидная конъюгатная вакцина), GVAX® (вакцина против рака предстательной железы), галофунинон, гистерелин, гидроксикарбамид, ибандроновая кислота, IGN-101, IL-13-PE38, IL-13-PE38QQR (цинтредекин безудотокс), экзотоксин IL-13-псевдомонас, интерферон-α, интерферон-γ, JUNOVAN™ или MEPACT™ (мифамуртид), лонафарниб, 5,10-метилентетрагидрофолат, милтефозин (гексадецилфосфохолин), NEOVASTAT® (АЕ-941), NEUTREXIN® (триметрексатглюкуронат), NIPENT® (пентостатин), ONCONASE® (фермент рибонуклеазы), ONCOPHAGE® (вакцина для лечения меланомы), ONCOVAX® (вакцина IL-2), ORATHECIN™ (рубитекан), OSIDEM® (лекарственный препарат из клеток на основе антител), OVAREX® Mab (моноклональное антитело мыши), паклитаксель, PANDIMEX™ (агликоны сапонинов из женьшеня, включающие 20(S)протопанаксадиол (aPPD) и 20(S)протопанаксатриол (aPPT)), панитумумаб, PANVAC®-VF (проходящая клиническое испытание вакцина против рака), пегаспаргаза, ПЭГ интерферон А, феноксодиол, прокарбазин, ребимастат, REMOVAB® (катумаксомаб), REVLIMID® (леналидомид), RSR13 (эфапроксирал), SOMATULINE® LA (ланреотид), SORIATANE® (ацитретин), стауроспорин (стауроспоры Streptomyces), талабостат (РТ100), TARGRETIN® (бексаротен), TAXOPREXIN® (DHA-паклитаксель), TELCYTA® (канфосфамид, TLK286), темилифен, TEMODAR® (темозоломид), тесмилифен, талидомид, THERATOPE® (STn-KLH), тимитад (дигидрохлорид 2-амино-3,4-дигидро-6-метил-4-оксо-5-(4-пиридилтио)хиназолина), TNFERADE™ (аденовектор: носитель ДНК, содержащий ген для фактора-α некторза опухоли), TRACLEER® или ZAVESCA® (бозентан), третиноин (ретин-А), тетрандрин, TRISENOX® (триоксид мышьяка), VIRULIZIN®, украин (производное алкалоидов из растения чистоте большой), витаксин (анти-альфабета3 антитело), XCYTRIN® (мотексафин гадолиния), XINLAY® (атрасентан), XYOTAX™ (паклитаксель полиглумекс), YONDELIS® (трабектедин), ZD-6126, ZINECARD® (дексразоксан), ZOMETA® (золендроновая кислота), зорубицин и т.п.
Данные
Определение применимости соединений формулы I в качестве связующих и ингибиторов антиапоптотических белков Bcl-2 и Bcl-xL проводили с использованием анализа резонансного переноса энергии флуоресценции с разрешением по времени (TR-FRET). Антитело Tb-анти-GST приобретали у Invitrogen (каталог № PV4216).
Пилотный синтез
Все использованные реагенты получали от производителя, если не указано иначе. Реагенты пептидного синтеза, включая диизопропилэтиламин (DIEA), хлористый метилен (DCM), N-метилпирролидон (NMP), гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU), N-гидроксибензотриазол (HOBt) и пиперидин получали от Applied Biosystems, Inc. (ABI), Foster City, CA или American Bioanalytical, Natick, MA. Предварительно заполненные кассеты с 9-флуоренилметоксикарбонил (Fmoc)-аминокислотами (Fmoc-Ala-OH, Fmoc-Cys(Trt)-OH, Fmoc-Asp(tBu)-OH, Fmoc-Glu(tBu)-OH, Fmoc-Phe-OH, Fmoc-Gly-OH, Fmoc-His(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, Fmoc-Lys(Boc)-OH, Fmoc-Met-OH, Fmoc-Asn(Trt)-OH, Fmoc-Pro-OH, Fmoc-Gln(Trt)-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Val-OH, Fmoc-Trp(Boc)-OH, Fmoc-Tyr(tBu)-OH) получали от Anaspec, San Jose, CA. Смолу для синтеза пептида (Fmoc-Rink амидный МВНА полимер) и Fmoc-Lys(Mtt)-ОН получали от Novabiochem, San Diego, CA, 6-карбоксифлуоресцеинсукцинимидиловый эфир (6-FAM-NHS) в виде индивидуального изомера получали от Anaspec. Трифторуксусную кислоту (ТФУ) получали от Oakwood Products, West Columbia, SC. Тиоанизол, фенол, триизопропилсилан (TIS), 3,6-диокса-1,8-октандитиол (DODT) и изопропанол получали от Aldrich Chemical Co., Milwaukee, WI. Масс-спектры с матрично-активированной лазерной десорбцией/ионизацией (MALDI-MS) регистрировали на Applied Biosystems Voyager DE-PRO MS). Масс-спектры с ионизацией методом электроспрея (ESI-MS) регистрировали на Finnigan SSQ7000 (Finnigan Corp., San Jose, CA) в режиме детектирования как положительных, так и отрицательных ионов.
Общая методика твердофазного пептидного синтеза (SPPS)
Белки синтезировали с использованием, по большей части, 250 мкмоль предварительно заполненного смолой Ванга/сосуда на пептидном синтезаторе ABI 433А с использованием циклов сочетания Fastmoc на шкале 250 мкмоль. Предварительно заполненные патроны, содержащие 1 ммоль стандартных Fmoc-аминокислот, за исключением положения присоединения флуорофора, где 1 ммоль Fmoc-Lys(Mtt)-OH помещали в патрон, использовали при мониторинге обратной связи проводимости. N-терминальное ацетилирование осуществляли с использованием 1 ммоль уксусной кислоты в патроне в стандартных условиях сочетания.
Удаление 4-метилтритил (Mtt) из лизина
Смолу из синтезатора трижды промывали хлористым метиленом (дихлорметаном) и сохраняли в сухом состоянии. 150 мл смеси 95:4:1 хлористого метилена:триизопропилсилана:трифторуксусной кислоты пропускали через слой смолы в течение 30 минут. Цвет смеси изменялся на темно-желтый, затем обесцвечивался до бледно-желтого. Через слой пропускали 100 мл ДМФА в течение 15 минут. После этого смолу трижды промывали ДМФА и фильтровали. В тестах с нингидрином проявлялся интенсивный сигнал первичного амина.
Введение в смолу метки 6-карбоксифлуоресцеин-NHS (6-FAM-NHS)
Смолу обрабатывали 2 эквивалентами 6-FAM-NHS в 1% DIEA/ДМФА и перемешивали или встряхивали при температуре окружающей среды в течение ночи. По завершении смолу фильтровали, трижды промывали ДМФА, трижды (1% DCM и 1% метанола) и сушили, получая смолу оранжевого цвета, которая давала отрицательный результат в нигидриновой реакции.
Общая методика расщепления и снятия защиты со связанного со смолой белка
Белки отщепляли от смолы встряхиванием в течение 3 часов при температуре окружающей среды в расщепляющей смеси, состоящей из 80% ТФУ, 5% воды, 5% тиоанизола, 5% фенола, 2,5% TIS и 2,5% EDT (1 мл/0,1 г смолы). Смолу удаляли фильтрованием и дважды промывали ТФУ. ТФУ выпаривали из фильтратов и осаждали продукт эфиром (10 мл/0,1 г смолы), выделяли центрифугированием, дважды промывали эфиром (10 мл/0,1 г смолы) и сушили, получая сырой белок.
Общая методика очистки белков
Сырые белки очищали на препаративной системе ВЭЖХ Gilson с программным обеспечением анализа Unipoint® (Gilson, Inc., Middleton, WI) на радиальной компрессионной колонке, содержащей два сегмента 20×100 мм, заполненных Delta-Pak™ C18 15 мкм частицами с размером пор 100Å, и элюировали одним из перечисленных ниже градиентных способов. За один ввод очищали от одного до двух миллилитров раствора сырого белка (10 мг/мл в смеси 90% ДМСО/вода). Пики, содержащие продукт(ы) из каждого опыта, объединяли и лиофилизировали. Все препаративные опыты проводили при 20 мл/мин с элюентами в виде буфера А: 0,1% ТФУ-вода и буфера В: ацетонитрил.
Общая методика для аналитической ВЭЖХ
Аналитическую ВЭЖХ проводили на системе серии Hewlett-Packard c детектором на диодной матрице и детектором флуоресценции Hewlett-Packard 1046А с функционированием программного обеспечения HPLC 3D ChemStation версии А.03.04 (Hewlett-Packard. Palo Alto, CA) на колонке YMC 4,6×250 мм, заполненной частицами ODS-AQ 5 мкм с размером пор 120 Å и элюировали одним из перечисленных ниже градиентных способов после предварительного установления равновесия в стартовых условиях в течение 7 минут. Элюенты представляли собой буфер А: 0,1% ТГФ - вода и буфер В: ацетонитрил. Скорость потока для всех градиентов составляла 1 мл/мин.
F-Bak: белковая проба: ацетил--(SEQ ID NO: 1)GQVGRQLAIIGDK(6-FAM)-(SEQ ID NO: 2) IRN-NH2
Fmoc-Rink-амидный МВНА полимер расширяли с использованием общей методики пептидного синтеза, получая защищенный полимер-связанный белок (1,020 г). Mtt группу удаляли, вводили метку 6-FAM-NHS и отщепляли и снимали защиту, как описано ранее, получая сырой продукт в виде твердого вещества оранжевого цвета (0,37 г). Данный продукт очищали методом ОФ-ВЭЖХ. Фракции на протяжении основного пика тестировали методом аналитической ОФ-ВЭЖХ, а чистые фракции выделяли и лиофилизировали, при этом главный пик предоставлял указанное в заголовке соединение (0,0802 г) в виде твердого вещества желтого цвета; MALDI-MS m/z=2137,1 ((М+Н)+).
Альтернативный синтез пептидного зонда F-Bak: ацетил--(SEQ ID NO: 1)GQVGRQLAIIGDK(6-FAM)--(SEQ ID NO: 2)INR-NH2
Защищенный белок собирали на 0,25 ммоль Fmoc-Rink-амидный МВНА полимер (Novabiochem) на автоматическом пептидном синтезаторе Applied Biosystems 433A с функционированием циклов сочетания Fastmoc™ с использованием предварительно заполненных аминокислотных патронов, за исключением флуоресцеин(6-FAM)-меченного лизина, для которого в патрон отвешивали 1 ммоль Fmoc-Lys(4-метилтритил). N-терминальную ацетильную группу вводили, помещая в патрон 1 ммоль уксусной кислоты и проводя сочетание, как описано выше. Селективное снятие 4-метилтритильной группы осуществляли действием раствора 95:4:1 DCM:TIS:TFA (об./об./об.), пропускаемого через полимер в течение 15 минут с последующим гашением при помощи потока диметилформамида. Индивидуальный изомер 6-карбоксифлуоресцеин-NHS взаимодействовал с боковой цепью лизина в 1% DIEA в ДМФА и полноту протекания подтверждали нингидриновой пробой. Белок отщепляли от полимера и снимали защиту с боковых цепей, обрабатывая смесью 80:5:5:5:2,5:2,5 ТФУ:вода:фенол:тиоанизол:триизопропилсилан:3,6-диокса:1,8-октандитиол (об./об./об./об./об./об.), а сырой белок выделяли осаждением диэтиловым эфиром. Сырой белок очищали высокоэффективной жидкостной хроматографией с обращенными фазами, а его чистоту и идентичность подтверждали аналитической высокоэффективной жидкостной хроматографией с обращенными фазами и масс-спектрометрией с матрично-активированной лазерной десорбцией (m/z=2137,1 ((М+Н)+).
Анализ резонансного переноса энергии флуоресценции с разрешением по времени (TR-FRET)
Осуществляли серийные разбавления репрезентативных соединений в диметилсульфоксиде (ДМСО), начиная с 50 мкМ (2× исходная концентрация; 10% ДМСО) и 10 мкл переносили в 384-луночный планшет. Затем в каждую лунку добавляли 10 мкл смеси белок/зонд/антитело с конечными концентрациями, перечисленными в таблице 1.
После этого образцы перемешивали в шейкере в течение 1 минуты и инкубировали еще в течение 3 часов при комнатной температуре. Для каждого анализа зонд/антитело и белок/зонд/антитело включали в каждый планшет для анализа в качестве положительного и отрицательного контроля, соответственно. Измерение флуоресценции проводили на приборе Envision (Perkin Elmer) с использованием фильтра возбуждения и фильтров эмиссии 520/525 (F-Bak белок) и 495/510 нм (Tb-меченое антигистидиновое антитело).
Константы ингибирования (Ki) соединений согласно изобретению, и АВТ-737, и соотношение селективности связывания (Bcl-XL Ki:Bcl-2 Ki) для каждого приведены в таблице 2 далее. Константа ингибирования (Ki) представляет собой константу диссоциации комплекса фермент-ингибитор или комплекса белок/низкомолекулярное соединение, где низкомолекулярное соединение ингибирует связывание одного белка с другим белком или пептидом. В том случае, когда Ki соединения представлена в виде «>» (более чем) некоторого численного значения, подразумевается, что это означает, что величина сродства к связыванию (например, для Bcl-XL) больше пределов определения использованного анализа. В том случае, когда соотношение селективности связывания соединения представлено в виде «>» (более чем) некоторого численного значения, подразумевается, что это означает, что селективность конкретного соединения для Bcl-2 относительно Bcl-XL, по меньшей мере, больше указанного числа. В том случае, когда Ki соединения представлена в виде «<» (менее чем) некоторого численного значения, подразумевается, что это означает, что величина сродства к связыванию (например, для Bcl-2) меньше пределов определения использованного анализа. Константы ингибирования определяли с использованием уравнении Ванга (Wang Z-X., An Exact Mathematical Expression For Describing Competitive Binding Of Two Different Ligands To A Protein Molecule. FEBSLett. 1995, 360:111-4).
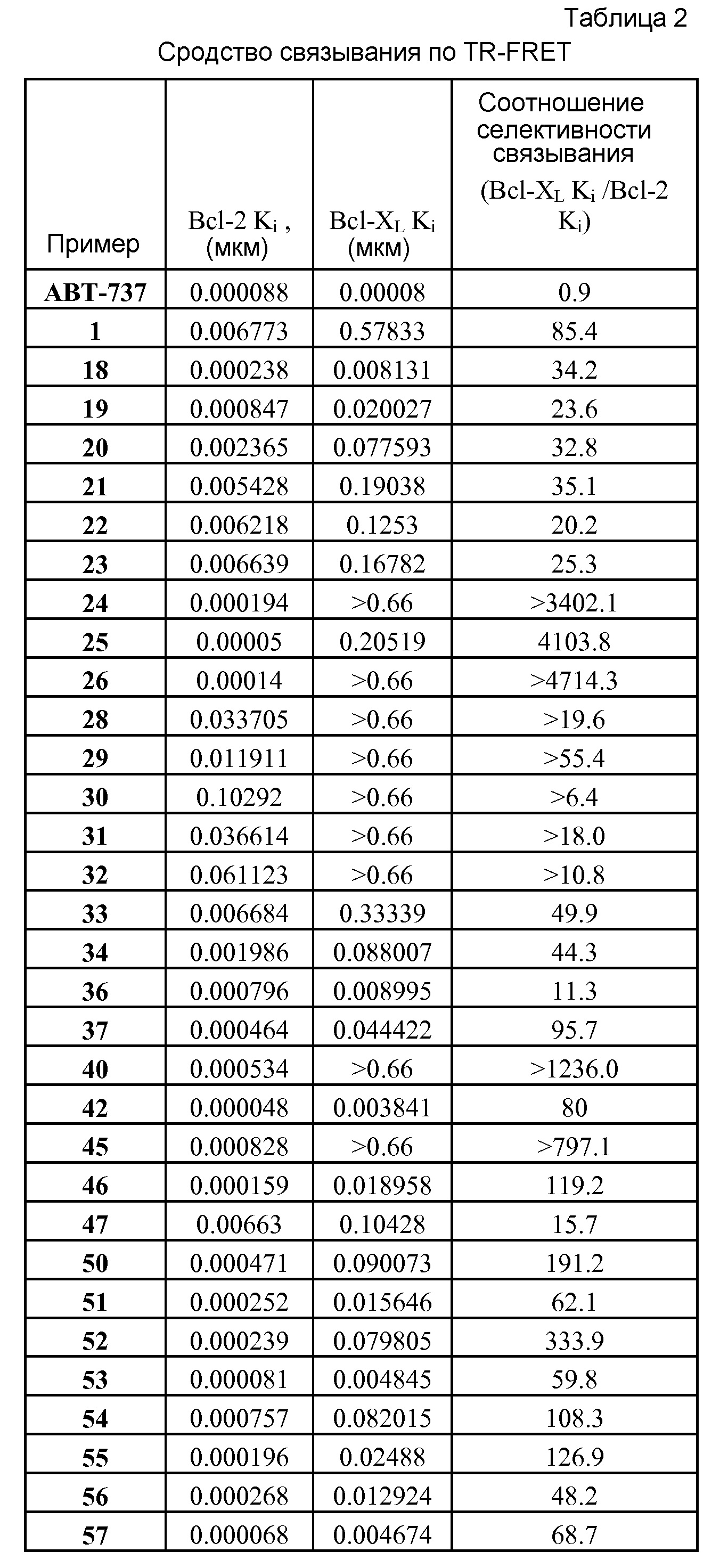



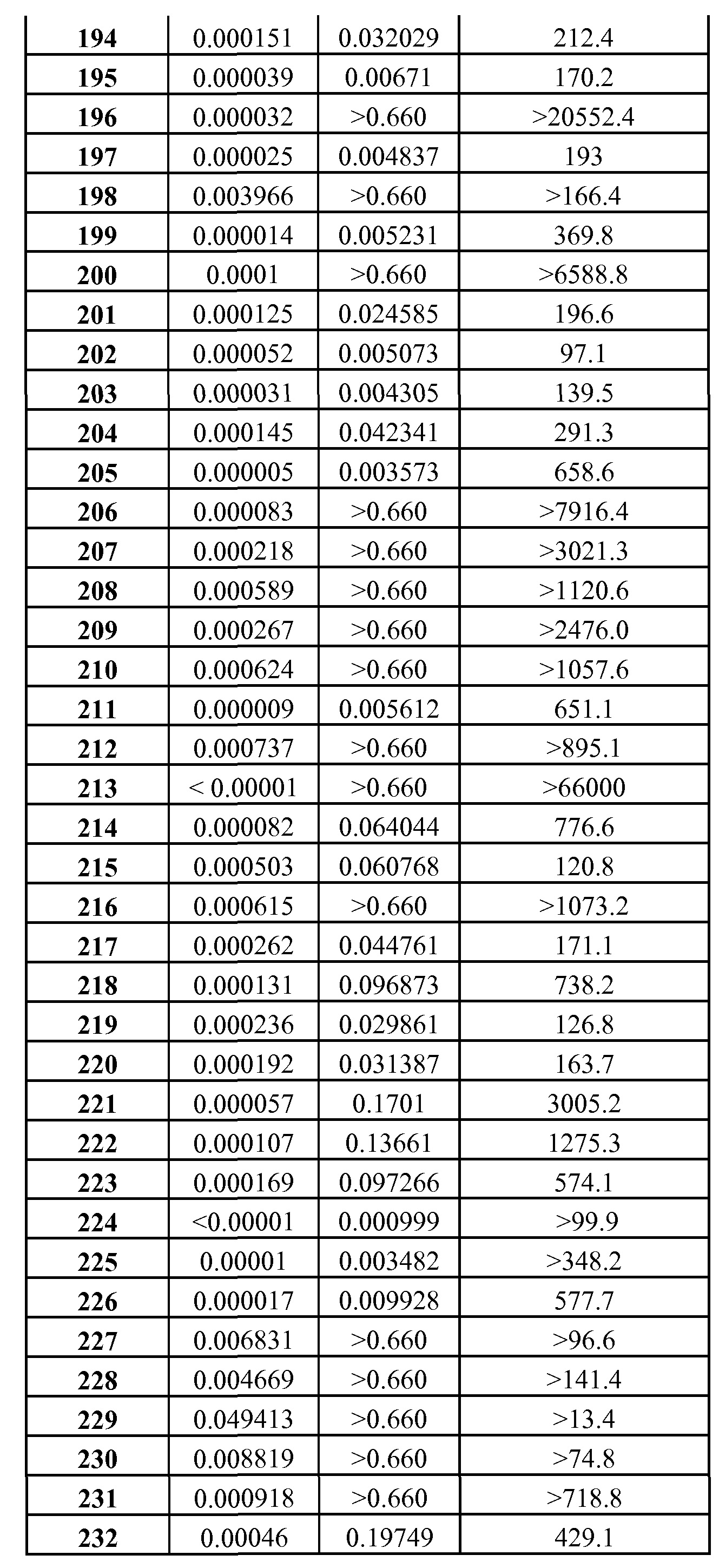

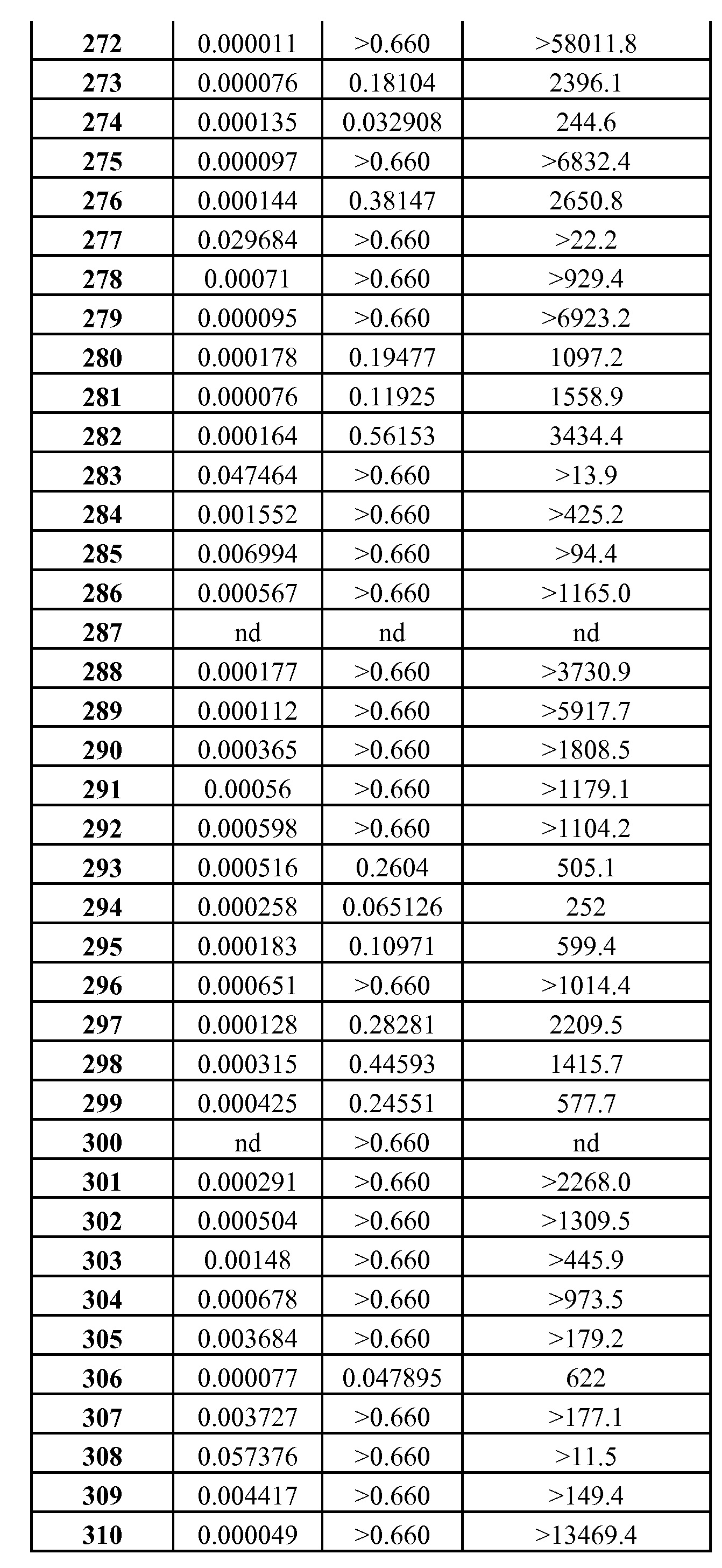

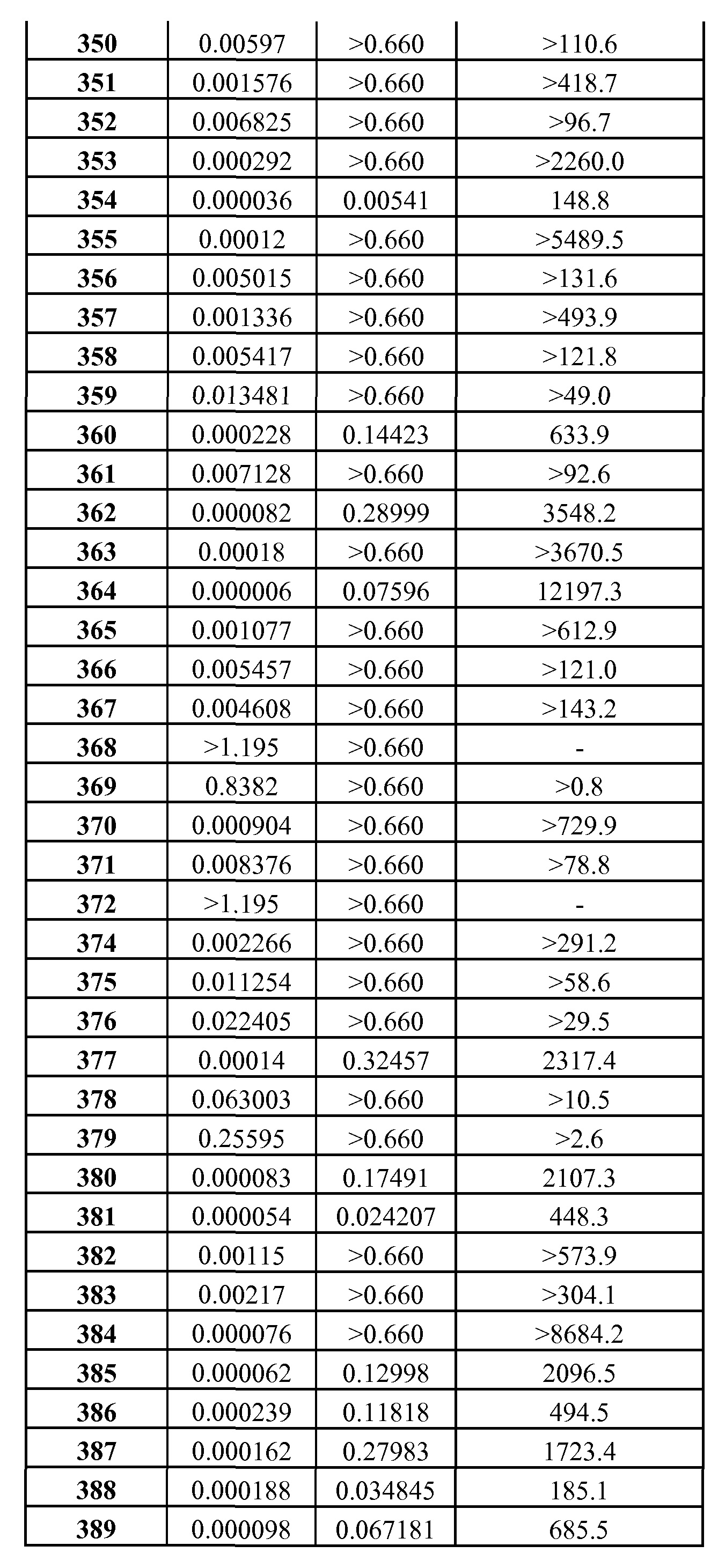


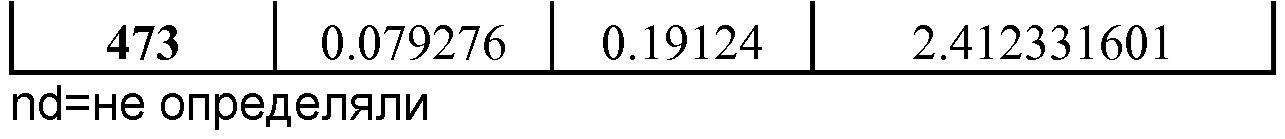
В таблице 2 представлена применимость соединений формулы I для функционального ингибирования антиапоптотического белка Bcl-2. Кроме того, к удивлению, из нее видно, что данные соединения проявляют сравнительно малое сродство к антиапоптотическому белку Bcl-xL, что, в свою очередь, приводит к высоким соотношениям селективности связывания (Bcl-xL Ki/Bcl-2 Ki), изменяющимся в интервале от >2 до >263,263. Данная селективность по отношению к белку Bcl-2 существенно выше, чем для соединений, описанных ранее в РСТ US 2004/36770 и РСТ US 2004/367911, представленных в виде примера АВТ-737 в таблице 2.
Для некоторых соединений (например, 192 и 193) анализ не выявил никакой активности в отношении Bcl-2 или Bcl-XL в условиях, установленных выше в описании эксперимента для анализа FRET. Специалисты в данной области примут во внимание, что на верхние и нижние пределы определения в любом анализе влияют условия данного анализа, а конкретно для FRET анализа, концентрация использованной пробы. Поскольку соединения, представленные примерами 192 и 193, проявляют значения Ki, превышающие пределы определения в использованном формате анализа, можно утверждать, что их сродство к Bcl-2 или Bcl-XL меньше верхнего предела определения анализов. Однако они все же имеют сродство к одному или обоим белкам, а авторы изобретения ожидают, что они также будут обладать селективностью к Bcl-2.
Оценка жизнеспособности тромбоцитарных клеток
Обогащенную тромбоцитами плазму (PRP) (собственного производства по обычной методике) инкубировали с АВТ-737 (4-(4-((4’-хлор-1,1’-дифенил-2-ил)метил)пиперазин-1-ил)-N-((4-(((1R)- 3-(диметиламино)-1-((фенилтио)метил)пропил)амино)-3-нитрофенил)сульфонил)бензамид) или соединениями данного изобретения в различных концентрациях в течение пяти часов при 37°С. После инкубации тромбоциты приводили в равновесие к комнатной температуре в течение 20 минут, а затем прибавляли равный объем реагента Cell Titer Glo (Promega Corporation). Образцы перемешивали в течение двух минут, а затем оставляли для равновесия еще в течение 10 минут при комнатной температуре. Количественную оценку люминесценции, генерируемой образцами, с использованием планшетного счетчика LJL Analyst. Значения IC50 представляют собой концентрации соединений, необходимые для 50% ингибирования жизнеспособности клеток.
Оценка жизнеспособности клеток FL5.12/Bcl-2
FL5.12 представляют собой IL-3 зависимую пролимфоцитарную мышиную клеточную линию, подвергающуюся апоптозу при удалении IL-3 в результате повышающей регуляции проапоптотических белков Bcl-2, таких, как Bim и Puma. Стабильная сверхэкспрессия антиапоптотического белка Bcl-2 (FL5.12/Bcl-2) защищает от апоптоза, вызванного удалением IL-3 при секвестрировании Bim и Puma [Ссылки. Harada, et al. PNAS 101, 15313 (2004); Certo, et al. Cancer Cell 9, 351 (2006).] Способность соединений убивать клетки FL5.12/Bcl-2 при удалении IL-3 представляет собой непосредственную меру способности данных соединений ингибировать антиапоптотическую деятельность белка Bcl-2.
Стабильные трансфектанты, сверхэкспрессирующие FL5.12/Bcl-2 дикого типа, выращивали в RPMI-1640 с добавкой 2 мМ L-глутамина, 10% FBS, 1 мМ пирувата натрия, 2 мМ HEPES, 1% пенициллина/стрептомицина (Invitrogen), 57 мкМ β-МЕ и 10% WEHI-3B кондиционированной среды (источник IL-3), и выдерживали при 37°С при содержании 5% СО2. 1×106 клеток/мл промывали 1×PBS и повторно суспендировали в среде без добавки 10% WEHI-3B в течение 48 ч перед анализом на цитотоксичность. Затем клетки обрабатывали еще в течение 24 ч в присутствии различных концентраций указанных соединений. Оценку жизнеспособности клеток проводили методом анализа CellTitre Glo (Promega Corp) согласно рекомендациям производителя.
Анализ данных проводили с использованием GraphPad Prism 4.0, а результаты приведены в таблице 3 ниже.


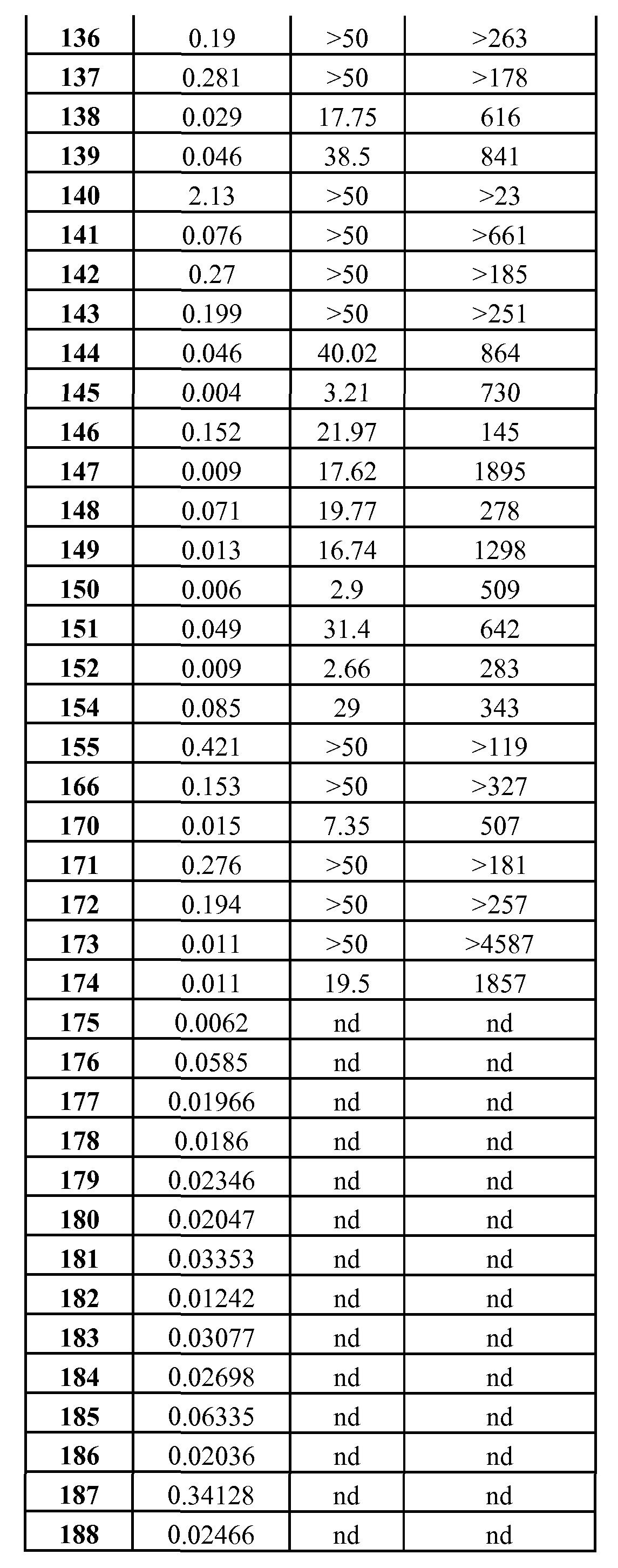
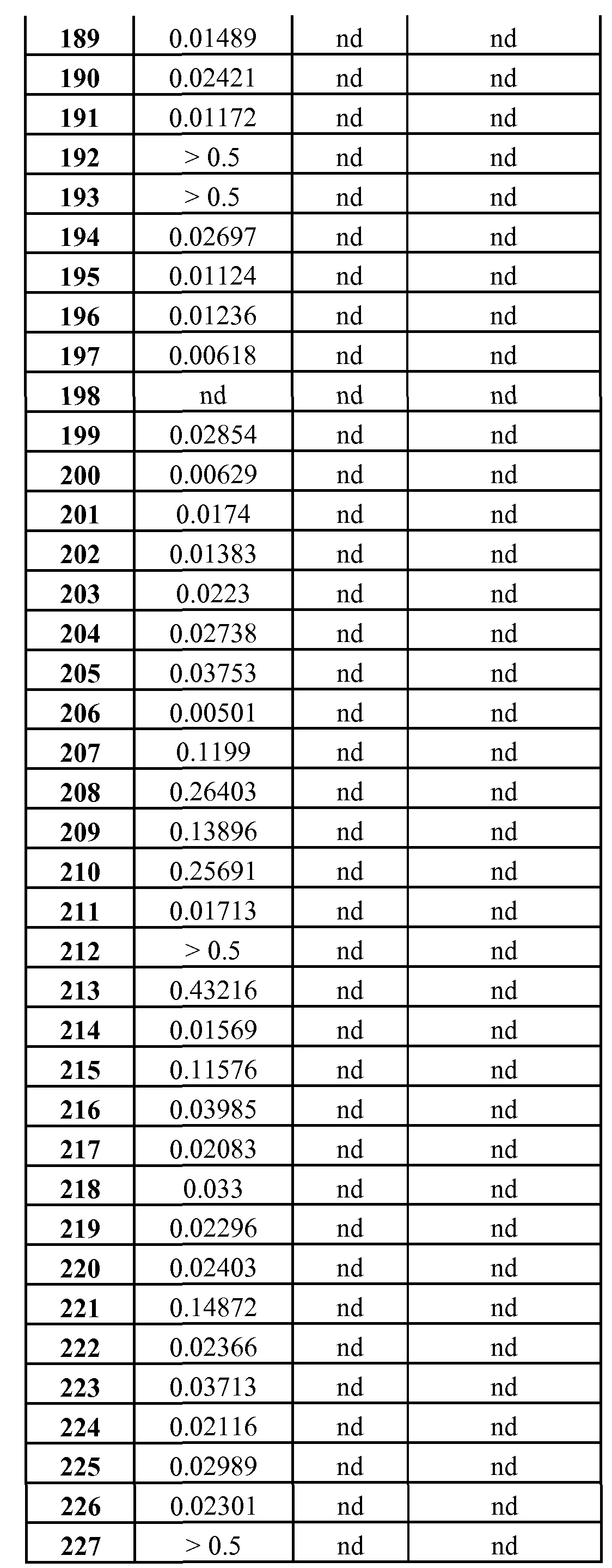
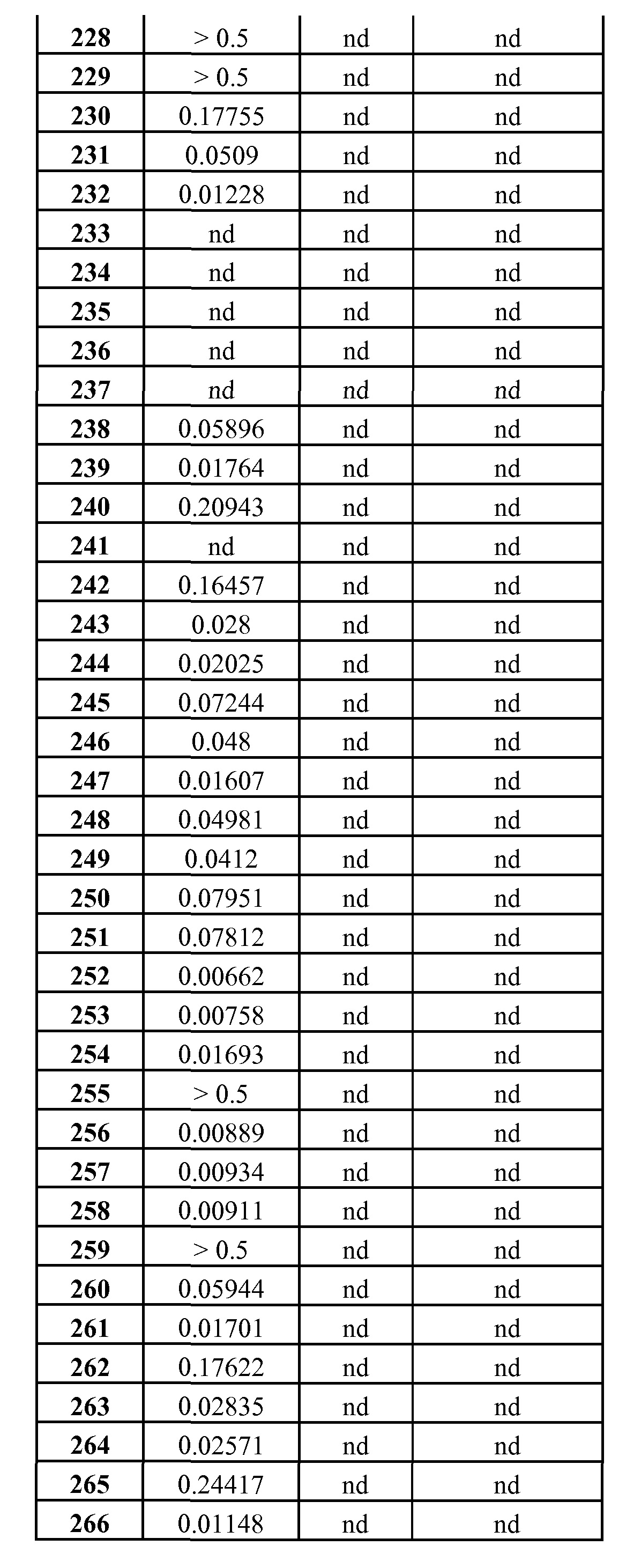
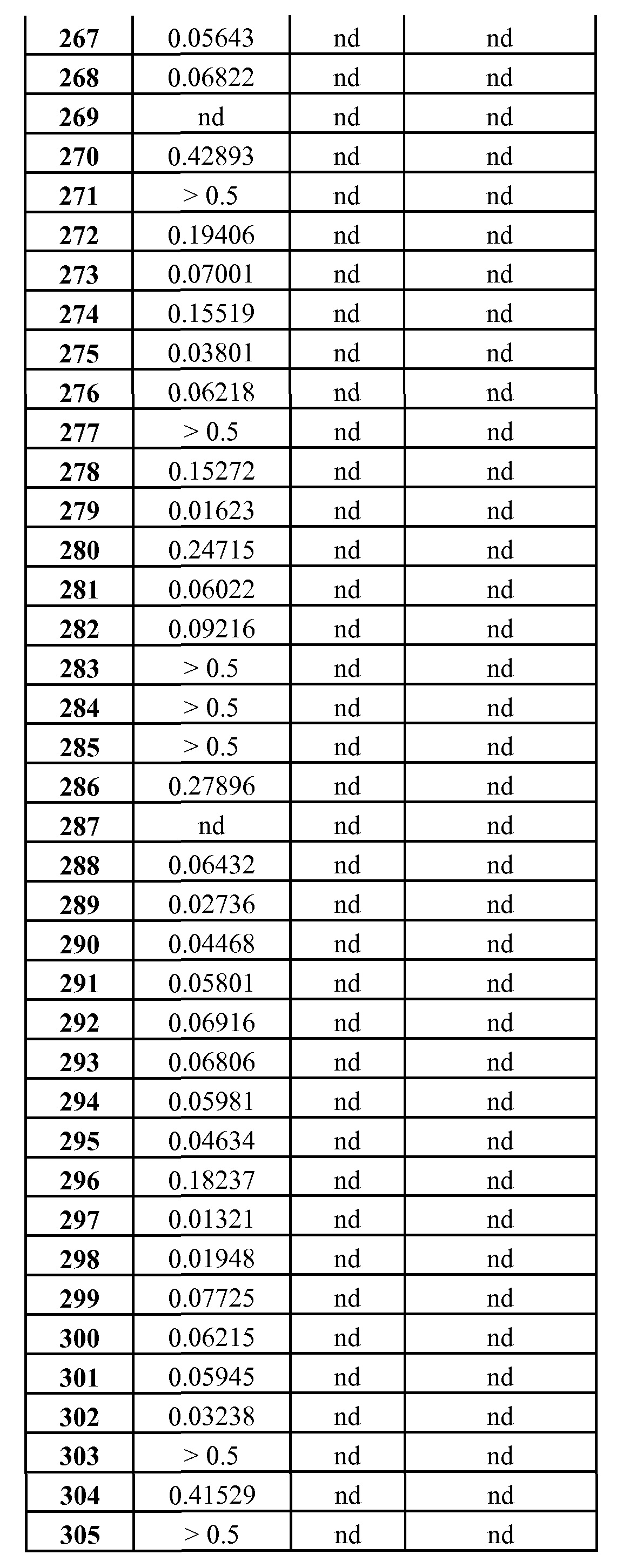
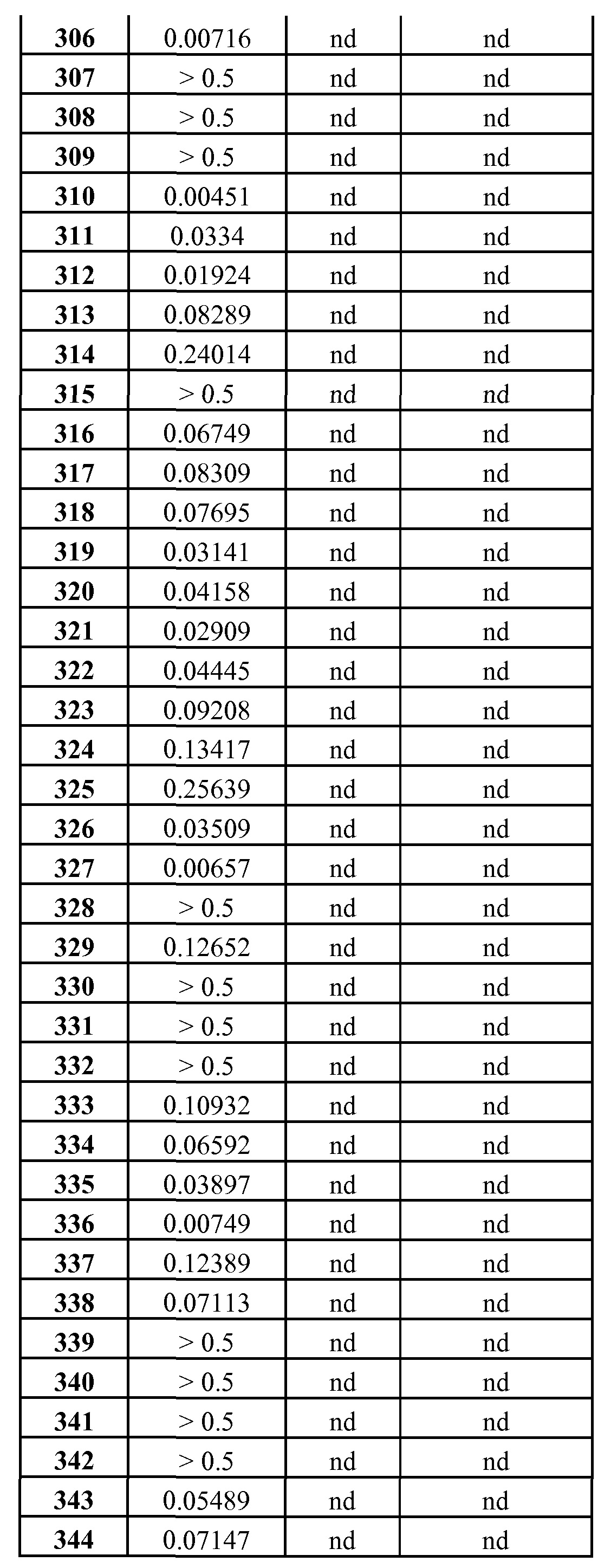
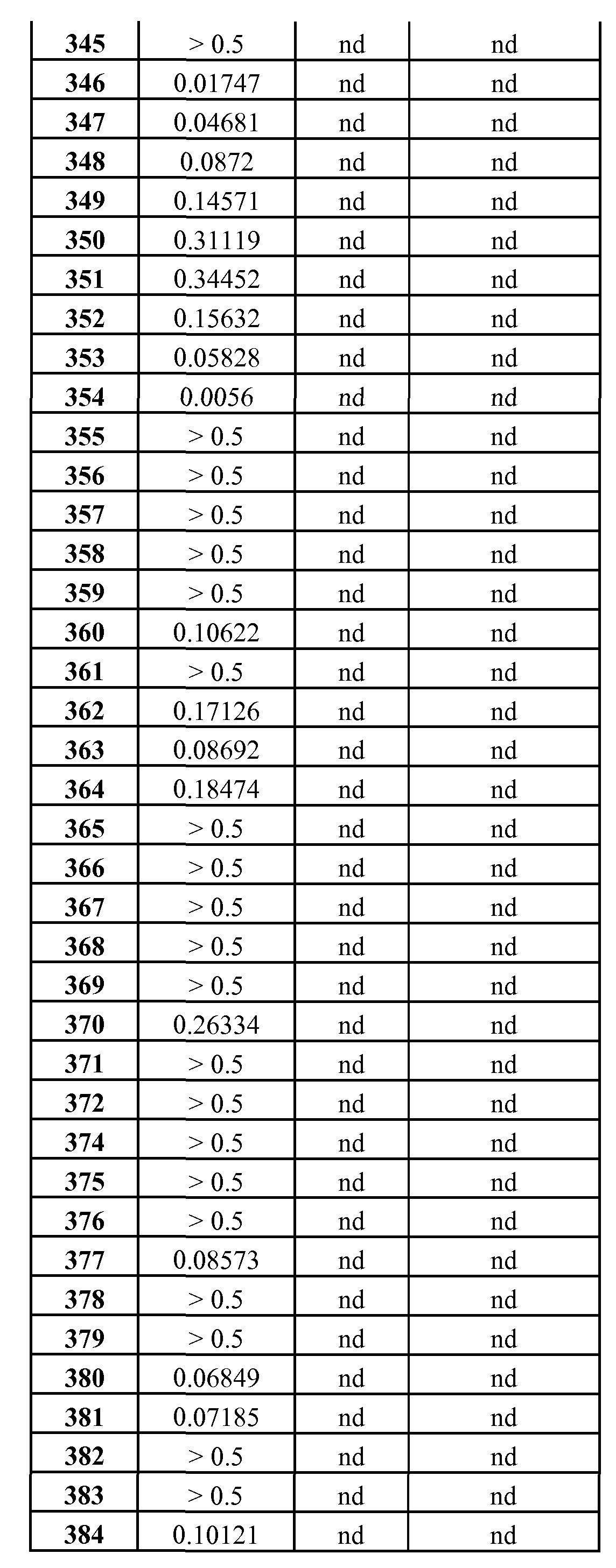
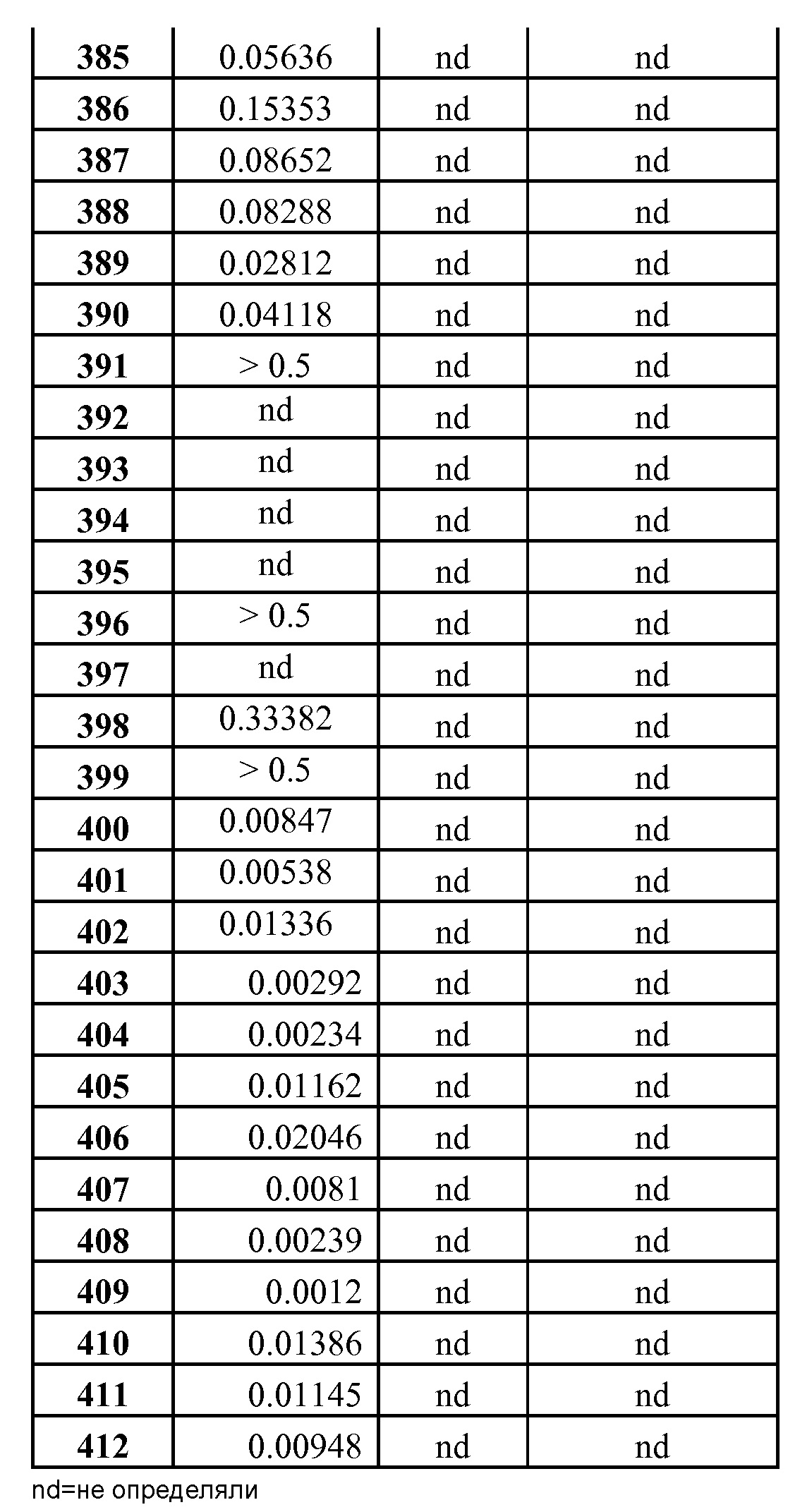
В таблице 3 показана способность соединений формулы I функционально ингибировать антиапоптотический белок Bcl-2 в клеточном контексте. FL5.12 представляет собой IL-3 зависимую пролимфотическую мышиную клеточную линию, подвергающуюся апоптозу при удалении IL-3 в результате повышающей регуляции проапоптотических белков семейства Bcl-2, таких как Bim и Puma. Стабильная сверхэкспрессия антиапоптотического белка Bcl-2 (FL5.12/Bcl-2) защищает от апоптоза, вызванного удалением IL-3 при секвестрировании Bim и Puma (Ссылки. Harada, et al. PNAS 2004, 101, 15313; Certo, et al. Cancer Cell 2006, 9, 351). Способность соединений убивать клетки FL5.12/Bcl-2 при удалении IL-3 представляет собой непосредственную меру способности данных соединений ингибировать антиапоптотическую деятельность белка Bcl-2. Соединения формулы I очень эффективны при уничтожении клеток FL5.12/Bcl-2 при удалении IL-3, что показано низкими значениями ЕС50.
Соединения данного изобретения связываются с антиапоптотическими белками Bcl-2 с высоким сродством и эффективно ингибируют антиапоптотическую деятельность белка Bcl-2 в клеточном контексте и, следовательно, ожидается, что они применимы для лечения заболеваний, при которых экспрессируется антиапоптотический белок Bcl-2.
Антиапоптотический белок Bcl-2 был описан в другом издании (Cell March 23, 2007, 128, 1173-1176) как являющийся основным регулятором жизнеспособности циркулирующих тромбоцитов у животных. Генетические мутации в белке Bcl-xL, снижающие стабильность и период полураспада белка Bcl-xL, вызывают сокращение жизнеспособности и продолжительности жизни тромбоцитов у мышей с подобными мутациями. Эффективный фармакологический ингибитор Bcl-xL, АВТ-737, вызывает быстрое, зависящее от концентрации, снижение циркулирующих тромбоцитов после инъекции C57BL/6 мышам или гончим (Cell March 23, 2007, 128, 1173-1176.; Cell Death Differ. May 2007; 14(5), 943-51). Таким образом, не будучи ограниченными теорией, можно ожидать, что соединения данного изобретения, обладающие пониженным сродством к Bcl-xL, проявят более низкие уровни апоптоза тромбоцитов, чем ранее описанные соединения с более высоким сродством к Bcl-xL.
Влияние соединений на выживание тромбоцитов можно оценить непосредственно ex vivo, исследуя жизнеспособность выделенных тромбоцитов собаки в присутствии различных концентраций соединения. Из данных в таблице 3 видно, что соединения формулы I оказывают от существенного меньшего до отсутствия влияния на жизнеспособность выделенных тромбоцитов собаки ex vivo (более высоким значения ЕС50) по сравнению с соединениями, описанными ранее в РСТ US 2004/36770 и РСТ US 2004/367911, как показано на примере АВТ-737. Кроме того, соотношение функциональной селективности (ЕС50 тромбоцитов собаки: ЕС50 FL5.12/Bcl-2) для соединений формулы I изменяется в интервале от 32 до 4849, что существенно выше, чем для соединений, описанных ранее в РСТ US 2004/36770 и РСТ US 2004/367911, как показано на примере АВТ-737.
Поскольку соединения формулы I связываются с анти-апоптотическим белком Bcl-2 при сравнительно меньшем связывании с анти-апоптотическим белком Bcl-XL, данные соединения могли бы быть применимы в качестве лекарственных средств для лечения рака и аутоиммунных и иммунных заболеваний с уменьшением побочного влияния тромбоцитопении (то есть они оказывали бы угнетающее действие на циркулирующие тромбоциты). Как описано в настоящем описании и где-либо еще, эффективный ингибитор Bcl-XL, АВТ-737, вызывает зависящее от дозы сокращение циркулирующих тромбоцитов после инъекции C57BL/6 мышам или собакам (Cell Death Differ. May 2007; 14(5), 943-51). Соединения со сниженным сродством к Bcl-XL проявляют от существенно более низкого до отсутствия сокращения циркулирующих тромбоцитов. Таким образом, не будучи ограниченными теорией, можно ожидать, что соединения данного изобретения, обладающие пониженным сродством к Bcl-XL, проявят более низкие уровни апоптоза тромбоцитов, чем ранее описанные соединения с более высоким сродством к Bcl-XL. Данные по ЕС50 в таблице 2 показывают влияние введения соединений данного изобретения со сравнению с АВТ-737 на тромбоциты собаки.
Участие белка Bcl-2 в раке мочевого пузыря, раке мозга, раке груди, раке костного мозга, раке шейки матки, хроническом лимфолейкозе, колоректальном раке, раке пищевода, гепатоцеллюлярном раке, лимфобластном лейкозе, фолликулярной лимфомы, лимфоидных злокачественных опухолях Т-клеточного или В-клеточного происхождения, меланоме, миелогенной лейкозе, миеломе, оральном раке, раке яичника, немелкоклеточном раке легких, раке предстательной железы, мелкоклеточном раке легких, хроническом лимфолейкозе, миеломе, раке предстательной железы, раке селезенки и т.п., описано в общественной РСТ US 2004/36770, опубликованной как WO 2005/049593, и РСТ US 2004/37911, опубликованной как WO 2005/024636.
Участие белков Bcl-2 в иммунных и аутоиммунных заболеваниях описано в Current Allergy and Asthma Reports 2003, 3, 378-384; British Journal of Haemotology 2000, 110(3), 584-90; Blood 2000, 95(4), 1283-92 и New England Journal of Medicine 2004, 351(14), 1409-1418.
Участие белка Bcl-2 в артрите описано в общественной предварительной патентной заявке Соединенных Штатов № 60/988479.
Участие белка Bcl-2 в отторжении трансплантата костного мозга описано в общественной патентной заявке Соединенных Штатов № 11/941196 (в настоящее время патентная публикация США 20080182845А1).
Сверхэкспрессия белка Bcl-2 согласуется с невосприимчивостью к химиотерапии, клиническому результату, развитию заболевания, общему прогнозу или их сочетанию при различных видах рака и нарушениях иммунной системы. Виды рака включают, но без ограничения, опухоли гематологических и солидных типов, такие как акустическая неврома, острый лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз (моноцитарный, миелобластный, аденокарцинома, ангиосаркома, астроцитома, миеломоноцитарный и промиелоцитарный), острый Т-клеточный лейкоз, базально-клеточная карцинома, карцинома желчных протоков, рак мочевого пузыря, рак мозга, рак груди (включая эстроген-рецептор положительный рак груди), бронхогенная карцинома, лимфома Беркитта, рак шейки матки, хондросаркома, хордома, хориокарцинома, хронический лейкоз, хронический лимфоцитарный лейкоз, хронический миелоцитарный (гранулоцитарный) лейкоз, хронический миелогенный лейкоз, рак толстой кишки, колоректальный рак, краниофарингиома, цистаденокарцинома, диспролиферативные изменения (дисплазии и метаплазии), эмбриональная карцинома, рак эндометрия, эндотелиосаркома, эпендимальная глиома, эпителиальная карцинома, эритролейкоз, рак пищевода, эстроген-рецептор положительный рак груди, эссенциальная тромбоцитопения, опухоль Эвинга, фибросаркома, карцинома желудка, герминогенный рак яичка, гестационная трофобластическая болезнь, глиобластома, рак головы и шеи, болезнь тяжелых цепей, гемангиобластома, гепатома, гепатоцеллюлярный рак, гормон-нечувствительный рак предстательной железы, лейомиосаркома, липосаркома, рак легких (включая мелкоклеточный рак легких и немелкоклеточный рак легких), лимфангиоэндотелиосаркома, лимфангиосаркома, лимфобластный лейкоз, лимфома (лимфома, включая диффузную крупноклеточную В-клеточную лимфому, фолликулярную лимфому, лимфому Ходжкина), злокачественные и гиперпролиферативные нарушения мочевого пузыря, груди, толстой кишки, легкого, яичников, поджелудочной железы, предстательной железы, кожи и уретры, лимфоидные злокачественные образования Т-клеточного или В-клеточного происхождения, лейкоз, медуллярная карцинома, медуллобластома, меланома, менингиома, мезотелиома, множественная миелома, миелогенный лейкоз, миелома, миксосаркома, нейробластома, олигодендроглиома, рак полости рта, остеогенная саркома, рак яичника, рак поджелудочной железы, папиллярные аденокарциномы, папиллярная карцинома, периферическая Т-клеточная лимфома, пинеалома, истинная полицитемия, рак предстательной железы (включая гормон-нечувствительный (рефракторный) рак предстательной железы), ректальный рак, карцинома почечного эпителия, ретинобластома, рабдомиосаркома, саркома, карцинома сальных желез, семинома, рак кожи, мелкоклеточная карцинома легких, солидные опухоли (карциномы и саркомы), рак желудка, карцинома сквамозных клеток, синовиома, карцинома сальных желез, рак яичка (включая герминогенный рак яичка), рак щитовидной железы, макроглобулинемия Вальденстрема, опухоли яичка, рак матки, опухоль Вильма и т.п.
Кроме того, ожидается, что соединения формулы I будут ингибировать рост клеток, экспрессирующих белок Bcl-2, происходящих из педиатрического рака или новообразования, включая эмбриональную рабдомиосаркому, педиатрический острый лимфобластный лейкоз, педиатрический острый миелогенный лейкоз, педиатрическую альвеолярную рабдомиосакрому, педиатрическую анапластическую эпендимому, педиатрическую крупноклеточную лимфому, педиатрическую анапластическую медуллобластому, педиатрическую атипическую тератоидную/рабдоидную опухоль центральной нервной системы, педиатрический бифенотипический острый лейкоз, педиатрическую лимфому Беркитта, педиатрические типы рака семейства опухолей Эвинга, такие как примитивные нейроэктодермальные опухоли, педиатрическую диффузную анапластическую опухоль Вильма, педиатрическую опухоль Вильма с благоприятной гистологией, педиатрическую глиобластому, педиатрическую медуллобластому, педиатрическую нейробластому, педиатрический миелоцитоматоз, происходящий из нейробластомы, пре-В-клеточные типы рака (такие как лейкоз), педиатрическую остеосаркому, педиатрическую рабдоидную опухоль почек, педиатрическую рабдомиосаркому и педиатрические Т-клеточные типы рака, такие как лимфома и рак кожи, и т.п.
Аутоиммунные заболевания включают заболевание синдромом приобретенного иммунодефицита (СПИД), аутоиммунный лимфопролиферативный синдром, гемолитическую анемию, воспалительные заболевания и тромбоцитопению, острое или хроническое иммунное заболевание, связанное с трансплантацией органа, болезнь Аддисона, аллергические заболевания, алопецию, очаговую алопецию, атероматозное заболевание/артериосклероз, атеросклероз, артрит (включая остеоартрит, ювенильный хронический артрит, септический артрит, артрит Лиме, псориатический артрит и реактивный артрит), аутоиммунное буллезное заболевание, абеталипопротеинемию, заболевания, связанные с приобретенным иммунодефицитом, острые иммунные заболевания, связанные с трансплантацией органов, приобретенный акроцианоз, острые и хронические паразитические или инфекционные процессы, острый панкреатит, острую почечную недостаточность, острую ревматическую лихорадку, острый поперечный миелит, аденокарциномы, передаваемую воздушным путем эктопическую систолу, (острый) респираторный дистресс-синдром взрослых, комплекс слабоумия СПИД, алкогольный синдром, вызванное алкоголем повреждение печени, вызванный алкоголем гепатит, аллергический конъюнктивит, аллергический контактный дерматит, аллергический ринит, аллергию и астму, отторжение аллотрансплантата, дефицит альфа-1-антитрипсина, болезнь Альцгеймера, амиотрофический боковой склероз, анемию, стенокардию, болезнь легких, связанная с анкилозирующим спондилитом, дегенерацию передних роговых клеток, антитело-опосредованную цитотоксичность, антифосфолипидный синдром, антирецепторные реакции гиперчувствительности, аневризмы аорты и периферических артерий, расслоение аорты, артериальную гипертензию, артериосклероз, артериовенозную фистулу, артропатию, астению, астму, атаксию, атопическую аллергию, мерцательную аритмию (стойкую или пароксизмальную), трепетание предсердий, атриовентрикулярную блокаду, атрофический аутоиммунный гипотиреоидизм, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунный гепатит 1 типа (классический аутоиммунный или волчаночный гепатит), аутоиммунно опосредованную гипогликемию, аутоиммунную нейтропению, аутоиммунную тромбоцитопению, аутоиммунное тироидное заболевание, В-клеточную лимфому, отторжение костных трансплантатов, отторжение трансплантатов костного мозга (ВМТ), облитерирующий бронхиолит, блокаду ножки пучка Гиса, ожоги, кахексию, сердечную аритмию, синдром сердечной оглушенности, опухоли сердца, кардиомиопатию, воспалительную реакцию на экстракорпоральное кровообращение, отторжение хрящевого трансплантата, церебеллярную кортикальную дегенерацию, церебеллярные нарушения, хаотичную или множественную предсердную тахикардию, нарушения, связанные с химиотерапией, хламидии, холеостаз, хронический алкоголизм, хронический активный гепатит, синдром хронической усталости, хроническое иммунное заболевание, связанное с пересадкой органов, хроническую эозинофильную пневмонию, хронические воспалительные патологии, хронический слизисто-кожный кандидоз, хроническая обструктивная болезнь легких (COPD), хроническую интоксикацию салицилатами, колоректальный вариабельный неклассифицируемый иммунодефицит (вариабельную неклассифицируемую гипогаммаглобулинемию), конъюнктивит, интерстициальное заболевание легких, связанное с болезнью соединительной ткани, контактный дерматит, гемолитическую анемию с положительной пробой Кумбса, хроническое легочное сердце, болезнь Крейтцфельдта-Якоба, криптогенный аутоиммунный гепатит, криптогенный фиброзный альвеолит, сепсис с отрицательным результатом культуры, кистозный фиброз, болезни, связанные с цитокиновой терапией, болезнь Крона, слабоумие боксеров, демиелинизирующие заболевания, геморрагическую лихорадку денге, дерматит, дерматит склеродермию, дерматологические состояния, болезнь легких, связанную с дерматомиозитом/полимиозитом, диабет, диабетическую артериосклеротическую болезнь, сахарный диабет, болезнь диффузных телец Леви, дилатационную кардиомиопатию, дилатационную конгестивную кардиомиопатию, дискоидную красную волчанку, нарушения базальных ганглий, диссеминированное внутрисосудистое свертывание, синдром Дауна среднего возраста, интерстициальное заболевание легких, вызванное лекарственными средствами, вызванный лекарственными средствами гепатит, вызванное лекарственными средствами нарушение движений, вызванное лекарственными средствами, который блокируют допаминовые рецепторы ЦНС, чувствительность к лекарственным средствам, экзему, энцефаломиелит, эндокардит, эндокринопатию, энтеропатический синовит, эпиглоттит, вирусную инфекцию Эпштейна-Барра, эритромелалгию, экстрапирамидные и церебеллярные нарушения, семейный гематофагоцитарный лимфогистиоцитоз, отторжение трансплантата фетального тимуса, атаксию Фридрейха, функциональные заболеваний периферических артерий, женское бесплодие, фиброз, фиброзное заболевание легких, грибковый сепсис, газовую гангрену, язву желудка, гигантоклеточный артрит, гломерулярный нефрит, гломерулонефрит, синдром Гудпасчера, зобный аутоиммунный гипотиреоз (болезнь Хашимото), подагрический артрит, отторжение трансплантата любого органа или ткани, болезнь трансплантат-против-хозяина, грамотрицательный сепсис, грамположительный сепсис, гранулему вследствие внутриклеточных организмов, инфекцию стрептококков группы В (GBS), болезнь Грейва, болезнь легких, связанную с гемосидерозом, лейкоз волосковых клеток, лейкоз волосковых клеток, болезнь Галлерордена-Шпатца, тиреоидит Хашимото, сенная лихорадка, отторжение сердечного трансплантата, гемахроматоз, гематопоэтические злокачественные новообразования (лейкоз и лимфома), гемолитическую анемию, гемолитический уремический синдром/тромболитический тромбоцитопенический акроангиотромбоз, кровоизлияние, пурпуру Геноха-Шенлейха, гепатит А, гепатит В, гепатит С, ВИЧ инфекция/ВИЧ невропатия, болезнь Ходжкина, гипопаратиреоидизм, хорею Хантингтона, гиперкинетические нарушения движения, реакции гиперчувствительности, пневмонит гиперчувствительности, гипертиреоидизм, гипокинетические нарушения движения, оценку гипоталамо-гипофизарно-надпочечниковой системы, идиопатичекую болезнь Аддисона, идиопатическую лейкопению, идиопатический фиброз легких, идиопатическую тромбоцитопению, идиосинкратическую болезнь печени, детскую спинальную мышечную атрофию, инфекционные заболевания, воспаление аорты, воспалительные заболевания костей, инсулинозависимый сахарный диабет, интерстициальный пневмонит, иридоциклит/увеит/ретробульбарный неврит, ишемическое реперфузионное поражение, ишемический инсульт, ювенильную злокачественную анемию, ювенильный ревматоидный артрит, ювенильную спинальную мышечную атрофию, саркому Капоши, болезнь Кавазаки, отторжение трансплантата почки, легионеллу, лейшманиоз, проказу, поражение корково-спинномозговой системы, болезнь с линейным IgA, липидемию, отторжение трансплантата печени, болезнь Лиме, лимфедему, лимфоцитарное инфильтрационное заболевание легких, малярию, мужское бесплодие илиопатическое или NOS, злокачественный гистиоцитоз, злокачественную меланому, менингит, менингококкемию, микроскопический васкулит почек, мигрень, митохондриальное мультисистемное нарушение, смешанное заболевания соединительной ткани, болезнь легких, связанную со смешанным заболеванием соединительной ткани, моноклональную гаммапатию, множественную миелому, множественные системные дегенерации (Менсел Дежерин-Томас Ши-Драгер и Мачадо-Джозеф), миалгический энцефалит/синдром хронической усталости, глоточно-лицевую миастению, микроскопический васкулит почек, mycobacterium avium intracellulare, туберкулезные микобактерии, миелодиспластический синдром, инфаркт миокарда, ишемические нарушения миокарда, назофарингеальную карциному, неонатальную хроническую болезнь легких, нефрит, нефроз, нефротический синдром, нейродегенеративные заболевания, нейрогенные мышечные атрофии I, нейтропеническую лихорадку, неалкогольный стеатогепатит, окклюзию брюшной аорты и ее ветвей, окклюзивные артериальные нарушения, отторжение трансплантата органов, орхит/эпидидимит, орхит/процедуры отмены вазэктомии, органомегалию, остеоартроз, остеопороз, недостаточность яичников, отторжение трансплантата поджелудочной железы, паразитарные заболевания, отторжение паратиреоидного трансплантата, болезнь Паркинсона, воспалительное заболевание таза, обыкновенную пузырчатку, листовидную пузырчатку, пемфигоид, перениальный ринит, перикардиальное заболевание, атеросклеротические заболевания периферических артерий, заболевания периферических сосудов, перитонит, злокачественную анемию, факогенный увеит, плазмоклеточную пневмонию, пневмонию, синдром POEMS (полиневропатия, органомегалия, эндокринопатия, моноклональная гаммопатия и синдром изменений кожи), постперфузионный синдром, синдром пост-ИК, синдром пост-MI кардиотомии, постинфекционную интерстициальную болезнь легких, преждевременную недостаточность яичников, первичный билиарный цирроз, первичный склерозирующий гепатит, первичную миксоедему, первичную легочную гипертензию, первичный склерозирующий холангит, первичный васкулит, прогрессирующий супрануклеарный паралич, псориаз, псориаз 1 типа, псориаз 2 типа, псориатическую артропатию, легочную гипертензию, вторичную по отношению к болезни соединительной ткани, легочное проявление нодозного полиартериита, поствоспалительную интерстициальную болезнь легких, радиационный фиброз, радиотерапию, феномен и болезнь Рейно, болезнь Рефсума, регулярную узкую QRS тахикардию, болезнь Рейтера, заболевание NOS почек, реноваскулярную гипертензию, реперфузионное повреждение, рестриктивную кардиомиопатию, интерстициальную болезнь легких, связанную с ревматоидным артриром, ревматоидный спондилит, саркоидоз, синдром Шмидта, склеродермию, старческую хорею, старческое слабоумие с тельцами Леви, септический синдром, септический шок, серонегативную артропатию, шок, дрепаноцитарную анемию, болезнь легких, связанную с болезнью Шегрена, синдром Шегрена, отторжение кожного трансплантата, синдром изменений кожи, отторжение трансплантата тонкой кишки, спермальный аутоиммунитет, множественный склероз (все подтипы), спинальную атаксию, спиноцеребеллярные дегенерации, спондилоартропатию, спорадическую, спорадическую плюригландулярную недостаточность I типа, спорадическую плюригландулярную недостаточность II типа, болезнь Стилла, стрептококковый миозит, инсульт, структурные повреждения мозжечка, подострый склерозирующий панэнцефалит, симпатическую офтальмию, обморок, сифилис сердечно-сосудистой системы, системную анафилаксию, синдром системной воспалительной реакции, синдром приступа ювенильного ревматоидного артрита, системную красную волчанку, заболевание легких, связанное с системной красной волчанкой, системный склероз, интерстициальную болезнь легких, связанную с системным склерозом, Т-клеточный или FAB ALL, болезнь/артериит Такаясу, телеангиэктазию, болезни, опосредованные Th2 типа и Th1 типа, облитерирующий тромбоангиит, тромбоцитопению, тиреоидит, токсичность, синдром токсического шока, трансплантаты, травмы/кровоизлияния, аутоиммунный гепатит 2 типа (гепатит с антителами анти-LKM), инсулинорезистентность типа В с черным акантозом, реакции гиперчувствительности III типа, гиперчувствительность IV типа, артропатию при неспецифическом язвенном колите, неспецифический язвенный колит, нестабильную стенокардию, уремию, уросепсис, крапивницу, увеит, пороки клапана сердца, варикозное расширение вен, васкулит, васкулитную диффузную болезнь легких, заболевания венозной системы, венозный тромбоз, фибрилляцию желудочков, острое заболевание печени с витилиго, вирусные и грибковые инфекции, вирусный энфецалит/асептический менингит, вирус-ассоциированный гемафагоцитарный синдром, грануломатоз Вегенера, синдром Вернике-Корсакова, болезнь Вильсона, отторжение ксенотрансплантата какого-либо органа или ткани, иерсиния- и сальмонелла-ассоциированную артропатию и т.п.
Схемы и подробности эксперимента
Следующие схемы даны для предоставления того, что, как предполагается, является наиболее применимым, и легкого понимания методик и концептуальных аспектов данного изобретения. Соединения данного изобретения можно получить синтетическими химическими процессами, примеры которых приведены в настоящем описании. Подразумевается, что понятно, что порядок стадий в данных способах может изменяться, что реагенты, растворители и условия реакций можно заменить на конкретно упомянутые реагенты, растворители и условия реакций, и что уязвимые группы при необходимости можно защитить и снять с них защиту.
Следующие сокращения имеют указанные значения. ADDP означает 1,1’-(азодикарбонил)дипиперидин, AD-микс-β означает смесь (DHQD)2PHAL, K3Fe(CN)6, K2CO3 и K2SO4), 9-BBN означает 9-борабицикло(3.3.1)нонан, Вос означает трет-бутоксикарбонил, (DHQD)2PHAL означает диэтиловый эфир гидрохинидин 1,4-фталазиндиила, DBU означает 1,8-диазабицикло(5.4.0)ундец-7-ен, DIBAL означает гидрид диизобутилалюминия, DIEA означает диихопропилэтиламин, DMAP означает N,N-диметиламинопиридин, ДМФА означает N,N-диметилформамид, dmpe означает 1,2-бис(диметилфосфино)этан, DMSO означает ДМСО, dppb означает 1,4-бис(дифенилфосфино)бутан, dppe означает 1,2-бис(дифенилфосфино)этан, dppf означает 1,1’-бис(дифенилфосфино)ферроцен, dppm означает 1,1- бис(дифенилфосфино)метан, EDAC⋅HCl означает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, Fmoc означает флуоренилметоксикарбонил, HATU означает гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N’N’N’-тетраметилурония, HMPA означает гексаметилфосфорамид, IPA означает изопропиловый спирт, MP-BH3 означает макропористый цианоборгидрид триметиламмоний метилполистирола, ТЕА означает триэтиламин, ТФУ означает трифторуксусную кислоту, ТГФ означает тетрагидрофуран, NCS означает N-хлорсукцинимид, NMM означает N-метилморфолин, NMP означает N-метилпирролидин, PPh3 означает трифенилфосфин.
Схема 1
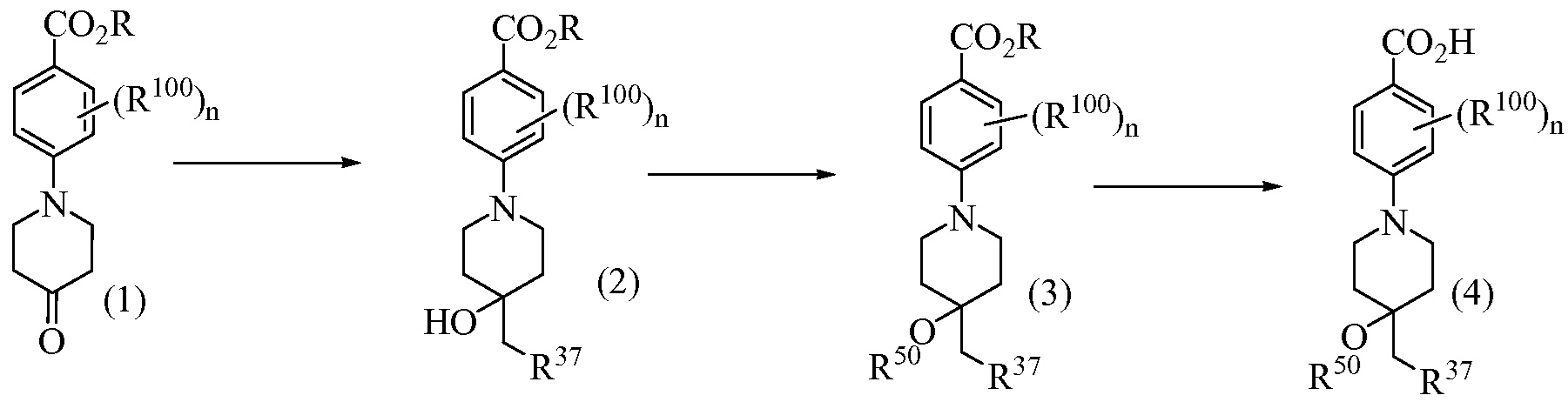
Соединения формулы (4) можно получить, как показано на схеме 1, и можно использовать, как описано на схеме 7, для получения соединений формулы (I), которые являются представительными для соединений настоящего изобретения. Соединения формулы (I), в которых R представляет собой алкил, R100 аналогичен описанному для заместителей при R26, а n равно 1, 2 или 3, можно превратить в соединения формулы (2) при использовании R37CH2MgX1, где X1 представляет собой галогенид, в растворителе, таком как диэтиловый эфир или тетрагидрофуран, но не ограничиваясь ими. Соединения формулы (3) можно получить из соединений формулы (2) при помощи сильного основания, такого как NaH, и R50X2, где X2 представляет собой галогенид, а R50a описан в настоящем описании. Обработка соединений формулы (3) водным NaOH или LiOH приведет к соединениям формулы (4)
Схема 2
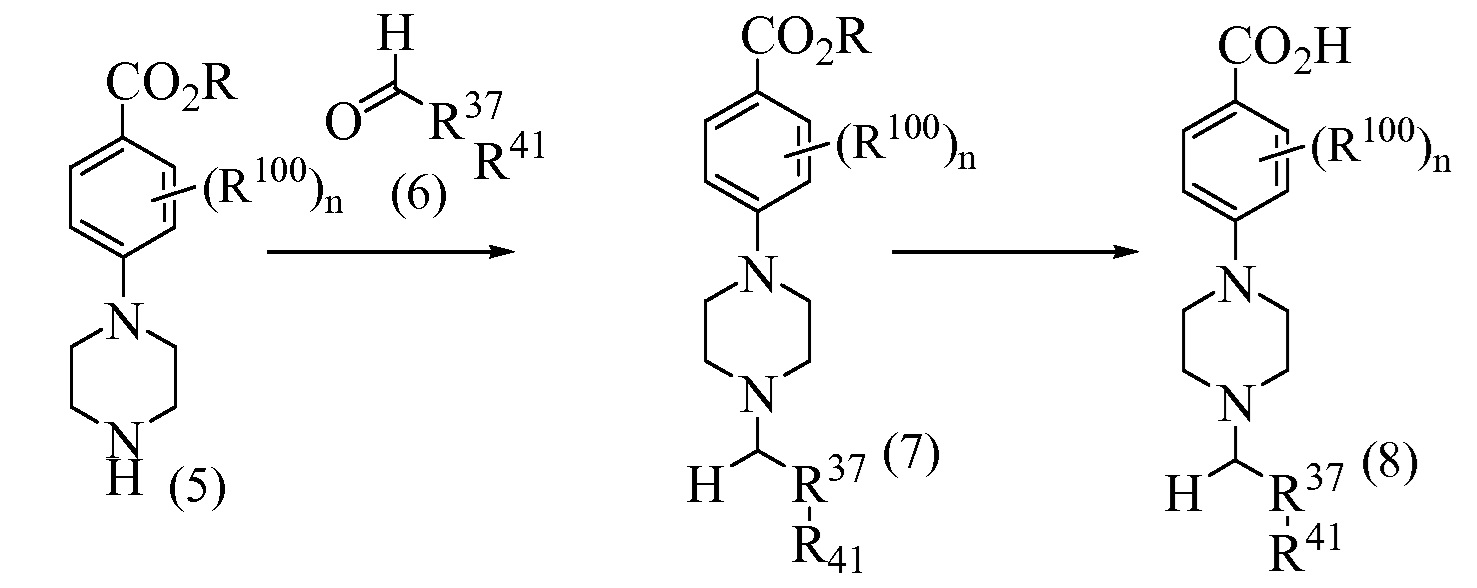
Как показано на схеме 2, соединения формулы (5) можно ввести во взаимодействие с соединениями формулы (6) и восстановителем, получая соединения формулы (7). Примеры восстановителей включают боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия, цианоборгидрид на полимерном носителе и т.п. Данную реакцию обычно проводят в растворителе, таком как метанол, тетрагидрофуран и хлористый метилен или их смесях, но не ограничиваясь ими. Соединения формулы (8) можно получить из соединений формулы (7), как показано на схеме 1, и можно использовать, как описано на схеме 7, для получения соединений формулы (I).
Схема 3
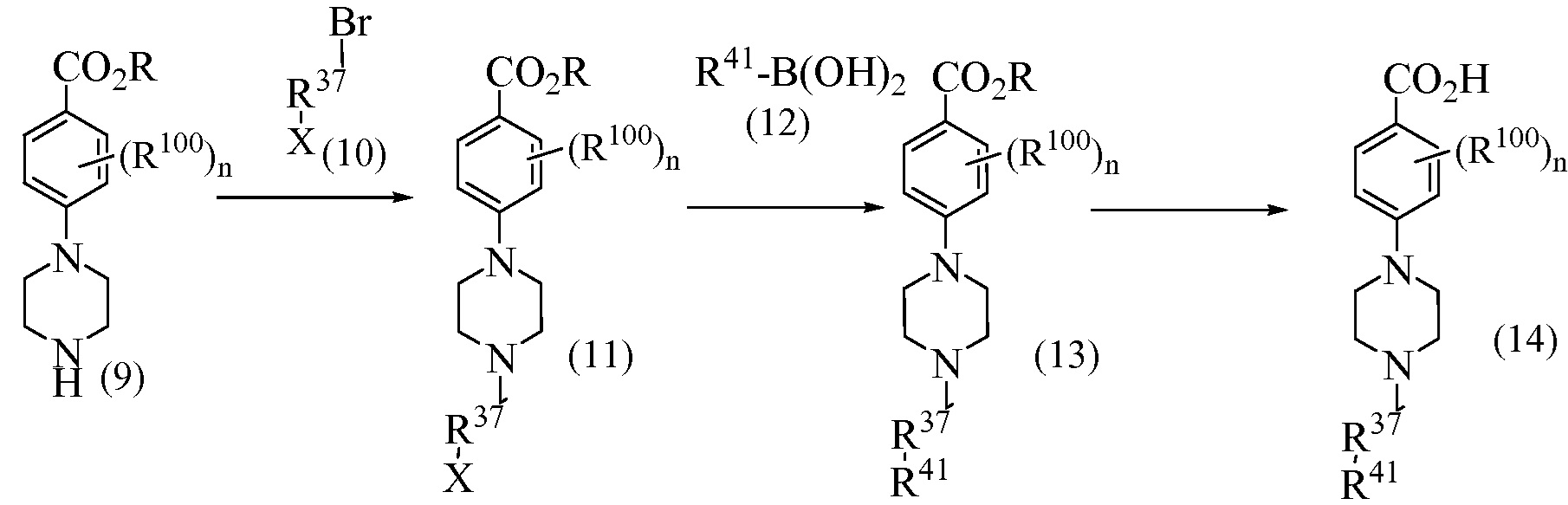
Взаимодействие соединений формулы (9) с соединением формулы (10), в котором Х представляет собой галогенид или трифлат, и основанием, приведет к соединению формулы (11). Основания, применимые в данной реакции, включают триэтиламин, диизопропилэтиламин и т.п. Соединения формулы (13), в которых R41 аналогичен описанному в настоящем описании для заместителей при R37, можно получить из соединений формулы (11) и соединений формулы (12) с использованием условий сочетания Сузуки, которые известны специалистам в данной области и легко доступны из литературы. Соединения формулы (14) можно получить из соединений формулы (13), как описано на схеме 1, и можно использовать, как описано на схеме 7, для получения соединений формулы (I).
Схема 4
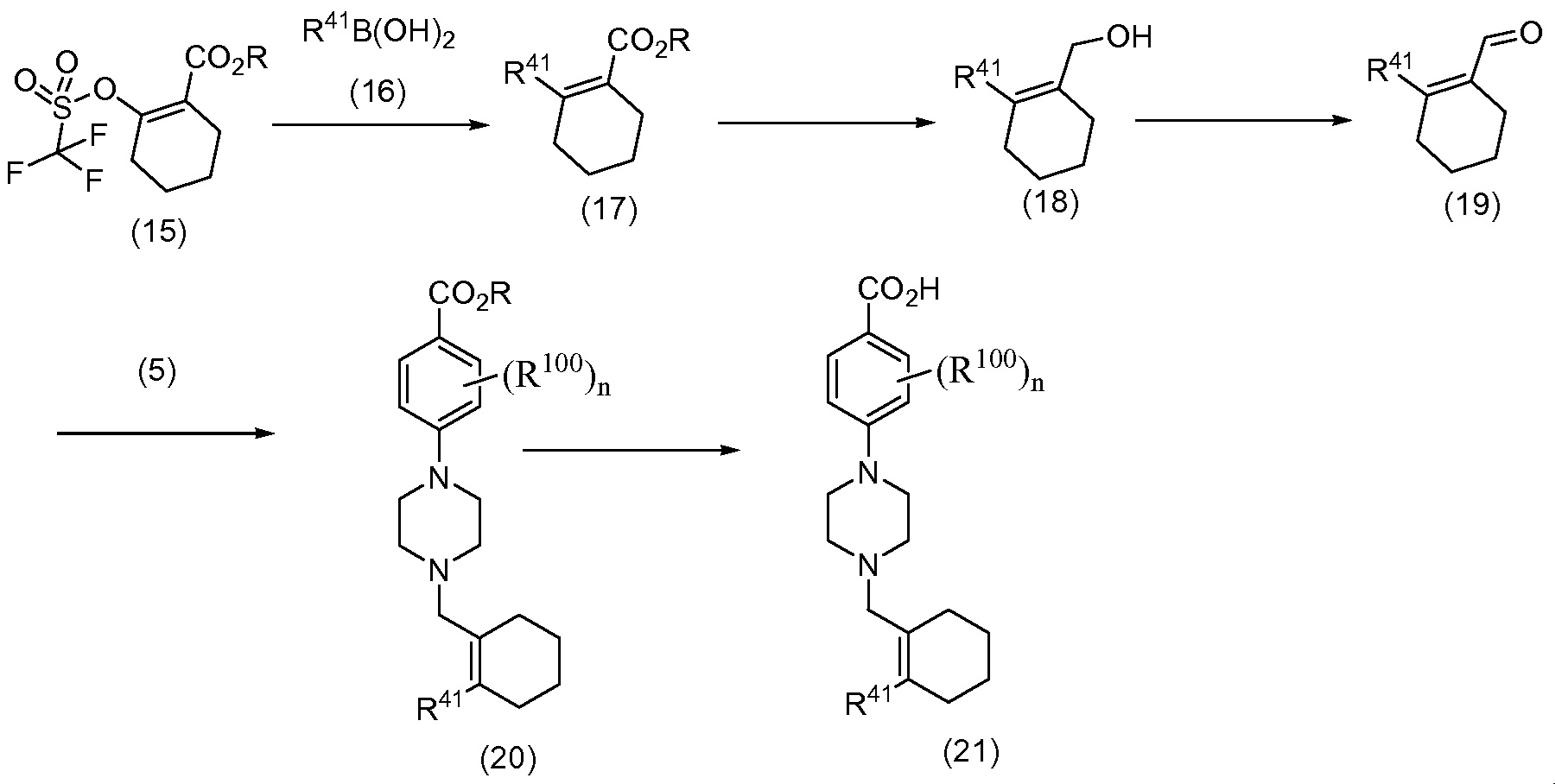
Как показано на схеме 4, соединения формулы (17) можно получить из соединений формулы (15) и соединений формулы (16), в которых R представляет собой алкил, а R41 описан в настоящем описании, с использованием условий сочетания по Сузуки, которые известны специалистам в данной области и легко доступны из литературы. Соединения формулы (17) можно восстановить до соединений формулы (18) с использованием восстановителя, такого как LiAlH4, в растворителе, таком как диэтиловый эфир или ТГФ, но не ограничиваясь ими. Соединения формулы (19) можно получить из соединений формулы (18) с использованием перйодинана Десс-Мартина или условий окисления по Сверну, которые известны специалистам в данной области и легко доступны из литературы. Соединения формулы (19) можно ввести во взаимодействие с соединением формулы (5) и восстановителем, получая соединения формулы (20). Примеры восстановителей включают боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия, цианоборгидрид на полимерном носителе и т.п. Данную реакцию обычно проводят в растворителе, таком как метанол, тетрагидрофуран, 1,2-дихлорэтан и хлористый метилен, или их смесях, но не ограничиваясь ими. Соединения формулы (21) можно получить из соединений формулы (20), как показано на схеме 1, и можно использовать, как описано на схеме 7, для получения соединений формулы (I).
Схема 5
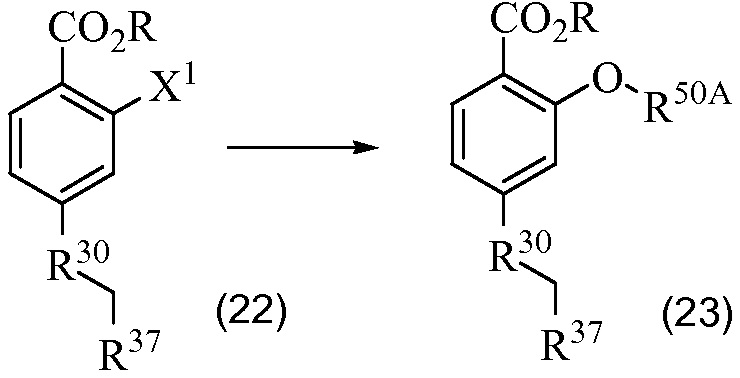
Как показано на схеме 5, соединения формулы (22), в которых R представляет собой алкил, можно превратить в соединения формулы (23), вводя во взаимодействие первые, в которых X1представляет собой Cl, Br, I или CF3SO3-, с соединениями формулы R50A-ОН и катализатор, в присутствии или в отсутствие первого основания. Примеры катализаторов включают комплекс трифторметансульфоната меди(I) с толуолом, PdCl2, Pd(OAc)2 и Pd2(dba)3. Примеры первого основания включают триэтиламин, N,N-диизопропилэтиламин, Cs2CO3, Na2CO3, K3PO4 и их смеси.
Соединения формулы (22) можно также превратить в соединения формулы (23), вводя во взаимодействие первые, в которых X1представляет собой Cl, F или NO2, с соединениями формулы R50A-ОН, в присутствии первого основания. Примеры первого основания включают триэтиламин, N,N-диизопропилэтиламин, Cs2CO3, Na2CO3, K3PO4 и их смеси.
Схема 6

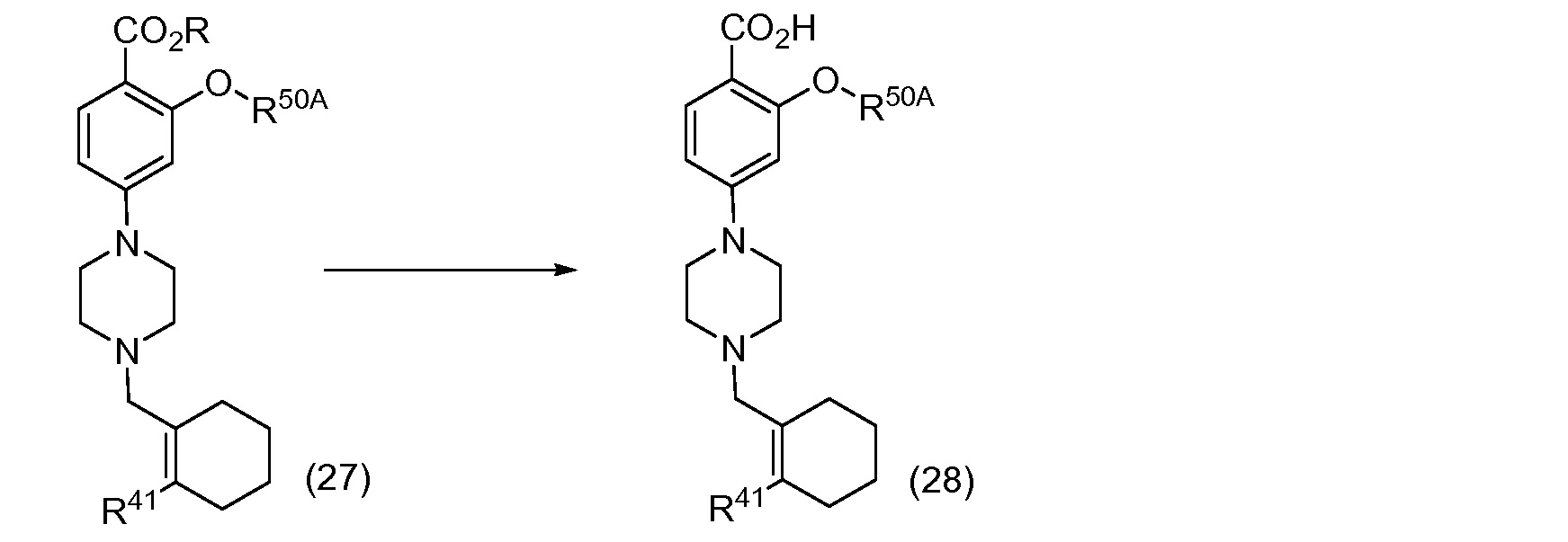
Соединения формулы (18) можно ввести во взаимодействие с мезилхлоридом и основанием, таким как триэтиламин, но не ограничиваясь им, затем с N-трет-бутоксикарбонилпиперазином, получая соединения формулы (24). Соединения формулы (25) можно получить, вводя во взаимодействие соединения формулы (24) с триэтилсиланом и трифторуксусной кислотой. Соединения формулы (25) можно ввести во взаимодействие с соединениями формулы (26) и НК2РО4, получая соединения формулы (27), в растворителе, таком как диметилсульфоксид, но не ограничиваясь им. Соединения формулы (28) можно получить из соединений формулы (27), как показано на схеме 1, и можно использовать, как описано на схеме 7, для получения соединений формулы (I).
Схема 7
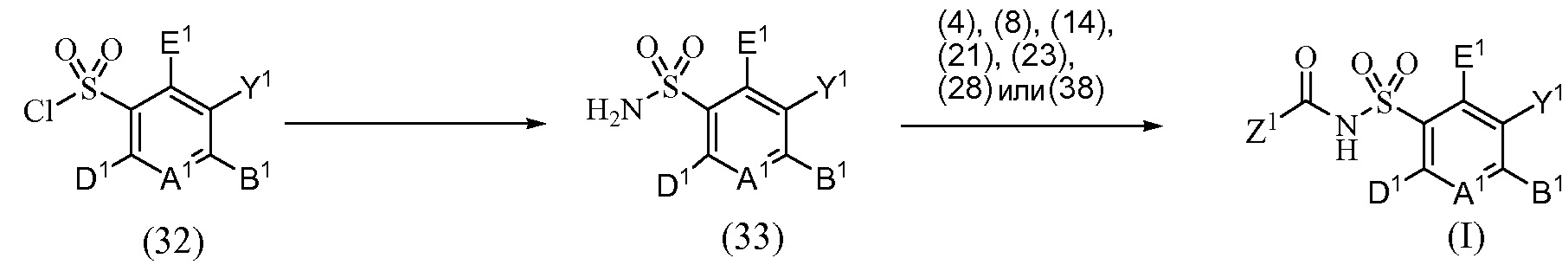
Как показано на схеме 7, соединения формулы (32), которые можно получить, как описано в настоящем описании, можно превратить в соединения формулы (33), вводя во взаимодействие первые с аммиаком. Соединения формулы (33) можно превратить в соединения формулы (I), вводя во взаимодействие первые с соединениями формулы (4), (8), (14), (21), (23), (28) или (38) и агентом сочетания, в присутствии или в отсутствие первого основания. Примеры агентов сочетания включают гидрохлорид 1-этил-3-[3-(диметиламино)пропил]карбодиимида, 1,1’-карбонилдиимидазол и гексафторфосфат бензотриазол-1-илокситрипирролидинфосфония. Примеры первого основания включают триэтиламин, N,N-диизопропилэтиламин, 4-(диметиламино)пиридин и их смеси.
Схема 8

Соединения формулы (33), полученные, как показано на схеме 7, можно также превратить в соединения формулы (I), вводя во взаимодействие первые с соединениями формулы (34) и первым основанием. Примеры первого основания включают гидрид натрия, триэтиламин, N,N-диизопропилэтиламин, 4-(диметиламино)пиридин и их смеси, но не ограничиваются ими.
Схема 9
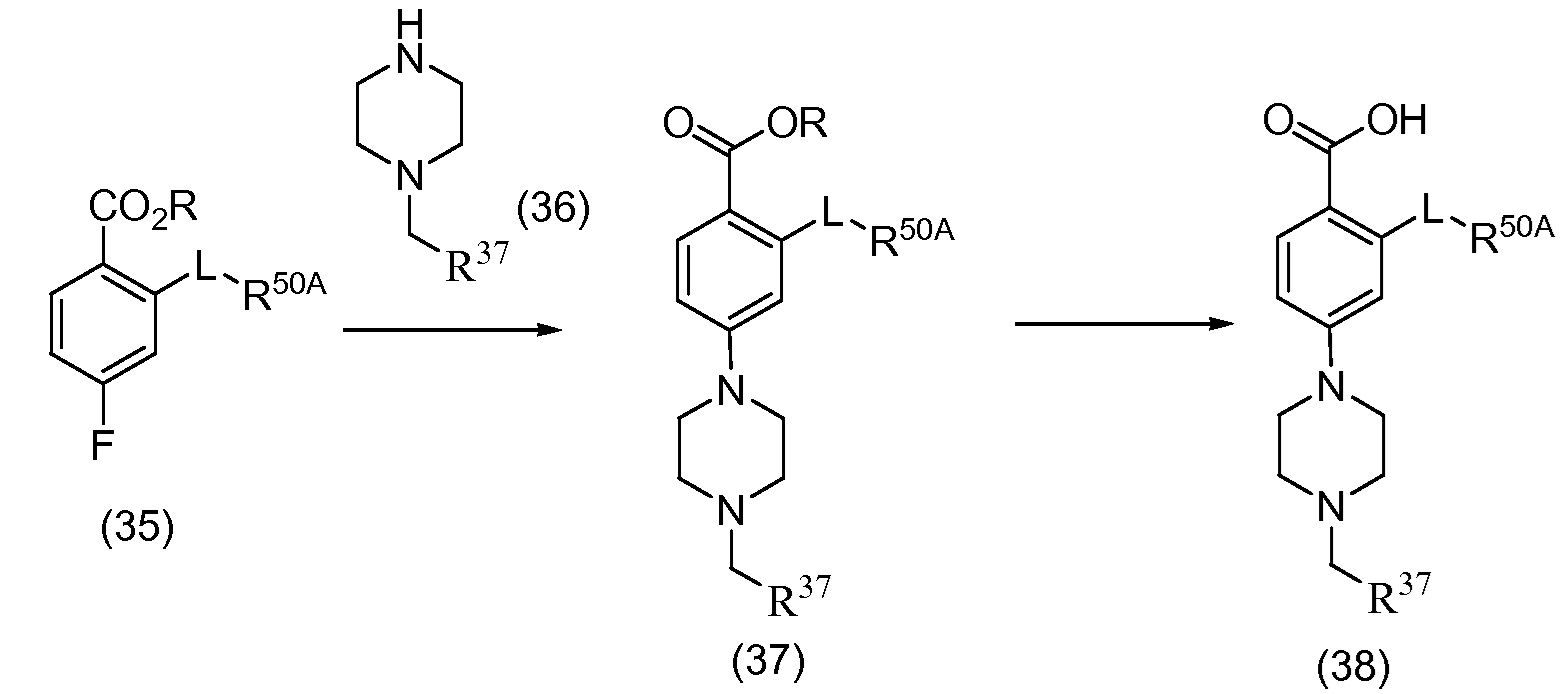
Как показано на схеме 9, соединения формулы (35), в которых L представляет собой связь, алкил, О, S, S(O), S(O)2, NH и т.п., можно ввести во взаимодействие с соединениями формулы (36), получая соединения формулы (37). Данную реакцию обычно осуществляют при повышенной температуре в растворителе, таком как диметилсульфоксид, но не ограничиваясь им, и может потребоваться использование основания, такого как фосфат калия, карбонат калия и т.п., но не ограничиваясь ими. Соединения формулы (38) можно получить из соединений формулы (37), как показано на схеме 1, и можно использовать, как описано на схеме 7, для получения соединений формулы (I).
Схема 10
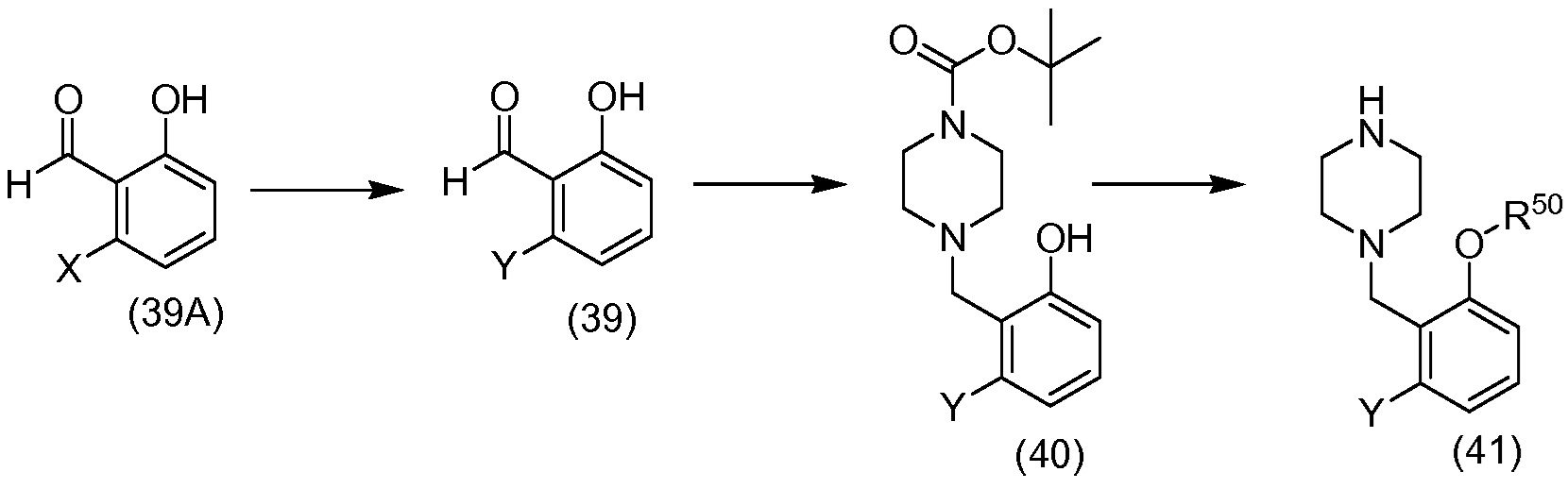
Соединения формулы (39), в которых Y аналогичен описанному в настоящем описании для заместителей при R37, можно получить из соединений формулы (39А), в которых Х представляет собой галогенид или трифлат, и Y-B(OH)2 с использованием условий сочетания по Сузуки, которые известны специалистам в данной области и легко доступны из литературы. Соединения формулы (39) можно ввести во взаимодействие с трет-бутил пиперазин-1-карбоксилатом и восстановителем, таким как триацетоксиборгидрид натрия, получая соединения формулы (40). Данную реакцию обычно проводят в растворителе, таком как метиленхлорид, но не ограничиваясь им. Соединения формулы (41) можно получить из соединений формулы (40), вводя во взаимодействие последние с R50X, где Х представляет собой галогенид, и NaH в растворителе, таком как N,N-диметилформамид, а затем полученное вещество можно обработать триэтилсиланом и трифторуксусной кислотой в хлористом метилене. Соединения формулы (41) можно использовать, как показано на схеме 9, где CH2R37 аналогичен показанному в формуле (41).
Схема 11

Как показано на схеме 11, замещенные пиперазин-2-оны, в которых R50представляет собой алкил, можно ввести во взаимодействие с соединениями формулы (6а) и восстановителем, таким как триацетоксиборгидрид натрия, в хлористом метилене, получая соединения формулы (42). Соединения формулы (42) можно восстановить в соединения формулы (43) при помощи восстановителя, такого как алюмогидрид лития, но не ограничиваясь им, в растворителе, таком как тетрагидрофуран, но не ограничиваясь им. Соединения формулы (43) можно использовать, как показано на схеме 9, где CH2R37 аналогичен показанному в формуле (43).
Следующие примеры даны для предоставления того, что, как предполагается, представляет собой наиболее применимое и легко понятное описание методик и концептуальных аспектов данного изобретения. Приведенные в качестве примеров соединения называли с использованием ACD/ChemSketch версии 5.06 (05 июня 2001, Advanced Chemistry Development Inc., Toronto, Ontario) или ChemDraw® вер. 9.0.5 (CambridgeSoft, Cambridge, MA). Промежуточные соединения называли с использованием ChemDraw® вер. 9.0.5 (CambridgeSoft, Cambridge, MA).
Пример 1
4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 1А
Трет-бутил 4-((4’-хлордифенил-2-ил)метил)пиперазин-1-карбоксилат
4’-Хлордифенил-2-карбальдегид (пример 27С) (4,1 г), трет-бутил пиперазин-1-карбоксилат (4,23 г) и триацетоксиборгидрид натрия (5,61 г) в CH2Cl2 (60 мл) соединяли при перемешивании в течение 24 часов. Реакционную смесь гасили метанолом и выливали в простой эфир. Раствор промывали водой и насыщенным раствором соли, концентрировали и хроматографировали на силикагеле с использованием 2-25% смеси этилацетат/гексаны.
Пример 1В
1-((4’-Хлордифенил-2-ил)метил)пиперазин
Соединение примера 1А (3,0 г) и триэтилсилан (1 мл) перемешивали в CH2Cl2 (30 мл) и трифторуксусной кислоте (30 мл) в течение 2 часов, и реакционную смесь концентрировали, а затем растворяли в эфире и снова концентрировали. Продукт использовали без дополнительной очистки.
Пример 1С
Метил 4-фтор-2-феноксибензоат
Метил 2-бром-4-фторбензоат (1 г), фенол (0,565 г), карбонат цезия (1,96 г), комплекс трифлата меди(I) с толуолом и этилацетат (0,034 мл) в толуоле (12 мл) перемешивали при 110°С в течение 24 часов. Реакционную смесь охлаждали и хроматографировали на силикагеле с использованием 5% смеси этилацетат/гексаны.
Пример 1D
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение примера 1С (630 мг), соединение примера 1В и К2СО3 (707 мг) перемешивали в диметилсульфоксиде при 125°С в течение 5 часов. Реакционную смесь охлаждали и хроматографировали на силикагеле с использованием 10% смеси этилацетат/гексаны.
Пример 1Е
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение примера 1D (600 мг) перемешивали в 25 мл смеси 2:1 диоксан/1М NaOH при 60°С в течение 24 часов. Раствор охлаждали и доводили до рН 4 действием раствора NaH2PO4 и концентрированной HCl, и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и сушили (Na2SO4), фильтровали и концентрировали.
Пример 1F
3-Нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)бензолсульфонамид
4-Фтор-3-нитробензолсульфонамид (2,18 г), (тетрагидропиран-4-ил)метиламин (1,14 г) и триэтиламин (1 г) перемешивали в тетрагидрофуране (30 мл) в течение 24 часов. Раствор разбавляли этилацетатом, промывали раствором NaH2PO4 и насыщенным раствором соли и сушили (Na2SO4), фильтровали и концентрировали. Продукт растирали с этилацетатом.
Пример 1G
4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение примера 1Е (90 мг), соединение примера 1F (45 мг), гидрохлорид 1-этил-3-[3-(диметиламино)пропил]карбодиимида (65 мг) и 4-диметиламинопиридин (22 мг) перемешивали в CH2Cl2 (4 мл) в течение 24 часов. Реакционную смесь охлаждали и хроматографировали на силикагеле с использованием 20-100% смеси этилацетат/гексаны.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,55 (уш.с, 1H), 8,63 (т, 1H), 8,47 (д, 1H), 7,75 (д, 1H), 7,46 (м, 6H), 7,35 (м, 2H), 7,24 (м, 3H), 7,15 (д, 1H), 6,99 (дд, 1H), 6,82 (д, 2H), 6,75 (д, 1H), 6,38 (д, 1H), 3,86 (уш.д, 2H), 3,49 (м, 2H), 3,37 (уш.с, 2H), 3,15 (уш.с, 4H), 2,34 (уш.с, 4H), 1,91 (уш.с, 4H), 1,64 (уш.д, 2H), 1,29 (м, 3H).
Пример 2
4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 2А
4-((Тетрагидро-2Н-пиран-4-ил)метиламино)бензолсульфонамид
4-Аминобензолсульфонамид (6,80 г), тетрагидропиран-4-карбоксальдегид (4,96 г) и триацетоксиборгидрид натрия (16,74 г) в тетрагидрофуране (300 мл) и уксусной кислоте (15 мл) перемешивали в течение 24 часов. Реакционную смесь концентрировали и растворяли в этилацетате. Полученный раствор промывали водой и насыщенным раствором соли, концентрировали и хроматографировали на силикагеле с использованием 50% смеси этилацетат/гексаны.
Пример 2В
4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 2А в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6/D2O) δ 7,54 (д, 1H), 7,46 (м, 8H), 7,36 (м, 4H), 7,24 (д, 1H), 7,13 (дд, 1H), 6,93 (д, 2H), 6,75 (д, 1H), 6,55 (д, 2H), 6,30 (д, 1H), 3,86 (дд, 2H), 3,36 (с, 2H), 3,28 (т, 2H), 3,10 (уш.с, 4H), 2,96 (д, 2H), 2,32 (уш.с, 4H), 1,76 (м, 1H), 1,64 (д, 2H), 1,20 (м, 2H).
Пример 3
2-(Бензилокси)-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 3А
Метил 2-(бензилокси)-4-фторбензоат
Метил 4-фтор-2-гидроксибензоат (2,00 г), бензилбромид (1,54 мл) и карбонат цезия (4,60 г) в N,N-диметилформамиде (50 мл) перемешивали в течение 24 часов. Реакционную смесь растворяли в простом эфире и промывали 3× 1М раствором NaOH и насыщенным раствором соли, затем концентрировали, получая чистый продукт.
Пример 3В
Метил 2-(бензилокси)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 3А в примере 1D.
Пример 3С
2-(Бензилокси)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 3В в примере 1E.
Пример 3D
2-(Бензилокси)-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 3C в примере 1G.
1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,90 (уш.с, 1H), 8,66 (м, 1H), 8,59 (с, 1H), 7,82 (д, 1H), 7,33-7,55 (м, 12H), 7,18-7,27 (м, 3H), 6,61 (с, 1H), 6,56 (д, 1H), 5,22 (с, 2H), 3,86 (уш.д, 2H), 3,40 (м, 2H), 3,31 (м, 8H), 2,34 (уш.с, 4H), 1,91 (уш.с, 2H), 1,64 (уш.д, 2H), 1,29 (м, 3H).
Пример 4
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(2-фенилэтокси)бензамид
Пример 4А
Метил 4-фтор-2-фенэтоксибензоат
Метил 4-фтор-2-гидроксибензоат (1,00 г) и фенетиловый спирт (0,64 мл) прибавляли к трифенилфосфину (1,54 г) и диизопропилазодикарбоксилату (1,04 мл) в тетрагидрофуране (20 мл) при 0°С, и перемешивали реакционную смесь при комнатной температуре в течение 24 часов. Смесь хроматографировали на силикагеле с использованием 5% смеси этилацетат/гексаны.
Пример 4В
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-фенетоксибензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 4А в примере 1D.
Пример 4С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-фенетоксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 4В в примере 1E.
Пример 4D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(2-фенилэтокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 4C в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,75 (уш.с, 1H), 8,66 (м, 2H), 7,91 (д, 1H), 7,47 (м, 6H), 7,20-7,40 (м, 8H), 6,53 (д, 1H), 6,47 (с, 1H), 4,35 (т, 2H), 4,03 (м, 1H), 3,85 (уш.д, 2H), 3,38 (с, 2H), 3,25 (м, 8H), 3,13 (т, 2H), 2,36 (уш.с, 4H), 2,21 (уш.с, 2H), 1,62 (уш.д, 2H), 1,20 (м, 2H), 1,17 (м, 1H).
Пример 5
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(фенилтио)бензамид
Пример 5А
Метил 4-фтор-2-(фенилтио)бензоат
5-Фтор-2-(метоксикарбонил)фенидороновую кислоту (1,00 г), 2-(фенилтио)изоиндолин-1,3-дион (0,86 г) и (2-гидрокси-3,5-диизопропилбензоилокси)медь (0,29 г) перемешивали в диоксане (15 мл) при 50°С в течение 24 часов. Реакционную смесь хроматографировали на силикагеле с использованием 5% смеси этилацетат/гексаны.
Пример 5В
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(фенилтио)бензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 5А в примере 1D.
Пример 5С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(фенилтио)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 5В в примере 1E.
Пример 5D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(фенилтио)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 5C в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,95 (уш.с, 1H), 8,59 (м, 2H), 7,93 (д, 1H), 7,63 (д, 1H), 7,15-7,50 (м, 14H), 6,73 (д, 1H), 6,18 (с, 1H), 3,82 (дд, 2H), 3,36 (м, 4H), 3,32 (м, 2H), 2,94 (уш.с, 4H), 2,30 (уш.с, 4H), 1,64 (м, 1H), 1,61 (м, 2H), 1,25 (м, 2H).
Пример 6
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(фенилтио)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 5C и соединение примера 1F соединением примера 2A в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6/D2O) δ 7,65 (д, 2H), 7,55 (д, 1H), 7,33-7,48 (м, 12H), 7,24 (м, 2H), 6,73 (д, 1H), 6,66 (д, 2H), 6,17 (д, 1H), 3,85 (дд, 2H), 3,34 (с, 2H), 3,26 (т, 2H), 2,98 (д, 2H), 2,92 (уш.с, 4H), 2,25 (уш.с, 4H), 1,78 (м, 1H), 1,63 (д, 2H), 1,20 (м, 2H).
Пример 7
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(фенилтио)бензамид
Пример 7А
4-(3-Морфолинпропиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 3-(N-морфолинил)-1-пропиламином в примере 1F.
Пример 7В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(фенилтио)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 5C и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,20 (уш.с, 1H), 8,69 (м, 1H), 8,57 (д, 1H), 7,95 (дд, 2H), 7,71 (м, 1H), 7,31-7,51 (м, 10H), 7,12-7,26 (м, 3H), 6,68 (дд, 1H), 6,07 (м, 1H), 4,06 (с, 2H), 3,68 (м, 4H), 3,50 (м, 2H), 3,32 (м, 6H), 2,88 (м, 4H), 2,27 (м, 4H), 1,91 (м, 2H).
Пример 8
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(фенилсульфонил)бензамид
Пример 8А
Метил 4-фтор-2-(фенилсульфонил)бензоат
Соединение примера 5А (0,30 г) и KMnO4 (1,80 г) перемешивали в уксусной кислоте (40 мл) при 60°С в течение 24 часов. Реакционную смесь фильтровали через слой силикагеля, концентрировали и хроматографировали на силикагеле с использованием 50% смеси этилацетат/гексаны.
Пример 8В
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(фенилсульфонил)бензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 8А в примере 1D.
Пример 8С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(фенилсульфонил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 8В в примере 1E.
Пример 8D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(фенилсульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 8C в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,95 (уш.с, 1H), 8,54 (с, 1H), 8,41 (дд, 1H), 7,90 (м, 2H), 7,82 (д, 1H), 7,76 (д, 1H), 7,66 (м, 1H), 7,46 (м, 5H), 7,40 (м, 4H), 7,11 (м, 2H), 6,67 (дд, 1H), 6,62 (м, 1H), 4,36 (м, 1H), 3,82 (дд, 2H), 3,39 (м, 6H), 3,19 (м, 6H), 2,37 (уш.с, 4H), 1,91 (м, 1H), 1,63 (м, 2H), 1,26 (м, 2H).
Пример 9
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(фенилсульфинил)бензамид
Пример 9А
Метил 4-фтор-2-(фенилсульфинил)бензоат
OXONE® (Dupont) (5,60 г) прибавляли порциями в течение 1 часа к соединению примера 5А (1,00 г) в смеси уксусной кислоты (30 мл), воды (30 мл) и CH2Cl2 (20 мл) и перемешивали реакционную смесь еще в течение 1 часа. Реакционную смесь растворяли в этилацетате, промывали раствором Na2S2O3, водой и насыщенным раствором соли, концентрировали и хроматографировали на силикагеле с использованием 5-25% смеси этилацетат/гексаны.
Пример 9В
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(фенилсульфинил)бензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 9А в примере 1D.
Пример 9С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(фенилсульфинил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 9В в примере 1E.
Пример 9D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(фенилсульфинил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 9C в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6/D2O) δ 8,51 (с, 1H), 7,85 (дд, 2H), 7,64 (д, 2H), 7,48 (м, 8H), 7,32 (м, 1H), 7,23 (м, 1H), 7,14 (м, 4H), 6,97 (д, 1H), 3,85 (дд, 2H), 3,35 (д, 2H), 3,34 (м, 6H), 3,27 (т, 2H), 2,74 (уш.с, 4H), 1,93 (м, 1H), 1,64 (д, 2H), 1,28 (м, 2H).
Пример 10
2-Бензил-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 10А
Метил 2-бензил-4-фторбензоат
5-Фтор-2-(метоксикарбонил)фенилбороновую кислоту (1,00 г), бензилбромид (0,50 мл), К2СО3 (1,75 г) и [1,1’-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (PdCl2(dppf)) (0,17 г) перемешивали в тетрагидрофуране (20 мл) при 60°С в течение 24 часов. Реакционную смесь хроматографировали на силикагеле с использованием 2% смеси этилацетат/гексаны.
Пример 10В
Метил 2-бензил-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 10А в примере 1D.
Пример 10С
2-Бензил-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 10В в примере 1E.
Пример 10D
2-Бензил-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 10C в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6/D2O) δ 8,55 (д, 1H), 7,90 (д, 1H), 7,38-7,56 (м, 10H), 7,25 (м, 2H), 6,96 (д, 2H), 6,83 (с, 2H), 6,75 (д, 1H), 4,06 (с, 2H), 3,85 (дд, 2H), 3,48 (с, 2H), 3,37 (д, 2H), 3,25 (т, 2H), 3,20 (уш.с, 4H), 2,44 (уш.с, 4H), 1,91 (м, 1H), 1,63 (д, 2H), 1,29 (м, 2H).
Пример 11
2-Бензил-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 10C и соединение примера 1F соединением примера 2A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,70 (уш.с, 1H), 7,48 (м, 6H), 6,88 (м, 6H), 6,62 (м, 6H), 6,42 (дд, 2H), 3,83 (дд, 4H), 3,24 (м, 6H), 2,96 (м, 4H), 1,82 (м, 2H), 1,63 (м, 3H), 1,18 (м, 4H).
Пример 12
2-Бензил-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 10C и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,90 (уш.с, 1H), 8,80 (м, 1H), 8,54 (д, 1H), 7,91 (дд, 1H), 7,48 (м, 7H), 7,40 (д, 2H), 7,26 (д, 2H), 6,97 (дд, 2H), 6,86 (м, 2H), 6,76 (д, 1H), 4,04 (м, 5H), 3,72 (м, 4H), 3,56 (м, 2H), 3,40 (м, 8H), 3,21 (м, 4H), 2,34 (м, 2H), 1,98 (м, 2H).
Пример 13
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(2-фенилэтил)бензамид
Пример 13А
Метил 4-фтор-2-фенетилбензоат
Метил 2-бром-4-фторбензоат (1,00 г), (Е)-стирилбороновую кислоту (0,89 г), тетракис(трифенилфосфин)палладий(0) (0,50 г) и К2РО4 (2,28 г) перемешивали в диоксане (17 мл) при 90°С в течение 24 часов. Реакционную смесь хроматографировали на силикагеле с использованием 1-5% смеси этилацетат/гексаны. Продукт в метаноле (10 мл) прибавляли к 20% масс. Свежевысушенного 5% Pd-C и перемешивали 4 дня в присутствии Н2 в сосуде для работы под давлением. Смесь фильтровали через нейлоновую мембрану и концентрировали.
Пример 13В
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-фенетилбензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 13А в примере 1D.
Пример 13С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-фенетилбензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 13В в примере 1E.
Пример 13D
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)-2-фенетилбензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 13C в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6/D2O) δ 8,62 (д, 1H), 7,95 (д, 1H), 7,91 (м, 1H), 7,35-7,52 (м, 6H), 7,19 (м, 2H), 7,13 (м, 2H), 6,99 (м, 4H), 6,83 (д, 1H), 6,70 (д, 1H), 6,65 (с, 1H), 3,80 (м, 2H), 3,24 (м, 2H), 3,18 (т, 2H), 3,11 (уш.с, 4H), 2,91 (т, 2H), 2,48 (м, 2H), 2,38 (уш.с, 4H), 1,81 (м, 1H), 1,54 (д, 2H), 1,23 (м, 2H).
Пример 14
2-(Бензиламино)-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 14А
Метил 2-(бензиламино)-4-фторбензоат
Метил 2-амино-4-фторбензоат (0,90 г), бензальдегид (0,54 мл), триацетоксиборгидрид натрия (1,58 г) и уксусную кислоту (0,3 мл) в CH2Cl2 (20 мл) перемешивали в течение 3 часов. Реакционную смесь гасили метанолом, концентрировали и хроматографировали на силикагеле с использованием 5% смеси этилацетат/гексаны.
Пример 14В
Метил 2-(бензиламино)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 14А в примере 1D.
Пример 14С
2-(Бензиламино)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 14В в примере 1E.
Пример 14D
2-(Бензиламино)-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 14C в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6/D2O) δ 8,58 (д, 1H), 7,92 (д, 1H), 7,87 (м, 1H), 7,59 (д, 2H), 7,48 (м, 2H), 7,43 (м, 4H), 7,20-7,29 (м, 8H), 6,15 (д, 1H), 4,32 (с, 2H), 3,85 (м, 2H), 3,49 (м, 2H), 3,33 (м, 2H), 3,26 (т, 2H), 3,12 (уш.с, 4H), 2,39 (уш.с, 4H), 1,90 (м, 1H), 1,62 (д, 2H), 1,27 (м, 2H).
Пример 15
2-Анилино-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 15А
Метил 4-фтор-2-(фениламино)бензоат
Метил 2-бром-4-фторбензоат (1,00 г), анилин (0,47 мл), ацетат палладия(II) (0,048 г), 2,2’-бис(дифенилфосфино)-1,1’-динафтил (0,214 г) и Cs2CO3 (2,08 г) в толуоле (12 мл) перемешивали при 90°С в течение 24 часов. Реакционную смесь концентрировали и хроматографировали на силикагеле с использованием 5-50% смеси этилацетат/гексаны.
Пример 15В
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(фениламино)бензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 15А в примере 1D.
Пример 15С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(фениламино)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 15В в примере 1E.
Пример 15D
2-Анилино-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 15C в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,55 (уш.с, 1H), 8,56 (м, 2H), 7,92 (д, 1H), 7,72 (д, 1H), 7,47 (м, 6H), 7,25 (м, 4H), 7,12 (д, 2H), 6,95 (м, 2H), 6,53 (с, 1H), 6,38 (дд, 1H), 3,81 (дд, 2H), 3,37 (уш.с, 4H), 3,12 (уш.с, 4H), 2,41 (уш.с, 4H), 1,91 (м, 1H), 1,61 (уш.д, 2H), 1,23 (м, 4H).
Пример 16
2-Анилино-4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 15C и соединение примера 1F соединением примера 2A в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6/D2O) δ 7,78 (д, 1H), 7,52 (д, 2H), 7,47 (м, 6H), 7,36 (м, 3H), 7,27 (м, 3H), 7,11 (м, 2H), 6,90 (м, 1H), 6,61 (с, 1H), 6,53 (д, 1H), 6,31 (д, 1H), 4,46 (с, 1H), 3,82 (м, 2H), 3,37 (с, 2H), 3,26 (т, 2H), 3,05 (уш.с, 4H), 2,93 (д, 2H), 2,37 (уш.с, 4H), 1,77 (м, 1H), 1,63 (д, 2H), 1,20 (м, 2H).
Пример 17
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-метокси-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 17А
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-метоксибензоат
Метил 4-бром-2-метоксибензойную кислоту (700 мг), соединение примера 1В (983 мг), K3PO4 (909 мг), трис(дибензилиденацетон)дипалладий(0) (78 мг) и 2-(ди-трет-бутилфосфино)дифенил (102 мг) перемешивали в 1,2-диметоксиэтане (10 мл) при 80°С в течение 24 часов. Реакционную смесь хроматографировали на силикагеле с использованием 20-50% смеси этилацетат/гексаны.
Пример 17В
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-метоксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 17А в примере 1E.
Пример 17С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-метокси-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 17В в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,81 (уш.с, 1H), 8,64 (м, 2H), 7,96 (д, 1H), 7,20-7,54 (м, 10H), 6,52 (д, 1H), 6,46 (с, 1H), 3,90 (с, 3H), 3,40 (м, 4H), 3,27 (уш.с, 4H), 2,39 (уш.с, 4H), 1,91 (м, 1H), 1,62 (уш.д, 2H), 1,27 (м, 4H).
Пример 18
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Пример 18А
Метил 4,4-диметил-2-(трифторметилсульфонилокси)циклогекс-1-енкарбоксилат
К суспензии промытого гексаном NaH (17 г) в хлористом метилене (700 мл) прибавляли по каплям 5,5-диметил-2-метоксикарбонилциклогексанон (38,5 г) при 0°С. После перемешивания в течение 30 минут смесь охлаждали до -78°С и прибавляли ангидрид трифторметансульфокислоты (40 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 24 часов. Органический слой промывали насыщенным раствором соли, сушили и концентрировали, получая продукт.
Пример 18В
Метил 2-(4-хлорфенил)-4,4-диметилциклогекс-1-енкарбоксилат
Соединение примера 18А (62,15 г), 4-хлорфенилбороновую кислоту (32,24 г), CsF (64 г) и тетракис(трифенилфосфин)палладий(0) (2 г) в смеси 2:1 1,2-диметоксиэтан/метанол (600 мл) нагревали при 70°С в течение 24 часов. Смесь концентрировали. Прибавляли эфир (4×200 мл) и фильтровали смесь. Объединенный эфирный раствор концентрировали, получая продукт.
Пример 18С
(2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)метанол
К смеси LiBH4 (13 г) медленно прибавляли соединение примера 18В (53,8 г) и простой эфир (400 мл) при помощи шприца. Смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь гасили 1N HCl при охлаждении льдом. Смесь разбавляли водой и экстрагировали эфиром (3×100 мл). Экстракты сушили и концентрировали. Сырой продукт хроматографировали на силикагеле с использованием 0-30% смеси этилацетат/гексаны.
Пример 18D
Метил 2-бром-4-(пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1В пиперазином с соединением примера 1С метил 2-бром-4-фторбензоатом в примере 1D.
Пример 18Е
Метил 2-бром-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
К соединению примера 18С (29,3 г) и триэтиламину (30 мл) в CH2Cl2 (500 мл) прибавляли при помощи шприца MsCl (7,5 мл) при 0°С и перемешивали смесь в течение 1 минуты. Прибавляли соединение примера 18D (25 г) и перемешивали реакционную смесь при комнатной температуре в течение 24 часов. Суспензию промывали насыщенным раствором соли, сушили и концентрировали. Сырой продукт хроматографировали на силикагеле с использованием 10-20% смеси этилацетат/гексаны.
Пример 18F
Метил 4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение примера 18Е (500 мг), фенол (195 мг), Cs2CO3 (674 мг), 1-нафтойную кислоту (356 мг), комплекс трифлата меди(I) с толуолом (45 мг), этилацетат (0,016 мл) и сита 4А (50 мг) в толуоле (2 мл) перемешивали при 105°С в течение 24 часов. Реакционную смесь охлаждали и растворяли в этилацетате (100 мл) и воде (40 мл). Слои разделяли и промывали органический слой 2х раствором Na2CO3 и насыщенным раствором соли, сушили и концентрировали. Сырой продукт хроматографировали на силикагеле с использованием 20% смеси этилацетат/гексаны.
Пример 18G
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 18F в примере 1E.
Пример 18Н
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 18G и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,10 (уш.с, 1H), 8,76 (м, 1H), 8,46 (д, 1H), 7,76 (дд, 1H), 7,50 (д, 1H), 7,35 (д, 2H), 7,23 (д, 2H), 7,06 (дд, 2H), 6,99 (дд, 1H), 6,81 (д, 2H), 6,74 (д, 1H), 6,34 (с, 1H), 3,62 (м, 4H), 3,46 (м, 2H), 3,13 (м, 4H), 2,76 (м, 2H), 2,48 (м, 2H), 2,22 (м, 6H), 1,97 (м, 2H), 1,82 (м, 2H), 1,40 (т, 2H), 1,06 (м, 7H), 0,94 (с, 3H).
Пример 19
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Пример 19А
Метил 5,5-диметил-2-(трифторметилсульфонилокси)циклогекс-1-енкарбоксилат
Соединение данного примера получали, заменяя 4,4-диметил-2-метоксикарбонилциклогексанон 5,5-диметил-2-метоксикарбонилциклогексаноном в примере 18А.
Пример 19В
Метил 2-(4-хлорфенил)-5,5-диметилциклогекс-1-енкарбоксилат
Соединение данного примера получали, заменяя соединение примера 18А соединением примера 19А в примере 18В.
Пример 19С
2-(4-Хлорфенил)-5,5-диметилциклогекс-1-енил)метанол
Соединение данного примера получали, заменяя соединение примера 18В соединением примера 19В в примере 18С.
Пример 19D
Метил 2-бром-4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 18С соединением примера 19С в примере 18Е.
Пример 19Е
Метил 4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 19D в примере 18F.
Пример 19F
4-(4-((2-(4-Хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 19E в примере 1E.
Пример 19G
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 19F и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,10 (уш.с, 1H), 8,71 (м, 1H), 8,42 (д, 1H), 7,73 (дд, 1H), 7,53 (д, 1H), 7,34 (д, 2H), 7,21 (дд, 2H), 7,10 (д, 2H), 6,96 (дд, 1H), 6,78 (д, 2H), 6,70 (д, 1H), 6,32 (с, 1H), 3,61 (м, 4H), 3,44 (м, 2H), 3,09 (м, 4H), 2,71 (м, 2H), 2,44 (м, 4H), 2,21 (м, 4H), 1,96 (м, 2H), 1,79 (м, 2H), 1,47 (т, 2H), 1,17 (м, 3H), 1,08 (м, 4H), 0,95 (с, 3H).
Пример 20
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 20А
Этил 2-(1Н-индазол-5-илокси)-4-фторбензоат
Этил 2,4-дифторбензоат (1,14 г), К3РО4 (1,30 г) и 5-гидроксииндазол (0,90 г) перемешивали при 110°С в диглиме (12 мл) в течение 24 часов. Раствор три раза промывали 1М раствором NaOH и насыщенным раствором соли и сушили. Затем раствор концентрировали, а сырой продукт хроматографировали на силикагеле с использованием 20% смеси этилацетат/гексаны.
Пример 20В
Трет-бутил 4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-карбоксилат
Соединение данного примера получали, заменяя соединение примера 18D N-трет-бутоксикарбонилпиперазином в примере 18Е.
Пример 20С
1-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 20В в примере 1В.
Пример 20D
Этил 2-(1Н-индазол-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение примера 20А (330 мг), соединение примера 20С (335 мг) и НК2РО4 (191 мг) перемешивали в диметилсульфоксиде (5 мл) при 140°С в течение 24 часов. Реакционную смесь разбавляли этилацетатом, три раза промывали водой, промывали насыщенным раствором соли, сушили и концентрировали. Сырой продукт хроматографировали на силикагеле с использованием 30% смеси этилацетат/гексаны.
Пример 20Е
2-(1Н-Индазол-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 20D в примере 1E.
Пример 20F
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 20E и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,03 (уш.с, 1H), 11,25 (уш.с, 1H), 8,70 (м, 1H), 8,48 (д, 1H), 7,94 (дд, 1H), 7,68 (дд, 1H), 7,52 (м, 2H), 7,34 (д, 2H), 7,06 (м, 4H), 6,96 (дд, 1H), 6,88 (д, 1H), 6,23 (с, 1H), 3,61 (м, 4H), 3,44 (м, 2H), 3,05 (м, 4H), 2,73 (м, 2H), 2,42 (м, 4H), 2,18 (м, 4H), 1,99 (м, 2H), 1,91 (д, 2H), 1,78 (м, 2H), 1,39 (т, 2H), 1,17 (м, 2H), 0,93 (с, 6H).
Пример 21
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 21А
4-(1-метилпиперидин-4-иламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 4-амино-N-метилпиперидином в примере 1F.
Пример 21В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 20E и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 12,80 (уш.с, 1H), 10,70 (уш.с, 1H), 8,34 (с, 1H), 8,02 (д, 1H), 7,87 (д, 1H), 7,70 (дд, 1H), 7,55 (м, 2H), 7,36 (д, 2H), 7,06 (м, 2H), 6,95 (м, 1H), 6,72 (д, 1H), 6,62 (д, 1H), 6,24 (с, 1H), 3,35 (м, 4H), 3,18 (м, 2H), 3,00 (м, 2H), 2,80 (м, 4H), 2,73 (м, 2H), 2,20 (м, 4H), 1,99 (м, 2H), 1,91 (с, 3H), 1,54 (м, 1H), 1,41 (т, 2H), 1,22 (м, 2H), 1,09 (с, 6H).
Пример 22
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензамид
Пример 22А
Этил 4-фтор-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензоат
Соединение данного примера получали, заменяя соединение 5-гидроксихиназол на 5-гидрокси-1,2,3,4-тетрагидрохинолин в примере 20А.
Пример 22В
Этил 4-(4-((2-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензоат
Соединение данного примера получали, заменяя соединение примера 20А соединением примера 22А в примере 20D.
Пример 22C
4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 22B в примере 1E.
Пример 22D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 22С и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,95 (уш.с, 1H), 8,83 (м, 1H), 8,60 (д, 1H), 7,90 (дд, 1H), 7,46 (д, 1H), 7,35 (д, 2H), 7,21 (дд, 2H), 7,06 (д, 2H), 6,62 (м, 2H), 6,42 (д, 1H), 6,11 (д, 1H), 5,61 (уш.с, 1H), 4,02 (м, 1H), 3,61 (м, 4H), 3,48 (м, 2H), 3,17 (м, 2H), 3,07 (м, 4H), 2,74 (м, 2H), 2,63 (м, 2H), 2,44 (м, 4H), 2,19 (м, 4H), 1,97 (м, 4H), 1,79 (м, 4H), 1,41 (т, 2H), 1,17 (м, 4H), 0,94 (с, 6H).
Пример 23
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1,2,3,4-тетрагидрохинолин-6-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 22С и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,10 (уш.с, 1H), 8,71 (м, 1H), 8,42 (д, 1H), 7,73 (дд, 1H), 7,53 (д, 1H), 7,34 (д, 2H), 7,21 (дд, 2H), 7,10 (д, 2H), 6,96 (дд, 1H), 6,78 (д, 2H), 6,70 (д, 1H), 6,32 (с, 1H), 3,61 (м, 4H), 3,44 (м, 2H), 3,09 (м, 4H), 2,71 (м, 2H), 2,44 (м, 4H), 2,21 (м, 4H), 1,96 (м, 2H), 1,79 (м, 2H), 1,47 (т, 2H), 1,17 (м, 3H), 1,08 (м, 4H), 0,95 (с, 3H).
Пример 24
4-(4-{[4’-Хлор-4-(пирролидин-1-илметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 24А
Метил 5-формил-2-(трифторметилсульфонилокси)бензоат
Ангидрид трифторметансульфокислоты (7,74 мл) прибавляли к метил 5-формил-2-гидроксибензоату (7,5 г) в 150 мл CH2Cl2 при 0°С и реакционную смесь перемешивали и оставляли нагреваться до комнатной температуры в течение 3 часов. Реакционную смесь разбавляли CH2Cl2 (150 мл), промывали 3× насыщенным раствором соли, сушили над Na2SO4 и концентрировали. Продукт использовали без дополнительной очистки.
Пример 24В
Метил 4’-хлор-4-формилдифенил-2-карбоксилат
Соединение примера 24А (14,5 г), 4-хлорфенилбороновую кислоту (6,88 г), CsF (12,2 г) и тетракис(трифенилфосфин)палладий(0) перемешивали при 70°С в течение 24 часов. Реакционную смесь охлаждали, фильтровали и концентрировали. Сырой продукт растворяли в этилацетате (250 мл), промывали 3х 1М NaOH и насыщенным раствором соли, концентрировали и хроматографировали на силикагеле с использованием 10% смеси этилацетат/гексаны.
Пример 24С
Метил 4’-хлор-4-(пирролидин-1-илметил)дифенил-2-карбоксилат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 24В и трет-бутил пиперазин-1-карбоксилат пирролидином в примере 1А.
Пример 24D
(4’-Хлор-4-(пирролидин-1-илметил)дифенил-2-ил)метанол
DIBAL в гексанах (1М, 5,9 мл) прибавляли к соединению примера 24С (650 мг) в CH2Cl2 (30 мл) при 0°С и перемешивали реакционную смесь в течение 20 минут. Реакционную смесь гасили, медленно прибавляя метанол (2 мл) и 1М NaOH (10 мл) и дважды экстрагировали полученный раствор этилацетатом. Экстракты промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали. Продукт использовали без дополнительной очистки.
Пример 24Е
4’-Хлор-4-(пирролидин-1-илметил)дифенил-2-карбальдегид
Перйодинан Десс-Мартина (1,30 г) прибавляли к соединению примера 24D (770 мг) в CH2Cl2 (30 мл) при комнатной температуре и перемешивали реакционную смесь в течение 24 часов. Реакционную смесь концентрировали и хроматографировали на силикагеле с использованием 1% триэтиламина в 25% смеси этилацетат/гексаны.
Пример 24F
Метил 2-(1Н-индол-4-илокси)-4-фторбензоат
Соединение данного примера получали, заменяя 5-гидроксииндазол 4-гидроксииндолом и этил 2,4-дифторбензоат метил 2,4-дифторбензоатом в примере 20А.
Пример 24G
Трет-бутил 4-(3-(1Н-индол-4-илокси)-4-(метоксикарбонил)фенил)пиперазин-1-карбоксилат
Соединение данного примера получали, заменяя соединение примера 20А соединением примера 24F и соединение примера 20С трет-бутил пиперазин-1-карбоксилатом в примере 20D.
Пример 24Н
Метил 2-(1Н-индол-4-илокси)-4-(пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 24G в примере 1B.
Пример 24I
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-4-(пирролидин-1-илметил)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 24Е и трет-бутил пиперазин-1-карбоксилат соединением примера 24Н в примере 1А.
Пример 24J
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-4-(пирролидин-1-илметил)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 24I в примере 1E.
Пример 24К
4-(4-{[4’-Хлор-4-(пирролидин-1-илметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 24J в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,52 (уш.с, 1H), 11,26 (с, 1H), 10,68 (уш.с, 1H), 8,61 (дд, 1H), 8,49 (с, 1H), 8,19 (уш.с, 1H), 7,66 (д, 2H), 7,54 (м, 3H), 7,36 (м, 2H), 7,28 (с, 1H), 7,24 (д, 1H), 7,05 (д, 1H), 6,95 (дд, 1H), 6,75 (д, 1H), 6,35 (м, 2H), 6,26 (с, 1H), 4,38 (м, 3H), 3,85 (дд, 2H), 3,61 (м, 4H), 3,24 (м, 4H), 3,09 (м, 4H), 2,85 (м, 2H), 2,35 (м, 2H), 2,02 (м, 2H), 1,87 (м, 4H), 1,60 (м, 2H), 1,25 (м, 2H).
Пример 25
4-(4-{[4’-Хлор-4-(2-пирролидин-1-илэтил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 25А
Метил 4’-хлор-4-(2-оксоэтил)дифенил-2-карбоксилат
К раствору (метоксиметил)дифенилфосфиноксида (1,62 г) в 40 мл тетрагидрофурана при -78°С прибавляли диизопропиламид лития (2М, 3,3 мл) и после перемешивания в течение 3 минут прибавляли соединение примера 24В (1,57 г) и нагревали раствор до комнатной температуры. Прибавляли NaH (230 мг) и 40 мл N,N-диметилформамида и нагревали смесь до 60°С в течение 1 ч. Реакционную смесь охлаждали и выливали в раствор NaH2PO4. Полученный раствор дважды экстрагировали простым эфиром, а объединенные экстракты дважды промывали водой и насыщенным раствором соли и концентрировали. Сырую смесь еноловых эфиров растворяли в 1М HCl (50 мл) и диоксане (50 мл) и перемешивали при 60°С в течение 3 часов. Реакционную смесь охлаждали и выливали в раствор NaHCO3. Полученный раствор дважды экстрагировали простым эфиром, а объединенные экстракты промывали водой и насыщенным раствором соли и концентрировали. Продукт использовали без дополнительной очистки.
Пример 25В
Метил 4’-хлор-4-(2-пирролидин-1-ил)этил)дифенил-2-карбоксилат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 25А и трет-бутил пиперазин-1-карбоксилат пирролидином в примере 1А.
Пример 25С
(4’-Хлор-4-(2-пирролидин-1-ил)этил)дифенил-2-ил)метанол
Соединение данного примера получали, заменяя соединение примера 24С соединением примера 25В в примере 24D.
Пример 25D
4’-Хлор-4-(2-пирролидин-1-ил)этил)дифенил-2-карбальдегид
Соединение данного примера получали, заменяя соединение примера 24D соединением примера 25C в примере 24E.
Пример 25Е
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-4-(2-пирролидин-1-ил)этил)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 25D и трет-бутил пиперазин-1-карбоксилат соединением примера 24H в примере 1А.
Пример 25F
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-4-(2-пирролидин-1-ил)этил)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 25Е в примере 1E.
Пример 25G
4-(4-{[4’-Хлор-4-(2-пирролидин-1-илэтил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 25F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,15 (с, 1H), 8,47 (т, 1H), 8,42 (с, 1H), 7,68 (дд, 1H), 7,58 (д, 1H), 7,44 (м, 4H), 7,22 (м, 3H), 7,10 (д, 1H), 6,92 (м, 2H), 6,68 (д, 1H), 6,34 (д, 1H), 6,26 (с, 2H), 3,87 (дд, 2H), 3,61 (м, 4H), 3,10-3,24 (м, 11H), 2,97 (м, 4H), 2,31 (м, 4H), 1,89 (м, 4H), 1,61 (м, 2H), 1,26 (м, 2H).
Пример 26
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопентилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 26А
Этил 2-(1Н-индол-5-илокси)-4-фторбензоат
Соединение данного примера получали, заменяя 5-гидроксииндазол 5-гидроксииндолом в примере 20А.
Пример 26В
Этил 2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 20А соединением примера 26А в примере 20D.
Пример 26С
2-(1Н-Индол-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 26B в примере 1E.
Пример 26D
4-(1-циклопентилпиперидин-4-иламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 1-циклопентилпиперидин-4-амином в примере 1F.
Пример 26Е
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопентилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1E соединением примера 26С и соединение примера 1F соединением примера 26D в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,13 (уш.с, 1H), 8,52 (с, 1H), 8,14 (д, 1H), 7,80 (д, 1H), 7,52 (д, 1H), 7,35 (м, 4H), 7,04 (м, 4H), 6,80 (д, 1H), 6,61 (д, 1H), 6,36 (с, 1H), 6,14 (с, 1H), 5,76 (с, 1H), 3,84 (м, 2H), 3,24 (м, 4H), 2,99 (м, 4H), 2,85 (м, 2H), 2,71 (м, 2H), 2,16 (м, 6H), 1,95 (м, 4H), 1,50-1,70 (м, 6H), 1,38 (м, 2H), 1,17 (м, 2H), 0,93 (с, 6H).
Пример 27
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]3-изобутилпиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 27А
Метил 2-бром-4-метилпентаноат
К концентрированной HBr (48%) (20 мл) в воде (214 мл) прибавляли KBr (17,6 г), охлаждали до 0°С, затем нитрит натрия (5,2 г), сразу весь, затем DL-лейцин (5,2 г) в виде нескольких порций. Реакционную смесь перемешивали механически при 0°С в течение 1,5 часов, затем экстрагировали 2× 200 мл этилацетатата. Объединенные органические слои промывали насыщенным раствором соли и сушили над Na2SO4. После фильтрования и концентрирования полученное масло растворяли в смеси CH2Cl2/метанол и обрабатывали 0,2М (TMS)CHN2 в эфире (30 мл) при комнатной температуре в течение 10 минут. Реакционную смесь концентрировали, а затем очищали флэш-хроматографией с использованием 97,5/2,5 смеси гексан/этилацетат.
Пример 27В
3-Изобутилпиперазин-2-он
Соединение примера 27А (2,2 г) в этаноле (15 мл) прибавляли по каплям в течение 2,5 часов к перемешиваемому кипящему раствору этан-1,2-диамина (13,2 мл) в этаноле (60 мл). Нагревание продолжали еще в течение 2,5 часов, затем прибавляли NaOEt в этаноле (21 масс., 4,0 мл) и нагревали еще в течение 90 минут. После этого реакционную смесь охлаждали и концентрировали. После растирания с эфиром указанное в заголовке соединение использовали без очистки.
Пример 27С
4’-Хлордифенил-2-карбальдегид
К 2-бромбензальдегиду (2,3 мл) и тетракис(трифенилфосфин)палладию(0) в толуоле (50 мл) прибавляли 4-хлорфенилбороновую кислоту (4,0 г) и 2М Na2CO3 (70 мл). Смесь нагревали при кипении с обратным холодильником в течение одного часа. Реакционную смесь охлаждали, разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, а объединенные водные слои вновь экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4. Сырое вещество очищали флэш-хроматографией с использованием 97,5/2,5 смеси гексан/этилацетат.
Пример 27D
4-((4’-Хлордифенил-2-ил)метил)-3-изобутилпиперазин-2-он
Соединение данного примера получали, заменяя трет-бутилпиперазин-1-карбоксилат соединением примера 27В в примере 1А.
Пример 27Е
1-((4’-Хлордифенил-2-ил)метил)-2-изобутилпиперазин
К раствору соединения примера 27D в тетрагидрофуране (3,6 мл) прибавляли комплекс боран-метилсульфид (10 М в тетрагидрофуране) (0,24 мл). Реакционную смесь нагревали при кипении с обратным холодильником в течение 16 часов, затем охлаждали на бане со льдом/водой. Осторожно прибавляли метанол (5 мл) и перемешивали смесь на холоду в течение 75 минут. Добавляли 4N HCl в диоксане (0,65 мл) и нагревали реакционную смесь при кипении с обратным холодильником в течение 60 минут. После охлаждения до комнатной температуры прибавляли 1N NH4OH (2,6 мл) и перемешивали реакционную смесь в течение 15 минут. После этого реакционную смесь концентрировали, повторно растворяли в метаноле, концентрировали, повторно растворяли в толуоле и концентрировали. Сырое твердое вещество суспендировали в смеси CHCl3/метанол, твердое вещество отфильтровывали, а фильтрат концентрировали, получая указанное в заголовке соединение.
Пример 27F
Метил 4-(4-((4’-хлордифенил-2-ил)метил)-3-изобутилпиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 1В соединением примера 27Е в примере 1D.
Пример 27G
4-(4-((4’-Хлордифенил-2-ил)метил)-3-изобутилпиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 27F в примере 1E.
Пример 27Н
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]3-изобутилпиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение примера 27G (13 мг), соединение примера 1F (7 мг), гидрохлорид 1-этил-3-[3-(диметиламино)пропил]карбодиимида (8 мг) и 4-диметиламинопиридин (5 мг) перемешивали в CH2Cl2 (1 мл) в течение 24 часов. Продукт очищали препаративной ВЭЖХ с использованием колонки С18, 250×50 мм, 10 мк; и элюирования с градиентом 20-100% CH3CN vs. 0,1% трифторуксусной кислоты в воде, получая продукт в виде трифторацетатной соли.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,62 (уш.с, 1H), 9,10 (уш.с, 1H), 8,65 (т, 1H), 8,47 (д, 1H), 7,77 (дд, 1H), 7,70 (уш.с, 1H), 7,50 (м, 5H), 7,39 (м, 3H), 7,25 (м, 2H), 7,18 (д, 1H), 7,01 (дд, 1H), 6,83 (м, 2H), 6,76 (м, 1H), 6,40 (уш.с, 1H), 4,70 и 4,15 (оба очень ш.с, всего 1H), 3,85 (дд, 2H), 3,60 (очень ш.с, 1H), 3,32, 3,27, 3,24, 3,06 (все м, всего 11H), 1,90 (м, 1H), 1,62 (м, 3H), 1,30 (м, 4H), 0,70 (уш.м, 6H).
Пример 28
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-{[ 4-(2,4-диоксо-3-азабицикло[3.2.0]гепт-3-ил)фенил]сульфонил}-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 1Е и соединение примера 1F на 4-(2,4-диоксо-3-азабицикло[3.2.0]гептан-3-ил)бензолсульфонамид в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,87 (уш.с, 1H), 9,58 (уш.с, 1H), 7,93 (д, 2H), 7,71 (уш.с, 1H), 7,54 (м, 7H), 7,35 (м, 5H), 7,10 (дд, 1H), 6,89 (д, 2H), 6,78 (дд, 1H), 6,42 (с, 1H), 4,37 (уш.с, 1H), 3,78 (уш.с, 1H), 3,43 (м, 4H), 3,22, 3,00, 2,85 (все очень ш.с, всего 6H), 2,62 (м, 2H), 2,18 (м, 2H).
Пример 29
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-{[ 4-(4-метил-6-оксо-1,4,5,6-тетрагидропиридазин-3-ил)фенил]сульфонил}-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 1Е и соединение примера 1F на 4-(4-метил-6-оксо-1,4,5,6-тетрагидропиридазин-3-ил)бензолсульфонамид в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,87 (уш.с, 1H), 11,20 (с, 1H), 9,58 (уш.с, 1H), 7,90 (д, 2H), 7,83 (д, 2H), 7,50 (м, 5H), 7,32 (м, 5H), 7,08 (дд, 1H), 6,85 (д, 2H), 6,76 (дд, 1H), 6,43 (с, 1H), 4,38 (уш.с, 1H), 3,80 (уш.с, 1H), 3,60 (м, 2H), 3,40 (м, 2H), 3,21, 3,00, 2,84 (все уш.с, всего 6H), 2,75 (дд, 1H), 2,28 (д, 1H), 1,08 (д, 3H).
Пример 30
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-{[ 4-(3,3-диметил-2-оксоазетидин-1-ил)фенил]сульфонил}-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 1Е и соединение примера 1F на 4-(3,3-диметил-2-оксоазетидин-1-ил)бензолсульфонамид в примере 27Н.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,62 (уш.с, 1H), 9,58 (уш.с, 1H), 7,80 (д, 2H), 7,72 (уш.с, 1H), 7,50 (м, 5H), 7,40 (м, 4H), 7,33 (м, 3H), 7,08 (дд, 1H), 6,85 (д, 2H), 6,76 (дд, 1H), 6,41 (с, 1H), 4,38 (уш.с, 1H), 3,77 (уш.с, 1H), 3,58 (с, 2H), 3,45 (м, 2H), 3,21, 3,00, 2,84 (все уш.с, всего 6H), 1,32 (с, 6H).
Пример 31
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-{[4-(4-нитро-2Н-1,2,3-триазол-2-ил)фенил]сульфонил}-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 1Е и соединение примера 1F на 4-(4-нитро-2Н-1,2,3-триазол-2-ил)бензолсульфонамид в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,98 (уш.с, 1H), 9,58 (уш.с, 1H), 9,11 (с, 1H), 8,21 (д, 2H), 8,05 (д, 2H), 7,70 (уш.с, 1H), 7,50 (м, 5H), 7,39 (м, 2H), 7,30 (м, 1H), 7,24 (м, 2H), 7,00 (дд, 1H), 6,82 (д, 2H), 6,78 (дд, 1H), 6,43 (с, 1H), 4,38 (уш.с, 1H), 3,77 (уш.с, 1H), 3,45 (м, 2H), 3,21, 3,00, 2,84 (все уш.с, всего 6H).
Пример 32
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-фенокси-N-{[2-(2-пиперидин-1-илэтокси)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 1Е и соединение примера 1F на 2-(2-(пиперидин-1-ил)этокси)бензолсульфонамид в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,65 (уш.с, 1H), 9,77 (уш.с, 1H), 8,95 (уш.с, 1H), 7,80 (дд, 1H), 7,70 (уш.с, 1H), 7,68 (м, 1H), 7,50 (м, 5H), 7,36 (м, 5H), 7,23 (д, 1H), 7,15 (м, 2H), 6,90 (д, 2H), 6,78 (дд, 1H), 6,42 (с, 1H), 4,40 (м, 3H), 3,80 (уш.с, 1H), 3,40, 3,20 3,00, 2,90 (все очень ш.м, всего 13H), 1,63 (м, 5H), 1,27 (очень ш.с, 1H).
Пример 33
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-{[3-({[(1-этилпирролидин-2-ил)метил]амино}карбонил)-4-метоксифенил]сульфонил}-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 1Е и соединение примера 1F на N-((1-этилпирролидин-2-ил)метил)-2-метокси-5-сульфамоилбензамид в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,75 (уш.с, 1H), 9,70 (уш.с, 1H), 9,25 (уш.с, 1H), 8,62 (т, 1H), 8,25 (д, 1H), 7,90 (дд, 1H), 7,70 (уш.с, 1H), 7,50 (м, 5H), 7,40 (м, 2H), 7,10 (м, 5H), 7,09 (дд, 1H), 6,85 (д, 2H), 6,76 (дд, 1H), 6,40 (с, 1H), 4,39 (уш.с, 1H), 3,96 (с, 3H), 3,77 (уш.с, 1H), 3,60 (м, 4H), 3,55-2,80 (конверт, 10H), 2,12 (м, 1H), 2,00 (м, 1H), 1,85 (м, 2H), 1,23 (т, 3H).
Пример 34
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(1-нафтилокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 34А
Метил 2-бром-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1С на 2-бром-4-фторбензоат в примере 1D.
Пример 34В
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(нафталин-1-илокси)бензоат
Соединение данного примера получали, заменяя соединение примера 18Е на соединение примера 34А и фенол на 1-нафтол в примере 18F.
Пример 34С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(нафталин-1-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 34B в примере 1E.
Пример 34D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(1-нафтилокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 34С в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,82 (уш.с, 1H), 9,50 (уш.с, 1H), 8,58 (т, 1H), 8,29 (д, 1H), 8,18 (д, 1H), 7,85 (д, 1H), 7,70 (уш.с, 1H), 7,50 (м, 8H), 7,38 (м, 4H), 7,20 (дд, 1H), 6,82 (м, 2H), 6,55 (с, 1H), 6,45 (д, 1H), 4,38 (уш.с, 1H), 3,85 (дд, 2H), 3,78 (уш.с, 1H), 3,27 (м, 6H), 3,22, 3,02, 2,85 (все уш.с, всего 6H), 1,84 (м, 1H), 1,60 (м, 2H), 1,29 (м, 2H).
Пример 35
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(2-нафтилокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 35А
1-(Дифторметилсульфонил)-2-фторбензол
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол на 2-нафтол в примере 18F.
Пример 35В
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(нафталин-2-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 35А в примере 1E.
Пример 35С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(2-нафтилокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 35В в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,80 (уш.с, 1H), 9,55 (уш.с, 1H), 8,50 (т, 1H), 8,39 (д, 1H), 7,83 (м, 2H), 7,69 (уш.с, 1H), 7,64 (д, 1H), 7,50 (м, 6H), 7,37 (м, 5H), 7,18 (дд, 1H), 7,00 (д, 1H), 6,81 (дд, 1H), 6,77 (д, 1H), 6,56 (д, 1H), 4,38 (уш.с, 1H), 3,85 (дд, 2H), 3,78 (уш.с, 1H), 3,27 (м, 6H), 3,22, 3,02, 2,85 (все уш.с, всего 6H), 1,84 (м, 1H), 1,60 (м, 2H), 1,29 (м, 2H).
Пример 36
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(2-нафтилокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 35В и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,80 (уш.с, 1H), 9,61 (уш.с, 2H), 8,57 (т, 1H), 8,40 (д, 1H), 7,83 (м, 2H), 7,66 (м, 2H), 7,50 (м, 6H), 7,40 (м, 5H), 7,18 (дд, 1H), 7,02 (д, 1H), 6,81 (д, 1H), 6,57 (с, 1H), 4,38 (уш.с, 1H), 4,00 (м, 2H), 3,80 (уш.с, 1H), 3,40 (м, 8H), 3,30-2,80 (конверт, 10H), 1,92 (м, 2H).
Пример 37
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(2-нафтилокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 35В и соединение примера 1F соединением примера 163A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,82 (уш.с, 1H), 9,58 (уш.с, 1H), 8,03 (д, 1H), 7,90 (м, 2H), 7,70 (д, 1H), 7,69 (уш.с, 1H), 7,65 (дд, 1H), 7,50 (м, 7H), 7,36 (м, 3H), 7,18 (м, 2H), 7,05 (д, 1H), 6,81 (дд, 1H), 6,75 (д, 1H), 6,56 (д, 1H), 4,38 (уш.с, 1H), 3,83 (дд, 2H), 3,78 (уш.с, 1H), 3,23 (м, 4H), 3,22, 3,02, 2,85 (все уш.с, всего 6H), 3,15 (м, 2H), 1,80 (м, 1H), 1,55 (м, 2H), 1,22 (м, 2H).
Пример 38
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(хинолин-7-илокси)бензамид
Пример 38А
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(хинолин-7-илокси)бензоат
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол на хинолин-7-ол в примере 18F.
Пример 38В
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(хинолин-7-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 38А в примере 1Е.
Пример 38С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(хинолин-7-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 38В в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,80 (д, 1H), 8,48 (т, 1H), 8,35 (д, 1H), 8,32 (д, 1H), 7,90 (д, 1H), 7,74 (м, 1H), 7,59 (м, 2H), 7,50 (м, 4H), 7,45 (дд, 1H), 7,38 (д, 2H), 7,30 (м, 2H), 6,95 (д, 1H), 6,86 (дд, 1H), 6,83 (д, 1H), 6,71 (д, 1H), 4,38 (уш.с, 1H), 3,85 (дд, 2H), 3,78 (уш.с, 1H), 3,30-2,80 (конверт, 12H), 1,84 (м, 1H), 1,60 (м, 2H), 1,25 (м, 2H).
Пример 39
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(хинолин-6-илокси)бензамид
Пример 39А
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(хинолин-6-илокси)бензоат
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол на хинолин-6-ол в примере 18F.
Пример 39В
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(хинолин-6-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 39А в примере 1Е.
Пример 39С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(хинолин-6-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 39В в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,90 (уш.с, 1H), 9,65 (уш.с, 1H), 8,80 (д, 1H), 8,46 (т, 1H), 8,35 (д, 1H), 7,90 (д, 1H), 7,72 (м, 1H), 7,50 (м, 6H), 7,45 (дд, 1H), 7,37 (м, 4H), 7,02 (д, 1H), 6,83 (дд, 1H), 6,79 (д, 1H), 6,63 (д, 1H), 4,38 (уш.с, 1H), 3,85 (дд, 2H), 3,78 (уш.с, 1H), 3,40-2,80 (конверт 12H), 1,87 (м, 1H), 1,62 (м, 2H), 1,26 (м, 2H).
Пример 40
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 40А
1-(Триизопропилсилил)-1Н-индол-5-ол
5-Бензилоксииндол (1,0 г) обрабатывали NaH (135 мг) и триизопропилсилилхлоридом (1,0 г) в тетрагидрофуране в течение 1 часа, очищали флэш-хроматографией (98/2 этилацетат/гексаны), затем дебензилировали в этаноле (35 мл) с использованием катализатора Перельмана (0,19 г) и баллона с водородом.
Пример 40В
Метил 2-(1Н-индол-5-илокси)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол на соединение примера 40А в примере 18F. В данном примере сырое вещество, полученное при образовании простого эфира, перед очисткой десилилировали с использованием фторида тетрабутиламмония в смеси тетрагидрофуран/вода 95/5.
Пример 40С
2-(1Н-Индол-5-илокси)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 40В в примере 1Е.
Пример 40D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 40С в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,40 (уш.с, 1H), 11,17 (с, 1H), 9,50 (очень ш.с, 1H), 8,61 (т, 1H), 8,57 (д, 1H), 7,77 (дд, 1H), 7,70 (уш.с, 1H), 7,50 (м, 5H), 7,36 (м, 5H), 7,10 (с, 1H), 7,08 (д, 1H), 6,83 (дд, 1H), 6,69 (дд, 1H), 6,37 (м, 1H), 6,21 (д, 1H), 4,30 (уш.с, 1H), 3,84 (дд, 2H), 3,70 (уш.с, 1H), 3,30 (м, 6H), 3,20, 2,95, 2,80 (все уш.с, всего 6H), 1,86 (м, 1H), 1,60 (м, 2H), 1,25 (м, 2H).
Пример 41
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(изохинолин-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 41А
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(изохинолин-5-илокси)бензоат
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол на изохинолин-5-ол в примере 18F.
Пример 41В
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(изохинолин-5-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 41А в примере 1Е.
Пример 41С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(изохинолин-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 41В в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,90 (уш.с, 1H), 9,55 (очень ш.с, 1H), 9,26 (с, 1H), 8,47 (м, 2H), 8,14 (д, 1H), 7,99 (д, 1H), 7,65 (уш.с, 1H), 7,60 (д, 1H), 7,45 (м, 6H), 7,29 (м, 4H), 6,80 (м, 2H), 6,60 (м, 2H), 4,38 (уш.с, 1H), 3,85 (дд, 2H), 3,78 (уш.с, 1H), 3,24 (м, 6H), 3,22, 3,00, 2,85 (все уш.с, всего 6H), 1,87 (м, 1H), 1,62 (м, 2H), 1,26 (м, 2H).
Пример 42
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(изохинолин-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 41В и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,90 (уш.с, 1H), 9,38 (очень ш.с, 1H), 9,22 (с, 1H), 8,54 (т, 1H), 8,45 (д, 1H), 8,16 (д, 1H), 7,96 (д, 1H), 7,62 (уш.с, 1H), 7,56 (д, 1H), 7,50 (д, 1H), 7,45 (м, 5H), 7,29 (м, 4H), 6,80 (м, 2H), 6,60 (м, 2H), 4,23 (уш.с, 1H), 3,78 (уш.с, 1H), 3,40 (м, 2H), 3,35-2,80 (конверт, 8H), 3,08 (м, 2H), 2,72, 2,70 (оба с, всего 6H), 1,87 (м, 2H).
Пример 43
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(хинолин-6-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 39B и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,96 (уш.с, 1H), 9,38 (очень ш.с, 1H), 8,77 (дд, 1H), 8,51 (т, 1H), 8,35 (д, 1H), 8,05 (д, 1H), 7,90 (д, 1H), 7,70 (уш.с, 1H), 7,50 (м, 6H), 7,38 (м, 5H), 6,98 (д, 1H), 6,83 (дд, 1H), 6,79 (д, 1H), 6,63 (д, 1H), 4,38 (уш.с, 1H), 3,78 (уш.с, 1H), 3,42 (м, 2H), 3,35-2,80 (конверт, 8H), 3,15 (м, 2H), 2,81, 2,79 (оба с, всего 6H), 1,93 (м, 2H).
Пример 44
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 40С и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,40 (уш.с, 1H), 11,18 (с, 1H), 9,30 (очень ш.с, 1H), 8,66 (т, 1H), 8,60 (д, 1H), 7,85 (дд, 1H), 7,52 (д, 1H), 7,50 (м, 5H), 7,40 (м, 4H), 7,30 (уш.с, 1H), 7,14 (с, 1H), 7,10 (д, 1H), 6,84 (дд, 1H), 6,67 (дд, 1H), 6,39 (м, 1H), 6,20 (с, 1H), 4,35 (уш.с, 1H), 3,78 (уш.с, 1H), 3,40 (м, 2H), 3,35-2,80 (конверт, 8H), 3,10 (м, 2H), 2,78, 2,76 (оба с, всего 6H), 1,95 (м, 2H).
Пример 45
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 45А
1-(Триизопропилсилил)-1Н-индол-4-ол
4-Бензилоксииндол (1,0 г) обрабатывали NaH (135 мг) и триизопропилсилилхлоридом (1,0 г) в тетрагидрофуране в течение 1 часа, очищали флэш-хроматографией (98/2 этилацетат/гексаны), затем дебензилировали в этаноле (35 мл) с использованием катализатора Перельмана (0,19 г) и баллона с водородом.
Пример 45В
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол на соединение примера 45А в примере 18F. В данном примере сырое вещество, полученное при образовании простого эфира, перед очисткой десилилировали с использованием фторида тетра-н-бутиламмония в смеси тетрагидрофуран/вода 95/5.
Пример 45С
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 45В в примере 1Е.
Пример 45D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 45С в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,50 (уш.с, 1H), 11,24 (с, 1H), 9,50 (очень ш.с, 1H), 8,61 (т, 1H), 8,47 (д, 1H), 7,70 (уш.с, 1H), 7,64 (дд, 1H), 7,50 (м, 5H), 7,30 (м, 4H), 7,15 (д, 2H), 7,04 (д, 2H), 6,92 (дд, 1H), 6,75 (дд, 1H), 6,33 (м, 2H), 6,23 (с, 1H), 4,30 (уш.с, 1H), 3,84 (дд, 2H), 3,70 (уш.с, 1H), 3,30 (м, 6H), 3,20, 2,95, 2,80 (все уш.с, всего 6H), 1,86 (м, 1H), 1,60 (м, 2H), 1,25 (м, 2H).
Пример 46
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 45С и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,50 (очень ш.с, 1H), 11,24 (с, 1H), 9,30 (уш.с, 1H), 8,66 (т, 1H), 8,53 (д, 1H), 7,85 (дд, 1H), 7,55 (д, 1H), 7,50 (м, 5H), 7,39 (м, 2H), 7,30 (м, 2H), 7,148 (д, 1H), 7,10 (д, 1H), 6,96 (дд, 1H), 6,72 (дд, 1H), 6,41 (д, 1H), 6,32 (с, 1H), 6,23 (с, 1H), 4,35 (уш.с, 1H), 3,78 (уш.с, 1H), 3,40 (м, 2H), 3,35-2,80 (конверт, 8H), 3,10 (м, 2H), 2,78, 2,76 (оба с, всего 6H), 1,95 (м, 2H).
Пример 47
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-6-илокси)бензамид
Пример 47А
1-(Триизопропилсилил)-1Н-индол-6-ол
6-Бензилоксииндол (1,0 г) обрабатывали NaH (135 мг) и триизопропилсилилхлоридом (1,0 г) в тетрагидрофуране в течение 1 часа, очищали флэш-хроматографией (98/2 этилацетат/гексаны), затем дебензилировали в этаноле (35 мл) с использованием катализатора Перельмана (0,19 г) и баллона с водородом.
Пример 47В
Метил 2-(1Н-индол-6-илокси)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол на соединение примера 47А в примере 18F. В данном примере сырое вещество, полученное при образовании простого эфира, перед очисткой десилилировали с использованием фторида тетрабутиламмония в смеси тетрагидрофуран/вода 95/5.
Пример 47С
2-(1Н-Индол-6-илокси)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 47В в примере 1Е.
Пример 47D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-6-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 47С и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,50 (очень ш.с, 1H), 11,00 (с, 1H), 9,38 (уш.с, 1H), 8,64 (т, 1H), 8,58 (д, 1H), 7,75 (дд, 1H), 7,65 (уш.с, 1H), 7,55 (д, 1H), 7,50 (м, 5H), 7,39 (м, 2H), 7,30 (м, 2H), 7,00 (д, 1H), 6,90 (с, 1H), 6,70 (м, 2H), 6,42 (м, 1H), 6,30 (с, 1H), 4,35 (уш.с, 1H), 3,78 (уш.с, 1H), 3,40 (м, 2H), 3,35-2,80 (конверт, 8H), 3,10 (м, 2H), 2,78, 2,76 (оба с, всего 6H), 1,95 (м, 2H).
Пример 48
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(изохинолин-7-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 48А
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол на изохинолин-7-ол в примере 18F.
Пример 48В
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(изохинолин-7-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 48А в примере 1Е.
Пример 48С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-2-(изохинолин-7-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 48В и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,98 (очень ш.с, 1H), 9,70 (очень ш.с, 2H), 9,10 (с, 1H), 8,56 (т, 1H), 8,42 (д, 1H), 8,13 (д, 1H), 7,93 (д, 1H), 7,81 (д, 1H), 7,70 (уш.с, 1H), 7,60 (м, 2H), 7,50 (м, 5H), 7,40 (д, 2H), 7,35 (м, 1H), 7,14 (д, 1H), 6,84 (м, 2H), 6,70 (д, 1H), 4,38 (уш.с, 1H), 4,00 (м, 2H), 3,80 (уш.с, 1H), 3,40 (м, 4H), 3,30-2,80 (конверт, 10H), 3,20 (м, 4H), 1,92 (м, 2H).
Пример 49
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил]метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(изохинолин-7-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 48В и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,98 (очень ш.с, 1H), 9,40 (уш.с, 2H), 9,10 (с, 1H), 8,56 (т, 1H), 8,40 (д, 1H), 8,13 (д, 1H), 7,93 (д, 1H), 7,81 (д, 1H), 7,70 (уш.с, 1H), 7,60 (м, 2H), 7,50 (м, 5H), 7,40 (д, 2H), 7,35 (м, 1H), 7,14 (д, 1H), 6,84 (м, 2H), 6,70 (д, 1H), 4,38 (уш.с, 1H), 3,78 (уш.с, 1H), 3,42 (м, 2H), 3,35-2,80 (конверт, 8H), 3,15 (м, 2H), 2,81, 2,79 (оба с, всего 6H), 1,93 (м, 2H).
Пример 50
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 50А
Метил-2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 34А соединением примера 19D в примере 40B.
Пример 50В
2-(1Н-Индол-5-илокси)-4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 50A в примере 1E.
Пример 50С
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 50В и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,98 (уш.с, 1H), 11,20 (с, 1H), 9,70 (очень ш.с, 1H), 9,35 (очень ш.с, 1H), 8,71 (т, 1H), 8,62 (д, 1H), 7,86 (дд, 1H), 7,54 (д, 1H), 7,40 (м, 4H), 7,12 (м, 4H), 6,87 (дд, 1H), 6,70 (дд, 1H), 6,40 (м, 1H), 6,20 (д, 1H), 3,98 (м, 2H), 3,50, 3,40, 3,30 (все м, всего 12H), 3,19 (м, 2H), 3,00 (м, 4H), 2,75 (уш.с, 2H), 2,23 (уш.м, 2H), 1,97 (уш.м, 2H), 1,43 (уш.т, 2H), 0,98 (с, 6H).
Пример 51
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 50В и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,42 (уш.с, 1H), 11,20 (с, 1H), 9,40 (очень ш.с, 1H), 9,30 (очень ш.с, 1H), 8,66 (т, 1H), 8,61 (д, 1H), 7,86 (дд, 1H), 7,54 (д, 1H), 7,40 (м, 4H), 7,18 (д, 1H), 7,12 (м, 3H), 6,87 (дд, 1H), 6,70 (дд, 1H), 6,40 (с, 1H), 6,20 (с, 1H), 3,60 (уш.с, 2H), 3,50 (м, 4H), 3,35 (уш.с, 2H), 3,13 (м, 3H), 3,00 (уш.м, 2H), 2,78, 2,77 (оба с, всего 6H), 2,70 (уш.с, 1H), 2,12 (уш.м, 2H), 1,97 (м, 4H), 1,42 (уш.т, 2H), 0,97 (с, 6H).
Пример 52
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 26C и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,40 (уш.с, 1H), 11,20 (с, 1H), 9,60 (очень ш.с, 1H), 9,25 (очень ш.с, 1H), 8,70 (т, 1H), 8,62 (д, 1H), 7,86 (дд, 1H), 7,54 (д, 1H), 7,40 (м, 4H), 7,18 (д, 1H), 7,13 (д, 1H), 7,09 (д, 2H), 6,87 (дд, 1H), 6,70 (дд, 1H), 6,40 (м, 1H), 6,20 (с, 1H), 3,98 (м, 2H), 3,50, 3,40, 3,30 (все м, всего 12H), 3,19 (м, 2H), 3,00 (м, 4H), 2,75 (уш.с, 2H), 2,18 (уш.м, 2H), 2,00 (уш.м, 4H), 1,43 (уш.т, 2H), 0,96 (с, 6H).
Пример 53
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 55В и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,41 (уш.с, 1H), 11,20 (с, 1H), 9,35 (очень ш.с, 2H), 8,66 (т, 1H), 8,62 (д, 1H), 7,86 (дд, 1H), 7,54 (д, 1H), 7,40 (м, 4H), 7,18 (д, 1H), 7,13 (д, 1H), 7,09 (д, 2H), 6,87 (дд, 1H), 6,70 (дд, 1H), 6,40 (м, 1H), 6,20 (с, 1H), 3,50 (м, 4H), 3,35 (уш.с, 2H), 3,13 (м, 3H), 3,00 (уш.м, 2H), 2,78, 2,77 (оба с, всего 6H), 2,70 (уш.с, 1H), 2,20 (уш.м, 2H), 2,00 (м, 2H), 1,93 (м, 2H), 1,42 (уш.т, 2H), 0,97 (с, 6H).
Пример 54
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 54А
Метил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 34А соединением примера 19D в примере 45B.
Пример 54В
2-(1Н-Индол-4-илокси)-4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 54A в примере 1E.
Пример 54С
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 54В и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,50 (уш.с, 1H), 11,27 (с, 1H), 9,60 (очень ш.с, 1H), 9,20 (очень ш.с, 1H), 8,65 (т, 1H), 8,55 (д, 1H), 7,80 (дд, 1H), 7,57 (д, 1H), 7,40 (д, 2H), 7,30 (дд, 1H), 7,12 (д, 2H), 7,10 (д, 2H), 7,00 (дд, 1H), 6,73 (дд, 1H), 6,46 (д, 1H), 6,30 (с, 1H), 6,23 (м, 1H), 3,98 (м, 2H), 3,60, 3,50, 3,40 (все м, всего 12H), 3,19 (м, 2H), 3,00 (м, 4H), 2,75 (уш.с, 2H), 2,23 (уш.м, 2H), 1,97 (уш.м, 4H), 1,43 (уш.т, 2H), 0,98 (с, 6H).
Пример 55
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 55А
Метил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя фенол соединением примера 45А в примере 18F. При этом сырое вещество, полученное при образовании простого эфира, перед очисткой десилилировали с использованием фторида тетрабутиламмония в смеси тетрагидрофуран/вода 95/5.
Пример 55В
2-(1Н-Индол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 55A в примере 1E.
Пример 55С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 55В и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,50 (уш.с, 1H), 11,25 (с, 1H), 9,60 (очень ш.с, 1H), 9,20 (очень ш.с, 1H), 8,65 (т, 1H), 8,55 (д, 1H), 7,80 (дд, 1H), 7,57 (д, 1H), 7,40 (д, 2H), 7,30 (дд, 1H), 7,20 (д, 1H), 7,10 (м, 3H), 7,00 (дд, 1H), 6,73 (дд, 1H), 6,46 (д, 1H), 6,30 (с, 1H), 6,23 (м, 1H), 3,98 (м, 2H), 3,60, 3,50, 3,40 (все м, всего 12H), 3,19 (м, 2H), 3,00 (м, 4H), 2,75 (уш.с, 2H), 2,20 (уш.м, 2H), 2,00 (уш.м, 4H), 1,43 (уш.т, 2H), 0,98 (с, 6H).
Пример 56
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 54В и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,55 (уш.с, 1H), 11,27 (с, 1H), 9,40 (очень ш.с, 1H), 9,35 (очень ш.с, 1H), 8,65 (т, 1H), 8,55 (д, 1H), 7,79 (дд, 1H), 7,57 (д, 1H), 7,40 (д, 2H), 7,30 (дд, 1H), 7,20 (д, 1H), 7,10 (м, 3H), 7,00 (дд, 1H), 6,73 (дд, 1H), 6,46 (д, 1H), 6,30 (с, 1H), 6,23 (м, 1H), 3,50 (м, 4H), 3,35 (уш.с, 2H), 3,13 (м, 3H), 3,00 (уш.м, 2H), 2,78, 2,77 (оба с, всего 6H), 2,70 (уш.с, 1H), 2,22 (уш.м, 2H), 1,97 (м, 2H), 1,93 (м, 2H), 1,42 (уш.т, 2H), 0,97 (с, 6H).
Пример 57
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 55В и соединение примера 1F соединением примера 154A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,50 (уш.с, 1H), 11,25 (с, 1H), 9,60 (очень ш.с, 1H), 9,20 (очень ш.с, 1H), 8,65 (т, 1H), 8,55 (д, 1H), 7,79 (дд, 1H), 7,57 (д, 1H), 7,40 (д, 2H), 7,30 (дд, 1H), 7,20 (д, 1H), 7,10 (м, 3H), 7,00 (дд, 1H), 6,73 (дд, 1H), 6,46 (д, 1H), 6,30 (с, 1H), 6,23 (м, 1H), 3,50 (м, 4H), 3,35 (уш.с, 2H), 3,13 (м, 3H), 3,00 (уш.м, 2H), 2,78, 2,77 (оба с, всего 6H), 2,70 (уш.с, 1H), 2,20 (уш.м, 2H), 2,00 (м, 2H), 1,93 (м, 2H), 1,42 (уш.т, 2H), 0,97 (с, 6H).
Пример 58
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 45С и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,50 (уш.с, 1H), 11,24 (с, 1H), 9,50 (очень ш.с, 1H), 8,67 (т, 1H), 8,52 (д, 1H), 7,78 (дд, 1H), 7,70 (уш.с, 1H), 7,55 (д, 1H), 7,50 (м, 4H), 7,38 (д, 2H), 7,30 (дд, 2H), 7,18 (д, 1H), 7,08 (д, 1H), 6,96 (дд, 1H), 6,75 (дд, 1H), 6,40 (д, 1H), 6,33 (с, 1H), 6,23 (с, 1H), 4,38 (уш.с, 1H), 4,00 (м, 2H), 3,80 (уш.с, 1H), 3,40 (м, 4H), 3,30-2,80 (конверт, 10H), 3,20 (м, 4H), 1,95 (м, 2H).
Пример 59
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 40С и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,40 (уш.с, 1H), 11,19 (с, 1H), 9,60 (очень ш.с, 1H), 8,69 (т, 1H), 8,60 (д, 1H), 7,83 (дд, 1H), 7,65 (уш.с, 1H), 7,50 (м, 5H), 7,38 (м, 5H), 7,12 (м, 2H), 6,83 (дд, 1H), 6,69 (дд, 1H), 6,39 (м, 1H), 6,20 (д, 1H), 4,38 (уш.с, 1H), 4,00 (м, 2H), 3,80 (уш.с, 1H), 3,40 (м, 4H), 3,30-2,80 (конверт, 10H), 3,20 (м, 4H), 1,96 (м, 2H).
Пример 60
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-(метоксифенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 1Е и соединение примера 1F 4-метоксибензолсульфонамидом в примере 27Н.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,57 (с, 1H), 7,74 (д, 2H), 7,50 (м, 5H), 7,35 (м, 6H), 7,10 (т, 1H), 7,02 (м, 2H), 6,87 (д, 2H), 6,75 (дд, 1H), 6,41 (с, 1H), 4,36 (м, 2H), 3,83 (с, 3H), 3,76 (м, 2H), 3,23 (м, 2H), 3,01 (м, 2H), 2,84 (м, 2H).
Пример 61
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-(метилфенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 1Е и соединение примера 1F 4-метилбензолсульфонамидом в примере 27Н.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,64 (с, 1H), 7,68 (д, 2H), 7,50 (м, 5H), 7,38 (м, 2H), 7,32 (м, 6H), 7,11 (т, 1H), 6,87 (д, 2H), 6,75 (дд, 1H), 6,41 (с, 1H), 4,36 (м, 2H), 3,76 (м, 2H), 3,23 (м, 2H), 3,01 (м, 2H), 2,84 (м, 2H), 2,37 (с, 3H).
Пример 62
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 40С и соединение примера 1F соединением примера 163А в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,46 (с, 1H), 11,16 (с, 1H), 8,17 (д, 1H), 7,88 (дд, 1H), 7,68 (уш.с, 1H), 7,50 (м, 5H), 7,36 (м, 6H), 7,13 (с, 1H), 7,03 (д, 1H), 6,84 (дд, 1H), 6,68 (дд, 1H), 6,39 (м, 1H), 6,21 (уш.с, 1H), 4,32 (с, 2H), 3,84 (дд, 2H), 3,25 (м, 7H), 2,93 (м, 4H), 1,84 (м, 2H), 1,54 (м, 2H), 1,24 (м, 2H).
Пример 63
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 45С и соединение примера 1F соединением примера 163А в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,58 (с, 1H), 11,27 (с, 1H), 8,12 (д, 1H), 7,71 (м, 2H), 7,52 (м, 5H), 7,32 (м, 5H), 7,18 (д, 1H), 6,96 (м, 2H), 6,74 (дд, 1H), 6,36 (м, 2H), 6,26 (м, 1H), 4,32 (с, 2H), 3,84 (дд, 2H), 3,25 (м, 7H), 2,93 (м, 4H), 1,84 (м, 2H), 1,54 (м, 2H), 1,24 (м, 2H).
Пример 64
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-{[3-(диметиламино)пропил]амино}-3-[(трифторметил)сульфонил]фенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 40С и соединением примера 170А, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,46 (уш.с, 1H), 11,18 (с, 1H), 8,21 (д, 1H), 7,98 (дд, 1H), 7,50 (м, 6H), 7,41 (м, 5H), 7,29 (уш.с, 1H), 7,17 (с, 1H), 7,08 (д, 1H), 6,84 (дд, 1H), 6,68 (дд, 1H), 6,40 (м, 1H), 6,18 (уш.с, 1H), 4,32 (уш.с, 2H), 3,59 (м, 4H), 3,25 (м, 2H), 3,05 (м, 4H), 2,90 (м, 2H), 2,77 (д, 6H), 1,88 (м, 2H).
Пример 65
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-{[3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Пример 65А
4-(3-Морфолинпропиламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид и (тетрагидропиран-4-ил)метиламино на соединение примера 159С и 3-морфолинпропан-1-амино, соответственно, в примере 1F.
Пример 65В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-{[3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 40С и соединением примера 65А, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,46 (уш.с, 1H), 11,18 (с, 1H), 8,18 (д, 1H), 7,91 (м, 1H), 7,50 (м, 6H), 7,41 (м, 5H), 7,30 (м, 1H), 7,19 (д, 1H), 7,08 (м, 1H), 6,99 (м, 1H), 6,72 (дд, 1H), 6,48 (уш.с, 1H), 6,25 (м, 1H), 4,29 (уш.с, 2H), 4,01 (м, 2H), 3,59 (м, 2H), 3,41 (м, 4H), 3,05 (м, 10H), 2,58 (м, 2H), 1,91 (м, 2H).
Пример 66
N-[(3-{[хлор(дифтор)метил]сульфонил}-4-{[3-(диметиламино)пропил]амино}фенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Пример 66А
(Дифторметил)(2-фторфенил)сульфан
Порошкообразный NaOH (31,2 г), трис(2-(2-метоксиэтокси)этил)амин (5 мл) и 2-фторбензолтиол (33,6 мл) в бензоле (400 мл) насыщали хлордифторметаном, перемешивали при 80°С в течение 30 минут и фильтровали через диатомовую землю (Celite®). Фильтрат промывали насыщенным NaHCO3, а водный слой экстрагировали диэтиловым эфиром. Экстракты объединяли и сушили (MgSO4), фильтровали и концентрировали.
Пример 66В
1-(Дифторметилсульфонил)-2-фторбензол
Соединение примера 66А (46 г) в смеси 1:1:2 CCl4/CH3CN/вода (1,2 л) обрабатывали NaIO4 (164,6 г) и RuCl3⋅xH2O (534 мг), перемешивали в течение 18 часов, разбавляли хлористым метиленом и фильтровали через диатомовую землю (Celite®). Фильтрат промывали насыщенным NaHCO3 и сушили (Na2SO4), фильтровали и концентрировали. Концентрат фильтровали через силикагель.
Пример 66С
1-(Хлордифторметилсульфонил)-2-фторбензол
Соединение примера 66В (25 г) и N-хлорсукцинимид (17,55 г) в тетрагидрофуране (690 мл) при -78°С обрабатывали гексаметилдисилазидом лития (178,5 мл) в течение 1 часа, перемешивали в течение 1 часа и гасили хлоридом аммония. Смесь экстрагировали этилацетатом а экстракт промывали насыщенным раствором соли и сушили (MgSO4), фильтровали и концентрировали. Концентрат хроматографировали на силикагеле с использованием смеси 0-5% этилацетат/гексаны.
Пример 66D
3-(Хлордифторметилсульфонил)-4-фторбензол-1-сульфонилхлорид
Соединение примера 66С (44 г) в хлорсульфоновой кислоте (36,7 мл) при 120°С перемешивали в течение 18 часов, охлаждали до 25°С, капали пипеткой наколотый лед и экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили (MgSO4), фильтровали и концентрировали.
Пример 66Е
3-(Хлордифторметилсульфонил)-4-фторбензолсульфонамид
Соединение примера 66D (22 г) в изопропаноле (690 мл) при -78°С обрабатывали водным аммиаком (90 мл) в течение 1 часа, перемешивали еще час, гасили 6М HCl (300 мл), нагревали до 25°С и концентрировали. Концентрат смешивали с водой и экстрагировали этилацетатом. Экстракт сушили (MgSO4), фильтровали и концентрировали. Концентрат перекристаллизовывали из смеси гексаны/этилацетат.
Пример 66F
3-(Хлордифторметилсульфонил)-4-(3-(диметиламино)пропиламино)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид и (тетрагидропиран-4-ил)метиламин на соединение примера 66Е и N,N-диметилпропан-1,3-диамин, соответственно, в примере 1F.
Пример 66G
N-[(3-{[хлор(дифтор)метил]сульфонил}-4-{[3-(диметиламино)пропил]амино}фенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 54В и соединением примера 66F, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,20 (с, 1H), 8,28 (м, 1H), 7,99 (м, 1H), 7,55 (м, 2H), 7,38 (м, 2H), 7,21 (м, 3H), 7,09 (д, 2H), 6,98 (м, 1H), 6,71 (м, 1H), 6,41 (м, 2H), 6,21 (м, 1H), 3,57 (м, 2H), 3,28 (м, 4H), 2,84 (м, 6H), 2,67 (м, 5H), 2,19 (м, 2H), 2,02 (м, 2H), 1,77 (уш.с, 2H), 1,61 (м, 2H), 1,46 (м, 2H), 0,94 (с, 6H).
Пример 67
N-[(3-{[хлор(дифтор)метил]сульфонил}-4-{[3-(диметиламино)пропил]амино}фенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 26С и соединением примера 66F, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,20 (с, 1H), 8,28 (м, 1H), 8,05 (м, 1H), 7,99 (м, 1H), 7,55 (м, 2H), 7,38 (м, 2H), 7,21 (м, 3H), 7,09 (д, 2H), 6,98 (м, 1H), 6,71 (м, 1H), 6,41 (м, 2H), 6,21 (м, 1H), 3,57 (м, 2H), 3,28 (м, 4H), 3,05 (м, 2H), 2,96 (м, 2H), 2,88 (с, 3H), 2,78 (м, 2H), 2,68 (м, 3H), 2,19 (м, 2H), 2,01 (уш.с, 2H), 1,72 (м, 2H), 1,45 (м, 2H), 0,93 (с, 6H).
Пример 68
2-(1Н-индол-4-илокси)-4-(4-{[2-(4-метоксифенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 68А
(2-Бром-4,4-диметилциклогекс-1-енил)метанол
N,N-диметилформамид (18,41 мл) растворяли в хлороформе (64 мл) и охлаждали полученный раствор на бане со льдом. Прибавляли по каплям трехбромистый фосфор (20,18 мл) в течение 15 минут. Затем полученную суспензию нагревали до 70°С в течение 30 минут. Прибавляли по каплям раствор 3,3-диметилциклогексанона (10 г) в хлороформе (21 мл) в течение 30 минут. Смесь перемешивали при 70°С еще в течение 2 часов. Затем смесь оставляли остывать до комнатной температуры. Раствор осторожно выливали на лед. Для нейтрализации кислоты добавляли твердый гидрокарбонат натрия. Смесь трижды экстрагировали простым эфиром, а экстракты промывали водой и насыщенным раствором соли и сушили (MgSO4). Растворитель удаляли в вакууме, а сырое вещество пропускали через диоксид кремния с использованием простого эфира в качестве элюента. После концентрирования сырое вещество растворяли в метаноле. Осторожно прибавляли боргидрид натрия (1,757 г). Полученную смесь перемешивали при комнатной температуре в течение ночи и разбавляли этилацетатом. Смесь промывали водой и насыщенным раствором соли и сушили (MgSO4). Растворитель удаляли в вакууме, а остаток очищали флэш-хроматографией, элюируя смесью от 20% этилацетата в гексанах до 100% этилацетата.
Пример 68В
Метил 2-(1Н-индол-4-илокси)-4-(пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1С и соединение примера 1В соединением примера 24F и пиперазином, соответственно, в примере 1D.
Пример 68С
Метил 2-(1Н-индол-4-илокси)-4-(4-((2-бром-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 18С и соединение примера 18D соединением примера 68A и соединением примера 68B, соответственно, в примере 18Е.
Пример 68D
Метил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-метоксифенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение примера 68С (142 мг), 4-метоксифенилбороновую кислоту (45,6 мг), дихлорид бис(трифенилфосфин)палладия(II) (8,7 мг) и фторид цезия (114 мг) соединяли в диметоксиэтане (0,9 мл) и метаноле (0,4 мл) и нагревали до 90°С в течение 2 часов. Реакционную смесь разбавляли этилацетатом и выливали в воду. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Полученное твердое вещество растирали с метанолом и фильтровали.
Пример 68Е
2-(1Н-Индол-4-илокси)-4-(4-((2-(4-метоксифенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 68D в примере 1Е.
Пример 68F
3-Нитро-4-(3-пирролидин-1-ил)пропиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на 3-(пирролидин-1-ил)пропан-1-амин в примере 1F.
Пример 68G
2-(1Н-индол-4-илокси)-4-(4-{[2-(4-метоксифенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 68E и соединением примера 68F, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,56 (уш.с, 1H), 11,26 (с, 1H), 8,66 (т, 1H), 8,53 (д, 1H), 7,78 (дд, 1H), 7,56 (д, 1H), 7,29 (т, 1H), 7,19 (д, 1H), 7,10 (д, 1H), 6,98 (м, 3H), 6,88 (м, 2H), 6,74 (м, 1H), 6,43 (д, 1H), 6,36 (уш.с, 1H), 6,23 (м, 1H), 3,73 (с, 3H), 3,62 (м, 2H), 3,52 (м, 4H), 3,22 (м, 4H), 2,99 (м, 4H), 2,18 (м, 2H), 1,99 (м, 6H), 1,84 (м, 2H), 1,45 (м, 2H), 1,23 (м, 2H), 0,94 (с, 6H).
Пример 69
4-[4-({4,4-диметил-2-[4-(трифторметил)фенил]циклогекс-1-ен-1-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 69А
Метил 2-(1Н-индол-4-илокси)-4-(4-((4,4-диметил-2-(4-(трифторметил)фенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4-метоксифенилбороновую кислоту на 4-(трифторметил)фенилбороновую кислоту в примере 68D.
Пример 69В
2-(1Н-индол-4-илокси)-4-(4-((4,4-диметил-2-(4-(трифторметил)фенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 69А в примере 1Е.
Пример 69С
4-[4-({4,4-диметил-2-[4-(трифторметил)фенил]циклогекс-1-ен-1-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 69В и соединением примера 68F, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,55 (уш.с, 1H), 11,26 (с, 1H), 8,66 (т, 1H), 8,53 (д, 1H), 7,78 (м, 1H), 7,67 (м, 2H), 7,56 (м, 1H), 7,29 (м, 3H), 7,19 (д, 1H), 7,10 (д, 1H), 6,98 (м, 1H), 6,72 (м, 1H), 6,46 (м, 1H), 6,36 (уш.с, 1H), 6,23 (м, 1H), 3,62 (м, 4H), 3,52 (м, 4H), 3,18 (м, 4H), 3,02 (м, 4H), 2,19 (м, 2H), 2,02 (м, 6H), 1,82 (м, 2H), 1,47 (м, 2H), 0,94 (с, 6H).
Пример 70
4-[4-({4,4-диметил-2-[4-(трифторметокси)фенил]циклогекс-1-ен-1-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 70А
Метил 2-(1Н-индол-4-илокси)-4-(4-((4,4-диметил-2-(4-(трифторметокси)фенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4-метоксифенилбороновую кислоту на 4-(трифторметокси)фенилбороновую кислоту в примере 68D.
Пример 70В
2-(1Н-индол-4-илокси)-4-(4-((4,4-диметил-2-(4-(трифторметокси)фенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 70А в примере 1Е.
Пример 70С
4-[4-({4,4-диметил-2-[4-(трифторметокси)фенил]циклогекс-1-ен-1-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 70В и соединением примера 68F, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,56 (уш.с, 1H), 11,26 (с, 1H), 8,66 (т, 1H), 8,54 (д, 1H), 7,80 (м, 1H), 7,63 (м, 2H), 7,56 (м, 3H), 7,29 (м, 2H), 7,19 (м, 2H), 6,98 (м, 1H), 6,72 (м, 1H), 6,46 (м, 1H), 6,23 (м, 1H), 3,62 (м, 4H), 3,52 (м, 4H), 3,18 (м, 4H), 3,02 (м, 4H), 2,19 (м, 2H), 2,02 (м, 6H), 1,82 (м, 2H), 1,47 (м, 2H), 0,94 (с, 6H).
Пример 71
4-[4-({4,4-диметил-2-[3-(трифторметил)фенил]циклогекс-1-ен-1-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 71А
Метил 2-(1Н-индол-4-илокси)-4-(4-((4,4-диметил-2-(3-(трифторметил)фенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4-метоксифенилбороновую кислоту на 3-(трифторметил)фенилбороновую кислоту в примере 68D.
Пример 71В
2-(1Н-индол-4-илокси)-4-(4-((4,4-диметил-2-(3-(трифторметил)фенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 71А в примере 1Е.
Пример 71С
4-[4-({4,4-диметил-2-[3-(трифтормети)фенил]циклогекс-1-ен-1-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 71В и соединением примера 68F, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,55 (уш.с, 1H), 11,26 (с, 1H), 8,65 (т, 1H), 8,54 (д, 1H), 7,80 (дд, 1H), 7,63 (м, 2H), 7,56 (м, 3H), 7,38 (м, 2H), 7,29 (т, 1H), 7,19 (д, 1H), 7,11 (д, 1H), 6,98 (т, 1H), 6,72 (м, 1H), 6,46 (м, 1H), 6,31 (м, 1H), 6,23 (м, 1H), 3,58 (м, 7H), 3,18 (м, 4H), 3,02 (м, 4H), 2,19 (м, 3H), 2,02 (м, 6H), 1,82 (м, 2H), 1,47 (м, 2H), 0,96 (с, 6H).
Пример 72
4-(4-{[2-(3-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 72А
Метил 2-(1Н-индол-4-илокси)-4-(4-((2-(3-фторфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4-метоксифенилбороновую кислоту на 3-фторфенилбороновую кислоту в примере 68D.
Пример 72В
2-(1Н-индол-4-илокси)-4-(4-((2-(3-фторфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 72А в примере 1Е.
Пример 72С
4-(4-{[2-(3-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 72В и соединением примера 68F, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,55 (уш.с, 1H), 11,26 (с, 1H), 8,65 (т, 1H), 8,54 (д, 1H), 7,80 (м, 1H), 7,63 (м, 2H), 7,56 (м, 3H), 7,38 (м, 2H), 7,29 (т, 1H), 7,19 (д, 1H), 7,11 (д, 1H), 6,98 (м, 1H), 6,72 (м, 1H), 6,46 (м, 1H), 6,31 (м, 1H), 6,23 (м, 1H), 3,58 (м, 7H), 3,18 (м, 4H), 3,02 (м, 4H), 2,19 (м, 3H), 2,02 (м, 6H), 1,82 (м, 2H), 1,47 (м, 2H), 0,96 (с, 6H).
Пример 73
4-(4-{[2-(4-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 73А
Метил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-фторфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту в примере 68D.
Пример 73В
2-(1Н-индол-4-илокси)-4-(4-((2-(4-фторфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 73А в примере 1Е.
Пример 73С
4-(4-{[2-(4-фторфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G и соединение примера 1F соединением примера 73В и соединением примера 68F, соответственно, в примере 27Н.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,56 (уш.с, 1H), 11,26 (с, 1H), 8,66 (т, 1H), 8,54 (д, 1H), 7,80 (м, 1H), 7,63 (м, 2H), 7,56 (м, 3H), 7,29 (м, 2H), 7,19 (м, 2H), 6,98 (м, 1H), 6,72 (м, 1H), 6,46 (м, 1H), 6,23 (м, 1H), 3,62 (м, 4H), 3,52 (м, 4H), 3,18 (м, 4H), 3,02 (м, 4H), 2,19 (м, 2H), 2,02 (м, 6H), 1,82 (м, 2H), 1,47 (м, 2H), 0,94 (с, 6H).
Пример 74
N-({3-{[хлор(дифтор)метил]сульфонил}-4-[(1-метилпиперидин-4-ил)амино]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Пример 74А
3-(Хлордифторметилсульфонил)-4-(1-метилпиперидин-4-иламино)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид и (тетрагидропиран-4-ил)метиламин на соединение примера 66Е и 1-метилпиперидин-4-амин, соответственно, в примере 1F.
Пример 74В
N-({3-{[хлор(дифтор)метил]сульфонил}-4-[(1-метилпиперидин-4-ил)амино]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е и соединение примера 1F соединением примера 26С и соединением примера 74А, соответственно, в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,07 (с, 1H), 8,11 (д, 1H), 7,89 (дд, 1H), 7,50 (д, 1H), 7,34 (м, 4H), 7,05 (м, 3H), 6,96 (д, 1H), 6,78 (дд, 1H), 6,60 (м, 2H), 6,36 (с, 1H), 6,13 (д, 1H), 3,67 (м, 1H), 2,97 (м, 6H), 2,71 (с, 2H), 2,59 (м, 2H), 2,46 (с, 3H), 2,16 (м, 6H), 1,98 (м, 4H), 1,55 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 75
4-(4-{[2-(4-хлорфенил)циклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 75А
Метил 2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид и трет-бутилпиперазин-1-карбоксилат на соединение примера 149D и соединение примера 150А, соответственно, в примере 1А.
Пример 75В
2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 75А в примере 1Е.
Пример 75С
4-(4-{[2-(4-Хлорфенил)циклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е и соединение примера 1F соединением примера 75В и соединением примера 21А, соответственно, в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,07 (с, 1H), 8,52 (д, 1H), 8,12 (д, 1H), 7,79 (дд, 1H), 7,52 (д, 1H), 7,34 (м, 4H), 7,05 (м, 4H), 6,79 (дд, 1H), 6,59 (дд, 1H), 6,36 (с, 1H), 6,13 (д, 1H), 3,72 (м, 1H), 2,97 (м, 6H), 2,69 (с, 2H), 2,59 (м, 2H), 2,46 (с, 3H), 2,16 (м, 6H), 2,11 (м, 2H), 1,98 (м, 2H), 1,70 (м, 2H), 1,62 (м, 4H).
Пример 76
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-[(трифметил)сульфонил]фенил}сульфонил)бензамид
Пример 76А
4-(1-метилпиперидин-4-иламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид и (тетрагидропиран-4-ил)метиламин на соединение примера 159С и 1-метилпиперидин-4-амин, соответственно, в примере 1F.
Пример 76В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е и соединение примера 1F соединением примера 26С и соединением примера 76А, соответственно, в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,08 (с, 1H), 8,11 (д, 1H), 7,89 (дд, 1H), 7,50 (д, 1H), 7,34 (м, 4H), 7,05 (м, 3H), 6,98 (д, 1H), 6,78 (дд, 1H), 6,60 (м, 2H), 6,36 (т, 1H), 6,13 (д, 1H), 3,67 (уш.с, 1H), 2,97 (м, 6H), 2,71 (с, 3H), 2,63 (м, 1H), 2,47 (с, 3H), 2,17 (м, 6H), 1,98 (м, 4H), 1,60 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 77
4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(феноксиметил)бензамид
Пример 77А
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)изобензофуран-1(3Н)-он
5-Бромизобензофуран-1(3Н)-он (400 мг), соединение примера 1В (646 мг) и трехосновный фосфат калия (558 мг) прибавляли к 1,2-диметоксиэтану (10 мл). Раствор дегазировали в вакууме и три раза продували азотом. Прибавляли трис(дибензилиденацетон)дипалладий(0) (51,6 мг) и 2-(ди-трет-бутилфосфино)дифенил (67,2 мг) и нагревали раствор до 80°С в течение 16 часов. Раствор охлаждали, фильтровали, концентрировали и очищали колоночной флэш-хроматографией на силикагеле с использованием смеси 30% этилацетата в гексанах.
Пример 77В
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(гидроксиметил)бензойная кислота
К смеси 1,4-диоксана (4 мл) и воды (1 мл) прибавляли соединение примера 77А (256 мг) и моногидрат гидроксида лития (154 мг). Раствор нагревали до 65°С в течение 16 часов, охлаждали, концентрировали в вакууме и очищали колоночной флэш-хроматографией на силикагеле с использованием этилацетата. Затем раствор сушили над безводным сульфатом натрия, получая сырой продукт с чистотой, достаточной для последующего использования.
Пример 77С
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(гидроксиметил)бензоат
К соединению примера 77В (170 мг), растворенному в этилацетате (2 мл) и метаноле (2 мл), прибавляли триметилсилилдиазометан (2М раствор в диэтиловом эфире, 0,214 мл). Раствор перемешивали в течение 5 минут, после чего растворитель удаляли в вакууме, получая сырой продукт с чистотой, достаточной для последующего использования.
Пример 77D
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(феноксиметил)бензоат
Трифенилфосфин (93 мг) прибавляли к тетрагидрофурану (3 мл) и охлаждали до 0°С. Прибавляли диэтилазодикарбоксилат (40% раствор, 0,161 мл) и перемешивали раствор при 0°С в течение 15 минут. Добавляли фенол (33,3 мг) и соединение примера 77С (145 мг), и оставляли раствор нагреваться до комнатной температуры и перемешивали в течение 16 часов. Раствор концентрировали в вакууме и очищали колоночной флэш-хроматографией на силикагеле с использованием смеси 30% этилацетата (гексаны) с повышением до 50% этилацетата (гексаны).
Пример 77Е
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(феноксиметил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 77А соединением примера 77D в примере 77В.
Пример 77F
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 77Е в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,52 (м, 2H), 7,88 (дд, 1H), 7,84 (д, 1H), 7,50 (м, 2H), 7,48 (с, 3H), 7,37 (м, 2H), 7,26-7,10 (м, 4H), 7,01 (с, 1H), 6,87 (т, 1H), 6,83-6,75 (м, 3H), 5,22 (уш.с, 2H), 3,84 (дд, 2H), 3,41-3,10 (м, 10H), 2,39 (уш.с, 4H), 1,89 (м, 1H), 1,60 (м, 2H), 1,32-1,18 (м, 2H).
Пример 78
4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 78А
N-(4-сульфамоилфенил)акриламид
4-Аминобензолсульфонамид (1,00 г) и пиридин (1,41 мл) прибавляли к 1,4-диоксану (30 мл). Прибавляли по каплям акрилоилхлорид (0,49 мл) и перемешивали раствор в течение 3 часов при комнатной температуре. Добавляли 1М HCl и экстрагировали раствор этилацетатом. Экстракты сушили, используя насыщенный раствор соли и безводный сульфат натрия и удаляли растворитель, получая сырой продукт с чистотой, достаточной для последующего использования.
Пример 78В
3-Морфолин-N-(4-сульфамоилфенил)пропанамид
Соединение примера 78А (359 мг) и морфолин (1,38 мл) прибавляли к смеси ацетонитрила (10 мл) и N,N-диметилформамида (1 мл) и перемешивали раствор при комнатной температуре в течение 16 часов. Раствор концентрировали в вакууме и очищали колоночной флэш-хроматографией на силикагеле с использованием 5% метанола в хлористом метилене.
Пример 78С
4-(3-Морфолинпропиламино)бензолсульфонамид
Соединение примера 78В (268 мг) прибавляли к тетрагидрофурану (4 мл). Медленно добавляли боран (1М в тетрагидрофуране, 4,28 мл) и перемешивали раствор при комнатной температуре в течение 16 часов. Реакционную смесь медленно гасили метанолом. Прибавляли N,N-диизопропилэтиламиновую смолу (3,42 ммоль амина) и перемешивали раствор при комнатной температуре в течение 15 минут. Раствор фильтровали, концентрировали в вакууме и очищали колоночной флэш-хроматографией на силикагеле с использованием 10% метанола в этилацетате.
Пример 78D
4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 78С в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,98 (уш.с, 1H), 7,51-7,44 (м, 9H), 7,40-7,31 (м, 3H), 7,26-7,21 (м, 1H), 7,13 (тт, 1H), 6,94 (дд, 2H), 6,75 (дд, 1H), 6,66 (т, 1H), 6,54 (д, 2H), 6,32 (д, 1H), 3,57 (т, 4H), 3,35 (м, 2H), 3,16-3,04 (м, 6H), 2,35 (м, 10H), 1,60 (м, 2H).
Пример 79
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(пиридин-3-илокси)бензамид
Пример 79А
Метил 4-бром-2-фторбензоат
4-Бром-2-фторбензойную кислоту (5,00 г) прибавляли к этилацетату (35 мл) и метанолу (35 мл). Медленно добавляли триметилсилилдиазометан (2М раствор в диэтиловом эфире, 12,56 мл) и перемешивали раствор при комнатной температуре в течение 30 минут. Растворитель удаляли в вакууме, а сырой продукт растворяли в этилацетате. Раствор экстрагировали 0,5М гидроксидом натрия и сушили насыщенным раствором соли, затем безводным сульфатом натрия. После фильтрования растворитель удаляли в вакууме, получая сырой продукт с чистотой, достаточной для последующего использования.
Пример 79В
Метил 4-бром-2-(пиридин-3-илокси)бензоат
Соединение примера 79А (500 мг), пиридин-3-ол (204 мг) и карбонат калия (385 мг) прибавляли к N,N-диметилацетамиду (18 мл) и нагревали смесь до 145°С в течение 2 часов, а затем до 130°С в течение 16 часов. Раствор охлаждали, прибавляли к воде (100 мл), экстрагировали 70% этилацетатом в гексанах и сушили над безводным сульфатом натрия. После фильтрования раствор концентрировали в вакууме и очищали колоночной флэш-хроматографией на силикагеле с использованием смеси 50-70% этилацетата в гексанах.
Пример 79С
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(пиридин-3-илокси)бензоат
Соединение примера 79В (367 мг), соединение примера 1В (410 мг) и трехосновный фосфат калия (379 мг) прибавляли к 1,2-диметоксиэтану (6 мл). Раствор дегазировали в вакууме и три раза продували азотом.
Прибавляли трис(дибензилиденацетон)дипалладий(0) (32,7 мг) и 2-(ди-трет-бутилфосфино)дифенил (42,6 мг) и нагревали раствор до 80°С в течение 16 часов. Раствор охлаждали, фильтровали, концентрировали и очищали колоночной флэш-хроматографией на силикагеле с использованием смеси 50-70% этилацетата в гексанах.
Пример 79D
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(пиридин-3-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 79C в примере 1E.
Пример 79Е
4-{4-[(4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(пиридин-3-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 79D в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,72 (уш.с, 1H), 8,64 (т, 1H), 8,46 (д, 1H), 8,15 (т, 2H), 7,75 (дд, 1H), 7,52-7,44 (м, 6H), 7,37 (м, 2H), 7,26-7,10 (м, 4H), 6,79 (дд, 1H), 6,50 (д, 1H), 3,87 (дд, 2H), 3,40 (с, 2H), 3,38-3,24 (м, 4H), 3,19 (уш.с, 4H), 2,37 (уш.с, 4H), 1,92 (м, 1H), 1,65 (д, 2H), 1,28 (м, 2H).
Пример 80
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(пиридин-3-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е на соединение примера 79D и соединение примера 1F на соединение примера 2А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,34 (с, 1H), 8,27 (дд, 2H), 7,51-7,44 (м, 8H), 7,41-7,29 (м, 3H), 7,27-7,19 (м, 2H), 6,78 (дд, 1H), 6,72 (т, 1H), 6,56 (д, 2H), 6,44 (д, 1H), 3,86 (дд, 2H), 3,36 (с, 2H), 3,29-3,22 (м, 2H), 3,16 (м, 4H), 2,96 (т, 2H), 2,34 (м, 4H), 1,77 (м, 1H), 1,66 (д, 2H), 1,21 (м, 2H).
Пример 81
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-{[4-({(1R)-3-(диметиламино)-1-[(фенилтио)метил]пропил}амино)-3-нитрофенил]сульфонил}-2-феноксибензамид
Пример 81А
(R)-трет-бутил 3-(((9Н-флуорен-9-ил)метокси)карбониламино)-4-гидроксибутаноат
К тетрагидрофурану (100 мл) прибавляли Fmoc-D-Asp(OtBu)-ОН (9,0 г) и N,N-диизопропилэтиламин (4,6 мл) и охлаждали до -40°С. Добавляли изобутилхлорформиат (3,1 мл) и раствор постепенно нагревали до 0°С в течение 30 минут. Раствор охлаждали до -20°С и осторожно прибавляли к нему боргидрид натрия (1,64 г, 43,6 ммоль) и метанол (10 мл). Раствор постепенно нагревали до комнатной температуры в течение двух часов, разбавляли этилацетатом (200 мл), промывали водой (100 мл) и насыщенным раствором соли (50 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали, получая сырой продукт с чистотой, достаточной для последующего использования.
Пример 81В
(R)-трет-бутил 3-(((9Н-флуорен-9-ил)метокси)карбониламино)-4-(фенилтио)бутаноат
К тетрагидрофурану (4 мл) прибавляли три-н-бутилфосфин (90 мкл) и 1,1’-(азодикарбонил)дипиперидин (91 мг), обрабатывали соединением примера 81А (90 мг) и тиофенолом (21 мг) и перемешивали при комнатной температуре в течение 18 часов. Раствор концентрировали и очищали колоночной флэш-хроматографией на силикагеле с использованием смеси 50% этилацетата в гексанах.
Пример 81С
(R)-трет-бутил 3-(2-нитро-4-сульфамоилфениламино)-4-(фенилтио)бутаноат
Соединение примера 81В (600 мг), 4-фтор-3-нитробензолсульфонамид (298 мг) и N,N-диизопропилэтиламин (3 мл) прибавляли к N,N-диметилформамиду (3 мл) и перемешивали при 60°С в течение 12 часов. Реакционную смесь разбавляли этилацетатом (100 мл), промывали водой (45 мл) и насыщенным раствором соли (10 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием смеси 30% этилацетата в хлористом метилене.
Пример 81D
(R)-3-(2-нитро-4-сульфамоилфениламино)-4-(фенилтио)масляная кислота
Соединение примера 81С (468 мг) и 4М HCl в 1,4-диоксане (10 мл) перемешивали при 50°С в течение 5 часов. Раствор концентрировали, получая сырой продукт с чистотой, достаточной для последующего использования.
Пример 81Е
(R)-N,N-диметил-3-(2-нитро-4-сульфамоилфениламино)-4-(фенилтио)бутанамид
Соединение данного примера получали, заменяя соединение примера 1Е на соединение примера 81D и соединение примера 1F на диметиламин (2М в тетрагидрофуране) в примере 1G.
Пример 81F
(R)-4-(4-(диметиламино)-1-(фенилтио)бутан-2-иламино)-3-нитробензолсульфонамид
К соединению примера 81Е (4,06 г) прибавляли боран (1М в тетрагидрофуране, 20,0 мл). Раствор перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь медленно гасили метанолом (5,0 мл) и прибавляли концентрированную водную HCl (2,0 мл). Раствор перемешивали при 80°С в течение трех часов, охлаждали до комнатной температуры, осторожно подщелачивали 4М карбонатом натрия, разбавляли этилацетатом (150 мл), промывали водой (50 мл) и насыщенным раствором соли (10 мл), сушили над безводным сульфатом магния и фильтровали. Раствор концентрировали и очищали колоночной флэш-хроматографией на силикагеле с использованием 20% метанола в хлористом метилене.
Пример 81G
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-{[4-({(1R)-3-(диметиламино)-1-[(фенилтио)метил]пропил}амино)-3-нитрофенил]сульфонил}-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F на соединение примера 81F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,33 (д, 1H), 8,28 (д, 1H), 7,61 (дд, 2H), 7,50-7,43 (м, 4H), 7,37-7,14 (м, 11H), 6,90 (т, 1H), 6,84 (д, 1H), 6,71 (д, 2H), 6,70 (дд, 1H), 6,32 (д, 1H), 4,06 (м, 1H), 3,36 (с, 2H), 3,33-3,30 (м, 2H), 3,08 (т, 4H), 2,86 (м, 2H), 2,53 (с, 6H), 2,35 (т, 4H), 2,04 (м, 2H).
Пример 82
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(пиридин-4-илокси)бензамид
Пример 82А
Метил 4-бром-2-(пиридин-4-илокси)бензоат
Соединение примера 79А (800 мг), пиридин-4-ол (359 мг) и карбонат калия (617 мг) прибавляли к N,N-диметилацетамиду (20 мл) и нагревали смесь при 125°С в течение 16 часов. Раствор концентрировали в вакууме при 48°С и очищали колоночной флэш-хроматографией на силикагеле с использованием 20% метанола в хлористом метилене.
Пример 82В
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(пиридин-4-илокси)бензоат
Соединение данного примера получали, заменяя соединение примера 79В на соединение примера 82А в примере 79С.
Пример 82С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(пиридин-4-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D на соединение примера 82B в примере 1E.
Пример 82D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(пиридин-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е на соединение примера 82С в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,40 (т, 1H), 8,37 (д, 1H), 7,76 (дд, 1H), 7,65 (д, 1H), 7,54-7,48 (м, 1H), 7,47 (с, 3H), 7,42-7,35 (м, 5H), 7,27-7,23 (м, 1H), 7,06 (дд, 1H), 6,92 (дд, 1H), 6,88 (д, 1H), 5,91 (д, 2H), 3,85 (дд, 2H), 3,39 (с, 2H), 3,34-3,25 (м, 4H), 3,19 (уш.с, 4H), 2,39 (уш.с, 4H), 1,92 (м, 1H), 1,65 (д, 2H), 1,27 (м, 2H).
Пример 83
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(пиридин-3-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 79D и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,73 (т, 1H), 8,43 (д, 1H), 8,12 (т, 2H), 7,73 (дд, 1H), 7,55 (д, 1H), 7,51-7,44 (м, 4H), 7,37 (м, 2H), 7,25-7,17 (м, 3H), 7,07 (д, 2H), 6,78 (дд, 1H), 6,47 (д, 1H), 3,65 (т, 4H), 3,47 (кв, 2H), 3,38 (с, 2H), 3,28 (м, 2H), 3,17 (уш.с, 4H), 2,57 (уш.с, 4H), 2,36 (уш.с, 4H), 1,84 (м, 2H).
Пример 84
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(пиридин-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 82С и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,55 (т, 1H), 8,37 (д, 1H), 7,77 (дд, 1H), 7,65 (д, 1H), 7,54-7,43 (м, 5H), 7,42-7,32 (м, 4H), 7,26-7,22 (м, 1H), 7,01 (д, 1H), 6,91 (дд, 1H), 6,66 (д, 1H), 5,90 (д, 2H), 3,60 (т, 4H), 3,43 (кв, 2H), 3,39 (с, 2H), 3,18 (уш.с, 4H), 2,38 (м, 10H), 1,80 (т, 2H).
Пример 85
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[2-(4-метилпиперазин-1-ил)этил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Пример 85А
4-(2-(4-метилпиперазин-1-ил)этиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 2-(4-метилпиперазин-1-ил)этанамином в примере 1F.
Пример 85В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[2-(4-метилпиперазин-1-ил)этил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 85A в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,61 (т, 1H), 8,40 (д, 1H), 7,72 (дд, 1H), 7,57 (д, 1H), 7,51-7,44 (м, 5H), 7,36 (м, 2H), 7,26-7,15 (м, 3H), 6,95 (т, 2H), 6,75 (дд, 2H), 6,71 (дд, 1H), 6,34 (д, 1H), 3,45 (кв, 2H), 3,36 (с, 2H), 3,34 (м, 2H), 3,10 (т, 4H), 2,79 (уш.с, 4H), 2,68 (т, 2H), 2,60 (уш.с, 2H), 2,49 (с, 3H), 2,35 (т, 4H).
Пример 86
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[3-(4-метилпиперазин-1-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Пример 86А
4-(3-(4-метилпиперазин-1-ил)пропиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 3-(4-метилпиперазин-1-ил)пропан-1-амином в примере 1F.
Пример 86В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[3-(4-метилпиперазин-1-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 86A в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,57 (т, 1H), 8,38 (д, 1H), 7,71 (дд, 1H), 7,59 (д, 1H), 7,50-7,44 (м, 5H), 7,36 (м, 2H), 7,27-7,15 (м, 3H), 6,98 (д, 2H), 6,91 (т, 1H), 6,73 (дд, 2H), 6,70 (дд, 2H), 6,33 (д, 1H), 3,43 (кв, 2H), 3,36 (с, 2H), 3,34 (м, 2H), 3,09 (т, 4H), 2,82 (уш.с, 4H), 2,56 (уш.с, 2H), 2,49 (с, 3H), 2,35 (т, 4H), 1,79 (т, 2H).
Пример 87
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[[3-(диметиламино)пропил](метил)амино}-3-нитрофенил}сульфонил)-2-феноксибензамид
Пример 87А
4-((3-(диметиламино)пропил(метил)амино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 3-(пирролидин-1-ил)пропан-1-амин N1,N1,N3-триметилпропан-1,3-диамином в примере 68F.
Пример 87В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[[3-(диметиламино)пропил](метил)амино}-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 87A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,01 (д, 1H), 7,68 (дд, 1H), 7,63 (д, 1H), 7,51-7,44 (м, 5H), 7,36 (м, 2H), 7,26-7,13 (м, 3H), 6,93 (т, 1H), 6,83 (м, 1H), 6,74 (дд, 2H), 6,69 (дд, 1H), 6,32 (д, 1H), 3,46 (кв, 2H), 3,36 (с, 2H), 3,08 (т, 4H), 2,83 (т, 2H), 2,77 (с, 3H), 2,60 (с, 6H), 2,36 (т, 4H), 1,86 (м, 2H).
Пример 88
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[(1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Пример 88А
4-((1-метилпиперидин-4-ил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 3-(пирролидин-1-ил)пропан-1-амин (1-метилпиперидин-4-ил)метанамином в примере 68F.
Пример 88В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[(1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 88A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,44 (т, 1H), 8,35 (д, 1H), 7,79 (дд, 1H), 7,62 (д, 1H), 7,51-7,45 (м, 5H), 7,36 (м, 2H), 7,25-7,14 (м, 3H), 6,99 (д, 1H), 6,89 (т, 1H), 6,71 (д, 2H), 6,68 (дд, 1H), 6,31 (д, 1H), 3,36 (с, 2H), 3,34 (м, 4H), 3,07 (т, 4H), 2,73 (м, 2H), 2,62 (с, 3H), 2,36 (т, 4H), 1,90-1,82 (м, 3H), 1,47-1,31 (м, 2H).
Пример 89
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 21A в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,38 (т, 1H), 8,09 (д, 1H), 7,73 (м, 1H), 7,59 (д, 1H), 7,52-7,44 (м, 5H), 7,36 (м, 2H), 7,26-7,22 (м, 1H), 7,17 (т, 1H), 7,05 (д, 1H), 6,90 (т, 1H), 6,83 (м, 1H), 6,72 (д, 2H), 6,70 (дд, 1H), 6,33 (д, 1H), 3,36 (кв, 2H), 3,36 (с, 2H), 3,24-3,12 (м, 2H), 3,09 (т, 4H), 2,80 (м, 1H), 2,59 (с, 3H), 2,36 (т, 4H), 2,08 (м, 2H), 1,77 (м, 2H).
Пример 90
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-циано-4-{[3-(диметиламино)пропил]амино}фенил)сульфонил]-2-феноксибензамид
Пример 90А
3-Циано-4-фторбензолсульфонамид
Концентрированный гидроксид аммония (28% раствор в воде, 3,17 мл) охлаждали до 0°С и прибавляли 3-циано-4-фторбензол-1-сульфонилхлорид (1,00 г). Раствор перемешивали при 0°С в течение 4 минут. Медленно добавляли 4М HCl (10 мл) и экстрагировали раствор этилацетатом. Экстракт сушили насыщенным раствором соли и над безводным сульфатом натрия и удаляли растворитель в вакууме.
Пример 90В
3-Циано-4-(3-диметиламино)пропиламино)бензолсульфонамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид соединением примера 90А и 3-(пирролидин-1-ил)пропан-1-амин N1,N1-диметилпропан-1,3-диамином в примере 68F.
Пример 90С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-циано-4-{[3-(диметиламино)пропил]амино}фенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 90В в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 7,67 (с, 1H), 7,66 (дд, 1H), 7,59 (д, 1H), 7,51-7,44 (м, 5H), 7,36 (м, 2H), 7,28-7,20 (м, 3H), 6,98 (т, 2H), 6,77 (дд, 2H), 6,70 (д, 2H), 6,33 (д, 1H), 3,36 (с, 2H), 3,27 (кв, 2H), 3,09 (т, 4H), 2,82 (т, 2H), 2,54 (с, 6H), 2,35 (т, 4H), 1,82 (м, 2H).
Пример 91
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 68F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,49 (т, 1H), 8,37 (д, 1H), 7,72 (дд, 1H), 7,62 (д, 1H), 7,50-7,43 (м, 5H), 7,35 (м, 2H), 7,26-7,14 (м, 3H), 6,97 (д, 1H), 6,90 (т, 1H), 6,72 (д, 2H), 6,69 (дд, 1H), 6,31 (д, 1H), 3,47 (кв, 2H), 3,36 (с, 2H), 3,20 (м, 2H), 3,07 (уш.с, 8H), 2,35 (уш.с, 4H), 1,95-1,83 (м, 6H).
Пример 92
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-{[4-{[3-(диметиламино)пропил]амино}-3-(трифторметил)фенил]сульфонил}-2-феноксибензамид
Пример 92А
4-Фтор-3-(трифторметил)бензолсульфонамид
Соединение данного примера получали, заменяя 3-циано-4-фторбензол-1-сульфонилхлорид на 4-фтор-3-(трифторметил)бензол-1-сульфонилхлорид в примере 90А.
Пример 92В
4-(3-(диметиламино)пропиламино)-3-(трифторметил)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид соединением примера 92А и (тетрагидропиран-4-ил)метиламин N1,N1-диметилпропан-1,3-диамином в примере 1F.
Пример 92С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-{[4-{[3-(диметиламино)пропил]амино}-3-(трифторметил)фенил]сульфонил}-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 92В в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 7,77 (с, 1H), 7,68 (дд, 1H), 7,57 (д, 1H), 7,51-7,45 (м, 5H), 7,36 (м, 2H), 7,29-7,21 (м, 3H), 6,99 (т, 1H), 6,82-6,68 (м, 5H), 6,32 (д, 1H), 3,36 (с, 2H), 3,28 (кв, 2H), 3,09 (т, 4H), 2,73 (м, 2H), 2,48 (с, 6H), 2,35 (т, 4H), 1,79 (м, 2H).
Пример 93
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-{[4-({3-[изопропил(метил)амино]пропил}амино)-3-нитрофенил]сульфонил}-2-феноксибензамид
Пример 93А
Трет-бутилметил(3-(2-нитро-4-сульфамоилфениламино)пропил)карбамат
Соединение данного примера получали, заменяя 3-(пирролидин-1-ил)пропан-1-амин трет-бутил 3-аминопропил(метил)карбаматом в примере 68F.
Пример 93В
Трет-бутил (3-(4-(N-(4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(феноксибензоил)сульфамоил)-2-нитрофениламино)пропил)(метил)карбамат
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 93А в примере 1G.
Пример 93С
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-N-(4-(3-(метиламино)пропиламино)-3-нитрофенилсульфонил)-2-феноксибензамид
Соединение примера 93B (112 мг) и триэтилсилан (0,082 мл) прибавляли к хлористому метилену (2 мл). Добавляли трифторуксусную кислоту (0,198 мл), перемешивали раствор при комнатной температуре в течение одного часа и удаляли растворитель в вакууме.
Пример 93D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-{[4-({3-[изопропил(метил)амино]пропил}амино)-3-нитрофенил]сульфонил}-2-феноксибензамид
Соединение примера 93С (128 мг), ацетон (0,014 мл) и полимерного цианоборгидрида натрия (2,15 ммоль/г, 66 мг) прибавляли к смеси тетрагидрофурана (0,9 мл) и уксусной кислоты (0,3 мл) и перемешивали раствор при комнатной температуре в течение 16 часов. Прибавляли еще ацетона (0,014 мл) и полимерного цианоборгидрида натрия (66 мг) и перемешивали раствор в течение 24 часов. Раствор очищали колоночной флэш-хроматографией на силикагеле с использованием 1% уксусной кислоты и 10% метанола в хлористом метилене.1H ЯМР (300 МГц, диметилсульфоксид-dg) δ 11,93 (уш.с, 3H), 8,53 (уш.с, 1H), 8,40 (д, 1H), 7,75 (дд, 1H), 7,60 (д, 1H), 7,51-7,45 (м, 5H), 7,36 (м, 2H), 7,25-7,16 (м, 3H), 7,02 (д, 1H), 6,92 (т, 1H), 6,74 (д, 2H), 6,70 (дд, 1H), 6,32 (д, 1H), 3,47 (м, 4H), 3,36 (с, 2H), 3,09 (т, 4H), 3,01 (уш.с, 2H), 2,58 (с, 3H), 2,35 (т, 4H), 1,94 (м, 1H), 1,18-1,14 (м, 6H).
Пример 94
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[3-(диметиламино)пропокси]-3-нитрофенил}сульфонил)-2-феноксибензамид
Пример 94А
4-(3-(Диметиламино)пропокси)-3-нитробензолсульфонамид
К тетрагидрофурану (20 мл) прибавляли трифенилфосфин (1,398 г) и охлаждали до 0°С. Добавляли диэтилазодикарбоксилат (40% раствор, 2,428 мл) и перемешивали раствор при 0°С в течение 15 минут. Прибавляли 4-гидрокси-3-нитробензолсульфонамид (1,163 г) и 3-(диметиламино)пропан-1-ол (0,567 мл) и оставляли раствор нагреваться до комнатной температуры и перемешивали в течение 16 часов. Растворитель удаляли в вакууме и перекристаллизовывали вещество с использованием 20% метанола (хлористый метилен). Перекристаллизованное твердое вещество промывали хлористым метиленом, растворяли в смеси метанол/хлористый метилен, обрабатывали триэтиламином (0,13 мл, 0,924 ммоль) и очищали колоночной флэш-хроматографией на силикагеле с использованием 10-20% метанола в хлористом метилене.
Пример 94В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[3-(диметиламино)пропокси]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 94А в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,06 (д, 1H), 7,84 (дд, 1H), 7,65 (д, 1H), 7,52-7,45 (м, 5H), 7,36 (м, 2H), 7,26-7,22 (м, 2H), 7,18 (тд, 2H), 6,89 (т, 1H), 6,69 (д, 1H), 6,68 (д, 2H), 6,32 (д, 1H), 4,25 (т, 2H), 3,36 (с, 2H), 3,13 (т, 2H), 3,08 (т, 4H), 2,75 (с, 6H), 2,36 (т, 4H), 2,11 (м, 2H).
Пример 95
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(4-метилпиперазин-1-ил)этил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 85A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,10 (с, 1H), 8,67 (т, 1H), 8,53 (д, 1H), 7,78 (дд, 1H), 7,52 (д, 1H), 7,39-7,31 (м, 4H), 7,08-7,02 (м, 3H), 6,94 (д, 1H), 6,80 (дд, 1H), 6,61 (дд, 1H), 6,36 (т, 1H), 6,14 (д, 1H), 3,42 (кв, 2H), 2,99 (т, 4H), 2,71 (с, 2H), 2,70-2,48 (м, 10H), 2,39 (с, 3H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 96
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[3-(4-метилпиперазин-1-ил)пропил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 86A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,09 (с, 1H), 8,62 (т, 1H), 8,51 (д, 1H), 7,76 (дд, 1H), 7,53 (д, 1H), 7,38-7,31 (м, 4H), 7,05 (с, 1H), 7,02 (д, 2H), 6,96 (д, 1H), 6,79 (дд, 1H), 6,60 (дд, 1H), 6,35 (т, 1H), 6,14 (д, 1H), 3,40 (кв, 2H), 2,98 (т, 4H), 2,71 (с, 2H), 2,67 (уш.с, 4H), 2,55-2,40 (м, 6H), 2,39 (с, 3H), 2,16 (м, 6H), 1,95 (с, 2H), 1,77 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 97
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 68F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,06 (с, 1H), 8,58 (т, 1H), 8,49 (д, 1H), 7,77 (дд, 1H), 7,54 (д, 1H), 7,36-7,31 (м, 4H), 7,06-7,01 (м, 3H), 6,95 (д, 1H), 6,76 (дд, 1H), 6,57 (дд, 1H), 6,35 (т, 1H), 6,14 (д, 1H), 3,44 (кв, 2H), 2,97 (уш.с, 10H), 2,71 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,90-1,80 (м, 6H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 98
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 21А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,08 (с, 1H), 8,51 (д, 1H), 8,13 (д, 1H), 7,78 (дд, 1H), 7,52 (д, 1H), 7,37-7,31 (м, 4H), 7,06-7,00 (м, 4H), 6,79 (дд, 1H), 6,59 (дд, 1H), 6,35 (т, 1H), 6,14 (д, 1H), 3,73 (м, 1H), 3,05-2,95 (м, 6H), 2,71 (с, 2H), 2,60 (м, 2H), 2,48 (с, 3H), 2,16 (м, 6H), 2,01 (м, 2H), 1,95 (с, 2H), 1,70 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 99
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[3-(4-метилпиперазин-1-ил)пропил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 86А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,16 (с, 1H), 8,59 (т, 1H), 8,45 (д, 1H), 7,72 (дд, 1H), 7,55 (д, 1H), 7,34 (д, 2H), 7,23 (т, 1H), 7,12 (д, 1H), 7,02 (д, 2H), 6,95 (д, 1H), 6,94 (т, 1H), 6,64 (дд, 1H), 6,35 (д, 1H), 6,23 (м, 2H), 3,41 (кв, 2H), 2,98 (т, 4H), 2,71 (уш.с, 6H), 2,52-2,42 (м, 6H), 2,41 (с, 3H), 2,15 (м, 6H), 1,95 (с, 2H), 1,77 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 100
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[3-(диметиламино)пропокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26C и соединение примера 1F соединением примера 94А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,03 (с, 1H), 8,23 (д, 1H), 7,91 (дд, 1H), 7,56 (д, 1H), 7,36-7,29 (м, 4H), 7,19 (д, 1H), 7,05 (д, 2H), 6,97 (с, 1H), 6,73 (дд, 1H), 6,57 (дд, 1H), 6,33 (т, 1H), 6,15 (д, 1H), 4,23 (т, 2H), 3,04 (м, 2H), 2,96 (т, 4H), 2,72 (с, 2H), 2,67 (с, 6H), 2,22-2,02 (м, 8H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 101
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(4-метилпиперазин-1-ил)этил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 85А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,18 (с, 1H), 8,64 (т, 1H), 8,47 (д, 1H), 7,73 (дд, 2H), 7,56 (д, 1H), 7,34 (д, 2H), 7,24 (т, 1H), 7,04 (д, 2H), 6,96 (д, 1H), 6,94 (д, 1H), 6,65 (дд, 1H), 6,37 (д, 1H), 6,23 (м, 2H), 3,43 (кв, 2H), 2,99 (т, 4H), 2,71 (с, 2H), 2,65 (м, 6H), 2,56 (м, 4H), 2,42 (с, 3H), 2,15 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 102
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 68F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 8,54 (т, 1H), 8,44 (д, 1H), 7,76 (дд, 1H), 7,59 (д, 1H), 7,34 (д, 2H), 7,22 (т, 1H), 7,10 (д, 1H), 7,05 (д, 2H), 6,98-6,89 (м, 2H), 6,62 (дд, 1H), 6,33 (д, 1H), 6,23 (т, 1H), 6,21 (д, 1H), 3,44 (кв, 2H), 3,10-2,91 (м, 10H), 2,71 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,92-1,79 (м, 6H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 103
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 21А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 8,44 (д, 1H), 8,11 (д, 1H), 7,75 (дд, 1H), 7,56 (д, 1H), 7,34 (д, 2H), 7,23 (т, 1H), 7,11 (д, 1H), 7,04 (д, 2H), 7,03 (д, 1H), 6,93 (т, 1H), 6,64 (дд, 1H), 6,34 (д, 1H), 6,22 (м, 2H), 3,73 (м, 1H), 3,08-2,93 (м, 6H), 2,71 (с, 2H), 2,70-2,56 (м, 2H), 2,48 (с, 3H), 2,16 (м, 6H), 2,02 (м, 2H), 1,95 (с, 2H), 1,70 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 104
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 88А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,99 (с, 1H), 8,39 (д, 1H), 8,32 (т, 1H), 7,65 (дд, 1H), 7,54 (д, 1H), 7,34 (д, 2H), 7,30-7,26 (м, 2H), 7,05 (д, 2H), 6,92 (д, 1H), 6,81 (д, 1H), 6,70 (дд, 1H), 6,53 (дд, 1H), 6,30 (т, 1H), 6,15 (д, 1H), 3,28-3,19 (м, 2H), 2,93 (т, 4H), 2,83 (м, 2H), 2,71 (с, 2H), 2,68-2,50 (м, 2H), 2,54 (с, 3H), 2,24-2,10 (м, 6H), 1,95 (уш.с, 2H), 1,68 (д, 2H), 1,59 (м, 1H), 1,38 (т, 2H), 1,32-1,17 (м, 2H), 0,92 (с, 6H).
Пример 105
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[(1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 88А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,11 (с, 1H), 8,44 (т, 1H), 8,41 (д, 1H), 7,74 (дд, 1H), 7,59 (д, 1H), 7,34 (д, 2H), 7,21 (т, 1H), 7,11-7,02 (м, 3H), 6,98-6,90 (м, 2H), 6,61 (дд, 1H), 6,31 (д, 1H), 6,23 (т, 1H), 6,20 (д, 1H), 3,20 (м, 2H), 2,95 (т, 4H), 2,71 (с, 2H), 2,62-2,49 (м, 4H), 2,55 (с, 3H), 2,16 (м, 6H), 1,95 (с, 2H), 1,86-1,78 (м, 3H), 1,42-1,31 (м, 4H), 0,92 (с, 6H).
Пример 106
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[3-(диметиламино)пропокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 94А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,10 (с, 1H), 8,16 (д, 1H), 7,90 (дд, 1H), 7,61 (д, 1H), 7,35 (д, 2H), 7,24-7,19 (м, 2H), 7,10-7,01 (м, 3H), 6,91 (т, 1H), 6,60 (дд, 1H), 6,28 (д, 1H), 6,23 (т, 1H), 6,20 (д, 1H), 4,23 (т, 2H), 3,03 (т, 2H), 2,95 (т, 4H), 2,72 (с, 2H), 2,67 (с, 6H), 2,17 (м, 6H), 2,07 (м, 2H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 107
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(4-метилпиперазин-1-ил)-3-нитрофенил]сульфонил}бензамид
Пример 107А
4-(4-Метилпиперазин-1-ил)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 3-(пирролидин-1-ил)пропан-1-амин на 1-метилпиперазин в примере 68F.
Пример 107В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(4-метилпиперазин-1-ил)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 107А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,21 (с, 1H), 8,18 (д, 1H), 7,77 (дд, 1H), 7,57 (д, 1H), 7,34 (д, 2H), 7,26 (т, 1H), 7,22 (д, 1H), 7,16 (д, 1H), 7,07-7,02 (м, 2H), 6,96 (т, 1H), 6,87 (дд, 1H), 6,39 (д, 1H), 6,25 (м, 2H), 3,16 (м, 4H), 3,01 (т, 4H), 2,73 (с, 2H), 2,66 (уш.с, 4H), 2,39 (с, 3H), 2,18 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 108
4-(4-{[2-(4-{Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[1-(2,2,2-трифторэтил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Пример 108А
3-Нитро-4-(1-(2,2,2-трифторэтил)пиперидин-4-иламино)бензолсульфонамид
4-Хлор-3-нитробензолсульфонамид (1,300 г), гидрохлорид 1-(2,2,2-трифторэтил)пиперидин-4-амина (1,201 г) и триэтиламин (2,30 мл) прибавляли к 1,4-диоксану (50 мл) и воде (5 мл) и нагревали при 90°С в течение 16 часов. Раствор концентрировали в вакууме и очищали колоночной флэш-хроматографией на силикагеле с использованием этилацетатата, с увеличением до 5% метанола в этилацетате.
Пример 108В
4-(4-{[2-(4-{Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[1-(2,2,2-трифторэтил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 108A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,24 (с, 1H), 8,50 (д, 1H), 8,25 (д, 1H), 7,71 (дд, 1H), 7,52 (д, 1H), 7,34 (д, 2H), 7,27 (т, 1H), 7,17 (д, 1H), 7,11 (д, 1H), 7,04 (д, 2H), 6,97 (т, 1H), 6,71 (дд, 1H), 6,43 (д, 1H), 6,28 (д, 1H), 6,24 (т, 1H), 3,68 (м, 1H), 3,23 (кв, 2H), 3,06 (уш.с, 4H), 2,95-2,87 (м, 2H), 2,78-2,71 (м, 2H), 2,58 (т, 2H), 2,25-2,11 (м, 6H), 1,98-1,85 (м, 4H), 1,64 (м, 2H), 1,39 (т, 2H), 0,92 (с, 6H).
Пример 109
4-(4-{[2-(4-{Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(диметиламино)-1-метилпиперидин-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Пример 109А
4-((4-(диметиламино)-1-метилпиперидин-4-ил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя гидрохлорид 1-(2,2,2-трифторэтил)пиперидин-4-амина на 4-(аминометил)-N,N,1-триметилпиперидин-4-амин в примере 108А.
Пример 109В
4-(4-{[2-(4-{Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(диметиламино)-1-метилпиперидин-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 109A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,06 (с, 1H), 8,56 (уш.с, 1H), 8,50 (д, 1H), 7,81 (дд, 1H), 7,54 (д, 1H), 7,36-7,31 (м, 4H), 7,08-7,02 (м, 4H), 6,77 (дд, 1H), 6,57 (дд, 1H), 6,34 (т, 1H), 6,13 (д, 1H), 3,50 (д, 2H), 3,04 (м, 2H), 2,96 (т, 4H), 2,87 (м, 2H), 2,71 (с, 2H), 2,58 (с, 3H), 2,28 (с, 6H), 2,16 (м, 6H), 1,98 (м, 2H), 1,95 (с, 2H), 1,65-1,54 (м, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 110
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(2,3-дигидро-1,4-бензодиоксин-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 110А
Метил 4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(2,3-дигидробензо[b][1,4]диоксин-5-илокси)бензоат
Соединение данного примера получали, заменяя соединение примера 18Е соединением примера 34А и фенол 2,3-дигидробензо[b][1,4]диоксин-5-олом в примере 18F.
Пример 110В
4-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)-2-(2,3-дигидробензо[b][1,4]диоксин-5-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 110А в примере 1E.
Пример 110С
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(2,3-дигидро-1,4-бензодиоксин-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 110В в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ м.д. 11,40 (с, 1H), 8,65 (т, 1H), 8,55 (д, 1H), 7,83 (дд, 1H), 7,46 (м, 6H), 7,36 (м, 2H), 7,23 (м, 2H), 6,77 (д, 1H), 6,70 (дд, 1H), 6,42 (м, 2H), 6,27 (д, 1H), 4,20 (с, 4H), 3,85 (дд, 2H), 3,37 (м, 4H), 3,25 (м, 2H), 3,13 (м, 4H), 2,35 (м, 4H), 1,90 (м, 1H), 1,62 (дд, 2H), 1,27 (м, 2H).
Пример 111
5-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-1,1’-дифенил-2-карбоксамид
Пример 111А
Метил 5-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)дифенил-2-карбоксилат
Соединение примера 34А (100 мг, 0,2 ммоль) в тетрагидрофуране (1,5 мл) обрабатывали фенилбороновой кислотой (36,6 мг, 0,3 ммоль), трис(дибензилиденацетон)дипалладием(0) (9,2 мг, 0,01 ммоль), тетрафторборатом три-трет-бутилфосфония (5,8 мг, 0,02 ммоль) и фторидом цезия (91 мг, 0,6 ммоль), продували азотом и перемешивали в течение ночи при температуре окружающей среды. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Концентрат очищали колоночной хроматографией на силикагеле, элюируя с градиентом от 0 до 3% метанола в CH2Cl2, получая продукт.
Пример 111В
5-(4-((4’-Хлордифенил-2-ил)метил)пиперазин-1-ил)дифенил-2-карбоновая кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 111A в примере 1E.
Пример 111С
5-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-1,1’-дифенил-2-карбоксамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 111В в примере 27H.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ м.д. 12,09 (с, 1H), 8,72 (т, 1H), 8,46 (д, 1H), 7,79 (м, 2H), 7,52 (м, 4H), 7,35 (дд, 5H), 7,16 (м, 1H), 7,04 (м, 4H), 6,91 (дд, 1H), 6,78 (м, 1H), 4,39 (м, 1H), 3,88 (м, 3H), 3,42 (м, 4H), 3,27 (м, 4H), 2,96 (м, 4H), 1,95 (м, 1H), 1,67 (м, 2H), 1,31 (м, 2H).
Пример 112
5-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-1,1’-дифенил-2-карбоксамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 111В и соединение примера 1F соединением примера 154A в примере 27H.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ м.д. 12,09 (с, 1H), 8,74 (т, 1H), 8,47 (д, 1H), 7,83 (дд, 1H), 7,70 (м, 1H), 7,40 (м, 8H), 7,27 (м, 1H), 7,20 (м, 1H), 7,07 (м, 4H), 6,91 (дд, 1H), 6,77 (м, 1H), 4,39 (м, 1H), 3,87 (м, 1H), 3,55 (м, 4H), 3,26 (м, 2H), 3,16 (м, 4H), 3,03 (м, 2H), 2,80 (м, 6H), 1,98 (м, 2H).
Пример 113
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 113А
Метил 2-фенокси-4-(пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1В пиперазином в примере 1D.
Пример 113В
Метил 4-(4-(2-бром-5-гидроксибензил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид на 2-бром-5-гидроксибензальдегид и трет-бутилпиперазин-1-карбоксилат на соединение примера 113А в примере 1А.
Пример 113С
Метил 4-(4-(2-бром-5-(2-(диметиламино)этокси)бензил)пиперазин-1-ил)-2-феноксибензоат
Смесь соединения примера 113В (170 мг), гидрохлоридной соли 2-хлор-N,N-диметилэтанамина (80 мг) и карбоната цезия (278 мг) суспендировали в безводном N,N-диметилформамиде (3 мл). реакционную смесь нагревали до 50°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли и сушили над безводным Na2SO4. Растворитель удаляли в вакууме, получая маслянистый остаток, который использовали на следующей стадии без дополнительной очистки.
Пример 113D
Метил 4-(4-((4’-хлор-4-(2-диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 68С соединением примера 113С и 4-метоксифенилбороновую кислоту 4-хлорфенилбороновой кислотой в примере 68D.
Пример 113Е
4-(4-((4’-Хлор-4-(2-диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 113D в примере 1E.
Пример 113F
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 113Е в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,69 (уш.с, 1H), 9,87 (уш.с, 1H), 8,63 (т, 1H), 8,46 (д, 1H), 7,75 (дд, 1H), 7,50 (м, 3H), 7,34-7,23 (м, 6H), 7,14 (м, 2H), 6,98 (м, 1H), 6,78 (м, 3H), 6,44 (д, 1H), 4,37 (т, 2H), 3,86 (м, 2H), 3,60-3,41 (м, 10H), 3,34 (т, 4H), 3,28 (м, 2H), 2,89 (с, 6H), 1,91 (м, 1H), 1,62 (м, 2H), 1,28 (м, 2H).
Пример 114
4-[4-{[4’-Хлор-4-(3-пиперидин-1-илпропокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 114А
Метил 4-(4-(2-бром-5-(3-пиперидин-1-ил)пропокси)бензил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя гидрохлоридную соль 2-хлор-N,N-диметилэтанамина гидрохлоридной солью 1-(3-хлорпропил)пиперидина в примере 113С.
Пример 114В
Метил 4-(4-((4’-хлор-4-(3-пиперидин-1-ил)пропокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 68С соединением примера 114А и 4-метоксифенилбороновую кислоту 4-хлорфенилбороновой кислотой в примере 68D.
Пример 114С
4-(4-((4’-Хлор-4-(3-пиперидин-1-ил)пропокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 114В в примере 1E.
Пример 114D
4-[4-{[4’-Хлор-4-(3-пиперидин-1-илпропокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 114C в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,69 (уш.с, 1H), 9,18 (уш.с, 1H), 8,63 (т, 1H), 8,46 (д, 1H), 7,75 (дд, 1H), 7,50 (м, 3H), 7,33-7,21 (м, 6H), 7,15 (д, 2H), 6,98 (м, 1H), 6,78 (м, 3H), 6,44 (д, 1H), 4,11 (т, 2H), 3,87 (дд, 2H), 3,60-3,38 (м, 10H), 3,34 (м, 4H), 3,25 (м, 4H), 2,92 (м, 2H), 2,17 (м, 2H), 1,85 (м, 3H), 1,64 (м, 6H), 1,29 (м, 2H).
Пример 115
4-[4-{[4’-Хлор-4-(2-морфолин-4-этокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 115А
Метил 4-(4-(2-бром-5-(2-морфолинэтокси)бензил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя гидрохлоридную соль 2-хлор-N,N-диметилэтанамина гидрохлоридной солью 4-(2-хлорэтил)морфолина в примере 113С.
Пример 115В
Метил 4-(4-((4’-хлор-4-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 68С соединением примера 115А и 4-метоксифенилбороновую кислоту 4-хлорфенилбороновой кислотой в примере 68D.
Пример 115С
4-(4-((4’-Хлор-4-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 115В в примере 1E.
Пример 115D
4-[4-{[4’-Хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 115C в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,66 (уш.с, 1H), 8,63 (т, 1H), 8,46 (д, 1H), 7,75 (дд, 1H), 7,50 (м, 3H), 7,31 (м, 4H), 7,23 (м, 2H), 7,15 (м, 2H), 6,98 (м, 1H), 6,78 (м, 3H), 6,44 (д, 1H), 4,41 (м, 2H), 3,87 (м, 6H), 3,60-3,38 (м, 12H), 3,36-3,25 (м, 8H), 1,91 (м, 1H), 1,64 (м, 2H), 1,29 (м, 2H).
Пример 116
4-[4-({4’-Хлор-4-[3-(диметиламино)пропокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 116А
Метил 4-(4-(2-бром-5-(3-(диметиламино)пропокси)бензил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя гидрохлоридную соль 2-хлор-N,N-диметилэтанамина гидрохлоридной солью 3-хлор-N,N-диметилпропан-1-амина в примере 113С.
Пример 116В
Метил 4-(4-((4’-хлор-4-(3-(диметиламино)пропокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 68С соединением примера 116А и 4-метоксифенилбороновую кислоту 4-хлорфенилбороновой кислотой в примере 68D.
Пример 116С
4-(4-((4’-Хлор-4-(3-(диметиламино)пропокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 116В в примере 1E.
Пример 116D
4-[4-({4’-Хлор-4-[3-(диметиламино)пропокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 116C в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,64 (уш.с, 1H), 9,52 (уш.с, 1H), 8,63 (т, 1H), 8,47 (д, 1H), 7,75 (дд, 1H), 7,50 (м, 3H), 7,34 (м, 2H), 7,23 (м, 4H), 7,14 (д, 1H), 6,98 (м, 2H), 6,78 (м, 3H), 6,42 (с, 1H), 4,09 (т, 2H), 3,86 (м, 2H), 3,50-3,36 (м, 8H), 3,28 (м, 8H), 2,83 (с, 6H), 2,12 (м, 2H), 1,91 (м, 1H), 1,62 (м, 2H), 1,29 (м, 2H).
Пример 117
4-(4-{[4’-Хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 115C и соединение примера 1F соединением примера 163A в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 8,11 (д, 1H), 7,86 (дд, 1H), 7,49 (м, 3H), 7,36-7,26 (м, 7H), 7,10 (м, 3H), 6,84 (д, 2H), 6,77 (дд, 1H), 6,41 (с, 1H), 4,38 (м, 2H), 3,84 (м, 4H), 3,55 (м, 2H), 3,50-3,30 (м, 10H), 3,28 (м, 8H), 3,20 (м, 2H), 1,86 (м, 1H), 1,55 (м, 2H), 1,26 (м, 2H).
Пример 118
4-(4-{[4’-Хлор-4-(3-пиперидин-1-илпропокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 114C и соединение примера 1F соединением примера 163A в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,65 (уш.с, 1H), 9,06 (уш.с, 1H), 8,11 (д, 1H), 7,86 (дд, 1H), 7,49 (м, 3H), 7,36-7,20 (м, 7H), 7,06 (м, 3H), 6,83 (д, 2H), 6,76 (дд, 1H), 6,41 (с, 1H), 4,10 (т, 2H), 3,85 (дд, 2H), 3,40-3,05 (м, 16H), 2,90 (м, 2H), 2,15 (м, 2H), 1,84 (м, 3H), 1,60 (м, 6H), 1,41 (м, 2H), 1,26 (м, 2H).
Пример 119
4-[4-({4’-Хлор-4-[3-(диметиламино)пропокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 116C и соединение примера 1F соединением примера 163A в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 8,11 (д, 1H), 7,86 (дд, 1H), 7,49 (м, 3H), 7,36-7,26 (м, 7H), 7,06 (м, 3H), 6,84 (д, 2H), 6,76 (дд, 1H), 6,41 (д, 1H), 4,09 (т, 2H), 3,84 (дд, 2H), 3,50-3,24 (м, 14H), 3,10 (м, 2H), 2,83 (с, 6H), 2,12 (м, 2H), 1,86 (м, 1H), 1,55 (м, 2H), 1,26 (м, 2H).
Пример 120
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 113Е и соединение примера 1F соединением примера 163A в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,75 (уш.с, 1H), 9,90 (уш.с, 1H), 8,10 (д, 1H), 7,85 (дд, 1H), 7,49 (м, 3H), 7,38-7,25 (м, 7H), 7,11 (д, 2H), 7,03 (м, 1H), 6,82 (д, 2H), 6,77 (дд, 1H), 6,44 (с, 1H), 4,37 (т, 2H), 3,85 (м, 6H), 3,55 (м, 2H), 3,29 (м, 8H), 3,10 (м, 2H), 2,89 (с, 6H), 1,86 (м, 1H), 1,55 (м, 2H), 1,24 (м, 2H).
Пример 121
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 113Е и соединение примера 1F соединением примера 68F в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,70 (уш.с, 1H), 9,95 (уш.с, 1H), 9,73 (уш.с, 1H), 8,69 (т, 1H), 8,49 (д, 1H), 7,79 (дд, 1H), 7,50 (м, 3H), 7,34 (м, 2H), 7,23 (м, 3H), 7,16 (д, 1H), 7,09 (м, 1H), 7,00 (м, 1H), 6,82 (д, 2H), 6,77 (дд, 1H), 6,42 (с, 1H), 4,37 (м, 2H), 3,70 (м, 6H), 3,54 (м, 8H), 3,21 (м, 4H), 3,19 (м, 2H), 2,88 (с, 6H), 1,97 (м, 4H), 1,85 (м, 2H).
Пример 122
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 122А
Метил 4-(4-(2-бром-6-гидроксибензил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид на 2-бром-6-гидроксибензальдегид и трет-бутил пиперазин-1-карбоксилат на соединение примера 113А в примере 1А.
Пример 122В
Метил 4-(4-((4’-хлор-3-гидроксидифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 68С соединением примера 122А и 4-метоксифенилбороновую кислоту 4-хлорфенилбороновой кислотой в примере 68D.
Пример 122С
Метил 4-(4-((4’-хлор-3-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение примера 122В (100 мг) и гидрохлоридную соль 2-хлор-N,N-диметилэтанамина (30 мг) растворяли в смеси растворителей хлористого метилена (1,5 мл) и 50% водном растворе гидроксида натрия (0,5 мл), после чего добавляли йодид тетрабутиламмония (15 мг). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. Органическую фазу сушили над Na2SO4 и концентрировали. Очистку на флэш-колонке осуществляли с использованием 0-5% смеси метанол/хлористый метилен, получая продукт.
Пример 122D
4-(4-((4’-Хлор-3-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 122C в примере 1E.
Пример 122Е
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 122D в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 10,20 (уш.с, 1H), 9,46 (уш.с, 1H), 8,65 (т, 1H), 8,47 (д, 1H), 7,78 (д, 1H), 7,75 (дд, 1H), 7,52 (м, 4H), 7,38 (м, 3H), 7,23 (м, 3H), 7,12 (м, 1H), 6,98 (м, 2H), 6,78 (д, 2H), 6,76 (дд, 1H), 6,43 (с, 1H), 4,43 (м, 2H), 3,87 (м, 2H), 3,62 (м, 4H), 3,35-3,15 (м, 12H), 2,90 (с, 6H), 1,90 (м, 1H), 1,62 (м, 2H), 1,27 (м, 2H).
Пример 123
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 122С и соединение примера 1F соединением примера 68F в примере 1G.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 10,01 (уш.с, 1H), 9,63 (уш.с, 1H), 9,32 (уш.с, 1H), 8,69 (т, 1H), 8,49 (д, 1H), 7,80 (дд, 1H), 7,52 (м, 4H), 7,38 (м, 2H), 7,25 (м, 3H), 7,15 (д, 1H), 7,01 (м, 1H), 6,95 (м, 1H), 6,81 (д, 2H), 6,76 (м, 1H), 6,41 (с, 1H), 4,43 (м, 4H), 3,56-3,51 (м, 8H), 3,20 (м, 4H), 3,10 (м, 6H), 2,91 (с, 6H), 1,98 (м, 4H), 1,85 (м, 2H).
Пример 124
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-фенокси-N-({4-[(тетрагидро-2н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 122С и соединение примера 1F соединением примера 163A в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,71 (уш.с, 1H), 9,89 (уш.с, 1H), 9,14 (уш.с, 1H), 8,11 (д, 1H), 7,86 (дд, 1H), 7,52 (м, 4H), 7,38 (м, 2H), 7,29 (м, 3H), 7,20 (м, 1H), 7,11 (д, 1H), 7,05 (м, 1H), 6,95 (м, 1H), 6,83 (д, 2H), 6,76 (дд, 1H), 6,40 (с, 1H), 4,41 (м, 2H), 3,85 (м, 2H), 3,59 (м, 4H), 3,44 (м, 2H), 3,28 (м, 8H), 3,06 (м, 2H), 2,91 (с, 6H), 1,84 (м, 1H), 1,55 (м, 2H), 1,26 (м, 2H).
Пример 125
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 125А
4’-Хлор-4-гидроксидифенил-2-карбальдегид
Соединение данного примера получали, заменяя соединение примера 68С на 2-бром-5-гидроксибензальдегид и 4-метоксифенилбороновую кислоту на 4-хлорфенилбороновую кислоту в примере 68D.
Пример 125В
4’-Хлор-4-(2-(диметиламино)этокси)дифенил-2-карбальдегид
Соединение данного примера получали, заменяя соединение примера 122В соединением примера 125А в примере 122С.
Пример 125С
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-4-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 125В и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 125D
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-4-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 125C в примере 1E.
Пример 125Е
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 125D в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,46 (уш.с, 1H), 11,25 (с, 1H), 9,80 (уш.с, 1H), 8,60 (т, 1H), 8,48 (д, 1H), 7,65 (дд, 1H), 7,55 (д, 1H), 7,46 (д, 2H), 7,28 (м, 5H), 7,15 (д, 1H), 7,10 (м, 1H), 7,04 (д, 1H), 6,94 (м, 1H), 6,73 (дд, 1H), 6,36 (м, 2H), 6,26 (м, 1H), 4,35 (т, 2H), 3,85 (м, 6H), 3,54 (м, 4H), 3,31 (м, 6H), 3,06 (м, 2H), 2,88 (с, 6H), 1,88 (м, 1H), 1,60 (м, 2H), 1,28 (м, 2H).
Пример 126
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 126А
Метил 2-(1Н-индол-5-илокси)-4-(4-((4’-хлор-4-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 125В и трет-бутил пиперазин-1-карбоксилат соединением примера 150А в примере 1А.
Пример 126В
2-(1Н-Индол-5-илокси)-4-(4-((4’-хлор-4-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 126А в примере 1E.
Пример 126С
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 126В в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,35 (уш.с, 1H), 11,17 (с, 1H), 9,85 (уш.с, 1H), 8,61 (т, 1H), 8,57 (д, 1H), 7,77 (дд, 1H), 7,54 (д, 1H), 7,46 (д, 2H), 7,38 (м, 2H), 7,30 (м, 4H), 7,09 (м, 3H), 6,84 (дд, 1H), 6,69 (дд, 1H), 6,36 (м, 1H), 6,26 (м, 1H), 4,35 (т, 2H), 3,85 (м, 6H), 3,54 (м, 4H), 3,31 (м, 6H), 3,06 (м, 2H), 2,88 (с, 6H), 1,88 (м, 1H), 1,60 (м, 2H), 1,28 (м, 2H).
Пример 127
4-(4-{[4’-Хлор-4-[2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 127А
4’-Хлор-4-(2-морфолинэтокси)дифенил-2-карбальдегид
Соединение данного примера получали, заменяя соединение примера 122В соединением примера 125А и гидрохлоридную соль 2-хлор-N,N-диметилэтанамина гидрохлоридной солью 4-(2-хлорэтил)морфолина в примере 122С.
Пример 127В
Метил 2-(1Н-индол-5-илокси)-4-(4-((4’-хлор-4-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 127А и трет-бутил пиперазин-1-карбоксилат соединением примера 150А в примере 1А.
Пример 127С
2-(1Н-Индол-5-илокси)-4-(4-((4’-хлор-4-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 127В в примере 1E.
Пример 127D
4-(4-{[4’-Хлор-4-[2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 127C в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,35 (уш.с, 1H), 11,17 (с, 1H), 8,61 (т, 1H), 8,57 (д, 1H), 7,77 (дд, 1H), 7,54 (д, 1H), 7,46 (д, 2H), 7,38 (м, 2H), 7,29 (м, 4H), 7,09 (м, 3H), 6,84 (дд, 1H), 6,69 (дд, 1H), 6,36 (м, 1H), 6,26 (д, 1H), 4,39 (т, 2H), 3,85 (м, 6H), 3,54 (м, 10H), 3,31 (м, 8H), 3,06 (м, 2H), 1,88 (м, 1H), 1,60 (м, 2H), 1,27 (м, 2H).
Пример 128
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 128А
4’-Хлор-3-гидроксидифенил-2-карбальдегид
Соединение данного примера получали, заменяя соединение примера 68С на 2-бром-6-гидроксибензальдегид и 4-метоксифенилбороновую кислоту на 4-хлорфенилбороновую кислоту в примере 68D.
Пример 128В
4’-Хлор-3-(2-(диметиламино)этокси)дифенил-2-карбальдегид
Соединение данного примера получали, заменяя соединение примера 122В соединением примера 128А в примере 122С.
Пример 128С
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-3-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 128В и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 128D
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-3-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 128С в примере 1E.
Пример 128Е
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 128D в примере 27H.1Н ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,15 (с, 1H), 8,47 (т, 1H) 8,45 (д, 1H), 7,68 (дд, 1H), 7,57 (д, 1H), 7,50 (д, 2H), 7,42 (д, 2H), 7,32 (м, 1H), 7,24 (м, 1H), 7,12 (д, 1H), 7,05 (д, 1H), 6,94 (м, 2H), 6,84 (д, 1H), 6,66 (дд, 1H), 6,35 (д, 1H), 6,25 (м, 2H), 4,17 (т, 2H), 3,85 (м, 2H), 3,54 (м, 10H), 3,40 (м, 6H), 3,30 (с, 6H), 3,02 (м, 2H), 2,96 (м, 4H), 2,28 (м, 4H), 1,88 (м, 1H), 1,60 (м, 2H), 1,28 (м, 2H).
Пример 129
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 129А
Метил 2-(1Н-индол-5-илокси)-4-(4-((4’-хлор-3-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 128В и трет-бутил пиперазин-1-карбоксилат соединением примера 150А в примере 1А.
Пример 129В
2-(1Н-Индол-5-илокси)-4-(4-((4’-хлор-3-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 129А в примере 1E.
Пример 129С
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 129В в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,38 (уш.с, 1H), 11,19 (с, 1H), 10,00 (уш.с, 1H), 8,61 (т, 1H), 8,58 (д, 1H), 7,79 (дд, 1H), 7,53 (м, 4H), 7,39 (м, 4H), 7,19 (м, 1H), 7,11 (м, 2H), 6,93 (д, 1H), 6,84 (дд, 1H), 6,69 (дд, 1H), 6,39 (м, 1H), 6,19 (д, 1H), 4,40 (м, 2H), 3,85 (м, 8H), 3,58 (м, 2H), 3,27 (м, 6H), 3,06 (м, 2H), 2,89 (с, 6H), 1,89 (м, 1H), 1,60 (м, 2H), 1,27 (м, 2H).
Пример 130
4-(4-{[4’-Хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 130А
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-4-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 127А и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 130В
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-4-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 130А в примере 1E.
Пример 130С
4-(4-{[4’-Хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 130В в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,47 (уш.с, 1H), 11,23 (с, 1H), 8,59 (т, 1H), 8,47 (д, 1H), 7,63 (дд, 1H), 7,54 (д, 1H), 7,47 (д, 2H), 7,27 (м, 6H), 7,13 (м, 2H), 7,03 (м, 1H), 6,93 (м, 1H), 6,74 (дд, 1H), 6,35 (м, 1H), 6,24 (м, 1H), 4,39 (т, 2H), 3,85 (м, 6H), 3,54 (м, 10H), 3,26 (м, 10H), 1,88 (м, 1H), 1,59 (м, 2H), 1,27 (м, 2H).
Пример 131
4-(4-{[4’-Хлор-3-[2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 131А
4’-Хлор-3-(2-морфолинэтокси)дифенил-2-карбальдегид
Соединение данного примера получали, заменяя соединение примера 122В соединением примера 128А и гидрохлоридную соль 2-хлор-N,N-диметилэтанамина на гидрохлоридную соль 4-(2-хлорэтил)морфолина в примере 122С.
Пример 131В
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-3-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 131А и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 131С
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-3-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 131В в примере 1E.
Пример 131D
4-[4-{[4’-Хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 131С в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,49 (уш.с, 1H), 11,25 (с, 1H), 8,59 (т, 1H), 8,50 (д, 1H), 7,68 (дд, 1H), 7,52 (м, 4H), 7,34 (д, 2H), 7,28 (м, 1H), 7,18 (м, 2H), 7,06 (д, 1H), 6,94 (м, 2H), 6,73 (дд, 1H), 6,40 (д, 1H), 6,33 (д, 1H), 6,24 (м, 1H), 4,43 (т, 2H), 3,85 (м, 10H), 3,61 (м, 6H), 3,27 (м, 8H), 3,02 (м, 2H), 1,88 (м, 1H), 1,60 (м, 2H), 1,28 (м, 2H).
Пример 132
4-[4-{[4’-Хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 132А
Метил 2-(1Н-индол-5-илокси)-4-(4-((4’-хлор-3-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 131А и трет-бутил пиперазин-1-карбоксилат соединением примера 150А в примере 1А.
Пример 132В
2-(1Н-Индол-5-илокси)-4-(4-((4’-хлор-3-(2-морфолинэтокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 132А в примере 1E.
Пример 132С
4-[4-{[4’-Хлор-3-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 132В в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,34 (уш.с, 1H), 11,17 (с, 1H), 8,60 (т, 1H), 8,58 (д, 1H), 7,79 (дд, 1H), 7,50 (м, 4H), 7,39 (м, 4H), 7,19 (д, 1H), 7,14 (д, 1H), 7,09 (д, 1H), 6,93 (д, 1H), 6,84 (дд, 1H), 6,69 (дд, 1H), 6,39 (м, 1H), 6,19 (д, 1H), 4,40 (м, 2H), 3,85 (м, 6H), 3,48 (м, 8H), 3,27 (м, 10H), 3,06 (м, 2H), 1,89 (м, 1H), 1,60 (м, 2H), 1,27 (м, 2H).
Пример 133
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 113D и соединение примера 1F соединением примера 21A в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 8,34 (д, 1H), 8,05 (д, 1H), 7,69 (дд, 1H), 7,59 (д, 1H), 7,42 (м, 4H), 7,14 (м, 3H), 7,09 (д, 1H), 6,98 (д, 1H), 6,92 (дд, 1H), 6,87 (м, 1H), 6,84 (м, 3H), 6,30 (д, 1H), 4,16 (т, 2H), 3,07 (м, 6H), 2,95 (м, 4H), 2,56 (м, 2H), 2,45 (с, 3H), 2,35 (м, 4H), 2,03 (м, 2H), 1,68 (м, 2H).
Пример 134
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 129В и соединение примера 1F соединением примера 68F в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,34 (уш.с, 1H), 11,17 (с, 1H), 9,65 (уш.с, 1H), 8,63 (т, 1H), 8,60 (д, 1H), 7,86 (дд, 1H), 7,53 (д, 2H), 7,41 (м, 6H), 7,15 (м, 3H), 6,92 (м, 1H), 6,84 (дд, 1H), 6,66 (дд, 1H), 6,38 (м, 1H), 6,16 (д, 1H), 4,37 (м, 2H), 3,50 (м, 12H), 3,17 (м, 4H), 2,97 (м, 4H), 2,88 (с, 6H), 1,95 (м, 4H), 1,85 (м, 2H).
Пример 135
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 126В и соединение примера 1F соединением примера 68F в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,29 (уш.с, 1H), 11,16 (с, 1H), 9,56 (уш.с, 1H), 8,63 (т, 1H), 8,60 (д, 1H), 7,85 (дд, 1H), 7,53 (д, 1H), 7,41 (м, 4H), 7,32 (м, 3H), 7,24 (м, 1H), 7,12 (м, 3H), 6,84 (дд, 1H), 6,66 (дд, 1H), 6,38 (м, 1H), 6,18 (д, 1H), 4,33 (т, 2H), 3,50 (м, 12H), 3,17 (м, 4H), 2,97 (м, 4H), 2,86 (с, 6H), 1,95 (м, 4H), 1,85 (м, 2H).
Пример 136
4-(4-{[4’-Хлор-4-(2-морфолин-4-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 127C и соединение примера 1F соединением примера 68F в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,29 (уш.с, 1H), 11,16 (с, 1H), 9,54 (уш.с, 1H), 8,63 (т, 1H), 8,60 (д, 1H), 7,85 (дд, 1H), 7,53 (д, 1H), 7,45 (д, 2H), 7,38 (м, 2H), 7,3l (д, 2H), 7,23 (м, 2H), 7,12 (м, 3H), 6,84 (дд, 1H), 6,66 (дд, 1H), 6,38 (м, 1H), 6,18 (д, 1H), 4,36 (т, 2H), 3,82 (м, 4H), 3,50 (м, 8H), 3,17 (м, 10H), 2,98 (м, 4H), 1,95 (м, 6H), 1,85 (м, 2H).
Пример 137
4-[4-({4’-Хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-[(3-нитро-4-{[1-(2,2,2-трифторэтил)пиперидин-4-ил]амино}фенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 113Е и соединение примера 1F соединением примера 108А в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,71 (уш.с, 1H), 9,81 (уш.с, 1H), 8,46 (д, 1H), 8,29 (д, 1H), 7,75 (дд, 1H), 7,50 (м, 3H), 7,30 (м, 4H), 7,21 (м, 3H), 7,10 (м, 1H), 6,97 (м, 1H), 6,77 (м, 3H), 6,43 (с, 1H), 4,36 (т, 2H), 3,72 (м, 2H), 3,58 (м, 4H), 3,23 (м, 6H), 2,95 (м, 4H), 2,89 (с, 6H), 2,60 (м, 2H), 1,92 (м, 2H), 1,68 (м, 2H).
Пример 138
4-(4-{[4’-Хлор-4-(2-пирролидин-1-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 138А
Метил 4-(4-((4’-хлор-4-гидроксидифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 68С соединением примера 113В и 4-метоксифенилбороновую кислоту 4-хлорфенилбороновой кислотой в примере 68D.
Пример 138В
Метил 4-(4-((4’-хлор-4-(2-(пирролидин-1-ил)этокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 113В соединением примера 138А и гидрохлоридную соль 2-хлор-N,N-диметилэтанамина HCl солью 1-(2-хлорэтил)пирролидина в примере 113С.
Пример 138С
4-(4-((4’-хлор-4-(2-(пирролидин-1-ил)этокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 138В в примере 1E.
Пример 138D
4-(4-{[4’-Хлор-4-(2-пирролидин-1-илэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 138С в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,64 (уш.с, 1H), 9,98 (уш.с, 1H), 8,62 (д, 1H), 8,47 (д, 1H), 7,75 (дд, 1H), 7,50 (м, 3H), 7,26 (м, 6H), 7,14 (м, 2H), 6,99 (м, 1H), 6,81 (д, 2H), 6,77 (дд, 1H), 6,43 (д, 1H), 4,36 (т, 2H), 3,86 (дд, 2H), 3,62 (м, 8H), 3,28 (м, 8H), 3,10 (м, 4H), 2,04 (м, 2H), 1,90 (м, 3H), 1,65 (м, 2H), 1,29 (м, 2H).
Пример 139
4-[4-({4’-Хлор-4-[2-(диизопропиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 139А
Метил 4-(4-((4’-хлор-4-(2-(диизопропиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоат
Соединение данного примера получали, заменяя соединение примера 113В соединением примера 138А и гидрохлоридную соль 2-хлор-N,N-диметилэтанамина гидрохлоридной солью 2-диизопропиламиноэтилхлорида в примере 113С.
Пример 139В
4-(4-((4’-хлор-4-(2-(диизопропиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 139А в примере 1E.
Пример 139С
4-[4-({4’-Хлор-4-[2-(диизопропиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 139В в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,65 (уш.с, 1H), 8,75 (уш.с, 1H), 8,62 (д, 1H), 8,47 (д, 1H), 7,75 (дд, 1H), 7,50 (м, 3H), 7,31 (м, 4H), 7,23 (м, 2H), 7,13 (м, 2H), 6,99 (м, 1H), 6,79 (м, 3H), 6,44 (м, 1H), 4,31 (т, 2H), 3,86 (дд, 2H), 3,62 (м, 10H), 3,28 (м, 6H), 1,91 (м, 1H), 1,62 (м, 2H), 1,32 (м, 14H).
Пример 140
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(2,3-дигидро-1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Суспензию соединения примера 40D (22,57 мг) и цианоборгидрида натрия (25 мг) в уксусной кислоте (5 мл) перемешивали при комнатной температуре в течение 2 часов. Продукт распределяли между хлористым метиленом и водой. Органический слой отделяли, сушили над Na2SO4 и концентрировали. Сырой продукт очищали ВЭЖХ ОФ (C8, 30-100 ацетонитрил/вода/0,1% трифторуксусная кислота).1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,56 (с, 1H), 9,60 (с, 1H), 8,66 (т, 1H), 8,57 (д, 1H), 7,85 (дд, 1H), 7,71 (с, 1H), 7,46-7,60 (м, 5H), 7,29-7,42 (м, 3H), 7,25 (д, 1H), 6,95 (с, 1H), 6,82 (с, 1H), 6,73 (д, 1H), 6,36 (с, 1H), 4,32 (уш.с, 2H), 3,85 (дд, 4H), 3,59 (т, 4H), 3,35 (т, 2H), 3,27 (т, 2H), 3,02 (т, 4H), 1,80-1,99 (м, 1H), 1,62 (д, 2H), 1,15-1,36 (м, 2H).
Пример 141
4-(4-{[2-(4-Хлорфенил)циклогепт-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 141А
(Z)-метил 2-(трифторметилсульфонилокси)циклогепт-1-енкарбоксилат
Соединение данного примера получали, заменяя 5,5-диметил-2-метоксикарбонилциклогексанон на метил 2-оксоциклогептанкарбоксилат в примере 18А.
Пример 141В
(Z)-метил 2-(4-хлорфенил)циклогепт-1-енкарбоксилат
Соединение данного примера получали, заменяя соединение примера 18А соединением примера 141А в примере 18В.
Пример 141С
(Z)-(2-(4-хлорфенил)циклогепт-1-енил)метанол
Соединение данного примера получали, заменяя соединение примера 18В соединением примера 141В в примере 18С.
Пример 141D
(Z)-2-(4-хлорфенил)циклогепт-1-енкарбальдегид
Соединение данного примера получали, заменяя соединение примера 143С соединением примера 141С в примере 143D.
Пример 141Е
(Z)-этил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)циклогепт-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 141D и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 141F
(Z)-2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)циклогепт-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 143Е соединением примера 141Е в примере 143F.
Пример 141G
4-(4-{[2-(4-Хлорфенил)циклогепт-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 141F и соединение примера 1F соединением примера 68F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,45 (м, 1H), 10,03 (м, 1H), 8,58 (м, 2H), 8,30 (м, 1H), 7,26 (м, 11H), 6,25 (м, 2H), 3,14 (м, 12H), 2,73 (м, 5H), 1,94 (м, 12H), 1,54 (м, 5H).
Пример 142
4-(4-{[2-(4-Хлорфенил)циклоокт-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 142А
(Z)-этил 2-(трифторметилсульфонилокси)циклоокт-1-енкарбоксилат
Соединение данного примера получали, заменяя 5,5-диметил-2-метоксикарбонилциклогексанон на этил 2-оксоциклооктанкарбоксилат в примере 18А.
Пример 142В
(Z)-этил 2-(4-хлорфенил)циклоокт-1-енкарбоксилат
Соединение данного примера получали, заменяя соединение примера 18А соединением примера 142А в примере 18В.
Пример 142С
(Z)-(2-(4-хлорфенил)циклоокт-1-енил)метанол
Соединение данного примера получали, заменяя соединение примера 18В соединением примера 142В в примере 18С.
Пример 142D
(Z)-2-(4-хлорфенил)циклоокт-1-енкарбальдегид
Соединение данного примера получали, заменяя соединение примера 143С соединением примера 142С в примере 143D.
Пример 142Е
(Z)-этил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)циклоокт-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 142D и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 142F
(Z)-2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)циклоокт-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 143Е соединением примера 142Е в примере 143F.
Пример 142G
4-(4-{[2-(4-Хлорфенил)циклоокт-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 142F и соединение примера 1F соединением примера 68F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,51 (м, 1H), 10,01 (м, 1H), 8,58 (м, 2H), 7,26 (м, 12H), 6,35 (м, 2H), 3,14 (м, 13H), 2,73 (м, 5H), 1,88 (м, 7H), 1,45 (м, 10H).
Пример 143
4-(4-{[2-(4-Хлорфенил)циклопент-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Пример 143А
Этил 2-(трифторметилсульфонилокси)циклопент-1-енкарбоксилат
Соединение данного примера получали, заменяя 5,5-диметил-2-метоксикарбонилциклогексанон на этил 2-оксоциклопентанкарбоксилат в примере 18А.
Пример 143В
Этил 2-(4-хлорфенил)циклопент-1-енкарбоксилат
Соединение данного примера получали, заменяя соединение примера 18А соединением примера 143А в примере 18В.
Пример 142С
(2-(4-Хлорфенил)циклопент-1-енил)метанол
Соединение данного примера получали, заменяя соединение примера 18В соединением примера 143В в примере 18С.
Пример 143D
2-(4-Хлорфенил)циклопент-1-енкарбальдегид
К раствору оксалилхлорида (1,1 г) в хлористом метилене (30 мл) при -78°С прибавляли диметилсульфоксид (6,12 мл). Смесь перемешивали при -78°С в течение 30 минут, а затем прибавляли раствор соединения примера 143С (1,2 г) в хлористом метилене (10 мл). Смесь перемешивали при -78°С в течение 2 часов перед добавлением триэтиламина (10 мл). Смесь перемешивали в течение ночи и давали температуре подняться до комнатной температуры. Смесь разбавляли эфиром (300 мл) и промывали водой, насыщенным раствором соли и сушили над Na2SO4. Растворитель выаривали и очищали на колонке (5% этилацетата в гексане) с получением продукта.
Пример 143Е
Этил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)циклопент-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 143D и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 143F
2-(1Н-Индол-4-илокси)-4-(4-((2-(4-хлорфенил)циклопент-1-енил)метил)пиперазин-1-ил)бензойная кислота
К раствору соединения примера 143Е (254 мг) в тетрагидрофуране (4 мл), метаноле (2 мл) и воде (2 мл) прибавляли LiOH-H2O (126 мг). Смесь перемешивали в течение ночи. Затем смесь нейтрализовывали 5% HCl и разбавляли этилацетатом (200 мл). После промывания насыщенным раствором соли ее сушили над Na2SO4. Растворитель выпаривали с получением продукта.
Пример 143G
4-(4-{[2-(4-Хлорфенил)циклопент-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3-пирролидин-1-илпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 143F и соединение примера 1F соединением примера 68F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ м.д. 11,41 (м, 1H), 10,19 (м, 1H), 8,58 (м, 2H), 7,26 (м, 14H), 6,33 (м, 2H), 3,80 (м, 4H), 3,13 (м, 12H), 2,69 (м, 5H), 1,95 (м, 7H).
Пример 144
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклопент-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 144А
Метил 4,4-диметил-2-оксоциклопентанкарбоксилат
Данное соединение получали в соответствии с WO 2006/035061 (страница 53).
Пример 144В
Метил 4,4-диметил-2-(трифторметилсульфонилокси)циклопент-1-енкарбоксилат
Соединение данного примера получали, заменяя 5,5-диметил-2-метоксикарбонилциклогексанон на этил 2-оксоциклопентанкарбоксилат в примере 18А.
Пример 144С
Этил 2-(4-хлорфенил)-4,4-диметилциклопент-1-енкарбоксилат
Соединение данного примера получали, заменяя соединение примера 18А соединением примера 144В в примере 18В.
Пример 144D
(2-(4-Хлорфенил)-4,4-диметилциклопент-1-енил)метанол
Соединение данного примера получали, заменяя соединение примера 18В соединением примера 144С в примере 18С.
Пример 144Е
2-(4-Хлорфенил)-4,4-диметилциклопент-1-енкарбальдегид
Соединение данного примера получали, заменяя соединение примера 143С соединением примера 144D в примере 143D.
Пример 144F
Этил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклопент-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 144Е и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 144G
2-(1Н-Индол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклопент-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 143Е соединением примера 144F в примере 143F.
Пример 144Н
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклопент-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 144G и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,59 (м, 1H), 11,25 (с, 1H), 9,53 (м, 1H), 8,50 (д, 1H), 8,16 (д, 1H), 8,16 (д, 1H), 7,80 (м, 1H), 7,56 (д, 1H), 7,26 (м, 7H), 6,95 (м, 1H), 6,77 (дд, 1H), 6,41 (м, 2H), 6,23 (с, 1H), 2,87 (м, 10H), 2,28 (м, 12H), 1,11 (м, 6H).
Пример 145
4-(4-{[4-(4-Хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 145А
Метил 6,6-диметил-4-оксотетрагидро-2Н-пиран-3-карбоксилат
К суспензии промытого гексаном NaH (0,72 г, 60%) в тетрагидрофуране (30 мл) прибавляли раствор 2,2-диметилдигидро-2Н-пиран-4(3Н)-она (2,0 г) в тетрагидрофуране (20 мл). Суспензию перемешивали в течение 30 минут. Прибавляли по каплям из шприца диметилкарбонат (6,31 мл). Смесь нагревали при кипении с обратным холодильником в течение 4 часов. Смесь подкисляли 5% HCl и экстрагировали хлористым метиленом (3×100 мл) и промывали водой, насыщенным раствором соли и сушили над Na2SO4. После упаривания сырой продукт загружали на колонку и элюировали 10% этилацетата в гексане, получая продукт.
Пример 145В
Метил 6,6-диметил-4-(трифторметилсульфонилокси)-5,6-дигидро-2Н-пиран-3-карбоксилат
Соединение данного примера получали, заменяя 5,5-диметил-2-метоксикарбонилциклогексанон на соединение примера 145А в примере 18А.
Пример 145С
Метил 4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-карбоксилат
Соединение данного примера получали, заменяя соединение примера 18А соединением примера 145В в примере 18В.
Пример 145D
4-(4-Хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метанол
Соединение данного примера получали, заменяя соединение примера 18В соединением примера 145С в примере 18С.
Пример 145Е
4-(4-Хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-карбальдегид
Соединение данного примера получали, заменяя соединение примера 143С соединением примера 145D в примере 143D.
Пример 145F
Этил 2-(1Н-индол-4-илокси)-4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 145Е и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 146G
2-(1Н-Индол-4-илокси)-4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 143Е соединением примера 145F в примере 143F.
Пример 145Н
4-(4-{[4-(4-Хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 145G и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,56 (м, 1H), 11,26 (с, 1H), 9,52 (м, 1H), 8,51 (м, 1H), 8,16 (д, 1H), 7,80 (дд, 1H), 7,55 (д, 1H), 7,41 (д, 2H), 7,28 (т, 1H), 7,17 (м, 4H), 6,96 (м, 2H), 6,74 (д, 1H), 6,39 (м, 2H), 6,23 (с, 1H), 4,18 (с, 2H), 3,85 (м, 3H), 2,93 (м, 10H), 2,10 (м, 7H), 1,22 (с, 6H).
Пример 146
4-(4-{[2-(4-Хлорфенил)циклоокт-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 142F и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,59 (с, 1H), 11,25 (с, 1H), 9,36 (м, 2H), 8,50 (д, 1H), 8,16 (д, 1H), 7,79 (дд, 1H), 7,55 (д, 1H), 7,40 (д, 2H), 7,28 (м, 1H), 7,14 (м, 5H), 6,96 (т, 1H), 6,74 (дд, 1H), 6,38 (м, 2H), 6,23 (с, 1H), 2,91 (м, 14H), 2,27 (м, 6H), 1,49 (м, 11H).
Пример 147
4-(4-{[2-(4-Хлорфенил)циклогепт-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 141F и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,60 (с, 1H), 11,26 (с, 1H), 9,32 (м, 2H), 8,51 (м, 1H), 8,16 (д, 1H), 7,79 (м, 1H), 7,55 (д, 1H), 7,39 (д, 2H), 7,29 (т, 1H), 7,14 (м, 4H), 6,97 (т, 1H), 6,75 (дд, 1H), 6,40 (м, 2H), 6,22 (с, 1H), 2,94 (м, 17H), 2,27 (м, 4H), 1,80 (м, 4H), 1,55 (м, 5H).
Пример 148
4-(4-{[2-(4-Хлорфенил)циклопент-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 143F и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,60 (с, 1H), 11,26 (с, 1H), 9,47 (м, 2H), 8,51 (м, 1H), 8,16 (д, 1H), 7,77 (м, 1H), 7,56 (д, 1H), 7,43 (д, 2H), 7,20 (м, 6H), 6,96 (т, 1H), 6,77 (дд, 1H), 6,41 (м, 2H), 6,24 (с, 1H), 2,93 (м, 17H), 2,01 (м, 8H).
Пример 149
4-(4-{[2-(4-Хлорфенил)циклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 149А
Этил 2-(трифторметилсульфонилокси)циклогекс-1-енкарбоксилат
Данное соединение получали, заменяя 5,5-диметил-2-метоксикарбонилциклогексанон на этил 2-оксоциклогексанкарбоксилат в примере 18А.
Пример 149В
Этил 2-(4-хлорфенил)циклогекс-1-енкарбоксилат
Соединение данного примера получали, заменяя соединение примера 18А соединением примера 149А в примере 18В.
Пример 149С
2-(4-Хлорфенил)циклогекс-1-енил)метанол
Соединение данного примера получали, заменяя соединение примера 18В соединением примера 149В в примере 18С.
Пример 149D
2-(4-Хлорфенил)циклогекс-1-енкарбальдегид
Соединение данного примера получали, заменяя соединение примера 143С соединением примера 149С в примере 143D.
Пример 149Е
Этил 2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Указанное в заголовке соединение получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 149D и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 149F
2-(1Н-Индол-4-илокси)-4-(4-((2-(4-хлорфенил)циклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 143Е соединением примера 149Е в примере 143F.
Пример 149G
4-(4-{[2-(4-Хлорфенил)циклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 149F и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 8,44 (д, 1H), 8,10 (д, 1H), 7,74 (дд, 1H), 7,56 (д, 1H), 7,34 (д, 2H), 7,23 (м, 1H), 7,01 (м, 5H), 6,63 (дд, 1H), 6,34 (д, 1H), 6,22 (м, 2H), 3,74 (м, 1H), 3,03 (м, 7H), 2,67 (м, 5H), 2,07 (м, 11H), 1,67 (м, 7H).
Пример 150
4-(4-{[4-(4-Хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 150А
Метил 2-(1Н-индол-5-илокси)-4-(пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1С соединением примера 26А и соединение примера 1В пиперазином в примере 1D.
Пример 150В
Метил 2-(1Н-индол-5-илокси)-4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 145Е и трет-бутил пиперазин-1-карбоксилат соединением примера 150А в примере 1А.
Пример 150С
2-(1Н-Индол-5-илокси)-4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 143Е соединением примера 150В в примере 143F.
Пример 150D
4-(4-{[4-(4-Хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 150С и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,00 (с, 1H), 8,42 (д, 1H), 8,07 (д, 1H), 7,67 (дд, 1H), 7,52 (д, 1H), 7,37 (д, 2H), 7,29 (м, 1H), 7,14 (д, 2H), 6,93 (д, 1H), 6,86 (д, 1H), 6,72 (дд, 1H), 6,55 (дд, 1H), 6,31 (с, 1H), 6,15 (д, 1H), 5,85 (м, 3H), 4,11 (с, 2H), 3,00 (м, 8H), 2,82 (с, 2H), 2,73 (м, 3H), 2,23 (м, 8H), 1,57 (м, 2H), 1,18 (с, 6H).
Пример 151
4-(4-{[2-(4-Хлорфенил)циклогепт-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 151А
(Z)-метил 2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)циклогепт-1-енил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 141D и трет-бутил пиперазин-1-карбоксилат соединением примера 150А в примере 1А.
Пример 151В
(Z)-2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)циклогепт-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 143Е соединением примера 151А в примере 143F.
Пример 151С
4-(4-{[2-(4-Хлорфенил)циклогепт-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 151В и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,06 (с, 1H), 8,48 (д, 1H), 8,11 (д, 1H), 7,74 (дд, 1H), 7,52 (д, 1H), 7,33 (м, 4H), 7,01 (м, 4H), 6,76 (дд, 1H), 6,58 (дд, 1H), 6,34 (с, 1H), 6,14 (д, 1H), 5,75 (с, 1H), 3,69 (м, 1H), 2,96 (м, 6H), 2,71 (м, 2H), 2,36 (м, 8H), 2,21 (с, 5H), 1,98 (м, 2H), 1,63 (м, 8H).
Пример 152
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 18G и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 8,43 (м, 1H), 8,18 (д, 1H), 7,82 (дд, 1H), 7,52 (д, 1H), 7,40 (м, 2H), 7,22 (м, 3H), 7,11 (м, 2H), 7,01 (т, 1H), 6,79 (м, 3H), 6,45 (д, 1H), 3,06 (м, 14H), 2,20 (м, 4H), 2,04 (с, 3H), 1,85 (м, 2H), 1,47 (м, 2H), 0,96 (с, 6H).
Пример 153
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[2-(диметиламино)этил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Пример 153А
4-(2-Диметиламино)этиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на N,N-диметилэтилендиамин в примере 1F.
Пример 153В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[2-(диметиламино)этил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 153А и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,75 (уш.с, 1H), 9,78 (уш.с, 1H), 9,44 (уш.с, 1H), 8,66 (т, 1H), 8,49 (д, 1H), 7,83 (д, 1H), 7,70 (м, 2H), 7,51 (м, 4H), 7,38 (д, 2H), 7,33 (м, 1H), 7,24 (д, 2H), 7,18 (д, 1H), 7,02 (дд, 1H), 6,81 (д, 2H), 6,76 (д, 1H), 6,44 (с, 1H), 4,30 (м, 1H), 3,83 (м, 4H), 3,31 (м, 6H), 3,15 (м, 2H), 3,04 (м, 2H), 2,85 (с, 6H).
Пример 154
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Пример 154А
4-(3-Диметиламино)пропиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на N,N-диметил-1,3-пропандиамин в примере 1F.
Пример 154В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 154А и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,68 (уш.с, 1H), 9,38 (уш.с, 1H), 8,66 (т, 1H), 8,49 (д, 1H), 7,80 (д, 1H), 7,68 (м, 2H), 7,51 (м, 4H), 7,38 (д, 1H), 7,33 (м, 2H), 7,24 (д, 2H), 7,16 (д, 1H), 7,02 (дд, 1H), 6,81 (д, 2H), 6,76 (д, 1H), 6,43 (с, 1H), 4,25 (м, 1H), 3,50 (м, 4H), 3,30 (м, 4H), 3,12 (м, 6H), 2,78 (с, 6H), 1,95 (м, 2H).
Пример 155
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 7А и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,70 (уш.с, 1H), 9,72 (уш.с, 1H), 8,68 (т, 1H), 8,49 (д, 1H), 7,81 (д, 1H), 7,70 (м, 2H), 7,51 (м, 4H), 7,37 (д, 2H), 7,33 (м, 1H), 7,24 (д, 2H), 7,15 (д, 1H), 7,03 (дд, 1H), 6,81 (д, 2H), 6,76 (д, 1H), 6,44 (с, 1H), 4,24 (м, 1H), 3,97 (м, 2H), 3,63 (м, 4H), 3,28 (м, 4H), 3,18 (м, 4H), 3,06 (м, 4H), 2,88 (м, 4H), 1,99 (м, 2H).
Пример 156
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[4-(диметиламино)бутил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Пример 156А
4-(4-Диметиламино)бутиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на N,N-диметил-1,4-бутандиамин в примере 1F.
Пример 156В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[4-(диметиламино)бутил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 156А и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,70 (уш.с, 1H), 9,34 (уш.с, 1H), 8,63 (т, 1H), 8,48 (д, 1H), 7,79 (д, 1H), 7,70 (м, 2H), 7,51 (м, 4H), 7,39 (д, 2H), 7,33 (м, 1H), 7,24 (д, 2H), 7,12 (д, 1H), 7,01 (дд, 1H), 6,80 (д, 2H), 6,75 (д, 1H), 6,44 (с, 1H), 4,28 (м, 1H), 3,83 (м, 4H), 3,45 (м, 10H), 3,10 (м, 4H), 2,85 (с, 6H), 1,66 (м, 4H).
Пример 157
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[1-(фенилсульфонил)пиперидин-4-ил]амино}фенил)сульфонил]-2-феноксибензамид
Пример 157А
Трет-бутил 4-(2-нитро-4-сульфамоилфениламино)пиперидин-1-карбоксилат
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на 1-Вос-4-аминопиперидин в примере 1F.
Пример 157В
3-Нитро-4-(пиперидин-4-иламино)бензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 157А в примере 1В.
Пример 157С
3-Нитро-4-(1-(фенилсульфонил)пиперидин-4-иламино)бензолсульфонамид
Смесь соединения примера 157В (84 мг), бензолсульфонилхлорида (46 мг) и триэтиламина (101 мг) в CH2Cl2 (2 мл) перемешивали в течение 1 часа. Продукт хроматографировали на силикагеле с использованием 25% смеси этилацетат/гексаны.
Пример 157D
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[1-(фенилсульфонил)пиперидин-4-ил]амино}фенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 157С и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,68 (уш.с, 1H), 9,65 (уш.с, 1H), 8,42 (с, 1H), 8,19 (д, 1H), 7,78 (м, 2H), 7,70 (м, 4H), 7,51 (м, 5H), 7,37 (м, 3H), 7,19 (м, 3H), 6,94 (дд, 1H), 6,75 (м, 3H), 6,44 (с, 1H), 4,28 (м, 1H), 3,73 (м, 4H), 3,50 (м, 4H), 3,17 (м, 2H), 3,03 (м, 2H), 2,86 (м, 2H), 1,99 (м, 2H), 1,74 (м, 2H).
Пример 158
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[1-(хинолин-8-илсульфонил)пиперидин-4-ил]амино}фенил)сульфонил]-2-феноксибензамид
Пример 158А
3-Нитро-4-(1-хинолин-8-илсульфонил)пиперидин-4-иламино)бензолсульфонамид
Соединение данного примера получали, заменяя бензолсульфонилхлорид на хинолин-8-сульфонилхлорид в примере 157С.
Пример 158В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[1-(хинолин-8-илсульфонил)пиперидин-4-ил]амино}фенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 158А и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,66 (уш.с, 1H), 9,10 (дд, 1H), 8,55 (с, 1H), 8,41 (м, 2H), 8,32 (д, 1H), 8,20 (д, 1H), 7,78 (дд, 2H), 7,72 (д, 2H), 7,48 (м, 4H), 7,39 (дд, 2H), 7,33 (м, 1H), 7,17 (м, 3H), 6,95 (дд, 1H), 6,76 (м, 3H), 6,42 (с, 1H), 4,35 (м, 1H), 3,90 (д, 2H), 3,77 (м, 2H), 3,34 (м, 6H), 2,99 (м, 4H), 1,97 (м, 2H), 1,65 (м, 2H).
Пример 159
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-фенокси-N-({4-{[1-(фенилсульфонил)пиперидин-4-ил]амино}-3-[(тритфторметил)сульфонил]фенил}сульфонил)бензамид
Пример 159А
(2-Фторфенил)(трифторметил)сульфан
Гидрохлорид метилвиологена (1,17 г) в N,N-диметилформамиде (80 мл) при 25°С насыщали трифторметилйодидом, обрабатывали 2-фторбензолтиолом (9,7 мл) и триэтиламином (20 мл), перемешивали в течение 24 часов, разбавляли водой (240 мл) и экстрагировали диэтиловым эфиром. Экстракт промывали 1М NaOH, насыщенным раствором хлорида аммония и насыщенным раствором соли и концентрировали.
Пример 159В
1-Фтор-1-(трифторметилсульфонил)бензол
Соединение примера 159А (17,346 г) в смеси 1:1:2 четыреххлористый углерод:ацетонитрил:вода (800 мл) при 25°С обрабатывали перйодатом натрия (56,8 г) и гидратом хлорида рутения(III) (183 мг), перемешивали в течение 18 часов, разбавляли хлористым метиленом (100 мл) и фильтровали через диатомовую землю (Celite®). Фильтрат промывали насыщенным раствором гидрокарбоната натрия и экстрагировали хлористым метиленом. Экстракт промывали насыщенным раствором соли и сушили (MgSO4), фильтровали и концентрировали. Концентрат фильтровали через силикагель.
Пример 159С
4-Фтор-3-(трифторметилсульфонил)бензолсульфонамид
Соединение примера 159В (37,3 г) в хлорсульфоновой кислоте (32,8 мл) при 120°С перемешивали в течение 18 часов, охлаждали до 25°С и переносили при помощи пипетки на измельченный лед. Смесь экстрагировали этилацетатом, а экстракт промывали водой и насыщенным раствором соли и сушили (MgSO4), фильтровали и концентрировали. Сырой продукт растворяли в изопропаноле (706 мл) при -78°С, обрабатывали гидроксидом аммония (98 мл) в течение 1 часа, перемешивали 1 час, гасили 6М HCl (353 мл), нагревали до 25°С и концентрировали. Концентрат смешивали с водой и экстрагировали этилацетатом. Экстракт сушили над MgSO4, фильтровали и концентрировали. Концентрат перекристаллизовывали из смеси этилацетат/гексан.
Пример 159D
Трет-бутил 4-(4-сульфамоил-2-(трифторметилсульфонил)фениламино)пиперидин-1-карбоксилат
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на 1-Вос-4-аминопиперидин и 4-фтор-3-нитробензолсульфонамид на соединение примера 159С в примере 1F.
Пример 159Е
4-(Пиперидин-4-иламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 159D в примере 1В.
Пример 159F
4-(1-(Фенилсульфонил)пиперидин-4-иламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 157В соединением примера 159Е в примере 157С.
Пример 159G
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-фенокси-N-({4-{[1-(фенилсульфонил)пиперидин-4-ил]амино}-3-[(тритфторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 159F и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,72 (уш.с, 1H), 9,70 (уш.с, 1H), 8,07 (с, 1H), 7,67-7,82 (м, 7H), 7,52 (д, 2H), 7,47 (д, 2H), 7,36 (м, 3H), 7,24 (дд, 2H), 7,14 (д, 1H), 7,01 (м, 1H), 6,78 (д, 2H), 6,72 (м, 2H), 6,44 (д, 1H), 4,27 (м, 1H), 3,73 (м, 4H), 3,46 (м, 4H), 3,17 (м, 2H), 3,03 (м, 2H), 2,87 (м, 2H), 1,97 (м, 2H), 1,64 (м, 2H).
Пример 160
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-фенокси-N-({4-{[1-(хинолин-8-илсульфонил)пиперидин-4-ил]амино}-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Пример 160А
4-(1-(хинолин-8-илсульфонил)пиперидин-4-иламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 157В соединением примера 159Е и бензолсульфонилхлорид хинолин-8-сульфонилхлоридом в примере 157С.
Пример 160В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-фенокси-N-({4-{[1-(хинолин-8-илсульфонил)пиперидин-4-ил]амино}-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 160А и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,74 (уш.с, 1H), 9,50 (уш.с, 1H), 9,08 (дд, 1H), 8,55 (с, 1H), 8,39 (д, 1H), 8,33 (д, 1H), 8,06 (с, 1H), 7,82 (дд, 2H), 7,70 (м, 1H), 7,50 (м, 3H), 7,40 (дд, 2H), 7,33 (м, 1H), 7,21 (м, 2H), 7,08 (м, 2H), 6,99 (дд, 1H), 6,95 (с, 1H), 6,78 (д, 1H), 6,73 (м, 2H), 6,42 (с, 1H), 4,35 (м, 1H), 3,75 (м, 4H), 3,34 (м, 6H), 3,05 (м, 4H), 1,93 (м, 2H), 1,55 (м, 2H).
Пример 161
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[(1S)-3-(диметиламино)-1-тиен-2-илпропил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Пример 161А
(S)-3-(бензилоксикарбониламино)-3-(тиофен-2-ил)пропионовая кислота
(S)-3-амино-3-(тиофен-2-ил)пропионовую кислоту (0,894 г) и бензилоксикарбонилхлорид (0,980 г) перемешивали в 2М NaOH (8 мл) и диоксане (26 мл) при 0°С в течение 24 часов. Реакционную смесь подкисляли концентрированной водной HCl, дважды экстрагировали этилацетатом, а экстракты сушили над MgSO4, фильтровали, концентрировали и хроматографировали на силикагеле с использованием 50% смеси этилацетат/гексаны.
Пример 161В
(S)-бензил 3-(диметиламино)-3-оксо-1-(тиофен-2-ил)пропилкарбамат
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 161А и соединение примера 1F диметиламином в примере 1G.
Пример 161С
(S)-N1,N1-диметил-3-(тиофен-2-ил)пропан-1,3-диамин
Раствор соединения примера 161В (400 мг) и борана в тетрагидрофуране (1М, 2,5 мл) в тетрагидрофуране (6 мл) перемешивали в течение 24 часов. Реакционную смесь гасили метанолом, растворяли в буферном растворе с рН 7 и трижды экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным раствором соли и концентрировали. Сырой продукт растворяли в HBr в уксусной кислоте (1,1 мл) и перемешивали в течение 2 часов. Реакционную смесь выливали в CH2Cl2 (50 мл) и промывали 1М раствором NaOH. Органический слой сушили над Na2SO4 и концентрировали.
Пример 161D
(S)-4-(3-(диметиламино)-1-(тиофен-2-ил)пропиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин соединением примера 161С в примере 1F.
Пример 161Е
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[(1S)-3-(диметиламино)-1-тиен-2-илпропил]амино}-3-нитрофенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 161D и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6/D2O) δ 11,72 (уш.с, 1H), 9,51 (уш.с, 1H), 8,60 (д, 1H), 8,48 (с, 1H), 7,75 (д, 1H), 7,70 (м, 1H), 7,51 (м, 4H), 7,38 (д, 2H), 7,32 (м, 1H), 7,25 (д, 1H), 7,16 (м, 3H), 7,06 (д, 1H), 6,92 (м, 1H), 6,75 (д, 3H), 6,44 (д, 1H), 5,31 (м, 1H), 4,30 (м, 1H), 3,54 (м, 8H), 3,20 (м, 2H), 3,07 (м, 2H), 2,80 (с, 6H), 2,35 (м, 2H).
Пример 162
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тиен-2-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 162А
3-Нитро-4-(тиофен-2-илметиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 2-тиофенметиламином в примере 1F.
Пример 162В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тиен-2-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 162В и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6/D2O) δ 11,67 (уш.с, 1H), 9,55 (уш.с, 1H), 9,11 (т, 1H), 8,47 (с, 1H), 7,70 (м, 2H), 7,51 (м, 4H), 7,38 (д, 2H), 7,33 (м, 1H), 7,15 (м, 4H), 7,02 (д, 1H), 6,94 (м, 1H), 6,74 (д, 3H), 6,44 (д, 1H), 4,87 (м, 2H), 4,37 (м, 1H), 3,34 (м, 8H), 3,03 (м, 2H).
Пример 163
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[{трифторметил)сульфонил]фенил}сульфонил)бензамид
Пример 163А
4-((Тетрагидро-2Н-пиран-4-ил)метиламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид соединением примера 159С в примере 1F.
Пример 163В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[{трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 163А и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,71 (уш.с, 1H), 8,10 (д, 1H), 7,86 (д, 1H), 7,10 (м, 1H), 7,50 (м, 4H), 7,37 (м, 2H), 7,27 (м, 3H), 7,08 (м, 1H), 7,03 (дд, 1H), 6,95 (д, 1H), 6,82 (д, 1H), 6,76 (д, 1H), 6,43 (с, 1H), 4,35 (м, 1H), 3,84 (дд, 2H), 3,35 (м, 8H), 3,22 (м, 2H), 3,03 (м, 2H), 2,86 (м, 2H), 1,86 (м, 1H), 1,55 (м, 2H), 1,26 (м, 2H).
Пример 164
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[2-(1Н-1,2,3-триазол-1-ил)этил]амино}фенил)сульфонил]-2-феноксибензамид
Пример 164А
4-(2-Гидроксиэтиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 2-аминоэтанолом в примере 1F.
Пример 164В
4-(2-Трет-бутилдиметилсилилокси)этиламино)-3-нитробензолсульфонамид
Соединение примера 164А (131 мг), трет-бутилдиметилсилихлорид (75 мг) и имидазол (68 мг) перемешивали в CH2Cl2 (17 мл) в течение 24 часов. Реакционную смесь хроматографировали на силикагеле с использованием 10% смеси этилацетат/гексаны.
Пример 164С
N-(4-(2-(трет-бутилдиметилсилилокси)этиламино)-3-нитрофенилсульфонил)-4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 164В в примере 1G.
Пример 164D
2-(4-(N-(4-(4-((4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-2-феноксибензоил)сульфамоил)-2-нитрофениламино)этил 4-метилбензолсульфонат
Соединение примера 164С (150 мг) и концентрированную водную HCl (0,020 мл) перемешивали в тетрагидрофуране (1 мл) и метаноле (1 мл) в течение 1 часа. Смесь фильтровали через короткую колонку с силикагелем. Продукт растворяли в CH2Cl2 (1 мл) и к нему прибавляли триэтиламин (0,074 мл) и ангидрид п-толуолсульфокислоты (58 мг) и перемешивали реакционную смесь в течение 24 часов. Реакционную смесь хроматографировали на силикагеле с использованием 10% смеси этилацетат/гексаны.
Пример 164Е
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[2-(1Н-1,2,3-триазол-1-ил)этил]амино}фенил)сульфонил]-2-феноксибензамид
Соединение примера 164D (30 мг), 1,2,3-триазол (7 мг) и карбонат цезия (55 мг) перемешивали в N,N-диметилформамиде (0,2 мл) в течение 24 часов. Реакционную смесь гасили хлоридом аммония и дважды экстрагировали этилацетатом. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Продукт очищали препаративной ВЭЖХ с использованием колонки С18, 250×50 мм, 10 мкм, и элюировали с градиентом 20-100% CH3CN vs. 0,1% трифторуксусной кислоты в воде, получая продукт в виде трифторацетатной соли.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,75 (уш.с, 1H), 9,62 (уш.с, 1H), 8,66 (дд, 1H), 8,44 (д, 1H), 8,18 (с, 1H), 7,72 (м, 3H), 7,51 (м, 5H), 7,36 (м, 3H), 7,19 (дд, 2H), 7,06 (м, 1H), 6,93 (дд, 1H), 6,75 (д, 2H), 6,45 (с, 1H), 4,70 (т, 2H), 3,93 (дт, 2H), 3,61 (м, 4H), 3,22 (м, 2H), 3,01 (м, 2H), 2,84 (м, 2H).
Пример 165
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[2-(2Н-1,2,3-триазол-2-ил)этил]амино}фенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали по реакции, аналогичной реации для соединения примера 164Е.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,75 (уш.с, 1H), 9,70 (уш.с, 1H), 8,67 (дд, 1H), 8,42 (с, 1H), 7,80 (с, 1H), 7,75 (м, 1H), 7,68 (д, 2H), 7,51 (м, 5H), 7,37 (м, 3H), 7,18 (дд, 2H), 6,97 (м, 1H), 6,92 (дд, 1H), 6,75 (д, 2H), 6,46 (с, 1H), 4,76 (т, 2H), 3,93 (дт, 2H), 3,67 (м, 4H), 3,22 (м, 2H), 3,03 (м, 2H), 2,84 (м, 2H).
Пример 166
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(4-{[3-(диметиламино)пропил]амино}-3-нитрофенил)сульфонил]-2-(2-нафтилокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 35В и соединение примера 1F соединением примера 154А в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,83 (уш.с, 1H), 9,46 (уш.с, 1H), 8,53 (т, 1H), 8,40 (с, 1H), 7,81 (д, 2H), 7,71 (м, 1H), 7,63 (м, 2H), 7,51 (м, 5H), 7,37 (м, 4H), 7,17 (д, 1H), 7,03 (с, 1H), 6,82 (д, 2H), 6,57 (д, 1H), 4,27 (м, 1H), 3,62 (м, 6H), 3,39 (м, 2H), 3,09 (м, 2H), 2,80-3,25 (м, 6H), 2,79 (с, 6H), 1,91 (м, 2H).
Пример 167
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[2-(2-оксопиридин-1(2Н)-ил)этил]амино}фенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя 1,2,3-триазол пиридин-2-олом в примере 164Е.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,70 (уш.с, 1H), 9,65 (уш.с, 1H), 8,75 (т, 1H), 8,44 (д, 1H), 7,72 (д, 2H), 7,64 (д, 1H), 7,51 (м, 5H), 7,37 (м, 3H), 7,20 (м, 3H), 6,95 (т, 1H), 6,77 (д, 3H), 6,46 (с, 1H), 6,41 (д, 1H), 6,21 (т, 1H), 4,31 (м, 1H), 4,17 (т, 2H), 3,74 (дт, 2H), 3,60 (м, 6H), 3,20 (м, 2H), 3,03 (м, 2H), 2,87 (м, 2H).
Пример 168
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-[(3-нитро-4-{[2-(пиридин-2-илокси)этил]амино}фенил)сульфонил]-2-феноксибензамид
Соединение данного примера получали, заменяя 1,2,3-триазол пиридин-2-олом в примере 164Е.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,71 (уш.с, 1H), 9,65 (уш.с, 1H), 8,84 (т, 1H), 8,44 (д, 1H), 8,19 (д, 1H), 7,74 (м, 3H), 7,51 (м, 5H), 7,37 (м, 3H), 7,20 (м, 3H), 7,00 (дд, 1H), 6,92 (т, 1H), 6,83 (д, 1H), 6,76 (м, 2H), 6,45 (д, 1H), 4,56 (т, 2H), 4,31 (м, 1H), 3,81 (дт, 2H), 3,71 (м, 6H), 3,23 (м, 2H), 3,04 (м, 2H), 2,89 (м, 2H).
Пример 169
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(2-пиридин-4-илэтил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 169А
3-нитро-4-(2-(пиридин-4-ил)этиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 2-(пиридин-4-ил)этанамином в примере 1Е.
Пример 169В
4-{4-[(4’-Хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(2-пиридин-4-илэтил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 169А и соединение примера 27G соединением примера 1E в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,71 (уш.с, 1H), 9,70 (уш.с, 1H), 8,69 (д, 1H), 8,61 (т, 1H), 8,46 (с, 1H), 7,79 (дд, 1H), 7,72 (д, 3H), 7,51 (м, 5H), 7,37 (д, 2H), 7,32 (д, 1H), 7,21 (м, 3H), 6,95 (т, 1H), 6,78 (д, 2H), 6,75 (д, 1H), 6,44 (д, 1H), 4,23 (м, 1H), 3,76 (дт, 2H), 3,63 (м, 4H), 3,13 (т, 2H), 2,76-3,24 (м, 6H).
Пример 170
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-{[3-(диметиламино)пропил]амино}-3-[(трифторметил)сульфонил]фенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 170А
4-(3-(Диметиламино)пропиламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин N,N-диметил-1,3-пропандиамином и 4-фтор-3-нитробензолсульфонамид соединением примера 159С в примере 1F.
Пример 170В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-{[3-(диметиламино)пропил]амино}-3-[(трифторметил)сульфонил]фенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 170А и соединение примера 27G соединением примера 26С в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,42 (уш.с, 1H), 11,17 (с, 1H), 9,37 (уш.с, 1H), 8,22 (д, 1H), 7,98 (д, 1H), 7,52 (д, 1H), 7,35-7,45 (м, 4H), 7,19 (д, 1H), 7,08 (м, 3H), 6,85 (дд, 1H), 6,67 (дд, 1H), 6,40 (д, 1H), 6,19 (д, 1H), 3,55 (м, 8H), 3,04 (м, 4H), 2,77 (с, 6H), 2,72 (м, 2H), 2,17 (м, 2H), 2,00 (м, 2H), 1,88 (м, 2H), 1,44 (м, 2H), 0,93 (с, 6H).
Пример 171
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-{[3-(диметиламино)пропил]амино}-3-(трифторметил)фенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 26С и соединение примера 1F соединением примера 92В в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,19 (уш.с, 1H), 9,33 (уш.с, 1H), 7,94 (д, 1H), 7,85 (д, 1H), 7,54 (д, 1H), 7,35-7,45 (м, 4H), 7,20 (д, 1H), 7,07 (д, 2H), 6,88 (дд, 2H), 6,67 (дд, 1H), 6,58 (м, 1H), 6,41 (с, 1H), 6,18 (с, 1H), 3,57 (м, 6H), 3,33 (м, 2H), 3,09 (м, 2H), 3,04 (м, 2H), 2,77 (с, 6H), 2,74 (м, 2H), 2,17 (м, 2H), 2,00 (м, 2H), 1,87 (м, 2H), 1,44 (м, 2H), 0,93 (с, 6H).
Пример 172
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(3-циано-4-{[3-
(диметиламино)пропил]амино}фенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 26С и соединение примера 1F соединением примера 90В в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,19 (уш.с, 1H), 9,38 (уш.с, 1H), 7,98 (с, 1H), 7,81 (д, 1H), 7,55 (д, 1H), 7,35-7,45 (м, 4H), 7,20 (с, 1H), 7,16 (т, 1H), 7,07 (д, 2H), 6,86 (дд, 2H), 6,68 (дд, 1H), 6,41 (с, 1H), 6,18 (с, 1H), 3,57 (м, 6H), 3,31 (м, 2H), 3,09 (м, 2H), 3,04 (м, 2H), 2,77 (с, 6H), 2,74 (м, 2H), 2,17 (м, 2H), 2,00 (м, 2H), 1,87 (м, 2H), 1,44 (м, 2H), 0,93 (с, 6H).
Пример 173
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Пример 173А
Трет-бутил 1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-илкарбамат
Смесь трет-бутил пиперидин-4-илкарбамата (45 г) и дигидро-2Н-пиран-4(3Н)-она (24,74 г) в хлористом метилене (1000 мл) обрабатывали триацетоксиборгидридом натрия (61,9 г), перемешивали при комнатной температуре в течение 16 часов, промывали 1М гидроксидом натрия и сушили над безводным сульфатом натрия, фильтровали и концентрировали. Концентрат флэш-хроматографировали на колонке с силикагелем с использованием 10-20% смеси метанол/хлористый метилен.
Пример 173В
1-(Тетрагидро-2Н-пиран-4-ил)пиперидин-4-амин
Раствор соединение примера 173А (52,57 г) в хлористом метилене (900 мл) обрабатывали 4M HCl (462 мл), энергично перемешивали при комнатной температуре в течение 16 часов и концентрировали.
Пример 173С
3-Нитро-4-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-иламино)бензолсульфонамид
Смесь соединения примера 173В (22,12 г), воды (43 мл) и триэтиламина (43,6 мл) в 1,4-диоксане (300 мл) перемешивали при комнатной температуре до полного растворения соединения примера 173В. Затем раствор обрабатывали 4-хлор-3-нитробензолсульфонамидом, нагревали при 90°С в течение 16 часов, охлаждали и концентрировали. Прибавляли 10% метанола в хлористом метилене и энергично перемешивали раствор при комнатной температуре до образования мелкой суспензии и смесь фильтровали.
Пример 173D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Смесь соединения примера 26С (3,95 г), соединения примера 173С (2,66 г), гидрохлорида 1-этил-3-[3-(диметиламино)пропил]карбодиимида (2,66 г) и 4-диметиламинопиридина (0,846 г) в хлористом метилене (70 мл) и ацетонитриле (20 мл) перемешивали при 35°С в течение 24 часов, охлаждали и хроматографировали на силикагеле с использованием 0-10% смеси метанола в этилацетате, затем 10% метанола в смеси 1:1 этилацетат/хлористый метилен. Объединенные фракции концентрировали, растворяли в 5% смеси метанол/этилацетат (1,5 л) и промывали насыщенным раствором NaH2PO4 и насыщенным раствором соли и сушили над Na2SO4, фильтровали, концентрировали до 300 мл, охлаждали и фильтровали. Оставшийся раствор частично концентрировали и снова фильтровали, выделяя еще продукт.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,17 (уш.с, 1H), 10,70 (уш.с, 1H), 8,60 (д, 1H), 8,20 (уш.д, 1H), 7,88 (дд, 1H), 7,50 (д, 1H), 7,39 (м, 2H), 7,33 (д, 2H), 7,16 (м, 2H), 7,03 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (с, 1H), 3,97 (м, 4H), 3,44 (м, 4H), 3,04 (м, 6H), 2,75 (м, 2H), 2,14 (м, 8H), 1,95 (м, 6H), 1,66 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 174
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 174А
4-(4-Метилпиперазин-1-иламино)-3-нитробензолсульфонамид
Смесь 4-хлор-3-нитробензолсульфонамида (1 г), дигидрохлорид 4-метилпиперазин-1-амина (1 г) и N1,N1,N2,N2-тетраметилэтан-1,2-диамина (3 мл) в диоксане (10 мл) кипятили с обратным холодильником в течение 12 часов, охлаждали до температуры окружающей среды и фильтровали. Фильтрат вносили на колонку с силикагелем (Analogix, SF65-200 г) и очищали, элюируя 1-5% смесью метанол/хлористый метилен.
Пример 174В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид
Смесь соединения примера 26С (0,108 г), соединения примера 174А (64 мг), гидрохлорида 1-этил-3-[3-(диметиламино)пропил]карбодиимида (0,08 г) и 4-диметиламинопиридина (0,08 г) в хлористом метилене (3 мл) перемешивали при температуре окружающей среды в течение ночи и концентрировали. Концентрат вносили на колонку препаративной ВЭЖХ и элюировали 20-100% смесью ацетонитрил/вода с 0,1% трифторуксусной кислоты. Раствор соли трифторуксусной кислоты нейтрализовывали NaHCO3 и экстрагировали хлористым метиленом. Данный раствор промывали насыщенным раствором NaHCO3, сушили над Na2SO4 и фильтровали и концентрировали.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 9,17 (с, 1H), 8,52 (с, 1H), 7,83 (м, 1H), 7,53 (м, 2H), 7,36 (м, 4H), 7,12 (с, 1H), 7,03 (д, 2H), 6,83 (м, 1H), 6,62 (м, 1H), 6,38 (с, 1H), 6,13 (м, 1H), 5,76 (с, 2H), 2,85 (м, 12H), 2,35 (м, 4H), 2,14 (м, 6H), 1,94 (м, 2H), 1,38 (м, 2H), 0,92 (с, 6H).
Пример 175
4-{4-[1-(4’-Хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 175А
1-(4’-хлордифенил-2-ил)этанон
Смесь 1-(2-бромфенил)этанона (3,1 г, 15,57 ммоль), 4-хлорфенилбороновой кислоты (2,92 г), (Ph3P)2PdCl2 (дихлорид бис(трифенилфосфин)палладия(II)) (1,202 г) и Na2CO3 (3,30 г) в смеси диметоксиэтан-этанол-вода (7:2:3, 50 мл) нагревали при 100°С в течение 3 часов и концентрировали. Концентрат суспендировали в хлористом метилене (30 мл) и удаляли нерастворимое вещество фильтрованием. Фильтрат вносили на колонку с силикагелем, элюировали 0%-50% смесью хлористого метилена в гексане, получая указанное в заголовке соединение.
Пример 175В
Трет-бутил 4-(1-(4’-хлордифенил-2-ил)этил)пиперазин-1-карбоксилат
Соединение примера 175А (1,9 г) растворяли в хлористом метилене (3 мл) и прибавляли хлорид титана(IV) (9,06 мл, 9,06 ммоль). Раствор охлаждали до 0°С и добавляли трет-бутил пиперазин-1-карбоксилат (3,07 г). Полученную смесь перемешивали при температуре окружающей среды в течение 3 часов и добавляли NaCNBH3 (0,828 г) в метаноле (5 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи и нейтрализовывали водным NaOH, а затем концентрировали. К концентрату добавляли этилацетат и отфильтровывали нерастворимое вещество. Органический слой промывали водой и концентрировали. Концентрат растворяли в смеси метанол-трифторуксусная кислота-диметилсульфоксид, вносили на колонку С18 с обращенной фазой и элюировали 0-80% ацетонитрила в 0,1% смеси трифторуксусной кислоты и воды в течение 70 минут.
Пример 175С
1-(1-(4’-Хлордифенил-2-ил)этил)пиперазин
К раствору соединения примера 175В (650 мг) в хлористом метилене (6 мл) прибавляли трифторуксусную кислоту (6 мл) при 0°С. Реакционную смесь перемешивали при 0°С в течение 50 минут и концентрировали. Концентрат растворяли в хлористом метилене, промывали водным NaHCO3 и сушили органический слой над Na2SO4 и концентрировали.
Пример 175D
Этил 2-(1Н-индол-4-илокси)-4-(4-(1-(4’-хлордифенил-2-ил)этил)пиперазин-1-ил)бензоат
Соединение примера 175С (193 мг) и этил 2-(1Н-индол-4-илокси)-4-фторбензоат (211 мг) в диметилсульфоксиде (15 мл) обрабатывали гидрофосфатом калия (168 мг) при 135°С в течение ночи и охлаждали. Реакционную смесь разбавляли хлористым метиленом и промывали водой. Органический слой концентрировали. Концентрат растворяли в хлористом метилене, вносили на колонку с силикагелем, элюировали 0%-10% 10М аммиака в метаноле в хлористом метилене.
Пример 175Е
2-(1Н-Индол-4-илокси)-4-(4-(1-(4’-хлордифенил-2-ил)этил)пиперазин-1-ил)бензойная кислота
Соединение примера 175D (200 мг) в тетрагидрофуране (10 мл) и метаноле (10 мл) обрабатывали 10% NaOH (3 мл) при 50°С в течение ночи и нейтрализовывали HCl. Смесь концентрировали и растворяли концентрат в воде и экстрагировали хлористым метиленом. Органический слой сушили над Na2SO4 и концентрировали.
Пример 175F
4-(4-(1-(4’-Хлор-1,1’-дифенил-2-ил)этил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-((3-нитро-4-((тетрагидро-2Н-пиран-4-илметил)амино)фенил)сульфонил)бензамид
К смеси соединения примера 175Е (66 мг), 3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)бензолсульфонамид (75 мг) и 4-диметиламинопиридина (58,4 мг) в хлористом метилене (5 мл) прибавляли гидрохлорид 1-этил-3-[3-(диметиламино)пропил]карбодиимида (45,8 мг). Смесь перемешивали при температуре окружающей среды в течение ночи и концентрировали. Концентрат очищали ВЭЖХ ОФ (10-70% ацетонитрила в 0,1% водной трифторуксусной кислоте/70 минут). Требуемые фракции концентрировали для удаления ацетонитрила и разбавляли концентрат хлористым метиленом и нейтрализовывали водным NaHCO3. Слой хлористого метилена сушили над Na2SO4 и концентрировали, получая указанное в заголовке соединение.lH ЯМР (500 МГц, диметилсульфоксид-de) δ м.д. 11,31 (1H, с), 11,25 (1H, с), 8,62 (1H, т), 8,50 (1H, д), 7,68 (1H, дд), 7,53 (2H, д), 7,46 (2H, д), 7,37 (1H, т), 7,24-7,31 (4H, м), 7,17 (1H, д), 7,12 (1H, дд), 7,07 (1H, д), 6,96 (1H, т), 6,69 (1H, дд), 6,42 (1H, д), 6,26 (2H, с), 3,85 (2H, дд), 3,21-3,33 (5H, м), 3,01 (4H, с), 2,29-2,39 (2H, м), 2,15-2,22 (2H, м), 1,83-1,94 (1H, м), 1,57-1,68 (2H, м), 1,22-1,31 (2H, м), 1,17 (3H, д).
Пример 176
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Пример 176А
4-((4-Аминотетрагидро-2Н-пиран-4-ил)метиламино)-3-нитробензолсульфонамид
Смесь 4-хлор-3-нитробензолсульфонамида, бис-соли 4-(аминометил)тетрагидро-2Н-пиран-4-амина с хлористоводородной кислотой и триэтиламина в диоксане (10 мл) нагревали при 110°С в течение ночи. После охлаждения реакционную смесь разбавляли водой (10 мл) и отфильтровывали твердое вещество, получая указанное в заголовке соединение.
Пример 176В
N-((4-(((4-аминотетрагидро-2Н-пиран-4-ил)метил)амино)-3-нитрофенил)сульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 55В и соединение примера 1G соединением примера 176А (4-аминотетрагидро-2Н-пиран-4-ил)метиламино)-3-нитробензолсульфонамид) в примере 1Н.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,15 (с, 1H), 8,51 (с, 1H), 8,45 (д, J=2,14 Гц, 1H), 7,70 (дд, J=9,0, 1,98 Гц, 1H), 7,59 (д, J=8,85 Гц, 1H), 7,34 (д, J=8,24 Гц, 2H), 7,22 (т, J=2,59 Гц, 1H), 7,11-7,12 (м, 2H), 7,04 (д, J=8,54 Гц, 2H), 6,93 (т, J=7,78 Гц, 1H), 6,62 (дд, J=9,0, 1,98 Гц, 1H), 6,34 (д, J=7,63 Гц, 1H), 6,20-6,23 (м, 2H), 3,55-3,70 (м, 6H), 2,96 (м, 3H), 2,71 (с, 2H), 2,16 (м, 6H), 1,95 (м, 2H), 1,70-1,74 (м, 2H), 1,55-1,59 (м, 2H), 1,37-1,39 (м, 2H), 0,92 (с, 6H).
Пример 177
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Смесь соединения примера 26С (2,85 г, 10 ммоль), соединения примера 1F (1,577 г, 5 ммоль), гидрохлорида 1-этил-3-[3-(диметиламино)пропил]карбодиимида (1,917 г, 10 ммоль), 4-(диметиламино)пиридина (1,222 г, 10 ммоль) и триэтиламина (2,8 мл, 20 ммоль) обрабатывали CH2Cl2 (20 мл) и N,N-диметилформамидом (2 мл). Реакционную смесь перемешивали в течение ночи. Растворитель удаляли и распределяли остаток между водой и этилацетатом. Органические слои дважды промывали 1% HCl, затем насыщенным NaHCO3, насыщенным раствором соли, сушили, фильтровали и концентрировали. Остаток очищали ВЭЖХ с обращенной фазой на колонке С18 с использованием градиента 40-60% ацетонитрил/0,1% ТФУ в воде, получая указанное в заголовке соединение в виде трифторацетатной соли. Соль ТФУ растворяли в хлористом метилене (6 мл) и промывали 50% водным NaHCO3. Органический слой сушили над безводным Na2SO4 и концентрировали, получая указанное в заголовке соединение.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,18 (с, 2H), 8,59-8,64 (м, 2H), 7,80 (дд, 1H), 7,52 (д, 1H), 7,39-7,42 (м, 2H), 7,33 (д, 2H), 7,16 (д, 1H), 7,10 (д, 1H), 7,03 (д, 2H), 6,8 (дд, 1H), 6,65 (дд, 1H), 6,40 (с, 1H), 6,14 (д, 1H), 3,85 (дд, 2H), 3,24-3,32 (м, 4H), 3,03 (с, 3H), 2,73 (с, 2H), 2,12-2,17 (м, 5H), 1,68-1,94 (м, 3H), 1,61 (д, 2H), 1,37 (т, 2H), 1,24-1,27 (м, 2H), 0,92 (с, 6H).
Пример 178
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 178А
Транс-4-(4-морфолиноциклогексиламино)-3-нитробензолсульфонамид)
Соединение данного примера получали, заменяя 1-(тетрагидропиран-4-ил)метиламин на 4-амино-N-морфолинилпиперидин в примере 1F.
Пример 178В
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 1F соединением примера 178А.1H ЯМР (500 МГц, пиридин-d5) δ 12,29 (с, 1H), 9,29 (д, J=2,1 Гц, 1H), 8,37 (д, J=7,6 Гц, 1H), 8,32 (дд, J=9,3, 2,3 Гц, 1H), 8,18 (д, J=8,8 Гц, 1H), 7,52-7,57 (м, 2H), 7,39-7,47 (м, 3H), 7,10 (дд, J=8,7, 2,3 Гц, 1H), 7,05-7,08 (м, 2H), 6,90 (д, J=9,5 Гц, 1H), 6,74 (дд, J=9,0, 2,3 Гц, 1H), 6,59-6,63 (м, 1H), 6,55 (д, J=2,4 Гц, 1H), 3,72-3,78 (м, 4H), 3,33-3,43 (м, 1H), 2,99-3,09 (м, 4H), 2,76 (с, 2H), 2,46-2,54 (м, 4H), 2,16-2,29 (м, 3H), 2,09-2,14 (м, 4H), 2,05 (д, J=1,9 Гц, 2H), 1,97 (д, J=1,8 Гц, 2H), 1,87 (д, J=1,6 Гц, 2H), 1,19-1,42 (м, 6H), 0,93 (с, 6H).
Пример 179
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 179А
4-(2-Метоксиэтиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1-(тетрагидропиран-4-ил)метиламин 2-метоксиэтиламином в примере 1F.
Пример 179В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 1F соединением примера 179А.1H ЯМР (400 МГц, DMSO-d6) δ 11,20 (уш.с, 1H), 11,15 (с, 1H), 8,59 (м, 2H), 7,81 (дд, 1H), 7,50 (д, 1H), 7,36 (м, 4H), 7,08 (м, 4H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,38 (м, 1H), 6,14 (м, 1H), 3,58 (м, 4H), 3,30 (с, 3H), 3,03 (м, 4H), 2,73 (с, 2H), 2,15 (м, 6H), 1,96 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 180
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3S)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид
Пример 180А
(R)-3-нитро-4-((тетрагидро-2Н-пиран-3-ил)метиламино)бензолсульфонамид и (S)-3-нитро-4-((тетрагидро-2Н-пиран-3-ил)метиламино)бензолсульфонамид
Соединение данного примера получали, заменяя 1-(тетрагидропиран-4-ил)метиламин(тетрагидро-2Н-пиран-3-ил)метиламином в примере 1F.
Пример 180В
(S)-3-нитро-4-((тетрагидро-2Н-пиран-3-ил)метиламино)бензолсульфонамид
Рацемическую смесь соединения примера 180А разделяли при помощи хиральной SFC на колонке AD (21 мм в.д. × 250 мм длины) с использованием градиента 10-30% 0,1% диэтиламина в метаноле в СО2 в течение 15 мин (температура печи: 40°С, скорость потока: 40 мл/мин), получая указанное в заголовке соединение.
Пример 180С
(R)-3-нитро-4-((тетрагидро-2Н-пиран-3-ил)метиламино)бензолсульфонамид
Рацемическую смесь соединения примера 180А разделяли при помощи хиральной SFC на колонке AD (21 мм в.д. × 250 мм длины) с использованием градиента 10-30% 0,1% диэтиламина в метаноле в СО2 в течение 15 мин (температура печи: 40°С, скорость потока: 40 мл/мин), получая указанное в заголовке соединение.
Пример 180D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3S)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 1F соединением примера 180А.1H ЯМР (400 МГц, DMSO-d6) δ 11,17 (с, 2H), 8,53-8,65 (м, 2H), 7,80 (д, 1H), 7,51 (д, 1H), 7,38-7,44 (м, 2H), 7,33 (д, 2H), 7,15 (с, 1H), 7,02-7,09 (м, 3H), 6,82-6,92 (м, 1H), 6,65 (д, 1H), 6,39 (с, 1H), 6,14 (с, 1H), 3,68-3,82 (м, 2H), 3,22-3,32 (м, 2H), 3,13-3,22 (м, 1H), 3,03 (с, 4H), 2,72 (с, 2H), 2,09-2,23 (м, 6H), 1,78-1,98 (м, 4H), 1,56-1,66 (м, 1H), 1,43-1,51 (м, 1H), 1,37 (т, 2H), 1,22-1,33 (м, 1H), 0,92 (с, 6H).
Пример 181
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(3R)-тетрагидро-2Н-пиран-3-илметил]амино}фенил)сульфонил]бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 1F соединением примера 180С.1H ЯМР (400 МГц, DMSO-d6) δ 11,17 (с, 2H), 8,53-8,65 (м, 2H), 7,80 (д, 1H), 7,51 (д, 1H), 7,38-7,44 (м, 2H), 7,33 (д, 2H), 7,15 (с, 1H), 7,02-7,09 (м, 3H), 6,82-6,92 (м, 1H), 6,65 (д, 1H), 6,39 (с, 1H), 6,14 (с, 1H), 3,68-3,82 (м, 2H), 3,22-3,32 (м, 2H), 3,13-3,22 (м, 1H), 3,03 (с, 4H), 2,72 (с, 2H), 2,09-2,23 (м, 6H), 1,78-1,98 (м, 4H), 1,56-1,66 (м, 1H), 1,43-1,51 (м, 1H), 1,37 (т, 2H), 1,22-1,33 (м, 1H), 0,92 (с, 6H).
Пример 182
4-(4-{[4-(4-Хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 26С соединением примера 150С.1H ЯМР (400 МГц, DMSO-d6) δ 11,20 (уш.с, 1H), 11,17 (с, 1H), 8,63 (т, 1H), 8,59 (д, 1H), 7,79 (дд, 1H), 7,51 (д, 1H), 7,36 (м, 3H), 7,13 (м, 2H), 6,86 (дд, 1H), 6,66 (дд, 1H), 6,39 (с, 1H), 6,15 (д, 1H), 4,10 (с, 2H), 3,85 (м, 3H), 3,50 (м, 2H), 3,42 (м, 2H), 3,24 (м, 4H), 3,02 (м, 4H), 2,82 (м, 2H), 2,16 (м, 2H), 1,61 (м, 3H), 1,25 (м, 4H), 1,17 (с, 6H).
Пример 183
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил}пиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Пример 183А
4-((4-Гидрокси-1-метилпиперидин-4-ил)метиламино-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 4-(аминометил)-1-метилпиперидин-4-олом в примере 1F.
Пример 183В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил}метилпиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 183A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,04 (с, 1H), 8,46-8,48 (м, 2H), 7,92 (с, 1H), 7,74 (д, 1H), 7,54 (д, 1H), 7,32-7,34 (м, 5H), 6,97-7,05 (м, 5H), 6,74-6,76 (м, 1H), 6,55-6,57 (м, 1H), 6,33 (с, 1H), 6,13 (д, 1H), 5,10 (с, 1H), 3,14-3,17 (м, 2H), 2,95 (уш., 5H), 2,71 (уш., 2H), 2,14-2,17 (м, 6H), 1,95 (уш.с, 2H), 1,70 (уш., 4H), 1,36-1,39 (м, 2H), 1,24-1,26 (м, 2H), 0,92 (с, 6H).
Пример 184
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 184А
Этил 2-(1Н-индол-5-илокси)-3,4-дифторбензоат
Соединение данного примера получали, заменяя этил 2,3,4-трифторбензоат на этил 2,4-дифторбензоат и 5-гидроксииндазол на 5-гидроксииндол в примере 20А.
Пример 184В
Этил 2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-3-фторбензоат
Соединение данного примера получали, заменяя соединение примера 20А соединением примера 184А в примере 20D.
Пример 184С
2-(1Н-Индол-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-3-фторбензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 184B в примере 1E.
Пример 184D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({4-[(1- метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 184С и соединение примера 1F соединением примера 21A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,98 (уш.с, 1H), 8,35 (д, 1H), 7,98 (дд, 1H), 7,59 (дд, 1H), 7,35 (м, 3H), 7,28 (т, 1H), 7,21 (д, 1H), 7,06 (д, 2H), 6,78 (м, 2H), 6,67 (м, 2H), 6,22 (с, 1H), 3,74 (дд, 2H), 3,39 (м, 4H), 3,06 (м, 3H), 2,97 (м, 4H), 2,79 (м, 2H), 2,73 (с, 3H), 2,29 (м, 2H), 2,18 (м, 2H), 2,05 (м, 2H), 1,81 (м, 2H), 1,41 (т, 2H), 0,94 (с, 6H).
Пример 185
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-3-фтор-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 184С и соединение примера 1F соединением примера 173С в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 10,98 (уш.с, 1H), 8,33 (д, 1H), 8,02 (дд, 1H), 7,50 (дд, 1H), 7,35 (м, 3H), 7,26 (т, 1H), 7,19 (д, 1H), 7,06 (д, 2H), 6,77 (дд, 2H), 6,67 (м, 2H), 6,22 (с, 1H), 3,90 (дд, 2H), 3,57 (м, 5H), 3,30 (дд, 2H), 3,06 (м, 3H), 2,94 (м, 4H), 2,78 (м, 2H), 2,27 (м, 4H), 2,18 (м, 2H), 1,98 (м, 4H), 1,80 (м, 2H), 1,55 (м, 2H), 1,41 (т, 2H), 0,94 (с, 6H).
Пример 186
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидрокси-1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 183А и соединение примера 26С соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,12 (с, 1H), 8,49 (с, 1H), 8,42 (с, 1H), 7,73-7,75 (м, 1H), 7,58 (д, 1H), 7,34 (д, 2H), 7,22 (с, 1H), 7,09 (д, 1H), 7,01-7,05 (м, 3H), 6,92 (т, 1H), 6,61-6,62 (м, 1H), 6,31 (д, 1H), 6,23 (с, 1H), 6,20 (с, 1H), 5,16 (с, 1H), 4,05 (с, 3H), 2,95 (уш.с, 6H), 2,71 (уш.с, 2H), 2,62 (уш., 3H), 2,16 (уш.с, 6H), 1,95 (уш.с, 2H), 1,72 (уш., 4H), 1,37-1,39 (м, 2H), 0,92 (с, 6H).
Пример 187
N-[(4-{[(3S,4R)-1-бензил-3-гидроксипиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Пример 187А
2-(1Н-Индол-5-илокси)-N-(4-хлор-3-нитрофенилсульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F 4-хлор-3-нитробензолсульфонамидом и соединение примера 1Е соединением примера 26С в примере 1G.
Пример 187В
N-[(4-{[(3S,4R)-1-бензил-3-гидроксипиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Смесь соединения примера 187А (0,158 г), соли (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты (0,049 г) и триэтиламина (0,1 мл) в диоксане (2 мл) нагревали при 100°С в течение ночи. Растворитель удаляли, а остаток повторно растворяли в смеси 1:1 метанол:диметилсульфоксид (3 мл). Затем его очищали препаративной ВЭЖХ с обращенной фазой. Остаток очищали ВЭЖХ с обращенной фазой на колонке С18 с использованием градиента 20-80% ацетонитрила/0,1% ТФУ в воде. Требуемые фракции собирали и частично удаляли органический растворитель при пониженном давлении. Полученную смесь обрабатывали насыщенной водной смесью NaHCO3. После этого ее три раза экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали, получая требуемый продукт.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 8,69 (д, 1H), 8,14 (д, 1H), 7,77 (дд, 1H), 7,51 (д, 1H), 7,29-7,41 (м, 9H), 7,10-7,13 (м, 1H), 7,13 (д, 2H), 6,84 (дд, 1H), 6,63 (дд, 1H), 6,38 (с, 1H), 6,13 (д, 1H), 5,21-5,22 (уш.с, 1H), 3,82 (м, 2H), 3,62 (уш.с, 2H), 3,01 (уш.с, 4H), 2,71-2,82 (м, 4H), 2,12-2,15 (м, 7H), 1,94 (уш.с, 2H), 1,81 (уш.с, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 188
N-[(4-{[(4-Аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на 4-(аминометил)тетрагидро-2Н-пиран-4-амин в примере 187В.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,08 (с, 1H), 8,60 (уш.с, 1H), 8,51 (д, 1H), 7,80 (дд, 1H), 7,54 (д, 1H), 7,32-7,36 (м, 4H), 7,12 (д, 1H), 7,03-7,05 (м, 3H), 6,77 (дд, 1H), 6,58 (дд, 1H), 6,35 (с, 1H), 6,13 (д, 1H), 3,61-3,70 (м, 4H), 3,53 (уш.с, 2H), 2,97 (уш., 4H), 2,71 (уш., 2H), 2,16 (уш.с, 6H), 1,94 (уш.с, 2H), 1,67-1,72 (м, 2H), 1,52-1,57 (м, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 189
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[1-(2-метоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 189A
4-[1-(2-Метоксиэтил)пиперидин-4-иламино]-3-нитробензолсульфонамид
1-(2-Метоксиэтил)пиперидин-4-иламин (2,01 г) и триэтиламин (3,24 мл, 2,35 г) прибавляли к 1,4-диоксану (60 мл). Добавляли 4-хлор-3-нитробензолсульфонамид (2,50 г) и нагревали смесь до 90°С в течение 16 часов. Смесь охлаждали и очищали вещество колоночной флэш-хромаотграфией на силикагеле с использованием 10% метанола в хлористом метилене.
Пример 189В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[1-(2-метоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 189A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,12 (уш.с, 1H), 8,52 (д, 1H), 8,18 (д, 1H), 7,76 (дд, 1H), 7,51 (д, 1H), 7,39-7,31 (м, 4H), 7,08-7,05 (м, 4H), 6,80 (дд, 1H), 6,61 (дд, 1H), 6,36 (т, 1H), 6,14 (д, 1H), 3,70 (м, 1H), 3,50 (т, 2H), 3,27 (с, 3H), 2,99 (м, 6H), 2,71 (уш.с, 4H), 2,16 (м, 6H), 2,02-1,90 (м, 6H), 1,65 (м, 2H), 1,37 (т, 2H), 0,92 (с, 6H).
Пример 190
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 174A и соединение примера 26C соединением примера 55В в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,21 (уш.с, 1H), 9,14 (с, 1H), 8,45 (д, 1H), 7,71 (дд, 1H), 7,52 (м, 2H), 7,34 (м, 2H), 7,26 (м, 1H), 7,15 (д, 1H), 7,04 (м, 2H), 6,95 (т, 1H), 6,67 (м, 1H), 6,38 (д, 1H), 6,25 (м, 2H), 3,01 (м, 4H), 2,87 (м, 5H), 2,72 (м, 2H), 2,33 (м, 4H), 2,15 (м, 6H), 1,95 (с, 2H), 1,39 (м, 2H), 0,92 (с, 6H).
Пример 191
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2-гидроксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Пример 191А
Трет-бутил 4-(4-(N-(2-(1Н-индол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоил)сульфамоил)-2-нитрофениламино)пиперидин-1-карбоксилат
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 157A в примере 1G, за исключением того, что для хроматографии использовали 5-7% метанола в CH2Cl2.
Пример 191В
2-(1Н-индол-4-илокси)-N-(4-(1-(2-(трет-бутилдиметилсилилокси)этил)пиперидин-4-иламино)-3-нитрофенилсульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензамид
Соединение примера 191А (400 мг) растворяли в CH2Cl2 (2,5 мл) и прибавляли 4N HCl в диоксане (2,5 мл), затем перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали, а затем распределяли между CH2Cl2 и насыщенным водным NaHCO3. Органический слой промывали насыщенным раствором соли и сушили над Na2SO4. После фильтрования и коцентрирования полученный сырой амин суспендировали в CH2Cl2 (2,5 мл) и прибавляли (трет-бутилдиметилсилилокси)ацетальдегид (73 мг). После перемешивания в течение 15 минут прибавляли триацетоксиборгидрид натрия (400 мг) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли CH2Cl2 и промывали насыщенным водным NaHCO3. Органический слой промывали насыщенным раствором соли и сушили над Na2SO4. Продукт очищали колоночной хроматографией с использованием 1,0-2,5% метанола в CH2Cl2.
Пример 191C
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2-гидроксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение примера 191В (46 мг) растворяли в тетрагидрофуране (0,8 мл), затем прибавляли 1,0М фторид тетрабутиламмония в смеси 95/5 тетрагидрофуран/Н2О (0,075 мл) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Реакционную смесь концентрировали и очищали колоночной хроматографией с использованием 2-6% метанола в CH2Cl2.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,15 (уш.с, 1H), 8,44 (д, 1H), 8,13 (уш.д, 1H), 7,74 (дд, 1H), 7,55 (д, 1H), 7,33 (д, 2H), 7,23 (с, 1H), 7,11 (д, 1H), 7,03 (м, 3H), 6,93 (дд, 1H), 6,64 (д, 1H), 6,33 (д, 1H), 6,23 (с, 1H), 6,22 (с, 1H), 3,75 (уш.с, 1H), 3,61 (уш.с, 2H), 3,40 (уш.с, 2H), 3,10 (уш.с, 2H), 2,98 (уш.с, 4H), 2,78 (уш.с, 2H), 2,71 (с, 2H), 2,16 (уш.м, 6H), 2,00 (уш.д, 2H), 1,95 (с, 2H), 1,72 (уш.с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 194
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[1-(2-метоксиэтил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил] бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 189A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,19 (уш.с, 1H), 8,46 (д, 1H), 8,17 (д, 1H), 7,72 (дд, 1H), 7,55 (д, 1H), 7,35 (д, 2H), 7,25 (т, 1H), 7,12 (д, 1H), 7,07-7,02 (м, 3H), 6,94 (т, 1H), 6,66 (дд, 1H), 6,36 (д, 1H), 6,24 (м, 2H), 3,73 (м, 1H), 3,52 (т, 2H), 3,27 (с, 3H), 3,00 (м, 6H), 2,79 (м, 2H), 2,72 (уш.с, 2H), 2,16 (м, 6H), 2,04-1,93 (м, 6H), 1,68 (м, 2H), 1,37 (т, 2H), 0,92 (с, 6H).
Пример 195
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Пример 195А
4-(1-(3-(трет-бутилдиметилсилилокси)пропил)пиперидин-4-иламино)-3-нитробензолсульфонамид
Смесь соединения примера 157В (300 мг), (3-бромпропокси)(трет-бутил)диметилсилана (304 мг) и карбоната цезия (967 мг) суспендировали в безводном N,N-диметилформамиде (5 мл). Реакционную смесь нагревали при 70°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Органическую фазу промывали водой, насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали. Сырое вещество очищали флэш-хроматографией на колонке с использованием 3-10% смеси метанол/хлористый метилен, получая указанное в заголовке соединение.
Пример 195А
2-(1Н-индол-4-илокси)-N-(4-(1-(3-(трет-бутилдиметилсилилокси)пропил)пиперидин-4-иламино)-3-нитрофенилсульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 195A в примере 1G.
Пример 195С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Смесь соединения примера 195В (180 мг) в безводном тетрагидрофуране (1 мл) и фторида тетрабутиламмония (0,5 мл 1М в тетрагидрофуране) перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли в вакууме. Остаток очищали ВЭЖХ с обращенной фазой на колонке С18 с использованием градиента 40-70% ацетонитрила/0,1% трифторуксусной кислоты в воде, получая указанное в заголовке соединение в виде трифторацетатной соли. Трифторацетатную соль растворяли в хлористом метилене (6 мл) и промывали 50% водным NaHCO3. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали, получая указанное в заголовке соединение.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,16 (с, 1H), 8,43 (д, 1H), 8,10 (м, 1H), 7,74 (дд, 1H), 7,57 (д, 1H), 7,34 (д, 2H), 7,23 (м, 1H), 7,10 (м, 1H), 7,02 (м, 3H), 6,93 (м, 1H), 6,65 (дд, 1H), 6,34 (д, 1H), 6,22 (м, 2H), 3,74 (м, 2H), 3,47 (м, 4H), 3,14 (м, 2H), 2,97 (м, 4H), 2,74 (м, 4H), 2,60 (м, 1H), 2,17 (м, 4H), 1,97 (м, 4H), 1,69 (м, 4H), 1,40 (м, 2H), 0,93 (с, 6H).
Пример 196
4-[4-({4’-Хлор-3-[3-(диметиламино)пропил]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 196А
4’-Хлор-3-гидроксидифенил-2-карбальдегид
Указанное в заголовке соединение получали, как в примере 175А, заменяя 1-(2-бромфенил)этанон на 2-бром-6-гидроксибензальдегид.
Пример 196В
Трет-бутил 4-((4’-хлор-3-гидроксидифенил-2-ил)метил)пиперазин-1-карбоксилат
Указанное в заголовке соединение получали, как в примере 1А, заменяя 4’-хлордифенил-2-карбоксальдегид на соединение примера 196А.
Пример 196С
Трет-бутил 4-((4’-хлор-3-(трифторметилсульфонилокси)дифенил-2-ил)метил)пиперазин-1-карбоксилат
К смеси примера 196В (390 мг) в пиридине (5 мл) при 0°С прибавляли по каплям ангидрид трифторметансульфокислоты (0,326 мл). Реакционную смесь перемешивали на бане со льдом в течение 1 часа и разбавляли этилацетатом. Полученную смесь экстенсивно промывали насыщенным раствором соли, а органический слой сушили над безводным Na2SO4, фильтровали и концентрировали, получая указанное в заголовке соединение.
Пример 196D
Трет-бутил 4-((4’-хлор-3-(3-(диметиламино)проп-1-инил)дифенил-2-ил)метил)пиперазин-1-карбоксилат
К смеси соединения примера 196С (380 мг), N,N-диметилпроп-2-ин-1-амина (0,227 мл), тетракис(трифенилфосфин)палладия(0) и триэтиламина (0,492) в N,N-диметилформамиде (1,5 мл) прибавляли йодид меди(I) (27,1 мг) иtBuNI (394 мг). Реакционную смесь нагревали до 100°С в течение 4 часов, охлаждали и разбавляли этилацетатом. Органический слой сушили над Na2SO4 и концентрировали. Остаток очищали флэш-хроматографией, элюируя смесью метанола, хлористого метилена и триэтиламина, получая указанное в заголовке соединение.
Пример 196Е
Трет-бутил 4-((4’-хлор-3-(3-(диметиламино)пропил)дифенил-2-ил)метил)пиперазин-1-карбоксилат
Соединение примера 196D (200 мг) в метаноле (8 мл) обрабатывали оксидом платины(IV) (29,1 мг) в атмосфере Н2 в течение ночи. Нерастворимое вещество отфильтровывали, а фильтрат концентрировали, получая указанное в заголовке соединение.
Пример 196F
3-(4’-Хлор-2-(пиперазин-1-илметил)дифенил-3-ил)-N,N-диметилпропан-1-амин
Указанное в заголовке соединение получали, как в примере 175С, заменяя соединение примера 175В соединением примера 196Е.
Пример 196G
Этил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-3-(3-(диметиламино)пропил)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Указанное в заголовке соединение получали, как в примере 175D, заменяя соединение примера 175C соединением примера 196F.
Пример 196H
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-3-(3-(диметиламино)пропил)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Указанное в заголовке соединение получали, как в примере 175Е, заменяя соединение примера 175D соединением примера 196G.
Пример 196I
4-[4-({4’-Хлор-3-[3-(диметиламино)пропил]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 175F, заменяя соединение примера 175E соединением примера 196H.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,11 (с, 1H), 8,38-8,44 (м, 2H), 7,68 (дд, 1H), 7,56 (д, 1H), 7,44 (д, 2H), 7,19-7,29 (м, 5H), 7,07 (д, 1H), 6,99 (дд, 1H), 6,87-6,93 (м, 2H), 6,59 (дд, 1H), 6,26 (д, 1H), 6,23 (с, 1H), 6,19 (д, 1H), 3,84 (дд, 2H), 3,22-3,29 (м, 4H), 2,87 (с, 6H), 2,69-2,75 (м, 2H), 2,59 (с, 5H), 2,14 (с, 4H), 1,83-1,92 (м, 3H), 1,56-1,65 (м, 2H), 1,19-1,31 (м, 4H), 0,81-0,90 (м, 1H).
Пример 197
4-[4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Пример 197А
2-(1Н-индол-5-илокси)-N-(4-(1-(3-(трет-бутилдиметилсилилокси)пропил)пиперидин-4-иламино)-3-нитрофенилсульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 195A в примере 1G.
Пример 197В
4-[4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-гидроксипропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 195В соединением примера 197А в примере 195С.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,07 (уш.с, 1H), 8,50 (д, 1H), 8,14 (д, 1H), 7,75 (дд, 1H), 7,52 (д, 1H), 7,34 (м, 4H), 7,02 (м, 4H), 6,78 (дд, 1H), 6,59 (дд, 1H), 6,34 (м, 1H), 6,14 (д, 1H), 3,46 (м, 4H), 3,16 (м, 2H), 2,98 (м, 4H), 2,68 (м, 4H), 2,60 (м, 1H), 2,16 (м, 6H), 1,97 (м, 4H), 1,68 (м, 4H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 198
4-{4-[(4’-Хлор-4-морфолин-4-ил-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 198А
Трет-бутил 4-((4’-хлор-4-гидроксидифенил-2-ил)метил)пиперазин-1-карбоксилат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид на соединение примера 125А в примере 1А.
Пример 198В
Трет-бутил 4-((4’-хлор-4-(трифторметилсульфонилокси)дифенил-2-ил)метил)пиперазин-1-карбоксилат
Смесь соединения примера 198А (3,0 г), ангидрида трифторметансульфокислоты (3,14 г) в безводном пиридине (50 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом. Органическую фазу промывали водой, насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали. Остаток использовали на следующей стадии без дополнительной очистки.
Пример 198С
Трет-бутил 4-((4’-хлор-4-морфолиндифенил-2-ил)метил)пиперазин-1-карбоксилат
Суспензию соединения примера 198В (500 мг), морфолина (80 мг), ацетата палладия(II), дифенил-2-ил-ди-трет-бутилфосфина (50 мг) и карбоната цезия (427 мг) в безводном тетрагидрофуране (6 мл) нагревали при 50°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Органическую фазу промывали водой, насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Сырое вещество очищали флэш-хроматографией на колонке с использованием 30-50% смеси этилацетат/гексан, получая указанное в заголовке соединение.
Пример 198D
4-((4’-Хлор-2-(пиперазин-1-илметил)дифенил-4-ил)морфолин
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 198С в примере 1В.
Пример 198Е
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-4-морфолиндифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 20А соединением примера 24F и соединение примера 20С соединением примера 198D в примере 20D.
Пример 198F
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-4-морфолиндифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 198Е в примере 1Е.
Пример 198G
4-{4-[(4’-Хлор-4-морфолин-4-ил-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 198F в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,26 (уш.с, 1H), 8,63 (т, 1H), 8,49 (д, 1H), 7,66 (дд, 1H), 7,54 (д, 1H), 7,40 (м, 4H), 7,29 (м, 1H), 7,02 (м, 6H), 6,73 (дд, 1H), 6,39 (д, 1H), 6,30 (м, 2H), 3,85 (дд, 2H), 3,74 (м, 4H), 3,24 (м, 6H), 3,10 (м, 8H), 2,29 (м, 4H), 1,89 (м, 1H), 1,63 (м, 2H), 1,28 (м, 2H).
Пример 199
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Пример 199А
Трет-бутил 4-((4’-хлор-3-гидроксидифенил-2-ил)метил)пиперазин-1-карбоксилат
Указанное в заголовке соединение получали, как описано в примере 1А, заменяя соединение примера 27С соединением примера 196А.
Пример 199В
Трет-бутил 4-((4’-хлор-3-(2-(диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-карбоксилат
К смеси соединения примера 199А (1,5 г) в N,N-диметилформамиде (20 мл) прибавляли 60% гидрид натрия (0,596 г). Смесь перемешивали при комнатной температуре в течение 30 минут и добавляли гидрохлоридную соль диметиламиноэтилхлорида (1,073 г). После перемешивания полученной смеси в течение ночи прибавляли еще 60% гидрида натрия (0,596 г) и гидрохлоридной соли диметиламиноэтилхлорида (1,073 г). Реакционную смесь дополнительно перемешивали в течение ночи, разбавляли этилацетатом и промывали водой, насыщенным NaHCO3 и насыщенным раствором соли. Органический слой сушили над Na2SO4, фильтровали и концентрировали, получая указанное в заголовке соединение.
Пример 199С
2-((4’-Хлор-2-(пиперазин-1-илметил)дифенил-3-илокси)-N,N-диметилэтанамин
К смеси соединения примера 199В (2 г) в хлористом метилене (10 мл) прибавляли трифторуксусную кислоту (10 мл) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут и концентрировали. Остаток вносили на колонку С18 и элюировали смесью 0-50% 0,1% трифторуксусная кислота/вода в ацетонитриле. Указанное в заголовке соединение получали в виде соли трифторуксусной кислоты.
Пример 199D
Этил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-3-(2-диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Указанное в заголовке соединение получали, как описано в примере 175D, заменяя соединение примера 175С соединением примера 199С.
Пример 199Е
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-3-(2-диметиламино)этокси)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Указанное в заголовке соединение получали, как описано в примере 175Е, заменяя соединение примера 175D соединением примера 199D.
Пример 199F
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как описано в примере 175F, заменяя соединение примера 175Е и соединение примера 1F соединением примера 199E и соединением примера 173С, соответственно.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,13 (с, 1H), 8,41 (д, 1H), 8,12 (д, 1H), 7,70 (дд, 1H), 7,58 (д, 1H), 7,52 (д, 2H), 7,43 (д, 2H), 7,31 (т, 1H), 7,22 (т, 1H), 7,06 (дд, 2H), 6,89-6,97 (м, 2H), 6,84 (д, 1H), 6,64 (дд, 1H), 6,30 (д, 1H), 6,24 (дд, 2H), 4,14 (т, 2H), 3,90 (дд, 2H), 3,53-3,73 (м, 2H), 3,22-3,32 (м, 4H), 2,93 (с, 6H), 2,34-2,46 (м, 7H), 2,29 (с, 5H), 1,97 (д, 2H), 1,73 (д, 2H), 1,41-1,62 (м, 4H).
Пример 201
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Пример 201А
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на N1,N1-диэтилциклогексан-1,4-диамин в примере 189А.
Пример 201В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 201A в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ м.д. 12,28 (с, 1H), 9,29 (д, 1H), 8,29-8,38 (м, 2H), 8,19 (д, 1H), 7,52-7,57 (м, 2H), 7,40-7,47 (м, 3H), 7,10 (дд, 1H), 7,06 (д, 2H), 6,92 (д, 1H), 6,74 (дд, 1H), 6,61 (с, 1H), 6,55 (д, 1H), 3,31-3,42 (м, 1H), 3,00-3,08 (м, 4H), 2,76 (с, 2H), 2,54-2,61 (м, 1H), 2,51 (кв, 4H), 2,21-2,28 (м, 2H), 2,08-2,15 (м, 4H), 2,04 (д, 2H), 1,97 (с, 2H), 1,81 (д, 2H), 1,38 (т, 2H), 1,29-1,36 (м, 2H), 1,17-1,28 (м, 2H), 1,05 (т, 6H), 0,93 (с, 6H).
Пример 202
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диметиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Пример 202А
4-(4-(Диметиламино)циклогексиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на N1,N1-диметилциклогексан-1,4-диамин в примере 189А.
Пример 202В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диметиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 202A в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ м.д. 12,45 (с, 1H), 9,21 (д, 1H), 8,33 (д, 1H), 8,27 (дд, 1H), 8,18 (д, 1H), 7,48 (т, 1H), 7,45 (д, 2H), 7,40 (д, 1H), 7,11 (т, 1H), 7,08 (д, 2H), 6,87 (д, 1H), 6,72-6,81 (м, 3H), 6,67 (д, 1H), 3,31-3,41 (м, 1H), 3,00-3,06 (м, 4H), 2,77 (с, 2H), 2,31 (с, 6H), 2,25 (т, 2H), 2,20-2,25 (м, 1H), 2,10-2,16 (м, 4H), 2,00-2,07 (д, 2H), 1,97 (с, 2H), 1,88 (д, 2H), 1,39 (т, 3H), 1,34 (д, 2H), 1,15-1,28 (м, 4H), 0,94 (с, 6H).
Пример 203
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(диэтиламино)циклогексил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 201A в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 12,44 (с, 1H), 9,21 (д, 1H), 8,34 (д, 1H), 8,28 (дд, 1H), 8,18 (д, 1H), 7,47-7,50 (м, 1H), 7,45 (д, 2H), 7,40 (д, 1H), 7,11 (т, 1H), 7,08 (д, 2H), 6,90 (д, 1H), 6,73-6,81 (м, 3H), 6,67 (д, 1H), 3,32-3,40 (м, 1H), 2,99-3,06 (м, 4H), 2,76 (с, 2H), 2,52-2,60 (м, 1H), 2,49 (кв, 4H), 2,25 (т, 2H), 2,09-2,16 (м, 4H), 2,04 (д, 2H), 1,97 (с, 2H), 1,79 (д, 2H), 1,29-1,42 (м, 4H), 1,16-1,28 (м, 2H), 1,04 (т, 6H), 0,92-0,95 (м, 6H).
Пример 204
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 204А
Транс-4-(4-Морфолиноциклогексиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин транс-4-морфолинциклогексанамином в примере 189А.
Пример 204В
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 204A в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 12,45 (с, 1H), 9,21 (д, 1H), 8,36 (д, 1H), 8,26 (дд, 1H), 8,16 (д, 1H), 7,47-7,51 (м, 1H), 7,45 (д, 1H), 7,40 (д, 1H), 7,12 (т, 1H), 6,87 (д, 1H), 6,73-6,81 (м, 3H), 6,68 (д, 1H), 3,71-3,78 (м, 2H), 3,33-3,42 (м, 1H), 3,00-3,06 (м, 4H), 2,76 (с, 2H), 2,44-2,52 (м, 4H), 2,25 (т, 2H), 2,16-2,23 (м, 2H), 2,09-2,16 (м, 4H), 2,06 (д, 2H), 1,97 (с, 2H), 1,86 (с, 2H), 1,39 (т, 2H), 1,17-1,35 (м, 6H), 0,94 (с, 6H).
Пример 205
4-[4-({4’-Хлор-3-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 26С и соединение примера 1F на соединение примера 199Е и соединение примера 21A, соответственно.1H ЯМР (500 МГц, дихлорметан-d2) δ 8,70 (д, 1H), 8,56 (с, 1H), 8,40 (д, 1H), 7,95 (дд, 1H), 7,91 (д, 1H), 7,46 (д, 2H), 7,24-7,35 (м, 5H), 7,15 (т, 1H), 6,90 (дд, 2H), 6,83 (д, 1H), 6,75 (д, 1H), 6,60 (дд, 1H), 6,41 (д, 1H), 6,19 (д, 1H), 4,05 (т, 2H), 3,58 (с, 1H), 3,32 (с, 2H), 2,95-3,02 (м, 4H), 2,66-2,80 (м, 4H), 2,30-2,35 (м, 4H), 2,24-2,29 (м, 9H), 2,15-2,23 (м, 2H), 2,05 (д, 2H), 1,63-1,73 (м, 2H).
Пример 206
4-{4-[1-(4’-Хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 26С и соединение примера 1F на соединение примера 175Е и соединение примера 21A, соответственно.1H ЯМР (400 МГц, дихлорметан-d2) δ 8,70 (д, 1H), 8,51 (с, 1H), 8,40 (д, 1H), 7,94 (дд, 1H), 7,90 (д, 1H), 7,54 (д, 1H), 7,33 (т, 4H), 7,21-7,27 (м, 2H), 7,10-7,19 (м, 4H), 6,91 (д, 1H), 6,73 (д, 1H), 6,55-6,60 (м, 1H), 6,41 (с, 1H), 6,16 (д, 1H), 3,52-3,63 (м, 1H), 3,36 (кв, 1H), 2,96-3,07 (м, 4H), 2,72-2,79 (м, 2H), 2,33-2,41 (м, 2H), 2,27 (с, 3H), 2,14-2,27 (м, 4H), 2,00-2,09 (м, 2H), 1,63-1,74 (м, 2H), 1,19 (д, 3H).
Пример 207
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(диметиламино)тетрагидро-2Н-пиран-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на 4-(аминометил)-N,N-диметилтетрагидро-2Н-пиран-4-амин в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,84 (уш.с, 1H), 8,59 (д, 1H), 7,84 (дд, 1H), 7,51 (д, 1H), 7,39-7,43 (м, 2H), 7,33 (д, 2H), 7,17-7,21 (м, 2H), 7,03 (д, 2H), 6,89 (дд, Гц, 1H), 6,64 (д, 1H), 6,40 (с, 1H), 6,13 (д, 1H), 3,72-3,75 (м, 2H), 3,34-3,57 (м, 4H), 3,02 (уш., 4H), 2,71 (уш., 2H), 2,27 (с, 6H), 2,16 (уш.с, 6H), 1,94 (уш.с, 2H), 1,78-1,85 (м, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 208
N-({4-[(2-Аминоциклогексил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Пример 208A
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на трет-бутил 2-аминоциклогексилкарбамат в примере 187В.
Пример 208В
N-({4-[(2-Аминоциклогексил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение примера 208А (0,1 г) в диметилсульфоксиде (4 мл) нагревали в условиях микроволнового облучения (200°С, 1 час). Остаток очищали ВЭЖХ с обращенными фазами на колонке С18 с использованием градиента 30-70% ацетонитрила/0,1% ТФУ в воде. Требуемые фракции собирали и частично удаляли органический растворитель при пониженном давлении. Полученную смесь обрабатывали насыщенной водной смесью NaHCO3. Затем ее три раза экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали, получая указанное в заголовке соединение.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,02 (с, 1H), 8,45 (с, 1H), 8,05 (д, 1H), 7,79-7,81 (м, 1H), 7,56 (д, 1H), 7,30-7,34 (м, 4H), 6,98-7,06 (м, 4H), 6,73 (д, 1H), 6,54 (дд, 1H), 6,33 (с, 1H), 6,11 (д, 1H), 3,64-3,70 (м, 1H), 2,93 (уш., 4H), 2,71 (уш., 2H), 2,14-2,16 (уш.с, 6H), 1,95 (уш.с, 2H), 1,67-1,73 (м, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 209
4-[4-({4’-Хлор-4-[3-(диметиламино)проп-1-инил]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 209А
Трет-бутил 4-((4’-хлор-4-(3-(диметиламино)проп-1-инил)дифенил-2-ил)метил)пиперазин-1-карбоксилат
Суспензию соединения примера 198В (800 мг), N,N-диметилпроп-2-ин-1-амина (373 мг), йодида меди(I) (57 мг), тетракис(трифенилфосфин)палладия(0) (259 мг), триэтиламина (757 мг) и йодида трет-бутиламмония (829 мг) в безводном N,N-диметилформамиде (5 мл) нагревали при 100°С в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетом. Органическую фазу промывали водой, насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Сырое вещество очищали флэш-хроматорафией на колонке с использованием 0-3% смеси метанол/хлористый метилен, получая указанное в заголовке соединение.
Пример 209В
3-(4’-хлор-2-(пиперазин-1-илметил)дифенил-4-ил)-N,N-диметилпроп-2-ин-1-амин
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 209А в примере 1В.
Пример 209С
Метил 2-(1Н-индол-4-илокси)-4-(4-((4’-хлор-4-(3-(диметиламино)проп-1-инил)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 20А соединением примера 24F и соединение примера 20С соединением примера 209В в примере 20D.
Пример 209D
2-(1Н-Индол-4-илокси)-4-(4-((4’-хлор-4-(3-(диметиламино)проп-1-инил)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 209C в примере 1E.
Пример 209Е
4-[4-({4’-Хлор-4-[3-(диметиламино)проп-1-инил]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 209D в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,23 (уш.с, 1H), 8,57 (т, 1H), 8,47 (д, 1H), 7,67 (дд, 1H), 7,54 (м, 2H), 7,43 (м, 5H), 7,24 (м, 2H), 7,14 (м, 1H), 7,03 (м, 1H), 6,94 (м, 1H), 6,71 (д, 1H), 6,38 (д, 1H), 6,27 (д, 2H), 3,85 (м, 2H), 3,60 (м, 2H), 3,23 (м, 6H), 3,04 (м, 4H), 2,35 (с, 6H), 2,28 (м, 4H), 1,88 (м, 1H), 1,58 (м, 2H), 1,24 (м, 2H).
Пример 210
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Пример 210А
3-Нитро-4-(1-(4,4,4-трифторбутил)пиперидин-4-иламино)бензолсульфонамид
Соединение примера 157В (600 мг) соединяли с 1,1,1-трифтор-4-йодбутаном (595 мг) и карбонатом калия (829 мг) в ацетонитриле (15 мл). Реакционную смесь нагревали при 70°С в течение ночи. Реакционную смесь концентрировали, а затем растворяли в эфире и вновь концентрировали. Продукт использовали на следующей стадии без дополнительной очистки.
Пример 210В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 210A и соединение примера 1E соединением примера 55В в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,20 (с, 1H), 8,47 (д, 1H), 8,20 (д, 1H), 7,72 (дд, 1H), 7,54 (д, 1H), 7,34 (д, 2H), 7,25 (т, 1H), 7,14 (д, 1H), 7,05 (м, 3H), 6,95 (т, 1H), 6,68 (дд, 1H), 6,38 (д, 1H), 6,25 (с, 2H), 3,71 (м, 1H), 3,01 (м, 4H), 2,92 (м, 2H), 2,72 (с, 2H), 2,40 (м, 2H), 2,30 (м, 2H), 2,16 (м, 6H), 1,95 (м, 4H), 1,68 (м, 4H), 1,38 (т, 2H), 1,24 (уш.с, 1H), 0,92 (с, 6H).
Пример 211
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[2-(4-гидрокси-1-метилпиперидин-4-ил)этил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на 4-(2-аминоэтил)-1-метилпиперидин-4-ол в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,05 (с, 1H), 8,61 (с, 1H), 8,47 (д, 1H), 7,77 (дд, 1H), 7,54 (д, 1H), 7,32-7,34 (м, 4H), 7,04 (д, 2H), 7,01 (с, 1H), 6,90 (д, 2H), 6,76 (дд, 1H), 6,57 (дд, 1H), 6,33 (с, 1H), 6,13 (д, 1H), 4,92 (с, 1H), 3,43-3,46 (м, 2H), 2,95-3,01 (уш., 8H), 2,71 (уш., 2H), 2,65 (с, 3H), 2,12-2,16 (уш.с, 6H), 1,95 (уш.с, 2H), 1,77-1,80 (м, 2H), 1,67-1,71 (м, 4H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 212
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-2-ил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на 4-(2-аминоэтил)-1-метилпиперидин-4-ол в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 1H), 8,58 (с, 1H), 8,28 (д, 1H), 7,82 (дд, 1H), 7,51 (д, 1H), 7,39-7,42 (м, 2H), 7,33 (д, 2H), 7,20 (д, 1H), 7,17 (д, 1H), 7,14 (д, 1H), 7,03 (д, 2H), 6,86 (д, 1H), 6,85 (д, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,15 (д, 1H), 3,87-3,90 (м, 2H), 3,20-3,24 (м, 2H), 3,04 (уш., 4H), 2,73 (уш., 2H), 2,11-2,17 (м, 5H), 1,95 (уш.с, 2H), 1,71-1,75 (м, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 213
4-(4-{[4’-Хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 213А
4-(2-Трет-бутилдиметилсилилокси)этокси)-4’-хлордифенил-2- карбальдегид
Смесь соединения примера 125А (0,5 г), (2-бромэтокси)(трет-бутил)диметилсилана (0,771 г) и карбоната цезия (1,4 г) суспендировали в безводном N,N-диметилформамиде (5 мл). Реакционную смесь нагревали при 70°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетом. Органическую фазу промывали водой, насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Сырое вещество очищали флэш-хроматорафией на колонке с использованием 0-5% смеси этилацетат/гексан, получая указанное в заголовке соединение.
Пример 213В
Метил 2-(1Н-индол-4-илокси)-4-(4-((4-(2-(трет-бутилдиметилсилилокси)этокси)-4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 213А и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 213С
2-(1Н-индол-4-илокси)-4-(4-((4-(2-(трет-бутилдиметилсилилокси)этокси)-4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 213В в примере 1E.
Пример 213D
2-(1Н-индол-4-илокси)-4-(4-((4-(2-(трет-бутилдиметилсилилокси)этокси)-4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 213С в примере 1G.
Пример 213Е
4-(4-{[4’-Хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 195В соединением примера 213D в примере 195С.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,24 (м, 1H), 8,62 (т, 1H), 8,50 (д, 1H), 7,67 (дд, 1H), 7,54 (м, 1H), 7,43 (д, 2H), 7,37 (д, 2H), 7,28 (м, 1H), 7,15 (м, 2H), 7,05 (м, 2H), 6,96 (м, 1H), 6,90 (дд, 1H), 6,73 (дд, 1H), 6,40 (д, 1H), 6,31 (м, 1H), 6,27 (м, 1H), 4,82 (т, 1H), 3,99 (т, 2H), 3,86 (м, 2H), 3,71 (м, 2H), 3,26 (м, 6H), 2,66 (м, 2H), 2,31 (м, 5H), 1,89 (м, 1H), 1,63 (м, 2H), 1,27 (м, 2H).
Пример 214
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(циклопропилметил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Пример 214А
Трет-бутил 1-(циклопропилметил)пиперидин-4-илкарбамат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид на циклопропанкарбальдегид и трет-бутил пиперазин-1-карбоксилат на трет-бутил пиперидин-4-илкарбамат в прмиере 1А.
Пример 214В
1-(Циклопропилметил)пиперидин-4-амин бис(2,2,2-трифторацетат)
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 214А в примере 1В.
Пример 214С
4-(1-(циклопропилметил)пиперидин-4-иламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин соединением примера 214В в примере 189А.
Пример 214D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(циклопропилметил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 214C в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 12,28 (с, 1H), 9,30 (д, 1H), 8,49 (д, 1H), 8,34 (дд, 1H), 8,18 (д, 1H), 7,52-7,56 (м, 2H), 7,41-7,46 (м, 3H), 7,09 (дд, 1H), 7,06 (д, 2H), 6,91 (д, 1H), 6,73 (дд, 1H), 6,61 (д, 1H), 6,54 (д, 1H), 3,45-3,56 (м, 1H), 3,00-3,08 (м, 4H), 2,87 (д, 2H), 2,76 (с, 2H), 2,25 (т, 2H), 2,19 (д, 4H), 2,09-2,14 (м, 4H), 1,97 (с, 4H), 1,63-1,73 (м, 2H), 1,38 (т, 2H), 0,84-0,91 (м, 1H), 0,43-0,50 (м, 2H), 0,11 (кв, H).
Пример 215
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Пример 215А
4-(4-Метилпиперазин-1-иламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метанамин 4-метилпиперазин-1-амином и 4-фтор-3-нитробензолсульфонамид соединением примера 159С в примере 1F.
Пример 215В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 215A и соединение примера 26C соединением примера 55B в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,21 (уш.с, 1H), 8,09 (м, 1H), 7,98 (м, 1H), 7,83 (дд, 1H), 7,53 (д, 1H), 7,45 (д, 1H), 7,34 (д, 2H), 7,26 (т, 1H), 7,16 (д, 1H), 7,04 (д, 2H), 6,97 (т, 1H), 6,66 (дд, 1H), 6,39 (д, 1H), 6,24 (м, 2H), 2,87 (м, 13H), 2,38 (с, 3H), 2,17 (м, 6H), 1,95 (с, 2H), 1,39 (т, 2H), 0,93 (с, 6H).
Пример 216
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(4,4,4-трифторбутил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 210A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,13 (с, 1H), 10,89 (уш.с, 1H), 8,55 (д, 1H), 8,22 (д, 1H), 7,79 (дд, 1H), 7,50 (д, 1H), 7,34 (м, 4H), 7,07 (м, 4H), 6,83 (дд, 1H), 6,63 (дд, 1H), 6,37 (м, 1H), 6,15 (д, 1H), 3,71 (м, 1H), 3,01 (м, 4H), 2,92 (м, 2H), 2,72 (с, 2H), 2,40 (м, 2H), 2,30 (м, 2H), 2,16 (м, 6H), 1,95 (м, 4H), 1,68 (м, 4H), 1,38 (т, 2H), 1,24 (уш.с, 1H), 0,92 (с, 6H).
Пример 217
4-{4-[1-(4’-Хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 26С и соединение примера 1F на соединение примера 175Е и соединение примера 174A, соответственно.1Н ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,21 (с, 1H), 9,15 (с, 1H), 8,45 (д, 1H), 7,70 (дд, 1H), 7,43-7,56 (м, 5H), 7,34-7,41 (м, 1H), 7,24-7,31 (м, 4H), 7,10-7,16 (м, 2H), 6,94 (т, 1H), 6,66 (дд, 1H), 6,37 (д, 1H), 6,24 (дд, 2H), 2,80-3,02 (м, 10H), 2,28-2,39 (м, 5H), 2,14-2,24 (м, 2H), 1,16 (д, 3H).
Пример 218
4-[4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 218А
2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енкарбальдегид
Соединение данного примера получали, заменяя соединение примера 143С соединением примера 18С в примере 143D.
Пример 218В
Трет-бутил 4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)-3-(гидроксиметил)пиперазин-1-карбоксилат
Соединение данного примера получали, заменяя соединение примера 27С соединением примера 218А и трет-бутил пиперазин-1-карбоксилат трет-бутил 3-(гидроксиметил)пиперазин-1-карбоксилатом в примере 1А.
Пример 218С
(1-((2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-2-ил)метанол
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 218В в примере 1В.
Пример 218D
Этил 2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)-3-(гидроксиметил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 20С соединением примера 218С и соединение примера 20А соединением примера 26A в примере 20D.
Пример 218Е
2-(1Н-Индол-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)-3-(гидроксиметил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 218D в примере 1E.
Пример 218F
4-[4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 218Е и соединение примера 1F соединением примера 21A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,07 (с, 1H), 8,50 (д, 1H), 8,14 (д, 1H), 7,45 (д, J=9,46 Гц, 1H), 7,52 (д, 1H), 7,32-7,35 (м, 4H), 6,99-7,05 (м, 4H), 6,78 (дд, 1H), 6,58-6,59 (м, 1H), 6,34 (с, 1H), 6,14 (д, 1H), 4,42-4,44 (м, 1H), 3,72 (уш.с, 1H), 3,10-3,25 (м, 6H), 3,00 (уш, 2H), 2,58-2,69 (м, 6H), 1,82-2,01 (м, 6H), 1,70 (уш, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 219
4-[4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 218Е и соединение примера 1F соединением примера 173С в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,11 (с, 1H), 8,52 (д, 1H), 8,20 (д, 1H), 7,77 (дд, 1H), 7,52 (д, 1H), 7,32-7,38 (м, 4H), 7,03-7,07 (м, 4H), 6,81 (дд, 1H), 6,58-6,60 (м, 1H), 6,36 (с, 1H), 6,14 (д, 1H), 4,44 (с, 1H), 3,92 (дд, 2H), 3,71 (уш.с, 1H), 3,41-3,43 (м, 2H), 3,02-3,06 (м, 4H), 2,55-2,72 (м, 6H), 2,18-2,24 (м, 2H), 1,91-2,00 (м, 8H), 1,76-1,80 (м, 2H), 1,63-1,65 (м, 2H), 1,49-1,51 (м, 2H), 1,35-1,38 (м, 2H), 0,92 (с, 6H).
Пример 220
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 215A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 8,15 (д, 1H), 8,04 (с, 1H), 7,95 (дд, 1H), 7,50 (т, 2H), 7,35 (м, 4H), 7,12 (д, 1H), 7,04 (д, 2H), 6,83 (дд, 1H), 6,61 (дд, 1H), 6,39 (м, 1H), 6,12 (д, 1H), 2,92 (м, 10H), 2,71 (с, 2H), 2,35 (с, 3H), 2,17 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 221
4-(4-{[4’-Хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 221А
2-(1Н-Индол-4-илокси)-4-(4-((4-(2-(трет-бутилдиметилсилилокси)этокси)-4’-хлордифенил-2-ил)метил)пиперазин-1-ил)-N-(4-(1-метилпиперидин-4-иламино)-3-нитрофенилсульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 213С и соединение примера 1F соединением примера 21А в примере 1G.
Пример 221В
4-(4-{[4’-Хлор-4-(2-гидроксиэтокси)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 195В соединением примера 221A в примере 195.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,12 (с, 1H), 8,42 (д, 1H), 8,10 (д, 1H), 7,74 (дд, 1H), 7,58 (д, 1H), 7,40 (м, 4H), 7,21 (м, 1H), 7,06 (м, 4H), 6,90 (м, 2H), 6,65 (м, 1H), 6,31 (д, 1H), 6,23 (м, 2H), 4,84 (т, 1H), 4,00 (т, 2H), 3,71 (м, 3H), 3,24 (м, 4H), 3,02 (м, 6H), 2,66 (м, 2H), 2,32 (м, 5H), 2,00 (м, 2H), 1,69 (м, 2H).
Пример 222
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид
Пример 222А
3-Нитро-4-[3-(3-оксопиперазин-1-ил)пропиламино]бензолсульфонамид
4-(3-Аминопропил)пиперазин-2-он (3,45 г) и триэтиламин (5,18 мл, 3,76 г) прибавляли к 1,4-диоксану (100 мл) и N,N-диметилацетамиду (20 мл) и перемешивали до растворения. Прибавляли 4-хлор-3-нитробензолсульфонамид (4,00 г) и нагревали смесь до 90°С в течение 16 часов. Смесь охлаждали и удаляли растворитель в вакууме. Вещество очищали перекристаллизацией из 20% метанола в хлористом метилене с последующим промыванием перекристаллизованного твердого вещества 10% метанолом в хлористом метилене, после чего промывали 100% хлористым метиленом.
Пример 222В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 222А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,16 (уш.с, 1H), 8,85 (т, 1H), 8,58 (д, 1H), 7,79 (дд, 1H), 7,74 (уш.с, 1H), 7,51 (д, 1H), 7,43-7,37 (м, 2H), 7,34 (д, 2H), 7,16 (д, 1H), 7,07-7,01 (м, 3H), 6,86 (дд, 1H), 6,65 (д, 1H), 6,39 (т, 1H), 6,15 (д, 1H), 3,43 (кв, 2H), 3,17 (т, 2H), 3,03 (м, 4H), 2,95 (с, 2H), 2,72 (с, 2H), 2,56 (т, 2H), 2,47 (т, 2H), 2,16 (м, 6H), 1,95 (уш.с, 2H), 1,79 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 223
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[3-(3-оксопиперазин-1-ил)пропил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 222А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,24 (уш.с, 1H), 8,83 (т, 1H), 8,50 (д, 1H), 7,75 (уш.с, 1H), 7,68 (дд, 1H), 7,53 (д, 1H), 7,34 (д, 2H), 7,28 (т, 1H), 7,18 (д, 1H), 7,04 (д, 2H), 7,02-6,94 (м, 2H), 6,71 (дд, 1H), 6,42 (д, 1H), 6,29-6,23 (м, 2H), 3,43 (кв, 2H), 3,17 (м, 2H), 3,05 (м, 4H), 2,96 (с, 2H), 2,72 (с, 2H), 2,57 (т, 2H), 2,48 (т, 2H), 2,17 (м, 6H), 1,95 (уш.с, 2H), 1,79 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 224
4-(4-{[2-(4-Хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 224А
2-Хлор-5-гидроксициклогекс-1-енкарбальдегид
К охлажденному (-10°С) N,N-диметилформамиду (20 мл) прибавляли оксихлорид фосфора (4,08 мл). Температуру поддерживали ниже 0°С. Перемешивание продолжали еще в течение 30 минут перед добавлением 4-(трет-бутилдиметилсилилокси)циклогексанон (10 г). После этого смесь перемешивали при комнатной температуре в течение 2 часов перед разбавлением ее этилацетатом (300 мл) и промывали водой (3×), насыщенным раствором соли и сушили над Na2SO4. После фильтрования и концентрирования сырой продукт непосредственно использовали в следующей реакции без дополнительной очистки.
Пример 224В
2-(4-Хлорфенил)-5-гидроксициклогекс-1-енкарбальдегид
К смеси 4-хлорфенилбороновой кислоты (6,88 г), соединению примера 224А (4,65 г), ацетата палладия(II) (131 мг), К2СО3 (18,24 г) и бромида тетрабутиламмония (14,18 г) добавляли воду (200 мл). Смесь перемешивали при 50°С в течение 4 часов, охлаждали и разбавляли этилацетатом (400 мл) и промывали водой (3х) и насыщенным раствором соли и сушили над Na2SO4. После фильтрования и концентрирования остаток вносили на колонку и элюировали 5-20% смесью этилацетата в гексане, получая указанное в заголовке соединение.
Пример 224С
Метил 2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)-5-гидроксициклогекс-1-енил)метил)пиперазин-1-ил)бензоат
К смеси соединения примера 224В (0,8 г) и соединения примера 150А (1,2 г) в хлористом метилене (20 мл) прибавляли триацетоксиборгидрид натрия (1,2 г). Смесь перемешивали в течение ночи. Смесь разбавляли этилацетатом (200 мл) и промывали 2% NaOH, водой и насыщенным раствором соли. После сушки над Na2SO4 растворитель выпаривали в вакууме и вносили остаток на колонку и элюировали 5-10% смесью метанола в дихлорметане, получая указанное в заголовке соединение.
Пример 224D
2-(1Н-Индол-5-илокси)-4-(4-((2-(4-хлорфенил)-5-гидроксициклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
К смеси соединения примера 224С (1,78 г) в тетрагидрофуране (30 мл), метанола (10 мл) и воды (10 мл) прибавляли LiOH⋅H2O (0,262 г). Смесь перемешивали в течение ночи. Затем смесь нейтрализовывали 5% водной HCl и экстрагировали этилацетатом (3х), а объединенные органические экстракты промывали насыщенным раствором соли и сушили над Na2SO4. В результате выпаривания растворителя получали указанное в заголовке соединение.
Пример 224Е
4-(4-{[2-(4-Хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 224D и соединение примера 1F соединением примера 21А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,08 (с, 1H), 8,50 (д, 1H), 8,13 (д, 1H), 7,77 (дд, 1H), 7,52 (д, 1H), 7,34 (м, 4H), 7,04 (м, 4H), 6,78 (дд, 1H), 6,59 (дд, 1H), 6,35 (с, 1H), 6,13 (д, 1H), 4,59 (д, 1H), 3,74 (м, 2H), 3,39 (м, 1H), 3,03 (м, 7H), 2,68 (м, 3H), 2,41 (м, 4H), 2,17 (м, 7H), 2,00 (м, 3H), 1,71 (м, 3H).
Пример 225
4-(4-{[2-(4-Хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 224D и соединение примера 1F соединением примера 173С в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,07 (с, 1H), 8,47 (д, 1H), 8,14 (д, 1H), 7,92 (с, 1H), 7,72 (дд, 1H), 7,52 (д, 1H), 7,46 (д, 1H), 7,33 (м, 4H), 7,07 (д, 2H), 6,98 (д, 1H), 6,77 (м, 1H), 6,58 (дд, 1H), 6,34 (с, 1H), 6,14 (д, 1H), 4,59 (м, 1H), 3,90 (дд, 2H), 3,70 (м, 1H), 3,01 (м, 8H), 2,71 (м, 6H), 2,56 (м, 8H), 2,19 (м, 4H), 1,94 (м, 3H), 1,56 (м, 3H).
Пример 226
4-(4-{[2-(4-Хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 224D и соединение примера 1F соединением примера 174А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,13 (с, 1H), 9,13 (с, 1H), 8,52 (д, 1H), 7,83 (дд, 1H), 7,53 (т, 2H), 7,36 (м, 4H), 7,09 (м, 3H), 6,83 (дд, 1H), 6,61 (дд, 1H), 6,38 (с, 1H), 6,12 (д, 1H), 4,59 (д, 1H), 3,75 (м, 1H), 2,81 (м, 12H), 2,27 (м, 12H), 1,79 (м, 4H).
Пример 227
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Пример 227А
4-(1-Индан-2-илпиперидин-4-иламино)-3-нитробензолсульфонамид
2-Аминоиндан (12,84 г) и триэтиламин (15,04 мл, 10,92 г) прибавляли к 1,4-диоксану (150 мл) и перемешивали смесь до растворения твердого вещества. Добавляли 4-хлор-3-нитробензолсульфонамид (12,77 г) и нагревали смесь до 90°С в течение 16 часов. Смесь охлаждали и отфильтровывали осадок в вакууме, промывали 20% смесью метанола в хлористом метилене и промывали 100% хлористым метиленом.
Пример 227В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 227А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,20 (уш.с, 1H), 8,48 (д, 1H), 8,21 (д, 1H), 7,73 (дд, 1H), 7,54 (д, 1H), 7,34 (д, 2H), 7,26-7,21 (м, 3H), 7,16-7,12 (м, 2H), 7,09-7,02 (м, 3H), 6,95 (т, 2H), 6,68 (дд, 1H), 6,39 (д, 1H), 6,24 (м, 2H), 3,74 (м, 1H), 3,18-2,80 (м, 13H), 2,72 (уш.с, 2H), 2,16 (м, 6H), 2,03 (м, 2H), 1,95 (уш.с, 2H), 1,68 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 228
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(2,3-дигидро-1Н-инден-2-ил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 227А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,12 (уш.с, 1H), 8,55 (д, 1H), 8,23 (д, 1H), 7,79 (дд, 1H), 7,51 (д, 1H), 7,41-7,31 (м, 4H), 7,22 (м, 2H), 7,16-7,09 (м, 3H), 7,07-7,01 (м, 3H), 6,83 (дд, 1H), 6,63 (дд, 1H), 6,37 (т, 1H), 6,15 (д, 1H), 3,73 (м, 1H), 3,16-2,82 (м, 13H), 2,71 (уш.с, 2H), 2,16 (м, 6H), 2,02 (м, 2H), 1,95 (уш.с, 2H), 1,67 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 229
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-морфолин-4-илциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола с хлористоводородной кислотой на (1-морфолинциклогексил)метанамин в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,19 (с, 1H), 9,08 (с, 1H), 8,60 (д, 1H), 7,81 (дд, 1H), 7,51 (д, 1H), 7,43 (д, 1H), 7,39 (т, 1H), 7,33 (д, 2H), 7,16-7,18 (м, 2H), 7,03 (д, 2H), 6,88 (дд, 1H), 6,65 (дд, 1H), 6,40 (с, 1H), 6,13 (д, 1H), 3,60 (с, 4H), 3,42-3,43 (м, 2H), 3,01 (уш.с, 4H), 2,72 (уш.с, 2H), 2,57 (уш.с, 4H), 2,12-2,16 (м, 7H), 1,94 (уш.с, 2H), 1,46-1,60 (м, 12H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 230
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-2-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Пример 230А
Трет-бутил 1-(тиазол-2-илметил)пиперидин-4-илкарбамат
Соединение данного примера получали, заменяя соединение примера 27С тиазол-2-карбальдегидом и трет-бутил пиперазин-1-карбоксилат трет-бутилпиперидин-4-илкарбаматом в примере 1А.
Пример 230В
1-(Тиазол-2-илметил)пиперидин-4-амин
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 230А в примере 1В.
Пример 230С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-2-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты соединением примера 230В в примере 187В.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 8,23 (д, 1H), 7,76-7,79 (м, 2H), 7,65 (с, 1H), 7,53 (д, 1H), 7,38-7,40 (м, 2H), 7,34 (д, 2H), 7,17 (д, 1H), 7,11 (с, 1H), 7,04 (д, 2H), 6,82 (дд, 1H), 6,62 (д, 1H), 6,38 (с, 1H), 6,14 (д, 1H), 4,19 (с, 2H), 3,01 (с, 4H), 2,91-2,96 (м, 2H), 2,72 (с, 2H), 2,12-2,17 (м, 6H), 1,95-1,99 (м, 4H), 1,47-1,51 (м, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 231
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-4-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Пример 231А
Трет-бутил 1-(тиазол-4-илметил)пиперидин-4-илкарбамат
Соединение данного примера получали, заменяя соединение примера 27С тиазол-4-карбальдегидом и трет-бутил пиперазин-1-карбоксилат трет-бутилпиперидин-4-илкарбаматом в примере 1А.
Пример 231В
1-(Тиазол-4-илметил)пиперидин-4-амин
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 231А в примере 1В.
Пример 231С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[1-(1,3-тиазол-4-илметил)пиперидин-4-ил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты соединением примера 231В в примере 187В.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,11 (с, 1H), 9,06 (с, 1H), 8,21 (д, 1H), 7,98 (с, 1H), 7,77 (дд, 1H), 7,54 (д, 1H), 7,33-7,38 (м, 4H), 7,13 (д, 2H), 7,03-7,07 (м, 3H), 6,79 (дд, 1H), 6,60 (дд, 1H), 6,37 (с, 1H), 6,14 (д, 1H), 4,23 (с, 2H), 2,99 (с, 4H), 2,89-2,94 (м, 2H), 2,71 (с, 2H), 2,12-2,17 (м, 6H), 1,95-1,99 (м, 4H), 1,47-1,51 (м, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 232
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на (4-(аминометил)тетрагидро-2Н-пиран-4-ил)метанол в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 9,10 (т, 1H), 8,59 (д, 1H), 7,81 (дд, 1H), 7,51 (д, 1H), 7,42 (д, 1H), 7,39 (т, 1H), 7,16-7,18 (м, 2H), 7,03 (д, 2H), 6,87 (дд, 1H), 6,65 (д, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 5,22 (т, 1H), 3,51-3,62 (м, 6H), 3,19 (д, 2H), 3,03 (с, 4H), 2,72 (с, 2H), 2,12-2,17 (м, 6H), 1,94 (с, 2H), 1,45-1,49 (м, 4H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 233
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(2-гидроксиэтил)пиперазин-1-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Пример 233А
4-(4-(2-Гидроксиэтил)пиперазин-1-иламино)-3-нитробензолсульфамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин на 2-(4-аминопиперазин-1-ил)этанол в примере 1F.
Пример 233В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(2-гидроксиэтил)пиперазин-1-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 233А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,15 (с, 1H), 9,17 (м, 1H), 8,53 (д, 1H), 7,83 (дд, 1H), 7,56 (д, 1H), 7,51 (д, 1H), 7,36 (м, 4H), 7,13 (м, 1H), 7,03 (м, 2H), 6,84 (дд, 1H), 6,62 (дд, 1H), 6,38 (м, 1H), 6,12 (м, 1H), 4,57 (м, 1H), 3,54 (м, 2H), 2,95 (м, 10Н), 2,71 (с, 2H), 2,57 (м, 2H), 2,15 (м, 6H), 1,94 (с, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 234
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3S)-1-метилпирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 234А
(S)-трет-бутил 1-метилпирролидин-3-илкарбамат
К смеси (S)-трет-бутил 1-метилпирролидин-3-илкарбамата (438 мг) в метаноле (10 мл) прибавляли 37% смесь формальдегида в воде (0,53 мл) и боргидрид натрия (267 мг). Реакционную смесь перемешивали в течение ночи при комнатной температуре, а затем концентрировали. Остаток растворяли в хлороформе (15 мл), промывали насыщенным раствором соли и раствором NaHCO3, сушили над MgSO4, фильтровали и концентрировали. Указанное в заголовке соединение использовали на следующей стадии без дополнительной очистки.
Пример 234В
(S)-1-метилпирролидин-3-амин
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 234А в примере 1В.
Пример 234С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3S)-1-метилпирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин соединением примера 234В и 4-хлор-3-нитробензолсульфонамид соединением примера 310В в примере 189А.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 10,98 (с, 1H), 8,38 (д, 1H), 8,16 (д, 1H), 7,64 (дд, 1H), 7,53 (д, 1H), 7,34 (д, 2H), 7,28 (м, 2H), 7,05 (д, 2H), 6,89 (д, 1H), 6,72 (д, 1H), 6,68 (дд, 1H), 6,53 (дд, 1H), 6,29 (т, 1H), 6,15 (д, 1H), 4,14 (уш.с, 1H), 2,93 (м, 4H), 2,71 (м, 4H), 2,33 (м, 2H), 2,27 (с, 3H), 2,16 (м, 6H), 1,95 (с, 2H), 1,61 (м, 1H), 1,38 (т, 2H), 1,24 (уш.с, 1H), 0,92 (с, 6H).
Пример 235
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-фторпропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Пример 235А
4-(1-(3-Фторпропил)пиперидин-4-иламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1,1,1-трифтор-4-йодбутан 1-фтор-3-йодпропаном в примере 210А.
Пример 235В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[1-(3-фторпропил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 235A и соединение примера 1E соединением примера 26C в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,12 (с, 1H), 10,89 (уш.с, 1H), 8,48 (д, 1H), 8,152 (д, 1H), 7,79 (дд, 1H), 7,50 (д, 1H), 7,34 (м, 4H), 7,03 (м, 4H), 6,83 (дд, 1H), 6,63 (дд, 1H), 6,37 (м, 1H), 6,15 (д, 1H), 3,71 (уш.с, 1H), 3,01 (м, 4H), 2,92 (м, 2H), 2,72 (м, 2H), 2,56 (м, 1H), 2,30 (м, 2H), 2,16 (м, 6H), 1,95 (м, 5H), 1,83 (м, 1H), 1,68 (м, 2H), 1,38 (м, 2H), 1,24 (уш.с, 1H), 0,92 (с, 6H).
Пример 236
4-[4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 218Е в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,62 (с, 1H), 8,58 (с, 1H), 7,78 (д, 1H), 7,52 (д, 1H), 7,39-7,42 (м, 2H), 7,33 (д, 1H), 7,14 (с, 1H), 7,09 (д, 1H), 7,04 (д, 1H), 6,86 (д, 1H), 6,62 (д, 1H), 6,39 (с, 1H), 6,14 (с, 1H), 4,46 (м, 1H), 3,85 (дд, 2H), 3,17-3,25 (м, 8H), 2,76 (уш.с, 2H), 2,58 (уш.с, 2H), 1,89-2,01 (м, 6H), 1,80 (уш., 2H), 1,29-1,38 (м, 2H), 0,91 (с, 6H).
Пример 237
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)бензамид
Пример 237А
4-((4-Аминотетрагидро-2Н-пиран-4-ил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на 4-(аминометил)тетрагидро-2Н-пиран-4-амин в примере 1F.
Пример 237В
N-[(4-{[(4-аминотетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-4-[4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}-3-(гидроксиметил)пиперазин-1-ил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 218Е и соединение примера 1F соединением примера 237A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,46 (с, 1H), 11,19 (с, 1H), 8,16 (д, 1H), 8,51-8,55 (м, 1H), 8,11 (с, 2H), 7,88 (д, 1H), 7,53 (д, 1H), 7,32-7,43 (м, 5H), 7,15 (с, 1H), 7,09 (д, 1H), 6,85 (дд, 1H), 6,68 (с, 1H), 6,40 (с, 1H), 6,21 (с, 1H), 3,81-3,82 (м, 2H), 3,70-3,72 (м, 4H), 3,10 (уш.с, 2H), 2,02-2,09 (м, 2H), 1,60-1,85 (м, 2H), 1,66-1,73 (м, 2H), 1,35-1,38 (м, 2H), 0,93 (с, 6H).
Пример 238
4-[4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил]-N-[(4-{[(1-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на 1-(аминометил)циклогексанол в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,69 (т, 1H), 8,60 (д, 1H), 7,80 (дд, 1H), 7,51 (д, 1H), 7,39-7,43 (м, 2H), 7,33 (д, 2H), 7,17 (д, 2H), 7,14 (д, 1H), 7,03 (д, 2H), 6,87 (дд, 1H), 6,65 (д, 1H), 6,40 (с, 1H), 6,14 (д, 1H), 4,73 (с, 1H), 3,03 (с, 4H), 2,74 (с, 2H), 2,12-2,18 (м, 6H), 1,94 (с, 2H), 1,54-1,58 (м, 4H), 1,36-1,43 (м, 7H), 0,92 (с, 6H).
Пример 239
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-[(2-метоксиэтил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 179A и соединение примера 26C соединением примера 55B в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,25 (с, 2H), 8,57 (м, 1H), 8,50 (д, 1H), 7,70 (дд, 1H), 7,52 (д, 1H), 7,34 (д, 2H), 7,28 (т, 1H), 7,17 (д, 1H), 7,05 (м, 3H), 6,97 (т, 1H), 6,71 (дд, 1H), 6,42 (д, 1H), 6,26 (м, 2H), 3,58 (м, 4H), 3,31 (с, 3H), 3,05 (м, 4H), 2,73 (с, 2H), 2,17 (м, 6H), 1,96 (с, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 240
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил]-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Пример 240А
4-(4-(гидроксиметил)тетрагидро-2Н-пиран-4-иламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин (4-аминотетрагидро-2Н-пиран-4-ил)метанолом и 4-хлор-3-нитробензолсульфонамид 4-фтор-3-нитробензолсульфонамидом в примере 1F.
Пример 240В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил]-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 240A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 2H), 8,63 (д, 1H), 8,50 (с, 1H), 7,92 (с, 1H), 7,79 (дд, 1H), 7,52 (д, 1H), 7,39-7,43 (м, 2H), 7,33-7,34 (м, 3H), 7,18 (с, 1H), 7,03 (д, 2H), 6,87 (дд, 1H), 6,65 (дд, 1H), 6,40 (с, 1H), 6,13 (д, 1H), 5,04 (т, 1H), 3,67-3,72 (м, 4H), 3,56 (т, 2H), 3,02 (с, 4H), 2,72 (уш., 2H), 2,12-2,16 (м, 6H), 1,94-2,01 (м, 3H), 1,81-1,85 (м, 2H), 1,36-1,39 (м, 2H), 1,24 (м, 6H), 0,92 (с, 6H).
Пример 241
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[4-(гидроксиметил)тетрагидро-2Н-пиран-4-ил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 240A и соединение примера 26C соединением примера 55B в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,26 (с, 2H), 8,55 (д, J=2,14 Гц, 1H), 8,48 (с, 1H), 7,66 (дд, 1H), 7,54 (д, 1H), 7,34 (д, 2H), 7,27-7,29 (м, 2H), 7,19 (д, 2H), 7,03 (д, 2H), 6,99 (т, 1H), 6,70 (дд, 1H), 6,44 (д, 1H), 6,27 (с, 1H), 5,04 (т, 1H), 3,67-3,72 (м, 4H), 3,56 (т, 2H), 3,04 (с, 4H), 2,74 (с, 2H), 2,12-2,17 (м, 6H), 1,95-2,01 (м, 5H), 1,80-1,85 (м, 2H), 1,38 (т, 2H), 1,24 (м, 4H), 0,92 (с, 6H).
Пример 242
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-гидрокси-1-тетрагидро-2Н-пиран-4-илэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на 2-амино-2-(тетрагидро-2Н-пиран-4-ил)этанол в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,18 (с, 1H), 8,60 (д, 1H), 8,57 (д, 1H), 7,79 (дд, 1H), 7,52 (д, 1H), 7,43 (д, 1H), 7,40 (т, 1H), 7,33 (д, 2H), 7,23 (д, 1H), 7,19 (д, 1H), 7,03 (д, 2H), 6,88 (дд, 1H), 6,65 (дд, 1H), 6,41 (с, 1H), 6,13 (д, 1H), 5,03 (т, 1H), 3,83-3,87 (м, 2H), 3,56-3,73 (м, 4H), 3,26 (т, 2H), 3,03 (с, 4H), 2,72 (с, 2H), 2,12-2,17 (уш.с, 4H), 1,58-1,62 (м, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 243
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-({1-[2-(1Н-пиразол-1-ил)этил]пиперидин-4-ил}амино)фенил]сульфонил}бензамид
Пример 243А
4-(1-(2-(1Н-пиразол-1-ил)этил)пиперидин-4-иламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1,1,1-трифтор-4-йодбутан на 1-(2-бромэтил)-1Н-пиразол в примере 210А. После концентрирования реакционной смеси указанное в заголовке соединение выделяли фильтрованием из суспензии в эфире.
Пример 243В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-({1-[2-(1Н-пиразол-1-ил)этил]пиперидин-4-ил}амино)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 243A и соединение примера 1Е соединением примера 26С в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,25 (уш.с, 1H), 11,14 (с, 1H), 8,55 (д, 1H), 8,22 (д, 1H), 7,74 (м, 2H), 7,50 (д, 1H), 7,40 (м, 3H), 7,33 (д, 2H), 7,10 (м, 1H), 7,03 (д, 2H), 6,83 (дд, 1H), 6,63 (дд, 1H), 6,38 (т, 1H), 6,22 (т, 1H), 6,15 (д, 1H), 4,24 (т, 2H), 3,65 (уш.с, 1H), 3,02 (м, 4H), 2,78 (м, 6H), 2,27 (м, 2H), 2,16 (м, 6H), 1,94 (м, 3H), 1,60 (м, 2H), 1,38 (т, 2H), 1,23 (уш.с, 1H), 0,92 (с, 6H).
Пример 244
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,26 (с, 2H), 8,61 (т, 1H), 8,50 (д, 1H), 7,69 (дд, 1H), 7,28 (т, 1H), 7,18 (д, 2H), 7,07 (д, 1H), 7,04 (д, 2H), 6,97 (т, 1H), 6,71 (дд, 1H), 6,43 (д, 1H), 6,28 (д, 1H), 6,26 (д, 1H), 5,04 (т, 1H), 3,85 (дд, 2H), 3,25-3,31 (м, 6H), 3,05 (с, 4H), 2,74 (с, 2H), 2,14-2,18 (м, 6H), 1,87-1,90 (м, 2H), 1,61-1,63 (м, 2H), 1,38 (т, 1H), 0,92 (с, 1H).
Пример 245
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-(метиламино)-3-нитрофенил]сульфонил}бензамид
Пример 245А
4-(метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин на метанамин в примере 1F.
Пример 245В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(метиламино)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 245A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,12 (м, 2H), 8,54 (м, 2H), 7,76 (м, 1H), 7,51 (д, 1H), 7,35 (м, 4H), 7,06 (м, 3H), 6,85 (м, 2H), 6,63 (д, 1H), 6,37 (м, 1H), 6,15 (д, 1H), 3,01 (м, 4H), 2,96 (д, 3H), 2,71 (с, 2H), 2,15 (м, 6H), 1,94 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 246
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(метиламино)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 245A и соединение примера 26С соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,32 (уш.с, 1H), 11,20 (уш.с, 1H), 8,54 (уш.с, 1H), 8,46 (с, 1H), 7,70 (дд, 1H), 7,53 (д, 1H), 7,34 (д, 2H), 7,26 (м, 1H), 7,14 (д, 1H), 7,04 (д, 2H), 6,94 (т, 1H), 6,87 (м, 1H), 6,67 (м, 1H), 6,37 (м, 1H), 6,25 (м, 2H), 3,02 (м, 4H), 2,97 (д, 3H), 2,72 (с, 2H), 2,16 (м, 6H), 1,94 (с, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 247
4-{4-[1-(4’-Хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 175Е и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ м.д. 12,45 (с, 1H), 9,24 (д, 1H), 8,96 (т, 1H), 8,26 (дд, 1H), 8,16 (д, 1H), 7,65 (д, 1H), 7,46 (м, 5H), 7,35 (т, 1H), 7,30 (д, 2H), 7,24 (д, 1H), 7,15 (т, 1H), 6,86 (д, 1H), 6,79 (д, 1H), 6,74 (м, 2H), 6,61 (д, 1H), 3,78 (т, 4H), 3,41 (кв, 1H), 3,31 (м, 2H), 2,94 (м, 4H), 2,34 (м, 6H), 2,24 (м, 2H), 2,10 (м, 2H), 1,72 (м, 2H), 1,15 (д, 3H).
Пример 248
4-(4-{[2-(4-Хлорфенил)-5-гидроксициклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 224D в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,60 (м, 1H), 7,80 (дд, 1H), 7,52 (д, 1H), 7,38 (м, 4H), 7,11 (м, 4H), 6,87 (дд, 1H), 6,65 (дд, 1H), 6,40 (с, 1H), 6,13 (д, 1H), 4,59 (д, 1H), 3,85 (м, 2H), 3,28 (м, 6H), 3,03 (м, 2H), 2,72 (м, 2H), 2,18 (м, 3H), 1,87 (м, 3H), 1,53 (м, 5H), 1,26 (м, 7H).
Пример 249
4-(4-{[2-(4-Хлорфенил)-5-морфолин-4-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 249А
8-Хлор-1,4-диоксаспиро[4.5]дец-7-ен-7-карбальдегид
Соединение данного примера получали, заменяя 4-(трет-бутилдиметилсилилокси)циклогексанон на 1,4-диоксаспиро[4.5]декан-8-он в примере 224А.
Пример 249В
8-(4-Хлорфенил)-1,4-диоксаспиро[4.5]дец-7-ен-7-карбальдегид
Соединение данного примера получали, заменяя соединение примера 224А соединением примера 249А в примере 224В.
Пример 249С
Метил 2-(1Н-индол-5-илокси)-4-(4-((8-(4-хлорфенил)-1,4-диоксаспиро[4.5]дец-7-ен-7-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 224В соединением примера 249В в примере 224С.
Пример 249D
2-(1Н-Индол-5-илокси)-4-(4-((8-(4-хлорфенил)-1,4-диоксаспиро[4.5]дец-7-ен-7-ил)метил)пиперазин-1-ил)бензойная кислота
Указанное в заголовке соединение получали, заменяя соединение примера 224С соединением примера 249С в примере 224D.
Пример 249Е
2-(1Н-Индол-5-илокси)-4-(4-((8-(4-хлорфенил)-1,4-диоксаспиро[4.5]дец-7-ен-7-ил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1Е соединением примера 249D в примере 1G.
Пример 249F
2-(1Н-Индол-5-илокси)-4-(4-((2-(4-хлорфенил)-5-оксоциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамид
Смесь соединения примера 249Е (20 мг) и п-толуолсульфоната пиридиния (16,8 мг) в смеси ацетон/Н2О (1:1, 3 мл) нагревали в микроволновой печи до 135°С в течение 8 минут. Смесь разбавляли хлористым метиленом (100 мл), промывали водой и насыщенным раствором соли и сушили над Na2SO4. В результате выпаривания растворителя получали продукт.
Пример 249G
4-(4-{[2-(4-Хлорфенил)-5-морфолин-4-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
К смеси соединения примера 249F (120 мг) в хлористом метилене (2 мл) и метаноле (0,5 мл) прибавляли морфолин (37 мг) и комплекс борана с 2-пиколином (15,04 мг). Смесь перемешивали в течение ночи. Затем смесь разбавляли хлористым метиленом (200 мл) и промывали водным NaHCO3, водой и насыщенным раствором соли и сушили над Na2SO4. Остаток, после выпаривания растворителя, растворяли в хлористом метилене и хроматографировали с использованием 0-10% 7N NH3 в 5% смеси метанола в хлористом метилене, получая указанное в заголовке соединение.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,15 (с, 1H), 8,58 (м, 2H), 7,79 (дд, 1H), 7,53 (м, 1H), 7,35 (м, 4H), 7,17 (м, 1H), 7,07 (м, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,39 (с, 1H), 6,13 (д, 1H), 3,84 (м, 2H), 3,58 (м, 5H), 3,01 (м, 5H), 2,63 (м, 6H), 2,10 (м, 14H), 1,61 (м, 3H), 1,26 (м, 3H).
Пример 250
N-[(4-{[(1-аминоциклогексил)метил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на дигидрохлоридную соль 1-(аминометил)циклогексанамина в примере 187В.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,04 (с, 1H), 8,47 (д, 1H), 8,39 (с, 1H), 7,79 (дд, 1H), 7,55 (д, 1H), 7,31-7,34 (м, 4H), 6,99-7,08 (м, 4H), 6,73 (дд, 1H), 6,65 (дд, 1H), 6,33 (с, 1H), 6,12 (д, 1H), 3,55 (д, 2H), 2,94 (с, 4H), 2,71 (с, 2H), 2,14-2,17 (м, 6H), 1,95 (с, 2H), 1,50-1,64 (м, 8H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 251
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксопирролидин-1-ил)этил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на 1-(2-аминоэтил)пирролидин-2-он в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,58-8,60 (м, 2H), 7,84 (дд, 1H), 7,51 (д, 1H), 7,39-7,32 (м, 2H), 7,33 (д, 2H), 7,18 (д, 1H), 7,12 (д, 1H), 7,03 (д, 2H), 6,87 (дд, 1H), 6,65 (дд, 1H), 6,40 (с, 1H), 6,17 (д, 1H), 3,53-3,56 (м, 2H), 3,45 (т, 2H), 3,39 (т, 2H), 3,04 (с, 4H), 2,74 (с, 2H), 2,11-2,18 (м, 8H), 1,94 (с, 2H), 1,83-1,90 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 252
4-{4-[1-(4’-Хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 252А
Метил 2-(1Н-индол-5-илокси)-4-(4-(1-(4’-хлордифенил-2-ил)
этил)пиперазин-1-ил)бензоат
Указанное в заголовке соединение получали, как описано в примере 175D, заменяя этил 2(1Н-индол-4-илокси)-4-фторбензоат на соединение примера 26А.
Пример 252В
2-(1Н-Индол-5-илокси)-4-(4-(1-(4’-хлордифенил-2-ил)
этил)пиперазин-1-ил)бензойная кислота
Указанное в заголовке соединение получали, как в примере 175Е, заменяя соединение примера 175D соединением примера 252A.
Пример 252С
4-{4-[1-(4’-Хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 175F, заменяя соединение примера 175E соединением примера 252B.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,20 (с, 1H), 11,16 (с, 1H), 8,62 (т, 1H), 8,58 (д, 1H), 7,79 (дд, 1H), 7,48-7,54 (м, 2H), 7,45 (д, 2H), 7,35-7,41 (м, 3H), 7,25-7,29 (м, 3H), 7,15 (д, 1H), 7,08-7,13 (м, 2H), 6,86 (дд, 1H), 6,63 (дд, 1H), 6,38 (с, 1H), 6,13 (д, 1H), 3,85 (дд, 2H), 3,22-3,32 (м, 4H), 3,00 (с, 4H), 2,33 (с, 2H), 2,18 (с, 2H), 1,84-1,95 (м, 1H), 1,56-1,66 (м, 2H), 1,21-1,31 (м, 3H), 1,16 (д, 3H).
Пример 253
4-(4-{1-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 253А
1-(2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)этанол
К смеси соединения примера 218А (3,52 г) в тетрагидрофуране (30 мл) медленно прибавляли метилмагнийхлорид (3 М в тетрагидрофуране, 7,08 мл) при -78°С. По окончании прибавления реакционную смесь перемешивали при 0°С в течение 30 минут и добавляли ледяную воду. Полученную смесь экстрагировали хлористым метиленом, а органический слой сушили над Na2SO4 и концентрировали. Остаток очищали флэш-хроматографией, элюируя 0-100% хлористого метилена в гексане, получая указанное в заголовке соединение.
Пример 253В
1-(2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)этанон
К смеси соединения примера 253А (1,18 г) в хлористом метилене (20 мл) медленно прибавляли перйодинан Десс-Мартина (2,457 г). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов и разбавляли эфиром. Полученную смесь промывали водным NaOH и водой. Органический слой сушили над Na2SO4 и концентрировали. Остаток очищали флэш-хроматографией, элюируя 0-100% хлористого метилена в гексане, получая указанное в заголовке соединение.
Пример 253С
Трет-бутил 4-(1-(2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)этил)пиперазин-1-карбоксилат
Соединение примера 253В (2,06 г) и трет-бутил пиперазин-1-карбоксилат (2,92 г) обрабатывали изопропилатом титана(IV) (4,59 мл) при температуре окружающей среды в течение 24 часов. Прибавляли цианоборгидрид натрия (0,493 г) в метаноле (10 мл). Реакционную смесь перемешивали в течение ночи и добавляли водный NaOH. Полученную смесь разбавляли этилацетатом (300 мл). Осадок отфильтровывали и промывали этилацетатом. Органический слой отделяли и промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали. Остаток растворяли в хлористом метилене и вносили на колонку с силикагелем, элюируя 0-25% этилацетата в хлористом метилене, получая указанное в заголовке соединение.
Пример 253D
1-(1-(2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)этил)пиперазин
Указанное в заголовке соединение получали, как в примере 175С, заменяя соединение примера 175В соединением примера 253С.
Пример 253Е
Этил 2-(1Н-индол-5-илокси)-4-(4-(1-(2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)этил)пиперазин-1-ил)бензоат
Указанное в заголовке соединение получали, как в примере 175D, заменяя этил 2-(1Н-индол-4-илокси)-4-фторбензоат и соединение примера 175С на соединение примера 26А и соединение примера 253D, соответственно.
Пример 253F
2-(1Н-Индол-5-илокси)-4-(4-(1-(2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)этил)пиперазин-1-ил)бензойная кислота
Указанное в заголовке соединение получали, как в примере 175Е, заменяя соединение примера 175D соединением примера 253Е.
Пример 253G
4-(4-{1-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил} пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 177, заменяя соединение примера 26С соединением примера 253F.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,18 (с, 2H), 8,62 (т, 1H), 8,59 (д, 1H), 7,81 (дд, 1H), 7,52 (д, 1H), 7,38-7,44 (м, 2H), 7,34 (д, 2H), 7,17 (д, 1H), 7,11 (д, 1H), 7,01 (д, 2H), 6,87 (дд, 1H), 6,65 (дд, 1H), 6,40 (т, 1H), 6,13 (д, 1H), 3,85 (дд, 2H), 3,22-3,31 (м, 4H), 3,02 (с, 4H), 2,57-2,73 (м, 1H), 2,23 (с, 4H), 1,78-2,15 (м, 5H), 1,57-1,65 (м, 2H), 1,32-1,42 (м, 2H), 1,19-1,31 (м, 2H), 1,01 (д, 3H), 0,91 (д, 6H).
Пример 254
4-(4-{1-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 175F, заменяя соединение примера 175E и соединение примера 1F соединением примера 253F и соединением примера 174А.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,15 (с, 1H), 9,19 (с, 1H), 8,54 (д, 1H), 7,85 (дд, 1H), 7,57 (д, 1H), 7,52 (д, 1H), 7,37-7,41 (м, 2H), 7,34 (д, 2H), 7,14 (д, 1H), 7,01 (д, 2H), 6,84 (дд, 1H), 6,62 (дд, 1H), 6,39 (с, 1H), 6,12 (д, 1H), 2,81-3,04 (м, 10H), 2,58-2,67 (м, 1H), 2,29-2,45 (м, 5H), 2,15-2,28 (м, 4H), 1,92-2,13 (м, 3H), 1,82 (д, 1H), 1,29-1,41 (м, 2H), 1,00 (д, 3H), 0,91 (д, 6H).
Пример 255
4-{4-[(1R)-1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали разделением рацемической смеси соединения примера 175F методом хиральной ВЭЖХ.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,31 (1H, с), 11,25 (1H, с), 8,62 (1H, т), 8,50 (1H, д), 7,68 (1H, дд), 7,53 (2H, д), 7,46 (2H, д), 7,37 (1H, т), 7,24-7,31 (4H, м), 7,17 (1H, д), 7,12 (1H, дд), 7,07 (1H, д), 6,96 (1H, т), 6,69 (1H, дд), 6,42 (1H, д), 6,26 (2H, с), 3,85 (2H, дд), 3,21-3,33 (5H, м), 3,01 (4H, с), 2,29-2,39 (2H, м), 2,15-2,22 (2H, м), 1,83-1,94 (1H, м), 1,57-1,68 (2H, м), 1,22-1,31 (2H, м), 1,17 (3H, д).
Пример 256
4-{4-[(1S)-1-(4’-хлор-1,1’-дифенил-2-ил)этил]пиперазин-1-ил}-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали разделением рацемической смеси соединения примера 175F методом хиральной ВЭЖХ.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,31 (1H, с), 11,25 (1H, с), 8,62 (1H, т), 8,50 (1H, д), 7,68 (1H, дд), 7,53 (2H, д), 7,46 (2H, д), 7,37 (1H, т), 7,24-7,31 (4H, м), 7,17 (1H, д), 7,12 (1H, дд), 7,07 (1H, д), 6,96 (1H, т), 6,69 (1H, дд), 6,42 (1H, д), 6,26 (2H, с), 3,85 (2H, дд), 3,21-3,33 (5H, м), 3,01 (4H, с), 2,29-2,39 (2H, м), 2,15-2,22 (2H, м), 1,83-1,94 (1H, м), 1,57-1,68 (2H, м), 1,22-1,31 (2H, м), 1,17 (3H, д).
Пример 257
4-(4-{1-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 175F, заменяя соединение примера 175E и соединение примера 1F соединением примера 253F и соединением примера 7А.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 8,79 (т, 1H), 8,57 (д, 1H), 7,80 (дд, 1H), 7,51 (д, 1H), 7,37-7,44 (м, 2H), 7,34 (д, 2H), 7,15 (д, 1H), 7,06 (д, 1H), 7,01 (д, 2H), 6,85 (дд, 1H), 6,63 (дд, 1H), 6,39 (с, 1H), 6,13 (д, 1H), 3,60 (т, 4H), 3,43 (кв, 2H), 3,01 (с, 4H), 2,63 (д, 1H), 2,33-2,47 (м, 6H), 2,22 (д, 4H), 1,94-2,15 (м, 3H), 1,75-1,86 (м, 3H), 1,32-1,40 (м, 2H), 1,00 (д, 3H), 0,91 (с, 3H), 0,90 (с, 3H).
Пример 258
4-(4-{1-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]этил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 175F, заменяя соединение примера 175E и соединение примера 1F соединением примера 253F и соединением примера 173С.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,12 (с, 1H), 8,53 (д, 1H), 8,19 (д, 1H), 7,79 (дд, 1H), 7,52 (д, 1H), 7,32-7,40 (м, 4H), 6,99-7,12 (м, 4H), 6,81 (дд, 1H), 6,60 (дд, 1H), 6,37 (с, 1H), 6,13 (д, 1H), 3,92 (дд, 2H), 3,72 (с, 1H), 3,26-3,31 (м, 2H), 2,98 (с, 6H), 2,77 (с, 1H), 2,54-2,66 (м, 3H), 2,15-2,30 (м, 4H), 1,94-2,14 (м, 5H), 1,73-1,87 (м, 3H), 1,57-1,68 (м, 2H), 1,44-1,54 (м, 2H), 1,31-1,40 (м, 2H), 1,00 (д, 3H), 0,91 (д, 2H).
Пример 259
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(циклогексилметил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 259А
4-(циклогексилметиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на циклогексилметиламин в примере 1F.
Пример 259В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(циклогексилметил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 259А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,10 (с, 1H), 8,53 (м, 1H), 8,52 (д, 1H), 7,72 (дд, 1H), 7,44 (д, 1H), 7,32 (д, 1H), 7,31 (дд, 1H), 7,26 (д, 2H), 7,08 (д, 1H), 6,99 (д, 1H), 6,96 (д, 2H), 6,80 (дд, 1H), 6,58 (дд, 1H), 6,32 (с, 1H), 6,07 (д, 1H), 3,18 (т, 2H), 2,96 (уш.м, 4H), 2,65 (д, 2H), 2,06 (уш.м, 6H), 1,87 (с, 2H), 1,63 (м, 4H), 1,56 (м, 2H), 1,30 (т, 2H), 1,11 (м, 2H), 0,91 (м, 3H), 0,85 (с, 6H).
Пример 260
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид
Пример 260А
4-(Морфолинамино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин морфолин-4-амином в примере 189А.
Пример 260В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 260A в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 9,28 (с, 1H), 9,25 (д, 1H), 8,39 (дд, 1H), 8,18 (д, 1H), 7,66 (д, 1H), 7,52-7,56 (м, 2H), 7,40-7,46 (м, 3H), 7,09 (дд, 1H), 7,06 (д, 2H), 6,73 (дд, 1H), 6,60 (с, 1H), 6,54 (д, 1H), 3,87 (с, 2H), 3,74 (д, 2H), 3,00-3,08 (м, 4H), 2,89 (д, 4H), 2,76 (с, 2H), 2,24 (т, 2H), 2,08-2,15 (м, 4H), 1,97 (с, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 261
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-3-илметил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как в примере 175F, заменяя соединение примера 175E и соединение примера 1F соединением примера 26С и соединением примера 180А, соответственно.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,45-8,70 (м, 2H), 7,80 (дд, 1H), 7,51 (д, 1H), 7,38-7,42 (м, 2H), 7,33 (д, 2H), 7,16 (д, 1H), 7,07 (д, 1H), 7,03 (д, 2H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 3,79 (дд, 1H), 3,68-3,75 (м, 1H), 3,23-3,38 (м, 3H), 3,18 (дд, 1H), 3,03 (с, 4H), 2,72 (с, 2H), 2,07-2,21 (м, 6H), 1,79-1,96 (м, 4H), 1,57-1,64 (м, 1H), 1,41-1,51 (м, 1H), 1,37 (т, 2H), 1,22-1,33 (м, 1H), 0,92 (с, 6H).
Пример 262
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(морфолин-4-иламино)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 260A в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 12,45 (с, 1H), 9,26 (с, 1H), 9,17 (д, 1H), 8,27 (дд, 1H), 8,17 (д, 1H), 7,61 (д, 1H), 7,48 (т, 1H), 7,45 (д, 2H), 7,39 (д, 1H), 7,05-7,13 (м, 3H), 6,71-6,81 (м, 3H), 6,67 (д, J=2,1 Гц, 1H), 3,87 (с, 2H), 3,61-3,78 (м, 2H), 2,99-3,08 (м, 4H), 2,89 (д, 4H), 2,76 (с, 2H), 2,25 (т, 2H), 2,08-2,16 (м, 4H), 1,97 (с, 2H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 263
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-иламино)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на соль тетрагидро-2Н-пиран-4-амина хлористоводородной кислоты в примере 187В.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,15 (с, 2H), 8,57 (д, 1H), 8,24 (д, 1H), 7,78 (дд, 1H), 7,49 (д, 1H), 7,37-7,40 (м, 3H), 7,32 (д, 2H), 7,12-7,16 (м, 2H), 7,22 (д, 2H), 6,84 (дд, 1H), 6,64 (дд, 1H), 6,37 (с, 1H), 6,13 (д, 1H), 3,85-3,87 (м, 2H), 3,45 (т, 2H), 3,02 (с, 4H), 2,71 (с, 2H), 2,11-2,16 (м, 7H), 1,87-1,93 (м, 4H), 1,58-1,62 (м, 2H), 1,36 (т, 2H), 0,90 (с, 6H).
Пример 264
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(3-метилоксетан-3-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на (3-метилоксетан-3-ил)метанамин в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 2H), 8,67 (т, 1H), 8,58 (д, 1H), 7,81 (дд, 1H), 7,49 (д, 1H), 7,36-7,39 (м, 2H), 7,32 (д, 2H), 7,12-7,14 (м, 2H), 7,02 (д, 2H), 6,84 (дд, 1H), 6,63 (дд, 1H), 6,37 (с, 1H), 6,13 (д, 1H), 4,44 (д, 2H), 4,30 (д, 2H), 3,55 (д, 2H), 3,01 (с, 4H), 2,70 (с, 2H), 2,11-2,15 (м, 7H), 1,93 (с 3H), 1,36 (т, 2H), 0,90 (с, 6H).
Пример 265
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метоксициклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на 4-метоксициклогексанамин в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,83 (д, 1H), 8,30 (д, 1H), 7,79 (дд, 1H), 7,50 (д, 1H), 7,37-7,41 (м, 2H), 7,33 (д, 2H), 7,10-7,14 (м, 2H), 7,03 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 3,24-3,25 (м, 5H), 3,03 (с, 4H), 2,72 (с, 2H), 2,14-2,17 (м, 8H), 1,92 (м 3H), 1,63-1,65 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 266
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1,1-диоксидотиоморфолин-4-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на 4-(3-аминопропил)тиоморфолин-1,1-диоксид в примере 189А.1Н ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,16 (с, 1H), 8,86 (т, 1H), 8,58 (д, 1H), 7,82 (дд, 1H), 7,50 (т, 1H), 7,40 (м, 2H), 7,33 (д, 2H), 7,15 (м, 1H), 7,04 (м, 3H), 6,85 (дд, 1H), 6,64 (м, 1H), 6,38 (м, 1H), 6,13 (м, 1H), 3,43 (м, 2H), 3,12 (м, 4H), 3,01 (м, 4H), 2,89 (м, 4H), 2,72 (м, 2H), 2,57 (т, 2H), 2,16 (м, 6H), 1,94 (м, 2H), 1,78 (т, 2H), 1,37 (т, 2H), 0,93 (с, 6H).
Пример 267
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксопиперидин-1-ил)этил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на 1-(2-аминоэтил)пиперидин-2-он в примере 189А.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,12 (с, 1H), 8,61 (м, 1H), 8,52 (м, 1H), 7,78 (д, 1H), 7,51 (д, 1H), 7,37 (м, 2H), 7,33 (д, 2H), 7,10 (м, 2H), 7,04 (д, 2H), 6,81 (м, 1H), 6,61 (д, 1H), 6,37 (с, 1H), 6,13 (д, 1H), 3,52 (м, 4H), 3,28 (т, 2H), 3,00 (м, 4H), 2,71 (м, 2H), 2,17 (м, 8H), 1,94 (м, 2H), 1,63 (м, 4H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 268
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(2-оксоимидазолин-1-ил)этил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на 1-(2-аминоэтил)-2-имидазолидон в примере 189А.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,60 (т, 1H), 8,56 (д, 1H), 7,81 (дд, 1H), 7,50 (м, 1H), 7,39 (м, 2H), 7,33 (д, 2H), 7,15 (м, 1H), 7,08 (д, 1H), 7,02 (д, 2H), 6,85 (дд, 1H), 6,65 (м, 1H), 6,39 (м, 2H), 6,15 (м, 1H), 3,51 (м, 2H), 3,39 (т, 2H), 3,30 (м, 2H), 3,21 (т, 2H), 3,03 (м, 4H), 2,72 (м, 2H), 2,14 (м, 6H), 1,93 (м, 2H), 1,37 (т, 2H), 0,92 (с, 6H).
Пример 269
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2-пиридин-4-илэтил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 4-(2-аминоэтил)пиридин и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А, за исключением того, что вещество очищали препаративной ВЭЖХ на колонке Phenomenex Luna C8(2) 5 мкм 100Å AXIA (30 мм × 75 мм). Использовали градиент ацетонитрила и 0,1% трифторуксусной кислоты в воде при скорости потока 50 мл/минута (0-0,5 минуты 10% ацетонитрила, 0,5-6,0 минут линейный градиент 10-100% ацетонитрила, 6,0-7,0 минут 100% ацетонитрила, 7,0-8,0 минут линейный градиент 100-10% ацетонитрила), выделяя указанное в заголовке соединение в виде бис-соли трифторуксусной кислоты.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,45 (уш.с, 1H), 11,18 (уш.с, 1H), 8,77 (д, 2H), 8,61 (т, 1H), 8,60 (д, 1H), 7,86 (дд, 1H), 7,84 (д, 2H), 7,54 (д, 1H), 7,43-7,37 (м, 4H), 7,22 (д, 1H), 7,15 (д, 1H), 7,08 (д, 2H), 6,85 (дд, 1H), 6,70 (дд, 1H), 6,38 (т, 1H), 6,22 (д, 1H), 3,77 (кв, 2H), 3,68-3,54 (м, 4H), 3,27 (м, 2H), 3,16 (т, 2H), 3,00 (м, 2H), 2,74 (м, 2H), 2,18 (м, 2H), 2,01 (д, 2H), 1,45 (т, 2H), 0,94 (с, 6H).
Пример 270
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-морфолин-4-ил-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на морфолин в примере 189А, за исключением того, что сырое вещество очищали препаративной ВЭЖХ с использованием колонки С18, 250 мм × 50 мм, 10 мкм, и элюируя с градиентом 20-100% ацетонитрила vs. 0,1% трифторуксусной кислоты в воде, получая указанное в заголовке соединение в виде трифторацетатной соли. Данную соль растворяли в хлористом метилене (6 мл) и промывали 50% водным NaHCO3. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали, получая указанное в заголовке соединение.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,31 (д, 1H), 7,87 (дд, 1H), 7,53 (д, 1H), 7,41 (м, 2H), 7,33 (д, 2H), 7,24 (д, 1H), 7,16 (с, 1H), 7,02 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,40 (с, 1H), 6,14 (с, 1H), 3,69 (т, 4H), 3,13 (т, 4H), 3,03 (уш.с, 4H), 2,75 (с, 2H), 2,19 (уш.с, 4H), 2,14 (уш.т, 2H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 271
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(4-метоксипиперидин-1-ил)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на 4-метоксипиперидин в примере 189А, за исключением того, что сырое вещество очищали препаративной ВЭЖХ с использованием колонки С18, 250 мм × 50 мм, 10 мкм, и элюируя с градиентом 20-100% CH3CN vs. 0,1% трифторуксусной кислоты в воде, получая продукт в виде трифторацетатной соли. Данную соль растворяли в хлористом метилене (6 мл) и промывали 50% водным NaHCO3. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали, получая указанное в заголовке соединение.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,28 (д, 1H), 7,81 (дд, 1H), 7,53 (д, 1H), 7,41 (м, 2H), 7,33 (д, 2H), 7,22 (д, 1H), 7,16 (с, 1H), 7,04 (д, 2H), 6,86 (дд, 1H), 6,64 (дд, 1H), 6,40 (с, 1H), 6,14 (с, 1H), 3,42 (м, 1H), 3,27 (с, 3H), 3,25 (м, 2H), 3,00 (м, 6H), 2,73 (с, 2H), 2,18 (уш.с, 4H), 2,13 (уш.т, 2H), 1,94 (с, 2H), 1,91 (м, 2H), 1,56 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 272
4-(4-{[2-(4-Хлорфенил)-5-пирролидин-1-илциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя морфолин пирролидином в примере 249G.1Я ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,04 (с, 1H), 8,44 (д, 1H), 8,42 (м, 1H), 7,70 (дд, 1H), 7,55 (д, 1H), 7,37 (д, 2H), 7,32 (м, 2H), 7,09 (д, 2H), 7,00 (д, 1H), 6,89 (д, 1H), 6,76 (д, 1H), 6,54 (д, 1H), 6,32 (д, 1H), 6,13 (д, 1H), 3,83 (м, 3H), 3,06 (м, 15H), 2,23 (м, 6H), 1,84 (м, 6H), 1,62 (м, 4H), 1,24 (м, 3H).
Пример 273
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид
Пример 273А
3-Нитро-4-[2-(3-оксопиперазин-1-ил)этиламино]бензолсульфонамид
4-(2-Аминоэтил)пиперазин-2-он (5,51 г) и триэтиламин (9,07 мл, 6,59 г) прибавляли к 1,4-диоксану (100 мл), N,N-диметилацетамиду (20 мл) и воде (10 мл) и перемешивали до растворения. Добавляли 4-хлор-3-нитробензолсульфонамид (7,00 г) и нагревали смесь при 90°С в течение 16 часов. Смесь охлаждали и удаляли растворитель в вакууме. Сырое вещество очищали перекристаллизацией из 20% метанола в хлористом метилене с последующим промыванием перекристаллизованного твердого вещества 10% метанолом в хлористом метилене, после чего следовало промывание 100% хлористым метиленом.
Пример 273В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 273A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,15 (уш.с, 1H), 8,73 (т, 1H), 8,58 (д, 1H), 7,82 (дд, 1H), 7,76 (уш.с, 1H), 7,51 (д, 1H), 7,42-7,38 (м, 2H), 7,34 (д, 2H), 7,16 (д, 1H), 7,06-7,01 (м, 3H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,38 (т, 1H), 6,15 (д, 1H), 3,48 (кв, 2H), 3,17 (м, 2H), 3,04 (м, 6H), 2,72 (уш.с, 2H), 2,70-2,62 (м, 2H), 2,16 (м, 8H), 1,95 (уш.с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 274
4-[4-({4’-хлор-4-[2-(диметиламино)этокси]-1,1’-дифенил-2-ил}метил)пиперазин-1-ил]-2-(1Н-индол-4-илокси)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 125D и соединение примера 1F соединением примера 174A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,62 (с, 1H), 11,33 (с, 1H), 9,55 (д, 1H), 8,49 (д, 1H), 7,74 (дд, 30 1H), 7,55 (м, 5H), 7,35 (м, 2H), 7,30 (м, 1H), 7,19 (дд, 2H), 6,96 (м, 2H), 6,73 (дд, 1H), 6,40 (м, 1H), 6,33 (м, 1H), 6,24 (с, 1H), 4,37 (м, 2H), 3,53 (м, 8H), 3,30 (м, 8H), 3,23 (м, 4H), 2,90 (с, 6H), 2,84 (с, 3H).
Пример 275
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидротиен-3-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на гидрохлорид (1,1-диоксидотетрагидротиен-3-ил)метиламин в примере 189А.1Н ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,72 (т, 1H), 8,59 (д, 1H), 7,82 (дд, 1H), 7,51 (д, 1H), 7,40 (м, 2H), 7,33 (д, 2H), 7,16 (м, 2H), 7,03 (д, 2H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,40 (м, 1H), 6,14 (д, 1H), 3,55 (т, 2H), 3,28 (м, 1H), 3,23 (м, 1H), 3,05 (м, 5H), 2,91 (м, 1H), 2,74 (м, 3H), 2,27 (м, 1H), 2,15 (м, 6H), 1,95 (м, 2H), 1,86 (м, 1H), 1,38 (т, 2H), 0,91 (с, 6H).
Пример 276
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотетрагидротиен-3-ил)амино]-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на 1,1-диоксидотетрагидротиен-3-иламин в примере 189А.1Н ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,20 (уш.с, 1H), 11,15 (с, 1H), 8,59 (д, 1H), 8,50 (д, 1H), 7,86 (дд, 1H), 7,50 (д, 1H), 7,39 (м, 2H), 7,33 (д, 2H), 7,19 (д, 1H), 7,14 (м, 1H), 7,03 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (м, 1H), 6,15 (д, 1H), 4,63 (м, 1H), 3,64 (м, 1H), 3,37 (м, 2H), 3,20 (м, 1H), 3,03 (м, 4H), 2,73 (м, 2H), 2,57 (м, 1H), 2,28 (м, 1H), 2,15 (м, 6H), 1,95 (м, 2H), 1,38 (т, 2H), 0,91 (с, 6H).
Пример 277
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-(трифторметил)фенил]сульфонил}бензамид
Пример 277А
4-((Тетрагидро-2Н-пиран-4-ил)метиламино)-3-(трифторметил)бензолсульфонамид
Смесь 4-фтор-3-(трифторметил)бензолсульфонамида (1,056 г), (тетрагидро-2Н-пиран-4-ил)метанамина (0,5 г) и N,N-диизопропилэтиламина (1,68 г) в растворе безводного диметилсульфоксида (15 мл) нагревали при 90°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Органическую фазу промывали водой, насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали, получая указанное в заголовке соединение.
Пример 277В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-(трифторметил)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 277A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11, 22 (с, 1H), 11,20 (с, 1H), 7,91 (д, 1H), 7,76 (дд, 1H), 7,55 (д, 1H), 7,41 (м, 4H), 7,20 (м, 1H), 7,08 (д, 2H), 6,88 (м, 2H), 6,70 (дд, 1H), 6,58 (м, 1H), 6,42 (м, 1H), 6,19 (м, 1H), 3,83 (м, 2H), 3,56 (м, 4H), 3,25 (м, 4H), 3,15 (м, 2H), 2,99 (м, 2H), 2,74 (м, 2H), 2,18 (м, 2H), 2,02 (м, 2H), 1,84 (м, 1H), 1,57 (м, 2H), 1,44 (м, 2H), 1,19 (м, 2H), 0,93 (с, 6H).
Пример 278
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[2-(1,3-диоксолан-2-ил)этил]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Смесь соединения примера 187А (0,079 г), дициклогексил(2’,6’-диметоксидифенил-2-ил)фосфина (0,016 г) и ацетата палладия (0,0045 г) в тетрагидрофуране (1 мл) перемешивали при комнатной температуре в течение 5 минут. К данной смеси прибавляли бромид (2-(1,3-диоксолан-2-ил)этил)цинка(II) (0,6 мл). Реакционную смесь перемешивали в течение ночи. Растворитель удаляли, а остаток очищали препаративной ВЭЖХ с обращенными фазами. Требуемые фракции объединяли и частично удаляли органический растворитель. Полученную смесь обрабатывали насыщенным водным NaHCO3, экстрагировали этилацетатом, сушили над MgSO4, фильтровали и концентрировали, получая указанное в заголовке соединение.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 8,37 (с, 1H), 8,00 (с, 1H), 7,55 (уш.с., 1H), 7,52 (д, 1H), 7,33-7,39 (м, 4H), 7,08 (уш.с, 1H), 7,04 (д, 2H), 6,83 (дд, 1H), 6,62 (д, 1H), 6,38 (с, 1H), 6,15 (д, 1H), 4,85 (т, 1H), 3,87-3,89 (м, 2H), 3,76-3,79 (м, 2H), 3,04 (с, 4H), 2,91-2,94 (м, 2H), 2,11-2,15 (м, 4H), 1,88-1,91 (с, 4H), 1,39 (т, 2H), 0,92 (с, 6H).
Пример 279
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид
Пример 279А
3-Нитро-4-((тетрагидро-2Н-пиран-4-ил)метокси)бензолсульфонамид
(Тетрагидро-2Н-пиран-4-ил)метанол (2,0 г) в тетрагидрофуране (20 мл) обрабатывали 60% NaH (1,377 г). Смесь перемешивали в течение 20 минут при комнатной температуре. К данной смеси прибавляли порциями 4-фтор-3-нитробензолсульфонамид (2,84 г). Реакционную смесь перемешивали еще в течение 2 часов. Смесь выливали в воду, нейтрализовывали 10% HCl и три раза экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя смесью 20%-60% этилацетата в гексанах.
Пример 279В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 279A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 1H), 8,38 (д, 1H), 8,05 (дд, 1H), 7,51 (д, 1H), 7,38-7,41 (м, 3H), 7,34 (д, 1H), 7,15 (д, 1H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,15 (д, 1H), 4,08 (д, 2H), 3,88 (дд, 2H), 3,04 (с, 4H), 2,77 (с, 2H), 2,12-2,22 (м, 4H), 1,95 (уш.с, 2H), 1,64 (дд, 2H), 1,36-1,39 (м, 2H), 0,92 (с, 6H).
Пример 280
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(3-оксопиперазин-1-ил)этил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 273A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,24 (уш.с, 1H), 8,72 (т, 1H), 8,51 (д, 1H), 7,76 (уш.с, 1H), 7,72 (дд, 1H), 7,53 (д, 1H), 7,34 (д, 2H), 7,28 (т, 1H), 7,18 (д, 1H), 7,04 (д, 2H), 6,97 (т, 2H), 6,70 (дд, 1H), 6,43 (д, 1H), 6,28-6,23 (м, 2H), 3,48 (кв, 2H), 3,17 (м, 2H), 3,04 (м, 6H), 2,70 (уш.с, 2H), 2,68-2,63 (м, 2H), 2,16 (м, 8H), 1,95 (уш.с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 281
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метил-5-оксопирролидин-3-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на гидрохлорид 4-амино-1-метилпирролидин-2-она в примере 189А, за исключением того, что сырой продукт очищали препаративной ВЭЖХ с использованием колонки С18, 250 мм × 50 мм, 10 мкм, и элюируя с градиентом 20-100% CH3CN vs. 0,1% трифторуксусной кислоты в воде, получая продукт в виде трифторацетатной соли. Данную соль растворяли в хлористом метилене (6 мл) и промывали 50% водным NaHCO3. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали, получая указанное в заголовке соединение.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 8,56 (д, 1H), 8,34 (уш.д, 1H), 7,82 (дд, 1H), 7,53 (д, 1H), 7,39 (м, 2H), 7,33 (д, 2H), 7,11 (с, 1H), 7,04 (м, 3H), 6,83 (дд, 1H), 6,64 (дд, 1H), 6,38 (с, 1H), 6,15 (с, 1H), 4,45 (м, 1H), 3,80 (дд, 1H), 3,35 (м, 1H), 3,02 (уш.с, 4H), 2,81 (дд, 1H), 2,75 (с, 3H), 2,71 (с, 2H), 2,40 (дд, 1H), 2,15 (м, 6H), 1,94 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 282
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метил-6-оксопиперидин-3-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид на соединение примера 187А и 1-(2-метоксиэтил)пиперидин-4-иламин на гидрохлорид 5-амино-1-метилпиперидин-2-она в примере 189А, за исключением того, что сырой продукт очищали препаративной ВЭЖХ с использованием колонки С18, 250 мм × 50 мм, 10 мкм, и элюируя с градиентом 20-100% CH3CN vs. 0,1% трифторуксусной кислоты в воде, получая продукт в виде трифторацетатной соли. Данную соль растворяли в хлористом метилене (6 мл) и промывали 50% водным NaHCO3. Органический слой сушили над безводным Na2SO4 и концентрировали, получая указанное в заголовке соединение.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 1H), 8,58 (д, 1H), 8,31 (уш.д, 1H), 7,85 (дд, 1H), 7,53 (д, 1H), 7,39 (м, 2H), 7,33 (д, 2H), 7,25 (д, 1H), 7,14 (с, 1H), 7,03 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,39 (с, 1H), 6,14 (с, 1H), 4,22 (м, 1H), 3,57 (дд, 1H), 3,02 (уш.с, 4H), 2,84 (м, 1H), 2,83 (с, 3H), 2,72 (с, 2H), 2,36 (м, 2H), 2,16 (м, 6H), 2,05 (м, 2H), 1,94 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 283
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид
Пример 283А
3-Нитро-4-(пиперидин-1-иламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин пиперидин-1-амином в примере 1F.
Пример 283В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 283A и соединение примера 26C соединением примера 55B в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,27 (уш.с, 1H), 11,33 (с, 1H), 9,14 (с, 1H), 8,48 (д, 1H), 7,66 (дд, 1H), 7,52 (т, 2H), 7,34 (д, 2H), 7,29 (т, 1H), 7,19 (д, 1H), 7,04 (д, 2H), 6,97 (т, 1H), 6,71 (дд, 1H), 6,41 (д, 1H), 6,28 (м, 2H), 3,05 (м, 4H), 2,78 (м, 6H), 2,17 (м, 6H), 1,95 (с, 2H), 1,67 (м, 6H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 284
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(пиперидин-1-иламино)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 283A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,28 (с, 1H), 11,11 (с, 1H), 9,02 (с, 1H), 8,50 (с, 1H), 7,79 (дд, 1H), 7,52 (м, 2H), 7,35 (м, 4H), 7,07 (м, 3H), 6,82 30 (м, 1H), 6,60 (м, 1H), 6,36 (м, 1H), 6,14 (м, 1H), 2,99 (м, 4H), 2,75 (м, 6H), 2,16 (м, 6H), 1,99 (м, 2H), 1,94 (м, 2H), 1,64 (м, 4H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 285
4-(4-{[4-(4-Хлорфенил)-1-метил-1Н-пиразол-5-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 285А
4-(4-Хлорфенил)-1-метил-1Н-пиразол-5-карбальдегид
4-Бром-1-метил-1Н-пиразол-5-карбальдегид (0,500 г), 4-хлорфенилбороновую кислоту (0,455 г), бромид тетрабутиламмония (0,853 г), карбонат калия (0,914 г) и ацетат палладия (0,030 г) перемешивали вместе в 5 мл воды и нагревали до 45°С. После перемешивания в течение 2,5 часов реакционную смесь разбавляли этилацетатом (75 мл) и промывали водой (25 мл), насыщенным раствором соли (50 мл), сушили над сульфатом магния, фильтровали и концентрировали, получая сырое вещество. Твердое вещество хроматографировали на силикагеле (SF40-80), элюируя с использованием градиента от 5% до 25% смеси этилацетат/гексаны в течение 30 минут.
Пример 285В
Метил 2-(1Н-индол-5-илокси)-4-(4-((4-(4-хлорфенил)-1-метил-1Н-пиразол-5-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 285А и трет-бутил пиперазин-1-карбоксилат метил 2-(1Н-индол-5-илокси)-4-(пиперазин-1-ил)бензоатом в примере 1А.
Пример 285С
2-(1Н-Индол-5-илокси)-4-(4-((4-(4-хлорфенил)-1-метил-1Н-пиразол-5-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 285B в примере 1E.
Пример 285D
2-(1Н-Индол-5-илокси)-4-(4-((4-(4-хлорфенил)-1-метил-1Н-пиразол-5-ил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 285С в примере 1G.1H ЯМР (300 МГц, CDCl3) δ 10,30 (с, 1H), 8,85 (д, 1H), 8,50 (с, 1H), 8,30 (с, 1H), 8,12 (дд, 1H), 7,95 (д, 1H), 7,49 (с, 1H), 7,43 (д, 1H), 7,36-7,22 (м, 6H), 6,97 (дд, 1H), 6,87 (д, 1H), 6,53 (д, 2H), 6,08 (с, 1H), 4,08-3,98 (м, 2H), 3,92 (с, 3H), 3,55 (с, 2H), 3,42 (с, 2H), 3,33-3,19 (м, 2H), 3,08 (с, 4H), 2,38 (с, 4H), 1,98 (д, 1H), 1,72 (с, 2H), 1,52-1,33 (м, 2H).
Пример 286
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-метилоксетан-3-ил)метокси]-3-нитрофенил}сульфонил)бензамид
Пример 286А
4-((3-Метилоксетан-3-ил)метокси)-3-нитробезолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол на (3-метилоксетан-3-ил)метанол в примере 279А.
Пример 286В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-метилоксетан-3-ил)метокси]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 286A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,08 (с, 1H), 8,26 (д, 1H), 8,18 (д, 1H), 7,92 (м, 1H), 7,53 (м, 1H), 7,34 (м, 3H), 7,25 (м, 1H), 7,04 (м, 3H), 6,91 (м, 1H), 6,76 (м, 1H), 6,59 (м, 1H), 6,35 (м, 1H), 6,15 (д, 1H), 4,47 (д, 1H), 4,29 (д, 1H), 3,40 (м, 2H), 3,13 (м, 2H), 2,98 (м, 4H), 2,72 (м, 2H), 2,16 (м, 6H), 1,94 (м, 2H), 1,36 (м, 5H), 0,93 (с, 6H).
Пример 287
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1-оксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}фенил)сульфонил]бензамид
Пример 287А
3-Нитро-4-((тетрагидро-2Н-тиопиран-4-ил)метиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на гидрохлорид (тетрагидро-2Н-тиопиран-4-ил)метанамина в примере 1F.
Пример 287В
3-Нитро-4-((1-оксидотетрагидро-2Н-тиопиран-4-ил)метиламино)бензолсульфонамид
Соединение примера 287А (150 мг) суспендировали в метаноле (5 мл). Реакционную смесь охлаждали до 0°С, после чего прибавляли Oxone® (220 мг) в воде (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Осадок отфильтровывали и промывали раствором Na2S2O3 и водой. Твердое вещество сушили в вакуумной печи в течение ночи и использовали на следующей стадии без дополнительной очистки.
Пример 287С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1-оксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 287В в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,69 (т, 1H), 8,58 (д, 1H), 7,81 (дд, 1H), 7,51 (д, 1H), 7,40 (м, 2H), 7,33 (д, 2H), 7,15 (м, 2H), 7,03 (д, 2H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,40 (м, 1H), 6,13 (м, 1H), 3,38 (м, 4H), 3,05 (м, 6H), 2,73 (м, 2H), 2,11 (м, 8H), 1,95 (м, 3H), 1,67 (м, 2H), 1,38 (т, 2H), 0,90 (с, 6H).
Пример 288
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1,3-тиазол-5-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на тиазол-5-илметанамин в примере 187В.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,18 (с, 2H), 9,13 (т, 1H), 8,99 (с, 1H), 8,60 (д, 1H), 7,95 (с, 1H), 7,82 (дд, 1H), 7,50 (д, 1H), 7,39-7,42 (, 2H), 7,33 (д, 2H), 7,17 (д, 1H), 7,14 (д, 1H), 7,03 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,40 (с, 1H), 6,13 (д, 1H), 4,91 (д, 2H), 3,03 (с, 4H), 2,73 (с, 2H), 2,12-2,18 (м, 6H), 1,94 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 289
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 279А и соединение примера 26С соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,25 (с, 1H), 8,21 (д, J=2,14 Гц, 1H), 7,95 (дд, 1H), 7,54 (д, 1H), 7,33-7,38 (м, 3H), 7,28 (т, 1H), 7,17 (д, 1H), 7,04 (д, 2H), 6,97 (т, 1H), 6,70 (дд, 1H), 6,41 (д, 1H), 6,27-6,29 (м, 2H), 4,08 (д, 2H), 3,88 (дд, 2H), 3,07 (с, 4H), 2,80 (с, 2H), 2,24 (уш.с, 2H), 2,12-2,16 (м, 2H), 1,96 (с, 2H), 1,65 (дд, 2H), 1,37-1,40 (м, 2H), 0,92 (с, 6H).
Пример 290
4-(4-{[2-(4-Хлорфенил)-5,5-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 290А
2-(4-Хлорфенил)-5,5-диметилциклогекс-1-енкарбальдегид
Указанное в заголовке соединение получали, как описано в примере 253В, заменяя соединение примера 253А соединением примера 19С.
Пример 290В
Трет-бутил 4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-карбоксилат
Указанное в заголовке соединение получали, как описано в примере 1А, заменяя соединение примера 27С соединением примера 290А.
Пример 290С
1-((2-(4-Хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин
Указанное в заголовке соединение получали, как описано в примере 1В, заменяя соединение примера 1А соединением примера 290В.
Пример 290D
Этил 2-(1Н-индол-5-илокси)-4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
Указанное в заголовке соединение получали, как описано в примере 20D, заменяя соединение примера 20А и соединение примера 20С соединением примера 26А и соединением примера 290С, соответственно.
Пример 290Е
2-(1Н-Индол-5-илокси)-4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Указанное в заголовке соединение получали, как описано в примере 1Е, заменяя соединение примера 1D соединением примера 290D.
Пример 290F
2-(1Н-Индол-5-илокси)-4-(4-((2-(4-хлорфенил)-5,5-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамид
Указанное в заголовке соединение получали, как описано в примере 175F, заменяя соединение примера 175E соединением примера 290E.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,62 (т, 1H), 8,58 (д, 1H), 7,80 (дд, 1H), 7,51 (д, 1H), 7,38-7,43 (м, 2H), 7,33 (д, 2H), 7,16 (д, 1H), 7,10 (д, 1H), 7,07 (д, 3H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 3,85 (дд, 2H), 3,23-3,31 (м, 4H), 3,02 (с, 4H), 2,68 (с, 2H), 2,17 (д, 6H), 1,85-1,95 (м, 3H), 1,61 (д, 2H), 1,39 (т, 2H), 1,20-1,30 (м, 2H), 0,92 (с, 6H).
Пример 291
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2-тетрагидро-2Н-пиран-4-илэтил)амино]фенил}сульфонил)бензамид
Пример 291А
3-Нитро-4-(2-(тетрагидро-2Н-пиран-4-ил)этиламино)бензолсульфонамид
Указанное в заголовке соединение получали, как описано в примере 1F, заменяя (тетрагидропиран-4-ил)метиламин на 2-(тетрагидро-2Н-пиран-4-ил)этанамин.
Пример 291В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2-тетрагидро-2Н-пиран-4-илэтил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, как описано в примере 175F, заменяя соединение примера 175E и соединение примера 1А соединением примера 26С и соединением примера 291А, соответственно.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,57 (д, 1H), 8,53 (т, 1H), 7,80 (дд, 1H), 7,51 (д, 1H), 7,37-7,42 (м, 2H), 7,33 (д, 2H), 7,14 (д, 1H), 7,01-7,05 (м, 3H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 3,83 (дд, 2H), 3,41 (кв, 2H), 3,23-3,30 (м, 2H), 3,02 (с, 4H), 2,71 (с, 2H), 2,08-2,21 (м, 6H), 1,94 (с, 2H), 1,52 -1,67 (м, 5H), 1,37 (т, 2H), 1,14-1,25 (м, 2H), 0,92 (с, 6H).
Пример 292
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид
Пример 292А
3-Нитро-4-(2-(трифторметокси)этиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин на пиперидин-1-амин в примере 1F.
Пример 292В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 292A и соединение примера 26C соединением примера 55B в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,07 (с, 1H), 8,36 (м, 2H), 7,72 (дд, 1H), 7,58 (д, 1H), 7,34 (д, 2H), 7,19 (м, 1H), 7,05 (м, 3H), 6,91 (м, 2H), 6,59 (д, 1H), 6,21 (м, 3H), 4,28 (т, 2H), 3,72 (кв, 2H), 2,94 (м, 4H), 2,71 (с, 2H), 2,15 (м, 6H), 1,95 (с, 2H), 1,39 (т, 2H), 0,93 (с, 6H).
Пример 293
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 293А
4-(2-(2-Метоксиэтокси)этиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин на 2-(2-метоксиэтокси)этанамин в примере 1F.
Пример 293В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 293A и соединение примера 26C соединением примера 55B в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,28 (с, 1H), 11,23 (с, 1H), 8,59 (м, 1H), 8,50 (д, 1H), 7,70 (дд, 1H), 7,52 (д, 1H), 7,34 (д, 2H), 7,28 (т, 1H), 7,17 (д, 1H), 7,05 (м, 3H), 6,96 (т, 1H), 6,71 (дд, 1H), 6,42 (д, 1H), 6,26 (м, 2H), 3,67 (т, 2H), 3,56 (м, 4H), 3,45 (м, 2H), 3,22 (с, 3H), 3,04 (м, 4H), 2,74 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 294
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[3-(метилсульфонил)пропил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 294А
4-(3-(Метилтио)пропиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на 3-(метилтио)пропан-1-амин в примере 1F.
Пример 294В
4-(3-(Метилсульфонил)пропиламино)-3-нитробензолсульфонамид
Соединение примера 294А (150 мг) суспендировали в безводном хлористом метилене (5 мл) и прибавляли при 0°С мета-хлорпероксибензойную кислоту (848 мг). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Мутную суспензию фильтровали. Осадок промывали водным раствором Na2S2O3, насыщенным водным раствором NaHCO3 и водой. Твердое вещество сушили и использовали на следующей стадии без дополнительной очистки.
Пример 294С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[3-(метилсульфонил)пропил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 26C соединением примера 55B и соединение примера 1F соединением примера 294В в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,25 (м, 1H), 8,65 (т, 1H), 8,51 (д, 1H), 7,69 (дд, 1H), 7,52 (д, 1H), 7,34 (д, 2H), 7,28 (м, 1H), 7,18 (м, 1H), 7,05 (м, 3H), 6,97 (м, 1H), 6,70 (дд, 1H), 6,42 (д, 1H), 6,26 (м, 2H), 3,55 (м, 2H), 3,23 (т, 2H), 3,05 (т, 4H), 2,98 (с, 3H), 2,76 (м, 2H), 2,18 (м, 6H), 2,02 (м, 2H), 1,96 (м, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 295
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1,1-диоксидотиоморфолин-4-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид соединением примера 337А и 1-(2-метоксиэтил)пиперидин-4-иламин 4-(3-аминопропил)тиоморфолин-1,1-диоксидом в примере 189А.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,23 (с, 1H), 8,79 (с, 1H), 8,48 (д, 1H), 7,72 (дд, 1H), 7,54 (д, 1H), 7,34 (д, 2H), 7,26 (т, 1H), 7,15 (д, 1H), 6,99 (м, 4H), 6,67 (дд, 1H), 6,40 (д, 1H), 6,24 (м, 2H), 3,42 (кв, 2H), 3,11 (м, 4H), 3,01 (м, 4H), 2,90 (м, 4H), 2,72 (м, 2H), 2,56 (т, 2H), 2,16 (м, 6H), 1,95 (м, 2H), 1,78 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 296
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтил)фенил]сульфонил}бензамид
Пример 296А
Бромид (2-(тетрагидро-2Н-пиран-4-ил)этил)цинка(II)
Круглодонную колбу на 25 мл сушили при 120°С в течение 6 часов. Ее охлаждали в токе сухого N2. В данную колбу помещали цинк (0,508 г). Колбу нагревали при 70°С в высоком вакууме в течение 30 минут. После повторного заполнения N2 прибавляли йод (0,033 г) и N,N-диметилацетамид (5,2 мл) и полученную смесь перемешивали до обесцвечивания красной окраски йода. Затем к указанной выше смеси добавляли 4-(2-бромэтил)тетрагидро-2Н-пиран (1,0 г) при помощи шприца. Реакционную смесь оставляли перемешиваться в течение 12 часов при 70°С. После охлаждения реакционную смесь непосредственно использовали на следующей стадии.
Пример 296В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтил)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя бромид (2-(1,3-диоксолан-2-ил)этил)цинка(II) соединением примера 296А в примере 278.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,15 (с, 2H), 8,38 (д, 1H), 8,01 (д, 1H), 7,57 (д, 1H), 7,51 (д, 1H), 7,38-7,40 (м, 2H), 7,34 (д, 2H), 7,12 (д, 1H), 7,04 (д, 2H), 6,82 (дд, 1H), 6,64 (дд, 1H), 6,38 (с, 1H), 6,16 (д, 1H), 3,83 (дд, 2H), 3,24-3,29 (м, 4H), 3,06 (с, 4H), 2,83-2,86 (м, 3H), 2,27 (уш.с, 2H), 2,12-2,14 (м, 4H), 1,96 (с, 2H), 1,95 (с, 2H), 1,46-1,62 (м, 6H), 1,37-1,40 (м, 2H), 0,92 (с, 6H).
Пример 297
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Пример 297А
4-((1,4-Диоксан-2-ил)метокси)-3-нитробензолсульфонамид
(1,4-Диоксан-2-ил)метанол (380 мг) в тетрагидрофуране (30 мл) обрабатывали гидридом натрия (60%) (245 мг) при комнатной температуре в течение 30 минут. Реакционную смесь охлаждали на бане со льдом и прибавляли 4-фтор-3-нитробензолсульфонамид (675 мг). Полученную смесь перемешивали при комнатной температуре в течение 2 часов и добавляли следующую порцию гидрида натрия (60%, 245 мг). Реакционную смесь перемешивали в течение ночи и гасили ледяной водой (3 мл). Мутную смесь фильтровали и концентрировали фильтрат. Остаток растирали с метанолом, получая указанное в заголовке соединение.
Пример 297В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Указанное в заголовке соединение получали, как описано в примере 175F, заменяя соединение примера 175Е и соединение примера 1F соединением примера 26С и соединением примера 297А, соответственно.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,39 (д, 1H), 8,06 (дд, 1H), 7,51 (д, 1H), 7,38-7,43 (м, 3H), 7,34 (д, 2H), 7,15 (д, 1H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,39 (с, 1H), 6,15 (д, 1H), 4,20-4,28 (м, 2H), 3,85-3,91 (м, 1H), 3,82 (дд, 1H), 3,74-3,78 (м, 1H), 3,59-3,69 (м, 2H), 3,40-3,51 (м, 2H), 3,05 (с, 4H), 2,78 (с, 2H), 2,23 (с, 4H), 2,14 (с, 2H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 298
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 293А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 11,15 (с, 1H), 8,59 (м, 2H), 7,80 (дд, 1H), 7,50 (д, 1H), 7,36 (м, 4H), 7,15 (д, 1H), 7,09 (д, 1H), 7,03 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (м, 1H), 6,14 (д, 1H), 3,67 (т, 2H), 3,56 (м, 4H), 3,44 (м, 2H), 3,22 (с, 3H), 3,03 (м, 4H), 2,72 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 299
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотетрагидротиен-3-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид соединением примера 337А и 1-(2-метоксиэтил)пиперидин-4-иламин 1,1-диоксидотетрагидротиен-3-иламином в примере 189А.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,35 (с, 1H), 11,23 (с, 1H), 8,49 (м, 2H), 7,78 (дд, 1H), 7,52 (д, 1H), 7,34 (д, 2H), 7,27 (м, 1H), 7,16 (м, 2H), 7,04 (д, 1H), 6,97 (м, 1H), 6,70 (дд, 1H), 6,42 (д, 1H), 6,26 (м, 2H), 4,63 (м, 1H), 3,64 (дд, 1H), 3,37 (м, 2H), 3,20 (м, 1H), 3,05 (м, 4H), 2,74 (м, 2H), 2,58 (м, 1H), 2,28 (м, 1H), 2,16 (м, 6H), 1,95 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 300
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[2-(трифторметокси)этил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 292А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (м, 2H), 8,64 (т, 1H), 8,59 (д, 1H), 7,84 (дд, 1H), 7,51 (д, 1H), 7,40 (м, 2H), 7,33 (д, 2H), 7,16 (м, 2H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,39 (м, 1H), 6,14 (д, 1H), 4,31 (т, 2H), 3,78 (кв, 2H), 3,04 (м, 4H), 2,74 (с, 2H), 2,17 (м, 6H), 1,94 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 301
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Пример 301А
3-Нитро-4-((1-диоксидотетрагидро-2Н-тиопиран-4-ил)метиламино)бензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 294А соединением примера 287А в примере 294В.
Пример 301В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидро-2Н-тиопиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26C соединением примера 55B и соединение примера 1F соединением примера 301А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,26 (с, 1H), 8,68 (т, 1H), 8,51 (д, 1H), 7,73 (дд, 1H), 7,53 (д, 1H), 7,34 (д, 2H), 7,29 (м, 1H), 7,19 (д, 1H), 7,12 (д, 1H), 7,04 (д, 2H), 6,99 (м, 1H), 6,70 (дд, 1H), 6,46 (д, 1H), 6,26 (м, 2H), 3,38 (т, 2H), 3,09 (м, 8H), 2,75 (м, 2H), 2,16 (м, 6H), 2,07 (м, 2H), 1,95 (м, 3H), 1,70 (м, 2H), 1,38 (т, 2H), 0,91 (с, 6H).
Пример 302
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-дифторэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 302А
4-(2,2-дифторэтиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2н-пиран-4-ил)метанамин 2,2-дифторэтанамином в примере 1F.
Пример 302В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-дифторэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 302A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,22 (с, 1H), 11,05 (с, 1H), 8,46 (м, 2H), 7,76 (м, 1H), 7,53 (д, 1H), 7,33 (м, 4H), 7,05 (м, 4H), 6,76 (м, 1H), 6,57 (д, 1H), 6,34 (м, 1H), 6,14 (м, 1H), 3,89 (м, 2H), 2,97 (м, 4H), 2,71 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 303
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26C соединением примера 55В и соединение примера 1F соединением примера 163A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,28 (м, 1H), 8,13 (д, 1H), 7,78 (дд, 1H), 7,52 (д, 1H), 7,34 (д, 2H), 7,29 (м, 2H), 7,20 (д, 1H), 7,01 (м, 4H), 6,70 (дд, 1H), 6,45 (д, 1H), 6,27 (м, 2H), 3,85 (дд, 2H), 3,26 (т, 4H), 3,05 (м, 4H), 2,75 (м, 2H), 2,16 (м, 6H), 1,95 (м, 2H), 1,84 (м, 1H), 1,55 (м, 2H), 1,38 (т, 2H), 1,23 (м, 2H), 0,92 (с, 6H).
Пример 304
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 163A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,46 (с, 1H), 11,20 (с, 1H), 9,23 (с, 1H), 8,19 (д, 1H), 7,90 (дд, 1H), 7,53 (д, 1H), 7,41 (м, 4H), 7,33 (м, 1H), 7,17 (д, 1H), 6,86 (дд, 1H), 6,70 (дд, 1H), 6,41 (м, 1H), 6,21 (д, 1H), 3,84 (дд, 2H), 3,57 (м, 4H), 3,26 (м, 6H), 3,00 (м, 2H), 2,74 (с, 2H), 2,18 (с, 2H), 2,01 (с, 2H), 1,83 (м, 1H), 1,54 (м, 2H), 1,45 (т, 2H), 1,23 (м, 2H), 0,94 (с, 6H).
Пример 305
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4,4-дифторциклогексил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на соль 4,4-дифторциклогексанамина хлористоводородной кислоты в примере 187В.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,59 (д, 1H), 8,25 (д, 1H), 7,84 (дд, 1H), 7,50 (д, 2H), 7,39-7,41 (м, 2H), 7,33 (д, 2H), 7,15-7,18 (м, 2H), 7,03 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 3,86 (д, 1H), 3,04 (с, 4H), 2,74 (с, 2H), 1,95-2,18 (м, 14H), 1,69-1,73 (м, 2H), 1,38 (д, 2H), 0,92 (с, 6H).
Пример 306
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид
Пример 306А
1,6-Диоксаспиро[2,5]октан-2-карбонил
Смесь дигидро-2н-пиран-4(3Н)-она (10,0 г) и 2-хлорацетонитрила (7,55 г) в трет-бутаноле (10 мл) обрабатывали 1,0 N трет-бутилатом калия (100 мл) по каплям в течение 20 минут. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Ее разбавляли водой (10 мл) и 10% HCl (20 мл). Реакционную смесь концентрировали до одной трети ее первоначального объема и четыре раза экстрагировали диэтиловым эфиром. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя 20-40% этилацетата в гексанах, получая указанное в заголовке соединение.
Пример 306В
2-(4-Фтортетрагидро-2Н-пиран-4-ил)-2-гидроксиацетонитрил
Соединение примера 306А (11,5 г) растворяли в хлористом метилене (40 мл) в полипропиленовой бутылке. Бутылку охлаждали до 0°С. К данной смеси медленно прибавляли 70% фтороводород-пиридин (10,31 мл). Смесь оставляли нагреваться до комнатной температуры в течение 3 часов и перемешивали в течение 24 часов. Реакционную смесь разбавляли этилацетатом (200 мл) и выливали в насыщенный водный NaHCO3. Осторожно использовали дополнительное количество твердого NaHCO3для нейтрализации смеси, пока не прекратилось образование пузырей. Органический слой отделяли, а водный слой три раза экстрагировали дополнительным количеством этилацетата (каждый по 150 мл). Объединенные органические слои промывали 1% HCl, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали, получая требуемое соединение, которое непосредственно использовали в следующей реакции.
Пример 306С
(4-Фтортетрагидро-2Н-пиран-4-ил)метанол
Соединение примера 306В (11,78 г) в 2-пропаноле (150 мл) и воде (37,5 мл) охлаждали до 0°С. Смесь перемешивали и оставляли нагреваться до комнатной температуры в течение 3 часов. Реакционную смесь гасили ацетоном и перемешивали еще в течение 1 часа. Прозрачную жидкость отделяли от твердого вещества декантированием. Для промывания твердого вещества использовали дополнительное количество этилацетата и его декантировали. Объединенный органический раствор концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя 20-40% этилацетата в гексане, получая указанное в заголовке соединение.
Пример 306D
4-((4-Фтортетрагидро-2Н-пиран-4-ил)метокси)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 306С в примере 279А.
Пример 306Е
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 306D и соединение примера 26C соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,24 (с, 1H), 8,28 (д, 1H), 7,98 (дд, 1H), 7,54 (д, 1H), 7,42 (д, 1H), 30 7,34 (д, 2H), 7,28 (т, 1H), 7,17 (д, 1H), 7,04 (д, 2H), 6,97 (т, 1H), 6,70 (дд, 1H), 6,41 (д, 1H), 6,26-6,28 (м, 2H), 4,38 (д, 2H), 3,76-3,80 (м, 2H), 3,57-3,62 (м, 2H), 3,06 (с, 4H), 2,80 (с, 2H), 2,24 (уш.с, 2H), 2,15-2,25 (м, 2H), 1,96 (с, 2H), 1,82-1,89 (м, 4H), 1,39 (т, 2H), 0,93 (с, 6H).
Пример 307
4-(4-{[4-(4-Хлорфенил)-1-изопропил-6-оксо-1,6-дигидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 307А
4-(4-Хлорфенил)-2-фтор-5-метилпиридин
Смесь 2-фтор-4-йод-5-метилпиридина (1,9 г), 4-хлорфенилбороновой кислоты (1,504 г), тетракис(трифенилфосфин)палладия(0) (0,463 г) и карбоната натрия (2,55 г) в этаноле (20 мл), воде (10 мл) и толуоле (10 мл) нагревали при кипении с обратным холодильником в течение 6 часов. Реакционную смесь распределяли между этилацетатом и водой. Органический слой отделяли, а водные слои три раза экстрагировали дополнительным количеством этилацетата. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием 5% смеси этилацетата в гексане, получая указанное в заголовке соединение.
Пример 307В
5-(бромметил)-4-(4-хлорфенил)-2-фторпиридин
Смесь соединения примера 307А (1,2 г), N-бромсукцинимида (1,06 г) и AIBN (азобисизобутиронитрил) (0,178 г) в CCl4 (30 мл) нагревали при кипении с обратным холодильником в течение 6 часов. После охлаждения твердое вещество отфильтровывали. Фильтрат концентрировали и вносили на колонку с силикагелем, элюируя 3% смесью этилацетата в гексанах, получая указанное в заголовке соединение.
Пример 307С
Трет-бутил 4-((4-(4-хлорфенил)-6-фторпиридин-3-ил)метил)пиперазин-1-карбоксилат
Смесь соединения примера 307В (1,24 г), трет-бутил пиперазин-1-карбоксилата (0,768 г) и карбоната калия (0,570 г) в N,N-диметилформамиде (20 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь распределяли между этилацетатом и водой. Органический слой отделяли, а водный слой три раза экстрагировали дополнительным количеством этилацетата. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием 10% смеси этилацетата в гексанах, получая указанное в заголовке соединение.
Пример 307D
Трет-бутил 4-((4-(4-хлорфенил)-6-оксо-1,6-дигидропиридин-3-ил)метил)пиперазин-1-карбоксилат
Смесь соединения примера 307С (1,6 г) и 5% HCl (20 мл) в тетрагидрофуране (20 мл) нагревали при 80°С в течение ночи. Растворитель удаляли досуха. Твердое вещество повторно растворяли и добавляли к тетрагидрофурану (50 мл). К данной смеси прибавляли ВОС2О (ди-трет-бутилдикарбонат) (1,118 г), триэтиламин (0,72 мл) и 4-диметиламинопиридин (1,4 г). Растворитель удаляли, а остаток распределяли между водой и этилацетатом. Реакционную смесь перемешивали в течение ночи. Органические слои сушили (MgSO4), фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ, элюируя 20-100% смесью ацетонитрил/вода с 0,1% трифторуксусной кислотой, получая указанное в заголовке соединение.
Пример 307Е
Трет-бутил 4-((4-(4-хлорфенил)-1-изопропил-6-оксо-1,6-дигидропиридин-3-ил)метил)пиперазин-1-карбоксилат
Соединение примера 307D (0,404 г) в N,N-диметилформамиде (5 мл) обрабатывали 60% гидридом натрия (0,24 г) при комнатной температуре. К данной смеси прибавляли 2-йодпропан (0,204 г). Смесь перемешивали в течение ночи. Реакционную смесь распределяли между этилацетатом и водой. Органический слой отделяли, а водные слои три раза экстрагировали дополнительным количеством этилацетата. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием 10% смеси этилацетата в гексанах, получая соединение примера 307Е и соединение примера 307F.
Пример 307F
Трет-бутил 4-((4-(4-хлорфенил)-6-изопропоксипиридин-3-ил)метил)пиперазин-1-карбоксилат
Данное соединение выделяли в качестве побочного продукта при получении соединения примера 307Е.
Пример 307G
4-(4-Хлорфенил)-1-изопропил-5-(пиперазин-1-илметил)пиридин-2(1Н)-он
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 307Е в примере 1В.
Пример 307Н
Этил 2-(1Н-индол-5-илокси)-4-(4-((4-(4-хлорфенил)-1-изопропил-6-оксо-1,6-дигидропиридин-3-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 20C соединением примера 307G и соединение примера 20A соединением примера 26A в примере 20D.
Пример 307I
2-(1Н-Индол-5-илокси)-4-(4-((4-(4-хлорфенил)-1-изопропил-6-оксо-1,6-дигидропиридин-3-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 307Н в примере 1Е.
Пример 307J
4-(4-{[4-(4-Хлорфенил)-1-изопропил-6-оксо-1,6-дигидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 307I в примере 177.1Я ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,07 (с, 1H), 8,62 (т, 1H), 8,59 (д, 1H), 7,79 (дд, 1H), 7,59 (с, 1H), 7,52-7,53 (м, J 3H), 7,38-7,45 (м, 4H), 7,15 (д, 1H), 7,10 (д, 1H), 6,87 (дд, 1H), 6,68 (дд, 1H), 6,39 (с, 1H), 6,22 (с, 1H), 6,17 (д, 1H), 5,01-5,06 (м, 1H), 3,85 (дд, 2H), 3,24-3,31 (м, 6H), 3,09 (с, 2H), 3,00 (с, 4H), 2,26 (м, 4H), 2,09 (м, 2H), 1,60-1,63 (м, 2H), 1,30 (д, 6H).
Пример 308
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид
Пример 308А
4-Сульфамоил-N-((тетрагидро-2Н-пиран-4-ил)метил)бензамид
4-Сульфамоилбензойную кислоту (201 мг), (тетрагидро-2Н-пиран-4-ил)метанамин (144 мг), гидрат 1-гидроксибензотриазола (230 мг) и гидрохлорид 1-этил-3-[3-(диметиламино)пропил]карбодиимида (288 мг) соединяли в ацетонитриле. Смесь перемешивали при комнатной температуре в течение ночи. Твердое вещество отфильтровывали и концентрировали реакционную смесь. Сырое вещество очищали флэш-хроматографией, элюируя с градиентом от 2% смеси метанол/хлористый метилен до 10% смеси метанол/хлористый метилен.
Пример 308В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 308A и соединение примера 1E соединением примера 26С в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,19 (с, 1H), 8,57 (т, 1H), 7,94 (м, 4H), 7,48 (д, 1H), 7,43 (д, 1H), 7,40 (т, 1H), 7,33 (д, 2H), 7,21 (д, 1H), 7,03 (д, 2H), 6,88 (дд, 1H), 6,63 (дд, 1H), 6,42 (т, 1H), 6,13 (д, 1H), 3,84 (дд, 2H), 3,26 (м, 2H), 3,16 (т, 2H), 3,03 (уш.с, 4H), 2,74 (уш.с, 2H), 2,15 (м, 6H), 1,95 (с, 2H), 1,79 (м, 1H), 1,59 (д, 2H), 1,38 (т, 2H), 1,19 (м, 2H), 0,92 (с, 6H).
Пример 309
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Пример 309А
4-(2-Метоксиэтиламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид соединением примера 159С и (тетрагидропиран-4-ил)метиламин 2-метоксиэтиламином в примере 1F.
Пример 309В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В и соединение примера 1F соединением примера 309A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,26 (с, 1H), 8,13 (д, 1H), 7,79 (дд, 1H), 7,51 (д, 1H), 7,34 (д, 2H), 7,29 (т, 1H), 7,24 (м, 1H), 7,19 (д, 1H), 7,04 (д, 2H), 6,99 (м, 3H), 6,70 (дд, 1H), 6,44 (д, 1H), 6,27 (м, 2H), 3,52 (м, 4H), 3,28 (с, 3H), 3,05 (м, 4H), 2,75 (с, 2H), 2,17 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 310
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Пример 310А
4-(Аминометил)циклогексанол
Указанное в заголовке соединение получали, как описано в примере 311А, заменяя (4-метоксифенил)метанамин на (4-гидроксифенил)метанамин.
Пример 310В
2-(1Н-Индол-5-илокси)-N-(4-хлор-3-нитрофенилсульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензамид
Указанное в заголовке соединение получали, как описано в примере 1G, заменяя соединение примера 1Е и соединение примера 1F на соединение примера 26С и 4-хлор-3-нитробензолсульфонамид.
Пример 310С
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Смесь соединения примера 310В (100 мг), триэтиламина (0,2 мл) и соединения примера 310А (35 мг) в диоксане (5 мл) нагревали при 100°С в течение 20 часов и концентрировали. Остаток очищали ОФ-ВЭЖХ (10-70% ацетонитрила в 0,1% смеси трифторуксусная кислота в воде/70 минут), получая указанное в заголовке соединение в виде соли трифторуксусной кислоты.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,40 (с, 1H), 11,18 (с, 1H), 9,20 (с, 1H), 8,60 (т, 1H), 8,58 (д, 1H), 7,77 (дд, 1H), 7,54 (д, 1H), 7,42 (с, 1H), 7,37-7,41 (м, 3H), 7,14 30 (д, 1H), 7,04-7,09 (м, 3H), 6,86 (дд, 1H), 6,69 (дд, 1H), 6,39 (с, 1H), 6,21 (с, 1H), 3,50-3,68 (м, 3H), 3,20-3,27 (м, 3H), 2,93-3,07 (м, 2H), 2,66-2,82 (м, 2H), 2,13-2,22 (м, 2H), 2,01 (с, 2H), 1,83 (д, 2H), 1,67-1,77 (м, 3H), 1,50-1,60 (м, 1H), 1,44 (с, 2H), 0,96-1,17 (м, 4H), 0,94 (с, 6H).
Пример 311
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 311А
(4-метоксициклогексил)метанамин
(4-Метоксифенил)метанамин (1 г) в этаноле (10 мл) обрабатывали 5% сухим Rh-Al2O3 (0,5 г) в атмосфере Н2 (200 фунтов/кв.дюйм) при 60°С в течение 6 часов, а затем при 125°С в течение 26 часов. Нерастворимое вещество отфильтровывали, а фильтрат концентрировали, получая указанное в заголовке соединение.
Пример 311В
4-(((Транс-4-метоксициклогексил)метиламино)-3-нитробензолсульфонамид
4-Фтор-3-нитробензолсульфонамид (15 г) и соединение примера 311А (11,71 г) в тетрагидрофуране (200 мл) обрабатывали триэтиламином (28,5 мл) в течение ночи. Реакционную смесь концентрировали, а остаток вносили на колонку С18 и элюировали 40-55% ацетонитрила в воде, получая указанное в заголовке соединение.
Пример 311С
4-(((Цис-4-метоксициклогексил)метиламино)-3-нитробензолсульфонамид
Данное соединение получали по той же методике, по которой получали соединение примера 311В.
Пример 311D
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Указанное в заголовке соединение получали, как описано в примере 175F, заменяя соединение примера 175E и соединение примера 1F на соединение примера 26С и соединение примера 311B, соответственно.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,55-8,62 (м, 2H), 7,78 (дд, 1H), 7,51 (д, 1H), 7,37-7,43 (м, 2H), 7,33 (д, 2H), 7,15 (д, 1H), 7,01-7,08 (м, 3H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 3,25 (т, 2H), 3,22 (с, 3H), 3,00-3,10 (м, 5H), 2,72 (с, 2H), 2,15 (д, 6H), 2,00 (д, 2H), 1,94 (с, 2H), 1,78 (д, 2H), 1,53-1,65 (м, 1H), 1,38 (т, 2H), 0,96-1,12 (м, 4H), 0,92 (с, 6H).
Пример 312
Цис-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-гидроксициклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Указанное в заголовке соединение (соль трифторуксусной кислоты) получали в процессе очистки соединения примера 310С.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,39 (с, 1H), 11,18 (с, 1H), 9,17 (с, 1H), 8,61 (т, 1H), 8,58 (д, 1H), 7,78 (дд, 1H), 7,54 (д, 1H), 7,34-7,43 (м, 5H), 7,14 (д, 1H), 7,07 (т, 3H), 6,85 (дд, 1H), 6,69 (д, 1H), 6,39 (с, 1H), 6,21 (с, 1H), 3,77 (с, 1H), 3,58 (с, 2H), 3,24-3,29 (м, 2H), 2,91-3,07 (м, 2H), 2,60-2,81 (м, 2H), 2,17 (с, 2H), 2,00 (с, 2H), 1,57-1,72 (м, 4H), 1,43 (т, 7H), 0,94 (с, 6H).
Пример 313
Цис-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Указанное в заголовке соединение получали, как описано в примере 175F, заменяя соединение примера 175Е и соединение примера 1F соединением примера 26С и соединением примера 311С, соответственно.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,60 (т, 1H), 8,58 (д, 1H), 7,78 (дд, 1H), 7,51 (д, 1H), 7,37-7,44 (м, 2H), 7,33 (д, 2H), 7,16 (д, 1H), 7,07 (д, 1H), 7,03 (д, 2H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 3,36-3,39 (м, 1H), 3,26 (т, 2H), 3,20 (с, 3H), 3,03 (с, 4H), 2,72 (с, 2H), 2,15 (д, 6H), 1,94 (с, 2H), 1,81 (дд, 2H), 1,63-1,73 (м, 1H), 1,48 (дд, 2H), 1,23-1,41 (м, 6H), 0,92 (с, 6H).
Пример 314
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтокси)фенил]сульфонил}бензамид
Пример 314А
3-Нитро-4-(2-(тетрагидро-2Н-пиран-4-ил)этокси)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол 2-(тетрагидро-2Н-пиран-4-ил)этанолом в примере 279А.
Пример 314В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[3-нитро-4-(2-тетрагидро-2Н-пиран-4-илэтокси)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В и соединение примера 1F соединением примера 314A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,25 (с, 1H), 8,25 (д, 1H), 7,95 (дд, 1H), 7,54 (д, 1H), 7,39 (д, 1H), 7,34 (д, 2H), 7,29 (м, 1H), 7,17 (м, 1H), 7,04 (д, 2H), 6,97 (м, 1H), 6,70 (дд, 1H), 6,41 (д, 1H), 6,28 (м, 2H), 4,26 (т, 2H), 3,83 (м, 2H), 3,27 (м, 2H), 3,07 (м, 4H), 2,80 (м, 2H), 2,15 (м, 6H), 1,96 (с, 2H), 1,70 (м, 3H), 1,60 (м, 2H), 1,39 (т, 2H), 1,22 (м, 2H), 0,93 (с, 6H).
Пример 315
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-метоксиэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 309A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,18 (д, 1H), 7,92 (дд, 1H), 7,49 (д, 1H), 7,40 (м, 2H), 7,33 (д, 2H), 7,26 (м, 1H), 7,17 (д, 1H), 7,04 (м, 3H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,40 (м, 1H), 6,14 (д, 1H), 3,51 (м, 4H), 3,28 (с, 3H), 3,03 (с, 4H), 2,74 (м, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H)
Пример 316
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[3-(метилсульфонил)пропокси]-3-нитрофенил}сульфонил)бензамид
Пример 316А
4-(3-(Метилтио)пропокси)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол 3-(метилтио)пропан-1-ол в примере 279А.
Пример 316В
4-(3-(Метилсульфонил)пропокси)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 294А соединением примера 316A в примере 294В.
Пример 316С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[3-(метилсульфонил)пропокси]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В и соединение примера 1F соединением примера 316В в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,24 (с, 1H), 8,28 (д, 1H), 7,96 (дд, 1H), 7,54 (д, 1H), 7,35 (м, 3H), 7,29 (т, 1H), 7,17 (д, 1H), 7,04 (д, 2H), 6,96 (м, 1H), 6,71 (дд, 1H), 6,39 (д, 1H), 6,29 (м, 2H), 4,34 (т, 2H), 3,27 (м, 4H), 3,07 (м, 4H), 3,03 (с, 3H), 2,81 (с, 2H), 2,21 (м, 6H), 1,96 (с, 2H), 1,39 (т, 2H), 0,93 (с, 6H).
Пример 317
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 317А
4-(3-Метоксипропиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 3-метоксипропан-1-амином в примере 1F.
Пример 317В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 317А в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 12,24 (с, 1H), 9,30 (д, 1H), 8,88 (т, 1H), 8,28 (дд, 1H), 8,19 (д, 1H), 7,51-7,56 (м, 2H), 7,41-7,46 (м, 3H), 7,04-7,12 (м, 3H), 6,78 (д, 1H), 6,73 (дд, 1H), 6,60 (с, 1H), 6,55 (д, 1H), 3,40 (т, 2H), 3,29-3,36 (м, 2H), 3,27 (с, 3H), 3,01-3,08 (м, 4H), 2,76 (с, 2H), 2,25 (т, 2H), 2,06-2,15 (м, 4H), 1,97 (с, 2H), 1,78-1,86 (м, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 318
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-метоксипропил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 317А в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 12,39 (с, 1H), 9,21 (д, 1H), 8,86 (т, 1H), 8,15-8,24 (м, 2H), 7,42-7,50 (м, 3H), 7,38 (д, 1H), 7,04-7,13 (м, 3H), 6,73-6,81 (м, 4H), 6,67 (д, 1H), 3,39 (т, 2H), 3,32 (кв, 2H), 3,27 (с, 3H), 2,96-3,07 (м, 4H), 2,76 (с, 2H), 2,25 (т, 2H), 2,07-2,16 (м, 4H), 1,97 (с, 2H), 1,77-1,87 (м, 2H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 319
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 319А
4-(2-Цианоэтиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин 3-аминопропаннитрилом в примере 1F.
Пример 319В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 319А в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 9,26 (д, 1H), 9,06 (т, 1H), 8,34 (дд, 1H), 8,18 (д, 1H), 7,51-7,57 (м, 2H), 7,39-7,47 (м, 3H), 7,04-7,11 (м, 3H), 7,00 (д, 1H), 6,74 (дд, 1H), 6,60 (с, 1H), 6,54 (д, 1H), 3,83 (кв, J=6,7 Гц, 2H), 3,01-3,08 (м, 4H), 2,98 (т, 2H), 2,76 (с, 2H), 2,25 (т, 2H), 2,07-2,15 (м, 4H), 1,97 (с, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 320
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2-цианоэтил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F соединением примера 319А в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 12,41 (с, 1H), 9,16 (д, 1H), 9,05 (т, 1H), 8,31 (дд, 1H), 8,17 (д, 1H), 7,39 (д, 1H), 7,05 -7,13 (м, 3H), 6,99 (д, 1H), 6,78 (дд, 1H), 6,72-6,76 (м, 2H), 6,66 (д, 1H), 3,83 (кв, 2H), 3,01-3,07 (м, 4H), 2,98 (т, 2H), 2,76 (с, 2H), 2,25 (т, 2H), 2,08-2,16 (м, 4H), 1,97 (с, 2H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 321
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(3R)-4-гидрокси-1-адамантил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Указанное в заголовке соединение получали, как описано в примере 310С, заменяя соединение примера 310А 5-аминометиладамантан-2-олом.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,57 (д, 1H), 8,51 (т, 1H), 7,76 (дд, 1H), 7,50 (д, 1H), 7,38-7,42 (м, 2H), 7,33 (д, 2H), 7,11-7,16 (м, 2H), 7,03 (д, 2H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 4,61 (д, 1H), 3,63 (д, 1H), 3,13 (д, 2H), 3,03 (с, 4H), 2,73 (с, 2H), 2,11-2,21 (м, 6H), 2,04 (д, 2H), 1,95 (с, 2H), 1,78-1,86 (м, 3H), 1,49-1,60 (м, 6H), 1,38 (т, 2H), 1,29 (д, 2H), 0,92 (с, 6H).
Пример 322
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[цис-4-гидрокси-1-адамантил]метил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Указанное в заголовке соединение получали, как описано в примере 310С, заменяя соединение примера 310А 5-аминометиладамантан-2-олом.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,57 (д, 1H), 8,52 (т, 1H), 7,71-7,80 (м, 1H), 7,51 (д, 1H), 7,37-7,42 (м, 2H), 7,33 (д, 2H), 7,09-7,17 (м, 2H), 7,03 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 4,61 (д, 1H), 3,61 (д, 1H), 3,08 (д, 2H), 3,03 (с, 4H), 2,72 (с, 2H), 2,09-2,21 (м, 6H), 1,82-1,96 (м, 7H), 1,55-1,69 (м, 4H), 1,49 (с, 2H), 1,38 (т, 2H), 1,19-1,27 (м, 3H), 0,92 (с, 6H).
Пример 323
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид
Пример 323А
3-Нитро-4-(3,3,3-трифторпропиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин 3,3,3-трифторпропан-1-амином в примере 1F.
Пример 323В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 323A и соединение примера 26C соединением примера 55B в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,34 (с, 1H), 11,19 (с, 1H), 8,53 (м, 1H), 8,47 (с, 1H), 7,74 (дд, 1H), 7,54 (д, 1H), 7,34 (д, 2H), 7,25 (м, 1H), 7,13 (д, 1H), 6,99 (м, 4H), 6,67 (д, 1H), 6,36 (д, 1H), 6,24 (м, 2H), 3,65 (кв, 2H), 3,01 (м, 4H), 2,68 (м, 4H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 324
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(3,3,3-трифторпропил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 323A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,06 (с, 1H), 8,44 (м, 2H), 7,75 (дд, 1H), 7,54 (д, 1H), 7,33 (м, 4H), 7,02 (м, 3H), 6,90 (д, 1H), 6,76 (дд, 1H), 6,58 (дд, 1H), 6,33 (м, 1H), 6,15 (д, 1H), 3,63 (кв, 2H), 2,97 (м, 4H), 2,68 (м, 4H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 325
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Пример 325А
5-Бром-6-((тетрагидро-2Н-пиран-4-ил)метиламино)пиридин-3-сульфонамид
Смесь соединения примера 329А (93 мг), (тетрагидро-2Н-пиран-4-ил)метанамина (40 мг) и триэтиламина (0,144 мл) в безводном диоксане (4 мл) нагревали при 100°С в течение ночи. Органический растворитель удаляли в вакууме. Остаток суспендировали в хлористом метилене. Твердое вещество фильтровали и сушили, получая указанное в заголовке соединение.
Пример 325В
N-({5-бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26C соединением примера 55В и соединение примера 1F соединением примера 325A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,28 (с, 1H), 11,10 (с, 1H), 8,38 (д, 1H), 7,93 (д, 1H), 7,57 (д, 1H), 7,32 (м, 4H), 7,22 (д, 1H), 7,02 (м, 3H), 6,71 (дд, 1H), 6,51 (д, 1H), 6,27 (м, 2H), 3,82 (дд, 2H), 3,31 (м, 2H), 3,23 (м, 2H), 3,05 (м, 4H), 2,74 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,88 30 (м, 1H), 1,55 (м, 2H), 1,37 (м, 2H), 1,18 (м, 2H), 0,92 (с, 6H).
Пример 326
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1,1-диоксидотетрагидротиен-3-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид соединением примера 337A и 1-(2-метоксиэтил)пиперидин-4-иламин гидрохлоридом (1,1-диоксидотетрагидротиен-3-ил)метиламина в примере 189А.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,25 (с, 1H), 8,71 (м, 1H), 8,51 (д, 1H), 7,72 (дд, 1H), 7,53 (д, 1H), 7,34 (д, 2H), 7,29 (м, 1H), 7,18 (д, 1H), 7,12 (д, 1H), 7,04 (д, 2H), 6,98 (м, 1H), 6,70 (дд, 1H), 6,44 (д, 1H), 6,26 (дд, 2H), 3,55 (т, 2H), 3,27 (м, 2H), 3,04 (м, 5H), 2,91 (м, 1H), 2,74 (с, 3H), 2,28 (м, 1H), 2,16 (м, 6H), 1,95 (с, 2H), 1,85 (м, 1H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 327
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 306D в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,41 (д, 1H), 8,10 (дд, 1H), 7,51 (д, 1H), 7,39-7,46 (м, 3H), 7,34 (д, 2H), 7,16 (с, 1H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,40 (д, 1H), 6,15 (д, 1H), 4,38 (д, 2H), 3,76-3,80 (м, 2H), 3,56-3,61 (м, 2H), 3,05 (с, 4H), 2,78 (с, 2H), 2,12-2,23 (м, 6H), 1,95 (с, 2H), 1,80-1,89 (м, 4H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 328
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-(метиламино)-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Пример 328А
4-(Метиламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя 4-хлор-3-нитробензолсульфонамид соединением примера 159С и (тетрагидропиран-4-ил)метиламин на метиламин в примере 1F.
Пример 328В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-(метиламино)-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 328А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,17 (д, 1H), 7,91 (дд, 1H), 7,49 (д, 1H), 7,40 (м, 3H), 7,33 (д, 2H), 7,16 (м, 1H), 7,04 (д, 2H), 6,87 (м, 2H), 6,65 (дд, 1H), 6,40 (м, 1H), 6,14 (д, 1H), 3,03 (м, 4H), 2,91 (д, 3H), 2,73 (с, 2H), 2,15 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 329
N-{[5-Бром-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Пример 329А
5-Бром-6-хлорпиридин-3-сульфонамид
5-Бром-6-хлорпиридин-3-сульфонилхлорид (8,2 г) в метаноле (20 мл) охлаждали до 0°С. К данной смеси прибавляли 7N NH3 в метаноле (80 мл). Реакционную смесь перемешивали в течение ночи. Растворитель удаляли при пониженной температуре, а остаток распределяли между этилацетатом и водой. Водный слой три раза экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле с использованием 10-50% этилацетата в гексанах, получая указанное в заголовке соединение.
Пример 329В
5-Бром-6-((тетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонамид
(Тетрагидро-2Н-пиран-4-ил)метанол (0,65 г) в тетрагидрофуране (20 мл) обрабатывали 60% гидридом натрия (0,895 г). Реакционную смесь перемешивали в течение 10 минут. К данной смеси прибавляли соединение примера 329А (1,519 г). Реакционную смесь перемешивали в течение ночи. Ее выливали в воду, нейтрализовывали 10% водным HCl и три раза экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя 20-60% этилацетата в гексанах, получая указанное в заголовке соединение.
Пример 329С
N-{[5-Бром-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 329В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,15 (с, 1H), 8,60 (с, 1H), 8,38 (д, 1H), 7,54 (д, 1H), 7,38-7,42 (м, 2H), 7,34 (д, 2H), 7,17 (с, 1H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 4,25 (д, 2H), 3,87 (дд, 2H), 3,05 (с, 4H), 2,80 (с, 2H), 2,25 (с, 4H), 2,12-2,14 (м, 4H), 1,95 (с, 2H), 1,63-1,66 (м, 2H), 1,37-1,40 (м, 2H), 0,92 (с, 6H).
Пример 330
4-(4-{[4-(4-Хлорфенил)-6-изопропоксипиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4- [(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 330А
1-((4-(4-Хлорфенил)-6-изопропоксипиридин-3-ил)метил)пиперазин
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 307F в примере 1В.
Пример 330В
Этил 2-(1Н-индол-5-илокси)-4(4-((4-(4-хлорфенил)-6-изопропоксипиридин-3-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 20С соединением примера 330A и соединение примера 20А соединением примера 26А в примере 20D.
Пример 330С
2-(1Н-Индол-5-илокси)-4(4-((4-(4-хлорфенил)-6-изопропоксипиридин-3-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 330B в примере 1Е.
Пример 330D
4-(4-{[4-(4-Хлорфенил)-6-изопропоксипиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 330С в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,21, (с, 1H), 11,17 (с, 1H), 8,63 (т, 1H), 8,59 (д, 1H), 8,08 (с, 1H), 7,79 (дд, 1H), 7,54-7,56 (м, 3H), 7,47 (д, 2H), 7,38-7,42 (м, 2H), 7,15 (д, 1H), 7,10 (д, 1H), 6,87 (дд, 1H), 6,68 (дд, 1H), 6,59 (с, 1H), 6,39 (с, 1H), 6,17 (д, 1H), 5,23-5,28 (м, 1H), 3,85 (дд, 2H), 3,24-3,31 (м, 4H), 3,02 (с, 4H), 2,29 (с, 4H), 1,86-1,91 (м, 1H), 1,61-1,63 (м, 2H), 1,28 (д, 6H).
Пример 331
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[6-(тетрагидро-2Н-пиран-4-илметокси)-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид
Пример 331А
6-((Тетрагидро-2Н-пиран-4-ил)метокси)-5-(тиазол-2-ил)пиридин-3-сульфонамид
Смесь соединения примера 329В (0,070 г), 2-(трибутилстаннил)тиазола (0,090 г) и тетракис(трифенилфосфин)палладия(0) в диоксане (2 мл) нагревали до 90°С в течение 4 часов. После охлаждения смесь вносили на колонку с силикагелем и элюировали смесью 1:3 этилацетат:гексаны, получая указанное в заголовке соединение.
Пример 331В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[6-(тетрагидро-2Н-пиран-4-илметокси)-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 331A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,14 (с, 1H), 9,09 (с, 1H), 8,73 (с, 1H), 8,06 (д, 1H), 7,98 (д, 1H), 7,50 (д, 1H), 7,37-7,38 (м, 2H), 7,33 (д, 2H), 7,17 (д, 1H), 7,03 (д, 2H), 6,84 (дд, 1H), 6,62 (дд, 1H), 6,37 (с, 1H), 6,11 (д, 1H), 4,46 (д, 2H), 3,91 (дд, 2H), 3,36-3,39 (м, 4H), 3,02 (с, 4H), 2,76 (с, 2H), 2,12-2,20 (с, 8H), 1,94 (с, 2H), 1,45-1,47 (м, 2H), 1,37 (т, 2H), 0,91 (с, 6H).
Пример 332
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(2-метоксиэтил)амино]карбонил}фенил)сульфонил]бензамид
Пример 332А
N-(2-метоксиэтил)-4-сульфамоилбензамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин 2-метоксиэтанамином в примере 308А.
Пример 332В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(2-метоксиэтил)амино]карбонил}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 332A и соединение примера 1E соединением примера 26C в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,28 (уш.с, 1H), 11,17 (с, 1H), 8,71 (м, 1H), 7,94 (м, 4H), 7,48 (д, 1H), 7,41 (м, 2H), 7,33 (д, 2H), 7,21 (д, 1H), 7,03 (д, 2H), 6,88 (дд, 1H), 6,63 (дд, 1H), 6,42 (т, 1H), 6,13 (д, 1H), 3,45 (м, 4H), 3,27 (с, 3H), 3,03 (м, 4H), 2,73 (уш.с, 2H), 2,16 (м, 6H), 1,95 (уш.с, 2H), 1,38 (м, 2H), 0,92 (с, 6H).
Пример 333
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Пример 333А
5-Циано-6-((тетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонамид
Смесь соединения примера 329В (0,702 г), дицианоцинка (0,129 г) и тетракис(трифенилфосфин)палладия(0) (0,231 г) в N,N-диметилформамиде (2 мл) дегазировали путем циклов вакуум/азот три раза. Реакционную смесь нагревали при 120°С в течение 3 часов. После охлаждения ее выливали в воду и три раза экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя 20-60% этилацетата в гексанах, получая указанное в заголовке соединение.
Пример 333В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 333A в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,84 (д, 1H), 8,64 (д, 1H), 7,57 (д, 1H), 7,38-7,41 (м, 4H), 7,12 (д, 1H), 7,08 (д, 2H), 6,87 (дд, 1H), 6,71 (дд, 1H), 6,38 (с, 1H), 6,23 (д, 1H), 4,31 (д, 2H), 3,88 (дд, 2H), 3,54 (уш.с, 2H), 3,02 (уш.с, 4H), 2,76 (уш.с, 2H), 2,18 (с, 4H), 2,01 (с, 2H), 1,63-1,66 (м, 2H), 1,49 (т, 2H), 0,94 (с, 6H).
Пример 334
N-({4-[(1-ацетилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин 1-ацетилпиперидин-4-амином и 4-хлор-3-нитробензолсульфонамид соединением примера 310В в примере 189А.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,16 (уш.с, 1H), 8,58 (д, 1H), 8,25 (д, 1H), 7,81 (дд, 1H), 7,51 (д, 1H), 7,43-7,37 (м, 2H), 7,34 (д, 2H), 7,19 (д, 1H), 7,15 (д, 1H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (т, 1H), 6,15 (д, 1H), 4,32-4,23 (м, 1H), 3,96-3,77 (м, 2H), 3,21 (м, 2H), 3,03 (м, 4H), 2,80 (м, 2H), 2,73 (уш.с, 2H), 2,16 (м, 6H), 2,02 (с, 3H), 1,95 (уш.с, 2H), 1,65-1,44 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 335
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[1-(метилсульфонил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил}бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин 1-(метилсульфонил)пиперидин-4-амином и 4-хлор-3-нитробензолсульфонамид соединением примера 187А в примере 189А.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,15 (уш.с, 1H), 8,59 (д, 1H), 8,25 (д, 1H), 7,82 (дд, 1H), 7,51 (д, 1H), 7,43-7,38 (м, 2H), 7,34 (д, 2H), 7,14 (м, 2H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,39 (т, 1H), 6,15 (д, 1H), 3,80 (м, 1H), 3,57 (м, 2H), 3,04 (м, 4H), 2,95 (м, 2H), 2,92 (уш.с, 3H), 2,73 (м, 2H), 2,15 (м, 6H), 2,06-1,98 (м, 2H), 1,95 (уш.с, 2H), 1,70 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 336
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 336А
4-((1,4-Диоксан-2-ил)метиламино)-3-нитробензолсульфонамид
Указанное в заголовке соединение получали, как описано в примере 1F, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин на (1,4-диоксан-2-ил)метанамин.
Пример 336В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Указанное в заголовке соединение получали, как описано в примере 175F, заменяя соединение примера 175Е и соединение примера 1F соединением примера 26С и соединением примера 336А, соответственно.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,54-8,63 (м, 2H), 7,82 (дд, 1H), 7,50 (д, 1H), 7,38-7,42 (м, 2H), 7,33 (д, 2H), 7,16 (д, 1H), 7,10 (д, 1H), 7,03 (д, 2H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 3,76-3,82 (м, 3H), 3,57-3,68 (м, 2H), 3,45-3,52 (м, 2H), 3,36-3,42 (м, 1H), 3,03 (с, 4H), 2,73 (д, 2H), 2,10-2,22 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 337
N-({4-[(1-ацетилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Пример 337А
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 55В и соединение примера 1F 4-хлор-3-нитробензолсульфонамидом в примере 1G.
Пример 337В
N-({4-[(1-ацетилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин 1-ацетилпиперидин-4-амином и 4-хлор-3-нитробензолсульфонамид соединением примера 337А в примере 189А.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,24 (уш.с, 1H), 8,50 (д, 1H), 8,24 (д, 1H), 7,73 (дд, 1H), 7,52 (д, 1H), 7,34 (д, 2H), 7,27 (т, 1H), 7,19-7,13 (м, 2H), 7,04 (т, 2H), 6,97 (т, 1H), 6,70 (дд, 1H), 6,42 (д, 1H), 6,27 (дд, 1H), 6,24 (т, 1H), 4,29 (м, 1H), 3,97-3,78 (м, 2H), 3,22 (м, 2H), 3,05 (м, 4H), 2,81 (м, 2H), 2,72 (уш.с, 2H), 2,15 (м, 6H), 2,03 (с, 3H), 1,95 (уш.с, 2H), 1,66-1,44 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 338
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[1-(метилсульфонил)пиперидин-4-ил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин 1-(метилсульфонил)пиперидин-4-амином и 4-хлор-3-нитробензолсульфонамид соединением примера 337А в примере 189А.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,24 (уш.с, 1H), 8,50 (д, 1H), 8,25 (д, 1H), 7,74 (дд, 1H), 7,52 (д, 1H), 7,34 (д, 2H), 7,27 (т, 1H), 7,17 (д, 1H), 7,12 (д, 1H), 7,04 (д, 2H), 6,97 (т, 1H), 6,70 (дд, 1H), 6,42 (д, 1H), 6,27 (д, 1H), 6,24 (т, 1H), 3,81 (м, 1H), 3,58 (м, 2H), 3,05 (м, 4H), 2,96 (м, 2H), 2,92 (с, 3H), 2,74 (м, 2H), 2,16 (м, 6H), 2,06-1,98 (м, 2H), 1,95 (уш.с, 2H), 1,70 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 339
4-(4-{[4’-Хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 339А
Метил 2-(1Н-индол-5-илокси)-4-(4-(2-бром-4-(трифторметил)бензил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 27С 4-трифторметил-2-бромбензальдегидом и трет-бутилпиперазин-1-карбоксилат соединением примера 150А в примере 1А.
Пример 339В
Метил 2-(1Н-индол-5-илокси)-4-(4-((4’-хлор-5-(трифторметил)дифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 2-фтор-4-йод-5-метилпиридин соединением примера 339А в примере 307А.
Пример 339С
2-(1Н-индол-5-илокси)-4-(4-((4’-хлор-5-(трифторметил)дифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 339B в примере 1E.
Пример 339D
4-(4-{[4’-Хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 339С в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,24 (с, 1H), 11,17 (с, 1H), 8,63 (т, 1H), 7,79 (дд, 1H), 7,72 (м, 2H), 7,38-7,53 (м, 8H), 7,15 (д, 1H), 7,10 (д, 1H), 6,87 (дд, 1H), 6,67 (дд, 1H), 6,39 (с, 1H), 6,16 (д, 1H), 3,85 (дд, 2H), 3,41 (с, 2H), 3,24-3,31 (м, 6H), 3,04 (с, 4H), 2,29 (с, 4H), 1,60-1,63 (м, 2H), 1,24-1,28 (м, 2H).
Пример 340
4-(4-{[4’-Хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 339С и соединение примера 1F соединением примера 279А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,40 (с, 1H), 11,17 (с, 1H), 8,41 (д, 1H), 8,07 (дд, 1H), 7,70-7,74 (м, 2H), 7,38-7,53 (м, 8H), 7,16 (д, 1H), 6,87 (дд, 1H), 6,67 (дд, 1H), 6,40 (с, 1H), 6,17 (д, 1H), 4,09 (д, 2H), 3,88 (дд, 2H), 3,42 (с, 2H), 3,05 (с, 4H), 2,30 (с, 4H), 2,00-2,05 (м, 1H), 1,63-1,66 (м, 2H), 1,31-1,37 (м, 2H).
Пример 341
4-{4-[(5-Трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 341А
Метил 2-(1Н-индол-5-илокси)-4-(4-(2-бром-4-трет-бутилбензил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 27С 4-трет-бутил-2-бромбензальдегидом и трет-бутилпиперазин-1-карбоксилат соединением примера 150А в примере 1А.
Пример 341В
Метил 2-(1Н-индол-5-илокси)-4-(4-((5-трет-бутил-4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя 2-фтор-4-йод-5-метилпиридин соединением примера 341А в примере 307А.
Пример 341С
2-(1Н-индол-5-илокси)-4-(4-((5-трет-бутил-4’-хлордифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 341B в примере 1E.
Пример 341D
4-{4-[(5-Трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 341С в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,22 (с, 1H), 11,16 (с, 1H), 8,62 (т, 1H), 8,58 (д, 1H), 7,79 (дд, 1H), 7,53 (д, 1H), 7,34-7,44 (м, 8H), 7,18 (с, 1H), 7,14 (д, 1H), 7,09 (д, 1H), 6,86 (дд, 1H), 6,67 (дд, 1H), 6,39 (с, 1H), 6,17 (д, 1H), 3,85 (дд, 2H), 3,24-3,30 (м, 6H), 3,04 (с, 4H), 2,29 (с, 4H), 1,86-1,91 (м, 1H), 1,60-1,63 (м, 2H), 1,28 (с, 9H).
Пример 342
4-{4-[(5-Трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 341С и соединение примера 1F соединением примера 279А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,25 (уш.с, 1H), 11,16 (с, 1H), 8,40 (д, 1H), 8,06 (дд, 1H), 7,52 (д, 1H), 7,35-7,46 (м, 8H), 7,19 (с, 1H), 7,15 (д, 1H), 6,85 (дд, 1H), 6,66 (дд, 1H), 6,39 (с, 1H), 6,17 (д, 1H), 4,08 (д, 2H), 3,88 (дд, 2H), 3,05 (с, 4H), 2,32 (с, 4H), 1,64 (дд, 2H), 1,32-1,37 (м, 2H), 1,28 (с, 9H).
Пример 343
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид
Пример 343А
3-Нитро-4-(2,2,2-трифторэтиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин 2,2,2-трифторэтанамином в примере 1F.
Пример 343В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 343А и соединение примера 26С соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 10,98 (с, 1H), 8,41 (м, 2H), 7,75 (дд, 1H), 7,54 (д, 1H), 7,34 (д, 2H), 7,28 (м, 2H), 7,06 (м, 3H), 6,93 (м, 1H), 6,70 (дд, 1H), 6,53 (дд, 1H), 6,30 (м, 1H), 6,14 (д, 1H), 4,32 (м, 2H), 2,93 (м, 4H), 2,71 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 344
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(2,2,2-трифторэтил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 343А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,05 (с, 1H), 8,40 (м, 2H), 7,77 (дд, 1H), 7,60 (д, 1H), 7,34 (д, 2H), 7,18 (м, 1H), 7,12 (д, 1H), 7,04 (м, 3H), 6,88 (т, 1H), 6,58 (дд, 1H), 6,22 (м, 3H), 4,33 (м, 2H), 2,93 (м, 4H), 2,71 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 345
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид
Пример 345А
3-Сульфамоил-N-((тетрагидро-2Н-пиран-4-ил)метил)бензамид
Соединение данного примера получали, заменяя 4-сульфамоилбензойную кислоту на 3-сульфамоилбензойную кислоту в примере 308А.
Пример 345В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-{[(тетрагидро-2Н-пиран-4-илметил)амино]карбонил}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 345А и соединение примера 1Е соединением примера 26С в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,28 (уш.с, 1H), 11,18 (с, 1H), 8,75 (т, 1H), 8,41 (м, 1H), 8,10 (д, 1H), 8,01 (д, 1H), 7,60 (т, 1H), 7,48 (д, 1H), 7,41 (м, 2H), 7,33 (д, 2H), 7,23 (д, 1H), 7,03 (д, 2H), 6,88 (дд, 1H), 6,83 (дд, 1H), 6,42 (т, 1H), 6,11 (д, 1H), 3,83 (дд, 2H), 3,19 (м, 4H), 3,02 (м, 4H), 2,73 (м, 2H), 2,16 (м, 6H), 1,94 (уш.с, 2H), 1,80 (м, 1H), 1,58 (дд, 2H), 1,37 (т, 2H), 1,24 (м, 2H), 0,92 (с, 6H).
Пример 346
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2R)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 346А
(R)-4-((1,4-диоксан-2-ил)метокси)-3-нитробензолсульфонамид
Рацемическую смесь соединения примера 297А разделяли на хиральной AD колонке SFC, получая указанное в заголовке соединение.
Пример 346В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2R)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Указанное в заголовке соединение получали, как в примере 175F, заменяя соединение примера 175Е и соединение примера 1F на соединение примера 26С и соединение примера 346А, соответственно.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,39 (д, 1H), 8,06 (дд, 1H), 7,51 (д, 1H), 7,38-7,43 (м, 3H), 7,34 (д, 2H), 7,15 (д, 1H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,39 (с, 1H), 6,15 (д, 1H), 4,20-4,28 (м, 2H), 3,85-3,91 (м, 1H), 3,82 (дд, 1H), 3,74-3,78 (м, 1H), 3,59-3,69 (м, 2H), 3,40-3,51 (м, 2H), 3,05 (с, 4H), 2,78 (с, 2H), 2,23 (с, 4H), 2,14 (с, 2H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 347
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2S)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 347А
(S)-4-((1,4-диоксан-2-ил)метокси)-3-нитробензолсульфонамид
Рацемическую смесь соединения примера 297А разделяли на хиральной AD колонке SFC, получая указанное в заголовке соединение.
Пример 347В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2S)-1,4-диоксан-2-илметокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Указанное в заголовке соединение получали, как в примере 175F, заменяя соединение примера 175Е и соединение примера 1F на соединение примера 26С и соединение примера 347А, соответственно.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,16 (с, 2H), 8,39 (д, 1H), 8,06 (дд, 1H), 7,51 (д, 1H), 7,38-7,43 (м, 3H), 7,34 (д, 2H), 7,15 (д, 1H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,39 (с, 1H), 6,15 (д, 1H), 4,20-4,28 (м, 2H), 3,85-3,91 (м, 1H), 3,82 (дд, 1H), 3,74-3,78 (м, 1H), 3,59-3,69 (м, 2H), 3,40-3,51 (м, 2H), 3,05 (с, 4H), 2,78 (с, 2H), 2,23 (с, 4H), 2,14 (с, 2H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 348
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Пример 348А
4-(3-Морфолинпропиламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид на соединение примера 159С и (тетрагидропиран-4-ил)метиламин на 3-морфолинпропан-1-амин в примере 1F.
Пример 348В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 348А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,17 (д, 1H), 7,91 (дд, 1H), 7,49 (д, 1H), 7,40 (м, 3H), 7,33 (д, 2H), 7,15 (д, 1H), 7,03 (м, 3H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,40 (с, 1H), 6,13 (д, 1H), 3,59 (м, 4H), 3,38 (м, 4H), 3,02 (м, 4H), 2,72 (с, 2H), 2,40 (м, 6H), 2,15 (м, 6H), 1,95 (с, 2H), 1,73 (м, 2H), 0,92 (с, 6H).
Пример 349
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({4-[(3-морфолин-4-илпропил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В и соединение примера 1F соединением примера 348А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,25 (с, 1H), 11,08 (м, 1H), 8,12 (д, 1H), 7,81 (дд, 1H), 7,52 (д, 1H), 7,36 (м, 3H), 7,28 (м, 1H), 7,19 (д, 1H), 7,04 (д, 2H), 6,98 (м, 2H), 6,69 (дд, 1H), 6,44 (д, 1H), 6,25 (м, 2H), 3,60 (м, 4H), 3,38 (м, 2H), 3,03 (м, 4H), 2,73 (с, 2H), 2,43 (м, 6H), 2,16 (м, 6H), 1,95 (с, 2H), 1,73 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 350
N-({5-Бром-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 325А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,19 (с, 1H), 11,02 (с, 1H), 8,47 (д, 1H), 8,07 (д, 1H), 7,55 (д, 1H), 7,39 (м, 5H), 7,25 (д, 1H), 7,03 (д, 2H), 6,89 (дд, 1H), 6,65 (дд, 1H), 6,42 (с, 1H), 6,11 (д, 1H), 3,82 (дд, 2H), 3,31 (м, 2H), 3,24 (м, 2H), 3,03 (м, 4H), 2,72 (с, 2H), 2,15 (м, 6H), 1,94 (с, 2H), 1,89 (м, 1H), 1,54 (м, 2H), 1,38 (т, 2H), 1,17 (м, 2H), 0,92 (с, 6H).
Пример 351
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-морфолин-4-илэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Пример 351А
4-(2-Морфолинэтиламино)-3-(трифторметилсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя 4-фтор-3-нитробензолсульфонамид соединением примера 159С и (тетрагидропиран-4-ил)метиламин 2-морфолинэтанамином в примере 1F.
Пример 351В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(2-морфолин-4-илэтил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 351А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,22 (с, 1H), 11,17 (с, 1H), 8,17 (д, 1H), 7,92 (дд, 1H), 7,61 (с, 1H), 7,48 (д, 1H), 7,40 (м, 2H), 7,33 (д, 2H), 7,15 (д, 1H), 7,03 (д, 2H), 6,93 (д, 1H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,40 (с, 1H), 6,13 (м, 1H), 3,57 (м, 4H), 3,35 (м, 2H), 3,02 (м, 4H), 2,72 (с, 2H), 2,58 (т, 2H), 2,42 (м, 4H), 2,15 (м, 6H), 1,95 (с, 2H), 1,37 (м, 2H), 0,92 (с, 6H).
Пример 352
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 352А
5-Циано-6-((тетрагидро-2Н-пиран-4-ил)метиламино)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 329В соединением примера 325А в примере 333А.
Пример 352В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(тетрагидро-2Н-пиран-4-илметил)амино]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 352А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,18 (с, 1H), 8,65 (д, 1H), 8,27 (д, 1H), 8,15 (с, 1H), 7,56 (д, 1H), 7,41 (м, 2H), 7,34 (д, 2H), 7,22 (д, 1H), 7,04 (д, 2H), 6,88 (дд, 1H), 6,65 (дд, 1H), 6,41 (м, 1H), 6,12 (д, 1H), 3,82 (дд, 2H), 3,33 (м, 2H), 3,24 (т, 2H), 3,04 (м, 4H), 2,75 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,89 (м, 1H), 1,55 (м, 2H), 1,38 (т, 2H), 1,19 (м, 2H), 0,91 (с, 6H).
Пример 353
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)окси]-3-нитрофенил}сульфонил)бензамид
Пример 353А
4-(1-Метилпиперидин-4-илокси)-3-нитробензолсульфонамид
К смеси 1-метилпиперидин-4-ола (0,542 г) в тетрагидрофуране (10 мл) при 0°С прибавляли NaH (60% в минеральном масле) (0,753 г). После перемешивания в течение 15 минут прибавляли 4-фтор-3-нитробензолсульфонамид (1,036 г) в виде раствора в тетрагидрофуране (10 мл). Реакционную смесь вынимали из бани со льдом и оставляли нагреваться до комнатной температуры. Спустя 1 час реакционную смесь выливали в воду и доводили рН до ~7 1N водной HCl. Реакционную смесь экстрагировали хлористым метиленом (3×100 мл), промывали насыщенным раствором соли, сушили над сульфатом магния, фильтровали и концентрировали. Продукт суспендировали в хлористом метилене (мл), облучали микроволновым излучением и фильтровали, получая указанное в заголовке соединение.
Пример 353В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)окси]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 353А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид) δ 11,03 (с, 1H), 8,21 (д, 1H), 7,87 (дд, 1H), 7,55 (д, 1H), 7,33 (дд, 4H), 7,25 (д, 1H), 7,04 (д, 2H), 6,98 (д, 1H), 6,73 (дд, 1H), 6,56 (д, 1H), 6,33 (с, 1H), 6,14 (д, 1H), 4,79 (с, 1H), 2,96 (с, 6H), 2,72 (с, 2H), 2,57 (с, 3H), 2,18 (с, 6H), 1,94 (м, 6H), 1,39 (м, 2H), 0,92 (с, 6H).
Пример 354
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид
Пример 354А
4-((1-Метилпиперидин-4-ил)метокси)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1-метилпиперидин-4-ол на (1-метилпиперидин-4-ил)метанол в примере 353А.
Пример 354В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(1-метилпиперидин-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 354А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид) δ 11,01 (с, 1H), 8,19 (д, 1H), 7,87 (дд, 1H), 7,55 (д, 1H), 7,39-7,26 (м, 4H), 7,16 (д, 1H), 7,08-7,01 (м, 2H), 6,96 (д, 1H), 6,72 (дд, 1H), 6,54 (д, 1H), 6,32 (с, 1H), 6,14 (д, 1H), 4,05 (д, 2H), 2,95 (с, 4H), 2,89-2,59 (м, 7H), 2,17 (с, 6H), 2,00-1,78 (м, 5H), 1,53 (с, 2H), 1,37 (м, 2H), 0,92 (с, 6H).
Пример 355
4-(4-{[4-(4-Хлорфенил)-1-(3-гидроксипропил)-1,2,5,6-тетрагидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 355А
Трет-бутил 4-хлор-3-формил-5,6-дигидропиридин-1(2Н)-карбоксилат
К N,N-диметилформамиду (3,87 мл) при 0°С прибавляли по каплям оксихлорид фосфора (3,73 мл), поддерживая температуру ниже 5°С. Полученную смесь разбавляли хлористым метиленом (15 мл) и перемешивали при комнатной температуре в течение 1,5 часов. Затем смесь охлаждали на бане со льдом. Прибавляли трет-бутил 4-оксопиперидин-1-карбоксилат (4,89 г) в виде раствора в хлористом метилене (20 мл) и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Реакционную смесь выливали на лед и твердый ацетат натрия, перемешивали в течение 15 минут и экстрагировали хлористым метиленом. Экстракты тщательно промывали водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали, получая указанное в заголовке соединение.
Пример 355В
Трет-бутил 4-(4-хлорфенил)-3-формил-5,6-дигидропиридин-1(2Н)-карбоксилат
Соединение примера 355А (6,14 г), 4-хлорфенилбороновую кислоту (4,10 г) и ацетат палладия(II) (0,112 г) соединяли в воде, получая суспензию. Добавляли карбонат калия (8,98 г) и бромид тетрабутиламмония (4,03 г). Полученную смесь перемешивали при 45°С в течение ночи, охлаждали и разбавляли реакционную смесь этилацетатом (200 мл), чтобы растворить какое-либо нерастворившееся вещество, затем тщательно промывали водой, сушили над MgSO4, фильтровали и концентрировали. Сырое вещество очищали флэш-хроматографией, элюируя с градиентом от 10% смеси этилацетат/гексаны до 40% смеси этилацетат/гексаны.
Пример 355С
Трет-бутил 3-((4-(3-(1Н-индол-4-илокси)-4-(метоксикарбонил)фенил)пиперазин-1-ил)метил)-4-(4-хлорфенил)-5,6-дигидропиридин-1(2Н)-карбоксилат
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 335В и трет-бутил пиперазин-1-карбоксилат соединением примера 68В в примере 1А.
Пример 355D
Метил 2-(1Н-индол-4-илокси)-4-(4-((4-(4-хлорфенил)-1,2,5,6-тетрагидропиридин-3-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 355С в примере 1В.
Пример 355Е
Метил 2-(1Н-индол-4-илокси)-4-(4-((4-(4-хлорфенил)-1-(3-гидроксипропил)-1,2,5,6-тетрагидропиридин-3-ил)метил)пиперазин-1-ил)бензоат
Соединение примера 355D (539 мг), 3-бромпропан-1-ол (83 мг) и триэтиламин (0,42 мл) соединяли в ацетонитриле. Смесь нагревали до 60°С в течение ночи, концентрировали, а затем растирали с эфиром и фильтровали, получая указанное в заголовке соединение.
Пример 355F
2-(1Н-индол-4-илокси)-4-(4-((4-(4-хлорфенил)-1-(3-гидроксипропил)-1,2,5,6-тетрагидропиридин-3-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 355Е в примере 1Е.
Пример 355G
4-(4-{[4-(4-Хлорфенил)-1-(3-гидроксипропил)-1,2,5,6-тетрагидропиридин-3-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 355F в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,49 (уш.с, 1H), 8,44 (с, 1H), 7,69 (дд, 1H), 7,56 (д, 1H), 7,40 (д, 1H), 7,24 (м, 1H), 7,13 (м, 3H), 6,98 (м, 1H), 6,94 (т, 1H), 6,86 (дд, 1H), 6,36 (м, 1H), 6,24 (м, 2H), 3,84 (дд, 2H), 3,47 (т, 2H), 3,26 (м, 4H), 2,99 (уш.с, 4H), 2,80 (м, 3H), 2,44 (м, 2H), 2,21 (м, 4H), 1,86 (м, 1H), 1,73 (м, 2H), 1,62 (м, 2H), 1,26 (м, 5H), 1,17 (м, 2H).
Пример 356
Бензил 4-({[4-({[4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензоил]амино}сульфонил)-2-нитрофенил]амино}метил)пиперидин-1-карбоксилат
Пример 356А
Бензил 4-((2-нитро-4-сульфамоилфениламино)метил)пиперидин-1-карбоксилат
Указанное в заголовке соединение получали, как описано в примере 1F, заменяя (тетрагидро-2Н-пиран-4-ил)метанамин на бензил 4-(аминометил)пиперидин-1-карбоксилат.
Пример 356В
Бензил 4-({[4-({[4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензоил]амино}сульфонил)-2-нитрофенил]амино}метил)пиперидин-1-карбоксилат
Указанное в заголовке соединение получали, как описано в примере 175F, заменяя соединение примера 175Е и соединение примера 1F соединением примера 26С и соединением примера 356А, соответственно.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,63 (т, 1H), 8,58 (д, 1H), 7,79 (дд, 1H), 7,51 (д, 1H), 7,30-7,42 (м, 8H), 7,16 (д, 1H), 7,10 (д, 1H), 7,03 (д, 2H), 6,86 (дд, 1H), 6,65 (дд, 1H), 6,39 (с, 1H), 6,14 (д, 1H), 5,07 (с, 2H), 4,02 (д, 2H), 3,29-3,34 (м, 2H), 3,03 (с, 4H), 2,70-2,88 (м, 4H), 2,08-2,23 (м, 6H), 1,94 (с, 2H), 1,81-1,89 (м, 1H), 1,71 (д, 2H), 1,37 (т, 2H), 1,07-1,16 (м, 2H), 0,92 (с, 6H).
Пример 357
N-{[3-(аминокарбонил)-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Пример 357А
3-Циано-4-((тетрагидро-2Н-пиран-4-ил)метокси)бензолсульфонамид
К (тетрагидро-2Н-пиран-4-ил)метанолу (0,206 г) в тетрагидрофуране (5 мл) прибавляли гидрид натрия (0,284 г) и перемешивали реакционную смесь при комнатной температуре в течение 20 минут. Реакционную смесь охлаждали до 0°С и прибавляли по каплям 3-циано-4-фторбензолсульфонамид (0,355 г) в тетрагидрофуране (2 мл) и оставляли нагреваться реакционную смесь до комнатной температуры. Спустя 3 часа реакционную смесь выливали в воду, подкисляли 1N HCl (рН=1) и экстрагировали хлористым метиленом (2×75 мл). Органические слои объединяли, промывали насыщенным раствором соли (50 мл), сушили над сульфатом магния, фильтровали и концентрировали, получая указанное в заголовке соединение.
Пример 357В
5-Сульфамоил-2-((тетрагидро-2Н-пиран-4-ил)метокси)бензамид
Смесь соединения примера 357А (0,455 г) в этаноле (3 мл) и тетрагидрофуране (1 мл) прибавляли к перекиси водорода (30%, 2 мл), затем добавляли NaOH (1,024 мл) и нагревали при 35°С в течение 3 часов. Смесь выливали в хлористый метилен (50 мл) и 1N водную HCl (25 мл), после чего образовывался осадок. Указанное в заголовке соединение экстрагировали хлористым метиленом (3×50 мл). В органическим слое содержалось твердое вещество, которое выделяли фильтрованием и сушили, получая указанное в заголовке соединение.
Пример 357С
N-{[3-(аминокарбонил)-4-(тетрагидро-2Н-пиран-4-илметокси)фенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 357В в примере 1G.1H ЯМР (300 МГц, CDCl3) δ 10,35 (с, 1H), 8,80 (д, 1H), 8,35 (дд, 2H), 7,91 (д, 1H), 7,44 (д, 2H), 7,39 (д, 1H), 7,34-7,29 (м, 1H), 7,22 (д, 2H), 7,07 (д, 1H), 6,99 (дд, 1H), 6,93-6,87 (м, 2H), 6,58 (с, 1H), 6,48 (дд, 1H), 6,06 (д, 1H), 5,80 (с, 1H), 4,05 (дд, 4H), 3,46 (дд, 2H), 3,03 (с, 4H), 2,73 (с, 2H), 2,19 (м, 7H), 1,96 (с, 2H), 1,74 (м, 2H), 1,43 (м, 4H), 0,93 (с, 6H).
Пример 358
4-(4-{[4’-Хлор-5-(трифторметил)-1,1’-дифенил-2-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 339С и соединение примера 1F соединением примера 173С в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,11 (с, 1H), 8,54 (д, 1H), 8,19 (д, 1H), 7,78 (дд, 1H), 7,71-7,74 (м, 2H), 7,44-7,54 (м, 7H), 7,36-7,38 (м, 2H), 7,04-7,07 (м, 2H), 6,87 (дд, 1H), 6,63 (дд, J=8,7, 1,68 Гц, 1H), 6,36 (с, 1H), 6,16 (д, 1H), 3,93 (дд, 2H), 3,75 (уш.с, 2H), 3,41 (с, 2H), 3,01-3,07 (м, 6H), 2,66-2,68 (м, 2H), 2,30 (с, 4H), 1,77-1,80 (м, 2H), 1,47-1,53 (м, 2H).
Пример 359
4-{4-[(5-Трет-бутил-4’-хлор-1,1’-дифенил-2-ил)метил]пиперазин-1-ил}-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 341С и соединение примера 1F соединением примера 173С в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,11 (с, 1H), 8,53 (т, 1H), 8,19 (д, 1H), 7,76 (дд, 1H), 7,53 (д, 1H), 7,36-7,44 (м, 8H), 7,19 (с, 1H), 7,04-7,07 (м, 2H), 6,81 (дд, 1H), 6,63 (дд, 1H), 6,36 (с, 1H), 6,17 (д, 1H), 3,93 (дд, 2H), 3,74-3,75 (м, 2H), 3,01-3,07 (м, 6H), 2,64-2,67 (м, 2H), 2,29 (с, 4H), 1,99-2,03 (м, 4H), 1,77-1,80 (м, 2H), 1,65-1,67 (м, 2H), 1,28 (с, 9H).
Пример 360
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1-метил-1Н-имидазол-5-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соль (3S,4R)-4-амино-1-бензилпиперидин-3-ола хлористоводородной кислоты на (1-метил-1Н-имидазол-5-ил)метанамин в примере 187В.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,81 (т, 1H), 8,59 (д, 1H), 7,83 (дд, 1H), 7,64 (с, 1H), 7,50 (д, 1H), 7,39-7,42 (м, 2H), 7,33 (д, 2H), 7,16-7,17 (м, 2H), 7,03 (д, 2H), 6,98 (с, 1H), 6,85 (дд, 1H), 6,63 (дд, 1H), 6,40 (с, 1H), 6,13 (д, 1H), 4,66 (д, 2H), 3,64 (с, 3H), 3,02 (с, 4H), 2,72 (с, 2H), 2,12-2,16 (м, 6H), 1,94 (с, 2H), 1,37 (т, 2H), 0,92 (с, 6H).
Пример 361
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(морфолин-4-илсульфонил)фенил]сульфонил}бензамид
Пример 361А
4-(Морфолинсульфонил)бензолсульфонамид
Соединение данного примера получали, заменяя соединение прмиера 66D на 4-(морфолинсульфонил)бензол-1-сульфонилхлорид в примере 66Е.
Пример 361В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(морфолин-4-илсульфонил)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 361А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 10,99 (с, 1H), 7,76 (д, 2H), 7,57 (д, 1H), 7,46 (д, 2H), 7,35 (д, 2H), 7,28 (м, 2H), 7,05 (д, 2H), 6,89 (д, 1H), 6,70 (дд, 1H), 6,57 (дд, 1H), 6,31 (м, 1H), 6,21 (м, 1H), 3,60 (м, 4H), 2,97 (м, 4H), 2,79 (м, 4H), 2,72 (с, 2H), 2,18 (м, 6H), 1,96 (с, 2H), 1,39 (т, 2H), 0,93 (с, 6H).
Пример 362
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотиоморфолин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 362А
4-[(1,1-Диоксидотиоморфолин-4-ил)амино]-3-нитрофенил}сульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на 4-аминотиоморфолин-1,1-диоксид в примере 1F.
Пример 362В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,1-диоксидотиоморфолин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 362А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,19 (с, 1H), 11,17 (с, 1H), 9,64 (с, 1H), 8,55 (д, 1H), 7,86 (м, 1H), 7,78 (м, 1H), 7,51 (д, 1H), 7,40 (м, 2H), 7,33 (д, 2H), 7,16 (с, 1H), 7,03 (д, 2H), 6,86 (дд, 1H), 6,64 (дд, 1H), 6,39 (с, 1H), 6,13 (д, 1H), 3,50 (м, 4H), 3,17 (м, 4H), 3,02 (м, 4H), 2,72 (с, 2H), 2,15 (м, 6H), 1,94 (с, 2H), 1,37 (т, 2H), 0,91 (с, 6H).
Пример 363
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 363А
Трет-бутил цис-4-морфолинциклогексилкарбамат
К смеси морфолина (4,08 мл) и трет-бутил 4-оксоциклогексилкарбамата (10 г), перемешиваемой в течение 24 часов при комнатной температуре в изопропилате титана(IV) (27,5 мл), после чего осторожно добавляли боргидрид натрия (3,55 г) прибавляли метанол (10 мл), после чего осторожно прибавляли боргидрид натрия (3,55 г). Реакционную смесь гасили водой, экстрагировали эфиром (2×100 мл), сушили над сульфатом магния, фильтровали и концентрировали. Сырой продукт очищали методом ФХ (силикагель 200 г, 30%-100% смесь ацетон/гексаны), получая два продукта, указанное в заголовке соединение и транс 4-морфолинциклогексилкарбамат.
Пример 363В
Цис-4-морфолинциклогексанамин бис(2,2,2-трифторацетат)
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 363А в примере 1В.
Пример 363С
4-(Цис-4-морфолинциклогексиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин соединением примера 363В в примере 1F.
Пример 363D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[цис-(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 363С в примере 1G.1H ЯМР (500 МГц, пиридин-d5) δ 12,28 (с, 1H), 9,31 (д, 1H), 8,65 (д, 1H), 8,34 (дд, 1H), 8,17 (д, 1H), 7,53-7,57 (м, 2H), 7,40-7,47 (м, 3H), 7,03-7,12 (м, 3H), 6,89 (д, 1H), 6,72 (дд, 1H), 6,62 (с, 1H), 6,54 (д, 1H), 3,69-3,75 (м, 4H), 3,67 (с, 1H), 3,00-3,07 (м, 4H), 2,75 (с, 2H), 2,41-2,47 (м, 4H), 2,24 (т, 2H), 2,07-2,16 (м, 5H), 1,97 (с, 2H), 1,76-1,85 (м, 2H), 1,54-1,65 (м, 6H), 1,38 (т, 2H), 0,93 (с, 6H).
Пример 364
N-{[5-Бром-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В соединение примера 1F соединением примера 329В в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,65 (д, 1H), 8,33 (с, 1H), 7,58 (д, 1H), 7,35 (д, 2H), 7,24 (т, 1H), 7,07 (м, 3H), 6,89 (м, 1H), 6,67 (дд, 1H), 6,27 (м, 3H), 4,29 (д, 2H), 3,88 (дд, 2H), 3,35 (м, 4H), 3,09 (м, 4H), 2,88 (м, 2H), 2,34 (м, 2H), 2,17 (с, 2H), 2,06 (м, 1H), 1,98 (м, 2H), 1,65 (м, 2H), 1,36 (м, 4H), 0,93 (с, 6H).
Пример 365
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[6-[(тетрагидро-2Н-пиран-4-илметил)амино]-5-(1,3-тиазол-2-ил)пиридин-3-ил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 325В соединением примера 329В в примере 331А.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,22 (с, 1H), 9,76 (т, 1H), 9,12 (м, 1H), 8,50 (д, 1H), 8,26 (д, 1H), 8,02 (д, 1H), 7,87 (д, 1H), 7,58 (д, 1H), 7,38 (д, 2H), 7,23 (т, 1H), 7,15 (д, 1H), 7,08 (д, 2H), 6,96 (м, 1H), 6,74 (дд, 1H), 6,47 (д, 1H), 6,33 (с, 1H), 6,22 (с, 1H), 3,86 (дд, 2H), 3,52 (т, 6H), 3,29 (м, 4H), 2,99 (м, 2H), 2,74 (м, 2H), 2,18 (с, 2H), 2,01 (с, 2H), 1,88 (м, 1H), 1,62 (м, 2H), 1,45 (т, 2H), 1,28 (м, 2H), 0,94 (с, 6H).
Пример 366
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид
Пример 366А
3-Циано-4-((тетрагидро-2Н-пиран-4-ил)метиламино)бензолсульфонамид
3-Циано-4-фторбензолсульфонамид (500 мг), (тетрагидропиран-4-ил)метиламин (288 мг) и N,N-диизопропилэтиламин (1,3 мл) нагревали при 80°С в тетрагидрофуране (15 мл) в течение ночи. Смесь разбавляли этилацетатом, промывали раствором NaHCO3 и насыщенным раствором соли и сушили (Na2SO4), фильтровали и концентрировали. Продукт растирали с этилацетатом.
Пример 366В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В соединение примера 1F соединением примера 366В в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,30 (с, 1H), 11,08 (м, 1H), 7,81 (д, 1H), 7,63 (дд, 1H), 7,55 (д, 1H), 7,32 (м, 3H), 7,22 (д, 1H), 7,17 (м, 1H), 7,02 (м, 3H), 6,79 (д, 1H), 6,71 (дд, 1H), 6,47 (д, 1H), 6,28 (м, 2H), 3,84 (дд, 2H), 3,25 (т, 2H), 3,13 (т, 2H), 3,05 (м, 4H), 2,73 (с, 2H), 2,15 (м, 6H), 1,95 (с, 2H), 1,82 (м, 1H), 1,59 (м, 2H), 1,38 (т, 2H), 1,20 (м, 2H), 0,92 (с, 6H).
Пример 367
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-циано-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 366А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,20 (с, 1H), 10,99 (с, 1H), 7,94 (д, 1H), 7,74 (дд, 1H), 7,53 (д, 1H), 7,44 (д, 1H), 7,41 (м, 1H), 7,33 (д, 2H), 7,21 (м, 2H), 7,04 (д, 2H), 6,89 (дд, 1H), 6,82 (д, 1H), 6,66 (дд, 1H), 6,42 (с, 1H), 3,83 (дд, 2H), 3,25 (т, 2H), 3,13 (т, 2H), 3,03 (м, 4H), 2,72 (с, 2H), 2,14 (м, 6H), 1,94 (с, 2H), 1,83 (м, 1H), 1,57 (м, 2H), 1,37 (м, 2H), 1,21 (м, 2H), 0,92 (с, 6H).
Пример 368
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3,3-диметилбутил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 3,3-диметилбутиламин и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 369
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1S)-1-(гидроксиметил)-3-метилбутил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на L-лейцинол и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 370
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(2R)-тетрагидрофуран-2-илметил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на (R)-(-)тетрагидрофурфуриламин и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 371
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1R)-1-(гидроксиметил)-2-метилпропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на D-валинол и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 372
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-метоксифенил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 4-анизидин и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 373
N-[(4-{[2-(1,3-бензодиоксил-5-ил)этил]амино}-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 2-бензо[1,3]диоксол-5-илэтиламин и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 374
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[3-(2-оксопирролидин-1-ил)пропил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 1-(3-аминопропил)пирролидин-2-он и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 375
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-гидроксифенил)амино]-3-нитрофенил}сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 4-аминофенол и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 376
N-{[4-({2-[4-(аминосульфонил)фенил]этил}амино}-3-нитрофенил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 4-(2-аминоэтил)бензолсульфонамид на 1-(2-метоксиэтил)пиперидин-4-иламин и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 377
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[3-(1Н-имидазол-1-ил)пропил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 1-(3-аминопропил)имидазол и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 378
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(3-нитро-4-{[(1S)-1-фенилэтил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на (S)-(-)-1-фенилэтиламин и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 379
N-({2-хлор-5-фтор-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Пример 379А
2-Хлор-5-фтор-4-((тетрагидро-2Н-пиран-4-ил)метиламино)бензолсульфонамид
2-Хлор-4,5-дифторбензолсульфонамид (0,683 г), (тетрагидро-2Н-пиран-4-ил)метанамин (0,346 г), N,N-диизопропилэтиламин (0,681 мл) и диоксан (10 мл) нагревали при 65°С в течение 2,5 дней. Добавляли еще (тетрагидро-2Н-пиран-4-ил)метанамин (0,346 г) и N,N-диизопропилэтиламин (0,681 мл) и продолжали наргевание при 70°С в течение 1,5 дней. Реакционную смесь концентрировали и хроматографировали на колонке с силикагелем с использованием 0-3% метанола в хлористом метилене в качестве элюента. Полученное твердое вещество растирали с хлористым метиленом, получая указанное в заголовке соединение.
Пример 379В
N-({2-хлор-5-фтор-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 379А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ м.д. 11,23 (с, 1H), 11,02 (с, 1H), 7,61 (м, 2H), 7,44 (м, 2H), 7,33 (д, 2H), 7,30 (м, 1H), 7,03 (д, 2H), 6,95 (м, 1H), 6,88 (м, 2H), 6,67 (дд, 1H), 6,44 (м, 1H), 6,09 (д, 1H), 3,82 (дд, 2H), 3,22 (м, 2H), 3,03 (м, 6H), 2,72 (м, 2H), 2,14 (м, 6H), 1,94 (м, 2H), 1,81 (м, 1H), 1,61 (м, 2H), 1,37 (т, 2H), 1,18 (м, 2H), 0,91 (с, 6H).
Пример 380
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид
Пример 380А
4-(2-(2-Метоксиэтокси)этилтио)-3-нитробензолсульфонамид
В круглодонную колбу на 100 мл помещали гидрид натрия (0,6 г) в тетрагидрофуране (10 мл), получая суспензию. Медленно прибавляли 2-(2-метоксиэтокси)этантиол (1 г). После перемешивания смеси в течение 30 минут медленно прибавляли 4-фтор-3-нитробензолсульфонамид (1,616 г) в 10 мл тетрагидрофурана. После перемешивания смеси в течение ночи медленно прибавляли воду и использовали этилацетат (20 мл × 3) для экстрагирования продукта. Объединенные органические слои сушили над Na2SO4. После фильтрования и концентрирования смеси сырой продукт вносили на колонку с силикагелем и очищали, элюируя 0-10% метанола в хлористом метилене.
Пример 380В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 380А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 10,99 (с, 1H), 8,42 (с, 1H), 7,75 (д, 1H), 7,56 (д, 1H), 7,34 (м, 5H), 7,05 (д, 2H), 6,90 (д, 1H), 6,69 (дд, 1H), 6,55 (дд, 1H), 6,30 (м, 1H), 6,17 (д, 1H), 3,67 (т, 2H), 3,54 (м, 2H), 3,43 (м, 2H), 3,21 (м, 5H), 2,95 (м, 4H), 2,71 (с, 2H), 2,17 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 381
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-[(4-{[2-(2-метоксиэтокси)этил]тио}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 380А и соединение примера 26С соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,06 (с, 1H), 8,37 (д, 1H), 7,80 (дд, 1H), 7,61 (д, 1H), 7,45 (д, 1H), 7,34 (д, 2H), 7,18 (т, 1H), 7,04 (м, 3H), 6,87 (т, 1H), 6,60 (дд, 1H), 6,22 (м, 3H), 3,68 (т, 2H), 3,55 (м, 2H), 3,43 (м, 2H), 3,22 (м, 5H), 2,94 (м, 4H), 2,72 (с, 2H), 2,16 (м, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 382
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-{[4-(метилсульфонил)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F на 4-(метиламино)-3-нитробензолсульфонамид в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,05 (м, 4H), 7,51 (д, 1H), 7,38 (м, 4H), 7,14 (м, 1H), 7,04 (д, 2H), 6,85 (д, 1H), 6,64 (дд, 1H), 6,40 (м, 1H), 6,17 (д, 1H), 3,27 (с, 3H), 3,05 (м, 4H), 2,79 (м, 2H), 2,21 (м, 6H), 1,96 (с, 2H), 1,39 (т, 2H), 0,92 (с, 6H).
Пример 383
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)-N-{[4-(метилсульфонил)фенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 1F на 4-(метиламино)-3-нитробензолсульфонамид и соединение примера 26С соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,26 (с, 1H), 7,96 (м, 4H), 7,54 (д, 1H), 7,35 (д, 2H), 7,30 (м, 1H), 7,18 (д, 1H), 7,05 (д, 2H), 6,97 (т, 1H), 6,70 (дд, 1H), 6,37 (д, 1H), 6,30 (м, 2H), 3,25 (с, 3H), 3,08 (м, 4H), 2,84 (м, 2H), 2,26 (м, 6H), 1,97 (с, 2H), 1,40 (т, 2H), 0,93 (с, 6H).
Пример 384
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-диметилтетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 384А
Указанное в заголовке соединение получали, как описано в прмиере 297А, заменяя (1,4-диоксан-2-ил)метанол на (2,2-диметилтетрагидро-2Н-пиран-4-ил)метанол.
Пример 384В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(2,2-диметилтетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Указанное в заголовке соединение получали, как описано в прмиере 175F, заменяя соединение примера 175Е и соединение примера 1F на соединение примера 26С и соединение примера 384А, соответственно.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 2H), 8,38 (д, 1H), 8,05 (дд, 1H), 7,51 (д, 1H), 7,31-7,43 (м, 5H), 7,15 (д, 1H), 7,04 (д, 2H), 6,85 (дд, 1H), 6,65 (дд, 1H), 6,40 (с, 1H), 6,15 (д, 1H), 3,98-4,07 (м, 2H), 3,54-3,67 (м, 2H), 3,05 (с, 4H), 2,78 (с, 2H), 2,09-2,31 (м, 7H), 1,95 (с, 2H), 1,56-1,68 (м, 2H), 1,38 (т, 2H), 1,08-1,27 (м, 8H), 0,92 (с, 6H).
Пример 385
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Пример 385А
5-Бром-6-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол на соединение примера 306С в примере 329В.
Пример 385В
5-Циано-6-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 329В соединением примера 385А в примере 333А.
Пример 385С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 385В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,10 (с, 1H), 8,79 (с, 1H), 8,59 (с, 1H), 7,54 (д, 1H), 7,34-7,38 (м, 4H), 7,04-7,06 (м, 3H), 6,79 (дд, 1H), 6,62 (дд, 1H), 6,35 (с, 1H), 6,17 (д, 1H), 4,28 (д, 2H), 3,76-3,79 (м, 2H), 3,56-3,62 (м, 2H), 3,07 (уш.с, 4H), 2,12-2,17 (м, 4H), 1,96 (с, 2H), 1,80-1,84 (м, 2H), 1,40 (т, 2H), 0,94 (с, 6H).
Пример 386
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26C соединением примера 55В и соединение примера 1F соединением примера 335А в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,20 (с, 1H), 8,67 (д, 1H), 8,35 (д, 1H), 7,57 (д, 1H), 7,36 (д, 2H), 7,26 (т, 1H), 7,11 (д, 1H), 7,05 (д, 2H), 6,90 (т, 1H), 6,70 (дд, 1H), 6,31 (д, 1H), 6,30 (д, 1H), 6,27 (с, 1H), 4,30 (д, 2H), 3,88 (дд, 2H), 3,35 (м, 2H), 3,12 (уш.с, 4H), 2,96 (уш.с, 2H), 2,40 (уш.с, 4H), 2,16 (уш.м, 2H), 2,06 (м, 1H), 1,98 (с, 2H), 1,65 (д, 2H), 1,41 (т, 2H), 1,36 (м, 2H), 0,93 (с, 6H).
Пример 387
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид
Пример 387А
5,6-Дихлорпиридин-3-сульфонамид
Соединение данного примера получали, заменяя 5-бром-6-хлорпиридин-3-сульфонилхлорид на 5,6-дихлорпиридин-3-сульфонилхлорид в примере 329А.
Пример 387В
5-Хлор-6-((тетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 329А соединением примера 387А в примере 329В.
Пример 387С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26C соединением примера 55В и соединение примера 1F соединением примера 387В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,24 (с, 1H), 8,45 (д, 1H), 8,05 (д, 1H), 7,56 (д, 1H), 7,36 (д, 2H), 7,28 (т, 1H), 7,15 (д, 1H), 7,05 (д, 2H), 6,95 (т, 1H), 6,71 (дд, 1H), 6,39 (д, 1H), 6,30 (д, 1H), 6,27 (с, 1H), 4,26 (д, 2H), 3,88 (дд, 2H), 3,35 (м, 2H), 3,09 (уш.с, 4H), 2,85 (уш.с, 2H), 2,30 (уш.с, 4H), 2,15 (уш.м, 2H), 2,07 (м, 1H), 1,96 (с, 2H), 1,65 (д, 2H), 1,41 (т, 2H), 1,35 (м, 2H), 0,93 (с, 6H).
Пример 388
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Пример 388А
5-Бром-6-(2-морфолинэтокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол на 2-морфолинэтанол в примере 329В.
Пример 388В
5-Циано-6-(2-морфолинэтокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 329В соединением примера 388А в примере 335А.
Пример 388С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 388В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,09 (с, 1H), 8,77 (с, 1H), 8,55 (с, 1H), 7,55 (д, 1H), 7,34-7,36 (м, 4H), 7,04-7,06 (м, 3H), 6,78 (дд, 1H), 6,63 (д, 1H), 6,35 (с, 1H), 6,16 (с, 1H), 4,61 (т, 2H), 3,58 (м, 4H), 3,05 (уш.с, 4H), 2,89 (уш.с, 4H), 2,65 (уш.с, 4H), 2,32-2 (уш.с, 2H), 2,15 (уш.с, 2H), 1,96 (с, 2H), 1,39 (т, 2H), 0,92 (с, 6H).
Пример 389
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)окси]фенил}сульфонил)бензамид
Пример 389А
1-(Тетрагидро-2Н-пиран-4-ил)пиперидин-4-ол
Пиперидин-4-ол (7,8 г) и дигидро-2Н-пиран-4(3Н)-он (5,0 г) растворяли в изопропилате титана(IV) (30 мл) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Добавляли метанол (40 мл) и охлаждали реакционную смесь до 0°С. Прибавляли NaBH4 (3,8 г) в виде нескольких порций в течение одного часа. Через два часа добавляли 1N водный NaOH, после чего добавляли этилацетат. После фильтрования через целит слои разделяли, водный слой экстрагировали этилацетатом, а объединенные органические слои сушили над Na2SO4. Сырое вещество очищали колоночной хроматографией с использованием CH2Cl2 с 5-10% 7N NH3 в метаноле.
Пример 389В
3-Нитро-4-(1-тетрагидро-2Н-пиран-4-ил)пиперидин-4-илокси)бензолсульфонамид
Соединение примера 389А (370 мг) растворяли в тетрагидрофуране (10 мл) и прибавляли 95% NaH (200 мг). После перемешивания в течение 10 минут добавляли 4-фтор-3-нитробензолсульфонамид (420 мг) и перемешивали реакционную смесь при комнатной температуре в теченире ночи. Реакционную смесь очищали колоночной хроматографией с использованием CH2Cl2 с 6-10% 7N NH3 в метаноле, с последующим суспендированием в диэтиловом эфире и отфильтровыванием твердого продукта.
Пример 389С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)окси]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 389В в примере 1G, за исключением того, что для хроматографии использовали 5-7% метанола в CH2Cl2.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,07 (уш.с, 1H), 8,27 (с, 1H), 7,92 (д, 1H), 7,55 (д, 1H), 7,33 (м, 5H), 7,04 (м, 3H), 6,77 (дд, 1H), 6,58 (д, 1H), 6,35 (с, 1H), 6,14 (с, 1H), 4,85 (с, 1H), 3,93 (дд, 2H), 3,27 (м, 4H), 2,98 (уш.м, 7H), 2,72 (с, 2H), 2,16 (м, 6H), 2,04 (м, 2H), 1,95 (с, 2H), 1,84 (м, 4H), 1,55 (м, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 390
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илбут-2-инил)окси]-3-нитрофенил}сульфонил)бензамид
Пример 390А
4-Морфолинбут-2-ин-1-ол
К смеси морфолина (4,36 г) в толуоле (15 мл) прибавляли 4-хлорбут-2-ин-1-ол (2,09 г) в толуоле (5 мл). Смесь перемешивали при 85°С в течение трех часов. После охлаждения твердое вещество отфильтровывали. Фильтрат подвергали перегонке в вакууме, получая указанное в заголовке соединение.
Пример 390В
4-(4-Морфолинбут-2-инилокси)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол соединение примера 390А в примере 279А.
Пример 390С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-({4-[(4-морфолин-4-илбут-2-инил)окси]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 390В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,40 (д, 1H), 8,11 (дд, 1H), 7,49-7,53 (м, 2H), 7,39-7,42 (м, 4H), 7,34 (д, 2H), 7,17 (д, 1H), 7,04 (д, J=8,54 Гц, 2H), 6,85 (дд, 1H), 6,64 (дд, 1H), 6,40 (с, 1H), 6,14 (д, 1H), 5,15 (с, 2H), 3,52-3,54 (м, 4H), 3,04 (уш.с, 4H), 2,78 (уш.с, 2H), 2,37-2,39 (м, 4H), 2,12-2,20 (уш.с, 6H), 1,95 (с, 2H), 1,38 (т, 2H), 0,92 (с, 6H).
Пример 391
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-этинил-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид
Пример 391А
6-((Тетрагидро-2Н-пиран-4-ил)метокси)-5-((триизопропилсилил)этинил)пиридин-3-сульфонамид
Соединение примера 329В (0,176 г), хлорид бис(трифенилфосфин)палладия(II) (0,176 г), йодиди меди(I) (0,010 г), диметилацетамид (2,5 мл) и триэтиламин (0,105 мл) смешивали, продували азотом и перемешивали в течение 2 минут. Добавляли (триизопропил)ацетилен (0,135 мл) и снова продували реакционную смесь азотом, нагревали до 60°С в течение ночи, разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле с использованием 10-30% этилацетата в гексанах в качестве элюента, получая указанное в заголовке соединение.
Пример 391В
5-Этинил-6-((тетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонамид
Соединение примера 391А (0,205 г) в тетрагидрофуране (3 мл) при температуре окружающей среды обрабатывали фторидом тетрабутиламмония (1М в тетрагидрофуране) (0,906 мл) и перемешивали при температуре окружающей среды в течение 4 часов. Прибавляли еще фторида тетрабутиламмония (1М в тетрагидрофуране) (1,8 мл) и перемешивали смесь при 40°С в течение 45 минут. Прибавляли твердый фторид тетрабутиламмония (0,253 г) и продолжали нагревание в течение 30 минут. Реакционную смесь концентрировали и хроматографировали на силикагеле с использованием 0-2% метанола в хлористом метилене в качестве элюента, получая указанное в заголовке соединение.
Пример 391С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-этинил-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В и соединение примера 1F соединением примера 391В в примере 177.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ м.д. 11,23 (с, 1H), 8,50 (д, 1H), 8,09 (д, 1H), 7,56 (д, 1H), 7,34 (м, 2H), 7,28 (м, 1H), 7,18 (д, 1H), 7,04 (м, 2H), 6,98 (т, 1H), 6,70 (дд, 1H), 6,44 (д, 1H), 6,27 (м, 2H), 4,55 (с, 1H), 4,25 (д, 2H), 3,87 (дд, 2H), 3,34 (м, 2H), 3,06 (м, 4H), 2,81 (м, 1H), 2,20 (м, 6H), 2,04 (м, 1H), 1,96 (м, 2H), 1,65 (дд, 2H), 1,35 (м, 5H), 0,92 (м, 6H).
Пример 392
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-морфолин-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В и соединение примера 1F соединением примера 388В в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,15 (с, 1H), 10,99 (с, 1H), 8,64 (д, 1H), 8,33 (д, 1H), 7,58 (д, 1H), 7,35 (д, 2H), 7,24 (м, 1H), 7,07 (м, 3H), 6,89 (м, 1H), 6,66 (дд, 1H), 6,26 (м, 3H), 4,59 (т, 2H), 3,58 (м, 4H), 3,05 (м, 4H), 2,87 (м, 4H), 2,62 (м, 4H), 2,24 (м, 6H), 1,98 (м, 2H), 1,40 (т, 2H), 0,93 (с, 6H).
Пример 393
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 55В и соединение примера 1F соединением примера 385В в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,17 (с, 1H), 8,66 (с, 1H), 8,36 (с, 1H), 7,58 (д, 1H), 7,36 (д, 2H), 7,25 (с, 1H), 7,07 (м, 3H), 6,89 (м, 1H), 6,68 (м, 1H), 6,27 (м, 3H), 4,60 (с, 1H), 4,54 (с, 1H), 3,78 (м, 2H), 3,60 (м, 2H), 3,33 (м, 2H), 3,09 (м, 4H), 2,92 (м, 2H), 2,36 (м, 2H), 2,16 (м, 2H), 1,97 (с, 2H), 1,87 (м, 4H), 1,40 (т, 2H), 0,93 (с, 6H).
Пример 394
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(3-гидрокси-4-метоксифенил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индол-5-илокси)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 5-амино-2-метоксифенол и 4-хлор-3-нитробензолсульфонамид на соединение примера 187А в примере 189А.
Пример 395
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(2,3-дигидро-1Н-индол-4-илокси)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение примера 103 (676 мг) и NaCNBH3 (49 мг) соединяли в уксусной кислоте (10 мл) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и экстрагировали смесью 95/5 CH2Cl2/метанол. Органический слой концентрировали, а сырое вещество очищали препаративной ВЭЖХ с использованием колонки С18, 250×50 мм, 10 мкм, и элюированием с градиентом 20-100% CH3CN vs. 0,1% трифторуксусной кислоты в воде, получая указанное в заголовке соединение в виде бис-трифторацетатной соли.lH ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,57 (уш.с, 1H), 9,70, 9,50 (оба очень ш.с, всего 2H), 8,57 (д, 1H), 8,20 (уш.д, 1H), 7,85 (дд, 1H), 7,50 (д, 1H), 7,40 (д, 2H), 7,26 (д, 1H), 7,10 (д, 2H), 6,82 (дд, 1H), 6,75 (дд, 1H), 6,40 (д, 1H), 6,27 (д, 1H), 5,94 (д, 1H), 4,00, 3,70 (оба очень ш.м, всего 8H), 3,55 (очень ш.м, 3H), 3,42 (т, 2H), 3,37 (очень ш.м, 1H), 3,10 (уш.м, 2H), 2,80 (м, 6H), 2,20 (уш.м, 4H), 2,03 (с, 2H), 1,82 (уш.м, 2H), 1,46 (т, 2H), 0,96 (с, 6H).
Пример 396
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(пиридин-3-иламино)бензамид
Пример 396А
Метил 4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-(пиридин-3-иламино)бензоат
Раствор соединения примера 18Е (500 мг), карбоната цезия (429 мг), ацетата палладия(II) (21 мг), рац-2,2’-бис(дифенилфосфин)-1,1’-динафтила (58,5 мг) и толуола (6,4 мл) дегазировали N2. Смесь перемешивали при 115°С в течение 5 минут. После охлаждения до комнатной температуры добавляли пиридин-3-амин (106 мг) и снова дегазировали реакционную смесь N2 и перемешивали при 115°С в течение 45 минут. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом и промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Сырой продукт очищали флэш-хроматографией на силикагеле, элюируя смесью CH2Cl2/1% метанола, получая указанное в заголовке соединение.
Пример 396В
4-(4-((2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-(пиридин-3-иламино)бензойная кислота, 2 хлористоводородная кислота
Соединение данного примера получали, заменяя соединение примера 224С соединением примера 396А в примере 224D.
Пример 396С
4-(4-((2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)- N-(4-(1-метилпиперидин-4-иламино)-3-нитрофенилсульфонил)-2-(пиридин-3-иламино)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 396В и соединение примера 1F соединением примера 21А в примере 177.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,32-11,40 (уш.с, 1H), 9,21-9,39 (уш.с, 1H), 8,51 (д, 1H), 8,33 (д, 1H), 8,09 (дд, 1H), 7,98-8,07 (м, 1H), 7,94 (дд, 1H), 7,81 (д, 1H), 7,52-7,58 (м, 1H), 7,36 (д, 2H), 7,24-7,30 (м, 1H), 7,15 (д, 1H), 7,08 (д, 2H), 6,53 (д, 1H), 6,33 (дд, 1H), 3,81-3,96 (уш.с, 2H), 3,02-3,12 (уш.с, 6H), 2,67-2,80 (м, 5H), 2,07-2,32 (м, 8H), 1,98 (с, 3H), 1,70-1,85 (уш.с, 1H), 1,41 (т, 3H), 0,95 (с, 6H).
Пример 397
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)-2-(пиридин-3-иламино)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 396В и соединение примера 1F соединением примера 173С в примере 177.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 9,10-9,33 (уш.с, 1H), 8,53 (д, 1H), 8,36 (д, 1H), 8,12 (дд, 1H), 8,00-8,07 (м, 1H), 7,96 (дд, 1H), 7,80 (д, 1H), 7,53-7,59 (м, 1H), 7,38 (д, 2H), 7,25-7,31 (м, 1H), 7,20 (д, 1H), 7,09 (д, 2H), 6,53 (с, 1H), 6,36 (м, 1H), 4,28-4,75 (уш.с, 1H), 3,90-4,09 (м, 8H), 3,51-3,61 (м, 2H), 3,35 (м, 8H), 3,01-3,18 (уш.с, 4H), 2,15-2,26 (м, 1H), 1,88-2,09 (м, 5H), 1,56-1,86 (м, 4H), 1,44 (т, 2H), 0,96 (с, 6H).
Пример 398
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)-2-(пиридин-3-илокси)бензамид
Пример 398А
Метиловый эфир 4-фтор-2-(пиридин-3-илокси)бензойной кислоты
Соединение данного примера получали, заменяя этил 2,4-дифторбензоат на метил 2,4-дифторбензоат и 5-гидроксииндазол на 3-гидроксипиридин в примере 20А.
Пример 398В
Метиловый эфир 4-{4-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-(пиридин-3-илокси)бензойной кислоты
Соединение данного примера получали, заменяя соединение примера 20А соединением примера 398А в примере 20D.
Пример 398С
4-{4-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-(пиридин-3-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 398В в примере 1Е.
Пример 398D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(пиридин-3-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 398С и соединение примера 1F соединением примера 173С в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,36 (д, 1H), 8,11 (т, 1H), 8,08 (т, 2H), 7,70 (дд, 1H), 7,60 (д, 1H), 7,37 (д, 2H), 7,15 (дд, 1H), 7,10-7,03 (м, 3H), 7,00 (дд, 1H), 6,73 (дд, 1H), 6,43 (д, 1H), 3,99-3,93 (м, 3H), 3,86 (м, 1H), 3,13 (м, 6H), 2,78 (уш.с, 2H), 2,30-2,05 (м, 10H), 1,98 (уш.с, 2H), 1,92-1,67 (м, 6H), 1,57 (м, 2H), 1,41 (т, 2H), 0,94 (с, 6H).
Пример 399
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1,2,3,4-тетрагидроизохинолин-5-илокси)бензамид
Пример 399А
Трет-бутил 5-гидрокси-3,4-дигидроизохинолин-2(1Н)-карбоксилат
Смесь соли 1,2,3,4-тетрагидроизохинолин-5-ола хлористоводородной кислоты (1,0 г), ди-трет-бутилдикарбоната (1,27 г) и 1,0N NaOH (14,5 мл) в диоксане (20 мл) перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь распределяли между водой и этилацетатом. Водный слой нейтрализовывали 5% HCl. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией на силикагеле, получая указанное в заголовке соединение.
Пример 399В
Трет-бутил 5-(2-этоксикарбонил)-5-фторфенокси)-3,4-дигидроизохинолин-2(1Н)-карбоксилат
Соединение данного примера получали, заменяя 5-гидроксииндазол соединением примера 399А в примере 20А.
Пример 399С
Трет-бутил 5-(5-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-(этоксикарбонил)фенокси)-3,4-дигидроизохинолин-2(1Н)-карбоксилат
Соединение данного примера получали, заменяя соединение примера 20А соединением примера 399В в примере 20D.
Пример 399D
2-(2-(Трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 399С в примере 1Е.
Пример 399Е
Ангидрид 2-(2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-5-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойной 3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)бензолсульфокислоты
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 399D в примере 177.
Пример 399F
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-(1,2,3,4-тетрагидроизохинолин-5-илокси)бензамид
Смесь соединения примера 399Е (0,058 г) и трифторуксусной кислоты (1 мл) в хлористом метилене (10 мл) перемешивали в течение 2 часов. Растворитель удаляли, а остаток растворяли в этилацетате. Затем его промывали насыщенным NaHCO3, насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали, получая указанное в заголовке соединение.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 8,36 (т, 1H), 8,27 (д, 1H), 7,65 (д, 1H), 7,36 (д, 2H), 7,07 (д, 2H) 6,93-6,97 (м, 2H), 6,73 (д 1H), 6,69 (дд, 1H), 6,33(д, 1H), 6,26 (д, 1H), 4,19 (с, 2H), 3,85 (дд, 2H), 3,05-3,09 (м, 6H), 2,77 (с, 2H), 2,17-2,24 (м, 6H), 1,98-1,99 (м, 2H), 1,60-1,63 (м, 2H), 1,41 (т, 2H), 0,94 (с, 6H).
Пример 400
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 400А
Трет-бутиловый эфир 4-гидроксииндазол-1-карбоновой кислоты и трет-бутиловый эфир 4-гидроксииндазол-2-карбоновой кислоты
4-Гидроксииндазол (3,94 г) прибавляли к тетрагидрофурану (250 мл) и охлаждали до 0°С на бане со льдом. Добавляли гидрид натрия (60% дисперсию с минеральном масле, 1,23 г) и перемешивали смесь при 0°С в течение 5 минут. Смесь оставляли нагреваться до комнатной температуры и перемешивали еще в течение 20 минут. Смесь снова охлаждали до 0°С на бане со льдом и прибавляли трет-бутилдиметилхлорсилан (4,65 г). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 16 часов. Объем растворителя уменьшали в вакууме, остаток фильтровали в вакууме через слой силикагеля и промывали этилацетатом, и удаляли растворитель в вакууме. К остатку прибавляли ацетонитрил (200 мл), ди-трет-бутилдикарбонат (7,06 г) и 4-(диметиламино)пиридин (0,359 г). Смесь перемешивали при комнатной температуре в течение трех часов и удаляли растворитель в вакууме. К остатку прибавляли тетрагидрофуран (200 мл) и фторид тетрабутиламмония (1М в тетрагидрофуране, 82 мл). Смесь перемешивали при комнатной температуре в течение четырех дней, растворитель удаляли в вакууме, а остаток растворяли в этилацетате. Смесь промывали насыщенным водным хлористым аммонием, промывали насыщенным водным раствором соли и сушили над безводным сульфатом натрия. Смесь фильтровали в вакууме через силикагель и удаляли растворитель в вакууме, получая смесь двух продуктов, которые использовали на следующей стадии без дополнительной очистки.
Пример 400В
Метиловый эфир 4-фтор-2-(1Н-индазол-4-илокси)бензойной кислоты
Соединение примера 400А (5,56 г) прибавляли к диглиму (200 мл) и добавляли трет-бутилат калия (1М в тетрагидрофуране, 30,8 мл). Смесь перемешивали при комнатной температуре в течение 15 минут, добавляли метил 2,4-дифторбензоат и нагревали смесь при 115°С в течение 16 часов. Смесь охлаждали, растворитель удаляли в вакууме, остаток растворяли в хлористом метилене (100 мл) и прибавляли трифторуксусную кислоту (22,6 мл). Смесь перемешивали при комнатной температуре в течение 16 часов, растворитель удаляли в вакууме, остаток растворяли в этилацетате и промывали насыщенной водной смесью гидрокарбоната натрия и сушили органический слой над безводным сульфатом натрия. Вещество очищали колоночной флэш-хроматографией на силикагеле с использованием 30% этилацетата (в гексане) с повышением до 40% этилацетата (в гексане).
Пример 400С
Метиловый эфир 2-(1Н-индазол-4-илокси)-4-пиперазин-1-илбензойной кислоты
Соединение примера 400В (2,00 г) и пиперазин (2,71 г) прибавляли к диметилсульфоксиду (60 мл) и нагревали при 100°С в течение 1 часа. Смесь охлаждали, прибавляли к хлористому метилену, дважды промывали водой, промывали насыщенной водной смесью гидрокарбоната натрия и сушили над безводным сульфатом натрия. После фильтрования растворитель удаляли в вакууме.
Пример 400D
Метиловый эфир 4-{4-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-(1Н-индазол-4-илокси)бензойной кислоты
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид соединением примера 218А и трет-бутил пиперазин-1-карбоксилат соединением примера 400С в примере 1А.
Пример 400Е
4-{4-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-(1Н-индазол-4-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 400D в примере 1Е.
Пример 400F
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 400Е в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,09 (с, 1H), 8,56 (т, 1H), 8,38 (д, 1H), 7,80 (с, 1H), 7,56 (дд, 1H), 7,53 (д, 1H), 7,36 (д, 2H), 7,16-7,05 (м, 4H), 6,99 (д, 1H), 6,80 (дд, 1H), 6,52 (д, 1H), 6,19 (дд, 1H), 3,87 (дд, 2H), 3,25-3,12 (м, 6H), 2,78 (м, 2H), 2,30-2,16 (м, 6H), 1,97 (уш.с, 2H), 1,90 (м, 1H), 1,63 (м, 2H), 1,53 (м, 1H), 1,40 (т, 2H), 1,29 (м, 3H), 0,94 (с, 6H).
Пример 401
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Пример 401А
N-[(4-хлор-3-нитрофенил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 400Е и соединение примера 1F 4-хлор-3-нитробензолсульфонамидом в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,04 (с, 1H), 8,17 (уш.с, 1H), 7,75 (с, 1H), 7,73 (д, 1H), 7,66-7,61 (м, 2H), 7,38 (д, 2H), 7,11-7,01 (м, 4H), 6,79 (дд, 1H), 6,54 (д, 1H), 6,10 (дд, 1H), 3,38-3,05 (м, 8H), 2,73 (уш.с, 2H), 2,19 (м, 2H), 2,00 (уш.с, 2H), 1,44 (т, 2H), 0,95 (с, 6H).
Пример 401В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин соединением примера 178В и 4-хлор-3-нитробензолсульфонамид соединением примера 401А в примере 189А.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,05 (уш.с, 1H), 8,35 (д, 1H), 8,13 (д, 1H), 7,78 (с, 1H), 7,61-7,52 (м, 2H), 7,35 (д, 2H), 7,11-7,03 (м, 4H), 6,98 (д, 1H), 6,77 (дд, 1H), 6,48 (д, 1H), 6,18 (м, 1H), 3,69-3,52 (м, 4H), 3,12 (м, 6H), 2,76 (уш.с, 2H), 2,67 (м, 4H), 2,28-2,16 (м, 6H), 2,09-2,01 (м, 2H), 1,97 (уш.с, 2H), 1,95 (м, 2H), 1,50-1,38 (м, 6H), 0,93 (с, 6H).
Пример 402
Транс-4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин транс-4-морфолин-4-илциклогексиламином и 4-хлор-3-нитробензолсульфонамид соединением примера 401А в примере 189А.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,02 (уш.с, 1H), 8,35 (д, 1H), 8,12 (м, 1H), 7,75 (с, 1H), 7,65-7,55 (м, 2H), 7,35 (д, 2H), 7,10-7,03 (м, 4H), 6,97 (м, 1H), 6,76 (дд, 1H), 6,44 (м, 1H), 6,17 (т, 1H), 3,95 (м, 2H), 3,77 (м, 1H), 3,62 (м, 1H), 3,10 (м, 6H), 2,75 (уш.с, 2H), 2,28-2,14 (м, 8H), 2,06 (м, 2H), 1,97 (уш.с, 2H), 1,85 (м, 2H), 1,71 (м, 2H), 1,55 (м, 4H), 1,40 (т, 2H), 0,93 (с, 6H).
Пример 403
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Пример 403А
Метил 4-фтор-2-(3-фтор-2-нитрофенокси)бензоат
К раствору метил 4-фтор-2-гидроксибензоата (3,0 г) в тетрагидрофуране (65 мл) порциями прибавляли трет-бутилат калия (1,979 г). Полученный раствор перемешивали при температуре окружающей среды в течение 30 минут и прибавляли по каплям раствор 1,3-дифтор-2-нитробензола (2,338 г) в тетрагидрофуране (15 мл). Через 1 час реакционную смесь нагревали при кипении в течение 18 часов. Реакционную смесь гасили водой (10 мл), разбавляли насыщенным раствором соли (75 мл) и экстрагировали хлористым метиленом (2×75 мл). Сырой продукт выделяли концентрированием и очищали на силикагеле, элюируя с постепенным градиентом 10, 20, 50% этилацетата в гексане, получая указанное в заголовке соединение.
Пример 403В
Метил 2-(3-бис(4-метоксифенил)метиламино)-2-нитрофенокси)-4-фторбензоат
К раствору соединения примера 403А (3,82 г) и бис(4-метоксифенил)метанамина (4,51 г) в N-метил-2-пирролидиноне (65 мл) прибавляли N-этил-N-изопропилпропан-2-амин (4,30 мл) и нагревали смесь при 100°С в течение 24 часов. Сырой продукт, выделенный концентрированием, очищали на силикагеле и элюировали с постепенным градиентом 10, 25 и 65% этилацетата в гексане, получая указанное в заголовке соединение.
Пример 403С
Метил 2-(2-амино-3-(бис(4-метоксифенил)метиламино)фенокси)-4-фторбензоат
К раствору соединения примера 403В (2,76 г) в тетрагидрофуране (125 мл) в сосуде для работы под давлением из нержавеющей стали прибавляли никелевый катализатор (2,76 г). Смесь перемешивали в течение 1 часа в атмосфере водорода при 30 фунтах/кв.дюйм при температуре окружающей среды. Смесь фильтровали через нейлоновую мембрану, чтобы удалить катализатор, и концентрировали, получая продукт.
Пример 403D
Метил 2-(1-(бис(4-метоксифенил)метиламино)-1Н-бензо[d]имидазол-4-илокси)-4-фторбензоат
К раствору соединения примера 403С (1,25 г) в триэтил-орто-формиате (30 мл) прибавляли концентрированную хлористоводородную кислоту (0,75 мл). Смесь перемешивали в течение 18 часов, гасили медленным добавлением 50% насыщенного водного раствора карбоната натрия (100 мл) и экстрагировали этилацетатом (2×100 мл). Сырой продукт выделяли концентрированием и очищали на силикагеле и элюировали с постепенным градиентом 25, 50 и 70% этилацетата в гексане, получая указанное в заголовке соединение.
Пример 403Е
Метил 2-(1-(бис(4-метоксифенил)метил)-1Н-бензо[d]имидазол-4-илокси)-4-(пиперазин-1-ил)бензоат
Раствор соединения примера 403D (500 мг) и пиперазина (420 мг) в диметилсульфоксиде (9 мл) нагревали при 100°С в течение 3 часов. Сырой продукт выделяли концентрированием и после водной обработки очищали на силикагеле и элюировали с постепенным градиентом 5% и 10% метанола в хлористом метилене, получая указанное в заголовке соединение.
Пример 403F
Метил 2-(1-(бис(4-метоксифенил)метил)-1Н-бензо[d]имидазол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензоат
К раствору соединения примера 403Е (430 мг) и соединения примера 218А (259 мг) в хлористом метилене (13 мл) прибавляли порциями триацетоксиборгидрид натрия (323 мг). После перемешивания в течение 42 часов реакционную смесь медленно гасили насыщенным водным раствором гидрокарбоната натрия (80 мл) и экстрагировали метиленхлоридом (2×70 мл). Сырой продукт выделяли концентрированием и очищали на силикагеле и элюировали с постепенным градиентом 0, 2% и 10% метанола в метиленхлориде, получая указанное в заголовке соединение.
Пример 403G
2-(1-(Бис(4-метоксифенил)метил)-1Н-бензо[d]имидазол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)бензойная кислота
К раствору соединения примера 403F (545 мг) в смеси метанола (7,50 мл) и тетрагидрофурана (7,50 мл) прибавляли раствор гидроксида натрия (269 мг) в воде (3,0 мл). Смесь нагревали при 50°С в течение 18 часов, а затем концентрировали. Остаток смешивали с водой (100 мл) и доводили рН приблизительно до 7 1М водной хлористоводородной кислотой. Смесь экстрагировали 10% метанола в метиленхлориде (10×50 мл) и концентрировали объединенные органические слои, получая указанное в заголовке соединение.
Пример 403Н
2-(1-(Бис(4-метоксифенил)метил)-1Н-бензо[d]имидазол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)бензамид
К раствору соединения примера 403G (200 мг), соединения примера 1F (99 мг), триэтиламина (0,122 мл), N,N-диметилпиридин-4-амина (77 мг) в смеси хлористого метилена (8 мл) и N,N-диметилформамида (1 мл) прибавляли соль N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина хлористоводородной кислоты (96 мг). Реакционную смесь перемешивали в течение 18 часов, а затем концентрировали. Сырой продукт очищали на силикагеле, элюируя с постепенным градиентом 80 и 100% этилацетата в гексане, получая указанное в заголовке соединение.
Пример 403I
2-(1Н-Бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Раствор соединения примера 403Н (174 мг) и хлористого метилена (25 мл) охлаждали на бане со льдом и медленно прибавляли по каплям 2,2,2-трифторуксусную кислоту (25 мл). Реакционную смесь перемешивали в течение 30 минут в атмосфере азота и убирали баню со льдом. Реакционную смесь перемешивали в течение 18 часов, а затем концентрировали. Сырой продукт очищали хроматографией с обращенными фазами с буфером из ацетата аммония в ацетонитриле, получая указанное в заголовке соединение.1H ЯМР (400 МГц, пиридин-d5) δ 9,30 (д, 1H), 8,69 (т, 1H), 8,59 (с, 1H), 8,42 (дд, 1H), 7,99 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,26 (м, 1H), 7,18 (м, 1H), 7,06 (д, 2H), 6,94 (д, 1H), 6,72-6,66 (м, 2H), 5,53 (м, 2H), 3,98 (м, 2H), 3,32 (м, 2H), 3,18 (т, 2H), 2,03 (м, 4H), 2,76 (с, 2H), 2,25 (м, 2H), 2,13 (м, 4H), 1,97 (с, 2H), 1,83 (м, 1H), 1,60 (м, 2H), 1,40-1,29 (м, 4H), 0,94 (с, 6H).
Пример 404
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 404А
5-Хлор-6-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонамид
Указанное в заголовке соединение получали, заменяя соединение примера 329А соединением примера 387А и (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 306С в примере 329В.
Пример 404В
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 404А и соединение примера 26С соединением примера 400Е в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,09 (с, 1H), 8,27 (д, 1H), 7,88 (д, 1H), 7,80 (с, 1H), 7,60 (д, 1H), 7,37 (д, 2H), 7,03-7,10 (м, 4H), 6,79 (дд, 1H), 6,53 (д, 1H), 6,13 (д, 1H), 4,50 (д, 2H), 3,76-3,81 (м, 2H), 3,57-3,63 (м, 2H), 3,04 (уш.с, 4H), 2,84 (уш.с, 2H), 2,18 (м, 2H), 1,82-1,92 (м, 4H), 1,42 (т, 2H), 0,94 (с, 6H).
Пример 405
N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 404А и соединение примера 26С соединением примера 55В в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,21 (с, 1H), 8,43 (д, 1H), 8,06 (д, 1H), 7,55 (д, 1H), 7,34 (д, 2H), 7,27 (т, 1H), 7,13 (д, 1H), 7,04 (д, 2H), 6,93 (т, 1H), 6,69 (дд, 1H), 6,36 (д, 1H), 6,28 (д, 1H), 6,26 (д, 1H), 4,51 (д, 2H), 3,73-3,79 (м, 2H), 3,55-3,61 (м, 2H), 3,08 (уш.с, 4H), 2,86 (уш.с, 2H), 2,31 (уш.с, 2H), 2,18 (м, 2H), 1,95 (с, 2H), 1,79-1,90 (м, 4H), 1,36 (т, 2H), 0,92 (с, 6H).
Пример 406
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-циано-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 385В и соединение примера 26С соединением примера 400Е в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,03 (с, 1H), 8,48 (д, 1H), 8,17 (с, 1H), 7,74 (с, 1H), 7,63 (д, 1H), 7,37 (д, 2H), 7,00-7,08 (м, 4H), 6,77 (дд, 1H), 6,51 (с, 1H), 6,07 (д, 1H), 4,55 (д, 2H), 3,77-3,81 (м, 2H), 3,58-3,63 (м, 2H), 3,20 (уш.с, 4H), 2,19 (уш.с, 2H), 1,99 (с, 2H), 1,85-1,92 (м, 4H), 1,42 (т, 2H), 0,94 (с, 6H).
Пример 407
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 407А
(R)-трет-бутил 1-(2,2-дифторэтил)пирролидин-3-илкарбамат
К раствору (R)-трет-бутил пирролидин-3-илкарбамата (500 мг), 1,1-дифтор-2-йодэтана (618 мг) в N,N-диметилформамиде (6 мл) прибавляли N-этил-N-изопропилпропан-2-амин (1,403 мл) и перемешивали реакционную смесь в течение 72 часов при 70°С. Реакционную смесь концентрировали и очищали сырой продукт на силикагеле и элюировали с постепенным градиентом 0, 2 и 5% метанола в метиленхлориде, получая указанное в заголовке соединение.
Пример 407В
(R)-1-(2,2-дифторэтил)пирролидин-3-амин
К раствору соединения примера 407А (525 мг) в смеси хлористого метилена (3 мл) и метанола (2,0 мл) прибавляли хлористоводородную кислоту, 4М в диоксане (5,24 мл). Реакционную смесь перемешивали в течение 3 часов и концентрировали, получая указанное в заголовке соединение.
Пример 407С
(R)-4-(1-(2,2-дифторэтил)пирролидин-3-иламино)-3-нитробензолсульфонамид
К раствору соединения примера 407В (468 мг) в тетрагидрофуране (20 мл), N-этил-N-изопропан-2-амине (2,193 мл) и N,N-диметилформамиде (2 мл) прибавляли 4-фтор-3-нитробензолсульфонамид (473 мг) и перемешивали реакционную смесь в течение 72 часов. Сырой продукт выделяли концентрированием и очищали на силикагеле, и элюировали с постепенным градиентом 0,5, 2,5 и 5% метанола в метиленхлориде, получая указанное в заголовке соединение.
Пример 407D
(R)-2-(1-(бис(4-метоксифенил)метил)-1Н-бензо[d]имидазол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-нитрофенилсульфонил)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 407С в примере 403Н.
Пример 407Е
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 403Н соединением примера 407D в примере 403I.1H ЯМР (400 МГц, пиридин-d5) δ 9,26 (д, 1H), 8,60-8,55 (м, 2H), 8,39 (м, 1H), 7,99 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 1H), 7,17 (м, 1H), 7,06 (д, 2H), 6,86 (д, 1H), 6,72-6,69 (м, 2H), 6,00-6,33 (м, 1H), 5,27 (м, 2H), 4,09 (м, 1H), 3,03 (м, 4H), 2,96-2,86 (м, 4H), 2,81-2,74 (м, 3H), 2,48 (м, 1H), 2,26 (м, 3H), 2,13 (м, 4H), 1,97 (с, 2H), 1,67 (м, 1H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 408
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид
Пример 408А
2-(1-(бис(4-метоксифенил)метил)-1Н-бензо[d]имидазол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(4-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)-3-нитрофенилсульфонил)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 306D в примере 403H.
Пример 408В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 403Н соединением примера 408А в примере 403I.1H ЯМР (400 МГц, пиридин-d5) δ 9,01 (д, 1H), 8,57 (м, 2H), 7,99 (д, 1H), 7,53 (д, 1H), 7,44 (д, 2H), 7,25 (м, 1H), 7,21 (м, 1H), 7,12 (д, 1H), 7,07 (д, 2H), 6,73-6,70 (м, 2H), 5,35 (м, 2H), 4,36 (с, 1H), 4,31 (с, 1H), 3,88 (м, 2H), 3,78 (м, 2H), 3,05 (м, 4H), 2,77 (с, 2H), 2,26 (м, 2H), 2,15 (м, 4H), 2,07-192 (м, 6H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 409
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид
Пример 409А
(4-Фтортетрагидро-2Н-пиран-4-ил)метилметансульфонат
Смесь соединения примера 306С (1,4 г), метансульфонилхлорида (1,054 мл), триэтиламина (2,99 мл) и 4-(диметиламино)пиридина (0,051 г) в CH2Cl2 (20 мл) перемешивали при 0°С в течение 2 часов, концентрировали и хроматографировали на силикагеле с использованием 30% этилацетата в гексане в качестве элюента, получая продукт.
Пример 409В
2-((4-Фтортетрагидро-2Н-пиран-4-ил)метил)изоиндолин-1,3-дион
Смесь соединения примера 409А (1,8 г) и фталимида калия (2,356 г) в N,N-диметилформамиде (30 мл) нагревали при 150°С в течение ночи, разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле с использованием 30% этилацетата в гексане в качестве элюента, получая продукт.
Пример 409С
(4-Фтортетрагидро-2Н-пиран-4-ил)метанамин
Смесь соединения примера 409В (1,4 г) и гидразина (1,548 мл) в этаноле (40 мл) нагревали при 70°С в течение ночи, охлаждали до комнатной температуры, суспендировали в CH2Cl2 (200 мл) и удаляли твердое вещество фильтрованием. Фильтрат концентрировали и хроматографировали на силикагеле с использованием смеси 100:5:1 этилацетат/метанол/NH4OH в качестве элюента, получая продукт.
Пример 409D
4-((4-Фтортетрагидро-2Н-пиран-4-ил)метиламино)-3-нитробензолсульфонамид
Смесь 4-фтор-3-нитробензолсульфонамида (0,44 г), соединения примера 409С (0,266 г) и триэтиламина (1,11 мл) в тетрагидрофуране (10 мл) нагревали при 70°С в течение ночи, разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле с использованием 50% этилацетата в гексанах в качестве элюента, получая продукт.
Пример 409Е
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 409D и соединение примера 26С соединением примера 400Е в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,09 (с, 1H), 8,59 (т, 1H), 8,37 (д, 1H), 7,80 (с, 1H), 7,59 (дд, 1H), 7,37 (д, 2H), 7,04-7,13 (м, 5H), 6,79 (дд, 1H), 6,51 (д, 1H), 6,18 (д, 1H), 3,70-3,79 (м, 4H), 3,50-3,56 (м, 2H), 3,15 (уш.с, 4H), 2,78 (уш.с, 2H), 2,32 (уш.с, 4H), 2,17 (уш.с, 2H), 1,97 (с, 2H), 1,75-1,83 (м, 4H), 1,40 (т, 2H), 0,93 (с, 6H).
Пример 410
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Пример 410А
5-Нитро-3-(трифторметил)пиридин-2-ол
3-(Трифторметил)пиридин-2-ол (2,3 г) прибавляли к концентрированной серной кислоте (15 мл) при 0°С. Смесь перемешивали при 0°С в течение 5 минут. К раствору добавляли по каплям азотную кислоту (дымящую) (6 мл) в течение 5 минут. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и нагревали при 50°С в течение 3 часов. После охлаждения реакционную смесь выливали на лед (200 г) и три раза экстрагировали смесь этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении, получая указанное в заголовке соединение.
Пример 410В
2-Хлор-5-нитро-3-(трифторметил)пиридин
Смесь соединения примера 410А (1,69 г), пятихлористого фосфора (2,03 г) и треххлористого фосфора (0,97 мл) нагревали при 90°С в течение 3 часов. После охлаждения реакционную смесь выливали на лед и три раза экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя смесью 1:9 этилацетат/гексаны, получая указанное в заголовке соединение.
Пример 410С
Смесь железа (1,5 г) и хлорида аммония (2,38 г) в воде (40 мл) перемешивали при комнатной температуре в течение 5 минут. К данной суспензии прибавляли соединение примера 410В в метаноле (40 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли еще железа (1,8 г) и перемешивали ее еще в течение 3 часов. Твердое вещество из реакционной смеси отфильтровывали, а фильтрат распределяли между водой и этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя смесью 1:4 этилацетат/гексан, получая указанное в заголовке соединение.
Пример 410D
6-Хлор-5-(трифторметил)пиридин-3-сульфонилхлорид
При охлаждении льдом тионилхлорид (4 мл) прибавляли по каплям к воде (27 мл) в течение 20 минут. Смесь перемешивали 12 часов в течение ночи, получая раствор, содержащий SO2. Отдельно от этого к концентрированной HCl (20 мл) прибавляли соединение примера 410С (1,14 г) в диоксане (5 мл) при 0°С. Раствор перемешивали в течение 5 минут. К данной смеси добавляли по каплям нитрит натрия (0,44 г) в воде (6 мл) при 0°С. Раствор перемешивали при 0°С в течение трех часов. В течение этого времени какие-либо образующиеся осадки раздавливали стеклянной палочкой, чтобы гарантировать полное взаимодействие соединения примера 410С. К раствору, содержащему SO2, прибавляли хлорид меди(I) (0,115 г). Затем к данному раствору прибавляли диазотированное соединение примера 410С при 0°С. Раствор перемешивали в течение 30 минут. Реакционную смесь экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле, элюируя смесью 1:20 этилацетат/гексаны, получая указанное в заголовке соединение.
Пример 410Е
6-Хлор-5-(трифторметил)пиридин-3-сульфонамид
Указанное в заголовке соединение получали, заменяя 5-бром-6-хлорпиридин-3-сульфонилхлорид на соединение примера 410D в примере 329A.
Пример 410F
Указанное в заголовке соединение получали, заменяя соединение примера 329А соединением примера 410Е и (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 306С в примере 329В.
Пример 410G
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 410F и соединение примера 26C соединением примера 400E в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,05 (с, 1H), 8,59 (с, 1H), 8,17 (д, 1H), 7,76 (с, 1H), 7,62 (д, 1H), 7,37 (д, 2H), 7,00-7,08 (м, 4H), 6,78 (дд, 1H), 6,51 (с, 1H), 6,11 (д, 1H), 4,56 (д, 2H), 3,77-3,80 (м, 2H), 3,57-3,62 (м, 2H), 3,18 (уш.с, 2H), 2,32 (уш.с, 4H), 2,18 (уш.с, 2H), 1,99 (с, 2H), 1,81-1,90 (м, 4H), 1,42 (т, 2H), 0,94 (с, 6H).
Пример 411
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1Е соединением примера 400E и соединение примера 1F соединением примера 432А в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,09 (с, 1H), 8,57 (м, 1H), 8,37 (д, 1H), 7,81 (с, 1H), 7,56 (дд, 1H), 7,52 (д, 1H), 7,38-7,31 (м, 3H), 7,11-7,07 (м, 3H), 6,97 (д, 1H), 6,80 (дд, 1H), 6,52 (д, 1H), 6,17 (д, 1H), 3,84 (д, 1H), 3,24-3,10 (м, 6H), 2,93 (д, 2H), 2,76 (м, 2H), 2,73 (с, 2H), 2,34-2,10 (м, 8H), 1,97 (уш.с, 2H), 1,67 (м, 1H), 1,40 (т, 2H), 0,93 (с, 6H), 0,47-0,26 (м, 4H).
Пример 412
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид
Пример 412А
Трет-бутил (4,4-дифторциклогексил)метилкарбамат
Трет-бутил (4-оксоциклогексил)метилкарбамат (5 г) и трифторид диэтиламиносеры (7,45 г) перемешивали в хлористом метилене (100 мл) в течение 24 часов. Смесь гасили буфером с рН 7 (100 мл) и выливали в эфир (400 мл). Полученный раствор разделяли, а органический слой дважды промывали водой и один раз насыщенным раствором соли, а затем концентрировали, получая сырой продукт и фторолефин в соотношении 3:2. Сырой продукт растворяли в тетрагидрофуране (70 мл) и воде (30 мл) и прибавляли N-метилморфолин-N-оксид (1,75 г) и OsO4 (2,5% масс. раствор в трет-бутаноле) и перемешивали смесь в течение 24 часов. Затем прибавляли Na2S2O3 (10 г) и перемешивали смесь в течение 30 минут. После этого смесь разбавляли эфиром (300 мл) и разделяли полученный раствор и дважды промывали водой и один раз насыщенным раствором соли, и концентрировали. Сырой продукт хроматографировали на силикагеле с использованием 5-10% этилацетата в гексане, получая указанное в заголовке соединение.
Пример 412В
(4,4-Дифторциклогексил)метанамин
Раствор соединения примера 412А (3 г) в хлористом метилене (35 мл), трифторуксусной кислоте (15 мл) и триэтилсилане (1 мл) перемешивали в течение 2 часов. Раствор концентрировали, затем концентрировали из толуола и оставляли в высоком вакууме на 24 часа. Полутвердое вещество растворяли в смеси эфир/гексан и фильтровали, получая продукт в виде соли трифторуксусной кислоты.
Пример 412С
4-((4,4-Дифторциклогексил)метиламино)-3-нитробензолсульфонамид
Указанное в заголовке соединение получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на соединение примера 412В в примере 189А.
Пример 412D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1Е соединением примера 400E и соединение примера 1F соединением примера 412С в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,16 (с, 1H), 11,70 (уш.с, 1H), 8,65 (м, 1H), 8,44 (д, 1H), 7,87 (д, 1H), 7,61 (дд, 2H), 7,41 (д, 2H), 7,02-7,20 (м, 4H), 6,88 (дд, 1H), 6,58 (д, 1H), 6,26 (дд, 1H), 3,22 (м, 4H), 2,86 (м, 2H), 2,20-2,35 (м, 7H), 2,14 (с, 2H), 2,10 (м, 2H), 2,03 (м, 2H), 1,91 (м, 2H), 1,87 (м, 2H), 1,46 (м, 2H), 1,27-1,39 (м, 3H), 1,00 (с, 6H).
Пример 413
N-[(5-хлор-6-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)- 2-(1Н-индазол-4-илокси)бензамид
Пример 413А
Указанное в заголовке соединение получали, заменяя 4-фтор-3-нитробензолсульфонамид соединением примера 387А и (тетрагидропиран-4-ил)метиламин соединением примера 409С в примере 1F.
Пример 413В
N-[(5-хлор-6-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)- 2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 413А и соединение примера 26С соединением примера 400E в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,14 (с, 1H), 8,19 (д, 1H), 7,87 (с, 1H), 7,60 (д, 1H), 7,56 (д, 1H), 7,36 (д, 2H), 7,31 (уш.с, 1H), 7,08-7,17 (м, 2H), 7,06 (д, 2H), 6,80 (дд, 1H), 6,53 (д, 1H), 6,20 (д, 1H), 3,70-3,78 (м, 4H), 3,43-3,54 (м, 2H), 3,18 (уш.с, 4H), 2,81 (с, 2H), 2,26 (уш.с, 4H), 2,17 (уш.с, 2H), 1,97 (с, 2H), 1,64-1,80 (м, 4H), 1,40 (т, 2H), 0,94 (с, 6H).
Пример 414
Транс-N-({5-хлор-6-[(4-метоксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 414А
Цис-(4-метоксициклогексил)метанол и транс-(4-метоксициклогексил)метанол
Этил 4-метоксициклогексанкарбоксилат (1 г) в тетрагидрофуране (10 мл) обрабатывали 1,0N LiAlH4 в ТГФ (2 мл) при 0°С. Смесь перемешивали в течение 2 часов. Реакционную смесь гасили водой (0,6 мл), затем 2,0N водным NaOH (0,2 мл). Смесь перемешивали еще в течение 20 минут и отфильтровывали твердое вещество. Фильтрат растворяли в этилацетате, промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали, получая указанное в заголовке соединение в виде смеси цис- и транс-изомеров.
Пример 414В
5-Хлор-6-((транс-4-метоксициклогексил)метокси)пиридин-3-сульфонамид
Указанное в заголовке соединение получали, заменяя соединение примера 329А соединением примера 387А и (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 414А в примере 329В. Транс-изомер выделяли флэш-хроматографией на колонке с силикагелем.
Пример 414С
Транс-N-({5-хлор-6-[(4-метоксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 414В и соединение примера 26С соединением примера 400E в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,10 (с, 1H), 8,27 (д, 1H), 7,85 (д, 1H), 7,80 (с, 1H), 7,59 (д, 1H), 7,36 (д, 2H), 7,03-7,10 (м, 4H), 6,79 (дд, 1H), 6,53 (д, 1H), 6,14 (д, 1H), 4,19 (д, 2H), 3,24 (с, 3H), 3,20 (м, 4H), 3,07-3,10 (м, 2H), 2,93 (уш.с, 2H), 2,39 (с, 4H), 2,18 (с, 2H), 1,98-2,02 (м, 4H), 1,70-1,86 (м, 3H), 1,42 (т, 2H), 1,08-1,17 (м, 4H), 0,94 (с, 6H).
Пример 415
2-(1Н-Бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(2,2-дифторэтил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Пример 415А
Трет-бутил 2-((2-нитро-4-сульфамоилфениламино)метил)морфолин-4-карбоксилат
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин трет-бутил 2-(аминометил)морфолин-4-карбоксилатом в примере 1F.
Пример 415В
4-(морфолин-2-илметиламино)-3-нитробензолсульфонамид
Раствор соединения примера 415А (0,8 г) в метиленхлориде (10 мл) и трифторуксусной кислоте (10 мл) перемешивали при комнатной температуре в течение 2 часов. Растворители выпаривали и растирали осадок с диэтиловым эфиром. Полученное твердое вещество растворяли в 5% водном растворе карбоната натрия (20 мл). Раствор упаривали досуха и несколько раз растирали полученное твердое вещество с 10% раствором метанола в хлористом метилене. В результате выпаривания органического раствора получали указанное в заголовке соединение.
Пример 415С
4-((4-(2,2-Дифторэтил)морфолин-2-ил)метиламино)-3-нитробензолсульфонамид
К раствору соединения примера 415В (633 мг) в безводном N,N-диметилформамиде (10 мл) прибавляли карбонат натрия (254 мг) и 2,2-дифторэтилйодид (422 мг). После перемешивания при 110°С в течение 48 часов смесь концентрировали. Остаток смешивали с водой (20 мл) и экстрагировали этилацетатом. Сырой продукт очищали на колонке с силикагелем, элюируя 10% метанола в метиленхлориде, получая указанное в заголовке соединение.
Пример 415D
2-(1Н-Бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(2,2-дифторэтил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 428D соединением примера 415С в примере 428Е.1H ЯМР (500 МГц, пиридин-d5) δ 9,26 (д, 1H), 8,87 (т, 1H), 8,57 (с, 1H), 8,37 (дд, 1H), 7,99 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 2H), 7,17 (д, 1H), 7,06 (д, 2H), 6,96 (д, 1H), 6,72-6,69 (м, 2H), 6,31, 6,20, 6,09 (тт, 1H), 3,90 (м, 1H), 3,86 (д, 1H), 3,68 (дт, 1H), 3,54-3,41 (м, 2H), 3,03 (м, 4H), 2,97 (д, 1H), 2,83-2,75 (м, 4H), 2,69 (д, 1H), 2,35 (дт, 1H), 2,27-2,23 (м, 3H), 2,14 (м, 4H), 1,97 (с, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 416
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид
Пример 416А
5-Бром-3-фтор-2-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин
Указанное в заголовке соединение получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 306С и 4-фтор-3-нитробензолсульфонамид 5-бром-2,3-дифторпиридином в примере 279А.
Пример 416В
Трет-бутил 5-фтор-6-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-илкарбамат
Соединение примера 416А (0,658 г), трет-бутилкарбамат (0,300 г), ацетат палладия(II) (0,024 г), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,093 г) и карбонат цезия (1,044 г) смешивали в сосуде на 20 мл с диоксаном (10,7 мл). Сосуд продували азотом, затыкали пробкой и перемешивали при 100°С в течение ночи. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали, концентрировали и хроматографировали на силикагеле с использованием 20% этилацетата в гексане в качестве элюента.
Пример 416С
5-Фтор-6-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонилхлорид
При охлаждении льдом тионилхлорид (1,563 мл) прибавляли по каплям в течение 20 минут к воде (9 мл). Смесь перемешивали в течение 12 часов, получая SO2-содержащий раствор. Отдельно от этого соединение примера 416В (0,295 г) прибавляли к смеси диоксана (3,2 мл) и концентрированной HCl (8 мл) при 0°С. Раствор перемешивали в течение 15 минут, обрабатывали раствором нитрита натрия (0,065 г) в воде (2 мл) по каплям при 0°С и перемешивали при 0°С в течение трех часов. SO2-содержащий раствор охлаждали до 0°С, последовательно обрабатывали хлоридом меди(I) (0,042 г) и диазотированной смесью и перемешивали в течение 30 минут. Затем реакционную смесь разбавляли этилацетатом, а органический слой сушили (MgSO4), фильтровали и концентрировали. Концентрат хроматографировали на силикагеле с использованием 5-10% этилацетата в гексане в качестве элюента.
Пример 416D
5-Фтор-6-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-сульфонамид
Соединение примера 416С (0,08 г) в изопропаноле (2 мл) при 0°С обрабатывали гидроксидом аммония (1,70 мл) и перемешивали в течение ночи. Реакционную смесь концентрировали досуха, суспендировали в воде, фильтровали, промывали водой и сушили в вакууме, получая указанное в заголовке соединение.
Пример 416Е
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 26С соединением примера 400E и соединение примера 1F соединением примера 416D в примере 177.1H ЯМР (400 МГц, ПИРИДИН-d5) δ 14,67 (с, 1H), 8,84 (д, 1H), 8,38 (д, 1H), 8,06 (д, 1H), 8,00 (дд, 1H), 7,46 (м, 2H), 7,35 (д, 1H), 7,12 (м, 3H), 6,87 (м, 2H), 6,47 (д, 1H), 4,56 (д, 2H), 3,80 (м, 4H), 3,18 (м, 4H), 2,83 (с, 2H), 2,31 (т, 2H), 2,24 (м, 4H), 1,99 (с, 2H), 1,86 (м, 4H), 1,41 (т, 2H), 0,96 (с, 6H).
Пример 417
2-(1Н-Бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Пример 417А
2-(1-(Бис(4-метоксифенил)метил)-1Н-бензо[d]имидазол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(3-нитро-4-(1-тетрагидро-2Н-пиран-4-ил)пиперидин-4-иламино)фенилсульфонил)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 173С в примере 403Н.
Пример 417В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)- N-({3-нитро-4-[(1-тетрагидро-2Н-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 403Н соединением примера 417А в примере 403I.1H ЯМР (500 МГц, пиридин-d5) δ 9,27 (м, 1H), 8,59 (с, 1H), 8,47 (д, 1H), 8,43 (д, 1H), 8,01 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,24 (м, 1H), 7,18 (м, 1H), 7,07 (д, 2H), 6,96 (д, 1H), 6,70 (м, 2H), 5,34 (м, 2H), 4,03 (м, 2H), 3,53 (м, 1H), 3,31 (м, 2H), 3,03 (м, 4H), 2,82 (м, 2H), 2,76 (с, 2H), 2,42 (м, 1H), 2,32 (м, 2H), 2,26-2,19 (м, 2H), 2,14 (м, 4H), 1,98 (м, 4H), 1,67-1,52 (м, 6H), 1,38 (м, 2H), 0,94 (с, 6H).
Пример 418
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 418А
2-(1-(Бис(4-метоксифенил)метил)-1Н-бенз[d]имидазол-4-илокси)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил)метил)пиперазин-1-ил)-N-(4-(1-метилпиперидин-4-иламино)-3-нитрофенилсульфонил)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 21А в примере 403Н.
Пример 418В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-метилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 403Н соединением примера 418А в примере 403I.1H ЯМР (500 МГц, пиридин-d5) δ 9,25 (м, 1H), 8,58 (с, 1H), 8,42 (м, 2H), 8,02 (д, 1H), 7,52 (д, 1H), 7,43 (д, 2H), 7,23 (м, 1H), 7,14 (д, 1H), 7,07 (д, 2H), 6,92 (д, 1H), 6,70 (м, 2H), 5,52 (м, 2H), 3,50 (м, 1H), 3,03 (м, 4H), 2,77 (с, 2H), 2,68 (м, 2H), 2,25 (м, 2H), 2,20 (с, 3H), 2,14 (м, 6H), 1,97-1,90 (м, 4H), 1,67 (м, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 419
N-[(5-хлор-6-{[1-(цианометил)-4-фторпиперидин-4-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 419А
Трет-бутил 4-фтор-4-(гидроксиметил)пиперидин-1-карбоксилат
1-Трет-бутил 4-этил 4-фторпиперидин-1,4-дикарбоксилат (1,0 г) в тетрагидрофуране (10 мл) при 0°С обрабатывали 1N раствором LiAlH4 в тетрагидрофуране (2,54 мл), перемешивали в течение 2 часов при комнатной температуре, последовательно обрабатывали по каплям водой (0,2 мл) и 2N раствором NaOH (0,6 мл) и перемешивали в течение 1 часа. Твердое вещество удаляли фильтрованием через слой диатомовой земли, промывая этилацетатом. Фильтрат промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали, получая указанное в заголовке соединение.
Пример 419В
Трет-бутил 4-((3-хлор-5-сульфамоилпиридин-2-илокси)метил)-4-фторпиперидин-1-карбоксилат
Указанное в заголовке соединение получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 419А и 4-фтор-3-нитробензолсульфонамид соединением примера 387А в примере 279А.
Пример 419С
Соль 5-хлор-6-((4-фторпиперидин-4-ил)пиридин-3-сульфонамид, 2•трифторуксусная кислота
Указанное в заголовке соединение получали, заменяя соединение примера 1А соединением примера 419В в примере 1В.
Пример 419D
5-Хлор-6-((1-(цианометил)-4-фторпиперидин-4-ил)метокси)пиридин-3-сульфонамид
Соединение примера 419С (0,166 г) в ацетонитриле (3,00 мл) обрабатывали 2-хлорацетонитрилом (0,027 г) и карбонаом натрия (0,064 г), нагревали при 60°С в течение ночи, охлаждали до комнатной температуры и хроматографировали на силикагеле с использованием от 0 до 3% метанола CH2Cl2 в качестве элюента. Полученное твердое вещество суспендировали в воде, фильтровали, промывали водой и диэтиловым эфиром и сушили в вакуумной печи при 80°С, получая указанное в заголовке соединение.
Пример 419Е
N-[(5-хлор-6-{[1-(цианометил)-4-фторпиперидин-4-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 26С соединением примера 400Е и соединение примера 1F соединением примера 419D в примере 177.1H ЯМР (400 МГц, пиридин-d5) δ 14,70 (с, 1H), 8,91 (д, 1H), 8,39 (д, 2H), 8,10 (д, 1H), 7,46 (м, 2H), 7,35 (д, 1H), 7,11 (м, 3H), 6,87 (м, 2H), 6,50 (д, 1H), 4,49 (д, 2H), 3,72 (с, 2H), 3,17 (м, 4H), 2,82 (с, 2H), 2,72 (м, 4H), 2,31 (м, 2H), 2,23 (м, 4H), 2,06 (м, 2H), 1,99 (с, 2H), 1,89 (м, 2H), 1,41 (т, 2H), 0,96 (с, 6H).
Пример 420
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидрофуран-3-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Пример 420А
5-Хлор-6-((тетрагидрофуран-3-ил)метокси)пиридин-3-сульфонамид
Указанное в заголовке соединение получали, заменяя соединение примера 329А соединением примера 387А и (тетрагидро-2Н-пиран-4-ил)метанол (тетрагидрофуран-3-ил)метанолом в примере 329В.
Пример 420В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидрофуран-3-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 420В и соединение примера 26С соединением примера 400Е в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,07 (с, 1H), 8,25 (д, 1H), 7,85 (д, 1H), 7,79 (с, 1H), 7,60 (д, 1H), 7,36 (д, 2H), 7,03-7,09 (м, 4H), 6,78 (дд, 1H), 6,51 (д, 1H), 6,13 (дд, 1H), 4,25-4,37 (м, 2H), 3,77-3,81 (м, 2H), 3,64-3,70 (м, 2H), 3,54-3,57 (м, 2H), 3,17 (уш.с, 4H), 2,89 (уш.с, 2H), 2,68-2,71 (м, 1H), 2,33 (м, 3H), 2,16-2,18 (м, 2H), 1,98-2,01 (м, 3H), 1,66-1,71 (м, 1H), 1,41 (т, 2H), 0,94 (с, 6H).
Пример 421
Транс-N-({5-хлор-6-[(4-гидроксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 421А
6-((Транс-4-(трет-бутилдиметилсилилокси)циклогексил)метокси)-5-хлорпиридин-3-сульфонамид
Указанное в заголовке соединение получали, заменяя соединение примера 329А на соединение примера 387А и (тетрагидро-2Н-пиран-4-ил)метанол на транс-4-(трет-бутилдиметилсилилокси)циклогексилметанол, синтезированный по методике, описанной в WO 2008/124878 (страница 100).
Пример 421В
Транс-N-({5-хлор-6-[(4-гидроксициклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 421А и соединение примера 26С соединением примера 400Е в примере 177, после удаления трет-бутилдиметилсилильной группы трифторуксусной кислотой.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,12 (с, 1H), 8,29 (д, 1H), 7,88 (д, 1H), 7,84 (с, 1H), 7,40 (д, 2H), 7,07-7,13 (м, 4H), 6,83 (дд, 1H), 6,56 (с, 1H), 6,17 (д, 1H), 4,58 (д, 1H), 4,21 (д, 2H), 3,22 (уш.с, 4H), 2,36-2,40 (м, 3H), 2,20-2,24 (м, 2H), 2,02-2,03 (м, 2H), 1,75-1,89 (м, 5H), 1,45 (т, 2H), 1,11-1,21 (м, 4H), 0,98 (с, 6H).
Пример 422
N-[(5-хлор-6-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]окси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 422А
(R)-трет-бутил 3-(3-хлор-5-сульфамоилпиридин-2-илокси)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол на (R)-трет-бутил 3-гидроксипирролидин-1-карбоксилат в примере 387В.
Пример 422В
Гидрохлоридная соль(R)-5-хлор-6-(пирролидин-3-илокси)пиридин-3-сульфонамида
Соединение примера 422А (480 мг) растворяли в безводном тетрагидрофуране (10 мл), после чего добавляли хлористый водород в растворе диоксана (4М, 2,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме, получая указанное в заголовке соединение.
Пример 422C
(R)-5-хлор-6-(1-(2,2-дифторэтил)пирролидин-3-илокси)пиридин-3-сульфонамид
Реакционную смесь из примера 422В (353 мг), 1,1-дифтор-2-йодэтан (268 мг) и Na2CO3 (283 мг) в N,N-диметилформамиде (10 мл) нагревали при 80°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали. Сырое вещество очищали смесью 2,5-3% метанол/хлористый метилен, получая указанное в заголовке соединение.
Пример 422D
N-[(5-хлор-6-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]окси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 26С соединением примера 400Е и соединение примера 1F соединением примера 422С в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 12,98 (с, 1H), 8,17 (д, 1H), 7,80 (д, 1H), 7,73 (с, 1H), 7,66 (д, 1H), 7,35 (д, 2H), 7,05 (м, 4H), 6,73 (м, 1H), 6,41 (д, 1H), 6,10 (м, 2H), 5,37 (м, 1H), 2,92 (м, 11H), 2,56 (м, 2H), 2,24 (м, 7H), 1,99 (м, 2H), 1,82 (м, 1H), 1,39 (м, 2H), 0,93 (с, 6H).
Пример 423
2-(1Н-бензимидазол-4-илокси)- N-[(5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Пример 423А
(S)-трет-бутил 2-((3-хлор-5-сульфамоилпиридин-2-илокси)метил)морфолин-4-карбоксилат
Соединение данного примера получали, заменяя 4-гидроксиметилтетрагидропиран на (S)-трет-бутил 2-(гидроксиметил)морфолин-4-карбоксилат в примере 387В.
Пример 423В
(S)-5-хлор-6-(морфолин-2-илметокси)пиридин-3-сульфонамид
Указанное в заголовке соединение получали, заменяя соединение примера 415А соединением примера 423А в примере 415В.
Пример 423С
(S)-5-хлор-6-((4-(2-диметиламино)ацетил)морфолин-2-ил)метокси)пиридин-3-сульфонамид
К раствору соединения примера 423В (0,32 г) в безводном N,N-диметилформамиде (10 мл) прибавляли карбонат натрия (0,165 г) и гидрохлорид 2-(диметиламино)ацетилхлорида (0,40 г). После перемешивания при температуре окружающей среды в течение ночи смесь концентрировали досуха. Остаток смешивали с 5% водным Na2CO3 (20 мл) и экстрагировали этилацетатом. Сырой продукт очищали на колонке с силикагелем, элюируя 10% метанола в хлористом метилене, насыщенном аммиаком, получая указанное в заголовке соединение.
Пример 423D
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 423C в примере 428Е.1H ЯМР (500 МГц, пиридин-d5) δ 9,08 (д, 1H), 8,60 (т, 1H), 8,57 (с, 1H), 8,01 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 2H), 7,15 (м, 1H), 7,07 (д, 2H), 6,73-6,69 (м, 2H), 4,86-4,36 (м, 4H), 4,05-3,90 (м, 1H), 3,88 (д, 1H), 3,62-3,18 (м, 4H), 3,04 (м, 4H), 2,87 (т, 1H), 2,77 (с, 2H), 2,33 (м, 6H), 2,26 (м, 2H), 2,15 (м, 4H), 1,97 (с, 2H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 424
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Пример 424А
(R)-трет-бутил 2-((3-хлор-5-сульфамоилпиридин-2-илокси)метил)морфолин-4-карбоксилат
Соединение данного примера получали, заменяя 4-гидроксиметилтетрагидропиран на (R)-трет-бутил 2-(гидроксиметил)морфолин-4-карбоксилат в примере 387В.
Пример 424В
(R)-5-хлор-6-(морфолин-2-илметокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 415А соединением примера 424А в примере 415В.
Пример 424С
(R)-5-хлор-6-((4-(2-диметиламино)ацетил)(морфолин-2-ил)метокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 423В соединением примера 424В в примере 423С.
Пример 424D
2-(1Н-бензимидазол-4-илокси)-N-[(5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 424C в примере 428Е.1H ЯМР (500 МГц, пиридин-d5) δ 9,08 (д, 1H), 8,60 (т, 1H), 8,57 (с, 1H), 8,01 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 2H), 7,15 (м, 1H), 7,07 (д, 2H), 6,73-6,69 (м, 2H), 4,86-4,36 (м, 4H), 4,05-3,90 (м, 1H), 3,88 (д, 1H), 3,62-3,18 (м, 4H), 3,04 (м, 4H), 2,87 (т, 1H), 2,77 (с, 2H), 2,33 (м, 6H), 2,26 (м, 2H), 2,15 (м, 4H), 1,97 (с, 2H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 425
N-[(5-хлор-6-{[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 400Е и соединение примера 1F соединением примера 423С в примере 1G, и очищая ВЭЖХ с обращенными фазами с использованием препаративной системы LC4000 Waters с колонкой Phenomonex Luna C18 и подвижной фазы вода-ацетонитрил с буфером из ацетата аммония.1H ЯМР (500 МГц, пиридин-d5) δ 8,87 (дд, 1H), 8,40 (т, 2H), 8,13 (дд, 1H), 7,46 (д, 2H), 7,35 (д, 1H), 7,15-7,10 (м, 3H), 6,87 (д, 1H), 6,85 (с, 1H), 6,50 (дд, 1H), 4,84-4,46 (м, 4H), 4,02-3,90 (м, 1H), 3,88 (м, 1H), 3,60-3,33 (м, 2H), 3,25-3,15 (м, 6H), 2,89-2,84 (м, 1H), 2,83 (с, 2H), 2,32-2,23 (м, 12H), 1,99 (с, 2H), 1,41 (т, 2H), 0,96 (с, 6H).
1250969 Пример 426 Gary Wang
N-[(5-хлор-6-{[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 400Е и соединение примера 1F соединением примера 424С в примере 1G, и очищая ВЭЖХ с обращенными фазами с использованием препаративной системы LC4000 Waters с колонкой Phenomonex Luna C18 и подвижной фазы вода-ацетонитрил с буфером из ацетата аммония.1H ЯМР (500 МГц, пиридин-d5) δ 8,87 (дд, 1H), 8,40 (т, 2H), 8,13 (дд, 1H), 7,46 (д, 2H), 7,35 (д, 1H), 7,15-7,10 (м, 3H), 6,87 (д, 1H), 6,85 (с, 1H), 6,50 (дд, 1H), 4,84-4,46 (м, 4H), 4,02-3,90 (м, 1H), 3,88 (м, 1H), 3,60-3,33 (м, 2H), 3,25-3,15 (м, 6H), 2,89-2,84 (м, 1H), 2,83 (с, 2H), 2,32-2,23 (м, 12H), 1,99 (с, 2H), 1,41 (т, 2H), 0,96 (с, 6H).
Пример 427
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(тетрагидро-2Н-пиран-4-илметокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 1F соединением примера 387В и соединение примера 26С соединением примера 400Е в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,09 (с, 1H), 8,27 (д, 1H), 7,85 (д, 1H), 7,80 (с, 1H), 7,59 (д, 1H), 7,36 (д, 2H), 7,03-7,10 (м, 4H), 6,79 (дд, 1H), 6,52 (д, 1H), 6,13 (д, 1H), 4,27 (д, 2H), 3,88 (дд, 2H), 3,19 (уш.с, 4H), 2,91 (уш.с, 2H), 2,36-2,40 (уш., 3H), 2,18 (м, 2H), 2,05 (м, 1H), 1,98 (с, 2H), 1,64-1,68 (м, 2H), 1,34-1,43 (м, 4H), 1,11-1,21 (м, 4H), 0,94 (с, 6H).
Пример 428
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(цианометил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 428А
8-{4-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-6-окса-2,11а-диазабензо[c,d,g]азулен-11-он
Раствор соединения примера 403G (4,5 г) в безводном хлористом метилене (100 мл) охлаждали на бане со льдом и добавляли каталитическое количество N,N-диметилформамида. После этого прибавляли по каплям раствор оксалилдихлорида (1,231 мл) в безводном метиленхлориде (5 мл). Баню со льдом убирали и перемешивали реакционную смесь еще в течение 1 часа, пока она нагревалась до температуры окружающей среды. Реакционную смесь гасили добавлением льда (150 мл) и насыщенного раствора гидрокарбоната натрия (100 мл). Смесь дополнительно разбавляли насыщенным раствором гидрокарбоната натрия (200 мл) и метиленхлоридом (200 мл). Органический слой очищали на силикагеле и элюировали с постепенным градиентом 0, 10, 25 и 100% этилацетата в метиленхлориде, получая указанное в заголовке соединение.
Пример 428В
(R)-трет-бутил 3-(2-нитро-4-сульфамоилфениламино)пирролидин-1-карбоксилат
К раствору (R)-трет-бутил 3-аминопирролидин-1-карбоксилата (1,0 г), тетрагидрофурана (50 мл), N-этил-N-изопропан-2-амина (5,61 мл) и N,N-диметилформамида (10 мл) прибавляли 4-фтор-3-нитробензолсульфонамид (1,212 г) и перемешивали смесь в течение 18 часов. Сырой продукт выделяли концентрированием и очищали вещество на силикагеле и элюировали с постепенным градиентом 30, 50 и 75% этилацетата в гексане, получая указанное в заголовке соединение.
Пример 428С
(R)-3-нитро-2-пирролидин-3-иламино)бензолсульфонамид
Суспензию соединения примера 428В (2,018 г) в безводном хлористом метилене (25 мл) охлаждали на бане со льдом и прибавляли 2,2,2-трифоруксусную кислоту (20 мл). После перемешивания в течение 15 минут баню со льдом убирали и оставляли реакционную смесь дойти до температуры окружающей среды на 2 часа. Реакционную смесь концентрировали, а остаток растворяли в воде и подщелачивали водным раствором карбоната натрия. Смесь многократно экстрагировали 10% смесью метанола в метиленхлориде и концентрировали органические слои, получая указанное в заголовке соединение.
Пример 428D
(R)-4-(1-цианометил)пирролидин-3-иламин)-3-нитробензолсульфонамид
К раствору соединения примера 428С (440 мг) в безводном N,N-диметилформамиде (10 мл) прибавляли карбонат натрия (132 мг). К полученной суспензии прибавляли 2-бромацетонитрил (0,077 мл) и нагревали смесь при 60°С в течение 18 часов. Сырое вещество выделяли концентрированием и очищали на силикагеле и элюировали с постепенным градиентом 0,5, 2,5 и 5% метанола в метиленхлориде, получая указанное в заголовке соединение.
Пример 428Е
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(цианометил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
К раствору соединения примера 428D (82,6 мг) в тетрагидрофуране (7 мл) прибавляли 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-a]азепин (0,063 мл). Данную смесь перемешивали при температуре окружающей среды в течение 45 минут и прибавляли раствор соединения примера 428А (117 мг) в тетрагидрофуране (3 мл). После перемешивания в течение 18 часов сырой продукт выделяли концентрированием и очищали хроматографией с обращенными фазами с буфером из ацетата аммония в ацетонитриле, получая указанное в заголовке соединение.1H ЯМР (400 МГц, пиридин-d5) δ 9,27 (д, 1H), 8,59 (с, 1H), 8,55 (д, 1H), 8,40 (дд, 1H), 7,99 (д, 1H), 7,54 (м, 1H), 7,43 (д, 2H), 7,25 (м, 1H), 7,16 (м, 1H), 7,07 (д, 2H), 6,86 (д, 1H), 6,69 (м, 2H), 5,73 (м, 2H), 4,15 (м, 1H), 3,90 (с, 2H), 3,03 (м, 4H), 2,96-2,87 (м, 2H), 2,81-2,76 (м, 3H), 2,58 (м, 1H), 2,32-2,23 (м, 3H), 2,14 (м, 4H), 1,97 (с, 2H), 1,73 (м, 1H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 429
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-(2-метоксиэтокси)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}бензамид
Пример 429А
(R)-4-(1-(2-(2-метоксиэтокси)этил]пирролидин-3-иламино)-3-нитробензолсульфонамид
Указанное в заголовке соединение получали, заменяя 2-бромацетонитрил 1-бром-2-(2-метоксиэтокси)этаном в примере 428D.
Пример 429В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-(2-метоксиэтокси)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 428D соединением примера 429A в примере 428E.1H ЯМР (400 МГц, пиридин-d5) δ 9,26 (д, 1H), 8,58 (м, 2H), 8,38 (дд, 1H), 8,01 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (д, 1H), 7,16 (д, 1H), 7,07 (д, 2H), 6,85 (д, 1H), 6,71-6,69 (м, 2H), 5,33 (м, 2H), 4,05 (м, 1H), 3,63 (м, 4H), 3,54 (м, 2H), 3,29 (с, 3H), 3,03 (м, 4H), 2,86 (м, 1H), 2,77 (м, 4H), 2,70 (т, 2H), 2,38 (м, 1H), 2,27-2,18 (м, 3H), 2,14 (м, 4H), 1,97 (с, 2H), 1,64 (м, 1H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 430
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(N,N-диметилглицил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 430А
(R)-4-(1-(2-диметиламино)ацетил)пирролидин-3-иламино)-3-нитробензолсульфонамид
Указанное в заголовке соединение получали, заменяя 2-бромацетонитрил 2-(диметиламино)ацетилхлоридом в примере 428D.
Пример 430В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(3R)-1-(N,N-диметилглицил)пирролидин-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 428D соединением примера 430A в примере 428E.1H ЯМР (400 МГц, пиридин-d5) δ 9,25 (м, 1H), 8,59 (д, 1H), 8,47-8,35 (м, 2H), 8,01 (д, 1H), 7,54 (д, 1H), 7,44 (д, 2H), 7,25-7,20 (м, 2H), 7,16-6,92 (м, 4H), 6,71 (м, 2H), 5,55 (м, 1H), 4,34-4,18 (м, 1H), 4,03 (м, 1H), 3,84-3,63 (м, 3H), 3,44-3,34 (м, 2H), 3,03 (м, 4H), 2,77 (с, 2H), 2,43 (м, 6H), 2,25 (м, 3H), 2,14 (м, 4H), 2,03-1,83 (м, 3H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 431
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(цианометил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Пример 431А
4-((4-(Цианометил)морфолин-2-ил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 2,2-дифторэтилйодид на 2-бромацетонитрил в примере 415С при температуре окружающей среды.
Пример 431В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(цианометил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 431A в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,25 (д, 1H), 8,87 (т, 1H), 8,58 (с, 1H), 8,38 (дд, 1H), 8,00 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 2H), 7,16 (д, 1H), 7,07 (д, 2H), 6,97 (д, 1H), 6,73-6,68 (м, 2H), 3,96-3,85 (м, 2H), 3,78 (с, 2H), 3,66 (дт, 1H), 3,53-3,42 (м, 2H), 3,03 (м, 4H), 2,90 (д, 1H), 2,76 (с, 2H), 2,61 (д, 1H), 2,51 (дт, 1H), 2,40 (т, 1H), 2,25 (м, 2H), 2,14 (м, 4H), 1,97 (с, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 432
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-{[(4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 432А
4-((4-Циклопропилморфолин-2-ил)метиламино)-3-нитробензолсульфонамид
Соединение примера 415В (0,633 г) и (1-этоксициклопропокси)триметилсилан (1,601 мл) в безводном метаноле (15 мл) и уксусную кислоту (1,7 мл) кипятили в течение 30 минут и оставляли остывать до комнатной температуры. Затем добавляли цианоборгидрид натрия (0,377 г) и перемешивали смесь при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали досуха. Остаток смешивали с 5% водным раствором Na2CO3 (25 мл) и экстрагировали этилацетатом. Сырой продукт очищали на колонке с силикагелем, элюируя 5% и 10% метанола в хлористом метилене, получая указанное в заголовке соединение.
Пример 432В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-{[(4-циклопропилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 432A в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,25 (д, 1H), 8,89 (т, 1H), 8,57 (с, 1H), 8,38 (дд, 1H), 8,00 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 2H), 7,16 (д, 1H), 7,07 (д, 2H), 6,98 (д, 1H), 6,73-6,68 (м, 2H), 3,90-3,83 (м, 2H), 3,60 (дт, 1H), 3,55-3,41 (м, 2H), 3,03 (м, 4H), 2,96 (д, 1H), 2,76 (с, 2H), 2,69 (д, 1H), 2,35 (дт, 1H), 2,26-2,20 (м, 3H), 2,14 (м, 4H), 1,97 (с, 2H), 1,59 (м, 1H), 1,38 (т, 2H), 0,94 (с, 6H), 0,47-0,37 (м, 4H).
Пример 433
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(3-нитро-4-{[(4-оксетан-3-илморфолин-2-ил)метил]амино}фенил)сульфонил]бензамид
Пример 433А
3-Нитро-4-((4-оксетан-3-ил)морфолин-2-ил)метиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (1-этоксициклопропокси)триметилсилан на оксетан-3-он в примере 432А.
Пример 433В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(3-нитро-4-{[(4-оксетан-3-илморфолин-2-ил)метил]амино}фенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 433A в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,25 (д, 1H), 8,87 (т, 1H), 8,57 (с, 1H), 8,38 (дд, 1H), 8,02 (д, 1H), 7,53 (д, 1H), 7,44 (д, 2H), 7,24 (м, 2H), 7,13 (д, 1H), 7,07 (д, 2H), 6,98 (д, 1H), 6,73-6,68 (м, 2H), 4,69-4,62 (м, 4H), 3,98-3,88 (м, 2H), 3,69 (дт, 1H), 3,55-3,35 (м, 3H), 3,03 (м, 4H), 2,77 (с, 2H), 2,74 (д, 1H), 2,44 (д, 1H), 2,25 (м, 2H), 2,14 (м, 4H), 1,97 (с, 2H), 1,94 (м, 1H), 1,87 (т, 1H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 434
N-{[5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил]окси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 434А
(R)-5-хлор-6-(1-(1,3-дифторпропан-2-ил)пирролидин-3-илокси)пиридин-3-сульфонамид
Соединение примера 422В (278 мг) и 1,3-дифторпропан-2-он (94 мг) суспендировали в дихлорэтане (10 мл). Прибавляли по каплям N,N-диметилформамид (1,5 мл) до образования молочно-белой суспензии. Реакционную смесь перемешивали при комнатной температуре в течение 15 минут, после чего прибавляли триацетоксиборгидрид натрия (424 мг). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме, а сырое вещество очищали с использованием 2,5-5% смеси метанол/хлористый метилен, получая указанное в заголовке соединение.
Пример 434В
N-{[5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил]окси)пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Указанное в заголовке соединение получали, заменяя соединение примера 26С соединением примера 400Е и соединение примера 1F соединением примера 434А в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 12,96 (с, 1H), 8,16 (д, 1H), 7,79 (м, 1H), 7,69 (м, 2H), 7,35 (д, 2H), 7,05 (м, 4H), 6,72 (м, 1H), 6,39 (д, 1H), 6,09 (дд, 3,05 Гц, 1H), 5,37 (м, 1H), 4,66 (т, 2H), 4,54 (т, 2H), 2,91 (м, 12H), 2,23 (м, 7H), 1,97 (с, 2H), 1,82 (м, 1H), 1,40 (т, 2H), 0,93 (с, 6H).
Пример 435
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Пример 435А
(R)-1-(1,3-дифторпропан-2-ил)пирролидин-3-амин
К раствору (R)-трет-бутил пирролидин-3-илкарбамата (0,500 г) и 1,3-дифторпропан-2-она (0,278 г) в хлористом метилене (5 мл) прибавляли триацетоксиборгидрид натрия (0,853 г). После перемешивания в течение одного часа реакционную смесь гасили насыщенным раствором NaHCO3 (5 мл). Смесь экстрагировали хлористым метиленом (25 мл), а органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток обрабатывали HCl (4,0 М в 1,4-диоксане, 4 мл) и метанолом (1 мл) и перемешивали в течение одного часа. Смесь концентрировали, получая указанное в заголовке соединение.
Пример 435В
(R)-4-(1-(1,3-дифторпропан-2-ил)пирролидин-3-иламино)-3-нитробензолсульфонамид
К 4-фтор-3-нитробензолсульфонамиду (0,272 г) и соединению примера 435А (0,195 г) в тетрагидрофуране (3,0 мл) прибавляли N-этил-N-изопропилпропан-2-амин (0,512 мл) и перемешивали реакционную смесь при комнатной температуре. После перемешивания в течение шести часов реакционную смесь концентрировали, наносили на силикагель (Reveleris 40 г) и элюировали продукт с использованием градиента 25-100% этилацетат/гексан в течение 30 минут, получая указанное в заголовке соединение.
Пример 435С
Метиловый эфир 4-{4-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-[1-(2-триметилсиланилэтоксиметил)-1Н-индазол-4-илоксибензойной кислоты
Соединение примера 400D (1000 мг) растворяли в N,N-диметилформамиде (12 мл) и прибавляли гидрид нария (60% в минеральном масле, 45 мг). Раствор перемешивали при комнатной температуре в течение 15 минут, добавляли 2-(триметилсилил)этоксиметилхлорид (299 мг) и перемешивали раствор при комнатной температуре в течение 45 минут. Раствор прибавляли к воде и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали, концентрировали и очищали колоночной флэш-хроматографией на силикагеле с использованием 30-50% этилацетата в гексане.
Пример 435D
4-{4-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-[1-(2-триметилсиланилэтоксиметил)-1Н-индазол-4-илоксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 435С в примере 1E.
Пример 435Е
N-{4-{4-[2-(4-хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-[1-(2-триметилсиланилэтоксиметил)-1Н-индазол-4-илокси]бензоил}-4-[(R)-1-(2-фтор-1-фторметилэтил)пирролидин-3-иламино]-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 435D и соединение примера 1F соединением примера 435B в примере 1G.
Пример 435F
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}амино)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Соединение примера 435Е (103 мг) растворяли в трифторуксусной кислоте (1,8 мл) и воде (0,2 мл) и перемешивали при комнатной температуре в течение 90 минут. Растворители удаляли в вакууме, остаток растворяли в 1,4-диоксане (2 мл) и обрабатывали 1М гидроксидом натрия (1 мл) и перемешивали раствор при комнатной температуре в течение 30 минут. Раствор прибавляли к насыщенному водному раствору гидрокарбоната натрия и экстрагировали хлористым метиленом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и удаляли растворитель в вакууме.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,09 (уш.с, 1H), 8,37 (м, 2H), 7,84 (д, 1H), 7,58-7,45 (м, 2H), 7,36 (д, 2H), 7,17-7,03 (м, 4H), 6,95 (дд, 1H), 6,84-6,76 (м, 1H), 6,53 (дд, 1H), 6,17 (т, 1H), 4,72 (д, 2H), 4,56 (д, 2H), 4,23 (м, 1H), 3,17 (м, 4H), 3,12-3,03 (м, 2H), 3,02-2,91 (м, 2H), 2,86-2,73 (м, 4H), 2,40-2,14 (м, 6H), 1,97 (уш.с, 2H), 1,70 (м, 1H), 1,40 (т, 2H), 0,94 (с, 6H).
Пример 436
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{([4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид
Пример 436А
4-(1-Циклопропилпиперидин-4-иламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 1-циклопропилпиперидин-4-иламин в примере 189А.
Пример 436В
N-{4-{4-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-[1-(2-триметилсиланилэтоксиметил)-1Н-индазол-4-илокси]бензоил}-4-(1-циклопропилпиперидин-4-иламин)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 435D и соединение примера 1F соединением примера 436А в примере 1G.
Пример 436С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{(4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 435Е соединением примера 436В в примере 435F.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,05 (уш.с, 1H), 8,35 (д, 1H), 8,17 (д, 1H), 7,77 (уш.с, 1H), 7,57 (тд, 2H), 7,35 (д, 2H), 7,09-7,03 (м, 4H), 6,98 (д, 1H), 6,77 (дд, 1H), 6,48 (уш.с, 1H), 6,17 (м, 1H), 3,66 (м, 1H), 3,12 (уш.с, 4H), 2,92 (м, 2H), 2,76 (уш.с, 2H), 2,21 (м, 8H), 1,97 (уш.с, 2H), 1,94 (м, 2H), 1,73 (м, 1H), 1,55 (м, 2H), 1,40 (т, 2H), 0,93 (с, 6H), 0,46 (д, 2H), 0,35 (уш.с, 2H).
Пример 437
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Пример 437А
(R)-трет-бутил 2-((2-нитро-4-сульфамоилфениламино)метил)морфолин-4-карбоксилат
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на (R)-трет-бутил 2-(аминометил)морфолин-4-карбоксилат в примере 1F.
Пример 437В
(S)-4-(морфолин-2-илметиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 415А соединением примера 437А в примере 415В.
Пример 437С
(R)-4-((4-(2-диметиламино)ацетил)(морфолин-2-ил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 423В соединением примера 437В в примере 423С.
Пример 437D
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2R)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 437C в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,25 (с, 1H), 8,86 (т, 1H), 8,57 (с, 1H), 8,38 (т, 1H), 8,02 (д, 1H), 7,53 (д, 1H), 7,44 (д, 2H), 7,24 (м, 2H), 7,13 (д, 1H), 7,07 (д, 2H), 6,97 (дд, 1H), 6,73-6,68 (м, 2H), 4,75, 4,50 (дд, 1H), 4,33,4,02 (дд, 1H), 3,93 (м, 1H), 3,85-3,70 (м, 1H), 3,65-3,40 (м, 3H), 3,33 (дд, 1H), 3,25-3,10 (м, 2H), 3,03 (м, 4H), 2,90 (м, 1H), 2,77 (с, 2H), 2,27-2,25 (м, 8H), 2,14 (м, 4H), 1,97 (с, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 438
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Пример 438А
(S)-трет-бутил 2-((2-нитро-4-сульфамоил)фениламино)метил)морфолин-4-карбоксилат
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на (S)-трет-бутил 2-(аминометил)морфолин-4-карбоксилат в примере 1F.
Пример 438В
(S)-4-(морфолин-2-илметиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 415А соединением примера 438А в примере 415В.
Пример 438С
(S)-4-((4-(2-диметиламино)ацетил)(морфолин-2-ил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 423В соединением примера 438В в примере 423С.
Пример 438D
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[(2S)-4-(N,N-диметилглицил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 438C в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,25 (с, 1H), 8,86 (т, 1H), 8,57 (с, 1H), 8,38 (т, 1H), 8,02 (д, 1H), 7,53 (д, 1H), 7,44 (д, 2H), 7,24 (м, 2H), 7,13 (д, 1H), 7,07 (д, 2H), 6,97 (дд, 1H), 6,73-6,68 (м, 2H), 4,75, 4,50 (дд, 1H), 4,33,4,02 (дд, 1H), 3,93 (м, 1H), 3,85-3,70 (м, 1H), 3,65-3,40 (м, 3H), 3,33 (дд, 1H), 3,25-3,10 (м, 2H), 3,03 (м, 4H), 2,90 (м, 1H), 2,77 (с, 2H), 2,27-2,25 (м, 8H), 2,14 (м, 4H), 1,97 (с, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 439
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидрофуран-3-илметил)амино]фенил}сульфонил)бензамид
Пример 439А
3-Нитро-4-((тетрагидрофуран-3-ил)метиламино)бензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин на (тетрагидрофуран-3-ил)метиламин в примере 1F.
Пример 439В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидрофуран-3-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 439А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,26 (д, 1H), 8,70 (т, 1H), 8,57 (с, 1H), 8,40 (дд, 1H), 8,01 (д, 1H), 7,51 (д, 1H), 7,44 (д, 2H), 7,24 (м, 2H), 7,14 (д, 1H), 7,07 (д, 2H), 6,89 (д, 1H), 6,73-6,68 (м, 2H), 3,93-3,89 (м, 1H), 3,83 (дд, 1H), 3,83-3,68 (м, 2H), 3,33-3,23 (м, 2H), 3,03 (м, 4H), 2,77 (с, 2H), 2,55-2,50 (м, 1H), 2,25 (м, 2H), 2,14 (м, 4H), 2,00-1,93 (м, 3H), 1,65-1,58 (м, 1H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 440
Транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 311В в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,29 (д, 1H), 8,67 (т, 1H), 8,59 (с, 1H), 8,41 (дд, 1H), 7,99 (д, 1H), 7,52 (д, 1H), 7,43 (д, 2H), 7,24 (м, 1H), 7,17 (м, 1H), 7,07 (д, 2H), 6,90 (д, 1H), 6,72-6,68 (м, 2H), 5,97 (м, 2H), 3,29 (с, 3H), 3,14 (т, 2H), 3,02 (м, 5H), 2,76 (с, 2H), 2,25 (м, 2H), 2,13 (м, 4H), 2,07 (м, 2H), 1,97 (с, 2H), 1,82 (м, 2H), 1,57 (м, 1H), 1,38 (т, 2H), 1,22 (м, 2H), 1,01 (м, 2H), 0,94 (с, 6H).
Пример 441
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-фтортетрагидро-2Н-пиран-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 409D в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,27 (д, 1H), 8,84 (т, 1H), 8,57 (с,1H), 8,41 (дд, 1H), 7,99 (д, 1H), 7,52 (д, 1H), 7,43 (д, 2H), 7,23 (м, 1H), 7,15 (м, 1H), 7,14-7,02 (м, 3H), 6,70 (м, 2H), 6,49 (м, 2H), 3,86 (м, 2H), 3,76-3,69 (м, 3H), 3,65 (д, 1H), 3,03 (м, 4H), 2,76 (с, 2H), 2,25 (м, 2H), 2,14 (м, 4H), 1,97 (с, 2H), 1,92-1,76 (м, 4H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 442
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({5-фтор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 416D в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,02 (д, 1H), 8,59 (с, 1H), 8,35 (м, 1H), 8,01 (д, 1H), 7,51 (д, 1H), 7,44 (д, 2H), 7,22 (м, 2H), 7,12 (д, 1H), 7,07 (д, 2H), 6,84 (м, 1H), 6,73 (м, 2H), 4,59 (с, 1H), 4,54 (с, 1H), 3,89-3,74 (м, 4H), 3,05 (м, 4H), 2,78 (с, 2H), 2,26 (м, 2H), 2,16 (м, 4H), 2,02-1,81 (м, 6H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 443
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 404А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,12 (д, 1H), 8,68 (д, 1H), 8,59 (с, 1H), 7,99 (д, 1H), 7,52 (д, 1H), 7,44 (д, 2H), 7,24 (д, 1H), 7,15 (д, 1H), 7,07 (д, 2H), 6,73-6,69 (м, 3H), 6,56 (м, 1H), 4,56 (с, 1H), 4,51 (с, 1H), 3,91-3,76 (м, 4H), 3,04 (м, 4H), 2,77 (с, 2H), 2,26 (м, 2H), 2,15 (м, 4H), 1,99-1,85 (м, 6H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 444
N-{[5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}метокси]пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 444А
(R)-5-хлор-6-((1-(1,3-дифторпропан-2-ил)пирролидин-3-ил)метокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 422В соединением примера 445В в примере 434А.
Пример 444В
N-{[5-хлор-6-({(3R)-1-[2-фтор-1-(фторметил)этил]пирролидин-3-ил}метокси]пиридин-3-ил]сульфонил}-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 400Е и соединение примера 1F соединением примера 444A в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 12,98 (с, 1H), 8,19 (д, 1H), 7,81 (д, 1H), 7,73 (с, 1H), 7,66 (д, 1H), 7,35 (д, 2H), 7,05 (м, 4H), 6,73 (дд, 1H), 6,42 (д, 1H), 6,10 (м, 1H), 4,64 (с, 2H), 4,54 (д, 2H), 4,24 (м, 2H), 3,07 (с, 4H), 2,89 (с, 2H), 2,74 (м, 4H), 2,56 (м, 2H), 2,20 (м, 6H), 1,98 (м, 4H), 1,54 (м, 1H), 1,40 (т, 2H), 0,91 (с, 6H).
Пример 445
N-[(5-хлор-6-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 445A
(R)-трет-бутил 3-((3-хлор-5-сульфамоилпиридин-2-илокси)метил)пирролидин-1-карбоксилат
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол на (R)-трет-бутил 3-(гидроксиметил)пирролидин-1-карбоксилат в примере 387В.
Пример 445В
(R)-5-хлор-6-(пирролидин-3-илметокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 422А соединением примера 445А в примере 422В.
Пример 445С
(R)-5-хлор-6-((1-(2,2-дифторэтил)пирролидин-3-ил)метокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 422В соединением примера 445В в примере 422С.
Пример 445С
N-[(5-хлор-6-{[(3R)-1-(2,2-дифторэтил)пирролидин-3-ил]метокси}пиридин-3-ил)сульфонил]-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 400Е и соединение примера 1F соединением примера 445С в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 12,98 (с, 1H), 8,19 (д, 1H), 7,81 (д, 1H), 7,73 (с, 1H), 7,66 (д, 1H), 7,35 (д, 2H), 7,05 (м, 4H), 6,72 (дд, 1H), 6,41 (д, 1H), 6,10 (м, 2H), 4,23 (м, 2H), 3,07 (с, 4H), 2,82 (м, 5H), 2,62 (м, 3H), 2,24 (с, 4H), 2,17 (с, 2H), 1,94 (м, 3H), 1,53 (м, 1H), 1,40 (т, 2H), 0,93 (с, 6H).
Пример 446
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 446А
2-[1-(2-Триметилсиланилэтоксиметил)-1Н-индазол-4-илокси]-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-N-(4-((транс-4-метоксициклогексил)метиламино)-3-нитрофенилсульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 435D и соединение примера 1F соединением примера 311B в примере 1G.
Пример 446В
Транс-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)-N-[(4-{[(4-метоксициклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 435Е соединением примера 446А в примере 435F.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,08 (уш.с, 1H), 8,53 (т, 1H), 8,37 (д, 1H), 7,84 (д, 1H), 7,53 (м, 2H), 7,35 (д, 2H), 7,09 (д, 2H), 7,05 (д, 2H), 6,94 (д, 1H), 6,79 (м, 1H), 6,51 (дд, 1H), 6,18 (м, 1H), 3,23 (с, 3H), 3,17-3,00 (м, 5H), 2,78 (уш.с, 2H), 2,30-2,13 (м, 8H), 2,02 (м, 2H), 1,97, (уш.с, 2H), 1,80 (м, 2H), 1,60 (м, 1H), 1,40 (т, 2H), 1,07 (м,4H), 0,93 (с, 6H).
Пример 447
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Пример 447А
N-{4-{4-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-[1-(2-триметилсиланилэтоксиметил)-1Н-индазол-4-илокси]бензоил}-4([1,4]диоксан-2-илметокси)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 435D и соединение примера 1F соединением примера 297А в примере 1G.
Пример 447В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-(1,4-диоксан-2-илметокси)-3-нитрофенил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 435Е соединением примера 447А в примере 435F.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,04 (уш.с, 1H), 8,07 (уш.с, 1H), 7,78 (т, 2H), 7,59 (д, 1H), 7,36 (д, 2H), 7,25 (д, 1H), 7,08 (д, 2H), 7,06 (д, 2H), 6,77 (д, 1H), 6,48 (уш.с, 1H), 6,15 (м, 1H), 4,20 (т, 2H), 3,92-3,76 (м, 3H), 3,65 (м, 2H), 3,48 (тд, 2H), 3,14 (уш.с, 4H), 2,80 (м, 2H), 2,38-2,13 (м, 6H), 1,97 (уш.с, 2H), 1,40 (т, 2H), 0,94 (с, 6H).
Пример 448
N-({5-Хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 448А
Амид 5-хлор-6-(1-циклопропилпиперидин-4-иламино)пиридин-3-сульфокислоты
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на 1-циклопропилпиперидин-4-иламин и 4-хлор-3-нитробензолсульфонамид на соединение примера 387А в примере 189А.
Пример 448В
4-{4-[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-енилметил]пиперазин-1-ил}-2-[1-(2-триметилсиланилэтоксиметил)-1Н-индазол-4-илокси]бензоиламид 5-хлор-6-(1-циклопропилпиперидин-4-иламино)пиридин-3-сульфокислоты
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 435D и соединение примера 1F соединением примера 448А в примере 1G.
Пример 448С
N-({5-Хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 435Е соединением примера 448В в примере 435F.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,03 (уш.с, 1H), 8,18 (д, 1H), 7,79 (уш.с, 1H), 7,65-7,58 (м, 2H), 7,36 (д, 2H), 7,33 (м, 1H), 7,10 (д, 2H), 7,06 (д, 2H), 6,74 (дд, 1H), 6,43 (уш.с, 1H), 6,19 (м, 1H), 3,95 (м, 1H), 3,08 (м, 4H), 2,96 (м, 2H), 2,75 (уш.с, 2H), 2,37-2,10 (м, 9H), 1,97 (уш.с, 2H), 1,78 (м, 2H), 1,56 (м, 2H), 1,40 (т, 2H), 0,93 (с, 6H), 0,42 (д, 2H), 0,33 (уш.с, 2H).
Пример 449
2-(1Н-бензимидазол-4-илокси)-N-({5-Хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Пример 449А
5-Хлор-6-(1-циклопропилпиперидин-4-иламино)пиридин-3-сульфонамид
Смесь соединения примера 387А (0,4 г), 1-циклопропилпиперидин-4-амина (0,3 г) и N,N-диизопропилэтиламина (0,37 мл) в диоксане (3 мл) нагревали при 100°С в течение 18 часов. Сырой продукт выделяли концентрированием и очищали на силикагеле, с которого элюировали этилацетатом, получая указанное в заголовке соединение.
Пример 449В
2-(1Н-бензимидазол-4-илокси)-N-({5-Хлор-6-[(1-циклопропилпиперидин-4-ил)амино]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 449А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,22 (м, 1H), 8,55 (с, 1H), 8,47 (с, 1H), 8,00 (д, 1H), 7,54 (д, 1H), 7,44 (д, 2H), 7,25 (м, 1H), 7,19 (м, 1H), 7,07 (д, 2H), 7,01 (м, 1H), 6,68 (м, 2H), 5,35 (м, 2H), 4,22 (м, 1H), 3,04-2,95 (м, 6H), 2,77 (с, 2H), 2,29-2,24 (м, 4H), 2,14 (м, 4H), 2,03 (м, 2H), 1,97 (с, 2H), 1,70 (м, 2H), 1,52 (м, 1H), 1,38 (т, 2H), 0,94 (с, 6H), 0,35 (м, 4H).
Пример 450
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1,4-диоксан-2-илметил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 336А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,24 (м, 1H), 8,81 (м, 1H), 8,56 (с, 1H), 8,37 (дд, 1H), 8,03 (д, 1H), 7,52 (д, 1H), 7,44 (д, 2H), 7,21 (м, 1H), 7,11 (м, 1H), 7,07 (д, 2H), 6,92 (д, 1H), 6,71 (м, 2H), 5,33 (м, 2H), 3,94 (м, 2H), 3,78 (м, 1H), 3,73-3,66 (м, 2H), 3,58 (м, 1H), 3,51-3,36 (м, 3H), 3,03 (м, 4H), 2,77 (с, 2H), 2,26 (м, 2H), 2,15 (м, 4H), 1,97 (с, 2H), 1,39 (т, 2H), 0,94 (с, 6H).
Пример 451
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 451А
4-(1-Циклопропилпиперидин-4-иламино)-3-нитробензолсульфонамид
К раствору 4-фтор-3-нитробензолсульфонамида (1,26 г) и 1-циклопропилпиперидин-4-амина (0,802 г) в тетрагидрофуране (20 мл) прибавляли N,N-диизопропилэтиламин (2,22 г) и 4-диметиламинопиридин (35 мг). Смесь нагревали при кипении с обратным холодильником в течение 18 часов и разбавляли этилацетатом (200 мл) и водным NaHCO3. Сырой продукт выделяли концентрированием органического слоя и очищали на силикагеле, с которого элюировали 5% метанольным аммиаком в метиленхлориде, получая указанное в заголовке соединение.
Пример 451В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(1-циклопропилпиперидин-4-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 451А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,26 (м, 1H), 8,59 (с, 1H), 8,46 (д, 1H), 8,42 (дд, 1H), 8,01 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (д, 1H), 7,17 (д, 1H), 7,07 (д, 2H), 6,96 (д, 1H), 6,72-6,67 (м, 2H), 5,48 (м, 2H), 3,54 (м, 1H), 3,03 (м, 4H), 2,90 (м, 2H), 2,76 (с, 2H), 2,37 (м, 2H), 2,25 (м, 2H), 2,14 (м, 4H), 1,98-1,91 (м, 4H), 1,56 (м, 3H), 1,38 (т, 2H), 0,94 (с, 6H), 0,42 (м, 4H).
Пример 452
Транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-морфолин-4-илциклогексил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 204А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,27 (м, 1H), 8,59 (с, 1H), 8,42 (дд, 1H), 8,36 (д, 1H), 8,01 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 1H), 7,17 (м, 1H), 7,07 (д, 2H), 6,95 (д, 1H), 6,71 (д, 2H), 6,33 (м, 2H), 3,76 (м, 4H), 3,40 (м, 1H), 3,03 (м, 4H), 2,76 (с, 2H), 2,52 (м, 4H), 2,25 (м, 3H), 2,14 (м, 4H), 2,07 (м, 2H), 1,97 (м, 2H), 1,89 (м, 2H), 1,42-1,21 (м, 6H), 0,94 (с, 6H).
Пример 453
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[(4-метилпиперазин-1-ил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 174А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,25 (м, 2H), 8,59 (с, 1H), 8,44 (м, 1H), 8,00 (д, 1H), 7,68 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 1H), 7,17 (м, 1H), 7,06 (д, 2H), 6,72-6,67 (м, 2H), 6,36 (м, 1H), 2,02 (м, 4H), 2,93 (м, 4H), 2,76 (с, 2H), 2,74-2,61 (м, 2H), 2,35-2,22 (м, 5H), 2,19 (с, 3H), 2,16-2,10 (м, 4H), 1,97 (м, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 454
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(1-метилпиперидин-4-ил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 88А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,28 (м, 1H), 8,66 (м, 1H), 8,58 (с, 1H), 8,40 (дд, 1H), 8,02 (д, 1H), 7,53 (д, 1H), 7,44 (д, 2H), 7,24 (м, 1H), 7,15 (м, 1H), 7,07 (д, 2H), 6,89 (д, 1H), 6,73-6,69 (м, 2H), 5,86 (м, 2H), 3,17 (т, 2H), 3,01-3,04 (м, 4H), 2,86 (м, 2H), 2,77 (с, 2H), 2,25 (м, 5H), 2,14 (м, 4H), 1,96-1,97 (с, 2H), 1,92 (м, 2H), 1,70 (м, 2H), 1,60 (м, 1H), 1,48-1,37 (м, 4H), 0,94 (с, 6H).
Пример 455
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[({(2R)-4-[2-(2-метоксиэтокси)этил]морфолин-2-ил}метил)амино]-3-нитрофенил}сульфонил)бензамид
Пример 455А
(R)-4-((4-(2-(2-метоксиэтокси)этил)морфолин-2-ил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 415В соединением примера 437В и 2,2-дифторэтилйодид 2-(2-метоксиэтокси)этилбромидом в примере 415С.
Пример 455В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({4-[({(2R)-4-[2-(2-метоксиэтокси)этил]морфолин-2-ил}метил)амино]-3-нитрофенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 455А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,24 (д, 1H), 8,85 (т, 1H), 8,56 (с, 1H), 8,36 (дд, 1H), 8,03 (д, 1H), 7,51 (д, 1H), 7,44 (д, 2H), 7,24 (м, 2H), 7,12 (д, 1H), 7,07 (д, 2H), 6,91 (д, 1H), 6,73-6,68 (м, 2H), 3,93-3,86 (м, 2H), 3,72-3,61 (м, 5H), 3,53 (м, 2H), 3,48-3,40 (м, 2H), 3,28 (с, 3H), 3,03 (м, 4H), 2,95 (д, 1H), 2,77 (с, 2H), 2,70 (д, 1H), 2,69 (т, 2H), 2,27-2,10 (м, 8H), 1,97 (с, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 456
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4,4-дифторциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 412С в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,29 (д, 1H), 8,73 (т, 1H), 8,58 (с, 1H), 8,42 (дд, 1H), 7,99 (д, 1H), 7,52 (д, 1H), 7,43 (д, 2H), 7,24 (м, 2H), 7,17 (д, 1H), 7,07 (д, 2H), 6,94 (д, 1H), 6,72 (д, 1H), 6,69 (дд, 1H), 3,22 (т, 2H), 3,03 (м, 4H), 2,76 (с, 2H), 2,25 (м, 2H), 2,13 (м, 6H), 1,97 (с, 2H), 1,85-1,70 (м, 5H), 1,38 (т, 2H), 1,36-1,33 (м, 2H), 0,94 (с, 6H).
Пример 457
N-[(4-{[(4-ацетилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Пример 457А
4-((4-Ацетилморфолин-2-ил)метиламино)-3-нитробензолсульфонамид
Раствор соединения примера 415В (145 мг) и N-этил-N-изопропилпропан-2-амина (120 мкл) в безводном хлористом метилене (5 мл) и N,N-диметилформамиде (2 мл) охлаждали на бане со льдом с прибавляли по каплям уксусный ангидрид (56 мкл). Смесь перемешивали при комнатной температуре в течение 3 часов и концентрировали досуха. Остаток растирали с водой. Полученное твердое вещество сушили в вакууме, получая указанное в заголовке соединение.
Пример 457В
N-[(4-{[(4-ацетилморфолин-2-ил)метил]амино}-3-нитрофенил)сульфонил]-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 457А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,24 (д, 1H), 8,83 (т, 1H), 8,56 (с, 1H), 8,38 (дд, 1H), 8,03 (д, 1H), 7,51 (д, 1H), 7,43 (д, 2H), 7,24 (м, 2H), 7,09 (д, 1H), 7,07 (д, 2H), 6,91 (дд, 1H), 6,72 (м, 2H), 3,89 (м, 1H), 3,80-3,70 (м, 1H), 3,60-3,40 (м, 4H), 3,06 (м, 1H), 3,03 (м, 4H), 2,77 (с, 2H), 2,70 (м, 1H), 2,26 (м, 2H), 2,18-2,13 (м, 5H), 2,09 (с, 3H), 1,97 (с, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 458
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(метилсульфонил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Пример 458А
4-((4-(Метилсульфонил)морфолин-2-ил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя уксусный ангидрид на метансульфонилхлорид в примере 457А.
Пример 458В
2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[4-({[4-(метилсульфонил)морфолин-2-ил]метил}амино)-3-нитрофенил]сульфонил}бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 458А в примере 428E.1H ЯМР (500 МГц, пиридин-d5) δ 9,23 (д, 1H), 8,85 (т, 1H), 8,57 (с, 1H), 8,37 (дд, 1H), 8,01 (д, 1H), 7,52 (д, 1H), 7,43 (д, 2H), 7,24 (м, 2H), 7,15 (д, 1H), 7,07 (д, 2H), 6,97 (д, 1H), 6,72 (м, 2H), 4,00-3,90 (м, 3H), 3,68-3,59 (м, 3H), 3,58-3,48 (м, 1H), 3,06-3,02 (м, 7H), 2,98-2,89 (м, 2H), 2,77 (с, 2H), 2,25 (м, 2H), 2,14 (м, 4H), 1,97 (с, 2H), 1,38 (т, 2H), 0,94 (с, 6H).
Пример 459
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-({4-фтор-1-[2-фтор-1-(фторметил)этил]пиперидин-4-ил}метокси)-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Пример 459А
Трет-бутил 4-фтор-4-((5-сульфамоил-3-(трифторметил)пиридин-2-илокси)метил)пиперидин-1-карбоксилат
Соединение данного примера получали, заменяя соединение примера 329А соединением примера 410Е и (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 419А в примере 329В.
Пример 459В
6-((4-Фторпиперидин-4-ил)метокси)-5-(трифторметил)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 422А соединением примера 459А в примере 422В.
Пример 459С
6-((1-(1,3-Дифторпропан-2-ил)-4-фторпиперидин-4-ил)метокси)-5-(трифторметил)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 422В соединением примера 459В в примере 434А.
Пример 459D
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[6-({4-фтор-1-[2-фтор-1-(фторметил)этил]пиперидин-4-ил}метокси)-5-(трифторметил)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 26С соединением примера 400Е и соединение примера 1F соединением примера 459С в примере 177.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 12,94 (д, 1H), 8,40 (д, 1H), 8,11 (д, 1H), 7,68 (м, 2H), 7,35 (д, 2H), 7,06 (д, 2H), 6,99 (д, 2H), 6,71 (дд, 1H), 6,39 (д, 1H), 6,06 (т, 1H), 4,67 (д, 2H), 4,55 (д, 2H), 4,47 (д, 2H), 3,07 (м, 5H), 2,74 (м, 6H), 2,19 (м, 6H), 1,90 (м, 6H), 1,40 (т, 2H), 0,93 (с, 6H).
Пример 460
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Указанное в заголовке соединение получали, как описано в примере 177, заменяя соединение примера 26С соединением примера 18G.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 12,87 (с, 1H), 11,60 (с, 1H), 8,58 (с, 1H), 8,47 (д, 1H), 8,11 (с, 1H), 7,81-7,91 (м, 1H), 7,76 (дд, 1H), 7,59-7,66 (м, 1H), 7,48 (д, 1H), 7,34 (д, 2H), 7,00-7,11 (м, 5H), 6,73 (дд, 1H), 6,67 (дд, 1H), 6,08 (д, 1H), 3,85 (дд, 2H), 3,20-3,30 (м, 4H), 3,04 (с, 4H), 2,77 (с, 2H), 2,17 (д, 6H), 1,96 (с, 2H), 1,81-1,92 (м, 1H), 1,55-1,66 (м, 2H), 1,39 (т, 2H), 1,17-1,32 (м, 2H), 0,93 (с, 6H).
Пример 461
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(2-тетрагидрофуран-2-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Пример 461А
5-Хлор-6-(2-(тетрагидрофуран-2-ил)этокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 329А соединением примера 387А и (тетрагидро-2Н-пиран-4-ил)метанол на 2-(тетрагидрофуран-2-ил)этанол в примере 329В.
Пример 461В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-хлор-6-(2-тетрагидрофуран-2-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 461А и соединение примера 26С соединением примера 400Е в примере 177.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,08 (с, 1H), 8,27 (д, J=2,17 Гц, 1H), 7,83 (д, J=1,83 Гц, 1H), 7,80 (с, 1H), 7,58 (д, J=8,85 Гц, 1H), 7,36 (д, J=8,54 Гц, 2H), 7,03-7,10 (м, 4H), 6,79 (дд, J=9, 2,29 Гц, 1H), 6,54 (д, J=1,53 Гц, 1H), 6,13 (д, J=7,02 Гц, 1H), 4,41-4,47 (м, 2H), 3,91-3,94 (м, 1H), 3,71-3,80 (м, 1H), 3,56-3,63 (м, 2H), 3,25 (уш.с, 2H), 2,33 (уш.с, 2H), 2,16-2,18 (м, 2H), 1,92-2,01 (м, 5H), 1,80-1,86 (м, 2H), 1,47-1,53 (м, 1H), 1,42 (т, J=6,26 Гц, 2H), 0,94 (с, 6H).
Пример 462
Транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-цианоциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 462А
2-(Транс-4-(аминометил)циклогексил)ацетонитрил
К раствору трет-бутил (транс-4-(цианометил)циклогексил)метилкарбамата (500 мг) в хлористом метилене (5 мл) медленно прибавляли трифторуксусную кислоту (3 мл) при 0°С. Смесь нагревали до комнатной температуры, перемешивали в течение 1 часа. Указанное в заголовке соединение получали концентрированием.
Пример 462В
4-((Транс-4-цианоциклогексил)метиламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя (тетрагидропиран-4-ил)метиламин соединением примера 462А в примере 1F.
Пример 462С
Транс-2-(1Н-бензимидазол-4-илокси)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-[(4-{[(4-цианоциклогексил)метил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 462В в примере 428Е.1H ЯМР (500 МГц, пиридин-d5) δ 9,29 (д, 1H), 8,67 (т, 1H), 8,59 (с, 1H), 8,41 (дд, 1H), 7,98 (д, 1H), 7,53 (д, 1H), 7,43 (д, 2H), 7,25 (м, 1H), 7,19 (м, 1H), 7,07 (д, 2H), 6,91 (д, 1H), 6,73-6,68 (м, 2H), 5,24 (м, 2H), 3,13 (т, 2H), 3,03 (м, 4H), 2,76 (с, 2H), 2,43 (м, 1H), 2,25 (м, 2H), 2,13 (м, 4H), 1,99-1,94 (м, 4H), 1,77 (м,H), 1,59 (м, 1H), 1,46 (м, 2H), 1,38 (т, 2H), 0,99-0,90 (м, 8H).
Пример 463
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4,4-дифторциклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Пример 463А
(4,4-Дифторциклогексил)метанол
К суспензии алюмогидрида лития (0,24 г) в диэтиловом эфире (15 мл) прибавляли по каплям этил 4,4-дифторциклогексанкарбоксилат (1,0 г) в диэтиловом эфире (2 мл). Реакционную смесь нагревали при кипении в атмосфере азота в течение 4 часов. Реакционную смесь охлаждали до 0°С, после чего осторожно добавляли воду (0,24 мл), 4N NaOH (0,24 мл) и воду (0,72 мл). Реакционную смесь разбавляли диэтиловым эфиром (40 мл) и перемешивали с сульфатом натрия в течение 30 минут. Смесь фильтровали через диатомовую землю, а фильтрат концентрировали, получая указанное в заголовке соединение.
Пример 463В
5-Хлор-6-(4,4-дифторциклогексил)метокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 463А и соединение примера 329А соединением примера 387А в примере 329В.
Пример 463С
2-(1Н-бензимидазол-4-илокси)-N-({5-хлор-6-[(4,4-дифторциклогексил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 428D соединением примера 463В в примере 428Е.1H ЯМР (500 МГц, пиридин-d5) δ 9,15 (д, 1H), 8,69 (м, 1H), 8,59 (с, 1H), 7,99 (д, 1H), 7,53 (д, 1H), 7,44 (д, 2H), 7,24 (м, 1H), 7,16 (м, 1H), 7,07 (д, 2H), 6,70 (м, 2H), 5,45 (м, 2H), 4,22 (д, 2H), 3,04 (м, 4H), 2,77 (с, 2H), 2,26 (м, 2H), 2,16-2,08 (м, 6H), 1,97 (с, 2H), 1,86-1,68 (м, 5H), 1,47-1,36 (м, 4H), 0,94 (м, 6H).
Пример 464
N-({3-Хлор-4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 464А
3-Хлор-4-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)бензолсульфонамид
Соединение данного примера получали, заменяя соединение примера 329А 3,4-дихлорбензолсульфонамидом и (тетрагидро-2Н-пиран-4-ил)метанол соединением примера 306С в примере 329В.
Пример 464В
N-(3-Хлор-4-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)фенилсульфонил)-4-(4-((2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метил)пиперазин-1-ил)-2-(1-((2-(триметилсилил)этокси)метил)-1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 435D и соединение примера 1F соединением примера 464A в примере 1G.
Пример 464С
N-({3-Хлор-4-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]фенил}сульфонил)-4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 435Е соединением примера 464В в примере 435F.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 13,15 (с, 1H), 11,74-11,31 (м, 1H), 7,85 (с, 1H), 7,67 (д, 1H), 7,62-7,49 (м, 2H), 7,35 (д, 2H), 7,22-7,09 (м, 3H), 7,05 (д, 2H), 6,80 (д, 1H), 6,53 (с, 1H), 6,23 (д, 1H), 4,26 (д, 2H), 3,79 (д, 2H), 3,62 (дд, 2H), 3,17 (с, 4H), 2,77 (д, 2H), 2,22 (д, 6H), 1,88 (дд, 6H), 1,40 (т, 2H), 0,94 (с, 6H).
Пример 465
N-({5-Хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Пример 465А
Метил 2-(1Н-индазол-4-илокси)-4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)бензоат
Соединение данного примера получали, заменяя трет-бутил пиперазин-1-карбоксилат соединением примера 400С и соединение примера 27С соединением примера 145Е в примере 1А.
Пример 465В
Метил 4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1-((2-(триметилсилил)этокси)метил)-1Н-индазол-4-илокси)бензоат
Соединение данного примера получали, заменяя соединение примера 400D соединением примера 465А в примере 435С.
Пример 465С
4-(4-((4-(4-Хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1-((2-(триметилсилил)этокси)метил)-1Н-индазол-4-илокси)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 175D соединением примера 465В в примере 175Е.
Пример 465D
N-(5-Хлор-6-((4-фтортетрагидро-2Н-пиран-4-ил)метокси)пиридин-3-илсульфонил)-4-(4-((4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил)метил)пиперазин-1-ил)-2-(1-((2-(триметилсилил)этокси)метил)-1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 465C и соединение примера 1F соединением примера 404A в примере 27H.
Пример 465Е
N-({5-Хлор-6-[(4-фтортетрагидро-2Н-пиран-4-ил)метокси]пиридин-3-ил}сульфонил)-4-(4-{[4-(4-хлорфенил)-6,6-диметил-5,6-дигидро-2Н-пиран-3-ил]метил}пиперазин-1-ил)-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 435Е соединением примера 465D в примере 435F, за исключением того, что в данном случае конечное соединение очищали препаративной ВЭЖХ с использованием колонки С18, 250×50 мм, 10 мкм, и элюировали с градиентом 20-100% CH3CN vs. 0,1% трифторуксуной кислоты в воде, с последующей колоночной хроматографией, элюируя смесью 98/2 хлористый метилен/метанол.1Н ЯМР (400 МГц, диметилсульфоксид-d6) δ 13,13 (с, 1H), 8,28 (д, 1H), 7,90 (д, 1H), 7,83 (с, 1H), 7,58 (д, 1H), 7,39 (д, 2H), 7,17 (д, 2H), 7,08 (м, 2H), 6,82 (дд, 1H), 6,57 (д, 1H), 6,14 (д, 1H), 4,52 (д, 2H), 4,15 (с, 2H), 3,80 (м, 2H), 3,60 (м, 2H), 3,20 (очень ш.м, 4H), 2,98 (очень ш.с, 2H), 2,35 (очень ш.м, 4H), 2,18 (с, 2H), 1,87 (м, 4H), 1,20 (с, 6H).
Пример 466
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-тетрагидро-2Н-пиран-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Пример 466А
5-Бром-6-(2-(тетрагидро-2Н-пиран-4-ил)этокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя (тетрагидро-2Н-пиран-4-ил)метанол на 2-(тетрагидро-2Н-пиран-4-ил)этанол в примере 329В.
Пример 466В
5-Циано-6-(2-(тетрагидро-2Н-пиран-4-ил)этокси)пиридин-3-сульфонамид
Соединение данного примера получали, заменяя соединение примера 329А соединением примера 466А в примере 333А.
Пример 466С
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-{[5-циано-6-(2-тетрагидро-2Н-пиран-4-илэтокси)пиридин-3-ил]сульфонил}-2-(1Н-индазол-4-илокси)бензамид
Соединение данного примера получали, заменяя соединение примера 1F соединением примера 466В и соединение примера 26С соединением примера 400Е в примере 177С.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 13,04 (с, 1H), 8,48 (д, 1H), 8,13 (с, 1H), 7,75 (с, 1H), 7,62 (д, 1H), 7,37 (д, 2H), 7,01-7,08 (м, 4H), 6,76 (дд, 1H), 6,51 (д, 1H), 6,08 (д, 1H), 4,47 (т, 2H), 3,81-3,85 (м, 2H), 3,71-3,80 (м, 1H), 2,18 (м, 2H), 1,99 (м, 2H), 1,62-1,72 (м, 5H), 1,42 (т, 2H), 1,23 (м, 2H), 0,94 (с, 6H).
Пример 467
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Пример 467А
4-((1R,3R,5S)-8-метил-8-азабицикло[3.2.1]октан-3-иламино)-3-нитробензолсульфонамид
Соединение данного примера получали, заменяя 1-(2-метоксиэтил)пиперидин-4-иламин на (1R,3R,5S)-8-метил-8-азабицикло[3.2.1]октан-3-амин в примере 189А.
Пример 467В
4-(4-{[2-(4-Хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-2-(1Н-индол-5-илокси)-N-[(4-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}-3-нитрофенил)сульфонил]бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 26С и соединение примера 1F соединением примера 467А в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,47 (уш.с, 1H), 11,17 (с, 1H), 9,43 (уш.с, 1H), 8,69 (д, 1H), 8,62 (д, 1H), 7,90 (дд, 1H), 7,52 (д, 1H), 7,40 (м, 3H), 7,15 (д, 1H), 7,06 (м, 3H), 6,85 (дд, 1H), 6,68 (м, 1H), 6,39 (т, 1H), 6,19 (уш.с, 1H), 4,01 (м, 1H), 3,91 (м, 2H), 3,58 (м, 3H), 3,01 (м, 3H), 2,73 (м, 5H), 2,32 (м, 6H), 2,16 (м, 6H), 2,0 (м, 2H), 1,45 (м, 2H), 0,94 (с, 6H).
Пример 468
N-({3-Нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропаноил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид
Пример 468А
Метил 2-фенокси-4-(1,4-диокса-8-азаспиро[4.5]декан-8-ил)бензоат
1,4-Диокса-8-азаспиро[4.5]декан (1,18 г), метил 4-фтор-2-феноксибензоат (1,85 г) и К2СО3 (1,14 г) перемешивали при 125°С в диметилсульфоксиде (25 мл) в течение 24 часов. Смесь охлаждали, выливали в 300 мл воды, экстрагировали три раза эфиром, а эфирные экстракты объединяли, три раза промывали водой и насыщенным раствором соли и концентрировали. Остаток хроматографировали на силикагеле с использованием 10-30% этилацетата в гексанах в качестве элюента, получая указанное в заголовке соединение.
Пример 468В
Метил-4-(4-оксопиперидин-1-ил)-2-феноксибензоат
Соединение примера 468А (23,7 г) нагревали при 80°С в смеси уксусной кислоты (30 мл), тетрагидрофурана (40 мл) и воды (30 мл) в течение 24 часов. Смесь охлаждали и концентрировали. Сырой продукт хроматографировали на силикагеле, используя в качестве элюента 25% этилацетат в гексанах, с получением указанного в заголовке соединения.
Пример 468С
Метил 2-фенокси-4-(4-((1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гептан-3-иламино)пиперидин-1-ил)бензоат
Соединение примера 468В (0,99 г) и (1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гептан-3-амин (0,51 мл) кипятили с обратным холодильником в 200 мл метанола с насадкой Дина-Старка в течение 24 часов. Растворитель упаривали до объема 75 мл и охлаждали смесь до комнатной температуры. Прибавляли NaBH4 (0,115 г) и перемешивали смесь в течение 30 минут. Реакционную смесь гасили 10 мл воды, частично концентрировали и хроматографировали на силикагеле с использованием 1% триэтиламина в этилацетате в качестве элюента, получая указанное в заголовке соединение.
Пример 468D
Метил 2-фенокси-4-(4-(3-фенил-N-((1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гептан-3-ил)пропанамидо)пиперидин-1-ил)бензоат
Смесь соединения примера 468С (320 мг), 3-фенилпропаноилхлорида (0,113 мл) и триэтиламина (0,116 мл) перемешивали в хлористом метилене (15 мл) в течение 24 часов. Реакционную смесь частично концентрировали и хроматографировали остаток на силикагеле с использованием 20% этилацетата в гексане в качестве элюента, получая указанное в заголовке соединение.
Пример 468Е
2-Фенокси-4-(4-(3-фенил-N-((1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гептан-3-ил)пропанамидо)пиперидин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 468D в примере 1E.
Пример 468F
N-({3-Нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропаноил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 468Е в примере 1G.1Н ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,32 (м, 2H), 7,64 (м, 2H), 7,11-7,29 (м, 6H), 6,95 (дд, 1H), 6,89 (дд, 1H), 6,70 (м, 3H), 6,32 (м, 1H), 3,85 (м, 3H), 3,70 (м, 3H), 2,91 (м, 6H), 2,65-2,80 (м, 6H), 1,91 (с, 6H), 1,61 (м, 4H), 1,16-1,36 (м, 4H), 1,11 (м, 6H), 0,95 (м, 4H), 0,87 (д, 2H).
Пример 469
N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропаноил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 468Е и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,72 (м, 1H), 8,44 (д, 1H), 7,73 (дд, 1H), 7,54 (м, 1H), 7,12-7,28 (м, 6H), 7,05 (дд, 1H), 6,95 (дд, 1H), 6,82 (д, 1H), 6,74 (м, 2H), 6,34 (м, 1H), 3,77 (м, 2H), 3,63 (м, 4H), 3,10 (м, 4H), 3,05 (м, 4H), 2,78 (м, 6H), 1,75-2,10 (м, 8H), 1,55 (м, 2H), 1,40 (м, 2H), 1,19 (м, 6H), 1,01 (м, 2H), 0,95 (м, 2H), 0,88 (д, 2H).
Пример 470
N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид
Пример 470А
Метил 2-фенокси-4-(4-((3-фенилпропил)((1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гептан-3-ил)амино)пиперидин-1-ил)бензоат
Соединение примера 468С (320 мг), 3-фенилпропаналь (111 мг) и NaBH(OAc)3 (205 мг) перемешивали в хлористом метилене (15 мл) в течение 24 часов. Реакционную смесь хроматографировали на силикагеле с использованием 20% этилацетата в гексане в качестве элюента, получая указанное в заголовке соединение.
Пример 470В
2-Фенокси-4-(4-((3-фенилпропил)((1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гептан-3-ил)амино)пиперидин-1-ил)бензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 470A в примере 1Е.
Пример 470С
N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 470В в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,57 (м, 1H), 8,47 (д, 1H), 7,50 (м, 1H), 7,32 (м, 1H), 7,12-7,31 (м, 7H), 6,99 (дд, 1H), 6,81 (м, 3H), 6,37 (д, 1H), 4,44 (т, 1H), 3,84 (м, 4H), 3,37 (м, 2H), 3,25 (м, 2H), 3,06 (м, 2H), 2,70 (м, 4H), 2,57 (м, 4H), 1,82 (м, 2H), 1,77 (м, 4H), 1,52-1,71 (м, 8H), 1,25 (м, 3H), 1,15 (с, 3H), 0,95 (д, 2H), 0,93 (с, 3H), 0,74 (д, 2H).
Пример 471
N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-фенокси-4-(4-{(3-фенилпропил)[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]амино}пиперидин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 470В и соединение примера 1F соединением примера 7A в примере 1G.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 8,68 (м, 1H), 8,40 (д, 1H), 7,70 (дд, 1H), 7,55 (д, 1H), 7,11-7,29 (м, 7H), 7,01 (дд, 1H), 6,95 (дд, 1H), 6,76 (д, 2H), 6,34 (м, 1H), 3,75 (м, 2H), 3,61 (м, 4H), 3,43 (м, 4H), 3,05 (м, 6H), 2,75 (м, 2H), 2,60 (м, 2H), 2,41 (м, 4H), 2,15 (м, 1H), 1,82 (м, 4H), 1,69 (м, 2H), 1,51 (м, 1H), 1,18 (м, 8H), 0,96 (м, 1H), 0,94 (с, 3H).
Пример 472
4-[4-(2-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}бензил)пиперазин-1-ил]-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Пример 472А
Этил 4-фтор-2-феноксибензоат (600 мг) и пиперазин (596 мг) растворяли в безводном диметилсульфоксиде и нагревали при 130°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали, получая указанное в заголовке соединение.
Пример 472В
Соединение примера 472А (400 мг), 1-(бромметил)-2-нитробензол (277 мг) и карбонат натрия (408 мг) суспендировали в безводном N,N-диметилформамиде (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь разбавляли этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате очистки флэш-хроматографией на колонке с использованием 10-40% смеси этилацетат/гексан получали указанное в заголовке соединение.
Пример 472С
Раствор соединения примера 472В (0,6 г) в метаноле (20 мл) прибавляли к промытому растворителем Ra-Ni (0,480 г) в сосуде для работы под давлением на 250 мл и перемешивали в течение 3 часов при 30 фунтах/кв. дюйм при комнатной температуре. Смесь фильтровали через нейлоновую мембрану и концентрировали, получая продукт.
Пример 472D
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид на (1R,5S)-8-метил-8-азабицикло[3.2.1]октан-3-он и трет-бутилпиперазин-1-карбоксилат на соединение примера 472С в примере 1А.
Пример 472Е
Соединение данного примера получали, заменяя соединение примера 175D соединением примера 472D в примере 175Е.
Пример 472F
4-[4-(2-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}бензил)пиперазин-1-ил]-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 472Е и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,66 (уш.с, 1H), 9,90 (уш.с, 1H), 9,56 (с, 1H), 8,69 (т, 1H), 8,50 (д, 1H), 7,81 (дд, 1H), 7,54 (д, 1H), 7,22 (м, 5H), 7,01 (м, 1H), 6,83 (м, 3H), 6,47 (с, 1H), 3,84 (м, 4H), 3,65 (д, 6H), 3,54 (м, 4H), 3,43 (м, 2H), 3,19 (м, 8H), 2,68 (д, 3H), 2,34 (м, 2H), 2,25 (м, 4H), 1,99 (м, 4H).
Пример 473
4-[4-(2-{[(1R,5S)-8-метил-8-азабицикло[3.2.1]окт-3-ил]амино}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 472E в примере 27H.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,61 (уш.с, 1H), 9,38 (уш.с, 1H), 8,64 (с, 1H), 8,47 (д, 1H), 7,75 (дд, 1H), 7,55 (д, 1H), 7,23 (т, 3H), 7,15 (д, 2H), 6,98 (т, 1H), 6,82 (д, 3H), 6,47 (с, 2H), 3,85 (м, 6H), 3,31 (м, 12H), 2,68 (д, 3H), 2,06 (м, 9H), 1,62 (м, 2H), 1,29 (м, 2H).
Пример 474
4-[4-(2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 474А
2-Фторбензальдегид (264 мг), (1S,5S)-3-азабицикло[3.2.2]нонан (500 мг) и карбонат натрия (846 мг) суспендировали в безводном диметилсульфоксиде (3 мл). Реакционную смесь нагревали при 135°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия, фильтровали и концентрировали. В результате очистки флэш-хроматографией на колонке с использованием 0-10% смеси этилацетат/гексан получали указанное в заголовке соединение.
Пример 474В
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид на соединение примера 474А и трет-бутилпиперазин-1-карбоксилат на соединение примера 113А в примере 1А.
Пример 474С
Соединение данного примера получали, заменяя соединение примера 175D соединением примера 474В в примере 175Е.
Пример 474D
4-[4-(2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 474С в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,74 (уш.с, 1H), 8,64 (т, 1H), 8,47 (д, 1H), 7,76 (дд, 1H), 7,54 (м, 2H), 7,43 (д, 2H), 7,23 (м, 3H), 7,15 (д, 1H), 6,98 (т, 1H), 6,83 (м, 3H), 6,53 (д, 1H), 4,45(уш.с, 2H), 3,87 (м, 4H), 3,30 (м, 6H), 3,06 (м, 8H), 1,89 (м, 7H), 1,64 (м, 6H), 1,29 (м, 2H).
Пример 475
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]-3-[(трифторметил)сульфонил]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 474С и соединение примера 1F соединением примера 163A в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,78 (уш.с, 1H), 8,11 (д, 1H), 7,86 (дд, 1H), 7,54 (д, 2H), 7,44 (д, 2H), 7,28 (м, 4H), 7,11 (д, 1H), 7,04 (м, 1H), 6,85 (м, 3H), 6,53 (д, 1H), 4,46 (м, 2H), 3,86 (м, 4H), 3,28 (м, 6H), 3,10 (м, 4H), 2,98 (д, 4H), 1,97 (с, 2H), 1,84 (м, 5H), 1,64 (м, 6H), 1,26 (м, 2H).
Пример 476
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-2-фенокси-N-({4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)бензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 474С и соединение примера 1F соединением примера 2A в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,19 (уш.с, 1H), 9,83 (уш.с, 1H), 7,52 (м, 6H), 7,33 (м, 3H), 7,12 (т, 1H), 6,93 (д, 2H), 6,83 (м, 1H), 6,56 (д, 2H), 6,47 (д, 1H), 4,47 (с, 2H), 3,85 (м, 4H), 3,26 (м, 2H), 3,11 (м, 4H), 2,96 (м, 6H), 1,97 (с, 2H), 1,81 (м, 6H), 1,64 (м, 7H), 1,22 (м, 2H).
Пример 477
4-{4-[2-(3-азабицикло[3.2.2]нон-3-ил)бензил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 27G соединением примера 474С и соединение примера 1F соединением примера 7A в примере 27Н.1H ЯМР (400 МГц, диметилсульфоксид-d6) δ 11,77 (уш.с, 1H), 10,04 (уш.с, 1H), 8,69 (т, 1H), 8,50 (д, 1H), 7,81 (дд, 1H), 7,55 (д, 2H), 7,43 (д, 2H), 7,24 (м, 3H), 7,15 (д, 1H), 7,01 (т, 1H), 6,84 (м, 3H), 6,52 (д, 1H), 4,44 (с, 2H), 3,97 (с, 2H), 3,54 (м, 6H), 3,39 (м, 4H), 3,19 (м, 8H), 2,97 (д, 4H), 1,99 (м, 4H), 1,83 (м, 4H), 1,64 (м, 4H).
Пример 478
4-{4-[2-[(4R,7S)-2,3,3a,4,7,7a-гексагидро-1Н-4,7-метаноинден-5-ил]бензил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 478А
Трет-бутиловый эфир 4-(4-метоксикарбонил-3-феноксифенил)пиперазин-1-карбоновой кислоты
Соединение данного примера получали, заменяя соединение примера 1В трет-бутиловым эфиром пиперазин-1-карбоновой кислоты в примере 1D.
Пример 478В
Трет-бутиловый эфир 4-(4-карбокси-3-феноксифенил)пиперазин-1-карбоновой кислоты
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 478A в примере 1E.
Пример 478С
Трет-бутиловый эфир 4-(4-{3-нитро-4-[(тетрагидропиран-4-илметил)амино]бензолсульфониламинокарбонил}-3-феноксифенил)пиперазин-1-карбоновой кислоты
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 478В в примере 1G.
Пример 478D
3-Нитро-N-(2-фенокси-4-пиперазин-1-илбензоил)-4-[(тетрагидропиран-4-илметил)амино]бензолсульфониламинокарбонил
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 478С в примере 1В, выделяя указанное в заголовке соединение в виде моносоли трифторуксусной кислоты.
Пример 478Е
(4R,7S)-(2,3,3a,4,7,7a-гексагидро-1Н-4,7-метаноинден-5-иловый эфир) трифторметансульфокислоты
(4R,7R)-октагидро-4,7-метаноинден-5-он (2,00 г) растворяли в тетрагидрофуране (25 мл) и охлаждали до -78°С с использованием бани с изопропиловым спиртом/сухим льдом. Медленно прибавляли бис(триметилсилил)амид натрия (1 М в тетрагидрофуране, 14,65 мл). Раствор оставляли нагреваться до комнатной температуры, перемешивали в течение одного часа, охлаждали до -78°С с использованием бани с изопропиловым спиртом/сухим льдом и прибавляли N-фенилтрифторметансульфонимид (5,23 г). Раствор оставляли нагреваться до комнатной температуры и перемешивали в течение 16 часов. Добавляли гексан и перемешивали раствор при комнатной температуре в течение одного часа, фильтровали и удаляли растворитель в вакууме.
Пример 478F
(4R,7S)-2-(2,3,3a,4,7,7a-гексагидро-1Н-4,7-метаноинден-5-ил)бензальдегид
Соединение примера 478Е (941 мг), 2-формилфенилбороновую кислоту (600 мг) и трехосновный фосфат калия (1415 мг) прибавляли к тетрагидрофурану (20 мл). Раствор дегазировали и три раза продували азотом. Прибавляли тетракис(трифенилфосфин)палладий(0) (244 мг) и нагревали раствор при 60°С в течение 16 часов. Раствор охлаждали, добавляли к воде и экстрагировали 50% смесью этилацетат (гексаны). Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом натрия, концентрировали и очищали колоночной флэш-хроматографией на силикагеле с использованием 10% смеси этилацетата (гексаны).
Пример 478G
4-{4-[2-[(4R,7S)-2,3,3a,4,7,7a-гексагидро-1Н-4,7-метаноинден-5-ил]бензил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение примера 478D (200 мг), соединение примера 478F (74 мг) и цианоборгидрид натрия на полимере (2,15 ммоль/г, 144 мг) прибавляли к тетрагидрофурану (3 мл) и уксусной кислоте (0,7 мл) и перемешивали при комнатной температуре в течение 16 часов. Раствор концентрировали в вакууме и очищали колоночной флэш-хроматографией на силикагеле с использованием 5% смеси метанол (хлористый метилен), получая указанное в заголовке соединение в в виде моносоли уксусной кислоты.1H ЯМР (300 МГц, диметилсульфоксид-d6) δ 11,94 (уш.с, 1H), 8,64 (т, 1H), 8,48 (д, 1H), 7,76 (дд, 1H), 7,51 (д, 1H), 7,40 (м, 1H), 7,27-7,18 (м, 5H), 7,16 (д, 1H), 6,99 (тт, 1H), 6,83 (дт, 2H), 6,78 (дд, 1H), 6,41 (д, 1H), 6,23 (д, 1H), 3,87 (дд, 2H), 3,50 (м, 2H), 3,34 (т, 2H), 3,21 (уш.с, 4H), 2,73 (уш.с, 1H), 2,63 (уш.с, 1H), 2,46 (м, 4H), 2,11 (м, 2H), 1,95-1,75 (м, 4H), 1,91 (с, 3H), 1,66-1,52 (м, 6H), 1,28 (м, 2H), 1,02 (м, 2H), 0,85 (м, 1H).
Пример 479
4-[4-(2-{5-[(1R,5S)-8-азабицикло[3.2.1]окт-8-илметил]тиен-2-ил}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 479А
Трет-бутил 4-(4-метоксикарбонил-3-феноксифенил)пиперазин-1-карбоксилат
Соединение данного примера получали, заменяя соединение примера 1В трет-бутиловым эфиром пиперазин-1-карбоксилата в примере 1D.
Пример 479В
4-(4-(Трет-бутилкарбонил)пиперазин-1-ил)-2-феноксибензойная кислота
Соединение данного примера получали, заменяя соединение примера 1D соединением примера 479А в примере 1Е.
Пример 479С
Трет-бутил 4-(4-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонилкарбамоил)-3-феноксифенил)пиперазин-1-карбоксилат
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 479В в примере 1G.
Пример 479D
N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)-2-фенокси-4-(пиперазин-1-ил)бензамид
Соединение данного примера получали, заменяя соединение примера 1А соединением примера 479С в примере 1В.
Пример 479Е
2-((4-(4-(3-Нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонилкарбамоил)-3-феноксифенил)пиперазин-1-ил)метил)фенилбороновая кислота
Соединение примера 479D (213 мг), 2-формилфенилбороновую кислоту (54 мг) и цианоборгидрид натрия на полимере (2,38 ммоль/г, 252 мг) прибавляли к тетрагидрофурану (3,5 мл) и уксусной кислоте (1,1 мл) и перемешивали раствор при комнатной температуре в течение 16 часов. Раствор очищали колоночной флэш-хроматографией на силикагеле с использованием 1% уксусной кислоты и 10% метанола в хлористом метилене.
Пример 479F
Гидрохлорид 8-((5-бромтиофен-2-ил)метил)-8-азабицикло[3.2.1]октана
Соединение данного примера получали, заменяя 4’-хлордифенил-2-карбоксальдегид на 5-бромтиофен-2-карбальдегид и трет-бутилпиперазин-1-карбоксилат на гидрохлорид 8-азабицикло[3.2.1]октана в примере 1А.
Пример 479G
4-[4-(2-{5-(8-азабицикло[3.2.1]октан-8-илметил]тиофен-2-ил}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-ил)метиламино]фенилсульфонил)-2-феноксибензамид
Соединение примера 479Е (80 мг), соединение примера 479F (42,5 мг), дихлорид бис(трифенилфосфин)палладия(II) (7,7 мг) и гидроксид лития (10,5 мг) соединяли в смеси диметоксиэтана (1,6 мл), метанола (0,5 мл) и воды (0,7 мл) в сосуде для микроволнового облучения. Реакционную смесь нагревали в микроволновом реакторе CEM Discover при 150°С в течение 15 минут. Сырое вещество очищали колоночной флэш-хроматографией, элюируя с градиентом от 1% метанола/хлористый метилен до 5% метанола/хлористый метилен.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 8,33 (м, 2H), 7,64 (м, 2H), 7,44 (м, 1H), 7,39 (м, 1H), 7,32 (м, 2H), 7,12 (м, 3H), 6,90 (м, 2H), 6,85 (т, 1H), 6,68 (м, 3H), 6,30 (д, 1H), 3,83 (дд, 2H), 3,65 (с, 2H), 3,51 (с, 2H), 3,17 (м, 4H), 3,08 (м, 4H), 2,45 (м, 6H), 1,92 (м, 2H), 1,62 (м, 4H), 1,54 (м, 3H), 1,28 (м, 6H).
Пример 480
4-[4-(2-{5-[(1R,5S)-8-азабицикло[3.2.1]окт-8-илметил]тиен-2-ил}бензилиден)пиперидин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 480А
Метил 2-фенкси-4-(1,4-диокса-8-азаспиро[4.5]декан-8-ил)бензоат
Метил 4-фтор-2-феноксибензоат (2 г) и 1,4-диокса-8- азаспиро[4.5]декан (1,279 г) соединяли в диметилсульфоксиде (12 мл) в круглодонной колбе на 250 мл. Прибавляли карбонат натрия (1,291 г). Колбу герметизировали и нагревали при 130°С в течение ночи. Реакционную смесь разбавляли этилацетатом, тщательно промывали водой и насыщенным раствором соли, и сушили над MgSO4, фильтровали и концентрировали, получая требуемый продукт.
Пример 480В
Метил 4-(4-оксопиперидин-1-ил)-2-феноксибензоат
Соединение примера 480А растворяли в уксусной кислоте (30%, 20 мл) и тетрагидрофуране (10 мл). Реакционную смесь нагревали при 75°С в течение ночи. Объем уменьшали в вакууме, а остаток нейтрализовывали раствором гидроксида натрия и экстрагировали этилацетатом. Экстракты промывали водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме, получая требуемый продукт.
Пример 480С
Метил 4-(4-(2-бромбензилиден)пиперидин-1-ил)-2-феноксибензоат
Диметилсульфоксид (22,88 мл) с гидридом натрия (0,332 г) нагревали при 70°С в течение 1 часа, затем охлаждали до комнатной температуры и прибавляли бромид (2-бромбензил)трифенилфосфония (3,40 г) в виде нескольких порций, а затем перемешивали при комнатной температуре в течение 1 часа. Затем прибавляли раствор метил 4-(4-оксопиперидин-1-ил)-2-феноксибензоата (1,8 г) в диметилсульфоксиде (5,20 мл) и нагревали реакционную смесь при 70°С в течение выходных. Реакционную смесь подкисляли 1М водным раствором HCl и экстрагировали эфиром. Объединенные экстракты тщательно промывали водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией, элюируя 0-20% этилацетата в гексане.
Пример 480D
Метил 2-фенокси-4-(4-(2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензилиден)пиперидин-1-ил)бензоат
Соединение примера 480С (259 мг), бис(пинаколято)дибор (206 мг), комплекс [1,1’-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с хлористым метиленом (22 мг) и ацетат калия (159 мг) соединяли в диметилсульфоксиде (2,7 мл). Реакционную смесь нагревали при 90°С в течение 36 часов. Реакционную смесь разбавляли этилацетатом, тщательно промывали водой и насыщенным раствором соли, и сушили над MgSO4, фильтровали и концентрировали в вакууме. Сырое твердое вещество промывали гексанами и смесью гексаны/эфир (2:1), получая требуемый продукт.
Пример 480Е
4-(4-(2-(5-(8-Азабицикло[3.2.1]октан-8-илметил)тиофен-2-ил)бензилиден)пиперидин-1-ил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 479Е соединением примера 480D в примере 479G.
Пример 480F
4-(4-(2-(5-(8-Азабицикло[3.2.1]октан-8-илметил)тиофен-2-ил)бензилиден)пиперидин-1-ил)-N-(3-нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 1Е соединением примера 480Е в примере 1G.1H ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,54 (с, 1H), 9,36 (уш.с, 1H), 8,48 (д, 1H), 7,76 (дд, 1H), 7,53 (м, 2H), 7,34 (м, 3H), 7,25 (м, 4H), 7,16 (д, 1H), 7,00 (т, 1H), 6,84 (д, 2H), 6,81 (дд, 1H), 6,44 (д, 1H), 6,37 (уш.с, 1H), 4,36 (д, 2H), 3,85 (м, 3H), 3,44 (м, 2H), 3,28 (м, 6H), 2,36 (м, 3H), 2,23 (м, 4H), 1,90 (м, 3H), 1,81 (м, 2H), 1,62 (м, 5H), 1,47 (м, 1H), 1,29 (м, 2H).
Пример 481
4-[4-(3-{5-[(1R,5S)-8-азабицикло[3.2.1]окт-8-илметил]тиен-2-ил}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Пример 481А
3-((4-(4-(3-Нитро-4-((тетрагидро-2Н-пиран-4-ил)метиламино)фенилсульфонилкарбамоил)-3-феноксифенил)пиперазин-1-ил)метил)фенилбороновая кислота
Соединение данного примера получали, заменяя 2-формилфенилбороновую кислоту на 3-формилфенилбороновую кислоту в примере 479Е.
Пример 481В
4-[4-(3-{5-(8-азабицикло[3.2.1]октан-8-илметил]тиофен-2-ил}бензил)пиперазин-1-ил]-N-({3-нитро-4-[(тетрагидро-2Н-пиран-4-илметил)амино]фенил}сульфонил)-2-феноксибензамид
Соединение данного примера получали, заменяя соединение примера 479Е соединением примера 481А в примере 479G.1Н ЯМР (500 МГц, диметилсульфоксид-d6) δ 11,76 (уш.с, 1H), 9,55 (уш.с, 1H), 8,55 (т, 1H), 8,46 (д, 1H), 7,75 (м, 2H), 7,54 (м, 2H), 7,40 (м, 1H), 7,20 (м, 4H), 6,97 (м, 1H), 6,86 (м, 1H), 6,82 (м, 3H), 6,55 (м, 1H), 4,41 (д, 2H), 3,88 (м, 6H), 3,43 (м, 3H), 3,30 (м, 6H), 3,06 (м, 6H), 1,90 (м, 4H), 1,65 (м, 5H), 1,30 (м, 3H).
Реферат
Изобретение относится к области органической химии, а именно к конкретным гетероциклическим соединениям, содержащим сульфониламинокарбонильную группу. Также изобретение относится к фармацевтической композиции на основе указанного соединения. Технический результат: получены новые гетероциклические соединения, обладающие ингибирующей активностью в отношении антиапоптотических белков семейства Bcl-2. 2 н.п. ф-лы, 3 табл., 481 пр.

Комментарии