Производные пиперидина в качестве агонистов gpr119 - RU2603346C2
Код документа: RU2603346C2
Описание
Область техники
Данное изобретение относится к новым соединениям, пригодным для лечения метаболических нарушений, включая сахарный диабет (I и II типа) и подобные нарушения, фармацевтическим композициям, содержащим эти соединения, а также терапевтическому применению этих соединений.
Уровень техники
Сахарный диабет является серьезным заболеванием, поражающим все большее количество людей в мире. Согласно прогнозу Международной федерации диабета, общее количество людей, страдающих сахарным диабетом, к 2025 году достигнет 380 000 000 человек (триста восемьдесят миллионов). Риск возникновения диабета повышается с возрастающей тенденцией ожирения во многих странах. Тяжелые осложнения сахарного диабета включают повышенный риск инсульта, сердечной недостаточности, почечной недостаточности, слепоты и ампутации. Сердечно-сосудистые нарушения являются причиной 70% смертей среди пациентов, страдающих диабетом II типа (T2DM) [B. Pourcet et al. Expert Opin. Emerging Drugs 2006, 11, 379-401].
Сахарный диабет характеризуется секрецией инсулина и/или нарушением инсулиновых сигнальных реакций в периферических тканях. Существует два типа сахарного диабета: инсулинозависимый сахарный диабет и не инсулинозависимый сахарный диабет. Большинство пациентов с сахарным диабетом страдают от не инсулинозависимого сахарного диабета, известного как диабет II типа или NIDDM. Из-за тяжелых последствий сахарного диабета крайне необходим контроль этого заболевания.
Лечение NIDDM в общем случае начинается со снижения веса, здоровой диеты и программы физических упражнений. При том, что эти факторы важны для снижения риска сердечно-сосудистых заболеваний, связанных с сахарным диабетом, они не способствуют обретению контроля над диабетом как таковым. Существует много медикаментов для лечения сахарного диабета, таких как инсулин, метформин, сульфонилмочевины, акарбоза, тиазолидиндион, аналог GLP-1 и ингибитор DPP IV. Однако, некоторые из таких медикаментов обладают такими нежелательными побочными эффектами, как риск гипогликемии, набор веса, проблемы с пищеварением и потеря реакции на терапию с течением времени.
Несмотря на то, что для лечения сахарного диабета одобрено большое количество медикаментов с различным механизмом действия, многие медикаменты все еще находятся в стадии клинических исследований, и все еще существует необходимость разработки новых медикаментов для лечения сахарного диабета. Недавно были опубликованы результаты исследования, показывающие, что функция бета-клеток у пациентов, страдающих сахарным диабетом, отказывает с течением времени независимо от успеха или неудачи лечения с применением диеты, метформина или инсулина [R. R. Holman Metabolism 2006, 55, S2-S5].
GPR119 является белком, состоящим из 335 аминокислот, который выделяется в бета-клетках панкреатического островка [Z.-L. Chu et al., Endocrinol. 2007, J 48, 2601-2609] и желудочно-кишечного тракта [Z.-L. Chu et. al. Endocrinol. 2008, 149, 2038-2047]. Этот белок принадлежит к семейству рецепторов, связанных с Г-белком, и в качестве лигандов были предположены некоторые кандидаты, включая олеоилэтаноламид (OEA), N-олеилдопамин и олванил [H. A. Overton et al. Brit. J. Pharmacol. 2007, 1-6].
В результате многих исследований, проведенных на животных и клеточных линиях, было показано, что GPR119 может играть определенную роль в глюкозозависимой секреции инсулина, и нацеливание на рецептор GPR119 может быть эффективно при лечении сахарного диабета. Активация рецептора GPR119 лизофосфатидилхолином усиливает глюкозозависимую секрецию поджелудочной линии бета-клеток у мышей, а секреция инсулина может быть блокирована GPR119-специфичной siRNA [T. Soga et al. Biochem. Biophys. Res. Commun. 2005, 326]
Таким образом, активатор рецептора GPR119 необходим для лечения заболеваний, таких как сахарный диабет.
Раскрытие изобретения
Техническая проблема
Целью данного изобретения является предоставление нового производного пиперидина, его стереоизомеров, фармацевтически приемлемых солей и способа его получения.
Другой целью данного изобретения является предоставление нового производного пиперидина, способного контролировать активность GPR119 с низким побочным эффектом, его стереоизомеров, фармацевтически приемлемых солей и способа его получения.
Техническое решение
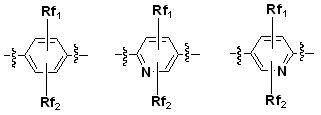
Для достижения указанных выше целей, данное изобретение представляет новое производное пиперидина формулы 1, его стереоизомеры и фармацевтически приемлемые соли:
[Формула 1]
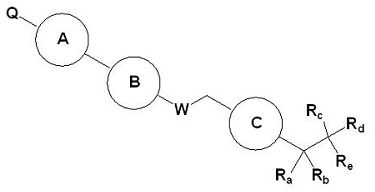
где
W является O или N-Rh;
Ra, Rb и Rh каждая независимо является H или C1-3 алкильной группой;
Rc является -F или -C1-3 гиперфторид алкильной группой;
Rd и Re каждую независимо выбирают из группы, состоящей из H, галогена, -C1-5 алкильной группы и -C3-7 циклоалкильной группы, где -C1-5 алкильная группа и -C3-7 циклоалкильная группа каждая независимо является незамещенной или замещенной галогеном, -CN, -OC1-5 алкильной группой или -C1-5 алкильной группой;
или Rd и Re являются комбинированными, образуя -C3-7 циклоалкильную группу, где -C3-7 циклоалкильная группа является незамещенной или замещенной галогеном, -OC1-5 алкильной группой или -C1-5 алкильной группой;



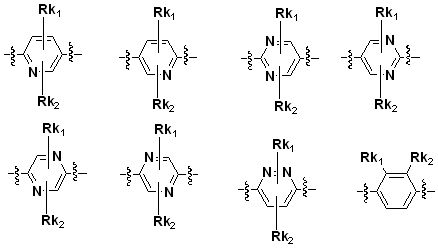
Q является H, -S(O)R1 группой, -S(O)2R1 группой, -C(O)R1 группой, -C(O)OR1 группой, -C(O)NHR1 группой, -C(O)NR2R3 группой, -S(O)2NHR1 группой, -S(O)2NR2R3 группой или

где
R1 является H, -CF3, -C1-5 алкильной группой, от 3 до 7-членной гетероциклической группой, C3-7 циклоалкильной группой, или Ar группой,
R2 и R3 каждая независимо является C1-5 алкильной группой, C3-7 циклоалкильной группой, от 3 до 7-членной гетероциклической группой или Ar группой (в R1, R2 и R3, -C1-5 алкильная группа, от 3 до 7-членная гетероциклическая группа, C3-7 циклоалкильная группа и Ar группа могут каждая быть независимо замещенной Rx1 и Rx2),
или R2 и R3 вместе с N атомами, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое ароматическое или неароматическое соединение далее включающее от 0 до 3 членов, независимо выбираемых из группы, состоящей из N, O, S и C (O), где гетероциклическое ароматическое или неароматическое соединение может быть замещено Rx1 и Rx2,
где Ar является C6 моноциклическим ароматическим соединением; или 5- или 6-членной гетероарильной группой, включающей от 1 до 3 членов, выбираемых из группы, состоящей из N, O и S,
где Rx1 и Rx2 каждая независимо является H, -OH, галогеном, -CN, -CF3, от 3- до 7- членным гетероциклом, -C1-5 алкильной группой, -C3-7 циклоалкильной группой, -C1-5 алкил(OH) группой, -C1-5 алкил(OR4) группой, -C1-5 алкил(галоген) группой, -C(O)NR4R5 группой, -C(O)R4 группой, -C(O)OR4 группой, -S(O)2R4 группой, -OR4 группой,
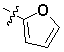
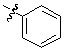
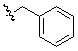
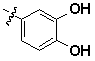
Кроме того, предпочтительным образом,
W является O;
Ra и Rb каждая независимо является H;
Rc является -F или -CF3;
Rd и Re каждая независимо является -C1-5 алкильной группой,
или Rd и Re являются комбинированными, образуя -C3-7 циклоалкильную группу, где -C3-7 циклоалкильная группа является незамещенной или замещенной галогеном, -OC1-5 алкильной группой или -C1-5 алкильной группой;

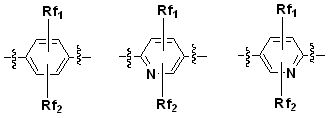


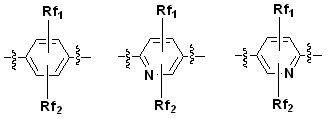
Q является -S(O)2R1 группой, -C(O)NR2R3 группой или -S(O)2NR2R3 группой,
где R1, R2 и R3 каждая независимо является C1-5 алкильной группой замещенной Rx1 и Rx2,
или R2 и R3 вместе с N атомами, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое ароматическое или неароматическое соединение далее включающее от 0 до 3 членов, независимо выбираемых из группы, состоящей из N, O, S и C(O),
где гетероциклическое ароматическое или неароматическое соединение может быть замещено Rx1 и Rx2,
где Rx1 и Rx2 каждая независимо является H, -OH, галогеном, -CN, -CF3, от 3- до 7-членным гетероциклом, -C1-5 алкильной группой, -C3-7 циклоалкильной группой, -C1-5 алкил(OH) группой, -C1-5 алкил(OR4) группой, -C1-5 алкил(галоген) группой, -C(O)NR4R5 группой, -C(O)R4 группой, -C(O)OR4 группой, -S(O)2R4 группой или -OR4 группой [где R4 и R5 каждая независимо является H, -C1-5 алкильной группой или -C3-7 циклоалкильной группой].
Кроме того, более предпочтительным образом:
W является O;
Ra и Rb каждая независимо является H;
Rc является -F или -CF3;
Rd и Re каждая независимо является -C1-5 алкильной группой,
или Rd и Re являются комбинированными, образуя -C3-7 циклоалкильную группу, где -C3-7 циклоалкильная группа является незамещенной или замещенной галогеном, -OC1-5 алкильной группой или -C1-5 алкильной группой;





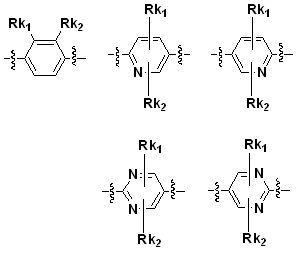
Q является -C(O)NR2R3,
где R2 и R3 вместе с N атомами, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое ароматическое или неароматическое соединение далее включающее от 0 до 3 членов, независимо выбираемых из группы, состоящей из N, O, S и C(O),
где гетероциклическое ароматическое или неароматическое соединение может быть замещено Rx1 и Rx2,
где Rx1 и Rx2 каждая независимо является H, -OH, галогеном, -CN, -CF3, от 3- до 7-членным гетероциклом, -C1-5 алкильной группой, -C3-7 циклоалкильной группой, -C1-5 алкил(OH) группой, -C1-5 алкил(OR4) группой, -C1-5 алкил(галоген) группой, -C(O)NR4R5 группой, -C(O)R4 группой, -C(O)OR4 группой, -S(O)2R4 группой или -OR4 группой [где R4 и R5 каждая независимо является H, -C1-5 алкильной группой или -C3-7 циклоалкильной группой].
Также, альтернативным образом,
W является O;
Ra и Rb каждая независимо является H;
Rc является -F или -CF3;
Rd и Re каждый независимо выбирают из группы, состоящей из -CH3 и -CH2CH3.





Q выбирают из группы, состоящей из:
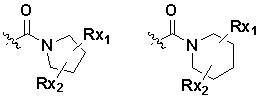
Соединение формулы 1 может использоваться в форме своей фармацевтически приемлемой соли. Такие фармацевтически приемлемые соли включают фармацевтически приемлемые соли присоединения основания и соли присоединения кислоты, например, соли металлов, такие как соли щелочных и щелочноземельных металлов, соли аммония, соли присоединения органических аминов, соли присоединения аминокислот и сульфонатные соли. Соли присоединения кислоты включают соли присоединения неорганической кислоты, такие как соль соляной кислоты, соль сульфоновой кислоты и соль фосфорной кислоты; и соли присоединения органической кислоты, такие как алкил сульфонат, арил сульфонат, ацетат, малеат, фумарат, тартрат, цитрат и лактат. Примеры солей металлов включают соли щелочных металлов, такие как соли лития, соли натрия и соли калия; соли щелочноземельных металлов, такие как соли магния, соли кальция, соли алюминия и соли цинка. Примеры солей аммония включают соли аммония и соли тетраметиламмония. Примеры солей присоединения органического амина включают соли с морфолином и пиперидином. Примеры солей присоединения аминокислот включают соли с глицином, фенилаланином, глютаминовой кислотой и лизином. Примеры сульфонатных солей включают мезилат, тозилат и соли бензольсульфоновой кислоты.
Термин “стереоизомер” означает изомерные молекулы, обладающие одинаковой молекулярной формулой и связями, но отличающиеся своей трехмерной ориентацией.
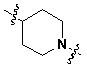
Специфические примеры предпочтительных соединений формулы 1 по данному изобретению включают:
Соединение 431: 1-(2-фтор-2-метилпропил)-4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин
Соединение 470: 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид
Соединение 498: метил 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат
Соединение 499: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-(2,2,2-трифторэтил)пиперидин
Соединение 500: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклопропил)метил)пиперидин
Соединение 515: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 516: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-карбоксамид
Соединение 517: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(морфолино)метанон
Соединение 524: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-(3,3,3-трифторпропил)пиперидин
Соединение 526: N-циклопропил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 527: N-циклобутил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 528: N-циклопентил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 529: N-циклогексил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 530: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(пирролидин-1-ил)метанон
Соединение 531: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(пиперидин-1-ил)метанон
Соединение 533: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(4-гидроксибутил)бифенил-4-карбоксамид
Соединение 534: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-карбоксамид
Соединение 540: 5-(4-((1-(2,2,2-трифторэтил)пиперидин-4-ил)метокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид
Соединение 542: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидин
Соединение 546: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклопентил)метил)пиперидин
Соединение 547: 1-(2,2-дифторпропил)-4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин
Соединение 548: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота
Соединение 549: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(2-гидроксиэтил)бифенил-4-карбоксамид
Соединение 550: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(3-гидроксипропил)бифенил-4-карбоксамид
Соединение 551: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(2-гидроксиэтил)-N-метилбифенил-4-карбоксамид
Соединение 552: N,N-диметил-4'-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 553: (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 554: (S)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 555: (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 556: (S)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 557: (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(метоксиметил)пирролидин-1-ил)метанон
Соединение 558: (S)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(метоксиметил)пирролидин-1-ил)метанон
Соединение 559: N-бутил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(2-гидроксиэтил)бифенил-4-карбоксамид
Соединение 560: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(фуран-2-илметил)бифенил-4-карбоксамид
Соединение 561: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-пропилбифенил-4-карбоксамид
Соединение 562: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-пропилбифенил-4-карбоксамид
Соединение 563: N-бензил-N-этил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 564: (S)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(трифторметил)пирролидин-1-ил)метанон
Соединение 565: (S)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 566: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-фторпирролидин-1-ил)метанон
Соединение 567: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-(гидроксиметил)пиперидин-1-ил)метанон
Соединение 568: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-гидроксипиперидин-1-ил)метанон
Соединение 569: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 570: (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-фторпирролидин-1-ил)метанон
Соединение 571: (S)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-фторпирролидин-1-ил)метанон
Соединение 574: 4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота
Соединение 575: 1-(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)этанон
Соединение 576: N,N-диметил-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензамид
Соединение 578: (S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 579: (R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 580: N,N-диметил-4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензамид
Соединение 581: (S)-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 582: морфолино(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 583: пиперидин-1-ил(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 584: пирролидин-1-ил(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 585: (S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 586: (S)-1-(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 587: (4-(гидроксиметил)пиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 588: (4-(гидроксиметил)пиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 589: 5-(4-(метилсульфонил)фенил)-2-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин
Соединение 593: 1-(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)этанон
Соединение 594: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-(трифторметил)-5,6-дигидро-[1,2,4]триазол[4,3-a]пиразин-7(8H)-ил)метанон
Соединение 595: (3-(трифторметил)-5,6-дигидро-[1,2,4]триазол[4,3-a]пиразин-7(8H)-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 596: 2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5-(4-(метилсульфонил)фенил)пиридин
Соединение 597: 5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-2-(4-(метилсульфонил)фенил)пиридин
Соединение 598: N-этил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-карбоксамид
Соединение 599: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-изопропил-N-метилбифенил-4-карбоксамид
Соединение 600: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксиазетидин-1-ил)метанон
Соединение 601: (3,3-дифторазетидин-1-ил)(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 602: N-трет-бутил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 603: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-изопропилбифенил-4-карбоксамид
Соединение 604: N,N-диэтил-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 605: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидрокси-2-метилпропан-2-ил)бифенил-4-карбоксамид
Соединение 606: (S)-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидроксипропан-2-ил)бифенил-4-карбоксамид
Соединение 607: (R)-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидроксибутан-2-ил)бифенил-4-карбоксамид
Соединение 608: (R)-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидрокси-3-метилбутан-2-ил)бифенил-4-карбоксамид
Соединение 609: (S)-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидрокси-3-метилбутан-2-ил)бифенил-4-карбоксамид
Соединение 610: N-(1,3-дигидроксипропан-2-ил)-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 611: N-(2,3-дигидроксипропил)-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 612: (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 613: (S)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 614: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-сульфонамид
Соединение 615: 1-(2-фтор-2-метилпропил)-4-((4'-(пирролидин-1-илсульфонил)бифенил-4-илокси)метил)пиперидин
Соединение 616: 1-(2-фтор-2-метилпропил)-4-((4'-(пиперидин-1-илсульфонил)бифенил-4-илокси)метил)пиперидин
Соединение 617: 2-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)-5-(метилсульфонил)пиридин
Соединение 618: 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)-2-(метилсульфонил)пиридин
Соединение 619: (R)-метил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксилат
Соединение 620: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоновая кислота
Соединение 621: 2-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-илкарбоксамидо)уксусная кислота
Соединение 622: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(тиазолидин-3-ил)метанон
Соединение 623: (4-(циклопропанкарбонил)пиперазин-1-ил)(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 624: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-(метилсульфонил)пиперазин-1-ил)метанон
Соединение 625: (S)-метил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксилат
Соединение 626: трет-бутил 4-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-1-карбоксилат
Соединение 627: (4-бензилпиперазин-1-ил)(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 628: 1-(4-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-1-ил)этанон
Соединение 629: (3,3-дифторпирролидин-1-ил)(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 630: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(пиперазин-1-ил)метанон
Соединение 631: N,N-диметил-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 632: (S)-(3-гидроксипирролидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 633: (R)-(2-(гидроксиметил)пирролидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 634: (3-гидроксипиперидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 635: (S)-1-(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 636: N-(2-гидроксиэтил)-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 637: N-(2-гидроксиэтил)-N-метил-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 638: 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-карбоксамид
Соединение 639: N,N-диэтил-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 640: (S)-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 641: (R)-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 642: (3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 643: 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидрокси-2-метилпропан-2-ил)бифенил-4-карбоксамид
Соединение 644: (S)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 645: метил 2-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)ацетат
Соединение 646: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(оксэтан-3-ил)бифенил-4-карбоксамид
Соединение 647: метил 3-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)пропаноат
Соединение 648: (R)-метил 2-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)-3-гидроксипропаноат
Соединение 649: (S)-метил 2-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)-3-гидроксипропаноат
Соединение 650: этил 4-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)пиперидин-1-карбоксилат
Соединение 651: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-пентилбифенил-4-карбоксамид
Соединение 652: (R)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 653: (S)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 654: (S)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 655: (R)-(4'-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 656: (S)-1-(4'-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 657: (R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 658: (S)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 659: (S)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 666: (S)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пирролидин-3-ол
Соединение 667: (R)-(1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пирролидин-2-ил)метанол
Соединение 668: (S)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пирролидин-2-карбоксамид
Соединение 669: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пиперидин-3-ол
Соединение 670: (S)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пиперидин-3-ол
Соединение 671: (R)-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 672: (R)-(3-гидроксипиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 673: (S)-(3-гидроксипиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 674: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-сульфонамид
Соединение 675: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-сульфонамид
Соединение 676: 5-(4-(метилсульфонил)фенил)-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин
Соединение 677: этил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксилат
Соединение 678: этил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксилат
Соединение 679: этил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксилат
Соединение 680: (4-этилпиперазин-1-ил)(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 681: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-изопропилпиперазин-1-ил)метанон
Соединение 682: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 683: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-N,N-диметилпирролидин-2-карбоксамид
Соединение 684: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-N-метилпирролидин-2-карбоксамид
Соединение 685: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-метилпиперазин-1-ил)метанон
Соединение 686: (3,5-диметилпиперазин-1-ил)(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 687: (2,6-диметилморфолино)(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 688: 4'-((1-(2-фторпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-карбоксамид
Соединение 689: (4'-((1-(2-фторпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 690: (4'-((1-(2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 691: (S)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 692: (R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 693: (S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 694: (R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 695: (S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 696: (S)-1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 697: (R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 698: (R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 699: (S)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 700: (R)-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 701: (S)-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 702: (R)-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 703: (S)-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 704: (2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 705: (2S)-1-(2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 706: (S)-1-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 707: (R)-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 708: (R)-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 709: (R)-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 710: (S)-1-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 711: (R)-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 712: (R)-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 713: (R)-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 714: 1-(2-фтор-2-метилпропил)-4-((2-фтор-4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин
Соединение 715: (S)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 716: (R)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 717: (S)-1-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 718: (R)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 719: (S)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 720: (S)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 721: (R)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 722: (S)-1-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 723: (R)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 724: (S)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 725: (S)-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 726: (R)-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 727: (R)-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 728: (S)-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 729: (R)-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 730: (S)-1-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 731: (S)-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 732: (S)-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 733: (R)-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 734: (R)-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 735: (S)-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 736: (R)-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 737: (S)-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 738: (S)-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 739: (S)-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 740: (S)-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 741: (2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((S)-3-гидроксипиперидин-1-ил)метанон
Соединение 742: (2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-3-гидроксипирролидин-1-ил)метанон
Соединение 743: (2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((S)-3-гидроксипирролидин-1-ил)метанон
Соединение 744: (2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((S)-2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 745: (2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-3-гидроксипиперидин-1-ил)метанон
Соединение 746: (S)-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 747: (S)-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 748: (S)-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 749: (R)-(2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 750: (S)-1-(2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 751: (R)-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 752: (S)-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 753: (S)-1-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 754: (R)-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 755: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 756: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 757: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 758: (R)-(6-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиридин-3-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 759: (R)-(5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиридин-2-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 760: (S)-1-(4'-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 761: (R)-(4'-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 763: (R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 764: (S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 765: (S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 766: (R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 767: (S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 768: (R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 769: (S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 770: (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 771: (R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 772: (S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 773: (R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 774: (S)-1-(4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 775: (R)-(3-гидроксипиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 776: (S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 777: (R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 778: (S)-1-(4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 779: (R)-(3-гидроксипиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 782: (S)-1-(5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамид
Соединение 783: (R)-(5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиридин-2-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 784: (R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 785: (R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 786: (S)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 787: (S)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 789: 1-((1-фторциклогексил)метил)-4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин
Соединение 790: 4-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-2-он
Соединение 791: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбонитрил
Соединение 792: 1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 793: (3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-(трифторметил)-5,6-дигидро-[1,2,4]триазол[4,3-a]пиразин-7(8H)-ил)метанон
Соединение 794: (R)-(3-гидроксипиперидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 795: (S)-(3-гидроксипиперидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 796: (R)-(3-гидроксипирролидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 797: (S)-(2-(гидроксиметил)пирролидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
Соединение 798: 1-(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 799: 1-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 800: 1-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 801: 1-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 802: 1-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 803: 1-(2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 804: 1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-4-карбоксамид
Соединение 805: 1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-4-карбоксамид
Соединение 806: (R)-1-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 807: (S)-1-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 809: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 810: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 811: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 812: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 813: 1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-4-карбоксамид
Соединение 814: 1-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенилкарбонил)пиперидин-4-карбоксамид
Соединение 815: (S)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 816: (R)-1-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 817: (S)-1-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 818: 1-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
Соединение 819: (R)-1-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 820: (S)-1-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 821: (R)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-2-карбоксамид
Соединение 822: (R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-2-карбоксамид
Соединение 823: (R)-1-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 824: (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-2-карбоксамид
Соединение 825: (2R)-1-(2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 828: (S)-1-(4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 829: (R)-(3-гидроксипиперидин-1-ил)(4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
Соединение 830: N-(3,4-дигидроксифенэтил)-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
Соединение 831: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 832: (S)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 833: (S)-1-(2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 834: (R)-(2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 835: (S)-(2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 836: (S)-(2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 837: (S)-1-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 838: (R)-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 839: (S)-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 840: (R)-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 842: (S)-(3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 843: (S)-1-(3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 844: (R)-(3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 845: (S)-(3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 846: (R)-(3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 847: (S)-1-(2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 848: (R)-(2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 849: (R)-(2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 850: (S)-(2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 851: (S)-(2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 852: (R)-(4'-(((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)(метил)амино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 853: (R)-(4'-(этил((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)амино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 854: (R)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамид
Соединение 855: (S)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамид
Соединение 856: 1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-4-карбоксамид
Соединение 857: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 858: (S)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 859: (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 860: (2S)-1-(2,6' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 861: (S)-1-(3,6' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 862: (R)-1-(3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамид
Соединение 863: (S)-1-(3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамид
Соединение 864: 1-(3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-4-карбоксамид
Соединение 866: (S)-1-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенилкарбонил)пирролидин-2-карбоксамид
Соединение 867: (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 868: (S)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 869: (S)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 870: (S)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 871: (R)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 872: (R)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 873: (R)-1-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 874: (S)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 875: (S)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 876: (S)-1-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 877: (R)-1-(2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 878: (S)-1-(2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 879: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 880: (R)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 881: (R)-1-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 882: (R)-1-(2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 883: (S)-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 884: (S)-1-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 885: (R)-1-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
Соединение 886: (R)-1-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 887: (S)-1-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 888: (S)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 889: (S)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 890: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 891: (S)-1-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 892: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 893: (S)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 894: (S)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 895: (S)-1-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенилкарбонил)пирролидин-2-карбоксамид
Соединение 896: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 897: (R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 898: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторбензоил)пирролидин-2-карбоксамид
Соединение 899: (S)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторфенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 900: (R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторфенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 901: (S)-1-(3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 902: (R)-(3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 903: (R)-(3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 904: (S)-(3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 905: (S)-(3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 906: (S)-1-(5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамид
Соединение 907: (R)-(5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиридин-2-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 908: (2,2' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 909: (2S)-1-(2,2' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 910: (2,2' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-3-гидроксипиперидин-1-ил)метанон
Соединение 911: (2,2' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)((S)-3-гидроксипиперидин-1-ил)метанон
Соединение 912: (R)-(2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 913: (S)-1-(2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 914: (R)-(2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 915: (S)-(2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 916: (S)-(2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 917: (R)-(2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 918: (S)-1-(2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 919: (R)-(2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 920: (S)-(2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 921: (S)-(2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 922: (S)-1-(4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 923: (R)-(4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 924: (S)-(4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 925: (R)-(4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 926: (R)-(3-гидроксипиперидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон
Соединение 927: (R)-(3-гидроксипиперидин-1-ил)(4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон
Соединение 928: (R)-(3-гидроксипиперидин-1-ил)(4'-(метил((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метил)амино)бифенил-4-ил)метанон
Соединение 929: (R)-(4'-(этил((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метил)амино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 930: (R)-(3-гидроксипиперидин-1-ил)(4'-(метил((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метил)амино)бифенил-4-ил)метанон
Соединение 931: (2S,4R)-метил 4-гидрокси-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксилат
Соединение 932: (2S,4R)-метил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксилат
Соединение 933: (2S,4R)-4-гидрокси-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 934: (2S,4R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксамид
Соединение 935: (S)-1-(5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамид
Соединение 936: 1-(4-(3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-1-ил)этанон
Соединение 937: (S)-1-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенилкарбонил)пирролидин-2-карбоксамид
Соединение 938: (S)-1-(3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 939: (R)-3' -фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
Соединение 940: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 941: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 942: (S)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Соединение 943: (S)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 944: (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 945: (R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 946: (S)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-3' -(гидроксиметил)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 947: (S)-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5' -(гидроксиметил)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
Соединение 948: (R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 949: (S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 950: (S)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 951: (S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 953: (S)-1-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 954: (R)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 955: (S)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 956: (R)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторфенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 957: (S)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторфенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 963: (R)-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
Соединение 964: (S)-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
Соединение 965: (S)-1-(3' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 966: (S)-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрил
Соединение 967: (R)-2' -фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
Соединение 968: (S)-2' -фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
Соединение 969: (S)-1-(3' -циано-2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 970: (S)-(3-гидроксипирролидин-1-ил)(4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)метанон
Соединение 971: (R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)метанон
Соединение 972: (R)-(3-гидроксипиперидин-1-ил)(4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)метанон
Соединение 973: (S)-1-(4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоил)пирролидин-2-карбоксамид
Соединение 974: (S)-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 975: (R)-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 976: (R)-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 977: (S)-1-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоил)пирролидин-2-карбоксамид
Соединение 978: (S)-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 979: (R)-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 980: (R)-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 981: (S)-1-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоил)пирролидин-2-карбоксамид
Соединение 982: (R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 983: (S)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 984: (S)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 985: (R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 986: (S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 987: (S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 988: (R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 989: (S)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 990: (R)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 991: (S)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамид
Соединение 992: (R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 1000: (S)-1-(3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1001: (R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3' -фтор-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1002: (R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3' -фтор-4'-(2-(гидроксиметил)пирролидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1003: (S)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3' -фтор-4'-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1004: (S)-1-(3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1005: (R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-4'-(2-(гидроксиметил)пирролидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1006: (S)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-4'-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1007: (R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)метанон
Соединение 1008: (R)-(3-гидроксипиперидин-1-ил)(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)метанон
Соединение 1009: (S)-1-(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 1010: (R)-(3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 1011: (S)-1-(3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 1012: (R)-(2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
Соединение 1013: (R)-(2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 1014: (S)-1-(2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 1015: (R)-1-(3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 1016: (S)-3' -фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1017: (S)-3' -фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1018: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 1020: (S)-(3-гидроксипирролидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон
Соединение 1021: (S)-1-(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1022: (S)-(3-гидроксипиперидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон
Соединение 1023: (R)-1-(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 1024: (S)-(3-гидроксипирролидин-1-ил)(4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон
Соединение 1025: (S)-1-(4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1026: (S)-(3-гидроксипиперидин-1-ил)(4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон
Соединение 1028: (S)-1-(2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1029: (R)-3' -фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-2-карбонитрил
Соединение 1030: (R)-1-(2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
Соединение 1031: (S)-1-(2' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1032: (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 1033: (R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 1034: (S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 1035: (R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 1036: (S)-1-(5-(3-циано-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамид
Соединение 1037: (R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пиперидин-2-карбоксамид
Соединение 1038: (S)-1-(5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбонил)пирролидин-2-карбоксамид
Соединение 1051: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 1052: (R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 1053: (R)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пиперидин-2-карбоксамид
Соединение 1054: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензоил)пирролидин-2-карбоксамид
Соединение 1055: (R)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензоил)пиперидин-2-карбоксамид
Соединение 1056: (R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторфенил)(3-гидроксипиперидин-1-ил)метанон
Соединение 1057: (R)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторбензоил)пиперидин-2-карбоксамид
Соединение 1067: (2S,4R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)-4-гидроксипирролидин-2-карбоксамид
Соединение 1072: (S)-1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид
Соединение 1073: (R)-1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пиперидин-2-карбоксамид
Соединение 1076: (R)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамид
Соединение 1077: (R)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 1078: (S)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
Соединение 1079: (S)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамид
Соединение 1080: (R)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пиперидин-2-карбоксамид
Соединение 1081: (S)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пиперидин-2-карбоксамид
Соединение 1082: (S)-1-(5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбонил)пирролидин-2-карбоксамид
Соединение 1097: (2S,4S)-4-фтор-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбонитрил
Соединение 1098: (2S,4R)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбонитрил
Соединение 1099: (2S,4S)-4-фтор-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1100: (2S,4R)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксамид
Соединение 1115: 3' -фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(4-гидроксипиперидин-1-карбонил)бифенил-2-карбонитрил
Соединение 1119: (S)-1-(3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1120: (R)-1-(3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенилкарбонил)пиперидин-2-карбоксамид
Соединение 1121: (S)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2' -фтор-4'-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1123: (R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2' -фтор-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
Соединение 1124: (S)-1-(2' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
Соединение 1125: (R)-1-(2' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид; и
Соединение 1126: (R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-2-карбонитрил.
Специфические примеры более предпочтительных соединений формулы 1 по данному изобретению включают:
Соединение 770: (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид;
Соединение 896: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид;
Соединение 938: (S)-1-(3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид;
Соединение 1028: (S)-1-(2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид; и
Соединение 1032: (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пирролидин-2-карбоксамид.
Данное изобретение также представляет фармацевтический состав, включающий производное пиперидина формулы 1, его стереоизомеры, или его фармацевтически приемлемые соли; и фармацевтически приемлемые носители.
Предпочтительным образом, такая композиция используется для лечения заболевания, ассоциируемого с агонистом GPR119.
Предпочтительным образом, упомянутое заболевание, ассоциируемое с агонистом GPR119, является сахарным диабетом, и более предпочтительным образом, сахарным диабетом II типа.
Полезные эффекты
Данное изобретение представляет новое производное пиперидина, его стереоизомеры и фармацевтически приемлемые соли.
Кроме того, данное изобретение представляет новое производное пиперидина, способное контролировать активность GPR119 с незначительными побочными эффектами, его стереоизомеры и фармацевтически приемлемые соли.
Схемы синтеза
Производное 5 можно синтезировать по следующим схемам реакций 1 и 2.
[Схема реакции 1]
Как показано на схеме реакции 1, защитную группу Boc вводят в аминогруппу соединения 1. Гидроксильную группу активируют с помощью MsCl, и замещают ариловым спиртом формулы 4 для получения желаемого соединения формулы 5.
[Схема реакции 2]

Как показано на схеме реакции 2, бромосодержащее или хлоросодержащее соединение 6 замещают соединением 2 для получения соединения 5.
Производное 8 можно синтезировать согласно следующей схеме реакции 3.
[Схема реакции 3]
Как показано на схеме реакции 3, соединение 8 получают путем окисления соединения 7.
Производное 13 можно синтезировать по следующим схемам реакций 4, 5 и 6.
[Схема реакции 4]
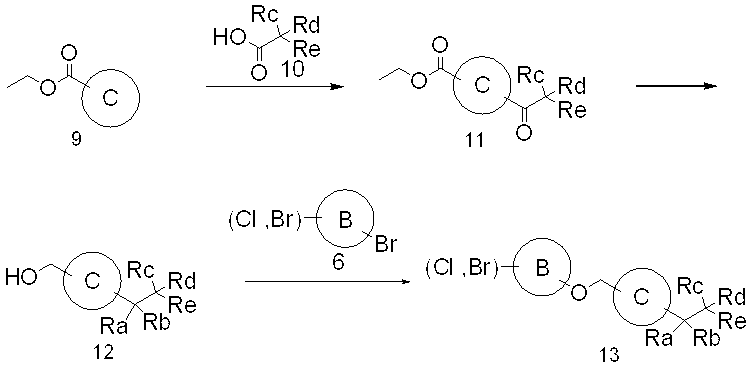
Как показано на схеме реакции 4, соединение 11 получают с помощью образования амидной связи соединения 9 с соединением 10, и последующего восстановления для получения соединения 12. Наконец, производное 13 получают путем реакции замещения соединения 12.
[Схема реакции 5]
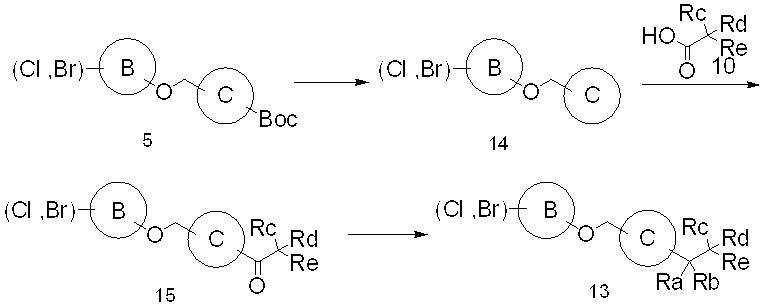
Как показано на схеме реакции 5, защитную группу соединения 5 удаляют, и подвергают образованию амидной связи с соединением 10 для получения соединения 15. Наконец, соединение 13 получают путем восстановления.
[Схема реакции 6]
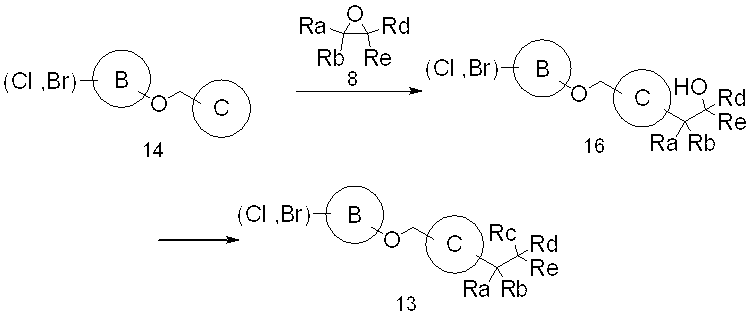
Как показано на схеме реакции 6, соединение 16 получают, используя соединение 14 и оксирановое соединение 8, и затем гидроксильную группу соединения 16 замещают фторидом для получения соединения 13.
Соединения 21 и 23 у которых Q является -S(O)2R1 в формуле 1 можно синтезировать по следующим схемам реакций 7, 8, 9, 10, 11 и 12.
[Схема реакции 7]
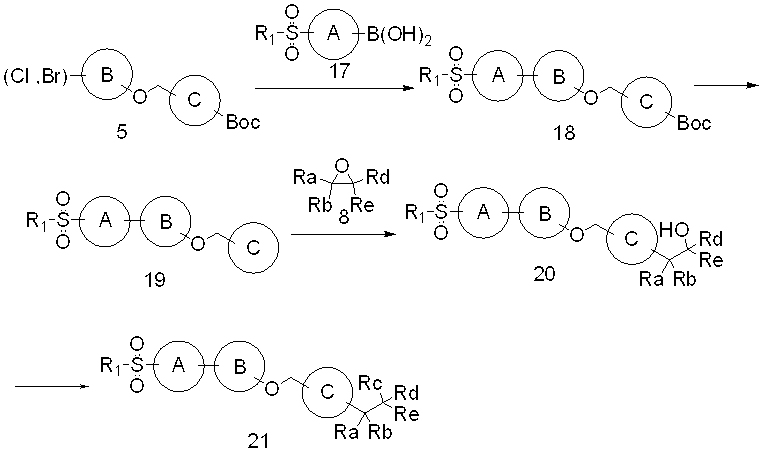
Как показано на схеме реакции 7, соединение 18 получают путем реакции Сузуки соединения 5 с борнокислым соединением 17. Защитную группу соединения 18 удаляют с помощью кислоты, и проводят реакцию с оксирановым соединением 8 для получения соединения 20. Наконец, гидроксильную группу соединения 20 замещают фторидом для получения соединения 21.
[Схема реакции 8]
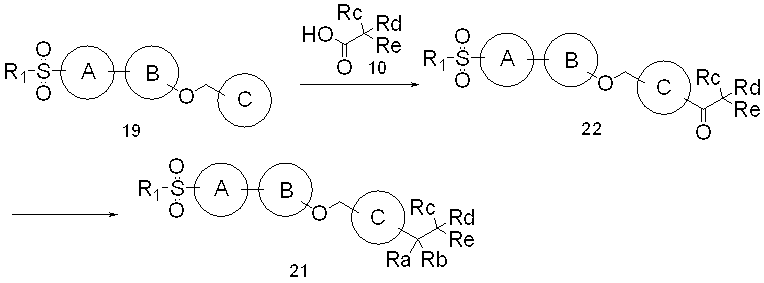
Как показано на схеме реакции 8, соединение 22 получают с помощью образования амидной связи между соединениями 19 и 10, и затем подвергают восстановлению для получения соединения 21.
[Схема реакции 9]
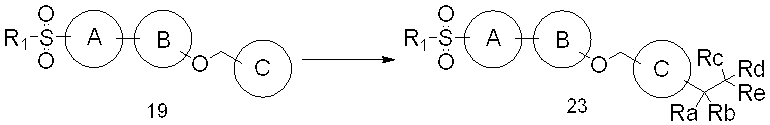
Как показано на схеме реакции 9, соединение 19 подвергают реакции с 2,2,2-трифторэтил трифторметансульфонатом для получения соединения 23.
[Схема реакции 10]
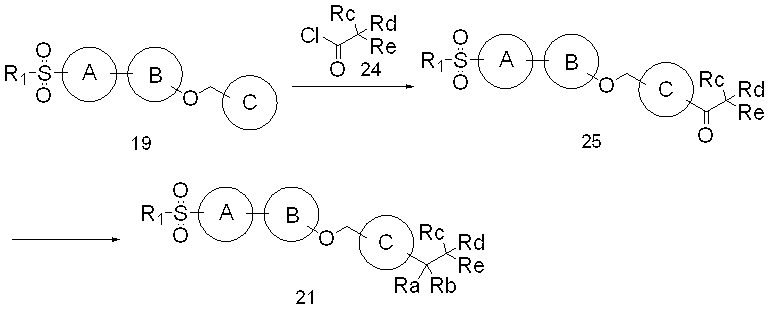
Как показано на схеме реакции 10, соединение 25 получают с помощью образования амидной связи между соединениями 19 и 24, и подвергают восстановлению для получения соединения 21.
[Схема реакции 11]

Как показано на схеме реакции 11, соединение 13 подвергают реакции Сузуки с борнокислым соединением 17 для получения соединения 21.
[Схема реакции 12]

Как показано на схеме реакции 12, борнокислое соединение 26 получают, используя соединение 13 в качестве исходного соединения, и затем подвергают реакции Сузуки с соединением 27 для получения соединения 21.
Соединение 29 у которого Q является -S(O)2NHR1 или -S(O)2NR2R3 в формуле 1 можно синтезировать согласно следующей схеме реакции 13.
[Схема реакции 13]
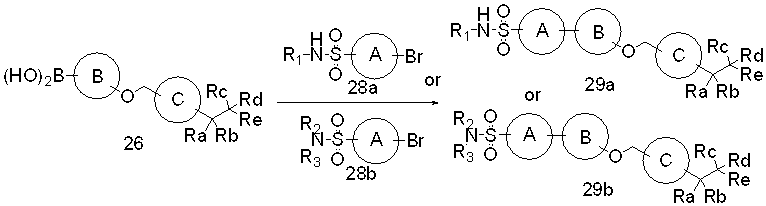
Как показано на схеме реакции 13, соединение 26 подвергают реакции Сузуки с соединением 28 для получения соединения 29.
Соединение 38 у которого кольцо А является
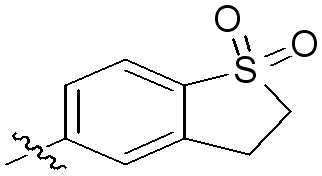
[Схема реакции 14]

Как показано на схеме реакции 14, соединение 30 подвергают реакции Сузуки с соединением 31 для получения соединения 32. Соединение 33 получают путем реакции замещения соединения 32 с соединением 3, и подвергают реакциям окисления и гидрирования для получения соединения 35. Защитную группу соединения 35 удаляют с помощью кислоты, с последующей реакцией с оксирановым соединением 8 для получения соединения 37. Наконец, гидроксильную группу соединения 37 замещают фторидом для получения соединения 38.
[Схема реакции 15]

Как показано на схеме реакции 15, соединение 36 подвергают реакции с 2,2,2-трифторэтил трифторметансульфонатом для получения соединения 38.
Соединение 44 у которого Q является -C(O)R1 в формуле 1 можно синтезировать согласно следующей схеме реакции 16.
[Схема реакции 16]
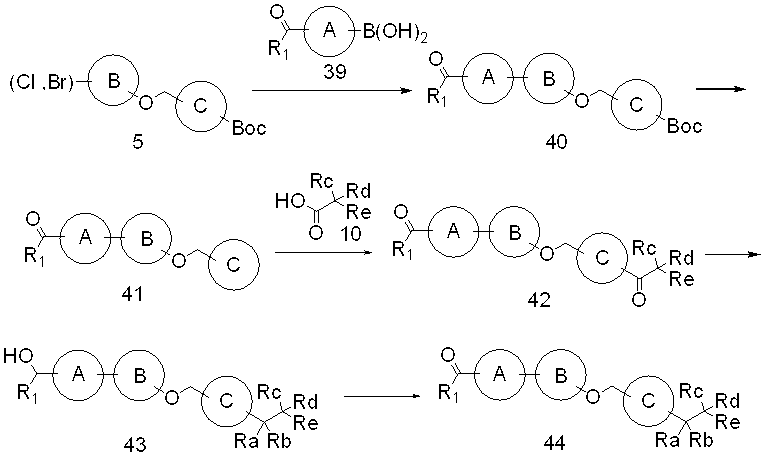
Как показано на схеме реакции 16, соединение 5 подвергают реакции Сузуки с соединением 39 для получения соединения 40. Защитную группу соединения 40 удаляют с помощью кислоты, с дальнейшим образованием амидной связи с соединением 10 для получения соединения 42. Карбонильную группу амида в соединении 42 удаляют путем восстановления, и затем, с целью возвращения нежелательно восстановленной кетонной группы, проводят окисление для получения соединения 44.
Производное 46 можно синтезировать по следующим схемам реакций 17, 18, 19 и 20.
[Схема реакции 17]
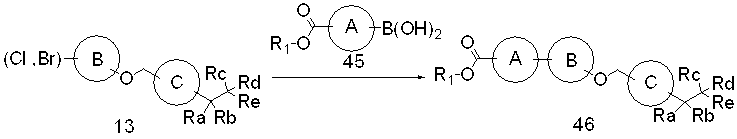
Как показано на схеме реакции 17, соединение 13 подвергают реакции Сузуки с борнокислым соединением 45 для получения соединения 46.
[Схема реакции 18]
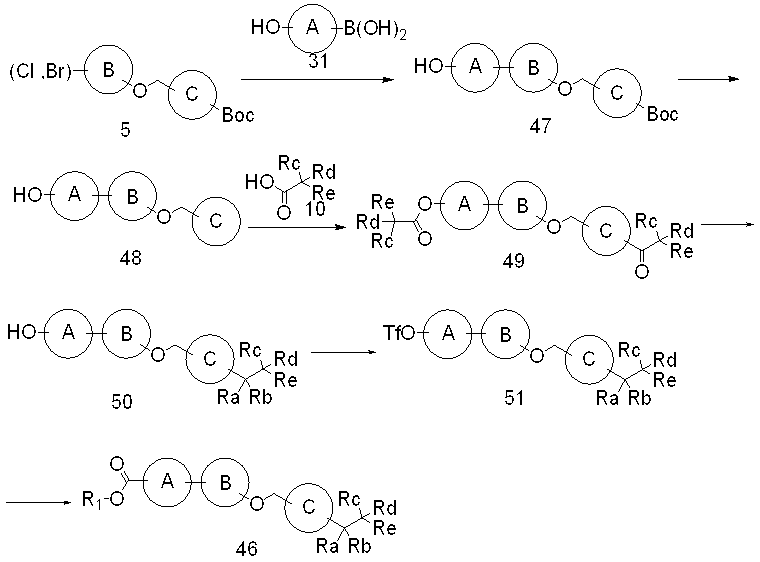
Как показано на схеме реакции 18, соединение 5 подвергают реакции Сузуки с борнокислым соединением 31 для получения соединения 47. Защитную группу удаляют с помощью кислоты, с дальнейшим образованием амидной связи с соединением 10 для получения соединения 49. При восстановлении, удаление карбонильной группы амида и восстановление сложноэфирной группы происходит одновременно, и затем образовавшуюся гидроксильную группу активируют с помощью трифлатной группы для получения соединения 51. Наконец, соединение 46 получают с помощью палладиевого катализатора и газообразного CO.
[Схема реакции 19]
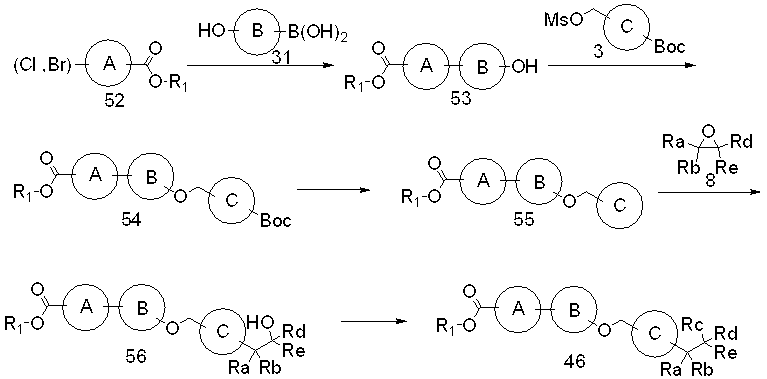
Как показано на схеме реакции 19, соединение 52 подвергают реакции Сузуки с борнокислым соединением 31 для получения соединения 53. Соединение 53 подвергают реакции замещения с соединением 3 для получения соединения 54. Защитную группу соединения 54 удаляют. Полученное соединение 55 подвергают реакции с оксирановым соединением 8 для получения соединения 56. Гидроксильную группу соединения 56 замещают фторидом для получения соединения 46.
[Схема реакции 20]
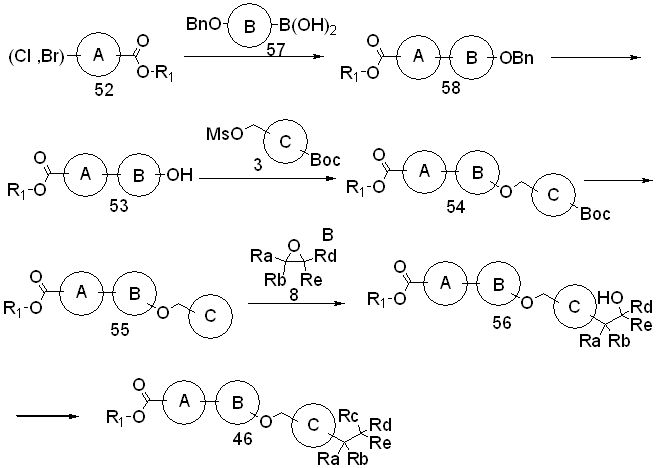
Как показано на схеме реакции 20, соединение 52 подвергают реакции Сузуки с борнокислым соединением 57 для получения соединения 58. С помощью палладия и водорода получают соединение 53, и затем подвергают реакции замещения с соединением 3 для получения соединения 54. После удаления защитной группы соединения 54, соединение 55 подвергают реакции с оксирановым соединениям 8 для получения соединения 56. Гидроксильную группу соединения 56 замещают фторидом для получения соединения 46.
Соединение 61 у которого Q является -C(O)NHR1 или -C(O)NR2R3 в формуле 1 можно синтезировать согласно следующей схеме реакции 21.
[Схема реакции 21]
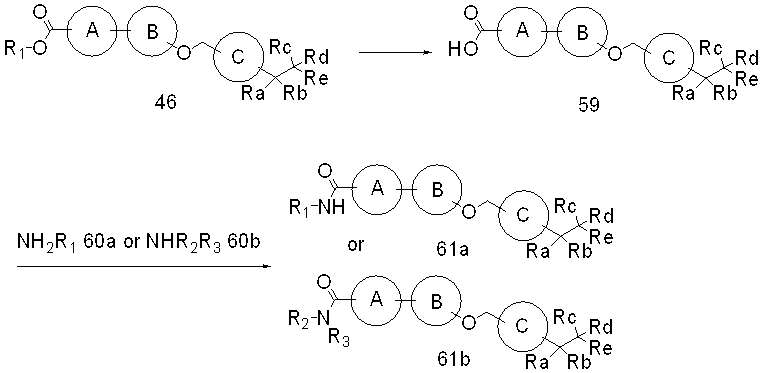
Как показано на схеме реакции 21, соединение 46 гидролизуют для получения соединения 59. Наконец, соединение 59 подвергают образованию амидной связи с аминным соединением 60 для получения соединения 61a или соединение 61b.
Производное 68 можно синтезировать согласно следующей схеме реакции 22 и 23.
[Схема реакции 22]
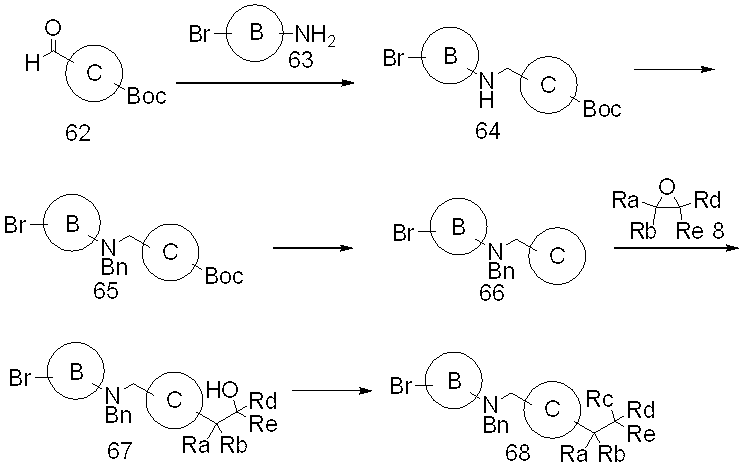
Как показано на схеме реакции 22, соединение 62 подвергают восстановительному аминированию с соединением 63 для получения соединения 64. Во вторичный амин соединения 64 вводят защитную группу для получения соединения 65. Защитную группу соединения 65 удаляют, с последующей реакцией с оксирановым соединениям 8 для получения соединения 67. Наконец, гидроксильную группу соединения 67 замещают фторидом для получения соединения 68.
[Схема реакции 23]
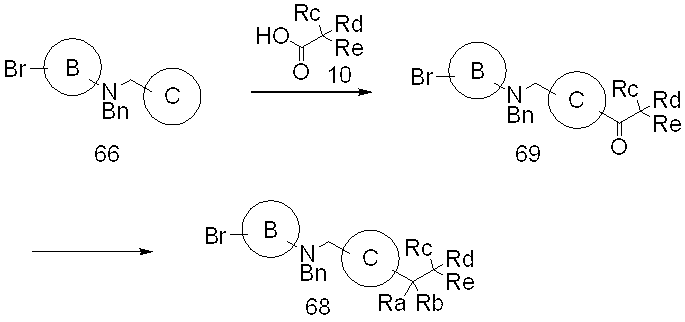
Как показано на схеме реакции 23, соединение 66 подвергают образованию амидной связи с соединением 10 для получения соединения 69, с последующей реакцией восстановления для получения соединения 68.
Соединения 72 и 73 у которых Q является -C(O)NHR1 или -C(O)NR2R3 в формуле 1 можно синтезировать по следующим схемам реакций 24 и 25.
[Схема реакции 24]
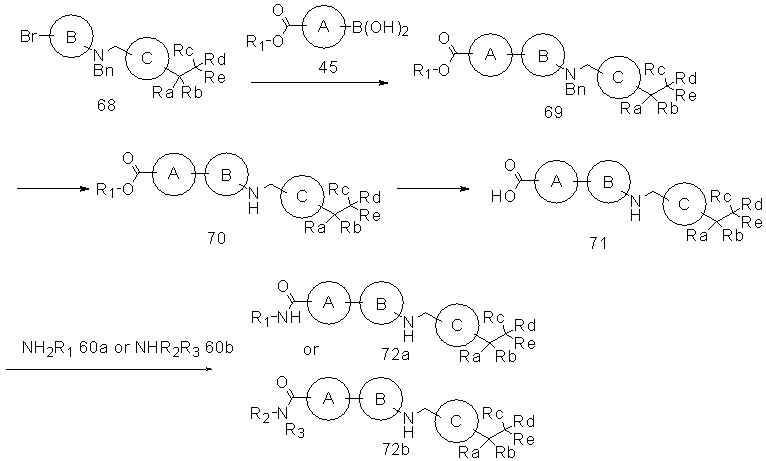
Как показано на схеме реакции 24, соединение 68 подвергают реакции Сузуки с борнокислым соединением 45 для получения соединения 69. Вторичный амин соединения 69 удаляют для получения соединения 70. И затем, соединение 71 получают путем гидролиза соединения 70, и подвергают реакции образования амидной связи с аминным соединением 60 для получения соединения 72.
[Схема реакции 25]
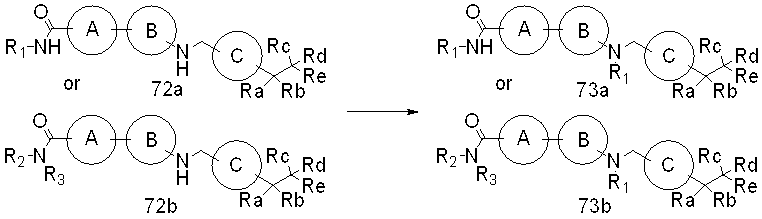
Как показано на схеме реакции 25, соединение 72 подвергают восстановительному аминированию с альдегидом для получения соединения 73.
Соединение 77 с Q или -C(O)NR2R3 в формуле 1 можно синтезировать согласно следующей схеме реакции 26
[Схема реакции 26]
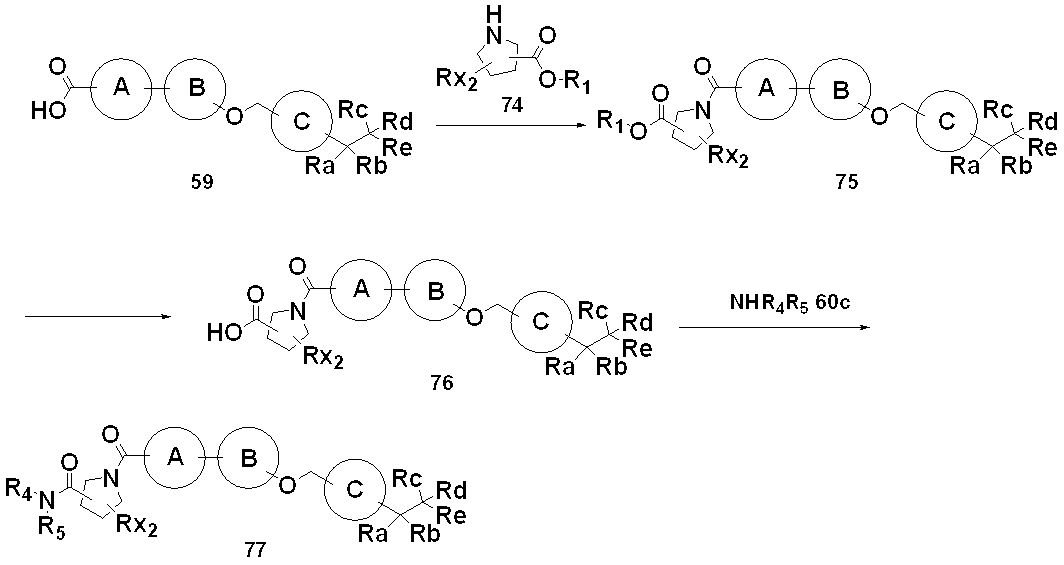
Как показано на схеме реакции 26, соединение 59 подвергают образованию амидной связи с аминным соединением 74 для получения соединения 75. Соединение 75 гидролизуют для получения соединения 76. И соединение 76 подвергают образованию амидной связи с аминным соединением 60 для получения соединения 77.
Используемые сокращения
В данном описании используются следующие сокращения и термины:
Ac = ацетил
Boc = трет-бутоксикарбонил
BOP = бензотриазол-1-илокси-трис(диметиламино)фосфоний гексафторфосфат
Bu = бутил
DAST = диэтиламиносера трифторид
DCM = дихлорметан = метилен хлорид = MC = CH2Cl2
DIPEA = N,N-диизопропилэтиламин
DME = диметоксиэтан
DMF = N,N-диметилформамид
DMSO = диметил сульфоксид
dppp = 1,3-бис(дифенилфосфин)пропан
EDC = 1-этил-3-(3-диметиламинопропил) карбодиимид = EDCI
Et = этил
EtOAc = этил ацетат = EA
EtOH = этанол
HOBt = 1-гидроксибензотриазол
HX = гексан
LAH = литий алюминий гидрид
m-CPBA = мета-хлорпероксибензойная кислота
Me = метил
MeCN = метил цианид = ацетонитрил = ACN
MeOH = метанол
MsCl = метансульфонил хлорид
Pd(dbpf)Cl2 = [1,1' -бис(ди-трет-бутилфосфин)ферроцен]дихлорпалладий(II)
Pd(dppf)Cl2 = [1,1′-бис(дифенилфосфин)ферроцен]дихлорпалладий(II)
PyBOP = бензотриазол-1-ил-окситрипирролидинофосфоний гексафторфосфат
t- или трет- = третичный
TEA = триэтиламин
TFA = трифторуксусная кислота
THF = тетрагидрофуран
Лучший вариант осуществления изобретения
Получение соединений и способы получения соединений
Соединение формулы 1 можно получить способом, известным из различных источников. В дальнейшем, способ получения соединения формулы 1 будет описан подробно в соответствии со схемой реакции.
Пример 1. Соединение 431:
1-(2-фтор-2-метилпропил)-4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин
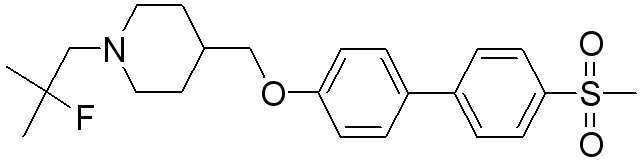
Стадия 1. трет-Бутил 4-(гидроксиметил)пиперидин-1-карбоксилат: 4-Пиперидинметанол (10,00 г, 86,83 ммоль) растворили в CH2Cl2 200 мл, после чего охладили на ледяной бане. Ди-трет-бутил дикарбонат добавили к этой смеси, с последующим медленным повышением температуры до комнатной и перемешиванием в течение 3 часов. Полученную реакционную смесь промыли по порядку водой, насыщенным раствором NH4Cl и насыщенным водным соляным раствором. Промытую реакционную смесь высушили над MgSO4 и отфильтровали. После удаления осадка, фильтрат упарили при пониженном давлении для удаления органического растворителя с получением целевого соединения в виде твердого вещества белого цвета (18,35 г, 98%)
Стадия 2. трет-Бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилат (18,35 г, 85,24 ммоль) растворили в CH2Cl2 200 мл. Et3N (35,45 мл, 255,71 ммоль) добавили к этой смеси, и затем смесь охладили на ледяной бане. MsCl (9,83 мл, 127,86 ммоль) медленно добавили по каплям, с последующим медленным повышением температуры до комнатной и перемешиванием в течение 15 часов. Полученную реакционную смесь промыли по порядку 1 N HCl, насыщенным водным раствором NaHCO3 и насыщенным водным соляным раствором. Промытую реакционную смесь высушили над MgSO4 и отфильтровали. После удаления осадка, фильтрат упарили при пониженном давлении для удаления органического растворителя с получением целевого соединения в виде твердого вещества желтого цвета (24,80 г, 99%).
Стадия 3. трет-Бутил 4-((4-бромфенокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат (13,63 г, 46,46 ммоль) и 4-бромфенол (8,34 г, 46,46 ммоль) растворили в DMF 100 мл, и затем K2CO3 (19,26 г, 139,38 ммоль) добавили к этой смеси, после чего перемешивали при 80 ºC в течение 15 часов. К этой смеси добавили достаточное количество воды, после чего отфильтровали для получения твердого вещества. Полученное твердое вещество перекристаллизовали из MeOH с получением целевого соединения в виде твердого вещества белого цвета (11,31 г, 66%). Полученный фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10% EtOAc/гексан) с дальнейшим получением целевого соединения в виде твердого вещества белого цвета (2,38 г, 14%).
Стадия 4. трет-Бутил 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((4-бромфенокси)метил)пиперидин-1-карбоксилат (3,00 г, 8,10 ммоль) и 4-(метилсульфонил)фенилборную кислоту (1,78 г, 8,91 ммоль) растворили в DME 15 мл, и затем добавили к этой смеси 5 мл воды. Pd(dbpf)Cl2 (528 мг, 0,81 ммоль) и Cs2CO3 (3,96 г, 12,15 ммоль) добавили туда же, после чего кипятили с обратным холодильником при 80 ºC в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc три раза. Полученный органический слой высушили над MgSO4, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества желтого цвета (2,50 г, 69%).
Стадия 5. 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин 2,2,2-трифторацетат:
трет-бутил 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-карбоксилат (2,50 г, 5,61 ммоль) растворили в CH2Cl2 8 мл, и затем TFA 644 мкл добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 3 часов. Полученную реакционную смесь отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (2,40 г, 96%). Альтернативным образом 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин 2,2,2-трифторацетат (3,78 г, 8,48 ммоль) растворили в диоксане 20 мл, и затем к этой смеси добавили 4 M раствор HCl (14,85 мл, 59,39 ммоль), после чего перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь суспендировали в EtOAc, и затем отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (3,15 г, 97%).
Стадия 6. 2-метил-1-(4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)пропан-2-ол: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин 2,2,2-трифторацетат (100 мг, 0,22 ммоль) и K2CO3 (15 мг, 0,11 ммоль) суспендировали в EtOH 1 мл. Воду 0,5 мл добавили к этой смеси, и затем суспендировали при нагревании. 2,2-Диметил оксиран (0,19 мл, 2,18 ммоль) добавили к этой смеси, и затем реакцию проводили при 110 ºC в течение 20 минут с одновременным микроволновым облучением. К этой смеси добавили немного воды, и отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (90 мг, 99%).
Стадия 7. Соединение 431: 2-Метил-1-(4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)пропан-2-ол (50 мг, 0,12 ммоль) растворили в CH2Cl2 2 мл, и затем Deoxo-Fluor (24 мкл, 0,13 ммоль) добавили к этой смеси. После перемешивания при комнатной температуре в течение 3 часов, насыщенный водный раствор NaHCO3 добавили к этой смеси, и смесь проэкстрагировали с CH2Cl2. Полученный органический слой высушили над MgSO4, и затем отфильтровали для удаления твердого осадка. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (40 мг, 79%).
1H NMR (400 MHz, CDCl3) δ 8,02 - 7,96 (m, 2 H), 7,78 - 7,71 (m, 2 H), 7,59 - 7,54 (m, 2 H), 7,04 - 6,98 (m, 2 H), 3,86 (d, 2 H, J = 6,0 Hz), 3,10 (s, 3 H), 3,00 (d, 2 H, J = 11,5 Hz), 2,48 (s, 1 H), 2,43 (s, 1 H), 2,23 - 2,13 (m, 2 H), 1,88 - 1,75 (m, 3 H), 1,48 - 1,40 (m, 2 H), 1,41 (s, 3 H), 1,35 (s, 3 H); MS (ESI) m/z 420 (M+ + H).
Пример 2. Соединение 596: 2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5-(4-(метилсульфонил)фенил)пиридин
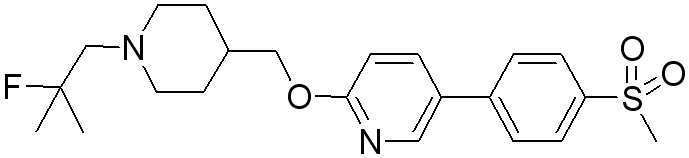
Стадия 1. трет-Бутил 4-((5-бромпиридин-2-илокси)метил)пиперидин-1-карбоксилат: N-Boc-4-пиперидинметанол (500 мг, 2,32 ммоль) растворили в DMF 10 мл. 2,5-бромпиридин (600 мг, 2,55 ммоль) и 95% NaH (83 мг, 3,48 ммоль) медленно добавили туда же при 0 °C, с последующим повышением температуры и перемешиванием при комнатной температуре в течение 3 часов. По окончании реакции, реакционную смесь проэкстрагировали с помощью EtOAc. Полученный органический слой промыли три раза насыщенным водным раствором NH4Cl и насыщенным водным соляным раствором. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-20% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (67 мг, 78%).
Стадия 2. трет-Бутил 4-((5-(4-(метилсульфонил)фенил)пиридин-2-илокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((5-бромпиридин-2-илокси)метил)пиперидин-1-карбоксилат (0,65 г, 1,80 ммоль) растворили в диоксане 20 мл и H2O 5 мл. 4-Метилсульфонилфенилборную кислоту (0,36 г, 1,80 ммоль), Pd(dbpf)Cl2 (59 мг, 0,09 ммоль) и Cs2CO3 (1,17 г, 3,61 ммоль) добавили к этой смеси, и кипятили с обратным холодильником при перемешивании в течение 2 часов. По окончании реакции, реакционную смесь отфильтровали через цеолиты. Полученный фильтрат упарили при пониженном давлении. Полученный концентрат растворили в CH2Cl2, промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (0,67 г, 83%).
Стадия 3. 5-(4-(метилсульфонил)фенил)-2-(пиперидин-4-илметокси)пиридин гидрохлорид:
трет-бутил 4-((5-(4-(метилсульфонил)фенил)пиридин-2-илокси)метил)пиперидин-1-карбоксилат (0,2 г, 0,45 ммоль) растворили в MeOH. 1,25 M HCl в MeOH (2,24 ммоль, 1,8 мл) добавили к этой смеси. Полностью удалили растворитель и остаток промыли эфиром с получением целевого соединения в виде твердого вещества белого цвета (0,15 г, 88%). Полученный продукт использовали без дальнейшей очистки.
Стадия 4. 2-метил-1-(4-((5-(4-(метилсульфонил)фенил)пиридин-2-илокси)метил)пиперидин-1-ил)пропан-2-ол: 5-(4-(метилсульфонил)фенил)-2-(пиперидин-4-илметокси)пиридин гидрохлорид (0,20 г, 0,58 ммоль) растворили в EtOH 3 мл и H2O 3 мл. Изобутилен оксид (0,42 г, 5,77 ммоль) и K2CO3 (0,40 г, 2,89 ммоль) медленно добавили к реакционной смеси. Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 20 минут. По окончании реакции, реакционную смесь упарили при пониженном давлении. Концентрат растворили в CH2Cl2 , и промыли водой три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-5% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (0,15 г, 62%).
Стадия 5. Соединение 596: 2-метил-1-(4-((5-(4-(метилсульфонил)фенил)пиридин-2-илокси)метил)пиперидин-1-ил)пропан-2-ол (0,15 г, 0,36 ммоль) растворили в CH2Cl2 2 мл, и затем Deoxo-Fluor (0,34 мл, 1,80 ммоль) медленно добавили к реакционной смеси, после чего перемешивали при комнатной температуре в течение 2 часов. По окончании реакции, полученный CH2Cl2 слой промыли водой несколько раз. Органический слой упарили при пониженном давлении. Органический слой упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-30% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (0,1 г, 66%).
1H NMR (400 MHz, CDCl3) δ 8,41 (d, 1 H, J = 2,5 Hz), 8,02 (d, 2 H, J = 12,0 Hz), 7,82 (dd, 1 H, J = 8,6, 2,6 Hz), 7,72 (d, 2 H, J = 8,4 Hz), 6,86 (d, 1 H, J = 8,6 Hz), 4,22 - 4,20 (m, 2 H), 3,10 (s, 3 H), 3,0 (brs, 2 H), 2,45 (d, 2 H, J = 24,0 Hz), 2,17 (brs, 2 H), 1,81 (brs, 3 H), 1,40 - 1,25 (m, 8 H); MS (ESI) m/z 421 (M+ + H).
Пример 3. Соединение 597: 5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-2-(4-(метилсульфонил)фенил)пиридин

Стадия 1. трет-Бутил 4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-карбоксилат:
N-Boc-4-пиперидинметанол (0,50 г, 2,32 ммоль) растворили в CH2Cl2 5 мл, и затем Et3N (0,48 мл, 3,48 ммоль) и MsCl (0,32 г, 2,79 ммоль) медленно добавили по каплям при 0 ºC. Смесь перемешивали в течение 30 минут, с последующим повышением температуры и перемешиванием при комнатной температуре в течение 12 часов. По окончании реакции, реакционную смесь промыли с избытком воды три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета ( 0,68 г, 100%). Продукт растворили в DMF 10 мл. K2CO3 (1,13 г, 3,48 ммоль) и 2-хлор-5-гидроксипиридин (0,3 г, 2,32 ммоль) медленно добавили туда же. После повышения температуры, смесь перемешивали с нагреванием при 100 ºC в течение 3 часов. По окончании реакции, реакционную смесь три раза промыли насыщенным водным соляным раствором. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-30% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (0,45 г, 59%).
Стадия 2. трет-Бутил 4-((6-(4-(метилсульфонил)фенил)пиридин-3-илокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-карбоксилат (0,45 г, 1,37 ммоль) растворили в диоксане 20 мл и H2O 5 мл. 4-Метилсульфонилфенилборную кислоту (0,28 г, 1,38 ммоль) и Pd(dbpf)Cl2 (45 мг, 0,07 ммоль), Cs2CO3 (0,89 г, 2,75 ммоль) добавили к этой смеси, и кипятили с обратным холодильником при перемешивании в течение 2 часов. По окончании реакции, реакционную смесь отфильтровали через цеолиты. Полученный фильтрат промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (0,45 г, 73%).
Стадия 3. 2-(4-(метилсульфонил)фенил)-5-(пиперидин-4-илметокси)пиридин гидрохлорид:
трет-бутил 4-((6-(4-(метилсульфонил)фенил)пиридин-3-илокси)метил)пиперидин-1-карбоксилат (0,45 г, 1,0 ммоль) растворили в диоксане 10 мл. 4M HCl в MeOH (1,26 мл, 5,0 ммоль) добавили к этой смеси. Полностью удалили растворитель и остаток промыли эфиром с получением целевого соединения в виде твердого вещества белого цвета (0,36 г, 93%). Полученный продукт использовали без дальнейшей очистки.
Стадия 4. 2-метил-1-(4-((6-(4-(метилсульфонил)фенил)пиридин-3-илокси)метил)пиперидин-1-ил)пропан-2-ол: 2-(4-(метилсульфонил)фенил)-5-(пиперидин-4-илметокси)пиридин гидрохлорид (0,15 г, 0,39 ммоль) растворили в EtOH 5 мл и H2O 5 мл. Изобутилен оксид (0,28 г, 3,92 ммоль) и K2CO3 (0,27 г, 1,96 ммоль) медленно добавили к реакционной смеси. Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 20 минут. По окончании реакции, реакционную смесь упарили при пониженном давлении. Концентрат растворили в CH2Cl2, и промыли водой три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-5% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (0,15 г, 92%).
Стадия 5. Соединение 597: 2-метил-1-(4-((6-(4-(метилсульфонил)фенил)пиридин-3-илокси)метил)пиперидин-1-ил)пропан-2-ол (0,15 г, 0,36 ммоль) растворили в CH2Cl2 10 мл. Deoxo-Fluor (0,34 мл, 1,79 ммоль) медленно добавили к реакционной смеси, после чего перемешивали при комнатной температуре в течение 2 часов. По окончании реакции, полученный CH2Cl2 слой промыли водой несколько раз. Органический слой упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-30% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (0,1 г, 66%).
1H NMR (400 MHz, CDCl3) δ 8,42 (d, 1 H, J = 12,0 Hz), 8,16 (d, 2 H, J = 1,6 Hz), 8,02 (d, 2 H, J = 8,5 Hz), 7,74 (d, 1 H, J = 8,7 Hz), 7,30 (s, 1 H), 3,91 (d, 2 H, J = 5,5 Hz), 3,09 (s, 3 H), 3,0 (brs, 2 H), 2,48 - 2,42 (m, 2 H), 2,25 - 2,15 (m, 2 H), 1,93 - 1,78 (m, 3 H), 1,47 - 1,35 (m, 8 H); MS (ESI) m/z 421 (M+ + H).
Пример 4. Соединение 789:
1-((1-фторциклогексил)метил)-4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин
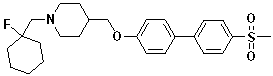
Стадия 1. 1-((4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)метил)циклогексанол: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин гидрохлорид (0,04 г, 0,11 ммоль) и K2CO3 (0,01 г, 0,06ммоль) суспендировали в EtOH (1 мл). Воду (0,5 мл) добавили к этой смеси, и смесь суспендировали при небольшом нагревании. 1-оксаспиро[2,5]октан (0,13 г, 1,18 ммоль) добавили к этой смеси. Реакцию проводили в микроволновой печи при 110 °C в течение 20 минут. Немного воды добавили к этой смеси, и отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (0,05 г, 87%).
Стадия 2. Соединение 789: 1-((4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)метил)циклогексанол (0,05 г, 0,10 ммоль) растворили в CH2Cl2 (2 мл), и затем температуру понизили с помощью сухого льда в ацетоне. DAST (0,02 мл, 0,10 ммоль) добавили к этой смеси небольшими порциями, и перемешивали в течение 4 часов, и затем далее перемешивали при комнатной температуре в течение 1 часа. К этой смеси добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г, ISU силикагелевый картридж, 10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества коричневого цвета (0,01 г, 27%).
1H NMR (400 MHz, CDCl3) δ 7,97 (d, 2 H, J = 8,5 Hz), 7,72 (d, 2 H, J = 8,5 Hz), 7,55 (d, 2 H, J = 8,8 Hz), 6,99 (d, 2 H, J = 8,8 Hz), 3,85 (d, 2 H, J = 5,8 Hz), 3,08 (s, 3 H), 2,98 (d, 2 H, J = 10,0 Hz), 2,48 (s, 1 H), 2,42 (s, 1 H), 2,16 (t, 2 H, J = 11,3 Hz), 1,92 - 1,74 (m, 5 H), 1,68 - 1,55 (m, 4 H), 1,55 - 1,35 (m, 6 H); MS (ESI) m/z 460 (M+ + H).
Пример 5. Соединение 500: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклопропил)метил)пиперидин

Стадия 1. (4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)(1-(трифторметил) циклопропил)метанон: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин гидрохлорид [продукт синтеза стадии 5 соединения 431; 74 мг, 0,20 ммоль], 1-(трифторметил)циклопропан-1-карбоновую кислоту (30 мг, 0,20 ммоль), и EDC (74 мг, 0,39 ммоль) и HOBt (52 мг, 0,39 ммоль) растворили в DMF 3 мл, и затем DIPEA (173 мкл, 0,97 ммоль) добавили к этой смеси. При 80 °C, реакцию проводили в течение 16 часов. Реакционную смесь разбавили CH2Cl2, и промыли насыщенным водным раствором NH4Cl. Полученный органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (30 мг, 32%).
Стадия 2. Соединение 500: (4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)(1-(трифторметил)циклопропил)метанон (50 мг, 0,10 ммоль) растворили в сухом THF 2 мл, после чего охладили на ледяной бане. LAH (1 M в THF, 0,21 мл, 0,21 ммоль) медленно добавили по каплям, с последующим повышением температуры до комнатной температуры медленно и перемешивали в течение 4 часов. В реакционную смесь влили воду. Образовавшийся осадок удалили фильтрованием, и фильтрат проэкстрагировали с помощью EtOAc три раза. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (20-40% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (26 мг, 54%).
1H NMR (400 MHz, CDCl3) δ 7,99 - 7,96 (m, 2 H), 7,74 - 7,71 (m, 2 H), 7,56 - 7,52 (m, 2 H), 7,01 - 6,98 (m, 2 H), 3,86 (d, 2 H, J = 6,0 Hz), 3,09 (s, 3 H), 3,06 - 2,96 (m, 4 H), 2,41 (t, 2 H, J = 10,9 Hz), 1,87 - 1,81 (m, 3 H), 1,56 (s, 2 H), 1,52 - 1,43 (m, 2 H); MS (ESI) m/z 468 (M+ + H).
Пример 6. Соединение 542: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидин
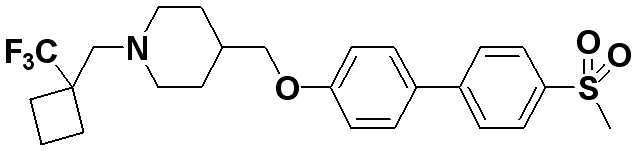
Стадия 1. (4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)(1-(трифторметил) циклобутил)метанон: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин 2,2,2-трифторацетат [продукт синтеза стадии 5 соединения 431; 140 мг, 0,37 ммоль], 1-(трифторметил)циклобутанекарбоновую кислоту (92 мг, 0,55 ммоль), EDC (141 мг, 0,73 ммоль) и HOBt (99 мг, 0,73 ммоль) растворили в DMF 2 мл, и затем DIPEA (95 мг, 0,73 ммоль) добавили к этой смеси. При 60 °C, реакцию проводили в течение 10 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (50-60% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (105 мг, 57%).
Стадия 2. Соединение 542: (4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)(1-(трифторметил)циклобутил)метанон (80 мг, 0,16 ммоль) растворили в сухом THF 6 мл, после чего охладили на ледяной бане. LAH (1 M в THF, 0,18 мл, 0,18 ммоль) медленно добавили по каплям, с последующим повышением температуры до комнатной температуры медленно и перемешивали в течение 1 часа. В реакционную смесь влили воду. Образовавшийся осадок удалили фильтрованием, и фильтрат проэкстрагировали с помощью EtOAc три раза. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (9 мг, 11%).
1H NMR (400 MHz, CDCl3) δ 7,97 (dd, 2 H, J = 6,7, 1,9 Hz), 7,73 (dd, 1 H, J = 6,7, 1,8 Hz), 7,55 (dd, 2 H, J = 6,8, 2,0 Hz), 7,00 (dd, 2 H, J = 6,3, 2,0 Hz), 3,85 (d, 2 H, J = 6,1 Hz), 3,08 (s, 3 H), 2,09 (m, 2 H), 2,53 (s, 2 H), 2,23 (m, 4 H), 1,92 (m, 7 H), 1,45 (m, 2 H).; MS (ESI) m/z 482 (M+ + H).
Пример 7. Соединение 546: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклопентил)метил)пиперидин

Стадия 1. (4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)(1-(трифторметил)циклопентил)метанон: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин 2,2,2-трифторацетат [продукт синтеза стадии 5 соединения 431; 150 мг, 0,39 ммоль], 1-(трифторметил)циклопентанекарбоновую кислоту (107 мг, 0,59 ммоль), EDC (151 мг, 0,79 ммоль) и HOBt (106 мг, 0,79 ммоль) растворили в DMF 2 мл, и затем DIPEA (101 мг, 0,79 ммоль) добавили к этой смеси. При 60 °C, реакцию проводили в течение 10 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (50-60% EtOAc / гексан) с получением целевого соединения в виде твердого вещества белого цвета (90 мг, 45%).
Стадия 2. Соединение 546: (4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)(1-(трифторметил)циклопентил)метанон (35 мг, 0,07 ммоль) растворили в сухом THF 4 мл, после чего охладили на ледяной бане. LAH (1 M в THF, 0,18 мл, 0,18 ммоль) медленно добавили по каплям, с последующим повышением температуры до 60 ºC медленно и перемешивали в течение дня. В реакционную смесь влили воду. Образовавшийся осадок удалили фильтрованием, и фильтрат проэкстрагировали с помощью EtOAc три раза. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью препаративной тонкослойной хроматографии (40% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (5 мг, 14%).
1H NMR (400 MHz, CDCl3) δ 7,97 (dd, 2 H, J = 6,8, 1,9 Hz), 7,72 (dd, 2 H, J = 6,8, 1,9 Hz), 7,54 (dd, 2 H, J = 6,8, 2,0 Hz), 6,99 (dd, 2 H, J = 6,8, 2,0 Hz), 3,84 (d, 2 H, J = 6,0 Hz), 3,08 (s, 3 H), 2,46 (s, 2 H), 2,26 (m, 2 H), 2,17 (s, 4 H), 1,81 (m, 4 H), 1,67 (m, 5 H), 1,40 (m, 2 H); MS (ESI) m/z 496 (M+ + H).
Пример 8. Соединение 547:
1-(2,2-дифторпропил)-4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин
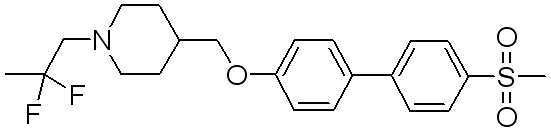
Стадия 1. 1-(4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)пропан-2-он
4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин 2,2,2-трифторацетат (продукт синтеза стадии 5 соединения 431; 50 мг, 0,11 ммоль) и 1-хлорпропан-2-он (13 мкл, 0,16 ммоль) растворили в MeCN 2 мл. K2CO3 (53 мг, 0,38 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2 три раза. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-5% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества светло-серого цвета (30 мг, 68%).
Стадия 2. Соединение 547: 1-(4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)пропан-2-он (32 мг, 0,08 ммоль) растворили в CH2Cl2 0,5 мл, и затем Deoxo-Fluor (29 мкл, 0,16 ммоль) добавили к этой смеси. EtOH (1 мкл, 0,02 ммоль) добавили к этой смеси, с последующим повышением температуры до комнатной температуры и перемешивали в течение 15 часов. Реакционную смесь разбавили насыщенным водным раствором NaHCO3, и проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-5% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета. Полученный продукт очистили снова с помощью колоночной хроматографии на силикагеле (0-50% EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (7 мг, 20%).
1H NMR (400 MHz, CDCl3) δ 7,95 - 8,01 (m, 2 H), 7,77 - 7,69 (m, 2 H), 7,59 - 7,53 (m, 2 H), 7,03 - 6,97 (m, 2 H), 3,85 (d, 2 H, J = 5,8 Hz), 3,09 (s, 3 H), 3,00 (d, 2 H, J = 11,8 Hz), 2,68 (t, 2 H, J = 13,8 Hz), 2,26 (td, 2 H, J = 11,7, 1,9 Hz), 1,88 - 1,77 (m, 3 H), 1,65 (t, 3 H, J = 18,7 Hz), 1,46 - 1,42 (m, 2 H); MS (ESI) m/z 424 (M+ + H).
Пример 9. Соединение 589: 5-(4-(метилсульфонил)фенил)-2-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин
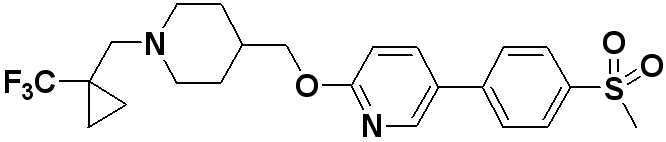
Стадия 1. этил 1-(1-(трифторметил)циклопропанкарбонил)пиперидин-4-карбоксилат:
1-(трифторметил)циклопропанкарбоновую кислоту (500 мг, 3,25 ммоль), этил пиперидин-4-карбоксилат (561 мг, 3,57 ммоль), EDC (1,24 г, 6,49 ммоль) и HOBt (877 мг, 6,49 ммоль) растворили в CH2Cl2 10 мл, и затем DIPEA (114 мкл, 6,49 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 8 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде бесцветного масла (800 мг, 84%).
Стадия 2. (1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метанол: этил 1-(1-(трифторметил)циклопропанкарбонил)пиперидин-4-карбоксилат (818 мг, 2,79 ммоль) растворили в сухом THF 20 мл. При 0ºC, LAH (1 M в THF, 13,94 мл, 13,94 ммоль) медленно добавили к реакционной смеси. При 50 °C, реакцию проводили в течение 10 часов. Реакцию погасили путем медленного добавления MeOH при 0 ºC. Реакционную смесь разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный экстрагированный органический слой высушили над MgSO4, и затем отфильтровали с получением целевого соединения в виде бесцветного масла (577 мг, 87%).
Стадия 3. 5-бром-2-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин: (1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метанол (577 мг, 2,43 ммоль) растворили в THF 10 мл. При 0 °C, NaH (87 мг, 3,65 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при комнатной температуре в течение 20 минут. При 0 °C, 2,5-дибромпиридин (0,57 г, 2,43 ммоль) в THF 5 мл медленно добавили к реакционной смеси. При 50 ºC, реакцию проводили в течение 10 часов. По окончании реакции, реакционную смесь разбавили ледяной водой и проэкстрагировали с помощью EtOAc. Полученный экстрагированный органический слой высушили над MgSO4, и затем отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (500 мг, 52%).
Стадия 4. Соединение 589: 5-бром-2-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин (100 мг, 0,25 ммоль), 4-(метилсульфонил)фенилборную кислоту (76 мг, 0,38 ммоль), Pd(dbpf)Cl2 (5 мг, 0,01 ммоль), Cs2CO3 (247 мг, 0,76 ммоль) добавили в микроволновой реактор, и затем диоксан 6 мл и воду 3 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. Реакционную смесь отфильтровали через цеолиты. Фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (10-50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (38 мг, 32%).
1H NMR (400 MHz, CDCl3) δ 8,40 (m, 1 H), 8,02 (dd, 2 H, J = 5,2, 3,4 Hz), 7,83 (dd, 1 H, J = 8,6, 2,6 Hz), 7,72 (dt, 2 H, J = 8,6, 1,9 Hz), 6,86 (dd, 1 H, J = 8,6, 0,6 Hz), 4,21 (d, 2 H, J = 6,0 Hz), 3,10 (s, 3 H), 2,98 (d, 2 H, J = 10,1 Hz), 2,54 (s, 2 H), 1,99 (m, 2 H), 1,81 (d, 2 H, J = 10,0 Hz), 1,41 (m, 2 H), 0,98 (s, 2 H), 0,65 (s, 2 H); MS (ESI) m/z 469 (M+ + H).
Пример 10. Соединение 676: 5-(4-(метилсульфонил)фенил)-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин
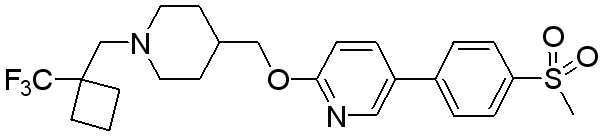
Стадия 1. этил 1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-карбоксилат:
1-(трифторметил)циклобутанекарбоновую кислоту (500 мг, 2,97 ммоль), этил пиперидин-4-карбоксилат (514 мг, 3,27 ммоль), EDC (1,14 г, 5,94 ммоль) и HOBt (803 мг, 5,95 ммоль) растворили в CH2Cl2 10 мл. DIPEA (1,05 мл, 5,95 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 8 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, и затем отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде бесцветного масла (750 мг, 82%).
Стадия 2. (1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метанол: этил 1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-карбоксилат (759 мг, 2,47 ммоль) растворили в сухом THF 20 мл. При 0 ºC, LAH (1 M в THF, 12,34 мл, 12,34 ммоль) медленно добавили к реакционной смеси. При 50 ºC, реакцию проводили в течение 10 часов. Реакцию погасили путем медленного добавления MeOH при 0 ºC. Реакционную смесь разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный экстрагированный органический слой высушили над MgSO4, и затем отфильтровали с получением целевого соединения в виде бесцветного масла (581 мг, 94%).
Стадия 3. 5-бром-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) пиридин: (1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метанол ( 581 мг, 2,31 ммоль) растворили в THF 10 мл. При 0 ºC, NaH (83 мг, 3,47 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при комнатной температуре в течение 20 минут. При 0 ºC, 2,5-дибромпиридин (547 мг, 2,31 ммоль) в THF 5 мл медленно добавили к реакционной смеси. При 50 ºC, реакцию проводили в течение 10 часов. По окончании реакции, реакционную смесь разбавили ледяной водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (500 мг, 53%).
Стадия 4. Соединение 676: 5-бром-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин (500 мг, 0,12 ммоль), 4-(метилсульфонил)фенилборную кислоту (27 мг, 0,13 ммоль), Pd(dbpf)Cl2 (2 мг, 0,01 ммоль), Cs2CO3 (119 мг, 0,37 ммоль) добавили в микроволновой реактор, и затем диоксан 2 мл и воде 1 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. Реакционную смесь отфильтровали через цеолиты. Фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (10-50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (20 мг, 34%).
1H NMR (400 MHz, CDCl3) δ 8,41 (d, 1 H, J = 2,6 Hz), 8,02 (dd, 2 H, J = 8,5, 1,8 Hz), 7,83 (dd, 1 H, J = 8,7, 2,6 Hz), 7,72 (dd, 2 H, J = 6,6, 1,7 Hz), 6,87 (d, 1 H, J = 8,6 Hz), 4,22 (d, 2 H, J = 6,2 Hz), 3,10 (s, 3 H), 2,90 (d, 2 H, J = 11,4 Hz), 2,53 (s, 2 H), 2,24 - 2,18 (m, 4 H), 2,10 - 1,79 (m, 7 H), 1,47 - 1,43 (m, 2 H); MS (ESI) m/z 483 (M+ + H).
Пример 11. Соединение 714: 1-(2-фтор-2-метилпропил)-4-((2-фтор-4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин
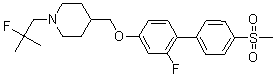
4-((4-бром-3-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 4 соединения 704; 850 мг, 2,35 ммоль), 4-(метилсульфонил)фенилборную кислоту (563 мг, 2,82 ммоль), Pd(dbpf)Cl2 (77 мг, 0,12 ммоль) и Cs2CO3 (1,53 г, 4,69 ммоль) добавили к смеси вода (2 мл)/1,4-диоксан (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Добавили воду, и реакционную смесь проэкстрагировали с помощью EtOAc, органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1/7) с получением целевого соединения в виде твердого вещества желтого цвета (390 мг, 38%).
1H NMR (400 MHz, CDCl3) δ 8,01 - 7,98 (m, 2 H), 7,73 - 7,70 (m, 2 H), 7,39 - 7,27 (m, 1 H), 6,82 - 6,72 (m, 2 H), 3,84 (d, 2 H, J = 6,0 Hz), 3,10 (s, 3 H), 3,02 (brs, 2 H), 2,49 - 2,44 (m, 2 H), 2,19 (brs, 2 H), 1,82 - 1,79 (m, 3 H), 1,45 - 1,36 (m, 8 H); MS (ESI) m/z 438 (M+ + H).
Пример 12. Соединение 617: 2-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)-5-(метилсульфонил)пиридин
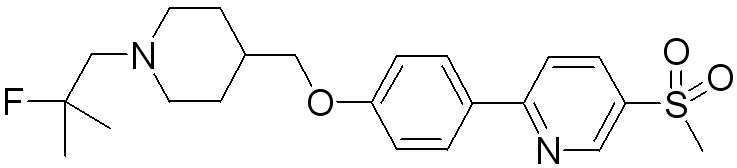
Стадия 1. 4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенилборная кислота:
4-((4-бромфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 3 соединения 498; 0,54 г, 1,57 ммоль) растворили в сухом THF 10 мл. При -78 ºC, n-BuLi (1,6 M в гексан, 1,17 мл, 1,88 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при -78 ºC в течение 30 минут. При -78 ºC, триизопропил борат (0,47 мл, 2,04 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 4 часов. При 0 ºC, 1 M HCl 5 мл добавили к этой смеси, и реакцию проводили в течение 1 часа. Реакционную смесь разбавили с EtOAc, и перемешали. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (0,40 г, 83%).
Стадия 2. Соединение 617: 4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенилборную кислоту (50 мг, 0,16 ммоль), 2-бром-5-(метилсульфонил)пиридин (42 мг, 0,18 ммоль), Pd(dbpf)Cl2 (3 мг, 0,01 ммоль), Cs2CO3 (104 мг, 0,32 ммоль) добавили в микроволновой реактор, и затем диоксан 2 мл и воде 1 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. Реакционную смесь отфильтровали через цеолиты. Фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (30 мг, 44%).
1H NMR (400 MHz, CDCl3) δ 9,14 (m, 1 H), 8,21 (dd, 1 H, J = 8,5, 2,4 Hz), 8,05 (dt, 2 H, J = 9,0, 2,5 Hz), 7,85 (dd, 1 H, J = 8,5, 0,8 Hz), 7,02 (dt, 2 H, J = 8,9, 2,4 Hz), 3,88 (d, 2 H, J = 5,9 Hz), 3,14 (s, 3 H), 3,07 (m, 2 H), 2,60 - 2,40 (m, 2 H), 2,22 (m, 2 H), 1,85 - 1,82 (m, 3 H), 1,47 - 1,37 (m, 8 H); MS (ESI) m/z 421 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 617 (Стадия 2), соединения Таблицы 2 синтезировали с использованием 4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенилборной кислоты и реагента из Таблицы 1.
Таблица 1.
Таблица 2.
Пример 13. Соединение 499:
4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-(2,2,2-трифторэтил)пиперидин
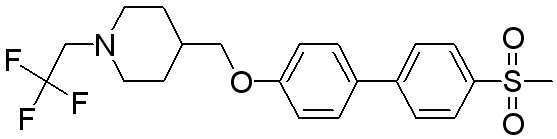
4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 5 соединения 431; 50 мг, 0,13 ммоль) растворили в DMSO 2 мл. 2,2,2-трифторэтил трифторметансульфонат (30 мг, 0,13 ммоль) и K2CO3 (91 мг, 0,66 ммоль) добавили туда же, после чего перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавили с EtOAc, и промыли водой три раза. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-40% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (23 мг, 41%).
1H NMR (400 MHz, CDCl3) δ 7,99 - 7,96 (m, 2 H), 7,74 - 7,71 (m, 2 H), 7,56 - 7,52 (m, 2 H), 7,01 - 6,98 (m, 2 H), 3,86 (d, 2 H, J = 6,0 Hz), 3,09 (s, 3 H), 3,06 - 2,96 (m, 4 H), 2,41 (t, 2 H, J = 10,9 Hz), 1,87 - 1,81 (m, 3 H), 1,56 (s, 2 H), 1,52 - 1,43 (m, 2 H); MS (ESI) m/z 428 (M+ + H).
Пример 14. Соединение 524:
4-((4'-(метилсульфонил)бифенил-4-илокси)метил)-1-(3,3,3-трифторпропил)пиперидин
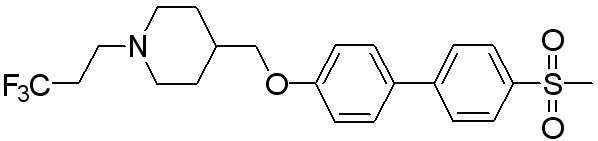
Стадия 1. 3,3,3-трифтор-1-(4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин-1-ил)пропан-1-он: 4-((4'-(метилсульфонил)бифенил-4-илокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 5 соединения 431; 40 мг, 0,11 ммоль) и CF3CH2COCl (16 мкл, 0,16 ммоль) растворили в CH2Cl2 2 мл. Et3N (44 мкл, 0,31 ммоль) добавили к этой смеси, после чего перемешивали в течение 5 часов при комнатной температуре. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, отфильтровали для удаления осадка, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (54 мг, 113%).
Стадия 2. Соединение 524: 3,3,3-трифтор-1-(4-((4'-(метилсульфонил)бифенил-4-илокси)метил) пиперидин-1-ил)пропан-1-он (46 мг, 0,10 ммоль) растворили в сухом THF 2 мл, после чего охладили на ледяной бане. 1 M LAH в THF (0,20 мл, 0,20 ммоль) медленно добавили по каплям, с последующим медленным повышением температуры до комнатной температуры, и перемешивали в течение 4 часов. В реакционную смесь влили воду. Образовавшийся осадок удалили фильтрованием, и фильтрат проэкстрагировали с помощью EtOAc три раза. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-40% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (9 мг, 19%).
1H NMR (400 MHz, CDCl3) δ 8,00 - 7,93 (m, 2 H), 7,77 - 7,69 (m, 2 H), 7,59 - 7,52 (m, 2 H), 7,03 - 6,95 (m, 2 H), 3,86 (d, 2 H, J = 6,0 Hz), 3,08 (s, 3 H), 2,95 (d, 2 H, J = 11,5 Hz), 2,66 - 2,57 (m, 2 H), 2,41 - 2,26 (m, 2 H), 2,11 - 2,01 (m, 2 H), 1,93 - 1,81 (m, 3 H), 1,50 - 1,36 (m, 2 H); MS (ESI) m/z 468 (M+ + H).
Пример 15. Соединение 470: 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид
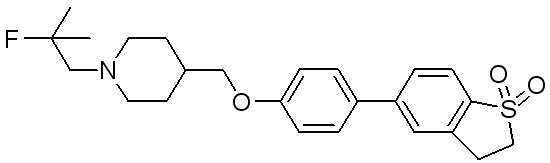
Стадия 1. 4-(бензо[b]тиофен-5-ил)фенол: 5-бромбензо[b]тиофен (3,0 г, 14,08 ммоль) и 4-гидроксифенилборную кислоту (2,91 г, 21,11 ммоль) растворили в DME 40 мл. Воду 10 мл добавили к этой смеси. Pd(dbpf)Cl2 (459 мг, 0,70 ммоль) и Cs2CO3 (13,68 г, 42,24 ммоль) добавили туда же, после чего кипятили с обратным холодильником при 90 ºC в течение дня. Реакционную смесь отфильтровали через цеолиты. Полученный фильтрат проэкстрагировали с помощью EtOAc три раза, высушили над MgSO4, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (15-20% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (2,30 г, 72%).
Стадия 2. трет-Бутил 4-((4-(бензо[b]тиофен-5-ил)фенокси)метил)пиперидин-1-карбоксилат:
4-(бензо[b]тиофен-5-ил)фенол (1,30 г, 5,74 ммоль) и трет-бутил 4-((метилсульфонилокси) метил)пиперидин-1-карбоксилат (продукт синтеза стадии 2 соединения 431; 2,02 г, 6,89 ммоль) растворили в ACN 10 мл. Cs2CO3 (3,74 г, 11,49 ммоль) добавили к этой смеси, и кипятили с обратным холодильником в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-30% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (1,81 г, 74%).
Стадия 3. трет-Бутил 4-((4-(1,1-диоксидобензо[b]тиофен-5-ил)фенокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((4-(бензо[b]тиофен-5-ил)фенокси)метил)пиперидин-1-карбоксилат (1,8 г, 4,28 ммоль) растворили в CHCl3 30 мл. m-CPBA (1,85 г, 10,70 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. К этой смеси добавили насыщенный водный раствор NaHCO3, и затем проэкстрагировали с CH2Cl2. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-20% EtOAc/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (1,50 г, 77%).
Стадия 4. трет-Бутил 4-((4-(1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)фенокси)метил) пиперидин-1-карбоксилат: трет-бутил 4-((4-(1,1-диоксидобензо[b]тиофен-5-ил)фенокси)метил) пиперидин-1-карбоксилат (700 мг, 1,54 ммоль) растворили в THF 10 мл и EtOH 10 мл. 10% (весовых) Pd/C (70 мг) добавили к этой смеси, после чего наблюдали выделение водорода и перемешивали при комнатной температуре в течение двух дней. Реакционную смесь отфильтровали через цеолиты для удаления осадка. Полученный фильтрат упарили. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-30% EtOAc/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (680 мг, 96%).
Стадия 5. 5-(4-(пиперидин-4-илметокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид 2,2,2-трифторацетат: трет-бутил 4-((4-(1,1-диоксидо-2,3-дигидробензо[b]тиофен-5-ил)фенокси) метил)пиперидин-1-карбоксилат (800 мг, 1,75 ммоль) растворили в CH2Cl2 6 мл. TFA 161 мкл добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь отфильтровали, и перекристаллизовали из эфира с получением целевого соединения в виде твердого вещества белого цвета (740 мг, 93%).
Стадия 6. 5-(4-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид: 5-(4-(пиперидин-4-илметокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид 2,2,2-трифторацетат (50 мг, 0,13 ммоль) и K2CO3 (35 мг, 0,25 ммоль) суспендировали в EtOH 0,5 мл. Воду 0,5 мл добавили к этой смеси, и смесь суспендировали при небольшом нагревании. 2,2-диметил оксиран (35 мг, 1,27 ммоль) добавили к этой смеси. Реакцию проводили при микроволновом облучении при 110 ºC в течение 20 минут. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (50-60% EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (31 мг, 57%).
Стадия 7. Соединение 470: 5-(4-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси) фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид (14 мг, 0,03 ммоль) растворили в CH2Cl2 1 мл. Deoxo-Fluor (8 мг, 0,04 ммоль) добавили к этой смеси при 0 ºC, после чего перемешивали при комнатной температуре в течение 3 часов. К этой смеси добавили насыщенный водный раствор NaHCO3, и смесь проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, отфильтровали для удаления осадка, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (50-60% EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (11 мг, 78%).
1H NMR (400 MHz, CDCl3) δ 7,76 (d, 1 H, J = 8,2 Hz), 7,63 (d, 1 H, J = 8,7 Hz), 7,49 (m, 3 H), 6,98 (dd, 2 H, J = 9,2, 2,4 Hz), 3,84 (d, 2 H, J = 6,0 Hz), 3,53 (m, 2 H), 3,42 (m, 2 H), 2,98 (m, 2 H), 2,47 (s, 1 H), 2,41 (s, 1 H), 2,17 (td, 2 H, J = 11,7, 1,6 Hz), 1,80 (m, 3 H), 1,40 (m, 5 H), 1,33 (s, 3 H); MS (ESI) m/z 432 (M+ + H).
Пример 16. Соединение 540: 5-(4-((1-(2,2,2-трифторэтил)пиперидин-4-ил)метокси) фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид
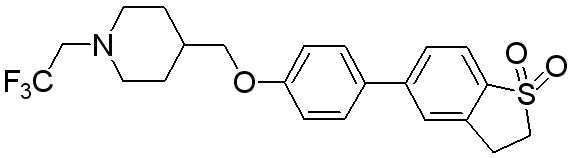
5-(4-(пиперидин-4-илметокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксид 2,2,2-трифторацетат (продукт синтеза стадии 5 соединения 470; 50 мг, 0,11 ммоль) растворили в DMSO 1 мл. 2,2,2-трифторэтил трифторметансульфонат (26 мг, 0,11 ммоль) и K2CO3 (76 мг, 0,55 ммоль) добавили туда же, и перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления осадка, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (40-60% EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (9 мг, 18%).
1H NMR (400 MHz, CDCl3) δ 7,77 (d, 1 H, J = 8,2 Hz), 7,64 (m, 1 H), 7,51 (m, 3 H), 6,98 (dd, 2 H, J = 6,8, 2,0 Hz), 3,85 (d, 2 H, J = 5,9 Hz), 3,53 (m, 2 H), 3,42 (m, 2 H), 3,00 (m, 4 H), 2,40 (m, 2 H), 1,85 (m, 3 H), 1,31 (m, 2 H); MS (ESI) m/z 440 (M+ + H).
Пример 17. Соединение 574: 4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота
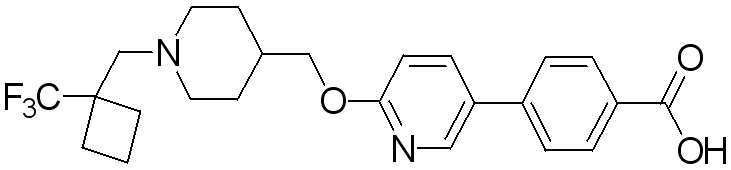
Стадия 1. метил 4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиридин (продукт синтеза стадии 3 соединения 676; 0,34 г, 0,85 ммоль), 4-(метоксикарбонил)фенилборную кислоту (306 мг, 1,70 ммоль), Pd(dbpf)Cl2 (55 мг, 0,09 ммоль), Cs2CO3 (1,19 г, 3,68 ммоль) добавили в микроволновой реактор, и затем диоксан 5 мл и воду 2 мл добавили туда же. Реакцию проводили при микроволновом облучении при 120 ºC в течение 20 минут. Реакционную смесь разбавили насыщенным водным раствором NaHCO3, и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (15-20% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (80 мг, 20%).
Стадия 2. Соединение 574: метил 4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (135 мг, 0,29 ммоль) растворили в смеси растворителей THF 2 мл / MeOH 1 мл / вода 0,5 мл. LiOH·H2O (24 мг, 0,58 ммоль) добавили к этой смеси, и кипятили с обратным холодильником и перемешиванием в течение 4 часов. Растворитель упарили при пониженном давлении. После добавления 1M HCl 5 мл к этой смеси, полученный осадок отфильтровали. Полученное твердое вещество очистили с помощью колоночной хроматографии на силикагеле (30-80% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (80 мг, 62%).
1H NMR (400 MHz, DMSO) δ 8,53 (s, 1 H), 8,07 (d, 1 H, J = 7,8 Hz), 7,99 (d, 2 H, J = 7,6 Hz), 7,78 (d, 2 H, J = 7,7 Hz), 6,92 (d, 1 H, J = 8,5 Hz), 4,15 (m, 2 H), 2,94 (m, 2 H), 2,51 (m, 2 H), 2,12 (m, 7 H), 1,90 (m, 2 H), 1,71 (m, 2 H), 1,28 (m, 2 H); MS (ESI) m/z 449 (M+ + H).
Пример 18. Соединение 575: 1-(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)этанон
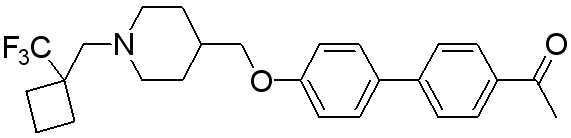
Стадия 1. трет-Бутил 4-((4'-ацетилбифенил-4-илокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((4-бромфенокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 3 соединения 431; 500 мг, 1,35 ммоль) и 4-ацетилфенилборную кислоту (244 мг, 1,49 ммоль) растворили в диоксане 4 мл. Воду 1,5 мл добавили к этой смеси. Pd(dbpf)Cl2 (88 мг, 0,14 ммоль) и Cs2CO3 (660 мг, 2,03 ммоль) добавили туда же. Реакцию проводили при микроволновом облучении при 120 ºC в течение 20 минут. Реакционную смесь отфильтровали через цеолиты, и фильтрат растворили в EtOAc. Раствор промыли насыщенным водным раствором NaHCO3 , высушили воду над MgSO4, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (30-40% EtOAc/гексан) с получением целевого соединения в виде твердого вещества желтого цвета (400 мг, 72%).
Стадия 2. 1-(4'-(пиперидин-4-илметокси)бифенил-4-ил)этанон гидрохлорид: трет-бутил 4-((4'-ацетилбифенил-4-илокси)метил)пиперидин-1-карбоксилат (400 мг, 0,98 ммоль) растворили в CH2Cl2 4 мл. 4 M HCl 488 мкл добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. Полученную реакционную смесь отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (330 мг, 97%).
Стадия 3. 1-(4'-((1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-ил)метокси)бифенил-4-ил)этанон: 1-(4'-(пиперидин-4-илметокси)бифенил-4-ил)этанон гидрохлорид (380 мг, 1,10 ммоль), 1-(трифторметил)циклобутанекарбоновую кислоту (185 мг, 1,10 ммоль), EDC (421 мг, 2,20 ммоль) и HOBt (270 мг, 2,20 ммоль) растворили в DMF 6 мл. DIPEA (284 мг, 2,20 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 3 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (40 - 50% EtOAc / гексан) с получением целевого соединения в виде твердого вещества желтого цвета (350 мг, 69%).
Стадия 4. 1-(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)этанол: 1-(4'-((1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-ил)метокси) бифенил-4-ил)этанон (193 мг, 0,42 ммоль) растворили в сухом THF 10 мл, после чего охладили на ледяной бане. LAH (1 M в THF, 0,13 мл, 0,13 ммоль) медленно добавили по каплям, с последующим повышением температуры до 50 ºC и перемешивали в течение дня. В реакционную смесь влили воду. Образовавшийся осадок удалили фильтрованием, и фильтрат проэкстрагировали с помощью EtOAc три раза. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (90 мг, 48%).
Стадия 5. Соединение 575: 1-(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)этанол (27 мг, 0,06 ммоль) растворили в CH2Cl2 2 мл. Dess-Martin перйодинан (38 мг, 0,09 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 3 часов. К этой смеси добавили насыщенный водный раствор NaHCO3, и смесь проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc / гексан) с получением целевого соединения в виде твердого вещества белого цвета (16 мг, 59%).
1H NMR (400 MHz, CDCl3) δ 8,02 (d, 2 H, J = 8,4 Hz), 7,66 (d, 2 H, J = 8,3 Hz), 7,58 (d, 2 H, J = 8,7 Hz), 7,00 (d, 2 H, J = 8,7 Hz), 3,86 (d, 2 H, J = 6,0 Hz), 2,91 (d, 2 H, J = 11,3 Hz), 2,64 (s, 3 H), 2,54 (s, 2 H), 2,22 (m, 4 H), 2,01 (m, 4 H), 1,82 (m, 3 H), 1,43 (m, 2 H); MS (ESI) m/z 446 (M+ + H).
Пример 19. Соединение 593: 1-(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)этанон
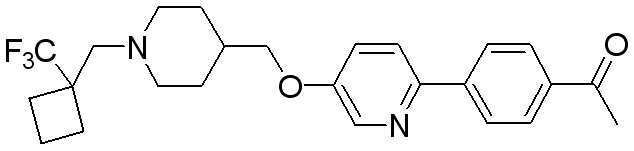
Стадия 1. трет-Бутил 4-((6-(4-ацетилфенил)пиридин-3-илокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 1 соединения 597; 500 мг, 1,53 ммоль) и 4-ацетилфенилборную кислоту (276 мг, 1,68 ммоль) растворили в диоксане 4 мл. Воду 1 мл добавили к этой смеси. Pd(dppf)Cl2 (63 мг, 0,08 ммоль) и Na2CO3 (660 мг, 2,03 ммоль) добавили туда же. Реакцию проводили при микроволновом облучении при 120 ºC в течение 20 минут. Реакционную смесь отфильтровали через цеолиты, и полученный органический слой промыли насыщенным водным раствором NaHCO3 и высушили воду над MgSO4, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (30-40% EtOAc/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (300 мг, 47%).
Стадия 2. 1-(4-(5-(пиперидин-4-илметокси)пиридин-2-ил)фенил)этанон гидрохлорид:
трет-бутил 4-((6-(4-ацетилфенил)пиридин-3-илокси)метил)пиперидин-1-карбоксилат (300 мг, 0,73 ммоль) растворили в CH2Cl2 3 мл. 4 M HCl 201 мл добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. Полученную реакционную смесь отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (250 мг, 98%).
Стадия 3. 1-(4-(5-((1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)этанон: 1-(4-(5-(пиперидин-4-илметокси)пиридин-2-ил)фенил)этанон гидрохлорид (250 мг, 0,72 ммоль), 1-(трифторметил)циклобутанекарбоновую кислоту (145 мг, 0,87 ммоль), EDC (276 мг, 1,44 ммоль) и HOBt (195 мг, 1,44 ммоль) растворили в DMF 2 мл. DIPEA (186 мг, 1,44 ммоль) добавили к этой смеси. При 50 ºC, реакцию проводили в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (40-50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (158 мг, 47%).
Стадия 4. 1-(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)этанол: 1-(4-(5-((1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)этанон (148 мг, 0,32 ммоль) растворили в сухом THF 7 мл, после чего охладили на ледяной бане. LAH (1 M в THF, 0,96 мл, 0,96 ммоль) медленно добавили по каплям, с последующим повышением температуры до 50 ºC и перемешивали в течение 6 часов. В реакционную смесь влили воду. Образовавшийся осадок удалили фильтрованием, и фильтрат проэкстрагировали с помощью EtOAc три раза. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (110 мг, 76%).
Стадия 5. Соединение 593: 1-(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)этанол (96 мг, 0,21 ммоль) растворили в CH2Cl2 2 мл. DMP (118 мг, 0,28 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 3 часов. К этой смеси добавили насыщенный водный раствор NaHCO3, и смесь проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (78 мг, 81%).
1H NMR (400 MHz, CDCl3) δ 8,42 (d, 1 H, J = 2,9 Hz), 8,02 (s, 4 H), 7,74 (d, 1 H, J = 8,7 Hz), 7,29 (dd, 1 H, J = 8,8, 3,0 Hz), 3,91 (d, 2 H, J = 6,0 Hz), 2,94 (d, 2 H, J = 11,4 Hz), 2,65 (s, 3 H), 2,57 (s, 2 H), 2,21 (m, 4 H), 2,08 (m, 2 H), 1,99 (m, 1 H), 1,94 (m, 1 H), 1,89 (m, 3 H), 1,49 (m, 2 H); MS (ESI) m/z 447 (M+ + H).
Пример 20. Соединение 498:
метил 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат
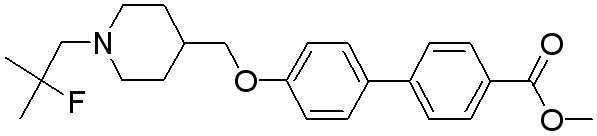
Стадия 1. 4-((4-бромфенокси)метил)пиперидин гидрохлорид: трет-бутил 4-((4-бромфенохил) метил)пиперидин-1-карбоксилат (продукт синтеза стадии 3 соединения 431; 5,00 г, 13,50 ммоль) растворили в EtOAc 10 мл. 1 M HCl 30 мл добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов и кипятили с обратным холодильником и перемешиванием в течение 2 часов. Реакционную смесь охладили до комнатной температуры, и отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (4,01 г, 97%).
Стадия 2. 1-(4-((4-бромфенокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол: 4-((4-бромфенокси)метил)пиперидин гидрохлорид (1,00 г, 3,26 ммоль) и K2CO3 (0,23 г, 1,63 ммоль) суспендировали в EtOH 10 мл. Воду 5 мл добавили к этой смеси для получения раствора. 2,2-Диметил оксиран (2,90 мл, 32,61 ммоль) добавили к этой смеси. Реакцию проводили при микроволновом облучении при 110 ºC в течение 20 минут. Немного воды добавили к этой смеси, после чего удалили EtOH при пониженном давлении, и проэкстрагировали с помощью CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (1,10 г, 98%).
Стадия 3. 4-((4-бромфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин:
1-(4-((4-бромфенокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол(1,10 г, 3,21 ммоль) растворили в CH2Cl2 10 мл. DAST (0,43 мл, 3,21 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 1 часа. К этой смеси добавили насыщенный водный раствор NaHCO3, и смесь проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-5% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (0,77 г, 70%).
Стадия 4. Соединение 498: 4-((4-бромфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (770 мг, 2,24 ммоль) и 4-(метоксикарбонил)фенилборную кислоту (483 мг, 2,68 ммоль) растворили в диоксане 3 мл. Воду 1 мл добавили к этой смеси. Pd(dbpf)Cl2 (44 мг, 0,07 ммоль) и Cs2CO3 (2,18 г, 6,71 ммоль) добавили туда же. Реакцию проводили при микроволновом облучении при 140ºC в течение 15 минут. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc три раза. Органический слой высушили над MgSO4, и затем упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (20% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (682 мг, 76%).
1H NMR (400 MHz, CDCl3) δ 8,11 - 8,04 (m, 2 H), 7,66 - 7,60 (m, 2 H), 7,59 - 7,53 (m, 2 H), 7,02 - 6,94 (m, 2 H), 3,93 (s, 3 H), 3,84 (d, 2 H, J = 6,0 Hz), 2,99 (d, 2 H, J = 11,0 Hz), 2,47 (s, 1 H), 2,42 (s, 1 H), 2,22 - 2,12 (m, 2 H), 1,82 - 1,79 (m, 3 H), 1,49 - 1,37 (m, 1 H), 1,39 (s, 3 H), 1,34 (s, 3 H); MS (ESI) m/z 400 (M+ + H).
Пример 21. Соединение 548:
4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота

Метил 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (682 мг, 1,71 ммоль) растворили в THF 6 мл. MeOH 2 мл и H2O 2 мл добавили туда же. LiOH (358 мг, 8,53 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре, и кипятили с обратным холодильником и перемешиванием в течение 15 часов. После подкисления с помощью 1 N HCl, полученный осадок отфильтровали. Полученное твердое вещество растворили в MeOH, после чего отфильтровали для удаления осадка и упарили при пониженном давлении с получением целевого соединения в виде твердого вещества светло-серого цвета (625 мг, 95,1%).
1H NMR (400 MHz, DMSO-d6) δ 7,95 (d, 2 H, J = 8,3 Hz), 7,72 (d, 2 H, J = 8,3 Hz), 7,65 (d, 2 H, J = 8,7 Hz), 7,02 (d, 2 H, J = 8,7 Hz), 3,85 (d, 2 H, J = 5,8 Hz), 2,90 (d, 2 H, J = 11,2 Hz), 2,42 (s, 1 H), 2,36 (s, 1 H), 2,06 (t, 2 H, J = 11,4 Hz), 1,72 - 1,69 (m, 3 H), 1,30 (m, 2 H), 1,30 (s, 3 H), 1,25 (s, 3 H); MS (ESI) m/z 486 (M+ + H).
Пример 22. Соединение 515:
4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
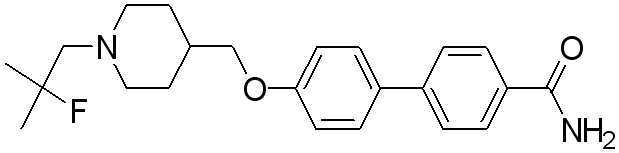
4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (соединение 548, 15 мг, 0,04 ммоль) и NH4Cl (4 мг, 0,08 ммоль) растворили в DMF 1 мл. EDC (15 мг, 0,08 ммоль) и HOBt (11 мг, 0,08 ммоль) добавили туда же. Наконец, DIPEA (34 мкл, 0,20 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов. Растворитель упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (7 мг, 48%).
1H NMR (400 MHz, CDCl3) δ 7,81 - 7,87 (m, 2 H), 7,64 - 7,58 (m, 2 H), 7,56 - 7,50 (m, 2 H), 6,99 - 6,93 (m, 2 H), 3,82 (d, 2 H, J = 6,0 Hz), 2,97 (d, 2 H, J = 11,8 Hz), 2,46 (s, 1 H), 2,40 (s, 1 H), 2,20 - 2,04 (m, 6 H), 1,84 - 1,72 (m, 3 H), 1,49 - 1,35 (m, 2 H), 1,38 (s, 3 H), 1,32 (s, 3 H); MS (ESI) m/z 385 (M+ + H).
Пример 23. Соединение 612: (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон

4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (соединение 548, 50 мг, 0,13 ммоль) суспендировали в CH2Cl2 1 мл, и затем добавили EDC (50 мг, 0,26 ммоль), HOBt (35 мг, 0,26 ммоль) и DIPEA (113 мкл, 0,65 ммоль), добившись полного растворения. Наконец, (R)-гидроксипиперидин гидрохлорид (36 мг, 0,26 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь упарили при пониженном давлении, растворили в небольшом количестве MeOH, и затем разбавили водой. Полученный осадок отфильтровали для получения осадка. Полученное твердое вещество очистили с помощью колоночной хроматографии на силикагеле (0-10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (45 мг, 73%).
1H NMR (400 MHz, CDCl3) δ 7,61 - 7,56 (m, 2 H), 7,56 - 7,50 (m, 2 H), 7,50 - 7,46 (m, 2 H), 7,02 - 6,95 (m, 2 H), 3,94 (brs, 1 H), 3,85 (d, 2 H, J = 6,0 Hz), 3,47 (br, 4 H), 3,00 (d, 2 H, J = 11,3 Hz), 2,48 (s, 1 H), 2,43 (s, 1 H), 2,18 (t, 2 H, J = 11,2 Hz), 1,97 (br, 2 H), 1,83 - 1,80 (m, 3 H), 1,67 (br, 2 H), 1,52 - 1,38 (m, 2 H), 1,41 (s, 3 H), 1,35 (s, 3 H); MS (ESI) m/z 469 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 515, соединения Таблицы 4 синтезировали с использованием 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 3.
Таблица 3.
Таблица 4.
Пример 24. Соединение 620: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоновая кислота
(R)-метил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил) пирролидин-2-карбоксилат (соединение 619, 53 мг, 0,11 ммоль) растворили в THF 1,5 мл, H2O 0,5 мл и MeOH 0,5 мл. LiOH·H2O (25 мг, 0,53 ммоль) медленно добавили к реакционной смеси, после чего перемешивали при комнатной температуре в течение 2 часов. По окончании реакции, реакционную смесь подкислили до pH 5 путем добавления 1 N HCl, после чего добавили избыточное количество воды. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (41 мг, 80%).
1H NMR (400 MHz, CDCl3) δ 7,55 (d, 2 H, J = 10,2 Hz), 7,37 - 7,23 (m, 4 H), 6,65 (d, 2 H, J = 7,6 Hz), 3,82 (d, 2 H, J = 5,8 Hz), 3,72 - 3,50 (m, 6 H), 3,32 - 3,16 (m, 2 H), 2,70 (brs, 2 H), 2,32 (m, 1 H), 2,18 -2,14 (m, 2 H), 2,02 - 2,00 (m, 2 H), 1,96 (brs, 1 H), 1,79 (d, 3 H, J = 10,5 Hz), 1,38 - 1,33 (m, 8 H); MS (ESI) m/z 483 (M+ + H).
Пример 25. Соединение 621: 2-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-илкарбоксамидо)уксусная кислота
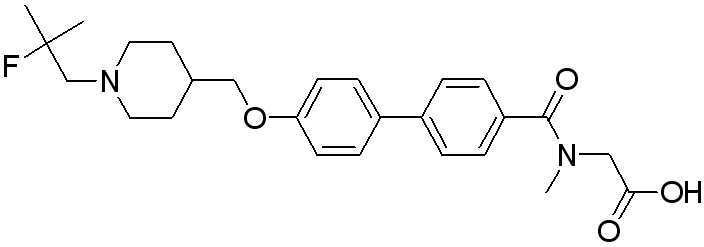
4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (соединение 548, 0,12 г, 0,31 ммоль) и метил 2-(метиламино)ацетат (29 мг, 0,28 ммоль) растворили в DMF 1 мл. EDC (0,12 г, 0,62 ммоль) и HOBt (84 мг, 0,62 ммоль) добавили туда же. Наконец, DIPEA (0,27 мл, 1,56 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавили с EtOAc, и промыли три раза водой. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (0,12 г, 82%). Полученный продукт (90 мг, 0,19 ммоль) растворили в THF 1,5 мл, H2O 0,5 мл и MeOH 0,5 мл. LiOH·H2O (40 мг, 0,96 ммоль) медленно добавили к реакционной смеси, после чего перемешивали при комнатной температуре в течение 2 часов. По окончании реакции, реакционную смесь подкислили до pH 5 путем добавления 1 N HCl. К этой смеси добавили избыточное количество воды. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (16 мг, 18%).
1H NMR (400 MHz, CDCl3) δ 7,51 - 7,42 (m, 6 H), 6,92 - 6,89 (m, 2 H), 4,03 - 3,85 (m, 2 H), 3,80 - 3,79 (m, 2 H), 2,83 (brs, 5 H), 2,51 - 2,44 (m, 2 H), 2,20 - 2,18 (m, 2 H), 1,80 - 1,78 (m, 3 H), 1,45 - 1,42 (m, 2 H), 1,38 (s, 3 H), 1,33 (s, 3 H); MS (ESI) m/z 457 (M+ + H).
Пример 26. Соединение 630: (4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(пиперазин-1-ил)метанон
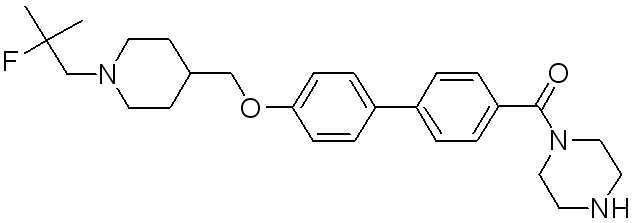
трет-бутил 4-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-1-карбоксилат (соединение 626, 20 мг, 0,04 ммоль) растворили в MeOH. Трифторуксусную кислоту (8 мкл, 0,11 ммоль) медленно добавили к реакционной смеси, после чего перемешивали при комнатной температуре в течение 1 часа. По окончании реакции, полученную реакционную смесь подщелочили насыщенным водным раствором NaHCO3, и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над MgSO4 с получением целевого соединения в виде твердого вещества белого цвета (5 мг, 31%).
1H NMR (400 MHz, CDCl3) δ 7,59 (d, 2 H, J = 6,0 Hz), 7,53 (d, 2 H, J = 6,5 Hz), 7,46 (d, 2 H, J = 6,2 Hz), 6,98 (d, 2 H, J = 6,5 Hz), 3,85 (d, 2 H, J = 4,2 Hz), 3,79 (brs, 4 H), 3,01 (d, 2 H, J = 8,5 Hz), 2,93 (brs, 4 H), 2,50 - 2,44 (m, 2 H), 2,19 (t, 2 H, J = 8,3 Hz), 1,83 - 1,80 (m, 3 H). 1,49 - 1,40 (m, 2 H), 1,35 (s, 3 H), 1,26 (s, 3 H); MS (ESI) m/z 454 (M+ + H).
Пример 27. Соединение 682: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
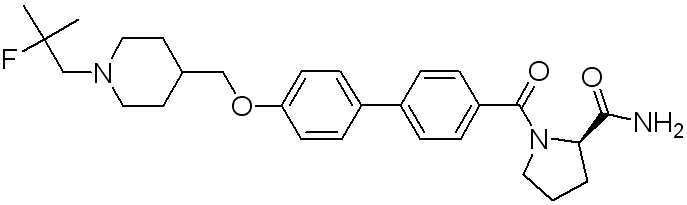
(R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоновую кислоту (соединение 620, 40 мг, 0,084 ммоль) и NH4Cl (6 мг, 0,12 ммоль) растворили в DMF 1 мл. EDC (31 мг, 0,17 ммоль) и HOBt (22 мг, 0,17 ммоль) добавили туда же. Наконец, DIPEA (72 мкл, 0,42 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавили с EtOAc, и промыли три раза водой. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (15 мг, 37%).
1H NMR (400 MHz, CDCl3) δ 7,60 (s, 4 H), 7,53 (d, 2 H, J = 8,0 Hz), 6,98 (d, 2 H, J = 8,0 Hz), 5,53 (s, 1 H), 4,83 (t, 1 H, J = 6,0 Hz), 3,85 (d, 2 H, J = 8,0 Hz), 3,66 - 3,58 (m, 2 H), 2,50 - 2,47 (m, 2 H), 2,20 - 2,06 (m, 4 H), 1,88 - 1,81 (m, 5 H), 1,42 - 1,26 (m, 8 H); MS (ESI) m/z 482 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 682, соединения Таблицы 6 синтезировали с использованием 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 5.
Таблица 5.
Таблица 6.
Пример 28. Соединение 755: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамид
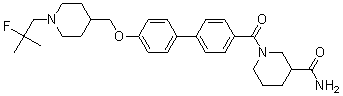
Стадия 1. 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоновая кислота: этил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенилкарбонил)пиперидин-3-карбоксилат (соединение 677, 0,07 г, 0,14 ммоль) растворили в THF (1,5 мл). MeOH (0,5 мл) и H2O (0,5 мл) добавили туда же. LiOH (0,3 г, 0,70 ммоль) добавили к этой смеси, и кипятили с обратным холодильником и перемешиванием в течение 4 часов. Реакционную смесь подкислили с помощью 1 N HCl, и проэкстрагировали с помощью EtOAc и CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества желтого цвета (0,070 г, 100%).
Стадия 2. Соединение 755: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенилкарбонил)пиперидин-3-карбоновую кислоту (0,07 г, 0,14 ммоль), EDC (0,05 г, 0,28 ммоль), HOBt (0,05 г, 0,28 ммоль) и DIPEA (0,12 мл, 0,70 ммоль) растворили в DMF (21 мл) полностью. Наконец, NH4Cl (0,02 г, 0,28 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов . Добавили воду (10 мл) и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г, ISCO силикагелевый картридж, 0 - 10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (0,03 г, 51%).
1H NMR (400 MHz, CDCl3) δ 7,57 (d, 2 H, J = 8,3 Hz), 7,51 (d, 2 H, J = 8,8 Hz), 7,43 (d, 2 H, J = 8,5 Hz), 6,96 (d, 2 H, J = 8,8 Hz), 6,84 - 6,67 (m, 1 H), 5,65 (s, 1 H), 4,09 (s, 1 H), 3,83 (d, 2 H, J = 5,8 Hz), 3,69 - 3,80 (m, 1 H), 3,49 - 3,63 (m, 1 H), 3,47 - 3,32 (m, 1 H), 2,98 (d, 2 H, J = 11,3 Hz), 2,57 (s, 1 H), 2,47 (s, 1 H), 2,41 (s, 1 H), 2,17 (t, 2 H, J = 11,0 Hz), 2,11 - 2,05 (m, 1 H), 1,92 (s, 1 H), 1,85 - 1,72 (m, 1 H), 1,61 (s, 1 H), 1,50 - 1,37 (m, 2 H), 1,39 (s, 3 H), 1,34 (s, 3 H); MS (ESI) m/z 496 (M+ + H).
Пример 29. Соединение 756: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамид
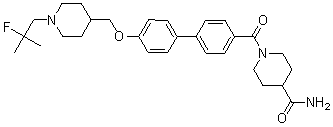
Стадия 1. 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоновая кислота: этил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенилкарбонил)пиперидин-4-карбоксилат (соединение 678, 0,09 г, 0,17 ммоль) растворили в THF (1,5 мл). MeOH (0,5 мл) и H2O (0,5 мл) добавили туда же. LiOH (0,4 г, 0,87 ммоль) добавили к этой смеси, и кипятили с обратным холодильником и перемешиванием в течение 4 часов. Реакционную смесь подкислили с помощью 1 N HCl, и проэкстрагировали с помощью EtOAc и CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества желтого цвета (0,087 г, 100%).
Стадия 2. Соединение 756: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенилкарбонил)пиперидин-4-карбоновую кислоту (0,08 г, 0,17 ммоль), EDC (0,06 г, 0,35 ммоль), HOBt (0,05 г, 0,35 ммоль) и DIPEA (0,11 мл, 0,87 ммоль) растворили в DMF (21 мл) полностью. Наконец, NH4Cl (0,02 г, 0,35 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов . Добавили воду (10 мл), и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г, ISCO силикагелевый картридж, 0 - 10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (0,06 г, 70%).
1H NMR (400 MHz, CDCl3) δ 7,59 - 7,54 (m, 2 H), 7,50 (d, 2 H, J = 8,8 Hz), 7,42 (d, 2 H, J = 8,5 Hz), 6,96 (d, 2 H, J = 8,8 Hz), 5,82 (d, 2 H, J = 15,6 Hz), 4,78 - 4,55 (m, 1 H), 3,99 - 3,85 (m, 1 H), 3,83 (d, 2 H, J = 5,8 Hz), 3,11 - 2,83 (m, 2 H), 2,98 (d, 2 H, J = 11,3 Hz), 2,48 - 2,40 (m, 1 H), 2,49 - 2,37 (m, 1 H), 2,47 (s, 1 H), 2,41 (s, 1 H), 2,16 (t, 2 H, J = 11,0 Hz), 2,05 - 1,84 (m, 2 H), 1,84 - 1,65 (m, 6 H), 1,50 - 1,36 (m, 2 H), 1,39 (s, 3 H), 1,33 (s, 3 H); MS (ESI) m/z 496 (M+ + H).
Пример 30. Соединение 757: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамид
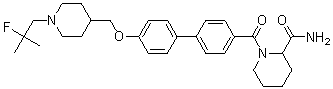
Стадия 1. 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоновая кислота: этил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенилкарбонил)пиперидин-2-карбоксилат (соединение 679, 0,09 г, 0,16 ммоль) растворили в THF (1,5 мл). MeOH (0,5 мл) и H2O (0,5 мл) добавили туда же. LiOH (0,3 г, 0,83 ммоль) добавили к этой смеси, и кипятили с обратным холодильником и перемешиванием в течение 4 часов. Реакционную смесь подкислили с помощью 1 N HCl, и проэкстрагировали с помощью EtOAc и CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества желтого цвета (0,082 г, 100%).
Стадия 2. Соединение 757: 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенилкарбонил)пиперидин-2-карбоновую кислоту (0,08 г, 0,17 ммоль), EDC (0,06 г, 0,33 ммоль), HOBt (0,05 г, 0,33 ммоль) и DIPEA (0,11 мл, 0,83 ммоль) растворили в DMF (21 мл) полностью. Наконец, NH4Cl (0,02 г, 0,33 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов . Добавили воду (10 мл), и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г, ISCO силикагелевый картридж, 0 - 10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (0,04 г, 46%).
1H NMR (400 MHz, CDCl3) δ 7,64 - 7,40 (m, 6 H), 6,97 (d, 2 H, J = 8,5 Hz), 6,54 (s, 1 H), 3,84 (d, 2 H, J = 5,8 Hz), 3,79 (s, 1 H), 3,12 (t, 1 H, J = 13,8 Hz), 2,99 (d, 2 H, J = 11,0 Hz), 2,48 (s, 1 H), 2,42 (s, 1 H), 2,33 (d, 1 H, J = 12,3 Hz), 2,17 (t, 2 H, J = 11,2 Hz), 1,89 - 1,72 (m, 5 H), 1,64 (s, 2 H), 1,61 - 1,51 (m, 2 H), 1,49 - 1,37 (m, 2 H), 1,39 (s, 3 H), 1,34 (s, 3 H); MS (ESI) m/z 496 (M+ + H).
Пример 31. Соединение 932: (2S,4R)-метил 1-(4'-((1-(2-фтор-2-метилпропил) пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксилат
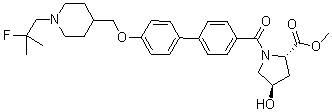
4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (соединение 548; 300 мг, 0,78 ммоль), (2S,4R)-метил 4-гидроксипирролидин-2-карбоксилат гидрохлорид (212 мг, 1,17 ммоль), EDC (298 мг, 1,56 ммоль), HOBt (210 мг, 1,56 ммоль) и DIPEA (0,28 мл, 1,56 ммоль) растворили в DMF (5 мл) при комнатной температуре. После перемешивания при 80 °C в течение 12 часов, реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 40 г картридж; EtOAc / гексан = 5% - 80%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (240 мг, 60%).
1H NMR (400 MHz, CDCl3) δ 7,63 - 7,50 (m, 6 H), 6,97 (m, 2 H), 4,87 (m, 1 H), 4,53 (m, 1 H), 3,89 - 3,79 (m, 5 H), 3,62 (m, 1 H), 3,11 (m, 2 H), 2,59 - 2,13 (m, 7 H), 1,86 (m, 4 H), 1,58 (m, 2 H), 1,41 (m, 6 H); MS (ESI) m/z 513 (M+ + H).
Пример 32. Соединение 934: (2S,4R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксамид
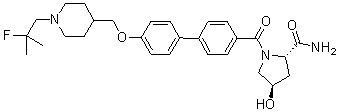
Стадия 1. (2S,4R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоновая кислота: (2S,4R)-метил 1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксилат (400 мг, 0,78 ммоль) и LiOH·H2O (65 мг, 1,56 ммоль) растворили в THF (10 мл) / H2O (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 10 часов. Реакционную смесь упарили при пониженном давлении чтобы удалить растворитель. Полученный концентрат разбавили 1 M HCl, и упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки.
Стадия 2. Соединение 934: (2S,4R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоновую кислоту (400 мг, 0,80 ммоль), аммоний хлорид (64 мг, 1,20 ммоль), EDC (231 мг, 1,20 ммоль), HOBt (163 мг, 1,20 ммоль) и DIPEA (21 мг, 1,61 ммоль) растворили в DMF (10 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 10 часов, реакционную смесь разбавили водой (10 мл), и перемешали. Полученный осадок отфильтровали, и высушили с получением целевого соединения в виде твердого вещества коричневого цвета (100 мг, 25%).
1H NMR (400 MHz, CDCl3 + MeOD) δ 7,58 - 7,46 (m, 6 H), 7,22 (brs, 1 H), 6,91 (m, 2 H), 6,07 (br, 1 H), 4,76 (m, 1 H), 4,37 (m, 1 H), 3,81 - 3,73 (m, 3 H), 3,51 (m, 1 H), 3,95 (m, 2 H), 2,49 - 2,11 (m, 6 H), 1,76 (m, 3 H), 1,41 - 1,31 (m, 8 H); MS (ESI) m/z 498 (M+ + H).
Пример 33. Соединение 749: (R)-(2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
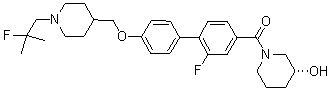
Стадия 1. метил 2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бромфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 3 соединения 498; 180 мг, 0,52 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (124 мг, 0,63 ммоль), Pd(dppf)Cl2 (43 мг, 0,05 ммоль) и Cs2CO3 (341 мг, 1,05 ммоль) добавили к смеси вода (2 мл)/1,4-диоксан (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (30% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (114 мг, 52%).
Стадия 2. 2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: метил 2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (114 мг, 0,27 ммоль) растворили в THF (10 мл)/вода (5 мл). При комнатной температуре, LiOH·H2O (57 мг, 1,36 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 1 часа. Реакционную смесь подкислили путем добавления 1N HCl. Полученный осадок отфильтровали, и высушили с получением целевого соединения в виде твердого вещества белого цвета (90 мг, 81%).
Стадия 3. Соединение 749: 2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенил-4-карбоновую кислоту (45 мг, 0,11 ммоль), (R)-пиперидин-3-ол гидрохлорид (13 мг, 0,13 ммоль), BOP (94 мг, 0,21 ммоль) и Et3N (30 мкл, 0,21 ммоль) растворили в DMF (1 мл). При 60 ºC, реакцию проводили в течение дня. По окончании реакции, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (18 мг, 33%).
1H NMR (400 MHz, CDCl3) δ 7,50 - 7,43 (m, 3 H), 7,27 - 7,22 (m, 2 H), 7,00 - 6,96 (m, 2 H), 3,96 (brs, 1 H), 3,85 (d, 2 H, J = 6,0 Hz), 3,68 - 3,39 (m, 3 H), 3,04 - 3,02 (m, 2 H), 2,52 - 2,46 (m, 2 H), 2,35 - 2,21 (m, 2 H), 2,20 - 1,95 (m, 2 H), 1,84 - 1,82 (m, 4 H), 1,69 (brs, 2 H), 1,42 (m, 2 H), 1,42 (s, 3 H), 1,37 (s, 3 H); MS (ESI) m/z 487 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 749, соединения Таблицы 8 синтезировали с использованием 2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 7.
Таблица 7.
Таблица 8.
Пример 34. Соединение 638: 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-карбоксамид
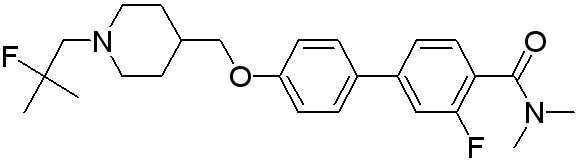
Стадия 1. этил 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бромфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 3 соединения 498; 450 мг, 1,31 ммоль) и 4-(этоксикарбонил)-3-фторфенилборную кислоту (305 мг, 1,44 ммоль) растворили в диоксане 6 мл. Воду 2 мл добавили к этой смеси. Pd(dbpf)Cl2 (43 мг, 0,07 ммоль) и Cs2CO3 (851 мг, 2,61 ммоль) добавили туда же. Реакцию проводили при микроволновом облучении при 120 ºC в течение 20 минут. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, и затем упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (350 мг, 62%).
Стадия 2. 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: этил 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (350 мг, 0,84 ммоль) растворили в THF 2 мл. MeOH 1 мл и H2O 0,5 мл добавили туда же. LiOH (70 мг, 1,68 ммоль) добавили к этой смеси, и кипятили с обратным холодильником и перемешиванием в течение 5 часов. После подкисления с помощью 1 N HCl, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (300 мг, 88%).
Стадия 3. Соединение 638: 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенил-4-карбоновую кислоту (30 мг, 0,07 ммоль), диметиламин гидрохлорид (9 мг, 0,11 ммоль) и PyBOP (58 мг, 0,11 ммоль) растворили в CH2Cl2 1 мл. DIPEA (19 мг, 0,15 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (15 мг, 47%).
1H NMR (400 MHz, CDCl3) δ 7,50 (d, 2 H, J = 8,8 Hz), 7,39 (m, 2 H), 7,27 (s, 1 H), 6,97 (d, 2 H, J = 8,8 Hz), 3,84 (d, 2 H, J = 6,0 Hz), 3,15 (m, 3 H), 2,99 (m, 5 H), 2,52 (s, 1 H), 2,47 (s, 1 H), 2,22 (m, 2 H), 1,82 (m, 3 H), 1,44 (m, 5 H), 1,27 (m, 3 H); MS (ESI) m/z 431 (M+ + H).
Пример 35. Соединение 640: (S)-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
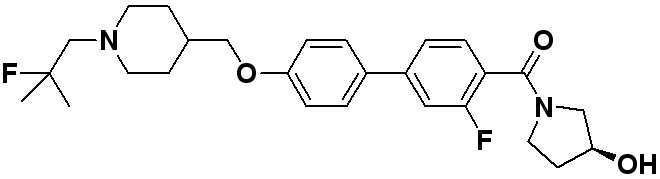
3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (30 мг, 0,07 ммоль), (S)-3-пирролидинол (10 мг, 0,11 ммоль) и PyBOP (58 мг, 0,11 ммоль) растворили в CH2Cl2 1 мл, после чего перемешивали в течение 10 минут. DIPEA (19 мг, 0,15 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления осадка, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (18 мг, 51%).
1H NMR (400 MHz, CDCl3) δ 7,46 (m, 3 H), 7,35 (m, 1 H), 7,24 (m, 1 H), 6,96 (d, 2 H, J = 8,6 Hz), 4,57 (m, 0,5 H), 4,44 (m, 0,5 H), 3,83 (d, 2 H, J = 6,0 Hz), 3,78 (m, 1 H), 3,75 (m, 2 H), 3,53 (m, 2 H), 3,13 (m, 2 H), 3,01 (m, 2 H), 2,50 (s, 1 H), 2,44 (s, 1 H), 2,20 (m, 2 H), 1,98 (m, 1 H), 1,40 (m, 5 H), 1,25 (s, 3 H); MS (ESI) m/z 473 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 638 (Стадия 3), соединения Таблицы 10 синтезировали с использованием 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 9.
Таблица 9.
Таблица 10.
Пример 36. Соединение 1099: (2S,4S)-4-фтор-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
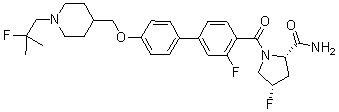
Стадия 1. (2S,4S)-метил 4-фтор-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксилат: 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (150 мг, 0,37 ммоль), (2S,4S)-метил 4-фторпирролидин-2-карбоксилат (55 мг, 0,37 ммоль), EDC (107 мг, 0,56 ммоль), HOBt (75 мг, 0,56 ммоль) и DIPEA (0,13 мл, 0,74 ммоль) растворили в DMF (4 мл) при комнатной температуре. Раствор перемешивали при 80 °C в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; этил ацетат / гексан = 10% - 50%), и упарили с получением целевого соединения в виде бесцветного масла (0,12 г, 61%).
Стадия 2. (2S,4S)-4-фтор-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенилкарбонил)пирролидин-2-карбоновая кислота: (2S,4S)-метил 4-фтор-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксилат (120 мг, 0,23 ммоль) и LiOH·H2O (19 мг, 0,45 ммоль) растворили в THF (10 мл) / H2O (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 4 часов. Реакционную смесь упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки.
Стадия 3. Соединение 1099: (2S,4S)-4-фтор-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил) пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоновую кислоту (200 мг, 0,39 ммоль), аммоний хлорид (31 мг, 0,58 ммоль), EDC (111 мг, 0,58 ммоль), HOBt (78 мг, 0,58 ммоль) и DIPEA (0,14 мл, 0,77 ммоль) растворили в DMF (6 мл) при комнатной температуре. Раствор перемешивали при 80 °C в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; этил ацетат / гексан = 10% - 90%), и упарили с получением целевого соединения в виде твердого вещества ярко-красного цвета (30 мг, 15%).
1H NMR (400 MHz, CDCl3) δ 7,53 - 7,28 (m, 5 H), 7,00 - 6,96 (m, 2 H), 6,68 (s, 0,78 H), 6,35 (s, 0,16 H), 5,70 (m, 1 H), 5,33 - 5,20 (m, 1 H), 5,00 (m, 1 H), 3,92 - 3,83 (m, 3 H), 3,74 - 3,62 (m, 1 H), 3,18 - 2,89 (m, 3 H), 2,58 - 2,18 (m, 5 H), 1,85 (m, 3 H), 1,43 - 1,27 (m, 8 H); MS (ESI) m/z 518,2 (M+ + H).
Пример 37. Соединение 1100: (2S,4R)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил) пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксамид
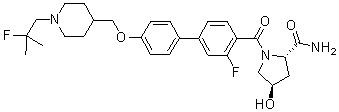
Стадия 1. (2S,4R)-метил 1-(3- фтор-4'-((1-(2- фтор-2- метилпропил) пиперидин-4- ил)метокси) бифенилкарбонил)-4-гидроксипирролидин-2-карбоксилат: 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (100 мг, 0,25 ммоль), (2S,4R)-метил 4-гидроксипирролидин-2-карбоксилат гидрохлорид (45 мг, 0,25 ммоль), EDC (71 мг, 0,37 ммоль), HOBt (50 мг, 0,37 ммоль) и DIPEA (0,09 мл, 0,50 ммоль) растворили в DMF (4 мл) при комнатной температуре. Раствор перемешивали при 80 °C в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; этил ацетат / гексан = 10% - 80%), и упарили с получением целевого соединения в виде бесцветного масла (70 мг, 53%).
Стадия 2. (2S,4R)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенилкарбонил)-4-гидроксипирролидин-2-карбоновая кислота: (2S,4R)-метил 1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксилат (70 мг, 0,13 ммоль) и LiOH·H2O (11 мг, 0,26 ммоль) растворили в THF (6 мл) / H2O (3 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 4 часов. Реакционную смесь упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки.
Стадия 3. Соединение 1100: (2S,4R)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоновую кислоту (100 мг, 0,19 ммоль), аммоний хлорид (16 мг, 0,29 ммоль), EDC (56 мг, 0,29 ммоль), HOBt (39 мг, 0,29 ммоль) и DIPEA (0,07 мл, 0,39 ммоль) растворили в DMF (5 мл) при комнатной температуре. Раствор перемешивали при 80 °C в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества ярко-красного цвета (15 мг, 15%).
1H NMR (400 MHz, CDCl3+MeOD) δ 7,57 - 7,44 (m, 3 H), 7,38 - 7,31 (m, 1 H), 7,28 - 7,27 (m, 1 H), 6,93 (m, 2 H), 4,79 (t, 1 H, J = 8,2 Hz), 4,41 (m, 1 H), 3,86 (m, 2 H), 3,72 - 3,68 (m, 2 H), 3,41 - 3,37 (m, 2H), 2,34 - 2,25 (m, 3 H), 2,01 - 1,90 (m, 4 H), 1,47 - 1,38 (m, 6 H), 1,37 - 1,21 (m, 4 H); MS (ESI) m/z 516,2 (M+ + H).
Пример 38. Соединение 758: (R)-(6-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиридин-3-ил)(3-гидроксипиперидин-1-ил)метанон
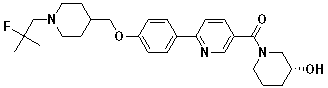
Стадия 1. метил 6-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)никотинат:
Метил 6-бромникотинат (0,07 г, 46%) растворили в 1,4-диоксане 2 мл и H2O 1 мл. 4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенилборную кислоту (продукт синтеза стадии 1 соединения 617; 0,1 г, 0,32 ммоль), Pd(dbpf)Cl2 (0,01g, 0,02 ммоль) и Cs2CO3 (0,21 г, 0,65 ммоль) добавили туда же. Смесь перемешивали в микроволновой печи при 110 ºC в течение 30 минут. По окончании реакции, реакционную смесь отфильтровали через цеолиты. Фильтрат разбавили водой и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (12 г ISCO силикагелевый картридж, 0 - 20% EtOAc/Гексан) с получением целевого соединения в виде твердого вещества желтого цвета (0,06 г, 46%).
Стадия 2. 6-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)никотиновая кислота:
Метил 6-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)никотинат (0,06 г, 0,15 ммоль) растворили в THF 10 мл, H2O 3 мл и MeOH 3 мл. LiOH·H2O (0,03 г, 0,75 ммоль) добавили к этой смеси, с последующим медленным повышением температуры. Смесь кипятили с обратным холодильником при перемешивании в течение 3 часов. По окончании реакции, HCl добавили к этой смеси чтобы довести до значения рН 5. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,03 г, 55%).
Стадия 3. Соединение 758: 6-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил) никотиновую кислоту (0,03 г, 0,08 ммоль) и (R)-пиперидин-3-ол (0,02 г, 0,15 ммоль) растворили в DMF 2 мл. DIPEA (0,05 г, 0,38 ммоль), EDCI (0,03 г, 0,15 ммоль) и HOBt (0,02 г, 0,15 ммоль) медленно добавили туда же, после чего перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным раствором NH4Cl, высушили над MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (12 г ISCO силикагелевый картридж, 0 - 20% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества коричневого цвета (0,02 г, 61%).
1H NMR (400 MHz, CDCl3) δ 8,70 (s, 1 H), 7,96 (d, 2 H, J = 8,4 Hz), 7,82 (d, 1 H, J = 6,8 Hz), 7,71 (d, 1 H, J = 8,4 Hz), 7,00 (d, 2 H, J = 8,8 Hz), 3,99 - 3,57 (m, 7 H), 3,00 (d, 2 H, J = 10,4 Hz), 2,48 - 2,43 (m, 2 H), 2,19 (t, 2 H, J = 11,2 Hz), 2,05 - 1,67 (m, 7 H), 1,55 - 1,35 (m, 8 H).
Пример 39. Соединение 759: (R)-(5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиридин-2-ил)(3-гидроксипиперидин-1-ил)метанон
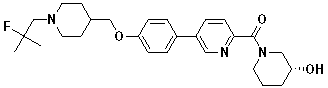
Стадия 1. метил 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколинат:
Метил 5-бромпиколинат (0,10 г, 0,46 ммоль) растворили в 1,4-диоксане 2 мл и H2O 1 мл. 4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенилборную кислоту (стадия синтеза 1 соединения 617, 0,13 г, 0,42 ммоль), Pd(dbpf)Cl2 (0,01 г, 0,02 ммоль) и Cs2CO3 (0,27 г, 0,84 ммоль) добавили туда же. Смесь перемешивали в микроволновой печи при 110 ºC в течение 30 минут. По окончании реакции, реакционную смесь отфильтровали через цеолиты. Фильтрат разбавили водой и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (12 г ISCO силикагелевый картридж, 0 - 20% EtOAc/Hex) с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,03 г, 18%).
Стадия 2. 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил) пиколиновая кислота: метил 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил) пиколинат (0,03 г, 0,08 ммоль) растворили в THF 10 мл, H2O 3 мл, MeOH 3 мл. LiOH·H2O (0,02 г, 0,38 ммоль) добавили к этой смеси, с последующим медленным повышением температуры и затем кипятили с обратным холодильником и перемешиванием в течение 3 часов. По окончании реакции, реакционную смесь подкислили до pH 5 путем добавления HCl. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (0,03 г, 97%).
Стадия 3. Соединение 759: 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил) пиколиновую кислоту (0,03 г, 0,07 ммоль) и (R)-пиперидин-3-ол (0,01 г, 0,08 ммоль) растворили в DMF. DIPEA (0,05 г, 0,36 ммоль), EDCI (0,03 г, 0,15 ммоль) и HOBt (0,02 г, 0,15 ммоль) медленно добавили туда же, после чего перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным раствором NH4Cl, высушили над MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (12 г ISCO силикагелевый картридж, 0 - 20% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,01 г, 38%).
1H NMR (400 MHz, CDCl3) δ 8,72 (s, 1 H), 8,00 (d, 1 H, J = 6,1 Hz), 7,84 (d, 1 H, J = 8,4 Hz), 7,53 (d, 2 H, J = 7,7 Hz), 7,02 (d, 2 H, J = 7,6 Hz), 5,84 (s, 1 H), 4,61 (d, 1 H, J = 12,8 Hz), 4,10 - 4,03 (m, 2 H), 3,86 (d, 2 H, J = 5,4 Hz), 3,27 (d, 1 H, J = 14,0 Hz), 3,01 - 2,91 (m, 3 H), 2,48 - 2,43 (m, 2 H), 2,21 - 1,98 (m, 4 H), 1,82 - 1,48 (m, 5 H), 1,46 - 1,26 (m, 8 H); MS (ESI) m/z 470 (M+ + H).
Пример 40. Соединение 1038: (S)-1-(5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбонил)пирролидин-2-карбоксамид
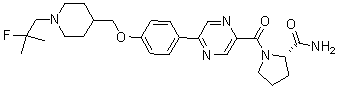
Стадия 1. метил 5-(4-гидроксиметил)пиразин-2-карбоксилат: метил 5-бромпиразин-2-карбоксилат (500 мг, 2,30 ммоль), 4-гидроксифенилборную кислоту (381 мг, 2,77 ммоль), метил 5-бромпиразин-2-карбоксилат, Pd(dppf)Cl2 (188 мг, 0,23 ммоль) и Cs2CO3 (1,50 г, 4,61 ммоль) добавили к смеси вода (2 мл)/DME (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (30% EtOAc/гексан) с получением целевого соединения в виде твердого вещества коричневого цвета (210 мг, 40%).
Стадия 2. метил 5-(4-((1-(трет-бутоксикарбонил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоксилат: метил 5-(4-гидроксиметил)пиразин-2-карбоксилат(150 мг, 0,65 ммоль) растворили в DMF(10 мл). При комнатной температуре, K2CO3 (318 мг, 0,98 ммоль) добавили к этой смеси. Через 5 минут, трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилат (229 мг, 0,78 ммоль) добавили к этой смеси, после чего перемешивали при 80 ºC в течение 5 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки. (170 мг, 61%).
Стадия 3. метил 5-(4-(пиперидин-4-илметокси)фенил)пиразин-2-карбоксилат гидрохлорид:
Метил 5-(4-((1-(трет-бутоксикарбонил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоксилат (170 мг, 0,39 ммоль) растворили в CH2Cl2 (10 мл) . При комнатной температуре, 4 M HCl в 1,4-диоксане (1,99 мл, 7,95 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 1 часа. Полученный осадок отфильтровали, и высушили с получением целевого соединения в виде твердого вещества белого цвета (142 мг, 98%).
Стадия 4. метил 5-(4-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоксилат: метил 5-(4-(пиперидин-4-илметокси)фенил)пиразин-2-карбоксилат гидрохлорид (142 мг, 0,39 ммоль), 2,2-диметилоксиран (352 мкл, 0,28 ммоль) и K2CO3 (27 мг, 0,19 ммоль) растворили в этаноле (10 мл), Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (117 мг, 100%).
Стадия 5. метил 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоксилат: метил 5-(4-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)фенил) пиразин-2-карбоксилат (117 мг, 0,29 ммоль) растворили в CH2Cl2 (15 мл). При комнатной температуре, DAST (39 мкл, 0,29 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 1 часа. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (100 мг, 85%).
Стадия 6. 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоновая кислота: метил 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил) пиразин-2-карбоксилат (100 мг, 0,24 ммоль) растворили в THF (10 мл)/вода (5 мл). При комнатной температуре, LiOH·H2O (52 мг, 1,24 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 1 часа. Реакционную смесь упарили при пониженном давлении. Полученное твердое вещество отфильтровали, и высушили с получением целевого соединения в виде твердого вещества белого цвета (75 мг, 78%).
Стадия 7. Соединение 1038: 5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) фенил)пиразин-2-карбоновую кислоту (35 мг, 0,09 ммоль), (S)-пирролидин-2-карбоксамид (21 мг, 0,18 ммоль), EDC (35 мг, 0,18 ммоль), HOBt (24 мг, 0,18 ммоль) и DIPEA (32 мкл, 0,18 ммоль) растворили в CH2Cl2 (1 мл), после чего перемешивали при комнатной температуре в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (19 мг, 44%).
1H NMR (400 MHz, CDCl3) δ 9,25 - 9,15 (m, 1 H), 8,93 - 8,87 (m, 1 H), 8,05 - 7,99 (m, 2 H), 7,05 - 6,99 (m, 2 H), 5,48 (brs, 1 H), 5,04 - 4,85 (m, 1 H), 4,12 - 4,06 (m, 1 H), 3,95 - 3,84 (m, 3 H), 3,04 (brs, 2 H), 2,50 - 2,41 (m, 3 H), 2,39 - 2,20 (m, 3 H), 2,18 - 1,97 (m, 3 H), 1,83 (brs, 3 H), 1,61 - 1,22 (m, 8 H); MS (ESI) m/z 484 (M+ + H).
Пример 41. Соединение 725: (S)-(3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
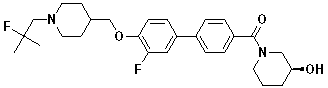
Стадия 1. трет-Бутил 4-((4-бром-2-фторфенокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 2 соединения 431; 4,50 г, 15,34 ммоль) растворили в DMF. K2CO3 (4,24 г, 30,67 ммоль) и 2-фтор-4-бром фенол (1,85 мл, 16,87 ммоль) медленно добавили туда же, с последующим повышением температуры и перемешивали при 60 ºC в течение 3 часов. По окончании реакции, реакционную смесь проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором три раза, высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г ISCO силикагелевый картридж, 0 - 20% EtOAc/Hex) с получением целевого соединения в виде твердого вещества белого цвета (5,10 г, 86%).
Стадия 2. 4-((4-бром-2-фторфенокси)метил)пиперидин гидрохлорид: трет-бутил 4-((4-бром-2-фторфенокси)метил)пиперидин-1-карбоксилат (5,60 г, 14,42 ммоль) растворили в MeOH. И 1,25 M HCl в MeOH (57,69 мл, 72,12 ммоль) добавили к этой смеси. После полной отгонки растворителя, остаток промыли эфиром с получением целевого соединения в виде твердого вещества белого цвета (4,1 г, 99%).
Стадия 3. 1-(4-((4-бром-2-фторфенокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
4-((4-бром-2-фторфенокси)метил)пиперидин гидрохлорид (2,30 г, 7,98 ммоль) растворили в EtOH 50 мл и H2O 50 мл. И 1,2-эпокси-2-метилпропан (5,76 г, 79,82 ммоль) и K2CO3 (5,52 г, 39,91 ммоль) медленно добавили к реакционной смеси. Смесь перемешивали в микроволновой печи при 120 ºC в течение 20 минут. По окончании реакции, реакционную смесь упарили при пониженном давлении. Избыточное количество H2O добавили к этой смеси, и затем небольшое количество MeOH добавили к этой смеси. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (2,4 г, 86%).
Стадия 4. 4-((4-бром-2-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин:
1-(4-((4-бром-2-фторфенокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (4,88 г, 13,55 ммоль) растворили в CH2Cl2. При 0 ºC, DAST (1,97 мл, 14,90 ммоль) медленно добавили к реакционной смеси, после чего перемешивали при 0 ºC в течение 2 часов. Реакционную смесь нейтрализовали насыщенным водным раствором NaHCO3 до pH 7, и затем промыли насыщенным водным соляным раствором три раза. Органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, 0 ~ 40% EtOAc/Hex) с получением целевого соединения в виде твердого вещества светло-желтого цвета (3,3 г, 67%).
Стадия 5. метил 3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-2-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (0,62 г, 1,71 ммоль) растворили в 1,4-диоксане 12 мл и H2O 3 мл. Затем, 4-(метоксикарбонил)фенилборную кислоту (0,31 г, 1,71 ммоль), Pd(dbpf)Cl2 (0,056 г, 0,086 ммоль) и Cs2CO3 (1,12 г, 3,42 ммоль) добавили туда же, с последующим медленным повышением температуры и перемешивали при 120 ºC в течение 3 часов. По окончании реакции, реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. MeOH добавили к этой смеси. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (0,23 г, 32%).
Стадия 6. 3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: метил 3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенил-4-карбоксилат (0,32 г, 0,77 ммоль) растворили в THF 10 мл, H2O 3 мл и MeOH 3 мл. LiOH·H2O (0,26 г, 6,13 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 12 часов. По окончании реакции, реакционную смесь подкислили до pH 5 путем добавления HCl. Реакционную смесь проэкстрагировали с CH2Cl2. Органический слой промыли насыщенным водным соляным раствором три раза, высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (0,12 г, 39%).
Стадия 7. Соединение 725: 3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенил-4-карбоновую кислоту (0,04 г, 0,10 ммоль) и (S)-пиперидин-3-ол (0,02 г, 0,20 ммоль) растворили в DMF 2 мл. DIPEA (0,06 г, 0,50 ммоль), EDCI (0,04 г, 0,20 ммоль) и HOBt (0,03 г, 0,20 ммоль) медленно добавили туда же, после чего перемешивали при комнатной температуре в течение 3 часов. По окончании реакции, к реакционной смеси добавили избыточное количество воды. Полученный осадок отфильтровали, и затем растворили в CH2Cl2. Раствор упарили при пониженном давлении. Полученный концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, 0 - 20% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,032 г, 68%).
1H NMR (400 MHz, CDCl3) δ 7,50 (m, 4 H), 7,32 - 7,24 (m, 2 H), 7,00 (t, 1 H, J = 8,5 Hz), 3,89 (d, 2 H, J = 6,0 Hz), 3,44 - 2,98 (m, 6 H), 2,47 (s, 1 H), 2,41 (s, 1 H), 2,17 - 1,65 (m, 9 H), 1,38 - 1,23 (m, 8 H); MS (ESI) m/z 487 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 725, соединения Таблицы 12 синтезировали с использованием 3' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 11.
Таблица 11.
Таблица 12.
Пример 42. Соединение 730: (S)-1-(3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил) пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
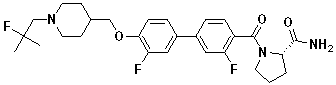
Стадия 1. метил 3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-2-фторфенокси)метил)-1-(2-фтор-2-метилпропил) пиперидин (продукт синтеза стадии 4 соединения 725; 0,6 г, 1,66 ммоль) растворили в 1,4-диоксане 12 мл и H2O 3 мл. 4-(этоксикарбонил)-3-фторфенилборная кислота, Pd(dbpf)Cl2 (0,05 г, 0,08 ммоль) и Cs2CO3 (1,07 г, 3,13 ммоль) добавили туда же, с последующим медленным повышением температуры и перемешивали при 120 ºC в течение 3 часов. По окончании реакции, реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. MeOH добавили к этой смеси. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества коричневого цвета (0,5 г, 69%).
Стадия 2. 3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: метил 3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,5 г, 1,15 ммоль) растворили в THF 10 мл, H2O 3 мл и MeOH 3 мл. LiOH·H2O (0,24 г, 5,74 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 12 часов. По окончании реакции, реакционную смесь подкислили до pH 5 путем добавления HCl. Реакционную смесь проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза, высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (0,37 г, 77%).
Стадия 3. Соединение 730: 3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,04 г, 0,10 ммоль) и (S)-пирролидин-2-карбоксамид (0,02 г, 0,19 ммоль) растворили в DMF 1 мл. DIPEA (0,08 мл, 0,47 ммоль), EDCI (0,04 г, 0,19 ммоль) и HOBt (0,03 г, 0,19 ммоль) медленно добавили туда же, после чего перемешивали при 60 ºC в течение 3 часов. По окончании реакции, к реакционной смеси добавили избыточное количество воды. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества коричневого цвета (0,04 г, 75%).
1H NMR (400 MHz, CDCl3) δ 7,24 - 7,21 (m, 5 H), 7,00 (t, 1 H, J = 8,4 Hz), 6,89 (brs, 1 H), 5,41 (brs, 1 H), 4,81 - 4,80 (m, 1 H), 3,91 (brs, 2 H), 3,53 - 3,41 (m, 2 H), 3,13 - 2,43 (m, 4 H), 2,21 - 1,86 (m, 3 H), 1,71 - 1,23 (m, 10 H); MS (ESI) m/z 518 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 730, соединения Таблицы 14 синтезировали с использованием 3,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 13.
Таблица 13.
Таблица 14.
Пример 43. Соединение 735: (S)-(2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил) пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
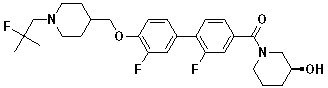
Стадия 1. метил 2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-2-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 4 соединения 725; 0,60 г, 1,66 ммоль) растворили в 1,4-диоксане 12 мл и H2O 3 мл. 2-Фтор-4-(метоксикарбонил)фенилборную кислоту (0,33 г, 1,66 ммоль), Pd(dbpf)Cl2 (0,05 г, 0,08 ммоль) и Cs2CO3 (1,07 г, 3,31 ммоль) добавили к этой смеси. Смесь перемешивали в микроволновой печи при 120 ºC в течение 30 минут. По окончании реакции, реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. MeOH добавили к этой смеси. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,35 г, 49%).
Стадия 2. 2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: метил 2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,35 г, 0,80 ммоль) растворили в THF 10 мл, H2O 3 мл и MeOH 3 мл. LiOH·H2O (0,17 г, 4,02 ммоль) добавили к этой смеси, с последующим медленным повышением температуры и затем кипятили с обратным холодильником и перемешиванием в течение 3 часов. По окончании реакции, реакционную смесь подкислили до pH 5 путем добавления HCl. Реакционную смесь проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза. Органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (0,33 г, 97%).
Стадия 3. Соединение 735: 2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,04 г, 0,10 ммоль) и (S)-пиперидин-3-ол (0,02 г, 0,19 ммоль) растворили в DMF 2 мл. DIPEA (0,08 мл, 0,48 ммоль), EDCI (0,04 г, 0,19 ммоль) и HOBt (0,03 г, 0,19 ммоль) медленно добавили туда же, после чего перемешивали при 60 ºC в течение 3 часов. По окончании реакции, к реакционной смеси добавили избыточное количество воды. Полученный осадок отфильтровали, и растворили в CH2Cl2 . Раствор упарили при пониженном давлении. Полученный концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, 0 - 20% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,02 г, 42%).
1H NMR (400 MHz, CDCl3) δ 7,40 (t, 1 H, J = 5,8 Hz), 7,29 - 7,21 (m, 4 H), 6,99 (t, 1 H, J = 6,4 Hz), 3,88 (d, 2 H, J = 4,6 Hz), 3,78 - 3,27 (m, 4 H), 2,97 (d, 2 H, J = 8,2 Hz), 2,45 (s, 1 H), 2,40 (s, 1 H), 2,16 (t, 2 H, J = 8,5 Hz), 1,91 - 1,65 (m, 7 H), 1,45 - 1,23 (m, 8 H); MS (ESI) m/z 505 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 735, соединения Таблицы 16 синтезировали с использованием 2,3' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 15.
Таблица 15.
Таблица 16.
Пример 44. Соединение 782: (S)-1-(5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамид
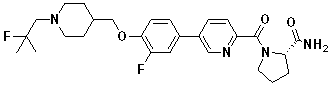
Стадия 1. метил 5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил) пиколинат: 4-((4-бром-2-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 4 соединения 725; 1,0 г, 2,76 ммоль) растворили в 1,4-диоксане 8 мл и H2O 2 мл. 6-(Метоксикарбонил)пиридин-3-илборную кислоту (0,50 г, 2,76 ммоль), Pd(dbpf)Cl2 (0,22 г, 0,28 ммоль) и Cs2CO3 (1,80 г, 5,52 ммоль) добавили туда же. Смесь перемешивали в микроволновой печи при 110 ºC в течение 30 минут. По окончании реакции, реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с CH2Cl2. Органический слой промыли три раза насыщенным водным соляным раствором, высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. MeOH добавили к этой смеси. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества темно-коричневого цвета (0,1 г, 9%).
Стадия 2. 5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиновая кислота: метил 5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил) пиколинат (0,12 г, 0,29 ммоль) растворили в THF 10 мл, H2O 3 мл и MeOH 3 мл. LiOH·H2O (0,06 г, 1,43 ммоль) добавили к этой смеси, с последующим медленным повышением температуры и затем кипятили с обратным холодильником и перемешиванием в течение 3 часов. По окончании реакции, реакционную смесь подкислили до pH 5 путем добавления HCl, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным раствором NaHCO3 три раза, высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества темно-коричневого цвета (0,08 г, 69%).
Стадия 3. Соединение 782: 5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиновую кислоту (0,03 г, 0,07 ммоль) и (S)-пирролидин-2-карбоксамид (0,02 г, 0,15 ммоль) растворили в DMF 1 мл. DIPEA (0,05 г, 0,37 ммоль, EDCI (0,03 г, 0,15 ммоль) и HOBt (0,02 г, 0,15 ммоль) медленно добавили туда же, после чего перемешивали при 60 ºC в течение 3 часов. По окончании реакции, к реакционной смеси добавили избыточное количество воды. Полученный осадок отфильтровали, и растворили в CH2Cl2 снова. Концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, 0 - 20% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,01 г, 38%).
1H NMR (400 MHz, CDCl3) δ 8,77 (brs, 1 H), 8,14 - 7,93 (m, 2 H), 7,37 - 7,29 (m, 2 H), 7,07 - 7,05 (m, 1 H), 5,50 (brs, 1 H), 5,16 - 4,82 (m, 1 H), 3,93 - 3,89 (m, 5 H), 3,02 (d, 2 H, J = 12,5 Hz), 2,50 - 1,78 (m, 11 H), 1,47 - 1,26 (m, 8 H); MS (ESI) m/z 501 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 782, соединения Таблицы 18 синтезировали с использованием 5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиновой кислоты и реагента из Таблицы 17.
Таблица 17.
Таблица 18.
Пример 45. Соединение 706: (S)-1-(2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
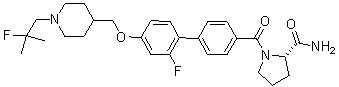
Стадия 1. метил 2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-3-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 4 соединения 704; 500 мг, 1,38 ммоль), 4-(метоксикарбонил) фенилборную кислоту (298 мг, 1,57 ммоль), Pd(dppf)Cl2 (56 мг, 0,07 ммоль) и Cs2CO3 (341 мг, 1,05 ммоль) добавили к смеси вода (2 мл)/1,4-диоксан (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1/7) с получением целевого соединения в виде твердого вещества белого цвета (210 мг, 36%).
Стадия 2. 2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: метил 2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (210 мг, 0,50 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (106 мг, 2,52 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь подкислили путем добавления 1N HCl. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (200 мг, 98%).
Стадия 3. Соединение 706: 2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (50 мг, 0,12 ммоль), (S)-пирролидин-2-карбоксамид (17 мг, 0,15 ммоль), BOP (110 мг, 0,248 ммоль) и Et3N (34 мкл, 0,25 ммоль) растворили в DMF. Реакцию проводили при 60 ºC в течение дня. По окончании реакции, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 10/1) с получением целевого соединения в виде твердого вещества желтого цвета (23 мг, 37%).
1H NMR (400 MHz, CDCl3) δ 7,61 - 7,53 (m, 4 H), 7,37 - 7,27 (m, 1 H), 7,04 (brs, 1 H), 6,79 - 6,70 (m, 2 H), 5,53 (brs, 1 H), 4,85 - 4,82 (m, 1 H), 3,83 (d, 2 H, J = 5,8 Hz), 3,67 - 3,56 (m, 2 H), 3,01 (brs, 1 H), 2,50 - 2,39 (m, 2 H), 2,20 - 2,12 (m, 2 H), 2,10 - 2,06 (m, 2 H), 1,89 - 1,80 (m, 4 H), 1,42 - 1,37 (m, 8 H), 1,29 - 1,21 (m, 2 H); MS (ESI) m/z 500 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 706, соединения Таблицы 20 синтезировали с использованием 2' -фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 19.
Таблица 19.
Таблица 20.
Пример 46. Соединение 704: (2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-2-(гидроксиметил)пирролидин-1-ил)метанон
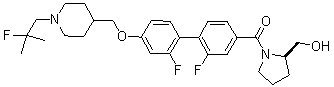
Стадия 1. трет-Бутил 4-((4-бром-3-фторфенокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 2 соединения 431; 6,0 г, 20,45 ммоль) растворили в DMF (60 мл). 4-Бром-3-фторфенол (3,91 г, 20,45 ммоль) и K2CO3 (8,48 г, 61,35 ммоль) медленно добавили туда же, после чего перемешивали при 80 ºC в течение 5 часов. По окончании реакции, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан 1/10) с получением целевого соединения в виде твердого вещества белого цвета (6,27g, 79%).
Стадия 2. 4-((4-бром-3-фторфенокси)метил)пиперидин гидрохлорид:
трет-бутил 4-((4-бром-3-фторфенокси)метил)пиперидин-1-карбоксилат (6,27 г, 16,15 ммоль) растворили в CH2Cl2 (70 мл). 4 M HCl в 1,4-диоксане (80,74 мл, 322,97 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (5,03 г, 96%).
Стадия 3. 1-(4-((4-бром-3-фторфенокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
4-((4-бром-3-фторфенокси)метил)пиперидин гидрохлорид (5,32 г, 16,39 ммоль) растворили в EtOH (5 мл) и H2O (5 мл). 2,2-Диметилоксиран (14,59 мл, 163,88 ммоль) и K2CO3 (1,13 г, 8,19 ммоль) медленно добавили туда же. Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 20 минут, и затем охладили до комнатной температуры. К реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1/4) с получением целевого соединения в виде твердого вещества белого цвета (5,2 г, 88%).
Стадия 4. 4-((4-бром-3-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин:
1-(4-((4-бром-3-фторфенокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (5,2 г, 14,43 ммоль) растворили в CH2Cl2 (15 мл). При 0 ºC, DAST (1,91 мл, 14,43 ммоль) медленно добавили к реакционной смеси. После перемешивания в течение 1 часа при комнатной температуре, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1/7) с получением целевого соединения в виде твердого вещества желтого цвета (2,50 г, 48%).
Стадия 5. метил 2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-3-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (200 мг, 0,55 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (131 мг, 0,06 ммоль), Pd(dppf)Cl2 (22 мг, 0,03 ммоль) и Cs2CO3 (360 мг, 1,10 ммоль) добавили к смеси вода (2 мл)/1,4-диоксан (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1/7) с получением целевого соединения в виде твердого вещества белого цвета (81 мг, 34%).
Стадия 6. 2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: метил 2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (81 мг, 0,19 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (39 мг, 0,93 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь подкислили путем добавления 1N HCl. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (60 мг, 77%).
Стадия 7. Соединение 704: 2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (30 мг, 0,07 ммоль),(R)-пирролидин-2-илметанол (9 мг, 0,09 ммоль), BOP (63 мг, 0,14 ммоль) и Et3N (20 мкл, 0,14 ммоль) растворили в DMF, и при 60 ºC. Реакцию проводили в течение дня. По окончании реакции, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 10/1) с получением целевого соединения в виде твердого вещества желтого цвета (17 мг, 47%).
1H NMR (400 MHz, CDCl3) δ 7,44 - 7,27 (m, 4 H), 6,77 - 6,70 (m, 2 H), 4,43 - 3,83 (m, 1 H), 4,12 - 3,83 (m, 3 H), 3,78 - 3,47 (m, 4 H), 3,05 - 2,81 (m, 2 H), 2,67 - 2,49 (m, 2 H), 2,22 - 2,21 (m, 1 H), 2,20 (s, 1 H), 2,06 - 1,85 (m, 5 H), 1,57 (s, 3 H), 1,51 (s, 3 H), 1,36 - 1,31 (m, 3 H); MS (ESI) m/z 505 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 704, соединения Таблицы 22 синтезировали с использованием 2,2' -дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 21.
Таблица 21.
Таблица 22.
Пример 47. Соединение 710: (S)-1-(2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
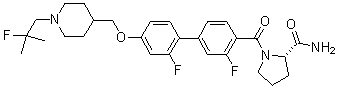
Стадия 1. этил 2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-3-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 4 соединения 704; 500 мг, 1,38 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (351 мг, 1,66 ммоль), Pd(dppf)Cl2 (56 мг, 0,07 ммоль) и Cs2CO3 (899 мг, 2,76 ммоль) добавили к смеси вода (2 мл)/1,4-диоксан (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1/7) с получением целевого соединения в виде твердого вещества белого цвета (287 мг, 46%).
Стадия 2. 2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: этил 2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (287 мг, 0,64 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (134 мг, 3,19 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь подкислили путем добавления 1N HCl. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (220 мг, 82%).
Стадия 3. Соединение 710: 2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (50 мг, 0,12 ммоль), (S)-пирролидин-2-карбоксамид (16 мг, 0,14 ммоль), BOP (105 мг, 0,24 ммоль) и Et3N (33 мкл, 0,24 ммоль) растворили в DMF. Реакцию проводили при 60 ºC в течение дня. По окончании реакции, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 10/1) с получением целевого соединения в виде твердого вещества желтого цвета (19 мг, 31%).
1H NMR (400 MHz, CDCl3) δ 7,49 - 7,45 (m, 1 H), 7,39 - 7,32 (m, 3 H), 6,95 (brs, 1 H), 6,80 - 6,70 (m, 2 H), 5,56 (brs, 1 H), 4,84 - 4,81 (m, 1 H), 3,83 (d, 2 H, J = 6,0 Hz), 3,58 - 3,51 (m, 1 H), 3,47 - 3,52 (m, 1 H), 3,00 (brs, 2 H), 2,51 - 2,43 (m, 3 H), 2,20 (brs, 2 H), 2,18 - 2,04 (m, 2 H), 1,94 - 1,91 (m, 1 H), 1,89 - 1,82 (m, 3 H), 1,80 - 1,42 (m, 8 H); MS (ESI) m/z 518 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 710, соединения Таблицы 24 синтезировали с использованием 2',3-дифтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 23.
Таблица 23.
Таблица 24.
Пример 48. Соединение 1082: (S)-1-(5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбонил)пирролидин-2-карбоксамид
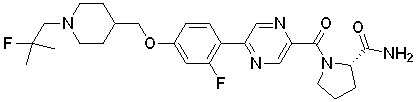
Стадия 1. метил 5-(4-(бензокси)-2-фторфенил)пиразин-2-карбоксилат: к DME (8 мл) / H2O (2 мл) добавили 4-(бензокси)-2-фторфенилборную кислоту (1,00 г, 4,06 ммоль), метил 5-бромпиразин-2-карбоксилат (0,77 г, 4,47 ммоль), Pd(dppf)Cl2 (0,16 г, 0,20 ммоль) и Cs2CO3 (2,64 г, 8,12 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 25 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. К фильтрату добавили насыщенный водный раствор NH4Cl, и проэкстрагировали этилацетатом. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; этил ацетат / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,75 г, 54%).
Стадия 2. метил 5-(2-фтор-4-гидроксифенил)пиразин-2-карбоксилат: метил 5-(4-(бензокси)-2-фторфенил)пиразин-2-карбоксилат (0,750 г, 2,21 ммоль) растворили в MeOH (10 мл) / THF (10 мл) при комнатной температуре. 10% (весовых) Pd/C (150 мг) медленно добавили к реакционной смеси, после чего перемешивали при такой же температуре в течение 1 часа под шариком, наполненным водородом. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат упарили при пониженном давлении. К полученному концентрату добавили метанол (5 мл) и гексан (20 мл), после чего перемешали. Полученный осадок отфильтровали, и высушили с получением целевого соединения в виде твердого вещества зеленого цвета (0,19 г, 34%).
Стадия 3. метил 5-(4-((1-(трет-бутоксикарбонил)пиперидин-4-ил)метокси)-2-фторфенил)пиразин-2-карбоксилат: метил 5-(2-фтор-4-гидроксифенил)пиразин-2-карбоксилат (0,19 г, 0,76 ммоль), трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат (0,22 г, 0,76 ммоль) и K2CO3 (0,15 г, 1,14 ммоль) растворили при 70 °C в DMF (10 мл), после чего перемешивали при такой же температуре в течение 18 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали этилацетатом. Органический слой промыли водой, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (0,28 г, 82%, твердое вещество белого цвета).
Стадия 4. метил 5-(2-фтор-4-(пиперидин-4-илметокси)фенил)пиразин-2-карбоксилат гидрохлорид: метил 5-(4-((1-(трет-бутоксикарбонил)пиперидин-4-ил)метокси)-2-фторфенил)пиразин-2-карбоксилат (0,28 г, 0,62 ммоль) растворили в DCM (10 мл). При комнатной температуре, HCl (4,00M раствор в диоксане, 0,62 мл, 2,51 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 18 часов. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,14 г, 59%).
Стадия 5. метил 5-(2-фтор-4-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоксилат: в EtOH (10 мл) добавили метил 5-(2-фтор-4-(пиперидин-4-илметокси)фенил)пиразин-2-карбоксилат гидрохлорид (0,14 г, 0,29 ммоль), 2,2-диметил оксиран (0,26 мл, 2,96 ммоль) и K2CO3 (0,20 г, 1,48 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали этилацетатом. Органический слой промыли водой, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (0,12 г, 96%, твердое вещество красного цвета).
Стадия 6. метил 5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоксилат: метил 5-(2-фтор-4-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоксилат (0,12 г, 0,28 ммоль) и DAST (0,05 мл, 0,34 ммоль) растворили в DCM (10 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 4 часов. Реакционную смесь разбавили насыщенным водным раствором NaHCO3, и проэкстрагировали этилацетатом. Органический слой промыли водой, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (0,09 г, 73%, твердое вещество желтого цвета).
Стадия 7. 5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоновая кислота: метил 5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоксилат (0,09 г, 0,21 ммоль) и LiOH·H2O (0,04 г, 1,04 ммоль) растворили в THF / MeOH (8 мл) / H2O (1мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (10 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,06 г, 76%).
Стадия 8. Соединение 1082: 5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбоновую кислоту (0,06 г, 0,14 ммоль), (S)-пирролидин-2-карбоксамид (0,01 г, 0,17 ммоль), HOBt (0,04 г, 0,29 ммоль), EDC (0,05 г, 0,29 ммоль) и iPr2NEt (0,05 мл, 0,29 ммоль) растворили в DCM (2 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали этилацетатом. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,02 г, 35%).
1H NMR (400 MHz, CDCl3) δ 9,18 - 9,19 (m, 1 H), 8,95 - 9,02 (m, 1 H), 8,06 (td, 1 H, J = 8,9, 2,5 Hz), 6,85 (td, 1 H, J = 8,4, 2,2 Hz), 6,68 - 6,74 (m, 1 H), 6,19 (s, 1 H), 5,44 (s, 1 H), 5,04 - 4,83 (m, 1 H), 4,83 - 4,86 (m, 1 H), 4,06 - 4,11 (m, 1 H), 3,88 - 3,96 (m, 1 H), 3,83 - 3,86 (m, 2 H), 2,97 - 3,00 (m, 2 H), 2,41 - 2,47 (m, 3 H), 2,13 - 2,21 (m, 3 H), 1,97 - 2,06 (m, 2 H), 1,77 - 1,80 (m, 3 H), 1,41 - 1,47 (m, 2 H), 1,39 (s, 3 H), 1,33 (s, 3 H); MS (ESI) m/z 502,3 (M+ + H).
Пример 49. Соединение 935: (S)-1-(5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамид
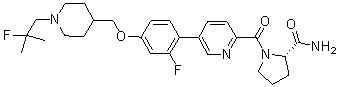
Стадия 1. метил 5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколинат: 4-((4-бром-3-фторфенокси)метил)-1-(2-фтор-2-метилпропил)пиперидин (продукт синтеза стадии 4 соединения 704; 1,00 г, 2,76 ммоль), 6-(метоксикарбонил)пиридин-3-илборную кислоту (600 мг, 3,31 ммоль), Pd(dppf)Cl2 (113 мг, 0,14 ммоль) и Cs2CO3 (1,80 г, 5,52 ммоль) добавили к смеси вода (2 мл)/1,4-диоксан (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1/7) с получением целевого соединения в виде твердого вещества белого цвета (200 г, 17%).
Стадия 2. 5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиновая кислота: метил 5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколинат (200 мг, 0,48 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (100 г, 2,39 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь подкислили путем добавления 1N HCl. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (145 мг, 75%).
Стадия 3. Соединение 935: 5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиновую кислоту (30 мг, 0,07 ммоль), EDC (28 мг, 0,15 ммоль), HOBt (20 мг, 0,15 ммоль) и DIPEA (26 мкл, 0,15 ммоль) растворили в CH2Cl2 (1 мл). (S)-пирролидин-2-карбоксамид (17 мг, 0,15 ммоль) добавили к этой смеси при комнатной температуре, после чего перемешивали при такой же температуре в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (19 мг, 51%).
1H NMR (400 MHz, CDCl3) δ 8,75 - 8,70 (m, 1 H), 8,10 - 7,91 (m, 2 H), 7,40 - 7,34 (m, 1 H), 6,95 (brs, 0,5 H), 6,84 - 6,73 (m, 2 H), 5,44 (brs, 0,5 H), 5,07 (d, 0,5 H, J = 7,1 Hz), 4,88 - 4,85 (m, 0,5 H), 3,84 (d, 2 H, J = 5,9 Hz), 3,01 (d, 2 H, J = 10,4 Hz), 2,49 - 2,41 (m, 2 H), 2,21 - 1,95 (m, 5 H), 1,82 - 1,61 (m, 7 H), 1,49 - 1,46 (m, 2 H), 1,41 (s, 3 H), 1,35 (s, 3 H); MS (ESI) m/z 501 (M+ + H).
Пример 50. Соединение 963: (R)-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
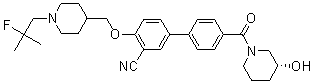
Стадия 1. метил 3' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: к DME (4 мл) / H2O (1 мл) добавили 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил (продукт синтеза стадии 4 соединения 938; 0,25 г, 0,67 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,14 г, 0,81 ммоль), Pd(dppf)Cl2 (0,02 г, 0,03 ммоль) и Cs2CO3 (0,44 г, 1,35 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,22 г, 78%).
Стадия 2. 3' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 3' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,22 г, 0,53 ммоль) и LiOH·H2O (0,11 г, 2,65 ммоль) растворили в THF / MeOH (8 мл) / H2O (2 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 2 часов, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,18 г, 86%).
Стадия 3. Соединение 963: 3' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,04 г, 0,09 ммоль), (R)-пиперидин-3-ол (0,01 г, 0,11 ммоль), HOBt (0,02 г, 0,19 ммоль), EDC (0,03 г, 0,19 ммоль) и DIPEA (0,02 г, 0,19 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; дихлорметан / метанол = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества красного цвета (0,02 г, 49%).
1H NMR (400 MHz, CDCl3) δ 7,72 - 7,74 (m, 2 H), 7,53 (dd, 4 H, J = 14,7, 8,5 Hz), 7,04 (d, 1 H, J = 8,8 Hz), 3,95 - 4,01 (m, 3 H), 3,43 - 3,94 (m, 4 H), 2,99 - 3,02 (m, 2 H), 2,49 (s, 1 H), 2,44 (s, 1 H), 2,17 - 2,23 (m, 2 H), 1,86 - 1,95 (m, 6 H), 1,63 - 1,72 (m, 2 H), 1,42 - 1,56 (m, 2 H), 1,40 (s, 3 H), 1,35 (s, 3 H); MS (ESI) m/z 494,3 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 963, соединения Таблицы 26 синтезировали с использованием 3' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 25.
Таблица 25.
Таблица 26.
Пример 51. Соединение 967: (R)-2' -фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4'-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрил
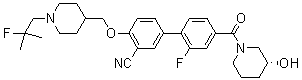
Стадия 1. метил 3' -циано-2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: к DME (4 мл) / H2O (1 мл) добавили 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил (продукт синтеза стадии 4 соединения 938; 0,25 г, 0,67 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (0,14 г, 0,81 ммоль), Pd(dppf)Cl2 (0,02 г, 0,03 ммоль) и Cs2CO3 (0,44 г, 1,35 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,14 г, 49%).
Стадия 2. 3' -циано-2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 3' -циано-2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,14 г, 0,32 ммоль) и LiOH·H2O (0,06 г, 1,63 ммоль) растворили в THF / MeOH (8 мл) / H2O (2 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 2 часов, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,13 г, 95%).
Стадия 3. Соединение 967: 3' -циано-2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,04 г, 0,093 ммоль), (R)-пиперидин-3-ол (0,01 г, 0,11 ммоль), HOBt (0,02 г, 0,18 ммоль), EDC (0,03 г, 0,18 ммоль) и DIPEA (0,03 мл, 0,18 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; дихлорметан / метанол = 0% - 10%), и упарили с получением целевого соединения в виде желтого масла (0,02 г, 46%).
1H NMR (400 MHz, CDCl3) δ 7,69 - 7,70 (m, 2 H), 7,42 (t, 1 H, J = 7,8 Hz), 7,24 - 7,30 (m, 2 H), 7,04 (d, 1 H, J = 8,8 Hz), 3,95 (d, 2 H, J = 6,4 Hz), 3,38 - 3,78 (m, 4 H), 2,99 - 3,02 (m, 2 H), 2,49 (s, 1 H), 2,43 (s, 1 H), 2,17 - 2,27 (m, 3 H), 1,85 - 1,95 (m, 5 H), 1,63 - 1,71 (m, 1 H), 1,42 - 1,56 (m, 3 H),1,40 (s, 3 H), 1,35 (s, 3 H); MS (ESI) m/z 512,3 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 967, соединения Таблицы 28 синтезировали с использованием 3' -циано-2-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 27.
Таблица 27.
Таблица 28.
Пример 52. Соединение 938: (S)-1-(3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
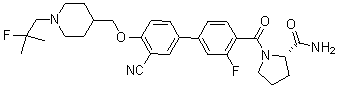
Стадия 1. трет-Бутил 4-((4-бром-2-цианофенокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 2 соединения 431; 800 мг, 2,73 ммоль) растворили в ACN (80 мл). При комнатной температуре, 5-бром-2-гидроксибензонитрил (540 мг, 2,73 ммоль) добавили к этой смеси, и перемешивали в течение 5 минут. Cs2CO3 (1,33 г, 4,09 ммоль) добавили к этой смеси, после чего перемешивали при 80 ºC в течение 5 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 30% ~ 70%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (655 мг, 60%).
Стадия 2. 5-бром-2-(пиперидин-4-илметокси)бензонитрил гидроксихлорид: трет-бутил 4-((4-бром-2-цианофенокси)метил)пиперидин-1-карбоксилат (655 мг, 1,66 ммоль) растворили в CH2Cl2 (10 мл). 4 M HCl раствор в 1,4-диоксане (414 мкл, 1,66 ммоль) добавили к этой смеси при комнатной температуре. Смесь перемешивали при такой же температуре в течение 1 часа. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (540 мг, 98%).
Стадия 3. 5-бром-2-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил: 5-бром-2-(пиперидин-4-илметокси)бензонитрил гидроксихлорид (540 мг, 1,63 ммоль), 2,2-диметил оксиран (1,45 мл, 16,3 ммоль) и K2CO3 (112 мг, 0,81 ммоль) добавили к EtOH (5 мл) / H2O (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал, представляющий собой целевое соединение в виде твердого вещества белого цвета (440 мг, 73%), использовали без дополнительной очистки.
Стадия 4. 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил:
5-бром-2-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил (440 мг, 1,20 ммоль) растворили в CH2Cl2 (10 мл). При 0 ºC, DAST (158 мкл, 1,20 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 30% ~ 70%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (254 мг, 57%).
Стадия 5. этил 3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бифенил-4-карбоксилат: 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) бензонитрил (продукт синтеза стадии 4 соединения 963; 254 мг, 0,69 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (160 мг, 0,76 ммоль), Pd(dppf)Cl2 (56 мг, 0,07 ммоль) и Cs2CO3 (448 мг, 1,38 ммоль) добавили к смеси вода (2 мл)/DME (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (205 мг, 65%).
Стадия 6. 3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Этил 3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (205 мг, 0,45 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (94 мг, 2,25 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (120 мг, 62%).
Стадия 7. Соединение 938: 3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (30 мг, 0,07 ммоль), EDC (27 мг, 0,14 ммоль), HOBt (19 мг, 0,14 ммоль) и DIPEA (25 мкл, 0,14 ммоль) растворили в CH2Cl2 (1 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (16 мг, 0,14 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (21 мг, 57%).
1H NMR (400 MHz, CDCl3) δ 7,77 - 7,71 (m, 2 H), 7,52 (t, 1 H, J = 7,5 Hz), 7,44 - 7,39 (m, 1 H), 7,37 - 7,23 (m, 1 H), 7,06 (d, 1 H, J = 8,9 Hz), 6,89 (brs, 1 H), 5,50 (brs, 1 H), 4,83 - 4,80 (m, 1 H), 3,96 (d, 2 H, J = 6,4 Hz), 3,56 - 3,39 (m, 2 H), 3,03 (brs, 2 H), 2,52 - 2,41 (m, 2 H), 2,22 - 2,14 (m, 2 H), 2,12 - 2,01 (m, 2 H), 1,94 - 1,87 (m, 4 H), 1,67 (brs, 2 H), 1,57 - 1,45 (brs, 1 H), 1,42 (s, 3 H), 1,36 (s, 3 H); MS (ESI) m/z 525 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 938, соединения Таблицы 30 синтезировали с использованием 3' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 29.
Таблица 29.
Таблица 30.
Пример 53. Соединение 1036: (S)-1-(5-(3-циано-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамид
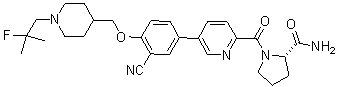
Стадия 1. метил 5-(3-циано-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил) пиколинат: 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил (продукт синтеза стадии 4 соединения 938; 673 мг, 1,82 ммоль), 6-(метоксикарбонил) пиридин-3-илборную кислоту (330 мг, 1,82 ммоль), Pd(dppf)Cl2 (59 мг, 0,09 ммоль) и Cs2CO3 (1,19 г, 3,65 ммоль) добавили к смеси вода (2 мл)/1,4-диоксан (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества коричневого цвета (150 мг, 19%).
Стадия 2. 5-(3-циано-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиновая кислота: Метил 5-(3-циано-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколинат (150 мг, 0,35 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (74 мг, 1,76 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (41 мг, 28%).
Стадия 3. Соединение 1036: 5-(3-циано-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиновую кислоту (30 мг, 0,07 ммоль), (S)-пирролидин-2-карбоксамид (22 мг, 0,19 ммоль), EDC (37 мг, 0,19 ммоль), HOBt (26 мг, 0,19 ммоль) и DIPEA (34 мкл, 0,19 ммоль) растворили в CH2Cl2 (1 мл), после чего перемешивали при такой же температуре в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (21 мг, 42%).
1H NMR (400 MHz, CDCl3) δ 8,77 - 8,72 (m, 1 H), 8,14 - 8,12 (m, 0,4 H), 7,99 - 7,93 (m, 1,6 H), 7,82 - 7,75 (m, 2 H), 7,11 - 7,08 (m, 1 H), 6,39 (brs, 0,5 H), 6,39 (brs, 0,5 H), 5,43 (brs, 1 H), 4,87 - 4,86 (m, 0,5 H), 4,85 - 4,84 (m, 0,5 H), 4,06 - 3,87 (m, 4 H), 3,05 (brs, 2 H), 2,46 - 2,36 (m, 2 H), 2,21 - 2,15 (m, 2 H), 2,13 - 1,97 (m, 5 H), 1,64 (brs, 2 H), 1,58 - 1,39 (m, 6 H), 1,36 - 1,25 (m, 2 H); MS (ESI) m/z 508 (M+ + H).
Пример 54. Соединение 1031: (S)-1-(2' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид

Стадия 1. метил 2' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: к DME (4 мл) / H2O (1 мл) добавили 2-бром-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил (продукт синтеза стадии 4 соединения 1028; 0,30 г, 0,81 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,17 г, 0,97 ммоль), Pd(dppf)Cl2 (0,03 г, 0,04 ммоль) и Cs2CO3 (0,52 г, 1,62 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; EtOAc / гексан = 0% - 40%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,05 г, 14%).
Стадия 2. 2' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 2' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,05 г, 0,11 ммоль) и LiOH·H2O (0,02 г, 0,58 ммоль) растворили в THF / MeOH (8 мл) / H2O (2 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 12 часов. Реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (10 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,01 г, 20%).
Стадия 3. Соединение 1031: 2' -циано-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,03 г, 0,08 ммоль), L-пролинамид (0,01 г, 0,10 ммоль), HOBt (0,02 г, 0,17 ммоль), EDC (0,03 г, 0,17 ммоль) и DIPEA (0,02 мл, 0,17 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой промыли водой, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,02 г, 64%).
1H NMR (400 MHz, CDCl3) δ 7,65 (d, 2 H, J = 8,2 Hz), 7,59 (d, 2 H, J = 8,3 Hz), 7,42 (d, 1 H, J = 8,7 Hz), 7,25 (d, 1 H, J = 2,6 Hz), 7,19 (dd, 1 H, J = 8,7, 2,6 Hz), 7,01 (s, 1 H), 5,59 (s, 1 H), 4,83 (dd, 1 H, J = 7,4, 5,2 Hz), 3,86 (d, 2 H, J = 6,0 Hz), 3,57 - 3,68 (m, 2 H), 2,99 - 3,02 (m, 2 H), 2,43 - 2,50 (m, 3 H), 2,05 - 2,21 (m, 4 H), 1,78 - 1,92 (m, 4 H), 1,43 - 1,49 (m, 2 H), 1,40 (s, 3 H), 1,35 (s, 3 H); MS (ESI) m/z 507,3 (M+ + H).
Пример 55. Соединение 1028: (S)-1-(2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
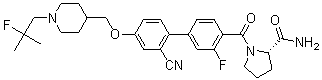
Стадия 1. трет-Бутил 4-(гидроксиметил)пиперидин-1-карбоксилат:
Пиперидин-4-илметанол (10,0 г, 86,8 ммоль), (Boc)2O (21,9 мл, 95,5 ммоль) и TEA (14,4 мл, 104,1 ммоль) растворили в DCM (50 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 1 часа. Реакционную смесь разбавили водой и проэкстрагировали этилацетатом. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат перекристаллизовали из этилацетата (10 мл) и гексана (150 мл) при 25 °C с получением целевого соединения в виде твердого вещества белого цвета (18,0 г, 96%).
Стадия 2. трет-Бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилат (18,0 г, 83,6 ммоль), MsCl (7,16 мл, 91,9 ммоль) и TEA (13,9 мл, 100,3 ммоль) растворили в DCM (50 мл) при 0 °C, после чего перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавили водой и проэкстрагировали этилацетатом. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат перекристаллизовали из этилацетата (10 мл) и гексана (150 мл) при 25 °C с получением целевого соединения в виде твердого вещества белого цвета (16,0 г, 65%).
Стадия 3. трет-Бутил 4-((4-бром-3-цианофенокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат ( 2,00 г, 6,81 ммоль), 2-бром-5-гидроксибензонитрил (1,35 г, 6,87 ммоль) и K2CO3 (1,88 г, 13,63 ммоль) растворили в DMF (50 мл) при 80 °C, после чего перемешивали при такой же температуре в течение 5 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (1,90 г, 70%).
Стадия 4. 2-бром-5-(пиперидин-4-илметокси)бензонитрил гидрохлорид: трет-бутил 4-((4-бром-3-цианофенокси)метил)пиперидин-1-карбоксилат (1,90 г, 4,80 ммоль) и 4 M HCl раствор в 1,4-диоксане (6,00 мл, 24,03 ммоль) растворили в CH2Cl2 (15 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 2 часов. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (1,52 г, 95%).
Стадия 5. 2-бром-5-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил: к EtOH (8 мл) / H2O (2 мл) добавили 2-бром-5-(пиперидин-4-илметокси)бензонитрил гидрохлорид (1,72 г, 5,18 ммоль), 2,2-диметил оксиран (4,61 мл, 51,86 ммоль) и K2CO3 (3,58 г, 25,93 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (1,70 г, 89%, твердое вещество белого цвета).
Стадия 6. 2-бром-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил:
2-бром-5-((1-(2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил (1,70 г, 4,62 ммоль) растворили в CH2Cl2 (20 мл). При 0 °C, DAST (0,72 мл, 5,55 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 2 часов. Реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NaHCO3. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (1,10 г, 64%).
Стадия 7. этил 2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: к DME (4 мл) / H2O (1 мл) добавили 2-бром-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензонитрил (0,30 г, 0,81 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (0,17 г, 0,97 ммоль), Pd(dppf)Cl2 (0,03 г, 0,04 ммоль) и Cs2CO3 (0,52 г, 1,62 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; EtOAc / гексан = 0% - 40%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,16 г, 43%).
Стадия 8. 2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Этил 2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,16 г, 0,35 ммоль) и LiOH·H2O (0,07 г, 1,75 ммоль) растворили в THF / MeOH (8 мл) / H2O (2 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (15 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,15 г, 93%).
Стадия 9. Соединение 1028: 2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,04 г, 0,10 ммоль), L-пролинамид (0,01 г, 0,12 ммоль), HOBt (0,02 г, 0,21 ммоль), EDC (0,04 г, 0,21 ммоль) и DIPEA (0,03 мл, 0,21 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой промыли водой, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,05 г, 92%).
1H NMR (400 MHz, CDCl3) δ 7,52 - 7,56 (m, 1 H), 7,41 (dd, 2 H, J = 8,0, 1,7 Hz), 7,30 - 7,33 (m, 2 H), 7,19 - 7,22 (m, 1 H), 6,91 (s, 1 H), 5,45 (s, 1 H), 4,83 (dd, 1 H, J = 7,6, 3,9 Hz), 3,87 (d, 2 H, J = 6,0 Hz), 3,44 - 3,56 (m, 2 H), 2,99 - 3,02 (m, 2 H), 2,48 - 2,52 (m, 2 H), 2,43 (s, 1 H), 2,06 - 2,21 (m, 4 H), 1,91 - 1,94 (m, 2 H), 1,79 - 1,81 (m, 2H), 1,635 (s, 2 H), 1,41 (s, 3 H), 1,35 (s, 3 H); MS (ESI) m/z 525,3 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1028, соединения Таблицы 32 синтезировали с использованием 2' -циано-3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 31.
Таблица 31.
Таблица 32.
Пример 56. Соединение 691: (S)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид

Стадия 1. трет-Бутил 4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 2 соединения 431; 2,0 г, 6,82 ммоль) растворили в ACN 10 мл. 6-хлорпиридин-3-ол (1,06 г, 8,18 ммоль), Cs2CO3 (3,33 г, 10,23 ммоль) добавили к этой смеси, и кипятили с обратным холодильником в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (1,6 г, 72%).
Стадия 2. 2-хлор-5-(пиперидин-4-илметокси)пиридин гидрохлорид:
трет-бутил 4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-карбоксилат (1,6 г, 4,90 ммоль) растворили в CH2Cl2 8 мл. 4 M HCl 1,47 мл добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь отфильтровали, промыли гексаном, и упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (1,25 г, 97%).
Стадия 3. 1-(4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
2-хлор-5-(пиперидин-4-илметокси)пиридин гидрохлорид (1,25 г, 4,75 ммоль) растворили в EtOH 6 мл. 2,2-диметилоксиран (3,42 г, 47,5 ммоль), K2CO3 (1,31 г, 9,5 ммоль) и воду 3 мл добавили туда же. Смесь перемешивали при микроволновом облучении при 110 ºC в течение 20 минут. По окончании реакции, EtOH упарили из реакционной смеси при пониженном давлении, и затем к ней добавили немного воды. Полученный осадок отфильтровали и высушили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (980 г, 69%).
Стадия 4. 2-хлор-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин: 1-(4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (980 мг, 3,28 ммоль) растворили в CH2Cl2 6 мл. Затем DAST (793 мг, 4,92 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 3 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3, и проэкстрагировали с CH2Cl2. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и отфильтровали для удаления твердого остатка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества желтого цвета (460 мг, 46%).
Стадия 5. метил 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат: 2-хлор-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин (230 мг, 0,77 ммоль), 4-(метоксикарбонил)фенилборную кислоту (165 мг, 0,92 ммоль), Pd(dppf)Cl2 (62 мг, 0,08 ммоль), Na2CO3 (162 мг, 1,53 ммоль) растворили в DME 6 мл и воде 2 мл, и затем кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (220 мг, 71%).
Стадия 6. 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойная кислота:
метил 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат (220 мг, 0,55 ммоль) растворили в THF:MeOH:Вода = 2/1/0,5 мл. LiOH·H2O (46 мг, 1,10 ммоль) добавили к этой смеси. Затем смесь кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении с получением целевого соединения в виде твердого вещества желтого цвета (210 мг, 98%).
Стадия 7. Соединение 691: 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойную кислоту (40 мг, 0,10 ммоль), (S)-пирролидин-2-карбоксамид (24 мг, 0,20 ммоль) и BOP (91 мг, 0,21 ммоль) растворили в DMF 1 мл. После перемешивания в течение 10 минут при комнатной температуре, TEA (31 мг, 0,31 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и отфильтровали для удаления твердого остатка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (19 мг, 38%).
1H NMR (400 MHz, CDCl3) δ 8,39 (d, 1 H, J = 2,9 Hz), 7,97 (d, 2 H, J = 8,2 Hz), 7,68 (d, 1 H, J = 8,7 Hz), 7,52 (d, 2 H, J = 8,2 Hz), 3,90 (d, 2 H, J = 6,0 Hz), 3,14 (m, 3 H), 3,02 (m, 5 H), 2,46 (m, 2 H), 2,04 (m, 2 H), 1,73 (m, 2 H), 1,46 (m, 2 H), 1,36 (m, 8 H); MS (ESI) m/z 469 (M + H).
Согласно вышеописанному процессу синтеза соединения 691, соединения Таблицы 34 синтезировали с использованием 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойной кислоты и реагента из Таблицы 33.
Таблица 33.
Таблица 34.
Пример 57. Соединение 696: (S)-1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид
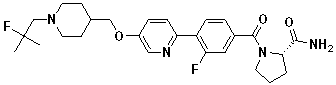
Стадия 1. метил 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат: 2-хлор-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин (продукт синтеза стадии 5 соединения 691; 366 мг, 1,06 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (231 мг, 1,17 ммоль), Pd(dppf)Cl2 (87 мг, 0,11 ммоль), Na2CO3 (225 мг, 2,12 ммоль) растворили в DME 6 мл и воде 2 мл, и затем кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (210 мг, 47%).
Стадия 2. 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойная кислота: Метил 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат (220 мг, 0,53 ммоль) растворили в THF/MeOH/H2O = 2/1/0,5 мл. LiOH·H2O (44 мг, 1,05 ммоль) добавили к этой смеси, и кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении, после чего отрегулировали pH до значения ниже 6 с помощью 1N HCl. Полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (195 мг, 91%).
Стадия 3. Соединение 696: 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойную кислоту (40 мг, 0,10 ммоль), (R)-пирролидин-2-илметанол (23 мг, 0,20 ммоль) и BOP (88 мг, 0,20 ммоль) растворили в DMF 1 мл, после чего перемешивали в течение 10 минут при комнатной температуре. TEA (30 мг, 0,30 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (20 мг, 40%).
1H NMR (400 MHz, CDCl3) δ 8,42 (d, 1 H, J = 2,8 Hz), 8,05 (t, 1 H, J = 7,9 Hz), 7,78 (d, 1 H, J = 8,8 Hz), 7,38 (m, 2 H), 7,27 (m, 2 H), 6,92 (s, 1 H), 5,51 (s, 1 H), 4,79 (m, 1 H), 3,91 (d, 2 H, J = 5,9 Hz), 3,55 (m, 2 H), 3,01 (m, 2 H), 2,46 (m, 3 H), 2,13 (m, 2 H), 2,06 (m, 2 H), 1,92 (m, 4 H), 1,35 (m, 5 H), 1,26 (s, 3 H); MS (ESI) m/z 501 (M + H).
Согласно вышеописанному процессу синтеза соединения 696, соединения Таблицы 36 синтезировали с использованием 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойной кислоты и реагента из Таблицы 35.
Таблица 35.
Таблица 36.
Пример 58. Соединение 770: (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид

Стадия 1. трет-Бутил 4-(гидроксиметил)пиперидин-1-карбоксилат: Пиперидин-4-илметанол (33,0 г, 286,53 ммоль) растворили в DCM (400 мл). TEA (47,9 мл, 343,84 ммоль) и (Boc)2O (68,79 г, 315,18 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 1 часа. По окончании реакции, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с DCM. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Концентрат перекристаллизовали из HX : EA = (4 : 1) с получением целевого соединения в виде твердого вещества желтого цвета (59,0 г, 96%).
Стадия 2. трет-Бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилат (59,0 г, 274,05 ммоль) растворили в DCM (400 мл). TEA (45,84 мл, 328,86 ммоль) добавили к этой смеси. При 0 °C, MsCl (23,4 мл, 301,45 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. По окончании реакции, реакционную смесь разбавили водой и проэкстрагировали с DCM. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат перекристаллизовали из HX : EA = (4 : 1) с получением целевого соединения в виде твердого вещества белого цвета (70,0 г, 87%).
Стадия 3. трет-Бутил 4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат ( 3,00 г, 10,23 ммоль) растворили в ACN (50 мл). Cs2CO3 (4,99 г, 15,34 ммоль) добавили к этой смеси. Затем, 6-хлорпиридин-3-ол (1,32 г, 10,23 ммоль) добавили к этой смеси, после чего перемешивали в течение 5 часов при температуре кипения. По окончании реакции, реакционную смесь разбавили водой и затем проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2; гексан / EtOAc = 5/1) с получением целевого соединения в виде твердого вещества белого цвета (2,8 г, 83%).
Стадия 4. 2-хлор-5-(пиперидин-4-илметокси)пиридин гидрохлорид: трет-бутил 4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-карбоксилат (2,80 г, 8,57 ммоль) растворили в DCM (70 мл), после чего перемешивали в течение 5 минут. Затем, 4 M HCl раствор в 1,4-диоксане (42,84 мл, 171,35 ммоль) медленно добавили по каплям, после чего перемешивали в течение 1 часа при комнатной температуре. По окончании реакции, реакционную смесь отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (1,50 г, 77%).
Стадия 5. 1-(4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
2-хлор-5-(пиперидин-4-илметокси)пиридин гидрохлорид (1,50 г, 5,70 ммоль), 2,2-диметил оксиран (5,07 мл, 57,0 ммоль) и K2CO3 (0,39 г, 2,85 ммоль) растворили в EtOH (5 мл) / H2O (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут. По окончании реакции, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2; гексан / EtOAc = 4/1) с получением целевого соединения в виде твердого вещества белого цвета (1,3 г, 76%).
Стадия 6. 2-хлор-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин:
1-(4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (1,30 г, 4,35 ммоль) растворили в CH2Cl2 (15 мл). При 0 °C, DAST (0,57 мл, 4,35 ммоль) добавили к этой смеси небольшими порциями. Реакционную смесь перемешивали в течение 1 часа при комнатной температуре. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2; гексан / EtOAc = 7/1) с получением целевого соединения в виде твердого вещества белого цвета (1,20 г, 92%).
Стадия 7. этил 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат: 2-хлор-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин (0,60 г, 1,99 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (0,51 г, 2,39 ммоль), Pd(dppf)Cl2 (0,08 г, 0,10 ммоль) и Cs2CO3 (1,29 г, 3,98 ммоль) добавили к 1,4-диоксану (6 мл) / H2O (2 мл). Реакцию проводили при микроволновом облучении при 110 ºC в течение 15 минут. По окончании реакции, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2; гексан / EtOAc = 7/1) с получением целевого соединения в виде твердого вещества белого цвета (0,66 г, 76%).
Стадия 8. 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойная кислота: Этил 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат (0,66 г, 0,35 ммоль) растворили в THF (10 мл) / MeOH (10 мл) / H2O (5 мл). LiOH·H2O (0,32 г, 7,64 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь подкислили путем добавления 1N HCl. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (0,60 г, 97%).
Стадия 9. Соединение 770: 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойную кислоту (0,08 г, 0,19 ммоль), L-пролинамид (0,03 г, 0,24 ммоль), BOP (0,17 г, 0,39 ммоль) и TEA (0,06 мл, 0,39 ммоль) растворили в DMF (1 мл). При 60 °C, реакцию проводили в течение дня. По окончании реакции, к реакционной смеси добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2; MC / MeOH = 10/1) с получением целевого соединения в виде твердого вещества желтого цвета (0,03 г, 35%).
1H NMR (400 MHz, CDCl3) δ 8,39 (m, 1 H), 7,78 - 7,75 (m, 2 H), 7,68 - 7,66 (m, 1 H), 7,50 (t, 1 H, J = 7,5 Hz), 7,29 - 7,26 (m, 1 H), 6,93 (brs, 1 H), 5,50 (brs, 1 H), 4,84 - 4,81 (m, 1 H), 3,90 (d, 2 H, J = 5,8 Hz), 3,55 - 3,40 (m, 2 H), 3,03 (brs, 2 H), 2,51 - 2,45 (m, 3 H), 2,21 - 2,19 (m, 2 H), 2,16 - 2,01 (m, 2 H), 1,93 - 1,90 (m, 1 H), 1,89 - 1,81 (m, 3 H), 1,57 - 1,48 (m, 2 H), 1,41 (s, 3 H), 1,36 (s, 3 H); MS (ESI) m/z 501 (M+ + H).
Пример 59. Соединение 694: (R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
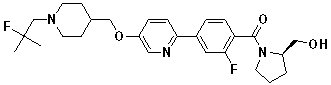
Стадия 1. этил 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат: 2-хлор-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин (продукт синтеза стадии 5 соединения 691; 230 мг, 0,77 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (195 мг, 0,92 ммоль), Pd(dppf)Cl2 (62 мг, 0,08 ммоль) и Na2CO3 (162 мг, 1,35 ммоль) растворили в DME 6 мл и воде 2 мл, и затем кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (210 мг, 68%).
Стадия 2. 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойная кислота: Этил 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат (210 мг, 0,49 ммоль) растворили в THF/MeOH/H2O = 2/1/0,5 мл. LiOH·H2O (41 мг, 0,97 ммоль) добавили к этой смеси, и кипятили с обратным холодильником и перемешиванием в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении с получением целевого соединения в виде твердого вещества желтого цвета (195 мг, 99%).
Стадия 3. Соединение 694: 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойную кислоту (40 мг, 0,10 ммоль), (R)-пирролидин-2-илметанол (20 мг, 0,20 ммоль), и BOP (88 мг, 0,20 ммоль) растворили в DMF 1 мл. После перемешивания в течение 10 минут при комнатной температуре, TEA (30 мг, 0,30 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (22 мг, 45%).
1H NMR (400 MHz, CDCl3) δ 8,38 (d, 1 H, J = 2,7 Hz), 7,75 (m, 2 H), 7,65 (m, 1 H), 7,49 (m, 1 H), 7,26 (m, 1 H), 4,78 (s, 1 H), 4,40 (m, 2 H), 3,90 (d, 2 H, J = 6,0 Hz), 3,77 (m, 2 H), 3,43 (m, 2 H), 3,15 (m, 2 H), 3,00 (m, 2 H), 2,49 (s, 1 H), 2,43 (s, 1 H), 2,19 (m, 2 H), 1,81 (m, 3 H), 1,68 (m, 1 H), 1,47 (m, 5 H), 1,34 (s, 3 H)
Согласно вышеописанному процессу синтеза соединения 694, соединения Таблицы 38 синтезировали с использованием 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойной кислоты и реагента из Таблицы 37.
Таблица 37.
Таблица 38.
Пример 60. Соединение 1067: (2S,4R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил) пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)-4-гидроксипирролидин-2-карбоксамид
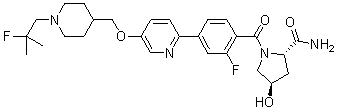
Стадия 1. (2S,4R)-метил 1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)-4-гидроксипирролидин-2-карбоксилат:
2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойную кислоту (продукт синтеза стадии 2 соединения 694; 200 мг, 0,49 ммоль), (2S,4R)-метил 4-гидроксипирролидин-2-карбоксилат гидрохлорид (135 мг, 0,74 ммоль), EDC (190 мг, 0,99 ммоль), HOBt (134 мг, 0,99 ммоль) и DIPEA (0,18 мл, 0,99 ммоль) растворили в DMF (10 мл) при комнатной температуре. Раствор перемешивали при 80 °C в течение 14 часов. Реакционную смесь разбавили водой (20 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества красного цвета (230 мг, 88%).
Стадия 2. (2S,4R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) пиридин-2-ил)бензоил)-4-гидроксипирролидин-2-карбоновая кислота: (2S,4R)-метил 1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)-4-гидроксипирролидин-2-карбоксилат(230 мг, 0,43 ммоль) и LiOH·H2O (36 мг, 0,86 ммоль) растворили в THF (20 мл) / H2O (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 14 часов. Реакционную смесь упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки.
Стадия 3. Соединение 1067: (2S,4R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)-4-гидроксипирролидин-2-карбоновую кислоту (290 мг, 0,56 ммоль), аммоний хлорид (45 мг, 0,84 ммоль), EDC (161 мг, 0,84 ммоль), HOBt (114 мг, 0,84 ммоль) и DIPEA (0,20 мл, 1,12 ммоль) растворили в DMF (10 мл) при комнатной температуре. Раствор перемешивали при 80 °C в течение 16 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества желтого цвета (10 мг, 3%).
1H NMR (400 MHz, CDCl3 + MeOD) δ 8,33 (m, 1 H), 7,72 - 7,64 (m, 3 H), 7,54 (m, 1 H), 7,26 (m, 1 H), 7,01 (br, 1 H), 5,99 (br, 1 H), 4,84 (m, 1 H), 4,42 (m, 1 H), 3,89 (m, 2 H), 3,68 (m, 1 H), 3,38 (m, 1 H), 2,99 (m, 2 H), 2,51 - 2,01 (m, 7 H), 1,80 (m, 2 H), 1,63 - 1,25 (m, 9 H); MS (ESI) m/z 517 (M+ + H).
Пример 61. Синтез соединения 652: (R)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
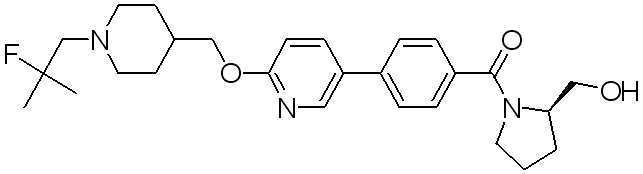
Стадия 1. 5-бром-2-(пиперидин-4-илметокси)пиридин гидрохлорид: трет-бутил 4-((5-бромпиридин-2-илокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 1 соединения 596; 710 мг, 1,91 ммоль) растворили в CH2Cl2 5 мл. 4 M HCl 526 мкл добавили к этой смеси. Затем, реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Полученную реакционную смесь отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (580 мг, 98%).
Стадия 2. 1-(4-((5-бромпиридин-2-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
5-бром-2-(пиперидин-4-илметокси)пиридин гидрохлорид (500 мг, 1,63 ммоль) и K2CO3 (450 мг, 3,25 ммоль) суспендировали в EtOH 2 мл. К этой смеси добавили 2 мл воды, и смесь суспендировали при небольшом нагревании. 2,2-диметил оксиран (1,17 г, 16,25 ммоль) добавили к этой смеси. Реакцию проводили при микроволновом облучении при 110 ºC в течение 20 минут. Реакционную смесь разбавили водой и полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (490 мг, 88%).
Стадия 3. 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин:
1-(4-((5-бромпиридин-2-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (490 мг, 1,43 ммоль) растворили в CH2Cl2 4 мл. Deoxo-Fluor (347 мг, 1,57 ммоль) добавили к этой смеси. После перемешивания в течение 3 часов при комнатной температуре, к этой смеси добавили насыщенный водный раствор NaHCO3, и смесь проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде жидкости желтого цвета (470 мг, 95%).
Стадия 4. метил 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат: 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин (270 мг, 0,78 ммоль) и 4-(метоксикарбонил)фенилборную кислоту (169 мг, 0,94 ммоль) растворили в диоксане 2 мл. К этой смеси добавили 0,5 мл воды. Pd(dbpf)Cl2 (26 мг, 0,04 ммоль) и Cs2CO3 (510 мг, 1,56 ммоль) добавили туда же. Реакцию проводили при микроволновом облучении при 120 ºC в течение 20 минут. Реакционную смесь отфильтровали через цеолиты. К этой смеси добавили насыщенный водный раствор NaHCO3, и смесь проэкстрагировали с CH2Cl2. Полученный органический слой высушили над MgSO4, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (210 мг, 67%).
Стадия 5. 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота:
метил 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (210 мг, 0,52 ммоль) растворили в THF 2 мл. MeOH 1 мл и H2O 0,5 мл добавили туда же. LiOH (44 мг, 1,05 ммоль) добавили к этой смеси, и кипятили с обратным холодильником и перемешиванием в течение дня. После подкисления с помощью 1 N HCl, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (110 мг, 54%).
Стадия 6. Соединение 652: 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (35 мг, 0,09 ммоль), (R)-пирролидин-2-илметанол (14 мг, 0,14 ммоль) и PyBOP (71 мг, 0,14 ммоль) растворили в DMF 1 мл. DIPEA (23 мг, 0,18 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 10 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (23 мг, 54%).
1H NMR (400 MHz, CDCl3) δ 8,36 (d, 1 H, J = 2,0 Hz), 7,78 (dd, 1 H, J = 8,6, 2,3 Hz), 7,56 (m, 4 H), 6,80 (d, 1 H, J = 8,6 Hz), 4,94 (s, 1 H), 4,41 (m, 2 H), 4,17 (d, 2 H, J = 6,1 Hz), 3,74 (m, 2 H), 3,55 (m, 2 H), 2,97 (d, 2 H, J = 11,2 Hz), 2,46 (s, 1 H), 2,40 (s, 1 H), 2,15 (m, 3 H), 1,76 (m, 5 H), 1,40 (m, 5 H), 1,23 (s, 3 H); MS (ESI) m/z 470 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 652, соединения Таблицы 40 синтезировали с использованием 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 39.
Таблица 39.
Таблица 40.
Пример 62. Соединение 862: (R)-1-(3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамид
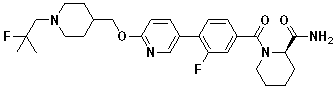
Стадия 1. метил 3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат: 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин (продукт синтеза стадии 4 соединения 784; 0,5 г, 1,45 ммоль) растворили в 1,4-диоксане 12 мл и H2O 3 мл. 2-Фтор-4-(метоксикарбонил)фенилборную кислоту (0,29 г, 1,45 ммоль), Pd(dbpf)Cl2 (0,05 г, 0,07 ммоль) и Cs2CO3 (0,94 г, 2,90 ммоль) добавили туда же. Реакционную смесь нагревали при микроволновом облучении при 120 ºC в течение 45 минут. По окончании реакции, реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Добавили MeOH и полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,48 г, 79%).
Стадия 2. 3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота: Метил 3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (0,47 г, 1,12 ммоль) растворили в THF 3 мл, H2O 1 мл и MeOH 1 мл. LiOH·H2O (0,24 г, 5,62 ммоль) добавили к этой смеси, с последующим медленным повышением температуры, и перемешивали при 50 ºC в течение дня. По окончании реакции, растворитель упарили при пониженном давлении. К этой смеси добавили избыточное количество воды, и полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (0,45 г, 99%).
Стадия 3. Соединение 862: 3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (0,05 г, 0,12 ммоль) и (R)-пиперидин-2-карбоксамид (0,032 г, 0,25 ммоль) растворили в DMF 2 мл. DIPEA (0,10 мл, 0,62 ммоль), EDCI (0,05 г, 0,25 ммоль) и HOBt (0,03 г, 0,25 ммоль) медленно добавили туда же, после чего перемешивали при 60 ºC в течение 3 часов. По окончании реакции, к реакционной смеси добавили избыточное количество воды. Полученный осадок отфильтровали, и растворили в CH2Cl2 снова. Концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, 0 - 20% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,016 г, 25%).
1H NMR (400 MHz, CDCl3) δ 8,33 (s, 1 H), 7,79 - 7,77 (m, 1 H), 7,49 - 7,45 (m, 1 H), 7,32 - 7,27 (m, 2 H), 6,84 (d, 1 H, J = 8,6 Hz), 6,40 (brs, 1 H), 5,26 (brs, 1 H), 4,20 (d, 2 H, J = 6,4 Hz), 3,78 (d, 1 H, J = 12,8 Hz), 3,19 - 3,17 (m, 1 H), 2,99 (d, 2 H, J = 9,6 Hz), 2,48 (s, 1 H), 2,42 (s, 1 H), 2,34 (d, 1 H, J = 13,2 Hz), 2,17 (t, 2 H, J = 11,2 Hz), 2,05 - 1,54 (m, 8 H), 1,48 - 1,24 (m, 8 H)
Согласно вышеописанному процессу синтеза соединения 862, соединения Таблицы 42 синтезировали с использованием 3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 41.
Таблица 41.
Таблица 42.
Пример 63. Соединение 784: (R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил) пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
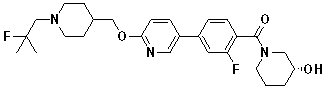
Стадия 1. трет-Бутил 4-((5-бромпиридин-2-илокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилат (продукт синтеза стадии 1 соединения 431; 7,0 г, 32,51 ммоль) растворили в DMF. 2,5-бромпиридин (8,47 г, 35,77 ммоль) и NaH (1,23 г, 48,77 ммоль) медленно добавили туда же, после чего перемешивали при комнатной температуре в течение 3 часов. По окончании реакции, реакционную смесь три раза промыли насыщенным водным соляным раствором. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г ISCO силикагелевый картридж, 0 - 20% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (11,8 г, 98%).
Стадия 2. 5-бром-2-(пиперидин-4-илметокси)пиридин гидрохлорид: трет-бутил 4-((5-бромпиридин-2-илокси)метил)пиперидин-1-карбоксилат (22,0 г, 59,26 ммоль) растворили в 1,4-диоксане 300 мл. 4 M HCl в 1,4-диоксане (74,0 мл, 296,28 ммоль) добавили к этой смеси. После полной отгонки растворителя, остаток промыли эфиром с получением целевого соединения в виде твердого вещества белого цвета (17,0 г, 93%).
Стадия 3. 1-(4-((5-бромпиридин-2-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
5-бром-2-(пиперидин-4-илметокси)пиридин гидрохлорид (4,5 г, 14,63 ммоль) растворили в EtOH 50 мл и H2O 50 мл. 1,2-эпокси-2-метилпропан (10,55 г, 146,29 ммоль) и K2CO3 (10,11 г, 73,15 ммоль) медленно добавили к реакционной смеси. Смесь перемешивали в микроволновой печи при 110 ºC в течение 20 минут. По окончании реакции, реакционную смесь упарили при пониженном давлении, после чего промыли с использованием H2O три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (5,00 г, 99%).
Стадия 4. 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин:
1-(4-((5-бромпиридин-2-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (10,20 г, 29,71 ммоль) растворили в CH2Cl2 200 мл. DAST (4,32 мл, 32,69 ммоль) медленно добавили по каплям при 0 ºC, после чего перемешивали при 0 ºC в течение 2 часов. По окончании реакции, реакционную смесь промыли насыщенным водным раствором NaHCO3 несколько раз. Слой CH2Cl2 упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г ISCO силикагелевый картридж, 0 - 10% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (5,80 г, 57%).
Стадия 5. этил 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат: 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин (0,5 г, 1,45 ммоль) растворили в 1,4-диоксане 12 мл и H2O 3 мл. 4-(Этоксикарбонил)-3-фторфенилборную кислоту (0,31 г, 1,45 ммоль), Pd(dbpf)Cl2 (0,05 г, 0,07 ммоль) и Cs2CO3 (0,94 г, 2,90 ммоль) добавили туда же. Смесь перемешивали в микроволновой печи при 110 ºC в течение 45 минут. По окончании реакции, реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Добавили MeOH к этой смеси. Полученный осадок отфильтровали с получением целевого соединения в виде прозрачного масла (0,17 г, 27%).
Стадия 6. 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота: Этил 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (0,17 г, 0,39 ммоль) растворили в THF (3 мл) / H2O (1 мл) / MeOH 1 мл). LiOH·H2O (0,08 г, 1,97 ммоль) добавили к этой смеси, с последующим медленным повышением температуры, и затем кипятили с обратным холодильником при перемешивании при 80 ºC в течение 30 минут. По окончании реакции, растворитель упарили при пониженном давлении. К этой смеси добавили избыточное количество воды, и полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества желтого цвета (0,12 г, 76%).
Стадия 7. Соединение 784: 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (0,04 г, 0,10 ммоль) и (R)-пиперидин-3-ол(0,02 г, 0,19 ммоль) растворили в DMF 2 мл. DIPEA (0,06 г, 0,47 ммоль), EDCI (0,04 г, 0,19 ммоль) и HOBt (0,03 г, 0,19 ммоль) медленно добавили туда же, после чего перемешивали при 60 ºC в течение 3 часов. По окончании реакции, к реакционной смеси добавили избыточное количество воды. Полученный осадок отфильтровали, и растворили в CH2Cl2 снова. Концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, 0 - 20% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества коричневого цвета (0,02 г, 47%).
1H NMR (400 MHz, CDCl3) δ 8,36 (s, 1 H), 7,78 (d, 1 H, J = 2,0 Hz), 7,49 - 7,24 (m, 4 H), 6,83 (d, 1 H, J = 8,6 Hz), 4,20 (d, 2 H, J = 6,0 Hz), 4,10 - 3,11 (m, 5 H), 3,01 (brs, 2 H), 2,49 - 2,44 (m, 2 H), 2,18 - 1,61 (m, 9 H), 1,41 - 1,26 (m, 8 H); MS (ESI) m/z 488 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 784, соединения Таблицы 44 синтезировали с использованием 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 43.
Таблица 43.
Таблица 44.
Пример 64. Соединение 946 :
(S)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-3' -(гидроксиметил)бифенилкарбонил)пирролидин-2-карбоксамид
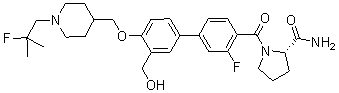
Стадия 1. трет-Бутил 4-((4-бром-2-формилфенокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 2 соединения 431; 1,00 г, 3,41 ммоль) растворили в DMF (80 мл). K2CO3 (1,67 г, 5,11 ммоль) добавили к этой смеси, и перемешивали в течение 5 минут. 5-бром-2-гидроксибензальдегид (685 мг, 3,41 ммоль)добавили к этой смеси, после чего перемешивали при 80 ºC в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (840 мг, 61%).
Стадия 2. 5-бром-2-(пиперидин-4-илметокси)бензальдегид гидрохлорид:
трет-бутил 4-((4-бром-2-формилфенокси)метил)пиперидин-1-карбоксилат (840 мг, 2,11 ммоль) растворили в CH2Cl2 (20 мл). 4 M HCl в 1,4-диоксане (1,06 мл, 4,22 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (500 мг, 70%).
Стадия 3. 5-бром-2-((1-2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)бензальдегид:
5-бром-2-(пиперидин-4-илметокси)бензальдегид гидрохлорид(500 мг, 1,68 ммоль) растворили в EtOH (5 мл) и H2O (5 мл). 2,2-Диметилоксиран (1,49 мл, 16,77 ммоль) и K2CO3 (116 мг, 0,84 ммоль) медленно добавили туда же. Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученный материал, представляющий собой целевое соединение в виде твердого вещества белого цвета (620 мг, 99%), использовали без дополнительной очистки.
Стадия 4. 5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензальдегид:
5-бром-2-((1-2-гидрокси-2-метилпропил)пиперидин-4-ил)метокси)бензальдегид (620 мг, 1,67 ммоль) растворили в CH2Cl2 (10 мл). При 0 ºC, DAST (221 мкл, 1,67 ммоль) медленно добавили к реакционной смеси. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 40% ~ 60%) с получением целевого соединения в виде твердого вещества белого цвета (310 мг, 49%).
Стадия 5. (5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)метанол:
5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бензальдегид (310 мг, 0,83 ммоль) растворили в THF (10 мл). При комнатной температуре, NaBH4 (95 мг, 2,50 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 1 часа. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 50%) с получением целевого соединения в виде твердого вещества белого цвета (200 мг, 64%).
Стадия 6. этил 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-3' -(гидроксиметил)бифенил-4-карбоксилат: (5-бром-2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)метанол (200 мг, 0,534 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (125 мг, 0,59 ммоль), Pd(dppf)Cl2 (44 мг, 0,05 ммоль) и Cs2CO3 (348 мг, 1,07 ммоль) добавили к смеси вода (2 мл)/DME (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 40% ~ 60%) с получением целевого соединения в виде твердого вещества белого цвета (146 мг, 59%).
Стадия 7. 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-3' -(гидроксиметил)бифенил-4-карбоновая кислота: Этил 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-3' -(гидроксиметил)бифенил-4-карбоксилат (146 мг, 0,32 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (66 мг, 1,58 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. Реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (120 мг, 87%).
Стадия 8. Соединение 946: 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-3' -(гидроксиметил)бифенил-4-карбоновую кислоту (30 мг, 0,07 ммоль), (S)-пирролидин-2-карбоксамид (16 мг, 0,14 ммоль), EDC (27 мг, 0,14 ммоль), HOBt (19 мг, 0,14 ммоль) и DIPEA (25 мкл, 0,14 ммоль) растворили в CH2Cl2 (1 мл), после чего перемешивали при такой же температуре в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (21 мг, 42%).
1H NMR (400 MHz, CDCl3) δ 7,56 - 7,55 (m, 1 H), 7,49 - 7,41 (m, 3 H), 7,33 - 7,27 (m, 1 H), 6,96 - 6,94 (m, 1 H), 5,50 (brs, 1 H), 5,31 - 4,81 (m, 3 H), 3,93 (d, 2 H, J = 5,4 Hz), 3,57 - 3,40 (m, 2 H), 3,03 (brs, 1 H), 2,51 - 2,43 (m, 3 H), 2,23 - 2,21 (m, 2 H), 2,16 - 2,03 (m, 3 H), 1,94 - 1,80 (m, 4 H), 1,69 (brs, 2 H), 1,43 (s, 3 H), 1,38 (s, 3 H), 1,32 - 1,28 (m, 2 H); MS (ESI) m/z 530 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 946, соединения Таблицы 46 синтезировали с использованием 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-3' -(гидроксиметил)бифенил-4-карбоновой кислоты и реагента из Таблицы 45.
Таблица 45.
Таблица 46.
Пример 65. Соединение 948: (R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
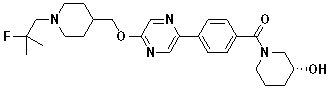
Стадия 1. метил 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат: к 2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5-йодопиразину (продукт синтеза стадии 4 соединения 944; 0,35 г, 0,89 ммоль) добавили 4-(метоксикарбонил) фенилборную кислоту (0,19 г, 1,06 ммоль), Pd(dbpf)Cl2 (0,03 г, 0,04 ммоль) и Cs2CO3 (0,58 г, 1,78 ммоль), и DME (9 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,21 г, 59%).
Стадия 2. 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойная кислота:
Метил 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат (0,21 г, 0,52 ммоль) и LiOH·H2O (0,11 г, 2,62 ммоль) растворили в THF (2 мл) / H2O /MeOH (3 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (0,16 г, 78%).
Стадия 3. Соединение 948: 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойную кислоту (0,04 г, 0,10 ммоль), EDCI (0,04 г, 0,20 ммоль), HOBt (0,02 г, 0,20 ммоль) и DIPEA (0,09 мл, 0,51 ммоль) растворили в DMF (2 мл). При комнатной температуре, (R)-пиперидин-3-ол (0,02 г, 0,20 ммоль) добавили к этой смеси, после чего перемешивали при 60 °C в течение 12 часов. Концентрат разбавили водой (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили, и очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества желтого цвета (0,02 г, 49%).
1H NMR (400 MHz, CDCl3) δ 8,48 (s, 1 H), 8,26 (s, 1 H), 7,93 (d, 2 H, J = 8,4 Hz), 7,51 (d, 2 H, J = 8,0 Hz), 4,20 (d, 2 H, J = 6,1 Hz), 3,98 - 3,25 (m, 5 H), 2,97 (d, 2 H, J = 11,2 Hz), 2,45 (s, 1 H), 2,39 (s, 1 H), 2,18 - 1,67 (m, 9 H), 1,44 - 1,32 (m, 8 H); MS (ESI) m/z 471 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 948, соединения Таблицы 48 синтезировали с использованием 4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойной кислоты и реагента из Таблицы 47.
Таблица 47.
Таблица 48.
Пример 66. Соединение 982: (R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
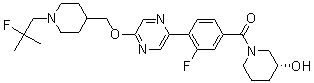
Стадия 1. метил 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат: к 2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5-йодопиразину (продукт синтеза стадии 4 соединения 944; 0,50 г, 1,27 ммоль), 2-фтор-4-(метоксикарбонил)фенилборной кислоте (0,29 г, 1,39 ммоль), Pd(dppf)Cl2 (0,05 г, 0,06 ммоль) и Cs2CO3 (0,82 г, 2,54 ммоль), добавили DME (9 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,24 г, 45%).
Стадия 2. 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойная кислота: Метил 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат (0,24 г, 0,57 ммоль) и LiOH·H2O (0,12 г, 2,86 ммоль) растворили в THF / MeOH (16 мл) / H2O (4 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 2 часов, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,20 г, 86%).
Стадия 3. Соединение 982: 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси) пиразин-2-ил)бензойную кислоту (0,04 г, 0,09 ммоль), (R)-пиперидин-3-ол (0,01 г, 0,11 ммоль), HOBt (0,02 г, 0,19 ммоль), EDC (0,03 г, 0,19 ммоль) и DIPEA (0,03 мл, 0,19 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; дихлорметан / метанол = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,02 г, 41%).
1H NMR (400 MHz, CDCl3) δ 8,61 (s, 1 H), 8,32 (s, 1 H), 8,00 (t, 1 H, J = 7,8 Hz), 7,26 - 7,32 (m, 2 H), 4,23 (d, 2 H, J = 6,2 Hz), 3,27 - 3,95 (m, 5 H), 2,98 - 3,01 (m, 2 H), 2,42 - 2,48 (m, 2 H), 2,14 - 2,22 (m, 3 H), 1,77 - 2,05 (m, 4 H), 1,43 - 1,67 (m, 5 H), 1,40 (s, 3 H), 1,34 (s, 3 H); MS (ESI) m/z 489,2 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 982, соединения Таблицы 50 синтезировали с использованием 3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойной кислоты и реагента из Таблицы 49.
Таблица 49.
Таблица 50.
Пример 67. Соединение 944 : (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид

Стадия 1. трет-Бутил 4-((5-йодопиразин-2-илокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилат (продукт синтеза стадии 1 соединения 431; 2,70 г, 12,54 ммоль), 2-бром-5-йодопиразин (3,57 г, 12,54 ммоль) и NaH (0,36 г, 15,05 ммоль) растворили в 70 °C в течение THF (30 мл), после чего перемешивали при такой же температуре в течение 6 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (4,04 г, 76%).
Стадия 2. 2-йодо-5-(пиперидин-4-илметокси)пиразин гидрохлорид: трет-бутил 4-((5-йодопиразин-2-илокси)метил)пиперидин-1-карбоксилат (4,00 г, 9,54 ммоль) растворили в CH2Cl2 (30 мл). При комнатной температуре, 4 M HCl раствор в 1,4-диоксане (11,92 мл, 47,70 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 2 часов. Реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (3,20 г, 94%).
Стадия 3. 1-(4-((5-йодопиразин-2-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
к 2-йодо-5-(пиперидин-4-илметокси)пиразин гидрохлориду (1,20 г, 3,37 ммоль), 2,2-диметил оксирану (3,00 мл, 33,74 ммоль) и K2CO3 (2,33 г, 16,87 ммоль), добавили EtOH (8 мл) / H2O (2 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (1,30 г, 98%).
Стадия 4. 2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5-йодопиразин: 1-(4-((5-йодопиразин-2-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (1,30 г, 3,32 ммоль) и DAST (0,53 мл, 3,98 ммоль) растворили в CH2Cl2 (20 мл) при 0 °C, после чего перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,81 г, 62%).
Стадия 5. этил 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат: к 2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5-йодопиразину (250 мг, 0,64 ммоль), 4-(этоксикарбонил)-3-фторфенилборной кислоте (162 мг, 0,76 ммоль), Pd(dppf)Cl2 (26 мг, 0,03 ммоль) и Cs2CO3 (414 мг, 1,27 ммоль), добавили DME (9 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 0% ~ 15%) с получением целевого соединения в виде твердого вещества белого цвета (162 мг, 58%).
Стадия 6. 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойная кислота: Этил 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат (158 мг, 0,36 ммоль) растворили в THF (10 мл) и H2O (5 мл). При комнатной температуре, LiOH·H2O (77 мг, 1,82 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. Реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (120 мг, 81%).
Стадия 7. Соединение 944: 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойную кислоту (30 мг, 0,07 ммоль), EDC (28 мг, 0,15 ммоль), HOBt (20 мг, 0,15 ммоль) и DIPEA (26 мкл, 0,15 ммоль) растворили в CH2Cl2 (1 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (17 мг, 0,15 ммоль) добавили к этой смеси, после чего перемешивали в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (20 мг, 53%).
1H NMR (400 MHz, CDCl3) δ 8,50 (s, 1 H), 8,29 (s, 1 H), 7,78 - 7,51 (m, 2 H), 7,53 (t, 1 H, J = 7,5 Hz), 6,91 (s, 1 H), 5,54 (s, 1 H), 4,84 - 4,81 (m, 1 H), 4,33 (d, 2 H, J = 5,6 Hz), 3,85 - 3,81 (m, 2 H), 3,56 - 3,38 (m, 2 H), 3,26 - 3,21 (m, 2 H), 2,92 - 2,85 (m, 2 H), 2,51 - 2,46 (m, 1 H), 2,27 - 2,26 (m, 2 H), 2,18 - 2,06 (m, 6 H), 1,66 (s, 3 H), 1,60 (s, 3 H); MS (ESI) m/z 502 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 944, соединения Таблицы 52 синтезировали с использованием 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойной кислоты и реагента из Таблицы 51.
Таблица 51.
Таблица 52.
Пример 68. Соединение 989: (S)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамид
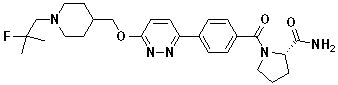
Стадия 1. трет-Бутил 4-((6-хлорпиридазин-3-илокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилат (продукт синтеза стадии 1 соединения 431; 3,00 г, 13,94 ммоль) и NaH (0,50 г, 20,90 ммоль) растворили в DMF (100 мл). При 0 °C, 3,6-дихлорпиридазин (2,49 г, 16,72 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 40 г картридж; EtOAc / гексан = 0% - 50%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (2,60 г, 56%).
Стадия 2. 3-хлор-6-(пиперидин-4-илметокси)пиридазин гидрохлорид: трет-бутил 4-((6-хлорпиридазин-3-илокси)метил)пиперидин-1-карбоксилат (2,60 г, 7,93 ммоль) и 4,0 M раствор в 1,4-диоксане (9,91 мл, 39,66 ммоль) растворили в MeOH (30 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 3 часов, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (1,80 г, 85%).
Стадия 3. 1-(4-((6-хлорпиридазин-3-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
к 3-хлор-6-(пиперидин-4-илметокси)пиридазин гидрохлориду (0,60 г, 2,27 ммоль) добавили 2,2-диметилоксиран (1,64 г, 22,71 ммоль), K2CO3 (0,63 г, 4,54 ммоль) и EtOH (4 мл) / H2O (4 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры, после чего упарили при пониженном давлении. Концентрат разбавили водой (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (0,44 г, 64%).
Стадия 4. 3-хлор-6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин:
1-(4-((6-хлорпиридазин-3-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (0,55 г, 1,84 ммоль) растворили в CH2Cl2 (8 мл). При 0 °C, DAST (0,26 мл, 2,02 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (0,40 г, 72%, желтое масло).
Стадия 5. метил 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоат: к 3-хлор-6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазину (0,20 г, 0,66 ммоль) добавили 4-(метоксикарбонил)фенилборную кислоту (0,13 г, 0,73 ммоль), Pd(dppf)Cl2 (0,05 г, 0,07 ммоль), Na2CO3 (0,14 г, 1,33 ммоль) и DME (12 мл) / вода (3 мл). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 20% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,17 г, 63%).
Стадия 6. 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензойная кислота: Метил 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоат (0,17 г, 0,42 ммоль) и LiOH·H2O (0,04 г, 0,85 ммоль) добавили в THF/MeOH (6/3 мл) / вода (2 мл). Смесь кипятили с обратным холодильником в течение 8 часов, и затем охладили до комнатной температуры, после чего упарили при пониженном давлении. Концентрат разбавили водой (2 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества желтого цвета (0,12 г, 73%).
Стадия 7. Соединение 989: 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензойную кислоту (0,03 г, 0,08 ммоль), EDC (0,03 г, 0,16 ммоль), HOBt (0,02 г, 0,16 ммоль) и DIPEA (0,04 мл, 0,23 ммоль) растворили в DMF (1 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (0,01 г, 0,12 ммоль) добавили к этой смеси, после чего перемешивали при 50 °C в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 5%), и упарили с получением целевого соединения в виде бесцветного масла (2 мг, 5%).
1H NMR (400 MHz, CDCl3) δ 8,07 (d, 2 H, J = 8,3 Hz), 7,82 (d, 1 H, J = 9,2 Hz), 7,67 (d, 2 H, J = 8,3 Hz), 7,09 (d, 2 H, J = 8,3 Hz), 6,97 (s, 1 H), 5,52 (s, 1 H), 4,82 (m, 1 H), 4,48 (d, 2 H, J = 6,3 Hz), 3,60 (m, 3 H), 3,07 (m, 1 H), 2,44 (m, 4 H), 1,62 (m, 4 H), 1,45 (m, 9 H).
Согласно вышеописанному процессу синтеза соединения 989, соединения Таблицы 54 синтезировали с использованием 4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензойной кислоты и реагента из Таблицы 53.
Таблица 53.
Таблица 54.
Пример 69. Соединение 991: (S)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамид
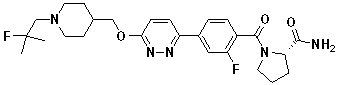
Стадия 1. этил 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоат: 3-хлор-6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин (продукт синтеза стадии 4 соединения 989; 0,20 г, 0,66 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (0,16 г, 0,73 ммоль), Pd(dppf)Cl2 (0,05 г, 0,06 ммоль) и Na2CO3 (0,14 г, 1,33 ммоль) растворили в DME (12 мл) / вода (3 мл) при 120 °C, после чего перемешивали при такой же температуре в течение 20 минут. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 20% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,17 г, 59%).
Стадия 2. 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензойная кислота: Этил 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоат (0,17 г, 0,39 ммоль) и LiOH·H2O (0,03 г, 0,78 ммоль) добавили к THF/MeOH (6/3 мл) / вода (2 мл). Смесь кипятили с обратным холодильником в течение 8 часов, и затем охладили до комнатной температуры, после чего упарили при пониженном давлении. Концентрат разбавили водой (2 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества желтого цвета (0,13 г, 81%).
Стадия 3. Соединение 991: 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензойную кислоту (0,03 г, 0,07 ммоль), EDC (0,03 г, 0,15 ммоль), HOBt (0,02 г, 0,15 ммоль) и DIPEA (0,03 г, 0,22 ммоль) растворили в DMF (1 мл). При комнатной температуре, к этой смеси добавили (S)-пирролидин-2-карбоксамид (0,01 г, 0,11 ммоль), после чего перемешивали при 50 °C в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 5%), и упарили с получением целевого соединения в виде бесцветного масла (2 мг, 5%).
Согласно вышеописанному процессу синтеза соединения 991, соединения Таблицы 56 синтезировали с использованием 2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензойной кислоты и реагента из Таблицы 55.
Таблица 55.
Таблица 56.
Пример 70. Соединение 1032 : (S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пирролидин-2-карбоксамид
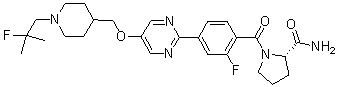
Стадия 1. трет-Бутил 4-((2-хлорпиримидин-5-илокси)метил)пиперидин-1-карбоксилат: трет-бутил 4-((метилсульфонилокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 2 соединения 431; 2,00 г, 6,82 ммоль) растворили в DMF (80 мл). K2CO3 (3,33 г, 10,23 ммоль) добавили к этой смеси, и перемешивали в течение 5 минут. 2-Хлорпиримидин-5-ол (890 мг, 6,82 ммоль) добавили к этой смеси, после чего перемешивали при 80 ºC в течение 5 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (2,10 г, 94%).
Стадия 2. 2-хлор-5-(пиперидин-4-илметокси)пиримидин гидрохлорид: трет-бутил 4-((2-хлорпиримидин-5-илокси)метил)пиперидин-1-карбоксилат (2,10 г, 6,41 ммоль) растворили в CH2Cl2 (50 мл). 4 M HCl в 1,4-диоксане (32,03 мл, 128,12 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (1,50 г, 88%).
Стадия 3. 1-(4-((2-хлорпиримидин-5-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол:
2-хлор-5-(пиперидин-4-илметокси)пиримидин гидрохлорид (1,50 г, 5,68 ммоль), 2,2-диметилоксиран (5,06 мл, 56,79 ммоль) и K2CO3 (392 мг, 2,84 ммоль) растворили в EtOH (5 мл) и H2O (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученный материал, представляющий собой целевое соединение в виде твердого вещества белого цвета (1,70 г, 99%), использовали без дополнительной очистки.
Стадия 4. 2-хлор-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин:
1-(4-((2-хлорпиримидин-5-илокси)метил)пиперидин-1-ил)-2-метилпропан-2-ол (1,70 г, 5,67 ммоль) растворили в CH2Cl2 (15 мл). При 0 ºC, DAST (749 мкл, 5,67 ммоль) медленно добавили к реакционной смеси. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученный материал, представляющий собой целевое соединение в виде твердого вещества белого цвета (1,20 г, 70%), использовали без дополнительной очистки.
Стадия 5. этил 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоат: 2-хлор-5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин (600 мг, 1,99 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (421 мг, 1,99 ммоль), Pd(dppf)Cl2 (81 мг, 0,10 ммоль) и Cs2CO3 (1,30 г, 3,98 ммоль) добавили к смеси вода (2 мл)/DME (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (480 мг, 55%).
Стадия 6. 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензойная кислота: Этил 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоат (480 мг, 1,11 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (232 мг, 5,54 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. Реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (360 мг, 80%).
Стадия 7. Соединение 1032: 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензойную кислоту (40 мг, 0,10 ммоль), (S)-пирролидин-2-карбоксамид (23 мг, 0,20 ммоль), EDC (38 мг, 0,20 ммоль), HOBt (27 мг, 0,20 ммоль) и DIPEA (35 мкл, 0,20 ммоль) растворили в CH2Cl2 (1 мл), после чего перемешивали при такой же температуре в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (21 мг, 42%).
1H NMR (400 MHz, CDCl3) δ 8,46 (s, 2 H), 8,23 (d, 1 H, J = 6,6 Hz), 8,16 (d, 1 H, J = 10,2 Hz), 7,51 (t, 1 H, J = 7,4 Hz), 6,94 (brs, 1 H), 5,56 (brs, 1 H), 4,84 - 4,81 (m, 1 H), 3,96 (d, 2 H, J = 5,9 Hz), 3,55 - 3,49 (m, 1 H), 3,43 - 3,37 (m, 1 H), 3,03 (brs, 2 H), 2,51 - 2,45 (m, 2 H), 2,19 (brs, 2 H), 2,16 - 2,01 (m, 3 H), 1,96 - 1,81 (m, 4 H), 1,70 - 1,36 (m, 8 H); MS (ESI) m/z 502 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1032, соединения Таблицы 58 синтезировали с использованием 2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензойной кислоты и реагента из Таблицы 57.
Таблица 57.
Таблица 58.
Пример 71. Соединение 631: N,N-диметил-4'-((1-((1-(трифторметил)циклобутил) метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
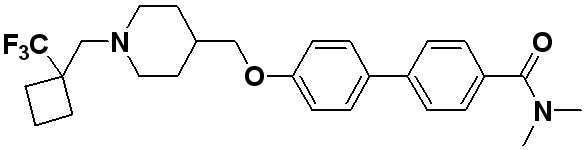
Стадия 1. трет-Бутил 4-((4'-гидроксибифенил-4-илокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((4-бромфенокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 3 соединения 431; 3,45 г, 9,32 ммоль) и 4-гидроксифенилборную кислоту (1,41 г, 10,25 ммоль) растворили в диоксане 12 мл. К этой смеси добавили 3 мл воды. Pd(dbpf)Cl2 (607 мг, 0,93 ммоль) и Cs2CO3 (6,07 г, 18,64 ммоль) добавили туда же, и кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты, и полученный органический слой промыли насыщенным водным раствором NaHCO3 и высушили воду над MgSO4, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/CH2Cl2), и затем перекристаллизовали из CH2Cl2 и гексана с получением целевого соединения в виде твердого вещества белого цвета (2,50 г, 70%).
Стадия 2. 4'-(пиперидин-4-илметокси)бифенил-4-ол гидрохлорид: трет-бутил 4-((4'-гидроксибифенил-4-илокси)метил)пиперидин-1-карбоксилат (2,50 г, 6,51 ммоль) растворили в CH2Cl2 6 мл. 4 M HCl 1,79 мл добавили к этой смеси, после чего перемешивали в течение 1 часа при комнатной температуре. Полученную реакционную смесь отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (2,00 г, 96%).
Стадия 3. 4'-((1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-ил)метокси)бифенил-4-ил 1-(трифторметил)циклобутанекарбоксилат: 4'-(пиперидин-4-илметокси)бифенил-4-ол гидрохлорид (1,50 г, 4,69 ммоль), 1-(трифторметил)циклобутанекарбоновую кислоту (946 мг, 5,63 ммоль) и PyBOP (3,66 г, 7,04 ммоль) растворили в DMF 4 мл. DIPEA (3,63 г, 28,14 ммоль) добавили к этой смеси. При 50 ºC, реакцию проводили в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (1,16 г, 42%).
Стадия 4. 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ол:
4'-((1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-ил)метокси)бифенил-4-ил 1-(трифторметил)циклобутанекарбоксилат (1,16 г, 2,67 ммоль) растворили в сухом THF 15 мл, после чего охладили на ледяной бане. LAH (1 M в THF, 8,03 мл, 8,03 ммоль) медленно добавили по каплям, с последующим повышением температуры до 50 ºC и перемешивали в течение дня. В реакционную смесь влили воду. Образовавшийся осадок удалили фильтрованием, и фильтрат проэкстрагировали с помощью EtOAc три раза. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (640 мг, 57%).
Стадия 5. 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил трифторметансульфонат: 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ол (640 мг, 1,53 ммоль) растворили в CH2Cl2 6 мл. При 0 ºC, пиридин (181 мг, 2,29 ммоль) и трифторметансульфоновый ангидрид (560 мг, 1,98 ммоль) добавили туда же, Реакцию проводили при комнатной температуре в течение 3 часов. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (590 мг, 70%).
Стадия 6. метил 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил трифторметансульфонат (200 мг, 0,36 ммоль), Pd(OAc)2 (4 мг, 0,02 ммоль) и dppp (9 мг, 0,02) растворили в DMSO 3 мл. MeOH 3 мл добавили к этой смеси, после чего пропустили достаточное количество газообразного СО. Наконец, TEA (184 мг, 1,81 ммоль) добавили к этой смеси, после чего перемешивали при 120 ºC в течение 4 часов. Реакционную смесь отфильтровали через цеолиты. Фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой упарили при пониженном давлении, и очистили с помощью колоночной хроматографии на силикагеле (EtOAc/CH2Cl2) с получением целевого соединения в виде твердого вещества розового цвета (105 мг, 62%).
Стадия 7. 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (105 мг, 0,23 ммоль) растворили в THF 2 мл. MeOH 1 мл и H2O 0,5 мл добавили туда же. LiOH (19 мг, 0,46 ммоль) добавили к этой смеси, и кипятили с обратным холодильником и перемешиванием в течение 5 часов. После подкисления с помощью 1 N HCl, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (98 мг, 96%).
Стадия 8. Соединение 631: 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (30 мг, 0,07 ммоль), диметиламин гидрохлорид (11 мг, 0,13 ммоль) и PyBOP (52 мг, 0,10 ммоль) растворили в DMF 0,5 мл. DIPEA (43 мг, 0,34 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (16 мг, 50%).
1H NMR (400 MHz, CDCl3) δ 7,52 (m, 6 H), 6,98 (d, 2 H, J = 6,8 Hz), 3,85 (d, 2 H, J = 6,0 Hz), 3,14 (s, 3 H), 3,05 (s, 3 H), 2,85 (m, 2 H), 2,53 (s, 2 H), 2,19 (m, 4 H), 2,01 (m, 3 H), 1,96 (m, 1 H), 1,83 (m, 3 H), 1,46 (m, 2 H); MS (ESI) m/z 475 (M+ + H).
Пример 72. Соединение 633: (R)-(2-(гидроксиметил)пирролидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанон
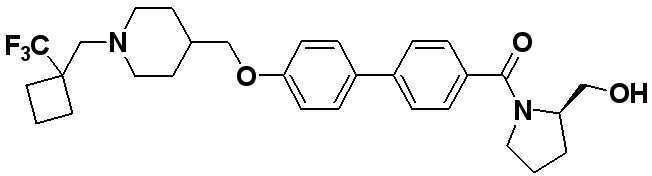
4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (30 мг, 0,07 ммоль), (R)-пролинол (14 мг, 0,13 ммоль) и PyBOP (52 мг, 0,10 ммоль) растворили в DMF 0,5 мл после чего перемешивали в течение 10 минут при комнатной температуре. DIPEA (43 мг, 0,34 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 8 часов. В реакционную смесь влили воду. Образовавшийся осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (17 мг, 47%).
1H NMR (400 MHz, CDCl3) δ 7,56 (m, 6 H), 6,99 (d, 2 H, J = 8,7 Hz), 5,01 (d, 1 H, J = 8,7 Hz), 4,46 (m, 1 H), 3,77 (m, 4 H), 3,53 (m, 2 H), 2,90 (m, 2 H), 2,54 (s, 2 H), 2,22 (m, 5 H), 2,11 (m, 3 H), 1,92 (m, 6 H), 1,64 (m, 2 H), 1,48 (m, 2 H); MS (ESI) m/z 531 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 631 (Стадия 8), соединения Таблицы 60 синтезировали с использованием 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 59.
Таблица 59.
Таблица 60.
Пример 73. Соединение 917: (R)-(2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
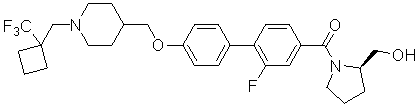
Стадия 1. метил 2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: К 4-((4-бромфенокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидину (продукт синтеза стадии 2 соединения 842; 0,78 г, 1,92 ммоль), 2-фтор-4-(метоксикарбонил)фенилборной кислоте (0,45 г, 2,30 ммоль), Pd(dppf)Cl2 (0,07 г, 0,09 ммоль) и Cs2CO3 (1,25 г, 3,84 ммоль) добавили DME (9 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 100%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,54 г, 59%).
Стадия 2. 2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) бифенил-4-карбоновая кислота: Метил 2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,54 г, 1,13 ммоль) и LiOH·H2O (0,23 г, 5,68 ммоль) растворили в THF / MeOH (16 мл) / H2O (4мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 1 часа. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,50 г, 94%).
Стадия 3. Соединение 917: 2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,07 г, 0,15 ммоль), (R)-пирролидин-2-илметанол (0,01 г, 0,18 ммоль), HOBt (0,04 г, 0,30 ммоль), EDC (0,05 г, 0,30 ммоль) и DIPEA (0,05 мл, 0,30 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, дихлорметан / метанол = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,05 г, 69%).
1H NMR (400 MHz, CDCl3) δ 7,45 - 7,51 (m, 3 H), 7,31 - 7,37 (m, 2 H), 6,99 (d, 2 H, J = 8,6 Hz), 4,75 (s, 1 H), 4,40 - 4,45 (m, 1 H), 3,74 - 3,87 (m, 4 H), 3,51 - 3,65 (m, 2 H), 2,89 - 2,92 (m, 2 H), 2,54 (s, 2 H), 2,20 - 2,28 (m, 5 H), 1,87 - 2,11 (m, 6 H), 1,72 - 183 (m, 4 H), 1,43 - 1,49 (m, 2 H); MS (ESI) m/z 549,2 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 917, соединения Таблицы 62 синтезировали с использованием 2-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 61.
Таблица 61.
Таблица 62.
Пример 74. Соединение 842: (S)-(3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
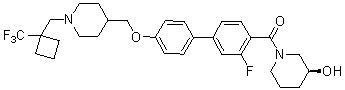
Стадия 1. (4-((4-бромфенокси)метил)пиперидин-1-ил)(1-(трифторметил)циклобутил)метанон:
4-((4-бромфенокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 1 соединения 498; 2,00 г, 6,52 ммоль) растворили в CH2Cl2 (40 мл). EDC (2,50 г, 13,05 ммоль), HOBt (1,76 г, 13,05 ммоль), DIPEA (2,31 мл, 13,05 ммоль), 1-(трифторметил) циклобутанекарбоновую кислоту (1,09 г, 6,52 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 12 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с CH2Cl2. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1 / 4) с получением целевого соединения в виде твердого вещества белого цвета (2,10 г, 76%).
Стадия 2. 4-((4-бромфенокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидин:
(4-((4-бромфенокси)метил)пиперидин-1-ил)(1-(трифторметил)циклобутил)метанон (812 мг, 1,93 ммоль) растворили в THF (10 мл). К этой смеси добавили 2,0 M раствор боран диметил сульфидного комплекса в THF (4,83 мл, 9,66 ммоль), после чего перемешивали при комнатной температуре в течение 2 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1 / 8) с получением целевого соединения в виде твердого вещества желтого цвета (480 мг, 61%).
Стадия 3. метил 3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: К 4-((4-бромфенокси)метил)-1-((1-(трифторметил) циклобутил)метил)пиперидину (480 мг, 1,18 ммоль), 4-(этоксикарбонил)-3-фторфенилборной кислоте (300 мг, 1,42 ммоль), Pd(dppf)Cl2 (97 мг, 1,42 ммоль) и Cs2CO3 (770 мг, 2,36 ммоль) добавили DME (6 мл)/ H2O (2 мл), и кипятили с обратным холодильником в течение дня. По окончании реакции, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 1 / 7) с получением целевого соединения в виде твердого вещества белого цвета (250 мг, 42%).
Стадия 4. 3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (250 мг, 0,51 ммоль) растворили в THF (10 мл) и H2O (5 мл). При комнатной температуре, LiOH·H2O (106 мг, 2,53 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь подкислили с помощью 1 N HCl. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (201 мг, 85%).
Стадия 5. Соединение 842: 3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (40 мг, 0,09 ммоль), EDC (33 мг, 0,17 ммоль), HOBt (23 мг, 0,17 ммоль), DIPEA (30 мкл, 0,17 ммоль) и (S)-пиперидин-3-ол гидрохлорид (24 мг, 0,17 ммоль) растворили в CH2Cl2 (1 мл), после чего перемешивали в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества желтого цвета (24 мг, 50%).
1H NMR (400 MHz, CDCl3) δ 7,51 (d, 2 H, J = 8,6 Hz), 7,45 - 7,38 (m, 2 H), 7,27 - 7,26 (m, 1 H), 6,98 (d, 2 H, J = 8,6 Hz), 4,11 - 3,94 (m, 1 H), 3,85 (d, 2 H, J = 6,0 Hz), 3,62 - 3,50 (m, 1 H), 3,40 - 3,27 (m, 1 H), 2,90 (d, 2 H, J = 10,9 Hz), 2,54 (s, 2 H), 2,28 - 2,20 (m, 4 H), 2,11 - 2,01 (m, 10 H), 1,99 - 1,63 (m, 3 H), 1,49 - 1,34 (m, 3 H); MS (ESI) m/z 549 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 842, соединения Таблицы 64 синтезировали с использованием 3-фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 63.
Таблица 63.
Таблица 64.
Пример 75. Соединение 833: (S)-1-(2' -фтор-4'-((1-((1-(трифторметил)циклобутил) метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
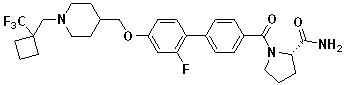
Стадия 1. трет-Бутил 4-((2-фтор-4'-гидроксибифенил-4-илокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((4-бром-3-фторфенокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 1 соединения 704; 3,7 г, 9,53 ммоль), 4-гидроксифенилборную кислоту (1,31 г, 9,53 ммоль), Pd(dppf)Cl2 (778 мг, 0,95 ммоль), Na2CO3 (2,02 г, 19,06 ммоль) растворили в DME 15 мл и воде 5 мл, и затем кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (2,8 г, 73%).
Стадия 2. 2' -фтор-4'-(пиперидин-4-илметокси)бифенил-4-ол гидрохлорид:
трет-бутил 4-((2-фтор-4'-гидроксибифенил-4-илокси)метил)пиперидин-1-карбоксилат (2,8 г, 6,97 ммоль) растворили в CH2Cl2 15 мл. 4 M HCl 2,09 мл добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь отфильтровали, промыли EtOAc, и упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (2,3 г, 97%).
Стадия 3. 2' -фтор-4'-((1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-ил)метокси)бифенил-4-ил 1-(трифторметил)циклобутанекарбоксилат:
2' -фтор-4'-(пиперидин-4-илметокси)бифенил-4-ол гидрохлорид (1,5 г, 4,44 ммоль), 1-(трифторметил)циклобутанекарбоновую кислоту (1,12 г, 6,66 ммоль) и BOP (3,93 г, 8,88 ммоль) растворили в DMF 6 мл. После перемешивания в течение 10 минут при комнатной температуре, TEA (1,35 г, 13,32 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (580 мг, 29%).
Стадия 4. 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ол: 2' -фтор-4'-((1-(1-(трифторметил)циклобутанекарбонил) пиперидин-4-ил)метокси)бифенил-4-ил 1-(трифторметил)циклобутанекарбоксилат (1,38 г, 2,23 ммоль) растворили в сухом THF 20 мл. При 0 ºC, LAH (6,88 ммоль) добавили к этой смеси, после чего перемешивали при 60 ºC в течение дня. По окончании реакции, реакционную смесь немного разбавили водой, и затем проэкстрагировали избыточным количеством EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (12 г ISCO силикагелевый картридж, 15 - 20% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (980 мг, 97%).
Стадия 5. 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил трифторметансульфонат: 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ол (980 мг, 2,24 ммоль) растворили в сухом CH2Cl2 6 мл. Пиридин (266 мг, 3,36 ммоль) добавили к этой смеси. Затем, трифторметансульфоновый ангидрид (266 мг, 3,36 ммоль) добавили к этой смеси при 0 ºC, после чего перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2 два раза. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (880 мг, 69%).
Стадия 6. метил 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 2' -фтор-4'-((1-((1-(трифторметил)циклобутил) метил)пиперидин-4-ил)метокси)бифенил-4-ил трифторметансульфонат (880 мг, 1,55 ммоль), Pd(OAc)2 (17 мг, 0,08 ммоль) и dppp (40 мг, 0,09 ммоль) растворили в DMSO 6 мл. MeOH 6 мл добавили к этой смеси, после чего пропустили достаточное количество моноксида углерода (CO). Затем, TEA (782 мг, 7,73 ммоль) добавили к этой смеси, после чего перемешивали при 120 ºC в течение 6 часов. После фильтрования через цеолиты, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (470 мг, 63%).
Стадия 7. 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (470 мг, 0,98 ммоль) растворили в THF/MeOH/H2O = 6/3/2 мл. LiOH·H2O (82 мг, 1,96 ммоль) добавили к этой смеси, и кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель упарили при пониженном давлении, после чего отрегулировали pH до значения ниже 6 с помощью 1N HCl. Полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (410 мг, 89%).
Стадия 8. Соединение 833: 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (40 мг, 0,09 ммоль), (S)-пирролидин-2-карбоксамид (15 мг, 0,13 ммоль) и BOP (76 мг, 0,17 ммоль) растворили в DMF 1 мл. После перемешивания в течение 10 минут при комнатной температуре, TEA (26 мг, 0,26 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (22 мг, 45%).
1H NMR (400 MHz, CDCl3) δ 7,54 (m, 4 H), 7,35 (t, 1 H, J = 4,8 Hz), 6,99 (s, 1 H), 6,73 (m, 2 H), 5,50 (s, 1 H), 4,82 (t, 2 H, J = 2,1 Hz), 3,83 (d, 2 H, J = 5,9 Hz), 3,58 (m, 2 H), 2,90 (m, 2 H), 2,49 (m, 3 H), 2,30 (m, 4 H), 2,09 (m, 5 H), 1,89 (m, 5 H), 0,98 (m, 2 H)
Согласно вышеописанному процессу синтеза соединения 833, соединения Таблицы 66 синтезировали с использованием 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 65.
Таблица 65.
Таблица 66.
Пример 76. Соединение 908: (2,2' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-ил)((R)-2-(гидроксиметил)пирролидин-1-ил)метанон
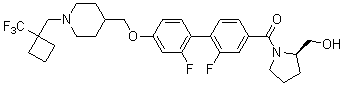
Стадия 1. (4-((4-бром-3-фторфенокси)метил)пиперидин-1-ил)(1-(трифторметил)циклобутил) метанон: 4-((4-бром-3-фторфенокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 2 соединения 704; 2,60 г, 8,00 ммоль), DIPEA (2,77 мл, 16,01 ммоль), HOBt (2,16 г, 16,01 ммоль), EDC (3,07 г, 16,01 ммоль) и 1-(трифторметил)циклобутанекарбоновую кислоту (1,61 г, 9,61 ммоль) растворили в DMF (30 мл) при 60 °C, после чего перемешивали при такой же температуре в течение 18 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде желтого масла (2,83 г, 80%).
Стадия 2. 4-((4-бром-3-фторфенокси)метил)-1-((1-(трифторметил)циклобутил)метил) пиперидин: (4-((4-бром-3-фторфенокси)метил)пиперидин-1-ил)(1-(трифторметил)циклобутил)метанон (1,40 г, 3,33 ммоль) растворили в THF (30 мл). При 0 °C, 2,0 M BH3·SMe2 в THF (8,3 мл, 16,66 ммоль) добавили к этой смеси, после чего перемешивали при 60 °C в течение 2 часов Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 5% - 20%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (1,84 г, 67%).
Стадия 3. метил 2,2' -дифтор-4'-((4-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: к 4-((4-бром-3-фторфенокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидину (0,80 г, 1,89 ммоль), 2-фтор-4-(метоксикарбонил)фенилборной кислоте (0,44 г, 2,26 ммоль), Pd(dppf)Cl2 (0,07 г, 0,09 ммоль) и Cs2CO3 (1,23 г, 3,78 ммоль) добавили DME (9 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,39 г, 42%).
Стадия 4. 2,2' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 2,2' -дифтор-4'-((4-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,39 г, 0,78 ммоль) и LiOH·H2O (0,16 г, 3,92 ммоль) растворили в THF/MeOH (20 мл) / H2O (5 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 1 часа. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,21 г, 55%).
Стадия 5. Соединение 908: 2,2' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,04 г, 0,08 ммоль), (R)-пирролидин-2-илметанол (0,01 г, 0,09 ммоль), HOBt (0,02 г, 0,16 ммоль), EDC (0,03 г, 0,16 ммоль) и DIPEA (0,02 мл, 0,16 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г, метанол / дихлорметан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,02 г, 57%).
1H NMR (400 MHz, CDCl3) δ 7,43 (t, 1 H, J = 7,3 Hz), 7,27 - 7,37 (m, 3 H), 6,78 (dd, 1 H, J = 8,5, 2,5 Hz), 6,73 (dd, 1 H, J = 11,9, 2,4 Hz), 4,40 - 4,44 (m, 1 H), 3,74 - 3,84 (m, 4 H), 3,53 - 3,64 (m, 2 H), 2,89 -2,92 (m, 2 H), 2,54 (s, 2 H), 2,20 - 2,28 (m, 4 H), 1,65 - 2,11 (m, 10 H), 1,40 - 1,48 (m, 2 H), 1,25 - 1,26 (m, 2 H); MS (ESI) m/z 567,2 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 908, соединения Таблицы 68 синтезировали с использованием 2,2' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 67.
Таблица 67.
Таблица 68.
Пример 77. Соединение 912: (R)-(2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил) метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон
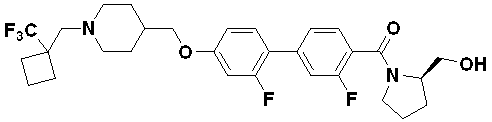
Стадия 1. этил 2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-3-фторфенокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидин (продукт синтеза стадии 2 соединения 908; 0,80 г, 1,89 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (0,48 г, 2,26 ммоль), Pd(dppf)Cl2 (0,07 г, 0,09 ммоль) и Cs2CO3 (1,23 г, 3,78 ммоль) добавили в DME (9 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,70 г, 75%).
Стадия 2. 2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Этил 2',3-дифтор-4'-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,70 г, 1,36 ммоль) и LiOH·H2O (0,28 г, 6,84 ммоль) растворили в THF/MeOH (20 мл) / H2O (5 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 1 часа. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,66 г, 99%).
Стадия 3. Соединение 912: 2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,07 г, 0,14 ммоль), (R)-пирролидин-2-илметанол (0,01 г, 0,17 ммоль), HOBt (0,03 г, 0,29 ммоль), EDC (0,05 г, 0,29 ммоль) и DIPEA (0,05 мл, 0,29 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, метанол / дихлорметан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,07 г, 90%).
1H NMR (400 MHz, CDCl3) δ 7,48 (t, 1 H, J = 7,5 Hz), 7,27 - 7,38 (m, 2 H), 6,78 (dd, 1 H, J = 8,6, 2,4 Hz), 6,72 (dd, 1 H, J = 12,7, 2,3 Hz), 4,78 - 4,79 (s, 1 H), 4,40 - 4,44 (m, 1 H), 3,75 - 3,84 (m, 4 H), 3,46 - 3,50 (m, 2 H), 2,89 - 2,92 (m, 2 H), 2,54 (s, 2 H), 2,19 - 2,28 (m, 5 H), 2,01 - 2,11 (m, 3 H), 1,90 - 1,99 (m, 2 H), 1,82 - 1,89 (m, 4 H), 1,64 - 1,79 (m, 2 H), 1,42 - 1,48 (m, 2 H); MS (ESI) m/z 567,3 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 912, соединения Таблицы 70 синтезировали с использованием 2',3-дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 69.
Таблица 69.
Таблица 70.
Пример 78. Соединение 883: (S)-(3' -фтор-4'-((1-((1-(трифторметил)циклобутил) метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
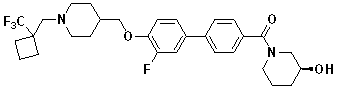
Стадия 1. трет-Бутил 4-((3-фтор-4'-гидроксибифенил-4-илокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((4-бром-2-фторфенокси)метил)пиперидин-1-карбоксилат (продукт синтеза стадии 1 соединения 725; 3,75 г, 9,67 ммоль), 4-гидроксифенилборную кислоту (1,33 г, 9,67 ммоль), Pd(dppf)Cl2 (789 мг, 0,97 ммоль) и Na2CO3 (2,04 г, 19,32 ммоль) растворили в DME 15 мл и воде 5 мл, и затем кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (2,90 г, 75%).
Стадия 2. 3' -фтор-4'-(пиперидин-4-илметокси)бифенил-4-ол гидрохлорид:
трет-бутил 4-((3-фтор-4'-гидроксибифенил-4-илокси)метил)пиперидин-1-карбоксилат (2,90 г, 7,22 ммоль) растворили в CH2Cl2 15 мл. 4 M HCl 2,17 мл добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь отфильтровали, промыли EtOAc, и упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (2,40 г, 98%).
Стадия 3. 3-фтор-4'-((1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-ил)метокси)бифенил-4-ил 1-(трифторметил)циклобутанекарбоксилат:
3' -фтор-4'-(пиперидин-4-илметокси)бифенил-4-ол гидрохлорид (0,83 г, 2,46 ммоль), 1-(трифторметил)циклобутанекарбоновую кислоту (0,62 г, 3,69 ммоль) и BOP (2,17 г, 4,93 ммоль) растворили в DMF 6 мл. После перемешивания в течение 10 минут при комнатной температуре, TEA (0,75 г, 7,39 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (500 мг, 45%).
Стадия 4. 3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ол: 3-фтор-4'-((1-(1-(трифторметил)циклобутанекарбонил) пиперидин-4-ил)метокси)бифенил-4-ил 1-(трифторметил)циклобутанекарбоксилат (672 мг, 1,12 ммоль) растворили в сухом THF 15 мл. При 0 ºC, LAH (3,35 ммоль) добавили к этой смеси, после чего перемешивали при 60 ºC в течение дня. По окончании реакции, реакционную смесь немного разбавили водой, и затем проэкстрагировали избыточным количеством EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (12 г ISCO силикагелевый картридж, 15 - 20% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (485 мг, 99%).
Стадия 5. 3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил трифторметансульфонат: 3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ол (485 мг, 1,11 ммоль) растворили в сухом CH2Cl2 6 мл. Пиридин (132 мг, 1,66 ммоль) добавили к этой смеси. Затем, трифторметансульфоновый ангидрид (401 мг, 1,44 ммоль) добавили к этой смеси при 0 ºC, после чего перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2 два раза. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (395 мг, 62%).
Стадия 6. метил 3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) бифенил-4-карбоксилат: 3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил трифторметансульфонат (785 мг, 1,38 ммоль), Pd(OAc)2 (16 мг, 0,07 ммоль) и dppp (35 мг, 0,08 ммоль) растворили в DMSO 3 мл. MeOH 2 мл добавили к этой смеси, после чего пропустили достаточное количество моноксида углерода (CO). TEA (697 мг, 6,89 ммоль) добавили к этой смеси, после чего перемешивали при 120 ºC в течение 4 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (380 мг, 57%).
Стадия 7. 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) бифенил-4-карбоновая кислота: Метил 3' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоксилат (420 мг, 0,88 ммоль) растворили в THF / MeOH/H2O = 6/3/2 мл. LiOH·H2O (73 мг, 1,75 ммоль) добавили к этой смеси. Затем смесь кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении, после чего отрегулировали pH до значения ниже 6 с помощью 1N HCl. Полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (380 мг, 93%).
Стадия 8. Соединение 883: 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (50 мг, 0,11 ммоль), EDC (33 мг, 0,22 ммоль), HOBt (29 мг, 0,22 ммоль) и DIPEA (42 мг, 32 ммоль) растворили в DMF 1 мл. После перемешивания в течение 10 минут при комнатной температуре, (S)-пиперидин-3-ол (16 мг, 0,16 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (35 мг, 59%).
1H NMR (400 MHz, CDCl3) δ 7,49 (m, 4 H), 7,29 (m, 2 H), 7,00 (t, 1 H, J = 8,5 Hz), 3,90 (m, 4 H), 3,59 (m, 3 H), 2,88 (m, 2 H), 2,53 (s, 2 H), 2,21 (m, 4 H), 1,98 (m, 10 H), 1,24 (m, 3 H); MS (ESI) m/z 549 (M + H).
Согласно вышеописанному процессу синтеза соединения 883, соединения Таблицы 72 синтезировали с использованием 2' -фтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 71.
Таблица 71.
Таблица 72.
Пример 79. Соединение 847: (S)-1-(2,3' -дифтор-4'-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид

Стадия 1. (4-((4-бром-2-фторфенокси)метил)пиперидин-1-ил)(1-(трифторметил)циклобутил) метанон: 4-((4-бромфенокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 2 соединения 725; 3,90 г, 12,01 ммоль) растворили в CH2Cl2 (50 мл). EDC (4,61 г, 24,03 ммоль), HOBt (3,25 г, 24,03 ммоль), DIPEA (4,25 мл, 24,03 ммоль) и 1-(трифторметил)циклобутанекарбоновую кислоту (2,02 г, 12,01 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение дня. По окончании реакции, реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2. Полученный органический слой проэкстрагировали с насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (3,10 г, 58%).
Стадия 2. 4-((4-бром-2-фторфенокси)метил)-1-((1-(трифторметил)циклобутил)метил) пиперидин: (4-((4-бром-2-фторфенокси)метил)пиперидин-1-ил)(1-(трифторметил) циклобутил)метанон (2,28 г, 5,20 ммоль) растворили в THF (50 мл). При 0 ºC, 2,0 M Раствор боран диметил сульфидного комплекса в THF (13,01 мл, 26,01 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 5 часов. По окончании реакции, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным раствором NaHCO3. Органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 20% ~ 80%) с получением целевого соединения в виде твердого вещества белого цвета (1,50 г, 68%).
Стадия 3. метил 2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-2-фторфенокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидин (800 мг, 1,89 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (448 мг, 2,26 ммоль), Pd(dppf)Cl2 (154 мг, 0,19 ммоль) и Cs2CO3 (1,23 г, 3,77 ммоль) добавили в DME (6 мл) / H2O (2 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (535 мг, 57%).
Стадия 4. 2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 2,3' -дифтор-4'-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (535 мг, 1,08 ммоль) растворили в THF (10 мл) и H2O (5 мл). При комнатной температуре, LiOH·H2O (226 мг, 5,38 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (400 мг, 76%).
Стадия 5. Соединение 847: 2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (50 мг, 0,10 ммоль), EDC (40 мг, 0,21 ммоль), HOBt (28 мг, 0,21 ммоль) и DIPEA (37 мкл, 0,21 ммоль) растворили в CH2Cl2 (1 мл). (S)-пирролидин-2-карбоксамид (24 мг, 0,21 ммоль) добавили к этой смеси, после чего перемешивали в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (43 мг, 71%).
1H NMR (400 MHz, CDCl3) δ 7,48 - 7,45 (m, 1 H), 7,40 - 7,27 (m, 4 H), 7,03 (t, 1 H, J = 8,6 Hz), 6,91 (brs, 1 H), 5,60 (brs, 1 H), 4,81 - 4,78 (m, 1 H), 3,92 (d, 2 H, J = 6,2 Hz), 3,68 - 3,54 (m, 2 H), 2,90 (d, 2 H, J = 11,3 Hz), 2,54 (s, 2 H), 2,49 - 2,42 (m, 1 H), 2,27 - 2,20 (m, 4 H), 2,16 - 1,98 (m, 5 H), 1,96 - 1,91 (m, 4 H), 1,90 - 1,73 (brs, 1 H), 1,48 - 1,42 (m, 2 H); MS (ESI) m/z 580(M+ + H).
Согласно вышеописанному процессу синтеза соединения 847, соединения Таблицы 74 синтезировали с использованием 2,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 73.
Таблица 73.
Таблица 74.
Пример 80. Соединение 901 : (S)-1-(3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил) метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
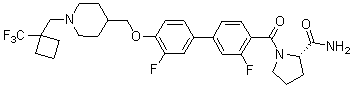
Стадия 1. этил 3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бром-2-фторфенокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидин (продукт синтеза стадии 2 соединения 847; 627 мг, 1,48 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (345 мг, 1,63 ммоль), Pd(dppf)Cl2 (121 мг, 0,15 ммоль) и Cs2CO3 (963 мг, 2,96 ммоль) добавили к DME (6 мл) / H2O (2 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (580 мг, 76%).
Стадия 2. 3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Этил 3,3' -дифтор-4'-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (580 мг, 1,13 ммоль) растворили в THF (10 мл) и H2O (5 мл). При комнатной температуре, LiOH·H2O (238 мг, 5,67 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (500 мг, 91%).
Стадия 3. Соединение 901: 3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (60 мг, 0,12 ммоль), EDC (48 мг, 0,25 ммоль), HOBt (34 мг, 0,25 ммоль) и DIPEA (44 мкл, 0,25 ммоль) растворили в CH2Cl2 (1 мл). (S)-пирролидин-2-карбоксамид (28 мг, 0,25 ммоль) добавили к этой смеси, после чего перемешивали в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (46 мг, 64%).
1H NMR (400 MHz, CDCl3) δ 7,48 (t, 1 H, J = 7,5 Hz), 7,41 - 7,27 (m, 4 H), 7,03 (t, 1 H, J = 8,5 Hz), 6,93 (brs, 1 H), 5,65 (brs, 1 H), 4,83 - 4,80 (m, 1 H), 3,91 (d, 2 H, J = 6,3 Hz), 3,55 - 3,53 (m, 1 H), 3,44 - 3,41 (m, 1 H), 2,90 (d, 2 H, J = 11,4 Hz), 2,54 (s, 2 H), 2,47 - 2,44 (m, 1 H), 2,27 - 2,19 (m, 4 H), 2,15 - 1,82 (m, 10 H), 1,46 - 1,42 (m, 2 H); MS (ESI) m/z 580 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 901, соединения Таблицы 76 синтезировали с использованием 3,3' -дифтор-4'-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 75.
Таблица 75.
Таблица 76.
Пример 81. Соединение 906 : (S)-1-(5-(3-фтор-4-((1-((1-(трифторметил)циклобутил) метил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамид
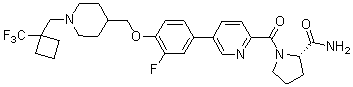
Стадия 1. метил 5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиколинат: 4-((4-бром-2-фторфенокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидин (продукт синтеза стадии 2 соединения 847; 856 мг, 2,02 ммоль), 6-метоксикарбонил)пиридин-3-ил борную кислоту (402 мг, 2,22 ммоль), Pd(dppf)Cl2 (165 мг, 0,20 ммоль) и Cs2CO3 (1,31 г, 4,04 ммоль), добавили к DME (6 мл) / H2O (2 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (80 мг, 8%).
Стадия 2. 5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиколиновая кислота: Метил 5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиколинат (80 мг, 0,17 ммоль) растворили в THF (10 мл) и H2O (5 мл). При комнатной температуре, LiOH·H2O (35 мг, 0,83 ммоль) добавили к этой смеси, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (60 мг, 77%).
Стадия 3. Соединение 906: 5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиколиновую кислоту (60 мг, 0,12 ммоль), EDC (48 мг, 0,25 ммоль), HOBt (34 мг, 0,25 ммоль) и DIPEA (44 мкл, 0,25 ммоль) растворили в CH2Cl2 (1 мл). (S)-пирролидин-2-карбоксамид (28 мг, 0,25 ммоль) добавили к этой смеси, после чего перемешивали в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (46 мг, 64%).
1H NMR (400 MHz, CDCl3) δ 8,77 - 8,72 (m, 1 H), 8,09 - 7,91 (m, 2 H), 7,37 - 7,27 (m, 2 H), 7,07 (t, 1 H, J = 8,7 Hz), 6,94 (brs, 0,5 H), 6,53 (brs, 0,5 H), 5,53 (brs, 1 H), 5,06 - 5,05 (m, 0,5 H), 4,86 - 4,83 (m, 0,5 H), 4,07 - 3,82 (m, 3 H), 2,90 (d, 2 H, J = 11,4 Hz), 2,54 (s, 2 H), 2,41 - 2,37 (m, 1 H), 2,36 - 1,78 (m, 15 H), 1,48 - 1,40 (m, 2 H); MS (ESI) m/z 563 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 906, соединения Таблицы 78 синтезировали с использованием 5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиколиновая кислота и реагента из Таблицы 77.
Таблица 77.
Таблица 78.
Пример 82. Соединение 576: N,N-диметил-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензамид
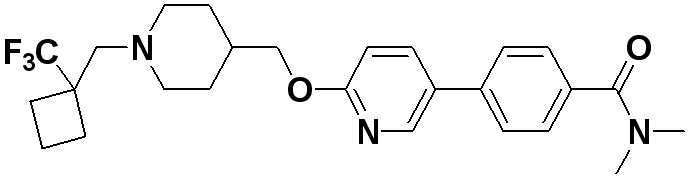
4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (продукт синтеза стадии 2 соединения 574; 20 мг, 0,05 ммоль), диметиламин (4 мг, 0,09 ммоль), EDC (17 мг, 0,09 ммоль) и HOBt (12 мг, 0,09 ммоль) растворили в DMF 1 мл. DIPEA (11 мг, 0,09 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 16 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (20-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (9 мг, 42%).
1H NMR (400 MHz, CDCl3) δ 8,38 (d, 1 H, J = 2,5 Hz), 7,80 (dd, 1 H, J = 8,6, 2,6 Hz), 7,52 (m, 4 H), 6,83 (d, 1 H, J = 8,5 Hz), 4,20 (d, 2 H, J = 6,2 Hz), 3,14 (s, 3 H), 3,05 (s, 3 H), 2,88 (m, 2 H), 2,26 (s, 2 H), 2,06 (m, 4 H), 1,90 (m, 7 H), 1,43 (m, 2 H); MS (ESI) m/z 476 (M+ + H).
Пример 83. Соединение 578:(S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон

4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (продукт синтеза стадии 2 соединения 574; 30 мг, 0,07 ммоль), (S)-пирролидин-3-ол (11 мг, 0,13 ммоль) и BOP (59 мг, 0,13 ммоль) растворили в DMF 1 мл. TEA (13 мг, 0,13 ммоль) добавили к этой смеси. При 50 ºC, реакцию проводили в течение 16 часов. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (5-10% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (13 мг, 38%).
1H NMR (400 MHz, CDCl3) δ 8,37 (s, 1 H), 7,79 (m, 1 H), 7,62 (m, 2 H), 7,54 (m, 2 H), 6,82 (d, 1 H, J = 8,5 Hz), 4,58 (m, 1 H), 4,19 (d, 2 H, J = 6,2 Hz), 3,81 (m, 2 H), 3,63 (m, 1 H), 3,57 (m, 1 H), 2,99 (m, 2 H), 2,66 (s, 3 H), 2,63 (s, 3 H), 2,26 (s, 2 H), 2,20 (m, 2 H), 2,04 (m, 3 H), 1,79 (m, 2 H), 1,43 (m, 2 H); MS (ESI) m/z 518 (M+ + H).
Пример 84. Соединение 581: (S)-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
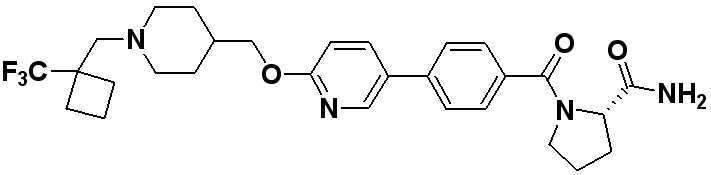
4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (продукт синтеза стадии 2 соединения 574; 50 мг, 0,11 ммоль), L-пролинамид (26 мг, 0,22 ммоль), EDC (43 мг, 0,22 ммоль) и HOBt (30 мг, 0,22 ммоль) растворили в DMF 1 мл. DIPEA (29 мг, 0,22 ммоль) добавили к этой смеси. При 60 ºC, реакцию проводили в течение 10 часов. Реакционную смесь охладили до комнатной температуры и разбавили водой. Образовавшийся осадок отфильтровали, промыли водой и высушили с получением целевого соединения в виде твердого вещества белого цвета (40 мг, 66%).
1H NMR (400 MHz, CDCl3) δ 8,38 (s, 1 H), 7,80 (dd, 1 H, J = 8,4, 2,3 Hz), 7,60 (dd, 4 H, J = 19,3, 8,3 Hz), 7,00 (m, 1 H), 6,83 (d, 1 H, J = 8,7 Hz), 5,54 (m, 1 H), 4,84 (m, 1 H), 4,21 (m, 2 H), 3,65 - 3,54 (m, 2 H), 2,88 - 2,65 (m, 2 H), 2,52 - 2,47 (m, 2 H), 2,22 - 1,79 (m, 15 H), 1,46 (m, 2 H); MS (ESI) m/z 545 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 581, соединения Таблицы 80 синтезировали с использованием 4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 79.
Таблица 79.
Таблица 80.
Пример 85. Соединение 931: (2S,4R)-метил 4-гидрокси-1-(4-(6-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксилат
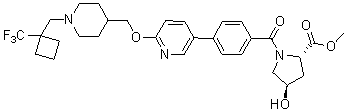
4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (продукт синтеза стадии 2 соединения 574; 300 мг, 0,67 ммоль), (2S,4R)-метил 4-гидроксипирролидин-2-карбоксилат гидрохлорид (182 мг, 1,00 ммоль), EDC (257 мг, 1,34 ммоль), HOBt (181 мг, 1,34 ммоль) и DIPEA (0,24 мл, 1,34 ммоль) растворили в DMF (5 мл) при комнатной температуре. Раствор перемешивали при 80 °C в течение 12 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 40 г картридж; EtOAc / гексан = 5% - 80%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (250 мг, 65%).
1H NMR (400 MHz, CDCl3) δ 8,34 (m, 1 H), 7,78 (m, 1 H), 7,63 (m, 2 H), 7,52 (m, 2 H), 6,80 (m, 1 H), 4,86 (m, 1 H), 4,55 (m, 1 H), 4,18 (m, 2 H), 3,85 - 3,61 (m, 6 H), 3,02 (m, 2 H), 2,68 (m, 2 H), 2,40 - 2,11 (m, 8 H), 2,10 - 1,79 (m, 5 H), 1,57 (m, 2 H); MS (ESI) m/z 576 (M+ + H).
Пример 86. Соединение 933: (2S,4R)-4-гидрокси-1-(4-(6-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид

Стадия 1. (2S,4R)-4-гидрокси-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоновая кислота: (2S,4R)-метил 4-гидрокси-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксилат(400 мг, 0,70 ммоль) и LiOH·H2O (58 мг, 1,39 ммоль) растворили в THF (10 мл) / H2O (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 10 часов. Реакционную смесь упарили при пониженном давлении чтобы удалить растворитель. Концентрат разбавили 1 M HCl, и упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки.
Стадия 2. Соединение 933: (2S,4R)-4-гидрокси-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоновую кислоту (400 мг, 0,71 ммоль), аммоний хлорид (57 мг, 1,07 ммоль), EDC (205 мг, 1,07 ммоль), HOBt (144 мг, 1,07 ммоль) и DIPEA (18 мг, 1,43 ммоль) растворили в DMF (10 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 10 часов. Реакционную смесь разбавили водой (10 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества коричневого цвета (110 мг, 28%).
1H NMR (400 MHz, CDCl3 + MeOD) δ 8,33 (m, 1 H), 7,79 (m, 1 H), 7,62 (m, 2 H), 7,54 (m, 2 H), 7,22 (br, 1 H), 6,80 (m, 1 H), 5,97 (br, 1 H), 4,86 (m, 1 H), 4,41 (m, 1 H), 4,18 (m, 2 H), 3,78 (m, 1 H), 3,55 (m, 1 H), 2,78 (m, 2 H), 2,60 - 1,65 (m, 16 H), 1,42 (m, 2 H); MS (ESI) m/z 561 (M+ + H),
Пример 87. Соединение 715:(S)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанон

Стадия 1. этил 1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-карбоксилат:
1-(трифторметил)циклобутанекарбоновую кислоту (500 мг, 2,97 ммоль), этил пиперидин-4-карбоксилат (514 мг, 3,27 ммоль), EDC (1,14 г, 5,94 ммоль) и HOBt (803 мг, 5,95 ммоль) растворили в CH2Cl2 10 мл. DIPEA (1,05 мл, 5,95 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 8 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Экстрагированный органический слой высушили над MgSO4, и затем отфильтровали. Фильтрат очистили с помощью колоночной хроматографии на силикагеле (10-30% EtOAc/гексан) с получением целевого соединения в виде бесцветного масла (850 мг, 93%).
Стадия 2. (1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метанол:
Этил 1-(1-(трифторметил)циклобутанекарбонил)пиперидин-4-карбоксилат(1,73 г, 5,63 ммоль) растворили в сухом THF 40 мл. При 0 ºC, LAH (1 M в THF, 28,15 мл, 28,15 ммоль) медленно добавили к реакционной смеси. При 50 ºC, реакцию проводили в течение 10 часов. Реакцию погасили путем медленного добавления MeOH при 0 ºC. Реакционную смесь разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный экстрагированный органический слой высушили над MgSO4, и затем отфильтровали с получением целевого соединения в виде бесцветного масла (1,4 г, 99%).
Стадия 3. 5-бром-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) пиридин: (1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метанол(760 мг, 3,02 ммоль) растворили в THF 10 мл. При 0 ºC, NaH (109 мг, 4,54 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при комнатной температуре в течение 20 минут. При 0 ºC, 2,5-дибромпиридин(788 мг, 3,32 ммоль) в THF медленно добавили к реакционной смеси. При 50 ºC, реакцию проводили в течение 10 часов. По окончании реакции, реакционную смесь разбавили ледяной водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (1,10 г, 89%).
Стадия 4. метил 3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин (550 мг, 1,35 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (294 мг, 1,48 ммоль), Pd(dbpf)Cl2 (26 мг, 0,04 ммоль), Cs2CO3 (1,31 г, 4,05 ммоль) добавили в микроволновой реактор, и затем 1,4-диоксан 4 мл и воду 2 мл добавили туда же. Реакцию проводили при микроволновом облучении в течение 30 минут при 110 ºC. Реакционную смесь отфильтровали через слой цеолитов. Фильтрат разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (300 мг, 46%).
Стадия 5. 3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота: Метил 3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (488 мг, 1,02 ммоль) растворили в смеси растворителей THF 10 мл / вода 10 мл. LiOH·H2O (85 мг, 2,03 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 4 часов. Растворитель упарили при пониженном давлении. После добавления 1M HCl к этой смеси, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (410 мг, 86%).
Стадия 6. Соединение 715: 3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (50 мг, 0,11 ммоль), (S)-пирролидин-3-ол (14 мг, 0,16 ммоль), EDC (41 мг, 0,21 ммоль) и HOBt (29 мг, 0,21 ммоль) растворили в DMF 2 мл. DIPEA (0,04 мл, 0,21 ммоль) добавили к этой смеси, реакцию проводили при 60 ºC в течение 10 часов. Реакционную смесь охладили до комнатной температуры и разбавили водой. Образовавшийся осадок отфильтровали, тщательно промыли водой, и высушили с получением целевого соединения в виде твердого вещества белого цвета (25 мг, 43%).
1H NMR (400 MHz, CDCl3) δ 8,33 (s, 1 H), 7,79 (d, 1 H, J = 8,8 Hz), 7,47 - 7,33 (m, 3 H), 6,83 (dd, 1 H, J = 10,2, 3,6 Hz), 4,62 - 6,51 (m, 1 H), 4,21 (d, 2 H, J = 5,5 Hz), 3,87 - 3,49 (m, 4 H), 2,90 (m, 2 H), 2,54 (s, 2 H), 2,22 - 1,80 (m, 15 H), 1,26 (m, 2 H); MS (ESI) m/z 536 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 715, соединения Таблицы 82 синтезировали с использованием 3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 81.
Таблица 81.
Таблица 82.
Пример 88. Соединение 720:(S)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
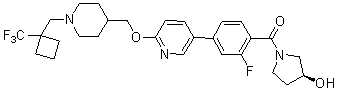
Стадия 1. этил 2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиридин (продукт синтеза стадии 3 соединения 715; 250 мг, 0,61 ммоль), 3-фтор-4-(этоксикарбонил)фенилборную кислоту (143 мг, 0,68 ммоль), Pd(dbpf)Cl2 (12 мг, 0,02 ммоль), Cs2CO3 (596 мг, 1,84 ммоль) добавили в микроволновой реактор, и затем 1,4-диоксан 3 мл и воду 2 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. Реакционную смесь отфильтровали через слой цеолитов. Фильтрат разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (200 мг, 66%).
Стадия 2. 2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота: Этил 2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (533 мг, 1,08 ммоль) растворили в смеси растворителей THF 10 мл / вода 10 мл. LiOH·H2O (90 мг, 2,16 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 4 часов. Растворитель упарили при пониженном давлении. После добавления 1M HCl к этой смеси, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (350 мг, 70%).
Стадия 3. Соединение 720: 2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (50 мг, 0,11 ммоль), (S)-пирролидин-3-ол (14 мг, 0,16 ммоль), EDC (41 мг, 0,21 ммоль) и HOBt (29 мг, 0,21 ммоль) растворили в DMF 2 мл. DIPEA (0,04 мл, 0,21 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 10 часов. Реакционную смесь охладили до комнатной температуры и разбавили водой. Образовавшийся осадок отфильтровали, тщательно промыли водой, и высушили с получением целевого соединения в виде твердого вещества белого цвета (21 мг, 37%).
1H NMR (400 MHz, CDCl3) δ 8,36 (t, 1 H, J = 1,8 Hz), 7,78 (dt, 1 H, J = 8,6, 1,3 Hz), 7,51 (m, 1 H), 7,37 (dd, 1 H, J = 10,2, 3,6 Hz), 7,27 (m, 1 H), 6,83 (d, 1 H, J = 8,5 Hz), 4,60 (m, 1 H), 4,21 (d, 2 H, J = 5,8 Hz), 3,84 - 3,25 (m, 5 H), 2,88 (m, 2 H), 2,53 (m, 2 H), 2,21 - 1,79 (m, 14 H), 1,42 (m, 2 H); MS (ESI) m/z 536,1 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 720, соединения Таблицы 84 синтезировали с использованием 2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 83.
Таблица 83.
Таблица 84.
Пример 89. Соединение 970:(S)-(3-гидроксипирролидин-1-ил)(4-(2-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)метанон
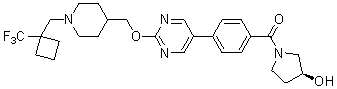
Стадия 1. 5-бром-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин: (1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метанол (760 мг, 3,02 ммоль) растворили в THF (40 мл). При 0 °C, NaH (143 мг, 5,97 ммоль) добавили к этой смеси, и перемешивали в течение 30 минут. 5-бром-2-йодопиримидин (1,25 г, 4,38 ммоль) добавили к этой смеси, после чего перемешивали при 55 °C в течение 10 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки.
Стадия 2. метил 4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин (450 мг, 1,10 ммоль), 4-(метоксикарбонил)фенилборную кислоту (218 мг, 1,21 ммоль), Pd(dbpf)Cl2 (22 мг, 0,03 ммоль) и Cs2CO3 (1,07 г, 3,31 ммоль) добавили к 1,4-диоксану (10 мл) / вода (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 45 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 5% - 25%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (300 мг, 59%).
Стадия 3. 4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензойная кислота: Метил 4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоат (300 мг, 0,65 ммоль) и LiOH·H2O (27 мг, 0,65 ммоль) растворили в THF (10 мл) / вода (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 6 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили 1M HCl (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (290 мг, 99%).
Стадия 4. Соединение 970: 4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензойную кислоту (50 мг, 0,11 ммоль), (S)-пирролидин-3-ол (15 мг, 0,17 ммоль), EDC (32 мг, 0,17 ммоль), HOBt (23 мг, 0,17 ммоль) и DIPEA (0,04 мл, 0,22 ммоль) растворили в DMF (4 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 16 часов , разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (20 мг, 35%).
1H NMR (400 MHz, CDCl3) δ 8,72 (s, 2 H), 7,69 - 7,55 (m, 4 H), 4,63 - 4,48 (m, 1 H), 4,28 (m, 2 H), 3,88 - 3,45 (m, 4 H), 2,90 (m, 2 H), 2,52 (s, 2 H), 2,22 - 1,83 (m, 14 H), 1,46 (m, 2 H); MS (ESI) m/z 519 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 970, соединения Таблицы 86 синтезировали с использованием 4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензойной кислоты и реагента из Таблицы 85.
Таблица 85.
Таблица 86.
Пример 90. Соединение 974:(S)-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
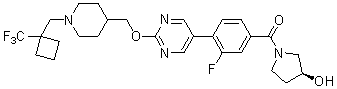
Стадия 1. метил 3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин (продукт синтеза стадии 1 соединения 970; 450 мг, 1,10 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (240 мг, 1,21 ммоль), Pd(dbpf)Cl2 (22 мг, 0,03 ммоль) и Cs2CO3 (1,07 мг, 3,31 ммоль) добавили к 1,4-диоксану (10 мл) / вода (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 45 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 5% - 25%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (300 мг, 57%).
Стадия 2. 3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензойная кислота: Метил 3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоат (300 мг, 0,62 ммоль) и LiOH·H2O (52 мг, 1,25 ммоль) растворили в THF (10 мл) / вода (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 6 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили 1M HCl (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (250 мг, 86%).
Стадия 3. Соединение 974: 3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензойную кислоту (50 мг, 0,11 ммоль), (S)-пирролидин-3-ол (14 мг, 0,16 ммоль), EDC (31 мг, 0,16 ммоль), HOBt (22 мг, 0,16 ммоль) и DIPEA (0,04 мл, 0,21 ммоль) растворили в DMF (4 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 16 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (20 мг, 35%).
1H NMR (400 MHz, CDCl3) δ 8,71 (s, 2 H), 7,46 - 7,37 (m, 3 H), 4,63 - 4,52 (m, 1 H), 4,28 (m, 2 H), 3,88 - 3,47 (m, 4 H), 2,88 (m, 2 H), 2,52 (s, 2 H), 2,25 - 1,78 (m, 14 H), 1,47 (m, 2 H); MS (ESI) m/z 537 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 974, соединения Таблицы 88 синтезировали с использованием 3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензойной кислоты и реагента из Таблицы 87.
Таблица 87.
Таблица 88.
Пример 91. Соединение 978:(S)-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипирролидин-1-ил)метанон
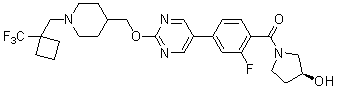
Стадия 1. этил 2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин (продукт синтеза стадии 1 соединения 970; 450 мг, 1,10 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (257 мг, 1,21 ммоль), Pd(dbpf)Cl2 (22 мг, 0,03 ммоль) и Cs2CO3 (1,07 мг, 3,31 ммоль) добавили к 1,4-диоксану (10 мл) / вода (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 45 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 5% - 25%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (300 мг, 55%).
Стадия 2. 2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) пиримидин-5-ил)бензойная кислота: Этил 2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиримидин-5-ил)бензоат (300 мг, 0,61 ммоль) и LiOH·H2O (51 мг, 1,21 ммоль) растворили в THF (10 мл) / вода (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 6 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили 1M HCl (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (280 мг, 99%).
Стадия 3. Соединение 978: 2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензойную кислоту (50 мг, 0,11 ммоль), (S)-пирролидин-3-ол (14 мг, 0,16 ммоль), EDC (31 мг, 0,16 ммоль), HOBt (22 мг, 0,16 ммоль) и DIPEA (0,04 мл, 0,21 ммоль) растворили в DMF (4 мл) при комнатной температуре. После перемешивания при 60 °C в течение 16 часов, реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (20 мг, 35%).
1H NMR (400 MHz, CDCl3) δ 8,71 (m, 2 H), 7,55 (m, 1 H), 7,37 (m, 1 H), 7,26 (m, 1 H), 4,62 - 4,51 (m, 1 H), 4,29 (m, 2 H), 3,84 - 3,32 (m, 4 H), 2,89 (m, 2 H), 2,53 (m, 2 H), 2,35 - 1,62 (m, 14 H), 1,48 (m, 2 H); MS (ESI) m/z 537 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 978, соединения Таблицы 90 синтезировали с использованием 2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензойной кислоты и реагента из Таблицы 89.
Таблица 89.
Таблица 90.
Пример 92. Соединение 1007: (R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)метанон
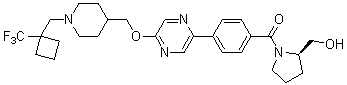
Стадия 1. 2-йодо-5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин:
(1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метанол (880 мг, 3,50 ммоль) растворили в THF (30 мл). При 0 °C, NaH (126 мг, 5,25 ммоль) добавили к этой смеси, и перемешивали в течение 30 минут. 2-бром-5-йодопиразин (1,09 г, 3,85 ммоль) добавили к этой смеси, после чего перемешивали при 55 °C в течение 10 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки.
Стадия 2. метил 4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) пиразин-2-ил)бензоат: 2-йодо-5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин (350 мг, 0,77 ммоль), 4-(метоксикарбонил)фенилборную кислоту (152 мг, 0,85 ммоль), Pd(dbpf)Cl2 (15 мг, 0,02 ммоль) и Cs2CO3 (747 мг, 2,31 ммоль) добавили к 1,4-диоксану (10 мл) / вода (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 45 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 5% - 25%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (210 мг, 59%).
Стадия 3. 4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойная кислота: Метил 4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат (210 мг, 0,45 ммоль) и LiOH·H2O (38 мг, 0,91 ммоль) растворили в THF (10 мл) / вода (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 4 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили 1M HCl (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (200 мг, 98%).
Стадия 4. Соединение 1007: 4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойную кислоту (50 мг, 0,11 ммоль), (R)-пирролидин-2-илметанол (17 мг, 0,17 ммоль), EDC (32 мг, 0,17 ммоль), HOBt (23 мг, 0,17 ммоль) и DIPEA (0,04 мл, 0,22 ммоль) растворили в DMF (2 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 16 часов. Концентрат разбавили водой (4 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества светло-коричневого цвета (25 мг, 42%).
1H NMR (400 MHz, CDCl3) δ 8,52 (s, 1 H), 8,29 (s, 1 H), 7,98 (d, 2 H, J = 8,2 Hz), 7,63 (d, 2 H, J = 8,2 Hz), 4,91 (d, 1 H, J = 6,7 Hz), 4,44 (q, 1 H, J = 7,2 Hz), 4,24 (d, 2 H, J = 5,4 Hz), 3,81 (m, 2 H), 3,55 (m, 2 H), 2,89 (m, 2 H), 2,53 (s, 2 H), 2,25 - 1,62 (m, 15 H), 1,45 (m, 2 H); MS (ESI) m/z 533 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1007, соединения Таблицы 92 синтезировали с использованием 4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойной кислоты и реагента из Таблицы 91.
Таблица 91.
Таблица 92.
Пример 93. Соединение 1010: (R)-(3-фтор-4-(5-((1-((1-(трифторметил)циклобутил) метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
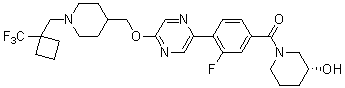
Стадия 1. метил 3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат: 2-йодо-5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин (продукт синтеза стадии 1 соединения 1007; 350 мг, 0,77 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (167 мг, 0,85 ммоль), Pd(dbpf)Cl2 (15 мг, 0,02 ммоль) и Cs2CO3 (747 мг, 2,31 ммоль) добавили к 1,4-диоксану (10 мл) / вода (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 45 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 5% - 25%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (210 мг, 57%).
Стадия 2. 3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) пиразин-2-ил)бензойная кислота: Метил 3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиразин-2-ил)бензоат (210 мг, 0,44 ммоль) и LiOH·H2O (37 мг, 0,87 ммоль) растворили в THF (10 мл) / вода (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 4 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили 1M HCl (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (200 мг, 98%).
Стадия 3. Соединение 1010: 3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойную кислоту (50 мг, 0,11 ммоль), (R)-пиперидин-3-ол гидрохлорид (22 мг, 0,16 ммоль), EDC (31 мг, 0,16 ммоль), HOBt (22 мг, 0,16 ммоль) и DIPEA (0,04 мл, 0,21 ммоль) растворили в DMF (2 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 16 часов. Концентрат разбавили водой (4 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества светло-коричневого цвета (21 мг, 36%).
1H NMR (400 MHz, CDCl3) δ 8,62 (s, 1 H), 8,33 (m, 1 H), 8,02 (t, 1 H, J = 7,8 Hz), 7,32 (m, 2 H), 4,33 (m, 2 H), 4,04 - 3,21 (m, 7 H), 2,90 (m, 2 H), 2,54 (s, 2 H), 2,35 - 1,44 (m, 16 H); MS (ESI) m/z 551 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1010, соединения Таблицы 94 синтезировали с использованием 3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиразин-2-ил)бензойной кислоты и реагента из Таблицы 93.
Таблица 93.
Таблица 94.
Пример 94. Соединение 1012:
(R)-(2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанон
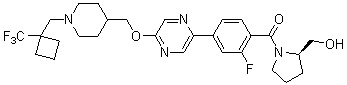
Стадия 1. этил 2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат: 2-йодо-5-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиразин (продукт синтеза стадии 1 соединения 1007; 350 мг, 0,77 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (179 мг, 0,85 ммоль), Pd(dbpf)Cl2 (15 мг, 0,02 ммоль) и Cs2CO3 (747 мг, 2,31 ммоль) добавили к 1,4-диоксану (10 мл) / вода (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 45 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc/гексан = 5% - 25%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (300 мг, 79%).
Стадия 2. 2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси) пиразин-2-ил)бензойная кислота: Этил 2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиразин-2-ил)бензоат (300 мг, 0,61 ммоль) и LiOH·H2O (51 мг, 1,21 ммоль) растворили в THF (10 мл) / вода (5 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 4 часов. Реакционную смесь упарили при пониженном давлении. Концентрат разбавили 1M HCl (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (280 мг, 99%).
Стадия 3. Соединение 1012: 2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойную кислоту (50 мг, 0,11 ммоль), (R)-пирролидин-2-илметанол (16 мг, 0,16 ммоль), EDC (31 мг, 0,16 ммоль), HOBt (22 мг, 0,16 ммоль) и DIPEA (0,04 мл, 0,21 ммоль) растворили в DMF (2 мл) при комнатной температуре. Раствор перемешивали при 60 °C в течение 16 часов. Концентрат разбавили водой (4 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества светло-коричневого цвета (24 мг, 41%).
1H NMR (400 MHz, CDCl3) δ 8,52 (m, 1 H), 8,29 (m, 1 H), 7,75 (m, 2 H), 7,53 (m, 1 H), 4,72 (m, 1 H), 4,40 (m, 1 H), 4,23 (d, 2 H, J = 5,4 Hz), 3,84 - 3,78 (m, 2 H), 3,45 (m, 2 H), 2,89 (m, 2 H), 2,54 (s, 2 H), 2,24 - 1,64 (m, 15 H), 1,45 (m, 2 H); MS (ESI) m/z 551 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1012, соединения Таблицы 96 синтезировали с использованием 2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метокси)пиразин-2-ил)бензойной кислоты и реагента из Таблицы 95.
Таблица 95.
Таблица 96.
Пример 95. Соединение 772:(S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил) циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
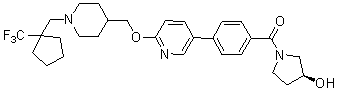
Стадия 1. этил 1-(1-(трифторметил)циклопентанекарбонил)пиперидин-4-карбоксилат:
1-(трифторметил)циклопентанекарбоновую кислоту (500 мг, 2,74 ммоль), этил пиперидин-4-карбоксилат (518 мг, 3,29 ммоль), EDC (1,05 г, 5,49 ммоль) и HOBt (742 мг, 5,49 ммоль) растворили в DMF 5 мл. DIPEA (0,97 мл, 5,49 ммоль) добавили к этой смеси, и реакцию проводили при 60ºC в течение 8 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Экстрагированный органический слой высушили над MgSO4, и затем отфильтровали. Фильтрат очистили с помощью колоночной хроматографии на силикагеле (10-30% EtOAc/гексан) с получением целевого соединения в виде бесцветного масла (400 мг, 45%).
Стадия 2. (1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метанол: Этил 1-(1-(трифторметил)циклопентанекарбонил)пиперидин-4-карбоксилат (1,06 г, 3,30 ммоль) растворили в сухом THF 20 мл. При 0ºC, LAH (1 M в THF, 16,49 мл, 16,49 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при 50 ºC в течение 10 часов. Реакцию погасили путем медленного добавления MeOH при 0 ºC. Реакционную смесь разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный экстрагированный органический слой высушили над MgSO4, и затем отфильтровали с получением целевого соединения в виде бесцветного масла (844 мг, 96%).
Стадия 3. 5-бром-2-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин: (1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метанол (844 мг, 3,18 ммоль) растворили в THF 10 мл. При 0 ºC, NaH (115 мг, 4,77 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при комнатной температуре в течение 20 минут. При 0 ºC, 2,5-дибромпиридин (829 мг, 3,50 ммоль) в THF медленно добавили к реакционной смеси. Реакцию проводили при 50 ºC в течение 10 часов. По окончании реакции, реакционную смесь разбавили ледяной водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (900 мг, 67%).
Стадия 4. метил 4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин (400 мг, 0,95 ммоль), 4-(метоксикарбонил)фенилборную кислоту (188 мг, 1,04 ммоль), Pd(dbpf)Cl2 (19 мг, 0,03 ммоль), Cs2CO3 (922 мг, 2,85 ммоль) добавили в микроволновой реактор, и затем 1,4-диоксан 4 мл и воду 2 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. Реакционную смесь отфильтровали через слой цеолитов. Фильтрат разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (330 мг, 73%).
Стадия 5. 4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота: Метил 4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (330 мг, 0,69 ммоль) растворили в смеси растворителей THF 4 мл / вода 4 мл. LiOH·H2O (58 мг, 1,38 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 4 часов. Растворитель упарили при пониженном давлении. После добавления 1M HCl к этой смеси, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (300 мг, 94%).
Стадия 6. Соединение 772: 4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (50 мг, 0,11 ммоль), (S)-пирролидин-3-ол (14 мг, 0,16 ммоль), EDC (41 мг, 0,22 ммоль) и HOBt (29 мг, 0,22 ммоль) растворили в DMF 2 мл. DIPEA (0,04 мл, 0,22 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 10 часов. Реакционную смесь охладили до комнатной температуры и разбавили водой. Образовавшийся осадок отфильтровали, тщательно промыли водой, и высушили с получением целевого соединения в виде твердого вещества белого цвета (21 мг, 37%).
1H NMR (400 MHz, CDCl3) δ 8,37 (s, 1 H), 7,80 (dd, 1 H, J = 10,2, 3,6 Hz), 7,65 - 7,53 (m, 4 H), 6,83 (d, 1 H, J = 8,6 Hz), 4,62 - 4,50 (m, 1 H), 4,29 - 4,18 (m, 2 H), 3,87 - 3,48 (m, 5 H), 2,89 (m, 2 H), 2,47 (s, 2 H), 2,30 (t, 2 H, J = 11,2 Hz), 2,20 - 1,96 (m, 3 H), 1,87 - 1,76 (m, 10 H), 1,45 (m, 2 H); MS (ESI) m/z 532 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 772, соединения Таблицы 98 синтезировали с использованием 4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 97.
Таблица 97.
Таблица 98.
Пример 96. Соединение 776:(S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил) циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанон
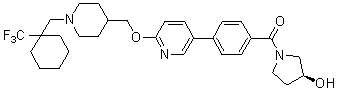
Стадия 1. этил 1-(1-(трифторметил)циклогексанкарбонил)пиперидин-4-карбоксилат:
1-(трифторметил)циклогексанкарбоновую кислоту (500 мг, 2,55 ммоль), этил пиперидин-4-карбоксилат (481 мг, 3,06 ммоль), EDC (977 мг, 5,09 ммоль) и HOBt (689 мг, 5,09 ммоль) растворили в DMF 5 мл. DIPEA (0,90 мл, 5,09 ммоль) добавили к этой смеси. Реакцию проводили при 60 ºC в течение 8 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl и проэкстрагировали с помощью EtOAc. Экстрагированный органический слой высушили над MgSO4, и затем отфильтровали. Фильтрат очистили с помощью колоночной хроматографии на силикагеле (10-30% EtOAc/гексан) с получением целевого соединения в виде бесцветного масла (250 мг, 29%).
Стадия 2. (1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метанол:
Этил 1-(1-(трифторметил)циклогексанкарбонил)пиперидин-4-карбоксилат (576 мг, 1,72 ммоль) растворили в сухом THF 10 мл. При 0 ºC, LAH (1 M в THF, 8,59 мл, 8,59 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при 50 ºC в течение 10 часов. Реакцию погасили путем медленного добавления MeOH при 0 ºC. Реакционную смесь разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный экстрагированный органический слой высушили над MgSO4, и затем отфильтровали с получением целевого соединения в виде бесцветного масла (430 мг, 90%).
Стадия 3. 5-бром-2-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин: (1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метанол (430 мг, 1,54 ммоль) растворили в THF 10 мл. При 0 ºC, NaH (55 мг, 2,31 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при комнатной температуре в течение 20 минут. При 0 ºC, 2,5-дибромпиридин (401 мг, 1,69 ммоль) в THF медленно добавили к реакционной смеси. Реакцию проводили при 50 ºC в течение 10 часов. По окончании реакции, реакционную смесь разбавили ледяной водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (380 мг, 57%).
Стадия 4. метил 4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси) пиридин-3-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин (380 мг, 0,87 ммоль), 4-(метоксикарбонил)фенилборную кислоту (173 мг, 0,96 ммоль), Pd(dbpf)Cl2 (17 мг, 0,03 ммоль), Cs2CO3 (848 мг, 2,62 ммоль) добавили в микроволновой реактор, и затем 1,4-диоксан 4 мл и воду 2 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. Реакционную смесь отфильтровали через слой цеолитов. Фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (20-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (250 мг, 58%).
Стадия 5. 4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота: Метил 4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (250 мг, 0,51 ммоль) растворили в смеси растворителей THF 4 мл / вода 4 мл. LiOH·H2O (43 мг, 1,02 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 4 часов. Растворитель упарили при пониженном давлении. После добавления 1M HCl к этой смеси, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (210 мг, 87%).
Стадия 6. Соединение 776: 4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (45 мг, 0,09 ммоль), (S)-пирролидин-3-ол (12 мг, 0,14 ммоль), EDC (36 мг, 0,19 ммоль) и HOBt (26 мг, 0,19 ммоль) растворили в DMF 2 мл. DIPEA (0,03 мл, 0,19 ммоль) добавили к этой смеси, реакцию проводили при 60 ºC в течение 10 часов. Реакционную смесь охладили до комнатной температуры и разбавили водой. Образовавшийся осадок отфильтровали, тщательно промыли водой, и высушили с получением целевого соединения в виде твердого вещества белого цвета (24 мг, 47%).
1H NMR (400 MHz, CDCl3) δ 8,37 (s, 1 H), 7,80 (m, 1 H), 7,67 - 7,54 (m, 4 H), 6,81 (m, 1 H), 4,61 - 4,45 (m, 1 H), 4,28 - 4,17 (m, 2 H), 3,84 - 3,48 (m, 4 H), 2,87 (m, 2 H), 2,48 (s, 2 H), 2,32 - 2,00 (m, 5 H), 1,88 - 1,35 (m, 15 H); MS (ESI) m/z 546 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 776, соединения Таблицы 100 синтезировали с использованием 4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 99.
Таблица 99.
Таблица 100.
Пример 97. Соединение 828: (S)-1-(4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамид
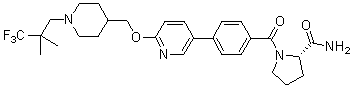
Стадия 1. этил 1-(3,3,3-трифтор-2,2-диметилпропаноил)пиперидин-4-карбоксилат: 3,3,3-трифтор-2,2-диметилпропановую кислоту (500 мг, 3,20 ммоль), этил пиперидин-4-карбоксилат (604 мг, 3,84 ммоль), EDC (1,23 г, 6,41 ммоль) и HOBt (866 мг, 6,41 ммоль) растворили в DMF 15 мл. DIPEA (1,13 мл, 6,41 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 8 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl и проэкстрагировали с помощью EtOAc. Экстрагированный органический слой высушили над MgSO4, и затем отфильтровали. Фильтрат очистили с помощью колоночной хроматографии на силикагеле (10-30% EtOAc/гексан) с получением целевого соединения в виде бесцветного масла (300 мг, 36%).
Стадия 2. (1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метанол: Этил 1-(3,3,3-трифтор-2,2-диметилпропаноил)пиперидин-4-карбоксилат (260 мг, 0,88 ммоль) растворили в сухом THF 20 мл. При 0 ºC, LAH (1 M в THF, 4,40 мл, 4,40 ммоль) медленно добавили к реакционной смеси и реакцию проводили при 50 ºC в течение 10 часов. Реакцию погасили путем медленного добавления MeOH при 0 ºC. Реакционную смесь разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный экстрагированный органический слой высушили над MgSO4, и затем отфильтровали с получением целевого соединения в виде бесцветного масла (170 мг, 81%).
Стадия 3. 5-бром-2-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин:
(1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метанол(170 мг, 0,71 ммоль) растворили в THF 10 мл. При 0ºC, NaH (26 мг, 1,07 ммоль) медленно добавили к реакционной смеси. Реакцию проводили при комнатной температуре в течение 20 минут. При 0 ºC, 2,5-дибромпиридин (185 мг, 0,78 ммоль) в THF медленно добавили к реакционной смеси, и реакцию проводили при 50 ºC в течение 10 часов. По окончании реакции, реакционную смесь разбавили ледяной водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде бесцветного масла (260 мг, 93%).
Стадия 4. метил 4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат: 5-бром-2-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин (260 мг, 0,66 ммоль), 4-(метоксикарбонил)фенилборную кислоту (130 мг, 0,72 ммоль), Pd(dbpf)Cl2 (13 мг, 0,02 ммоль), Cs2CO3 (640 мг, 1,97 ммоль) добавили в микроволновой реактор, и затем 1,4-диоксан 6 мл и воду 3 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. Реакционную смесь отфильтровали через слой цеолитов. Фильтрат разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (200 мг, 68%).
Стадия 5. 4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота: Метил 4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (200 мг, 0,44 ммоль) растворили в смеси растворителей THF 10 мл / вода 10 мл. LiOH·H2O (37 мг, 0,89 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 4 часов. Растворитель упарили при пониженном давлении. После добавления 1M HCl к этой смеси, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (150 мг, 77%).
Стадия 6. Соединение 828: 4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (40 мг, 0,09 ммоль), L-пролинамид (16 мг, 0,14 ммоль), EDC (35 мг, 0,18 ммоль) и HOBt (25 мг, 0,18 ммоль) растворили в DMF 2 мл. DIPEA (24 мг, 0,18 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 10 часов. Реакционную смесь охладили до комнатной температуры и разбавили водой. Образовавшийся осадок отфильтровали, тщательно промыли водой, и высушили с получением целевого соединения в виде твердого вещества белого цвета (20 мг, 41%).
1H NMR (400 MHz, CDCl3) δ 8,38 (d, 1 H, J = 2,1 Hz), 7,81 (dd, 1 H, J = 10,2, 3,6 Hz), 7,64 - 7,56 (m, 4 H), 6,99 (s, 1 H), 6,83 (d, 1 H, J = 8,6 Hz), 5,56 (s, 1 H), 4,82 (dd, 1 H, J = 10,2, 3,6 Hz), 4,19 (d, 2 H, J = 4,8 Hz), 3,66 - 3,56 (m, 2 H), 2,83 (d, 2 H, J = 9,0 Hz), 2,47 - 2,30 (m, 4 H), 2,10 (m, 2 H), 1,90 - 1,70 (m, 5 H), 1,42 (m, 2 H), 1,11 (m, 6 H); MS (ESI) m/z 423 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 828, соединения Таблицы 102 синтезировали с использованием 4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 101.
Таблица 101.
Таблица 102.
Пример 98. Соединение 809: (R)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
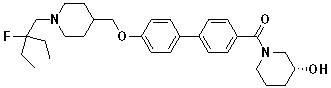
Стадия 1. 2,2-диэтилоксиран: 3-метиленпентан (2 г, 23,76 ммоль) и m-CPBA (6,56 г, 38,02 ммоль) растворили в CH2Cl2 30 мл. При 0 ºC, реакцию проводили в течение дня. Реакционную смесь разбавили насыщенным водным раствором Na2SO3 и проэкстрагировали с CH2Cl2. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении с получением целевого соединения в виде бесцветного масла (1,8 г, 75%).
Стадия 2. 3-((4-((4-бромфенокси)метил)пиперидин-1-ил)метил)пентан-3-ол:
4-((4-бромфенокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 4 соединения 686; 500 мг, 1,85 ммоль) растворили в EtOH 4 мл. 2,2-Диэтилоксиран (продукт синтеза стадии 1 соединения 809; 930 мг, 9,25 ммоль), K2CO3 (512 мг, 3,70 ммоль) и воду 2 мл добавили туда же. Смесь перемешивали при микроволновом облучении при 110 ºC в течение 20 минут. По окончании реакции, EtOH упарили из реакционной смеси при пониженном давлении, и затем к ней добавили немного воды. Полученный осадок отфильтровали и высушили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (600 мг, 87%).
Стадия 3. 4-((4-бромфенокси)метил)-1-(2-этил-2-фторбутил)пиперидин:
3-((4-((4-бромфенокси)метил)пиперидин-1-ил)метил)пентан-3-ол (596 мг, 1,61 ммоль) растворили в CH2Cl2 5 мл. DAST (285 мг, 1,77 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 3 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с CH2Cl2. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и отфильтровали для удаления твердого остатка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, 15 - 20% EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (520 мг, 87%).
Стадия 4. метил 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат:
4-((4-бромфенокси)метил)-1-(2-этил-2-фторбутил)пиперидин (130 мг, 0,35 ммоль), 4-(метоксикарбонил)фенилборную кислоту (69 мг, 0,38 ммоль), Pd(dbpf)Cl2 (11 мг, 0,02 ммоль) и Cs2CO3 (228 мг, 0,70 ммоль) растворили в 1,4-диоксане 4 мл и воде 1 мл. Реакцию проводили при микроволновом облучении при 120 ºC в течение 15 минут. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (105 мг, 70%).
Стадия 5. 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота:
Метил 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (105 мг, 0,25 ммоль) растворили в THF:MeOH:вода = 3/1,5/1 мл. LiOH·H2O (21 мг, 0,49 ммоль) добавили к этой смеси. Затем смесь кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении, после чего отрегулировали pH до значения ниже 6 с помощью 1N HCl. Полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (72 мг, 71%).
Стадия 6. Соединение 809: 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (35 мг, 0,09 ммоль), (R)-пиперидин-3-ол (13 мг, 0,13 ммоль) и BOP (75 мг, 0,17 ммоль) растворили в DMF 1 мл. После перемешивания в течение 10 минут при комнатной температуре, TEA (26 мг, 0,26 ммоль) добавили к этой смеси, после чего перемешивали при 50 ºC в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (17 мг, 40%).
1H NMR (400 MHz, CDCl3) δ 7,49 (m, 6 H), 6,96 (d, 2 H, J = 6,8 Hz), 3,82 (m, 4 H), 3,42 (m, 3 H), 2,99 (m, 2 H), 2,49 (s, 1 H), 2,43 (s, 1 H), 2,15 (m, 2 H), 1,71 (m, 11 H), 1,64 (m, 2 H), 0,89 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 497 (M + H).
Согласно вышеописанному процессу синтеза соединения 809, соединения Таблицы 104 синтезировали с использованием 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 103.
Таблица 103.
Таблица 104.
Пример 99. Соединение 888: (S)-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(3-гидроксипирролидин-1-ил)метанон
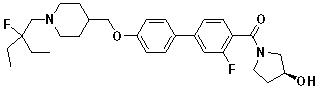
Стадия 1. этил 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоксилат: 4-((4-бромфенокси)метил)-1-(2-этил-2-фторбутил)пиперидин (продукт синтеза стадии 3 соединения 809; 130 мг, 0,35 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (345 мг, 1,63 ммоль), Pd(dppf)Cl2 (60 мг, 0,07 ммоль) и Na2CO3 (313 мг, 2,95 ммоль) растворили в DME 12 мл и воде 3 мл, и затем кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (390 мг, 54%).
Стадия 2. 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоновая кислота: Этил 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоксилат (390 мг, 0,85 ммоль) растворили в THF/MeOH/вода = 6/3/2 мл. LiOH·H2O (71 мг, 1,70 ммоль) добавили к этой смеси. Затем смесь кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении, после чего отрегулировали pH до значения ниже 6 с помощью 1 N HCl. Полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (340 мг, 92%).
Стадия 3. Соединение 888: 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоновую кислоту (0,03 г, 0,07 ммоль), EDC (0,03 г, 0,14 ммоль), HOBt (0,02 г, 0,14 ммоль) и DIPEA (0,036 мл, 0,209 ммоль) растворили в DMF (1 мл). При комнатной температуре, (S)-пирролидин-3-ол (0,01 г, 0,10 ммоль) добавили к этой смеси, после чего перемешивали при 50 °C в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, метанол / дихлорметан = 2% - 5%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (22 мг, 63%).
1H NMR (400 MHz, CDCl3) δ 7,49 (m, 3 H), 7,39 (m, 1 H), 7,28 (m, 1 H), 6,98 (d, 2 H, J = 8,7 Hz), 4,62 (s, 0,5 H), 4,49 (s, 0,5 H), 3,86 (m, 2 H), 3,70 (m, 2 H), 3,46 (m, 1 H), 2,96 (m, 2 H), 2,43 (m, 2 H), 1,97 - 1,65 (m, 11 H), 0,91 (t, 6 H, J = 7,4 Hz); MS (ESI) m/z 501 (M + H).
Согласно вышеописанному процессу синтеза соединения 888, соединения Таблицы 106 синтезировали с использованием 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоновой кислоты и реагента из Таблицы 105.
Таблица 105.
Таблица 106.
Пример 100. Соединение 895: (S)-1-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенилкарбонил)пирролидин-2-карбоксамид
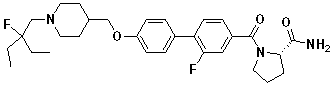
Стадия 1. метил 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-карбоксилат: 4-((4-бромфенокси)метил)-1-(2-этил-2-фторбутил)пиперидин (продукт синтеза стадии 3 соединения 809; 550 мг, 1,48 ммоль), 2-фтор-4-(метоксикарбонил) фенилборную кислоту (322 мг, 1,63 ммоль), Pd(dppf)Cl2 (60 мг, 0,07 ммоль), Na2CO3 (313 мг, 2,95 ммоль) растворили в DME 12 мл и воде 3 мл, и затем кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (350 мг, 53%).
Стадия 2. 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-карбоновая кислота: Метил 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-карбоксилат (350 мг, 0,79 ммоль) растворили в THF/MeOH/вода = 6/3/2 мл. LiOH·H2O (66 мг, 1,57 ммоль) добавили к этой смеси. Затем смесь кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении, после чего отрегулировали pH до значения ниже 6 с помощью 1 N HCl. Полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (310 мг, 91%).
Стадия 3. Соединение 895: 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-карбоновую кислоту (0,03 г, 0,07 ммоль), EDC (0,03 г, 0,14 ммоль), HOBt (0,02 г, 0,14 ммоль) и DIPEA (0,04 мл, 0,21 ммоль) растворили в DMF (1 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (12 мг, 0,10 ммоль) добавили к этой смеси, после чего перемешивали при 50 °C в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, метанол / дихлорметан = 2% - 5%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (23 мг, 62%).
1H NMR (400 MHz, CDCl3) δ 7,48 (m, 3 H), 7,35 (m, 2 H), 6,97 (d, 2 H, J = 8,7 Hz), 6,91 (s, 1 H), 5,56 (s, 1 H), 4,78 (m, 1 H), 3,84 (d, 2 H, J = 5,9 Hz), 3,61 (m, 2 H), 3,00 (m, 2 H), 2,44 (m, 2 H), 2,03 (m, 4 H), 1,89 - 1,44 (m, 12 H), 0,89 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 528 (M + H).
Согласно вышеописанному процессу синтеза соединения 895, соединения Таблицы 108 синтезировали с использованием 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-карбоновой кислоты и реагента из Таблицы 107.
Таблица 107.
Таблица 108.
Пример 101. Соединение 896: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамид
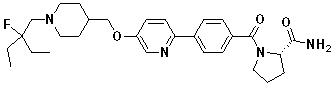
Стадия 1. 3-((4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол:
2-хлор-5-(пиперидин-4-илметокси)пиридин гидрохлорид (продукт синтеза стадии 2 соединения 691; 1,4 г, 5,32 ммоль) растворили в EtOH 6 мл. 2,2-диэтилоксиран (продукт синтеза стадии 1 соединения 809; 1,60 г, 15,96 ммоль), K2CO3 (1,47 г, 10,64 ммоль) и воду 3 мл добавили туда же. Смесь перемешивали при микроволновом облучении при 110 ºC в течение 20 минут. Этанол упарили из реакционной смеси при пониженном давлении, после чего к этой смеси добавили воду. Полученный осадок отфильтровали и высушили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (1,61 г, 92%).
Стадия 2. 2-хлор-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин:
3-((4-((6-хлорпиридин-3-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол (1,61 г, 4,93 ммоль) растворили в CH2Cl2 10 мл. DAST (873 мг, 5,42 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 3 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с CH2Cl2. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и отфильтровали для удаления твердого остатка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (40 г ISCO силикагелевый картридж, 15 - 20% Гексан/EtOAc) с получением целевого соединения в виде твердого вещества белого цвета (1,24 г, 76%).
Стадия 3. метил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат:
2-хлор-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин (550 мг, 1,67 ммоль), 4-(метоксикарбонил)фенилборную кислоту (331 мг, 1,84 ммоль), Pd(dppf)Cl2 (68 мг, 0,08 ммоль) и Na2CO3 (354 мг, 3,35 ммоль) растворили в DME 12 мл и воде 3 мл, и затем кипятили с обратным холодильником и перемешивали в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (310 мг, 43%).
Стадия 4. 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойная кислота:
метил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоат (310 мг, 0,98 ммоль) растворили в THF/MeOH/вода = 6/3/2 мл. LiOH·H2O (61 мг, 1,45 ммоль) добавили к этой смеси. Затем смесь кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении, после чего отрегулировали pH до значения ниже 6 с помощью 1 N HCl. Полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (210 мг, 70%).
Стадия 5. Соединение 896: 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойную кислоту (0,05 г, 0,12 ммоль), EDC (0,05 г, 0,24 ммоль), HOBt (0,03 г, 0,24 ммоль) и DIPEA (0,06 мл, 0,36 ммоль) растворили в CH2Cl2 (3 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (0,02 г, 0,18 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, метанол / дихлорметан = 2% - 5%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,04 г, 61%).
1H NMR (400 MHz, CDCl3) δ 8,37 (d, 1 H, J = 2,6 Hz), 7,97 (d, 2 H, J = 8,2 Hz), 7,62 (m, 3 H), 7,26 (m, 1 H), 7,06 (s, 1 H), 5,78 (s, 1 H), 4,78 (m, 1 H), 3,88 (d, 2 H, J = 5,9 Hz), 3,61 (m, 2 H), 3,00 (d, 2 H, J = 10,7 Hz), 2,49 - 2,43 (m, 2 H), 2,38 (m, 1 H), 2,08 (m, 4 H), 1,80 (m, 8 H), 1,42 (m, 2 H), 0,88 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 511 (M + H).
Согласно вышеописанному процессу синтеза соединения 896, соединения Таблицы 110 синтезировали с использованием 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензойной кислоты и реагента из Таблицы 109.
Таблица 109.
Таблица 110.
Пример 102. Соединение 898: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторбензоил)пирролидин-2-карбоксамид
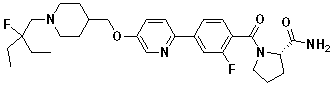
Стадия 1. этил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторбензоат: 2-хлор-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин (продукт синтеза стадии 2 соединения 896; 550 мг, 1,67 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (390 мг, 1,84 ммоль), Pd(dppf)Cl2 (68 мг, 0,08 ммоль) и Na2CO3 (354 мг, 3,35 ммоль) растворили в DME 12 мл и воде 3 мл, и затем кипятили с обратным холодильником в течение дня. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (290 мг, 37%).
Стадия 2. 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторбензойная кислота: Этил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторбензоат (290 мг, 0,63 ммоль) растворили в THF/MeOH/вода = 6/3/2 мл. LiOH·H2O (53 мг, 1,26 ммоль) добавили к этой смеси. Затем смесь кипятили с обратным холодильником в течение 3 часов. По окончании реакции, растворитель высушили при пониженном давлении, после чего отрегулировали pH до значения ниже 6 с помощью 1 N HCl. Полученный осадок отфильтровали, получив целевое соединение в виде твердого вещества белого цвета (220 мг, 80%).
Стадия 3. Соединение 898: 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторбензойную кислоту (0,05 г, 0,12 ммоль), EDC (0,05 г, 0,24 ммоль), HOBt (0,03 г, 0,24 ммоль) и DIPEA (0,06 мл, 0,36 ммоль) растворили в CH2Cl2 (3 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (0,02 г, 0,18 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, метанол / дихлорметан = 2% - 5%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,04 г, 61%).
1H NMR (400 MHz, CDCl3) δ 8,37 (d, 1 H, J = 2,9 Hz), 7,75 (m, 2 H), 7,67 (d, 1 H, J = 8,8 Hz), 7,49 (t, 1 H, J = 7,6 Hz), 7,27 (dd, 1 H, J = 8,5, 3,1 Hz), 6,93 (s, 1 H), 5,64 (s, 1 H), 4,81 (m, 1 H), 3,89 (d, 2 H, J = 6,0 Hz), 3,50 (m, 1 H), 3,40 (m, 1 H), 3,00 (m, 2 H), 2,43 (m, 3 H), 2,08 (m, 4 H), 1,92 - 1,46 (m, 10 H), 0,89 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 529 (M + H).
Согласно вышеописанному процессу синтеза соединения 898, соединения Таблицы 112 синтезировали с использованием 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторбензойной кислоты и реагента из Таблицы 111.
Таблица 111.
Таблица 112.
Пример 103. Соединение 954: (R)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанон
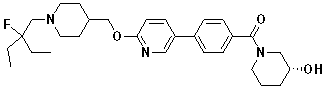
Стадия 1. 3-((4-((5-бромпиридин-2-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол:
5-бром-2-(пиперидин-4-илметокси)пиридин гидрохлорид (продукт синтеза стадии 3 соединения 784; 2,70 г, 8,77 ммоль), 2,2-диэтилоксиран (продукт синтеза стадии 1 соединения 809; 4,39 г, 43,88 ммоль) и K2CO3 (2,42 г, 17,55 ммоль), добавили к EtOH (6 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 115 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (1,50 г, 46%, желтое масло).
Стадия 2. 5-бром-2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин: 3-((4-((5-бромпиридин-2-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол (1,50 г, 4,04 ммоль) растворили в CH2Cl2 (8 мл). При 0 °C, DAST (0,58 мл, 4,44 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 3 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (0,95 г, 63%, желтое масло).
Стадия 3. метил 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат:
5-бром-2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин (0,30 г, 0,80 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,17 г, 0,96 ммоль), Pd(dppf)Cl2 (0,06 г, 0,08 ммоль) и Na2CO3 (0,17 г, 1,60 ммоль) растворили в DME (12 мл) / вода (3 мл). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. К фильтрату добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 20% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,21 г, 61%).
Стадия 4. 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторбензойная кислота: Метил 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (0,18 г, 0,39 ммоль) и LiOH·H2O (0,03 г, 0,78 ммоль) растворили в THF / MeOH (6 мл / 3 мл) / вода (2 мл). Смесь кипятили с обратным холодильником в течение 10 часов, и затем охладили до комнатной температуры, после чего упарили при пониженном давлении. После добавления воды к концентрату, полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества желтого цвета (0,15 г, 88%).
Стадия 5. Соединение 954: 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторбензойную кислоту (0,04 г, 0,09 ммоль), EDC (0,03 г, 0,19 ммоль), HOBt (0,02 г, 0,19 ммоль) и DIPEA (0,03 г, 0,28 ммоль) растворили в DMF (1 мл). При комнатной температуре, (R)-пиперидин-3-ол (0,02 г, 0,15 ммоль) добавили к этой смеси, после чего перемешивали при 50 °C в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; дихлорметан / метанол = 0% - 5%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,02 г, 31%).
1H NMR (400 MHz, CDCl3) δ 8,36 (d, 1 H, J = 2,5 Hz), 7,78 (dd, 1 H, J = 8,6, 2,6 Hz), 7,52 (m, 4 H), 6,81 (d, 1 H, J = 8,6 Hz), 4,17 (d, 2 H, J = 6,2 Hz), 3,98 - 3,05 (m, 6 H), 2,96 (m, 2 H), 2,46 - 2,39 (m, 2 H), 2,11 (m, 2 H), 1,95 (m, 3 H), 1,69 (m, 8 H), 1,43 (m, 3 H), 0,88 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 498 (M + H).
Согласно вышеописанному процессу синтеза соединения 954, соединения Таблицы 114 синтезировали с использованием 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторбензойной кислоты и реагента из Таблицы 113.
Таблица 113.
Таблица 114.
Пример 104. Соединение 956: (R)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторфенил)(3-гидроксипиперидин-1-ил)метанон

Стадия 1. этил 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторбензоат: 5-бром-2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин (продукт синтеза стадии 2 соединения 954; 0,30 г, 0,80 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (0,18 г, 0,88 ммоль), Pd(dppf)Cl2 (0,06 г, 0,08 ммоль) и Na2CO3 (0,17 г, 1,60 ммоль), добавили к DME (12 мл) / вода (3 мл). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. К фильтрату добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 20% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,18 г, 48%).
Стадия 2. 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторбензойная кислота: Этил 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторбензоат (0,18 г, 0,39 ммоль) и LiOH·H2O (0,03 г, 0,78 ммоль) растворили в THF / MeOH (6 мл / 3 мл) / вода (2 мл). Смесь кипятили с обратным холодильником в течение 10 часов, и затем охладили до комнатной температуры, после чего упарили при пониженном давлении. После добавления воды к концентрату, полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества желтого цвета (0,15 г, 88%).
Стадия 3. Соединение 956: 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторбензойную кислоту (0,04 г, 0,08 ммоль), EDC (0,03 г, 0,16 ммоль), HOBt (0,02 г, 0,16 ммоль) и DIPEA (0,03 г, 0,24 ммоль) растворили в DMF (1 мл). При комнатной температуре, (R)-пиперидин-3-ол (0,01 г, 0,12 ммоль) добавили к этой смеси, после чего перемешивали при 50 °C в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; дихлорметан / метанол = 0% - 5%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (17 мг, 40%).
1H NMR (400 MHz, CDCl3) δ 8,34 (s, 1 H), 7,75 (m, 1 H), 7,44 (m, 1 H), 7,35 (m, 1 H), 7,24 (m, 1 H), 6,81 (d, 1 H, J = 8,6 Hz), 4,17 (d, 2 H, J = 6,1 Hz), 3,92 (m, 2 H), 3,33 (m, 3 H), 2,96 (m, 2 H), 2,46 - 2,40 (m, 2 H), 1,96 (m, 6 H), 1,69 (m, 8 H), 1,39 (m, 2 H), 0,88 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 516 (M + H).
Согласно вышеописанному процессу синтеза соединения 956, соединения Таблицы 116 синтезировали с использованием 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторбензойной кислоты и реагента из Таблицы 115.
Таблица 115.
Таблица 116.
Пример 105. Соединение 953: (S)-1-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамид
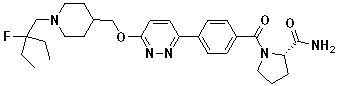
Стадия 1. трет-Бутил 4-((6-хлорпиридазин-3-илокси)метил)пиперидин-1-карбоксилат:
трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилат (продукт синтеза стадии 1 соединения 686; 3,00 г, 13,94 ммоль) и NaH (0,50 г, 20,90 ммоль) растворили в DMF (100 мл). При 0 °C, 3,6-дихлорпиридазин (2,49 г, 16,72 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 40 г картридж; EtOAc / гексан = 0% - 50%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (2,60 г, 56%).
Стадия 2. 3-хлор-6-(пиперидин-4-илметокси)пиридазин: трет-бутил 4-((6-хлорпиридазин-3-илокси)метил)пиперидин-1-карбоксилат (2,60 г, 7,93 ммоль) и HCl в 1,4-диоксане (4 M раствор в 1,4-диоксан, 9,91 мл, 39,66 ммоль) растворили в MeOH (30 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 3 часов, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (1,80 г, 85%).
Стадия 3. 3-((4-((6-хлорпиридазин-3-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол:
3-хлор-6-(пиперидин-4-илметокси)пиридазин (1,20 г, 5,27 ммоль) и Et3N (7,31 мл, 52,70 ммоль) растворили в EtOH (10 мл). 2,2-диэтилоксиран (продукт синтеза стадии 1 соединения 809; 1,06 г, 10,54 ммоль) добавили к этой смеси. Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (0,30 г, 17%, твердое вещество белого цвета ).
Стадия 4. 3-хлор-6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин:
3-((4-((6-хлорпиридазин-3-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол (0,30 г, 0,91 ммоль) растворили в дихлорметане (20 мл). При 0 °C, DAST (0,16 г, 1,00 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным раствором NaHCO3. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 50%), и упарили с получением целевого соединения в виде твердого вещества желтого цвета (0,14 г, 46%).
Стадия 5. метил 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоат: 3-хлор-6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин (0,14 г, 0,42 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,08 г, 0,42 ммоль), Pd(dbpf)Cl2 (0,01 г, 0,02 ммоль) и Cs2CO3 (0,27 г, 0,85 ммоль) добавили к 1,4-диоксану (12 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 115 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 80%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,05 г, 37%).
Стадия 6. 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензойная кислота:
метил 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоат (0,05 г, 0,12 ммоль) и LiOH·H2O (0,02 г, 0,58 ммоль) растворили в THF (2 мл) / H2O /MeOH (3 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 1 часа. Реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества желтого цвета (0,05 г, 93%).
Стадия 7. Соединение 953: 4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензойную кислоту (0,02 г, 0,05 ммоль), EDCI (0,02 г, 0,10 ммоль), HOBt (0,01 г, 0,10 ммоль) и DIPEA (0,03 г, 0,24 ммоль) растворили в DMF (2 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (0,01 г, 0,10 ммоль) добавили к этой смеси, после чего перемешивали при 60 °C в течение 12 часов. Концентрат разбавили водой (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили, и очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 10%), и упарили получив целевое соединение в виде твердого вещества светло-желтого цвета (0,01 г, 44%).
1H NMR (400 MHz, CDCl3) δ 8,05 (d, 2 H, J = 8,1 Hz), 7,79 (d, 1 H, J = 9,3 Hz), 7,64 (d, 2 H, J = 10,0 Hz), 7,04 (d, 2 H, J = 9,3 Hz), 6,95 (brs, 1 H), 4,81 - 4,80 (m, 1 H), 4,42 (d, 2 H, J = 6,4 Hz), 3,59 - 3,53 (m, 2 H), 2,96 (d, 2 H, J = 11,2 Hz), 2,44 - 2,38 (m, 3 H), 2,13 - 1,62 (m, 11 H), 1,46 - 1,23 (m, 3 H), 0,87 (t, 6 H, J = 7,4 Hz); MS (ESI) m/z 512 (M+ + H).
Пример 106. Соединение 1004 : (S)-1-(3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
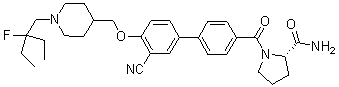
Стадия 1. метил 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 5-бром-2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бензонитрил (продукт синтеза стадии 4 соединения 1000; 400 мг, 1,01 ммоль), 4-(метоксикарбонил)фенилборную кислоту (199 мг, 1,11 ммоль), Pd(dppf)Cl2 (82 мг, 0,10 ммоль) и Cs2CO3 (656 мг, 2,01 ммоль) добавили к смеси вода (2 мл)/DME (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (184 мг, 40%).
Стадия 2. 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (184 мг, 0,41 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (85 мг, 2,03 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (158 мг, 88%).
Стадия 3. Соединение 1004: 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (35 мг, 0,08 ммоль), (S)-пирролидин-2-карбоксамид (18 мг, 0,16 ммоль), EDC (31 мг, 0,16 ммоль), HOBt (22 мг, 0,16 ммоль) и DIPEA (28 мкл, 0,16 ммоль) растворили в CH2Cl2 (1 мл). После перемешивания при комнатной температуре в течение дня, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (22 мг, 51%).
1H NMR (400 MHz, CDCl3) δ 7,79 - 7,70 (m, 2 H), 7,63 - 7,60 (m, 2 H), 7,54 - 7,52 (m, 2 H), 7,34 - 7,27 (m, 1 H), 7,02 - 6,99 (m, 1 H), 5,72 (brs, 1 H), 4,80 - 4,78 (m, 1 H), 3,94 (d, 2 H, J = 6,3 Hz), 3,66 - 3,63 (m, 1 H), 3,52 - 3,48 (m, 3 H), 3,00 (s, 1 H), 2,95 (s, 1 H), 2,71 - 2,60 (m, 2 H), 2,48 - 2,37 (m, 1 H), 2,10 - 1,99 (m, 5 H), 1,82 - 1,69 (m, 7 H), 0,87 - 0,83 (m, 6 H); MS (ESI) m/z 535 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1004, соединения Таблицы 118 синтезировали с использованием 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 117.
Таблица 117.
Таблица 118.
Пример 107. Соединение 1000 : (S)-1-(3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенилкарбонил)пирролидин-2-карбоксамид
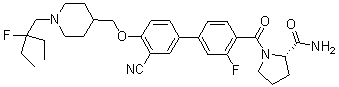
Стадия 1. 5-бром-2-((1-(2-этил-2-гидроксибутил)пиперидин-4-ил)метокси)бензонитрил:
5-бром-2-(пиперидин-4-илметокси)бензонитрил гидроксихлорид (продукт синтеза стадии 2 соединения 938; 1,00 г, 3,39 ммоль), 2,2-диэтилоксиран (1,70 г, 16,94 ммоль) и K2CO3 (937 мг, 6,78 ммоль), добавили к EtOH (5 мл) / H2O (5 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал, представляющий собой целевое соединение в виде твердого вещества белого цвета (1,33 г, 99%), использовали без дополнительной очистки.
Стадия 2. 5-бром-2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бензонитрил:
5-бром-2-((1-(2-этил-2-гидроксибутил)пиперидин-4-ил)метокси)бензонитрил (1,33 г, 3,36 ммоль) растворили в CH2Cl2 (10 мл). При 0 ºC, DAST (444 мкл, 3,36 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал, представляющий собой целевое соединение в виде желтого масла (800 мг, 59%), использовали без дополнительной очистки.
Стадия 3. этил 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоксилат: 5-бром-2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бензонитрил (400 мг, 1,01 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (235 мг, 1,11 ммоль), Pd(dppf)Cl2 (82 мг, 0,10 ммоль) и Cs2CO3 (656 мг, 2,01 ммоль) добавили к смеси вода (2 мл)/DME (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (189 мг, 38%).
Стадия 4. 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоновая кислота: Этил 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоксилат (189 мг, 0,39 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (82 мг, 1,95 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (161 мг, 90%).
Стадия 5. Соединение 1000: 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоновую кислоту (35 мг, 0,08 ммоль), (S)-пирролидин-2-карбоксамид (18 мг, 0,15 ммоль), EDC (29 мг, 0,15 ммоль) HOBt (21 мг, 0,15 ммоль) и DIPEA (27 мкл, 0,15 ммоль) растворили в CH2Cl2 (1 мл). После перемешивания при комнатной температуре в течение дня, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (25 мг, 59%).
1H NMR (400 MHz, CDCl3) δ 7,77 - 7,71 (m, 2 H), 7,51 (t, 1 H, J = 7,5 Hz), 7,38 (d, 1 H, J = 8,0 Hz), 7,30 - 7,26 (m, 1 H), 7,05 (d, 1 H, J = 8,8 Hz), 6,90 (brs, 1 H), 5,57 (brs, 1 H), 4,83 - 4,80 (m, 1 H), 3,96 (d, 2 H, J = 6,2 Hz), 3,56 - 3,39 (m, 2 H), 3,02 (brs, 2 H), 2,50 - 2,43 (m, 2 H), 2,18 - 2,03 (m, 4 H), 1,95 - 1,87 (m, 4 H), 1,74 - 1,68 (m, 5 H), 1,45 (brs, 2 H), 0,92 - 0,88 (m, 6 H); MS (ESI) m/z 553 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1000, соединения Таблицы 120 синтезировали с использованием 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-карбоновой кислоты и реагента из Таблицы 119.
Таблица 119.
Таблица 120.
Пример 108. Соединение 1124 : (S)-1-(2' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
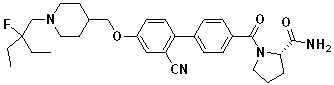
Стадия 1. 2-бром-5-((1-(2-этил-2-гидроксибутил)пиперидин-4-ил)метокси)бензонитрил:
5-бром-2-(пиперидин-4-илметокси)бензонитрил гидроксихлорид (продукт синтеза стадии 2 соединения 1028; 3,00 г, 9,05 ммоль) растворили в EtOH 6 мл. 2,2-диэтилоксиран (продукт синтеза стадии 1 соединения 809; 2,72 г, 27,14 ммоль), K2CO3 (2,50 г, 18,09 ммоль) и воду 3 мл добавили туда же. Смесь перемешивали при микроволновом облучении при 110 ºC в течение 15 минут. Этанол упарили из реакционной смеси при пониженном давлении. После добавления воды к этой смеси, полученный осадок отфильтровали и высушили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (2,9 г, 81%).
Стадия 2. 2-бром-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бензонитрил:
2-бром-5-((1-(2-этил-2-гидроксибутил)пиперидин-4-ил)метокси)бензонитрил (2,90 г, 7,34 ммоль) растворили в CH2Cl2 (10 мл). При комнатной температуре, DAST (1,30 г, 8,07 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 3 часов. Реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали этилацетатом. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал (желтое масло) использовали без дальнейшей очистки (2,20 г, 75%).
Стадия 3. метил 2' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 2-бром-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бензонитрил (700 мг, 1,76 ммоль), 4-(метоксикарбонил)фенилборную кислоту (381 мг, 2,11 ммоль), Pd(dbpf)Cl2 (57 мг, 0,09 ммоль) и Cs2CO3 (1,15 г, 3,52 ммоль) растворили в 1,4-диоксане (3 мл) / H2O (1 мл). При 120 °C, смесь перемешивали в течение 15 минут. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали этилацетатом. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 40 г картридж; этил ацетат / гексан = 20% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,52 г, 65%).
Стадия 4. 2' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 2' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,52 г, 1,15 ммоль) и LiOH·H2O (0,10 г, 2,30 ммоль) растворили в THF / MeOH (6 мл / 3 мл) / вода (2 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили небольшим количеством концентрированной HCl до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (0,45 г, 89%).
Стадия 5. Соединение 1124: 2' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,60 г, 0,14 ммоль), EDC (0,05 г, 0,27 ммоль), HOBt (0,04 г, 0,27 ммоль) и DIPEA (0,05 г, 0,41 ммоль) растворили в CH2Cl2 (1 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (0,02 г, 0,16 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 2% - 5%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,05 г, 61%).
1H NMR (400 MHz, CDCl3) δ 7,66 (d, 2 H, J = 8,2 Hz), 7,58 (d, 2 H, J = 8,2 Hz), 7,41 (d, 1 H, J = 8,6 Hz), 7,20 (m, 2 Hz), 7,07 (s, 1 H), 5,82 (s, 1 H), 4,80 (m, 1 H), 3,85 (d, 2 H, J = 6,0 Hz), 3,66 (m, 2 H), 3,01 - 2,98 (m, 2 H), 2,48 (s, 1 H), 2,42 (s, 1 H), 2,40 (m, 1 H), 2,09 (m, 4 H), 1,88 - 1,65 (m, 8 H), 1,41 (m, 2 H), 0,90 (t, 6 H, J = 7,5 Hz)
Согласно вышеописанному процессу синтеза соединения 1124, соединения Таблицы 122 синтезировали с использованием 2' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 121.
Таблица 121.
Таблица 122.
Пример 109. Соединение 1119 : (S)-1-(3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенилкарбонил)пирролидин-2-карбоксамид
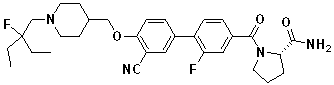
Стадия 1. метил 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)2-фторбифенил-4-карбоксилат: 5-бром-2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси) бензонитрил (продукт синтеза стадии 4 соединения 1000; 850 мг, 2,14 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (508 мг, 2,57 ммоль), Pd(dbpf)Cl2 (70 мг, 0,11 ммоль) и Cs2CO3 (1,39 г, 4,28 ммоль) добавили к 1,4-диоксану (3 мл) / H2O (1 мл). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали этилацетатом. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 40 г картридж; этил ацетат/гексан = 20% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,71 г, 70%).
Стадия 2. 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-карбоновая кислота: Метил 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)2-фторбифенил-4-карбоксилат (710 мг, 1,51 ммоль) и LiOH·H2O (0,13 г, 3,02 ммоль) растворили в THF / MeOH (6 мл / 3 мл) / вода (2 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили небольшим количеством концентрированной HCl до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (0,62 г, 90%).
Стадия 3. Соединение 1119: 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-карбоновую кислоту (0,06 г, 0,13 ммоль), EDC (0,05 г, 0,26 ммоль), HOBt (0,04 г, 0,26 ммоль) и DIPEA (0,05 г, 0,39 ммоль) растворили в CH2Cl2 (1 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (0,02 г, 0,16 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 2% - 5%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,04 г, 53%).
1H NMR (400 MHz, CDCl3) δ 7,72 (s, 1 H), 7,70 (d, 2 H, J = 8,9 Hz), 7,38 (m, 3 H), 7,03 (d, 1 H, J = 8,8 Hz), 6,90 (s, 1 H), 5,75 (s, 1 H), 4,75 (m, 1 H), 3,93 (d, 2 H, J = 6,4 Hz), 3,62 (m, 2 H), 3,54 (m, 2 H), 2,98 - 2,95 (m, 2 H), 2,38 (m, 2 H), 2,06 (m, 5 H), 1,88 (m, 4 H), 1,70 (m, 4 H), 1,41 (m, 2 H), 0,90 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 553 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1119, соединения Таблицы 124 синтезировали с использованием 3' -циано-4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-карбоновой кислоты и реагента из Таблицы 123.
Таблица 123.
Таблица 124.
Пример 110. Соединение 1018: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамид
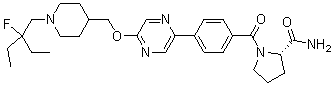
Стадия 1. 3-((4-((5-йодопиразин-2-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол:
2-йодо-5-(пиперидин-4-илметокси)пиразин гидрохлорид (продукт синтеза стадии 2 соединения 944 ; 1,00 г, 2,81 ммоль), 2,2-диэтилоксиран (1,01 г, 14,06 ммоль) и K2CO3 (1,94 г, 14,06 ммоль), добавили к EtOH (8 мл) / H2O (2 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (1,15 г, 97%).
Стадия 2. 2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-5-йодопиразин:
3-((4-((5-йодопиразин-2-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол (2,00 г, 5,44 ммоль) растворили в CH2Cl2 (20 мл). При 0 °C, DAST (0,87 мл, 6,53 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным раствором NaHCO3. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,41 г, 17%).
Стадия 3. метил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат:
2-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-5-йодопиразин (0,40 г, 0,94 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,20 г, 1,13 ммоль), Pd(dppf)Cl2 (0,03 г, 0,04 ммоль) и Cs2CO3 (0,61 г, 1,89 ммоль), добавили к DME (3 мл) / H2O (1 мл). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,08 г, 19%).
Стадия 4. 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойная кислота:
Метил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоат (0,08 г, 0,18 ммоль) и LiOH·H2O (0,03 г, 0,93 ммоль) растворили в THF / MeOH (8 мл) / H2O (1 мл) при 60 °C, после чего перемешивали при такой же температуре в течение 18 часов. Реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,04 г, 54%).
Стадия 5. Соединение 1018: 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиразин-2-ил)бензойную кислоту (0,04 г, 0,10 ммоль), L-пролинамид (0,01 г, 0,12 ммоль), HOBt (0,02 г, 0,20 ммоль), EDC (0,03 г, 0,20 ммоль) и DIPEA (0,03 мл, 0,20 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов, реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; дихлорметан / метанол = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,01 г, 34%).
1H NMR (400 MHz, CDCl3) δ 8,53 (s, 1 H), 8,30 (s, 1 H), 7,98 (d, 2 H, J = 8,3 Hz), 7,65 (d, 2 H, J = 8,2 Hz), 6,69 (s, 1 H), 5,46 (s, 1 H), 4,83 (dd, 1 H, J = 7,4, 4,7 Hz), 4,22 (d, 2 H, J = 6,2 Hz), 3,54 - 4,03 (m, 2H), 2,98 - 3,00 (m, 2 H), 2,48 - 2,51 (m, 2 H), 2,43 (s, 1 H), 2,03 - 2,16 (m, 3 H), 1,65 - 1,89 (m, 7 H), 1,39 - 1,48 (m, 2 H), 1,26 - 1,31 (m, 2H), 0,90 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 512,3 (M+ + H).
Пример 111. Соединение 1051: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пирролидин-2-карбоксамид
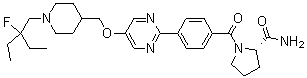
Стадия 1. 3-((4-((2-хлорпиримидин-5-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол:
К EtOH (4 мл) / H2O (1 мл) добавили 2-хлор-5-(пиперидин-4-илметокси)пиримидин гидрохлорид (продукт синтеза стадии 2 соединения 1032 ; 1,20 г, 4,54 ммоль), 2,2-диэтилоксиран (3,18 г, 31,80 ммоль) и K2CO3 (1,25 г, 9,08 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал использовали без дальнейшей очистки (1,47 г, 98%, твердое вещество белого цвета ).
Стадия 2. 2-хлор-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин:
3-((4-((2-хлорпиримидин-5-илокси)метил)пиперидин-1-ил)метил)пентан-3-ол (1,47 г, 4,48 ммоль) растворили в CH2Cl2 (20 мл). При 0 °C, DAST (0,70 мл, 5,38 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным раствором NaHCO3, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,71 г, 48%).
Стадия 3. метил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоат: к DME (4 мл) / H2O (1 мл) добавили 2-хлор-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин (0,20 г, 0,60 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,13 г, 0,72 ммоль), Pd(dppf)Cl2 (0,02 г, 0,03 ммоль) и Cs2CO3 (0,39 г, 1,21 ммоль). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. К фильтрату добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,20 г, 76%).
Стадия 4. 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метилокси)пиримидин-2-ил)бензойная кислота:
Метил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоат (0,20 г, 0,46 ммоль) и LiOH·H2O (0,09 г, 2,32 ммоль) растворили в THF (4 мл) / MeOH (4 мл) / H2O (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 5 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (20 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,15 г, 77%).
Стадия 5. Соединение 1051: 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метилокси)пиримидин-2-ил)бензойную кислоту (0,04 г, 0,10 ммоль), L-пролинамид (0,01 г, 0,13 ммоль), HOBt (0,02 г, 0,21 ммоль), EDC (0,04 г, 0,21 ммоль) и DIPEA (0,03 мл, 0,21 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой промыли водой, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,05 г, 93%).
1H NMR (400 MHz, CDCl3) δ 8,48 (s, 2 H), 8,41 (d, 2 H, J = 8,4 Hz),7,64 (d, 2 H, J = 8,3 Hz), 7,08 (s, 1 H), 5,71 (s, 1 H), 4,82 (dd, 1 H, J = 7,3, 5,1 Hz), 3,95 (d, 2 H, J = 6,0 Hz), 3,50 - 3,66 (m, 2 H), 2,99 - 3,02 (m, 2 H), 2,40 - 2,49 (m, 3 H), 2,05 - 2,17 (m, 4 H), 1,65 - 1,91 (m, 4 H), 1,41 - 1,49 (m, 4 H), 1,20 - 1,26 (m, 2 H), 0,91 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 512,3 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1051, соединения Таблицы 126 синтезировали с использованием 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метилокси)пиримидин-2-ил)бензойной кислоты и реагента из Таблицы 125.
Таблица 125.
Таблица 126.
Пример 112. Соединение 1056: (R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторфенил)(3-гидроксипиперидин-1-ил)метанон
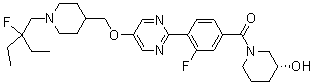
Стадия 1. метил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторбензоат: 2-хлор-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин (продукт синтеза стадии 2 соединения 1051; 0,25 г, 0,75 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (0,16 г, 0,83 ммоль), Pd(dppf)Cl2 (0,03 г, 0,03 ммоль) и Cs2CO3 (0,49 г, 1,51 ммоль), добавили к DME (4 мл) / H2O (1 мл). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. К фильтрату добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,21 г, 61%).
Стадия 2. 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторбензойная кислота: Метил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторбензоат (0,21 г, 0,46 ммоль) и LiOH·H2O (0,09 г, 2,34 ммоль) растворили в THF (4 мл) / MeOH (4 мл) / H2O (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 5 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (30 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,14 г, 71%).
Стадия 3. Соединение 1056: 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторбензойную кислоту (0,04 г, 0,10 ммоль), (R)-пиперидин-3-ол гидрохлорид (0,01 г, 0,12 ммоль), HOBt (0,02 г, 0,20 ммоль), EDC (0,04 г, 0,20 ммоль) и DIPEA (0,02 г, 0,20 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой промыли водой, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,02 г, 42%).
1H NMR (400 MHz, CDCl3) δ 8,53 (s, 2 H), 8,06 (t, 1 H, J = 7,8 Hz), 7,24 - 7,33 (m, 2H), 3,97 (d, 2 H, J = 6,0 Hz), 3,29 - 3,79 (m, 4H), 3,00 - 3,02 (m, 2H), 2,49 (s, 1 H), 2,43 (s, 1 H), 2,15 (t, 2 H, J = 11,0 Hz), 1,27 - 2,06 (m, 15 H), 0,91 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 517,3 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1056, соединения Таблицы 128 синтезировали с использованием 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторбензойной кислоты и реагента из Таблицы 127.
Таблица 127.
Таблица 128.
Пример 113. Соединение 1054: (S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензоил)пирролидин-2-карбоксамид
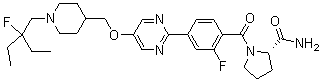
Стадия 1. этил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензоат: к DME (4 мл) / H2O (1 мл) добавили 2-хлор-5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин (продукт синтеза стадии 2 соединения 1051; 0,25 г, 0,75 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (0,17 г, 0,83 ммоль), Pd(dppf)Cl2 (0,03 г, 0,03 ммоль) и Cs2CO3 (0,49 г, 1,51 ммоль). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. К фильтрату добавили насыщенный водный раствор NH4Cl, и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; EtOAc / гексан = 0% - 30%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,26 г, 74%).
Стадия 2. 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензойная кислота: Этил 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензоат (0,26 г, 0,60 ммоль) и LiOH·H2O (0,12 г, 3,02 ммоль) растворили в THF (4 мл) / MeOH (4 мл) / H2O (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 5 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (20 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,19 г, 72%).
Стадия 3. Соединение 1054: 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензойную кислоту (0,04 г, 0,10 ммоль), L-пролинамид (0,01 г, 0,12 ммоль), HOBt (0,02 г, 0,20 ммоль), EDC (0,04 г, 0,20 ммоль) и DIPEA (0,03 мл, 0,20 ммоль) растворили в CH2Cl2 (1 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 18 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с помощью EtOAc. Органический слой промыли водой, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 4 г картридж; метанол / дихлорметан = 0% - 15%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,05 г, 90%).
1H NMR (400 MHz, CDCl3) δ 8,47 (s, 2 H), 8,23 (d, 1 H, J = 8,0 Hz), 8,14 (d, 1 H, J = 11,1 Hz), 7,52 (t, 1 H, J = 7,5 Hz), 6,96 (s, 1 H), 5,71 (s, 1 H), 4,81 - 4,84 (m, 1 H), 3,96 (d, 2 H, J = 6,0 Hz), 3,38 - 3,56 (m, 2 H), 3,03 - 3,00 (m, 2 H), 2,44 - 2,50 (m, 3 H), 1,26 - 2,18 (m, 14 H), 0,90 (t, 6 H, J = 7,5 Hz); MS (ESI) m/z 530,3 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1054, соединения Таблицы 130 синтезировали с использованием 4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензойной кислоты и реагента из Таблицы 129
Таблица 129.
Таблица 130.
Пример 114. Соединение 937:(S)-1-(4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенилкарбонил)пирролидин-2-карбоксамид
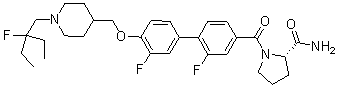
Стадия 1. 3-((4-((4-бром-2-фторфенокси)метил)пиперидин-1-ил)метил)пентан-3-ол: к
EtOH (5 мл) / H2O (5 мл) добавили 4-((4-бром-2-фторфенокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 2 соединения 725; 500 мг, 1,54 ммоль), 2,2-диэтилоксиран (771 мг, 7,70 ммоль) и K2CO3 (426 мг, 3,08 ммоль). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученный материал, представляющий собой целевое соединение в виде твердого вещества белого цвета (542 мг, 90%), использовали без дополнительной очистки.
Стадия 2. 4-((бром-2-фторфенокси)метил)-1-(2-этил-2-фторбутил)пиперидин: 3-((4-((4-бром-2-фторфенокси)метил)пиперидин-1-ил)метил)пентан-3-ол (524 мг, 1,40 ммоль) растворили в CH2Cl2 (10 мл). При 0 ºC, DAST (184 мкл, 1,40 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (371 мг, 68%).
Стадия 3. этил 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-карбоксилат: 4-((бром-2-фторфенокси)метил)-1-(2-этил-2-фторбутил)пиперидин (371 мг, 0,95 ммоль), 2-фтор-4-(метоксикарбонил)фенилборную кислоту (188 мг, 0,95 ммоль), Pd(dppf)Cl2 (78 мг, 0,10 ммоль) и Cs2CO3 (619 мг, 1,90 ммоль) добавили к смеси вода (2 мл)/DME (6 мл). Реакционную смесь нагревали при микроволновом облучении при 110 ºC в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (EtOAc/гексан = 30% ~ 70%) с получением целевого соединения в виде твердого вещества белого цвета (242 мг, 53%).
Стадия 4. 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-карбоновая кислота: Этил 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-карбоксилат (242 мг, 0,51 ммоль) растворили в THF (10 мл) и воде (5 мл). LiOH·H2O (106 мг, 2,53 ммоль) добавили к этой смеси небольшими порциями при комнатной температуре, после чего перемешивали в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (200 мг, 87%).
Стадия 5. Соединение 937: 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-карбоновую кислоту (40 мг, 0,09 ммоль), EDC (34 мг, 0,18 ммоль), HOBt (24 мг, 0,18 ммоль) и DIPEA (32 мкл, 0,18 ммоль) растворили в CH2Cl2 (1 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (20 мг, 0,18 ммоль) добавили к этой смеси, после чего перемешивали в течение дня. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, и затем органический слой высушили над безводным MgSO4, и упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии на силикагеле (CH2Cl2 /MeOH = 95% ~ 5%) с получением целевого соединения в виде твердого вещества белого цвета (35 мг, 87%).
1H NMR (400 MHz, CDCl3) δ 7,47 (t, 1 H, J = 7,8 Hz), 7,40 - 7,27 (m, 4 H), 7,03 (t, 1 H, J = 8,6 Hz), 6,89 (brs, 0,5 H), 5,47 (brs, 0,5 H), 4,82 - 4,79 (m, 1 H), 3,92 (d, 2 H, J = 6,2 Hz), 3,66 - 3,57 (m, 2 H), 3,00 (d, 2 H, J = 10,4 Hz), 2,49 - 2,43 (m, 2 H), 2,18 - 2,06 (m, 4 H), 1,92 - 1,66 (m, 10 H), 1,47 - 1,41 (m, 2 H), 0,92 (s, 3 H), 0,88 (s, 3 H); MS (ESI) m/z 546 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 937, соединения Таблицы 132 синтезировали с использованием 4'-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3' -дифторбифенил-4-карбоновой кислоты и реагента из Таблицы 131.
Таблица 131.
Таблица 132.
Пример 115. Соединение 922: (S)-1-(4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
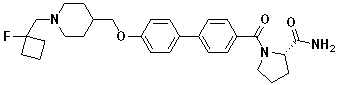
Стадия 1. 1-((4-((4-бромфенокси)метил)пиперидин-1-ил)метил)циклобутанол:
4-((4-бромфенокси)метил)пиперидин (продукт синтеза стадии 4 соединения 686; 0,10 г, 0,33 ммоль), 1-оксаспиро[2,3]гексан (55 мг, 0,65 ммоль) и Et3N (0,23 мкл, 1,63 ммоль) растворили в EtOH 2 мл. Реакцию проводили при микроволновом облучении при 110 ºC в течение 20 минут. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (90 мг, 78%).
Стадия 2. 4-((4-бромфенокси)метил)-1-((1-фторциклобутил)метил)пиперидин:
1-((4-((4-бромфенокси)метил)пиперидин-1-ил)метил)циклобутанол (0,61 г, 1,72 ммоль) растворили в CH2Cl2 10 мл. DAST (0,23 мкл, 1,72 ммоль) добавили к этой смеси. После перемешивания в течение 1 часа при комнатной температуре, к этой смеси добавили насыщенный водный раствор NaHCO3, и проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (12 г, ISU силикагелевый картридж, 0-5% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (234 мг, 38%).
Стадия 3. метил 4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бромфенокси)метил)-1-((1-фторциклобутил)метил)пиперидин (234 мг, 0,66 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,14 г, 0,79 ммоль), Pd(dbpf)Cl2 (13 мг, 0,02 ммоль) и Cs2CO3 (0,64 г, 1,97 ммоль) добавили к смеси растворителей 1,4-диоксан/H2O 3 мл/1 мл. Реакционную смесь нагревали при микроволновом облучении при 140 °C в течение 15 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, отфильтровали через цеолиты для удаления осадка, и затем упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, метанол/дихлорметан = 0% - 5%), и упарили с получением целевого соединения в виде твердого вещества светло-желтого цвета (194 мг, 72%).
Стадия 4. 4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота:
Метил 4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (0,19 г, 0,47 ммоль) и LiOH·H2O (0,1 г, 2,35 ммоль) растворили в THF/MeOH/H2O 6 мл/2 мл/2 мл, и затем кипятили с обратным холодильником и перемешивали в течение 4 часов. Реакционную смесь охладили до комнатной температуры и разбавили водой. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества светло-коричневого цвета (0,18 г, 94%).
Стадия 5. Соединение 922: 4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (0,04 г, 0,10 ммоль), EDCI (0,04 г, 0,20 ммоль), HOBt (0,03 г, 0,20 ммоль) и DIPEA (0,09 мл, 0,50 ммоль) растворили в DMF (2 мл). При комнатной температуре, (0,02 г, 0,20 ммоль) добавили к этой смеси, после чего перемешивали при 60 °C в течение 12 часов. Концентрат разбавили водой (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили, и очистили с помощью колоночной хроматографии (SiO2; метанол/дихлорметан = 0% - 10%), получив целевое соединение в виде твердого вещества светло-желтого цвета (0,03 г, 58%).
1H NMR (400 MHz, CDCl3) δ 7,59 (s, 4 H), 7,53 (d, 2 H, J = 8,8 Hz), 7,04 (brs, 1 H), 6,98 (d, 2 H, J = 9,0 Hz), 5,65 (brs, 1 H), 4,81 (brs, 1 H), 3,85 (d, 2 H, J = 6,0 Hz), 3,63 - 3,59 (m, 2 H), 3,01 (d, 2 H, J = 11,4 Hz), 2,66 (s, 1 H), 2,60 (s, 1 H), 2,28 - 2,00 (m, 10 H), 1,87 - 1,81 (m, 3 H), 1,50 - 1,44 (m, 4 H); MS (ESI) m/z 494 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 922, соединения Таблицы 134 синтезировали с использованием 4'-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 133.
Таблица 133.
Таблица 134.
Пример 116. Соединение 760: (S)-1-(4'-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамид
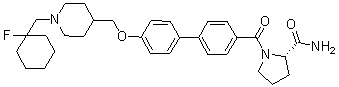
Стадия 1. 1-((4-((4-бромфенокси)метил)пиперидин-1-ил)метил)циклогексанол: 4-((4-бромфенокси)метил)пиперидин гидрохлорид (500 мг, 1,63 ммоль), 1-оксаспиро[2,5]октан (274 мг, 2,45 ммоль) и K2CO3 (113 мг, 0,82 ммоль) добавили в микроволновой реактор, и затем этанол 4 мл и воду 2 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. После удаления этанола, к реакционной смеси добавили немного воды. Полученный осадок тщательно промыли водой, и высушили с получением целевого соединения в виде твердого вещества белого цвета (520 мг, 83%).
Стадия 2. 4-((4-бромфенокси)метил)-1-((1-фторциклогексил)метил)пиперидин:
1-((4-((4-бромфенокси)метил)пиперидин-1-ил)метил)циклогексанол (400 мг, 1,05 ммоль) растворили в CH2Cl2 10 мл. Deoxo-Fluor® (0,23 мл, 1,26 ммоль) добавили к этой смеси. , после чего перемешивали при комнатной температуре в течение 5 часов. К этой смеси добавили насыщенный водный раствор NaHCO3, и смесь проэкстрагировали с CH2Cl2. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-50% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (100 мг, 25%).
Стадия 3. метил 4'-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бромфенокси)метил)-1-((1-фторциклогексил)метил)пиперидин (115 мг, 0,30 ммоль), 4-(метоксикарбонил)фенилборную кислоту (60 мг, 0,33 ммоль), Pd(dbpf)Cl2 (6 мг, 0,01 ммоль), Cs2CO3 (291 мг, 0,90 ммоль) добавили в микроволновой реактор, и затем 1,4-диоксан 4 мл и воду 2 мл добавили туда же. Реакцию проводили при микроволновом облучении при 110 ºC в течение 30 минут. Реакционную смесь отфильтровали через слой цеолитов. Фильтрат разбавили водой и затем проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (100 мг, 76%).
Стадия 4. 4'-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота:
Метил 4'-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат(100 мг, 0,23 ммоль) растворили в смеси растворителей THF 2 мл / вода 2 мл. LiOH·H2O (20 мг, 0,46 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 4 часов. Растворитель упарили при пониженном давлении. После добавления 1M HCl к этой смеси, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (95 мг, 98%).
Стадия 5. Соединение 760: 4'-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота(50 мг, 0,12 ммоль), L-пролинамид (20 мг, 0,18 ммоль), EDC (45 мг, 0,24 ммоль) и HOBt (32 мг, 0,24 ммоль) растворили в DMF 2 мл. DIPEA (30 мг, 0,24 ммоль) добавили к этой смеси, и реакцию проводили при 60 ºC в течение 10 часов. Реакционную смесь охладили до комнатной температуры и разбавили водой. Образовавшийся осадок отфильтровали, тщательно промыли водой, и высушили с получением целевого соединения в виде твердого вещества желтого цвета (15 мг, 25%).
1H NMR (400 MHz, CDCl3) δ 7,62 - 7,52 (m, 5 H), 7,02 - 6,97 (m, 3 H), 5,42 (s, 1 H), 4,85 (t, 1 H, J = 6,2 Hz), 3,86 (s, 2 H), 3,61 (m, 2 H), 3,01 (m, 2 H), 2,53 (m, 3 H), 2,21 - 2,04 (m, 4 H), 1,85 (m, 6 H), 1,65 - 1,24 (m, 11 H); MS (ESI) m/z 522 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 760, соединения Таблицы 136 синтезировали с использованием 4'-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 135.
Таблица 135.
Таблица 136.
Пример 117. Соединение 857: (R)-1-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пиперидин-2-карбоксамид
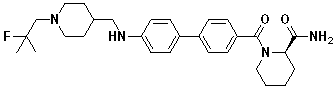
Стадия 1. трет-Бутил 4-((4-бромфениламино)метил)пиперидин-1-карбоксилат:
4-бромбензоламин (4,00 г, 18,76 ммоль) растворили в MeOH 100 мл. Уксусную кислоту (1,03 мл, 18,76 ммоль) и трет-бутил 4-формилпиперидин-1-карбоксилат (3,38 г, 19,69 ммоль) добавили туда же, после чего перемешивали при комнатной температуре в течение 5 часов. NaCNBH3 (1,17 г, 18,75 ммоль) медленно добавили к этой смеси при 0 ºC, после чего перемешивали при комнатной температуре в течение 3 часов и проэкстрагировали с помощью CH2Cl2. Полученный органический слой промыли насыщенным водным соляным раствором три раза. Полученный органический слой высушили над Na2SO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (4 г ISCO силикагелевый картридж, 0 - 30% EtOAc/гексан) с получением целевого соединения в виде твердого вещества светло-желтого цвета (3,00 г, 43%).
Стадия 2. трет-Бутил 4-((бензил(4-бромфенил)амино)метил)пиперидин-1-карбоксилат:
трет-бутил 4-((4-бромфениламино)метил)пиперидин-1-карбоксилат (3,00 г, 8,12 ммоль) и NaH (0,39 г, 16,24 ммоль) растворили в DMF (100 мл). При 0 °C, бензил бромид (2,08 г, 12,18 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (2,70 г, 72%).
Стадия 3. N-бензил-4-бром-N-(пиперидин-4-илметил)бензоламин гидрохлорид: трет-бутил 4-((бензил(4-бромфенил)амино)метил)пиперидин-1-карбоксилат (5,20 г, 14,08 ммоль) растворили в EtOAc (100 мл). При комнатной температуре, HCl в 1,4-диоксане (17,60 мл, 70,40 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 2 часов. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (4,80 г, 86%).
Стадия 4. 1-(4-((бензил(4-бромфенил)амино)метил)пиперидин-1-ил)-2 метилпропан-2-ол:
N-бензил-4-бром-N-(пиперидин-4-илметил)бензоламин гидрохлорид (2,40 г, 6,70 ммоль) и K2CO3 (4,63 г, 33,51 ммоль) растворили в EtOH (10 мл) / H2O (10 мл). 1,2-эпокси-2-метилпропан (5,95 мл, 67,02 ммоль) добавили к этой смеси. Реакционную смесь нагревали при микроволновом облучении при 110 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат использовали без дополнительной очистки в следующей стадии (2,00 г, 69%, бесцветное масло).
Стадия 5. N-бензил-4-бром-N-((1-(2-фтор-2-метилпропил)пиперидин-2-ил)метил)бензоламин: 1-(4-((бензил(4-бромфенил)амино)метил)пиперидин-1-ил)-2 метилпропан-2-ол (4,00 г, 9,27 ммоль) растворили в CH2Cl2 (100 мл). При 0 °C, DAST (1,64 г, 10,19 ммоль) добавили к этой смеси. После чего перемешивали при такой же температуре в течение 1 часа. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде бесцветного масла (2,87 г, 71%).
Стадия 6. метил 4'-(бензил((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)амино)бифенил-4-карбоксилат: N-бензил-4-бром-N-((1-(2-фтор-2-метилпропил)пиперидин-2-ил)метил)бензоламин (1,00 г, 2,30 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,41 г, 2,30 ммоль), Pd(dbpf)Cl2 (0,07 г, 0,11 ммоль) и Cs2CO3 (1,50 г, 4,61 ммоль) добавили к 1,4-диоксану (12 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде желтого масла (0,89 г, 78%).
Стадия 7. метил 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоксилат: Метил 4'-(бензил((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)амино)бифенил-4-карбоксилат (0,89 г, 1,82 ммоль) растворили в MeOH (3 мл) / EtOAc (5 мл). При комнатной температуре, NH4COOH (1,14 г, 18,21 ммоль) добавили к этой смеси, после чего перемешивали при 80 °C в течение 2 часов. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 30%), и упарили получив целевое соединение в виде твердого вещества светло-желтого цвета (0,40 г, 55%).
Стадия 8. 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновая кислота: Метил 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоксилат (0,40 г, 1,0 ммоль) растворили в THF (3 мл) / H2O /MeOH (2 мл). При комнатной температуре, LiOH·H2O (0,21 г, 5,01 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 1 часа. Реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (10 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,32 г, 84%).
Стадия 9. Соединение 857: 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновую кислоту (0,10 г, 0,23 ммоль), EDCI (0,09 г, 0,47 ммоль), HOBt (0,06 г, 0,47 ммоль) и DIPEA (0,15 г, 1,18 ммоль) растворили в DMF (2 мл). При комнатной температуре, (R)-пиперидин-2-карбоксамид (0,06 г, 0,47 ммоль) добавили к этой смеси, после чего перемешивали при 60 °C в течение 5 часов. Концентрат разбавили водой (6 мл), и перемешали. Полученный осадок отфильтровали, высушили, и очистили с помощью колоночной хроматографии (SiO2, дихлорметан / метанол = 0% - 5%), и упарили с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,06 г, 51%).
1H NMR (400 MHz, CDCl3) δ 7,56 - 7,27 (m, 6 H), 6,67 - 6,61 (m, 3 H), 5,92 (brs, 1 H), 5,28 (brs, 1 H), 3,83 (d, 1 H, J = 12,0 Hz), 3,13 - 2,94 (m, 5 H), 2,45 (s, 1 H), 2,39 (s, 1 H), 2,33 (d, 1 H, J = 12,0 Hz), 2,12 (t, 2 H, J = 11,4 Hz), 1,75 - 1,55 (m, 8 H), 1,38 - 1,23 (m, 8 H); MS (ESI) m/z 495 (M+ + H)
Согласно вышеописанному процессу синтеза соединения 857, соединения Таблицы 138 синтезировали с использованием 4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновой кислоты и реагента из Таблицы 137.
Таблица 137.
Таблица 138.
Пример 118. Соединение 870: (S)-1-(3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамид
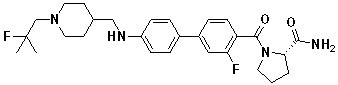
Стадия 1. этил 4'-(бензил((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)амино)-3-фторбифенил-4-карбоксилат: N-бензил-4-бром-N-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)бензоламин (0,80 г, 1,84 ммоль), 4-(этоксикарбонил)-3-фторфенилборную кислоту (0,36 г, 1,84 ммоль), Pd(dbpf)Cl2 (0,06 г, 0,09 ммоль) и Cs2CO3 (1,20 г, 3,69 ммоль) добавили к 1,4-диоксану (12 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 120 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили насыщенным водным соляным раствором добавили к этой смеси, и затем проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде желтого масла (0,74 г, 79%).
Стадия 2. этил 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоксилат: Этил 4'-(бензил((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)амино)-3-фторбифенил-4-карбоксилат (0,74 г, 1,41 ммоль) растворили в MeOH (3 мл) / EtOAc (5 мл). При комнатной температуре, NH4COOH (0,89 г, 14,15 ммоль) добавили к этой смеси, после чего перемешивали при 80 °C в течение 2 часов. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества светло-желтого цвета (0,40 г, 67%).
Стадия 3. 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновая кислота: Этил 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоксилат (0,37 г, 0,88 ммоль) растворили в THF (3 мл) / H2O /MeOH (2 мл). При комнатной температуре, LiOH·H2O (0,18 г, 4,44 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 1 часа. Реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (10 мл), и перемешали. Полученный осадок отфильтровали и высушили с получением целевого соединения в виде твердого вещества белого цвета (0,35 г, 97%).
Стадия 4. Соединение 870: 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновую кислоту (0,06 г, 0,14 ммоль), EDCI (0,05 г, 0,29 ммоль), HOBt (0,04 г, 0,29 ммоль) и DIPEA (0,13 мл, 0,74 ммоль) растворили в DMF (2 мл). При комнатной температуре, (S)-пирролидин-2-карбоксамид (0,03 г, 0,29 ммоль) добавили к этой смеси, после чего перемешивали при 60 °C в течение 5 часов. Концентрат разбавили водой (5 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили, и очистили с помощью колоночной хроматографии (SiO2, дихлорметан / метанол = 0% - 10%), и упарили получив целевое соединение в виде твердого вещества светло-желтого цвета (0,04 г, 61%).
1H NMR (400 MHz, CDCl3) δ 7,57 - 7,37 (m, 4 H), 7,27 (t, 1 H, J = 5,6 Hz), 6,95 (brs, 1 H), 6,67 (d, 2 H, J = 8,8 Hz), 5,59 (brs, 1 H), 4,83 - 4,80 (m, 1 H), 3,55 - 3,42 (m, 2 H), 3,06 (d, 2 H, J = 6,8 Hz), 2,98 (d, 2 H, J = 11,2 Hz), 2,46 - 2,40 (m, 3 H), 2,15 - 1,86 (m, 5 H), 1,74 (d, 2 H, J = 12,4 Hz), 1,60 - 1,56 (m, 1 H), 1,39 - 1,26 (m, 8 H); MS (ESI) m/z 499 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 870, соединения Таблицы 140 синтезировали с использованием 3-фтор-4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновой кислоты и реагента из Таблицы 139.
Таблица 139.
Таблица 140.
Пример 119. Соединение 1020: (S)-(3-гидроксипирролидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон

Стадия 1. (4-((бензил(4-бромфенил)амино)метил)пиперидин-1-ил)(1-(трифторметил) циклобутил)метанон: N-бензил-4-бром-N-(пиперидин-4-илметил)бензоламин гидрохлорид (продукт синтеза стадии 3 соединения 857; 0,80 г, 4,75 ммоль), EDCI (1,82 г, 9,51 ммоль), HOBt (1,28 г, 9,51 ммоль) и DIPEA (4,15 мл, 23,79 ммоль) растворили в DMF (20 мл). При комнатной температуре, 1-(трифторметил)циклобутанекарбоновую кислоту (1,97 г, 4,99 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 12 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде желтого масла (1,30 г, 53%).
Стадия 2. N-бензил-4-бром-N-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метил)бензоламин: (4-((бензил(4-бромфенил)амино)метил)пиперидин-1-ил)(1-(трифторметил)циклобутил)метанон (1,30 г, 2,55 ммоль) растворили в THF (15 мл) и затем охладили до комнатной температуры, после чего упарили при пониженном давлении. Концентрат нагревали и перемешивали в течение 1 часа, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным раствором NaHCO3. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 40 г картридж; EtOAc / гексан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,96 г, 75%).
Стадия 3. метил 4'-(бензил((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метил)амино)бифенил-4-карбоксилат: N-бензил-4-бром-N-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метил)бензоламин (0,96 г, 1,93 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,34 г, 1,93 ммоль), Pd(dbpf)Cl2 (0,06 г, 0,09 ммоль) и Cs2CO3 (1,26 г, 3,87 ммоль) добавили к 1,4-диоксану (12 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 115 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,80 г, 75%).
Стадия 4. метил 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино) бифенил-4-карбоксилат: Метил 4'-(бензил((1-((1-(трифторметил)циклобутил)метил) пиперидин-4-ил)метил)амино)бифенил-4-карбоксилат (0,80 г, 1,45 ммоль) и 10% (весовых) Pd/C (0,3 г), NH4COOH (0,91 г, 14,52 ммоль) растворили в MeOH (6 мл) / EtOAc (12 мл). Реакционную смесь кипятили с обратным холодильником в течение 3 часов, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат упарили при пониженном давлении чтобы удалить растворитель. Концентрат разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,44 г, 65%).
Стадия 5. 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-карбоновая кислота: Метил 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-карбоксилат (0,44 г, 0,95 ммоль) и LiOH·H2O (0,20 г, 4,77 ммоль) растворили в THF (2 мл) / H2O / MeOH (3 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (20 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (0,42 г, 98%).
Стадия 6. Соединение 1020: 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-карбоновую кислоту (0,05 г, 0,11 ммоль), EDCI (0,04 г, 0,22 ммоль), HOBt (0,03 г, 0,22 ммоль) и DIPEA (0,09 мл, 0,56 ммоль) растворили в DMF (2 мл). При комнатной температуре, (S)-пирролидин-3-ол (0,02 г, 0,22 ммоль) добавили к этой смеси, после чего перемешивали при 60 °C в течение 12 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества желтого цвета (0,03 г, 64%).
1H NMR (400 MHz, CDCl3) δ 7,56 (d, 2 H, J = 7,2 Hz), 7,45 (d, 2 H, J = 8,4 Hz), 6,67 (d, 2 H, J = 8,5 Hz), 4,62 (brs, 0,5 H), 4,41 (brs, 0,5 H), 3,81 - 3,43 (m, 5 H), 3,07 (d, 2 H, J = 6,6 Hz), 2,88 (d, 2 H, J = 11,6 Hz), 2,23 - 1,73 (m, 12 H), 1,39 - 1,35 (m, 3 H)); MS (ESI) m/z 516 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1020, соединения Таблицы 142 синтезировали с использованием 4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-карбоновой кислоты и реагента из Таблицы 141.
Таблица 141.
Таблица 142.
Пример 120. Соединение 1024: (S)-(3-гидроксипирролидин-1-ил)(4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон
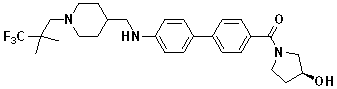
Стадия 1. 1-(4-((бензил(4-бромфенил)амино)метил)пиперидин-1-ил)-3,3,3-трифтор-2,2-диметилпропан-1-он: N-бензил-4-бром-N-(пиперидин-4-илметил)бензоламин гидрохлорид (продукт синтеза стадии 3 соединения 857; 0,80 г, 5,12 ммоль), EDCI (1,96 г, 10,25 ммоль), HOBt (1,38 г, 10,25 ммоль) и DIPEA (4,47 мл, 25,62 ммоль) растворили в DMF (20 мл). При комнатной температуре, 3,3,3-трифтор-2,2-диметилпропановую кислоту (2,13 г, 5,38 ммоль) добавили к этой смеси, после чего перемешивали при такой же температуре в течение 12 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества светло-желтого цвета (1,54 г, 60%).
Стадия 2. N-бензил-4-бром-N-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метил)бензоламин: 1-(4-((бензил(4-бромфенил)амино)метил)пиперидин-1-ил)-3,3,3-трифтор-2,2-диметилпропан-1-он (1,54 г, 3,09 ммоль) растворили в THF (15 мл) и затем охладили до комнатной температуры, после чего упарили при пониженном давлении. Концентрат нагревали в течение 1 часа, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным раствором NaHCO3. Органический слой высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 40 г картридж; EtOAc / гексан = 0% - 10%), и упарили с получением целевого соединения в виде прозрачного масла (0,42 г, 28%).
Стадия 3. метил 4'-(бензил((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метил)амино)бифенил-4-карбоксилат: N-бензил-4-бром-N-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метил)бензоламин (0,42 г, 0,86 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,15 г, 0,86 ммоль), Pd(dppf)Cl2 (0,02 г, 0,04 ммоль) и Cs2CO3 (0,56 г, 1,73 ммоль) добавили к 1,4-диоксану (12 мл) / H2O (3 мл). Реакционную смесь нагревали при микроволновом облучении при 115 °C в течение 20 минут, и затем охладили до комнатной температуры. Реакционную смесь разбавили водой и проэкстрагировали дихлорметаном. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,37 г, 79%).
Стадия 4. метил 4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино) бифенил-4-карбоксилат: Метил 4'-(бензил((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метил)амино)бифенил-4-карбоксилат (0,37 г, 0,68 ммоль), 10% Pd/C (0,15 г) и NH4COOH (0,43 г, 6,86 ммоль) добавили к MeOH (3 мл) / EtOAc (6 мл). Смесь кипятили с обратным холодильником в течение 5 часов, и затем охладили до комнатной температуры. Реакционную смесь отфильтровали через слой цеолитов для удаления осадка. Полученный фильтрат упарили при пониженном давлении. Полученный концентрат разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой промыли насыщенным водным соляным раствором, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; EtOAc / гексан = 0% - 20%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,24 г, 77%).
Стадия 5. 4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновая кислота: Метил 4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоксилат (0,24 г, 0,53 ммоль) и LiOH·H2O (0,11 г, 2,67 ммоль) растворили в THF (2 мл) / H2O / MeOH (3 мл) при комнатной температуре. Раствор перемешивали при такой же температуре в течение 12 часов, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой (20 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили с получением целевого соединения в виде твердого вещества белого цвета (0,22 г, 94%).
Стадия 6. Соединение 1024: 4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновую кислоту (0,06 г, 0,13 ммоль), EDCI (0,05 г, 0,27 ммоль), HOBt (0,03 г, 0,27 ммоль) и DIPEA (0,12 мл, 0,69 ммоль) растворили в DMF (2 мл). При комнатной температуре, (S)-пирролидин-3-ол (0,02 г, 0,27 ммоль) добавили к этой смеси, после чего перемешивали при 60 °C в течение 12 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным раствором NH4Cl, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества желтого цвета (0,04 г, 67%).
1H NMR (400 MHz, CDCl3) δ 7,55 - 7,53 (m, 4 H), 7,44 (d, 2 H, J = 8,4 Hz), 6,66 (d, 2 H, J = 8,5 Hz), 4,58 (brs, 0,5 H), 4,41 (brs, 0,5 H), 3,82 - 3,43 (m, 5 H), 3,05 (d, 2 H, J = 6,4 Hz), 2,82 (d, 2 H, J = 11,6 Hz), 2,39 (s, 2 H), 2,29 (t, 2 H, J = 11,0 Hz), 1,95 - 1,70 (m, 5 H), 1,37 - 1,31 (m, 2 H), 1,10 (s, 6 H); MS (ESI) m/z 504 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 1024, соединения Таблицы 144 синтезировали с использованием 4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-карбоновой кислоты и реагента из Таблицы 143.
Таблица 143.
Таблица 144.
Пример 121. Соединение 852: (R)-(4'-(((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)(метил)амино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
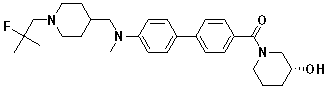
(R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон (соединение 867, 0,02 г, 0,05 ммоль) растворили в ацетонитриле 5 мл. Формальдегид (0,01 мл, 0,27 ммоль) и уксусную кислоту (0,30 мл, 0,05 ммоль) добавили туда же, после чего перемешивали в течение дня и затем охладили. При 0 ºC, NaCNBH3 (0,30 мг, 0,05 ммоль) медленно добавили к реакционной смеси, с последующим повышением температуры и перемешивали при комнатной температуре в течение 2 часов. После этого реакцию погасили путем добавления воды, реакционную смесь разбавили водой и затем проэкстрагировали с CH2Cl2. Полученный органический слой промыли несколько раз с H2O, высушили над безводным MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества желтого цвета (0,01 г, 62%).
1H NMR (400 MHz, CDCl3) δ 7,57 (d, 2 H, J = 8,0 Hz), 7,47 (dd, 4 H, J = 20,7, 8,7 Hz), 6,74 (d, 2 H, J = 8,8 Hz), 3,98 (brs, 2 H), 3,24 (d, 2 H, J = 6,8 Hz), 3,02 - 2,96 (m, 5 H), 2,50 - 2,41 (m, 5 H), 2,13 - 1,65 (m, 9 H), 1,39 - 1,26 (m, 8 H); MS (ESI) m/z 482 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 852, соединения Таблицы 146 синтезировали с использованием (R)-(4'-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино) бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона и реагента из Таблицы 145.
Таблица 145.
Таблица 146.
Пример 122. Соединение 928: (R)-(3-гидроксипиперидин-1-ил)(4'-(метил((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метил)амино)бифенил-4-ил)метанон
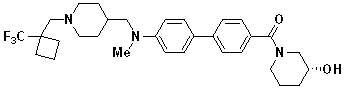
(R)-(3-гидроксипиперидин-1-ил)(4'-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон (соединение 926, 0,03 г, 0,05 ммоль), формальдегид (8 мкл, 0,28 ммоль) и AcOH (3 мкл, 0,05 ммоль) растворили в ацетонитриле (3 мл), после чего перемешивали 12 часов при комнатной температуре и медленно охладили до 0 °C. NaCNBH3 (4 мг, 0,05 ммоль) добавили к этой смеси при 0 °C, после чего перемешивали при комнатной температуре в течение 1 часа. Концентрат разбавили водой (10 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили, и очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,02 г, 81%).
1H NMR (400 MHz, CDCl3) δ 7,58 (d, 2 H, J = 8,0 Hz), 7,51 (d, 2 H, J = 8,8 Hz), 7,45 (d, 2 H, J = 8,0 Hz), 6,75 (d, 2 H, J = 8,8 Hz), 4,03 - 3,42 (m, 5 H), 3,25 (d, 2 H, J = 7,1 Hz), 3,02 (s, 3 H), 2,86 (d, 2 H, J = 11,2 Hz), 2,51 (s, 2 H), 2,24 - 1,65 (m, 15 H), 1,38 - 1,34 (m, 2 H); MS (ESI) m/z 544 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 928, соединения Таблицы 148 синтезировали с использованием (R)-(3-гидроксипиперидин-1-ил)(4'-((1-((1-(трифторметил) циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанона и реагента из Таблицы 147.
Таблица 147.
Таблица 148.
Пример 123. Соединение 930: (R)-(3-гидроксипиперидин-1-ил)(4'-(метил((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метил)амино)бифенил-4-ил)метанон
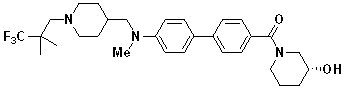
(R)-(3-гидроксипиперидин-1-ил)(4'-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанон (продукт синтеза соединения 927; 0,03 г, 0,05 ммоль), формальдегид (8 мкл, 0,29 ммоль) и AcOH (3 мкл, 0,05 ммоль) растворили в ацетонитриле (3 мл). При 0 °C, NaCNBH3 (4,00 мг, 0,05 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 2 часов. Концентрат разбавили водой (8 мл) до образования суспензии, и отфильтровали. Полученное твердое вещество высушили, и очистили с помощью колоночной хроматографии (SiO2, 12 г картридж; метанол / дихлорметан = 0% - 10%), и упарили с получением целевого соединения в виде твердого вещества белого цвета (0,01 г, 48%).
1H NMR (400 MHz, CDCl3) δ 7,58 (d, 2 H, J = 8,4 Hz), 7,48 (dd, 4 H, J = 20,3, 8,5 Hz), 6,74 (d, 2 H, J = 8,9 Hz), 4,17 - 3,42 (m, 5 H), 3,24 (d, 2 H, J = 7,2 Hz), 3,02 (s, 3 H), 2,80 (d, 2 H, J = 11,4 Hz), 2,37 (s, 2 H), 2,27 (t, 2 H, J = 5,9 Hz), 2,23 - 1,50 (m, 7 H), 1,37 - 1,24 (m, 2 H), 1,51 (s, 6 H); MS (ESI) m/z 532 (M+ + H).
Пример 124. Соединение 552: N,N-диметил-4'-((1-((1-(трифторметил)циклопропил) метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамид
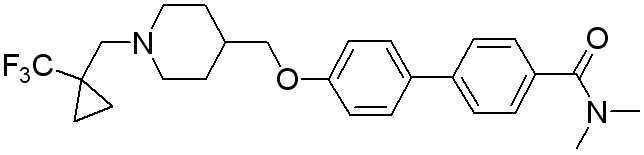
Стадия 1. (4-((4-бромфенокси)метил)пиперидин-1-ил)(1-(трифторметил)циклопропил) метанон: 4-((4-бромфенокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 1 соединения 498; 200 мг, 0,65 ммоль) и 1-(трифторметил)циклопропанкарбоновую кислоту (101 мг, 0,65 ммоль) растворили в CH2Cl2 4 мл. EDC (250 мг, 1,31 ммоль) и HOBt (176 мг, 1,31 ммоль) добавили туда же. Наконец, DIPEA (0,57 мл, 3,26 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2 три раза. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-50% EtOAc/Гексан) с получением целевого соединения в виде твердого вещества белого цвета (239 мг, 90%).
Стадия 2. 4-((4-бромфенокси)метил)-1-((1-(трифторметил)циклопропил)метил)пиперидин:
(4-((4-бромфенокси)метил)пиперидин-1-ил)(1-(трифторметил)циклопропил)метанон (239 мг, 0,59 ммоль) растворили в сухом THF 10 мл, после чего охладили на ледяной бане. 1 M LAH в THF (1,77 мл, 1,77 ммоль) медленно добавили по каплям, с последующим повышением температуры до комнатной температуры медленно и перемешивали в течение 1 часа. Реакцию погасили путем добавления вода. После добавления EtOAc к этой смеси, полученный осадок отфильтровали, и проэкстрагировали с помощью EtOAc. Органический слой высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-40% EtOAc/гексан) с получением целевого соединения в виде бесцветной жидкости (64 мг, 28%).
Стадия 3. метил 4'-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси) бифенил-4-карбоксилат: 4-((4-бромфенокси)метил)-1-((1-(трифторметил)циклопропил) метил)пиперидин (50 мг, 0,127 ммоль) и 4-(метоксикарбонил)фенилборную кислоту (28 мг, 0,15 ммоль) растворили в диоксане 1 мл. Воду 0,3 мл добавили к этой смеси. Pd(dbpf)Cl2 (30 мкг, 0,01 ммоль) и Cs2CO3 (125 мг, 0,38 ммоль) добавили туда же. Реакцию проводили при микроволновом облучении при 140 ºC в течение 15 минут. Реакционную смесь разбавили водой и проэкстрагировали с CH2Cl2 три раза. Органический слой высушили над MgSO4, отфильтровали через цеолиты чтобы удалить осадок, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (0-40% EtOAc/Гексан) с получением целевого соединения в виде твердого вещества светло-желтого цвета (30 мг, 53%).
Стадия 4. 4'-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 4'-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (30 мг, 0,07 ммоль) растворили в THF 2 мл. MeOH 1 мл и H2O 1 мл добавили туда же. LiOH (14 мг, 0,34 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов. После подкисления с помощью 1 N HCl, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (28 мг, 97%).
Стадия 5. Соединение 552: 4'-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (28 мг, 0,07 ммоль) и диметиламин гидрохлорид (11 мг, 0,13 ммоль) растворили в DMF 1 мл. EDC (25 мг, 0,13 ммоль) и HOBt (18 мг, 0,13 ммоль) добавили туда же. Наконец, DIPEA (57 мкл, 0,26 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 15 часов. Воду 5 мл добавили к этой смеси, и отфильтровали с получением осадка. Остаток очистили с помощью колоночной хроматографии на силикагеле (0-5% MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (23 мг, 76%).
1H NMR (400 MHz, CDCl3) δ7,60 - 7,55 (m, 2 H), 7,55 - 7,50 (m, 2 H), 7,50 - 7,45 (m, 2 H), 7,00 - 6,93 (m, 2 H), 3,83 (d, 2 H, J = 6,0 Hz), 3,13 (s, 3 H), 3,04 (s, 3 H), 2,98 (d, 2 H, J = 11,3 Hz), 2,54 (s, 2 H), 2,03 - 1,94 (m, 2 H), 1,86 - 1,74 (m, 3 H), 1,40 (dd, 2 H, J = 12,2, 2,6 Hz), 1,02 - 0,95 (m, 2 H), 0,65 (s, 2 H); MS (ESI) m/z 461 (M+ + H).
Пример 125. Соединение 580: N,N-диметил-4-(6-((1-((1-(трифторметил)циклопропил) метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензамид
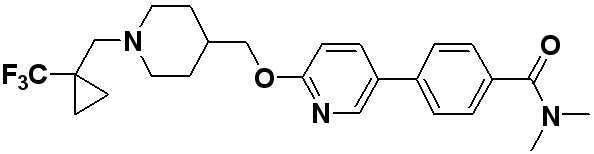
Стадия 1. метил 4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси) пиридин-3-ил)бензоат: 5-бром-2-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин (продукт синтеза стадии 3 соединения 589; 0,50 г, 1,27 ммоль), 4-(метоксикарбонил)фенилборную кислоту (0,25 г, 1,40 ммоль), Pd(dbpf)Cl2 (24 мг, 0,04 ммоль), Cs2CO3 (1,24 г, 3,81 ммоль) добавили в микроволновой реактор, и затем диоксан 6 мл и воду 3 мл добавили туда же. Реакцию проводили при микроволновом облучении при 100 ºC в течение 30 минут. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (20-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (0,40 г, 70%).
Стадия 2. 4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойная кислота: Метил 4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоат (0,40 г, 0,89 ммоль) растворили в THF 10 мл. LiOH·H2O (0,07 г, 1,78 ммоль) в вода 10 мл добавили к этой смеси, и реакцию проводили при 60 ºC в течение 4 часов. Растворитель упарили при пониженном давлении. После добавления 1M HCl 5 мл к этой смеси, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (0,37 г, 96%).
Стадия 3. Соединение 580: 4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойную кислоту (0,05 г, 0,12 ммоль), диметиламин гидрохлорид (0,02 г, 0,23 ммоль), EDC (0,04 г, 0,23 ммоль) и HOBt (0,03 г, 0,23 ммоль) растворили в DMF 2 мл. DIPEA (0,04 мл, 0,23 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 10 часов. Реакционную смесь разбавили насыщенным водным раствором NH4Cl, и проэкстрагировали с CH2Cl2. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (10-70% EtOAc/гексан) с получением целевого соединения в виде твердого вещества белого цвета (0,01 г, 19%).
1H NMR (400 MHz, CDCl3) δ 8,37 (s, 1 H), 7,80 (dd, 1 H, J = 8,4, 2,3 Hz), 7,54 (dd, 4 H, J = 19,3, 8,3 Hz), 6,83 (d, 1 H, J = 8,7 Hz), 4,26 - 4,19 (m, 2 H), 3,14 - 2,98 (m, 8 H), 2,54 (m, 2 H), 2,19 - 1,80 (m, 5 H), 1,52 - 1,26 (m, 2 H), 1,03 (m, 2 H), 0,66 (m, 2 H); MS (ESI) m/z 462,2 (M+ + H); MS (ESI) m/z 462 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 580 (Стадия 3), соединения Таблицы 150 синтезировали с использованием 4-(6-((1-((1-(трифторметил)циклопропил)метил) пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты и реагента из Таблицы 149.
Таблица 149.
Таблица 150.
Пример 126. Соединение 688:
4'-((1-(2-фторпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-карбоксамид
Стадия 1. 1-(4-((4-бромфенокси)метил)пиперидин-1-ил)пропан-2-ол:
4-((4-бромфенокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 2 соединения 686; 200 мг, 0,65 ммоль) растворили в EtOH 1 мл. 2-метилоксиран (379 мг, 6,52 ммоль), K2CO3 (180 мг, 1,31 ммоль) и воду 1 мл добавили туда же. Смесь перемешивали при микроволновом облучении при 110 ºC в течение 20 минут. По окончании реакции, EtOH упарили из реакционной смеси при пониженном давлении, и затем к ней добавили немного воды. Полученный осадок отфильтровали и высушили при пониженном давлении с получением целевого соединения в виде красного масла (190 мг, 88%).
Стадия 2. 4-((4-бромфенокси)метил)-1-(2-фторпропил)пиперидин:
1-(4-((4-бромфенокси)метил)пиперидин-1-ил)пропан-2-ол (190 мг, 0,58 ммоль) растворили в CH2Cl2 2 мл. Deoxo-fluor (141 мг, 0,64 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 3 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с CH2Cl2. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, и отфильтровали для удаления твердого остатка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде желтого масла (180 мг, 94%).
Стадия 3. метил 4'-((1-(2-фторпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат:
4-((4-бромфенокси)метил)-1-(2-фторпропил)пиперидин (190 мг, 0,58 ммоль), 4-(метоксикарбонил)фенилборную кислоту (124 мг, 0,69 ммоль), Pd(dbpf)Cl2 (19 мг, 0,03 ммоль) и Cs2CO3 (375 мг, 1,15 ммоль) растворили в 1,4-диоксане 2 мл и воде 0,5 мл. Смесь перемешивали при микроволновом облучении при 120 ºC в течение 20 минут. Реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с CH2Cl2. Полученный органический слой высушили над MgSO4, и отфильтровали для удаления твердого остатка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (87 мг, 39%).
Стадия 4. 4'-((1-(2-фторпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота:
метил 4'-((1-(2-фторпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (87 мг, 0,23 ммоль) растворили в THF:MeOH:вода =4:2:1. LiOH·H2O (19 мг, 0,45 ммоль) добавили к этой смеси, и кипятили с обратным холодильником в течение 7 часов. По окончании реакции растворитель упарили при пониженном давлении. Затем отрегулировали pH до значения ниже 6 с помощью 1 N HCl, полученный осадок тщательно промыли с EtOAc и отфильтровали с получением целевого соединения в виде твердого вещества серого цвета (80 мг, 95%).
Стадия 5. Соединение 688: 4'-((1-(2-фторпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (40 мг, 0,11 ммоль), диметиламин гидрохлорид (18 мг, 0,22 ммоль) и PyBOP (84 мг, 0,16 ммоль) растворили в CH2Cl2 1 мл. После перемешивания при комнатной температуре в течение 10 минут, DIPEA (28 мг, 0,22 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EA) с получением целевого соединения в виде твердого вещества белого цвета (17 мг, 45%).
1H NMR (400 MHz, CDCl3) δ 7,52 (m, 6 H), 6,98 (d, 2 H, J = 8,8 Hz), 4,71 (m, 0,5 H), 4,58 (m, 0,5 H), 3,86 (d, 2 H, J = 6,0 Hz), 3,01 (m, 6 H), 2,66 (m, 1 H), 2,47 (m, 1 H), 2,14 (m, 2 H), 1,81 (m, 3 H), 1,66 (m, 2 H), 1,57 (m, 2 H), 1,01 (t, 3 H, J = 7,5 Hz); MS (ESI) m/z 413 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 688, соединения Таблицы 152 синтезировали с использованием 4'-((1-(2-фторпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 151.
Таблица 151.
Таблица 152.
Пример 127. Соединение 690: (4'-((1-(2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанон
Стадия 1. 1-(4-((4-бромфенокси)метил)пиперидин-1-ил)бутан-2-ол:
4-((4-бромфенокси)метил)пиперидин гидрохлорид (продукт синтеза стадии 2 соединения 686; 200 мг, 0,65 ммоль) растворили в EtOH 1 мл. 2-этилоксиран (470 мг, 6,52 ммоль), K2CO3 (180 мг, 1,31 ммоль) и воду 1 мл добавили туда же. Смесь перемешивали при микроволновом облучении при 110 ºC в течение 20 минут. По окончании реакции, EtOH упарили из реакционной смеси при пониженном давлении, и затем к ней добавили немного воды. Полученный осадок отфильтровали и высушили при пониженном давлении с получением целевого соединения в виде красного масла (134 мг, 88%).
Стадия 2. 4-((4-бромфенокси)метил)-1-(2-фторбутил)пиперидин:
1-(4-((4-бромфенокси)метил)пиперидин-1-ил)бутан-2-ол (134 мг, 0,39 ммоль) растворили в CH2Cl2 2 мл. Deoxo-fluor (95 мг, 0,43 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 3 часов. По окончании реакции, реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с CH2Cl2. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4 и отфильтровали для удаления твердого остатка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, EtOAc/Гексан) с получением целевого соединения в виде желтого масла (120 мг, 89%).
Стадия 3. метил 4'-((1-(2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат: 4-((4-бромфенокси)метил)-1-(2-фторбутил)пиперидин (150 мг, 0,44 ммоль), 4-(метоксикарбонил) фенилборную кислоту (94 мг, 0,52 ммоль), Pd(dbpf)Cl2 (14 мг, 0,02 ммоль), Cs2CO3 (284 мг, 0,87 ммоль) растворили в 1,4-диоксане 2 мл и воде 0,5 мл. Смесь перемешивали при микроволновом облучении при 120 ºC в течение 20 минут. Реакционную смесь разбавили насыщенным водным раствором NaHCO3 и проэкстрагировали с CH2Cl2. Полученный органический слой высушили над MgSO4, и отфильтровали для удаления твердого остатка. Фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества желтого цвета (30 мг, 17%).
Стадия 4. 4'-((1-(2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота: Метил 4'-((1-(2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (30 мг, 0,08 ммоль) растворили в THF:MeOH: вода =4:2:1. LiOH·H2O (6 мг, 0,15 ммоль) добавили к этой смеси, и кипятили с обратным холодильником в течение 7 часов. По окончании реакции растворитель упарили при пониженном давлении. Затем отрегулировали pH до значения ниже 6 с помощью 1 N HCl, полученный осадок тщательно промыли с EtOAc и отфильтровали с получением целевого соединения в виде твердого вещества серого цвета (21 мг, 72%).
Стадия 5. Соединение 690: 4'-((1-(2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (21 мг, 0,05 ммоль), пиперидин-3-ол (11 мг, 0,11 ммоль) и PyBOP (43 мг, 0,08 ммоль) растворили в CH2Cl2 1 мл. После перемешивания при комнатной температуре в течение 10 минут, DIPEA (14 мг, 0,11 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Органический слой промыли насыщенным водным соляным раствором, высушили над MgSO4, отфильтровали для удаления твердого остатка, и фильтрат упарили при пониженном давлении. Концентрат очистили с помощью колоночной хроматографии (ISCO силикагелевый картридж, MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (14 мг, 54%).
1H NMR (400 MHz, CDCl3) δ 7,53 (m, 6 H), 6,97 (d, 2 H, J = 6,8 Hz), 4,60 (m, 0,5 H), 3,86 (m, 0,5 H), 3,08 (m, 4 H), 3,45 (m, 2 H), 2,66 (m, 2 H), 2,53 (m, 1 H), 2,45 (m, 1 H), 2,13 (m, 2 H), 1,82 (m, 6 H), 1,64 (m, 3 H), 1,59 (m, 3 H), 1,01 (t, 3 H, J = 7,4 Hz); MS (ESI) m/z 469 (M+ + H).
Пример 128. Соединение 655: (R)-(4'-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанон

Стадия 1. 1-(4-((4-бромфенокси)метил)пиперидин-1-ил)пентан-2-ол: 4-((4-бромфенокси) метил)пиперидин гидрохлорид (продукт синтеза стадии 1 соединения 498; 500 мг, 1,63 ммоль) и K2CO3 (450 мг, 3,26 ммоль) суспендировали в EtOH 2 мл. К этой смеси добавили 2 мл воды, и смесь суспендировали при небольшом нагревании. 2-пропилоксиран (1,40 г, 16,31 ммоль) добавили к этой смеси. Реакцию проводили при микроволновом облучении при 110 ºC в течение 20 минут. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде твердого вещества белого цвета (510 мг, 88%).
Стадия 2. 4-((4-бромфенокси)метил)-1-(2-фторпентил)пиперидин:
1-(4-((4-бромфенокси)метил)пиперидин-1-ил)пентан-2-ол (510 мг, 1,43 ммоль) растворили в CH2Cl2 4 мл. Deoxo-Fluor (348 мг, 1,58 ммоль) добавили к этой смеси. После перемешивания в течение 3 часов при комнатной температуре, к этой смеси добавили насыщенный водный раствор NaHCO3, и смесь проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, и отфильтровали для удаления осадка. Фильтрат упарили при пониженном давлении с получением целевого соединения в виде желтого масла (395 мг, 77%).
Стадия 3. метил 4'-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат:
4-((4-бромфенокси)метил)-1-(2-фторпентил)пиперидин(250 мг, 0,70 ммоль) и 4-(метоксикарбонил)фенилборную кислоту (151 мг, 0,84 ммоль) растворили в диоксане 2 мл. К этой смеси добавили 0,5 мл воды. Pd(dbpf)Cl2 (23 мг, 0,04 ммоль) и Cs2CO3 (455 мг, 1,40 ммоль) добавили туда же. Реакцию проводили при микроволновом облучении при 120 ºC в течение 20 минут. Реакционную смесь отфильтровали через цеолиты. К фильтрату добавили насыщенный водный раствор NaHCO3 и проэкстрагировали с CH2Cl2. Органический слой высушили над MgSO4, и затем упарили при пониженном давлении. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества белого цвета (115 мг, 40%).
Стадия 4. 4'-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенил-4-карбоновая кислота:
Метил 4'-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенил-4-карбоксилат (115 мг, 0,28 ммоль) растворили в THF 2 мл. MeOH 1 мл и H2O 0,5 мл добавили туда же. К смеси добавили LiOH·H2O (23 мг, 0,56 ммоль), и затем кипятили с обратным холодильником и перемешивали в течение дня. После подкисления с помощью 1 N HCl, полученный осадок отфильтровали с получением целевого соединения в виде твердого вещества белого цвета (100 мг, 90%).
Стадия 5. Соединение 655: 4'-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенил-4-карбоновую кислоту (40 мг, 0,10 ммоль), (R)-пирролидин-2-илметанол (15 мг, 0,15 ммоль) и PyBOP (78 мг, 0,15 ммоль) растворили в DMF 1 мл. DIPEA (26 мг, 0,20 ммоль) добавили к этой смеси. Реакцию проводили при комнатной температуре в течение 8 часов. Реакционную смесь разбавили водой и проэкстрагировали с помощью EtOAc. Полученный органический слой высушили над MgSO4, и отфильтровали. Полученную концентрированную смесь очистили с помощью колоночной хроматографии на силикагеле (MeOH/CH2Cl2) с получением целевого соединения в виде твердого вещества светло-желтого цвета (21 мг, 43%).
1H NMR (400 MHz, CDCl3) δ 7,57 (m, 4 H), 7,52 (d, 2 H, J = 8,7 Hz), 6,97 (d, 2 H, J = 8,7 Hz), 4,78 (m, 0,5 H), 4,64 (m, 0,5 H), 4,42 (m, 1 H), 3,75 (m, 4 H), 3,55 (m, 2 H), 3,16 (m, 2 H), 2,62 (m, 1 H), 2,53 (m, 1 H), 2,17 (m, 3 H), 1,80 (m, 5 H), 1,63 (m, 2 H), 1,47 (m, 3 H), 0,95 (t, 3 H, J = 7,1 Hz); MS (ESI) m/z 483 (M+ + H).
Согласно вышеописанному процессу синтеза соединения 655 (Стадия 5), соединения Таблицы 154 синтезировали с использованием 4'-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты и реагента из Таблицы 153.
Таблица 153.
Таблица 154.
Структурные формулы приведены в следующих Таблицах 155-180.
Таблица 155.
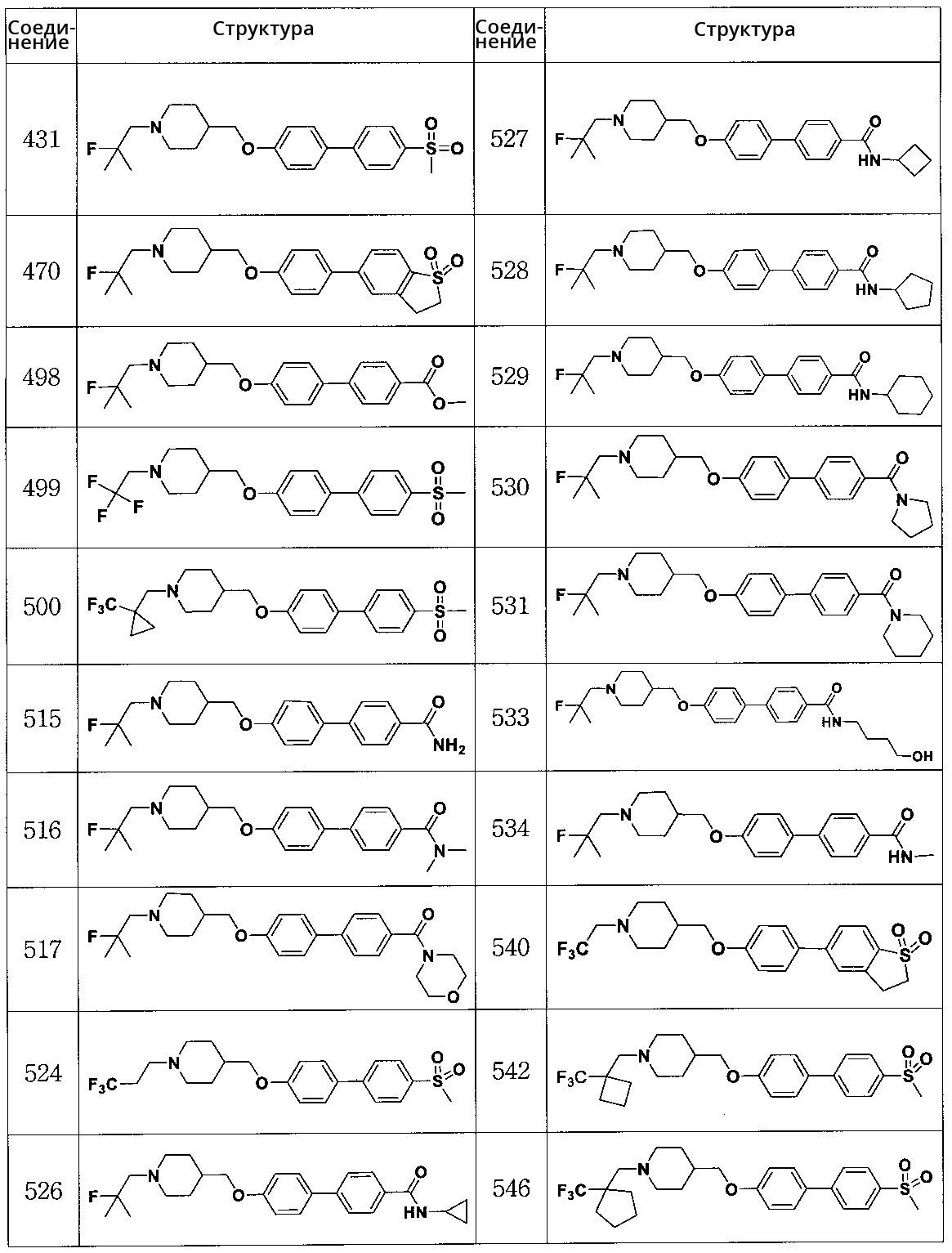
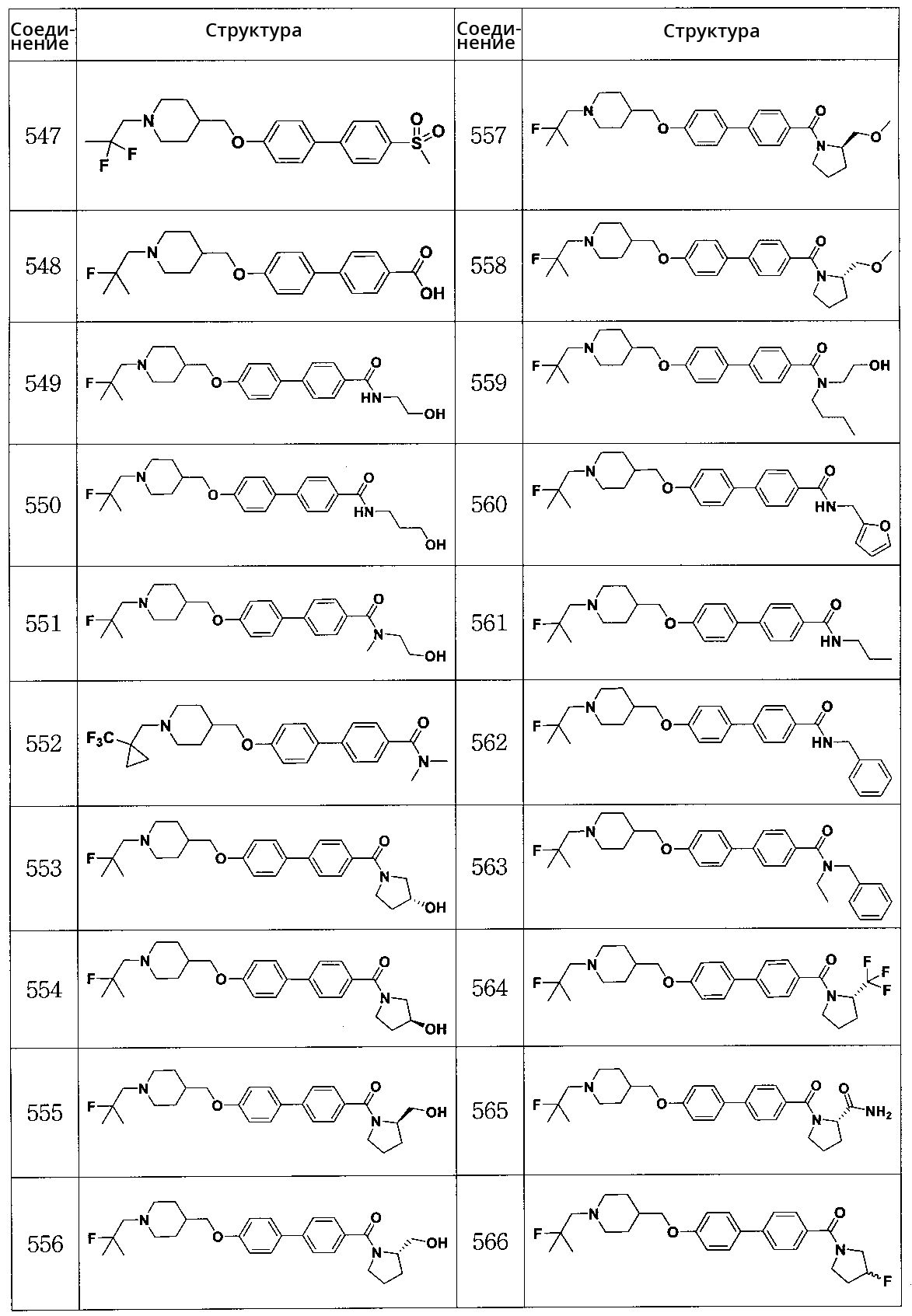
Таблица 157.

Таблица 158.
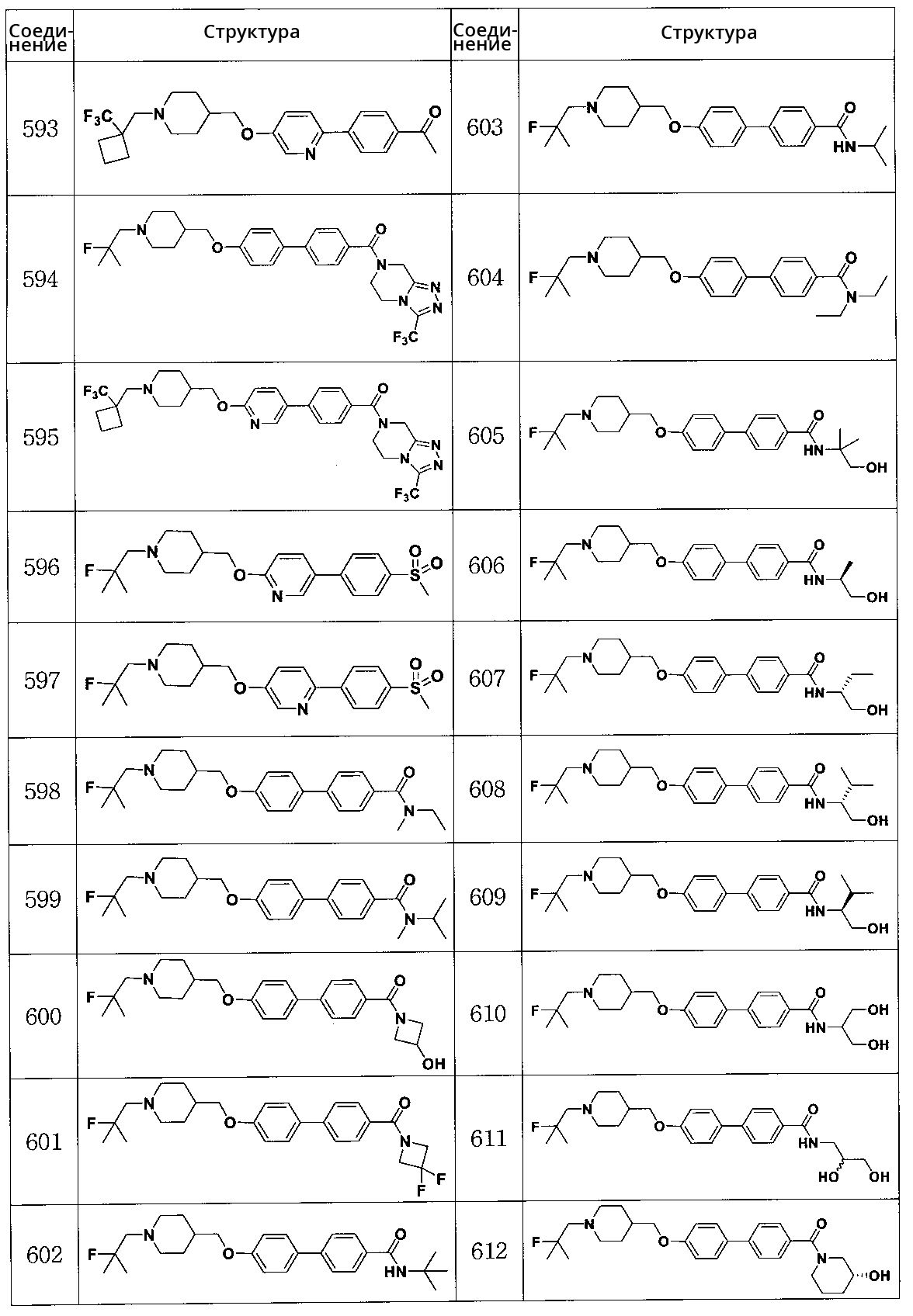
Таблица 159.
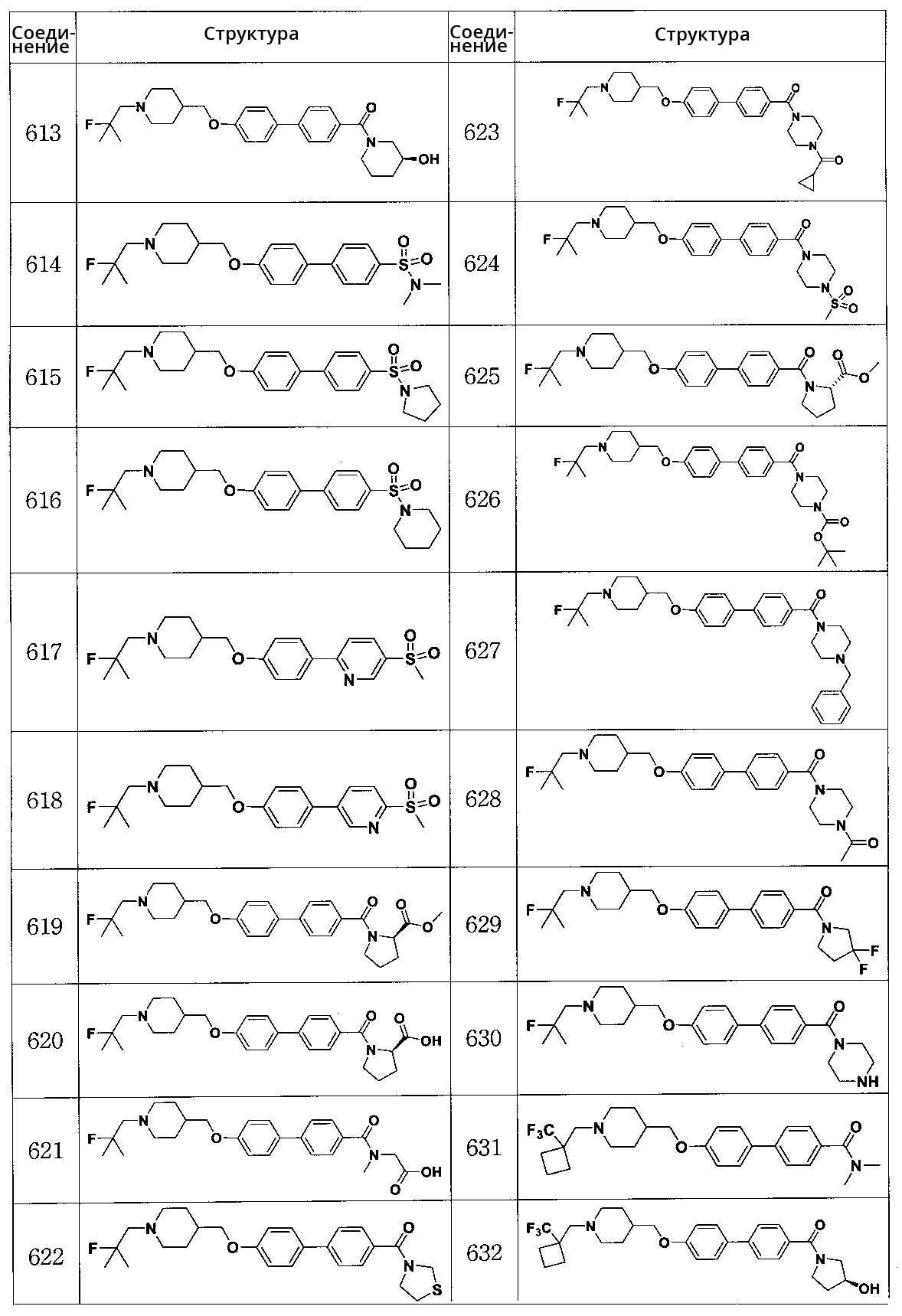
Таблица 160.
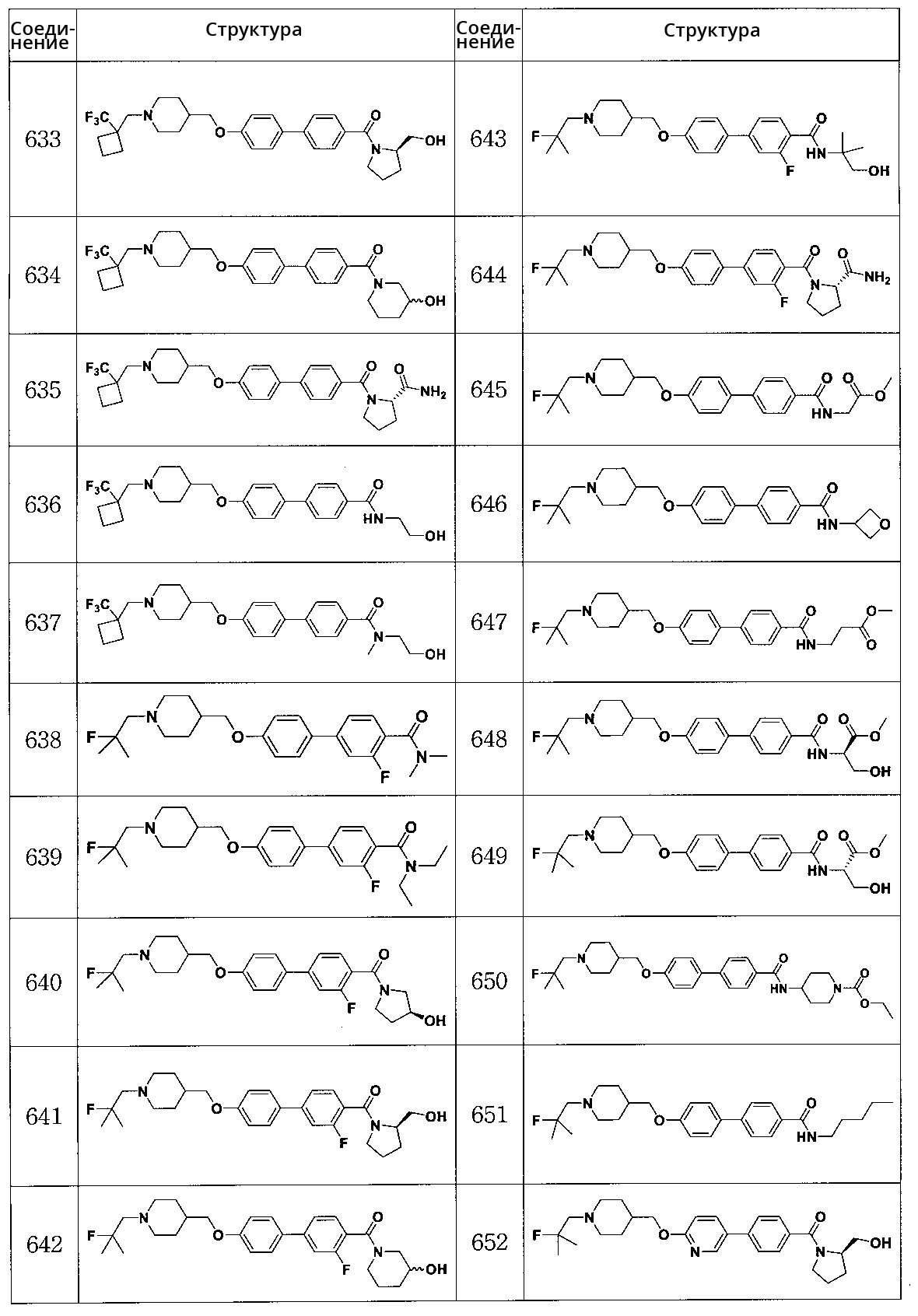
Таблица 161.
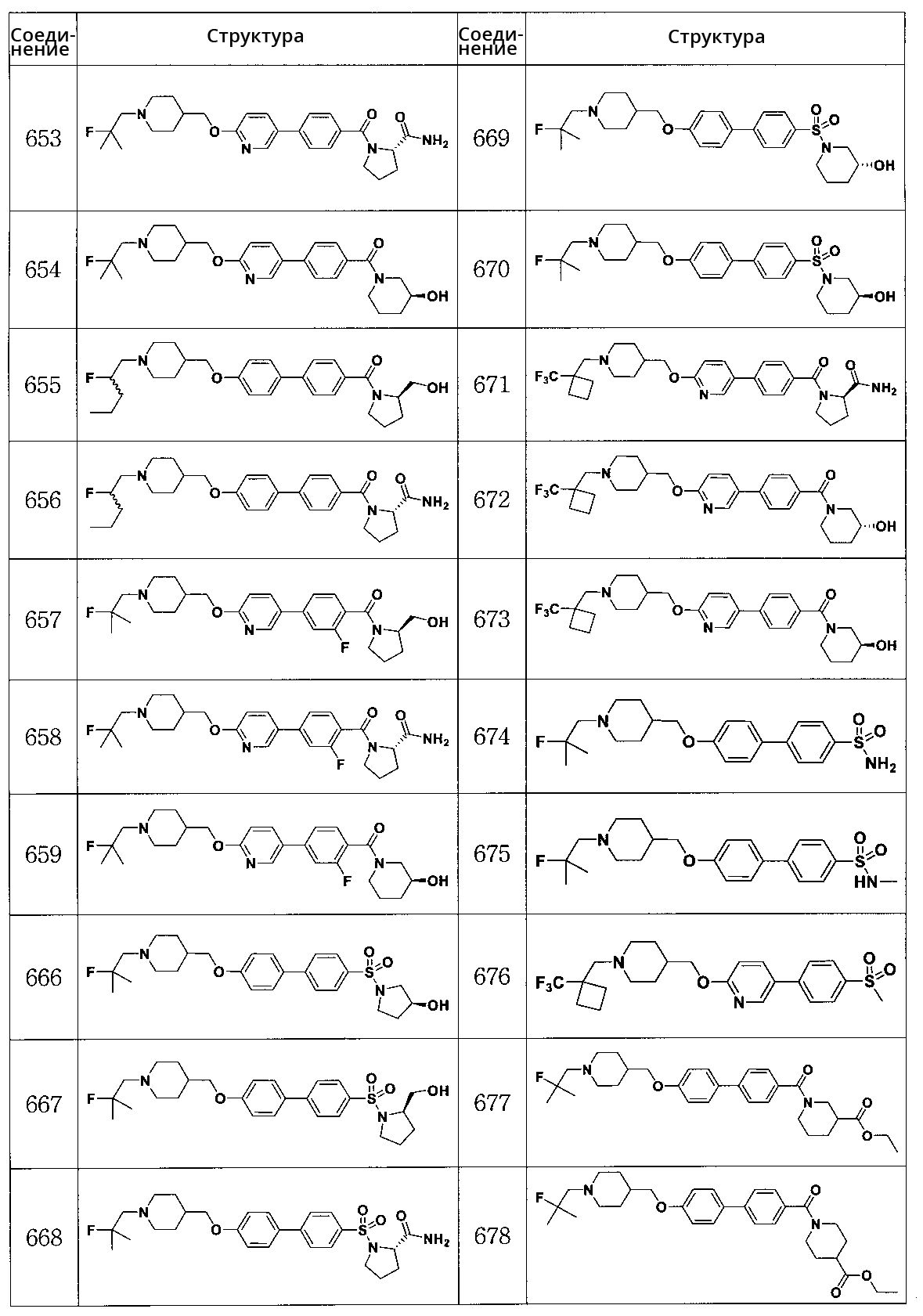
Таблица 162.
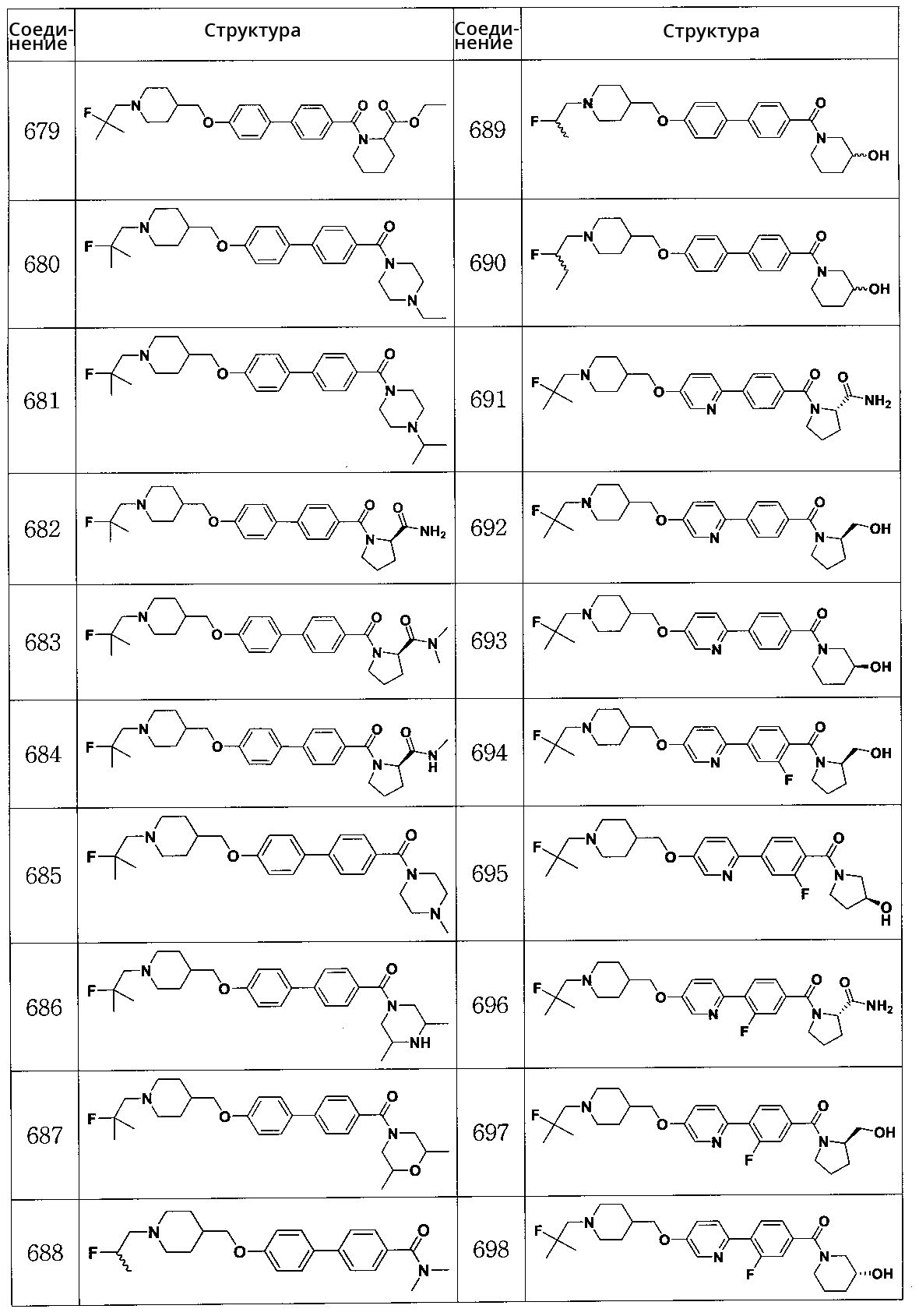
Таблица 163.
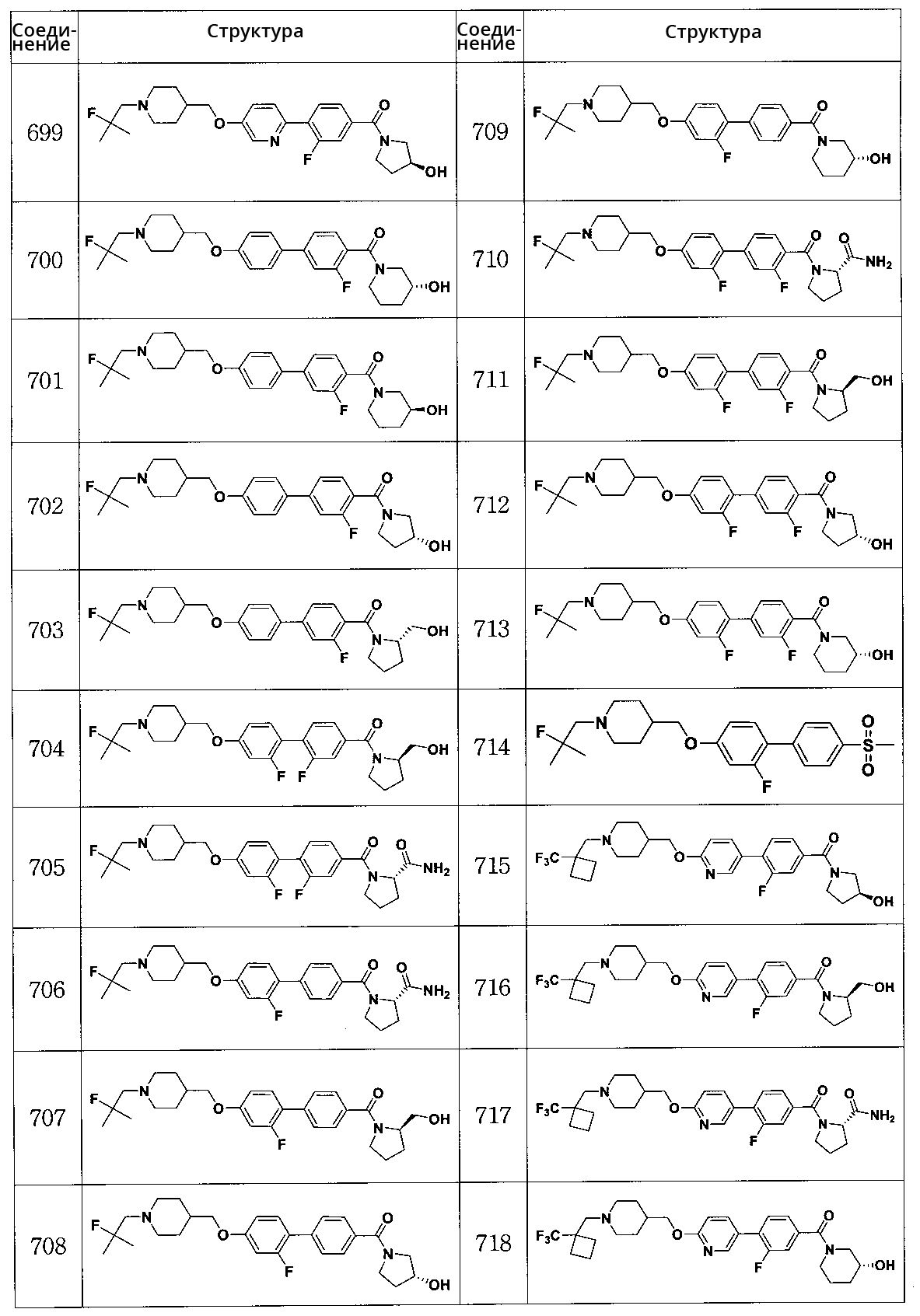
Таблица 164.
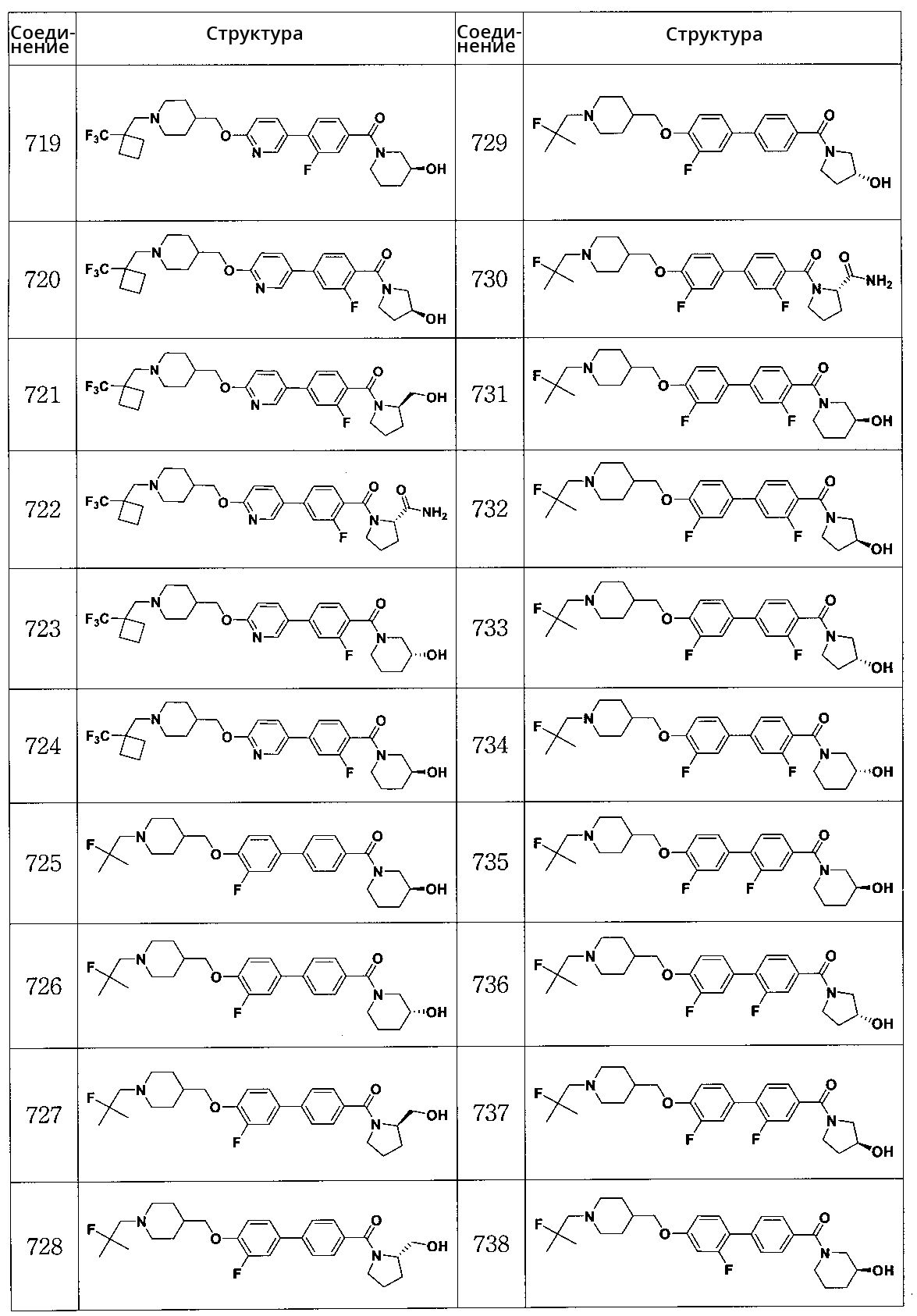
Таблица 165.
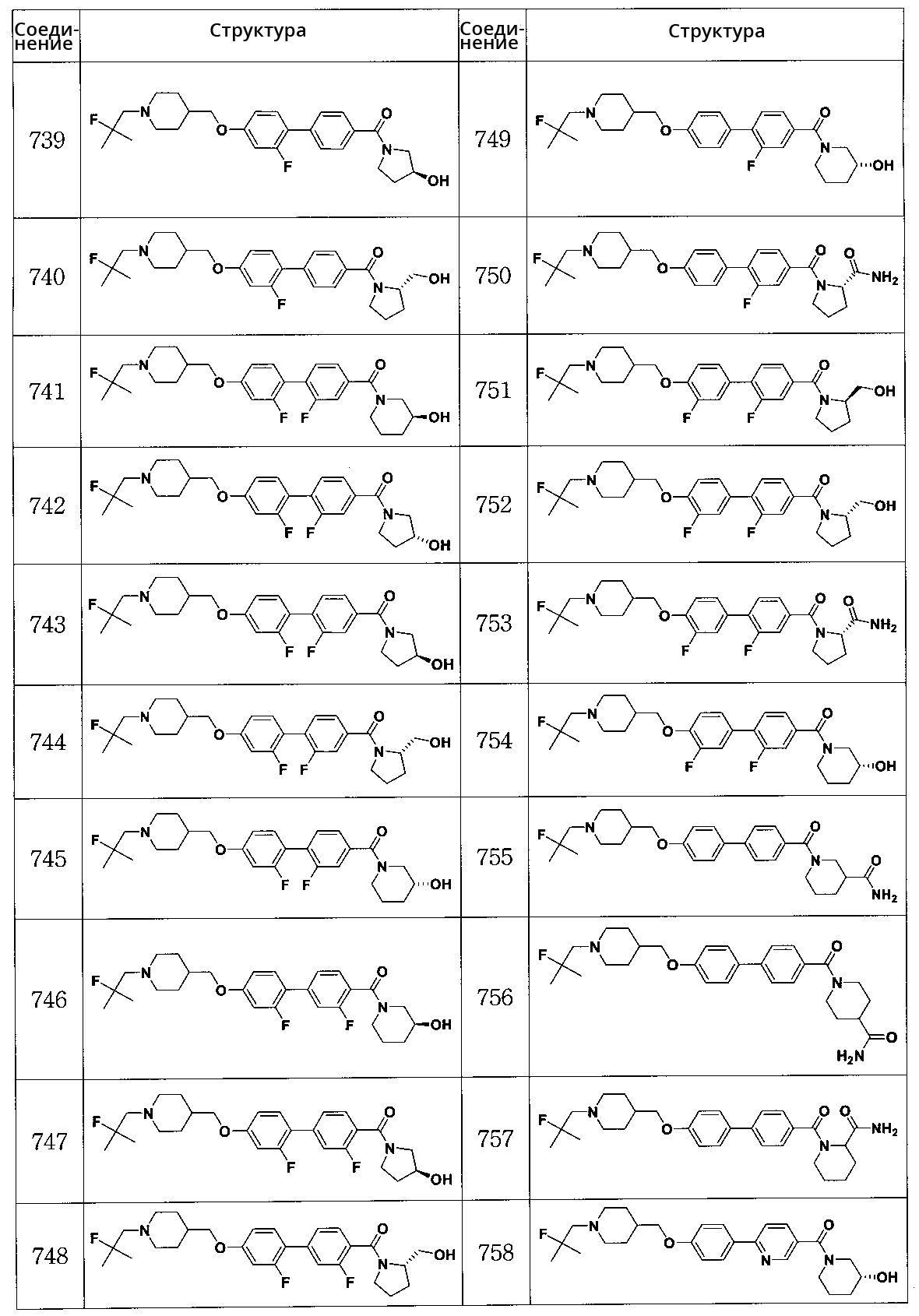
Таблица 166.

Таблица 167.
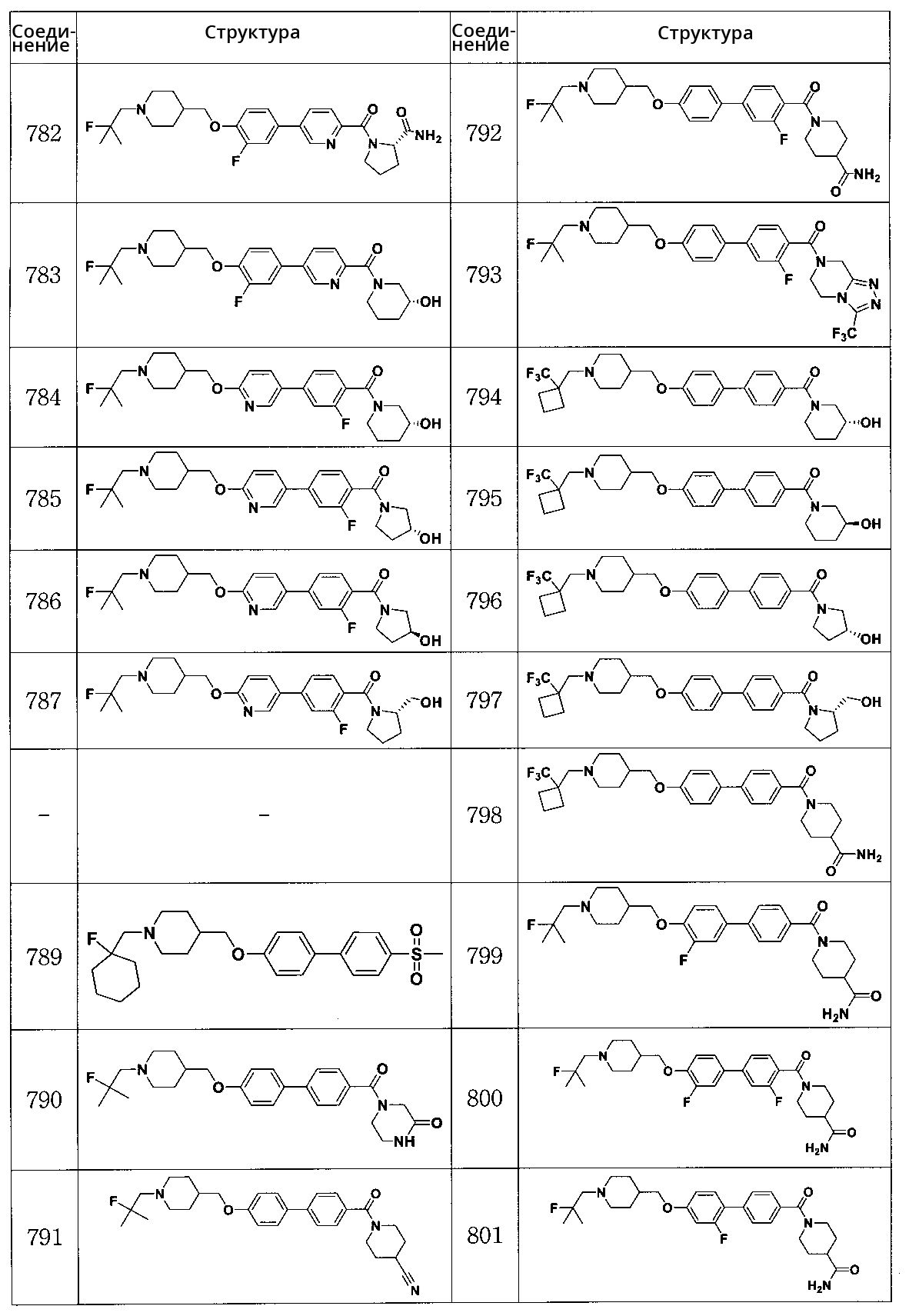
Таблица 168.
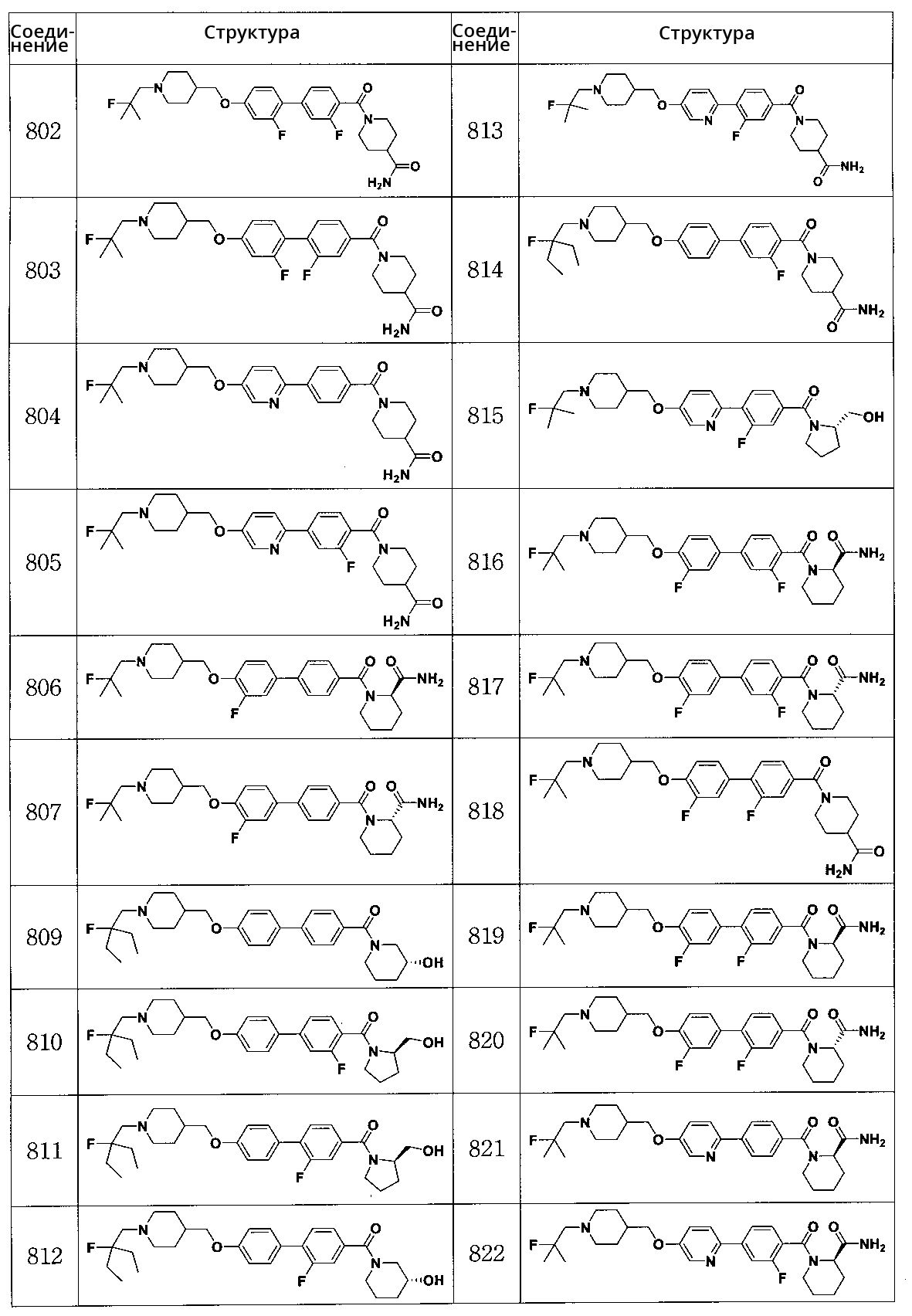
Таблица 169.
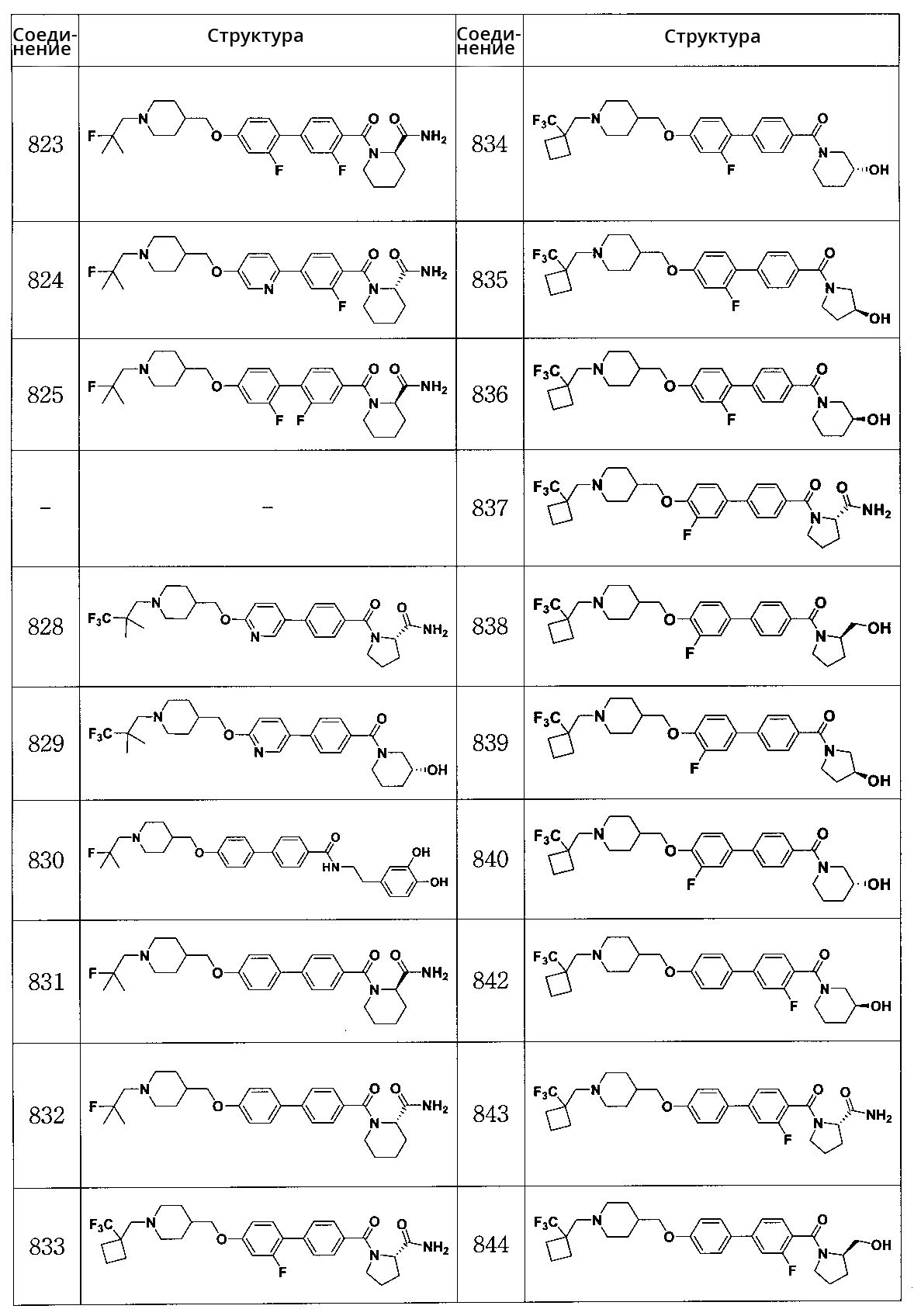
Таблица 170.
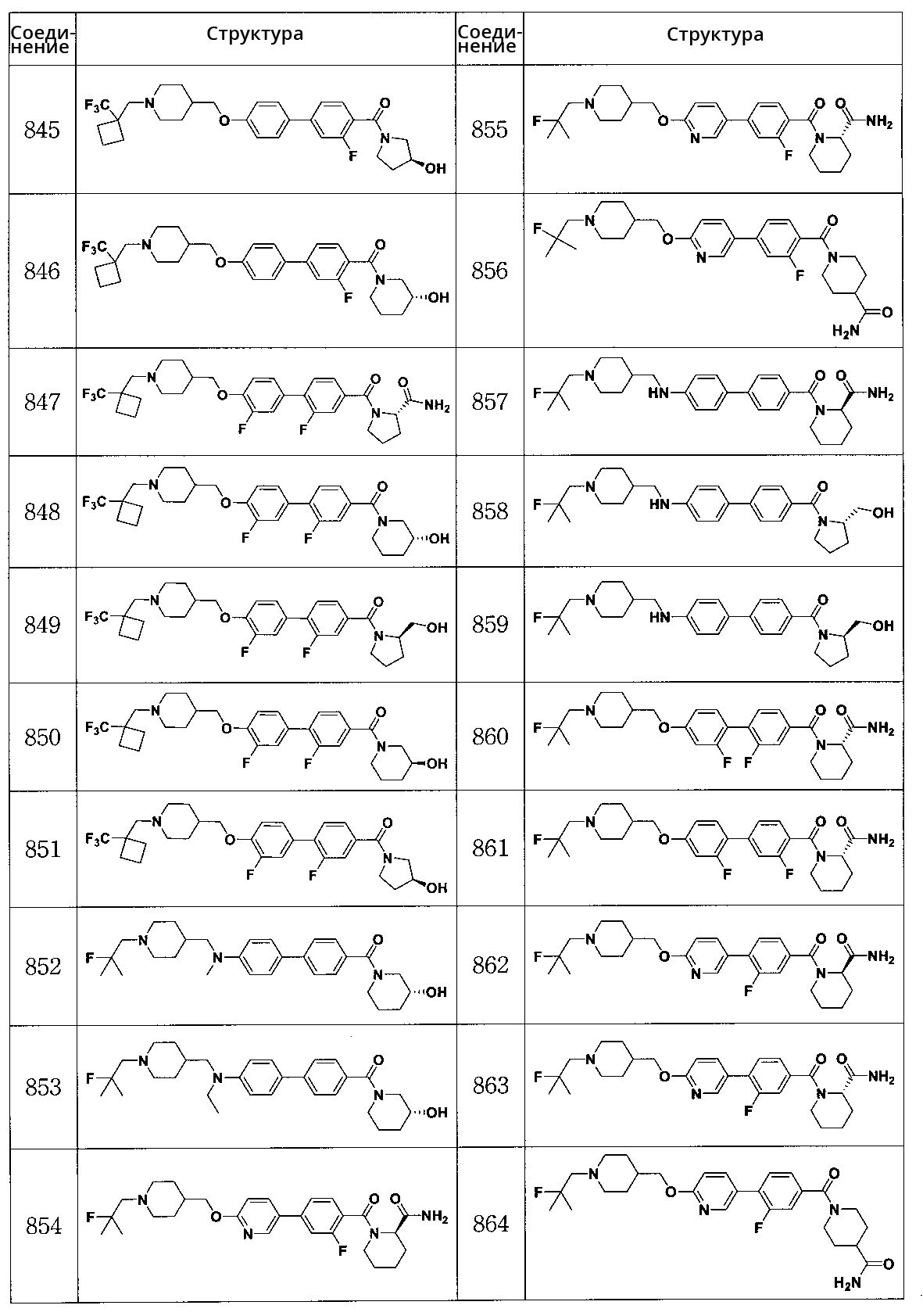
Таблица 171.
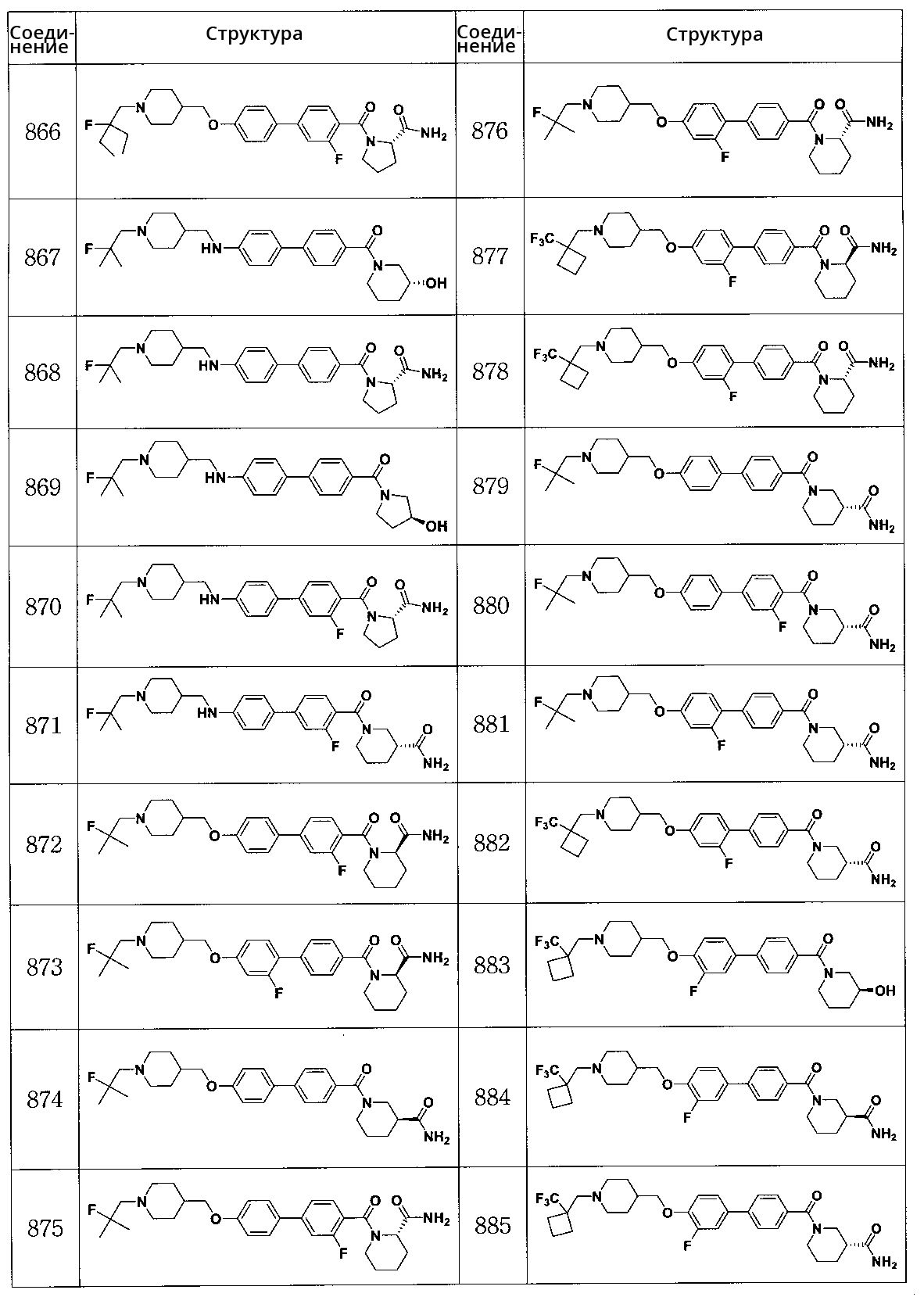
Таблица 172.

Таблица 173.
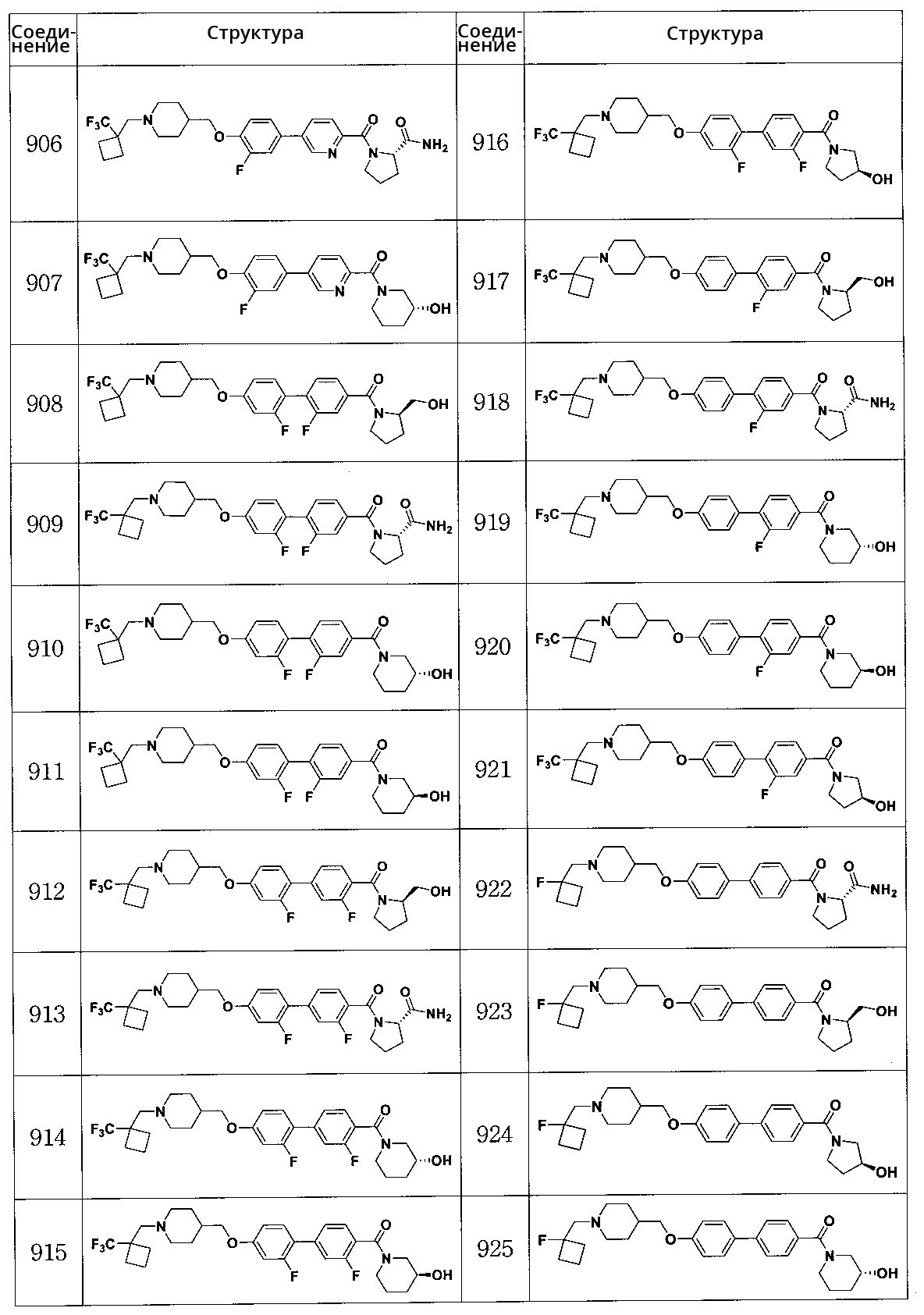
Таблица 174.
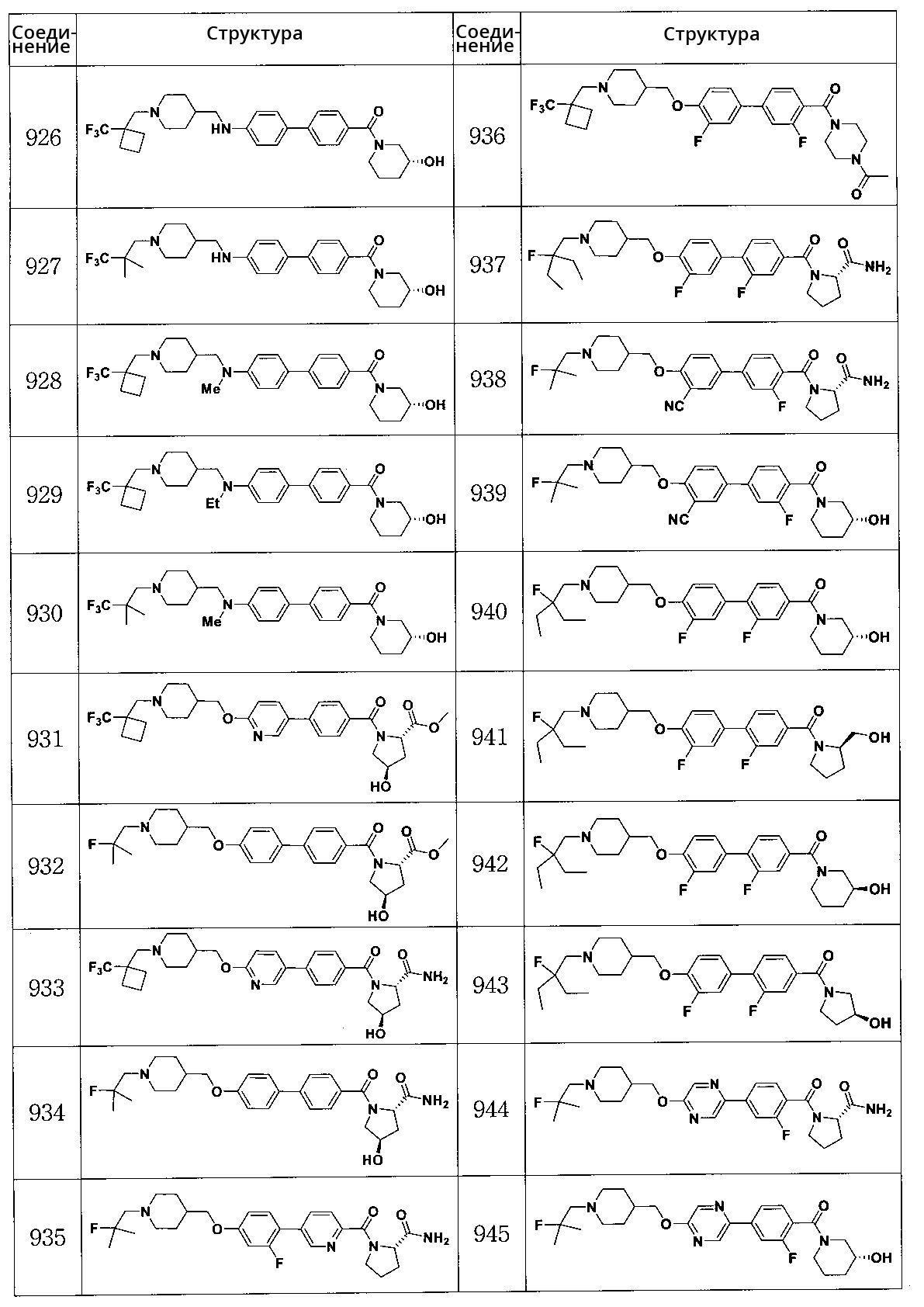
Таблица 175.
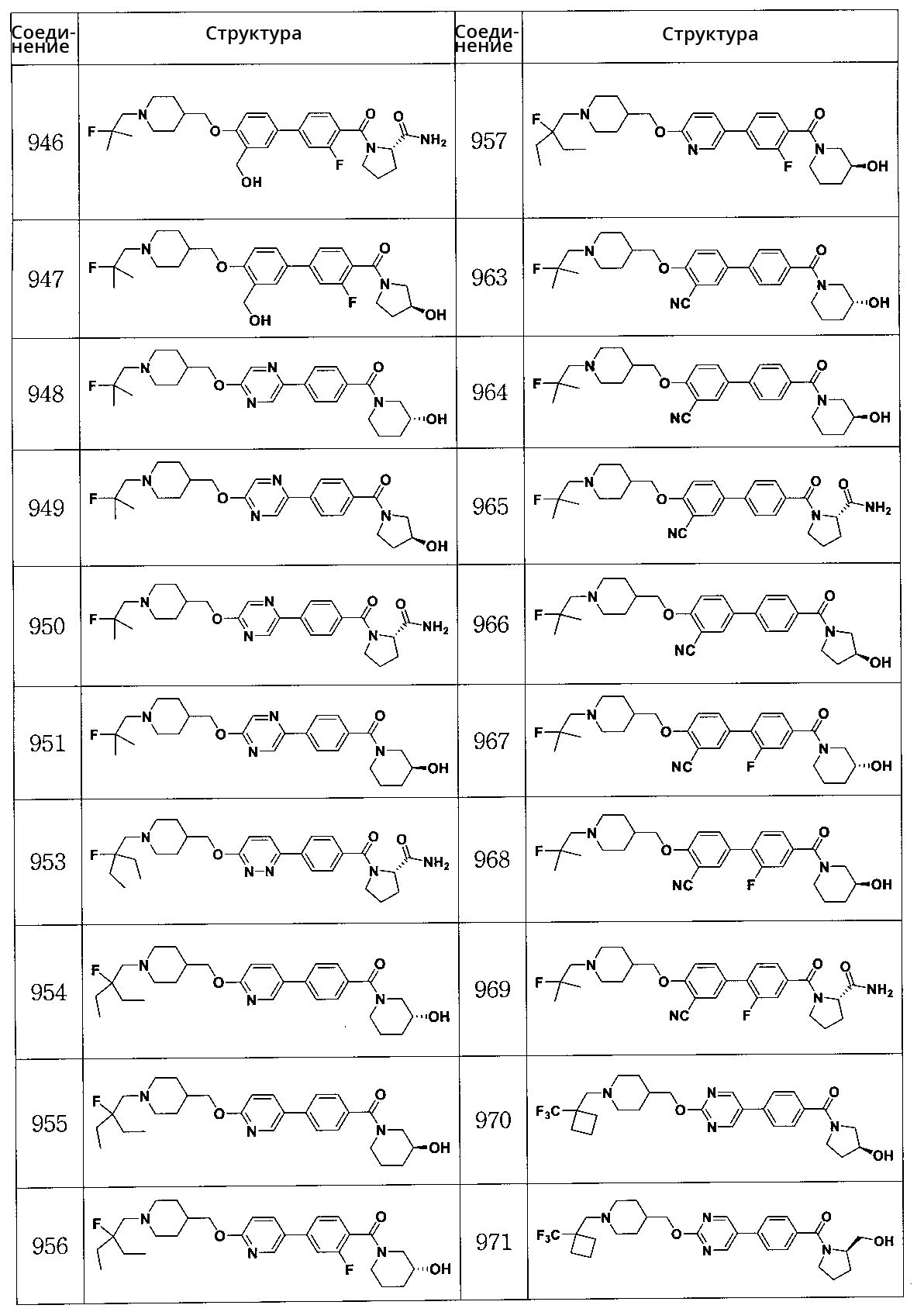
Таблица 176.
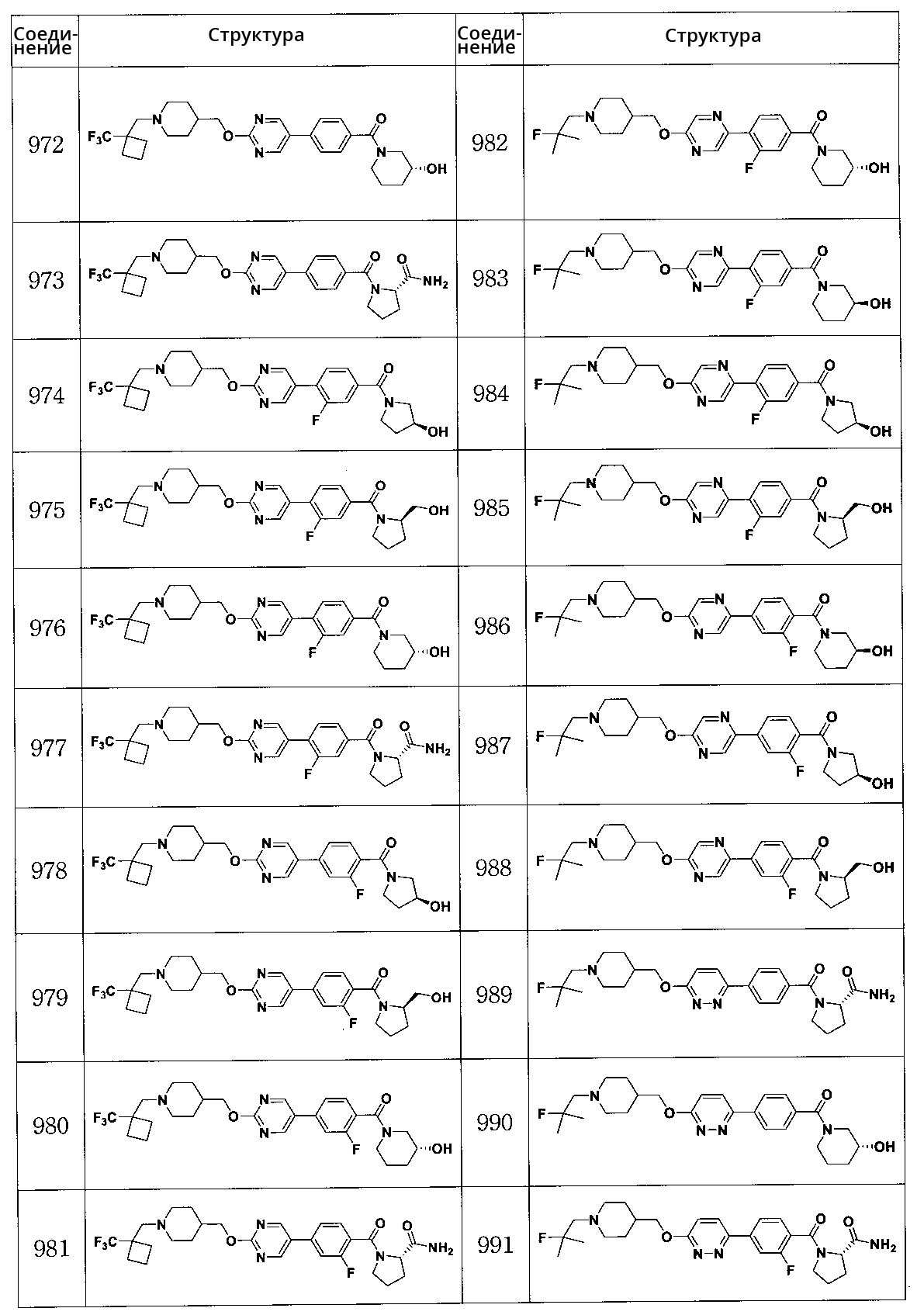
Таблица 177.

Таблица 178.
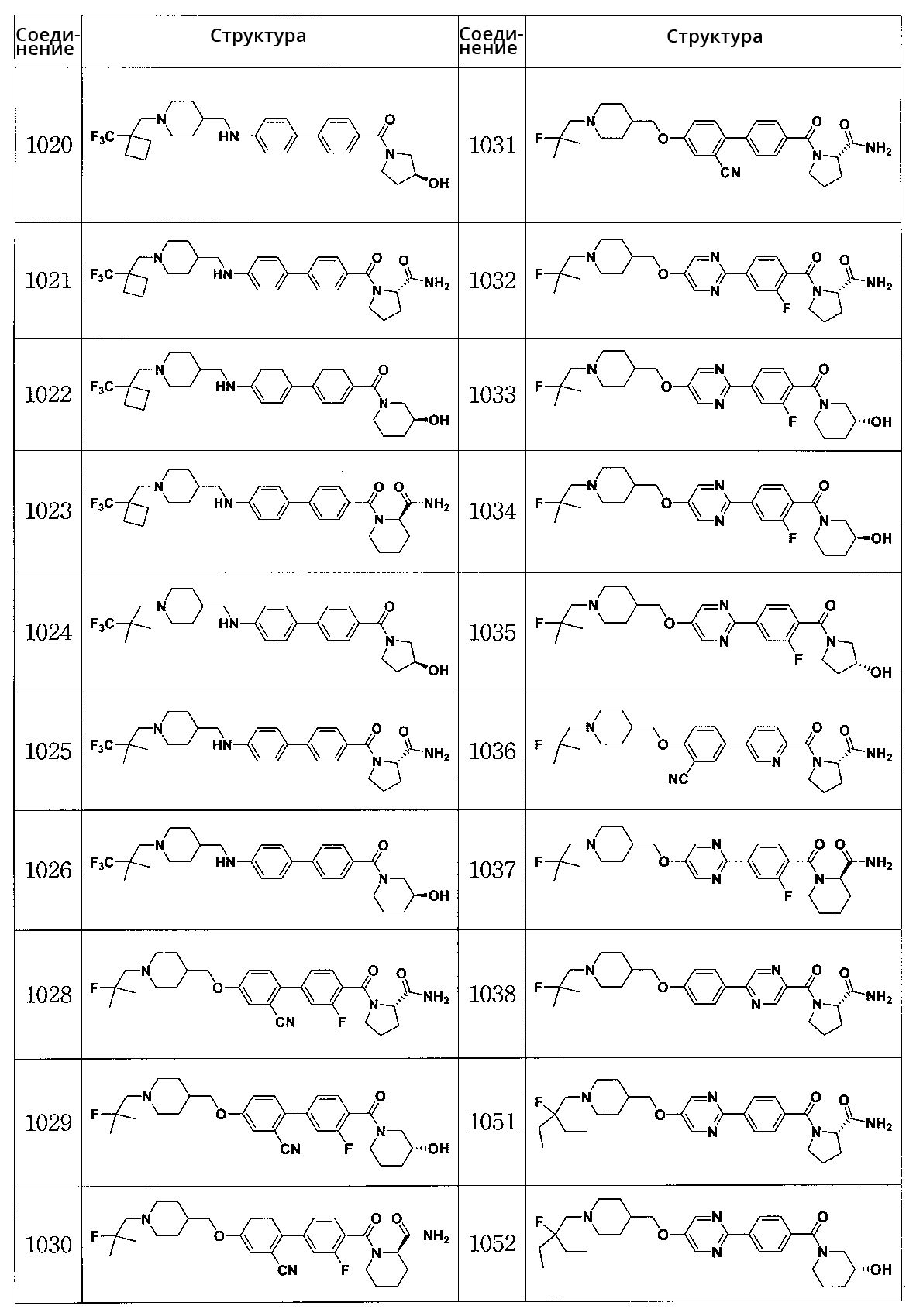
Таблица 179.
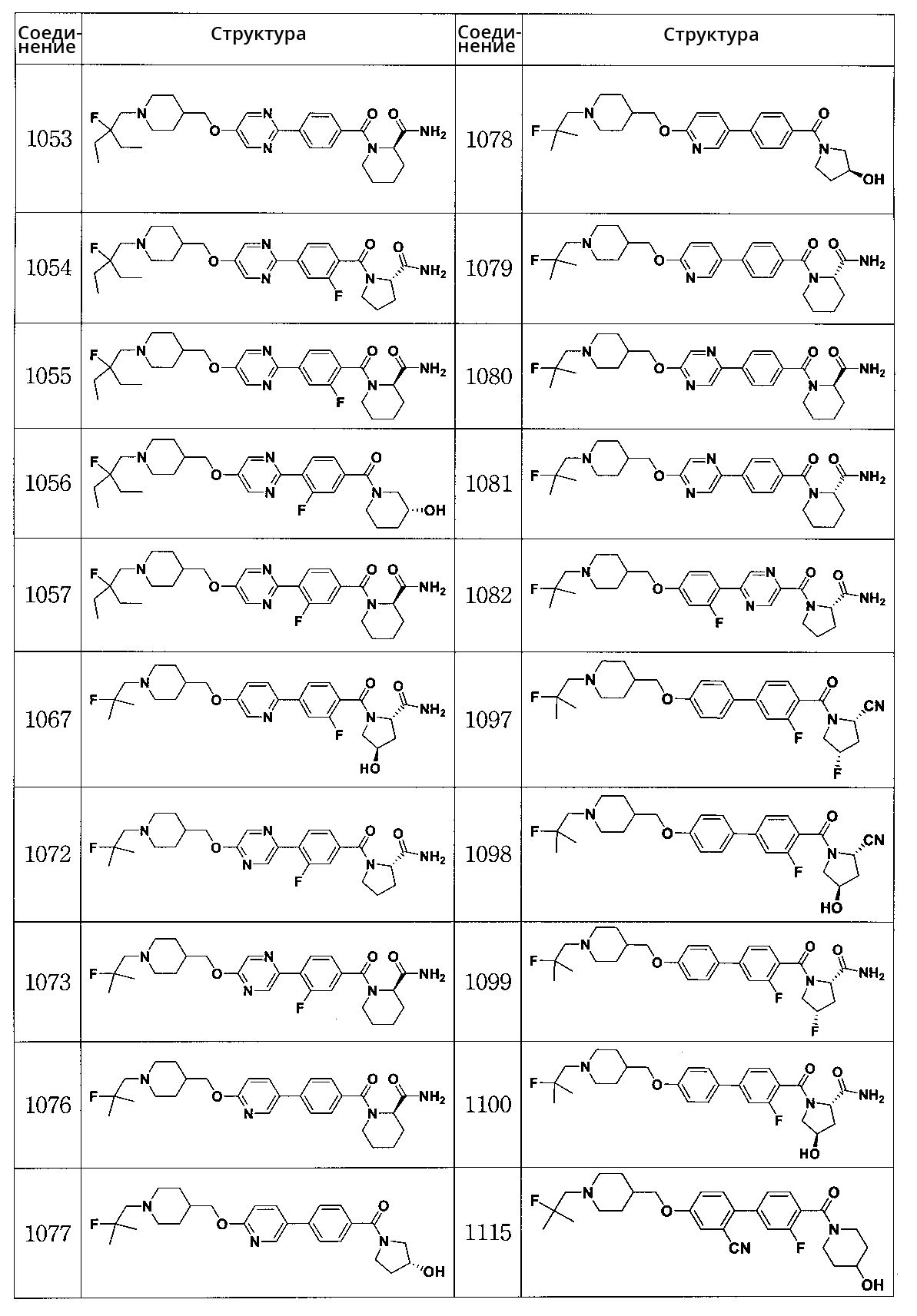
Таблица 180.
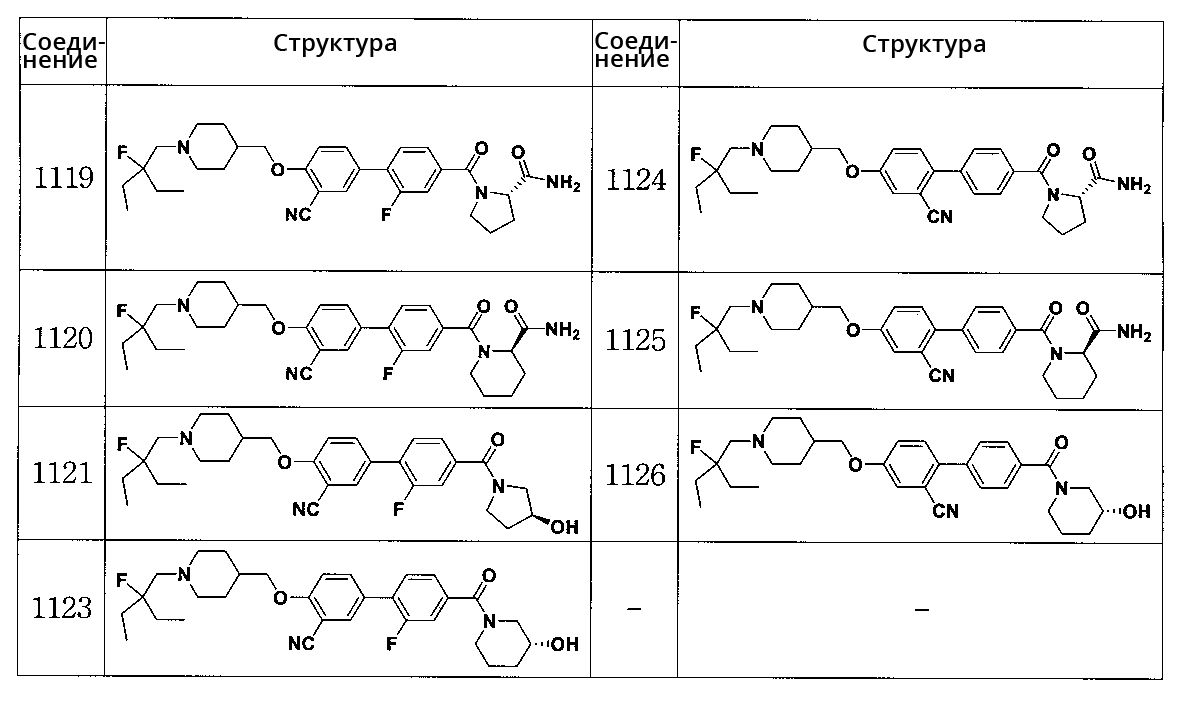
Протокол эксперимента: проверка активности соединения по данному изобретению
Лечебную активность соединения 1 по данному изобретению в отношении диабета II типа проверяли, используя в качестве контроля коммерческие продукты, а также проверяли безопасность соединений формулы 1.
Экспериментальный пример 1. Проверка активности в отношении GPR 119 рецептора (in vitro)
1. Человеческая рецепторная клетка GPR119
В качестве человеческой клетки, экспрессирующей GPR119 рецептор, для этого теста использовали коммерчески доступную клеточную линию “GeneBLAzerTM T-Rex GPR 119 CHO-K1 DA cells” производства Invitrogen. Клетки инкубировали в DMEM среде, содержащей 1% диализированной фетальной бычьей сыворотки. В клеточном инкубаторе поддерживали постоянную температуру 37 ºC и постоянную влажность с 5% CO2.
2. Проверка активности в отношении человеческого GPR119 рецептора
Для этого теста использовали человеческие клетки, экспрессирующие GPR119 рецептор. Каждое проверяемое соединение добавили до финальной концентрации 0,1, 1, 10 мкмоль/л на 96-луночном планшете и проверяли дважды. В каждую из 96 лунок добавляли фиксированное количество клеток и обрабатывали проверяемым соединением в течение 5 часов. После обработки с окрашивающим агентом в течение 2 часов, с помощью планшетного ридера определяли значение флуоресценции. Вычисляли отношение длин волн флуоресценции из обработанных агонистом лунок к таковым из контрольных лунок, содержащих только носитель (например, клетки), и конвертировали для получения процентных значений.
3. Статистическая обработка
Все результаты представлены как средние значения ± стандартное отклонение, и все проверяемые группы и контрольную группу сравнивали с применением критерия Стьюдента для установления эффекта каждой проверяемой группы.
4. Результаты проверки активности в отношении человеческого GPR119
Таблица 181. Результаты проверки активности в отношении человеческого GPR119
В Таблице 181, “% активации” показывает степень активации человеческого GPR119 рецептора проверяемыми соединениями при каждой концентрации. Большее значение% активации означает лучшую активность. Максимальное значение% активации контрольного соединения (MBX-2982) равняется 200, и большинство соединений по данному изобретению продемонстрировали более чем 200% активации. Соединения 1013 и 1028 продемонстрировали прекрасную активность со значениями активации в 490% и 402% активации соответственно.
Экспериментальный пример 2. Животный тест активности в отношении GPR 119 рецептора нормальной мыши (in vivo)
1. Методика проверки толерантности к глюкозе
Мышей мужского пола C57/6J Jms возрастом 6-7 недель воздерживали от принятия пищи 16 часов перед началом теста на толерантность к глюкозе. Экспериментальная группа животных состояла из:
A. группа носителя (10% EtOH, 20% HPBCD в солевом растворе),
B. группа позитивного контроля получившая MBX-2982 (10 мг/кг), и
C. проверяемая группа, получившая соединения 516, 581, 586, 612, 640, 644 и т.д. (10 мг/кг).
Перед введением соединений, т.е. в момент времени 0, общий уровень глюкозы в крови определили с помощью Glucometer (ACCU-CHEK, Roche). Через 30 минут после введения соединения, общий уровень глюкозы в крови определили снова, и ввели 20% глюкозы (2 г/ кг/10 мл) орально. Общий уровень глюкозы в крови определяли через 20, 40, 60, 80, и 120 минут после введения 20% глюкозы. Площадь под кривой (AUC) общего уровня глюкозы в крови определяли с помощью GraphPad Prism 5,0. Эффект толерантности к глюкозе устанавливали по скорректированной площади под кривой (cAUC), для чего вычитали базовое значение глюкозы площади под кривой.
2. Результат теста толерантности к глюкозе
В Таблице 182, “Понижение% AUC” показывает степень уменьшения общего уровня глюкозы в крови под действием проверяемых соединений после орального введения глюкозы нормальным мышам. Чем больше значение уменьшения% AUC, тем лучше эффект падения уровня глюкозы в крови. Контрольное соединение (MBX-2982) демонстрирует только 24% падение уровня глюкозы в крови, и некоторые из соединений по данному изобретению демонстрируют более чем 40% падение уровня глюкозы в крови. Соединения 612 и 1028 демонстрируют очень сильное падение уровня глюкозы в крови размером в 50% и 46% соответственно.
Таблица 182. Результат теста толерантности к глюкозе
Экспериментальный пример 3. Животный тест активности в отношении GPR 119 рецептора при наличии болезни (DIO мыши)
1. Методика проверки толерантности к глюкозе
Мышей мужского пола C57BL/6J возрастом 6,5 недель держали на диете с высоким содержанием жиров (60% ккал, Research Diets) в течение 12 недель. Полученных мышей мужского пола с ожирением (DIO) C57BL/6J возрастом 18,5 недель воздерживали от принятия пищи 16 часов перед началом теста на толерантность к глюкозе. Экспериментальная группа животных состояла из:
A. группа носителя (10% EtOH, 20% HPBCD в D.W.),
B. группа позитивного контроля получившая ситаглиптин (30 мг/кг), и
C. проверяемые группы, получившая соединение 770 и соединение 1028 (10, 30 мг/кг и в комбинации с ситаглиптином 30 мг/кг).
Каждое проверяемое соединение вводили в одно и то же время ежедневно в течение 2 недель. Перед введением соединения, общий уровень глюкозы в крови определяли с помощью Glucometer (ACCU-CHEK, Roche). Через 30 минут после введения соединения, общий уровень глюкозы в крови определили снова, и ввели 20% глюкозы (2 г/ кг/10 мл) орально. Общий уровень глюкозы в крови определяли через 20, 40, 60, 80, и 120 минут после введения 20% глюкозы. Площадь под кривой (AUC) общего уровня глюкозы в крови определяли с помощью GraphPad Prism 5,0. Эффект толерантности к глюкозе устанавливали по скорректированной площади под кривой (cAUC), для чего вычитали базовое значение глюкозы площади под кривой.
2. Измерение изменения общего уровня глюкозы в крови
Общий уровень глюкозы в крови измеряли примерно через 1 час после введения проверяемого соединения в крови из хвостовой вены с помощью Glucometer. В целом, общий уровень глюкозы в крови измеряли три раза: (1) перед началом введения лекарства, (2) через 1 неделю после начала двухнедельного введения лекарства, и (3) после прекращения двухнедельного введения лекарства. Каждое измерение начинали с введения 20% глюкозы, и затем проводили через 20, 40, 60, 80, и 120 минут после введения 20% глюкозы.
3. Результат теста толерантности к глюкозе (DIO)
В таблице 183 показана степень уменьшения общего уровня глюкозы в крови под действием проверяемых соединений после орального введения глюкозы мышам с смоделированным заболеванием (DIO mouse). Более высокие значения означают более эффективное падение уровня глюкозы в крови. Эффект проверяли отдельно после введения только проверяемого соединения и после совместного введения проверяемого соединения и ситаглиптина, который является DPP IV ингибитором. В результате, соединения по данному изобретению, вводимые отдельно, показали более чем 20% падение уровня глюкозы в крови, и совместное введение соединений по данному изобретению с ситаглиптином также показало хороший эффект. Соединение 1028 показало 28,5% при отдельном введении и 32,3% при совместном введении.
Таблица 183.
Реферат
Изобретение относится к производному пиперидина формулы 1, его стереоизомерам или фармацевтически приемлемым солям. Соединения формулы 1 обладают свойствами агониста GPR119. В формуле 1[Формула 1]W является О или N-Rгруппой; R, Rи Rкаждая независимо является Н или Салкильной группой; Rявляется -F или -Сгиперфторид алкильной группой; Rи Rкаждую независимо выбирают из группы, состоящей из Н, галогена, -Салкильной группы; или Rи Rобъединяются, образуя -Сциклоалкильную группу;выбирают из группы, состоящей из:, в котором Rfи Rfкаждая независимо является Н, галогеном или -CN группой;выбирают из группы, состоящей из:, в котором Rkи Rkкаждая независимо является Н, -CN группой, галогеном или -Салкил(ОН) группой;является; Q является Н, -S(O)Rгруппой, -S(O)Rгруппой, -C(O)Rгруппой, -C(O)ORгруппой, -C(O)NHRгруппой, -C(O)NRRгруппой, -S(O)NHRгруппой, -S(O)NRRгруппой или. Изобретение также относится к фармацевтической композиции. Технический результат: получены новые производные пиперидина формулы 1, которые контролируют активность GPR119. 2 н. и 6 з.п. ф-лы, 183 табл., 131 пр.
Формула
[Формула 1]
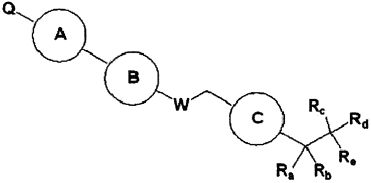
в котором
W является О или N-Rh группой;
Ra, Rb и Rh каждая независимо является Н или С1-3 алкильной группой;
Rc является -F или -С1-3 гиперфторид алкильной группой;
Rd и Re каждую независимо выбирают из группы, состоящей из Н, галогена, -С1-5 алкильной группы;
или Rd и Re объединяются, образуя -С3-7 циклоалкильную группу;

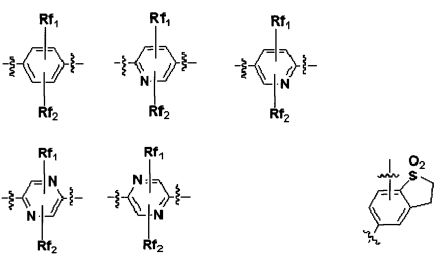
в котором Rf1 и Rf2 каждая независимо является Н, галогеном или -CN группой;

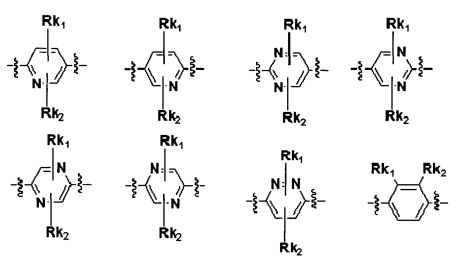
в котором Rk1 и Rk2 каждая независимо является Н, -CN группой, галогеном или -С1-5 алкил(ОН) группой;
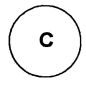
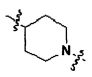
Q является Н, -S(O)R1 группой, -S(O)2R1 группой, -C(O)R1 группой, -C(O)OR1 группой, -C(O)NHR1 группой, -C(O)NR2R3 группой, -S(O)2NHR1 группой, -S(O)2NR2R3 группой или
в котором
R1 является Н, -CF3, -С1-5 алкильной группой, от 3- до 7-членной гетероциклической группой, содержащей от 1 до 3 членов, выбранных из группы, состоящей из N, О и S, С3-7 циклоалкильной группой или Ar группой,
R2 и R3 каждая независимо является С1-5 алкильной группой, С3-7 циклоалкильной группой или от 3- до 7-членной гетероциклической группой с О (в R1, R2 и R3 -С1-5 алкильная группа может быть независимо замещена Rx1 и Rx2),
или R2 и R3 вместе с N атомами, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое неароматическое циклическое соединение, возможно далее включающее от 0 до 2 членов, независимо выбираемых из группы, состоящей из N, О, S и С(О),
в котором гетероциклическое неароматическое циклическое соединение может быть замещено Rx1 и Rx2,
в котором Rx1 и Rx2 каждая независимо является Н, -ОН, галогеном, -CN, -CF3, -С1-5 алкильной группой, -С1-5 алкил(ОН) группой, -С1-5 алкил-О-С1-5 алкильной группой, -C(O)NR4R5 группой, -C(O)R4 группой, -C(O)OR4 группой, -S(O)2R4 группой,
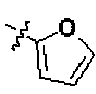

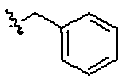

W является О;
Ra и Rb каждая независимо является Н;
Rc является -F или -CF3;
Rd и Re каждая независимо является -С1-5 алкильной группой;

в котором Rf1 и Rf2 каждая независимо является Н, галогеном или -CN группой;


в котором Rk1 и Rk2 каждая независимо является Н, галогеном или -С1-5 алкил(ОН) группой;
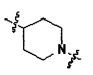
Q является -S(O)2R1 группой, -C(O)NR2R3 группой или -S(O)2NR2R3 группой,
в котором R1, R2 и R3 каждая независимо является С1-5 алкильной группой, замещенной Rx1 и Rx2,
или R2 и R3 вместе с N атомами, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое неароматическое соединение, далее возможно включающее от 0 до 2 членов, независимо выбираемых из группы, состоящей из N, О, S и С(О),
в котором гетероциклическое неароматическое циклическое соединение может быть замещено Rx1 и Rx2,
в котором Rx1 и Rx2 каждая независимо является Н, -ОН, галогеном, -CN, -CF3, -C1-5 алкильной группой, -С1-5 алкил(ОН) группой, -С1-5 алкил-O-C1-5 алкильной группой, -C(O)NR4R5 группой, -C(O)R4 группой, -C(O)OR4 группой или -S(O)2R4 группой [в котором R4 и R5 каждая независимо является Н, -С1-5 алкильной группой или -С3-7 циклоалкильной группой].
W является О;
Ra и Rb каждая независимо является Н;
Rc является -F или -CF3;
Rd и Re каждая независимо является -С1-5 алкильной группой или Rd и Re объединяются, образуя -С3-7 циклоалкильную группу;
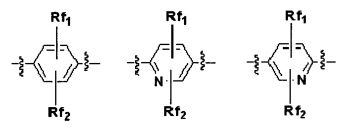
в котором Rf1 и Rf2 каждая независимо является Н, галогеном или -CN группой;

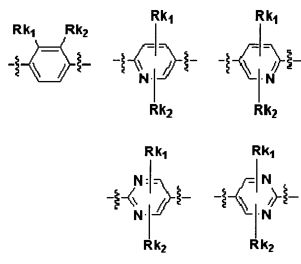
в котором Rk1 и Rk2 каждая независимо является Н, галогеном или -С1-5 алкил(ОН) группой;
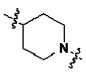
Q является -C(O)NR2R3,
в котором R2 и R3 вместе с N атомами, с которыми они связаны, могут образовывать 5- или 6-членное гетероциклическое неароматическое циклическое соединение, далее возможно включающее от 0 до 2 членов, независимо выбираемых из группы, состоящей из N, О, S и С(О),
в котором гетероциклическое неароматическое циклическое соединение может быть замещено Rx1 и Rx2,
в котором Rx1 и Rx2 каждая независимо является Н, -ОН, галогеном, -CN, -CF3, -C1-5 алкильной группой, -С1-5 алкил(ОН) группой, -C1-5 алкил-O-C1-5 алкильной группой, -C(O)NR4R5 группой, -C(O)R4 группой, -C(O)OR4 группой, -S(O)2R4 группой или -OR4 группой,
в котором R4 и R5 каждая независимо является Н, -С1-5 алкильной группой или -С3-7 циклоалкильной группой.
W является О;
Ra и Rb каждая независимо является Н;
Rc является -F или -CF3;
Rd и Re каждую независимо выбирают из группы, состоящей из -СН3 и -СН2СН3;

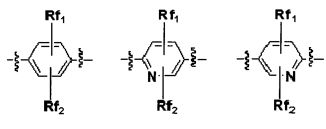
в котором Rf1 и Rf2 каждая независимо является Н, -F или -CN;
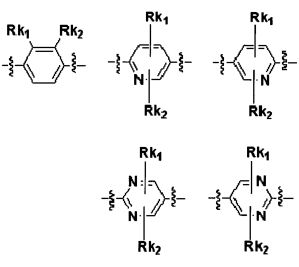
в котором Rk1 и Rk2 каждая независимо является Н, -F или -CN;
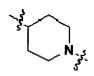
Q выбирают из группы, состоящей из:

в котором Rx1 и Rx2 каждая независимо является Н, ОН, -F, -CN, -CF3, -СН2ОН или -C(O)NH2.
1-(2-фтор-2-метилпропил)-4-((4′-(метилсульфонил)бифенил-4-илокси)метил)пиперидина;
5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксида;
метил 4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксилата;
4-((4′-(метилсульфонил)бифенил-4-илокси)метил)-1-(2,2,2-трифторэтил)пиперидина;
4-((4′-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклопропил)метил)пиперидина;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-карбоксамида;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(морфолино)метанона;
4-((4′-(метилсульфонил)бифенил-4-илокси)метил)-1-(3,3,3-трифторпропил)пиперидина;
N-циклопропил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
N-циклобутил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
N-циклопентил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
N-циклогексил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(пирролидин-1-ил)метанона;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(пиперидин-1-ил)метанона;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(4-гидроксибутил)бифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-карбоксамида;
5-(4-((1-(2,2,2-трифторэтил)пиперидин-4-ил)метокси)фенил)-2,3-дигидробензо[b]тиофен 1,1-диоксида;
4-((4′-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклобутил)метил)пиперидина;
4-((4′-(метилсульфонил)бифенил-4-илокси)метил)-1-((1-(трифторметил)циклопентил)метил)пиперидина;
1-(2,2-дифторпропил)-4-((4′-(метилсульфонил)бифенил-4-илокси)метил)пиперидина;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоновой кислоты;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(2-гидроксиэтил)бифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(3-гидроксипропил)бифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(2-гидроксиэтил)-N-метилбифенил-4-карбоксамида;
N,N-диметил-4′-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
(R)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(метоксиметил)пирролидин-1-ил)метанона;
(S)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(метоксиметил)пирролидин-1-ил)метанона;
N-бутил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(2-гидроксиэтил)бифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(фуран-2-илметил)бифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-пропилбифенил-4-карбоксамида;
N-бензил-N-этил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
(S)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(трифторметил)пирролидин-1-ил)метанона;
(S)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-фторпирролидин-1-ил)метанона;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-(гидроксиметил)пиперидин-1-ил)метанона;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-гидроксипиперидин-1-ил)метанона;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-фторпирролидин-1-ил)метанона;
(S)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-фторпирролидин-1-ил)метанона;
4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензойной кислоты;
1-(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)этанона;
N,N-диметил-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензамида;
(S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
N,N-диметил-4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензамида;
(S)-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
морфолино(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
пиперидин-1-ил(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
пирролидин-1-ил(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(S)-1-(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(4-(гидроксиметил)пиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(4-(гидроксиметил)пиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
5-(4-(метилсульфонил)фенил)-2-((1-((1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридина;
1-(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)этанона;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-(трифторметил)-5,6-дигидро-[1,2,4]триазол[4,3-а]пиразин-7(8Н)-ил)метанона;
(3-(трифторметил)-5,6-дигидро-[1,2,4]триазол[4,3-а]пиразин-7(8Н)-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
2-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5-(4-(метилсульфонил)фенил)пиридина;
5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-2-(4-(метилсульфонил)фенил)пиридина;
N-этил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-изопропил-N-метилбифенил-4-карбоксамида;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксиазетидин-1-ил)метанона;
(3,3-дифторазетидин-1-ил)(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
N-трет-бутил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-изопропилбифенил-4-карбоксамида;
N,N-диэтил-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидрокси-2-метилпропан-2-ил)бифенил-4-карбоксамида;
(S)-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидроксипропан-2-ил)бифенил-4-карбоксамида;
(R)-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидроксибутан-2-ил)бифенил-4-карбоксамида;
(R)-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидрокси-3-метилбутан-2-ил)бифенил-4-карбоксамида;
(S)-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидрокси-3-метилбутан-2-ил)бифенил-4-карбоксамида;
N-(1,3-дигидроксипропан-2-ил)-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
N-(2,3-дигидроксипропил)-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
(R)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-сульфонамида;
1-(2-фтор-2-метилпропил)-4-((4′-(пирролидин-1-илсульфонил)бифенил-4-илокси)метил)пиперидина;
1-(2-фтор-2-метилпропил)-4-((4′-(пиперидин-1-илсульфонил)бифенил-4-илокси)метил)пиперидина;
2-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)-5-(метилсульфонил)пиридина;
5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)-2-(метилсульфонил)пиридина;
(R)-метил 1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксилата;
(R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоновой кислоты;
2-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-илкарбоксамидо)уксусной кислоты;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(тиазолидин-3-ил)метанона;
(4-(циклопропанкарбонил)пиперазин-1-ил)(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-(метилсульфонил)пиперазин-1-ил)метанона;
(S)-метил 1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксилата;
трет-бутил 4-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-1-карбоксилата;
(4-бензилпиперазин-1-ил)(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
1-(4-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-1-ил)этанона;
(3,3-дифторпирролидин-1-ил)(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(пиперазин-1-ил)метанона;
N,N-диметил-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
(S)-(3-гидроксипирролидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(R)-(2-(гидроксиметил)пирролидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(3-гидроксипиперидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(S)-1-(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
N-(2-гидроксиэтил)-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
N-(2-гидроксиэтил)-N-метил-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-карбоксамида;
N,N-диэтил-3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
(S)-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(1-гидрокси-2-метилпропан-2-ил)бифенил-4-карбоксамида;
(S)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
метил 2-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)ацетата;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-(оксэтан-3-ил)бифенил-4-карбоксамида;
метил 3-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)пропаноата;
(R)-метил 2-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)-3-гидроксипропаноата;
(S)-метил 2-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)-3-гидроксипропаноата;
этил 4-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илкарбоксамидо)пиперидин-1-карбоксилата;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-пентилбифенил-4-карбоксамида;
(R)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(S)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(4′-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(4′-((1-(2-фторпентил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(S)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пирролидин-3-ола;
(R)-(1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пирролидин-2-ил)метанола;
(S)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пирролидин-2-карбоксамида;
(R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пиперидин-3-ола;
(S)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-илсульфонил)пиперидин-3-ола;
(R)-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(3-гидроксипиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(S)-(3-гидроксипиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-сульфонамида;
4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-N-метилбифенил-4-сульфонамида;
5-(4-(метилсульфонил)фенил)-2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридина;
этил 1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксилата;
этил 1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксилата;
этил 1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксилата;
(4-этилпиперазин-1-ил)(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-изопропилпиперазин-1-ил)метанона;
(R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-N,N-диметилпирролидин-2-карбоксамида;
(R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-N-метилпирролидин-2-карбоксамида;
(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(4-метилпиперазин-1-ил)метанона;
(3,5-диметилпиперазин-1-ил)(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(2,6-диметилморфолино)(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
4′-((1-(2-фторпропил)пиперидин-4-ил)метокси)-N,N-диметилбифенил-4-карбоксамида;
(4′-((1-(2-фторпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(4′-((1-(2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-2-(гидроксиметил)пирролидин-1-ил)метанона;
(2S)-1-(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-1-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
1-(2-фтор-2-метилпропил)-4-((2-фтор-4′-(метилсульфонил)бифенил-4-илокси)метил)пиперидина;
(S)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2-фтор-4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(3′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(3′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(3′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(3′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(3,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-(3,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((S)-3-гидроксипиперидин-1-ил)метанона;
(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-3-гидроксипирролидин-1-ил)метанона;
(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((S)-3-гидроксипирролидин-1-ил)метанона;
(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((S)-2-(гидроксиметил)пирролидин-1-ил)метанона;
(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-3-гидроксипиперидин-1-ил)метанона;
(S)-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(2-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(2-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамида;
1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(R)-(6-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиридин-3-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиридин-2-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(4′-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(4′-((1-((1-фторциклогексил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(S)-1-(4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(3-гидроксипиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклопентил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(S)-(3-гидроксипирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(S)-1-(4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(3-гидроксипиперидин-1-ил)(4-(6-((1-((1-(трифторметил)циклогексил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
(S)-1-(5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамида;
(R)-(5-(3-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиридин-2-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
1-((1-фторциклогексил)метил)-4-((4′-(метилсульфонил)бифенил-4-илокси)метил)пиперидина;
4-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-2-она;
1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбонитрила;
1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-(трифторметил)-5,6-дигидро-[1,2,4]триазол[4,3-а]пиразин-7(8Н)-ил)метанона;
(R)-(3-гидроксипиперидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(S)-(3-гидроксипиперидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(R)-(3-гидроксипирролидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
(S)-(2-(гидроксиметил)пирролидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)метанона;
1-(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
1-(3′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
1-(3,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
1-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
1-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
1-(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-4-карбоксамида;
1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-4-карбоксамида;
(R)-1-(3′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(3′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(R)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-4-карбоксамида;
1-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенилкарбонил)пиперидин-4-карбоксамида;
(S)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-1-(3,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(3,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
1-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-4-карбоксамида;
(R)-1-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(2,3′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(R)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-2-карбоксамида;
(R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-2-карбоксамида;
(R)-1-(2′,3-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пиперидин-2-карбоксамида;
(2R)-1-(2,2′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(3-гидроксипиперидин-1-ил)(4-(6-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)метанона;
N-(3,4-дигидроксифенэтил)-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенил-4-карбоксамида;
(R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(2′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(2′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(3-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(3-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(3-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(2,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(2,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(2,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(4′-(((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)(метил)амино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(4′-(этил((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метил)амино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамида;
(S)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамида;
1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-4-карбоксамида;
(R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(2S)-1-(2,6′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(3,6′-дифтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(R)-1-(3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамида;
(S)-1-(3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамида;
1-(3-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-4-карбоксамида;
(S)-1-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пиперидин-3-карбоксамида;
(R)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(R)-1-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамида;
(S)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(R)-1-(2′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(2′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамида;
(R)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамида;
(R)-1-(2′-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамида;
(R)-1-(2′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамида;
(S)-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамида;
(R)-1-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-3-карбоксамида;
(R)-1-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(3′-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенилкарбонил)пирролидин-2-карбоксамида;
(S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторбензоил)пирролидин-2-карбоксамида;
(S)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторфенил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)-2-фторфенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(3,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(3,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(3,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(3,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамида;
(R)-(5-(3-фтор-4-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)фенил)пиридин-2-ил)(3-гидроксипиперидин-1-ил)метанона;
(2,2′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-2-(гидроксиметил)пирролидин-1-ил)метанона;
(2S)-1-(2,2′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(2,2′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)((R)-3-гидроксипиперидин-1-ил)метанона;
(2,2′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)((S)-3-гидроксипиперидин-1-ил)метанона;
(R)-(2′,3-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(2′,3-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2′,3-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2′,3-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2′,3-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(2-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(2-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(2-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2-фтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(4′-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-(4′-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(4′-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(4′-((1-((1-фторциклобутил)метил)пиперидин-4-ил)метокси)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(3-гидроксипиперидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанона;
(R)-(3-гидроксипиперидин-1-ил)(4′-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанона;
(R)-(3-гидроксипиперидин-1-ил)(4′-(метил((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метил)амино)бифенил-4-ил)метанона;
(R)-(4′-(этил((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метил)амино)бифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(3-гидроксипиперидин-1-ил)(4′-(метил((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метил)амино)бифенил-4-ил)метанона;
(2S,4R)-метил 4-гидрокси-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксилата;
(2S,4R)-метил 1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксилата;
(2S,4R)-4-гидрокси-1-(4-(6-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пирролидин-2-карбоксамида;
(2S,4R)-1-(4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксамида;
(S)-1-(5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамида;
1-(4-(3,3′-дифтор-4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперазин-1-ил)этанона;
(S)-1-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3′-дифторбифенилкарбонил)пирролидин-2-карбоксамида;
(S)-1-(3′-циано-3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-3′-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрила;
(R)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3′-дифторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3′-дифторбифенил-4-ил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3′-дифторбифенил-4-ил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2,3′-дифторбифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-3′-(гидроксиметил)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-5′-(гидроксиметил)бифенил-4-ил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамида;
(S)-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторфенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(4-(6-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-3-ил)-2-фторфенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрила;
(S)-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрила;
(S)-1-(3′-циано-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрила;
(R)-2′-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрила;
(S)-2′-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрила;
(S)-1-(3′-циано-2-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-(3-гидроксипирролидин-1-ил)(4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)метанона;
(R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)метанона;
(R)-(3-гидроксипиперидин-1-ил)(4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)метанона;
(S)-1-(4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоил)пирролидин-2-карбоксамида;
(S)-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(3-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоил)пирролидин-2-карбоксамида;
(S)-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(2-фтор-4-(2-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиримидин-5-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(S)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(2-фтор-4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридазин-3-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(3′-циано-4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3-фторбифенилкарбонил)пирролидин-2-карбоксамида;
(R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3′-фтор-4′-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрила;
(R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3′-фтор-4′-(2-(гидроксиметил)пирролидин-1-карбонил)бифенил-3-карбонитрила;
(S)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-3′-фтор-4′-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрила;
(S)-1-(3′-циано-4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-4′-(2-(гидроксиметил)пирролидин-1-карбонил)бифенил-3-карбонитрила;
(S)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-4′-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрила;
(R)-(2-(гидроксиметил)пирролидин-1-ил)(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)метанона;
(R)-(3-гидроксипиперидин-1-ил)(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)метанона;
(S)-1-(4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(3-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(2-(гидроксиметил)пирролидин-1-ил)метанона;
(R)-(2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-1-(2-фтор-4-(5-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-1-(3′-циано-3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-3′-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрила;
(S)-3′-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрила;
(S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамида;
(S)-(3-гидроксипирролидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанона;
(S)-1-(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-(3-гидроксипиперидин-1-ил)(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанона;
(R)-1-(4′-((1-((1-(трифторметил)циклобутил)метил)пиперидин-4-ил)метиламино)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-(3-гидроксипирролидин-1-ил)(4′-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанона;
(S)-1-(4′-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-(3-гидроксипиперидин-1-ил)(4′-((1-(3,3,3-трифтор-2,2-диметилпропил)пиперидин-4-ил)метиламино)бифенил-4-ил)метанона;
(S)-1-(2′-циано-3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-3′-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(3-гидроксипиперидин-1-карбонил)бифенил-2-карбонитрила;
(R)-1-(2′-циано-3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида;
(S)-1-(2′-циано-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(S)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(5-(3-циано-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиколиноил)пирролидин-2-карбоксамида;
(R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пиперидин-2-карбоксамида;
(S)-1-(5-(4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбонил)пирролидин-2-карбоксамида;
(S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)фенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пиперидин-2-карбоксамида;
(S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензоил)пирролидин-2-карбоксамида;
(R)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-2-фторбензоил)пиперидин-2-карбоксамида;
(R)-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторфенил)(3-гидроксипиперидин-1-ил)метанона;
(R)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиримидин-2-ил)-3-фторбензоил)пиперидин-2-карбоксамида;
(2S,4R)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)-4-гидроксипирролидин-2-карбоксамида;
(S)-1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пирролидин-2-карбоксамида;
(R)-1-(3-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пиперидин-2-карбоксамида;
(R)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамида;
(R)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)фенил)(3-гидроксипирролидин-1-ил)метанона;
(S)-1-(4-(6-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-3-ил)бензоил)пиперидин-2-карбоксамида;
(R)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пиперидин-2-карбоксамида;
(S)-1-(4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиразин-2-ил)бензоил)пиперидин-2-карбоксамида;
(S)-1-(5-(2-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)фенил)пиразин-2-карбонил)пирролидин-2-карбоксамида;
(2S,4S)-4-фтор-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбонитрила;
(2S,4R)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбонитрила;
(2S,4S)-4-фтор-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(2S,4R)-1-(3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)-4-гидроксипирролидин-2-карбоксамида;
3′-фтор-4-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)-4′-(4-гидроксипиперидин-1-карбонил)бифенил-2-карбонитрила;
(S)-1-(3′-циано-4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенилкарбонил)пирролидин-2-карбоксамида;
(R)-1-(3′-циано-4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2-фторбифенилкарбонил)пиперидин-2-карбоксамида;
(S)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2′-фтор-4′-(3-гидроксипирролидин-1-карбонил)бифенил-3-карбонитрила;
(R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-2′-фтор-4′-(3-гидроксипиперидин-1-карбонил)бифенил-3-карбонитрила;
(S)-1-(2′-циано-4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(R)-1-(2′-циано-4′-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)бифенилкарбонил)пиперидин-2-карбоксамида; и
(R)-4-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)-4′-(3-гидроксипиперидин-1-карбонил)бифенил-2-карбонитрила.
(S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамида;
(S)-1-(4-(5-((1-(2-этил-2-фторбутил)пиперидин-4-ил)метокси)пиридин-2-ил)бензоил)пирролидин-2-карбоксамида;
(S)-1-(3′-циано-3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида;
(S)-1-(2′-циано-3-фтор-4′-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)бифенилкарбонил)пирролидин-2-карбоксамида; и
(S)-1-(2-фтор-4-(5-((1-(2-фтор-2-метилпропил)пиперидин-4-ил)метокси)пиримидин-2-ил)бензоил)пирролидин-2-карбоксамида.
Документы, цитированные в отчёте о поиске
Соединения и композиции в качестве модуляторов активности gpr119

Комментарии