Стереоизомерные соединения и способы лечения желудочно-кишечных расстройств и расстройств центральной нервной системы - RU2374244C2
Код документа: RU2374244C2
Чертежи

Описание
Настоящая заявка испрашивает приоритет согласно временной патентной заявке США номер 60/534892, зарегистрированной 7 января 2004 г., и временной патентной заявке США номер 60/560938, зарегистрированной 9 апреля 2004 г.
Предпосылки к созданию изобретения
Цизаприд является одним из представителей класса соединений, известных как производные бензамида, родоначальным соединением которого является метоклопрамид. Патент США №№ 4962115 и 5057525 (в совокупности «Van Daele», включенный в данное описание в качестве ссылки) раскрывает N-(3-гидрокси-4-пипериденил)бензамиды цизаприда. Van Daele раскрывает, что указанные соединения, фармацевтически приемлемые кислотно-аддитивные соли этих соединений и их стереоизомерные формы стимулируют моторику желудочно-кишечного тракта.
Группа этих производных бензамида обладает несколькими заметными фармакологическими действиями. Заметное фармакологическое действие производных бензамида проявляется вследствие их влияния на нейронные системы, которые регулируются нейромедиатором серотонином. В течение многих лет роль серотонина, и соответственно фармакологии производных бензамида, имела многообразное толкование. Поэтому исследования были направлены на определение местонахождения центров выработки и накопления серотонина, а также на локализацию рецепторов серотонина в организме человека для того, чтобы установить связь между этими центрами и различными болезненными состояниями.
В этом отношении было обнаружено, что главным центром выработки и накопления серотонина является энтерохромаффинная (аргирофильная) клетка слизистой оболочки желудочно-кишечного тракта. Также было выяснено, что серотонин оказывает мощное стимулирующее действие на моторику желудочно-кишечного тракта, усиливая деятельность гладких мышц, ускоряя кишечный транзит и сокращая время всасывания, как при диарее. Это стимулирующее действие, в том числе, связано с тошнотой и рвотой.
Вследствие своего влияния на серотониновую систему желудочно-кишечного тракта многие производные бензамида являются эффективными противорвотными средствами и широко используются для сдерживания рвоты при химиотерапии или лучевой терапии рака, особенно при применении обладающих рвотным действием препаратов, таких как цисплатин. Этот эффект почти наверняка является результатом способности указанных соединений блокировать действие серотонина (5HT) на специфические центры активности, называемые 5HT3-рецепторами, которые традиционно обозначаются в научной литературе как M-рецепторы к серотонину. Химиотерапия или лучевая терапия может вызвать тошноту и рвоту вследствие высвобождения серотонина из поврежденных аргирофильных клеток в желудочно-кишечном тракте. Высвободившийся нейромедиатор серотонин возбуждает как вагусные афферентные нервные волокна (вызывая таким образом рвотный рефлекс), так и рецепторы серотонина в хеморецепторной триггерной зоне постремальной области головного мозга. Нерешенными остаются вопросы об анатомической области, на которую воздействуют производные бензамида, а также является ли это воздействие центральным (на центральную нервную систему ЦНС (CNS)), периферическим или комбинированным (Barnes et al., J. Pharm. Pharmacol. 40: 586-588, 1988). Цизаприд, как и другие производные бензамида, мог бы стать эффективным противорвотным средством, вследствие своей способности регулировать воздействие серотонина на 5HT3-рецептор.
Другое заметное действие производных бензамида заключается в усилении сократительной активности гладких мышц желудочно-кишечного тракта от пищевода до проксимального отдела тонкой кишки, что ускоряет пищеводный и кишечный транзит, а также облегчает опорожнение желудка и повышает тонус нижнего пищеводного сфинктера (Decktor et al., Eur. J. Pharmacol. 147: 313-316, 1988). Хотя производные бензамида сами по себе не являются агонистами холинергических рецепторов, их вышеупомянутому влиянию на гладкие мышцы могут воспрепятствовать вещества, блокирующие мускариновые рецепторы, такие как атропин или нейронные ингибиторы тетродоксинового типа, воздействующие на натриевые каналы. Подобное блокирующее действие описано для сократительного эффекта серотонина в тонкой кишке. В настоящее время считается, что 20 основных видов влияния производных бензамида на гладкие мышцы - результат воздействия агониста на новый класс рецепторов серотонина, называемых 5HT4-рецепторами, которые расположены на интернейронах мышечно-кишечного сплетения кишечной стенки. Возбуждение этих рецепторов в дальнейшем способствует высвобождению ацетилхолина из парасимпатических нервных окончаний, расположенных около гладкомышечных волокон, и именно соединение ацетилхолина с его рецепторами, расположенными на гладкомышечных мембранах, фактически является механизмом запуска сокращения мышц.
Обсуждение различных 5HT-рецепторов, включая 5HT4-рецептор, можно найти, например, в патентах США №№ 6331401 и 6632827, включенных в настоящее описание в качестве ссылки.
Цизаприд, в основном, использовался для лечения гастроэзофагального рефлюкса (GERD). Для этой болезни характерно наличие обратного хода содержимого желудка в пищевод. Одним из наиболее важных факторов в патогенезе гастроэзофагального рефлюкса является ослабление нижнего пищеводного сфинктера вследствие его недостаточности. Недостаточность нижнего пищеводного сфинктера возникает из-за низкого базального давления, снижения тонуса сфинктера или же декомпенсированного повышения внутрижелудочного давления. Другие факторы патогенеза заболевания представляют собой задержку опорожнения желудка, недостаточную очистку пищевода из-за нарушения перистальтики и агрессивных свойств рефлюксного содержимого, которое может повредить слизистую оболочку пищевода. Предполагается, что цизаприд укрепляет противорефлюксный барьер и улучшает очистку пищевода, за счет увеличения давления в нижнем пищеводном сфинктере и усиления перистальтических сокращений.
Поскольку цизаприд действует как прокинетическое средство, он также может быть полезен для лечения диспепсии, гастропареза, запоров, послеоперационного илеуса и динамической кишечной непроходимости. Диспепсия представляет собой состояние, характеризующееся нарушением пищеварения, которое появляется как симптом первичной дисфункции желудочно-кишечного тракта, либо как осложнение вследствие других расстройств, таких как аппендицит, нарушение работы желчного пузыря или недостаточное питание. Гастропарез - это паралич желудка, вызванный аномалией моторики желудка либо проявившийся как осложнение таких заболеваний как диабет, прогрессирующий системный склероз, нервная анорексия или миотоническая дистрофия. Запор - состояние, характеризующееся редкой или затрудненной дефекацией, вызванное такими причинами, как недостаточный мышечный тонус или мышечная спастичность желудочно-кишечного тракта. Послеоперационный илеус - это непроходимость кишечника вследствие нарушения мышечного тонуса после операции. Динамическая кишечная непроходимость - состояние, характеризующееся запором, коликами и рвотой, но без признаков физической непроходимости.
При лечении людей и животных большое значение имеет лекарственная токсичность. Токсические побочные действия (отрицательные действия), возникающие вследствие применения лекарств, включают ряд состояний, варьирующихся от невысокой лихорадки до смерти. Медикаментозное лечение оправдано только в том случае, если польза от применения лечебного протокола превышает связанные с лечением потенциальные риски. Факторы, которые сопоставляет лечащий врач, включают качественное и количественное воздействие применяемого лекарства, а также исход в случае, если лекарство не принимается. Дополнительные факторы, которые также учитываются, включают физическое состояние пациента, стадию болезни и историю ее прогрессирования, а также все известные отрицательные действия, связанные с приемом лекарства.
Удаление лекарства из организма, как правило, - результат метаболической активности в отношении лекарства и его последующего выведения. Метаболическая активность осуществляется за счет кровоснабжения и/или в клеточных органеллах или органах. Печень является центром метаболизма лекарств. Различают синтетические и несинтетические реакции метаболического процесса. При несинтетических реакциях происходит химическое преобразование лекарства путем окисления, восстановления, гидролиза или любого сочетания перечисленных процессов. В совокупности эти процессы обозначаются реакции Фазы I.
При реакциях Фазы II, известных также как синтетические реакции или сопряжения, исходное лекарственное вещество или его промежуточные метаболиты соединяются с эндогенными субстратами и образуют продукт присоединения или сопряжения. Метаболиты, образующиеся при синтетических реакциях, как правило, более полярны и биологически не активны. Следовательно, эти метаболиты легче выводятся через почки (с мочой) или печень (с желчью). Синтетические реакции включают в себя глюкуронидацию, аминокислотную конъюгацию, ацетилирование, сульфоконъюгацию и метилирование.
Более 90% дозы цизарпида метаболизируется путем окислительного N-деалкилирования пиперидинового азота или ароматического гидроксилирования, происходящего на 4-фторфенокси или бензамидных кольцах.
Обнаружено, что назначение цизаприда человеку вызывает серьезные отрицательные действия, включая расстройства ЦНС, повышенное систолическое давление, взаимодействие с другими лекарствами, диарею и спазмы в брюшной полости. Более того, отмечено, что назначение цизаприда внутривенно демонстрирует возникновение дополнительных отрицательных действий, не отмечавшихся после назначения цизаприда для приема внутрь (Stacher et al. [1987] Digestive Diseases and Sciences 32(11):1223-1230). Считается, что эти отрицательные действия вызываются метаболитами, образующимися вследствие окислительного деалкилирования или ароматического гидроксилирования соединения, происходящих в системе детоксикации с помощью цитохрома P450. Цизаприд также подвергается ряду нежелательных взаимодействий между лекарствами, которые также являются результатом метаболизма, вызываемого системой цитохрома P450.
В период с июля 1993 по декабрь 1999 года было отмечено, что цизаприд (PROPULSID, Janssen Pharmaceutica Products, L.P.) ассоциировался по меньшей мере с 341 серьезным случаем аритмии сердца. Такие случаи аритмии включают в себя желудочковую тахикардию, фибрилляцию желудочков, мерцание и трепетание желудочков (желудочковая асистолия) и удлинение интервала QT. Отмечено 80 (восемьдесят) смертельных случаев. Как результат этих отрицательных действий продукция была добровольно снята с открытой продажи в США; в то же время лекарство можно получить через исследовательскую программу с ограниченным доступом.
Безопасность агонистов 5HT4-рецептора с прокинетической активностью в желудочно-кишечном тракте ограничена вследствие действия на сердце (удлинение интервалов QTс, тахикардия, желудочковая асистолия) и отрицательных взаимодействий лекарств вследствие воздействующего на печень метаболизма цитохрома P-450. Прокинетическое средство для желудочно-кишечного тракта представленного класса, не имеющее таких ограничений, было бы крайне ценным в ряде терапевтических областей, включая GERD и расстройства при опорожнении желудка. Определенные производные цизарпида описаны в патенте США № 6552046 и WO 01/093849 (включенных в данное описание в качестве ссылки); в то же время были бы желательны более совершенные соединения с еще более эффективными свойствами.
В настоящее время обнаружено, что отдельные стереоизомеры одного подобного этерифицированного структурного и/или функционального аналога цизаприда обладают явными и особо эффективными свойствами.
Краткий обзор
Настоящее изобретение представляет собой соединения и композиции формулы (X), являющиеся стереоизомерными этерифицированными аналогами цизаприда, для безопасного и эффективного лечения различных расстройств желудочно-кишечного тракта, включая, но не ограничиваясь гастропарезом, гастроэзофагальным рефлюксом и связанными с ними состояниями. Соединения настоящего изобретения также полезны для лечения ряда состояний, затрагивающих центральную нервную систему.
Соединения данного изобретения представляют собой соединения формулы X:

и их фармацевтически приемлемые соли, в которых
связи в положениях 3 и 4 находятся в цис-положении друг к другу;
L представляет собой -(C1-C6-алкил)- (предпочтительно, -(C3-C5-алкил)-), -(C1-C6-алкил)-C(O)-, либо -C(O)-(C1-C6-алкил)-, где каждая из - алкильных групп может быть замещена 1 или 2 группами, которые независимо представляют собой галоген, C1-C4-алкокси, или OH и где один углерод в - алкильном фрагменте L можно заменить на -N(R9)-;
R1 - галоген;
R2 - аминогруппа, NH(C1-C4-алкил) либо N(C1-C4-алкил)(C1-C4-алкил);
R3 - OH либо C1-C4-алкокси;
R4 - H либо метил; и
R5 представляет собой -O-C3-C8 циклоалкил, -О-гетероциклоалкил, гетероциклоалкил, арил, -О-арил, -N(R9)-(C0-C6-алкил)-C(O)-арил, либо -N(R9)-C0-C6-алкиларил, -O-гетероарил, -N(R9)-C1-C6(O)-гетероарил, либо -N(R9)-C0-C6-алкилгетероарил, где каждая из циклических групп не замещена или замещена по одной или более замещаемых позиций C1-C6-алкилом, C1-C6-алкокси, галогеном, C1-C6-галоалкилом, C1-C6-галоалкокси, гидроксилом, гидрокси-C1-C4-алкилом, аминогруппой, -NH(C1-C6-алкилом), -N(C1-C6-алкил)(C1-C6-алкилом), -(C0-C6-алкил)-C(O)R11, либо -O-(C0-C6-алкил)-C(O)R11, метилсульфоном, C0-C6-сульфонамид, или NO2; где
R9 при каждом появлении независимо представляет собой H или C1-C4-алкил;
R11 представляет собой C1-C6-алкил, OH, либо
R11 представляет собой C1-C6-алкокси, который может быть замещен 1 или 2 группами, которые независимо представляют собой C1-C4-алкокси, амино, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), -(C0-C6-алкил)-C(O)N(R9)-гетероциклоалкил, -О-гетероциклоалкил, -C1-C6(O)N(R9)-гетероарил, либо гетероарил, где
гетероциклоалкильные группы могут быть замещены 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3,
гетероарильная группа может быть замещена 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3; либо
R11 представляет собой -О-гетероциклоалкил, где гетероциклоалкил может быть замещен 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, годрокси, гидрокси C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3; и
R20 представляет собой C1-C6-алкокси (предпочтительно C1-C4-алкокси, более предпочтительно метокси), либо OH.
Изобретение также относится к композициям, содержащим по меньшей мере одно соединение формулы (X) и по меньшей мере один фармацевтически приемлемый наполнитель, адъювант, носитель или растворитель.
Композиции формулы (X) полезны при лечении или профилактике гастроэзофагального рефлюкса и значительно сокращают отрицательные действия, связанные с назначением цизаприда. Такие отрицательные действия включают в себя, но не ограничены перечисленным, диарею, спазмы в брюшной полости и подъем кровяного давления и нарушения сердечного ритма.
Кроме того, соединения и композиции изобретения полезны при лечении рвоты и других состояний, включая, но не ограничиваясь перечисленным, диспепсию, гастропарез, запоры, послеоперационный илеус и динамическую кишечную непроходимость. Дополнительным преимуществом является то, что при указанных методах лечения отрицательные действия, связанные с назначением цизаприда, также сокращаются.
Как преимущество, соединения настоящего изобретения представляют собой лиганды для 5HT4-рецептора и, соответственно, могут использоваться для лечения состояний, опосредованных этим рецептором. Эти рецепторы расположены в нескольких областях центральной нервной системы, а модуляция этих рецепторов может использоваться для воздействия на нужные модуляции ЦНС.
Как преимущество, настоящее изобретение предоставляет стереоизомерные соединения, содержащие эфирные частицы, которые не уменьшают способность этих соединений обеспечивать терапевтическую полезность, а делают их более подверженными деградации под действием сыворотки и/или цитозольных эстераз, избегая таким образом системы детоксикации лекарства с помощью цитохрома P450, которая ассоциируется с отрицательными действиями, вызываемыми цизапридом, и снижая частоту возникновения подобных отрицательных случаев.
Настоящее изобретение предоставляет более совершенные методы лечения, включающие назначение соединений формулы (X) и терапевтически эффективные дозы тем, кто нуждается в лечении гастроэзофагального рефлюкса, диспепсии, гастропареза, запоров, послеоперационного илеуса и динамической кишечной непроходимости, а также связанных с этим состояний.
Как преимущество, терапевтические соединения настоящего изобретения хорошо сохраняются и обеспечивают более безопасный метаболизм лекарств по сравнению с остальными лекарствами, поэтому соединения настоящего изобретения могут применяться с пониженной частотой возникновения побочных эффектов и токсичности.
Еще одним аспектом является то, что настоящее изобретение относится к продуктам разложения (предпочтительно к продуктам метаболического разложения), которые образуются при воздействии эстераз на терапевтические соединения. Эти продукты разложения могут применяться, как описывается в настоящем документе, для наблюдения за выведением терапевтических соединений из организма пациента.
И еще одним аспектом является то, что настоящее изобретение предоставляет методы для синтезирования терапевтических стереоизомерных соединений настоящего изобретения, а также промежуточные продукты, полезные для приготовления нужных соединений.
Краткое описание чертежей
На Фиг.1 представлены графические зависимости Концентрация-Ответ агониста для 5-HT4-рецептора ATI-7505, серотонина, цизаприда и ATI-7500.
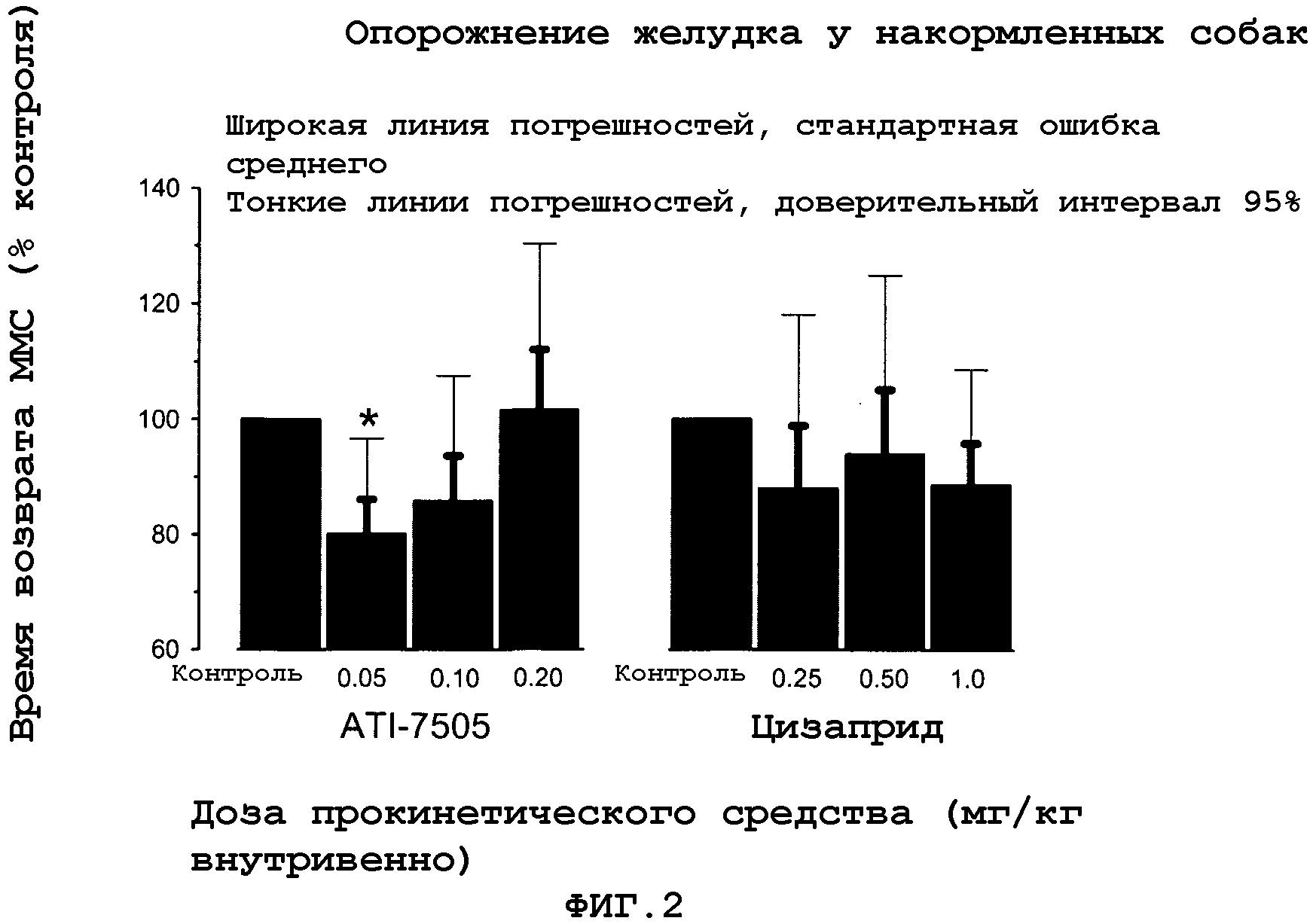
На Фиг.2 представлен график, иллюстрирующий опорожнение желудка у накормленных собак. Показанные данные нормализованы к средней частоте возвращаемых значений MMC для регулирования среды. Значения представляют среднее + стандартная ошибка среднего для 5 собак. *p<0,05 в зависимости от настроек.
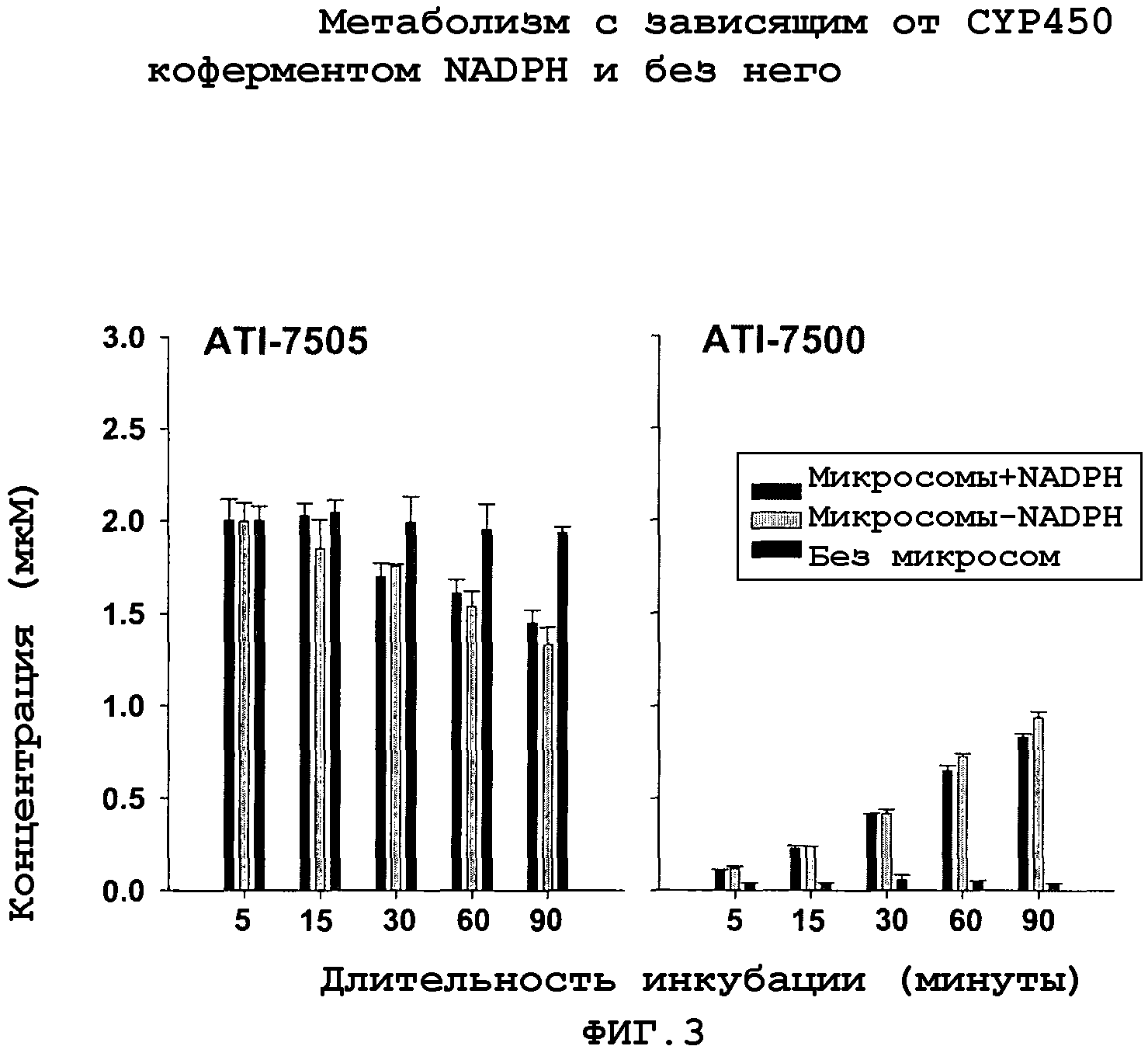
На Фиг.3 представлен график, иллюстрирующий метаболизм ATI-7505 и ATI-7500 с CYP450 (цитохром P450) зависимым коферментом, NADPH и без него. Диаграммы показывают средние и стандартное отклонение мкM-концентрации ATI-7505 и ATI-7500. ATI-7505 (2 мкM) был инкубирован с микросомальным белком человека (1 мг) в присутствии или отсутствии воспроизводящей системы NADPH (кофермента).
Подробное описание изобретения
Еще одним аспектом изобретения являются соединения формулы (X), в которых
R5 представляет собой -O-C3-C8 циклоалкил, -О-гетероциклоалкил, гетероциклоалкил, где гетероциклоалкильная группа выбрана из пиперидинила, пиперазинила, пирролидинила, аза-бициклооктила, в некоторых вариантах аза-бицикло[2.2.2]октила, аза-бицикло[3.2.1]октила, аза-бициклононила, аза-бициклодецила, индолинила, морфолинила, тиоморфолинила, S,S-диоксотиоморфолинила и имидазолидинила, -О-арила, -N(R9)-C(O)-арила, либо -N(R9)-C0-C6-алкиларила, где каждая из циклических групп может быть незамещенной или замещенной по одной или более замещаемых позиций следующими заместителями C1-C6-алкил, C1-C6-алкокси, галоген, C1-C6-галоалкил, C1-C6-галоалкокси, гидроксил, гидрокси-C1-C4-алкил, амино, -NH(C1-C6-алкил),
-N(C1-C6-алкил)(C1-C6-алкил), -C(O)R11, либо NO2; где
R9 при каждом появлении независимо представляет собой H или C1-C4-алкил; и
R11 представляет собой C1-C6-алкил, OH, либо
R11 представляет собой C1-C6-алкокси, который необязательно замещен 1 или 2 группами, которые независимо представляют собой C1-C4-алкокси, амино, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), -C(O)N(R9)-гетероциклоалкил, гетероциклоалкил или гетероарил, где
гетероциклоалкильная группа выбрана из пирролидинила, пиперидинила, пиперазинила, морфолинила, аза-бициклооктила, в некоторых вариантах аза-бицикло[2.2.2]октила, аза-бицикло[3.2.1]октила, аза-бициклононила и аза-бициклодецила, в котором гетероциклоалкильные группы необязательно замещены 1, 2 или 3 группами, независимо представляющими галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-С1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3,
гетероарильная группа выбрана из пиридила, пиримидила, хинолинила, изохинолинила и индолила, где гетероарильные группы могут быть замещены 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3; либо
R11 представляет собой -О-гетероциклоалкил, где гетероциклоалкил выбран из пиперидинила, пирролидинила, имидазолидинила, морфолинила, аза-бициклооктила, в некоторых вариантах азабицикло[2.2.2]октила, аза-бицикло[3.2.1]октила, аза-бициклононила, аза-бициклодецила и тетрагидрофуранила, и где каждая гетероциклоалкильная группа необязательно замещена 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3.
Другой аспект изобретения составляют соединения формулы (X), в которых R1 - хлор.
Следующий аспект изобретения составляют соединения формулы (X), в которых R2 представляет собой аминогруппу.
Также изобретение представляет соединения формулы (X), в которых R3 представляет собой метоксигруппу.
Еще один аспект изобретения составляют соединения формулы (X), в которых R4 представляет собой H или метил.
А также изобретение представляет соединения формулы (X), в которых R1 представляет собой хлор; R2 представляет собой аминогруппу; R3 представляет собой метоксигруппу; а R4 представляет собой H или метил.
Еще один аспект изобретения составляют соединения формулы (X), в которых R1 представляет собой хлор; R2 представляет собой аминогруппу; R3 представляет собой метоксигруппу; R4 представляет собой H, а L представляет собой -(C4-C6-алкил)-C(O)-.
Кроме того, изобретение представляет соединения формулы (X), в которых сочетаются два или более описанных ранее аспектов настоящего изобретения.
Следующий аспект изобретения составляют соединения формулы (XI), которые представляют собой соединения формулы (X), в которых L означает -(CH2)5-C(O)-:

Также изобретение представляет собой соединения формулы (XI), в которых R1 - хлор; R2 - аминогруппа; R3 - метоксигруппа; а R4 - H или метил.
Следующий аспект изобретения составляют соединения формулы (XI), в которых R5является -O-гетероциклоалкил, где гетероциклоалкильная группа выбрана из аза-бициклооктила, в некоторых вариантах 1-аза-бицикло[2.2.2]окт-3-ила или 8-аза-бицикло[3.2.1]окт-3-ила, азабициклононила, аза-бициклодецила, где аза-азот может быть замещен метилом или этилом; а R4 - это H или метил.
Изобретение, в том числе, представляет соединения формулы (XI), в которых R5 представляет собой -О-гетероциклоалкил, где гетероциклоалкильная группа выбрана из пиперидинила, пиперазинила или пирролидинила, каждый из которых может быть незамещен или замещен по одной или по двум замещаемым позициям группами, которые независимо представляют собой C1-C4-алкил, C1-C4-алкокси, галоген, C1-C4-галоалкил (предпочтительно, CF3), C1-C4-галоалкокси (предпочтительно, OCF3), гидроксил, гидрокси-C1-C4-алкил, амино, -NH(C1-C4-алкил), -N(C1-C4-алкил)(C1-C4-алкил), -(C1-C6-алкил)-C(O)R11, либо NO2; а R4 представляет собой H или метил.
Еще один аспект изобретения составляют соединения формулы (XI), в которых R5 - это -О-гетероциклоалкил, где гетероциклоалкильная группа выбрана из индолинила, морфолинила, тиоморфолинила, S,S-диоксотиоморфолинила и имидазолидинила, каждый из которых не замещен или замещен по одной или по двум позициям группами, которые независимо представляют собой C1-C4-алкил, C1-C4-алкокси, галоген, C1-C4-галоалкил (предпочтительно, CF3), C1-C4-галоалкокси (предпочтительно, OCF3), гидроксил, гидрокси-C1-C4-алкил, амино, -NH(C1-C4-алкил), -N(C1-C4-алкил)(C1-C4-алкил), -(C1-C6-алкил)-C(O)R11, либо NO2; а R4 - это H или метил.
Следующий аспект изобретения составляют соединения формулы (XI), в которых R5представляет собой -О-фенил, N(R9)-(C0-C6-алкил)-C(O)-фенил, либо -N(R9)-C0-C4-алкил-фенил, где фенильная группа замещена одной или двумя группами, которые независимо представляют собой C1-C4-алкил, C1-C4-алкокси, галоген, C1-C4-галоалкил (предпочтительно, CF3), C1-C4-галоалкокси (предпочтительно, OCF3), гидроксил, гидрокси-C1-C4-алкил, амино, -NH(C1-C4-алкил), -N(C1-C4-алкил)(C1-C4-алкил), -(C0-C6-алкил)-C(O)R11, либо NO2; а R4 и R9 независимо представляют собой H или метил.
Также изобретение представляет соединения формулы (XI), в которых R4 представляет собой H.
Еще один аспект изобретения составляют соединения формулы (XI), в которых R11 представляет собой C1-C6-алкокси, необязательно замещенный 1 или 2 группами, которые независимо представляют собой C1-C4-алкокси, амино, -NH(C1-C6-алкил),
-N(C1-C6-алкил)(C1-C6-алкил), -(C0-C6-алкил)-C(O)N(R9)-гетероциклолалкил или гетероциклоалкил, где гетероциклоалкильная группа выбрана из пирролидинила, пиперидинила, пиперазинила и морфолинила, где гетероциклоаклильные группы могут быть замещены 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3.
Кроме того, изобретение представляет соединения формулы (XI), в которых сочетаются два или более описанных ранее аспектов настоящего изобретения.
Также изобретение представляет соединения формулы (XII), т.е. соединения формулы (X) формулы:

в которых R15представляет собой H, C1-C6-алкил, C1-C6-алкокси, галоген, C1-C6-галоалкил (предпочтительно, CF3) , C1-C6-галоалкокси (предпочтительно, OCF3), гидроксил, гидрокси-C1-C4-алкил, амино, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), метилсульфон, C0-C6-сульфонамид или NO2, а R16представляет собой H или -O-(C0-C6-алкил)-C(O)R11. При этом R15представляет собой H.
Еще один аспект изобретения составляют соединения формулы (XII), в которых R4 и R9 независимо представляют H или метил, а R11представляет собой OH.
Еще один аспект изобретения составляют соединения формулы (XII), в которых R4 и R9 независимо представляют H или метил, а R11является C1-C6-алкокси, который может быть замещен 1 или 2 группами, независимо представляющими C1-C4-алкокси, амино, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), -(C0-C6-алкил)-C(O)N(R9)-гетероциклоалкил или гетероциклоалкил, где гетероциклоалкильная группа выбрана из аза-бициклооктила, в предпочтительных вариантах 1-аза-бицикло[2.2.2]окт-3-ила или 8-аза-бицикло[3.2.1]окт-3-ила, азабициклононила, аза-бициклодецила, в которых аза-азот может быть замещен метилом или этилом, пирролидинила, пиперидинила, пиперазинила и морфолинила, где гетероциклоалкильные группы могут быть замещены 1, 2 или 3 группами, независимо представляющими галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3 или OCF3, а R4 и R9 независимо представляют собой H или метил. С другой стороны, R4, R9 и R11 такие, как определено выше, R15представляет собой H, R1 представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Следующий аспект изобретения составляют соединения формулы (XII), в которых R4 и R9 независимо представляют H или метил, а R11является C1-C6-алкокси, который может быть замещен 1 или 2 группами, независимо представляющими C1-C4-алкокси, амино, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил) или гетероарил, где гетероарильная группа выбрана из пиридила, пиримидила, квинолинила, изоквинолинила и индолила, в которых гетероарильные группы могут быть замещены 1, 2 или 3 группами, независимо представляющими галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-С1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3 или OCF3; а R4 и R9 независимо представляют собой H или метил. С другой стороны, R4, R9и R11 такие, как определено выше, R15представляет собой H, R1 представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Следующий аспект изобретения составляют соединения формулы (XII), в которых по меньшей мере один из R4 и R9 представляет собой H.
Также изобретение представляет соединения формулы (XII), в которых сочетаются два или более описанных ранее аспектов настоящего изобретения.
Еще один аспект изобретения составляют соединения формулы (XIII), т.е. соединения формулы (XII):
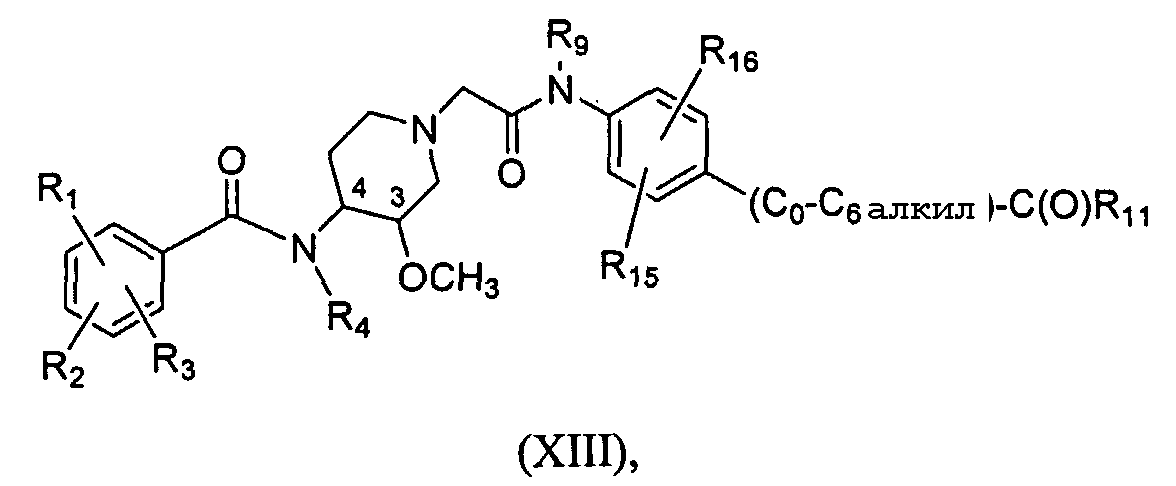
в которых R15представляет собой H, C1-C6-алкил, C1-C6-алкокси, галоген, C1-C6-галоалкил (предпочтительно, CF3) , C1-C6-галоалкокси (предпочтительно, OCF3), гидроксил, гидрокси-С1-C4-алкил, амино, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил) или метилсульфон, C0-C6-сульфонамид, NO2, а R16представляет собой H или -O-(C0-C6-алкил)-C(O)R11. В другом варианте R15представляет собой H.
Следующий аспект изобретения составляют соединения формулы (XIII), в которых
R4 и R9 независимо представляют H или метил, а R11 является OH, C1-C4-алкокси (предпочтительно, C1-C3-алкокси), либо C1-C2-алкокси-C1-C3-алкокси-. В другом варианте R4, R9и R11такие, как определено выше, R1 представляет собой хлор; R2 представляет собой амино; а R3 представляет собой метоксигруппу.
Еще один аспект изобретения составляют соединения формулы (XIII), в которых R4 и R9 независимо представляют H или метил, а R11является C1-C4-алкокси, замещенный аминогруппой, группами -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), аза-бициклооктилом, в некоторых вариантах 1-аза-бицикло[2.2.2]окт-3-илом или 8-аза-бицикло[3.2.1]окт-3-илом, аза-бициклононилом, аза-бициклодецилом, в которых аза-азот может быть замещен метилом или этилом; а R4 представляет собой H или метил, пирролидинил, пиперидинил, морфолинил, пиридил или -(C0-C6-алкил)-C(O)NH-пирид-4-ил. В другом варианте R4, R9 и R11 представляют собой, как определено выше, а R1представляет собой хлор; R2 представляет собой аминогруппу; а R3 представляет собой метоксигруппу.
Еще один аспект изобретения составляют соединения формулы (XIII), в которых R4 и R9 независимо представляют H или метил, а R11 - это C1-C4-алкоксигруппа, замещенная аминогруппой, группами -NH(C1-C6-алкил) или -N(C1-C6-алкил)(C1-C6-алкил). В другом варианте R4, R9и R11такие, как определено выше, R1представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Следующий аспект изобретения составляют соединения формулы (XIII), в которых
R4 и R9 независимо представляют H или метил, а R11представляет собой C1-C4-алкокси, замещенный пирролидинилом, пиперидинилом, морфолинилом, пиридилом, либо -(C0-C6-алкил)-C(O)NH-пирид-4-илом. В другом варианте R4, R9и R11такие, как определено выше, R1представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Следующий аспект изобретения составляют соединения формулы (XIII), в которых по меньшей мере один из R4 и R9 представляет собой H.
Также изобретение представляет соединения формулы (XIII), в которых сочетаются два или более описанных ранее аспектов настоящего изобретения.
Еще один аспект изобретения составляют соединения формулы (XIV), т.е. соединения формулы (X) формулы:

в которых R15представляет H, C1-C6-алкил, C1-C6-алкокси, галоген, C1-C6-галоалкил (предпочтительно, CF3) , C1-C6-галоалкокси (предпочтительно, OCF3), гидроксил, гидрокси-C1-C4-алкил, амино, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), метилсульфон, C0-C6-сульфонамид или NO2, а R16 представляет собой H или -O-(С0-C6-алкил)-C(O)R11.
Еще одним аспектом является то, что R15представляет собой H.
Еще один аспект изобретения составляют соединения формулы (XIV), в которых R4 и R9 независимо представляют H или метил, а R11 - это OH, C1-C4-алкокси (предпочтительно, C1-C3-алкокси), либо C1-C2-алкокси-C1-C3-алкоксигруппа. В другом варианте R4, R9 и R11 такие, как определено выше, R1 представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу. Согласно еще одному аспекту изобретения по меньшей мере один из R4 и R9 представляет собой H.
В еще одном варианте изобретение составляют соединения формулы (XIV), в которых R4 и R9 независимо представляют H или метил, а R11- это C1-C4-алкокси, замещенный аминогруппой, группами -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), аза-бициклооктилом, предпочтительно 1-аза-бицикло[2.2.2]окт-3-илом или 8-аза-бицикло[3.2.1]окт-3-илом, аза-бициклононилом, аза-бициклодецилом, в которых аза-азот может быть замещен метилом или этилом; а R4 представляет собой H или же метил, пирролидинил, пиперидинил, морфолинил, пиридил или -(C0-C6-алкил)-C(O)NH-пирид-4-ил. В другом варианте R4, R9 и R11 такие, как определено выше, R1представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Еще один вариант изобретения составляют соединения формулы (XIV), в которых
R4 и R9 независимо представляют H или метил, а R11 - это C1-C4-алкокси, замещенный аминогруппой, группами -NH(C1-C6-алкил) или -N(C1-C6-алкил)(C1-C6-алкил). Еще одним аспектом является то, что R4, R9 и R11 имеют вышеуказанные значения, а R1представляет собой хлор; R2 представляет собой амино; а R3 представляет собой метокси.
Следующий аспект изобретения составляют соединения формулы (XIV), в которых
R4 и R9 независимо представляют H или метил, а R11 - это C1-C4-алкокси, замещенный пирролидинилом, пиперидинилом, морфолинилом, пиридилом, либо -(C0-C6-алкил)-C(O)NH-пирид-4-илом. В другом варианте R4, R9и R11 имеют вышеуказанные значения, R1представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Еще один аспект изобретения составляют соединения формулы (XIV), в которых по меньшей мере один из R4 и R9 - это H.
Также изобретение представляет соединения формулы (XIV), в которых сочетаются два или более описанных ранее вариантов настоящего изобретения.
Следующий аспект изобретения составляют соединения формулы (XV), т.е. соединения формулы (X) формулы:

в которых n представляет собой 1 или 2.
Также изобретение представляет соединения формулы (XV), в которых R4 представляет H или метил, а R11 - это OH, C1-C4-алкокси (предпочтительно, C1-C3-алкокси), либо C1-C2-алкокси-C1-C3-алкоксигруппа. В другом варианте R4и R11имеют вышеуказанные значения, R1представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу. Согласно еще одному аспекту изобретения по меньшей мере один из R4 и R9 представляет собой H.
Следующий аспект изобретения составляют соединения формулы (XV), в которых R4 и R9 независимо представляют H или метил, а R11- это C1-C4-алкокси, замещенный аминогруппой, группами -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), аза-бициклооктилом, предпочтительно, 1-аза-бицикло[2.2.2]окт-3-илом или 8-аза-бицикло[3.2.1]окт-3-илом, аза-бициклононилом, аза-бициклодецилом, в которых аза-азот может быть замещен метилом или этилом; а R4 представляет собой H или метил, пирролидинил, пиперидинил, морфолинил, пиридил или -C(O)NH-пирид-4-ил. В другом варианте R4, R9и R11имеют вышеуказанные значения, R1представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Следующий аспект изобретения составляют соединения формулы (XV), в которых R4 и R9 независимо представляют H или метил, а R1l- это C1-C4-алкокси, замещенный аминогруппой, группами -NH(C1-C6-алкил), либо -N(C1-C6-алкил)(C1-C6-алкил). В другом варианте R4, R9и R11имеют вышеуказанные значения, R1представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Еще один аспект изобретения составляют соединения формулы (XV), в которых R4 представляет H или метил, а R11- это C1-C4-алкокси, замещенный аза-бициклооктилом, предпочтительно, 1-аза-бицикло[2.2.2]окт-3-илом или 8-аза-бицикло[3.2.1]окт-3-илом, аза-бициклононилом, аза-бициклодецилом, в которых аза-азот может быть замещен метилом или этилом; а R4 представляет собой H или метил, пирролидинил, пиперидинил, морфолинил, пиридил или -(С0-C6-алкил)-C(O)NH-пирид-4-ил. В другом варианте R4, R9и R11имеют вышеуказанные значения, R1представляет собой хлор; R2 представляет собой аминогруппу; и R3 представляет собой метоксигруппу.
Также изобретение представляет соединения формулы (XV), в которых сочетаются два или более описанных ранее аспектов настоящего изобретения.
Следующий аспект изобретения составляют соединения любой из формул (X), (XI), (XII), (XIII), (XIV) или (XV), в которых R1, R2 и R3 ориентированы в фенильном кольце следующим образом:

Следующий аспект изобретения составляют соединения по любой из формул (X), (XI), (XII), (XIII), (XIV) или (XV), в которых связь 3 имеет конфигурацию «S», а связь 4 имеет конфигурацию «R».
Еще один аспект изобретения составляют соединения любой из формул (X), (XI), (XII), (XIII), (XIV) или (XV), в которых R1 R2 и R3 ориентированы на фенильном кольце следующим образом:
связь 3 имеет конфигурацию «S», а связь 4 имеет конфигурацию «R».
Также изобретение представляет соединения любой из формул (X), (XI), (XII), (XIII), (XIV) или (XV), в которых связь 3 имеет конфигурацию «R», а связь 4 имеет конфигурацию «S».
Следующий аспект изобретения составляют соединения любой из формул (X), (XI), (XII), (XIII), (XIV) или (XV), в которых R1 R2 и R3 ориентированы в фенильном кольце следующим образом:

связь 3 имеет конфигурацию «R», а связь 4 имеет конфигурацию «S».
Еще один аспект изобретения составляют соединения формулы (X), в которых R1 представляет собой хлор; R2 представляет собой аминогруппу; R3 представляет собой метоксигруппу; R4 представляет собой H, а R1, R2 и R3 имеют следующую ориентацию в фенильном кольце:

а L представляет собой -(C3-C5-алкил)-, где один углерод может быть заменен на -N(R9)- или -(C2-C6-алкил)-C(O)-. В другом варианте R1, R2, и R3 такие, как определено выше и ориентированные в фенильном кольце так, как описано выше, R4 такой, как определено выше, а R5 - это -O-гетероциклоалкил, в котором гетероциклоалкильная группа выбрана из аза-бициклооктила, в некоторых вариантах 1-аза-бицикло[2.2.2]окт-3-ила или 8-аза-бицикло[3.2.1]окт-3-ила, аза-бициклононила, аза-бициклодецила, где аза-азот может быть замещен метилом или этилом, пиперидинилом, пиперазинилом и пирролидинилом, где пиперидиновая, пиперазиниловая и пирролидиниловая группа может быть незамещенной или замещенной по одной или двум замещаемым позициям группами, которые независимо представляют собой C1-C4-алкил, C1-C4-алкокси, галоген, C1-C4-галоалкил, C1-C4-галоалкокси, гидроксил, гидрокси-C1-C4-алкил, аминогруппу, -NH(C1-C4-алкил), -N(C1-C4-алкил)(C1-C4-алкил), -(С0-C6-алкил)-C(O)R11, либо NO2, где
R11 - это C1-C6-алкокси, который может быть замещен 1 или 2 группами, независимо представляющими C1-C4-алкокси, аминогруппу, группы -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), -(С0-C6-алкил)-C(O)N(R9)-гетероциклоалкил или гетероциклоалкил, где гетероциклоалкильная группа выбрана из аза-бициклооктила, в некоторых вариантах 1-аза-бицикло[2.2.2]окт-3-ила или 8-аза-бицикло[3.2.1]окт-3-ила, азабициклононила, аза-бициклодецила, в которых аза-азот может быть замещен метилом или этилом, R4 представляет собой H или метил, пирролидинил, пиперидинил, пиперазинил и морфолинил, где гетероциклоалкильные группы могут быть замещены 1, 2 или 3 группами, независимо представляющими галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-С1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3 или OCF3.
Еще один аспект изобретения составляют соединения формулы (X), в которых R1 представляет собой хлор; R2 представляет собой аминогруппу; R3 представляет собой метоксигруппу; R4 представляет собой H, а R1, R2 и R3 имеют следующую ориентацию в фенильном кольце:
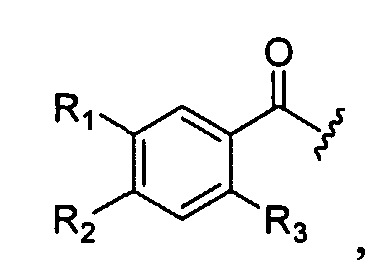
а L представляет собой -(C3-C5-алкил)-, где один углерод может быть заменен на -N(R9)- или -(C2-C6-алкил)-C(O)-. В другом варианте R1, R2, и R3 такие, как определено выше и ориентированные в фенильном кольце так, как описано выше, R4 такой, как определено выше, а R5 - это гетероциклоалкил, выбранный из аза-бициклооктила, в некоторых вариантах 1-аза-бицикло[2.2.2]окт-3-ила или 8-аза-бицикло[3.2.1]окт-3-ила, аза-бициклононила, аза-бициклодецила, где аза-азот может быть замещен метилом или этилом.
Еще один аспект изобретения составляют соединения формулы (X), в которых R1 представляет собой хлор; R2 представляет собой аминогруппу; R3 представляет собой метоксигруппу; R4 представляет собой H, а R1, R2 и R3 имеют следующую ориентацию в фенильном кольце:
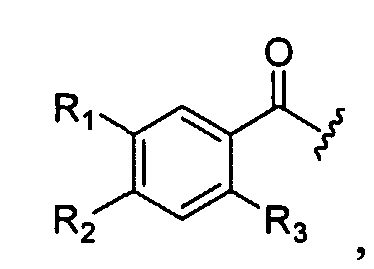
а L представляет собой -(C3-C5-алкил)-, где один углерод может быть заменен на -N(R9)- или -(C2-C6-алкил)-C(O)-. В другом варианте R1, R2, и R3 такие, как определено выше и ориентированные в фенильном кольце так, как описано выше, R4 такой, как определено выше, а R5 - это -N(R9)-C0-C4-алкиларил, либо -N(R9)-(С0-C6-алкил)-C(O)-арил, в которых арильная группа может быть незамещенной или замещенной на одной или более замещаемых позиций следующими заместителями C1-C6-алкил, C1-C6-алкоксигруппа, галоген, C1-C6-галоалкил, C1-C6-галоалкокси, гидроксил, гидроксиалкил, аминогруппа, -NH(C1-C6-алкил),
-N(C1-C6-алкил)(C1-C6-алкил), -(С0-C6-алкил)-C(O)R11, либо NO2. Также арильная группа представляет собой фенил, замещенный -(С0-C6-алкил)-C(O)R11, и необязательно замещенный 1 или 2 группами, которые независимо представляют C1-C6-алкил, C1-C6-алкокси, галоген, CF3, OCF3, гидроксил, гидроксиалкил, аминогруппу, -NH(C1-C4-алкил), -N(C1-C4-алкил)(C1-C4-алкил), либо NO2, где
R11 представляет собой C1-C6-алкоксигруппу, необязательно замещенную 1 или 2 группами, независимо представляющими собой C1-C4-алкокси, аминогруппу,
-NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), -(С0-C6-алкил)-C(O)N(R9)-гетероциклолалкил или гетероциклоалкил, где гетероциклоалкильная группа выбрана из пирролидинила, пиперидинила, пиперазинила и морфолинила, в которых гетероциклоалкильные группы могут быть замещены 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, гидроксильную группу, гидрокси-С1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3. Предпочтительным является вариант, когда -(С0-C6-алкил)-C(O)R11группа присоединена к фенильному кольцу в позиции 4.
В другом варианте ориентация связей 3 и 4 следующая:
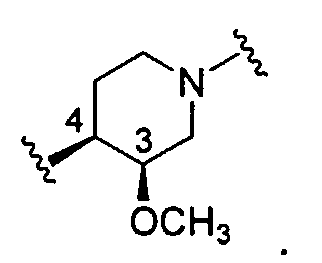
Предпочтительным является вариант со следующей ориентацией связей 3 и 4:

Настоящее изобретение также представляет методы лечения рвоты, диспепсии, гастропареза, запоров, динамической кишечной непроходимости, гастроэзофагального рефлюкса и послеоперационного илеуса, включающие назначение соединений или солей соединения формулы (X) в терапевтически эффективных дозах тем, кто нуждается в лечении.
Настоящее изобретение представляет собой соединения, более восприимчивые к расщепляющему действию сыворотки и/или цитозольных эстераз, чем цизаприд, за счет чего исключаются отрицательные действия, связанные с метаболизмом в системе цитохрома P450.
Преимуществом терапевтических соединений настоящего изобретения является то, что они хорошо сохраняются, но при этом имеют относительно короткий период полувыведения из организма, поэтому соединения настоящего изобретения менее токсичны и частота возникновения побочных эффектов при их применении снижена.
Преимуществом данного изобретения является то, что представленные терапевтические стереоизомерные соединения полезны при лечении гастроэзофагального рефлюкса и содержат эфирную группу, восприимчивую к расщепляющему действию эстераз, за счет которого соединение разрушается и облегчается его вывод из организма пациента. Преимущественно, терапевтические стереоизомерные соединения метаболизируются в Фазе I системы детоксификации лекарств.
Изобретение, в том числе, относится к продуктам распада (предпочтительно, к продуктам метаболического распада, т.е. метаболитам, в основном, сульфонатам исходных сложных эфиров), которые образуются при воздействии эстераз на представленные терапевтические соединения. Содержание этих продуктов распада в моче или сыворотке крови может быть исследовано для наблюдения за скоростью выведения терапевтических соединений из организма пациента.
Распад представленных в изобретении соединений под воздействием эстераз является особенно важным для метаболизма лекарств, поскольку эти ферменты представлены в любом организме и их действие не зависит от возраста, пола или болезненного состояния, также как и печеночный окислительный метаболизм лекарств.
Настоящее изобретение предоставляет методы лечения таких расстройств, как гастроэзофагальный рефлюкс, включающие назначение по меньшей мере одного из структурных и/или функциональных аналогов цизаприда в терапевтически эффективных дозах тем, кто нуждается в лечении. Характерной особенностью настоящего изобретения является то, что оно представляет структурные и/или функциональные аналоги цизаприда и фармацевтические композиции этих этерифицированных соединений.
Настоящее изобретение также представляет методы и средства для лечения рвоты и других состояний, в том числе диспепсии, гастропареза, запоров и динамической кишечной непроходимости, причем значительно сокращаются отрицательные действия, связанные с применением цизаприда
Преимуществом данного изобретения является то, что представленные терапевтические стереоизомерные соединения применимы для лечения гастроэзофагального рефлюкса, диспепсии, гастропареза, запоров, послеоперационного илеуса и динамической кишечной непроходимости и содержат эфирную группу, восприимчивую к разрушающему действию эстераз, за счет которого соединение распадается и облегчается его вывод из организма пациента.
Помимо этого настоящее изобретение представляет методы синтеза уникальных и полезных соединений данного изобретения. Большинство методов получения и очистки этих стереоизомерных соединений изучаются. Методы присоединения радикалов сложных эфиров, а также получения и очистки стереоизомеров хорошо известны опытным специалистам и уже могут быть реализованы в соответствии с представленным руководством.
Предпочтенные соединения
Настоящее изобретение представляет изолированные стереоизомеры Соединения I, содержащие три хиральных центра.

1-аза-бицикло[2.2.2]окт-3-иловый эфир 6-[4-(4-амино-5-хлор-2-метоксибензоиламино)-3-метоксипиперидин-1-ил]гексановой кислоты
Соединение I
Два из этих хиральных центров входят в цизаприд и норцизаприд и в активных лекарствах имеют цис-конфигурацию:

Так, например, фармацевтически активный норцизаприд представляет собой рацемическую смесь двух цис-энантиомеров:

Один из аспектов данного изобретения непосредственно касается конфигурации третьего хирального центра в хинуклидинольном фрагменте. Эта группа исключается из преобразования в кислотный метаболит, обозначенный здесь как ± Соединение II:

Соединение II
Представленное в настоящем изобретении Соединение I образуется путем сочетания R- или S-хинуклидинола и (+)- или (-)-норцизаприда с образованием Соединений III, IV, VI.

1-аза-бицикло[2.2.2]окт-3-иловый эфир (3S,4R,3'S)-6-[4-(4-амино-5-хлор-2-метоксибензоиламино)-3-метоксипиперидин-1-ил]гексановой кислоты
Соединение III: (-)(R)-соединение I
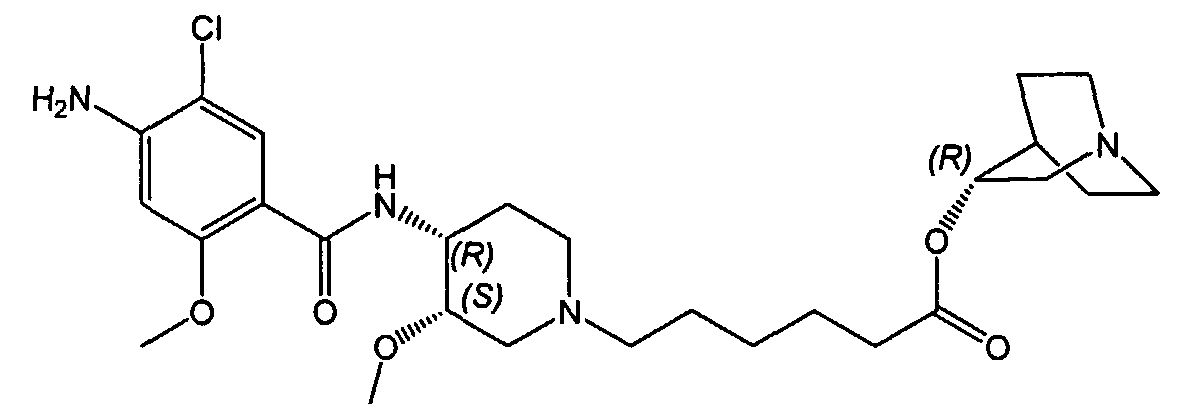
1-аза-бицикло[2.2.2]окт-3-иловый эфир (3S,4R,3'S)-6-[4-(4-амино-5-хлор-2-метоксибензоиламино)-3-метоксипиперидин-1-ил]гексановой кислоты
Соединение IY: (+)(R)-соединение I

1-аза-бицикло[2.2.2]окт-3-иловый эфир (3S,4R,3'S)-6-[4-(4-амино-5-хлор-2-метоксибензоиламино)-3-метоксипиперидин-1-ил]гексановой кислоты
Соединение V: (-)(S)-соединение

1-аза-бицикло[2.2.2]окт-3-иловый эфир (3S,4R,3'S)-6-[4-(4-амино-5-хлор-2-метоксибензоиламино)-3-метоксипиперидин-1-ил]гексановой кислоты
Соединение VI: (+)(S)-соединение I
Кроме того, настоящее изобретение относится к изолированным стереоизомерным соединениям и композициям, включающим эти соединения. Изолированные стереоизомерные формы соединений настоящего изобретения независимы друг от друга (т.е. находятся в стереоизомерном избытке). Другими словами «R»-формы соединений независимы от «S»-форм соединений и, таким образом, находятся в стереоизомерном избытке по отношению к «S»-формам. И наоборот «S»-формы соединений независимы от «R»-форм соединений и, таким образом, находятся в стереоизомерном избытке по отношению к «R»-формам. Один из аспектов настоящего изобретения составляет то, что стереоизомерные соединения находятся в стереизомерным избытке по меньшей мере на 80%. Предпочтительным является стереизомерный избыток соединений около 90%. Еще более предпочтительным является стереизомерный избыток соединений около 95%. Еще более предпочтительным является стереизомерный избыток соединений около 97,5%. Самым предпочтительным является стереизомерный избыток соединений около 99%. Подобным образом «(+)» и «(-)» формы соединений представлены в стереоизомерном избытке.
Как описывается в настоящем документе, различные стереоизомеры обладают неожиданными особыми свойствами, которые могут быть выгодно использованы для подбора лечения в определенных случаях. Так, например, соединения, содержащие (3'R)-изомер в эфире хинуклидинила, т.е. соединения III и IV, быстро метаболизируются эстеразами плазмы человека, тогда как метаболизм соединений, содержащих (3'S))-изомер хинуклидинола, т.е. соединений V и VI, гораздо более медленный.
Соответственно (3'R)-изомеры соединения I могут быть использованы, когда предпочтительно кратковременное воздействие, например, для стимуляции желудочной моторики в острых ситуациях, таких как прием высокой дозы пациентами с острым гастропарезом или острой гастроэзофагальным рефлюксом. Другим преимуществом быстрого метаболизма эстеразами до значительно менее активных метаболитов, т.е. соединений II, является очень маленькая вероятность межлекарственных взаимодействий и пониженная токсичность. Поэтому эти кратковременно действующие (R)-изомеры могут быть использованы внутривенно для лечения гастроэзофагального рефлюкса у недоношенных новорожденных, которые, как известно, не могут усваивать лекарства так же хорошо, как взрослые, поскольку их система CYP450 (цитохрома P450) не развита в достаточной степени. Для лечения таких новорожденных возможность метаболизма лекарств системой, отличной от CYP450, например эстеразами, является значительным преимуществом. С другой стороны, (3'S)-изомеры соединения I лучше всего использовать для лечения хронических проявлений этих заболеваний, например гастропареза у больных диабетом или больных раком, принимающих опиаты, а также гастроэзофагального рефлюкса у пациентов, требующих круглосуточного воздействия.
Кроме различий в метаболизме представленные изолированные изомеры также обладают различным сродством к 5-HT4-рецептору, за счет чего различается их воздействие и, соответственно, терапевтическое применение. Так, по снижению сродства к 5-HT4-рецептору изомеры могут быть распределены следующим образом (в скобках приведены значения коэффициента связывания Ki); соединение IV (1,4 нМ), соединение VI (3,4 нМ), соединение III (28 нМ) и соединение V (72 нМ). Эксперименты по определению степени сродства проводились с использованием радиоизотопного метода, описанного в общедоступных руководствах, и могут быть легко воспроизведены опытными специалистами по молекулярной биологии.
Исходя из рассмотренных положений можно сделать следующий вывод: когда связи 3 и 4 находятся в цис-положениях, соединение I представляет собой смесь 4 изомеров, состоящих из 2 пар энантиомеров. Первая пара энантиомеров - это (+)(R)-соединение I и (-)(S)-соединение I (соединения IV и V, соответственно), вторая пара энантиомеров - это (-)(R)-соединение I и (+)(S)-соединение I (соединения III и VI, соответственно). В каждой из пар энантиомеров каждый отдельный энантиомер обладает различными свойствами, обусловливающими и скорость их гидролиза эстеразами, и их сродство к 5-HT4-рецептору. Эти различающиеся свойства обеспечивают широчайшее терапевтическое применение представленных соединений, которые не являются взаимозаменяемыми, т.е. характерны для каждого из изомеров, и не присущи рацемической смеси. Эти различия в сродстве к рецептору и в скорости метаболизма не являются предсказуемыми, и эти свойства невозможно проанализировать при исследовании рацемической смеси.
Пояснения
В рамках настоящего изобретения термином «алкил» обозначаются алкильные группы с заданным числом атомов углерода. Алкильные группы могут быть линейными или разветвленными. Примерами «алкилов» могут служить метил, этил, пропил, изопропил, бутил, изо-, втор- и трет-бутил, пентил, гексил, гептил, 3-этилбутил и тому подобные. Если число атомов углерода не определено, то остаток представленного «алкила» содержит от 1 до 6 атомов углерода.
Термином «алкокси» обозначается алкильная группа с определенным количеством атомов углерода, присоединенная к остатку исходной молекулы через кислород. Примерами алкоксигрупп могут служить метокси, этокси, пропокси и изопропокси.
Под термином «арил» подразумевается ароматическая группа, включающая одно кольцо (например, фенил), которое может конденсироваться или иным способом присоединяться к другим ароматическим углеводородным кольцам или неароматическим углеводородным кольцам. «Арил» включает конденсированные полициклические соединения с хотя бы одним ароматическим кольцом (например, 1,2,3,4-тетрагидронафтил, нафтил), каждое из которых может содержать один, два или три атома, замещенных группами, представленными ниже, а также неконденсированные полициклические соединения как, например, бифенил или бинафтил. Предпочтительными арильными группами настоящего изобретения являются фенил, 1-нафтил, 2-нафтил, инданил, инденил, дигидронафтил, флуоренил, тетралинил или 6,7,8,9-тетрагидро-5H-бензо[a]циклогептенил. Наиболее предпочтительными являются фенил, бифенил и нафтил. Самым предпочтительным является фенил. Арильные группы в данном случае являются незамещенными или, если указано, замещенными в одной или более замещаемых позиций различными группами. Эти арильные группы могут быть замещены, например, C1-C6-алкилом, C1-C6-алкокси, галогеном, гидроксильной группой, цианорадикалом, нитрогруппой, аминогруппой, моно(C1-C6)алкиламино, ди(C1-C6)алкиламино, C2-C6-алкенилом, C2-C6-алкинилом, C1-C6-галоалкилом, C1-C6-галоалкокси, амино(C1-C6)алкилом, моно(C1-C6)алкиламино(C1-C6)алкилом или ди(C1-C6)алкиламино(C1-C6)алкилом.
Термин «галоалкокси» подразумевает алкоксигруппу, которая замещена хотя бы одним атомом галогена и, кроме того, может быть в дальнейшем замещена хотя бы одним дополнительным атомом галогена, при этом каждый из галогенов независимо представляют F, Cl, Br или I. Предпочтительными галогенами являются F или Cl. Предпочтительные галоалкокси группы содержат 1-4 атома углерода, а наиболее предпочтительные - 1-2 атома углерода. «Галоалкокси» включают пергалоалкокси группы, такие как OCF3 или OCF2CF3.
Термин «гетероарил» подразумевает ароматическую кольцевую систему, содержащую хотя бы один гетероатом, выбранный из азота, кислорода и серы. Гетероарильное кольцо может конденсироваться или иным способом присоединяться к одному или более гетероарильным кольцам, ароматическим или неароматическим углеводородным кольцам или гетероциклоалкильным кольцам. Примерами гетероарильных групп могут служить пиридил, пиримидил, хинолинил, бензотиенил, индолил, индолинил, пиридазинил, пиразинил, изоиндолил, изохинолил, хиназолинил, хиноксалинил, фталазинил, имидазолил, изоксазолил, пиразолил, оксазолил, тиазолил, индолизинил, индазолил, бензатиазолил, бензимидазолил, бензофуранил, фуранил, тиенил, пирролил, оксадиазолил, тиадиазолил, бензо[1,4]оксазинил, триазолил, тетразолил, изотиазолил, нафтиридинил, изохроманил, хроманил, тетрагидроизохинолинил, изоиндолинил, изобензотетрагидрофуранил, изобензотетрагидрофиенил, изобензотиенил, бензоксазолил, пиридопиридинил, бензотетрагидрофуранил, бензотетрагидротиенил, пуринил, бензодиоксолил, триазинил, фтеридинил, бензотиазолил, имидазопиридинил, имидазотиазолил, дигидробезисоксазинил, безисоксазинил, безоксазинил, дигидробезисотиазинил, бензопиранил, бензотиопиранил, хромонил, хроманонил, пиридинил-N-оксид, тетрагидрохинолинил, дигидрохинолинил, дигидрохинолинонил, дигидроизохинолинонил, дигидрокумаринил, дигидроизокумаринил, изоиндолинонил, бензодиоксанил, бензооксазолинонил, пирролил-N-оксид, пиримидинил-N-оксид, пиридазинил-N-оксид, пиразинил-N-оксид, хинолинил-N-оксид, индолил-N-оксид, индолинил-N-оксид, изохинолил-N-оксид, хиназолинил-N-оксид, хиноксалинил-N-оксид, фталазинил-N-оксид, имидазолил-N-оксид, изоксазолил-N-оксид, оксазолил-N-оксид, тиазолил-N-оксид, индолизинил-N-оксид, индазолил-N-оксид, бензотиазолил-N-оксид, бензимидазолил-N-оксид, пирролил-N-оксид, оксадиазолил-N-оксид, тиадиазолил-N-оксид, триазолил-N-оксид, тетразолил-N-оксид, бензотиопиранил-S-оксид, бензотиопиранил-S,S-диоксид. Предпочтительными гетероарильными группами являются пиридил, пиримидил, хинолинил, индолил, пирролил, фуранил, тиенил и имидазолил. Наиболее предпочтительными гетероарильными группами являются пиридил, пирролил и индолил. Гетероарильные группы в данном случае являются незамещенными или, если указано, замещенными в одной или более замещаемых позиций различными группами. Эти гетероарильные группы могут быть замещены, например, C1-C6-алкилом, C1-C6-алкокси, галогеном, гидрокси, циано, нитро, амино, моно(C1-C6)алкиламино, ди(C1-C6)алкиламино, C2-C6-алкенилом, C2-C6-алкинилом, C1-C6-галоалкилом, C1-C6-галоалкокси, амино(C1-C6)алкилом, моно(C1-C6)алкиламино(C1-C6)алкилом или ди(C1-C6)алкиламино(C1-C6)алкилом.
Термин «гетероциклоалкил» обозначает кольцо или систему колец, содержащую хотя бы один гетероатом, выбранный предпочтительно из азота, кислорода и серы, при этом названный гетероатом находится в неароматическом кольце. Гетероциклоалкильное кольцо может конденсироваться или иным способом присоединяться к другим гетероциклоалкильным кольцам и/или ароматическим или неароматическим углеводородным кольцам и/или фениловым кольцам. Предпочтительно гетероциклоалкильные группы имеют от 3 до 7 атомов. Наиболее предпочтительно гетероциклоалкильные группы имеют 5 или 6 атомов. Примерами гетероциклоалкильных групп могут служить аза-бицикло[2.2.2]октил, аза-бицикло[3.2.1]октил, морфолинил, тиоморфолинил, тиоморфолинил S-оксид, тиоморфолинил S,S-диоксид, пиперазинил, гомопиперазинил, пирролидинил, тетрагидропиранил, пиперидинил, тетрагидрофуранил, тетрагидротиенил, гомопиперидинил, гомоморфолинил, гомотиоморфолинил, гомотиоморфолинил S,S-диоксид, оксазолидинонил, дигидропиразонил, дигидропирролил, дигидропиразинил, дигидропиридинил, дигидропиримидинил, дигидрофурил, тетрагидротиенил-S-оксид, тетрагидротиенил S,S-диоксид и гомотиоморфолинил-S-оксид. Предпочтительными гетероциклоалкильными группами являются аза-бицикло[2.2.2]октил, аза-бицикло[3.2.1]октил, пиперидинил, пиперазинил, пирролидинил, тиоморфолинил, S,S-диоксотиоморфолинил, морфолинил и имидазолидинил.
Наиболее предпочтительными являются аза-бицикло[2.2.2]октил, аза-бицикло[3.2.1]октил, пиперидинил, пиперазинил, пирролидинил, имидазолидинил и морфолинил. Группы гетероцикла в данном случае являются незамещенными или, если указано, замещенными в одной или более замещаемых позиций различными группами. Эти группы гетероцикла могут быть замещены, например, C1-C6-алкилом,
C1-C6-алкокси, галогеном, гидроксильной группой, цианорадикалом, нитрогруппой, аминогруппой, моно(C1-C6)алкиламино, ди(C1-C6)алкиламино, C2-C6-алкенилом, C2-C6-алкинилом, C1-C6-галоалкилом, C1-C6-галоалкокси, амино(C1-C6)алкилом, моно(C1-C6)алкиламино(C1-C6)алкилом, ди(C1-C6)алкиламино(C1-C6)алкилом или =О.
Термин «фармацевтически приемлемые соли» или «их фармацевтически приемлемые соли» означает соли, полученные из фармацевтически приемлемых нетоксичных кислот или оснований, в том числе неорганических кислот и оснований и органических кислот и оснований. Поскольку соединения настоящего изобретения являются основаниями, соли могут быть получены из фармацевтически приемлемых нетоксичных кислот. Подходящие фармацевтически приемлемые кислотно-аддитивные соли соединений настоящего изобретения включают уксусную, бензолсульфоновую (безилат), бензойную, камфаросульфоновую, лимонную, этиленсульфоновую, фумаровую, глюконовую, глутаминовую, бромистоводородную, соляную, изетионовую, молочную, малеиновую, миндальную, метансульфоновую, муциновую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую и тому подобные. Предпочтительными являются аддитивные соли соляной и серной кислот. В наиболее предпочтительном варианте структурные и/или функциональные аналоги цизаприда применяются в виде свободных оснований или как моно- или дигидрохлориды.
В рамках настоящего изобретения термины «лечение» или «проведение курса лечения» включают профилактический прием соединения или фармацевтических композиций, включающих соединение, («профилактика»), а также лечебную терапию, направленную на сокращение или полное избавление от описанных выше симптомов заболеваний или расстройств. Профилактический прием соединения направлен на предупреждение возникновения расстройств и может быть использован для лечения пациентов группы риска возникновения описанных выше расстройств. Таким образом, термин «лечение», в рамках настоящего изобретения или следующий из него, предполагает частичное или полное подавление определенного болезненного состояния за счет приема активного ингредиента настоящего изобретения профилактически или в случае приступа заболевания, для излечения которого предназначен этот активный ингредиент. «Профилактика» предполагает назначение активного ингредиента(ов) млекопитающим для защиты от расстройств, описанных выше, а также от других.
Термин «эффективная терапевтическая доза» означает дозу, необходимую для получения терапевтического эффекта, а именно: 1) доза, достаточная для облегчения состояния рефлюкса, 2) доза, достаточная для облегчения тошноты и рвоты, или 3) доза, достаточная для облегчения состояния, вызванного дисфункцией желудочно-кишечного тракта. Эффективные терапевтические дозы структурного и/или функционального аналогов цизаприда определяются описанными выше дозировками и частотой приема.
«Млекопитающим» может быть, например, мышь, крыса, свинья, лошадь, кролик, козел, корова, кошка, собака или человек. Чаще всего под млекопитающим подразумевается человек.
Термин «пациент(ы)» подразумевает отдельное млекопитающее, которое принимает соединение настоящего изобретения. Млекопитающим может быть, например, мышь, крыса, свинья, лошадь, кролик, козел, корова, кошка, собака или человек. Чаще всего под млекопитающим подразумевается человек.
Термин «этерифицированный цизаприд» относится к терапевтическим соединениям настоящего изобретения, которые являются структурными и/или функциональными аналогами цизаприда и содержат способную гидролизоваться группу, обычно эфирную, что не умаляет пользу от терапии с использованием этих соединений, а делает их более восприимчивыми к разлагающему действию гидролаз, преимущественно сыворотки и/или цитозольных эстераз, причем взаимодействие цитохром P450 системы детоксификации лекарств с соединениями цизаприда исключается. Метаболизм соединений этерифицированного цизаприда под действием эстераз умаляет роль системы детоксификации лекарств цитохрома P450 в метаболизме цизаприда и уменьшает или исключает отрицательные эффекты, связанные с приемом цизаприда.
Термин «структурный аналог» в рамках настоящего изобретения означает, что описанное соединение имеет такие же структурные характеристики, как и исходное соединение. Например, структурный аналог цизаприда может иметь одну или несколько структурных характеристик, подобных свойствам исходного соединения цизаприда, в частности замещенное арильное кольцо, связанное с кольцом пиперидина посредством амидной связи, но в остальном структурно отличаться, например, в том, что касается включения или исключения одного или более других химических остатков.
Термин «функциональный аналог» в рамках настоящего изобретения означает, что описанное соединение имеет такие же функциональные свойства, как и исходное соединение. Например, функциональный аналог цизаприда может иметь несколько структурных характеристик, подобных характеристикам цизаприда, но выполнять ту же функцию, например, сродство к 5-HT4.
Термин «отрицательные действия» подразумевает, в том числе, расстройства желудочно-кишечного тракта, такие как диарея, спазмы и вздутие в брюшной полости; усталость; головную боль; повышение систолического давления; смерть; желудочковую тахикардию; фибрилляцию желудочков; желудочковую асистолию; удлинение интервалов QT; учащение сердечного ритма; неврологические расстройства и расстройства ЦНС; и взаимодействие цизаприда с другими лекарствами, при одновременном приеме, в том числе с дигоксином, диазепамом, этанолом, аценокумаролом, циметидином, ранитидином, парацетамолом и пропранололом.
Термин «гастроэзофагальный рефлюкс» в рамках настоящего изобретения означает наличие симптомов, обусловленных обратным ходом содержимого желудка в пищевод.
Термины «имеющий противорвотное действие» и «противорвотная терапия» означают снятие или предупреждение симптомов тошноты и рвоты, возникших самопроизвольно или вследствие вызывающей рвоту химиотерапии или лучевой терапии рака.
Термин «лечение состояния, вызванного нарушением моторики желудочно-кишечного тракта» в рамках настоящего изобретения означает лечение симптомов и состояний, связанных с этим расстройством и включающих, в том числе, гастроэзофагальный рефлюкс, диспепсию, гастропарез, запоры, послеоперационный илеус и динамическую кишечную непроходимость.
Термин «прокинетический» означает улучшение перистальтики органов желудочно-кишечного тракта и, следовательно, продвижения по нему.
Термин «диспепсия» в рамках настоящего изобретения означает состояние, характеризующееся нарушением пищеварения, которое проявляется как симптом первичной дисфункции желудочно-кишечного тракта, либо как осложнение вследствие других расстройств, таких как аппендицит, нарушение работы желчного пузыря или недостаточное питание.
Термин «гастропарез» означает паралич желудка, вызванный аномалией моторики желудка либо проявившийся в виде осложнения после таких болезней как диабет, прогрессирующий системный склероз, нервная анорексия или миотоническая дистрофия.
Термин «запор» в рамках настоящего изобретения означает состояние, характеризующееся редкой или затрудненной дефекацией, вызванное такими причинами, как недостаточный мышечный тонус или мышечная спастичность желудочно-кишечного тракта.
Термин «послеоперационный илеус» означает непроходимость кишечника вследствие нарушения мышечного тонуса после операции.
Термин «динамическая кишечная непроходимость» используется для обозначения состояния, характеризующегося запором, коликами и рвотой, но без признаков физической непроходимости.
Получение соединений
Химический синтез различных аналогов цизаприда может быть осуществлен с помощью методов, описанных в европейской патентной заявке № 0076530A2, опубликованной 13 апреля 1983 года, патентных заявках США №№ 4962115 и 5057525, а также в Van Daele et al., Drug Development Res. 8: 225-232 (1986), содержание которых включено в качестве ссылки в настоящее описание и модифицировано путем введения эфирной группы в точке, удобной для синтеза раскрытых в настоящем патенте соединений. Типичные схемы неограниченного синтеза определенных этерифицированных аналогов цизаприда настоящего изобретения изложены в WO 01/093849.
Далее настоящее изобретение описывается на примерах, которые предназначены только для иллюстрации, а вовсе не для ограничения объема изобретения описанными действиями. Опытные специалисты обнаружат, что исходные материалы и дополнительные шаги для получения соединений, представленных в изобретении, могут быть различными, что и доказывают следующие примеры. Также опытные специалисты обнаружат, что для получения некоторых из описанных выше преобразований может быть необходимо использовать различные растворители и реагенты. В некоторых случаях для получения описанных выше преобразований может быть необходима защита функциональных реагентов. В целом, такая необходимость защиты функциональных групп, также как и условия, необходимые для присоединения или удаления этих групп, должны быть очевидны опытным специалистам по органическому синтезу. При использовании защитной группы может потребоваться дополнительный шаг для снятия защиты. Подходящие защитные группы и способы защиты и снятия защиты, например, описанные в работе «Защитные группы при органическом синтезе» Т.Грина (Protecting Groups in Organic Synthesis by T. Greene), хорошо известны опытным специалистам.
Если не указано иного, все реактивы и растворители стандартного товарного качества и используются без предварительной очистки. Подходящая для протекания реакции атмосфера, например воздух, азот, водород, аргон и тому подобные, должна быть очевидна опытным специалистам.
Пример 1
Приготовление 1-аза-бицикло[2.2.2]окт-3'R-илового эфира 6-[4R-(4-амино-5-хлор-2-метоксиаминобензоил)-3S-метоксипапередин-1-ил]капроновой кислоты, соль дихлоргидрата (ATI-7505 Соль дихлоргидрата)

Шаг 1: Разложение рацемического норцизаприда
(-)-Дибензоил-1-винная кислота ((-)-DBT, около 1 части по весу) растворена в этаноле и профильтрована для удаления остаточных частиц. Отдельно в растворе этанола или воды растворен рацемический норцизаприд (около 0,8 частей по весу), а затем профильтрован. Фильтрат разогрет примерно до 75°C перед добавлением (-)-DBT раствора. После перемешивания в течение около 30 минут при данной температуре смесь медленно охлаждалась в течение нескольких часов до температуры 5°C и в процессе вакуумной фильтрации собрана и промыта смесью EtOH/H2О получаемая соль. Сырой осадок рекристаллизован из EtOH/H2О нагревом до приблизительно 79°С и медленным охлаждением до 5°C, как и ранее. Продукт собран на вакуумном фильтре и промыт EtOH/H2О для получения сырого остатка.
Сырой остаток взвешен в воде и pH был изменен примерно до 12 с помощью 7% (В/В) водн. NaOH. Полученная суспензия перемешивалась в течение 3 часов при комнатной температуре перед вакуумной фильтрацией, промыванием твердых веществ водой и вакуумной сушкой. Затем, для образования соли, продукт повторно обработан (-)-DBT, следуя указанным выше общим процедурам. Выделенная соль нейтрализована водн. NaOH, как описано выше. Продукт выделен на фильтре и высушен, как и ранее, для получения (+)-норцизапридной основы (около 0,25 частей на по весу). Определенный методом хиральной ВЭЖХ e.e. составляет около 100% (+)-норцизаприда. Подтверждающее положительный изомер норцизаприда оптическое вращение составляло около +5° (метанол; 25°C и 589 нм).
Шаг 2: Сочетание с этил-6-бромогексаноатом
(+)-Норцизаприд (около 1 части по весу), углекислый калий (около 0,48 части по весу) и калий йодид (около 0,063 части по весу) взвешены в безводном этаноле USP. Этил-6-бромогексаноат (около 0,76 частей по весу) медленно добавлен в суспензию при комнатной температуре. Смесь нагрета до температуры дефлегмации, пока не завершится реакция. После нагрева до комнатной температуры реакционная смесь процежена для удаления, например, неорганических твердых частиц, и фильтрат сконцентрирован пониженным давлением до приблизительно половины объема. Продукт осажден медленным добавлением сырья в холодную воду (около 13 частей по весу) с быстрым перемешиванием. Осадок профильтрован под вакуумом, промыт водой, а затем осажден еще два раза растворением в безводном этаноле и медленным добавлением в холодную воду, как описано выше. Полученный сырой остаток промыт н-гептаном и повторно суспензирован в уксусно-этиловом эфире с н-гептаном (соотношение объемов 1:9), перемешивался около 1 часа до фильтрации и вакуумного высушивания для получения 0,73 частей по весу соединенного продукта в виде белой твердой фазы.
Шаг 3: Сочетание с (R)-3-хинуклидинолом и образование дигидрохлоридной соли.
Эфир (1 часть по весу) и (R)-3-хинуклидинол (около 1,12 частей по весу) были взвешены в толуоле перед медленным добавлением этоксида титана (IV) (около 0,5 частей по весу) в перемешанную суспензию. Парами азота смесь медленно нагрета до примерно 91°C, и через дистилляционный аппарат в колбе был создан неполный вакуум, чтобы азеотропно удалить этанол. Для поддержания минимального объема растворителя в колбу был добавлен дополнительный толуол. Реакцию посчитали завершенной после приблизительно 33 часов.
Смесь была охлаждена до приблизительно комнатной температуры и экстрагирована пять раз водой. Органический слой был сконцентрирован при пониженном давлении и получившийся остаток был повторно растворен в EtOH/iPrOH (соотношение объемов приблизительно 1:1), а затем профильтрован через фильтр с пористой диафрагмой 0,45 микрон для удаления всех частиц. Концентрированная соляная кислота медленно добавлена в перемешанный фильтрат для выделения требуемого продукта в виде дигидрохлоридной соли. Полученная суспензия была перемешана в течение нескольких часов при комнатной температуре, собрана в процессе вакуумной фильтрации и промыта EtOH/iPrOH (соотношение объемов 1:1) для получения 0,53 частей по весу неочищенной соли.
Неочищенная дигидрохлоридная соль была повторно взвешена в этаноле и нагрета до температуры дефлегмации перед охлаждением до комнатной температуры в течение примерно 1 часа. Продукт был собран в процессе вакуумной фильтрации и промыт этанолом, а затем просушен воздухом. Твердые вещества были повторно взвешены в этаноле и нагреты до температуры около 55°С для получения чистого раствора перед добавлением теплого изопропилового спирта, затем продукт осаждали, медленно охлаждая его при комнатной температуре. Полученная суспензия перемешивалась в течение нескольких часов перед вакуумной фильтрацией и промывкой, например, изопропиловым спиртом. Продукт был окончательно высушен в вакууме при комнатной температуре в течение нескольких часов и затем при приблизительно 55°C, пока не был достигнут постоянный вес.
Пример 2
Приготовление (R)-хинуклидин-3-ил-6-((3S,4R)-4-(4-амино-2-хлор-6-метоксибензамид)-3-метоксипапередин-1-ил)гексаноата
Шаг 1: Синтез этил-4-(дибензиламино)-3-метоксипипередин-1-карбоксилата (1):
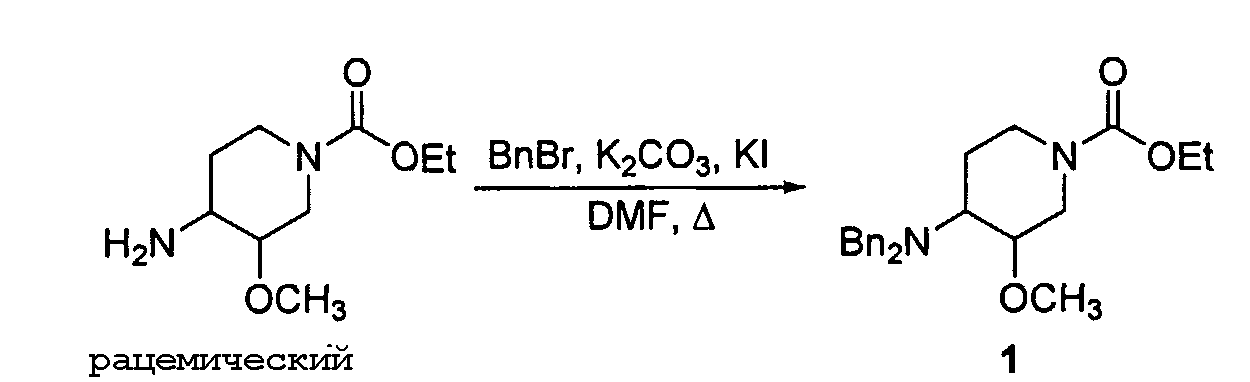
В раствор рацемического этил-4-амино-3-метоксипапередин-1-карбоксилата (1 часть на моль) в DMF был добавлен бромистый бензол (около 2,2 частей на моль), углекислый калий (около 2,4 частей на моль) и калий йодид (около 0,2 частей на моль) соответственно. Реакционная смесь была нагрета до приблизительно 80°C. Через примерно 6 часов реакционная смесь медленно разбавлена водой (около 12 частей на объем) и извлечена, например, уксусно-этиловым эфиром. Органический слой был промыт соляным раствором и затем высушен над безводным Na2SO4. Последующая фильтрация и концентрация раствора дает продукт 1 в виде желто-оранжевого масла (1 часть на моль).
Шаг 2: Синтез N,N-дибензил-3-метоксипапередин-4 амина (2):

В раствор 1 был добавлен NaOH (около 10 частей на моль) в изопропиловом спирте и раствор был перемешан и нагрет до температуры дефлегмации. По истечении 3-5 часов реакционную смесь охлаждали до комнатной температуры, и спиртовой растворитель удаляется путем ротационного выпаривания. Раствор был разбавлен водой и экстрагирован этилацетатом. Органический слой промывается соляным раствором и затем высушивается над безводным Na2SO4. Последующая фильтрация и концентрирование раствора дали неочищенный сырой продукт, который был очищен над SiO2 (CH2Cl2 МеОН NH4OH; (около) 15:1:0,01) с получением продукта 2.
Шаг 3: Синтез (3S,4R)-N,N-дибензил-3-метоксипиперидин-4-амина (3):

(-)-Дибензоил-1-винная кислота ((-)-DBT, около 1,2 части по весу) растворена в этаноле перед медленным добавлением к раствору продукта 2 (около 1 части по весу). Раствор умеренно нагревают, а затем позволяют ему остыть до комнатной температуры для кристаллизации соли. Соль фильтруется и промывается смесью EtOH/H2О перед взвешиванием в воде и преобразованием к основанию путем добавления водного раствора NaOH (7%, вес/вес) до тех пор, пока показатель pH не достигнет примерно 12. Суспензия интенсивно размешивается при нужной температуре, и плотные частицы отфильтровываются, отмываются водой и подвергаются вакуумной сушке для выделения цис-изомера 3.
Шаг 4: Синтез этил-6-((3S,4R)-4-(дибензиламино)-3-метоксипиперидин-1-ил)гексаноата (4):

В раствор продукта 3 (1 часть на моль) в DMF добавлен этил бромогексаноат (около 1,2 частей на моль), карбонат калия (около 1,4 частей на моль) и иодид калия (около 0,2 частей на моль) соответственно. Реакционная смесь затем нагревается приблизительно до 80°C. Примерно через 8 часов реакционная смесь медленно разбавляется водой (около 12 частей на объем) и выделяется при помощи этилацетата. Органический слой промывается соляным раствором и затем высушивается над безводным Na2SO4. Последующая фильтрация и концентрация раствора дает неочищенный сырой продукт. Очистка над SiO2 дает алкилированный продукт 4.
Шаг 5: Синтез (R)-хинуклидин-3-ил-6-((3S,4R)-4-(дибензиламино)-3-метоксипиперидин-1-ил)гексаноата (5):

Тетраэтоксид титана добавлен к смеси продукта 4 (1 часть на моль) и (R)-(-)-3-хинуклидинола (1 часть на моль) в толуоле. Реакционная смесь приготовлена с помощью аппарата Дина-Старка перед нагревом приблизительно до 90°C, потом подается неполный вакуум (для поддержания требуемого объема растворителя дополнительно добавляют толуол). Реакционная смесь затем охлаждается до нужной температуры и разбавляется этилацетатом, а затем в полученную смесь добавляют воду. Органический слой промывается соляным раствором и затем высушивается над безводным Na2SO4, фильтруется и сгущается. Очистка над SiO2 дает обогащенный энантиомерами продукт 5.
Шаг 6: Синтез (R)-хинуклидин-3-ил-6-((3S,4R)-4-амино-3-метоксипиперидин-1-ил)гексаноата (6):

Раствор продукта 5 (1 часть на моль) в EtOH добавляют в колбу, содержащую палладий на угле, (около 0,2 частей на моль). Далее из смеси откачивают воздух, перед тем как подвергнуть ее гидрогенолизу с использованием атмосферного H2. После завершения реакции палладий отфильтровывается под целитовой прокладкой, за чем следует промывка EtOH. Фильтрат концентрируется посредством роторного испарения до получения продукта 6.
Шаг 7: Синтез (R)-хинуклидин-3-ил-6-((3S,4R)-4-(4-амино-2-хлор-6-метоксибензамидо)-3-метоксипиперидин-1-ил)гексаноата (7):
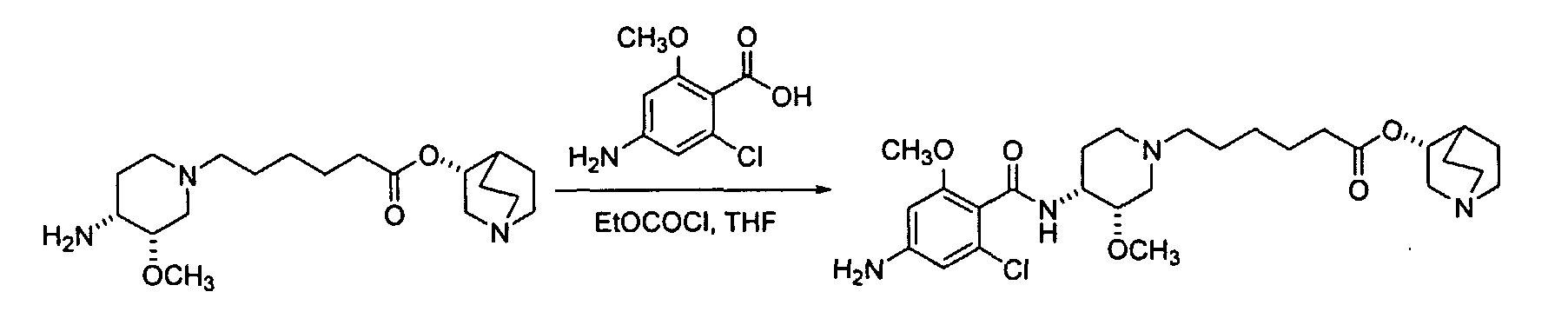
Для растворения, например, этилхлороформиата (1 часть на моль) в THF при приблизительно 0°C добавляют бензойную кислоту (1 часть на моль) в соответствующей пропорции. Смесь нагревают до нужной температуры в течение приблизительно часа пред охлаждением до около 0°C и капельным добавлением раствора 6 (1 часть на моль). Затем реакционную смесь нагревают до нужной температуры. После завершения реакции она подавляется добавлением насыщенного раствора NaHCO3 и выделением через EA. Органический слой промывается соляным раствором и затем высушивается над безводным Na2SO4, фильтруется и концентрируется до получения требуемого продукта 7.
Пример 3
Варианты cинтеза ATI-7505:

В кислых условиях 1-бензилпипередин-4-он (1) и бромистоводородная кислота реагируют в присутствии уксусной кислоты с образованием N-бензил-3-бромопипередина-4-она (2). Обработка продукта 2 метоксидом натрия и раствором метанола обеспечивает получение 1-бензил-4,4-диметоксипиперидин-3-ола (3). [Присутствие бета-аминогруппы сводит к нулю вероятность протекания реакции Фаворского.] Метилирование гидроксильной группы осуществляется при помощи гидридного основания, за ним следует обработка йодометаном в присутствии DMF в качестве растворителя для получения соединения 4.

Последующий ацетальный гидролиз с использованием 1% серной кислоты при нагревании дает пиперидин 5, который затем подвергается восстановительному аминированию с использованием, например, цианоборгидрида натрия и ацетата аммония в метаноле для получения 1-бензил-3-метоксипиперидин-4-амина (6). На этой стадии продукт 6 может быть подвергнут хиральному разделению. Для завершения может использоваться, например, (-)-DBT или другой вариант винной кислоты в присутствии подходящего для получения исключительно чистого асимметричного соединения 7 растворителя. Защита первичного амина в 7 BOC-группой может быть выполнена с использованием ВОС-ангидрида в присутствии THF растворителя, для получения продукта 8. Реакция дебензилирования за счет гидрогенолиза с использованием Pd/C в метаноле в присутствии атмосферного водорода обеспечивает переход к стадии алкилирования. Обработка 6-бромгексаннитрила в присутствии мягкого основания и DMF обеспечивает получение соединения 10. Преобразование нитрила в сложный эфир с использованием (R)-хинуклидинола в присутствии кислоты в качестве разбавителя дает соединение 11. Последующее удаление защиты (BOC-группы) с использованием TFA дает свободный амин, который может участвовать в реакции сочетания с требуемой бензойной кислотой в присутствии связующего реагента, такого как этилхлороформиат, для получения ATI-7505 в виде энантиомерно чистого сырья.

В другом варианте соединение 9 может быть алкилировано с использованием 6-бромогексаноата в присутствии мягкого основания. Последующее удаление BOC-группы дает соединение 13. Переэтерификация 13 посредством титана с использованием (R)-хинуклидинола и тетраэтоксида титана в толуоловом растворителе дает ATI-7505. Эстераза Карлсбурга гидролизирует эфиры, которые имеют S-конфигурацию, поэтому неповрежденными остаются эфиры R-конфигурации. Следовательно, воздействие на диастереоизомерные смеси 14 эстеразой Карлсбурга также может дать ATI-7505.
Пример 4
(+) и (-)-норцизаприд могут быть получены из их рацемической смеси путем разложения энантиомеров с использованием общепринятых средств, таких как оптически разделяющие кислоты, в соответствии с методом, описанным в патенте США № 6147093, или в работе «Энантиомеры, рацематы и разложения» Дж. Жака, А. Колета и С.Г. Уилена («Enantiomers, Racemates and Resolutions», by J. Jacques, A. Collet, and S.H. Wilen (Wiley-Interscience, New York, NY), а также С.Г. Уилен и др. «Тетрагедрон» (S.H. Wilen et al. Tetrahedron (1977) 33:2725).
Изомеры 4 были получены в количествах меньше миллиграмма с использованием колоночной хроматографии, за которой последовало выпаривание растворителя. Этот метод полезен при получении небольших количеств вещества для исследовательских и описательных целей. Это стандартный метод разделения, обычно применяющийся в аналитических лабораториях для выделения и описания метаболитов.
Возможные пути синтеза Соединения IV, Соединения VI и (+)-Соединения II с использованием (+)-норцизаприда в качестве исходного материала описаны ниже. Пути синтеза Соединения III, Соединения V и (-)-Соединения II аналогичны, только исходным материалом является (-)-норцизаприд.
Пример 5
Получение (+)-Соединения II, этиловый эфир
Эквимолярная смесь (+)-норцизаприда и этил 6-бромогексаноата (по 1 эквиваленту каждого), каталитическое количество KI и K2CO3 (2 эквивалента) в DMF нагревают до приблизительно 60°C в течение нескольких часов, пока анализ с помощью тонкослойной хроматографии (TLC) не покажет, что реакция закончилась. После охлаждения до комнатной температуры добавляют воду и выделяют смесь при помощи EtOAc. Объединенные органические экстракты последовательно промывают водой, водным раствором LiCl и солевым раствором, а затем высушивают через
Na2SO4. Сгущение дает (+)-Соединение II, этиловый эфир.
Получение (+)-Соединения II
Смесь неочищенного (+)-Соединения II, сложного этилового эфира, полученного как описано выше (1 эквивалент), KOH (2 молекулярных веса, 5 эквивалентов) в MeOH и THF (достаточно для растворения) перемешивается в течение приблизительно 1-2 часов при комнатной температуре. MeOH и THF удаляются под вакуумом, и остаток растворяется в воде. Осуществляется промывка органическим растворителем, таким как EtOAc. Водный слой окисляется до значения -5 показателя pH с использованием HCl. Осадок отфильтровывается и высушивается до получения (+)-Соединения II.
Получение Соединения IV и Соединения VI
Смесь (+)-Соединения II (1 эквивалент), (R)-(-)-3-хинуклидинола, HCl соль, (1 эквивалент), EDAC (1 эквивалент) и DMAP (1 эквивалент) в DMF в течение ночи нагревают до приблизительно 50°C. После охлаждения и разбавления водой смесь очищают с использованием хроматографии или кристаллизации для получения Соединения IV. Также с использованием (S)-(+)-хинуклидинола получают Соединение VI.
Следующие соединения в основном получают с использованием методов и процедур, описанных выше. Названия соединений сгенерированы с использованием ChemDraw Ultra версии 8.03, которую можно получить от Cambridgesoft Corporation, а также программного обеспечения ACD Namepro версии 6.0.
(3S)-1-азабицикло[2.2.2]окт-3-ил-6-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}гексаноат;
(3S)-1-азабицикло[2.2.2]окт-3-ил-6-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}гексаноат;
(3R)-1-азабицикло[2.2.2]окт-3-ил-6-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}гексаноат;
8-метил-8-азабицикло[3.2.1]окт-3-ил-6-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}гексаноат;
4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензойная кислота;
метил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
метил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
метил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
изоприл-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-метоксиэтил-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-пирролидин-1-ил-этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
1-метилпиперидин-4-ил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-пиридин-2-ил-этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-(диметиламино)этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2- метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
1-метилпиперидин-3-ил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-морфолин-4-ил-этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
1,4-диметилпиперидин-4-ил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензойная кислота;
2-оксо-2-(пиперидин-4-ил-амино)этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
1-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)пиперидин-4-карбоновая кислота;
метил-1-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)пиперидин-4-карбоксилат;
метил-1-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)пиперидин-4-карбоксилат;
метил-1-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)пиперидин-4-карбоксилат;
метил-1-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)пиперидин-4-карбоксилат;
2-метоксиэтил-1-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)пиперидин-4-карбоксилат;
4-{[2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)(метил)амино]метил}бензойная кислота;
метил-4-{[2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)(метил)амино]метил}бензоат;
метил-4-{[2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]метил}бензоат;
изопропил-4-{[(2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]метил}бензоат;
дигидрохлорид-этил-4-{[(2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]метил}бензоата;
(3R)-1-азабицикло[2.2.2]окт-3-ил-4-{[(2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]карбонил}бензоат;
(R)-хиноклидин-3-ил-6-((3S,4R)-4-(4-амино-2-хлор-6-метоксибензамидо)-3-метоксипиперидин-1-ил)гексаноат; или
6-((3S,4R)-4-(4-амино-2-хлор-6-метоксибензамидо)-3-метоксипиперидин-1-ил)капроевая кислота.
Технология приготовления, назначение и применение лекарственных средств
Дозировка и способы применения описанных выше компонентов подобны тем, которые используют опытные специалисты (например, см. Терапевтический справочник, 54-е изд., Медицинская экономическая компания, Монтвэйл, НДж, 2000).
Дозы структурного и/или функционального аналогов при профилактике или терапии острых или хронических заболеваний и/или расстройств будут зависеть от степени тяжести состояния больного и назначенных способов применения. Дозировка и частота приема изменяются в зависимости от возраста, веса тела и индивидуальной реакции пациента. В большинстве случаев дневная доза структурного и/или функционального аналогов при описанных выше условиях находится в диапазоне от 1 до 200 мг за один или несколько приемов. Желательно, чтобы дневная доза составляла от 5 до 100 мг за один или несколько приемов, но еще лучше, чтобы дневная доза составляла от 5 до 75 мг за один или несколько приемов. Желательно назначать прием лекарства от 1 до 4 раз в день. В процессе лечения терапию нужно начинать с низкой дозы примерно от 5 мг до 10 мг и повышать до 50 мг и выше в зависимости от общей реакции пациента. Рекомендуется, чтобы дети, пациенты старше 65 лет и пациенты с ослабленной почечной или печеночной функцией начинали с небольших доз, урегулированных в соответствии с индивидуальной реакцией и уровнем в крови. В некоторых случаях по усмотрению специалистов может возникнуть необходимость применить дозировки, выходящие за рекомендуемые пределы. Клинический или лечащий врач будет знать, когда прерывать, изменять или прекращать терапию в связи с индивидуальной реакцией пациента.
Составы согласно настоящему изобретению можно получать в соответствии с известными способами приготовления фавмацевтически пригодных композиций. Технологии приготовления детально описаны в серии хорошо известных и доступных специалистам источников. Например, Ремингтон: Фармацевтическая наука, Е.В.Мартина описывает технологии приготовления, которые можно использовать в связи с настоящим изобретением. Композиции настоящего изобретения составлены так, чтобы скомбинировать эффективное количество биоактивного соединения с подходящим носителем для удобства назначения препарата.
Композиции настоящего изобретения включают в себя суспензии, растворы и эликсиры; аэрозоли или композиции, включающие носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, растворители, гранулирующие агенты, смазывающие агенты, связующие вещества, разрыхляющие вещества и тому подобные, в случае твердых оральных лекарств (таких как порошки, капсулы или таблетки), если твердые пероральные лекарства предпочтительнее жидких пероральных лекарств. Желательно использовать твердые оральные препараты в виде капсул. Лучше всего использовать твердые оральные препараты в виде таблеток. Предпочтительная дозировка активного ингредиента (т.е. структурного и/или функционального аналога цизаприда) в твердой форме - 5 мг, 10 мг и 25 мг.
Кроме того, можно использовать и твердые, и жидкие носители. Препараты в твердой форме включают в себя порошки, таблетки, пилюли, желатиновые капсулы, крахмальные капсулы, медицинские свечи и диспергируемые гранулы. Твердым носителем может быть одно и более веществ, действующих как разбавители, вкусовые добавки, солюбилизаторы, смазывающие, суспендирующие, связующие вещества, консерванты, дезинтегрирующие агенты или материалы для капсулирования.
Описанные здесь фармацевтические композиции могут быть подразделены на однократные дозы, содержащие необходимое количество активного компонента. Однократная доза может быть представлена в виде запечатанных таблеток, капсул и порошков в бумажных или пластиковых контейнерах, либо пузырьков или ампул. Также однократные дозы могут быть в виде препаратов на жидкой основе или включенных в состав твердых продуктов питания жевательных резинок или пастилок.
В добавление к описанным выше основным формам однократных доз соединения настоящего изобретения могут быть назначены проверенными способами дозирования и/или средствами доставки, описанными в патентах США №№ 3845700, 3916899, 3536809, 3598123 и 4008719, включенных в описание в качестве ссылок.
Чтобы обеспечить требуемую для пациента дозировку структурного и/или функционального аналога цизаприда, ему может быть назначен любой подходящий курс приема лекарства. Могут применяться, например, пероральный, ректальный, парентеральный (подкожный, внутримышечный, внутривенный), чрескожный и другие подобные методы введения. Дозированные формы включают пилюли, таблетки, дисперсии, суспензии, растворы, капсулы, пластыри и тому подобные.
Один из аспектов изобретения составляет метод лечения гастроэзофагального рефлюкса у млекопитающих, при котором значительно сокращаются отрицательные действия, связанные с применением цизаприда, и который включает прием человеком, нуждающимся в подобном лечении, структурного и/или функционального аналога цизаприда или его фармацевтически приемлемой соли в терапевтически эффективных дозах. Предпочтительно применение изобретения для лечения гастроэзофагального рефлюкса у человека.
Еще один аспект изобретения составляет композиция для лечения человека, страдающего гастроэзофагальным рефлюксом, которая содержит эффективную терапевтическую дозу структурного и/или функционального аналога цизаприда или его фармацевтически приемлемой соли.
Еще один аспект изобретения составляет оказание противорвотного действия на млекопитающих, при котором значительно сокращаются отрицательные действия, связанные с применением цизаприда, и который включает прием млекопитающим, нуждающимся в подобной противорвотной терапии, структурных и/или функциональных аналогов цизаприда или их фармацевтически приемлемых солей в эффективных терапевтических дозах. В основном, под млекопитающим подразумевается человек.
Кроме того, настоящее изобретение представляет противорвотную композицию для лечения млекопитающих, нуждающихся в противорвотной терапии, которая содержит эффективную терапевтическую дозу структурного и/или функционального аналога цизаприда или его фармацевтически приемлемой соли.
Настоящее изобретение также включает метод лечения состояний, вызванных дисфункцией желудочно-кишечного тракта у млекопитающих, при котором значительно сокращаются отрицательные действия, связанные с применением цизаприда, и который включает прием млекопитающим, нуждающимся в лечении дисфункции желудочно-кишечного тракта, структурного и/или функционального аналога цизаприда или его фармацевтически приемлемых солей в терапевтически эффективных дозах. Состояния, вызванные дисфункцией желудочно-кишечного тракта, включают, в том числе, диспепсию, гастропарез, запоры, послеоперационный илеус и динамическую кишечную непроходимость. В основном, под млекопитающим подразумевается человек.
Факт наличия взаимодействия цизаприда с центральной нервной системой и его сродство к 5HT4-рецепторам, указывает на то, что цизаприд может опосредованно оказывать влияние на ЦНС. Цизаприд является сильным лигандом 5HT4-рецепторов, а эти рецепторы расположены в нескольких областях центральной нервной системы. Воздействие на серотонинергическую систему влечет за собой различные поведенческие реакции. Соответственно, соединения настоящего изобретения могут быть использованы для лечения: 1) когнитивных расстройств, в том числе болезнь Альцгеймера; 2) расстройств поведения, в том числе шизофрении, мании, навязчивых состояний и зависимости от психоактивных средств; 3) расстройств настроения, в том числе депрессии и тревожных состояний; и 4) расстройств вегетативных функций в том числе эссенциальной гипертензии и расстройств сна.
Соответственно, настоящее изобретение также представляет методы лечения когнитивных, поведенческих расстройств, расстройств настроения и вегетативных функций у млекопитающих, которые включают прием структурного и/или функционального аналога цизаприда или его фармацевтически приемлемой соли в терапевтически эффективных дозах. В основном, под млекопитающим подразумевается человек.
ATI-7505 обладает высоким сродством к 5-HT4-рецепторам
Известно, что 5-HT4-рецептор является основным подтипом рецепторов, влияющих на прокинетическую активность цизаприда в кишечнике. ATI-7505 обладает высоким сродством к 5-HT4-рецептору при низких наномолярных значениях IC50. Как показано в Таблице 1, сродство ATI-7505 к 5-HT4-рецептору было в 18 раз больше, чем у цизаприда и по крайней мере в 360 раз больше, чем к главному метаболиту ATI-7505, ATI-7500.
ATI-7505 - высокоэффективный частичный агонист 5-HT4-рецептора человека
ARYx, представленный в in vitro анализе, основанном на стимуляции аденилат-циклазы в клетках, выведеных для устойчивой экспрессии рецептора 5-HT4человека. Было доказано, что ATI-7505 - высокоэффективный агонист 5-HT4-рецептора, тогда как его основной метаболит, ATI-7500, оказался относительно слабым (Фиг.2 и Таблица 2). Оценка EC50 для ATI-7505 (4 нМ) была приблизительно в 10 раз ниже, чем для цизаприда (49 нМ), и приблизительно в 100 раз ниже, чем для ATI-7500 (395 нМ). На основе оценки значения Eмакс ATI-7505 имеет эффективность 85% по отношению к 5-HT4-рецептору (серотонина) (Таблица 2), это означает, что ATI-7505 - частичный агонист 5-HT4-рецепторов.
ATI-7505 ускоряет опорожнение желудка у собак, получивших пищу
Чтобы проанализировать воздействие ATI-7505 на опорожнение желудка, были поставлены эксперименты с использованием модели послеобеденных процессов, при участии находящихся в сознании собак, состояние которых оценивалось с помощью тензодатчиков, размещенных на желудке и на тонкой кишке. Целью экспериментов было измерение времени, которое требуется мигрирующим сокращениям пищеварительного тракта (MMC) на возврат к исходному состоянию для последующего всасывания твердой пищи. Уменьшение времени возврата MMC в исходное состояние под воздействием лекарств означает раннее завершение пищеварения за счет ускорения опорожнения желудка. Сразу же после прекращения MMC в среднем отделе тонкой кишки различные дозы тестируемых лекарств (переносчики, ATI-7505, или цизаприд) были введены внутривенно в течение 20 минут. После окончания ввода лекарств собакам дали пищу. Сокращения кишечника были зарегистрированы минимум за 60 минут до начала ввода лекарств, чтобы определить состояния натощак и установить начало MMC в двенадцатиперстной кишке, и по крайней мере через 30 минут после возврата MMC в двенадцатиперстную кишку. Количественное сравнение лекарств основывалось на времени возврата MMC как показателе опорожнения желудка, следующего за всасыванием твердой еды. Как представлено на Фиг. 2, ATI-7505 значительно ускоряет время возврата MMC. Цизаприд демонстрирует схожее действие.
ATI-7505 улучшает моторику желудка и тонкой кишки при незначительном воздействии на толстую кишку
Эксперименты проводились на голодных собаках, находящихся в сознании, чтобы оценить влияние ATI-7505 на моторику желудка, тонкой и толстой кишки, в сравнении с цизапридом. Особой задачей было определение размеров дозы ATI-7505 (внутривенно и перорально), воздействие которой наиболее близко имитирует влияние цизаприда в обычной терапевтической дозе (0,5 мг/кг внутривенно; 1 мг/кг перорально) на сократительную активность у собак.
При введении внутривенно и перорально как ATI-7505 , так и цизаприд оказывали прокинетическое действие на кишечник собак. Начало действия обычно в течение 1-2 минут и 25-30 минут при приеме внутривенно и перорально соответственно. Воздействие ATI-7505 на моторику желудка и тонкой кишки такое же, как у цизаприда. Также как и цизаприд, ATI-7505 используется для дозозависимой стимуляции антральных сокращений и сокращений тонкой кишки с незначительным воздействием на моторику толстой кишки. Прокинетический эффект, вызванный воздействием ATI-7505 в верхней части ЖКТ, сопровождается небольшим (p<0,05), но значимым увеличением частоты гигантских мигрирующих сокращений (GMC).
ATI-7505 не связано с развитием ретроградных гигантских мигрирующих сокращений (RGC). Как и цизаприд, ATI-7505 оказывает минимальное воздействие на характеристики мигрирующего комплекса пищеварительного тракта (MMC) в антральном отделе желудка, а также в проксимальном, среднем и дистальном отделах тонкой кишки. В том, что касается частоты MMC и длительности Фазы III, было отмечено только одно значительное различие: PO ATI-7505 увеличивает частоту MMC в проксимальном отделе тонкой кишки по отношению к контрольной группе. Собаки переносили внутривенные и пероральные дозы ATI-7505 хорошо, и таких побочных эффектов как диарея, анорексия и потеря веса не было выявлено.
В целом, полученные результаты показали, что при расчете доз в мг/кг ATI-7505 приблизительно в 2 раза сильнее цизаприда. Кроме того, воздействия ATI-7505, подобно воздействиям цизаприда, были согласованы с действием механизма, облегчающего высвобождение ацетилхолина из энтеральных нейронов, в большей степени, чем с прямым действием гладкой мышцы. Вывод: ATI-7505 улучшает моторику желудка и тонкой кишки, подобно цизаприду, почти без воздействия на толстую кишку.
Метаболизм ATI-7505 является CYP450-независимым
На основе данных, полученных на объединенных микросомах человека, ATI-7505 претерпевает биотрансформацию в единственный метаболит, ATI-7500, который, как оказалось, не является объектом дальнейшего метаболизма. Превращение ATI-7505 в ATI-7500 не зависит от присутствия NADPH. Таким образом, направление главной биотрансформации для ATI-7505 не зависит от ферментов CYP450.
ATI-7505 не ингибирует ферменты CYP450
Чтобы проверить возможность ATI-7505 и/или его главного метаболита ATI-7500 действовать в качестве ингибиторов CYP450, эти две молекулы были испытаны с использованием Gentest SupersomesTM. В соответствии с опубликованными отчетами цизаприд проявляет ингибиторную активность по отношению к изоформам ферментов CYP450 - CYP3A4, 2D6 и в меньшей степени к 2C9. Ни ATI-7505, ни его главный метаболит, ATI-7500, не обнаружили значительной ингибиторной активности ни по отношению к этим трем изоформам ферментов CYP450, ни к ряду других изоформ, принимающих участие в метаболизме лекарств.
ATI-7505 обладает незначительным сродством к сердечному каналу, IKr
За быструю активизацию калиевого (K+) тока задержанного выпрямления у человека (IKr человека) отвечает K+-канал, который кодируется геном человека hERG. Как известно, под воздействием цизаприда происходит удлинение QT-интервалов за счет блокады IKr, поэтому интерес представляла задача определить, оказывают ли ATI-7505 и ATI-7500 влияние на IKr человека. Тестируемой системой были HEK-293 клетки млекопитающего, в которых экспрессированы K+-каналы hERG, при этом калиевый ток измерялся методом фиксации потенциала. Расстановка в соответствии со значениями IC50: цизаприд (9,5 нМ)>ATI-7505 (24,521 нМ)>ATI-7500 (204,080 нМ) (Таблица 3). В целом, полученные данные показывают, что ATI-7505 имеет значительно более низкий проаритмический потенциал, чем цизаприд, а также предполагается, что и ATI-7505, и ATI-7500 обладает незначительным сродством к каналам человека.
ATI-7505 не вызывают значительных электрофизиологических изменений в сердечной мышце морской свинки
Электрофизиологические эффекты на сердечную мышцу, связанные с ATI-7505, были исследованы на изолированных перфузируемых сердцах морских свинок. При исследовании изучались ATI-7505, ATI-7500 и цизаприд, каждый из которых был протестирован при концентрациях вплоть до 10000 нМ. Уровень, при котором эффект не наблюдается (NOEL), был определен как самая высокая концентрация тестируемого соединения, при которой ответ незначительно отличается от исходного состояния (p<0,05). Были рассмотрены следующие 6 параметров сердечной мышцы: (1) QT-интервал; (2) MAPD90; (3) SA-интервал; (4) QRS-интервал; (5) AH-интервал; и (6) HV. Если ATI-7505 оказался очень слабым модулятором электрофизиологических параметров сердечной мышцы, его метаболит, ATI-7500, вообще не подействовал на электрофизиологическую активность. NOEL для ATI-7500 был >10000 нМ для всего набора из 6 сердечно-сосудистых параметров. Поскольку цизаприд имеет NOEL 10 нМ для объединенного набора из 6 исследовавшихся параметров сердечной мышцы, тогда как ATI-7505 имеет объединенный NOEL 1000 нМ, оказалось, что ATI-7505 не обладает действенностью цизаприда для модулирования электрофизиологических параметров сердечной мышцы. В целом, полученные данные показывают, что ATI-7505 является значительно более безопасным, чем цизаприд, в том, что касается возможности индуцировать электрофизиологические изменения в сердечной мышце.
Микросомальный метаболизм у человека
Метаболизм представленных соединений изучался на объединенных микросомах человека в случаях присутствия и отсутствия кофермента NADPH системы цитохрома P-450, а также при одновременном исчезновении исходного соединения и возникновении соответствующего кислотного метаболита, т.е. изомера соединения II, наблюдаемом во времени.
Как показано в Таблице 5, Соединения III и IV были быстро гидролизированы эстеразой в соответствующие метаболиты - (+) и (-)-Соединения II. Метаболизм не зависел от CYP450, т.к. скорость гидролиза не зависела от присутствия NADPH, который является необходимым коферментом для функционирования CYP450. Напротив, (±)-S Соединения V и VI оказались довольно устойчивыми во времени при тех же условиях. В данном эксперименте количество субстрата (соединений III, IV, V, и VI) в реакции после 5, 60, и 90 минут оценивалось методом хромато-масс-спектрометрии (сочетание) высокоэффективной колоночной хроматографии с масс-спектрометрией. Это оставшееся количество коррелировало с появлением метаболита соединения II. В совокупности оставшийся субстрат и соединение II составляли неизменное в течение времени количество, равное количеству исходного материала в нулевой момент времени, а это указывает, что единственной реакцией метаболизма был гидролиз.
Метаболизм в крови человека
Исследуемые соединения были растворены в DMSO для получения 12,5 мМ исходного раствора и разбавлена водой до получения конечной концентрации 2,5 мМ (DMSO/H2О=20/80). Свежая кровь была отобрана в пробирки, обработанные гепарином от 3 доноров-людей, и хранилась во льду вплоть до инкубации. Аликвотные количества крови от каждого из доноров были отмерены пипеткой в отдельные пробирки для центрифугирования по 1,5 мл, и пробирки были подготовлены к инкубации в качалке с водяным термостатом при 37°C в течение 5 минут. Реакция была запущена с помощью добавления 10 мкл соответствующих исследуемых соединений в каждую пробирку (конечная концентрация = 100 мкM). Инкубация была подавлена на 0, 5, 15, 30 и 60 минутах за счет добавления ацетонитрила (750 мл), после чего осуществлялось центрифугирование при 12000 оборотах в минуту в течение 2 минут, и всплывающий слой анализировался с помощью системы Agilent 1100 для проведения высокоэффективной колоночной хроматографии. Разделение выполнялось на Keystone Intersil ODS2, 250×4,6 мм, 5 м колонке. Жидкая подвижная фаза состояла из 20 мМ буферного раствора ацетата аммония (pH 5,7) и органической фазы ацетонитрила. Использованный градиент: начальное условие - 20% ацетонитрила в минуту. Концентрация ацетонитрила линейно снизилась до 90% в течение 8 последующих минут и удерживалась в течение 1 минуты. Затем система была возвращена к начальным условиям в течение минуты и оставалась в этом состоянии в течение 4 минут до следующего введения. Площадь пика для исходного пика определялась путем отслеживания логарифма коэффициента распределения на 240, 254 и 290 нМ. Результаты были выражены как оставшееся количество исходного соединения и в виде данных, подвергшихся кинетическому анализу с использованием WinNonLin. Периоды полувыведения отдельных соединений представлены в Таблице 6.
Следует иметь в виду, что примеры и аспекты, описанные в настоящем изобретении, являются иллюстративными, и что их различные модификации или изменения в их интерпретации могут быть предложены опытным специалистам и, предположительно, будут включены в настоящее изобретение в соответствии с сущностью и перспективами конкретного приложения и объемом патентной формулы изобретения. Кроме того, все патенты, заявки на патент, предварительные заявки, публикации, на которые ссылается данное изобретение, и цитируемые публикации включены в виде ссылки в настоящее описание, если они не противоречат открытым положениям данного описания.
Изобретение, а также методы и способы его получения и использования описаны здесь полными, ясными, лаконичными и точными терминами для того, чтобы каждый опытный в данной сфере специалист мог получить и использовать это изобретение. Следует иметь в виду, что выше описаны предпочтительные аспекты изобретения, и их модификации могут быть включены в настоящее изобретение, если они не содержат отклонений от объема и сущности настоящего изобретения, изложенных в патентной формуле изобретения. Особо отмечено и четко провозглашается, что предмет обсуждения рассматривается в качестве изобретения, и приведенная ниже патентная формула подводит итог подробного описания настоящего изобретения.
Реферат
Описаны стереизомерные соединения формулы (X): ! ! где переменные определены настоящим изобретением, соединения для безопасного и эффективного лечения различных расстройств желудочно-кишечного тракта, в том числе гастропареза, гастроэзофагального рефлюкса и связанных с ними состояний. Соединения настоящего изобретения также применимы для лечения ряда состояний, затрагивающих центральную нервную систему. 7 н. и 20 з.п.ф-лы, 6 табл., 3 ил.
Формула

и их фармацевтически приемлемые соли, в которых связи 3 и 4 находятся в цис-положениях относительно друг друга;
R1 - галоген;
R2- аминогруппа, NН(С1-С4-алкил), либо N(С1-С4-алкил)(С1-С4-алкил);
R3 - OH, либо С1-С4-алкокси;
R4 - Н или метил; и
R5 представляет собой -O-C3-C8 циклоалкил, -О-гетероциклоалкил, гетероциклоалкил, арил, -О-арил, -N(R9)-(C0-C6-алкил)-C(O)-арил, либо -N(R9)-C0-C6-алкиларил, -O-гетероарил, -N(R9)-C1-C6(O)-гетероарил, либо -N(R9)-C0-C6-алкилгетероарил, где каждая из циклических групп может быть незамещенной или замещенной по одной или более замещаемым позициям следующими заместителями: C1-C6-алкил, C1-C6-алкокси, галоген, C1-C6-галоалкил, C1-C6-галоалкокси, гидроксил, гидрокси-C1-C4-алкил, амин, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), -(C0-C6-алкил)-C(O)R11, либо -O-(C0-C6-алкил)-C(O)R11, метилсульфон, C0-C6-сульфонамид, или NO2;
где R9 при каждом появлении независимо представляет собой Н или C1-C4-алкил;
R11 представляет собой C1-С6-алкил, ОН, либо
R11 представляет собой C1-C6-алкокси, необязательно замещенный 1 или 2 группами, независимо представляющими C1-C4-алкокси, аминогруппу, -NH(C1-C6-алкил), -N(C1-C6-алкил)(C1-C6-алкил), -(C0-C6-алкил)-C(O)N(R9)-гетероциклоалкил, -О-гетероциклоалкил, -C1-C6(O)N(R9)-гетероарил, либо гетероарил, где
гетероциклоалкильные группы необязательно замещены 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3,
гетероарильная группа может быть замещена 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, гидрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3; либо
R11 означает -О-гетероциклоалкил, где гетероциклоалкил необязательно замещен 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-C6-алкил, C1-C6-алкокси, годрокси, гидрокси-C1-C6-алкил, C1-C6-алкоксикарбонил, -CO2H, CF3, либо OCF3.
где R1 представляет собой хлор,
R2 представляет собой аминогруппу, NН(С1-С4-алкил), либо N(C1-C4-алкил)(С1-С4-алкил);
R3 -ОН либо С1-С4-алкокси;
R4 - Н или метил; и
R5 представляет собой -O-гетероциклоалкил, где гетероциклоалкильная группа выбрана из аза-бициклооктила, аза-бициклононила, аза-бициклодецила, в которых аза-азот может быть замещен метилом или этилом, и гетероциклоалкильная группа необязательно замещена метилом или этилом;
независимо представляющими С1-С4-алкил, С1-С4-алкокси, галоген, C1-C4-галоалкил, С1-С4-галоалкокси, гидроксил, гидрокси-С1-С4-алкил, аминогруппу, -NH(C1-C4-алкил), -N(С1-С4-алкил)(С1-С4-алкил), -(C1-С6-алкил)-С(O)R11, либо NO2.
где R5 представляет собой это гетероциклоалкил, выбранный из 1-аза-бицикло[2.2.2]окт-3-ила или 8-аза-бицикло[3.2.1]окт-3-ила, где азот в группе 8-аза-бицикло[3.2.1]окт-3-ила может быть замещен метилом или этилом.

и их фармацевтически приемлемые соли, в которых связи 3 и 4 находятся в цис-положениях относительно друг друга;
R1 - галоген;
R2 - аминогруппа, NН(С1-С4-алкил) либо N(С1-С4-алкил)(С1-С4-алкил);
R3 - ОН либо С1-С4-алкокси;
R4 - Н или метил;
R9 при каждом появлении независимо представляет собой Н или С1-С4-алкил;
R11 представляет собой C1-С6-алкил, ОН, либо
R11 представляет собой C1-С6-алкокси, необязательно замещенный 1 или 2 группами, независимо представляющими С1-С4-алкокси, аминогруппу, -NH(C1-С6-алкил), -N(C1-С6-алкил)(C1-С6-алкил), -(C0-C6-алкил)-C(O)N(R9)-гетероциклоалкил, -O-гетероциклоалкил, -C1-C6(O)N(R9)-гетероарил, либо гетероарил, где гетероциклоалкильные группы
необязательно замещены 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, C1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, -СO2Н, СF3, либо ОСF3, гетероарильная группа необязательно замещена 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, С1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, -СO2Н, СF3, либо ОСF3; либо
R11 означает -O-гетероциклоалкил, где гетероциклоалкил необязательно замещен 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, C1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, -СO2Н, СF3, либо ОСF3;
R15 представляет собой Н, C1-С6-алкил, C1-С6-алкокси, галоген, C1-С6-галоалкил, C1-С6-галоалкокси, гидроксил, гидрокси-С]-С4-алкил, амино, -NH(С1-С6-алкил), -N(С1-С6-алкил)(С1-С6-алкил) или метилсульфон, С0-С6-сульфонамид, NO2, а
R16 представляет собой Н или -O-(С0-С6-алкил)-С(O)R11.
где R1 - галоген;
R2 - аминогруппа, NH(С1-С4-алкил) либо N(С1-С4-алкил)(С1-С4-алкил);
R3 - ОН либо С1-С4-алкокси;
R4 - Н или метил;
R9 - Н или метил;
R11 является ОН, С1-С4-алкокси либо С1-С2-алкокси-С1-С3-алкокси-, где C1-С6-алкокси необязательно замещен аминогруппой, -NH(С1-С6-алкил), -N(C1-С6-алкил)(С1-С6-алкил), аза-бициклооктилом, аза-бициклононилом, аза-бициклодецилом, в которых аза-азот может быть замещен метилом или этилом;
пирролидинил, пиперидинил, морфолинил, пиридил или -(С0-С6-алкил) -С(O)NН-пирид-4-ил;
R15 представляет собой Н, C1-C6-алкил, C1-C6-алкокси, галоген, C1-C6-галоалкил, C1-С6-галоалкокси, гидроксил, гидрокси-С1-С4-алкил, амино, -NH(С1-С6-алкил), -N(С1-С6-алкил)(С1-С6-алкил) или метилсульфон, С0-С6-сульфонамид, NO2, а
R16 представляет собой Н или -O-(С0-С6-алкил)-С(O)R11.

и их фармацевтически приемлемые соли, в которых связи 3 и 4 находятся в цис-положениях относительно друг друга;
n представляет собой 1 или 2;
R1 - галоген;
R2 - аминогруппа, NН(С1-С4-алкил) либо N(С1-С4-алкил)(С1-С4-алкил);
R3 - ОН либо С1-С4-алкокси;
R4 - Н или метил;
R11 - это ОН у С1-С4-алкокси; или
R11 представляет собой C1-С6-алкокси, необязательно замещенный 1 или 2 группами, независимо представляющими С1-С4-алкокси, аминогруппу, -NН(С1-С6-алкил), -N(С1-С6-алкил)(C1-С6-алкил), -(С0-С6-алкил)-С(O)N(R9)-гетероциклоалкил, -O-гетероциклоалкил, -C1-C6(O)N(R9)-гетероарил, либо гетероарил, где гетероциклоалкильные группы необязательно замещены 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, C1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, -СO2Н, СF3, либо ОСF3,
гетероарильная группа необязательно замещена 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, C1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, -CO2H, СF3, либо ОСF3;
R9 при каждом появлении независимо представляет собой Н или C1-C4-алкил; либо
R11 означает -O-гетероциклоалкил, где гетероциклоалкил необязательно замещен 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, C1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, -CO2H, СF3, либо ОСF3.
R1 - галоген;
R2 - аминогруппа, NН(С1-С4-алкил) либо N С1-С4-алкил)(С1-С4-алкил);
R3 - ОН либо С1-С4-алкокси;
R4 - Н или метил;
R11 - ОН, С1-С4-алкокси или С1-С2-алкокси-С1-С3-алкоксигруппа, где С1-С4-алкокси необязательно замещен аминогруппой, группами -NH(C1-C6-алкил),
-N(С1-С6-алкил) (C1-С6-алкил), аза-бициклооктилом, аза-бициклононилом, аза-бициклодецилом, в которых аза-азот может быть замещен метилом или этилом; пирролидинил, пиперидинил, морфолинил, пиридил или -(С0-С6алкил)-С(O)NН-пирид-4-ил.

и их фармацевтически приемлемые соли, в которых связи 3 и 4 находятся в цис-положениях относительно друг друга;
R1 - галоген;
R2 - аминогруппа, NH (С1-С4-алкил) либо N(С1-С4-алкил)(С1-С4-алкил);
R3 - ОН либо С1-С4-алкокси;
R4 - Н или метил; и
R9 при каждом появлении независимо представляет собой Н или С1-C4алкил;
R11 представляет собой C1-С6-алкил, ОН, либо
R11 представляет собой C1-С6-алкокси, необязательно замещенный 1 или 2 группами, независимо представляющими С1-С4-алкокси, аминогруппу, -NH(C1-С6-алкил), -N(C1-С6-алкил) (C1-С6-алкил), - (С0-С6-алкил)-С(O)N(R9)-гетероциклоалкил, -O-гетероциклоалкил, -C1-C6(O)N(R9)-гетероарил, либо гетероарил, где
гетероциклоалкильные группы необязательно замещены 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, C1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, - СO2Н, СF3, либо ОСF3, гетероарильная группа необязательно замещена 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, C1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, -СO2Н, СF3, либо ОСF3;
R9 при каждом появлении независимо представляет собой Н или С1-С4-алкил;
R11 означает -O-гетероциклоалкил, где гетероциклоалкил необязательно замещен 1, 2 или 3 группами, которые независимо представляют собой галоген, C1-С6-алкил, C1-С6-алкокси, гидрокси, гидрокси-С1-С6-алкил, C1-С6-алкоксикарбонил, -СO2Н, СF3, либо ОСF3;
R15 представляет собой Н, C1-С6-алкил, C1-С6-алкокси, галоген, C1-С6-галоалкил, C1-С6-галоалкокси, гидроксил, гидрокси-С1-С4-алкил, амино, -NН(С)-С6-алкил), NH(C1-С6-алкил)(C1-С6-алкил) или метилсульфон, С0-С6-сульфонамид, NO2, a
R16 представляет собой Н или -О-(С0-С6-алкил) -С(O)R11.
где R1 - галоген;
R3 - аминогруппа, NH(С1-С4-алкил) либо N(С1-С4-алкил) (С1-С4-алкил);
R3 - ОН либо С1-С5-алкокси;
R4 - Н или метил; и
R9- Н или метил;
R11 - ОН, С1-С4-алкокси или С1-С2-алкокси-С1-С3-алкоксигруппа, где C1-C4-алкокси необязательно замещен аминогруппой, группами
-NН(C1-С6-алкил), -N(C1-С6-алкил)(C1-С6-алкил), аза-бициклооктилом, аза-бициклононилом, аза-бициклодецилом, в которых аза-азот может быть замещен метилом или этилом;
пирролидинил, пиперидинил, морфолинил, пиридил или
-(С0-С6алкил)-С(O)NН-пирид-4-ил;
R15 представляет собой Н, C1-С6-алкил, C1-С6-алкокси, галоген, C1-С6-галоалкил, C1-С6-галоалкокси, гидроксил, гидрокси-С1-С4-алкил, амино, -NH(C1-C6-алкил), -N(C1-С6-алкил) (C1-С6-алкил), метилсульфон, С0-С6-сульфонамид, или NO2, а
R16 представляет собой Н или -O-(С0-С6-алкил)-С(O)R11.
где R1 представляет собой хлор.
где R2 представляет собой аминогруппу.
где R3 представляет собой метокси.
где R4 представляет собой Н.



(3S)-1-азабицикло[2.2.2]окт-3-ил-6-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}гексаноат;
(3S)-1-азабицикло[2.2.2]окт-3-ил-6-{(3R,4S)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3 -метоксипиперидин-1-ил} гексаноат;
(3R)-1-азабицикло[2.2.2]окт-3-ил-6-{(3R,4S)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил} гексаноат;
8-метил-8-азабицикло[3.2.1]окт-3-ил-6-{(3S,4R}-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил} гексаноат;
(R)-хинуклидин-3-ил-6-((3S,4R)-4-(4-амино-5-хлор-2-метоксибензамидо)-3-метоксипиридин-1-ил)гексаноат.
метил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
метил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
метил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
изопропил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-метоксиэтил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-
3-метоксипиперидин-1-ил}ацетил) амино]бензоат;
2-пирролидин-1-ил-этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
1-метилпиперидин-4-ил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-пиридин-2-ил-этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-(диметиламино)этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
1-метилпиперидин-3-ил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-морфолин-4-ил-этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
1,4-диметилпиперидин-4-ил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
2-оксо-2-(пиперидин-4-ил-амино)этил-4-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)амино]бензоат;
(3R)-1-азабицикло[2.2.2]окт-3-ил-4-{[(2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]карбонил}бензоат.
1-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил} ацетил)пиперидин-4-карбоновая кислота;
метил-1-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил} ацетил)пиперидин-4-карбоксилат;
этил-1-[({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]карбонил}бензоат;
2-метоксиэтил-2-({(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}ацетил)пиперидин-4-карбоксилат.
4-{[2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)метил)амино]метил} бензойная кислота;
метил-4-{[2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)(метил)амино]метил}бензоат;
метил-4-{[2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]метил}бензоат;
изопропил-4-{[2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]метил}бензоат;
дигидрохлорид этил-4-{[(2-{(3S,4R)-4-[(4-амино-5-хлор-2-метоксибензоил)амино]-3-метоксипиперидин-1-ил}этил)амино]метил}бензоата.

Комментарии