Триазиновые, пиримидиновые и пиридиновые аналоги и их применение в качестве терапевтических агентов и диагностических проб - RU2537945C2
Код документа: RU2537945C2
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым терапевтическим агентам и диагностическим пробам, включая их фармацевтически приемлемые соли, пролекарства и метаболиты, которые подходят для модулирования активности белка или фермента, для модулирования клеточной активности, такой как сигнальная трансдукция, пролиферация, дифференцировка, запрограммированная гибель клеток, миграция и секреция цитокина. Более конкретно, в изобретении предложены соединения, которые ингибируют, регулируют, обеспечивают детектирование и/или модулируют активность киназы, в частности, фосфоинозитид-3-киназы (PI3K), мишени рапамицина у млекопитающих (mTOR), соединения, ингибирующие ДНК-ПК и АТМ-киназу, их фармацевтически приемлемые соли и пролекарства; композиции указанных новых соединений, как взятых в отдельности, так и в комбинации с по меньшей мере одним дополнительным терапевтическим агентом, с фармацевтически приемлемым носителем; и применения указанных новых соединений, как взятых в отдельности, так и в комбинации с по меньшей мере одним дополнительным терапевтическим агентом, для профилактики или лечения ряда заболеваний, в частности, заболеваний, характеризующихся патологической активностью серин/треонин-киназ, рецепторных тирозинкиназ и липидных киназ. Изобретение также относится к способам применения соединений для in vitro, in situ u in vivo диагностики, разработки исследований или лечения клеток млекопитающих или родственных патологических состояний.
УРОВЕНЬ ТЕХНИКИ
Протеинкиназы участвуют в передаче сигналов, контролирующих активацию, рост, дифференцировку, выживание и миграцию клеток в ответ на действие внеклеточных медиаторов или раздражителей, включая факторы роста, цитокины или хемокины. В целом, указанные киназы подразделяют на две группы: киназы, которые предпочтительно фосфорилируют тирозиновые остатки, и киназы, которые предпочтительно фосфорилируют сериновые и/или треониновые остатки. Тирозинкиназы включают рецепторы мембранного фактора роста, например, рецептор эпидермального фактора роста (EGFR), и цитозольные нерецепторные киназы, включая киназы семейства Src, киназы семейства Syk и киназы семейства Тес.
Нежелательно высокая активность протеинкиназы играет роль во многих заболеваниях, включая рак, нарушения обмена веществ, иммунологические заболевания и воспалительные нарушения. Указанные заболевания могут быть вызваны непосредственно или косвенно за счет нарушения механизмов контроля вследствие мутации, избыточной экспрессии или нежелательной активации фермента.
Протеинтирозинкиназы - как рецепторные тирозинкиназы, так и нерецепторные киназы - имеют большое значение для активации и пролиферации клеток иммунной системы. В числе поддающихся наиболее раннему обнаружению явлений при активации иммунорецептора в мастоцитах, Т-клетках и В-клетках, находится стимулирование нерецепторных тирозинкиназ.
Ранее фосфоинозитид-3-киназы (PI3K) были идентифицированы как липидкиназы, ассоциированные с вирусными онкогенами [Whitman et al., Nature 315:239-242 (1985), Sugimoto et al., Proc. Natl. Acad. Sci. 81:2117-2121 (1984); Mascara et al., Proc. Natl. Acad. Sci. 81:2728-2732 (1984)], а в последние 20 лет были получены дополнительные доказательства взаимосвязи между раковыми заболеваниями и PI3KCully et al., Nat. Rev., Cancer 6:184-192 (2006); Wimann et al., Curr. Opin. Cell Biol. 17:141-149 (2005); Vivanco et al., Nat. Rev., Cancer 2:489-501 (2002). С того времени считается, что PI3K модулируют широкий диапазон клеточной активности и играют важную роль в контроле роста и метаболизма. Путь маркировки PI3K у генетически модифицированных мышей и исследования наследственных заболеваний у людей, таких как синдром Каудена, туберозный склероз, атаксия-телеангиэктазия, Х-сцепленная миотубулярная миопатия и нейропатия Шарко-Мари-Тус, предоставили дополнительную информацию о клеточной и системной роли фосфоинозитидной сигнальной системы. Нарушение регуляции уровня фосфоинозитидов и, в частности, продуктов класса I PI3K, Ptdlns (3,4,5)P3, играет роль в патогенезе рака, хронических воспалительных, аллергических заболеваний, нарушений обмена веществ, диабета и проблем с сердечнососудистой системой.
PI3K представляют собой семейство ферментов, которые осуществляют фосфорилирование по положению 3'-ОН инозитольного кольца фосфоинозитидов. PI3K разделяют на три класса на основании структурных особенностей и специфичности в отношении липидного субстрата in vitro [Marone et al., Biochimica et Biophysica Acta 1784:159-185 (2008)]. PI3K I класса образуют гетеродимеры, которые состоят из одного из четырех тесно связанных каталитических субъединиц ~110 кДа и ассоциированной регуляторной субъединицы, относящейся к двум различным семействам. In vitro они способны превращать PtdIns в PtdIns-3-P, PtdIns-4-P в PtdIns(3,4)P2 и PtdIns(4,5)P2 в PtdIns(3,4,5)P3, но субстрат in vivo представляет собой PtdIns(4,5)P2 [Cantley et al., Science 296:1655-1657 (2002)]. PI3K I класса активируются при помощи широкого спектра рецепторов клеточной поверхности, включающих рецепторы фактора роста, а также рецепторы, связанные с G-белками.
PI3K II класса способны фосфорилировать PtdIns и PtdIns-4-P in vitro, но до сих пор соответствующие субстраты in vivo являются предметом исследований. Указанный класс крупных (170-200 кДа) ферментов содержит три представителя, характеризуемых С-терминальным доменом гомологии С2. В настоящее время для PI3K II класса молекулы-адаптеры не идентифицированы. PI3K III класса способны фосфорилировать исключительно PtdIns и вырабатывать, таким образом только PtdIns-3-P. Единственный представитель указанного класса представляет собой Vps34, прототипом которого является S. cerevisiae Vps34p (вакуолярный белок, сортирующий мутантные белки 34), который, как было показано, играет важную роль в миграции вновь синтезированных белков из аппарата Гольджи в вакуоль дрожжевых клеток, эквивалент лизосом млекопитающих в органеллах [Schu et al., Science 260:88-91 (1993)].
Фосфоинозитид-4-киназы (PI4K) осуществляют фосфорование по положению 4'-ОН инозитольного кольца PtdIns и вырабатывают, таким образом, PtdIns-4-P. Указанный липид затем может быть дополнительно фосфорилирован при помощи PtdIns-4-P 5-киназ для выработки PtdIns(4,5)P2, который представляет собой главный источник фосфолипазы С и сигнала PI3K в плазматической мембране. Известны четыре изоформы PI4K: P14KIIα и β и P14KIIIα и β. PI4KIII являются наиболее тесно связанными с PI3K.
Класс PI3K-связанных белков, называемый PI3K IV класса, состоит из высокомолекулярных ферментов с каталитическим ядром, аналогичным PI3K и PI4K, и включает мишень рапамицина (mTOR, также называемую FRAP), ДНК-зависимую протеинкиназу (ДНК-ПК), мутировавший генный продукт атаксии-телангиэктазии (ATM), атаксию, связанную с телеангиэкстазией (ATR), SMG-1 и трансформационный/транскрипционный ассоциированный с доменом белок (TRRAP). Первые пять представителей являются активными белковыми серин-треонинкиназами, которые участвуют в контроле роста клеток и контроле генома/транскриптома [Marone et al., Biochimica et Biophysica Acta 1784:159-185 (2008)]. ДНК-ПК, ATM, ATR и SMG-1 участвуют в ответе на повреждение ДНК. Единственной активной киназой, не участвующей в повреждении ДНК, является mTOR, которая регулируется факторами роста и доступностью питательных веществ и координирует синтез белка, рост и пролиферацию клеток. Мишень рапамицина (mTOR) образует комплекс 1 и интегрирует сигнал фактора роста (посредством PI3K7PKB и каскад Ras/MAPK), энергетический статус (LKB1 и АМРК) и детектирование питательных веществ. TOR позитивно регулируется PKB/Akt, которая фосфорилирует негативный регулятор TSC2 в комплексе туберозного склероза (TSC), что приводит к активации GТРазы Rheb и mTOR [Marone et al., Biochimica et Biophysica Acta 1784:159-185 (2008)]. В то же время, mTOR стимулирует трансляцию рибосомных белков и, следовательно, биогенез рибосом посредством активации p70S6K[Wullschleger et al., Cell 124:471 (2006)]. Рапамицин и его производные RAD001 и CCI-779 связываются с FKBP12 и очень селективно блокируют активность комплекса mTOR 1 (mTORC1). С применением рапамицина и его производных проводили множество клинических испытаний, в основном на пациентах с опухолью, характеризующейся усиленной передачей сигнала PI3K и гиперактивной mTOR. Многообещающие результаты были получены для лимфомы из клеток зоны мантии, рака эндометрия и почечно-клеточной карциномы [Guertin et al., Cancer Cell 12:9 (2007)]. Рапамицин и его производные сохраняют анти-ангиогенную активность, так как они нейтрализуют действие VEGF [Guba et al., Nat. Med. 8:128 (2002)], что открывает возможность для лечения, комбинированного с традиционной химиотерапией [Beuvink et al.), Cell 120:747 (2005)].
Путь PI3K представляет собой ключевой каскад трансдукции сигнала, контролирующий регуляцию роста, пролиферации, выживания клеток, а также миграцию клеток. PI3K активируются большим количеством различных стимулов, включающих факторы роста, воспалительные медиаторы, гормоны, нейротрансмиттеры и иммуноглобулины и антигены [Wimann et al., Trends Pharmacol. Sci. 24:366-376 (2003)]. Изоформы PI3K 1 класса: PI3Kα, β и δ - связываются с одной из р85/р55/р50 регуляторных субъединиц, которые содержат два SH2 домена, которые связываются с высокой аффинностью с фосфорилированными мотивами Tyr-X-X-Met. Указанные мотивы присутствуют в активированных рецепторах факторов роста, их субстратах и в ряде белков-адаптеров. В соответствии с представленным выше описанием, активация сигнального каскада PI3K/PKB обладает положительным действием на рост, выживание и пролиферацию клеток. Конститутивная позитивная регуляция сигнала PI3K может обладать разрушающим действием на клетки, приводя к неконтролируемой пролиферации, усиленной миграции и росту, независимому от адгезии. Указанные явления благоприятствуют не только образованию злокачественных опухолей, но также развитию воспалительных и аутоиммунных заболеваний.
Путь «PI3 киназа/Akt/PTEN» является привлекательной мишенью для разработки противораковых лекарственных средств, так как можно ожидать, что указанные агенты будут ингибировать пролиферацию, обращать подавление апоптоза и подавлять резистентность раковых клеток к цитокиновым агентам. Ингибиторы PI3 киназы представлены в литературе [см., в частности, Marone et al., Biochimica et Biophysica Acta 1784:159-185 (2008), Yaguchi et al. (2006), Jour. Of the Nat. Cancer Inst. 98(8):545-556; US 6770641; US 6653320; US 6403588; US 6703414; WO 9715658; WO 2006046031; WO 2006046035; WO 2006046040; WO 2007042806; WO 2007042810; WO 2004017950; US2004092561; WO 2004007491; WO 2004006916; WO 2003037886; US2003149074; WO 2003035618; WO 2003034997; WO 2007084786; WO 2007095588; WO 2008098058; US 2003158212; EP 1417976; US 2004053946; JP 2001247477; JP 08175990; JP 08176070]. Производные 1,3,5-триазина и пиримидина в качестве фармацевтических средств были получены в связи с их противораковой, противовоспалительной, анальгетической и антиспазматической активностью. В частности, хорошо известен гексаметилмеламин или алтретамин (ГММ или N2,N2,N4,N4,N6,N6-гексаметил-1,3,5-триазин-2,4,6-триамип), который разрабатывали в качестве аналога противоопухолевого агента триэтиленмеламина (ТЭМ); ГММ выступает в качестве пролекарства гидроксиметилпентаметилмеламина (ГМПММ: метаболически активная форма ГММ) [Johnson et al., Cancer, 42:2157-2161 (1978)]. ГММ представлен на рынке в Европе при показаниях для лечения рака яичников и мелкоклеточного рака легких.
Известны некоторые соединения триазина, обладающие активностью, ингибирующей PI3 киназу, и ингибирующие рост раковых клеток [WO 02088112 (ЕР1389617), «HETEROCYCLIC COMPOUNDS AND ANTITUMOR AGENT CONTAINING THE SAME AS ACTIVE INGREDIENT», Kawashima et al., Дата подачи заявки: 26.04.2002; WO 05095389 (ЕР1741714). «HETEROCYCLIC COMPOUND AND ANTI-MALIGNANT-TUMOR AGENT CONTAINING THE SAME AS ACTIVE INGREDIENT», Kawashima et al., Дата подачи заявки: 30.03.2005; WO 06095906 (ЕР1864665), «IMMUNOSUPPRESSIVE AGENT AND ANTI-TUMOR AGENT COMPRISING HETEROCYCLIC COMPOUND AS ACTIVE INGREDIENTS», Haruta et al., Дата подачи заявки: 11.03.2005; WO 09905138 (ЕР1020462), HETEROCYCLIC COMPOUNDS AND ANTITUMOR AGENT CONTAINING THE SAME AS ACTIVE INGREDIENT, Kawashima et al., Дата подачи заявки: 24.07.1998]. Триазиновое соединение ZSTK474, разработанное в исследовательских лабораториях Zenyaku Kogyo, представляет собой первое, вводимое перорально, триазиновое соединение, обладающее высокой активностью против PI3K, которое проявляло сильную противораковую активность против ксенотрансплантатов человеческого рака у мышей без проявлений критической токсичности [Yaguchi et al., Journal of The National Cancer Institute, 98:545-556, (2006)]. ZSTK474 представляет собой конкурирующий с АТР ингибитор изоформ фосфатидилинозитол 3-киназы I класса [Kong et al., Cancer Sci, 98:1638-1642 (2007)].
Известны некоторые пиримидиновые соединения, связывающие р110 альфа, обладающие активностью, ингибирующей PI3 киназу, и ингибирующие рост раковых клеток (Интеллектуальная собственность компании AstroZeneca: WO 07066103, WO 07080382, WO 08023159, WO 08023180, WO 08032027, WO 08032033, WO 08032036, WO 08032041, WO 08032072, WO 08032077, WO 08032086, WO 08032089, WO 08032091; Интеллектуальная собственность компании Genentech/Piramed/Roche: US2007009880, WO 07127183, WO 08073785, WO 07042810, WO 07122410, WO 07127175, WO 07129161, WO 08070740, WO 2006046031, WO 2006046040, WO 2007042806, WO 2007122410; Интеллектуальная собственность компании Novartis: WO 07084786, WO 08098058).
Для увеличения спектра раковых заболеваний, которые можно лечить указанными соединениями, и увеличения противораковой активности указанных соединений, активных против PI3K и/или mTOR, авторы настоящего изобретения провели углубленные исследования производных на основе триазина, пиримидина и пиридина и получили, таким образом, новые гетероциклические соединения, представленные формулой (I) и формулами от (Ia) до (Ii), которые проявляют сильную биологическую активность против липидных киназ.
По сравнению с ингибиторами PI3K, описанными Zenyaku Kogyo (WO 02088112 (ЕР 1389617), WO 2005095389 (ЕР 1741714), WO 2006095906 (ЕР 1864665), WO 09905138 (ЕР 1020462)], AstraZeneca (WO 07066103, WO 07080382, WO 08023159, WO 08023180, WO 08032027, WO 08032033, WO 08032036, WO 08032041, WO 08032072, WO 08032077, WO 08032086, WO 08032089, WO 08032091), Piramed/Genentech (US 2007009880, WO 07127183, WO 08073785, WO 07042810, WO 07122410, WO 07127175, WO 08070740, WO 2006046031, WO 2006046040, WO 2007122410), Yamanouchi/Piramed (WO 01083456) и Novartis (WO 07084786, WO 08098058), ингибиторы согласно настоящему изобретению отличаются включением атома N в основное гетероциклическое кольцо, что обеспечивает лучшую биологическую активность относительно целевого фермента, и/или включением нового молекулярного фрагмента, делающего молекулу в целом более активной или более селективной к соответствующему ферменту.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится в целом к новым производным на основе триазина, пиримидина и пиридина и их применению в качестве терапевтических агентов и диагностических проб.
Изобретение также относится к ингибиторам киназы и диагностическим пробам для определения киназы.
Изобретение также относится к соединениям, ингибирующим фосфоинозитид 3-киназу (PI3K) и мишень рапамицина у млекопитающих (mTOR), с противораковой активностью, их фармацевтическим составам указанных соединений, которые потенциально являются применимыми для лечения заболеваний, состояний и/или нарушений, модулированных PI3K и mTOR киназами. Соединения могут ингибировать рост опухоли у млекопитающих и могут быть применимыми для лечения пациентов, страдающих от рака.
Изобретение также относится к способам применения соединений для диагностики т vitro, in situ и in vivo или лечения или клеток млекопитающих, организмов или связанных патологических состояний.
Конкретно, в одном из аспектов настоящего изобретения предложены соединения формулы (I).
Более конкретно, в одном из аспектов настоящего изобретения предложены триазиновые соединения формул от (Ia) до (Id), пиримидиновые соединения формул от (If) до (Ii) и пиридиновые соединения формул (Ie) и от (If) до (Ii):










и их стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая триазиновое или пиримидиновое или пиридиновое соединение формулы (I) или одной из формул от (Ia) до (Ii) и фармацевтически приемлемый носитель. Фармацевтическая композиция может дополнительно содержать один или более дополнительный терапевтический агент, выбранный из антипролиферативных агентов, противовоспалительных агентов, иммуномодулирующих агентов, нейротропных факторов, агентов для лечения заболеваний крови, агентов для лечения диабета и агентов для лечения иммунодефицитных нарушений.
В другом аспекте настоящего изобретения предложены способы ингибирования активности PI3K киназы, включающие взаимодействие PI3K киназы с эффективным для ингибирования количеством соединения формулы (I) или одной из формул от (Ia) до (Ii) или его стереоизомера, геометрического изомера, таутомера, сольвата, метаболита, N-оксидного производного или фармацевтически приемлемой соли или пролекарства.
В другом аспекте настоящего изобретения предложены способы профилактики или лечения заболевания или нарушения, модулированных PI3 киназами, включающий введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения формулы (I) или одной из формул от (Ia) до (Ii) или его стереоизомера, геометрического изомера, таутомера, сольвата, метаболита, N-оксидного производного или фармацевтически приемлемой соли или пролекарства. Примеры указанных заболеваний, состояний или нарушений включают, но не ограничиваются только ими, гиперпролиферативные нарушения (например, рак, включающий меланому и другие раковые заболевания кожи), нейродегенерацию, гипертрофию сердца, боли, мигрени, нейротравматические заболевания, инсульт, диабет, гепатомегалию, сердечнососудистые заболевания, болезнь Альцгеймера, кистозный фиброз, аутоиммунные заболевания, атеросклероз, рестеноз, псориаз, аллергические заболевания, воспаление, неврологические нарушения, заболевания, связанные с гормонами, состояния, связанные с трансплантацией органов, иммунодефицитные нарушения, деструктивные поражения костей, гиперпролиферативные нарушения, инфекционные заболевания, состояния, связанные с гибелью клеток, агрегацию тромбоцитов, вызванную тромбином, хроническую миелогенную лейкемию (ХМЛ), заболевание печени, патологические иммунные состояния, включающие активацию Т-клеток, и нарушения ЦНС.
В другом аспекте настоящего изобретения предложены способы профилактики или лечения гиперпролиферативного нарушения, включающие введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения формулы (I) или одной из формул от (Ia) до (Ii) или его стереоизомера, геометрического изомера, таутомера, сольвата, метаболита, N-оксидного производного или фармацевтически приемлемой соли или пролекарства, индивидуально или в комбинации с одним или более дополнительным соединением, обладающим антигиперпролиферативными свойствами.
В другом аспекте настоящего изобретения предложен способ применения соединения согласно настоящему изобретению для лечения заболевания или состояния, модулированных PI3 киназой и/или mTOR, у млекопитающего.
Дополнительный аспект настоящего изобретения включает применение соединения согласно настоящему изобретению в получении лекарственного средства для лечения или профилактики заболевания или состояния, модулированного PI3 киназой, у млекопитающего.
Другой аспект настоящего изобретения включает наборы, содержащие соединение формулы (I) или одной из формул от (Ia) до (Ii) или его стереоизомер, геометрический изомер, таутомер, сольват, метаболит, N-оксидное производное или фармацевтически приемлемую соль или пролекарство; контейнер и, возможно инструкцию по применению или вкладыш с показаниями для лечения.
Другой аспект настоящего изобретения включает способы получения, способы выделения и способы очистки соединений формулы (I) или одной из формул от (Ia) до (Ii).
Другой аспект настоящего изобретения включает новые промежуточные соединения, применимые для получения соединений формулы (I) или одной из формул от (Ia) до (ii).
Дополнительные преимущества и новые особенности настоящего изобретения предложены, в частности, в следующем описании, и, в частности, станут понятными специалистам в данной области техники после рассмотрения следующего описания или могут быть изучены при практическом исследовании настоящего изобретения. Преимущества настоящего изобретения могут быть реализованы и получены при помощи средств, комбинаций, композиций и способов, конкретно отмеченных в прилагаемой формуле изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ТИПИЧНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
Обратимся к подробному описанию конкретных вариантов реализации настоящего изобретения, примеры которых проиллюстрированы в прилагаемых структурах или формулах. При том, что изобретение описывают совместно с пронумерованными вариантами реализации, следует понимать, что они приведены, как не ограничивающие изобретение в рамках указанных вариантов реализации. Напротив, изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в рамки настоящего изобретения, определенного формулой изобретения.
Специалисту в данной области техники станут понятны способы и вещества, аналогичные или эквивалентные, описанным в настоящей заявке, которые можно применять при практическом осуществлении настоящего изобретения. Настоящее изобретение никаким образом не ограничено способами и веществами, описанными в настоящей заявке.
В случае если одна или более ссылка на публикацию, патенты и аналогичные материалы, отличается или противоречит настоящей заявке в отношении, включающем, но не ограничивающимся, конкретными терминами, применением терминов, описанных техник и т.д., следует принимать во внимание исключительно содержание настоящей заявки.
ОПРЕДЕЛЕНИЯ
Термин «алкил», используемый в настоящей заявке, относится к насыщенному линейному или разветвленному одновалентному углеводородному радикалу, содержащему от одного до двенадцати атомов углерода (С1-С12), где алкильный радикал может быть возможно независимо замещен одним или более заместителем, описанным ниже. В другом варианте реализации алкильный радикал содержит от одного до восьми атомов углерода (С1-С8), или от одного до шести атомов углерода (С1-С6). Примеры алкильных групп включают, но не ограничиваются только ими, метил (Me, -СН3), этил (Et, -СН2СН3), 1-пропил (н-Pr, н-пропил, -СН2СН2СН3), 2-пропил (и-Pr, изопропил, -СН(СН3)2), 1-бутил (н-Bu, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (и-Bu, изобутил, -CH2CH(СН3)2), 2-бутил (втор-Bu, втор-бутил, -СН(СН3)СН2СН3), 2-метил-2-пропил (трет-Bu, трет-бутил, -С(СН3)3), 1-пентил (н-пентил, -СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-2-пентил (-СН(СН3)(СН2СН3)2), 2-метил-3-пептил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-димстил-2-бутил (-СН(СН3)С(СН3)3, 1-гептил, 1-октил, и т.д.
Термин «алкенил» относится к линейному или разветвленному одновалентному углеводородному радикалу, содержащему от двух до восьми атомов углерода (С2-С8), содержащему по меньшей мере один ненасыщенный участок, т.е. углерод-углеродную sp2 двойную связь, где алкенильный радикал может быть возможно замещен одним или более заместителем, описанным в настоящей заявке, и включает радикалы, обладающие «цис-» и «транс-» ориентациями, или как альтернатива, «Е» и «Z» ориентациями. Примеры включают, но не ограничиваются только ими, этиленил или винил (-СН=СН2), аллил (-СН2СН=СН2) и т.д.
Термин «алкинил» относится к линейному или разветвленному одновалентному углеводородному радикалу, содержащему от двух до восьми атомов углерода (С2-С8), содержащему по меньшей мере одни ненасыщенный участок, т.е., углерод-углеродную sp тройную связь, где алкинильный радикал может быть возможно независимо замещен одним или более заместителем, описанным в настоящей заявке. Примеры включают, но не ограничиваются только ими, этинил (-С≡СН), пропинил (пропаргил, -СН2С≡СН) и т.д. Термин «галоген» (или гало-) предпочтительно представляет собой хлор или фтор, но также может представлять собой бром или йод.
Термины «карбоцикл», «карбоциклил», «карбоциклическое кольцо» и «циклоалкил» относятся к одновалентному, неароматическому, насыщенному или частично ненасыщенному кольцу, содержащему от 3 до 12 атомов углерода (С3-С12) в составе моноциклического кольца или от 7 до 12 атомов углерода в составе бициклического кольца. Бициклические карбоциклы, содержащие от 7 до 12 атомов, могут быть сгруппированы, например, в виде бицикло [4,5], [5,5], [5,6] или [6,6] систем, а бициклические карбоциклы, содержащие 9 или 10 атомов в кольце, могут быть сгруппированы в виде бицикло [5,6] или [6,6] систем или мостиковых систем, таких как бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло [3.2.2] нонан. Примеры моноциклических карбоциклов включают, но не ограничиваются только ими, циклопропил, циклобутил, циклопентил, 1-циклопен-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил и т.д.
«Арил» означает одновалентный ароматический углеводородный радикал, содержащий 6-20 атомов углерода (С6-С20), полученный при удалении одного атома водорода от одного атома углерода исходной ароматической системы. Некоторые арильные группы представлены в типичных структурах, как «Ar». Арил включает бициклические радикалы, содержащие ароматическое кольцо, конденсированное с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим кольцом. Типичные арильные группы включают, но не ограничиваются только ими, радикалы, полученные из бензола (фенил), замещенных бензолов, нафталина, антрацена, бифенил, инденил, инданил, 1,2-дигидронафталин, 1,2,3,4-тетрагидронафтил и т.д. Арильные группы являются возможно независимо замещенными одним или более заместителем, описанным в настоящей заявке.
Термины «гетероцикл», «гетероциклил» и «гетероциклическое кольцо», которые в настоящей заявке используют взаимозаменяемо, относятся к насыщенному или частично ненасыщенному (т.е, содержащему одну или более двойную и/или тройную связь внутри кольца) карбоциклическому радикалу, содержащему от 3 до 20 атомов в кольце, в котором по меньшей мере один атом кольца представляет собой гетероатом, выбранный из азота, кислорода, фосфора и серы, остальные атомы кольца представляют собой атомы С, где один или более атом кольца возможно независимо замещен одним или более заместителем, описанным далее. Гетероцикл может представлять собой моноцикл, содержащий от 3 до 7 членов в кольце (от 2 до 6 атомов углерода и от 1 до 4 гетероатомов, выбранных из N, О, Р и S) или бицикл, содержащий от 7 до 10 членов в кольце (от 4 до 9 атомов углерода и от 1 до 6 гетероатомов, выбранных из N, О, Р и S), например: бицикло [4,5], [5,5], [5,6] или [6,6] систему. Гетероциклы, описанные в работе Лео А. Паке: «Principles of Modern Heterocyclic Chemistry» (W.A. Benjamin, New York, 1968), особенно в Разделах 1, 3, 4, 6, 7 и 9; «The Chemistry of Heterocyclic Compounds, A series of Monographs» (John Wiley & Sons, New York, от 1950 до настоящего времени), особенно в Разделах 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566. «Гетероциклил» также включает радикалы, в которых гетероциклические радикалы конденсированы с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим или гетероциклическим кольцом. Примеры гетероциклических колец включают, но не ограничиваются только ими, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепипил, тиазепинил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиснил, дигидрофуранил, пиразолидинилимидазолинил, имидазолинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 3Н-индолилхинолизинил и N-пиридил мочевину. Также в рамки настоящего определения включены спирогруппы. Примеры гетероциклической группы, в которой 2 углеродных атома кольца замещены оксо (=O) группами, представляют собой пиримидинонил и 1,1-диоксотиоморфолинил. Гетероциклические группы, описанные в настоящей заявке, являются возможно независимо замещенными одним или более заместителем, описанным в настоящей заявке.
Термин «гетероарил» относится к одновалентному ароматическому радикалу 5-, 6- или 7-членных колец и включает конденсированные системы колец (по меньшей мере одно из которых является ароматическим), состоящие из 5-20 атомов, содержащие один или более гетероатом, независимо выбранный из азота, кислорода и серы. Примеры гетероарильных групп представляют собой пиридинил (включая, например, 2-гидроксипиридинил), имидазолил, имидазопиридинил, пиримидинил (включая, например, 4-гидроксипиримидинил), пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксадиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, тетрагидроизохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофиенил, бензотиазолил, бензооксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Гетероарильные группы являются возможно независимо замещенными одним или более заместителем, описанным в настоящей заявке.
Гетероциклические или гетероарильные группы могут быть связаны с углеродом (связанными через атом углерода) или с азотом (связанными через атом азота), где связывание возможно. В качестве примера и не для ограничения, связанные через атом углерода гетероциклы или гетероарилы присоединены в положении 2, 3, 4, 5 или 6 пиридина, положении 3, 4, 5 или 6 пиридазина, положении 2, 4, 5 или 6 пиримидина, положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола, положении 3, 4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, положении 2, 3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или положении 1, 3, 4, 5, 6, 7 или 8 изохинолина.
В качестве примера и не для ограничения, связанные через атом азота гетероциклы и гетероарилы присоединены в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолипа, 3-имидазолипа, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, положении 2- изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или β-карболина.
Термин «моноциклический гетероарил» относится к пяти- или шестичленному незамещенному или замещенному моноциклическому гетероарильному радикалу, который содержит 1, 2, 3 или 4 гетероатома в кольце, независимо выбранных из N, О и S. Моноциклический гетероарил может быть присоединен в положении С-2 пиримидинового кольца в соответствии с формулами Ia-Ii по любому атому углерода (связанный через атом углерода) или азота (связанный через атом азота) моноциклической гетероарильной R3 группы. Моноциклические гетероарильные радикалы включают, но не ограничиваются только ими, 2-пиридил, 3-пиридил, 4-пиридил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-имидазолил, 4-имидазолил, 3-пиразолил, 4-пиразолил, 2-пирролил, 3-пирролил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 2-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 2-оксазолил. 4-оксазолил, 5-оксазолил, 2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил, 3-триазолил, 1-триазолил, 5-тетразолил, 1-тетразолил и 2-тетразолил. Моноциклический гетероарил является возможно независимо замещенным одним или более заместителем, описанным в настоящей заявке.
Термины «лечить» и «лечение» относятся к терапевтическому лечению и профилактическим или превентивным мерам, где целью является предотвращение или замедление (ослабление) нежелательного патологического изменения или нарушения, такого как развитие или распространение рака. Для задач настоящего изобретения благоприятные или желательные клинические результаты включают, но не ограничиваются только ими, уменьшение симптомов, снижение тяжести заболевания, стабильное (т.е., не ухудшающееся) состояние заболевания, задержка или замедление прогрессирования болезни, облегчение или ослабление состояние заболевания и ремиссия болезни (частичная или полная), детектируемые или недетектируемые. «Лечение» также может означать повышение выживаемости по сравнению с предполагаемой выживаемостью без получения лечения. Пациенты, нуждающиеся в лечении, включают пациентов, страдающих от болезненного состояния или нарушения, а также к пациентам, которые склонны к болезненному состоянию или нарушению, или пациентов, которым необходима профилактика болезненного состояния или нарушения.
Фраза «терапевтически эффективное количество» означает количество соединения согласно настоящему изобретению, которое (i) лечит или предотвращает конкретное заболевание, состояние или нарушение, (ii) уменьшает, облегчает или устраняет один или более симптом конкретного заболевания, состояния или нарушения или (iii) предотвращает или задерживает проявление одного или более симптома конкретного заболевания, состояния или нарушения, описанного в настоящей заявке. В случае рака, терапевтически эффективное количество лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли, ингибировать (т.е., замедлять до некоторой степени, а предпочтительно останавливать) проникновение раковых клеток в периферические органы, ингибировать (т.е., замедлять до некоторой степени, а предпочтительно останавливать) метастазы опухоли, ингибировать до некоторой степени рост опухоли и/или ослаблять до некоторой степени один или более симптом, вызванный раком. В зависимости от степени, в которой лекарственное средство может предотвращать рост и/или убивать существующие раковые клетки, лекарственное средство может быть цитостатическим и/или цитотоксическим. Эффективность раковой терапии можно измерить, например, при помощи определения времени до прогрессирования (ТТР) и/или определения скорости ответа (RR).
Термины «рак» и «раковый» относятся или описывают физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. «Опухоль» содержит одну или более раковую клетку. Примеры раковых заболеваний включают, но не ограничиваются только ими, карциному, лимфому, бластому, саркому и лейкемию или лимфолейкоз. Более конкретные примеры указанных раковых заболеваний включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких (НМРЛ), аденокарциному легких и плоскоклеточную карциному легких, рак брюшной полости, гепатоклеточный рак, рак желудка или ЖКТ, включающий рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карциному эндометрия или матки, рак слюнных желез, рак почек или ренальный рак, рак простаты, вульварный рак, рак щитовидной железы, карциному печени, карциному полового члена, а также рак головы и шеи.
«Химиотерапевтический агент» представляет собой химическое соединение, применимое для лечения рака. Примеры известных химиотерапевтических агентов включают трастузумаб, пертузумаб, эрлотиниб (TARCEVA®, Genetech/OSI Pharm.), бортезомиб (VELCADE®, Millennium Pharm.), фулвестрант (FASLODEX®, AstraZeneca), сунитиниб (SUTENT®, Pfizer/Sugen), летрозол (FEMARA®, Novartis), иматиниб мезилат (GLEEVEC®, Novartis), финасунат (VATALANIB®, Novartis), оксалиплатип (ELOXATIN®, Sanofi), 5-FU (5-фторурацил), лейковорип, рапамицин (сиролимус, RAPAMUNE®, Wyeth), лапатиниб (TYKERB®, GSK572016, Glaxo Smith Kline), лонафамиб (SCH 66336), сорафениб (NEXAVAR, Bayer Labs) и гефитиниб (IRESSA®, AstraZeneca), AG1478, алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилмеламин; ацетогенины; камптотецин (включая синтетический аналог топотекана);бриостатин; каллистатин; СС-1065 (включая его адозелесиновые, карзелесиновые и бизелисиновые синтетические аналоги); криптофицины; доластатин; дуокармицип (включая ситетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистиые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид мехлорэтаминоксида, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урамустин; нитромочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихемицин, конкретно калихемицин гаммаII и калихемицин омегаII; динемицин, включая динемицин А; бифосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарциностатина и связанные хромофоры хромопротеиновых энедииновых антибиотиков), аклациномицины, актипомицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазол-5-оксо-L-норлейцин, ADRIAMYCIN® (доксорубицин), морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и деоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофенольная кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; анти-метаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлуридип, эноцитабип, флоксуридин; андрогены, такие как калустерон, пропионат дроностанолопа, эпитиостанол, мепитиостан, тестолактон; анти-адренальные агенты, такие как аминоглутетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквоп; элфорнитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинии; майтанзиноиды, такие как тайтанзин и ансамитоцины; митогуазоп; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лосоксантрон; подофилиновая кислота; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс; разоксан; ризоксин; сизофиран; спирогермапий; тенуазоновая кислота; триазиквон; трихотецены; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид; таксоиды, например, TAXOL® (паклитаксел; Bristol-Myers Squibb), ABRAXANE™ (не содержащий кремофор), паночастичные составы паклитакссла. созданные с включением альбумина, и TAXOTERE® (доцетаксел, доксетаксел; Sanofi-Aventis); хлорамбуцил; GEMZAR® (гемцитабин); 6-тиогуанин; меркаптопурии; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; этопозид; ифосфамид; митоксантрон; винкристин; NAVELBINE® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин (XELODA®); ибандронат; СР-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДФМО); ретиноиды, такие как ретиноевая кислота; и фармацевтически приемлемые соли, кислоты и производные любых представленных выше соединений.
В определение «химиотерапевтического агента» также включают (i) противогормональные агенты, которые участвуют в регуляции или ипгибировании действия гормона на опухоли, например, анти-эстрогены и селективные модуляторы рецепторов (СМЭР), включая, например, тамоксифен (включая NOLVADEX®, цитрат тамоксифена), ралоксифен, дролоксифен и FARESTON® (цитрат торемифина); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продуцирование эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, MEGASE® (ацетат мегестрола), AROMASIN® (экземестан, Pfizer), форместатин, фадразол, RIVISOR® (ворозол), FEMARA® (летрозол, Novartis) и ARIMIDEX® (анастрозол, AstraZeneca); (iii) анти-андрогены, такие как флутамид, нилутамид; (iv) ингибиторы протеинкиназы; (v) ингибиторы липидкиназы; (vi) антисмысловыс олигонуклеотиды, особенно олигонуклеотиды, которые ингибируют экспрессию генов в сигнальных путях, происходящих при нарушенной пролиферации клеток, такие как, например, РКС-альфа, Rafl и H-Ras; (vii) рибозимы, такие как ингибиторы экспрессии VEGF (например, ANGIOZYME®) и ингибиторы экспрессии HER2; (viii) вакцины, такие как вакцины, применяемые в генной терапии, например, ALLOVECTIN®, LEUVECTIN® и VAXID®; PROLEUKIN® rIL-2, ингибитор топоизомеразы 1, такой как LURTOTECANE®; ABARELIX® rmRH; (ix) анти-ангиогенные агенты, такие как бевацизумаб (AVASTIN®, Genentech); и (х) фармацевтически приемлемые соли, кислоты и производные любых представленных выше соединений.
Термин «пролекарство», используемый в настоящей заявке, относится к предшественнику или производной форме соединения согласно настоящему изобретению, которые могут быть менее цитотоксическими к клеткам по сравнению с исходным соединением или лекарством, и которые способны ферментативно или гидролитически активироваться или превращаться в более активную исходную форму. пролекарства согласно настоящему изобретению включают, но не ограничиваются только ими, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, пролекарства, модифицированные D-аминокислотами, гликозилированпые пролекарства, β-лактамсодержащие пролекарства, возможно замещенные феноксиацетамидсодержащие пролекарства, 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примеры цитотоксических лекарственных средств, которые могут быть превращены в форму пролекарства для применения в настоящем изобретении, включают, но не ограничиваются только ими, соединения согласно настоящему изобретению и химиотерапевтические агенты, аналогичные описанным выше.
«Метаболит» представляет собой продукт, получаемый в результате метаболизма в организме конкретного соединения или его соли. Метаболиты соединения можно определить с применением стандартных техник, известных в данной области техники, а их активности можно определить с применением исследований, аналогичных описанным в настоящей заявке. Указанные продукты могут быть получены, например, в результате окисления, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации, ферментативного расщепления и т.д., вводимого соединения. Соответственно, изобретение включает метаболиты соединений согласно настоящему изобретению, включая соединения, получаемые в результате процесса, включающего взаимодействие соединения согласно настоящему изобретению с млекопитающим в течение времени, достаточного для получения его метаболического продукта.
«Липосома» представляет собой небольшую везикулу, состоящую из различных гипов липидов, фосфолипидов и/или поверхностно активных веществ, которые являются применимыми для доставки лекарственного средства (такого как ингибиторы PI3K и mTOR киназы, описанные в настоящей заявке, и, возможно, химиотерапевтический агент) млекопитающему. Компоненты липосомы, как правило, распределены в двухслойном образовании, аналогичном распределению липидов в биологических мембранах.
Термин «инструкция по применению» используют как ссылку на инструкции, обычно прилагаемые в упаковках терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях, касающихся применения указанных терапевтических продуктов.
Термин «хиральный» относится к молекулам, которые обладают тем свойством, что не совпадают с молекулой, которая является их зеркальным отображением, тогда как термин «ахиральный» относится к молекулам, которые совпадают с молекулой, которая является их зеркальным отражением.
Термин «стереоизомеры» относится к соединениям, которые обладают идентичным химическим составом, то отличаются распределением атомов и групп в пространстве.
«Диастереомер» относится к стереоизомеру, которые содержит два или более центра хиральности, молекулы которого не являются зеркальными отображениями друг друга. Диастереомеры обладают различными физическими свойствами, например, температурой плавления, температурой кипения, спектральными свойствами и реакционной способностью. Смеси диастереомеров можно разделять с применением аналитических процедур с высоким разрешением, таких как электрофорез и хроматография.
«Энантиомеры» относятся к двум стереоизомерам соединения, которые представляют собой несовпадающие зеркальные отображения друг друга.
Стереохимические определения и условные обозначения, используемые в настоящей заявке, как правило, взяты из работы S.P.Parker, Ed., McRaw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и работы Eliel E. и Wilen S. «Stereochemistry of Organic Compounds», John Wiley & Sons, Inc., New York, 1994. Соединения согласно настоящему изобретению могут содержать асимметрические или хиральные центры, и существовать, таким образом, в различных стереоизомерных формах. Понимают, что все стереоизомерные формы соединений согласно настоящему изобретению, включающие, но не ограничивающиеся только ими, диастерсомеры, энантиомерыи и атропоизомеры, а также их смеси, такие как рацемические смеси, образуют часть настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е., обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения префиксы D и L или R и S используют для описания абсолютной конфигурации молекулы относительно ее хирального(ых) центра(ов). Префиксы d и l или (+) и (-) применяют для обозначения знака вращения соединением плоско-поляризованного света, причем (-) или l обозначает, что соединение является левовращающим. Соединение с префиксов (+) или d является правовращающим. Для заданной химической структуры, указанные стереоизомеры являются одинаковыми за исключением того, что они являются зеркальными отображениями друг друга. Конкретный стереоизомер также может быть назван энантиомером, а смесь указанных изомеров часто называют энантиомерной смесью. 50:50 смесь энантиомеров называют рацемической смесью или рацематом.
Термин «таутомер» или «таутомерная форма» относятся к структурным изомерам с различными энергетическими состояниями, которые превращаются друг в друга, переходя через низкий энергетический барьер. Например, протонные таутомеры включают взаимные превращения за счет миграции протона, такие как кето-енольные и имин-енаминовые изомеризации.
Термин «фармацевтически приемлемая соль», используемый настоящей заявке, относится к фармацевтически приемлемой органической или неорганической соли соединения согласно настоящему изобретению. Типичные соли включают, но не ограничиваются только ими, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат «мезилат», этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат. Фармацевтически приемлемая соль может содержать вставку другой молекулы, такой как ацетат-ион, сукцинат-ион и другие противоионы. Противоион может представлять собой любую органическую или неорганическую группу, которая стабилизирует заряд исходного соединения. Кроме того, фармацевтически приемлемая соль может содержать более чем один заряженный атом в структуре. В случае, если частью фармацевтически приемлемой соли являются несколько заряженных атомов, соль может обладать несколькими противоионами. Таким образом, фармацевтически приемлемая соль может содержать один или более заряженный атом и/или один или более противоион.
В случае, если соединение согласно настоящему изобретению представляет собой основание, целевая фармацевтически приемлемая соль может быть получены любым подходящим способом, доступным в данной области техники, например, при помощи обработки свободного основания неорганической кислотой, такой как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, метансульфокислота, фосфорная кислота и т.д., или органической кислотой, такой как уксусная кислота, трифторуксусная кислота, малеиновая кислота, сукциновая кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, оксалиловая кислота, гликолиевая кислота, салициловая кислота, пиранозидная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксильная кислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфокислота, такая как п-толуолсульфокислота или этансульфокислота и т.д.
В случае, если соединение согласно настоящему изобретению представляет собой кислоту, целевая фармацевтически приемлемая соль может быть получена любым подходящим способом, например, при помощи обработки свободной кислоты неорганическим или органическим основанием, таким как амин, гидроксид щелочного металла или гидроксид щелочно-земельного металла и т.д. Иллюстративные примеры подходящих солей включают, но не ограничиваются только ими, органические соли, являющиеся производными аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин и неорганические соли, являющиеся производными натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
Термин «фармацевтически приемлемый» означает, что вещество или композиция должны быть совместимыми химически и/или токсикологически с другими ингредиентами, составляющими состав и/или млекопитающим, которое лечат указанным составом.
«Сольват» относится к ассоциату или комплексу одной или более молекулы растворителя и соединения согласно настоящему изобретению. Примеры растворителей, которые образуют сольваты, включают, но не ограничиваются только ими, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин. Термин «гидрат» относится к комплексу, в котором молекула растворителя представляет собой воду.
Термин «защитная группа» относится к заместителю, который, как правило, применяют для блокировки или защиты конкретной функции, при которой реакционно-способными остаются другие функциональные группы соединения. Например, «амино-защитная группа» представляет собой заместитель, присоединенный к аминогруппе, который блокирует или защищает аминофункцию соединения. Подходящие амино-защитные группы включают ацетил, трифторацетил, т-бутоксикарбонил (ВОС), бензилоксикарбонил и 9-флуоренилметиленоксикарбонил (Fmoc). Для подробного описания защитных групп и их применения см. работу T.W. Greene, Protective Groups I Organic Synthesis, John Wiley & Sons, New York, 1991.
Термины «соединение согласно настоящему изобретению» и «соединения согласно данному изобретению» и «соединения формулы (I) или одной из формул от (Ia) до (Ii)» включают соединения формулы (I) или одной из формул от (Ia) до (Ii) и их стереоизомерам, геометрическим изомерам, таутомерам, сольватам, метаболитам, N-оксидным производным и фармацевтически приемлемым солям и пролекарствам. Термин «млекопитающее» включает, но не ограничивается только ими, людей, мышей, крыс, морских свинок, обезьян, собак, кошек, лошадей, коров, свиней и овец.
АНАЛОГИ ТРИАЗИНА, ПИРИМИДИНА И ПИРИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ И ДИАГНОСТИЧЕСКИХ ПРОБ
В настоящем изобретении предложены триазиновые, пиримидиновые и пиридиновые соединения и их фармацевтические составы, которые являются применимыми в качестве терапевтических агентов и новых диагностических проб. Кроме того, указанные соединения потенциально являются применимыми для лечения заболеваний, состояний и/или нарушений, модулируемых протеинкиназами и липидкиназами. Более конкретно, в настоящем изобретении предложены соединения формулы I,

и его стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли, где:
Q=N, G=N, U=N (соединения формул от (Ia) до (Id) на основе триазина);
Q=C, G=C, U=N (соединения формулы (Ie) на основе пиридина);
Q=C, U=C, G=N (соединения формулы (Ie) на основе пиридина);
U=C, G=C, Q=N (соединения формулы (Ie) на основе пиридина);
Q=CRz, G=N, U=N (конденсированные соединения формул от (If) до (Ii) на основе пиримидина); или
Q=CRz, G=С, U=N (конденсированные соединения формул от (If) до (Ii) на основе пиридина);
где Rz выбран из группы, состоящей из:
(1) водорода, (2) циано, (3) галогена, (4) метила, (5) трифторметила, (6) сульфонамидо, (7) сульфона, (8) линкерного фрагмента (гидрофобных линкеров, гидрофильных линкеров (ПЭГилированных линкеров), отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительных реакций линкеров), (9) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционно-способные группы), (10) F, Cl, Br, I, -С(С1-С6-алкил)2NR10R11, -(CR14R15)tNR10R11, -C(R14R15)nNR12C(=Y)R10, -(CR14R15)nNR12S(O)2R10, -CH(OR10)R10, -(CR14R15)nOR10, -(CR14R15)nS(O)2R10, -(CR14R15)nS(O)2NR10R11, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -C(=Y)NR12OR10, -C(=O)NR12S(O)2R10, -C(=O)NR12(CR14R15)mNR10R11, -NO2, -NHR12, -NR12C(=Y)R11, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12S(O)2R10, -NR12SO2NR10R11, -S(O)2R10, -S(O)2NR10R11, -SC(=Y)R10, -SC(=Y)OR10, C1-C12 алкила, С2-С8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила и C1-C20 гетероарила; или С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила или C1-C20 гетероарила; где указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил являются возможно замещенными одной или более группой, независимо выбранной из F, Cl, Br, I, -CN, CF3, -NO2, оксо, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -(CR14R15)nNR10R11, -(CR14R15)nC(=Y)NR10R11, -(CR14R15)nRC(=Y)OR10, (CR14R15)nNR12SO2R10, -(CR14R15)nOR10, -(CR14R15)nR10, -(CR14R15)nSO2R10, -NR10R11, -NR12C(=Y)R10, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12SO2R10, =NR12, OR10, -OC(=Y)R10, -OC(=Y)OR10, -OC(=Y)NR10R11, -OS(O)2(OR10), -OP(=Y)(OR10)(OR11), -OP(OR10)(OR11), SR10, -S(O)R10, -S(O)2R10, -S(O)2NR10R11, -S(O)(OR10), -S(O)2(OR10), -SC(=Y)R10, -SC(=Y)OR10, -SC(=Y)NR10R11, возможно замещенного C1-C12 алкила, возможно замещенного C2-C8 алкенила, возможно замещенного C2-C8 алкинила, возможно замещенного С3-С12 карбоциклила, возможно замещенного С2-С20 гетероциклила, возможно замещенного С6-С20 арила и возможно замещенного C1-C20 гетероарила;
Х представляет собой CRx или О, S, NRy, где Rx и Ry независимо выбраны из группы, состоящей из:
(1) водорода, (2) циано, (3) галогена, (4) метила, (5) трифторметила, (6) сульфонамидо, (7) сульфона, (8) линкерного фрагмента (гидрофобных, гидрофильных, отщепляемых па свету, отщепляемых в результате окислительно-восстановительных реакций линкеров), (9) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционно-способные группы);
линкерного фрагмента, выбранной из группы, состоящей из:
возможно замещенного C1-C20 алкила, возможно замещенного галоген-замещенного C1-C20 алкила, возможно замещенного C1-C20 алкокси, возможно замещенного галоген-замещенного C1-C20 алкокси, возможно замещенного C1-С20 ПЭГилированного алкила;
TAG-молекулы, выбранной из группы, состоящией из:
молекул красителя, флуорофорных красителей (например, производных BODIPY или родамина), биотина, полимерной смолы или реакционно-способной группы (например, акриламида, йодацетамида, фторацетамида, хлорацетамида, бромацетамида, реакционно-способных на свету химических групп, карбоксамида оксирана, окислительно-восстановительных реакционно-способных химических групп);
R3x, R3y, R3z и R3p независимо выбраны из группы, состоящей из: водорода, F, Cl, Br, I, -C(C1-C6 алкил)2NR10R11, -(CR14R15)tNR10R11, -C(R14R15)nNR12C(=Y)R10, -(CR14R15)nNR12S(O)2R10, -CH(OR10)R10, -(CR14R15)nOR10, -(CR14R15)nS(O)2R10, -(CR14R15)nS(O)2NR10R11, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -C(=Y)NR12OR10, -C(=O)NR12S(O)2R10, -C(=O)NR12(CR14R15)mNR10R11, -NO2, -NHR12, -NR12C(=Y)R11, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12S(O)2R10, -NR12SO2NR10R11, -S(O)2R10-, -S(O)2NR10R11, -SC(=Y)R10, -SC(=Y)OR10, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила и C1-C20 гетероарила; или группы, в которой С3-С12 карбоциклил, С2-С20 гетероциклил, C6-C20 арил или С1-С20 гетероарил являются замещенными по соседним атомам углерода морфолина и образуют конденсированный бициклический морфолинил;
где указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил являются возможно замещенными одной или более группой, независимо выбранной из F, Cl, Br, I, -CN, CF3, -NO2, оксо, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -(CR14R15)nNR10R11, -(CR14R15)nC(=Y)NR10R11, -(CR14R15)nC(=Y)OR10, (CR14R15)nNR12SO2R10, -(CR14R15)nOR10, -(CR14R15)nR10, -(CR14R15)nSO2R10, -NR10R11, -NR12C(=Y)R10, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12SO2R10, =NR12, OR10, -OC(=Y)R10, -OC(=Y)OR10, -OC(=Y)NR10R11, -OS(O)2(OR10), -OP(=Y)(OR10)(OR11), -OP(OR10)(OR11), SR10, -S(O)R10, -S(O)2R10, -S(O)2NR10R11, -S(O)(OR10), -S(O)2(OR10), -SC(=Y)R10, -SC(=Y)OR10, -SC(=Y)NR10R11, возможно замещенного C1-C12 алкила, возможно замещенного C2-C8 алкенила, возможно замещенного C2-C8 алкинила, возможно замещенного С3-С12карбоциклила, возможно замещенного С2-С20 гетероциклила, возможно замещенного С6-С20 арила и возможно замещенного C1-C20 гетероарила;
R1 выбран из группы, состоящей из:
(1) Н, F, Cl, Br, I, (2) циано, (3) нитро, (4) галогена, (5) замещенного и незамещенного алкила, (6) замещенного и незамещенного алкенила, (7) замещенного и незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного и незамещенного гетероарила, (10) замещенного и незамещенного гетероциклила, (11) замещенного и незамещенного циклоалкила, (12) -C(C1-C6 алкил)2NR10R11, -(CR14R15)tNR10R11, -C(R14R15)nNR12C(=Y)R10, -(CR14R15)nNR12S(O)2R10, -CH(OR10)R10, -(CR14R15)nOR10, -(CR14R15)nS(O)2R10, -(CR14R15)nS(O)2NR10R11, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -C(=Y)NR12OR10, -C(=O)NR12S(O)2R10, -C(=O)NR12(CR14R15)mNR10R11, -NO2, -NHR12, -NR12C(=Y)R11, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12S(O)2R10, -NR12SO2NR10R11, -S(O)2R10, -S(O)2NR10R11, -SC(=Y)R10, -SC(=Y)OR10, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила или C1-C20 гетероарила;
R2 выбран из группы, состоящей из:
(1) водорода, (2) циано, (3) нитро, (4) галогена, (5) замещенного и незамещенного алкила, (6) замещенного и незамещенного алкенила, (7) замещенного и незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного и незамещенного гетероарила, (10) замещенного и незамещенного гетероциклила, (11) замещенного и незамещенного циклоалкила, (12) -COR2a, (13) -CO2R2a, (14) -CONR2aR2b, (15) -NR2aR2b, (16) -NR2aCOR2b, (17) -NR2aSO2R2b, (18) -OCOR2a, (19) -OR2a, (20) -SR2a, (21) -SOR2a, (22) -SO2R2a и (23) -SO2NR2aR2b; (24) линкерного фрагмента (гидрофобной линкеров, гидрофильных линкеров, отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительной реакции линкеров), (25) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционно-способные группы);
где R2a и R2b независимо выбраны из группы, состоящей из (а) водорода, (b) замещенного или незамещенного алкила, (с) замещенного или незамещенного арила, (d) замещенного или незамещенного гетероарила, (е) замещенного или незамещенного гетероциклила и (f) замещенного или незамещенного циклоалкила,
где R10, R11 и R12 независимо представляют собой Н, C1-C12 алкил, C2-C8 алкенил, C2-C8 алкинил, С3-С12 карбоциклил, С2-С20 гетероциклил, С6-С20 арил или C1-C20 гетероарил,
или R10, R11 вместе с атомом азота, к которому они присоединены возможно образуют С3-С20 гетероциклическое кольцо, возможно содержащее один или более дополнительный атом в кольце, выбранный из N, О или S, где указанное гетероциклическое кольцо возможно замещено одной или более группой, независимо выбранной из оксо, CF3, F, Cl, Br, I, С1-С12 алкила, C2-C8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила и C1-C20 гетероарила;
где R14 и R15 независимо выбраны из Н, C1-C12 алкила или -(СН2)n-арила,
или R14 и R15 вместе с атомами, к которым они присоединены, образуют насыщенное или частично ненасыщенное С3-С12 карбоциклическое кольцо
где
Y представляет собой О, S или NR12;
m равно 0, 1, 2, 3, 4, 5 или 6;
n равно 1, 2, 3, 4, 5 или 6; и
t равно 2, 3, 4, 5 или 6.
Предпочтительно
X представляет собой О (кольцо, содержащее Х представляет собой морфолин) и/или R3x, R3y, R3z, R3p независимо выбраны из следующих структур:































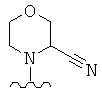

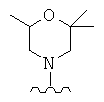
где волнистая линия обозначает место присоединения в положение 4 основного кольца (триазинового или пиримидинового или пиридинового кольца).
В другом аспекте настоящего изобретения R1 представляет собой замещенный или незамещенный гетероциклил или замещенный или незамещенный -O-гетероциклил. В другом аспекте R1 представляет собой замещенный или незамещенный морфолинил, более конкретно, R1 представляет собой связанные через атом N морфолинил.
В другом аспекте R1 включает замещенный или незамещенный гетероциклилалкил или замещенный или незамещенный гетероарилалкил.
В другом аспекте R1 представляет собой замещенный или незамещенный тетрагидропиран или замещенный или незамещенный тетрагидропиранилокси. Более конкретно, R1 представляет собой незамещенный 4-тетрагидропиранилокси.
В другом аспекте R1 включает замещенный или незамещенный тетрагидропиран. В более конкретном аспекте тетрагидропиран включает 4-тетрагидропиранилокси.
В другом аспекте R1 представляет собой замещенный или незамещенный тетрагидрофуран или замещенный или незамещенный тетрагидрофуранилокси. Более конкретно, R1 представляет собой незамещенный 3-тетрагидрофуранилокси.
В другом аспекте R1 представляет собой фенил, причем фенил является незамещенным или замещенным одной или более группой, выбранной из N-метилкарбоксамида, изопропилсульфониламино, метилсульфонил, 2-гидрокси-2-метилпропанамида, 2-гидроксипропанамида, 2-метоксиацетамида, (пропан-2-ол)сульфонила, 2-амино-2-метилпропанамида, 2-аминоацетамида, 2-гидроксиацетамида, метилсульфониламино, 2-(диметиламино)ацетамида, амино, ацетиламино, карбоксамида, (4-метилсульфонилпиперазино)-1-метила, (4-метилпиперазино)-1-метила, гидроксиметила и метокси.
В некоторых вариантах реализации R1 представляет собой пиридил, тиазолил, изоксазолил, оксадиазолил или пиримидил, причем гетероциклическая группа является незамещенной или замещенной одной или более группой, выбранной из N-метилкарбоксамида, изопропилсульфониламино, метилсульфонила, 2-гидрокси-2-метилпропанамида, 2-гидроксипропанамида, 2-метоксиацетамида, (пропан-2-ол)сульфопила, 2-амино-2-метилпропанамида, 2-аминоацетамида, 2-гидроксиацетамида, метилсульфониламино, 2-(диметиламино)ацетамида, амино, ацетиламино, карбоксамида, (4-метилсульфопилпиперазино)-1-метила, (4-метилпиперазино)-1-метила, гидроксиметила и метокси.
В другом аспекте настоящего изобретения R2 представляет собой замещенный или незамещенный гетероциклил или замещенный или незамещенный -O-гетероциклил.
В другом аспекте R2 включает замещенный или незамещенный гетероциклилалкил, или замещенный или незамещенный гетероарилалкил.
В другом аспекте R2 представляет собой моноциклическую гетероарильную группу, выбранную из пиридила, имидазолила, пиразолила, пирролила, тиазолила, пиридазинила, пиримидинила, пиразинила, оксазолила, фуранила, тиенила, тетразолила, где моноциклическая гетероарильная группа является возможно замещенной одной или более группой, выбранной из F, Cl, Br, I, -CN, -NR10R11, -OR10, -C(O)R10, -NR10C(O)R11, -N(C(O)R11)2, -NR10C(O)NR10R11, -C(=O)OR10, -C(=O)NR10R11, C1-C12 алкила и (С1-С12алкил)-OR10.
В конкретном варианте реализации R2 выбран из следующих структур:








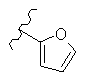
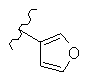















где волнистая линия обозначает место присоединения в положение 4 основного кольца (триазинового или пиримидинового или пиридинового кольца), и
где моноциклическая гетероарильная группа является возможно замещенной одной или более группой, выбранной из F, Cl, Br, I, -NR10R11, -OR10, -C(O)R10, -NR10C(O)R11, -N(C(O)R11)2, -NR10C(O)NR10R11, -C(=O)OR10, -C(=O)NR10R11 и C1-C12 алкила.
В конкретных вариантах реализации R2 выбран из следующих структур:










где волнистая линия обозначает место присоединения в положение 4 основного кольца (триазинового или пиримидинового или пиридинового кольца), и
где моноциклическая гетероарильная группа является возможно замещенной одной или более группой, выбранной из F, Cl, Br, I, -NR10R11, -OR10, -C(O)R10, -NR10C(O)R11, -N(C(O)R11)2, -NR10C(O)NR10R11, -C(=O)OR10, -C(=O)NR10R11 и C1-C12 алкила.
В конкретных вариантах реализации R2 представляет собой моноциклическую или бициклическую гетероарильную группу, выбранную из следующих структур:






























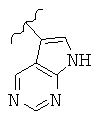






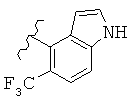












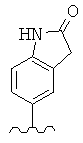















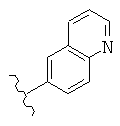
























































где волнистая линия обозначает место присоединения.
В конкретных вариантах реализации моноциклическая или бициклическая гетероарильная группа является замещенной одной или более группой, выбранной из F, -NH2, -NHCH3, -N(СН3)2, -ОН, -ОСН3, -С(O)СН3, -NHC(O)СН3, -N(С(O)СН3)2, -NHC(O)NH2, -CO2H, -СНО, -CH2OH, -С(=O)NHCH3, -C(=O)NH2 и -СН3.
В одном из аспектов настоящего изобретения предложены соединения, обладающие общей формулой (Ia):

и их стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли, где
X, R3x, R3y, R3z, R3p. R1 и R2 аналогичны определенным ранее для формулы (I).
Предпочтения, конкретные аспекты и варианты реализации, представленные выше для X, R3x, R3y, R3z, R3p, R1 и R2 формулы (I), применяют для указанных заместителей в формуле (Ia).
В другом аспекте настоящего изобретения предложено соединение, обладающее общей формулой (Ib):

и его стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли, где
R3x, R3y, R3z, R3p и R2 аналогичны определенным ранее для формулы (I),
R4x, R4y, R4z и R4p не зависят друг от друга и выбраны из группы, состоящей из:
F, Cl, Br, I, -С(С1-С6 алкил)2NR10R11, -(CR14R15)tNR10R11, -C(R14R15)nNR12C(=Y)R10, -(CR14R15)nNR12S(O)2R10, -CH(OR10)R10, -(CR14R15)nOR10, -(CR14R15)nS(O)2R10, -(CR14R15)nS(O)2NR10R11, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -C(=Y)NR12OR10, -C(=O)NR12S(O)2R10, -C(=O)NR12(CR14R15)mNR10R11, -NO2, -NHR12, -NR12C(=Y)R11, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12S(O)2R10, -NR12SO2NR10R11, -S(O)2R10, -S(O)2NR10R11, -SC(=Y)R10, -SC(=Y)OR10, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила и C1-C20 гетероарила, или группы, в которой С3-С12 карбоциклил, С2-С20 гетероциклил, С6-С20 арил или C1-C20 гетероарил являются замещенными по соседним атомам морфолина и образуют конденсированный бициклический морфолинил;
где указанный алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил возможно замещены одной или более группой, независимо выбранной из F, Cl, Br, I, -CN, CF3, -NO2, оксо, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -CR14R15)nNR10R11, -(CR14R15)nC(=Y)NR10R11, -(CR14R15)nC(=Y)OR10, (CR14R15)nNR12SO2R10, -CR14R15)nOR10, -(CR14R15)nR10, -(CR14R15)nSO2R10, -NR10R11, -NR12C(=Y)R10, -R12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12SO2R10, =NR12, OR10, -OC(=Y)R10, -C(-Y)OR10, -OC(=Y)NR10R11, -OS(O)2(OR10), -OP(=Y)(OR10)(OR11), -OP(OR10)(OR11), SR10, -S(O)R10, -S(O)2R11, -S(O)2NR10R11, -S(O)(OR10), -S(O)2(OR10), -SC(=Y)R10, -C(=Y)OR10, -SC(=Y)NR10R11, возможно замещенного C1-C12 алкила, возможно замещенного C2-C8 алкенила, возможно замещенного С2-С8 алкинила, возможно замещенного С3-С12 карбоциклила, возможно замещенного С2-С20 гетероциклила, возможно замещенного С6-С20 арила и возможно замещенного C1-C20 гетероарила;
где R10, R11 и R12 независимо представляют собой Н, C1-C12 алкил, C2-C8 алкенил, C2-C8алкинил, С3-С12 карбоциклил, С2-С20 гетероциклил, С6-С20 арил или C1-C20 гетероарил,
или R10, R11 вместе с атомом азота, к которому они присоединены, возможно образуют С3-С20 гетероциклическое кольцо, возможно содержащее один или более дополнительный атом в кольце, выбранный из N, О или S, где указанное гетероциклическое кольцо возможно замещено одной или более группой, независимо выбранной из оксо, (СН2)mOR10, (CH2)mNR10R11, CF3, F, Cl, Br, I, SO2R10, C(=O)R10, NR12C(=Y)R11, C(=Y)NR10R11, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20гетероциклила, С6-С20 арила и C1-C20 гетероарила,
где R14 и R15 независимо выбраны из Н, C1-C12 алкила или -(СН2)n-арила,
или R14 и R15 вместе с атомами, к которым они присоединены, образуют насыщенное или частично ненасыщенное С3-С12 карбоциклическое кольцо
где
Y представляет собой О, S или NR12;
m равно 0, 1, 2, 3, 4, 5 или 6,
n равно 1, 2, 3, 4, 5 или 6 и
t равно 2, 3, 4, 5 или 6
Предпочтения, конкретные аспекты и варианты реализации, представленные для R3x, R3y, R3z, R3p, R1 и R2 в формуле (I), применяют для указанных заместителей в формуле (Ib).
В другом аспекте настоящего изобретения предложено соединение, обладающее общей формулой (Ic):

и его стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли, где
R3x, R3y, R3z, R3p и R2 аналогичны определенным ранее для формулы (I),
Ya представляет собой О, S, NH или непосредственно связь,
R'1 выбран из группы, состоящей из:
(I) Н, F, Cl, Br, I, (2) циано, (3) нитро, (4) галогена, (5) замещенного или незамещенного алкила, (6) замещенного или незамещенного алкенила, (7) замещенного или незамещенного алкинила, (8) замещенного или незамещенного арила, (9) замещенного или незамещенного гетероарила, (10) замещенного или незамещенного гетероциклила, (11) замещенного или незамещенного циклоалкила, (12) -C(C1-C6 алкил)2NR10R11, -(CR14R15)tNR10R11, -C(R14R15)nNR12C(=Y)R10, -(CR14R15)nNR12S(O)2R10, -CH(OR10)R10, -(CR14R15)nOR10, -(CR14R15)nS(O)2R10, -(CR14R15)nS(O)2NR10R11, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -C(=Y)NR12OR10, -C(=O)NR12S(O)2R10, -C(=O)NR12(CR14R15)mNR10R11, -NO2, -NHR12, -NR12C(=Y)R11, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12S(O)2R10, -NR12SO2NR10R11, -S(O)2R10, -S(O)2NR10R11, -SC(=Y)R10, -SC(=Y)OR10, C1-C12 алкила, C2-C8 алкенила, С2-С8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила или C1-C20 гетероарила, (13) линкерного фрагмента (гидрофобных линкеров, гидрофильных линкеров, отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительной реакции линкеров), (14) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотип, различные полимерные гранулы и различные реакционно-способные группы), где R10, R11, R12, R14, R15, Y, m, n и t определены выше для формулы (I).
Предпочтения, конкретные аспекты и варианты реализации, представленные выше для R3x, R3y, R3z, R3p и R2 в формуле (I), применяют для указанных заместителей в формуле (Ic).
В другом аспекте настоящего изобретения R'1 представляет собой замещенный или незамещенный гетероциклил или замещенный или незамещенный -O-гетероциклил. В другом аспекте R'1 представляет собой замещенный или незамещенный морфолинил; более конкретно R'1 представляет собой незамещенный, связанный через атом N, морфолинил; более конкретно, Х представляет собой непосредственно связь. В другом более конкретном варианте реализации R1 представляет собой 4-тетрагидропиранил; более конкретно Х представляет собой О. В другом варианте реализации R1 представляет собой 3-тетрагидрофуранил; более конкретно, Х представляет собой О.
В другом аспекте R'1 включает замещенный или незамещенный гетероциклилалкил или замещенный или незамещенный гетероарилалкил.
В другом аспекте R'1 представляет собой замещенный или незамещенный тетрагидропиран или замещенный или незамещенный тетрагидропиранилокси. Более конкретно R'1 представляет собой 4-тетрагидропирапилокси.
В другом аспекте R'1 включает замещенный или незамещенный тетргидропиран. В более конкретном аспекте тетрагидропиран включает 4-тетрагидропиранилокси.
В другом аспекте R'1 представляет собой замещенный или незамещенный тетрагидрофуран или замещенный или незамещенный тетрагидрофуранилокси. Более конкретно, R'1 представляет собой незамещенный 3-тетрагидрофуранилокси.
В другом аспекте R'1 представляет собой фенил, причем фенил является незамещенным или замещенным одной или более группой, выбранной из N-метилкарбоксамида, изопропилсульфониламино, метилсульфонила, 2-гидрокси-2-метилпропанамида, 2-гидроксипропанамида, 2-метоксиацетамида, (пропан-2-ол)сульфонила, 2-амино-2-метилпропанамида, 2-аминоацетамида, 2-гидроксиацетамида, метилсульфониламино, 2-(диметиламино)ацетамида, амино, ацетиламино, карбоксамида, (4-метилсульфонилпиперазино)-1-метила, (4-метилпиперазино)-1-метила, гидроксиметила и метокси.
В конкретных вариантах реализации R'1 представляет собой пиридил, тиазолил, изоксазолил, оксадиазолил или пиримидил, причем гетероциклическая группа является незамещенной или замещенной одной или более группой, выбранной из N-метилкарбоксамида, изопропилсульфониламино, метилсульфонила, 2-гидрокси-2-метилпропанамида, 2-гидроксипропанамида, 2-метоксиацетамида, (пропан-2-ол)сульфонила, 2-амино-2-метилпропанамида, 2-аминоацетамида, 2-гидроксиацетамида. метилсульфониламино, 2-(диметиламино)ацетамида, амино, ацетиламино, карбоксамида, (4-метилсульфонилпиперазино)-1-метила, (4-метилпиперазино)-1-метила, гидроксиметила и метокси.
В другом варианте реализации R'1 выбран из группы, состоящей из: (1) замещенного или незамещенного морфолинила, (2) замещенного или незамещенного тетрагидропиранила и (3) замещенного или незамещенного тетрагидрофуранила.
В более конкретном варианте реализации R'1 представляет собой связанный через атом N морфолинил. В другом более конкретном варианте реализации R'1 представляет собой 4-тетрагидропиранил. В другом варианте реализации R'1 представляет собой 3-тетрагидрофуранил.
В другом аспекте настоящего изобретения предложено соединение, обладающее общей формулой (Id):

и его стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли, где
R3x, R3y, R3z, R3p и R2 такие, как определены ранее для формулы (I),
W представляет собой CRw или N, где Rw выбран из группы, состоящей из:
(1) водорода, (2) пиано, (3) галогена, (4) метила, (5) трифторметила, (6) сульфонамидо;
R5 выбран из группы, состоящей из:
(1) водорода и (2) галогена,
R6 выбран из группы, состоящей из:
(1) водорода, (2) циано, (3) нитро, (4) галогена, (5) замещенного и незамещенного алкила, (6) замещенного и незамещенного алкенила, (7) замещенного и незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного и незамещенного гетероарила, (10) замещенного и незамещенного гетероциклила, (11) замещенного и незамещенного циклоалкила, 12) -COR3a, (13) -NR3aR3b, (14) -NR3aCOR3b, (15) -NR3aSO2R3b, (16) -OR3a, (17) -SR3a, (18) -SOR3a, (19) -SO2R3a, и (20) -SO2NR3aR3b,
где R3a и R3b независимо выбраны из группы, состоящей из: (а) водорода, (b) замещенного или незамещенного алкила, (с) замещенного или незамещенного арила, (d) замещенного или незамещенного гетероарила, (е) замещенного или незамещенного гетероциклила и (О замещенного или незамещенного циклоалкила, и
R7 выбран из группы, состоящей из:
(1) водорода, (2) замещенного и незамещенного алкила и (3) замещенного и незамещенного циклоалкила, (4) метила, (5) этила, (6) трифторметила, (7) сульфонамида, (8) ацетата, (9) линкерного фрагмента (гидрофобных линкеров, гидрофильных линкеров, отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительной реакции линкеров), (10) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционноспособные группы).
Предпочтения, конкретные аспекты и варианты реализации, представленные выше для R3x, R3y; R3z, R3p и R2 в формуле (I), применяют для указанных заместителей формулы (Id).
В более конкретном варианте реализации W представляет собой СН.
В другом варианте реализации W представляет собой N. В более конкретном варианте реализации R6 представляет собой =O.
В другом варианте реализации R6 выбран из группы, состоящей из:
(1) циано, (2) нитро, (3) галогена, (4) гидроксила, (5) амино и (6) трифторметила.
В другом варианте реализации R6 представляет собой трифторметил. В другом варианте реализации R6 представляет собой циано.
В другом аспекте настоящего изобретения предложено соединение, имеющее общую формулу (Ie):

и его стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли, где
Q=С, G=С, U=N;
Q=С, U=С, G=N; или
V=C, G=C, Q=N,
X, R3x, R3y, R3z, R3p и R2 определены выше в формуле (I),
Ya представляет собой О, S, NH или непосредственно связь,
R'1 выбран из группы, состоящей из:
(1) H, F, Cl, Br, I, (2) пиано, (3) нитро, (4) галогена, (5) замещенного и незамещенного алкила, (6) замещенного и незамещенного алкенила, (7) замещенного и незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного и незамещенного гетероарила, (10) замещенного и незамещенного гетероциклила, (11) замещенного и незамещенного циклоалкила, (12) -С(С1-С6 алкил)2NR10R11, -(CR14R15)tNR10R11, -C(R14R15)nNR12C(=Y)R10, -(CR14R15)nNR12S(O)2R10, -CH(OR10)R10, -(CR14R15)nOR10, -(CR14R15)nS(O)2R10, -(CR14R15)nS(O)2NR10R11, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -C(=Y)NRnOR10, -C(=O)NR12S(O)2R10, -C(=O)NR12(CR14R15)mNR10R11, -NO2, -NHR12, -NR12C(=Y)R11, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12S(O)2R10, -NR12SO2NR10R11, -S(O)2R10, -S(O)2NR10R11, -SC(=Y)R10, -SC(=Y)OR10, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила или С1-С20 гетероарила, (13) линкерного фрагмента (гидрофобных линкеров, гидрофильных линкеров, отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительной реакции линкеров), (14) линкерного фрагмента, с ковалелетно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционно-способные группы), где R10, R11, R12, R14, R15, Y, m, n и t определены выше для формулы (I).
Предпочтения, конкретные аспекты и варианты реализации, представленные выше для X,
R3x, R3y, R3z, R3p и R2 в формуле (I), применяют для указанных заместителей в формуле (Ie).
В другом аспекте настоящего изобретения R'1 представляет собой замещенный или незамещенный гетероциклил или замещенный или незамещенный -O-гетероциклил. В другом варианте реализации R'1 представляет собой замещенный или незамещенный морфолинил; более конкретно R'1 представляет собой незамещенный связанный через атом N морфолинил; более конкретно, Х представляет собой непосредственно связь. В другом более конкретном варианте реализации R1 представляет собой 4-тетрагидропиранил; более конкретно, Х представляет собой О. В другом варианте реализации R1 представляет собой 3-тетрагидрофуранил; более конкретно Х представляет собой О.
В другом аспекте R'1 включает замещенный или незамещенный гетероциклилалкил или замещенный или незамещенный гетероарилалкил.
В другом аспекте R'1 представляет собой замещенный или незамещенный тетрагидрониран или замещенный или незамещенный тетрагидропиранилокси. Более конкретно R'1 представляет собой незамещенный 4-тетрагидропиранилокси.
В другом аспекте R'1 включает замещенный или незамещенный тетрагидропиран. В более конкретном аспекте тетрагидропиран включает 4-тетрагидропиранилокси.
В другом аспекте R'1 представляет собой замещенный или незамещенный тетрагидрофуран или замещенный или незамещенный тетрагидрофуранилокси. Более конкретно R'1 представляет собой незамещенный 3-тетрагидрофуранилокси.
В другом аспекте R'1 представляет собой фенил, причем фенил является незамещенным или замещенным одной или более группой, выбранной из N-метилкарбоксамида, изопропилсульфониламино, метилсульфонила, 2-гидрокси-2-метилпропанамида, 2-гидроксипропанамида, 2-метоксиацетамида, (пропан-2-ол)сульфонила, 2-амипо-2-метилпропанамида, 2-аминоацетамида, 2-гидроксиацетамида, метилсульфониламино, 2-(диметиламино)ацетамида, амино, ацетиламино, карбоксамида, (4-метилсульфонилпиперазино)-1-метила, (4-метилпиперазино)-1-метила, гидроксиметила и метокси.
В конкретных вариантах реализации R'1 представляет собой пиридил, тиазолил, изоксазолил или пиримидил, причем гетероциклическая группа является незамещенной или замещенной одной или более группой, выбранной из N-метилкарбоксамида, изопропилсульфониламино, метилсульфонила, 2-гидрокси-2-метилпропанамида, 2-гидроксипропанамида, 2-метоксиацетамида, (пропан-2-ол)сульфонила, 2-амино-2-метилпропанамида, 2-аминоацетамида, 2-гидроксиацетамида, метилсульфониламино, 2-(диметиламино)ацетамида, амино, ацетиламино, карбоксамида, (4-метилсульфонилпиперазино)-1-метила, (4-метилпиперазино)-1-метила, гидроксиметила и метокси.
В другом варианте реализации R'1 выбран из группы, состоящей из: (1) замещенного или незамещенного морофолинила, (2) замещенного или незамещенного тетрагидрониранила и (3) замещенного или незамещенного тетрагидрофуранила.
В более конкретном варианте реализации R'1 представляет собой связанный через атом N морфолинил. В другом более конкретном варианте реализации R'1 представляет собой 4-тетрагидропиранил. В другом варианте реализации R'1 представляет собой 3-тетрагидрофуранил.
В другом аспекте настоящего изобретения предложены соединения, обладающие одной из общих формул (If) и (Ig):


и их стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли, где
G представляет собой N или G представляет собой С,
X, R3x, R3y, R3z, R3p и R2 определены выше для формулы (I),
Yb представляет собой О, S или SO2,
Z представляет собой N или CRq, где Rq выбран из группы, состоящей из:
(1) линкерного фрагмента (гидрофобных линкеров, гидрофильных линкеров, отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительных реакции линкеров), (2) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционно-способные группы),
R8 выбран из группы, состоящей из:
(1) Н, F, Cl, Br, I, (2) циано, (3) нитро, (4) галогена, (5) замещенного и незамещенного алкила, (б) замещенного и незамещенного алкенила, (7) замещенного и незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного и незамещенного гетероарила, (10) замещенного и незамещенного гетероциклила, (11) замещенного и незамещенного циклоалкила, (12) -С(С1-С6 алкил)2NR10R11, -(CR14R15)tNR10R11, -C(R14R15)nNR12C(=Y)R10, -(CR14R15)nNR12S(O)2R10, -CH(OR10)R10, -(CR14R15)nOR10, -(CR14R15)nS(O)2R10, -(CR14R15)nS(O)2NR10R11, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -C(=Y)NRnOR10, -C(=O)NR12S(O)2R10, -C(=O)NR12(CR14R15)mNR10R11, -NO2, -NHR12, -NR12C(=Y)R11, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12S(O)2R10, -NR12SO2NR10R11, -S(O)2R10, -S(O)2NR10R11, -SC(=Y)R10, -SC(=Y)OR10, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила или С1-С20 гетероарила, (13) линкерного фрагмента (гидрофобных линкеров, гидрофильных линкеров, отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительных реакции линкеров), (14) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционно-способные группы), где
R11 и R12 независимо представляют собой Н, C1-C12 алкил, C2-C8 алкенил, C2-C8 алкинил, С3-С12 карбоциклил, С2-С20 гетероциклил, С6-С20 арил или C1-C20 гетероарил,
R10 выбран из группы, состоящей из:
(1) водорода, (2) циано, (3) нитро, (4) галогена, (5) замещенного и незамещенного алкила, (6) замещенного и незамещенного алкенила, (7) замещенного и незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного и незамещенного гетероарила, (10) замещенного и незамещенного гетероциклила, (11) замещенного и незамещенного циклоалкила, (12) -COR2a, (13) -CO2R2a, (14) -CONR2aR2b, (15) -NR2aR2b, (16) -NR2aCOR2b, (17) -NR2aSO2R2b, (18) -OCOR2a, (19) -OR2a, (20) -SR2a, (21) -SOR2a, (22) -SO2R2a и (23) -SO2NR2aR2b, (24) линкерного фрагмента (гидрофобных линкеров, гидрофильных линкеров, отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительных реакции линкеров), (25) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционно-способные группы);
где R2a и R2b независимо выбраны из группы, состоящей из (а) водорода, (b) замещенного или незамещенного алкила, (с) замещенного или незамещенного арила, (d) замещенного или незамещенного гетероарила, (е) замещенного или незамещенного гетероциклила и (f) замещенного или незамещенного циклоалкила,
или R10, R11 вместе с атомом азота, к которому они присоединены, возможно образуют С3-С20 гетероциклическое кольцо, возможно содержащее один или более дополнительный атом в кольце, выбранный из N, О или S, причем указанное гетероциклическое кольцо возможно замещено одной или более группой, независимо выбранной из оксо, CF3, F, Cl, Br, I, C1-C12 алкила, С2-С8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила и C1-C20 гетероарила;
где R14 и R15 независимо выбраны из Н, C1-C12 алкила или -(СН2)n-арила,
или R14 и R15 вместе с атомами, к которым они присоединены, образуют насыщенное или частично ненасыщенное С3-С12 карбоциклическое кольцо,
где
Y представляет собой О, S или NR12;
m равно 0, 1, 2, 3, 4, 5 или 6;
n равно 1, 2, 3, 4, 5 или 6; и
t равно 2, 3, 4, 5 или 6.
Предпочтения, конкретные аспекты и варианты реализации, представленные выше для X, R3x, R3y, R3z, R3p и R2 в формуле (I), применяют для указанных заместителей формул (If) и (Ig).
В конкретном аспекте настоящего изобретения R8 представляет собой замещенный или незамещенный гетероциклил или замещенный или незамещенный -O-гетероциклил. В другом аспекте R8 представляет собой замещенный или незамещенный морфолинил; более конкретно R8 представляет собой незамещенный связанный через атом N морфолинил.
В другом аспекте R8 включает замещенный или незамещенный гетероциклилалкил или замещенный или незамещенный гетероарилалкил.
В другом аспекте R8 представляет собой замещенный или незамещенный тетрагидропиран или замещенный или замещенный или незамещенный тетрагидропиранилокси. Более конкретно R8 представляет собой незамещенный 4-тетрагидропиранилокси.
В другом аспекте R8 включает замещенный или незамещенный тетрагидропиран. В более конкретном варианте реализации тетрагидропиран включает 4-тетрагидропиранилокси.
В другом аспекте R8 представляет собой замещенный или незамещенный тетрагидрофуран или замещенный или незамещенный тетрагидрофуранилокси. Более конкретно, R8 представляет собой незамещенный 3-тетрагидрофуранилокси.
В другом аспекте R8 представляет собой возможно замещенный фенил, причем фенил является незамещенным или замещенным одной или более группой, выбранной из N-метилкарбоксамида, изопропилсульфониламино, метилсульфонила, 2-гидрокси-2-метилпропанамида, 2-гидроксипропанамида, 2-метоксиацетамида, (пропан-2-ол)сульфонила, 2-амино-2-метилпропанамида, 2-аминоацетамида, 2-гидроксиацетамида, метилсульфониламино, 2-(диметиламино)ацетамида, амино, ацетиламино, карбоксамида, (4-метилсульфонилпиперазино)-1-метила, (4-метилпипсразипо)-1-метила, гидроксиметила и метокси.
В конкретных вариантах реализации R8 представляет собой возможно замещенный пиридил, возможно замещенный тиазолил, возможно замещенный изоксазолил, возможно замещенный оксадиазолил или возможно замещенный пиримидил.
В другом варианте реализации R8 выбран из группы, состоящей из: (1) замещенного или незамещенного морфолинила, (2) замещенного или незамещенного тетрагидропиранила и (3) замещенного или незамещенного тетрагидрофуранила.
В более конкретном варианте реализации R8 представляет собой связанный через атом N морфолинил. В другом более конкретном варианте реализации R8 представляет собой 4-тетрагидропиранил; в другом варианте реализации R8 представляет собой 3-тетрагидрофуранил.
Для применения R10 см. общую схему реакции 45.
В другом аспекте настоящего изобретения предложены соединения, обладающие общими формулами (Ih) и (Ii):


и их стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли, где
G представляет собой N или G представляет собой С,
X, R3x, R3y, R3z, R3p и R2 определены выше для формулы (I),
Ye представляет собой О, S, SO2, NH или непосредственно связь,
L представляет собой С, N или N-оксид,
R9 выбран из группы, состоящей из:
(1) Н, F, Cl, Br, I, (2) циано, (3) нитро, (4) галогена, (5) замещенного и незамещенного алкила, (6) замещенного и незамещенного алкенила, (7) замещенного и незамещенного алкинила, (8) замещенного и незамещенного арила, (9) замещенного и незамещенного гетероарила, (10) замещенного и незамещенного гетероциклила, (11) замещенного и незамещенного циклоалкила, (12) -С(С1-С6 алкил)2NR10R11, -(CR14R15)tNR10R11, -C(R14R15)nNR12C(=Y)R10, -(CR14R15)nNR12S(O)2R10, -CH(OR10)R10, -(CR14R15)nOR10, -(CR14R15)nS(O)2R10, -(CR14R15)nS(O)2NR10R11, -C(=Y)R10, -C(=Y)OR10, -C(=Y)NR10R11, -C(=Y)NRnOR10, -C(=O)NR12S(O)2R10, -C(=O)NR12(CR14R15)mNR10R11, -NO2, -NHR12, -NR12C(=Y)R11, -NR12C(=Y)OR11, -NR12C(=Y)NR10R11, -NR12S(O)2R10, -NR12SO2NR10R11, -S(O)2R10, -S(O)2NR10R11, -SC(=Y)R10, -SC(=Y)OR10, C1-C12 алкила, C2-C8 алкенила, C2-C8 алкинила, С3-С12 карбоциклила, С2-С20 гетероциклила, С6-С20 арила или С1-С20 гетероарила, (13) линкерного фрагмента (гидрофобных линкеров, гидрофильных линкеров, отщепляемых на свету линкеров, отщепляемых в результате окислительно-восстановительных реакции линкеров), (14) линкерного фрагмента с ковалентно связанными TAG-молекулами (TAG может представлять собой флуорофор, биотин, различные полимерные гранулы и различные реакционно-способные группы), где R10, R11, R12, R14, R15, Y, m, n и t определены выше для формулы (I).
В другом аспекте настоящего изобретения R9 представляет собой замещенный или незамещенный гетероциклил или замещенный или незамещенный -O-гетероциклил. В другом аспекте R9 представляет собой замещенный или незамещенный морфолинил; более конкретно, R9 представляет собой незамещенный, связанный через атом N, морфолинил.
В другом аспекте R9 включает замещенный или незамещенный гетероциклилалкил или замещенный или незамещенный гетероарилалкил.
В другом аспекте R9 представляет собой замещенный или незамещенный тетрагидропиран или замещенный или незамещенный тетрагидропиранилокси. Более конкретно R9представляет собой незамещенный 4-тетрагидропиранилокси.
В другом аспекте R9 включает замещенный или незамещенный тетрагидропиран. В более конкретном аспекте тетрагидропиран включает 4-тетрагидропиранилокси.
В другом аспекте R9 представляет собой замещенный или незамещенный тетрагидрофуран или замещенный или незамещенный тетрагидрофуранилокси. Более конкретно R9 представляет собой незамещенный 3-тетрагидрофуранилокси.
В другом аспекте R9 представляет собой возможно замещенный фенил, причем фенил является незамещенным или замещенным одной или более группой, выбранной из N-метилкарбоксамида, изопропилсульфониламино, метилсульфонила, 2-гидрокси-2-метилпропанамида, 2-гидроксипропанамида, 2-метоксиацетамида, (пропан-2-ол)сульфонила, 2-амино-2-метилпропанамида, 2-аминоацетамида, 2-гидроксиацетамида, метилсульфониламино, 2-(диметиламино)ацетамида, амино, ацетиламино, карбоксамида, (4-метилсульфонилпиперазино)-1-метила, (4-метилпиперазино)-1-метила, гидроксиметила и метокси.
В конкретных вариантах реализации R9 представляет собой возможно замещенный пиридил, возможно замещенный тиазолил, возможно замещенный изоксазолил, возможно замещенный оксадиазолил или возможно замещенный пиримидил.
В другом варианте реализации R9 выбран из группы, состоящей из: (1) замещенного или незамещенного морфолинила, (2) замещенного или незамещенного тетрагидропиранила и (3) замещенного или незамещенного тетрагидрофуранила.
В более конкретном варианте реализации R9 представляет собой связанный через атом N морфолинил. В другом более конкретном варианте реализации R9 представляет собой 4-тетрагидропиранил; в другом варианте реализации R9 представляет собой 3-тетрагидрофуранил.
Соединения согласно настоящему изобретению могут содержать асимметрические или хиральные центры и существовать, таким образом, в различных стереоизомерных формах. Понимают, что все стереоизомерные формы соединений согласно настоящему изобретению, включающие, но не ограничивающиеся только ими, диастереомеры, энантиомеры и атропоизомеры, а также их смеси, такие как рацемические смеси, образуют часть настоящего изобретения.
В дополнение, настоящее изобретение охватывает все геометрические и позиционные изомеры. Например, в случае, если соединение согласно изобретению содержит двойную связь или конденсированное кольцо, цис- и транс-формы, а также их смеси охвачены в рамках настоящего изобретению. Индивидуальные позиционные изомеры и смеси позиционных изомеров также попадают в рамки настоящего изобретения.
В структурах, представленных в настоящей заявке, когда стереохимия каждого конкретного хирального атома не уточнена, все стереоизомеры охвачены и включены в качестве соединений согласно настоящему изобретению. В случае, когда стереохимия конкретизирована при помощи клиновидной или пунктирной линии, представляющей конкретную конфигурацию, указанный стереоизомер также является, таким образом, конкретизированным и описанным.
Соединения согласно настоящему изобретению могут существовать в нерастворенных, а также в растворенных формах в фармацевтически приемлемых растворителях, таких как вода, этанол и т.д., понимают, что изобретение охватывает растворенные и нерастворенные формы.
Соединения согласно настоящему изобретению также могут существовать в различных таутомерных формах (таутомерах) и все указанные формы попадают в рамки настоящего изобретения.
Настоящее изобретение также охватывает соединения согласно настоящему изобретению, меченые изотопами, которые являются одинаковыми с описанными в настоящей заявке с учетом того, что один или более атом замещен атомом, обладающим атомной массой или массовым числом, отличающимися от атомной массы или массового числа атома, как правило, встречающего в природе. Все изотопы любого конкретного атома или элемента, а также их применения, которые являются описанными, попадают в рамки настоящего изобретения. Типичные изотопы, которые могут быть включены в состав соединений, согласно настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как2Н,3Н,11С,13С,14С,13N,15N,15О,17О,18О,32P,33P,35S,18F,36Cl,123I и125I. Конкретные соединения согласно настоящему изобретению, меченые изотопами, (например, соединения, меченые3H и14С) являются применимыми для исследования распределения соединения и/или субстрата в тканях. Тритиевые (3Н) изотопы и изотопы углерода-14 (14С) являются применимыми как следствие простоты получения и детектирования. Также, замещение более тяжелыми изотопами, такими как дейтерий (т.е,2H) может привести к конкретным терапевтическим преимуществам, выражающимся в повышенной метаболической стабильности (например, повышенному периоду полураспада в организме или пониженной требуемой дозировке) и, следовательно, могут являться предпочтительными в некоторых случаях. Испускающие позитрон изотопы, такие как15О,13N,11С и18F, подходят для позитрон-эмиссионной томографии (ПЭТ) для определения степени занятости субстратом рецептора. Соединения согласно настоящему изобретению, меченые изотопами, можно, как правило, получить при помощи процедур, аналогичных процедурам, описанным в Схемах и/или в Примерах настоящей заявки, представленных ниже, при помощи замещения реагента, не меченого изотопами, реагентом, меченым изотопами.
ПОЛУЧЕНИЕ СОЕДИНЕНИЙ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Соединения согласно настоящему изобретению могут быть синтезированы при помощи способов синтеза, которые включают способы, хорошо известные в области химии, особенно в свете описания, содержащегося в настоящей заявке. Исходные вещества, как правило, доступны из коммерческих источников, таких как Aldrich Chemicals или могут быть легко получены с применением способов, хорошо известных специалистам в данной области техники (например, получены способами, в целом, описанными в работу Луиса Ф. Физера и Мари Физер (Louis F, Fieser and Mary Fieser), Reagentsfor Organic Synthesis, v. 1-19, Wiley, N.Y. (1967-1999 ed.) или Beilsteins Handbuch der Organischcn Chemie, 4, Aufl. Ed. Springer-Verlag, Berlin, включая приложения (также доступные в онлайновой базе данных Beilstein)).
В конкретных вариантах реализации соединения согласно настоящему изобретению могут быть легко получены с применением методик, хорошо известных для получения триазинов и других гетероциклов, которые описаны в: Comprehensive Heterocyclic Chemistry, Editors Katritzky and Rees, Pergamon Press, 1984.
Соединения согласно настоящему изобретению могут быть получены индивидуально или в виде серии соединений, содержащих по меньшей мере 2, например от 5 до 1000 соединений или от 10 до 100 соединений. Серии соединений согласно настоящему изобретению могут быть получены при помощи комбинированного подхода «разделить и смешать» (split and mix) или в результате нескольких параллельных синтезов с применением растворной химии или химии твердого тела, при помощи методик, хорошо известных специалистам в данной области техники. Таким образом, в соответствии с другим аспектом настоящего изобретения предложена серия соединений, содержащая по меньшей мере 2 соединения или их фармацевтически приемлемый соли.
Для иллюстрации на Схемах 1-52 представлены общие способы получения соединений согласно настоящему изобретению, а также ключевых промежуточных соединений. Для более подробного описания конкретных реакционных стадий, см. Примеры, представленные далее в настоящей заявке. Специалистам в данной области техники станет понятно, что для синтеза соединений согласно настоящему изобретению можно применять другие способы синтеза. Хотя конкретные исходные вещества и реагенты представлены в Схемах и описаны далее, их можно легко заменить на другие исходные вещества и реагенты для получения различных производных и/или условий проведения реакций. В дополнение, многие соединения, получаемые способами, описанными ниже, могут быть дополнительно модифицированы в свете настоящего описания с применением подходящей химии, хорошо известной специалистам в данной области техники.
При получении соединений согласно настоящему изобретению может быть необходима защита необходимых на будущих стадиях функций (например, первичного или вторичного амина) промежуточных соединений. Необходимость в указанной защите изменяется в зависимости от природы необходимой на будущих стадиях функции и условий способов получения. Подходящие амино-защитные группы включают ацетил, трифторацетил, т-бутоксикарбонил (ВОС), бензилоксикарбонил (CBz) и 9-флуоренилметиленоксикарбонил (Fmoc). Необходимость в указанной защите станет легко попятной специалистам в данной области техники. Для общего описания защитных групп и их применения, см. работу Т.В.Грина (T.W.Greene), Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
СХЕМЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ

На Схеме 1 представлен общий способ получения промежуточного триазинового соединения 2 из 2,4,6-тригалоген-1,3,5-триазинового реагента (1), где Hal представляет собой Cl, Br или I, a R1 определен для соединений формул Ia-d, или его предшественников, или пролекарств.

На Схеме 2 представлен общий способ получения промежуточного триазинового соединения 3 из 2,4,6-тригалоген-1,3,5-триазинового реагента (1), где Hal представляет собой Cl, Br или I, a R1 определен для соединений формул Ia-d, или его предшественников, или пролекарств.

На Схеме 3 представлен общий способ селективного замещения галида из бис-галогентриазинового промежуточного соединения 2 морфолином в органическом растворителе с получением промежуточных морфолинотриазиновых соединений 4, где Hal представляет собой Cl, Br или I, a R1определен для соединений формул Ia-d, или его предшественников, или пролекарств.

На Схеме 4 представлен общий способ селективного замещения двух галидов из трис-галогентриазина 1 морфолином в органическом растворителе с получением бис-морфолинотриазинового промежуточных соединений 5, где Hal представляет собой Cl, Br или I.
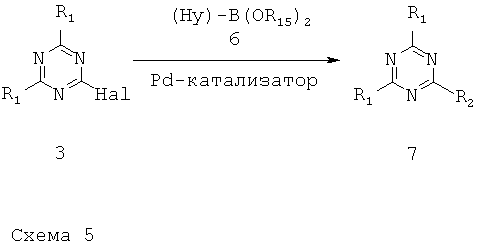
На Схеме 5 представлен общий способ сочетания по Сузуки 1-галогентриазинового промежуточного соединения 3 и реагента циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (7) формул Ia, где Hal представляет собой Cl, Br или I, a R1 и R2 описаны для соединений формулы 1а, или предшественников или пролекарств. Для обзора реакции Сузуки, см. работу Miyaura et al., (1995), Chem. Rev. 95:2457-2843; Suzuki A., (1999), J. Organomet. Chem. 576:147-168; Suzuki A. in Metal-Catalyzed Cross-Coupling Reactions, Diederich F., Stang P.J., Eds., VCH, Weinheim, DE (1998), pp 49-97. Палладиевый катализатор может представлять собой любой катализатор, который, как правило, применяют для кросс-сочетания по Сузуки, такой как PdCl2(PPh3)2, Pd(PPh3)4, Pd(OAc)2, PdCl2(dppf)-DCM, Pd2(dba)3/Pt-Bu)3 Owens et al., 2003 Bioorganic & Med. Chem. Letters 13:4143-4145; Molander et al., 2002 Organic Letters 4(11): 1867-1870; US 6448433).

На Схеме 6 представлен общий способ сочетания по Сузуки промежуточного 1-галогенморфолинотриазинового соединения 4 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (8) формул Ia, где Hal представляет собой Cl, Br или I, a R1 и R2 описаны для соединений формулы Ia, или его предшественников или пролекарств.

На Схеме 7 представлен общий способ сочетания по Сузуки промежуточного 1-галогенбис-морфолинотриазионого соединения 5 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (9) формул Ib, где Hal представляет собой Cl, Br или I, a R2 описан для соединений формулы Ib, или его предшественников или пролекарств.

На Схеме 8 представлен общий способ получения промежуточного триазинового соединения 10 из 2,4,6-тригалоген-1,3,5-триазинового реагента (1), где Hal представляет собой Cl, Br или I; и R'1 и Ya определены для соединений формулы Ic, или его предшественников или пролекарств.

На Схеме 9 представлен общий способ получения промежуточного триазипового соединения 11 из 2,4,6-тригалоген-1,3,5-триазинового реагента (1), где Hal представляет собой Cl, Br или I; и R'1 и Ya определены для соединений формулы Ic, или его предшественников или пролекарств.
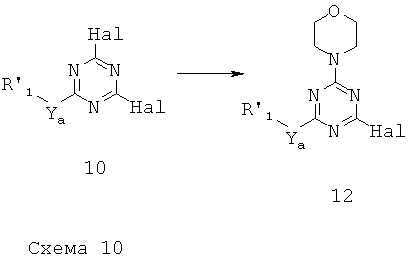
На Схеме 10 представлен общий способ получения промежуточного триазинового соединения 12 из 2,4,6-тригалоген-1,3,5-триазинового реагента (1), где Hal представляет собой Cl, Br или I; и R'1 и Ya определены для соединений формулы Ic, или его предшественников или пролекарств.

На Схеме 11 представлен общий способ получения промежуточного триазинового соединения 12 из промежуточного триазинового соединения 13, где Hal представляет собой Cl, Br или I; и R'1 и Ya определены для соединений формулы Ic, или его предшественников или пролекарств.

На Схеме 12 представлен общий способ сочетания по Сузуки промежуточного триазинового соединения 11 и циклической гетероарилбороповой кислоты (R15=H) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (14), где Hal представляет собой Cl, Br или I, a R'1 и Ya определены для соединений формулы Ic, R2 определен для соединений формулы I, или его предшественников или пролекарств.

На Схеме 13 представлен общий способ сочетания по Сузуки промежуточного триазинового соединения 12 и циклической гетероарилбороновой кислоты (R15=H) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (15), где Hal представляет собой Cl, Br или I, a R'1 и Ya определены для соединений формулы Ic, R2 определен для соединений формулы I, или его предшественников или пролекарств.

На Схеме 14 представлен общий способ сочетания по Сузуки промежуточного триазинового соединения 12 и циклической гетероарилбороновой кислоты (R15=H) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (16), где R'1 и Ya определены для соединений формулы Ic, R5, R6 и W определены для соединений формулы Id, или его предшественников или пролекарств.

На Схеме 15 представлен общий способ сочетания по Сузуки промежуточного триазинового соединения 12 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (17), где R'1 и Ya определены для соединений формулы Ic, R5, R6, R7 и W определены для соединений формулы Id, или его предшественников или пролекарств.

На Схеме 16 представлен общий способ получения триазиновых соединений 17 из триазиновых соединений 16, где R'1 и Ya определены для соединений формулы Ic, R5, R6, R7 и W определены для соединений формулы Id, или его предшественников или пролекарств.

На Схеме 17 представлен общий способ получения промежуточного пиридинового соединения 19 из 2,4,6-тригалогенпиридинового реагента (18), где Hal представляет собой Cl, Br или I, a R1 определен для соединений формулы I, или его предшественников или пролекарств.

На Схеме 18 представлен общий способ получения промежуточного пиридинового соединения 20 из 2,4,6-тригалогенпиридинового реагента (18), где Hal представляет собой Cl, Br или I, a R1 определен для соединений формулы I, или его предшественников или пролекарств.
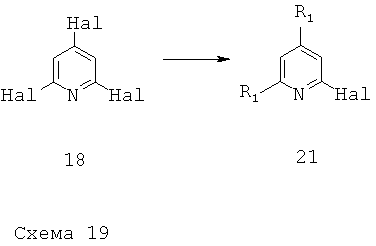
На Схеме 19 представлен общий способ получения промежуточного пиридинового соединения 21 из 2,4,6-тригалогенпиридинового реагента (18), где Hal представляет собой Cl, Br или I, a R1 определен для соединений формулы I, или его предшественников или пролекарств.

На Схеме 20 представлен общий способ получения промежуточного пиридинового соединения 22 из 2,4,6-тригалогенпиридинового реагента (18), где Hal представляет собой Cl, Br или I, a R1 определен для соединений формулы I, его предшественников или пролекарств.

На Схеме 21 представлен общий способ получения промежуточного пиридинового соединения 21 из дигалогенпиридинового реагента 19, где Hal представляет собой Cl, Br или I, a R1 определен для соединений формулы I, или его предшественников или пролекарств.

На Схеме 22 представлен общий способ получения промежуточного пиридинового соединения 22 из дигалогенпиридинового реагента 19, где Hal представляет собой Cl, Br или I, a R1 определен для соединений формулы I, или его предшественников или пролекарств.

На Схеме 23 представлен общий способ получения промежуточного пиридинового соединения 21 из дигалогенпиридинового реагента 20, где Hal представляет собой Cl, Br или I, а R1 определен для соединений формулы I, его предшественников или пролекарств.

На Схеме 21 представлен общий способ получения промежуточного пиридинового соединения 23 из 2,4,6-тригалогенпиридинового (18) и морфолинового реагентов, где Hal представляет собой Cl, Br или I, или его предшественников или пролекарств.

На Схеме 22 представлен общий способ получения промежуточного пиридинового соединения 24 из 2,4,6-тригалогенпиридинового (18) и морфолинового реагентов, где Hal представляет собой Cl, Br или I, или его предшественников или пролекарств.

На Схеме 23 представлен общий способ получения промежуточного пиридинового соединения 25 из 2,4,6-тригалогенпиридинового (18) и морфолинового реагентов, где Hal представляет собой Cl, Br или I.

На Схеме 24 представлен общий способ получения промежуточного пиридинового соединения 26 из 2,4,6-тригалогенпиридинового (18) и морфолинового реагентов, где Hal представляет собой Cl, Br или I.

На Схеме 25 представлен общий способ сочетания по Сузуки промежуточного 1-галогенпиридинового соединения 21 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (27) формулы I, где Hal представляет собой Cl, Br или I; a R1 и R2 определены для соединений формулы I или его предшественников или пролекарств.

На Схеме 26 представлен общий способ сочетания по Сузуки промежуточного 1-галогенпиридинового соединения 22 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (28) формулы I, где Hal представляет собой Cl, Br или I; a R1 и R2 определены для соединений формулы I или его предшественников или пролекарств.

На Схеме 27 представлен общий способ сочетания по Сузуки промежуточного диморфолинопиридинового соединения 25 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (29) формулы I, где Hal представляет собой Cl, Br или I; a R2 определен для соединений формулы I или его предшественников или пролекарств.

На Схеме 28 представлен общий способ сочетания по Сузуки промежуточного диморфолинопиридинового соединения 26 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений (30) формулы I, где Hal представляет собой Cl, Br или I; a R2 определен для соединений формулы I или его предшественников или пролекарств.

На Схеме 29 представлен общий способ получения промежуточного пиридинового соединения 32 из 2,4,6-тригалогенпиридинового реагента (18), где Hal представляет собой Cl, Br или I; a R'1 и Ya определены для соединений формулы Ie, или его предшественников или пролекарств.

На Схеме 30 представлен общий способ получения промежуточного пиридинового соединения 33 из 2,4,6-тригалогенпиридинового реагента (18), где Hal представляет собой Cl, Br или I; a R'1 и Ya определены для соединений формулы Ie, или его предшественников или пролекарств.

На Схеме 31 представлен общий способ получения промежуточного пиридинового соединения 34 из дигалогенпиридинового реагента, где Hal представляет собой Cl, Br или I; а R'1 и Ya определены для соединений формулы Ie, R1 определен для соединений формулы I, или его предшественников или пролекарств.

На Схеме 32 представлен общий способ получения промежуточного пиридинового соединения 34 из дигалогенпиридинового реагента (32), где Hal представляет собой Cl, Br или I; a R'1 и Ya определены для соединений формулы Ie, R1 определен для соединений формулы I, или его предшественников или пролекарств.

На Схеме 33 представлен общий способ получения промежуточного морфолинопиридинового соединения 36 из дигалогенпиридинового реагента, где Hal представляет собой Cl, Br или I; a R'1 и Ya определены для соединений формулы Ie, или его предшественников или пролекарств.

На Схеме 34 представлен общий способ получения промежуточного морфолинопиридинового соединения 37 из дигалогенпиридинового реагента, где Hal представляет собой Cl, Br или I; a R'1 и Ya определены для соединений формулы Ie, или его предшественников или пролекарств.
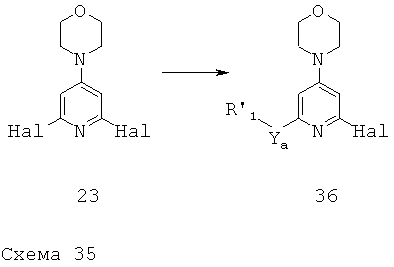
На Схеме 35 представлен общий способ получения промежуточного морфолинопиридинового соединения 36 из морфолинодигалогенпиридинового реагента 23, где где Hal представляет собой Cl, Br или I; a R'1 и Ya определены для соединений формулы Ie, или его предшественников или пролекарств.

На Схеме 36 представлен общий способ получения промежуточного морфолинопиридинового соединения 37 из морфолинодигалогенпиридинового реагента 24, где где Hal представляет собой Cl, Br или I; a R'1 и Ya определены для соединений формулы Ie, или его предшественников или пролекарств.

На Схеме 37 представлен общий способ получения промежуточного морфолинопиридинового соединения 38 из морфолинодигалогенпиридинового реагента 24, где где Hal представляет собой Cl, Br или I; a R'1 и Ya определены для соединений формулы Ie, или его предшественников или пролекарств.

На Схеме 38 представлен общий способ сочетания по Сузуки промежуточного пиридинового соединения 34 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений 39 формулы I, где Hal представляет собой Cl, Br или I; R'1 и Ya определены для соединений формулы Ie, a R1 и R2 определены для соединений формулы I, или их предшественников или пролекарств.

На Схеме 39 представлен общий способ сочетания по Сузуки промежуточного пиридинового соединения 35 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (Ri5=алкил) 6 с получением циклических гетероарильных (Ну) соединений 40 формулы I, где Hal представляет собой Cl, Br или I; R'1 и Ya определены для соединений формулы Ie, a R1 и R2 определены для соединений формулы I, или их предшественников или пролекарств.

На Схеме 40 представлен общий способ сочетания по Сузуки промежуточного пиридинового соединения 36 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений 41 формулы Ie, где Hal представляет собой Cl, Br или I; R'1 и Ya определены для соединений формулы Ie, a R2 определен для соединений формулы I, или их предшественников или пролекарств.

На Схеме 41 представлен общий способ сочетания по Сузуки промежуточною пиридинового соединения 37 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений 42 формулы Ie, где Hal представляет собой Cl, Br или I; R'1 и Ya определены для соединений формулы Ie, a R2 определен для соединений формулы I, или их предшественников или пролекарств.

На Схеме 42 представлен общий способ сочетания по Сузуки промежуточного пиридинового соединения 38 и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением циклических гетероарильных (Ну) соединений 43 формулы Ie, где Hal представляет собой Cl, Br или I; R'1 и Ya определены для соединений формулы Ie, a R2 определен для соединений формулы I, или их предшественников или пролекарств.

На Схеме 43 представлен общий способ получения промежуточных тиазолопиримидиновых и оксазолопиримидиновых соединений 48 и 49 из 5-карбоксисложного эфира, 4-аминотиазола (X=S) и оксазола (X=О), и 4-карбоксисложного эфира, 5-аминотиазола (X=S) и оксазола (X=О), соответственно реагентов 44 и 45, где Yb представляет собой О или S, Hal представляет собой Cl, Br или I;
R8 и R10 определены для формул If-g.

На Схеме 44 представлен общий способ селективного замещения 7-галида из промежуточных бис-галогентиазолопиримидиновых и бис-галогеноксазолопиримидиновых соединений 48 и 49 морфолином с основных условиях в органическом растворителе с получением 5-галоген-7-морфолинотиазоло- и оксазолопиримидиновых соединений 50 и 51, где Yb представляет собой О или S, Hal представляет собой Cl, Br или I; a R8 определен для формул If-g.

На Схеме 45 представлен общий способ получения производных по положению 2 для тиазолопиримидиновых и оксазолопиримидиновых соединений 52 и 53, в которых R8 представляет собой H. Обработка 52 и 53 литирующим реагентом для удаления протона в положении 2 с последующим добавлением ацилирующего реагента R10C(O)Z, где Z представляет собой уходящую группу, такую как галид, NHS сложный эфир, карбоксилат или диалкиламино, приводит к получению 5-галоген-7-морфолино-2-ацилтиазолопиримидинового и оксазолопиримидинового соединения 54 и 55, где Yb представляет собой О или S, Hal представляет собой Cl, Br или I; a R10 определен для формулы If-g.

На Схеме 46 представлен общий способ сочетания по Сузуки промежуточного 5-галогенпиримидинового соединения (50 и 51) и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением 5-циклический гетероарил (Ну)-7-морфолинотиазолопиримидинового и оксазолопиримидинового соединений (52 и 53) формул If-g, где Yb представляет собой О или S, Hal представляет собой Cl, Br или I; a R10 определен для соединений формул If-g, или предшественников или пролекарств. Для обзора реакции Сузуки, Miyaura et al., 1995 Chem. Rev. 95:2457-2483; Suzuki A., 1999, J. Organomet. Chem. 576:147-168; Suzuki A. in Metal-Catalyzed Cross-Coupling Reactions, Diedrich P., Stang P.J., Eds., VCH, Weinheim, DE (1998), pp 49-97. Палладиевый катализатор может представлять собой любой катализатор, который, как правило, применяют для кросс-сочетаний по Сузуки, такой как PdCl2(PPh3)2, Pd(PPh3)4, Pd(OAc)2, PdCl2(dppf)-DCM, Pd2(dba)3/Pt-Bu)3 Owens et al., 2003 Bioorganic & Med. Chem. Letters 13:4143-4145; Molander et al., 2002 Organic Letters 4(11): 1867-1870; US 6448433).

На Схеме 47 представлен общий способ окисления серы в клетках тиено- и тиазолопиримидиновых соединений 56 и 57 посредством цитохромов. После окисления серы в тиофенпиримидиновых соединениях 54 (ИС Piramed/Roche) тиофеновое кольцо выступает в качестве активированной системы Михаэля, в которой возможна нуклеофильная атака по положению 7, а следовательно, возможна быстрая модификация в клетке тиенопиримидиновых соединений 54. По сравнению с тиенопиримидинами тиазолопиримидиновые соединения 55 являются более химически стабильными за счет N-атома в положении 7, при этом не возможна нуклеофильная атака после окисления серы.

На Схеме 48 представлен общий способ получения линкер-TAG-модифицированных конденсированных пиримидиновых соединений 59 из промежуточного морфолиносодержащего соединения 58, где Ну представляет собой циклический гетероарильный фрагмент, Yb и Z определены для соединений формулы If-g, линкер и TAG определены для соединений формулы I, или предшественников или пролекарств.

На Схеме 49 представлен общий способ получения конденсированных пиримидиновых промежуточных соединений 64 и 65 из, например, 2-карбоксамида, 3-аминобензофурана и 3-аминофуропиридина (X=О, L=С) и 2-карбоксамида, 3-аминобепзотиофена и 3-аминотиенопиридина (X=S, L=С), соответственно соединений 60 и 61, где Yc представляет собой О или S, Hal представляет собой Cl, Br или I; a R9 и L определены для формул Ih-i.

На Схеме представлен общий способ селективного замещения 4-галида промежуточных конденсированных бис-галогенпиримидиновых соединений 66 и 67 морфолином в основных условиях в органическом растворителе с получением конденсированного 2-галоген-4-морфолинопиримидиновых соединений 68 и 69, где Yc представляет собой О или S, Hal представляет собой Cl, Br или I; а R9 и L определены для формул Ih-i.

На Схеме 51 представлен общий способ сочетания по Сузуки 2-галогенпиримидипового промежуточного соединения (70 и 71) и циклической гетероарилбороновой кислоты (R15=Н) или ее сложного эфира (R15=алкил) 6 с получением конденсированного 2-циклический гетероарил (Ну)-4-морфолинопиримидиновых соединений (72 и 73) формул Ih-i, где Yc представляет собой О или S, Hal представляет собой Cl, Br или I; a R9 и L определены для формул Ih-i, или предшественников или пролекарств. Для обзора реакции Сузуки, см.: Miyaura et al., 1995 Chem. Rev. 95:2457-2483; Suzuki A., 1999, J. Organomet. Chem. 576:147-168; Suzuki A. in Metal-Catalyzed Cross-Coupling Reactions, Diedrich F., Stang P.J., Eds., VCH, Weinheim, DE (1998), pp 49-97. Палладиевый катализатор может представлять собой любой катализатор, который, как правило, применяют для кросс-сочетаний по Сузуки, такой как PdCl2(PPh3)2, Pd(PPh3)4, Pd(OAc)2, PdCl2(dppf)-DCM, Pd2(dba)3/Pt-Bu)3 (Owens et al., 2003 Bioorganic & Med. Chem. Letters 13:4143-4145: Molander et al., 2002 Organic Letters 4(11): 1867-1870; US 6448433).

На Схеме 52 представлен общий способ получения линкер-TAG-модифицированных конденсированных пиримидиновых соединений 75 из промежуточного морфолиносодержащего соединения 74, где Ну представляет собой циклический гетероарильный фрагмент, Yc и L определены для соединений формулы Ih-i, связывающий фрагмент и TAG определены для соединений формулы I, или их предшественников или пролекарств.
ОБЩИЕ МЕТОДИКИ ПОЛУЧЕНИЯ
Общая методика А Замещение триазинов:

Раствор 2,4,6-трихлор-1,3,5-триазина (1,00 г, 5,42 ммоль, 1,0 экв.) в диоксане (15 мл) при комнатной температуре обрабатывали диизопропилэтиламином (1,03 мл, 5,96 ммоль, 1,1 экв.) и по каплям добавляли аминопиридин (1,1 экв.) и перемешивали в течение 2 часов. Выпаривали диоксан в вакууме и разделяли остаток между H2O (15 мл) и CH2Cl2 (15 мл). Отделяли органический слой, а водный слой дополнительно экстрагировали CH2Cl2 (2×10 мл). Объединенные экстракты сушили (MgSO4) и концентрировали в вакууме. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Общая методика А-1 Замещение триазинов:

Раствор бис-хлортриазипового соединения (100 мг, 390 µмоль, 1,0 экв.) в диоксане (1 мл) при комнатной температуре обрабатывали диизопропилэтиламином (0,10 мл, 590 µмоль, 1,5 экв.) и морфолином (0,05 мл, 590 µмоль, 1,5 экв.) и перемешивали при комнатной температуре в течение 2 часов. Выпаривали диоксан в вакууме и разделяли остаток в H2O (5 мл) и CH2Cl2 (5 мл). Отделяли органический слой, а водный слой дополнительно экстрагировали CH2Cl2 (2×2 мл). Объединенные экстракты сушили (MgSO4) и концентрировали в вакууме. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Примечание: для некоторых соединений необходимым являлось добавление дополнительного количества морфолина (0,3 экв.) через 12 часов прохождения реакции, затем реакционную смесь нагревали при 70°С в течение 8 часов.
Общая методика А-2 Замещение триазинов:

247 мг NaH (60% в минеральном масле, 10,3 ммоль, 0,95 экв.) добавляли к раствору 2-пиримидинметанола (940 ил, 9,76 ммоль, 0,90 экв.) в ТГФ (20 мл) при комнатной температуре и перемешивали в течение 30 минут. После охлаждения до -78°С но каплям добавляли 2,4,6-трихлор-1,3,5-триазин (2,00 г, 10,84 ммоль, 1,0 экв.) и оставляли реакционную смесь нагреваться до комнатной температуры и перемешивали в течение 3 часов. Добавляли насыщенный водный раствор NH4Cl (20 мл) и смесь экстрагировали EtOAc (20 мл). Органическую фазу сушили (MgSO4) и выпаривали в вакууме. Колоночная хроматография позволила получить целевой продукт.
Общая методика В Сочетание по Сузуки:

Реакция сочетания по Сузуки является применимой для присоединения циклического гетероарила в положение 6 триазинового или пиридинового кольца (см. Схемы 7 и 27), в положение 5 или 6 пиримидинового кольца (см. Схемы 46 и 51). Как правило, 4,4'-(6-хлор-1,3,5-триазип-2,4-диил)диморфолин (77), 4,4'-(6-хлорпиридии-2,4-диил)диморфолин (79), 4-(5-хлортиазоло[4,5-d]пиримидин-7-ил)морфолин (81) и 2-хлор-4-морфолинобензофуро[3,2-d]пиримидин (83) можно объединить с пинаколиновым эфиром бороновой кислоты (4,0 экв.) в 1,2-диметоксиэтане и 2М Na2CO3 (3:1) в течение 15 минут. Добавляли каталитическое количество, или более, палладиевого реагента, такого как дихлор 1,1'-бис(дифенилфосфино)ферроцена палладия(II) (0,025 экв.) и стеклянный сосуд, стойкий к давлению, продваули газообразным аргоном и герметизировали. Вместо пинаколинового эфира бороновой кислоты можно применять различные бороновые кислоты или сложные эфиры бороновых кислот. Также в качестве альтернативы, азот пиримидин-2-амина может быть защищен, например, тетрагидропиранильной группой. Затем реакционную смесь нагревали при 90°С в течение 15 часов или более, охлаждали и разбавляли этилацетатом. Органический раствор промывали смесью вода: Na2CO3: NH4OH (конц. 32% раствор NH4OH в воде)=5:4:1, NH4Cl (насыщ.) и солевым раствором, сушили MgSO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной флэш-хроматографии на силикагеле или, в случае необходимости, при помощи обращено-фазовой ВЭЖХ.
Общая методика С Амидное сочетание:

7-Морфолино-5-(пиримидин-5-ил)тиазоло[4,5-d]пиримидин-2-карбоновую кислоту (84) или пиридинилфуранопиримидин 86 обрабатывали 1,5 экв. HATU, 3 экв. алкиламина (R-NH2 и 3 экв. DIPEA в ДМФ до достижения концентрации, равной примерно 0,1М. Реакционную смесь перемешивали до завершения прохождения реакции и однократно экстрагировали в этилацетате и насыщенном растворе бикарбоната. Органический слой сушили, фильтровали и концентрировали с получением неочищенного промежуточного соединения. Указанное промежуточное соединение очищали при помощи колоночной хроматографии или препаративной ТСХ с получением продукта 85 или 87.
Общая методика С-1 Амидное сочетание:

4-(2-(Пиперазин-1-илметил)-5-(пиримидин-5-ил)тиазоло[4,5-d]пиримидин-7-ил)морфолин (88) или пиридинилфуропиримидин 90 обрабатывали 1,5 экв. HATU, 3 экв. карбоновой кислоты (RCO2H) и 3 экв. DIPEA в ДМФ до достижения концентрации, равной примерно 0,1М. Реакционную смесь перемешивали до завершения прохождения реакции и однократно экстрагировали в этилацетате и насыщенном растворе бикарбоната. Органический слой сушили, фильтровали и концентрировали с получением неочищенного промежуточного соединения, которое применяли без дополнительной очистки или которое при необходимости очищали при помощи препаративной ТСХ.
Общая методика D Восстановительное аминирование:

7-Морфолино-5-(пиримидин-5-ил)тиазоло[4,5-d]пиримидин-2-карбальдегид (92) или пиридинилфуропиримидин 94 растворяли до достижения 0,2М концентрации в дихлорэтане. К указанному раствору добавляли от 1,5 до 2,0 эквивалентов амина (R'R''NH), 10 эквивалентов триметилортоформиата и 1 эквивалент уксусной кислоты. Оставляли смесь перемешиваться в течение 2-6 часов перед добавлением 1,5 эквивалентов триацетоксиборгидрида натрия. После 12-16 часов перемешивания реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия и несколько раз экстрагировали этилацетатом. Указанное промежуточное соединение очищали на силикагеле или применяли неочищенным на следующих реакционных стадиях.
Общая методика Е Образование сульфонамида:

7-Морфолино-5-(пиримидин-5-ил)тиазоло[4,5-d]пиримидин-2-сульфонилхлорид (96) суспендировали в 1 мл метиленхлорида перед добавлением 2 экв. амина (R'R''NH) и 3 экв. DIPEA. Прохождение реакции контролировали при помощи ТСХ до завершения. Неочищенные реакционные смеси разбавляли этилацетатом, экстрагировали насыщенным раствором хлорида аммония и однократно реэкстрагировали в этилацетате. Органические слои объединяли и концентрировали насухо. Неочищенные промежуточные сульфонамидные соединения 97 непосредственно применяли в последующем сочетании по Сузуки.
Общая методика F Синтез альдегида:

К суспензии 4-(5-(пиримидин-5-ил)тиазоло[4,5-d]пиримидин-7-ил)морфолина (6,85 ммоль, 1,0 экв.) в сухом ТГФ (40 мл) при -78°С добавляли 2,5М раствор н-бутиллития (n-BuLi) в гексане (1,2 экв.). После перемешивания в течение 1 часа добавляли сухой ДМФ (1,5 экв.). Реакционную смесь перемешивали в течение 1 часа при -78°С, затем медленно нагревали до комнатной температуры. После дополнительного выдерживания в течение 2 часов при комнатной температуре реакционную смесь выливали в смесь лед/вода с получением осадка, который собирали при помощи фильтрования и сушили на воздухе с получением титульного соединения.
СПОСОБЫ РАЗДЕЛЕНИЯ
В способах получения соединений согласно настоящему изобретению разделение продуктов реакции друг от друга и/или от исходных веществ может являться преимуществом. Целевые продукты каждой стадии или серии стадий разделяют и/или очищают (далее - разделяют) до необходимой степени гомогенности при помощи общепринятых в данной области техники способов. Как правило, указанные разделения включают многофазовую экстракцию, кристаллизацию из растворителя или смеси растворителей, перегонку, сублимацию или хроматографию. Хроматография может включать целый ряд способов, включая, например, обращено-фазовую и нормально-фазовую хроматографию; эксклюзионную хроматографию; ионообменную хроматографию; способы и оборудование жидкостной хроматографии высокого, среднего и низкого давления; аналитическая хроматографию для определения небольших количеств соединений; хроматографию на псевдоподвижном слое (SMB) и препаративную тонко- или толстослойную хроматографию, а также способы тонкослойной и флэш-хроматографии для определения небольших количеств веществ.
Другой класс способов разделения включает обработку смеси реагентом, выбранном для связывания или разделения другим способом целевого продукта, непрореагировавшего исходного вещества, побочного продукта реакции и т.д. Указанные реагенты включают адсорбенты и абсорбенты, такие как активированный уголь, молекулярные сита, ионообменные среды и т.д. Как альтернатива, реагенты могут представлять собой кислоты в случае основных веществ, основания в случае кислотных веществ, связывающие реагенты, такие как антитела, связывающие белки, селективные хелаторы, такие как краун-эфиры, экстрагирующие ионы реагенты в системе жидкость/жидкость (LIX) и т.д.
Выбор подходящих способов разделения зависит от природы содержащихся веществ. Например, температура кипения и молекулярная масса при перегонке и сублимации, наличие или отсутствие полярных функциональных групп при хроматографии, стабильность веществ в кислотной и основной среде при многофазовой экстракции и т.д. Специалист в данной области техники станет применять способы, наиболее подходящие для осуществления необходимого разделения.
Диастереомерные смеси могут быть разделены на индивидуальные диастереомеры на основании различий в химических свойствах при помощи способов, известных специалистам в данной области техники, таких как хроматография и/или фракционная кристаллизация. Энантиомеры могут быть разделены при помощи превращения энантиомерной смеси в диастереомерную смесь при помощи взаимодействия с соответствующим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорид кислоты Мошера), разделения диастереомеров и превращения (например, гидролиза) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Также, некоторые соединения согласно настоящему изобретению могут представлять собой атропоизомеры (например, замещенные биарилы) и рассматриваться как часть настоящего изобретения. Энантиомеры также могут быть разделены с применением хиральной колонки ВЭЖХ.
Единственный стереоизомер, например, энантиомер, по существу не содержащий свои стереоизомеры, может быть получен при помощи перерастворения рацемической смеси с применением способа, такого как образование диастереомеров с применением оптически активных перерастворяющих агентов (Е.Эльель и С.Вилен (Eliel E. and Wilen S.) «Stereochemistry of Organic Compounds», John Wiley & Sons, Inc., New York, 1994; K.X. Лохмюллер (Lochmuller C.H., 1975) J. Chromatogr., 113(3):283-302). Рацемические смеси хиральных соединений согласно настоящему изобретению могут быть разделены и выделены любым подходящим способом, включая: (1) образование ионных диастереомерных солей с хиральными соединениями и разделение при помощи фракциональной кристаллизации или других способов, (2) образование диастереомерных соединений с хиральными дериватизирующими реагентами, разделение диастереомеров и превращение в чистые стереоизомеры, и (3) разделение по существу чистых стереоизомеров или стереоизомеров, содержащих преимущественно один из изомеров, непосредственно в хиральных условиях. См.: «Drug Stereochemistry, Analytical Methods and Pharmacology», Ирвинг В.Вайнер (Irving W. Wainer), Ed., Varcel Dekker, Inc., New York (1993).
В способе (1) диастереомерные соли могут быть получены в результате взаимодействия энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, α-метил-β-фенилэтиламин (амфетамин) и т.д. с асимметрическими соединениями, содержащими кислотную функцию, такими как карбоновые кислоты и сульфокислоты. Могут быть получены диастереомерные соли для разделения при помощи фракционной кристаллизации или ионной хроматографии. Для разделения оптических изомеров аминосоединений, добавление хиральных карбоновых или сульфокислот, таких как камфорсульфокислота, винная кислота, миндалевая кислота или молочная кислота, может привести к получению диастереомерных солей.
Как альтернатива, в способе (2), субстрат, который необходимо перерастворить, взаимодействует с одним из энантиомеров хирального соединения с образованием диастереомерной пары (Е.Эльель и С.Вилен (Eliel E. and Wilen S.) «Stereochemistry of Organic Compounds», John Wiley & Sons, Inc., New York, 1994, стр.322). Дистереомерные соединения могут быть получены при помощи взаимодействия асимметрических соединений с энантиомерно чистыми хиральными дериватизирующими реагентами, такими как ментиловые производные, последующего разделения диастереомеров и гидролиза с получением чистого энантиомера или энантиомера, содержащего преимущественно один из изомеров. Способ определения оптической чистоты включает получение хиральных сложных эфиров, таких как ментиловый сложный эфир, например, (-) ментилхлорформиат, в присутствии основания или сложного эфира Мошера, α-метокси-α-(трифторметил)фенилацетата (Jacob III. J. Org. Chem. (1982) 47:4165), или рацемической смеси и анализа1Н ЯМР спектра на наличие двух атропоизомерных энантиомеров или диастереомеров. Стабильные диастереомеры атропоизомерных соединений могут быть разделены и выделены при помощи нормально- и обращено-фазовой хроматографии, затем способами разделения атропоизомерных нафтил-изохинолинов (WO 96/15111). В способе (3) рацемическая смесь двух энантиомеров может быть разделена при помощи хроматографии с применением хиральной неподвижной фазы («Chiral Liquid Chromalography» (1989) В. Дж. Лоу (W.J.Lough), Ed., Chapman and Hall, New York; Окамото (Okamoto) J. Chromatogr., (1990), 513:375-378). Насыщенные или очищенные энантиомеры можно различить при помощи способов, применяемых для различения других хиральных молекул с асимметрическими атомами углерода, таких как оптическое вращение и циркулярный дихроизм.
ВВЕДЕНИЕ СОЕДИНЕНИЙ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Соединения согласно настоящему изобретению могут быть введены любым способом, подходящим для состояния, требующего лечения. Подходящие способы включают оральный, парентеральный (включая подкожный, внутримышечный, внутривенный, внутриартериальный, внутрикожный, интратекальный и эпидуральный), трансдермальный, ректальный, назальный, местный (включая трансбуккальный и подъязычный), вагинальный, интраперитонеальный, внутрилегочный и интраназальный. Для местного иммуносупрессивного лечения соединения могут быть введены при помощи внутритканевого введения, включая опрыскивание или другое взаимодействие трансплантанта и ингибитора перед трансплантацией. Следует понимать, что предпочтительный способ введения может изменяться, например, в зависимости от состояния пациента. При оральном введении соединение может входить в состав пилюль, капсул, таблеток и т.д. с фармацевтически приемлемым носителем или наполнителем. При парентеральном введении соединение может входить в состав с фармацевтически приемлемым парентеральным носителем и в инъецируемой дозированной лекарственной форме, как показано ниже.
Дозировка для лечения пациентов-людей может изменяться от примерно 10 мг до примерно 1000 мг соединения формул Ia-d. Типичная доза может составлять от примерно 100 мг до примерно 300 мг соединения. Доза может быть введена один раз в день (QID), два раза в день (BID) или более часто в зависимости от фармакокинетических и фармакодинамических свойств, включая абсорбцию, распределение, метаболизм и экскрецию конкретного соединения. В дополнение, факторы токсичности могут влиять на дозировку и схему введения. При оральном введении пилюля, капсула или таблетка могут быть введены ежедневно или менее часто в течение конкретного периода времени. Схему лечения можно повторять на протяжении нескольких циклов лечения.
СПОСОБЫ ЛЕЧЕНИЯ СОЕДИНЕНИЯМИ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Соединения согласно настоящему изобретению являются применимыми для лечения заболеваний, состояний и/или нарушений, включающих, но не ограничивающихся только ими, заболевания, характеризуемые повышенной экспрессией липидкиназ, например, PI3 киназы. Соответственно, другой аспект настоящего изобретения включает способы лечения или профилактики заболеваний или состояний, которые могут быть вылечены или предотвращены в результате ингибирования липидкиназ, включая PI3. В одном из вариантов реализации способ включает введение млекопитающему, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения формул Ia-d или его стереоизомера, геометрического изомера, таутомера, сольвата, метаболита, N-оксидного производного или фармацевтически приемлемой соли или пролекарства.
Заболевания и состояния, которые возможно лечить в соответствии со способами согласно настоящему изобретению, включают, но не ограничиваются только ими, рак, инсульт, диабет, гепатомегалию, сердечно-сосудистые заболевания, болезнь Альцгеймера, кистозный фиброз, аутоиммунные заболевания, атеросклероз, рестеноз, псориаз, аллергические нарушения, воспаления, неврологические нарушения, заболевания, связанные с гормонами, состояния, связанные с трансплантацией органов, иммунологическую недостаточность, деструктивные поражения костей. гиперпролиферативные нарушения, инфекционные заболевания, состояния, связанные с гибелью клеток, агрегацию тромбоцитов, вызванную тромбином, хроническую миелогенную лейкемию (ХМЛ), заболевания печени, патологические иммунные состояния, включающие активацию Т-клеток, и нарушения ЦНС. В одном из вариантов реализации пациента-человека лечат соединением формул Ia-d и фармацевтически приемлемым носителем, адъювантом или веществом-носителем, где указанное вещество формул Ia-d присутствует в количестве для видимого ингибирования активности PI3 киназы.
Раковые заболевания, которые могут быть вылечены в соответствии со способами согласно настоящему изобретению, включают, но не ограничиваются только ими, рак груди, рак яичников, рак шейки матки, рак простаты, рак мужских половых желез, рак мочеполового тракта, рак пищевода, рак гортани, глиобластому, нейробластому, рак желудка, рак кожи, кератоакантому, рак легких, эпидермоидную карциному, крупноклеточную карциному, немелкоклеточную карциному легких (НМККЛ), мелкоклеточную карциному, аденокарциному легких, рак костей, рак толстой кишки, аденому, рак поджелудочной железы, аденокарциному, рак щитовидной железы, фолликулярную карциному, недифференцированную карциному, папиллярную карциному, семиному, меланому, саркому, карциному мочевого пузыря, карциному печени и желчного протока, карциному почек, нарушения спинного мозга, лимфатические нарушения, волосатоклеточный лейкоз, рак полости рта и глотки, рак губ, рак языка, рак полости рта, рак глотки, рак тонкого кишечника, рак толстой и прямой кишки, рак толстого кишечника, рак прямой кишки, рак мозга и центральной нервной системы, рак Ходжкина и лейкемию.
Сердечнососудистые заболевания, которые можно вылечить в соответствии со способами согласно настоящему изобретению, включают, но не ограничиваются только ими, рестеноз, кардиомегалию, атеросклероз, инфаркт миокарда и застойную сердечную недостаточность.
Нейродегенеративные заболевания, которые можно вылечить в соответствии со способами согласно настоящему изобретению, включают, но не ограничиваются только ими, болезнь Альцгеймера, болезнь Паркинсона, амиотропный латеральный склероз, болезнь Хантингтона и церебральную ишемию, также Нейродегенеративные заболевания, вызванные травмами, глутаматную нейротоксичность и гипоксию. Воспалительные заболевания, которые можно вылечить в соответствии со способами согласно настоящему изобретению, включают, но не ограничиваются только ими, ревматоидный артрит, псориаз, контактный дерматит и повышенную чувствительность замедленного типа.
В другом аспекте настоящего изобретения предложено соединение согласно настоящему изобретению, применяемое для лечения заболеваний или состояний, описанных в настоящей заявке, у млекопитающего, например, человека, страдающего от указанного заболевания или состояния. Также предложено применение соединения согласно настоящему изобретению для получения лекарственного средства для лечения заболеваний и состояний, описанных в настоящей заявке, у теплокровных животных, таких млекопитающие, например, человек, страдающих от подобного нарушения.
ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ
Для применения соединения согласно настоящему изобретению для терапевтического лечения (включая профилактическое лечение) млекопитающих, включая людей, вещество, как правило, входит в состав, в соответствии с общепринятой фармацевтической практикой, фармацевтической композиции. В соответствии с представленным аспектом настоящего изобретения предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению совместно с фармацевтически приемлемым разбавителем или носителем.
Типичный состав получают при помощи смешения соединения согласно настоящему изобретению и носителя, разбавителя или наполнителя. Подходящие носители, разбавители и наполнители хорошо известны специалистам в данной области техники и включают вещества, такие как углеводы, воски, водорастворимые и/или набухающие полимеры, гидрофильные или гидрофобные вещества, желатин, масла, растворители, воду и т.д. Конкретный применяемый носитель, разбавитель или наполнитель зависит от способов и целей, в которых соединение согласно настоящему изобретению применяют. Растворители, как правило, выбирают из растворителей, которые определены специалистами в данной области техники как безопасные (GRAS) для введения млекопитающему. В целом, безопасные растворители представляют собой нетоксичные водные растворители, такие как вода и другие нетоксичные растворители, которые растворяются или смешиваются с водой. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например, ПЭГ 400, ПЭГ 300) и т.д., а также их смеси. Составы также могут содержать один или более буфер, стабилизирующий агент, консервант, антиоксидант, рентгеноконтрастные агенты, глиданты, вещества для улучшения технологических свойств, красители, подсластители, ароматизирующие добавки, ароматизаторы и другие известные добавки для обеспечения удобной лекарственной формы лекарственного средства (т.е., соединения согласно настоящему изобретению или его фармацевтической композиции) или помощи при производстве фармацевтического продукта (т.е., лекарственного средства).
Составы могут быть получены с применением подходящих методик растворения и смешения. Например, массу лекарственного вещества (т.е., соединения согласно настоящему изобретению или стабилизированной формы соединения (например, комплекса с производным циклодекстрина или другим известным комплексообразующим агентом)) растворяют в подходящем растворителе в присутствии одного или более наполнителя, описанного выше. Соединение согласно настоящему изобретению, как правило, входит в состав фармацевтических дозируемых форм, что обеспечивает легко контролируемую дозировку лекарственного средства и обеспечивает соблюдение пациентом предписанного режима лечения.
Применяемая фармацевтическая композиция (или состав) может быть упакована различными способами в зависимости от способа, применяемого для введения лекарственного средства. Как правило, изделие для распространения включает контейнер, содержащий хранящийся в нем фармацевтический состав в соответствующей форме. Подходящие контейнеры хорошо известны специалистам в данной области техники и включают упаковки, такие как бутылки (пластиковые и стеклянные), сашеты, ампулы, пакеты, металлические цилиндры и т.д. Контейнер также может включать устройство для защиты от неумелого использования для предотвращения неосторожного доступа к содержимому упаковки. В дополнение, контейнер содержит бирку, на которой описано содержимое контейнера. Бирка также может содержать соответствующие предупреждения.
Фармацевтические составы соединений согласно настоящему изобретению могут быть получены для различных способов и типов введения. Например, соединение формул Ia-d, обладающее необходимой степенью чистоты, может быть возможно смешано с фармацевтически приемлемыми разбавителями, носителями, наполнителями или стабилизаторами (Remingrton's Pharmaceutical Sciences (1980) 16th Edition, Л. Эд. Осол (Osol A. Ed.)) в виде лиофилизированного состава, измельченного порошка или водного раствора, состав может быть получен в результате смешения при температуре окружающей среды при соответствующем pH, и при необходимой степени чистоты, с физиологически приемлемыми носителями, т.е., носителями, которые являются нетоксичными для пациентов в применяемых дозировках и концентрациях. рН состава зависит главным образом от конкретного применения и концентрации соединения, но может изменяться от примерно 3 до примерно 8. Подходящий вариант реализации представляет собой состав в ацетатном буфере с рН, равным 5.
Соединение согласно настоящему изобретению, применяемое для задач настоящей заявки, предпочтительно является стерильным. В частности, составы, применяемые для введения в организм, должны быть стерильными. Указанную стерилизацию легко осуществляют при помощи фильтрования через стерильные фильтрующие мембраны.
Соединение, как правило, можно хранить в виде твердой композиции, лиофилизированного состава или в виде водного раствора.
Фармацевтические композиции согласно настоящему изобретению должны быть составлены, дозированы и введены способом, т.е. в количествах, концентрациях, расписании, курсе лечения, носителе и способе введения, соответствующем надлежащей медицинской практике. Рассматриваемые в указанном контексте факторы включают конкретное нарушение, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние конкретного пациента, причину нарушения, место введения лекарственного средства, способ введения, схему введения и другие факторы, известные врачам-терапевтам. «Терапевтически эффективное количество» соединения, которое необходимо ввести, основано на следующих условиях, таких как минимальное количество, необходимое для профилактики, замедления или лечения нарушения механизма свертывания крови. Указанное количество предпочтительно является более низким по сравнению с количеством, которое является токсичным для пациента или делает пациента значительно более подверженным кровотечению.
Как общая норма, первоначальное фармацевтически эффективное количество ингибитора, вводимого парентерально, на дозу находится в диапазоне, составляющем примерно 0,01-100 мг/кг, более конкретно, примерно от 0,1 до 20 мг/кг тела пациента в день, причем типичный первоначальный диапазон концентрации применяемого соединения составляет от 0,3 до 15 мг/кг/день.
Подходящие разбавители, носители, наполители и стабилизаторы являются нетоксичными для пациентов в применяемых дозировках и концентрациях, и включают буферы, такие как фосфорная, лимонная и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (содержащие менее чем примерно 10 остатков) полипептиды; белки, такие как альбумин сыворотки, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глютамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; образующие соли противоионы, такие как натрий; металлические комплексы (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ). Активные фармацевтические ингредиенты также могут быть включены в состав микрокапсул, полученных, например, при помощи коацервации или межфазовой полимеризации, например, гидроксиметилцеллюлозы или желатиновых микрокапсул и поли(метилметакрилат)ных микрокапсул, соответственно, коллоидных систем доставки лекарственных средств (например, липосом, микросфер альбумина, микроэмульсий, наночастиц и папокапсул) или макроэмульсий. Указанные способы описаны в Remington's Pharmaceutical Sciences 16th edition, А. Эд. Осол (Osol A. Ed., 1980).
Могут быть получены препараты соединений формул Ia-d с замедленным высвобождением. Подходящие примеры препаратов с замеделенным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащие соединения формул Ia-d, причем матрицы находятся в виде имеющих форму изделий, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают полисложные эфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды (патент США №3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной и гликолиевой кислот, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной и гликолиевой кислот и лейпролидацетата) и поли-D-(-)-3-гидроксибутановой кислоты.
Составы включают составы, подходящие для введения способами, подробно описанными в настоящей заявке. Составы могут подходящим способом находиться в дозированной лекарственной форме и могут быть получены любым способом, хорошо известным в области фармацевтики. Способы и составы, как правило, можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Указанные способы включают стадию проведения взаимодействия активного ингредиента и носителя, который содержит один или более вспомогательный ингредиент. В целом, составы получают в результате однородного и равномерного взаимодействия активного ингредиента и жидких носителей или мелкодисперсных твердых носителей или обоих типов носителей, а затем при необходимости придания продукты формы.
Составы соединения формул Ia-d, подходящие для орального введения, могут быть получены в виде отдельных частиц, таких как пилюли, капсулы, сашеты или таблетки, каждая из которых содержит заданное количество соединения формул Ia-d.
Прессованные таблетки могут быть получены в результате прессования в подходящем устройстве активного ингредиента в свободно-текучей форме, такой как порошок или гранулы, возможно смешанного со связующим веществом, смазкой, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим веществом. Формованные таблетки могут быть получены в результате формования в подходящем устройстве смеси порошкового активного ингредиента, увлаженного инертным жидким разбавителем. Таблетки могут возможно содержать оболочки или представлять собой делимые таблетки и возможно входить в такой состав, которые обеспечивает медленное и контролируемое высвобождение активного ингредиента.
Таблетки, формованные пастилки, пастилки, водные или масляные суспензии, диспергированные порошки или гранулы, эмульсии, твердые или мягкие капсулы, например, желатиновые капсулы, сиропы или эликсиры могут быть получены для орального применения. Составы соединений формул Ia-d, предназначенные для орального введения, могут быть получены в соответствии с любым способом, известным в данной области технике, производства фармацевтических композиций, и указанные композиции могут содержать один или более агент, включая подсластители, ароматизаторы, красители и консерванты, для получения препарата с приятным внешним видом. Таблетки, содержащие активный ингредиент в смеси с нетоксическим фармацевтически приемлемым наполнителем, который является подходящим для производства таблеток, являются приемлемыми. Указанные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция или натрия, лактозу, фосфат кальция или натрия; гранулирующие и улучшающие распадаемость таблеток вещества, такие как кукурузный крахмал или альгиновая кислота; связывающие агенты, такие как крахмал, жалатин или камедь; и смазки, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть безоболочечными или содержать оболочку, полученную с применением известных способов, включающих микроинкапсулирование для задержки разложения и адсорбции в желудочно-кишечном тракте и обеспечения, таким образом, замедленного действия в течение продолжительного периода времени. Например, можно применять вещество, задерживающее время высвобождения, такое как глицерилмоностеарат или глицерилдистеарат индивидуально или вместе с воском.
Для лечения глаз или других внеших органов, например, рта или кожи, составы предпочтительно применяют в виде мази или крема местного применения, содержащей активный(е) ингредиент(ы) в количестве, равном, например, от 0,075 до 20% (масс./масс.). В случае вхождения в состав мазей активные ингредиенты можно применять с парафиновой или смешиваемой с водой основой мази. Как альтернатива, активные ингредиенты могут входить в состав крема с маслянистой или водной основой крема.
При необходимости, водную фазу основы крема может содержать полигидроксильный спирт, т.е. спирт, содержащие две или более гидроксильные группы, такой как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль (включая ПЭГ 400) и их смеси. Составы для местного применения могут предпочтительно включать соединение, которое усиливает абсорбцию или проникновение активного ингредиента в кожу или другую пораженную поверхность. Примеры указанных усилителей проникновения в кожу включают диметилсульфоксид и аналоги на его основе.
Маслянистая фаза эмульсий согласно настоящему изобретению может состоять из известных ингредиентов известным способом. Тогда как фаза может содержать исключительно эмульгатор, предпочтительно фаза содержит смесь по меньшей мере одного эмульгатора и жира или масла, или и жира и масла. Предпочтительно, гидрофильный эмульгатор применяют вместе с липофильным эмульгатором, который выступает в качестве стабилизатора. Также предпочтительным является содержание и масла и жира. К тому же, эмульгатор(ы) со стабилизатором(ами) или без стабилизаторов, образуют так называемый эмульгирующий воск, а воск, взятый совместно с маслом и жиром, образует так называемую эмульгирующую основу мази, которая образует маслянистую диспергированную фазу составов крема. Эмульгаторы и стабилизаторы эмульсии, подходящие для применения в составах согласно настоящему изобретению, включают Tween® 60, Span® 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия.
Водные суспензии соединений формул Ia-d содержат активные вещества в смеси с наполнителями, подходящими для производства водных суспензий. Указанные наполнители содержат суспендирующий агент, такой как натриевая соль карбоксиметилцеллюлозы, кроскармеллоза, повидоп, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь, и диспергирующие агенты или увлажнители, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида и жирной кислоты (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида и длинноцепочечного алифатического спирта (например, гептадекаэтиленоксиэтанола), продукта конденсации этиленоксида и неполного сложного эфира, полученного из жирной кислоты и ангидрида гекситола (например, полиоксиэтиленсорбитанмоноолеат). Водная суспензия также может содержать один или более консервант, такой как этил- или н-пропил-п-гидроксибензоат, один или более краситель, один или более ароматизатор и один или более подсластитель, такой как сахароза или сахарин.
Фармацевтические композиции соединений согласно настоящему изобретению могут находиться в виде стерильного инъецируемого препарата, такого как стерильная водная или маслянистая суспензия. Указанная суспензия может входить в состав в соответствии со способами, известными в данной области техники, например с подходящими/диспергирующими агентами или увлажнителями и суспендирующими агентами, которые представлены выше. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, такой как раствор в 1,3-бутандиоле, также может быть получен в виде лиофилизированного порошка. Среди приемлемых носителей и растворителей, которые можно применять, присутствуют вода, раствор Рингера и изотопический раствор хлорида натрия. В дополнение, в качестве растворителя или суспепдирующей среды можно применять стерильные жирные масла. Для указанной цели можно применять любые легкие жирные масла, включая моно- или диглицериды. В дополнение, для получения инъектируемых композиций аналогично можно применять жирные кислоты, такие как олеиновая кислота.
Количество активного ингредиента, которое можно смешивать с носителем для получения единичной дозируемой формы, изменяется в зависимости от пациента, которого лечат, и конкретного способа введения. Например, состав с замедленным высвобождением, предназначенный для орального введения человеку, может содержать примерно от 1 до 1000 мг активного вещества, входящего в состав вместе с соответствующим и подходящим количеством носителя, которое может изменяться от примерно 5% до примерно 95% общей массы композиции (масса: масса). Фармацевтическая композиция может быть получена для обеспечения легко дозируемых количеств для введения. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать примерно от 3 до 500 µг активного ингредиента на миллилитр раствора для проведения инфузии подходящего объема со скоростью, равной примерно 30 мл/час.
Составы, подходящие для парентерального введения включают водные и неводные стерильные инъецируемые растворы, которые могут содержать анти-оксиданты, буферы, бактериостаты и растворенные вещества, которые превращают состав в изотонический с кровью пациента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители.
Составы, подходящие для местного введения в глаз, также включают глазные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе, конкретно в водном растворителе активного ингредиента. Активный ингредиент предпочтительно присутствует в указанных составах в концентрации, равной примерно от 0,5 до 20% (масс./масс.), например, примерно от 0,5 до 10% (масс./масс.), например, примерно 1,5% (масс./масс.)
Составы, подходящие для местного введения в рот, включают пастилки, содержащие активный ингредиент в ароматизированной основе, как правило, сахарозе или камеди или трагакантовой камеди; пастилы содержат активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и камедь; растворы для промывания полости рта содержат активный ингредиент в подходящем жидком носителе.
Составы для ректального введения могут находиться в виде суппозиториев в подходящей основой, содержащих, например, масло какао или салицилат.
Составы, подходящие для внутрилегочного или назального введения обладают размером частиц, например, в диапазоне от 0,1 до 500 микрон (включая размеры частиц в диапазоне от 0,1 до 500 микрон с интервалом, таким как 0,5, 1, 30 микрон, 35 микрон и т.д.), которые вводят при помощи быстрой ингаляции через носовой ход или при помощи ингаляции через рот, чтобы таким образом достигнуть альвеолярных мешочков. Подходящие составы включают водные или маслянистые растворы активного ингредиента. Составы, подходящие для введения в виде аэрозоля или порошка, могут быть получены в соответствии с подходящими способами и могут быть доставлены совместно с другими терапевтическими агентами, такими как соединения, ранее применявшиеся для лечения или профилактики нарушений, описанных далее.
Составы, подходящие для вагинального введения могут находиться в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев, содержащих в дополнение к активному ингредиенту такие носители, которые известны в данной области техники, как подходящие.
Составы могут быть упакованы в одноразовые контейнеры или контейнеры многоразового использования, например, герметичные ампулы и пузырьки, также могут храниться в высушенном на холоду (лиофилизированном) состоянии, требующем исключительно добавления стерильного жидкого носителя, например, воды, непосредственно перед применением в качестве инъекции. Приготовленные для немедленной инъекции растворы и суспензии получают из стерильных порошков, гранул и таблеток описанных ранее видов. Предпочтительные дозированные составы представляют собой составы, содержащие дневную дозу или единичную поддозировку, представленную ранее, или их соответствующую долю активного ингредиента.
В изобретении также предложены ветеринарные композиции, содержащие по меньшей мере один активный ингредиент, описанный ранее, совместно с ветеринарным носителем. Ветеринарные носители представляют собой вещества, применимые для введения композиции, и могут представлять собой твердые, жидкие или газообразные вещества, которые являются инертными или применимыми для ветеринарных целей и являются совместимыми с активным ингредиентом. Указанные ветеринарные композиции можно вводить парентерально, орально или любых другим подходящим способом.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
Соединения согласно настоящему изобретению можно применять индивидуально или в комбинации с другими терапевтическими агентами для лечения заболевания или нарушения, описанного в настоящей заявке, такого как гиперпролиферативное нарушение (например, рак). В некоторых вариантах реализации соединение формул Ia-d объединяют в фармацевтическом комбинированном составе или при комбинированном режиме дозирования, таком как комбинированная терапия, со вторым соединением, которое обладает антигиперпролиферативными свойствами или которое является применимым для лечения гиперпролиферативного нарушения (например, рака). Второе соединение фармацевтического комбинированного состава или при комбинированном режиме дозирования предпочтительно проявляют активность, дополняющую активность соединения формул Ia-d таким образом, что они не влияют отрицательно друг на друга. Указанные соединения подходящим способом присутствуют в комбинации в количествах, которые являются эффективными для предназначенных целей. В одном из вариантов реализации композиция согласно настоящему изобретению содержит соединение формул Ia-d или его стереоизомер, геометрический изомер, таутомер, сольват, метаболит, N-оксидное производное или фармацевтически приемлемую соль или пролекарство, в комбинации с химиотерапевтическим агентом, описанным в настоящей заявке.
Комбинированную терапию можно применять в одновременном или последовательном режиме дозировки. При последовательном введении комбинацию можно вводить при помощи двух или более введений. Комбинированное введение включает совместное введение, с применением отдельных составов или единственного фармацевтического состава, и последовательное введение в любом порядке, причем предпочтительным является такой период времени, чтобы оба (или все) активных агента одновременно проявляли свои биологические активности
Подходящие дозировки любого из представленных выше вводимых совместно агентов представляют собой дозировки, применяющиеся в настоящее время, которые могут быть снижены как результат комбинированного действия (синергии) определенных в настоящей заявке агентов и других химиотерапевтических агентов или лечений.
Комбинированная терапия может обеспечивать «синергию» и проявлять «синергический эффект», т.е. эффект, достигаемый в случае, когда активные ингредиенты применяют вместе, который является более сильным по сравнению с суммой эффектов, которые проявляются от раздельного применения соединений. Синергический эффект может быть достигнут, когда активные ингредиенты: (1) входят в один состав и введены или доставлены одновременно в комбинированном дозированном составе; (2) доставлены раздельно или параллельно в виде различных составов; или (3) вводят в некоторых других режимах дозировки. При последовательной терапии синергический эффект может быть достигнут, когда соединения вводят или доставляют последовательно, например, при помощи различных инъекций отдельными шприцами, отдельных пилюль или капсул или отдельных инфузий. В целом, в течение последовательной терапии эффективную дозу каждого из активных ингредиентов вводят последовательно, т.е., сериями, тогда как при комбинированной терапии эффективные дозы двух или более активных ингредиентов вводят совместно.
В конкретном варианте реализации противораковой терапии соединений формул Ia-d или его стереоизомер, геометрический изомер, таутомер, сольват, метаболит, N-оксидное производное или фармацевтически приемлемая соль или пролекарство, может быть объединено с другими химиотерапевтическими, гормональными агентами или антителами, описанными в настоящей заявке, а также могут быть объединены с хирургическим лечением или радиотерапией. Комбинированные терапии согласно настоящему изобретению, таким, образом, включают введение по меньшей мере одного соединения формул Ia-d, или его стереоизомера, геометрического изомера, таутомера, сольвата, метаболита, N-оксидного производного или фармацевтически приемлемой соли или пролекарства, и применение по меньшей мере одного другого способа лечения рака. Количества соединения(ий) формул Ia-d и другого(их) фармацевтически приемлемого(ых) химиотерапевтического(их) агента(ов) и относительные времена введения выбирают для достижения целевого комбинированного терапевтического эффекта.
МЕТАБОЛИТЫ СОЕДИНЕНИЙ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Продукты метаболизма в организме соединений формул (I) и от (Ia) до (II), описанных в настоящей заявке, попадают в рамки настоящего изобретения. Указанные продукты могут быть получены, например, в результате окисления, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации, ферментативного расщепления и т.д., введенного соединения. Соответственно изобретение охватывает метаболиты соединений формул (I) и от (Ia) до (Ii), включая соединения, полученные в результате процесса, включающего взаимодействие соединения согласно настоящему изобретению и млекопитающего в течение периода времени, достаточного для получения метаболического продукта соединения.
Метаболические продукты, как правило, определяют при помощи получения соединения согласно настоящему изобретению, меченного радиоактивным изотопом (например, H или С), введения указанного соединения парентерально в детектируемой дозировке (например, более чем 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна или человек, выдерживания в течение периода времени, достаточного для прохождения метаболизма (как правило, от 30 секунд до 30 часов) и выделения продуктов превращения из мочи, крови или других биологических образцов. Указанные продукты легко выделить, так как они являются мечеными (другие выделяют при помощи применения антител, способных связывать эпитопы, остающиеся в метаболите). Метаболические структуры определяют подходящим способом, например, при помощи МС, MCHP или ЯМР анализа. В целом, анализ метаболитов проводят способом, аналогичным общепринятым исследованиям метаболизма лекарственных средств, которые хорошо известны специалистам в данной области техники. Так как метаболические продукты ни в каком другом случае не могут быть найдены в организме, они являются применимыми для диагностических исследований терапевтической дозировки соединений согласно настоящему изобретении.
ПРОЛЕКАРСТВА СОЕДИНЕНИЙ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
В дополнение к соединениям согласно настоящему изобретению изобретение также включает фармацевтически приемлемые пролекарства указанных соединений. Пролекарства включают соединения, в которых аминокислотный остаток, или полипептидная цепь, состоящая из двух или более (например, двух, трех или четырех) аминокислотных остатков, ковалентно присоединены посредством амидной или сложноэфирной связи со свободной амино-, гидрокси- или карбоксильной группой соединения согласно настоящему изобретению. Аминокислотные остатки включают, но не ограничиваются только ими, 20 существующих в природе аминокислот, как правило, обозначаемых тремя буквенными символами, а также включают фосфосерин, фосфотреонип, фосфотирозин, 4-гидроксипролин, гидроксилизин, демозин, изодемозин, гамма-карбоксиглутамат, гиппуровую кислоту, октагидроиндол-2-карбоновую кислоту, статин, 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту, пеницилламин, орпитин, 3-метилгистидин, норвалин, бета-аланин, гамма-аминобутановую кислоту, цигруллин, гомоцистеин, гомосерин, метилаланин, пара-бензоилфенилаланин, фенилглицин, пропаргилглицин, саркозин, метионинсульфон и трет-бутилглицин.
Также охвачены дополнительные типы пролекарств. Например, свободная карбоксильная группа соединения согласно настоящему изобретению может быть превращена в амид или сложный эфир с алкилом. В качестве другого примера соединения согласно настоящему изобретению, содержащие свободные гидроксильные группы, могут быть превращены в пролекарства при помощи превращения гидроксильной группы в группу, включающую, но не ограничивающуюся только ими, сложнофосфатный эфир, гемисукцинат, диметиламино ацетат или фосфорилоксиметилоксикарбонильную группу, описанные в Advanced Drug Delivery Reviews, (1996) 19:115. Также включены карбаматные пролекарства гидроксильных и аминогрупп, такие как карбонатные пролекарства, сульфонатные сложные эфиры и сульфатные сложные эфиры гидроксильных групп. Также охвачено превращение гидроксильных групп в (ацилокси)метиловые и (ацилокси)этиловые эфиры, в которых ацильная группа может представлять собой сложно алкильный эфир возможно замещенный группами, включающими, но не ограничивающимися только ими, эфирную, аминовую или карбоксильную функцию, или в которых ацильная группа представляет собой сложный эфир аминокислоты, описанной выше. Пролекарства указанного типа описаны в J. Med. Chem., (1996), 39:10. Более конкретные примеры включают замещение атома водорода спиртовой группы на группу, такую как (C1-С6)алканоилоксиметил, 1-((C1-С6)алканоилокси)этил, 1-метил-1-((С1-С6)алканоилокси)этил, (C1-С6)алкоксикарбонилоксиметил, N-(C1-С6)алкоксикарбониламинометил, сукциноил, (С1-С6)алканоил, α-амино(С1-С4)алканоил, арилацил и α-аминоацил или α-аминоацил-α-аминоацил, где каждая из α-аминоацильных групп независимо выбрана из природных L-аминокислот, Р(O)(ОН)2, -P(O)(O(C1-С6)алкил)2 или гликозила (радикала, получающегося при удалении гидроксилыюй группы гемиацетальной формы углевода).
Для дополнительных примеров производных пролекарств, см., например, a) Design of Prodrugs, под редакцией Н.Bundgaard, Elsevier, 1985 и Methods in Enzymology, Vol.42, p.309-396 под редакцией К.Widder et al., Academic Press, 1985; b) A Textbook of Drug Design and Development, под редакцией Krogsgaard-Larsen и Н.Bundgaard, Chapter 5 «Design and Application of Prodrugs» под редакцией Н.Bundgaard p.113-191 (1991); с) Н.Bundgaard, Advanced Drug Delivery Reviews, 8:1-38 (1992); d) Н.Bundgaard et al., Journal of Pharmaceutical Sciences, 77:285 (1988); и е) N.Kakeya et al., Chem. Pharm. Bull., 32:692 (1984), каждая из которых включена в настоящую заявку посредством ссылки.
ИЗДЕЛИЯ
В другом варианте реализации предложено изделие, или «набор», содержащее вещества, применимые для лечения заболеваний и нарушений, описанных выше. В одном из вариантов реализации набор содержит контейнер, содержащий соединение формул Ia-d или его стереоизомер, геометрический изомер, таутомер, сольват, метаболит, N-оксиднот производное или фармацевтическую соль или пролекарство. Набор может дополнительно содержать бирку или инструкцию по применению, расположенную на контейнере или связанную с ним. Термин «инструкция по применению» применяют для ссылки на инструкции, обычно прилагаемые к коммерческим упаковкам терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях, относящихся к применению указанных терапевтических продуктов. Подходящие контейнеры включают, например, бутылки, ампулы, шприцы, блистеры, и т.д. Контейнер может быть получен из множества веществ, таких как стекло или пластик. Контейнер может содержать соединение формул Ia-d или состав, содержащий указанное соединение, которое является эффективным для лечения состояния и может содержать стерильный порт доступа (например, контейнер может представлять собой контейнер или ампулу с внутривенным раствором, содержащий пробку, проницаемую при помощи иглы для подкожной инъекции). По меньшей мере один активный агент композиции представляет собой соединение формул Ia-d. Бирка или инструкция по применению показывает, что композицию применяют для лечения выбранного состояния, такого как рак. В дополнение, бирка или инструкция по применению могут показывать, что пациент, нуждающийся в указанном лечении, представляет собой пациента, страдающего от нарушения, такого как гиперпролиферативное нарушение, нейродегенерация, гипертрофия сердца, боль, мигрень или нейротравматическое заболевание или явление. В одном из вариантов реализации бирка или инструкция по применению показывают, что композицию, содержащую соединение формул Ia-d, можно применять для лечения нарушения, вызванного аномальным ростом клеток. Бирка или инструкция по применению также могут показывать, что композицию можно применять для лечения других нарушений. Как альтернатива или в дополнение, изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-буферный солевой раствор, раствор Рингера и раствор декстрозы. Изделие также может содержать другие вещества, важные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Набор также может содержать руководство по введению соединения формул Ia-d и, в случае если присутствует, второго фармацевтического состава. Например, в случае если набор содержит первую композицию, содержащую соединение формул Ia-d и второй фармацевтический состав, набор может дополнительно содержать руководства для одновременного, последовательного или раздельного введения первой и второй фармацевтических композиций пациенту, нуждающемуся в указанном лечении.
В другом варианте реализации наборы подходят для доставки твердых форм для орального введения соединения формул Ia-d, таких как таблетки или капсулы. Указанный набор предпочтительно содержит ряд единичных дозированных форм. Указанные наборы могут содержать карточку, содержащую дозировки, предназначенные для предполагаемого применения. Пример подобного набора представляет собой «блистер». Блистеры хорошо известны в упаковочной промышленности, их широко применяют для упаковки фармацевтических дозированных форм. При необходимости, может быть предложена памятка, например, в виде чисел, букв или других отметок или графика приема лекарственного средства, на котором отображены дни в схеме лечения, в которые можно вводить дозировки.
В соответствии с одним из вариантов реализации набор может содержать (а) первый контейнер, содержащий соединение формул Ia-d; и возможно (b) второй контейнер, содержащий вторую фармацевтическую композицию, где вторая фармацевтическая композиция содержит второй соединение с анти-гиперпролиферативной активностью. Как альтернатива или дополнительно, набор может дополнительно содержать третий контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFJ), фосфатно-буферный солевой раствор, раствор Рингера и раствор декстрозы. Набор также может содержать другие вещества, важные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
В некоторых других вариантах реализации, когда набор содержит композицию соединения формул Ia-d и второй терапевтический агент, данный набор может содержать контейнер для содержания отдельных композиций, такой как отдельная бутылка или отдельный пакет с внутренним покрытием из фольги, тем не менее, отдельные композиции также могут содержаться внутри единственного неразделенного контейнера. Как правило, набор содержит руководства для введения раздельных компонентов.
Особенно преимущественной является форма набора, в которой раздельные компоненты предпочтительно вводят в различных дозируемых формах (например, орально и парентерально), вводят с различными интервалами в дозировке или когда титрование индивидуальных компонентов комбинации назначено лечащим врачом.
ПРИМЕР БИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
Определение потенциала выявления PI3K/PI3K-связанных киназ (PIKK) соединением формулы I возможно осуществить рядом прямых и косвенных способов определения. Конкретные типовые соединения, описанные в настоящей заявке, исследовали на предмет активности, блокирующей фосфо РКВ, и активности против опухолевых клеток в лабораторных условиях. Диапазон фосфо РКВ активностей составлял от менее чем 1 нМ (наномолярный) до примерно 10 µМ (микромолярный). Другие типовые соединения согласно настоящему изобретению обладали значениями IC50 для активности, блокирующей фосфо РКВ, равными менее чем 10 нМ. Конкретные соединения согласно настоящему изобретению обладали значениями IC50 для активности против опухолевых клеток, равными менее чем 100 нМ.
Цитотоксическую или цитостатическую активность типовых соединений формулы I определяли при помощи: выдерживания пролиферирующих опухолевых клеточных линий млекопитающих в среде клеточной культуры, добавления соединения формулы I, культивирования клеток в течение от примерно 6 часов до примерно 3 дней; и измерения жизнеспособности клеток. Клеточные исследования применяли для определения жизнеспособности, т.е., пролиферации (IC50), цитотоксичности (ЕС50) и индуцирования апоптоза (активации каспазы).
Активность соединений формулы I in vitro определяли при помощи внутриклеточного исследования по типу Western, разработанного в лаборатории Университета Базеля. Анализ указанным способом проводили в микротитрованных планшетах, что обеспечило восприимчивость к скринингу высокой производительности (HTS). К среде добавляли ингибиторы и инкубировали. Антитела, разбавленные в ФСБ/Т против рРКВ Ser473 (Cell Signalling) и РКВ (полученный в дар от Э.Хирша (Е.Hirsch)) или pS6 Ser 235/236 (Cell Signalling) инкубировали в течение ночи, а затем применяли вторичные меченные флуоресцентами антитела (LI-COR), и планшеты сканировали на устройстве для чтения Odyssey для определения отношения рРКВ/РКВ.
Следующие соединения проявили особенно значительные биологические активности:
- 4,4'-(6-(пиридин-3-ил)-1,3,5-триазин-2,4-диил)диморфолин,
- 3-(4,6-диморфолино-1,3,5-триазин-2-ил)фенол,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиридин-3-ол,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиридин-2-амин,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиримидин-2-амин,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)-4-(трифторметил)пиридин-2-амин,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)-4-(трифторметил)пиримидин-2-амин,
- N-(5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиридин-2-ил)ацетамид,
- N-(5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиримидин-2-ил)ацетамид,
- N-(5-(4,6-диморфолино-1,3,5-триазин-2-ил)-4-(трифторметил)пиримидин-2-ил)ацетамид,
- N(5-(4,6-диморфолино-1,3,5-триазин-2-ил)-4-(трифторметил)пиридин-2-ил)ацетамид,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)-6-(трифторметил)пиридин-2-амин,
- 4,4'-(6-(1H-индазол-5-ил)-1,3,5-триазин-2,4-диил)диморфолин,
- 4,4'-(б-(1Н-индол-5-ил)-1,3,5-триазин-2,4-диил)диморфолин,
- 4,4'-(6-(1Н-бензо[d]имидазол-5-ил)-1,3,5-триазин-2,4-диил)диморфолин,
- 4,4'-(6-(1Н-бензо[d]имидазол-4-ил)-1,3,5-триазин-2,4-диил)диморфолин,
- 4,4'-(6-(1Н-индол-4-ил)-1,3,5-триазин-2,4-диил)диморфолин,
- 4,4'-(6-(1Н-индазол-4-ил)-1,3,5-триазин-2,4-диил)диморфолин,
- 4,4'-(6-(1Н-индазол-6-ил)-1,3,5-триазин-2,4-диил)диморфолин,
- 5-(4-морфолино-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)пиридин-2-амин,
- 5-(4-морфолино-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)пиримидин-2-амин,
- 4-(4-(1Н-индол-4-ил)-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)морфолин,
- 4-(4-(1Н-индазол-4-ил)-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)морфолин,
- 4-(4-(1Н-бензо[d]имидазол-4-ил)-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)морфолин,
- 4-(4-(1Н-бензо[d]имидазол-5-ил)-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)морфолин,
- 4-(4-(1Н-индазол-5-ил)-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)морфолин,
- 4-(4-(1Н-индол-5-ил)-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)морфолин,
- 3-(4-морфолино-6-(пиридин-2-илметиламино)-1,3,5-триазин-2-ил)фенол,
- 4-(6-аминопиридин-3-ил)-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин,
- 4-(2-аминопиримидин-5-ил)-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин,
- 4-(1Н-индол-5-ил)-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин,
- 4-(1Н-индазол-5-ил)-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин,
- 4-(1Н-бензо[d]имидазол-5-ил)-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин,
- 4-(1Н-бензо[d]имидазол-4-ил)-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амип,
- 4-(1Н-индол-4-ил)-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин,
- 4-(1H-индазол-4-ил)-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин,
- 3-(7-морфолинотиазоло[4,5-d]пиримидин-5-ил)фенол,
- 3-(7-морфолинооксазоло[4,5-d]пиримидин-5-ил)фенол,
- 3-(2-((4-метилпиперазин-1-ил)метил)-7-морфолинооксазоло[4,5-d]пиримидин-5-ил)фенол,
- 3-(2-((4-метилпиперазин-1-ил)метил)-7-морфолинотиазоло[4,5-d]пиримидин-5-ил)фенол,
- 3-(2-((4-(метилсульфонил)пиперазин-1-ил)метил)-7-морфолинотиазоло[4,5-d]пиримидин-5-ил)фенол,
- 5-(7-морфолинотиазоло[4,5-d]пиримидин-5-ил)пиримидин-2-амин,
- 5-(7-морфолинотиазоло[4,5-d]пиримидин-5-ил)пиридин-2-амин,
- 5-(2-((4-метилпиперазин-1-ил)метил)-7-морфолинотиазоло[4,5-d]пиримидин-5-ил)пиримидин-2-амин,
- 5-(2-((4-метилпиперазин-1-ил)метил)-7-морфолинооксазоло[4,5-d]пиримидин-5-ил)пиримидин-2-амин,
- 4-(5-(1Н-индазол-4-ил)тиазоло[4,5-d]пиримидин-7-ил)морфолин,
- 4-(5-(1Н-индазол-4-ил)-2-((4-метилпиперазин-1-ил)метил)тиазоло[4,5-d]пиримидин-7-ил)морфолин,
- 4-(5-(1Н-индазол-4-ил)-2-((4-(метилсульфонил)пиперазин-1-ил)метил)тиазоло[4,5-d]пиримидин-7-ил)морфолин,
- 4-(5-(1Н-индол-4-ил)тиазоло[4,5-е]пиримидин-7-ил)морфолин,
- 4-{5-(1Н-бензо[d]имидазол-4-ил)тиазоло[4,5-d]пиримидин-7-ил)морфолин,
- 4-(5-(1Н-бензо[d]имидазол-5-ил)тиазоло[4,5-d]пиримидин-7-ил)морфолин,
- 4-(5-(1Н-индол-5-ил)тиазоло[4,5-d]пиримидин-7-ил)морфолин,
- 4-(5-(1Н-индол-5-ил)-2-((4-метилпиперазин-1-ил)метил)тиазоло[4,5-d]пиримидин-7-ил)морфолин,
- 4-(5-(1Н-индазол-5-ил)тиазоло[4,5-d]пиримидин-7-ил)морфолин,
- 2-(1Н-бензо[d]имидазол-5-ил)-4-морфолинобензофуро[3,2-d]пиримидин,
- 2-(1Н-индол-5-ил)-4-морфолинобензофуро[3,2-d]пиримидин,
- 2-(1Н-индазол-5-ил)-4-морфолинобензофуро[3,2-d]пиримидин,
- 6-(1Н-индазол-5-ил)-8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен,
- 6-(1Н-бензоимидазол-5-ил)-8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен,
- 6-(1Н-индол-5-ил)-8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен,
- 2-(1Н-индол-4-ил)-4-морфолинобензофуро[3,2-d]пиримидин,
- 2-(1Н-индазол-4-ил)-4-морфолинобензофуро [3,2-d]пиримидин,
- 2-(1Н-бензо[d]имидазол-4-ил)-4-морфолинобензофуро[3,2-d]пиримидин,
- 6-(1Н-индазол-4-ил)-8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен,
- 6-(1Н-индазол-4-ил)-2-(4-метилпиперазин-1-илметил)-8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен,
- 6-(1Н-бензоимидазол-4-ил)-8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен,
- 6-(1Н-индол-4-ил)-8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен,
- 5-(8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен-6-ил)пиримидин-2-иламин,
- 3-[2-(4-метилпиперазин-1-илметил)-8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен-6-ил] фенол,
- 5-(8-морфолин-4-ил-9-окса-1,5,7-триазафлуорен-6-ил)пиридин-2-иламин,
- 5-(4-морфолинобензофуро[3,2-d]пиримидин-2-ил)пиридин-2-амин,
- 5-(4-морфолинобензофуро[3,2-d]пиримидин-2-ил)пиримидин-2-амин, и
3-(4-морфолинобензофуро[3,2-d]пиримидин-2-ил)фенол.
Среди перечисленных выше соединений 5-(4,6-диморфолино-1,3,5-триазин-2-ил)-4-(трифторметил)пиридин-2-амин и 5-(4,6-диморфолино-1,3,5-триазин-2-ил)-4-(трифторметил)пиримидин-2-амин обладают превосходными биологическими свойствами, которые превращают их в очень перспективные терапевтические агенты (см. Таблицу 6 далее).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее изобретение будет описано более подробно с учетом конкретных вариантов реализации и примеров настоящего изобретения, которые являются типовыми, но не ограничивающими изобретение.
В Таблице 1 представлены структуры и соответствующие названия по IUPAC (с применением ChemDraw Ultra Version 11.0.1, а также более ранних и поздних версий программного обеспечения, CambridgeSoft Corp., Cambridge MA) типовых соединений №1-259 формул (Ia), (Ib) или (Id).
В Таблице 2 представлены структуры и соответствующие названия по IUPAC (с применением ChemDraw Ultra Version 11.0.1, а также более ранних и поздних версий программного обеспечения, CambridgeSoft Corp., Cambridge MA) типовых соединений №260-385 формулы (Ie).
В Таблице 3 представлены структуры и соответствующие названия по IUPAC (с применением ChemDraw Ultra Version 11.0.1, а также более ранних и поздних версий программного обеспечения, CambridgeSoft Corp., Cambridge MA) типовых соединений №386-473 формул (If) или (Ig).
В Таблице 4 представлены структуры и соответствующие названия по IUPAC (с применением ChemDraw Ultra Version 11.0.1, а также более ранних и поздних версий программного обеспечения, CambridgeSoft Corp., Cambridge MA) типовых соединений 5 №474-537 формул (Ih) или (Ii).
В Таблице 5 представлены структуры и соответствующие названия по IUPAC (с применением ChemDraw Ultra Version 11.0.1, а также более ранних и поздних версий программного обеспечения, CambridgeSoft Corp., Cambridge MA) типовых соединений №538-590 формулы (Ie).
ПРИМЕРЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Химические реакции, описанные в Примерах, легко могут быть адаптированы для получения ряда других ингибиторов липидкиназы согласно настоящему изобретению, альтернативные способы получения соединений согласно настоящему изобретению также попадают в рамки настоящего изобретения. Например, синтез нетиповых соединений в соответствии с изобретением может быть успешно проведен в результате модификаций, очевидных специалистам в данной области техники, например, при помощи соответствующей защиты взаимодействующих групп, при помощи применения других подходящих реагентов, известных в данной области техники, отличающихся от описанных в настоящей заявке реагентов, и/или при помощи осуществления обычных модификаций условий проведения реакций. Как альтернатива, понимают, что другие реакции, описанные в настоящей заявке или известные в данной области техники, применимы для получения других соединений согласно настоящему изобретению.
В Примерах, описанных ниже, если не указано обратное, все температуры выражены в градусах Цельсия. Реагенты приобретали у коммерческих поставщиков, таких как Aldrich Chemical Company, Fluorochem, Acros, Lancaster, TCI или Maybridge, и применяли без дополнительной очистки, если не указано обратное. Реакции, представленные далее, проводили, как правило, при положительном избыточном давлении азота или аргона или с применением осушительной трубки (если не указано обратное) в безводных растворителях, реакционные колбы, как правило, были оборудованы резиновой мембраной для введения субстратов и реагентов через шприц. Стеклянную посуду сушили в сушильном шкафу или при нагревании. Колоночную хроматографию проводили с применением силикагеля Merck. Спектры1Н ЯМР получали на приборе Bruker с рабочими частотами 400 МГц, 500 МГц и 600 МГц. Спектры1Н ЯМР получали в растворах дейтерированного CDCl3, d6-ДМСО, CH3OD или d6-ацетона (выраженные в ppm) с применением хлороформа в качестве контрольного раствора (7,25 ppm) или ТМС (0 ppm). Если отмечают мультиплетность сигналов, применяют следующие аббревиагуры: s (синглет), d (дублет), t (триплет), m (мультиплет), br (уширенный пик), dd (дублет-дублетов), dt (дублет триплетов). Константы спин-спинового взаимодействия, когда приведены, выражены в герцах (Гц).
Пример Р1

4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин:
Хлорангидрид циануровой кислоты (1,00 г, 5,42 ммоль, 1,0 экв.) растворяли в ДМФ (5 мл) и к реакционной смеси при 0°С медленно добавляли морфолин (2,11 мл, 24,4 ммоль, 4,5 экв.), перемешивали в течение 20 минут при указанной температуре, выливали в воду и отфильтровывали бесцветный осадок, промывали гексаном и диэтиловым эфиром и сушили с получением титульного соединения в виде бесцветного твердого вещества (860 мг, 56%). Данные анализа:
1Н-ЯМР (400 МГц, CDCl3): δ 3.78-3.69 (16Н, m).
13С-ЯМР (100 МГц, CDCl3): δ 170.10, 164.88, 67.28, 66.98, 44.23.
ESI-MC (70 эВ, m/z): рассчитанная для C11H16ClN5O2 [M+H]+: 286, экспериментальная 360.
Рентгеновский анализ: структура 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолина была подтверждена при помощи рентгеновского анализа.
Пример Р2

5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиридин-2-амин:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 2-аминопиридин-5-бороновой кислоты в течение времени проведения реакции, равного 15 часам. Хроматография (метиленхлорид/метанол 97:3) позволила получить 69% титульного соединения в виде светло-желтого твердого вещества.
Данные анализа:
1H ЯМР (400 МГц, CDCl3): δ 9.06 (s, 1H), 8.36 (dd, J=2.28, 8.59 Гц, 1Н), 6.50 (d, J=8.59 Гц, 1H), 4.82 (s, 2H), 3.87-3.73 (m, 16H), 2.22 (s, 1H), 1.23 (s, 1H).
13С ЯМР (100 МГц, CDCl3): δ 169.42, 165.37, 160.56, 150.02, 138.31, 123.91, 107.89, 67.27, 44.01, 25.27.
ESIMC (70 эВ, m/z): рассчитанная для C16H21N7O2 [M+H]+: 344.38, экспериментальная 344.30.
Пример Р3

3-(4,6-диморфолино-1,3,5-триазин-2-ил)фе11ол:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 3-гидроксифенилбороновой кислоты в течение времени проведения реакции, равного 15 часам. Хроматография (гексан/этилацетат 1:1) позволила получить титульное соединение в виде бесцветного твердого вещества.
Данные анализа:
1Н ЯМР (400 МГц, ДМСО): δ 9.51 (s, 1Н), 7.77-7.74 (m, 2H), 7.23 (t, J=8.08 Гц, 1Н), 6.90-6.88 (m, 1Н), 3.81-3.55 (m, 16H), 1.25 (s, 1H).
13С ЯМР (100 МГц, ДМСО): δ 170.27, 165.60, 165.47, 158.12, 138.99, 130.01, 119.73, 119.36, 115.56, 66.86, 44.10.
ESI-MC (70 эВ, m/z): рассчитанная для C17H21N5O3 [2М]+: 685.32, экспериментальная 685.8.
Пример Р4

4-(4,6-диморфолино-1,3,5-триазин-2-ил)анилин:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 4-аминофенилбороновой кислоты в течение времени проведения реакции, равного 24 часам. Хроматография (гексан/этилацетат 6:4) позволила получить титульное соединение в виде желтого твердого вещества.
Данные анализа:
1H ЯМР (400 МГц, CDCl3): δ 8.21 (d, J=8.59, 2H), 6.68 (d, J=8.84, 2H), 3.93-3.73 (m, 19Н), 3.71-3.68 (m, 2H).
13С ЯМР (100 МГц, CDCl3): δ 170.59, 165.62, 149.97, 130.45, 127.82, 114.54, 67.32, 67.29, 44.04, 44.01.
ESI-MC (70 эВ, m/z): рассчитанная для C17H21N5O3 [М+Н]+: 343.18, экспериментальная 343.40.
Пример Р5

3-(4,6-диморфолино-1,3,5-триазин-2-ил)анилин:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 3-амииофенилбороновой кислоты в течение времени проведения реакции, равного 15 часам. Колоночная хроматография (гексан/этилацетат 1:1) позволила получить титульное соединение в виде бесцветного твердого вещества.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 7.80-7.77 (m, 1Н), 7.72-7.71 (m, 1H), 7.22 (t, J=7.83 Гц, 1H), 6.82-6.79 (m, 1H), 3.90-3.74 (m, 18H).
13С ЯМР (100 МГц, CDCl3): δ 170.91, 165.64, 146.68, 138.86, 129.47, 119.26, 118.53, 115.21, 67.29, 44.03.
ESI-MC (70 эВ, m/z): рассчитанная для C17H22N6O2 [М+Н]+: 343.18, экспериментальная 343.30.
Пример Р6

3-(4,6-диморфолино-1,3,5-триазин-2-ил)бензонитрил:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 3-цианофенилбороновой кислоты в течение времени проведения реакции, равного 15 часам. Колоночная хроматография (гексан/этилацетат 1:1) позволила получить 57% титульного соединения в виде бесцветного твердого вещества.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 8.68-8.67 (m, 1H), 8.61-8.59 (m, 1Н), 7.76-7.74 (m, 1Н), 7.57 (t, J=7.83 Гц, 1Н), 3.95-3.76 (m, 17H).
13C ЯМР (100 МГц, CDCl3): δ 168.79, 165.47, 139.09, 134.64, 132.83, 132.64, 129.36, 119.30, 112.73, 67.23, 44.06.
ESI-MC (70 эВ, m/z): рассчитанная для C18H20N6O2 [M+H]+: 353.16, экспериментальная 353.50.
Пример Р7

4-(4,б-диморфолино-1,3,5-триазин-2-ил)бензонитрил:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 4-цианофепилбороновой кислоты в течение времени проведения реакции, равного 15 часам. Колоночная хроматография (гексан/этилацетат 1:1) позволила получить 40% титульного соединения в виде бесцветного твердого вещества.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 8.47 (d, J=8.34, 2H), 7.71 (d, J=8.08, 2H), 3.93-3.75 (m, 16H), 1.35 (s, 1Н).
13С ЯМР (100 МГц, CDCl3): δ 169.14, 165.50, 142.09, 132.33, 129.20, 123.67, 119.23, 114.79, 67.22, 44.13, 44.08, 25.27.
ESI-MC (70 эВ, m/z): рассчитанная для C18H20N6O2 [M+H]+: 353.16, требуемая масса не была определена.
Пример Р8

4,4'-(6-(пиридин-3-ил)-1,3,5-триазин-2,4-диил)диморфолин:
В соответствии с общей методикой А 4,4'-(б-хлор-1,3,5-триазин-2,4-диил)диморфолии подвергали реакции сочетания с пииаколииовым эфиром 3-пиридинбороновой кислоты в течение времени проведения реакции, равного 15 часам. Колоночная хроматография (гексан/этилацетат 1:1) позволила получить гитульное соединение в виде бесцветною твердого вещества.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 9.53 (s, 1H), 8.70-8.68 (m, 1H), 8.61-8.57 (m, 1H), 7.36-7.32 (m, 1H), 3.92-3.75 (m, 1H), 1.92 (s, 1H).
13C ЯМР (100 МГц, CDCl3): δ 169.24, 165.40, 152.25, 150.54, 136.04, 133.24, 123.40, 67.23, 44.06.
ESI-MC (70 эВ, m/z): рассчитанная для C16H20N6O2 [M+H]+: 329.16, экспериментальная 329.20.
Пример Р9

4,4'-(6-(6-морфолинопиридин-3-ил)-1,3,5-триазин-2,4-диил)диморфолин:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 6-(морфолин-4-ил)пиридин-3-бороновой кислоты в течение времени проведения реакции, равного 15 часам. Колоночная хроматография (гексан/этилацетат 1:1) позволила получить титульное соединение в виде бесцветного твердого вещества.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 9.19-9.18 (m, 1H), 8.39 (dd, J=2.40, 8.97 Гц, 1H), 6.61 (d, J=8.71 Гц, 1H), 3.87-3.81 (m, 12Н), 3.74 (t, J=4.8 Гц, 8Н), 3.62 (t, J=4.92, 4H), 1.66 (s, 1H).
13С ЯМР (100 МГц, CDCl3): δ 169.49, 165.40, 161.08, 149.99, 137.78, 123.05, 105.67, 67.27, 67.08, 45.68, 44.02.
ESI-MC (70 эВ, m/z): рассчитанная для C20H27N7O3 [M+H]+: 414.22, экспериментальная 414.40.
Пример Р10

5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)пиридин-2-амин:
В сухую 25 мл колбу добавляли 5-бром-4-(трифторметил)пиридин-2-амин (300 мг, 1,24 ммоль, 1,0 экв.), ацетат калия (366 мг, 3,73 ммоль, 3,0 экв.), бис(пинаколато)диборан (348 мг, 1,37 ммоль, 1,1 экв.) и диоксан (8 мл). Через раствор продували аргон в течение 15 минут, при этом добавляли комплекс дихлорида 1,1-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана (50,8 мг, 60 µмоль, 0,05 экв.). Реакционную смесь кипятили с обратным холодильником в 115°С масляной бане в течение 8 часов в атмосфере аргона. После охлаждения до комнатной температуры удаляли диоксан в вакууме. Добавляли этилацетат и полученную суспензию обрабатывали ультразвуком и фильтровали. Для промывания твердого вещества применяли дополнительное количество этилацетата. Объединенные органические экстракты концентрировали, и неочищенное вещество частично очищали при помощи хроматографии на силикагеле (гексан/этилацетат 6:4). После удаления растворителя добавляли гексан, проводили декантацию и полученное бесцветное твердое вещество сушили в глубоком вакууме в течение трех дней.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 8.49 (s, 1Н), 6.71 (s, 1H), 4.86 (s, 2H), 1.33 (s, 12H), 1.27 (s, 2H), 1.24 (s, 2H).
19F (400 МГц, CDCl3): δ -64.24.
ESI-MC (70 эВ, m/z): рассчитанная для C12H16BF3N2O2 [M+H]+: 289.13, экспериментальная 289.10.
Пример P11

5-(4,6-диморфолино-1,3,5-триазип-2-ил)-4-(трифторметил)пиридин-2-амин:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)пиридин-2-амином в течение времени проведения реакции, равного 15 часам. Хроматография (дихлорметан/метанол 97:3) позволила получить титульное соединение в виде бесцветного маслянистого вещества.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 8.71 (s, 1H), 6.78 (s, 1H), 4.93 (s, 2H), 3.85-3.73 (m, 16H), 1.73 (s, 1H), 1.24 (s, 1H).
13C ЯМР (125 МГц, CDCl3): δ 169.90, 164.71, 159.49, 152.65, 138.30, 122.34, 105.40, 105.35, 66.81, 43.59, 24.87.
19F (400 МГц, CDCl3): δ -60.95.
ESI-MC (70 эВ, m/z): рассчитанная для C17H20F3N7O2 [М+Н]+: 412.16, экспериментальная 412.20.
Пример Р12
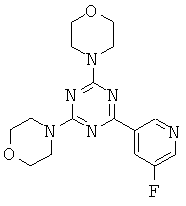
4,4'-(6-(5-фторпиридин-3-ил)-1,3,5-триазин-2,4-диил)диморфолин:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 3-фторпиридин-5-бороновой кислоты в течение времени проведения реакции, равного 15 часам. Хроматография (гексан/этилацетат 1:1) позволила получить 31% титульного соединения.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 9.36-9.35 (m, 1H), 8.55 (d, J=3.03 Гц, 1H), 8.31-8.28 (m, 1H), 3.94-3.75 (m, 16H).
13С ЯМР (100 МГц, CDCl3): δ 165.30, 146.30, 142.65, 140.68, 140.45, 122.69, 122.50, 67.29, 67.20, 44.04.
19F (400 МГц, CDCl3): δ -128.86, -128.88.
ESI-MC (70 эВ, m/z): рассчитанная для C16H19FN6O2 [М+Н]+: 347.16, экспериментальная 347.50.
Пример Р13

5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиримидин-2-амин:
В соответствии с общей методикой А 4,4'-(6-хлор-1,3,5-триазин-2,4-диил)диморфолин подвергали реакции сочетания с пинаколиновым эфиром 2-аминопиримидин-5-бороновой кислоты в течение времени проведения реакции, равного 17 часам. Хроматография (гексан/этилацетат 1:1) позволила получить титульное соединение в виде бесцветного твердого вещества.
Данные анализа:
1Н ЯМР (400 МГц, CDCl3): δ 9.17 (s, 2Н), 5.37 (s, 2H), 3.87-3.74 (m, 17H), 1.63 (s, 3H).
ESI-MC (70 эВ, m/z): рассчитанная для C15H20N8O2 [M+H]+: 345.17, экспериментальная 345.80.
Пример P14

4,6-дихлор-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А 2,4,6-трихлор-1,3,5-триазин подвергали реакции сочетания с 2-аминометилпиридипом в течение времени проведения реакции, равного 2 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C9H8Cl2N5 [М+Н]+: 256.01, экспериментальная 256.
Пример Р15

В соответствии с общей методикой А 2,4,6-трихлор-1,3,5-триазип подвергали реакции сочетания с 3-аминометилпиридином в течение времени проведения реакции, равного 2 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C9H8Cl2N5 [M+H]+: 256.01, экспериментальная 256.
Пример Р16

4,6-дихлор-N-(пиридин-4-илмстил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А 2,4,6-трихлор-1,3,5-триазин подвергали реакции сочетания с 4-аминометилпиридипом в течение времени проведения реакции, равного 2 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C9H8Cl2N5 [M+H]+: 256.01, экспериментальная 256.
Пример Р17

4,6-дихлор-N-(2-(пиридин-2-ил)этил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А 2,4,6-трихлор-1,3,5-триазип подвергали реакции сочетания с 2-(2-аминоэтил)пиридином в течение времени проведения реакции, равного 2 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C10H10Cl2N5 [M+H]+: 270.02, экспериментальная 270.
Пример Р18

4,6-дихлор-N-(2-(пиридин-3-ил)этил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А 2,4,6-трихлор-1,3,5-триазин подвергали реакции сочетания с 3-(2-аминоэтил)пиридином в течение времени проведения реакции, равного 2 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C10H10Cl2N5 [M+H]+: 270.02, экспериментальная 270.
Пример Р19

4,6-дихлор-N-(2-(пиридин-4-ил)этил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А 2,4,б-трихлор-1,3,5-триазин подвергали реакции сочетания с 4-(2-аминоэтил)пиридином в течение времени проведения реакции, равного 2 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C10H10Cl2H5 [M+H]+: 270.02, экспериментальная 270.
Пример Р20

4,6-дихлор-N-(2-(пиперидип-1-ил)этил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А 2,4,6-трихлор-1,3,5-триазин подвергали реакции сочетания с 1-(2-аминоэтил)пиперидином в течение времени проведения реакции, равного 2 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C10H16Cl2N5 [М+Н]+: 276.07, экспериментальная 276.
Пример Р21

4,6-дихлор-N-(2-морфолиноэтил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А 2,4,6-трихлор-1,3,5-триазин подвергали реакции сочетания с N-(2-аминоэтил)морфолином в течение времени проведения реакции, равного 2 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C9H14Cl2N5O [М+Н]+: 278.05, экспериментальная 278.
Пример Р22

4-хлор-6-морфолино-N-(пиридин-2-илметил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C9H14Cl2N5O [M+H]+: 278.05, экспериментальная 278.
Пример Р23

4-хлор-6-морфолино-N-(пиридип-3-илметил)-1,3,5-триазип-2-амин:
В соответствии с общей методикой А-1 было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C13H16ClN6O [М+Н]+: 307.10, экспериментальная 307.
Пример Р24

4-хлор-6-морфолино-N-(пиридин-4-илметил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А-1 было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C13H16ClN6O [М+Н]+: 307.10, экспериментальная 307.
Пример Р25

4-хлор-6-морфолино-N-(2-(пиридин-2-ил)этил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А-1 было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C14H18ClN6O [M+H]+: 321.12, экспериментальная 321.
Пример Р26

4-хлор-6-морфолино-N-(2-(пиридин-3-ил)этил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А-1 было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C14H18ClN6O [M+H]+: 321.12, экспериментальная 321.
Пример Р27

4-хлор-6-морфолино-N-(2-(пиридин-4-ил)этил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А-1 было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C14H18ClN6O [M+H]+: 321.12, экспериментальная 321.
Пример Р28

4-хлор-6-морфолино-N-(2-(пиперидин-1-ил)этил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А-1 было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C14H24ClN6O [М+Н]+: 327.17, экспериментальная 327.
Пример Р29

4-хлор-6-морфолино-N-(2-морфолиноэтил)-1,3,5-триазин-2-амин:
В соответствии с общей методикой А-1 было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C13H22ClN6O2 [М+Н]+: 329.14, экспериментальная 329.
Пример Р30

2,4-дихлор-6-(пиридин-2-илметокси)-1,3,5-триазин:
В соответствии с общей методикой А-2 4,6-дихлор-N-(2-(пиперидин-1-ил)этил)-1,3,5-триазин-2-амин подвергали реакции сочетания с 2-пиридинметанолом в течение времени проведения реакции, равного 3 часа. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C9H7Cl2N4O [М+Н]+: 256.99, экспериментальная 257.
Пример Р31

4-(4-хлор-6-(пиридин-2-илметокси)-1,3,5-триазин-2-ил)морфолин:
В соответствии с общей методикой А-1 было получено целевое соединение. Очистка при помощи колоночной хроматографии позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C13H15ClN5O2 [M+H]+: 256.99, экспериментальная 257.
Пример Р32

4-(4,6-дихлор-1,3,5-триазин-2-ил)морфолин:
Хлорангидрид циануровой кислоты (10,0 г, 54,2 ммоль, 1,0 экв.) растворяли в метиленхлориде (60 мл) и к реакционной смеси при -50°С медленно (по каплям) добавляли морфолин (4,70 мл, 54,2 ммоль, 1,0 экв.), перемешивали в течение 20 минут при указанной температуре и выливали в воду. После экстракции метиленхлоридом и этилацетатом (2×) органические слои сушили MgSO4 и концентрировали. Дополнительную очистку проводили при помощи флэш-хроматографии (1:1 гексан/этилацетат) с получением титульного соединения в виде бесцветного твердого вещества (3,56 г, 28%).
Данные анализа:
1Н-ЯМР (400 МГц, CDCl3): δ 3.76-3.74 (8Н, m).
ESI-MC (70 эВ, m/z): рассчитанная для C7H8Cl2N4O [М+Na]+ (258); экспериментальная 258.
Рентгеновский анализ: структура титульного соединения подтверждена рентгеновским анализом.
Альтернативный способ 1 синтеза 4-(4,6-дихлор-1,3,5-триазин-2-ил)морфолина в соответствии с ЕР 1020462 В1:
Хлорангидрид циануровой кислоты (10,0 г, 54,0 ммоль), растворенный в ацетоне (100 мл) охлаждали до -5°С, медленно но каплям добавляли триэтиламин (4,70 мл, 49,0 ммоль), а затем медленно по каплям добавляли морфолин (7,50 г, 54,0 ммоль). Реакционную смесь перемешивали при указанной температуре в течение одного часа, затем перемешивали при комнатной температуре в течение одного часа. Реакционный раствор выливали в воду (500 мл). Осажденные кристаллы собирали при помощи фильтрования, промывали небольшим количеством ацетона и сушили с получением 9,70 г (выход: 69%) 2,4-дихлор-6-морфолино-1,3,5-триазина в виде бесцветных кристаллов с температурой плавления, равной 155°С-157°С.
Альтернативный способ 2 синтеза 4-(4,6-дихлор-1,3,5-триазин-2-ил)морфолина в соответствии с ЕР 1020462 В1:
Водный раствор морфолина (120 ммоль, 2,0 экв.) медленно по каплям добавляли к раствору хлорангидрида циануровой кислоты (60,2 ммоль, 1,0 экв.) в диметиловом эфире этиленгликоля (130 мл) при температуре от -15°С до -5°С. Реакционную смесь перемешивали при -15°С в течение 2 часов, а затем при комнатной температуре в течение 20 часов. После удаления растворителя остаток экстрагировали CH2Cl2. Экстракт промывали солевым раствором, сушили MgSO4 и концентрировали с получением титульного соединения в виде бесцветных кристаллов (выход: 63%).
Данные анализа:
1H-ЯМР (400 МГц, CDCl3): δ 3.60-3.80 (8Н, m).
ESI-MC (70 эВ, m/z): рассчитанная для C7H8Cl2N4O [М+] (234); экспериментальная 234.
Рентгеновский анализ: структура титульного соединения подтверждена при помощи рентгеновского анализа.
Пример Р33

4-(4-хлор-6-(4-метилпиперазин-1-ил)-1,3,5-триазин-2-ил)морфолин:
4-(4,6-дихлор-1,3,5-триазин-2-ил)морфолин (1,40 г, 5,96 ммоль, 1,0 экв.) растворяли в дихлорметане (21 мл). В реакционную смесь при 0°С добавляли N-метилпиперазин (727 µл, 6,56 ммоль, 1,1 экв.) и перемешивали в течение 30 минут при указанной температуре. Выпаривали растворитель при пониженном давлении, и очистка при помощи флэш-хроматографии позволила получить титульное соединение в виде белого твердого вещества (690 мг, 39%).
Данные анализа:
1Н-ЯМР (400 МГц, CDCl3): δ 3.78-3.68 (17Н, m), 2.42 (4H, t, J=5.3, J=5.05), 2.32 (3H, s), 0.87-0.72 (1H, m).
13С-ЯМР (100 МГц, CDCl3): δ 170.05, 164.92, 164.69, 46.51, 44.24, 43.75, 43.68.
ESI-MC (70 эВ, m/z): рассчитанная для C12H19ClN6O [М+Н]+ (299); экспериментальная 299.
Пример Р34

Смесь метил 4-аминотиазол-5-карбоксилата (1,0 экв.) и мочевины (5 экв.) нагревали при 190°С в течение 2 часов. Горячую реакционную смесь выливали в раствор гидроксида натрия и нерастворившееся вещество удаляли при помощи фильтрования. Затем смесь подкисляли (HCl, 2Н) с получение тиазоло[4,5-d]пиримидин-5,7(4Н,6Н)-диона в виде белого осадка, который собирали при помощи фильтрования и осушили на воздухе.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C5H4N3O2S [М+Н]+ (170); экспериментальная 170.
Смесь тиазоло[4,5-d]пиримидин-5,7(4Н,6Н)-диона (9,49 г, 56,5 ммоль) и оксихлорида фосфора (150 мл) кипятили с обратным холодильником в течение 6 часов. Затем реакционную смесь охлаждали и POCl3 выпаривали при пониженном давлении. Неочищенный продукт промывали диэтиловым эфиром и NaHCO3. Затем смесь фильтровали с получением 5,7-дихлортиазоло[4,5-d]пиримидина в виде белого твердою вещества.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C5H2Cl2N3S [М+Н]+ (206); экспериментальная 206.

Смесь 5,7-дихлортиазоло[4,5-d]пиримидина (1,0 экв.), морфолина (2,2 экв.) и МеОН перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь фильтровали, промывали водой и МеОН с получением 4-(5-хлортиазоло[4,5-d]пиримидин-7-ил)морфолина в виде белого твердого вещества (100%).
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C9H10ClN4OS [M+H]+ (257); экспериментальная 257.
Альтернативная схема синтеза

Пример Р35

4-(2-(3-(трет-бутилдиметилсилилокси)фенил)тиено[3,2-d]пиримиди11-4-ил)морфолин:
3-(4-Морфолинотиено[3,2-d]пиримидин-2-ил)фенол (полученный согласно Hayakawa et al., Bioorganic & Med. Chem. 14:6847-6858 (2006)) (540 мг, 1,72 ммоль, 1,0 экв.) растворяли в ДМФ (5 мл). К полученному раствору добавляли имидазол (936 мг, 13,8 ммоль, 8,0 экв.) и TBDMSC1 (909 мг, 6,02 ммоль, 3,5 экв.) и смесь нагревали при 70°С в течение 3 часов. ДМФ выпаривали при пониженном давлении, и очистка при помощи флэш-хроматографии (гексан: этилацетат, градиент от 100 до 50% гексана в EtOAc) позволила получить титульное соединение в виде белого твердого вещества.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C22H30H3O2SSi [М+Н]+ (428); экспериментальная 428.
Пример Р36

4-(5-(3-(трет-бутилдиметилсилилокси)фенил)тиазоло['4,5-d]пиримидин-7-ил)морфолин:
3-(7-морфолинотиазоло[4,5-d]пиримидин-5-ил)фенол (1,0 экв.) растворяли в ДМФ (5 мл). К указанному раствору добавляли имидазол (8,0 экв.) и TBDMSCl (3,5 экв.) и смесь нагревали при 70°С в течение 5 часов. Выпаривали ДМФ при пониженном давлении, и очистка при помощи флэш-хроматографии (гексан: этилацетат, градиент от 100% до 50% гексана в EtOAc) позволила получить титульное соединение в виде белого твердого вещества.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C21H29N4O2SSi [M+H]+ (428); экспериментальная 428.
Пример Р37

Трет-бутил 2-(2-(3-(трет-бутилдиметилсилилокси)фенил)-4-морфолинотиено[3,2-d]пиримидин-6-ил)этилкарбамат:
4-(2-(3-(Трет-бутилдиметилсилилокси)фенил)тиено[3,2-d]пиримидин-4-ил)морфолин (166 мг, 388 µмоль, 1,0 экв.) растворяли в сухом ТГФ (3 мл) при комнатной температуре и добавляли в круглодонную двухгорлую колбу, которую нагревали в вакууме и продували азотом. Затем раствор охлаждали до -78°С и по каплям добавляли n-BuLi (315 ал, 1,6М раствор в гексане, 1,3 экв.). После перемешивания в течение 20 минут к реакционной смеси добавляли 2-(Boc-амино)этилбромид (130 мг, 582 µмоль, 1,5 экв.) и реакционную смесь перемешивали при -78°С в течение 20 минут, затем нагревали до комнатной температуры. Реакционную смесь дополнительно перемешивали при комнатной температуре в течение ночи.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C29H43N4O4SSi [M+H]+ (571.27); экспериментальная 571.
Пример Р38

2-(2-(3-(трет-бутилдиметилсилилокси)фенил)-4-морфолинотиено[3,2-d]пиримидиц-6-ил)этанамин:
Трет-бутил 2-(2-(3-(трет-бутилдиметилсилилокси)фенил)-4-морфолинотиено[3,2-d]пиримидин-6-ил)этилкарбамат (10,0 мг, 1,0 экв.) растворяли в 3 мл ТФУК:ДХМ (1:1). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Колоночная хроматография на оксиде кремния (ДХМ:МеОН/95:5) позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C24H35N4O2SSi [М+Н]+ (471.22); экспериментальная 471.
Пример Р39

10-(3-(2-(2-(3-(трет-бутилдиметилсилилокси)фенил)-4-морфолинотиено[3,2-d]пиримидин-6-ил)этиламино)-3-оксопропил)-5,5-дифтор-1,3,7,9-тетраметил-5Н-дипирроло[1,2-с:1',2'-f][1,3,2]диазаборинин-4-ий-5-уид:
К раствору 2-(2-(3-(трет-бутилдиметилсилилокси)фенил)-4-морфолинотиено[3,2-d]пиримидин-6-ил)этанамина (0,010895 ммоль, 1,0 экв.) в ДМФ (200 µл) при комнатной температуре добавляли Bodipy-NHS (0,011984 ммоль, 1,1 экв.), затем DIPEA (0,02179 ммоль, 2,0 экв.). После 24 часов перемешивания при комнатной температуре в темноте удаляли растворители в глубоком вакууме и смесь очищали при помощи флэш-хроматографии (ДХМ:МеОН/35:1). Дополнительная очистка при помощи препаративной ТСХ позволила получить титульное соединение.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C40H52BF2N6O3SSi [M+H]+ (773); экспериментальная 773.
Пример Р40

5,5-дифтор-10-(3-(2-(2-(3-гидроксифенил)-4-морфолинотиено[3,2-d]пиримидин-6-ил)этиламино)-3-оксопропил)-1,3,7,9-тетраметил-5Н-дипирроло[1,2-с:1',2'-f]диазаборинин-4-ий-5-уид:
К раствору TBDMS защищенного производного фенола (0,060269 ммоль, 1,0 экв.) в 3 мл абс. ТГФ, охлажденного до 0°С, добавляли 1М раствор фторида тетрабутиламмония (ТБАФ) в ТГФ (0,120538 ммоль, 2,0 экв.). После перемешивания при 0°С в течение 40 минут удаляли растворитель в вакууме и остаток очищали при помощи флэш-хроматографии (градиент, гексан: этилацетат), затем остаток растирали в смеси EtOAc/МеОН с получением титульного соединения в виде бесцветного твердого вещества.
Данные анализа:
ESI-MC (70 эВ, m/z): рассчитанная для C34H38BF2N6O3S [M+H]+ (659); экспериментальная 659.
Пример Р41

Бензофуро[3,2-d]пиримидин-2,4(1Н,3Н)-дион:
К перемешиваемому раствору 3-амино-2,3-дигидробензофуран-2-карбоксамида (82,2 мг, 0,461 ммоль, 1,0 экв.) в безводном толуоле (8 мл) в инертной атмосфере по каплям добавляли оксалилхлорид (70,2 мг, 553 µмоль, 1,2 экв.). Полученную смесь кипятили с обратным холодильником (115°С) в течение 4 часов, после чего охлаждали и дополнительно перемешивали в течение 16 часов. Неочищенную реакционную смесь концентрировали до половины объема и фильтровали с получением бесцветного твердого вещества (41,5 мг, 45%). Данные анализа:
1Н-ЯМР (400 МГц, ДМСО): δ 11.80 (s, 1H), 8.50-7.20 (m, 4H).
13С-ЯМР (125 МГц, ДМСО): δ 162.2, 157.0, 152.7, 134.6, 128.4, 125.9, 125.1, 123.5, 121.1, 112.2.
Пример Р42

Этил 2-карбамоилбензофуран-3-илкарбамат:
3-амино-2,3-дигидробензофуран-2-карбоксамид (200 мг, 1,14 ммоль, 1,0 экв.) и этилхлорформиат (109 мл, 1,14 ммоль, 1,0 экв.) в безводном толуоле (10 мл) в инертной атмосфере кипятили с обратным холодильником (115°С) в течение 6 часов, затем перемешивали при комнатной температуре в течение ночи. Удаляли растворитель и остаток очищали при помощи хроматографии (градиент от 100% гексана в EtOAc до 50%) с получением белого твердого вещества (130 мг, 46%).
Данные анализа:
1Н-ЯМР (400 МГц, CDCl3): δ 9.19 (s, 1H), 8.45 (d,3JHH=8.1 Гц, 1H), 7.45-7.41 (m, 2H), 7.28-7.26 (m, 1H), 6.34 (s, br, 1H), 5.8 (s, br, 1H), 4.28 (q,3JHH=7.1 Гц, 2Н), 1.35 (t,3JHH=7.1 Гц, 3Н).
13С-ЯМР (100 МГц, CDCl3): δ 163.4, 154.0, 153.9, 129.6, 128.7, 126.7, 123.6, 122.0, 112.1.
ESI-MC (MeOH, 70 эВ): рассчитанная для C12H12N2O4 [M+Na]+ (271); экспериментальная 271.
Пример Р43

Бензофуро[3,2-d]пиримидин-2,4(1H,3Н)-диол:
Этил 2-карбамоилбспзофуран-3-илкарбамат (114 мг, 0,460 ммоль, 1,0 экв.) в 5% растворе NaOH (3,7 мл, 4,60 ммоль, 10,0 экв.) и EtOH (2,2 мл) кипятили с обратным холодильником в течение 1 часа. После охлаждения смеси до комнатной температуры продукт осаждали при помощи добавления HCl (конц., 37%) и твердое вещество собирали при помощи фильтрования и промывали водой и Et2O. Полученное соединение (40 мг, 43%) применяли на следующей стадии без дополнительной очистки.
Данные анализа:
1Н-ЯМР (500 МГц, ДМСО): δ 12.03 (s, 1H), 11.43 (s, 1H), 8.00 (d,3JHH=7.3 Гц, 1H), 7.75 (d,3JHH=8.5 Гц, 1H), 7.64 (t,3JHH=7.3 Гц, 1H), 7.45 (t,3JHH=7.3 Гц, 1H)
13С-ЯМР (100 MHz, ДМСО): δ 155.5, 154.9, 151.3, 133.3, 130.6, 129.8, 123.9, 121.6, 117.6, 112.9.
Пример Р44

2,4-дихлорбензофуро[3,2-d]пиримидин:
В бензофуро[3,2-d]пиримидип-2,4(1Н,3Н)-дион (100 мг, 495 µмоль, 1,0 экв.) в толуоле (810 µл) в инертной атмосфере добавляли N,N-диизопропилэтиламин (427 мл, 2,48 ммоль, 5,0 экв.). Затем к смеси по каплям добавляли оксихлорид фосфора (227 мл, 2,48 ммоль, 5,0 экв.) перед нагреванием реакционной смеси до 100°С в течение 22 часов. Затем смесь концентрировали в вакууме, добавляли воду (20 мл) и экстрагировали смесь ДХМ, промывали насыщенным раствором NaHCO3. Удаляли растворители в глубоком вакууме и очищали соединение при помощи хроматографии (градиент от 100% гексана в EtOAc до 50% гексана) с получением бесцветного твердого вещества (68,3 мг, 58%).
Данные анализа:
1Н-ЯМР (500 МГц, ДМСО): δ 8.28 (d,3JHH=7.3 Гц, 1H), 8.01 (d,3JHH=8.5 Гц, 1H), 7.93 (t,3JHH=7.9 Гц, 1H), 7.65 (t,3JHH=7.3 Гц, 1H).
13C-ЯМР (125 МГц, ДМСО): δ 158.4, 153.3, 151.8, 143.6, 142.4, 133.9, 125.5, 122.8, 120.1, 113.5.
TCX (SiO2, гексан/EtOAc (1:1), Rf=0.88
Пример Р45

2-хлор-4-морфолинобензофуро[3,2-d]пиримидин:
2,4-Дихлорбензофуро[3,2-d]пиримидин (61 мг, 0,255 ммоль, 1,0 экв.) растворяли в МеОН (2 мл) и добавляли морфолин (49,1 мл, 562 µмоль, 2,2 экв.) Реакционную смесь кипятили с обратным холодильником в течение 30 минут, затем охлаждали до комнатной температуры. Удаляли растворители в вакууме и очищали остаток при помощи хроматографии на силикагеле (градиент от 100% гексана в EtOAc до 50% гексана) с получением бесцветного твердого вещества (59,4 мг, 80%).
Данные анализа:
1Н-ЯМР (400 МГц, ДМСО): δ 8.06 (d,3JHH=7.3 Гц, 1Н), 7.82 (d,3JHH=8.3 Гц, 1Н), 7.71 (t,3JHH=7.8 Гц, 1Н), 7.50 (t,3JHH=7.6 Гц, 1Н), 4.00-3.99 (m, 4H), 3.77 (t,3JHH=5.1 Гц, 4Н).
MC-ESI (МеОН, 70 эВ): рассчитанная для C14H13ClN3O2 [М+Н]+ (290); экспериментальная 290.
Пример Р46

3-(4-морфолинобензофуромидин-2-ил)фенол:
Газообразным аргоном продували смесь 2-хлор-4-морфолинобензофуро[3,2-d]пиримидина (ASA66) (48,7 мг, 168 µмоль, 1,0 экв.) и пинаколинового эфира 3-гидроксифепилбороновой кислоты (ММ 220) (148 мг, 672 µмоль, 4,0 экв.) в 1,2-диметоксиэтане и 2М Na2CO3 (3:1) (4 мл) в течение 5 минут. Добавляли комплекс дихлор 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана (ММ 732) (3,07 мг, 4,20 µмоль, 0,025 экв.) и реакционную смесь кипятили с обратным холодильником (90°С) в течение 15,5 часов. Раствор красного цвета охлаждали и разбавляли EtOAc (6,5 мл). Органический раствор промывали смесью H2O:Na2CO3:NH4OH (конц., 32% раствор в воде)=5:4:1 (6,5 мл), затем NH4Cl (нас.) и солевым раствором (2×), сушили Na2CO3, фильтровали и концентрировали. Очистка при помощи хроматографии на силикагеле позволила получить бесцветное твердое вещество (49 мг, 85%).
Данные анализа:
1Н-ЯМР (400 МГц, ДМСО): δ 9.52 (s, 1H), 8.14-8.12 (d,3JHH=7.0 Гц, 1Н), 7.88-7.86 (m, 2H), 7.80-7.78 (d,3JHH=8.3 Гц, 1H), 7.68 (t,3JHH=7.7 Гц, 1H), 7.49 (t,3JHH=7.3 Гц, 1H), 7.27 (t,3JHH=7.6 Гц, 1H), 6.87-6.84 (m, 1H), 4.08 (t,3JHH=4.6 Гц, 4Н), 3.81 (3JHH=4.8 Гц, 4Н).
13С-ЯМР (100 МГц, ДМСО): δ 158.9, 158.3, 156.7, 149.2, 148.9, 140.1, 134.8, 131.3, 130.2, 124.9, 122.8, 122.2, 119.6, 117.8, 115.4, 113.6, 66.9, 46.1.
MC-ESI (MeOH, 70 эВ): рассчитанная для C20H17N3O3 [М+Н]+ (348); экспериментальная 349.
Пример Р47

5-(4-морфолинобензофуро[3,2-d]пиримидин-2-ил)пиридин-2-амин:
Газообразным аргоном продували смесь 2-хлор-4-морфолинобензофуро[3,2-d]пиримидина (ASA75) (80 мг, 0,276 ммоль, 1,0 экв.) и пинаколинового эфира 2-аминопиридин-5-бороновой кислоты (ММ 220) (243 мг, 1,10 ммоль, 4,0 экв.) в 1,2-диметоксиэтане и 2М Na2CO3 (3:1) (6 мл) в течение 5 минут. Добавляли комплекс дихлор 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана (ММ 732) (5,05 мг, 0,00690 ммоль, 0,025 экв.) и реакционную смесь кипятили с обратным холодильником (90°С) в течение 14 часов 45 минут, охлаждали и разбавляли EtOAc (9 мл). Органический раствор промывали смесью H2O:Na2CO3:NH4OH (конц., 32% раствор в воде)=5:4:1 (9 мл), затем NH4Cl (нас.) и солевым раствором (2×), сушили Na2CO3, фильтровали и концентрировали. Очистка при помощи хроматографии на силикагеле (градиент от = % MeOH в ДХМ до 5% MeOH в ДХМ) позволила получить бесцветное твердое вещество (4,40 мг, 5%).
Данные анализа:
1Н-ЯМР (400 МГц, ДМСО): δ 8.96 (d, JHH=1.8 Гц, 1H), 8.37 (dd,3JHH=8,4 Гц,4JHH=2.5 Гц, 1H), 8.12 (d,3JHH=7.6 Гц, 1H), 7.78 (d,3JHH=8.4 Гц, 1H), 7.67 (dt,3JHH=7.1 Гц,4JHH=1.3 Гц, 1H), 7.48 (t,3JHH=7.1 Гц, 1H), 6.58 (s, 1H), 6.56 (s, 2H), 4.06-4.05 (m, 4H), 3.81-3.80 (m, 4H).
MC-ESI (MeOH, 70 эВ): рассчитанная для C19H17N5O2 [M+H]+ (348); экспериментальная 348.
Пример Р48

2-(1Н-индол-4-ил)-4-морфолинобензофуро[3,2-d]пиримидин:
Газообразным аргоном продували смесь 2-хлор-4-морфолинобензофуро[3,2-d]пиримидина (ASA75) (80 мг, 0,276 ммоль, 1,0 экв.) и пинаколинового эфира индол-4-бороновой кислоты (ММ 243) (267 мг, 1,10 ммоль, 4,0 экв.) в 1,2-диметоксиэтане и 2М Na2CO3 (3:1) (6 мл) в течение 5 минут. Добавляли комплекс дихлор 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана (ММ 732) (5,05 мг, 0,00690 ммоль, 0,025 экв.) и реакционную смесь кипятили с обратным холодильником (90°С) в течение 15 часов 30 минут, охлаждали и разбавляли EtOAc (20 мл). Органический раствор промывали смесью H2O:Na2CO3:NH4OH (конц., 32% раствор в воде)=5:4:1 (9 мл), затем NH4Cl (нас.) и солевым раствором (2×), сушили Na2CO3, фильтровали и концентрировали. Очистка при помощи хроматографии па силикагеле (градиент от 100% гексана в EtOAc до 50% гексана) позволила получить желтоватое твердое вещество (89,0 мг, 87%).
Данные анализа:
1Н-ЯМР (400 МГц, ДМСО): δ 11.26 (s, 1H), 8.20-8.17 (m, 2H), 7.76 (d,3JHH=8.4 Гц, 1H), 7.66 (dt,3JHH=6.0 Гц,4JHH=1.3 Гц, 1H), 7.55-7.53 (m, 2H), 7.50-7.47 (m, 2H), 7.22 (t,3JHH=7.8 Гц, 1H), 4.08 (t,3JHH=5.1 Гц, 4H), 3.81 (t,3JHH=5.0 Гц, 4H).
13С-ЯМР (100 МГц, ДМСО): δ 161.2, 156.6. 149.3. 148.9, 138.0, 134.3. 131.1, 130.5, 127.2, 126.9, 124.8, 123.0, 122.2, 121.5, 121.3, 114.2, 113.5, 104.4, 66.9, 46.3.
MC-ESI (MeOH, 70 эВ): рассчитанная для C22H18N4O2 [М+Н]+ (371); экспериментальная 372.
Пример Р49

2-(1Н-индол-5-ил)-4-морфолинобензофуро[3,2-d]пиримидин:
Газообразным аргоном продували смесь 2-хлор-4-морфолинобензофуро[3,2-d]пиримидина (ASA75) (80 мг, 0,276 ммоль, 1,0 экв.) и пинаколинового эфира индол-5-бороновой кислоты (ММ 243) (267 мг, 1,10 ммоль, 4,0 экв.) в 1,2-диметоксиэтане и 2М Na2CO3 (3:1) (6 мл) в течение 5 минут. Добавляли комплекс дихлор 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана (ММ 732) (5.05 мг, 0,00690 ммоль, 0,025 экв.) и реакционную смесь кипятили с обратным холодильником (90°С) в течение 15 часов, охлаждали и разбавляли EtOAc (20 мл). Органический раствор промывали смесью H2O:Na2CO3:NH4OH (конц., 32% раствор в воде)=5:4:1 (9 мл), затем NH4Cl (нас.) и солевым раствором (2×), осушили Na2CO3, фильтровали и концентрировали. Очистка при помощи хроматографии на силикагеле (градиент от 100% гексана в EtOAc до 70% гексана) позволила получить бесцветное твердое вещество (35 мг, 34%).
Данные анализа:
1Н-ЯМР (400 МГц, ДМСО): δ 11.23 (s, 1Н), 8.71 (s, 1H), 8.29 (dd,3JHH=8.6 Гц,4JHH=1.5 Гц, 1H), 8.17 (d,3JHH=7.6 Гц, 1H), 7.75 (d, 8.3 Гц, 1H), 7.65 (dt,3JHH=7.8 Гц,4JHH=1.0 Гц, 1H), 7.50-7.46 (m, 2H), 7.39 (t, JHH=2.8 Гц, 1H), 6.57 (s, 1H), 4.09-4.06 (m, 4H), 3.82.3.80 (m, 4H).
Пример Р50
Внутриклеточное исследование ингибирования по типу Western (протокол определения фосфо-РКВ/РКВ при А2058 меланоме):
Ингибирующую эффективность соединений формулы I определяли при помощи клеточного исследования с применением следующего способа:
Клетки помещали в 96-луночные планшеты (Packard) за 24 часа до начала эксперимента. К среде добавляли ингибитор или ДМСО в качестве контрольного образца (каждый образец в двух экземплярах) и инкубировали в течение 3 часов. Для фиксации клетки обрабатывали 4% пара-формальдегидом в течение 20 минут. После промывания ФСБ/0,1% Triton/X-100, проводили заливку 100% козьей сыворотки в ФСБ в течение 1 часа. Растворенные в ФСБ антитела против рРКВ Ser473 (Cell Signalling) и РКВ (получены в дар от Э.Хирша (Е.Hirsch)) или pS6 Ser235/236 (Cell Signalling) инкубировали во встряхивателе в течение ночи при 4°С. После промывания ФСБ применяли вторичные антитела (LI-COR), разбавленные ФСБ, при комнатной температуре в темноте. Планшеты промывали ФСБ перед сканированием на устройстве для чтения планшетов Odyssey.
День 0
1. Помещали 80000 клеток/лунку в черный 96-луночный ViewPlate производства Packard.
2. Помещали 200 µл клеточной суспензии на лунку при помощи многоканальной пипетки.
3. Исследовали гомогенность распределения под микроскопом.
4. Инкубировали клетки в течение 24 часов.
День 1
1. Осторожно удаляли среду и повторно помещали в лунки 100 µл среды. Проверяли под микроскопом потерю клеток.
2. Добавляли 1 µл 100× концентрированного ДМСО или ингибитора.
3. Инкубировали в течение 3 часов при 37°С.
4. Добавляли 60 µл параформальдегида 10% (конечная концентрация 4%) и инкубировали при комнатной температуре в течение 20 минут.
5. Промывали 3×5 минут (200 µл) ФСБ/0,1% Triton/X-100.
6. Заливали в течение 60 минут (100 µл) 10% FCS в ФСБ при комнатой температуре.
7. Инкубировали в течение ночи 50 µл рРКВ Ser473 (1:500) и РКВ (1:500) или pS6 Ser235/236 (1:500) в ФСБ при 4°С на встряхивателе.
День 2
1. Промывали 3×5 минут ФСБ.
2. Инкубировали в течение 60 минут 50 µл вторичных противокроличьих антител IRDye800 (1:800) и противомышиных антител IRDye680 (1:500) в ФСБ при комнатной температуре в темноте во встряхивателе.
3. Промывали 3×5 минут ФСБ.
4. Исследовали планшет па устройстве для чтения планшетов Odyssey.
Реагенты:
Packard ViewPlate (черный) #6005225
Анти-Phospho РКВ Scr473 (Cell Signalling кат.4058)
Анти-РКВ (полученный в дар от Э.Хирша, Турин)
Анти-р86 Ser 235/236 (Cell Signalling кат.4856)
Козий противокроличий IRDye800 CW (LI-COR кат. 926-32211)
Козий противомышиный IRDye680 (LI-COR кат. 923-32220)
Примеры проведения внутриклеточного исследования ингибирования по типу Western:
Для более фосфорилированных РКВ, определенных на скане Odyssey, получали более высокие значения рРКВ/РКВ, т.е. происходило менее сильное ингибирование сигнала. Обобщенные результаты, полученные для некоторых типовых соединений, представлены в Таблице 7.
Подтверждение проницаемости соединение косвенным образом отражено с применением указанного исследования. Соединения применяли на апикальной поверхности клеточных монослоев, и проникновение соединения в клеточные полости можно определить при помощи определения ингибирования PI3K.
Рис.1 и рис.2 (см в конце описания).
Представленное описание следует рассматривать как иллюстрацию основ данного изобретения. Также, так как ряд модификаций и изменений являются очевидными специалистам в данной области техники, описание не ограничивает изобретение в конкретных определениях и процессах, описанных выше. Соответственно, все подходящие модификации и эквиваленты можно рассматривать как входящие в объем настоящего изобретения, определенного формулой изобретения, представленной далее.
Термины «содержит», «содержащий», «включают», «включающий» и «включает» при использовании в указанном описании и в представленной далее формуле изобретения предназначены для уточнения наличия указанных признаков, численных значений, компонентов или стадий, но не исключают наличия или добавления одного или более признаков, численного значения, компонента, стадий или их групп.
Реферат
Изобретение относится к соединениям формулы (Ib):где Rпредставляет собой гетероарильную группу и где указанная моноциклическая гетероарильная группа является незамещенной или замещенной одной или более группами, выбранными из F, Cl, Br, I, -NRRи С-Салкила; а также группами, выбранными из F, -NH, -NHCH, -N(CH), -ОН, -ОСН, -С(O)СН, -NHC(O)CH, -N(C(O)CH), -NHC(O)NH, -COH, -СНО, -СНОН, -C(=O)NHCH, -C(=O)NH, и -СН; R, R, Rи Rпредставляют собой водород; R, R, Rи Rнезависимо друг от друга выбраны из группы, состоящей из: водорода, F, Cl, Br, I, и -С(С-Салкил)NRR; и Rи Rпредставляют собой водород, которые являются ингибиторами фосфоипозитид-3-киназы (PI3K) и мишенью рапамицина у млекопитающих (mTOR). 5 н. и 2 з.п. ф-лы., 7 табл., 50 пр.
Формула

и его фармацевтически приемлемые соли, где
R2 представляет собой гетероарильную группу структуры:

где волнистая линия показывает место присоединения триазинового кольца, и
где указанная моноциклическая гетероарильная группа является незамещенной или замещенной одной или более группами, выбранными из F, Cl, Br, I, -NR10R11 и С1-С12алкила;
или моноциклическую гетероарильную группу структуры

где волнистая линия показывает место присоединения триазинового кольца, и
где указанная моноциклическая гетероарильная группа является незамещенной или дополнительно замещенной одной или более группами, выбранными из F, -NH2, -NHCH3, -N(CH3)2, -ОН, -ОСН3, -С(O)СН3, -NHC(O)CH3, -N(C(O)CH3)2, -NHC(O)NH2, -CO2H, -СНО, -СН2ОН, -C(=O)NHCH3, -C(=O)NH2, и -СН3;
R3x, R3y, R3z и R3p представляют собой водород;
R4x, R4y, R4z и R4p независимо друг от друга выбраны из группы, состоящей из:
водорода, F, Cl, Br, I, и -С(С1-С6 алкил)2NR10R11; и
R10 и R11 представляют собой водород.
R3x, R3y, R3z, R3p и R4x, R4z, и R4p представляют собой водород.
- 4,4′-(6-(пиридин-3-ил)-1,3,5-триазин-2,4-диил)диморфолина,
- 3-(4,6-диморфолино-1,3,5-триазин-2-ил)фенола,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиридин-2-амина,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)пиримидин-2-амина,
- 5-(4,6-диморфолино-1,3,5-триазин-2-ил)-4-(трифторметил)пиридин-2-амина,
- 4-(4,6-диморфолино-1,3,5-триазин-2-ил)анилина,
- 3-(4,6-диморфолино-1,3,5-триазин-2-ил)анилина,
- 3-(4,6-диморфолино-1,3,5-триазин-2-ил)бензонитрила,
- 4-(4,6-диморфолино-1,3,5-триазин-2-ил)бензонитрила,
- 4,4′-(6-(6-морфолинопиридин-3-ил)-1,3,5-триазин-2,4-диил)диморфолина, и
- 4,4′-(6-(5-фторпиридин-3-ил)-1,3,5-триазин-2,4-диил)диморфолина.





































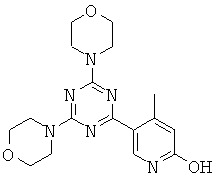



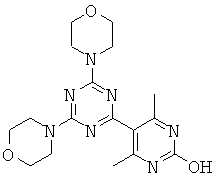












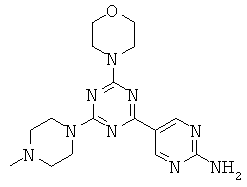









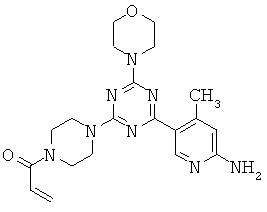

















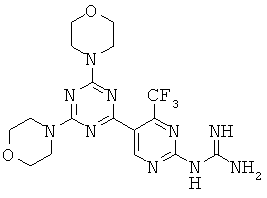























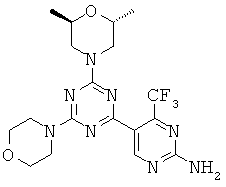





















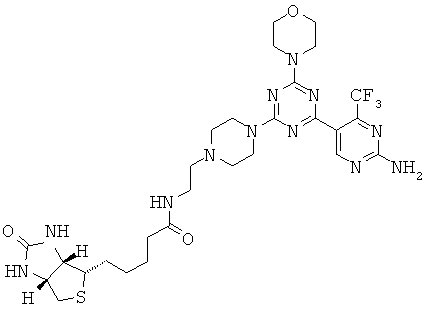

























































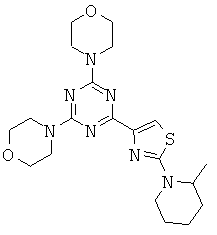



















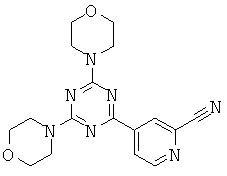











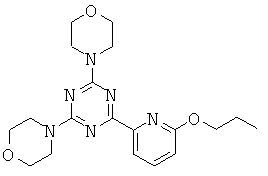
























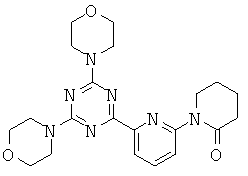
















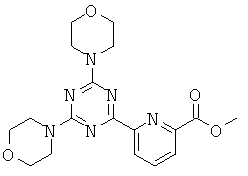












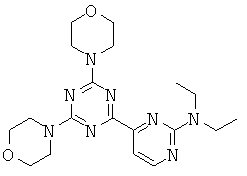

















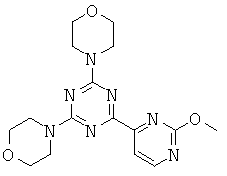














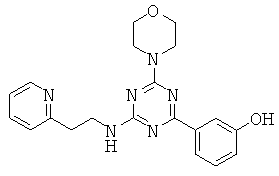


































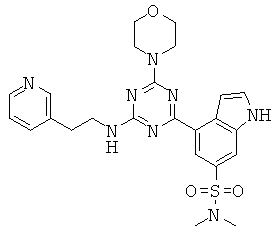










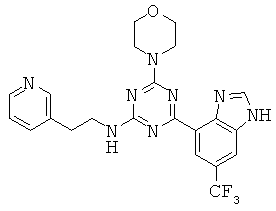
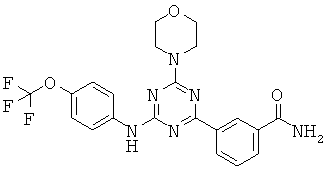
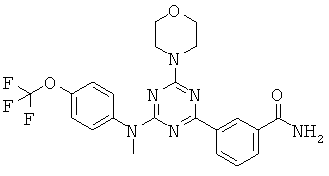



























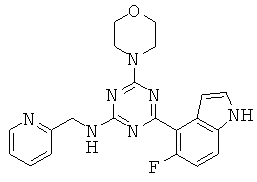

































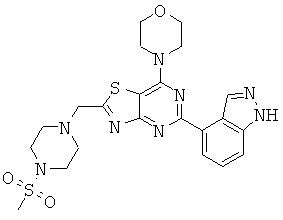


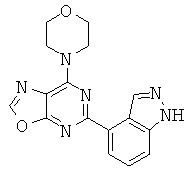




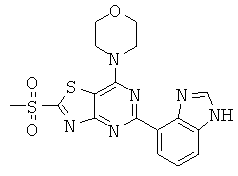













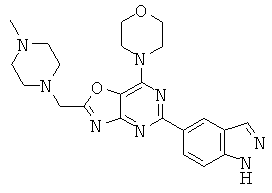





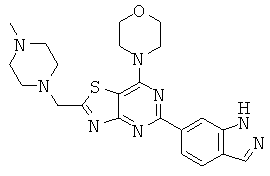



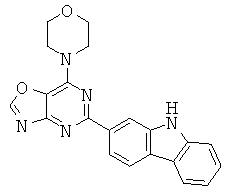









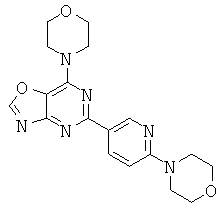




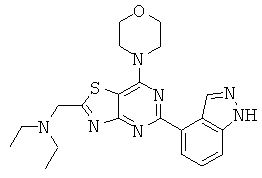




















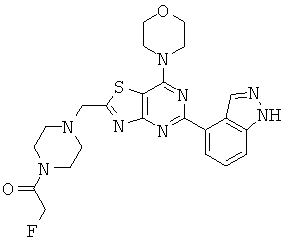



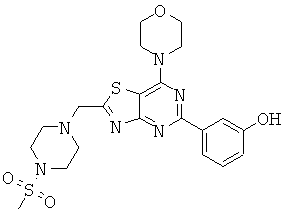

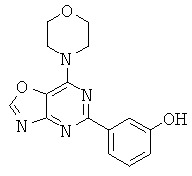
























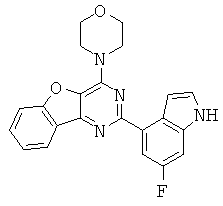





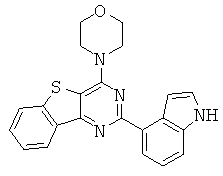


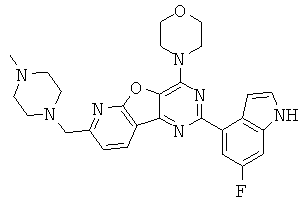



























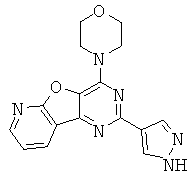
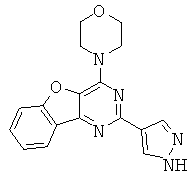























































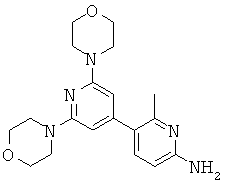































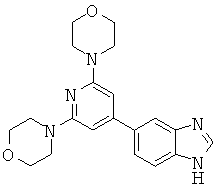














Комментарии