Производное пиридина - RU2640588C2
Код документа: RU2640588C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается производного пиридина, которое может применяться в качестве фармацевтического средства. Более конкретно, оно касается производного пиридина, которое оказывает ингибирующее действие на URAT1 и может применяться в лечении или профилактике заболеваний, связанных с URAT1, таких как подагра, гиперурикемия, гипертензия, заболевания почек, такие как интерстициальный нефрит, диабет, артериосклероз или синдром Леша-Найхана, или его пролекарства, или его фармацевтически приемлемой соли или его сольвата.
Предшествующий уровень техники
Мочевая кислота является конечным продуктом метаболизма пурина в печени. Главным путем выведения мочевой кислоты являются почки. Примерно две трети мочевой кислоты выводится с мочой, а остальное выводится с калом. В то время как уровень мочевой кислоты в крови у здоровых людей поддерживается на необходимом уровне, может возникать гиперурикемия при избыточном поступлении мочевой кислоты или снижении скорости выведения мочевой кислоты.
Гиперурикемия, при которой повышается уровень содержания мочевой кислоты в крови, является фактором возникновения подагры и мочевого конкремента, и кроме того считается, что она вносит свой вклад в развитие нефропатии и артериосклероза. Кроме того, в последнее время появляется растущее число сообщений касательно того, что чем выше концентрация мочевой кислоты в крови, тем выше показатель частоты заболеваемости болезнями образа жизни, такими как метаболический синдром и гипертензия, хроническая болезнь почек и т.п., и гиперурикемия признана фактором риска для перечисленных заболеваний. Так, положительная динамика гиперурикемии дает основания ожидать улучшений при различных заболеваниях (Непатентный Документ 1).
Недавно был идентифицирован ген (SLC22A12), кодирующий переносчик урата в почках человека. Данный переносчик (урат-транспортер 1, URAT1), кодируемый указанным геном, представляет собой молекулу 12-трансмембранного типа, принадлежащую к семейству ОАТ. Его матричная РНК в особенности экспрессирована в почках, и кроме того, его локализация в верхушечной части проксимальной трубочки наблюдалась на разрезах ткани почек человека. URAT1-опосредованное поглощение мочевой кислоты было показано экспериментально с помощью экспрессирующей системы ооцита Xenopus. Кроме того, сообщалось, что пробенецид или бензбромарон, которые ингибируют URAT1, являются полезным средством предотвращения или лечения гиперурикемии, подагры и т.п. (Непатентный документ 2).
Документы из предшествующего уровня техники
Непатентные документы
[Непатентный документ 1] The Guideline Revising Committee of Japanese Society of Gout and Nucleic Acid Metabolism, ed., Guideline for the management of hyperuricemia and gout, second edition, Medical Review (2010).
[Непатентный документ 2] Enomoto A. et al., Nature 417, 447-452 (2002).
Раскрытие изобретения
Проблемы, на решение которых направлено изобретение
Целью настоящего изобретения является разработка нового соединения, обладающего URAT1-ингибирующим действием.
Кроме того, целью настоящего изобретения является разработка средства для лечения или профилактики связанного с URAT1 заболевания, такого как подагра, гиперурикемия, гипертензия, заболевание почек, такое как интерстициальный нефрит, диабет, артериосклероз, или Синдром Леша-Найхана, содержащего новое соединение, обладающее URAT1-ингибирующим действием, в качестве действующего вещества
Способы решения указанных проблем
Результатом кропотливых исследований авторами настоящего изобретения перечисленных выше проблем стало описанное далее изобретение.
Так, настоящее изобретение касается производного пиридина, представленного изображенной далее формулой (I), или его фармацевтически приемлемой соли, или его сольвата:

где:
А представляет собой простую связь, атом кислорода, атом серы, NH или CH2;
R1 представляет собой атом азота или СН;
один из X1-Х5 представляет собой атом азота, а остальные четыре представляют собой CR2;
R2 каждый независимо представляют собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, алкенильную группу, содержащую 2-6 атомов углерода, алкинильную группу, содержащую 2-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, алкилкарбонильную группу, содержащую 2-7 атомов углерода, алкилсульфонильную группу, содержащую 1-6 атомов углерода, нитро-группу, амино-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, формильную группу, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), при условии, что когда два фрагмента CR2 pacпoлoжeны рядом, два радикала R2 опционально могут объединяться с образованием цикла;
R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкенильную группу, содержащую 2-6 атомов углерода, алкинильную группу, содержащую 2-6 атомов углерода, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы и атома галогена), алкилкарбонильную группу, содержащую 2-7 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, алкилсульфинильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), пиридильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5;
R4 представляет собой карбоксильную группу, тетразолильную группу, -CONHSO2R5, -CO2R5, или любой из представленных далее заместителей:
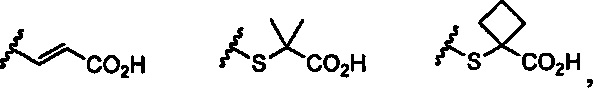
при условии, что когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, и когда R4 представляет собой карбоксильную группу, то R3 и R4 опционально могут быть соединены с образованием лактонового цикла;
R5 в R3 и R4 каждый независимо представляют собой алкильную группу, содержащую 1-6 атомов углерода;
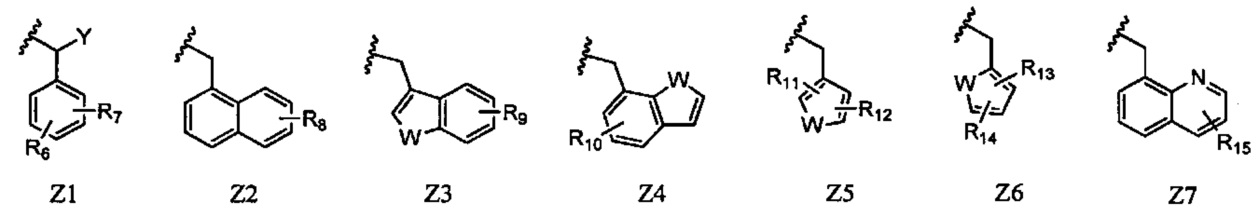
Z представляет собой любой из следующих заместителей, обозначенных Z1-Z7:
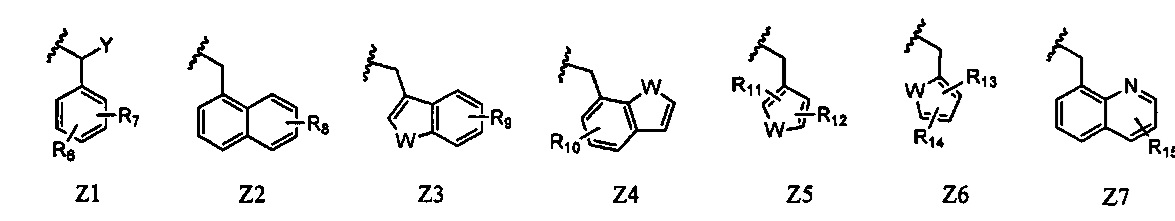
R6 и R7 каждый независимо представляют собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, трифторметильную группу, трифторметокси-группу или циано-группу, при условии, что исключен случай, когда R6 и R7 одновременно представляют собой атомы водорода;
R8 представляет собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу;
R9 представляет собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу;
R10 представляет собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу;
R11 и R12 каждый независимо представляют собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу;
R13 и R14 каждый независимо представляют собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу;
R15 представляет собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу;
Y представляет собой атом водорода или алкильную группу, содержащую 1-6 атомов углерода; и
W представляет собой атом серы, атом кислорода или NR16 (где R16 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, или бензильную группу).
В настоящем изобретении также описано пролекарство производного пиридина, представленного изображенной выше формулой (I), или его фармацевтически приемлемой соли, или его сольват. Кроме того, в настоящем изобретении описаны: фармацевтическая композиция, содержащая производное пиридина, представленное изображенной выше формулой (I), или его пролекарство, или его фармацевтически приемлемую соль, или его сольват, и фармацевтически приемлемый носитель; ингибитор URAT1, содержащий в качестве действующего вещества производное пиридина, представленное изображенной выше формулой (I), или его пролекарство, или его фармацевтически приемлемую соль, или его сольват; и средство для лечения или профилактики связанного с URAT1 заболевания, такого как подагра, гиперурикемия, гипертензия, заболевание почек, такое как интерстициальный нефрит, диабет, артериосклероз, или Синдром Леша-Найхана, содержащее в качестве действующего вещества производное пиридина, представленное изображенной выше формулой (I), или его пролекарство, или его фармацевтически приемлемую соль, или его сольват.
Кроме того, в настоящем изобретении описаны соединения, соответствующие изображенной далее формуле (II) и формуле (III), которые могут применяться в синтезе производных пиридина, представленных изображенной выше формулой (I), или их фармацевтически приемлемых солей, или их сольватов.
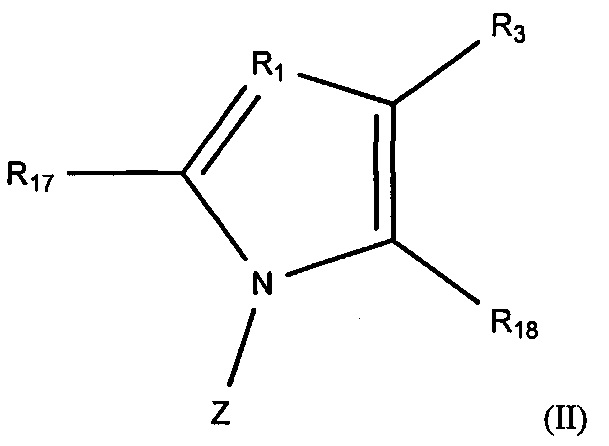
где:
R1 и R3 такие же, как в формуле (I);
R17 представляет собой атом хлора, атом брома или атом иода;
R18 представляет собой формильную группу или -CO2R5;
R5 в R3 и R18 каждый независимо представляют собой алкильную группу, содержащую 1-6 атомов углерода; и
Z представляет собой любой из следующих заместителей, обозначенных Z1-Z7:
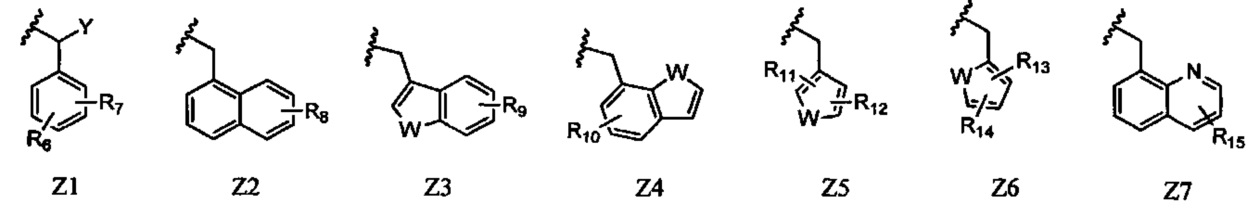
где R6-R15, Y, и W такие же, как в формуле (I), при условии, что исключены 2-хлор-1-(тиофен-2-илметил)-1Н-пиррол-5-карбальдегид, этил 2-бром-1-(4-метилбензил)-1Н-пиррол-5-карбоксилат и диметил 2-бром-1-(2-хлорбензил)-1Н-имидазол-4,5-дикарбоксилат.

где:
R3 такой же, как в формуле (I);
R19 представляет собой -CO2R5;
R5 в R3 и R19 каждый независимо представляют собой алкильную группу, содержащую 1-6 атомов углерода; и
Za представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил)метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил) метильную группу, (5-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
Суть изобретения
В настоящем изобретении описано новое производное пиридина или его пролекарство, или его фармацевтически приемлемая соль, или его сольват, которое может применяться в качестве средства для лечения или профилактики связанного с URAT1 заболевания, такого как подагра, гиперурикемия, гипертензия, заболевание почек, такое как интерстициальный нефрит, диабет, артериосклероз или синдром Леша-Найхана.
Способ практического осуществления изобретения
Используемые термины в контексте настоящего изобретения имеют следующие значения.
Алкильной группой, в контексте настоящего изобретения, называют линейную, разветвленную или циклическую насыщенную углеводородную группу. Частные примеры алкильной группы, содержащей 1-6 атомов углерода, могут включать, например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутыльную группу, изобутильную группу, трет-бутальную группу, пентильную группу, изопентильную группу, гексильную группу, циклопропильную группу, циклопропилметильную группу, циклопентильную группу или циклогексильную группу.
Алкенильной группой, в контексте настоящего изобретения, называют линейную, разветвленную или циклическую ненасыщенную углеводородную группу, содержащую по меньшей мере одну двойную связь углерод-углерод. Частные примеры алкенильной группы, содержащей 2-6 атомов углерода, могут включать, например, этенильную группу, 1-пропенильную группу, 2-пропенильную группу, 2-метил-1-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 3-метил-2-бутенильную группу, 1-пентенильную группу, 2-пентенильную группу, 3-пентенильную группу, 4-пентенильную группу, 4-метил-3-пентенильную группу, 1-гексенильную группу, 3-гексенильную группу, 5-гексенильную группу, 1-циклопентен-1-ильную группу, 3-циклопентен-1-ильную группу, 2-циклогексен-1-ильную группу, 3-циклогексен-1-ильную группу и т.д.
Алкинильной группой, в контексте настоящего изобретения, называют линейную или разветвленную ненасыщенную углеводородную группу, содержащую по меньшей мере одну тройную связь углерод-углерод. Частные примеры алкинильной группы, содержащей 2-6 атомов углерода, могут включать, например, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу, 1-пентинильную группу, 2-пентинильную группу, 3-пентинильную группу, 4-пентинильную группу, 1-гексинильную группу, 2-гексинильную группу, 3-гексинильную группу, 4-гексинильную группу, 5-гексинильную группу и т.д.
Алкилкарбонильной группой, в контексте настоящего изобретения, называют описанную выше алкильную группу, присоединенную к карбонильной группе. Частные примеры алкилкарбонильной группы, содержащей 2-7 атомов углерода, могут включать, например, ацетильную группу, пропаноильную группу, бутаноильную группу, изобутаноильную группу, втор-бутаноильную группу, трет-бутаноильную группу, пентаноильную группу, изопентаноильную группу, гексаноильную группу, циклопропилкарбонильную группу, циклогексилкарбонильную группу и т.д.
Алкилсульфонильной группой, в контексте настоящего изобретения, называют описанную выше алкильную группу, присоединенную к сульфонильной группе. Частные примеры алкилсульфонильной группы, содержащей 1-6 атомов углерода, могут включать, например, метилсульфонильную группу, этилсульфонильную группу, изопропилсульфонильную группу или циклопропилсульфонильную группу.
Алкилсульфинильной группой, в контексте настоящего изобретения, называют описанную выше алкильную группу, присоединенную к сульфинильной группе. Частные примеры алкилсульфинильной группы, содержащей 1-6 атомов углерода, могут включать, например, метилсульфинильную группу, этилсульфинильную группу, изопропилсульфинильную группу или циклопропилсульфинильную группу.
Алкокси-группой, в контексте настоящего изобретения, называют линейную, разветвленную или циклическую насыщенную алифатическую гидрокарбонокси-группу. Частные примеры алкокси-группы, содержащей 1-6 атомов углерода, могут включать, например, метокси-группу, этокси-группу, пропокси-группу, изопропокси-группу, бутокси-группу, изобутокси-группу, пентилокси-группу, изопентилокси-группу, гексилокси-группу, циклопропокси-группу, циклопропилметокси-группу или циклогексилокси-группу.
Алкилтио-группой, в контексте настоящего изобретения, называют линейную, разветвленную или циклическую насыщенную алифатическую гидрокарбонсульфидную группу. Частные примеры алкилтио-группы, содержащей 1-6 атомов углерода, могут включать, например, метилтио-группу, этилтио-группу, пропилтио-группу, изопропилтио-группу, бутилтио-группу, изобутилтио-группу, пентилтио-группу, изопентилтио-группу, гексилтио-группу, циклопропилтио-группу, циклопропилметилтио-группу или циклогексилтио-группу.
Диалкиламино-группой, в контексте настоящего изобретения, называют аминогруппу, замещенную двумя одинаковыми или разными описанными выше алкильными группами. Диалкиламино-группой, содержащей 1-6 атомов углерода, в контексте настоящего изобретения, называют амино-группу, замещенную двумя одинаковыми или разными алкильными группами, каждая из которых содержит 1-6 атомов углерода. Диалкиламино-группа, в контексте настоящего изобретения, опционально может формировать цикл при соединении алкильных групп. Частные примеры диалкиламино-групп, содержащих 1-6 атомов углерода, которые опционально могут формировать цикл, могут включать, например, диметиламино-группу, диэтиламино-группу, пирролидин-1-ильную группу или пиперидин-1-ильную группу.
Атомом галогена, в контексте настоящего изобретения, называют атом фтора, атом хлора, атом брома и атом иода.
В контексте настоящего изобретения, "когда две группы CR2 расположены рядом, два заместителя R2 объединены с образованием цикла" означает, что два заместителя R2 соединены и вместе с атомами углерода, к которым они присоединены в пиридиновом цикле, формируют неароматическое или ароматическое кольцо. Соединение двух заместителей R2 с образованием кольца приводит к формированию бициклического кольца, в котором образующееся кольцо сконденсировано с пиридиновым циклом. Такое неароматическое или ароматическое кольцо может представлять собой углеводородный цикл или гетероцикл, содержащий атом кислорода, атом азота или атом серы в качестве атомов в цикле.
В контексте настоящего изобретения, "замещенный имидазольным циклом, пиразольным циклом, пирролидиновым циклом, гашеридиновым циклом, морфолиновым циклом или пиперазиновым циклом" означает наличие заместителя в виде одной из групп, полученной из перечисленных циклов при удалении от них одного атома водорода.
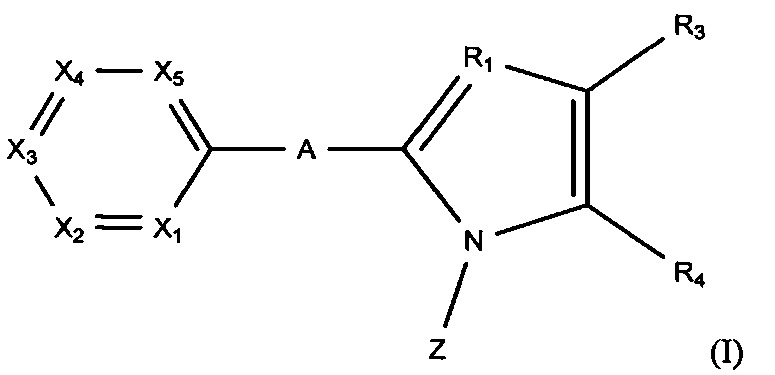
В изображенной выше формуле (I), А представляет собой простую связь, атом кислорода, атом серы, NH или CH2. Предпочтительно, А представляет собой простую связь или атом кислорода, и более предпочтительно простую связь.
R1 представляет собой атом азота или CH, и предпочтительно атом азота.
Один из X1-Х5 представляет собой атом азота, а остальные четыре представляют собой CR2. Предпочтительно, X1 или Х2 представляет собой атом азота, и более предпочтительно Х2 представляет собой атом азота.
R2 каждый независимо представляют собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, алкенильную группу, содержащую 2-6 атомов углерода, алкинильную группу, содержащую 2-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, алкилкарбонильную группу, содержащую 2-7 атомов углерода, алкилсульфонильную группу, содержащую 1-6 атомов углерода, нитро-группу, амино-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, формильную группу, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), при условии, что когда два фрагмента CR2 расположены рядом, то два заместителя R2 опционально могут объединяться с образованием цикла. Цикл, формируемый двумя соседними фрагментами CR2, предпочтительно представляет собой ароматический углеводородный цикл, и более предпочтительно бензольное кольцо. Предпочтительно, R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена). Более предпочтительно, R2 представляет собой атом водорода, метильную группу, этильную группу, циклопропильную группу, метокси-группу, этокси-группу, метилтио-группу, атом фтора, атом хлора, атом брома, циано-группу, гидроксильную группу, пирролидин-1-ильную группу, трифторметильную группу, дифторметильную группу, нитро-группу, фенильную группу или фенокси-группу. Еще более предпочтительно, R2 представляет собой атом водорода, метильную группу, этильную группу, циклопропильную группу, атом фтора, атом хлора, атом брома, метокси-группу, этокси-группу, метилтио-группу, трифторметильную группу, дифторметильную группу, нитро-группу или фенильную группу.
Когда три из четырех CR2 представляют собой CH, предпочтительные положения оставшегося CR2 могут включать X4. Когда три из четырех CR2 представляют собой СН, комбинация положений атома азота и оставшегося CR2 предпочтительно представляет собой комбинацию, в которой X2 представляет собой атом азота, а X4 представляет собой CR2.
Когда два из четырех CR2 представляют собой CH, комбинация положений атома азота и оставшихся CR2 может включать, например, комбинацию, в которой X2 представляет собой атом азота, и X1 и X3 представляют собой CR2, и комбинацию, в которой X2 представляет собой атом азота, и X3 и X4 представляют собой CR2.
R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкенильную группу, содержащую 2-6 атомов углерода, алкинильную группу, содержащую 2-6 атомов углерода, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы и атома галогена), алкилкарбонильную группу, содержащую 2-7 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, алкилсульфинильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), пиридильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу, или -CO2R5. Предпочтительно, R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5. Более предпочтительно, R3 представляет собой атом водорода, метильную группу, этильную группу, изопропильную группу, циклопропильную группу, трифторметильную группу, дифторметильную группу, атом хлора, атом брома, атом иода, метокси-группу, метилтио-группу, этилтио-группу, циано-группу, фенильную группу, карбоксильную группу, -CO2R5, гидроксиметильную группу, 2-гидроксипропан-2-ильную группу, 3-гидроксипентан-3-ильную группу или морфолин-4-илметильную группу.
R4 представляет собой карбоксильную группу, тетразолильную группу, -CONHSO2R5 или -CO2R5, или любой из представленных далее заместителей:

при условии, что когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, и когда R4 представляет собой карбоксильную группу, то R3 и R4 опционально могут быть соединены с образованием лактонового цикла. Предпочтительно, R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO2-циклопропил или -CO2R5.
R5 в R3 и R4 каждый независимо представляют собой алкильную группу, содержащую 1-6 атомов углерода.
Кроме того, Z в изображенной выше формуле (I) представляет собой любой из следующих заместителей, обозначенных Z1-Z7.

В Z1, R6 и R7 каждый независимо представляют собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, трифторметильную группу, трифторметокси-группу или циано-группу, при условии, что исключен случай, когда R6 и R7 одновременно представляют собой атомы водорода. Предпочтительно, R6 и R7 каждый представляют собой метильную группу, атом фтора, атом хлора, атом брома или трифторметильную группу. Более предпочтительно, R6 и R7 каждый представляют собой атом хлора, метильную группу или трифторметильную группу. Предпочтительными положениями, в которых находятся заместители R6 и R7 в бензольном цикле являются 2,5-дизамещение и 3,5-дизамещение, и более предпочтительно 2,5-дизамещение. Предпочтительная комбинация R6 и R7 с их положениями в бензольном кольце представляет собой 2,5-дихлор замещение, 3,5-дихлор замещение, 2,5-диметил замещение, 2,5-бис(трифторметил) замещение или 2-хлор-5-метил замещение.
Y представляет собой атом водорода или алкильную группу, содержащую 1-6 атомов углерода. Предпочтительно, Y представляет собой атом водорода.
В Z2, R8 представляет собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу. Предпочтительная комбинация R8 с его положением в нафталиновом кольце представляет собой атом водорода, 2-метильную группу, 4-метильную группу, 8-метильную группу или 8-бром группу.
В Z3, R9 представляет собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу. W представляет собой атом серы, атом кислорода или NR16 (где R16 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, или бензильную группу), и предпочтительно атом серы.
Предпочтительная комбинация R9 с его положением в бензотиофеновом, бензофурановом или индольном цикле представляет собой атом водорода, 4-метильную группу, 4-хлор группу, 4-бром группу, 4-трифторметильную группу, 5-метильную группу, 5-хлор группу или 5-трифторметильную группу.
В Z4, R10 представляет собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу. W представляет собой атом серы, атом кислорода или NR16 (где R16 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, или бензильную группу), и предпочтительно атом серы. Предпочтительная комбинация R10 с его положением в бензотиофеновом, бензофурановом или индольном цикле представляет собой атом водорода или 5-фтор группу.
В Z5, R11 и R12 каждый независимо представляют собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу. W представляет собой атом серы, атом кислорода или NR16 (где R16 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, или бензильную группу), и предпочтительно атом серы. Предпочтительная комбинация R11 и R12 с их положениями в тиофеновом, фурановом или пиррольном цикле представляет собой 2,5-дихлор замещение.
В Z6, R13 и R14 каждый независимо представляют собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу. W представляет собой атом серы, атом кислорода или NR16 (где R16 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, или бензильную группу), и предпочтительно атом серы. Предпочтительная комбинация R13 и R14 с их положениями в тиофеновом, фурановом или пиррольном цикле представляет собой 2,4-дихлор замещение.
В Z7, R15 представляет собой атом водорода, атом галогена, алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу. Предпочтительно, R15 представляет собой атом водорода.
Предпочтительными из Z1-Z7 являются Z1-Z6, и более предпочтительны Z1-Z4.
Предпочтительный Z представляет собой в частности, например, 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил) метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил) метильную группу, (5-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу, и более предпочтительный Z представляет собой, например, 2,5-дихлорбензильную группу, 2,5-диметилбензильную группу, нафталин-1-илметильную группу, (4-хлорбензо[b]тиофен-3-ил)метильную группу или бензо[b]тиофен-7-илметильную группу.
Предпочтительные комбинации A, Х1-Х5, R1-R4 и Z, присутствующих в формуле (I) по настоящему изобретению, могут включать описанные далее комбинации 1)-11).
1) А представляет собой простую связь; R1 представляет собой атом азота; X1 представляет собой атом азота; X4 представляет собой CR2, и Х2, Х3 и Х5 представляют собой СН; R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, диалкиламино-группу, опционально формирующую цикл, с алкильными группами, каждая из которых содержит 1-6 атомов углерода, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена); R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5; R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO2-циклопропил или -CO2R5; и Z представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил) метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил)метильную группу, (5-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
2) А представляет собой простую связь; R1 представляет собой атом азота; X2 представляет собой атом азота; X4 представляет собой CR2, и Х1, X3 и Х5 представляют собой CH; R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена); R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5; R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO2-циклопропил или -CO2R5; и Z представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил)метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил) бензо|b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил)метильную группу, (5-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
3) А представляет собой простую связь; R1 представляет собой CH; X1 представляет собой атом азота; X4 представляет собой CR2, и X2, X3 и Х5 представляют собой CH; R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, даалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена); R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5; R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO2-циклопропил или -CO2R5; и Z представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил)метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил)метильную группу, (5-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
4) А представляет собой простую связь; R1 представляет собой CH; X2 представляет собой атом азота; X4 представляет собой CR2, и X1, X3 и Х5 представляют собой CH; R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена); R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5; R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO2-циклопропил или -CO2R5; и Z представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил)метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил)метильную группу, (5-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
5) А представляет собой атом кислорода; R1 представляет собой атом азота; X1 представляет собой атом азота; X4 представляет собой CR2, и X2, X3 и Х5 представляют собой CH; R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена); R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5; R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO2-циклопропил или -CO2R5; и Z представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил) метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил)метильную группу, (5-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
6) А представляет собой атом кислорода; R1 представляет собой атом азота; X2 представляет собой атом азота; X4 представляет собой CR2, и X1, X3 и X5 представляют собой CH; R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена); R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5; R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO2-циклопропил или -CO2R5; и Z представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил) метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил)метильную группу, (5-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
7) А представляет собой атом кислорода; R1 представляет собой CH; X1 представляет собой атом азота; X4 представляет собой CR2, и Х2, X3 и Х5 представляют собой CH; R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена); R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5; R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO2-циклопропил или -CO2R5; и Z представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил) метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил)метильную группу, (5-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
8) А представляет собой атом кислорода; R1 представляет собой CH; X2 представляет собой атом азота; X4 представляет собой CR2, и X1, X3 и Х5 представляют собой CH; R2 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, нитро-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена); R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкокси-группу, содержащую 1-6 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу или -CO2R5; R4 представляет собой карбоксильную группу (которая, когда R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, может быть опционально сопряжена с R3 с образованием лактонового цикла), тетразолильную группу, -CONHSO2CH3, -CONHSO3-циклопропил или -CO2R5; и Z представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил) метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил)метильную группу, (5-(трифторметил) бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
9) В описанных выше пунктах 1)-8), R2 представляет собой атом водорода, метильную группу, этильную группу, циклопропильную группу, атом фтора, атом хлора, атом брома, метокси-группу, этокси-группу, метилтио-группу, трифторметильную группу, дифторметильную группу, нитро-группу или фенильную группу.
10) В описанных выше пунктах 1)-9), R3 представляет собой атом водорода, метильную группу, этильную группу, изопропильную группу, циклопропильную группу, трифторметильную группу, дифторметильную группу, атом хлора, атом брома, атом иода, метокси-группу, метилтио-группу, этилтио-группу, циано-группу, фенильную группу, карбоксильную группу, -CO2R5, гидроксиметильную группу, 2-гидроксипропан-2-ильную группу, 3-гидроксипентан-3-ильную группу или морфолин-4-илметильную группу.
11) В описанных выше пунктах 1)-10), Z представляет собой 2,5-дихлорбензильную группу, 2,5-диметилбензильную группу, нафталин-1-илметильную группу, (4-хлорбензо[b]тиофен-3-ил)метильную группу или бензо[b]тиофен-7-илметильную группу.
Промежуточные соединения, которые могут применяться в синтезе производного пиридина, представленного изображенной выше формулой (I), или его фармацевтически приемлемой соли, или его сольвата, могут включать соединения, соответствующие изображенной далее формуле (II) и формуле (III).

где:
R1 и R3 такие же, как в формуле (I);
R17 представляет собой атом хлора, атом брома или атом иода;
R18 представляет собой формильную группу или -CO2R5;
R5 в R3 и R18 каждый независимо представляют собой алкильную группу, содержащую 1-6 атомов углерода; и
Z представляет собой любой из следующих заместителей, обозначенных Z1-Z7:
где R6-R15, Y и W такие же, как в формуле (I), при условии, что исключены 2-хлор-1-(тиофен-2-илметил)-1Н-пиррол-5-карбальдегид, этил 2-бром-1-(4-метилбензил)-1Н-пиррол-5-карбоксилат и диметил 2-бром-1-(2-хлорбензил)-1Н-имидазол-4,5-дикарбоксилат.
Предпочтительно, R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может быть замещена одной или больше гидроксильными группами), атом галогена, трифторметильную группу или -CO2R5. Более предпочтительно, R3 представляет собой атом водорода, метильную группу, этильную группу, изопропильную группу, циклопропильную группу, трифторметильную группу, атом хлора, атом брома или -CO2R5.
Предпочтительный R17 представляет собой атом брома или атом иода.
Предпочтительный R18 представляет собой формильную группу, -CO2CH3 или -CO2C2H5.

где:
R3 такой же, как в формуле (I);
R19 представляет собой -CO2R5;
R5 в R3 и R19 каждый независимо представляют собой алкильную группу, содержащую 1-6 атомов углерода; и
Za представляет собой 2,5-дихлорбензильную группу, 3,5-дихлорбензильную группу, 2,5-диметилбензильную группу, 2,5-бис(трифторметил)бензильную группу, 2-хлор-5-метилбензильную группу, нафталин-1-илметильную группу, (2-метилнафталин-1-ил)метильную группу, (4-метилнафталин-1-ил)метильную группу, (8-метилнафталин-1-ил)метильную группу, (8-бромнафталин-1-ил)метильную группу, бензо[b]тиофен-3-илметильную группу, (4-метилбензо[b]тиофен-3-ил)метильную группу, (4-хлорбензо[b]тиофен-3-ил)метильную группу, (4-бромбензо[b]тиофен-3-ил)метильную группу, (4-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, (5-метилбензо[b]тиофен-3-ил)метильную группу, (5-хлорбензо[b]тиофен-3-ил) метильную группу, (5-(трифторметил)бензо[b]тиофен-3-ил)метильную группу, бензо[b]тиофен-7-илметильную группу, (5-фторбензо[b]тиофен-7-ил)метильную группу, (2,5-дихлортиофен-3-ил)метильную группу, (2,4-дихлортиофен-5-ил)метильную группу или хинолин-8-илметильную группу.
Предпочтительно, R3 представляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может быть замещена одной или больше гидроксильными группами), атом галогена, трифторметильную группу или -CO2R5. Более предпочтительно R3 представляет собой атом водорода, метильную группу, этильную группу, изопропильную группу, циклопропильную группу, трифторметильную группу, атом хлора, атом брома или -CO2R5.
Предпочтительный R19 представляет собой -CO2CH3 или -CO2C2H5
Предпочтительный Za представляет собой 2,5-дихлорбензильную группу, 2,5-диметилбензильную группу, нафталин-1-илметильную группу, (4-хлорбензо[b]тиофен-3-ил)метильную группу или бензо[b]тиофен-7-илметильную группу.
Частные примеры производного пиридина, представленного формулой (I) по настоящему изобретению, могут включать перечисленные далее соединения.
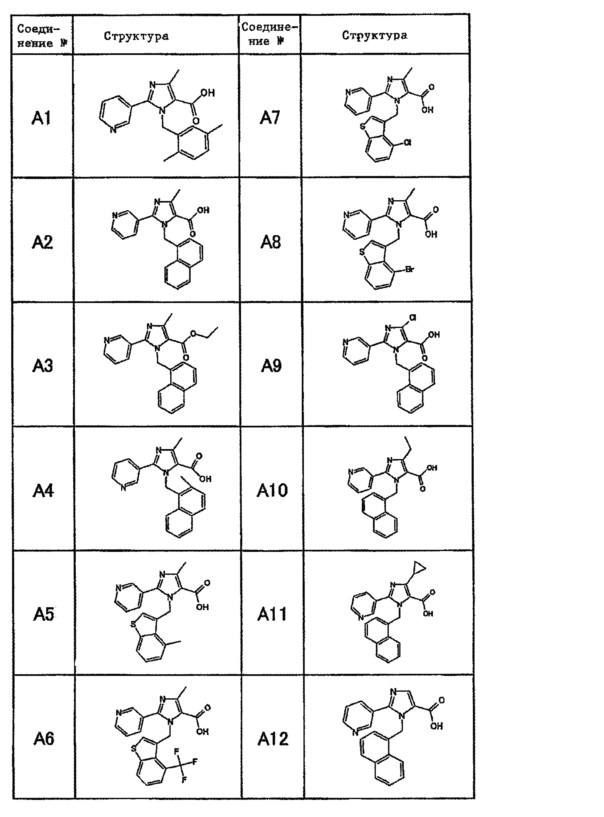
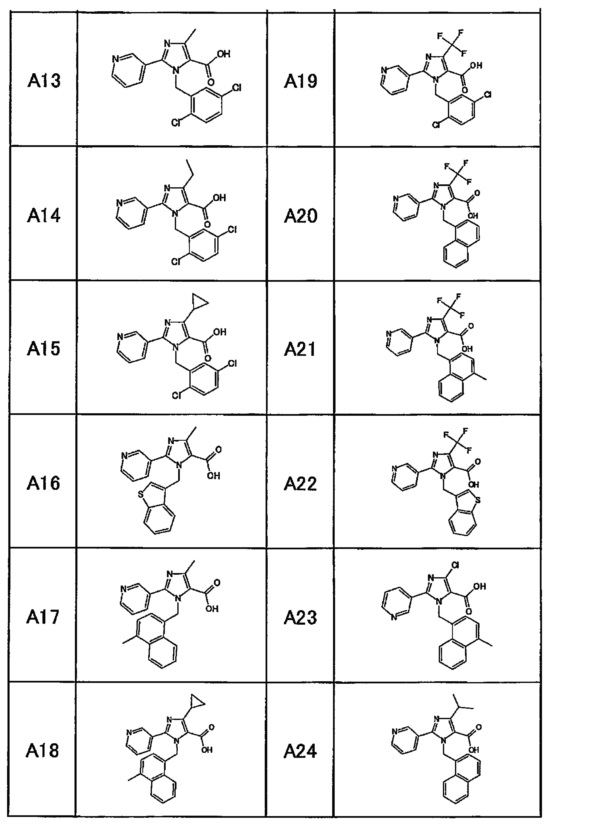




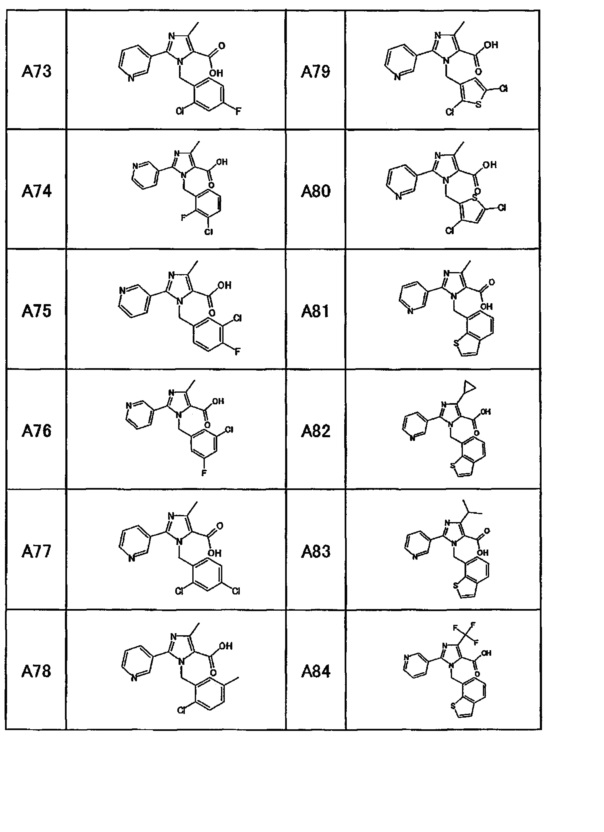
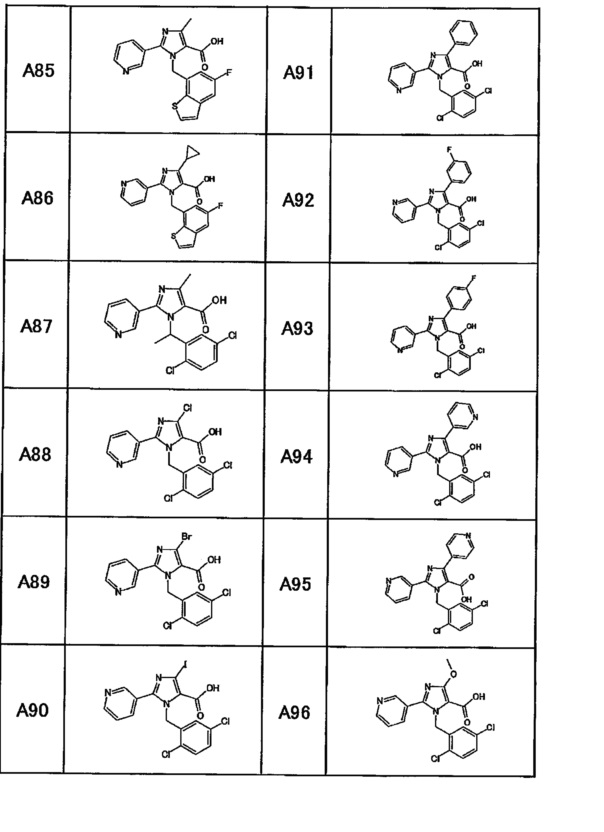

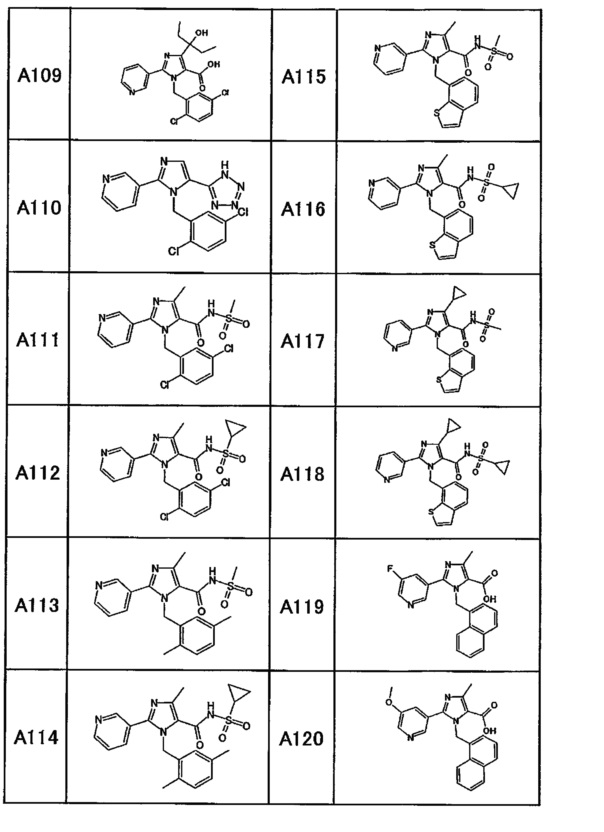
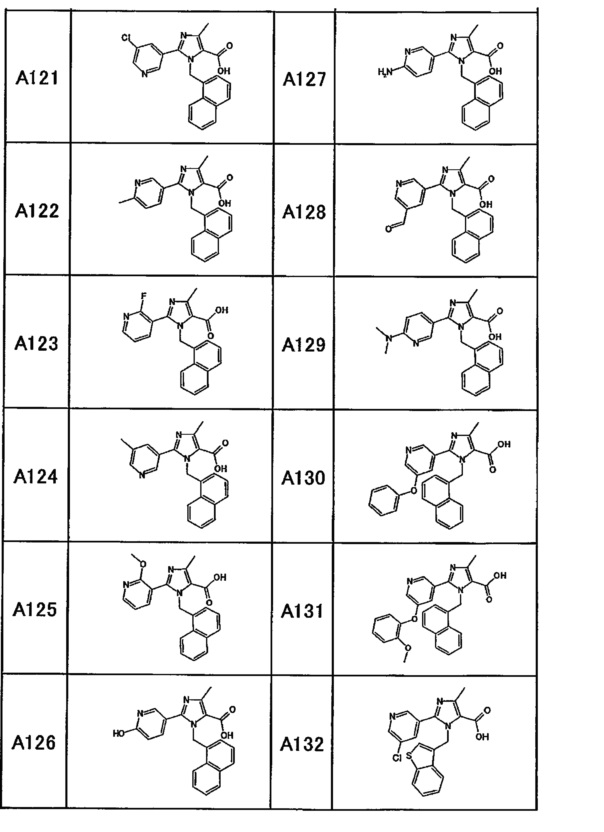

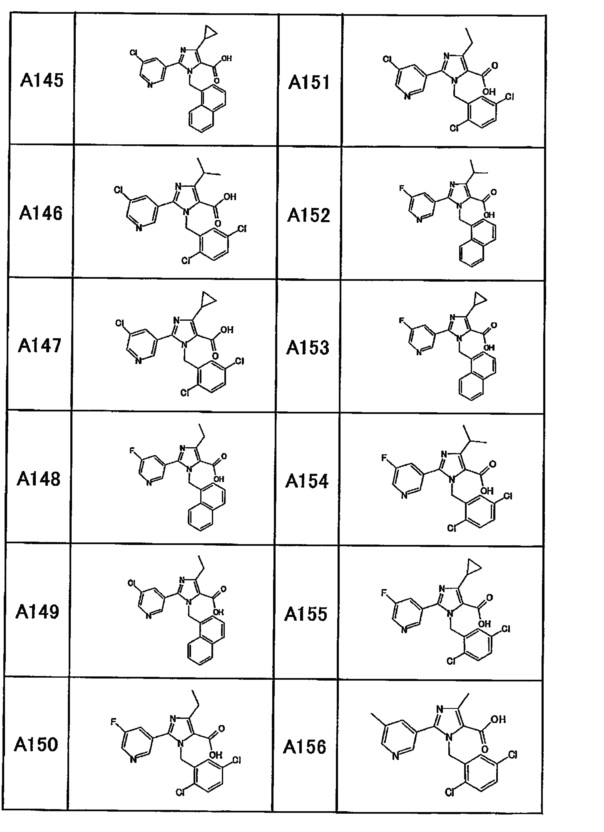






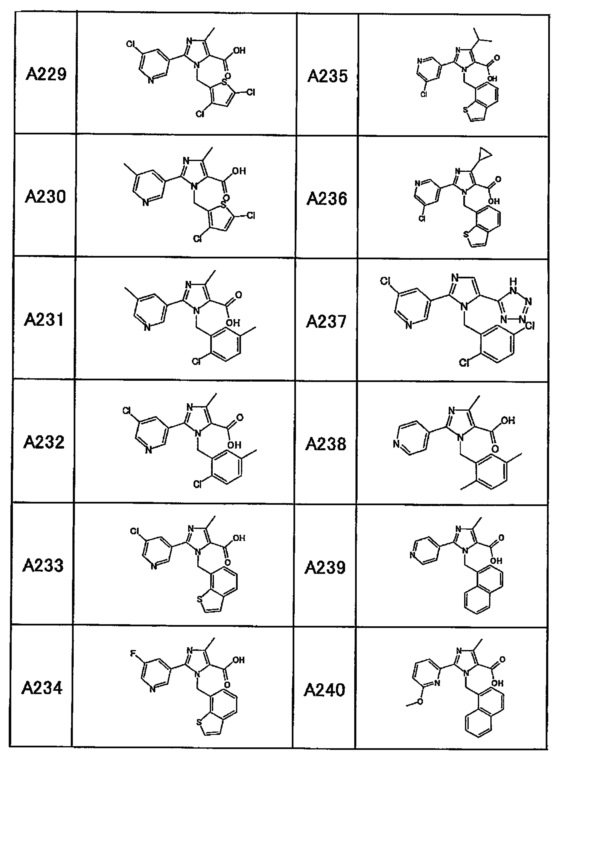

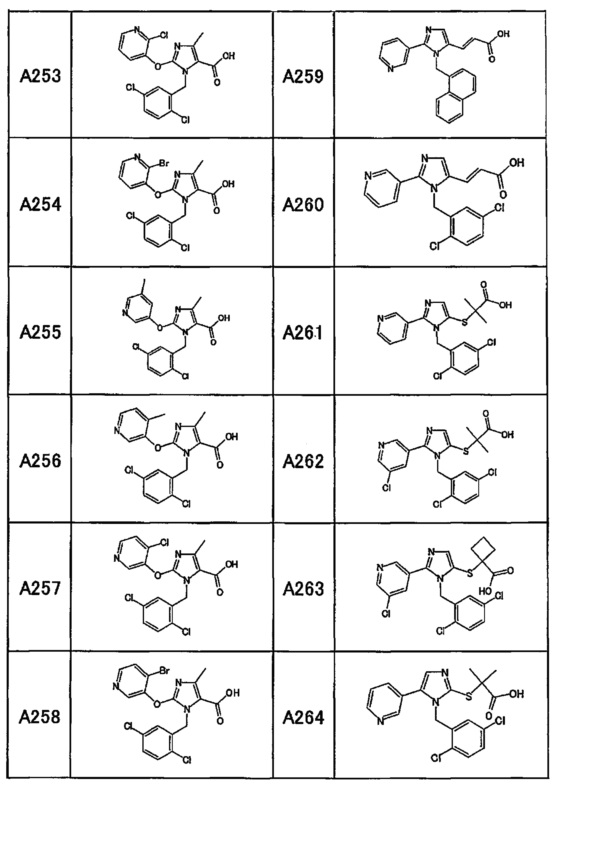
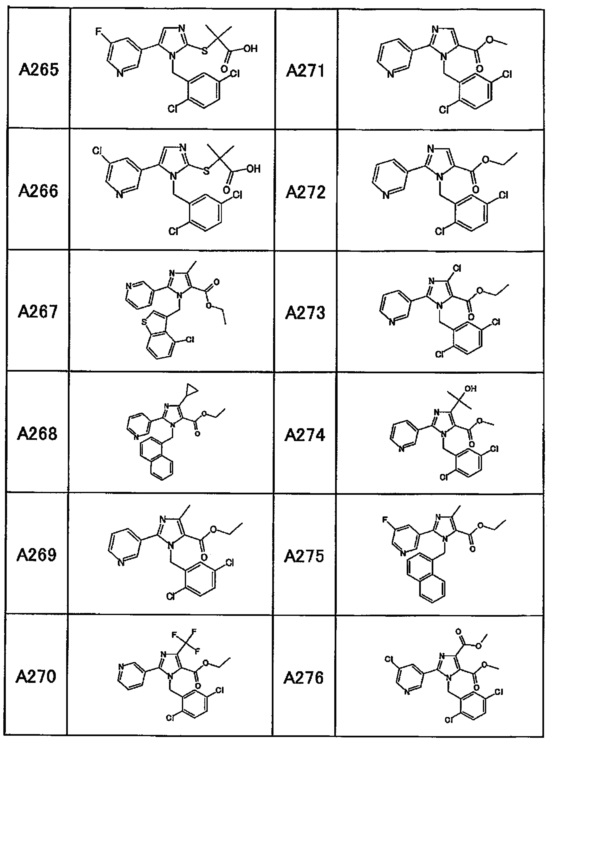




Из перечисленных соединений, предпочтительными соединениями являются перечисленные ниже в таблицах.

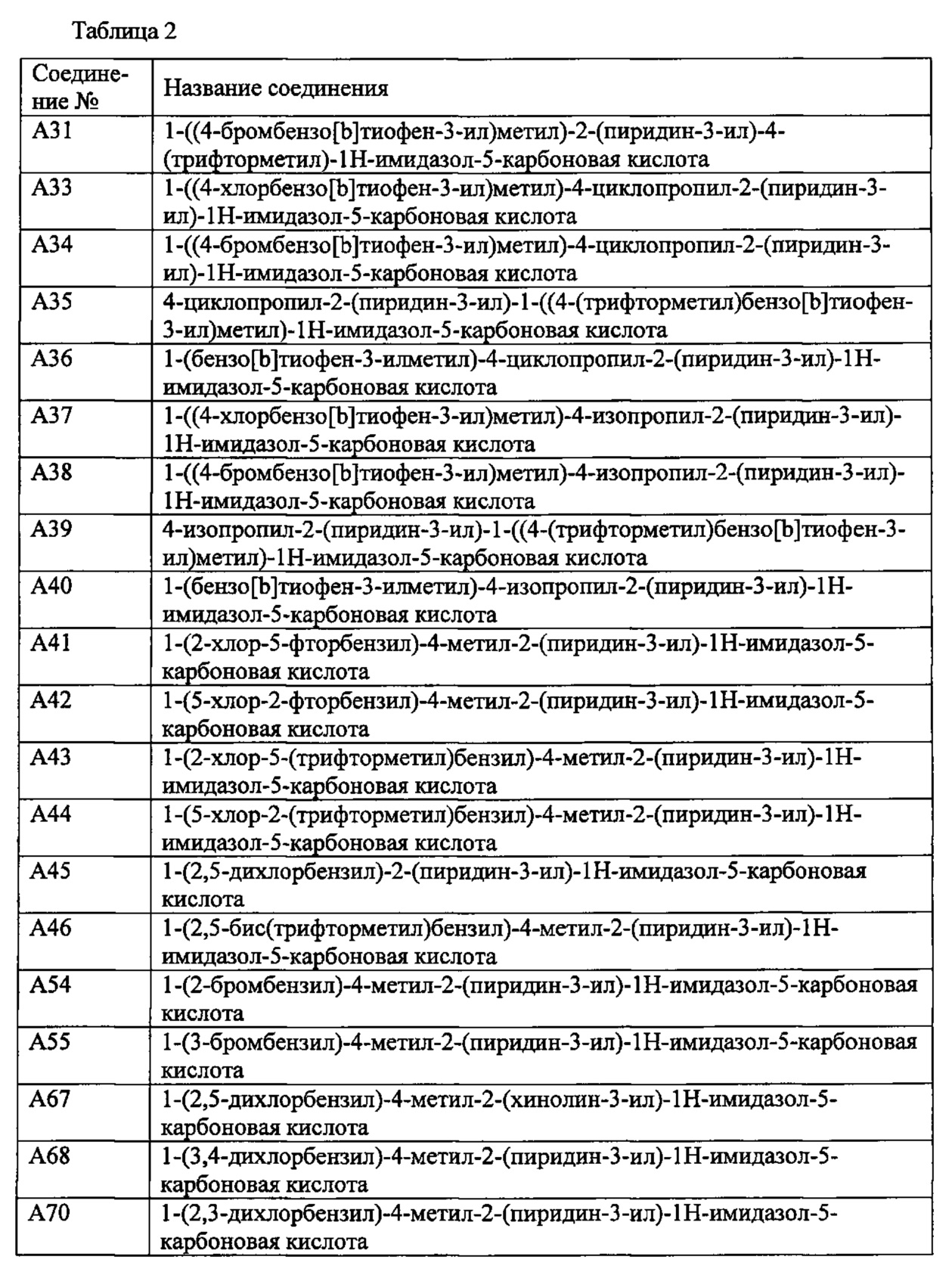




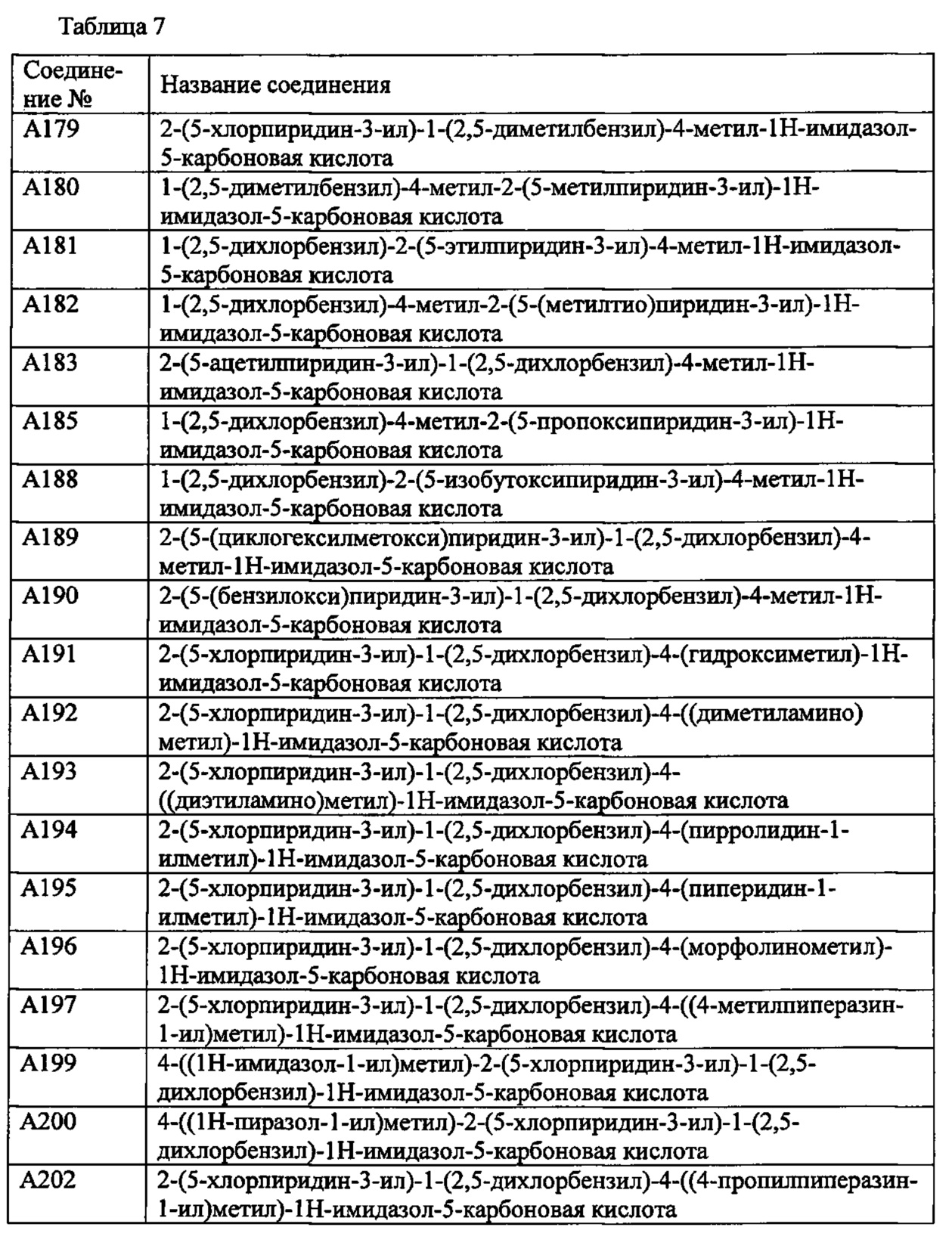








Более предпочтительными являются соединения A1, А2, А7, А13, А14, А15, А18, А19, А25, А26, А37, А38, А39, А43, А45, А71, А78, А81, А85, А86, А88, А89, А90, А91, А92, А93, А96, А98, А99, А100, А101, А104, А105, А108, А119, А121, А134, А135, А136, А137, А139, А140, А142, А143, А144, А145, А146, А147, А149, А150, А151, А154, А155, А156, А157, А166, А167, А168, А169, А171, А173, А174, А176, А177, А179, А180, А181, А182, А183, А185, А188, А191, А193, А194, А195, А196, А197, А200, А202, А204, А205, А206, А207, А208, А209, А210, А211, А212, А213, А214, А215, А216, А217, А218, А219, А220, А221, А225, А226, А227, А231, А232, А233, А235, А236, А237, А245, А248, А250, А251, А252, А253, А254, А255, А256, А257, А258, B1, B2, В3, В6, В7, В8, В9, B10, В11, В12, В13, В14, В15, В16, В17, В18, В20, В21, В22, В23, В24, В25, В26, В27, В28, В29, В30, В31, В32, В33, В34 и В35. Еще более предпочтительны A1, A2, А7, А13, А14, А15, А19, А26, А81, А119, А121, А134, А135, А137, А139, А147, А156, А169, А233, В1 и В11.
Производное пиридина, представленное изображенной выше формулой (I), можно превратить в его пролекарства обычными способами. Пролекарством называют соединение, которое в организме превращается в производное пиридина, представленное формулой (I), под действием ферментов, кислот желудка и т.д. Пролекарства для производного пиридина, представленного формулой (I), включают соединения, в которых карбоксильная группа в производном пиридина этерифицирована или амидирована (такие как соединения, в которых карбоксильная группа была C1-6 алкил этерифицирована, фенил этерифицирована, карбоксиметил этерифицирована, диметиламинометил этерифицирована, пивалоилоксиметил этерифицирована, этоксикарбонилоксиэтил этерифицирована, фталидил этерифицирована, (5-метил-2-оксо-1,3-диоксолен-4-ил)метил этерифицирована, циклогексилоксикарбонилэтил этерифицирована или метил амидирована), соединения, в которых гидроксильная группа в производном пиридина была ацилирована, алкилирована, фосфорилирована или борилирована (такие как соединения, в которых гидроксильная группа была ацетилирована, пальмитоилирована, пропаноилирована, пивалоилирована, сукцинилирована, фумарилирована, аланилирована, диметиламинометилкарбонилирована или тетрагидропиранилирована), или соединения, в которых амино-группа в производном пиридина была ацилирована, алкилирована или фосфорилирована (такие как соединения, в которых амино-группа была эйкозаноилирована, аланилирована, пентиламинокарбонилирована, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонилирована, тетрагидрофуранилирована, тетрагидропиранилирована, пирролидилметилирована, пивалоилоксиметилирована или трет-бутилирована). Кроме того, пролекарства для производного пиридина, представленного формулой (I), могут представлять собой соединения, которые превращаются в производное пиридина, представленное формулой (I), в физиологических условиях, таких как описанные на страницах 163-198 работы "Iyakuhin no Kaihatsu [Development of Pharmaceuticals]," volume 7, Bunshi Sekkei [Molecular Design], опубликованной Hirokawa Shoten в 1990. Отметим, что среди производных пиридина, представленных формулой (I), соединение, в котором R3 и/или R4 представляет собой -CO2R5, или соединение, в котором R3 и R4 объединены с образованием лактонового цикла, также могут представлять собой пролекарство, которое в организме дает соединение, в котором R3 и/или R4 представляет собой карбоновую кислоту, или соединение, в котором R3 представляет собой алкильную группу, замещенную гидроксильной группой, и R4 представляет собой карбоксильную группу. Такие производные пиридин, представленные формулой (I), которые также могут являться пролекарствами, включают A3, А221, А267, А268, А269, А270, А271, А272, А273, А274, А275, А276, А277, А278, А279, А280, А281 и А282.
При необходимости, производное пиридина, представленное формулой (I), или его пролекарство по настоящему изобретению можно превратить в его фармацевтически приемлемые соли. Такие соли включают, например, соли с неорганическими кислотам, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и угольная кислота; соли с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, трифторуксусная кислота, фталевая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, бензойная кислота, метансульфокислота, этансульфокислота, бензолсульфокислота, п-толуолсульфокислота; соли с аминокислотами, такими как лизин, аргинин, орнитин, глютаминовая кислота и аспарагиновая кислота; соли со щелочными металлами, такими как натрий, калий и литий; соли со щелочно-земельными металлами, такими как кальций и магний; соли с металлами, такими как алюминий, цинк и железо; соли с органическими основаниями, такими как метиламин, этил амин, диэтиламин, триметиламин, триэтиламин, этилендиамин, пиперидин, пиперазин, пиридин, пиколин, этаноламин, диэтаноламин, триэтаноламин, циклогексиламин, дициклогексиламин, N-метилглюкамин и N,N'-дибензилэтилендиамин; соли аммония и т.п..
При необходимости, производное пиридина, представленное изображенной выше формулой (I), или его пролекарство, или его фармацевтически приемлемая соль, можно превратить в его сольваты. Растворители могут включать воду, метанол, этанол, 1-пропанол, 2-пропанол, бутанол, т-бутанол, ацетонитрил, ацетон, метилэтилкетон, хлороформ, этилацетат, диэтиловый эфир, трет-бутилметиловый эфир, бензол, толуол, ДМФА, ДМСО и т.д. В частности, в качестве предпочтительных растворителей могут быть упомянуты вода, метанол, этанол, 1-пропанол, 2-пропанол, ацетонитрил, ацетон, метилэтилкетон и этилацетат.
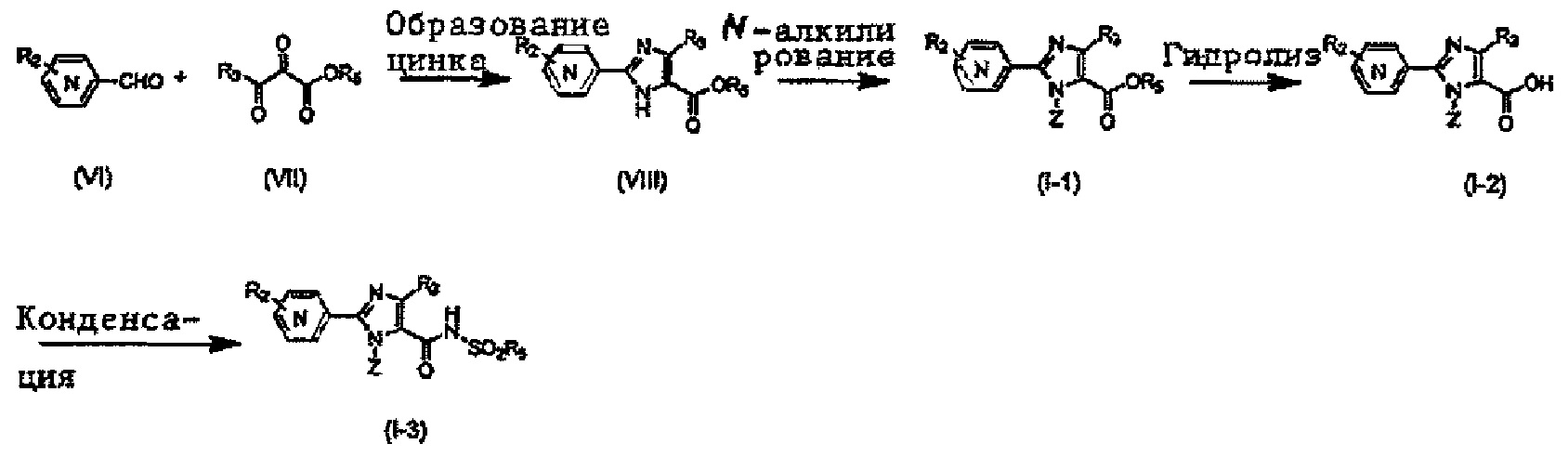
Хотя синтез производных пиридина, представленных изображенной выше формулой (I), можно проводить любым способом, описанные производные можно синтезировать как показано ниже на Схеме A, когда A представляет собой простую связь; R1 представляет собой атом азота; R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, или трифторметильную группу; и R4 представляет собой карбоксильную группу, -CO2R5 или -CONHSO2R5. Так, после бромирования имидазольного производного (IV) с получением соединения (V), проводят N-алкилирование реакцией с использованием основания и галогенидного соединения, или по реакции Мицунобу с использованием спирта, с получением соединения (II-1). Соединение (I-1) получают реакцией Сузуки соединения (II-1) и боронатного производного. Соединение (I-2) можно получить гидролизом сложноэфирной группы. Кроме того, при необходимости, ацилсульфонамид (I-3) можно также получить реакцией конденсации с алкилсульфонамидом.
Схема A

Подходящие реагенты для бромирования соединения (IV) до (V) на Схеме A могут включать бром, N-бромсукцинимид (NBS) и т.д. Растворители для данной реакции включают (но не ограничены только ими), например, простые эфиры, такие как тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан или 1,2-диэтоксиэтан, галогенированные растворители, такие как дихлорметан или тетрахлорид углерода, ацетонитрил, смесь указанных растворителей или им подобные. Данная реакция протекает при 0°C-100°C, но ее предпочтительно проводят при температуре от комнатной до 50°C.
N-алкилирование соединения (V) с получением соединения (II-1) проходит по реакции с использованием основания и галогенидного соединения, или по реакции Мицунобу с использованием спирта. Когда применяются основание и галогенидное соединение, основание может включать карбонат калия, карбонат цезия, триэтиламин, диизопропилэтиламин, гидрид натрия и т.д., из которых предпочтительным основанием явлется карбонат калия, карбонат цезия, триэтиламин или диизопропилэтиламин. Галогенидное соединение включает хлорид, бромид или иодид, из которых предпочтительным галогенидньгм соединением является хлорид или бромид. Температура реакции в присутствии основания и галогенидного соединения предпочтительно составляет от комнатной температуры до 150°C, и более предпочтительно 50°C-120°C. Растворители для данной реакции включают (но не ограничены только ими), например, простые эфиры, такие как тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан или 1,2-диэтоксиэтан, амиды, такие как диметилформамид или N-метилпирролидон, диметилсульфоксид (ДМСО), толуол, ксилол, смесь указанных растворителей или им подобные. N-алкилирование соединения (V) с получением соединения (II-1) походит также по реакции Мицунобу со спиртом. Что касается условий реакции Мицунобу, фосфиновое соединение, конденсирующий агент, спирт и соединение (V) реагируют в инертном растворителе, с получением соединения (II-1). Фосфин включает трибутилфосфин, трифенилфосфин, трициклогексилфосфин и т.д., но предпочтительно трифенилфосфин. Предпочтительным конденсирующим агентом является диэтил азодикарбоксилат (DEAD) или диизопропил азодикарбоксилат (DIAD). Температура реакции для данной реакции Мицунобу может составлять от 0°C до 100°C, но предпочтительная температура реакции составляет от комнатной температуры до 80°C. Растворитель для данной реакции Мицунобу включает (но не ограничен только ими), например, простые эфиры, такие как тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан или 1,2-диэтоксиэтан, амиды, такие как диметилформамид или N-метилпирролидон, галогенированные растворители, такие как дихлорметан, толуол, ксилол, смесь указанных растворителей или им подобные.
Реакция Сузуки соединения (II-1) с получением соединения (I-1) протекает при нагревании соединения (II-1), бороната, палладиевого катализатора и основания в инертном растворителе. Предпочтительно, данную реакцию проводят в атмосфере инертного газа. Предпочтительные примеры бороната могут включать бороновую кислоту и пинаколовый эфир бороновой кислоты. В качестве палладиевого катализатора предпочтительно применяют [1,1'-бис(дафенилфосфино)ферроцен]дихлорпалладий (II) (PdCl2(dppf)), тетракис(трифенилфосфин)палладий (Pd(PPh3)4) или им подобные. В качестве основания предпочтительны карбонат калия, карбонат цезия или фосфат калия. Хотя выбор растворителя для данной реакции особо не ограничен, предпочтительно применять, например, простые эфиры, такие как тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан или 1,2-диэтоксиэтан, амиды, такие как диметилформамид или N-метилпирролидон, спирты, такие как этанол, 2-пропанол или бутанол, толуол, ксилол, воду или смесь указанных растворителей. Данная реакция протекает при 50°C-150°C, но ее предпочтительно проводят при 80°C-120°C.
Реакция гидролиза соединения (I-1) с получением соединения (I-2) протекает при реакции соединения (I-1) с эквивалентным или немного избыточным количеством основания в смеси растворителей, состоящей из инертного в условиях реакции растворитель и воды. Предпочтительные основания могут включать гидроксид натрия, гидроксид калия или гидроксид лития. Хотя варианты растворителя ничем особо не ограничены, для данной реакции предпочтительно использовать, например, смешанный растворитель, состоящий из органического растворителя, такого как тетрагидрофуран (ТГФ) или спирт (такой как метанол или этанол) и воды. Данная реакция протекает при 0°C-100°C, но ее предпочтительно проводят при температуре от комнатной до 60°C.
Реакция конденсации соединения (I-2) с получением соединения (I-3) протекает при взаимодействии соединения (I-2) с алкилсульфонамидом в присутствии основания и конденсирующего агента в инертном растворителе. Растворитель включает, например, простые эфиры, такие как тетрагидрофуран (ТГФ), 1,4-диоксан, 1,2-диметоксиэтан или 1,2-диэтоксиэтан, галогенированные растворители, такие как дихлорметан или тетрахлорид углерода, ацетонитрил, смесь указанных растворителей или им подобные. Предпочтительным растворителем является тетрагидрофуран (ТГФ), диметилформамид, или дихлорметан. Основание может включать карбонат калия, карбонат цезия, триэтиламин, диизопропилэтиламин, гидрид натрия и т.д., но предпочтительным основанием является триэтиламин или диизопропилэтиламин. Конденсирующий агент включает дициклогексилкарбодиимид (DCC), дифенилфосфорилазид (DPPA), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (EDCI или WSC), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (TATU) и т.д., но предпочтительно WSC. Температура реакции может находиться в диапазоне 0°C-100°C, но предпочтительная температура реакции составляет от комнатной температуры до 50°C.
Следует отметить, что описанное выше соединение формулы (II) может использоваться в качестве соединения (II-1) в приведенной выше Схеме А.
Описанные производные можно также синтезировать согласно приведенной ниже Схеме B, например когда A представляет собой простую связь, R1 представляет собой атом азота, R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, и R4 представляет собой карбоксильную группу, -CO2R5 или -CONHSO2R5. Так, после получения соединения (VIII) реакцией формирования имидазольного цикла с применением соединения (VI) и соединения (VII), проводят N-алкилирование по реакции с применением основания и галогенидного соединения, или по реакции Мицунобу с использованием спирта, получая соединение (I-1). Как на Схеме A, соединение (I-2) можно получить гидролизом сложноэфирной группы. Кроме того, при необходимости, ацилсульфонамидное соединение (I-3) можно также получить путем конденсации с алкилсульфонамидом.
Схема B
В данном случае, реакция фомирования имидазольного цикла с использованием соединения (VI) и соединения (VII) протекает, например, при нагревании соединения (VI) и соединения (VII) в смеси растворителей, состоящей из толуола и воды, в присутствии 2 или больше эквивалентов, предпочтительно 10 или больше эквивалентов, ацетата аммония. Температура проведения данной реакции предпочтительно составляет от комнатной температуры до 150°C, и более предпочтительно от 50°C до 120°C. Предпочтительно, реакция N-алкилирования соединения (VIII) с получением соединения (I-1), реакцию гидролиза соединения (I-1) с получением соединения (I-2) и реакцию конденсации соединения (I-2) с получением соединения (I-3) проводят в условиях, описанных на Схеме А.
Описанные производные можно синтезировать согласно приведенной ниже Схеме C, когда A представляет собой простую связь, R1 представляет собой атом азота, R3 представляет собой атом водорода или алкильную группу, содержащую 1-6 атомов углерода, и R4 представляет собой карбоксильную группу или -CO2R5. Так, после получения соединения (III-1) получают реакцией N-алкилирования имидазольного производного (TV), бромированием получают соединение (II-1). Как на Схеме A, проводят сочетание по Сузуки соединения (II-1) и бороната с получением соединения (I-1). Кроме того, соединение (I-2) можно получить гидролизом сложноэфирной группы. Кроме того, в качестве альтернативного пути, когда R3 представляет собой атом водорода, соединение (I-1) можно также получить реакцией N-алкилирования легко синтезируемого соединения (IX) с получением соединения (X), после чего проводят бромирование с получением соединения (XI), и далее проводят реакцию СО-включения в спирт с применением палладия.
Схема C
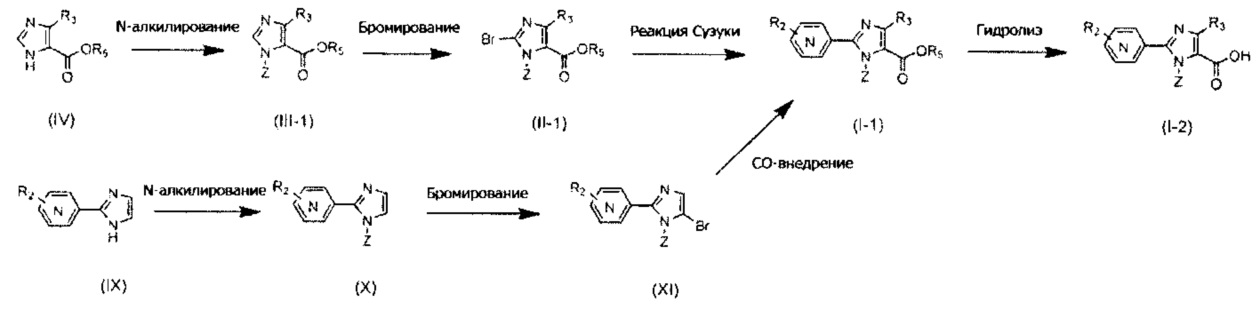
Для реакции N-алкилирования соединения (IV) с получением соединения (III-1) на Схеме C, предпочтительны условия, описанные на Схеме А. Для бромирования соединения (III-1) с получением соединения (II-1), предпочтительны условия, описанные на Схеме, и более предпочтительны условия с дополнительным добавлением каталитического количества 2,2'-азобис(изобутиронитрила) (AIBN). Предпочтительно, реакцию Сузуки с соединением (II-1) с получением соединения (I-1) и последующий гидролиз проводят в условиях, описанных на Схеме А. Реакция N-алкилирования соединения (IХ) с получением соединения (X) и бромирование соединения (X) с получением соединения (XI) предпочтительно проводят в условиях, описанных на Схеме А. Реакция СО-внедрения в соединение (XI) с получением соединения (I-1) протекает при применении палладиевого катализатора, основания и соединения (XI) в спиртовом растворителе в атмосфере CO. В качестве спиртового растворителя предпочтительны метанол или этанол. В качестве палладиевого катализатора предпочтителен [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II) (PdCl2(dppf)), тетракис(трифенилфосфин)палладий (Pd(PPh3)4) и т.д. Основанием предпочтительно является предпочтительно триэтиламин или диизопропилэтиламин. Температура проведения данной реакции предпочтительно составляет от комнатной температуры до 150°C, и более предпочтительно от 50°C до 90°C.
Следует отметить, что описанное выше соединение формулы (II) может использоваться в качестве соединения (II-1) в представленной выше Схеме C, и описанное выше соединение формулы (III) может использоваться в качестве соединения (III-1) в представленной выше Схеме С.
Представленное производное можно синтезировать согласно изображенной ниже Схеме D, когда A представляет собой простую связь, R1 представляет собой атом азота, R3 представляет собой атом хлора, и R4 представляет собой карбоксильную группу. Так, амидин гидрохлорид (XII) и димер дигидроксиацетона используют для образования имидазольного цикла, получая спирт (XIII). После получения соединения (XIV) путем хлорирования, окислением получают альдегид (XV). Соединение (1-4) можно получить N-алкилированием с получением соединения (XVI), после чего проводят окисление. Кроме того, в качестве альтернативного пути, соединение (I-4) можно также получить хлорированием соединения (I-5), которое соответствует соединению (I-1) в изображенной выше Схеме C, где R3 представляет собой атом водорода, с получением соединения (I-6), после этого осуществляют гидролиз.
Схема D

Реакцию фомирования имидазольного цикла соединения (XII) с получением соединения (XIII) предпочтительно проводят в условиях, когда хлорид аммония и димер дигидроксиацетона применяют в водном растворе аммиака. Данная реакция протекает при 50°C-100°C, но ее предпочтительно проводят при 80-100°C. Хлорирующие агенты для соединения (XIII) могут включать N-хлорсукцинимид (NCS), хлор и т.д., но предпочтительно используют N-хлорсукцинимид (NCS). Данная реакция протекает при температуре от комнатной до 50°C, но более предпочтительно проводить данную реакцию при комнатной температуре для уменьшения вклада побочных реакций. Окисление соединения (XIV) с получением соединения (XV) предпочтительно проводят с помощью диоксида магния, и растворителем для данной реакции предпочтительно является галогенированный растворитель, такой как дихлорметан. N-алкилирование соединения (XV) с получением соединения (XVI) предпочтительно проводят в условиях, описанных на Схеме А. Для реакции окисления соединения (XVI) с получением соединения (1-4), широко известна реакция Пинника, и предпочтительны условия с использованием хлорита натрия и дигидрорфосфата натрия в присутствии 2-метил-2-бутена. В качестве растворителя для данной реакции предпочтительно применять смешанный растворитель, состоящий из тетрагидрофурана (ТГФ) или спирта, такого как т-бутанол или пропанол, и воды. Температура реакции предпочтительно составляет от комнатной температуры до 50°C.Что касается хлорирования соединения (I-5) с получением соединения (1-6), предпочтительно проводить данную реакцию с использованием N-хлорсукцинимида (NCS) в ацетонитриле. Данная реакция протекает при температуре от комнатной до 100°C, но ее предпочтительно проводят при 50°C-80°C. Гидролиз соединения (1-6) с получением соединения (1-4) предпочтительно проводят в условиях, описанных на Схеме А.
Описанные производные можно синтезировать согласно приведений ниже Схеме E, когда A представляет собой простую связь, R1 представляет собой атом азота, R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), ацетильную группу, дифторметильную группу или этинильную группу, и R4 представляет собой карбоксильную группу. Так, диэфир (XVII) превращают в соединение (XVIII) реакцией бромирования, и затем в соединение (II-2) реакцией N-алкилирования. После дальнейшего получения соединения (I-7) по реакции Сузуки, гидроксиметильное соединение (I-8), восстановленное только по положению 4, получают реакцией селективного восстановления с применением диизобутилалюминия гидрида (DIBAL-H). Соединение (I-2) можно синтезировать путем превращения гидроксиметильного фрагмента в различные фрагменты R3 посредством различных известных в органическом синтезе реакций, в завершении осуществляя реакцию гидролиза.
Схема E
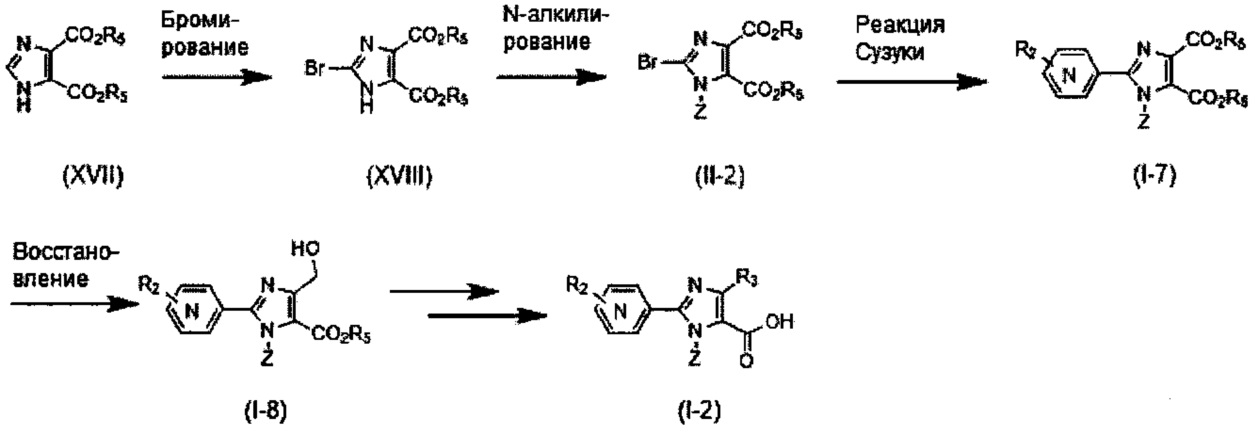
На Схеме E, бромирование соединения (XVII) с получением соединения (XVIII), реакцию N-алкилирования соединения (XVIII) с получением соединения (II-2) и реакцию Сузуки с соединением (II-2) с получением соединения (I-7) предпочтительно проводят в условиях, описанных на Схеме A. Что касается реакции восстановления соединения (I-7) с получением соединения (I-8), предпочтительно проводить данную реакцию восстановления в тетрагидрофуране (ТГФ) с применением диизобутиалюминия гидрида (DIBAL-H). Данная реакция протекает при -50°C-50°C, но ее предпочтительно проводят при температуре от -40°C до комнатной. Что касается превращения гидроксиметильного фрагмента соединения (I-8), дальнейшее превращение различных фрагментов R3 возможно путем превращения спиртового фрагмента в альдегид окислением с помощью диоксида марганца, или путем превращения спиртового фрагмента в атом брома с применением трибромфосфина, с последующей трансформацией полученной альдегидной и бромной группы в различные фрагменты R3. Гидролиз предпочтительно проводят в условиях, описанных на Схеме А.
Следует отметить, что описанное выше соединение формулы (II) может использоваться в качестве соединения (II-2) в приведенной выше Схеме Е.
Описанные производные можно синтезировать согласно приведенной ниже Схеме F, когда A представляет собой простую связь, R1 представляет собой атом азота, R3 представляет собой атом иода, фенильную группу, пиридильную группу, фенокси-группу, циано-группу, алкокси-группу, содержащую 1-6 атомов углерода, или алкенильную группу, содержащую 2-6 атомов углерода, и R4 представляет собой карбоксильную группу. Так, соединение (X), полученное по Схеме (C), иодируют с получением соединения (ХIХ), после чего проводят селективное формилирование с получением соединения (XX). После дальнейшего получения соединения (XXI) путем сочетания по Сузуки, цианирования или этерификации с введением спиртовой, тиольной, фенольной или им подобных групп и т.д. в условиях применения палладия, можно получить соединение (I-2) окислением по Пиннику. Когда R3 представляет собой атом иода, соединение (XX) окисляют напрямую с получением соединения (I-2).
Схема F
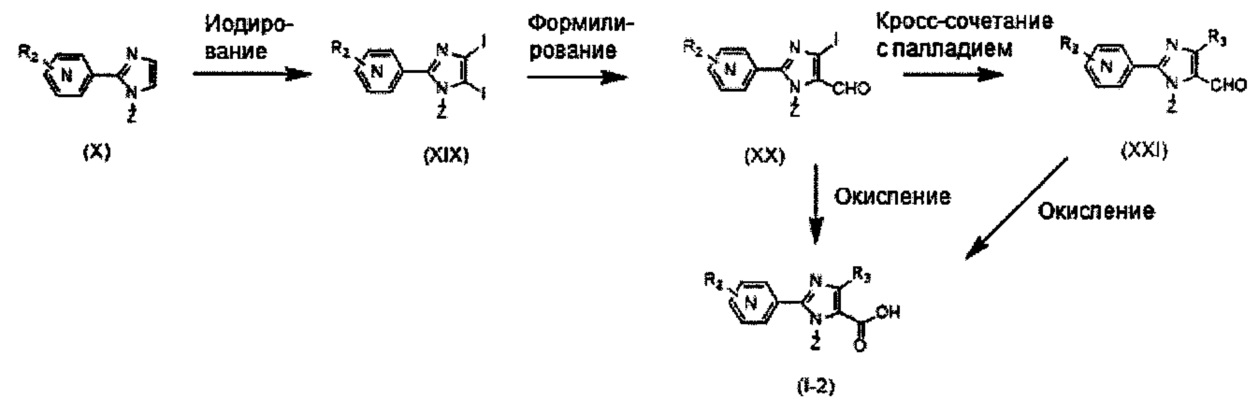
Предпочтительно, реакцию иодирования соединения (X) с получением соединения (XIX) на Схеме F проводят в метаноле с использованием иода и сульфата серебра. Данная реакция протекает при 0°C-100°C, но ее предпочтительно проводят при температуре от комнатной до 50°C. Что касается селективного формилирования соединения (ХIХ) с получением соединения (XX), предпочтительно проводить данную реакцию с использованием реагента Гриньяра, такого как EtMgBr, или литийорганического реагента, такого как nBuLi, в ДМФА или в смеси растворителей, состоящей из тетрагидрофурана (ТГФ) и ДМФА. Данная реакция протекает при -50°C-50°C, но ее предпочтительно проводят при температуре от 0°C до комнатной. При превращении соединения (XX) в соединение (XXI), реакцию Сузуки предпочтительно проводят в условиях, описанных на Схеме А. Цинарирование с применением палладия предпочтительно проводят в условиях, когда палладиевый катализатор, такой как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II) (PdCl2 (dppf)) или тетракис(трифенилфосфин)палладий (Pd(PPh3)4), и ZnCN2 нагревают в ДМФА. Данная реакция протекает при 50°C-150°C, но ее предпочтительно проводят при 80°C-100°C. При этерификации с введением спирта, тиола, фенола или им подобных, предпочтительны условия с применением CuI, 1,10-фенантролина и карбоната цезия, в присутствии соединения (XX) и спирта, тиола, фенола или им подобных, в толуол sьном растворителе. Температура реакции предпочтительно составляет 50°C-100°C. Реакцию окисления по Пиннику соединения (XX) или соединения (XXI) предпочтительно проводят в условиях, описанных на Схеме D.
Описанные производные можно синтезировать согласно приведенной ниже Схеме G, когда A представляет собой простую связь, R1 представляет собой атом азота, R3 представляет собой атом водорода, R4 представляет собой тетразолильную группу, акриловую кислоту или тиометилпропановую кислоту. Так, для тетразольного соединения, соединение (I-9) можно получить введением циано-группы с применением палладия в соединение (XI), полученное по приведенной выше Схеме C, с получением соединения (XXII) и последующим превращением циано-группы в тетразолильную группу реакцией с азидом натрия. Для акриловой кислоты, соединение (I-10) можно получить из соединения (XI) реакцией Хека с получением соединения (XXIII), после чего проводят реакцию гидролиза. Для тиометилпропановой кислоты, соединение (I-11) можно получить введением SH-группы с применением палладия, с получением соединения (XXIV), после чего проводят S-алкилирование с получением соединения (XXV), которое в конце гидролизуют.
Схема G

Для реакции цианирования соединения (XI) с получением соединения (XXII), предпочтительны условия нагревания в ДМФА с палладиевым катализатором, таким как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II) (PdCl2 (dppf)) или тетракис(трифенилфосфин)палладий (Pd(PPh3)4), и ZnCN2. Данная реакция протекает при 50°C-150°C, но ее предпочтительно проводят при 80°C-100°C. Превращение соединения (XXII) с получением соединения (I-9) предпочтительно проводят с применением триэтиламина гидрохлорида и азида натрия в ДМФА. Данная реакция протекает при 100°C-170°C, но ее предпочтительно проводят при 120°C-150°C. Превращение соединения (XI) по реакции Хека в соединение (XXIII) протекает при использовании палладиевого катализатора, такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II) (PdCl2 (dppf)) или тетракис(трифенилфосфин)палладий (Pd(PPh3)4), основания, такого как карбонат калия, ацетат калия, триэтиламин или диизопропилэтиламин, соединения (XI) и сложного эфира акриловой кислоты в ацетонитриле, или в амидном растворителе, таком как ДМФА или ДМА, при нагревании. Данная реакция протекает при температуре от комнатной до 150°C, но ее предпочтительно проводят при 80°C-140°C. Гидролиз предпочтительно проводят в условиях, описанных на Схеме A. Что касается введения SH-группы в соединение (XI) с получением соединения (XXIV), алкилтиольный фагмент вводят нагреванием соединения (XI), 2-этилгексил 3-меркаптопропионата, Pd2(dba)3, Xantphos и диизопропилэтиламина в 1,4-диоксане в атмосфере азота, и затем проводят реакцию β-элиминирования в основных условиях, с получением соединения (XXIV), по методике, описанной в работе: Org. Lett. 2004, 6, 4587-4590; или Org. Lett. 2007, 9, 3687-3689. Для реакции β-элиминирования, предпочтительны условия использования небольшого избытка KOtBu в ДМФА при комнатной температуре. S-алкилирование соединения (XXIV) с получением соединения (XXV) предпочтительно проводят в условиях, аналогичных описанным для N-алкилирования на Схеме A, и более предпочтительно в условиях применения основания и галогенидного соединения. Гидролиз предпочтительно проводят в условиях, описанных на Схеме А.
Описанные производные можно синтезировать согласно приведенной ниже Схеме Н, когда A представляет собой атом кислорода, R1 представляет собой атом азота, R3 представляет собой алкильную группу, содержащую 1-6 атомов углерода, и R4 представляет собой карбоксильную группу. Так, соединение (I-13) можно синтезировать реакцией замещения с фенолом и основанием, используя соединение (II-1) полученное по описанной выше Схеме A, получая соединение (I-12) и проводя затем реакцию гидролиза.
Схема Н

Реакцию замещения для соединения (II-1) с получением соединения (I-12) протекает при реакции соединения (II-1) с фенолом в ДМФА в присутствии основания, такого как карбонат калия или карбонат цезия. Данная реакция протекает при 50°C-150°C, но ее предпочтительно проводят при 90°C-130°C. Гидролиз соединения (I-12) с получением соединения (I-13) предпочтительно проводят в условиях, описанных на Схеме А.
Следует отметить, что описанное выше соединение формулы (II) может использоваться в качестве соединения (II-1) в приведенной выше Схеме Н.
Кроме того, описанные производные можно синтезировать согласно приведенной ниже Схеме I, когда A представляет собой простую связь, R1 представляет собой CH, R3 представляет собой атом водорода, и R4 представляет собой карбоксильную группу или акриловую кислоту. Так, для карбоновой кислоты, после N-алкилирования известного пиррольного соединения (XXVI) с получением соединения (II-3), соединение (XXVII) получают по реакции Сузуки с боронатом. Целевое соединение (I-14) можно получить последующей реакцией окисления. Для акриловой кислоты, соединение (I-15) можно получить реакцией Хорнера-Эммонса из соединения (XXVII), с получением соединения (XXVIII), после чего проводят гидролиз.
Схема I
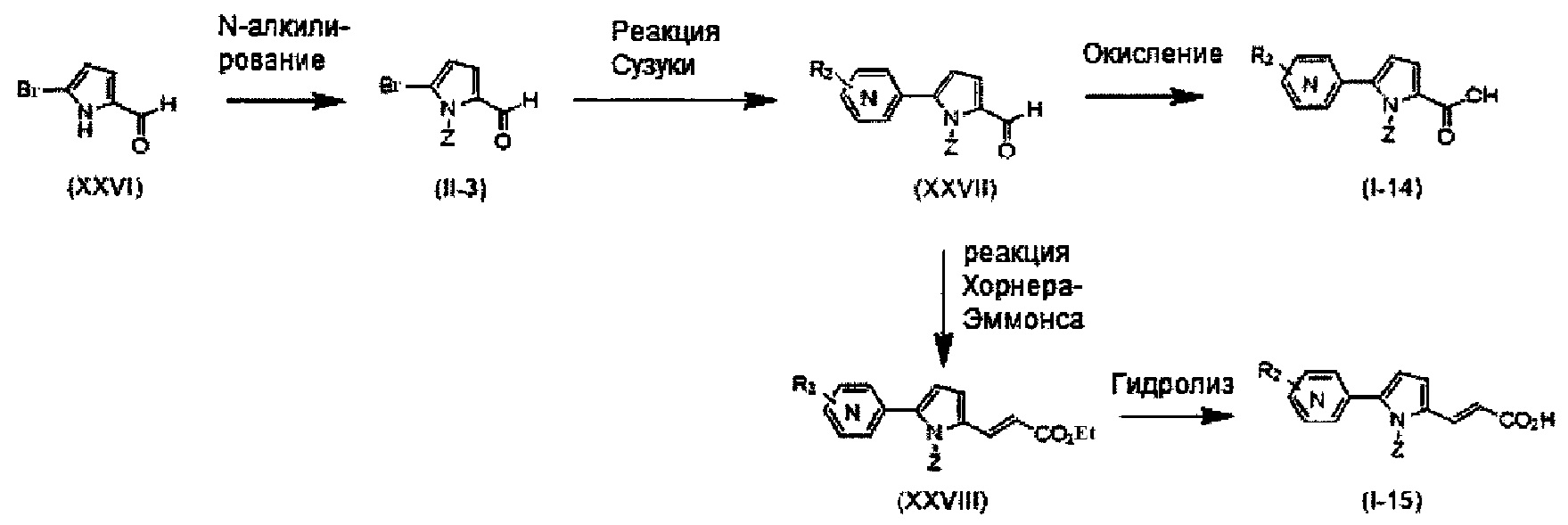
Предпочтительно, реакцию N-алкилирования соединения (XXVI) с получением соединения (II-3) на Схеме I и последующую реакцию Сузуки с соединением (II-3) проводят в условиях, описанных на Схеме А. Предпочтительно, реакцию окисления соединения (XXVII) проводят в условиях, описанных на Схеме D. Реакция Хорнера-Эммонса соединения (XXVII) с получением соединения (XXVIII) протекает при реакции соединение (XXVII) с этил диэтилфосфоноацетатом в ТГФ, в присутствии основания, такого как гидрид натрия или nBuLi. Температура реакции предпочтительно составляет от 0°C до комнатной температуры. Последующий гидролиз предпочтительно проводят в условиях, описанных на Схеме A.
Следует отметить, что описанное выше соединение формулы (II) может использоваться в качестве соединения (II-3) в приведенной выше Схеме I.
Средство для лечения или профилактики подагры, гиперурикемии и т.п., содержащее в качестве действующего вещества производное пиридина или его пролекарство, или его фармацевтически приемлемую соль, или его сольват по настоящему изобретению, готовят смешиванием с носителями, вспомогательными веществами и другими добавками, обычно используемыми для приготовления фармацевтических препаратов. Носители и вспомогательные вещества для приготовления фармацевтических препаратов могут быть твердыми или жидкими и включают, например, лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, гуммиарабик, оливковое масло, сезамовое масло, масло какао, этиленгликоль и т.д., а также другие широко применяющиеся материалы. Введение может осуществлять посредством перорального приема таблеток, пилюль, капсул, гранул, порошков или жидких препаратов, или парэнтерально, например посредством инъекций, таких как внутривенные инъекции и внутримышечные инъекции, суппозиториев, или чрезкожно.
В контексте настоящего изобретения, "профилактика" означает недопущение наступления или развития заболевания у человека, у которого данное заболевание еще не наступило или не развилось, и "лечение" означает исцеление, подавление или облегчение тяжести заболевания или симптома у человека, у которого данное заболевание уже наступило или развилось.
Эффективная дозировка действующего вещества в ингибиторе URAT1 или в средстве для лечения или профилактики по настоящему изобретению может варьироваться в зависимости от способа введения, возраста и пола пациента, степени тяжести заболевания и т.п., но обычно составляет примерно от 0.1 до 100 мг/день. Частота дозирования в целом составляет от 1 до 3 раз в день или от 1 до 7 раз в неделю. Предпочтительно готовить фармацевтические препараты, соответствующие указанным условиям.
Примеры
Далее настоящее изобретение описано более детально с помощью рабочих примеров, но не ограничиваясь только ими. В настоящем изобретении используются следующие сокращения:
ДМФА = N,N-диметилформамид
ТГФ = тетрагидрофуран
NBS = N-бромсукцинимид
NCS = N-хлорсукцинимид
DEAD = диэтил азодикарбоксилат
DIAD = диизопропил азодикарбоксилат
PdCl2 (dppf)=[1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)
PdCl2(dppf)⋅CH2Cl2 = [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) комплекс с дихлорметаном
BSA = N,O-бис(триметилсилил)ацетамид
AIBN = 2,2'-азобис(изобутиронитрил)
HATU = O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат
WSC = 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид
DMAP = N,N-диметиламино-4-аминопиридин
DIBAL-H = диизобутилалюминия гидрид
DAST = диэтиламиносеры трифторид
Строение выделенных новых соединений подтверждали методами1Н-ЯМР и/или масс-спектрометрии с использованием квадрупольного прибора, оснащенного источником электроспрея, и другими подходящими аналитическими методами.
В случае соединений, для которых были записаны1Н-ЯМР спектры (400 МГц, ДМСО-d6, CDCl3 или CD3OD), представлены значения химических сдвигов (δ: м.д.) и констант спин-спинового взаимодействия (J: Гц). В случае данных масс-спектрометрии, полученный результат показан как М++Н, т.е. значение молекулярной массы вещества (М) плюс протон (Н+). Ниже приведены расшифровки использованных сокращений.
с = синглет, д = дублет, т = триплет, кв = квадруплет, ушир.с = уширенный синглет, м = мультиплет.
Соединения, синтезированные по методикам, описанным далее в Примерах, анализировали также методом высокоэффективной жидкостной хроматографии (ВЭЖХ) и масс-спектрометрии с использованием времяпролетного масс-спектрометра (TOF-MS: Time of Flight-Mass Spectroscopy), оснащенного источником ионов для электроспрея.
Время удерживания (в минутах) соединения в ВЭЖХ анализе при описанных далее условиях приведено как время удерживания в ВЭЖХ.
Условия проведения анализа методом ВЭЖХ
Прибор: Hewlett-Packard 1100ВЭЖХ
Колонка: Imtakt Cadenza CD-C18 100 мм×4.6 мм 3 мкм
УФ: PDA детектор (254 нм)
Температура колонки: 40°C
Градиент:
Растворители: А: H2O/ацетонитрил = 95/5
0.05% ТФУК (трифторуксусная кислота)
В: H2O/ацетонитрил = 5/95
0.05% ТФУК (трифторуксусная кислота)
Скорость потока: 1.0 мл/мин
Градиенты: 0-1 минут, Растворитель B: 2%, Растворитель A: 98%
1-14 минут, Растворитель B: 2%→100%, Растворитель A: 98%→0%
14-17 минут, Растворитель B: 100%, Растворитель A: 0%
17-19 минут, Растворитель B: 100%→2%, Растворитель A: 0%→98%
Для результатов масс-спектрометрии приведено значение "М++Н", полученное на приборе и в условиях, описанных ниже (Найденная масса: т.е. наблюдаемое значение молекулярной массы соединения (М) плюс протон (Н+)) и вычисленное значение "М++Н" (Ожид. масса), а также брутто-формула, вычисленная по наблюдаемому значению "М++Н".
Условия TOF-MS
Масс-спектрометр: Shimadzu Corporation LCMS-IT-TOF
Жидкостной хроматограф: Prominence
Колонка: Phenomenex Synergi Hydro-RP 4.0 мм×20 мм 2.5 мкм
УФ: PDA детектор (254 нм)
Скорость потока: 0.6 мл/мин
Температура колонки: 40°C
Разность потенциалов детектирования: 1.63 кВ
Градиент:
Растворители: А: H2O/ацетонитрил = 95/5
0.1% HCO2H
В: H2O/ацетонитрил = 5/95
0.1% HCO2H
Скорость потока: 0.5 мл/мин
Градиенты: 0-0.2 минут, Растворитель B: 2%, Растворитель A: 98%
0.2-2.5 минут, Растворитель B: 2%→100%, Растворитель A: 98%→0%
2.5-3.8 минут, Растворитель B: 100%, Растворитель A: 0%
3.8-4.0 минут, Растворитель B: 100%→2%, Растворитель A: 0%→98%
4.0-5.0 минут, Растворитель B: 2%, Растворитель A: 98%
[Пример 1]
Получение 4-метил-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение A2) (Схема А)

(1) Этил 4-метил-1Н-имидазол-5-карбоксилат (7.5 г, 48,7 ммоль) растворяли в ацетонитриле (120 мл), добавляли N-бромсукцинимид (10.4 г, 58.4 ммоль), и затем полученную смесь перемешивали при комнатной температуре 3 часа. По окончании реакции добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь два раза экстрагировали этил ацетатом. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 2-бром-4-метил-1Н-имидазол-5-карбоксилат (3.6 г):
1Н-ЯМР (CDCl3) δ: 4.35 (2Н, кв, J=7.1 Гц), 2.51 (3H, с), 1.37 (3H, т, J=7.1 Гц);
ESI-MS m/z=233 (М+ +Н).
(2) Этил 2-бром-4-метил-1Н-имидазол-5-карбоксилат (5 г, 21.45 ммоль) растворяли в ДМФА (40 мл), добавляли карбонат калия (5.93 г, 42.9 ммоль) и 1-(хлорметил)нафталин (4.56 г, 25.8 ммоль), и смесь перемешивали при 80°C в течение 2 часов. По окончании реакции добавляли воду, и смесь два раза экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 2-бром-4-метил-1-(нафталин-1-илметил)-1Н-имидазол-5-карбоксилат (3.25 г):
1H-ЯМР (CDCl3) δ: 8.01 (1Н, д, J=8.3 Гц), 7.91 (1Н, д, J=7.8 Гц), 7.77 (1H, д, J=8.3 Гц), 7.63-7.53 (2Н, м), 7.33 (1H, т, J=7.6 Гц), 6.43 (1Н, дд, J=7.3, 1.0 Гц), 6.07 (2Н, с), 4.13 (2Н, кв, J=7.1 Гц), 2.58 (3H, с), 1.11 (3H, т, J=7.1 Гц);
ESI-MS m/z=373 (М+ +Н).
(3) Этил 2-бром-4-метил-1-(нафталин-1-илметил)-1Н-имидазол-5-карбоксилат (1.5 г, 4.0 ммоль), пиридин-3-илбороновую кислоту (0.74 г, 6.0 ммоль), карбонат цезия (2.62 г, 8.0 ммоль) и PdCl2 (dppf) (0.3 г, 0.4 ммоль) растворяли в смешанном растворителе, состоящем из диоксана (15 мл) и воды (3 мл), и полученный раствор нагревали и перемешивали при 100°C 6 часов в атмосфере азота. После охлаждения, реакционную смесь упаривали при пониженном давлении, в остаток добавляли этилацетат и полученный раствор промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия, после чего упаривали в вакууме. Полученный остаток очищали методом колоночной хроматографии, получая этил 4-метил-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (Соединение A3,1.46 г):
1Н-ЯМР (CDCl3) δ: 8.78 (1Н, д, J=2.0 Гц), 8.58 (1Н, дд, J=4.9, 1.5 Гц), 7.93-7.85 (2Н, м), 7.82-7.77 (2Н, м), 7.57-7.53 (2Н, м), 7.38 (1Н, т, J=7.6 Гц), 7.24-7.20 (1H, м), 6.73 (1Н, д, J=6.3 Гц), 6.03 (2Н, с), 4.13 (2Н, кв, J=7.2 Гц), 2.67 (3H, с), 1.07 (3H, т, J=7.1 Гц);
ESI-MS m/z=372 (М+ +Н).
(4) Этил 4-метил-1-(нафталин-1-илметил)-2-(пиридин-3-ил-1Н-имидазол-5-карбоксилат (1.46 г, 3.93 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (10 мл) и метанола (10 мл), и добавляли в раствор 2М водный раствор гидроксида натрия (4 мл, 8.0 ммоль), затем полученную смесь нагревали и перемешивали при 50°C 1 час. После охлаждения до комнатной температуры, добавляли 2М раствор хлористоводородной кислоты (4 мл, 8.0 ммоль) и упаривали смесь при пониженном давлении. Остаток очищали общеизвестным способом, получая 4-метил-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение A2, 0.88 г):
1Н-ЯМР (ДMCO-D6) δ: 8.69 (1H, д, J=2.0 Гц), 8.60 (1Н, дд, J=4.9, 1.5 Гц), 8.05-8.01 (1Н, м), 7.99-7.95 (1H, м), 7.93 (1H, дт, J=8.0, 2.0 Гц), 7.84 (1H, д, J=8.3 Гц), 7.60-7.57 (2Н, м), 7.46-7.40 (2Н, м), 6.59 (1H, д, J=7.3 Гц), 6.09 (2Н, с), 2.56 (3H, с);
ВЭЖХ время удерживания = 7.40 мин;
Ожид. масса = 344.1394 (M++Н, C21H17N3O2);
Найденная масса = 344.1391 (М+ +Н).
[Пример 2]
Получение 1-((4-хлорбензо[b]тиофен-3-ил)метил)-4-метил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение А7) (Схема А)
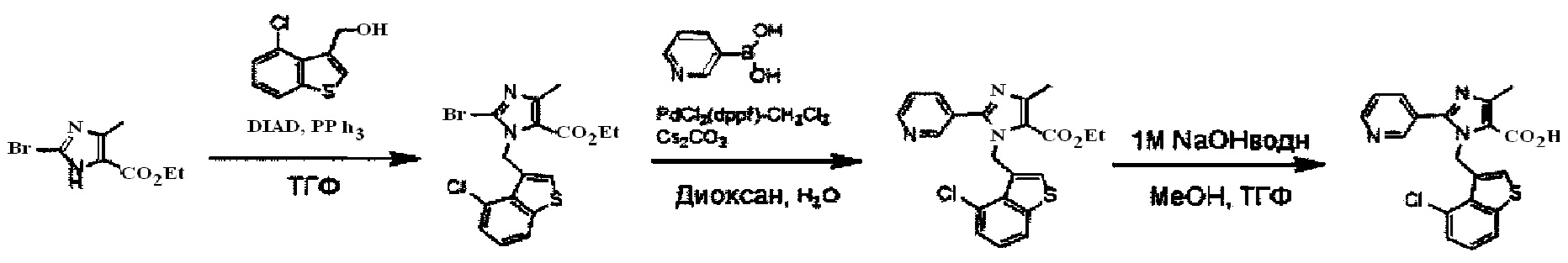
(1) Этил 2-бром-4-метил-1Н-имидазол-5-карбоксилат (1.52 г, 6.0 ммоль), (4-хлорбензо[b]тиофен-3-ил)метанол (1.79 г, 9.0 ммоль), полученный согласно описанному в литературе способу (например, WO 2002/066457), и трифенилфосфин (2.36 г, 9.0 ммоль) растворяли в ТГФ (15 мл), прикапывали 1.9 М раствор DIAD в толуоле (4.73 мл, 9.0 ммоль) при охлаждении до 0°C, и смесь перемешивали при 30°C 10 часов. Растворитель упаривали, и остаток очищали методом колоночной хроматографии, получая этил 2-бром-1-((4-хлорбензо[b]тиофен-3-ил)метил)-4-метил-1Н-имидазол-5-карбоксилат (1.73 г):
1Н-ЯМР (CDCl3)δ8: 7.72 (1H, д, J=8.3 Гц), 7.41-7.24 (3H, м), 6.15 (2Н, с), 4.21 (2Н, кв, J=7.1 Гц), 2.57 (3H, с), 1.20 (3H, т, J=7.1 Гц);
ESI-MS m/z=413 (М+ +Н).
(2) Этил 2-бром-1-((4-хлорбензо[b]тиофен-3-ил)метил)-4-метил-1Н-имидазол-5-карбоксилат (800 мг, 1.93 ммоль), пиридин-3-илбороновую кислоту (366 мг, 3.0 ммоль), карбонат цезия (1.06 г, 3.0 ммоль), PdCl2 (dppf)⋅CH2Cl2 (245 мг, 0.3 ммоль) растворяли в смешанном растворителе, состоящем из диоксана (19 мл) и воды (1 мл), и полученный раствор нагревали и перемешивали при 100°C 5 часов в атмосфере азота. После охлаждения добавляли этилацетат для экстрагирования реакционной смеси, органический слой промывали насыщенным водным раствором хлорида натрия, сушили безводным сульфатом натрия и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии, получая этил 1-((4-хлорбензо[b]тиофен-3-ил)метил)-4-метил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (Соединение А267, 0.63 г):
ESI-MS m/z=412 (М+ +Н).
(3) Этил 1-((4-хлорбензо[b]тиофен-3-ил)метил)-4-метил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (0.63 г, 1.53 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (6 мл), метанола (6 мл) и воды (3 мл), добавляли в раствор 1М водный раствор гидроксида натрия (3 мл, 3.0 ммоль), и смесь перемешивали при 60°C 3 часа. После охлаждения реакционную смесь нейтрализовывали добавлением 1М раствора хлористоводородной кислоты (3 мл, 3.0 ммоль) и отгоняли органический растворитель. Остаток экстрагировали этилацетатом, и органический слой промывали насыщенным водным раствором хлорида натрия. После сушки над безводным сульфатом магния, органический слой упаривали при пониженном давлении. Остаток очищали обычным способом, получая 1-((4-хлорбензо[b]тиофен-3-ил)метил)-4-метил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение А7, 0.26 г):
1Н-ЯМР (ДМСО-D6) δ: 8.72 (1H, д, J=2.0 Гц), 8.60 (1H, дд, J=4.9, 2.0 Гц), 7.99-7.93 (2Н, м), 7.47-7.44 (2Н, м), 7.37 (1H, т, J=8.0 Гц), 6.87 (1H, с), 6.05 (2Н, с), 2.60 (3H, с);
ВЭЖХ время удерживания = 7.76 мин:
Ожид. масса = 384.0568 (М++Н, C19H14ClN3O2S);
Найденная масса = 384.0564 (М+ +Н).
[Пример 3]
Получение 4-хлор-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение А9) (Схема D)

(1) 3-амидинопиридин гидрохлорид (10 г, 63.5 ммоль), димер дигидроксиацетона (11.43 г, 63.6 ммоль) и хлорид аммония (17 г, 317 ммоль) растворяли в 28%-ном водном растворе аммиака (100 мл), и полученный раствор перемешивали при 80°C в течение 2 часов. По окончании реакции добавляли насыщенный водный раствор хлорида натрия (50 мл), и водный слой экстрагировали три раза смешанным растворителем, состоящим из этилацетата и ТГФ. Органический слой сушили над безводным сульфатом натрия и упаривали, получая сырой продукт, который затем промывали ацетонитрилом и гексаном, получая (2-(пиридин-3-ил)-1Н-имидазол-5-ил)метанол (3 г):
ESI-MS m/z=176 (М+ +Н).
(2) В смеси растворителей, состоящей из этанола (30 мл) и 1,4-диоксана (30 мл), растворяли (2-(пиридин-3-ил)-1Н-имидазол-5-ил)метанол (2.1 г, 12 ммоль), добавляли N-хлорсукцинимид (1.6 г, 12 ммоль), и смесь перемешивали при комнатной температуре 48 часов. По окончании реакции добавляли воду (50 мл) и насыщенный водный раствор хлорида натрия (50 мл), и смесь два раза экстрагировали смешанным растворителем, состоящим из этилацетата и ТГФ. После сушки над безводным сульфатом натрия, органический слой упаривали, и остаток очищали методом колоночной хроматографии, получая (4-хлор-2-(пиридин-3-ил)-1Н-имидазол-5-ил)метанол (600 мг):
1Н-ЯМР (ДМСО-d6) δ: 13.16 (1Н, с), 9.09 (1Н, д, J=2.0 Гц), 8.54 (1Н, дд, J=4.9,1.5 Гц), 8.24 (1Н, дт, J=8.1, 2.0 Гц), 7.47 (1H, дд, J=7.8, 4.9 Гц), 5.31 (1Н, т, J=5.1 Гц), 4.45 (2Н, д, J=4.9 Гц);
ESI-MS m/z=210 (М+ +Н).
(3) В дихлорметане (7 мл) суспендировали (4-хлор-2-(пиридин-3-ил)-1Н-имидазол-5-ил)метанол (600 мг, 2.86 ммоль), добавляли диоксид марганца (4 г, 46 ммоль), и смесь перемешивали при комнатной температуре 20 часов. По окончании реакции реакционную смесь фильтровали через целит и упаривали полученный фильтрат, получая 4-хлор-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (460 мг). Полученное вещество использовали в следующей реакции без дополнительной очистки:
1Н-ЯМР (ДМСО-d6) δ: 14.22 (1Н, с), 9.72 (1H, с), 9.24 (1H, с), 8.66 (1Н, д, J=4.4 Гц), 8.42 (1H, д, J=7.3 Гц), 7.54 (1Н, дд, J=7.8,4.9 Гц);
ESI-MS m/z=208 (М+ +Н).
(4) В ДМФА (1 мл) растворяли 4-хлор-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (50 мг, 0.241 ммоль), добавляли в раствор карбонат калия (66.6 мг, 0.482 ммоль) и 1-(хлорметил)нафталин (51.0 мг, 0.289 ммоль), и смесь нагревали и перемешивали при 80°C 5 часов. По окончании реакции добавляли воду (5 мл), и смесь два раза экстрагировали этилацетатом (5 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия и затем упаривали, получая 4-хлор-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (100 мг). Полученное вещество использовали в следующей реакции без дополнительной очистки:
ESI-MS m/z=348 (М+ +Н).
(5) 4-хлор-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (100 мг) и 2-метил-2-бутен (141 мг, 2 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и т-бутанола (1 мл), прикапывали водный раствор (2 мл) хлорита натрия (221 мг, 2.44 ммоль) и дигидрофосфата натрия (292 мг, 1.87 ммоль), и смесь перемешивали при комнатной температуре 6 часов. По окончании реакции добавляли воду (5 мл), и смесь два раза экстрагировали этилацетатом (5 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом ВЭЖХ, получая 4-хлор-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1H-имидазол-5-карбоновую кислоту (Соединение А9, 2.53 мг):
ВЭЖХ время удерживания = 8.52 мин;
Ожид. масса = 364.0847 (М++Н, C20H14ClN3O2);
Найденная масса = 364.0847 (М+ +Н).
[Пример 4]
Получение 4-циклопропил-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение А11) (Схема В)
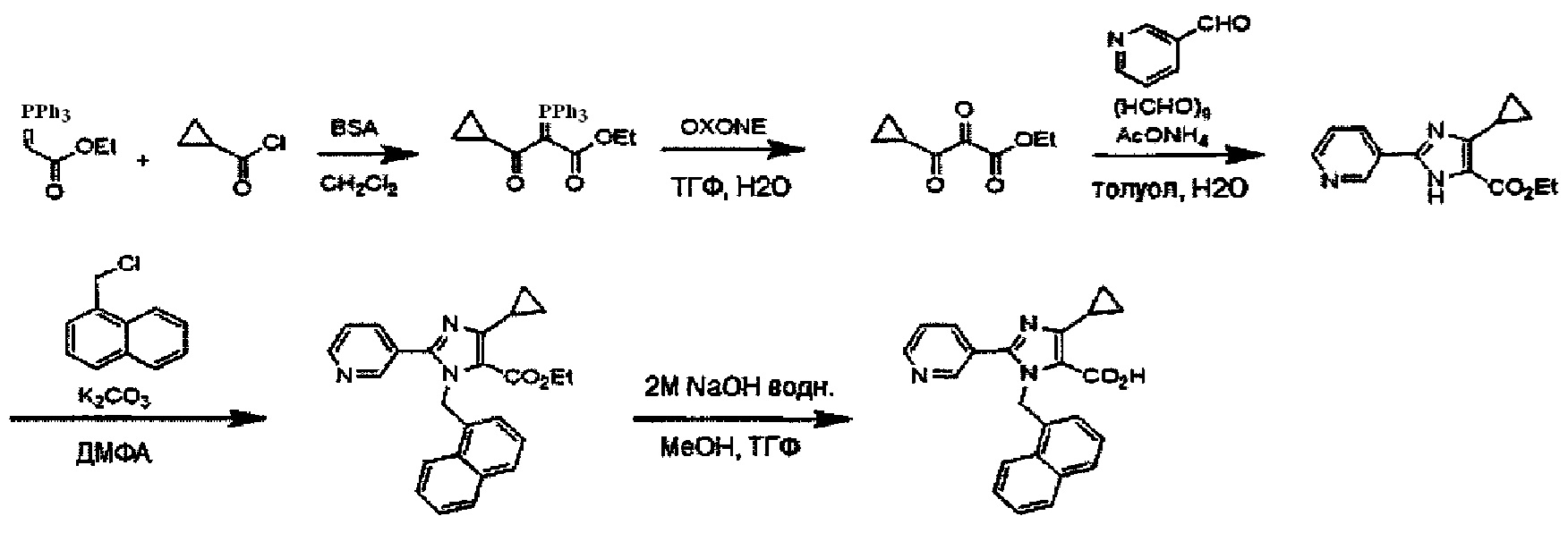
(1) Этил 2-(трифенилфосфоранилиден)ацетат (16.3 г, 47 ммоль) растворяли в дихлорметане (160 мл), добавляли циклопропанкарбонил хлорид (5.4 г, 51 ммоль) и N,O-бис(триметилсилил)ацетамид (BSA) (11.9 г, 58 ммоль) при охлаждении льдом, и полученую смесь перемешивали при комнатной температуре 3 часа. По окончании реакции добавляли воду (100 мл), и водный слой два раза экстрагировали дихлорметаном. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом магния и упаривали, получая этил 3-циклопропил-3-оксо-2-(трифенилфосфоранилиден)пропаноат (19.0 г):
1H-ЯМР (CDCl3) δ: 7.67-7.40 (15Н, м), 3.74 (2Н, кв, J=7.2 Гц), 3.35-3.33 (1Н, м), 0.85-0.81 (2Н, м), 0.71-0.67 (2Н, м), 0.65 (3H, т, J=7.3 Гц);
ESI-MS m/z=417 (M+ +Н).
(2) Этил 3-циклопропил-3-оксо-2-(трифенилфосфоранилиден)пропаноат (19.0 г, 47 ммоль) растворяли в смеси растворителей, состоящей из тетрагидрофурана (300 мл) и воды (200 мл), добавляли оксон (34.7 г, 56 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре 4 часа. По окончании реакции нерастворимый осадок удаляли фильтрованием, и отфильтрованное твердое вещество промывали этилацетатом. Фильтрат упаривали, и растворитель упаривали. Водный слой два раза экстрагировали этилацетатом (100 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом магния. Полученный остаток после упаривания органического слоя очищали методом колоночной хроматографии, получая этил 3-циклопропил-2,3-диоксопропаноат (7.47 г):
1Н-ЯМР (CDCl3) δ: 4.34 (2Н, кв, J=7.1 Гц), 2.16-2.11 (1H, м), 1.31 (3H, т, J=7.1 Гц), 1.25-1.22 (2Н, м), 1.15-1.10 (2Н, м).
(3) Этил 3-циклопропил-2,3-диоксопропаноат (500 мг, 2.9 ммоль), никотиновый альдегид (315 мг, 2.9 ммоль) и ацетат аммония (2.26 г, 29 ммоль) растворяли в смеси растворителей, состоящей из толуола (4 мл) и воды (2 мл), и смесь нагревали и перемешивали при 70°C 3 часа. По окончании реакции остаток, полученный после упаривания толуола, очищали обычным способом, получая этил 4-циклопропил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (416 мг):
1Н-ЯМР (ДМСО-d6) δ: 13.07 (1Н, ушир.с), 9.16 (1H, ушир.с), 8.56 (1Н, д, J=4.9 Гц), 8.33 (1Н, ушир.с), 7.46 (1Н, дд, J=7.8, 4.9 Гц), 4.30 (2Н, ушир.с), 2.59 (1H, ушир.с), 1.32 (3H, т, J=7.1 Гц), 0.97 (4Н, ушир.с);
ESI-MS m/z=258 (M+ +Н).
(4) Этил 4-циклопропил-2-(пиридин-3-ил)-1H-имидазол-5-карбоксилат (50 мг, 0.194 ммоль) растворяли в ДМФА (1 мл), добавляли в раствор карбонат калия (53.7 мг, 0.389 ммоль) и 1-(хлорметил)нафталин (41.2 мг, 0.233 ммоль), и смесь перемешивали при 90°C 3 часа. По окончании реакции добавляли воду (5 мл), и смесь два раза экстрагировали этилацетатом (5 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 4-циклопропил-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (Соединение А268, 40 мг):
ESI-MS m/z=398 (М+ +Н).
(5) Этил 4-циклопропил-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (40 мг) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C 3 часа. По окончании реакции смесь нейтрализовывали добавлением 2М водного раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 4-циклопропил-1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение А11, 30 мг):
1Н-ЯМР (ДМСО-d6) δ: 8.62 (1H, д, J=2.0 Гц), 8.56 (1Н, дд, J=4.9,1.5 Гц), 8.05-7.95 (2Н, м), 7.89-7.82 (2Н, м), 7.60-7.56 (2Н, м), 7.45-7.38 (2Н, м), 6.55 (1H, д, J=6.8 Гц), 6.05 (2Н, с), 2.78-2.71 (1Н, м), 1.04-0.96 (4Н, м);
ВЭЖХ время удерживания = 8.28 мин;
Ожид. масса = 370.1550 (М++Н, C23H19N3O2);
Найденная масса = 370.1548 (М+ +Н).
[Пример 5]
Получение 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-4-метил-1Н-имидазол-5-карбоновой кислоты (Соединение А13) (Схема А)

(1) Этил 2-бром-4-метил-1Н-имидазол-5-карбоксилат (2.75 г, 11.81 ммоль), описанный в Примере 1 (1), растворяли в ДМФА (20 мл), добавляли карбонат калия (3.26 г, 23.62 ммоль) и 2,5-дихлорбензил бромид (3.4 г, 14.17 ммоль), и смесь перемешивали при 90°C 3 часа. По окончании реакции добавляли воду (50 мл), и смесь два раза экстрагировали этил ацетатом (50 мл). Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 2-бром-1-(2,5-дихлорбензил)-4-метил-1Н-имидазол-5-карбоксилат (1.72 г):
1H-ЯМР (CDCl3) δ: 7.34 (1Н, д, J=8.8 Гц), 7.20 (1Н, дд, J=8.8,2.4 Гц), 6.40 (1Н, д, J=2.4 Гц), 5.60 (2Н, с), 4.25 (2Н, кв, J=7.2 Гц), 2.56 (3H, с), 1.27 (3H, т, J=7.1 Гц);
ESI-MS m/z=391 (М+ +Н).
(2) Этил 2-бром-1-(2,5-дихлорбензил)-4-метил-1Н-имидазол-5-карбоксилат (1 г, 2.55 ммоль), пиридин-3-илбороновую кислоту (627 мг, 5.1 ммоль), PdCl2(dppf) (467 мг, 0.64 ммоль) и карбонат цезия (1.66 г, 5.1 ммоль) растворяли в смеси растворителей, состоящей из 1.4-диоксана (7 мл) и воды (1.5 мл), и полученный раствор перемешивали при 100°C 3 часа в атмосфере азота. По окончании реакции добавляли воду (50 мл), и смесь два раза экстрагировали этилацетатом (50 мл). Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 1-(2,5-дихлорбензил)-4-метил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (Соединение А269, 565 мг):
1H-ЯМР (CDCl3) δ: 8.69-8.66 (2Н, м), 7.82-7.78 (1H, м), 7.37-7.33 (2Н, м), 7.26-7.22 (1Н, м), 6.66 (1H, д, J=2.4 Гц), 5.53 (2Н, с), 4.25 (2Н, кв, J=7.2 Гц), 2.65 (3H, с), 1.27 (3H, т, J=7.1 Гц);
ESI-MS m/z=391 (М+ +Н).
(3) Этил 1-(2,5-дихлорбензил)-4-метил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (859 мг, 2.2 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (8 мл) и метанола (3 мл), добавляли в раствор 2М водный раствор гидроксида натрия (2.2 мл, 4.4 ммоль), и полученную смесь перемешивали при 50°C 3 часа. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (2.2 мл, 4.4 ммоль) и упаривали. Остаток очищали обычным способом, получая 1-(2,5-дихлорбензил)-4-метил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение А13, 393 мг):
1Н-ЯМР (ДМСО-d6) δ: 13.01 (1H, с), 8.64-8.61 (2Н, м), 7.84 (1Н, д, J=7.8 Гц), 7.52-7.44 (2Н, м), 7.37 (1H, дд, J=8.5,2.2 Гц), 6.54 (1Н, д, J=2.0 Гц), 5.55 (2Н, с), 2.49 (3H, с);
ВЭЖХ время удерживания = 7.33 мин;
Ожид. масса = 362.0458 (М++Н, C17H13Cl2N3O2);
Найденная масса = 362.0455 (М+ +Н).
[Пример 6]
Получение 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-4-(трифторметил)-1Н-имидазол-5-карбоновой кислоты (Соединение А19) (Схема А)

(1) Этил 4-трифторметил-1Н-имидазол-5-карбоксилат (5.73 г, 27 ммоль), известный из более ранних публикаций (например, Journal of Medicinal Chemistry, 2011, 54, 7621-7638), растворяли в ацетонитриле (100 мл), добавляли N-бромсукцинимид (5.88 г, 33 ммоль), и смесь перемешивали при 50°C в течение 2 часов. По окончании реакции ацетонитрил отгоняли, добавляли насьпценный водный раствор бикарбоната натрия (50 мл), и полученную смесь два раза экстрагировали этил ацетатом (50 мл). После промывки насыщенным водным раствором хлорида магния, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 2-бром-4-трифторметил-1Н-имидазол-5-карбоксилат (5.71 г):
1Н-ЯМР (CDCl3) δ: 4.44 (2Н, кв, J=7.2 Гц), 1.40 (3H, т, J=7.2 Гц);
ESI-MS m/z=287 (М+ +Н).
(2) Этил 2-бром-4-трифторметил-1Н-имидазол-5-карбоксилат (1.57 г, 5.47 ммоль) растворяли в ДМФА (11 мл), добавляли карбонат калия (1.51 г, 10.9 ммоль) и 2,5-дихлорбензил бромид (1.58 г, 6.56 ммоль), и смесь перемешивали при 90°C 3 часа. По окончании реакции добавляли воду (50 мл), и смесь два раза экстрагировали этилацетатом (50 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 2-бром-1-(2,5-дихлорбензил)-4-трифторметил-1Н-имидазол-5-карбоксилат (2.07 г):
1Н-ЯМР (CDCl3) δ: 7.38 (1Н, д, J=8.3 Гц), 7.26-7.23 (1Н, м), 6.43 (1Н, д, J=2.4 Гц), 5.66 (2Н, с), 4.32 (2Н, кв, J=7.1 Гц), 1.32 (3H, т, J=7.1 Гц);
ESI-MS m/z=445 (М+ +Н).
(3) Этил 2-бром-1-(2,5-дихлорбензил)-4-трифторметил-1Н-имидазол-5-карбоксилат (2.05 г, 4.6 ммоль), пиридин-3-илбороновую кислоту (847 мг, 6.89 ммоль), PdCl2(dppf) (673 мг, 0.92 ммоль) и карбонат цезия (2.99 г, 9.19 ммоль) растворяли в смеси растворителей, состоящей из 1,4-диоксана (13 мл) и воды (3 мл), и полученный раствор нагревали и перемешивали при 100°C 3 часа в атмосфере азота. По окончании реакции добавляли воду (50 мл), и смесь два раза экстрагировали этилацетатом (50 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-4-трифторметил-1Н-имидазол-5-карбоксилат (Соединение А270, 1.42 г):
1Н-ЯМР (CDCl3) δ: 8.72 (1Н, дд, J=4.9, 1.5 Гц), 8.68 (1Н, д, J=1.2 Гц), 7.85-7.81 (1Н, м), 7.41-7.35 (2Н, м), 7.28-7.25 (1H, м), 6.64 (1H, д, J=2.0 Гц), 5.60 (2Н, с), 4.33 (2Н, кв, J=7.1 Гц), 1.32 (3H, т, J=7.1 Гц);
ESI-MS m/z=444 (М+ +Н).
(4) Этил 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-4-трифторметил-1Н-имидазол-5-карбоксилат (1.42 г, 3.2 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (13 мл) и метанола (3 мл), добавляли в раствор 2М водный раствор гидроксида натрия (3.2 мл, 6.4 ммоль), и затем полученную смесь перемешивали при 50°C 3 часа. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (3.2 мл, 6.4 ммоль) и упаривали. Остаток очищали обычным способом, получая 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-4-трифторметил-1Н-имидазол-5-карбоновую кислоту (Соединение А19, 683 мг):
1H-ЯМР (ДМСО-d6) δ: 14.13 (1Н, с), 8.70-8.66 (2Н, м), 7.92 (1H, дт, J=7.8, 2.0 Гц), 7.53-7.47 (2Н, м), 7.39 (1Н, дд, J=8.8,2.4 Гц), 6.80 (1H, д, J=2.4 Гц), 5.60 (2Н, с);
ВЭЖХ время удерживания = 9.32 мин;
Ожид. масса = 416.0175 (М++Н, C17H10Cl2F3N3O2);
Найденная масса = 416.0175 (М+ +Н).
[Пример 7]
Получение 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение А45) (Схема С)

(1) Метил 1H-имидазол-4-карбоксилат (1 г, 7.93 ммоль), (2,5-дихлорфенил)метанол (1.68 г, 9.52 ммоль) и трифенилфосфин (3.12 г, 11.89 ммоль) растворяли в ТГФ (15 мл) и прикапывали толуольный раствор DIAD (2.4 г, 11.89 ммоль), затем полученную смесь перемешивали при 50°C в течение 2 часов. По окончании реакции добавляли воду (50 мл), и смесь два раза экстрагировали этилацетатом (50 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая метил 1-(2,5-дихлорбензил)-1Н-имидазол-5-карбоксилат (4 г):
1H-ЯМР (CDCl3) δ: 7.83 (1Н, с), 7.67 (1Н, с), 7.36 (1Н, д, J=8.8 Гц), 7.24 (1Н, дд, J=8.3,2.4 Гц), 6.78 (1Н, д, J=2.4 Гц), 5.61 (2Н, с), 3.83 (3H, с);
ESI-MS m/z=285 (М+ +Н).
(2) Метил 1-(2,5-дихлорбензил)-1Н-имидазол-5-карбоксилат (2.4 г), 2,2'-азобис(изобутиронитрил) (AIBN) (69 мг, 0.421 ммоль) растворяли в тетрахлориде углерода (20 мл) и добавляли N-бромсукцинимид (3 г, 16.83 ммоль), и затем полученную смесь перемешивали при 50°C 20 часов. По окончании реакции добавляли воду (50 мл), и смесь два раза экстрагировали дихлорметаном (50 мл). После промывки водным раствором тиосульфата натрия и насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая метил 2-бром-1-(2,5-дихлорбензил)-1Н-имидазол-5-карбоксилат (890 мг):
1Н-ЯМР (CDCl3) δ: 7.83 (1Н, с), 7.36 (1Н, д, J=8.3 Гц), 7.21 (1Н, дд, J=8.8,2.4 Гц), 6.34 (1Н, д, J=2.4 Гц), 5.66 (2Н, с), 3.82 (3H, с);
ESI-MS m/z=363 (М+ +Н).
(3) В атмосфере азота растворяли метил 2-бром-1-(2,5-дихлорбензил)-1Н-имидазол-5-карбоксилат (100 мг, 0.275 ммоль), пиридин-3-илбороновую кислоту (67.5 мг, 0.55 ммоль), PdCl2 (dppf) (40.2 мг, 0.055 ммоль) и карбонат цезия (179 мг, 0.55 ммоль) в смеси растворителей, состоящей из 1,4-диоксана (1 мл) и воды (0.2 мл), и полученный раствор перемешивали при 100°C 20 часов. По окончании реакции добавляли воду (5 мл), и смесь два раза экстрагировали этил ацетатом (5 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая метил 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (Соединение А271, 15 мг):
ESI-MS m/z=362 (М+ +Н).
(4) Метил 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (15 мг) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл) и добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), затем полученную смесь перемешивали при 50°C 3 часа. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение А45, 9.43 мг):
1Н-ЯМР (ДМСО-d6) δ: 8.71 (2Н, с), 7.98 (1H, с), 7.94 (1Н, д, J=8.3 Гц), 7.57-7.49 (2Н, м), 7.39 (1H, дд, J=8.8, 2.4 Гц), 6.54 (1H, д, J=2.4 Гц), 5.65 (2Н, с);
ВЭЖХ время удерживания = 7.25 мин;
Ожид. масса = 348.0301 (М++Н, C16H11Cl2N3O2);
Найденная масса = 348.0296 (М+ +Н).
[Пример 8]
Получение 4-хлор-1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение А88) (Схема D)

(1) В ДМФА (70 мл) растворяли 3-(1Н-имидазол-2-ил)пиридин (10 г, 68.9 ммоль), известный по более ранним публикациям, добавляли карбонат калия (19 г, 138 ммоль) и 2,5-дихлорбензил бромид (19.83 г, 83 ммоль), и смесь перемешивали при комнатной температуре 7 часов. По окончании реакции добавляли воду, и смесь два раза экстрагировали этилацетатом (100 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая 3-(1-(2,5-дихлорбензил)-1Н-имидазол-2-ил)пиридин (12.49 г):
1Н-ЯМР (ДМСО-d6) δ: 8.71 (1Н, д, J=2.0 Гц), 8.58 (1H, дд, J=4.9,1.5 Гц), 7.92 (1Н, дт, J=8.1, 2.0 Гц), 7.52-7.36 (4Н, м), 7.15 (1H, д, J=1.5 Гц), 6.81 (1Н, д, J=2.4 Гц), 5.41 (2Н, с);
ESI-MS m/z=304 (М+ +Н).
(2) В дихлорметане (65 мл) растворяли 3-(1-(2,5-дихлорбензил)-1Н-имидазол-2-ил)пиридин (6.4 г, 21.1 ммоль), добавляли N-бромсукцинимид (3.76 г, 21.1 ммоль), и смесь перемешивали при комнатной температуре 16 часов. По окончании реакции добавляли воду, и смесь два раза экстрагировали дихлорметаном (100 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая 3-(5-бром-1-(2,5-дихлорбензил)-1Н-имидазол-2-ил)пиридин (3.5 г):
1Н-ЯМР (CDCl3) δ: 8.67-8.63 (2Н, м), 7.80 (1Н, дт, J=7.8, 2.0 Гц), 7.40-7.33 (3H, м), 7.30-7.26 (1H, м), 6.64 (1Н, с), 5.28 (2Н, с);
ESI-MS m/z=382 (М+ +Н).
(3) В атмосфере азота 3-(5-бром-1-(2,5-дихлорбензил)-1Н-имидазол-2-ил)пиридин (1.74 г, 4.54 ммоль), PdCl2 (dppf) (500 мг, 0.68 ммоль) и триэтиламин (5.4 мл, 39.1 ммоль) растворяли в этаноле (10 мл) и, после замены атмосферы на газообразный СО, полученный раствор перемешивали при 70°C 16 часов. По окончании реакции растворитель упаривали, добавляли к остатку воду (20 мл), и смесь два раза экстрагировали этилацетатом (30 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (Соединение А272, 1.2 г):
1H-ЯМР (CDCl3) δ: 8.72-8.67 (2Н, м), 8.03 (1Н, с), 7.82 (1Н, тд, J=5.0, 2.8 Гц), 7.39-7.34 (2Н, м), 7.24 (1H, дд, J=8.8,2.4 Гц), 6.59 (1Н, д, J=2.4 Гц), 5.61 (2Н, с), 4.28 (2Н, кв, J=7.2 Гц), 1.31 (3H, т, J=7.1 Гц);
ESI-MS m/z=376 (М+ +Н).
(4) Этил 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (100 мг, 0.266 ммоль) растворяли в ацетонитриле (0.5 мл) и добавляли N-хлорсукцинимид (71 мг, 0.532 ммоль), затем полученную смесь перемешивали при 60°C в течение 2 часов. По окончании реакции добавляли воду (5 мл), и смесь два раза экстрагировали этилацетатом (5 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 4-хлор-1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (Соединение А273, 100 мг):
1H-ЯМР (CDCl3) δ: 8.72-8.67 (2Н, м), 7.83 (1H, дт, J=8.1, 2.0 Гц), 7.40-7.35 (2Н, м), 7.26 (1H, дд, J=8.8, 2.4 Гц), 6.70 (1Н, д, J=2.0 Гц), 5.58 (2Н, с), 4.30 (2Н, кв, J=7.2 Гц), 1.30 (3H, т, J=7.3 Гц);
ESI-MS m/z=410 (М+ +Н).
(5) Этил 4-хлор-1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (100 мг) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C 3 часа. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 4-хлор-1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение А88, 71 мг):
1Н-ЯМР (ДМСО-d6) δ: 13.57 (1Н, с), 8.69-8.64 (2Н, м), 7.88 (1H, дт, J=8.1, 2.0 Гц), 7.53-7.48 (2Н, м), 7.39 (1Н, дд, J=8.5, 2.7 Гц), 6.79 (1Н, д, J=2.4 Гц), 5.57 (2Н, с);
ВЭЖХ время удерживания = 8.74 мин;
Ожид. масса = 381.9911 (М++Н, C16H10Cl3N3O2);
Найденная масса = 381.9908 (М+ +Н).
[Пример 9]
Получение 1-(2,5-дихлорбензил)-4-иод-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение А90) (Схема F)

(1) В метаноле (250 мл) растворяли 3-(1-(2,5-дихлорбензил)-1Н-имидазол-2-ил)пиридин (16.1 г, 52.9 ммоль), полученный в Примере 8, добавляли иод (26.9 г, 106 ммоль) и нитрат серебра (16.5 г, 52.9 ммоль), и смесь перемешивали при 50°C 1 час. После охлаждения реакционной смеси добавляли иод (13.4 г, 52.9 ммоль) и нитрат серебра (8.2 г, 26.4 ммоль), и смесь перемешивали при 50°C еше 1 час. По окончании реакции реакционную смесь фильтровали, применяя метанол, и полученный фильтрат упаривали. В остаток добавляли водный раствор тиосульфата натрия и водный раствор гидрокарбоната натрия, и смесь два раза экстрагировали дихлорметаном (100 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая 3-(1-(2,5-дихлорбензил)-4,5-дииод-1Н-имидазол-2-ил)пиридин (5.1 г):
1H-ЯМР (CDCl3) δ: 8.67-8.62 (2Н, м), 7.81 (1Н, дт, J=8.0, 2.0 Гц), 7.40-7.27 (3H, м), 6.66 (1Н, д, J=2.4 Гц), 5.32 (2Н, с);
ESI-MS m/z=556 (М+ +Н).
(2) В атмосфере азота 3-(1-(2,5-дихлорбензил)-4,5-дииод-1Н-имидазол-2-ил)пиридин (3.87 г, 6.96 ммоль) растворяли в ДМФА (130 мл), и при 0°C прикапывали 1М раствор (13.9 мл, 13.9 ммоль) EtMgBr в ТГФ в течение 10 минут. После перемешивания еще в течение 10 минут, смесь перемешивали далее при комнатной температуре 1 час. Добавляли воду в реакционную смесь и два раза экстрагировали этилацетатом. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая 1-(2,5-дихлорбензил)-4-иод-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (2.5 г):
1Н-ЯМР (CDCl3) δ: 9.69 (1Н, с), 8.74-8.68 (2Н, м), 7.84 (1H, дт, J=8.1, 1.7 Гц), 7.42-7.36 (2Н, м), 7.27-7.25 (1Н, м), 6.63 (1Н, д, J=2.0 Гц), 5.61 (2Н, с);
ESI-MS m/z=458 (М+ +Н).
(3) 1-(2,5-дихлорбензил)-4-иод-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (50 мг, 0.109 ммоль) и 2-метил-2-бутен (23 мг, 0.33 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (0.5 мл) и т-бутанола (0.5 мл), прикапывали водный раствор (0.25 мл) хлорита натрия (30 мг, 0.332 ммоль) и дигидрофосфата натрия (51 мг, 0.327 ммоль), и затем полученную смесь перемешивали при комнатной температуре 16 часов. По окончании реакции добавляли насыщенный водный раствор хлорида натрия, и смесь два раза экстрагировали этилацетатом (1 мл). Органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом ВЭЖХ, получая 1-(2,5-дихлорбензил)-4-иод-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение А90, 14.2 мг):
1Н-ЯМР (ДМСО-d6) δ: 8.69-8.64 (2Н, м), 7.90 (1H, дт, J=7.8, 2.0 Гц), 7.54-7.48 (2Н, м), 7.39 (1H, дд, J=8.8,2.4 Гц), 6.69 (1Н, д, J=2.4 Гц), 5.57 (2Н, с);
ВЭЖХ время удерживания = 8.71 мин;
Ожид. масса = 473.9268 (М++Н, C16H10Cl2IN3O2);
Найденная масса = 473.9277 (М+ +Н).
[Пример 10]
Получение 1-(2,5-дихлорбензил)-4-фенил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение А91) (Схема F)
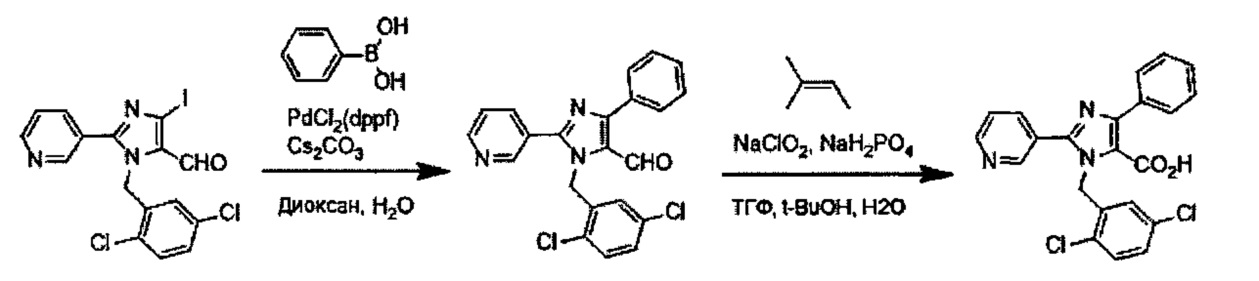
(1) В атмосфере азота, 1-(2,5-дихлорбензил)-4-иод-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (69 мг, 0.151 ммоль), фенилбороновую кислоту (22 мг, 0.180 ммоль), PdCl2 (dppf) (11 мг, 0.015 ммоль) и карбонат цезия (100 мг, 0.31 ммоль) растворяли в смеси растворителей, состоящей из 1,4-диоксана (2 мл) и воды (0.5 мл), и полученный раствор перемешивали при 100°C 1 час. По окончании реакции добавляли воду (5 мл), и смесь два раза экстрагировали этилацетатом (5 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая 1-(2,5-дихлорбензил)-4-фенил-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (48.3 мг):
ESI-MS m/z=408 (М+ +Н).
(2) 1-(2,5-дихлорбензил)-4-фенил-2-(пиридин-3-ил)-1Н-имидазол-5-карбальдегид (48.3 мг, 0.118 ммоль) и 2-метил-2-бутен (25 мг, 0.36 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (0.5 мл) и т-бутанола (0.5 мл), прикапывали водный раствор (0.25 мл) хлорита натрия (32 мг, 0.354 ммоль) и дигидрофосфата натрия (55 мг, 0.352 ммоль), и затем полученную смесь перемешивали при комнатной температуре 16 часов. По окончании реакции добавляли насыщенный водный раствор хлорида натрия, и смесь два раза экстрагировали этилацетатом (1 мл). Органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом ВЭЖХ, получая 1-(2,5-дихлорбензил)-4-фенил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение А91, 20 мг):
1H-ЯМР (ДМСО-d6) δ: 8.73 (1Н, с), 8.68 (1Н, д, J=3.9 Гц), 7.95 (1Н, д, J=8.0 Гц), 7.78-7.74 (2Н, м), 7.54-7.50 (2Н, м), 7.45-7.35 (4Н, м), 6.73 (1Н, д, J=2.0 Гц), 5.61 (2Н, с);
ВЭЖХ время удерживания = 9.08 мин;
Ожид. масса = 424.0614 (М++Н, C22H15Cl2N3O2);
Найденная масса = 424.0602 (М+ +Н).
[Пример 11]
Получение 1-(2,5-дихлорбензил)-4-(2-гидроксипропан-2-ил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновой кислоты (Соединение А108) (Схема А)
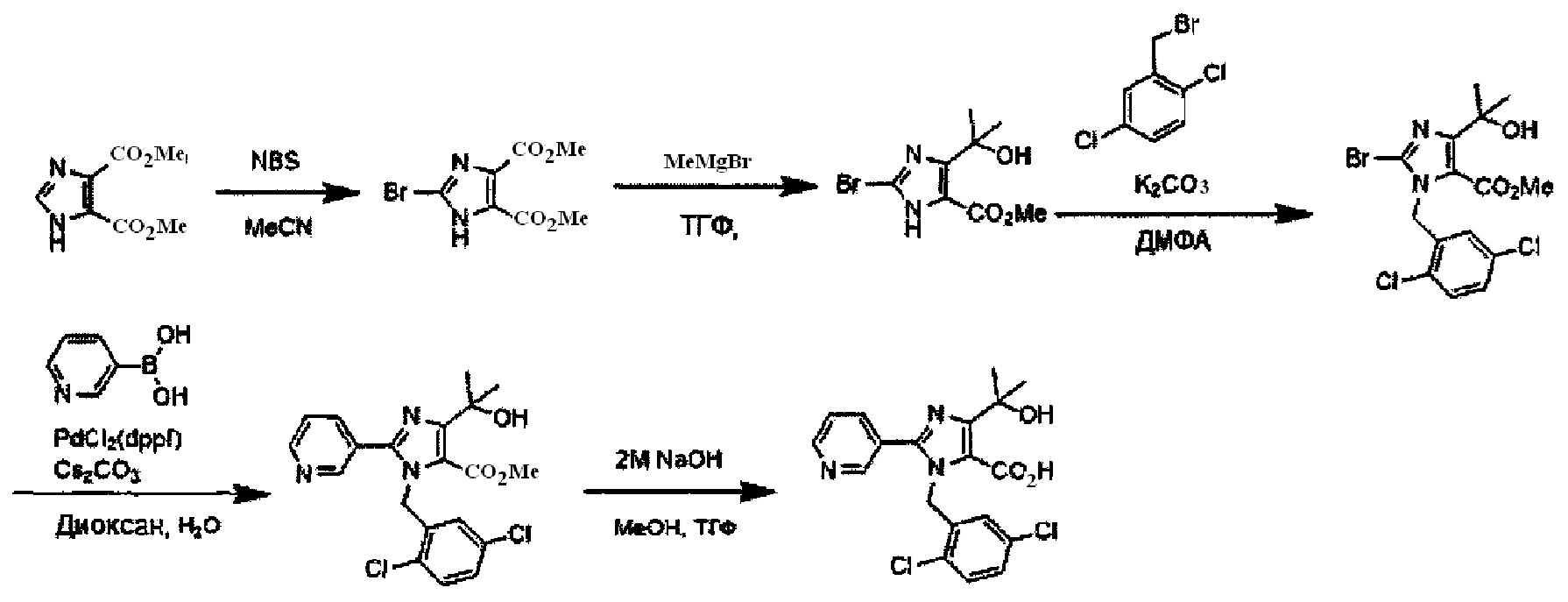
(1) Диметил 1Н-имидазол-4,5-дикарбоксилат (9.6 г, 52 ммоль) растворяли в ацетонитриле (200 мл), добавляли N-бромсукцинимид (13.92 г, 78 ммоль), и затем полученную смесь перемешивали при 50°C 4 часа. По окончании реакции добавляли воду, и смесь два раза экстрагировали этилацетатом. После промывки насыщенным водным раствором тиосульфата натрия и насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. Органический слой упаривали, получая диметил 2-бром-1Н-имидазол-4,5-дикарбоксилат (8.3 г). Полученный продукт использовали в следующей реакции без дополнительной очистки:
1Н-ЯМР (CDCl3) δ: 10.56 (1Н, с), 3.96 (6Н, с);
ESI-MS m/z=263 (М+ +Н).
(2) В атмосфере азота диметил 2-бром-1Н-имидазол-4,5-карбоксилат (2 г, 7.6 ммоль) растворяли в ТГФ (38 мл), и при -10°C прикапывали 1 М раствор (30 мл) EtMgBr в ТГФ в течение 10 минут. После 30 минут реакции, реакционную смесь гасили добавлением водного раствора хлорида аммония. Добавляли воду, и смесь два раза экстрагировали этилацетатом. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая метил 2-бром-4-(2-гидроксипропан-2-ил)-1Н-имидазол-5-дикарбоксилат (830 мг):
1H-ЯМР (CDCl3) δ: 9.78 (1Н, с), 3.93 (3H, с), 1.68 (3H, с), 1.61 (3H, с);
ESI-MS m/z=263 (М+ +Н).
(3) Метил 2-бром-4-(2-гидроксипропан-2-ил)-1Н-имидазол-4,5-дикарбоксилат (830 мг, 3.15 ммоль) растворяли в ДМФА (3 мл), добавляли карбонат калия (872 мг, 6.31 ммоль) и 2,5-дихлорбензил бромид (908 мг, 3.79 ммоль), и затем полученную смесь перемешивали при 90°C 1 час. По окончании реакции добавляли воду, и смесь два раза экстрагировали этилацетатом. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая метил 2-бром-1-(2,5-дихлорбензил)-4-(2-гидроксипропан-2-ил)-1Н-имидазол-5-карбоксилат (673 мг):
1Н-ЯМР (CDCl3) δ: 7.37 (1Н, д, J=8.8 Гц), 7.24 (1Н, д, J=8.8 Гц), 6.46 (1Н, с), 5.55 (2Н, с), 3.77 (3H, с), 1.65 (6Н, с);
ESI-MS m/z=421 (М+ +Н).
(4) Метил 2-бром-1-(2,5-дихлорбензил)-4-(2-гидроксипропан-2-ил)-1Н-имидазол-5-карбоксилат (100 мг, 0.237 ммоль), пиридин-3-илбороновую кислоту (58.2 мг, 0.474 ммоль), карбонат цезия (154 мг, 0.474 ммоль) и PdCl2 (dppf) (34.7 мг, 0.047 ммоль) растворяли в смешанном растворителе, состоящем из диоксана (1 мл) и воды (0.2 мл). В атмосфере азота полученный раствор нагревали и перемешивали при 100°C 3 часа. После охлаждения реакционную смесь упаривали при пониженном давлении, и в остаток добавляли этил ацетат. Органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии, получая метил 1-(2,5-дагхлорбензил)-4-(2-гидроксипропан-2-ил)-2-(пиридин-3-ил)-1H-имидазол-5-карбоксилат (Соединение А274, 71 мг):
ESI-MS m/z=420 (М+ +Н).
(5) Метил 1-(2,5-дихлорбензил)-4-(2-гидроксипропан-2-ил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (71 мг, 0.169 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C в течение 2 часов. По окончании реакции смесь нейтрализовьшали добавлением 2М раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 1-(2,5-дихлорбензил)-4-(2-гидроксипропан-2-ил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (Соединение А108, 61 мг):
1Н-ЯМР (ДМСО-d6) δ: 8.71-8.65 (2Н, м), 7.91 (1Н, д, J=7.8 Гц), 7.56-7.48 (2Н, м), 7.39 (1H, дд, J=8.5,2.2 Гц), 6.56 (1H, д, J=1.5 Гц), 5.59 (2Н, с), 1.62 (6Н, с);
ВЭЖХ время удерживания = 8.16 мин;
Ожид. масса = 406.0720 (М++Н, C19H17Cl2N3O3);
Найденная масса = 406.0725 (М+ +Н).
[Пример 12]
Получение 3-(1-(2,5-дихлорбензил)-5-(1Н-тетразол-5-ил)-1Н-имидазол-2-ил)пиридина (Соединение Al 10) (Схема G)
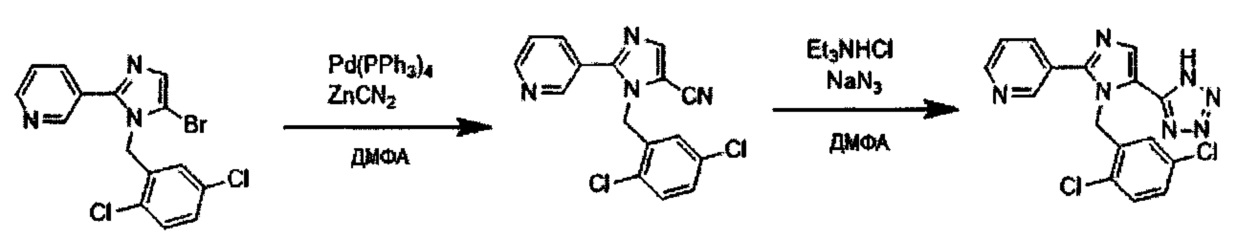
(1) В атмосфере азота 3-(5-бром-1-(2,5-дихлорбензил)-1Н-имидазол-2-ил)пиридин (300 мг, 0.784 ммоль), полученный в Примере 8, ZnCN2 (138 мг, 1.174 ммоль), тетракис(трифенилфосфин)палладий (272 мг, 0.117 ммоль) растворяли в ДМФА (3 мл), и смесь перемешивали при 100°C 16 часов. По окончании реакции добавляли воду, и смесь два раза экстрагировали этилацетатом (10 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбонитрил (83 мг):
1Н-ЯМР (CDCl3) δ: 8.74-8.71 (2Н, м), 7.92 (1Н, с), 7.86 (1H, дт, J=8.3, 2.0 Гц), 7.43-7.38 (2Н, м), 7.31 (1H, дд, J=8.3,2.4 Гц), 6.67 (1Н, д, J=2.4 Гц), 5.41 (2Н, с);
ESI-MS m/z=329 (М+ +Н).
(2) В ДМФА (1 мл) растворяли 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбонитрил (83 мг, 0.252 ммоль) и добавляли гидрохлорид триэтиламина (34.7 мг, 0.252 ммоль) и азид натрия (82 мг, 1.26 ммоль), затем полученную смесь перемешивали при 140°C 3 часа. После фильтрования реакционного раствора, полученный фильтрат очищали методом ВЭЖХ, получая 3-(1-(2,5-дихлорбензил)-5-(1Н-тетразол-5-ил)-1Н-имидазол-2-ил)пиридин (Соединение А110, 80 мг):
1H-ЯМР (ДМСО-d6) δ: 8.75 (1Н, д, J=2.0 Гц), 8.69-8.65 (1Н, м), 8.00-7.96 (2Н, м), 7.56-7.48 (2Н, м), 7.35 (1H, дд, J=8.3,2.4 Гц), 6.51 (1Н, д, J=2.4 Гц), 5.83 (2Н, с);
ВЭЖХ время удерживания = 7.97 мин;
Ожид. масса = 372.0526 (М++Н, C16H11Cl2N7);
Найденная масса = 372.0527 (М+ +Н).
[Пример 13]
Получение 1-(2,5-дихлорбензил)-4-метил-N-(метилсульфонил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксамида (Соединение A111) (Схема А)
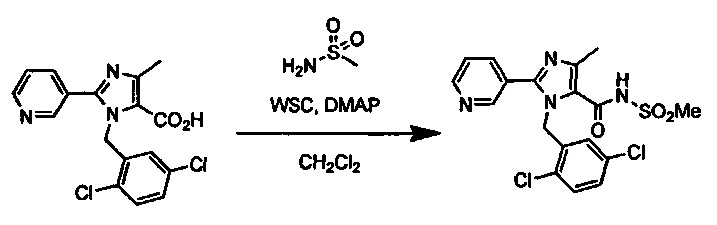
(1) В дихлорметане (1 мл) растворяли 1-(2,5-дихлорбензил)-4-метил-2-(пиридин-3-ил)-1Н-имидазол-5-карбоновую кислоту (30 мг, 0.083 ммоль), метансульфонамид (15.76 мг, 0.166 ммоль) и DMAP (20.24 мг, 0.166 ммоль), добавляли 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (WSC) (31.8 мг, 0.166 ммоль), и смесь перемешивали при комнатной температуре 16 часов. Проводили очистку методом ВЭЖХ, получая 1-(2,5-дихлорбензил)-4-метил-N-(метилсульфонил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксамид (Соединение A111, 18 мг):
1Н-ЯМР (ДМСО-d6) δ: 8.74 (1Н, д, J=2.0 Гц), 8.69 (1H, дд, J=4.9,2.0 Гц), 7.99 (1Н, дт, J=8.0, 1.8 Гц), 7.58-7.53 (1Н, м), 7.46 (1H, д, J=8.3 Гц), 7.38 (1Н, дд, J=8.5, 2.7 Гц), 6.78 (1Н, д, J=2.4 Гц), 5.50 (2Н, с), 3.13 (3H, с), 2.45 (3H, с);
ВЭЖХ время удерживания = 7.76 мин;
Ожид. масса = 439.0393 (М++Н, C18H16Cl2N4O3S);
Найденная масса = 439.0397 (М+ +Н).
[Пример 14]
Получение 2-(5-фторпиридин-3-ил)-4-метил-1-(нафталин-1-илметил)-1Н-имидазол-5-карбоновой кислоты (Соединение А119) (Схема А)

(1) Этил 2-бром-4-метил-1-(нафталин-1-илметил)-1Н-имидазол-5-карбоксилат (1.26 г, 3.39 ммоль), описанный в Примере 1 (2), 3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин (800 мг, 3.59 ммоль), PdCl2 (dppf) (496 мг, 0.678 ммоль) и карбонат цезия (2.2 г, 6.78 ммоль) растворяли в смеси растворителей, состоящей из 1,4-диоксана (9 мл) и воды (2 мл), и полученный раствор перемешивали при 100°C 3 часа в атмосфере азота. По окончании реакции добавляли воду (50 мл), и смесь два раза экстрагировали этилацетатом (50 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 2-(5-фторпиридин-3-ил)-4-метил-1-(нафталин-1-илметил)-1Н-имидазол-5-карбоксилат (Соединение А275, 1.2 г):
1Н-ЯМР (CDCl3) δ: 8.53 (1Н, с), 8.44 (1H, д, J=2.9 Гц), 7.94-7.85 (2Н, м), 7.80 (1H, д, J=8.3 Гц), 7.63-7.53 (3H, м), 7.38 (1H, т, J=7.8 Гц), 6.70 (1Н, д, J=6.8 Гц), 6.06 (2Н, с), 4.14 (2Н, кв, J=7.2 Гц), 2.67 (3H, с), 1.09 (3H, т, J=7.2 Гц);
ESI-MS m/z=390 (M+ +Н).
(2) Этил 2-(5-фторпиридин-3-ил)-4-метил-1-(нафталин-1-илметил)-1Н-имидазол-5-карбоксилат (1.2 г, 3.08 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (12 мл) и метанола (3 мл), добавляли 2М водный раствор гидроксида натрия (3 мл, 6 ммоль), и смесь перемешивали при 40°C 3 часа. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (3 мл, 6 ммоль) и затем упаривали. Остаток очищали обычным способом, получая 2-(5-фторпиридин-3-ил)-4-метил-1-(нафталин-1-илметил)-1Н-имидазол-5-карбоновую кислоту (Соединение А119, 648 мг):
1Н-ЯМР (ДМСО-d6) δ: 12.95 (1H, с), 8.58 (1Н, д, J=2.9 Гц), 8.48 (1Н, с), 8.06-7.95 (2Н, м), 7.85-7.80 (2Н, м), 7.61-7.57 (2Н, м), 7.40 (1Н, т, J=7.6 Гц), 6.52 (1Н, д, J=7.3 Гц), 6.12 (2Н, с), 2.53 (3H, с);
ВЭЖХ время удерживания = 8.53 мин;
Ожид. масса = 362.1299 (М+ +Н, C21H16FN3O2);
Найденная масса = 362.1300 (М+ +Н).
[Пример 15]
Получение 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(гидроксиметил)-1Н-имидазол-5-карбоновой кислоты (Соединение А191) (Схема Е)
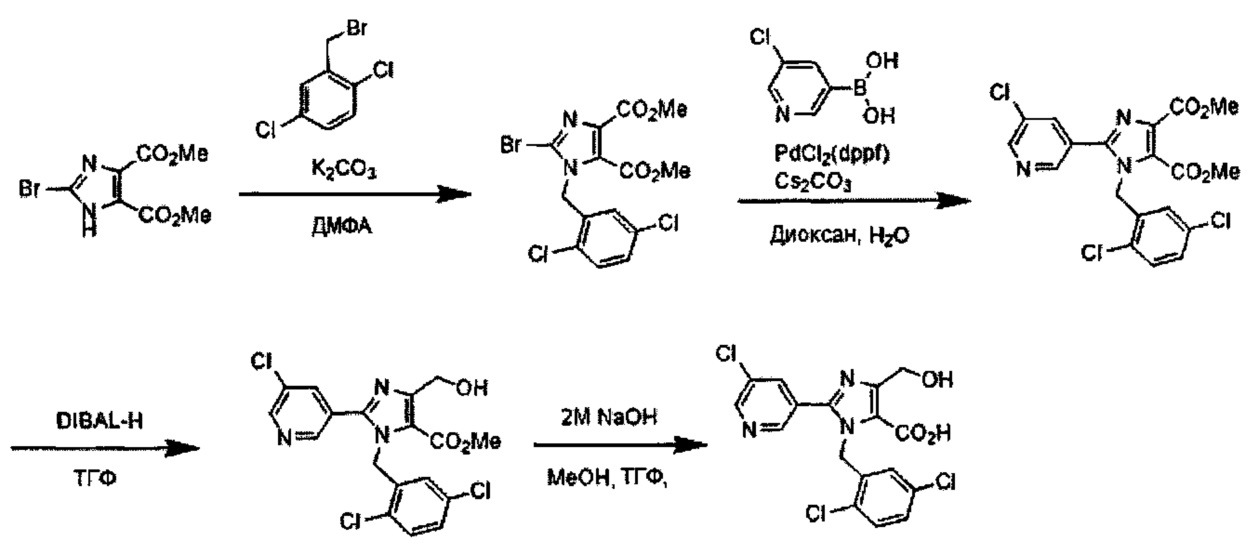
(1) Диметил 2-бром-1Н-имидазол-4,5-карбоксилат (1.1 г, 4.18 ммоль), полученный в Примере 11, растворяли в ДМФА (4 мл) и добавляли карбонат калия (1.15 г, 8.36 ммоль) и 2,5-дихлорбензил бромид (1.3 г, 5.44 ммоль), затем полученную смесь перемешивали при 100°C в течение 2 часов. По окончании реакции добавляли воду, и смесь два раза экстрагировали этилацетатом. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая 2-бром-1-(2,5-дихлорбензил)-1Н-имидазол-4,5-дикарбоксилат (1.54 г):
1Н-ЯМР (CDCl3) δ: 7.36 (1H, д, J=8.8 Гц), 7.24 (1Н, дд, J=8.8,3.0 Гц), 6.52 (1Н, д, J=2.4 Гц), 5.54 (2Н, с), 3.96 (3H, с), 3.85 (3H, с);
ESI-MS m/z=421 (М+ +Н).
(2) Диметил 2-бром-1-(2,5-дихлорбензил)-1Н-имидазол-4,5-дикарбоксилат (300 мг, 0.711 ммоль), (5-хлорпиридин-3-ил)бороновую кислоту (244 мг, 1.422 ммоль), карбонат цезия (463 мг, 1.422 ммоль) и PdCl2 (dppf) (104 мг, 0.142 ммоль) растворяли в смешанном растворителе, состоящем из диоксана (2 мл) и воды (0.5 мл). Полученный раствор нагревали и перемешивали при 100°C 3 часа в атмосфере азота. После охлаждения реакционную смесь упаривали при пониженном давлении. В остаток добавляли этилацетат и органический слой промывали водой и насыщенным водным раствором хлорида натрия. После сушки над безводным сульфатом магния, органический слой упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии, получая диметил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-1Н-имидазол-4,5-дикарбоксилат (Соединение А276, 168 мг):
1Н-ЯМР (CDCl3) δ: 8.66 (1Н, д, J=2.0 Гц), 8.50 (1H, д, J=2.0 Гц), 7.91 (1Н, т, J=2.0 Гц), 7.36 (1H, д, J=8.3 Гц), 7.29-7.26 (1Н, м), 6.72 (1Н, д, J=2.4 Гц), 5.51 (2Н, с), 3.99 (3H, с), 3.86 (3H, с);
ESI-MS m/z=454 (М+ +Н).
(3) Диметил 2-(5-хлоргшридин-3-ил)-1-(2,5-дихлорбензил)-1Н-имидазол-4,5-дикарбоксилат (168 мг, 0.369 ммоль) растворяли в ТГФ (3 мл), прикапывали 1М раствор диизобутилалюминия гидрида (DIBAL-H) (0.739 мл, 0.739 ммоль) в течение 5 минут при -40°C в атмосфере азота, и смесь перемешивали 5 часов. После нагревания смеси до комнатной температуры, реакцию гасили водным раствором хлорида аммония, затем добавляли воду, и смесь два раза экстрагировали этилацетатом. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(гидроксиметил)-1Н-имидазол-5-карбоксилат (соединение А277, 57 мг):
1Н-ЯМР (CDCl3) δ: 8.65 (1Н, д, J=2.4 Гц), 8.50 (1Н, д, J=2.0 Гц), 7.91 (1H, т, J=2.2 Гц), 7.39 (1H, д, J=8.8 Гц), 7.27 (1Н, дд, J=8.3, 2.4 Гц), 6.63 (1H, д, J=2.4 Гц), 5.59 (2Н, с), 4.99-4.96 (2Н, м), 3.85 (3H, с), 3.21 (1Н, т, J=5.6 Гц);
ESI-MS m/z=426 (М+ +Н).
(4) Метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(гидроксиметил)-1Н-имидазол-5-карбоксилат (57 мг, 0.134 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C в течение 2 часов. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(гидроксиметил)-1Н-имидазол-5-карбоновую кислоту (Соединение А191, 35 мг):
1Н-ЯМР (ДМСО-d6) δ: 8.72 (1H, д, J=2.4 Гц), 8.56 (1H, д, J=2.0 Гц), 8.04 (1H, т, J=2.0 Гц), 7.51 (1H, д, J=8.8 Гц), 7.39 (1Н, дд, J=8.3, 2.4 Гц), 6.60 (1Н, д, J=2.4 Гц), 5.64 (2Н, с), 4.71 (2Н, с);
ВЭЖХ время удерживания = 8.81 мин;
Ожид. масса = 412.0017 (М+ +Н, C17H12Cl3N3O3);
Найденная масса = 412.0018 (М+ +Н).
[Пример 16]
Получение 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-((диэтиламино)метил)-1Н-имидазол-5-карбоновой кислоты (Соединение A193) (Схема Е)
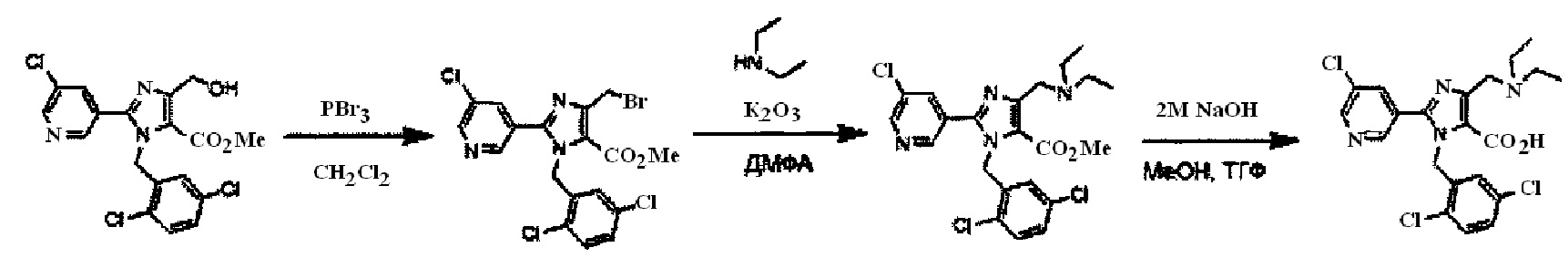
(1) Метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(гидроксиметил)-1Н-имидазол-5-карбоксилат (500 мг, 1.17 ммоль) растворяли в дихлорметане (5 мл), добавляли трибромфосфин (317 мг, 1.17 ммоль), и затем полученную смесь перемешивали при комнатной температуре в течение 2 часов. По окончании реакции добавляли воду, и смесь два раза экстрагировали этилацетатом. После промывки насьпценным водным раствором хлорида натрия, органический слой сушили над безводным сульфатом натрия. Органический слой упаривали, получая метил 4-(бромметил)-2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-1Н-имидазол-5-карбоксилат (500 мг). Полученное вещество использовали в следующей реакции без дополнительной очистки.
(2) Метил 4-(бромметил)-2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-1Н-имидазол-5- карбоксилат (90 мг, 0.184 ммоль) растворяли в ДМФА (1 мл), добавляли карбонат калия (50 мг, 0.368 ммоль) и диэтиламин (26.9 мг, 0.368 ммоль), и затем полученную смесь перемешивали при 40°C 3 часа. По окончании реакции добавляли воду, реакционную смесь два раза экстрагировали этилацетатом, и органический слой сушили над безводным сульфатом натрия. Органический слой упаривали, получая метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-((диэтиламино)метил)-1Н-имидазол-5-карбоксилат (Соединение А278, 100 мг). Полученное вещество использовали в следующей реакции без дополнительной очистки:
ESI-MS m/z=481 (М+ +Н).
(3) Метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-((диэтиламино)метил)-1Н-имидазол-5-карбоксилат (100 мг) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C в течение 2 часов. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-((диэтиламино)метил)-1Н-имидазол-5-карбоновую кислоту (Соединение А193, 55 мг):
1H-ЯМР (ДМСО-d6) δ: 9.58 (1H, с), 8.76 (1Н, д, J=2.4 Гц), 8.61 (1Н, д, J=2.0 Гц), 8.10 (1Н, т, J=2.2 Гц), 7.51 (1Н, д, J=8.8 Гц), 7.39 (1Н, дд, J=8.3,2.4 Гц), 6.69 (1Н, д, J=2.4 Гц), 5.70 (2Н, с), 4.60 (2Н, д, J=4.4 Гц), 3.35-3.19 (4Н, м), 1.27 (6Н, т, J=7.3 Гц);
ВЭЖХ время удерживания = 8.55 мин;
Ожид. масса = 467.0803 (М+ +Н, C21H21Cl3N4O2);
Найденная масса = 467.0806 (М+ +Н).
[Пример 17]
Получение 2-(5-бромпиридин-3-ил)-1-(2,5-дихлорбензил)-1Н-имидазол-5-карбоновой кислоты (Соединение А205) (Схема С)
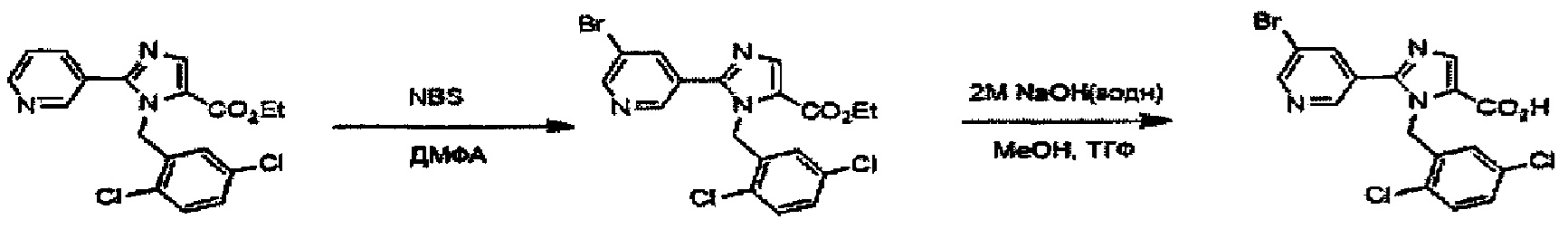
(1) Этил 1-(2,5-дихлорбензил)-2-(пиридин-3-ил)-1Н-имидазол-5-карбоксилат (50 мг, 0.133 ммоль) растворяли в ДМФА (1 мл), добавляли N-бромсукцинимид (48 мг, 0.266 ммоль), и затем полученную смесь перемешивали при 100°C в течение 2 часов. По окончании реакции добавляли воду (5 мл), и смесь два раза экстрагировали этилацетатом (5 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 2-(5-бромпиридин-3-ил)-1-(2,5-дихлорбензил)-1Н-имидазол-5-карбоксилат (Соединение А279, 39 мг):
1Н-ЯМР (CDCl3) δ: 8.74 (1Н, д, J=2.0 Гц), 8.53 (1Н, д, J=1.5 Гц), 8.05-8.01 (2Н, м), 7.38 (1H, д, J=8.8 Гц), 7.25 (1H, дд, J=9.0, 2.2 Гц), 6.59 (1H, д, J=2.0 Гц), 5.63 (2Н, с), 4.29 (2Н, кв, J=7.2 Гц), 1.32 (3H, т, J=7.3 Гц);
ESI-MS m/z=454 (М+ +Н).
(2) Этил 2-(5-бромпиридин-3-ил)-1-(2,5-дихлорбензил)-1Н-имидазол-5-карбоксилат (39 мг) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C 3 часа. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 2-(5-бромпиридин-3-ил)-1-(2,5-дихлорбензил)-1H-имидазол-5-карбоновую кислоту (Соединение А205, 23 мг):
1Н-ЯМР (ДМСО-d6) δ: 13.23 (1Н, с), 8.79 (1Н, д, J=2.0 Гц), 8.61 (1Н, д, J=2.0 Гц), 8.15 (1Н, т, J=2.2 Гц), 7.93 (1Н, с), 7.51 (1Н, д, J=8.8 Гц), 7.38 (1Н, дд, J=8.3, 2.4 Гц), 6.56 (1Н, д, J=2.4 Гц), 5.70 (2Н, с);
ВЭЖХ время удерживания = 9.99 мин;
Ожид. масса = 425.9406 (М+ +Н, С16H10BrCl2N3O2);
Найденная масса = 425.9404 (М+ +Н).
[Пример 18]
Получение 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(дифторметил)-1Н-имидазол-5-карбоновой кислоты (Соединение А207) (Схема Е)

(1) Метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(гидроксиметил)-1Н-имидазол-5-карбоксилат (620 мг, 1.45 ммоль) растворяли в дихлорметане (10 мл), добавляли диоксид марганца (1.426 г, 16.41 ммоль), и затем полученную смесь перемешивали при комнатной температуре 96 часов. По окончании реакции реакционную смесь фильтровали через целит и промывали остаток дихлорметаном. После упаривания раствора, остаток очищали методом колоночной хроматографии, получая метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-формил-1Н-имидазол-5-карбоксилат (413 мг):
1H-ЯМР (CDCl3) δ: 10.51 (1Н, с), 8.68 (1Н, д, J=2.4 Гц), 8.50 (1Н, д, J=2.0 Гц), 7.98 (1H, т, J=2.2 Гц), 7.40 (1H, д, J=8.3 Гц), 7.29 (1Н, дд, J=8.8, 2.4 Гц), 6.59 (1Н, д, J=2.4 Гц), 5.66 (2Н, с), 3.97 (3H, с);
ESI-MS m/z=424 (М+ +Н).
(2) В атмосфере азота метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-формил-1Н-имидазол-5-карбоксилат (100 мг, 0.235 ммоль) растворяли в дихлорметане (1 мл), добавляли диэтиламиносеры трифторид (DAST) (49.3 мг, 0.306 ммоль), и затем полученную смесь перемешивали при комнатной температуре 6 часов. По окончании реакции добавляли воду, затем водный раствор гидрокарбоната натрия, и смесь два раза экстрагировали этилацетатом. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя остаток очищали методом колоночной хроматографии, получая метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(дифторметил)-1Н-имидазол-5-карбоксилат (Соединение А280, 86 мг):
1Н-ЯМР (CDCl3) δ: 8.67 (1H, д, J=2.4 Гц), 8.49 (1Н, д, J=2.0 Гц), 7.95 (1H, т, J=2.2 Гц), 7.39 (1Н, д, J=8.8 Гц), 7.28 (1H, дд, J=8.8, 2.2 Гц), 7.21 (1Н, т, J=54.1 Гц), 6.60 (1Н, д, J=2.4 Гц), 5.63 (2Н, с), 3.91 (3H, с);
ESI-MS m/z=446 (М+ +Н).
(3) Метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(дифторметил)-1Н-имидазол-5-карбоксилат (86 мг) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C 7 часов. По окончании реакции, реакционную смесь нейтрализовывали 2М раствором хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(дифторметил)-1Н-имидазол-5-карбоновую кислоту (Соединение А207, 42 мг):
1Н-ЯМР (ДМСО-d6) δ: 14.16 (1Н, с), 8.75 (1Н, д, J=2.4 Гц), 8.58 (1Н, д, J=2.0 Гц), 8.07 (1Н, т, J=2.2 Гц), 7.53-7.20 (3H, м), 6.75 (1H, д, J=2.4 Гц), 5.66 (2Н, с);
ВЭЖХ время удерживания = 11.04 мин;
Ожид. масса = 431.9879 (М+ +Н, C17H10Cl3F2N3O2);
Найденная масса = 431.9878 (М+ +Н).
[Пример 19]
Получение 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-этинил-1Н-имидазол-5-карбоновой кислоты (Соединение А209) (Схема Е)

(1) Метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-формил-1Н-имидазол-5-карбоксилат (70 мг, 0.165 ммоль) растворяли в метаноле (2 мл), добавляли карбонат калия (45.6 мг, 0.33 ммоль) и диметил (1-диазо-2-оксопропил)фосфонат (44.3 мг, 0.231 ммоль), и затем полученную смесь перемешивали при комнатной температуре 16 часов. По окончании реакции добавляли воду, и смесь два раза экстрагировали этилацетатом. После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-этинил-1Н-имидазол-5-карбоксилат (Соединение А281, 51 мг):
ESI-MS m/z=420 (М+ +Н).
(2) Метил 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-этинил-1Н-имидазол-5-карбоксилат (51 мг) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C 3 часа. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-этинил-1Н-имидазол-5-карбоновую кислоту (Соединение А209, 35 мг):
1Н-ЯМР (ДМСО-d6) δ: 13.59 (1Н, с), 8.73 (1Н, д, J=2.0 Гц), 8.57 (1H, д, J=1.5 Гц), 8.06 (1Н, т, J=2.2 Гц), 7.48 (1Н, д, J=8.3 Гц), 7.38 (1H, д, J=8.8 Гц), 6.73 (1Н, с), 5.62 (2Н, с), 4.44 (1Н, с);
ВЭЖХ время удерживания = 10.67 мин;
Ожид. масса = 405.9911 (М+ +Н, C18H10Cl3N3O2);
Найденная масса = 405.9922 (М+ +Н).
[Пример 20]
Получение 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-1Н-фуро[3,4-d]имидазол-6(4Н)-она (Соединение А221) (Схема Е)

(1) 2-(5-Хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-4-(гадроксиметил)-1H-имидазол-5-карбоновую кислоту (100 мг, 0.242 ммоль) растворяли в ДМФА (1 мл), добавляли HATU (138 мг, 0.364 ммоль) и триэтиламин (49 мг, 0.485 ммоль), и затем полученную смесь перемешивали при комнатной температуре 1 час. Реакционную смесь очищали методом ВЭЖХ, получая 2-(5-хлорпиридин-3-ил)-1-(2,5-дихлорбензил)-1Н- фуро[3,4-d]имидазол-6(4Н)-он (Соединение А221, 38 мг):
1Н-ЯМР (ДМСО-d6) δ: 8.79 (1Н, д, J=2.2 Гц), 8.75 (1Н, д, J=2.0 Гц), 8.23 (1Н, т, J=2.2 Гц), 7.47-7.37 (2Н, м), 7.30 (1Н, д, J=2.0 Гц), 5.51 (2Н, с), 5.34 (2Н, с);
ВЭЖХ время удерживания = 11.16 мин;
Ожид. масса = 393.9911 (М+ +Н, C17H10Cl3N3O2);
Найденная масса = 393.9911 (М+ +Н).
[Пример 21]
Получение 1-(2,5-дихлорбензил)-4-метил-2-((2-метилпиридин-3-ил)окси)-1Н-имидазол-5-карбоновой кислоты (Соединение А252) (Схема Н)

(1) Этил 2-бром-1-(2,5-дихлорбензил)-4-метил-1Н-имидазол-5-карбоксилат (60 мг, 0.153 ммоль) растворяли в ДМФА (1 мл), добавляли карбонат калия (43 мг, 0.306 ммоль) и 2-метилгшридин-3-ол (25 мг, 0.23 ммоль), и затем полученную смесь перемешивали при 120°C 12 часов. По окончании реакции добавляли воду (5 мл), и смесь два раза экстрагировали этилацетатом (5 мл). После промывки насыщенным водным раствором хлорида натрия, органический слой сушили над сульфатом натрия. После упаривания органического слоя, остаток очищали методом колоночной хроматографии, получая этил 1-(2,5-дихлорбензил)-4-метил-2-((2-метилпиридин-3-ил)окси-1Н-имидазол- 5-карбоксилат (Соединение А282, 44 мг):
ESI-MS m/z=420 (М+ +Н).
(2) Этил 1-(2,5-дихлорбензил)-4-метил-2-((2-метилпиридин-3-ил)окси-1Н-имидазол-5- карбоксилат (44 мг, 0.105 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (1 мл) и метанола (0.5 мл), добавляли 2М водный раствор гидроксида натрия (0.2 мл, 0.4 ммоль), и затем полученную смесь перемешивали при 50°C 7 часов. По окончании реакции смесь нейтрализовывали добавлением 2М раствора хлористоводородной кислоты (0.2 мл, 0.4 ммоль) и упаривали. Остаток очищали методом ВЭЖХ, получая 1-(2,5-дихлорбензил)-4-метил-2-((2-метилпиридин-3-ил)окси)-1Н-имидазол-5-карбоновую кислоту (Соединение А252, 30 мг):
1Н-ЯМР (ДМСО-d6) δ: 8.43 (1H, дд, J=4.9,1.0 Гц), 7.95 (1Н, д, J=8.3 Гц), 7.58-7.40 (3H, м), 6.77 (1H, д, J=2.4 Гц), 5.55 (2Н, с), 2.33 (3H, с), 2.28 (3H, с);
ВЭЖХ время удерживания = 8.20 мин;
Ожид. масса = 392.0563 (М+ +Н, C18H15Cl2N3O3);
Найденная масса = 392.0570 (М+ +Н).
Соединения, имеющие номера A1-А266, синтезировали по методикам, аналогичным описанным в Примерах 1-21.



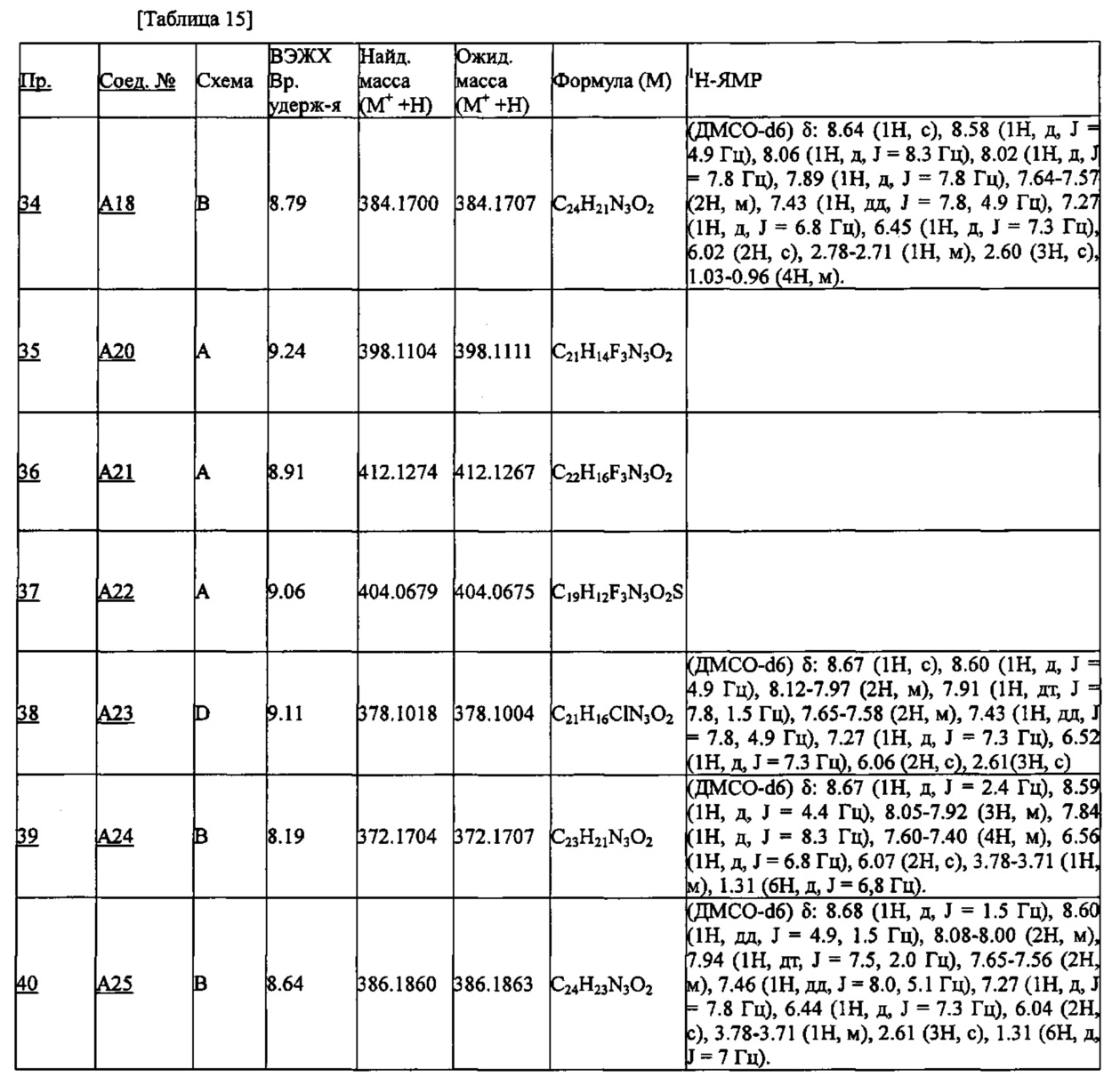




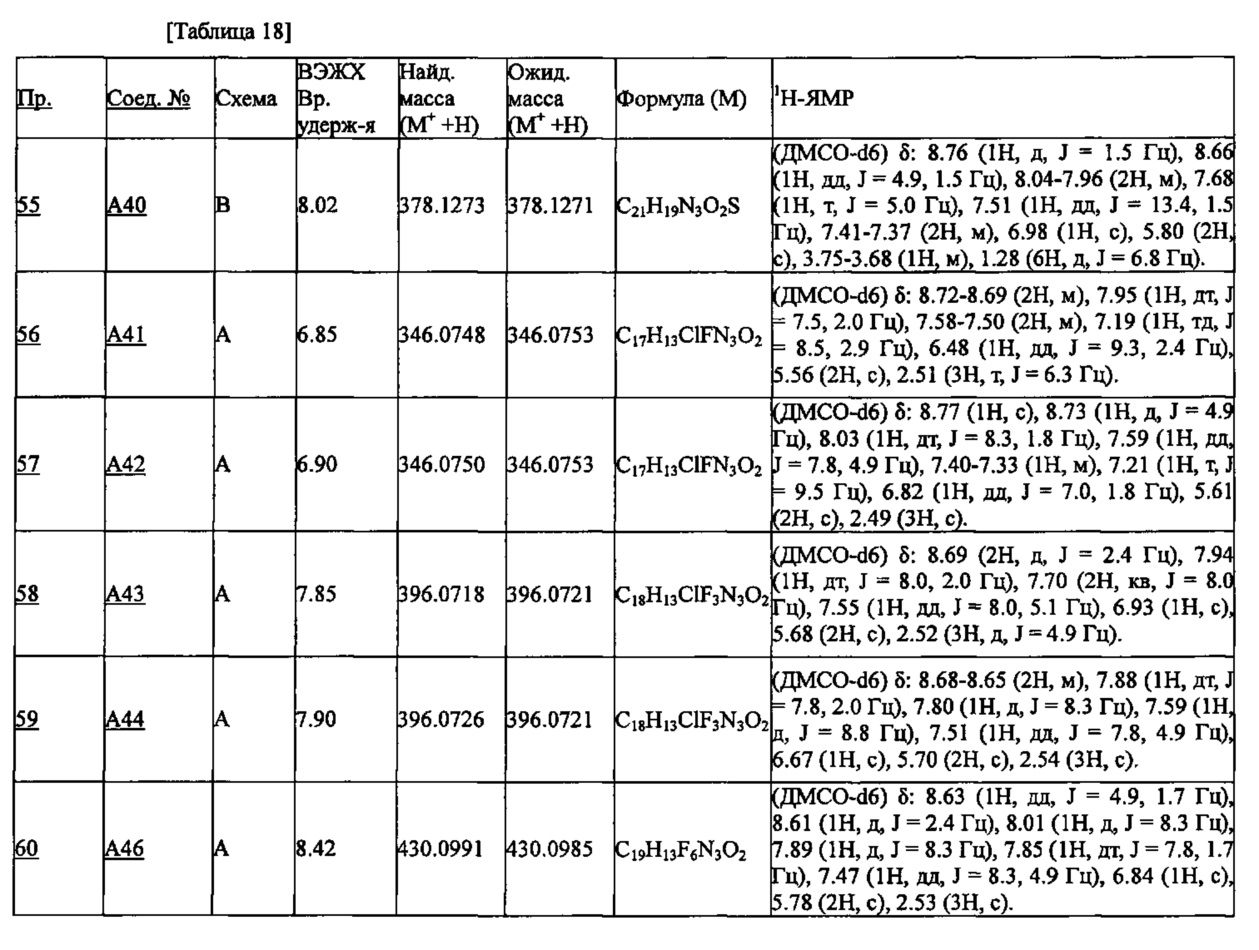


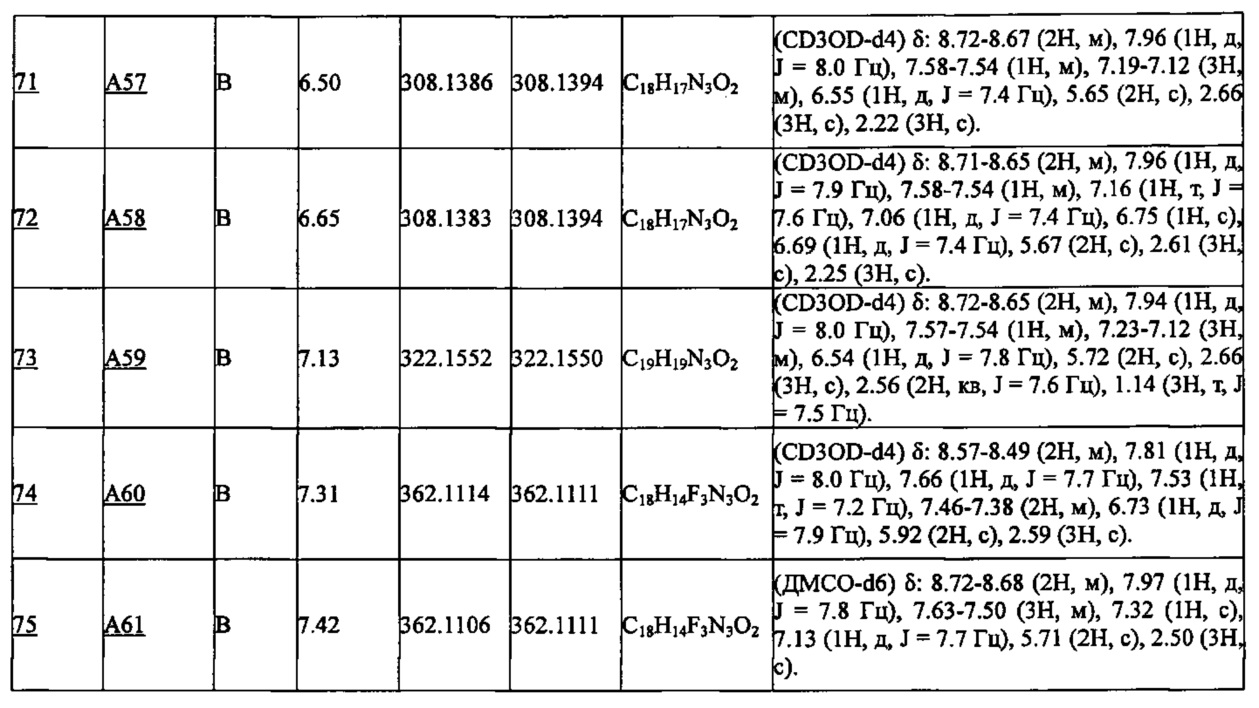






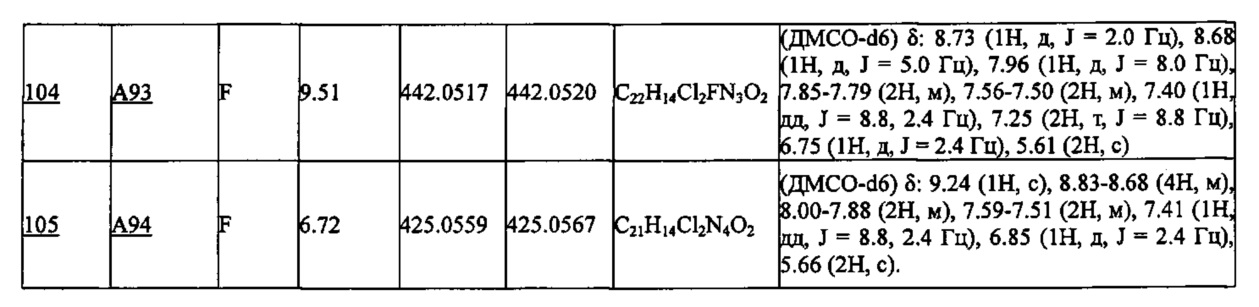











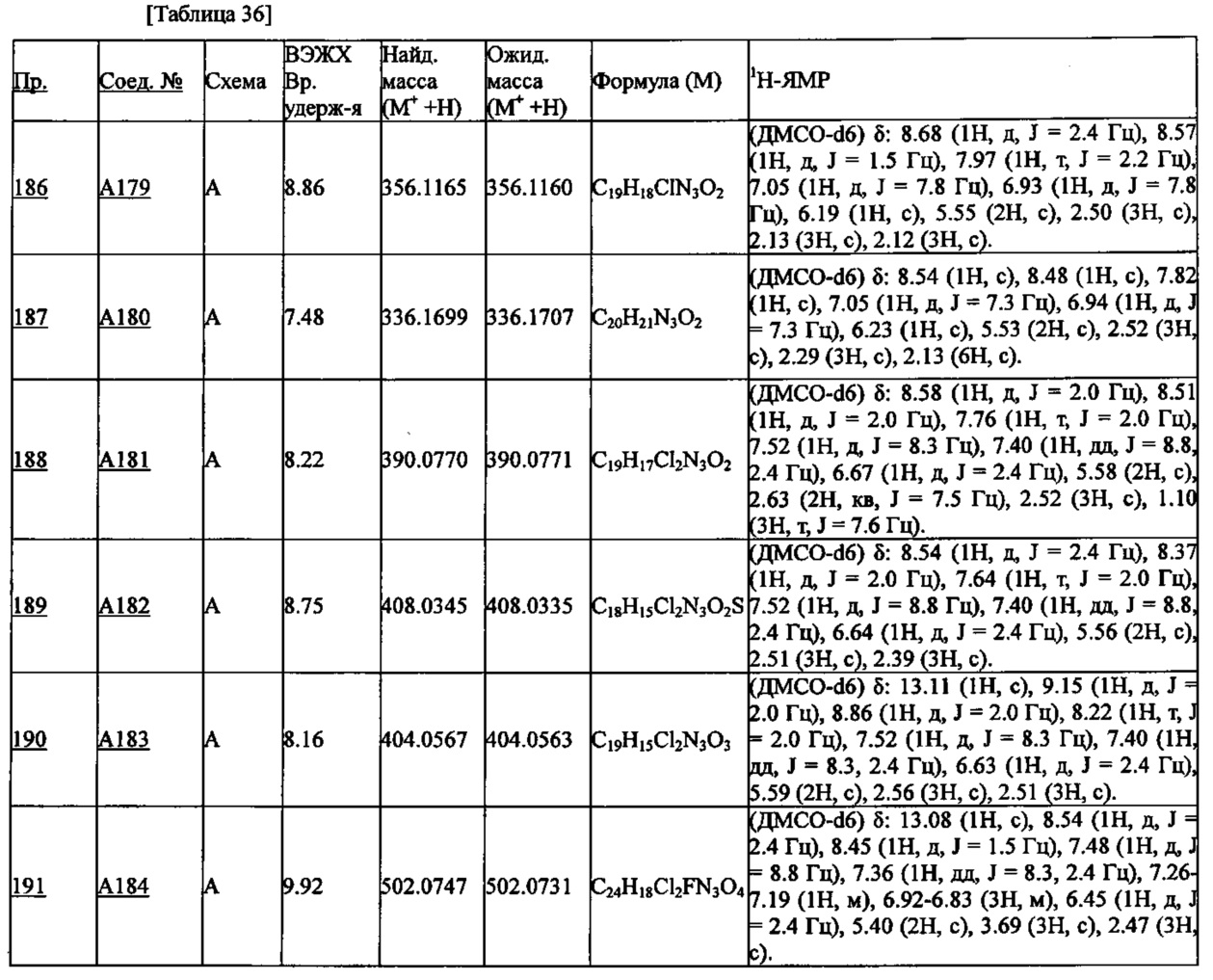
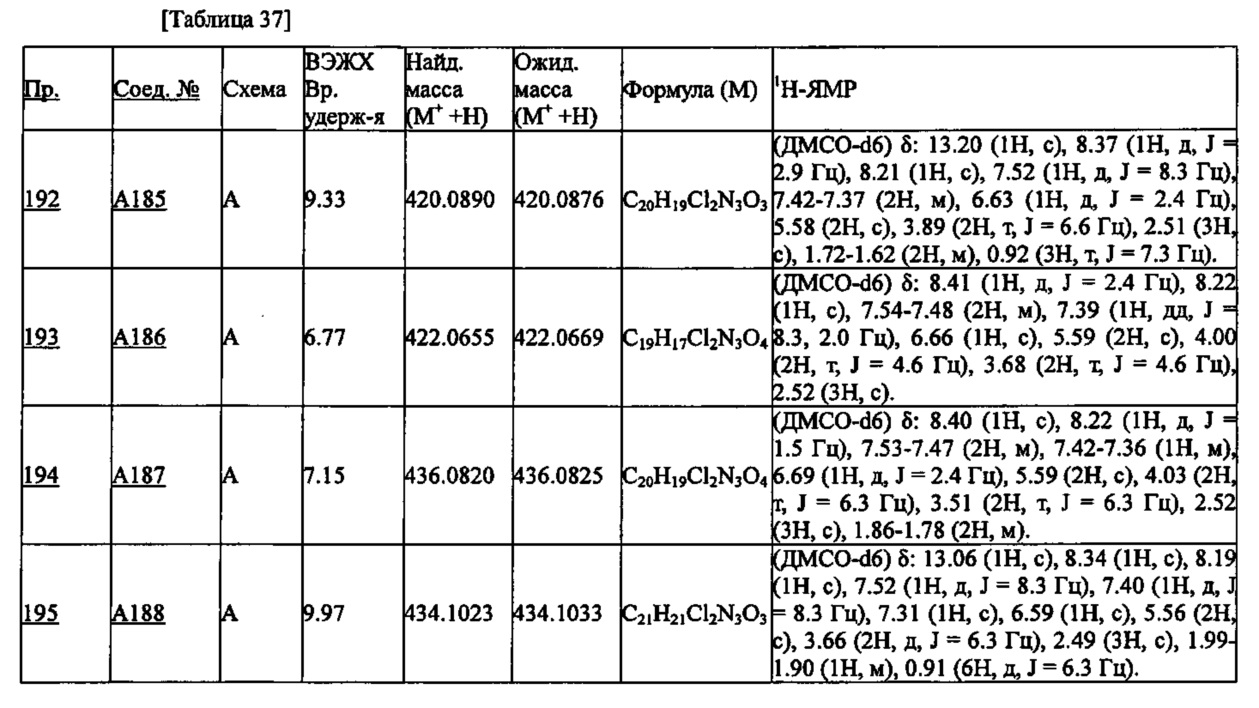


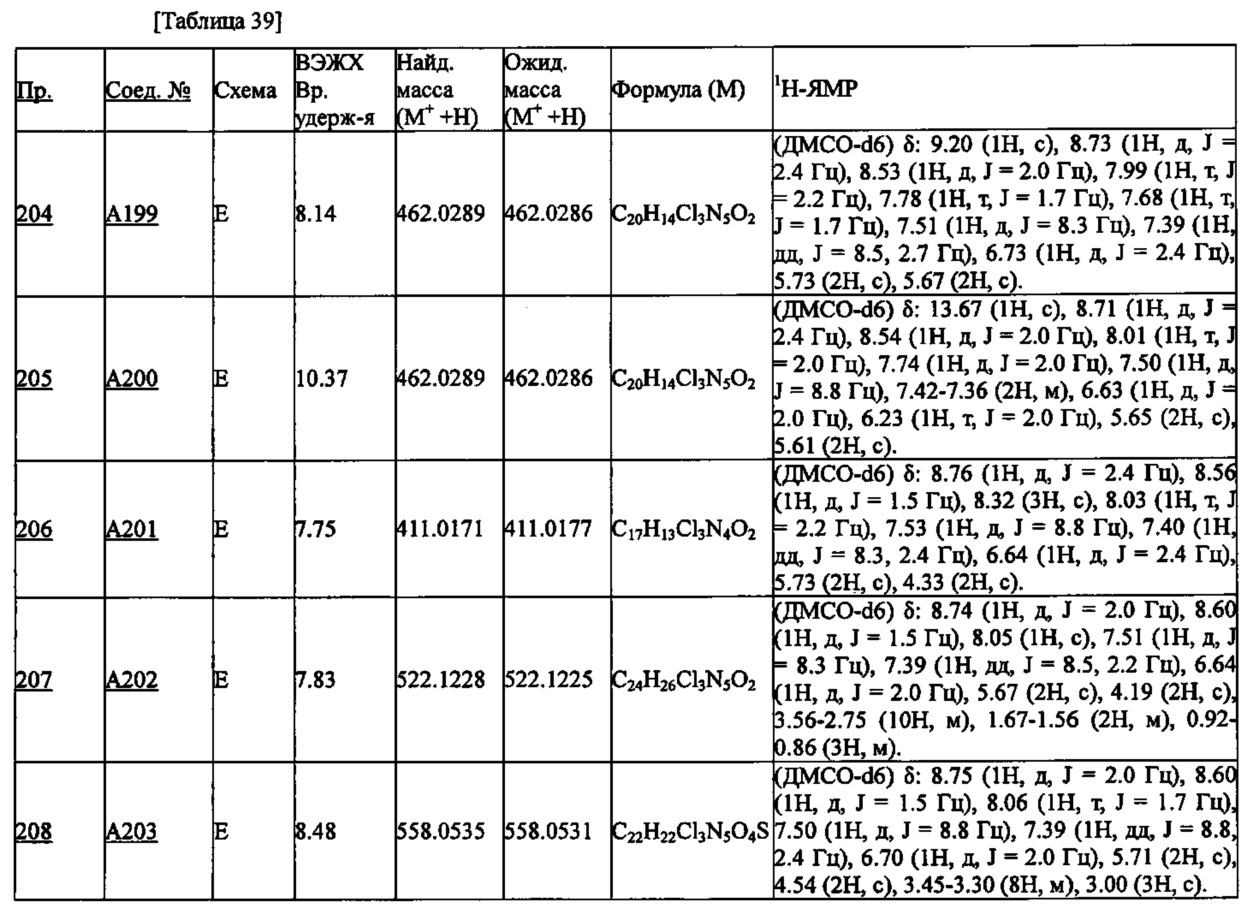
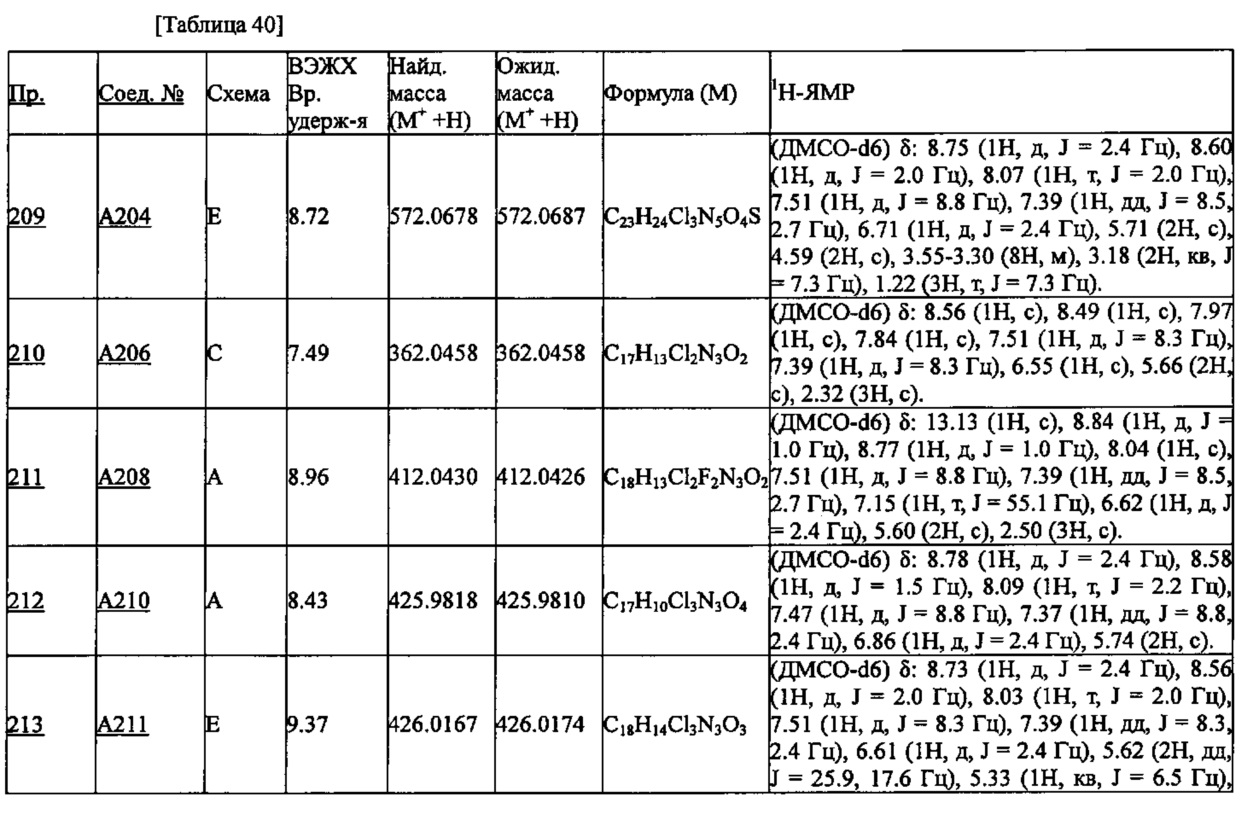
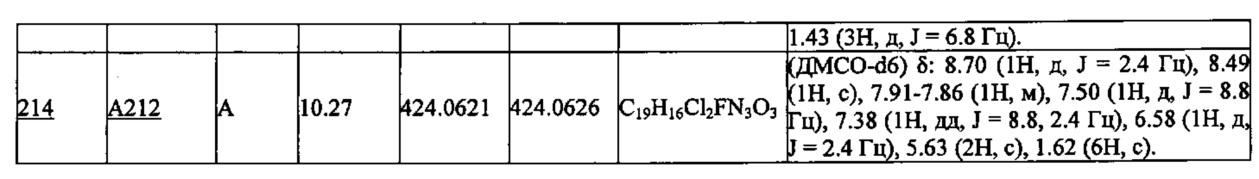


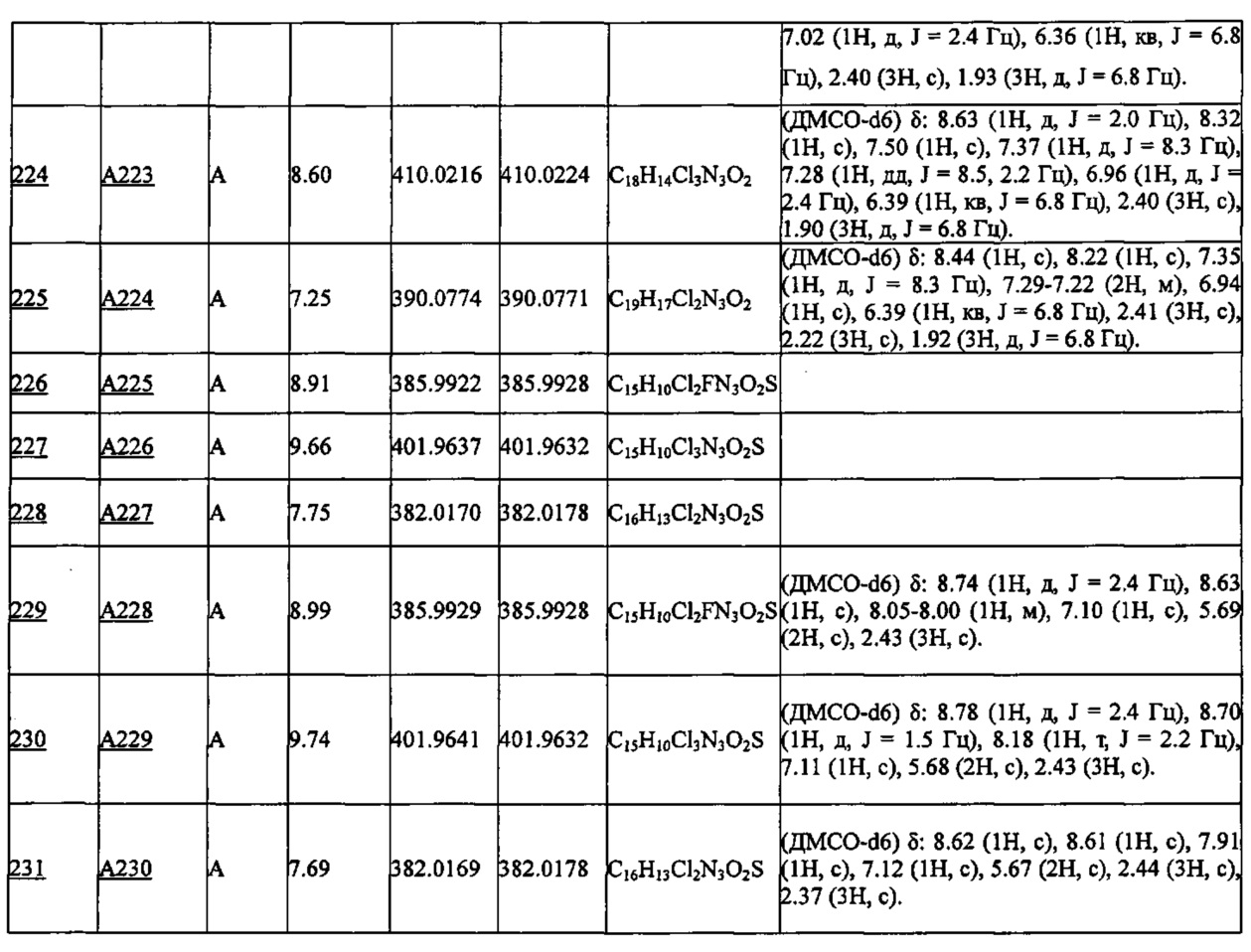

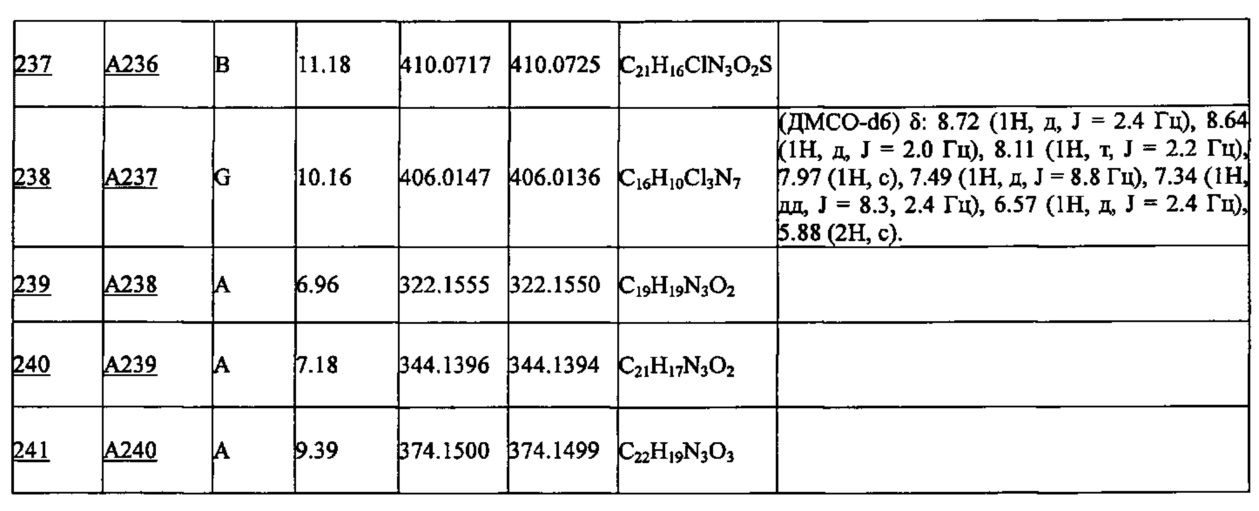


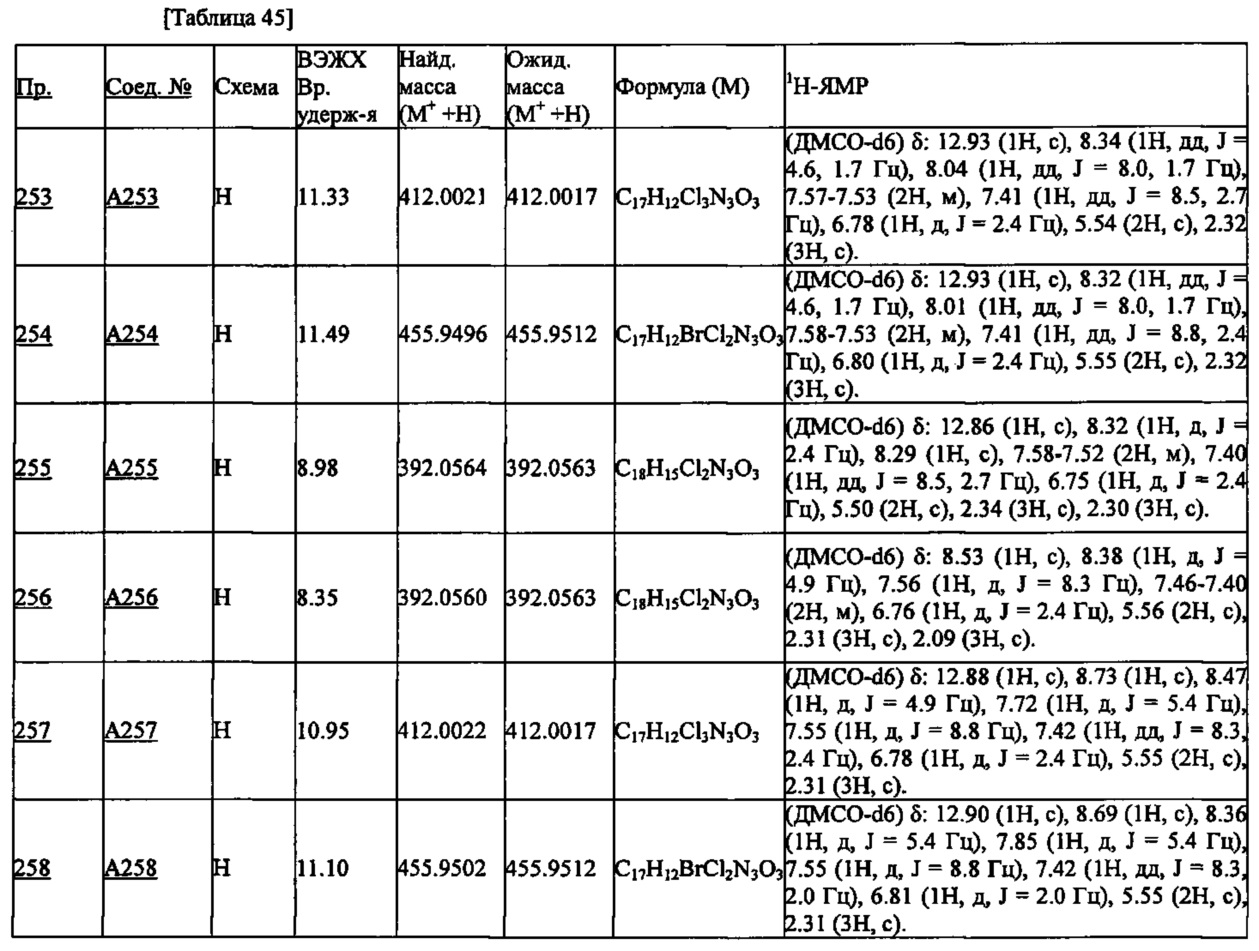


[Пример 267]
Получение 1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-пиррол-5-карбоновой кислоты (Соединение В1) (Схема I)
[Химическая формула 70]
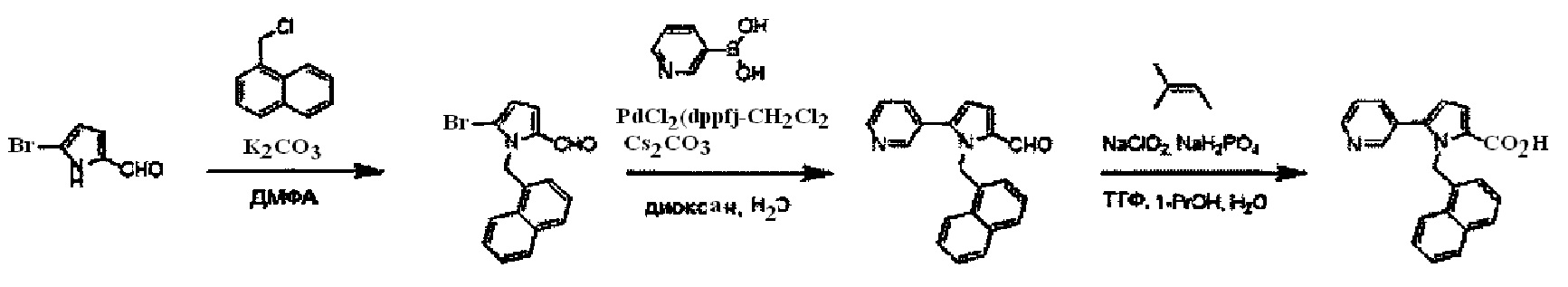
(1) 2-Бром-1Н-пиррол-5-карбальдегид (0.53 г, 3.05 ммоль), описанный в литературе (например, Canadian Journal of Chemistry, 1995, 73, 675-684), и 1-хлорметил-нафталин (0.6 мл, 4.0 ммоль) растворяли в ДМФА (5 мл), добавляли карбонат калия (0.69 г, 5 ммоль), и затем полученную смесь нагревали и перемешивали при 80°C 1 час. После охлаждения добавляли этилацетат и смесь промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии, получая 2-бром-1-(нафталин-1-илметил)-1Н-пиррол-5-карбальдегид (0.90 г):
1H-ЯMH (CDCl3) δ: 9.41 (1Н, с), 8.04 (1H, д, J=8.3 Гц), 7.89 (1Н, д, J=7.8 Гц), 7.74 (1Н, д, J=8.3 Гц), 7.63-7.59 (1Н, м), 7.57-7.52 (1Н, м), 7.29 (1Н, т, J=7.8 Гц), 7.08 (1Н, д, J=4.4 Гц), 6.50 (1Н, д, J=3.9 Гц), 6.29 (1H, д, J=7.3 Гц), 6.20 (2Н, с);
ESI-MS m/z=314 (М+ +Н).
(2) К 2-бром-1-(нафталин-1-илметил)-1Н-пиррол-5-карбальдегиду (0.98 г, 3.12 ммоль), пиридин-3-илбороновой кислоте (0.77 г, 6.24 ммоль), карбонату цезия (3.05 г, 9.36 ммоль) и PdCl2 (dppf) (346 мг, 0.47 ммоль) добавляли диоксан (24 мл) и воду (2 мл), и смесь нагревали и перемешивали при 95°C 12 часов в атмосфере азота. После охлаждения реакционную смесь упаривали при пониженном давлении. В остаток добавляли этилацетат и органический слой промывали насыщенным водным раствором хлорида натрия. После сушки над безводным сульфатом магния, органический слой упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии, получая 1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-пиррол-5-карбальдегид (0.89 г):
ESI-MS m/z=313 (М+ +Н).
(3) 1-(Нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-пиррол-5-карбальдегид (0.6 г, 1.92 ммоль) и 2-метил-2-бутен (2 мл, 6 ммоль) растворяли в смеси растворителей, состоящей из ТГФ (12 мл) и 1-пропанола (24 мл), и полученный раствор охлаждали до 0°C. Прикапывали водный раствор (12 мл) смеси хлорита натрия (0.9 г, 10 ммоль) и дигидрофосфата натрия дигидрата (1.56 г, 10 ммоль), и смесь перемешивали при комнатной температуре 17 часов. Добавляли еще хлорит натрия (0.18 г, 2 ммоль), дигидрофосфата натрия дигидрат (0.36 г, 2.3 ммоль), 2-метил-2-бутен (5 мл, 15 ммоль) и 1-пропанол (12 мл), и смесь нагревали и перемешивали при 40°C 29 часов. После охлаждения полученную смесь экстрагировали этилацетатом, и органический слой промывали насыщенным водным раствором хлорида натрия. После сушки над безводным сульфатом магния, органический слой упаривали при пониженном давлении. Полученный остаток очищали обычным способом, получая 1-(нафталин-1-илметил)-2-(пиридин-3-ил)-1Н-пиррол-5-карбоновую кислоту (0.27 г):
1Н-ЯМР (ДМСО-d6) δ: 12.30 (1Н, с), 8.52 (1Н, д, J=2.4 Гц), 8.44 (1Н, дд, J=4.9, 1.5 Гц), 8.05-7.92 (2Н, м), 7.78 (1Н, д, J=8.3 Гц), 7.71 (1Н, дт, J=7.8, 2.0 Гц), 7.58-7.53 (2Н, м), 7.37 (1H, т, J=7.6 Гц), 7.31 (1Н, дд, J=8.3, 4.9 Гц), 7.15 (1Н, д, J=3.9 Гц), 6.54 (1Н, д, J=3.9 Гц), 6.31 (1Н, д, J=7.3 Гц), 6.10 (2Н, с);
ВЭЖХ время удерживания = 8.04 мин;
Ожид. масса = 329.1285 (М+ +Н, C21H16N2O2);
Найденная масса = 329.1288 (М+ +Н).
Соединения B2-В35 синтезировали по методикам, аналогичным описанным в Примере 267.
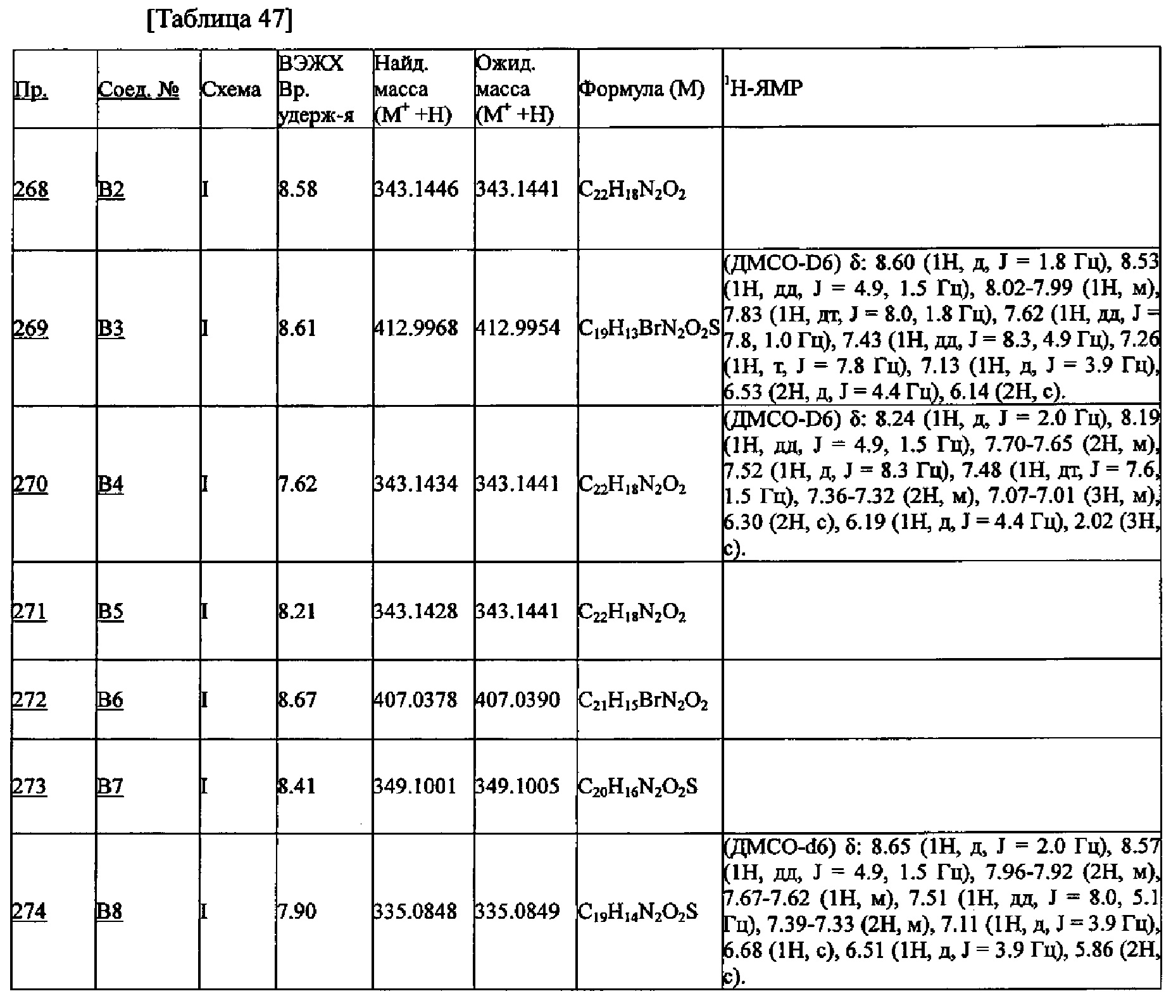

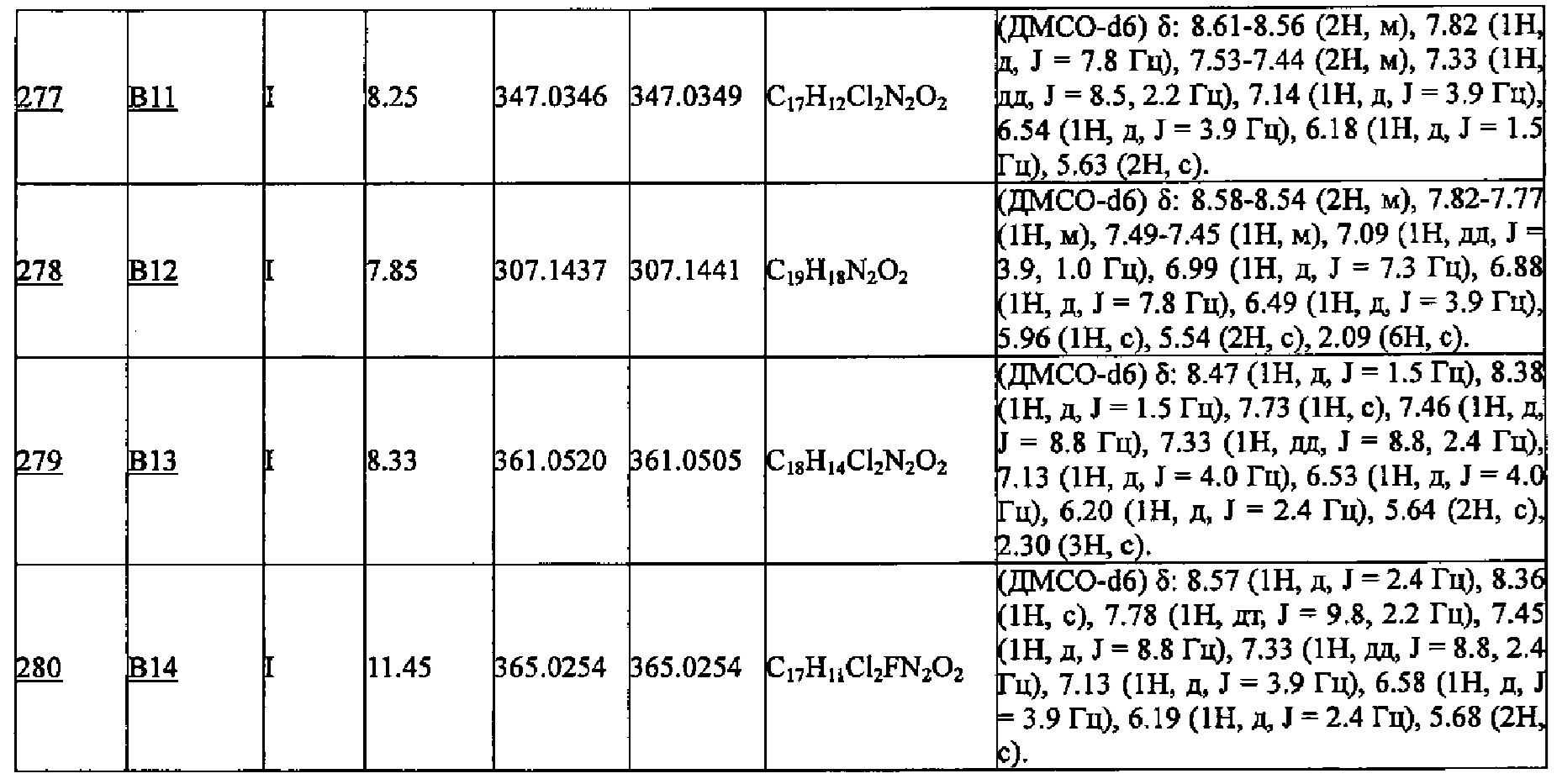



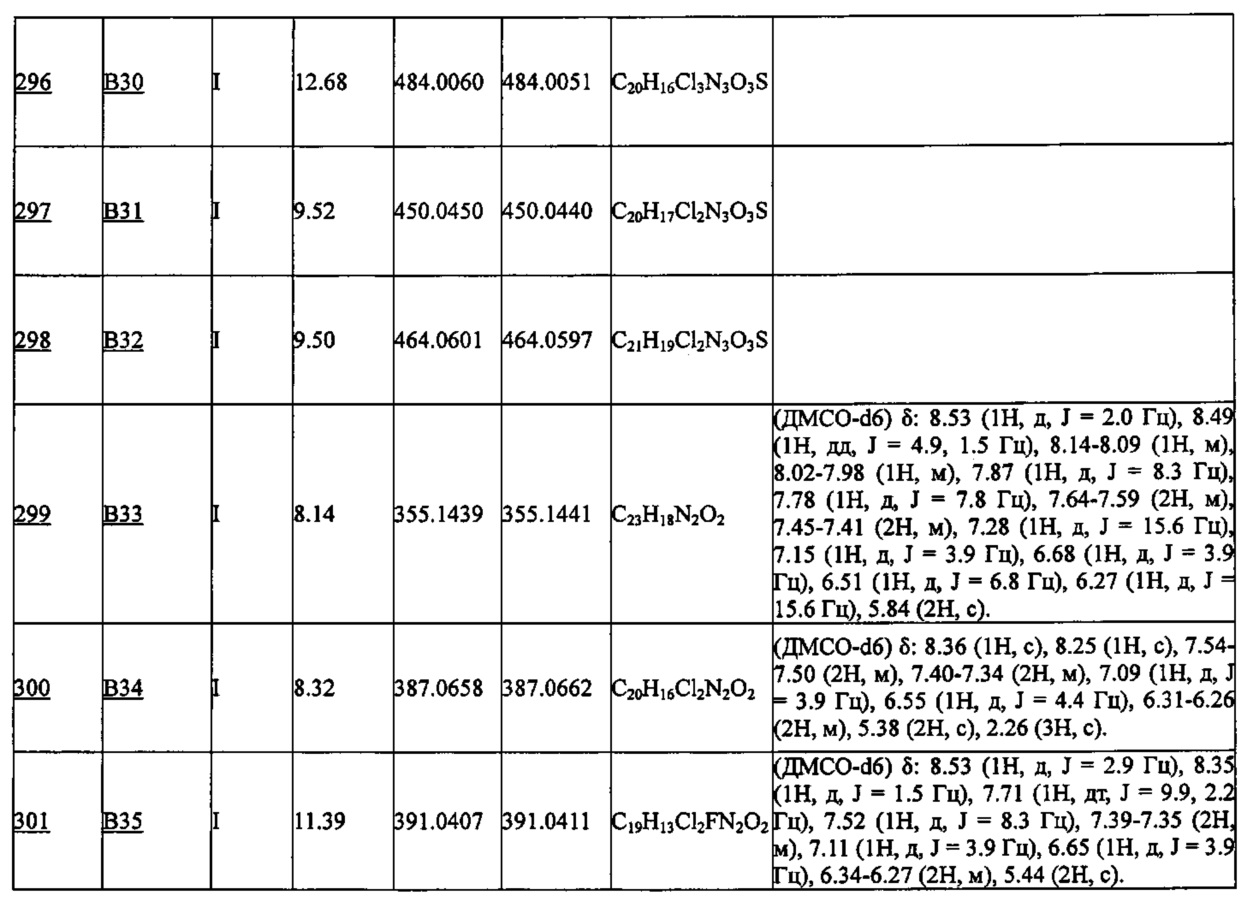
[Пример 302]
Тест на ингибирование транспорта мочевой кислоты с использованием клеток, экпрессируюпщх человеческий URAT1.
(1) Приготовление испытуемого соединения
Испытуемое соединение растворяли в ДМСО (Sigma) в концентрации 20 мМ, и затем использовали полученный раствор для разбавления до целевых концентраций.
(2) Тест на ингибирование транспорта мочевой кислоты с использованием клеток, экспрессирующих человеческий URAT1.
Полноразмерную кДНК человеческого URAT1 (hURAT1) (производство OriGene Technologies, Inc., NCBI Reference Sequence: NM 144585) субклонировали в экспрессирующий вектор pCMV6-Kan/Neo (производство OriGene Technologies, Inc.) и трансфектировали ген hURAT1 в почечные эмбриональные клетки человека (клетки НЕК 293) липосомным методом с помощью Lipofectamine 2000 (производство Invitrogen Corporation), после чего клетки НЕК 293, экспрессирующие человеческий ген URAT1, скринировали на устойчивость к генетицину. Аналогично описанному далее методу подтверждали функциональное экспрессирование человеческого гена URAT1, используя в качестве показателя перенос в клетки14С-меченой мочевой кислоты.
Клетки НЕК 293, экспрессирующие человеческий ген URAT1, высевали в 24-луночную чашку для клеточных культур в количестве 3×105 клеток/мл/лунку и выращивали в модифицированной по способу Дульбекко среде Игла (среда D-MEM), содержащей 10% фетальной бычьей сыворотки, при 37°C в течение 2 дней. После этого проводили описанный далее тест ингибирования переноса мочевой кислоты.
После удаления среды из каждой лунки путем аспирации, среду заменяли раствором, полученным путем замены NaCl в сбалансированном солевом растворе Хэнкса (HBSS) на глюконат Na (далее по тексту обозначается как HBSS/Na-глюконат), и клетки преинкубировали при 37°C около 10 минут. Удаляли HBSS/Na-глюконат аспирацией и добавляли раствор14С-мочевой кислоты, заранее нагретый до 37°C, содержащий различные концентрации испытуемого соединения, описанного в пункте (1), и радиоактивного лиганда (14С-меченая мочевая кислота; конечная концентрация 25 мкМ), и оставляли для реакции поглощения на 5 минут при 37°C. После инкубирования удаляли аспирацией раствор14С-меченой мочевой кислоты, и клетки три раза промывали ледяным HBSS. Клетки НЕК 293, экспрессирующие человеческий ген URAT1, лизировали в 0.2 моль/л водном растворе NaOH (далее по тексту именуется образцом клеток), и собирали образцы клеток. Образец клеток и сцинтиляционную жидкость ULTIMA GOLD (производство PerkinElmer, Inc.) смешивали, и замеряли радиоактивность на жидкостном сцинтилляционном счетчике (Beckman Coulter, Inc.).
Скорость транспорта мочевой кислоты для испытуемого соединения в каждой концентрации (% от значения для контрольного образца) вычисляли по радиоактивности (радиоактивность человеческих URAT1 - экспрессирующих клеток НЕК 293 без добавления испытуемого соединения (добавление ДМСО)), принимая URAT1-специфический транспорт мочевой кислоты за 100%, и определяли концентрацию испытуемого соединения (IC50), при которой скорость транспорта мочевой кислоты снижалась на 50%. Полученные результаты приведены ниже в таблице. Кроме того, символы (*, ** и ***) в таблице означают следующие значения ингибирующей активности:
IC50≤0.2 мкМ: ***
0.2 мкМ
2 мкМ
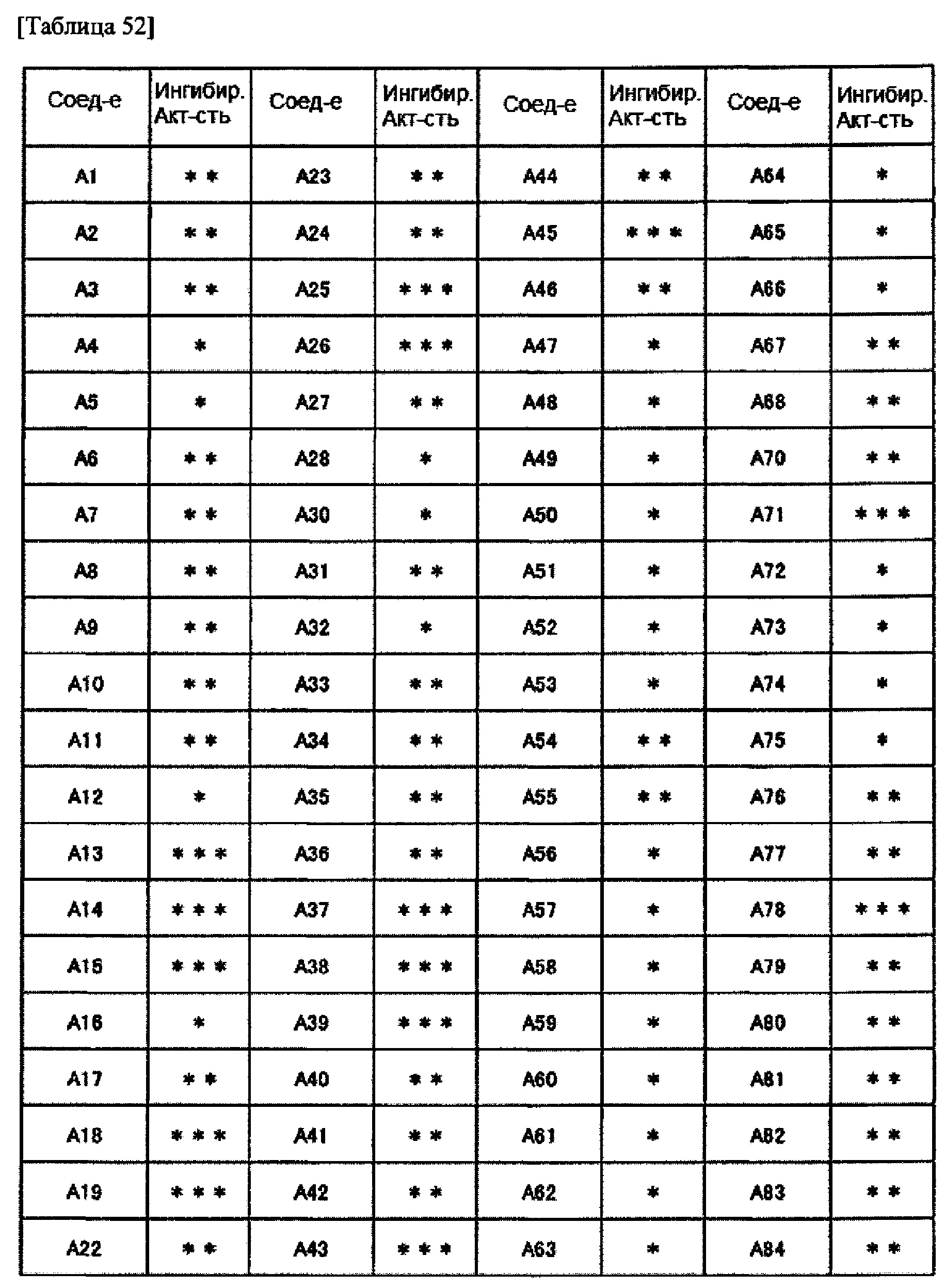

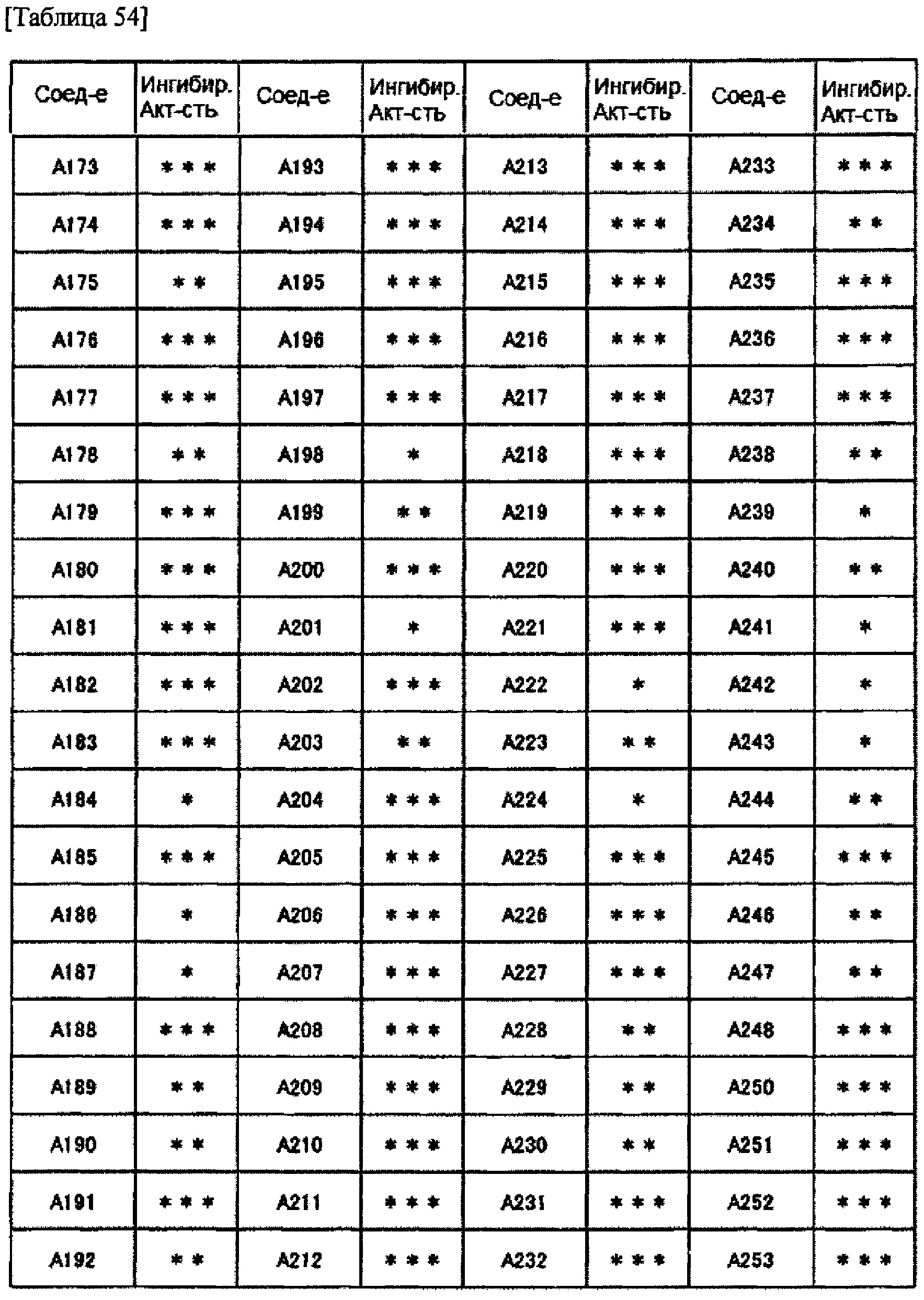

Тестирование эффективности лекарственного средства на капуцинах-фавнах (Cebus apella)
[Пример 303]
Тестируемое соединение (от 3 мг/кг до 30 мг/кг), приготовленное суспендированием в 0.5%-ном растворе метилцеллюлозы, вводили обезьянам Cebus apella в желудок через полость носа с помощью одноразового катетера и шприца. Образцы крови брали перед введением и через 30 минут, 1 час, 2 часа, 4 часа, 8 часов, 12 часов и 24 часа после введения, а образцы мочи брали в моменты времени от 0 до 4 часов после введения, от 4 до 8 часов после введения, от 8 до 16 часов после введения и от 16 до 24 часов после введения. Концентрации мочевой кислоты и креатинина во взятых образцах крови и мочи измеряли на аналитическом анализаторе (JEOL Ltd.). Содержание мочевой кислоты и креатинина определяли с помощью L-type Wako UA⋅F (Wako Pure Chemicals Industries, Ltd.) и L-type Creatine F (Wako Pure Chemicals Industries, Ltd.), соответственно. Выведение мочевой кислоты вычисляли по концентрациям мочевой кислоты в крови и моче, и аналогично - выведение креатинина вычисляли по концентрациям креатинина. Основываясь на полученных данных, скорость выведения мочевой кислоты определяли по следующему уравнению:
Скорость выведения мочевой кислоты (%) = (выведение мочевой кислоты/выведение креатинина)×100
В данном тесте прекрасное урикозурическое действие было подтверждено для соединений А1, А2, А7, А13, А14, А15, А19, А26, А81, А119, А121, А134, А135, А137, А139, А147, А156, А169, А233, В1 и В11.
Описанные выше результаты показывают, что производное пиридина по настоящему изобретению обладает сильным урикозурическим действием.
Промышленная применимость
Производное пиридина по настоящему изобретению или его пролекарство, или его фармацевтически приемлемая соль, или его сольват могут применяться в качестве фармацевтического средства.
Реферат
Изобретение относится к производному пиридина формулы (I), его пролекарству,где А представляет собой простую связь или атом кислорода; Rпредставляет собой атом азота или CH; один из X-Хпредставляет собой атом азота, и остальные четыре представляют собой CR; Rкаждый независимо представляют собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода, алкенильную группу, содержащую 2-6 атомов углерода, алкинильную группу, содержащую 2-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, алкилкарбонильную группу, содержащую 2-7 атомов углерода, алкилсульфонильную группу, содержащую 1-6 атомов углерода, нитро-группу, амино-группу, диалкиламино-группу, содержащую 1-6 атомов углерода, которые опционально могут формировать цикл, формильную группу, гидроксильную группу, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, фенильной группы, циклогексильной группы и атома галогена), алкилтио-группу, содержащую 1-6 атомов углерода, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), или фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), при условии, что когда два CRрасположены рядом, два заместителя Rопционально могут объединяться с образованием цикла; Rпредставляет собой атом водорода, алкильную группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы, амино-группы, диалкиламино-группы, содержащей 1-6 атомов углерода, которые опционально могут формировать цикл, имидазольный цикл, пиразольный цикл, пирролидиновый цикл, пиперидиновый цикл, морфолиновый цикл и пиперазиновый цикл (который опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, и алкилсульфонильной группы, содержащей 1-6 атомов углерода), алкенильную группу, содержащую 2-6 атомов углерода, алкинильную группу, содержащую 2-6 атомов углерода, алкокси-группу, содержащую 1-6 атомов углерода (которая опционально может иметь один или больше заместителей, выбранных из гидроксильной группы и атома галогена), алкилкарбонильную группу, содержащую 2-7 атомов углерода, алкилтио-группу, содержащую 1-6 атомов углерода, алкилсульфинильную группу, содержащую 1-6 атомов углерода, атом галогена, трифторметильную группу, дифторметильную группу, циано-группу, фенильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), пиридильную группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), фенокси-группу (которая опционально может иметь один или больше заместителей, выбранных из алкильной группы, содержащей 1-6 атомов углерода, алкокси-группы, содержащей 1-6 атомов углерода, и атома галогена), карбоксильную группу, или -COR; Rпредставляет собой карбоксильную группу, тетразолильную группу, -CONHSOR, -CORили любой из представленных далее заместителей:при условии, что когда Rпредставляет собой алкильную группу, содержащую 1-6 атомов углерода, замещенную гидроксильной группой, и когда Rпредставляет собой карбоксильную группу, то Rи Rопционально могут быть соединены с образованием лактонового цикла; Rв Rи Rкаждый независимо представляют собой алкильную группу, содержащую 1-6 атомов углерода; Z представляет собой любой из следующих заместителей, обозначенных Z1-Z7 (их значения представлены в п.1 формулы), которые могут применяться для лечения или профилактики заболеваний, связанных с URAT1, таких как подагра, гиперурикемия, гипертензия, заболевания почек, такие как интерстициальный нефрит, диабет, артериосклероз и синдром Леша-Найхана. 9 н. и 14 з.п. ф-лы,55 табл., 303 пр.
Формула
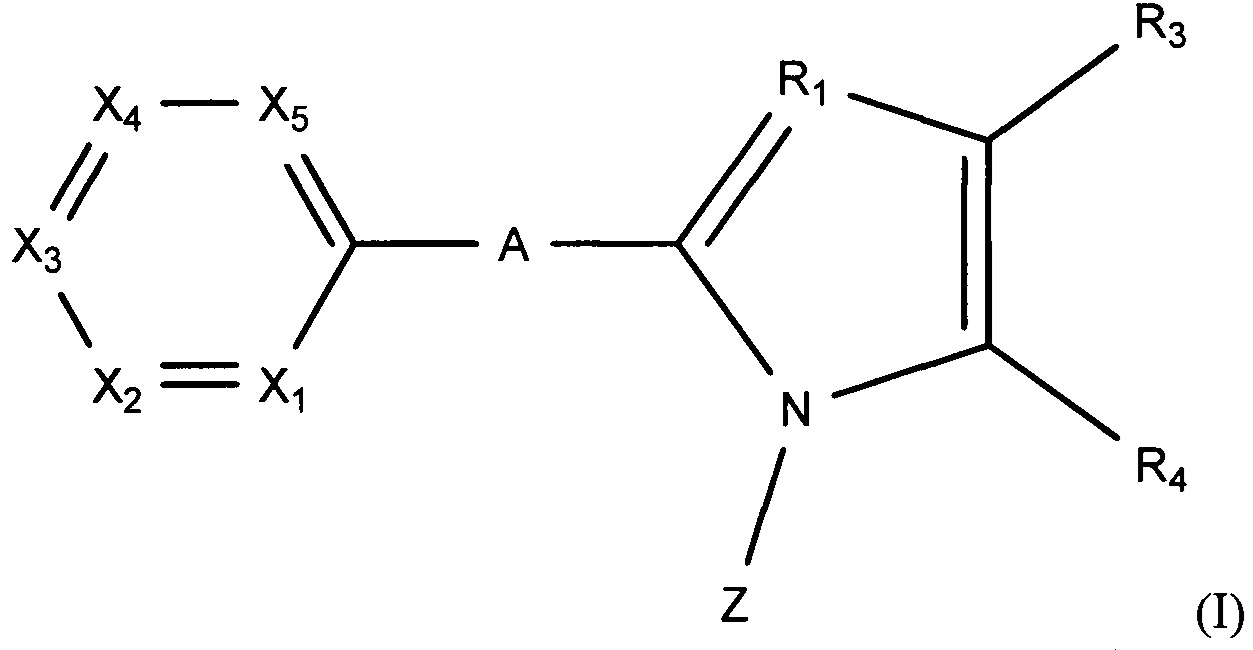


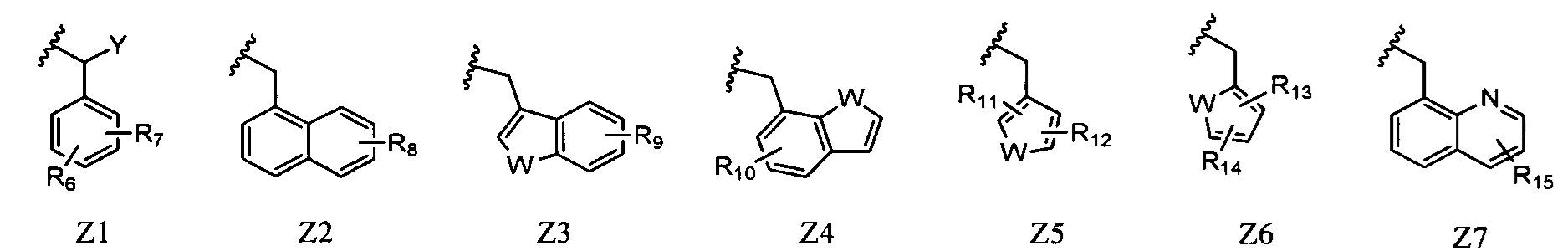


Комментарии