Ингибиторы трансглутаминазы 2 (tg2) - RU2781370C2
Код документа: RU2781370C2
Описание
УРОВЕНЬ ТЕХНИКИ
Трансглутаминаза 2 (TG2) является членом семейства ферментов трансглутаминазы человека, которая в большом количестве экспрессируется в различных тканях и обнаруживается как внутри, так и вне клетки. Она обладает каталитической активностью поперечного сшивания глутаминовых боковых цепей на субстратных пептидах или белках с биогенными малыми молекулами или аминах, связанных белками, что является предметом сложной посттрансляционной регуляции. TG2 участвует в патогенезе широкого спектра заболеваний человека, особенно воспалительных заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе описаны ингибиторы трансглутаминазы 2 (TG2). Здесь также раскрыты способы синтеза таких ингибиторов TG2 и способы использования таких ингибиторов TG2 при лечении заболеваний, при которых ингибирование TG2 обеспечивает терапевтический эффект для пациента, страдающего этим заболеванием. Далее описаны фармацевтические составы, которые включают ингибитор TG2.
В другом аспекте представлено соединение, имеющее структуру формулы (Q):

где:

X, Y и Z выбирают из =C(R11)- и =N-, где, по меньшей мере, два из X, Y и Z являются =C(R11)-;
W является -C(O)NR1R2 или -S(O)2R12;
R1 и R2 независимо выбирают из H, C1-6алкила и -C1-6алкил-OH; или R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R3 выбирают из -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 и -N(H)C(O)R8;
каждый R4 независимо выбирают из галоген, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10алкил-OR9, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, -C2-6алкенил-C3-12циклоалкила, фенила, -C1-6алкил-фенила, -C2-6алкенил-фенила, C2-9гетероциклоалкил и C2-9гетероарила, где фенил, -C1-6алкил-фенил, -C2-6алкенил-фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила;
R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где C2-9гетероциклоалкил, -C1-6алкил-C2-9гетероциклоалкил, фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2; или R6 и R7, вместе с атомом азота, к которому они присоединены образуют 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R8 выбирают из C1-6алкила, C1-6галоалкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, C3-6циклоалкила, фенила, C2-9гетероциклоалкила и C2-9гетероарила, где C3-6циклоалкил, фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R10 независимо выбирают из H, C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R11 независимо выбирают из H, галогена, C1-6алкила и C1-6галоалкила;
R12является C1-6алкилом;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В одном аспекте представлено соединение, имеющее формулу (I):

где:

X, Y и Z выбирают из =C(R11)- и =N-, где, по меньшей мере, два из X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и необязательно замещенного алкила; или R1 и R2, вместе с атомом азота, к которому они присоединены образуют необязательно замещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо;
R3 является -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 или -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, необязательно замещенного алкила, необязательно замещенного алкенила, необязательно замещенного алкинила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
R5 выбирают из необязательно замещенного алкила, необязательно замещенного гетероциклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
R6 и R7 независимо выбирают из H и необязательно замещенного алкила; или R6 и R7, вместе с атомом азота, к которому они присоединены образуют необязательно замещенное 5- или 6-членное гетероциклоалкильное кольцо;
R8 выбирают из необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила, необязательно замещенного гетероциклоалкила и необязательно замещенного гетероарила;
каждый R9 независимо выбирают из необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
каждый R10 независимо выбирают из H, необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
каждый R11 независимо выбирают из H, галогена и необязательно замещенного алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В другом аспекте представлено соединение, имеющее структурную формулу (II):
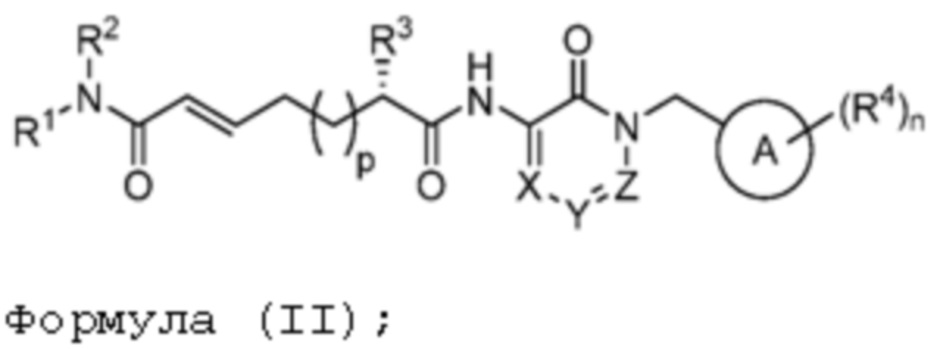
где:

X, Y и Z выбирают из =C(R11)- и =N-, где, по меньшей мере, два из X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H, C1-6алкила и -C1-6алкил-OH; или R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R3 выбирают из -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 и -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10алкил-OR9, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, -C2-6алкенил-C3-12циклоалкила, фенила, -C1-6алкил-фенила, -C2-6алкенил-фенила, C2-9гетероциклоалкила и C2-9гетероарила, где фенил, -C1-6алкил-фенил, -C2-6алкенил-фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила;
R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где C2-9гетероциклоалкил, -C1-6алкил-C2-9гетероциклоалкил, фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2; или R6 и R7, вместе с атомом азота, к которому они присоединены образует 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R8 выбирают из C1-6алкила, C1-6галоалкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, C3-6циклоалкила, фенила, C2-9гетероциклоалкила и C2-9гетероарила, где C3-6циклоалкил, фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R10 независимо выбирают из H, C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R11 независимо выбирают из H, галогена, C1-6алкила и C1-6галоалкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является H. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является C1-6алкилом. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует незамещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 выбирают из C1-6алкила, -C1-6алкил-OH, C1-6алкил-O-C1-6алкила, C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, -C1-6алкил-фенила и C2-9гетероарила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-C2-9гетероциклоалкила и -C1-6алкил-фенила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 является C1-6алкилом. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 является -CH3. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 является -C1-6алкил-C2-9гетероциклоалкилом. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 является -C1-6алкил-фенилом. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R5 является -CH2-фенилом. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)NR6R7. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R6 и R7 независимо выбирают из C1-6алкила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R6 и R7 каждый является -CH3. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R8 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R8 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R8 является фенилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где R8 является C2-9гетероарилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, -C(O)-C1-10алкила, C1-10алкила, C1-10алкил-OH, C2-10алкенила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где




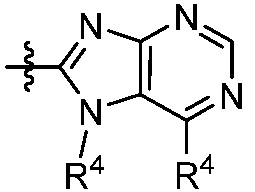






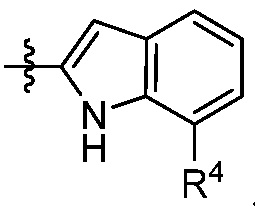


















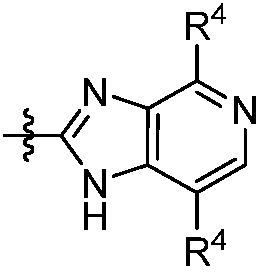








В другом аспекте, описанным в настоящем документе, представлена фармацевтическая композиция, содержащая соединение формулы (Q), (I) или (II) или его фармацевтически приемлемую соль или сольват и, по меньшей мере, один фармацевтически приемлемый эксципиент.
В другом аспекте представлен способ лечения заболевания или расстройства, опосредованного трансглутаминазой 2, у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата, и фармацевтически приемлемого эксципиента.
Другой аспект настоящего изобретения относится к способу лечения заболевания или расстройства, опосредованного трансглутаминазой 2, у пациента, нуждающегося в этом, где заболеванием или расстройством является целиакия, нейродегенеративное заболевание, заболевание глаз, рак или фиброз.
В другом аспекте представлен способ лечения рака у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции, содержащей соединение формулы (Q), (I) или (II) или его фармацевтически приемлемую соль или сольват.
Также в настоящем документе описан способ лечения целиакии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления, представлен способ лечения фиброза почек у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата.
Также в настоящем документе описан способ лечения нейродегенеративного заболевания у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват. В некоторых вариантах осуществления представлен способ лечения нейродегенеративного заболевания у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где нейродегенеративное заболевание выбирают из болезни Паркинсона, болезни Хантингтона и болезни Альцгеймера.
В некоторых вариантах осуществления, представлен способ лечения заболевания глаз у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват. В некоторых вариантах осуществления, представлен способ лечения заболевания глаз у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, где заболевание глаз выбирают из дегенерации желтого пятна, глаукомы, катаракты и увеита.
В некоторых вариантах осуществления, представлен способ лечения рака у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения рака у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата, где рак выбирают из меланомы, глиобластомы, менингиомы, рака поджелудочной железы, почечно-клеточной карциномы и рака груди.
В некоторых вариантах осуществления, представлен способ лечения фиброза у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления, представлен способ лечения фиброза почек у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления, представлен способ лечения идиопатического легочного фиброза у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления, представлен способ лечения фиброза печени у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата.
Также в настоящем документе описан способ снижения активации трансглутаминазы 2 (TG2) у индивидуума, включающий введение индивидууму соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата, в дозе, эффективной для снижения активности TG2.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль для применения в терапии.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении целиакии, нейродегенеративного заболевания, заболевания глаз, рака или фиброза.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении целиакии.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении нейродегенеративного заболевания.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении нейродегенеративного заболевания, где нейродегенеративное заболевание выбирают из болезни Паркинсона, болезни Хантингтона и болезни Альцгеймера.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении заболевания глаз.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении заболевания глаз, где заболевание глаз выбирают из дегенерации желтого пятна, глаукомы, катаракты и увеита.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении рака.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении рак, где рак выбирают из меланомы, глиобластомы, менингиомы, рака поджелудочной железы, почечно-клеточной карциномы и рака груди.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении фиброза.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении фиброза почек.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении идиопатического легочного фиброза.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения в лечении фиброза печени.
В другом аспекте представлено соединение формулы (Q), (I) или (II) или его фармацевтически приемлемая соль или сольват, для применения для снижения активации трансглутаминазы 2 (TG2).
В другом аспекте, представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении заболевания или расстройства, опосредованного трансглутаминазой 2 (TG2).
В некоторых вариантах осуществления, представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении заболевания или расстройства, опосредованного трансглутаминазой 2, где заболеванием или расстройством является целиакия, нейродегенеративное заболевание, заболевание глаз, рак или фиброз.
В некоторых вариантах осуществления представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата, в производстве лекарственного средства для применения в лечении целиакии. В некоторых вариантах осуществления, представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении нейродегенеративного заболевания. В некоторых вариантах осуществления, представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении заболевания глаз. В некоторых вариантах осуществления представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении рака. В некоторых вариантах осуществления, представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении фиброза. В некоторых вариантах осуществления представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении фиброза почек. В некоторых вариантах осуществления представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении идиопатического легочного фиброза. В некоторых вариантах осуществления, представлено применение соединения формулы (Q), (I) или (II) или его фармацевтически приемлемой соли или сольвата в производстве лекарственного средства для применения в лечении фиброза печени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Используемые здесь и в прилагаемой формуле изобретения формы единственного числа включают ссылки во множественном числе, если контекст явно не диктует иное. Таким образом, например, ссылка на «агент» включает множество таких агентов, а ссылка на «клетку» включает в себя ссылку на одну или несколько клеток (или на множество клеток) и их эквиваленты. Когда здесь используются диапазоны физических свойств, таких как молекулярная масса, или химических свойств, таких как химические формулы, предполагается, что все комбинации и субкомбинации диапазонов и конкретные варианты осуществления в них включены. Термин «примерно» при обращении к числу или числовому диапазону означает, что указанное число или числовой диапазон является приблизительным в пределах колебания показаний от эксперимента к эксперименту (или в пределах статистической экспериментальной ошибки) и, таким образом, число или числовой диапазон варьируется от 1% до 15% от указанного числа или числового диапазона. Термин «содержащий» (и родственные термины, такие как «содержит» или «содержит» или «имеющий» или «включающий») не предназначен для исключения того, что в других определенных вариантах осуществления, например, варианте осуществления любой композиции вещества, композиции, способа или процесса или тому подобного, описанных здесь, может «состоять из» или «состоять по существу из» описанных признаков.
Используемые в описании и прилагаемой формуле изобретения, если не указано иное, следующие термины имеют значение, указанное ниже.
В настоящем документе, C1-Cx включает C1-C2,C1-C3 . . . C1-Cx. C1-Cx относится к числу атомов углерода, которые составляют группу, которую оно обозначает (исключая необязательные заместители)
«Амино» относится к -NH2 радикалу.
«Циано» относится к -CN радикалу.
«Нитро» относится к -NO2 радикалу.
«Окса» относится к -O- радикалу.
«Оксо» относится к =O радикалу.
«Тиоксо» относится к =S радикалу.
«Имино» относится к =N-H радикалу.
«Оксимо» относится к =N-OH радикалу.
«Алкил» или «алкилен» относится к радикалу с прямой или разветвленной углеводородной цепью, состоящему только из атомов углерода и водорода, не содержащему ненасыщенности, имеющему от одного до пятнадцати атомов углерода (например, C1-C15 алкилу). В определенных вариантах осуществления, алкил содержит от одного до тринадцати атомов (например, C1-C13 алкил). В определенных вариантах осуществления, алкил содержит от одного до десяти атомов углеводорода (например, C1-C10 алкил). В определенных вариантах осуществления, алкил содержит от одного до восьми атомов углерода (например, C1-C8 алкил). В других вариантах осуществления, алкил содержит от одного до шести атомов углерода (например, C1-C6 алкил). В других вариантах осуществления, алкил содержит от одного до пяти атомов углерода (например, C1-C5 алкил). В других вариантах осуществления, алкил содержит от одного до четырех атомов углерода (например, C1-C4 алкил). В других вариантах осуществления, алкил содержит от одного до трех атомов углерода (например, C1-C3 алкил). В других вариантах осуществления, алкил содержит от одного до двух атомов углерода (например, C1-C2 алкил). В других вариантах осуществления, алкил содержит один атом углерода (например, C1 алкил). В других вариантах осуществления, алкил содержит от пяти до пятнадцати атомов углерода (например, C5-C15 алкил). В других вариантах осуществления, алкил содержит от пяти до восьми атомов углерода (например, C5-C8 алкил). В других вариантах осуществления, алкил содержит от двух до пяти атомов углерода (например, C2-C5 алкил). В других вариантах осуществления, алкил содержит от трех до пяти атомов углерода (например, C3-C5 алкил). В других вариантах осуществления, алкильную группу выбирают из метила, этила, 1-пропила (н-пропила), 1-метилэтила (изопропила), 1-бутила (н-бутила), 1-метилпропила (втор-бутила), 2-метилпропила (изобутила), 1,1-диметилэтила (трет-бутила) и 1-пентила (н-пентила). Алкил присоединен к остальной части молекулы одинарной связью. Если не указано иное специально в описании, алкильная группа необязательно замещена одним или несколькими из следующих заместителей: галоген, циано, нитро, оксо, тиоксо, имино, оксимо, триметилсиланил, ORa, -SRa, -OC(O)Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORf, -OC(O)-NRaRf, -N(Ra)C(O)Rf, -N(Ra)S(O)tRf (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tRf (где t равно 1 или 2) и -S(O)tN(Ra)2 (где t равно 1 или 2), где каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, арилом, аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом, и каждый Rf независимо является алкилом, фторалкилом, циклоалкилом, арилом, аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом.
«Алкокси» относится к радикалу, связанному через атом кислорода формулы -O-алкил, где алкилом является алкильная цепь, как определено выше.
«Алкенил» относится к радикальной группе с прямой или разветвленной углеводородной цепью, состоящей исключительно из атомов углерода и водорода, содержащей, по меньшей мере, одну двойную связь углерод-углерод и имеющей от двух до двенадцати атомов углерода. В других вариантах осуществления, алкенил содержит от двух до десяти атомов углерода. В определенных вариантах осуществления, алкенил содержит от двух до восьми атомов углерода. В других вариантах осуществления, алкенил содержит от двух до шести атомов углерода. В других вариантах осуществления, алкенил содержит от двух до четырех атомов углерода. Алкенил присоединен к остальной части молекулы одинарной связью, например, этенил (т.е. винил), проп-1-енил (т.е. аллил), бут-1-енил, пент-1-енил, пента-1,4-диенил и подобные. Если в описании специально не указано иное, алкенильная группа необязательно замещена одним или несколькими из следующих заместителей: галоген, циано, нитро, оксо, тиоксо, имино, оксимо, триметилсиланил, -ORa, -SRa, -OC(O)-Rf, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORf, -OC(O)-nRaRf, -N(Ra)C(O)Rf, -N(Ra)S(O)tRf (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tRf (где t равно 1 или 2) и -S(O)tN(Ra)2 (где t равно 1 или 2), где каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, арилом, аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом, и каждый Rf независимо является алкилом, фторалкилом, циклоалкилом, арилом, аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом.
«Алкинил» относится к радикальной группе с прямой или разветвленной углеводородной цепью, состоящей исключительно из атомов углерода и водорода, содержащей, по меньшей мере, одну тройную связь углерод-углерод, имеющую от двух до двенадцати атомов углерода. В определенных вариантах осуществления, алкинил содержит от двух до десяти атомов углерода. В определенных вариантах осуществления, алкинил содержит от двух до восьми атомов углерода. В других вариантах осуществления алкинил имеет от двух до четырех атомов углерода. Алкинил присоединен к остальной части молекулы одинарной связью, например, этинил, пропинил, бутинил, пентинил, гексинил и подобные. Если в описании специально не указано иное, алкинильная группа необязательно замещена одним или несколькими следующими заместителями: галоген, циано, нитро, оксо, тиоксо, имино, оксимо, триметилсиланил, -ORa, -SRa, -OC(O)Ra, -N(Ra)2, -C(O)Ra, -C(O)ORa, -C(O)N(Ra)2, -N(Ra)C(O)ORf, -OC(O)-NRaRf, -N(Ra)C(O)Rf, -N(Ra)S(O)tRf (где t равно 1 или 2), -S(O)tORa (где t равно 1 или 2), -S(O)tRf (где t равно 1 или 2) и -S(O)tN(Ra)2 (где t равно 1 или 2), где каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, арилом, аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом, и каждый Rf независимо является алкилом, фторалкилом, циклоалкилом, арилом, аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом.
«Арил» относится к радикалу, полученному из ароматической моноциклической или полициклической углеводородной кольцевой системы путем удаления атома водорода от атома углерода кольца. Ароматическая моноциклическая или полициклическая углеводородная кольцевая система содержит только водород и углерод, от шести до восемнадцати атомов углерода, где, по меньшей мере, одно из колец в кольцевой системе полностью ненасыщено, т. е. оно содержит циклическую, делокализованную (4n+2) π-электронную систему в соответствии с теорией Хюккеля. Кольцевая система, из которой происходят арильные группы, включает, но не ограничивается ими, такие группы, как бензол, флуорен, индан, инден, тетралин и нафталин. Если в описании специально не указано иное, термин «арил» или префикс «ар-» (например, в «аралкиле») предназначен для включения арильных радикалов, необязательно замещенных одним или несколькими заместителями, независимо выбранными из алкила, алкенила, алкинила, галогена, фторалкила, циано, нитро, арила, аралкила, аралкенила, аралкинила, циклоалкила, гетероциклоалкила, гетероарила, гетероарилалкила, -Rb-ORa, -Rb-OC(O)-Ra, -Rb-OC(O)-ORa, -Rb-OC(O)-N(Ra)2, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-C(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N(Ra)S(O)tRa (где t равно 1 или 2), -Rb-S(O)tORa (где t равно 1 или 2), -Rb-S(O)tRa (где t равно 1 или 2) и -Rb-S(O)tN(Ra)2 (где t равно 1 или 2), где каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, циклоалкилалкилом, арилом (необязательно замещенным одной или несколькими галогеновыми группами), аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом, каждый Rb независимо является прямой связью или прямой или разветвленной алкиленовой или алкениленовой цепью, и Rc является прямой или разветвленной алкиленовой или алкениленовой цепью.
«Арилокси» относится к радикалу, связанному через атом кислорода формулы -O-арил, где арил такой, как определено выше.
«Аралкил» относится к радикалу формулы -Rc-арил, где Rc представляет собой алкиленовую цепь, как определено выше, например метилен, этилен и подобные. Часть алкиленовой цепи аралкильного радикала необязательно замещена, как описано выше для алкиленовой цепи. Арильная часть аралкильного радикала необязательно замещена, как описано выше для арильной группы.
«Аралкилокси» относится к радикалу, связанному через атом кислорода формулы -O-аралкил, где аралкил определен выше.
«Аралкенил» относится к радикалу формулы -Rd-арил, где Rd представляет собой алкениленовую цепь, как определено выше. Арильная часть аралкенильного радикала необязательно замещена, как описано выше для арильной группы. Часть алкениленовой цепи аралкенильного радикала необязательно замещена, как определено выше для алкениленовой группы.
«Аралкинил» относится к радикалу формулы -Re-арил, где Re является алкиниленовой цепью, как определено выше. Арильная часть аралкинильного радикала необязательно замещена, как описано выше для арильной группы. Часть алкиниленовой цепи аралкинильного радикала необязательно замещена, как определено выше для алкиниленовой цепи.
«Циклоалкил» относится к стабильному неароматическому моноциклическому или полициклическому углеводородному радикалу, состоящему только из атомов углерода и водорода, который включает конденсированные или мостиковые кольцевые системы, имеющие от трех до пятнадцати атомов углерода. В некоторых вариантах осуществления, циклоалкил содержит от трех до десяти атомов углерода. В других вариантах осуществления, циклоалкил содержит от пяти до семи атомов углерода. Циклоалкил присоединен к остальной части молекулы одинарной связью. Циклоалкилы являются насыщенными (т.е. содержат только одинарные связи C-C) или частично ненасыщенными (т.е. содержат одну или несколько двойных связей или тройных связей). Примеры моноциклических циклоалкилов включают, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. В определенных вариантах осуществления, циклоалкил содержит от трех до восьми атомов углерода (например, C3-C8 циклоалкил). В других вариантах осуществления, циклоалкил содержит от трех до семи атомов углерода (например, C3-C7 циклоалкил). В других вариантах осуществления, циклоалкил содержит от трех до шести атомов углерода (например, C3-C6 циклоалкил). В других вариантах осуществления, циклоалкил содержит от трех до пяти атомов углерода (например, C3-C5 циклоалкил). В других вариантах осуществления, циклоалкил содержит от трех до четырех атомов углерода (например, C3-C4 циклоалкил). Частично ненасыщенный циклоалкил также называют «циклоалкенил». Примеры моноциклических циклоалкенилов включают, например, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Полициклические циклоалкильные радикалы включают, например, адамантил, норборнил (т.е. бицикло[2.2.1]гептанил), норборненил, декалинил, 7,7-диметил-бицикло[2.2.1]гептанил и подобные. Если в описании специально не указано иное, термин «циклоалкил» включает циклоалкильные радикалы, необязательно замещенные одним или несколькими заместителями, независимо выбранными из алкила, алкенила, алкинила, галогена, фторалкила, циано, нитро, арила, аралкила, аралкенила, аралкинила, циклоалкила, гетероциклоалкила, гетероарила, гетероарилалкила, -Rb-ORa, -Rb-OC(O)-Ra, -Rb-OC(O)-ORa, -Rb-OC(O)-N(Ra)2, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-C(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N(Ra)S(O)tRa (где t равно 1 или 2), -Rb-S(O)tORa (где t равно 1 или 2), -Rb-S(O)tRa (где t равно 1 или 2) и -Rb-S(O)tN(Ra)2 (где t равно 1 или 2), где каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, циклоалкилалкилом, арилом (необязательно замещенным одной или несколькими галогеновыми группами), аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом, каждый Rb независимо является прямой связью или прямой или разветвленной алкиленовой или алкениленовой цепью, и Rc является прямой или разветвленной алкиленовой или алкениленовой цепью.
«Гало» или «галоген» относится к бромным, хлорным, фторным или йодным заместителям.
«Галоалкил» относится к алкильному радикалу, как определено выше, который замещен одним или несколькими галогеновыми радикалами, как определено выше.
«Фторалкил» относится к алкильному радикалу, как определено выше, который замещен одним или несколькими фторными радикалами, как определено выше, например, трифторметилу, дифторметилу, фторметилу, 2,2,2-трифторэтилу, 1-фторметил-2-фторэтилу и подобным. Алкильная часть фторалкильного радикала необязательно замещена алкильной группой, как определено выше.
«Галоалкокси» относится к алкоксильному радикалу, как определено выше, который замещен одним или несколькими галогеновыми радикалами, как определено выше.
«Гетероциклоалкил» относится к стабильному 3-18-членному неароматическому кольцевому радикалу, который содержит от двух до двенадцати атомов углерода и от одного до шести гетероатомов, выбранных из азота, кислорода и серы. Если в описании специально не указано иное, гетероциклоалкильным радикалом является моноциклическая, бициклическая, трициклическая или тетрациклическая кольцевая система, которая включает конденсированные, спиро или мостиковые кольцевые системы. Гетероатомы в гетероциклоалкильном радикале необязательно окислены. Один или несколько атомов азота, если они присутствуют, необязательно кватернизованы. Гетероциклоалкильный радикал частично или полностью насыщен. В некоторых вариантах осуществления, гетероциклоалкил присоединен к остальной части молекулы через любой атом кольца(колец). Примеры таких гетероциклоалкильных радикалов включают, но не ограничены ими, диоксоланил, тиенил[1,3]дитианил, декагидроизохинолил, имидазолинил, имидазолидинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, оксазолидинил, пиперидинил, пиперазинил, 4-пиперидонил, пирролидинил, пиразолидинил, хинуклидинил, тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, тиоморфолинил, тиаморфолинил, 1-оксотиоморфолинил и 1,1-диоксотиоморфолинил. Если в описании специально не указано иное, термин «гетероциклоалкил» включает гетероциклоалкильные радикалы, как определено выше, которые необязательно замещены одним или несколькими заместителями, выбранным из алкила, алкенила, алкинила, галогена, фторалкила, оксо, тиоксо, циано, нитро, арила, аралкила, аралкенила, аралкинила, циклоалкила, гетероциклоалкила, гетероарила, гетероарилалкила, -Rb-ORa, -Rb-OC(O)-Ra, -Rb-OC(O)-ORa, -Rb-OC(O)-N(Ra)2, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-C(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N(Ra)S(O)tRa (где t равно 1 или 2), -Rb-S(O)tORa (где t равно 1 или 2), -Rb-S(O)tRa (где t равно 1 или 2) и -Rb-S(O)tN(Ra)2 (где t равно 1 или 2), где каждый Ra независимо является водородом, алкилом, фторалкилом, циклоалкилом, циклоалкилалкилом, арилом, аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом, каждый Rb независимо является прямой связью или прямой или разветвленной алкиленовой или алкениленовой цепью, и Rc является прямой или разветвленной алкиленовой или алкениленовой цепью.
«Гетероарил» относится к радикалу, производному от 5-18-членного ароматического кольцевого радикала, который включает от одного до семнадцати атомов углерода и от одного до шести гетероатомов, выбранных из азота, кислорода и серы. В настоящем документе гетероарильным радикалом является моноциклическая, бициклическая, трициклическая или тетрациклическая кольцевая система, где, по меньшей мере, одно из колец в кольцевой системе полностью ненасыщено, т. е. содержит циклическую, делокализованную (4n+2) π-электронную систему в соответствии с теорией Хюккеля. Гетероарил включает конденсированные или мостиковые кольцевые системы. Гетероатом(ы) в гетероарильном радикале необязательно окислены. Один или несколько атомов азота, если они присутствуют, необязательно кватернизованы. Гетероарил присоединен к остальной части молекулы через любой атом кольца (колец). Иллюстративные примеры гетероарилов, используемых в настоящем изобретении, включают, но не ограничиваются ими, фуранил, тиенил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, тиазолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, изотиазолил, пиридинил, пиридазинил, пиразинил, пиримидинил, триазинил, бензофуранил, изобензофурил, 2,3-дигидробензофурил, 1,3-бензодиоксолил, дигидробензодиоксинил, бензотиенил, индолизинил, индолил, изоиндолил, дигидроиндолил, бензимидазолил, дигидробензимидазолил, бензоксазолил, дигидробензоксазолил, бензтиазолил, бензоизотиазолил, дигидробензоизотиазолил, индазолил, имидазопиридинил, пиразолопиридинил, бензотриазолил, триазолопиридинил, пуринил, хинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, хиноксалинил, циннолинил, фталазинил, хиназолинил, 1,5-нафтиридинил, 1,6-нафтиридинил, 1,7-нафтиридинил, 1,8-нафтиридинил и птеридинил. Примеры 5-членных «гетероарильных» групп включают фуранил, тиенил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, тиазолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил и изотиазолил. Примеры 6-членных «гетероарильных» групп включают оксопиридил, пиридинил, пиридазинил, пиразинил и пиримидинил. Примеры 6,6-конденсированных «гетероарильных» групп включают хинолинил, изохинолинил, хиноксалинил, циннолинил, фталазинил, хиназолинил, 1,5-нафтиридинил, 1,6-нафтиридинил, 1,7-нафтиридинил, 1,8-нафтиридинил и птеридинил. Примеры 6,5-конденсированных «гетероарильных» групп включают бензофуранил, бензотиенил, бензимидазолил, бензтиазолил, индолизинил, индолил, изоиндолил и индазолил. Если в описании специально не указано иное, термин «гетероарил» включает гетероарильные радикалы, как определено выше, которые необязательно замещены одним или несколькими заместителями, выбранными из алкила, алкенила, алкинила, галогена, галоалкила, оксо, тиоксо, циано, нитро, арила, аралкила, аралкенила, аралкинила, циклоалкила, гетероциклоалкила, гетероарила, гетероарилалкила, -Rb-ORa, -Rb-OC(O)-Ra, -Rb-OC(O)-ORa, -Rb-OC(O)-N(Ra)2, -Rb-N(Ra)2, -Rb-C(O)Ra, -Rb-C(O)ORa, -Rb-C(O)N(Ra)2, -Rb-O-Rc-C(O)N(Ra)2, -Rb-N(Ra)C(O)ORa, -Rb-N(Ra)C(O)Ra, -Rb-N(Ra)S(O)tRa (где t равно 1 или 2), -Rb-S(O)tORa (где t равно 1 или 2), -Rb-S(O)tRa (где t равно 1 или 2) и -Rb-S(O)tN(Ra)2 (где t равно 1 или 2), где каждый Ra независимо является водородом, алкил, фторалкил, циклоалкил, циклоалкилалкил, арил, аралкилом, гетероциклоалкилом, гетероарилом или гетероарилалкилом, каждый Rb независимо является прямой связью или прямой или разветвленной алкиленовой или алкениленовой цепью, и Rc является прямой или разветвленной алкиленовой или алкениленовой цепью. В настоящем документе, “9-членное бициклическое гетероарильное кольцо” представляет группу или часть, содержащую ароматический бициклический радикал, содержащий 9 атомов в кольце, включающий, по меньшей мере, один атом углерода и гетероатомы, независимо выбранные из азота, кислорода и серы. Иллюстративные примеры 9-членного бициклического гетероарильного кольца включают, но не ограничиваются ими, бензимидазолил, имидазопиридинил, пуринил, индолил, пирролопиридинил, пирролопиримидинил, бензоксазолил, бензотиазолил, имидазопиразинил, имидазопиридазинил, пирролопиразинил, пирролопиридазинил, оксазолопиридинил, оксазолопиримидинил, оксазолопиразинил, оксазолопиридазинил, бензофуранил, фуропиридинил, фуропиримидинил, фуропиразинил, фуропиридазинил, тиазолопиридинил, тиазолопиримидинил, тиазолопиразинил, тиазолопиридазинил, бензотиофенил, тиенопиридинил, тиенопиримидинил, тиенопиразинил, тиенопиридазинил, индолизинил, пирролотриазинил, имидазотриазинил, триазолопиридинил, триазолопиридазинил, триазолопиримидинил и триазолопиразинил.
«N-гетероарил» относится к гетероарильному радикалу, как определено выше, содержащему, по меньшей мере, один азот, и где точка присоединения гетероарильного радикала к остальной части молекулы находится на атоме азота в гетероарильном радикале. N-гетероарильный радикал необязательно замещен, как описано выше для гетероарильных радикалов.
«C-гетероарил» относится к гетероарильному радикалу, как определено выше, и где точка присоединения гетероарильного радикала к остальной части молекулы находится на атоме углерода в гетероарильном радикале. C-гетероарильный радикал необязательно замещен, как описано выше для гетероарильных радикалов.
«Гетероарилокси» относится к радикалу, связанному через атом кислорода формулы -O-гетероарил, где гетероарил определен выше.
«Гетероарилалкил» относится к радикалу формулы -Rc-гетероарил, где Rc является алкиленовой цепью, как определено выше. Если гетероарилом является азотсодержащий гетероарил, гетероарил необязательно присоединен к алкильному радикалу на атоме азота. Алкиленовая цепь гетероарилалкильного радикала необязательно замещена, как определено выше для алкиленовой цепи. Гетероарильная часть гетероарилалкильного радикала необязательно замещена, как определено выше для гетероарильной группы.
«Гетероарилалкокси» относится к радикалу, связанному через атом кислорода формулы -O-Rc-гетероарил, где Rc является алкиленовой цепью, как определено выше. Если гетероарилом является азотсодержащий гетероарил, гетероарил необязательно присоединен к алкильному радикалу на атоме азота. Алкиленовая цепь гетероарилалкильного радикала необязательно замещена, как определено выше для алкиленовой цепи. Гетероарильная часть гетероарилалкильного радикала необязательно замещена, как определено выше для гетероарильной группы.
«Таутомер» относится к молекуле, где возможен протоновый сдвиг от одного атома молекулы к другому атому той же молекулы. В определенных вариантах осуществления, соединения, представленные в настоящем документе, существуют в виде таутомеров. В условиях, когда возможна таутомеризация, будет существовать химическое равновесие таутомеров. Точное соотношение таутомеров зависит от нескольких факторов, включая физическое состояние, температуру, растворитель и pH. Некоторые примеры таутомерного равновесия включают:

«Необязательный» или «необязательно» означает, что описываемое впоследствии событие или обстоятельство может или не может произойти, и что описание включает случаи, когда событие или обстоятельство происходит, и случаи, когда оно не происходит. Термин «необязательно замененный» или «замещенный» означает, что указанная группа может быть замещена одной или несколькими дополнительными группами, индивидуально и независимо выбранными из алкила, циклоалкила, арила, гетероарила, гетероциклоалкила, -OH, алкокси, арилокси, алкилтио, арилтио, алкилсульфоксида, арилсульфоксида, алкилсульфона, арилсульфона, -CN, алкина, C1-C6алкилалкина, галогена, ацила, ацилокси, -CO2H, -CO2-алкила, нитро, галоалкила, фторалкила и амино, включая моно- и дизамещенные аминогруппы (например -NH2, -NHR, -N(R)2) и их защищенные производные. В качестве примера, необязательными заместителями могут быть LsRs, где каждый Ls независимо выбирают из связи, -O-, -C(=O)-, -S-, -S(=O)-, -S(=O)2-, -NH-, -NHC(O)-, -C(O)NH-, S(=O)2NH-, -NHS(=O)2, -OC(O)NH-, -NHC(O)O-, -(C1-C6алкила)- или -(C2-C6алкенила)-; и каждый Rs независимо выбирают из H, (C1-C6алкила), (C3-C8циклоалкила), арила, гетероарила и гетероциклоалкила.
Термин «независимо» означает, что если более одного заместителя выбирают из ряда возможных заместителей, эти заместители могут быть одинаковыми или разными. Альтернативные определения для различных групп и групп заместителей формулы (I), приведенные в описании, предназначены для конкретного описания каждого вида соединения, раскрытого в данном документе, индивидуально, а также групп одного или нескольких видов соединений. Объем этого изобретения включает любую комбинацию этих определений групп и групп заместителей.
«Фармацевтически приемлемая соль» включает кислотно- или основно-аддитивные соли. Подразумевается, что фармацевтически приемлемая соль любого из описанных здесь соединений пиразола охватывает любые и все фармацевтически подходящие формы солей. Предпочтительными фармацевтически приемлемыми солями соединений, описанных в настоящем документе, являются фармацевтически приемлемые кислотно-аддитивные соли и фармацевтически приемлемые основно-аддитивные соли. В настоящем документе, термин «фармацевтически приемлемые соли» относится к солям, которые сохраняют желаемую биологическую активность рассматриваемого соединения и проявляют минимальные нежелательные токсикологические эффекты. Эти фармацевтически приемлемые соли могут быть получены in situ во время окончательного выделения и очистки соединения, или путем отдельной реакции очищенного соединения в форме свободной кислоты или свободного основания с подходящим основанием или кислотой, соответственно.
«Фармацевтически приемлемая кислотно-аддитивная соль» относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом нежелательными и которые образуются с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, йодистоводородная кислота, фтористоводородная кислота, фосфористая кислота и подобные. Также включены соли, которые образованы с органическими кислотами, такими как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, алкандикислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и т.д., и включают, например, уксусную кислоту, трифторуксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и подобные. Типовые соли, таким образом, включают сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, нитраты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, трифторацетаты, пропионаты, каприлаты, изобутираты, оксалаты, малонаты, сукцинатные субераты, себакаты, фумараты, малеаты, миндаляты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, фталаты, бензолсульфонаты, толуолсульфонаты, фенилацетаты, цитраты, лактаты, малаты, тартраты, метансульфонаты и подобные. Также рассматриваются соли аминокислот, такие как аргинаты, глюконаты и галактуронаты (см., например, Berge S.M. et al., «Pharmaceutical Salts,» Journal of Pharmaceutical Science, 66:1-19 (1997)). Кислотно-аддитивные соли основных соединений получают контактом форм свободного основания с достаточным количеством желаемой кислоты для получения соли.
«Фармацевтически приемлемая основно-аддитивная соль» относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются нежелательными с биологической или иной точки зрения. Эти соли получают добавлением неорганического основания или органического основания к свободной кислоте. В некоторых вариантах осуществления, фармацевтически приемлемые основно-аддитивные соли образуются с металлами или аминами, такими как щелочные и щелочноземельные металлы или органические амины. Соли, полученные из неорганических оснований, включают, но не ограничиваются ими, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и подобные. Соли, полученные из органических оснований, включают, но не ограничиваются ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклических аминов и основных ионообменных смол, например, изопропиламина, триметиламина, диэтиламина, триэтиламина, трипропиламина, этаноламина, диэтаноламина, 2-диметиламиноэтанола, 2-диэтиламиноэтанола, дициклогексиламина, лизина, аргинина, гистидина, кофеина, прокаина, N, N-дибензилэтилендиамина, хлорпрокаина, гидрабамина, холина, бетаина, этилендиамина, этилендианилина, N-метилглюкамина, глюкозамина, метилглюкамина, теобромина, пуринов, пиперазина, пиперидина, N-этилпиперидина, полиаминовых смол и подобных. См. Berge et al., supra.
В настоящем документе, термины «лечение» или «лечить» или «ослабление» или «облегчение» используются здесь взаимозаменяемо. Эти термины относятся к подходу к получению полезных или желаемых результатов, включая, но не ограничиваясь ими, терапевтический эффект и/или профилактический эффект. Под «терапевтическим эффектом» подразумевают уничтожение или улучшение основного заболевания, подлежащего лечению. Кроме того, терапевтический эффект достигается за счет уничтожения или облегчения одного или нескольких физиологических симптомов, связанных с основным заболеванием, так что улучшение наблюдается у пациента, несмотря на то, что пациент все еще страдает основным расстройством. Для профилактического эффекта композиции вводят пациенту с риском развития определенного заболевания или пациенту, сообщающему об одном или нескольких физиологических симптомах заболевания, даже если диагноз этого заболевания не был поставлен.
Термин «терапевтически эффективное количество» означает любое количество, которое, по сравнению с соответствующим субъектом, не получавшим такое количество, приводит к улучшенному лечению, исцелению или облегчению заболевания, расстройства или побочного эффекта или снижению скорости прогрессирования заболевания, болезни или расстройства. Термин также включает в себя количества, эффективные для улучшения нормальной физиологической функции. Для использования в терапии, терапевтически эффективные количества соединения формулы (I) или формулы (II), а также их солей, можно вводить в виде неочищенного химического вещества. Дополнительно активный ингредиент может быть представлен в виде фармацевтической композиции.
Термин “пациент” означат человека иди животное.
Термин “индивидуум” означает человека или животное.
Соединения
Соединения формулы (Q), (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанные в настоящем документе, являются ингибиторами TG2. В некоторых вариантах осуществления, соединения формулы (Q), (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанные в настоящем документе, и фармацевтические композиции, содержащие эти соединения, применяют для лечения целиакии, нейродегенеративных заболеваний, глазных заболеваний, рака или фиброзных заболеваний.
В некоторых вариантах представлено соединение формулы (I):

где:

X, Y и Z выбирают из =C(R11)- и =N-, где, по меньшей мере, два из X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и необязательно замещенного алкила; или R1 и R2, вместе с атомом азота, к которому они присоединены образуют необязательно замещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо;
R3 является -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 или -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, необязательно замещенного алкила, необязательно замещенного алкенила, необязательно замещенного алкинила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
R5 выбирают из необязательно замещенного алкила, необязательно замещенного гетероциклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
R6 и R7 независимо выбирают из H и необязательно замещенного алкила; или R6 и R7, вместе с атомом азота, к которому они присоединены образуют необязательно замещенное 5- или 6-членное гетероциклоалкильное кольцо;
R8 выбирают из необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила, необязательно замещенного гетероциклоалкила и необязательно замещенного гетероарила;
каждый R9 независимо выбирают из необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
каждый R10 независимо выбирают из H, необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
каждый R11 независимо выбирают из H, галогена и необязательно замещенного алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где X, Y и Z каждый является =C(R11)-. В некоторых вариантах осуществления формулы (I) или его фармацевтически приемлемой соли или сольвата, где X и Y каждый является =C(H)-; и Z является =C(CH)-, =C(CH3)- или =C(Cl)-. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где X, Y и Z каждый является =C(H)-. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где X является =N-, Y является =C(R11)- и Z является =C(R11)-. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где X является =N-, Y является =C(H)- и Z является =C(H)-. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где Х является =C(R11)-, Y является =N- и Z является =C(R11)-. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где Х является =C(H)-, Y является =N- и Z является =C(H)-. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где Х является =C(R11)-, Y является =C(R11)- и Z является =N-. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где Х является =C(H)-, Y является =C(H)- и Z является =N-.
В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является H. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является C1-6алкилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 4-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 5-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 6-членное гетероциклоалкильное кольцо.
В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, C1-6алкил-O-C1-6алкила, C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, -C1-6алкил-фенила и C2-9гетероарила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-C2-9гетероциклоалкила и -C1-6алкил-фенила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является C1-6алкилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH3. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-C2-9гетероциклоалкилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-фенилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH2-фенилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R3 является -N(H)C(O)NR6R7. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из C1-6алкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 каждый является -CH3. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является фенилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является C2-9гетероарилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7; R5 является C1-6алкилом; и R6 и R7 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5; и R5 является метилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7; и R6 и R7 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7; и R6 и R7 являются C1-6алкилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7; и R6 и R7 являются метилом.
В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где n равно 0, 1, 2 или 3. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где n равно 0. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где n равно 1, 2 или 3. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где n равно 1. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где n равно 2. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где n равно 3. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где n равно 4.
В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, -C(O)-C1-10алкила, C1-10алкила, C1-10алкил-OH, C2-10алкенила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах осуществления представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где

В некоторых вариантах осуществления представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где

В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где







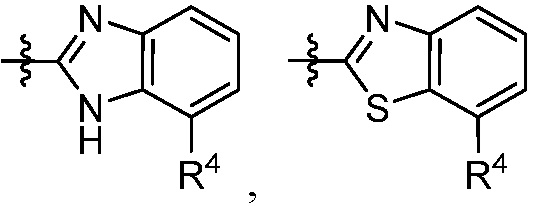



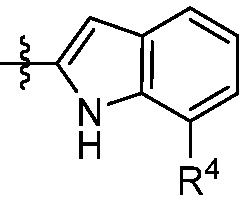





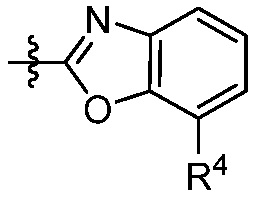



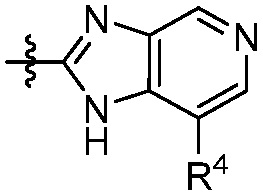




В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где





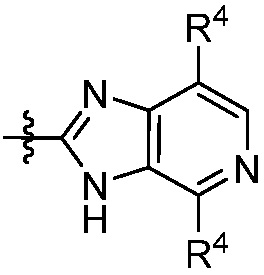










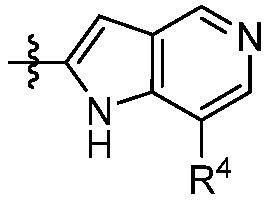

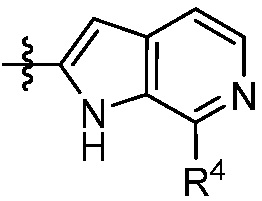





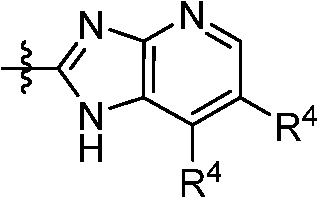



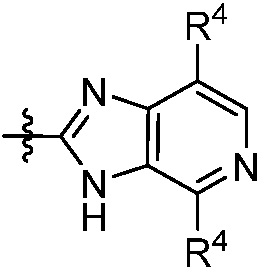


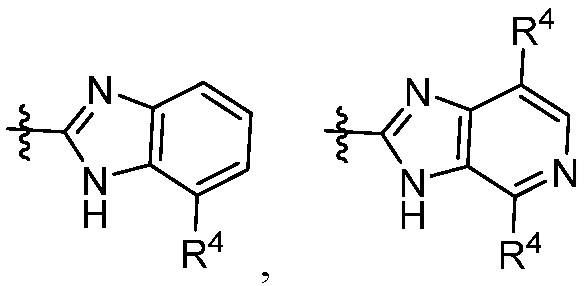
В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где


В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила, C2-10алкенила, C1-10галоалкила и -C1-6алкил-C3-12циклоалкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила и каждый R9 является C1-10алкилом. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена и C1-10алкила.
В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где p равно 0. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где p равно 1. В некоторых вариантах представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где p равно 2.
В другом варианте осуществления, настоящее изобретение относится к соединениями формулы (I)
где:

X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и C1-6алкила,
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из H и C1-6алкила;
каждый R11 независимо выбирают из H, галогена и C1-6алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В другом варианте осуществления, настоящее изобретение относится к соединениям формулы (I), где:

X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и C1-6алкила,
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из H и C1-6алкила;
каждый R11 независимо выбирают из H, галогена и C1-6алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В другом варианте осуществления, настоящее изобретение относится к соединениям формулы (I)
где:

X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и C1-6алкила,
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из H и C1-6алкила;
каждый R11 независимо выбирают из H, галогена и C1-6алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В другом варианте осуществления, настоящее изобретение относится к соединениям формулы (I)
где:

X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и C1-6алкила,
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из H и C1-6алкила;
каждый R11 независимо выбирают из H, галогена и C1-6алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах осуществления представлено соединение, имеющее структуру формулы (II):

где:

X, Y и Z выбирают из =C(R11)- и =N-, где, по меньшей мере, два из X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H, C1-6алкила и -C1-6алкил-OH; или R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R3 выбирают из -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 и -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10алкил-OR9, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, -C2-6алкенил-C3-12циклоалкила, фенила, -C1-6алкил-фенила, -C2-6алкенил-фенила, C2-9гетероциклоалкила и C2-9гетероарила, где фенил, -C1-6алкил-фенил, -C2-6алкенил-фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила;
R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где C2-9гетероциклоалкил, -C1-6алкил-C2-9гетероциклоалкил, фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2; или R6 и R7, вместе с атомом азота, к которому они присоединены образует 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R8 выбирают из C1-6алкила, C1-6галоалкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, C3-6циклоалкила, фенила, C2-9гетероциклоалкила и C2-9гетероарила, где C3-6циклоалкил, фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R10 независимо выбирают из H, C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R11 независимо выбирают из H, галогена, C1-6алкила и C1-6галоалкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где X, Y и Z каждый является =C(R11)-. В некоторых вариантах осуществления формулы (II) или его фармацевтически приемлемой соли или сольвата, X и Y каждый является =C(H)-; и Z является =C(CH)-, =C(CH3)- или =C(Cl)-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где X, Y и Z каждый является =C(H)-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где X и Y каждый является =C(H)- и Z является каждый =C(Cl)-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где X и Y каждый является =C(H)- и Z является каждый =C(CH3)-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где Х является =N-, Y является =C(R11)- и Z является =C(R11)-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где Х является =N-, Y является =C(H)- и Z является =C(H)-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где Х является =C(R11)-, Y является =N- и Z является =C(R11)-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где Х является =C(H)-, Y является =N- и Z является =C(H)-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где Х является =C(R11)-, Y является =C(R11)- и Z является =N-. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где Х является =C(H)-, Y является =C(H)- и Z является =N-.
В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является H. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является C1-6алкилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 4-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 5-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 6-членное гетероциклоалкильное кольцо.
В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, C1-6алкил-O-C1-6алкила, C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, -C1-6алкил-фенила и C2-9гетероарила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-C2-9гетероциклоалкила и -C1-6алкил-фенила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является C1-6алкилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH3. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-C2-9гетероциклоалкилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-фенилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH2-фенилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R3 является -N(H)C(O)NR6R7. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из C1-6алкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 каждый является -CH3. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является фенилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является C2-9гетероарилм, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7; R5 является C1-6алкилом; и R6 и R7 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5; и R5 является метилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7; и R6 и R7 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7; и R6 и R7 являются C1-6алкилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7; и R6 и R7 являются метилом.
В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где n равно 0, 1, 2 или 3. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где n равно 0. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где n равно 1, 2 или 3. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где n равно 1. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где n равно 2. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где n равно 3. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где n равно 4.
В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, -C(O)-C1-10алкила, C1-10алкила, C1-10алкил-OH, C2-10алкенила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах осуществления представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где

В некоторых вариантах осуществления представлено соединение формулы (I) или его фармацевтически приемлемая соль или сольват, где

В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где















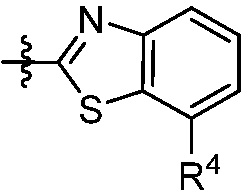










В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где































В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где




В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галоген, -OR9, -N(R10)2, C1-10алкила, C2-10алкенила, C1-10галоалкила и -C1-6алкил-C3-12циклоалкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила и каждый R9 является C1-10алкилом. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена и C1-10алкила.
В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где p равно 0. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где p равно 1. В некоторых вариантах представлено соединение формулы (II) или его фармацевтически приемлемая соль или сольват, где p равно 2.
В другом варианте осуществления, настоящее изобретение относится к соединениям формулы (II)
где:

X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и C1-6алкила,
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из H и C1-6алкила;
каждый R11 независимо выбирают из H, галогена и C1-6алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В другом варианте осуществления, настоящее изобретение относится к соединениям формулы (II)
где:

X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и C1-6алкила,
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из H и C1-6алкила;
каждый R11 независимо выбирают из H, галогена и C1-6алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
В другом варианте осуществления, настоящее изобретение относится к соединениям формулы (II)
где:

X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и C1-6алкила,
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из H и C1-6алкила;
каждый R11 независимо выбирают из H, галогена и C1-6алкила;
n равно 1, 2 или 3; и
p равно 1;
или его фармацевтически приемлемая соль или сольват.
В другом варианте осуществления, настоящее изобретение относится к соединениям формулы (II)
где:

X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и C1-6алкила,
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из H и C1-6алкила;
каждый R11 независимо выбирают из H, галогена и C1-6алкила;
n равно 1, 2 или 3; и
p равно 1;
или его фармацевтически приемлемая соль или сольват.
В другом аспекте представлены соединения, имеющие структуру формулы (IIa):

где:

R1 и R2 независимо выбирают из H, C1-6алкила и -C1-6алкил-OH; или R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R3 выбирают из -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 и -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10алкил-OR9, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, -C2-6алкенил-C3-12циклоалкила, фенила, -C1-6алкил-фенила, -C2-6алкенил-фенила, C2-9гетероциклоалкила и C2-9гетероарила, где фенил, -C1-6алкил-фенил, -C2-6алкенил-фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила;
R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где C2-9гетероциклоалкил, -C1-6алкил-C2-9гетероциклоалкил, фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2; или R6 и R7, вместе с атомом азота, к которому они присоединены образует 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R8 выбирают из C1-6алкила, C1-6галоалкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, C3-6циклоалкила, фенила, C2-9гетероциклоалкила и C2-9гетероарила, где C3-6циклоалкил, фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R10 независимо выбирают из H, C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила; и
n равно 0, 1, 2, 3 или 4;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является H. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 4-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 5-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 6-членное гетероциклоалкильное кольцо.
В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, C1-6алкил-O-C1-6алкила, C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, -C1-6алкил-фенила и C2-9гетероарила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-C2-9гетероциклоалкила и -C1-6алкил-фенила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH3. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-C2-9гетероциклоалкилом. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-фенилом. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH2-фенилом. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R3 является -N(H)C(O)NR6R7. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из C1-6алкила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 каждый является -CH3. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является фенилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является C2-9гетероарилом, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где n равно 0, 1, 2 или 3. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где n равно 0. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где n равно 1, 2 или 3. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где n равно 1. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где n равно 2. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где n равно 3. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где n равно 4.
В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, -C(O)-C1-10алкила, C1-10алкила, C1-10алкил-OH, C2-10алкенила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где

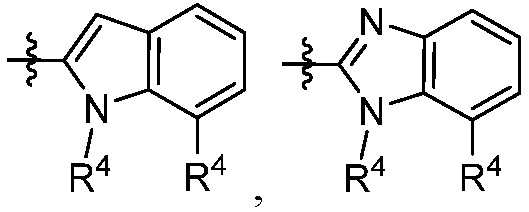
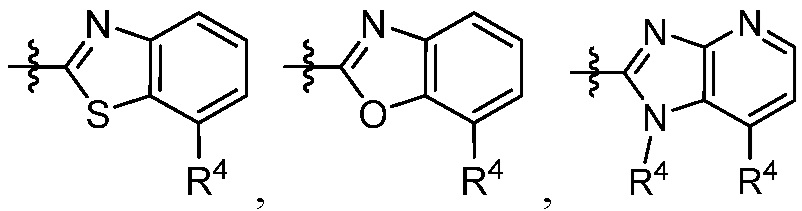




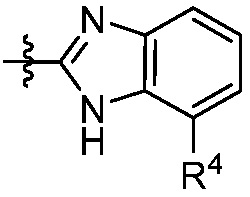







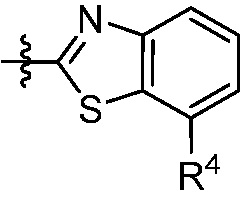










В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где































В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила, C2-10алкенила, C1-10галоалкила и -C1-6алкил-C3-12циклоалкила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила и каждый R9 является C1-10алкилом. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (IIa) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена и C1-10алкила.
В другом аспекте представлены соединения, имеющие структуру формулы (IIb):

где:

R1 и R2 независимо выбирают из H, C1-6алкила и -C1-6алкил-OH; или R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R3 выбирают из -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 и -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10алкил-OR9, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, -C2-6алкенил-C3-12циклоалкила, фенила, -C1-6алкил-фенила, -C2-6алкенил-фенила, C2-9гетероциклоалкила и C2-9гетероарила, где фенил, -C1-6алкил-фенил, -C2-6алкенил-фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила;
R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где C2-9гетероциклоалкил, -C1-6алкил-C2-9гетероциклоалкил, фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2; или R6 и R7, вместе с атомом азота, к которому они присоединены образует 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R8 выбирают из C1-6алкила, C1-6галоалкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, C3-6циклоалкила, фенила, C2-9гетероциклоалкила и C2-9гетероарила, где C3-6циклоалкил, фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R10 независимо выбирают из H, C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила; и
n равно 0, 1, 2, 3 или 4;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является H. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 4-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 5-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 6-членное гетероциклоалкильное кольцо.
В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, C1-6алкил-O-C1-6алкила, C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, -C1-6алкил-фенила и C2-9гетероарила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-C2-9гетероциклоалкила и -C1-6алкил-фенила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH3. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-C2-9гетероциклоалкилом. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-фенилом. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH2-фенилом. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R3 является -N(H)C(O)NR6R7. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из C1-6алкила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 каждый является -CH3. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является фенилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является C2-9гетероарилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где n равно 0, 1, 2 или 3. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где n равно 0. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где n равно 1, 2 или 3. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где n равно 1. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где n равно 2. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где n равно 3. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где n равно 4.
В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, -C(O)-C1-10алкила, C1-10алкила, C1-10алкил-OH, C2-10алкенила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где









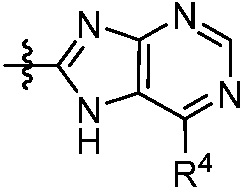













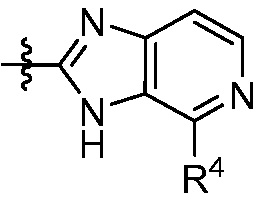


В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где










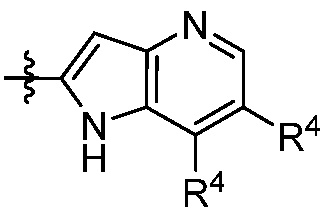







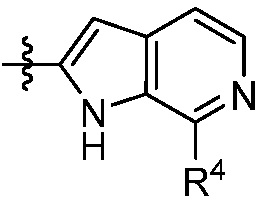












В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила, C2-10алкенила, C1-10галоалкила и -C1-6алкил-C3-12циклоалкила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила и каждый R9 является C1-10алкилом. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (IIb) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена и C1-10алкила.
В другом аспекте представлены соединения, имеющие структуру формулы (IIc):

где:

R1 и R2 независимо выбирают из H, C1-6алкила и -C1-6алкил-OH; или R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R3 выбирают из -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 и -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10алкил-OR9, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, -C2-6алкенил-C3-12циклоалкила, фенила, -C1-6алкил-фенила, -C2-6алкенил-фенила, C2-9гетероциклоалкила и C2-9гетероарила, где фенил, -C1-6алкил-фенил, -C2-6алкенил-фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила;
R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где C2-9гетероциклоалкил, -C1-6алкил-C2-9гетероциклоалкил, фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2; или R6 и R7, вместе с атомом азота, к которому они присоединены образует 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R8 выбирают из C1-6алкила, C1-6галоалкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, C3-6циклоалкила, фенила, C2-9гетероциклоалкила и C2-9гетероарила, где C3-6циклоалкил, фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R10 независимо выбирают из H, C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила; и
n равно 0, 1, 2, 3 или 4;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является H. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 4-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 5-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 6-членное гетероциклоалкильное кольцо.
В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, C1-6алкил-O-C1-6алкила, C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, -C1-6алкил-фенила и C2-9гетероарила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-C2-9гетероциклоалкила и -C1-6алкил-фенила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH3. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-C2-9гетероциклоалкилом. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-фенилом. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH2-фенилом. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R3 является -N(H)C(O)NR6R7. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из C1-6алкила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 каждый является -CH3. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является фенил, необязательно замещенный одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является C2-9гетероарил, необязательно замещенный одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где n равно 0, 1, 2 или 3. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где n равно 0. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где n равно 1, 2 или 3. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где n равно 1. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где n равно 2. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где n равно 3. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где n равно 4.
В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, -C(O)-C1-10алкила, C1-10алкила, C1-10алкил-OH, C2-10алкенила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (IIс) или его фармацевтически приемлемая соль или сольват, где


























В некоторых вариантах представлено соединение формулы (IIс) или его фармацевтически приемлемая соль или сольват, где































В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила, C2-10алкенила, C1-10галоалкила и -C1-6алкил-C3-12циклоалкила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила и каждый R9 является C1-10алкилом. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (IIc) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена и C1-10алкила.
В другом аспекте представлены соединения, имеющие структуру формулы (IId):

где:

R1 и R2 независимо выбирают из H, C1-6алкила и -C1-6алкил-OH; или R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R3 выбирают из -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 и -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10алкил-OR9, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, -C2-6алкенил-C3-12циклоалкила, фенила, -C1-6алкил-фенила, -C2-6алкенил-фенила, C2-9гетероциклоалкила и C2-9гетероарила, где фенил, -C1-6алкил-фенил, -C2-6алкенил-фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила;
R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где C2-9гетероциклоалкил, -C1-6алкил-C2-9гетероциклоалкил, фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2; или R6 и R7, вместе с атомом азота, к которому они присоединены образует 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R8 выбирают из C1-6алкила, C1-6галоалкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, C3-6циклоалкила, фенила, C2-9гетероциклоалкила и C2-9гетероарила, где C3-6циклоалкил, фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R10 независимо выбирают из H, C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила; и
n равно 0, 1, 2, 3 или 4;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2 независимо выбирают из H и C1-6алкила. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является H. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является C1-6алкилом. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо, необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 4-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 5-членное гетероциклоалкильное кольцо. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 6-членное гетероциклоалкильное кольцо.
В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, C1-6алкил-O-C1-6алкила, C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, -C1-6алкил-фенила и C2-9гетероарила. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-C2-9гетероциклоалкила и -C1-6алкил-фенила. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является C1-6алкилом. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH3. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-C2-9гетероциклоалкилом. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -C1-6алкил-фенилом. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH2-фенилом. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R3 является -N(H)C(O)NR6R7. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 независимо выбирают из C1-6алкила. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 каждый является -CH3. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-OH. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является -C1-6алкил-O-C1-6алкилом. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является фенилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8 и R8 является C2-9гетероарилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где n равно 0, 1, 2 или 3. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где n равно 0. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где n равно 1, 2 или 3. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где n равно 1. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где n равно 2. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где n равно 3. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где n равно 4.
В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, -C(O)-C1-10алкила, C1-10алкила, C1-10алкил-OH, C2-10алкенила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами. В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
В некоторых вариантах представлено соединение формулы (IId) или его фармацевтически приемлемая соль или сольват, где

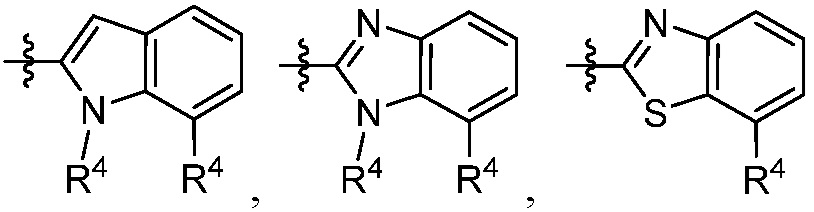





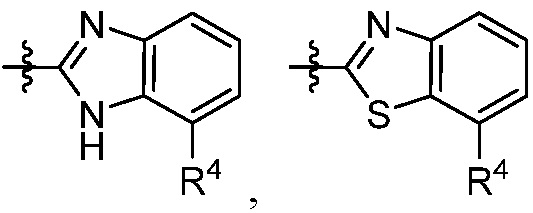

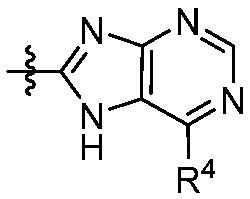



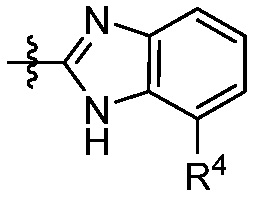












В другом аспекте представлены соединения, имеющие структуру формулы (IIe):

где:



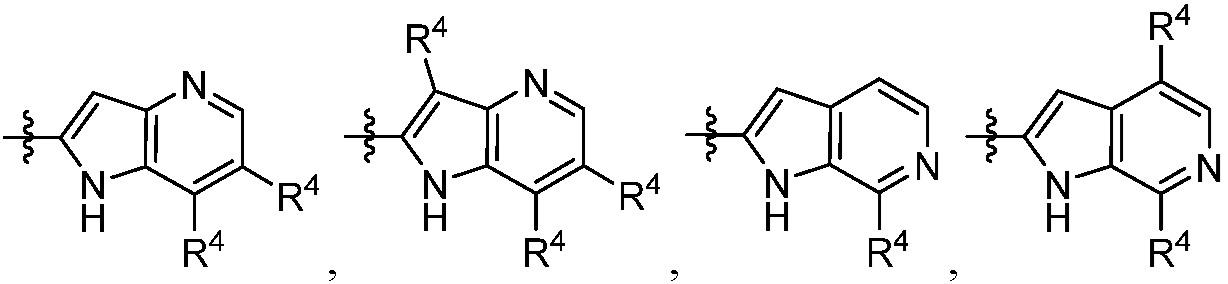

R1 и R2 независимо выбирают из C1-6алкила;
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C3-12циклоалкила и -C1-6алкил-C3-12циклоалкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила и -C1-6алкил-фенила;
каждый R10 независимо выбирают из H и C1-10алкила; и
R11 выбирают из H, галогена, C1-6алкила и C1-6галоалкила;
или его фармацевтически приемлемая соль или сольват.
В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3.
В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5. В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5 и R5 является -CH3. В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7. В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7 и R6 и R7 каждый является -CH3.
В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где

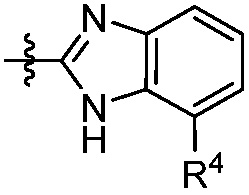









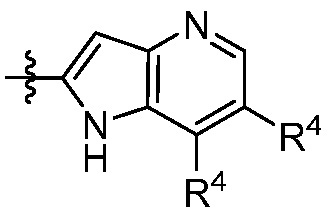



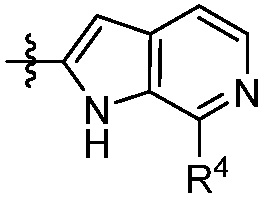

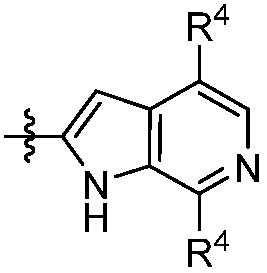

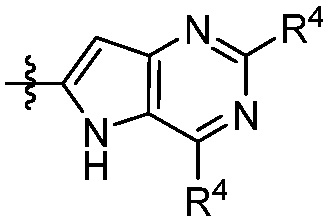
В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила, C2-10алкенила, C1-10галоалкила и -C1-6алкил-C3-12циклоалкила. В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -N(R10)2, C1-10алкила и C1-10галоалкила и каждый R9 является C1-10алкилом. В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, C1-10алкила и C1-10галоалкила. В некоторых вариантах представлено соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена и C1-10алкила.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
R4 является C1-10алкилом;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 выбирают из H, галогена и C1-6алкила.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
R4 является C1-10алкилом;
R5 является C1-6алкил; и
R11 является H.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
R4 является C1-10алкилом;
R5 является C1-6алкилом; и
R11 является галогеном.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
R4 является C1-10алкилом;
R5 является C1-6алкилом; и
R11 является C1-6алкилом.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
R4 является C1-10алкилом;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 выбирают из H, галогена и C1-6алкила.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
R4 является C1-10алкилом;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является H.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
R4 является C1-10алкилом;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является галогеном.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
R4 является C1-10алкилом;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является C1-6алкилом.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 выбирают из H, галогена и C1-6алкила.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом; и
R11 выбирают из H, галогена и C1-6алкила.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом; и
R11 является H.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом; и
R11 является галогеном.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом; и
R11 является C1-6алкилом.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 выбирают из H, галогена и C1-6алкила.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является H.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является галогеном.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является C1-6алкилом.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 выбирают из -N(H)C(O)OR5 и -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 выбирают из H, галогена и C1-6алкила.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом; и
R11 выбирают из H, галогеном и C1-6алкилом.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом; и
R11 является H.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкилом;
R3 является -N(H)C(O)OR5;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом; и
R11 является галогеном.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -N(H)C(O)OR5;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R5 является C1-6алкилом; и
R11 является C1-6алкилом.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 выбирают из H, галогена и C1-6алкила.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является H.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является галогеном.
В настоящем документе описано соединение формулы (IIe) или его фармацевтически приемлемая соль или сольват, где:


R1 и R2 независимо выбирают из C1-6алкила;
R3 является -OC(O)NR6R7;
каждый R4 независимо выбирают из галогена и C1-10алкила;
R6 и R7 независимо выбирают из C1-6алкила; и
R11 является C1-6алкилом.
В некоторых вариантах осуществления представлено соединение, выбранное из:
трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-4-изобутил-бензимидазол-1-карбоксилата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; трет-бутил (S, E)-2-((3-(7-амино-2-(((бензилокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; бензил (S, E)-(7-амино-1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(7-амино-1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(2-(((бензилокси)карбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; бензил (S, E)-(7-(диметиламино)-1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил 2-((3-((2S, E)-7-амино-7-оксо-2-((((тетрагидрофуран-3-ил)окси)карбонил)амино)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; (тетрагидрофуран-3-ил)метил ((S, E)-7-(диметиламино)-1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; тетрагидрофуран-3-ил ((S, E)-7-амино-1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил 2-((3-((2S, E)-7-амино-7-оксо-2-((((тетрагидрофуран-3-ил)метокси)карбонил)амино)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; (тетрагидрофуран-3-ил)метил ((S, E)-7-амино-1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; 2-гидроксиэтил (S, E)-(7-(диметиламино)-1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-4-изобутил-2-((3-(2-((метоксикарбонил)амино)-7-(метиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; (S, E)-1-((1-((5,6-дифтор-7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((5,6-дифтор-7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-6-фтор-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-6-(3,3-диметилуреидо)-N7-(1-((5-фтор-7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-(3,3-диметилуреидо)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-6-фтор-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; метил (R, E)-(7-(диметиламино)-1-((1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-(3,3-диметилуреидо)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-6-(3,3-диметилуреидо)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-(3-(2-метоксиэтил)-3-метилуреидо)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-6-фтор-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-N7-(1-((5-фтор-7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(3-(2-метоксиэтил)-3-метилуреидо)-N1,N1-диметилгепт-2-ендиамида; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-имидазо[4,5-c]пиридин-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-3H-имидазо[4,5-b]пиридин-3-карбоксилата; метил (S, E)-(7-(диметиламино)-1-((1-((7-изобутил-3H-имидазо[4,5-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-изобутил-2-метил-9H-purin-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-8-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-6-изобутил-2-метил-9H-пурин-9-карбоксилата; метил (S, E)-(1-((1-((6-(2-циклопропилэтил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((6-пентил-9H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-(2-метилпроп-1-енил)-9H-пурин-8-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-изобутил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((6-(2-метилпроп-1-ен-1-ил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((6-изобутил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-(2-метилпроп-1-ен-1-ил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-(2-метилпроп-1-ен-1-ил)-1H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((6-циклогексил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((6-циклогексил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((2-метил-6-(2-метилпроп-1-ен-1-ил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-(2-метилпроп-1-ен-1-ил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-(2-метилпроп-1-ен-1-ил)-1H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((S, E)-7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((6-((E)-стирил)-9H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-изобутил-6-метил-1H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-метил-4-(2-метилпроп-1-ен-1-ил)-1H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((6-фенэтил-7H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((6-фенэтил-9H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((7-(2-метилпроп-1-ен-1-ил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил ((S, E)-1-((1-((6-((E)-2-циклопропилвинил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5,7-дифтор-4-изобутил-бензимидазол-1-карбоксилата; метил N-[(E,1S)-1-[[1-[(5,7-дифтор-4-изобутил-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; (S, E)-трет-бутил 2-((3-(2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-5-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(пиримидин-2-карбоксамидо)гепт-2-ендиамида; (S, E)-6-(2-фторбензамидо)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида; (S, E)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(1-метил-1H-имидазол-5-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(1-метил-1H-имидазол-2-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(пиколинамидо)гепт-2-ендиамида; (S, E)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(3-метоксипропанамидо)-N1,N1-диметилгепт-2-ендиамида; (S, E)-N7-(1-((7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)-N1,N1-диметилгепт-2-ендиамида; (6S, E)-N7-(1-((7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(тетрагидрофуран-2-карбоксамидо)гепт-2-ендиамида; (S, E)-трет-бутил 2-((3-(7-амино-2-(((2-метоксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-2-метоксиэтил (1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; бензил (S, E)-(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил (S, E)-2-((3-(2-((метоксикарбонил)амино)-7-(метиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((5,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((5,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (R, E)-7-(диметиламино)-1-((1-((5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил-3,3-d2 диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил-3,3-d2 диметилкарбамата; (S, E)-2- гидроксиэтил(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамата; (S)-2-((((S, E)-1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамоил)окси)этил 2-((S)-2-амино-3-метилбутанамидо)-3-метилбутаноата; (S, E)-N7-(1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-гидроксиацетамидо)-N1,N1-диметилгепт-2-ендиамид; (E,6S)-N'-[1-(1H-бензимидазол-2-илметил)-2-оксо-3-пиридил]-6-(3-гидроксипропаноиламино)-N, N-диметил-гепт-2-ендиамида; (S, E)-N7-(1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-гидроксибутанамидо)-N1,N1-диметилгепт-2-ендиамида; (S, E)-метил(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-((2-гидроксиэтил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-метил (7-(диметиламино)-1-((1-((6-фтор-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((6-фтор-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; 2-метоксиэтил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил (2-метоксиэтил)(метил)карбамата; (S, E)-1-((1-((5-фтор-7-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-6-метокси-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((6-метокси-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; трет-бутил (S, E)-2-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(7-амино-1-((1-((7-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-7-оксо-2-((((тетрагидро-2H-пиран-4-ил)метокси)карбонил)амино)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; (тетрагидро-2H-пиран-4-ил)метил (S, E)-(7-(диметиламино)-1-((1-((7-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; тетрагидрофуран-3-ил ((S, E)-7-(диметиламино)-1-((1-((4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил 2-((3-((2S, E)-7-амино-7-оксо-2-((((тетрагидрофуран-3-ил)окси)карбонил)амино)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; тетрагидрофуран-3-ил ((S, E)-7-амино-1-((1-((4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-амино-7-оксо-2-((((тетрагидро-2H-пиран-4-ил)метокси)карбонил)амино)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; (тетрагидро-2H-пиран-4-ил)метил (S, E)-(7-амино-1-((1-((4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,7-дифтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((5,7-дифтор-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; [(E,1S)-6-(диметиламино)-1-[[1-[[4-(2,2-диметилпропил)-6-фтор-1-метил-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; 2-метоксиэтил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-1-метил-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиридазин-1-ил]метил]-4-(2,2-диметилпропил)-6-фтор-бензимидазол-1-карбоксилата; [(E,1S)-6-(диметиламино)-1-[[2-[[7-(2,2-диметилпропил)-5-фтор-1H-бензимидазол-2-ил]метил]-3-оксо-пиридазин-4-ил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамат соль ТФК; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиразин-1(2H)-ил)метил)-6-фтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-неопентил-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[5-фтор-7-(3,3,3-трифторпропил)-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; метил (S, E)-(7-амино-1,7-диоксо-1-((2-оксо-1-((4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-6-фтор-2-((3-(2-((метоксикарбонил)амино)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((6-фтор-4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(2-((диметилкарбамоил)окси)-7-(метиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-7-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-1-((1-((5-фтор-7-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((4,6-дифтор-7-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,7-дифтор-4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-1-((1-((4,6-дифтор-7-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((5,6-дифтор-4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; [(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-1-метил-4-(3,3,3-трифторпропил)бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; 2-метоксиэтил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-1-метил-4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиримидин-1-ил]метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[5-фтор-7-(3,3,3-трифторпропил)-1H-бензимидазол-2-ил]метил]-6-оксо-пиримидин-5-ил]карбамоил]-6-оксо-гекс-4-енил]карбамата; метил (S, E)-(1-((1-((5-фтор-7-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-6-фтор-2-((5-(2-((метоксикарбонил)амино)-7-(метиламино)-7-оксогепт-5-енамидо)-6-оксопиримидин-1(6H)-ил)метил)-4-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил 4-(циклопропилметил)-2-[[3-[[(E,2S)-7-(диметиламино)-2-метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-6-фтор-бензимидазол-1-карбоксилата; метил N-[(E,1S)-1-[[1-[[4-(циклопропилметил)-6-фтор-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; трет-бутил (S, E)-4-(циклопропилметил)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((4-(циклопропилметил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-(циклопропилметил)-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(7-амино-1-((1-((4-(циклопропилметил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-метил (1-((1-((4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-фенокси-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((7-фенокси-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1,7-диоксо-1-((2-оксо-1-((4-фенокси-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((6-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-метил(1-((1-((7-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; бензил (S, E)-(7-амино-1-((1-((4-изопропокси-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((7-(бензилокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; бензил (S, E)-(7-(диметиламино)-1-((1-((7-изобутокси-1-метил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((7-изобутокси-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((7-(бензилокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((4-изопропокси-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((7-(циклопропилметокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((6-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((4-(2,2-дифторэтокси)-6-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((4-(2,2-дифторэтокси)-6-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-4-(2,2,2-трифторэтокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((6-фтор-4-(2,2,2-трифторэтокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((4-((2,4-дифторбензил)окси)-6-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; 2-метоксиэтил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила (2-метоксиэтил)(метил)карбамата; метил (S, E)-(1-((1-((7-(циклопропилметокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-метил (7-(диметил-амино)-1-((1-((5-фтор-7-(1,1,2,2-тетрафторэтокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-N7-(1-((7-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((7-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)-N1,N1-диметилгепт-2-ендиамида; (S, E)-N7-(1-((7-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(1-метил-1H-имидазол-5-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((4-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)-N1,N1-диметилгепт-2-ендиамида; (S, E)-N7-(1-((4-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(1-метил-1H-имидазол-2-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(4,4-дифторциклогексан-1-карбоксамидо)-N1,N1-диметилгепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)гепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(5-фторпиколинамидо)гепт-2-ендиамида; (S, E)-N7-(1-((4-((2,4-дифторбензил)окси)-6-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)-N1,N1-диметилгепт-2-ендиамида; (S, E)-N7-(1-((4-((2,4-дифторбензил)окси)-6-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(5-фторпиколинамидо)-N1,N1-диметилгепт-2-ендиамида; метил N-[(E,1S)-1-[[1-[[4-[(2,4-дифторфенокси) метил]-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-(изопропоксиметил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-метил(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1,7-диоксо-1-((2-оксо-1-((4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-(диметиламино)-1-((1-((4-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-амино-1-((1-((4-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-фтор-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-амино-1-((1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (6S, E)-N7-(1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида; (S, E)-метил (7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((7-пивалоил-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-фтор-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-амино-1-((1-((4-(1-фтор-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-метил(1-((1-((4-(1,1-дифтор-2-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-метил (1-((1-((4-(1,1-дифтор-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((4-(1,1-дифтор-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((4-(1,1-дифтор-2-метилаллил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((4-(1,1-дифтор-2-метилаллил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-метил (1-((1-((7-(трет-бутокси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((7-(трет-бутокси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-бензимидазол-2-ил)метил]-6-оксо-пиримидин-5-ил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-1-((1-((5,6-дифтор-1-изопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((1-(циклопропилметил)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((1-этил-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-(3,3,3-трифторпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((1-(2-циклопропилэтил)-5,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((1-(2-циклопропилэтил)-5,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((1-(2-((дифтор-l3-метил)-l2-fluoraneyl)этил)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((1-бензил-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((1-(2,4-дифторбензил)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((1-(2,4-дифторбензил)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-неопентил-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((5,6-дифтор-1-(2-изопропоксиэтил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((5-фтор-1-(4-фторбензил)-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((1-(циклопропилметил)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((5-фтор-1-изобутил-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((1-этил-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-метил-1H-бензо[d]имидазол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; этил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5-фтор-бензимидазол-1-карбоксилата; циклопропилметил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5-фтор-бензимидазол-1-карбоксилата; метил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-бензо[d]имидазол-1-карбоксилата; этил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-1H-бензо[d]имидазол-1-карбоксилата; циклопропилметил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-1H-бензо[d]имидазол-1-карбоксилата; этил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-1H-бензо[d]имидазол-1-карбоксилата; циклопропилметил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-бензо[d]имидазол-1-карбоксилата; этил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-бензо[d]имидазол-1-карбоксилата; метил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиримидин-1-ил]метил]-5-фтор-бензимидазол-1-карбоксилата; [(E,1S)-1-[[1-[(1-бензил-6-фтор-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил] N, N-диметилкарбамата; [(E,1S)-1-[[1-[(1-бензил-5-фтор-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил] N, N-диметилкарбамата; (S, E)-1-((1-((1-(2,4-дифторбензил)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((1-(2,4-дифторбензил)-6-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-(4-фторбензил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-1-(4-фторбензил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-метил (7-(диметиламино)-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-5-фтор-2-((3-(2-((метоксикарбонил)амино)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; трет-бутил (S, E)-5-фтор-2-((3-(2-(((2-гидроксиэтокси)карбонил)амино)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; 2-гидроксиэтил (S, E)-(1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил (2-метоксиэтил)(метил)карбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил пирролидин-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-амино-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; (S, E)-7-амино-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; трет-бутил (S, E)-2-((3-(2-((bis(2-метоксиэтил)карбамоил)окси)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил бис(2-метоксиэтил)карбамата; бензил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; (E)-7-(диметиламино)-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил-3,3-d2 диметилкарбамата; трет-бутил (E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо-3,3-d2)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-pyrazin-1-ил]метил]-5-фтор-индол-1-карбоксилата; [(E,1S)-6-(диметиламино)-1-[[4-[(5-фтор-1H-индол-2-ил)метил]-3-оксо-pyrazin-2-ил]карбамоил]-6-оксо-гекс-4-енил]N, N-диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1H-индол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-индол-1-карбоксилата; (S, E)-метил (7-(диметиламино)-1-((1-((4-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-индол-1-карбоксилата; метил (S, E)-(7-амино-1-((1-((4-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата; метил (S, E)-(7-амино-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилат; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила метилкарбамата; (S, E)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-7-оксо-2-((пирролидин-1-карбонил)окси)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила пирролидин-1-карбоксилата; трет-бутил (S, E)-7-изобутил-2-((3-(2-((метоксикарбонил)амино)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; метил (S, E)-(1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; (E)-7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил-3,3-d2 диметилкарбамата; трет-бутил (E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо-3,3-d2)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата; (S, E)-2-(((7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамоил)окси)этилацетата; (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-(((2-гидроксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата; (S, E)-2-гидроксиэтил (7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(2-(((2-гидроксиэтокси)карбонил)амино)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата; 2-гидроксиэтил (S, E)-(1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(4,4-дифторциклогексанкарбоксамидо)-N1,N1-диметилгепт-2-ендиамида; трет-бутил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)-N1,N1-диметилгепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(3,3,3-трифторпропанамидо)гепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-фторбензамидо)-N1,N1-диметилгепт-2-ендиамида; метил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-7-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-амино-2-((трет-бутоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-1H-индол-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-1H-индол-1-карбоксилата; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-фторбензамидо)гепт-2-ендиамида; метил (S, E)-(7-амино-1-((1-((7-(2,2-дифторэтокси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((7-(2,2-дифторэтокси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-7-(2,2-дифторэтокси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; метил (S, E)-(7-амино-1-((1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)гепт-2-ендиамида; (S, E)-трет-бутил 7-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; (S, E)-метил (1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-1-карбоксилата; метил (S, E)-(7-амино-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-7-(2,2-дифторэтокси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; метил (S, E)-(1-((1-((7-(2,2-дифторэтокси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-(2,2-дифторэтокси)-5-фтор-1H-индол-1-карбоксилата; метил (S, E)-(7-амино-1-((1-((7-(2,2-дифторэтокси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-7-((2,4-дифторбензил)окси)-5-фтор-2-((3-(2-((метоксикарбонил)амино)-7-(метиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; метил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-7-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-2-(((2-метоксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; трет-бутил (S, E)-7-((2,4-дифторбензил)окси)-5-фтор-2-((3-(2-((метоксикарбонил)амино)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; метил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-7-изобутил-1H-индол-1-карбоксилат; метил (S, E)-(7-(диметиламино)-1-((1-((5-фтор-7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; 2-гидроксиэтил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-7-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-2-(((2-метоксиэтил)(метил)карбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; (S, E)-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила (2-метоксиэтил)(метил)карбамата; трет-бутил (S, E)-7-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-7-оксо-2-((пирролидин-1-карбонил)окси)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; (S, E)-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил пирролидин-1-карбоксилата; 2-метоксиэтил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбаматаа; трет-бутил (S, E)-7-((2,4-дифторбензил)окси)-2-((3-(2-((диметилкарбамоил)окси)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; (S, E)-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ила диметилкарбамата; (S, E)-7-амино-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((5-фтор-7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-5-фтор-7-изобутил-2-((3-(2-((метоксикарбонил)амино)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; метил (S, E)-(7-(бис(метил-d3)амино)-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(бис(метил-d3)амино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-1-карбоксилата; трет-бутил (E)-7-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо-3,3-d2)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; (E)-1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил-3,3-d2 диметилкарбамата; трет-бутил (E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо-3,3-d2)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-7-изобутил-1H-индол-1-карбоксилата; (E)-7-(диметиламино)-1-((1-((5-фтор-7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил-3,3-d2 диметилкарбамата; [(E,1S)-6-(диметиламино)-1-[[1-[[5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; трет-бутил (S, E)-5-фтор-2-((3-(2-((метоксикарбонил)амино)-7-оксо-7-(пирролидин-1-ил)гепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-(3,3,3-трифторпропил)-1H-индол-1-карбоксилата; метил (S, E)-(1-((1-((5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-7-(3,3,3-трифторпропил)-1H-индол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-(трифторметил)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-7-(трифторметил)-1H-индол-1-карбоксилата; трет-бутил (S, E)-2-((3-(2-((диметилкарбамоил)окси)-7-(метиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-7-(3,3,3-трифторпропил)-1H-индол-1-карбоксилата; (S, E)-1-((1-((5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-7-оксо-2-(пирролидин-1-карбонилокси)гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата; [(E,1S)-6-(диметиламино)-1-[[1-[[7-(2,2-диметилпропил)-5-фтор-1H-индол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]пирролидин-1-карбоксилата; 2-метоксиэтил (S, E)-(7-(диметиламино)-1-((1-((5-фтор-7-неопентил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-неопентил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((5-фтор-7-неопентил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-неопентил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила (2-метоксиэтил)(метил)карбамата; (S, E)-1-((1-((5-фтор-7-неопентил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ила пирролидин-1-карбоксилата; метил (S, E)-(7-(диметиламино)-1-((1-((5-фтор-7-неопентил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-pyrazin-1-ил]метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата; [(E,1S)-6-(диметиламино)-1-[[4-[[7-(2,2-диметилпропил)-5-фтор-1H-индол-2-ил]метил]-3-оксо-пиразин-2-ил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; трет-бутил (S, E)-2-((5-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-6-оксопиримидин-1(6H)-ил)метил)-5-фтор-7-неопентил-1H-индол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-неопентил-1H-индол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиразин-1(2H)-ил)метил)-5-фтор-7-(3,3,3-трифторпропил)-1H-индол-1-карбоксилата; трет-бутил (S, E)-2-((5-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-6-оксопиримидин-1(6H)-ил)метил)-5-фтор-7-(3,3,3-трифторпропил)-1H-индол-1-карбоксилата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил (S, E)-2-((5-(2-((диметилкарбамоил)окси)-7-(метиламино)-7-оксогепт-5-енамидо)-6-оксопиримидин-1(6H)-ил)метил)-5-фтор-7-(3,3,3-трифторпропил)-1H-индол-1-карбоксилата; (S, E)-1-((1-((5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-изобутил-индол-2-ил) метил]-6-оксо-пиримидин-5-ил]карбамоил]-6-оксо-гекс-4-енил]N, N-диметилкарбамата; (S, E)-1-((1-((1-бензил-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((1-(циклопропилметил)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-метил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-(4-фторбензил)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((1-этил-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((1-(2,4-дифторбензил)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5-фтор-индол-1-карбоксилата; 2,4-дифторбензил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата; [(E,1S)-6-(диметиламино)-1-[[4-[(5-фтор-1-изобутил-индол-2-ил)метил]-3-оксо-пиразин-2-ил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; (S, E)-7-(диметиламино)-1-((4-((1-этил-5-фтор-1H-индол-2-ил)метил)-3-оксо-3,4-дигидропиразин-2-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; (S, E)-1-((4-((1-бензил-5-фтор-1H-индол-2-ил)метил)-3-оксо-3,4-дигидропиразин-2-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((4-((1-(циклопропилметил)-5-фтор-1H-индол-2-ил)метил)-3-оксо-3,4-дигидропиразин-2-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((4-((5-фтор-1-(4-фторбензил)-1H-индол-2-ил)метил)-3-оксо-3,4-дигидропиразин-2-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((5-фтор-1-изобутил-1H-индол-2-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((4-((1-(2,4-дифторбензил)-5-фтор-1H-индол-2-ил)метил)-3-оксо-3,4-дигидропиразин-2-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-индол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-[2-[трет-бутоксикарбонил(метил)амино]этил]-N-метил-карбамата; [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-индол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-2-(диметиламино)этил]-N-метил-карбамата; (S, E)-трет-бутил 7-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; (S, E)-метил (7-(диметиламино)-1-((1-((7-изобутилбензо[d]oxazol-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((7-изобутилбензо[d]оксазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-изобутилбензо[d]оксазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((4-изобутилбензо[d]оксазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; 2-гидроксиэтил (S, E)-(7-(диметиламино)-1-((1-((7-изобутилбензо[d]оксазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-метил (7-(диметиламино)-1-((1-((7-изобутилбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((7-изобутилбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; 2-гидроксиэтил (S, E)-(7-(диметиламино)-1-((1-((7-изобутилбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-трет-бутил (1-((1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(4,4-дифторциклогексан-1-карбоксамидо)-N1,N1-диметилгепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-фторбензамидо)-N1,N1-диметилгепт-2-ендиамида; метил (S, E)-(7-амино-1-((1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)-N1,N1-диметилгепт-2-ендиамида; метил (S, E)-(7-амино-1-((1-((7-(2,2-дифторэтокси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((7-(2,2-дифторэтокси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1,7-диоксо-1-((2-оксо-1-((7-(1,1,2,2-тетрафторэтокси)бензо[d]тиазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((7-(1,1,2,2-тетрафторэтокси)бензо[d]тиазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((7-(2,2,2-трифторэтокси)бензо[d]тиазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1,7-диоксо-1-((2-оксо-1-((7-(2,2,2-трифторэтокси)бензо[d]тиазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-(7-амино-1-((1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-метоксиацетамидо)гепт-2-ендиамида; (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-фторбензамидо)гепт-2-ендиамида; (S, E)-метил(7-(диметиламино)-1-((1-((5-фторбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-амино-1-((1-((5-фторбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((5-фторбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксо-7-(пирролидин-1-ил)гепт-5-ен-2-ил)карбамата; метил (S, E)-метил (1-((1-((7-((2,4-дифторфенокси)метил)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-2-гидроксиэтил (1-((1-(бензо[d]тиазол-2-илметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-(((2-гидроксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; 2-гидроксиэтил (S, E)-(7-амино-1-((1-(бензо[d]оксазол-2-илметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; 2-гидроксиэтил (S, E)-(7-амино-1-((1-(бензо[d]тиазол-2-илметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; 2-гидроксиэтил (S, E)-(1-((1-((1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-амино-2-(((2-гидроксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; (S, E)-метил (7-амино-1-((1-((7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-(((2-гидроксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата; метил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(метиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил N-[(E)-1-[[[1-[(5,7-дифтор-4-изобутил-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]амино]метил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; метил N-[(E,1S)-1-[[1-[[4-(2,4-дифторфенокси)-5,6-дифтор-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; метил (S, E)-(1-((1-((5,6-дифтор-7-изопропокси-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((7-(бензилокси)-5,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((7-((2,4-дифторбензил)окси)-5,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((5,6-дифтор-7-фенокси-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((5,6-дифтор-7-изопропокси-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((4-(2,4-дифторфенокси)-5,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((1-((4-((2,4-дифторбензил)окси)-5,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил 4-(2,4-дифторфенокси)-2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5,6-дифтор-бензимидазол-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-4-изопропокси-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил (S, E)-4-(бензилокси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил (S, E)-4-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-4-фенокси-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил (S, E)-4-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-4-(2,2-диметилпропил)-5,6-дифтор-бензимидазол-1-карбоксилата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[4-(2,2-диметилпропил)-5,6-дифтор-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,6-дифтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата; (S, E)-1-((1-((5,6-дифтор-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5,7-дифтор-4-фенокси-бензимидазол-1-карбоксилата; трет-бутил (S, E)-4-(2,4-дифторфенокси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,7-дифтор-1H-бензо[d]имидазол-1-карбоксилата; метил N-[(E,1S)-1-[[1-[(5,7-дифтор-4-фенокси-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; трет-бутил (S, E)-4-(бензилокси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,7-дифтор-1H-бензо[d]имидазол-1-карбоксилата; трет-бутил (S, E)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5,7-дифтор-4-изопропокси-1H-бензо[d]имидазол-1-карбоксилата; метил (S, E)-(1-((1-((4-(2,4-дифторфенокси)-5,7-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((4-(бензилокси)-5,7-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((4-((2,4-дифторбензил)окси)-5,7-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((7-((2,4-дифторбензил)окси)-4,6-дифтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; метил N-[(E,1S)-6-(диметиламино)-6-оксо-1-[[2-оксо-1-[(6-фенокси-9H-пурин-8-ил)метил]-3-пиридил]карбамоил]гекс-4-енил]карбамата; трет-бутил (S, E)-6-(2,4-дифторфенокси)-8-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-9H-пурин-9-карбоксилата; метил (S, E)-(1-((1-((6-(2,4-дифторфенокси)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-изопропокси-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-изобутокси-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил N-[(E,1S)-1-[[1-[(6-бензилокси-9H-пурин-8-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; метил (S, E)-(1-((1-((6-((2,4-дифторбензил)окси)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((6-((2,4-дифторбензил)окси)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; метил N-[(E,1S)-1-[[1-[(6-бензил-9H-пурин-8-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; метил (S, E)-(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((6-(3,3,3-трифторпропил)-9H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((6-(циклопропилметил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил ((2S, E)-7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((9-(тетрагидро-2H-пиран-2-ил)-6-(3,3,3-трифторпропил)-9H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; (2S, E)-7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((9-(тетрагидро-2H-пиран-2-ил)-6-(3,3,3-трифторпропил)-9H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил диметилкарбамата; (S, E)-7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((6-(3,3,3-трифторпропил)-9H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил диметилкарбамата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-(2,2-диметилпропил)-9H-пурин-8-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((6-неопентил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-изопентил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((1-((6-(2-циклогексилэтил)-7H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-(3,3-диметилбутил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((6-(3,3-диметилбутил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; (2S, E)-7-(диметиламино)-1-((1-((6-(3,3-диметилбутил)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; метил ((2S, E)-7-(диметиламино)-1-((1-((6-(3,3-диметилбутил)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (2S, E)-7-(диметиламино)-1-((1-((6-изопентил-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((6-изопентил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-5H-пирроло[3,2-d]пиримидин-6-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((4-изобутил-5H-пирроло[3,2-d]пиримидин-6-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((4-(3,3,3-трифторпропил)-5H-пирроло[3,2-d]пиримидин-6-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((4-(3,3,3-трифторпропил)-5H-пирроло[3,2-d]пиримидин-6-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ила диметилкарбамата; метил ((2S, E)-7-(диметиламино)-1-((1-((2-метил-6-неопентил-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((2-метил-6-неопентил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((2-метил-6-неопентил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((6-(циклогексилметил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((6-(циклогексилметил)-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-изобутил-2-метил-5H-пирроло[3,2-d]пиримидин-6-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((4-изобутил-2-метил-5H-пирроло[3,2-d]пиримидин-6-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((6-(3,3,3-трифтор-2-(трифторметил)пропил)-9H-пурин-8-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ила диметилкарбамата; 2-метоксиэтил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-6-(3,3-диметилуреидо)-N7-(1-((6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; метил (S, E)-(1-((6-хлор-1-((6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((6-хлор-1-((6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; метил (S, E)-(1-((1-((7-(циклобутилметил)-6-фтор-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((7-(циклобутилметил)-6-фтор-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-7-изопропокси-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изопропокси-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-7-изобутокси-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутокси-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((7-(бензилокси)-6-фтор-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((7-(бензилокси)-6-фтор-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил N-[(E,1S)-1-[[1-[(6-хлор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; (S, E)-1-((1-((6-хлор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((7-(циклопропилметил)-6-фтор-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-изобутил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-1H-пирроло[3,2-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (E)-(7-(диметиламино)-1-((1-((7-изобутил-1H-пирроло[3,2-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-(2-метилпроп-1-ен-1-ил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-(2-метилпроп-1-ен-1-ил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-(2-метилпроп-1-ен-1-ил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-7-изобутил-5-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутил-5-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-7-(3,3,3-трифторпропил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-(3,3,3-трифторпропил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((4-фтор-7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-фтор-7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((4-фтор-7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-фтор-7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((6-хлор-1-((4-фтор-7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((6-хлор-1-((4-фтор-7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((4-фтор-7-(2-метилпроп-1-ен-1-ил)-1H-пирроло[2,3-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((4-фтор-7-(2-метилпроп-1-ен-1-ил)-1H-пирроло[2,3-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-(диметиламино)-2-метил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил адиметилкарбамата; метил (S, E)-(1-((6-хлор-1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((6-хлор-1-((7-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил-N-[(E,1S)-6-(диметиламино)-1-[[1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-6-(метилсульфонил)-1-оксогекс-5-ен-2-ил)карбамата; метил N-[(E,1S)-1-[[6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата; [(E,1S)-1-[[6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил] N, N-диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((6-хлор-1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((6-хлор-1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((4-(циклопропилметил)-7-фтор-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((4-(циклопропилметил)-7-фтор-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((1-((4-(циклопропилметил)-7-фтор-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((1-((4-(циклопропилметил)-7-фтор-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((6-хлор-1-((4-(циклопропилметил)-7-фтор-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((6-хлор-1-((4-(циклопропилметил)-7-фтор-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-5-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-5-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((5-хлор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((5-хлор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((5-фтор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((5-фтор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-изобутил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-изобутил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-изопропил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-изопропил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((6-этил-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((6-этил-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-6-пропил-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-6-пропил-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-5,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-5,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-(метоксиметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((6-фтор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((6-фтор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((5-фтор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((5-фтор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-7-изобутил-3H-имидазо[4,5-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутил-1H-имидазо[4,5-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((6-фтор-7-изобутил-3H-имидазо[4,5-b]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутил-1H-имидазо[4,5-b]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-1-((6-хлор-1-((6-фтор-7-изобутил-3H-имидазо[4,5-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((6-хлор-1-((6-фтор-7-изобутил-1H-имидазо[4,5-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; [(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-[2-(диметиламино)этил]-N-метил-карбамата; 2-(диметиламино)этил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; метил (S, E)-(1-((6-хлор-1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((6-хлор-1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((6-фтор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(1-((6-хлор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-6-(трифторметил)-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-1-((6-хлор-1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; (S, E)-7-(диметиламино)-1-((1-((6-фтор-7-(3,3,3-трифторпропил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ила диметилкарбамата; метил (S, E)-(1-((6-хлор-1-((4-(циклопропилметил)-7-фтор-3H-имидазо[4,5-c]пиридин-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата; (S, E)-7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил диметилкарбамата; и метил (S, E)-(7-(диметиламино)-1-((1-((7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил)-6-метил-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата; [(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; [(E,1S)-6-(диметиламино)-1-[[1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; и [(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата; или их фармацевтически приемлемых солей или сольватов.
В некоторых вариантах осуществления представлено соединение, выбранное из:
метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата;
метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата;
[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата;
метил N-[(E,1S)-1-[[6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата;
[(E,1S)-1-[[6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил] N, N-диметилкарбамата;
метил-N-[(E,1S)-6-(диметиламино)-1-[[1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата;
[(E,1S)-6-(диметиламино)-1-[[1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата;
метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата; или
[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата;
или их фармацевтически приемлемых солей.
Любое сочетание вышеописанных групп для разных переменных рассматривается в настоящем документе.
В описании, группы и заместители на них могут быть выбраны так, чтобы получить стабильные группы и соединения.
В некоторых вариантах осуществления, описанное в настоящем документе соединение является соединением из любых из соединений, описанных в настоящем документе или их фармацевтически приемлемых солей или сольватов.
Получение соединений
Соединения, используемые в описанных в настоящем документе реакциях, получают в соответствии с известными методами органического синтеза, исходя из коммерчески доступных химикатов и/или из соединений, описанных в химической литературе. «Коммерчески доступные химикаты» получают из стандартных коммерческих источников, включая Acros Organics (Geel, Belgium), Aldrich Chemical (Milwaukee, WI, включая Sigma Chemical и Fluka), Apin Chemicals Ltd. (Milton Park, UK), Ark Pharm, Inc. (Libertyville, IL), Avocado Research (Lancashire, U.K.), BDH Inc. (Toronto, Canada), Bionet (Cornwall, U.K.), Chemservice Inc. (West Chester, PA), Combi-blocks (San Diego, CA), Crescent Chemical Co. (Hauppauge, NY), eMolecules (San Diego, CA), Fisher Scientific Co. (Pittsburgh, PA), Fisons Chemicals (Leicestershire, UK), Frontier Scientific (Logan, UT), ICN Biomedicals, Inc. (Costa Mesa, CA), Key Organics (Cornwall, U.K.), Lancaster Synthesis (Windham, NH), Matrix Scientific, (Columbia, SC), Maybridge Chemical Co. Ltd. (Cornwall, U.K.), Parish Chemical Co. (Orem, UT), Pfaltz & Bauer, Inc. (Waterbury, CN), Polyorganix (Houston, TX), Pierce Chemical Co. (Rockford, IL), Riedel de Haen AG (Hanover, Germany), Ryan Scientific, Inc. (Mount Pleasant, SC), Spectrum Chemicals (Gardena, CA), Sundia Meditech, (Shanghai, China), TCI America (Portland, OR), Trans World Chemicals, Inc. (Rockville, MD) и WuXi (Shanghai, China).
Подходящие справочники и трактаты, в которых подробно описан синтез реагентов, используемых для получения описанных здесь соединений, или которые содержат ссылки на статьи, описывающие получение, включают, например, «Synthetic Organic Chemistry», John Wiley & Sons, Inc., New York; S. R. Sandler et al., «Organic Functional Group Preparations» 2nd Ed., Academic Press, New York, 1983; H. O. House, «Modern Synthetic Reactions», 2nd Ed., W. A. Benjamin, Inc. Menlo Park, Calif. 1972; T. L. Gilchrist, «Heterocyclic Chemistry», 2nd Ed., John Wiley & Sons, New York, 1992; J. March, «Advanced Organic Chemistry: Reactions, Mechanisms and Structure», 4th Ed., Wiley-Interscience, New York, 1992. Дополнительные подходящие справочники и трактаты, в которых подробно описан синтез реагентов, используемых для получения описанных здесь соединений, или которые содержат ссылки на статьи, описывающие получение, включают, например, Fuhrhop, J. и Penzlin G. «Organic Synthesis: Concepts, Methods, Starting Materials», Second, Revised и Enlarged Edition (1994) John Wiley & Sons ISBN: 3-527-29074-5; Hoffman, R.V. «Organic Chemistry, An Intermediate Text» (1996) Oxford University Press, ISBN 0-19-509618-5; Larock, R. C. «Comprehensive Organic Transformations: A Guide to Functional Group Preparations» 2nd Edition (1999) Wiley-VCH, ISBN: 0-471-19031-4; March, J. «Advanced Organic Chemistry: Reactions, Mechanisms and Structure» 4th Edition (1992) John Wiley & Sons, ISBN: 0-471-60180-2; Otera, J. (editor) «Modern Carbonyl Chemistry» (2000) Wiley-VCH, ISBN: 3-527-29871-1; Patai, S. «Patai's 1992 Guide to the Chemistry of Functional Groups» (1992) Interscience ISBN: 0-471-93022-9; Solomons, T. W. G. «Organic Chemistry» 7th Edition (2000) John Wiley & Sons, ISBN: 0-471-19095-0; Stowell, J.C., «Intermediate Organic Chemistry» 2nd Edition (1993) Wiley-Interscience, ISBN: 0-471-57456-2; «Industrial Organic Chemicals: Starting Materials and Intermediates: An Ullmann's Encyclopedia» (1999) John Wiley & Sons, ISBN: 3-527-29645-X, в 8 томах; «Organic Reactions» (1942-2000) John Wiley & Sons, в более чем 55 томах; и «Chemistry of Functional Groups» John Wiley & Sons, в 73 томах.
Специфические и аналогичные реагенты также идентифицируют с помощью индексов известных химических веществ, подготовленных Химической реферативной службой Американского химического общества, которые доступны в большинстве публичных и университетских библиотек, а также через онлайн базы данных (за более подробным описанием можно обратиться в American Chemical Society, Washington, D.C.). Химические вещества, которые известны, но не доступны коммерчески в каталогах, могут быть получены специализированными организациями химического синтеза, где многие стандартные химические компании (например, перечисленные выше) предоставляют услуги индивидуального синтеза. Ссылкой на получение и выбор фармацевтических солей описанных здесь соединений является P. H. Stahl & C. G. Wermuth «Handbook of Pharmaceutical Salts», Verlag Helvetica Chimica Acta, Zurich, 2002.
Другие формы соединений, описанных здесь
Изомеры
Кроме того, в некоторых вариантах осуществления, описанные в настоящем документе соединения существуют в виде геометрических изомеров. В некоторых вариантах осуществления, соединения, описанные в настоящем документе, содержат одну или несколько двойных связей. Представленные здесь соединения включают все цис, транс, син, анти, entgegen (E) и zusammen (Z) изомеры, а также их соответствующие смеси. В некоторых ситуациях соединения существуют в виде таутомеров. Описанные здесь соединения включают все возможные таутомеры в описанных здесь формулах. В некоторых ситуациях, описанные здесь соединения обладают одним или несколькими хиральными центрами, и каждый центр существует в R конфигурации или S конфигурации. Описанные в настоящем документе соединения включают все диастереомерные, энантиомерные и эпимерные формы, а также их соответствующие смеси. В дополнительных вариантах осуществления, соединения и способы, представленные в настоящем документе, смеси энантиомеров и/или диастереоизомеров, полученные на одной препаративной стадии, комбинации или взаимного превращения, полезны для описанных здесь областей применения. В некоторых вариантах осуществления, описанные в настоящем документе соединения получают в виде оптически чистых энантиомеров путем хирального хроматографического разделения рацемической смеси. В некоторых вариантах осуществления, соединения, описанные в настоящем документе, получают в виде их индивидуальных стереоизомеров путем взаимодействия рацемической смеси соединения с оптически активным разделяющим агентом с образованием пары диастереоизомерных соединений, разделением диастереомеров и восстановлением оптически чистых энантиомеров. В некоторых вариантах осуществления предпочтительны диссоциируемые комплексы (например, кристаллические диастереомерные соли). В некоторых вариантах осуществления, диастереомеры имеют различные физические свойства (например, температуры плавления, температуры кипения, растворимость, реакционную способность и т.д.) и разделены с использованием преимуществ этих различий. В некоторых вариантах осуществления диастереомеры разделяют хиральной хроматографией или, предпочтительно, методами разделения/расщепления, основанными на различиях в растворимости. В некоторых вариантах осуществления оптически чистый энантиомер затем восстанавливают вместе с разделяющим агентом любыми практическими способами, которые не приводят к рацемизации.
Меченые соединения
В некоторых вариантах осуществления, соединения, описанные в данном документе, существуют в их меченых изотопами формах. В некоторых вариантах осуществления, способы, раскрытые в настоящем документе, включают способы лечения заболеваний путем введения таких меченых изотопами соединений. В некоторых вариантах осуществления, способы, раскрытые в настоящем документе, включают способы лечения заболеваний путем введения таких меченых изотопами соединений в виде фармацевтических композиций. Таким образом, в некоторых вариантах осуществления, соединения, раскрытые в настоящем документе, включают меченые изотопами соединения, которые идентичны перечисленным в настоящем документе, но фактически, в которых один или несколько атомов замещены атомом, атомная масса или массовое число которого отличается от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые вводятся в соединения, описанные в настоящем документе, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как2H,3H,13C,14C,l5N,18O,17O,31P,32P,35S,18F и36Cl, соответственно. Описанные в настоящем документе соединения и их фармацевтически приемлемые соли, сложные эфиры, сольваты, гидраты или производные, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Определенные меченые изотопами соединения, например те, в которые введены радиоактивные изотопы, такие как3H и14C, применяют в лекарственных средствах и/или в анализах распределения в ткани субстрата. Тритированные, т.е.3H, и углерод-14, т.е.14C, изотопы особенно предпочтительны благодаря простоте их получения и определяемости. Кроме того, замещение тяжелыми изотопами, такими как дейтерий, т.е.2H, дает определенные терапевтические преимущества, возникающие из большей метаболической стабильности, например, повышенного периода полужизни in vivo или пониженных требований к дозировке. В некоторых вариантах осуществления, изотопно-меченые соединения, их фармацевтически приемлемые соли, сложные эфиры, сольваты, гидраты или производные, получают любым подходящим способом.
В некоторых вариантах осуществления, описанные здесь соединения помечены другими способами, включая, но не ограничиваясь ими, использование хромофоров или флуоресцентных групп, биолюминесцентных меток или хемилюминесцентных меток.
Фармацевтически приемлемые соли
В некоторых вариантах осуществления, описанные здесь соединения существуют в виде их фармацевтически приемлемых солей. В некоторых вариантах осуществления, способы, раскрытые в настоящем документе, включают способы лечения заболеваний введением таких фармацевтически приемлемых солей. В некоторых вариантах осуществления, способы, раскрытые в настоящем документе, включают способы лечения заболеваний введением таких фармацевтически приемлемых солей в виде фармацевтических композиций.
В некоторых вариантах осуществления, соединения, описанные в настоящем документе, имеют кислотные или основные группы и поэтому вступаю в реакцию с любым из ряда неорганических или органических оснований и неорганических и органических кислот с образованием фармацевтически приемлемой соли. В некоторых вариантах осуществления эти соли получают in situ во время окончательного выделения и очистки соединений, описанных в настоящем документе, или отдельной реакцией очищенного соединения в его свободной форме с подходящей кислотой или основанием и выделением полученной таким образом соли.
Обычно, но не абсолютно, соли по настоящему изобретению являются фармацевтически приемлемыми солями. Соли, охватываемые термином «фармацевтически приемлемые соли», относятся к нетоксичным солям соединений по настоящему изобретению. Соли описанных соединений, содержащих основной амин или другую основную функциональную группу, могут быть получены любым подходящим способом, известным в данной области, включая обработку свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные или органической кислотой, такой как уксусная кислота, трифторуксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота, метансульфоновая кислота, этансульфоновая кислота или подобные. Примеры фармацевтически приемлемых солей включают сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, фенилацетаты, фенилпропионаты, фенилбутраты, цитраты, лактаты, γ-гидроксибутираты, гликоляты, тартраты, миндаляты и сульфонаты, такие как ксилолсульфонаты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты и нафталин-2-сульфонаты.
Соли описанных соединений, содержащих карбоновую кислоту или другую кислотную функциональную группу, могут быть получены взаимодействием с подходящим основанием. Такая фармацевтически приемлемая соль может быть получена с основанием, которое дает фармацевтически приемлемый катион, который включает соли щелочных металлов (особенно натрия и калия), соли щелочноземельных металлов (особенно кальция и магния), соли алюминия и соли аммония, а также соли из физиологически приемлемых органических оснований, таких как триметиламин, триэтиламин, морфолин, пиридин, пиперидин, пиколин, дициклогексиламин, N, N'-дибензилэтилендиамин, 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, три-(2-гидроксиэтил)амин, прокаин, дибензилпиперидин, дегидроабиетиламин N, N′-бисдегидроабиетиламин, глюкамин, N-метилглюкамин, коллидин, холин, хинин, хинолин и основные аминокислоты, такие как лизин и аргинин.
Другие соли, которые не являются фармацевтически приемлемыми, могут быть полезны при получении соединений по настоящему изобретению, и их следует рассматривать как составляющие еще один аспект изобретения. Эти соли, такие как оксалат или трифторацетат, хотя сами по себе не являются фармацевтически приемлемыми, могут быть полезны при получении солей, используемых в качестве промежуточных продуктов при получении соединений по изобретению и их фармацевтически приемлемых солей.
Сольваты
В некоторых вариантах осуществления соединения, описанные в настоящем документе, существуют в виде сольватов. В некоторых вариантах осуществления представлены способы лечения заболеваний введением таких сольватов. Далее в настоящем документе описаны способы лечения заболеваний введением таких сольватов в виде фармацевтических композиций.
Сольваты содержат либо стехиометрические, либо не стехиометрические количества растворителя и, в некоторых вариантах осуществления, образуются во время процесса кристаллизации с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные. Гидраты образуются, когда растворителем является вода, или алкоголяты образуются, когда растворителем является спирт. Сольваты описанных здесь соединений обычно получают или они образуются во время описанных в настоящем документе процессов. Только в качестве примера, гидраты описанных в настоящем документе соединений удобно получать перекристаллизацией из смеси водный/органический растворитель с использованием органических растворителей, включая, но не ограничиваясь ими, диоксан, тетрагидрофуран или метанол. Кроме того, представленные в настоящем документе соединения существуют в не сольватированной, а также в сольватированной формах. В общем, сольватированные формы считаются эквивалентными не сольватированным формам для целей соединений и способов, представленных в настоящем документе.
Пролекарства
В некоторых вариантах осуществления, соединения, описанные в настоящем документе, существуют в форме пролекарства. В настоящем документе дополнительно описаны способы лечения заболеваний введением таких пролекарств. В настоящем документе также описаны способы лечения заболеваний введением таких пролекарств в виде фармацевтических композиций.
В некоторых вариантах осуществления, пролекарства включают соединения, в которых аминокислотный остаток или полипептидная цепь из двух или более (например, двух, трех или четырех) аминокислотных остатков ковалентно присоединена через амидную или сложноэфирную связь к свободной амино, гидрокси или группе карбоновой кислоты соединения, описанного в настоящем документе. Аминокислотные остатки включают, но не ограничиваются ими, 20 встречающихся в природе аминокислот и также включают 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин, норвалин, бета-аланин, гамма-аминомасляную кислоту, цитруллин, гомоцистеин, гомосерин, орнитин и метионин сульфон. В других вариантах осуществления, пролекарства включают соединения, в которых остаток нуклеиновой кислоты или олигонуклеотид из двух или более (например, двух, трех или четырех) остатков нуклеиновой кислоты ковалентно присоединен к соединению, описанному в настоящем документе.
Фармацевтически приемлемые пролекарства соединений, описанных в настоящем документе, также включают, но не ограничиваются ими, сложные эфиры, карбонаты, тиокарбонаты, производные N-ацила, производные N-ацилоксиалкила, четвертичные производные третичных аминов, N-основания Манниха, основания Шиффа, конъюгаты аминокислот, сложные эфиры фосфорной кислоты, соли металлов и сложные эфиры сульфоновой кислоты. В некоторых вариантах осуществления, соединения, содержащие свободные амино, амидо, гидрокси или карбоксильные группы, превращаются в пролекарства. Например, свободные карбоксильные группы дериватизируются в виде амидов или алкиловых эфиров. В некоторых случаях, все эти пролекарства включают группы, включая, но не ограничиваясь ими, функциональные группы простого эфира, амина и карбоновой кислоты.
Гидрокси пролекарства включают сложные эфиры, такие как, но не ограниченные ими, сложные эфиры ацилоксиалкила (например, ацилоксиметил, ацилоксиэтил), сложные эфиры алкоксикарбонилоксиалкила, сложные эфиры алкила, сложные эфиры арила, сложные эфиры фосфорной кислоты, сложные эфиры сульфоната, сульфатные эфиры и сложные эфиры, содержащие дисульфид; простые эфиры, амиды, карбаматы, гемисукцинаты, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как указано в Advanced Drug Delivery Reviews 1996, 19, 115.
Пролекарства, полученные из амина, включают, но не ограничены ими, следующие группы и комбинации групп:

а также сульфонамиды и фосфонамиды.
В некоторых случаях, участки на любых частях ароматического кольца подвержены различным метаболическим реакциям, поэтому введение соответствующих заместителей в структуры ароматического кольца уменьшает, минимизирует или устраняет этот метаболический путь.
Фармацевтические композиции и способы введения
В определенных вариантах осуществления, соединение формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанное в настоящем документе, вводят в виде чистого химического вещества. В некоторых вариантах осуществления, соединение формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанные в настоящем документе, объединены с фармацевтически подходящим и приемлемым носителем (также называемым в настоящем документе фармацевтически подходящим (или приемлемым) эксципиентом, физиологически подходящим (или приемлемым) эксципиентом или физиологически подходящим (или приемлемым) носителем), выбранным на основе выбранного пути введения и стандартной фармацевтической практики, описанной, например, в Remington: The Science and Practice of Pharmacy (Gennaro, 21st Ed. Mack Pub. Co., Easton, PA (2005)).
Соответственно, в настоящем документе представлена фармацевтическая композиция, содержащая, по меньшей мере, одно соединение формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанное в настоящем документе, или его фармацевтически приемлемую соль или сольват вместе с одним или несколькими фармацевтически приемлемыми носителями. Носитель(и) (или эксципиент(ы)) является приемлемым или подходящим, если носитель совместим с другими ингредиентами композиции и не вреден для реципиента (т.е. субъекта) композиции.
В одном варианте представлена фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулы (I) или его фармацевтически приемлемую соль.
В одном варианте представлена фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулы (II) или его фармацевтически приемлемую соль.
В одном варианте представлена фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулы (IIa) или его фармацевтически приемлемую соль.
В одном варианте представлена фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулы (IIb) или его фармацевтически приемлемую соль.
В одном варианте представлена фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулы (IIc) или его фармацевтически приемлемую соль.
В одном варианте представлена фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулы (IId) или его фармацевтически приемлемую соль.
В одном варианте представлена фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент и соединение формулы (IIe) или его фармацевтически приемлемую соль.
В другом варианте представлена фармацевтическая композиция, состоящая по существу из фармацевтически приемлемого эксципиента и соединения формулы (I) или его фармацевтически приемлемой соли. В другом варианте представлена фармацевтическая композиция, состоящая по существу из фармацевтически приемлемого эксципиента и соединения формулы (II) или его фармацевтически приемлемой соли. В другом варианте представлена фармацевтическая композиция, состоящая по существу из фармацевтически приемлемого эксципиента и соединения формулы (IIa) или его фармацевтически приемлемой соли. В другом варианте представлена фармацевтическая композиция, состоящая по существу из фармацевтически приемлемого эксципиента и соединения формулы (IIb) или его фармацевтически приемлемой соли. В другом варианте представлена фармацевтическая композиция, состоящая по существу из фармацевтически приемлемого эксципиента и соединения формулы (IIc) или его фармацевтически приемлемой соли. В другом варианте представлена фармацевтическая композиция, состоящая по существу из фармацевтически приемлемого эксципиента и соединения формулы (IId) или его фармацевтически приемлемой соли. В другом варианте представлена фармацевтическая композиция, состоящая по существу из фармацевтически приемлемого эксципиента и соединения формулы (IIe) или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления, соединения, описанные в настоящем документе, составлены в фармацевтические композиции. Фармацевтические композиции составляют обычным способом с использованием одного или нескольких фармацевтически приемлемых неактивных ингредиентов, которые облегчают переработку активных соединений в препараты, которые используются в фармацевтике. Правильный состав зависит от выбранного пути введения. Краткое изложение фармацевтических композиций, описанных в настоящем документе, можно найти, например, в Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington’s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. и Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins1999), включенные в настоящий документ в качестве ссылки для такого раскрытия.
В некоторых вариантах осуществления, соединения, описанные в настоящем документе, вводят либо отдельно, либо в комбинации с фармацевтически приемлемыми носителями, эксципиентами или разбавителями в фармацевтической композиции. Введение соединений и композиций, описанных в настоящем документе, может осуществляться любым способом, который обеспечивает доставку соединений к месту действия. Эти способы включают, но не ограничиваются ими, доставку энтеральными путями (включая пероральный, желудочный или дуоденальный питательный зонд, ректальный суппозиторий и ректальную клизму), парентеральные пути (инъекцию или инфузию, включая внутриартериальный, внутрисердечный, внутрикожный, интрадуоденальный, интрамедуллярный, внутримышечный, внутрикостный, внутрибрюшинный, интратекальный, внутрисосудистый, внутривенный, интравитреальный, эпидуральный и подкожный), ингаляционный, трансдермальный, трансмукозальный, сублингвальный, буккальный и местный (в том числе накожный, кожный, клизмы, глазные капли, ушные капли, интраназальный, вагинальный) пути введения, хотя наиболее подходящий путь может зависеть, например, от состояния и расстройства реципиента. Только в качестве примера, соединения, описанные в настоящем документе, можно вводить локально в область, нуждающуюся в лечении, например, местной инфузией во время операции, местным нанесением, таким как кремы или мази, инъекция, катетер или имплантат. Введение также может осуществляться прямой инъекцией в пораженную ткань или орган.
В некоторых вариантах осуществления фармацевтические композиции, подходящие для перорального введения, представлены в виде дискретных единиц, таких как капсулы, облатки или таблетки, каждая из которых содержит заранее определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или не водной жидкости; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. В некоторых вариантах осуществления активный ингредиент представлен в виде болюса, электуария или пасты.
Фармацевтические композиции, которые могут применяться перорально, включают таблетки, твердые капсулы из желатина, а также мягкие герметичные капсулы из желатина и пластификатора, такого как глицерин или сорбит. Таблетки могут быть изготовлены прессованием или формованием, необязательно с одним или несколькими дополнительными ингредиентами. Прессованные таблетки могут быть приготовлены прессованием в подходящей машине активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно смешанной со связующими агентами, инертными разбавителями или смазывающими агентами, поверхностно-активными веществами или диспергирующими агентами. Формованные таблетки могут быть изготовлены формованием в подходящей машине смеси порошкового соединения, смоченного инертным жидким разбавителем. В некоторых вариантах осуществления, в настоящем документе таблетки имеют покрытие или насечки и составлены таким образом, чтобы обеспечивать медленное или контролируемое высвобождение активного ингредиента. Все составы для перорального введения должны быть в дозировках, подходящих для такого введения. Твердые капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими агентами, такими как крахмалы, и/или смазывающими агентами, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах, активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. В некоторых вариантах осуществления, добавлены стабилизаторы. Сердцевины драже имеют подходящие покрытия. Для этой цели могут использоваться концентрированные растворы сахаров, которые могут необязательно содержать аравийскую камедь, тальк, поливинилпирролидон, гель карбопол, полиэтиленгликоль и/или диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. К таблеткам или покрытиям драже могут быть добавлены красители или пигменты для идентификации или для характеристики различных комбинаций доз активного соединения.
В некоторых вариантах осуществления, фармацевтические композиции составлены для парентерального введения инъекцией, например, болюсной инъекцией или непрерывной инфузией. Составы для инъекций могут быть представлены в виде стандартной дозированной формы, например, в ампулах или в многодозовых контейнерах с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать вспомогательные вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Композиции могут быть представлены в однодозовых или многодозовых контейнерах, например, в запечатанных ампулах и флаконах, и могут храниться в форме порошка или в условиях сушки вымораживанием (лиофилизаци), требующих только добавления стерильного жидкого носителя, например, физиологического раствора или стерильной апирогенной воды непосредственно перед использованием. Приготовленные для немедленного приема растворы и суспензии для инъекций могут быть приготовлены из стерильных порошков, гранул и таблеток, описанного ранее типа.
Фармацевтические композиции для парентерального введения включают водные и не водные (масляные) стерильные инъекционные растворы для инъекций активных соединений, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые делают композицию изотоничной с кровью предполагаемого реципиента; и водные и не водные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или сложные эфиры синтетических жирных кислот, такие как этилолеат или триглицериды или липосомы. Водные суспензии для инъекций могут содержать вещества, повышающие вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Необязательно, суспензия может также содержать подходящие стабилизаторы или агенты, которые увеличивают растворимость соединений, что позволяет приготовить высококонцентрированные растворы.
Фармацевтические композиции также могут быть составлены в виде депо препаратов. Такие препараты длительного действия могут быть введены имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, соединения могут быть составлены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами или в виде труднорастворимых производных, например, в виде труднорастворимой соли.
Для трансбуккального или сублингвального введения композиции могут иметь форму таблеток, лепешек, пастилок или гелей, составленных обычным способом. Такие композиции могут содержать активный ингредиент на ароматизированной основе, такой как сахароза и аравийская камедь или трагакант.
Фармацевтические композиции могут быть введены местно, то есть не системным введением. Оно включает нанесение соединения по настоящему изобретению снаружи на эпидермис или на ротовую полость и закапывание такого соединения в ухо, глаз и нос, так что соединение значительно не попадает в кровоток. Напротив, системное введение относится к пероральному, внутривенному, внутрибрюшинному и внутримышечному введению.
Фармацевтические композиции, подходящие для местного введения, включают жидкие или полужидкие препараты, подходящие для проникновения через кожу к месту воспаления, такие как гели, линименты, лосьоны, кремы, мази или пасты и капли, подходящие для введения в глаз, ухо или нос. Активный ингредиент может содержать, для местного применения, от 0,001% до 10% масс./масс., например от 1% до 2% массовых состава.
Фармацевтические композиции для введения ингаляцией удобно доставлять из инсуффлятора, распылителей под давлением или других удобных средств доставки аэрозольного спрея. Упаковки под давлением могут содержать подходящий пропеллянт, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае аэрозоля под давлением, дозированная единица может быть определена клапаном для доставки отмеренного количества. Альтернативно, для введения ингаляцией или инсуффляцией, фармацевтические препараты могут принимать форму сухой порошковой композиции, например порошковой смеси соединения и подходящей порошковой основы, такой как лактоза или крахмал. Порошковая композиция может быть представлена в виде стандартной дозированной формы, например, в капсулах, картриджах, желатиновых или блистерных упаковках, из которых порошок можно вводить с помощью ингалятора или инсуффлятора.
Следует понимать, что в дополнение к ингредиентам, конкретно упомянутым выше, соединения и композиции, описанные в настоящем документе, могут включать другие агенты, обычные в данной области техники, с учетом типа рассматриваемого препарата, например, те, которые подходят для перорального введения, могут включать ароматизаторы.
Обычно агент, такой как соединение формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), вводят в количестве, эффективном для облегчения или профилактики развития симптомов заболевания или расстройства (т.е. терапевтически эффективном количестве). Таким образом, терапевтически эффективным количеством может быть количество, которое способно, по меньшей мере, частично предотвращать или обращать вспять заболевание или расстройство. Доза, требуемая для получения эффективного количества, может варьироваться в зависимости от агента, состава, заболевания или расстройства, и индивидуума, которому вводят агент.
Определение эффективных количеств может также включать анализы in vitro, в которых различные дозы агента вводят в клетки в культуре, и концентрацию агента, эффективную для облегчения некоторых или всех симптомов, определяют для расчета концентрации, необходимой in vivo. Эффективные количества также могут быть основаны на исследованиях на животных in vivo.
Агент может быть введен до, одновременно и после появления симптомов заболевания или расстройства. В некоторых вариантах осуществления, агент вводят субъекту с семейным анамнезом заболевания или расстройства или имеющему фенотип, который может указывать на предрасположенность к заболеванию или расстройству, или имеющему генотип, который предрасполагает субъекта к заболеванию или расстройству.
Пероральные дозы обычно варьируются от примерно 1,0 мг до примерно 1000 мг, от одного до четырех раз или более в сутки.
Способы
Аномальные уровни TG2 и/или активности наблюдались при многих болезненных состояниях, включая, помимо прочего, целиакию-спру, нейродегенеративные заболевания (болезнь Альцгеймера, Паркинсона, Хантингтона), фиброз, катаракту и метастазы рака. В настоящем документе раскрыты способы ингибирования активности TG2. Рассматриваемые способы, например, включают воздействие на указанный фермент соединения, описанного в настоящем документе. В некоторых вариантах осуществления, соединением, используемым в одном или нескольких вышеперечисленных способах, является одно из родовых, подродовых или конкретных соединений, описанных в настоящем документе, таких как соединение формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe) или его приемлемая соль или сольват. Способность соединений, описанных в настоящем документе, ингибировать TG2 оценивается процедурами, известными в данной области и/или описанными в настоящем документе.
При целиакии-спру воспаление вызывается специфическими для заболевания Т-клетками, которые находятся в тонком кишечнике и распознают токсичные пептиды глютена из рациона. Этому процессу распознавания способствует модификация пептидов глютена с помощью TG2. Таким образом, энтеральное ингибирование TG2 является целью не пищевой терапии целиакии-спру.
В некоторых вариантах осуществления представлен способ лечения кишечного воспалительного расстройства у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления, представлен способ лечения кишечного воспалительного расстройства у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата, где кишечное воспалительное расстройство выбирают из целиакии, синдрома раздраженного кишечника, болезни Крона и герпетиформного дерматита.
В некоторых вариантах осуществления представлен способ лечения целиакии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления, представлен способ лечения синдрома раздраженного кишечника у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения болезни Крона у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения герпетиформного дерматита у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения фиброза у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения фиброза почек у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения идиопатического легочного фиброза у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения кистозного фиброза у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения фиброза печени у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения реперфузионного повреждения/ишемии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe) описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения ишемии миокарда у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения ишемии легких у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения ретинальной ишемии-реперфузии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения реперфузионного повреждения мозга у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения воспаления кожи у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения воспалительного состояния кожи у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения дерматита у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения нейродегенеративного заболевания у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения болезни Хантингтона у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения болезни Альцгеймера у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения болезни Паркинсона у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения синдрома Шегрена у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения системной красной волчанки у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения диабетической нефропатии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe) описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения сердечнососудистого заболевания у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения атеросклероза у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения гипертонии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения сердечной гипертрофии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения рака у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения меланомы у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения глиобластомы у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения менингиомы у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения рака поджелудочной железы у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения почечно-клеточной карциномы у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения рака груди у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения панкреатита у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения рассеянного склероза у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения заболевания глаз у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения дегенерации желтого пятна у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения катаракты у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения глаукомы у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения увеита у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения неоваскуляризации хориоидеи у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения неоваскуляризации роговицы у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения воспаления сетчатки у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения болезни раздраженного кишечника у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения болезни Крона у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения язвенного колита у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения амиотрофического бокового склероза (АБС) у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения болезни Шарко у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата. В некоторых вариантах осуществления представлен способ лечения болезни двигательного нейрона у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения склеродермии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения мышечной дистрофии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения воспалительного увеита у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения хронического повреждения аллотрансплантата у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения преэклампсии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ лечения сепсиса у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе, или его фармацевтически приемлемой соли или сольвата.
В некоторых вариантах осуществления представлен способ снижения активации трансглутаминазы 2 (TG2) у индивидуума, включающий введение индивидууму соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe), описанного в настоящем документе или его фармацевтически приемлемой соли или сольвата в дозе, эффективной для снижения активности TG2.
В определенных вариантах осуществления, раскрытое соединение, используемое одним или несколькими из вышеупомянутых способов, является одним из родовых, подродовых или конкретных соединений, описанных в настоящем документе, таких как соединения формулы (I), (II), (IIa), (IIb), (IIc), (IId) или (IIe).
Раскрытые соединения вводят пациентам (животным и людям), нуждающимся в таком лечении, в дозах, которые обеспечат оптимальную фармацевтическую эффективность. Следует понимать, что доза, необходимая для использования в любом конкретном варианте применения, будет варьироваться от пациента к пациенту не только в зависимости от конкретного выбранного соединения или композиции, но также в зависимости от пути введения, природы состояния, которое лечат, возраста и состояния пациента, сопутствующих лекарственных средств или специальной диеты, которой следует пациент, и других факторов, при этом соответствующая дозировка, в конечном счете, определяется лечащим врачом. Для лечения клинических состояний и заболеваний, указанных выше, предполагаемое соединение, раскрытое в настоящем документе, вводят перорально, подкожно, местно, парентерально, с помощью ингаляционного спрея или ректально в виде стандартных дозированных форм, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и носители. Парентеральное введение включает подкожные инъекции, внутривенные или внутримышечные инъекции или методы инфузии.
В настоящем документе также рассматриваются комбинированные терапии, например, совместное введение раскрытого соединения и дополнительного активного агента, как часть конкретной схемы лечения, предназначенной для обеспечения благоприятного эффекта от совместного действия этих терапевтических агентов. Благоприятный эффект комбинации включает, но не ограничивается этим, фармакокинетическое или фармакодинамическое совместное действие, возникающее в результате комбинации терапевтических агентов. Введение этих терапевтических агентов в комбинации обычно проводят в течение определенного периода времени (обычно недель, месяцев или лет в зависимости от выбранной комбинации). Комбинированная терапия предполагает введение нескольких терапевтических агентов последовательно, то есть, где каждый терапевтический агент вводят в разное время, а также введение этих терапевтических агентов или, по меньшей мере, двух из терапевтических агентов, по существу одновременно.
По существу одновременное введение осуществляется, например, путем введения субъекту одного состава или композиции (например, таблетки или капсулы с фиксированным соотношением каждого терапевтического агента) или нескольких отдельных составов (например, капсул) для каждого из терапевтических агентов. Последовательное или по существу одновременное введение каждого терапевтического агента осуществляется любым подходящим путем, включая, но не ограничиваясь ими, пероральные пути, внутривенные пути, внутримышечные пути и прямое всасывание через ткани слизистой оболочки. Терапевтические агенты вводят одним и тем же путем или разными путями. Например, первый терапевтический агент выбранной комбинации вводят внутривенной инъекцией, тогда как другие терапевтические агенты комбинации вводят перорально. Альтернативно, например, все терапевтические агенты вводят перорально или все терапевтические агенты вводят внутривенной инъекцией.
Комбинированная терапия также включает введение терапевтических агентов, как описано выше, в дополнительной комбинации с другими биологически активными ингредиентами и немедикаментозными терапиями. Если комбинированная терапия дополнительно включает немедикаментозную терапию, немедикаментозную терапию проводят в любое подходящее время до тех пор, пока достигается положительный эффект от совместного действия комбинации терапевтических агентов и немедикаментозной терапии. Например, в соответствующих случаях, положительный эффект все еще достигается, когда немедикаментозную терапию временно отменяют от введения терапевтических агентов, возможно на дни или даже недели.
Компоненты комбинации вводят пациенту одновременно или последовательно. Следует понимать, что компоненты присутствуют в одном и том же фармацевтически приемлемом носителе и, следовательно, их вводят одновременно. Альтернативно, активные ингредиенты присутствуют в отдельных фармацевтических носителях, таких как обычные пероральные дозированные формы, которые вводят либо одновременно, либо последовательно.
Наборы/Готовые изделия
Для использования в терапевтических целях, описанных в настоящем документе, наборы и готовые изделия также описаны в настоящем документе. Такие наборы могут включать носитель, упаковку или контейнер, который разделен на отсеки для приема одного или нескольких контейнеров, таких как флаконы, пробирки и подобные, где каждый из контейнеров, включая один из отдельных элементов, которые будут использоваться в способе, описанном в настоящем документ. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и пробирки. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик.
Готовые изделия, представленные в настоящем документе, содержат упаковочные материалы. Упаковочные материалы для использования при упаковке фармацевтических продуктов включают, например, патенты США №№ 5,323,907, 5,052,558 и 5,033,252. Примеры фармацевтических упаковочных материалов включают, но не ограничиваются ими, блистерные упаковки, бутылки, пробирки, ингаляторы, насосы, пакеты, флаконы, контейнеры, шприцы, флаконы и любой упаковочный материал, подходящий для выбранного состава и предполагаемого способа введения и лечения. Рассматривается широкий спектр составов соединений и композиций, представленных в настоящем документе, а также множество способов лечения любого заболевания, расстройства или состояния, для которых может быть полезным ингибирование TG2.
Например, контейнер(ы) может включать одно или несколько соединений, описанных в настоящем документе, необязательно в составе или в комбинации с другим агентом, как раскрыто в настоящем документе. Контейнер(ы) необязательно имеет стерильный порт доступа (например, контейнер может быть пакетом с раствором для внутривенного введения или флаконом, имеющим пробку, которую можно проткнуть иглой для подкожных инъекций). Такие наборы необязательно содержат соединение с идентифицирующим описанием или этикеткой или инструкциями, относящимися к его использованию в способах, описанных в настоящем документе.
Набор обычно может включать один или несколько дополнительных контейнеров, каждый с одним или несколькими различными материалами (такими как реагенты, необязательно в концентрированной форме, и/или устройства), желательными с коммерческой и пользовательской точки зрения для использования соединения, описанного в настоящем документе. Неограничивающие примеры таких материалов включают, но не ограничиваются ими, буферы, разбавители, фильтры, иглы, шприцы; этикетки на носителе, упаковке, контейнере, флаконе и/или пробирке с указанием содержимого, и/или инструкции по применению и вкладыши в упаковку с инструкциями по применению. Также обычно включается набор инструкций.
Этикетка может быть на контейнере или связана с ним. Этикетка может быть на контейнере, где буквы, цифры или другие символы, образующие этикетку, прикреплены, формованы или вытравлены на самом контейнере; этикетка может быть связана с контейнером, если он присутствует в резервуаре или носителе, который также удерживает контейнер, например, в виде вкладыша в упаковку. Этикетка может использоваться для обозначения того, что содержимое должно использоваться для определенного терапевтического применения. Этикетка также может указывать направления использования содержимого, например, в способах, описанных в настоящем документе.
В определенных вариантах осуществления, фармацевтические композиции могут быть представлены в упаковке или дозирующем устройстве, которое может содержать одну или несколько стандартных дозированных форм, содержащих соединение, представленное в настоящем документе. Например, упаковка может содержать металлическую или пластиковую фольгу, например блистерную упаковку. К упаковке или дозирующему устройству может прилагаться инструкция по введению. К упаковке или диспенсеру также может прилагаться уведомление, связанное с контейнером, в форме, предписанной государственным агентством, регулирующим производство, использование или продажу фармацевтических препаратов, где уведомление отражает одобрение U.S. Food and Drug Administration формы лекарственного средства для человека или применения в ветеринарии. Таким уведомлением, например, может быть этикетка, утвержденная для рецептурных лекарств, или одобренный вкладыш продукта. Композиции, содержащие соединение, представленное в настоящем документе, составленное в совместимом фармацевтическом носителе, также могут быть приготовлены, помещены в соответствующий контейнер и помечены для лечения указанного состояния.
Изобретение включает следующие признаки:
Признак 1. Соединение, имеющее структуру формулы (I):

где:

X, Y и Z выбирают из =C(R11)- и =N-, где, по меньшей мере, два из X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H и необязательно замещенного алкила; или R1 и R2, вместе с атомом азота, к которому они присоединены образуют необязательно замещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо;
R3 является -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 или -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, необязательно замещенного алкила, необязательно замещенного алкенила, необязательно замещенного алкинила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
R5 выбирают из необязательно замещенного алкила, необязательно замещенного гетероциклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
R6 и R7 независимо выбирают из H и необязательно замещенного алкила; или R6 и R7, вместе с атомом азота, к которому они присоединены образуют необязательно замещенное 5- или 6-членное гетероциклоалкильное кольцо;
R8 выбирают из необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила, необязательно замещенного гетероциклоалкила и необязательно замещенного гетероарила;
каждый R9 независимо выбирают из необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
каждый R10 независимо выбирают из H, необязательно замещенного алкила, необязательно замещенного циклоалкила, необязательно замещенного фенила и необязательно замещенного гетероарила;
каждый R11 независимо выбирают из H, галогена и необязательно замещенного алкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
Признак 2. Соединение, имеющее структуру формулы (II):

где:

X, Y и Z выбирают из =C(R11)- и =N-, где, по меньшей мере, два из X, Y и Z являются =C(R11)-;
R1 и R2 независимо выбирают из H, C1-6алкила и -C1-6алкил-OH; или R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R3 выбирают из -N(H)C(O)OR5, -OC(O)NR6R7, -N(H)C(O)NR6R7 и -N(H)C(O)R8;
каждый R4 независимо выбирают из галогена, -CN, -OR9, -SR9, -N(R10)2, -S(O)R9, -S(O)2R9, -NHS(O)2R9, -S(O)2N(R10)2, -C(O)R9, -C(O)OR9, -OC(O)R9, -C(O)N(R10)2, -OC(O)N(R10)2, -NR10C(O)N(R10)2, -NR10C(O)R9, -NR10C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10алкил-OR9, C2-10алкенила, C2-10алкинила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, -C2-6алкенил-C3-12циклоалкила, фенила, -C1-6алкил-фенила, -C2-6алкенил-фенила, C2-9гетероциклоалкила и C2-9гетероарила, где фенил, -C1-6алкил-фенил, -C2-6алкенил-фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила;
R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где C2-9гетероциклоалкил, -C1-6алкил-C2-9гетероциклоалкил, фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2; или R6 и R7, вместе с атомом азота, к которому они присоединены образует 5- или 6-членное гетероциклоалкильное кольцо необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
R8 выбирают из C1-6алкила, C1-6галоалкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, C3-6циклоалкила, фенила, C2-9гетероциклоалкила и C2-9гетероарила, где C3-6циклоалкил, фенил, C2-9гетероциклоалкил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R10 независимо выбирают из H, C1-10алкила, C1-10галоалкила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила, -C1-6алкил-фенила и C2-9гетероарила, где фенил, -C1-6алкил-фенил и C2-9гетероарил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила;
каждый R11 независимо выбирают из H, галогена, C1-6алкила и C1-6галоалкила;
n равно 0, 1, 2, 3 или 4; и
p равно 0, 1 или 2;
или его фармацевтически приемлемая соль или сольват.
Признак 3. Соединение по признаку 1 или признаку 2 или его фармацевтически приемлемая соль или сольват, где R1 и R2 независимо выбирают из H и C1-6алкила.
Признак 4. Соединение по признаку 3 или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является H.
Признак 5. Соединение по признаку 3 или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является C1-6алкилом.
Признак 6. Соединение по признаку 5 или его фармацевтически приемлемая соль или сольват, где R1 и R2 каждый является -CH3.
Признак 7. Соединение по признаку 1 или признаку 2 или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образует 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо необязательно замещенное одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
Признак 8. Соединение по признаку 1 или признаку 2 или его фармацевтически приемлемая соль или сольват, где R1 и R2, вместе с атомом азота, к которому они присоединены образуют незамещенное 3-, 4-, 5- или 6-членное гетероциклоалкильное кольцо.
Признак 9. Соединение по любому из признаков 1-8 или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)OR5.
Признак 10. Соединение по любому из признаков 1-9 или его фармацевтически приемлемая соль или сольват, где R5 выбирают из C1-6алкила, -C1-6алкил-OH, C1-6алкил-O-C1-6алкила, C1-6алкил-O-C(O)C1-6алкила, C2-9гетероциклоалкила, -C1-6алкил-C2-9гетероциклоалкила, -C1-6алкил-фенила и C2-9гетероарила.
Признак 11. Соединение по любому из признаков 1-10 или его фармацевтически приемлемая соль или сольват, где R5 выбирают из C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила, -C1-6алкил-C2-9гетероциклоалкила и -C1-6алкил-фенила.
Признак 12. Соединение по признаку 11 или его фармацевтически приемлемая соль или сольват, где R5 является C1-6алкилом.
Признак 13. Соединение по признаку 12 или его фармацевтически приемлемая соль или сольват, где R5 является -CH3.
Признак 14. Соединение по признаку 11 или его фармацевтически приемлемая соль или сольват, где R5 является -C1-6алкил-OH.
Признак 15. Соединение по признаку 11 или его фармацевтически приемлемая соль или сольват, где R5 является -C1-6алкил-O-C1-6алкилом.
Признак 16. Соединение по признаку 11 или его фармацевтически приемлемая соль или сольват, где R5 является -C1-6алкил-C2-9гетероциклоалкилом.
Признак 17. Соединение по признаку 11 или его фармацевтически приемлемая соль или сольват, где R5 является -C1-6алкил-фенилом.
Признак 18. Соединение по признаку 17 или его фармацевтически приемлемая соль или сольват, где R5 является -CH2-фенилом.
Признак 19. Соединение по любому из признаков 1-8 или его фармацевтически приемлемая соль или сольват, где R3 является -OC(O)NR6R7.
Признак 20. Соединение по любому из признаков 1-8 или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)NR6R7.
Признак 21. Соединение по признаку 19 или признаку 20 или его фармацевтически приемлемая соль или сольват, где R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-OH, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2.
Признак 22. Соединение по признаку 21 или его фармацевтически приемлемая соль или сольват, где R6 и R7 независимо выбирают из H, C1-6алкила, -C1-6алкил-O-C1-6алкила и -C1-6алкил-N(C1-6алкила)2.
Признак 23. Соединение по признаку 22 или его фармацевтически приемлемая соль или сольват, где R6 и R7 независимо выбирают из C1-6алкила.
Признак 24. Соединение по признаку 23 или его фармацевтически приемлемая соль или сольват, где R6 и R7 каждый является -CH3.
Признак 25. Соединение по любому из признаков 1-8 или его фармацевтически приемлемая соль или сольват, где R3 является -N(H)C(O)R8.
Признак 26. Соединение по признаку 25 или его фармацевтически приемлемая соль или сольват, где R8 является -C1-6алкил-OH.
Признак 27. Соединение по признаку 25 или его фармацевтически приемлемая соль или сольват, где R8 является -C1-6алкил-O-C1-6алкилом.
Признак 28. Соединение по признаку 25 или его фармацевтически приемлемая соль или сольват, где R8 является фенилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
Признак 29. Соединение по признаку 25 или его фармацевтически приемлемая соль или сольват, где R8 является C2-9гетероарилом, необязательно замещенным одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
Признак 30. Соединение по любому из признаков 1-29 или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, -C(O)-C1-10алкила, C1-10алкила, C1-10алкил-OH, C2-10алкенила, C1-10галоалкила, C1-10галоалкил-OH, C2-10галоалкенила, C3-12циклоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной, двумя или тремя группами, независимо выбранными из галогена и C1-6алкила.
Признак 31. Соединение по любому из признаков 1-29 или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10алкил-OH, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами.
Признак 32. Соединение по любому из признаков 1-31 или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена, -OR9, -C(O)OR9, C1-10алкила, C1-10галоалкила и -C1-6алкил-фенила, где -C1-6алкил-фенил необязательно замещен одним или двумя галогенами.
Признак 33. Соединение по любому из признаков 1- 32 или его фармацевтически приемлемая соль или сольват, где каждый R9 независимо выбирают из C1-10алкила, C1-10галоалкила, -C1-6алкил-C3-12циклоалкила, фенила и -C1-6алкил-фенила, где фенил и -C1-6алкил-фенил необязательно замещены одной или двумя группами, независимо выбранными из галогена и C1-6алкила.
Признак 34. Соединение по любому из признаков 1-33 или его фармацевтически приемлемая соль или сольват, где



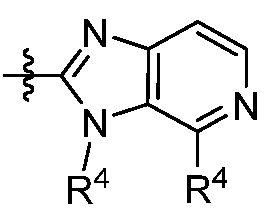

Признак 35. Соединение по любому из признаков 1-34 или его фармацевтически приемлемая соль или сольват, где





Признак 36. Соединение по признаку 35 или его фармацевтически приемлемая соль или сольват, где


Признак 37. Соединение по признаку 35 или его фармацевтически приемлемая соль или сольват, где


Признак 38. Соединение по признаку 35 или его фармацевтически приемлемая соль или сольват, где


Признак 39. Соединение по признаку 35 или его фармацевтически приемлемая соль или сольват, где


Признак 40. Соединение по признаку 35 или его фармацевтически приемлемая соль или сольват, где


Признак 41. Соединение по признаку 36 или его фармацевтически приемлемая соль или сольват, где


Признак 42. Соединение по признаку 35 или его фармацевтически приемлемая соль или сольват, где


Признак 43. Соединение по признаку 35 или его фармацевтически приемлемая соль или сольват, где


Признак 44. Соединение по любому из признаков 35-43 или его фармацевтически приемлемая соль или сольват, где R4 является C1-10алкилом.
Признак 45. Соединение по любому из признаков 35-43 или его фармацевтически приемлемая соль или сольват, где R4 является C1-10галоалкилом.
Признак 46. Соединение по любому из признаков 35-43 или его фармацевтически приемлемая соль или сольват, где R4 является -OR9.
Признак 47. Соединение по признаку 46 или его фармацевтически приемлемая соль или сольват, где R9 является -C1-6алкил-фенилом, необязательно замещенным одним или двумя галогенами.
Признак 48. Соединение по любому из признаков 1-33 или его фармацевтически приемлемая соль или сольват, где

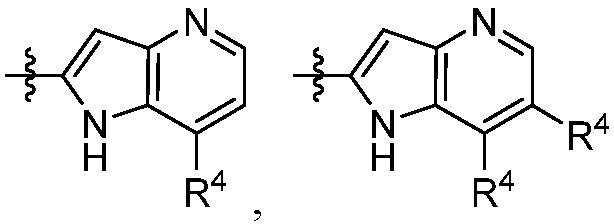
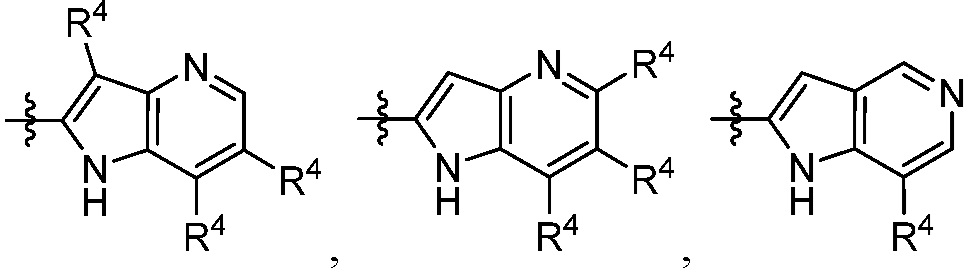



Признак 49. Соединение по признаку 48 или его фармацевтически приемлемая соль или сольват, где

Признак 50. Соединение по признаку 48 или его фармацевтически приемлемая соль или сольват, где


Признак 51. Соединение по признаку 48 или его фармацевтически приемлемая соль или сольват, где


Признак 52. Соединение по любому из признаков 48-51 или его фармацевтически приемлемая соль или сольват, где каждый R4 независимо выбирают из галогена и C1-10алкила.
Признак 53. Соединение по любому из признаков 1-52 или его фармацевтически приемлемая соль или сольват, где p равно 0.
Признак 54. Соединение по любому из признаков 1-52 или его фармацевтически приемлемая соль или сольват, где p равно 1.
Признак 55. Соединение по любому из признаков 1-52 или его фармацевтически приемлемая соль или сольват, где p равно 2.
Признак 56. Соединение по любому из признаков 1-55 или его фармацевтически приемлемая соль или сольват, где X, Y и Z каждый является =C(R11)-.
Признак 57. Соединение по любому из признаков 1-55 или его фармацевтически приемлемая соль или сольват, где Х является =N-, Y является =C(R11)- и Z является =C(R11)-.
Признак 58. Соединение по любому из признаков 1-55 или его фармацевтически приемлемая соль или сольват, где Х является =C(R11)-, Y является =C(R11)- и Z является =N-.
Признак 59. Соединение по любому из признаков 1-55 или его фармацевтически приемлемая соль или сольват, где Х является =C(R11)-, Y является =N- и Z является =C(R11)-.
Признак 60. Соединение по любому из признаков 1-59 или его фармацевтически приемлемая соль или сольват, где каждый R11 является H.
Признак 61. Соединение по любому из признаков 1-55 или его фармацевтически приемлемая соль или сольват, где Х является =C(H)-, Y является =C(H)- и Z является =C(Cl)-.
Признак 62. Соединение по любому из признаков 1-55 или его фармацевтически приемлемая соль или сольват, где Х является =C(H)-, Y является =C(H)- и Z является =C(CH3)-.
Признак 63. Фармацевтическая композиция, содержащая соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват и, по меньшей мере, один фармацевтически приемлемый эксципиент.
Признак 64. Способ лечения целиакии у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата.
Признак 65. Способ лечения нейродегенеративного заболевания у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата.
Признак 66. Способ по признаку 65, где нейродегенеративное заболевание выбирают из болезни Паркинсона, болезни Хантингтона и болезни Альцгеймера.
Признак 67. Способ лечения заболевания глаз у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата.
Признак 68. Способ по признаку 67, где заболевание глаз выбирают из дегенерации желтого пятна, глаукомы, катаракты и увеита.
Признак 69. Способ лечения рака у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата.
Признак 70. Способ по признаку 69, где рак выбирают из меланомы, глиобластомы, менингиомы, рака поджелудочной железы, почечно-клеточной карциномы и рака груди.
Признак 71. Способ лечения фиброз у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата.
Признак 72. Способ лечения фиброза почек у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата.
Признак 73. Способ лечения идиопатического легочного фиброза у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата.
Признак 74. Способ лечения фиброза печени у пациента, нуждающегося в этом, включающий введение пациенту терапевтически эффективного количества соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата.
Признак 75. Способ снижения активации трансглутаминазы 2 (TG2) у индивидуума, включающий введение индивидууму соединения по любому из признаков 1-62 или его фармацевтически приемлемой соли или сольвата, в дозе, эффективной для снижения активности TG2.
Признак 76. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в лечении целиакии.
Признак 77. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в лечении нейродегенеративного заболевания.
Признак 78. Соединение для применения по признаку 77, где нейродегенеративное заболевание выбирают из болезни Паркинсона, болезни Хантингтона и болезни Альцгеймера.
Признак 79. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в лечении заболевания глаз.
Признак 80. Соединение для применения по признаку 79, где заболевание глаз выбирают из дегенерации желтого пятна, глаукомы, катаракты и увеита.
Признак 81. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в лечении рака.
Признак 82. Соединение для применения по признаку 81, где рак выбирают из меланомы, глиобластомы, менингиомы, рака поджелудочной железы, почечно-клеточной карциномы и рака груди.
Признак 83. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в лечении фиброза.
Признак 84. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в лечении фиброза почек.
Признак 85. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в лечении идиопатического легочного фиброза.
Признак 86. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в лечении фиброза печени.
Признак 87. Соединение по любому из признаков 1-62 или его фармацевтически приемлемая соль или сольват, для применения в снижении активации трансглутаминазы 2 (TG2).
ПРИМЕРЫ
Аббревиатуры
ДМФ: N, N-диметилформамид
EtOAc: этилацетат
ДХМ: дихлорметан
MeOH: метанол
Py: пиридин
ДМСО: диметилсульфоксид
ТГФ: тетрагидрофуран
IPA: изопропил
IPAm: изопропамид
ТФК: трифторуксусная кислота
CAN: ацетонитрил
TEA: N, N-диметилформамид триэтиламин
Me: метил
Boc: т-бутоксикарбонил
DMP: периодинан Десса-Мартина
PMB: п-метоксибензил
Ph: фенил
Bn: бензил
TBDPS: т-бутилдифенилсилил
TBS: т-бутилдиметилсилил
SEM: 2-(триметилсилил)этоксиметил
DIBALH: гидрид диизобутилалюминия
PTSA: п-толуолсульфоновая кислота
TBAF: фторид тетрабутиламмония
HATU: гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония
EDCl: гидрохлорид 1-этил-3-(3-диметиламинопропил) карбодиимида
CDI: N, N-Карбонилдиимидазол
Pd2(dba)3: три(дибензилиденацетон)дипалладий(0) CAS: 51364-51-3
Pd(dppf)Cl2: [1,1'-бис(дифенилфосфино)ферроцен] дихлорпалладий(II)
t-BuXphos: 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил
MsCl: мезил (метансульфонил) хлорид
POCl3: оксихлорид фосфора
t-BuOK: трет-бутоксид калия
DMAP: N, N-4-диметиламинопиридин
DIPEA/DIEA: диизопропилэтиламин
T3P: пропилфосфоновый ангидрид
ЖХВД: жидкостная хроматография высокого давления
ЖХМС: жидкостная хроматография и масс спектрометрия
СЖХ: сверхкритическая жидкостная хроматография
МС: масс спектрометрия
m/z: соотношение массы к заряду
экв: эквивалент
Синтез промежуточной карбаматной кислоты (I-9):


К раствору (4S)-4-амино-5-трет-бутокси-5-оксо-пентановой кислоты (100 г, 492 ммоль) и TEA (99,6 г, 984 ммоль, 137 мл) в диоксане (500 мл) и H2O (500 мл) добавляют метил карбонохлоридат (55,8 г, 590 ммоль, 45,7 мл) при 0°C. Смесь перемешивают при 25°C в течение 16 ч. Насыщ. Na2CO3 (водн) добавляют для доведения pH~9. Затем промывают этилацетатом (500 мл x 2). HCl (6 N) затем добавляют для доведения pH~3 и смесь экстрагируют этилацетатом (500 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (500 мл x 1), сушат над Na2SO4 и концентрируют с получением желтого масла. Неочищенный продукт (4S)-5-трет-бутокси-4-(метоксикарбониламино)-5-оксо-пентановую кислоту (I-2) (320 г) применяют на следующей стадии без дальнейшей очистки в виде светло-желтого масла.
К раствору (4S)-5-трет-бутокси-4-(метоксикарбониламино)-5-оксо-пентановой кислоты (150 г, 574 ммоль) в ДХМ (750 мл) и MeOH (750 мл) добавляют диазометил(триметил)силан (2 M, 344 мл) при 0°C. Смесь перемешивают при 25°C в течение 15 мин. Смесь фильтруют и концентрируют при пониженном давлении с получением O1-трет-бутил O5-метил (2S)-2-(метоксикарбониламино)пентандиоата (I-3) (250 г) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 5,30-5,28 (м, 1H), 4,27-4,24 (м, 1H), 3,68 (с, 6H), 2,46-2,29 (м, 2H), 2,25-2,12 (м, 1H), 2,02-1,85 (м, 1H), 1,46 (с, 9H).
К раствору O1-трет-бутил O5-метил (2S)-2-(метоксикарбониламино)пентандиоата (125 г, 454 ммоль) в MeCN (1300 мл) добавляют DMAP (55,5 г, 454 ммоль) и Boc2O (248 г, 1,14 моль, 261 мл) при 25°C. Смесь перемешивают при 70°C в течение 3 ч. Смесь концентрируют при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищают колоночной хроматографией с получением O1-трет-бутил O5-метил (2S)-2-[трет-бутоксикарбонил(метоксикарбонил)амино]пентандиоата (I-4) (264 г, 77% выход) в виде желтого масла,1H ЯМР (400 МГц, CDCl3) δ 4,87 (дд, J=9,2, 4,4 Гц, 1H), 3,81 (с, 3H), 3,67 (с, 3H), 2,50-2,31 (м, 3H), 2,23-2,12 (м, 1H), 1,50 (с, 9H), 1,44 (с, 9H).
К раствору O1-трет-бутил O5-метил (2S)-2-[трет-бутоксикарбонил(метоксикарбонил)амино]пентандиоата (100 г, 266 ммоль) в ТГФ (1 л) добавляют DIBAL-H (1 M, 532,7 мл) при -65°C. Смесь перемешивают при -65°C в течение 30 мин. Реакционную смесь гасят насыщенным раствором NH4Cl (500 мл) при 0°C. Полученную суспензию экстрагируют EtOAc (1000 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (500 мл) сушат над безводным Na2SO4. Фильтруют и концентрируют при пониженном давлении с получением масла. Масло очищают колоночной хроматографией с получением трет-бутил (2S)-2-[трет-бутоксикарбонил(метоксикарбонил)амино]-5-гидрокси-пентаноата (I-5) (37 г, 20% выход) в виде желтого масла и трет-бутил (2S)-2-[трет-бутоксикарбонил(метоксикарбонил)амино]-5-оксо-пентаноата (I-6) (107 г, 58% выход) в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 9,77-9,73 (м, 1H), 4,81 (дд, J=5,2, 9,4 Гц, 1H), 4,13-4,06 (м, 1H), 4,10 (кв, J=7,1 Гц, 1H), 3,81-3,79 (м, 3H), 3,70-3,62 (м, 2H), 2,50-2,41 (м, 2H), 2,29 (ш дд, J=5,6, 13,6 Гц, 1H), 2,21-2,06 (м, 1H), 1,49 (с, 9H), 1,43 (с, 9H), 1,24 (т, J=7,2 Гц, 2H), 0,23-0,15 (м, 1H).
К раствору 2-диизопропоксифосфорил-N, N-диметил-ацетамида (I-7) (20,7 г, 82,5 ммоль) в ТГФ (200 мл) добавляют t-BuOK (7,41 г, 66,0 ммоль) при -10°C. Смесь перемешивают в течение 0,5 ч. Затем трет-бутил (2S)-2-[трет-бутоксикарбонил (метоксикарбонил)амино]-5-оксо-пентаноат (I-6) (19 г, 55,0 ммоль) добавляют при -10°C и полученную реакционную смесь перемешивают в течение дополнительных 0,5 ч. Реакционную смесь гасят насыщенным раствором NH4Cl (500 мл) при 0°C. Полученную суспензию экстрагируют EtOAc (500 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (250 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Масло очищают колоночной хроматографией с получением трет-бутил (E,2S)-2-[трет-бутоксикарбонил(метоксикарбонил)амино]-7-(диметиламино)-7-оксо-гепт-5-еноата (I-8) (44 г, 55% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 6,87-6,76 (м, 1H), 6,25 (д, J=14,9 Гц, 1H), 4,84-4,77 (м, 1H), 3,80 (с, 3H), 3,05 (с, 3H), 2,97 (с, 3H), 2,29-2,18 (м, 3H), 2,07-1,97 (м, 1H), 1,48 (с, 9H), 1,42 (с, 9H).
К раствору трет-бутил (E,2S)-2-[трет-бутоксикарбонил(метоксикарбонил)амино]-7-(диметиламино)-7-оксо-гепт-5-еноата (20,5 г, 49,5 ммоль) в ТФК (40 мл) и ДХМ (100 мл) при 25°C. Смесь перемешивают в течение 30 мин. Смесь концентрируют при пониженном давлении с получением неочищенного продукта. Неочищенный продукт(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (I-9) (48 г) применяют на следующей стадии без дальнейшей очистки в виде желтого масла.
Синтез i-Pr фосфата (I-7):
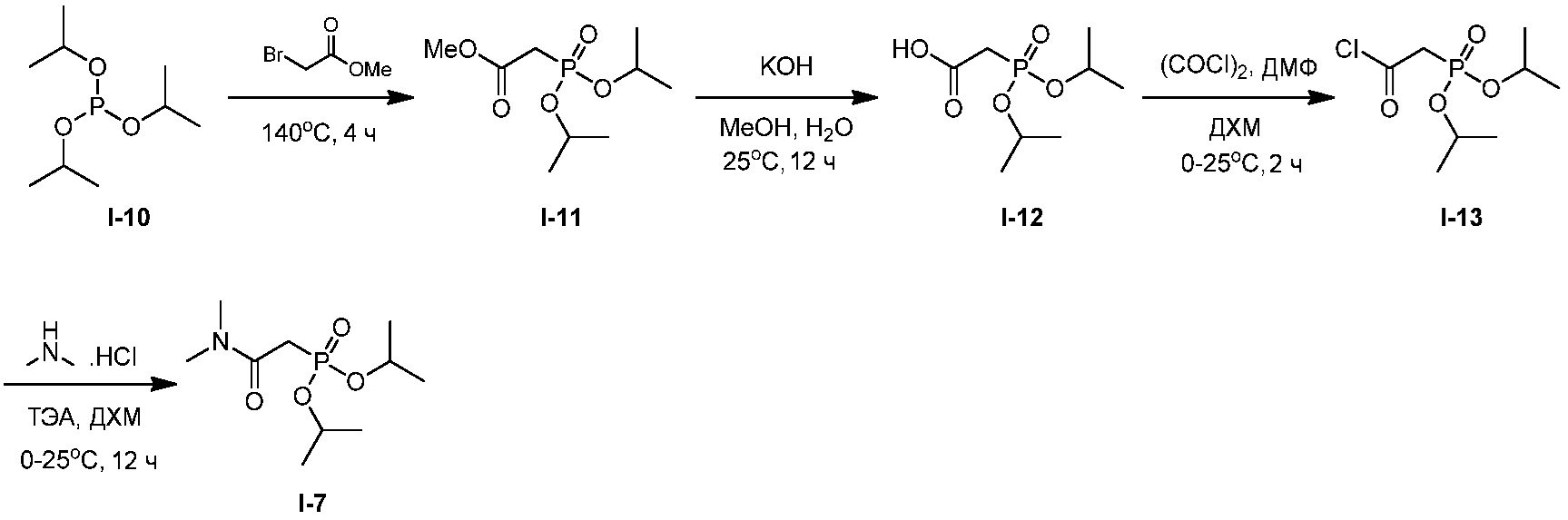
Триизопропил фосфит (44,5 г, 213,70 ммоль, 49,17 мл) и метил 2-бромацетат (35,96 г, 235,07 ммоль, 22,20 мл) загружают в реактор и реакционную смесь перемешивают при 140°C в течение 4 ч. Смесь концентрируют с получением метил 2-диизопропоксифосфорилацетата (I-11) (220 г) в виде бесцветного масла, которое применяют на следующей стадии без дальнейшей очистки.
К раствору метил 2-диизопропоксифосфорилацетата (55 г, 230,88 ммоль) в MeOH (280 мл) и H2O (280 мл) добавляют KOH (25,91 г, 461,76 ммоль) при 25°C. Реакционную смесь перемешивают при 25°C в течение 12 часов. Реакционную смесь концентрируют при пониженном давлении для удаления MeOH, затем остаток промывают EtOAc (100 мл х 2), отделяют водную фазу, которую доводят до pH~1 добавлением HCl (12 N) и экстрагируют EtOAc (150 мл x 3), объединенные органические слои промывают насыщенным солевым раствором (100 мл x 2), сушат над безводным Na2SO4 и затем концентрируют при пониженном давлении с получением 2-диизопропоксифосфорилуксусной кислоты (I-12) (150 г) в виде светло-желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,50 (шс, 2H), 4,78 (квинд, J=6,2, 7,7 Гц, 2H), 3,02-2,84 (м, 2H), 1,33 (д, J=6,2 Гц, 12H).
Раствор 2-диизопропоксифосфорилуксусной кислоты (25 г, 111,51 ммоль, 1 экв) в ДХМ (250 мл), затем оксалил дихлорид (28,31 г, 223,02 ммоль, 19,52 мл) и ДМФ (815,09 мг, 11,15 ммоль, 857,98 мкл) добавляют под N2 при 0°C. Смесь перемешивают при 25°C в течение 2 ч. Реакционную смесь концентрируют с получением неочищенного продукта 2-диизопропоксифосфорилацетилхлорида (I-13) (104 г) в виде красной жидкости, которую применяют на следующей стадии без дальнейшей очистки.
Смесь N-метилметанамина HCl (13,11 г, 160,73 ммоль, 14,73 мл) и TEA (32,53 г, 321,47 ммоль, 44,74 мл) в ДХМ (120 мл) перемешивают при 0°C в течение 0,5 часа и затем 2-диизопропоксифосфорилацетилхлорид (26 г, 107,16 ммоль, 1 экв) добавляют под N2. Смесь перемешивают при 25°C в течение 10 часов под N2 атмосферой. Реакционную смесь гасят добавлением насыщ. NH4Cl раствора 200 мл и органическую фазу промывают насыщ. NH4Cl раствором (100 мл х 5), солевым раствором (100 мл х 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 2-диизопропоксифосфорил-N, N-диметил-ацетамида (I-7) (100 г) в виде красного масла.1H ЯМР (400 МГц, CDCl3) δ 7,25 (с, 1H), 4,80-4,67 (м, 2H), 3,11 (с, 1H), 3,13-3,07 (м, 1H), 3,15-3,07 (м, 1H), 3,02 (с, 1H), 3,04-3,00 (м, 1H), 2,98-2,96 (м, 1H), 2,95 (д, J=1,3 Гц, 1H), 2,99-2,93 (м, 1H), 1,39-1,21 (м, 12H).
Следующие промежуточные кислоты получают согласно вышеуказанным методикам, описанным для синтеза I-9 с применением подходящих реагентов.
Синтез промежуточных обратных карбаматных кислот (I-37):


К смеси (S)-5-оксотетрагидрофуран-2-карбоновой кислоты (5 г, 38,4 ммоль) и DMAP (2,35 г, 19,2 ммоль) в t-BuOH (50 мл) добавляют Boc2O (10,1 г, 46,1 ммоль, 10,6 мл). Смесь перемешивают при 40°C в течение 3 ч. Смесь разбавляют водой (100 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (200 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением (S)-трет-бутил 5-оксотетрагидрофуран-2-карбоксилата (I-28) (3,9 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 4,87-4,78 (м, 1H), 2,70-2,43 (м, 3H), 2,35-2,19 (м, 1H), 1,50 (с, 9H).
К смеси (S)-трет-бутил 5-оксотетрагидрофуран-2-карбоксилата (10,1 г, 54,2 ммоль) в ТГФ (60 мл) добавляют раствор NaBH4 (8,21 г, 217 ммоль) в ледяной H2O (30 мл). NaBH4 (4,1 г, 108 ммоль) добавляют в полученный выше раствор маленькими порциями при 0°C. Смесь перемешивают при 10°C в течение 3 ч. Смесь гасят насыщенным раствором NH4Cl (100 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением (S)-трет-бутил 2,5-дигидроксипентаноата (I-29) (4,8 г) в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 4,17-4,03 (м, 1H), 3,75-3,60 (м, 2H), 2,02-1,85 (м, 1H), 1,78-1,61 (м, 3H), 1,57-1,44 (м, 9H).
К смеси (S)-трет-бутил 2,5-дигидроксипентаноата (4,8 г, 25,2 ммоль) в ДХМ (40 мл) добавляют TBDPS-Cl (8,32 г, 30,3 ммоль, 7,78 мл) и имидазол (5,15 г, 75,7 ммоль). Смесь перемешивают при 10°C в течение 1 ч под N2 атмосферой. Смесь разбавляют водой (100 мл) и экстрагируют ДХМ (100 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (250 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением (S)-трет-бутил 5-((трет-бутилдифенилсилил)окси)-2-гидроксипентаноата (I-30) (8,8 г) в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 7,71-7,63 (м, 4H), 7,47-7,35 (м, 6H), 4,15-4,04 (м, 1H), 3,75-3,64 (м, 2H), 2,91 (с, 1H), 1,80-1,61 (м, 1H), 1,80-1,55 (м, 3H), 1,50 (с, 9H), 1,06 (с, 9H).
К смеси (S)-трет-бутил 5-((трет-бутилдифенилсилил)окси)-2-гидроксипентаноата (0,8 г, 1,87 ммоль) в CHCl3 (10 мл) добавляют CDI (333 мг, 2,05 ммоль). Смесь перемешивают при 15°C в течение 2 ч. Смесь концентрируют в вакууме с получением (S)-1-(трет-бутокси)-5-((трет-бутилдифенилсилил)окси)-1-оксопентан-2-ил 1H-имидазол-1-карбоксилата (I-31) (976 мг) в виде бесцветного масла.
К смеси (S)-1-(трет-бутокси)-5-((трет-бутилдифенилсилил)окси)-1-оксопентан-2-ила 1H-имидазол-1-карбоксилата (976 мг, 1,87 ммоль) и гидрохлорида N-метилметанамина (167 мг, 2,05 ммоль) в CHCl3 (20 мл) добавляют DMAP (228 мг, 1,87 ммоль) и TEA (378 мг, 3,73 ммоль, 0,520 мл). Смесь перемешивают при 40°C в течение 16 ч. Реакционную смесь разбавляют водой (20 мл) и экстрагируют ДХМ (15 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением (S)-трет-бутил 5-((трет-бутилдифенилсилил)окси)-2-((диметилкарбамоил)окси)пентаноат (I-32) (800 мг) в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 7,70-7,61 (м, 4H), 7,48-7,33 (м, 6H), 4,95-4,75 (м, 1H), 3,78-3,62 (м, 2H), 2,93 (с, 6H), 2,04-1,82 (м, 2H), 1,75-1,61 (м, 2H), 1,47 (с, 9H), 1,06 (с, 9H).
К смеси (S)-трет-бутил 5-((трет-бутилдифенилсилил)окси)-2-((диметилкарбамоил)окси)пентаноата (0,8 г, 1,6 ммоль) в ТГФ (10 мл) добавляют TBAF (1 M, 1,6 мл). Смесь перемешивают при 15°C в течение 2 ч. Смесь концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением (S)-трет-бутил 2-((диметилкарбамоил)окси)-5-гидроксипентаноата (I-33) (0,36 г) в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 4,94-4,84 (м, 1H), 3,70 (т, J=6,4 Гц, 2H), 3,03-2,87 (м, 6H), 2,00-1,82 (м, 2H), 1,76-1,66 (м, 2H), 1,47 (с,9H).
К смеси (S)-трет-бутил 2-((диметилкарбамоил)окси)-5-гидроксипентаноата (0,31 г, 1,19 ммоль) в ДХМ (20 мл) добавляют DMP (755 мг, 1,78 ммоль, 0,551 мл) при 0°C. Смесь перемешивают при 15°C в течение 0,5 ч. Смесь концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением (S)-трет-бутил 2-((диметилкарбамоил)окси)-5-оксопентаноата (I-34) (0,3 г) в виде белого твердого вещества,1H ЯМР (400 МГц, CDCl3) δ 9,83-9,76 (м, 1H), 4,96-4,82 (м, 1H), 3,00-2,83 (м, 6H), 2,67-2,49 (м, 2H), 2,28-2,11 (м, 2H), 1,48 (с, 9H).
К смеси диэтил (2-(диметиламино)-2-оксоэтил)фосфоната (I-35) (310 мг, 1,39 ммоль) в ТГФ (10 мл) добавляют t-BuOK (156 мг, 1,39 ммоль) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. (S)-трет-бутил 2-((диметилкарбамоил)окси)-5-оксопентаноат (I-34) (0,3 г, 1,16 ммоль) в ТГФ (5 мл) добавляют в полученный выше раствор. Смесь перемешивают при 0°C в течение 0,5 ч. Полученный раствор разбавляют водой (10 мл) и экстрагируют этилацетатом (20 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением (S, E)-трет-бутил 7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-еноата (I-36) (0,3 г, 78% выход) в виде бесцветного масла.
К смеси (S, E)-трет-бутил 7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-еноат (0,3 г, 0,904 ммоль) в ДХМ (1 мл) добавляют ТФК (3,08 г, 27 ммоль, 2 мл) при 0°C. Смесь перемешивают при 15°C в течение 3,5 ч. Смесь концентрируют в вакууме и лиофилизируют с получением (S, E)-7-(диметиламино)-2-((диметилкарбамоил)окси)-7-оксогепт-5-еновой кислоты (I-37) (250 мг) в виде розового масла.
Смесь 2-хлор-N, N-диметилацетамида (5,0 г, 41,1 ммоль) и триэтилфосфита (6,83 г, 41,1 ммоль) дегазируют и продувают N2 в течение 3 раз. Смесь перемешивают при 160°C в течение 8 ч под N2 атмосферой. Смесь концентрируют и очищают колоночной хроматографией с получением диэтил (2-(диметиламино)-2-оксоэтил)фосфоната (I-35) (4,5 г) в виде желтого масла. ЖХМС m/z 224,3 (M+1)+,1H ЯМР (400 МГц, CDCl3) δ 4,20-4,12 (м, 4H), 3,11 (с, 3H), 3,07-3,01 (д, J=22 Гц, 2H), 2,97 (с, 3H), 1,35-1,31 (т, J=7,2 Гц, 6H).
Следующие промежуточные обратные карбаматные кислоты получают согласно описанных выше методов, описанных для синтеза I-37 с применением подходящих реагентов.
Синтез дейтерированной обратной карбаматной кислоты (I-54):

К раствору (S)-трет-бутил 5-((трет-бутилдифенилсилил)окси)-2-гидроксипентаноата (20 г, 46,7 ммоль) в ДХМ (200 мл) добавляют DMP (27,8 г, 65,3 ммоль) порциями при 0°C. После перемешивания при 15°C в течение 18 ч, смесь выливают в H2O (300 мл). Водную фазу экстрагируют EtOAc (200 мл х 2). Объединенные органические слои (ДХМ и EtOAc) сушат над Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 5-((трет-бутилдифенилсилил)окси)-2-оксопентаноата (I-46) (14 г) в виде светло-желтого масла. ЖХМС m/z 449,2 (M+23)+.
К раствору трет-бутил 5-[трет-бутил(дифенил)силил]окси-2-оксо-пентаноата (15,5 г, 26,9 ммоль) в пиридине (32,0 мл) добавляют D2O (10,8 г, 538 ммоль). Смесь перемешивают при 15°C в течение 24 ч. Реакционную смесь концентрируют с получением остатка. Остаток растворяют в пиридине (32,0 мл) и добавляют D2O (10,8 г, 538 ммоль). Смесь перемешивают при 15°C в течение 72 ч. Реакционную смесь концентрируют с получением остатка второй раз, и остаток растворяют в пиридине (32,0 мл) и добавляют D2O (10,8 г, 538 ммоль). Реакционную смесь перемешивают при 15°C в течение еще 24 ч. Реакционную смесь концентрируют с получением трет-бутил 5-[трет-бутил(дифенил)силил]окси-3,3-дидейтерио-2-оксо-пентаноата (I-47) (16 г) в виде светло-желтого масла. ЖХМС m/z 451,2 (M+23)+.
К раствору трет-бутил 5-[трет-бутил(дифенил)силил]окси-3,3-дидейтерио-2-оксо-пентаноата (10 г, 23,3 ммоль) в CD3OD(30 мл) добавляют NaBH4 (265 мг, 7,00 ммоль) при 0°C. После перемешивания при 0°C в течение 0,25 ч, смесь гасят H2O (100 мл) и доводят pH=7 добавлением HCl (1 M). Результат экстрагируют EtOAc (100 млх3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 5-[трет-бутил(дифенил)силил]окси-3,3-дидейтерио-2-гидрокси-пентаноата (I-48) (7,5 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,71-7,64 (м, 4H), 7,46-7,35 (м, 6H), 4,09 (с, 1H), 3,70 (т, J=6,0 Гц, 2H), 2,90 (шс, 1H), 1,77-1,61 (м, 2H), 1,50 (с, 9H), 1,06 (с, 9H).
К раствору трет-бутил 5-[трет-бутил(дифенил)силил]окси-3,3-дидейтерио-2-гидрокси-пентаноата (7 г, 16,3 ммоль) в трихлорметане (120 мл) добавляют ди(имидазол-1-ил)метанон (3,16 г, 19,5 ммоль). Смесь перемешивают при 15°C в течение 1 ч. Желаемое соединение (I-49) [1-трет-бутоксикарбонил-4-[трет-бутил(дифенил)силил]окси-2,2-дидейтерио-бутил]имидазол-1-карбоксилат получают в виде бесцветного раствора в CHCl3 (120 мл), который применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 524,3 (M+23)+.
К раствору [1-трет-бутоксикарбонил-4-[трет-бутил(дифенил)силил]окси-2,2-дидейтерио-бутил]имидазол-1-карбоксилата (8,5 г, 16,2 ммоль) в CHCl3 (120 мл) добавляют N-метилметанамин HCl (2,10 г, 25,9 ммоль) и TEA (3,28 г, 22,4 ммоль) при 0°C. После перемешивания при 15°C в течение 88 ч, смесь выливают в H2O (100 мл). Результат разделяют. Водную фазу экстрагируют EtOAc (50 мл х 2). Объединенные органические слои (EtOAc и ДХМ) сушат над Na2SO4, фильтруют и концентрируют с получением трет-бутил5-[трет-бутил(дифенил)силил]окси-3,3-дидейтерио-2-(диметилкарбамоилокси)пентаноата (I-50) (8,3 г, 11,6 ммоль) в виде светло-желтого масла. ЖХМС m/z 524,3 (M+23)+.
К раствору трет-бутил 5-[трет-бутил(дифенил)силил]окси-3,3-дидейтерио-2-(диметилкарбамоилокси)пентаноата (8,3 г, 11,6 ммоль) в ТГФ (100 мл) добавляют N, N-диэтилэтанамин тригидрофторид (3,73 г, 23,2 ммоль) и TEA (2,93 г, 29,0 ммоль). После перемешивания при 15°C в течение 16 ч, смесь выливают в H2O (200 мл). Полученную смесь экстрагируют EtOAc (100 мл х 2). Объединенные органические слои концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 3,3-дидейтерио-2-(диметилкарбамоилокси)-5-гидрокси-пентаноата (I-51) (3,5 г) в виде светло-желтого масла,1H ЯМР (400 МГц, CDCl3) δ 4,88 (с, 1H), 3,69 (т, J=6,4 Гц, 2H), 2,97 (с, 3H), 2,93 (с, 3H), 1,69 (т, J=6,4 Гц, 2H), 1,47 (с, 9H).
К раствору трет-бутил 3,3-дидейтерио-2-(диметилкарбамоилокси)-5-гидрокси-пентаноата (3,5 г, 13,3 ммоль) в ДХМ (50 мл) добавляют DMP (8,46 г, 19,9 ммоль) при 0°C. После перемешивания при 15°C в течение 2 ч, смесь разбавляют EtOAc (100 мл) и затем выливают в H2O (100 мл). Образуется белое твердое вещество и смесь фильтруют. Фильтрат разделяют, и концентрируют органической слой с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 3,3-дидейтерио-2-(диметилкарбамоилокси)-5-оксо-пентаноата (I-52) (2,7 г) в виде светло-желтого масла,1H ЯМР (400 МГц, CDCl3) δ 9,80 (т, J=1,2 Гц, 1H), 4,89 (с, 1H), 2,95 (с, 3H), 2,93 (с, 3H), 2,51-2,64 (м, 2H), 1,47 (с, 9H).
К раствору диэтил (2-(диметиламино)-2-оксоэтил)фосфоната (I-35) (2,77 г, 12,4 ммоль) в ТГФ (20 мл) добавляют NaH (496 мг, 12,4 ммоль, 60% чистота) при -10°C. Смесь перемешивают в течение 10 мин. Затем раствор трет-бутил 3,3-дидейтерио-2-(диметилкарбамоилокси)-5-оксо-пентаноата (I-52) (2,7 г, 10,3 ммоль) в ТГФ (10 мл) добавляют по каплям к реакционной смеси при -10°C. После перемешивания при -10°C в течение 1 ч, смесь выливают в H2O (100 мл). Результат экстрагируют EtOAc (50 млх3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют с получением трет-бутил (E)-3,3-дидейтерио-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноата (I-53) (3,0 г, 8,72 ммоль) в виде светло-желтого масла. ЖХМС m/z 331,1 (M+1)+.
К раствору трет-бутил(E)-3,3-дидейтерио-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноат (3 г, 8,72 ммоль) в ДХМ (10 мл) добавляют ТФК (20 мл). После перемешивания при 15°C в течение 16 ч, смесь концентрируют с получением остатка при 30°C с получением остатка. Остаток очищают преп-ЖХВД с получением (E)-3,3-дидейтерио-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (I-54) (1,7 г, 5,39 ммоль) в виде белого твердого вещества. ЖХМС m/z 275,1 (M+1)+.
Синтез промежуточного соединения (I-63):

К раствору 3-нитро-1H-пиридин-2-она (50,00 г, 356,90 ммоль, 1 экв) в CH3CN (600 мл) добавляют трет-бутил 2-бромацетат (83,54 г, 428,28 ммоль, 63,29 мл, 1,2 экв) и DIEA (92,25 г, 713,79 ммоль, 124,33 мл, 2 экв) при 25°C. Реакционную смесь перемешивают при 25°C в течение 16 ч. Смесь концентрируют в вакууме для удаления большей части CH3CN, разбавляют водой (1500 мл), экстрагируют EtOAc (1500 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (1500 мл х 2), сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением трет-бутил 2-(3-нитро-2-оксо-1-пиридил)ацетата (I-56) (230 г) в виде красного твердого вещества.
К смеси трет-бутил 2-(3-нитро-2-оксо-1-пиридил)ацетата (110 г, 432,66 ммоль, 1 экв) в CF3COOH (250 мл) и ДХМ (400 мл) перемешивают при 20°C в течение 0,5 часов. Смесь концентрируют при пониженном давлении. Остаток промывают этилацетатом (200 мл х 3) и 2-(3-нитро-2-оксо-1-пиридил)уксусную кислоту (I-57) (160 г) получают в виде зеленого твердого вещества,1H ЯМР (400 МГц, ДМСО-d6) δ 8,48 (дд, J=8,0 Гц, 1,6 Гц, 1H), 8,20 (дд, J=7,2 Гц, 2,0 Гц, 2H), 6,50 (т, J=6,8 Гц, 1H), 4,79 (с, 2H).
К раствору 3-бром-2-нитро-анилина (44 г, 202,75 ммоль, 1 экв) и 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (40,60 г, 223,02 ммоль, 1,1 экв) в диоксане (450 мл)/H2O (45 мл) добавляют Pd(dppf)Cl2 (2,97 г, 4,05 ммоль, 0,02 экв) и Cs2CO3 (132,12 г, 405,49 ммоль, 2 экв) при 25°C. Смесь перемешивают при 90°C в течение 16 ч. Смесь концентрируют в вакууме для удаления большей части диоксана и воды, затем разбавляют водой (450 мл)/EtOAc (350 мл) и фильтруют. Фильтрат разделяют и водную фазу экстрагируют EtOAc (300 мл x 2). Объединенный органический слой промывают насыщенным солевым раствором (500 мл), сушат над Na2SO4 и концентрируют в вакууме с получением продукта. Остаток очищают колоночной хроматографией с получением 3-(2-метилпроп-1-енил)-2-нитро-анилина (I-59) (45 г) в виде коричневой жидкости,1H ЯМР (400 МГц, CDCl3) δ 1,60 (с, 3 H) 1,80 (с, 3 H) 5,03 (шс, 2 H) 6,25 (с, 1 H) 6,47 (д, J=7,21 Гц, 1 H) 6,61 (д, J=8,43 Гц, 1 H) 7,12 (т, J=8,02 Гц, 1 H).
К раствору 3-(2-метилпроп-1-енил)-2-нитро-анилина (38 г, 197,70 ммоль) и Et3N (6,14 г, 60,67 ммоль, 8,44 мл) в MeOH (300 мл) добавляют Pd/C (10 г). Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 14 часов. Смесь фильтруют, и фильтрат концентрируют с получением 3-изобутилбензол-1,2-диамина (I-60) (30 г) в виде красного масла,1H ЯМР (400 МГц, ДМСО-d6) δ 0,87 (д, J=6,60 Гц, 6 H) 1,85 (дквин, J=13,46, 6,75, 6,75, 6,75, 6,75 Гц, 1 H) 2,29 (д, J=7,09 Гц, 2 H) 4,09 (с, 2 H) 4,37 (с, 2 H) 6,22-6,27 (м, 1 H) 6,32 (т, J=7,52 Гц, 1 H) 6,40 (дд, J=7,58, 1,47 Гц, 1 H).
К смеси 3-изобутилбензол-1,2-диамина (30 г, 182,65 ммоль, 1 экв), 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (38,00 г, 191,78 ммоль, 1,05 экв) и DIPEA (47,21 г, 365,30 ммоль, 63,63 мл, 2 экв) в ДХМ (300 мл) добавляют T3P (127,86 г, 200,92 ммоль, 119,49 мл, 50% чистота, 1,1 экв) при 20°C в течение 16 ч. Смесь перемешивают при 40°C в течение 18 ч. Смесь охлаждают до 20°C и концентрируют в вакууме. Остаток выливают в воду (300 мл). Водную фазу экстрагируют этилацетатом (300 мл х 2). Объединенную органическую фазу промывают насыщенным солевым раствором (250 мл х 2), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Неочищенный продукт очищают колоночной хроматографией на силикагеле с получением 1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (I-61) (23,9 г, 40% выход) в виде желтого твердого вещества,1H ЯМР (400 МГц, ДМСО-d6) δ 8,47 (дд, J=8,0 Гц, 2,0 Гц, 1H), 8,36 (дд, J=6,4 Гц, 2,0 Гц, 1H), 7,31 (д, J=8,0 Гц,1H), 7,06 (т, J=8,0 Гц, 1H), 6,93 (д, J=6,8 Гц, 1H), 6,54 (т, J=6,8 Гц, 1H), 2,69 (д, J=7,2 Гц, 2H), 2,02-1,96 (м, 1H), 0,85 (д, J=6,8 Гц, 6H).
К раствору 1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (5 г, 15,32 ммоль, 1 экв) и Boc2O (4,01 г, 18,39 ммоль, 4,22 мл, 1,2 экв) в ДХМ (50 мл) добавляют DIEA (2,97 г, 22,98 ммоль, 4,00 мл, 1,5 экв) и DMAP (93,59 мг, 766,05 мкмоль, 0,05 экв) при 0°C, затем реакционную смесь перемешивают при 25°C в течение 1 ч. Органическую фазу концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 4-изобутил-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (I-62) (23,4 г, 90% выход) в виде коричневого твердого вещества,1H ЯМР (400 МГц, ДМСО-d6) δ 8,54 (дд, J=7,67, 1,97 Гц, 1 H) 8,29 (дд, J=6,80, 1,97 Гц, 1 H) 7,76 (д, J=7,89 Гц, 1 H) 7,29 (т, J=7,89 Гц, 1 H) 7,09 (д, J=7,45 Гц, 1 H) 6,55 (дд, J=7,45, 6,58 Гц, 1 H) 5,72 (с, 2 H) 2,62 (д, J=6,58 Гц, 2 H) 1,87 (дквин, J=13,43, 6,62, 6,62, 6,62, 6,62 Гц, 1 H) 1,70 (с, 9 H) 0,72 (д, J=6,58 Гц, 6 H).
К раствору трет-бутил 4-изобутил-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (25,1 г, 58,86 ммоль, 1 экв) в EtOAc (300 мл) добавляют Pd/C (8 г, 58,86 ммоль, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 1 часа и затем фильтруют и концентрируют при пониженном давлении с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-4-изобутил-бензимидазол-1-карбоксилата (23,9 г) в виде коричневого масла,1H ЯМР (I-63) (400 МГц, ДМСО-d6) δ 7,71-7,79 (м, 1 H) 7,21-7,32 (м, 1 H) 7,09 (д, J=7,02 Гц, 1 H) 6,94 (дд, J=6,80, 1,53 Гц, 1 H) 6,50 (дд, J=7,24, 1,53 Гц, 1 H) 6,08 (т, J=6,80 Гц, 1 H) 5,55 (с, 2 H) 5,05 (с, 2 H) 2,65 (д, J=7,02 Гц, 2 H) 1,87-2,00 (м, 1 H) 1,63-1,72 (м, 9 H) 0,76 (д, J=6,58 Гц, 6 H).
Следующие промежуточные соединения получают по методике, описанной для синтеза I-63 с применением подходящих реагентов.
Синтез 3-амино-1-[[6-(2-метилпроп-1-енил)-9H-пурин-8-ил]метил]пиридин-2-она (I-65)

Смесь 1-[[6-(2-метилпроп-1-енил)-9H-пурин-8-ил]метил]-3-нитро-пиридин-2-она (100 мг, 306,46 мкмоль) в H2O (0,5 мл) и EtOH (2,5 мл) затем добавляют Fe (85,57 мг, 1,53 ммоль), NH4Cl (163,93 мг, 3,06 ммоль, 107,14 мкл) при 15°C и затем смесь перемешивают при 80°C в течение 1 ч. Смесь фильтруют и фильтрат концентрируют при пониженном давлении с получением твердого вещества. Остаток разбавляют водой 10 мл и экстрагируют EtOAc 16 мл (8 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором 8 мл, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 3-амино-1-[[6-(2-метилпроп-1-енил)-9H-пурин-8-ил]метил]пиридин-2-она (I-65) (100 мг) в виде коричневого твердого вещества. ЖХМС m/z 297,2 (M+H)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-65 с применением подходящих реагентов.
Пример 1:

Смесь трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-4-изобутил-бензимидазол-1-карбоксилата (I-63) (11,6 г, 29,26 ммоль), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (I-9) (23 г, 89,05 ммоль) и DIEA (30,25 г, 234,06 ммоль, 40,77 мл) в ДМФ (80 мл) охлаждают до 0°C, затем HATU (18,91 г, 49,74 ммоль, 1,7 экв) в ДМФ (40 мл) добавляют по каплям к смеси при 0°C. Затем реакционную смесь перемешивают при 25°C в течение 12 часов. Реакционную смесь выливают в ледяной насыщ. водн. NH4Cl (1000 мл) и экстрагируют этилацетатом (200 мл х 3). Объединенную органическую фазу промывают насыщенным солевым раствором (500 мл х 2), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-4-изобутил-бензимидазол-1-карбоксилата (Соединение 1) (25 г, 39,26 ммоль, 67% выход) в виде светло-зеленой пены. ЖХМС m/z 637,3 (M+1)+.
К смеси трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-4-изобутил-бензимидазол-1-карбоксилата (Соединение 1) (12,5 г, 19,63 ммоль) в ДХМ (100 мл) добавляют ТФК (30,80 г, 270,12 ммоль, 20,00 мл, 13,76 экв) одной порцией при 25°C. Затем реакционную смесь перемешивают при 25°C в течение 1 часа. Получают две партии параллельно реакции. Две параллельных реакционных смеси объединяют, и реакционную смесь сушат пропусканием N2, затем добавляют ледяной насыщ. водн. NaHCO3, доводя pH до ~8. Затем экстрагируют этилацетатом (100 мл х 3). Объединенную органическую фазу промывают насыщенным солевым раствором (200 мл х 1), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме с получением светло-зеленого твердого вещества. К остатку добавляют этилацетат (100 мл), некоторое количество твердого вещества не растворяется, и смесь перемешивают при 60°C в течение 0,5 часа. Смесь фильтруют с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 2) (12,1 г, 57% выход) в виде беловатого твердого вещества. ЖХМС m/z 537,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 12,17-12,60 (м, 1H) 9,27 (шд, J=11,62 Гц, 1H) 8,26 (шд, J=7,09 Гц, 1H) 7,68-7,81 (м, 1H) 7,74 (шс, 1H) 7,56 (шт, J=5,93 Гц, 1H) 7,21-7,39 (м, 1H) 7,05 (дт, J=11,92, 7,61 Гц, 1H) 6,87-6,97 (м, 1H) 6,53-6,68 (м, 1H) 6,29-6,43 (м, 2H) 5,41 (с, 2H) 4,18 (шс, 1H) 3,55 (шс, 3H) 2,98 (с, 3H) 2,83 (с, 3H) 2,65-2,78 (м, 2H) 2,19-2,31 (м, 2H) 1,94-2,17 (м, 1H) 1,65-1,94 (м, 2H) 0,88 (ш дд, J=18,95, 6,48 Гц, 6H).
Следующие соединения получают согласно методикам, описанным в Примере 1 с применением подходящих промежуточных соединений.
Пример 2:

К смеси 3-амино-1-[[6-(2-метилпроп-1-енил)-9H-пурин-8-ил]метил]пиридин-2-она (220 мг, 742,42 мкмоль) и (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (153,40 мг, 593,94 мкмоль) в ДМФ (2,5 мл) добавляют HATU (508,13 мг, 1,34 ммоль), DIEA (143,93 мг, 1,11 ммоль) при 25°C. Смесь перемешивают при 40°C в течение 12 ч. Смесь фильтруют и концентрируют. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-(2-метилпроп-1-енил)-9H-пурин-8-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 27) (91,8 мг, 21% выход) в виде коричневого твердого вещества. ЖХМС m/z 537,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,43 (шс, 1H) 9,27 (с, 1H) 8,76 (с, 1H) 8,27 (дд, J=7,46, 1,59 Гц, 1H) 7,72 (шд, J=7,95 Гц, 1H) 7,56-7,64 (м, 1H) 6,73 (шс, 1H) 6,54-6,65 (м, 1H) 6,32-6,43 (м, 2H) 5,44 (с, 2H) 4,14-4,21 (м, 1H) 3,54 (с, 3H) 2,99 (с, 3H) 2,78-2,87 (м, 3H) 2,34 (д, J=0,73 Гц, 3H) 2,17-2,27 (м, 2H) 2,02 (с, 3H) 1,68-1,92 (м, 1H) 1,66-1,94 (м, 1H).
Следующие соединения получают согласно методикам, описанным в Примере 2 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-79:

NIS (56,89 г, 252,86 ммоль) добавляют маленькими порциями к хорошо перемешиваемому раствору 2,4-дифтор-1-нитро-бензола (35,6 г, 223,77 ммоль, 24,55 мл) в CF3SO3H (177,99 г, 1,19 моль, 104,70 мл) при 0°C, затем реакционную смесь нагревают до 25°C и перемешивают в течение 12 часов. Смесь гасят ледяной водой (400 мл) и экстрагируют EtOAc (100 мл x 3). Объединенные органические слои промывают насыщ. Na2SO3 водн. (200 мл x 2) и солевым раствором (100 мл), затем сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают колоночной хроматографией с получением 1,5-дифтор-2-йод-4-нитро-бензола (I-69) (70 г) в виде желтого масла.
Смесь 1,5-дифтор-2-йод-4-нитро-бензола (8 г, 28,07 ммоль), 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (5,62 г, 30,88 ммоль), Pd(dppf)Cl2 (2,05 г, 2,81 ммоль), Cs2CO3 (18,29 г, 56,14 ммоль) в диоксане (100 мл) и H2O (10 мл) дегазируют и продувают N2 3 раза и затем смесь перемешивают при 90°C в течение 12 часов под N2 атмосферой. Реакционную смесь фильтруют и фильтрат концентрируют с получением остаток. Остаток очищают колоночной хроматографией с получением 1,5-дифтор-2-(2-метилпроп-1-енил)-4-нитро-бензола (I-70) (3,3 г, 55% выход) в виде желтого масла.
Смесь 1,5-дифтор-2-(2-метилпроп-1-енил)-4-нитро-бензола (3,3 г, 15,48 ммоль), Pd/C (0,5 г, 10% чистота) в EtOAc (100 мл) дегазируют и продувают H2 3 раза и затем смесь перемешивают при 40°C в течение 12 часов под H2 атмосферой (15 ф./кв.д.). Реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении с получением 2,4-дифтор-5-изобутил-анилина (I-71) (2,7 г) в виде желтого масла. ЖХМС m/z 186,1 (M+1)+.
Смесь 2,4-дифтор-5-изобутил-анилина (2,7 г, 14,58 ммоль) в Ac2O (30 мл) перемешивают при 20°C в течение 0,5 ч. Реакционную смесь выливают в ледяную воду 40 мл для гашения Ac2O, затем некоторое количество твердого вещества отделяют, смесь фильтруют и фильтровальную лепешку концентрируют при пониженном давлении с получением N-(2,4-дифтор-5-изобутил-фенил)ацетамида (I-72) (2,4 г, 72% выход) в виде белого твердого вещества. ЖХМС m/z 228,2 (M+1)+.
Смесь N-(2,4-дифтор-5-изобутил-фенил)ацетамида (1,2 г, 5,28 ммоль) в H2SO4 (12 мл) добавляют в смесь HNO3 (998,18 мг, 15,84 ммоль, 712,99 мкл) в H2SO4 (1 мл) по каплям при 0°C и затем смесь перемешивают при 20°C в течение 1 ч. Реакционную смесь выливают в ледяную воду 50 мл и затем экстрагируют EtOAc 40 мл (20 мл x 2). Объединенную органическую фазу промывают насыщенным солевым раствором 30 мл, сушат над безводным Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением N-(4,6-дифтор-3-изобутил-2-нитро-фенил)ацетамид (I-73) (3 г) в виде оранжевого масла.
Смесь N-(4,6-дифтор-3-изобутил-2-нитро-фенил)ацетамида (3 г, 11,02 ммоль) в HCl (20 мл, 12M) и EtOH (10 мл) перемешивают при 90°C в течение 12 часов. Реакционную смесь выливают в ледяную воду 50 мл и затем экстрагируют EtOAc (20 мл x 2). Объединенные органические слои промывают насыщ. NaHCO3 (30 мл x 2), сушат над Na2SO4, фильтруют и фильтрат концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 4,6-дифтор-3-изобутил-2-нитро-анилина (I-74) (0,83 г, 33% выход) в виде оранжевого масла. ЖХМС m/z 231,2 (M+1)+
Смесь 4,6-дифтор-3-изобутил-2-нитро-анилина (1,36 г, 5,91 ммоль), Pd/C (0,5 г) в EtOAc (30 мл) дегазируют и продувают H2 3 раза и затем смесь перемешивают при 30°C в течение 5 часов под H2 атмосферой (15 ф./кв.д.). Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением 4,6-дифтор-3-изобутил-бензол-1,2-диамина (I-75) (1,2 г) в виде коричневого масла.
Смесь 4,6-дифтор-3-изобутил-бензол-1,2-диамина (1,2 г, 5,99 ммоль), 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (1,19 г, 5,99 ммоль), DIEA (1,55 г, 11,99 ммоль, 2,09 мл), T3P (5,72 г, 8,99 ммоль, 5,35 мл) в ДХМ (15 мл) перемешивают при 40°C в течение 12 часов. Реакционную смесь разбавляют насыщ. NH4Cl (40 мл) и экстрагируют ДХМ (30 мл x 2). Объединенные органические слои концентрируют при пониженном давлении с получением N-(2-амино-3,5-дифтор-6-изобутил-фенил)-2-(3-нитро-2-оксо-1-пиридил)ацетамида (I-76) (2,8 г) в виде коричневого твердого вещества.
Смесь N-(2-амино-3,5-дифтор-6-изобутил-фенил)-2-(3-нитро-2-оксо-1-пиридил)ацетамида (2,8 г, 7,36 ммоль,) в AcOH (30 мл) перемешивают при 120°C в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении с получением остатка и остаток разбавляют насыщ. NaHCO3 (50 мл) и затем экстрагируют EtOAc (20 мл х 10). Объединенные органические слои концентрируют при пониженном давлении с получением остатка. Остаток разбавляют смесью EtOAc (4 мл) и PE (40 мл) и перемешивают при 20°C в течение 15 мин. Смесь фильтруют с получением 1-[(5,7-дифтор-4-изобутил-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (I-77) (1,8 г) в виде коричневого твердого вещества.
Смесь 1-[(5,7-дифтор-4-изобутил-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (1,75 г, 4,83 ммоль), Boc2O (1,37 г, 6,28 ммоль, 1,44 мл) в ДХМ (20 мл) добавляют DMAP (59,01 мг, 482,98 мкмоль) и TEA (733,10 мг, 7,24 ммоль, 1,01 мл) при 0°C и затем смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь гасят добавлением насыщ. раствора NH4Cl (40 мл) при 0°C, затем экстрагируют ДХМ (20 мл x 10). Объединенные органические слои концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 5,7-дифтор-4-изобутил-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (I-78) (0,88 г, 39% выход) в виде коричневого твердого вещества.
Смесь трет-бутил 5,7-дифтор-4-изобутил-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (0,15 г, 324,36 мкмоль), Pd/C (0,2 г) в EtOAc (25 мл) дегазируют и продувают H2 3 раза и затем смесь перемешивают при 20°C в течение 0,5 ч под H2 атмосферой (15 ф./кв.д.). Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-5,7-дифтор-4-изобутил-бензимидазол-1-карбоксилата (I-79) (0,15 г) в виде коричневого масла. ЖХМС m/z 433,2 (M+1)+.
Пример 3:

Смесь (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (125,41 мг, 485,59 мкмоль), трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-5,7-дифтор-4-изобутил-бензимидазол-1-карбоксилата (0,14 г, 323,73 мкмоль), DIEA (83,68 мг, 647,45 мкмоль) в ДМФ (2 мл) добавляют к HATU (184,64 мг, 485,59 мкмоль) при 40°C и затем смесь перемешивают при 40°C в течение 12 часов. Реакционную смесь выливают в воду (20 мл) и экстрагируют EtOAc (8 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (20 мл) и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5,7-дифтор-4-изобутил-бензимидазол-1-карбоксилата (Соединение 29) 0,1 г, 45% выход) в виде коричневой камеди. ЖХМС m/z 673,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,28 (с, 1H) 8,34 (дд, J=7,40, 1,65 Гц, 1H) 7,79 (шд, J=7,70 Гц, 1H) 7,56 (дд, J=6,85, 1,71 Гц, 1H) 7,29 (т, J=11,13 Гц, 1H) 6,60-6,73 (м, 1H) 6,37-6,48 (м, 2H) 5,65 (с, 2H) 4,17-4,28 (м, 1H) 3,59 (с, 3H) 3,05 (с, 3H) 2,90 (с, 3H) 2,63 (шд, J=6,85 Гц, 2H) 2,22-2,35 (м, 2H) 1,83-1,98 (м, 2H) 1,66-1,81 (м, 10 H) 0,77 (д, J=6,60 Гц, 6H).
Смесь трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5,7-дифтор-4-изобутил-бензимидазол-1-карбоксилата (Соединение 29) (0,1 г, 144,19 мкмоль) в ТФК (0,5 мл) и ДХМ (2 мл) перемешивают при 20°C в течение 1 ч. Реакционную смесь выливают в 10 мл насыщ. водн. NaHCO3, затем экстрагируют ДХМ (8 мл x 2), объединенные органические слои промывают насыщенным солевым раствором 10 мл, затем сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением метил N-[(E,1S)-1-[[1-[(5,7-дифтор-4-изобутил-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 30) (77,9 мг, 92% выход) в виде коричневого твердого вещества. ЖХМС m/z 573,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,00 (шс, 1H) 9,26 (с, 1H) 8,21-8,31 (м, 1H) 7,72 (шд, J=7,34 Гц, 1H) 7,51-7,62 (м, 1H) 6,95 (т, J=10,76 Гц, 1H) 6,55-6,65 (м, 1H) 6,32-6,42 (м, 2H) 5,40 (с, 2H) 4,11-4,23 (м, 1H) 3,54 (с, 3H) 2,98 (с, 3H) 2,83 (с, 3H) 2,69 (шд, J=7,34 Гц, 2H) 2,17-2,30 (м, 2H) 1,82-1,98 (м, 2H) 1,64-1,78 (м, 1H) 0,82-0,92 (м, 6H).
Синтез промежуточных соединений I-86 и I-87:

К смеси (4S)-4-амино-5-трет-бутокси-5-оксо-пентановой кислоты (50 г, 246 ммоль) в диоксане (150 мл) и H2O (150 мл) добавляют Et3N (49,7 г, 492 ммоль) и Boc2O (59,1 г, 270 ммоль). Смесь перемешивают при 25°C в течение 16 ч. Смесь разбавляют раствором NaOH (2M, 800 мл) и EtOAc (200 мл). Полученный раствор экстрагируют раствором NaOH (2M, 200 мл). HCl (водн., 6M) добавляют к полученному выше водному слою для доведения рН~5. Полученный раствор экстрагируют EtOAc (500 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (300 мл), сушат над безводным Na2SO4 и концентрируют в вакууме с получением (S)-5-(трет-бутокси)-4-((трет-бутоксикарбонил)амино)-5-оксопентановой кислоты (I-80) (55 г, 73% выход) в виде оранжевого масла,1H ЯМР (400 МГц, CDCl3) δ 5,16 (д, J=7,3 Гц, 1H), 4,29-4,15 (м, J=5,0 Гц, 1H), 2,53-2,33 (м, 2H), 2,21-2,11 (м, 1H), 1,99-1,84 (м, 1H), 1,50-1,39 (м, 18H).
К раствору (S)-5-(трет-бутокси)-4-((трет-бутоксикарбонил)амино)-5-оксопентановой кислоты (27,5 г, 90,6 ммоль) в ДХМ (200 мл) и MeOH (200 мл) добавляют TMSCHN2 (2 M, 90,6 мл) на ледяной бане до прекращения выделения газа и превращения раствора в желтый. Смесь перемешивают при 25°C в течение 30 мин. Реакционную смесь концентрируют в вакууме с получением (S)-1-трет-бутил 5-метил 2-((трет-бутоксикарбонил) амино)пентандиоата (I-81) (46 г, 80% выход, 2 партии) в виде желтого масла.
К смеси (S)-1-трет-бутил 5-метил 2-((трет-бутоксикарбонил)амино)пентандиоата (28 г, 88,2 ммоль) и DMAP (5,39 г, 44,1 ммоль) в MeCN (400 мл) добавляют Boc2O (20 г, 88,1 ммоль) при 25°C. К реакционной смеси добавляют Boc2O (40 г, 176 ммоль) при 80°C. Смесь перемешивают при 80°C в течение 1,5 ч до смены цвета на черный. Полученный раствор концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением (S)-1-трет-бутил 5-метил 2-(бис(трет-бутоксикарбонил)амино)пентандиоата (I-82) (53 г, 72% выход) в виде желтого масла,1H ЯМР (400 МГц, CDCl3) δ 4,81-4,72 (м, 1H), 3,65 (с, 3H), 2,43-2,34 (м, 3H), 2,19-2,10 (м, 1H), 1,49 (с, 18H), 1,43 (с, 9H).
К раствору (S)-1-трет-бутил 5-метил 2-(бис(трет-бутоксикарбонил)амино)пентандиоата (26,5 г, 63,4 ммоль) в сухом ТГФ (300 мл) в стоячей колбе добавляют DIBAL-H (95,2 мл, 1M) при -65°C. Смесь перемешивают при -65°C в течение 30 мин. Реакционную смесь гасят насыщенным раствором NH4Cl раствора (100 мл) при 0°C, разбавляют раствором тартрата калия-натрия (100 мл) и перемешивают в течение 1 ч. Смесь экстрагируют EtOAc (200 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (200 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением (S)-трет-бутил 2-(бис(трет-бутоксикарбонил)амино)-5-оксопентаноата (I-84) (7,5 г, 15% выход) в виде желтого масла и (S)-трет-бутил 2-(бис(трет-бутоксикарбонил)амино)-5-гидроксипентаноата (I-83) (33 г, 66% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 4,70 (дд, J=5,4, 9,2 Гц, 1H), 3,62 (шс, 2H), 2,20-2,06 (м, 1H), 1,93-1,80 (м, 2H), 1,63-1,54 (м, 2H), 1,47 (с, 18H), 1,41 (с, 9H).
К раствору (S)-трет-бутил 2-(бис(трет-бутоксикарбонил)амино)-5-гидроксипентаноата (I-83) (18,7 г, 48,1 ммоль) в ДХМ (200 мл) добавляют реагент Десса-Мартина (26,4 г, 62,4 ммоль) на ледяной бане. Смесь перемешивают при 25°C в течение 30 мин. Реакционную смесь концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением (S)-трет-бутил 2-(бис(трет-бутоксикарбонил)амино)-5-оксопентаноата (I-84) (13,5 г, 72% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 9,75 (с, 1H), 4,72 (дд, J=5,1, 9,4 Гц, 1H), 2,64-2,36 (м, 3H), 2,19-2,07 (м, 1H), 1,49 (с, 18H), 1,44 (с, 9H).
К раствору 2-диэтоксифосфорил-N, N-диметил-ацетамида (633 мг, 2,84 ммоль) в ДМЭ (10 мл) добавляют LiHMDS (1M, 2,84 мл) при 0°C. Смесь перемешивают при°C в течение 0,5 ч. Затем добавляют трет-бутил (2S)-2-[бис(трет-бутоксикарбонил)амино]-5-оксо-пентаноат (1 г, 2,58 ммоль) в ДМЭ (5 мл), смесь перемешивают при 0°C в течение 1 ч. В смесь добавляют H2O (50 мл) и экстрагируют EtOAc(30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (30 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением (E,2S)-2-[бис(трет-бутоксикарбонил)амино]-7-(диметиламино)-7-оксо-гепт-5-еноата (I-85) (1,1 г) в виде желтого масла,1H ЯМР (400 МГц, CDCl3) δ 6,93-6,78 (м, 1H), 6,27 (д, J=15,2 Гц, 1H), 4,80-4,64 (м, 1H), 3,09-2,94 (м, 6H), 2,30-2,16 (м, 3H), 2,03-1,95 (м, 1H), 1,49 (с, 18H), 1,43 (с, 9H).
К раствору трет-бутил (E,2S)-2-[бис(трет-бутоксикарбонил)амино]-7-(диметиламино)-7-оксо-гепт-5-еноата (1,1 г, 2,41 ммоль) в ДХМ (2,5 мл) добавляют ТФК (5,39 г, 47,28 ммоль, 3,50 мл) при 0°C. Смесь перемешивают при 25°C в течение 4 ч. Реакционную смесь концентрируют в вакууме с получением (S, E)-2-амино-7-(диметиламино)-7-оксогепт-5-еновой кислоты (I-86) (482 мг) в виде желтого масла.
Стадия 8: Синтез (S, E)-2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-еновой кислоты (I-87)

К раствору (S, E)-2-амино-7-(диметиламино)-7-оксогепт-5-еновой кислоты (920 мг, 4,59 ммоль) в ДХМ (10 мл) добавляют (Boc)2O (2 г, 9,18 ммоль) и DIPEA (2,97 г, 23 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 16 ч. Смесь разбавляют насыщенным NaHCO3 (60 мл), промывают ДХМ (30 мл). Водную фазу доводят до рН~2 с HCl (1M) и экстрагируют ДХМ (30 мл х 3). Органические слои сушат над безводным Na2SO4 и концентрируют в вакууме с получением (S, E)-2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-еновой кислоты (I-87) (1,5 г) в виде желтого масла,1H ЯМР (400 МГц, CDCl3) δ 6,85-6,71 (м, 1H), 6,27 (д, J=15,2 Гц, 1H), 5,22 (д, J=7,6 Гц, 1H), 4,40-4,21 (м, 1H), 3,09-2,99 (м, 6H), 2,37-2,17 (м, 2H), 2,06-1,91 (м, 1H), 1,81-1,67 (м, 1H), 1,43 (с, 9H).
Следующие промежуточные соединения получают согласно методикам, описанным в I-87 с применением подходящих промежуточных соединений.
Пример 4:

К раствору (S, E)-2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-еновой кислоты (485 мг, 1,61 ммоль) и трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата (320 мг, 0,807 ммоль) в ДМФ (3 мл) добавляют HATU (614 мг, 1,61 ммоль) и DIPEA (313 мг, 2,42 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 2 ч. Реакционную смесь разбавляют H2O (50 мл) и экстрагируют EtOAc (30 мл х 3). Объединенные органические слои промывают солевым раствором (30 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией и преп-ЖХВД с получением (S, E)-трет-бутил 2-((3-(2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата (Соединение 31) (475 мг, 83% выход) в виде желтого масла. ЖХМС m/z 679,5 (M+1)+.
К раствору (S, E)-трет-бутил 2-((3-(2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-бензо[d]имидазол-1-карбоксилата (1,7 г, 2,50 ммоль) в ДХМ (6 мл) добавляют ТФК (4,62 г, 40,5 ммоль, 3,00 мл) при 0°C. Смесь перемешивают при 25°C в течение 2 ч. Реакционную смесь концентрируют в вакууме с получением (S, E)-6-амино-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (I-90) (1,48 г, неочищенный, ТФК) в виде желтого масла. ЖХМС m/z 479,2 (M+1)+.
К раствору (S, E)-6-амино-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (200 мг, 0,337 ммоль, ТФК) и оксазол-5-карбоновой кислоты (57,2 мг, 0,506 ммоль) в ДМФ (2 мл) добавляют HATU (257 мг, 0,675 ммоль) и DIPEA (131 мг, 1,01 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 16 ч. Реакционную смесь очищают преп-ЖХВД с получением (S, E)-N7-(1-((4-изобутил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-5-карбоксамидо)гепт-2-ендиамида (Соединение 32) (78,5 мг, 39% выход) в виде белого твердого вещества. ЖХМС m/z 574,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 12,71 (с, 1H), 9,39 (с, 1H), 9,00 (д, J=7,6 Гц, 1H), 8,59 (с, 1H), 8,25 (дд, J=7,6, 2,0 Гц, 1H), 7,87 (с, 1H), 7,57 (дд, J=6,8, 1,6 Гц, 1H), 7,32 (д, J=7,6 Гц, 1H), 7,08 (т, J=7,6 Гц, 1H), 6,95 (д, J=7,2 Гц, 1H), 6,69-6,56 (м, 1H), 6,41-6,31 (м, 2H), 5,50-5,34 (м, 2H), 4,71-4,58 (м, 1H), 2,95 (с, 3H), 2,81 (с, 3H), 2,76-2,69 (м, 2H), 2,36-2,19 (м, 2H), 2,08-1,77 (м, 3H), 0,88 (д, J=6,4 Гц, 6H).
Следующие соединения получают согласно методикам, описанным в Примере 4 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-95:

2-хлоруксусную кислоту (1,3 г, 13,8 ммоль) и бензол-1,2-диамин (1,0 г, 9,3 ммоль) растворяют в HCl (5 мл)/H2O (15 мл). Смесь перемешивают при 100°C в течение 10 ч. Гидроксид аммония (25%-28%) добавляют для доведения pH~8. Полученную суспензию фильтруют. Твердый остаток промывают водой (50 мл) и затем его сушат при пониженном давлении с получением 2-(хлорметил)-1H-бензимидазола (I-92) (800 мг, 4,8 ммоль) в виде желтого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,58-7,51 (м, 2H), 7,25-7,19 (м, 2H), 4,92 (с, 2H).
2-(хлорметил)-1H-бензимидазол (500 мг, 3,0 ммоль) растворяют в диоксане (10 мл). Boc2O (720 мг, 3,3 ммоль) и DMAP (366 мг, 3,0 ммоль) добавляют к реакционной смеси. Смесь перемешивают при 20°C в течение 10 ч. Полученный раствор концентрируют и очищают колоночной хроматографией с получением трет-бутил 2-(хлорметил)бензимидазол-1-карбоксилата (I-93) (690 мг) в виде светло-желтого масла.
3-нитро-1H-пиридин-2-он (341 мг, 2,4 ммоль) и TEA (493 мг, 4,9 ммоль) добавляют к раствору трет-бутил 2-(хлорметил)бензимидазол-1-карбоксилата (650 мг, 2,4 ммоль) в ДМФ (3 мл). Смесь перемешивают при 50°C в течение 10 ч. Полученный раствор разбавляют этилацетатом (30 мл) и промывают водой (50 мл) и солевым раствором (50 мл). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением трет-бутил 2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (I-94) (850 мг) в виде коричневого твердого вещества. ЖХМС m/z 271,0 (M+1)+.
К раствору трет-бутил 2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (400 мг) в MeOH (30 мл) добавляют Pd/C (50 мг) (10% влажный). Смесь перемешивают при 20°C под H2 атмосферой (15 ф./кв.д.) в течение 1 ч. После фильтрации, фильтрат концентрируют с получением трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (I-95) (350 мг) в виде желтого твердого вещества.
Пример 5:

К раствору (S, E)-7-амино-2-(((2-метоксиэтокси)карбонил)амино)-7-оксогепт-5-еновой кислоты (0,17 г, 620 мкмоль) и трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил) метил)-1H-бензо[d]имидазол-1-карбоксилата (211 мг, 620 мкмоль) в ДХМ (2 мл) добавляют HATU (354 мг, 930 мкмоль) и DIPEA (240 мг, 1,86 ммоль). Смесь перемешивают при 30°C в течение 12 часов. Ее разбавляют EtOAc (30 мл), промывают насыщенным солевым раствором (30 мл х 2). Органическую фазу концентрируют в вакууме. Остаток очищают преп-ТСХ и преп-СЖХ с получением желаемого продукта (S, E)-трет-бутил 2-((3-(7-амино-2-(((2-метоксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (Соединение 42) (0,1 г, 26% выход) в виде желтого твердого вещества. ЖХМС m/z 597,1 (M+1)+.
К раствору (S, E)-трет-бутил 2-((3-(7-амино-2-(((2-метоксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (0,08 г, 134 мкмоль) в ДХМ (2 мл) добавляют ТФК (924 мг, 8,10 ммоль) при 0°C. Смесь перемешивают при 10°C в течение 3 часов и концентрируют в вакууме. Остаток очищают преп-ЖХВД с получением желаемого продукта (S, E)-2-метоксиэтил (1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 43) (0,05 г, 67% выход) в виде белого твердого вещества. ЖХМС m/z 497,1 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 13,10-11,80 (м, 1H), 9,28 (с, 1H), 8,28-8,23 (м, 1H), 7,84 (д, J= 8,0 Гц, 1H), 7,57 (дд, J= 7,2, 1,6 Гц, 1H), 7,55-7,45 (м, 2H), 7,34 (с, 1H), 7,18-7,11 (м, 2H), 6,90 (с, 1H), 6,62-6,50 (м, 1H), 6,36 (т, J=7,2 Гц, 1H), 5,83 (д, J=15,6 Гц, 1H), 5,40 (с, 2H), 4,21-4,14 (м, 1H), 4,11-4,01 (м, 2H), 3,54-3,44 (м, 2H), 3,21 (с, 3H), 2,26-2,09 (м, 2H), 1,89-1,78 (м, 1H), 1,74-1,62 (м, 1H).
Следующие соединения получают согласно методикам, описанным в Примере 6 с применением подходящих промежуточных соединений.
Синтез промежуточных соединений I-106 и I-111:


К раствору этиленгликоля (100 г, 1,61 моль) и имидазола (219 г, 3,22 моль) в ДХМ (2 л) добавляют по каплям TBDPSCl (354 г, 1,29 моль) при 0°C. Смесь перемешивают при 30°C в течение 2 ч под N2 атмосферой. Смесь выливают в H2O (1 л) и экстрагируют ДХМ (1 л х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((трет-бутилдифенилсилил)окси)этанола (I-97) (117 г, 389 ммоль) в виде светло-желтого масла,1H ЯМР (400 МГц, CDCl3) δ 7,73-7,68 (м, 4H), 7,49-7,39 (м, 6H), 3,82-3,77 (м, 2H), 3,74-3,68 (м, 2H), 1,10 (с, 9H).
К раствору 2-((трет-бутилдифенилсилил)окси)этанола (117 г, 389 ммоль) и DIEA (69,8 мл) в сухом ДХМ (1000 мл) добавляют трифосген (57,8 г, 195 ммоль) порциями при 0°C. Смесь перемешивают при 30°C в течение 1 ч, 2-((трет-бутилдифенилсилил)окси)этил карбонохлоридат (I-98) в виде бесцветного раствора в ДХМ (1000 мл) применяют на следующей стадии без дальнейшей обработки.
К смеси (S)-4-амино-5-(трет-бутокси)-5-оксопентановой кислоты (87,1 г, 428 ммоль) и DIEA (23,3 мл) в сухом ДХМ (500 мл) добавляют по каплям раствор 2-((трет-бутилдифенилсилил)окси)этил карбонохлоридата (~389 ммоль) в ДХМ (1000 мл) при 0°C в течение более 1 ч. Реакционную смесь перемешивают при 30°C в течение 2H под N2 атмосферой. Смесь выливают в ледяную воду (1 л). Результат доводят до pH~3 применением HCl (1M) и экстрагируют EtOAc (1 л х 3). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением (S)-10-(трет-бутоксикарбонил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силатридекан-13-овой кислоты (I-99) (110 г, 162 ммоль)в виде желтого масла. ЖХМС m/z 552,1 (M+23)+.
К раствору (S)-10-(трет-бутоксикарбонил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силатридекан-13-овой кислоты (110 г, 162 ммоль)в ДХМ (500 мл)/MeOH (500 мл) добавляют TMSCHN2 (2 M, 243 мл) при 0°C в течение более 0,5 ч. Смесь перемешивают при 30°C в течение 1 ч. Реакционную смесь концентрируют с получением (S)-1-трет-бутил 5-метил 2-(((2-((трет-бутилдифенилсилил)окси)этокси)карбонил)амино)пентандиоата (I-100) (100 г) в виде светло-желтого масла. ЖХМС m/z 566,4 (M+23)+.
К раствору (S)-1-трет-бутил 5-метил 2-(((2-((трет-бутилдифенилсилил)окси)этокси)карбонил)амино)пентандиоата (100 г, 184 ммоль) и DMAP (112 г, 920 ммоль) в MeCN (1 л) добавляют по каплям (Boc)2O (169 мл, 736 ммоль) при 80°C в течение более 0,5 ч. Смесь перемешивают при 80°C в течение 16 ч. Полученный раствор концентрируют, разбавляют EtOAc (1 л) и затем выливают в H2O (1 л). Результат экстрагируют EtOAc (1 л х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением (2S)-O1-трет-бутил-O5-метил-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]пентандиоата (I-101) (51 г, 53,9 ммоль) в виде светло-желтого масла. ЖХМС m/z 666,3 (M+23)+.
К раствору (2S)-O1-трет-бутил-O5-метил-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]пентандиоата (41 г, 63,7 ммоль) в ТГФ (500 мл) добавляют по каплям DIBAL-H (1 M, 382 мл) при -65°C в течение более 0,5 ч. Смесь перемешивают при -65°C в течение 1 ч под N2 атмосферой. Реакционную смесь гасят EtOAc (500 мл) при -65°C. Смесь выливают в насыщенный тартрат калия-натрия (1 л) при 0°C и перемешивают при той же температуре в течение 1 ч. Полученный раствор экстрагируют EtOAc (1 л х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением (2S)-трет-бутил-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-5-гидрокси-пентаноат (I-102) (15 г, 14,6 ммоль) в виде светло-желтого масла. ЖХМС m/z 638,1 (M+23)+.
К раствору (2S)-трет-бутил-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-5-гидрокси-пентаноата (15 г, 14,6 ммоль) в сухом ДХМ (200 мл) добавляют DMP (12,4 г, 29,2 ммоль) при 0°C. Смесь перемешивают при 30°C в течение 2 ч. Полученную суспензию фильтруют через слой целита. Фильтрат концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением(2S)-трет-бутил-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-5-оксо-пентаноата (I-103) (9,7 г, 10,8 ммоль) в виде светло-желтого масла. ЖХМС m/z 636,3 (M+23)+.
К раствору диэтил (2-амино-2-оксоэтил)фосфоната (I-104) (4,77 г, 24,4 ммоль) в ТГФ (250 мл) добавляют t-BuOK (2,74 г, 24,4 ммоль) при -10°C. Реакционную смесь перемешивают при -10°C в течение 0,5 ч. Затем раствор (2S)-трет-бутил-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-5-оксо-пентаноата (I-103) (15 г, 12,2 ммоль) в ТГФ (50 мл) добавляют по каплям к реакционной смеси при -10°C в течение более 1 ч. Результат перемешивают при -10°C в течение еще 1 ч. Смесь выливают в H2O (500 мл) и экстрагируют EtOAc (500 мл х 3). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением(E,2S)-трет-бутил-7-амино-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-7-оксо-гепт-5-еноата (I-105) (5,60 г, 8,55 ммоль) в виде светло-желтого масла. ЖХМС m/z 677,4 (M+23)+.
К раствору (E,2S)-трет-бутил-7-амино-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-7-оксо-гепт-5-еноата (9,6 г, 14,7 ммоль) в ДХМ (120 мл) добавляют ТФК (405 ммоль, 30 мл). Смесь перемешивают при 25°C в течение 2 ч. Смесь разбавляют EtOAc (100 мл) и доводят pH~3 с насыщенным NaHCO3. Результат экстрагируют EtOAc (300 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением (S, E)-10-(5-амино-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундекан-11-овой кислоты (I-106) (1,6 г, 2,95 ммоль) в виде светло-желтого масла. ЖХМС m/z 499,2 (M+1)+.
К раствору (S)-2-((трет-бутоксикарбонил)амино)-3-метилбутановой кислоты (I-107) (3 г, 13,8 ммоль) в MeCN (5 мл) добавляют CDI (4,48 г, 27,6 ммоль) и DIEA (5,35 г, 41,4 ммоль, 7,23 мл) при 0°C. Смесь перемешивают при 25°C в течение 1 ч. Затем фенилметанол (2,24 г, 20,7 ммоль, 2,15 мл) добавляют к реакционной смеси, полученной выше. Смесь перемешивают при 25°C в течение еще 2 ч. Полученный раствор концентрируют с получением остатка. Остаток разбавляют EtOAc (300 мл) и промывают H2O (200 мл). Органическую фазу концентрируют и очищают колоночной хроматографией с получением (S)-бензил 2-((трет-бутоксикарбонил)амино)-3-метилбутаноата (I-108) (3,8 г, 12,2 ммоль) в виде светло-желтого масла. ЖХМС m/z 330,1 (M+23)+.
К раствору бензил (S)-бензил 2-((трет-бутоксикарбонил)амино)-3-метилбутаноата (3,8 г, 12,4 ммоль) в ДХМ (30 мл) добавляют ТФК (15 мл). Смесь перемешивают при 25°C в течение 1 ч. Реакционную смесь концентрируют с получением остатка. Остаток разбавляют H2O (100 мл) и доводят до pH~8 насыщенным NaHCO3. Результат экстрагируют EtOAc (100 млх3). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением (S)-бензил 2-амино-3-метилбутаноата (I-109) (3,00 г) в виде светло-желтого масла. ЖХМС m/z 208,1 (M+1)+.
К раствору (S)-2-((трет-бутоксикарбонил)амино)-3-метилбутановой кислоты (3,77 г, 17,4 ммоль) в MeCN (50 мл) добавляют T3P (18,4 г, 29,0 ммоль, 17,2 мл) и DIEA (5,61 г, 43,4 ммоль, 7,58 мл) при 0°C. Смесь перемешивают при 25°C в течение 0,5 ч. Затем (S)-бензил 2-амино-3-метилбутаноат (3 г, 14,5 ммоль) добавляют к реакционной смеси и перемешивают при 25°C в течение еще 18 ч. Реакционную смесь концентрируют, экстрагируют EtOAc (100 мл) и промывают водой (100 мл). Органическую фазу концентрируют и очищают колоночной хроматографией с получением (S)-бензил 2-((S)-2-((трет-бутоксикарбонил)амино)-3-метил бутанамидо)-3-метилбутаноата (I-110) (1,5 г, 3,65 ммоль) в виде светло-желтого масла. ЖХМС m/z 407,2 (M+1)+.
К раствору бензил (S)-бензил 2-((S)-2-((трет-бутоксикарбонил)амино)-3-метилбутанамидо)-3-метилбутаноата (1,50 г, 3,69 ммоль) в MeOH (30 мл) добавляют Pd(OH)2 (518 мг). Смесь перемешивают при 25°C в течение 16 ч под H2 (15 ф./кв.д.). Полученную суспензию фильтруют через слой целита. Фильтрат концентрируют с получением (S)-2-((S)-2-((трет-бутоксикарбонил)амино)-3-метилбутанамидо)-3-метилбутановой кислоты (I-111) (1,00 г, 3,16 ммоль) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,77 (д, J=8,4 Гц, 1H), 6,78 (д, J=9,2 Гц, 1H), 4,14 (дд, J=8,0, 5,6 Гц, 1H), 3,85 (дд, J=8,8, 7,2 Гц, 1H), 2,11-2,00 (м, 1H), 1,99-1,88 (м, 1H), 1,38 (с, 9H), 0,95-0,78 (м, 12H).
Пример 6:

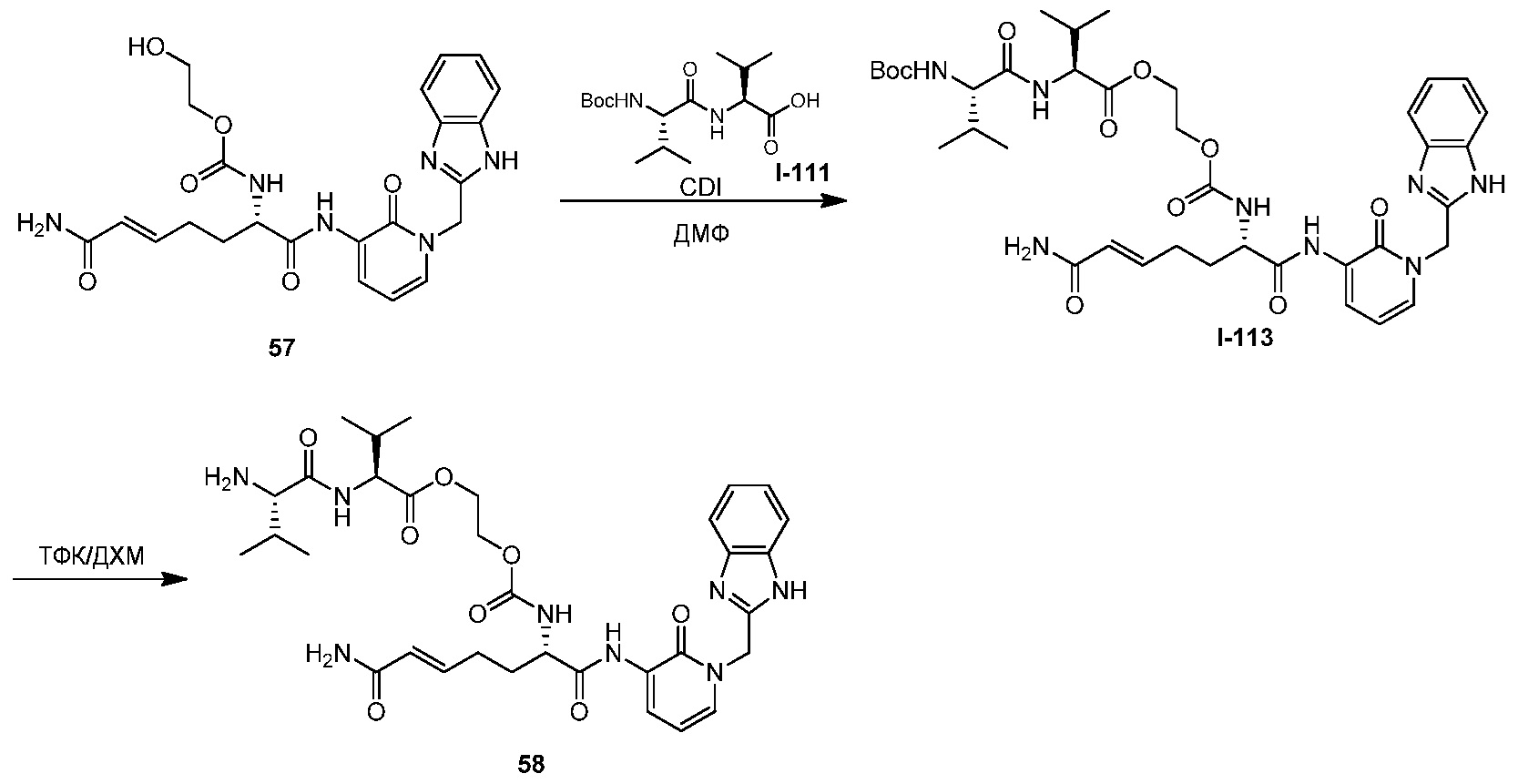
К раствору (S, E)-10-(5-амино-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундекан-11-овой кислоты (600 мг, 1,03 ммоль) и трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (423 мг, 1,24 ммоль) в MeCN (1 мл) добавляют HATU (787 мг, 2,07 ммоль) и DIEA (401 мг, 3,10 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 18 ч. Полученный раствор выливают в H2O (100 мл) и экстрагируют EtOAc (100 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением (S, E)-трет-бутил 2-((3-(10-(5-амино-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундеканамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (I-112) (1 г) в виде коричневого твердого вещества. ЖХМС m/z 821,1 (M+1)+.
(S, E)-трет-бутил 2-((3-(10-(5-амино-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундеканамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилат (900 мг, 1,10 ммоль) добавляют в ТФК (18 мл). Смесь перемешивают при 25°C в течение 2 ч. Смесь концентрируют с получением остатка. Остаток разбавляют H2O (10 мл) и доводят до pH~8 насыщенным NaHCO3. Результат лиофилизируют с получением остатка, который очищают преп-ЖХВД с получением (S, E)-2- гидроксиэтил(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 57) (250 мг) в виде белого твердого вещества. ЖХМС m/z 483,2 (M+1)+.
К раствору (S)-2-((S)-2-((трет-бутоксикарбонил)амино)-3-метилбутанамидо)-3-метилбутановой кислоты (I-111) (197 мг, 622 мкмоль) в ДМФ (2 мл) добавляют CDI (101 мг, 622 мкмоль) и DMAP (75,9 мг, 622 мкмоль). Смесь перемешивают при 10°C в течение 1 ч. Затем (S, E)-2-гидроксиэтил(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамат (Соединение 57) (150 мг, 311 мкмоль) добавляют к реакционной смеси выше и результат перемешивают при 60°C в течение 72 ч. Реакционную смесь выливают в H2O (20 мл) и экстрагируют EtOAc (20 млх3). Объединенные органические слои концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением (S)-2-((((S, E)-1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамоил)окси)этил 2-((S)-2-((трет-бутоксикарбонил)амино)-3-метилбутанамидо)-3-метилбутаноата (I-113) (50 мг) в виде белого твердого вещества. ЖХМС m/z 781,4 (M+1)+.
К раствору (S)-2-((((S, E)-1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамоил)окси)этил 2-((S)-2-((трет-бутоксикарбонил)амино)-3-метилбутанамидо)-3-метилбутаноата (80 мг, 102 мкмоль) в ДХМ (3 мл) добавляют ТФК (4,62 г, 40,5 ммоль, 3 мл). Реакционную смесь перемешивают при 15°C в течение 1 ч. Полученный раствор концентрируют с получением остатка и очищают преп-ЖХВД с получением (S)-2-((((S, E)-1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-амино-1,7-диоксогепт-5-ен-2-ил)карбамоил)окси)этил 2-((S)-2-амино-3-метилбутанамидо)-3-метилбутаноата (Соединение 58) (33,8 мг) в виде белого твердого вещества. ЖХМС m/z 681,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,29 (с, 1H), 8,31-8,22 (м, 2H), 8,16 (д, J=8,8 Гц, 1H), 7,84 (д, J=7,6 Гц, 1H), 7,56 (дд, J=7,2, 2,0 Гц, 1H), 7,49 (дд, J=5,6, 3,2 Гц, 2H), 7,32 (шс, 1H), 7,17-7,09 (м, 2H), 6,87 (шс, 1H), 6,63-6,52 (м, 1H), 6,35 (т, J=7,2 Гц, 1H), 5,83 (д, J=15,6 Гц, 1H), 5,40 (с, 2H), 4,33-4,09 (м, 6H), 3,19-3,13 (м, 1H), 2,23-2,10 (м, 2H), 2,10-1,99 (м, 1H), 1,94-1,76 (м, 2H), 1,75-1,61 (м, 1H), 0,73-0,93 (м, 12H).
Пример 7:

К смеси трет-бутил 2-[[3-[[(E,2S)-2-(трет-бутоксикарбониламино)-7-(диметиламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]бензимидазол-1-карбоксилата (0,3 г, 482 мкмоль) в ДХМ (3 мл) добавляют ТФК (1,54 г, 13,5 ммоль, 1 мл) при 0°C. Смесь перемешивают при 0°C в течение 20 мин. Смесь концентрируют при комнатной температуре с получением (E,6S)-6-амино-N'-[1-(1H-бензимидазол-2-илметил)-2-оксо-3-пиридил]-N, N-диметил-гепт-2-ендиамида (I-114) (0,25 г, соль ТФК) в виде светло-коричневого масла. ЖХМС m/z 423,3 (M+1)+.
К смеси 2-гидроксиуксусной кислоты (32,4 мг, 426 мкмоль, 25,9 мкл) и (E,6S)-6-амино-N'-[1-(1H-бензимидазол-2-илметил)-2-оксо-3-пиридил]-N, N-диметил-гепт-2-ендиамида (0,12 г, 284 мкмоль) в ДМФ (2 мл) добавляют HATU (162 мг, 426 мкмоль) и DIEA (73,4 мг, 568 мкмоль, 99,0 мкл) при 0°C. Смесь перемешивают при 15°C в течение 16 ч. Реакционную смесь (объединенную с меньшим масштабом) разбавляют EtOAc (20 мл), промывают водой (10 мл) и солевым раствором (10 мл). Органическую фазу сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-N7-(1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(2-гидроксиацетамидо)-N1,N1-диметилгепт-2-ендиамида (Соединение 59) (28 мг, 20% выход) в виде белого твердого вещества. ЖХМС m/z 481,1 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,40 (с, 1H), 8,29 (д, J=7,2 Гц, 1H), 8,11 (д, J=8,2 Гц, 1H), 7,73-7,68 (м, 2H), 7,62 (д, J=5,8 Гц, 1H), 7,45 (с, 2H), 6,63-6,54 (м, 1H), 6,44 (т, J=6,8 Гц, 1H), 6,37-6,34 (м, 1H), 6,39-6,31 (м, 1H), 5,58 (с, 2H), 4,53 (м, 1H), 3,96-3,80 (м, 2H), 2,98 (с, 3H), 2,83 (с, 3H), 2,19 (м, 2H), 1,92-1,79 (м, 2H), 1,25 (т, J=5,9 Гц, 1H).
Пример 8:

К смеси 3-гидроксипропановой кислоты (1 г, 11,1 ммоль) и TBDPSCl (3,66 г, 13,32 ммоль, 3 мл) в ДХМ (30 мл) добавляют имидазол (1,51 г, 22,2 ммоль). Смесь перемешивают при 15°C в течение 1 ч. Смесь промывают насыщенным солевым раствором (15 мл х 2), сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 3-[трет-бутил(дифенил)силил]оксипропановой кислоты (I-116) (1,5 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ7,72-7,65 (м, 4H), 7,46-7,37 (м, 6H), 4,00-3,92 (м, 2H), 2,62 (т, J=6,2 Гц, 2H), 1,13-1,04 (м, 9H).
К раствору (E,6S)-6-амино-N'-[1-(1H-бензимидазол-2-илметил)-2-оксо-3-пиридил]-N, N-диметил-гепт-2-ендиамида (0,15 г, 279,59 мкмоль, соль ТФК) и 3-[трет-бутил(дифенил)силил]оксипропановой кислоты (184 мг, 559 мкмоль) в ДМФ (3 мл) добавляют HATU (127,57 мг, 336 мкмоль) и DIEA (72,3 мг, 559 мкмоль, 97,4 мкл) при 0°C. Смесь перемешивают при 15°C в течение 16 ч. Смесь разбавляют водой (10 мл) и экстрагируют EtOAc (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл х 3), сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением (E,6S)-N'-[1-(1H-бензимидазол-2-илметил)-2-оксо-3-пиридил]-6-[3-[трет-бутил(дифенил)силил]оксипропаноиламино]-N, N-диметил-гепт-2-ендиамида (I-117)(0,07 г) в виде белого твердого вещества.
К смеси (E,6S)-N'-[1-(1H-бензимидазол-2-илметил)-2-оксо-3-пиридил]-6-[3-[трет-бутил(дифенил)силил]оксипропаноиламино]-N, N-диметил-гепт-2-ендиамида (0,07 г, 95,5 мкмоль) в ТГФ (5 мл) добавляют Et3N, 3HF (92,3 мг, 573 мкмоль) и Et3N (29,0 мг, 287 мкмоль, 39 мкл) при 0°C. Смесь перемешивают при 15°C в течение 16 ч. Реакционную смесь (объединенную с меньшим масштабом) концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (E,6S)-N'-[1-(1H-бензимидазол-2-илметил)-2-оксо-3-пиридил]-6-(3-гидроксипропаноиламино)-N, N-диметил-гепт-2-ендиамида (Соединение 60) (13,5 мг, 28% выход) в виде белого твердого вещества. ЖХМС m/z 495,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ12,47 (с, 1H), 9,23 (с, 1H), 8,34 (д, J=7,6 Гц, 1H), 8,24 (д, J=6,1 Гц, 1H), 7,57 (д, J=5,6 Гц, 1H), 7,49 (с, 2H), 7,15 (с, 2H), 6,65-6,55 (м, 1H), 6,41-6,32 (м, 2H), 5,39 (с, 2H), 4,60 (с, 1H), 4,45-4,34 (м, 1H), 3,62 (т, J=6,5 Гц, 2H), 2,98 (с, 3H), 2,83 (с, 3H), 2,40-2,15 (м, 4H), 1,97-1,84 (м, 1H), 1,79-1,64 (м, 1H).
Следующие промежуточные соединения получают согласно методикам, описанным для Примера 8 с применением подходящих реагентов.
Синтез промежуточного соединения I-122:


К раствору метил 2-(диэтоксифосфорил)ацетата (5,00 г, 23,8 ммоль) в MeOH (10 мл) добавляют 2-аминоэтанол (2,91 г, 47,6 ммоль). Смесь перемешивают при 70°C в течение 16 ч. Полученный раствор концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением диэтил (2-((2-гидроксиэтил)амино)-2-оксоэтил)фосфоната (I-119) (4,2 г) в виде желтого масла. ЖХМС m/z 240,1 (M+1)+,1H ЯМР (400 МГц, CDCl3) δ7,22 (шс, 1H), 4,19-4,12 (м, 4H), 3,71-3,70 (м, 3H), 3,44-3,41 (м, 2H), 2,89 (д, J=20,8Гц, 2H), 1,36-1,33 (м, 6H).
К смеси диэтил (2-((2-гидроксиэтил)амино)-2-оксоэтил)фосфоната (2,7 г, 11,3 ммоль) и имидазола (1,54 г, 22,6 ммоль) в ДХМ (30 мл) добавляют TBDPSCl (3,72 г, 13,5 ммоль). После перемешивания при 15°C в течение 1 ч, смесь разбавляют водой (30 мл) и экстрагируют ДХМ (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением диэтил (2-((2-((трет-бутилдифенилсилил) окси)этил)амино)-2-оксоэтил)фосфоната (I-120) (4,2 г) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,79-7,58 (м, 4H), 7,57-7,34 (м, 6H), 6,89 (с, 1H), 4,28-4,04 (м, 4H), 3,85-3,64 (м, 2H), 3,56-3,34 (m 2H), 2,92-2,72 (м, 2H), 1,33 (т, J=6,8 Гц, 6H), 1,08 (с, 9H).
К раствору диэтил(2-((2-((трет-бутилдифенилсилил)окси)этил)амино)-2-оксоэтил)фосфоната (3,1 г, 6,49 ммоль) в ТГФ (45 мл) добавляют t-BuOK (874 мг, 7,79 ммоль) при -10°C. Реакционную смесь перемешивают при той же температуре в течение 0,5 ч. Раствор (S)трет-бутил-2-[трет-бутоксикарбонил(метоксикарбонил)амино]-5-оксо-пентаноата (2,24 г, 6,49 ммоль) в ТГФ (15 мл) добавляют по каплям к реакционной смеси выше. После перемешивания при -10°C в течение 2 ч под N2 атмосферой, смесь выливают в H2O (100 мл). Результат экстрагируют EtOAc (100 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением (S, E)-2-[трет-бутоксикарбонил(метоксикарбонил)амино]-7-[2-[трет-бутил(дифенил)силил]оксиэтиламино]-7-оксо-гепт-5-еноата (I-121) (1,7 г)в виде бесцветного масла. ЖХМС m/z 569,3 (M-99)+,1H ЯМР (400 МГц, CDCl3) δ 7,69-7,61 (м, 4H), 7,47-7,35 (м, 6H), 6,82-6,72 (м, 1H), 5,79-5,69 (м, 2H), 5,11-5,01 (м, 1H), 4,87-4,79 (м, 1H), 4,28-4,17 (м, 1H), 3,75-3,85 (м, 3H), 3,47 (кв, J=5,44 Гц, 2H), 2,31-2,16 (м, 2H), 2,02-1,86 (м, 1H), 1,80-1,67 (м, 1H), 1,41-1,55 (м, 18H), 1,08 (с, 9H).
К раствору трет-бутил (S, E)-2-[трет-бутоксикарбонил(метоксикарбонил)амино]-7-[2-[трет-бутил(дифенил)силил]оксиэтиламино]-7-оксо-гепт-5-еноата (1,7 г, 2,39 ммоль) в ДХМ (10 мл) добавляют ТФК (18,8 мл, 254 ммоль). После перемешивания при 10°C в течение 16 ч, смесь концентрируют с получением остатка при 10°C. Остаток очищают флэш-хроматографией с обращенной фазой и преп-ЖХВД по очереди с получением (S, E)-7-((2-гидроксиэтил)амино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (I-122) (130 мг) в виде светло-желтого масла. ЖХМС m/z 275,0 (M+1)+.
Пример 9:

К раствору (S, E)-7-((2-гидроксиэтил)амино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (130 мг, 469 мкмоль) и трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (176 мг, 516 мкмоль) в MeCN (3 мл)/ДМФ (1 мл) добавляют HATU (357 мг, 938 мкмоль) и DIEA (182 мг, 1,41 ммоль) при 0°C. После перемешивания при 30°C в течение 40 ч, смесь выливают в H2O (50 мл) и результат экстрагируют EtOAc (50 мл х 4). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией и преп-ТСХ с получением (S, E)-трет-бутил2-((3-(7-((2-гидроксиэтил)амино)-2-((метокси-карбонил) амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (I-123) (50 мг) в виде светло-желтого твердого вещества. ЖХМС m/z 597,3 (M+1)+.
К раствору (S, E)-трет-бутил 2-((3-(7-((2-гидроксиэтил)амино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (38 мг, 45,9 мкмоль) в ДХМ (3 мл) добавляют ZnBr2 (51,6 мг, 229 мкмоль). После перемешивания при 30°C в течение 16 ч, смесь концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил(1-((1-((1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-((2-гидроксиэтил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 62) (10,3 мг) в виде белого твердого вещества. ЖХМС m/z 497,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 12,51 (шс, 1H), 9,28 (с, 1H), 8,25 (дд, J=7,2, 1,6 Гц, 1H), 7,94 (т, J=5,6 Гц, 1H), 7,75 (д, J=7,6 Гц, 1H), 7,57 (дд, J=7,2, 1,6 Гц, 1H), 7,49 (с, 2H), 7,18-7,10 (м, 2H), 6,62-6,51 (м, 1H), 6,36 (т, J=7,2 Гц, 1H), 5,88 (д, J=15,6 Гц, 1H), 5,40 (с, 2H), 4,69 (шс, 1H), 4,22-4,12 (м, 1H), 3,54 (с, 3H), 3,15 (кв, J=6,0 Гц, 2H), 2,24-2,10 (м, 2H), 1,90-1,78 (м, 1H), 1,73-1,62 (м, 1H).
Синтез трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-6-фтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата:


Смесь 4-фтор-2-йод-анилина (10 г, 42,2 ммоль) в Ac2O (50 мл) перемешивают при 15°C в течение 1 ч. Смесь разбавляют водой (100 мл) и экстрагируют этилацетатом (50 мл х 2). Объединенные органические слои промывают солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением N-(4-фтор-2-йодфенил)ацетамида (I-125) (12 г) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 8,12-8,08 (м, 1H), 7,50 (дд, J=7,6, 1,6 Гц, 1H), 7,29 (с, 1H), 7,13-7,02 (м, 1H), 2,23 (с, 3H).
К раствору 3,3-диметилбутановой кислоты (3 г, 25,8 ммоль) в ДХМ (20 мл) добавляют 2-гидроксиизоиндолин-1,3-дион (4,21 г, 25,8 ммоль), DMAP (631 мг, 5,17 ммоль) и EDCI (5,45 г, 28,4 ммоль). Смесь перемешивают при 15°C в течение 16 ч. Реакционный раствор концентрируют, разбавляют водой (40 мл) и экстрагируют этилацетатом (40 мл х 2). Объединенные органические слои промывают солевым раствором (80 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 1,3-диоксоизоиндолин-2-ила 3,3-диметилбутаноата (I-128) (5,3 г) в виде белого твердого вещества,1H ЯМР (400 МГц, CDCl3) δ 7,94-7,87 (м, 2H), 7,84-7,77 (м, 2H), 2,55 (с, 2H), 1,24-1,13 (м, 9H).
К суспензии 1,3-диоксоизоиндолин-2-ил 3,3-диметилбутаноата (7,02 г, 26,9 ммоль), N-(4-фтор-2-йодфенил)ацетамида (5 г, 17,9 ммоль) и Zn (2,34 г, 35,8 ммоль) в DMA (17 мл) добавляют раствор (dtbbpy)NiBr2 (610 мг, 1,25 ммоль) в DMA (3 мл). Смесь перемешивают при 30°C в течение 16 ч. Реакционную смесь разбавляют H2O (50 мл) и EtOAc (50 мл). Полученную суспензию фильтруют и фильтрат собирают. Фильтрат экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают солевым раствором (30 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением N-(4-фтор-2-неопентилфенил)ацетамида (I-129) (4,25 г) в виде белого твердого вещества.
К смеси N-(4-фтор-2-неопентилфенил)ацетамида (1 г, 4,48 ммоль) в Ac2O (2 мл) добавляют смешанный раствор HNO3 (941 мг) и Ac2O (914 мг, 8,96 ммоль) при 0°C. Смесь перемешивают при 15°C в течение 7 ч. Полученный раствор разбавляют водой (50 мл) и экстрагируют этилацетатом (30 мл х 2).Объединенные органические слои промывают насыщенным NaHCO3 (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением N-(4-фтор-2-неопентил-6-нитрофенил)ацетамида (I-130) (440 мг) в виде желтого твердого вещества.
К раствору N-(4-фтор-2-неопентил-6-нитрофенил)ацетамида (440 мг, 1,64 ммоль) в EtOH (3 мл) добавляют HCl (12M, 6 мл). Смесь перемешивают при 90°C в течение 16 ч. pH смеси доводят до 7 добавлением NaOH раствора (1M) при 0°C. Полученный раствор экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 4-фтор-2-неопентил-6-нитроанилина (I-131) (400 мг) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,77 (дд, J=8,8, 3,2 Гц, 1H), 7,04 (дд, J=8,4, 3,2 Гц, 1H), 6,19 (с, 2H), 2,50 (с, 2H), 1,00 (м, 9H).
К раствору 4-фтор-2-неопентил-6-нитроанилина (400 мг, 1,77 ммоль) в MeOH (50 мл) добавляют влажный Pd/C (300 мг). Суспензию дегазируют под вакуумом и продувают H2 3 раза. Смесь перемешивают под H2 (15ф./кв.д.) при 15°C в течение 1 ч. Полученную суспензию фильтруют, и фильтрат концентрируют в вакууме с получением 5-фтор-3-неопентилбензол-1,2-диамина (I-132) (200 мг) в виде желтого твердого вещества. ЖХМС m/z 197,1 (M+1)+.
Смесь 5-фтор-3-неопентилбензол-1,2-диамина (200 мг, 1,02 ммоль) и 2-хлоруксусной кислоты (193 мг, 2,04 ммоль) в HCl (6M, 5 мл) перемешивают при 100°C в течение 16 ч. Смесь доводят до pH~9 с NH3.H2O и экстрагируют EtOAc (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 2), сушат над безводным Na2SO4, фильтруют и фильтрат концентрируют в вакууме с получением 2-(хлорметил)-5-фтор-7-неопентил-1H-бензо[d]имидазола (I-133) (260 мг) в виде желтого масла. ЖХМС m/z 355,1 (M+1)+.
К раствору 2-(хлорметил)-5-фтор-7-неопентил-1H-бензо[d]имидазола (260 мг, 1,02 ммоль) в ДХМ (10 мл) добавляют (Boc)2O (245 мг, 1,12 ммоль) и DMAP (137 мг, 1,12 ммоль). Смесь перемешивают при 15°C в течение 1 часа. Полученный раствор концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 2-(хлорметил)-6-фтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата (I-134) (140 мг) в виде желтого масла. ЖХМС m/z 355,1 (M+1)+.
К раствору трет-бутил 2-(хлорметил)-6-фтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата (140 мг, 0,395 ммоль) и 3-нитро-1H-пиридин-2-она (82,9 мг, 0,592 ммоль) в CH3CN (5 мл) добавляют DIPEA (102 мг, 0,790 ммоль). Смесь перемешивают при 25°C в течение 16 ч. Реакционную смесь концентрируют в вакууме с получением остатка. Остаток разбавляют H2O (50 мл) и экстрагируют EtOAc(20 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением трет-бутил 6-фтор-4-неопентил-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (I-135) (100 мг). ЖХМС m/z 459,3 (M+1)+.
К раствору трет-бутил 6-фтор-4-неопентил-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (100 мг, 0,218 ммоль) в MeOH (5 мл) добавляют влажный Pd/C (50 мг). Суспензию дегазируют под вакуумом и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 15°C в течение 0,5 ч. Полученную суспензию фильтруют и концентрируют в вакууме с получением трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-6-фтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата (I-136) (90 мг) в виде желтого твердого вещества. ЖХМС m/z 429,1 (M+1)+.
Следующие промежуточные соединения получают согласно методикам, описанным в I-136 с применением подходящих реагентов.
Пример 10:


К раствору (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (81,4 мг, 0,315 ммоль) и трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-6-фтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата (90 мг, 0,210 ммоль) в ДМФ (2 мл) добавляют HATU (160 мг, 0,420 ммоль) и DIEA (81,4 мг, 0,630 ммоль) при 0°C. Смесь перемешивают при 30°C в течение 4 ч. Реакционную смесь разбавляют H2O (50 мл) и экстрагируют EtOAc (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (30 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-6-фтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата (I-140) (130 мг) в виде желтого масла. ЖХМС m/z 569,2 (M+1)+.
К раствору (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-6-фтор-4-неопентил-1H-бензо[d]имидазол-1-карбоксилата (130 мг, 0,194 ммоль) в ДХМ (4 мл) добавляют ТФК (3,08 г, 27 ммоль, 2 мл) при 0°C. Смесь перемешивают при 15°C в течение 1 ч. Реакционную смесь концентрируют в вакууме с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил (7-(диметиламино)-1-((1-((6-фтор-4-неопентил-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 63) (47,2 мг, 36% выход) в виде белого твердого вещества. ЖХМС m/z 569,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,26 (с, 1H), 8,25 (дд, J=7,2, 1,6 Гц, 1H), 7,73 (д, J=7,6, 1H), 7,55 (дд, J=7,2, 1,6 Гц, 1H), 7,16 (дд, J=9,2, 2,0 Гц, 1H), 6,80 (дд, J=10,6, 2,0 Гц, 1H), 6,66-6,53 (м, 1H), 6,42-6,30 (м, 2H), 5,40 (с, 1H), 4,24-4,09 (м, 1H), 3,54 (с, 3H), 2,98 (с, 3H), 2,83 (с, 3H), 2,78 (с, 2H), 2,29-2,14 (м, 2H), 1,93-1,64 (м, 2H), 0,91 (с, 9H).
Следующие соединения получают согласно методикам, описанным в Примере 10 с применением подходящих промежуточных соединений.
Пример 11:

К раствору 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (77,23 мг, 389,78 мкмоль), 3-(2,2-диметилпропил)-5-фтор-бензол-1,2-диамина (85 мг, 433,09 мкмоль) и DIEA (111,95 мг, 866,18 мкмоль) в ДХМ (2 мл) добавляют T3P (413,40 мг) при 20°C и реакционную смесь перемешивают в течение 12 ч при этой температуре. Реакционную смесь концентрируют. Остаток разбавляют насыщ. NH4Cl (10 мл) и экстрагируют EtOAc (5 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (10 мл х 2), сушат над Na2SO4, фильтруют и фильтрат концентрируют с получением N-[2-амино-3-(2,2-диметилпропил)-5-фтор-фенил]-2-(3-нитро-2-оксо-1-пиридил)ацетамида (I-141) (140 мг) в виде коричневой камеди.
Раствор N-[2-амино-3-(2,2-диметилпропил)-5-фтор-фенил]-2-(3-нитро-2-оксо-1-пиридил)ацетамида (140 мг, 371,96 мкмоль) в AcOH (2 мл) перемешивают в течение 2H при 120°C. Реакционную смесь концентрируют и остаток разбавляют насыщ. NaHCO3 (5 мл) и затем экстрагируют EtOAc (5 мл х 3). Объединенные органические слои сушат над Na2SO4, фильтруют и остаток концентрируют. Остаток разбавляют в EtOAc (2 мл) и фильтруют. Лепешку 1-[[4-(2,2-диметилпропил)-6-фтор-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (I-142) (94 мг, 262,30 мкмоль, 70,52% выход) получают в виде белого твердого вещества.
К раствору 1-[[4-(2,2-диметилпропил)-6-фтор-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (84 мг, 234,40 мкмоль) и Cs2CO3 (152,74 мг, 468,79 мкмоль) в ДМФ (2 мл) добавляют MeI (66,54 мг, 468,79 мкмоль) при 0°C, и реакционную смесь перемешивают в течение 1 ч при 20°C. Реакционную смесь разбавляют насыщ. NH4Cl (10 мл) и экстрагируют EtOAc (10 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (20 мл х 2), сушат над Na2SO4, фильтруют и фильтрат концентрируют. Остаток очищают преп-ТСХ с получением 1-[[4-(2,2-диметилпропил)-6-фтор-1-метил-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (I-143) (40 мг, 46% выход) в виде оранжевого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,26 (дд, J=2,1, 7,6 Гц, 1H), 8,13 (дд, J=2,1, 6,7 Гц, 1H), 6,85-6,71 (м, 2H), 6,28 (дд, J=6,8, 7,6 Гц, 1H), 5,47 (с, 2H), 3,82 (с, 3H), 2,84 (с, 2H), 0,87 (с, 9H).
Раствор 1-[[4-(2,2-диметилпропил)-6-фтор-1-метил-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (65 мг, 174,55 мкмоль, 1 экв.) в EtOAc (10 мл) гидрогенируют над Pd/C (10 мг) (50% влажный) под H2 атмосферой (примерно 15 ф./кв.д.) при 25°C в течение 15 мин. Смесь фильтруют и фильтрат концентрируют досуха с получением 3-амино-1-[[4-(2,2-диметилпропил)-6-фтор-1-метил-бензимидазол-2-ил]метил]пиридин-2-она (I-144) (60 мг) в виде коричневой камеди, которую сразу используют.
К смеси (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (65 мг, 238,71 мкмоль, 1,49 экв) и 3-амино-1-[[4-(2,2-диметилпропил)-6-фтор-1-метил-бензимидазол-2-ил]метил]пиридин-2-она (55 мг, 160,63 мкмоль, 1 экв) в пиридине (2 мл) добавляют POCl3 (30 мг, 195,66 мкмоль, 18,18 мкл, 1,22 экв) при -30°C. Смесь перемешивают при этой температуре в течение 30 мин. Желаемый МС получают на ЖХМС. Смесь гасят H2O (10 мл) и экстрагируют EtOAc/MeOH (10:1,5 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[1-[[4-(2,2-диметилпропил)-6-фтор-1-метил-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 82) (15,2 мг, 15% выход) в виде беловатого твердого вещества. ЖХМС m/z 597,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,32 (с, 1H), 8,21 (дд, J=1,5, 7,3 Гц, 1H), 7,51 (дд, J=1,5, 6,8 Гц, 1H), 7,28 (дд, J=2,3, 9,2 Гц, 1H), 6,78 (дд, J=2,2, 10,8 Гц, 1H), 6,69-6,57 (м, 1H), 6,41-6,30 (м, 2H), 5,45 (с, 2H), 5,08 (дд, J=4,6, 7,5 Гц, 1H), 3,83 (с, 3H), 2,99-2,92 (м, 6H), 2,85-2,78 (м, 6H), 2,31-2,20 (м, 2H), 1,98-1,86 (м, 2H), 0,83 (с, 10H).
Следующее соединение получают по методикам, описанным в примере 11 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-148:

Смесь 3,6-дихлорпиридазин-4-амина (6 г, 36,59 ммоль, 1 экв) в водн. NaOH (100 мл, 4% водн.) перемешивают при 100°C в течение 24 ч. Реакционную смесь гасят добавлением HCl 1N до pH~5~6 и затем экстрагируют EtOAc (30 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (150 мл x 1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 5-амино-3-хлор-1H-пиридазин-6-она (I-145) (4,1 г) в виде коричневого твердого вещества, которое применяют на следующей стадии без очистки.
К раствору 5-амино-3-хлор-1H-пиридазин-6-она (98,44 мг, 676,35 мкмоль, 1,2 экв) в ДМФ (3 мл) добавляют NaH (33,81 мг, 845,44 мкмоль, 60% чистота, 1,5 экв) при -10°C, затем добавляют трет-бутил 2-(хлорметил)-4-(2,2-диметилпропил)-6-фтор-бензимидазол-1-карбоксилат (200,00 мг, 563,63 мкмоль, 1 экв) при -10°C. Смесь перемешивают при 25°C в течение 1 ч. Реакционную смесь гасят добавлением насыщ. NH4Cl (3 мл) и экстрагируют EtOAc (2 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (5 мл x 1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением трет-бутил 2-[(5-амино-3-хлор-6-оксо-пиридазин-1-ил)метил]-4-(2,2-диметилпропил)-6-фтор-бензимидазол-1-карбоксилата (I-147) (0,11 г) в виде желтого масла.
К раствору трет-бутил 2-[(5-амино-3-хлор-6-оксо-пиридазин-1-ил)метил]-4-(2,2-диметилпропил)-6-фтор-бензимидазол-1-карбоксилата (I-147) (110,00 мг, 237,10 мкмоль, 1 экв) в EtOAc (5 мл) добавляют Pd/C (0,1 г, 237,10 мкмоль, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 1 часа. ЖХМС показала оставшийся I-147, поэтому смесь перемешивают в течение еще 3 ч под H2 (15 ф./кв.д.) при 25°C. Реакционную смесь фильтруют и фильтрат концентрируют с получением трет-бутил 2-[(5-амино-6-оксо-пиридазин-1-ил)метил]-4-(2,2-диметилпропил)-6-фтор-бензимидазол-1-карбоксилата (I-148) (100 мг) в виде желтого масла, которое применяют на следующей стадии без очистки.
Пример 12:


К раствору трет-бутил 2-[(5-амино-6-оксо-пиридазин-1-ил)метил]-4-(2,2-диметилпропил)-6-фтор-бензимидазол-1-карбоксилата (90 мг, 209,55 мкмоль, 1 экв) и (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (57,06 мг, 209,55 мкмоль, 1 экв) в py (3 мл) добавляют POCl3 (64,26 мг, 419,10 мкмоль, 38,95 мкл, 2 экв) при -30°C. Смесь перемешивают при -30°C в течение 0,5 ч. Смесь гасят 1N HCl 0,5 мл и концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением трет-бутил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиридазин-1-ил]метил]-4-(2,2-диметилпропил)-6-фтор-бензимидазол-1-карбоксилата (Соединение 84) (52 мг, 36% выход) в виде белого твердого вещества.
Смесь трет-бутил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиридазин-1-ил]метил]-4-(2,2-диметилпропил)-6-фтор-бензимидазол-1-карбоксилата (48,00 мг, 70,20 мкмоль, 1 экв), ТФК (320,17 мг, 2,81 ммоль, 207,90 мкл, 40 экв) в ДХМ (1 мл) дегазируют и продувают N2 3 раза и затем смесь перемешивают при 25°C в течение 1 ч под N2 атмосферой. Смесь концентрируют с получением [(E,1S)-6-(диметиламино)-1-[[2-[[7-(2,2-диметилпропил)-5-фтор-1H-бензимидазол-2-ил]метил]-3-оксо-пиридазин-4-ил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата, соль ТФК (Соединение 85) (29,3 мг, 59% выход) в виде светло-зеленого твердого вещества,1H ЯМР (400 МГц, ДМСО-d6) δ 0,89 (с, 8 H) 1,82-2,00 (м, 2H) 2,23-2,34 (м, 2H) 2,51 (шс, 2H)2,80 (шд, J=11,03 Гц, 7 H) 2,85-3,00 (м, 6H) 5,16 (дд, J=8,38, 4,19 Гц, 1H) 5,61 (с, 2H) 6,38 (д, J=15,21 Гц, 1H) 6,59-6,68 (м, 1H) 6,91 (шд, J=10,36 Гц, 1H) 7,25 (шд, J=7,28 Гц, 1H) 7,93 (д, J=4,63 Гц, 1H) 8,02 (д, J=4,85 Гц, 1H) 10,12 (с, 1H).
Следующие соединения получают согласно методикам, описанным в Примере 12 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-157:

К раствору N-(4-фтор-2-йод-фенил)ацетамида (20,0 г, 71,7 ммоль) в ДМФ (20 мл) добавляют Pd(OAc)2 (322 мг, 1,43 ммоль), K2CO3 (34,7 г, 251 ммоль) и 1,1,1-трифтор-3-йодпропан (48,2 г, 215 ммоль, 25,2 мл). Смесь перемешивают при 110°C в течение 36 ч под N2 атмосферой. Смесь разбавляют водой (200 мл). Полученную смесь экстрагируют EtOAc (200 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (100 х 2 мл), сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток растирают с (Петролейным эфиром/EtOAc=20/1, 100 мл) с получением N-[4-фтор-2-[(E)-3,3,3-трифторпроп-1-енил]фенил]ацетамида (I-149) (13,5 г, 57% выход) в виде светло-желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ7,53 (дд, J=8,8, 5,3 Гц, 1H), 7,24-7,16 (м, 2H), 7,14-7,07 (м, 2H), 6,16 (м, 1H), 2,23 (с, 3H).
К раствору N-[4-фтор-2-[(E)-3,3,3-трифторпроп-1-енил]фенил]ацетамида (13,5 г, 41,0 ммоль) в MeOH (80 мл) добавляют влажный Pd/C (0,1 г, 10% чистота). Смесь перемешивают при 15°C в течение 12 ч под H2 атмосферой (15 ф./кв.д.). Полученную суспензию фильтруют, и фильтрат концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением N-[4-фтор-2-(3,3,3-трифторпропил)фенил]ацетамида (I-150) (12 г) в виде светло-желтого твердого вещества.
К раствору N-[4-фтор-2-(3,3,3-трифторпропил)фенил]ацетамида (5,5 г, 22,1 ммоль) в Ac2O (15 мл) добавляют HNO3 (4,28 г, 44,1 ммоль, 3,06 мл, 65% чистота) по каплям при 0°C. Смесь перемешивают при 0°C в течение 15 мин. Смесь перемешивают при 12°C в течение 6 ч. Смесь разбавляют водой (40 мл) и экстрагируют EtOAc (40 мл х 2). Объединенные органические слои промывают насыщенным NaHCO3 (40 мл х 2) и солевым раствором (60 мл) по очереди, сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением N-[4-фтор-2-нитро-6-(3,3,3-трифторпропил)фенил]ацетамида (I-151) (3,4 г, 47% выход) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ8,02 (с, 1H), 7,66 (дд, J=7,5, 2,9 Гц, 1H), 7,29 (дд, J=8,3, 2,9 Гц, 1H), 2,97-2,88 (м, 2H), 2,54-2,41 (м, 2H), 2,25 (с, 3H).
К раствору N-[4-фтор-2-нитро-6-(3,3,3-трифторпропил)фенил]ацетамида (2,90 г, 8,87 ммоль) в H2O (20 мл)/диоксане (20 мл) добавляют конц. HCl (18,4 г, 171 ммоль, 18,0 мл). Смесь перемешивают при 80°C в течение 14 ч под N2 атмосферой. Смесь разбавляют водой (60 мл). Полученную смесь экстрагируют EtOAc (60 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (60 мл х 2) и насыщенным NaHCO3 (60 мл х 2) по очереди, сушат над безводным Na2SO4 и концентрируют с получением 4-фтор-2-нитро-6-(3,3,3-трифторпропил)анилина (I-152) (2,5 г) в виде коричневого твердого вещества. Остаток применяют на следующей стадии без дальнейшей очистки.1H ЯМР (400 МГц, CDCl3) δ7,83 (дд, J=8,8, 2,9 Гц, 1H), 7,13 (дд, J=8,1, 2,9 Гц, 1H), 6,23-5,90 (м, 2H), 2,91-2,78 (м, 2H), 2,56-2,38 (м, 2H).
К раствору 4-фтор-2-нитро-6-(3,3,3-трифторпропил)анилина (2,50 г, 9,91 ммоль) в MeOH (25 мл) добавляют Pd/C (0,2 г, 10% чистота). Смесь перемешивают при 15°C в течение 12 ч под H2 атмосферой (15 ф./кв.д.). Полученную суспензию фильтруют, и фильтрат концентрируют с получением 5-фтор-3-(3,3,3-трифторпропил)бензол-1,2-диамина (I-153) (2,2 г) в виде коричневого масла. Остаток применяют на следующей стадии без очистки.1H ЯМР (400 МГц, CDCl3) δ6,51-6,23 (м, 2H), 3,24 (шс, 4H), 2,82-2,68 (м, 2H), 2,50-2,26 (м, 2H).
Смесь 5-фтор-3-(3,3,3-трифторпропил)бензол-1,2-диамина (1,20 г, 5,40 ммоль) и 2-хлоруксусной кислоты (612 мг, 6,48 ммоль, 729 мкл) в HCl (6M, 12 мл) перемешивают при 100°C в течение 6 ч. Смесь гасят NH3.H2O (40 мл). Полученный раствор экстрагируют EtOAc (50 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4 и концентрируют с получением 2-(хлорметил)-6-фтор-4-(3,3,3-трифтор пропил)-1H-бензимидазола (I-154) (1,5 г, 79% выход) в виде коричневого твердого вещества. Остаток применяют на следующей стадии без очистки. ЖХМС m/z 281,0 (M+1)+.
К раствору 2-(хлорметил)-6-фтор-4-(3,3,3-трифторпропил)-1H-бензимидазола (1,50 г, 4,28 ммоль) и DMAP (522 мг, 4,28 ммоль) в ДХМ (20 мл) добавляют Boc2O (933 мг, 4,28 ммоль, 982 мкл) порциями. Смесь перемешивают при 15°C в течение 1 ч. Полученный раствор концентрируют с получением остатка. Остаток очищают хроматографией на диоксиде кремния с получением трет-бутил 2-(хлорметил)-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (I-155) (1,2 г, 63% выход) в виде светло-желтого масла.1H ЯМР (400 МГц, CDCl3) δ7,61 (дд, J=9,2, 2,3 Гц, 1H), 6,95 (дд, J=9,9, 1,9 Гц, 1H), 5,04 (с, 2H), 3,30-3,22 (м, 2H), 2,69-2,54 (м, 2H), 1,74 (с, 9H).
К раствору трет-бутил 2-(хлорметил)-6-фтор-4-(3,3,3-трифторпропил)бензмидазол-1-карбоксилата (1,20 г, 2,68 ммоль) и 3-нитропиридин-2(1H)-она (450 мг, 3,21 ммоль) в MeCN (10 мл) добавляют DIEA (692 мг, 5,36 ммоль, 933 мкл). Смесь перемешивают при 30°C в течение 14 ч. Полученный раствор концентрируют с получением остатка. Остаток растирают с (H2O/этилацетат=5/1, 24 мл) с получением трет-бутил 6-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (I-156) (0,7 г, 51% выход) в виде светло-фиолетового твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ8,54 (дд, J=7,7, 2,1 Гц, 1H), 8,28 (дд, J=6,7, 2,0 Гц, 1H), 7,53 (дд, J=9,3, 2,4 Гц, 1H), 7,22 (дд, J=10,4, 2,4 Гц, 1H), 6,58-6,54 (м, 1H), 5,72 (с, 2H), 3,04-2,94 (м, 2H), 2,65-2,54 (м, 2H), 1,70 (с, 9H).
К раствору трет-бутил 6-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (0,7 г, 1,37 ммоль) в этилацетате (20 мл) добавляют влажный Pd/C (70 мг, 10% чистота). Смесь перемешивают при 15°C в течение 1 ч под H2 атмосферой (15 ф./кв.д.). Смесь фильтруют, и фильтрат концентрируют с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (I-157) (0,65 г, 99% выход) в виде светло-коричневого твердого вещества. ЖХМС m/z 455,3 (M+1)+.1H ЯМР (400 МГц, CDCl3) δ7,50 (дд, J=9,2, 2,4 Гц, 1H), 6,87 (дд, J=9,9, 2,4 Гц, 1H), 6,76 (дд, J=6,8, 1,6 Гц, 1H), 6,62 (дд, J=7,2, 1,6 Гц, 1H), 6,14 (т, J=7,0 Гц, 1H), 5,59 (с, 2H), 4,20 (с, 2H), 3,14-3,01 (м, 2H), 2,56-2,41 (м, 2H), 1,72 (с, 9H).
Следующие промежуточные соединения получают по методике, описанной для синтеза I-157 с применением подходящих реагентов.
Пример 13:

К раствору трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-6-фтор-4-(3,3,3- трифторпропил)бензимидазол-1-карбоксилата (30 мг, 62,7 мкмоль) и (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (19,4 мг, 75,3 мкмоль) в ДМФ (1 мл) добавляют HATU (28,6 мг, 75,3 мкмоль), DIEA (16,2 мг, 125 мкмоль, 21,9 мкл) по очереди. Смесь перемешивают при 30°C в течение 16 ч. Смесь разбавляют водой (40 мл). Полученную смесь экстрагируют EtOAc (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (60 х 3 мл), сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (Соединение 88) (24,9 мг, 57% выход) в виде белого твердого вещества. ЖХМС m/z 695,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ8,43 (с, 1H), 7,45 (д, J=7,0 Гц, 1H), 7,00-6,85 (м, 1H), 6,90 (д, J=7,7 Гц, 1H), 6,74-6,61 (м, 2H), 6,37 (д, J=8,9 Гц, 1H), 5,84-5,69 (м, 1H), 5,58-5,46 (м, 2H), 4,81 (с, 2H), 3,34 (шс, 1H), 2,70 (с, 3H), 2,21-2,09 (м, 5H), 2,00 (с, 3H), 1,85-1,71 (м, 2H), 1,45-1,31 (м, 2H), 1,03 (д, J=5,3 Гц, 2H), 0,88-0,83 (м, 1H), 0,86 (с, 7H), 0,88-0,81 (м, 1H).
К раствору трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (0,120 г, 173 мкмоль) в ДХМ (6 мл) добавляют ТФК (3,08 г, 27,0 ммоль, 2 мл) при 0°C. Смесь перемешивают при 10°C в течение 1 ч. Смесь концентрируют с получением остатка. Остаток очищают преп-ЖХВД и преп-СЖХ с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[5-фтор-7-(3,3,3-трифторпропил)-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 89) (41,2 мг, 67% выход) в виде белого твердого вещества. ЖХМС m/z 595,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ9,27 (с, 1H), 8,25 (дд, J=7,4, 1,6 Гц, 1H), 7,74 (д, J=7,8 Гц, 1H), 7,57 (дд, J=6,9, 1,6 Гц, 1H), 7,15 (с, 1H), 7,00 (д, J=8,9 Гц, 1H), 6,68-6,53 (м, 1H), 6,43-6,29 (м, 2H), 5,40 (с, 2H), 4,28-4,07 (м, 1H), 3,54 (с, 3H), 3,16-3,06 (м, 2H), 2,98 (с, 3H), 2,83 (с, 3H), 2,77-2,63 (м, 2H), 2,30-2,16 (м, 2H), 1,94-1,65 (м, 2H).
Следующие соединения получают по методике, описанной для синтеза Примера 13 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-164:

К раствору 4-фтор-2-нитро-6-(3,3,3-трифторпропил)анилина (1,5 г, 5,95 ммоль) в EtOAc (40 мл) добавляют Pd/C (0,5 г, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 1 часа. Реакционную смесь фильтруют и фильтрат концентрируют в вакууме с получением 5-фтор-3-(3,3,3-трифторпропил)бензол-1,2-диамина (I-160) (1,35 г) в виде желтого масла.
Смесь 5-фтор-3-(3,3,3-трифторпропил)бензол-1,2-диамина (0,45 г, 2,03 ммоль), 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (300,97 мг, 1,52 ммоль) и DIEA (523,53 мг, 4,05 ммоль) в ДХМ (5 мл) добавляют T3P (1,93 г, 3,04 ммоль, 50% чистота) при 30°C. Реакционную смесь перемешивают при 30°C в течение 12 часов. В реакционную смесь добавляют H2O (10 мл) и затем экстрагируют ДХМ (5 мл х 2). Объединенную органическую фазу сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме с получением N-[2-амино-5-фтор-3-(3,3,3-трифторпропил)фенил]-2-(3-нитро-2-оксо-1-пиридил)ацетамида (I-161) (0,67 г) в виде коричневого твердого вещества.
Реакционную смесь N-[2-амино-5-фтор-3-(3,3,3-трифторпропил)фенил]-2-(3-нитро-2-оксо-1-пиридил)ацетамида (0,67 г, 1,67 ммоль) в AcOH (6 мл) перемешивают при 120°C в течение 11 часов. Реакционную смесь концентрируют в вакууме с получением коричневого твердого вещества. Остаток промывают петролейным эфиром (20 мл) с получением 1-[[5-фтор-7-(3,3,3-трифторпропил)-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (I-162) (0,6 г) в виде коричневого твердого вещества.
Смесь 1-[[5-фтор-7-(3,3,3-трифторпропил)-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (200 мг, 520,45 мкмоль) и Cs2CO3 (339,14 мг, 1,04 ммоль) в ДМФ (3 мл) добавляют MeI (147,74 мг, 1,04 ммоль) при 0°C. Реакционную смесь перемешивают при 25°C в течение 1 часа. Реакционную смесь гасят добавлением насыщенного NH4Cl (20 мл) и экстрагируют этилацетатом (5 мл х 3). Объединенную органическую фазу промывают насыщенным солевым раствором (20 мл х 1), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией с получением 1-[[6-фтор-1-метил-4-(3,3,3-трифторпропил)бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (I-163) (0,15 г, 56% выход) в виде светло-желтого твердого вещества.
К раствору 1-[[6-фтор-1-метил-4-(3,3,3-трифторпропил)бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (0,15 г, 376,59 мкмоль) в EtOAc (10 мл) добавляют Pd/C (0,2 г, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 1 ч. Реакционную смесь фильтруют и фильтрат концентрируют в вакууме с получением 3-амино-1-[[6-фтор-1-метил-4-(3,3,3-трифторпропил)бензимидазол-2-ил]метил]пиридин-2-она (I-164) (150 мг) в виде коричневого твердого вещества. ЖХМС m/z 369,3 (M+1)+.
Пример 14:

Смесь 3-амино-1-[[6-фтор-1-метил-4-(3,3,3-трифторпропил)бензимидазол-2-ил]метил]пиридин-2-она (65 мг, 176,47 мкмоль) и (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (52,86 мг, 194,12 мкмоль) в Py (2 мл) охлаждают до -30°C, затем POCl3 (54,12 мг, 352,95 мкмоль) добавляют по каплям при -30°C. Реакционную смесь перемешивают при -30°C в течение 0,5 часа. ТСХ показала, что реакционная смесь в основном прореагировала. Реакционную смесь гасят добавлением насыщенного NaHCO3 (10 мл) и экстрагируют этилацетатом (5 мл х 2). Объединенную органическую фазу промывают насыщенным солевым раствором (10 мл х 1), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением [(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-1-метил-4-(3,3,3-трифторпропил)бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 100) (23,6 мг, 20% выход) в виде коричневой камеди. ЖХМС m/z 623,4 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,33 (д, J=16,75 Гц, 1H) 8,22 (дд, J=7,34, 1,71 Гц, 1H) 7,57 (д, J=6,36 Гц, 1H) 7,36 (дд, J=9,17, 2,20 Гц, 1H) 7,01 (дд, J=10,70, 2,14 Гц, 1H) 6,58-6,69 (м, 1H) 6,31-6,43 (м, 2H) 5,46 (с, 2H) 5,05-5,12 (м, 1H) 3,87 (с, 3H) 3,05-3,13 (м, 2H) 3,01 (шд, J=6,48 Гц, 1H) 2,91-2,98 (м, 4 H) 2,78-2,86 (м, 6H) 2,65-2,73 (м, 3H) 2,21-2,35 (м, 2H) 1,82-2,02 (м, 2H).
Следующее соединение получают согласно методикам, описанным для синтеза Примера 14 с применением подходящих промежуточных соединений.
Пример15:

Стадия 1: Синтез трет-бутил 2-[(5-амино-6-оксо-пиримидин-1-ил)метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (I-165)
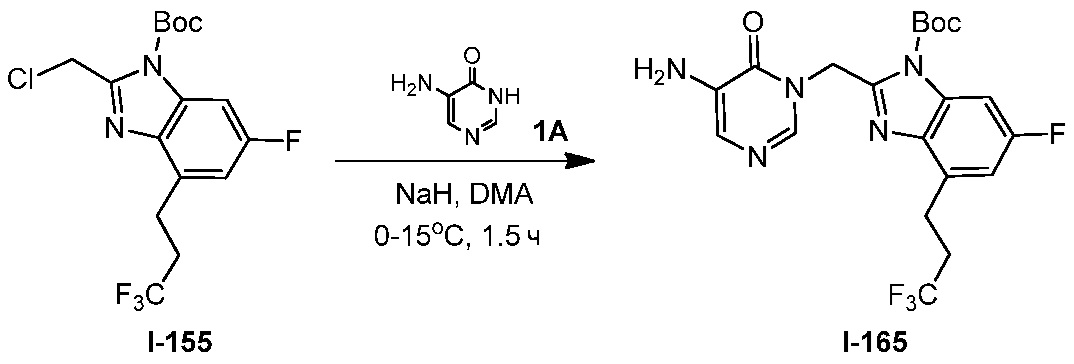
Смесь 5-амино-1H-пиримидин-6-она (87,54 мг, 787,89 мкмоль) в DMA (3 мл) охлаждают до 0°C, затем добавляют NaH (52,53 мг, 1,31 ммоль, 60% чистота). Смесь перемешивают при 0°C в течение 30 мин. Затем добавляют трет-бутил 2-(хлорметил)-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилат (250 мг, 656,57 мкмоль). Реакционную смесь перемешивают при 25°C в течение 1 часа. Реакционную смесь гасят добавлением H2O (20 мл) и экстрагируют этилацетатом (10 мл х 3). Объединенную органическую фазу сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением трет-бутил 2-[(5-амино-6-оксо-пиримидин-1-ил)метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (I-165) (70 мг, 20% выход) в виде светло-желтого твердого вещества. ЖХМС m/z 456,3 (M+1)+.
Смесь трет-бутил 2-[(5-амино-6-оксо-пиримидин-1-ил)метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (55,00 мг, 120,77 мкмоль) и (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (37,43 мг, 144,93 мкмоль) в Py (1 мл) охлаждают до -30°C, затем POCl3 (55,55 мг, 362,31 мкмоль, 33,67 мкл) добавляют по каплям при -30°C. Реакционную смесь перемешивают при -30°C в течение 0,5 часа. Реакционную смесь гасят добавлением насыщенного NaHCO3 (20 мл) и экстрагируют этилацетатом (5 мл х 3). Объединенную органическую фазу промывают HCl (1 N) (10 мл х 1) и солевым раствором (10 мл х 1), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением трет-бутил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиримидин-1-ил]метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (Соединение 102) (30,0 мг, 33% выход) в виде белого твердого вещества. ЖХМС m/z 696,2 (M+1)+.
Смесь трет-бутил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиримидин-1-ил]метил]-6-фтор-4-(3,3,3-трифторпропил)бензимидазол-1-карбоксилата (27,0 мг, 36,30 мкмоль) в ДХМ (0,6 мл) добавляют ТФК (308,00 мг, 2,70 ммоль, 0,2 мл) при 20°C. Затем реакционную смесь перемешивают при 20°C в течение 0,5 часа. Реакционную смесь сушат пропусканием N2. Холодный насыщ. водн. NaHCO3 добавляют для доведения pH смеси до ~8. Смесь экстрагируют этилацетатом (5 мл х 3). Объединенную органическую фазу сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[5-фтор-7-(3,3,3-трифторпропил)-1H-бензимидазол-2-ил]метил]-6-оксо-пиримидин-5-ил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 103) (19,5 мг, 88% выход) в виде светло-желтого твердого вещества. ЖХМС m/z 596,2 (M+1)+.
Следующие соединения получают по методике, описанной для синтеза Пример 15 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-174:

К раствору 4-бромбут-1-ена (50 г, 370 ммоль) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (106 г, 418,5 ммоль) в ТГФ (500 мл) добавляют CuCl (1,83 г, 18,52 ммоль) и Xantphos (10,72 г, 18,5 ммоль). t-BuOK (49,9 г, 444,4 ммоль) добавляют к смеси при 0-30°C. Смесь перемешивают при 30°C в течение 12 ч. Полученную суспензию фильтруют, и фильтрат концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 2-(циклопропилметил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (I-167) (70,0 г) в виде бесцветного масла.
К раствору 2-(циклопропилметил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (120 г, 659 ммоль) в MeCN (600 мл) и H2O (200 мл) добавляют KHF2 (103 г, 1,32 моль). Смесь перемешивают при 30°C в течение 12 ч. Смесь фильтруют, и фильтрат концентрируют до примерно 300 мл. Смесь перемешивают при 30°C в течение 30 мин и затем фильтруют с получением белого твердого вещества, промывают MeCN (30 мл х 2) с получением циклопропилметил(трифтор)борона; гидрида калия (I-168) (26 г, 24% выход) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6+D2O) δ 0,5-0,49(м, 1H), 0,17-0,14 (м, 2H), 0,05-0,04 (м, 2H), 0,22-0,21 (м, 2H).
К раствору 2-бром-4-фтор-6-нитро-анилина (5 г, 21,28 ммоль) и циклопропилметил(трифтор)борона; гидрида калия (8,62 г, 53,19 ммоль) в Тол. (50 мл) и H2O (5 мл) добавляют [2-(2-аминофенил)фенил]-хлор-палладий; тритрет-бутилфосфан (545,09 мг, 1,06 ммоль) и Cs2CO3 (13,86 г, 42,55 ммоль) под N2 атмосферой. Смесь перемешивают при 90°C в течение 12 ч. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток очищают колоночной хроматографией с получением 2-(циклопропилметил)-4-фтор-6-нитро-анилина (I-170) (1,6 г, 33% выход) в виде желтого твердого вещества.
К раствору 2-(циклопропилметил)-4-фтор-6-нитро-анилина (1 г, 4,76 ммоль) в EtOAc (10 мл) добавляют Pd/C (10%, 100 мг) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 2 ч. Реакционную смесь фильтруют и фильтрат концентрируют с получением 3-(циклопропилметил)-5-фтор-бензол-1,2-диамина (I-171) (890 мг) в виде коричневого масла, которое применяют на следующей стадии без дальнейшей очистки.
К раствору 3-(циклопропилметил)-5-фтор-бензол-1,2-диамина (890 мг, 4,94 ммоль) и 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (1,17 г, 5,93 ммоль) в ДХМ (10 мл) добавляют T3P (4,09 г, 6,42 ммоль, 3,82 мл, 50% чистота) и DIEA (1,28 г, 9,88 ммоль, 1,72 мл). Смесь перемешивают при 40°C в течение 2 ч и концентрируют с получением 1-[[4-(циклопропилметил)-6-фтор-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (I-172) (1,6 г) в виде фиолетового масла, которое применяют на следующей стадии без дальнейшей очистки.
К раствору 1-[[4-(циклопропилметил)-6-фтор-1H-бензимидазол-2-ил] метил]-3-нитро-пиридин-2-она (1,6 г, 4,67 ммоль) в ДХМ (15 мл) добавляют Boc2O (1,33 г, 6,08 ммоль, 1,40 мл) и DIEA (1,21 г, 9,35 ммоль, 1,63 мл) и DMAP (28,55 мг, 233,70 мкмоль). Смесь перемешивают при 25°C в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией с получением трет-бутил 4-(циклопропилметил)-6-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (I-173) (400 мг, 19% выход) в виде желтого твердого вещества.
К раствору трет-бутил 4-(циклопропилметил)-6-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (370 мг, 836,27 мкмоль) в MeOH (5 мл) и H2O (1 мл) добавляют Fe (233,51 мг, 4,18 ммоль) и NH4Cl (447,33 мг, 8,36 ммоль, 292,38 мкл). Смесь перемешивают при 80°C в течение 1 ч. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток очищают колоночной хроматографией с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-4-(циклопропилметил)-6-фтор-бензимидазол-1-карбоксилата (I-174) (80 мг, 23% выход) в виде зеленого масла. ЖХМС m/z 312,9 (M-100+1)+.
Следующий анилин получают по методикам, описанным для синтеза I-174 с применением подходящих реагентов.
Пример 16:

К раствору трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-4-(циклопропилметил)-6-фтор-бензимидазол-1-карбоксилата (70 мг, 169,71 мкмоль) и (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (48,22 мг, 186,69 мкмоль) в ДМФ (1 мл) добавляют HATU (96,80 мг, 254,57 мкмоль) и DIEA (43,87 мг, 339,43 мкмоль, 59,12 мкл). Смесь перемешивают при 20°C в течение 12 ч. Остаток выливают в насыщенный раствор хлорида аммония (5 мл) и экстрагируют этилацетатом (3 мл х 3). Объединенную органическую фазу промывают насыщенным солевым раствором (5 мл х 2), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ЖХВД с получением трет-бутил 4-(циклопропилметил)-2-[[3-[[(E,2S)-7-(диметиламино)-2-метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-6-фтор-бензимидазол-1-карбоксилата (Соединение 104) (87,3 мг, 60% выход) в виде белого твердого вещества. ЖХМС m/z 653,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,26 (с, 1H) 8,28 (дд, J=7,45, 1,32 Гц, 1H) 7,74 (шд, J=7,89 Гц, 1H) 7,45-7,51 (м, 2H) 7,14 (дд, J=10,52, 2,63 Гц, 1H) 6,55-6,65 (м, 1H) 6,31-6,40 (м, 2H) 5,62 (с, 2H) 4,12-4,21 (м, 1H) 3,53 (с, 3H) 2,98 (с, 3H) 2,83 (с, 3H) 2,63 (д, J=7,02 Гц, 2H) 2,16-2,30 (м, 2H) 1,86 (шд, J=7,89 Гц, 1H) 1,69 (с, 9 H) 0,89 (шт, J=7,24 Гц, 1H) 0,29-0,36 (м, 2H) 0,09-0,16 (м, 2H).
К раствору трет-бутил 4-(циклопропилметил)-2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-6-фтор-бензимидазол-1-карбоксилата (80 мг, 102,87 мкмоль) в ДХМ (2 мл) добавляют ТФК (646,27 мг, 5,67 ммоль, 419,66 мкл). Смесь перемешивают при 20°C в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении для удаления раствора и затем к остатку добавляют 5 мл насыщенного раствора NaHCO3 и экстрагируют этилацетатом (5 мл х 3). Объединенную органическую фазу промывают насыщенным солевым раствором (5 мл х 2), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-1-[[1-[[4-(циклопропилметил)-6-фтор-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 105) (30,7 мг, 53% выход) в виде белого твердого вещества. ЖХМС m/z 553,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 12,37-12,78 (м, 1H) 9,27 (шд, J=7,89 Гц, 1H) 8,25 (д, J=7,45 Гц, 1H) 7,75 (шс, 1H) 7,57 (д, J=5,26 Гц, 1H) 7,04-7,20 (м, 1H) 6,96 (ш дд, J=16,22, 10,96 Гц, 1H) 6,56-6,65 (м, 1H) 6,31-6,42 (м, 2H) 5,38 (шс, 2H) 4,17 (шс, 1H) 3,54 (шс, 3H) 2,99 (с, 3H) 2,84 (с, 3H) 2,73-2,80 (м, 2H) 2,15-2,30 (м, 2H) 1,87 (шс, 1H) 1,72 (шс, 1H) 1,11 (шс, 1H) 0,40-0,53 (м, 2H) 0,24 (шд, J=11,40 Гц, 2H).
Следующие соединения получают по методикам, описанным для синтеза Примера 16 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-184:

К раствору 2,4-дифторфенола (5,00 г, 38,4 ммоль) в ДМФ (50 мл) добавляют NaH (1,84 г, 46,1 ммоль, 60% чистота) при 0°C. Смесь перемешивают при 25°C в течение 1 ч. Затем 1,3-дифтор-2-нитробензол (6,11 г, 38,4 ммоль) в ДМФ (10 мл) добавляют к реакционной смеси. Смесь перемешивают при 25°C в течение 16 ч. Полученный раствор разбавляют водой (100 мл) и экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 1-(2,4-дифторфенокси)-3-фтор-2-нитробензола (I-178) (9,40 г) в виде желтого масла.
К раствору 1-(2,4-дифторфенокси)-3-фтор-2-нитробензола (9,40 г, 34,9 ммоль) и фенилметанамина (4,12 г, 38,4 ммоль) в NMP (20 мл) добавляют K2CO3 (9,65 г, 69,8 ммоль). Смесь перемешивают при 100°C в течение 16 часов. Смесь разбавляют водой (150 мл) и затем экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением N-бензил-3-(2,4-дифторфенокси)-2-нитроанилина (I-179) (10,0 г) в виде красного масла.
К раствору N-бензил-3-(2,4-дифторфенокси)-2-нитроанилина (5,00 г, 14,0 ммоль) в MeOH (100 мл) добавляют Pd(OH)2 (2,00 г, 2,14 ммоль, 15% чистота). Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 2 ч. Полученную суспензию фильтруют и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 3-(2,4-дифторфенокси)бензол-1,2-диамина (I-180) (2,50 г, 70% выход) в виде красного масла. ЖХМС m/z 237,0 (M+1)+.
К раствору 3-(2,4-дифторфенокси)бензол-1,2-диамина (5,00 г, 21,2 ммоль) в H2O (20 мл) и HCl (20 мл) добавляют 2-хлоруксусную кислоту (4,00 г, 42,3 ммоль) при 25°C. Смесь перемешивают при 90°C в течение 16 ч. pH смеси доводят до 7 добавлением насыщенного гидроксида аммония при 0°C. Полученную суспензию экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 2-(хлорметил)-7-(2,4-дифторфенокси)-1H-бензо[d]имидазола (I-181) (6,35 г) в виде коричневого твердого вещества.
К раствору 2-(хлорметил)-7-(2,4-дифторфенокси)-1H-бензо[d]имидазола (6,35 г, 21,6 ммоль) в ДХМ (30 мл) добавляют Boc2O (5,17 г, 23,7 ммоль) и DMAP (2,90 г, 23,7 ммоль). Смесь перемешивают при 25°C в течение 1 часа. В смесь добавляют H2O (100 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией с получением трет-бутил 2-(хлорметил)-4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-1-карбоксилата (I-182) (2,0 г, 21% выход) в виде желтого твердого вещества. ЖХМС m/z 338,9 (M+1)+.
К раствору 3-нитропиридин-2(1H)-она (427 мг, 3,04 ммоль) и трет-бутил 2-(хлорметил)-4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-1-карбоксилата (800 мг, 2,03 ммоль) в MeCN (15 мл) добавляют DIPEA (787 мг, 6,09 ммоль). Смесь перемешивают при 25°C в течение 16 часов. Реакционную смесь (две объединенные партии) концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 4-(2,4-дифторфенокси)-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (I-183) (1,15 г, 56% выход) в виде желтого твердого вещества. ЖХМС m/z 399,0 (M+1)+.
К раствору трет-бутил 4-(2,4-дифторфенокси)-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (1,15 г, 2,31 ммоль) в MeOH (100 мл) добавляют Pd/C (200 мг, 10% чистота). Смесь перемешивают при 20°C в течение 0,5 часа под H2 атмосферой (15 ф./кв.д.). Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-1-карбоксилата (I-184) (900 мг, 77% выход) в виде коричневого твердого вещества. ЖХМС m/z 469,0 (M+1)+.
Следующие промежуточные соединения получают согласно методикам, описанным в I-184 с применением подходящих реагентов.
Пример 17:

К раствору (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (185 мг, 718 мкмоль) и трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-1-карбоксилата (100 мг, 213 мкмоль) в ДМФ (3 мл) добавляют HATU (218 мг, 574 мкмоль) и DIPEA (186 мг, 1,44 ммоль) при 0°C. Раствор перемешивают при 25°C в течение 16 часов. Полученный раствор концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-трет-бутил 4-(2,4-дифторфенокси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (I-186) (100 мг, 29% выход) в виде белого твердого вещества. ЖХМС m/z 709,1 (M+1)+.
К раствору (S, E)-трет-бутил4-(2,4-дифторфенокси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-бензо[d]имидазол-1-карбоксилата (95 мг, 134 мкмоль) в ДХМ (6 мл) добавляют ТФК (2 мл) при 0°C. Смесь перемешивают при 20°C в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил (1-((1-((4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 110) (68,4 мг, 83% выход) в виде белого твердого вещества. ЖХМС m/z 609,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,27 (с, 1H), 8,26 (дд, J=7,6, 1,6 Гц, 1H), 7,75 (д, J=7,6 Гц, 1H), 7,58 (дд, J=6,8, 1,6 Гц, 1H), 7,52-7,43 (м, 1H), 7,29-7,16 (м, 2H), 7,08 (т, J=8,0 Гц, 2H), 6,65-6,57 (м, 1H), 6,51 (д, J=7,8 Гц, 1H), 6,41-6,34 (м, 2H), 5,40 (с, 2H), 4,21-4,14 (м, 1H), 3,55 (с, 3H), 2,99 (с, 3H), 2,84 (с, 3H), 2,28-2,19 (м, 2H), 1,95-1,85 (м, 1H), 1,78-1,69 (м, 1H).
Следующие соединения получают согласно методикам, описанным в Примере 17 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-195:


К раствору 2-амино-3-нитрофенола (5,00 г, 32,4 ммоль) и K2CO3 (4,04 г, 29,2 ммоль) в ДМФ (40 мл) добавляют 1-(бромметил)-2,4-дифторбензол (6,72 г, 32,4 ммоль). Смесь перемешивают при 23°C в течение 2 ч. Смесь выливают в воду (100 мл) и экстрагируют этилацетат (50 мл х 4). Объединенные органические слои промывают солевым раствором (200 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((2,4-дифторбензил)окси)-6-нитроанилина (I-189) (9,00 г) в виде белого твердого вещества. ЖХМС m/z 281,0 (M+1)+.
К раствору 2-((2,4-дифторбензил)окси)-6-нитроанилина (7,00 г, 25,0 ммоль) в MeOH (70 мл) и H2O (7 мл) добавляют Fe (6,98 г, 125 ммоль) и NH4Cl (13,4 г, 250 ммоль, 8,73 мл). Смесь перемешивают при 85°C в течение 2 ч. Полученную суспензию фильтруют и фильтрат концентрируют в вакууме с получением остатка. Остаток разбавляют водой (50 мл) и экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают солевым раствором (150 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 3-((2,4-дифторбензил)окси)бензол-1,2-диамина (I-190) (5,60 г) в виде черного масла.
К раствору 3-((2,4-дифторбензил)окси)бензол-1,2-диамина (5,60 г, 22,4 ммоль) в o-ксилоле (50 мл) добавляют 2-гидроксиуксусную кислоту (1,70 г, 22,4 ммоль, 1,36 мл). Реакционную смесь перемешивают при 150°C в течение 7 ч. Полученный раствор выливают в ледяную воду (50 мл) и экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают солевым раствором (150 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением (7-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метанола (I-191) (5,70 г, 18,7 ммоль, 83% выход) в виде коричневого твердого вещества. ЖХМС m/z 291,0 (M+1)+,1H ЯМР (400 МГц, CDCl3) δ7,50-7,52 (м, 1H), 7,19-7,23 (м, 2H), 6,80-6,90 (м, 3H), 5,47 (д, J=3,6 Гц, 1H), 5,27-5,32 (м, 2H), 4,27 (с, 1H).
К раствору (7-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метанола (5,70 г, 19,6 ммоль) в ТГФ (60 мл) добавляют NaH (1,18 г, 29,5 ммоль) при 0°C. Смесь перемешивают при той же температуре в течение 30 мин и затем SEM-Cl (2,95 г, 17,7 ммоль, 3,14 мл) добавляют к реакционной смеси выше. Полученную суспензию перемешивают при 23°C в течение 2 ч. Реакционную смесь выливают в воду (80 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои промывают солевым раствором (300 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением (4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метанола (I-192) (6,00 г) в виде коричневого масла.1H ЯМР (400 МГц, CDCl3) δ 7,75-7,55 (м, 1H), 7,48 (дд, J=8,4, 3,2 Гц, 1H), 7,31-7,25 (м, 1H), 7,07-6,91 (м, 3H), 5,89 (с, 1H), 5,67 (с, 1H), 5,49-5,40 (м, 1H), 5,32 (с, 1H), 5,08-5,00 (м, 2H), 3,67-3,54 (м, 2H), 1,02-0,83 (м, 2H), 0,05-0,03 (м, 3H), 0,00 (с, 6H).
К раствору (4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метанола (6,00 г, 14,3 ммоль) в ДХМ (50 мл) добавляют Et3N (2,89 г, 28,5 ммоль, 3,96 мл) и MsCl (1,63 г, 14,3 ммоль, 1,10 мл) при 0°C. Смесь перемешивают при 0-23°C в течение 1 ч. Полученный раствор выливают в воду (50 мл) и экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают солевым раствором (150 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением (4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (I-193) (6,60 г) в виде коричневого масла.
К раствору (4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (6,60 г, 14,2 ммоль) в ДМФ (50 мл) добавляют Et3N (2,88 г, 28,5 ммоль, 3,95 мл) и 3-нитропиридин-2(1H)-он (2,00 г, 14,24 ммоль). Смесь перемешивают при 23°C в течение 16 ч. Полученный раствор выливают в воду (100 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (300 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 1-((4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-194) (5,00 г) в виде коричневого масла.
К раствору 1-((4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (5,00 г, 9,21 ммоль) в MeOH (50 мл) и H2O (5 мл) добавляют Fe (2,57 г, 46,1 ммоль) и NH4Cl (4,93 г, 92,1 ммоль, 3,22 мл). Смесь перемешивают при 85°C в течение 1 ч. Полученную суспензию фильтруют и фильтрат концентрируют в вакууме с получением остатка. Остаток выливают в воду (100 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои промывают солевым раствором (300 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией с получением 3-амино-1-((4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-195) (4,00 г) в виде коричневого масла. ЖХМС m/z 513,1 (M+1)+.
Следующие промежуточные соединения получают согласно методикам, описанным в I-195 с применением подходящих реагентов.
Пример 18:


К смеси 3-амино-1-((4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (200 мг, 0,390 ммоль), (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (151 мг, 0,585 ммоль) и HATU (223 мг, 0,585 ммоль) в ДМФ (3 мл) добавляют DIPEA (151 мг, 1,17 ммоль, 0,2 мл) при 0°C. Смесь перемешивают при 0-20°C в течение 16 ч. Смесь выливают в ледяную воду (30 мл) и экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-метил (1-((1-((4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (I-205) (280 мг) в виде коричневого масла. ЖХМС m/z 753,4 (M+1)+.
К смеси (S, E)-метил (1-((1-((4-((2,4-дифторбензил)окси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (280 мг, 0,372 ммоль) в ДХМ (1 мл) добавляют ТФК (2,31 г, 20,3 ммоль, 1,5 мл) при 0°C. Смесь перемешивают при 0-20°C в течение 6 ч. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением метил (S, E)-метил(1-((1-((7-((2,4-дифторбензил)окси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 115) (61,1 мг, 26% выход) в виде белого твердого вещества. ЖХМС m/z 623,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ9,25 (с, 1H), 8,27 (д, J=7,2 Гц, 1H), 7,72 (д, J=7,6 Гц, 1H), 7,60-7,50 (м, 3H), 7,46-7,32 (м, 4H), 7,28-7,17 (м, 2H), 6,99 (д, J=8,0 Гц, 1H), 6,89 (с, 1H), 6,52-6,63 (м, 1H), 6,39 (т, J=7,2 Гц, 1H), 5,84 (д, J=15,6 Гц, 1H), 5,48 (с, 2H), 5,32 (с, 2H), 4,47-3,95 (м, 1H), 3,62-3,59 (м, 3H), 2,29-2,08 (м, 3H), 1,90-1,76 (м, 1H), 1,73-1,62 (м, 1H).
Следующие соединения получают согласно методикам, описанным в Примере 18 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-218:

К раствору BnOH (24,4 г, 226 ммоль) в ТГФ (500 мл) добавляют NaH (10,8 г, 271 ммоль, 60% чистота) при 0°C. Смесь перемешивают при 15°C в течение 0,5 ч. 1,3,5-трифтор-2-нитробензол (40 г, 225 ммоль) затем добавляют к реакционной смеси при 0°C. Смесь перемешивают при 15°C в течение 16 ч. Полученный раствор гасят ледяной водой (800 мл) при 0°C и экстрагируют EtOAc (1000 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (800 мл х 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 1-(бензилокси)-3,5-дифтор-2-нитробензол (I-207) (21,2 г) в виде светло-желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,47-7,34 (м, 5H), 6,65-6,55 (м, 2H), 5,20 (с, 2H).
Раствор 1-(бензилокси)-3,5-дифтор-2-нитробензол (5,6 г х 3, 21,1 ммоль) в NH3.MeOH (5 M, 21,1 мл) перемешивают при 60°C в течение 16 ч в душном резервуаре. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 3-(бензилокси)-5-фтор-2-нитроанилина (I-208) (15,5 г) в виде светло-желтого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,45-7,32 (м, 5H), 6,47 (с, 2H), 6,36 (дд, J=10,8, 2,4 Гц, 1H), 6,25 (дд, J=11,2, 2,4 Гц, 1H), 5,17 (с, 2H).
К раствору 3-(бензилокси)-5-фтор-2-нитроанилина (15,5 г, 59,1 ммоль) и Fe (16,5 г, 295 ммоль) в MeOH (300 мл) и H2O (60 мл) добавляют NH4Cl (31,6 г, 591 ммоль). Смесь перемешивают при 60°C в течение 3 ч. Полученную суспензию фильтруют, и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток разбавляют водой (200 мл) и экстрагируют EtOAc (200 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (200 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 3-(бензилокси)-5-фторбензол-1,2-диамина (I-209) (14 г) который применяют на следующей стадии без дальнейшей очистки.
К раствору 3-(бензилокси)-5-фторбензол-1,2-диамина (10,0 г, 60,3 ммоль), DIPEA (15,6 г, 121 ммоль) и T3P (57,5 г, 90,4 ммоль) в ДХМ (200 мл) добавляют 3-бензилокси-5-фтор-бензол-1,2-диамин (14 г, 60,3 ммоль) при 0°C. Смесь перемешивают при 15°C в течение 16 ч. Полученный раствор разбавляют водой (300 мл) и экстрагируют ДХМ (300 мл х 3). Объединенные органические слои промывают лимонной кислотой (5%, 300 мл х 2), промывают водой (300 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением N-(2-амино-3-(бензилокси)-5-фторфенил)-2-(бензилокси)ацетамида (I-210) (20 г), который применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 381,0 (M+1)+.
Раствор N-(2-амино-3-бензилокси-5-фтор-фенил)-2-бензилокси-ацетамида (20 г, 21,03 ммоль) в AcOH (200 мл) перемешивают при 85°C в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток разбавляют водой (300 мл) и экстрагируют EtOAc (200 мл х 3). Объединенные органические слои промывают насыщенным Na2CO3 (200 мл х 3), солевым раствором (200 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 4-(бензилокси)-2-((бензилокси)метил)-6-фтор-1H-бензо[d]имидазола (I-211) (5,1 г, 11,26 ммоль) в виде красного масла. ЖХМС m/z 363,2 (M+1)+.
К раствору 4-(бензилокси)-2-((бензилокси)метил)-6-фтор-1H-бензо[d]- имидазола (10 г, 27,6 ммоль) в ТГФ (100 мл) добавляют NaH (1,32 г, 33,11 ммоль, 60% чистота) при 0°C. Смесь перемешивают при 15°C в течение 0,5 ч. SEM-Cl (5,52 г, 33,1 ммоль) добавляют к реакционной смеси при 0°C. Полученный раствор перемешивают при 15°C в течение 1 ч. Реакционную смесь гасят ледяной водой (200 мл) при 0°C и экстрагируют EtOAc (200 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (200 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 4-(бензилокси)-2-((бензилокси)метил)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазола (I-212) (7 г, 46% выход) в виде желтого масла. ЖХМС m/z 493,1 (M+1)+.
К раствору 4-(бензилокси)-2-((бензилокси)метил)-6-фтор-1-((2-(триметилсилил)-этокси)метил)-1H-бензо[d]имидазола (6,6 г, 13,4 ммоль) в MeOH (60 мл) добавляют Pd(OH)2/C (1,52 г, 1,63 ммоль) и Pd/C (1,5 г, 13,40 ммоль, 15% чистота). Смесь перемешивают при 50°C в течение 30 ч под H2 атмосферой (45 ф./кв.д.). Реакционную смесь фильтруют и концентрируют при пониженном давлении с получением 6-фтор-2-(гидроксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d] имидазол-4-ола (I-213) (3,5 г) в виде светло-желтого масла. ЖХМС m/z 313,1 (M+1)+.
К раствору 6-фтор-2-(гидроксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ола (1,2 г, 3,84 ммоль) и 1,2-дибром-1,1,2,2-тетрафтор-этана (1,50 г, 5,76 ммоль) в ДМФ (10 мл) добавляют K2CO3 (1,06 г, 7,68 ммоль) и KI (63,7 мг, 0,384 ммоль). Смесь перемешивают при 90°C в течение 16 ч. Cs2CO3 (1,25 г, 3,84 ммоль) затем добавляют к реакционной смеси. Смесь перемешивают при 90°C в течение еще 6 ч. Полученный раствор разбавляют водой (20 мл) и экстрагируют EtOAc (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением (4-(2-бром-1,1,2,2-тетрафторэтокси)-6-фтор-1-((2-(триметил-силил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метанола (I-214) (500 мг, 24% выход) в виде желтого масла. ЖХМС m/z 493,0 (M+1)+.
К раствору (4-(2-бром-1,1,2,2-тетрафторэтокси)-6-фтор-1-((2-(триметил-силил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метанола (510 мг, 1,04 ммоль) в AcOH (5 мл) добавляют Zn (339 мг, 5,19 ммоль). Смесь перемешивают при 50°C в течение 1 ч. Полученный раствор разбавляют водой (20 мл) и экстрагируют EtOAc (30 мл х 3). Объединенные органические слои промывают насыщенным NaHCO3 (30 мл х 3), солевым раствором (30 мл х 2) и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением (6-фтор-4-(1,1,2,2-тетрафторэтокси)-1-((2-(триметилсилил)-этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (I-215) (0,41 г) в виде коричневого масла,1H ЯМР (400 МГц, ДМСО-d6) δ 7,67-6,75 (м, 3H), 5,82-5,74 (м, 1H), 5,73-5,61 (м, 2H), 4,75 (с, 2H), 3,56-3,46 (м, 2H), 0,85-0,72 (м, 2H), -0,06 - -0,16 (м, 9H).
К раствору (6-фтор-4-(1,1,2,2-тетрафторэтокси)-1-((2-(триметилсилил)этокси)-метил)-1H-бензо[d]имидазол-2-ил)метанола (0,41 г, 0,994 ммоль) и DIPEA (256 мг, 1,99 ммоль) в ДХМ (10 мл) добавляют MsCl (170 мг, 1,49 ммоль) при 0°C. Смесь перемешивают при 15°C в течение 1 ч. Полученный раствор разбавляют водой (30 мл) и экстрагируют ДХМ (30 мл х 3). Объединенные органические слои промывают водой (30 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении при 15°C с получением (6-фтор-4-(1,1,2,2-тетрафторэтокси)-1-((2-(триметилсилил)-этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (I-216) (550 мг), которое применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 513,0 (M+1)+.
К раствору (6-фтор-4-(1,1,2,2-тетрафторэтокси)-1-((2-(триметилсилил)-этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (550 мг, 1,12 ммоль) и 3-нитро-1H-пиридин-2-она (157 мг, 1,12 ммоль) в MeCN (10 мл) добавляют DIPEA (289 мг, 2,24 ммоль) при 0°C. Смесь перемешивают при 30°C в течение 16 ч. Реакционную смесь разбавляют водой (30 мл) и экстрагируют EtOAc (40 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (30 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 1-((6-фтор-4-(1,1,2,2-тетрафторэтокси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-217) (0,29 г) в виде светло-желтого масла. ЖХМС m/z 535,0 (M+1)+.
К раствору 1-((6-фтор-4-(1,1,2,2-тетрафторэтокси)-1-((2-(триметилсилил)-этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (290 мг, 0,542 ммоль) в EtOAc (8 мл) добавляют Pd/C (150 мг, 15% чистота). Смесь перемешивают при 15°C в течение 0,5 ч под H2 (15 ф./кв.д.). Реакционную смесь фильтруют и концентрируют при пониженном давлении с получением 3-амино-1-((6-фтор-4-(1,1,2,2-тетрафторэтокси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-218) (250 мг) в виде светло-желтого масла. ЖХМС m/z 505,1 (M+1)+.
Пример 19:


К раствору 3-амино-1-((6-фтор-4-(1,1,2,2-тетрафторэтокси)-1-((2-(триметил-силил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (100 мг, 0,198 ммоль), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (76,8 мг, 0,297 ммоль) и DIPEA (76,9 мг, 0,594 ммоль) в ДМФ (2 мл) добавляют HATU (128 мг, 0,336 ммоль) при 0°C. Смесь перемешивают при 30°C в течение 16 ч. Реакционную смесь разбавляют водой (20 мл) и экстрагируют EtOAc (20 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (20 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-метил (7-(диметиламино)-1-((1-((6-фтор-4-(1,1,2,2- тетрафторэтокси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (I-219) (75 мг, 0,096 ммоль, 48% выход) в виде бесцветного масла. ЖХМС m/z 745,3 (M+1)+.
К раствору (S, E)-метил (7-(диметиламино)-1-((1-((6-фтор-4-(1,1,2,2- тетрафторэтокси)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (75 мг, 0,0956 ммоль) в ДХМ (1 мл) добавляют ТФК (1,4 мл) при 0°C. Смесь перемешивают при 15°C в течение 6 ч. Реакционную смесь концентрируют при пониженном давлении с получением остатка при 30°C. Остаток очищают преп-ЖХВД с получением (S, E)-метил (7-(диметил-амино)-1-((1-((5-фтор-7-(1,1,2,2-тетрафторэтокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 134) (28,7 мг, 48% выход) в виде белого твердого вещества. ЖХМС m/z 615,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,27 (с, 1H), 8,26 (дд, J=7,6, 1,6 Гц, 1H), 7,73 (д, J=8,0 Гц, 1H), 7,58 (дд, J=6,8, 2,0 Гц, 1H), 7,36 (дд, J=8,8, 2,0 Гц, 1H), 7,06 (д, J=9,2 Гц, 1H), 7,03-6,74 (м, 1H), 6,67-6,55 (м, 1H), 6,42-6,33 (м, 2H), 5,41 (с, 2H), 4,20-4,13 (м, 1H), 3,54 (с, 3H), 2,98 (с, 3H), 2,83 (с, 3H), 2,26-2,21 (м, 2H), 1,90-1,86 (м, 1H), 1,82-1,73 (м, 1H).
Пример 20:

К раствору трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-1-карбоксилата (200 мг, 427 мкмоль) и (S, E)-2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-еновой кислоты (256 мг, 854 мкмоль) в ДМФ (3 мл) добавляют HATU (195 мг, 512 мкмоль) и DIPEA (166 мг, 1,28 ммоль) при 0°C. Реакционную смесь перемешивают при 25°C в течение 16 часов. Полученный раствор концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-трет-бутил 2-((3-(2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-1-карбоксилата (I-220) (190 мг, 53% выход) в виде коричневого твердого вещества. ЖХМС m/z 751,1 (M+1)+.
К раствору (S, E)-трет-бутил 2-((3-(2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-1-карбоксилата (190 мг, 253 мкмоль) в ДХМ (6 мл) добавляют ТФК (2 мл) при 0°C. Смесь перемешивают при 20°C в течение 2 часов. Полученный раствор концентрируют с получением (S, E)-6-амино-N7-(1-((4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (I-221) (140 мг) в виде серого масла, которое применяют на следующей стадии реакции без дальнейшей очистки. ЖХМС m/z 551,3 (M+1)+.
К раствору (S, E)-6-амино-N7-(1-((4-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (140 мг, 254 мкмоль) и оксазол-2-карбоновой кислоты (51,9 мг, 381 мкмоль) в ДМФ (3 мл) добавляют HATU (116 мг, 305 мкмоль) и DIPEA (98,6 мг, 763 мкмоль) при 0°C. Реакционную смесь перемешивают при 25°C в течение 16 часов. Полученный раствор концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-N7-(1-((7-(2,4-дифторфенокси)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида (Соединение 135) (118 мг, 71% выход) в виде белого твердого вещества. ЖХМС m/z 646,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,43 (с, 1H), 9,30 (д, J=8,0 Гц, 1H), 8,35 (с, 1H), 8,25 (дд, J=7,2, 1,6 Гц, 1H), 7,57 (дд, J=6,8, 1,2 Гц , 1H), 7,52-7,40 (м, 2H), 7,28-7,15 (м, 2H), 7,07 (т, J=8,0 Гц, 2H), 6,66-6,56 (м, 1H), 6,50 (д, J=7,2 Гц, 1H), 6,40-6,33 (м, 2H), 5,38 (с, 2H), 4,68-4,60 (м, 1H), 2,96 (с, 3H), 2,82 (с, 3H), 2,30-2,20 (м, 2H), 2,04-1,95 (м, 2H).
Следующие соединения получают согласно методикам, описанным в Примере 20 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-233:


К раствору метил 2-амино-3-нитро-бензоата (45,0 г, 255 ммоль) в этилацетате (250 мл) добавляют Pd/C (5 г, 10% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 3 раза. Смесь перемешивают под H2 атмосферой (50 ф./кв.д.) при 25°C в течение 18 ч. Реакционную смесь фильтруют и фильтрат концентрируют с получением неочищенного продукта. Неочищенный продукт очищают ЖХСД с получением метил 2,3-диаминобензоата (I-223) (36,9 г) в виде желтого твердого вещества.
К смеси метил 2,3-диаминобензоата (5,0 г, 30,1 ммоль) в o-ксилоле (20 мл) добавляют 2-гидроксиуксусную кислоту (3,43 г, 45,1 ммоль) одной порцией при 25°C под N2 атмосферой. Смесь нагревают до 130°C и перемешивают в течение 6 ч. Смесь охлаждают до 25°C и концентрируют при пониженном давлении с получением остатка. Остаток выливают в воду (20 мл) и экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией (Дихлорметан/Метанол=40/1, 20/1) с получением метил 2-(гидроксиметил)-1H-бензо [d]имидазол-4-карбоксилата (I-224) (3,0 г, 11,6 ммоль, 39% выход) в виде желтого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ12,08 (с, 1H), 7,88 (д, J=7,6 Гц, 1H), 7,81 (д, J=7,6 Гц, 1H), 4,73 (с, 2H), 3,98 (с, 3H).
К смеси метил 2-(гидроксиметил)-1H-бензимидазол-4-карбоксилата (3,0 г, 11,6 ммоль) в ТГФ (20 мл) добавляют NaH (559 мг, 14,0 ммоль, 60% чистота) порциями при 0°C под N2атмосферой. Смесь перемешивают при 0°C в течение 0,5 ч. SEM-Cl (1,94 г, 11,6 ммоль) добавляют к смеси при 0°C. Смесь нагревают до 25°C и перемешивают при той же температуре в течение 2,5 ч. Смесь выливают в воду (50 мл) и экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4 и концентрируют в вакууме с получением метил 2-(гидроксиметил)-1-(2- триметилсилилэтоксиметил)бензимидазол-4-карбоксилата (I-225) (2,30 г) в виде желтого твердого вещества.
К смеси метил 2-(гидроксиметил)-1-(2-триметилсилилэтоксиметил) бензимидазол-4-карбоксилата (550 мг, 1,63 ммоль) и DHP (274 мг, 3,26 ммоль) в ТГФ (15 мл) добавляют TsOH (56,1 мг, 326 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь нагревают до 70°C и перемешивают в течение 2 ч. Смесь охлаждают до 25°C и выливают в воду (50 мл). Полученный раствор экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 2-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбоксилата (I-226) (560 мг).
К смеси метил 2-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбоксилата (560 мг, 1,33 ммоль) в ТГФ (150 мл) добавляют LiBH4 (58,5 мг, 2,66 ммоль) одной порцией при 0°C под N2 атмосферой. Смесь нагревают до 25°C и перемешивают в течение 2 ч. Смесь выливают в воду (50 мл). Полученный раствор экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (70 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением (2-(((тетрагидро-2H-пиран-2-ил)окси)метил)-1-((2-(триметилсилил)этокси) метил)-1H-бензо[d]имидазол-4-ил)метанола (I-227) (500 мг) в виде желтого масла.
К смеси [2-(тетрагидропиран-2-илоксиметил)-1-(2-триметилсилилэтоксиметил)бензимидазол-4-ил]метанола (500 мг, 1,27 ммоль) и CBr4 (548 мг, 1,65 ммоль) в ДХМ (10 мл) добавляют PPh3 (433 мг, 1,65 ммоль) одной порцией при 0°C под N2 атмосферой. Смесь нагревают до 25°C и перемешивают в течение 2 ч. Смесь выливают в воду (30 мл). Полученный раствор экстрагируют ДХМ (40 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 2-[[4-(бромметил)-2-(тетрагидропиран-2-илоксиметил)бензимидазол-1-ил]метокси]этил-триметил-силана (I-228) (240 мг) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ7,51 (д, J=8,0 Гц, 1H), 7,40 (д, J=8,0 Гц, 1H), 7,35-7,31 (м, 1H), 5,76-5,73 (м, 2H), 5,35 (с, 1H), 5,14 (с, 2H), 4,94 (с, 1H), 4,83 (с, 1H), 4,18-4,16 (м, 1H), 3,97-3,58 (м, 3H), 1,85-1,78 (м, 2H), 1,67-1,60 (м, 6H), 1,31-1,26 (м, 1H), 1,67-1,60 (м, 6H), 0,97-0,93 (м, 2H), 0,02 (с, 9H).
К смеси 2-[[4-(бромметил)-2-(тетрагидропиран-2-илоксиметил) бензимидазол-1-ил]метокси]этил-триметил-силана (240 мг, 527 мкмоль) и 2,4-дифторфенола (82,3 мг, 632 мкмоль) в ДМФ (2 мл) добавляют Cs2CO3 (258 мг, 790 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь нагревают до 70°C и перемешивают в течение 1 ч. Смесь охлаждают до 25°C и выливают в воду (30 мл). Полученный раствор экстрагируют этилацетатом (30 мл х3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 2-[[4-[(2,4-дифторфенокси)метил]-2-(тетрагидропиран-2-илоксиметил)бензимидазол-1-ил]метокси]этил-триметил-силана (I-229) (300 мг, 482 мкмоль, 91% выход) в виде желтого масла.
К смеси 2-[[4-[(2,4-дифторфенокси)метил]-2-(тетрагидропиран-2-илоксиметил)бензимидазол-1-ил]метокси]этил-триметил-силана (240 мг, 385 мкмоль) в MeOH (3 мл) добавляют CBr4 (383 мг, 1,16 ммоль) одной порцией при 25°C под N2 атмосферой. Смесь нагревают до 70°C и перемешивают в течение 3 ч. Смесь охлаждают до 25°C и выливают в насыщенный водный раствор NaHCO3 (20 мл). Полученный раствор экстрагируют этилацетатом (30 мл х3). Объединенную органическую фазу промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением [4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метанола (I-230) (170 мг) в виде желтого масла.1H ЯМР (400 МГц, ДМСО-d6) δ 7,47-7,43 (м, 2H), 7,36-7,32 (м, 1H), 7,06-7,05 (м, 1H), 6,87-6,86 (м, 1H), 6,73-6,72 (м, 1H), 5,60 (с, 2H), 5,59 (с, 2H), 4,98 (с, 2H), 3,69-3,55 (м, 2H), 0,94-0,90 (м, 2H), -0,03 (с, 9H).
К смеси[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метанола (170 мг, 404 мкмоль) и Et3N (61,4 мг, 606 мкмоль) в ДХМ (10 мл) добавляют MsCl (60,2 мг, 526 мкмоль) одной порцией при 0°C под N2 атмосферой. Смесь нагревают до 25°C и перемешивают в течение 1 ч. Смесь выливают в воду (30 мл). Полученный раствор экстрагируют этилацетатом (30 мл х 3). Объединенную органическую фазу промывают солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метилметансульфоната (I-231) (200 мг)в виде желтого масла.
К смеси[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метилметансульфоната (200 мг, 401 мкмоль) и 3-нитропиридин-2(1H)-она (84,3 мг, 602 мкмоль) в CH3CN (10 мл) добавляют DIPEA (104 мг, 802 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 ч. Смесь выливают в воду (30 мл). Полученный раствор экстрагируют этилацетатом (30 мл х 3). Объединенную органическую фазу промывают солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 1-[[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (I-232) (210 мг) в виде желтого масла. ЖХМС m/z 543,2 (M+1)+.
К смеси 1-[[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (210 мг, 387 мкмоль) в EtOH (5 мл) и H2O (5 мл) добавляют Fe (64,9 мг, 1,16 ммоль) и NH4Cl (104 мг, 1,94 ммоль) одной порцией при 25°C под N2 атмосферой. Смесь нагревают до 70°C и перемешивают в течение 1 ч. Смесь охлаждают до 25°C и фильтруют. Фильтрат экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением 3-амино-1-[[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метил]пиридин-2-она (I-233) (140 мг) в виде желтого масла. ЖХМС m/z 513 (M+1)+.
Следующие промежуточные соединения получают согласно методикам, описанным в I-233 с применением подходящих реагентов.
Пример 21:

К смеси 3-амино-1-[[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метил]пиридин-2-она (140 мг, 273 мкмоль) и (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (141 мг, 546 мкмоль) в ДМФ (2 мл) добавляют HATU (156 мг, 410 мкмоль) и DIPEA (70,6 мг, 546 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 ч. Полученный раствор выливают в воду (20 мл) и экстрагируют этилацетатом (20 мл х 3). Объединенные органические слои промывают солевым раствором (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением метил N-[(E,1S)-1-[[1-[[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (I-235) (130 мг) в виде белого твердого вещества. ЖХМС m/z 753,3 (M+1)+.
К смеси метил N-[(E,1S)-1-[[1-[[4-[(2,4-дифторфенокси)метил]-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (110 мг, 146 мкмоль) в ДХМ (1 мл) добавляют ТФК (1 мл) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 6 ч. Смесь выливают в насыщенный водный раствор NaHCO3 (15 мл). Полученный раствор экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают ЖХВД с получением метил N-[(E,1S)-1-[[1-[[4-[(2,4-дифторфенокси)метил]-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 146) (62,2 мг, 68% выход) в виде белого твердого вещества. ЖХМС m/z 623,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ9,28 (с, 1H), 8,29 (д, J=7,8 Гц, 1H), 7,62 (д, J=6,8 Гц, 1H), 7,61-7,59 (м, 2H), 7,39-7,31 (м, 4H), 7,32-7,31 (м, 1H), 6,62-6,58 (м, 1H), 6,43-6,35 (м, 2H), 5,52 (с, 2H), 5,43 (с, 2H), 4,21-4,14 (м, 1H), 3,54 (с, 3H), 2,98 (с, 3H), 2,83 (с, 3H), 2,77-2,73 (м, 2H), 2,23-2,21 (м, 2H),1,88-1,86 (м, 1H), 1,73-1,71 (м, 1H).
Следующее соединение получают по методикам, описанным в примере 21 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-246

К смеси 2-нитробензальдегида (17 г, 112 ммоль) в ДХМ (1 л) добавляют CBr4 (149 г, 450 ммоль) и PPh3 (236 г, 900 ммоль) при 0°C под N2. Смесь перемешивают при 20°C в течение 0,5 ч. Смесь фильтруют, и фильтрат концентрируют в вакууме. Остаток очищают хроматографией на силикагеле до 1-(2,2-дибромвинил)-2-нитробензола (I-237) (46 г) в виде желтого масла,1H ЯМР (400 МГц, CDCl3) δ 8,16-8,10 (м, 1H), 7,79 (с, 1H), 7,72-7,49 (м, 3H).
К смеси 1-(2,2-дибромвинил)-2-нитробензола (23 г, 74,9 ммоль), CuI (4,28 г, 22,5 ммоль), Pd(PPh3)4 (4,33 г, 3,75 ммоль) и HMPA (40,8 г, 228 ммоль, 40 мл) в ДМФ (200 мл) добавляют метил 2,2-дифтор-2-(фторсульфонил)ацетат (72 г, 375 ммоль, 47,7 мл) под N2 атмосферой. Смесь перемешивают при 110°C в течение 60 ч. Смесь концентрируют в вакууме и разбавляют водой (400 мл). Водную фазу экстрагируют этилацетатом (400 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (500 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением смеси 1-нитро-2-(3,3,3-трифтор-2-(трифторметил)проп-1-ен-1-ил)бензола (I-238) и 1-(2-бром-3,3,3-трифторпроп-1-ен-1-ил)-2-нитробензола (I-238A) (20 г) в виде желтого масла.
К смеси 1-нитро-2-(3,3,3-трифтор-2-(трифторметил)проп-1-ен-1-ил)бензола и 1-(2-бром-3,3,3-трифторпроп-1-ен-1-ил)-2-нитробензола (5 г) в ТГФ (80 мл) добавляют Pd/C (2,5 г) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 три раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 12 часов. Смесь фильтруют, и фильтрат концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением 2-(3,3,3-трифтор-2-(трифторметил)проп-1-ен-1-ил)анилина (I-239) (2,5 г) в виде желтого масла.
К раствору 2-(3,3,3-трифтор-2-(трифторметил)проп-1-ен-1-ил)анилина (2,5 г, 9,8 ммоль) в ТГФ (40 мл) добавляют Pd/C (2 г) под N2. Суспензию дегазируют под вакуумом и продувают H2 три раза. Смесь перемешивают под H2 атмосферой (45 ф./кв.д.) при 45°C в течение 16 часов. Полученную суспензию фильтруют, и фильтрат концентрируют под вакуумом с получением остатка. Остаток очищают преп-ЖХВД с получением 2-(3,3,3-трифтор-2-(трифторметил) пропил)анилина (I-240) (700 мг) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,16-7,11 (м, 1H), 7,11-7,06 (м, 1H), 6,82-6,76 (м, 1H), 6,75-6,71 (м, 1H), 3,59-3,43 (м, 1H), 3,05-3,00 (м, 2H).
Смесь 2-(3,3,3-трифтор-2-(трифторметил)пропил)анилина (2,6 г, 10,1 ммоль) в Ac2O (5 мл) перемешивают при 25°C в течение 1 ч. Смесь разбавляют водой (40 мл) и экстрагируют этилацетатом (40 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (80 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением N-(2-(3,3,3-трифтор-2-(трифторметил)пропил)фенил)ацетамида (I-241) (2,6 г) в виде белого твердого вещества.
К смеси N-(2-(3,3,3-трифтор-2-(трифторметил)пропил)фенил)ацетамида (2,6 г, 8,69 ммоль) в Ac2O (9 мл) добавляют раствор HNO3 (1,83 г, 17,4 ммоль, 1,30 мл, 60% чистота) в Ac2O (1 мл) при 0°C. Смесь перемешивают при 0°C в течение 3 ч. Смесь разбавляют водой (30 мл) и экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают насыщенным NaHCO3 (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением N-(2-нитро-6-(3,3,3-трифтор-2-(трифторметил)пропил)фенил)ацетамида (I-242) (1,1 г) в виде желтого твердого вещества,1H ЯМР (300 МГц, CDCl3) δ 8,37 (с, 1H), 8,00 (дд, J=10,8, 2,0 Гц, 1H), 7,65-7,55 (м, 1H), 7,48-7,37 (м, 1H), 3,45-3,21 (м, 3H), 2,25 (с, 3H).
К смеси N-(2-нитро-6-(3,3,3-трифтор-2-(трифторметил)пропил)фенил)ацетамида (1,1 г, 3,2 ммоль) в EtOH (5 мл) добавляют HCl (4,38 г, 120 ммоль, 10 мл). Смесь перемешивают при 90°C в течение 12 ч. pH смеси доводят до 7 добавлением NaOH раствора (1M) при 0°C. Полученный раствор экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (70 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением 2-нитро-6-(3,3,3-трифтор-2-(трифторметил)пропил)анилина (I-243) (900 мг) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 8,16 (дд, J=8,8, 1,2 Гц, 1H), 7,41-734 (м, 1H), 6,76 (дд, J=8,6, 7,4 Гц, 1H), 6,11 (с, 2H), 3,43-3,29 (м, 1H), 3,16-3,08 (м, 2H).
К смеси 2-нитро-6-(3,3,3-трифтор-2-(трифторметил)пропил)анилина (900 мг, 2,98 ммоль) в EtOAc (50 мл) добавляют Pd/C (400 мг, 10% чистота) под H2 (15 ф./кв.д.). Смесь перемешивают при 25°C в течение 1,5 ч. Смесь фильтруют, и фильтрат концентрируют в вакууме с получением 3-(3,3,3-трифтор-2-(трифторметил)пропил)бензол-1,2-диамина (I-244) (800 мг) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 6,75-6,65 (м, 3H), 3,43 (с, 2H), 3,40-3,36 (м, 1H), 3,08-3,00 (м, 2H).
К смеси 3-(3,3,3-трифтор-2-(трифторметил)пропил)бензол-1,2-диамина (800 мг, 2,94 ммоль) в HCl (18 мл) и H2O (36 мл) добавляют 2-хлоруксусную кислоту (555 мг, 5,88 ммоль, 0,661 мл) при 0°C под N2 атмосферой. Смесь перемешивают при 90°C в течение 12 ч. pH смеси доводят до 7 добавлением гидроксида аммония при 0°C. Полученный раствор экстрагируют этилацетатом (20 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 2-(хлорметил)-7-(3,3,3- трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазола (I-245) (900 мг) в виде желтого масла.
К смеси 2-(хлорметил)-7-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазола (900 мг, 2,72 ммоль) в ДХМ (10 мл) добавляют DMAP (366 мг, 2,99 ммоль) и Boc2O (653 мг, 2,99 ммоль, 0,688 мл). Смесь перемешивают при 25°C в течение 1 ч. Смесь разбавляют водой (30 мл) и экстрагируют ДХМ (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением трет-бутил 2-(хлорметил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата (I-246) (800 мг, 62% выход) в виде белого твердого вещества. ЖХМС m/z 431,0 (M+1)+.
К смеси трет-бутил 2-(хлорметил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата (350 мг, 0,748 ммоль) и 3-нитро-1H-пиридин-2-она (157 мг, 1,12 ммоль) в CH3CN (10 мл) добавляют Et3N (151 мг, 1,49 ммоль, 0,207 мл). Смесь перемешивают при 25°C в течение 12 ч. Смесь разбавляют водой (20 мл) и экстрагируют этилацетатом (20 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением трет-бутил 2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата (I-247) (230 мг) в виде желтого твердого вещества.
К смеси трет-бутил 2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата (230 мг, 0,43 ммоль) в MeOH (5 мл) добавляют Pd/C (200 мг, 10% чистота). Смесь перемешивают при 25°C под H2 (15 ф./кв.д.) в течение 0,5 ч. Смесь фильтруют, и фильтрат концентрируют в вакууме с получением трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата (I-248) (190 мг) в виде бесцветного масла. ЖХМС m/z 505,3 (M+1)+.
Пример 22:

К смеси трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата (50 мг, 0,0991 ммоль) и (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (38,4 мг, 0,149 ммоль) в ДМФ (1 мл) добавляют HATU (67,8 мг, 0,178 ммоль) и DIEA (38,4 мг, 0,297 ммоль, 0,0519 мл) при 0°C. Смесь перемешивают при 25°C в течение 16 ч. Смесь разбавляют водой (20 мл) и экстрагируют этилацетатом (20 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата (Соединение 148) (5,4 мг, 7% выход) в виде белого твердого вещества. ЖХМС m/z 745,1 (M+1)+.
К смеси (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил) амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-1-карбоксилата (150 мг, 0,201 ммоль) в ДХМ (3 мл) добавляют ТФК (1,54 г, 13,5 ммоль, 1 мл) при 0°C. Смесь перемешивают при 25°C в течение 1 ч. Смесь концентрируют в вакууме и очищают преп-ЖХВД с получением (S, E)-метил(7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((4-(3,3,3-трифтор-2-(трифторметил)пропил)-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата (Соединение 149) (78,4 мг, 59% выход) в виде белого твердого вещества. ЖХМС m/z 645,1 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,28 (с, 1H), 8,28 (дд, J=7,6, 1,6 Гц, 1H), 7,77-7,69 (м, 1H), 7,60 (дд, J=6,8, 1,6 Гц, 1H), 7,5-7,44 (м, 1H), 7,33-7,22 (м, 2H), 6,65-6,54 (м, 1H), 6,43-6,32 (м, 2H), 5,51 (с, 2H), 4,75-4,62 (м, 1H), 4,22-4,12 (м, 1H), 3,53 (с, 3H), 3,48 (д, J=7,0 Гц, 2H), 2,98 (с, 3H), 2,83 (с, 3H), 2,28-2,15 (м, 2H), 1,92-1,80 (м, 1H), 1,78-1,62 (м, 1H).
Следующее соединение получают по методикам, описанным в примере 22 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-261:


К смеси 3-бромбензол-1,2-диамин (20,0 г, 107 ммоль) и 2-(бензилокси)уксусной кислоты (26,8 г, 161 ммоль) в ДХМ (30 мл)добавляют T3P (102 г, 160 ммоль, 50% чистота) и DIPEA (27,6 г, 214 ммоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 ч. Реакционную смесь выливают в H2O (300 мл). Полученный раствор экстрагируют ДХМ (200 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (200 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением N-(2-амино-6-бромфенил)-2-(бензилокси)ацетамида (I-250) (26,0 г, 73% выход) в виде желтого масла.
Раствор N-(2-амино-6-бромфенил)-2-(бензилокси)ацетамида (26,0 г, 77,6 ммоль) в AcOH (8 мл) перемешивают при 25°C под N2 атмосферой. Смесь нагревают до 80°C и перемешивают в течение 0,5 ч. Полученный раствор охлаждают до 25°C и выливают в насыщенный водный раствор NaHCO3 (100 мл). Полученный раствор экстрагируют этилацетатом (300 мл х 3). Объединенные органические слои промывают солевым раствором (400 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 2-((бензилокси)метил)-4-бром-1H-бензо[d]имидазола (I-251) (19,0 г) в виде желтого масла.
К смеси 2-((бензилокси)метил)-4-бром-1H-бензо[d]имидазола (19,0 г) в ТГФ (20мл) добавляют NaH (2,16 г, 89,9 ммоль, 60% чистота) порциями при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 0,5 ч. SEM-Cl (12,0 г, 71,9 ммоль) добавляют к смеси. Полученный раствор перемешивают при 25°C в течение 2 ч. Реакционную смесь выливают в H2O (300 мл). Полученный раствор экстрагируют этилацетатом (300 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (200 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((бензилокси)метил)-4-бром-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазола (I-252) (26,0 г, 97% выход) в виде желтого масла.
К раствору 2-((бензилокси)метил)-4-бром-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазола (10,0 г, 22,4 ммоль) в MeOH (30 мл) добавляют Et3N (4,52 г, 44,7 ммоль), Pd(OAc)2 (1,0 г, 4,47 ммоль) и DPPF (2,48 г, 4,47 ммоль) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают CO 3 раза. Смесь перемешивают под CO (50 ф./кв.д.) при 80°C в течение 18 ч. Смесь охлаждают до 0°C и концентрируют при пониженном давлении с получением остатка. Остаток выливают в H2O (20 мл). Полученный раствор экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают солевым раствором (40 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением метил 2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбоксилата (I-253) (4,30 г, 10,1 ммоль, 45% выход) в виде желтого масла.
К смеси метил 2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбоксилата (3,30 г, 7,74 ммоль) в ТГФ (20 мл) добавляют LiAlH4 (352 мг, 9,28 ммоль) порциями при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 1,5 ч. Полученный раствор выливают в воду (50 мл) и экстрагируют этилацетатом (50 мл х 2). Объединенные органические слои промывают солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)метанола (I-254) (1,20 г, 3,01 ммоль, 39% выход) в виде желтого масла. ЖХМС m/z 399,1 (M+1)+.
К смеси 2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)метанола (1,20 г, 3,01 ммоль) в ДХМ (10 мл) добавляют DMP (1,91 г, 4,51 ммоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 2 ч. Полученную суспензию фильтруют, и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбальдегида (I-255) (860 мг, 2,05 ммоль, 68% выход) в виде желтого масла. ЖХМС m/z 397,1 (M+1)+.
К смеси комплекса хлорид изопропилмагния-хлорид лития (1,3 M, 8,04 мл) в ТГФ (3 мл) добавляют 2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбальдегида (830 мг, 2,09 ммоль) одной порцией при -20°C под N2 атмосферой. Смесь нагревают до 25°C и перемешивают в течение 0,5 ч. Смесь выливают в воду (30 мл). Полученный раствор экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 1-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2-метилпропан-1-ола (I-256) (730 мг) в виде желтого масла. ЖХМС m/z 441,1 (M+1)+.
К смеси 1-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2-метилпропан-1-ола (570 мг, 1,29 ммоль) и TBSCl (390 мг, 2,59 ммоль) в ДМФ (2 мл) добавляют имидазол (264 мг, 3,88 ммоль) одной порцией при 25°C под N2 атмосферой. Смесь нагревают до 80°C и перемешивают в течение 4 ч. Смесь охлаждают до 25°C и выливают в воду (30 мл). Полученный раствор экстрагируют этилацетатом (50 мл х 2). Объединенные органические слои промывают солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 2-((бензилокси)метил)-4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазола (I-257) (680 мг, 92% выход) в виде желтого масла. ЖХМС m/z 555,2 (M+1)+.
К раствору 2-((бензилокси)метил)-4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазола (176 мг, 317 мкмоль) в MeOH (15 мл) добавляют Pd(OH)2/C (15% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 18 ч. Реакционную смесь фильтруют, и фильтрат концентрируют с получением (4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метанола (I-258) (120 мг, 81% выход) в виде белого твердого вещества. ЖХМС m/z 465,1 (M+1)+.
К смеси (4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метанола (400 мг, 861 мкмоль) и MsCl (148 мг, 1,29 ммоль)в ДХМ (10 мл) добавляют Et3N (174 мг, 1,72 ммоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 2 ч. Смесь выливают в воду (20 мл) и экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением (4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (I-259) (467 мг) в виде желтого масла.
К смеси (4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (467 мг, 860 мкмоль)и 3-нитропиридин-2(1H)-она (181 мг, 1,29 ммоль) в CH3CN (3 мл) добавляют Et3N (174 мг, 1,72 ммоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 ч. Полученный раствор выливают в воду (20 мл) и экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 1-((4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-260) (460 мг, 91% выход) в виде желтого масла. ЖХМС m/z 587,1 (M+1)+.
К раствору 1-((4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (460 мг, 784 мкмоль) в EtOAc (5 мл) добавляют Pd/C (10,0 мг, 15% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 1 ч. Реакционную смесь фильтруют, и фильтрат концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 3-амино-1-((4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-261) (420 мг, 96% выход) в виде желтого масла. ЖХМС m/z 557,2 (M+1)+.
Пример 23:

К смеси 3-амино-1-((4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (100 мг, 180 мкмоль) и (E)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (92,8 мг, 359 мкмоль) в ДМФ (1 мл) добавляют DIPEA (46,4 мг, 359 мкмоль) и HATU (102 мг, 269 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 ч. Полученный раствор выливают в воду (20 мл) и экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ (этилацетат) с получением метил ((2S, E)-1-((1-((4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (I-262) (99,0 мг, 118 мкмоль, 66% выход) в виде желтого масла. ЖХМС m/z 797,2 (M+1)+.
К смеси метил ((2S, E)-1-((1-((4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-7-оксогепт-5-ен-2-ил)карбамата (163 мг, 204 мкмоль) в ДХМ (3 мл) добавляют ТФК (1 мл) одной порцией при 25°C. Смесь перемешивают при 25°C в течение 8 ч. Полученный раствор концентрируют при пониженном давлении с получением остатка. Остаток очищают ЖХВД (ТФК) с получением метил ((2S, E)-7-(диметиламино)-1-((1-((4-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 151) (43,2 мг, 38% выход) в виде желтого твердого вещества. ЖХМС m/z 553,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ9,27 (с, 1H), 8,30 (д, J=7,6 Гц, 1H), 7,69 (д, J=7,6 Гц, 1H), 7,61 (д, J=6,8 Гц, 1H), 7,53 (д, J=7,2 Гц, 1H), 7,38-7,33 (м, 2H), 6,57-6,46 (м, 1H), 6,44-6,42 (м, 1H), 6,38-6,34 (м, 1H), 5,61 (с, 2H), 4,73-4,72 (м, 1H), 4,19-4,17 (м, 1H), 3,53 (с, 3H), 2,98-2,91 (м, 3H), 2,91-2,83 (м, 3H), 2,26-2,24 (м, 2H), 2,02-2,01 (м, 1H), 1,99-1,84 (м, 1H), 1,84-1,71 (м, 1H), 0,93-0,91 (м, 3H), 0,80-0,79 (м, 3H).
Следующие соединения получают согласно методикам, описанным в Примере 23 с применением подходящих промежуточных соединений.
Пример 24:

К смеси 1-((4-(1-((трет-бутилдиметилсилил)окси)-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (1,20 г, 2,04 ммоль) в ДХМ (3 мл) добавляют ТФК (3 мл) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 ч. Смесь концентрируют при пониженном давлении с получением остатка. Остаток выливают в насыщенный водный раствор NaHCO3 (20 мл). Полученный раствор экстрагируют ДХМ (30 мл х 2). Объединенные органические слои промывают солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 1-((4-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-263) (400 мг, 45% выход) в виде желтого твердого вещества. ЖХМС m/z 343 (M+1)+.
К раствору 1-((4-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (400 мг, 923 мкмоль) в ТГФ (20 мл) добавляют Pd/C (40,0 мг, 10% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 2 ч. Полученную суспензию фильтруют, и фильтрат концентрируют с получением остатка. Остаток очищают преп-ТСХ (этилацетат) с получением 3-амино-1-((4-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-264) (220 мг, 72% выход) в виде желтого твердого вещества. ЖХМС m/z 313 (M+1)+.
К смеси 3-амино-1-((4-(1-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (160 мг, 512 мкмоль) в ДХМ (3 мл) добавляют DAST (107 мг, 666 мкмоль) одной порцией при 0°C под N2 атмосферой. Смесь нагревают до 25°C и перемешивают 1 ч. Смесь выливают в воду (20 мл). Полученный раствор экстрагируют ДХМ (30 мл х 2). Объединенные органические слои промывают солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением 3-амино-1-((4-(1-фтор-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-265) (86,0 мг, 50% выход) в виде желтого масла. ЖХМС m/z 315 (M+1)+.
К смеси 3-амино-1-((4-(1-фтор-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (86,0 мг, 274 мкмоль) и (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (141 мг, 547 мкмоль) в ДМФ (500 мкл) добавляют HATU (156 мг, 410 мкмоль) и DIPEA (70,7 мг, 547 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 ч. Смесь выливают в воду (20 мл). Полученный раствор экстрагируют этилацетатом (20 мл х 2). Объединенные органические слои промывают солевым раствором (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают ЖХВД (ТФК) с получением метил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-фтор-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 155) (67,1 мг, 41% выход) в виде белого твердого вещества. ЖХМС m/z 555,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ9,27 (с, 1H), 8,28 (д, J=7,6 Гц, 1H), 7,70 (д, J=7,6 Гц, 1H), 7,59-7,55 (м, 2H), 7,32-7,27 (м, 2H), 6,61-6,57 (м, 1H), 6,42-6,34 (м, 2H), 5,71 (дд, J1=46,8 Гц, J2=6,8 Гц, 1H), 5,51 (с, 2H), 4,18-4,17 (м, 1H), 3,54 (с, 3H), 2,98 (с, 3H), 2,91 (с, 3H), 2,33-2,21 (м, 3H), 1,86-1,76 (м, 1H), 1,72-1,70 (м, 1H), 1,03-1,01 (м, 3H), 0,83-0,81 (м, 3H).
Синтез промежуточного соединения I-271:

К смеси Mg (4,1 г, 168 ммоль) в ТГФ (151 мл) добавляют I2 (2,8 г, 11,2 ммоль). Смесь нагревают до 70°C. К реакционной смеси медленно добавляют 2-бром-2-метилпропан (15,3 г, 111,9 ммоль) в течение более 0,5 ч. Смесь перемешивают при 70°C в течение 0,5 ч. К раствору 2-(бензилоксиметил)-3-(2-триметилсилилэтоксиметил)бензимидазол-4-карбальдегида (6,0 г, 15,1 ммоль) в ТГФ (20 мл) добавляют бром(трет-бутил)магний (1M, 15 мл, выше) при 0°C. Смесь перемешивают при 0-30°C в течение 1 ч. Реакционную смесь гасят насыщенным раствором NH4Cl (100 мл) при 0°C и экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 1-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2,2-диметилпропан-1-ола (I-266) (3,0 г) в виде желтого масла.
К раствору 1-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2,2-диметилпропан-1-ола (3,0 г, 6,6 ммоль) в MeOH (20 мл) добавляют Pd(OH)2/C (3,0 г, 10% влажный) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 три раза. Ее перемешивают под H2 (50 ф./кв.д.) при 30°C в течение 20 часов. Реакционную смесь фильтруют, и фильтрат концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 1-(2-(гидроксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2,2-диметилпропан-1-ола (1,00 г) в виде желтого масла и восстанавливают 1-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2,2-диметилпропан-1-ол (I-267) (3,4 г) в виде желтого масла.
К смеси 1-(2-(гидроксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2,2-диметилпропан-1-ола (1,0 г, 2,7 ммоль) в ДХМ (60 мл) добавляют MsCl (314 мг, 2,7 ммоль) и TEA (555 мг, 5,5 ммоль) одной порцией при 0°C под N2 атмосферой. Смесь перемешивают при 0-30°C в течение 2 часов. Реакционную смесь выливают в воду (100 мл). Водную фазу экстрагируют этилацетатом (80 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением (4-(1-гидрокси-2,2-диметилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (I-268) (1,2 г) в виде желтого масла.
К смеси (4-(1-гидрокси-2,2-диметилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (1,2 г, 2,7 ммоль) и 3-нитро-1H-пиридин-2-она (569 мг, 4,1 ммоль) в MeCN (50 мл) добавляют DIPEA (700 мг, 5,4 ммоль) одной порцией при 20°C. Смесь перемешивают при 20°C в течение 10 ч. Реакционную смесь гасят добавлением воды (80 мл) и экстрагируют этилацетатом (80 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением 1-((4-(1-гидрокси-2,2-диметилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-269) (500 мг, 1,0 ммоль) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 8,40 (д, J=7,8 Гц, 2H), 7,51-7,37 (м, 2H), 7,29-7,25 (м, 1H), 6,45 (т, J=7,2 Гц, 1H), 6,05-5,88 (м, 2H), 5,81-5,64 (м, 2H), 4,81 (с, 1H), 3,64-3,58 (м, 3H), 0,93 (с, 9H), 0,01 (с, 9H).
К раствору 1-((4-(1-гидрокси-2,2-диметилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (400 мг, 822 мкмоль) в ДХМ (2 мл) добавляют ТФК (3 мл). Смесь перемешивают при 0-30°C в течение 3 ч. Растворитель удаляют с получением 1-((4-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-270) (220 мг) в виде желтого масла.
К раствору 1-((4-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (220 мг, 617 мкмоль) в MeOH (10 мл) добавляют Pd/C (30 мг, 10% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 три раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 1 часа. Полученную суспензию фильтруют, и фильтрат концентрируют с получением 3-амино-1-((4-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d] имидазол-2-ил)метил)пиридин-2(1H)-она (I-271) (200 мг) в виде желтого масла. ЖХМС m/z 327,1 (M+1)+.
Пример 25:

К раствору (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (205 мг, 796 мкмоль) и 3-амино-1-[[4-(1-гидрокси-2,2-диметил-пропил)-1H-бензимидазол-2-ил]метил]пиридин-2-она (200 мг, 612 мкмоль) в ДМФ (3,0 мл) добавляют HATU (280 мг, 735 мкмоль) и DIPEA (237 мг, 1,8 ммоль). Смесь перемешивают при 0-20°C в течение 10 ч. После фильтрации, фильтрат очищают преп-ЖХВД дважды с получением метил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 156) (20 мг, 33 мкмоль) в виде белого твердого вещества. ЖХМС m/z 658,4 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,25 (с, 1H), 8,30-8,25 (м, 1H), 7,75-7,65 (м, 1H), 7,61-7,55 (м, 1H), 7,51-7,46 (м, 1H), 7,36-7,29 (м, 1H), 7,26-7,23 (м, 1H), 6,63-6,54 (м, 1H), 6,43 (т, J=7,2 Гц, 1H), 6,36 (д, J=15,2 Гц, 1H), 5,63-5,51 (м, 2H), 4,69 (с, 1H), 4,23-4,11 (м, 1H), 3,53 (с, 3H), 2,97 (с, 3H), 2,82 (с, 3H), 2,26-2,14 (м, 2H), 1,91-1,80 (м, 1H), 1,75-1,63 (м, 1H), 0,88 (с, 9H).
Следующие соединения получают согласно методикам, описанным в Примере 25 с применением подходящих промежуточных соединений.
Пример 26:


К раствору (E,2S)-2-(трет-бутоксикарбониламино)-7-(диметиламино)-7-оксо-гепт-5-еновой кислоты (69 мг, 229 мкмоль) и 3-амино-1-[[4-(1-гидрокси-2,2-диметил-пропил)-1H-бензимидазол-2-ил]метил]пиридин-2-она (50 мг, 153 мкмоль) в ДМФ (3 мл) добавляют HATU (87 мг, 229 мкмоль) и DIPEA (59 мг, 459 мкмоль). Смесь перемешивают при 0-20°C в течение 10 ч. После фильтрации, фильтрат очищают преп-ЖХВД с получением трет-бутил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 160) (23,9 мг, 38 мкмоль) в виде белого твердого вещества. ЖХМС m/z 609,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,21 (с, 1H), 8,25 (дд, J=7,6, 1,6 Гц, 1H), 7,57-7,51 (м, 1H), 7,49-7,44 (м, 1H), 7,43-7,33 (м, 1H), 7,15-7,01 (м, 2H), 6,63-6,51 (м, 1H), 6,41-6,33 (м, 2H), 5,58-5,36 (м, 3H), 4,65-4,56 (м, 1H), 4,11-4,01 (м, 1H), 2,97 (с, 3H), 2,82 (с, 3H), 2,27-2,15 (м, 2H), 1,91-1,81 (м, 1H), 1,74-1,61 (м, 1H), 1,35 (с, 9H), 0,88 (с, 9H).
К раствору трет-бутил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (60 мг, 98 мкмоль) в ДХМ (1 мл) добавляют ТФК (0,75 мл) при 0°C. Смесь перемешивают при 20°C в течение 2 ч. Реакционную смесь концентрируют с получением (6S, E)-6-амино-N7-(1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (I-272) (50 мг) в виде желтого масла.
К раствору (6S, E)-6-амино-N7-(1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (50 мг, 98 мкмоль) и оксазол-2-карбоксилата натрия (20 мг, 147 мкмоль) в ДМФ (3 мл) добавляют HATU (56 мг, 147 мкмоль) и DIPEA (38 мг, 294 мкмоль). Смесь перемешивают при 0-20°C в течение 10 ч. После фильтрации, фильтрат очищают преп-ЖХВД с получением (6S, E)-N7-(1-((7-(1-гидрокси-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида (Соединение 162) (25 мг, 41 мкмоль) в виде белого твердого вещества. ЖХМС m/z 604,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,45-9,41 (м, 1H), 9,35-9,26 (м, 1H), 8,35 (с, 1H), 8,26-8,21 (м, 1H), 7,56-7,52 (м, 1H), 7,49 (с, 1H), 7,40-7,28 (м, 1H), 7,13-7,02 (м, 2H), 6,66-6,56 (м, 1H), 6,40-6,30 (м, 2H), 5,54-5,35 (м, 3H), 4,66-4,56 (м, 2H), 2,97 (с, 3H), 2,82 (с, 3H), 2,31-2,21 (м, 2H), 2,05-1,95 (м, 2H), 0,95-0,77 (м, 9H).
Пример 27:

К раствору 1-[[4-(1-гидрокси-2,2-диметил-пропил)-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (300 мг, 841 мкмоль) в ДХМ (3 мл) добавляют DMP (535 мг, 1,3 ммоль). Смесь перемешивают при 20°C в течение 1 ч. Реакционную смесь концентрируют и очищают колоночной хроматографией с получением 3-нитро-1-((4-пивалоил-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-273) (200 мг, 496 мкмоль) в виде желтого твердого вещества.
К раствору 3-нитро-1-((4-пивалоил-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (200 мг, 564 мкмоль) в MeOH (30 мл) добавляют Fe (157 мг, 2,8 ммоль) и NH4Cl (301 мг, 5,6 ммоль). Смесь перемешивают при 80°C в течение 3 ч. Реакционную смесь фильтруют и фильтрат разбавляют водой (50 мл), экстрагируют этилацетатом (50 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением 3-амино-1-[[4-(2,2-диметилпропаноил)-1H-бензимидазол-2-ил]метил] пиридин-2-она (I-274) (150 мг) в виде желтого твердого вещества. ЖХМС m/z 325,1 (M+1)+.
К раствору (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (114 мг, 443 мкмоль) и 3-амино-1-[[4-(2,2-диметилпропаноил)-1H-бензимидазол-2-ил]метил]пиридин-2-она (120 мг, 369 мкмоль) в ДМФ (3 мл) добавляют HATU (211 мг, 555 мкмоль) и DIPEA (143 мг, 1,1 ммоль). Смесь перемешивают при 0-20°C в течение 10 ч. После фильтрации, фильтрат очищают преп-ЖХВД с получением (S, E)-метил (7-(диметиламино)-1,7-диоксо-1-((2-оксо-1-((7-пивалоил-1H-бензо[d]имидазол-2-ил)метил)-1,2-дигидропиридин-3-ил)амино)гепт-5-ен-2-ил)карбамата (Соединение 163) (182 мг, 306 мкмоль) в виде белого твердого вещества. ЖХМС m/z 565,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,28 (с, 1H), 8,27 (дд, J=7,6, 1,6 Гц, 1H), 7,98-7,90 (м, 1H), 7,77 (д, J=8,0 Гц, 1H), 7,75-7,66 (м, 1H), 7,59 (дд, J=6,8, 1,6 Гц, 1H), 7,36 (т, J=7,6 Гц, 1H), 6,64-6,54 (м, 1H), 6,43-6,34 (м, 2H), 5,62 (с, 2H), 4,21-4,10 (м, 1H), 3,52 (с, 3H), 2,97 (с, 3H), 2,82 (с, 3H), 2,30-2,15 (м, 2H), 1,95-1,85 (м, 1H), 1,76-1,63 (м, 1H), 1,37 (с, 9H).
Пример 28:
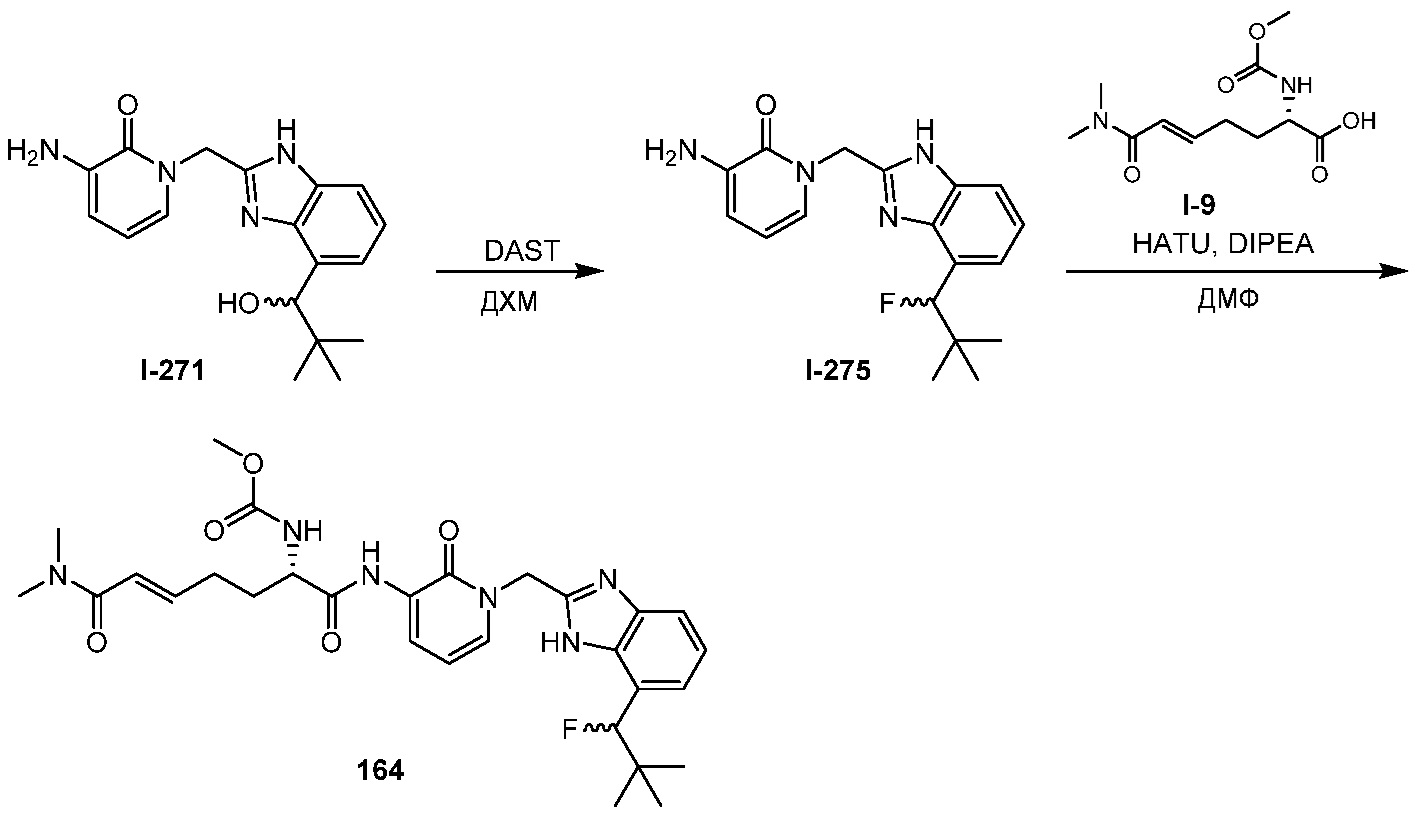
К смеси 3-амино-1-[[4-(1-гидрокси-2,2-диметил-пропил)-1H-бензимидазол-2-ил]метил]пиридин-2-она (300 мг, 919 мкмоль) в ДХМ (3 мл) добавляют BAST (305 мг, 1,4 ммоль) одной порцией при 0°C под N2 атмосферой. Смесь перемешивают при 30°C в течение 1 ч. Реакционную смесь гасят водой (50 мл) при 0°C и экстрагируют этилацетатом (50 мл х 2). Объединенные органические слои сушат над безводным Na2SO4. После фильтрации, фильтрат концентрируют при пониженном давлении с получением остатка, который очищают преп-ТСХ с получением 3-амино-1-((4-(1-фтор-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-275) (60 мг) в виде желтого масла. ЖХМС m/z 329,1 (M+1)+.
К раствору (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (66 мг, 255 мкмоль) и 3-амино-1-((4-(1-фтор-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (70 мг, 213 мкмоль) в ДМФ (3 мл) добавляют HATU (121 мг, 319 мкмоль) и DIPEA (82 мг, 639 мкмоль). Смесь перемешивают при 0-20°C в течение 10 ч. После фильтрации, фильтрат очищают преп-ЖХВД с получением метил ((2S, E)-7-(диметиламино)-1-((1-((7-(1-фтор-2,2-диметилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 164) (33,1 мг, 55 мкмоль) в виде белого твердого вещества. ЖХМС m/z 569,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ9,27 (с, 1H), 8,26 (д, J=7,2 Гц, 1H), 7,76-7,73 (м, 1H), 7,56 (дд, J=7,2, 1,6 Гц, 1H), 7,51-7,46 (м, 1H), 7,25-7,19 (м, 1H), 7,15-7,11 (м, 1H), 6,65-6,56 (м, 1H), 6,41-6,34 (м, 2H), 5,85-5,68 (м, 1H), 5,51-5,45 (м, 2H), 4,25-4,15 (м, 1H), 3,54 (с, 3H), 2,98 (с, 3H), 2,83 (с, 3H), 2,27-2,16 (м, 2H), 1,95-1,84 (м, 1H), 1,77-1,64 (м, 1H), 0,95 (с, 9H).
Следующее соединение получают по методикам, описанным в примере 28 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-284:


К смеси 2-(бензилоксиметил)-1-(2-триметилсилилэтоксиметил) бензимидазол-4-карбальдегида (10 г, 25,2 ммоль) и TMSCN (3,75 г, 37,8 ммоль) в ДХМ (50 мл) добавляют K2CO3 (1,74 г, 12,61 ммоль). Реакционную смесь перемешивают при 20°C в течение 1,5 ч. Полученный раствор гасят водой (100 мл) и экстрагируют ДХМ (200 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением 2-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2-((триметилсилил)окси)ацетонитрила (I-276) (12 г) в виде желтого масла.
К раствору 2-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2-((триметилсилил)окси)ацетонитрила (12 г, 24,2 ммоль) в MeOH (50 мл) добавляют HCl/MeOH (50 мл) при 0°C. Реакционную смесь перемешивают при 25°C в течение 2 ч. Полученный раствор разбавляют водой (50 мл), доводят pH~8 ледяным насыщенным NaHCO3, экстрагируют EtOAc (200 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением 2-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2-гидроксиацетата (I-277) (11 г) в виде желтого твердого вещества.
К смеси метил 2-[2-(бензилоксиметил)-1-(2- триметилсилилэтоксиметил)бензимидазол-4-ил]-2-гидрокси-ацетата (11 г, 24,1 ммоль) в ДХМ (100 мл) добавляют DMP (20,4 г, 48,2 ммоль). Реакционную смесь перемешивают при 25°C в течение 1 ч. Полученный раствор концентрируют и очищают хроматографией на силикагеле с получением метил 2-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-2-оксоацетата (I-278) (10 г) в виде желтого масла. ЖХМС m/z 455,3 (M+1)+.1H ЯМР (400 МГц, CDCl3) δ8,04 (д, J=6,8 Гц, 1H), 7,87 (д, J=7,2 Гц, 1H), 7,51 (т, J=7,6 Гц, 1H), 7,43-7,34 (м, 5H), 5,73 (с, 2H), 4,96 (с, 2H), 4,67 (с, 3H), 4,09 (с, 3H), 2,55 (т, J=8,0 Гц, 2H), 0,93 (т, J=8,0 Гц, 2H), 0,00 (с, 9H).
К раствору метил 2-[2-(бензилоксиметил)-1-(2- триметилсилилэтоксиметил) бензимидазол-4-ил]-2-оксо-ацетата (10 г, 22 ммоль) в DCE (20 мл) добавляют DAST (17,7 г, 110 ммоль, 14,5 мл) при 0°C. Реакционную смесь перемешивают при 20°C в течение 1,5 ч. Реакционную смесь гасят ледяным насыщенным NaHCO3 (100 мл) и экстрагируют ДХМ (150 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением метил 2-(2-((бензилокси) метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо [d]имидазол-4-ил)-2,2-дифторацетата (I-279) (10 г) в виде желтого масла. ЖХМС m/z 477,3 (M+1)+.
К раствору метил 2-[2-(бензилоксиметил)-1-(2- триметилсилилэтоксиметил) бензимидазол-4-ил]-2,2-дифтор-ацетата (8 г, 16,8 ммоль) в ТГФ (10 мл) добавляют MeMgBr (3M, 33,6 мл) при 0°C. Реакционную смесь перемешивают при 20°C в течение 1 ч. Полученный раствор гасят ледяным насыщенным NH4Cl (150 мл), экстрагируют EtOAc (200 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением 1-(2-((бензилокси)метил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-ил)-1,1-дифтор-2-метилпропан-2-ола (I-280) (5 г) в виде желтого масла.
К смеси 1-[2-(бензилоксиметил)-1-(2-триметилсилилэтоксиметил) бензимидазол-4-ил]-1,1-дифтор-2-метил-пропан-2-ола (2,50 г, 5,25 ммоль) в MeOH (10 мл) добавляют Pd(OH)2/C (1,50 г). Реакционную смесь перемешивают при 40°C в течение 16 ч под H2 (15 ф./кв.д.). Реакционную смесь фильтруют и концентрируют с получением 1,1-дифтор-1-(2-(гидроксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d] имидазол-4-ил)-2-метилпропан-2-ола (I-281) (4 г) в виде желтого масла. ЖХМС m/z 387,2 (M+1)+.
К раствору метил 2,2-дифтор-2-[2-(гидроксиметил)-1-(2- триметилсилилэтоксиметил)бензимидазол-4-ил]ацетата (4 г, 10,4 ммоль) и MsCl (3,81 г, 33,3 ммоль, 2,57 мл) в ДХМ (100 мл) добавляют DIPEA (4,01 г, 31,01 ммоль, 5,42 мл) при 0°C. Реакционную смесь перемешивают при 20°C в течение 2 ч. Полученный раствор гасят насыщенным раствором NaHCO3 (80 мл) и экстрагируют ДХМ (100 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением (4-(1,1-дифтор-2-гидрокси-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (I-282) (4,50 г) в виде желтого масла. ЖХМС m/z 465,0 (M+1)+.
К раствору 3-нитро-1H-пиридин-2-он (2,72 г, 19,4 ммоль) и [4-(1,1-дифтор-2-гидрокси-2-метил-пропил)-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метилметансульфоната (4,5 г, 9,69 ммоль) в MeCN (50 мл) добавляют DIPEA (3,76 г, 29,1 ммоль, 5,08 мл). Реакционную смесь перемешивают при 20°C в течение 5 ч. Полученный раствор разбавляют EtOAc (150 мл) и промывают насыщенным NH4Cl (70 мл х 2). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением 1-((4-(1,1-дифтор-2-гидрокси-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-283) (4 г) в виде желтого масла. ЖХМС m/z 509,1 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ8,40 (дд, J=7,6, 2,0 Гц, 1H), 8,13 (дд, J=6,8, 1,2 Гц, 1H), 7,65-7,62 (м, 2H), 7,48 (т, J=8,0 Гц, 1H), 6,49 (т, J=7,6 Гц, 1H), 6,40 (с, 1H), 5,88 (с, 2H), 5,58 (с, 2H), 3,63 (т, J=8,4 Гц, 1H), 1,31 (с, 6H), 0,92 (т, J=8,4 Гц, 1H), 0,00 (с, 9H).
К смеси 1-[[4-(1,1-дифтор-2-гидрокси-2-метил-пропил)-1-(2- триметилсилилэтоксиметил)бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (1,80 г, 3,54 ммоль) в ТГФ (20 мл) добавляют Pd/C (500 мг, 10% чистота). Реакционную смесь перемешивают при 20°C в течение 1 ч под H2 (15 ф./кв.д.). Полученную суспензию фильтруют и фильтрат концентрируют с получением 3-амино-1-((4-(1,1-дифтор-2-гидрокси-2-метилпропил)-1-((2-(триметилсилил)этокси) метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-284) (1,60 г) в виде желтого масла. ЖХМС m/z 479,1 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ7,68-7,66 (м, 2H), 7,47 (т, J=7,6 Гц, 1H), 7,10-7,08 (м, 1H), 6,57-6,55 (м, 1H), 6,19 (т, J=6,8 Гц, 1H), 5,87 (с, 2H), 5,36 (с, 2H), 4,26 (с, 2H), 3,54 (т, J=8,0 Гц, 1H), 1,35 (с, 6H), 0,93 (т, J=8,4 Гц, 1H), 0,00 (с, 9H).
Пример 29:

К смеси 1-[[4-(1,1-дифтор-2-гидрокси-2-метил-пропил)-1-(2- триметилсилилэтоксиметил)бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (200 мг, 0,393 ммоль), (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (183 мг, 0,708 ммоль) и HATU (449 мг, 1,18 ммоль) в ДМФ (10 мл) добавляют DIPEA (254 мг, 1,97 ммоль, 0,343 мл). Реакционную смесь перемешивают при 20°C в течение 16 ч. Реакционную смесь разбавляют EtOAc (40 мл), промывают насыщенным солевым раствором (30 мл х 3). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-метил (1-((1-((4-(1,1-дифтор-2- гидрокси-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (I-285) (200 мг) в виде желтого твердого вещества. ЖХМС m/z 723,6 (M+1)+.
К раствору (S, E)-метил (1-((1-((4-(1,1-дифтор-2-гидрокси-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (180 мг, 0,25 ммоль) в ДХМ (5 мл) добавляют ТФК (5 мл). Реакционную смесь перемешивают при 20°C в течение 3 ч. Полученный раствор доводят pH~8 с насыщенным NaHCO3 и экстрагируют ДХМ (30 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил(1-((1-((4-(1,1-дифтор-2-гидрокси-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 166) (82,8 мг, 56% выход) в виде белого твердого вещества. ЖХМС m/z 589,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ12,20 (шс, 1H), 9,25 (с, 1H), 8,26 (дд, J=7,2, 1,6 Гц, 1H), 7,75-7,73 (м, 1H), 7,63-7,56 (м, 2H), 7,26-7,20 (м, 2H), 6,64-6,56 (м, 1H), 6,39-6,33 (м, 2H), 5,44-5,35 (м, 3H), 4,19-4,14 (м, 1H), 3,54 (с, 3H), 2,98 (с, 3H), 2,79 (с, 3H), 2,27-2,19 (м, 2H), 1,89-1,85 (м, 1H), 1,74-1,69 (м, 1H), 1,25(с, 6H).
Синтез промежуточного соединения I-289:

К смеси 2-нитробензолсульфонилхлорида (5 г, 22,6 ммоль) в ТГФ (60 мл) добавляют N2H4.H2O (2,82 г, 56,4 ммоль, 2,74 мл) по каплям при -30°C. Реакционную смесь перемешивают при -30°C в течение 1 ч под N2 атмосферой, разбавляют EtOAc (100 мл), промывают ледяным солевым раствором (50 мл х 2). Органическую фазу выливают в петролейный эфир (400 мл) и фильтруют. Фильтровальную лепешку промывают петролейным эфиром (100 мл), полученный твердый остаток сушат под вакуумом с получением 2-нитробензолсульфоногидразида (I-287) (5,30 г) в виде желтого твердого вещества,1H ЯМР (400 МГц, CDCl3) δ8,24-8,21 (м, 1H), 7,92-7,90 (м, 1H), 7,84-7,81 (м, 2H), 6,57 (с, 1H).
К раствору 3-амино-1-[[4-(1,1-дифтор-2-гидрокси-2-метил-пропил)-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метил]пиридин-2-она (1,80 г, 3,76 ммоль) в ДХМ (20 мл) добавляют DAST (1,82 г, 11,3 ммоль, 1,49 мл) при -70°C. Реакционный раствор перемешивают при -70°C в течение 0,5 ч, и при 0°C в течение еще 0,5 ч под N2 атмосферой. Реакционную смесь гасят насыщенным раствором NaHCO3 (30 мл), экстрагируют ДХМ (50 мл х 2). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением 3-амино-1-[[4-(1,1-дифтор-2-метил-аллил)-1-(2-триметилсилилэтоксиметил)бензимидазол-2-ил]метил]пиридин-2-она (I-288) (1,10 г) в виде желтого масла. ЖХМС m/z 461,3 (M+1)+.
К смеси 2-нитробензолсульфоногидразида (660 мг, 3,04 ммоль) и K3PO4 (323 мг, 1,52 ммоль) в MeCN (10 мл) добавляют 2-нитробензолсульфоногидразид (660 мг, 3,04 ммоль). Реакционную смесь перемешивают при 28°C в течение 16 ч. Затем добавляют другую партию 2-нитробензолсульфоногидразида (377 мг, 1,74 ммоль) и K3PO4 (184 мг, 0,868 ммоль). Реакционную смесь перемешивают при 28°C в течение еще 3 ч. Полученный раствор разбавляют солевым раствором (30 мл) и экстрагируют EtOAc (40 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением 3-амино-1-((4-(1,1-дифтор-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-289) (200 мг) в виде желтого масла. ЖХМС m/z 455,3 (M+1)+.
Пример 30:

К смеси 3-амино-1-[[4-(1,1-дифтор-2-метил-пропил)-1-(2- триметилсилилэтоксиметил)бензимидазол-2-ил]метил]пиридин-2-она (200 мг, 0,432 ммоль), (S, E)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (201 мг, 0,778 ммоль) и HATU (493 мг, 1,30 ммоль) в ДМФ (10 мл) добавляют DIPEA (279 мг, 2,16 ммоль). Реакционную смесь перемешивают при 20°C в течение 16 ч. Реакционную смесь разбавляют EtOAc (40 мл) и промывают насыщенным солевым раствором (30 мл х 3). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-метил (1-((1-((4-(1,1-дифтор-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (I-290) (200 мг) в виде желтого твердого вещества. ЖХМС m/z 703,6 (M+1)+.
К раствору (S, E)-метил (1-((1-((4-(1,1-дифтор-2-метилпропил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (200 мг, 0,285 ммоль) в ДХМ (3 мл) добавляют ТФК (3 мл). Реакционную смесь перемешивают при 20°C в течение 3 ч. Реакционную смесь доводят pH~8 с насыщенным NaHCO3. Полученный раствор экстрагируют ДХМ (100 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил (1-((1-((4-(1,1-дифтор-2-метилпропил)-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 167) (64,30 мг, 39% выход) в виде желтого твердого вещества. ЖХМС m/z 573,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ12,57 (шс, 1H), 9,26 (с, 1H), 8,28-8,26 (м, 1H), 7,75-7,57 (м, 3H), 7,31-7,24 (м, 2H), 6,64-6,56 (м, 1H), 6,39-6,35 (м, 2H), 5,44 (с, 2H), 4,19-4,15 (м, 1H), 3,55 (с, 3H), 2,99 (с, 3H), 2,84 (с, 3H), 2,61-2,53 (м, 1H), 2,27-2,22 (м, 2H), 1,89-1,85 (м, 1H), 1,75-1,70 (м, 1H), 1,06-0,86 (м, 6H). ЖХМС [M+1]+ = 573,2.
Следующие соединения получают согласно методикам, описанным в Примере 30 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-300:

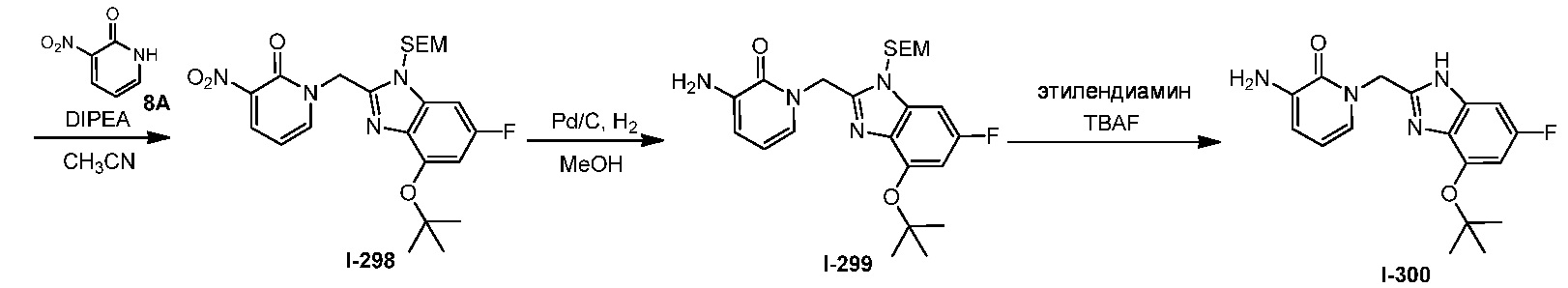
К раствору 1,3,5-трифтор-2-нитробензола (10,0 г, 56,5 ммоль) в толуоле (120 мл) добавляют трет-бутоксикалий (7,0 г, 62,1 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 2 ч. Смесь выливают в насыщенным NH4Cl (20 мл) и экстрагируют этилацетатом (100 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, отфильтровывают и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 1-(трет-бутокси)-3,5-дифтор-2-нитробензола (I-291) (8,0 г) в виде желтого масла,1H ЯМР (400 МГц, ДМСО-d6) δ 6,75-6,72 (м, 1H), 6,65-6,64 (м, 1H), 1,47 (с, 9H).
К раствору 1-(трет-бутокси)-3,5-дифтор-2-нитробензола (8,0 г, 34,6 ммоль) и фенилметанамина (3,89 г, 36,3 ммоль) в NMP (80 мл) добавляют K2CO3 (9,56 г, 69,2 ммоль). Смесь перемешивают при 100°C в течение 16 ч. Смесь выливают в воду (200 мл) и экстрагируют EtOAc (100 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 4), сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением N-бензил-3-(трет-бутокси)-5-фтор-2-нитроанилина (I-292) (5,5 г) в виде коричневого твердого вещества,1H ЯМР (400 МГц, ДМСО-d6) δ7,40-7,32 (м, 2H), 6,40 (с, 1H), 6,21-6,18 (м, 1H), 6,14-6,11(м, 1H), 4,37 (д, J=5,6 Гц, 1H), 1,45 (с, 9H).
К раствору N-бензил-3-(трет-бутокси)-5-фтор-2-нитроанилина (5,50 г, 17,3 ммоль) в MeOH (50 мл) добавляют Pd/C (10%, 1 г) под N2 атмосферой. Суспензию дегазируют и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) атмосферой при 25°C в течение 1 ч. Смесь отфильтровывают и фильтрат концентрируют с получением 3-(трет-бутокси)-5-фторбензол-1,2-диамина (I-293) (3,5 г) в виде коричневого масла.
К раствору 3-(трет-бутокси)-5-фторбензол-1,2-диамина (3,0 г, 15,1 ммоль) в ДМФ (35 мл) добавляют Na2S2O5 (5,75 г, 30,3 ммоль) и 2-бензилоксиацетальдегид (4,55 г, 30,3 ммоль). Смесь перемешивают при 85°C в течение 12 ч. Смесь выливают в воду (100 мл) и экстрагируют EtOAc (50 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл х 4), сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((бензилокси)метил)-4-(трет-бутокси)-6-фтор-1H-бензо[d]имидазола (I-294) (2,6 г) в виде коричневого твердого вещества. ЖХМС m/z 329,0 (M+1)+.
К раствору 2-((бензилокси)метил)-4-(трет-бутокси)-6-фтор-1H-бензо[d]имидазола (1,3 г, 3,96 ммоль) в ДМФ (20 мл) добавляют NaH (237 мг, 5,94 ммоль, 60% чистота). После перемешивания при 25°C в течение 0,5 ч, SEM-Cl (726 мг, 4,35 ммоль) добавляют в вышеуказанную смесь при 0°C. Смесь перемешивают при 25°C в течение 12 ч. Полученный раствор выливают в воду (100 мл) и экстрагируют EtOAc (80 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл х 4), сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((бензилокси)метил)-4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазола (I-295) (2,7 г, 5,89 ммоль, 74% выход) в виде желтого масла. ЖХМС m/z 459,1 (M+1)+.
К раствору 2-((бензилокси)метил)-4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазола (2,7 г, 5,89 ммоль) в MeOH (30 мл) добавляют Pd(OH)2/C (10%, 2 г) под N2 атмосферой. Суспензию дегазируют и продувают H2 3 раза. Смесь перемешивают под H2 (45 ф./кв.д.) при 25°C в течение 12 ч. Смесь отфильтровывают и фильтрат концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением (4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси) метил)-1H-бензо[d] имидазол-2-ил)метанола (I-296) (1,5 г, 68% выход) в виде желтого масла. ЖХМС m/z 369,1 (M+1)+.
К раствору (4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метанола (1,5 г, 4,07 ммоль) в ДХМ (20 мл) добавляют DIPEA (1,58 г, 12,2 ммоль) и MsCl (699 мг, 6,11 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 1 ч. Полученный раствор разбавляют ДХМ (50 мл) и промывают насыщенным солевым раствором (30 мл). Органической слой сушат над безводным Na2SO4 и концентрируют с получением (4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (I-297) (1,9 г)в виде желтого масла.
К раствору (4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метилметансульфоната (1,9 г, 4,25 ммоль) и 3-нитропиридин-2(1H)-она (893 мг, 6,38 ммоль) в CH3CN (2 мл) добавляют DIPEA (1,65 г, 12,8 ммоль). Смесь перемешивают при 30°C в течение 16 ч. Смесь концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 1-((4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-298) (1,5 г, 67% выход) в виде желтого масла. ЖХМС m/z 491,3 (M+1)+.
К раствору 1-((4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)-3-нитропиридин-2(1H)-она (1,5 г, 3,06 ммоль) в MeOH (20 мл) добавляют Pd/C (10%, 200 мг) под N2 атмосферой. Суспензию дегазируют и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) атмосферой при 20°C в течение 1 ч. Смесь отфильтровывают, и фильтрат концентрируют с получением 3-амино-1-((4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси) метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-299) (1,2 г) в виде желтого масла. ЖХМС m/z 461,1 (M+1)+.
К раствору 3-амино-1-((4-(трет-бутокси)-6-фтор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (1,2 г, 2,61 ммоль) в TBAF (1M, 10 мл) добавляют этан-1,2-диамин (470 мг, 7,82 ммоль). Смесь перемешивают при 80°C в течение 4 ч. Реакционную смесь концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 3-амино-1-((4-(трет-бутокси)-6-фтор-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-300) (220 мг, 24% выход) в виде коричневого масла. ЖХМС m/z 331,1 (M+1)+.
Пример 31:

К раствору 3-амино-1-((4-(трет-бутокси)-6-фтор-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (60 мг, 182 мкмоль) и (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (70 мг, 272 мкмоль) в ДМФ (1 мл) добавляют HATU (117 мг, 309 мкмоль) и DIEA (117 мг, 908 мкмоль) при 0°C. Смесь перемешивают при 30°C в течение 12 ч. Смесь выливают в воду (10 мл) и экстрагируют EtOAc (15 мл х 2). Органические слои промывают насыщенным солевым раствором (10 мл х3), сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил (1-((1-((7-(трет-бутокси)-5-фтор-1H-бензо[d]имидазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбаматв (Соединение 171) (19 мг, 18% выход) в виде желтого твердого вещества. ЖХМС m/z 571,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ9,26-9,25 (м, 1H), 8,25-8,24 (м, 1H), 7,73-7,72 (м, 1H), 7,56-7,53 (м, 1H), 7,05 (дд, J=9,2, 2,0 Гц, 1H), 6,94 (дд, J=8,4, 2,0 Гц, 1H), 6,74-6,56 (м, 2H), 6,39-6,33 (м, 2H), 5,38-5,35 (м, 1H), 4,17-4,16 (м, 1H), 3,54 (с, 3H), 2,98 (м, 3H), 2,83 (с, 3H), 2,24-2,21 (м, 2H), 1,41-1,35 (м, 9H).
Следующее соединение получают по методикам, описанным в примере 31 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-306:

К смеси 1,4-дифтор-2-нитро-бензола (0,5 г, 3,14 ммоль, 340,14 мкл, 1 экв) и метанамина (2M, 6,29 мл, 4 экв) в CH3CN (10 мл) при 25°C. Смесь перемешивают при 25°C в течение 2 часов. Реакционную смесь концентрируют с получением 4-фтор-N-метил-2-нитро-анилина (I-302) (1,33 г) в виде оранжевого твердого вещества, которое сразу используют.
К раствору 4-фтор-N-метил-2-нитро-анилина (1,28 г, 7,52 ммоль, 1 экв) в EA (10 мл) добавляют Pd/C (1 г, 10% чистота). Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 30 мин. Реакционную смесь фильтруют, и концентрируют при пониженном давлении с получением 4-фтор-N1-метил-бензол-1,2-диамина (I-303) (750 мг) в виде коричневого масла которую сразу используют.
К смеси 4-фтор-N1-метил-бензол-1,2-диамина (700 мг, 4,99 ммоль, 1 экв) и 2-хлоруксусной кислоты (707,93 мг, 7,49 ммоль, 842,77 мкл, 1,5 экв) в HCl (5,5 мл) (6M) и H2O (5,5 мл) одной порцией при 25°C. Смесь перемешивают при 100°C в течение 12 часов. Реакционную смесь гасят добавлением 30 мл воды и экстрагируют EtOAc 30 мл (15 мл x 2). Объединенные органические слои промывают насыщ. NaHCO3 (100 мл). Объединенные органические слои промывают насыщенным солевым раствором 30 мл (15 мл x 2), затем сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 2-(хлорметил)-5-фтор-1-метил-бензимидазола (I-304) (1 г) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,42 (дд, J=2,3, 9,2 Гц, 1H), 7,32-7,27 (м, 1H), 7,10 (дт, J=2,3, 9,1 Гц, 1H), 4,83 (с, 2H), 3,87 (с, 3H).
К раствору 3-нитро-1H-пиридин-2-она (193,97 мг, 1,38 ммоль, 1,1 экв) в MeCN (5 мл) добавляют DIEA (325,34 мг, 2,52 ммоль, 438,47 мкл, 2 экв) при 0°C. 2-(хлорметил)-5-фтор-1-метил-бензимидазол (250 мг, 1,26 ммоль, 1 экв) в MeCN (5 мл) затем капают в раствор при 0°C. Смесь перемешивают при 0°C в течение 30 мин, затем нагревают до 25°C и перемешивают в течение 12 часа. Реакционную смесь гасят добавлением воды (10 мл) при 25°C и затем разбавляют этилацетат (10 мл) и экстрагируют этилацетатом (10 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (5 мл x 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением 1-[(5-фтор-1-метил-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (I-305) (187 мг) в виде желтого твердого вещества, которое сразу используют,1H ЯМР (400 МГц, CDCl3) δ 8,30 (дд, J=2,1, 7,6 Гц, 1H), 8,14 (дд, J=2,1, 6,7 Гц, 1H), 7,31 (дд, J=2,3, 9,2 Гц, 1H), 7,23 (дд, J=4,5, 8,9 Гц, 1H), 7,19 (с, 2H), 7,03 (дт, J=2,4, 9,2 Гц, 1H), 6,35 (т, J=7,3 Гц, 1H), 5,42 (с, 2H), 3,94 (с, 3H), 1,53 (шс, 9H).
К раствору 1-[(5-фтор-1-метил-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (167 мг, 552,50 мкмоль, 1 экв) в EA (5 мл) добавляют Pd/C (0,3 г, 10% чистота). Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 15 мин. Реакционную смесь фильтруют и концентрируют при пониженном давлении с получением 3-амино-1-[(5-фтор-1-метил-бензимидазол-2-ил)метил]пиридин-2-она (I-306) (120 мг) в виде желтого масла, которую сразу используют.
Следующие промежуточные соединения получают согласно методикам, описанным в I-306 с применением подходящих реагентов.
Синтез промежуточного соединения I-314:

Смесь 5-амино-1H-пиримидин-6-она (234,93 мг, 2,11 ммоль) в DMA (4 мл), затем добавляют NaH (176,19 мг, 4,41 ммоль, 60% чистота) при 0°C и смесь перемешивают при 25°C в течение 15 мин. Затем добавляют 2-(хлорметил)-5-фтор-1-метил-бензимидазол (350 мг, 1,76 ммоль) при 0°C и смесь перемешивают при 40°C в течение 45 мин. Реакционную смесь разбавляют насыщ. NH4Cl раствором (10 мл) и экстрагируют EtOAc (15 мл x 2). Объединенную органическую фазу промывают насыщенным солевым раствором (15 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток разбавляют EtOAc 3 мл и фильтруют с получением 5-амино-3-[(5-фтор-1-метил-бензимидазол-2-ил)метил]пиримидин-4-она (I-314) (320 мг) в виде серого твердого вещества.
Следующие промежуточные соединения получают согласно методикам, описанным в I-314 с применением подходящих реагентов.
Пример 32:
Способ 1:

К смеси (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (180,01 мг, 661,10 мкмоль, 1,5 экв) и 3-амино-1-[(5-фтор-1-метил-бензимидазол-2-ил)метил]пиридин-2-она (120 мг, 440,73 мкмоль, 1 экв) в пиридине (1 мл) добавляют POCl3 (135,15 мг, 881,46 мкмоль, 81,91 мкл, 2 экв) одной порцией при -30°C. Смесь перемешивают при -30°C в течение 15 мин. Реакционную смесь гасят 5 мл воды при 0°C и затем разбавляют 10 мл воды и экстрагируют EtOAc (10 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (5 мл x 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ и преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 173) (11,8 мг, 5% выход) в виде белого твердого вещества. ЖХМС m/z 527,2 (M+1)+.
Способ 2:

К смеси (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (129,01 мг, 499,51 мкмоль), 5-амино-3-[(5-фтор-1-метил-бензимидазол-2-ил)метил]пиримидин-4-она (130 мг, 475,73 мкмоль) в ДМФ (2 мл) добавляют HATU (325,60 мг, 856,31 мкмоль) и DIEA (92,22 мг, 713,59 мкмоль, 124,29 мкл) при 25°C. Смесь перемешивают при 40°C в течение 12 ч. Реакционную смесь разбавляют насыщ. водн. NH4Cl (10 мл) и экстрагируют EtOAc (6 мл x 2). Объединенную органическую фазу промывают насыщенным солевым раствором (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-бензимидазол-2-ил)метил]-6-оксо-пиримидин-5-ил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 174) (37,9 мг, 15% выход) в виде белого твердого вещества. ЖХМС m/z 514,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,43 (с, 1H) 8,76 (с, 1H) 8,42 (с, 1H) 7,63 (шд, J=7,58 Гц, 1H) 7,53 (дд, J=8,93, 4,65 Гц, 1H) 7,43 (дд, J=9,66, 2,32 Гц, 1H) 7,28-7,35 (м, 2H) 7,15-7,22 (м, 2H) 7,10 (тд, J=9,26, 2,26 Гц, 1H) 6,57-6,67 (м, 1H) 6,37 (д, J=15,04 Гц, 1H) 5,65 (с, 2H) 5,53 (с, 2H) 4,29 (шд, J=3,67 Гц, 1H) 3,54 (с, 3H) 2,99 (с, 3H) 2,84 (с, 3H) 2,20-2,29 (м, 2H) 1,66-1,89 (м, 2H).
Следующие соединения получают по методикам, описанным для способа 1 Примера 32 с применением подходящих промежуточных соединений.
Следующие цели получают по методикам, описанным для способа 2 Примера 32 с применением подходящих промежуточных соединений.
Пример 33:

К смеси 4-фторбензол-1,2-диамина (5 г, 39,64 ммоль, 1 экв), DIPEA (10,25 г, 79,28 ммоль, 13,81 мл, 2 экв) и 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (7,85 г, 39,64 ммоль, 1 экв) в ДХМ (50 мл) добавляют T3P (37,84 г, 59,46 ммоль, 35,36 мл, 50% чистота, 1,5 экв) по каплям при 25°C под N2. Смесь перемешивают при 25°C в течение 16 ч. Реакционную смесь фильтруют. Лепешку промывают H2O и лепешку концентрируют при пониженном давлении с получением N-(2-амино-5-фтор-фенил)-2-(3-нитро-2-оксо-1-пиридил)ацетамида (I-321) (12,9 г) в виде фиолетового твердого вещества. ЖХМС m/z 307,0 (M+1)+.
Смесь N-(2-амино-5-фтор-фенил)-2-(3-нитро-2-оксо-1-пиридил)ацетамида (12,9 г, 42,12 ммоль, 1 экв) в AcOH (160 мл) нагревают до 120°C и перемешивают в течение 3 часов. Реакционную смесь охлаждают до 25°C. Смесь фильтруют и лепешку концентрируют при пониженном давлении с получением 1-[(5-фтор-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (I-322) (8,18 г) в виде белого твердого вещества. ЖХМС m/z 289,1 (M+1)+.
Смесь 1-[(5-фтор-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (1 г, 3,47 ммоль, 1 экв), Fe (968,83 мг, 17,35 ммоль, 5 экв) и NH4Cl (1,86 г, 34,69 ммоль, 1,21 мл, 10 экв) в MeOH (15 мл) и H2O (3 мл) нагревают до 80°C и перемешивают в течение 1 ч. Реакционную смесь фильтруют. и затем разбавляют 10 мл H2O и экстрагируют 200 мл EtOAc (50 мл x 4). Объединенные органические слои промывают насыщенным солевым раствором 150 мл, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 3-амино-1-[(5-фтор-1H-бензимидазол-2-ил)метил]пиридин-2-она (I-323) (0,735 г) в виде коричневого твердого вещества. ЖХМС m/z 259,3 (M+1)+.
К смеси 3-амино-1-[(5-фтор-1H-бензимидазол-2-ил)метил]пиридин-2-она (0,355 г, 1,37 ммоль, 1 экв) и (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (411,74 мг, 1,51 ммоль, 1,1 экв) в Py (6 мл) добавляют POCl3 (210,77 мг, 1,37 ммоль, 127,74 мкл, 1 экв) по каплям при -30°C под N2. Смесь перемешивают при -30°C в течение 10 мин. Реакционную смесь гасят добавлением 0,5 мл H2O. Реакционную смесь концентрируют и очищают преп-ТСХ с получением [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (I-324) (270 мг, 38% выход) в виде желтого твердого вещества.
К смеси [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (0,09 г, 175,60 мкмоль, 1 экв), DIEA (34,04 мг, 263,40 мкмоль, 45,88 мкл, 1,5 экв) и этил карбонохлоридата (22,87 мг, 210,72 мкмоль, 20,06 мкл, 1,2 экв) в ДХМ (2 мл) добавляют DMAP (214,53 мкг, 1,76 мкмоль, 0,01 экв) одной порцией при 0°C под N2. Смесь перемешивают при 30°C в течение 1 часа. Реакционную смесь концентрируют и очищают преп-ЖХВД (нейтральные условия) с получением этил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5-фтор-бензимидазол-1-карбоксилата (Соединение 193) (6,4 мг, 5% выход) в виде светло-желтого твердого вещества,1H ЯМР (400 МГц, ДМСО-d6) δ 9,35-9,26 (м, 1H), 8,32-8,22 (м, 1H), 7,78-7,63 (м, 1H), 7,61-7,48 (м, 2H), 7,35-7,17 (м, 1H), 6,71-6,59 (м, 1H), 6,45-6,34 (м, 2H), 5,67 (шс, 2H), 5,10 (шс, 1H), 4,64-4,50 (м, 2H), 2,97 (шд, J=16,8 Гц, 6H), 2,83 (шд, J=10,1 Гц, 6H), 2,30 (шд, J=6,7 Гц, 2H), 1,96 (шд, J=6,7 Гц, 2H), 1,48 (шт, J=7,0 Гц, 3H). ЖХМС m/z 585,3(M+1)+.
К смеси циклопропилметанола (20,10 мг, 278,73 мкмоль, 22,04 мкл, 1 экв) и DIPEA (180,11 мг, 1,39 ммоль, 242,74 мкл, 5 экв) в ДХМ (2 мл) добавляют трифосген (41,36 мг, 139,36 мкмоль, 0,5 экв) одной порцией при 0°C под N2. Смесь перемешивают при 0°C в течение 30 мин. Затем DMAP (3,41 мг, 27,87 мкмоль, 0,1 экв) и [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамат (0,1 г, 195,11 мкмоль, 0,7 экв) добавляют к смеси при 0°C. Реакционную смесь перемешивают при 0°C в течение 30 мин. Реакционную смесь гасят добавлением H2O (5мл) при 0°C и затем экстрагируют EtOAc(15 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением циклопропилметил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5-фтор-бензимидазол-1-карбоксилата (Соединение 194) (16,1 мг, 5% выход) в виде белого твердого вещества. ЖХМС m/z 611,4 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,45-9,31 (м, 1H), 8,34 (дд, J=1,5, 7,4 Гц, 1H), 8,11-7,94 (м, 1H), 7,87-7,69 (м, 1H), 7,63-7,54 (м, 1H), 7,41-7,23 (м, 1H), 6,78-6,65 (м, 1H), 6,54-6,38 (м, 2H), 5,79-5,68 (м, 2H), 5,16 (дд, J=4,8, 7,3 Гц, 1H), 4,45 (шд, J=7,6 Гц, 2H), 3,06-3,00 (м, 6H), 2,88 (шд, J=10,8 Гц, 6H), 2,79-2,66 (м, 1H), 2,42-2,33 (м, 2H), 1,46 (дт, J=4,5, 7,8 Гц, 1H), 0,81-0,67 (м, 2H), 0,62-0,45 (м, 2H).
Следующие соединения получают согласно методикам, описанным в Примере 33 с применением подходящих промежуточных соединений.
Пример 34:

Смесь 4-фторбензол-1,2-диамина (1 г, 7,93 ммоль, 1 экв) и 2-хлоруксусной кислоты (1,12 г, 11,89 ммоль, 1,34 мл, 1,5 экв) в HCl (15 мл) (6N) нагревают до 100°C и перемешивают в течение 6 часов. Реакционную смесь гасят добавлением насыщ. водн. NaHCO3до pH=7. Смесь фильтруют и концентрируют при пониженном давлении с получением 2-(хлорметил)-5-фтор-1H-бензимидазола (I-325) (1,46 г) в виде коричневого твердого вещества.
К смеси 2-(хлорметил)-5-фтор-1H-бензимидазола (0,5 г, 2,71 ммоль, 1 экв), DIPEA (420,07 мг, 3,25 ммоль, 566,13 мкл, 1,2 экв) и Boc2O (591,14 мг, 2,71 ммоль, 622,25 мкл, 1 экв) в ДХМ (5 мл) добавляют DMAP (3,31 мг, 27,09 мкмоль, 0,01 экв) одной порцией при 0°C под N2. Смесь перемешивают при 15°C в течение 30 мин. В реакционную смесь добавляют H2O (5 мл) и затем экстрагируют ДХМ (20 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над Na2SO4, фильтруют, концентрируют и очищают колоночной хроматографией с получением трет-бутил 2-(хлорметил)-5-фтор-бензимидазол-1-карбоксилата (I-326) (466 мг, 53% выход) в виде желтого масла. ЖХМС m/z 229,2 (M+1- трет-бутил).
К смеси 5-амино-1H-пиримидин-6-она (218,21 мг, 1,96 ммоль, 1,2 экв) в DMA (1 мл) добавляют NaH (130,94 мг, 3,27 ммоль, 60% чистота, 2 экв) порцией при 0°C под N2. Смесь перемешивают при 0°C в течение 30 мин, затем добавляют трет-бутил 2-(хлорметил)-5-фтор-бензимидазол-1-карбоксилат (466 мг, 1,64 ммоль, 1 экв) в DMA (1 мл) по каплям при 0°C. Смесь перемешивают при 15°C в течение 1,5 часов. Реакционную смесь добавляют H2O (10 мл) и затем разбавляют EtOAc (10 мл) и экстрагируют EtOAc (20 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (20 мл x 2), сушат над Na2SO4, фильтруют, концентрируют и очищают колоночной хроматографией с получением трет-бутил 2-[(5-амино-6-оксо-пиримидин-1-ил)метил]-5-фтор-бензимидазол-1-карбоксилата (I-327) (342 мг, 58% выход) в виде желтого твердого вещества. ЖХМС m/z 360,0 (M+1)+.
К смеси трет-бутил 2-[(5-амино-6-оксо-пиримидин-1-ил)метил]-5-фтор-бензимидазол-1-карбоксилата (237 мг, 659,52 мкмоль, 1 экв) и (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (170,33 мг, 659,52 мкмоль, 1 экв) в Py (1 мл) добавляют POCl3 (101,12 мг, 659,52 мкмоль, 61,29 мкл, 1 экв) по каплям при -30°C под N2. Смесь перемешивают при -30°C в течение 10 мин. Реакционную смесь гасят добавлением H2O (0,5 мл) и затем концентрируют и очищают колоночной хроматографией и преп-ТСХ с получением трет-бутил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиримидин-1-ил]метил]-5-фтор-бензимидазол-1-карбоксилата (I-328) (100 мг, 25% выход) в виде желтого твердого вещества. ЖХМС m/z 600,2(M+1)+.
Смесь трет-бутил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиримидин-1-ил]метил]-5-фтор-бензимидазол-1-карбоксилата (85 мг, 141,76 мкмоль, 1 экв) в ТФК (0,4 мл) и ДХМ (1,5 мл) нагревают до 25°C и перемешивают в течение 30 мин. Реакционную смесь гасят добавлением насыщ. NaHCO3до pH=7 и затем разбавляют EtOAc (8 мл) и экстрагируют EtOAc(20 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором(30мл), сушат над Na2SO4, фильтруют, концентрируют и очищают преп-ТСХ с получением N-[(E,1S)-6-(диметиламино)-1[1-[(5-фтор-1H-бензимидазол-2-ил)метил]-6-оксо-пиримидин-5-ил]карбамоил]-6-оксо-гекс-4-енил]карбамата (I-329) (65 мг, 92% выход) в виде белого твердого вещества.
К смеси метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1H-бензимидазол-2-ил)метил]-6-оксо-пиримидин-5-ил]карбамоил]-6-оксо-гекс-4-енил]карбамата (60 мг, 120,12 мкмоль, 1 экв), DIPEA (23,29 мг, 180,18 мкмоль, 31,38 мкл, 1,5 экв) и метил карбонохлоридата (13,62 мг, 144,15 мкмоль, 11,17 мкл, 1,2 экв) в ДХМ (0,5 мл) добавляют DMAP (146,75 мкг, 1,20 мкмоль, 0,01 экв) одной порцией при 0°C под N2. Смесь перемешивают при 15°C в течение 30 мин. Реакционную смесь гасят добавлением H2O 5 мл и затем разбавляют EtOAc 5 мл и экстрагируют EtOAc 20 мл (5 мл x 4). Объединенные органические слои промывают насыщенным солевым раствором 15 мл, сушат над Na2SO4, фильтруют, концентрируют и очищают преп-ТСХ с получением метил 2-[[5-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-6-оксо-пиримидин-1-ил]метил]-5-фтор-бензимидазол-1-карбоксилата (Соединение 201) (8,3 мг, 12% выход) в виде белого твердого вещества. СЖХ показала смесь примерно 39:61. ЖХМС m/z 558,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,45 (с, 1H), 8,78 (с, 1H), 8,31 (д, J=1,8 Гц, 1H), 7,95 (дд, J=4,9, 9,0 Гц, 1H), 7,75 (дд, J=2,5, 9,4 Гц, 1H), 7,70-7,66 (м, 1H), 7,64 (шд, J=9,5 Гц, 1H), 7,55 (дд, J=2,4, 9,0 Гц, 1H), 7,29-7,16 (м, 1H), 6,69-6,54 (м, 1H), 6,36 (д, J=15,0 Гц, 1H), 5,66 (д, J=4,0 Гц, 2H), 4,33-4,21 (м, 1H), 4,11 (д, J=1,1 Гц, 3H), 3,52 (с, 3H), 2,98 (с, 3H), 2,82 (с, 3H), 2,28-2,16 (м, 2H), 1,88-1,65 (м, 2H).
Синтез промежуточного соединения I-331:


К смеси 1-[(5-фтор-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (0,2 г, 693,88 мкмоль, 1 экв) в ДМФ (5 мл) добавляют NaH (33,30 мг, 832,66 мкмоль, 60% чистота, 1,2 экв) одной порцией при 0°C под N2. Смесь перемешивают при 0°C в течение 30 мин, затем добавляют бромметилбензол (130,55 мг, 763,27 мкмоль, 90,66 мкл, 1,1 экв) при 0°C. Смесь нагревают до 25°C и перемешивают в течение 2 часов. Реакционную смесь гасят добавлением насыщ. водн. NH4Cl (15 мл) при 0°C и затем экстрагируют EtOAc (30 мл x 5). Объединенные органические слои промывают насыщенным солевым раствором (50 мл x 1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением 1-[(1-бензил-5-фтор-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (I-330) (0,135 г, 41% выход) в виде желтого твердого вещества. ЖХМС m/z 379,1 (M+1)+.
Смесь 1-[(1-бензил-5-фтор-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (0,115 г, 303,95 мкмоль, 1 экв), Fe (84,88 мг, 1,52 ммоль, 5 экв) и NH4Cl (162,58 мг, 3,04 ммоль, 106,26 мкл, 10 экв) в MeOH (5 мл) и H2O (1 мл) нагревают до 80°C и перемешивают в течение 1 часа. Реакционную смесь добавляют H2O (10 мл) и затем разбавляют EtOAc (10 мл) и экстрагируют EtOAc (10 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором 20 мл, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 3-амино-1-[(1-бензил-5-фтор-бензимидазол-2-ил)метил]пиридин-2-она (I-331) (0,12 г) в виде желтого твердого вещества. ЖХМС m/z 349,0 (M+1)+.
Следующие промежуточные соединения получают согласно методикам, описанным в I-331 с применением подходящих реагентов.
Пример 35:

К смеси 3-амино-1-[(1-бензил-5-фтор-бензимидазол-2-ил)метил]пиридин-2-она (0,070 г, 200,93 мкмоль, 1,1 экв) и (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (49,74 мг, 182,67 мкмоль, 1 экв) в Py (3 мл) добавляют POCl3 (28,01 мг, 182,67 мкмоль, 16,98 мкл, 1 экв) одной порцией при -30°C под N2. Смесь перемешивают при -30°C в течение 40 мин. Реакционную смесь гасят добавлением H2O (1 мл) и затем фильтруют и концентрируют и очищают преп-ТСХ с получением 32,2 мг Соединения 202 в виде белого твердого вещества, 26 мг Соединения 202 далее разделяют СЖХ с получением [(E,1S)-1-[[1-[(1-бензил-6-фтор-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енила] N, N-диметилкарбамата (5,4 мг) и [(E,1S)-1-[[1-[(1-бензил-5-фтор-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енила] N, N-диметилкарбамата (5,6 мг) в виде белого твердого вещества. ЖХМС m/z 603,3 (M+1)+.
Соединение 202:1H ЯМР (400 МГц, ДМСО-d6 δ 9,27 (с, 1H), 8,15 (дд, J=1,8, 7,5 Гц, 1H), 7,57 (дд, J=4,8, 8,8 Гц, 1H), 7,50 (дд, J=1,8, 6,6 Гц, 1H), 7,38 (дд, J=2,6, 9,2 Гц, 1H), 7,32-7,21 (м, 3H), 7,16 (д, J=6,6 Гц, 2H), 7,01 (дт, J=2,4, 9,3 Гц, 1H), 6,67-6,57 (м, 1H), 6,41-6,26 (м, 2H), 5,60 (с, 2H), 5,46 (с, 2H), 5,05 (дд, J=4,6, 7,7 Гц, 1H), 2,99-2,85 (м, 6H), 2,84-2,73 (м, 6H), 2,31-2,21 (м, 2H), 1,99-1,87 (м, 2H).
Соединение 203:1H ЯМР (400 МГц, ДМСО-d6) δ 9,28 (с, 1H), 8,17 (дд, J=1,8, 7,5 Гц, 1H), 7,53 (дд, J=1,8, 7,0 Гц, 1H), 7,46 (дд, J=4,6, 9,0 Гц, 1H), 7,39 (дд, J=2,4, 9,9 Гц, 1H), 7,32-7,22 (м, 3H), 7,17 (д, J=7,0 Гц, 2H), 7,05 (дт, J=2,4, 9,3 Гц, 1H), 6,68-6,54 (м, 1H), 6,43-6,25 (м, 2H), 5,62 (с, 2H), 5,48 (с, 2H), 5,05 (дд, J=4,8, 7,5 Гц, 1H), 2,99-2,86 (м, 6H), 2,85-2,74 (м, 6H), 2,34-2,19 (м, 2H), 1,96-1,87 (м, 2H).
Соединение 204:1H ЯМР (400 МГц, ДМСО-d6) δ 9,30 (д, J=2,2 Гц, 1H), 8,17 (ддд, J=1,8, 4,4, 7,5 Гц, 1H), 7,63-7,45 (м, 2H), 7,40 (тд, J=2,7, 9,5 Гц, 1H), 7,34-7,23 (м, 3H), 7,21-7,15 (м, 2H), 7,04 (дтд, J=2,2, 9,4, 16,8 Гц, 1H), 6,68-6,58 (м, 1H), 6,42-6,29 (м, 2H), 5,62 (д, J=9,6 Гц, 2H), 5,48 (д, J=9,2 Гц, 2H), 5,06 (дд, J=4,6, 7,7 Гц, 1H), 2,98-2,91 (м, 6H), 2,82-2,78 (м, 6H), 2,33-2,23 (м, 2H), 1,96-1,86 (м, 2H).
Следующие соединения получают согласно методикам, описанным в Примере 35 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-339:

К раствору этил 5-фтор-1H-индол-2-карбоксилата (5 г, 24,1 ммоль) в ДХМ (20 мл) добавляют Boc2O (7,90 г, 36,2 ммоль), DMAP (2,95 г, 24,1 ммоль) и DIEA (7,80 г, 60,3 ммоль) при 10°C. Смесь перемешивают при 10°C в течение 2 часов. Реакционную смесь концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением желаемого продукта 1-трет-бутил 2-этил 5-фтор-1H-индол-1,2-дикарбоксилата (I-335) (6 г)в виде желтого масла.
К раствору 1-трет-бутил 2-этил 5-фтор-1H-индол-1,2-дикарбоксилата (6 г, 19,5 ммоль) в толуоле (50 мл) добавляют DIBAL-H (1M, 48,8 мл) при -70°C. Смесь перемешивают при -70°C в течение 1 часа. Полученный раствор концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением трет-бутил 5-фтор-2-(гидроксиметил)-1H- индол-1-карбоксилата (I-336) (4 г) в виде желтого масла.
К раствору трет-бутил 5-фтор-2-(гидроксиметил)-1H-индол-1-карбоксилата (4 г, 15,1 ммоль) в ДХМ (50 мл) добавляют DIPEA (5,85 г, 45,2 ммоль) и MsCl (2,07 г, 18,1 ммоль) при 0°C. Смесь перемешивают при 10°C в течение 1,5 часов. Смесь концентрируют в вакууме с получением трет-бутил 5-фтор-2-(((метилсульфонил)окси)метил)-1H-индол-1-карбоксилата (I-337) (5,18 г) в виде желтого масла.
К раствору трет-бутил 5-фтор-2-(((метилсульфонил)окси)метил)-1H-индол-1-карбоксилата (5,18 г, 15,1 ммоль) и 3-нитро-1H-пиридин-2-она (4,23 г, 30,2 ммоль) в CH3CN (50 мл) добавляют DIPEA (5,85 г, 45,3 ммоль). Смесь перемешивают при 30°C в течение 12 часов. Смесь концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением трет-бутил 5-фтор-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H -индол-1-карбоксилата (I-338) (2 г) в виде желтого твердого вещества.
К раствору трет-бутил 5-фтор-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (0,2 г, 516 мкмоль) в MeOH (5 мл) и H2O (1 мл) добавляют Fe (144 мг, 2,58 ммоль) и NH4Cl (221 мг, 4,13 ммоль). Смесь перемешивают при 80°C в течение 5 часов. Полученную суспензию фильтруют, и фильтрат концентрируют в вакууме с получением трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата (I-339) (0,1 г) в виде зеленого масла.
Пример 36:

К раствору (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (108 мг, 420 мкмоль) и трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил) метил)-5-фтор-1H-индол-1-карбоксилата (0,1 г, 280 мкмоль) в ДХМ (3 мл) добавляют HATU (213 мг, 560 мкмоль) и DIEA (108 мг, 839 мкмоль) при 0°C. Смесь перемешивают при 30°C в течение 12 часов. Реакционную смесь концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата (I-340) (0,08 г) в виде белого твердого вещества.
К раствору (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата (0,08 г, 134 мкмоль) в ДХМ (5 мл) добавляют ТФК (1,54 г, 1 мл) при 0°C. Смесь перемешивают при 10°C в течение 1 часа. Смесь концентрируют в вакууме с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил (7-(диметиламино)-1-((1-((5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 209) (57 мг, 85% выход) в виде белого твердого вещества. ЖХМС m/z 498,1 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 11,21 (с, 1H), 9,31 (с, 1H), 8,22 (дд, J=7,2, 1,6 Гц, 1H), 7,78 (д, J=7,6 Гц, 1H), 7,51 (дд, J=6,8, 2,0 Гц, 1H), 7,34 (дд, J=8,8, 4,4 Гц, 1H), 7,23 (дд, J=9,6, 2,4 Гц, 1H), 6,95-6,83 (м, 1H), 6,66-6,56 (м, 1H), 6,42-6,28 (м, 3H), 5,29 (с, 2H), 4,24-4,13 (м, 1H), 3,56 (с, 3H), 2,99 (с, 3H), 2,84 (с, 3H), 2,30-2,17 (м, 2H), 1,98-1,80 (м, 1H), 1,78-1,66 (м, 1H).
Следующие соединения получают согласно методикам, описанным в Примере 36 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-341:

К раствору трет-бутил 5-фтор-2-(гидроксиметил)индол-1-карбоксилата (500 мг, 1,88 ммоль, 1 экв) в ДХМ (5 мл) добавляют DIPEA (608,99 мг, 4,71 ммоль, 820,75 мкл, 2,5 экв) и MsCl (259,09 мг, 2,26 ммоль, 175,06 мкл, 1,20 экв) по каплям при 0°C. Смесь перемешивают при 15°C в течение 0,5 ч. Смесь выливают в насыщенный раствор NH4Cl (20 мл), смесь экстрагируют ДХМ 50 мл (25 мл х 2). Органическую фазу промывают насыщенным солевым раствором 50 мл (25 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением неочищенного трет-бутил 5-фтор-2-(метилсульфонилоксиметил)индол-1-карбоксилата (I-337) (647 мг) в виде оранжевого масла, который применяют на следующей стадии сразу.
Раствор один: К раствору 3-аминопиразин-2-ола (209,35 мг, 1,88 ммоль, 1 экв) в ДМФ (5 мл) добавляют NaH (82,90 мг, 2,07 ммоль, 60% чистота, 1,1 экв) при 0°C, затем реакционную смесь перемешивают при 0°C в течение 15 мин, затем раствор трет-бутил 5-фтор-2-(метилсульфонилоксиметил)индол-1-карбоксилата (647 мг, 1,88 ммоль, 1 экв) в ДМФ (10 мл) добавляют по каплям, реакционную смесь перемешивают при 20°C в течение 12 ч. Реакционную смесь разбавляют водой (50 мл). Смесь экстрагируют этилацетатом (50 мл х 2). Органическую фазу промывают насыщенным солевым раствором (50 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 2-[(3-амино-2-оксо-пиразин-1-ил)метил]-5-фтор-индол-1-карбоксилата (I-341) (350 мг, 52% выход) в виде желтого твердого вещества,1H ЯМР (400 МГц, CDCl3) δ 1,67 (с, 9 H) 5,42 (с, 2H) 5,48 (с, 2H) 6,25 (с, 1H) 6,58 (д, J=4,63 Гц, 1H) 6,83 (д, J=4,63 Гц, 1H) 7,01 (тд, J=9,15, 2,65 Гц, 1H) 7,11 (дд, J=8,60, 2,43 Гц, 1H) 8,03 (дд, J=9,04, 4,63 Гц, 1H).
Следующий анилин получают согласно методикам, описанным для синтеза I-341 с применением подходящих реагентов.
Пример 37:

К смеси (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (66,86 мг, 245,56 мкмоль, 1,1 экв) и трет-бутил 2-[(3-амино -2-оксо-пиразин-1-ил)метил]-5-фтор-индол-1-карбоксилата (80 мг, 223,24 мкмоль, 1 экв) в ДМФ (2 мл) добавляют HATU (101,86 мг, 267,88 мкмоль, 1,2 экв) и DIEA (34,62 мг, 267,88 мкмоль, 46,66 мкл, 1,2 экв) при 0°C. Реакционную смесь перемешивают при 20°C в течение 12 ч. Реакционную смесь выливают в воду (5 мл) и затем экстрагируют EtOAc (10 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (10 мл x 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-пиразин-1-ил]метил]-5-фтор-индол-1-карбоксилата (Соединение 227) (50 мг) в виде коричневого масла,1H ЯМР (400 МГц, ДМСО-d6) δ 1,65 (с, 9 H) 1,87-2,07 (м, 2H) 2,34 (кв, J=7,21 Гц, 2H) 2,79-2,89 (м, 6H) 2,93-3,06 (м, 5Н) 5,16-5,26 (м, 1H) 5,45 (с, 2H) 6,24 (с, 1H) 6,43 (д, J=15,04 Гц, 1H) 6,64-6,74 (м, 1H) 7,11-7,22 (м, 2H) 7,34 (дд, J=8,93, 2,57 Гц, 1H) 7,43 (д, J=4,40 Гц, 1H) 8,06 (дд, J=9,17, 4,65 Гц, 1H) 9,98 (с, 1H).
К раствору трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-пиразин-1-ил]метил]-5-фтор-индол-1-карбоксилата (50 мг, 81,61 мкмоль, 1 экв) в ДХМ (1 мл) добавляют ТФК (50 мг, 438,51 мкмоль, 32,47 мкл, 5,37 экв) при 20°C. Реакционную смесь перемешивают при 20°C в течение 0,5 ч. Реакционную смесь концентрируют в вакууме с получением масла, которое очищают преп-ТСХ с получением [(E,1S)-6-(диметиламино)-1-[[4-[(5-фтор-1H-индол-2-ил)метил]-3-оксо-пиразин-2-ил]карбамоил]-6-оксо-гекс-4-енил]N, N-диметилкарбамата (Соединение 228) (13,6 мг, 32% выход) в виде коричневой камеди,1H ЯМР (400 МГц, ДМСО-d6) δ 1,85-2,05 (м, 2H) 2,34 (с, 2H) 2,68 (с, 1H) 2,80-2,90 (м, 6H) 2,91-3,04 (м, 6H) 5,19 (д, J=4,89 Гц, 1H) 5,26 (с, 2H) 6,34-6,50 (м, 1H) 6,37-6,41 (м, 1H) 6,44 (с, 1H) 6,62-6,73 (м, 1H) 6,92 (тд, J=9,20, 2,51 Гц, 1H) 7,11 (д, J=4,52 Гц, 1H) 7,25 (дд, J=9,96, 2,38 Гц, 1H) 7,34 (дд, J=8,86, 4,59 Гц, 1H) 7,42 (д, J=4,52 Гц, 1H) 9,93 (с, 1H) 11,25 (с, 1H).
Следующее соединение получают согласно методикам, описанным для синтеза Примера 37 с применением подходящих реагентов.
Синтез I-350:
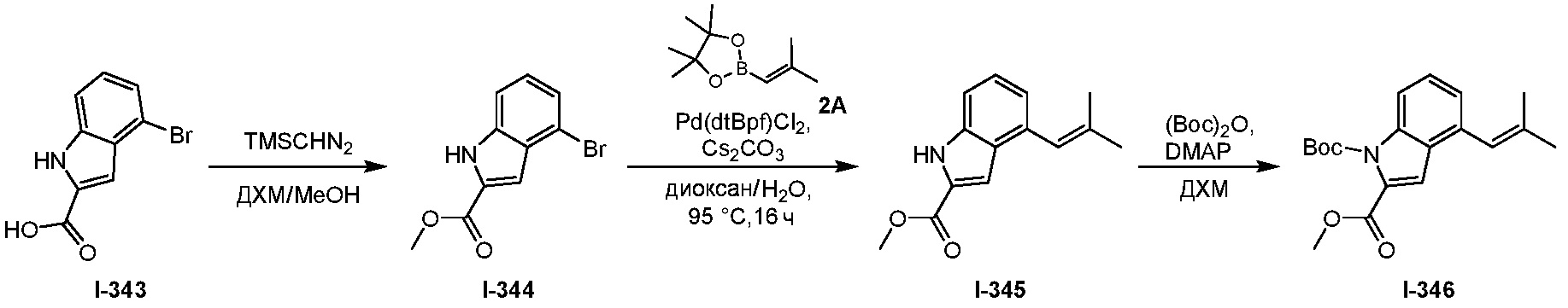

К смеси 4-бром-1H-индол-2-карбоновой кислоты (5 г, 20,8 ммоль) в MeOH (20 мл) и ДХМ (60 мл) добавляют TMSCHN2 (2 M, 20,8 мл) при 0°C. Смесь перемешивают при 20°C в течение 20 мин. Смесь концентрируют в вакууме с получением метил 4-бром-1H-индол-2-карбоксилата (I-344) (5,3 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 9,10 (с, 1H), 7,41-7,32 (м, 2H), 7,27-7,30 (м, 1H), 7,22-7,15 (м, 1H), 3,98 (с, 3H).
К смеси метил 4-бром-1H-индол-2-карбоксилата (5,3 г, 20,9 ммоль) и 4,4,5,5-тетраметил-2-(2-метилпроп-1-ен-1-ил)-1,3,2-диоксаборолана (5,7 г, 31,3 ммоль) в диоксане (100 мл) и H2O (10 мл) добавляют [1,1′-бис(ди-трет-бутилфосфино)ферроцен]дихлорпалладий(II) (2,04 г, 3,13 ммоль) и Cs2CO3 (13,6 г, 41,7 ммоль) под N2 атмосферой. Смесь перемешивают при 95°C в течение 16 ч. Смесь концентрируют в вакууме и очищают хроматографией на силикагеле с получением метил 4-(2-метилпроп-1-ен-1-ил)-1H-индол-2-карбоксилата (I-345) (3,8 г) в виде коричневого масла.
К смеси метил 4-(2-метилпроп-1-ен-1-ил)-1H-индол-2-карбоксилата (3,3 г, 14,4 ммоль) в ДХМ (10 мл) добавляют Boc2O (4,71 г, 21,6 ммоль, 4,96 мл), TEA (2,91 г, 28,8 ммоль, 3,99 мл) и DMAP (176 мг, 1,44 ммоль). Смесь перемешивают при 20°C в течение 1 ч. Полученный раствор концентрируют в вакууме и очищают хроматографией на силикагеле с получением 1-трет-бутил 2-метил 4-(2-метилпроп-1-ен-1-ил)-1H-индол-1,2-дикарбоксилата (I-346) (4,4 г) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,97-7,91 (м, 1H), 7,41-7,35 (м, 1H), 7,16-7,11 (м, 2H), 6,47 (с, 1H), 3,92 (с, 3H), 1,99-1,95 (м, 3H), 1,83-1,78 (м, 3H), 1,63 (с, 9H).
К раствору 1-трет-бутил 2-метил 4-(2-метилпроп-1-ен-1-ил)-1H-индол-1,2-дикарбоксилата (3,9 г, 11,8 ммоль) в толуоле (60 мл) добавляют DIBAL-H (1M, 29,6 мл) при -78°C. Смесь перемешивают при -78°C в течение 1 ч. Реакционную смесь гасят насыщенным раствором тартрат калия-натрия (60 мл). Полученный раствор экстрагируют этилацетатом (60 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением трет-бутил 2-(гидроксиметил)-4-(2-метилпроп-1-ен-1-ил)-1H-индол-1-карбоксилата (1,3 г, 4,31 ммоль, 36,4% выход) в виде желтого масла и трет-бутил 2-(гидроксиметил)-4-(2-метилпроп-1-ен-1-ил)-1H-индол-1-карбоксилата (I-347) (1,6 г) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,89-7,83 (м, 1H), 7,29-7,22 (м, 1H), 7,13-7,07 (м, 1H), 6,6 (с, 1H), 6,46 (с, 1H), 4,84-4,79 (м, 2H), 3,74 (т, J=7,4 Гц, 1H), 1,99-1,95 (м, 3H), 1,82-1,78 (м, 3H), 1,73 (с, 9H).
К смеси трет-бутил 2-(гидроксиметил)-4-(2-метилпроп-1-ен-1-ил)-1H- индол-1-карбоксилата (2,1 г, 6,97 ммоль) и Et3N (2,12 г, 21,0 ммоль, 2,9 мл) в ДХМ (40 мл) добавляют MsCl (1,6 г, 13,9 ммоль, 1,08 мл) при 0°C под N2 атмосферой. Смесь перемешивают при 20°C в течение 2 ч. Полученный раствор разбавляют водой (40 мл) и экстрагируют ДХМ (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (80 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением трет-бутил 4-(2-метилпроп-1-ен-1-ил)-2-(((метилсульфонил)окси)метил)-1H-индол-1-карбоксилата (I-348) (2,6 г) в виде желтого масла.
К смеси трет-бутил 4-(2-метилпроп-1-ен-1-ил)-2-(((метилсульфонил)окси)метил)-1H-индол-1-карбоксилата (2,6 г, 6,85 ммоль) и 3-нитропиридин-2(1H)-она (960 мг, 6,85 ммоль) в CH3CN (50 мл) добавляют Et3N (1,39 г, 13,7 ммоль, 1,90 мл). Смесь перемешивают при 20°C в течение 12 ч. Полученный раствор разбавляют водой (30 мл) и экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (80 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением трет-бутил 4-(2-метилпроп-1-ен-1-ил)-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (I-349) (1,4 г) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 8,37 (дд, J=7,8, 2,0 Гц, 1H), 7,97-7,91 (м, 1H), 7,78 (дд, J=6,8, 2,0 Гц, 1H), 7,31 (т, J=8,0 Гц, 1H), 7,15-7,11 (м, 1H), 6,69 (с, 1H), 6,44 (с, 1H), 6,28 (дд, J=7,6, 6,8 Гц, 1H), 5,60 (с, 2H), 1,97 (д, J=1,0 Гц, 3H), 1,80 (д, J=1,0 Гц, 3H), 1,64 (с, 9H).
К раствору трет-бутил 4-(2-метилпроп-1-ен-1-ил)-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (300 мг, 0,708 ммоль) в MeOH (15 мл) добавляют Pd/C (30 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 три раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 2 ч. Смесь фильтруют, фильтрат концентрируют в вакууме с получением трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-индол-1-карбоксилата (I-350) (260 мг, 0,657 ммоль, 92,8% выход) в виде белого твердого вещества. ЖХМС m/z 396,1 (M+1)+.
Следующие промежуточные соединения получают согласно методикам, описанным для синтеза I-350 с применением подходящего реагента.
Пример 38:


К раствору трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-индол-1-карбоксилата (130 мг, 0,329 ммоль) и (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (127 мг, 0,493 ммоль) в ДМФ (3 мл) добавляют HATU (225 мг, 0,592 ммоль) и DIEA (170 мг, 1,31 ммоль, 0,23 мл) при 0°C. Смесь перемешивают при 20°C в течение 12 ч. Воду (30 мл) добавляют к смеси. Полученный раствор экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ЖХВД с получением (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-индол-1-карбоксилата (90 мг, 39% выход) в виде серого масла и (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-индол-1-карбоксилата (Соединение 230) (27,4 мг, 13% выход) в виде белого твердого вещества. ЖХМС m/z 636,3 (M+1)+.
К смеси (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-4-изобутил-1H-индол-1-карбоксилата (90 мг, 0,142 ммоль) в ДХМ (4 мл) добавляют ТФК (1,54 г, 13,5 ммоль, 1 мл) при 0°C. Смесь перемешивают при 20°C в течение 1 ч. Смесь концентрируют в вакууме и очищают преп-ЖХВД с получением (S, E)-метил (7-(диметиламино)-1-((1-((4-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 231) (31,9 мг, 40% выход) в виде желтого твердого вещества. ЖХМС m/z 536,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 11,0 (с, 1H), 9,30 (с, 1H), 8,21 (дд, J=7,4, 1,6 Гц, 1H), 7,81-7,69 (м, 1H), 7,49 (дд, J=6,8, 1,6 Гц, 1H), 7,21-7,15 (м, 1H), 6,98 (т, J=7,6 Гц, 1H), 6,79-6,70 (м, 1H), 6,67-6,56 (м, 1H), 6,42-6,35 (м, 2H), 6,31 (т, 7,2 Гц, 1H), 5,29 (с, 2H), 4,23-4,14 (м, 1H), 3,57 (с, 3H), 2,99 (с, 3H), 2,84 (с, 3H), 2,66-2,58 (м, 2H), 2,28-2,19 (м, 2H), 2,02-1,85 (м, 2H), 1,80-1,67 (м, 1H), 0,87 (д, J=6,6 Гц, 6H).
Следующие соединения получают согласно методикам, описанным в Примере 38 с применением подходящих промежуточных соединений.
Пример 39:

К перемешиваемому раствору диэтил (2-(диметиламино)-2-оксоэтил)фосфоната (2,18 г, 9,77 ммоль) в ТГФ (50 мл) добавляют NaH (391 мг, 9,77 ммоль) при -5°C. Полученную суспензию перемешивают при 20°C в течение 0,5 ч. Раствор трет-бутил(2S)-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-5-оксо-пентаноата (5 г, 8,15 ммоль) в ТГФ (20 мл) затем добавляют по каплям при -5°C в течение более 0,5 ч. Реакционную смесь (объединенную с другими четырьмя партиями) выливают в насыщенным NH4Cl раствора (200 мл) и экстрагируют EtOAc (200 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (500 мл) и сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением трет-бутил(E,2S)-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-7-(диметиламино)-7-оксо-гепт-5-еноата (I-352) (6,3 г, 23% выход) в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 7,69-7,64 (м, 4H), 7,45-7,36 (м, 6H), 6,88-6,79 (м, 1H), 6,24 (д, J=14,8 Гц, 1H), 4,86-4,78 (м, 1H), 4,39-4,21 (м, 2H), 3,88 (т, J=5,2 Гц, 2H), 3,49 (с, 3H), 3,02 (с, 3H), 2,99 (с, 3H), 2,30-2,19 (м, 3H), 2,14-1,97 (м, 1H), 1,49 (с, 9H), 1,43 (с, 9H), 1,05 (с, 9H).
К раствору трет-бутил (E,2S)-2-[трет-бутоксикарбонил-[2-[трет-бутил(дифенил)силил]оксиэтоксикарбонил]амино]-7-(диметиламино)-7-оксо-гепт-5-еноата (5 г, 7,32 ммоль) в ДХМ (10 мл) добавляют ТФК (20 мл) при 0°C. Смесь перемешивают при 20°C в течение 4 ч. Реакционную смесь концентрируют при пониженном давлении при 20°C с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-7-(диметиламино)-2-(((2- гидроксиэтокси)карбонил)амино)-7-оксогепт-5-еновой кислоты (I-353) (1,36 г, 62% выход) в виде бесцветного масла и (S, E)-10-(5-(диметиламино)-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундекан-11-овой кислоты (I-354) (150 мг) в виде белого твердого вещества. ЖХМС m/z 527,1 (M+1)+. Промежуточное соединение I-353:1H ЯМР (400 МГц, ДМСО-d6) δ 7,50 (д, J=8,0 Гц, 1H), 6,65-6,53 (м, 1H), 6,40 (д, J=15,2 Гц, 1H), 4,02-3,85 (м, 3H), 3,54 (т, J=4,8 Гц, 2H), 3,01 (с, 3H), 2,84 (с, 3H), 2,29-2,15 (м, 2H), 1,87-1,64 (м, 2H). Промежуточное соединение I-354:1H ЯМР (400 МГц, ДМСО-d6) δ 7,65-7,61 (м, 4H), 7,48-7,42 (м, 6H), 6,65-6,54 (м, 1H), 6,35 (д, J=15,2 Гц, 1H), 4,21-4,11 (м, 1H), 4,08-4,00 (м, 1H), 3,93-3,86 (м, 1H), 3,78 (т, J=4,8 Гц, 2H), 2,97 (с, 3H), 2,84 (с, 3H), 2,26-2,17 (м, 2H), 1,89-1,78 (м, 1H), 1,78-1,66 (м, 1H), 0,99 (с, 9H).
К раствору трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата (80 мг, 202 мкмоль) и (S, E)-10-(5-(диметиламино)-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундекан-11-овой кислоты (160 мг, 303 мкмоль) в ДМФ (1 мл) добавляют HATU (162 мг, 425 мкмоль) и DIPEA (78 мг, 607 мкмоль) при 0°C. Смесь перемешивают при 20°C в течение 12 ч. Смесь (вместе с другой 20 мг партией) разбавляют EtOAc (40 мл) и промывают насыщенным солевым раствором (15 мл х 3). Органическую фазу сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-трет-бутил 2-((3-(10-(5-(диметиламино)-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундеканамидо)-2-оксопиридин-1 (2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата (I-355) (90 мг, 49% выход) в виде желтого твердого вещества. ЖХМС m/z 904,5 (M+1)+.
К раствору (S, E)-трет-бутил 2-((3-(10-(5-(диметиламино)-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундеканамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата (70 мг, 77 мкмоль) в ДХМ (0,5 мл) добавляют HCl/EtOAc (4 M, 0,7 мл). Смесь перемешивают при 20°C в течение 13 ч. Смесь концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-2-(((7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамоил)окси)этилацетата (Соединение 250) (19,4 мг, 40% выход) в виде белого твердого вещества. ЖХМС m/z 608,3 (M+1)+.
К раствору (S, E)-трет-бутил 2-((3-(10-(5-(диметиламино)-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундеканамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата (50 мг, 51 мкмоль) в ТГФ (1 мл) добавляют Et3N·3HF (49 мг, 305 мкмоль) и Et3N (15 мг, 153 мкмоль). Смесь перемешивают при 25°C в течение 12 ч. Смесь концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-(((2-гидроксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата (Соединение 251) (10 мг, 29% выход) в виде белого твердого вещества. ЖХМС m/z 666,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ9,32 (с, 1H), 8,31 (дд, J=7,2, 1,6 Гц, 1H), 7,78 (д, J=7,6 Гц, 1H), 7,48 (дд, J=6,8, 1,6 Гц, 1H), 7,36 (д, J=6,8 Гц, 1H), 7,13-7,10 (м, 1H), 7,04-7,03 (м, 1H), 6,65-6,58 (м, 1H), 6,41-6,37 (м, 2H), 5,98 (с, 1H), 5,38 (с, 2H), 4,19-4,03 (м, 1H), 4,03-3,92 (м, 2H), 3,55-3,46 (м, 3H), 3,00 (с, 3H), 2,84-2,81 (м, 5H), 2,30-2,19 (м, 2H), 1,90-1,67 (м, 3H), 1,62 (с, 9H), 0,74 (с, 3H), 0,72 (с, 3H).
К раствору (S, E)-трет-бутил 2-((3-(7-(диметиламино)-2-(((2-гидроксиэтокси)карбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-изобутил-1H-индол-1-карбоксилата (85,9 мг, 129 мкмоль) в ДХМ (5 мл) добавляют ТФК (1 мл). Смесь перемешивают при 15°C в течение 1 ч. Смесь концентрируют с получением (S, E)-2-(((7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамоил)окси)этила 2,2,2-трифторацетата (I-356) (90 мг) в виде желтого масла.
К раствору (S, E)-2-(((7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил) метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамоил)окси)этила 2,2,2-трифторацетата (90 мг, 136 мкмоль) в CH3CN (3 мл) добавляют NaHCO3 (57 мг, 680 мкмоль). Смесь перемешивают при 20°C в течение 12 ч. Смесь отфильтровывают и фильтрат концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-2-гидроксиэтил (7-(диметиламино)-1-((1-((7-изобутил-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 252) (22,3 мг, 29% выход) в виде белого твердого вещества. ЖХМС m/z 566,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ11,02 (с, 1H), 9,32 (с, 1H), 8,26-8,22 (м, 1H), 7,79 (д, J=7,6 Гц, 1H), 7,49-7,46 (м, 1H), 7,28 (д, J=7,6 Гц, 1H), 6,91-6,83 (м, 2H), 6,65-6,58 (м, 1H), 6,40-6,30 (м, 2H), 6,21 (с, 1H), 5,30 (с, 2H), 4,77 (ш, 1H), 4,22-4,16 (м, 1H), 4,04-3,95 (м, 2H), 3,56 (с, 2H), 2,99 (с, 3H), 2,83 (с, 3H), 2,68-2,67 (м, 2H), 2,30-2,21 (м, 1H), 2,01-1,71 (м, 3H), 0,91 (с, 3H), 0,89 (с, 3H).
Следующие соединения получают согласно методикам, описанным в Примере 39 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-365:

К смеси этил 7-бром-1H-индол-2-карбоксилата (7 г, 26,1 ммоль) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (9,95 г, 39,2 ммоль) в диоксане (70 мл) добавляют KOAc (5,12 г, 52,2 ммоль) и Pd(dppf)Cl2 (1,91 г, 2,61 ммоль). Смесь перемешивают при 90°C в течение 2H под N2 атмосферой. Смесь разбавляют водой (100 мл) и экстрагируют этилацетатом (100 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (300 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением этил 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол-2-карбоксилата (I-358) (10,4 г) в виде желтого масла.
К смеси 7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол-2-карбоксилата (11 г, 34,9 ммоль) в ТГФ (100 мл) добавляют H2O2 (39,6 г, 349 ммоль, 33,5 мл, 30% чистота) при 0°C. Смесь перемешивают при 15°C в течение 12 ч. Реакционную смесь гасят насыщенным раствором Na2SO3 (200 мл) и экстрагируют этилацетатом (200 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (300 мл), сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением этил 7-гидрокси-1H-индол-2-карбоксилата (I-359) (6,5 г) в виде желтого твердого вещества.
К смеси этил 7-гидрокси-1H-индол-2-карбоксилата (5,5 г, 26,8 ммоль) и 1-(бромметил)-2,4-дифтор-бензола (3,33 г, 16,1 ммоль) в ДМФ (40 мл) добавляют Cs2CO3 (17,5 г, 53,6 ммоль) и KI (4,45 г, 26,8 ммоль). Смесь перемешивают при 20°C в течение 1 ч. Полученный раствор разбавляют водой (30 мл) и экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением этил 7-((2,4-дифторбензил)окси)-1H-индол-2-карбоксилата (I-360) (3 г) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 9,04 (с, 1H), 7,56-7,47 (м, 1H), 7,36-7,29 (м, 1H), 7,24-7,19 (м, 1H), 7,07 (т, J=8,0 Гц, 1H), 6,99-6,86 (м, 2H), 6,85-6,77 (м, 1H), 5,24 (с, 2H), 4,46-4,37 (м, 2H), 1,47-1,38 (м, 3H).
К смеси этил 7-((2,4-дифторбензил)окси)-1H-индол-2-карбоксилата (1,9 г, 5,73 ммоль) в ДХМ (20 мл) добавляют Boc2O (1,88 г, 8,6 ммоль, 1,98 мл), TEA (1,16 г, 11,5 ммоль, 1,59 мл) и DMAP (70,1 мг, 0,573 ммоль). Смесь перемешивают при 20°C в течение 1 ч. Полученный раствор концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением 1-трет-бутил 2-этил 7-((2,4-дифторбензил)окси)-1H-индол-1,2-дикарбоксилата (I-361) (1,7 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,58-7,49 (м, 1H), 7,27-7,24 (м, 1H), 7,20 (с, 1H), 7,07 (т, J=7,6 Гц, 1H), 6,92-6,79 (м, 3H), 5,27 (с, 2H), 4,43-4,34 (м, 2H), 1,50 (с, 9H), 1,40 (т, J=7,2 Гц, 3H).
К смеси 1-трет-бутил 2-этил 7-((2,4-дифторбензил)окси)-1H-индол-1,2-дикарбоксилата (1,7 г, 3,94 ммоль) в толуоле (15 мл) добавляют DIBAL-H (1 M, 9,85 мл) при -78°C. Смесь перемешивают при -20°C в течение 1H под N2 атмосферой. Смесь гасят раствором тетрагидрата тартрата натрия-калия (40 мл) и перемешивают в течение 1 ч. Полученный раствор экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением трет-бутил 7-((2,4-дифторбензил)окси)-2-(гидроксиметил)-1H-индол-1-карбоксилата (I-362) (950 мг) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,54-7,44 (м, 1H), 7,20-7,12 (м, 2H), 6,95-6,81 (м, 3H), 6,52 (с, 1H), 5,22 (с, 2H), 4,72 (с, 2H), 3,34 (с, 1H), 1,45 (с, 9H).
К смеси трет-бутил 7-((2,4-дифторбензил)окси)-2-(гидроксиметил)-1H- индол-1-карбоксилата (950 мг, 2,44 ммоль) и DIEA (631 мг, 4,88 ммоль, 0,852 мл) в ДХМ (15 мл) добавляют MsCl (419 мг, 3,66 ммоль, 0,283 мл) при 0°C. Смесь перемешивают при 20°C в течение 1 ч. Полученный раствор гасят водой (30 мл) и экстрагируют ДХМ (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением трет-бутил 7-((2,4-дифторбензил)окси)-2-(((метилсульфонил)окси)метил)-1H-индол-1-карбоксилата (I-363) (1,14 г) в виде красного масла.
К смеси трет-бутил 7-((2,4-дифторбензил)окси)-2-(((метилсульфонил)окси)метил)-1H-индол-1-карбоксилата (1,14 г, 2,44 ммоль) и 3-нитропиридин-2(1H)-она (512 мг, 3,66 ммоль) в CH3CN (10 мл) добавляют DIEA (631 мг, 4,88 ммоль, 0,852 мл). Смесь перемешивают при 30°C в течение 12 ч. Смесь разбавляют водой (30 мл) и экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением трет-бутил 7-((2,4-дифторбензил) окси)-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (I-364) (750 мг) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 8,35 (дд, J=7,6, 2,00 Гц, 1H), 7,81 (дд, J=6,8, 2,4 Гц, 1H), 7,57-7,46 (м, 1H), 7,24-7,17 (м, 2H), 6,95-6,80 (м, 3H), 6,74 (с, 1H), 6,31-6,24 (м, 1H), 5,42 (с, 2H), 5,22 (с, 2H), 1,36 (с, 9H).
К смеси трет-бутил 7-((2,4-дифторбензил)окси)-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (750 мг, 1,47 ммоль) в EtOAc (5 мл) добавляют Pd/C (300 мг, 10% чистота). Смесь перемешивают при 15°C в течение 30 мин под H2 (15 ф./кв.д.) атмосферой. Смесь фильтруют, фильтрат концентрируют в вакууме с получением трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-1H-индол-1-карбоксилата (I-365) (600 мг) в виде желтого твердого вещества. ЖХМС m/z 482,2 (M+1)+.
Следующие промежуточные получают согласно методикам, описанным для синтеза I-365 с применением подходящих реагентов.
Пример 40:


К смеси трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-1H-индол-1-карбоксилата (600 мг, 1,25 ммоль) и (S, E)-2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-еновой кислоты (751 мг, 2,5 ммоль) в ДМФ (5 мл) добавляют HATU (1,14 г, 3 ммоль) и DIEA (646 мг, 5 ммоль, 0,873 мл) при 0°C. Смесь перемешивают при 15°C в течение 12 ч. Полученный раствор разбавляют водой (30 мл) и экстрагируют этилацетатом (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением (S, E)-трет-бутил 2-((3-(2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-1H-индол-1-карбоксилата (I-367) (600 мг) в виде желтого твердого вещества. ЖХМС m/z 764,4 (M+1)+.
К смеси (S, E)-трет-бутил 2-((3-(2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-1H-индол-1-карбоксилата (200 мг, 0,262 ммоль) в ДХМ (3 мл) добавляют ТФК (1,54 г, 13,5 ммоль, 1 мл) при 0°C. Смесь перемешивают при 15°C в течение 1,5 ч. Полученный раствор концентрируют в вакууме с получением (S, E)-6-амино-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (I-368) (177 мг, неочищенный, ТФК) в виде зеленого масла и применяют сразу на следующей стадии без дальнейшей очистки. ЖХМС m/z 564,3 (M+1)+.
К смеси ((S, E)-6-амино-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (177 мг, 0,261 ммоль, ТФК) и 4,4-дифторциклогексанкарбоновой кислоты (85,8 мг, 0,522 ммоль) в ДМФ (2 мл) добавляют HATU (238 мг, 0,627 ммоль) и DIEA (203 мг, 1,57 ммоль,0,274 мл) при 0°C. Смесь перемешивают при 15°C в течение 12 ч. Реакционную смесь очищают преп-ЖХВД с получением (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-6-(4,4-дифторциклогексанкарбоксамидо)-N1,N1-диметилгепт-2-ендиамида (Соединение 255) (84 мг, 45% выход) в виде белого твердого вещества. ЖХМС m/z 710,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 11,2 (с, 1H), 9,25 (с, 1H), 8,43 (д, J=7,6 Гц, 1H), 8,19 (дд, J=7,2, 1,8 Гц, 1H), 7,81-7,71 (м, 1H), 7,48 (дд, J=7,2, 2,0 Гц, 1H), 7,39-7,29 (м, 1H), 7,21-7,13 (м, 1H), 7,07 (д, J=7,6 Гц, 1H), 6,90 (т, J=8,0 Гц, 1H), 6,78 (д, J=7,6 Гц, 1H), 6,68-6,56 (м, 1H), 6,37 (д, J=15,1 Гц, 1H), 6,29 (т, J=7,2 Гц, 1H), 6,23 (д, J=2,0 Гц, 1H), 5,30-5,19 (м, 4H), 4,45-4,30 (м, 1H), 2,99 (с, 3H), 2,84 (с, 3H), 2,46-2,36 (м, 1H), 2,30-2,16 (м, 2H), 2,12-2,00 (м, 2H), 1,98-1,70 (м, 6H), 1,70-1,56 (м, 2H).
Следующие соединения получают согласно методикам, описанным в Примере 40 с применением подходящих промежуточных соединений
Синтез I-380:


К раствору 2-бром-4-фтор-анилина (10,0 г, 52,6 ммоль) в HCl (30 мл) добавляют раствор NaNO2 (4,36 г, 63,2 ммоль, 3,43 мл) в H2O (10 мл) при -5°C. Смесь перемешивают при -5°C в течение 1 ч. Затем раствор SnCl2·2H2O (14,8 г, 65,8 ммоль, 5,48 мл) в HCl (30 мл) добавляют по каплям при -5°C. Смесь перемешивают при -5°C в течение 2 ч. Полученную суспензию фильтруют и твердый остаток промывают ДХМ (200 мл х 3) и сушат при пониженном давлении с получением (2-бром-4-фторфенил)гидразин (I-370) (12,0 г, 92% выход, HCl соль) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 10,44 (с, 3H), 7,86 (с, 1H), 7,56 (дд, J=8,4, 2,8 Гц, 1H), 7,33-7,25 (м, 1H), 7,22-7,14 (м, 1H).
К раствору (2-бром-4-фторфенил)гидразина (32,0 г, 133 ммоль, HCl соль) и этил 2-оксопропаноата (15,4 г, 133 ммоль, 14,7 мл) в толуоле (500 мл) добавляют p-TsOH (228 мг, 1,33 ммоль). Смесь нагревают до кипения с обратным холодильником в течение 2H и удаляют воду ловушкой Дина-Старка. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением (E)-этил 2-(2-(2-бром-4-фторфенил)гидразоно)пропаноата (I-371) (23,0 г) в виде желтого твердого вещества. ЖХМС m/z 302,9 (M+1)+.
К раствору (E)-этил 2-(2-(2-бром-4-фторфенил)гидразоно)пропаноата (23,0 г, 75,9 ммоль) в толуоле (120 мл) добавляют p-TsOH (14,0 г, 81,3 ммоль). Смесь перемешивают при 110°C в течение 16 ч и удаляют воду ловушкой Дина-Старка. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением этил 7-бром-5-фтор-1H-индол-2-карбоксилата (I-372) (13,0 г, 59% выход) в виде желтого твердого вещества. ЖХМС m/z 285,9 (M+1)+.
К раствору этил 7-бром-5-фтор-1H-индол-2-карбоксилата (13,0 г, 45,4 ммоль) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (17,3 г, 68,2 ммоль) в диоксане (100 мл) добавляют Pd(dppf)Cl2 (4,99 г, 6,82 ммоль) и KOAc (8,92 г, 90,9 ммоль). Смесь перемешивают при 90°C в течение 2 часов. Смесь разбавляют водой (100 мл) и экстрагируют этилацетатом (200 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (300 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением этил 5-фтор-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол-2-карбоксилата (I-373) (16,8 г) в виде желтого твердого вещества. ЖХМС m/z 334,0 (M+1)+.
К раствору этил 5-фтор-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H- индол-2-карбоксилата (16,8 г, 50,4 ммоль) в ТГФ (20 мл) добавляют H2O2 (57,2 г, 504 ммоль, 48,5 мл, 30% чистота) при 0°C. Смесь перемешивают при 20°C в течение 16 ч. Реакционный раствор гасят насыщенным раствором Na2SO3 (200 мл) и экстрагируют этилацетатом (200 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (300 мл), сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением этил 5-фтор-7-гидрокси-1H-индол-2-карбоксилата (I-374) (10 г, 83% выход) в виде белого твердого вещества. ЖХМС m/z 224,0 (M+1)+.
К раствору этил 5-фтор-7-гидрокси-1H-индол-2-карбоксилата (5,00 г, 22,4 ммоль) и 1-(бромметил)-2,4-дифторбензола (3,25 г, 15,7 ммоль) в ДМФ (50 мл) добавляют KI (372 мг, 2,24 ммоль) и Cs2CO3 (14,6 г, 44,8 ммоль). Смесь перемешивают при 20°C в течение 2 часов. Реакционную смесь (с другой партией) фильтруют и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением этил 7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-карбоксилата (I-375) (3,00 г) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 9,02 (с, 1H), 7,55-7,44 (м, 1H), 7,15 (д, J=2,4 Гц, 1H), 7,01-6,86 (м, 3H), 6,64 (дд, J=10,8, 2,0 Гц, 1H), 5,21 (с, 2H), 4,45-4,35 (м, 2H), 1,41 (т, J=7,2 Гц, 3H).
К раствору этил 7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-карбоксилата (3,00 г, 8,59 ммоль) в ДХМ (20 мл) добавляют Boc2O (2,81 г, 12,9 ммоль, 2,96 мл), DMAP (105 мг, 859 мкмоль) и TEA (1,74 г, 17,2 ммоль, 2,38 мл). Смесь перемешивают при 20°C в течение 16 часов. Смесь разбавляют H2O (100 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 1-трет-бутил 2-этил 7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-1,2-дикарбоксилата (I-376) (3,30 г, 80% выход) в виде желтого твердого вещества. ЖХМС m/z 472,0 (M+23)+.
К раствору 1-трет-бутил 2-этил 7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-1,2-дикарбоксилата (2,00 г, 4,45 ммоль) в толуоле (20 мл) добавляют DIBAL-H (1M, 13,4 мл) при -40°C. Смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь гасят насыщенным раствором NH4Cl раствора (50 мл) при 0°C и разбавляют насыщенным раствором тартрата калия-натрия (100 мл). Смесь перемешивают в течение 2 ч. Полученный раствор экстрагируют EtOAc (100 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (200 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 7-((2,4-дифторбензил)окси)-5-фтор-2-(гидроксиметил)-1H-индол-1-карбоксилата (I-377) (1,00 г, 48% выход) в виде белого твердого вещества. ЖХМС m/z 430,0 (M+1)+.
К раствору трет-бутил 7-((2,4-дифторбензил)окси)-5-фтор-2-(гидроксиметил)-1H-индол-1-карбоксилата (1,30 г, 3,19 ммоль) в ДХМ (20 мл) добавляют MsCl (5,0 г, 43,6 ммоль, 3,38 мл) и DIPEA (825 мг, 6,38 ммоль, 1,11 мл) при 0°C. Смесь перемешивают при 20°C в течение 1 ч. Реакционную смесь разбавляют этилацетатом (100 мл) и промывают насыщенным солевым раствором (100 мл). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением трет-бутил 7-((2,4-дифторбензил)окси)-5-фтор-2-(((метилсульфонил)окси)метил)-1H-индол-1-карбоксилата (I-378) (1,60 г) в виде коричневого масла.
К раствору трет-бутил 7-((2,4-дифторбензил)окси)-5-фтор-2-(((метилсульфонил) окси)метил)-1H-индол-1-карбоксилата (1,60 г, 3,30 ммоль) и 3-нитропиридин-2(1H)-она (693 мг, 4,94 ммоль) в MeCN (20 мл) добавляют DIPEA (1,28 г, 9,89 ммоль, 1,73 мл). Смесь перемешивают при 30°C в течение 16 часов. Реакционную смесь (с другой партией) фильтруют и фильтровальную лепешку промывают этилацетатом (20 мл), сушат под вакуумом с получением трет-бутил 7-((2,4-дифторбензил)окси)-5-фтор-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (I-379) (750 мг) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,36 (дд, J=7,6, 2,0 Гц, 1H), 7,84 (дд, J=6,8, 2,0 Гц, 1H), 7,54-7,45 (м, 1H), 6,94-6,83 (м, 3H), 6,73-6,65 (м, 2H), 6,30 (дд, J=7,6, 6,8 Гц, 1H), 5,41 (с, 2H), 5,18 (с, 2H), 1,35 (с, 9H).
К раствору трет-бутил 7-((2,4-дифторбензил)окси)-5-фтор-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (650 мг, 1,23 ммоль) в EtOAc (5 мл) добавляют Pd/C (200 мг, 10% чистота). Смесь перемешивают при 20°C в течение 0,5 часа под H2 (15 ф./кв.д.) атмосферой. Реакционную смесь (с другой партией) фильтруют, и фильтрат концентрируют при пониженном давлении с получением трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-1-карбоксилата (I-380) (700 мг) в виде коричневого твердого вещества.
Следующие промежуточные соединения получают согласно методикам, описанным для синтез I-380 с применением подходящих реагентов.
Синтез промежуточного соединения I-388:

К смеси этил 7-бром-5-фтор-1H-индол-2-карбоксилата (700 мг, 2,03 ммоль) и 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (555 мг, 3,05 ммоль) в диоксане (15 мл) и H2O (1 мл) добавляют Cs2CO3 (1,32 г, 4,06 ммоль) и дитрет-бутил(циклопентил)фосфан;дихлорпалладий;железо (132 мг, 203 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь нагревают до 90°C и перемешивают в течение 18 часов. Смесь охлаждают до 25°C. Реакционную смесь выливают в воду (30 мл). Полученный раствор экстрагируют этилацетатом (40 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением этил 5-фтор-7-(2-метилпроп-1-енил)-1H-индол-2-карбоксилата (I-382) (0,45 г, 85% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ8,76 (с, 1H), 7,21 (д, J=8,0 Гц, 1H), 6,96 (д, J=8,0 Гц, 1H), 6,37 (с, 1H), 4,46-4,41 (м, 2H), 2,03 (с, 3H), 1,59 (с, 3H), 1,44-1,42 (м, 3H).
К раствору этил 5-фтор-7-(2-метилпроп-1-енил)-1H-индол-2-карбоксилата (0,42 г, 1,61 ммоль) в MeOH (10 мл) добавляют Pd/C (0,05 г, 10% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 2 часов. Реакционную смесь фильтруют, и фильтрат концентрируют с получением этил 5-фтор-7-изобутил-1H-индол-2-карбоксилата (I-383) (0,4 г) в виде желтого масла.
К смеси этил 5-фтор-7-изобутил-1H-индол-2-карбоксилата (0,4 г, 1,52 ммоль) и Boc2O (431 мг, 1,97 ммоль) в ДХМ (10 мл) добавляют DMAP (92,8 мг, 760 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 часов. Смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением 1-трет-бутил 2-этил 5-фтор-7- изобутил-1H-индол-1,2-дикарбоксилата (I-384) (0,42 г, 76% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ7,14 (с, 1H), 7,12 (д, J=8,0 Гц, 1H), 6,91 (д, J=8,0 Гц, 1H), 4,41-4,36 (м, 2H), 2,84-2,83 (м, 2H), 1,93-1,90 (м, 1H), 1,62 (с, 9H), 1,48-1,43 (м, 3H), 0,92-0,91 (м, 6H).
К смеси 1-трет-бутил 2-этил 5-фтор-7-изобутил-1H-индол-1,2-дикарбоксилата (0,42 г, 1,16 ммоль) в ТГФ (10 мл) добавляют DIBAL-H (1M, 2,31 мл) порциями при -65°C под N2 атмосферой. Смесь перемешивают при -65°C в течение 1 часа. Смесь выливают в воду (20 мл). Полученный раствор экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (40 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением трет-бутил 5-фтор-2-(гидроксиметил)-7-изобутил-1H-индол-1-карбоксилата (I-385) (90 мг, 24% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ7,05 (д, J=8,0 Гц, 1H), 6,85 (д, J=8,0 Гц, 1H), 6,53 (с, 1H), 4,78-4,77 (м, 2H), 2,85-2,83 (м, 2H), 1,89-1,86 (м, 1H), 1,70 (с, 9H), 0,83-0,82 (м, 6H).
К смеси трет-бутил 5-фтор-2-(гидроксиметил)-7-изобутил-индол-1-карбоксилата (80 мг, 249 мкмоль) и MsCl (42,8 мг, 373 мкмоль) в ДХМ (2 мл) добавляют DIPEA (64,3 мг, 498 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 1 часа. Смесь выливают в воду (20 мл). Полученный раствор экстрагируют этилацетатом (20 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением трет-бутил 5-фтор-7-изобутил-2-(метилсульфонилоксиметил)индол-1-карбоксилата (I-386) (100 мг) в виде желтого масла.
К смеси трет-бутил 5-фтор-7-изобутил-2-(метилсульфонилоксиметил)индол-1-карбоксилата (100 мг, 250 мкмоль) и 3-нитропиридин-2(1H)-она (52,6 мг, 376 мкмоль) в CH3CN (3 мл) добавляют DIPEA (64,7 мг, 501 мкмоль) одной порцией при 25°C под N2 атмосферой. Смесь перемешивают при 25°C в течение 18 часов. Смесь выливают в воду (20 мл). Полученный раствор экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением трет-бутил 5-фтор-7-изобутил-2-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (I-387) (80 мг, 72% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ8,39-8,47 (м, 1H), 7,63-7,61 (м, 1H), 7,08-7,05 (м, 1H), 6,94-6,90 (м, 1H), 6,55 (с, 1H), 6,34-6,30 (м, 1H), 5,43 (с, 2H), 2,85-2,83 (м, 2H), 1,87-1,84 (м, 1H), 1,57 (с, 9H), 0,84-0,82 (м, 6H).
К раствору трет-бутил 5-фтор-7-изобутил-2-((3-нитро-2-оксопиридин-1(2H)-ил) метил)-1H-индол-1-карбоксилата (170 мг, 383 мкмоль) в этилацетате (10 мл) добавляют Pd/C (30 мг, 10% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 3 часов. Реакционную смесь фильтруют, и фильтрат концентрируют с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-5-фтор-7-изобутил-индол-1-карбоксилата (I-388) (160 мг)в виде желтого масла.
Пример 41:
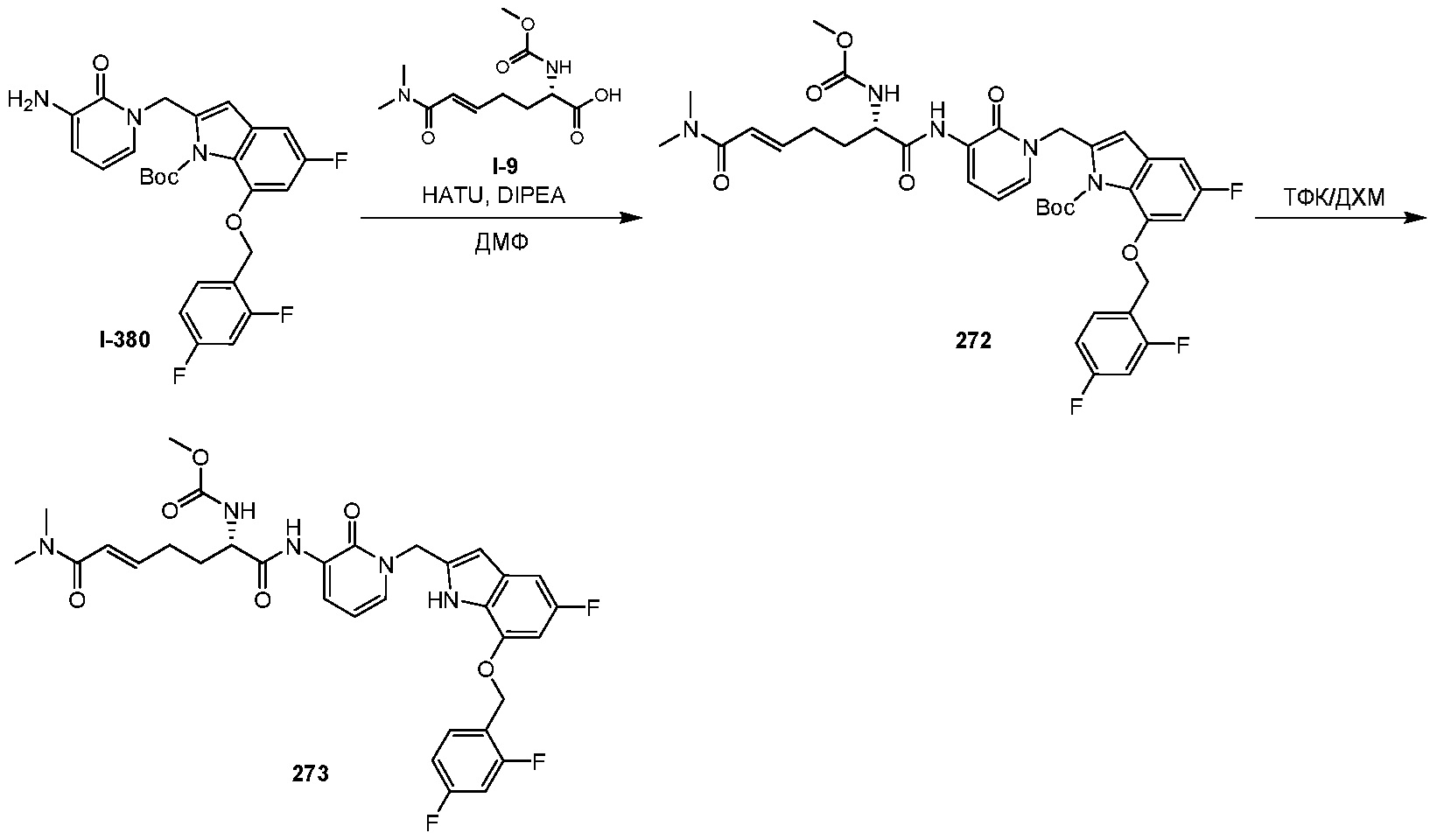
К раствору трет-бутил 2-((3-амино-2-оксопиридин-1(2H)-ил)метил)-7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-1-карбоксилата (200 мг, 400 мкмоль) и (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (155 мг, 601 мкмоль) в ДМФ (3 мл) добавляют HATU (183 мг, 481 мкмоль) и DIPEA (155 мг, 1,20 ммоль, 210 мкл) при 0°C. Раствор перемешивают при 30°C в течение 16 ч. Реакционную смесь концентрируют при пониженном давлении с получением (S, E)-трет-бутил 7-((2,4-дифторбензил)окси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата (Соединение 272) (230 мг) в виде белого твердого вещества. ЖХМС m/z 740,3 (M+1)+.
К раствору (S, E)-трет-бутил 7-(2,2-дифторэтокси)-2-((3-(7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-5-фтор-1H-индол-1-карбоксилата (180 мг, 231 мкмоль) в ДХМ (3 мл) добавляют ТФК (1 мл) при 0°C. Смесь перемешивают при 20°C в течение 1 часа. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил (1-((1-((7-((2,4-дифторбензил)окси)-5-фтор-1H-индол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 273) (73,8 мг, 47% выход) в виде белого твердого вещества. ЖХМС m/z 640,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 11,32 (с, 1H), 9,32 (с, 1H), 8,21 (дд, J=7,4, 1,6 Гц, 1H), 7,81-7,72 (м, 2H), 7,49 (дд, J=6,8, 1,6 Гц, 1H), 7,40-7,32 (м, 1H), 7,22-7,15 (м, 1H), 6,86 (дд, J=9,6, 2,0 Гц, 1H), 6,77 (дд, J=11,2, 2,0 Гц, 1H), 6,66-6,56 (м, 1H), 6,38 (д, J=15,2 Гц, 1H), 6,30 (т, J=7,2 Гц, 1H), 6,23 (с, 1H), 5,30-5,18 (м, 4H), 4,25-4,13 (м, 1H), 3,56 (с, 3H), 2,99 (с, 3H), 2,83 (с, 3H), 2,30-2,17 (м, 2H), 1,95-1,80 (м, 1H), 1,78-1,65 (м, 1H).
Следующие соединения получают согласно методикам, описанным в Примере 41 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-396

К смеси N-[4-фтор-2-(3,3,3-трифторпропил)фенил]ацетамида (2 г, 8,03 ммоль) в EtOH (15 мл) добавляют HCl (4M, 15 мл). Смесь перемешивают при 90°C в течение 12 ч. Полученный раствор концентрируют и NaOH (1M) раствора добавляют для доведения pH~8. Смесь экстрагируют EtOAc (15 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (15 мл), сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 4-фтор-2-(3,3,3-трифторпропил)анилина (I-389) (1,8 г) в виде светло-коричневого масла.1H ЯМР (400 МГц, CDCl3) δ6,86-6,73 (м, 2H), 6,65 (дд, J=5,0, 8,5 Гц, 1H), 3,63-3,30 (м, 2H), 2,77-2,67 (м, 2H), 2,50 (с, 1H), 2,50-2,32 (м, 1H).
К раствору 4-фтор-2-(3,3,3-трифторпропил)анилина (1,8 г, 8,69 ммоль) в HCl (3 мл, 37%) добавляют раствор NaNO2 (719 мг, 10,4 ммоль, 566 мкл) в H2O (1 мл) по каплям в течение 10 мин при -5°C. Смесь перемешивают при -5°C в течение 1 ч. Раствор SnCl2·2H2O (2,45 г, 10,9 ммоль, 904 мкл) в HCl (3 мл, 37%) добавляют к реакционной смеси смесь по каплям при -5°C в течение 10 мин. Реакционную смесь перемешивают при -5°C в течение 2 ч. Полученную суспензию фильтруют и фильтровальную лепешку собирают и сушат под вакуумом с получением [4-фтор-2-(3,3,3-трифторпропил)фенил]гидразина (I-390) (1,8 г, неочищенный, HCl) в виде белого твердого вещества.
К смеси метил 2-оксопропаноата (852 мг, 8,35 ммоль, 754 мкл) в толуоле (40 мл) добавляют PTSA (240 мг, 1,39 ммоль). Смесь перемешивают при 110°C в течение 16 ч. Смесь концентрируют с получением остатка. Остаток разбавляют EtOAc (30 мл) и промывают насыщенным солевым раствором (15 мл). Органическую фазу сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением метил 5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-карбоксилата (I-391) (0,3 г, 15% выход) в виде светло-желтого твердого вещества.1H ЯМР (400 МГц, CDCl3)δ8,98 (с, 1H), 7,41-7,27 (м, 2H), 7,00 (д, J=8,4 Гц, 1H), 4,04 (с, 3H), 3,25-3,08 (м, 2H), 2,70-2,52 (м, 2H).
К смеси метил 5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-карбоксилата (0,3 г, 1,02 ммоль) и (Boc)2O (266 мг, 1,22 ммоль, 280 мкл) в ДХМ (30 мл) добавляют DMAP (24,8 мг, 203 мкмоль) и Et3N (206 мг, 2,03 ммоль, 283 мкл). Смесь перемешивают при 20°C в течение 16 ч. Полученный раствор промывают NH4Cl (водн., 20 мл х 2) и солевым раствором (15 мл). Органическую фазу сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением O1-трет-бутил O2-метил 5-фтор-7-(3,3,3-трифторпропил)индол-1,2-дикарбоксилата (I-392) (0,3 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ7,19 (дд, J=2,5, 7,9 Гц, 1H), 7,15 (с, 1H), 6,96 (дд, J=2,5, 9,9 Гц, 1H), 3,93 (с, 3H), 3,26-3,14 (м, 2H), 2,61-2,45 (м, 2H), 1,63 (с, 9H).
К смеси O1-трет-бутил O2-метил 5-фтор-7-(3,3,3-трифторпропил)индол-1,2-дикарбоксилата (0,3 г, 771 мкмоль) в толуоле (15 мл) добавляют DIBAL-H (1M, 2 мл) при -70°C. Смесь перемешивают при -70°C в течение 0,5 ч. Реакционную смесь гасят NH4Cl (водн., 20 мл) и экстрагируют EtOAc (30 мл). Органический слой сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением трет-бутил 5-фтор-2-(гидроксиметил)-7-(3,3,3-трифторпропил)индол-1-карбоксилата (I-393) (0,22 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ7,08 (дд, J=2,4, 8,0 Гц, 1H), 6,86 (дд, J=2,5, 10,0 Гц, 1H), 6,54 (с, 1H), 4,78 (д, J=5,4 Гц, 2H), 3,19-3,08 (м, 2H), 2,60 (т, J=6,4 Гц, 1H), 2,52-2,36 (м, 2H), 1,68 (с, 9H).
К смеси трет-бутил 5-фтор-2-(гидроксиметил)-7-(3,3,3-трифторпропил)индол-1-карбоксилата (0,22 г, 609 мкмоль) и MsCl (83,7 мг, 731 мкмоль, 56,6 мкл) в ДХМ (10 мл) добавляют DIEA (157 мг, 1,22 ммоль, 212 мкл) при 0°C. Смесь перемешивают при 15°C в течение 0,5 ч. Полученный раствор разбавляют ДХМ (20 мл) и промывают насыщенным солевым раствором (15 мл). Органическую фазу сушат над безводным Na2SO4 и концентрируют с получением трет-бутил 2-(хлорметил)-5-фтор-7-(3,3,3-трифторпропил)индол-1-карбоксилата (I-394) (0,25 г) в виде светло-коричневого масла.
К смеси 3-нитро-1H-пиридин-2-она (138 мг, 987 мкмоль) и трет-бутил 2-(хлорметил)-5-фтор-7-(3,3,3-трифторпропил)индол-1-карбоксилата (0,25 г, 658 мкмоль) в CH3CN (15 мл) добавляют DIEA (170 мг, 1,32 ммоль, 229 мкл). Смесь перемешивают при 35°C в течение 16 ч. Смесь разбавляют EtOAc (30 мл), промывают водой (15 мл) и солевым раствором (15 мл). Органическую фазу сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 5-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]-7-(3,3,3-трифторпропил)индол-1-карбоксилата (I-395) (140 мг) в виде желтого твердого вещества.
Смесь трет-бутил 5-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]-7-(3,3,3-трифторпропил)индол-1-карбоксилата (0,115 г, 238 мкмоль) в MeOH (5 мл) добавляют Pd/C (0,01 г, 238 мкмоль, 10% чистота). Смесь перемешивают при 15°C в течение 5 мин под H2 атмосферой (15 ф./кв.д.). Реакционную смесь фильтруют и фильтрат концентрируют с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-5-фтор-7-(3,3,3-трифторпропил)индол-1-карбоксилата (I-396) (0,1 г) в виде светло-желтого масла.
Следующие промежуточные получают согласно методикам, описанным в I-396 с применением подходящих промежуточных соединений.
Пример 42:

К смеси (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (0,08 г, 291 мкмоль,) и трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-5-фтор-7-(3,3,3-трифторпропил)индол-1-карбоксилата (0,1 г, 221 мкмоль) в ДМФ (2 мл) добавляют HATU (101 мг, 265 мкмоль) и DIEA (57,0 мг, 441 мкмоль, 76,8 мкл) при 0°C. Смесь перемешивают при 30°C в течение 12 ч. Полученный раствор разбавляют EtOAc (30 мл), промывают водой (20 мл) и солевым раствором (20 мл). Органической слой сушат над безводным Na2SO4 и концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5-фтор-7-(3,3,3-трифторпропил)индол-1-карбоксилата (I-398) (100 мг, 58% выход) в виде светло-желтого твердого вещества.
К смеси трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5-фтор-7-(3,3,3-трифторпропил)индол-1-карбоксилата (0,09 г, 114 мкмоль) в ДХМ (2 мл) при 0°C добавляют ТФК (1,54 г, 13,5 ммоль, 1 мл) по каплям. Смесь перемешивают при 15°C в течение 3 ч. Реакционную смесь концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[1-[[5-фтор-7-(3,3,3-трифторпропил)-1H-индол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 309) (25 мг, 36% выход) в виде светло-желтого твердого вещества. ЖХМС m/z 608,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ11,34 (с, 1H), 9,35 (с, 1H), 8,22 (д, J=6,6 Гц, 1H), 7,49 (д, J=6,0 Гц, 1H), 7,19-7,05 (м, 1H), 6,89 (д, J=10,4 Гц, 1H), 6,72-6,57 (м, 1H), 6,46-6,29 (м, 2H), 6,23 (с, 1H), 5,37-5,26 (м, 2H), 5,10 (дд, J=4,6, 7,3 Гц, 1H), 3,12-3,04 (м, 2H), 2,98 (с, 6H), 2,83 (с, 6H), 2,76-2,63 (м, 2H), 2,29 (кв, J=6,8 Гц, 2H), 2,05-1,86 (м, 2H).
Следующие соединения получают согласно методикам, описанным в Примере 42 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-408:

Смесь N-[2-(2,2-диметилпропил)-4-фтор-фенил]ацетамида (7 г, 31,35 ммоль) в HCl (35 мл, 6N) и EtOH (35 мл) дегазируют и продувают N2 3 раза и затем смесь перемешивают при 90°C в течение 12 часов под N2 атмосферой. Реакционную смесь концентрируют при пониженном давлении для удаления растворителя с получением желтого твердого вещества. Реакционную смесь разделяют между насыщ. NaHCO3 (водн) (100 мл) и этилацетат (100 мл). Органическую фазу разделяют, промывают насыщенным солевым раствором (100 мл x 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают флэш-хроматографией на силикагеле с получением 2-(2,2-диметилпропил)-4-фтор-анилина (I-399) (3,38 г, 59% выход) в виде оранжевого масла.
К раствору 2-(2,2-диметилпропил)-4-фтор-анилина (6,25 г, 34,48 ммоль) в HCl (10,9 мл, 12N) и льде (50 мл) добавляют раствор NaNO2 (2,52 г, 36,55 ммоль) в H2O (9,4 мл) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. Неочищенный продукт 4-фтор-2-неопентилбензолдиазония (I-400) в растворителе применяют на следующей стадии без дальнейшей очистки.
К раствору соединения 5A (6,01 г, 34,50 ммоль, 5,89 мл), TEA (3,49 г, 34,50 ммоль, 4,80 мл) и Na2CO3 (3,66 г, 34,50 ммоль) в H2O (30 мл) и MeOH (60 мл) добавляют раствор 4-фтор-2-неопентилбензолдиазония (7,89 г, 34,50 ммоль) в желтом растворителе при 0°C и затем смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь разбавляют водой (50 мл) и экстрагируют TBME (50 мл x 2). Объединенную органическую фазу промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают флэш-хроматографией на силикагеле с получением диэтил 2-[(E)-[2-(2,2-диметилпропил)-4-фтор-фенил]азо]-2-метил-пропандиоата (I-401) (8,5 г, 67% выход) в виде коричневого масла.
Смесь EtONa (1,58 г, 23,20 ммоль) в EtOH (30 мл) добавляют раствор диэтил 2-[(E)-[2-(2,2-диметилпропил)-4-фтор-фенил]азо]-2-метил-пропандиоата (8,5 г, 23,20 ммоль) в EtOH (60 мл) при 40°C и затем смесь перемешивают при 40°C в течение 2,5 ч. Реакционную смесь гасят добавлением лимонной кислоты 100 мл при 0°C и затем концентрируют. Затем разбавляют водой (50 мл) и экстрагируют MTBE (100 мл x 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают флэш-хроматографией на силикагеле с получением этил (2E)-2-[[2-(2,2-диметилпропил)-4-фтор-фенил]гидразоно]пропаноата (I-402) (5,5 г, 81% выход) в виде желтого масла.
К раствору этил (2E)-2-[[2-(2,2-диметилпропил)-4-фтор-фенил]гидразоно]пропаноата (1 г, 3,40 ммоль) в EtOH (1 мл) добавляют HCl (6,88 г, 67,94 ммоль, 6,75 мл, 36% чистота) при 80°C. Смесь перемешивают при 80°C в течение 30 мин. Реакционную смесь концентрируют при пониженном давлении для удаления EtOH, затем остаток разбавляют насыщ. раствором NaHCO3 (50 мл) и экстрагируют EtOAc (40 мл x 2), объединенную органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают флэш-хроматографией на силикагеле с получением этил 7-(2,2-диметилпропил)-5-фтор-1H-индол-2-карбоксилата (I-403) (2,11 г, 45% выход) в виде желтого твердого вещества.
К раствору этил 7-(2,2-диметилпропил)-5-фтор-1H-индол-2-карбоксилата (2,11 г, 7,61 ммоль) в ДХМ (25 мл) добавляют Boc2O (4,15 г, 19,02 ммоль, 4,37 мл) и TEA (1,54 г, 15,22 ммоль, 2,12 мл) и DMAP (278,84 мг, 2,28 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 12 часов. Реакционную смесь разбавляют насыщ. раствором NH4Cl (50 мл) и экстрагируют ДХМ (30 мл x 2), объединенную органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают флэш-хроматографией на силикагеле с получением O1-трет-бутил O2-этил 7-(2,2-диметилпропил)-5-фтор-индол-1,2-дикарбоксилата (I-404) (2,3 г, 80% выход) в виде желтого твердого вещества.
К раствору O1-трет-бутил O2-этил 7-(2,2-диметилпропил)-5-фтор-индол-1,2-дикарбоксилата (1,02 г, 2,70 ммоль) в толуоле (8 мл) добавляют DIBAL-H (1M, 5,40 мл) при -60°C. Смесь перемешивают при -60°C в течение 1 ч. Реакционную смесь гасят добавлением насыщ. раствора NH4Cl (30 мл), затем смесь фильтруют, фильтровальную жидкость экстрагируют EtOAc 30 мл (15 мл x 2), объединенную органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением трет-бутил 7-(2,2-диметилпропил)-5-фтор-2-(гидроксиметил)индол-1-карбоксилата (I-405) (830 мг, 92% выход) в виде желтого масла.
К раствору трет-бутил 7-(2,2-диметилпропил)-5-фтор-2-(гидроксиметил)индол-1-карбоксилата (0,83 г, 2,47 ммоль) в ДХМ (10 мл) добавляют DIEA (1,92 г, 14,85 ммоль, 2,59 мл) и MsCl (1,42 г, 12,37 ммоль, 957,65 мкл) при 0°C. Смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь разбавляют насыщ. NH4Cl раствора (20 мл) и экстрагируют ДХМ (8 мл x 2). Объединенную органическую фазу промывают насыщенным солевым раствором (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением трет-бутил 7-(2,2-диметилпропил)-5-фтор-2-(метилсульфонилоксиметил)индол-1-карбоксилата (I-406) (1,02 г) в виде желтого масла.
Смесь соединение 1A (298,15 мг, 2,13 ммоль), DIEA (500,09 мг, 3,87 ммоль, 673,98 мкл) в ACN (8 мл) добавляют раствор трет-бутил 7-(2,2-диметилпропил)-5-фтор-2-(метилсульфонилоксиметил)индол-1-карбоксилата (0,8 г, 1,93 ммоль) в ACN (2 мл) при 0°C и затем смесь перемешивают при 25°C в течение 12 часов. Реакционную смесь разбавляют насыщ. раствора NH4Cl (20 мл), затем экстрагируют EtOAc (8 мл x 2), объединенную органическую фазу промывают насыщенным солевым раствором (10 мл), затем сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией с получением трет-бутил 7-(2,2-диметилпропил)-5-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]индол-1-карбоксилата (I-407) (0,55 г, 62% выход) в виде желтой камеди.
Смесь трет-бутил 7-(2,2-диметилпропил)-5-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]индол-1-карбоксилата (0,2 г, 437,16 мкмоль), Pd/C (0,2 г, 10% чистота) в EtOAc (20 мл) дегазируют и продувают H2 3 раза и затем смесь перемешивают при 25°C в течение 1 ч под H2 атмосферой (15 ф./кв.д.). Реакционную смесь фильтруют и концентрируют при пониженном давлении с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата (I-408) в виде светло-желтой камеди.
Пример 43:

Смесь трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата (0,11 г, 257,30 мкмоль), (E,2S)-7-(диметиламино)-7-оксо-2-(пирролидин-1-карбонилокси)гепт-5-еновой кислоты (61,41 мг, 205,84 мкмоль) в пиридине (2 мл) добавляют POCl3 (78,91 мг, 514,61 мкмоль, 47,82 мкл) при -40°C и затем смесь перемешивают при -40°C в течение 15 мин. Реакционную смесь гасят добавлением насыщ. раствора NaHCO3 (3 мл) и затем экстрагируют EtOAc (5 мл x 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают преп-ТСХ с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-7-оксо-2-(пирролидин-1-карбонилокси)гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата (Соединение 318) (30 мг) в виде светло-желтого твердого вещества которое применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 708,3 (M+1)+.
Смесь трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-7-оксо-2-(пирролидин-1-карбонилокси)гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата (30 мг, 42,38 мкмоль) в ТФК (0,5 мл) и ДХМ (2 мл) перемешивают при 25°C в течение 1 ч. Реакционную смесь выливают в насыщ. раствора NaHCO3 (20 мл) и экстрагируют ДХМ (5 мл x 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением [(E,1S)-6-(диметиламино)-1-[[1-[[7-(2,2-диметилпропил)-5-фтор-1H-индол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]пирролидин-1-карбоксилата (Соединение 319) (14,2 мг, 51% выход) в виде коричневого твердого вещества. ЖХМС m/z 608,3 (M+1)+.
Следующие соединения получают согласно методикам, описанным для синтеза Примера 43 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-409:

Смесь соединения 11A (64,48 мг, 580,41 мкмоль) в ДМФ (1,5 мл) добавляют NaH (38,69 мг, 967,35 мкмоль, 60% чистота) при 0°C. Смесь перемешивают при 0°C в течение 0,5 часа. Добавляют раствор трет-бутил 7-(2,2-диметилпропил)-5-фтор-2-(метилсульфонилоксиметил)индол-1-карбоксилата (0,2 г, 483,67 мкмоль) в ДМФ (1,5 мл), затем добавляют KI (40,15 мг, 241,84 мкмоль). Смесь перемешивают при 25°C в течение 1,5 ч. Реакционную смесь гасят добавлением к раствору раствора насыщ. NH4Cl (10 мл). Смесь экстрагируют EtOAc (5 мл x 2) и объединенную органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают преп-ТСХ с получением трет-бутил 2-[(3-амино-2-оксо-пиразин-1-ил)метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата (I-409) (80 мг, 39% выход) в виде желтой камеди.
Следующие промежуточные соединения получают согласно методикам, описанным в I-409 с применением подходящего промежуточного соединения.
Пример 44:

Смесь (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (71,49 мг, 262,54 мкмоль), трет-бутил 2-[(3-амино-2-оксо-пиразин-1-ил)метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата (0,075 г, 175,03 мкмоль), DIEA (45,24 мг, 350,06 мкмоль, 60,97 мкл) в DMA (2 мл) добавляют HATU (119,79 мг, 315,05 мкмоль) при 25°C и затем смесь перемешивают при 40°C в течение 12 часов. Реакционную смесь разбавляют насыщ. раствором NH4Cl (5 мл) и экстрагируют EtOAc (3 мл x 2). Объединенную органическую фазу промывают насыщенным солевым раствором (5 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают преп-ЖХВД с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-пиразин-1-ил]метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата (Соединение 327) (89,0 мг, 63% выход) в виде белого твердого вещества. ЖХМС m/z 683,3 (M+1)+.
Смесь трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-пиразин-1-ил]метил]-7-(2,2-диметилпропил)-5-фтор-индол-1-карбоксилата (85 мг, 124,49 мкмоль) в ДХМ (2,5 мл) добавляют ТФК (0,5 мл) при 25°C и затем смесь перемешивают при 25°C в течение 1 ч. Реакционную смесь выливают в 20 мл насыщ. раствора NH4Cl, затем экстрагируют ДХМ (5 мл x 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением желаемого продукта. Остаток очищают преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[4-[[7-(2,2-диметилпропил)-5-фтор-1H-индол-2-ил]метил]-3-оксо-пиразин-2-ил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 328) (35,6 мг, 48% выход) в виде белого твердого вещества. ЖХМС m/z 583,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 11,07 (шс, 1H), 9,96 (шс, 1H), 7,35 (шд, J=4,16 Гц, 1H), 7,10 (шд, J=4,65 Гц, 2H), 6,62-6,74 (м, 2H), 6,42 (шд, J=14,43 Гц, 1H), 6,31 (с, 1H), 5,25 (шс, 2H), 5,19 (шс, 1H), 2,98 (шд, J=16,87 Гц, 6H), 2,84 (шд, J=10,76 Гц, 6H), 2,74 (шс, 2H), 2,33 (шс, 2H), 1,86-2,01 (м, 2H), 0,92 (шс, 9 H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 44 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-416:

К раствору этил 5-фтор-1H-индол-2-карбоксилата (2 г, 9,65 ммоль) в ДМФ (20 мл) добавляют NaH (579,09 мг, 14,48 ммоль, 60% чистота) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. 1-йод-2-метил-пропан (3,55 г, 19,30 ммоль, 2,22 мл) добавляют к смеси, и смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь разбавляют NH4Cl 40 мл и экстрагируют EtOAc (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (30 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением этил 5-фтор-1-изобутил-индол-2-карбоксилата (I-412) (1,1 г, 43% выход) в виде светло-желтого масла.
К раствору этил 5-фтор-1-изобутил-индол-2-карбоксилата (2 г, 7,60 ммоль) в толуоле (25 мл) добавляют DIBALH (1M, 15,19 мл) при -40°C. Смесь перемешивают при -40°C в течение 0,5 ч. Реакционную смесь гасят насыщенным раствором тартрата калия-натрия (100 мл). Смесь перемешивают в течение 2 ч. Полученный раствор экстрагируют EtOAc (100 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением (5-фтор-1-изобутил-индол-2-ил)метанола (I-413) (1,5 г, 89% выход) в виде коричневой камеди.1H ЯМР (400 МГц, CDCl3) δ 7,10-7,17 (м, 2H) 6,86 (тд, J=9,14, 2,51 Гц, 1H) 6,34 (с, 1H) 4,66-4,77 (м, 2H) 3,92 (д, J=7,58 Гц, 2H) 2,08-2,27 (м, 1H) 0,84 (д, J=6,72 Гц, 6H).
К раствору (5-фтор-1-изобутил-индол-2-ил)метанола (0,3 г, 1,36 ммоль) в ДХМ (5 мл) добавляют DIEA (1,23 г, 9,49 ммоль, 1,65 мл) и MsCl (776,55 мг, 6,78 ммоль, 524,69 мкл) при 0°C. Смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь гасят водн. раствором NH4Cl (5 мл) при 0°C и затем экстрагируют ДХМ (5 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (5 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением (5-фтор-1-изобутил-индол-2-ил)метилметансульфоната (I-414) (0,4 г) в виде коричневого масла.
К раствору 3-нитро-1H-пиридин-2-она (224,63 мг, 1,60 ммоль) в ACN (5 мл) добавляют DIEA (414,46 мг, 3,21 ммоль, 558,57 мкл) и (5-фтор-1-изобутил-индол-2-ил)метилметансульфонат (0,32 г, 1,07 ммоль) при 0°C. Смесь перемешивают при 20°C в течение 12 ч. Реакционную смесь разбавляют NH4Cl (50 мл) и экстрагируют ДХМ (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 1-[(5-фтор-1-изобутил-индол-2-ил)метил]-3-нитро-пиридин-2-она (I-415) (0,12 г, 33% выход) в виде коричневой камеди,1H ЯМР (400 МГц, CDCl3) δ 8,31 (дд, J=7,45, 2,19 Гц, 1H) 7,59 (дд, J=6,58, 1,75 Гц, 1H) 7,25 (шс, 1H) 7,23 (д, J=3,07 Гц, 1H) 7,00 (тд, J=8,99, 2,63 Гц, 1H) 6,54 (с, 1H) 6,28 (т, J=7,24 Гц, 1H) 5,42 (с, 2H) 3,87 (д, J=7,89 Гц, 2H) 2,02-2,15 (м, 1H) 0,89 (д, J=6,58 Гц, 6H).
К раствору 1-[(5-фтор-1-изобутил-индол-2-ил)метил]-3-нитро-пиридин-2-она (0,12 г, 349,50 мкмоль) в EtOAc (5 мл) добавляют Pd/C (0,1 г, 195,14 мкмоль, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 1 ч. Реакционную смесь фильтруют и фильтрат концентрируют с получением 3-амино-1-[(5-фтор-1-изобутил-индол-2-ил)метил]пиридин-2-она (I-416) (93 мг, 85% выход) в виде бесцветного масла.
Следующие промежуточные получают согласно методикам, описанным в I-416 с применением подходящих реагентов.
Пример 45:
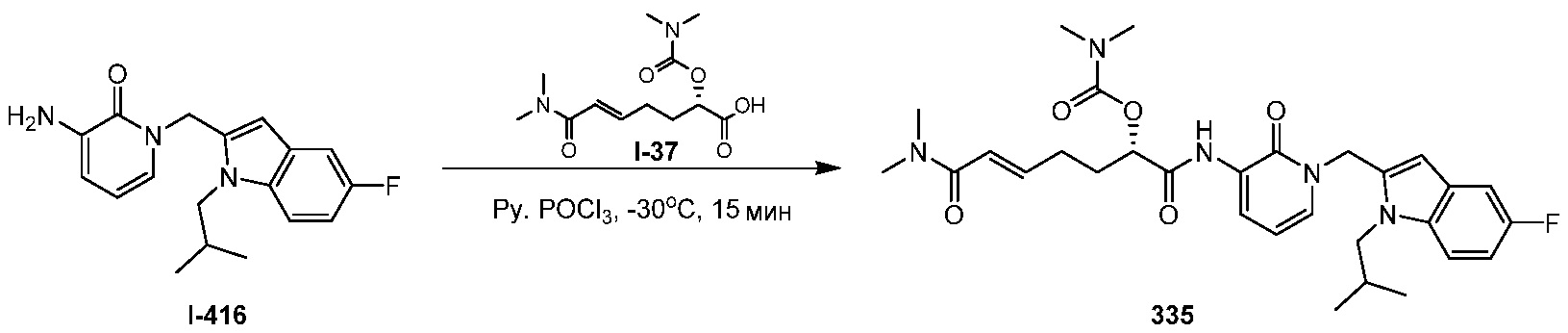
К смеси соединения I-416 (85,5 мг, 272,84 мкмоль) и соединения I-37 (111,44 мг, 409,26 мкмоль) в пиридине (2 мл) добавляют POCl3 (83,67 мг, 545,68 мкмоль, 50,71 мкл) одной порцией при -30°C под N2. Смесь перемешивают при -30°C в течение 15 мин. Реакционную смесь гасят добавлением воды 10 мл при -30°C и затем разбавляют 2 мл EtOAc и экстрагируют 20 мл EtOAc (10 мл х 2). Объединенные органические слои промывают 10 мл водн. HCl (1N) и солевым раствором (5 мл х 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ и концентрируют лиофилизацией с получением [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-изобутил-индол-2-ил) метил]-6-оксо-пиримидин-5-ил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 335) (38,2 мг, 24% выход) в виде белого твердого вещества. ЖХМС m/z 568,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,48 (с, 1H), 8,30 (дд, J=1,8, 7,3 Гц, 1H), 7,58-7,49 (м, 2H), 7,31 (дд, J=2,4, 9,7 Гц, 1H), 7,02 (дт, J=2,5, 9,2 Гц, 1H), 6,77-6,66 (м, 1H), 6,53-6,37 (м, 2H), 6,29 (с, 1H), 5,47 (с, 2H), 5,17 (дд, J=4,6, 7,7 Гц, 1H), 4,12 (д, J=7,5 Гц, 2H), 3,08-3,00 (м, 6H), 2,93-2,84 (м, 6H), 2,42-2,30 (м, 2H), 2,10 (тд, J=7,2, 14,2 Гц, 1H), 2,05 -1,94 (м, 1H), 0,90 (дд, J=3,7, 6,6 Гц, 6H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 45 с применением подходящих промежуточных соединений.
Пример 46:

К смеси 1-[(5-фтор-1H-индол-2-ил)метил]-3-нитро-пиридин-2-она (199,31 мг, 693,88 мкмоль, 1 экв) и DIEA (179,36 мг, 1,39 ммоль, 241,72 мкл, 2 экв) в ДХМ (2 мл) добавляют метил карбонохлоридат (98,35 мг, 1,04 ммоль, 80,61 мкл, 1,5 экв) и DMAP (8,48 мг, 69,39 мкмоль, 0,1 экв) порцией при 0°C под N2. Смесь нагревают до 25°C и перемешивают в течение 1,5 часов. В реакционную смесь добавляют H2O (10 мл) и экстрагируют EtOAc (15 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением метил 5-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]индол-1-карбоксилата (I-424) (0,17 г) в виде светло-желтого твердого вещества.
К раствору Pd/C (200 мг, 10% чистота) в EtOAc (5 мл) добавляют метил 5-фтор-2-[(3-нитро-2-оксо-1-пиридил)метил]индол-1-карбоксилат (150 мг, 434,43 мкмоль, 1 экв) при 30°C, реакционную смесь перемешивают при 30°C под H2 (15 ф./кв.д.) в течение 15 мин. Смесь фильтруют и фильтрат концентрируют в вакууме с получением метил 2-[(3-амино-2-оксо-1-пиридил)метил]-5-фтор-индол-1-карбоксилата (I-425) (150 мг) в виде желтого масла, которое сразу используют на следующей стадии.
К раствору метил 2-[(3-амино-2-оксо-1-пиридил)метил]-5-фтор-индол-1-карбоксилата (100 мг, 317,16 мкмоль, 1 экв) и (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (103,63 мг, 380,59 мкмоль, 1,2 экв) и DIEA (204,95 мг, 1,59 ммоль, 276,21 мкл, 5 экв) в ДМФ (3 мл) добавляют HATU (241,19 мг, 634,32 мкмоль, 2 экв) при 30°C, реакционную смесь перемешивают при 30°C в течение 12 ч. Реакционную смесь выливают в воду 20 мл и экстрагируют EtOAc 40 мл (20 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором 20 мл (10 мл x 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Масло очищают преп-ТСХ с получением масла, которое лиофилизируют с получением метил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5-фтор-индол-1-карбоксилата (Соединение 342) (33,3 мг, 17% выход) в виде коричневого твердого вещества,1H ЯМР (400 МГц, ДМСО-d6) δ 1,84-2,02 (м, 2H) 2,22-2,33 (м, 2H) 2,75-2,84 (м, 6H) 2,87-3,02 (м, 6H) 4,01 (с, 3H) 5,09 (дд, J=7,61, 4,52 Гц, 1H) 5,50 (с, 2H) 6,03 (с, 1H) 6,32-6,44 (м, 2H) 6,57-6,69 (м, 1H) 7,12 (тд, J=9,26, 2,65 Гц, 1H) 7,33 (дд, J=9,04, 2,65 Гц, 1H) 7,45 (дд, J=6,95, 1,87 Гц, 1H) 8,04 (дд, J=9,04, 4,63 Гц, 1H) 8,28 (дд, J=7,50, 1,76 Гц, 1H) 9,37 (с, 1H).
Следующее соединение получают согласно методикам, описанным для синтеза Примера 46 с применением подходящих промежуточных соединений
Синтез промежуточного соединения I-426:

К раствору 3-амино-1H-пиразин-2-она (298,39 мг, 2,69 ммоль) в DMA (10 мл) добавляют NaH (179,03 мг, 4,48 ммоль, 60% чистота) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. (5-Фтор-1-изобутил-индол-2-ил)метилметансульфонат (0,67 г, 2,24 ммоль) добавляют к смеси, и смесь перемешивают при 0°C в течение 1,5 ч. Реакционную смесь разбавляют NH4Cl (5 мл) и экстрагируют EtOAc (5 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (5 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 3-амино-1-[(5-фтор-1-изобутил-индол-2-ил)метил]пиразин-2-она (I-426) (0,2 г) в виде коричневой камеди.
Следующие промежуточные соединения получают согласно методикам, описанным в I-426 с применением подходящих реагентов.
Пример 47:
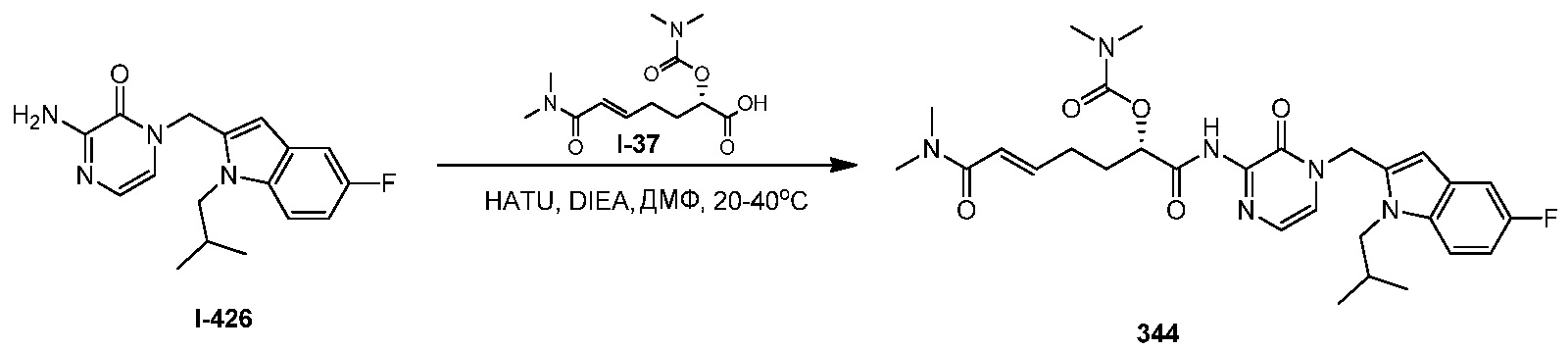
К раствору 3-амино-1-[(5-фтор-1-изобутил-индол-2-ил)метил]пиразин-2-она (0,2 г, 636,22 мкмоль) и (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (207,89 мг, 763,46 мкмоль) в ДМФ (5 мл) добавляют DIEA (164,45 мг, 1,27 ммоль, 221,63 мкл) и HATU (435,44 мг, 1,15 ммоль) при 20°C. Смесь перемешивают при 40°C в течение 12 ч. Реакционную смесь разбавляют водой (20 мл) и экстрагируют EtOAc (20 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (15 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией и преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[4-[(5-фтор-1-изобутил-индол-2-ил)метил]-3-оксо-пиразин-2-ил]карбамоил]-6-оксо-гекс-4-енил] N, N-диметилкарбамата (Соединение 344) (19,9 мг, 5% выход) в виде белого твердого вещества. ЖХМС m/z 569,3 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,99 (с, 1H) 7,48 (дд, J=9,04, 4,41 Гц, 1H) 7,41 (д, J=4,63 Гц, 1H) 7,26 (шд, J=12,35 Гц, 1H) 7,12 (д, J=4,41 Гц, 1H) 6,93-7,00 (м, 1H) 6,66 (д, J=15,21 Гц, 1H) 6,41 (д, J=15,21 Гц, 1H) 6,35 (с, 1H) 5,34 (с, 2H) 5,18 (с, 1H) 4,03 (д, J=7,50 Гц, 2H) 2,92-3,01 (м, 6H) 2,79-2,85 (м, 6H) 2,32 (с, 2H) 1,83-2,09 (м, 2H) 0,83 (дд, J=6,39, 2,21 Гц, 6H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 47 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-438:
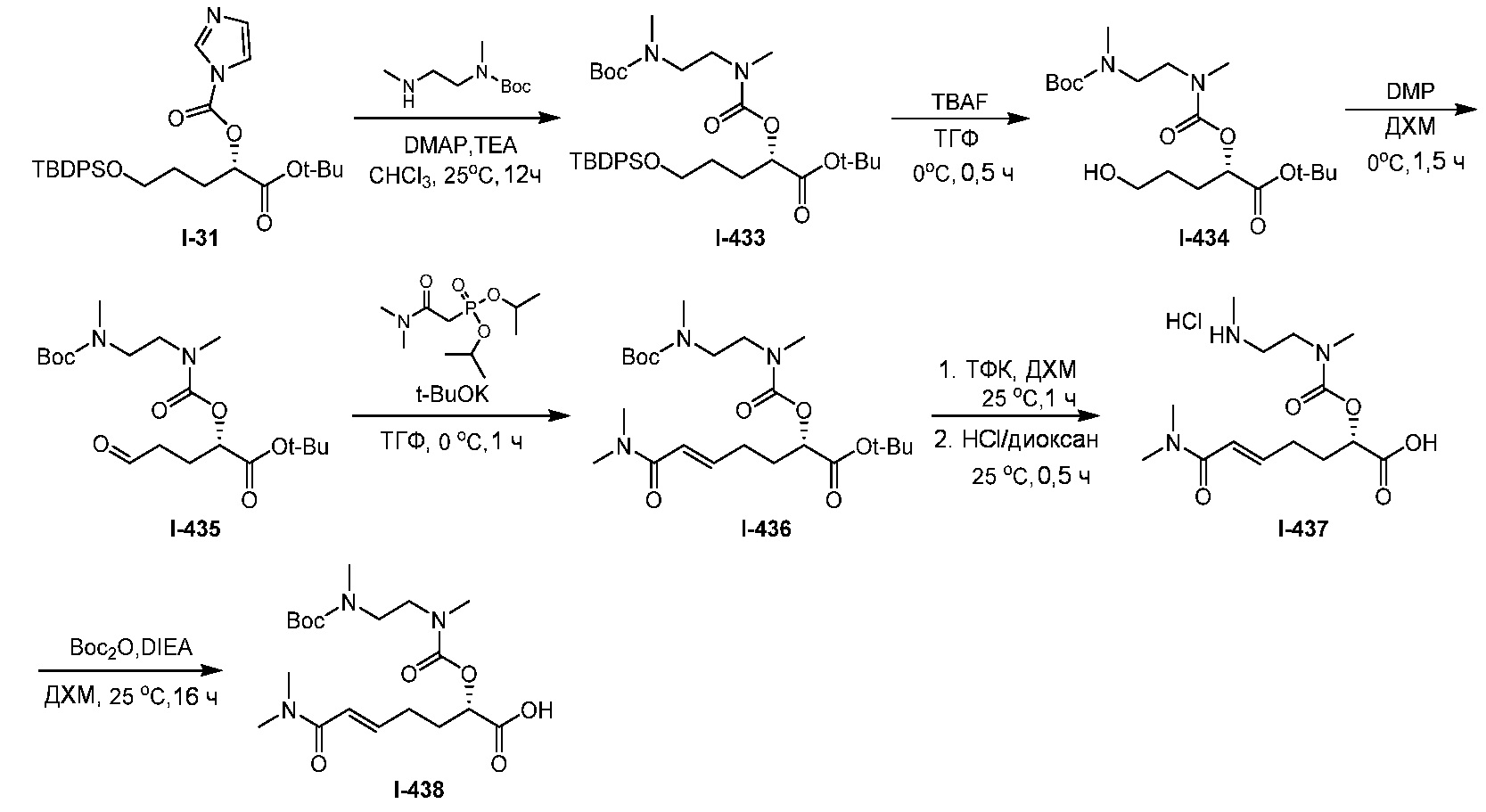
К раствору [(1S)-1-трет-бутоксикарбонил-4-[трет-бутил(дифенил)силил]окси-бутил]имидазол-1-карбоксилата (6,05 г, 11,57 ммоль) в CHCl3 (100 мл) добавляют трет-бутил N-метил-N-[2-(метиламино)этил]карбамат (2,61 г, 13,89 ммоль, 72,52 мкл), DMAP (282,81 мг, 2,31 ммоль) и TEA (3,51 г, 34,72 ммоль, 4,83 мл) при 25°C. Смесь перемешивают при 25°C в течение 12 ч. Получают две партии в параллельных реакциях. Две партии из параллельных реакций объединяют и промывают раствором насыщенного NH4Cl (80 мл), солевым раствором (80 мл) и разделяют, органический слой концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил(2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-5-[трет-бутил(дифенил)силил]окси-пентаноата (I-433) (8,2 г) в виде бесцветного масла. ЖХМС m/z 665,4 (M+23)+.
К раствору трет-бутил(2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-5-[трет-бутил(дифенил)силил]окси-пентаноата (3,5 г, 5,44 ммоль) в ТГФ (22 мл) добавляют TBAF (1M, 10,89 мл, 2 экв) при 25°C. Смесь перемешивают при 25°C в течение 0,5 ч. Реакционную смесь концентрируют в вакууме для удаления большей части ТГФ, разбавляют раствором NH4Cl (40 мл) и экстрагируют EtOAc (30 мл x 2). Объединенные органические слои промывают солевым раствором (40 мл x 2), затем сушат над Na2SO4 и фильтруют, и фильтрат концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил(2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-5-гидрокси-пентаноата (I-434) (3,4 г) в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 4,75-5,03 (м, 1H), 3,68 (шс, 2H), 3,45-3,61 (м, 1H), 3,09-3,44 (м, 2H), 2,80-3,05 (м, 5Н), 1,84-2,00 (м, 2H), 1,61-1,78 (м, 3H), 1,39-1,48 (м, 18H).
К раствору трет-бутил (2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-5-гидрокси-пентаноата (2,9 г, 7,17 ммоль) в CH2Cl2 (25 мл) добавляют DMP (1,82 г, 4,30 ммоль, 1,33 мл) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч и дополнительный DMP (1,82 г, 4,30 ммоль, 1,33 мл) добавляют к реакционной смеси при 0°C. Смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь фильтруют, и фильтровальную лепешку промывают CH2Cl2 (20 мл x 3). Фильтрат промывают смесью раствора NaHCO3 (50 мл) и Na2SO3 (50 мл), разделяют, и органической слой промывают насыщенным солевым раствором (40 мл x 2), сушат над Na2SO4, фильтруют, и фильтрат концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил (2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-5-оксо-пентаноата (I-435) (1,4 г, 49% выход) в виде бесцветного масла.
К раствору 2-диизопропоксифосфорил-N, N-диметил-ацетамида (786,59 мг, 3,13 ммоль) в ТГФ (7 мл) добавляют t-BuOK (292,74 мг, 2,61 ммоль) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. Затем раствор трет-бутил (2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-5-оксо-пентаноата (0,7 г, 1,74 ммоль, 1 экв) в ТГФ (4 мл) добавляют в реактор выше при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. Получают две партии в параллельных реакциях. Две параллельных партии реакционной смеси объединяют и выливают в ледяной водный раствор NH4Cl (60 мл), экстрагируют EtOAc (50 мл x 3) и разделяют. Объединенные органические слои промывают солевым раствором (70 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют в вакууме с получением остатка. Остаток и неочищенный продукт из предыдущего эксперимента очищают колоночной хроматографией с получением трет-бутил (E,2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-7-(диметиламино)-7-оксо-гепт-5-еноата (I-436) (1,4 г, 85% выход) в виде бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 6,77-6,91 (м, 1H), 6,29 (ш дд, J=15,10, 6,79 Гц, 1H), 4,81-4,97 (м, 1H), 3,16-3,59 (м, 4 H), 3,07 (с, 3H), 2,93-3,03 (м, 6H), 2,90 (шс, 3H), 2,33 (кв, J=7,13 Гц, 2H), 1,91-2,02 (м, 2H), 1,40-1,51 (м, 18H).
К раствору трет-бутил (E,2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-7-(диметиламино)-7-оксо-гепт-5-еноата (1,5 г, 3,18 ммоль) в ДХМ (8 мл) добавляют ТФК (13,20 г, 115,77 ммоль, 8,57 мл) при 25°C. Смесь перемешивают при 25°C в течение 1 ч. Реакционную смесь концентрируют в вакууме с получением (E,2S)-7-(диметиламино)-2-[метил-[2-(метиламино)этил]карбамоил]окси-7-оксо-гепт-5-еновой кислоты (1,37 г, неочищенный, соль ТФК) в виде светло-красного масла. Смесь трет-бутил (E,2S)-7-(диметиламино)-2-[метил-[2-(метиламино)этил]карбамоил]окси-7-оксо-гепт-5-еноата (1,37 г, ТФК) и HCl/диоксана (8M, 150,55 мл) перемешивают при 25°C в течение 0,5 ч. Реакционную смесь концентрируют в вакууме с получением трет-бутил (E,2S)-7-(диметиламино)-2-[метил-[2-(метиламино)этил]карбамоил]окси-7-оксо-гепт-5-еноата (I-437) (1,15 г, HCl соль) в виде светло-красного масла. ЖХМС m/z 316,0 (M+1)+.
К раствору (E,2S)-7-(диметиламино)-2-[метил-[2-(метиламино)этил]карбамоил]окси-7-оксо-гепт-5-еновой кислоты (1,15 г, 3,27 ммоль, HCl) в CH2Cl2 (12 мл) добавляют Boc2O (1,43 г, 6,54 ммоль, 1,50 мл) и DIEA (844,90 мг, 6,54 ммоль, 1,14 мл) при 25°C. Смесь перемешивают при 25°C в течение 16 ч. Реакционную смесь концентрируют в вакууме, разбавляют K2CO3 (2N, 25 мл) и экстрагируют EtOAc (30 мл). Водную фазу доводят pH=5 раствором HCl (1N), затем экстрагируют EtOAc (25 мл x 3), промывают насыщенным солевым раствором (40 мл x 2), сушат Na2SO4, фильтруют и концентрируют в вакууме с получением (E,2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-7-(диметиламино)-7-оксо-гепт-5-еновой кислоты (I-438) (1,17 г, 86% выход) в виде светло-желтого масла. ЖХМС m/z 414,1 (M-1)+.
Пример 48:

К раствору 3-амино-1-[(5-фтор-1-метил-индол-2-ил)метил]пиридин-2-она (110 мг, 405,47 мкмоль) в ДМФ (4 мл) добавляют (E,2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-7-(диметиламино)-7-оксо-гепт-5-еновой кислоты (336,93 мг, 810,94 мкмоль), DIEA (262,02 мг, 2,03 ммоль, 353,13 мкл) и HATU (308,34 мг, 810,94 мкмоль) при 25°C. Смесь перемешивают при 25°C в течение 16 ч. Реакционную смесь разбавляют насыщенным раствором NH4Cl (25 мл) и экстрагируют EtOAc (15 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (25 мл), сушат над Na2SO4 и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-индол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-[2-[трет-бутоксикарбонил(метил)амино]этил]-N-метил-карбамата (Соединение 351) (27 мг, 9% выход) в виде серого твердого вещества. ЖХМС m/z 669,2 (M+1)+.
К раствору [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-индол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-[2-[трет-бутоксикарбонил(метил)амино]этил]-N-метил-карбамата (30 мг, 44,86 мкмоль) в ДХМ (2 мл) добавляют ТФК (2,89 мг, 25,32 мкмоль, 1,88 мкл) при 25°C. Смесь перемешивают при 25°C в течение 1 ч. Смесь концентрируют в вакууме с получением [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-индол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-метил-N-[2-(метиламино)этил]карбамата (I-439) (35 мг, соль ТФК) в виде светло-коричневого масла.
К раствору [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-индол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-метил-N-[2-(метиламино)этил]карбамата (35 мг, 51,27 мкмоль, ТФК) в MeOH (2 мл) добавляют TEA (5,19 мг, 51,27 мкмоль, 7,14 мкл) и параформальдегид (4 мг) при 25°C. Реакционную смесь перемешивают при 25°C в течение 1 ч. NaBH3CN (6,44 мг, 102,54 мкмоль) добавляют к реакционной смеси. Смесь перемешивают при 25°C в течение 1 ч. Реакционную смесь гасят добавлением H2O (5 мл) и концентрируют в вакууме для удаления большей части MeOH. Затем смесь экстрагируют EtOAc (4 мл x 3) и объединенный органический слой промывают насыщенным солевым раствором (5 мл), сушат над Na2SO4 и концентрируют в вакууме с получением остатка. Остаток очищают преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[1-[(5-фтор-1-метил-индол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-2-(диметиламино)этил]-N-метил-карбамата (Соединение 352) (6,6 мг, 21% выход) в виде белого твердого вещества. ЖХМС m/z 583,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,40 (шс, 1H), 8,13-8,26 (м, 2H), 7,45 (шд, J=3,53 Гц, 2H), 7,25 (шд, J=8,82 Гц, 1H), 6,93-7,03 (м, 1H), 6,60-6,70 (м, 1H), 6,31-6,44 (м, 2H), 6,27 (шд, J=7,72 Гц, 1H), 5,40 (шс, 2H), 5,11 (шс, 1H), 3,76 (с, 3H), 2,98 (шс, 4 H), 2,83 (шс, 4 H), 2,38 (шд, J=6,17 Гц, 1H), 2,25-2,34 (м, 2H), 2,18 (шд, J=16,32 Гц, 6H), 1,95 (шс, 2H).
Пример 49:

К раствору 7-метил-1H-индола (1,0 г, 7,62 ммоль), DMAP (931 мг, 7,62 ммоль,) и Et3N (2,31 г, 22,9 ммоль) в MeCN (20 мл) добавляют Boc2O (1,83 г, 8,38 ммоль). Смесь перемешивают при 20°C в течение 16 ч. Смесь концентрируют, и остаток разбавляют EtOAc (100 мл). Полученный раствор промывают HCl (20 мл, 1M), NaHCO3 (20 мл, 1M) и солевым раствором (20 мл). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением трет-бутил 7-метил-1H-индол-1-карбоксилата (I-441) (1,7 г) в виде желтого масла.1H ЯМР (400 МГц, ДМСО-d6) δ 7,52 (д, J=3,6 Гц, 1H), 7,39 (д, J=7,4 Гц, 1H), 7,19-7,08 (м, 2H), 6,53 (д, J=3,6 Гц, 1H), 2,65 (с, 3H), 1,64 (с, 9H).
К раствору трет-бутил 7-метил-1H-индол-1-карбоксилата (800 мг, 3,46 ммоль) и BPO (83,8 мг, 0,346 ммоль) в CCl4 (10 мл) добавляют NBS (615 мг, 3,46 ммоль). Смесь перемешивают при 80°C в течение 2H под N2 атмосферой. Смесь концентрируют и очищают хроматографией на силикагеле с получением трет-бутил 7-(бромметил)-1H-индол-1-карбоксилата (I-442) (1,1 г) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,60-7,52 (м, 2H), 7,31-7,27 (м, 1H), 7,23-7,17 (м, 1H), 6,59 (д, J=3,6 Гц, 1H), 5,25 (с, 2H), 1,68 (с, 9H).
К раствору 3-нитропиридин-2(1H)-она (150 мг, 1,07 ммоль) и трет-бутил 7-(бромметил)-1H-индол-1-карбоксилата (332 мг, 1,07 ммоль) в ДМФ (5 мл) добавляют K2CO3 (444 мг, 3,21 ммоль). Смесь перемешивают при 30°C в течение 16 ч. Смесь разбавляют EtOAc (100 мл) и промывают насыщенным солевым раствором (30 мл х 2). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением трет-бутил трет-бутил 7-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (I-443) (300 мг, 76% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 8,35 (дд, J=7,8, 2,0 Гц, 1H), 7,67 (дд, J=6,8, 2,0 Гц, 1H), 7,63-7,58 (м, 2H), 7,29 (д, J=7,8 Гц, 1H), 7,09 (д, J=7,4 Гц, 1H), 6,64 (д, J=3,8 Гц, 1H), 6,23 (дд, J=7,6, 6,8 Гц, 1H), 5,77 (с, 2H), 1,60 (с, 9H).
К раствору трет-бутил 7-((3-нитро-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (300 мг, 0,813 ммоль) в MeOH (10 мл) добавляют влажный Pd/C (100 мг, 10% чистота) под N2 атмосферой. Смесь перемешивают при 20°C в течение 0,25 ч под H2 (15 ф./кв.д.). Реакционную смесь фильтруют, и фильтрат концентрируют с получением трет-бутил 7-((3-амино-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (I-444) (300 мг) в виде желтого масла.
К раствору (S, E)-7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (100 мг, 0,434 ммоль) и трет-бутил 7-((3-амино-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (147 мг, 0,434 ммоль) в ДМФ (2 мл) добавляют HATU (248 мг, 652 ммоль) и DIPEA (168 мг, 1,30 ммоль) при 0°C. Смесь перемешивают при 20°C в течение 16 ч. Полученный раствор концентрируют и очищают преп-ТСХ и преп-ЖХВД с получением (S, E)-трет-бутил 7-((3-(7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-енамидо)-2-оксопиридин-1(2H)-ил)метил)-1H-индол-1-карбоксилата (Соединение 353) (6,6 мг, 2% выход) в виде белого твердого вещества. ЖХМС m/z 552,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,28 (с, 1H), 8,26 (д, J=7,2 Гц, 1H), 7,78-7,68 (м, 2H), 7,55 (д, J=7,6 Гц, 1H), 7,39 (д, J=6,4 Гц, 1H), 7,33 (шс, 1H), 7,18 (т, J=7,6 Гц, 1H), 6,88 (шс, 1H), 6,74 (д, J=3,6 Гц, 1H), 6,67 (д, J=7,2 Гц, 1H), 6,62-6,53 (м, 1H), 6,31 (т, J=7,2 Гц, 1H), 5,84 (д, J=15,6 Гц, 1H), 5,63-5,51 (м, 2H), 4,24-4,13 (м, 1H), 3,55 (с, 3H), 2,23-2,12 (м, 2H), 1,91-1,80 (м, 1H), 1,73-1,65 (м, 1H), 1,59 (с, 9H).
Синтез промежуточного соединения I-453:

К раствору 2-амино-6-бром-фенола (5,00 г, 26,6 ммоль) в EtOH (10 мл) добавляют по каплям 2-хлор-1,1,1-триметоксиэтан (4,32 г, 27,9 ммоль) при 30°C. Смесь перемешивают при 80°C в течение 3 ч и концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением 7-бром-2-(хлорметил)бензо[d]оксазола (I-446) (6,10 г, 93% выход) в виде желтого масла.
К раствору 7-бром-2-(хлорметил)бензо[d]оксазола (3,50 г, 14,2 ммоль) в ДМФ (20 мл) добавляют KOAc (2,09 г, 21,3 ммоль) и KI (236 мг, 1,42 ммоль). Смесь перемешивают при 60°C в течение 12 часов. Смесь разбавляют EtOAc (40 мл) и солевым раствором (50 мл). Органической слой концентрируют в вакууме с получением (7-бромбензо[d]оксазол-2-ил)метилацетата (I-447) (3,70 г, 96% выход) в виде желтого масла.
К раствору (7-бромбензо[d]оксазол-2-ил)метилацетата (4,00 г, 14,8 ммоль) в MeOH (36 мл) и H2O (4 мл) добавляют K2CO3 (4,91 г, 35,5 ммоль) при 0°C. Смесь перемешивают при 30°C в течение 2 часов. Полученную суспензию фильтруют, и фильтрат концентрируют с получением (7-бромбензо[d]оксазол-2-ил)метанола (I-448) (3,10 г, 92% выход) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,66 (дд, J= 8,0,1,2 Гц, 1H), 7,50 (д, J= 8,0 Гц, 1H), 7,24 (т, J=8,0 Гц, 1H), 4,98 (д, J=5,6 Гц, 2H), 3,60-3,50 (с, 1H).
К раствору (7-бромбензо[d]оксазол-2-ил)метанола (2,90 г, 12,7 ммоль) и 4,4,5,5-тетраметил-2-(2-метилпроп-1-ен-1-ил)-1,3,2-диоксаборолана (4,63 г, 25,4 ммоль) в диоксане (40 мл) и H2O (8 мл) добавляют Cs2CO3 (7,46 г, 22,9 ммоль) и дитрет-бутил(циклопентил)фосфан;дихлорпалладий;железо (829 мг, 1,27 ммоль). Смесь перемешивают при 85°C в течение 12 часов и концентрируют. Остаток очищают хроматографией на силикагеле с получением (7-(2-метилпроп-1-ен-1-ил)бензо[d]оксазол-2-ил)метанола (I-449) (3,00 г) в виде красного масла.
К раствору (7-(2-метилпроп-1-ен-1-ил)бензо[d]оксазол-2-ил)метанола (1,00 г, 4,92 ммоль) в MeOH (20 мл) добавляют Pd/C (400 мг, 10% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 три раза. Смесь перемешивают под H2 (15 ф./кв.д.) атмосферой при 30°C в течение 30 мин. Полученную суспензию фильтруют, и фильтрат концентрируют с получением (7-изобутилбензо[d]оксазол-2-ил)метанола (I-450) (1,00 г) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,58 (дд, J= 7,6, 0,8 Гц, 1H), 7,31-7,28 (м, 1H), 7,15 (д, J=7,2 Гц, 1H), 4,96 (с, 2H), 3,27 (с, 1H), 2,78 (д, J=7,2 Гц, 2H), 2,16-2,06 (м, 1H), 0,97 (д, J=6,4 Гц, 6H).
К раствору (7-изобутилбензо[d]оксазол-2-ил)метанола (1,00 г, 4,87 ммоль) в ДХМ (10 мл) добавляют Et3N (986 мг, 9,74 ммоль) и MsCl (660 мг, 5,76 ммоль) при 0°C. Смесь перемешивают при 30°C в течение 1 часа и концентрируют с получением (7- изобутилбензо[d]оксазол-2-ил)метилметансульфоната (I-451) (900 мг, 65% выход) в виде желтого масла.
К раствору (7-изобутилбензо[d]оксазол-2-ил)метилметансульфоната (900 мг, 3,18 ммоль) и 3-нитропиридин-2(1H)-она (668 мг, 4,77 ммоль) в CH3CN (10 мл) добавляют Et3N (644 мг, 6,36 ммоль). Смесь перемешивают при 30°C в течение 12 часов и концентрируют. Остаток очищают хроматографией на силикагеле с получением 1-((7-изобутилбензо[d]оксазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-452) (300 мг, 29% выход) в виде желтого твердого вещества.
К раствору 1-((7-изобутилбензо[d]оксазол-2-ил)метил)-3-нитропиридин-2(1H)-она (300 мг, 917 мкмоль) в MeOH (10 мл) добавляют Pd/C (100 мг, 10% чистота) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 три раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 30°C в течение 0,5 ч. Полученную суспензию фильтруют, и фильтрат концентрируют с получением 3-амино-1-((7-изобутилбензо[d]оксазол-2-ил)метил)пиридин-2(1H)-она (I-453) (220 мг, 81% выход) в виде желтого масла.
Следующие промежуточные соединения получают согласно методикам, описанным для синтеза I-453 с применением подходящих реагентов.
Пример 50:

К раствору 3-амино-1-((7-изобутилбензо[d]оксазол-2-ил)метил)пиридин-2(1H)-она (110 мг, 370 мкмоль) и (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (191 мг, 740 мкмоль) в ДМФ (3 мл) добавляют DIPEA (143 мг, 1,11 ммоль) и HATU (352 мг, 925 мкмоль) при 0°C. Смесь перемешивают при 30°C в течение 3 ч. Полученный раствор разбавляют EtOAc (30 мл) и промывают насыщенным солевым раствором (20 мл х 2). Органическую фазу концентрируют в вакууме с получением остатка. Остаток очищают преп-ЖХВД и преп-ТСХ с получением (S, E)-метил (7-(диметиламино)-1-((1-((7-изобутилбензо[d]оксазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 357) (15,0 мг, 7% выход) в виде белого твердого вещества. ЖХМС m/z 538,1 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,28 (с, 1H), 8,28 (дд, J= 7,2, 1,6 Гц, 1H), 7,71 (д, J= 8,0 Гц, 1H), 7,61 (дд, J= 6,8, 1,6 Гц, 1H), 7,51 (д, J= 7,2 Гц, 1H), 7,27 (т, J=7,6 Гц, 1H), 7,18 (д, J= 6,8 Гц, 1H), 6,64-6,55 (м, 1H), 6,43-6,33 (м, 2H), 5,51 (с, 2H), 4,23-4,13 (м, 1H), 3,53 (с, 3H), 2,98 (с, 3H), 2,83 (с, 3H), 2,70 (д, J=7,2 Гц, 2H), 2,30-2,14 (м, 2H), 2,08-1,94 (м, 1H), 1,92-1,80 (м, 1H), 1,77-1,64 (м, 1H), 0,87 (д, J=6,4 Гц, 6H).
Следующие соединения получают согласно методикам, описанным в Примере 50 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-465:
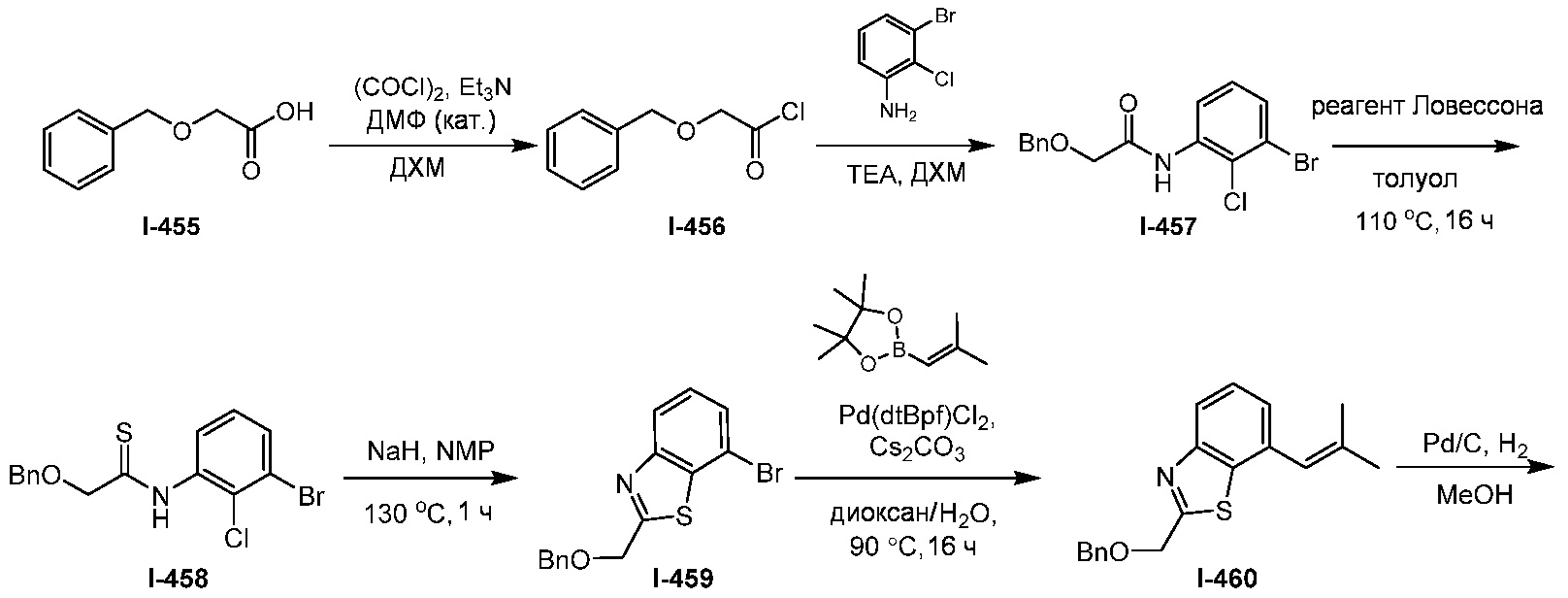

К раствору 2-бензилоксиуксусной кислоты (25,0 г, 150 ммоль) и ДМФ (219 мг, 3,01 ммоль) в ДХМ (250 мл) добавляют (COCl)2 (28,64 г, 225 ммоль) при 0°C. Смесь перемешивают при 20°C в течение 2 ч. Полученный раствор концентрируют при пониженном давлении при 20°C с получением 2-бензилоксиацетилхлорида (I-456) (60,0 г, неочищенный, две партии) в виде бесцветного масла которое применяют на следующей стадии без дальнейшей очистки.
К раствору 3-бром-2-хлор-анилина (17,5 г, 84,7 ммоль) и Et3N (17,1 г, 169 ммоль) в ДХМ (50 мл) добавляют 2-(бензилокси)ацетилхлорид (29,6 г, 144 ммоль) при 0°C. Смесь перемешивают при 20°C в течение 16 ч. Полученный раствор гасят ледяной водой (100 мл) при 0°C и экстрагируют ДХМ (300 мл х 3). Объединенные органические слои промывают раствором лимонной кислоты (10%, 300 мл х 2) и солевым раствором (300 мл х 2). Органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 2-(бензилокси)-N-(3-бром-2-хлорфенил)ацетамида (I-457) (80,0 г, неочищенный, две партии), который применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 353,9, 355,9 (M+1)+.
К раствору 2-(бензилокси)-N-(3-бром-2-хлорфенил)ацетамида (40,0 г, 112 ммоль) в толуоле (500 мл) добавляют 2,4-бис(4-метоксифенил)-2,4-дитиоксо-1,3,2,4-дитиадифосфетан (41,0 г, 101 ммоль). Смесь перемешивают при 110°C в течение 16 ч. Полученную суспензию фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 2-(бензилокси)-N-(3-бром-2-хлорфенил)этантиоамида (I-458) (52,0 г) в виде зеленого твердого вещества. ЖХМС m/z 371,8 (M+1)+.1H ЯМР (400 МГц, CDCl3) δ 10,48 (с, 1H), 8,91 (дд, J=8,0, 1,2 Гц, 1H), 7,55 (дд, J=8,0, 1,2 Гц, 1H), 7,42-7,34 (м, 5H), 7,23 (т, J=8,0 Гц, 1H), 4,74 (с, 2H), 4,52 (с, 2H).
К раствору 2-(бензилокси)-N-(3-бром-2-хлорфенил)этантиоамида (42,0 г, 113 ммоль) в NMP (400 мл) добавляют NaH (5,89 г, 147 ммоль) при 20°C. Смесь перемешивают при 130°C в течение 1 ч. Полученный раствор разбавляют водой (800 мл) и экстрагируют EtOAc (800 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (800 мл х 4), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((бензилокси)метил)-7-бромбензо[d]тиазола (I-459) (26,0 г, 69% выход) в виде коричневого масла.1H ЯМР (400 МГц, CDCl3) δ 7,94 (д, J=8,0 Гц, 1H), 7,53 (д, J=8,0 Гц, 1H), 7,45-7,33 (м, 6H), 4,94 (с, 2H), 4,75 (с, 2H).
К раствору 2-((бензилокси)метил)-7-бромбензо[d]тиазола (6,80 г, 20,3 ммоль), 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (9,26 г, 50,88 ммоль) и Cs2CO3 (13,3 г, 40,7 ммоль) в диоксане (100 мл)/H2O (10,0 мл) добавляют дитрет-бутил(циклопентил)фосфан;дихлорпалладий;железо (1,33 г, 2,03 ммоль) под N2 атмосферой. Смесь перемешивают при 90°C в течение 16 ч. Полученный раствор разбавляют водой (200 мл) и экстрагируют EtOAc (300 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (300 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((бензилокси)метил)-7-(2-метилпроп-1-ен-1-ил)бензо[d]тиазола (I-460) (3,80 г, 60% выход) в виде желтого масла. ЖХМС m/z 310,1 (M+1)+.
К раствору 2-((бензилокси)метил)-7-(2-метилпроп-1-ен-1-ил)бензо[d]тиазола (3,80 г, 12,3 ммоль) в MeOH (40 мл) добавляют Pd/C (400 мг, 12,3 ммоль). Смесь перемешивают при 25°C в течение 2 дней под H2 атмосферой (15 ф./кв.д.). Реакционную смесь фильтруют и концентрируют при пониженном давлении с получением 2-((бензилокси)-метил)-7-изобутилбензо[d]тиазола (I-461) (3,50 г, 91% выход) в виде желтого масла. ЖХМС m/z 312,0 (M+1)+.
К раствору 2-((бензилокси)метил)-7-изобутилбензо[d]тиазола (3,50 г, 11,24 ммоль) в ДХМ (40 мл) добавляют BBr3 (5,63 г, 22,48 ммоль) при -78°C. Смесь перемешивают при -78°C в течение 1,5 ч под N2 атмосферой. Реакционную смесь гасят водой (20 мл) при -78°C и экстрагируют EtOAc (30 мл х 3). Объединенные органические слои промывают насыщенным NaHCO3 (30 мл х 2), промывают насыщенным солевым раствором (30 мл х 2) и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением (7-изобутилбензо[d]тиазол-2-ил)-метанола (I-462) (2,00 г, 80% выход) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 7,85 (д, J=8,0 Гц, 1H), 7,42 (т, J=8,0 Гц, 1H), 7,17 (д, J=7,2 Гц, 1H), 5,08 (д, J=4,8 Гц, 2H), 3,18-3,12 (м, 1H), 2,74 (д, J=7,2 Гц, 2H), 2,17-2,08 (м, 1H), 0,96 (д, J=6,4 Гц, 6H).
К раствору (7-изобутилбензо[d]тиазол-2-ил)метанола (2,00 г, 9,04 ммоль) и TEA (1,83 г, 18,08 ммоль) в ДХМ (30,0 мл) добавляют MsCl (1,55 г, 13,56 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 1,5 ч. Реакционную смесь разбавляют солевым раствором (20 мл) и экстрагируют ДХМ (30 мл х 3). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 3,00 г (7-изобутилбензо[d]тиазол-2-ил)метилметансульфоната (I-463), который применяют на следующей стадии без дальнейшей очистки.
К раствору Et3N (1,83 г, 18,0 ммоль) и 3-нитро-1H-пиридин-2-она (1,90 г, 13,5 ммоль) в MeCN (40 мл) добавляют (7-изобутилбензо[d]тиазол-2-ил)метилметансульфонат (3,00 г, 9,02 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 16 ч. Реакционную смесь разбавляют водой (60 мл) и экстрагируют EtOAc (80 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (80 мл х 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением 1-((7-изобутилбензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-464) (900 мг, 29% выход) в виде желтого масла. ЖХМС m/z 305,1 (M+1)+.
К раствору 1-((7-изобутилбензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (900 мг, 2,62 ммоль) в MeOH (20 мл) добавляют Pd/C (100 мг, 2,62 ммоль). Смесь перемешивают при 25°C в течение 0,5 ч под H2 (15 ф./кв.д.). Реакционную смесь фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 3-амино-1-((7-изобутилбензо[d]тиазол-2-ил)метил)пиридин-2(1H)-она (I-465) (780 мг, 95% выход) в виде желтого масла. ЖХМС m/z 314,0 (M+1)+.1H ЯМР (400 МГц, CDCl3) δ 7,87 (д, J=8,0 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 7,16 (д, J=7,2 Гц, 1H), 6,96 (дд, J=6,8, 1,6 Гц, 1H), 6,56 (дд, J=7,2, 1,6 Гц, 1H), 6,13 (т, J=7,2 Гц, 1H), 5,55 (с, 2H), 4,32-4,26 (м, 2H), 2,69 (д, J=7,6 Гц, 2H), 2,13-2,06 (м, 1H), 0,92 (д, J=6,4 Гц, 6H).
Пример 51:

К раствору (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (124 мг, 479 мкмоль) и 3-амино-1-((7-изобутилбензо[d]тиазол-2-ил)метил)пиридин-2(1H)-она (100 мг, 319 мкмоль) в ДМФ (3 мл) добавляют HATU (146 мг, 383 мкмоль) и DIPEA (124 мг, 957 мкмоль, 167 мкл) при 0°C. Раствор перемешивают при 25°C в течение 16 ч. Полученный раствор концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил (7-(диметиламино)-1-((1-((7-изобутилбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 363) (16,6 мг, 9% выход) в виде белого твердого вещества. ЖХМС m/z 554,4 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,34 (с, 1H), 8,28 (дд, J=7,4, 1,6 Гц, 1H), 7,83 (д, J=7,6 Гц, 1H), 7,72 (д, J=7,8 Гц, 1H), 7,64 (дд, J=6,8, 1,6 Гц, 1H), 7,45 (т, J=7,6 Гц, 1H), 7,25 (д, J=7,2 Гц, 1H), 6,66-6,56 (м, 1H), 6,42-6,34 (м, 2H), 5,67-5,55 (м, 2H), 4,26-4,16 (м, 1H), 3,55 (с, 3H), 2,98 (с, 3H), 2,83 (с, 3H), 2,67 (д, J=7,2 Гц, 2H), 2,30-2,16 (м, 2H), 2,06-1,96 (м, 1H), 1,92-1,80 (м, 1H), 1,79-1,63 (м, 1H), 0,87 (д, J=6,8 Гц, 6H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 51 с применением подходящих реагентов.
Синтез промежуточного соединения I-472:


Смесь 2-((бензилокси)метил)-7-бромбензо[d]тиазола (3 г, 8,9 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (3,4 г, 13,5 ммоль), Pd(dppf)Cl2 (656 мг, 897 мкмоль), KOAc (1,8 г, 17,9 ммоль) в диоксане (20 мл) дегазируют и продувают N2 3 раза. Смесь перемешивают при 90°C в течение 2 ч под N2 атмосферой. Полученный раствор концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 2-((бензилокси)метил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазола (I-466) (3,1 г) в виде желтого масла. ЖХМС m/z 382 (M+1)+.
К раствору 2-((бензилокси)метил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]тиазола (3,1 г, 8,1 ммоль) в ТГФ (30 мл) добавляют H2O2 (9,2 г, 81,3 ммоль, 7,8 мл, 30% чистота) по каплям при 0°C. Смесь перемешивают при 35°C в течение 2 ч. Реакционную смесь гасят насыщенным раствором NaHSO3 (50 мл) и перемешивают при 35°C в течение 30 мин. Полученный раствор экстрагируют ДХМ (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 2-((бензилокси)метил)бензо[d]тиазол-7-ола (I-467) (2,6 г) в виде белого твердого вещества. ЖХМС m/z 272,1 (M+1)+.
К раствору 2-((бензилокси)метил)бензо[d]тиазол-7-ола (2,1 г, 7,6 ммоль) в ДХМ (20 мл) добавляют раствор BBr3 (2,8 г, 11,3 ммоль) в ДХМ (5 мл) при -78°C. Смесь перемешивают при -78°C в течение 2 ч. Полученный раствор гасят водой (20 мл) при -78°C и экстрагируют EtOAс (50 мл х 3). Объединенные органические слои сушат над безводным Na2SO4 и концентрируют при пониженном давлении с получением остатка 1. Водную фазу концентрируют в вакууме с получением остатка 2. Остаток 1 и остаток 2 очищают колоночной хроматографией с получением 2-(гидроксиметил)бензо[d]тиазол-7-ола (I-468) (400 мг) в виде желтого твердого вещества. ЖХМС m/z 182 (M+1)+.
К раствору 2-(гидроксиметил)бензо[d]тиазол-7-ола (300 мг, 1,7 ммоль) и 1-(бромметил)-2,4-дифторбензола (446 мг, 2,2 ммоль) в ДМФ (5 мл) добавляют Cs2CO3 (1,1 г, 3,3 ммоль) и KI (275 мг, 1,7 ммоль). Смесь перемешивают при 30°C в течение 12 ч. Реакционную смесь разбавляют водой (10 мл) и экстрагируют EtOAc(10 мл х3). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением (7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метанола (I-469) (600 мг) в виде желтого масла. ЖХМС m/z 308 (M+1)+.
К раствору (7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метанола (400 мг, 1,3 ммоль) в ДХМ (5 мл) добавляют DIPEA (336 мг, 2,6 ммоль) и MsCl (194 мг, 1,69 ммоль) при 0°C. Смесь перемешивают при 30°C в течение 1 ч. Реакционную смесь гасят водой (10 мл) при 0°C и экстрагируют ДХМ (10 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением (7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метилметансульфоната (I-470) (260 мг) в виде коричневого масла. ЖХМС m/z 386 (M+1)+.
К раствору (7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метилметансульфонат (260 мг, 674 мкмоль) в CH3CN (4 мл) добавляют 3-нитропиридин-2(1H)-он (123 мг, 877 мкмоль) и DIPEA (174 мг, 1,4 ммоль). Смесь перемешивают при 30°C в течение 12 ч. Смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-471) (300 мг) в виде желтого твердого вещества. ЖХМС m/z 430 (M+1)+.
К раствору 1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (300 мг, 698,6 мкмоль) в MeOH (10 мл) добавляют Pd/C (10%, 30 мг) под N2 атмосферой. Суспензию дегазируют под вакуумом и продувают H2 три раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 30°C в течение 20 мин. Полученную суспензию фильтруют и фильтрат концентрируют с получением 3-амино-1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)пиридин-2(1H)-он (I-472) (120 мг) в виде желтого твердого вещества. ЖХМС m/z 400 (M+1)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-472 с применением подходящих реагентов.
Пример 52:


К раствору 3-амино-1-((7-((2,4-дифторбензил)оксибензо[d]тиазол-2-ил)метил)пиридин-2(1H)-она (130 мг, 293 мкмоль) и (S, E)-2-((трет-бутоксикарбонил)амино)-7-(диметиламино)-7-оксогепт-5-еновой кислоты (176 мг, 586 мкмоль) в ДМФ (3 мл) добавляют HATU (223 мг, 586 мкмоль) и DIPEA (113 мг, 878 мкмоль) при 0°C. Смесь перемешивают при 30°C в течение 12 ч. Смесь разбавляют водой (15 мл) и экстрагируют EtOAc (10 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (10 мл х 3), сушат над безводным Na2SO4 и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ и преп-ЖХВД с получением (S, E)-трет-бутил (1-((1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 366) (18 мг) в виде белого твердого вещества. ЖХМС m/z 682,2 (M+1)+.
К раствору (S, E)-трет-бутил (1-((1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (73 мг, 107 мкмоль) в ДХМ (3 мл) добавляют ТФК (1,5 г, 13,5 ммоль, 1,00 мл) при 0°C. Смесь перемешивают при 20°C в течение 1 ч. Смесь концентрируют в вакууме с получением (S, E)-6-амино-N7-(1-((7-((2,4-дифторбензил) окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (I-477) (62 мг) в виде коричневого масла. ЖХМС m/z 582,2 (M+1)+.
К раствору оксазол-2-карбоновой кислоты (18 мг, 160 мкмоль) в ДМФ (2 мл) добавляют HATU (81 мг, 213 мкмоль), DIPEA (41 мг, 320 мкмоль) и (S, E)-6-амино-N7-(1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметилгепт-2-ендиамида (62 мг, 106 мкмоль) при 0°C. Смесь перемешивают при 30°C в течение 2 ч. Смесь концентрируют и остаток очищают преп-ЖХВД с получением (S, E)-N7-(1-((7-((2,4-дифторбензил)окси)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)-N1,N1-диметил-6-(оксазол-2-карбоксамидо)гепт-2-ендиамида (Соединение 367) (39 мг) в виде светло-зеленого твердого вещества. ЖХМС m/z 677,1 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,51 (с, 1H), 9,27 (д, J=8,0 Гц, 1H), 8,35 (с, 1H), 8,26 (д, J=6,8 Гц, 1H), 7,68-7,57 (м, 3H), 7,52-7,43 (м, 2H), 7,37-7,27 (м, 1H), 7,30-7,12 (м, 2H), 6,66-6,59 (м, 1H), 6,39-6,36 (м, 2H), 5,59 (с, 2H), 5,31 (с, 2H), 4,72-4,64 (м, 1H), 2,96 (с, 3H), 2,82 (с, 3H), 2,35-2,16 (м, 2H), 2,06-1,91 (м, 2H).
Следующие соединения получают согласно методикам, описанным в Примере 52 с применением подходящих промежуточных соединений.
Пример 53:

Смесь 5-фтор-2-метилбензо[d]тиазола (1 г, 5,98 ммоль), NBS (958 мг, 5,38 ммоль), AIBN (250 мг, 1,52 ммоль) в CCl4 (25 мл) дегазируют и продувают N2 3 раза и затем смесь перемешивают при 80°C в течение 16 ч под N2 атмосферой. Реакционную смесь фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией и преп-ТСХ с получением 2-(бромметил)-5-фторбензо[d]тиазола (I-479) (0,24 г, 0,917 ммоль, 15% выход) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,83-7,79 (м, 1H), 7,70 (дд, J=9,2, 2,0 Гц, 1H), 7,23-7,18 (м, 1H), 4,79 (с, 2H).
К раствору 2-(бромметил)-5-фторбензо[d]тиазола (240 мг, 0,917ммоль) и 3-нитро-1H-пиридин-2-она (193 мг, 1,38 ммоль) в CH3CN (5 мл) добавляют DIPEA (237 мг, 1,83 ммоль). Смесь перемешивают при 25°C в течение 16 часов. Реакционную смесь концентрируют в вакууме с получением остатка. Остаток очищают колоночной хроматографией с получением 1-((5-фторбензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-480) (240 мг) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,38 (дд, J=7,6, 2,0 Гц, 1H), 7,98 (дд, J=6,8, 1,6 Гц, 1H), 7,83-7,79 (м, 1H), 7,67 (дд, J=9,2, 2,4 Гц, 1H), 7,24-7,18 (м, 1H), 6,40 (т, J=7,2 Гц, 1H), 5,59 (с, 2H).
К раствору 1-((5-фторбензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (240 мг, 0,786 ммоль) в MeOH (50 мл) добавляют влажный Pd/C (100 мг, 10% чистота). Суспензию дегазируют под вакуумом и продувают H2 в 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 15°C в течение 0,5 ч. Полученную суспензию фильтруют, и фильтрат концентрируют в вакууме с получением 3-амино-1-((5-фторбензо[d]тиазол-2-ил)метил)пиридин-2(1H)-она (I-481) (160 мг) в виде желтого твердого вещества. ЖХМС m/z 276,0 (M+1)+.
К раствору 3-амино-1-((5-фторбензо[d]тиазол-2-ил)метил)пиридин-2(1H)-она (100 мг, 0,363 ммоль) и (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (113 мг, 0,436 ммоль) в ДМФ (5 мл) добавляют HATU (276 мг, 0,726 ммоль) и DIPEA (141 мг, 1,09 ммоль) при 0°C. Смесь перемешивают при 25°C в течение 16 ч. Реакционную смесь концентрируют в вакууме с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-метил(7-(диметиламино)-1-((1-((5-фторбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 382) (133,8 мг, 70% выход) в виде желтого твердого вещества. ЖХМС m/z 516,1 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,34 (с, 1H), 8,28 (дд, J=7,2, 1,2 Гц, 1H), 8,12 (дд, J=8,8, 5,2 Гц, 1H), 7,84 (дд, J=9,6, 2,4 Гц, 1H), 7,73 (д, J=7,6 Гц, 1H), 7,64 (дд, J=7,2, 2,0 Гц, 1H), 7,38-7,33 (м, 1H), 6,67-6,52 (м, 1H), 6,45-6,30 (м, 2H), 5,69-5,54 (м, 2H), 4,26-4,15 (м, 1H), 3,54 (с, 3H), 2,99 (с, 3H), 2,83 (с, 3H), 2,30-2,10 (м, 2H), 1,94-1,61 (м, 2H).
Следующие соединения получают согласно методикам, описанным для Примера 53 с применением подходящих реагентов.
Синтез промежуточного соединения I-495:

К раствору 2-хлор-3-нитробензойной кислоты (25,0 г, 124 ммоль) в MeOH (200 мл) добавляют H2SO4 (9,20 г, 93,8 ммоль). Смесь перемешивают при 60°C в течение 12 часов. Реакционную смесь концентрируют и разбавляют EtOAc (100 мл), промывают насыщенным NaHCO3 (150 мл). Органическую фазу концентрируют с получением остатка. Остаток очищают ЖХСД с получением метил 2-хлор-3-нитробензоат (I-483) (25,0 г) в виде белого твердого вещества.
К раствору метил 2-хлор-3-нитробензоата (23,0 г, 107 ммоль) в MeOH (100 мл) и H2O (20 мл) добавляют Fe (29,8 г, 533 ммоль) и NH4Cl (45,7 г, 853 ммоль). Смесь перемешивают при 80°C в течение 2 часов. Смесь фильтруют, и фильтрат концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением метил 3-амино-2-хлорбензоата (I-484) (19,0 г) в виде желтого масла.
К раствору 2-бензилоксиуксусной кислоты (18,7 г, 113 ммоль) и метил 3-амино-2-хлорбензоата (19,0 г, 102 ммоль) в CH3CN (100 мл) добавляют пиридин (32,4 г, 409 ммоль) и MsCl (18,4 г, 161 ммоль). Смесь перемешивают при 15°C в течение 12 часов. Реакционную смесь концентрируют с получением остатка. Остаток очищают хроматографией на силикагеле с получением метил 3-(2-(бензилокси)ацетамидо)-2-хлорбензоата (I-485) (30,0 г) в виде желтого масла.
К раствору метил 3-(2-(бензилокси)ацетамидо)-2-хлорбензоата (2,00 г, 5,99 ммоль) в толуоле (20 мл) добавляют Реагент Ловессона (2,42 г, 5,99 ммоль). Смесь перемешивают при 110°C в течение 12 часов. Смесь концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением метил 3-(2-(бензилокси)этантиоамидо)-2-хлорбензоата (I-486) в виде желтого твердого вещества.
К раствору метил 3-[(2-бензилоксиэтантиоил)амино]-2-хлор-бензоата (7,5 г, 21,4 ммоль) в ТГФ (30 мл) добавляют NaH (1,1 г, 27,5 ммоль, 60% чистота) при 0°C. Смесь перемешивают при 60°C в течение 1 ч. Реакционную смесь гасят водой (100 мл) и экстрагируют этилацетатом (120 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением метил 2-((бензилокси)метил)бензо[d]тиазол-7-карбоксилата (I-487) (2,5 г)в виде желтого твердого вещества.
К раствору метил 2-((бензилокси)метил)бензо[d]тиазол-7-карбоксилата (3,5 г, 11,1 ммоль) в ДХМ (20 мл) добавляют BBr3 (5,6 г, 22,3 ммоль). Смесь перемешивают при -70°C в течение 1 ч. Реакционную смесь гасят водой (100 мл), затем насыщенным NaHCO3 (80 мл). Смесь экстрагируют этилацетатом (100 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением метил 2-(гидроксиметил)-1,3-бензотиазол-7-карбоксилата (I-488) (2,0 г) в виде желтого твердого вещества.
К смеси метил 2-(гидроксиметил)-1,3-бензотиазол-7-карбоксилата (2,0 г, 8,9 ммоль) в ДХМ (30 мл) добавляют имидазол (731 мг, 10,7 ммоль) и TBS-Cl (1,6 г, 10,7 ммоль). Смесь перемешивают при 20°C в течение 1 ч. Реакционную смесь гасят водой (100 мл) и экстрагируют ДХМ (100 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением метил 2-(((трет-бутилдиметилсилил)окси)метил)бензо[d]тиазол-7-карбоксилата (I-489) (2,4 г) в виде желтого масла.
К раствору метил 2-(((трет-бутилдиметилсилил)окси)метил)бензо[d]тиазол-7-карбоксилата (1,0 г, 2,9 ммоль) в ТГФ (3,0 мл) добавляют DIBAL-H (1M, 5,9 мл) при -70°C. Смесь перемешивают при 20°C в течение 0,5 ч. Реакционную смесь гасят насыщенным раствором NH4Cl (80 мл) и тетрагидрата тартрата натрия-калия (80 мл). Смесь перемешивают при 20°C в течение 0,5 ч. Реакционную смесь экстрагируют этилацетатом (100 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением (2-(((трет-бутилдиметилсилил)окси)метил)бензо[d]тиазол-7-ил)метанола (I-490) (500 мг) в виде желтого масла.
К раствору (2-(((трет-бутилдиметилсилил)окси)метил)бензо[d]тиазол-7-ил)метанола (400 мг, 1,3 ммоль) и 2,4-дифторфенола (201 мг, 1,6 ммоль) в ТГФ (10 мл) добавляют PPh3 (406 мг, 1,6 ммоль) при 0°C, затем DIAD (313 мг, 1,6 ммоль). Смесь перемешивают при 0-20°C в течение 1 ч. Полученный раствор концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 2-(((трет-бутилдиметилсилил)окси)метил)-7-((2,4-дифторфенокси)метил)бензо[d]тиазола (I-491) (400 мг) в виде желтого масла.
К раствору 2-(((трет-бутилдиметилсилил)окси)метил)-7-((2,4-дифторфенокси)метил)бензо[d]тиазола (440 мг, 1,0 ммоль) в ДХМ (2,0 мл) добавляют ТФК (3,0 мл). Смесь перемешивают при 20°C в течение 10 ч. Реакционную смесь концентрируют с получением (7-((2,4-дифторфенокси)метил)бензо[d]тиазол-2-ил)метанола (I-492) (319 мг) в виде желтого масла. ЖХМС m/z 308,0 (M+1)+.
К смеси (7-((2,4-дифторфенокси)метил)бензо[d]тиазол-2-ил)метанола (340 мг, 1,1 ммоль) в ДХМ (10,0 мл) добавляют MsCl (253 мг, 2,2 ммоль) и DIPEA (286 мг, 2,2 ммоль) одной порцией при 0°C под N2 атмосферой. Смесь перемешивают при 0-30°C в течение 2 часов. Реакционную смесь выливают в воду (100 мл). Полученный раствор экстрагируют этилацетатом (80 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением (7-((2,4-дифторфенокси)метил)бензо[d]тиазол-2-ил)метилметансульфоната (I-493) (420 мг) в виде желтого масла.
К смеси (7-((2,4-дифторфенокси)метил)бензо[d]тиазол-2-ил)метилметансульфоната (100 мг, 306 мкмоль) и 3-нитро-1H-пиридин-2-она (64 мг, 460 мкмоль) в ДМФ (1,0 мл) добавляют DIPEA (79 мг, 614 мкмоль) одной порцией при 30°C. Смесь перемешивают при 70°C в течение 10 ч. Реакционную смесь гасят добавлением воды (80 мл) и экстрагируют этилацетатом (80 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением 1-((7-((2,4-дифторфенокси)метил) бензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-494) (120 мг, 271 мкмоль) в виде желтого масла. ЖХМС m/z 430,0 (M+1)+.
К раствору 1-((7-((2,4-дифторфенокси)метил)бензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (80 мг, 186 мкмоль) в MeOH (10 мл) добавляют Pd/C (30 мг, 10% влажный). Смесь перемешивают при 20°C в течение 1 ч под H2 атмосферой (15 ф./кв.д.). После фильтрации, фильтрат концентрируют с получением 3-амино-1-[[7-[(2,4-дифторфенокси)метил]-1,3-бензотиазол-2-ил]метил]пиридин-2-она (I-495) (70 мг) в виде желтого твердого вещества. ЖХМС m/z 400,0 (M+1)+.
Пример 54:

К раствору 3-амино-1-((7-((2,4-дифторфенокси)метил)бензо[d]тиазол-2-ил)метил)пиридин-2(1H)-она (70 мг, 175 мкмоль) и (S, E)-7-(диметиламино)-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (68 мг, 263 мкмоль) в ДМФ (1,0 мл) добавляют HATU (100 мг, 263 мкмоль) и DIPEA (68 мг, 525 мкмоль). Смесь перемешивают при 0-20°C в течение 10 ч. Фильтрат очищают преп-ЖХВД с получением метил (S, E)-метил (1-((1-((7-((2,4-дифторфенокси)метил)бензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 385) (35 мг, 53 мкмоль) в виде белого твердого вещества. ЖХМС m/z 640,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,34 (с, 1H), 8,28 (дд, J=7,2, 1,6 Гц, 1H), 7,98 (дд, J=6,8, 2,4 Гц, 1H), 7,76-7,71 (м, 1H), 7,65 (дд, J=7,2, 1,6 Гц, 1H), 7,59-7,51 (м, 2H), 7,35-7,25 (м, 2H), 7,04-6,96 (м, 1H), 6,69-6,56 (м, 1H), 6,43-6,31 (м, 2H), 5,70-5,57 (м, 2H), 5,43 (с, 2H), 4,26-4,15 (м, 1H), 3,54 (с, 3H), 2,98 (с, 3H), 2,83 (с, 3H), 2,30-2,16 (м, 2H), 1,91-1,83 (м, 1H), 1,76-1,65 (м, 1H).
Синтез промежуточного соединения I-500:

К раствору этил бензо[d]тиазол-2-карбоксилата (2,5 г, 12,1 ммоль) в MeOH (10 мл) добавляют NaBH4 (1,0 г, 26,5 ммоль). Смесь перемешивают при 25°C в течение 2 ч. Смесь концентрируют с получением остатка. pH остатка доводят до 4~5 добавлением HCl (1M) и результат экстрагируют EtOAc (20 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл) и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением бензо[d]тиазол-2-илметанола (I-497) (2,0 г) в виде белого твердого вещества. ЖХМС m/z 166,0 (M+1)+.
К раствору бензо[d]тиазол-2-илметанола (2,0 г, 12,1 ммоль) в ДХМ (20 мл) добавляют DIPEA (3,91 г, 30,3 ммоль) и MsCl (2,77 г, 24,2 ммоль) при 0°C. Смесь перемешивают при 20°C в течение 12 ч. Полученный раствор выливают в воду (30 мл) и экстрагируют ДХМ (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют с получением бензо[d]тиазол-2-илметилметансульфоната (I-498) (3,0 г) в виде коричневого масла. ЖХМС m/z 244 (M+1)+.
К раствору бензо[d]тиазол-2-илметилметансульфоната (3,0 г, 12,3 ммоль) и 3-нитропиридин-2(1H)-она (2,25 г, 16,0 ммоль) в CH3CN (20 мл) добавляют DIPEA (4,78 г, 37,0 ммоль). Смесь перемешивают при 30°C в течение 12 ч. Смесь концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 1-(бензо[d]тиазол-2-илметил)-3-нитропиридин-2(1H)-она (I-499) (2,0 г) в виде коричневого твердого вещества. ЖХМС m/z 287,9 (M+1)+.
К раствору 1-(бензо[d]тиазол-2-илметил)-3-нитропиридин-2(1H)-она (2,0 г, 6,96 ммоль) в MeOH (30 мл) добавляют Pd/C (10%, 300 мг) под N2 атмосферой. Суспензию дегазируют и продувают H2 3 раза. Смесь перемешивают под H2 атмосферой (15 ф./кв.д.) при 20°C в течение 0,5 ч. Полученную суспензию отфильтровывают, и фильтрат концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением 3-амино-1-(бензо[d]тиазол-2-илметил)пиридин-2(1H)-она (I-500) (300 мг) в виде коричневого твердого вещества. ЖХМС m/z 258,1 (M+1)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-500 с применением подходящих реагентов.
Пример 55:
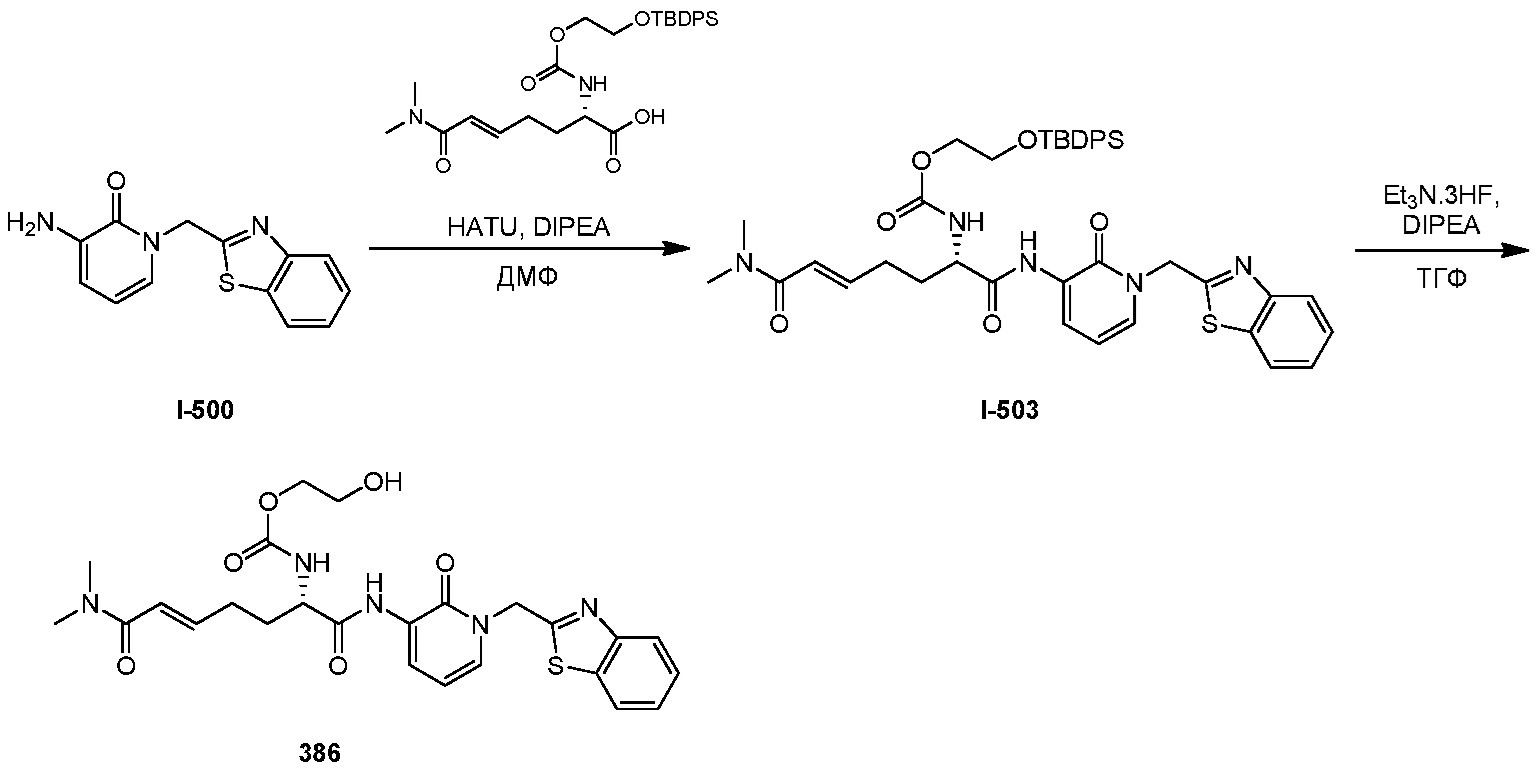
К раствору 3-амино-1-(бензо[d]тиазол-2-илметил)пиридин-2(1H)-она (65 мг, 253 мкмоль) и (S, E)-10-(5-(диметиламино)-5-оксопент-3-ен-1-ил)-2,2-диметил-8-оксо-3,3-дифенил-4,7-диокса-9-аза-3-силаундекан-11-овой кислоты (133 мг, 253 мкмоль) в ДМФ (0,5 мл) добавляют HATU (144 мг, 379 мкмоль) и DIPEA (97,9 мг, 759 мкмоль) при 0°C. Смесь перемешивают при 20°C в течение 12 ч. Полученный раствор разбавляют EtOAc (30 мл) и промывают насыщенным солевым раствором (10 мл х 4). Органическую фазу концентрируют с получением остатка. Остаток очищают преп-ТСХ с получением (S, E)-2-((трет-бутилдифенилсилил)окси)этил (1-((1-(бензо[d]тиазол-2-илметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (I-503) (90 мг) в виде желтого твердого вещества. ЖХМС m/z 766,3 (M+1)+.
К раствору (S, E)-2-((трет-бутилдифенилсилил)окси)этил (1-((1-(бензо[d]тиазол-2-илметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (85 мг, 111 мкмоль) в ТГФ (5 мл) добавляют Et3N⋅3HF (107 мг, 666 мкмоль) и Et3N (28 мг, 277 мкмоль). Смесь перемешивают при 25°C в течение 2 ч. Смесь (объединенную с другой 5 мг партией) концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением (S, E)-2-гидроксиэтил (1-((1-(бензо[d]тиазол-2-илметил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-7-(диметиламино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 386) (28,4 мг, 48% выход) в виде белого твердого вещества. ЖХМС m/z 528,0 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ9,34 (с, 1H), 8,28 (дд, J=7,6, 1,6 Гц, 1H), 8,06 (д, J=7,6 Гц, 1H), 7,97 (д, J=8,0 Гц, 1H), 7,65 (д, J=7,6 Гц, 1H), 7,64 (дд, J=6,8, 1,6 Гц, 1H), 7,52-7,48 (м, 1H), 7,45-7,42 (м, 1H), 6,65-6,58 (м, 1H), 6,41-6,36 (м, 2H), 5,67-5,58 (м, 2H), 4,76-4,74 (м, 1H), 4,23-4,18 (м, 1H), 4,03-3,93 (м, 2H), 3,56-3,54 (м, 2H), 2,98 (с, 3H), 2,83 (м, 3H), 2,33-2,19 (м, 2H), 1,88-1,68 (м, 2H).
Следующие соединения получают согласно методикам, описанным в примере 55 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-516:

К раствору 1,3-дибром-2-хлор-5-фтор-бензола (20 г, 69,4 ммоль) и дифенилметанамина (11,3 г, 62,4 ммоль, 10,5 мл) в толуоле (200 мл) добавляют t-BuONa (13 г, 135 ммоль), Pd2(dba)3 (3,18 г, 3,47 ммоль) и BINAP (3,46 г, 5,55 ммоль). Смесь перемешивают при 100°C в течение 2 часов. Полученную суспензию фильтруют, и фильтрат концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 3-бром-2-хлор-N-(дифенилметилен)-5-фторанилина (I-506) (10 г, 13,9 ммоль) в виде желтого твердого вещества. ЖХМС m/z 389,9 (M+1)+.
К раствору 3-бром-2-хлор-N-(дифенилметилен)-5-фторанилина (10 г, 13,9 ммоль) в ТГФ (100 мл) добавляют HCl (3 M, 20 мл). Смесь перемешивают при 30°C в течение 1 часа. Насыщенный Na2CO3 добавляют для доведения pH~8. Полученный раствор экстрагируют этилацетатом (100 мл х 2), промывают насыщенным солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 3-бром-2-хлор-5-фторанилина (I-507) (7,6 г) в виде желтого масла.
К раствору 2-бензилоксиуксусной кислоты (2,9 г, 17,5 ммоль, 2,5 мл), 3-бром-2-хлор-5-фторанилина (7,60 г, 14,6 ммоль) и пиридина (5,88 г, 74,3 ммоль, 6 мл) в MeCN (50 мл) добавляют MsCl (2 г, 17,5 ммоль, 1,35 мл) при 0-10°C. Смесь перемешивают при 30°C в течение 12 часов. Полученный раствор разбавляют этилацетатом (50 мл), промывают HCl (30 мл х 2, 1M) и солевым раствором (50 мл). Органической слой сушат над безводным Na2SO4, фильтруют и концентрируют с получением остатка. Остаток очищают колоночной хроматографией с получением 2-(бензилокси)-N-(3-бром-2-хлор-5-фторфенил)ацетамида (I-508) (4,5 г, 66,4% выход) в виде бесцветного твердого вещества.
К раствору 2-(бензилокси)-N-(3-бром-2-хлор-5-фторфенил)ацетамида (1 г, 2,68 ммоль) в Тол. (10 мл) добавляют реагент Ловессона (976 мг, 2,41 ммоль). Смесь перемешивают при 110°C в течение 12 часов. Полученный раствор концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением 2-(бензилокси)-N-(3-бром-2-хлор-5-фторфенил)этантиоамида (I-509) (670 мг) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 10,63 (шс, 1H), 9,10 (дд, J=10,8, 3,2 Гц, 1H), 7,44-7,34 (м, 5H), 7,31 (дд, J=7,2, 2,8 Гц, 1H), 4,73 (с, 2H), 4,50 (с, 2H).
К смеси 2-(бензилокси)-N-(3-бром-2-хлор-5-фторфенил)этантиоамида (7,2 г, 18,5 ммоль) в NMP (60 мл) добавляют NaH (963 мг, 24,1 ммоль, 60% чистота). Смесь перемешивают при 130°C в течение 3 часов под N2 атмосферой. Смесь гасят водой (60 мл) и экстрагируют этилацетатом (50 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (100 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением 2-((бензилокси)метил)-7-бром-5-фторбензо[d]тиазола (I-510) (2,9 г) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,63 (дд, J=10,4, 2,4 Гц, 1H), 7,45-7,33 (м, 6H), 4,92 (с, 2H), 4,75 (с, 2H).
К смеси 2-((бензилокси)метил)-7-бром-5-фторбензо[d]тиазола (2,3 г, 6,53 ммоль) в диоксане (10 мл) и H2O (10 мл) добавляют дитрет-бутил-[2-(2,4,6- триизопропилфенил)фенил]фосфан (111 мг, 0,261 ммоль), Pd2(dba)3 (120 мг, 0,131 ммоль) и KOH (1,1 г, 19,6 ммоль). Смесь перемешивают при 100°C в течение 12 ч под N2 атмосферой. Смесь разбавляют HCl (5 мл, 2M) и H2O (15 мл) и экстрагируют этилацетатом (20 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле с получением 2-((бензилокси)метил)-5-фторбензо[d]тиазол-7-ола (I-511) (730 мг) в виде желтого твердого вещества.1H ЯМР (400 МГц, CD3OD) δ 7,50-7,26 (м, 5H), 7,14 (дд, J=9,2, 2,0 Гц, 1H), 6,69-6,54 (м, 1H), 4,90 (с, 2H), 4,72 (с, 2H).
К смеси 2-((бензилокси)метил)-5-фторбензо[d]тиазол-7-ола (730 мг, 2,52 ммоль) в ДХМ (10 мл) добавляют BBr3 (2,21 г, 8,82 ммоль, 0,850 мл) при -65°C. Смесь перемешивают при -65°C в течение 3H под N2 атмосферой. Смесь гасят насыщенным раствором NaHCO3 (20 мл) и перемешивают в течение 30 мин. Смесь промывают ДХМ (20 мл) и экстрагируют раствором этилацетата и изопропанола (20 мл х 2). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением 5-фтор-2-(гидроксиметил)бензо[d]тиазол-7-ола (I-512) (380 мг) в виде желтого твердого вещества.1H ЯМР (400 МГц, CD3OD) δ 7,11 (дд, J=9,6, 2,4 Гц, 1H), 6,59 (дд, J=10,8, 2,4 Гц, 1H), 4,92 (с, 2H).
К раствору 5-фтор-2-(гидроксиметил)бензо[d]тиазол-7-ола (356 мг, 1,72 ммоль) в ацетоне (10 мл) добавляют K2CO3 (527 мг, 3,82 ммоль). Смесь перемешивают при 55°C в течение 1 ч под N2 атмосферой. Смесь разбавляют водой (30 мл) и экстрагируют этилацетатом (20 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением остатка. Остаток очищают хроматографией на силикагеле с получением (7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метанола (I-513) (430 мг) в виде белого твердого вещества.1H ЯМР (400 МГц, CD3OD) δ 7,65-7,52 (м, 1H), 7,27 (дд, J=9,2, 2,0 Гц, 1H), 7,11-6,90 (м, 3H), 5,32 (с, 2H), 4,92 (с, 2H).
К смеси (7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метанола (430 мг, 1,32 ммоль) и DIEA (341 мг, 2,64 ммоль, 0,461 мл) в ДХМ (10 мл) добавляют MsCl (302 мг, 2,64 ммоль, 0,204 мл) при 0°C. Смесь перемешивают при 15°C в течение 1 ч. Смесь разбавляют водой (20 мл) и экстрагируют ДХМ (20 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением (7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метилметансульфоната (I-514) (532 мг) в виде желтого масла.
К смеси (7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метилметансульфоната (532 мг, 1,32 ммоль) и 3-нитропиридин-2(1H)-она (277 мг, 1,98 ммоль) в CH3CN (10 мл) добавляют DIEA (341 мг, 2,64 ммоль, 0,461 мл). Смесь перемешивают при 30°C в течение 12 ч. Смесь фильтруют, фильтровальную лепешку промывают этилацетатом (10 мл х 2) и концентрируют в вакууме с получением 1-((7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (I-515) (320 мг) в виде серого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 8,51 (дд, J=8,0, 2,0 Гц, 1H), 8,42 (дд, J=6,4, 2,0 Гц, 1H), 7,73-7,62 (м, 1H), 7,49 (дд, J=9,6, 2,0 Гц, 1H), 7,39-7,23 (м, 2H), 7,21-7,12 (м, 1H), 6,61-6,53 (м, 1H), 5,68 (с, 2H), 5,35 (с, 2H).
К смеси 1-((7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метил)-3-нитропиридин-2(1H)-она (320 мг, 0,715 ммоль) в MeOH (10 мл) добавляют Pd/C (160 мг, 10% чистота). Смесь перемешивают при 30°C в течение 1 ч под H2 атмосферой (15 ф./кв.д.). Полученную суспензию фильтруют, фильтрат концентрируют в вакууме с получением 3-амино-1-((7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метил)пиридин-2(1H)-она (I-516) (290 мг) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 7,70-7,59 (м, 1H), 7,48 (дд, J=9,6, 2,0 Гц, 1H), 7,37-7,28 (м, 1H), 7,27-7,20 (м, 1H), 7,19-7,11 (м, 1H), 7,09-7,03 (м, 1H), 6,52-6,45 (м, 1H), 6,13 (т, J=7,2 Гц, 1H), 5,49 (с, 2H), 5,33 (с, 2H), 5,22-5,12 (м, 1H).
Пример 56:

К раствору 3-амино-1-((7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метил)пиридин-2(1H)-она (180 мг, 0,431 ммоль) и (S, E)-7-амино-2-((метоксикарбонил)амино)-7-оксогепт-5-еновой кислоты (199 мг, 0,862 ммоль) в ДМФ (2 мл) добавляют HATU (394 мг, 1,03 ммоль) и DIEA (334 мг, 2,59 ммоль, 0,452 мл) при 0°C. Смесь перемешивают при 30°C в течение 2 часов. Смесь разбавляют водой (30 мл) и экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают насыщенным солевым раствором (80 мл х 3), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением (S, E)-метил (7-амино-1-((1-((7-((2,4-дифторбензил)окси)-5-фторбензо[d]тиазол-2-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 354) (54,7 мг, 20% выход) в виде белого твердого вещества после очистки хроматографией на силикагеле и преп-ЖХВД. ЖХМС m/z 630,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,34 (с, 1H), 8,26 (дд, J=7,6, 1,6 Гц, 1H), 7,80-7,58 (м, 3H), 7,49 (дд, J=9,6, 2,4 Гц, 1H), 7,42-7,22 (м, 3H), 7,19-7,11 (м, 1H), 6,89 (с, 1H), 6,66-6,51 (м, 1H), 6,38 (т, J=7,2 Гц, 1H), 5,90-5,78 (м, 1H), 5,65-5,51 (м, 2H), 5,33 (с, 2H), 4,28-4,11 (м, 1H), 3,54 (с, 3H), 2,23-2,09 (м, 2H), 1,91-1,76 (м, 1H), 1,75-1,58 (м, 1H).
Следующие соединения получают согласно методикам, описанным в примере 56 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-525:

Смесь 3-гидрокси-4,4-диметил-тетрагидрофуран-2-она (25 г, 192,10 ммоль), CDI (37,38 г, 230,52 ммоль) в CHCl3 (250 мл) перемешивают при 20°C в течение 1,5 ч, затем добавляют N-метилметанамин (23,50 г, 288,15 ммоль, 26,40 мл, HCl) и TEA (58,32 г, 576,30 ммоль, 80,21 мл) и DMAP (2,35 г, 19,21 ммоль) и затем смесь перемешивают при 40°C в течение 1 ч. Реакционную смесь разбавляют 500 мл насыщ. NH4Cl раствора. Органическую фазу (CHCl3) собирают и промывают насыщенным солевым раствором (200 мл), сушат над безводным Na2SO4, водную фазу экстрагируют EtOAc 200 мл (100 мл х 2). Объединенную органическую фазу (EtOAc) промывают насыщенным солевым раствором (100 мл), затем сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают колоночной хроматографией с получением (4,4-диметил-2-оксо-тетрагидрофуран-3-ила) N, N-диметилкарбамата (I-518) (86,4 г) в виде белого твердого вещества.
Смесь (4,4-диметил-2-оксо-тетрагидрофуран-3-ила) N, N-диметилкарбамата (86,4 г, 429,38 ммоль), LiOH⋅H2O (36,04 г, 858,76 ммоль) в воде (500 мл) перемешивают при 20°C в течение 12 ч. Реакционную смесь промывают ДХМ 400 мл (200 мл х 2). Водную фазу доводят до pH~1 добавлением 12N раствора HCl и экстрагируют EtOAc 1000 мл (200 мл х 5). Объединенную органическую фазу концентрируют при пониженном давлении с получением 2-(диметилкарбамоилокси)-4-гидрокси-3,3-диметил-бутановой кислоты(I-519) (50 г) в виде светло-желтого масла.
К раствору 2-(диметилкарбамоилокси)-4-гидрокси-3,3-диметил-бутановой кислоты (20 г, 91,23 ммоль) в ТГФ (200 мл) добавляют 2-трет-бутил-1,3-диизопропил-изомочевину (49,34 г, 246,31 ммоль). Смесь перемешивают при 60°C в течение 3 ч под N2 атмосферой. Реакционную смесь фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил 2-(диметилкарбамоилокси)-4-гидрокси-3,3-диметил-бутаноата (I-520) (10 г, 40% выход) в виде светло-желтой жидкости.
Раствор (COCl)2 (10,60 г, 83,53 ммоль, 7,31 мл) добавляют по каплям к раствору ДМСО (13,05 г, 167,07 ммоль, 13,05 мл) в сухом ДХМ (100 мл) под атмосферой аргона при -65°C. Смесь перемешивают при той же температуре в течение 30 мин. Затем по каплям добавляют трет-бутил 2-(диметилкарбамоилокси)-4-гидрокси-3,3-диметил-бутаноат (10 г, 36,32 ммоль) в ДХМ (20 мл). Реакционную смесь перемешивают при -65°C в течение 30 мин. Затем TEA (32,34 г, 319,60 ммоль, 44,49 мл) добавляют по каплям к реакционной смеси смесь, затем перемешивают в течение 1 ч при -65°C. Реакционную смесь разбавляют насыщ. раствором NH4Cl (200 мл) и экстрагируют 100 мл ДХМ (50 мл х 2). Объединенную органическую фазу промывают насыщенным солевым раствором (100 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают колоночной хроматографией с получением трет-бутил 2-(диметилкарбамоилокси)-3,3-диметил-4-оксо-бутаноата (I-521) (6,8 г, 69% выход) в виде желтого масла.
Смесь метоксиметил(трифенил)фосфония;хлорида (12,79 г, 37,32 ммоль) в ТГФ (35 мл) добавляют n-BuLi (2,5M, 12,44 мл) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. Добавляют трет-бутил 2-(диметилкарбамоилокси)-3,3-диметил-4-оксо-бутаноат (3,4 г, 12,44 ммоль). Смесь перемешивают при 0°C в течение 0,5 ч под N2 атмосферой. Реакционную смесь добавляют в холодный насыщ. раствор NH4Cl (100 мл) и затем экстрагируют EtOAc (50 мл х 2). Объединенную органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Остаток очищают колоночной хроматографией с получением трет-бутил (E)-2-(диметилкарбамоилокси)-5-метокси-3,3-диметил-пент-4-еноата и трет-бутил (Z)-2-(диметилкарбамоилокси)-5-метокси-3,3-диметил-пент-4-еноата (I-522) (4,5 г) в виде желтого масла.
К смеси трет-бутил (E)-2-(диметилкарбамоилокси)-5-метокси-3,3-диметил-пент-4-еноата (1 г, 3,32 ммоль), трет-бутил (Z)-2-(диметилкарбамоилокси)-5-метокси-3,3-диметил-пент-4-еноата (1,00 г, 3,32 ммоль) в (HCl/диоксане (10 мл, 6M) и диоксане (2 мл)) добавляют воду (478,21 мг, 26,54 ммоль, 478,21 мкл) при 0°C. Смесь перемешивают при 0°C в течение 1 ч. К реакционной смеси добавляют холодный насыщ. раствор NaHCO3 (10 мл) и затем экстрагируют EtOAc 10 мл (5 мл х 2). Объединенную органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией с получением трет-бутил 2-(диметилкарбамоилокси)-3,3-диметил-5-оксо-пентаноата (I-523) (0,35 г, 37% выход) в виде желтого масла.
К смеси 2-диэтоксифосфорил-N, N-диметил-ацетамида (466,06 мг, 2,09 ммоль) в ТГФ (4 мл) добавляют t-BuOK (234,30 мг, 2,09 ммоль) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. Добавляют трет-бутил 2-(диметилкарбамоилокси)-3,3-диметил-5-оксо-пентаноат (0,3 г, 1,04 ммоль) и затем смесь перемешивают при 0°C в течение 0,5 ч. Смесь перемешивают при 25°C в течение 11 ч. Реакционную смесь разбавляют насыщ. раствором NH4Cl (20 мл) и экстрагируют EtOAc (6 мл х 2). Объединенную органическую фазу промывают насыщенным солевым раствором (15 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают преп-ЖХВД и СЖХ с получением трет-бутил (E)-7-(диметиламино)-2-(диметилкарбамоилокси)-3,3-диметил-7-оксо-гепт-5-еноата (I-524) (380 мг) в виде беловатой камеди.
К раствору трет-бутил (E)-7-(диметиламино)-2-(диметилкарбамоилокси)-3,3-диметил-7-оксо-гепт-5-еноата (0,38 г, 1,07 ммоль) в ДХМ (3 мл) добавляют ТФК (3,65 г, 31,98 ммоль, 2,37 мл). Смесь перемешивают при 25°C в течение 1,5 ч. Реакционную смесь концентрируют при пониженном давлении с получением масла. Остаток очищают преп-ЖХВД (ТФК) с получением (E)-7-(диметиламино)-2-(диметилкарбамоилокси)-3,3-диметил-7-оксо-гепт-5-еновой кислоты (I-525) (0,14 г, 44% выход) в виде бесцветного масла.
Пример 58:
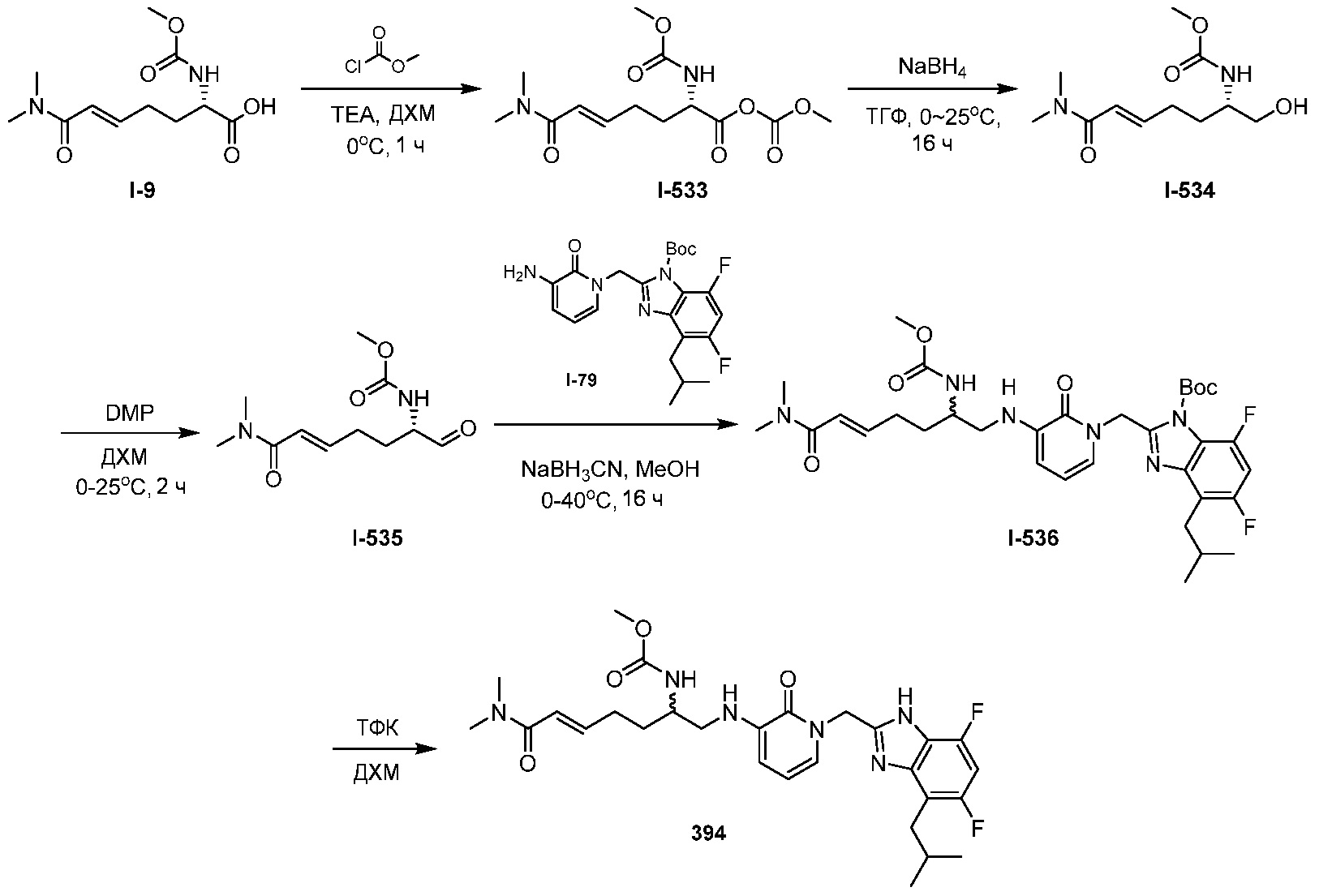
К раствору (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (1 г, 3,87 ммоль, 1 экв) в ДХМ (10 мл) добавляют TEA (1,18 г, 11,62 ммоль, 1,62 мл, 3 экв) и метил карбонохлоридат (548,83 мг, 5,81 ммоль, 449,86 мкл, 1,5 экв) при 0°C. Смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь разделяют между водой (20 мл) и дихлорметаном (20 мл). Органическую фазу разделяют, промывают насыщенным солевым раствором (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением метоксикарбонил (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноата (I-533) (910 мг) который применяют на следующей стадии без дальнейшей очистки в виде желтого масла.
К раствору метоксикарбонил (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноата (910 мг, 2,88 ммоль, 1 экв) в ТГФ (10 мл) добавляют NaBH4 (544,21 мг, 14,38 ммоль, 5 экв) при 0°C. Смесь перемешивают при 25°C в течение 16 ч. Реакционную смесь разделяют между насыщ. NH4Cl (20 мл) и этилацетатом (20 мл). Органическую фазу разделяют, промывают насыщенным солевым раствором (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением N-[(E,1S)-6-(диметиламино)-1-(гидроксиметил)-6-оксо-гекс-4-енил]карбамата (I-534) (220 мг, 31% выход) в виде желтого масла. ЖХМС: [M+1]+ =245,2.
К раствору метил N-[(E,1S)-6-(диметиламино)-1-(гидроксиметил)-6-оксо-гекс-4-енил]карбамата (200 мг, 818,71 мкмоль, 1 экв) в ДХМ (2 мл) добавляют DMP (208,35 мг, 491,23 мкмоль, 152,08 мкл, 0,6 экв) при 0°C. Смесь перемешивают в течение 0,5 ч при той же температуре. Дополнительный DMP (208,35 мг, 491,23 мкмоль, 152,08 мкл, 0,6 экв) добавляют при 0°C, и реакционную смесь перемешивают при 25°C в течение 1,5 ч. Реакционную смесь фильтруют и концентрируют при пониженном давлении для удаления растворителя с получением масла. Неочищенный продукт метил N-[(E,1S)-6-(диметиламино)-1-формил-6-оксо-гекс-4-енил]карбамата (I-535) (200 мг) применяют на следующей стадии без дальнейшей очистки в виде желтого масла. ЖХМС: [M+1]+ =243,2
Смесь метил N-[(E,1S)-6-(диметиламино)-1-формил-6-оксо-гекс-4-енил]карбамата (67,23 мг, 277,48 мкмоль), трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-5,7-дифтор-4-изобутил-бензимидазол-1-карбоксилата (0,08 г, 184,99 мкмоль), AcOH (5,55 мг, 92,49 мкмоль, 5,29 мкл) в MeOH (2 мл) перемешивают при 40°C в течение 1 часа, затем NaBH3CN (23,25 мг, 369,97 мкмоль) добавляют при 20°C и затем смесь перемешивают при 20°C в течение 11 часов. Реакционную смесь разбавляют водой 10 мл и затем экстрагируют EtOAc (8 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором 10 мл, сушат над Na2SO4, фильтруют и фильтрат концентрируют с получением остатка. Остаток очищают преп-ТСХ и преп-ЖХВД с получением трет-бутил 2-[[3-[[(E)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-енил]амино]-2-оксо-1-пиридил]метил]-5,7-дифтор-4-изобутил-бензимидазол-1-карбоксилата (I-536) (38 мг, 27% выход) в виде коричневой камеди. ЖХМС m/z 659,4 (M+1)+.
Смесь трет-бутил 2-[[3-[[(E)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-енил]амино]-2-оксо-1-пиридил]метил]-5,7-дифтор-4-изобутил-бензимидазол-1-карбоксилата (35 мг, 45,16 мкмоль) в ТФК (0,5 мл) и ДХМ (2 мл) перемешивают при 20°C в течение 1 ч. Реакционную смесь выливают в насыщ. NaHCO3 (10 мл) и экстрагируют ДХМ (8 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением метил N-[(E)-1-[[[1-[(5,7-дифтор-4-изобутил-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]амино]метил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 394) (23,6 мг, 92% выход) в виде зеленого твердого вещества. ЖХМС m/z 559,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 12,96 (шс, 1H) 7,16 (шд, J=8,44 Гц, 1H) 7,04 (шд, J=5,87 Гц, 1H) 6,95 (т, J=10,82 Гц, 1H) 6,56-6,65 (м, 1H) 6,31-6,40 (м, 2H) 6,19 (т, J=7,03 Гц, 1H) 5,49 (шт, J=5,56 Гц, 1H) 5,27-5,36 (м, 2H) 3,64 (шд, J=3,67 Гц, 1H) 3,51 (с, 3H) 3,00-3,12 (м, 2H) 2,98 (с, 3H) 2,83 (с, 3H) 2,69 (шд, J=7,21 Гц, 2H) 2,11-2,28 (м, 2H) 1,92 (дт, J=13,42, 6,68 Гц, 1H) 1,49-1,69 (м, 2H) 0,83-0,92 (м, 6H).
Синтез промежуточного соединения I-544:

К смеси 1,2,3-трифтор-4-нитро-бензола (5 г, 28,24 ммоль, 3,25 мл) в MeCN (100 мл) добавляют Cs2CO3 (18,40 г, 56,47 ммоль) и 2,4-дифторфенол (3,67 г, 28,24 ммоль), затем смесь перемешивают при 15°C в течение 16 ч. Смесь фильтруют, и фильтрат концентрируют с получением неочищенного продукта 3-(2,4-дифторфенокси)-1,2-дифтор-4-нитро-бензола (I-538) (8,0 г) в виде красного масла.
К раствору 3-(2,4-дифторфенокси)-1,2-дифтор-4-нитро-бензола (8 г, 27,86 ммоль) в EtOAc (80 мл) добавляют Pd/C (3 г, 27,86 ммоль, 10% чистота). Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 0,5 часов. Смесь фильтруют, и фильтрат концентрируют с получением 2-(2,4-дифторфенокси)-3,4-дифтор-анилина (I-539) (7,1 г) в виде коричневого масла которое применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 258,1 (M+1)+.
К раствору 2-(2,4-дифторфенокси)-3,4-дифтор-анилина (3,5 г, 13,61 ммоль) в ТФК (35 мл) добавляют KNO3 (1,65 г, 16,33 ммоль) при 0°C. Смесь перемешивают при 20°C в течение 1 ч. Реакционную смесь выливают в холодный насыщ. водн. NaHCO3 (300 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенную органическую фазу промывают насыщенным солевым раствором (100 мл х 2), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией с получением 2-(2,4-дифторфенокси)-3,4-дифтор-6-нитро-анилина (I-540) (6 г, 73% выход) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,73-7,91 (м, 1H) 6,81-6,96 (м, 2H) 6,74 (дддд, J=9,11, 7,61, 2,84, 1,71 Гц, 1H) 6,30 (шс, 2H).
К раствору 2-(2,4-дифторфенокси)-3,4-дифтор-6-нитро-анилина (2 г, 6,62 ммоль) в EtOAc (20 мл) добавляют Pd/C (0,6 г, 10% чистота). Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 0,5 часов. Смесь фильтруют, и фильтрат концентрируют с получением 3-(2,4-дифторфенокси)-4,5-дифтор-бензол-1,2-диамина (I-541) (1,5 г) в виде белого твердого вещества.
К раствору 3-(2,4-дифторфенокси)-4,5-дифтор-бензол-1,2-диамина (500 мг, 1,84 ммоль) и 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (545,93 мг, 2,76 ммоль) в ДХМ (5 мл) добавляют T3P (1,40 г, 2,20 ммоль, 1,31 мл, 50% чистота) и DIEA (474,80 мг, 3,67 ммоль, 639,89 мкл). Смесь перемешивают при 20°C в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении с получением N-[2-амино-3-(2,4-дифторфенокси)-4,5-дифтор-фенил]-2-(3-нитро-2-оксо-1-пиридил)ацетамида (I-542) (3 г) в виде коричневого масла. ЖХМС m/z 453,1 (M+1)+.
Смесь N-[2-амино-3-(2,4-дифторфенокси)-4,5-дифтор-фенил]-2-(3-нитро-2-оксо-1-пиридил)ацетамида (2,8 г, 6,19 ммоль) в AcOH (30 мл) перемешивают при 80°C в течение 1 ч. Воду (20 мл) добавляют к смеси и 1-[[4-(2,4-дифторфенокси)-5,6-дифтор-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-он (I-543) (800 мг, 30% выход) получают в виде белого твердого вещества, собранного фильтрацией.
К раствору 1-[[4-(2,4-дифторфенокси)-5,6-дифтор-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (100 мг, 230,26 мкмоль) в EtOAc (1 мл) добавляют Pd/C (30 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 0,5 часов. Реакционную смесь фильтруют, и фильтрат концентрируют с получением 3-амино-1-[[4-(2,4-дифторфенокси)-5,6-дифтор-1H-бензимидазол-2-ил]метил]пиридин-2-она (I-544) (100 мг) в виде белого твердого вещества, которое применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 405,1 (M+1)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-544 с применением подходящих реагентов.
Пример 59:

К раствору 3-амино-1-[[4-(2,4-дифторфенокси)-5,6-дифтор-1H-бензимидазол-2-ил]метил]пиридин-2-она (100 мг, 247,33 мкмоль) и (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (63,88 мг, 247,33 мкмоль) в ДМФ (1 мл) добавляют HATU (141,06 мг, 371,00 мкмоль) и DIEA (63,93 мг, 494,66 мкмоль, 86,16 мкл). Смесь перемешивают при 40°C в течение 0,5 ч. Реакционную смесь фильтруют. Фильтрат очищают преп-ЖХВД с получением метил N-[(E,1S)-1-[[1-[[4-(2,4-дифторфенокси)-5,6-дифтор-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 411) (23,9 мг, 15% выход) в виде белого твердого вещества. ЖХМС m/z 645,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 12,87 (шс, 1H) 9,24 (с, 1H) 8,18-8,28 (м, 1H) 7,73 (шд, J=7,58 Гц, 1H) 7,49 (шс, 3H) 6,87-7,01 (м, 2H) 6,54-6,65 (м, 1H) 6,28-6,41 (м, 2H) 5,33 (с, 2H) 4,13-4,22 (м, 1H) 3,54 (с, 3H) 2,98 (с, 3H) 2,83 (с, 3H) 2,14-2,31 (м, 2H) 1,88 (шд, J=6,85 Гц, 1H) 1,65-1,78 (м, 1H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 59 с применением подходящих промежуточных соединений.
Пример 60:

К раствору 1-[[4-(2,4-дифторфенокси)-5,6-дифтор-1H-бензимидазол-2-ил]метил]-3-нитро-пиридин-2-она (100 мг, 230,26 мкмоль) и трет-бутоксикарбонил-трет-бутилкарбоната (60,30 мг, 276,31 мкмоль, 63,48 мкл) в ДХМ (0,5 мл) добавляют DIEA (59,52 мг, 460,51 мкмоль, 80,21 мкл) и DMAP (2,81 мг, 23,03 мкмоль). Смесь перемешивают при 20°C в течение 0,5 ч. Реакционную смесь добавляют насыщенным NH4Cl раствора (5 мл) и экстрагируют этилацетатом (3 мл х 3). Объединенную органическую фазу промывают насыщенным солевым раствором (5 мл х 2), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ с получением трет-бутил 4-(2,4-дифторфенокси)-5,6-дифтор-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (I-545) (70 мг, 57% выход) в виде желтого твердого вещества. ЖХМС m/z 535,3 (M+1)+.
К раствору трет-бутил 4-(2,4-дифторфенокси)-5,6-дифтор-2-[(3-нитро-2-оксо -1-пиридил)метил]бензимидазол-1-карбоксилата (70 мг, 130,98 мкмоль) в EtOAc (0,5 мл) добавляют Pd/C (10 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 10 мин. Реакционную смесь фильтруют, и фильтрат концентрируют с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-4-(2,4-дифторфенокси)-5,6-дифтор-бензимидазол-1-карбоксилата (I-546) (50 мг) в виде белого твердого вещества которое применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 527,0 (M+23)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-546 с применением подходящих реагентов.
Смесь трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-4-(2,4-дифторфенокси)-5,6-дифтор-бензимидазол-1-карбоксилата (50 мг, 99,12 мкмоль), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (25,60 мг, 99,12 мкмоль), HATU (56,53 мг, 148,68 мкмоль) и DIEA (25,62 мг, 198,24 мкмоль, 34,53 мкл) в ДМФ (1 мл) и затем смесь перемешивают при 40°C в течение 1 ч. Реакционную смесь фильтруют и концентрируют. Остаток очищают преп-ЖХВД с получением трет-бутил 4-(2,4-дифторфенокси)-2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5,6-дифтор-бензимидазол-1-карбоксилата (Соединение 410) (14,8 мг, 19% выход) в виде белого твердого вещества. ЖХМС m/z 645,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,18 (с, 1H) 8,24 (шд, J=7,02 Гц, 1H) 7,80 (шд, J=8,33 Гц, 1H) 7,66-7,75 (м, 1H) 7,28 (шд, J=6,58 Гц, 1H) 7,11 (шд, J=9,65 Гц, 2H) 6,79 (шс, 1H) 6,55-6,68 (м, 1H) 6,39 (шд, J=14,91 Гц, 1H) 6,22 (т, J=7,02 Гц, 1H) 5,50 (с, 2H) 4,18 (шс, 1H) 3,55 (с, 3H) 2,99 (с, 3H) 2,84 (с, 3H) 2,25 (шд, J=7,02 Гц, 2H) 1,72-2,00 (м, 2H) 1,69 (с, 9 H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 60 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-556:

4,5-дифтор-2-нитро-анилин (5 г, 28,72 ммоль, 1 экв) добавляют одной порцией к I2 (21,87 г, 86,16 ммоль, 17,35 мл, 3 экв), растворяют в EtOH (50 мл), затем Ag2SO4 (22,39 г, 71,80 ммоль, 12,17 мл, 2,5 экв). Смесь нагревают до 90°C и перемешивают в течение 12 ч. Реакционную смесь фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 4-дифтор-2-йод-6-нитро-анилина (I-548) (15 г, 87% выход) в виде желтого твердого вещества.
К раствору 3,4-дифтор-2-йод-6-нитро-анилина (7,45 г, 24,83 ммоль, 1 экв) в H2O (20 мл) и EtOH (100 мл) добавляют Fe (6,93 г, 124,17 ммоль, 5 экв) и NH4Cl (13,28 г, 248,33 ммоль, 8,68 мл, 10 экв) под N2 при 25°C. Смесь нагревают и перемешивают при 80°C в течение 1 ч. Реакционную смесь фильтруют и концентрируют при пониженном давлении для удаления EtOH, затем разбавляют водой (50 мл) и экстрагируют EtOAc 100 мл (50 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 5-дифтор-3-йод-бензол-1,2-диамина (I-549) (14 г) в виде коричневого масла. ЖХМС m/z 271,0 (M+1)+.
Смесь 4,5-дифтор-3-йод-бензол-1,2-диамина (13,9 г, 51,48 ммоль, 1 экв) в Ac2O (30 мл) перемешивают при 25°C в течение 1 ч и затем смесь перемешивают при 60°C в течение 12 ч. Реакционную смесь выливают в ледяную воду (100 мл). Смесь фильтруют и концентрируют при пониженном давлении с получением N-(2-ацетамидо-4,5-дифтор-3-йод-фенил)ацетамида (I-550) (12,5 г) в виде желтого твердого вещества. ЖХМС m/z 355,1 (M+1)+.
К раствору N-(2-ацетамидо-4,5-дифтор-3-йод-фенил)ацетамида (7 г, 19,77 ммоль, 1 экв), (1,3-диоксоизоиндолин-2-ила) 3,3-диметилбутаноата (7,75 г, 29,65 ммоль, 1,5 экв) и Zn (2,59 г, 39,54 ммоль, 2 экв) в DMA (42 мл) добавляют (dtbbpy)NiBr (4,81 г, 9,88 ммоль, 0,5 экв) при 20°C, затем реакционную смесь перемешивают при 40°C в течение 12 ч. Реакционную смесь выливают в воду 50 мл и экстрагируют EtOAc (25 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (15 мл х 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением остатка. Остаток очищают преп-ТСХ с получением N-[2-ацетамидо-3-(2,2-диметилпропил)-4,5-дифтор-фенил]ацетамида (I-551) (330 мг, 5% выход) в виде белого твердого вещества.1H ЯМР (400 МГц, CD3OD) δ 0,94 (д, J=0,98 Гц, 9 H) 2,16 (д, J=6,97 Гц, 6H) 2,64 (д, J=2,69 Гц, 2H) 7,53 (дд, J=11,74, 8,31 Гц, 1H).
Раствор N-[2-ацетамидо-3-(2,2-диметилпропил)-4,5-дифтор-фенил]ацетамида (330 мг, 1,11 ммоль, 1 экв) и HCl (6 M, 5 мл, 27,12 экв) в EtOH (5 мл) перемешивают при 90°C в течение 1 ч. Смесь концентрируют в вакууме с получением твердого вещества. К твердому веществу добавляют насыщ. водн. NaHCO3 до pH=7 и смесь экстрагируют EtOAc (10 мл х 2), промывают насыщенным солевым раствором (5 мл х 2), сушат над Na2SO4 и концентрируют в вакууме с получением 4-(2,2-диметилпропил)-5,6-дифтор-2-метил-1H-бензимидазола (I-552) (320 мг) в виде желтого твердого вещества. ЖХМС m/z 238,9 (M+1)+.
К раствору 4-(2,2-диметилпропил)-5,6-дифтор-2-метил-1H-бензимидазола (320 мг, 1,34 ммоль, 1 экв), DIEA (347,13 мг, 2,69 ммоль, 467,84 мкл, 2 экв) и DMAP (16,41 мг, 134,30 мкмоль, 0,1 экв) в ДХМ (5 мл) добавляют Boc2O (381,04 мг, 1,75 ммоль, 401,09 мкл, 1,3 экв) при 0°C. Реакционную смесь перемешивают при 20°C в течение 0,5 ч и затем концентрируют. Остаток очищают колоночной хроматографией с получением трет-бутил 4-(2,2-диметилпропил)-5,6-дифтор-2-метил-бензимидазол-1-карбоксилата (I-553) (360 мг, 79% выход) в виде желтого твердого вещества. ЖХМС m/z 282,9 (M+1)+.
К раствору трет-бутил 4-(2,2-диметилпропил)-5,6-дифтор-2-метил-бензимидазол-1-карбоксилата (360 мг, 1,06 ммоль, 1 экв) в CCl4 (10 мл) добавляют AIBN (40,18 мг, 244,69 мкмоль, 0,23 экв) и NBS (189,35 мг, 1,06 ммоль, 1 экв) при 20°C. Реакционную смесь перемешивают при 70°C в течение 2 ч. Смесь концентрируют в вакууме с получением трет-бутил 2-(бромметил)-4-(2,2-диметилпропил)-5,6-дифтор-бензимидазол-1-карбоксилата (I-554) (710 мг) в виде желтого масла.
Раствор трет-бутил 2-(бромметил)-4-(2,2-диметилпропил)-5,6-дифтор-бензимидазол-1-карбоксилата (710 мг, 1,70 ммоль, 1 экв), 3-нитро-1H-пиридин-2-она (286,04 мг, 2,04 ммоль, 1,2 экв) и DIEA (329,85 мг, 2,55 ммоль, 444,54 мкл, 1,5 экв) в ACN (5 мл) перемешивают при 20°C в течение 2 ч. Реакционную смесь концентрируют и остаток очищают колоночной хроматографией с получением трет-бутил 4-(2,2-диметилпропил)-5,6-дифтор-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (I-555) (460 мг, 57% выход) в виде желтого масла. ЖХМС m/z 376,9 (M+1-100)+.
Раствор трет-бутил 4-(2,2-диметилпропил)-5,6-дифтор-2-[(3-нитро-2-оксо-1-пиридил)метил]бензимидазол-1-карбоксилата (300 мг, 629,63 мкмоль, 1 экв) и Pd/C (260 мг, 10% чистота) в EtOAc (10 мл) перемешивают при 20°C в течение 1 ч под H2 (15 ф./кв.д.). Смесь концентрируют в вакууме, и фильтрат концентрируют в вакууме с получением трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-4-(2,2-диметилпропил)-5,6-дифтор-бензимидазол-1-карбоксилата (I-556) (270 мг) в виде желтого твердого вещества. ЖХМС m/z 447,0 (M+1)+.
Пример 61:

К раствору трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-4-(2,2-диметилпропил)-5,6-дифтор-бензимидазол-1-карбоксилата (40 мг, 89,59 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (23,14 мг, 89,59 мкмоль, 1 экв) и DIEA (57,89 мг, 447,95 мкмоль, 78,02 мкл, 5 экв) в ДМФ (1 мл) добавляют HATU (68,13 мг, 179,18 мкмоль, 2 экв) при 20°C, затем реакционную смесь перемешивают при 20°C в течение 12 ч. Реакционную смесь выливают в воду 10 мл и экстрагируют EtOAc 10 мл (5 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором 5 мл (5 мл x 1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ и преп-ЖХВД с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-4-(2,2-диметилпропил)-5,6-дифтор-бензимидазол-1-карбоксилата (Соединение 461) (3,1 мг, 5% выход) в виде белого твердого вещества. ЖХМС m/z 687,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,68 (с, 9H) 1,64 (с, 10 H) 1,80 (шс, 1H) 2,09-2,22 (м, 2H) 2,57-2,67 (м, 2H) 2,78 (с, 3H) 2,93 (с, 3H) 3,47 (с, 3H) 4,10 (шс, 1H) 5,55 (с, 2H) 6,23-6,36 (м, 2H) 6,48-6,62 (м, 1H) 7,41 (дд, J=6,91, 1,65 Гц, 1H) 7,57-7,75 (м, 2H) 8,22 (дд, J=7,40, 1,65 Гц, 1H) 9,12 (с, 1H).
Раствор трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-4-(2,2-диметилпропил)-5,6-дифтор-бензимидазол-1-карбоксилата (300 мг, 436,84 мкмоль, 1 экв) и CF3COOH (924 мг, 8,10 ммоль, 600 мкл, 18,55 экв) в ДХМ (2,4 мл) перемешивают при 20°C в течение 0,5 ч. Смесь концентрируют в вакууме с получением масла. Масло очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[4-(2,2-диметилпропил)-5,6-дифтор-1H-бензимидазол-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 467) (74,3 мг, 29% выход) в виде белого твердого вещества. ЖХМС m/z 587,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,93 (с, 9 H) 1,64-1,78 (м, 1H) 1,87 (шд, J=6,72 Гц, 1H) 2,16-2,30 (м, 2H) 2,84 (с, 5Н) 2,99 (с, 3H) 3,54 (с, 3H) 4,10-4,23 (м, 1H) 5,40 (с, 2H) 6,30-6,44 (м, 2H) 6,53-6,68 (м, 1H) 7,38-7,49 (м, 1H) 7,52-7,60 (м, 1H) 7,74 (шд, J=7,58 Гц, 1H) 8,26 (дд, J=7,34, 1,22 Гц, 1H) 9,26 (с, 1H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 61 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-575:

К раствору 1,2,4-трифтор-5-нитро-бензола (23 г, 130 ммоль, 15 мл, 1 экв) в MeOH (250 мл) добавляют Pd/C (10 г, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 15°C в течение 13 часа. Смесь фильтруют и концентрируют при пониженном давлении с получением 2,4,5-трифторанилина (I-566) (18 г, 122 ммоль, 94,2% выход) в виде коричневого масла, которое применяют на следующей стадии без дальнейшей очистки.
Раствор 2,4,5-трифторанилина (18 г, 122 ммоль, 12 мл, 1 экв) в Ac2O (100 мл) перемешивают при 15°C в течение 1 ч. Осадок фильтруют с получением белого твердого вещества. Неочищенный продукт N-(2,4,5-трифторфенил)ацетамид (I-567) (21 г) применяют на следующей стадии без дальнейшей очистки в виде белого твердого вещества.
К раствору N-(2,4,5-трифторфенил)ацетамида (10 г, 53 ммоль, 1 экв) в H2SO4 (100 мл) добавляют HNO3 (3,33 г, 53 ммоль, 2,4 мл, 1 экв) при 0°C. Смесь перемешивают при 0°C в течение 1 ч. Выливают реакционную смесь на лед, затем смесь экстрагируют EtOAc (200 мл). Органической слой промывают насыщ. NaHCO3 (500 мл) и солевым раствором (250 мл), сушат над Na2SO4 и концентрируют с получением неочищенного продукта. Неочищенный N-(3,4,6-трифтор-2-нитро-фенил)ацетамид (I-568) (7,2 г, 30,7 ммоль, 58% выход) применяют на следующей стадии без дальнейшей очистки в виде желтого твердого вещества.
Смесь N-(3,4,6-трифтор-2-нитро-фенил)ацетамида (1 г, 4,3 ммоль, 1 экв), фенола (442 мг, 4,70 ммоль, 413 мкл, 1,1 экв) и Cs2CO3 (2,09 г, 6,41 ммоль, 1,5 экв) в CH3CN (10 мл) перемешивают при 55°C в течение 4 ч. Воду (5 мл) добавляют к смеси. Смесь экстрагируют EtOAc (10 мл). Объединенный органический слой промывают насыщенным солевым раствором (10 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают на колонке с получением N-(4,6-дифтор-2-нитро-3-фенокси-фенил)ацетамида (I-569) (0,95 г, 72% выход) в виде белого твердого вещества. ЖХМС m/z 307,9 (M+1)+.
Раствор N-(4,6-дифтор-2-нитро-3-фенокси-фенил)ацетамида (0,95 г, 3,08 ммоль, 1 экв) в HCl (12M) (5 мл) и EtOH (5 мл) нагревают до 90°C в течение 2 ч. Смесь концентрируют для удаления EtOH, затем экстрагируют EtOAc (10 мл). Органической слой промывают насыщ. NaHCO3 (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 4,6-дифтор-2-нитро-3-фенокси-анилина (I-570) (0,715 г, 87% выход) применяют на следующей стадии без дальнейшей очистки в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 7,28-7,36 (м, 2H) 7,06-7,19 (м, 2H) 6,94 (д, J=8,60 Гц, 2H) 5,12 (с, 2H).
Смесь 4,6-дифтор-2-нитро-3-фенокси-анилина (0,7 г, 2,63 ммоль, 1 экв), Fe (734 мг, 13,2 ммоль, 5 экв) и NH4Cl (1,41 г, 26,3 ммоль, 919 мкл, 10 экв) в EtOH/H2O (5:1) (10 мл) нагревают до 80°C в течение 1 ч. Смесь фильтруют, и фильтрат концентрируют с получением 4,6-дифтор-3-фенокси-бензол-1,2-диамина (I-571) (0,61 г) которое применяют на следующей стадии без дальнейшей очистки в виде коричневого твердого вещества.
К смеси 4,6-дифтор-3-фенокси-бензол-1,2-диамина (0,61 г, 2,58 ммоль, 1 экв), 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (563 мг, 2,84 ммоль, 1,1 экв) и DIPEA (667 мг, 5,16 ммоль, 900 мкл, 2 экв) в ДХМ (6 мл) добавляют T3P (2,46 г, 3,87 ммоль, 2,30 мл, 50% чистота, 1,5 экв) при 20°C. Смесь перемешивают при 20°C в течение 12 ч. Смесь концентрируют с получением неочищенного продукта. Неочищенный продукт N-(2-амино-4,6-дифтор-3-фенокси-фенил)-2-(3-нитро-2-оксо-1-пиридил)ацетамид (I-572) (1,08 г) применяют на следующей стадии без дальнейшей очистки в виде коричневого твердого вещества. ЖХМС m/z 417,0 (M+1)+.
Раствор N-(2-амино-4,6-дифтор-3-фенокси-фенил)-2-(3-нитро-2-оксо-1-пиридил)ацетамида (1,08 г, 2,6 ммоль, 1 экв) в HOAc (10 мл) нагревают до 100°C в течение 1 ч. Смесь концентрируют с получением неочищенного продукта. Неочищенный остаток разбавляют в EtOAc (50 мл) и промывают насыщ. NaHCO3 (10 мл х 3). Органической слой сушат над Na2SO4 и концентрируют с получением 1-[(5,7-дифтор-4-фенокси-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (I-573) (450 мг) в виде желтого твердого вещества. ЖХМС m/z 399,0 (M+1)+.
К раствору 1-[(5,7-дифтор-4-фенокси-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (0,08 г, 201 мкмоль, 1 экв), DIPEA (51,9 мг, 402 мкмоль, 70 мкл, 2 экв), DMAP (2,5 мг, 20 мкмоль, 0,1 экв) в ДХМ (1 мл) добавляют Boc2O (52,6 мг, 241 мкмоль, 55 мкл, 1,2 экв) при 20°C под N2. Смесь перемешивают при 20°C в течение 1 часа. Смесь концентрируют с получением неочищенного продукта при 20°C при пониженном давлении. Остаток очищают преп-ТСХ с получением трет-бутил 5,7-дифтор-2-[(3-нитро-2-оксо-1-пиридил)метил]-4-фенокси-бензимидазол-1-карбоксилата (I-574) (0,08 г, 161 мкмоль, 79,9% выход) в виде белого твердого вещества.
К раствору трет-бутил 5,7-дифтор-2-[(3-нитро-2-оксо-1-пиридил)метил]-4-фенокси-бензимидазол-1-карбоксилата (80 мг, 161 мкмоль, 1 экв) в EtOAc (2 мл) добавляют Pd/C (50 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 0,5 часов. Смесь фильтруют, и фильтрат концентрируют с получением трет-бутил [(3-амино-2-оксо-1-пиридил)метил]-5,7-дифтор-4-фенокси-бензимидазол-1-карбоксилата (I-575) (53 мг) в виде коричневого твердого вещества.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-575 с применением подходящих реагентов.
Пример 62:

HATU (64,5 мг, 170 мкмоль, 1,5 экв) добавляют к смеси трет-бутил 2-[(3-амино-2-оксо-1-пиридил)метил]-5,7-дифтор-4-фенокси-бензимидазол-1-карбоксилата (53 мг, 113 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (31 мг, 119 мкмоль, 1,05 экв) и DIPEA (29 мг, 226 мкмоль, 2 экв) в ДМФ (1 мл) при 15°C. Затем смесь нагревают до 40°C и перемешивают в течение 2 ч. Смесь экстрагируют EtOAc (10 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением трет-бутил 2-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-5,7-дифтор-4-фенокси-бензимидазол-1-карбоксилата (Соединение 413) (5,8 мг, 7% выход) в виде белого твердого вещества. ЖХМС m/z 709,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,12-9,29 (м, 1H) 8,14-8,32 (м, 1H) 7,72 (шс, 1H) 7,39-7,60 (м, 2H) 7,17-7,35 (м, 2H) 6,97-7,08 (м, 1H) 6,79-6,90 (м, 2H) 6,54-6,66 (м, 1H) 6,21-6,42 (м, 2H) 5,46-5,57 (м, 1H) 5,28 (с, 1H) 4,16 (шс, 1H) 3,53 (с, 3H) 2,97 (с, 3H) 2,82 (с, 3H) 2,15-2,30 (м, 2H) 1,69-1,94 (м, 2H) 1,65 (с, 4 H) 1,34-1,42 (м, 5Н).
Следующее соединение получают согласно методикам, описанным для синтеза Примера 62 с применением подходящих промежуточных соединений.
Пример 63:

К раствору 1-[(5,7-дифтор-4-фенокси-1H-бензимидазол-2-ил)метил]-3-нитро-пиридин-2-она (0,2 г, 502,11 мкмоль, 1 экв) в EtOH/H2O (5:1) (2 мл) добавляют Fe (140 мг, 2,51 ммоль, 5 экв), NH4Cl (269 мг, 5,02 ммоль, 10 экв) под N2. Смесь перемешивают при 80°C в течение 1 часа. Смесь фильтруют и фильтрат концентрируют с получением 3-амино-1-((5,7-дифтор-4-фенокси-1H-бензо[d]имидазол-2-ил)метил)пиридин-2(1H)-она (I-578) (185 мг) применяют на следующей стадии без дальнейшей очистки в виде коричневого твердого вещества. ЖХМС m/z 368,9 (M+1)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-578 с применением подходящих реагентов.
HATU (286 мг, 753 мкмоль, 1,5 экв) добавляют к смеси 3-амино-1-[(5,7-дифтор-4-фенокси-1H-бензимидазол-2-ил)метил]пиридин-2-она (185 мг, 502 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (143 мг, 552 мкмоль, 1,1 экв) и DIPEA (130 мг, 1,00 ммоль, 2 экв) в ДМФ (5 мл) при 15°C. Смесь нагревают до 40°C и перемешивают в течение 2 ч. Смесь фильтруют, фильтрат очищают преп-ЖХВД с получением метил N-[(E,1S)-1-[[1-[(5,7-дифтор-4-фенокси-1H-бензимидазол-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 434) (101,2 мг, 33% выход) в виде белого твердого вещества. ЖХМС m/z 609,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,25 (с, 1H) 8,25 (шд, J=6,11 Гц, 1H) 7,72 (шд, J=7,70 Гц, 1H) 7,56 (шд, J=6,85 Гц, 1H) 7,20-7,41 (м, 3H) 7,08 (шт, J=7,27 Гц, 1H) 6,92 (шд, J=8,07 Гц, 2H) 6,53-6,66 (м, 1H) 6,30-6,43 (м, 2H) 5,36 (с, 2H) 4,17 (шс, 1H) 3,54 (с, 3H) 2,99 (с, 3H) 2,84 (с, 3H) 2,17-2,31 (м, 2H) 1,64-1,93 (м, 2H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 63 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-603:


DHP (4,79 г, 56,9 ммоль, 5,2 мл, 1,1 экв) добавляют к смеси 6-хлор-9H-пурина (8 г, 51,7 ммоль, 1 экв) и TsOH⋅H2O (984 мг, 5,18 ммоль, 0,1 экв) в CHCl3 (80 мл) при 0°C по каплям. Смесь перемешивают при 20°C в течение 5 ч. Воду (100 мл) добавляют к смеси и смесь экстрагируют ДХМ (100 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (100 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток перемешивают в петролейном эфире (100 мл) в течение 2 ч. Осадок фильтруют и сушат с получением 6-хлор-9-тетрагидропиран-2-ил-пурина (I-596) (11,3 г, 92% выход) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,75 (с, 1H) 8,34 (с, 1H) 5,79 (дд, J=10,36, 2,43 Гц, 1H) 4,13-4,25 (м, 1H) 3,73-3,84 (м, 1H) 2,00-2,21 (м, 3H) 1,65-1,87 (м, 3H).
К раствору 6-хлор-9-тетрагидропиран-2-ил-пурина (3 г, 12,6 ммоль, 1 экв) в ТГФ (30 мл) добавляют LDA (2 M, 8,8 мл, 1,40 экв) при -78°C по каплям. Смесь перемешивают при -78°C в течение 0,5 ч, затем CH3I (17,8 г, 126 ммоль, 7,8 мл, 10 экв) добавляют к смеси и перемешивают в течение еще 2 ч. Реакционную смесь гасят насыщ. NH4Cl (20 мл). Смесь экстрагируют EtOAc (30 мл). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 6-хлор-8-метил-9-тетрагидропиран-2-ил-пурина (I-597) (3,5 г) применяют на следующей стадии без дальнейшей очистки в виде красного масла.1H ЯМР (400 МГц, CDCl3) δ 8,68 (с, 1H) 5,78 (дд, J=10,36, 2,43 Гц, 1H) 4,20-4,24 (м, 1H) 3,72-3,78 (м, 1H) 2,82(с, 3H) 2,49-2,54 (м, 1H) 2,12-2,14 (м, 1H) 1,92-1,95 (м, 1H) 1,76-1,81 (м, 2H)1,66-1,68 (м, 1H).
Смесь 6-хлор-8-метил-9-тетрагидропиран-2-ил-пурина (1 г, 3,96 ммоль, 1 экв), фенола (447 мг, 4,75 ммоль, 1,2 экв) и Cs2CO3 (2,58 г, 7,91 ммоль, 2 экв) в ДМФ (10 мл) перемешивают при 60°C в течение 1 ч. Воду (10 мл) добавляют к смеси. Смесь экстрагируют EtOAc (10 мл). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Неочищенный продукт 8-метил-6-фенокси-9-тетрагидропиран-2-ил-пурин (I-598) (1,2 г) применяют на следующей стадии без дальнейшей очистки в виде красного масла.1H ЯМР (400 МГц, CDCl3) δ 7,39-7,47 (м, 2H) 7,23-7,28 (м, 3H) 5,77 (дд, J=11,25, 2,43 Гц, 1H) 4,20 (дд, J=10,47, 3,20 Гц, 1H) 3,69-3,78 (м, 1H) 2,78 (с, 3H) 2,44-2,57 (м, 1H) 2,09-2,11 (м, 1H) 1,90-1,93 (м, 1H) 1,74-1,82 (м, 2H) 1,63-1,65(м, 1H).
ТФК (8,08 г, 70,9 ммоль, 5,3 мл, 20 экв) добавляют к раствору 8-метил-6-фенокси-9-тетрагидропиран-2-ил-пурина (1,1 г, 3,54 ммоль, 1 экв) в ДХМ (10 мл) при 20°C и перемешивают в течение 0,5 ч. К смеси добавляют насыщ. NaHCO3 до pH=7. Смесь экстрагируют ДХМ (20 мл х 3) и органические слои концентрируют с получением 8-метил-6-фенокси-9H-пурина (I-599) (0,61 г) в виде желтого масла, которое применяют на следующей стадии без дальнейшей очистки.
К смеси 8-метил-6-фенокси-9H-пурина (0,61 г, 2,70 ммоль, 1 экв), DIPEA (697 мг, 5,39 ммоль, 2 экв) и DMAP (33 мг, 270 мкмоль, 0,1 экв) в ДХМ (10 мл) добавляют Boc2O (706 мг, 3,24 ммоль, 1,2 экв) при 20°C, смесь перемешивают при 20°C в течение 20 мин. Смесь концентрируют. Остаток очищают колоночной хроматографией с получением трет-бутил 8-метил-6-фенокси-пурин-9-карбоксилата (I-600) (0,46 г, 1,41 ммоль, 52% выход) в виде белого твердого вещества.1H ЯМР (400 МГц, CD3OD) δ 8,34 (с, 1H) 7,33-7,41 (м, 2H) 7,13-7,24 (м, 3H) 2,74 (с, 3H) 1,62 (с, 9 H).
AIBN (34 мг, 207 мкмоль, 0,25 экв) и NBS (162 мг, 91 мкмоль, 1,1 экв) добавляют к раствору трет-бутил 8-метил-6-фенокси-пурин-9-карбоксилата (270 мг, 827 мкмоль, 1 экв) в CCl4 (1 мл) при 70°C под N2. Реакционную смесь перемешивают при 70°C в течение еще 3 ч. Воду (2 мл) добавляют к смеси, и смесь экстрагируют ДХМ (5 мл x 2). Объединенные органические слои сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением трет-бутил 8-(бромметил)-6-фенокси-пурин-9-карбоксилата (I-601) (335 мг), который применяют на следующей стадии без дальнейшей очистки в виде желтого твердого вещества.
Смесь трет-бутил 8-(бромметил)-6-фенокси-пурин-9-карбоксилата (335 мг, 827 мкмоль, 1 экв), 3-нитро-1H-пиридин-2-она (139 мг, 992 мкмоль, 1,2 экв) и DIPEA (213 мг, 1,65 ммоль, 2 экв) в CH3CN (1 мл) перемешивают при 20°C в течение 3 ч. Смесь концентрируют с получением неочищенного продукта. Остаток очищают колоночной хроматографией с получением трет-бутил 8-[(3-нитро-2-оксо-1-пиридил)метил]-6-фенокси-пурин-9-карбоксилата (I-602) (163 мг, 43% выход) в виде желтого твердого вещества.
К раствору трет-бутил 8-[(3-нитро-2-оксо-1-пиридил)метил]-6-фенокси-пурин-9- карбоксилата (150 мг, 323 мкмоль, 1 экв) в EtOAc (5 мл) добавляют Pd/C (50 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 0,5 часов. Смесь фильтруют, и фильтрат концентрируют с получением трет-бутил 8-[(3-амино-2-оксо-1-пиридил)метил]-6-фенокси-пурин-9-карбоксилата (I-603) (130 мг, 79% выход), который применяют на следующей стадии без дальнейшей очистки в виде желтого твердого вещества. ЖХМС m/z 435,0 (M+1)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-603 с применением подходящих реагентов.
Пример 64:

HATU (131 мг, 345 мкмоль, 1,5 экв) добавляют к смеси трет-бутил 8-[(3-амино-2-оксо-1-пиридил)метил]-6-фенокси-пурин-9-карбоксилата (100 мг, 230 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (62,4 мг, 242 мкмоль, 1,05 экв) и DIPEA (59,5 мг, 460 мкмоль, 2 экв) в ДМФ (2 мл) при 15°C. Смесь нагревают до 40°C и перемешивают в течение 12 ч. Смесь экстрагируют EtOAc (10 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением трет-бутил 8-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-6-фенокси-пурин-9-карбоксилата (I-607) (155 мг), который применяют на следующей стадии без дальнейшей очистки, в виде желтого твердого вещества. ЖХМС m/z 675,3 (M+1)+.
ТФК (524 мг, 4,59 ммоль, 20 экв) добавляют к смеси трет-бутил 8-[[3-[[(E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еноил]амино]-2-оксо-1-пиридил]метил]-6-фенокси-пурин-9-карбоксилата (155 мг, 230 мкмоль, 1 экв) в ДХМ (3 мл) при 20°C и перемешивают в течение 2 ч. Смесь концентрируют с получением неочищенного продукта. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-6-оксо-1-[[2-оксо-1-[(6-фенокси-9H-пурин-8-ил)метил]-3-пиридил]карбамоил]гекс-4-енил]карбамата (Соединение 607) (35,1 мг, 27% выход) в виде белого твердого вещества. ЖХМС m/z 575,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,27(с, 1H) 8,38 (с, 1H) 8,27-8,29(м, 1H) 7,62-7,74(м, 1H) 7,61-7,62 (м, 1H) 7,44-7,48 (м, 2H) 7,26-7,31 (м, 3H) 6,59-6,62 (м, 1H) 6,36-6,41 (м, 2H) 5,46 (с, 2H) 4,16-4,21 (м, 1H) 3,55 (с, 3H) 2,99 (с, 3H) 2,80 (с, 3H) 2,20-2,27 (м, 2H) 1,71-1,89 (м, 2H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 64 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-615:

К раствору 6-хлор-9-тетрагидропиран-2-ил-пурина (1 г, 4,19 ммоль, 1 экв) в ТГФ (10 мл) добавляют LDA (2 M, 3,14 мл, 1,5 экв) при -70°C и реакционную смесь перемешивают при -70°C в течение 0,5 ч. Затем ДМФ (918,75 мг, 12,57 ммоль, 967,11 мкл, 3 экв) добавляют при -70°C и смесь перемешивают при -70°C в течение еще 0,5 ч. Реакционную смесь гасят добавлением воды 10 мл при 0°C и затем разбавляют 10 мл этилацетата и экстрагируют 10 мл этилацетата (10 мл x 1). Объединенные органические слои промывают насыщенным солевым раствором (10 мл x 2), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Масло очищают колоночной хроматографией с получением 6-хлор-9-тетрагидропиран-2-ил-пурин-8-карбальдегида (I-608) (900 мг) в виде желтого масла. ЖХМС m/z 183,0 (M-84+1)+.
К раствору 6-хлор-9-тетрагидропиран-2-ил-пурин-8-карбальдегида (900 мг, 3,37 ммоль, 1 экв) в MeOH (10 мл) добавляют NaBH4 (255,35 мг, 6,75 ммоль, 2 экв) при 0°C. Смесь перемешивают при 15°C в течение 0,5 ч. Реакционную смесь гасят добавлением воды (5 мл) при 0°C и затем разбавляют этилацетатом (5 мл) и экстрагируют этилацетатом (5 мл x 1). Объединенные органические слои промывают насыщенным солевым раствором (5 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением (6-хлор-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (I-609) (880 мг) применяют на следующей стадии без дальнейшей очистки в виде светло-желтого твердого вещества. ЖХМС m/z 185,0 (M-84+1)+.
К раствору (6-хлор-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (830 мг, 3,09 ммоль, 1 экв) в ДМФ (10 мл) добавляют имидазол (420,58 мг, 6,18 ммоль, 2 экв) и TBSCl (558,69 мг, 3,71 ммоль, 454,22 мкл, 1,2 экв) при 15°C. Смесь перемешивают при 15°C в течение 0,5 ч. Реакционную смесь разделяют между водой (10 мл) и этилацетатом (10 мл). Органическую фазу разделяют, промывают насыщенным солевым раствором (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил-[(6-хлор-9-тетрагидропиран-2-ил-пурин-8-ил)метокси]-диметил-силана (I-610) (300 мг, 25% выход) в виде светло-желтого масла. ЖХМС m/z 383,0 (M+1)+.
К раствору фенилметанола (211,78 мг, 1,96 ммоль, 203,63 мкл, 3 экв) в ТГФ (3 мл) добавляют NaH (52,22 мг, 1,31 ммоль, 60% чистота, 2 экв) при 0°C. Смесь перемешивают при 15°C в течение 0,5 ч. Затем добавляют трет-бутил-[(6-хлор-9-тетрагидропиран-2-ил-пурин-8-ил)метокси]диметил-силан (250 мг, 652,81 мкмоль, 1 экв) и полученную реакционную смесь перемешивают при 15°C в течение 0,5 ч. Реакционную смесь гасят добавлением воды 5 мл при 0°C и затем разбавляют 5 мл этилацетата и экстрагируют 5 мл этилацетата (5 мл x 1). Объединенные органические слои промывают 5 мл насыщенного солевого раствора (5 мл x 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением масла. Масло очищают преп-ТСХ с получением (6-бензилокси-9-тетрагидропиран-2-ил-пурин-8-ил)метокси-трет-бутил-диметилсилана (I-611) (240 мг, 527,89 мкмоль, 81% выход) в виде бесцветного масла. ЖХМС m/z 455,1 (M+1)+.
К раствору (6-бензилокси-9-тетрагидропиран-2-ил-пурин-8-ил)метокси-трет-бутил-диметилсилана (230 мг, 505,90 мкмоль, 1 экв) в ТГФ (3 мл) добавляют TBAF (1M, 1,01 мл, 2 экв) при 15°C. Смесь перемешивают при 15°C в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении для удаления растворителя с получением желтого масла. Масло очищают колоночной хроматографией с получением (6-бензилокси-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (I-612) (130 мг, 76% выход) в виде бесцветного масла. ЖХМС m/z 341,1 (M+1)+.
К раствору (6-бензилокси-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (130 мг, 381,93 мкмоль, 1 экв) в ДХМ (2 мл) добавляют DIEA (148,09 мг, 1,15 ммоль, 199,58 мкл, 3 экв) и MsCl (87,50 мг, 763,86 мкмоль, 59,12 мкл, 2 экв) при 0°C. Смесь перемешивают при 15°C в течение 1 ч. Реакционную смесь разделяют между водой (2 мл) и дихлорметаном (2 мл). Органическую фазу разделяют, промывают насыщенным солевым раствором (2 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением (6-бензилокси-9-тетрагидропиран-2-ил-пурин-8-ил)метилметансульфоната (I-613) (180 мг), который применяют на следующей стадии без дальнейшей очистки в виде оранжевого масла.
К раствору 3-нитро-1H-пиридин-2-она (60,26 мг, 430,14 мкмоль, 1 экв) в ACN (2 мл) добавляют DIEA (111,19 мг, 860,28 мкмоль, 149,85 мкл, 2 экв) и (6-бензилокси-9-тетрагидропиран-2-ил-пурин-8-ил)метилметансульфонат (180 мг, 430,14 мкмоль, 1 экв) при 0°C. Смесь перемешивают при 15°C в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении для удаления растворителя с получением коричневого масла. Масло очищают преп-ТСХ с получением 1-[(6-бензилокси-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-3-нитро-пиридин-2-она (I-614) (70 мг, 35% выход) в виде светло-желтого твердого вещества. ЖХМС m/z 463,0 (M+1)+.
К раствору 1-[(6-бензилокси-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-3-нитро-пиридин-2-она (65 мг, 140,55 мкмоль, 1 экв) в EtOH (1 мл) и H2O (0,2 мл) добавляют Fe (39,25 мг, 702,77 мкмоль, 5 экв) и NH4Cl (75,18 мг, 1,41 ммоль, 49,14 мкл, 10 экв) при 15°C. Смесь перемешивают при 90°C в течение 0,5 ч. Реакционную смесь фильтруют и концентрируют при пониженном давлении для удаления растворителя с получением 3-амино-1-[(6-бензилокси-9H-пурин-8-ил)метил]пиридин-2-она (I-615) (50 мг) применяют на следующей стадии без дальнейшей очистки в виде желтого твердого вещества. ЖХМС m/z 349,0 (M+1)+.
Следующие промежуточные получают согласно методикам, описанным для синтеза I-615 с применением подходящих реагентов.
Пример 65:

К раствору 3-амино-1-[(6-бензилокси-9H-пурин-8-ил)метил]пиридин-2-она (45 мг, 129,18 мкмоль, 1 экв) и (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (33,36 мг, 129,18 мкмоль, 1 экв) в ДМФ (1 мл) добавляют HATU (58,94 мг, 155,01 мкмоль, 1,2 экв) и DIEA (33,39 мг, 258,35 мкмоль, 45,00 мкл, 2 экв) при 15°C. Смесь перемешивают при 15°C в течение 12 ч. Реакционную смесь фильтруют и концентрируют. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-1-[[1-[(6-бензилокси-9H-пурин-8-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 462) (18,7 мг, 22% выход) в виде оранжевого твердого вещества. ЖХМС m/z 589,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,23 (с, 1H), 8,47 (с, 1H), 8,22 (дд, J=1,4, 7,4 Гц, 1H), 7,71 (шд, J=7,7 Гц, 1H), 7,54 (дд, J=1,7, 6,9 Гц, 1H), 7,47 (шд, J=6,8 Гц, 2H), 7,42-7,26 (м, 4H), 6,64-6,49 (м, 1H), 6,40-6,28 (м, 2H), 5,55 (с, 2H), 5,37 (с, 2H), 4,20-4,10 (м, 1H), 3,52 (с, 3H), 2,96 (с, 3H), 2,81 (с, 3H), 2,28-2,13 (м, 2H), 1,91-1,61 (м, 2H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 65 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-621:
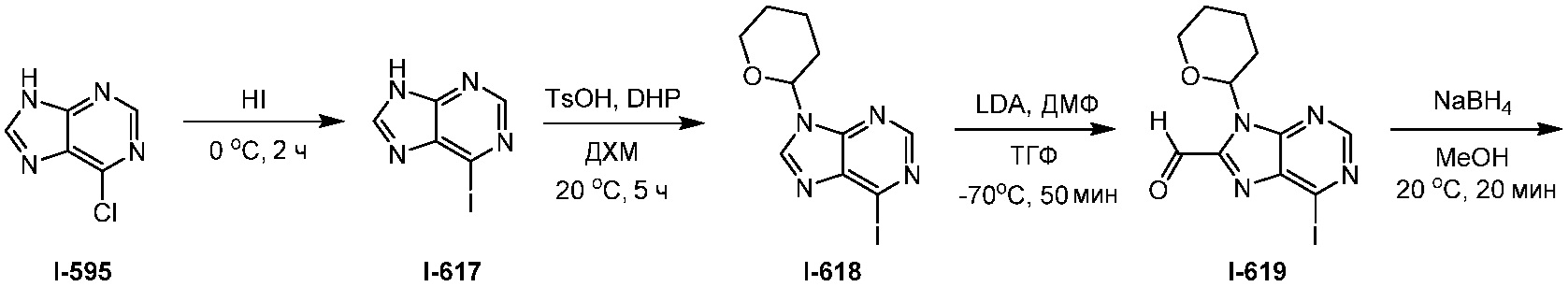

К HI (47%) (150 мл) в ледяной бане добавляют 6-хлор-9H-пурин (20 г, 129 ммоль, 1 экв) медленно при перемешивании при 0°C. Смесь перемешивают при 0°C в течение 2 часов. Смесь нагревают до 20°C и перемешивают в течение еще 2 ч. Смесь фильтруют. Фильтровальную лепешку суспендируют в 100 мл холодной воды и доводят до pH 7 добавлением NH3⋅H2O. Осадок фильтруют, промывают холодной водой (50 мл) и сушат в вакууме с получением 6-йод-9H-пурина (I-617) (23 г, 72% выход) в виде желтого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 13,85 (шс, 1H) 8,64 (с, 1H) 8,59 (с, 1H).
DHP (6,84 г, 81,3 ммоль, 2 экв) добавляют к смеси 6-йод-9H-пурина (10 г, 40,7 ммоль, 1 экв) и TsOH⋅H2O (773 мг, 4,06 ммоль, 0,1 экв) в ДХМ (150 мл) при 0°C по каплям. Смесь перемешивают при 20°C в течение 5 ч. Воду (100 мл) добавляют к смеси, и смесь экстрагируют ДХМ (100 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (100 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 6-йод-9-тетрагидропиран-2-ил-пурина (I-618) (11 г, 31,5 ммоль, 78% выход) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,62 (с, 1H) 8,38 (с, 1H) 5,75 (дд, J=10,4, 2,4 Гц, 1H) 4,16-4,19 (м, 1H) 3,74-3,84 (м, 1H) 2,03-2,21 (м, 3H) 1,68-1,79 (м, 3H).
n-BuLi (2,5 M, 13,6 мл, 1,25 экв) добавляют по каплям к раствору диизопропиламина (3,59 г, 35,4 ммоль, 5,01 мл, 1,3 экв) в ТГФ (30 мл) при -70°C под N2. Смесь перемешивают в течение 10 мин. Смесь добавляют по каплям к раствору 6-йод-9-тетрагидропиран-2-ил-пурина (9 г, 27,3 ммоль, 1 экв) в ТГФ (100 мл) при -70°C под N2 и перемешивают в течение 20 мин. ДМФ (5,98 г, 81,8 ммоль, 3 экв) добавляют к смеси при -70°C и перемешивают в течение 20 мин. Реакционную смесь гасят взаимодействием с насыщ. NH4Cl (100 мл). Смесь экстрагируют EtOAc (100 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (100 мл х 2), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 6-йод-9-тетрагидропиран-2-ил-пурин-8-карбальдегида (I-619) (8,75 г) применяют на следующей стадии без дальнейшей очистки в виде желтого твердого вещества.
NaBH4 (1,39 г, 36,6 ммоль, 1,5 экв) добавляют к раствору 6-йод-9-тетрагидропиран-2-ил-пурин-8-карбальдегида (8,75 г, 24,4 ммоль, 1 экв) в MeOH (100 мл) при 0°C. Смесь перемешивают при 20°C в течение 20 мин. Реакционную смесь гасят водой (100 мл) и концентрируют. Смесь экстрагируют EtOAc (50 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (50 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением (6-йод-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (I-620) (8,54 г), который применяют на следующей стадии без дальнейшей очистки, в виде желтого твердого вещества.
TBSCl (4,29 г, 28,5 ммоль, 1,2 экв) добавляют к смеси (6-йод-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (8,54 г, 23,7 ммоль, 1 экв) и имидазола (2,42 г, 35,6 ммоль, 1,5 экв) в ДМФ (100 мл) при 20°C. Смесь перемешивают при 20°C в течение 12 ч. Воду (100 мл) добавляют, и смесь экстрагируют EtOAc (100 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (100 мл х 2), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением трет-бутил-[(6-йод-9-тетрагидропиран-2-ил-пурин-8-ил)метокси]-диметил-силана (I-621) (4,5 г, 37% выход) в виде светло-желтого масла. ЖХМС m/z 475,0 (M+1)+.
Синтез промежуточного соединения I-626:

Pd(dppf)Cl2 (77,1 мг, 105 мкмоль, 0,05 экв) добавляют к смеси трет-бутил-[(6-йод-9-тетрагидропиран-2-ил-пурин-8-ил)метокси]-диметилсилана (1 г, 2,11 ммоль, 1 экв), 2-бензил-4,4,5,5-тетраметил-1,3,2-диоксаборолана (598 мг, 2,74 ммоль, 1,3 экв) и Cs2CO3 (1,37 г, 4,22 ммоль, 2 экв) в диоксане/H2O (10:1) (15 мл) под N2. Смесь перемешивают при 100°C в течение 18 ч. Смесь фильтруют, и фильтрат концентрируют с получением неочищенного продукта. Остаток очищают колоночной хроматографией с получением (6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метокси-трет-бутил-диметилсилана (I-622) (170 мг, 16% выход) в виде желтого масла. ЖХМС m/z 439,1 (M+1)+.
TBAF (1 M, 775 мкл, 2 экв) добавляют к раствору (6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метокси-трет-бутил-диметилсилана (170 мг, 388 мкмоль, 1 экв) в ТГФ (3 мл) при 20°C и перемешивают в течение 20 мин. Солевым раствором (5 мл) добавляют к смеси, и смесь экстрагируют EtOAc (5 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением (6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (I-623) (90 мг), который применяют на следующей стадии без дальнейшей очистки, в виде желтого масла.
MsCl (38,1 мг, 333 мкмоль, 1,2 экв) добавляют к смеси (6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (90 мг, 277 мкмоль, 1 экв) и DIPEA (71,7 мг, 555 мкмоль, 2 экв) в ДХМ (2 мл) при 0°C. Реакционную смесь перемешивают при 20°C в течение 0,5 ч. Реакционную смесь гасят взаимодействием с водой (5 мл), экстрагируют ДХМ (5 мл х 2), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением (6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метилметансульфоната (I-624) (111 мг), который применяют на следующей стадии без дальнейшей очистки, в виде желтого масла.
Смесь (6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метилметансульфоната (111 мг, 276 мкмоль, 1 экв), 3-нитро-1H-пиридин-2-она (46,4 мг, 331 мкмоль, 1,2 экв) и DIPEA (71,3 мг, 552 мкмоль, 2 экв) в CH3CN (3 мл) перемешивают при 20°C в течение 12 ч. Смесь концентрируют с получением неочищенного продукта. Остаток очищают преп-ТСХ с получением 1-[(6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-3-нитро-пиридин-2-она (I-625) (60 мг, 49% выход) в виде желтого масла. ЖХМС m/z 447,1 (M+1)+.
К раствору 1-[(6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-3-нитро-пиридин-2-она (60 мг, 134 мкмоль, 1 экв) в EtOAc (2 мл) добавляют Pd/C (30 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 10 мин. Смесь фильтруют, и фильтрат концентрируют с получением 3-амино-1-[(6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]пиридин-2-она (I-626) (40 мг, 69% выход) в виде белого твердого вещества. ЖХМС m/z 417,1 (M+1)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-626 с применением подходящих реагентов.
Пример 66:


HATU (54,8 мг, 144 мкмоль, 1,5 экв) добавляют к смеси 3-амино-1-[(6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]пиридин-2-она (40 мг, 96,0 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (27,3 мг, 106 мкмоль, 1,1 экв) и DIPEA (24,8 мг, 192 мкмоль, 2 экв) в ДМФ (1 мл). Смесь перемешивают при 35°C в течение 3 ч. Воду (3 мл) добавляют к смеси, и смесь экстрагируют EtOAc (5 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением метил N-[(E,1S)-1-[[1-[(6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (I-629) (60 мг), который применяют на следующей стадии без дальнейшей очистки в виде коричневого масла. ЖХМС m/z 657,3 (M+1)+.
ТФК (208 мг, 1,83 ммоль, 20 экв) добавляют к раствору метил N-[(E,1S)-1-[[1-[(6-бензил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (60 мг, 91,4 мкмоль, 1 экв) в ДХМ (1 мл) при 20°C. Смесь перемешивают в течение 10 мин. Смесь концентрируют с получением неочищенного продукта, который очищают преп-ЖХВД с получением метил N-[(E,1S)-1-[[1-[(6-бензил-9H-пурин-8-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 466) (18,6 мг, 33% выход) в виде белого твердого вещества. ЖХМС m/z 573,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,24 (с, 1H) 8,73 (с, 1H) 8,26 (дд, J=7,39, 1,65 Гц, 1H) 8,11 (с, 1H) 7,69 (шд, J=7,94 Гц, 1H) 7,59 (дд, J=6,95, 1,65 Гц, 1H) 7,27-7,31 (м, 2H) 7,22 (т, J=7,39 Гц, 2H) 7,12-7,18 (м, 1H) 6,52-6,63 (м, 1H) 6,29-6,41 (м, 2H) 5,45 (с, 2H) 4,31 (с, 2H) 4,11-4,19 (м, 1H) 3,50-3,54 (м, 3H) 2,95 (с, 3H) 2,78-2,84 (м, 3H) 2,12-2,27 (м, 2H) 1,84 (шд, J=7,28 Гц, 1H) 1,62-1,75 (м, 1H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 66 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-634:

К раствору (1,3-диоксоизоиндолин-2-ила) 3,3-диметилбутаноата (660,88 мг, 2,53 ммоль, 1,2 экв), трет-бутил-[(6-йод-9-тетрагидропиран-2-ил-пурин-8-ил)метокси]-диметил-силана (1 г, 2,11 ммоль, 1 экв) и Zn (275,67 мг, 4,22 ммоль, 2 экв) в DMA (4 мл) добавляют (dtbbpy)NiBr (153,95 мг, 316,18 мкмоль, 0,15 экв) при 20°C. Реакционную смесь перемешивают при 40°C в течение 12 ч. Смесь выливают в воду (2 мл) и фильтруют, фильтрат экстрагируют EtOAc (3 мл х 2), промывают насыщенным солевым раствором (2 мл), сушат над Na2SO4 и концентрируют в вакууме с получением остатка. Остаток очищают преп-ТСХ с получением 8-(((трет-бутилдиметилсилил)окси)метил)-6-неопентил-9-(тетрагидро-2H-пиран-2-ил)-9H-пурина (I-630) (0,56 г, 32% выход) в виде белого твердого вещества.
Раствор 8-(((трет-бутилдиметилсилил)окси)метил)-6-неопентил-9-(тетрагидро-2H-пиран-2-ил)-9H-пурина (560 мг, 1,34 ммоль, 1 экв) и TBAF (1 M, 668,82 мкл, 0,5 экв) в ТГФ (5 мл) перемешивают при 18°C в течение 0,5 ч. Смесь концентрируют в вакууме с получением масла, которое очищают колоночной хроматографией с получением [6-(2,2-диметилпропил)-9-тетрагидропиран-2-ил-пурин-8-ил]метанола (I-631) (360 мг) в виде бесцветного масла.
Раствор N-[5-амино-6-[(E)-2-циклопропилвинил]пиримидин-4-ил]-2-(3-нитро-2-оксо-1-пиридил)ацетамида (780 мг, 2,19 ммоль, 1 экв) в AcOH (20 мл) перемешивают при 120°C в течение 12 ч. Смесь концентрируют в вакууме с получением масла, которое очищают преп-ЖХВД с получением 1-[[6-[(E)-2-циклопропилвинил]-9H-пурин-8-ил]метил]-3-нитро-пиридин-2-она (I-632) (440 мг, 59% выход) в виде коричневого твердого вещества.
Раствор [6-(2,2-диметилпропил)-9-тетрагидропиран-2-ил-пурин-8-ил]метилметансульфоната (500 мг, 1,31 ммоль, 1 экв), 3-нитро-1H-пиридин-2-она (183,53 мг, 1,31 ммоль, 1 экв) и DIEA (203,17 мг, 1,57 ммоль, 273,81 мкл, 1,2 экв) в ACN (5 мл) перемешивают при 18°C в течение 2 ч. Реакционную смесь выливают в воду (20 мл) и экстрагируют EtOAc (10 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 1-[[6-(2,2-диметилпропил)-9-тетрагидропиран-2-ил-пурин-8-ил]метил]-3-нитро-пиридин-2-она (I-633) (210 мг, 38% выход) в виде желтого масла. ЖХМС m/z 427,2 (M+1)+.
Раствор 1-[[6-(2,2-диметилпропил)-9-тетрагидропиран-2-ил-пурин-8-ил]метил]-3-нитро-пиридин-2-она (210 мг, 492,42 мкмоль, 1 экв) и Pd/C (0,2 г, 10% чистота) в EtOAc (5 мл) перемешивают при 18°C под H2 (15 ф./кв.д.) в течение 5 мин. Смесь фильтруют, и фильтрат концентрируют в вакууме с получением 3-амино-1-[[6-(2,2-диметилпропил)-9-тетрагидропиран-2-ил-пурин-8-ил]метил]пиридин-2-она (I-634) (0,23 г) в виде зеленого масла, которое применяют на следующей стадии.
Пример 67:

К раствору 3-амино-1-[[6-(2,2-диметилпропил)-9-тетрагидропиран-2-ил-пурин-8-ил]метил]пиридин-2-она (110 мг, 277,44 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (85,98 мг, 332,93 мкмоль, 1,2 экв) и DIEA (71,71 мг, 554,88 мкмоль, 96,65 мкл, 2 экв) в ДМФ (1 мл) добавляют HATU (126,59 мг, 332,93 мкмоль, 1,2 экв) при 18°C. Реакционную смесь перемешивают при 40°C в течение 1 ч. Реакционную смесь выливают в воду 5 мл и экстрагируют EtOAc (4 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (4 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-(2,2-диметилпропил)-9-тетрагидропиран-2-ил-пурин-8-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (I-635) (250 мг) в виде черного масла.
Раствор метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-(2,2-диметилпропил)-9-тетрагидропиран-2-ил-пурин-8-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (250 мг, 392,62 мкмоль, 1 экв) и CF3COOH (525 мг, 8,74 ммоль, 500 мкл, 22,27 экв) в ДХМ (2 мл) перемешивают при 18°C в течение 0,5 ч. Смесь концентрируют в вакууме с получением масла, которое очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-(2,2-диметилпропил)-9H-пурин-8-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 468) (101,2 мг, 46% выход) в виде белого твердого вещества. ЖХМС m/z 553,1 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,88-1,04 (м, 9 H) 1,62-1,79 (м, 1H) 1,87 (шд, J=6,72 Гц, 1H) 2,15-2,31 (м, 2H) 2,84 (с, 3H) 2,90 (с, 2H) 2,99 (с, 3H) 3,54 (с, 3H) 4,13-4,23 (м, 1H) 5,46 (шд, J=18,46 Гц, 2H) 6,29-6,43 (м, 2H) 6,53-6,70 (м, 1H) 7,51-7,66 (м, 1H) 7,72 (шс, 1H) 8,27 (шт, J=7,34 Гц, 1H) 8,62-8,90 (м, 1H) 9,26 (с, 1H) 13,16-13,57 (м, 1H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 67 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-641:
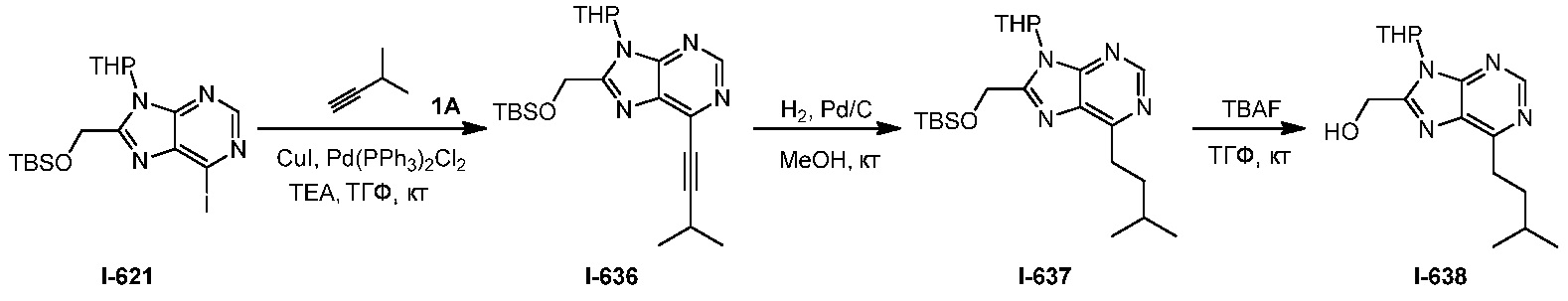

К раствору трет-бутил-[(6-йод-9-тетрагидропиран-2-ил-пурин-8-ил)метокси]-диметилсилана (800 мг, 1,69 ммоль) в ТГФ (10 мл) добавляют CuI (80,29 мг, 421,58 мкмоль) и Et3N (511,91 мг, 5,06 ммоль, 704,14 мкл), Pd(PPh3)2Cl2 (118,36 мг, 168,63 мкмоль) и 3-метилбут-1-ин (287,16 мг, 4,22 ммоль, 431,18 мкл). Смесь перемешивают при 20°C в течение 1 ч под N2. Смесь выливают в воду (10 мл), и водную фазу экстрагируют этилацетатом (5 мл х 3). Объединенную органическую фазу концентрируют в вакууме. Остаток очищают колоночной хроматографией с получением трет-бутил-диметил-[[6-(3-метилбут-1-инил)-9-тетрагидропиран-2-ил-пурин-8-ил]метокси]силана (I-636) (800 мг) в виде желтого масла. ЖХМС m/z 415,0 (M+1)+.
К раствору трет-бутил-диметил-[[6-(3-метилбут-1-инил)-9-тетрагидропиран-2-ил-пурин-8-ил]метокси]силана (800 мг, 1,93 ммоль) в EtOAc (15 мл) добавляют Pd/C (300 мг, 10% чистота). Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 12 часов. Реакционную смесь фильтруют и фильтрат концентрируют с получением трет-бутил-[(6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метокси]-диметилсилана (I-637) (700 мг) в виде желтого масла. ЖХМС m/z 419,1 (M+1)+.
К раствору трет-бутил-[(6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил) метокси]-диметил-силана (700 мг, 1,67 ммоль) в ТГФ (10 мл) добавляют TBAF (1M, 2,01 мл). Смесь перемешивают при 18°C в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении для удаления ТГФ. Остаток разбавляют H2O (5 мл) и экстрагируют EtOAc (5 мл x 3). Объединенные органические слои концентрируют при пониженном давлении с получением (6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (I-638) (600 мг) в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ 8,74 (с, 1H), 5,83 (дд, J=2,6, 11,1 Гц, 1H), 5,00-4,82 (м, 2H), 4,20-4,08 (м, 1H), 3,69 (дт, J=2,6, 11,7 Гц, 1H), 3,11-3,04 (м, 2H), 2,20-2,10 (м, 1H), 1,99 (шд, J=9,5 Гц, 1H), 1,90 (шд, J=13,1 Гц, 1H), 1,75-1,62 (м, 5H), 1,62-1,53 (м, 2H), 0,89 (д, J=6,5 Гц, 6H).
К раствору (6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (550 мг, 1,81 ммоль) в ДХМ (4 мл) добавляют DIPEA (700,59 мг, 5,42 ммоль, 944,20 мкл). MsCl (310,48 мг, 2,71 ммоль, 209,78 мкл) добавляют по каплям при 18°C. Смесь перемешивают при 18°C в течение 1 ч. Смесь выливают в воду (5 мл) и органическую фазу концентрируют в вакууме при 20°C с получением (6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метилметансульфоната (I-639) (680 мг) в виде желтого масла.
К раствору 3-нитро-1H-пиридин-2-она (273,98 мг, 1,96 ммоль) в MeCN (12 мл) добавляют DIPEA (459,55 мг, 3,56 ммоль, 619,34 мкл) и (6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метилметансульфонат (680 мг, 1,78 ммоль) при 0°C, смесь перемешивают при 18°C в течение 12 ч. Смесь выливают в воду (5 мл). Водную фазу экстрагируют этилацетатом (5 мл х 3) и объединенную органическую фазу концентрируют в вакууме. Остаток очищают колоночной хроматографией с получением 1-[(6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-3-нитро-пиридин-2-она (I-640) (400 мг) в виде желтого масла. ЖХМС m/z 449,0 (M+23)+.
К раствору 1-[(6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-3-нитро-пиридин-2-она (200 мг, 468,97 мкмоль) в MeOH (2 мл) и H2O (0,5 мл) добавляют Fe (340,46 мг, 6,10 ммоль) и NH4Cl (326,12 мг, 6,10 ммоль, 213,15 мкл). Смесь перемешивают при 80°C в течение 1 часа. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток выливают в воду (2 мл), и водную фазу экстрагируют ДХМ (2 мл х 3). Объединенную органическую фазу концентрируют в вакууме с получением 3-амино-1-[(6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]пиридин-2-она (I-641) (157 мг) в виде черно-коричневого твердого вещества. ЖХМС m/z 397,4 (M+1)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-641 с применением подходящих реагентов.
Пример 68:

К раствору 3-амино-1-[(6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]пиридин-2-она (157 мг, 395,98 мкмоль) в ДМФ (0,5 мл) добавляют (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (122,72 мг, 475,18 мкмоль) и DIPEA (102,36 мг, 791,96 мкмоль, 137,95 мкл) и HATU (225,85 мг, 593,97 мкмоль). Смесь перемешивают при 35°C в течение 12 ч. Смесь выливают в воду (4 мл). Водную фазу экстрагируют ДХМ (5 мл х 2). Объединенную органическую фазу промывают насыщенным солевым раствором (5 мл х 3), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (I-644) (180 мг) в виде черно-коричневого масла. ЖХМС m/z 637,1 (M+1)+.
К раствору метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-изопентил-9-тетрагидропиран-2-ил-пурин-8-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (173 мг, 271,70 мкмоль) в ДХМ (1,5 мл) добавляют ТФК (464,69 мг, 4,08 ммоль, 301,75 мкл). Смесь перемешивают при 18°C в течение 0,5 ч. Смесь выливают в насыщ. NaHCO3 раствор (5 мл). Объединенную органическую фазу промывают насыщенным солевым раствором (3 мл х 2), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают преп-ЖХВД с получением метил (S, E)-(7-(диметиламино)-1-((1-((6-изопентил-9H-пурин-8-ил)метил)-2-оксо-1,2-дигидропиридин-3-ил)амино)-1,7-диоксогепт-5-ен-2-ил)карбамата (Соединение 471) (51,1 мг, 33% выход) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 13,50 (шс, 1H), 9,27 (с, 1H), 8,74 (с, 1H), 8,28 (д, J=7,3 Гц, 1H), 7,73 (шд, J=7,7 Гц, 1H), 7,60 (шд, J=7,0 Гц, 1H), 6,65-6,54 (м, 1H), 6,44-6,31 (м, 2H), 5,45 (с, 2H), 4,18 (шс, 1H), 3,54 (с, 3H), 3,03-2,95 (м, 5H), 2,84 (с, 3H), 2,30-2,13 (м, 2H), 1,87 (шд, J=7,7 Гц, 1H), 1,76-1,63 (м, 3H), 1,56 (шс, 1H), 0,91 (шд, J=6,1 Гц, 6H). ЖХМС m/z 553,2 (M+1)+.
Следующие соединения получают согласно методикам, описанным для синтеза Пример 68 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-655:




4,6-дихлорпиримидин-5-амин (5 г, 30,49 ммоль) добавляют одной порцией до HI (47%) (60 мл) при 0°C, затем NaI (22,85 г, 152,45 ммоль) при 0°C. Смесь перемешивают при 20°C в течение 12 часов. Реакционную смесь выливают в воду 100 мл и экстрагируют ДХМ (50 мл x 2). Объединенную органическую фазу промывают насыщ. NaHCO3 (40 мл), насыщ. Na2S2O3 (40 мл) и солевым раствором (40 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 4,6-дийодпиримидин-5-амина (I-646) (5,8 г, 55% выход) в виде желтого твердого вещества.
Смесь 4,6-дийодпиримидин-5-амина (3,8 г, 10,95 ммоль), 3,3-диэтоксипроп-1-ина (1,54 г, 12,05 ммоль, 1,73 мл), CuI (521,56 мг, 2,74 ммоль), Pd(PPh3)2Cl2 (768,88 мг, 1,10 ммоль) и TEA (5,54 г, 54,77 ммоль, 7,62 мл) в ТГФ (45 мл) дегазируют и продувают N2 3 раза и затем смесь перемешивают при 20°C в течение 12 ч под N2 атмосферой. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают флэш-хроматографией на силикагеле с получением 4-(3,3-диэтоксипроп-1-инил)-6-йод-пиримидин-5-амина (I-647) (1,8 г) в виде желтого масла.
Смесь 4-(3,3-диэтоксипроп-1-инил)-6-йод-пиримидин-5-амина (1,8 г, 5,19 ммоль) в ТГФ (20 мл) добавляют t-BuOK (727,28 мг, 6,48 ммоль) при 0°C. Смесь перемешивают при 20°C в течение 1,5 часов. Реакционную смесь разбавляют насыщ. NH4Cl (30 мл) и экстрагируют EtOAc (20 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 6-(диэтоксиметил)-4-йод-5H-пирроло[3,2-d]пиримидина (I-648) (1,7 г, 94% выход) в виде коричневого твердого вещества.
Смесь 6-(диэтоксиметил)-4-йод-5H-пирроло[3,2-d]пиримидина (1,7 г, 4,90 ммоль) в ДМФ (20 мл) добавляют NaH (254,64 мг, 6,37 ммоль, 60% чистота) при 0°C и затем смесь перемешивают при 0°C в течение 0,5 часа, затем SEM-Cl (1,06 г, 6,37 ммоль, 1,13 мл) добавляют при 0°C и затем смесь перемешивают при 20°C в течение 1 ч. Реакционную смесь выливают в насыщ. NH4Cl (40 мл) и экстрагируют EtOAc (15 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 2-[[6-(диэтоксиметил)-4-йод-пирроло[3,2-d]пиримидин-5-ил]метокси]этил-триметил-силана (I-649) (1,2 г, 2,51 ммоль, 51,33% выход) в виде желтого масла.
Смесь 2-[[6-(диэтоксиметил)-4-йод-пирроло[3,2-d]пиримидин-5-ил]метокси]этил-триметил-силана (0,7 г, 1,47 ммоль), 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (400,43 мг, 2,20 ммоль), K2CO3 (405,29 мг, 2,93 ммоль), Pd(dppf)Cl2 (107,29 мг, 146,62 мкмоль) в диоксане (8 мл) и H2O (1,6 мл) дегазируют и продувают N2 3 раза. Смесь перемешивают при 100°C в течение 12 часов под N2 атмосферой. К реакционной смеси добавляют насыщ. NH4Cl (20 мл). Реакционную смесь экстрагируют EtOAc (10 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией с получением 2-[[6-(диэтоксиметил)-4-(2-метилпроп-1-енил)пирроло[3,2-d]пиримидин-5-ил]метокси]этил-триметилсилана (I-650) (0,29 г, 49% выход) в виде желтого масла.
Смесь 2-[[6-(диэтоксиметил)-4-(2-метилпроп-1-енил)пирроло[3,2-d]пиримидин-5-ил]метокси]этил-триметил-силана (0,29 г, 714,98 мкмоль) в ТГФ (2 мл) добавляют HCl (2 мл, 6N) при 45°C. Смесь перемешивают при 45°C в течение 1,5 ч. К реакционной смеси смесь добавляют NaOH (твердый) при 0°C до pH~8. Смесь разбавляют водой (10 мл) и экстрагируют EtOAc (8 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 4-(2-метилпроп-1-енил)-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-карбальдегида (I-651) (0,16 г) в виде коричневого масла.
В смесь 4-(2-метилпроп-1-енил)-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-карбальдегида (0,16 г, 482,68 мкмоль) в MeOH (2 мл) добавляют NaBH4 (36,52 мг, 965,36 мкмоль) при 0°C. Смесь перемешивают при 20°C в течение 2 ч. К реакционной смеси смесь добавляют воду (5 мл) для гашения NaBH4 и затем смесь концентрируют при пониженном давлении для удаления MeOH. Водную фазу экстрагируют EtOAc (4 мл x 2). Объединенные органические слои сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка, который очищают преп-ТСХ с получением [4-(2-метилпроп-1-енил)-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метанола (I-652) (0,04 г, 119,94 мкмоль, 25% выход) в виде желтого масла.
Смесь [4-(2-метилпроп-1-енил)-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метанола (0,04 г, 119,94 мкмоль), DIEA (46,50 мг, 359,82 мкмоль, 62,67 мкл) в ДХМ (1 мл) добавляют MsCl (27,48 мг, 239,88 мкмоль, 18,57 мкл) при 0°C. Смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь разбавляют насыщ. раствором NH4Cl (3 мл) и экстрагируют ДХМ (2 мл x 2). Объединенную органическую фазу сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением [4-(2-метилпроп-1-енил)-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метилметансульфоната (I-653) (0,065 г) в виде коричневого масла.
Смесь 3-нитро-1H-пиридин-2-она (22,12 мг, 157,92 мкмоль), DIEA (40,82 мг, 315,85 мкмоль, 55,02 мкл) в ACN (1 мл) добавляют раствор [4-(2-метилпроп-1-енил)-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метилметансульфоната (0,065 г, 157,92 мкмоль) в ACN (1 мл) при 0°C и затем смесь перемешивают при 20°C в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении с получением масла, которое очищают преп-ТСХ с получением 1-[[4-(2-метилпроп-1-енил)-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метил]-3-нитро-пиридин-2-она (I-654) (0,05 г) в виде желтого масла. ЖХМС m/z 458,3 (M+1)+.
Смесь 1-[[4-(2-метилпроп-1-енил)-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метил]-3-нитро-пиридин-2-она (0,05 г, 109,75 мкмоль), Pd/C (0,05 г, 10% чистота) в EtOAc (10 мл) дегазируют и продувают H2 3 раза и затем смесь перемешивают при 20°C в течение 1 ч под H2 атмосферой (15 ф./кв.д.). Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением 3-амино-1-[[4-изобутил-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метил]пиридин-2-она (I-655) (0,047 г) в виде зеленого масла. ЖХМС m/z 428,4 (M+1)+.
Следующие промежуточные получают согласно методикам, описанным для синтеза I-655 с применением подходящих реагентов.
Пример 69:

Смесь 3-амино-1-[[4-изобутил-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метил]пиридин-2-она (0,047 г, 109,91 мкмоль), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (34,06 мг, 131,89 мкмоль) и DIEA (28,41 мг, 219,82 мкмоль, 38,29 мкл) в ДМФ (1,5 мл) добавляют HATU (50,15 мг, 131,89 мкмоль) при 30°C. Смесь перемешивают при 30°C в течение 12 ч. Реакционную смесь выливают в воду (15 мл) и экстрагируют EtOAc (8 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (15 мл) и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[4-изобутил-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (I-657) (40 мг, 54% выход) в виде желтого масла. ЖХМС m/z 668,5 (M+1)+.
Смесь метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[4-изобутил-5-(2-триметилсилилэтоксиметил)пирроло[3,2-d]пиримидин-6-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (35 мг, 52,41 мкмоль) в ДХМ (1,5 мл) и ТФК (1,5 мл) и затем смесь перемешивают при 35°C в течение 2 ч. Реакционную смесь выливают в насыщ. водн. NaHCO3 (10 мл) и экстрагируют ДХМ (8 мл x 2). Объединенные органические слои промывают 10 мл насыщенного солевого раствора, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-5H-пирроло[3,2-d]пиримидин-6-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 459) (13,9 мг, 49% выход) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 12,08 (шс, 1H) 9,32 (с, 1H) 8,69 (с, 1H) 8,26 (дд, J=7,34, 1,34 Гц, 1H) 7,75 (шд, J=7,70 Гц, 1H) 7,55 (шд, J=5,50 Гц, 1H) 6,57-6,66 (м, 1H) 6,34-6,43 (м, 2H) 6,30 (с, 1H) 5,41 (с, 2H) 4,15-4,25 (м, 1H) 3,56 (с, 3H) 2,99 (с, 3H) 2,88 (д, J=7,34 Гц, 2H) 2,84 (с, 3H) 2,17-2,33 (м, 3H) 1,67-1,94 (м, 2H) 0,93 (д, J=6,60 Гц, 6H). ЖХМС m/z 538,3 (M+1)+.
Следующие соединения получают согласно методикам, описанным для синтеза Примера 69 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-671:

К раствору 2-бром-5-фтор-пиридин-3-амина (5,6 г, 29,32 ммоль, 1 экв), проп-2-иноксиметилбензола (6,43 г, 43,98 ммоль, 58,39 мкл, 1,5 экв), CuI (1,40 г, 7,33 ммоль, 0,25 экв) и TEA (10,38 г, 102,62 ммоль, 14,28 мл, 3,5 экв) в ДМФ (60 мл) добавляют дихлорпалладийтрифенилфосфан (2,06 г, 2,93 ммоль, 0,1 экв) при 18°C. Реакционную смесь перемешивают при 18°C в течение 12 ч. Реакционную смесь выливают в воду 60 мл и экстрагируют 60 мл EtOAc (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (30 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-(3-бензилоксипроп-1-инил)-5-фтор-пиридин-3-амина (I-662) (4,24 г, 56% выход) в виде коричневого масла. ЖХМС m/z 257 (M+1)+.
К раствору 2-(3-бензилоксипроп-1-инил)-5-фтор-пиридин-3-амина (4,24 г, 16,54 ммоль, 1 экв) в ТГФ (50 мл) добавляют т-BuOK (2,23 г, 19,85 ммоль, 1,2 экв) при 0°C, затем реакционную смесь перемешивают при 20°C в течение 3 ч. Реакционную смесь выливают в воду 60 мл и экстрагируют EtOAc 60 мл (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором 30 мл (30 мл х 1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-(бензилоксиметил)-6-фтор-1H-пирроло[3,2-b]пиридина (I-663) (3 г, 71% выход) в виде желтого твердого вещества. ЖХМС m/z 256,8 (M+1)+.
К раствору 2-(бензилоксиметил)-6-фтор-1H-пирроло[3,2-b]пиридина (3 г, 11,03 ммоль, 1 экв) в ДМФ (30 мл) добавляют NaH (661,57 мг, 16,54 ммоль, 60% чистота, 1,5 экв) при 0°C. Раствор перемешивают при 0°C в течение 0,5 ч и затем SEM-Cl (2,21 г, 13,23 ммоль, 2,34 мл, 1,2 экв) добавляют к раствору при 0°C. Раствор перемешивают при 0°C в течение 0,5 ч. Реакционную смесь выливают в воду 60 мл и экстрагируют EtOAc 60 мл (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором 30 мл (30 мл х 1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-[[2-(бензилоксиметил)-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-664) (2,5 г, 59% выход) в виде желтого масла. ЖХМС m/z 387,4 (M+1)+.
К раствору 2-[[2-(бензилоксиметил)-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (2,5 г, 6,47 ммоль, 1 экв) в CHCl3 (25 мл) добавляют m-CPBA (2,09 г, 9,70 ммоль, 80% чистота, 1,5 экв) при 0°C. Реакционную смесь перемешивают при 20°C в течение 2 ч. Реакционную смесь выливают в насыщ. водн. Na2SO3 (30 мл) и насыщ. водн. NaHCO3 (30 мл) и затем экстрагируют EtOAc (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл х 1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 2-[[2-(бензилоксиметил)-6-фтор-4-оксидо-пирроло[3,2-b]пиридин-4-ий-1-ил]метокси]этил-триметил-силана (I-665) (3 г) в виде желтого масла, которое сразу используют на следующей стадии.
К раствору 2-[[2-(бензилоксиметил)-6-фтор-4-оксидо-пирроло[3,2-b]пиридин-4-ий-1-ил]метокси]этил-триметил-силана (0,1 г, 248,43 мкмоль, 1 экв) в CHCl3 (1 мл) добавляют POCl3 (495,00 мг, 3,23 ммоль, 0,3 мл, 12,99 экв) при 80°C. Реакционную смесь перемешивают при 80°C в течение 0,5 ч. Реакционную смесь гасят ледяной водой (20 мл) при 0°C и затем доводят насыщ. водн. NaHCO3 до pH=7 и экстрагируют EtOAc (25 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл х 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают флэш-хроматографией на силикагеле с получением 2-[[2-(бензилоксиметил)-7-хлор-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силан (I-666) (0,78 г, 25% выход) в виде зеленого масла.
К раствору 2-[[2-(бензилоксиметил)-7-хлор-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (780 мг, 1,85 ммоль, 1 экв), 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (404,81 мг, 2,22 ммоль, 1,2 экв) и K2CO3 (768,21 мг, 5,56 ммоль, 3 экв) в диоксане (8 мл) и H2O (1,6 мл) добавляют Pd(dppf)Cl2⋅CH2Cl2 (181,57 мг, 222,34 мкмоль, 0,12 экв). Смесь перемешивают при 110°C под N2 в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают флэш-хроматографией на силикагеле с получением 2-[[2-(бензилоксиметил)-6-фтор-7-(2-метилпроп-1-енил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-667) (550 мг, 67% выход) в виде желтого масла. ЖХМС m/z 441,4 (M+1)+.
Раствор 2-[[2-(бензилоксиметил)-6-фтор-7-(2-метилпроп-1-енил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (550 мг, 1,25 ммоль, 1 экв) и Pd/C (550 мг, 10% чистота) в MeOH (10 мл) перемешивают при 50°C под H2 (15 ф./кв.д.) в течение 2 ч. Смесь фильтруют и фильтрат концентрируют в вакууме с получением неочищенного [6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метанола (I-668) (460 мг) в виде желтого масла. ЖХМС m/z 352,9 (M+1)+.
К раствору [6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метанола (0,25 г, 709,18 мкмоль, 1 экв) и DIEA (183,31 мг, 1,42 ммоль, 247,05 мкл, 2 экв) в ДХМ (2 мл) добавляют MsCl (121,86 мг, 1,06 ммоль, 82,33 мкл, 1,5 экв) по каплям при 0°C. Реакционную смесь перемешивают при 0°C в течение 1 ч. Реакционную смесь выливают в воду 5 мл и экстрагируют ДХМ (10 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (10 мл х 1), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением неочищенного [6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метилметансульфоната (I-669) (750 мг) в виде черного масла.
Раствор 3-нитро-1H-пиридин-2-она (292,81 мг, 2,09 ммоль, 1,2 экв), [6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метилметансульфоната (750 мг, 1,74 ммоль, 1 экв) и DIEA (337,66 мг, 2,61 ммоль, 455,07 мкл, 1,5 экв) в ACN (7 мл) перемешивают при 30°C в течение 12 ч. Реакционную смесь выливают в воду (40 мл) и экстрагируют EtOAc (20 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (10 мл х 2), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (I-670) (0,36 г, 44% выход) в виде черного масла. ЖХМС m/z 475,0(M+1)+.
К раствору 1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (0,36 г, 758,53 мкмоль, 1 экв) и Pd/C (200 мг, 10% чистота) в EtOAc (5 мл) перемешивают при 20°C в течение 0,5 ч под H2 (15 ф./кв.д.). Смесь фильтруют, и фильтрат концентрируют в вакууме с получением 3-амино-1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (I-671) (0,36 г) в виде зеленого масла. ЖХМС m/z 445,0 (M+1)+.
Пример 70:

Раствор 3-амино-1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (80 мг, 180 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(2-метоксиэтоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (109 мг, 360 мкмоль, 2 экв), DIEA (233 мг, 1,80 ммоль, 10 экв) и T3P (573 мг, 900 мкмоль, 50% чистота, 5 экв) в ДХМ (3 мл) перемешивают при 30°C в течение 12 ч. Насыщ. водн. NaHCO3 (5 мл) добавляют к смеси, и смесь экстрагируют ДХМ (5 мл х 3). Органической слой концентрируют при пониженном давлении с получением 2-метоксиэтил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (I-675) (131 мг) в виде коричневого масла, которое применяют на следующей стадии без дальнейшей очистки. ЖХМС m/z 729,4(M+1)+.
ТФК (1,54 г, 13,5 ммоль, 1 мл) добавляют к раствору 2-метоксиэтил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (131 мг, 180 мкмоль, 1 экв) в ДХМ (2 мл) при 25°C и перемешивают в течение 12,5 ч. Смесь концентрируют для удаления ДХМ, затем растворяют в MeOH (2 мл) и подщелачивают до pH 7 с NaHCO3. KOAc (35,3 мг, 359 мкмоль, 2 экв) добавляют к смеси и перемешивают при 25°C в течение 1 ч. Смесь концентрируют с получением остатка. Остаток очищают преп-ЖХВД с получением 2-метоксиэтил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 527) (37,4 мг, 34% выход) в виде белого твердого вещества. ЖХМС m/z 599,4 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,56 (с, 1H) 9,31 (с, 1H) 8,16-8,30 (м, 2H) 7,85 (шд, J=7,6 Гц, 1H) 7,48 (шд, J=5,4 Гц, 1H) 6,55-6,68 (м, 1H) 6,28-6,43 (м, 3H) 5,33 (с, 2H) 4,14-4,23 (м, 1H) 4,08 (шд, J=2,8 Гц, 2H) 3,50 (шт, J=4,4 Гц, 2H) 3,25 (с, 3H) 2,99 (с, 3H) 2,83 (с, 3H) 2,77 (шд, J=7,2 Гц, 2H) 2,17-2,30 (м, 2H) 2,01 (дт, J=13,6, 6,8 Гц, 1H) 1,66-1,92 (м, 2H) 0,91 (д, J=6,4 Гц, 6H).
Следующие соединения получают по методике, описанной для синтеза Примера 70 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-676:

К смеси[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метанола (500 мг, 1,42 ммоль), 3-амино-6-метил-1H-пиридин-2-она (352,15 мг, 2,84 ммоль) и трибутилфосфана (573,93 мг, 2,84 ммоль, 699,91 мкл) в толуоле (10 мл) добавляют TMAD (488,46 мг, 2,84 ммоль) при 0°C. Реакционную смесь перемешивают при 110°C в течение 12 часов под N2. Реакционную смесь концентрируют в вакууме. Остаток очищают колоночной хроматографией (SiO2) и затем очищают преп-ЖХВД с получением 3-амино-1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-6-метил-пиридин-2-она (I-676) (0,11 г, 239,84 мкмоль, 16,91% выход) в виде желтого масла.
Следующее промежуточное соединение получают согласно методикам, описанным для синтеза I-676 с применением подходящих реагентов.
Пример 71:


К смеси 3-амино-1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-6-метил-пиридин-2-она (45 мг, 98,12 мкмоль), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (32,94 мг, 127,55 мкмоль) и DIEA (25,36 мг, 196,23 мкмоль, 34,18 мкл) в ДХМ (2 мл) добавляют T3P (124,87 мг, 196,23 мкмоль, 116,70 мкл, 50% чистота) (в EtOAc), и затем смесь перемешивают при 40°C в течение 12 часов. В смесь добавляют насыщенный NH4Cl (10 мл) и экстрагируют ДХМ (3 мл х 3). Объединенную органическую фазу промывают солевым раствором (10 мл х 1), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (I-678) (80 мг) в виде светло-желтого масла.
Смесь метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (80 мг, 114,47 мкмоль) в ТФК (2 мл) перемешивают при 30°C в течение 1,5 часов. Реакционную смесь сушат пропусканием N2, затем добавляют MeOH (2 мл), доводят NaHCO3 (твердым) до pH~7, затем добавляют KOAc (22,47 мг, 228,93 мкмоль) к смеси и перемешивают при 40°C в течение 2 часов. Реакционную смесь фильтруют. Фильтрат очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 553) (29,0 мг, 40% выход) в виде светло-желтого твердого вещества. ЖХМС m/z 569,3 (M+1) ЖХМС m/z 569,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,61 (шс, 1H) 9,23 (шс, 1H) 8,12-8,23 (м, 2H) 7,75 (шд, J=7,28 Гц, 1H) 6,55-6,66 (м, 1H) 6,38 (шд, J=15,21 Гц, 1H) 6,25 (шд, J=7,50 Гц, 1H) 5,95 (шс, 1H) 5,45 (шс, 2H) 4,18 (шс, 1H) 3,55 (шс, 3H) 2,99 (с, 3H) 2,75-2,88 (м, 5Н) 2,37 (шс, 3H) 2,23 (шд, J=6,17 Гц, 2H) 1,98-2,09 (м, 1H) 1,65-1,94 (м, 2H) 0,93 (шд, J=5,95 Гц, 6H).
Следующие соединения получают по методике, описанной для синтеза Примера 71 с применением подходящих промежуточных соединений.
Пример 72:

Соединение 585 получают согласно методикам для Примеров 70 и 71 с применением подходящих промежуточных соединений. ЖХМС m/z 567,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,61 (с, 1H), 9,32 (с, 1H), 8,28-8,14 (м, 2H), 7,76 (шд, J=7,7 Гц, 1H), 7,51-7,44 (м, 1H), 6,67-6,52 (м, 1H), 6,41-6,27 (м, 3H), 5,32 (с, 2H), 4,24-4,13 (м, 1H), 3,55 (с, 3H), 2,98 (с, 5H), 2,82 (с, 3H), 2,70-2,58 (м, 1H), 2,23 (тд, J=7,2, 14,2 Гц, 2H), 1,95-1,68 (м, 8H).
Следующее соединение получают по методикам, описанным в примере 72 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-692:

К смеси 2-[[2-(бензилоксиметил)-7-хлор-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (0,1 г, 237,54 мкмоль, 1 экв), дициклогексил-[2-(2,4,6-триизопропилфенил)фенил]фосфана (13,59 мг, 28,50 мкмоль, 0,12 экв), KOH (39,98 мг, 712,62 мкмоль, 3 экв) в диоксане (1 мл) и H2O (1 мл), затем добавляют Pd2(dba)3 (6,53 мг, 7,13 мкмоль, 0,03 экв) под N2, затем смесь дегазируют и продувают N2 3 раза и затем смесь перемешивают при 100°C в течение 12 ч под N2 атмосферой. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-(бензилоксиметил)-6-фтор-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-7-ола (I-687) (60 мг) в виде желтого твердого вещества.
К раствору 2-(бензилоксиметил)-6-фтор-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-7-ола (0,8 г, 1,99 ммоль, 1 экв) и 2-йодпропана (506,76 мг, 2,98 ммоль, 298,10 мкл, 1,5 экв) в ДМФ (10 мл) добавляют Ag2CO3 (1,10 г, 3,97 ммоль, 180,27 мкл, 2 экв). Смесь перемешивают при 100°C в течение 12 ч. Реакционную смесь разбавляют водой 20 мл и экстрагируют EtOAc 30 мл. Объединенные органические слои промывают насыщенным солевым раствором 20 мл, сушат над, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-[[2-(бензилоксиметил)-6-фтор-7-изопропокси-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-688) (570 мг) в виде желтого масла.
К раствору 2-[[2-(бензилоксиметил)-6-фтор-7-изопропокси-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (520 мг, 1,17 ммоль, 1 экв) в MeOH (20 мл) добавляют Pd/C (500 мг, 10% чистота). Суспензию дегазируют и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 40°C в течение 12 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением (6-фтор-7-изопропокси-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[3,2-b]пиридин-2-ил)метанола (I-689) (300 мг) в виде светло-желтого твердого вещества.
К раствору [6-фтор-7-изопропокси-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метанола (300 мг, 846,28 мкмоль, 1 экв) и DIEA (218,75 мг, 1,69 ммоль, 294,81 мкл, 2 экв) в ДХМ (5 мл) добавляют MsCl (145,41 мг, 1,27 ммоль, 98,25 мкл, 1,5 экв.) по каплям при 0°C. Смесь перемешивают при 0°C в течение 7 ч. Смесь выливают в 10 мл воды и затем экстрагируют 20 мл ДХМ. Объединенные органические слои промывают 20 мл насыщенного солевого раствора, сушат над Na2SO4, затем фильтруют и фильтрат концентрируют при пониженном давлении с получением [6-фтор-7-изопропокси-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метилметансульфоната (I-690) (400 мг) в виде желтого масла.
К раствору 3-нитро-1H-пиридин-2-она (129,54 мг, 924,68 мкмоль, 1 экв) и DIEA (179,26 мг, 1,39 ммоль, 241,59 мкл, 1,5 экв) и KI (15,35 мг, 92,47 мкмоль, 0,1 экв) в MeCN (3 мл) добавляют[6-фтор-7-изопропокси-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метилметансульфонат (400 мг, 924,68 мкмоль, 1 экв) в MeCN (2 мл) при 0°C. Смесь перемешивают при 45°C в течение 12 ч. Реакционную смесь разбавляют 25 мл воды и экстрагируют 40 мл EtOAc. Объединенные органические слои промывают 30 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ (SiO2) с получением 1-[[6-фтор-7-изопропокси-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (I-691) (150 мг) в виде желтого твердого вещества.
К раствору 1-[[6-фтор-7-изопропокси-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (150 мг, 314,75 мкмоль, 1 экв) в EtOAc (20 мл) добавляют Pd/C (150 мг, 10% чистота). Суспензию дегазируют и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 30°C в течение 0,5 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением 3-амино-1-[[6-фтор-7-изопропокси-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (I-692) (140 мг) в виде желтого твердого вещества.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-692 с применением подходящих реагентов.
Пример 73:

Соединение 544 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 557,6(M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,58 (шс, 1H), 9,29 (с, 1H), 8,20 (шд, J=5,7 Гц, 2H), 7,73 (шд, J=8,2 Гц, 1H), 7,48 (шд, J=6,8 Гц, 1H), 6,58 (тд, J=7,0, 14,4 Гц, 1H), 6,38-6,26 (м, 3H), 5,28 (с, 2H), 4,85-4,79 (м, 1H), 4,17 (шс, 1H), 3,53 (с, 3H), 2,97 (с, 3H), 2,81 (с, 3H), 2,21 (шд, J=7,3 Гц, 2H), 1,88-1,66 (м, 2H), 1,32 (шд, J=6,0 Гц, 6H).
Следующие соединения получают согласно методикам, описанным для синтеза Примеров 72 и 73 с применением подходящих промежуточных соединений.
Пример 74:

К раствору 3-амино-1-[(6-хлор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]пиридин-2-она (54 мг, 163,24 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (42,16 мг,163,24 мкмоль,1 экв) и DIEA (63,29 мг, 489,71 мкмоль, 85,30 мкл, 3 экв) в ДХМ (2 мл) добавляют T3P (311,63 мг, 489,71 мкмоль, 291,24 мкл, 50% чистота, 3 экв) (50% в EtOAc) и смесь перемешивают при 40°C в течение 3 ч. Смесь концентрируют в вакууме с получением масла. Масло очищают преп-ЖХВД с получением метил N-[(E,1S)-1-[[1-[(6-хлор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (31,5 мг, 34% выход) в виде белого твердого вещества. ЖХМС m/z 571,1 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,93 (д, J=6,60 Гц, 6H) 1,64-1,81 (м, 1H) 1,89 (шд, J=6,97 Гц, 1H) 2,09 (дт, J=13,36, 6,83 Гц, 1H) 2,18-2,32 (м, 2H) 2,79-2,94 (м, 5Н) 3,00 (с, 3H) 3,56 (с, 3H) 4,15-4,27 (м, 1H) 5,36 (шс, 2H) 6,26-6,46 (м, 3H) 6,57-6,70 (м, 1H) 7,52 (шс, 1H) 7,76 (шд, J=7,83 Гц, 1H) 8,19-8,29 (м, 2H) 9,33 (с, 1H) 11,64 (шс, 1H).
Следующие соединения получают согласно методикам, описанным в Примере 74 с применением подходящих промежуточных соединений.
Пример 75:

Соединение 581 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 605,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,87 (д, J=6,39 Гц, 6H) 1,71 (шс, 1H) 1,86 (шс, 1H) 2,05-2,14 (м, 1H) 2,22 (дт, J=14,55, 7,28 Гц, 2H) 2,81 (с, 3H) 2,92 (шд, J=7,06 Гц, 2H) 2,97 (с, 3H) 3,53 (с, 3H) 4,10-4,24 (м, 1H) 5,39 (с, 2H) 6,26-6,40 (м, 3H) 6,50-6,67 (м, 1H) 7,52 (д, J=5,51 Гц, 1H) 7,74 (шд, J=7,50 Гц, 1H) 8,18-8,30 (м, 1H) 8,18-8,30 (м, 1H) 8,18-8,30 (м, 1H) 8,51 (с, 1H) 9,31 (с, 1H) 11,87 (с, 1H).
Пример 76:
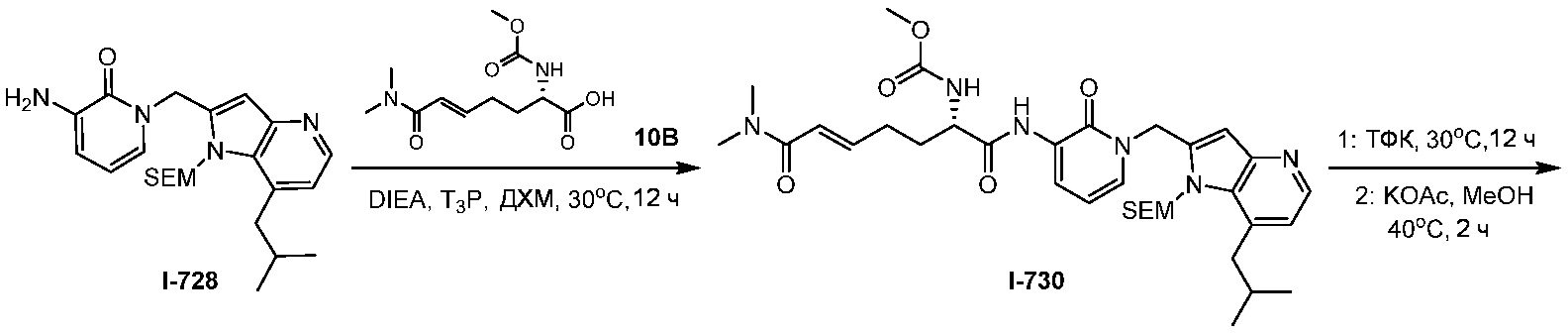

Соединение 506 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 537,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,49 (шс, 1H) 9,32 (с, 1H) 8,21-8,26 (м, 2H) 8,17 (д,J=4,63 Гц, 1H) 7,77 (шд,J=7,50 Гц, 1H) 7,54 (д,J=6,61 Гц, 1H) 6,87 (д,J=4,85 Гц, 1H) 6,56-6,65 (м, 1H) 6,27-6,41 (м, 3H) 5,35 (с, 2H) 4,15-4,23 (м, 1H) 3,56 (с, 3H) 2,99 (с, 3H) 2,83 (с, 3H) 2,71 (д,J=7,28 Гц, 2H) 2,24 (дт,J=14,55, 7,28 Гц, 2H) 2,02 (дт,J=13,62, 6,75 Гц, 1H) 1,66-1,93 (м, 1H) 1,64-1,91 (м, 1H) 0,90 (д,J=6,62 Гц, 6H).
Следующие соединения получают согласно методикам, описанным в Примере 76 с применением подходящих промежуточных соединений.
Пример 77:


Соединение 513 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 535,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,39 (шс, 1H) 9,32 (с, 1H) 8,16-8,28 (м, 3H) 7,77 (шд,J=7,70 Гц, 1H) 7,51 (шд,J=5,62 Гц, 1H) 6,94 (д,J=4,89 Гц, 1H) 6,56-6,67 (м, 1H) 6,52 (с, 1H) 6,29-6,42 (м, 3H) 5,33 (с, 2H) 4,14-4,24 (м, 1H) 3,52-3,59 (м, 3H) 2,97-3,02 (м, 3H) 2,82-2,86 (м, 3H) 2,24 (дт,J=14,00, 6,94 Гц, 2H) 1,99 (с, 3H) 1,86 (с, 3H) 1,57-1,81 (м, 2H).
Следующие соединения получают согласно методикам, описанным в Примере 77 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-739:


К раствору 2-бром-5-фтор-пиридин-3-амина (5 г, 26,18 ммоль, 1 экв), проп-2-иноксиметилбензола (5,74 г, 39,27 ммоль, 1,5 экв) CuI (1,25 г, 6,54 ммоль, 0,25 экв) и TEA (9,27 г, 91,62 ммоль, 12,75 мл, 3,5 экв) в ДМФ (50 мл) дегазируют и продувают N2 3 раза. Затем Pd(PPh3)2Cl2 (1,84 г, 2,62 ммоль, 0,1 экв) добавляют при 20°C, затем смесь дегазируют и продувают N2 3 раза. Смесь перемешивают при 75°C в течение 12 ч под N2. 2 партии обрабатывают вместе. Смесь фильтруют, и фильтрат разбавляют водой 300 мл и экстрагируют EtOAC 400 мл. Объединенные органические слои промывают насыщенным солевым раствором 400 мл, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают флэш-хроматографией на силикагеле с получением 2-(3-бензилоксипроп-1-инил)-5-фтор-пиридин-3-амина (I-662) (10,81 г) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,78 (д, J=2,4 Гц, 1H), 7,33-7,23 (м, 6H), 7,19 (с, 1H), 6,65 (дд, J=2,4, 9,8 Гц, 1H), 4,61 (с, 2H), 4,41 (с, 2H), 4,28 (шс, 1H), 4,32-4,21 (м, 1H).
К раствору 2-(3-бензилоксипроп-1-инил)-5-фтор-пиридин-3-амина (5,5 г, 21,46 ммоль, 1 экв) в ТГФ (60 мл) добавляют t-BuOK (3,61 г, 32,19 ммоль, 1,5 экв) при 0°C. Смесь перемешивают при 20°C в течение 6 ч. 2 партии обрабатывают вместе. Реакционную смесь разбавляют 100мл насыщ. раствора NH4Cl и экстрагируют 300 мл EtOAc. Объединенные органические слои промывают 200 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Неочищенный продукт растирают с EtOAc (50 мл) при 20°C в течение 30 мин. Затем смесь фильтруют, и фильтровальную лепешку концентрируют при пониженном давлении с получением желтого твердого вещества. 2-(бензилоксиметил)-6-фтор-1H-пирроло[3,2-b]пиридин (I-663) (8,5 г) получают в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,47 (шс, 1H), 7,33-7,24 (м, 6H), 6,53 (шс, 1H), 4,66 (с, 2H), 4,51 (с, 2H).
К раствору 2-(бензилоксиметил)-6-фтор-1H-пирроло[3,2-b]пиридина (11 г, 42,92 ммоль, 1 экв.) в ДМФ (100 мл) добавляют NaH (2,58 г, 64,38 ммоль, 60% чистота, 1,5 экв) при 0°C несколькими порциями, смесь перемешивают при 0°C в течение 0,5 ч. Затем SEM-Cl (8,59 г, 51,51 ммоль, 9,12 мл, 1,2 экв) добавляют к раствору при 0°C. Смесь перемешивают при 20°C в течение 0,5 ч. Реакционную смесь выливают в насыщ. раствор NH4Cl (200 мл) и экстрагируют EtOAc (300 мл). Объединенные органические слои промывают 200 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-[[2-(бензилоксиметил)-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-664) (11 г) в виде коричневого масла. ЖХМС m/z 387,3 (M+1)+.
К раствору 2-[[2-(бензилоксиметил)-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (5,25 г, 13,58 ммоль, 1 экв) в CHCl3 (60 мл) добавляют m-CPBA (4,39 г, 20,37 ммоль, 80% чистота, 1,5 экв) при 0°C. Смесь перемешивают при 20°C в течение 2 ч. Две партии обрабатывают вместе. Смесь выливают в 200 мл насыщ. раствора Na2SO3, затем экстрагируют 300 мл EtOAc. Объединенные органические слои промывают 200 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-[[2-(бензилоксиметил)-6-фтор-4-оксидо-пирроло[3,2-b]пиридин-4-ium-1-ил]метокси]этил-триметил-силана (I-665) (8,78 г) в виде коричневого масла.1H ЯМР (400 МГц, CDCl3) δ 8,23 (дд, J=1,8, 5,2 Гц, 1H), 7,47-7,36 (м, 5H), 7,35-7,29 (м, 1H), 7,34-7,29 (м, 1H), 6,98 (с, 1H), 5,58 (с, 2H), 4,76 (с, 2H), 4,61 (с, 2H), 3,56-3,46 (м, 2H), 0,97-0,87 (м, 2H), 0,04--0,05 (м, 9H).
К раствору 2-[[2-(бензилоксиметил)-6-фтор-4-оксидо-пирроло[3,2-b]пиридин-4-ium-1-ил]метокси]этил-триметил-силана (3 г, 7,45 ммоль, 1 экв) в CHCl3 (30 мл) добавляют POCl3 (9,90 г, 64,57 ммоль, 6,00 мл, 8,66 экв) при 80°C. Смесь перемешивают при 80°C в течение 0,5 ч. Две партии обрабатывают вместе. Реакционную смесь выливают в ледяную воду 100 мл для гашения POCl3, затем доводят насыщ. NaHCO3 до pH~7, затем экстрагируют 200 мл EtOAc. Объединенные органические слои промывают 100 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-[[2-(бензилоксиметил)-7-хлор-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-666) (2,57 г) в виде желтого масла.
К раствору 2-[[2-(бензилоксиметил)-7-хлор-6-фтор-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (2,9 г, 6,89 ммоль, 1 экв) и 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (1,51 г, 8,27 ммоль, 1,2 экв) в диоксане (30 мл) и H2O (6 мл) добавляют K2CO3 (2,86 г, 20,67 ммоль, 3 экв) и Pd(dppf)Cl2 (604,86 мг, 826,64 мкмоль, 0,12 экв), дегазируют и продувают N2 3 раза и затем смесь перемешивают при 90°C в течение 12 ч под N2 атмосферой. Реакционную смесь фильтруют, затем разбавляют 100 мл воды и экстрагируют 200 мл EtOAc. Объединенные органические слои промывают 100 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают флэш-хроматографией на силикагеле с получением 2-[[2-(бензилоксиметил)-6-фтор-7-(2-метилпроп-1-енил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-667) (2 г) в виде желтого масла.
К раствору 2-[[2-(бензилоксиметил)-6-фтор-7-(2-метилпроп-1-енил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (0,3 г, 680,85 мкмоль, 1 экв) в ДМФ (5 мл) добавляют NBS (133,30 мг, 748,94 мкмоль, 1,1 экв). Смесь перемешивают при 30°C в течение 1 ч. Реакционную смесь разбавляют 15 мл воды и экстрагируют 20 мл EtOAc. Объединенные органические слои промывают 20 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением 2-[[2-(бензилоксиметил)-3-бром-6-фтор-7-(2-метилпроп-1-енил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-734) (400 мг) в виде желтого масла. ЖХМС m/z 519,2 (M+1)+.
Смесь 2-[[2-(бензилоксиметил)-3-бром-6-фтор-7-(2-метилпроп-1-енил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (400 мг, 769,94 мкмоль, 1 экв), 2,4,6-триметил-1,3,5,2,4,6-триоксатриборинана (231,97 мг, 923,93 мкмоль, 258,32 мкл, 1,2 экв) (50% чистота), Cs2CO3 (501,72 мг, 1,54 ммоль, 2 экв) и Pd(dppf)Cl2 (56,34 мг, 76,99 мкмоль, 0,1 экв) в диоксане (6 мл) и H2O (1,2 мл) дегазируют и продувают N2 3 раза, и затем смесь перемешивают при 100°C в течение 12 ч под N2 атмосферой. Затем добавляют 2,4,6-триметил-1,3,5,2,4,6-триоксатриборинан (231,97 мг, 923,93 мкмоль, 258,32 мкл, 1,2 экв), смесь перемешивают при 100°C в течение еще 12 ч. Реакционную смесь фильтруют и затем разбавляют 25 мл воды и экстрагируют 50 мл EtOAc. Объединенные органические слои промывают 30 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ (SiO2) с получением 2-[[2-(бензилоксиметил)-6-фтор-3-метил-7-(2-метилпроп-1-енил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-735) (200 мг) в виде желтого масла. ЖХМС m/z 455,2 (M+1)+.
К раствору 2-[[2-(бензилоксиметил)-6-фтор-3-метил-7-(2-метилпроп-1-енил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (200 мг, 439,90 мкмоль, 1 экв) в MeOH (20 мл) добавляют Pd/C (200 мг, 10% чистота). Суспензию дегазируют и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 30°C в течение 5 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением [6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метанола (I-736) (200 мг) в виде бесцветного масла. ЖХМС m/z 367,2 (M+1)+.
К раствору [6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метанола (200 мг, 545,64 мкмоль, 1 экв) и DIEA (141,04 мг, 1,09 ммоль, 190,08 мкл, 2 экв) в ДХМ (5 мл) добавляют MsCl (93,75 мг, 818,45 мкмоль, 63,35 мкл, 1,5 экв) по каплям при 0°C. Смесь перемешивают при 0°C в течение 2 ч. Смесь выливают в 20 мл воды, затем экстрагируют 25 мл ДХМ. Объединенные органические слои промывают 25 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением [6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метилметансульфоната (I-737) (250 мг) в виде желтого масла. ЖХМС m/z 381,4 (M+1)+.
К раствору 3-нитро-1H-пиридин-2-она (78,77 мг, 562,26 мкмоль, 1 экв) и DIEA (109,00 мг, 843,39 мкмоль, 146,90 мкл, 1,5 экв) в MeCN (4 мл) добавляют [6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метилметансульфонат (250 мг, 562,26 мкмоль, 1 экв) в MeCN (3 мл) при 0°C. Смесь перемешивают при 45°C в течение 24 ч. Реакционную смесь разбавляют 20 мл воды и экстрагируют 30 мл EtOAc. Объединенные органические слои промывают 20 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ (SiO2) с получением 1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (I-738) (60 мг) в виде желтого твердого вещества. ЖХМС m/z 489,3 (M+1)+.
К раствору 1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (130 мг, 266,05 мкмоль, 1 экв) в EtOAc (20 мл) добавляют Pd/C (150 мг, 10% чистота). Суспензию дегазируют и продувают H2 3 раза. Смесь перемешивают под H2 (15 ф./кв.д.) при 30°C в течение 2 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении с получением 3-амино-1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (I-739) (150 мг) в виде желтого масла. ЖХМС m/z 459,4 (M+1)+.
Пример 78:

Смесь 3-амино-1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (I-739) (75 мг, 163,53 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (I-9) (42,23 мг, 163,53 мкмоль, 1 экв), T3P (135,28 мг, 212,58 мкмоль, 126,43 мкл, 50% чистота, 1,3 экв) и DIEA (31,70 мг, 245,29 мкмоль, 42,72 мкл, 1,5 экв) в ДХМ (3 мл) и затем смесь перемешивают при 40°C в течение 12 ч. Смесь выливают в 10 мл воды, затем экстрагируют 20 мл ДХМ. Объединенные органические слои промывают 20 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (I-740) (100 мг) в виде коричневого масла.
К раствору метил N-[(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (100 мг, 143,08 мкмоль, 1 экв) в ДХМ (3 мл) добавляют ТФК (1 мл). Смесь перемешивают при 30°C в течение 12 ч. Смесь выливают в насыщ. раствор NaHCO3 для доведения pH~7, затем разбавляют 20 мл воды и экстрагируют ДХМ (25 мл). Объединенные органические слои промывают 15 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 531) (15,5 мг, 18% выход) в виде светло-желтого твердого вещества. ЖХМС m/z 568,6(M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,20 (с, 1H), 9,32 (с, 1H), 8,21-8,16 (м, 2H), 7,74 (шд, J=7,9 Гц, 1H), 7,37 (шд, J=5,5 Гц, 1H), 6,64-6,55 (м, 1H), 6,36 (д, J=15,2 Гц, 1H), 6,28 (т, J=7,2 Гц, 1H), 5,31 (с, 2H), 4,17 (шс, 1H), 3,55 (с, 3H), 2,97 (с, 3H), 2,82 (с, 3H), 2,74 (д, J=7,5 Гц, 2H), 2,26-2,18 (м, 5H), 2,02-1,93 (м, 1H), 1,91-1,64 (м, 2H), 0,88 (д, J=6,4 Гц, 6H).
Пример 79:

Смесь 3-амино-1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (75 мг, 163,53 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (44,53 мг, 163,53 мкмоль, 1 экв), T3P (135,28 мг, 212,59 мкмоль, 126,43 мкл, 50% чистота, 1,3 экв) и DIEA (31,70 мг, 245,30 мкмоль, 42,72 мкл, 1,5 экв) в ДХМ (3 мл) и затем смесь перемешивают при 40°C в течение 20 ч. Смесь выливают в 10 мл воды и затем экстрагируют 20 мл ДХМ. Объединенные органические слои промывают 20 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением [(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (I-741) (100 мг) в виде коричневого масла. ЖХМС m/z 713,4 (M+1)+.
К раствору [(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-3-метил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (100 мг, 140,27 мкмоль, 1 экв) в ДХМ (3 мл) добавляют ТФК (1 мл). Смесь перемешивают при 30°C в течение 17 ч. Смесь выливают в насыщ. раствор NaHCO3 для доведения pH~7, затем разбавляют 20 мл воды и экстрагируют 25 мл ДХМ. Объединенные органические слои промывают 15 мл насыщенного солевого раствора, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-3-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 532) (14,2 мг, 17% выход) в виде белого твердого вещества. ЖХМС m/z 582,6(M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,18 (с, 1H), 9,37 (с, 1H), 8,21-8,15 (м, 2H), 7,36 (дд, J=1,7, 6,9 Гц, 1H), 6,67-6,59 (м, 1H), 6,38 (д, J=15,2 Гц, 1H), 6,28 (т, J=7,2 Гц, 1H), 5,31 (с, 2H), 5,09 (дд, J=4,5, 7,6 Гц, 1H), 2,96 (с, 6H), 2,81 (с, 6H), 2,73 (шд, J=7,3 Гц, 2H), 2,29-2,23 (м, 5H), 2,05 (с, 1H), 2,00-1,88 (м, 3H), 0,88 (д, J=6,6 Гц, 5H).
Пример 80:

Соединение 593 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 597,6(M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 10,98 (с, 1H), 9,33 (с, 1H), 8,19 (д, J=2,1 Гц, 1H), 8,16 (д, J=7,6 Гц, 1H), 6,70-6,63 (м, 1H), 6,41 (д, J=15,2 Гц, 1H), 6,23 (д, J=7,9 Гц, 1H), 5,53 (с, 2H), 5,12 (дд, J=4,5, 7,7 Гц, 1H), 3,01-2,98 (м, 6H), 2,84 (с, 6H), 2,78 (шд, J=7,2 Гц, 2H), 2,35-2,30 (м, 2H), 2,28 (с, 3H), 2,03-1,97 (м, 2H), 1,96 (с, 4H), 0,90 (д, J=6,6 Гц, 6H).
Следующее соединение получают согласно методиками, описанным в Примере 80 с применением подходящих промежуточных соединений.
Пример 81:

Соединение 541 получают согласно методикам для Примера 80 с применением подходящих промежуточных соединений. ЖХМС m/z 569,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,40 (шс, 1H) 9,32 (с, 1H) 8,23 (д, J=6,39 Гц, 1H) 8,13 (с, 1H) 7,76 (шд, J=7,72 Гц, 1H) 7,46 (шд, J=6,17 Гц, 1H) 6,57-6,65 (м, 1H) 6,29-6,42 (м, 2H) 6,25 (с, 1H) 5,31 (шс, 2H) 4,14-4,24 (м, 1H) 3,56 (с, 3H) 2,95-3,03 (м, 3H) 2,83 (с, 3H) 2,74 (шд, J=7,28 Гц, 2H) 2,43 (д, J=3,31 Гц, 3H) 2,24 (дт, J=14,06, 6,75 Гц, 2H) 1,99 (дт, J=13,51, 6,81 Гц, 1H) 1,66-1,93 (м, 2H) 0,91 (д, J=6,62 Гц, 6H).
Следующее соединение получают по методикам, описанным в примере 81 с применением подходящих промежуточных соединений.
Синтез промежуточн соединени I-759:
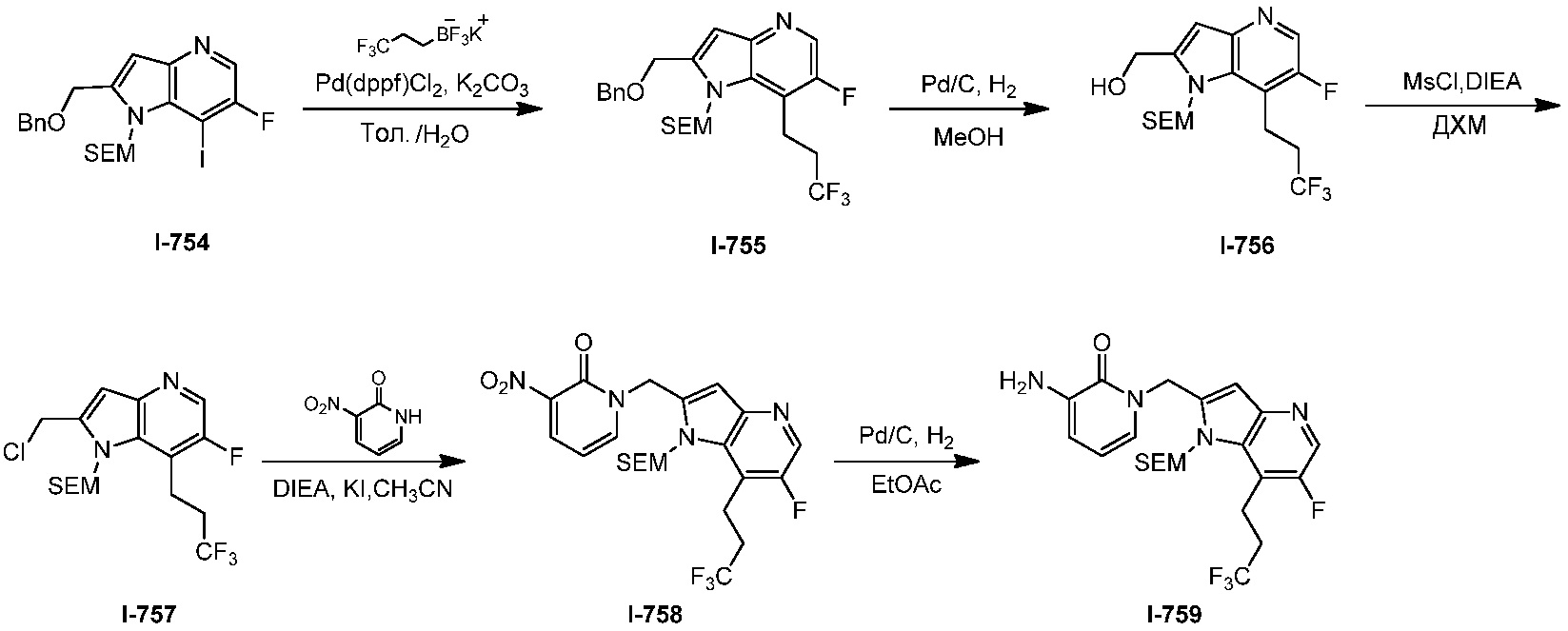
Pd(dppf)Cl2 (42,8 мг, 58,5 мкмоль, 0,1 экв) добавляют к смеси 2-[[2-(бензилоксиметил)-6-фтор-7-йод-пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (0,3 г, 585 мкмоль, 1 экв), гидрида калия;трифтор (3,3,3-трифторпропил)борона (167 мг, 820 мкмоль, 1,4 экв) и K2CO3 (162 мг, 1,17 ммоль, 2 экв) в Тол./H2O (10:1) (5 мл) под N2. Затем смесь нагревают до 100°C в течение 12 ч. Три реакционные смеси объединяют и обрабатывают вместе. Смесь фильтруют, и фильтрат экстрагируют между EtOAc (30 мл) и водой (30 мл), органической слой концентрируют с получением неочищенного продукта. Остаток очищают на колонке (SiO2) с получением 2-[[2-(бензилоксиметил)-6-фтор-7-(3,3,3-трифторпропил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (I-755) (828 мг, 1,61 ммоль, 92% выход) в виде желтого масла.
К раствору 2-[[2-(бензилоксиметил)-6-фтор-7-(3,3,3-трифторпропил)пирроло [3,2-b]пиридин-1-ил]метокси]этил-триметил-силана (800 мг, 1,66 ммоль, 1 экв.) в MeOH (30 мл) добавляют Pd/C (300 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 50°C в течение 12 часов. Смесь фильтруют, и фильтрат концентрируют с получением [6-фтор-7-(3,3,3-трифторпропил)-1-(2-триметилсилилэтоксиметил)пиррол[3,2-b]пиридин-2-ил]метанола (I-756) (676 мг) в виде желтого твердого вещества.
MsCl (587 мг, 5,12 ммоль, 3 экв) добавляют к смеси [6-фтор-7-(3,3,3-трифторпропил)-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метанола (670 мг, 1,71 ммоль, 1 экв) и DIEA (882 мг, 6,83 ммоль, 4 экв) в ДХМ (10 мл) при 0°C, затем перемешивают при 25°C в течение 0,5 ч. К смеси добавляют воду (10 мл). Смесь экстрагируют ДХМ (10 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (10 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Неочищенный продукт 2-[[2-(хлорметил)-6-фтор-7-(3,3,3-трифторпропил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силан (I-757) (701 мг) применяют на следующей стадии без дальнейшей очистки в виде желтого масла.
К смеси 3-нитро-1H-пиридин-2-он (262 мг, 1,87 ммоль, 1,1 экв), KI (282 мг, 1,70 ммоль, 1 экв) и DIEA (329 мг, 2,55 ммоль, 1,5 экв) в CH3CN (10 мл) добавляют 2-[[2-(хлорметил)-6-фтор-7-(3,3,3-трифторпропил)пирроло[3,2-b]пиридин-1-ил]метокси]этил-триметил-силан (700 мг, 1,70 ммоль, 1 экв) при 25°C. Затем смесь перемешивают при 40°C в течение 12 ч. Смесь концентрируют с получением неочищенного продукта. Остаток очищают колоночной хроматографией (SiO2) с получением 1-[[6-фтор-7-(3,3,3-трифторпропил)-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (I-758) (590 мг, 1,15 ммоль, 67,5% выход) в виде желтого масла.1H ЯМР (400 МГц, ДМСО-d6) δ 8,44-8,50 (м, 1H) 8,36-8,41 (м, 1H) 8,15-8,20 (м, 1H) 6,67-6,72 (м, 1H) 6,47-6,54 (м, 1H) 5,49-5,60 (м, 4 H) 3,49 (шт, J=8,05 Гц, 2H) 3,20-3,27 (м, 2H) 2,64-2,75 (м, 2H) 0,71-0,80 (м, 2H) -0,07 (с, 9 H)
К раствору 1-[[6-фтор-7-(3,3,3-трифторпропил)-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (300 мг, 583 мкмоль, 1 экв) в EtOAc (10 мл) добавляют Pd/C (100 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 0,5 часов. Смесь фильтруют, и фильтрат концентрируют с получением 3-амино-1-[[6-фтор-7-(3,3,3-трифторпропил)-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (I-759) (280 мг) в виде желтого масла.
Пример 82:

Соединение 540 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 595,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,78 (шс, 1H) 9,33 (с, 1H) 8,21-8,28 (м, 2H) 7,77 (шд, J=7,6 Гц, 1H) 7,51 (дд, J=6,8, 1,54 Гц, 1H) 6,56-6,67 (м, 1H) 6,31-6,42 (м, 3H) 5,35 (с, 2H) 4,13-4,25 (м, 1H) 3,56 (с, 3H) 3,10-3,21 (м, 2H) 3,00 (с, 3H) 2,84 (с, 3H) 2,66 (дт, J=10,8, 8,0 Гц, 2H) 2,25 (дт, J=14,4, 7,2 Гц, 2H) 1,82-1,95 (м, 1H) 1,65-1,79 (м, 1H).
Следующее соединение получают согласно методикам, описанным для синтеза Примера 82 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-770:


Две реакции проводят параллельно: К раствору 2-хлор-5-фтор-3-нитро-пиридина (5 г, 28,32 ммоль, 1 экв) в ТГФ (50 мл) добавляют бром(винил)магний (1M, 90,63 мл, 3,2 экв) при -78°C. Смесь перемешивают при -40°C в течение 1 ч. Две реакции объединяют для обработки. Реакционную смесь разделяют между 100 мл насыщ. NH4Cl (водн) и 100 мл этилацетата. Органическую фазу разделяют, промывают насыщенным солевым раствором 100 мл (100 мл х 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 7-хлор-4-фтор-1H-пирроло[2,3-c]пиридина (I-762) (5,6 г, 58% выход) в виде желтого твердого вещества. ЖХМС m/z 171,2 (M+1)+.
К раствору 7-хлор-4-фтор-1H-пирроло[2,3-c]пиридина (5,6 г, 32,83 ммоль, 1 экв) в ДМФ (60 мл) добавляют NaH (1,97 г, 49,25 ммоль, 60% чистота, 1,5 экв) при 0°C. Смесь перемешивают при 0°C в течение 0,5 ч. Затем SEM-Cl (7,12 г, 42,68 ммоль, 7,55 мл, 1,3 экв) добавляют по каплям и полученную реакционную смесь перемешивают при 20°C в течение 0,5 ч. Реакционную смесь гасят добавлением 50 мл насыщ. NH4Cl (водн) при 0°C и затем разбавляют 50 мл этилацетата и экстрагируют 50 мл этилацетата (50 мл х 1). Объединенные органические слои промывают насыщенным солевым раствором 50 мл (50 мл х 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 2-[(7-хлор-4-фтор-пирроло[2,3-c]пиридин-1-ил)метокси]этил-триметил-силана (I-763) (3,6 г, 36% выход) в виде желтого масла. ЖХМС m/z 301,1 (M+1)+.
Смесь 2-[(7-хлор-4-фтор-пирроло[2,3-c]пиридин-1-ил)метокси]этил-триметил-силана (3,6 г, 11,97 ммоль, 1 экв), 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (2,40 г, 13,16 ммоль, 1,1 экв), Na2CO3 (2,54 г, 23,93 ммоль, 2 экв), 4-дитрет-бутилфосфанил-N, N-диметил-анилина;дихлорпалладия (847,34 мг, 1,20 ммоль, 847,34 мкл, 0,1 экв) в диоксане (40 мл) и H2O (4 мл) дегазируют и продувают N2 3 раза и затем смесь перемешивают при 90°C в течение 12 ч под N2 атмосферой. Реакционную смесь концентрируют при пониженном давлении для удаления растворителя с получением черного масла. Масло очищают колоночной хроматографией (SiO2) с получением 2-[[4-фтор-7-(2-метилпроп-1-енил)пирроло[2,3-c]пиридин-1-ил]метокси]этил-триметил-силана (I-764) (2,2 г, 57% выход) в виде желтого масла. ЖХМС m/z 321,1 (M+1)+.
К раствору 2-[[4-фтор-7-(2-метилпроп-1-енил)пирроло[2,3-c]пиридин-1-ил] метокси]этил-триметил-силана (2,2 г, 6,86 ммоль, 1 экв) в ТГФ (25 мл) добавляют LDA (2 M, 5,15 мл, 1,5 экв) при -70°C. Смесь перемешивают при -70°C в течение 0,5 ч. Затем ДМФ (1,51 г, 20,59 ммоль, 1,58 мл, 3 экв) добавляют при -70°C и полученную реакционную смесь перемешивают при -70°C в течение еще 0,5 ч. Реакционную смесь гасят добавлением 20 мл насыщ. NH4Cl (водн.) при 0°C и затем разбавляют 20 мл этилацетата и экстрагируют 20 мл этилацетата (20 мл х 1). Объединенные органические слои промывают 20 мл насыщенного солевого раствора (20 мл х 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением 4-фтор-7-(2-метилпроп-1-енил)-1-(2-триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-карбальдегида (I-765) (350 мг, 1,00 ммоль, 14,57% выход) в виде желтого масла. ЖХМС m/z 349,1 (M+1)+.
К раствору 4-фтор-7-(2-метилпроп-1-енил)-1-(2-триметилсилилэтоксиметил) пирроло[2,3-c]пиридин-2-карбальдегида (350 мг, 1,00 ммоль, 1 экв) в MeOH (4 мл) добавляют NaBH4 (57,00 мг, 1,51 ммоль, 1,5 экв) при 0°C. Смесь перемешивают при 20°C в течение 0,5 ч. Реакционную смесь гасят добавлением 5 мл насыщ. NH4Cl (водн.) при 0°C и затем разбавляют 5 мл этилацетата и экстрагируют 5 мл этилацетата (5 мл х 1). Объединенные органические слои промывают 5 мл насыщенного солевого раствора (5 мл х 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ (SiO2) с получением [4-фтор-7-(2-метилпроп-1-енил)-1-(2-триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метанола (I-766) (150 мг, 43% выход) в виде бесцветного масла. ЖХМС m/z 350,9 (M+1)+.
К раствору [4-фтор-7-(2-метилпроп-1-енил)-1-(2- триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метанола (340 мг, 970,04 мкмоль, 1 экв) в ДХМ (4 мл) добавляют MsCl (166,68 мг, 1,46 ммоль, 112,62 мкл, 1,5 экв) и DIEA (250,74 мг, 1,94 ммоль, 337,93 мкл, 2 экв) при -10°C. Смесь перемешивают при -10°C в течение 0,5 ч. Реакционную смесь гасят добавлением 5 мл насыщ. NH4Cl (водн.) при 0°C и затем разбавляют 5 мл дихлорметана и экстрагируют 5 мл дихлорметана (5 мл х 1). Объединенные органические слои промывают 5 мл насыщенного солевого раствора (5 мл х 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Неочищенный продукт [4-фтор-7-(2-метилпроп-1-енил)-1-(2-триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метилметансульфонат (I-767) (420 мг) применяют на следующей стадии без дальнейшей очистки в виде коричневого масла. ЖХМС m/z 429,1 (M+1)+.
К раствору 3-нитро-1H-пиридин-2-она (164,75 мг, 1,18 ммоль, 1,2 экв) в MeCN (5 мл) добавляют DIEA (189,98 мг, 1,47 ммоль, 256,03 мкл, 1,5 экв) и [4-фтор-7-(2-метилпроп-1-енил)-1-(2-триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метилметансульфонат (420 мг, 979,95 мкмоль, 1 экв) при 20°C. Смесь перемешивают при 20°C в течение 12 ч. Органическую фазу разделяют, промывают 10 мл насыщенного солевого раствора (10 мл х 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ (SiO2) с получением 1-[[4-фтор-7-(2-метилпроп-1-енил)-1-(2-триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (I-768) (280 мг, 592,49 мкмоль, 60,46% выход) в виде светло-желтого масла. ЖХМС m/z 473,3 (M+1)+.
К раствору 1-[[4-фтор-7-(2-метилпроп-1-енил)-1-(2-триметилсилилэтокси метил)пирроло[2,3-c]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (250 мг, 529,01 мкмоль, 1 экв) в MeOH (5 мл) добавляют Pd/C (20 мг, 529,01 мкмоль, 10% чистота, 1,00 экв) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 15°C в течение 1 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении для удаления растворителя с получением неочищенного продукта 3-амино-1-[[4-фтор-7-(2- метилпроп-1-енил)-1-(2-триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метил]пиридин-2-она (I-769) (220 мг), который применяют на следующей стадии без дальнейшей очистки в виде желтого масла. ЖХМС m/z 443,3 (M+1)+.
К раствору 3-амино-1-[[4-фтор-7-(2-метилпроп-1-енил)-1-(2- триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метил]пиридин-2-она (190 мг, 429,28 мкмоль, 1 экв) в MeOH (5 мл) добавляют Pd/C (20 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 20°C в течение 2 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении для удаления растворителя с получением светло-желтого масла. Неочищенный продукт 3-амино-1-[[4-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метил]пиридин-2-он (I-770) (160 мг) применяют на следующей стадии без дальнейшей очистки в виде светло-желтого масла. ЖХМС m/z 445,2 (M+1)+.
Следующие промежуточные соединения получают согласно методикам, описанным для синтеза I-770 с применением подходящих реагентов.
Пример 83:

Соединение 507 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 569,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,94 (шс, 1H), 9,33 (шс, 1H), 8,21 (шд, J=7,3 Гц, 1H), 7,90 (шс, 1H), 7,52 (шд, J=6,8 Гц, 1H), 6,69-6,56 (м, 1H), 6,44-6,23 (м, 3H), 5,35 (шс, 2H), 5,08 (шд, J=4,4 Гц, 1H), 2,95 (шс, 6H), 2,86-2,73 (м, 8H), 2,33-2,11 (м, 3H), 1,92 (шс, 2H), 0,91-0,86 (м, 6H).
Следующие соединения получают согласно методикам, описанным в Примере 83 с применением подходящих промежуточных соединений.
Пример 84:

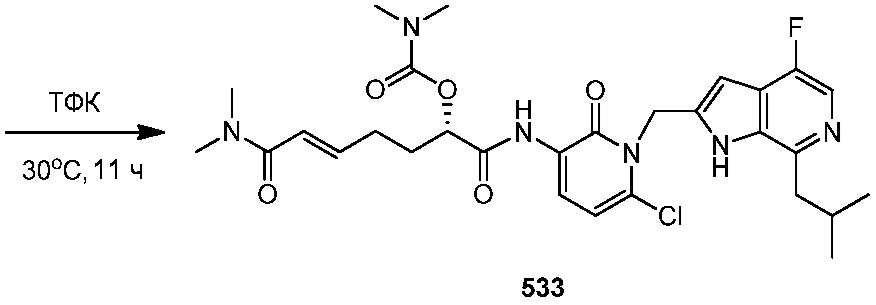
Соединение 533 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 603,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 12,06 (шс, 1H) 9,42 (с, 1H) 8,25 (д, J=8,07 Гц, 1H) 7,87-7,95 (м, 1H) 6,58-6,71 (м, 2H) 6,40 (шд, J=15,16 Гц, 1H) 6,11 (с, 1H) 5,62 (с, 2H) 5,12 (дд, J=7,52, 4,46 Гц, 1H) 2,92-3,01 (м, 6H) 2,78-2,88 (м, 8 H) 2,29 (кв, J=6,85 Гц, 2H) 2,13-2,24 (м, 1H) 1,85-2,03 (м, 2H) 0,91 (д, J=6,60 Гц, 6H).
Следующее соединение получают по методикам, описанным в примере 84 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-778:

К раствору 1-[[4-фтор-7-(2-метилпроп-1-енил)-1-(2-триметилсилилэтокси метил)пирроло[2,3-c]пиридин-2-ил]метил]-3-нитро-пиридин-2-она (I-768) (250 мг, 529,01 мкмоль, 1 экв) в MeOH (5 мл) добавляют Pd/C (20 мг, 529,01 мкмоль, 10% чистота, 1,00 экв) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 15°C в течение 1 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении для удаления растворителя с получением неочищенного продукта 3-амино-1-[[4-фтор-7-(2- метилпроп-1-енил)-1-(2-триметилсилилэтоксиметил)пирроло[2,3-c]пиридин-2-ил]метил]пиридин-2-она (I-778)) (220 мг), который применяют на следующей стадии без дальнейшей очистки в виде светло-желтого масла. ЖХМС m/z 443,3 (M+1)+.
Пример 85:

Соединение 501 получают согласно методикам для Примера 71 с применением подходящих промежуточных соединений. ЖХМС m/z 553,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,97 (шс, 1H), 9,30 (с, 1H), 8,22 (д, J=6,0 Гц, 1H), 7,97 (д, J=1,3 Гц, 1H), 7,73 (шд, J=7,7 Гц, 1H), 7,55-7,46 (м, 1H), 6,67-6,51 (м, 2H), 6,40-6,26 (м, 3H), 5,34 (с, 2H), 4,17 (шс, 1H), 3,54 (с, 3H), 2,97 (с, 3H), 2,81 (с, 3H), 2,30-2,16 (м, 2H), 2,12 (с, 3H), 1,97 (с, 3H), 1,91-1,64 (м, 2H).
Следующее соединение получают по методикам, описанным в примере 85 с применением подходящих промежуточных соединений.
Пример 86:

T3P (172 мг, 270 мкмоль, 50% чистота, 2 экв) добавляют к раствору 3-амино-1-[(7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил]пиридин-2-она (40 мг, 135 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (41,8 мг, 162 мкмоль, 1,2 экв) и DIEA (34,9 мг, 270 мкмоль, 2 экв) в ДХМ (2 мл) при 18°C. Затем смесь перемешивают при 30°C в течение 12 ч. Смесь концентрируют с получением неочищенного продукта. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(7-изобутил-1H-пирроло[2,3-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 512) (17,1 мг, 22% выход) в виде белого твердого вещества. ЖХМС m/z 537,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,58 (шс, 1H) 9,31 (с, 1H) 8,24 (дд, J=7,2, 1,8 Гц, 1H) 7,97 (д, J=5,6 Гц, 1H) 7,75 (шд, J=7,2 Гц, 1H) 7,52 (дд, J=6,8, 1,8 Гц, 1H) 7,26 (д, J=5,6 Гц, 1H) 6,56-6,65 (м, 1H) 6,31-6,42 (м, 2H) 6,19 (с, 1H) 5,35 (с, 2H) 4,14-4,24 (м, 1H) 3,56 (с, 3H) 2,99 (с, 3H) 2,78-2,89 (м, 5Н) 2,19-2,28 (м, 3H) 1,75-1,89 (м, 1H) 1,71-1,75 (м, 1H) 0,91 (д, J=6,6 Гц, 6H).
Следующее соединение получают по методикам, описанным в примере 86 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-801:


NH3 (г) барботируют в EtOH (60 мл) при -40°C в течение 0,5 ч (15 ф./кв.д.). Затем 4,6-дихлор-2-метил-пиримидин-5-амин (5 г, 28,09 ммоль, 1 экв) добавляют при 18°C и полученную реакционную смесь перемешивают при 120°C в течение 13,5 ч (15 ф./кв.д.). Реакционную смесь концентрируют при пониженном давлении для удаления EtOH. Соединение 6-хлор-2-метил-пиримидин-4,5-диамин (I-791) (5,8g) получают в виде желтого твердого вещества. ЖХМС m/z 158,8 (M+1)+.
Смесь 6-хлор-2-метил-пиримидин-4,5-диамина (4,8 г, 30,27 ммоль, 1 экв), диэтоксиметоксиэтана (13,46 г, 90,80 ммоль, 15,10 мл, 3 экв) и затем смесь перемешивают при 100°C в течение 4 ч. Реакционную смесь фильтруют и фильтровальную лепешку получают, фильтрат разбавляют 5 мл воды экстрагируют 15мл EtOAc (5 мл х 3). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка, объединяют с фильтровальной лепешкой, соединение 6-хлор-2-метил-9H-пурин (I-792) (5,3 г) получают в виде желтого твердого вещества. ЖХМС m/z 168,8 (M+1)+.
Раствор 6-хлор-2-метил-9H-пурина (4,1 г, 24,32 ммоль, 1 экв) в HI (15 мл) (чистота 47%) перемешивают при 18°C в течение 0,2 ч. Реакционную смесь фильтруют и фильтровальную лепешку 6-йод-2-метил-9H-пурина (I-793) (5,3 г) получают в виде желтого твердого вещества. ЖХМС m/z 260,8 (M+1)+.
К раствору 6-йод-2-метил-9H-пурина (2,4 г, 9,23 ммоль, 1 экв) в ТГФ (25 мл) добавляют TsOH⋅H2O (175,56 мг, 922,95 мкмоль, 0,1 экв) и DHP (1,55 г, 18,46 ммоль, 1,69 мл, 2 экв) при 18°C. Смесь перемешивают при 40°C в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают хроматографией на силикагеле (SiO2) с получением 6-йод-2-метил-9-тетрагидропиран-2-ил-пурина (I-794) (1,3 г, 41% выход) в виде желтого масла. ЖХМС m/z 345,0 (M+1)+.1H ЯМР (400 МГц, CDCl3) δ 8,19 (с, 1H), 5,68 (дд, J=2,2, 10,6 Гц, 1H), 4,15-4,08 (м, 1H), 3,72 (дт, J=2,6, 11,7 Гц, 1H), 2,73 (с, 3H), 2,09-1,94 (м, 3H), 1,77-1,60 (м, 3H).
К раствору 6-йод-2-метил-9-тетрагидропиран-2-ил-пурина (1,2 г, 3,49 ммоль, 1 экв) в ТГФ (15 мл) добавляют по каплям LDA (2 M, 2,62 мл, 1,5 экв) при -70°C под N2. После добавления смесь перемешивают при этой температуре (-70°C) в течение 20 мин и затем ДМФ (764,60 мг, 10,46 ммоль, 804,84 мкл, 3 экв) добавляют к реакционной смеси при -70°C под N2. Полученную смесь перемешивают при -70°C в течение 20 мин. Гасят взаимодействием с водой 5 мл при 0°C, затем добавляют 15% раствор NaOH (5 мл) и экстрагируют EtOAc (10 мл х 3), объединенные органические слои промывают насыщенным солевым раствором (15 мл), сушат над безводным Na2SO4 и концентрируют с получением неочищенного продукта. 1,7 г смеси 6-йод-2-метил-9-тетрагидропиран-2-ил-пурин-8-карбальдегида (неочищенный) и 6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-карбальдегида (I-795) (неочищенный) получают в виде желтого масла.
К раствору 6-йод-2-метил-9-тетрагидропиран-2-ил-пурин-8-карбальдегида (4,57 ммоль, 1 экв) и 6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-карбальдегида (4,57 ммоль, 1 экв) (1,7 г, неочищенный) в MeOH (10 мл) добавляют NaBH4 (207,38 мг, 5,48 ммоль, 1,2 экв) при 0°C. Смесь перемешивают при 18°C в течение 0,5 ч. Смесь выливают в воду (5 мл). Водную фазу экстрагируют этилацетатом (5 мл х 5). Объединенную органическую фазу промывают насыщенным солевым раствором (10 мл), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. 0,9 г смеси (6-йод-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил)метанола и [6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил]метанола (I-796) получают в виде желтого масла. ЖХМС m/z 291,9 (M+1)+.
К раствору (6-йод-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил)метанола (2,41 ммоль, 1 экв) и [6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил]метанола (2,41 ммоль, 1 экв) (0,9 г) в ДМФ (10 мл) добавляют трет-бутил-хлор-диметил-силан (544,86 мг, 3,62 ммоль, 442,98 мкл, 1,5 экв) и имидазол (410,16 мг, 6,03 ммоль, 2,5 экв). Смесь перемешивают при 18°C в течение 12 ч. Смесь выливают в воду (10 мл). Водную фазу экстрагируют этилацетатом (15 мл х 3). Объединенную органическую фазу промывают насыщенным солевым раствором (10 мл х 2), сушат с безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией (SiO2) с получением 8-[[трет-бутил(диметил)силил]оксиметил]-N, N,2-триметил-9-тетрагидропиран-2-ил-пурин-6-амина (I-797) (320 мг) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,72 (дд, J=2,3, 11,1 Гц, 1H), 4,93-4,89 (м, 1H), 4,80-4,76 (м, 1H), 3,73-3,56 (м, 2H), 3,40 (шс, 6H), 2,46 (с, 3H), 1,77-1,68 (м, 3H), 1,64-1,51 (м, 3H), 0,82 (с, 9H), 0,05-0,01 (м, 6H).
К раствору 8-[[трет-бутил(диметил)силил]оксиметил]-N, N,2-триметил-9-тетрагидропиран-2-ил-пурин-6-амина (0,32 г, 788,94 мкмоль, 1 экв) в ТГФ (5 мл) добавляют TBAF (1M, 946,73 мкл, 1,2 экв) при 18°C, смесь перемешивают при 18°C в течение 0,5 ч. Реакционную смесь концентрируют при пониженном давлении для удаления ТГФ. Остаток разбавляют H2O (5 мл) и экстрагируют EtOAc (5 мл х 3). Объединенные органические слои концентрируют при пониженном давлении с получением остатка. Соединение [6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил]метанол (I-798) (240 мг) получают в виде желтого масла. ЖХМС m/z 292,2 (M+1)+.
К раствору [6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил]метанола (220 мг, 755,11 мкмоль, 1 экв) в ДХМ (5 мл) добавляют DIPEA (292,77 мг, 2,27 ммоль, 394,57 мкл, 3 экв) и MsCl (129,75 мг, 1,13 ммоль, 87,67 мкл, 1,5 экв) при 0°C. Смесь перемешивают при 18°C в течение 1 ч. Остаток выливают в воду (3 мл). Водную фазу экстрагируют ДХМ (3 мл х 2). Объединенную органическую фазу промывают насыщенным солевым раствором (3 мл), сушат с безводным Na2SO4, фильтруют и из фильтрата выпаривают растворитель. Соединение 8-(хлорметил)-N, N,2-триметил-9-тетрагидропиран-2-ил-пурин-6-амин (I-799) (290 мг) получают в виде желтого твердого вещества. ЖХМС m/z 310,1 (M+1)+.
К раствору 8-(хлорметил)-N, N,2-триметил-9-тетрагидропиран-2-ил-пурин-6-амина (290 мг, 936,11 мкмоль, 1 экв) в CH3CN (5,0 мл) добавляют DIPEA (241,97 мг, 1,87 ммоль, 326,11 мкл, 2 экв) и 3-нитро-1H-пиридин-2-он (144,26 мг, 1,03 ммоль, 1,1 экв) при 18°C. Смесь перемешивают при 18°C в течение 16 ч. Смесь выливают в воду (5 мл). Реакционную смесь концентрируют при пониженном давлении для удаления CH3CN. Водную фазу экстрагируют этилацетатом (8 мл х 3) и объединенную органическую фазу концентрируют в вакууме. Остаток очищают преп-ТСХ с получением 1-[[6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил]метил]-3-нитро-пиридин-2-она (I-800) (130 мг) в виде желтого твердого вещества. ЖХМС m/z 414,0 (M+1)+.
К раствору 1-[[6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил]метил]-3-нитро-пиридин-2-она (80 мг, 193,50 мкмоль, 1 экв) в EtOAc (5 мл) добавляют Pd/C (40 мг, 10% чистота) при 18°C. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 18°C в течение 2 ч. Реакционную смесь фильтруют и фильтрат концентрируют. Соединение 3-амино-1-[[6-(диметиламино)-2-метил-9-тетрагидропиран-2-ил-пурин-8-ил]метил]пиридин-2-он (I-801) (40 мг) получают в виде бесцветного масла. ЖХМС m/z 384,0 (M+1)+.
Пример 87:

Соединение 504 получают согласно методикам для Примера 68 с применением подходящих промежуточных соединений. ЖХМС m/z 540,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,26 (с, 1H), 8,24 (шд, J=6,2 Гц, 1H), 7,74 (шд, J=7,3 Гц, 1H), 7,61-7,48 (м, 1H), 6,65-6,56 (м, 1H), 6,44-6,32 (м, 2H), 5,36 (шс, 2H), 4,18 (шс, 1H), 3,55 (с, 3H), 3,36-3,33 (м, 6H), 2,99 (с, 3H), 2,84 (с, 3H), 2,43 (шс, 3H), 2,30-2,17 (м, 2H), 1,88 (шд, J=7,0 Гц, 1H), 1,79-1,62 (м, 1H).
Синтез промежуточного соединения I-806:

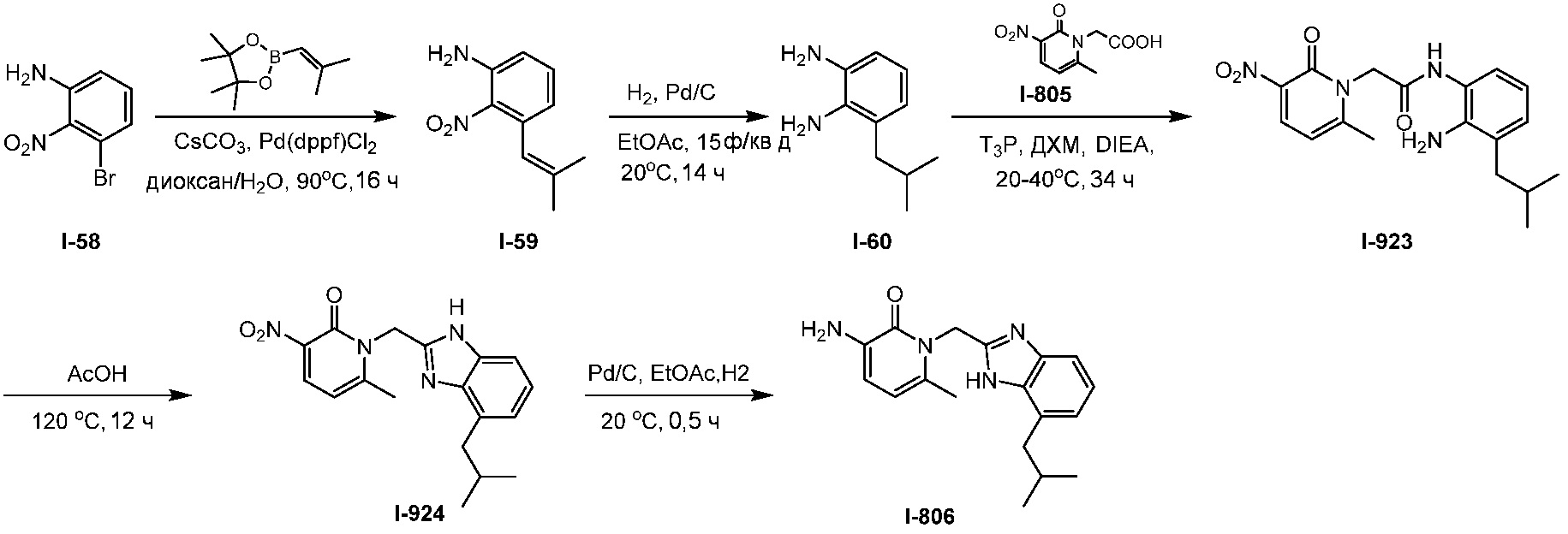
К раствору 6-метил-3-нитро-1H-пиридин-2-она (2 г, 12,98 ммоль, 1 экв) и DIEA (3,35 г, 25,95 ммоль, 4,52 мл, 2 экв) в MeCN (20 мл) добавляют трет-бутил 2-бромацетат (3,04 г, 15,57 ммоль, 2,30 мл, 1,2 экв) при 20°C, затем реакционную смесь перемешивают при 20°C в течение 12 ч. Смесь концентрируют с получением неочищенного продукта. Неочищенный продукт очищают колоночной хроматографией (SiO2) с получением трет-бутил 2-(6-метил-3-нитро-2-оксо-1-пиридил)ацетата (I-804) (2,55 г, 9,51 ммоль, 73,25% выход) в виде желтого твердого вещества.
К раствору трет-бутил 2-(6-метил-3-нитро-2-оксо-1-пиридил)ацетата (2,55 г, 9,51 ммоль, 1 экв) в ДХМ (30 мл) добавляют CF3COOH (23,10 г, 202,59 ммоль, 15 мл, 21,31 экв) при 0°C, затем реакционную смесь перемешивают при 20°C в течение 1 ч. Смесь концентрируют в вакууме с получением 2-(6-метил-3-нитро-2-оксо-1-пиридил)уксусной кислоты (I-805) (1,95 г) в виде желтого твердого вещества.
Раствор 2-(6-метил-3-нитро-2-оксо-1-пиридил)уксусной кислоты (I-805) (465,02 мг, 2,19 ммоль, 0,9 экв), 3-изобутилбензол-1,2-диамина (I-60) (0,4 г, 2,44 ммоль, 1 экв), DIEA (629,49 мг, 4,87 ммоль, 848,37 мкл, 2 экв) и T3P (2,32 г, 3,65 ммоль, 2,17 мл, 50% чистота, 1,5 экв) в ДХМ (10 мл) перемешивают при 30°C в течение 2 ч. Смесь концентрируют в вакууме с получением N-(2-амино-3-изобутил-фенил)-2-(6-метил-3-нитро-2-оксо-1-пиридил)ацетамида (I-923) (1 г) в виде коричневого твердого вещества, которое сразу используют на следующей стадии. ЖХМС m/z 358,9 (M+1)+.
Раствор N-(2-амино-3-изобутил-фенил)-2-(6-метил-3-нитро-2-оксо-1-пиридил)ацетамида (1 г, 2,79 ммоль, 1 экв) в AcOH (20 мл) перемешивают при 120°C в течение 12 ч. Смесь концентрируют в вакууме с получением масла. Масло очищают преп-ЖХВД с получением 1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-3-нитро-пиридин-2-она (I-924) (600 мг, 63% выход) в виде желтого твердого вещества. ЖХМС m/z 340,8 (M+1)+.
Раствор 1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-3-нитро-пиридин-2-она (300 мг, 881,38 мкмоль, 1 экв) и Pd/C (100 мг, 10% чистота) в EtOAc (30 мл) перемешивают при 20°C под H2(15 ф./кв.д.) в течение 0,5 ч. Смесь фильтруют, и фильтрат концентрируют в вакууме до 3-амино-1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-пиридин-2-она (I-806) (200 мг) в виде белого твердого вещества, которое сразу используют на следующей стадии. ЖХМС m/z 310,9 (M+1)+.
Пример 88:
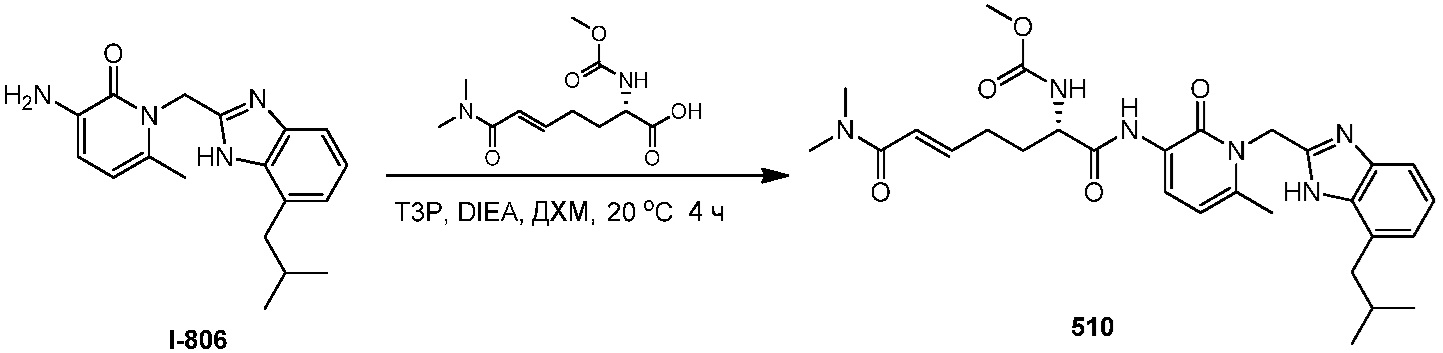
К раствору 3-амино-1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-пиридин-2-она (I-806) (100 мг, 322,17 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (I-9) (91,53 мг, 354,39 мкмоль, 1,1 экв) и DIEA (62,46 мг, 483,26 мкмоль, 84,17 мкл, 1,5 экв) в ДХМ (2 мл) добавляют T3P (246,02 мг, 386,61 мкмоль, 229,93 мкл, 50% чистота, 1,2 экв) (EtOAc раствор) и раствор перемешивают при 20°C в течение 4 ч. Смесь концентрируют в вакууме с получением масла. Масло очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 510) (79,5 мг, 44% выход) в виде белого твердого вещества. ЖХМС m/z 550,8 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,78-0,99 (м, 5Н) 0,78-0,99 (м, 1H) 1,64-1,94 (м, 2H) 1,95-2,14 (м, 1H) 2,15-2,31 (м, 2H) 2,44 (с, 3H) 2,67-2,78 (м, 2H) 2,84 (с, 3H) 2,89-3,05 (м, 3H) 3,55 (шд, J=6,97 Гц, 3H) 4,15 (шс, 1H) 5,50 (шд, J=6,60 Гц, 2H) 6,25 (д, J=7,70 Гц, 1H) 6,37 (шд, J=15,16 Гц, 1H) 6,55-6,68 (м, 1H) 6,86-6,96 (м, 1H) 7,00-7,12 (м, 1H) 7,21-7,37 (м, 1H) 7,65-7,83 (м, 1H) 8,17 (шд, J=7,46 Гц, 1H) 9,04-9,24 (м, 1H) 12,13-12,57 (м, 1H).
Пример 89:
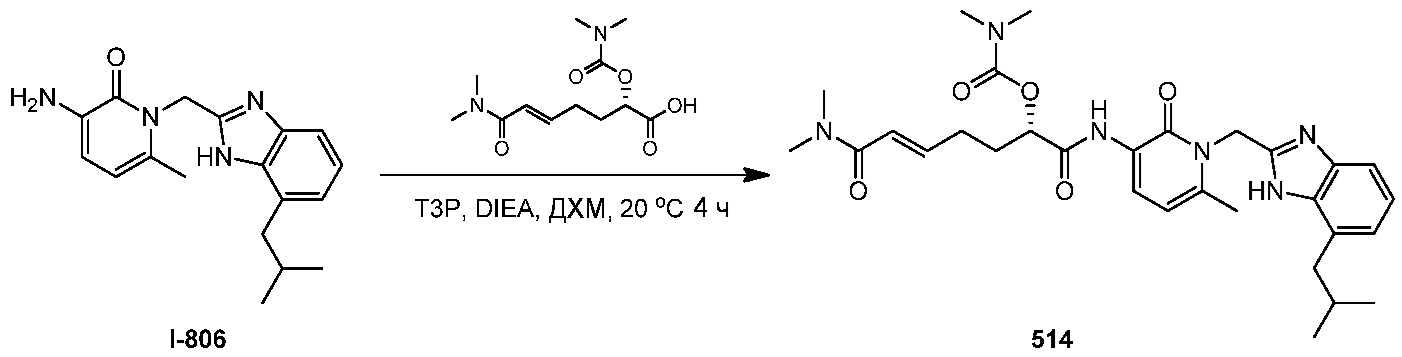
К раствору 3-амино-1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-пиридин-2-она (I-806) (100 мг, 322,17 мкмоль, 1 экв), (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (I-37) (96,50 мг, 354,39 мкмоль, 1,1 экв) и DIEA (62,46 мг, 483,26 мкмоль, 84,17 мкл, 1,5 экв) в ДХМ (2 мл) добавляют T3P (246,02 мг, 386,60 мкмоль, 229,93 мкл, 50% чистота, 1,2 экв) (EtOAc раствор) и раствор перемешивают при 20°C в течение 4 ч. Смесь концентрируют в вакууме с получением масла. Масло очищают преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[1-[(4-изобутил-1H-бензимидазол-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 514) (97,5 мг, 51% выход) в виде белого твердого вещества. ЖХМС m/z 564,9 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,83-0,95 (м, 6H) 1,84-2,16 (м, 3H) 2,22-2,36 (м, 2H) 2,44 (шд, J=3,18 Гц, 3H) 2,68-2,77 (м, 2H) 2,78-3,07 (м, 12H) 5,09 (ддд, J=11,37, 7,09, 4,65 Гц, 1H) 5,51 (шд, J=8,19 Гц, 2H) 6,26 (д, J=7,70 Гц, 1H) 6,35-6,45 (м, 1H) 6,57-6,71 (м, 1H) 6,87-6,97 (м, 1H) 6,99-7,11 (м, 1H) 7,23-7,37 (м, 1H) 8,11-8,21 (м, 1H) 9,11-9,25 (м, 1H) 12,15-12,55 (м, 1H).
Пример 90:

Соединение 522 получают согласно методикам для Примера 88 с применением подходящих промежуточных соединений. ЖХМС m/z 571,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,87-0,95 (м, 6H) 1,68-1,79 (м, 1H) 1,83-1,94 (м, 1H) 2,02 (шс, 1H) 2,19-2,32 (м, 2H) 2,72 (шд, J=7,28 Гц, 2H) 2,84 (с, 3H) 3,00 (с, 3H) 3,49-3,65 (м, 3H) 4,17-4,31 (м, 1H) 5,64 (с, 2H) 6,38 (д, J=15,21 Гц, 1H) 6,56-6,67 (м, 2H) 6,90-7,09 (м, 2H) 7,26-7,44 (м, 2H) 7,73 (шд, J=7,50 Гц, 1H) 8,27 (д, J=8,16 Гц, 1H) 9,36 (с, 1H).
Следующее соединение получают по методикам, описанным в примере 90 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-826:

К смеси 2-хлор-5-фтор-пиридина (50 г, 380,13 ммоль, 1 экв) в ТФК (400 мл) добавляют H2O2 (230,89 г, 1,90 моль, 195,67 мл, 28% чистота, 5 экв) медленно, под азотом при 70°C. Реакционную смесь перемешивают при 70°C в течение 16 ч. Смесь концентрируют для удаления большей части ТФК, затем остаток выливают в ледяную воду (500 мл), затем подщелачивают NaOH (твердым) до pH=7, экстрагируют ДХМ (1000 мл х 3). Органической слой сушат над Na2SO4, концентрируют с получением неочищенного продукта, 2-хлор-5-фтор-1-оксидо-пиридин-1-ий (I-816) (46 г, 82% выход) получают в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 6,99 (ддд, J=9,17, 6,48, 2,57 Гц, 1H) 7,41 (дд, J=9,17, 6,48 Гц, 1H) 8,24 (дд, J=4,03, 2,69 Гц, 1H).
К смеси 2-хлор-5-фтор-1-оксидо-пиридин-1-ия (36 г, 244,01 ммоль, 1 экв) в H2SO4 (200 мл) добавляют KNO3 (98,68 г, 976,04 ммоль, 4 экв) при 0°C. Затем смесь нагревают до 100°C в течение 12 ч под N2. Смесь выливают в ледяную воду (1000 мл), экстрагируют EtOAc (300 мл х 3). Органической слой сушат над Na2SO4, концентрируют с получением неочищенного продукта. Неочищенный продукт очищают колоночной хроматографией на силикагеле с получением 2-хлор-5-фтор-4-нитро-1-оксидо-пиридиния (I-817) (8 г, 41,55 ммоль, 17,03% выход) получают в виде желтого твердого вещества, которое подтверждают1H ЯМР.1H ЯМР (400 МГц, CDCl3) δ 7,86 (д, J=5,07 Гц, 1H) 8,53 (д, J=1,76 Гц, 1H). 2-хлор-5-фтор-4-нитро-пиридин (I-818) (8,1 г, 45,88 ммоль, 18,80% выход) получают в виде желтого масла, которое подтверждают1H ЯМР.1H ЯМР (400 МГц, CDCl3) δ 8,32 (д, J=8,16 Гц, 1H) 8,43 (д, J=5,51 Гц, 1H)
К смеси 2-хлор-5-фтор-4-нитро-пиридина (I-818) (8,1 г, 45,88 ммоль, 1 экв) в EtOH (150 мл) добавляют Ni (5 г), затем смесь перемешивают при 20°C в течение 4 ч под H2 (40 ф./кв.д.). Реакционную смесь фильтруют, и фильтрат концентрируют с получением неочищенного продукта, 2-хлор-5-фтор-пиридин-4-амин (I-819) (6,2 г) получают в виде белого твердого вещества.1H ЯМР (400 МГц, CD3OD) δ 6,71 (д, J=6,84 Гц, 1H) 7,80 (д, J=3,53 Гц, 1H).
Альтернативно, к смеси 2-хлор-5-фтор-4-нитро-1-оксидо-пиридин-1-ия (I-817) (8 г, 41,55 ммоль, 1 экв) в EtOH (150 мл) добавляют Ni (5 г) затем смесь перемешивают при 20°C в течение 3 ч под H2 (40 ф./кв.д.). Реакционную смесь фильтруют, и фильтрат концентрируют с получением неочищенного продукта, 2-хлор-5-фтор-пиридин-4-амин (I-819) (5 г, 34,12 ммоль, 82,11% выход) получают в виде желтого твердого вещества.1H ЯМР (400 МГц, CD3OD) δ 6,71 (д, J=6,84 Гц, 1H) 7,80 (д, J=3,53 Гц, 1H).
2-хлор-5-фтор-пиридин-4-амин (6,5 г, 44,35 ммоль, 1 экв) добавляют к концентрированной H2SO4 (70 мл) при 0-5°C, затем KNO3 (8,97 г, 88,71 ммоль, 2 экв) добавляют порциями к полученной выше смеси в течение 30 мин, поддерживая внутреннюю температуру ниже 5°C. Реакционную смесь перемешивают при 0-5°C в течение 1 ч и при 20°C в течение 30 мин. Две параллельные смеси объединяют и выливают в лед 400 г, экстрагируют ДХМ (100 мл х 5). Органической слой сушат над Na2SO4, концентрируют с получением неочищенного продукта. N-(2-хлор-5-фтор-4-пиридил)нитрамид (I-820) (13 г) получают в виде желтого твердого вещества, которое подтверждают1H ЯМР.1H ЯМР (400 МГц, CDCl3) δ 7,97 (д, J=5,29 Гц, 1H) 8,26 (д, J=1,54 Гц, 1H).
Смесь N-(2-хлор-5-фтор-4-пиридил)нитрамида (13 г, 67,87 ммоль, 1 экв) в концентрированной H2SO4 (100 мл) перемешивают при 20°C в течение 12 ч. Смесь добавляют в лед (2000 г) и экстрагируют EtOAc (100 мл х 3). Органической слой промывают насыщ. NaHCO3 (водн. 100 мл х 2), затем сушат над Na2SO4 и концентрируют с получением 2-хлор-5-фтор-3-нитро-пиридин-4-амина (I-821) (10 г,) в виде желтого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,80 (шс, 2H) 8,00 (д, J=1,32 Гц, 1H).
К смеси 2-хлор-5-фтор-3-нитро-пиридин-4-амина (7 г, 36,54 ммоль, 1 экв) и 4,4,5,5-тетраметил-2-(2-метилпроп-1-енил)-1,3,2-диоксаборолана (6,72 г, 36,91 ммоль, 1,01 экв) в диоксане (100 мл) и H2O (10 мл) добавляют K2CO3 (10,10 г, 73,09 ммоль, 2 экв) и 4-дитрет-бутилфосфанил-N, N-диметил-анилин;дихлорпалладий (1,29 г, 1,83 ммоль, 1,29 мл, 0,05 экв). Затем смесь перемешивают при 100°C в течение 12Hrs под N2. Смесь концентрируют с получением неочищенный продукт. Неочищенный продукт очищают колоночной хроматографией на силикагеле с получением 5-фтор-2-(2-метилпроп-1-енил)-3-нитро-пиридин-4-амина (I-822) (7,2 г, 34,09 ммоль, 93,29% выход) в виде красного масла.1H ЯМР (400 МГц, CDCl3) δ 1,85 (с, 3H) 1,93 (с, 3H) 5,85 (шс, 2H) 6,39 (шд, J=1,10 Гц, 1H) 8,24 (д, J=1,54 Гц, 1H).
К смеси 5-фтор-2-(2-метилпроп-1-енил)-3-нитро-пиридин-4-амина (7,2 г, 34,09 ммоль, 1 экв) в MeOH (150 мл) добавляют Pd/C (5 г, 10% чистота) и затем смесь перемешивают при 20°C в течение 36 ч под H2 (15 ф./кв.д.). Смесь фильтруют, и фильтрат концентрируют с получением неочищенного продукта 5-фтор-2-изобутил-пиридин-3,4-диамина (I-823) (7 г) в виде желтого масла.
К смеси 5-фтор-2-изобутил-пиридин-3,4-диамина (I-823) (90 мг, 491,20 мкмоль, 1 экв) и 2-(6-метил-3-нитро-2-оксо-1-пиридил)уксусной кислоты (I-805) (93,79 мг, 442,08 мкмоль, 0,9 экв) в ДХМ (10 мл) добавляют DIEA (126,96 мг, 982,40 мкмоль, 171,11 мкл, 2 экв) и T3P (406,35 мг, 638,56 мкмоль, 379,77 мкл, 50% чистота, 1,3 экв) при 20°C. Затем смесь перемешивают при 20°C в течение 1 ч. Смесь концентрируют с получением N-(3-амино-5-фтор-2-изобутил-4-пиридил)-2-(6-метил-3-нитро-2-оксо-1-пиридил)ацетамида (I-824) (200 мг) в виде черного масла.
Смесь N-(3-амино-5-фтор-2-изобутил-4-пиридил)-2-(6-метил-3-нитро-2-оксо-1-пиридил)ацетамида (200 мг, 529,99 мкмоль, 1 экв) в AcOH (5 мл) нагревают до 120°C и перемешивают при 120°C в течение 21 ч. Смесь концентрируют с получением неочищенного продукта. Неочищенный продукт очищают преп-ЖХВД с получением 1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-3-нитро-пиридин-2-она (I-825) (120 мг, 63% выход) в виде желтого твердого вещества.
К смеси 1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-3-нитро-пиридин-2-она (120 мг, 333,93 мкмоль, 1 экв) в EtOAc (5 мл) добавляют Pd/C (100 мг, 10% чистота), затем смесь перемешивают при 20°C в течение 1 ч под H2 (15 ф./кв.д.). Смесь фильтруют и фильтрат концентрируют с получением 3-амино-1-[(7-фтор-4-изобутил-1H-Имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-пиридин-2-она (I-826) (100 мг) получают в виде желтого масла. ЖХМС m/z 315,9 (M+1)+.
Пример 91:
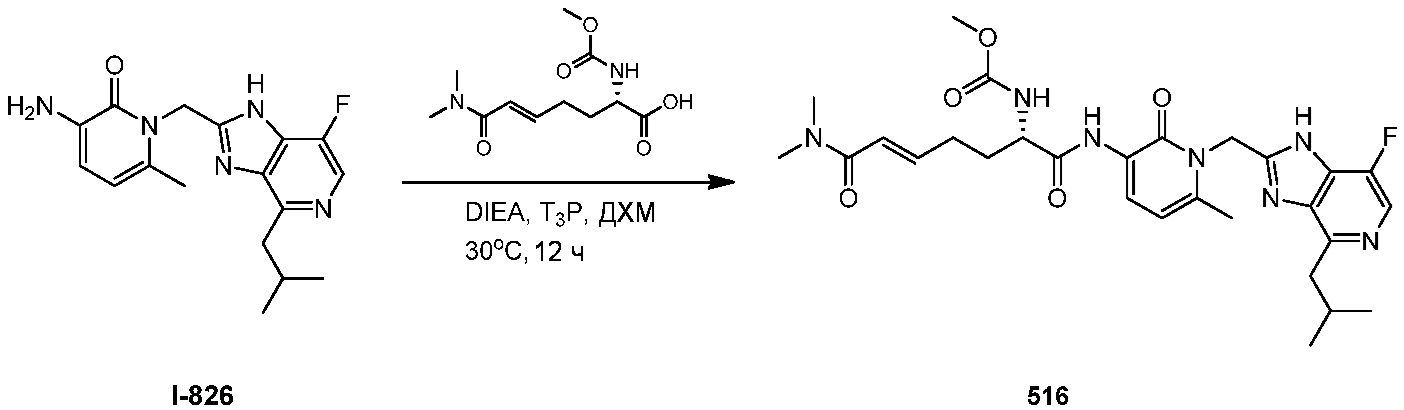
К смеси 3-амино-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-пиридин-2-она (I-826) (100 мг, 303,61 мкмоль, 1 экв) в ДХМ (3 мл) добавляют DIEA (117,72 мг, 910,83 мкмоль, 158,65 мкл, 3 экв), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (I-9) (78,41 мг, 303,61 мкмоль, 1 экв) и T3P (289,81 мг, 455,41 мкмоль, 270,85 мкл, 50% чистота, 1,5 экв) при 30°C. Затем смесь перемешивают при 30°C в течение 12 ч. Смесь концентрируют с получением неочищенного продукта. Неочищенный продукт очищают преп-ЖХВД с получением метил-N-[(E,1S)-6-(диметиламино)-1-[[1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 516) (56,8 мг, 32% выход) в виде белого твердого вещества.1H ЯМР (400 МГц, ДМСО-d6) δ 0,88 (шд, J=5,73 Гц, 6H) 1,63-1,75 (м, 1H) 1,86 (шд, J=7,06 Гц, 1H) 2,12-2,25 (м, 3H) 2,41 (с, 3H) 2,79-2,86 (м, 5Н) 2,96 (с, 3H) 3,52 (с, 3H) 4,09-4,18 (м, 1H) 5,51 (с, 2H) 6,25 (д, J=7,72 Гц, 1H) 6,35 (д, J=15,21 Гц, 1H) 6,52-6,63 (м, 1H) 7,68 (шд, J=7,50 Гц, 1H) 8,12 (д, J=1,76 Гц, 1H) 8,15 (д, J=7,50 Гц, 1H) 9,13 (с, 1H) 13,35 (шс, 1H). ЖХМС m/z 570,2 (M+1)+.
Пример 92:

К смеси 3-амино-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-пиридин-2-она (I-826) (70 мг, 212,53 мкмоль, 1 экв) в ДХМ (3 мл) добавляют DIEA (82,40 мг, 637,58 мкмоль, 111,05 мкл, 3 экв), (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (I-37) (57,87 мг, 212,53 мкмоль, 1 экв) и T3P (202,86 мг, 318,79 мкмоль, 189,59 мкл, 50% чистота, 1,5 экв) при 20°C. После добавления, смесь перемешивают при 20°C в течение 2 ч. Смесь концентрируют с получением неочищенного продукта. Неочищенный продукт очищают преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-6-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 517) (45,8 мг, 36% выход) в виде белого твердого вещества. ЖХМС m/z 584,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,88 (шд, J=5,07 Гц, 6H) 1,84-1,99 (м, 2H) 2,11-2,28 (м, 3H) 2,41 (с, 3H) 2,76-2,88 (м, 8 H) 2,89-3,01 (м, 6H) 5,05 (дд, J=7,39, 4,74 Гц, 1H) 5,52 (с, 2H) 6,27 (д, J=7,72 Гц, 1H) 6,36 (д, J=15,21 Гц, 1H) 6,54-6,68 (м, 1H) 8,07-8,18 (м, 2H) 9,15 (с, 1H) 13,37 (шс, 1H)
Следующее соединение получают по методикам, описанным в примере 92 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-829:

Смесь 6-хлор-1H-пиридин-2-она (20 г, 154,39 ммоль) в CHCl3 (250 мл) добавляют NBS (27,48 г, 154,39 ммоль) при 0°C и смесь перемешивают при 0°C в течение 0,5 ч. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением 3-бром-6-хлор-1H-пиридин-2-она (I-808) (3,25 г, 10% выход) в виде зеленого твердого вещества. ЖХМС m/z 210,0 (M+1)+.
Смесь 3-бром-6-хлор-1H-пиридин-2-она (2,75 г, 13,19 ммоль), трет-бутил 2-бромацетата (6,43 г, 32,98 ммоль, 4,87 мл), t-BuOK (2,22 г, 19,79 ммоль), KI (219,01 мг, 1,32 ммоль) в диоксане (30 мл) перемешивают при 90°C в течение 24 ч. Смесь концентрируют при пониженном давлении для удаления диоксана, остаток добавляют 50 мл насыщ. водн. NH4Cl, затем экстрагируют EtOAc (30 мл х 2), объединенную органическую фазу промывают 50 мл насыщенного солевого раствора, затем сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают флэш-хроматографией на силикагеле с получением трет-бутил 2-(3-бром-6-хлор-2-оксо-1-пиридил)ацетата (I-809) (3 г, 9,30 ммоль, 70,49% выход) в виде желтого масла.
Смесь трет-бутил 2-(3-бром-6-хлор-2-оксо-1-пиридил)ацетата (3,32 г, 10,29 ммоль), бензилкарбамата (1,56 г, 10,29 ммоль), Cs2CO3 (6,71 г, 20,58 ммоль), Ксантфос (357,31 мг, 617,52 мкмоль) и Pd2(dba)3 (282,74 мг, 308,76 мкмоль) в диоксане (40 мл) дегазируют и продувают N2 3 раза, и затем смесь перемешивают при 100°C в течение 12 ч под N2 атмосферой. Реакционную смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением трет-бутил 2-[3-(бензилоксикарбониламино)-6-хлор-2-оксо-1-пиридил]ацетата (I-810) (1,6 г, 40% выход) в виде светло-желтого твердого вещества. ЖХМС m/z 415,2 (M+23)+.
К раствору трет-бутил 2-[3-(бензилоксикарбониламино)-6-хлор-2-оксо-1-пиридил]ацетата (0,9 г, 2,29 ммоль) в ДХМ (10 мл) добавляют ТФК (2 мл) при 0°C. Смесь перемешивают при 25°C в течение 3,5 ч. Реакционную смесь концентрируют при пониженном давлении с получением 2-[3-(бензилоксикарбониламино)-6-хлор-2-оксо-1-пиридил]уксусной кислоты (I-811) (0,9 г) в виде желтого твердого вещества. ЖХМС m/z 336,7 (M+1)+.
Смесь 2-[3-(бензилоксикарбониламино)-6-хлор-2-оксо-1-пиридил]уксусной кислоты (I-811) (0,5 г, 1,48 ммоль), 5-фтор-2-изобутил-пиридин-3,4-диамина (I-823) (272,07 мг, 1,48 ммоль), DIEA (1,92 г, 14,85 ммоль, 2,59 мл) в ДХМ (8 мл) добавляют T3P (2,36 г, 3,71 ммоль, 2,21 мл, 50% чистота) при 0°C, и затем смесь перемешивают при 25°C в течение 12 ч. В смесь добавляют воду 0,1 мл и затем концентрируют в вакууме с получением бензил N-[1-[2-[(3-амино-5-фтор-2-изобутил-4-пиридил)амино]-2-оксо-этил]-6-хлор-2-оксо-3-пиридил]карбамата (I-827) (2 г) в виде желтого масла. ЖХМС m/z 502,2 (M+1)+.
Смесь бензил N-[1-[2-[(3-амино-5-фтор-2-изобутил-4-пиридил)амино]-2-оксо-этил]-6-хлор-2-оксо-3-пиридил]карбамата (2 г, 3,98 ммоль) в AcOH (22 мл) перемешивают при 130°C в течение 29,5 часов. Смесь концентрируют в вакууме с получением масла. Остаток очищают преп-ЖХВД с получением бензил N-[6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамата (I-828) (250 мг, 13% выход) в виде оранжевого твердого вещества. ЖХМС m/z 484,1 (M+1)+.
Смесь бензил N-[6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамата (250 мг, 516,61 мкмоль) в ТФК (4,5 мл) перемешивают при 25°C в течение 23 часа. Реакционную смесь выливают в 20 мл ледяного насыщ. водн. NaHCO3, затем смесь добавляют NaOH (твердый) до pH~8, смесь экстрагируют ДХМ (10 мл х 2), объединенную органическую фазу промывают 15 мл насыщенного солевого раствора, затем сушат над Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением 3-амино-6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]пиридин-2-она (I-829) (240 мг) в виде зеленой камеди. ЖХМС m/z 350,1 (M+1)+.
Пример 93:

Смесь 3-амино-6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]пиридин-2-она (I-829) (120 мг, 343,06 мкмоль), (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (I-9) (88,60 мг, 343,06 мкмоль), DIEA (88,68 мг, 686,13 мкмоль, 119,51 мкл) в ДХМ (3 мл) добавляют T3P (654,94 мг, 1,03 ммоль, 612,09 мкл, 50% чистота) при 25°C и затем смесь перемешивают при 40°C в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении с получением масла. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-1-[[6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енил]карбамата (Соединение 523) (48,6 мг, 23,29% выход) в виде белого твердого вещества. ЖХМС m/z 590,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,35-13,60 (м, 1H) 9,37 (шс, 1H) 8,28 (д, J=8,07 Гц, 1H) 8,16 (шс, 1H) 7,71 (шд, J=7,70 Гц, 1H) 6,57-6,67 (м, 2H) 6,38 (д, J=15,04 Гц, 1H) 5,70 (с, 2H) 4,25 (шс, 1H) 3,55 (с, 3H) 3,00 (с, 3H) 2,83-2,88 (м, 5Н) 2,23 (дкв, J=15,24, 7,51 Гц, 3H) 1,68-1,92 (м, 2H) 0,91 (шд, J=5,99 Гц, 6H).
Пример 94:

Смесь 3-амино-6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]пиридин-2-она (I-829) (120 мг, 343,06 мкмоль), (E,2S)-7-(диметиламино)-2-(диметилкарбамоилокси)-7-оксо-гепт-5-еновой кислоты (I-37) (93,41 мг, 343,06 мкмоль), DIEA (88,68 мг, 686,12 мкмоль, 119,51 мкл) в ДХМ (3 мл) добавляют T3P (654,94 мг, 1,03 ммоль, 612,09 мкл, 50% чистота) при 25°C и затем смесь перемешивают при 40°C в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении с получением масла. Остаток очищают преп-ЖХВД с получением [(E,1S)-1-[[6-хлор-1-[(7-фтор-4-изобутил-1H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-(диметиламино)-6-оксо-гекс-4-енила] N, N-диметилкарбамата (Соединение 524) (45,6 мг, 21% выход) в виде белого твердого вещества. ЖХМС m/z 604,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,36-13,56 (м, 1H) 9,38-9,48 (м, 1H) 8,26 (д, J=8,19 Гц, 1H) 8,12-8,20 (м, 1H) 6,61-6,71 (м, 2H) 6,40 (д, J=15,04 Гц, 1H) 5,70 (с, 2H) 5,11 (ш дд, J=7,15, 4,58 Гц, 1H) 2,90-3,01 (м, 6H) 2,78-2,89 (м, 8 H) 2,12-2,36 (м, 3H) 1,88-2,01 (м, 2H) 0,83-0,94 (м, 6H).
Синтез промежуточного соединения I-834:

Две реакции проводят параллельно: Pd(dppf)Cl2⋅CH2Cl2 (59,7 мг, 73,1 мкмоль, 0,1 экв) добавляют к смеси 2-хлор-5-фтор-3-нитро-пиридин-4-амина (140 мг, 731 мкмоль, 1 экв), гидрида калия;трифтор(3,3,3-трифторпропил)борона (209 мг, 1,02 ммоль, 1,4 экв) и K2CO3 (252 мг, 1,83 ммоль, 2,5 экв) в толуоле/H2O (10:1) (4 мл) под N2. Затем смесь нагревают до 110°C в течение 12 ч. Две реакционные смеси объединяют и обрабатывают вместе. Смесь фильтруют, и фильтрат экстрагируют между EtOAc (30 мл) и водой (30 мл), органической слой концентрируют с получением неочищенного продукта. Остаток очищают на колонке (SiO2) с получением 5-фтор-3-нитро-2-(3,3,3-трифторпропил)пиридин-4-амина (I-830) (340 мг, 1,34 ммоль, 91,9% выход) в виде желтого масла.
К раствору 5-фтор-3-нитро-2-(3,3,3-трифторпропил)пиридин-4-амина (0,63 г, 2,49 ммоль, 1 экв) в EtOAc (30 мл) добавляют Pd/C (200 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 20 мин. Реакционную смесь фильтруют, и фильтрат концентрируют. Неочищенный продукт 5-фтор-2-(3,3,3-трифторпропил)пиридин-3,4-диамин (I-831) (560 мг) применяют на следующей стадии без дальнейшей очистки в виде желтого твердого вещества.
T3P (556 мг, 874 мкмоль, 50% чистота, 1,5 экв) добавляют к раствору 5-фтор-2-(3,3,3-трифторпропил)пиридин-3,4-диамина (130 мг, 583 мкмоль, 1 экв) и 2-(3-нитро-2-оксо-1-пиридил)уксусной кислоты (150 мг, 757 мкмоль, 1,3 экв) в ДХМ (3 мл) при 25°C, затем смесь перемешивают при 40°C в течение 12 ч. Насыщ. NaHCO3 (10 мл) добавляют к смеси, смесь экстрагируют EtOAc (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Неочищенный продукт N-[3-амино-5-фтор-2- (3,3,3-трифторпропил)-4-пиридил]-2-(3-нитро-2-оксо-1-пиридил)ацетамид (I-832) (235 мг) применяют на следующей стадии без дальнейшей очистки в виде желтого твердого вещества. ЖХМС m/z 404,0 (M+1)+.
Раствор N-[3-амино-5-фтор-2-(3,3,3-трифторпропил)-4-пиридил]-2-(3-нитро-2-оксо-1-пиридил)ацетамида (230 мг, 570 мкмоль, 1 экв) в HOAc (3 мл) нагревают до 120°C в течение 12 ч. Смесь концентрируют для удаления HOAc. Насыщ. NaHCO3 (30 мл) добавляют к смеси, смесь экстрагируют EtOAc (30 мл х 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 1-[[7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2 -ил]метил]-3-нитро-пиридин-2-она (I-833) (191 мг) в виде белого твердого вещества. ЖХМС m/z 386,0 (M+1)+.
К раствору 1-[[7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил] метил]-3-нитро-пиридин-2-она (190 мг, 493 мкмоль, 1 экв) в EtOAc (20 мл) добавляют Pd/C (100 мг, 10% чистота) под N2. Суспензию дегазируют под вакуумом и продувают H2 несколько раз. Смесь перемешивают под H2 (15 ф./кв.д.) при 25°C в течение 15 мин. Смесь фильтруют, и фильтрат концентрируют с получением 3-амино-1-[[7-фтор-4-(3,3,3-трифторпропил)-3H-имидазо[4,5-c]пиридин-2-ил]метил]пиридин-2-она (I-834) (144 мг) в виде белого твердого вещества. ЖХМС m/z 356,0 (M+1)+.
Следующие промежуточные соединения получают согласно методикам, описанным для синтеза I-834 с применением подходящих реагентов.
Пример 95:

Соединение 552 получают согласно методикам для Примера 70 с применением подходящих промежуточных соединений. ЖХМС m/z 610,2 (M+1)+,1H ЯМР (400 МГц, ДМСО-d6) δ 9,30 (с, 1H) 8,14-8,33 (м, 2H) 7,62 (дд, J=6,95, 1,65 Гц, 1H) 6,55-6,71 (м, 1H) 6,32-6,45 (м, 2H) 5,48 (с, 2H) 5,07 (дд, J=7,50, 4,63 Гц, 1H) 3,23-3,28 (м, 2H) 2,89-3,01 (м, 6H) 2,74-2,88 (м, 8 H) 2,27 (кв, J=6,76 Гц, 2H) 1,85-2,00 (м, 2H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 95 с применением подходящих промежуточных соединений.
Пример 96:
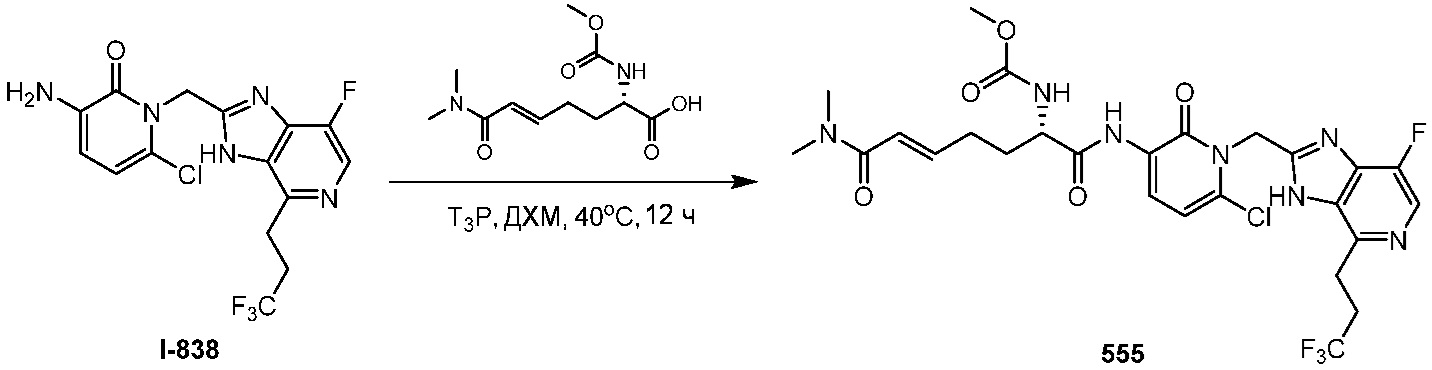
Соединение 555 получают согласно методикам для Примера 95 с применением подходящих промежуточных соединений. ЖХМС m/z 630,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,37-13,75 (м, 1H) 9,38 (с, 1H) 8,27 (д, J=7,94 Гц, 1H) 8,19 (д, J=2,20 Гц, 1H) 7,72 (шд, J=7,72 Гц, 1H) 6,55-6,69 (м, 2H) 6,37 (д, J=15,21 Гц, 1H) 5,70 (с, 2H) 4,18-4,29 (м, 1H) 3,54 (с, 3H) 3,21-3,28 (м, 2H) 2,99 (с, 3H) 2,75-2,88 (м, 5Н) 2,14-2,30 (м, 2H) 1,81-1,93 (м, 1H) 1,64-1,79 (м, 1H).
Следующее соединение получают согласно методикам, описанным для синтеза Примера 96 с применением подходящих промежуточных соединений.
Пример 97:

Соединение 578 получают согласно методикам для Примера 88 с применением подходящих промежуточных соединений. ЖХМС m/z 554,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,42 (шс, 1H), 9,27 (с, 1H), 8,27 (д, J=7,3 Гц, 1H), 8,15 (д, J=2,0 Гц, 1H), 7,73 (шд, J=7,7 Гц, 1H), 7,61 (шд, J=6,6 Гц, 1H), 6,64-6,55 (м, 1H), 6,41-6,33 (м, 2H), 5,45 (с, 2H), 4,22-4,14 (м, 1H), 3,53 (с, 3H), 2,98 (с, 3H), 2,89 (д, J=7,1 Гц, 2H), 2,83 (с, 3H), 2,22 (кв, J=7,5, 14,8 Гц, 2H), 1,93-1,81 (м, 1H), 1,78-1,64 (м, 1H), 1,26-1,12 (м, 1H), 0,42 (шд, J=7,5 Гц, 2H), 0,25 (шд, J=4,4 Гц, 2H).
Следующие соединения получают согласно методикам, описанным в Примере 97 с применением подходящих промежуточных соединений.
Синтез промежуточного соединения I-853:


К раствору 5-метил-3-нитро-1H-пиридин-2-она (1 г, 6,49 ммоль) в ACN (15 мл) добавляют DIEA (1,68 г, 12,98 ммоль, 2,26 мл) и трет-бутил 2-бромацетата (2,53 г, 12,98 ммоль, 1,92 мл) при 0°C. Смесь перемешивают при 25°C в течение 12 ч. Реакционную смесь концентрируют с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением трет-бутил 2-(5-метил-3-нитро-2-оксо-1-пиридил)ацетата (I-849) (1,53 г, 88% выход) в виде желтого твердого вещества. ЖХМС m/z 269,2 (M+1)+.
Смесь трет-бутил 2-(5-метил-3-нитро-2-оксо-1-пиридил)ацетата (1,6 г, 5,96 ммоль) в ДХМ (12 мл) добавляют к ТФК (6 мл) при 0°C и затем смесь перемешивают при 25°C в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении для удаления ДХМ. Остаток разбавляют 30 мл (петролейного эфира/этилацетата=10:1) и затем смесь перемешивают при 25°C в течение 10 мин. Затем смесь фильтруют, и фильтровальную лепешку концентрируют при пониженном давлении с получением желтого твердого вещества. Соединение 2-(5-метил-3-нитро-2-оксо-1-пиридил)уксусную кислоту (I-850) (1,3 г) получают в виде желтого твердого вещества. ЖХМС m/z 213,1 (M+1)+.
К раствору 2-(5-метил-3-нитро-2-оксо-1-пиридил)уксусной кислоты (0,3 г, 1,41 ммоль) и 5-фтор-2-изобутил-пиридин-3,4-диамина (297,95 мг, 1,63 ммоль) в ДХМ (6 мл) добавляют DIEA (365,51 мг, 2,83 ммоль, 492,60 мкл) и T3P (1,35 г, 2,12 ммоль, 1,26 мл, 50% чистота) при 0°C. Смесь перемешивают при 40°C в течение 12 ч. Смесь концентрируют при пониженном давлении с получением неочищенного N-(3-амино-5-фтор-2-изобутил-4-пиридил)-2-(5-метил-3-нитро-2-оксо-1-пиридил)ацетамида (I-851) (2,1 г) получают в виде желтого масла. ЖХМС m/z 378,2 (M+1)+.
К растворителю AcOH (20 мл) добавляют N-(3-амино-5-фтор-2-изобутил-4-пиридил)-2-(5-метил-3-нитро-2-оксо-1-пиридил)ацетамид (2,1 г, 5,56 ммоль) при 25°C. Затем смесь перемешивают при 130°C в течение 36 ч. Смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением 1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-5-метил-3-нитро-пиридин-2-она (I-852) (200 мг, 10% выход) в виде желтого твердого вещества. ЖХМС m/z 360,2 (M+1)+.
Смесь 1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-5-метил-3-нитро-пиридин-2-она (180 мг, 500,90 мкмоль), Pd/C (0,14 г, 10% чистота) в EtOAc (15 мл) дегазируют и продувают H2 3 раза и затем смесь перемешивают при 25°C в течение 1 ч под H2 атмосферой (15 ф./кв.д.). Смесь фильтруют, и фильтрат концентрируют с получением неочищенного продукта. Соединение 3-амино-1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-5-метил-пиридин-2-она (I-853) (200 мг) получают в виде желтого масла. ЖХМС m/z 330,2 (M+1)+.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-853 с применением подходящих реагентов.
Пример 98:

К раствору (E,2S)-7-(диметиламино)-2-(метоксикарбониламино)-7-оксо-гепт-5-еновой кислоты (86,25 мг, 333,97 мкмоль) и 3-амино-1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-5-метил-пиридин-2-она (100 мг, 303,61 мкмоль) в ДХМ (3 мл) добавляют DIEA (58,86 мг, 455,41 мкмоль, 79,32 мкл) и T3P (289,81 мг, 455,41 мкмоль, 270,85 мкл, 50% чистота) при 25°C. Затем смесь перемешивают при 40°C в течение 12 ч. Смесь концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ЖХВД с получением метил N-[(E,1S)-6-(диметиламино)-1-[[1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-5-метил-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (42,3 мг, 24% выход) в виде белого твердого вещества. ЖХМС m/z 570,4 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,30-13,44 (м, 1H) 9,19 (с, 1H) 8,17 (д, J=2,19 Гц, 1H) 8,18 (с, 1H) 7,66 (с, 1H) 7,33-7,42 (м, 1H) 6,53-6,62 (м, 1H) 6,30-6,39 (м, 1H) 5,41 (с, 2H) 4,09-4,19 (м, 1H) 3,45-3,55 (м, 3H) 2,94-2,97 (м, 3H) 2,83-2,87 (м, 2H) 2,80-2,83 (м, 3H) 2,14-2,25 (м, 3H) 2,08 (с, 3H) 1,66-1,87 (м, 2H) 0,87 (шд, J=5,70 Гц, 6H).
Следующие соединения получают согласно методикам, описанным в Примере 98 с применением подходящих промежуточных соединений.
Следующие промежуточные соединения получают по методике, описанной для синтеза I-65 с применением подходящих реагентов.
Пример 99:
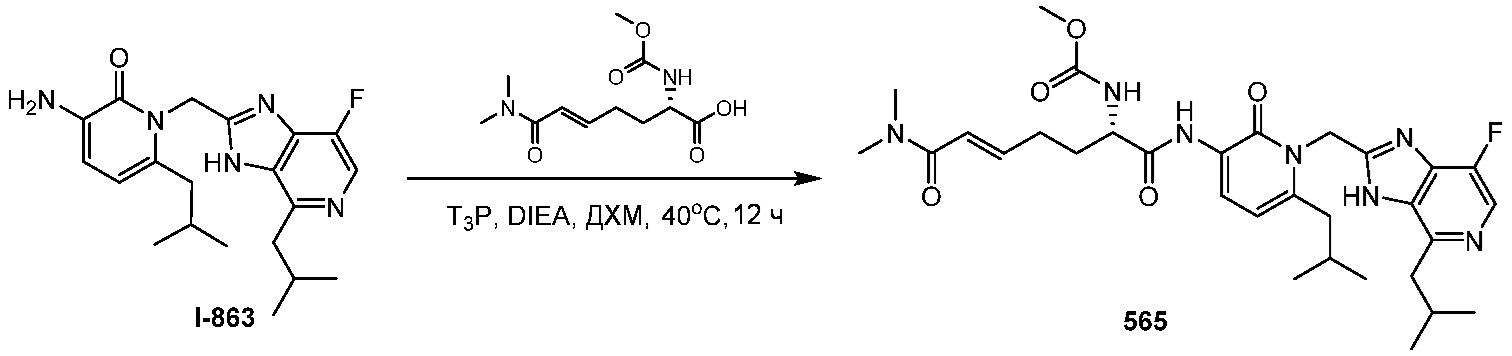
Соединение 565 получают согласно методикам для Примера 98 с применением подходящих промежуточных соединений. ЖХМС m/z 612,4 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,33-13,54 (м, 1H) 9,17 (шс, 1H) 8,18 (д, J=7,72 Гц, 1H) 8,09-8,15 (м, 1H) 7,69 (шд, J=7,50 Гц, 1H) 6,53-6,62 (м, 1H) 6,34 (д, J=14,99 Гц, 1H) 6,22 (д, J=7,72 Гц, 1H) 5,46 (шс, 2H) 4,09-4,17 (м, 1H) 3,51 (с, 3H) 2,96 (с, 3H) 2,79-2,86 (м, 5Н) 2,58 (шд, J=6,84 Гц, 2H) 2,10-2,27 (м, 3H) 1,85 (ш дд, J=13,12, 6,73 Гц, 2H) 1,62-1,73 (м, 1H) 0,79-0,91 (м, 12H).
Следующие соединения получают согласно методикам, описанным в Примере 99 с применением подходящих промежуточных соединений.
Синтез промежуточное соединение I-874:

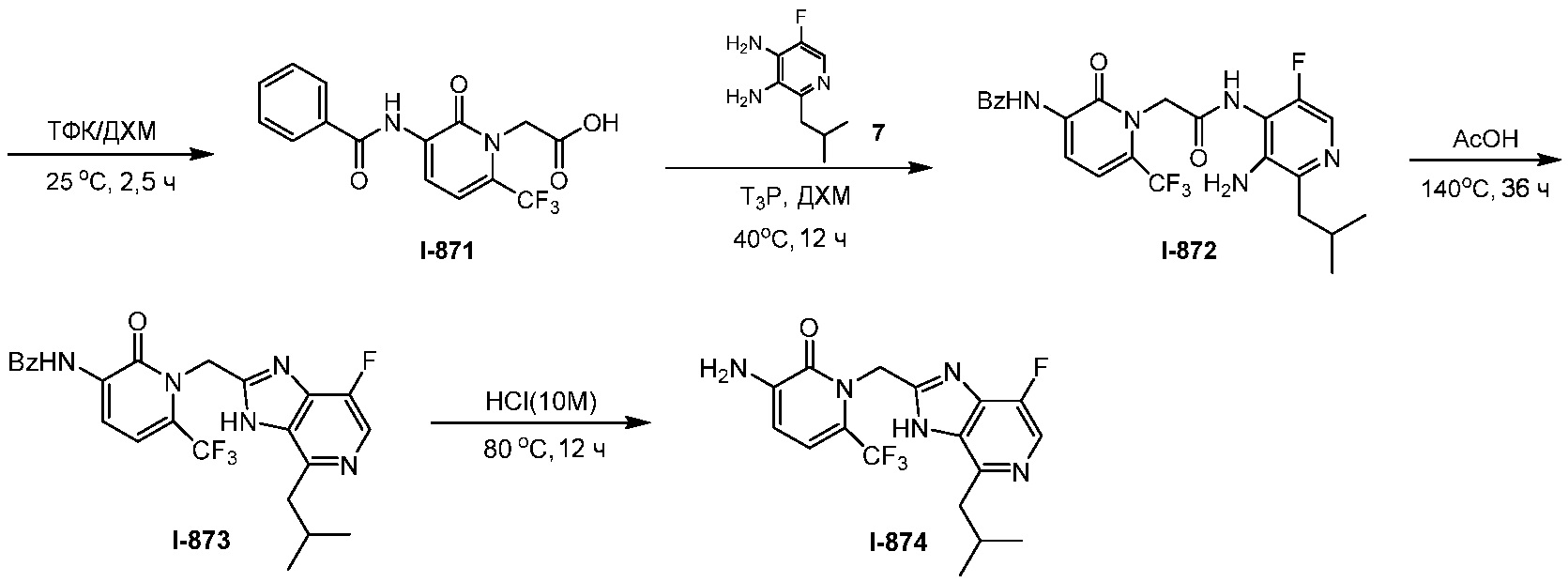
Раствор 2-бензамидоуксусной кислоты (10 г, 55,8 ммоль, 1 экв) и (E)-4-этокси-1,1,1-трифтор-бут-3-ен-2-она (8,91 г, 53,0 ммоль, 7,55 мл, 0,95 экв) в Ac2O (100 мл) нагревают до 60°C в течение 14 ч. Смесь концентрируют для удаления Ac2O. Затем насыщ. NaHCO3 (200 мл) добавляют к смеси. Смесь экстрагируют EtOAc (200 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (200 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением N-[2-оксо-6-(трифторметил)пиран-3-ил]бензамид (I-869) (4,76 г, 30% выход) в виде желтого твердого вещества.
Смесь N-[2-оксо-6-(трифторметил)пиран-3-ил]бензамида (4,76 г, 16,8 ммоль, 1 экв) и трет-бутил 2-аминоацетата (11,0 г, 84,0 ммоль, 5 экв) нагревают до 125°C в течение 12 ч. Насыщ. NH4Cl (100 мл) добавляют к смеси и затем смесь экстрагируют EtOAc (100 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (100 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают колоночной хроматографией (SiO2) с получением трет-бутил 2-[3-бензамидо-2-оксо-6-(трифторметил)-1-пиридил]ацетата (I-870) (2,9 г, 44% выход) в виде белого твердого вещества. ЖХМС m/z 397,1 (M+1)+.
ТФК (6,16 г, 54,0 ммоль, 4 мл, 21,4 экв) добавляют к раствору трет-бутил 2-[3-бензамидо-2-оксо-6-(трифторметил)-1-пиридил]ацетата (1 г, 2,52 ммоль, 1 экв) в ДХМ (8 мл) при 25°C. Смесь перемешивают в течение 2,5 ч. Смесь концентрируют для удаления ТФК и ДХМ с получением твердого вещества. Твердое вещество растирают в PE (10 мл), фильтруют и твердое вещество сушат с получением 2-[3-бензамидо-2-оксо-6-(трифторметил)-1-пиридил]уксусной кислоты (I-871) (810 мг) в виде белого твердого вещества. ЖХМС m/z 340,9 (M+1)+.
T3P (1,56 г, 2,46 ммоль, 1,46 мл, 50% чистота, 1,5 экв) добавляют к раствору 5-фтор-2-изобутил-пиридин-3,4-диамина (300 мг, 1,64 ммоль, 1 экв) и 2-[3-бензамидо-2-оксо-6-(трифторметил)-1-пиридил]уксусной кислоты (557 мг, 1,64 ммоль, 1 экв) в ДХМ (3 мл) при 25°C. Затем смесь перемешивают при 40°C в течение 12 ч. Насыщ. NaHCO3 (10 мл) добавляют к смеси, белое твердое вещество выпадают в осадок, его фильтруют, и фильтровальную лепешку сушат с получением неочищенного продукта. Неочищенный продукт N-[1-[2-[(3-амино-5-фтор-2-изобутил-4-пиридил)амино]-2-оксо-этил]-2-оксо-6-(трифторметил)-3-пиридил]бензамид (I-872) (1 г) применяют на следующей стадии без дальнейшей очистки в виде белого твердого вещества. ЖХМС m/z 506,2 (M+1)+.
Раствор N-[1-[2-[(3-амино-5-фтор-2-изобутил-4-пиридил)амино]-2-оксо-этил]-2-оксо-6-(трифторметил)-3-пиридил]бензамида (700 мг, 1,38 ммоль, 1 экв) в HOAc (7 мл) нагревают до 140°C в течение 36 ч. Смесь перемешивают при 140°C в течение еще 24 ч. Смесь концентрируют для удаления HOAc, затем насыщ. NaHCO3 (50 мл) добавляют к смеси и экстрагируют EtOAc (40 мл х 2), органической слой промывают насыщенным солевым раствором (40 мл), сушат над Na2SO4 и концентрируют с получением N-[1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-6-(трифторметил)-3-пиридил]бензамида (I-873) (500 мг) в виде коричневого твердого вещества. ЖХМС m/z 488,1 (M+1)+.
Следующие промежуточные получают согласно методикам, описанным для синтеза I-873 с применением подходящих реагентов.
Раствор N-[1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-2-оксо-6-(трифторметил)-3-пиридил]бензамида (500 мг, 1,03 ммоль, 1 экв) в HCl (10M) (10 мл) нагревают до 90°C в течение 5 ч. Смесь концентрируют для удаления HCl, затем NaHCO3 (50 мл) добавляют к смеси. Смесь экстрагируют EtOAc (30 мл x 2). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 3-амино-1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-6-(трифторметил)пиридин-2-она (I-874) (383 мг) в виде коричневого твердого вещества. ЖХМС m/z 384,0 (M+1)+.
Пример 100:

Соединение 576 получают согласно методикам для Примера 70 с применением подходящих промежуточных соединений.1H ЯМР (400 МГц, ДМСО-d6) δ 13,24-13,43 (м, 1H) 9,67 (с, 1H) 8,35 (д, J=7,95 Гц, 1H) 8,10-8,20 (м, 1H) 7,66-7,77 (м, 1H) 7,12 (д, J=8,07 Гц, 1H) 6,53-6,67 (м, 1H) 6,36 (д, J=15,04 Гц, 1H) 5,50 (шс, 2H) 4,23-4,35 (м, 1H) 3,53 (с, 3H) 2,98 (с, 3H) 2,75-2,89 (м, 5Н) 2,13-2,30 (м, 3H) 1,67-1,90 (м, 2H) 1,32-1,32 (м, 1H) 0,77-0,96 (м, 6H). ЖХМС m/z 624,3 (M+1)+.
Следующее соединение получают по методикам, описанным в примере 100 с применением подходящих промежуточных соединений.
Пример 101:

К раствору N-[1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-6-(метоксиметил)-2-оксо-3-пиридил]бензамида (215 мг, 463,86 мкмоль) в EtOH (5 мл) добавляют NaOH (55,66 мг, 1,39 ммоль) при 25°C. Смесь перемешивают при 80°C в течение 12 ч. К реакционной смеси добавляют NaOH(37,11 мг), затем смесь перемешивают при 80°C в течение 24 ч. Реакционную смесь концентрируют с получением остатка. Остаток очищают преп-ТСХ (SiO2) с получением 3-амино-1-[(7-фтор-4-изобутил-3H-имидазо[4,5-c]пиридин-2-ил)метил]-6-(метоксиметил)пиридин-2-она (I-876) (170 мг) в виде зеленого твердого вещества. ЖХМС m/z 360,2 (M+1)+.
Соединение 599 получают согласно методикам для Примера 70 с применением подходящих промежуточных соединений. ЖХМС m/z 600,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,26-13,44 (м, 1H) 9,29 (с, 1H) 8,24 (д, J=7,46 Гц, 1H) 8,12 (шс, 1H) 7,71 (шд, J=6,11 Гц, 1H) 6,55-6,64 (м, 1H) 6,48 (шд, J=7,58 Гц, 1H) 6,36 (д, J=15,04 Гц, 1H) 5,53 (шс, 2H) 4,47 (с, 2H) 4,15-4,22 (м, 1H) 3,53 (с, 3H) 3,24 (шс, 3H) 2,98 (с, 3H) 2,81-2,87 (м, 5Н) 2,22 (дкв, J=14,92, 7,38 Гц, 3H) 1,82-1,92 (м, 1H) 1,66-1,76 (м, 1H) 0,91 (шд, J=5,62 Гц, 6H).
Пример 102:

Соединение 591 получают согласно методикам для Примера 100 с применением подходящих промежуточных соединений. ЖХМС m/z 528,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 9,44 (д, J=3,91 Гц, 1H) 8,22-8,31 (м, 2H) 6,60-6,73 (м, 2H) 6,40 (д, J=15,04 Гц, 1H) 5,69 (с, 1H) 5,61 (с, 1H) 5,45 (д, J=5,99 Гц, 2H) 5,10-5,17 (м, 1H) 3,09 (д, J=7,09 Гц, 1H) 2,95-3,03 (м, 6H) 2,93 (д, J=7,46 Гц, 1H) 2,78-2,87 (м, 6H) 2,09-2,34 (м, 3H) 1,88-2,01 (м, 2H) 0,86-0,97 (м, 6H).
Следующее соединение получают по методикам, описанным в примере 102 с применением подходящих промежуточных соединений.
Пример 103:

Соединение 589 получают согласно методикам для Примера 70 с применением подходящих промежуточных соединений. ЖХМС m/z 574,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,48 (шс, 1H) 9,27 (с, 1H) 8,32 (т, J=8,25 Гц, 1H) 8,13-8,18 (м, 1H) 7,68 (шд, J=7,82 Гц, 1H) 6,56-6,66 (м, 1H) 6,38 (д, J=15,16 Гц, 1H) 6,29 (дд, J=8,38, 5,32 Гц, 1H) 5,54 (д, J=1,47 Гц, 2H) 4,22 (шд, J=3,55 Гц, 1H) 3,55 (с, 3H) 2,99 (с, 3H) 2,81-2,89 (м, 5Н) 2,22 (дт, J=15,34, 7,73 Гц, 3H) 1,87 (шд, J=7,58 Гц, 1H) 1,67-1,77 (м, 1H) 0,85-0,93 (м, 1H) 0,85-0,93 (м, 1H) 0,90 (шд, J=5,87 Гц, 4 H).
Следующее соединение получают по методикам, описанным в примере 103 с применением подходящих промежуточных соединений.
Пример 104:

Соединение 583 получают согласно методикам для Примера 70 с применением подходящих промежуточных соединений. ЖХМС m/z 588,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 13,42 (шс, 1H), 9,43 (с, 1H), 8,31 (д, J=10,6 Гц, 1H), 8,15 (шд, J=1,6 Гц, 1H), 7,72 (шд, J=7,2 Гц, 1H), 6,67-6,51 (м, 1H), 6,37 (шд, J=15,0 Гц, 1H), 5,55 (с, 2H), 4,23 (шс, 1H), 3,54 (с, 3H), 2,98 (с, 3H), 2,90-2,79 (м, 5H), 2,38 (шс, 3H), 2,23 (ш дд, J=6,8, 13,5 Гц, 3H), 1,94-1,65 (м, 2H), 0,90 (шд, J=6,4 Гц, 6H).
Следующее соединение получают по методикам, описанным в примере 104 с применением подходящих промежуточных соединений.
Пример 105:
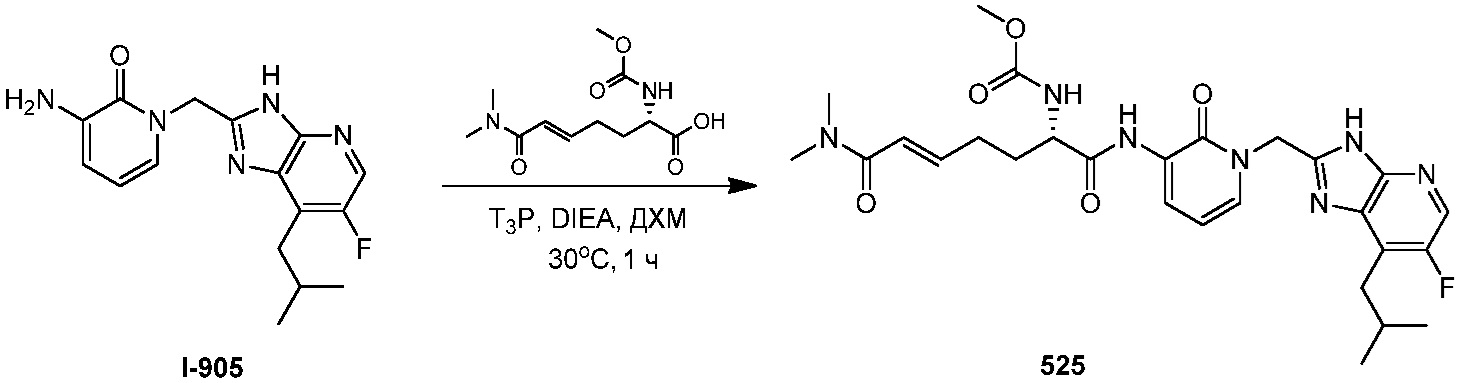
Соединение 525 получают согласно методикам для Примера 98 с применением подходящих промежуточных соединений. ЖХМС m/z 556,2 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 0,90 (шд, J=5,26 Гц, 6H) 1,65-1,79 (м, 1H) 1,80-1,96 (м, 1H) 1,99-2,13 (м, 1H) 2,16-2,35 (м, 2H) 2,73-2,88 (м, 5Н) 2,99 (с, 3H) 3,54 (с, 3H) 4,09-4,29 (м, 1H) 5,42 (шс, 2H) 6,32-6,45 (м, 2H) 6,54-6,67 (м, 1H) 7,59 (шс, 1H) 7,73 (шд, J=7,82 Гц, 1H) 8,19-8,33 (м, 2H) 9,27 (с, 1H).
Следующие соединения получают согласно методикам, описанным для синтеза Примера 105 с применением подходящих промежуточных соединений.
Пример 106:

Соединение 560 получают согласно методикам для Примера 70 с применением подходящих промежуточных соединений,1H ЯМР (400 МГц, ДМСО-d6) δ 0,85 (шс, 6H) 1,83-2,10 (м, 3H) 2,21-2,35 (м, 2H) 2,71-2,84 (м, 8H) 2,87-3,01 (м, 6H) 5,09 (дд, J=7,50, 4,63 Гц, 1H) 5,63 (с, 2H) 6,37 (д, J=14,99 Гц, 1H) 6,57-6,67 (м, 2H) 8,22 (шд, J=8,16 Гц, 2H) 9,41 (шс, 1H) 12,89-13,33 (м, 1H). ЖХМС m/z 604,2(M+1)+.
Следующее соединение получают по методикам, описанным в примере 106 с применением подходящих промежуточных соединений.
Пример 107:

Раствор 3-амино-1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (150 мг, 337 мкмоль, 1 экв), (E,2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этил-метил-карбамоил]окси-7-(диметиламино)-7-оксо-гепт-5-еновой кислоты (168 мг, 405 мкмоль, 1,2 экв), DIEA (349 мг, 2,70 ммоль, 8 экв) и T3P (859 мг, 1,35 ммоль, 50% чистота, 4 экв) в ДХМ (3 мл) перемешивают при 30°C в течение 36 ч. Воду (10 мл) добавляют к смеси. Смесь экстрагируют EtOAc (10 мл x 3). Объединенные органические слои промывают насыщенным солевым раствором (20 мл), сушат над Na2SO4 и фильтруют. Фильтрат концентрируют при пониженном давлении с получением 327 мг неочищенного продукта. Остаток очищают преп-ТСХ (SiO2) с получением [(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-[2-[трет-бутоксикарбонил(метил)амино]этил]-N-метил-карбамата (I-916) (180 мг, 63% выход) в виде желтого масла. ЖХМС m/z 842,4 (M+1)+.
Раствор [(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-[2-[трет-бутоксикарбонил(метил)амино]этил]-N-метил-карбамата (160 мг, 190 мкмоль, 1 экв) в ТФК (2 мл) перемешивают при 25°C в течение 0,5 ч. Смесь концентрируют для удаления ТФК. Остаток растворяют в MeOH (3 мл) доводят до pH 7 добавлением NaHCO3. Затем KOAc (37,3 мг, 380 мкмоль, 2 экв) добавляют к смеси и перемешивают в течение 1 ч. Смесь фильтруют, и фильтрат концентрируют с получением [(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7- изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-метил-N-[2-(метиламино)этил]карбамата (I-917) (180 мг) в виде желтого масла. ЖХМС m/z 612,1 (M+1)+.
Раствор [(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-метил-N-[2-(метиламино)этил]карбамата (100 мг, 163 мкмоль, 1 экв) и параформальдегида (30 мг, 16,3 мкмоль) в MeOH (4 мл) перемешивают при 25°C в течение 13 ч. Реакционную смесь гасят добавлением H2O (5 мл) и концентрируют в вакууме для удаления большей части MeOH. Затем смесь экстрагируют EtOAc (4 мл х 3) и объединенный органический слой промывают насыщенным солевым раствором (5 мл), сушат над Na2SO4 и концентрируют в вакууме с получением остатка. Остаток очищают преп-ЖХВД с получением [(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]N-[2-(диметиламино)этил]-N-метил-карбамата (Соединение 543) (15,5 мг, 14,1% выход) в виде светло-желтого масла. ЖХМС m/z 626,4 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,58 (шс, 1H) 9,36 (шд, J=8,8 Гц, 1H) 8,21 (шд, J=2,0 Гц, 2H) 7,51 (дд, J=6,8, 1,2 Гц, 1H) 6,59-6,70 (м, 1H) 6,26-6,44 (м, 3H) 5,34 (с, 2H) 5,11 (шс, 1H) 3,50 (шс, 3H) 2,97 (с, 5Н) 2,71-2,87 (м, 7 H) 2,26-2,34 (м, 2H) 2,17 (шд, J=16,8 Гц, 6H) 1,88-2,04 (м, 3H) 0,91 (д, J=6,4 Гц, 6H).
Пример 108:


К раствору (E,2S)-2-[2-[трет-бутоксикарбонил(метил)амино]этоксикарбониламино]-7-(диметиламино)-7-оксо-гепт-5-еновой кислоты (198,64 мг, 494,81 мкмоль, 1 экв) и 3-амино-1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]пиридин-2-она (220 мг, 494,81 мкмоль, 1 экв) в ДХМ (3 мл) добавляют T3P (629,75 мг, 989,62 мкмоль, 588,55 мкл, 50% чистота, 2 экв) и DIEA (191,85 мг, 1,48 ммоль, 258,55 мкл, 3 экв) при 25°C. Смесь перемешивают при 25°C в течение 24 ч. Реакционную смесь разделяют между 5 мл воды и 5 мл этилацетата. Органическую фазу разделяют, промывают насыщенным солевым раствором 5 мл (5 мл х 1), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают преп-ТСХ (SiO2) с получением трет-бутил N-[2-[[(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамоилокси]этил]-N-метил-карбамата (I-921) (240 мг, 59% выход) в виде коричневого масла. ЖХМС m/z 828,5 (M+1)+.
Смесь трет-бутил N-[2-[[(E,1S)-6-(диметиламино)-1-[[1-[[6-фтор-7-изобутил-1-(2-триметилсилилэтоксиметил)пирроло[3,2-b]пиридин-2-ил]метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамоилокси]этил]-N-метил-карбамата (140 мг, 169,07 мкмоль, 1 экв) в ТФК (1 мл) перемешивают при 25°C в течение 1 ч. Затем реакционную смесь концентрируют и затем растворяют в MeOH (1 мл), KOAc (16,59 мг, 169,07 мкмоль, 1 экв) добавляют и полученную реакционную смесь перемешивают при 40°C в течение 1 ч. Реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении для удаления растворителя с получением коричневого остатка. Неочищенный продукт 2-(метиламино)этил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамат (I-922) (100 мг) применяют на следующей стадии без дальнейшей очистки в виде коричневого масла. ЖХМС m/z 598,4 (M+1)+.
К раствору 2-(метиламино)этил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (100 мг, 167,31 мкмоль, 1 экв) в MeOH (1 мл) добавляют (HCHO)n (20 мг, 200,78 мкмоль) при 25°C. Смесь перемешивают при 25°C в течение 0,5 ч. Затем NaBH3CN (52,57 мг, 836,57 мкмоль, 5 экв) добавляют при 25°C, полученную реакционную смесь перемешивают при 25°C в течение еще 11,5 ч. Реакционную смесь фильтруют и очищают преп-ЖХВД с получением 2-(диметиламино)этил N-[(E,1S)-6-(диметиламино)-1-[[1-[(6-фтор-7-изобутил-1H-пирроло[3,2-b]пиридин-2-ил)метил]-2-оксо-3-пиридил]карбамоил]-6-оксо-гекс-4-енил]карбамата (Соединение 547) (33,1 мг, 32% выход) в виде желтого твердого вещества. ЖХМС m/z 612,3 (M+1)+.1H ЯМР (400 МГц, ДМСО-d6) δ 11,55 (с, 1H), 9,30 (с, 1H), 8,25-8,18 (м, 2H), 7,79 (шд, J=7,6 Гц, 1H), 7,49 (шд, J=6,5 Гц, 1H), 6,68-6,53 (м, 1H), 6,41-6,25 (м, 3H), 5,32 (с, 2H), 4,22-4,13 (м, 1H), 4,08-4,01 (м, 2H), 2,99 (с, 3H), 2,83 (с, 3H), 2,76 (шд, J=7,5 Гц, 2H), 2,30-2,07 (м, 9H), 2,01 (дт, J=6,8, 13,7 Гц, 2H), 1,91-1,67 (м, 2H), 0,91 (д, J=6,5 Гц, 6H).
Следующие соединения получают согласно методикам, описанным в предыдущих примерах с применением подходящих промежуточных соединений.
Биологическая оценка
Пример 1A: Анализ ингибитора трансглутаминазы (TG)
Этот анализ основан на способности активной TG сшивать группы доноров амина, такие как лизин, содержащийся в белках или пептидах, или другие свободные амины, присутствующие в субстратах малых молекул, на определенных белковых глутаминовых участках (акцепторах аминов). Используя флуоресцентный донор амина, дансил кадаверин (DSC) и акцептор амина, несущий множество глутаминов, N, N-диметиллированный казеин (NMC), активность TG измеряют по изменению флуоресценции поперечно-сшитого DSC в NMC с течением времени. Способность тестируемых соединений блокировать образование этих поперечных связей при различных концентрациях соединения является мерой эффективности ингибитора TG.
Распределяют тестируемые соединения в 96-луночном планшете в 8-точечном титровании при 5 мкл/лунку и 20x желаемых конечных концентрациях.
В момент времени=0 мин, начиная с 1,12x концентрации TG в реакционном буфере, добавляют TG в планшет в количестве 90 мкл/лунку (также включают контроль без TG=1,12x только буфер).
В момент времени=10 мин или 30 мин, начиная с 20x конечной концентрации TG субстратов NMC и DSC, добавляют субстраты в количестве 5 мул/лунку.
В момент времени=90 мин, измеряют флуоресценцию всех лунок в планшетном ридере.
Экспортируют полученные данные и анализируют для определения IC50 каждого тестированного соединения.
Данные IC50 для тестируемых соединений показаны в таблице 1.
Таблица 1
A: IC50 <0,5 мкМ; B: 0,5 мкМ ≤ IC50 ≤ 5 мкМ; C: 5 мкМ < IC50<100 мкМ.
Реферат
Группа изобретений относится к фармацевтической химии и включает конкретные соединения, указанные в формуле изобретения, фармацевтическую композицию на их основе, способ лечения заболевания или расстройства, опосредованного трансглутаминазой 2, и применение соединений в производстве лекарственного средства. Технический результат - соединения, которые ингибируют трансглутаминазу 2 (TG2). 13 н. и 9 з.п. ф-лы, 1 табл., 109 пр.
Формула














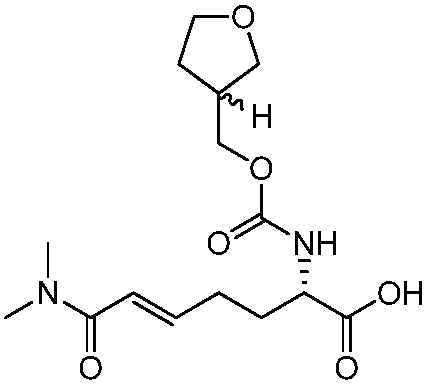


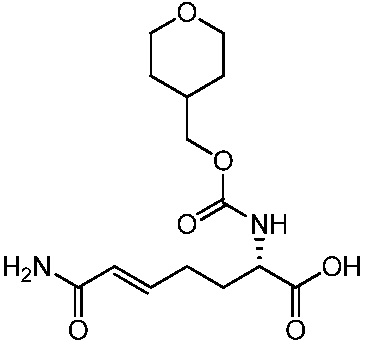





















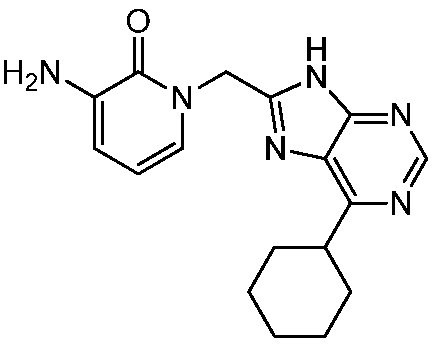





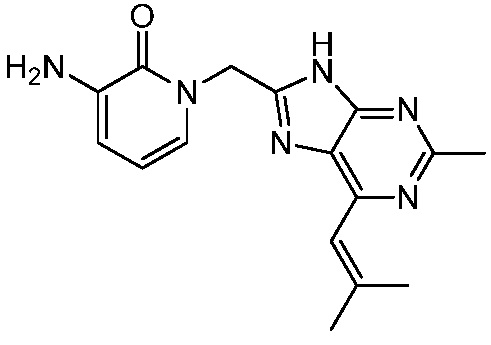


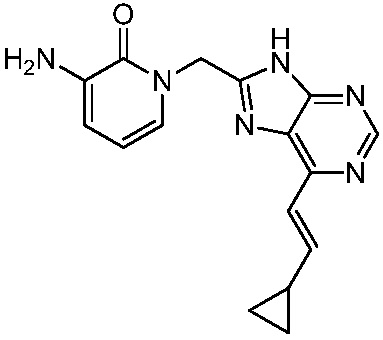











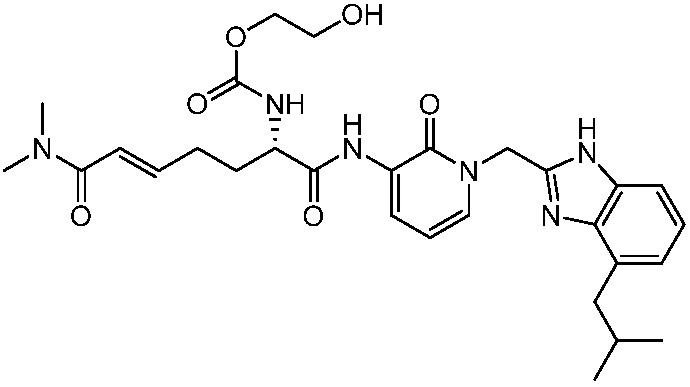










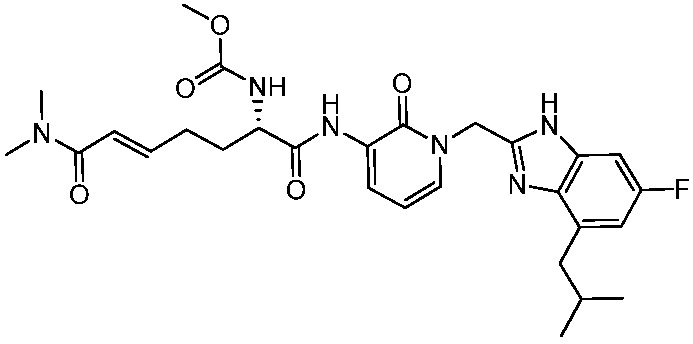
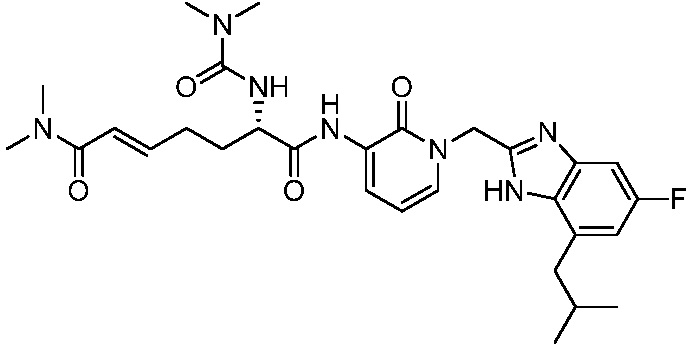












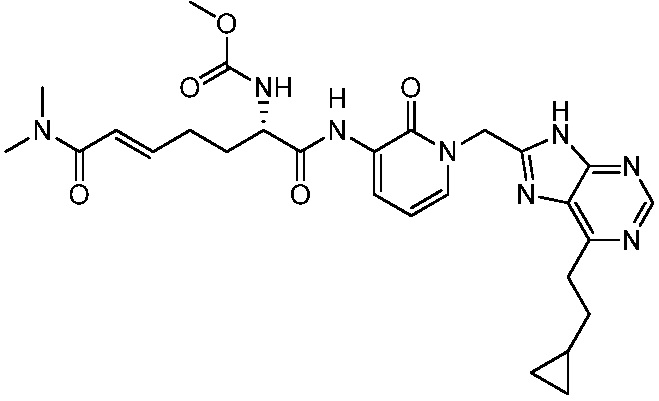

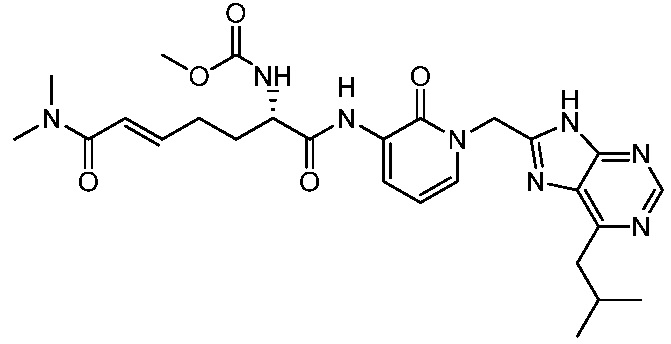
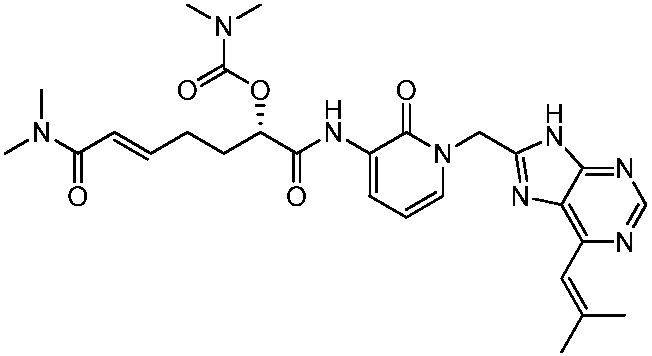
















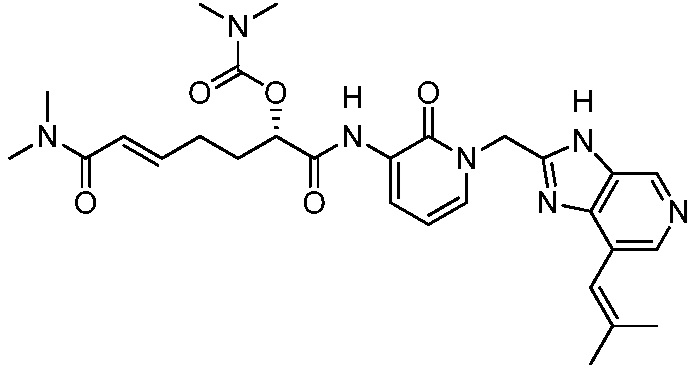
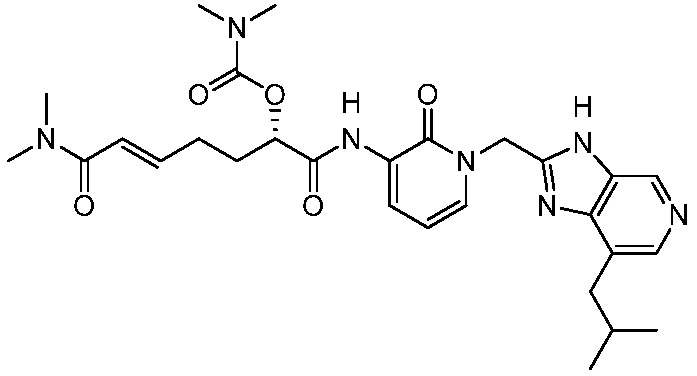












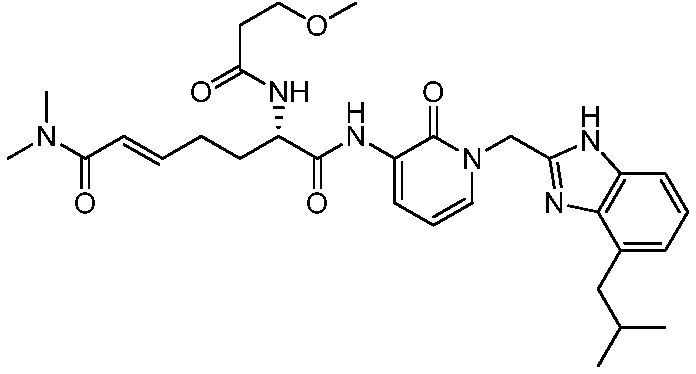






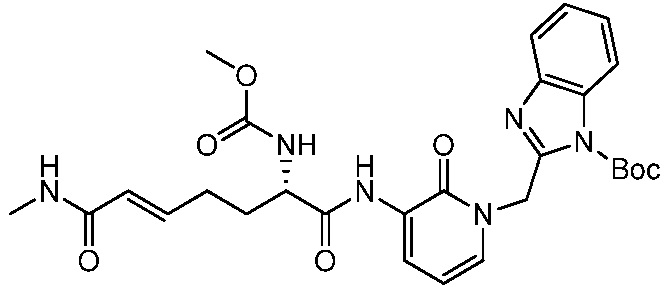













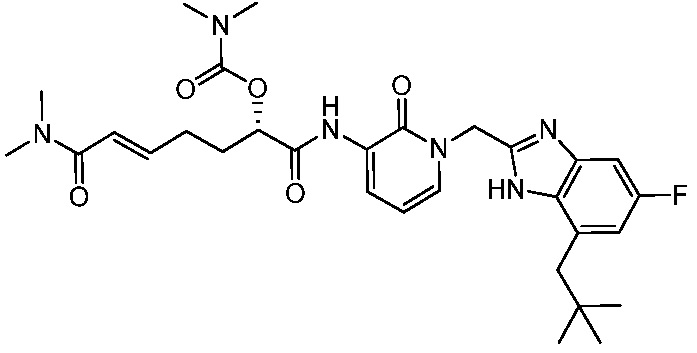

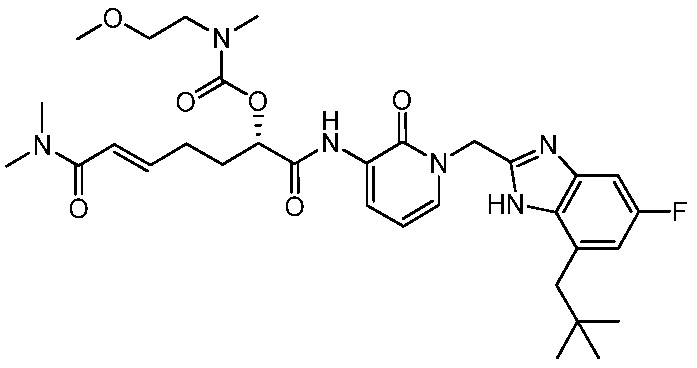





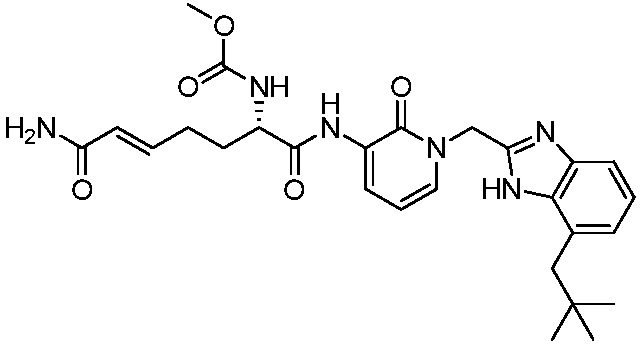



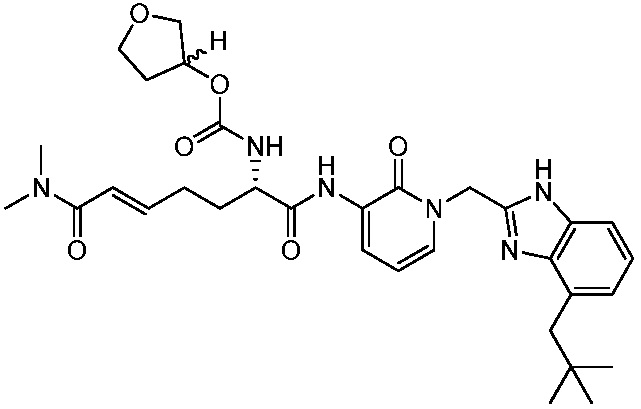









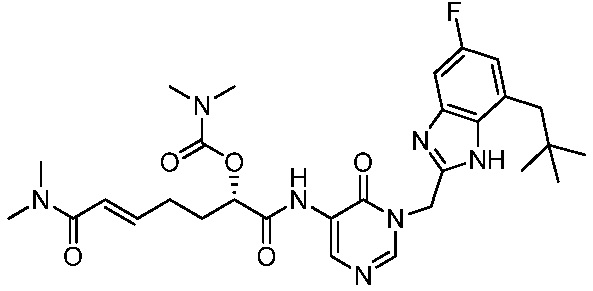





















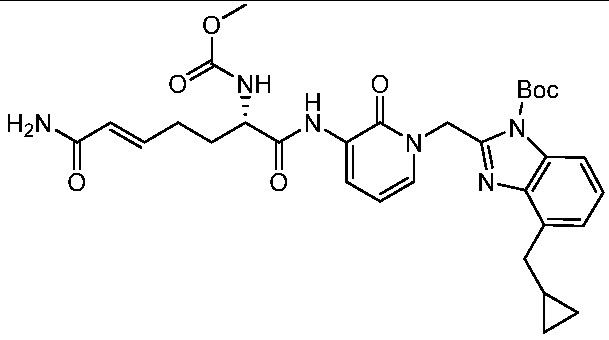








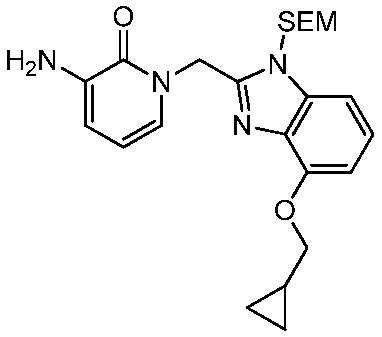



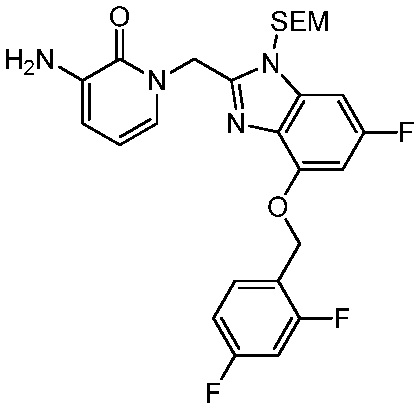











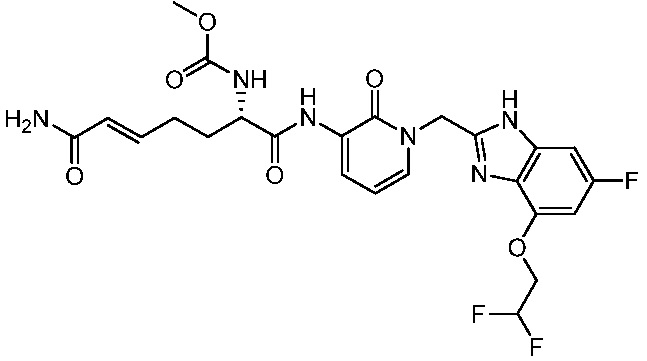





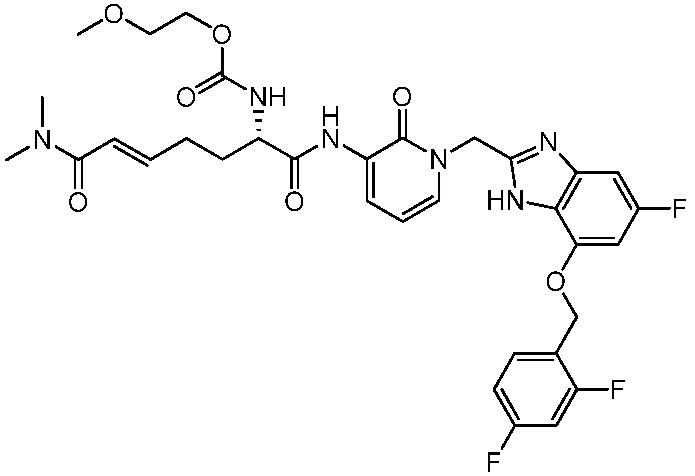




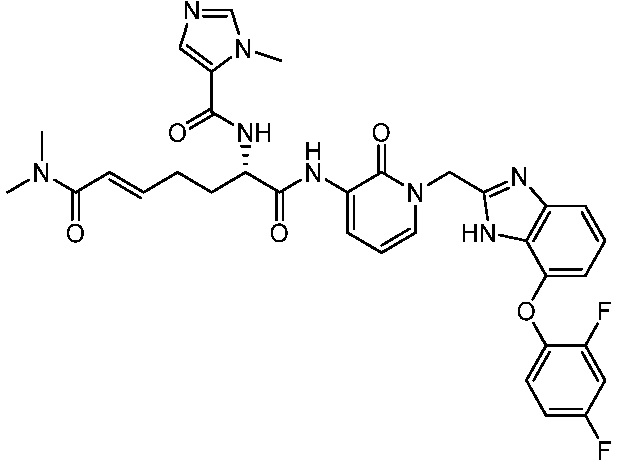

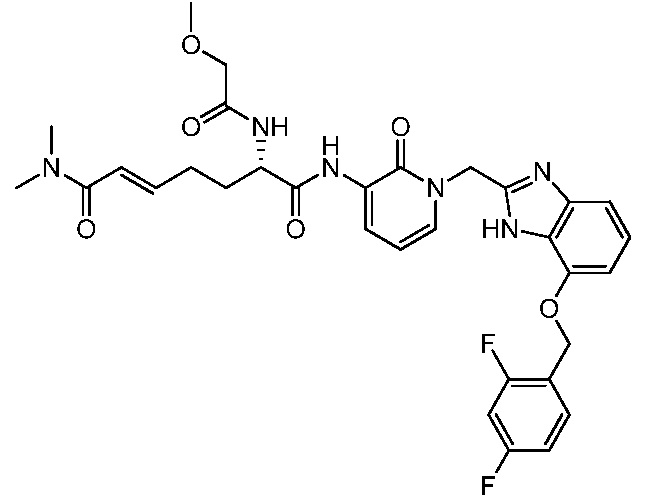






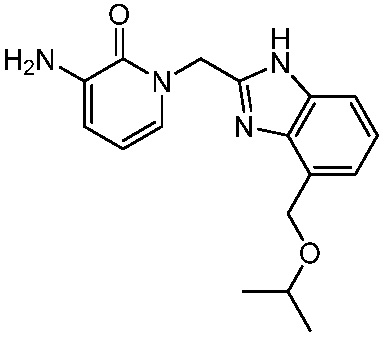



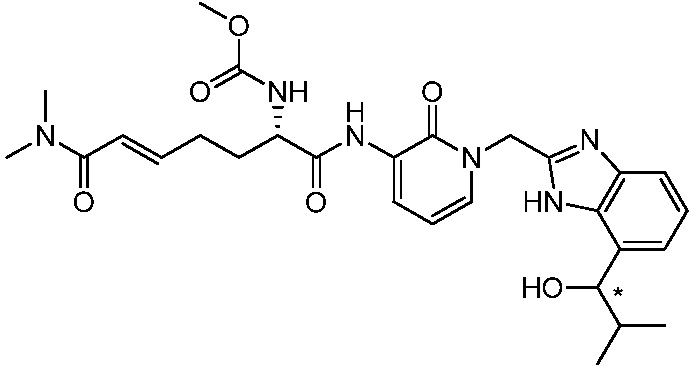

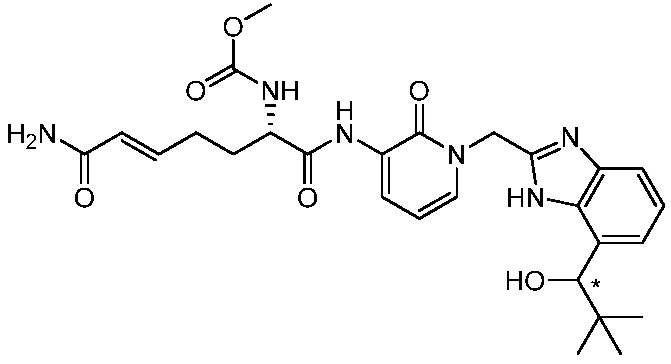













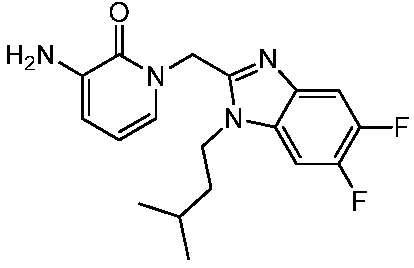

























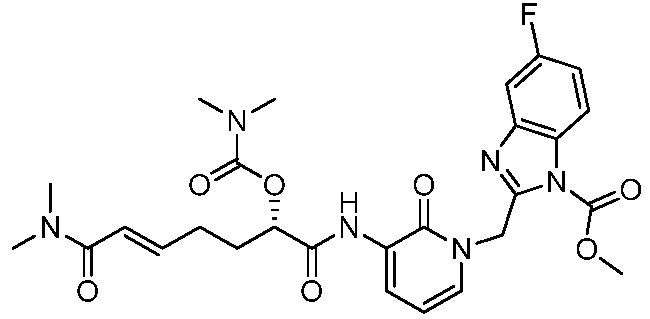






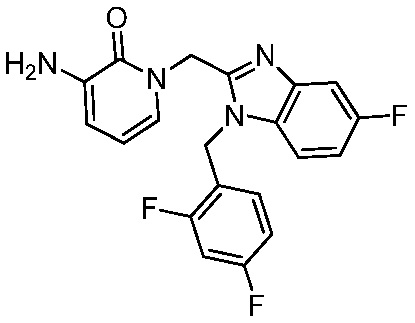






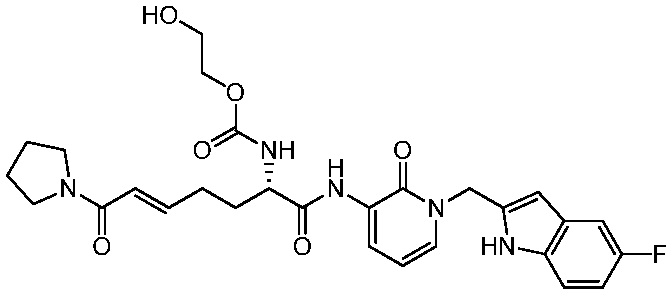










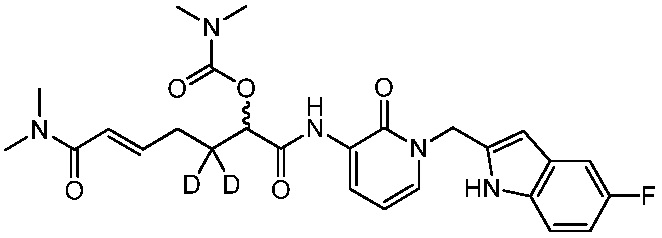










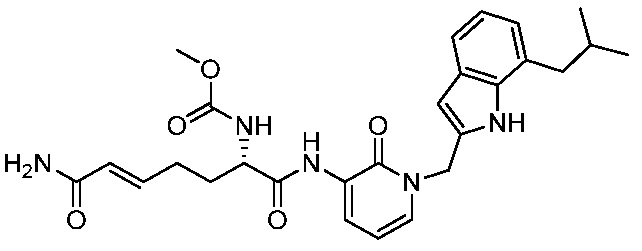





















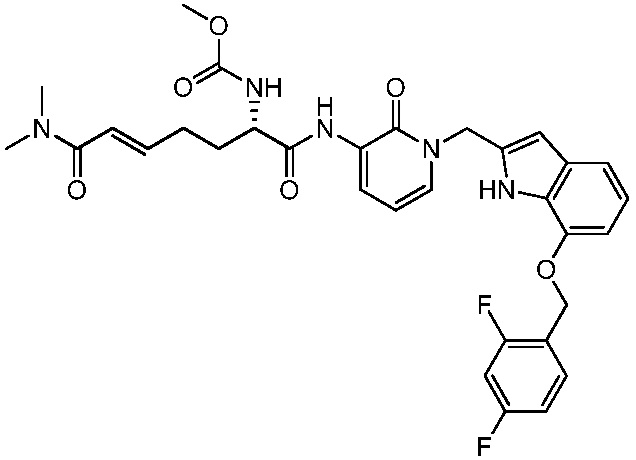


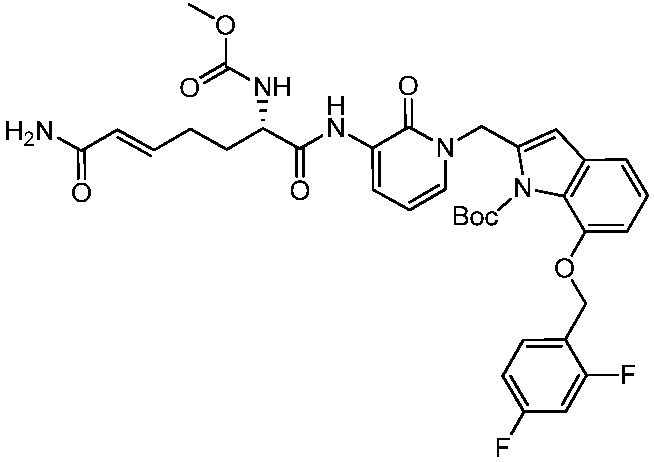







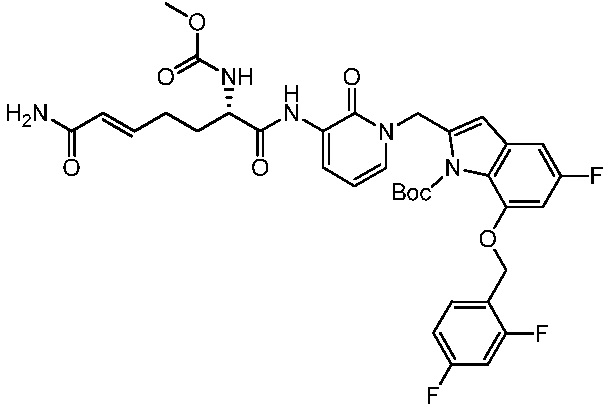









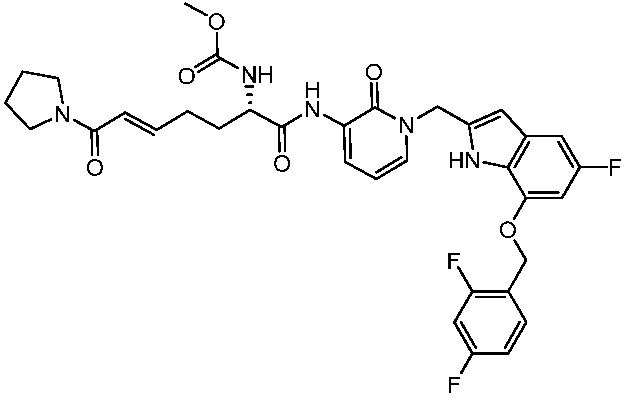





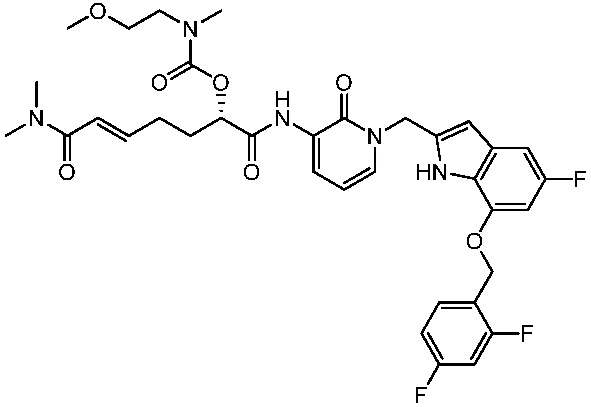

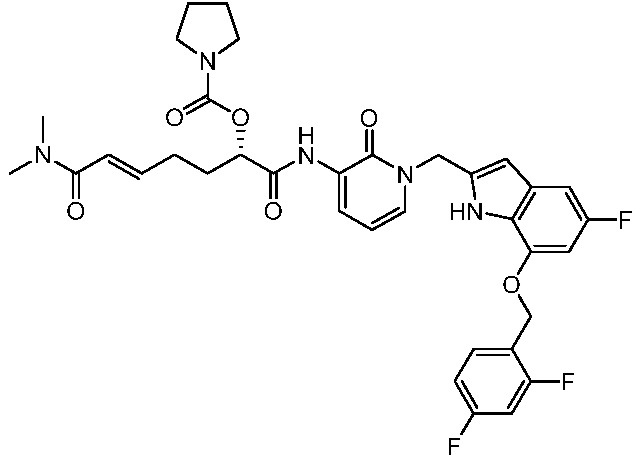




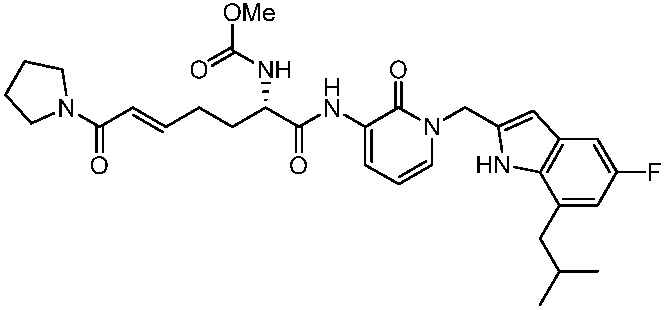

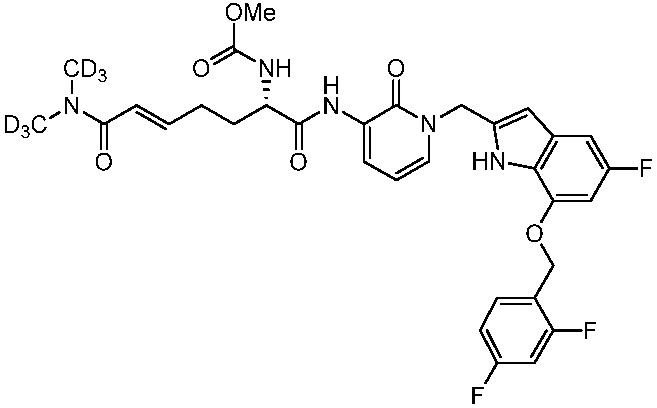





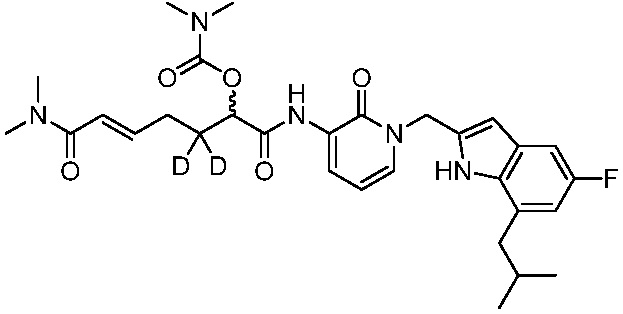
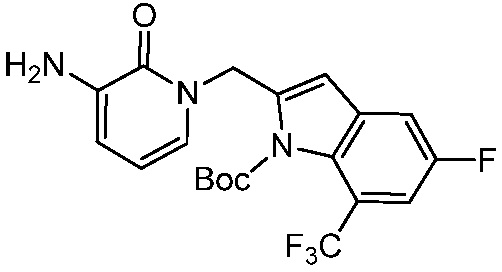





































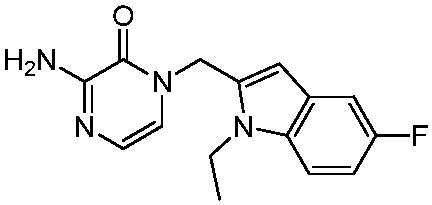









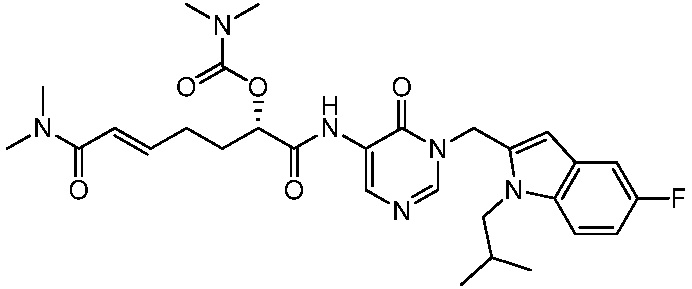





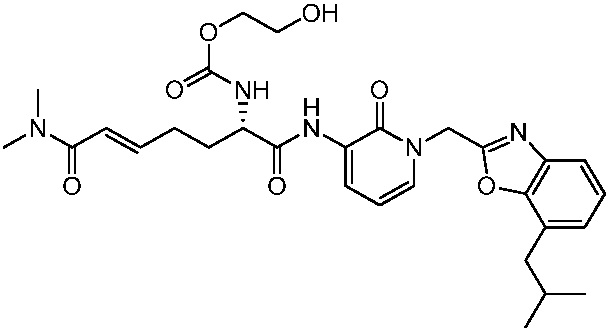
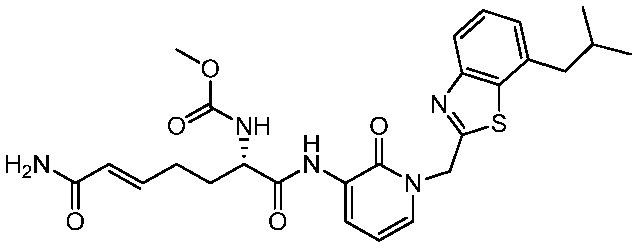


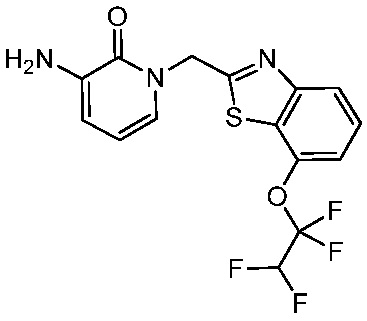













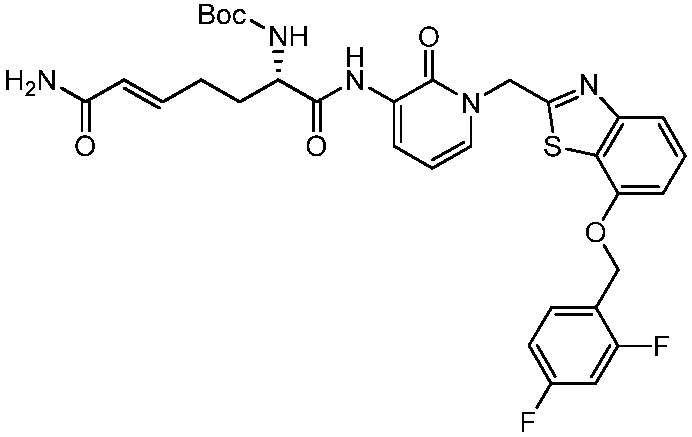








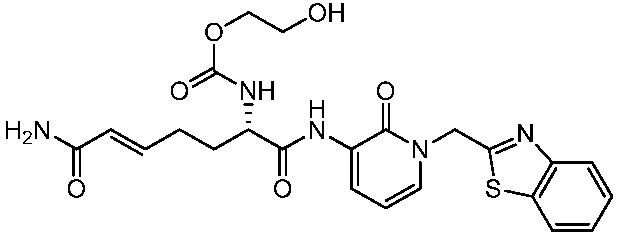

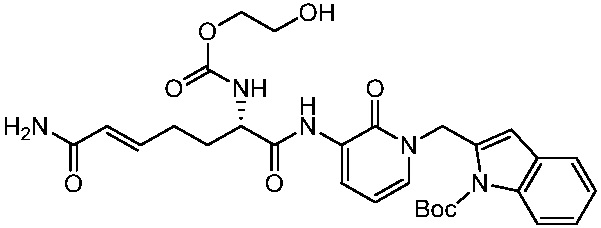
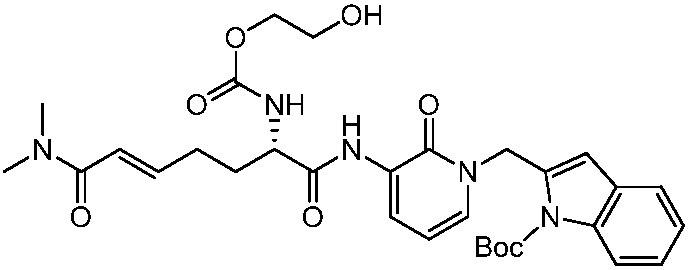




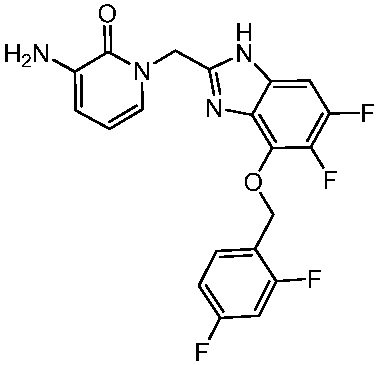




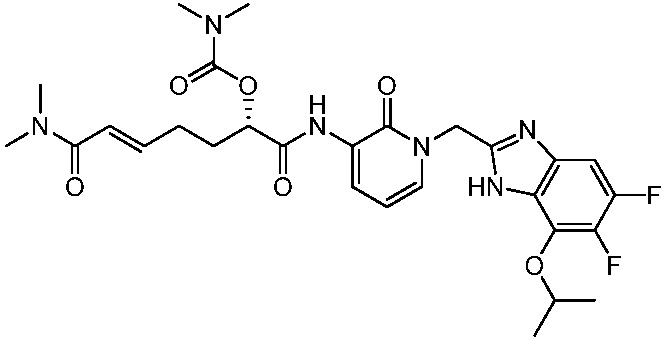





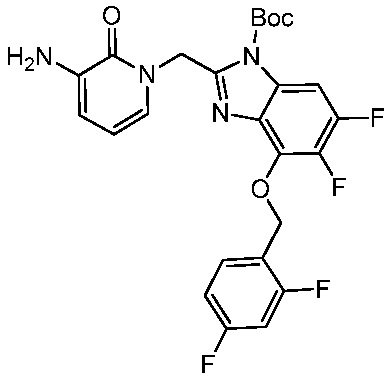




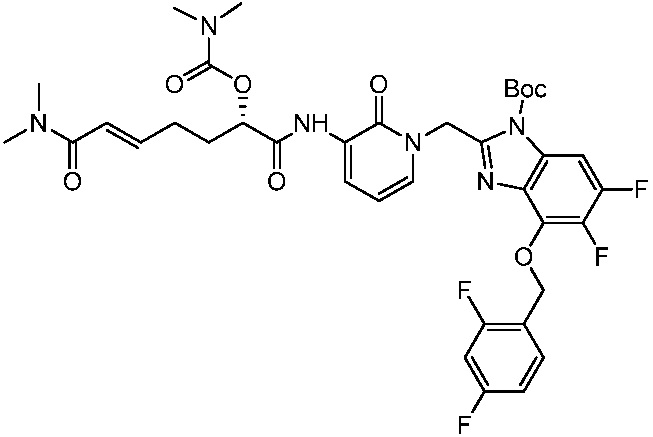


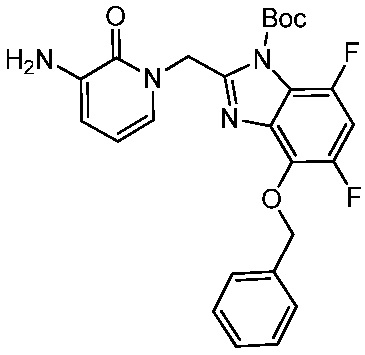


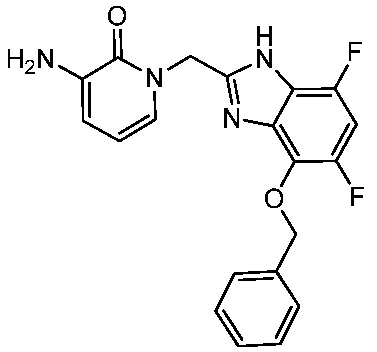

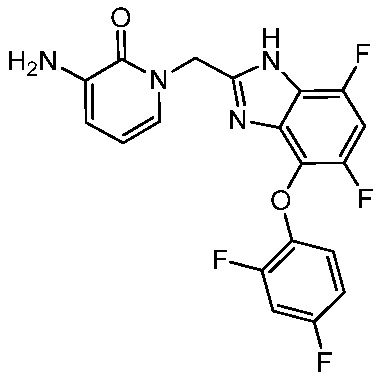












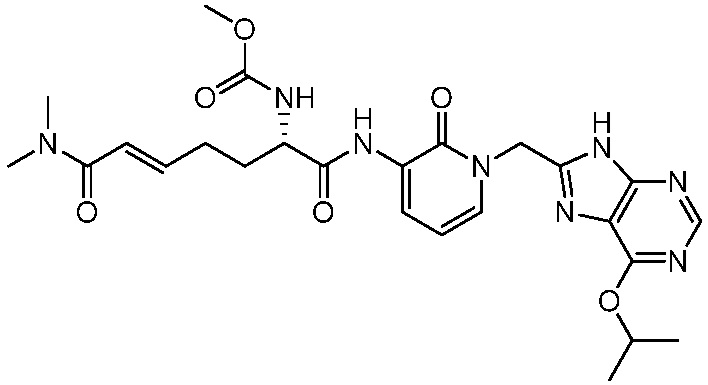


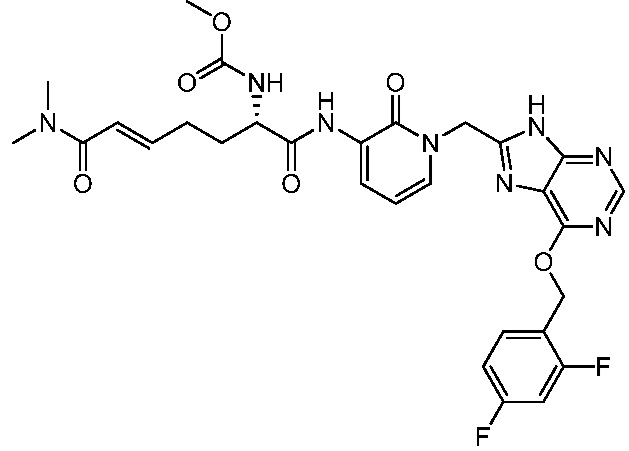








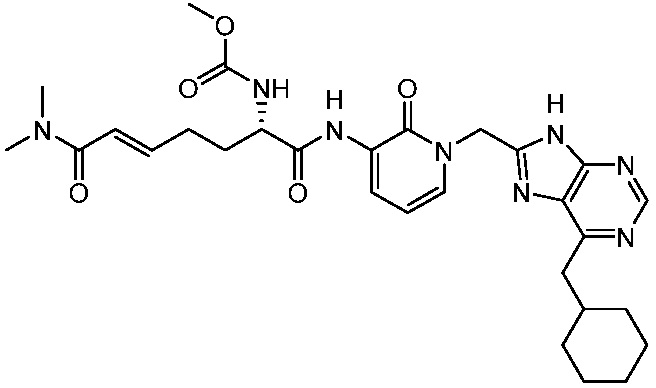



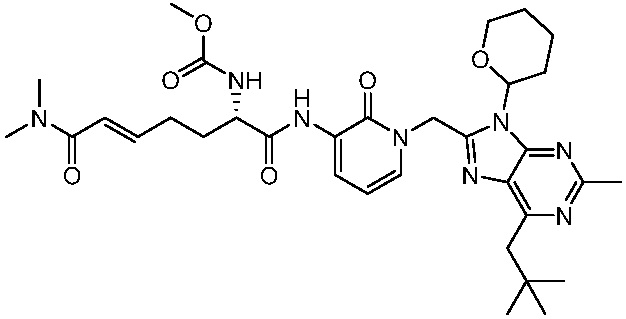






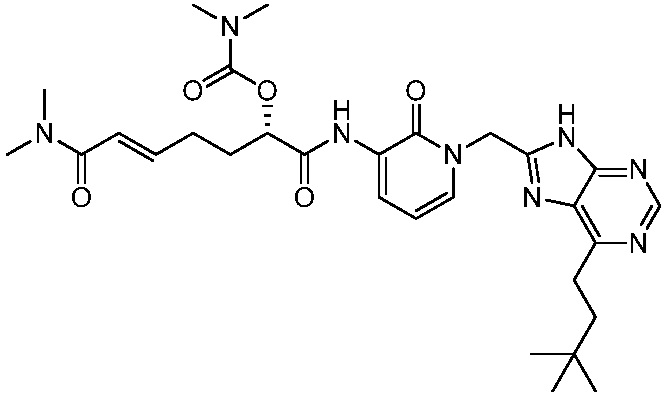
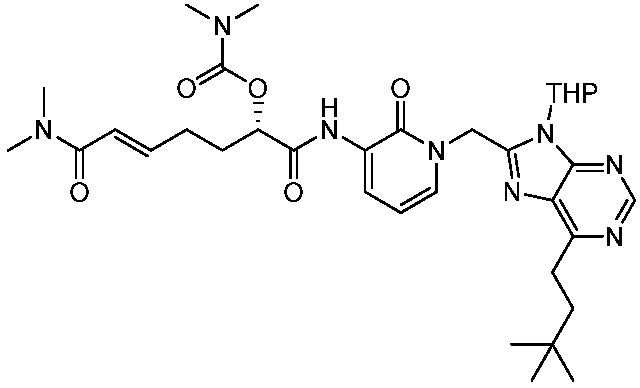





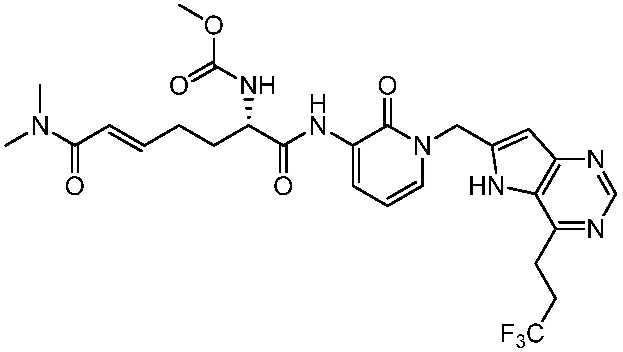






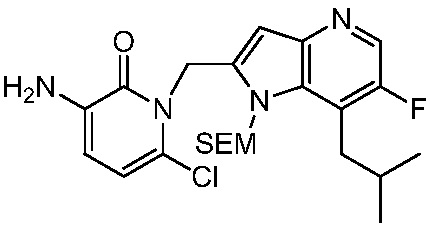




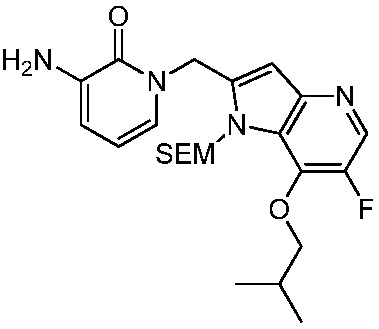







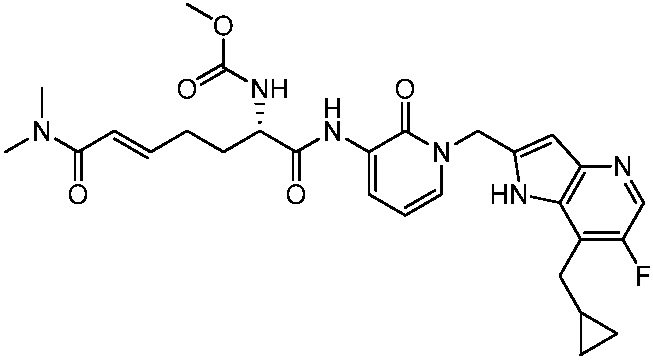
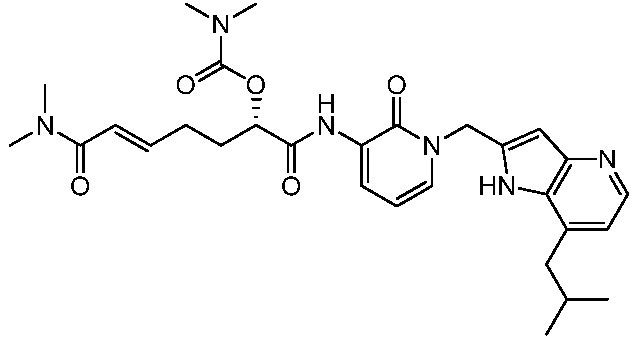
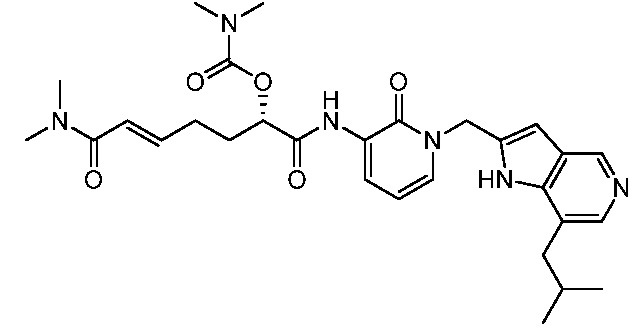



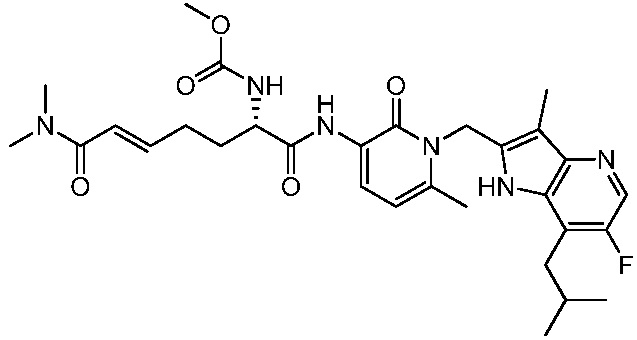









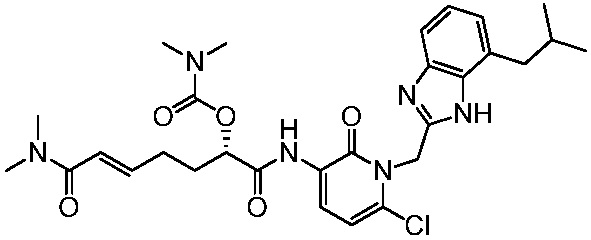
















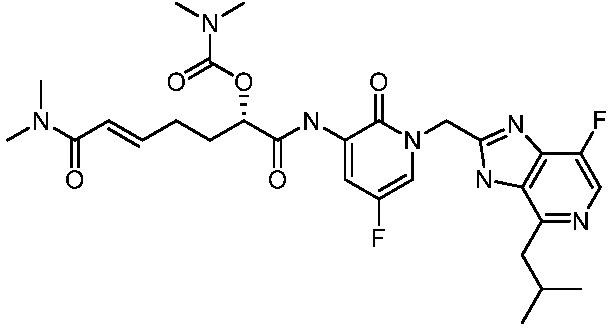
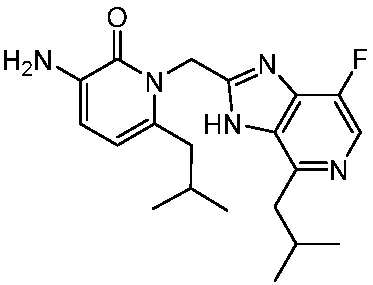




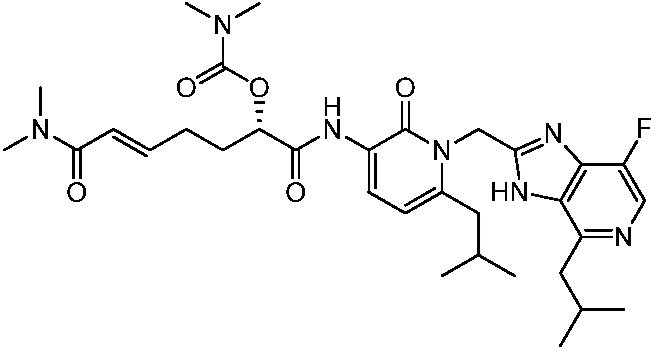

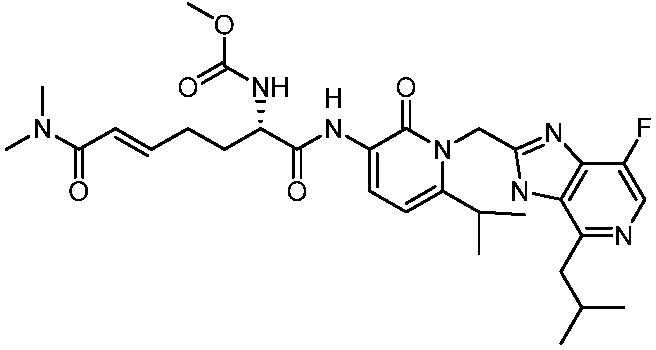

















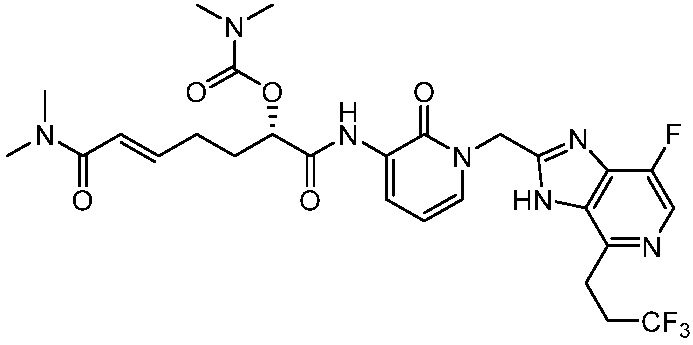


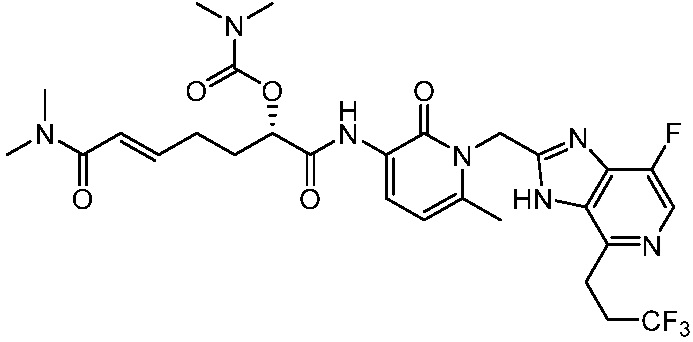
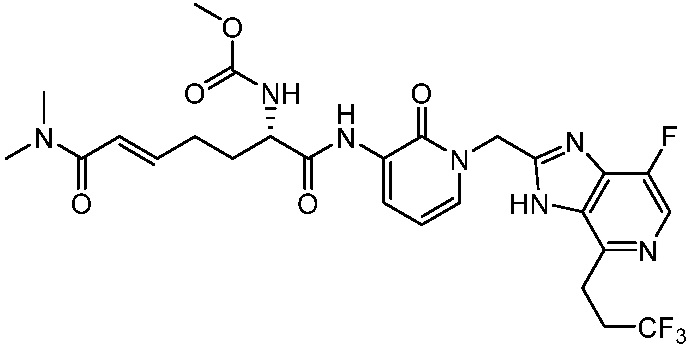





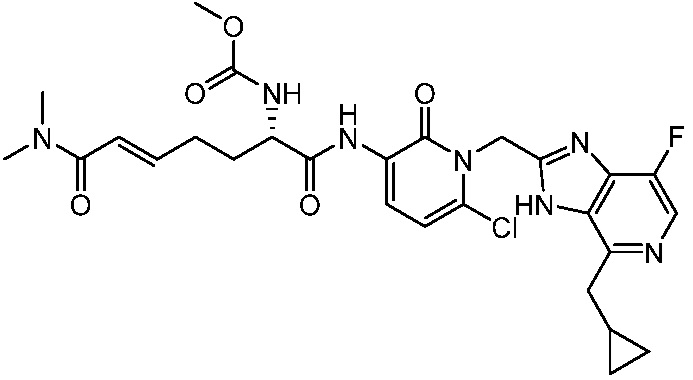



Комментарии