Соединения и композиции в качестве модуляторов пути hedgehog - RU2413718C2
Код документа: RU2413718C2
Описание
Перекрестная ссылка на родственную заявку
В настоящей заявке испрашивается приоритет в связи с предварительной заявкой US №60/797949, поданной 5 мая 2006 г. Содержание указанной заявки в полном объеме включено в настоящее описание в качестве ссылки.
Область изобретения
В настоящем изобретении предлагается способ модуляции активности сигнального пути hedgehog. Прежде всего, в настоящем изобретении предлагается способ подавления аберрантных состояний роста, опосредованных фенотипами, такими как фенотип с утраченной функцией Ptc, фенотип с приобретенной функцией hedgehog, фенотип с приобретенной функцией smoothened или фенотип с приобретенной функцией Gli, и указанный способ заключается в том, что клетка контактирует с достаточным количеством соединения формулы I.
Предпосылки создания настоящего изобретения
В ходе эмбрионального развития сигнальный путь hedgehog играет значительную роль во множестве процессов, таких как контроль пролиферации клеток, дифференциации клеток и формирования тканей. Однако аберрантная активность сигнального пути hedgehog, например, в результате повышенной активации может привести к развитию патологических состояний. В этом отношении активация пути hedgehog в тканях у взрослых субъектов приводит к развитию специфических типов рака, которые включают, без ограничения перечисленным, рак головного мозга, мышц и кожи, предстательной железы, медуллобластому, аденокарциному поджелудочной железы и мелкоклеточный рак легких. Повышенная активация сигнального пути hedgehog вносит вклад в патологию и/или симптоматологию ряда заболеваний. Соответственно, соединения, которые модулируют активность сигнального пути hedgehog, можно использовать в качестве терапевтических агентов для лечения указанных заболеваний.
Краткое изложение сущности изобретения
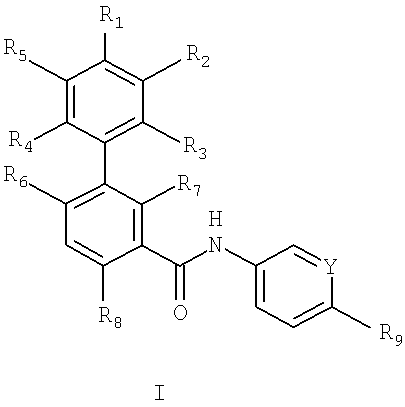
В первом объекте настоящего изобретения предлагаются соединения формулы I:
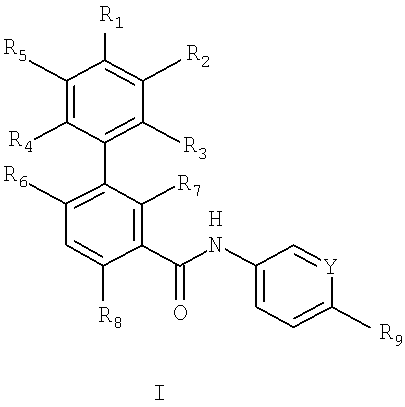
где
Y1 и Y2 независимо выбирают из N и CR10, где R10 выбирают из группы, включающей водород, галоген, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси, галоген(С1-С6)алкокси и -OXNR10aR10b, a R10a и R10b независимо выбирают из водорода и C1-С6алкила,
R1 выбирают из группы, включающей циано, галоген, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси, галоген(С1-С6)алкокси, С6-С10арил, диметиламино, C1-С6алкилсульфанил и С3-С8гетероциклоалкил, необязательно содержащий в качестве заместителей вплоть до 2 радикалов C1-С6алкил,
R2 и R5 независимо выбирают из группы, включающей водород, циано, галоген, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси, галоген(С1-С6)алкокси и диметиламино,
R3 и R4 независимо выбирают из группы, включающей водород, галоген, циано, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси и галоген(С1-С6)алкокси, или R1 и R2 или R1 и R5 вместе с фенилом, к которому они присоединены, образуют С5-С10гетероарил,
R6 и R7 независимо выбирают из группы, включающей водород, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси и галоген(С1-С6)алкокси, при условии, что R6 и R7 оба не означают водород,
R8 выбирают из группы, включающей водород, галоген, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси и галоген(С1-С6)алкокси,
R9 выбирают из -S(O)2R11, -C(O)R11, -OR11, -NR12aR12b и -R11, где R11выбирают из группы, включающей арил, гетероарил, циклоалкил и гетероциклоалкил, R12a и R12b независимо выбирают из C1-С6алкила и гидрокси(С1-С6)алкила,
при этом указанный арил, гетероарил, циклоалкил и гетероциклоалкил в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси, галоген(С1-С6)алкокси, С6-С10арил(С0-С4)алкил, С5-С10гетероарил(С0-С4)алкил, С3-С12циклоалкил и С3-С8гетероциклоалкил,
где указанный арилалкильный заместитель в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей галоген, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси, галоген(С1-С6)алкокси и метилпиперазинил,
и производные N-оксидов, пролекарств, защищенные производные, индивидуальные изомеры и смеси изомеров указанных соединений и их фармацевтически приемлемые соли и сольваты (например, гидраты).
Во втором объекте настоящего изобретения предлагается фармацевтическая композиция, которая включает соединение формулы I или производное N-оксидов, индивидуальные изомеры и смеси изомеров указанного соединения или его фармацевтически приемлемую соль в смеси с одним или более пригодными эксципиентами.
В третьем объекте настоящего изобретения предлагается способ лечения заболевания у животного, при котором модуляция активности пути hedgehog предотвращает, подавляет или ослабляет патологию и/или симптоматологию заболеваний, и указанный способ заключается в том, что животному вводят терапевтически эффективное количество соединения формулы I или его производного N-оксидов, индивидуального изомера и смеси изомеров указанного соединения или его фармацевтически приемлемой соли.
В четвертом объекте настоящего изобретения предлагается применение соединения формулы I для получения лекарственного средства, предназначенного для лечения заболевания у животного, при котором активность пути hedgehog вносит вклад в патологию и/или симптомалогию заболевания.
В пятом объекте настоящего изобретения предлагается способ получения соединений формулы I и производных N-оксидов, пролекарств, защищенных производных, индивидуальных изомеров и смесей изомеров указанных соединений, а также их фармацевтически приемлемых солей.
Определения
Термин «алкил» в отдельности или в составе других групп, например, галогеналкила и алкокси, означает радикал с прямой или разветвленной цепью. С1-С4алокси включает метокси, этокси и т.п. Галогеналкил включает трифторметил, пентафторэтил и т.п.
Термин «арил» означает моноциклическую или конденсированную бициклическую ароматическую циклическую систему, включающую от шести до десяти атомов углерода. Например, арил означает фенил или нафтил, предпочтительно фенил. Термин «арилен» означает двухвалентный радикал, полученный из арильной группы.
Термин «гетероарил» означает арил, как определено выше, где один или более атомов в цикле являются гетероатомом. Например, С5-С10гетероарил включает минимум 5 атомов, например указанное число атомов углерода, но при этом указанные атомы углерода могут быть заменены на гетероатом.
Следовательно, С5-С10гетероарил включает пиридил, индолил, индазолил, хиноксалинил, хинолинил, бензофуранил, бензопиранил, бензотиопиранил, бензо[1,3]диоксол, имидазолил, бензимидазолил, пиримидинил, фуранил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил, тиенил и т.п.
Термин «циклоалкил» означает насыщенную или частично ненасыщенную моноциклическую, конденсированную бициклическую или мостиковую полициклическую систему, включающую указанное число атомов в цикле. Например, С3-С10циклоалкил включает циклопропил, циклобутил, циклопентил, циклогексил и т.п.
Термин «гетероциклоалкил» означает циклоалкил, как определено в данном контексте, при условии, что один или более указанных атомов углерода в цикле заменены на фрагмент, выбранный из -О-, -N=, -NR-, -С(О)-, -S-, -S(O)- или -S(O)2-, где R означает водород, С1-С4алкил или азотзащитную группу. Например, С3-С8гетероциклоалкил, использованный в данном контексте для описания соединений по настоящему изобретению, включает морфолино, пирролидинил, пирролидинил-2-он, пиперазинил, пиперидинил, пиперидинилон, 1,4-диокса-8-азаспиро[4.5]дец-8-ил, тиоморфолино, сульфаноморфолино, сульфономорфолино и т.п.
Термин «галоген» предпочтительно означает хлор или фтор, но означает также бром или иод.
Термин «с приобретенной функцией hedgehog» означает аберрантную модификацию или мутацию гена Ptc, гена hedgehog или гена smoothened, или снижение (или отсутствие) уровня экспрессии указанного гена, что приводит к возникновению фенотипа, т.е. к явлению, которое обычно происходит после контактирования клетки с белком hedgehog, например к аберрантной активации пути hedgehog. Термин «приобретенная функция» означает неспособность образующегося гена Ptc регулировать уровень экспрессии генов Gli, например Gli1, Gli2 и Gli3. Термин «с приобретенной функцией hedgehog», использованный в данном контексте, также означает любой аналогичный клеточный фенотип (например, проявляющий избыточную пролиферацию), который возникает из-за изменения в любом участке пути передачи сигнала hedgehog, включая, без ограничения перечисленным, модификацию или мутацию самого гена hedgehog. Например, опухолевая клетка с аномально высокой скоростью пролиферации, обусловленной активацией сигнального пути hedgehog, характеризуется фенотипом «с приобретенной функцией hedgehog», даже если ген hedgehog в указанной клетке находится в немутированной форме.
Термин «утраченная функция patched» означает аберрантную модификацию или мутацию гена Ptc или снижение уровня экспрессии указанного гена, что приводит к возникновению фенотипа, т.е. к явлению, которое обычно происходит после контактирования клетки с белком hedgehog, например к аберрантной активации пути hedgehog. Термин «утраченная функция» означает неспособность образующегося гена Ptc регулировать уровень экспрессии генов Gli, например Gli1, Gli2 и Gli3.
Термин «с приобретенной функцией Gli» означает аберрантную модификацию или мутацию гена Gli или повышение уровня экспрессии указанного гена, что приводит к возникновению фенотипа, т.е. к явлению, которое обычно происходит после контактирования клетки с белком hedgehog, например к аберрантной активации пути hedgehog.
Термин «с приобретенной функцией smoothened» означает аберрантную модификацию или мутацию гена Smo или увеличение экспрессии указанного гена, что приводит к возникновению фенотипа, т.е. к явлению, которое обычно происходит после контактирования клетки с белком hedgehog, например к аберрантной активации пути hedgehog.
Термин «лечение» означает способ подавления или снижения интенсивности заболевания и/или сопутствующих симптомов.
Настоящее изобретение относится также к открытию, то есть предлагается способ модуляции путей передачи сигналов, регулируемых генами hedgehog, patched (Ptc), Gli и/или smoothened, в присутствии соединений формулы I.
Описание предпочтительных вариантов осуществления изобретения
В одном варианте в соединениях формулы I Y1 и Y2 выбирают из N и CR10, где R10 выбирают из группы, включающей водород, метил, фтор, хлор, бром, диметиламиноэтокси и трифторметил, R6 и R7 независимо выбирают из группы, включающей водород, метил, хлор, фтор, бром, трифторметил и метокси, при условии, что R6 и R7 оба не означают водород, a R8 выбирают из группы, включающей водород, фтор, хлор, метил и трифторметил.
В другом варианте R1 выбирают из группы, включающей циано, хлор, фтор, метил, этил, трет-бутил, пропил, изобутил, изопропил, изопропилокси, бутокси, метокси, диметиламино, этокси, метилсульфанил, фенил, трифторметил, трифторметокси и пиперазинил, необязательно содержащий в качестве заместителей вплоть до 2 радикалов метил, R2 и R5 независимо выбирают из группы, включающей водород, хлор, фтор, циано, метил, трифторметил, изопропилокси, метокси, этокси, трифторметокси и диметиламино, a R3 и R4 независимо выбирают из группы, включающей водород, хлор, метил, метокси и циано, или R1 и R2 или R1 и R5 вместе с фенилом, к которому они присоединены, образуют хиноксалинил.
В еще одном варианте R9 выбирают из группы, включающей -S(O)2R11, -OR11, -C(O)R11, -NR12aR12b и -R11, где R11 выбирают из группы, включающей тиоморфолино, сульфономорфолино, сульфаноморфолино, морфолино, циклогексил, фенил, азепан-1-ил, 2-оксопиперазин-1-ил, 1,4-оксазепан-4-ил, пиперидин-1-ил, тетрагидро-2Н-пиран-4-ил, пиперидин-3-ил, пиперазинил, пирролидинил и 1,4-диазепан-1-ил, R12a и R12b независимо выбирают из изобутила и гидроксиэтила, где указанный тиоморфолино, сульфономорфолино, сульфаноморфолино, морфолино, циклогексил, фенил, азепан-1-ил, 2-оксопиперазин-1-ил, 1,4-оксазепан-4-ил, пиперидин-1-ил, тетрагидро-2Н-пиран-4-ил, пиперидин-3-ил, пиперазинил, пирролидинил или 1,4-диазепан-1-ил в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей метил, этил, метокси, бензил, тиенилметил, пиридинилметил, бензо[d][1,3]диоксол-6-ил и 2,3-дигидробензо[b][1,4]диоксин-7-ил, где указанный фенильный или бензильный заместитель R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей метокси, этокси, метилпиперазинил, метил, трифторметокси, хлор, фтор и трифторметил.
Предпочтительные соединения формулы I выбирают из группы, включающей [4-(морфолин-4-сульфонил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-циано-2-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-метокси-2-метилбифенил-3-карбоновой кислоты, (4-циклогексилфенил)амид 4'-метокси-2-метилбифенил-3-карбоновой кислоты, [6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-метокси-2-метилбифенил-3-карбоновой кислоты, (4-циклогексилфенил)амид 4'-диметиламино-2-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 4'-диметиламино-2-метилбифенил-3-карбоновой кислоты, (6-[1,4]оксазепан-4-илпиридин-3-ил)амид 6-хлор-4'-диметиламинобифенил-3-карбоновой кислоты, (6-морфолин-4-илпиридин-3-ил)амид 6-хлор-4'-диметиламинобифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-хлор-4'-диметиламинобифенил-3-карбоновой кислоты, [6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 6-хлор-4'-метоксибифенил-3-карбоновой кислоты, (6-[1,4]оксазепан-4-илпиридин-3-ил)амид 6-хлор-4'-метоксибифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-хлор-4'-метоксибифенил-3-карбоновой кислоты, (6-морфолин-4-илпиридин-3-ил)амид 6-хлор-4'-метоксибифенил-3-карбоновой кислоты, (6-морфолин-4-илпиридин-3-ил)амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты, (6-[1,4]оксазепан-4-илпиридин-3-ил)амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты, [6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты, [6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-диметиламино-6-метилбифенил-3-карбоновой кислоты, (6-[1,4]оксазепан-4-илпиридин-3-ил)амид 4'-диметиламино-6-метилбифенил-3-карбоновой кислоты, (6-морфолин-4-илпиридин-3-ил)амид 4'-диметиламино-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-этокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3 -ил)амид 6-метил-4'-метилсульфанилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-диметиламино-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-метил[1,1';4',1'']терфенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 3'-хлор-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 2',4'-дихлор-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 2'-хлор-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 3'-хлор-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 3',4'-дихлор-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 3'-хлор-6-метил-4'-трифторметилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6,4'-диметилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-этил-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-трет-бутил-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-метил-4'-пропилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-изобутил-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-изопропил-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6,2',6'-триметилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6,2',3'-триметилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-метил-4'-трифторметилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-метил-3'-трифторметибифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-метил-3',5'-бис-трифторметилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 3'-изопропокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 3'-этокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 2',6'-диметокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 6-метил-3'-трифторметоксибифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 3'-метокси-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 4'-(2-диметиламиноэтокси)-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 3'-диметиламино-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 4'-фтор-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 3'-фтор-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 2'-фтор-6-метилбифенил-3-карбоновой кислоты, 4-метил-N-(4-морфолин-4-илфенил)-3-хиноксалин-6-илбензамид, (4-морфолин-4-илфенил)амид 6-метил-4'-(4-метилпиперазин-1-ил)бифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 2'-циано-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 3'-циано-6-метилбифенил-3-карбоновой кислоты, (6-[1,4]оксазепан-4-илпиридин-3-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (6-морфолин-4-илпиридиа-3-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-метилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (3-фтор-4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (3-хлор-4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (3-бром-4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (3-метил-4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (4-морфолин-4-ил-3-трифторметилфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (4-циклогексилфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, бифенил-4-иламид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (4'-метоксибифенил-4-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [4-(4-бензилпиперазин-1-ил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [4-(пирролидин-1-сульфонил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-циано-6-метоксибифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-циано-2-метоксибифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-циано-2-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 3'-фтор-4'-метокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-изопропокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-бутокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 3'-хлор-4'-метокси-6-метилбифенил-3-карбоновой кислоты, (6-азепан-1-илпиридин-3-ил)амид 4'-метокси-6,3'-диметилбифенил-3-карбоновой кислоты, [4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-2-метилбифенил-3-карбоновой кислоты, [4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-6-фторбифенил-3-карбоновой кислоты, [4-(пиперидин-1-сульфонил)фенил]амид 6-бром-4'-цианобифенил-3-карбоновой кислоты, [6-(4-бензил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-тиофен-3-илметил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-2-метилбифенил-3-карбоновой кислоты, [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-метокси-2-метилбифенил-3-карбоновой кислоты, [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметилбифенил-3-карбоновой кислоты, [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, [6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-2-метилбифенил-3-карбоновой кислоты, [4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-2-фторбифенил-3-карбоновой кислоты, [4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-6-трифторметилбифенил-3-карбоновой кислоты, [6-(4-пиридин-4-илметил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-пиридин-3-илметил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2,6-диметоксибензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2-этоксибензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (6-{4-[2-(4-метилпиперазин-1-ил)бензил][1,4]диазепан-1-ил}пиридин-3-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(4-метокси-2,3-диметилбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2,3-дигидробензо[1,4] диоксин-6-илметил)[1,4] диазепан-1-ил]пиридин-3-ил} амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-пиридин-2-илметил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-бензо[1,3]диоксол-4-илметил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2-трифторметоксибензил)[1,4] диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2-диметиламинобензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2-хлор-5-трифторметилбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2,3-дифторбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2-хлор-4-фторбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2,6-дифторбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [4-(пиперидин-1-сульфонил)фенил]амид 2-хлор-4'-цианобифенил-3-карбоновой кислоты, [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-трифторметилбифенил-3-карбоновой кислоты, [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-хлор-4'-цианобифенил-3-карбоновой кислоты, [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-этилбифенил-3-карбоновой кислоты, {6-[4-(3-фторбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(2-трифторметоксибензил)пиперазин-1-ил]пиридин-3-ил} амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(3-хлорбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(4-изобутилбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(4-трет-бутилбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(7-метоксибензо[1,3]диоксол-5-илметил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-бензилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-пиридин-3-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(4-дифторметоксибензил)пиперазин-1 -ил] пиридин-3-ил} амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(4-цианобензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-хинолин-5-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-пиридин-4-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-пиридин-2-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(4-имидазол-1-илбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, {6-[4-(3-цианобензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, [6-(4-изохинолин-5-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (R)-2-метил-N-(6-(2-метилморфолино)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид, 4'-циано-2-метил-N-(6-сульфонилморфолинопиридин-3-ил)бифенил-3-карбоксамид, (S)-4'-циано-2-метил-N-(6-(2-метилморфолино)пиридин-3-ил)бифенил-3-карбоксамид, (R)-6-хлор-N-(6-(2-метилморфолино)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид, 4'-циано-2-метил-N-(6-сульфинилморфолинопиридин-3-ил)бифенил-3-карбоксамид, 4'-циано-N-(6-(диизобутиламино)пиридин-3-ил)-2-метилбифенил-3-карбоксамид, 4'-циано-N-(2-((2S,6R)-2,6-диметилморфолино)пиримидин-5-ил)-2-метилбифенил-3-карбоксамид, N-(2-((2S,6R)-2,6-диметилморфолино)пиримидин-5-ил)-2-метил-4'-(трифторметил)бифенил-3-карбоксамид, N-(2-((2S,6R)-2,6-диметилморфолино)пиримидин-5-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид, N-(2-(бис(2-гидроксиэтил)амино)пиримидин-5-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид, 2-метил-N-(6-(тетрагидро-2Н-пиран-4-илокси)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид, N-(5-хлор-6-((2S,6R)-2,6-диметилморфолино)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид, N-(6-((2R,6S)-2,6-диметилтетрагидро-2Н-пиран-4-ил)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид, N-(6-(4-этилпиперазин-1-карбонил)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид, 2-метил-N-(6-(2-оксопиперазин-1-ил)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид, 2-метил-N-(6-(1-(пиридин-4-илметил)пиперидин-4-ил)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид, 2-метил-N-(6-(2-оксо-4-(пиридин-4-илметил)пиперазин-1-ил)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид, 2-метил-R-(6-(1-(пиридин-4-илметил)пиперидин-3-ил)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид, N-(6-(1-этилпиперидин-3-ил)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид и N-(6-((2R,6S)-2,6-диметилморфолино)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид.
Следовательно, следует специально отметить, что соединения формулы I, которые влияют на активность пути передачи сигнала hedgehog, Ptc или smoothened, аналогичным образом могут ингибировать пролиферацию (или другие биологические явления) в нормальных клетках и/или клетках, содержащих фенотип с утраченной функцией patched, фенотип с приобретенной функцией hedgehog, фенотип с приобретенной функцией smoothened или фенотип с приобретенной функцией Gli. В связи с этим в определенных вариантах осуществления настоящего изобретения указанные соединения можно использовать для ингибирования активности hedgehog в нормальных клетках, в которых, например, не происходит генетической мутации, активирующей путь hedgehog. В предпочтительных вариантах соединения ингибируют, по крайней мере, некоторые типы биологической активности белков hedgehog, т.е. предпочтительно проявляют специфичность в клетках-мишенях.
В связи с этим способы по настоящему изобретению включают применение соединений формулы I, которые проявляют агонистическую активность в отношении ингибирования Ptc в сигнальных путях hedgehog, например, за счет ингибирования активации компонентов smoothened или следующих компонентов каскада сигнального пути hedgehog при регуляции регенерации и/или функциональной эффективности множества типов клеток, тканей и органов, включая нормальные клетки, ткани и органы, а также клетки, ткани и органы, содержащие фенотип с утраченной функцией Ptc, фенотип с приобретенной функцией hedgehog, фенотип с приобретенной функцией smoothened или фенотип с приобретенной функцией Gli. Например, способ-объект по настоящему изобретению можно использовать в лечебных и косметических целях, которые включают регуляцию формирования и наращивания нервных, костных и хрящевых тканей, регуляцию сперматогенеза, регуляцию гладких мышц, регуляцию легких, печени и других органов, происходящих из архэнтерона, регуляцию кроветворной функции, регуляцию роста кожи и волос и т.п. Кроме того, способы-объекты можно осуществлять с использованием культур клеток in vitro или животных клеток в организме (in vivo).
В другом варианте способ-объект по настоящему изобретению заключается в том, что обрабатывают эпителиальные клетки, содержащие фенотип с утраченной функцией Ptc, фенотип с приобретенной функцией hedgehog, фенотип с приобретенной функцией smoothened или фенотип с приобретенной функцией Gli. Например, способ заключается в том, что проводят лечение или профилактику базально-клеточного рака или других нарушений, связанных с путем hedgehog.
В некоторых вариантах соединение формулы I ингибирует активацию пути hedgehog за счет связывания с белком smoothened или со следующими белками каскада сигнального пути hedgehog. В некоторых вариантах исследуемый антагонист ингибирует активацию пути hedgehog за счет связывания с белком patched.
В другом предпочтительном варианте способ-объект можно использовать для лечения злокачественной медуллобластомы и других первичных злокачественных нейроэктодермальных опухолей ЦНС в качестве одного из курсов лечения.
В другом объекте настоящего изобретения предлагаются фармацевтические препараты, включающие в качестве активного ингредиента модулятор сигнального пути hedgehog, такой как соединение формулы I, агонист Ptc, антагонист smoothened или антагонист следующих белков каскада сигнального пути hedgehog, как описано в данном контексте, в количестве, достаточном для ингибирования in vivo пролиферации или других биологических явлений, связанных с фенотипом с утраченной функцией Ptc, фенотипом с приобретенной функцией hedgehog, фенотипом с приобретенной функцией smoothened или фенотипом с приобретенной функцией Gli.
Заявленные способы лечения с использованием соединения формулы I, агонистов patched, антагонистов smoothened или антагонистов следующих компонентов каскада сигнального пути hedgehog являются эффективными в отношении человека и животных. Животные, которых можно лечить способами по настоящему изобретению, включают домашних и сельскохозяйственных животных. Примеры включают собак, кошек, крупный рогатый скот, лошадей, овец, свиней и коз.
Фармакология и промышленная применимость
В настоящем изобретении предлагаются способы и соединения, предназначенные для ингибирования активации сигнального пути hedgehog, например, для подавления аберрантных состояний роста, связанных с фенотипами, такими как фенотип с утраченной функцией Ptc, фенотип с приобретенной функцией hedgehog, фенотип с приобретенной функцией smoothened или фенотип с приобретенной функцией Gli, и указанные способы заключаются в том, что клетка контактирует с количеством соединения формулы I, достаточным для агонистического действия в отношении нормальной активности Ptc, антагонистического действия в отношении нормальной активности hedgehog, активности smoothened или активности Gli, например, для полного обращения или контроля аберрантного состояния роста.
Члены семейства молекул передачи сигнала Hedgehog опосредуют множество важных краткосрочных и долгосрочных процессов формирования тканей и органов в развитии позвоночных. Формирование тканей и органов связано с активностью, которая способствует развитию упорядоченных в пространстве структур дифференцированных тканей из эмбриональных клеток. Сложные физические высшие организмы развиваются в ходе эмбриогенеза в процессе взаимодействия последовательности клеточных поколений с внеклеточными сигналами. Индукционные взаимодействия играют важную роль в процессе формирования тканей при развитии позвоночных, начиная с ранней стадии формирования схемы организма до формирования системы органов, образования различных типов клеток в ходе дифференциации тканей. Влияние взаимодействий развивающихся клеток изменяется: реагирующие клетки переключаются от одного пути клеточной дифференциации на другой путь за счет индукции клеток, состояние которых отличается от неиндуцированного и индуцированного состояний реагирующих клеток (стадии индукции). В некоторых случаях клетки индуцируют дифференциацию соседних клеток, аналогичную собственной дифференциации (гомеогенетическая индукция), в других случаях клетка ингибирует дифференциацию соседних клеток, аналогичную своей собственной. Взаимодействия клеток на ранних стадиях развития могут быть последовательными, например, исходная индукция между двумя клеточными типами приводит к прогрессивной амплификации разновидности. Кроме того, индукционные взаимодействия происходят не только в эмбрионах, но и в клетках взрослых субъектов и могут способствовать развитию и поддерживанию морфогенетических типов, а также индуцировать дифференциацию.
Семейство генов hedgehog позвоночных включает три известных гена млекопитающих: гены Desert (Dhh) hedgehog, Sonic (Shh) hedgehog и Indian (Ihh) hedgehog, кодирующие секретируемые белки. Указанные различные белки hedgehog состоят из сигнального пептида, высоко консервативного N-концевого домена и более вариабельного С-концевого домена. Биохимические испытания свидетельствуют о том, что аутопротеолитическое расщепление белка-предшественника hedgehog происходит при образовании промежуточного внутреннего тиоэфира, который затем расщепляется при нуклеофильном замещении. Предполагают, что нуклеофилом является низкомолекулярная липофильная молекула, которая образует ковалентную связь с С-концевым фрагментом N-пептида и присоединяет его к поверхности клетки, что приводит к значительным биологическим последствиям. В результате указанного присоединения к поверхности клеток, продуцирующих hedgehog, повышается локальная концентрация N-концевого пептида hedgehog, которая является необходимой и достаточной для краткосрочной и долгосрочной активности сигнального пути hedgehog.
Инактивация сигнального пути hedgehog происходит, если рецептор трансмембранного белка Patched (Ptc) ингибирует активность белка Smoothened (Smo), седьмого трансмембранного белка. Проникновение фактора транскрипции Gli, следующего компонента каскада сигнального пути hedgehog, в ядро предотвращается за счет взаимодействий с цитоплазматическими белками, включая гибридный белок и супрессор гибридного белка (Sufu). В результате подавляется транскрипционная активация генов-мишеней hedgehog. Активация пути инициируется при связывании с белком Ptc любого из трех лигандов млекопитающих (Dhh, Shh или Ihh). Связывание лиганда приводит к обращению подавления Smo, при этом активируется каскад реакций, приводящий к перемещению активной формы транскрипционного фактора Gli в ядро. Ядерный Gli активирует экспрессию генов-мишеней, включая гены Ptc и Gli.
Повышенные уровни передачи сигнала hedgehog являются достаточными для инициирования развития рака и являются необходимыми для выживания опухоли. Указанные раковые заболевания включают, без ограничения перечисленным, рак предстательной железы (Karhadkar S. S., Bova G. S., Abdallah N., Dhara S., Gardner D., Maitra A., Isaacs J. Т., Berman D. M., Beachy P. A., «Hedgehog signalling in prostate regeneration, neoplasia and metastasis», Nature, 431 (7009), cc. 707-712 (7 октября 2004); Sanchez P., Hernandez A. M., Stecca В., Kahler A. J., DeGueme A. M., Barrett A., Beyna M., Datta M. W., Datta S., Ruiz i Altaba A., «Inhibition of prostate cancer proliferation by interference with SONIC HEDGEHOG-GLI1 signaling», Proc. Natl. Acad. Sci USA, 101 (34), cc. 12561-12566 (24 августа 2004)), рак молочной железы (Kubo М., Nakamura М., Tasaki А., Yamanaka N., Nakashima H., Nomura M., Kuroki S., Katano M., «Hedgehog signaling pathway is a new therapeutic target for patients with breast саnсеr», Cancer Res., 64 (17), cc. 6071-6074 (1 сентября 2004)), медуллобластому (Berman D. M., Karhadkar S. S., Hallahan A. R., Pritchard J. I., Eberhart C. G., Watkins D. N., Chen J. K., Cooper M. K., Taipale J., Olson J. M., Beachy P. A., «Medulloblastoma growth inhibition by hedgehog pathway blockade», Science, 297 (5586), 1559-1561 (30 августа 2002)), базально-клеточный рак (Williams J. A., Guicherit О. M, Zaharian В. I., Xu Y., Chai L., Wichterle H., Коn C., Gatchalian C., Porter J. A., Rubin L. L., Wang F.Y., «Identification of a small molecule inhibitor of the hedgehog signaling pathway: effects on basal cell carcinoma-like lesions», Proc. Natl. Acad. Sci USA, 100 (8), cc. 4616-4621 (15 апреля 2003); Xie J., Murone M., Luoh S. M., Ryan A., Gu Q., Zhang C., Bonifas J. M., Lam C. W., Hynes M., Goddard A., Rosenthal A., Epstein E. H. Jr, de Sauvage F. J., «Activating Smoothened mutations in sporadic basal-cell carcinoma», Nature, 391 (6662), cc. 90-92 (1 января 1998)), рак поджелудочной железы (Thayer S. P., di Magliano M. P., Heiser P. W., Nielsen C. M., Roberts D. J., Lauwers G. Y., Qi Y. P., Gysin S., Fernandez-del Castillo C., Yajnik V., Antoniu В., McMahon M., Warshaw A. L., Hebrok M., «Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis», Nature, 425 (6960), cc. 851-856 (23 октября 2003); Berman D. M., Karhadkar S. S., Maitra A., Montes De Oca R., Gerstenblith M. R., Briggs K., Parker A. R., Shimada Y., Eshleman J. R., Watkins D. N., Beachy P. A., «Widespread requirement for Hedgehog ligand stimulation in growth of digestive tract tumours», Nature, 425 (6960), cc. 846-851 (23 октября 2003)) и мелкоклеточный рак легких (Watkins D. N., Berman D. M., Burkholder S. G., Wang В., Beachy P. A., Baylin S. В., «Hedgehog signalling within airway epithelial progenitors and in small-cell lung cancer» Nature, 422 (6929), cc. 313-317(20 марта 2003)).
В соответствии с вышеуказанным в настоящем изобретении, кроме того, предлагается способ профилактики или лечения любых описанных выше заболеваний или нарушений у субъекта, нуждающегося в таком лечении, и указанный способ заключается в том, что указанному субъекту вводят терапевтически эффективное количество (см. раздел «Введение и фармацевтические композиции» ниже) соединения формулы I или его фармацевтически приемлемой соли. Для любого указанного выше применения требуемую дозировку изменяют в зависимости от способа введения, конкретного состояния, подлежащего лечению, и требуемого действия.
Введение и фармацевтические композиции
В основном соединения по настоящему изобретению вводят в терапевтически эффективных количествах любыми известными стандартными и пригодными способами, в отдельности или в комбинации с одним или более терапевтических агентов. Терапевтически эффективное количество изменяется в широких пределах в зависимости от тяжести заболевания, возраста и индивидуального состояния здоровья субъекта, эффективности используемого соединения и других факторов. В основном установлено, что удовлетворительные результаты получают при систематическом введении суточных доз от приблизительно 0,03 до 2,5 мг/кг массы тела. Указанная суточная доза для крупного млекопитающего, например человека, составляет величину в диапазоне от приблизительно 0,5 мг до приблизительно 100 мг, которую обычно вводят, например, в виде разделенных доз вплоть до четырех раз в сутки или в форме с замедленным высвобождением. Пригодные стандартные лекарственные формы для перорального введения включают от приблизительно 1 до 50 мг активного ингредиента.
Соединения по настоящему изобретению вводят в виде фармацевтических композиций любым стандартным способом, прежде всего энтеральным, например, перорально, например, в форме таблеток или капсул, или парентеральным способом, например, в форме растворов или суспензий для инъекций, местным способом, например, в форме лосьонов, гелей, мазей или кремов, или в назальной форме или в форме суппозиториев. Фармацевтические композиции, включающие соединение по настоящему изобретению в свободной форме или в форме фармацевтически приемлемой соли в смеси, по крайней мере, с одним фармацевтически приемлемым носителем или разбавителем, получают стандартным способом смешивания, грануляции или нанесения покрытий. Например, пероральные композиции получают в виде таблеток или желатиновых капсул, включающих активный ингредиент в смеси а) с разбавителями, например лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза и/или глицин, б) с замасливателями, например диоксид кремния, тальк, стеариновая кислота, стеарат магния или кальция и/или полиэтиленгликоль, в случае таблеток также наряду в) со связующими, например алюмосиликат магния, крахмальная паста, желатин, трагакант, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон, при необходимости г) с дезинтегрирующими агентами, например крахмалы, агар, альгиновая кислота или альгинат натрия, или шипучие смеси и/или д) с абсорбентами, красителями, ароматизаторами и подсластителями. Композиции для инъекций включают водные изотонические растворы или суспензии, а суппозитории получают из эмульсий или суспензий жиров. Композиции стерилизуют и/или они включают адъюванты, такие как консерванты, стабилизирующие, смачивающие или эмульгирующие агенты, агенты для повышения растворимости, соли для регулирования осмотического давления и/или буферные вещества. Кроме того, указанные композиции включают также другие терапевтически ценные соединения. Пригодные составы для чрескожного применения включают эффективное количество соединения по настоящему изобретению в смеси с носителем. Носитель содержит абсорбируемые фармакологически приемлемые растворители, увеличивающие проницаемость через кожу хозяина. Например, устройство для чрескожной доставки представлено в форме повязки, включающей защитный слой, резервуар, содержащий соединение необязательно в смеси с носителями, необязательно слой, контролирующий скорость доставки соединения на кожу хозяина с контролируемой и определенной скоростью в течение длительного периода времени, а также слой для приклеивания устройства к коже. Можно также использовать матричные чрескожные составы. Пригодные составы для местного применения, например на кожу и в глаза, предпочтительно включают известные водные растворы, мази, кремы или гели. Указанные составы включают солюбилизаторы, стабилизаторы, агенты для повышения тоничности, буферные вещества и консерванты.
Соединения по настоящему изобретению можно вводить в терапевтически эффективных количествах в комбинации с одним или более терапевтическими агентами (фармацевтические комбинации). Например, синергетическое действие достигается в смеси с иммуномодулирующими или противовоспалительными соединениями или другими противоопухолевыми терапевтическими агентами. Если соединения по настоящему изобретению вводят наряду с другими лекарственными средствами, дозировки совместно вводимых соединений изменяют в зависимости от типа совместно применяемого лекарственного средства, специфичности действия применяемого лекарственного средства, состояния, подлежащего лечению и т.п.
В настоящем изобретении предлагаются также фармацевтические комбинации, например набор, включающий а) первый агент, который означает соединение по настоящему изобретению, как описано в данном контексте, в свободной форме или в форме фармацевтически приемлемой соли и б) по крайней мере, один совместный агент. Набор включает инструкции по введению.
Использованные в данном контексте термины «совместное введение» или «комбинированное введение» или т.п. означают введение выбранных терапевтических агентов одному пациенту и включают курсы лечения, при которых агенты необязательно вводят одним и тем же способом введения или в одно и то же время.
Использованный в данном контексте термин «фармацевтическая комбинация» означает продукт, который получают в результате смешивания или комбинирования более одного активного ингредиента, и включает фиксированные и нефиксированные комбинации активных ингредиентов. Термин «фиксированная комбинация» означает, что активные ингредиенты, например соединение формулы I и совместный агент, вводят пациенту одновременно в виде одной формы или дозировки. Термин «нефиксированная комбинация» означает, что активные ингредиенты, например соединение формулы I и совместный агент, вводят пациенту в виде отдельных форм совместно, одновременно или последовательно без специальных временных ограничений, и указанное введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее относится также к комбинированному лечению, например введению трех или более активных ингредиентов.
Способы получения соединений по настоящему изобретению
Настоящее изобретение включает также способы получения соединений по настоящему изобретению. В описанных реакциях необходимо защищать реакционно-способные функциональные группы, например группы гидрокси, амино, имино, тио или карбокси, если присутствие указанных групп требуется в конечном продукте, для того чтобы исключить нежелательное участие указанных групп в реакциях. Стандартные защитные группы используют в соответствии со стандартной практикой, например, см. книгу Greene Т. W. и Wuts P. G. М., «Protective Groups in Organic Chemistry», John Wiley and Sons (1991).
Соединения формулы I получают по реакции, представленной на схеме I:
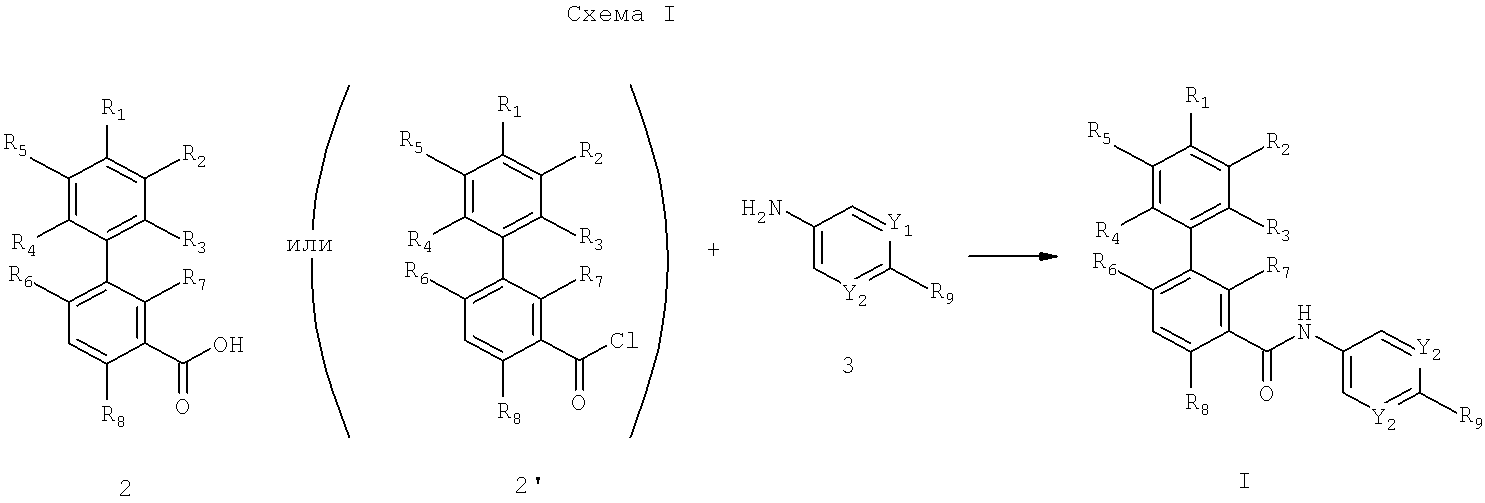
где Y1, Y2, R1, R2, R3, R4, R5, R6, R7, R8 и R9 имеют значения, как указано для формулы I в разделе «Краткое изложение сущности изобретения». Соединение формулы I получают при взаимодействии соединения формулы 2 (или 2') с соединением формулы 3 в присутствии пригодного растворителя (например, дихлорметан, N,N-диметилформамид или т.п.) при температуре от приблизительно -20°С до приблизительно 100°С. Для завершения реакции требуется приблизительно 20 ч.
Подробные примеры способов получения соединений формулы I приведены в разделе «Примеры» ниже.
Дополнительные способы получения соединений по настоящему изобретению
Соединение по настоящему изобретению получают в виде фармацевтически приемлемой кислотно-аддитивной соли при взаимодействии соединения в форме свободного основания с фармацевтически приемлемой неорганической или органической кислотой. В другом варианте фармацевтически приемлемую основно-аддитивную соль соединения по настоящему изобретению получают при взаимодействии соединения в форме свободной кислоты с фармацевтически приемлемым неорганическим или органическим основанием.
В другом варианте соли соединений по настоящему изобретению получают с использованием солей исходных или промежуточных соединений.
Соединения по настоящему изобретению в форме свободной кислоты или в форме свободного основания получают из соединений в форме основно-аддитивной соли или кислотно-аддитивной соли соответственно. Например, соединение по настоящему изобретению в форме кислотно-аддитивной соли превращают в соответствующее соединение в форме свободного основания при обработке пригодным основанием (например, раствор гидроксида аммония, гидроксид натрия и т.п.). Соединение по настоящему изобретению в форме основно-аддитивной соли превращают в соответствующее соединение в форме свободной кислоты при обработке пригодной кислотой (например, соляная кислота и т.п.).
Соединения по настоящему изобретению в неокисленной форме получают из N-оксидов соединений по настоящему изобретению при обработке восстановителем (например, сера, диоксид серы, трифенилфосфин, боргидрид лития, боргидрид натрия, трихлорид фосфора, трибромид фосфора или т.п.) в пригодном инертном органическом растворителе (например, ацетонитрил, этанол, водный раствор диоксана или т.п.) при температуре от 0 до 80°С.
Производные пролекарств соединений по настоящему изобретению получают известными способами (более подробная информация приведена, например, в статье Saulnier и др., Bioorganic and Medicinal Chemistry Letters, т.4, с.1985 (1994)). Например, соответствующие пролекарства получают при взаимодействии исходного соединения по настоящему изобретению с пригодным карбамилирующим агентом (например, 1,1-ацилоксиалкилкарбанохлоридат, пара-нитрофенилкарбонат или т.п.).
Защищенные производные соединений по настоящему изобретению получают известными способами. Подробное описание методик, пригодных для введения защитных групп и их удаления, приведено в книге Greene Т. W., «Protecting Groups in Organic Chemistry», 3е изд., John Wiley and Sons, Inc. (1999).
Соединения по настоящему изобретению получают стандартными способами или способами по настоящему изобретению в виде сольватов (например, гидратов). Гидраты соединений по настоящему изобретению обычно получают перекристаллизацией из смеси водный/органический растворитель с использованием органических растворителей, таких как диоксан, тетрагидрофуран или метанол.
Соединения по настоящему изобретению получают в виде индивидуальных стереоизомеров при взаимодействии рацемической смеси соединения с оптически активным разрешающим агентом с образованием пары диастереомеров, разделением диастереомеров и выделением оптически чистых энантиомеров. Хотя разделение энантиомеров проводят с использованием ковалентных диастереомерных производных соединений по настоящему изобретению, предпочтительны диссоциирующие комплексы (например, кристаллические соли диастереомеров). Диастереомеры характеризуются различными физическими свойствами (например, температура плавления, температура кипения, растворимость, реакционная способность и т.д.), и их можно разделять в соответствии с указанными различиями. Диастереомеры можно разделить хроматографией или предпочтительно методом разделения в соответствии с различиями в растворимости. Затем выделяют оптически чистый энантиомер наряду с разрешающим агентом любым известным способом, который не приводит к рацемизации. Более подробное описание методик, пригодных для выделения стереоизомеров соединений по настоящему изобретению из рацемической смеси, приведено в книге Jacques J., Collet А., Wilen S. H., «Enantiomers, Racemates and Resolutions)), John Wiley and Sons, Inc. (1981).
В основном соединения формулы I получают способом, который заключается в том, что:
(а) проводят реакцию, представленную на схеме I, и
(б) необязательно превращают соединение по настоящему изобретению в фармацевтически приемлемую соль,
(в) необязательно превращают соединение по настоящему изобретению в форме соли в соединение по настоящему изобретению в несолевой форме,
(г) необязательно превращают соединение по настоящему изобретению в неокисленной форме в фармацевтически приемлемый N-оксид,
(д) необязательно превращают соединение по настоящему изобретению в форме N-оксида в соединение по настоящему изобретению в неокисленной форме,
(е) необязательно выделяют индивидуальный изомер соединения по настоящему изобретению из смеси изомеров.
Примеры
Настоящее изобретение иллюстрируется, без ограничения перечисленным, приведенными ниже примерами, в которых описано получение соединений формулы I по настоящему изобретению.
Пример 1
[4-(Морфолин-4-сульфонил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты
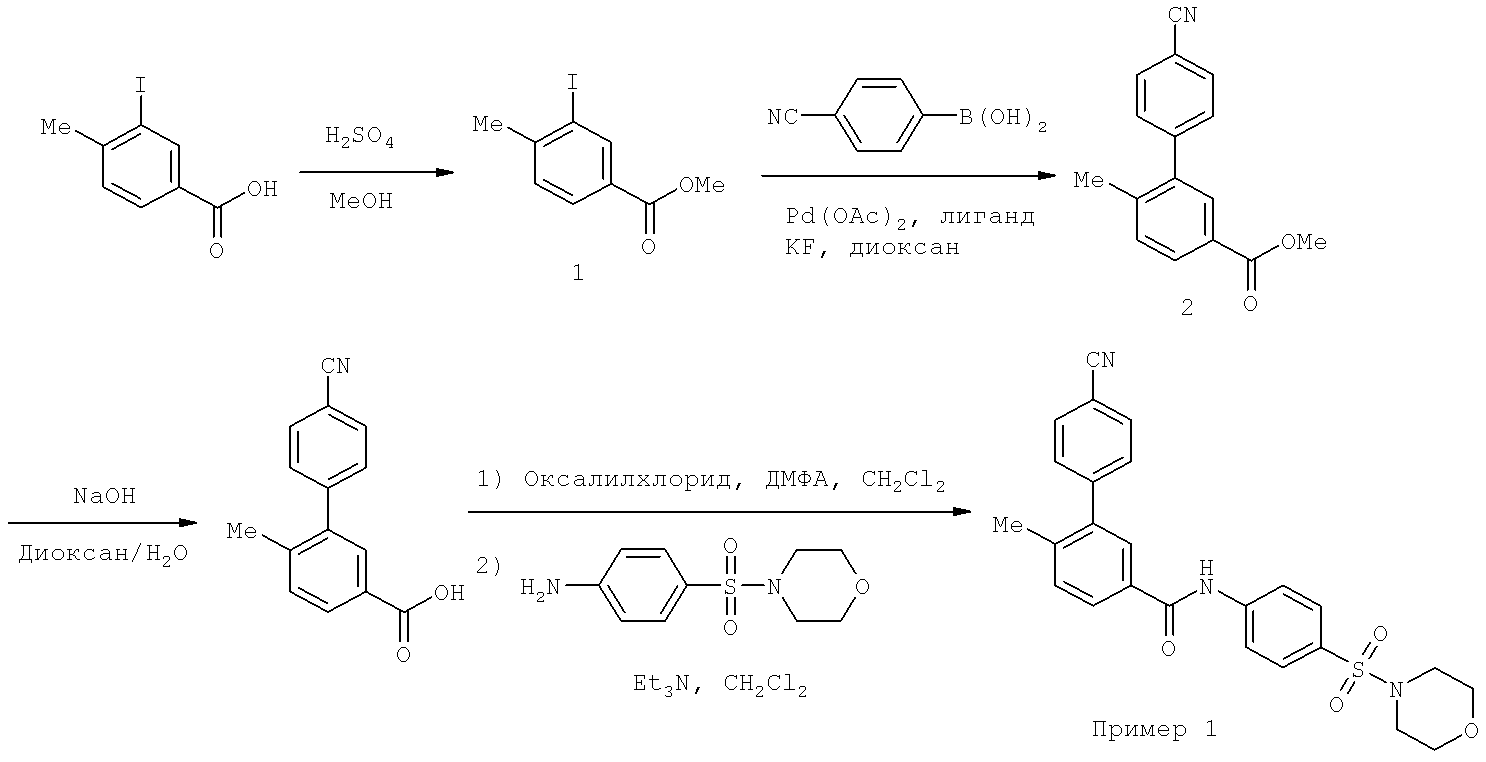
Стадия 1
В раствор 3-иод-4-метилбензойной кислоты (10,0 г, 38,2 ммоля) в метаноле (70 мл) добавляли концентрированную серную кислоту (0,5). Реакционную смесь нагревали при 70°С в течение 48 часов, охлаждали до КТ и концентрировали. Затем к остатку добавляли этилацетат (100 мл) и водный раствор NaHCO3 (насыщ., 100 мл). Органический слой отделяли и промывали еще раз водным раствором NaHCO3 (насыщ., 100 мл). Органический слой отделяли, сушили над безводным Na2SO4 и концентрировали, при этом получали метиловый эфир 3-иод-4-метилбензойной кислоты 1, который использовали на следующей стадии без дополнительной очистки.
1Н ЯМР (400 МГц, ДМСО-d6): δ (част./млн) 8,31 (s, 1Н), 7,87 (d, 1Н, J 8,4 Гц), 7,48 (d, 1Н, J 8,4 Гц), 3,85 (s, 3Н), 3,35 (s, 3Н). ЖХ-МС: (m/z) 277,0 (М+1).
Стадия 2
В круглодонную колбу, содержащую метиловый эфир 3-иод-4-метилбензойной кислоты (1,38 г, 5,00 ммоля), 4-цианофенилбороновую кислоту (1,10 г, 7,48 ммоля), ацетат палладия (168 мг, 0,748 ммоля), 2-(дициклогексилфосфино)бифенил (0,526 г, 1,50 ммоля) и фторид калия (0,870 г, 15,0 ммоля), добавляли безводный 1,4-диоксан (15 мл). Колбу продували аргоном и закрывали. Смесь перемешивали при 130°С в течение 18 ч, охлаждали до КТ и добавляли воду (20 мл) и этилацетат (20 мл). Твердое вещество удаляли фильтрованием в вакууме. Фильтрат экстрагировали EtOAc (20 мл × 2). Органические слои объединяли, промывали водным раствором НСl (5%, 20 мл) и насыщенным раствором NaHCO3 (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюент: градиент EtOAc/гексан), при этом поучали метиловый эфир 4'-циано-6-метилбифенил-3-карбоновой кислоты 2, ЖХ-МС: m/z 252,1 (М+1).
Стадия 3
В раствор метилового эфира 4'-циано-6-метилбифенил-3-карбоновой кислоты 2 (2,56 г, 10,3 ммоля) в 1,4-диоксане/Н2О (1:1, 20 мл) добавляли NaOH (1,22 г, 30,2 ммоля). Реакционную смесь перемешивали при КТ в течение 24 ч, затем добавляли водный раствор HCl (1н., 36 мл) и экстрагировали этилацетатом (40 мл × 3). Органические слои объединяли и сушили над безводным Na2SO4, растворитель удаляли. Полученное твердое вещество промывали небольшим количеством ацетонитрила и сушили на воздухе, при этом получали 4'-циано-6-метилбифенил-3-карбоновую кислоту 3.
1Н ЯМР (ДМСО-d6): δ (част./млн) 7,94 (d, 2 Н, J 8,0 Гц), 7,84 (dd, 1 Н, J, 8,4 Гц, J2 1,2 Гц), 7,75 (d, 1 Н, J 1,2 Гц), 7,61 (d, 2 Н, J 8,0 Гц), 7,48 (d, 1 Н, J 8,4 Гц), 2,29 (s, 3 Н). ЖХ-МС: m/z 238,1 (М+1).
Стадия 4
В суспензию 4'-циано-6-метилбифенил-3-карбоновой кислоты 3 (40 мг, 0,17 ммоля) в безводном хлористом метилене (5 мл) добавляли 2 капли ДМФА и оксалилхлорид (32 мг, 22 мкл, 0,25 ммоля). Смесь перемешивали при КТ до образования прозрачного раствора. Затем смесь концентрировали, снова растворяли в безводном хлористом метилене (3 мл) и добавляли в раствор 4-(морфолин-4-сульфонил)фениламина (61 мг, 0,25 ммоля) и триэтиламина (34 мг, 47 мкл, 0,33 ммоля) в хлористом метилене (2 мл). Смесь перемешивали в течение 2 ч, концентрировали и остаток очищали препаративной МС-ЖХВР (колонка С18, элюент: CH3CN/H2O, содержащий 0,05% ТФУ), при этом получали [4-(морфолин-4-сульфонил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты.
1Н ЯМР (ДМСО-d6): δ (част./млн) 10,64 (s, 1H), 8,07 (d, 2Н, J 8,8 Гц), 7,97 (d, 2Н, J 8,4 Гц), 7,95 (d, 1Н, J 8,8 Гц), 7,89 (s, 1H), 7,43 (d, 2Н, J 8,4 Гц), 7,67 (d, 2Н, J 8,8 Гц), 7,53 (d, 2Н, J 8,8 Гц), 3,63 (m, 4Н), 2,84 (m, 4Н) 2,32 (s, 3Н). ЖХ-МС: m/z 462,1 (М+1).
Пример 2
[6-(2,6-Диметилморфолин-4-ил)пиридин-3-ил]амид 4,-циано-6-метилбифенил-3-карбоновой кислоты
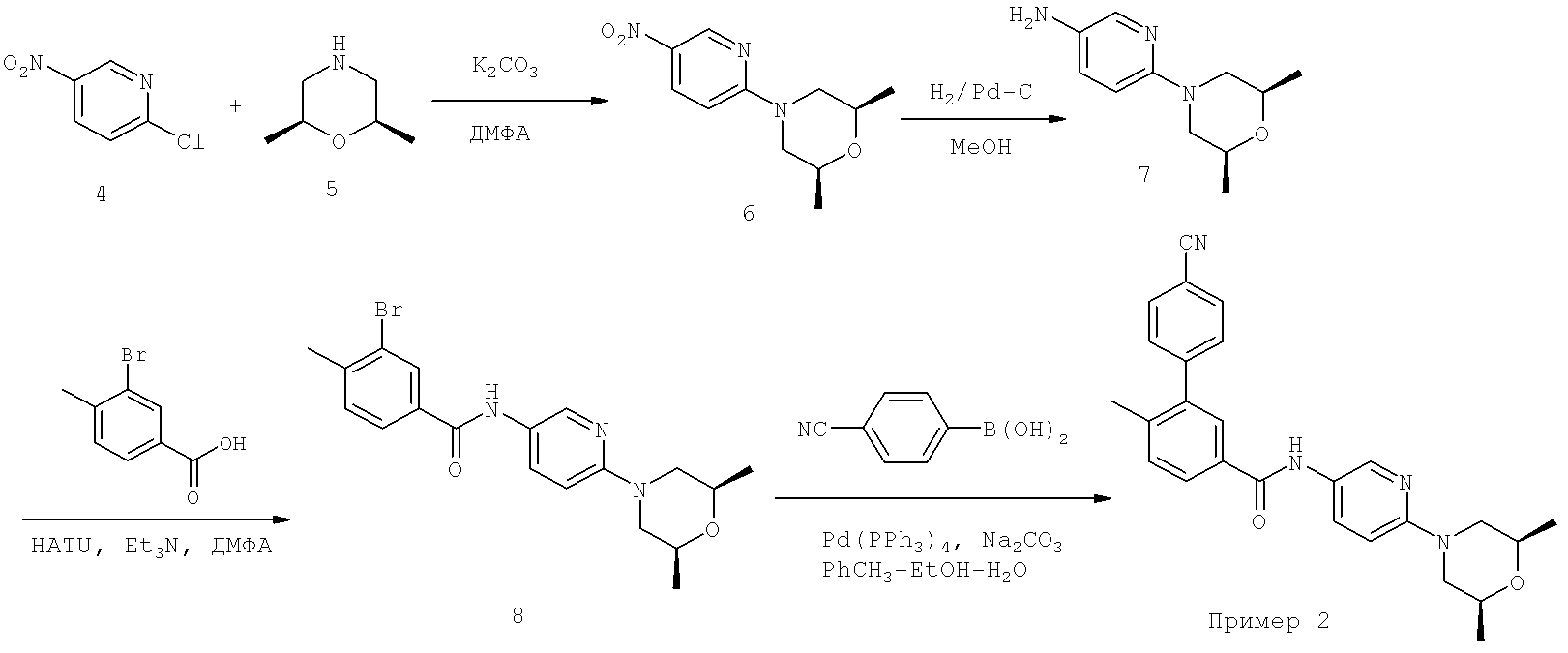
Стадия 1
В раствор 2-хлор-5-нитропиридина 4 (2,38 г, 15 ммолей) и цис-2,6-диметилморфолина (1,73 г, 15 ммолей) добавляли К2СО3 (4,14 г, 30 ммолей). Смесь нагревали при 50°С в течение ночи. После концентрирования остаток распределяли между EtOAc и водой. Слой EtOAc сушили над безводным Na2SO4 и концентрировали, при этом получали неочищенный продукт 6 в виде твердого вещества желтого цвета. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. ЖХ-МС: m/z 238,1 (М+1).
Стадия 2
Полученный на предыдущей стадии неочищенный продукт 6 гидрировали в присутствии Pd/C (0,2 г) в МеОН (100 мл) в атмосфере водорода в течение 10 ч. Суспензию фильтровали через целит и фильтрат концентрировали, при этом получали неочищенный продукт 7 в виде масла темно-коричневого цвета, который использовали на следующей стадии без дополнительной очистки. ЖХ-МС: m/z 208,1 (М+1).
Стадия 3
В раствор 3-бром-4-метилбензойной кислоты (108 мг, 0,5 ммоля), 6-(2,6-диметилморфолин-4-ил)пиридин-3-иламина 7 (104 мг, 0,5 ммоля) и HATU (190 мг, 0,5 ммоля) в сухом ДМФА (5 мл) по каплям добавляли триэтиламин (139 мкл, 1,0 ммоля). Полученную смесь перемешивали при КТ в течение 2 ч, после концентрирования остаток распределяли между EtOAc и водой. Органический слой сушили и концентрировали, при этом получали неочищенный продукт. Конечное соединение очищали колоночной экспресс-хроматографией, элюент: 50% EtOAc в гексане, при этом получали соединение 8 в виде твердого вещества белого цвета. ЖХ-МС: m/z 404,1 (М+1).
Стадия 4
Смесь 4-цианофенилбороновой кислоты (18 мг, 0,12 ммоля), 3-бром-N-[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]-4-метилбензамида 8 (40 мг, 0,1 ммоля), Pd(PPh3)4 (11 мг, 0,01 ммоля) и Na2CO3 (42 мг, 0,4 ммоля) в смеси толуола (0,2 мл), воды (0,2 мл) и этанола (0,05 мл) нагревали при 140°С в микроволновом реакторе в течение 30 мин. Реакционную смесь разбавляли EtOAc и водой. Водный слой экстрагировали EtOAc. Объединенный органический слой промывали солевым раствором и концентрировали, при этом получали неочищенный продукт, который очищали препаративной МС/ЖХВР (колонка С18, элюент: CH3CN/H2O, содержащий 0,05% ТФУ), при этом получали [6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты. ЖХ-МС: m/z 427,2 (М+1).
Соединения формулы I, приведенные в таблице, получали, как описано выше, но при использовании соответствующих исходных соединений.
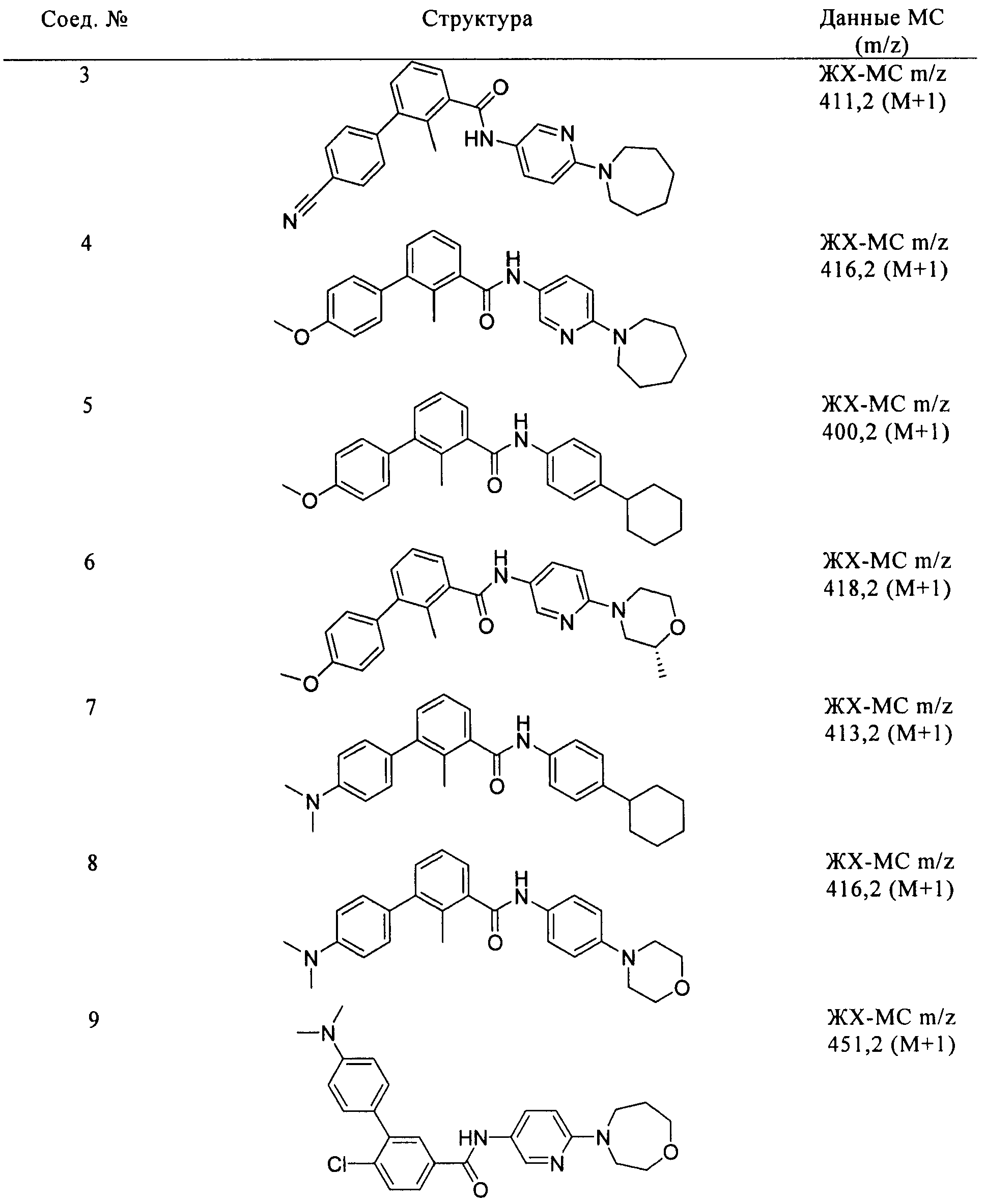
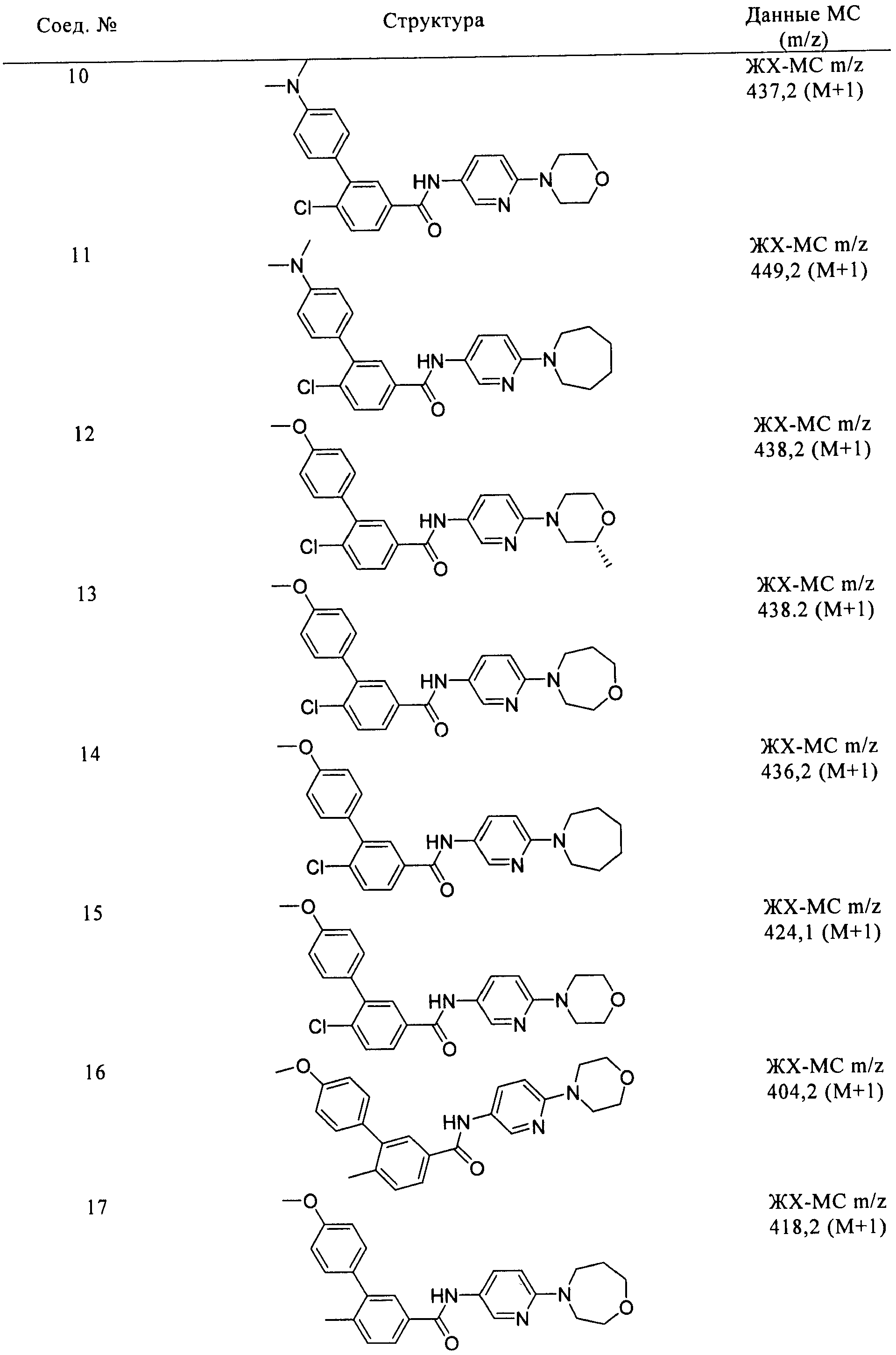
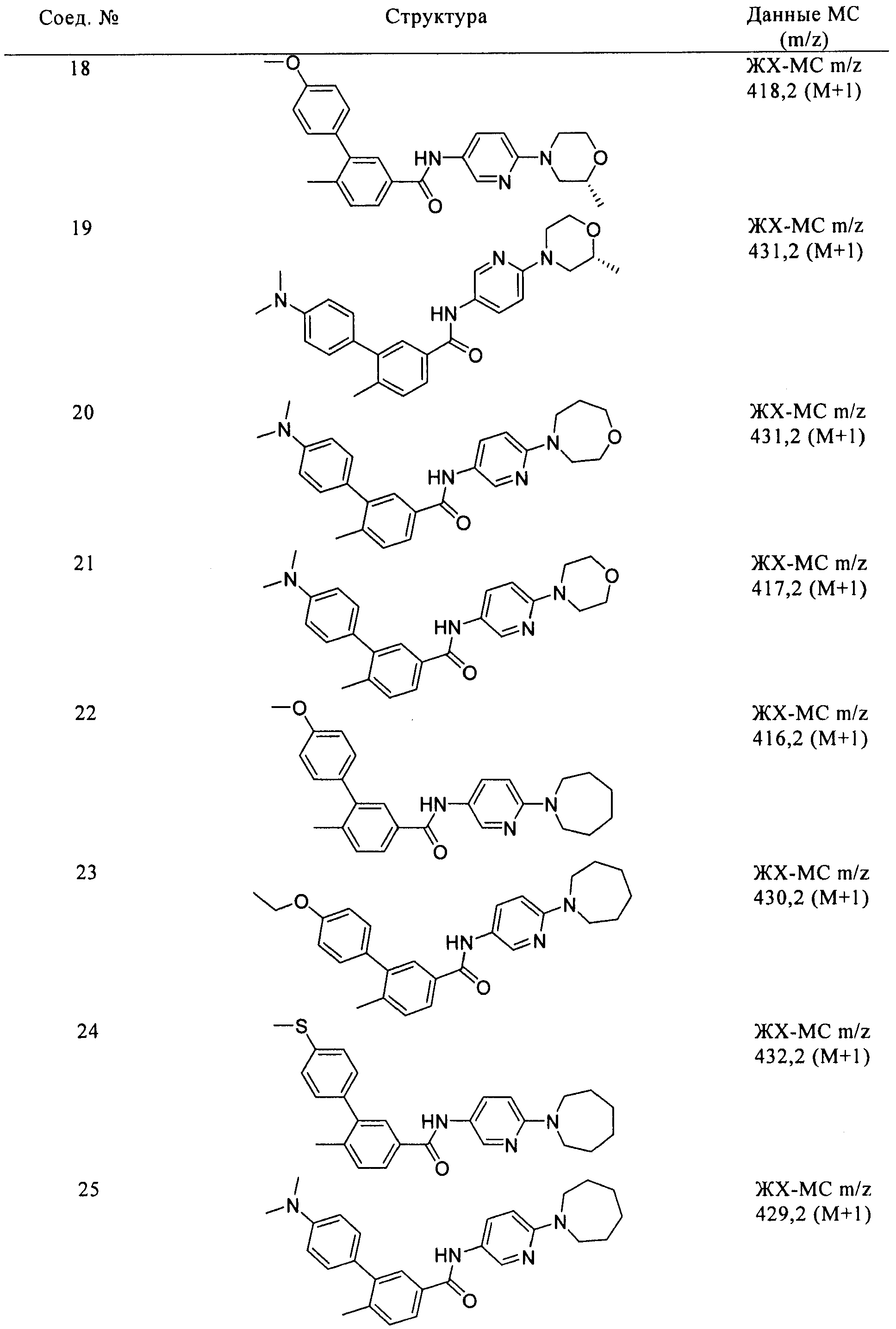
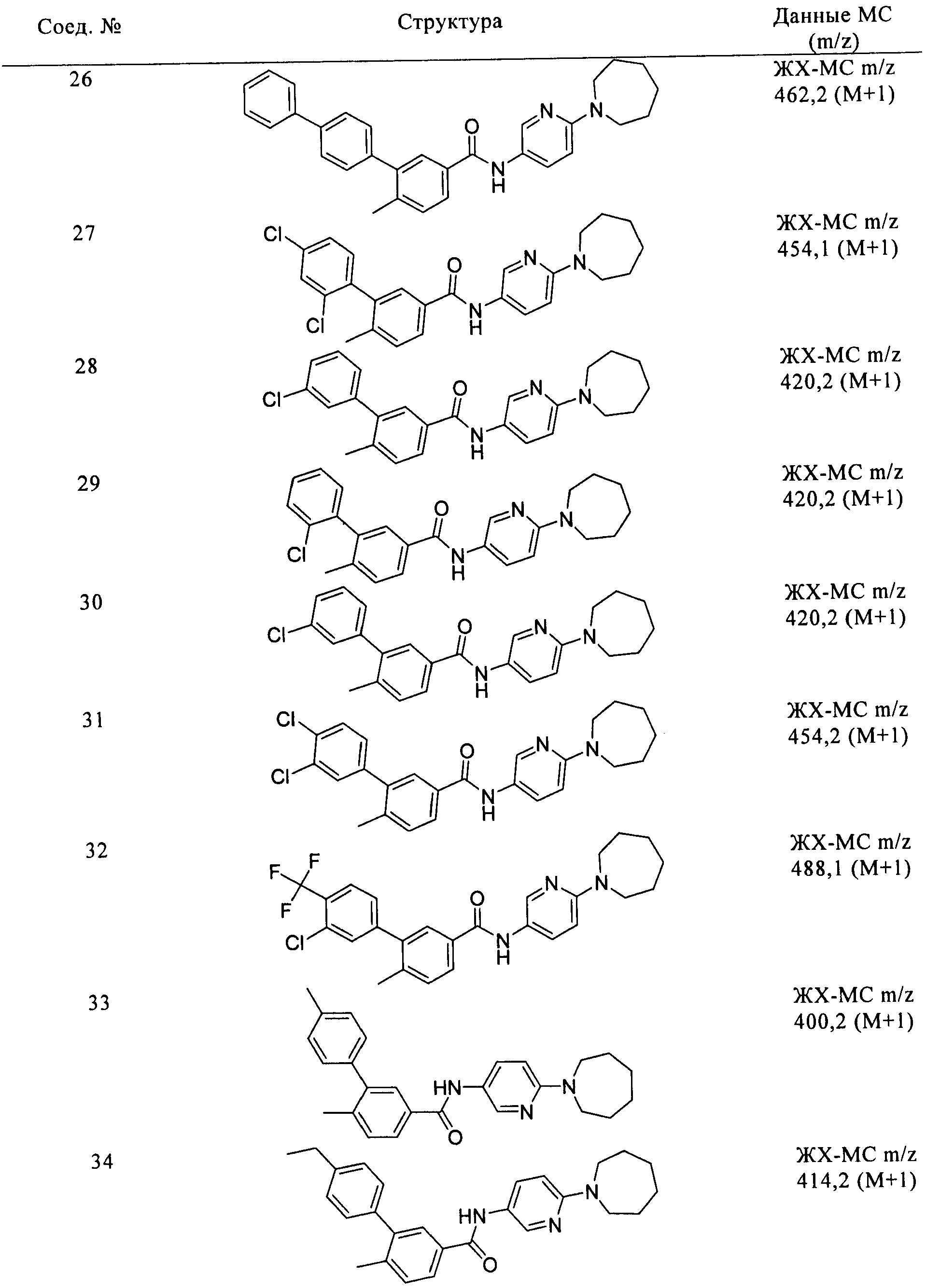
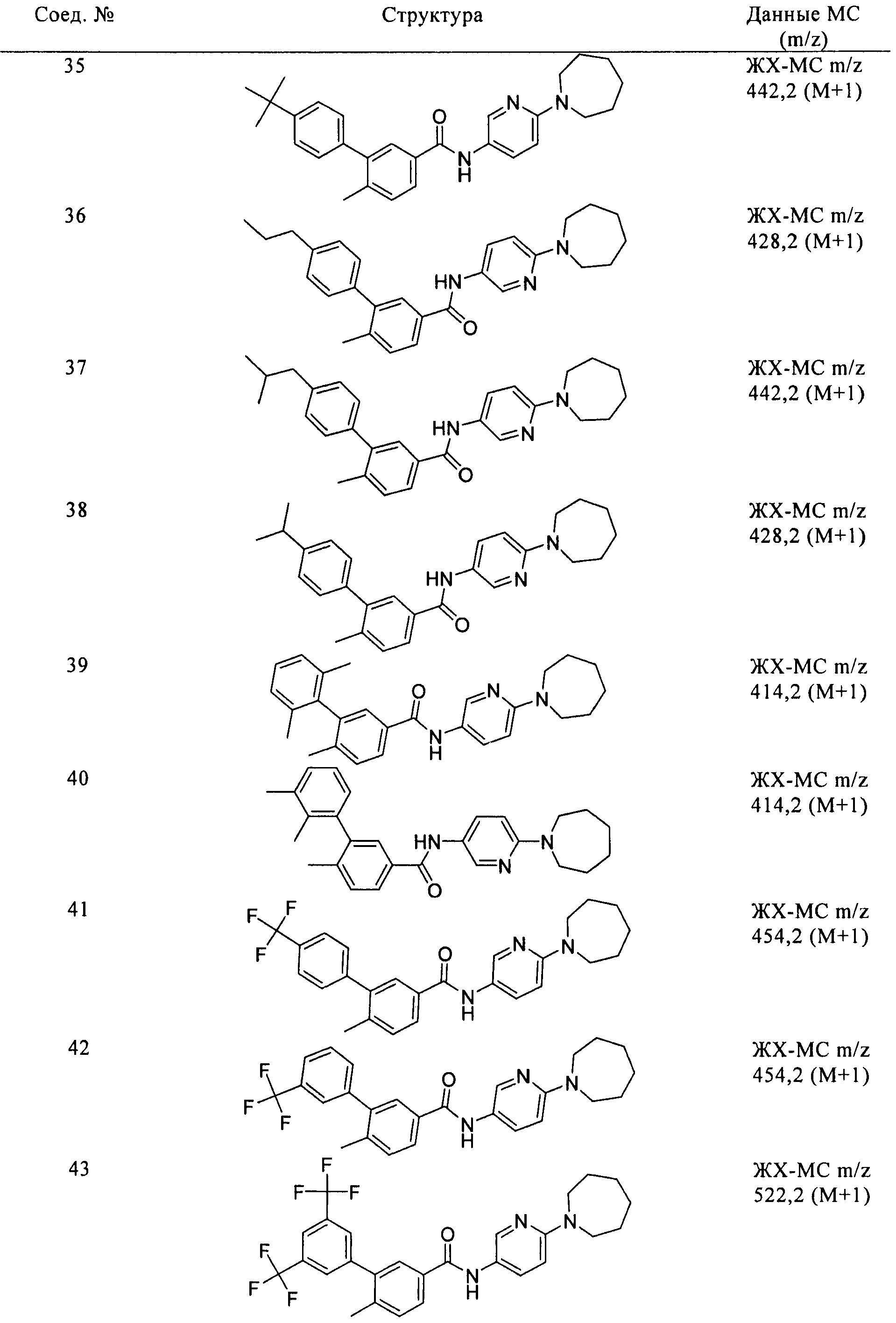
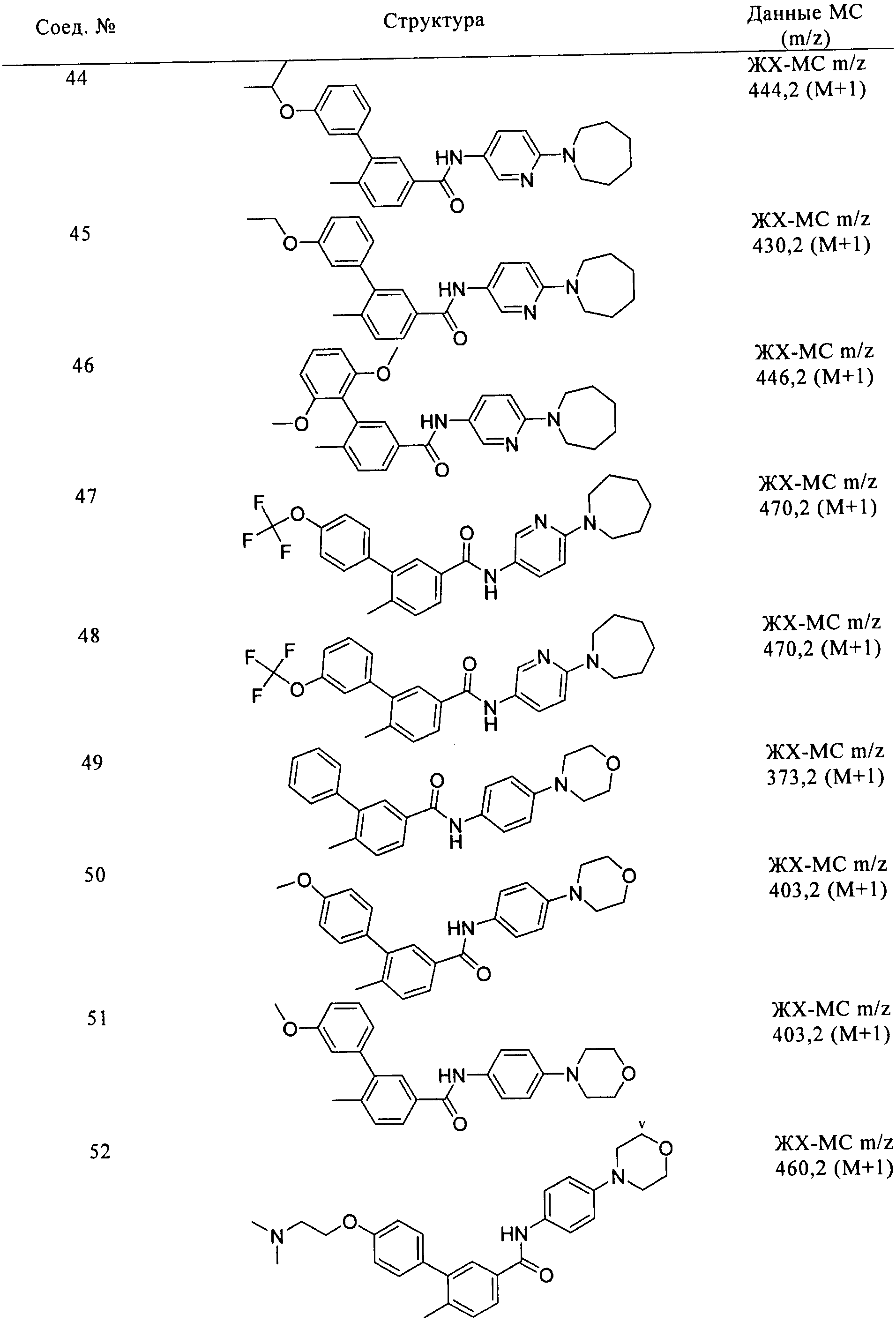
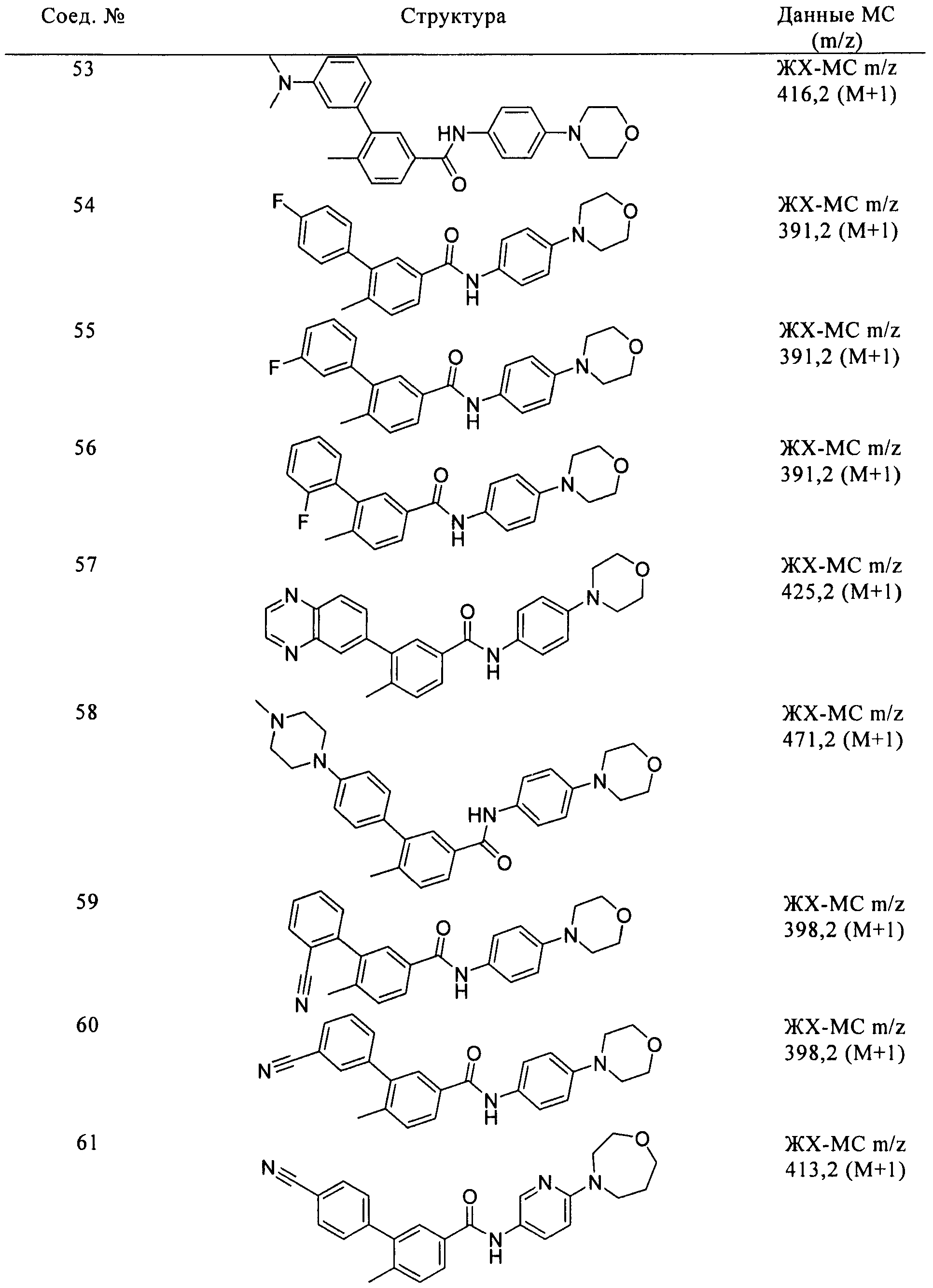
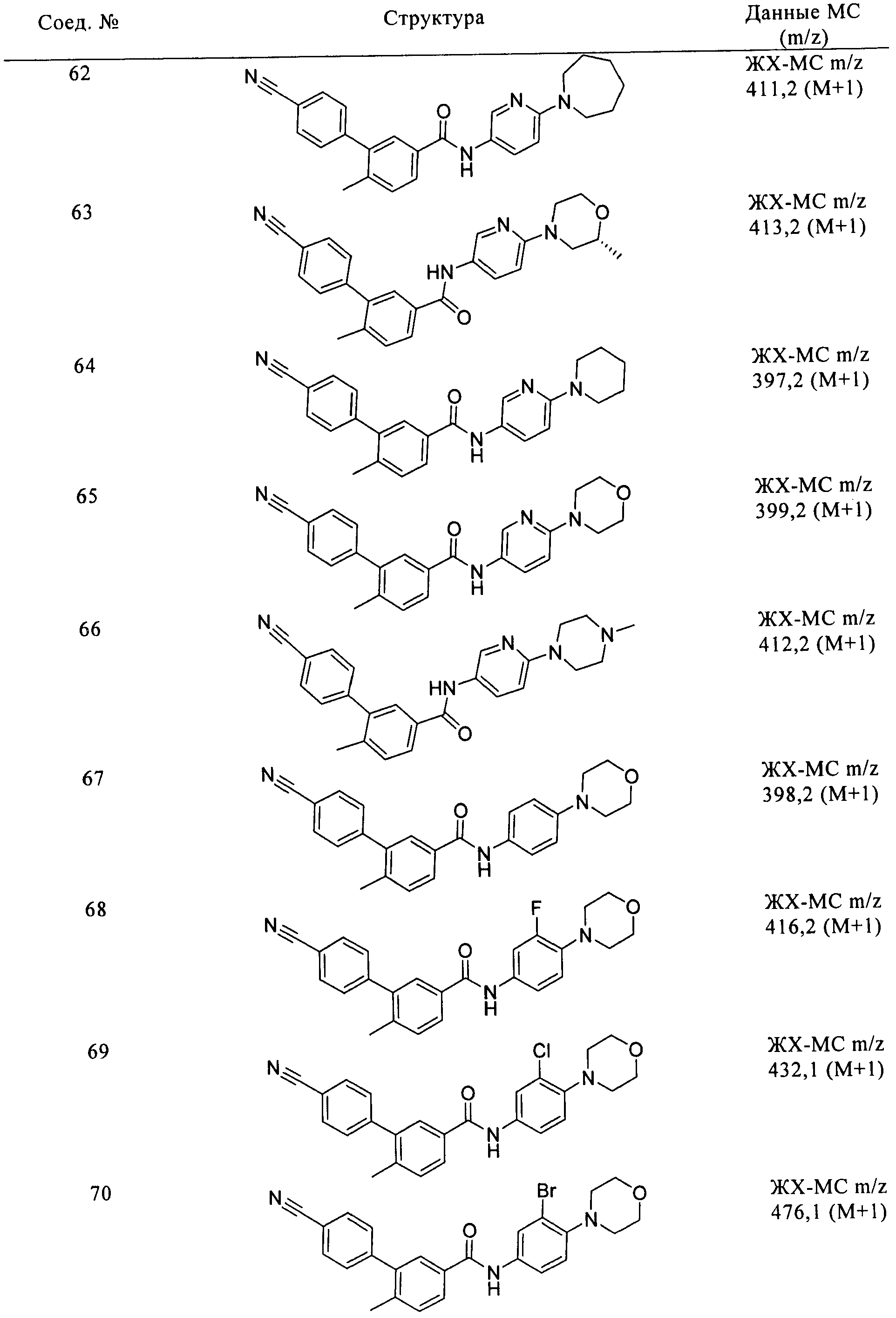
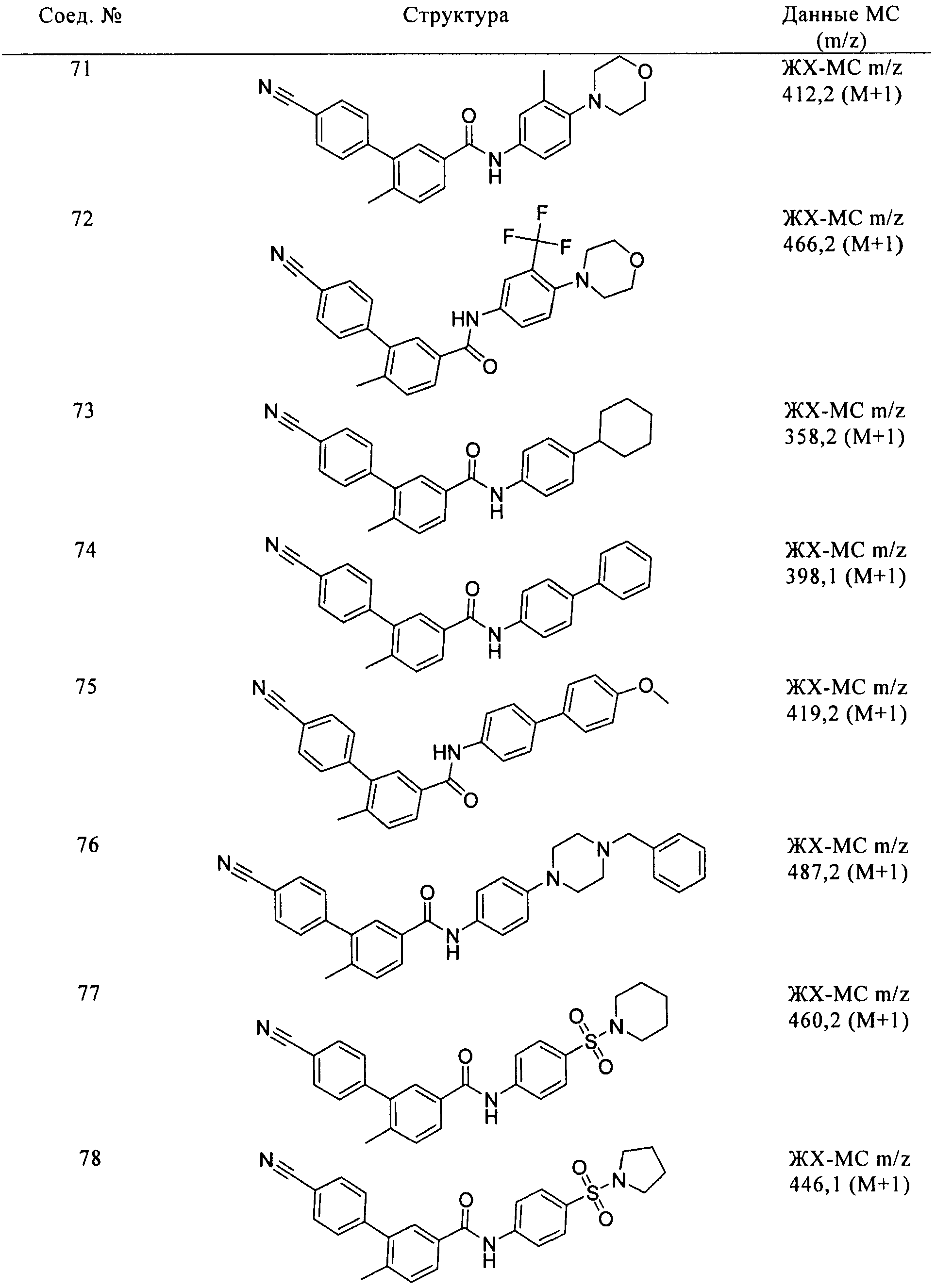
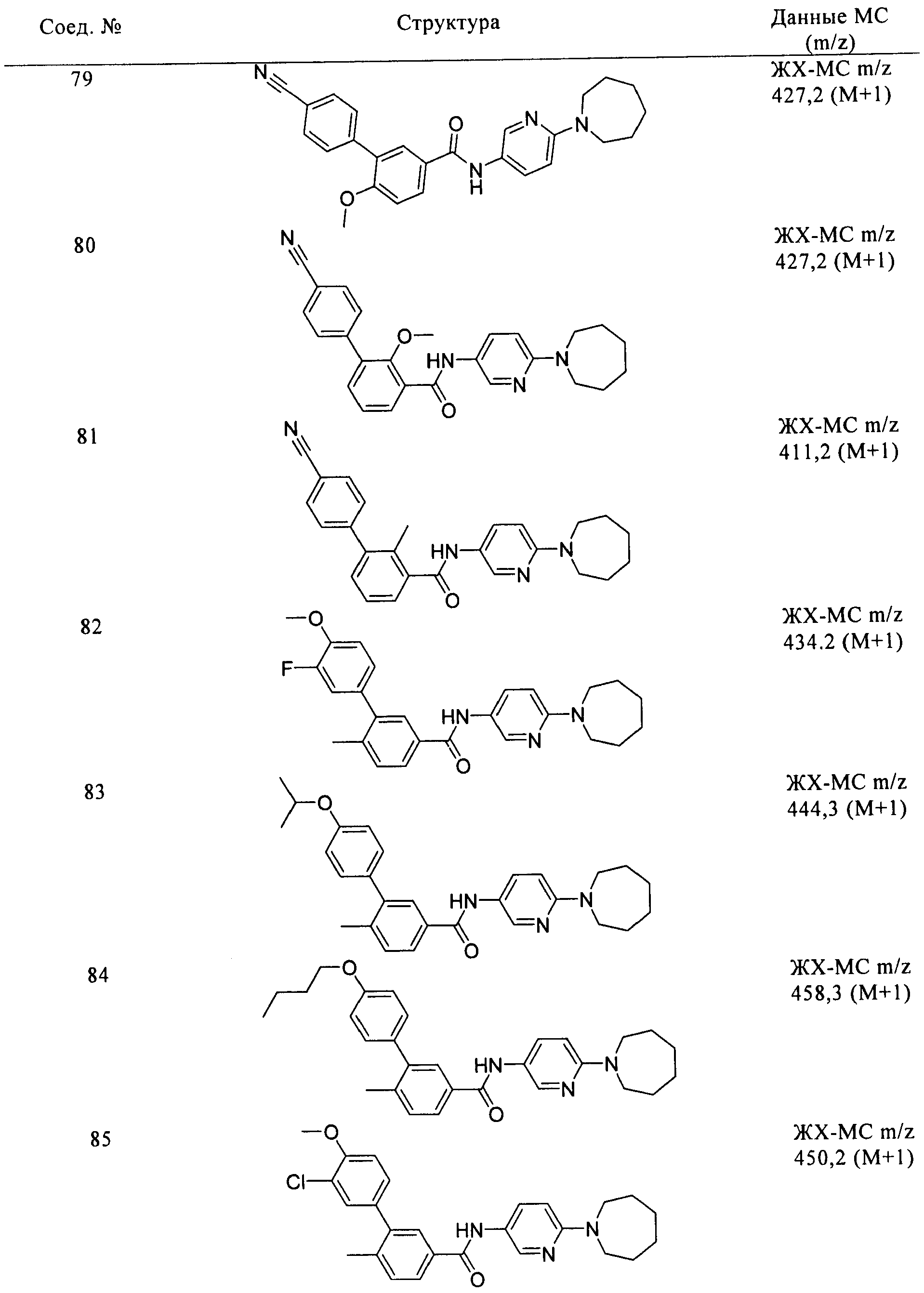
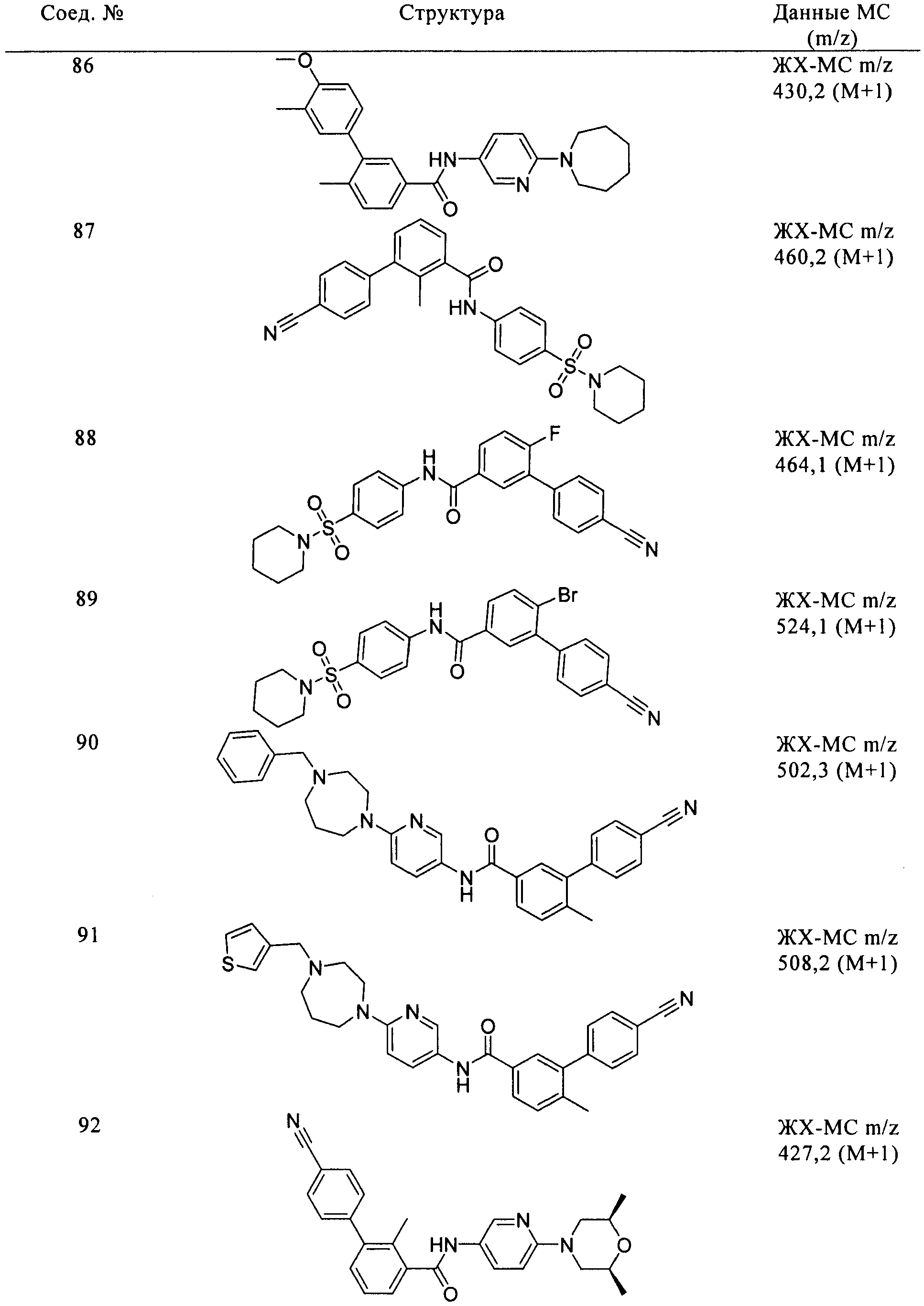
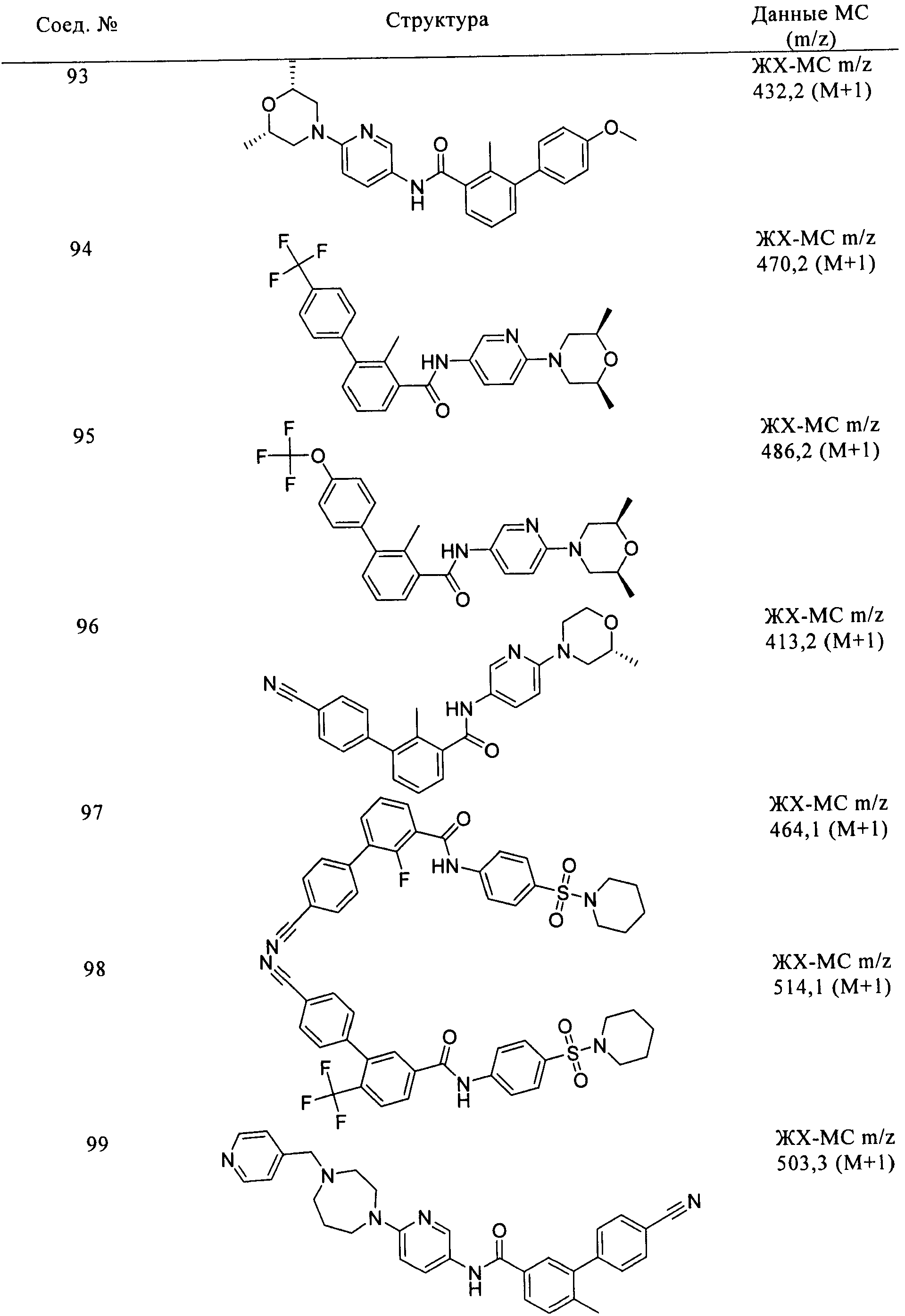
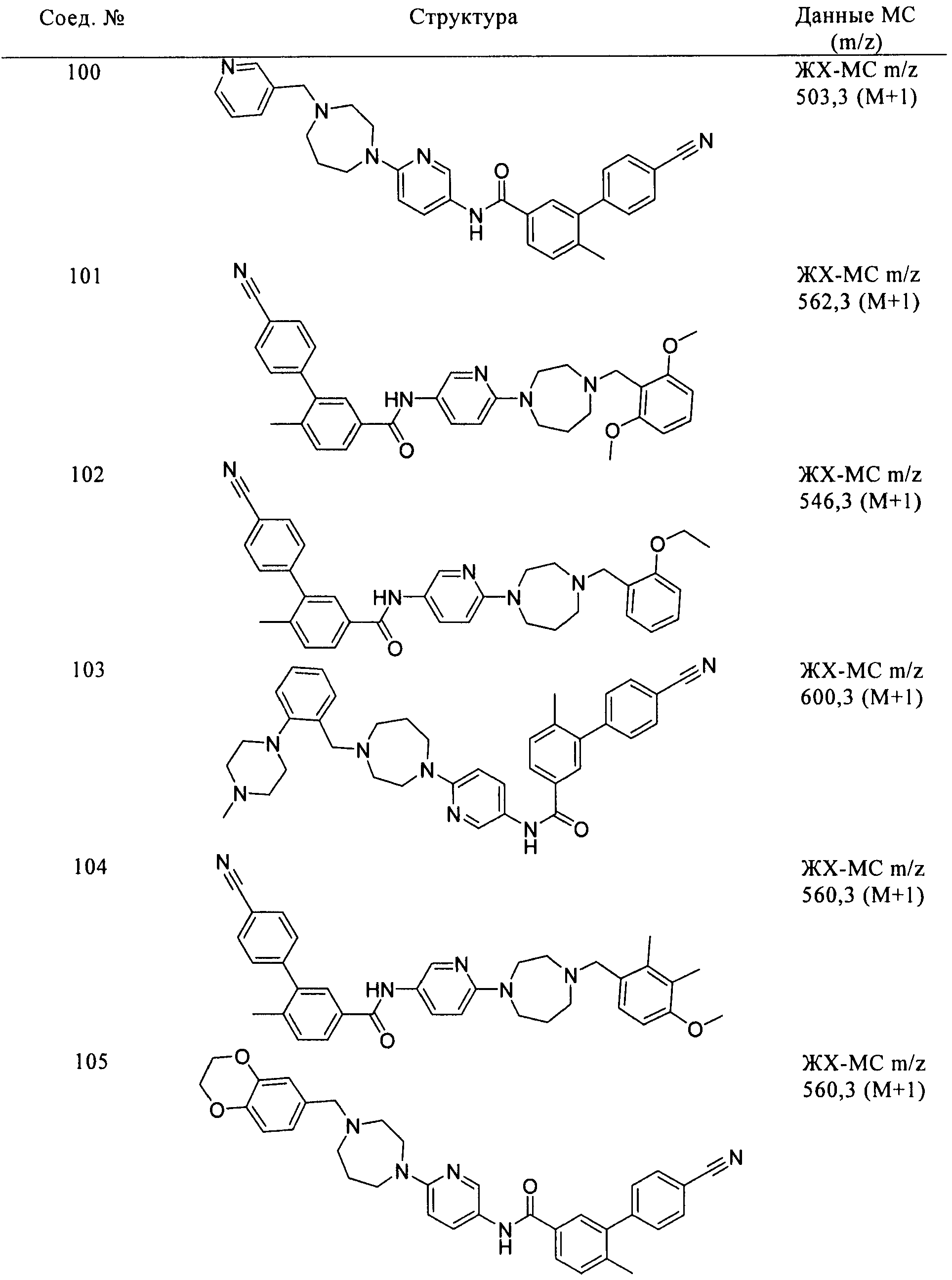
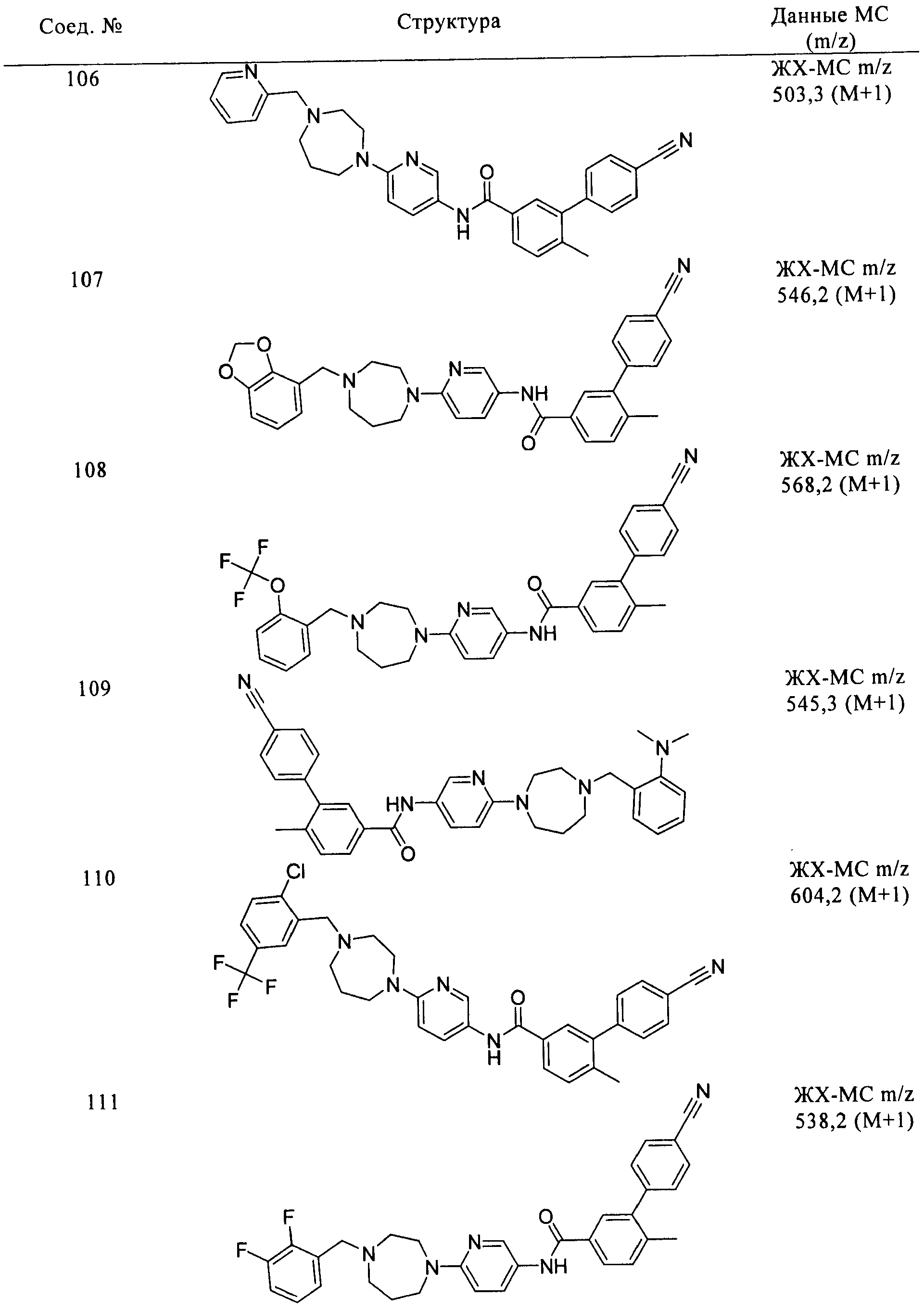
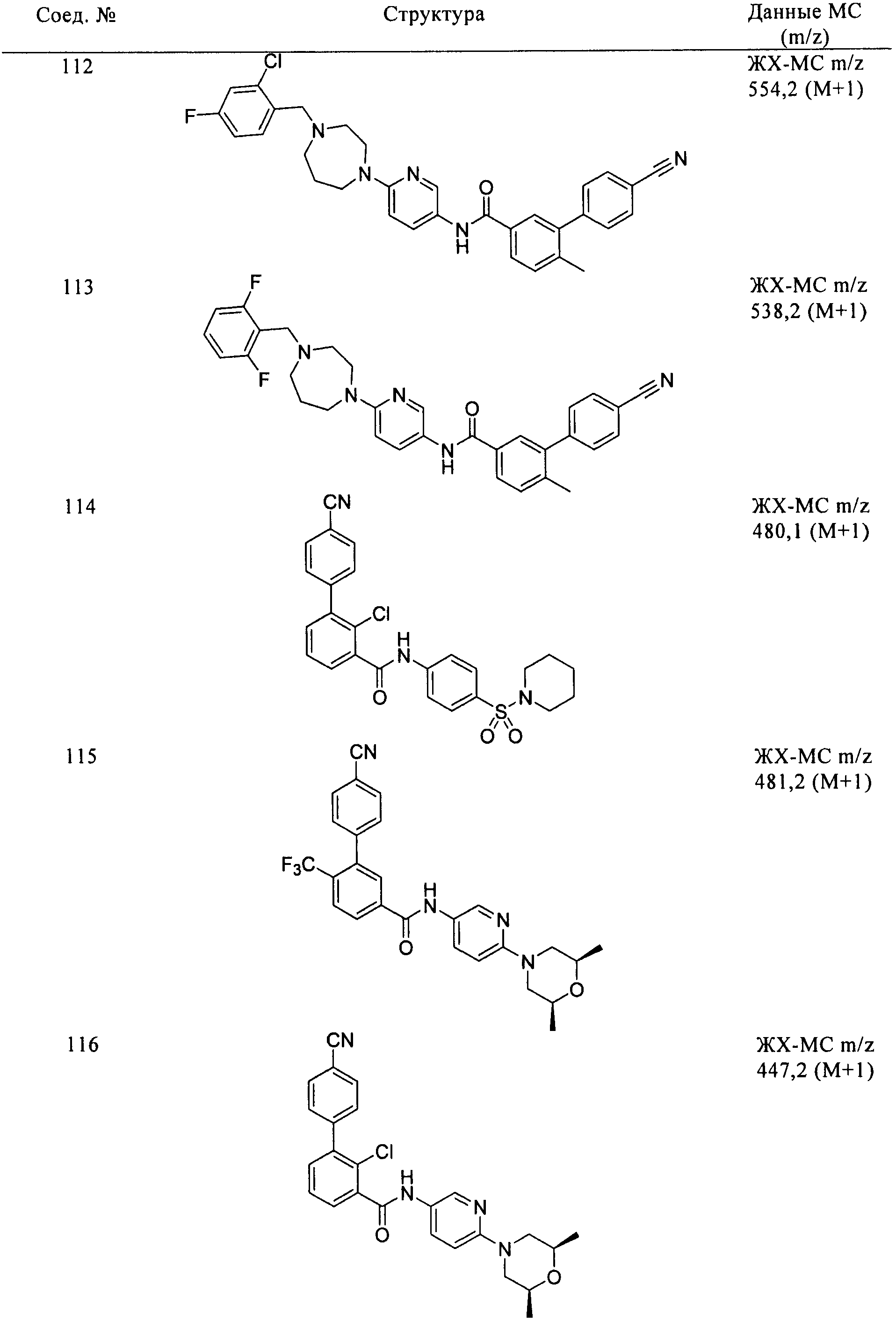
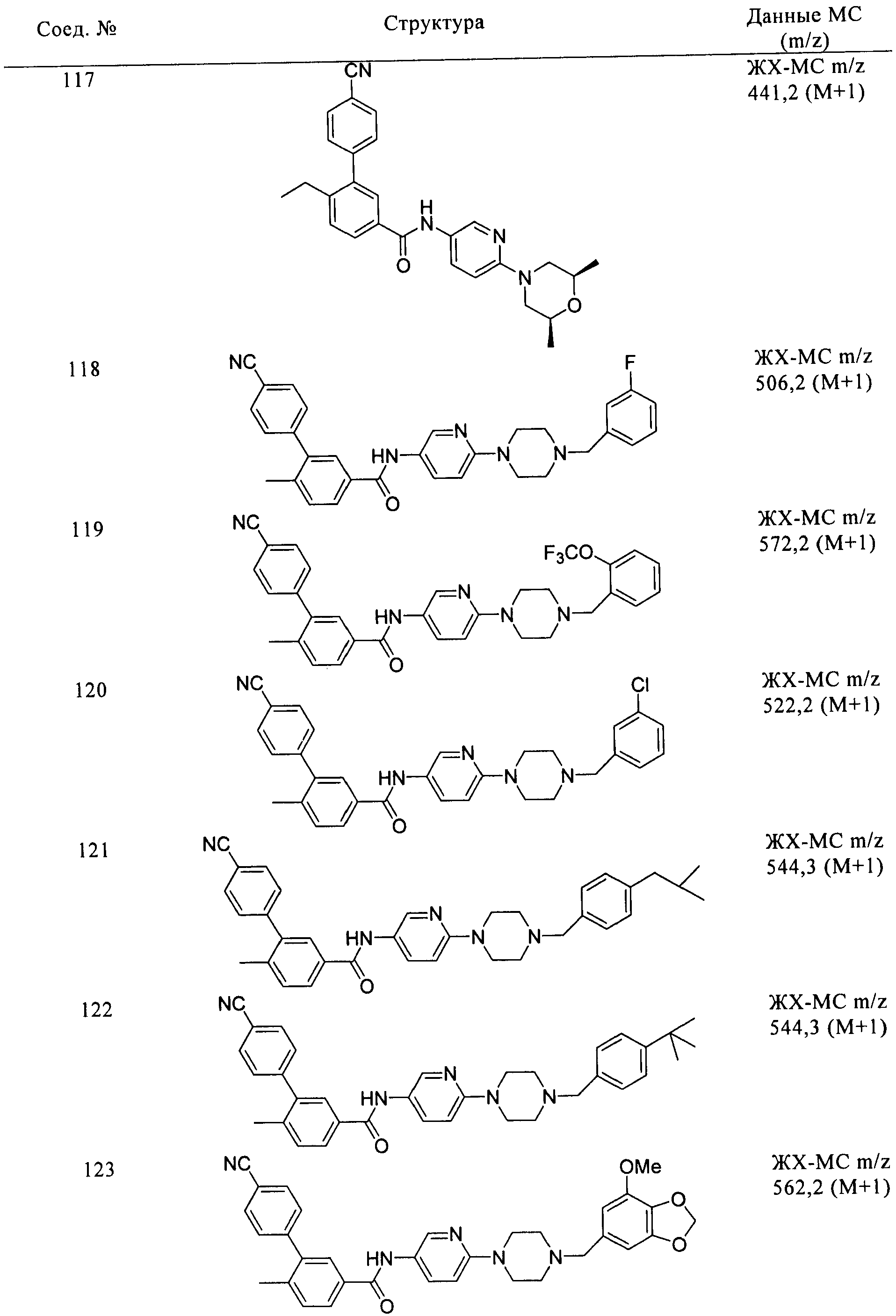
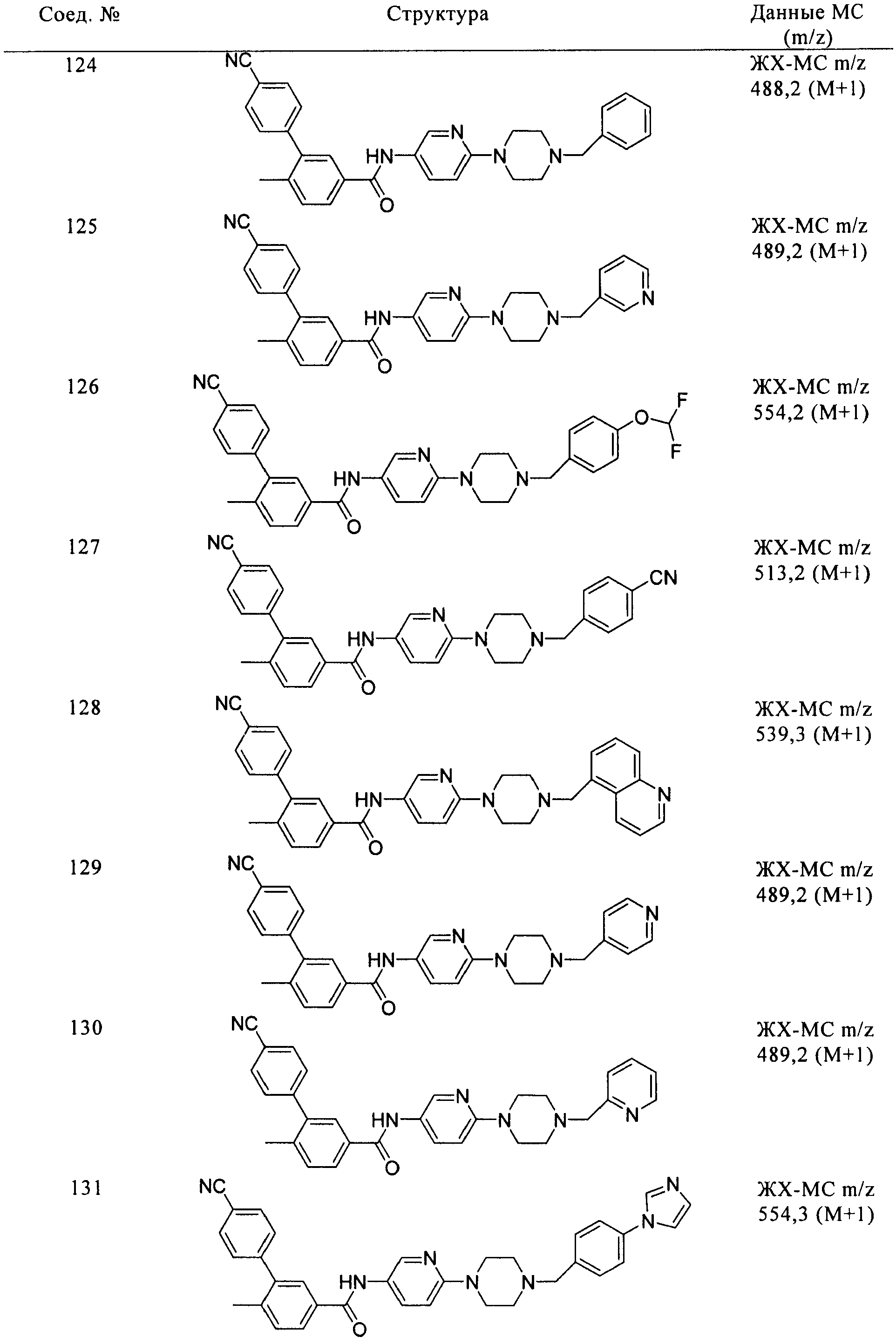
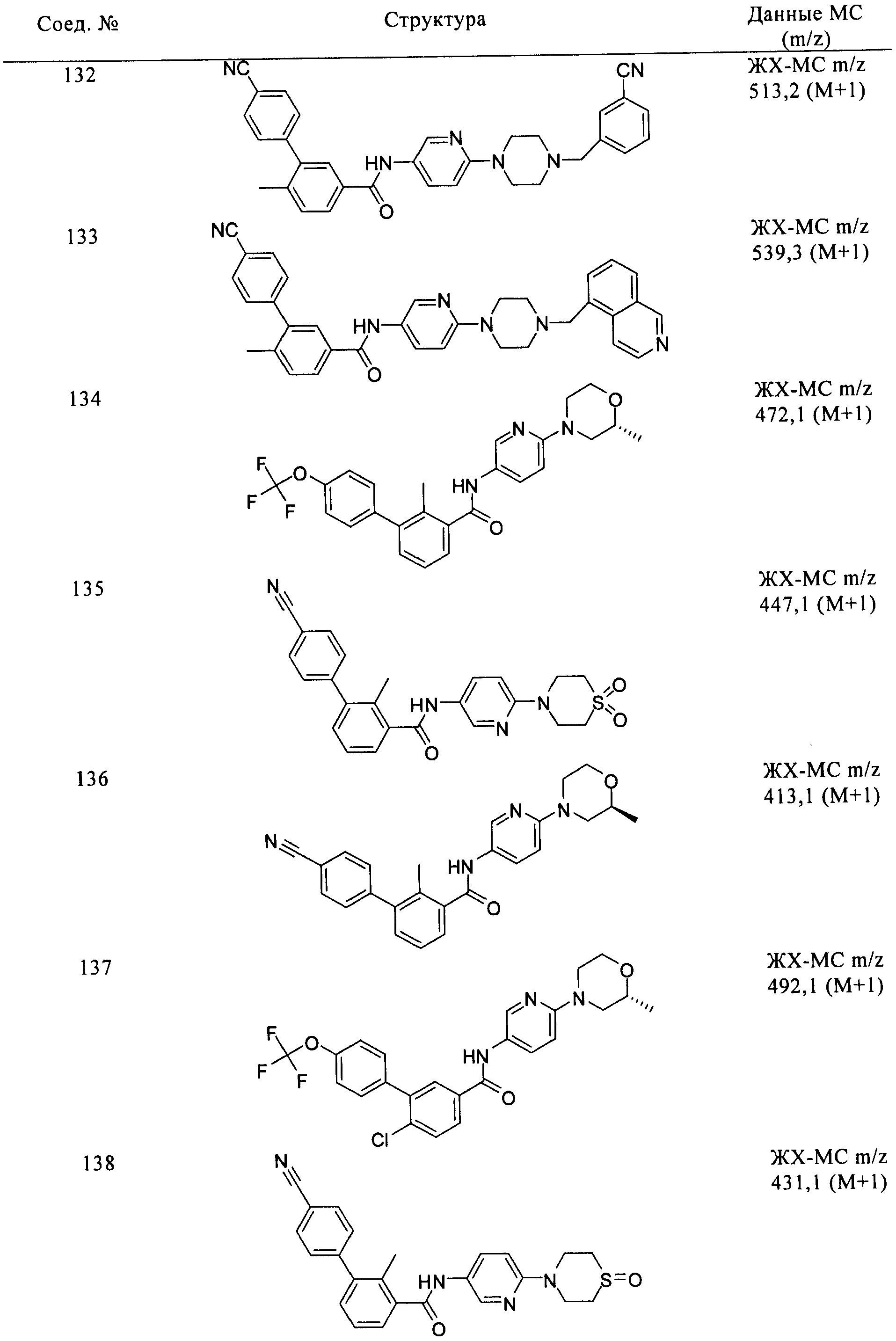
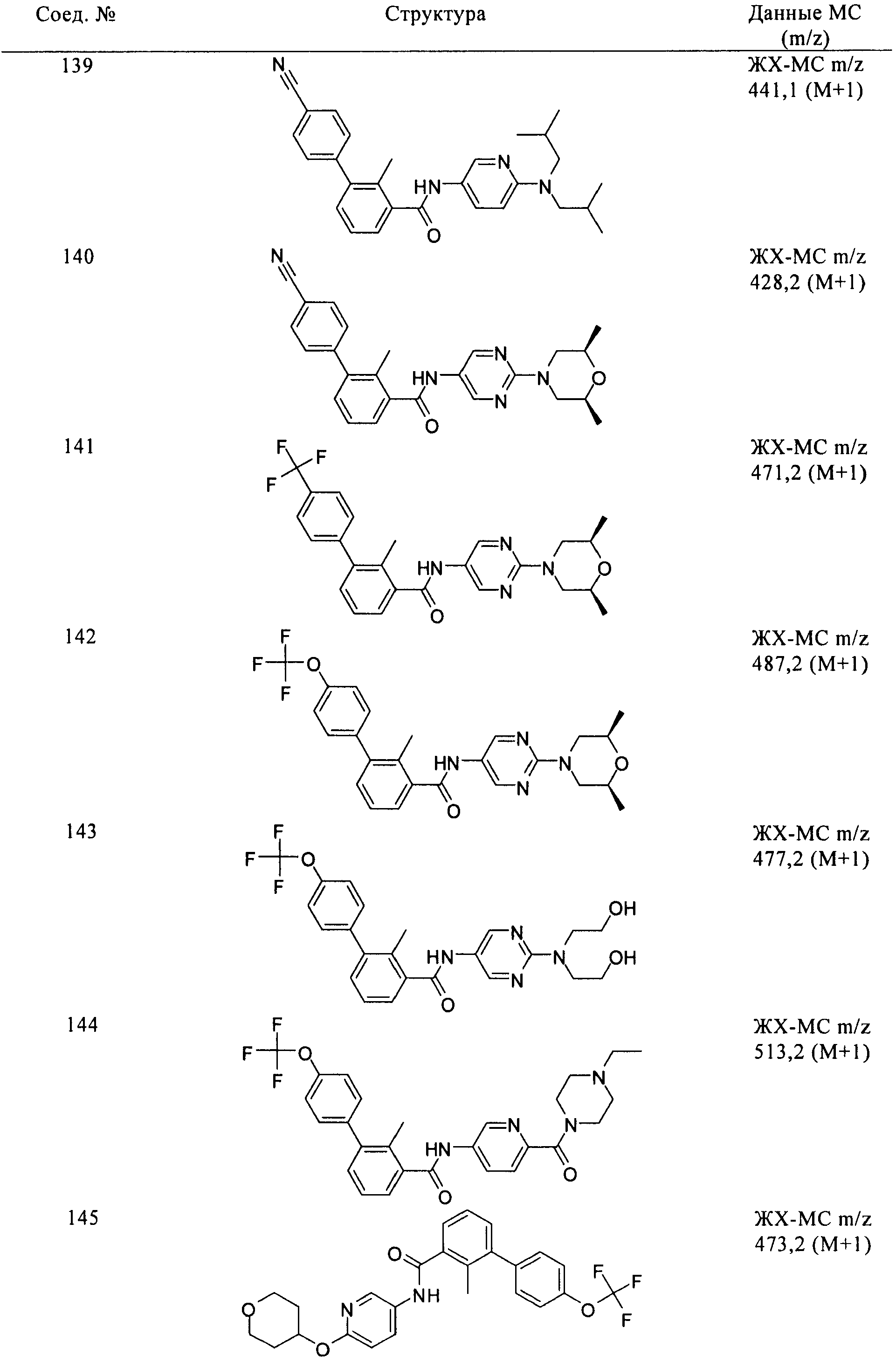
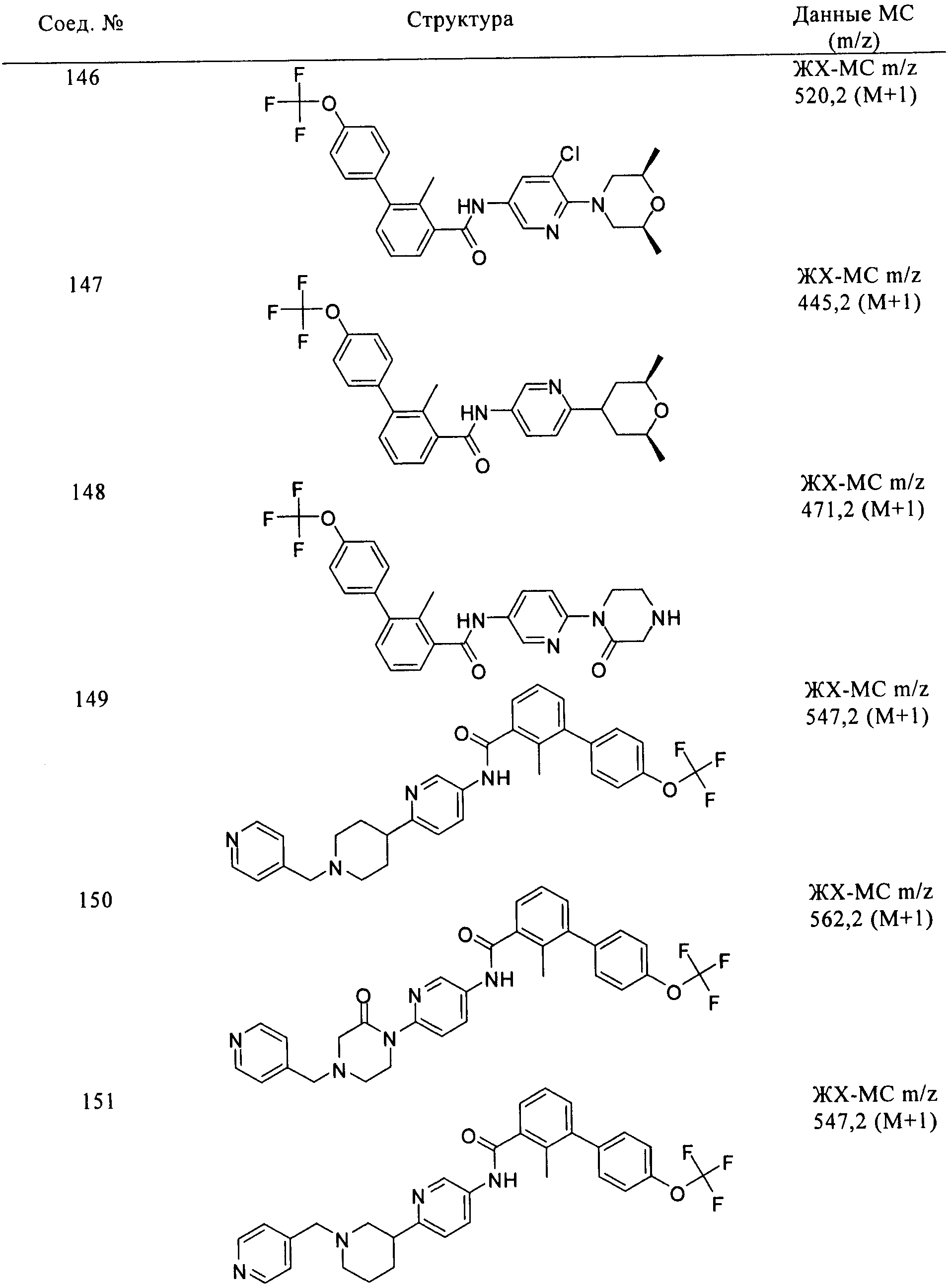
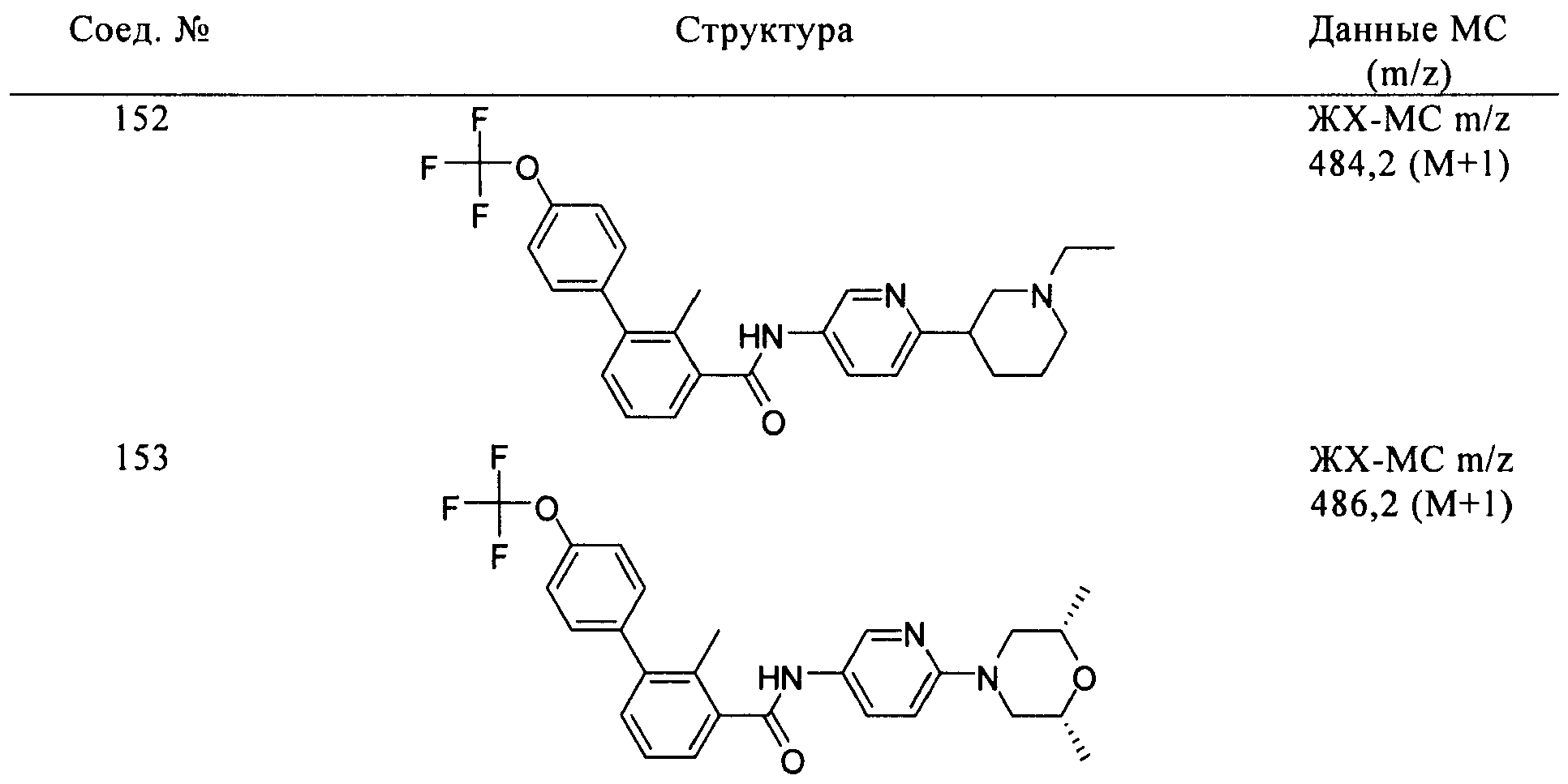
Соединения по настоящему изобретению анализировали и оценивали их способность ингибировать сигнальный путь heghehog.
Определение ингибирующей активности в отношении пути Hh с использованием репортерного гена Gli-Luc
Клетки мышей ТМ3 (American Type Culture Collection, АТСС, Manassas, VA) культивировали в среде DMEM/F12 (Gibco/Invitrogen, Carlsbad, СА), содержащей 5% сыворотку лошади, инактивированную нагреванием, 2,5% ЭТС (Gibco/Invitrogen, Carlsbad, СА), 50 Ед./мл пенициллина и 50 мкг/мл стрептомицина (Gibco/Invitrogen, Carlsbad, СА) при 37°С в атмосфере 5% CO2. Клетки ТМЗ трансфектировали репортерной плазмидой pTA-8xGli-Luc. Отбирали стабильно трансфектированный клон TMHh-12 с высокой ответной реакцией на стимуляцию Shh-N. Для определения величины IC50 для антагонистов, 8000 клеток TMHh-12 помещали в каждую лунку 384-луночного планшета, содержащую среду 50% DMEM/F12, содержащую 2% ЭТС. Через 12 ч активировали путь Hh добавлением рекомбинантного белка Shh мыши (экспрессированного в E.coli, 8 мкг/мл) или добавлением агонистов Smo. Исследуемые соединения добавляли в планшет при различной концентрации. Через 48 ч активность люциферазы светляков определяли с использованием системы Bright-Glo™ для определения активности люциферазы (Promega, Madison, WI). Величины IC50 рассчитывали по концентрации соединения, при которой наблюдается снижение люминесцентного сигнала на 50%. Токсичность указанных соединений оценивали с использованием клеток ТМЗ и реагентов CellTiter Glo или линии клеток ТМ3-Luc (клетки ТМЗ, стабильно трансфектированные конститутивным вектором экспрессии люциферазы).
Значение ЕС50 для соединений формулы I предпочтительно составляет менее 500 нМ, более предпочтительно менее 200 нМ.
Определение цитотоксичности
Определение цитотоксичности проводили для сравнения действия соединения по настоящему изобретению на клетки медуллобластомы (клетки Daoy), клетки базальноклеточной карциномы (клетки ТЕ354.Т) и контрольные клетки (нормальные фибробласты человека) с использованием следующей методики:
Клетки Daoy (линия клеток медуллобластомы, АТСС) культивировали в среде Minimum essential medium (Eagle), содержащей 2 мМ L-глутамина и среды Earle BSS, содержащей 1,5 г/л бикарбонат натрия, 0,1 мМ незаменимые аминокислоты, 1,0 мМ пируват натрия и 10% ЭТС при 37°С в атмосфере 5% CO2.
Клетки ТЕ354.Т (АТСС) культивировали в среде Dulbecco, модифицированной среде Eagle, содержащей 4 мМ L-глутамина в ЭТС и 10% ЭТС.
Нормальные фибробластные клетки кожи человека (Clonetics) культивировали в среде Fibroblast Growth Medium (Clonetics).
Каждую из описанных выше линий клеток независимо высеивали в 96-луночные планшеты и культивировали до плотности 5000-10000 клеток в лунке. Соединение по настоящему изобретению при различных концентрациях добавляли в культуры клеток. Через 2 сут жизнеспособность клеток оценивали с использованием набора реагентов Cell Titer-Glo для люминесцентной оценки жизнеспособности клеток (Promega) по методике фирмы-изготовителя. Жизнеспособность клеток оценивали напрямую при измерении люминесцентного сигнала, величину ЕС50 рассчитывали по концентрации соединения, при которой наблюдается снижение сигнала на 50%.
Значение ЕС50 для соединений формулы I предпочтительно составляет менее 500 нМ, более предпочтительно менее 200 нМ.
Специалисту в данной области представляется очевидным, что примеры и варианты осуществления настоящего изобретения, описанные в данном контексте, представлены только для иллюстрации изобретения, и возможны различные модификации или изменения, которые включены в объем настоящего изобретения. Все ссылки, патенты и заявки на выдачу патентов, приведенные в данном описании, включены в данное описание в качестве ссылок.
Реферат
Изобретение относится к соединению формулы I: ! ! где Y1 и Y2 независимо выбирают из N и CR10, где R10 выбирают из группы, включающей водород, галоген, С1-С6алкил, галоген(С1-С6)алкил, R1 выбирают из группы, включающей водород, циано, галоген, С1-С6алкил, галоген(С1-С6)алкил, С1-С6алкокси, галоген(С1-С6)алкокси, диметиламино, С1-С6алкилсульфанил, диметиламиноэтокси и пиперазинил, замещенной вплоть до 2 радикалов С1-С6алкил, R2 и R5 независимо выбирают из группы, включающей водород, циано, галоген, С1-С6алкил, галоген(С1-С6)алкил, С1-С6алкокси, галоген(С1-С6)алкокси и диметиламино, R3 и R4 независимо выбирают из группы, включающей водород, галоген, циано, С1-С6алкил, галоген(С1-С6)алкил, С1-С6алкокси, или R1 и R5 вместе с фенилом, к которому они присоединены, образуют С5-С10гетероарил, R6 и R7 независимо выбирают из группы, включающей водород, С1-С6алкил, С1-С6алкокси и галоген(С1-С6)алкил, при условии, что R6 и R7 оба не означают водород, R8 выбирают из группы, включающей водород, галоген, С1-С6алкил, С1-С6алкокси и галоген(С1-С6)алкокси, R9 выбирают из -S(O)2R11, -C(O)R11, -NR12aR12b и -R11, где R11 выбирают из группы, включающей арил, циклоалкил и гетероциклоалкил, R12a и R12b независимо выбирают из С1-С6алкила и гидрокси(С1-С6)алкила, при этом указанный арил, гетероарил, циклоалкил и гетероциклоалкил в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей С1-С6алкил, галоген(C1-С6)алкил, С1-С6алкокси, галоген(С1-С6)алкокси, С6-С10арил(С0-С4)алкил, C5-С10гетероарил(С0-С4)алкил, С3-С12циклоалкил и С3-С8гетероциклоалкил, где указанный арилалкильный заместитель в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо в
Формула
где Y1 и Y2 независимо выбирают из N и CR10, где R10 выбирают из группы, включающей водород, галоген, C1-С6алкил, галоген(С1-С6)алкил,
R1 выбирают из группы, включающей водород, циано, галоген, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси, галоген(С1-С6)алкокси, диметиламино, C1-С6алкилсульфанил, диметиламиноэтокси и пиперазинил, замещенный вплоть до 2 радикалов C1-С6алкил,
R2 и R5 независимо выбирают из группы, включающей водород, циано, галоген, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси, галоген(С1-С6)алкокси и диметиламино,
R3 и R4 независимо выбирают из группы, включающей водород, галоген, циано, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси,
или R1 и R5 вместе с фенилом, к которому они присоединены, образуют C5-С10гетероарил,
R6 и R7 независимо выбирают из группы, включающей водород, C1-С6алкил, C1-С6алкокси и галоген(С1-С6)алкил, при условии, что R6 и R7 оба не означают водород,
R8 выбирают из группы, включающей водород, галоген, C1-С6алкил, C1-С6алкокси и галоген(С1-С6)алкокси,
R9 выбирают из -S(O)2R11, -C(O)R11, -NR12aR12b и -R11, где R11 выбирают из группы, включающей арил, циклоалкил и гетероциклоалкил, R12a и R12b независимо выбирают из C1-С6алкила и гидрокси(С1-С6)алкила,
при этом указанный арил, гетероарил, циклоалкил и гетероциклоалкил в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей C1-С6алкил, галоген(С1-С6)алкил, С1-C6алкокси, галоген(С1-С6)алкокси, С6-С10арил(С0-С4)алкил, C5-С10гетероарил(С0-С4)алкил, С3-С12циклоалкил и С3-С8гетероциклоалкил,
где указанный арилалкильный заместитель в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей галоген, циано, C1-С6алкил, галоген(С1-С6)алкил, C1-С6алкокси, галоген(С1-С6)алкокси, диметиламино и метилпиперазинил,
а также фармацевтически приемлемые соли, гидраты, сольваты и изомеры указанного соединения.
Y1 и Y2 выбирают из N и CR10, где R10 выбирают из группы, включающей водород, метил, хлор, фтор, бром и трифторметил,
R6 и R7 независимо выбирают из группы, включающей водород, метил, хлор, фтор, бром, трифторметил и метокси, при условии, что R6 и R7 оба не означают водород, и
R8 выбирают из группы, включающей водород, фтор, хлор, метил.
R2 и R5 независимо выбирают из группы, включающей водород, хлор, фтор, циано, метил, трифторметил, изопропилокси, метокси, этокси, трифторметокси и диметиламино, а
R3 и R4 независимо выбирают из группы, включающей водород, хлор, метил, метокси и циано, или R1 и R5 вместе с фенилом, к которому они присоединены, образуют хиноксалинил.
-S(O)2R11, -C(O)R11, -NR12aR12b и -R11, где R11 выбирают из группы, включающей тиоморфолино, сульфономорфолино, сульфаноморфолино, морфолино, циклогексил, фенил, азепан-1-ил, 2-оксопиперазин-1-ил, 1,4-оксазепан-4-ил, пиперидин-1-ил, тетрагидро-2Н-пиран-4-ил, пиперидин-3-ил, пиперазинил, пирролидинил и 1,4-диазепан-1-ил, a R12a и R12b независимо выбирают из изобутила, гидроксиэтила,
где указанный тиоморфолино, сульфономорфолино, сульфаноморфолино, морфолино, циклогексил, фенил, азепан-1-ил, 2-оксопиперазин-1-ил, 1,4-оксазепан-4-ил, пиперидин-1-ил, тетрагидро-2Н-пиран-4-ил, пиперидин-3-ил, пиперазинил, пирролидинил или 1,4-диазепан-1-ил в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей метил, этил, метокси, бензил, тиенилметил, пиридинилметил, бензо[d][1,3]диоксол-6-ил и 2,3-дигидробензо[b][1,4]диоксин-7-ил,
где указанный фенильный или бензильный заместитель в составе R9 необязательно содержит в качестве заместителей от 1 до 3 радикалов, независимо выбранных из группы, включающей метокси, этокси, метилпиперазинил, метил, трифторметокси, хлор, фтор и трифторметил.
[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-циано-2-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-метокси-2-метилбифенил-3-карбоновой кислоты,
(4-циклогексилфенил)амид 4'-метокси-2-метилбифенил-3-карбоновой кислоты,
[6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-метокси-2-метилбифенил-3-карбоновой кислоты,
(4-циклогексилфенил)амид 4'-диметиламино-2-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 4'-диметиламино-2-метилбифенил-3-карбоновой кислоты,
(6-[1,4]оксазепан-4-илпиридин-3-ил)амид 6-хлор-4'-диметиламинобифенил-3-карбоновой кислоты,
(6-морфолин-4-илпиридин-3-ил)амид 6-хлор-4'-диметиламинобифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-хлор-4'-диметиламинобифенил-3-карбоновой кислоты,
[6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 6-хлор-4'-метоксибифенил-3-карбоновой кислоты,
(6-[1,4]оксазепан-4-илпиридин-3-ил)амид 6-хлор-4'-метоксибифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-хлор-4'-метоксибифенил-3-карбоновой кислоты,
(6-морфолин-4-илпиридин-3-ил)амид 6-хлор-4'-метоксибифенил-3-карбоновой кислоты,
(6-морфолин-4-илпиридин-3-ил)амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты,
(6-[1,4]оксазепан-4-илпиридин-3-ил)амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты,
[6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты,
[6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-диметиламино-6-метилбифенил-3-карбоновой кислоты,
(6-[1,4]оксазепан-4-илпиридин-3-ил)амид 4'-диметиламино-6-метилбифенил-3-карбоновой кислоты,
(6-морфолин-4-илпиридин-3-ил)амид 4'-диметиламино-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-этокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-метил-4'-метилсульфанилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-диметиламино-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 3'-хлор-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 2',4'-дихлор-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 2'-хлор-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 3'-хлор-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 3',4'-дихлор-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 3'-хлор-6-метил-4'-трифторметилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6,4'-диметилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-этил-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-трет-бутил-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-метил-4'-пропилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-изобутил-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-изопропил-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6,2',6'-триметилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6,2',3'-триметилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-метил-4'-трифторметилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-метил-3'-трифторметибифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-метил-3',5'-бистрифторметилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 3'-изопропокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 3'-этокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 2',6'-диметокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-метил-4'-трифторметоксибифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 6-метил-3'-трифторметоксибифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 4'-метокси-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 3'-метокси-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 4'-(2-диметиламиноэтокси)-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 3'-диметиламино-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 4'-фтор-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 3'-фтор-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 2' -фтор-6-метилбифенил-3-карбоновой кислоты,
4-метил-N-(4-морфолин-4-илфенил)-3-хиноксалин-6-илбензамид,
(4-морфолин-4-илфенил)амид 6-метил-4'-(4-метилпиперазин-1-ил)бифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 2' -циано-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 3'-циано-6-метилбифенил-3-карбоновой кислоты,
(6-[1,4]оксазепан-4-илпиридин-3-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(3,4,5,6-тетрагидро-2Н-[1,2']бипиридинил-5'-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(6-морфолин-4-илпиридин-3-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-метилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(3-фтор-4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(3-хлор-4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(3-бром-4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(3-метил-4-морфолин-4-илфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(4-морфолин-4-ил-3-трифторметилфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(4-циклогексилфенил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
бифенил-4-иламид 4'-циано-6-метилбифенил-3-карбоновой кислоты, (4'-метоксибифенил-4-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[4-(4-бензилпиперазин-1-ил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[4-(пирролидин-1-сульфонил)фенил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-циано-6-метоксибифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-циано-2-метоксибифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-циано-2-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 3'-фтор-4'-метокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-изопропокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-бутокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 3'-хлор-4'-метокси-6-метилбифенил-3-карбоновой кислоты,
(6-азепан-1-илпиридин-3-ил)амид 4'-метокси-6,3'-диметилбифенил-3-карбоновой кислоты,
[4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-2-метилбифенил-3-карбоновой кислоты,
[4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-6-фторбифенил-3-карбоновой кислоты,
[4-(пиперидин-1-сульфонил)фенил]амид 6-бром-4'-цианобифенил-3-карбоновой кислоты,
[6-(4-бензил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-тиофен-3-илметил [1,4]диазепан-1-ил)пиридин-3-ил] амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-2-метилбифенил-3-карбоновой кислоты,
[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-метокси-2-метилбифенил-3-карбоновой кислоты,
[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметилбифенил-3-карбоновой кислоты,
[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты,
[6-(2-метилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-2-метилбифенил-3-карбоновой кислоты,
[4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-2-фторбифенил-3-карбоновой кислоты,
[4-(пиперидин-1-сульфонил)фенил]амид 4'-циано-6-трифторметилбифенил-3-карбоновой кислоты,
[6-(4-пиридин-4-илметил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-пиридин-3-илметил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6- [4-(2,6-диметоксибензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2-этоксибензил)-[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(6-{4-[2-(4-метилпиперазин-1-ил)бензил][1,4]диазепан-1-ил)пиридин-3-ил)амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(4-метокси-2,3-диметилбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2,3-дигидробензо[1,4]диоксин-6-илметил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-пиридин-2-илметил[1,4]диазепан-1-ил)пиридин-3-ил] амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-бензо[1,3]диоксол-4-илметил[1,4]диазепан-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2-трифторметоксибензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2-диметиламинобензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2-хлор-5-трифторметилбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2,3-дифторбензил)-[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2-хлор-4-фторбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2,6-дифторбензил)[1,4]диазепан-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[4-(пиперидин-1-сульфонил)фенил]амид 2-хлор-4'-цианобифенил-3-карбоновой кислоты,
[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-трифторметилбифенил-3-карбоновой кислоты,
[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-хлор-4'-цианобифенил-3-карбоновой кислоты,
[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 4'-циано-6-этилбифенил-3-карбоновой кислоты,
{6-[4-(3-фторбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(2-трифторметоксибензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(3-хлорбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(4-изобутилбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-[4-(4-трет-бутилбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(7-метоксибензо [1,3]диоксол-5-илметил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-бензилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-пиридин-3-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(4-дифторметоксибензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(4-цианобензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-хинолин-5-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-пиридин-4-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-пиридин-2-илметилупиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(4-имидазол-1-илбензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
{6-[4-(3-цианобензил)пиперазин-1-ил]пиридин-3-ил}амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
[6-(4-изохинолин-5-илметилпиперазин-1-ил)пиридин-3-ил]амид 4'-циано-6-метилбифенил-3-карбоновой кислоты,
(R)-2-метил-N-(6-(2-метилморфолино)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид,
4'-циано-2-метил-N-(6-сульфонилморфолинопиридин-3-ил)бифенил-3-карбоксамид,
(S)-4'-циано-2-метил-N-(6-(2-метилморфолино)пиридин-3-ил)бифенил-3-карбоксамид,
(R)-6-хлор-N-(6-(2-метилморфолино)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид,
4'-циано-2-метил-N-(6-сульфинилморфолинопиридин-3-ил)бифенил-3-карбоксамид,
4'-циано-N-(6-(диизобутиламино)пиридин-3-ил)-2-метилбифенил-3-карбоксамид,
4'-циано-N-(2-((2S,6R)-2,6-диметилморфолино)пиримидин-5-ил)-2-метилбифенил-3-карбоксамид,
N-(2-((2S,6R)-2,6-диметилморфолино)пиримидин-5-ил)-2-метил-4'-(трифторметил)бифенил-3-карбоксамид,
N-(2-((2S,6R)-2,6-диметилморфолино)пиримидин-5-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид,
N-(2-(бис(2-гидроксиэтил)амино)пиримидин-5-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид,
2-метил-N-(6-(тетрагидро-2Н-пиран-4-илокси)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид,
N-(5-хлор-6-((2S,6R)-2,6-диметилморфолино)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид,
N-(6-((2R,6S)-2,6-диметилтетрагидро-2Н-пиран-4-ил)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид,
N-(6-(4-этилпиперазин-1-карбонил)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид,
2-метил-N-(6-(2-оксопиперазин-1-ил)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид,
2-метил-N-(6-(1-(пиридин-4-илметил)пиперидин-4-ил)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид,
2-метил-N-(6-(2-оксо-4-(пиридин-4-илметил)пиперазин-1-ил)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид,
2-метил-N-(6-(1-(пиридин-4-илметил)пиперидин-3-ил)пиридин-3-ил)-4'-(трифторметокси)бифенил-3-карбоксамид и
N-(6-(1-этилпиперидин-3-ил)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид.

Комментарии