Производные тетрагидропиридина и их использование в качестве антибактериальных средств - RU2722594C1
Код документа: RU2722594C1
Описание
Область техники
По настоящей заявке испрашивается приоритет на основании 35 U.S.C. 119(e), предварительной заявки на патент США №62/400694, поданной 28 сентября 2016 г., содержание которой полностью включено в настоящую заявку посредством ссылки.
Настоящее изобретение относится к новым производным тетрагидропиридина, которые являются полезными для лечения бактериальных инфекций, особенно грамотрицательных инфекций. Настоящее изобретение также относится к способам применения таких соединений в лечении бактериальных инфекций у млекопитающих, к их применению для получения лекарственных средств для лечения бактериальных инфекций и к фармацевтическим композициям, содержащим такие соединения.
Уровень техники
Заражение грамотрицательными бактериями, такими как энтеробактерии, продуцирующие бета-лактамазы расширенного спектра действия, (ESBL), Pseudomonas aeruginosa и Acinetobacter baumannii, представляет собой серьезную проблему для здоровья, особенно в случае внутрибольничных инфекций. Кроме того, повышается уровень устойчивости к современной антибиотикотерапии, что серьезно ограничивает варианты лечения.
Грамотрицательные бактерии уникальны тем, что их наружная мембрана содержит липополисахарид (ЛПС), который имеет решающее значение для поддержания целостности мембраны и необходим для жизнеспособности бактерий (Rev. Biochem 76: 295-329, 2007). Основным липидным компонентом ЛПС является липид А, и ингибирование биосинтеза липида А является смертельным для бактерий. Липид А синтезируется на цитоплазматической поверхности внутренней мембраны бактерии посредством сигнального пути, который состоит из девяти различных ферментов. Эти ферменты являются высококонсервативными у большинства грамотрицательных бактерий. LpxC является ферментом, который катализирует первую коммитированную стадию в пути биосинтеза липида A, удаление N-ацетильной группы UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозамина. LpxC представляет собой Zn2+ зависимый фермент, который не имеет гомолога у млекопитающих, что делает его хорошей мишенью для разработки новых антибиотиков.
Раскрытие сущности изобретения
Техническая задача
Целью настоящего изобретения является предоставление производных тетрагидропиридина, способных ингибировать UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозамин деацетилазу (LpxC) и лечить инфекции, вызванные грамотрицательными бактериями, их стереоизомеров или их фармацевтически приемлемых солей.
Другой целью настоящего изобретения является предоставление способов получения этих соединений.
Еще одной целью настоящего изобретения является предоставление способов ингибирования UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозамин деацетилазу (LpxC), которые включают введение терапевтически эффективного количества соединений.
Еще одной целью настоящего изобретения является предоставление способов лечения инфекций, вызванных грамотрицательными бактериями, которые включают введение терапевтически эффективного количества соединений.
Еще одной целью настоящего изобретения является предоставление применения соединений для получения терапевтических лекарственных средств для лечения инфекций, вызванных грамотрицательными бактериями.
Еще одной целью настоящего изобретения является предоставление фармацевтических композиций для профилактики или лечения инфекций, вызванных грамотрицательными бактериями, которые содержат соединения.
Решение задачи
Авторы настоящего изобретения открыли новые производные тетрагидропиридина, которые обладают ингибирующей активностью по отношению к UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозамин деацетилазе (LpxC), и обнаружили, что эти соединения можно использовать для лечения инфекций, вызванных грамотрицательными бактериями, тем самым завершая настоящее изобретение.
Производные тетрагидропиридина
Для достижения вышеуказанных целей в настоящем изобретении предложено производное тетрагидропиридина, представленное следующей формулой I, его стереоизомер или его фармацевтически приемлемая соль:
[Формула I]

n равно 1, 2 или 3;
R1 представляет собой C1-C6 алкил или C1-C6 галогеналкил;
R2 представляет собой водород или C1-C6 алкил;
R3 представляет собой водород, C1-C6 алкил, C1-C6 алкокси, -OH или галоген;
L представляет собой C3-C7 циклоалкил, арил, гетероарил, либо отсутствует, где по меньшей мере один H C3-C7 циклоалкила, арила или гетероарила может быть замещен галогеном, C1-C6 алкилом, C1-C6 галогеналкилом, -NRARB или -OH;
D представляет собой C≡C, C3-C7 циклоалкил, арил, гетероарил, либо отсутствует, где по меньшей мере один H C3-C7 циклоалкила, арила или гетероарила может быть замещен галогеном, C1-C6 алкилом, C1-C6 галогеналкилом, -NRARB или -OH;
E представляет собой C≡C, C3-C7 циклоалкил, арил, гетероарил, либо отсутствует, где по меньшей мере один H C3-C7 циклоалкила, арила или гетероарила может быть замещен галогеном, C1-C6 алкилом, C1-C6 галогеналкилом, -NRARB или -OH;
G представляет собой C1-C6 алкил, C3-C7 циклоалкил, 4-6-членный гетероциклоалкил, арил или гетероарил,
где по меньшей мере один H C1-C6 алкила может быть замещен галогеном, -NRARB, -OH или -ORC,
по меньшей мере один H C3-C7 циклоалкила или 4-6-членного гетероциклоалкила может быть замещен C1-C6 алкилом, C1-C6 алкил-NRARB, C1-C6 гидроксиалкилом, C1-C6 галогеналкилом, C1-C6 алкокси, C1-C6 алкил-ORC, -NRARB, -OH, -(C=O)-C1-C6 алкилом или -S(=O)2-C1-C6 алкилом,
по меньшей мере один H арила или гетероарила может быть замещен C1-C6 алкилом, C1-C6 гидроксиалкилом, C1-C6 алкил-NRARB, галогеном, нитро, циано, -NRARB, -OH, -ORC, -S(=O)2-C1-C6 алкилом, -S(=O)2-NRARB или -N-S(=O)2-C1-C6 алкилом;
RAи RB, каждый независимо, представляют собой водород или C1-C6 алкил, или RAи RB могут быть связаны вместе с образованием 4-6-членного кольца, где 4-6-членное кольцо может иметь атом O или S и по меньшей мере один H 4-6-членного кольца может быть замещен галогеном, -OH или C1-C6 гидроксиалкилом;
RCпредставляет собой C1-C6 алкил, C1-C6 гидроксиалкил, -(C=O)-NRDRE или -S(=O)2-C1-C6 алкил; и
RDи RE, каждый независимо, представляют собой водород или C1-C6 алкил.
В одном аспекте
n равно 1 или 2;
R1 представляет собой C1-C6 алкил;
R2 представляет собой C1-C6 алкил;
R3 представляет собой водород;
L представляет собой арил, гетероарил, либо отсутствует, где по меньшей мере один H арила или гетероарила может быть замещен галогеном, C1-C6 алкилом или C1-C6 галогеналкилом;
D представляет собой C≡C, либо отсутствует;
E представляет собой C≡C, либо отсутствует;
G представляет собой C1-C6 алкил, C3-C7 циклоалкил, 4-6-членный гетероциклоалкил, арил или гетероарил,
где по меньшей мере один H C1-C6 алкила может быть замещен галогеном, -NRARB, -OH или -ORC,
по меньшей мере один H 4-6-членного гетероциклоалкила может быть замещен C1-C6 алкилом, -(C=O)-C1-C6 алкилом или -S(=O)2-C1-C6 алкилом,
по меньшей мере один H арила или гетероарила может быть замещен C1-C6 алкилом, C1-C6 гидроксиалкилом, C1-C6 алкил-NRARB, галогеном, нитро, циано, -NRARB, -OH, -ORC, -S(=O)2-C1-C6 алкилом или -S(=O)2-NRARB;
RAи RB, каждый независимо, представляют собой водород или C1-C6 алкил, или RAи RBмогут быть связаны вместе с образованием 4-6-членного кольца, где 4-6-членное кольцо может иметь атом O и по меньшей мере один Н из 4-6-членного кольца может быть замещен С1-С6 гидроксиалкилом;
RCпредставляет собой C1-C6 алкил, C1-C6 гидроксиалкил, -(C=O)-NRDRE или -S(=O)2-C1-C6 алкил; и
RDи RE, каждый независимо, представляют собой водород.
В другом аспекте
n равно 1 или 2;
R1 представляет собой C1-C6 алкил;
R2 представляет собой C1-C6 алкил;
R3 представляет собой водород;
L представляет собой фенил, пиридинил, либо отсутствует, где по меньшей мере один Н фенила или пиридинила может быть замещен галогеном, C1-C6 алкилом или C1-C6 галогеналкилом;
D представляет собой C≡C, либо отсутствует;
E представляет собой C≡C, либо отсутствует;
G представляет собой C1-C6 алкил, C3-C6 циклоалкил, 4-6-членный гетероциклоалкил, фенил, пиридинил, фуранил, тиофенил или имидазолил,
где по меньшей мере один H C1-C6 алкила может быть замещен галогеном, -NRARB, -OH или -ORC,
по меньшей мере один H 4-6-членного гетероциклоалкила может быть замещен C1-C6 алкилом, -(C=O)-C1-C6 алкилом или -S(=O)2-C1-C6 алкилом,
по меньшей мере один H фенила, пиридинила, фуранила, тиофенила или имидазолила может быть замещен C1-C6 алкилом, C1-C6 гидроксиалкилом, C1-C6 алкил-NRARB, галогеном, нитро, циано, -NRARB, -OH, -ORC, -S(=O)2-C1-C6 алкилом или -S(=O)2-NRARB;
RAи RB, каждый независимо, представляют собой водород или C1-C6 алкил, или RAи RBмогут быть связаны вместе с образованием 4-6-членного кольца, где 4-6-членное кольцо может иметь атом O по меньшей мере один Н из 4-6-членного кольца может быть замещен С1-С6 гидроксиалкилом;
RC представляет собой C1-C6 алкил, C1-C6 гидроксиалкил, -(C=O)-NRDRE или -S(=O)2-C1-C6 алкил; и
RDи RE, каждый независимо, представляют собой водород.
Как используется в настоящем описании, включая формулу изобретения, следующие термины имеют значение, определенное ниже, если специально не указано иное.
Термин «алкил» относится к углеводороду с разветвленной или прямой цепью, содержащему от 1 до 10 атомов углерода, если не указано иное. Типичные примеры алкила включают, но не ограничиваются этим, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, н-гептил, н-октил, н-нонил или н-децил.
Термин «алкокси» относится к атому водорода гидроксильной группы, замещенному алкилом. Типичные примеры алкокси включают, но не ограничиваются им, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, пентилокси, неопентилокси или изопентилокси.
Термин «алкинил» относится к углеводородной группе с прямой цепью, содержащей от 2 до 10 атомов углерода, и содержащей по меньшей мере одну тройную углерод-углеродную связь. Типичные примеры алкинила включают, но не ограничиваются ими, ацетилен, пропинил, бутинил, пентинил, гексинил или гептинил.
Термин «арил» относится к моно-, би- или другой мультикарбоциклической ароматической кольцевой системе. Типичные примеры арила включают, но не ограничиваются ими, фенил, бифенил, нафтил, а также бензоконденсированные карбоциклические группы.
Термин «гетероарил» относится к моно-, би- или другой мультикарбоциклической ароматической кольцевой системе, содержащей один или несколько гетероатомов, выбранных из О, N или S. Типичные примеры гетероарила включают, но не ограничиваются ими, пирролил, имидазолил, пиразолил, триазолил, тетразолил, фурил, фуранил, тиофенил, пиридинил, пиримидинил, оксазолил, оксадиазолил, изоксазолил, индолили, хинолил, изохинолил, бензимидазолил, бензотиенил или бензофурил.
Термин «циклоалкил» относится к насыщенному циклическому углеводородному кольцу с 3-8 атомами углерода. Типичные примеры циклоалкила включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил или циклогексил.
Термин «гетероциклическая» относится к циклической группе, содержащей один или несколько гетероатомов, выбранных из O, N или S. Типичные примеры гетероциклических групп включают, но не ограничиваются ими, азетидинил, тетрагидрофуранил, имидазолидинил, пирролидинил, пиперидинил, пиперазинил, оксазолидинил, тиазолидинил, пиразолидинил, морфолинил, тиоморфолинил, оксазинил или тетрагидропиридинил.
Термин «фармацевтически приемлемый» означает, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, составляющими препарат, и/или с млекопитающим, которого лечат этим препаратом.
Термин «стереоизомер» означает соединения, которые обладают одним или несколькими хиральными центрами, и каждый центр может существовать в R или S конфигурации. Стереоизомеры включают все диастереомерные, энантиомерные и эпимерные формы, а также рацематы и их смеси.
В некотором аспекте новые производные тетрагидропиридина выбраны из группы, состоящей из следующих соединений:
1) 4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
2) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(фенилэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
3) N-гидрокси-4-(4-(4-((4-метоксифенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
4) 4-(4-(4-(циклопропилэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
5) N-гидрокси-4-(4-(4-(4-гидроксибут-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
6) 4-(4-(4-(гекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
7) 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
8) N-гидрокси-4-(4-(4-(3-гидроксибут-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
9) 4-(4-(4-(циклопентилэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
10) 4-(4-(4-(циклогексилэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
11) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(пент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
12) 4-(4-(4-(3-циклогексилпроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
13) N-гидрокси-2-метил-4-(4-(4-(4-метилпент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутанамид;
14) 4-(4-(4-(5-хлорпент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
15) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(3-(пирролидин-1-ил)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
16) 4-(4-(4-(3-(диэтиламино)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
17) N-гидрокси-4-(4-(4-(3-((S)-2-(гидроксиметил)пирролидин-1-ил)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
18) N-гидрокси-4-(4-(4-(5-гидроксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
19) 5-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил метансульфонат;
20) 4-(4-(4-(5-(диметиламино)пент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
21) 4-(4-(4-(5-аминопент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
22) N-гидрокси-4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
23) N-гидрокси-4-(4-(4-(3-метоксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
24) N-гидрокси-4-(4-(4-(3-(3-гидроксипропокси)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
25) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(3-морфолинопроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
26) 3-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)проп-2-ин-1-ил карбамат;
27) 5-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил карбамат;
28) N-гидрокси-4-(4-(4-(5-метоксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
29) N-гидрокси-4-(4-(4-(6-гидроксигекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
30) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(6-морфолиногекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
31) 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
32) 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3,5-дифторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
33) 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-2-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
34) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(тиофен-2-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
35) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-((4-нитрофенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
36) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-3-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
37) N-гидрокси-4-(4-(4-((4-гидроксифенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
38) N-гидрокси-2-метил-4-(4-(4-((1-метил-1H-имидазол-4-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутанамид;
39) N-гидрокси-2-метил-4-(4-(4-((1-метилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутанамид;
40) 4-(4-(4-((1-ацетилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
41) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-((1-(метилсульфонил)азетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
42) 4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
43) 4-(4-(3-фтор-4-(6-гидроксигекса-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
44) 4-(4-(4-(циклопропилбута-1,3-диин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
45) 4-(4-(4-(5-(диметиламино)пента-1,3-диин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
46) N-гидрокси-4-(4-(4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
47) N-гидрокси-4-(4-(4-(6-гидроксигекса-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
48) N-гидрокси-4-(4-(4-(5-гидроксипента-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
49) 4-(4-(4-(5-(диметиламино)пента-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
50) N-гидрокси-4-(4-(4-(5-метоксипента-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
51) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(фенилбута-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
52) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(пиридин-4-илэтинил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
53) 4-(4-((4-бромфенил)этинил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
54) N-гидрокси-4-(4-(7-гидроксигепта-1,3-диин-1-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
55) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
56) 4-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
57) 4-(4-(4'-хлор-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
58) 4-(4-(4'-фтор-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
59) N-гидрокси-4-(4-(4'-гидрокси-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
60) 4-(4-(3'-фтор-4'-метокси-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
61) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-3-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
62) 4-(4-(4-(6-фторпиридин-3-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
63) 4-(4-(4-(фуран-3-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
64) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4'-(метилсульфонил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
65) N-гидрокси-4-(4-(4'-(гидроксиметил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
66) 4-(4-(4'-циано-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
67) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4'-пентил-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
68) 4-(4-(4'-(азетидин-1-илсульфонил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
69) 4'-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)-[1,1'-бифенил]-4-ил метансульфонат;
70) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(тиофен-3-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
71) N-гидрокси-4-(4-(4-(3-метокситиофен-2-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
72) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(4-метилтиофен-2-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
73) 4-(4-(4'-(этилсульфонил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид;
74) N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4'-(морфолинометил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)бутанамид;
75) N-гидрокси-4-(6-(3-метоксипроп-1-ин-1-ил)-3',6'-дигидро-[3,4'-бипиридин]-1'(2'H)-ил)-2-метил-2-(метилсульфонил)бутанамид;
76) 3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)пропанамид;
77) 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-метилфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид; и
78) 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-(трифторметил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид.
В настоящем изобретении фармацевтически приемлемые соли предпочтительно представляют собой кислотно-аддитивные соли, образованные с фармацевтически приемлемыми свободными кислотами. Свободные кислоты, которые могут быть использованы в настоящем изобретении, включают органические кислоты и неорганические кислоты. Неорганические кислоты включают хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, фосфорную кислоту и т.п., и органические кислоты включают лимонную кислоту, щавелевую кислоту, уксусную кислоту, молочную кислоту, малеиновую кислоту, кумаровую кислоту, глюконовую кислоту, метансульфоновую кислоту, гликолевую кислоту, янтарную кислоту, 4-толуолсульфоновую кислоту, трифторуксусную кислоту, глутаминовую кислоту, аспарагиновую кислоту и т.п.
Кроме того, соединения формулы I или их фармацевтически приемлемые соли могут проявлять полиморфизм и также могут существовать в виде сольватов (например, гидратов и т.п.). Кроме того, соединения по настоящему изобретению также могут существовать в виде отдельного стереоизомера или смесей стереоизомеров.
Способы получения производных тетрагидропиридина
Настоящее изобретение предоставляет способы получения производных тетрагидропиридина формулы I, их стереоизомеров или их фармацевтически приемлемых солей.
Соединения по настоящему изобретению могут быть получены в соответствии с одной или несколькими схемами, рассматриваемыми ниже.
Эти способы могут быть использованы либо непосредственно, либо с очевидными вариациями квалифицированным химикам для получения ключевых промежуточных продуктов и некоторых соединений настоящего изобретения
Подходящие синтетические последовательности легко выбираются в соответствии с конкретными структурами настоящего изобретения, но в пределах уровня техники, известного специалистам в области органического синтеза, таким как способ, обобщенный в доступных базах данных химии, как в CAS Scifinder и Elesvier Reaxys. На основании этих общих способов, возможность получения соединений по настоящему изобретению является простой и может быть применена в рамках общих профессиональных знаний.
Некоторые общие способы синтеза для получения соединений по настоящему изобретению проиллюстрированы ниже.
[Общий способ 1]

a) Et3N, DMF; b) бороновая кислота, Pd(PPh3)2Cl2, K2CO3, 1,4-Диоксан, H2O, нагрев или ацетилен, Pd(PPh3)2Cl2, Et3N, CuI, DMF, нагрев; c) LiOH, THF, MeOH, H2O; d) HATU, HOBT, Et3N, NH2-OTHP, DMF; f) HCl, MeOH
[Общий способ 2]

a) Pd(PPh3)2Cl2, K2CO3, 1,4-Диоксан, H2O, нагрев; b) TFA, Дихлорметан; c) Et3N, DMF; d) LiOH, THF, MeOH, H2O; e) HATU, HOBT, Et3N, NH2-OTHP, DMF; f) HCl, MeOH
Применение производных тетрагидропиридина
Настоящее изобретение предоставляет фармацевтическую композицию для профилактики или лечения бактериальных инфекций, которая содержит фармацевтически приемлемый носитель и в качестве активного ингредиента соединение, представленное следующей формулой I, его стереоизомер или его фармацевтически приемлемую соль:
[Формула I]
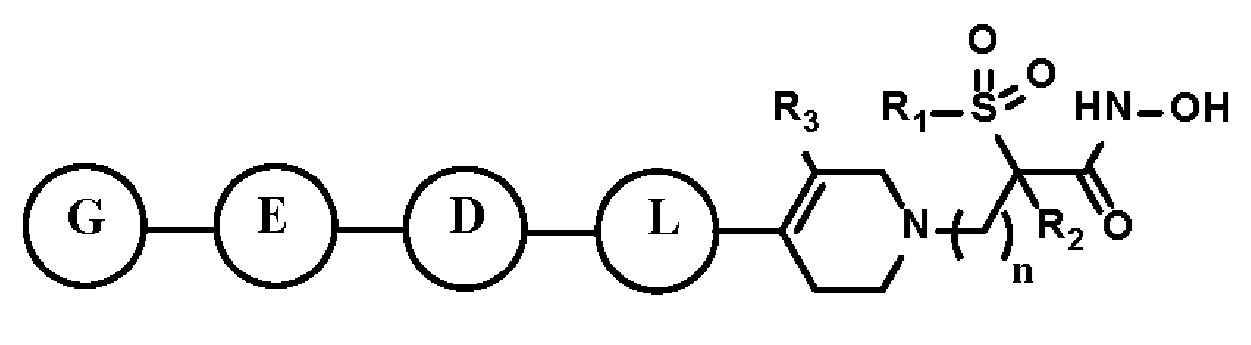
где формула I такая, как определено выше.
Соединения формулы I по настоящему изобретению, их стереоизомеры или их фармацевтически приемлемые соли проявляют антибактериальную активность, особенно в отношении грамотрицательных организмов, и, следовательно, подходят для лечения бактериальных инфекций у млекопитающих, особенно человека. Поэтому их можно использовать для профилактики или лечения бактериальной инфекции, вызванной грамотрицательными бактериями, особенно инфекции, вызванной чувствительными и с множественной лекарственной устойчивостью грамотрицательными бактериями. Примеры таких грамотрицательных бактерий включают Acinetobacter baumannii, Acinetobacter spp., Achromobacter spp., Aeromonas spp., Bacteroides spp., Bordetella spp., Borrelia spp., Brucella spp., Campylobacter spp., Chlamydia spp., Citrobacter spp., Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Francisella tularensis, Fusobacterium spp., Haemophilus influenza (бета-лактамаза положительные и отрицательные), Helicobacter pylori, Klebsiella oxytoca, Klebsiella pneumoniae (в том числе кодирующие бета-лактамазы расширенного спектра (в дальнейшем "ESBL")), Legionella pneumophila, Moraxella catarrhalis (beta-lactamase positive and negative), Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitides, Proteus vulgaris, Porphyromonas spp., Prevotella spp., члены Enterobacteriaceae, которые экспрессируют ESBL KPC, CTX-M, металло-бета-лактамазы и бета-лактамазы AmpC-типа, которые придают устойчивость к доступным в настоящее время цефалоспоринам, цефамицинам, карбапенемам и комбинации бета-лактам/ингибитор бета-лактамазы, Mannheimia haemolyticus, Pasteurella spp., Proteus mirabilis, Providencia spp., Pseudomonas aeruginosa (включая цефтазидим-, цефпиром- и цефепим-устойчивые P. Aeruginosa, карбапенем-устойчивые P. aeruginosa или хинолон-устойчивые P. aeruginosa), Pseudomonas spp., Salmonella spp., Shigella spp., Serratia marcescenes, Treponema spp., Burkholderia cepacia, Vibrio spp., Yersinia spp., и Stenotrophomonas maltophilia.
В более конкретном варианте осуществления примеры таких грамотрицательных бактерий включают Acinetobacter baumannii, Acinetobacter spp., Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Klebsiella oxytoca, Klebsiella pneumoniae, Serratia marcescens, Pseudomonas aeruginosa и представителей Enterobacteriaceae и Pseudomonas, которые экспрессируют ESBL, KPS, CTX-M, металло-бета-лактамазы и бета-лактамазы типа AmpC, которые придают устойчивость к доступным в настоящее время цефалоспоринам, цефамицинам, карбапенемам и комбинациям бета-лактам/ингибитор бета-лактамазы.
Таким образом, соединения формулы I по настоящему изобретению или их стереоизомеры или фармацевтически приемлемые соли могут быть использованы для профилактики или лечения бактериальной инфекции, выбранной из внутрибольничной пневмонии, инфекций мочевыводящих путей, системных инфекций (таких как бактериемия и сепсис), инфекций кожи и мягких тканей, хирургических инфекций, интраабдоминальных инфекций, инфекций легких (в том числе у пациентов с муковисцидозом), эндокардита, синдрома диабетической стопы, остеомиелита и инфекций центральной нервной системы.
Соединения формулы I по настоящему изобретению или стереоизомеры проявляют внутренние антибактериальные свойства и обладают способностью улучшать проницаемость внешней мембраны грамотрицательных бактерий для других антибактериальных средств. Их применение в комбинации с другим антибактериальным средством может дать некоторые дополнительные преимущества, такие как снижение побочных эффектов лекарств из-за более низких доз или более короткое временя лечения, более быстрое излечение от инфекции, сокращение пребывания в стационаре, увеличение спектра контролируемых патогенных микроорганизмов и снижение частоты развития резистентности к антибиотикам. Антибактериальное средство для применения в комбинации с соединением формулы I по настоящему изобретению будет выбран из группы, состоящей из антибиотика пенициллинового ряда (такого как ампициллин, пиперациллин, пенициллин G, амоксициллин или тетрациллин), цефалоспоринового антибиотика (такого как цефтриаксон, цефтазидим, цефепим, цефотаксим), антибиотика класса карбапенемов (например, имипенем или меропенем), антибиотика монобактама (например, азтреонам), антибиотика фторхинолонового ряда (например, ципрофлоксацин, моксифлоксацин или левофлоксацин), макролидного антибиотика (например, эритромицин или азитромицин), аминогликозидного антибиотика (такого как амикацин, гентамицин или тобрамицин), гликопептидного антибиотика (такого как ванкомицин или тейкопланин), тетрациклиновых антибиотиков (таких как тетрациклин) и линезолида, клиндамицина, телаванцина, даптомицина, новобиоцина, рифампицина и полимиксина.
Для того, чтобы проявить эту антибактериальную активность, соединения должны вводиться в терапевтически эффективном количестве. «Терапевтически эффективное количество» предназначено для описания достаточного количества соединения для лечения инфекции при разумном соотношении польза/риск, применимом к любому такому медицинскому лечению. Однако должно быть понятно, что лечащий врач в рамках здравого медицинского решения будет определять общую суточную дозу соединения. Конкретный терапевтически эффективный уровень дозы для любого конкретного пациента будет зависеть от множества факторов, включая заболевание, подлежащее лечению, и тяжесть заболевания; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и питание пациента; время введения; продолжительность лечения; лекарственные средства, используемые в комбинации или одновременно с конкретным применяемым соединением; и подобные факторы, хорошо известные в медицине. Однако в качестве общего руководства общая дневная доза обычно составляет от примерно 0,1 мг/кг/сутки до примерно 5000 мг/кг/сутки в однократной или разделенных дозах. Как правило, дозы для людей будут варьироваться от примерно 10 мг до примерно 3000 мг в день, в однократной или многократных дозах.
Любой путь, обычно используемый для лечения инфекционных заболеваний, включая пероральный, парентеральный, местный, ректальный, трансмукозальный и интестинальный, может быть использован для введения соединений. Парентеральные введения включают инъекции для создания системного эффекта или инъекции непосредственно в пораженную область. Примерами парентеральных способов введения являются подкожные, внутривенные, внутримышечные, внутрикожные, интратекальные и интраокулярные, интраназальные, внутриветрикулярные инъекции или инфузии. Местные введения включают лечение областей, легко доступных для местного применения, таких как, например, глаза, уши, включая инфекции наружного и среднего уха, влагалище, открытая рана, кожа, включая поверхность кожи и нижние кожные структуры, или другие нижние отделы кишечного тракта. Трансмукозальное введение включает назальные аэрозоли или ингаляции.
Настоящее изобретение также относится к способу ингибирования UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозамин деацетилазы (LpxC), включающему введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения, представленного формулой I, его стереоизомера или его фармацевтически приемлемой соли по настоящему изобретению. В некоторых вариантах осуществления настоящее изобретение предоставляет способ ингибирования UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозамин деацетилазы (LpxC), включающий контакт клетки (например, in vivo или in vitro) с терапевтически эффективным количеством соединения, представленного формулой I, его стереоизомера или его фармацевтически приемлемой соли в соответствии с настоящим изобретением.
Настоящее изобретение также предоставляет способ лечения бактериальных инфекций, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения, представленного формулой I, его стереоизомера или его фармацевтически приемлемой соли по настоящему изобретению.
Настоящее изобретение также предоставляет применение соединения, представленного формулой I, его стереоизомера или его фармацевтически приемлемой соли в соответствии с настоящим изобретением при приготовлении лекарственного средства для лечения бактериальных инфекций.
Полезные эффекты изобретения
Соединения, представленные формулой I, их стереоизомеры или их фармацевтически приемлемые соли в соответствии с настоящим изобретением могут демонстрировать превосходные эффекты при лечении бактериальных инфекций.
Принцип изобретения
Примеры
Варианты осуществления настоящего изобретения описаны в следующих примерах, которые предназначены для иллюстрации, а не для ограничения объема настоящего изобретения. Общие сокращения, хорошо известные специалистам в области синтеза, используются по всему описанию.
Все химические реагенты были коммерчески доступными. Колоночная флэш-хроматография означает хроматографию на силикагеле, если не указано иное, которую проводили на системе Teledyne Combiflash-RF-200.1H ЯМР спектр (δ,ppm) записывали на приборе 400 МГц или 600 МГц. Приведены данные масс-спектроскопии для метода положительной ионизации.
Получение 1: Синтез промежуточного соединения 1 {метил-4-бром-2-метил-2-(метилсульфонил)бутаноат}

Стадия 1: Синтез метил-2-(метилсульфонил)пропаноата
К раствору метил-2-хлорпропионата (150 г, 1 экв.) в MeOH (500 мл)добавляли метансульфинат натрия (162 г, 1,3 экв.) и перемешивали в течение 20 часов при 77°C. Смесь охлаждали до комнатной температуры, и осажденное твердое вещество отфильтровывали через целит. Фильтрат концентрировали в вакууме и остаток суспендировали в этилацетате (100 мл)/гексане (500 мл). После этого выпавшее в осадок твердое вещество отфильтровывали и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (162 г, 80%).
1H ЯМР (600 МГц, CDCl3-d1);δ 3,90 (кв, J=7,2 Гц, 1H), 3,82 (с, 3H), 3,03 (с, 3H), 1,66 (д, J=6,6 Гц, 3H).
Стадия 2: Синтез метил-4-бром-2-метил-2-(метилсульфонил)бутаноата
К суспендированному раствору гидрида натрия (60%, 33,7 г, 2 экв.) в DMF (300 мл) по каплям добавляли метил-2-(метилсульфонил)пропаноат (70 г, 1 экв.) в DMF (100 мл) при 0°C и и перемешивали в течение 30 мин. После этого к смеси добавляли 1,2-дибромэтан (158 г, 2 экв.) и перемешивали в течение 6 часов при комнатной температуре. Смесь гасили насыщ. водн. NH4Cl, экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (225 мг, 43%).
1H ЯМР (600 МГц, CDCl3-d1);δ3,81 (с, 3H), 3,49-3,45(м, 1H), 3,35-3,31 (м, 1H), 3,01 (с, 3H). 2,78-2,73 (м, 1H), 2,53-2,48 (м, 1H), 1,62 (с, 3H)
Получение 2: Синтез промежуточного соединения 2 {метил-4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноат}
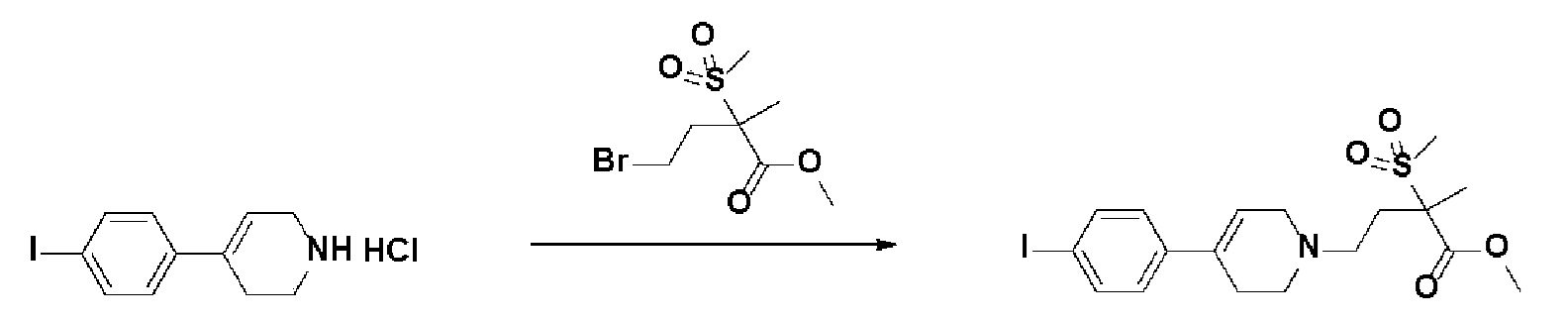
К раствору 4-(4-иодфенил)-1,2,3,6-тетрагидропиридин гидрохлорида (10 г, 1 экв.) в смеси DMF (100 мл)/ MeOH (50 мл) добавляли метил-4-бром-2-метил-2-(метилсульфонил)бутаноат (12,74 г, 1,5 экв.), N,N-диизопропилэтиламин (16,3 мл, 3 экв.) и перемешивали в течение 24 часов при 60oC. Смесь охлаждали до комнатной температуры, экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (11 г, 74%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,68 (д, J=7,8 Гц, 2H), 7,10 (д, J=8,4 Гц, 2H), 5,98 (с, 1H), 4,20-4,14 (м, 1H), 3,88 (д, J=6,0 Гц, 3H), 3,72-3,66 (м, 1H), 3,62-3,48 (м, 2H), 3,46-3,36 (м, 1H), 3,30-3,14 (м, 2H), 3,13 (д, J=6,6 Гц, 3H), 2,94-2,84 (м, 1H), 2,80-2,65 (м, 2H), 1,76 (д, J=6,6 Гц, 3H).
Получение 3: Синтез промежуточного соединения 3 {4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамид}

Стадия 1: Синтез 4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановой кислоты
К раствору метил-4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (2 г, 1 экв.) в смеси THF (8 мл)/MeOH (2 мл) добавляли раствор 2N-LiOH (12,6 мл, 3 экв.) и перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении, и остаток разбавляли водой (10 мл), доводили значение pH до 4,0. Воду концентрировали в вакууме и остаток подвергали колоночной хроматографии с получением указанного в заголовке соединения (1,76 г, 91%).
1H ЯМР (600 МГц, DMSO-d6);δ 7,72-7,70 (м, 2H), 7,28-7,26 (м, 2H), 6,21 (с, 1H), 3,68-3,64 (м, 2H), 3,25-3,01 (м, 4H), 2,65-2,62 (м, 2H), 2,29-2,19 (м, 2H), 1,45 (с, 3H).
Стадия 2: Синтез 4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида
К раствору 4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановой кислоты (1,76 г, 1 экв.) в DMF (10 мл) добавляли HATU (1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфат) (2,02 г, 1,4 экв.), HOBT (Гидроксибензотриазол) (0,81 г, 1,4 экв.), Et3N (1,6 мл, 3 экв.), O-(тетрагидро-2H-пиран-2-ил)гидроксиламин гидрохлорид (1,17 г, 2 экв.) и перемешивали в течение 1 часа при комнатной температуре. Смесь экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (0,6 г, 28%).
1H ЯМР (600 МГц, DMSO-d6);δ11,58 (ушир.с, 1H), 7,66-7,64 (м, 2H), 7,22-7,20 (м, 2H), 6,17 (с, 1H), 4,85-4,81 (м, 1H), 3,31-3,04 (м, 5H), 2,60-2,59 (м, 2H), 2,47-2,39 (м, 6H), 1,85-1,62 (м, 2H), 1,47-1,41 (с, 7H).
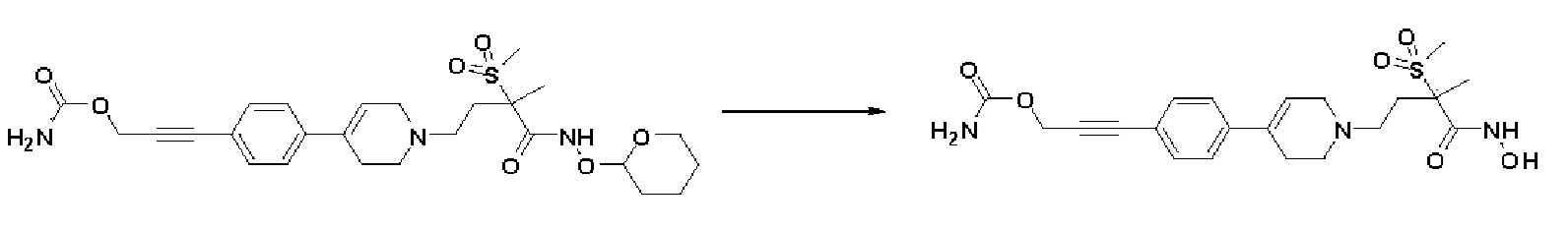
Пример 1: Синтез 4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез метил-4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата

К раствору метил-4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (промежуточное соединение 2) (500 мг, 1 экв.) в смеси THF (10 мл)/толуол (10 мл) добавляли CuI (20 мг, 0,1 экв.), Pd(PPh3)2Cl2 (74 мг, 0,1 экв.), Et3N (0,442 мл, 3 экв.) и 4-этинил-N,N-диметиланилин (228 мг, 1,5 экв.) и перемешивали в течение 12 часов при комнатной температуре. Смесь экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (225 мг, 43%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,43 (д, J=8,4 Гц, 2H), 7,39 (д, J=9 Гц, 2H), 7,32 (д, J=9 Гц, 2H), 6,65 (д, J=8,4 Гц, 2H), 6,08 (с, 1H), 3,87 (с, 3H), 3,24-3,22 (м, 1H), 3,07-3,05 (м, 1H), 3,04 (с, 3H), 2,98 (с, 6H), 2,82-2,76 (м, 1H), 2,67-2,56 (м, 4H), 2,62-2,58 (м, 2H), 2,03-2,00 (м, 1H), 1,63 (с, 3H).
MS (ESI, m/z): 495,3 [M+H]+.
Стадия 2: Синтез 4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановой кислоты

К раствору метил-4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (225 мг, 1 экв.) в смеси THF (8 мл)/ MeOH (2 мл) добавляли раствор 2N-LiOH (0,68 мл, 3 экв.) и перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении, и остаток разбавляли водой (6 мл), доводили значение pH до 4,0. Осажденное твердое вещество отфильтровывали с получением указанного в заголовке соединения (190 мг, 87%), которое использовали на следующей стадии без дополнительной очистки.
MS (ESI, m/z): 481,2 [M+H]+.
Стадия 3: Синтез 4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида

К раствору 4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановая кислота (190 мг, 1 экв.) в DMF (10 мл) добавляли HATU (210 мг, 1,4 экв.), HOBT (85 мг, 1,4 экв.), Et3N (0,17 мл, 3 экв.), O-(тетрагидро-2H-пиран-2-ил)гидроксиламин гидрохлорид (121 мг, 2 экв.) и перемешивали в течение 1 часа при комнатной температуре. Смесь экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (200 мг, 87%).
MS (ESI, m/z): 580,3 [M+H]+.
Стадия 4: Синтез 4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

К раствору 4-(4-(4-((4-(диметиламино)фенил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида (200 мг, 1 экв.) в MeOH (6 мл) добавляли раствор HCl в MeOH (1,25 н, 0,83 мл, 3 экв.) и перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении и остаток разбавляли водой (6 мл), доводили значение pH до 7,0. Воду концентрировали в вакууме, и полученный остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (40 мг, 24%).
1H ЯМР (600 МГц, DMSO-d6);δ 11,02 (ушир.с, 1H), 9,08 (ушир.с, 1H), 7,42-7,39 (м, 4H), 7,32 (д, J=8,4 Гц, 2H), 6,68 (д, J=9 Гц, 2H), 6,21 (с, 1H), 3,12-3,08 (м, 2H), 3,04 (с, 3H), 2,92 (с, 6H), 2,67-2,56 (м, 2H), 2,47-2,39 (м, 4H), 2,36-2,28 (м, 1H), 1,85-1,80 (м, 1H), 1,44 (с, 3H).
MS (ESI, m/z): 496,2 [M+H]+.
[Примеры 2-14]
Концевые ацетилены, перечисленные в следующей таблице, использовали для получения соединений примеров 2-14 таким же образом, как в примере 1.
Пример 15: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(3-(пирролидин-1-ил)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида

Стадия 1: Синтез 1-(проп-2-ин-1-ил)пирролидина

К раствору пирролидина (1,5 мл, 1 экв.) в толуоле (30 мл) добавляли K2CO3 (4,97 г, 2 экв.) и 3-бромпроп-1-ин (2,4 мл, 1,5 экв.). Смесь перемешивали в течение 15 часов при комнатной температуре и отфильтровывали, и фильтрат концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (0,32 г, 16%).
MS (ESI, m/z): 110,1 [M+H]+.
Стадия 2: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(3-(пирролидин-1-ил)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, с использованием 1-(проп-2-ин-1-ил)пирролидина.
1H ЯМР (600 МГц, DMSO-d6);δ11,03 (ушир.с, 1H), 9,14 (ушир.с, 1H), 7,45-7,36 (м, 4H), 6,22 (с, 1H), 3,63 (с, 2H), 3,18-3,04 (м, 5H), 2,70-2,56 (м, 6H), 2,48-2,41 (м, 4H), 2,37-2,31 (м, 1H), 1,87-1,80 (м, 1H), 1,77-1,68 (м, 4H), 1,46 (с, 3H).
MS (ESI, m/z): 460,2 [M+H]+.
Пример 16: Синтез 4-(4-(4-(3-(диэтиламино)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез N,N-диэтилпроп-2-ин-1-амина

К раствору диэтиламина (0,46 мл, 1 экв.) в толуоле (10 мл) добавляли K2CO3 (1,23 г, 2 экв.) и 3-бромпроп-1-ин (0,56 мл, 1,5 экв.). Смесь перемешивали в течение 15 часов при комнатной температуре и отфильтровывали, и фильтрат концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (0,46 г, 94%).
MS (ESI, m/z): 112,1 [M+H]+.
Стадия 2: Синтез 4-(4-(4-(3-(диэтиламино)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, с использованием N,N-диэтилпроп-2-ин-1-амина.
1H ЯМР (600 МГц, DMSO-d6);δ11,02 (ушир.с, 1H), 9,15 (ушир.с, 1H), 7,43-7,37 (м, 4H), 6,22 (с, 1H), 3,70-3,62 (м, 2H), 3,32-3,08 (м, 2H), 3,05 (с, 3H), 2,84-2,78 (м, 6H), 2,74-2,58 (м, 5H), 1,89-1,85 (м, 1H), 1,45 (с, 3H), 1,11-0,96 (м, 6H).
MS (ESI, m/z): 462,2 [M+H]+.
Пример 17: Синтез N-гидрокси-4-(4-(4-(3-((S)-2-(гидроксиметил)пирролидин-1-ил)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
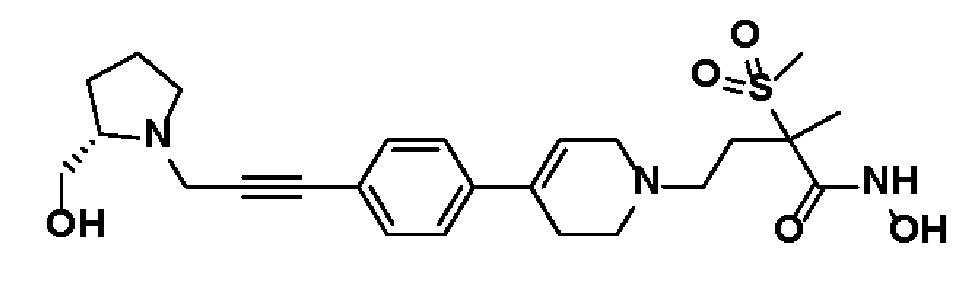
Стадия 1: Синтез (R)-(1-(проп-2-ин-1-ил)пирролидин-2-ил)метанола

К раствору 3-бромпроп-1-ина (3 г, 1 экв.) в толуоле (30 мл) добавляли (R)-пирролидин-2-илметанол (3,73 мл, 1,5 экв.) и K2CO3 (6,97 г, 2 экв.). Смесь перемешивали в течение 15 часов при комнатной температуре и экстрагировали этилацетатом и водой. Органический слой сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (2 г, 57%).
1H ЯМР (600 МГц, CDCl3-d1);δ 3,65-3,51 (м, 2H), 3,45-3,41 (м, 2H), 3,04-3,01 (м, 1H), 2,87-2,84 (м, 1H), 2,71-2,67 (м, 1H), 2,20-2,19 (м, 1H), 1,93-1,72 (м, 4H).
Стадия 2: Синтез N-гидрокси-4-(4-(4-(3-((S)-2-(гидроксиметил)пирролидин-1-ил)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, с использованием (R)-(1-(проп-2-ин-1-ил)пирролидин-2-ил)метанола.
1H ЯМР (600 МГц, DMSO-d6);δ11,04 (ушир.с, 1H), 9,21 (ушир.с, 1H), 7,48-7,40 (м, 4H), 6,26 (с, 1H), 3,55-3,52 (м, 2H), 3,36-3,33 (м, 4H), 3,09-3,08 (м, 4H), 2,89 (с, 3H), 2,69-2,58 (м, 4H), 1,95-1,87 (м, 1H), 1,79-1,62 (м, 6H), 1,49 (с, 3H).
MS (ESI, m/z): 490,2[M+H]+.
Пример 18: Синтез N-гидрокси-4-(4-(4-(5-гидроксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Стадия 1: Синтез метил-4-(4-(4-(5-гидроксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата

К раствору метил-4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (промежуточное соединение 2) (2 г, 1 экв.) в смеси THF (20 мл)/толуол (20 мл) добавляли CuI (79,8 мг, 0,1 экв.), Pd(PPh3)2Cl2 (295 мг, 0,1 экв.), Et3N (1,75 мл, 3 экв.) и пент-4-ин-1-ол (705 мг, 2 экв.). Смесь перемешивали в течение 12 часов при комнатной температуре и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (1,5 г, 83%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,33-7,32 (м, 2H), 7,28-7,27 (м, 2H), 6,05 (с, 1H), 3,82-3,79 (м, 2H), 3,75-3,72 (м, 3H), 3,69 (с, 3H), 3,05 (с, 3H), 2,70-2,62 (м, 1H), 2,53 (т, J=7,2 Гц, 3H), 2,38 (т, J=6,0 Гц, 3H), 1,78-1,64 (м, 4H), 1,64 (с, 3H).
Стадия 2-4: Синтез N-гидрокси-4-(4-(4-(5-гидроксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 4-(4-(4-(5-гидроксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, CD3OD-d4);δ11,04 (ушир.с, 1H), 9,13 (ушир.с, 1H), 7,43-7,38 (м, 2H), 7,33-7,28 (м, 2H), 6,19 (с, 1H), 4,52 (ушир.с, 1H), 3,54-3,50 (м, 2H), 3,17-3,15 (м, 2H), 3,06 (с, 3H), 2,64-2,54 (м, 2H), 2,48-2,38 (м, 4H), 1,90-1,84 (м, 2H), 1,69-1,57 (м, 4H), 1,46 (с, 3H).
MS (ESI, m/z): 435,0 [M+H]+.
Пример 19: Синтез 5-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил метансульфоната

Стадия 1: Синтез метил-2-метил-2-(метилсульфонил)-4-(4-(4-(5-((метилсульфонил)окси)пент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутаноата

К раствору метил-4-(4-(4-(5-гидроксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (1,5 г, 1 экв.) в дихлорметане (17,3 мл) добавляли Et3N (0,964 мл, 2 экв.) и метансульфонилхлорид (0,793 мл, 2 экв.). Смесь перемешивали в течение 2 часов при комнатной температуре и экстрагировали дихлорметаном и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (0,9 г, 51%).
1H ЯМР (600 МГц, CDCl3);δ7,34-7,32 (м, 2H), 7,29-7,27 (м, 2H), 6,04 (с, 1H), 4,40 (т, J=6,0 Гц, 2H), 3,72-3,70 (м, 3H), 3,13 (с, 6H), 3,06 (с, 3H), 3,03 (с, 3H), 2,70-2,62 (м, 1H), 2,59-2,56 (м, 3H), 2,05-2,01 (м, 3H), 1,71-1,62 (м, 4H).
MS (ESI, m/z): 512,2 [M+H]+.
Стадия 2: Синтез 2-метил-2-(метилсульфонил)-4-(4-(4-(5-((метилсульфонил)окси)пент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутановой кислоты

Указанное в заголовке соединение получали способами, описанным для синтеза примера 1, стадии 2, из метил-2-метил-2-(метилсульфонил)-4-(4-(4-(5-((метилсульфонил)окси)пент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутаноата.
MS (ESI, m/z): 498,2 [M+H]+.
Стадия 3: Синтез 5-(4-(1-(3-метил-3-(метилсульфонил)-4-оксо-4-(((тетрагидро-2H-пиран-2-ил)окси)амино)бутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил метансульфоната

Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадия 3, из 2-метил-2-(метилсульфонил)-4-(4-(4-(5-((метилсульфонил)окси)пент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутановой кислоты.
MS (ESI, m/z): 597,2 [M+H]+.
Стадия 4: Синтез 5-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил метансульфоната

Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадия 4 из 5-(4-(1-(3-метил-3-(метилсульфонил)-4-оксо-4-(((тетрагидро-2H-пиран-2-ил)окси)амино)бутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил метансульфоната.
1H ЯМР (600 МГц, DMSO-d6);δ11,01 (ушир.с, 1H), 9,10 (ушир.с, 1H), 7,47-7,32 (м, 4H), 6,25 (с, 1H), 4,38-4,31 (м, 2H), 3,19 (с, 3H), 3,10-3,09 (м, 2H), 3,06 (с, 3H), 2,66-2,56 (м, 2H), 2,54-2,94 (м, 8H), 1,98-1,85 (м, 2H), 1,46 (с, 3H).
MS (ESI, m/z): 513,1 [M+H]+.
Пример 20: Синтез 4-(4-(4-(5-(диметиламино)пент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида
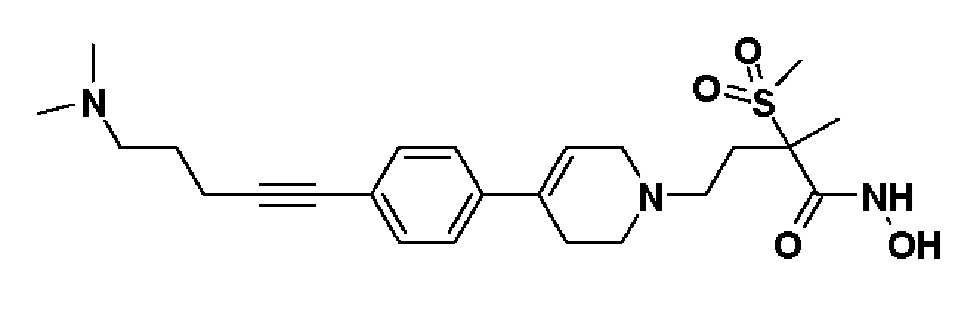
К раствору 5-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил метансульфоната (пример 19) (120 мг, 1 экв.) в THF (3 мл) добавляли диметиламин (1M в THF, 7 мл, 30 экв.). Смесь кипятили с обратным холодильником в течение 4 часов и охлаждали до комнатной температуры и растворитель концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (38 мг, 35%).
1H ЯМР (600 МГц, DMSO-d6);δ10,6 (ушир.с, 1H), 9,2 (ушир.с, 1H), 7,38-7,37 (м, 2H), 7,31-7,30 (м, 2H), 6,18 (с, 1H), 3,12-3,06 (м, 2H), 3,04 (с, 3H), 2,63-2,56 (м, 2H), 2,46-2,40 (м, 6H), 2,32-2,26 (м, 3H), 2,11 (с, 6H), 1,82-1,79 (м, 1H), 1,66-1,61 (м, 2H), 1,44 (с, 3H).
MS (ESI, m/z): 462,2 [M+H]+.
Пример 21: Синтез 4-(4-(4-(5-аминопент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез 4-(4-(4-(5-аминопент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида

К раствору 5-(4-(1-(3-метил-3-(метилсульфонил)-4-оксо-4-(((тетрагидро-2H-пиран-2-ил)окси)амино)бутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил метансульфоната (пример 19, стадия 3) (200 мг, 1 экв.) в 1,4-диоксане (0,67 мл) добавляли аммиак (0,5M в 1,4-диоксане, 6,7 мл, 10 экв.). Смесь кипятили с обратным холодильником в течение 12 часов и охлаждали до комнатной температуры, и растворитель концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (80 мг, 46%).
MS (ESI, m/z): 518,3 [M+H]+.
Стадия 2: Синтез 4-(4-(4-(5-аминопент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадия 4 из 4-(4-(4-(5-аминопент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида.
1H ЯМР (600 МГц, DMSO-d6);δ7,38-7,36 (м, 2H), 7,32-7,31 (м, 2H), 6,18 (с, 1H), 3,09-3,06 (м, 2H), 3,04 (с, 3H), 2,82 (т, J=7,2 Гц, 2H), 2,62-2,56 (м, 3H), 2,45-2,42 (м, 6H), 2,38-2,32 (м, 1H), 1,98-1,95 (м, 1H), 1,74-1,71 (м, 3H), 1,44 (с, 3H).
MS (ESI, m/z): 434,2 [M+H]+.
[Примеры 22-25]

Пример 22: Синтез N-гидрокси-4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез метил-4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадия 1, с использованием проп-2-ин-1-ола.
1H ЯМР (600 МГц, CDCl3-d1) δ;7,38-7,36 (м, 2H), 7,31-7,29 (м, 2H), 6,05 (с, 1H), 4,49 (с, 2H), 3,80-3,70 (м, 4H), 3,48-3,30 (м, 2H), 3,07-3,02 (м, 5H), 2,68-2,56 (м, 4H), 1,70-1,64 (м, 4H).
MS (ESI, m/z): 406,1[M+H]+.
Стадия 2-4: Синтез N-гидрокси-4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ11,00 (ушир.с, 1H), 9,12 (ушир.с, 1H), 7,40-7,35 (м, 4H), 6,16 (с, 1H), 5,31 (с, 1H), 4,37 (с, 2H), 3,40-3,34 (м, 2H), 3,07 (с, 3H), 2,95-2,92 (м, 2H), 2,86-2,85 (м, 2H), 2,64-2,56 (м, 4H), 2,14-2,10 (м, 2H), 1,59 (с, 3H).
MS (ESI, m/z): 407,0 [M+H]+.
Пример 23: Синтез N-гидрокси-4-(4-(4-(3-метоксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез метил-4-(4-(4-(3-метоксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата
К раствору метил-4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (пример 22, стадия 1) (500 мг, 1 экв.) в дихлорметане (10 мл) добавляли Et3N (0,34 мл, 2 экв.) и метансульфонилхлорид (0,19 мл, 2 экв.). Смесь перемешивали в течение 2 часов при комнатной температуре. Добавляли метоксид натрия (25% раствор в MeOH, 1,06 г, 4 экв.) и перемешивали в течение 3 часов при 60oC. Смесь охлаждали до комнатной температуры, экстрагировали дихлорметаном и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (250 мг, 48%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,42-7,41 (м, 2H), 7,32-7,30 (м, 2H), 6,02 (с, 1H), 4,31 (с, 2H), 3,90-3,79 (м, 3H), 3,48-3,42 (м, 4H), 3,14-3,08 (м, 5H), 2,70-2,62 (м, 3H), 1,78-1,68 (м, 3H), 1,64-1,52 (м, 4H).
MS (ESI, m/z): 420,1 [M+H]+.
Стадия 2: Синтез N-гидрокси-4-(4-(4-(3-метоксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 4-(4-(4-(3-метоксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ10,99 (ушир.с, 1H), 9,10 (ушир.с, 1H), 7,42-7,38 (м, 4H), 6,21 (с, 1H), 4,29 (с, 2H), 3,28-3,24 (м, 3H), 3,10-3,04 (м, 5H), 2,62-2,54 (м, 2H), 2,45-2,29 (м, 4H), 1,41 (с, 3H), 1,22-1,20 (м, 2H).
MS (ESI, m/z): 421,1 [M+H]+.
Пример 24: Синтез N-гидрокси-4-(4-(4-(3-(3-гидроксипропокси)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез метил-4-(4-(4-(3-(3-гидроксипропокси)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата
К раствору метил-4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (пример 22, стадия 1) (280 мг, 1 экв.) в DMF (15 мл) добавляли NaH (47 мг, 1,7 экв, 60% масс) и 3-бромпропан-1-ол (125 мг, 1,3 экв.). Смесь перемешивали в течение 4 часов при комнатной температуре и экстрагировали этилацетатом и водой. Органический слой сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (130 г, 51%).
MS (ESI, m/z): 464,1 [M+H]+.
Стадия 2: Синтез N-гидрокси-4-(4-(4-(3-(3-гидроксипропокси)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 4-(4-(4-(3-(3-гидроксипропокси)проп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ11,03 (ушир.с, 1H), 9,13 (ушир.с, 1H), 7,45-7,39 (м, 4H), 6,23 (с, 1H), 3,59-3,57 (м, 2H), 3,44-3,41 (м, 2H), 3,18-3,09 (м, 2H), 3,06 (с, 3H),2,65-2,57 (м, 2H),2,47-2,38 (м, 4H),1,70-1,62 (м, 2H),1,44 (с, 3H), 1,42-1,35 (м, 2H).
MS (ESI, m/z): 465,1 [M+H]+.
Пример 25: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(3-морфолинопроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида

Стадия 1: Синтез метил-2-метил-2-(метилсульфонил)-4-(4-(4-(3-морфолинопроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутаноата
К раствору метил-4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (пример 22, стадия 1) (500 мг, 1 экв.) в дихлорметане (10 мл) добавляли Et3N (0,34 мл, 2 экв.) и метансульфонилхлорид (0,19 мл, 2 экв.), и смесь перемешивали в течение 2 часов при комнатной температуре. Добавляли морфолин (0,22 мл, 2 экв.) и перемешивали в течение 3 часов при 60oC. Смесь охлаждали до комнатной температуры и экстрагировали дихлорметаном и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (450 мг, 77%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,38-7,36 (м, 2H), 7,31-7,29 (м, 2H), 6,06 (с, 1H), 4,49 (с, 2H), 3,78-3,74 (м, 6H), 3,70-3,64 (м, 2H), 3,54-3,44 (м, 2H), 3,22-3,18 (м, 2H), 3,05 (с, 3H), 2,78 (с, 3H), 2,72-2,62 (м, 6H), 2,58-2,48 (м, 2H), 1,72-1,62 (м, 4H).
MS (ESI, m/z): 475,2 [M+H]+.
Стадия 2: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(3-морфолинопроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 2-метил-2-(метилсульфонил)-4-(4-(4-(3-морфолинопроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ11,00 (ушир.с, 1H), 9,10 (ушир.с, 1H), 7,41-7,39 (м, 2H), 7,37-7,35 (м, 2H), 6,19 (с, 1H), 3,62-3,56 (м, 4H), 3,48 (с, 2H), 3,14-3,07 (м, 2H), 3,06 (с, 3H), 2,64-2,52 (м, 4H), 2,46-2,38 (м, 5H), 2,32-2,26 (м, 1H), 2,00-1,96 (м, 1H), 1,82-1,76 (м, 1H), 1,44 (с, 3H).
MS (ESI, m/z): 476,2 [M+H]+.
Пример 26: Синтез 3-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)проп-2-ин-1-ил карбамата

Стадия 1: Синтез 3-(4-(1-(3-метил-3-(метилсульфонил)-4-оксо-4-(((тетрагидро-2H-пиран-2-ил)окси)амино)бутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)проп-2-ин-1-ил карбамата

К раствору 4-(4-(4-(3-гидроксипроп-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида (200 мг, 1 экв.) в THF (10 мл) добавляли CDI (500 мг, 8 экв.) и Et3N (0,16 мл, 3 экв.), и смесь перемешивали в течение 4 часов при комнатной температуре. Добавляли NH4OH (0,15 мл, 10 экв.) и перемешивали в течение 2 часов при 0oC. Смесь экстрагировали этилацетатом и водой. Органический слой сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (50 мг, 23%).
Стадия 2: Синтез 3-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)проп-2-ин-1-ил карбамата
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадия 4, с использованием 3-(4-(1-(3-метил-3-(метилсульфонил)-4-оксо-4-(((тетрагидро-2H-пиран-2-ил)окси)амино)бутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)проп-2-ин-1-ил карбамата.
1H ЯМР (600 МГц, DMSO-d6);δ11,01 (ушир.с, 1H), 9,09 (ушир.с, 1H), 7,44-7,37 (м, 4H), 6,22 (с, 1H), 4,80 (с, 2H), 3,10-3,88 (м, 2H), 3,04 (с, 3H), 2,65-2,53 (м, 2H), 2,47-2,43 (м, 2H), 1,97-1,80 (м, 2H), 1,44 (с, 3H).
MS (ESI, m/z): 450,1 [M+H]+.
Пример 27: Синтез 5-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил карбамата

Стадия 1: Синтез 5-(4-(1-(3-метил-3-(метилсульфонил)-4-оксо-4-(((тетрагидро-2H-пиран-2-ил)окси)амино)бутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил карбамата

Указанное в заголовке соединение получали способами, описанными для синтеза примера 26, стадия 1, с использованием 4-(4-(4-(5-гидроксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида.
Стадия 2: Синтез 5-(4-(1-(4-(гидроксиамино)-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил карбамата

Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадия 4, с использованием 5-(4-(1-(3-метил-3-(метилсульфонил)-4-оксо-4-(((тетрагидро-2H-пиран-2-ил)окси)амино)бутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)пент-4-ин-1-ил карбамата
1H ЯМР (600 МГц, DMSO-d6);δ11,01 (ушир.с, 1H), 9,11 (ушир.с, 1H), 7,38-7,37 (м, 2H), 7,32-7,31 (м, 2H), 6,18 (с, 1H), 3,98-3,97 (м, 2H), 3,09-3,04 (м, 5H), 2,62-2,57 (м, 2H), 2,48-2,46 (м, 2H), 2,30-2,28 (м, 2H), 1,81-1,78 (м, 4H), 1,44 (с, 3H), 1,23-1,21 (м, 2H).
MS (ESI, m/z): 478,2 [M+H]+.
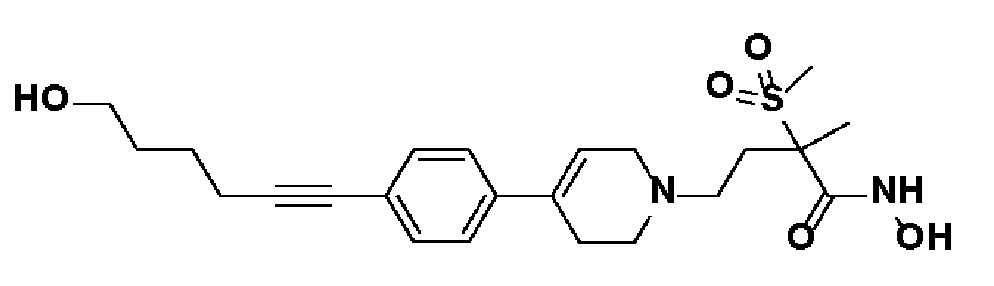
Пример 28: Синтез N-гидрокси-4-(4-(4-(5-метоксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 23, из метил-4-(4-(4-(5-гидроксипент-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (пример 18, стадия 1).
1H ЯМР (600 МГц, DMSO-d6);δ11,02 (ушир.с, 1H), 9,12 (ушир.с, 1H), 7,41-7,38 (м, 2H), 7,34-7,32 (м, 2H), 6,19 (с, 1H), 3,75-3,41 (м, 2H), 3,25 (с, 2H), 3,17-3,10 (м, 2H), 3,06 (с, 3H), 2,67-2,54 (м, 2H), 2,45-2,28 (м, 6H),1,78-1,72 (м, 2H),1,46 (с, 3H).
MS (ESI, m/z): 449,2 [M+H]+.
[Примеры 29-30]

Пример 29: Синтез N-гидрокси-4-(4-(4-(6-гидроксигекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Стадия 1: Синтез метил-4-(4-(4-(6-гидроксигекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадия 1, с использованием гекс-5-ин-1-ола.
1H ЯМР (600 МГц, CDCl3-d1);δ7,33-7,31 (м, 2H), 7,28-7,26 (м, 2H), 6,05 (с, 1H), 3,72-3,62 (м, 5H), 3,18-3,10 (м, 2H), 3,04 (с, 3H), 2,72-2,58 (м, 3H), 2,52-2,40 (м, 5H), 1,78-1,65 (м, 6H), 1,63 (с, 3H).
Стадия 2-4: Синтез N-гидрокси-4-(4-(4-(6-гидроксигекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 4-(4-(4-(6-гидроксигекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ11,04 (ушир.с, 1H), 9,10 (ушир.с, 1H), 7,37-7,36 (м, 2H), 7,30-7,28 (м, 2H), 6,17 (с, 1H), 4,43-4,28 (м, 2H), 3,40-3,5 (м, 4H), 3,09-3,05 (м, 2H), 3,04 (с, 3H), 2,6-2,58 (м, 2H), 2,43-2,39 (м, 4H), 1,47 (с, 3H), 1,41-1,38 (м, 4H).
MS (ESI, m/z): 449,1 [M+H]+.
Пример 30: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(6-морфолиногекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 25, с использованием метил-4-(4-(4-(6-гидроксигекс-1-ин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (пример 29, стадия 1).
1H ЯМР (600 МГц, DMSO-d6);δ11,06 (ушир.с, 1H), 9,15 (ушир.с, 1H), 7,43-7,41 (м, 2H), 7,35-7,33 (м, 2H), 6,22 (с, 1H), 3,62-3,56 (м, 4H), 3,18-3,10 (м, 2H), 3,08 (с, 3H), 2,72-2,58 (м, 3H), 2,48-2,40 (м, 5H), 2,40-2,28 (м, 6H), 2,05-1,98 (м, 1H), 1,82-1,70 (м, 1H), 1,62-1,56 (м, 4H), 1,48 (с, 3H).
MS (ESI, m/z): 518,3 [M+H]+.
Пример 31: Синтез 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез 3-(4-бром-2-фторфенил)-N,N-диметилпроп-2-ин-1-амина

К раствору 4-бром-2-фтор-1-йодбензола (3 г, 1 экв.) в смеси THF (10 мл)/толуол (10 мл) добавляли CuI (0,19 г, 0,1 экв.), Pd(PPh3)2Cl2 (0,7 г, 0,1 экв.), Et3N (4,2 мл, 3 экв.) и N,N-диметилпроп-2-ин-1-амин (1,61 мл, 1,5 экв.). Смесь перемешивали в течение 12 часов при комнатной температуре и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (1,87 г, 73%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,29-7,22 (м, 3H), 3,49 (с, 2H), 2,36 (с, 6H).
Стадия 2: Синтез трет-бутил-4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-карбоксилата
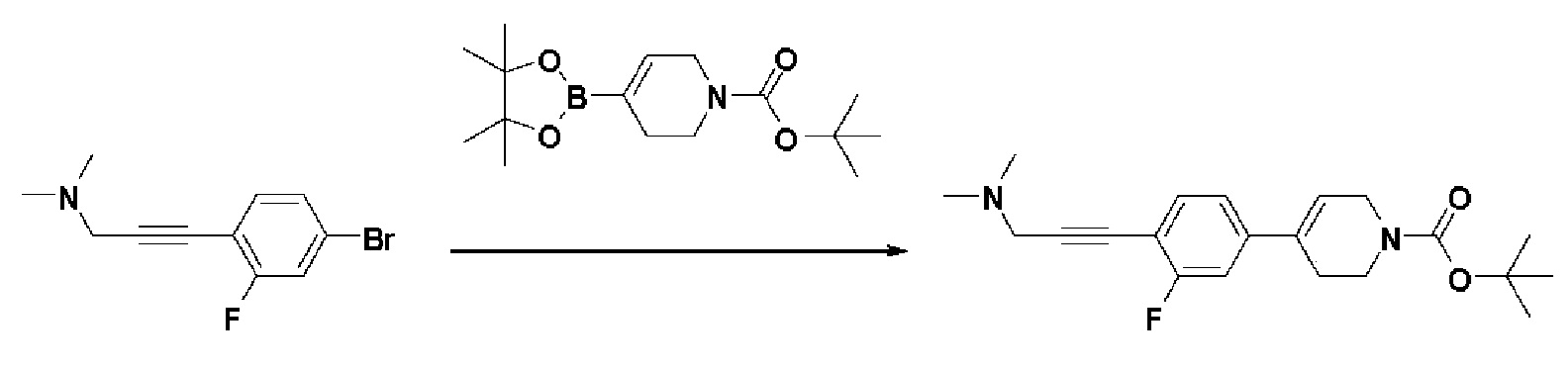
К раствору 3-(4-бром-2-фторфенил)-N,N-диметилпроп-2-ин-1-амина (1,87 г, 1 экв.) в смеси 1,4-диоксан (16 мл)/вода (4 мл) добавляли Pd(PPh3)2Cl2(0,51 г, 0,1 экв.), K2CO3 (3,03 г, 3 экв.), трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат (2,71 г, 1,2 экв.). Смесь перемешивали в течение 2 часов при 110°C и охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (2 г, 76%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,36 (т, J=7,2 Гц, 1H), 7,25-7,07 (м, 2H), 6,07 (с, 1H), 4,11-4,07 (м, 2H), 3,64-3,59 (м, 2H), 3,47 (с, 2H), 2,49-2,45 (м, 2H), 2,36 (с, 6H), 1,58 (с, 9H).
MS (ESI, m/z): 359,2 [M+H]+.
Стадия 3: Синтез 3-(2-фтор-4-(1,2,3,6-тетрагидропиридин-4-ил)фенил)-N,N-диметилпроп-2-ин-1-амин гидрохлорида

К раствору трет-бутил-4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-карбоксилата (2 г, 1 экв.) в MeOH (16 мл) добавляли ацетилхлорид (3,97 мл, 10 экв.). Смесь перемешивали в течение 3 часов при 60°C и охлаждали до комнатной температуры, и растворитель концентрировали в вакууме с получением указанного в заголовке соединения (1,6 г, 97%).
1H ЯМР (600 МГц, DMSO-d6;) δ11,52 (ушир.с, 1H), 9,56 (ушир.с, 2H), 7,61 (т, J=8,4 Гц, 1H), 7,48, (дд, J=11,4 Гц, 1,8 Гц, 1H), 7,38 (дд, J=8,4 Гц, 1,8 Гц, 1H), 6,39 (ушир.с, 1H), 4,36 (с, 2H), 3,72-3,70 (м, 2H), 3,27-3,23 (м, 2H), 2,78 (с, 6H), 2,68-2,64 (м, 2H).
MS (ESI, m/z): 259,2 [M+H]+.
Стадия 4: Синтез метил-4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата

К раствору 3-(2-фтор-4-(1,2,3,6-тетрагидропиридин-4-ил)фенил)-N,N-диметилпроп-2-ин-1-амин гидрохлорида (600 мг, 1 экв.) в DMF (10 мл) добавляли N,N-диизопропилэтиламин (1,42 мл, 4 экв.) и метил-4-бром-2-метил-2-(метилсульфонил)бутаноат (промежуточное соединение 1) (778 мг, 1,4 экв.). Смесь перемешивали в течение 12 часов при 60°C, охлаждали до комнатной температуры и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (280 мг, 28%).
1H ЯМР (600 МГц, CDCl3-d1);δ 7,35 (т, J=8,4 Гц, 1H), 7,10-7,05 (м, 2H), 6,11 (ушир.с, 1H), 3,66 (с, 3H), 3,54 (с, 2H), 3,23-3,18 (м, 1H), 3,04 (с, 3H), 3,03-3,00 (м, 1H), 2,79-2,75 (1H), 2,67-2,60 (м, 2H), 2,58-2,54 (м, 2H), 2,46-2,42 (м, 2H), 2,36 (с, 6H), 2,00-1,97 (м, 1H), 1,62 (с, 3H).
MS (ESI, m/z): 451,2 [M+H]+.
Стадия 5: Синтез 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановой кислоты

К раствору метил-4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (230 мг, 1 экв.) в смеси THF (8 мл)/MeOH (2 мл) добавляли раствор 2N-LiOH (0,77 мл, 3 экв.), и смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток разбавляли водой (10 мл) и доводили значение pH до 4,0. Осажденное твердое вещество отфильтровывали с получением указанного в заголовке соединения (200 мг, 90%), которое использовали на следующей стадии без дополнительной очистки.
Стадия 6: Синтез 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида

К раствору 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановой кислоты (200 мг, 1 экв.) в DMF (10 мл) добавляли HATU (244 мг, 1,4 экв.), HOBT (98 мг, 1,4 экв.), Et3N (0,19 мл, 3 экв.) и O-(тетрагидро-2H-пиран-2-ил)гидроксиламин гидрохлорид (141 мг, 2 экв.). Смесь перемешивали в течение 1 часа при комнатной температуре и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (166 мг, 68%).
MS (ESI, m/z): 536,2 [M+H]+.
Стадия 7: 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамид
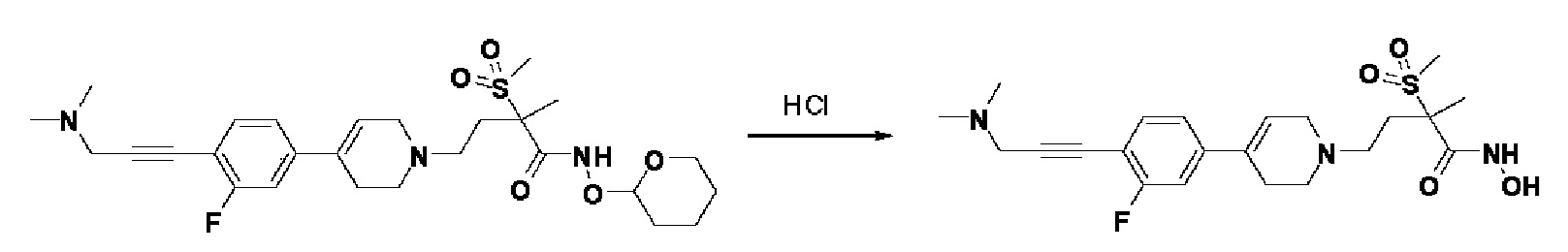
К раствору 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида (160 мг, 1 экв.) в MeOH (6 мл) добавляли раствор HCl в MeOH (1,25N, 0,72 мл, 3 экв.), и смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток разбавляли водой (6 мл) и доводили значение pH до 7,0. Воду концентрировали и полученный остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (89 мг, 57%).
1H ЯМР (600 МГц, DMSO-d6); δ 10,98 (ушир.с, 1H), 9,11 (ушир.с, 1H), 7,44-7,41 (м, 1H), 7,33-7,71 (м, 1H), 7,26-7,25 (м, 1H), 6,30 (с, 1H), 3,48 (с, 2H), 3,13-3,06 (м, 2H), 3,04 (с, 3H), 2,64-2,61 (м, 1H), 2,59-2,55 (м, 1H), 2,47-2,38 (м, 4H), 2,33-2,29 (м, 1H), 2,22 (с, 6H), 1,84-1,79 (м, 1H), 1,44 (с, 3H).
MS (ESI, m/z): 452,2 [M+H]+.
Пример 32: Синтез 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3,5-дифторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 31, с использованием 5-бром-1,3-дифтор-2-йодбензола в качестве исходного материала.
MS (ESI, m/z): 470,2 [M+H]+.
Пример 33: Синтез 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-2-фторфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 31, с использованием 1-бром-2-фтор-4-йодбензола в качестве исходного материала.
MS (ESI, m/z): 452,2 [M+H]+.
Пример 34: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(тиофен-2-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида

Стадия 1: Синтез 2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)-4-(4-(4-(тиофен-2-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида
К раствору 4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида (промежуточное соединение 3) (220 мг, 1 экв.) в THF (4 мл)/толуол (4 мл) добавляли CuI (7,5 мг, 0,1 экв.), Pd(PPh3)2Cl2 (27,4 мг, 0,1 экв.), Et3N (0,165 мл, 3 экв.) и 2-этинилтиофен (64 мг, 1,5 экв.). Смесь перемешивали в течение 12 часов при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (60 мг, 28%)
1H ЯМР (600 МГц, CDCl3-d1);δ 7,67-7,64 (м, 1H), 7,45-7,43 (м, 2H), 7,35-7,34 (м, 2H), 7,28-7,26 (м, 1H), 7,01-6,99 (м, 1H), 6,12 (с, 1H), 4,92-4,90 (м, 1H), 3,43-3,29 (м, 4H), 3,11 (с, 3H), 2,90-2,83 (м, 4H), 2,72-2,65 (м, 4H), 1,80-1,57 (м, 7H), 1,52-1,45 (с, 2 H).
MS (ESI, m/z): 543,2 [M+H]+.
Стадия 2: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(тиофен-2-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида
К раствору 2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)-4-(4-(4-(тиофен-2-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида (60 мг, 1 экв.) в MeOH (2 мл) добавляли раствор HCl в MeOH (1,25N, 0,27 мл, 3 экв.), и смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток разбавляли водой (4 мл) и доводили значение pH до 7,0. Воду концентрировали и полученный остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (7,7 мг, 15%).
1H ЯМР (600 МГц, DMSO-d6);δ11,00 (ушир.с, 1H), 9,08 (ушир.с, 1H), 7,65-7,64 (м, 1H), 7,48-7,45 (м, 4H), 7,40-7,39 (м, 1H), 7,11-7,10 (м, 1H), 6,25 (с, 1H), 3,11-3,06 (м, 2H), 3,04 (с, 3H), 2,63-2,58 (м, 2H), 2,46-2,31 (м, 2H), 2,00-1,80 (м, 2H), 1,45 (с, 3H), 1,23-1,20 (м, 2 H).
MS (ESI, m/z): 454,2 [M+H]+.
[Примеры 35-37]
Концевые ацетилены, перечисленные в следующей таблице, использовали для получения соединений примеров 35-37 таким же образом, как в примере 34.
Пример 38: Синтез N-гидрокси-2-метил-4-(4-(4-((1-метил-1H-имидазол-4-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутанамида

Стадия: Синтез 4-этинил-1-метил-1H-имидазола

Раствор 1-метил-1H-имидазол-4-карбальдегида (2 г, 1 экв.) в MeOH (180 мл) охлаждали до 0oC. Добавляли K2CO3 (5,02 г, 2 экв.) и диметил(1-диазо-2-оксопропил)фосфонат (7,7 г, 2,2 экв.). Смесь перемешивали в течение 4 часов при 0oC, и экстрагировали дихлорметаном и водой. Органический слой промывали насыщ. водн. NH4Cl, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (1,2 г, 62%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,60 (с, 1H), 7,32 (м, 1H), 3,37 (с, 3H), 3,48 (с, 1H).
MS (ESI, m/z): 107,1 [M+H]+.
Стадия 2: Синтез N-гидрокси-2-метил-4-(4-(4-((1-метил-1H-имидазол-4-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1 (Синтез гидроксамата), с использованием 4-этинил-1-метил-1H-имидазола.
1H ЯМР (600 МГц, DMSO-d6);δ11,02 (ушир.с, 1H), 9,14 (ушир.с, 1H), 7,76 (с, 1H), 7,52-7,48 (м, 4H), 7,29 (с, 1H), 6,26 (с, 1H), 3,69 (с, 3H), 3,16-3,04 (м, 5H), 2,66-2,56 (м, 3H), 2,46-2,38 (м, 4H), 1,86-1,76 (м, 1H), 1,44 (с, 3H).
MS (ESI, m/z): 457,2 [M+H]+.
[Примеры 39-41]

Получение 4: Синтез промежуточного соединения 4 {метил-4-(4-(4-(азетидин-3-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноат дигидрохлорид}

Стадия 1: Синтез трет-бутил-3-этинилазетидин-1-карбоксилата
Раствор трет-бутил-3-формилазетидин-1-карбоксилата (7 г, 1 экв.) вMeOH (378 мл) охлаждали до 0oC. Добавляли K2CO3 (10,5 г, 2 экв.), диметил(1-диазо-2-оксопропил)фосфонат (15,8 г, 2,2 экв.). Смесь перемешивали в течение 4 часов при 0oC, и экстрагировали дихлорметаном и водой. Органический слой промывали насыщ. водн. NH4Cl, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (5,95 г, 87%).
1H ЯМР (600 МГц, CDCl3-d1);δ4,10-4,07 (м, 2H), 3,90-3,87 (м, 2H), 3,27-3,24 (м, 1H), 2,26-2,25 (м, 1H), 1,39 (с, 9H).
Стадия 2: Синтез трет-бутил-3-((4-(1-(4-метокси-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)этинил)азетидин-1-карбоксилата
К раствору метил-4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (промежуточное соединение 2) (7 г, 1 экв.) в смеси THF (30 мл)/толуол (30 мл) добавляли CuI (0,28 г, 0,1 экв.), Pd(PPh3)2Cl2 (1,03 г, 0,1 экв.), Et3N (6,18 мл, 3 экв.) и трет-бутил-3-этинилазетидин-1-карбоксилат (3,99 г, 1,5 экв.). Смесь перемешивали в течение 12 часов при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (5 г, 64%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,35-7,25 (м, 4H), 6,07 (с, 1H), 4,30 (с, 2H), 4,21-4,17 (м, 2H), 4,02-4,00 (м, 2H), 3,67 (с, 3H), 3,54-3,50 (м, 2H), 3,04 (с, 3H), 2,77-2,49 (м, 8H), 1,63 (с, 3H), 1,44 (с, 9H).
MS (ESI, m/z): 531,3 [M+H]+.
Стадия 3: Синтез метил-4-(4-(4-(азетидин-3-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноат дигидрохлорид
К раствору трет-бутил-3-((4-(1-(4-метокси-3-метил-3-(метилсульфонил)-4-оксобутил)-1,2,3,6-тетрагидропиридин-4-ил)фенил)этинил)азетидин-1-карбоксилата (5 г, 1 экв.) в дихлорметане (100 мл) добавляли раствор HCl (4н в циклопентил метиловом эфире, 24 мл, 10 экв.). Смесь перемешивали в течение 3 часов при комнатной температуре. После этого растворитель концентрировали в вакууме с получением указанного в заголовке соединения (4,2 г, 89%).
1H ЯМР (600 МГц, CD3OD-d4);δ7,50-7,45 (м, 4H), 6,21 (с, 1H), 4,36-4,34 (м, 2H), 4,19-4,15 (м, 2H), 4,10-4,06 (м, 2H), 3,88-3,87 (м, 5H), 3,62-3,59 (м, 1H), 3,41-3,39 (м, 2H), 3,17 (с, 3H), 2,98-2,84 (м, 2H), 2,71-2,49 (м, 2H), 1,70 (с, 3H).
MS (ESI, m/z): 431,2 [M+H]+.
Пример 39: Синтез N-гидрокси-2-метил-4-(4-(4-((1-метилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутанамид дигидрохлорида

Стадия 1: Синтез метил-2-метил-4-(4-(4-((1-метилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутаноата
К раствору метил-4-(4-(4-(азетидин-3-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноат дигидрохлорида (промежуточное соединение 4) (1,5 г, 1 экв.) в дихлорметане (30 мл) добавляли формальдегид (37% мас, 0,89 мл, 4 экв.) и триацетоксиборгидрид натрия (2,53 г, 4 экв.). Смесь перемешивали в течение 5 часов при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой промывали насыщ. водн. NaHCO3, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (0,9 г, 68%).
1H ЯМР (600 МГц, CDCl3-d1); δ7,34-7,32 (м, 2H), 7,29-7,28 (м, 2H), 6,07 (с, 1H), 3,76-3,74 (м, 2H), 3,66 (с, 3H), 3,46-3,45 (м, 1H), 3,22-3,19 (м, 3H), 3,02-2,99 (м, 4H), 2,78-2,76 (м, 1H), 2,65-2,53 (м, 4H), 2,47-2,46 (м, 2H), 2,38 (с, 3H), 1,97-1,96 (м, 1H), 1,62 (с, 3H).
MS (ESI, m/z): 445,2 [M+H]+.
Стадия 2-4: N-гидрокси-2-метил-4-(4-(4-((1-метилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутанамид
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 2-метил-4-(4-(4-((1-метилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ11,22-11,04 (м, 3H), 9,35 (ушир.с, 1H), 7,52-7,50 (м, 2H), 7,47-7,44 (м, 2H), 6,28 (с, 1H), 4,38-4,00 (м, 4H), 3,83-3,77 (м, 2H), 3,36-3,34 (м, 2H), 3,11 (с, 3H), 3,08-2,82 (м, 5H), 2,73-2,69 (м, 2H), 2,23-2,21 (м, 1H), 1,51 (с, 3H).
MS (ESI, m/z): 446,2 [M+H]+.
Пример 40: Синтез 4-(4-(4-((1-ацетилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез метил-4-(4-(4-((1-ацетилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата
К раствору метил-4-(4-(4-(азетидин-3-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноат дигидрохлорида (промежуточное соединение 4) (800 мг, 1 экв.) в дихлорметане (15 мл) добавляли Et3N (0,89 мл, 4 экв.) и ацетилхлорид (0,17 мл, 1,5 экв.). Смесь перемешивали в течение 2 часов при 0oC, и экстрагировали дихлорметаном и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (560 мг, 75%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,35-7,32 (м, 4H), 6,06 (с, 1H), 4,41-4,29 (м, 2H), 4,20-4,07 (м, 2H), 3,87-3,61 (м, 7H), 3,14-3,07 (м, 5H), 2,77-2,59 (м, 4H), 2,04-2,03 (м, 1H), 1,88 (с, 3H), 1,67 (с, 3H).
MS (ESI, m/z): 473,2 [M+H]+.
Стадия 2-4: Синтез 4-(4-(4-((1-ацетилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 4-(4-(4-((1-ацетилазетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ11,0 (ушир.с, 1H), 9,11 (ушир.с, 1H), 7,42-7,40 (м, 2H), 7,38-7,36 (м, 2H), 6,20 (с, 1H), 4,41-4,38 (м, 2H), 4,13-4,10 (м, 2H), 3,78-3,67 (м, 2H), 3,15-3,14 (м, 2H), 3,04 (с, 3H), 2,62-2,56 (м, 2H), 2,49-2,43 (м, 4H), 2,32-2,30 (м, 1H), 1,74 (с, 3H), 1,44 (с, 3H).
MS (ESI, m/z): 474,1 [M+H]+.
Пример 41: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-((1-(метилсульфонил)азетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида

Стадия 1: Синтез метил-2-метил-2-(метилсульфонил)-4-(4-(4-((1-(метилсульфонил)азетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутаноата
К раствору метил-4-(4-(4-(азетидин-3-илэтинил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноат дигидрохлорида (промежуточное соединение 4) (600 мг, 1 экв.) в DMF (15 мл) добавляли N,N-диизопропилэтиламин (0,83 мл, 4 экв.) и метансульфонилхлорид (0,14 мл, 1,5 экв.). Смесь перемешивали в течение 2 часов при 0oC, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (220 мг, 36%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,37-7,36 (м, 2H), 7,31-7,30 (м, 2H), 6,03 (с, 1H), 4,19-4,02 (м, 6H), 3,63-3,60 (м, 2H), 3,13-3,02 (м, 5H), 2,94-2,87 (м, 2H), 2,75-2,69 (м, 1H), 2,26-2,20 (м, 2H), 2,03 (с, 3H), 1,23 (с, 3H).
MS (ESI, m/z): 509,2 [M+H]+.
Стадия 2-4: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-((1-(метилсульфонил)азетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 2-метил-2-(метилсульфонил)-4-(4-(4-((1-(метилсульфонил)азетидин-3-ил)этинил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутаноата.
1H ЯМР (600 МГц, CD3OD-d4);δ7,41-7,36 (м, 4H), 6,17 (с, 1H), 4,19-4,16 (м, 2H), 3,98-3,95 (м, 2H), 3,13 (с, 3H), 2,97 (с, 3H), 2,88-2,84 (м, 2H), 2,61-2,54 (м, 4H), 2,23-2,21 (м, 1H), 1,59 (с, 3H).
MS (ESI, m/z): 510,2 [M+H]+.
Получение 5: Синтез промежуточного соединения 5 {трет-бутил-4-(4-(2,2-дибромвинил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-карбоксилат}

Стадия 1: Синтез трет-бутил-4-(3-фтор-4-формилфенил)-3,6-дигидропиридин-1(2H)-карбоксилата

К раствору 4-бром-2-фторбензальдегида (6 г, 1 экв.) в смеси 1,4-диоксан (100 мл)/ воды (20 мл) добавляли Pd(PPh3)2Cl2 (2,07 г, 0,1 экв.), K2CO3 (12,25 г, 3 экв.) и трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат (10,97 г, 1,2 экв.). Смесь перемешивали в течение 4 часов при 110oC, охлаждали до комнатной температуры и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (7,8 г, 86%).
1H ЯМР (600 МГц, CDCl3-d1);δ10,32 (с, 1H), 7,84-7,82 (м, 1H), 7,29-7,26 (м, 1H), 7,16-7,14 (м, 1H), 6,24 (ушир.с, 1H), 4,14-4,10 (м, 2H), 3,66-3,64 (м, 2H), 2,54-2,50 (м, 2H), 1,49 (с, 9H).
Стадия 2: Синтез трет-бутил-4-(4-(2,2-дибромвинил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-карбоксилата
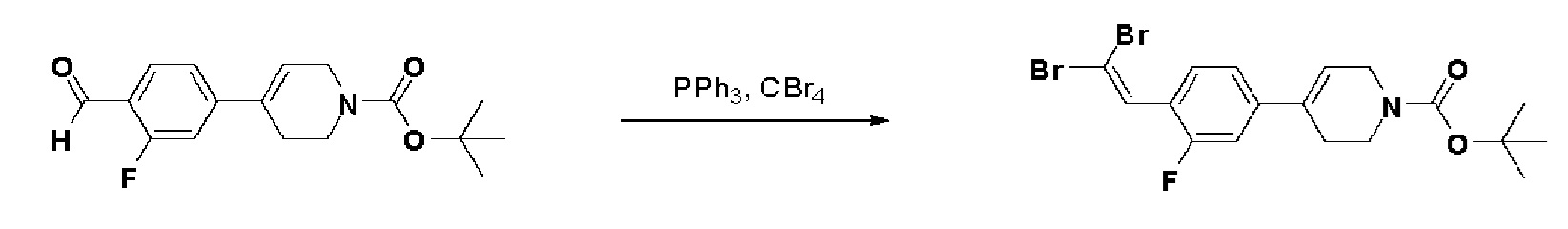
К раствору трет-бутил-4-(3-фтор-4-формилфенил)-3,6-дигидропиридин-1(2H)-карбоксилата (3 г, 1 экв.) в дихлорметане (50 мл) добавили тетрабромид углерода (4,89 г, 1,5 экв.) и трифенилфосфин (7,73 г, 3 экв.). Смесь перемешивали в течение 1 часа при 0oC, и экстрагировали дихлорметаном и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (4,13 г, 91%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,78-7,76 (м, 1H), 7,54 (с, 1H), 7,18-7,16 (м, 1H), 7,08-7,06 (м, 1H), 6,11 (ушир.с, 1H), 4,11-4,09 (м, 2H), 3,65-3,60 (м, 2H), 2,51-2,47 (м, 2H), 1,49 (с, 9H).
Пример 42: Синтез 4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида
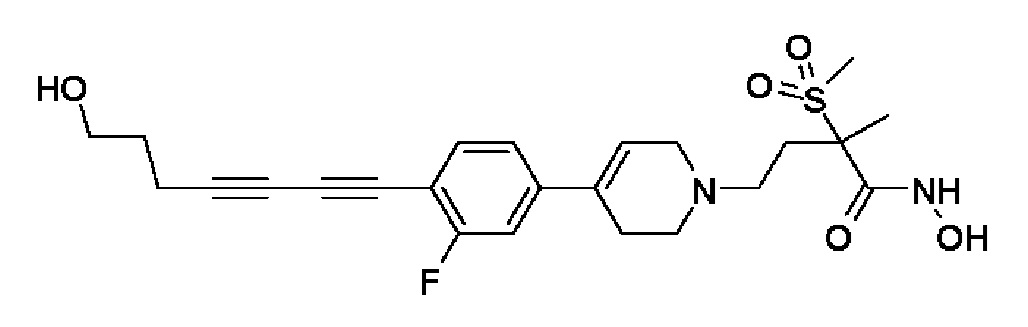
Стадия 1: Синтез трет-бутил-4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-карбоксилата

К раствору трет-бутил-4-(4-(2,2-дибромвинил)-3-фторфенил)-3,6-дигидропиридин-1(2H)-карбоксилата (промежуточное соединение 5) (2,29 г, 1 экв.) в DMF добавляли Pd(PPh3)2Cl2 (0,35 г, 0,1 экв.), трифенилфосфин (0,13 г, 0,1 экв.), Et3N (2,1 мл, 3 экв.) и пент-4-ин-1-ол (0,93 мл, 2 экв.). Смесь перемешивали в течение 2 часов при 80oC, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (790 мг, 42%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,41-7,38 (м, 1H), 7,11-7,09 (м, 1H), 7,07-7,06 (м, 1H), 6,10 (ушир.с, 1H), 4,10-4,06 (м, 2H), 3,78 (т, J=6 Гц, 2H), 3,64-3,60 (м, 2H), 2,52 (т, J=6,6 Гц, 2H), 2,49-2,45 (м, 2H), 1,86-1,81 (м, 2H), 1,48 (с, 9H).
Стадия 2: Синтез гидрохлорида 7-(2-фтор-4-(1,2,3,6-тетрагидропиридин-4-ил)фенил)гепта-4,6-диин-1-ола

К раствору трет-бутил-4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-карбоксилата (790 мг, 1 экв.) в MeOH добавляли конц-HCl (1,7 мл, 10 экв.). Смесь перемешивали в течение 1 часа при 110°C, охлаждали до комнатной температуры, и концентрировали в вакууме. Остаток разбавляли в MeOH (2 мл) и выливали в диэтиловый эфир (50 мл). Осажденное твердое вещество отфильтровывали с получением указанного в заголовке соединения (576 мг, 87%).
1H ЯМР (600 МГц, DMSO-d6);δ 9,34 (ушир.с, 2H), 7,63-7,60 (м, 1H), 7,49-7,47 (м, 1H), 7,37-7,36 (м, 1H), 6,41 (с, 1H), 3,78-3,74 (м, 2H), 3,47 (т, J=5,4 Гц, 2H), 3,30-3,26 (м, 2H), 2,69-2,65 (м, 2H), 2,50-2,47 (м, 2H), 1,68-1,63 (м, 2H).
Стадия 3: Синтез метил-4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата

К раствору гидрохлорида 7-(2-фтор-4-(1,2,3,6-тетрагидропиридин-4-ил)фенил)гепта-4,6-диин-1-ола (570 мг, 1 экв.) в DMF (12 мл) добавляли N,N-диизопропилэтиламин (0,93 мл, 3 экв.) и метил-4-бром-2-метил-2-(метилсульфонил)бутаноат (промежуточное соединение 1) (584 мг, 1,2 экв.). Смесь перемешивали в течение 12 часов при 60°C, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (230 мг, 27%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,39-7,37 (м, 1H), 7,11-7,09 (м, 1H), 7,07-7,05 (м, 1H), 6,13 (с, 1H), 3,78 (т, J=6 Гц, 2H), 3,67 (с, 3H), 3,24-3,21 (м, 1H), 3,05 (с, 3H), 3,04-3,01 (1H), 2,79-2,76 (м, 1H), 2,67-2,53 (м, 4H), 2,51 (т, J=6,6 Гц, 2H), 2,45-2,42 (м, 2H), 2,00-1,98 (м, 1H), 1,85-1,81 (м, 2H), 1,63 (с, 3H).
Стадия 4: Синтез 4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановой кислоты

К раствору метил-4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (230 мг, 1 экв.) в смеси THF (8 мл)/MeOH (2 мл) добавляли раствор 2N-LiOH (0,73 мл, 3 экв.). Смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток разбавляли водой (10 мл) и доводили значение pH до 4,0. Осажденное твердое вещество отфильтровывали с получением указанного в заголовке соединения (119 мг, 53%), которое использовали на следующей стадии без дополнительной очистки.
MS (ESI, m/z): 462,1 [M+H]+.
Стадия 5: Синтез 4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида
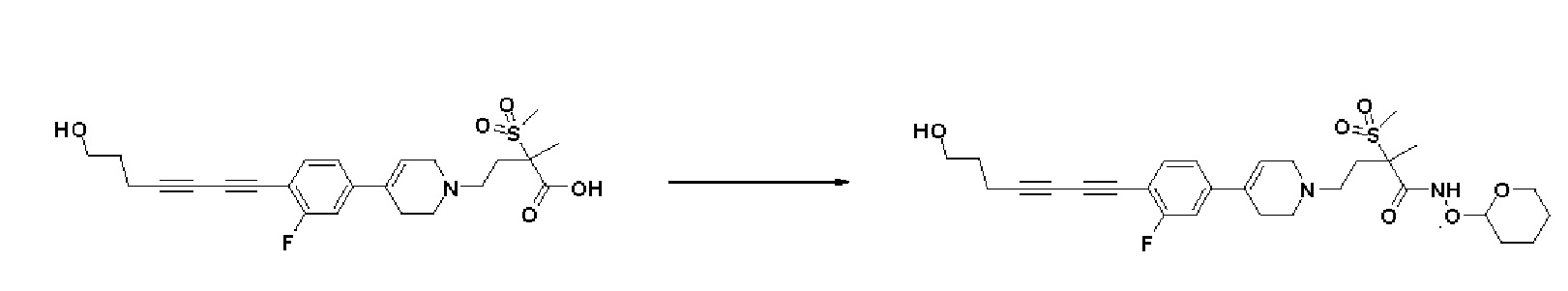
К раствору 4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутановой кислоты (119 мг, 1 экв.) в DMF (10 мл) добавляли HATU (137 мг, 1,4 экв.), HOBT (55 мг, 1,4 экв.), Et3N (0,11 мл, 3 экв.) и O-(тетрагидро-2H-пиран-2-ил)гидроксиламин гидрохлорид (60 мг, 2 экв.). Смесь перемешивали в течение 1 часа при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (127 мг, 88%).
MS (ESI, m/z): 561,2 [M+H]+.
Стадия 6: Синтез 4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

К раствору 4-(4-(3-фтор-4-(7-гидроксигепта-1,3-диин-1-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида (127 мг, 1 экв.) в MeOH (6 мл) добавляли раствор HCl в MeOH (1,25N, 0,54 мл, 3 экв.). Смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток разбавляли водой (6 мл) и доводили значение pH до 7,0. Воду концентрировали в вакууме и полученный остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (40 мг, 37%).
1H ЯМР (600 МГц, DMSO-d6);δ 10,99 (ушир.с, 1H), 9,12 (ушир.с, 1H), 7,56-7,54 (м, 1H), 7,39-7,36 (м, 1H), 7,31-7,28 (м, 1H), 6,37 (с, 1H), 4,60-4,58 (м, 1H), 3,48-3,45 (м, 2H), 3,35-3,33 (м, 2H), 3,13-3,08 (м, 2H), 3,06 (с, 3H), 2,64-2,58 (м, 2H), 2,51-2,43 (м, 4H), 2,37-2,29 (м, 1H), 1,85-1,78 (м, 1H), 1,66-1,62 (м, 2H), 1,46 (с, 3H).
MS (ESI, m/z): 477,2 [M+H]+.
[Примеры 43-45]
Концевые ацетилены, перечисленные в следующей таблице, использовали для получения соединений примеров 43-45 таким же образом, как в примере 42.
Получение 6: Синтез промежуточного соединения 6 {трет-бутил-4-(4-(2,2-дибромвинил)фенил)-3,6-дигидропиридин-1(2H)-карбоксилат}

Указанное в заголовке соединение получали способами, описанными для получения 5, с использованием 4-бромбензальдегида.
1H ЯМР (600 МГц, CDCl3-d1);δ7,52 (д, J=9 Гц, 2H), 7,46 (с, 1H), 7,37 (д, J=8,4 Гц, 2H), 6,09 (ушир.с, 1H), 4,09-4,06 (м, 2H), 3,66- 3,61 (м, 2H), 2,55-2,49 (м, 2H), 1,49 (с, 9H).
[Примеры 46-51]
Промежуточное соединение 6 в качестве исходного материала и концевые ацетилены, указанные в следующей таблице, использовали для получения соединений примера 46-51 таким же образом, как в примере 42.
Получение 7: Синтез промежуточного соединения 7 {трет-бутил-4-этинил-3,6-дигидропиридин-1(2H)-карбоксилат}

Стадия 1: Синтез трет-бутил-4-гидрокси-4-((триметилсилил)этинил)пиперидин-1-карбоксилата
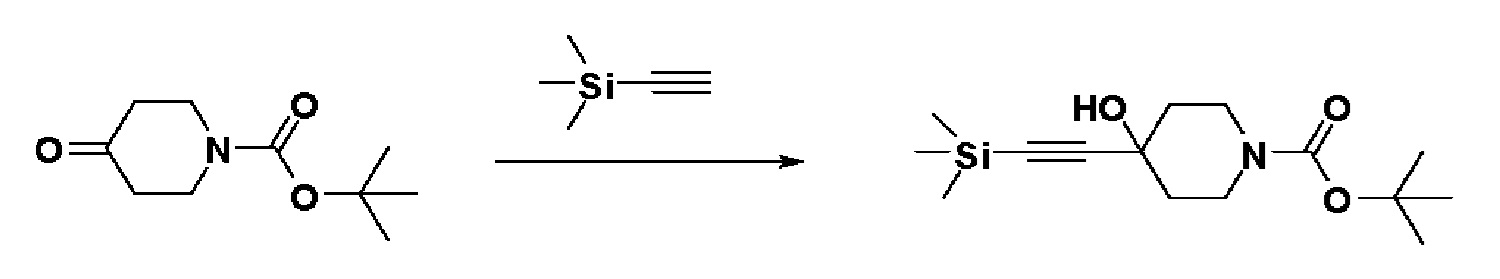
К раствору трет-бутил-4-оксопиперидин-1-карбоксилата (20 г, 1 экв.) в THF (335 мл) добавляли n-BuLi (2,5M, 64 мл, 1,6 экв.) при -78°C. Смесь перемешивали в течение 1 часа. Раствор этинилтриметилсилана (14,8 г, 1,5 экв.) в THF (335 мл) медленно добавляли при -78°C и перемешивали в течение 12 часов при комнатной температуре. Смесь гасили водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (9 г, 30%).
1H ЯМР (600 МГц, CDCl3-d1);δ 3,82-3,76 (м, 2H), 3,22-3,18 (м, 2H), 2,08 (ушир.с, 1H), 1,88-1,80 (м, 2H), 1,68-1,62 (м, 2H), 1,44 (с, 9H), 0,16 (с, 9H).
Стадия 2: Синтез трет-бутил-4-((триметилсилил)этинил)-3,6-дигидропиридин-1(2H)-карбоксилата

К раствору трет-бутил-4-гидрокси-4-((триметилсилил)этинил)пиперидин-1-карбоксилата (5,8 г, 1 экв.) в дихлорметане (195 мл) добавляли Et3N (5,44 мл, 2 экв.) и метансульфонилхлорид (3,04 мл, 2 экв.) при -10°C. Смесь перемешивали в течение 12 часов при комнатной температуре и затем экстрагировали дихлорметаном и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (3,3 г, 61%).
1H ЯМР (600 МГц, CDCl3-d1);δ 6,04 (с, 1H), 3,96-3,90 (м, 2H), 3,50-3,42 (м, 2H), 2,28-2,18 (м, 2H), 1,45 (с, 9H), 0,17 (с, 9H).
Стадия 3: Синтез трет-бутил-4-этинил-3,6-дигидропиридин-1(2H)-карбоксилата

К раствору трет-бутил-4-((триметилсилил)этинил)-3,6-дигидропиридин-1(2H)-карбоксилата (3,3 г, 1 экв.) в MeOH (100 мл) добавляли K2CO3 (2,45 г, 1,5 экв.). Смесь перемешивали в течение 4 часов при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (2,38 г, 97%).
1H ЯМР (600 МГц, CDCl3-d1);δ 6,08 (с, 1H), 3,96-3,90 (м, 2H), 3,50-3,42 (м, 2H), 2,88 (с, 1H), 2,28-2,18 (м, 2H), 1,45 (с, 9H).
Пример 52: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(пиридин-4-илэтинил)-3,6-дигидропиридин-1(2H)-ил)бутанамида

Стадия 1: Синтез трет-бутил-4-(пиридин-4-илэтинил)-3,6-дигидропиридин-1(2H)-карбоксилата
К раствору трет-бутил-4-этинил-3,6-дигидропиридин-1(2H)-карбоксилата (промежуточное соединение 7) (900 мг, 1 экв.) в THF (10 мл) добавляли CuI (83 мг, 0,1 экв.), Pd(PPh3)2Cl2 (152 мг, 0,05 экв.), Et3N (2,4 мл, 4 экв.) и 4-йодпиридин (890 мг, 1 экв.). Смесь перемешивали в течение 2 дней при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (500 мг, 41%).
1H ЯМР (600 МГц, CDCl3-d1);δ 8,90-8,56 (м, 2H), 7,58-7,34 (м, 2H), 6,20 (с, 1H), 4,08-4,00 (м, 2H), 3,56-3,50 (м, 2H), 2,48-2,40 (м, 2H), 1,47 (с, 9H).
Стадия 2: Синтез 4-((1,2,3,6-тетрагидропиридин-4-ил)этинил)пиридин гидрохлорида
К раствору трет-бутил-4-(пиридин-4-илэтинил)-3,6-дигидропиридин-1(2H)-карбоксилата (500 мг, 1 экв.) в MeOH (10 мл) добавляли ацетилхлорид (1,25 мл, 10 экв.). Смесь перемешивали в течение 4 часов при 60oC, охлаждали до комнатной температуры и концентрировали в вакууме с получением указанного в заголовке соединения (380 мг, 98%).
1H ЯМР (600 МГц, CD3OD-d4);δ 8,84-8,82 (м, 2H), 8,08-8,07 (м, 2H), 6,52 (м, 1H), 3,90-3,88 (м, 2H), 3,43-3,41 (м, 2H), 2,68-2,66 (м, 2H).
Стадия 3: Синтез метил-2-метил-2-(метилсульфонил)-4-(4-(пиридин-4-илэтинил)-3,6-дигидропиридин-1(2H)-ил)бутаноата
К раствору 4-((1,2,3,6-тетрагидропиридин-4-ил)этинил)пиридин гидрохлорида (380 мг, 1 экв.) в DMF (10 мл) добавляли N,N-диизопропилэтиламин (1,2 мл, 4 экв.) и метил-4-бром-2-метил-2-(метилсульфонил)бутаноат (промежуточное соединение 1) (940 мг, 2 экв.). Смесь перемешивали в течение 12 часов при 60oC, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (85 мг, 13%).
1H ЯМР (600 МГц, CDCl3-d1);δ 8,54-8,53 (м, 2H), 7,26-7,25 (м, 2H), 6,16 (с, 1H), 3,74 (с, 3H), 3,18-3,14 (м, 1H), 3,03 (с, 3H), 2,98-2,94 (м, 1H), 2,72-2,46 (м, 4H), 2,32-2,28 (м, 2H), 1,88-1,82 (м, 1H), 1,61 (с, 3H), 1,29-1,24 (м, 1H).
MS (ESI, m/z): 377,1 [M+H]+.
Стадия 4-6: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(пиридин-4-илэтинил)-3,6-дигидропиридин-1(2H)-ил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 2-метил-2-(метилсульфонил)-4-(4-(пиридин-4-илэтинил)-3,6-дигидропиридин-1(2H)-ил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ10,93 (ушир.с, 1H), 9,10 (ушир.с, 1H), 8,55-8,53 (м, 2H), 7,37-7,36 (м, 2H), 6,23 (с, 1H), 3,10-3,04 (м, 2H), 3,03 (с, 3H), 2,60-2,54 (м, 2H), 2,48-2,42 (м, 2H), 2,36-2,18 (м, 3H), 1,82-1,76 (м, 1H), 1,43 (с, 3H).
MS (ESI, m/z): 378,1 [M+H]+.
Пример 53: Синтез 4-(4-((4-бромфенил)этинил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 52, с использованием 1-бром-4-йодбензола.
1H ЯМР (600 МГц, DMSO-d6);δ10,94 (ушир.с, 1H), 9,10 (ушир.с, 1H), 7,55-7,54 (м, 2H), 7,35-7,34 (м, 2H), 6,14 (с, 1H), 3,06-2,98 (м, 5H), 2,58-2,43 (м, 4H), 2,32-2,16 (м, 3H), 1,80-1,72 (м, 1H), 1,48 (с, 3H).
MS (ESI, m/z): 454,9 [M+H]+.
Пример 54: Синтез N-гидрокси-4-(4-(7-гидроксигепта-1,3-диин-1-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез трет-бутил-4-(7-гидроксигепта-1,3-диин-1-ил)-3,6-дигидропиридин-1(2H)-карбоксилата
К раствору трет-бутил-4-этинил-3,6-дигидропиридин-1(2H)-карбоксилата (5 г, 1 экв.) в смеси MeOH (60 мл)/пиридин (60 мл) добавили ацетат меди (II) (8,76 г, 2 экв.) и пент-4-ин-1-ол (8,12 г, 4 экв.). Смесь перемешивали в течение 24 часов при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (1,8 г, 26%).
1H ЯМР (600 МГц, CDCl3-d1);δ 6,12 (с, 1H), 3,96-3,94 (м, 2H), 3,76-3,73 (м, 2H), 3,48-3,44 (м, 2H), 2,47-2,44 (м, 2H), 2,22-2,20 (м, 2H), 1,82-1,76 (м, 2H), 1,45 (с, 9H).
Стадия 2: Синтез 7-(1,2,3,6-тетрагидропиридин-4-ил)гепта-4,6-диин-1-ол гидрохлорида
К раствору трет-бутил-4-(7-гидроксигепта-1,3-диин-1-ил)-3,6-дигидропиридин-1(2H)-карбоксилата (1,8 г, 1 экв.) в MeOH (30 мл) добавляли ацетилхлорид (4,42 мл, 10 экв.). Смесь перемешивали в течение 4 часов при 60oC, охлаждали до комнатной температуры и разбавляли в диэтиловом эфире. Осажденное твердое вещество отфильтровывали с получением указанного в заголовке соединения (1 г, 71%).
1H ЯМР (600 МГц, CDCl3-d1);δ 6,17 (м, 1H), 3,76-3,74 (м, 2H), 3,62-3,59 (м, 2H), 3,33-3,29 (м, 2H), 2,48-2,46 (м, 2H), 2,44-2,42 (м, 2H), 1,75-1,70 (м, 2H).
Стадия 3: Синтез метил-4-(4-(7-гидроксигепта-1,3-диин-1-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата
К раствору 7-(1,2,3,6-тетрагидропиридин-4-ил)гепта-4,6-диин-1-ол гидрохлорида (900 мг, 1 экв.) в DMF (20 мл) добавляли N,N-диизопропилэтиламин (2,79 мл, 4 экв.) и метил-4-бром-2-метил-2-(метилсульфонил)бутаноат (промежуточное соединение 1) (2,18 г, 2 экв.). Смесь перемешивали в течение 12 часов при 60oC, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (300 мг, 19,8%).
MS (ESI, m/z): 382,2 [M+H]+.
Стадия 4-6: Синтез N-гидрокси-4-(4-(7-гидроксигепта-1,3-диин-1-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 4-(4-(7-гидроксигепта-1,3-диин-1-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ10,90 (ушир.с, 1H), 9,09 (ушир.с, 1H), 6,19 (с, 1H), 4,53 (т, J=5,4 Гц, 1H), 3,43-3,40 (м, 2H), 3,02 (с, 3H), 2,93-2,99 (м, 2H), 2,52-2,50 (м, 1H), 2,44-2,36 (м, 5H), 2,27-2,24 (м, 1H), 2,16-2,07 (м, 2H), 1,77-1,73 (м, 1H), 1,61-1,56 (м, 2H), 1,41 (с, 3H).
MS (ESI, m/z): 383,1 [M+H]+.
Пример 55: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида

Стадия 1: Синтез метил-2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутаноата
К раствору метил-4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (промежуточное соединение 2) (1,27 г. 1 экв.) в смеси 1,4-диоксан (12 мл)/вода (3 мл) добавляли Pd(PPh3)2Cl2 (0,21 г, 0,1 экв.), K2CO3 (1,27 г, 3 экв.) и пиридин-4-илбороновую кислоту (0,75 г, 2 экв.). Смесь перемешивали в течение 2 часов при 110oC, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (536 мг, 41%).
1H ЯМР (600 МГц, CDCl3-d1);δ8,65 (д, J=6 Гц, 2H), 7,61 (д, J=8,4 Гц, 2H), 7,51-7,49 (м, 4H), 6,16 (с, 1H), 3,70 (с, 3H), 3,28-3,25 (м, 1H), 3,09-3,07 (м, 1H), 3,06 (с, 3H), 2,84-2,82 (м, 1H), 2,70-2,55 (м, 6H), 2,04-2,02 (м, 1H), 2,65 (с, 3H).
MS (ESI, m/z): 429,1 [M+H]+.
Стадия 2: Синтез 2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутановой кислоты
К раствору метил-2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутаноата (536 мг, 1 экв.) в смеси THF (8 мл)/MeOH (2 мл) добавляли раствор 2N-LiOH (1,88 мл, 3 экв.). Смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток разбавляли водой (10 мл) и доводили значение pH до 4,0. Осажденное твердое вещество отфильтровывали с получением указанного в заголовке соединения (476 мг, 92%), которое использовали на следующей стадии без дополнительной очистки.
MS (ESI, m/z): 415,2 [M+H]+.
Стадия 3: Синтез 2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида
К раствору 2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутановой кислоты (476 мг, 1 экв.) в DMF (10 мл) добавляли HATU (611 мг, 1,4 экв.), HOBT (246 мг, 1,4 экв.), Et3N (0,48 мл, 3 экв.) и O-(тетрагидро-2H-пиран-2-ил)гидроксиламин гидрохлорид (353 мг, 2 экв.). Смесь перемешивали в течение 1 часа при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (400 мг, 68%).
MS (ESI, m/z): 514,3 [M+H]+.
Стадия 4: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)бутанамида
К раствору 2-метил-2-(метилсульфонил)-4-(4-(4-(пиридин-4-ил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-((тетрагидро-2H-пиран-2-ил)окси)бутанамида (400 мг, 1 экв.) в MeOH (10 мл) добавляли раствор HCl в MeOH (1,25N, 1,87 мл, 3 экв.). Смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток разбавляли водой (6 мл) и доводили значение pH до 7,0. Воду концентрировали в вакууме и полученный остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (91 мг, 27%).
1H ЯМР (600 МГц, DMSO-d6);δ 11,02 (ушир.с, 1H), 9,11 (ушир.с, 1H), 8,59 (д, J=6 Гц, 2H), 7,76 (д, J=8,4 Гц, 2H), 7,69 (дд, J=4,8 Гц, 1,8 Гц, 2H), 7,55 (д, J=7,8 Гц, 2H), 6,26 (с, 1H), 3,14-3,09 (м, 2H), 3,05 (с, 3H), 2,67-2,58 (м, 2H), 2,52-2,44 (м, 4H), 2,36-2,30 (м, 1H), 1,84-1,80 (м, 1H), 1,45 (с, 3H).
MS (ESI, m/z): 430,1 [M+H]+.
[Примеры 56-73]
Промежуточное соединение 2 в качестве исходного материала и производные бороновой кислоты, перечисленные в следующей таблице, использовали для получения соединений примеров 56-73 таким же образом, как в примере 55.
Пример 74: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4'-(морфолинометил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)бутанамида

Стадия 1: Синтез метил-4-(4-(4'-формил-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата
К раствору метил-4-(4-(4-иодфенил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (промежуточное соединение 2) (1,5 г. 1 экв.) в смеси 1,4-диоксан (12 мл)/ вода (3 мл) добавляли Pd(PPh3)2Cl2 (0,37 г, 0,1 экв.), K2CO3 (1,34 г, 3 экв.) и (4-формилфенил)бороновую кислоту (0,97 г, 2 экв.). Смесь перемешивали в течение 2 часов при 110oC, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (1 г, 68%).
1H ЯМР (600 МГц, CDCl3-d1);δ10,04 (с, 1H), 7,94-7,92 (м, 2H), 7,74-7,71 (м, 2H), 7,63-7,60 (м, 2H), 7,49-7,45 (м, 2H), 6,08 (с, 1H), 3,87 (с, 3H), 3,79-76 (м, 2H), 3,66-3,56 (м, 2H), 3,42-3,26 (м, 2H), 3,13 (с, 3H), 2,92-2,72 (м, 4H), 1,74 (с, 3H).
MS (ESI, m/z): 456,2 [M+H]+.
Стадия 2: Синтез метил-2-метил-2-(метилсульфонил)-4-(4-(4'-(морфолинометил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)бутаноата
К раствору метил-4-(4-(4'-формил-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)бутаноата (500 мг, 1 экв.) в THF (11 мл) добавляли морфолин (0,19 мл, 2 экв.) и триацетоксиборгидрид натрия (930 мг, 4 экв.). Смесь перемешивали в течение 2 часов при комнатной температуре, гасили насыщ. водн. NaHCO3, и экстрагировали дихлорметаном и водой. Органический слой сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (450 мг, 78%).
1H ЯМР (600 МГц, CDCl3-d1);δ 7,55-7,53 (м, 4H), 7,44-7,43 (м, 2H), 7,40-7,38 (м, 2H), 6,11-6,10 (м, 1H), 3,74-3,72 (м, 4H), 3,69 (с, 3H), 3,55 (с, 2H), 3,28-3,24 (м, 1H), 3,10-3,02 (м, 1H), 3,05 (с, 3H), 2,86-2,78 (м, 1H), 2,68-2,58 (м, 4H), 2,56-2,46 (м, 6H), 2,06-1,98 (м, 1H), 1,64 (с, 3H).
Стадия 3-5: Синтез N-гидрокси-2-метил-2-(метилсульфонил)-4-(4-(4'-(морфолинометил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадия 2-4 из метил-2-метил-2-(метилсульфонил)-4-(4-(4'-(морфолинометил)-[1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6);δ11,01 (с, 1H), 9,12 (с, 1H), 7,61-7,60 (м, 4H), 7,50-7,48 (м, 2H), 7,37-7,35 (м, 2H), 6,20 (с, 1H), 3,56-3,55 (м, 4H), 3,10-3,08 (м, 2H), 3,05 (с, 3H), 2,66-2,59 (м, 2H), 2,51-2,43 (м, 4H), 2,37-2,30 (м, 5H), 1,84-1,80 (м, 1H), 1,45 (с, 3H).
MS (ESI, m/z): 528,25 [M+H]+.
Пример 75: Синтез N-гидрокси-4-(6-(3-метоксипроп-1-ин-1-ил)-3',6'-дигидро-[3,4'-бипиридин]-1'(2'H)-ил)-2-метил-2-(метилсульфонил)бутанамида

Стадия 1: Синтез 5-бром-2-(3-метоксипроп-1-ин-1-ил)пиридина
К раствору 2,5-дибромпиридина (5 г, 1 экв.) в толуоле (60 мл) добавляли CuI (80 мг, 0,02 экв.), Pd(PPh3)2Cl2 (150 мг, 0,01 экв.), Et3N (5,96 мл, 2 экв.) и 3-метоксипроп-1-ин (1,6 г, 1,05 экв.). Смесь перемешивали в течение 24 часов при комнатной температуре, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (4,3 г, 90%).
1H ЯМР (600 МГц, CDCl3-d1) δ;8,62 (с, 1H), 7,78 (м, 1H), 7,73 (д, 1H), 4,32 (с, 2H), 3,45(с, 3H). MS (ESI, m/z): 228,0 [M+H]+.
Стадия 2: Синтез трет-бутил-6-(3-метоксипроп-1-ин-1-ил)-3',6'-дигидро-[3,4'-бипиридин]-1'(2'H)-карбоксилата
К раствору 5-бром-2-(3-метоксипроп-1-ин-1-ил)пиридина (4,3 г, 1 экв.) в смеси 1,4-диоксан (80 мл)/вода (20 мл) добавляли Pd(PPh3)2Cl2 (1,3 г, 0,1 экв.), K2CO3 (5,3 г, 2 экв.) и трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат (7,7 г, 1,3 экв.). Смесь перемешивали в течение 2 часов при 110oC, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (2 г, 32%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,64 (дд, 1H), 7,52 (м, 1H), 7,47 (м, 1H), 4,36 (с, 2H), 4,02(м, 2H), 3,46-3,45,(м, 2H), 2,82(м, 1H), 1,26(с, 9H).
MS (ESI, m/z): 329,1 [M+H]+.
Стадия 3: Синтез 6-(3-метоксипроп-1-ин-1-ил)-1',2',3',6'-тетрагидро-3,4'-бипиридин 2,2,2-трифторацетата
К раствору трет-бутил-6-(3-метоксипроп-1-ин-1-ил)-3',6'-дигидро-[3,4'-бипиридин]-1'(2'H)-карбоксилата (2 г, 1 экв.) в дихлорметане (90 мл) добавляли трифторуксусную кислоту (50 мл, избыток) при 0oC. Смесь перемешивали в течение 2 часов при комнатной температуре и концентрировали в вакууме с получением указанного в заголовке соединения (2 г, 96%).
MS (ESI, m/z): 229,1 [M+H]+.
Стадия 4: Синтез метил-4-(6-(3-метоксипроп-1-ин-1-ил)-3',6'-дигидро-[3,4'-бипиридин]-1'(2'H)-ил)-2-метил-2-(метилсульфонил)бутаноата
К раствору 6-(3-метоксипроп-1-ин-1-ил)-1',2',3',6'-тетрагидро-3,4'-бипиридин 2,2,2-трифторацетата (1 г, 1 экв.) в DMF (15 мл) добавляли Et3N (1,23 мл, 3 экв.) и метил-4-бром-2-метил-2-(метилсульфонил)бутаноат (промежуточное соединение 1) (957 мг, 1,2 экв.). Смесь перемешивали в течение 12 часов при 60oC, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (1,1 г, 89%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,62 (м, 1H), 7,95 (м, 1 H), 7,66 (м, 1 H), 6,15 (с, 1H), 4,33(с, 2H), 3,67,(с, 3H), 3,45(с, 3H), 3,25(м, 1H), 3,07(м, 1H), 3,03(с, 3H), 2,81(м, 1H) 2,63-2,57(м, 3H), 2,57(м, 2H), 1,62(с, 3H).
MS (ESI, m/z): 421,2 [M+H]+.
Стадия 5-7: Синтез N-гидрокси-4-(6-(3-метоксипроп-1-ин-1-ил)-3',6'-дигидро-[3,4'-бипиридин]-1'(2'H)-ил)-2-метил-2-(метилсульфонил)бутанамида
Указанное в заголовке соединение получали способами, описанными для синтеза примера 1, стадии 2-4 (синтез гидроксамата) из 4-(6-(3-метоксипроп-1-ин-1-ил)-3',6'-дигидро-[3,4'-бипиридин]-1'(2'H)-ил)-2-метил-2-(метилсульфонил)бутаноата.
1H ЯМР (600 МГц, DMSO-d6); δ 11,01 (ушир.с, 1H), 8,72 (ушир.с, 1 H), 7,93 (дд, 1 H), 7,57 (д, 1H), 6,41(с, 2H), 4,35,(с, 2H), 4,13(м, 1H), 4,01(м, 1H), 3,84(м, 1H), 3,76(м, 1H), 3,27(м, 1H), 3,19(м, 1H), 3,14(с, 3H), 2,98(м, 1H,) 2,87(м, 1H) 2,68(м, 1H), 2,25(м, 1H), 1,50(с, 3H).
MS (ESI, m/z): 415,1 [M+H]+.
Пример 76: Синтез 3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)пропанамида

Стадия 1: Синтез трет-бутил-4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилата

К раствору 4-бром-1,1'-бифенила (2 г, 1 экв.) в смеси 1,4-диоксан (24 мл)/вода (6 мл) добавляли Pd(PPh3)2Cl2 (0,6 г, 0,1 экв.), K2CO3 (2,37 г, 2 экв.) и трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат (3,45 г, 1,3 экв.). Смесь перемешивали в течение 2 часов при 110oC, охлаждали до комнатной температуры, и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (1,65 г, 57%).
1H ЯМР (600 МГц, DMSO-d6);δ 7,40-7,37 (м, 4H), 7,26-7,16 (м, 4H), 7,08-7,05 (м, 1H), 6,15 (с, 1H), 4,11 (с, 2H), 3,62 (с, 2H), 2,50 (с, 2H), 1,49(с, 9H).
MS (ESI, m/z): 336,3 [M+H]+.
Стадия 2: Синтез 4-([1,1'-бифенил]-4-ил)-1,2,3,6-тетрагидропиридин 2,2,2-трифторацетата

К раствору 4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-карбоксилата (1,1 г, 1 экв.) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (2 мл, 8 экв.). Смесь перемешивали в течение 1 часа при комнатной температуре и концентрировали в вакууме. Остаток разбавляли дихлорметаном и выливали в избыток диэтилового эфира. Осажденное твердое вещество отфильтровывали с получением указанного в заголовке соединения (1,08 г, 94%).
1H ЯМР (600 МГц, DMSO-d6);δ8,68 (ушир.с, 2H), 7,52-7,48 (м, 4H), 7,43-7,39 (м, 4H), 7,08-7,05 (м, 1H), 6,15 (с, 1H), 3,76 (с, 2H), 3,25 (с, 2H), 2,65 (с, 2H).
MS (ESI, m/z): 236,1 [M+H]+.
Стадия 3: Синтез метил-3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)пропаноата

К раствору трет-бутил-4-([1,1'-бифенил]-4-ил)-1,2,3,6-тетрагидропиридин 2,2,2-трифторацетата (1 г, 1 экв.) в смеси MeOH (30 мл)/THF (10 мл) добавляли Et3N (2 мл, 5 экв.), формальдегид (37% в воде, 0,5 мл, 2,2 экв.) и метил-2-(метилсульфонил)пропаноат (0,95 г, 2 экв.). Смесь перемешивали в течение 24 часов при комнатной температуре и концентрировали в вакууме. Остаток экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (0,25 г, 21%).
1H ЯМР (600 МГц, CDCl3-d1);δ7,70-7,65 (м, 4H), 7,61-7,58 (м, 2H), 7,48-7,42 (м, 2H), 7,40-7,35 (м, 1H) 6,03 (с, 1H), 3,85 (с, 3H), 3,31 (д, 1H, J=14,4 Hz), 3,26 (с, 2H), 3,18 (с, 3H), 3,05 (д, 1H, J=13,8 Hz), 2,81 (т, 2H, J=6,0Hz), 2,58-2,46 (м, 2H), 1,69(с, 3H).
MS (ESI, m/z): 413,2 [M+H]+.
Стадия 4: Синтез 3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)пропановой кислоты

К раствору метил-3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)пропаноата (200 мг, 1 экв.) в THF (10 мл) добавляли 1N-LiOH в MeOH (5 мл, 8,3 экв.). Смесь перемешивали в течение 3 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток подкисляли 2 н. HCl и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме с получением указанного в заголовке соединения (200 мг, 83%).
MS (ESI, m/z): 400,10 [M+H]+.
Стадия 5: Синтез 3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)пропанамида

К раствору метил-3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)пропаноата (50 мг, 1 экв.) в DMF (2 мл) добавляли HATU (67 мг, 1,4 экв.), HOBT (24 мг, 1,4 экв.), Et3N (0,053 мл, 3 экв.) и O-(тетрагидро-2H-пиран-2-ил)гидроксиламин гидрохлорид (29 мг, 2 экв.). Смесь перемешивали в течение 1 часа при комнатной температуре и экстрагировали этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (50 мг, 80%).
MS (ESI, m/z): 499,2 [M+H]+.
Стадия 6: Синтез 3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)пропанамида

К раствору 3-(4-([1,1'-бифенил]-4-ил)-3,6-дигидропиридин-1(2H)-ил)-2-метил-2-(метилсульфонил)-N-((тетрагидро-2H-пиран-2-ил)окси)пропанамида (30 мг, 1 экв.) в MeOH (1,5 мл) добавляли раствор HCl в MeOH (1,25N, 0,1 мл, 2 экв.). Смесь перемешивали в течение 2 часов при комнатной температуре. Растворитель удаляли при пониженном давлении. Остаток разбавляли водой (6 мл) и доводили значение pH до 7,0. Воду концентрировали и полученный остаток очищали колоночной хроматографией с получением указанного в заголовке соединения (10 мг, 40%).
1H ЯМР (600 МГц, DMSO-d6);δ 11,3 (ушир.с, 1H), 9,51 (ушир.с, 1H), 7,70-7,65 (м, 4H), 7,61-7,58 (м, 2H), 7,48-7,42 (м, 2H), 7,40-7,35 (м, 1H) 6,25 (с, 1H), 4,18-3,91 (м, 2H), 3,61-3,49 (м, 4H), 3,15 (с, 3H), 2,47-2,40 (м, 2H), 1,48 (с, 3H).
MS (ESI, m/z): 415,1 [M+H]+.
Пример 77: Синтез 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-метилфенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 31, с использованием 4-бром-1-иод-2-метилбензола в качестве исходного материала.
1H ЯМР (600 МГц, DMSO-d6);δ 11,03 (ушир.с, 1H), 9,13 (ушир.с, 1H), 7,34-7,33 (м, 2H), 7,24-7,23 (м, 1H), 6,20 (с, 1H), 3,50 (с, 2H), 3,12-3,10 (м, 2H), 3,07 (с, 3H), 2,66-2,63 (м, 2H), 2,48-2,44 (м, 4H), 2,39 (с, 3H), 2,25 (с, 6H), 1,84-1,82 (м, 2H), 1,43 (с, 3H).
MS (ESI, m/z): 448,2 [M+H]+.
Пример 78: Синтез 4-(4-(4-(3-(диметиламино)проп-1-ин-1-ил)-3-(трифторметил)фенил)-3,6-дигидропиридин-1(2H)-ил)-N-гидрокси-2-метил-2-(метилсульфонил)бутанамида

Указанное в заголовке соединение получали способами, описанными для синтеза примера 31, с использованием 4-бром-1-иод-2-(трифторметил)бензола в качестве исходного материала.
1H ЯМР (600 МГц, DMSO-d6);δ 11,03 (ушир.с, 1H), 9,11 (ушир.с, 1H), 7,71-7,69 (м, 2H), 7,63-7,62 (м, 1H), 6,36 (с, 1H), 3,50 (с, 2H), 3,32 (с, 3H), 3,17-3,16 (м, 2H), 2,66-2,57 (м, 2H), 2,46-2,32 (м, 4H), 2,23 (с, 6H), 1,83-1,80 (м, 2H), 1,45 (с, 3H).
MS (ESI, m/z): 502,2 [M+H]+.
Экспериментальный пример 1: Тест in vitro на антибиотическую активность
Для измерения антибиотической активности соединений, полученных в Примерах, тест на антибиотическую активность in vitro проводили методом разведения агара с использованием агара Мюллера-Хинтона в соответствии с NCCLS (National Committee for Clinical Laboratory Standards. 2000. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobiocally. Approved standard, NCCLS document M7-M5, 5thed, vol 20, no 2. National Committee for Clinical Laboratory Standards, Wayne, PA.). Тестируемым штаммом были Escherichia coli (ATCC 25922), Klebsiella pneumoniae (ATCC 29665) и Pseudomonas aeruginosa (PAO1). Их Минимальная Ингибирующая Концентрация (MIC, мкг/мл) показана в таблице 1.
<Таблица 1>
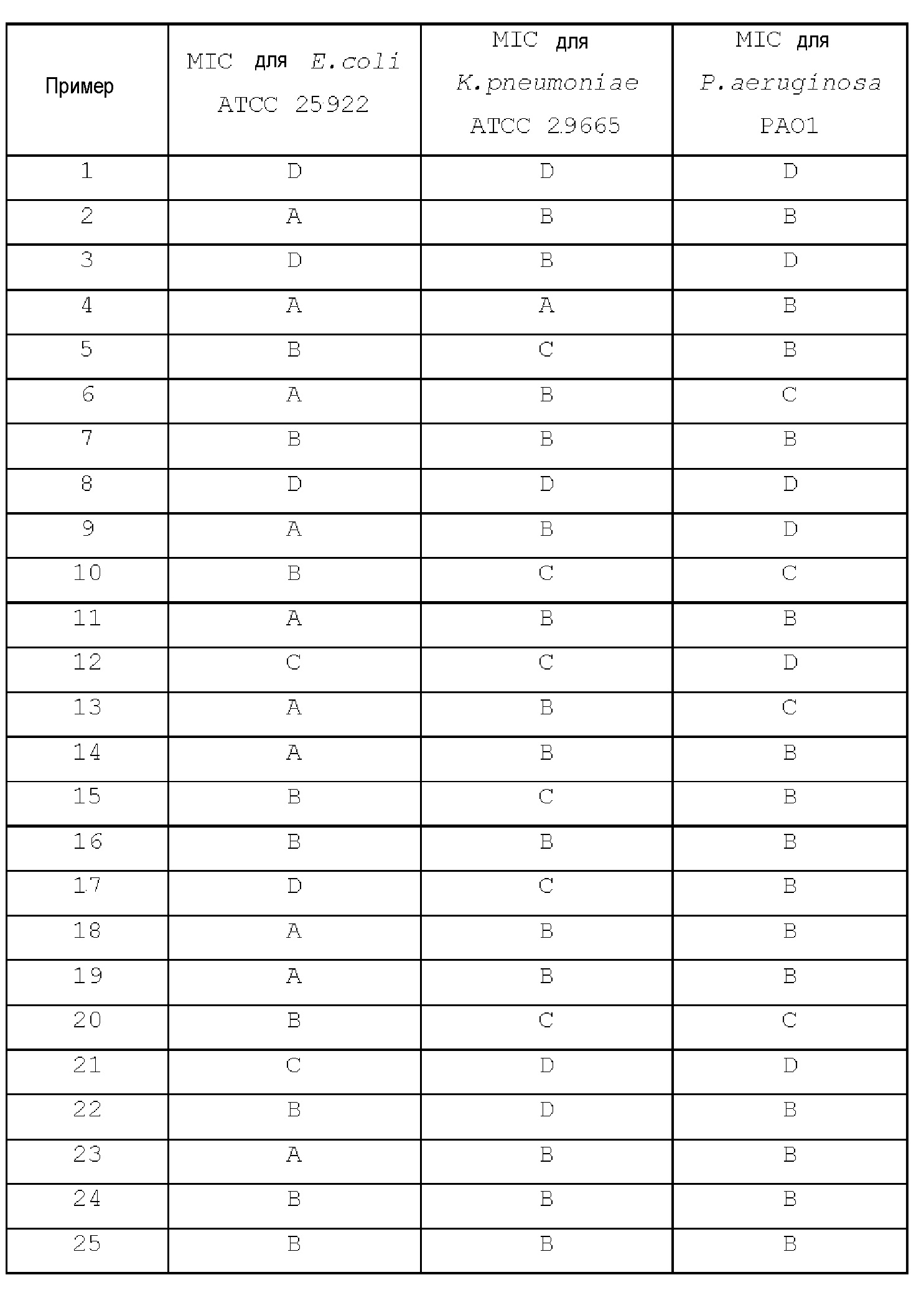

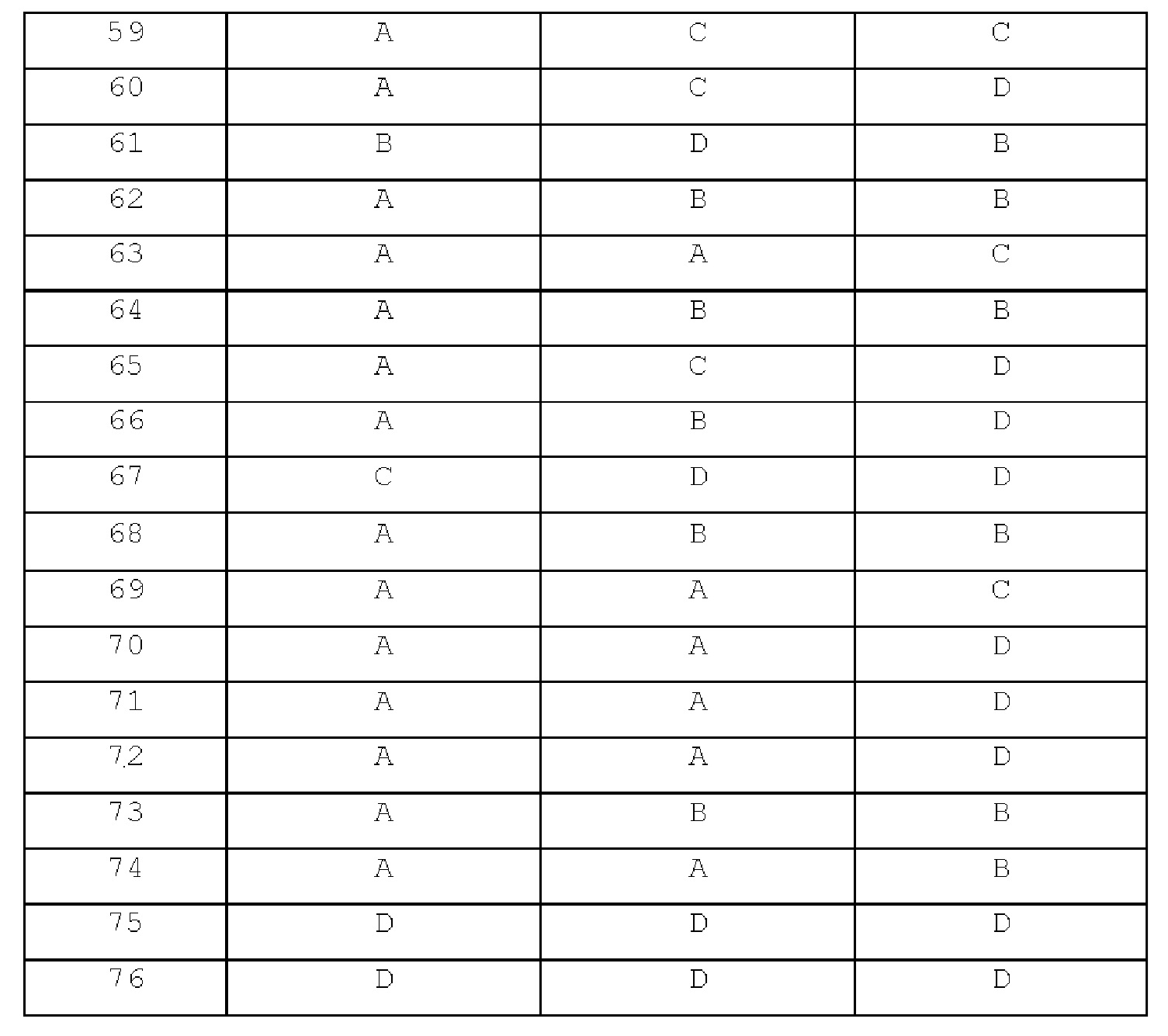
Основные MIC:
A=MIC 1,0 мкг/мл или менее
B=MIC более 1,0 мкг/мл до 8,0 мкг/мл
C=MIC более 8,0 мкг/мл до 16,0 мкг/мл
D=MIC более 16 мкг/мл
Реферат
Изобретение относится к тетрагидропиридиновому соединению формулы I, его стереоизомеру или его фармацевтически приемлемой соли, его применению, фармацевтической композиции на их основе и способу лечения бактериальных инфекций, вызванных грамотрицательными бактериями. В общей формуле I n равно 1 или 2; Rпредставляет собой C1-C6 алкил; Rпредставляет собой C1-C6 алкил; Rпредставляет собой водород; L представляет собой фенил, пиридинил либо отсутствует, где по меньшей мере один H фенила или пиридинила может быть замещен галогеном, C1-C6 алкилом или C1-C6 галогеналкилом; D представляет собой C≡C либо отсутствует; E представляет собой C≡C либо отсутствует; G представляет собой C1-C6 алкил, C3-C7 циклоалкил, 4-6-членный гетероциклоалкил с одним атомом N, фенил, пиридинил, фуранил, тиофенил или имидазолил, где по меньшей мере один H C1-C6 алкила может быть замещен галогеном, -NRR, -OH или -OR, по меньшей мере один H 4-6-членного гетероциклоалкила с одним атомом N может быть замещен C1-C6 алкилом, -(C=O)-C1-C6 алкилом или -S(=O)-C1-C6 алкилом, по меньшей мере один H фенила, пиридинила, фуранила, тиофенила или имидазолила может быть замещен C1-C6 алкилом, C1-C6 гидроксиалкилом, C1-C6 алкил-NRR, галогеном, нитро, циано, -NRR, -OH, -OR, -S(=O)-C1-C6 алкилом или -S(=O)-NRR; Rи R, каждый независимо, представляют собой водород или C1-C6 алкил, или Rи Rмогут быть связаны вместе с образованием 4-6-членного кольца, где 4-6-членное кольцо может иметь атом O, и по меньшей мере один H 4-6-членного кольца может быть замещен C1-C6 гидроксиалкилом; Rпредставляет собой C1-C6 алкил, C1-C6 гидроксиалкил, -(C=O)-NRRили -S(=O)-C1-C6 алкил; и Rи R,каждый независимо, представляют собой водород. Изобретение также относится к новому производному тетрагидропиридина, его стереоизомеру или его фармацевтически приемлемой соли, способам получения соединений, способам ингибирования UDP-3-O-(R-3-гидроксимиристоил)-N-ацетилглюкозамин деацетилазы (LpxC), способам лечения инфекций, вызванных грамотрицательными бактериями, применению соединений для получения терапевтических лекарственных средств для лечения инфекций, вызванных грамотрицательными бактериями, и фармацевтическим композициям для профилактики или лечения инфекций, вызванных грамотрицательными бактериями, которые содержат соединения. Соединения, представленные формулой I, их стереоизомеры или их фармацевтически приемлемые соли в соответствии с настоящим изобретением могут демонстрировать превосходные эффекты при лечении бактериальных инфекций. 4 н. и 2 з.п. ф-лы, 6 табл., 78 пр.Формула I
Формула


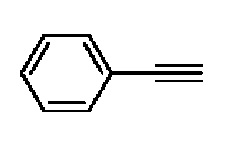









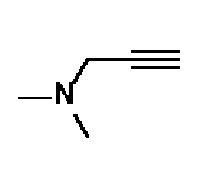


















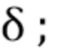
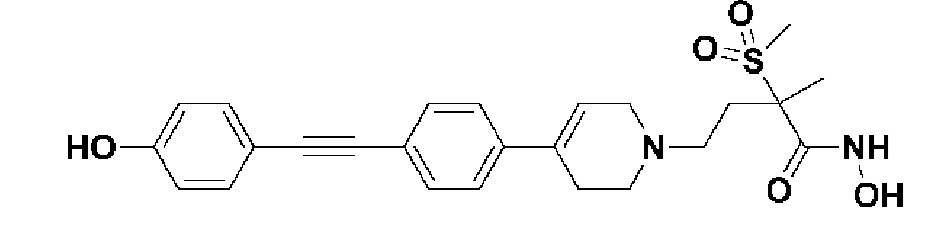








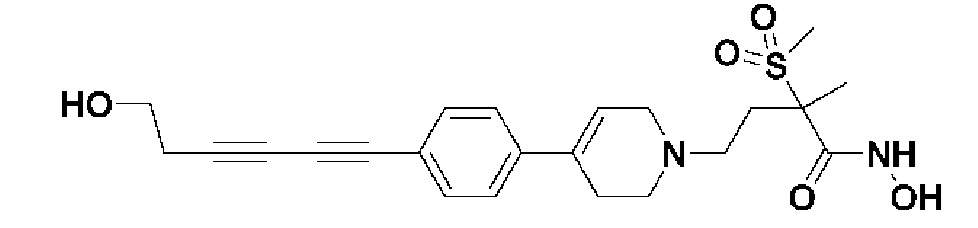





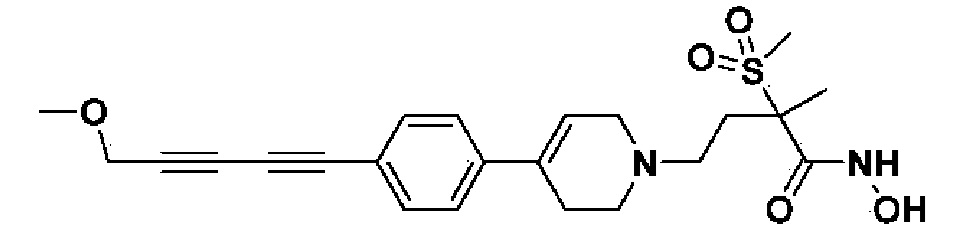






































Комментарии