Ингибиторы пролилгидроксилазы и способы их применения - RU2429226C9
Код документа: RU2429226C9
Чертежи


Описание
Область техники
Настоящее изобретение относится, в некоторых аспектах, к соединениям, ингибирующим HIF-1α пролилгидроксилазу, и их фармацевтически приемлемым солям, композициям, включающим соединения, ингибирующие HIF-1α пролилгидроксилазу, и к способам лечения или контролирования, в частности, заболевания периферических сосудов (PVD), заболевания коронарной артерии (CAD), сердечной недостаточности, ишемии и анемии.
Уровень техники
HIF-1α, в норме, когда клетки снабжаются достаточным количеством кислорода, легко деградирует с помощью одного из некоторых ферментов, пролилгидроксилазы, в частности EGLIN. Когда клетки испытывают гипоксию, это ферментное преобразование медленно или полностью останавливается и HIF-1α начинает накапливаться в клетке. Когда этот рост HIF-1α происходит, этот белок объединяется с другим фактором, HIF-1β, с которым вместе образуют активный комплекс фактора транскрипции. Затем этот фактор транскрипции активирует несколько биологических путей, которые присутствуют в качестве ответа на состояние организма при гипоксии и средства облегчения состояния организма при гипоксии. Эти ответы включают, в частности, ангиогенный, эритропоэтический (EPO) ответы, метаболизм глюкозы и изменение матрикса.
У пациентов, нуждающихся в стимулировании одной или нескольких таких реакций, например у пациентов, нуждающихся в повышенном содержании кислорода в тканях вследствие заболевания периферических сосудов (PVD), ингибирование фермента EGLIN будет стимулировать собственный ответ организма без последствий кислородного дефицита. Кроме того, при ишемических заболеваниях, в частности CAD и анемии, стимулирование ангиогенной, эритропоэтической и метаболической адаптации, как ожидают, обеспечит терапевтический эффект.
Соответственно, существует давно назревшая потребность в соединениях, которые ингибируют ферменты пролилгидроксилазы и таким образом регулируют концентрацию HIF-1α в клетках, для стимуляции ангиогенного или эритропоэтического ответов и, соответственно, лечения заболеваний, связанных с гипоксией или анемией.
Сущность изобретения
Замещенные арильные или гетероарильные амидные соединения по настоящему изобретению представляют собой новый класс соединений, которые могут ингибировать HIF-1α пролилгидроксилазу, что приводит, таким образом, к улучшению кровотока, доставке кислорода и утилизации энергии в ишемизированных тканях или стимуляции выработки эритропоэтина для лечения анемии.
В настоящем документе описаны соединения и их фармацевтически приемлемые соли и/или их фармацевтические композиции, содержащие: a) эффективное количество одного или нескольких соединений по настоящему изобретению; и b) наполнитель.
Настоящее изобретение также относится к способам контролирования, в частности заболевания периферических сосудов (PVD), заболевание коронарной артерии (CAD), сердечной недостаточности, ишемии и/или анемии.
Кроме того, настоящее изобретение относится к способам контролирования кровотока, доставки кислорода и/или утилизации энергии в ишемизированных тканях, где способы могут включать введение человеку эффективного количества одного или нескольких соединений или фармацевтически приемлемых солей, описанных в настоящем документе.
Эти и другие объекты, свойства и преимущества станут очевидны рядовому специалисту в данной области после прочтения следующего подробного описания и прилагаемой формулы изобретения. Все приведенные здесь документы находятся в релевантной части, включены в настоящем документе в качестве ссылки; цитирование любого документа не должно рассматриваться как признание того, что он представляет собой известный уровень техники по отношению к настоящему изобретению.
Краткое описание чертежей
Фиг.1. Иммуноблот-анализ экстрактов ядра, демонстрирующий стабилизацию HIF-1α в печени мыши с помощью {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты.
Фиг.2. Пример того, как уровень эритропоэтина повышается в сравнении с носителем в сыворотке мыши после перорального приема дозы {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты.
Подробное описание изобретения
В этом описании и в пунктах формулы изобретении ниже будет сделана ссылка на ряд терминов, которые должны быть определены в соответствии со следующим значениям:
Термин "фармацевтически приемлемый" относится к веществу, которое не является биологически или каким - либо иным образом неподходящим, то есть вещество может быть введено больному вместе с основным активным соединением без вызывания клинически неприемлемых биологических эффектов или взаимодействия нежелательным образом с любыми другими компонентами фармацевтической композиции, в которой оно содержится.
По всему объему описания и формулы по настоящему изобретению слово "содержат" и другие формы слова, такие как "содержащий" и "содержит", обозначает включение, но этим не ограничивается, и не предполагает исключение, например, других добавок, компонентов, чисел или стадий.
Используемые в настоящем описании и прилагаемой формуле изобретения сингулярные формы "a", "an" и "the" включают множественные обозначения, если в контексте ясно не указано иное. Таким образом, например, ссылка на "композицию" включает смеси из двух или нескольких таких композиций.
Термин "необязательный" или "необязательно" обозначает, что описанная в дальнейшем ситуация или условие имеет или не имеет место быть и что описание включает пример, когда ситуация или условие имеет место быть, и примеры, когда не имеет.
Диапазоны в настоящем документе могут быть выражены в виде от "около" одного конкретного значения и/или до "около" другого конкретного значения. Когда представлен такой диапазон, другой аспект включает от одной конкретной величины и/или до другой конкретной величины. Аналогично, когда величины выражены в виде приближений, используя предлог "около", будет понятно, что конкретная величина составляет другой аспект. Кроме того, будет понятно, что предельные величины каждого диапазона являются значимыми как относительно другой предельной величины, так и независимо от другой предельной величины. Также понятно, что существует множество указанных в настоящем документе величин и что каждая величина также указана в настоящем документе в виде "около" конкретной величины, помимо самой величины. Например, если описана величина "10", тогда "около 10" также указана. Также понятно, что если величина указана, то "меньше чем или равно" величине, "больше чем или равно величине" и возможные диапазоны между величинами также указаны, что соответственно понятно специалисту в данной области. Например, если указана величина "10", тогда "меньше чем или равно 10", как и "больше чем или равно 10" также указаны. Кроме того, следует учесть, что параметры по всему объему заявки приведены в разнообразном виде и эти параметры представлены конечными значениями и начальными значениями и областью любого сочетания значений параметров. Например, если описано конкретное частное значение "10" и конкретное частное значение "15", понятно, что “больше чем”, “больше чем или равно”, “меньше чем”, “меньше чем или равно” и “равно” 10 и 15 считаются указанными, а также между 10 и 15. Кроме того, понятно, что каждое значение между двумя конкретными значениями также указано. Например, если указаны 10 и 15, тогда 11, 12, 13 и 14 также указаны.
Термин "органическое звено", как описано в настоящем документе, относится к группам или фрагментам, которые содержат один или несколько атомов углерода и которые образуют часть одного из соединений или его фармацевтически приемлемой соли. Например, многие из заместителей, указанные в настоящем документе, являются органическими звеньями. Для эффективности их действия в случае наличия их в соединениях и/или солях, описанных в настоящем документе, обычно органические звенья должны иметь ограниченные параметры размера и/или молекулярного веса для того, чтобы обеспечить желаемое связывание с целевыми ферментами, необходимую растворимость, биоабсорбционные характеристики. Например, органическое звено может иметь, например, 1-26 атомов углерода, 1-18 атомов углерода, 1-12 атомов углерода, 1-8 атомов углерода или 1-4 атома углерода. Часто органические звенья имеют водородную связь по меньшей мере с некоторыми атомами углерода органических звеньев и могут необязательно содержать обычные для замещенных органических соединений гетероатомы, такие как кислород, азот, сера и тому подобное или неорганические атомы, такие как галогены, фосфор и тому подобное. Одним из примеров органического радикала, который не содержит неорганические атомы, является 5,6,7,8-тетрагидро-2-нафтильный радикал. В некоторых вариантах осуществления органический радикал может содержать 1-10 неорганических гетероатомов, связанных с ним или содержащихся в нем, включая галогены, кислород, серу, азот, фосфор и тому подобное. Примеры органических радикалов включают, но ими не ограничиваются, алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, монозамещенный амино, дизамещенный амино, ацилокси, циано, карбокси, карбоалкокси, алкилкарбоксамидо, замещенный алкилкарбоксамидо, диалкилкарбоксамидо, замещенный диалкилкарбоксамидо, алкилсульфонил, алкилсульфинил, тиоалкил, тиогалогеналкил, алкокси, замещенный алкокси, галогеналкил, галогеналкокси, арил, замещенный арил, гетероарил, гетероциклические или замещенные гетероциклические радикалы, где термины определены в настоящем документе. Некоторые не ограничивающие объем настоящего изобретения примеры органических радикалов, которые содержат гетероатомы, включают алкокси радикалы, трифторметокси радикалы, ацетокси радикалы, диметиламино радикалы и тому подобное.
Замещенные и незамещенные линейные, разветвленные или циклические алкильные звенья включают следующие не ограничивающие объем настоящего изобретения примеры: метил (C1), этил (C2), н-пропил (C3), изо-пропил (C3), циклопропил (C3), н-бутил (C4), втор-бутил (C4), изо-бутил (C4), трет-бутил (C4), циклобутил (C4), циклопентил (C5), циклогексил (C6) и тому подобное; а также замещенный линейный, разветвленный или циклический алкил, не ограничивающие объем настоящего изобретения примеры которого включают гидроксиметил (C1), хлорметил (C1), трифторметил (C1), аминометил (C1), 1-хлорэтил (C2), 2-гидроксиэтил (C2), 1,2-дифторэтил (C2), 2,2,2-трифторэтил (C3), 3-карбоксипропил (C3), 2,3-дигидроксициклобутил (C4) и тому подобное.
Замещенный и незамещенный линейный, разветвленный или циклический алкенил включает этенил (C2), 3-пропенил (C3), 1-пропенил (а также 2-метилэтенил) (C3), изопропенил (а также 2-метилэтен-2-ил) (C3), бутен-4-ил (C4) и тому подобное; замещенный линейный или разветвленный алкенил, неограничивающий пример которого включает 2-хлорэтенил (а также 2-хлорвинил) (C2), 4-гидроксибутен-1-ил (C4), 7-гидрокси-7-метилокт-4-ен-2-ил (C9), 7-гидрокси-7-метилокт-3,5-диен-2-ил (C9) и тому подобное.
Замещенный и незамещенный линейный или разветвленный алкинил включает этинил (C2), проп-2-инил (а также пропаргил) (C3), пропин-1-ил (C3) и 2-метил-гекс-4-ин-1-ил (C7); замещенный линейный или разветвленный алкинил, примеры которого, не ограничивающие объем настоящего изобретения, включают 5-гидрокси-5-метилгекс-3-инил (C7), 6-гидрокси-6-метилгепт-3-ин-2-ил (C8), 5-гидрокси-5-этилгепт-3-инил (C9) и тому подобное. Используемый в настоящем документе термин замещенный и незамещенный "алкокси" обозначает звено, имеющее общую формулу -OR100, где R100 представляет собой алкильное, алкиленильное или алкинильное звено, как определено в настоящем документе выше, например метокси, метоксиметил.
Используемый в настоящем документе термин замещенный и незамещенный "галогеналкил" обозначает алкильное звено, имеющее атом углерода, замещенный одним или несколькими атомами галогена, например трифторметил, 1,2-дихлорэтил и 3,3,3-трифторпропил.
Используемый в настоящем документе термин "арил" обозначает циклические органические звенья, которые содержат по меньшей мере одно бензольное кольцо, которое может быть конденсировано с ароматическим шестичленным кольцом, примеры которого, не ограничивающие объем настоящего изобретения, включают фенил (C6), нафтилен-1-ил (C10), нафтилен-2-ил (C10). Арильные кольца могут иметь один или несколько атомов углерода, замещенные другим органическим или неорганическим радикалом. Не ограничивающие объем настоящего изобретения примеры замещенных арильных колец включают: 4-фторфенил (C6), 2-гидроксифенил (C6), 3-метилфенил (C6), 2-амино-4-фторфенил (C6), 2-(N,N-диэтиламино)фенил (C6), 2-цианофенил (C6), 2,6-ди-трет-бутилфенил (C6), 3-метоксифенил (C6), 8-гидроксинафтилен-2-ил (C10), 4,5-диметоксинафтилен-1-ил (C10) и 6-цианонафтилен-1-ил (C10).
Термин "гетероарил" обозначает органическое звено, содержащее пяти- или шестичленное конденсированное ароматическое кольцо, где по меньшей мере один из кольцевых атомов представляет собой гетероатом, выбранный из азота, кислорода или серы. Гетероарильные кольца могут представлять собой одно кольцо, например кольцо, содержащее 5 или 6 атомов, где по меньшей мере один кольцевой атом представляет собой гетероатом, не ограничивающийся азотом, кислородом или серой, такое как пиридиновое кольцо, фурановое кольцо или тиофурановое кольцо. "Гетероарил" может также представлять собой конденсированную полициклическую и гетероароматическую кольцевую систему, в которой по меньшей мере одно кольцо является ароматическим кольцом и по меньшей мере один атом в ароматическом кольце представляет собой гетероатом, включая азот, кислород или серу.
Далее представлены не ограничивающие объем настоящего изобретения примеры гетероарильных колец в соответствии с настоящим изобретением:

Термин "гетероциклический" обозначает кольцевую систему, содержащую от 3 до 10 атомов, где по меньшей мере один из кольцевых атомов представляет собой гетероатом, не ограничивающийся азотом, кислородом или серой. Кольца могут представлять собой отдельные кольца, конденсированные кольца или бициклические кольца. Не ограничивающие объем настоящего изобретения примеры гетероциклических колец включают

Все вышеуказанные гетероарильные или гетероциклические кольца могут быть необязательно замещены одним или несколькими заместителями, как описано в настоящем документе далее.
По всему объему настоящего изобретения термины, имеющие написание "тиофен-2-ил и тиофен-3-ил", используются для описания гетероарильных звеньев, имеющих следующую формулу:
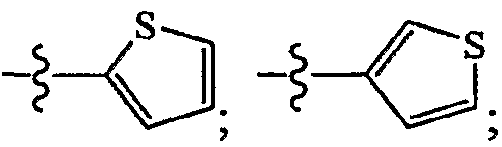
при этом в названии соединений по настоящему изобретению химическая номенклатура для этих фрагментов обычно имеет написание "тиофен-2-ил и тиофен-3-ил" соответственно. В настоящем документе используют термины "тиофен-2-ил и тиофен-3-ил", когда описывают эти кольца как звенья или фрагменты, которые образуют соединения по настоящему изобретению, только с целью сделать это понятным для среднего специалиста в данной области. Следующие не ограничивающие объем настоящего изобретения примеры звеньев, которые могут замещать атомы водорода в гидрокарбониле или другом звене, включают:
i) линейный, разветвленный или циклический алкил, алкенил и алкинил; например метил (C1), этил (C2), н-пропил (C3), изо-пропил (C3), циклопропил (C3), пропилен-2-ил (C3), пропаргил (C3), н-бутил (C4), изо-бутил (C4), втор-бутил (C4), трет-бутил (C4), циклобутил (C4), н-пентил (C5), циклопентил (C5), н-гексил (C6) и циклогексил (C6);
ii) замещенный или незамещенный арил; например фенил, 2-фторфенил, 3-хлорфенил, 4-метилфенил, 2-аминофенил, 3-гидроксифенил, 4-трифторметилфенил и бифенил-4-ил;
iii) замещенный или незамещенный гетероциклический радикал; примеры которого представлены в настоящем документе ниже;
iv) замещенный или незамещенный гетероарил; примеры которого представлены в настоящем документе ниже;
v) -(CR12aR12b)qOR11; например -OH, -CH2OH, -OCH3, -CH2OCH3, -OCH2CH3, -CH2OCH2CH3, -OCH2CH2CH3 и -CH2OCH2CH2CH3;
vi) -(CR12aR12b)qC(O)R11; например -COCH3, -CH2COCH3, -OCH2CH3, -CH2COCH2CH3, -COCH2CH2CH3 и -CH2COCH2CH2CH3;
vii) -(CR12aR12b)qC(O)OR11; например -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
viii) -(CR12aR12b)qC(O)N(R11)2; например -CONH2, -CH2CONH2,
-CONHCH3, -CH2CONHCH3, -CON(CH3)2 и -CH2CON(CH3)2;
ix) -(CR12aR12b)qOC(O)N(R11)2; например -OC(O)NH2, -CH2OC(O)NH2, -OC(O)NHCH3, -CH2OC(O)NHCH3, -OC(O)N(CH3)2 и CH2OC(O)N(CH3)2;
x) -(CR12aR12b)qN(R11)2; например -NH2, -CH2NH2, -NHCH3, -N(CH3)2, -NH(CH2CH3), -CH2NHCH3, -CH2N(CH3)2 и -CH2NH(CH2CH3);
xi) галоген: -F, -Cl, -Br и -I;
xii) - CHmXn; где X представляет собой галоген, m равно 0-2, m+n = 3; например -CH2F, -CHF2, -CF3, -CCl3 или -CBr3;
xiii) -(CR12aR12b)qCN; например -CN, -CH2CN и -CH2CH2CN;
xiv) -(CR12aR12b)qNO2; например -NO2, -CH2NO2 и -CH2CH2NO2;
xv) -(CR12aR12b)qSO2R11; например -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvi) -(CR12aR12b)qSO3R11; например -SO3H, -CH2SO3H, -SO3CH3, CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
xvii) гидроксильные группы или тиольные группы,
xviii) амино группы, моно замещенный амино или дизамещенный амино, где каждый R11 представляет собой, независимо, водород, замещенный или незамещенный C1-C4 линейный, разветвленный или циклический алкил; или два звена R11 могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R12a и R12b представляют собой, каждый, независимо, водород или C1-C4 линейный или разветвленный алкил; индекс q равен от 0 до 4.
Соединения и композиции, указанные в настоящем документе, могут иметь множество применений, и это применение направлено на обеспечение некоторых неудовлетворенных медицинских потребностей, в частности:
1) получение композиций, эффективных в качестве ингибиторов пролилгидроксилазы белка человека, стимулирующих таким образом ангиогенный ответ в тканях человека, тем самым обеспечивая способ повышения кровотока, доставки кислорода и утилизации энергии в ишемизированных тканях;
2) получение композиций, эффективных в качестве ингибиторов пролилгидроксилазы белка HIF-1α человека и таким образом повышающих концентрацию HIF-1α, приводящей к повышенной активации и поддержке различных биологических путей, что является нормальным ответом при клеточной гипоксии;
3) получение композиций, эффективных в стимулировании эритропоэтического (EPO) ответа в клетке; и соответственно повышение содержания эритроцитов путем контролирования пролиферации и дифференцировки эритроидных клеток-предшественников в эритроцитах;
4) получение композиций, эффективных в стимулировании ангиогенного ответа и таким образом повышая количество и густоту кровеносных сосудов и таким образом ослабляя вредные последствия гипертонии и диабета, в частности синдрома Шарко, ишемической язвы, злокачественной гипертонии и почечной недостаточности;
5) получение композиций, которые активируют генную транскрипцию сосудистого эндотелиального фактора роста (VEGF) в гипоксированных клетках, таким образом усиливая стимулирование важных биологических ответов, в частности вазодилатацию, проницаемость сосудов и эндотелиальную клеточную миграцию и пролиферацию.
Соответственно, эти и другие неудовлетворенные медицинские потребности обеспечиваются ингибиторами HIF-1α пролилгидроксилазы по настоящему изобретению, которые способны регулировать кровоток, доставку кислорода и утилизацию энергии в ишемизированных тканях, что вызвано недостаточным регулированием HIF-1α пролилгидроксилазы. Также специалист в данной области определит, что ингибирование ферментов HIF-1α пролилгидроксилазы будет оказывать другие положительные лечебные эффекты на ткань человека и ослабление симптомов и болезненных состояний, иных, чем симптомы или болезненные состояния, конкретно указанные в настоящем изобретении. Однако, поскольку основные детали рассматриваются в отношении заболеваний и состояний, связанных с ангиогенным процессом, композиций, которые стимулируют собственный ответ организма на гипоксию и другие состояния низкого содержания кислорода в крови, будут оказывать положительный эффект на эти все еще неописанные или неизвестные состояния.
Для целей по настоящему изобретению термины "соединение", "аналог" и "композиция" в равной степени относятся к описанным в настоящем документе ингибиторам фермента HIF-1α пролилгидроксилазы, включая все энантиомерные формы, диастереомерные формы, соли и тому подобное, и термины "соединение", "аналог" и "композиция" используются взаимозаменяемо по всему объему изобретения.
Соединения, описанные в настоящем документе, включают все виды солей, например, соли по обоим основным группам, в частности амино группам, а также соли по кислотным группам, в частности соли карбоновых кислот. Следующие не ограничивающие объем настоящего изобретения примеры анионов, которые могут образовывать фармацевтически приемлемые соли с основными группами, включают: хлорид, бромид, йодид, сульфат, бисульфат, карбонат, бикарбонат, фосфат, формат, ацетат, пропионат, бутират, пуриват, лактат, оксалат, малонат, малеат, сукцинат, тартрат, фумарат, цитрат и тому подобное. Следующими неограничивающими объем настоящего изобретения примерами катионов, которые могут образовывать фармацевтически приемлемые соли с анионной формой групп кислотных заместителей в соединениях, описанных в настоящем документе, являются натрий, литий, калий, кальций, магний, цинк, висмут и тому подобное.
Соединения, ингибирующие HIF-1α пролилгидроксилазу, описанные в настоящем документе, представляют собой замещенные арильные или гетероарильные амиды, имеющие структуру ядра, показанную в формуле (I) ниже

где X может представлять собой N или CH; L представляет собой органическое связывающее звено, как описано далее ниже, и Y, R, R1 и R2 могут представлять собой любое звено, описанное далее ниже.
Когда X представляет собой атом азота, соединения по настоящему изобретению представляют собой 2-амидопиридины, и когда X представляет собой CH, соединения по настоящему изобретению представляют собой ариламиды, как показано ниже:

R и R1 представляют собой необязательные группы заместителей, которые могут быть независимо выбраны из широкого ряда неорганических (водород, гидроксил, амино, галоген или тому подобное) или органических заместителей, таких как алкилы, циклоалкилы, гетероциклический, гетероарилы и тому подобное, где такие заместители могут необязательно содержать от 1 до 12 атомов углерода, или от 1 до 10 атомов углерода, или от 1 до шести атомов углерода. Во многих аспектах изобретения R и R1 могут быть, каждый, независимо, выбран из:
i) водорода;
ii) замещенного или незамещенного фенила; и
iii) замещенного или незамещенного гетероарила,
где необязательные заместители фенильного и гетероарильного кольца могут быть выбраны из широкого ряда неорганических и C1-C4 органических радикалов, и обычно присутствуют ноль, одна, две или три такие группы заместителей. Во многих таких аспектах один, два или три заместителя вышеуказанного фенильного и гетероарильного кольца могут быть независимо выбраны из:
i) C1-C4 линейного, разветвленного или циклического алкила;
ii) C1-C4 линейного, разветвленного или циклического алкокси;
iii) C1-C4 линейного, разветвленного или циклического галогеналкила;
iv) галогена;
v) -CN;
vi) -NHC(O)R4;
vii) -C(O)NR5aR5b;
viii) гетероарила; или
ix) два заместителя могут быть взяты вместе с образованием конденсированного кольца, содержащего от 5 до 7 атомов;
где вышеуказанное звено R4 может представлять собой водород или C1-C4 линейный, разветвленный или циклический алкил и где звенья R5a и R5b могут быть независимо выбраны из:
i) водорода;
ii) C1-C4 линейного, разветвленного или циклического алкила; или
iii) R5a и R5b могут быть взяты вместе с образованием кольца, содержащего от 3 до 7 атомов.
В некоторых аспектах соединений формулы (I) звенья R могут быть выбраны из замещенного или незамещенного фенила; или замещенных или незамещенных гетероарилов; и звенья R1 представляют собой водород.
В других аспектах соединений формулы (I) R может представлять собой замещенный или незамещенный фенил, содержащий один, два или три необязательных неорганических или органических заместителя, которые в некоторых вариантах осуществления выбраны из:
i) C1-C4 линейного, разветвленного или циклического алкила;
ii) C1-C4 линейного, разветвленного или циклического алкокси;
iii) C1-C4 линейного, разветвленного или циклического галогеналкила;
iv) галогена; или
v) -CN.
Не ограничивающие объем настоящего изобретения примеры звеньев R включают 2-фторфенил, 3-фторфенил, 4-фторфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-метилфенил, 3-метилфенил, 4-метилфенил, 2-этилфенил, 3-этилфенил, 4-этилфенил, 2-изо-пропилфенил, 3-изо-пропилфенил, 4-изо-пропилфенил, 2-цианофенил, 3-цианофенил, 4-цианофенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-этоксифенил, 3-этоксифенил, 4-этоксифенил, 2-изо-пропоксифенил, 3-изо-пропоксифенил, 4-изо-пропоксифенил, 2-цианофенил, 3-цианофенил, 4-цианофенил, 2-трифторметилфенил, 3-трифторметилфенил и 4-трифторметилфенил.
Согласно следующим аспектам в соединениях формулы (I) звенья R могут иметь формулу -NH(C(O)R4, где R4 представляет собой C1-C4 линейный, разветвленный или циклический алкил. Неограничивающие примеры таких звеньев R включают:
i) -NH(C(O)CH3;
ii) -NH(C(O)CH2CH3;
ii) -NH(C(O)CH2CH2CH3;
ii) -NH(C(O)CH(CH3)2;
ii) -NH(C(O)(циклопропил); и
ii) -NH(C(O)CH2CH2CH2CH3.
Согласно следующим аспектам в соединениях формулы (I) звенья R могут иметь формулу

где R10 имеет формулу -C(O)NR5aR5b; где R5a и R5b могут быть независимо выбраны из водорода, C1-C4 линейных или разветвленных алкилов или R5a и R5b взяты вместе с образованием кольца, содержащего 5 или 6 атомов. В некоторых случаях звенья R10 могут иметь формулу -C(O)NR5aR5b, где R5a и R5b, каждый, независимо, выбран из водорода, метила, этила, н-пропила, изо-пропила и циклопропила. Не ограничивающие объем настоящего изобретения примеры таких звеньев R10 включают:
i) -C(O)NH2;
ii) -C(O)NHCH3;
iii) -C(O)N(CH3)2;
iv) -C(O)NH(CH2CH3);
v) -C(O)N(CH2CH3)2;
vi) -C(O)N(CH3)(CH2CH3).
vii) -C(O)NH(CH2CH2CH3);
viii) -C(O)N(CH2CH2CH3)2;
ix) -C(O)NH[CH(CH3)2];
x) -C(O)N[CH(CH3)2]2;
xi) -C(O)N(CH2CH2CH3)[CH(CH3)2]; и
xii) -C(O)NH(циклопропил).
Согласно следующим аспектам в соединениях формулы (I) R5a и R5b вместе образуют кольцо, содержащее 5 или 6 кольцевых атомов, не ограничивающие объем настоящего изобретения примеры звеньев R10 представляют собой гетероарильные звенья, выбранные из пирролидин-1-ила, пиперидин-1-ила, пиперазин-1-ила и морфолин-4-ила.
Согласно следующим аспектам в соединениях формулы (I) звенья R10 могут представлять собой гетероарильные единицы, неограничивающими примерами которых являются тиазол-2-ил, тиазол-4-ил, 1,2,3,4-тетразол-5-ил, [1,2,4]триазол-5-ил, имидазол-2-ил, фуран-2-ил, фуран-3-ил, тиофен-2-ил, тиофен-3-ил, 1,2,3,4-тетразол-5-ил, [1,2,4]триазол-5-ил, имидазол-2-ил, фуран-2-ил, фуран-3-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, изохинолин-1-ил, изохинолин-3-ил и изохинолин-4-ил.
Согласно следующим аспектам в соединениях формулы (I) звенья R могут включать замещенные фенильные звенья, где два заместителя могут быть взяты вместе с образованием конденсированного кольца, содержащего от 5 до 7 кольцевых атомов, например 2,3-дигидро-бензо[1,4]диоксин-6-ильное кольцо, что дало бы соединение, имеющее формулу
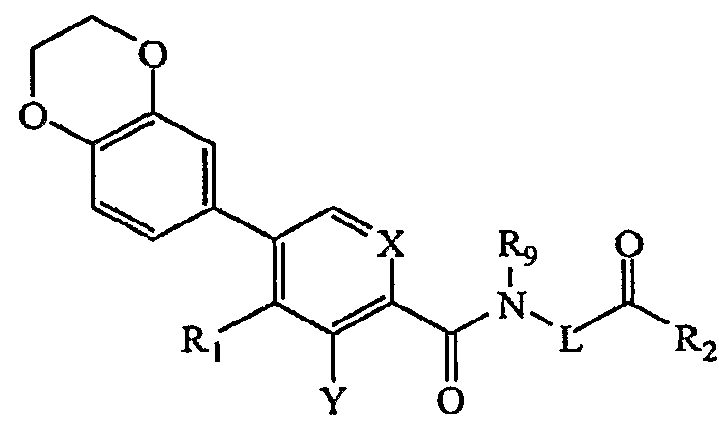
Другие примеры R включают звенья, где R представляет собой водород и R1 представляет собой водород.

где R2, X, Y, L и R9 могут быть независимо выбраны любым способом, если в отношении соединений формулы (I) в настоящем документе не описано иное.
Как описано ранее выше, заместители R1 для соединений формулы (I) могут быть выбраны из широкого ряда неорганических и органических звеньев. В некоторых вариантах осуществления R1 представляет собой фенильное кольцо, которое может быть необязательно замещено 1, 2 или 3 заместителями, независимо выбранными из неорганических или C1-C4 органических звеньев. Некоторые выбраны из:
i) C1-C4 линейного, разветвленного или циклического алкила;
ii) C1-C4 линейного, разветвленного или циклического алкокси;
iii) C1-C4 линейного, разветвленного или циклического галогеналкила;
iv) галогена; или
v) -CN.
Не ограничивающие объем настоящего изобретения примеры R1 включают 2-фторфенил, 3-фторфенил, 4-фторфенил, 2-фторфенил, 3-хлорфенил, 4-хлорфенил, 2-метилфенил, 3-метилфенил, 4-метилфенил, 2-этилфенил, 3-этилфенил, 4-этилфенил, 2-изо-пропилфенил, 3-изо-пропилфенил, 4-изопропилфенил, 2-цианофенил, 3-цианофенил, 4-цианофенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-этоксифенил, 3-этоксифенил, 4-этоксифенил, 2-изо-пропоксифенил, 3-изопропоксифенил, 4-изопропоксифенил, 2-цианофенил, 3-цианофенил, 4-цианофенил, 2-трифторметилфенил, 3-трифторметилфенил и 4-трифторметилфенил.
Другой пример звеньев R1 включает соединения, где R представляет собой водород, а звенья R1 представляют собой водород.
В некоторых случаях соединений формулы (I) R представляет собой водород, и R1 представляет собой замещенный или незамещенный фенил, где заместители выбраны из:
i) C1-C4 линейного, разветвленного или циклического алкила;
ii) C1-C4 линейного, разветвленного или циклического алкокси;
iii) C1-C4 линейного, разветвленного или циклического галогеналкила;
iv) галогена; и
v) -CN.
Применительно к соединениям формулы (I) Y представляет собой звено, которое может быть выбрано из широкого ряда неорганические единиц, таких как H, -OH, -NH2 или галогена, и C1-C4 органических единиц. Например, Y может быть выбран из:
i) водорода;
ii) -OR3, где R3 представляет собой водород или низший алкил, такой как метил или этил.
Применительно к соединениям формулы (I) звенья R2 могут быть выбраны из широкого ряда неорганических звеньев, таких как -OH или -NH2, или ряда органических звеньев.
В некоторых случаях соединений по изобретению R2 выбран из:
i) -OR6; или
ii) -NR7aR7b;
где R6 представляет собой водород или C1-C4 линейный, разветвленный или циклический алкил; и R7a и R7b, каждый, независимо, выбраны из:
i) водорода;
ii) C1-C4 линейного, разветвленного или циклического алкила; или
iii) R7a и R7b могут быть взяты вместе с образованием кольца, содержащего от 3 до 7 атомов.
В некоторых предпочтительных аспектах изобретения звенья R2 представляют собой гидроксил (-OH), и соединения представляют собой карбоновые кислоты или могут также быть представлены в виде соли, например соответствующий гидроксил/карбоксилат-анион, то есть R2 может представлять собой анион -O-, для образования соединения, содержащего карбоксилатную группу, как показано ниже.
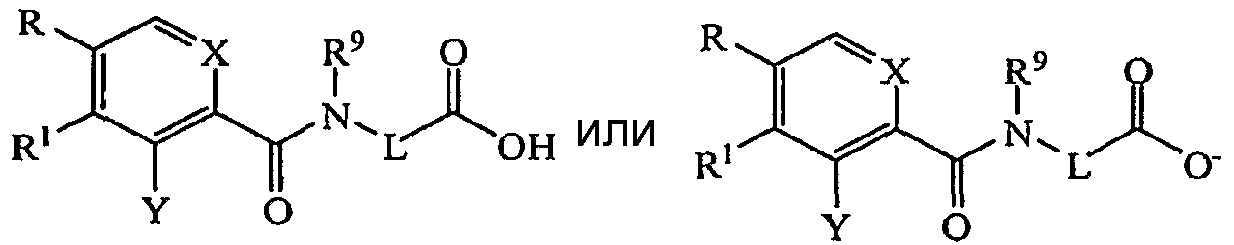
где R, R1, R2, X, Y, L и R9 могут быть независимо выбраны любым способом, если в отношении соединений формулы (I) в настоящем документе не описано иное.
Другой пример R2 включает соединения, где R6 представляет собой C1-C4 линейный, разветвленный или циклический алкил, образующий звенья R2, которые представляют собой алкокси, где образованными соединениями являются органические сложные эфиры, содержащие C1-C4 линейные, разветвленные или циклические алкильные группы. Не ограничивающие объем настоящего изобретения примеры звеньев R2 включают:
i) -OCH3;
ii) -OCH2CH3; и
iii) -OCH2CH2CH3.
Другие примеры звеньев R2 включают соединения, где R2 имеет формулу -NR7aR7b и R7a и R7b, каждый, независимо, выбран из:
i) водорода; и
ii) C1-C4 линейного, разветвленного или циклического алкила. Не ограничивающие объем настоящего изобретения примеры звеньев R2 включают:
i) -NH2;
ii) -NHCH3;
iii) -N(CH3)2;
iv) -NH(CH2CH3);
v) -N(CH2CH3)2;
vi) -N(CH3)(CH2CH3);
vii) -NH(CH2CH2CH3);
viii) -N(CH2CH2CH3)2;
ix) -NH[CH(CH3)2];
x) -N[CH(CH3)2]2;
xi) -N(CH2CH2CH3)[CH(CH3)2] и
xii) -NH(циклопропил).
Дальнейший пример звена R2 включает соединения, где R2 имеет формулу -NR7aR7b и R7a и R7b взяты вместе с образованием кольца, содержащего от 3 до 7 атомов, где не ограничивающие объем настоящего изобретения примеры звеньев R2 включают азиридин-1-ил, аксетидин-1-ил, пиролидин-1-ил, пиперидин-1-ил, пиперазин-1-ил и морфолин-4-ил.
Применительно к соединения формулы (I) L представляет собой звено, которое связывает атом азота карбоксиамидной группы со смежной карбонильной группой. Обычно L представляет собой C1-C6 или C1-C4 органическое связывающее звено. В некоторых вариантах осуществления L содержит одну или несколько необязательно замещенных метиленовых звеньев, имеющих формулу
-[C(R8aR8b)]y-;
где R8a и R8b представляют собой, каждый, независимо, водород, C1-C6 линейный или разветвленный алкил или фенил и индекс y равен от 1 до 4.
Пример звеньев L включает звенья, где R8a и R8b, оба, представляют собой водород и индекс n равен 1, звено L имеет формулу
-CH2-
и в настоящем документе обозначаются как метиленовые связывающие звенья для образования соединений, имеющих структуру, показанную ниже:

где R, R1, R2, X, Y и R могут быть независимо выбраны любым способом, если иное не описано в настоящем документе в отношении соединений формулы (I).
Другой пример звеньев L включает звенья, где R8a и R8b, каждый, представляют собой водород или метил и индекс n равен 1, эти звенья имеют формулу
-CH(CH3)- или -C(CH3)2-.
Другой пример звеньев L включает звенья, где все звенья R8a и R8b представляют собой водород и индекс n равен 2, эти звенья имеют формулу
-CH2CH2-
и в настоящем документе обозначаются как этиленовые связывающие звенья.
Применительно к соединениям формулы I заместитель амидного атома азота R9 может представлять собой водород или C1-C4 органический заместитель, такой как C1-C4 алкильная группа, например метил или C1-C4 галогеналкил, такой как трифторметильная группа.
Соединения формулы (I) могут быть разделены на несколько категорий с сугубо неограничивающей целью описания альтернативных синтетических методов получения подгруппы соединений, охватываемых формулой (I), которые не представлены здесь. Это мысленное разделение на группы не имеет какого-либо отношения к пониженной или повышенной биологической эффективности любого из соединений или композиций, описанных в настоящем документе.
Одна из таких подгрупп соединений формулы (I) относится к соединениям, имеющим формулу

которая может быть более подробно описана с помощью соединений метилового сложного эфира, имеющих формулу

где звенья R могут представлять собой замещенный или незамещенный фенил, примеры которых, не ограничивающие объем настоящего изобретения, приведены в таблице I в настоящем документе ниже.
Такие соединения могут быть получены способом, представленным на схеме I и далее описанным в примере 1 в настоящем документе ниже.

Реагенты и условия: (a) C6H5OH, NaH, ТГФ; микроволновая печь 190°C, 5 часов.

Реагенты и условия: (b) NaOH, H2O, MeOH; обратный холодильник, 16 часов.
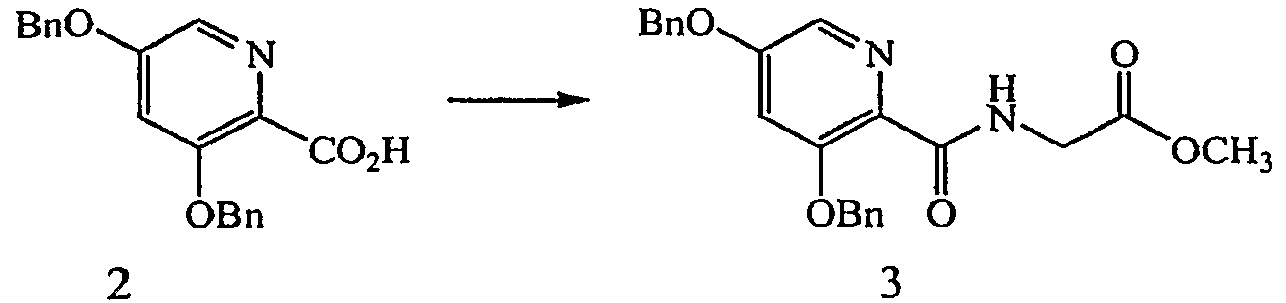
Реагенты и условия: (c) GlyOMe·HCl, EDCI, HOBt, ДМФ; 0°C до комнатной температуры, 3 дня.

Реагенты и условия: (d) H2: Pd/C, MeOH, комнатная температура, 16 часов.
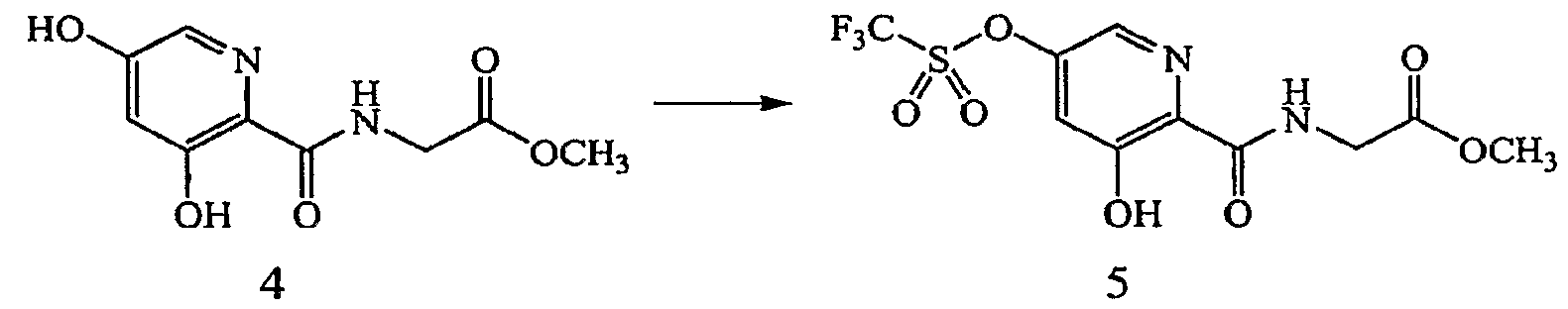
Реагенты и условия: (e) (CF3SO2)2NC6H5, MeOH, комнатная температура, 16 часов.

Реагенты и условия: (f) 3-хлорфенилбороновая кислота, Pd(dppf)Cl2, K3PO4, диоксан; 85°C, 16 часов.
ПРИМЕР 1
{[5-(3-Хлор-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты метиловый эфир (6)
Получение 3,5-бис-бензилоксипиридин-2-карбонитрила (1): В 80 мл сосуд для микроволновой печи заполняли сухим ТГФ (30 мл) и бензиловым спиртом (6,32 мл, 61,1 ммоль). Раствор охлаждали до 0°C и частями добавляли гидрид натрия (2,44 г 60% дисперсии в минеральном масле, 61,1 ммоль). Реакционную смесь оставляли постепенно нагреваться до комнатной температуры при интенсивном перемешивании до тех пор, пока не прекратилось выделение газообразного водорода. Раствор повторно охлаждали до 0 °C и добавляли 3,5-дихлор-2-цианопиридин (5,00 г, 29,1 ммоль), и раствор помещали в несфокусированную микроволновую печь Mars 5 (CEM), 190°C, 300 Вт, и нагревали в течение 5 часов. Реакционную смесь гасили H2O, концентрировали при пониженном давлении, разбавляли EtOAc и промывали 2M Na2CO3, H2O и насыщенным водным NaCl. Органический слой сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением твердого вещества коричневого цвета. Сырое твердое вещество очищали на силикагеле (EtOAc:гептан, градиент 1:1-1:0) с получением 8,6 г (94% выход) желаемого соединения в виде твердого вещества оранжевого цвета.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,96 (1H, д, J=2,2 Гц), 7,25-7,37 (10H, м), 6,78 (1H, д, J=2,2 Гц), 5,10 (2H, с), 5,03 (2H, с). ВЭЖХ-МС: m/z 317 [M+H]+.
Получение 3,5-бис-бензилоксипиридин-2-карбоновой кислоты (2): к раствору 3,5-бис-бензилоксипиридин-2-карбонитрила, 1, (26,0 г, 82,3 ммоль) в MeOH (217 мл) добавляли 30 мас.%/объем гидроксид натрия (320 мл) и реакционную смесь нагревали с обратным холодильником в течение 16 часов. Растворитель удаляли при пониженном давлении и полученную суспензию подкисляли концентрированной HCl до тех пор, пока pH не стал равен между 1 и 2. Полученный осадок собирали фильтрованием, промывали H2O (10 мл) и сушили в течение ночи в вакуумной печи с получением 30 г (количественный выход) желаемого продукта в виде гидрохлоридной соли.1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 8,02 (1H, д, J=2,4 Гц), 7,29-7,53 (11H, м), 5,96 (1H, ушир. с), 5,28 (4H, с). ВЭЖХ-МС: m/z 336 [M+H]+.
Получение метилового эфира [(3,5-бис-бензилоксипиридин-2-карбонил)амино]уксусной кислоты (3): к раствору 3,5-бис-бензилоксипиридин-2-карбоновой кислоты HCl, 2, (8,06 г, 21,7 ммоль) в ДМФ (100 мл) при 0°C в атмосфере N2 добавляли диизопропилэтиламин (11,35 мл, 65,1 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (6,23 г, 32,6 ммоль) и 1-гидроксибензотриазол (HOBt) (0,294 г, 2,2 ммоль). Раствор перемешивали в течение 5 минут и добавляли гидрохлорид метилового эфира глицина (4,09 г, 32,6 ммоль). Реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение 3 дней. Реакционную смесь частично концентрировали при пониженном давлении, затем разбавляли EtOAc и промывали насыщенным водным NaHCO3 и насыщенным водным раствором NaCl. Органический слой сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением желтого масла, которое очищали на силикагеле (EtOAc:гептан градиент 1:1 - 1:0) с получением 3,5 г (40% выход) желаемого продукта в виде желтого масла.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,12 (1H, т, J=4,9 Гц), 7,95 (1H, д, J=1,8 Гц), 7,38-7,44 (2H, м), 7,22-7,35(8H, м), 6,85 (1H, д, J=2,6 Гц), 5,14 (2H, с), 5,03 (2H, с), 4,18 (2H, д, J=5,5 Гц), 3,69 (3H, с). ВЭЖХ-МС: m/z 407 [M+H]+.
Получение метилового эфира [(3,5-дигидроксипиридин-2-карбонил)амино]уксусной кислоты (4): к раствору метилового эфира [(3,5-бис-бензилоксипиридин-2-карбонил)амино]уксусной кислоты (3,50 г, 8,62 ммоль) в MeOH (100 мл) добавляли 10% Pd/C (0,350 г, 0,862 ммоль) и реакционную смесь перемешивали в атмосфере H2 при комнатной температуре в течение 16 часов. Суспензию фильтровали через Celite™ и фильтрат концентрировали при пониженном давлении. Сырое вещество очищали на силикагеле (MeOH:CH2Cl2 градиент 1%-5%) с получением 1,95 г (количественный выход) желаемого соединения в виде твердого вещества желтоватого цвета.1H ЯМР (250 МГц, MeOD) δ м.д. 7,62 (1H, д, J=2,4 Гц), 6,53 (1H, д, J=2,4 Гц), 4,04 (2H, с), 3,64 (3H, с). ВЭЖХ-МС: m/z 227 [M+H]+.
Получение метилового эфира [(3-гидрокси-5-трифторметансульфонилоксипиридин-2-карбонил)амино]уксусной кислоты (5): к раствору метилового эфира [(3,5-дигидроксипиридин-2-карбонил)амино]уксусной кислоты, 4, (1,95 г, 8,62 ммоль) в MeOH (60 мл) добавляли диизопропилэтиламин (DIPEA) (1,62 мл, 9,3 ммоль). Смесь охлаждали до 0°C и добавляли N-фенил трифторметансульфонимид (3,32 г, 9,3 ммоль). Полученный раствор медленно нагревали до комнатной температуры и перемешивали в течение еще 16 часов. Растворитель удаляли при пониженном давлении и сырое вещество очищали на силикагеле (EtOAc:гексан 1:4) с получением 2,27 г (73% выход) желаемого продукта в виде твердого вещества желтоватого цвета.1H ЯМР (400 МГц, CDCl3) δ м.д. 12,17 (1H, с), 8,27 (1H, т, J=5,5 Гц), 8,08 (1H, д, J=2,2 Гц), 7,28 (1H, д, J=2,2 Гц), 4,24 (2H, д, J=5,5 Гц), 3,82 (3H, с). ВЭЖХ-МС: m/z 359 [M+H]+.
Получение метилового эфира {[5-(3-хлор-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты (6): к дегазированному раствору метилового эфира [(3-гидрокси-5-трифторметан-сульфонилоксипиридин-2-карбонил)амино]уксусной кислоты, 5, (0,30 г, 0,84 ммоль) в 1,4-диоксане (10 мл) при комнатной температуре в атмосфере N2 добавляли 3-фторфенилбороновую кислоту (0,196 г, 1,26 ммоль), Pd(dppf)Cl2 (0,068 г, 0,0084 ммоль) и K3PO4 (0,195 г, 0,92 ммоль). Полученную суспензию нагревали в герметически закрытом сосуде при 85°C в течение 16 часов. Затем смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Потом остаток обрабатывали 1M HCl (1 мл) и разбавляли EtOAc. Органический слой отделяли, промывали H2O, насыщенным водным NaCl и концентрировали при пониженном давлении. Сырое вещество очищали на силикагеле (EtOAc: гептан 3:7). Полученное твердое вещество может быть кристаллизовано из смеси EtOAc/гептан с получением 0,143 г (53% выход) желаемого соединения в виде бесцветного твердого вещества.1H ЯМР (400 МГц, CDCl3) δ м.д. 1 1,77 (1H, с), 8,36 (1H, т, J=5,7 Гц), 8,24 (1H, д, J=1,8 Гц), 7,50-7,53 (1H, м), 7,39-7,42 (2H, м), 7,34 - 7,37 (2H, м), 4,20 (2H, д, J=5,9 Гц), 3,76 (3H, с). ВЭЖХ-МС: m/z.
Способ, показанный на схеме I, может быть изменен путем замены на стадии (f) 3-хлорфенилбороновой кислоты другими реагентами. Не ограничивающие объем настоящего изобретения примеры включают 4-хлорфенилбороновую кислоту, 2-хлорфенилбороновую кислоту, 2-фторфенилбороновую кислоту, 3-фторфенилбороновую кислоту, 4-фторфенилбороновую кислоту, 2-метилфенилбороновую кислоту, 3-метилфенилбороновую кислоту и 4-метилфенилбороновую кислоту.
Далее представлены дальнейшие не ограничивающие объем настоящего изобретения примеры соединений, входящие в первый аспект категории I по настоящему изобретению.

Метиловый эфир {[5-(4-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (400 МГц, CDCl3) δ м.д. 11,77 (1H, с), 8,36 (1H, 1, J=5,5 Гц), 8,23 (1H, д, J=1,8 Гц), 7,44-7,49 (2H, м), 7,38-7,42 (3H, м), 4,20 (2H, д, J=5,9 Гц), 3,76 (3H, с). ВЭЖХ-МС: m/z 321 [M+H]+.

Метиловый эфир {[5-(2-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (400 МГц, MeOD) δ м.д. 8,10 (1H, д, J=1,8 Гц), 7,46 (1H, дд, J=7,5, 2,4 Гц), 7,30-7,35 (4H, м), 4,11 (2H, с), 3,68 (3H, с). ВЭЖХ-МС: m/z 321 [M+H]+.

Метиловый эфир {[5-(4-фторфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,88 (1H, с), 8,48 (1H, т, J=5,6 Гц), 8,33 (1H, д, J=2,1 Гц), 7,55-7,65 (2H, м), 7,49 (1H, д, J=2,1 Гц), 7,17-7,27 (2H, м), 4,28-4,32 (2H, м), 3,86 (3H, с). ВЭЖХ-МС: m/z 305 [M+H]+.

Метиловый эфир [(3-гидрокси-5-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты:1H ЯМР (400 МГц, CDCl3) δ м.д. 11,72 (1H, с), 8,36 (1H, т, J=5,1 Гц), 8,26 (1H, д, J=1,8 Гц), 7,43 (2H, д, J=8,0 Гц), 7,40 (1H, д, J=1,8 Гц), 7,23 (2H, д, J=8,1 Гц), 4,19 (2H, д, J=5,9 Гц), 3,75 (3H, с), 2,35 (3H, с). ВЭЖХ-МС: m/z 301 [M+H]+.

Метиловый эфир {[3-гидрокси-5-(4-изопропилфенил)пиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,88 (1H, с), 8,54 (1H, т, J=5,6 Гц), 8,38 (1H, д, J=1,8 Гц), 7,55-7,60 (2H, м), 7,54 (1H, д, J=2,1 Гц), 7,36-7,42 (2H, м), 4,30 (2H, д, J=5,8 Гц), 3,85 (3H, с), 2,93-3,07 (1H, м), 1,33 (6H, д, J=7,0 Гц). ВЭЖХ-МС: m/z 329 [M+H]+.
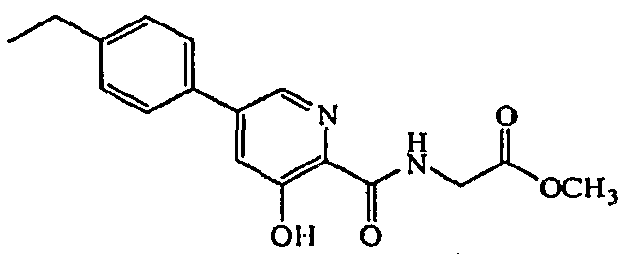
Метиловый эфир {[5-(4-этилфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,86 (1H, с), 8,51 (1H, т, J=5,8 Гц), 8,37 (1H, д, J=1,8 Гц), 7,56 (2H, д, J=8,2 Гц), 7,53 (1H, д, J=1,8 Гц), 7,36 (2H, д, J=8,5 Гц), 4,30 (2H, д, J=5,8 Гц), 3,85 (3H, с), 2,75 (2H, кв, J=7,6 Гц), 1,31 (3H, 1, J=7,6 Гц). ВЭЖХ-МС: m/z 315.
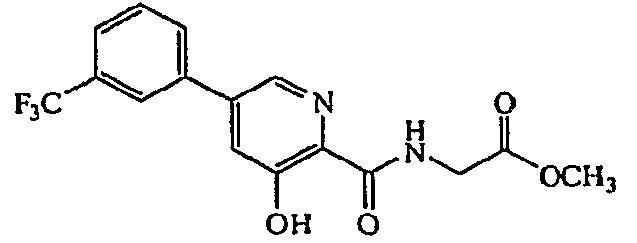
Метиловый эфир {[3-гидрокси-5-(3-трифторметилфенил)пиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,91 (1H, с), 8,48 (1H, т, J=6,1 Гц), 8,37 (1H, д, J=1,8 Гц), 7,60-7,92 (4H, м), 7,54 (1H, д, J=2,1 Гц), 4,31 (2H, д, J=5,8 Гц), 3,86 (3H, с). ВЭЖХ-МС: m/z 355 [MH-H]+.
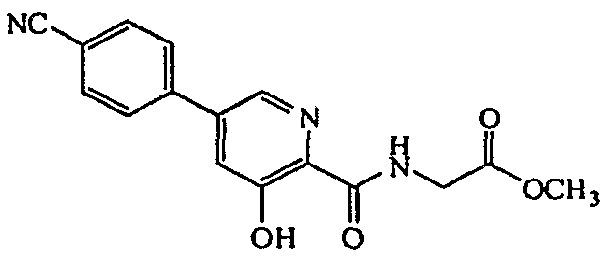
Метиловый эфир {[5-(4-цианофенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (400 МГц, CDCl3) δ м.д. 11,83 (1H, с), 8,36 (1H, т, J=5,12 Гц), 8,26 (1H, д, J=1,83 Гц), 7,70-7,75 (2H, м), 7,62-7,66 (2H, м), 7,43 (1H, д, J=1,83 Гц), 4,21 (2H, д, J=5,49 Гц), 3,76 (3H, с). ВЭЖХ-МС: m/z 312 [M+H]+.

Метиловый эфир {[5-(3-цианофенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,30 (1H, с), 9,51 (1H, т, J=5,8 Гц), 8,55 (1H, д, J=1,8 Гц), 8,32 (1H, с), 8,14 (1H, д, J=8,5 Гц), 7,89 (1H, д, J=7,8 Гц), 7,81 (1H, д, J=1,9 Гц), 7,68 (1H, т, J=7,8 Гц), 4,06 (2H, д, J=6,1 Гц), 3,63 (3H, с). ВЭЖХ-МС: m/z 312 [M+H]+.

Метиловый эфир {[5-(3-карбамоилфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,30 (1H, с), 9,54 (1H, т, J=6,0 Гц), 8,61 (1H, д, J=1,8 Гц), 8,29 (1H, с), 8,18 (1H, ушир. с), 7,98 (2H, 1, J=8,1 Гц), 7,84 (1H, д, J=1,7 Гц), 7,62 (1H, т, J=7,8 Гц), 7,53 (1H, ушир. с), 4,12 (2H, д, J=6,0 Гц), 3,69 (3H, с). ВЭЖХ-МС: m/z 330 [M+H]+.

Метиловый эфир ({3-гидрокси-5-[3-(пирролидин-1-карбонил)фенил]пиридин-2-карбонил}амино)уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,80 (1H, с), 8,44 (1H, т, J=5,3 Гц), 8,35 (1H, с), 7,77 (1H, с), 7,47-7,70 (4H, м), 4,28 (2H, д, J=5,7 Гц), 3,83 (3H, с), 3,64-3,76 (2H, м), 3,42-3,55 (2H, м), 1,84-2,07 (4H, м). ВЭЖХ-МС: m/z 384 [M+H]+.

Метиловый эфир ({5-[3-(циклопропанкарбониламино)фенил]-3-гидроксипиридин-2-карбонил}амино)уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,80 (1H, с), 8,45 (1H, ушир. с), 8,29 (1H, с), 7,65-7,88 (2H, м), 7,29-7,60 (4H, м), 4,18-4,31 (3H, м), 3,83 (3H, с), 1,05-1,17 (2H, м), 0,81-0,98 (2H, м). ВЭЖХ-МС: m/z 370 [M+H]+.
Следующие гетероарил замещенные фенильные соединение могут быть получены из метилового эфира {[5-(3-циано-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты обработкой триметилсилилазидом и ди-бутилоксидом олова в DME и нагреванием смеси до 140°C, 150 Вт, 200 фунт/кВ.дюйм, в микроволновой печи.
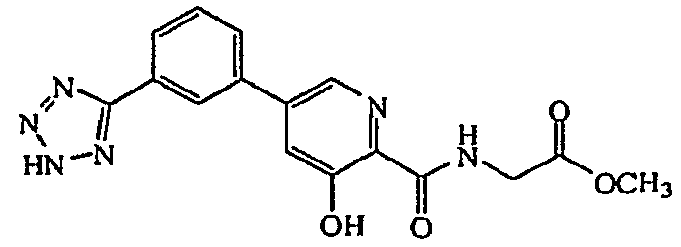
Метиловый эфир ({3-гидрокси-5-[3-(2H-тетразол-5-ил)фенил]пиридин-2-карбонил}амино)уксусной кислоты:1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,33 (1H, с), 9,55 (1H, т, J=6,1 Гц), 8,62 (1H, д, J=1,8 Гц), 8,43 (1H, с), 8,14 (1H, д, J=7,9 Гц), 8,05 (1H, д, J=8,1 Гц), 7,83 (1H, д, J=1,9 Гц), 7,76 (1H, т, J=7,8 Гц), 4,12 (2H, д, J=6,1 Гц), 3,69 (3H, с). ВЭЖХ-МС: m/z 355 [M+H]+.
С целью описания способов синтеза другая возможная подгруппа соединений формулы (I) имеет формулу

где звенья R, которые представляют собой замещенный или незамещенный гетероарил, примеры которого, не ограничивающие объем настоящего изобретения, представлены в таблице II в настоящем документе ниже.
Соединения, охватываемые соединениями, описанными непосредственно выше, могут быть получены способом, представленным на схеме I и описанным в примере 1 в настоящем документе выше.
Способ, показанный на схеме I, может быть изменен путем замены другими реагентами 3-хлорфенилбороновой кислоты на стадии (f). Не ограничивающие объем настоящего изобретения примеры заместителей включают 3-(тиазол-2-ил)фенилбороновую кислоту, 3-(тиазол-4-ил)фенилбороновую кислоту, 4-(тиазол-2-ил)фенилбороновую кислоту, 4-(тиазол-4-ил)фенилбороновую кислоту, 3-(имидазол-2-ил)фенилбороновую кислоту, 4-(имидазол-2-ил)фенилбороновую кислоту, 3-(фуран-2-ил)фенилбороновую кислоту, 3-(фуран-3-ил)фенилбороновую кислоту и 3-(тиофен-2-ил)фенилбороновую кислоту.
Далее представлены не ограничивающие объем настоящего изобретения примеры таких соединений

Метиловый эфир [(5-гидрокси-[3,3']бипиридинил-6-карбонил)амино]уксусной кислоты1H ЯМР (250 МГц, CDCl3) δ м.д. 11,80 (1H, с), 8,87 (1H, д, J=1,7 Гц), 8,70 (1H, дд, J=4,8, 1,6 Гц), 8,45 (1H, т, J=5,8 Гц), 8,33 (1H, д, J=1,9 Гц), 7,91 (1H, ддд, J=8,0, 2,3, 1,7 Гц), 7,51 (1H, д, J=1,9 Гц), 7,45 (1H, ддд, J=7,9, 4,8, 0,7 Гц), 4,28 (2H, д, J=5,8 Гц), 3,83 (3H, с). ВЭЖХ-МС: m/z 288 [M+H]+.
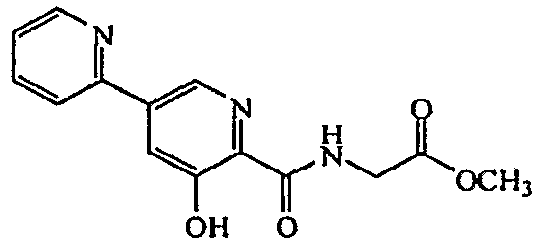
Метиловый эфир [(5'-гидрокси-[2,3']бипиридинил-6'-карбонил)амино]уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 8,70-8,79 (2H, м), 8,49 (1H, т, J=5,8 Гц), 7,72-7,92 (3H, м), 7,31-7,39 (1H, м), 4,28 (2H, д, J=5,8 Гц), 3,83 (3H, с). ВЭЖХ-МС: m/z 288 [M+H]+.

Метиловый эфир [(3-гидрокси-5-пиримидин-5-ил-пиридин-2-карбонил)амино]уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,90 (1H, с), 9,32 (1H, с), 9,00 (2H, с), 8,45 (1H, ушир. с), 8,34 (1H, д, J=1,8 Гц), 7,53 (1H, д, J=1,8 Гц), 4,29 (2H, д, J=5,7 Гц), 3,84 (3H, с). ВЭЖХ-МС: m/z 289 [M+H]+.

Метиловый эфир [(3-гидрокси-5-изохинолин-4-ил-пиридин-2-карбонил)амино]уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,80 (1H, с), 9,38 (1H, ушир. с), 8,51 (2H, т, J=5,7 Гц), 8,27 (1H, с), 8,13 (1H, д, J=7,2 Гц), 7,67-7,93 (3H, м), 7,51 (1H, с), 4,31 (2H, д, J=5,7 Гц), 3,85 (3H, с). ВЭЖХ-МС: m/z 338 [M+H]+.
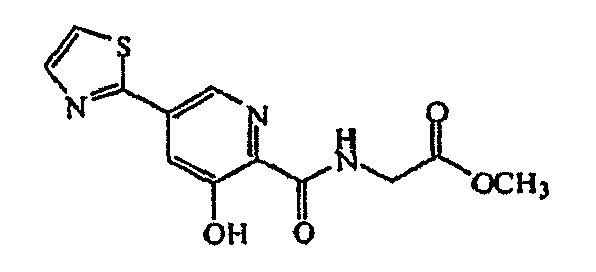
Метиловый эфир [(3-гидрокси-5-тиазол-2-ил-пиридин-2-карбонил)амино]уксусной кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,80 (1Н, с), 8,67 (1Н, д, J=1,8 Гц), 8,39 (1Н, ушир. с), 7,93 (1Н, д, J=3,3 Гц), 7,78 (1Н, д, J=1,7 Гц), 7,43 (1Н, д, J=3,2 Гц), 4,22 (2Н, д, J=5,8 Гц), 3,78 (3Н, с). ВЭЖХ-МС: m/z 294 [М+Н]+.
Другая возможная подгруппа соединений формулы (I) включает соединения, имеющие формулу
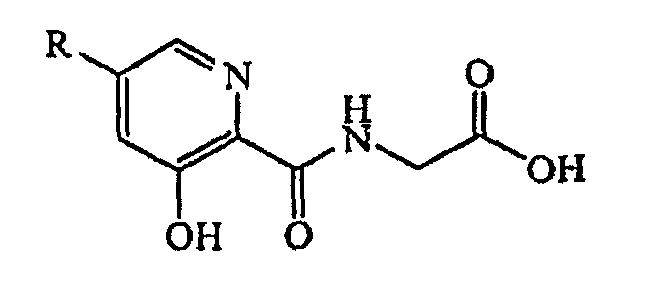
где звенья R представляют собой замещенный или незамещенный фенил, примеры которых, не ограничивающие объем настоящего изобретения, представлены в таблице III в настоящем документе ниже.
Соединения, описанные непосредственно выше, могут быть получены способом, представленным на схеме II и описанным в примере 2.
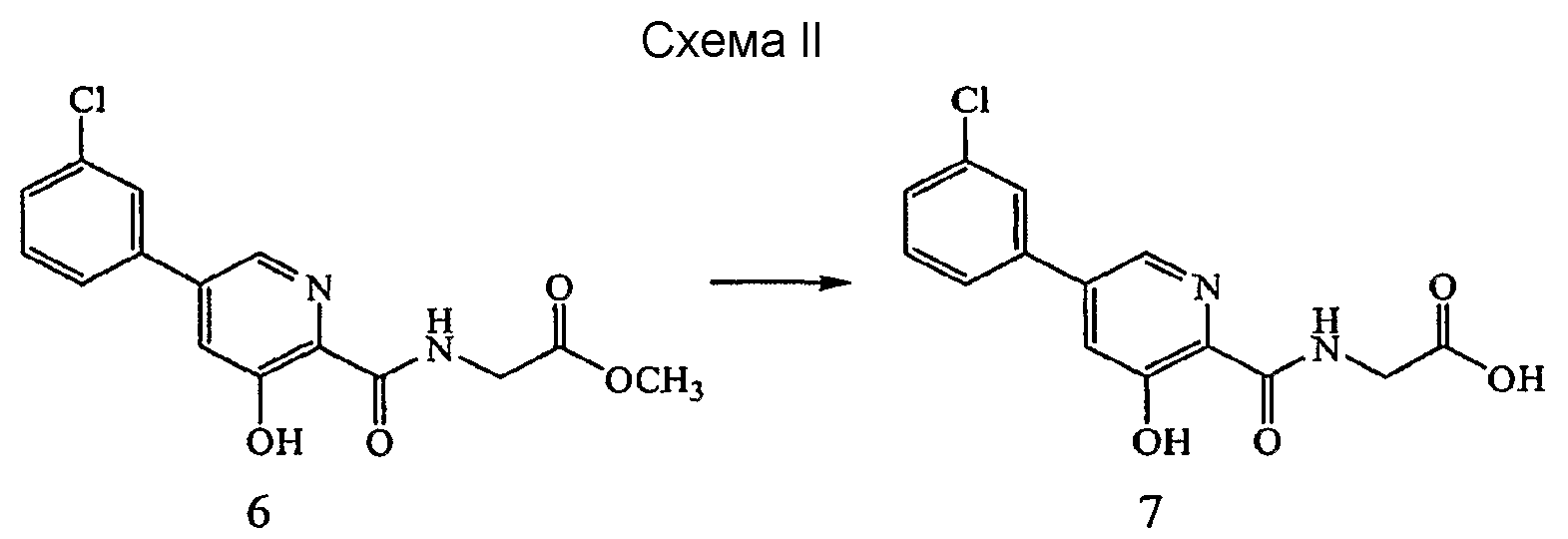
Реагенты и условия: (a) NaOH, H2O/ТГФ; комнатная температура, 1 час.
ПРИМЕР 2
{[5-(3-Хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота (7)
Получение {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты (7) к раствору метилового эфира {[5-(3-хлор-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты, 6, (0,163 г, 0,509 ммоль) в ТГФ (5 мл) добавляли 1M NaOH (1,5 мл, 1,27 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Раствор подкисляли, используя 1M HCl (3 мл), растворитель удаляли при пониженном давлении и полученное твердое вещество суспендировали в смеси CHCl3:изо-пропанол (1:1), фильтровали и фильтрат сушили (MgSO4), фильтровали и вновь концентрировали при пониженном давлении. Сырое вещество растирали в небольшом количестве MeOH с получением 0,10 г (64% выход) желаемого продукта в виде бесцветного твердого вещества.1H ЯМР (400 МГц, MeOD) δ м.д. 8,31 (1H, д, J=1,8 Гц), 7,47 (2H, д, J=1,8 Гц), 7,30-7,65 (4H, м), 4,07 (2H, с). ВЭЖХ-МС: m/z 307 [M+H]+.
Далее представлены дополнительные примеры, не ограничивающие объем настоящего изобретения.
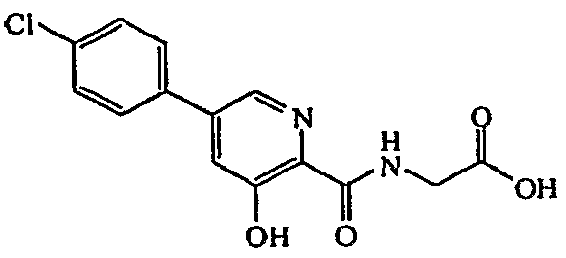
{[5-(4-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (400 МГц, MeOD) δ м.д. 8,33 (1H, д, J=1,5 Гц), 7,61 (2H, д, J=8,4 Гц), 7,48 (1H, д, J=1,8 Гц), 7,42 (2H, д, J=8,4 Гц), 4,06 (2H, с). ВЭЖХ-МС: m/z 307 [M+H]+.

{[5-(2-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (400 МГц, MeOD) δ м.д. 8,10 (1H, д, J=1,8 Гц), 7,40-7,56 (1H, м), 7,09-7,40 (4H, м), 4,07 (2H, с). ВЭЖХ-МС: m/z 307 [M+H]+.

{[5-(4-Фторфенил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,39 (1H, ушир. с), 9,38 (1H, т, J=6,2 Гц), 8,53 (1H, д, J=2,1 Гц), 7,91 (2H, дд, J=8,8, 5,5 Гц), 7,74 (1H, д, J=2,1 Гц), 7,38 (2H, т, J=8,8 Гц), 4,02 (2H, д, J=6,4 Гц). ВЭЖХ-МС: m/z 291 [M+H]+.

[(3-Гидрокси-5-(4-метилфенил)пиридин-2-карбонил)амино]уксусная кислота:1H ЯМР (400 МГц, MeOD) δ м.д. 8,40 (1H, с), 7,68 (1H, с), 7,53 (2H, д, J=8,42 Гц), 7,26 (2H, д, J=8,05 Гц), 4,10 (2H, с), 2,31 (3H, с). ВЭЖХ-МС: m/z 287 [M+H]+.
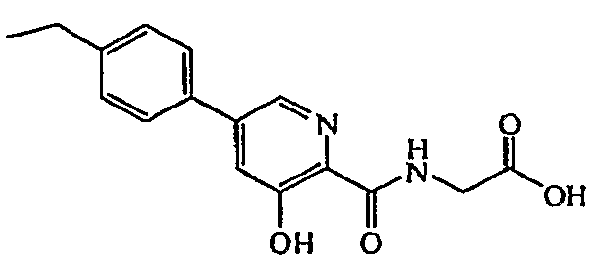
{[5-(4-Этилфенил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,40 (1H, с), 9,35 (1H, т, J=6,1 Гц), 8,52 (1H, д, J=2,1 Гц), 7,76 (2H, д, J=8,2 Гц), 7,71 (1H, д, J=1,8 Гц), 7,38 (2H, д, J=8,2 Гц), 4,02 (2H, д, J=6,1 Гц), 2,68 (2H, кв, J=7,6 Гц), 1,22 (3H, т, J=7,5 Гц). ВЭЖХ-МС: m/z 301 [M+H]+.

{[3-Гидрокси-5-(4-изопропилфенил)пиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,40 (1H, с), 9,36 (1H, т, J=6,2 Гц), 8,52 (1H, д, J=1,8 Гц), 7,70 (2H, д, J=1,8 Гц), 7,76 (2H, д, J=8,2 Гц), 7,41 (2H, д, J=8,2 Гц), 4,02 (2H, д, J=6,1 Гц), 2,97 (1H, м, J=7,0 Гц), 1,25 (6H, д, J=7,0 Гц). ВЭЖХ-МС: m/z [M+H]+ 315.
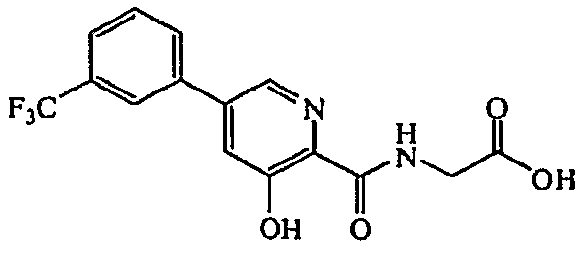
{[3-Гидрокси-5-(3-трифторметилфенил)пиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,42 (1H, ушир. с), 9,41 (1H, т, J=6,4 Гц), 8,61 (1H, д, J=1,8 Гц), 8,10-8,22 (2H, м), 7,88 (1H, д, J=1,8 Гц), 7,73-7,86 (2H, м), 4,03 (2H, д, J=6,1 Гц). ВЭЖХ-МС: m/z 341 [M+H]+.

{[5-(4-Цианофенил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (400 МГц, MeOD) δ м.д. 8,38 (1H, д, J=1,8 Гц), 7,75-7,83 (4H, м), 7,56 (1H, д, J=1,8 Гц), 4,06 (2H, с). ВЭЖХ-МС: m/z 298 [M+H]+.

{[5-(3-Цианофенил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,40 (1H, с), 9,40 (1H, т, J=6,17 Гц), 8,59 (1H, д, J=1,71 Гц), 8,37 (1H, с), 8,19 (1H, д, J=7,77 Гц), 7,93 (1H, д, J=7,88 Гц), 7,86 (1H, д, J=1,94 Гц), 7,73 (1H, т, J=7,77 Гц), 4,00 (2H, д, J=6,17 Гц). ВЭЖХ-МС: m/z 298 [M+H]+.

{[5-(5-Хлор-2-метилфенил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,35 (1H, ушир. с), 9,34 (1H, 1, J=6,0 Гц), 8,17 (1H, д, J=1,8 Гц), 7,47 (1H, д, J=1,8 Гц), 7,33-7,45 (3H, м), 3,95 (2H, д, J=5,9 Гц), 2,22 (3H, с). ВЭЖХ-МС: m/z 321 [M+H]+.

{[3-Гидрокси-5-(4-изопропоксифенил)пиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,36 (1H, ушир. с), 9,35 (1H, т, J=5,9 Гц), 8,50 (1H, д, J=1,8 Гц), 7,71 (1H, д, J=1,8 Гц), 7,27-7,46 (3H, м), 7,02 (1H, д, J=8,5 Гц), 4,70-4,85 (1H, м), 4,01 (2H, д, J=6,1 Гц), 1,29 (6H, д, J=5,9 Гц). ВЭЖХ-МС: m/z 331 [M+H]+.

({5-[3-(Циклопропанкарбониламино)фенил]-3-гидроксипиридин-2-карбонил}амино)уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,40 (1H, ушир. с), 10,39 (1H, с), 9,37 (1H, т, J=6,1 Гц), 8,43 (1H, д, J=1,9 Гц), 7,97 (1H, с), 7,64-7,71 (1H, м), 7,60 (1H, д, J=1,8 Гц), 7,41-7,49 (2H, м), 3,99 (2H, д, J=6,1 Гц), 1,73-1,86 (1H, м), 0,74-0,84 (4H, м). ВЭЖХ-МС: m/z 356 [M+H]+.
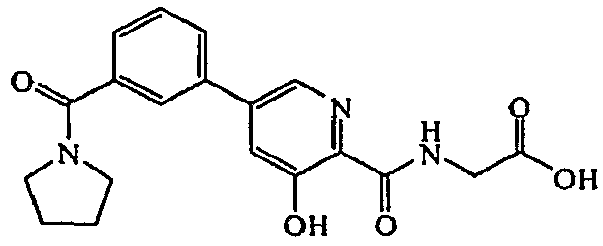
({3-Гидрокси-5-[3-(пирролидин-1-карбонил)фенил]пиридин-2-карбонил}амино)уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,40 (1H, с), 9,38 (1H, т, J=6,3 Гц), 8,55 (1H, д, J=1,8 Гц), 7,88-7,94 (2H, м), 7,77 (1H, д, J=1,8 Гц), 7,56-7,63 (2H, м), 4,01 (2H, д, J=6,0 Гц), 3,41-3,54 (4H, м), 1,76-1,96 (4H, м). ВЭЖХ-МС: m/z 370 [M+H]+.

({3-Гидрокси-5-[3-(2H-тетразол-5-ил)фенил]пиридин-2-карбонил}амино)уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,40 (1H, с), 9,51 (1H, ушир. с), 8,50 (1H, с), 8,20 (1H, с), 7,94 (1H, д, J=1,5 Гц), 7,88-7,99 (1H, м), 7,72 (1H, д, J=1,9 Гц), 7,34-7,53 (1H, м), 7,48 (2H, д, J=2,2 Гц), 7,00 (1H, д, J=1,8 Гц), 6,38 (1H, ушир. с), 3,54 (2H, ушир. с). ВЭЖХ-МС: m/z 341 [M+H]+.
Четвертый аспект категории I по настоящему изобретению включает соединения, имеющие формулу

где звенья R представляют собой замещенный или незамещенный гетероарил. Не ограничивающие объем настоящего изобретения примеры этих звеньев R представлены в таблице IV в настоящем документе ниже.
Соединения, которые включены в четвертый аспект категории I по настоящему изобретению, могут быть получены способом, представленным на схеме II и описанным в примере 2 в настоящем документе, исходя их соединений, которые являются членами первого и второго аспекта категории I. Далее приведены примеры соединений, включенных в четвертый аспект категории I, не ограничивающие объем настоящего изобретения.

[(5'-Гидрокси-[2,3']бипиридинил-6'-карбонил)амино]уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,45 (1H, с), 9,45 (1H, т, J=6,1 Гц), 8,91 (1H, д, J=1,8 Гц), 8,73-8,79 (1H, м) 8,20 (1H, д, J=8,0 Гц), 8,07 (1H, д, J=1,8 Гц), 8,01 (1H, дт, J=7,8, 1,8 Гц), 7,52 (1H, ддд, J=7,5, 4,8, 0,9 Гц), 4,01 (2H, д, J=6,1 Гц). ВЭЖХ-МС: m/z 274 [M+H]+.

[(5-Гидрокси-[3,3']бипиридинил-6-карбонил)амино]уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,44 (1H, ушир. с), 9,46 (1H, 1, J=6,1 Гц), 9,30 (1H, с), 8,86 (1H, д, J=5,3 Гц), 8,76 (1H, д, J=8,2 Гц), 8,67 (1H, д, J=1,9 Гц), 7,92-8,00 (2H, м), 4,02 (2H, д, J=6,1 Гц). ВЭЖХ-МС: m/z 274 [M+H]+.
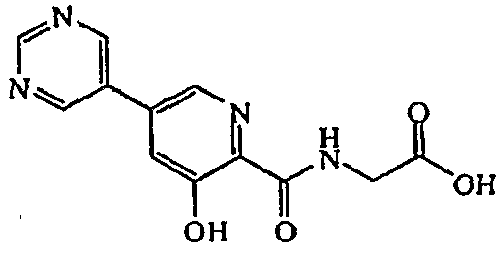
[(3-Гидрокси-5-пиримидин-5-ил-пиридин-2-карбонил)амино]уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,45 (1H, ушир. с), 9,45 (1H, т, J=5,9 Гц), 9,27-9,33 (3H, м), 8,67 (1H, д, J=1,8 Гц), 7,97 (1H, д, J=1,9 Гц), 4,02 (2H, д, J=6,2 Гц). ВЭЖХ-МС: m/z 275 [M+H]+.
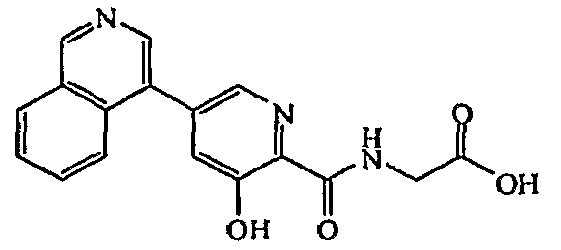
[(3-Гидрокси-5-изохинолин-4-ил-пиридин-2-карбонил)амино]уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,53 (1H, ушир. с), 9,83 (1H, с), 9,52 (1H, т, J=6,1 Гц), 8,71 (1H, с), 8,54 (1H, д, J=8,1 Гц), 8,38 (1H, д, J=1,7 Гц), 7,92-8,13 (3H, м), 7,73 (1H, д, J=1,7 Гц), 4,04 (2H, д, J=6,1 Гц). ВЭЖХ-МС: m/z 324 [M+H].
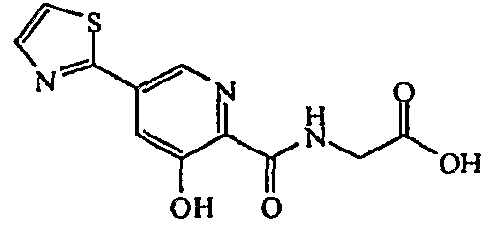
[(3-Гидрокси-5-тиазол-2-ил-пиридин-2-карбонил)амино]уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,50 (1H, с), 9,46 (1H, т, J=6,1 Гц), 8,76 (1H, д, J=1,8 Гц), 8,07 (1H, д, J=3,2 Гц), 8,00 (1H, д, J=3,2 Гц), 7,90 (1H, д, J=1,8 Гц), 4,00 (2H, д, J=6,1 Гц). ВЭЖХ-МС: m/z 280 [M+H]+.

{[5-(2,3-Дигидро-бензо[1,4]диоксин-6-ил)-3-гидроксипиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,83 (1H, ушир. с), 12,32 (1H, с), 9,31 (1H, т, J=6,1 Гц), 8,46 (1H, д, J=1,9 Гц), 7,64 (1H, д, J=1,9 Гц), 7,37 (1H, д, J=2,2 Гц), 7,28-7,34 (1H, м), 6,98 (1H, д, J=8,5 Гц), 4,29 (4H, с), 3,99 (2H, д, J=6,1 Гц). ВЭЖХ-МС: m/z 331 [M+H]+.
Категория II по настоящему изобретению относится к соединениям, имеющим формулу

где первый аспект включает соединения, имеющие формулу

Звенья R представляют собой замещенный или незамещенный фенил. Не ограничивающие объем настоящего изобретения примеры этих звеньев R описаны в таблице V в настоящем документе ниже.
Соединения, которые относятся к первому аспекту категории II по настоящему изобретению, могут быть получены способом, представленным на схеме V и описанным в примере 3 в настоящем документе ниже.
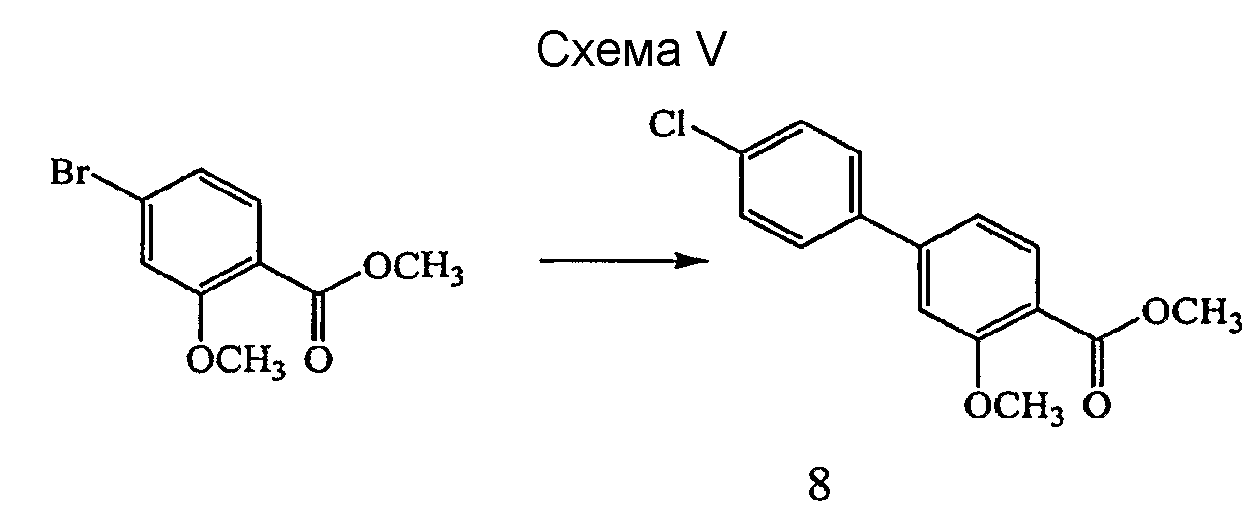
Реагенты и условия: (a) 4-хлорфенилбороновая кислота, Pd(dppf)Cl2,K3PO4, диоксан/MeOH, 80°C, 3 часа.

Реагенты и условия: (b) 4-хлорфенилбороновая кислота, Pd(dppf)Cl2, K3PO4,

Реагенты и условия: (c) этиловый эфир глицина·HCl, EDCI, HOBt, DIPEA, ДМФ, CH2Cl2; комнатная температура, 16 часов.
ПРИМЕР 3
Этиловый эфир [(4'-хлор-3-метокси-бифенил-4-карбонил)амино]уксусной кислоты (10)
Получение метилового эфира 4'-хлор-3-метокси-бифенил-4-карбоновой кислоты (8): к дегазированному раствору метил 4-бром-2-метоксибензоата (0,70 г, 2,86 ммоль) в 1,4-диоксане (10 мл) и MeOH (2,5 мл) при комнатной температуре в атмосфере азота добавляли 4-фторфенилбороновую кислоту (0,536 г, 3,43 ммоль), Pd(dppf)Cl2 (0,233 г, 0,286 ммоль) и K3PO4 (0,728 г, 3,43 ммоль). Полученную суспензию нагревали до 80°C и перемешивали в течение 3 часов, после чего реакционную смесь охлаждали до комнатной температуры и фильтровали через Celite™. Собранные твердые вещества промывали дополнительным количеством MeOH и фильтрат концентрировали при пониженном давлении. Сырое вещество очищали на силикагеле (гексан:EtOAc градиент 6:1-4:1) с получением 0,614 г (78% выход) желаемого продукта в виде кристаллического вещества оранжевого цвета.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,89 (1H, д, J=8,0 Гц), 7,52-7,56 (2H, м), 7,44 (2H, д, J=8,7 Гц), 7,17 (1H, д, J=8,0 Гц), 7,12 (1H, д, J=1,6 Гц), 3,99 (3H, с), 3,92 (3H, с). ВЭЖХ-МС: m/z 277 [M+H]+.
Получение 4'-хлор-3-метокси-бифенил-4-карбоновой кислоты (9): к раствору метилового эфира 4'-хлор-3-метокси-бифенил-4-карбоновой кислоты, 8, (0,615 г, 2,22 ммоль) в ТГФ (20 мл) и H2O (5 мл) при комнатной температуре добавляли LiOH (0,932 г, 22,2 ммоль). Полученную суспензию нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Сырой продукт подкисляли, используя концентрированную HCl, и полученное твердое вещество собирали фильтрованием, промывали H2O и сушили с получением 0,532 г (91%) желаемого продукта в виде твердого вещества серого цвета.1H ЯМР (400 МГц, CDCl3) δ м.д. 10,69 (1H, ушир. с), 8,26 (1H, д, J=8,1 Гц), 7,53-7,58 (2H, м), 7,44-7,50 (2H, м), 7,33 (1H, дд, J=8,1, 1,6 Гц), 7,20 (1H, д, J=1,3 Гц), 4,17 (3H, с). ВЭЖХ-МС: m/z 263 [M+H]+.
Получение этилового эфира [(4'-хлор-3-метокси-бифенил-4-карбонил)амино]уксусной кислоты (10): К раствору 4'-хлор-3-метокси-бифенил-4-карбоновой кислоты, 9, (0,325 г, 1,24 ммоль) в CH2Cl2 (5 мл) и ДМФ (1,5 мл) при комнатной температуре в атмосфере N2 добавляли гидрохлорид этилового эфира глицина (0,19 г, 1,36 ммоль), 1-(3-диметиламино-пропил)-3-этилкарбодиимид (EDCI) (0,261 г, 1,36 ммоль), 1-гидроксибензотриазол (HOBt) (0,033 г, 0,248 ммоль) и диизопропилэтиламин (DIPEA) (0,432 мл, 2,28 ммоль). Полученную суспензию перемешивали в течение 16 часов, после чего реакционную смесь разбавляли EtOAc и промывали 1M HCl, 1M NaOH и насыщенным водным NaCl. Органическую фазу отделяли, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Сырое вещество очищали на силикагеле (гексан:EtOAc 1:1) с получением 0,364 г (85% выход) желаемого продукта в виде бесцветного твердого вещества.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,51 (1H, ушир. с), 8,28 (1H, д, J=8,1 Гц), 7,53-7,57 (2H, м), 7,42-7,46 (2H, м), 7,27 (1H, дд, J=8,1, 1,6 Гц), 7,14 (1H, д, J=1,5 Гц), 4,29 (2H, д, J=4,8 Гц), 4,28 (2H, кв, J=7,1 Гц), 4,09 (3H, с), 1,34 (3H, т, J=7,2 Гц). ВЭЖХ-МС: m/z 348 [M+H]+.
Дополнительный неограничивающий пример включает следующее.

Этиловый эфир [(3-метокси-4'-метил-бифенил-4-карбонил)амино)уксусной кислоты:1H ЯМР (400 МГц, CDCl3) δ м.д. 8,52 (ушир. с, 1H), 8,26 (д, J=8,14 Гц, 1H), 7,53 (д, J=8,05 Гц, 2 H), 7,28-7,33 (м, 3H), 7,17 (д, J=1,37 Гц, 1H), 4,13-4,45 (м, 4H), 4,08 (c, 3H), 2,42 (c, 3H), 1,33 (т, J=7,18 Гц, 3H). ВЭЖХ-МС: m/z 328 [M+H]+.
Соединения формулы (I) также включают соединения, имеющие формулу

где R единицы представляют собой замещенный или незамещенный фенил. Не ограничивающие объем настоящего изобретения примеры этих звеньев R представлены в таблице VI в настоящем документе ниже.
Соединения, описанные непосредственно выше, могут быть получены способом, представленным на схеме VI и описанным в примере 4 в настоящем документе ниже.

Реагенты и условия: (a) BBr3, CH2Cl2; комнатная температура, 3 дня.
ПРИМЕР 4
[(4'-Хлор-3-гидрокси-бифенил-4-карбонил)амино]уксусная кислота (11)
Получение [(4'-хлор-3-гидрокси-бифенил-4-карбонил)амино]уксусной кислоты (11): К раствору этилового эфира [(4'-хлор-3-метокси-бифенил-4-карбонил)амино]уксусной кислоты (0,053 г, 0,152 ммоль) в CH2Cl2 (2 мл) при комнатной температуре в атмосфере азота по каплям добавляли BBr3 (1,52 мл 1M раствора в CH2Cl2, 1,52 ммоль). Полученную смесь перемешивали в течение 3 дней, после чего реакционную смесь гасили H2O (0,5 мл), затем подкисляли до pH 1 с помощью конц. HCl. Смесь экстрагировали EtOAc (×2), органическую фазу отделяли, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Сырое вещество очищали препаративной ВЭЖХ с получением 0,019 г (41% выход) желаемого продукта в виде твердого вещества белого цвета.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,41 (1H, с), 9,19 (1H, с), 7,96 (1H, д, J=8,3 Гц), 7,74 (2H, д, J=8,7 Гц), 7,54 (2H, д, J=8,7 Гц), 7,21 (1H, д, J=1,7 Гц), 7,26 (1H, дд, J=8,3, 1,8 Гц), 3,99 (2H, д, J=5,5 Гц). ВЭЖХ-МС: m/z 306 [M+H]+.
Далее представлен неограничивающий пример второго аспекта категории II по настоящему изобретению.
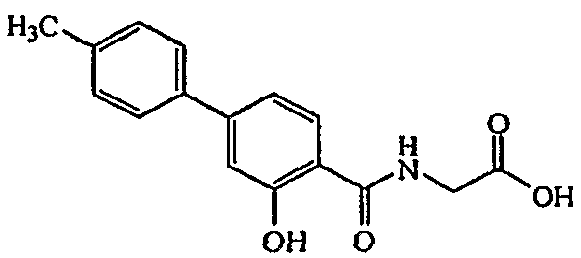
[(3-Гидрокси-4'-метил-бифенил-4-карбонил)амино]уксусная кислота:1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,37 (1H, с), 9,17 (1H, с), 7,94 (1H, д, J=8,32 Гц), 7,60 (2H, д, J=8,14 Гц), 7,29 (2H, д, J=7,96 Гц), 7,22 (1H, дд, J=8,32, 1,83 Гц), 7,18 (1H, д, J=1,74 Гц), 4,00 (2H, д, J=5,67 Гц), 2,35 (3H, с). ВЭЖХ-МС: m/z 286 [M+H]+.
Категория III по настоящему изобретению относится к соединениям, имеющим формулу

где не ограничивающие объем настоящего изобретения примеры R, R6a и R6b далее описаны в настоящем документе ниже в таблице VII.
Соединения, которые включены в категорию III по настоящему изобретению, могут быть получены способами, представленными в настоящем документе ниже на схемах VII и VIII и описанными в примерах 5 и 6.
Схема VII

Реагенты и условия: (а)
ПРИМЕР 5
5-(3-хлорфенил)-N-(2-диметиламино)-2-оксоэтил)-3-гидроксипиридин-2-иламид (12)
Получение 5-(3-хлорфенил)-N-(2-диметиламино)-2-оксоэтил)-3-гидроксипиридин-2-иламида (12): К раствору {[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты, 7, (0,043 г 0,139 ммоль) в ДМФ (2 мл) при 0°С в атмосфере N2 добавляли диизопропилэтиламин (0,072 мл, 0,42 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,040 г, 0,21 ммоль) и 1-гидроксибензотриазол (HOBt) (0,002 г, 0,014 ммоль). Перед добавлением диметиламина (0,10 мл 2М раствора в ТГФ, 0,21 ммоль) полученную смесь перемешивали в течение 5 минут. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 3 дней. Реакционную смесь разбавляли EtOAc, промывали H2O и насыщенным водным раствором NaCl. Органическую фазу сушили (MgSO4), фильтровали, концентрировали при пониженном давлении и сырое вещество очищали на силикагеле (EtOAc) с получением 0,20 г (43% выход) желаемого продукта в виде бесцветного твердого вещества.1H ЯМР (250 МГц, CDCl3) δ м.д. 11,90 (1H, с), 8,83 (1H, т, J=4,6 Гц), 8,25 (1H, д, J=1,8 Гц), 7,51 (1H, м), 7,31-7,44 (4H, м), 4,19 (2H, д, J=4,6 Гц), 2,99 (3H, с), 2,98 (3H, с). ВЭЖХ-МС: m/z 334 [M+H]+.

Реагенты и условия: (a) 2-аминоацетамид HCl, EDCI, HOBt, ДМФ; 0°C - комнатная температура, 3 дня.
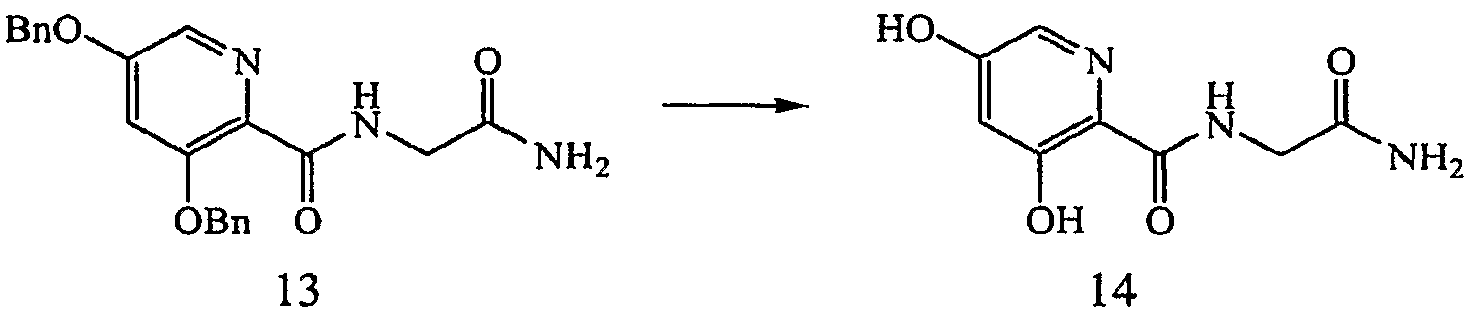
Реагенты и условия: (b) H2: Pd/C, MeOH, комнатная температура, 22 часа.

Реагенты и условия: (c) (CF3SO2)2NC6H5, MeOH; комнатная температура, 24 часа.
Реагенты и условия: (d) 3-хлорфенилбороновая кислота, Pd(dppf)Cl2, K3PO4, диоксан; 85°С, 48 часов.
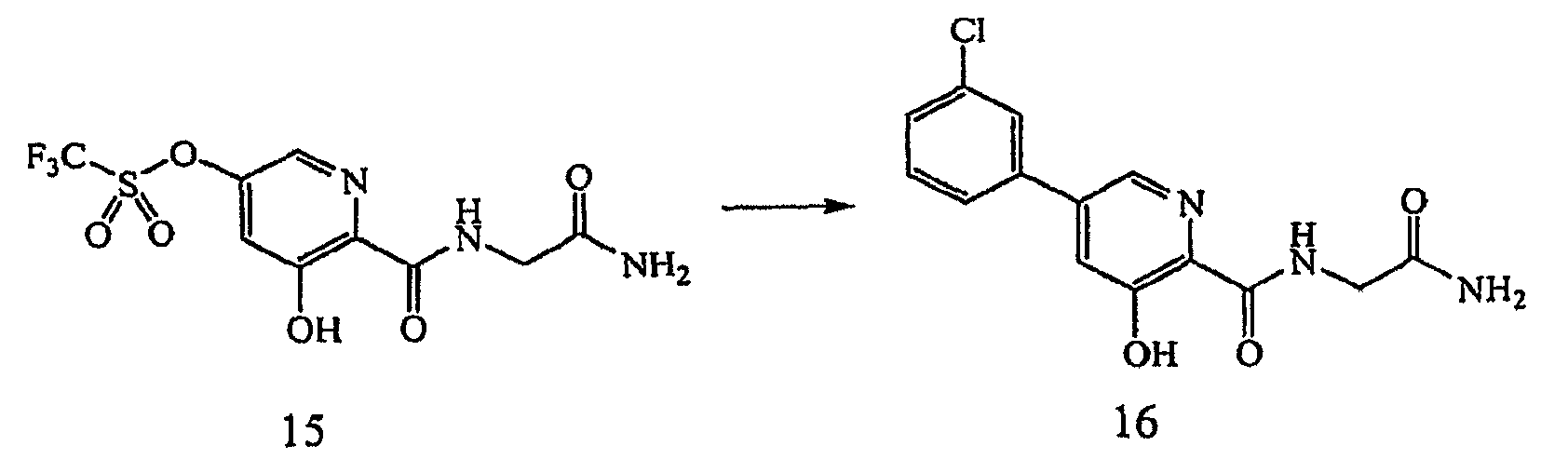
ПРИМЕР 6
5-(3-хлорфенил)-N-(2-амино-2-оксоэтил)-3-гидроксилпиридин-2-иламид (16)
Получение 3,5-бис-бензилокси-N-(2-амино-2-оксоэтил)пиридин-2-иламида (13): к раствору 3,5-бис-бензилоксипиридин-2-карбоновой кислоты, 2, (1,00 г, 2,99 ммоль) в ДМФ (20 мл) при комнатной температуре в атмосфере N2 добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,925 г, 5,97 ммоль) и 1-гидроксибензотриазол (HOBt) (0,806 г, 5,97 ммоль). Полученный раствор перемешивали в течение 15 минут, затем добавляли 2-аминоацетамид гидрохлорид (0,66 г, 5,97 ммоль) и диизопропилэтиламин (1,56 мл, 8,96 ммоль). Через 3 дня реакционную смесь концентрировали при пониженном давлении и добавляли H2O. Образовавшееся твердое вещество собирали фильтрованием и промывали водой с получением 0,598 г (51% выход) желаемого продукта в виде твердого вещества белого цвета.1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 8,39 (1Н, т, J=5,6 Гц), 8,01 (1Н, д, J=2,2 Гц), 7,28-7,56 (12Н, м), 7,11 (1Н, ушир. с), 5,26 (2Н, с), 5,25 (2Н, с), 3,81 (2Н, д, J=5,6 Гц). ВЭЖХ-МС: m/z 392 [М+Н]+.
Получение 3,5-дигидрокси-N-(2-амино-2-оксоэтил) пиридин-2-иламида (14): раствор 3,5-бис-бензилокси-N-(2-амино-2-оксоэтил) пиридин-2-иламида, 13, (0,598 г, 1,53 ммоль) в EtOH (100 мл), содержащий 10% Pd/C (0,120 г), перемешивали в атмосфере Н2 в течение 22 часов. Реакционный раствор фильтровали через Celite™ и собранные твердые вещества промывали горячим МеОН. Объединенный фильтрат и остатки, полученные после промывки, концентрировали при пониженном давлении с получением 0,32 г (99% выход) желаемого продукта в виде твердого вещества кремового цвета.1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,42 (1Н, с), 10,84 (1Н, ушир. с), 8,75 (1Н, т, J=5,8 Гц), 7,75 (1Н, д, J=2,3 Гц), 7,47 (1Н, ушир. с), 7,13 (1Н, ушир. с), 6,67 (1Н, д, J=2,3 Гц), 3,85 (2Н, д, J=5,9 Гц). ВЭЖХ-МС: m/z 212 [М+Н]+.
Получение 5-трифторметансульфонокси-N-(2-амино-2-оксоэтил)-3-гидроксипиридин-2-иламида (15): к раствору 3,5-дигидрокси-N-(2-амино-2-оксоэтил)пиридин-2-иламида, 14, (0,30 г, 1,42 ммоль) в МеОН (10 мл) и ДМФ (5 мл) при 0°С в атмосфере N2 добавляли диизопропилэтиламин (0,247 мл, 1,42 ммоль), затем N-фенилтрифторметансульфонамид (0,508 г, 1,42 ммоль). Полученную смесь медленно нагревали до комнатной температуры и перемешивание продолжали в течение 24 часов. Затем растворитель удаляли при пониженном давлении и сырое вещество очищали на силикагеле (2% МеОН:CH2Cl2) с получением 0,404 г (83% выход) желаемого продукта в виде твердого вещества светло-желтого цвета.1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,85 (1Н, ушир. с), 9,28 (1Н, т, J=5,9 Гц), 8,41 (1Н, д, J=2,3 Гц), 7,85 (1Н, д, J=2,4 Гц), 7,52 (1Н, ушир. с), 7,18 (1Н, ушир. с), 3,88 (2Н, д, J=6,1 Гц). ВЭЖХ-МС: m/z 344 [М+Н]+.
Получение 5-(3-хлорфенил)-N-(2-амино-2-оксоэтил)-3-гидроксипиридин-2-иламида (16): к дегазированному раствору 5-трифторметансульфонокси-N-(2-амино-2-оксоэтил)-3-гидроксипиридин-2-иламида, 15, (0,20 г, 0,58 ммоль) в 1,4-диоксане (3,5 мл) при комнатной температуре в атмосфере N2 добавляли 3-хлорфенилбороновую кислоту (0,109 г, 0,70 ммоль), K3PO4 (0,148 г, 0,70 ммоль) и Pd(dppf)Cl2 (0,048 г, 0,06 ммоль). Полученную суспензию нагревали до 90°С в герметически закрытом сосуде в течение 22 часов. Реакционную смесь охлаждали до комнатной температуры и дополнительно добавляли 3-хлорфенилбороновую кислоту (0,055 г, 0,35 ммоль) и Pd(dppf)Cl2 (0,048 г, 0,06 ммоль), и реакционную смесь повторно нагревали до 90°С в течение еще 22 часов. После охлаждения реакционный раствор фильтровали через Celite™ и собранные твердые вещества промывали дополнительным количеством МеОН. Фильтрат и остатки, полученные после промывки, концентрировали при пониженном давлении, и остаток растворяли в CH2Cl2, и промывали 10%-ной лимонной кислотой. Органический слой сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали на силикагеле (2% MeOH:CH2Cl2) с получением 0,033 г (18% выход) желаемого продукта в виде бесцветного твердого вещества.1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,46 (1Н, с), 9,17 (1Н, т, J=5,9 Гц), 8,55 (1Н, д, J=2,0 Гц), 7,93 (1Н, д, J=0,9 Гц), 7,75-7,84 (2Н, м), 7,49-7,60 (3Н, м), 7,18 (1Н, с), 3,91 (2Н, д, J=5,9 Гц). ВЭЖХ-МС: m/z 306 [М+Н]+.
Далее представлены не ограничивающие объем настоящего изобретения примеры соединений, включенные в категорию III по настоящему изобретению.
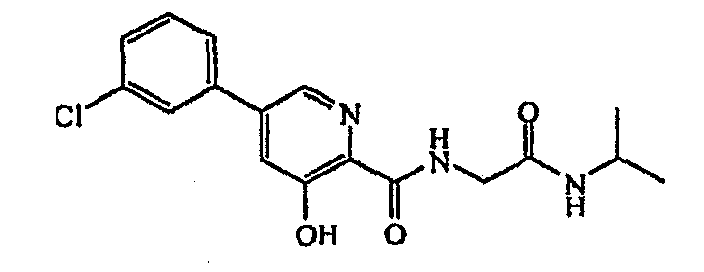
5-(3-хлорфенил)-N-(2-изопропиламино-2-оксоэтил)-3-гидроксипиридин-2-иламид:1H ЯМР (250 МГц, CDCl3) δ м.д. 8,60 (1Н, т, J=6,4 Гц), 8,25 (1Н, д, J=2,0 Гц), 7,50-7,53 (1Н, м), 7,44 (1Н, д, J=2,0 Гц), 7,35-7,43 (3Н, м), 5,69 (1Н, ушир. с), 4,04 (2Н, д, J=5,9 Гц), 3,41 (1Н, кв, J=7,0 Гц), 1,13 (6Н, д, J=6,6 Гц). ВЭЖХ-МС: m/z 348 [М+Н]+.

5-(4-метилфенил)-N-(2-метиламино-2-оксоэтил)-3-гидроксипиридин-2-иламид:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,90 (1Н, с), 8,47 (1Н, т, J=5,9 Гц), 8,25 (1Н, д, J=1,8 Гц), 7,33-7,56 (3Н, м), 7,12-7,31 (2Н, м), 6,07 (1Н, ушир. с), 3,90-4,24 (2Н, м), 2,66-2,98 (3Н, м), 2,35 (3Н, с). ВЭЖХ-МС: m/z 300 [M+H]+.

5-(3-хлорфенил)-N-(2-метиламино-2-оксоэтил)-3-гидроксипиридин-2-иламид:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,79 (1Н, ушир. с), 8,55 (1Н, ушир. с), 8,31 (1Н, с), 7,6С (1Н, с), 7,41-7,53 (4Н, м), 6,01 (1Н, ушир. с), 4,15 (2Н, д, J=5,8 Гц), 2,90 (3H, д, J=4,7 Гц). ВЭЖХ-МС: m/z 320 [M+H]+.
Категория IV по настоящему изобретению относится к соединениям, имеющим формулу

где первый аспект относится к соединениям, имеющим формулу

Не ограничивающие объем настоящего изобретения примеры этих звеньев R, R5, и L дополнительно описаны в настоящем документе ниже в таблице VIII.
Соединения, описанные непосредственно выше, где R5 представляет собой C1-C4 линейный, разветвленный или циклический алкил, могут быть получены способами, представленными в настоящем документе ниже на схеме IX и описанными в примере 7.

Реагенты и условия: (a) метиловый эфир 2-амино-2-метилпропионовой кислоты, EDCI, HOBt, ДМФ; 0°C - комнатная температура, 3 дня.

Реагенты и условия: (b) H2: Pd/C, MeOH, комнатная температура, 22 часа.

Реагенты и условия: (c) (CF3SO2)2NC6H5, MeOH; комнатная температура, 24 часа.

Реагенты и условия: (d) 3-фторфенилбороновая кислота, Pd(dppf)Cl2, K3PO4, диоксан; 85°C, 48 часов.
ПРИМЕР 7
Метиловый эфир 2-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовой кислоты (20)
Получение метилового эфира 2-[(3,5-бис-бензилоксипиридин-2-карбонил)амино]-2-метилпропионовой кислоты (17): к раствору 3,5-бис-бензилоксипиридин-2-карбоновой кислоты, 2, (1,0 г, 2,99 ммоль) в ДМФ (20 мл) при комнатной температуре в атмосфере N2 добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,925 г, 5,97 ммоль) и 1-гидроксибензотриазол (HOBt) (0,806 г, 5,97 ммоль). Смесь перемешивали в течение 15 минут, после чего добавляли α-аминоизомасляную кислоту (0,917 г, 5,97 ммоль) и диизопропилэтиламин (DIPEA) (1,56 мл, 8,96 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 16 часов, затем концентрировали при пониженном давлении. Полученное масло коричневого цвета очищали на силикагеле (EtOAc:гептан 1:1) с получением 0,58 г (45% выход) желаемого соединения в виде бесцветного твердого вещества.1H ЯМР (250 МГц, CDCl3) δ м.д. 8,13 (1H, с), 8,02 (1H, д, J=2,3 Гц), 7,31-7,48 (10H, м), 6,90 (1H, д, J=2,3 Гц), 5,19 (2H, с), 5,10 (2H, с), 3,74 (3H, с), 1,58 (6H, с). ВЭЖХ-МС: m/z 435 [M+H]+.
Получение метилового эфира 2-[(3,5-дигидроксипиридин-2-карбонил)амино]-2-метилпропионовой кислоты (18): раствор метилового эфира 2-[(3,5-бис-бензилоксипиридин-2-карбонил)амино]-2-метилпропионовой кислоты, 17, (0,58 г, 1,34 ммоль) в MeOH (100 мл), содержащий 10% Pd/C (0,116 г), перемешивали в атмосфере H2 в течение 22 часов. Реакционный раствор фильтровали через Celite™ и собранные твердые вещества промывали горячим MeOH. Объединенный фильтрат и остатки, полученные после промывки, концентрировали при пониженном давлении с получением 0,321 г (94% выход) желаемого соединения в виде твердого вещества серого цвета.1H ЯМР (250 МГц, MeOD) δ м.д. 7,67 (1H, д, J=2,4 Гц), 6,58 (1H, д, J=2,4 Гц), 3,69 (3H, с), 1,56 (6H, с). ВЭЖХ-МС: m/z 255 [M+H]+.
Получение метилового эфира 2-[(3-гидрокси-5-трифторметансульфонилоксипиридин-2-карбонил)амино]-2-метилпропионовой кислоты (19): к раствору метилового эфира 2-[(3,5-дигидроксипиридин-2-карбонил)амино]-2-метилпропионовой кислоты, 18, (0,312 г, 1,23 ммоль) в MeOH (10 мл), содержащему диизопропилэтиламин (0,214 мл, 1,23 ммоль), при 0 °C в атмосфере N2 добавляли N-фенилтрифторметансульфонамид (0,439 г, 1,23 ммоль). Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 40 часов. Растворитель удаляли при пониженном давлении и оставшееся сырое масло очищали на силикагеле (EtOAc:гептан 1:9) с получением 0,170 г (36% выход) желаемого соединения в виде желтого масла.1H ЯМР (250 МГц, MeOD) δ м.д. 8,85 (1H, ушир. с), 8,19 (1H, д, J=2,4 Гц), 7,46 (1H, д, J=2,3 Гц), 3,74 (3H, с), 1,63 (6H, с). ВЭЖХ-МС: m/z 387 [M+H]+.
Получение метилового эфира 2-{[5-(3-хлор-фенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовой кислоты (20): к дегазированному раствору метилового эфира 2-[(3-гидрокси-5-трифторметансульфонилоксипиридин-2-карбонил)амино]-2-метилпропионовой кислоты (0,17 г, 0,44 ммоль) в 1,4-диоксане (3 мл) при комнатной температуре в атмосфере N2 добавляли 3-фторфенил бороновую кислоту (0,082 г, 0,53 ммоль), K3PO4 (0,112 г, 0,53 ммоль) и Pd(dppf)Cl2 (0,036 г, 0,04 ммоль). Полученную суспензию нагревали до 85°C в герметически закрытом сосуде в течение 20 часов. После охлаждения реакционный раствор фильтровали через Celite™ и собранные твердые вещества промывали дополнительным количеством MeOH. Фильтрат и остатки, полученные после промывки, концентрировали при пониженном давлении, и остаток растворяли в CH2Cl2 и промывали 10%-ной лимонной кислотой. Органический слой сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали на силикагеле (EtOAc:гептан 1:4) с получением 0,112 г (73% выход) желаемого соединения в виде бесцветного масла.1H ЯМР (250 МГц, CDCl3) δ м.д. 11,83 (1H, ушир. с), 8,29 (1H, ушир. с), 8,10 (1H, д, J=2,0 Гц), 7,40 (1H, м), 7,08-7,34 (4H, м), 3,65 (3H, с), 1,55 (6H, с). ВЭЖХ-МС: m/z 349 [M+H]+.
Соединения формулы (I), где R5 представляет собой водород, могут быть получены способами, представленными в настоящем документе ниже на схеме X и описанным в примере 8.
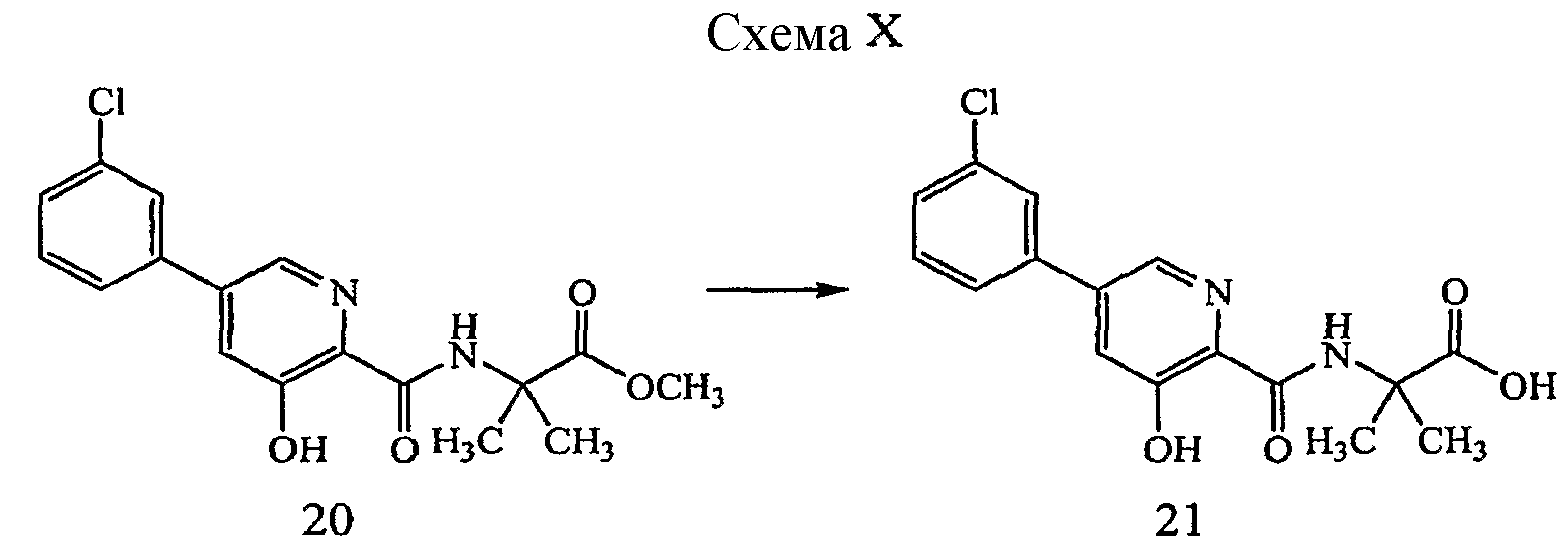
Реагенты и условия: (a) LiOH, ТГФ/H2O; комнатная температура, 3 дня.
ПРИМЕР 8
2-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовая кислота (21)
Получение 2-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовой кислоты (21): к раствору метилового эфира 2-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовой кислоты, 20, (0,082 г, 0,24 ммоль) в ТГФ (4 мл) добавляли LiOH (0,024 г, 0,98 ммоль) и H2O (1 мл) и полученный раствор перемешивали в течение нескольких дней при комнатной температуре. Растворитель удаляли при пониженном давлении и затем оставшееся твердое вещество светло-желтого цвета подкисляли 1M HCl до тех пор, пока pH не стал равен приблизительно 1, и раствор экстрагировали дважды EtOAc. Органические слои объединяли, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением 0,064 г (81% выход) желаемого соединения в виде твердого вещества белого цвета.1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,99 (1H, ушир. с), 12,25 (1H, с), 9,05 (1H, с), 8,53 (1H, д, J=2,0 Гц), 7,91 (1H, с), 7,74-7,83 (2H, м), 7,51-7,58 (2H, м), 1,58 (6H, с). ВЭЖХ-МС: m/z 335 [M+H]+.
Другие не ограничивающие объем настоящего изобретения примеры включают следующее.

Этиловый эфир 3-[(3-гидрокси-5-(4-метилфенил)пиридин-2-карбонил)амино]пропионовой кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 12,12 (1H, с), 8,44 (1H, т, J=5,9 Гц), 8,31 (1H, д, J=1,8 Гц), 7,44-7,55 (3H, м), 7,30 (2H, д, J=7,9 Гц), 4,21 (2H, кв, J=7,2 Гц), 3,76 (2H, кв, J=6,4 Гц), 2,68 (2H, т, J=6,2 Гц), 2,43 (3H, с), 1,30 (3H, т, J=7,2 Гц). ВЭЖХ-МС: m/z 325 [M+H]+.

Этиловый эфир 3-[(3-гидрокси-5-(3-хлорфенил)пиридин-2-карбонил)амино]пропионовой кислоты:1H ЯМР (400 МГц, CDCl3) δ м.д. 12,16 (1H, с), 8,45 (1H, т, J=5,7 Гц), 8,25 (1H, д, J=1,6 Гц), 7,55 (1H, с), 7,37-7,47 (4H, м), 4,20 (2H, кв, J=7,1 Гц), 3,75 (2H, кв, J=6,3 Гц), 2,68 (2H, т, J=6,2 Гц), 1,28 (3H, т, J=7,1 Гц). ВЭЖХ-МС: m/z 349 [M+H]+.

3-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}пропионовая кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,63 (1H, ушир. с), 12,37 (1H, ушир. с), 9,20 (1H, т, J=5,6 Гц), 8,50 (1H, д, J=1,8 Гц), 7,91 (1H, с), 7,72-7,84 (2H, м), 7,54 (2H, м), 3,54 (2H, кв, J=6,8 Гц), 2,58 (2H, т, J=6,9 Гц). ВЭЖХ-МС: m/z 321 [M+H]+.

3-[(3-Гидрокси-5-(4-метилфенил)пиридин-2-карбонил)амино]пропионовая кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,59 (1H, ушир. с), 9,15 (1H, т, J=5,9 Гц), 8,46 (1H, д, J=1,8 Гц), 7,70 (2H, д, J=8,2 Гц), 7,66 (1H, д, J=2,0 Гц), 7,33 (2H, д, J=8,1 Гц), 3,54 (2H, кв, J=6,7 Гц), 2,57 (2H, т, J=7,0 Гц), 2,36 (3H, с). ВЭЖХ-МС: m/z 301 [M+H]+.
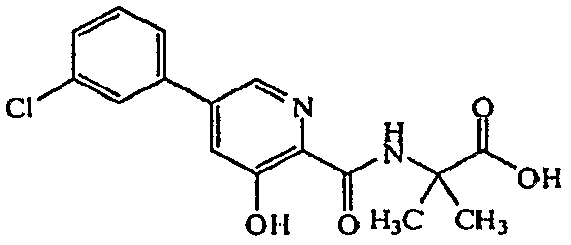
2-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовая кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,99 (1H, ушир. с), 12,25 (1H, с), 9,05 (1H, с), 8,53 (1H, д, J=2,0 Гц), 7,91 (1H, с), 7,74-7,83 (2H, м), 7,51-7,58 (2H, м), 1,58 (6H, с). ВЭЖХ-МС: m/z 335 [M+H]+.
Второй аспект категории IV относится к соединениям, имеющим формулу

где не ограничивающие примеры R, R6a, R6b и L описаны в настоящем документе ниже в таблице IX.
Другая подгруппа соединений формулы (I) может быть получена способами, представленными в настоящем документе ниже на схеме XI и описанными в примере 9.
Схема XI

Реагенты и условия: (а) CH3NH2 HCl, EDCI, HOBt, ДМФ; 0°С - комнатная температура, 2 дня.
ПРИМЕР 9
5-(3-хлорфенил)-N-(2-метиламино-2-оксо-1,1-диметилэтил)-3-гидроксипиридин-2-иламид (22)
Получение 5-(3-фторфенил)-N-(2-метиламино-2-оксо-1,1-диметилэтил)-3-гидроксипиридин-2-иламида (22): к раствору 2-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовой кислоты, 21, (0,030 г, 0,09 ммоль) в ДМФ (2 мл) при комнатной температуре в атмосфере N2 добавляли 1-(3-диметиламино-пропил)-3-этилкарбодиимид (EDCI) (0,021 г, 0,13 ммоль), 1-гидроксибензотриазол (HOBt) (0,012 г, 0,09 ммоль) и диизопропилэтиламин (DIPEA) (0,047 мл, 0,27 ммоль). Реакционную смесь перемешивали в течение 5 минут, затем добавляли метиламин гидрохлорид (0,09 г, 0,13 ммоль). После перемешивания в течение 2 дней растворитель удаляли при пониженном давлении и остаток распределяли между CH2Cl2 и H2O. Органический слой отделяли, промывали насыщенным NaCl, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали на силикагеле (MeOH:CH2Cl2 1:99) с получением 0,025 г (80% выход) желаемого соединения в виде бесцветного масла.1H ЯМР (250 МГц, CDCl3) δ м.д. 11,93 (1H, ушир. с), 8,50 (1H, с), 8,26 (1H, д, J=1,8 Гц), 7,56 (1H, д, J=1,4 Гц), 7,38-7,50 (4H, м), 6,50 (1H, ушир. с), 2,87 (3H, д, J=4,7 Гц), 1,71 (6H, с). ВЭЖХ-МС: m/z 348 [M+H]+.
Другая подгруппа соединений формулы (I) относится к соединениям, имеющим формулу

примерами которых могут быть соединения, имеющие формулу

где звенья R1 представляют собой замещенный или незамещенный фенил. Не ограничивающие объем настоящего изобретения примеры этих звеньев описаны в таблице X в настоящем документе ниже.
Другая подгруппа соединений формулы (I) может быть получена способом, представленным на схеме XII и описанным в примере 10 в настоящем документе ниже.

Реагенты и условия: (a) GlyOMe·HCl, EDCI, HOBt, CH2Cl2; комнатная температура, 16 часов.

Реагенты и условия: (b) 4-метилфенилбороновая кислота, Pd(dppf)Cl2, K3PO4, диоксан/H2O; 70°C, 16 часов.
ПРИМЕР 10
Метиловый эфир [(4-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты (24)
Получение метилового эфира [(4-йодпиридин-2-карбонил)амино]уксусной кислоты (23):
К раствору 4-йодпиколиновой кислоты (1,41 г, 5,66 ммоль) в CH2Cl2 (35 мл) при комнатной температуре в атмосфере N2 добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (1,62 г, 8,49 ммоль) и 1-гидроксибензотриазол (HOBt) (0,077 г, 0,57 ммоль). Раствор перемешивали в течение 5 минут, и добавляли гидрохлорид метилового эфира глицина (1,07 г, 8,49 ммоль), и реакционную смесь перемешивали 16 часов. Реакционную смесь концентрировали при пониженном давлении и сырое вещество распределяли между EtOAc и 1M K2CO3. Водную фазу удаляли и органическую фазу промывали H2O, насыщенным NaCl, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением масла коричневого цвета, которое очищали на силикагеле (EtOAc:гептан градиент 1:4) с получением 0,805 г (44% выход) желаемого продукта в виде бесцветного твердого вещества. ВЭЖХ-МС: m/z 321 [M+H]+.
Получение метилового эфира [(4-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты (24): к дегазированному раствору метилового эфира [(4-йодпиридин-2-карбонил)амино]уксусной кислоты, 23, (0,150, 0,47 ммоль) в 1,4-диоксане (4 мл) и MeOH (2 мл) добавляли K3PO4 (0,109 мг, 0,52 ммоль), Pd(dppf)Cl2 (0,038 г, 0,047 ммоль) и 4-метилфенилбороновую кислоту (0,064 г, 0,47 ммоль). Реакционную смесь нагревали до 70°C в герметически закрытом сосуде в атмосфере N2 в течение 16 часов. Затем растворители удаляли при пониженном давлении и оставшееся твердое вещество распределяли между CH2Cl2 и 1M K2CO3. Водную фазу удаляли и органическую фазу промывали H2O, насыщенным раствором NaCl, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Сырое вещество очищали на силикагеле (EtOAc:гептан градиент 1:4-3:7) с получением 0,113 г (85% выход) желаемого соединения.1H ЯМР (400 МГц, CDCl3) δ м.д. 8,60 (1H, дд, J=5,1, 0,7 Гц), 8,55 (1H, т, J=4,8 Гц), 8,43-8,44 (1H, м), 8,43 (1H, с), 7,66 (1H, дд, J=5,1, 1,8 Гц), 7,63 (2H, д, J=8,4 Гц), 7,32 (2H, д, J=8,1 Гц), 4,31 (1H, д, J=5,9 Гц), 3,81 (2H, с), 2,43 (3H, с). ВЭЖХ-МС: m/z 285 [M+H]+.
Далее представлены не ограничивающие объем настоящего изобретения примеры соединений, описанных непосредственно выше.

Метиловый эфир {[4-(4-цианофенил)пиридин-2-карбонил]амино}уксусной кислоты:1Η ЯМР (400 МГц, CDCl3) δ м.д. 8,63 (1H, д, J=5,1 Гц), 8,45 (1H, т, J=5,3 Гц), 8,36 (1H, д, J=1,8 Гц), 7,74 (4H, с), 7,59 (1H, дд, J=5,1, 1,8 Гц), 4,24 (2H, д, J=5,9 Гц), 3,74 (3H, с). ВЭЖХ-МС: m/z 296 [M+H]+.
Метиловый эфир {[4-(4-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (400 МГц, CDCl3) δ м.д. 8,56 (1H, дд, J=4,9, 0,9 Гц), 8,47 (1H, т, J=5,1 Гц), 8,33 (1H, дд, J=2,0, 0,9 Гц), 7,51-7,61 (3H, м), 7,41 (2H, м), 4,23 (2H, д, J=5,5 Гц), 3,74 (3H, с). ВЭЖХ-МС: m/z 305 [M+H]+.

Метиловый эфир {[4-(3-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (400 МГц, CDCl3) δ м.д. 8,57 (1H, дд, J=5,1, 0,7 Гц), 8,47 (1H, т, J=5,1 Гц), 8,33 (1H, м), 7,62 (1H, м), 7,57 (1H, дд, J=5,1, 1,8 Гц), 7,47-7,54 (1H, м), 7,31-7,42 (2H, м), 4,24 (2H, д, J=5,9 Гц), 3,74 (3H, с). ВЭЖХ-МС: m/z 305 [M+H]+.

Метиловый эфир {[4-(2-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты:1H ЯМР (400 МГц, CDCl3) δ м.д. 8,57 (1H, дд, J=5,1, 0,7 Гц), 8,46 (1H, т, J=4,6 Гц), 8,20 (1H, дд, J=1,8, 0,7 Гц), 7,50 (1H, дд, J=5,1, 1,8 Гц), 7,42-7,46 (1H, м), 7,30 (1H, д, J=1,8 Гц), 7,28-7,32 (2H, м), 4,23 (2H, д, J=5,5 Гц), 3,74 (3H, с). ВЭЖХ-МС: m/z 305 [M+H]+.
Второй аспект категории V включает соединения, имеющие формулу

где звенья R1 представляют собой замещенный или незамещенный фенил, не ограничивающие объем настоящего изобретения примеры которого описаны в таблице XI в настоящем документе ниже.
Соединения по второму аспекту могут быть получены способом, описанным на схеме XIII и описанным в примере 11 в настоящем документе ниже.
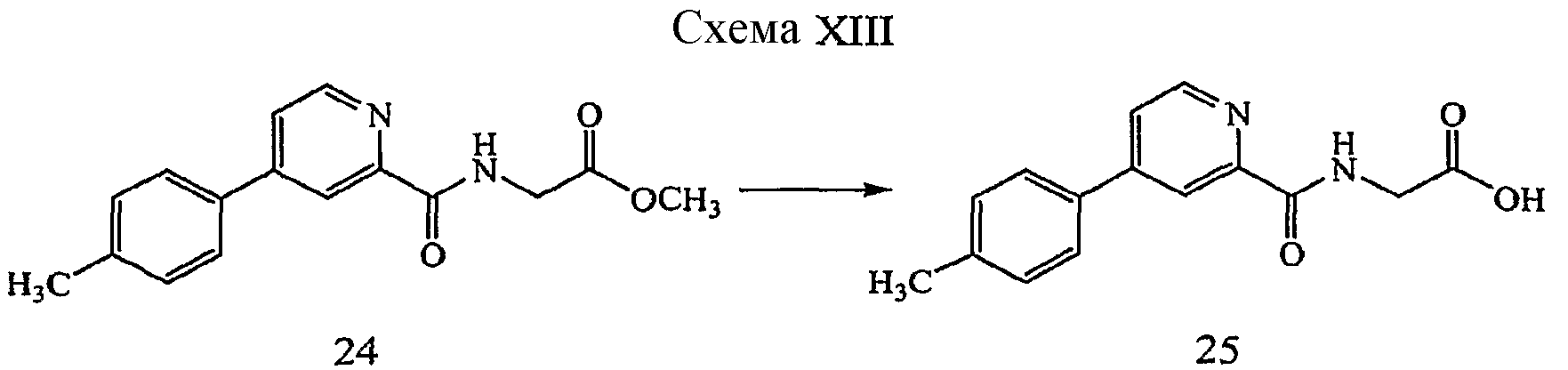
Реагенты и условия: (a) LiOH, ТГФ, H2O; комнатная температура, 16 часов.
ПРИМЕР 11
[(4-(4-Метилфенил)пиридин-2-карбонил)амино]уксусная кислота (25)
Получение [(4-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты (25): к раствору метилового эфира [(4-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты, 24, (0,092 г, 0,32 ммоль) в ТГФ (2 мл) при комнатной температуре добавляли H2O (1 мл) и LiOH·H2O (0,027 г, 0,64 ммоль). Реакционную смесь перемешивали в течение 16 часов, после чего раствор подкисляли с помощью 1M HCl. Растворители удаляли при пониженном давлении, и оставшееся твердое вещество суспендировали в смеси ТГФ:MeOH и фильтровали. Фильтрат концентрировали при пониженном давлении, и полученное твердое вещество растирали в MeOH, и собирали фильтрованием с получением 0,012 г (12% выход) желаемого соединения в виде бесцветного твердого вещества.1H ЯМР (250 МГц, MeOD) δ м.д. 8,69 (1H, д, J=4,8 Гц), 8,38 (1H, с), 7,86 (1H, д, J=6,2 Гц), 7,72 (2H, д, J=8,1 Гц), 7,38 (1H, д, J=7,9 Гц), 4,21 (1H, с), 2,44 (2H, с). ВЭЖХ-МС: m/z 271 [M+H]+.
Далее представлены не ограничивающие объем настоящего изобретения примеры соединений соединения формулы (I).

{[4-(4-Цианофенил)пиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, MeOD) δ м.д. 8,69 (1H, д, J=6,0 Гц), 8,38 (1H, ушир. с), 7,71-8,01 (2H, м), 4,10 (2H, с). ВЭЖХ-МС: m/z 282 [M+H]+.
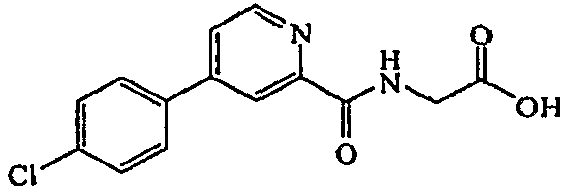
{[4-(4-Хлорфенил)пиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, MeOD) δ м.д. 8,75 (1H, с), 8,44 (1H, ушир. с), 7,85 (3H, м), 7,57 (2H, д, J=7,8 Гц), 4,23 (2 H с). ВЭЖХ-МС: m/z 291 [M+H]+.
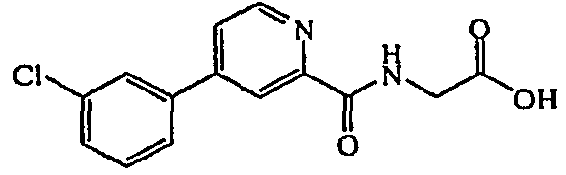
{[4-(3-Хлорфенил)пиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (400 МГц, MeOD) δ м.д. 8,63 (1H, д, J=5,5 Гц), 8,27 (1H, ушир. с), 7,73 (1H, с), 7,77 (1H, д, J=4,0 Гц), 7,64 (1H, д, J=7,0 Гц), 7,36-7,49 (3H, м), 4,09 (2H, с). ВЭЖХ-МС: m/z 291 [M+H]+.

{[4-(2-Хлорфенил)пиридин-2-карбонил]амино}уксусная кислота:1H ЯМР (250 МГц, MeOD) δ м.д. 8,63 (1H, д, J=4,9 Гц), 8,05-8,10 (1H, м), 7,55 (1H, дд, J=4,9, 1,6 Гц), 7,46 (1H, дт, J=3,9, 2,1 Гц), 7,35 (4H, д, J=2,7 Гц), 4,08 (2H, с). ВЭЖХ-МС: m/z 291 [M+H]+.
Другая подгруппа соединений формулы (I) имеет формулу

где не ограничивающие объем настоящего изобретения примеры R и R6 дополнительно описаны в настоящем документе ниже в таблице XII.
Соединения, описанные выше, могут быть получены способами, представленными на схемах XIV-XVI и описанными в примерах 12 -14 в настоящем документе ниже.

Реагенты и условия: (a) трет-бутиловый эфир глицина·HCl, EDCI, HOBt, DIPEA, ДМФ; комнатная температура, 48 часов.
Реагенты и условия: (b) H2: Pd/C, EtOH, комнатная температура, 22 часа.
ПРИМЕР 12
Трет-бутиловый эфир [(3,5-дигидроксипиридин-2-карбонил)амино]уксусной кислоты (27)
Получение трет-бутилового эфира [(3,5-бис-бензилоксипиридин-2-карбонил)амино]уксусной кислоты (26): к раствору 3,5-бис-бензилоксипиридин-2-карбоновой кислоты, 2, (2,36 г, 6,36 ммоль) в ДМФ (20 мл) при комнатной температуре в атмосфере N2 добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (1,83 г, 9,54 ммоль) и 1-гидроксибензотриазол (HOBt) (0,086 г, 0,64 ммоль). Смесь перемешивали в течение 15 минут, после чего добавляли гидрохлорид трет-бутилового эфира глицина (1,60 г, 9,54 ммоль) и диизопропилэтиламин (DIPEA) (3,32 мл, 19,08 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 48 часов, затем концентрировали при пониженном давлении. Полученное масло коричневого цвета очищали на силикагеле (EtOAc) с получением 3,04 г (99% выход) желаемого соединения в виде твердого вещества желтого цвета.1H ЯМР (250 МГц, CDCl3) δ м.д. 8,19 (1H, 1, J=5,2 Гц), 8,01-8,08 (2H, м), 7,27-7,54 (9H, м), 6,97 (1H, д, J=2,4 Гц), 5,24 (2H, с), 5,13 (2H, с), 4,17 (2H, д, J=5,2 Гц), 1,51 (9H, с). ВЭЖХ-МС: m/z 449 [M+H]+.
Получение трет-бутилового эфира [(3,5-дигидроксипиридин-2-карбонил)амино]уксусной кислоты (27): раствор трет-бутилового эфира [(3,5-бис-бензилоксипиридин-2-карбонил)амино]уксусной кислоты 26, (3,04 г, 6,79 ммоль) в EtOH (100 мл), содержащий 10% Pd/C (0,300 г), перемешивали в атмосфере H2 в течение 22 часов. Затем суспензию фильтровали через Celite™, концентрировали при пониженном давлении и сырой продукт очищали на силикагеле (2,5% MeOH/CH2Cl2) с получением 1,20 г (66% выход) желаемого соединения в виде бесцветного масла.1H ЯМР (250 МГц, CDCl3) δ м.д. 11,90 (1H, ушир. с), 8,94 (1H, ушир. с), 8,20 (1H, т, J=5,6 Гц), 7,76 (1H, д, J=2,4 Гц), 6,77 (1H, д, J=2,1 Гц), 4,13 (2H, д, J=5,5 Гц), 1,53 (9H, с). ВЭЖХ-МС: m/z 269 [M+H]+.

Реагенты и условия: (a) ТФУ, CH2Cl2; комнатная температура, 16 часов.
ПРИМЕР 13
[(3,5-Дигидроксипиридин-2-карбонил)амино]уксусная кислота (29)
Получение [(3,5-дигидроксипиридин-2-карбонил)амино]уксусной кислоты (29): к раствору трет-бутилового эфира [(3,5-дигидроксипиридин-2-карбонил)амино]уксусной кислоты, 28, (0,10 г, 0,37 ммоль) в CH2Cl2 (4 мл) при комнатной температуре добавляли трифторуксусную кислоту (1 мл). Реакционную смесь перемешивали в течение 16 часов при комнатной температуре и затем концентрировали при пониженном давлении. Оставшееся твердое вещество собирали фильтрованием, промывали Et2O с получением 0,070 г (89% выход) желаемого соединения в виде бесцветного твердого вещества.1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 10,86 (1H, ушир. с), 9,00 (1H, 1, J=6,1 Гц), 7,77 (1H, д, J=2,4 Гц), 6,69 (1H, д, J=2,4 Гц), 3,95 (1H, д, J=6,2 Гц). ВЭЖХ-МС: m/z 213 [M+H]+.

Реагенты и условия: (a) трет-бутиловый эфир глицина·HCl, EDCI, HOBt, DIPEA, ДМФ; комнатная температура, 3 дня.

Реагенты и условия: (b) ТФУ, CH2Cl2; комнатная температура, 5 часов.
ПРИМЕР 14
[(3-Гидроксипиридин-2-карбонил)амино]уксусная кислота (30)
Получение трет-бутилового эфира [(3-гидроксипиридин-2-карбонил)амино]уксусной кислоты (29): к раствору 3-гидроксипиколиновой кислоты (0,20 г, 1,44 ммоль) в ДМФ (5 мл) при 0°C в атмосфере N2 добавляли диизопропилэтиламин (DIPEA) (0,75 мл, 4,3 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,412 г, 2,9 ммоль) и 1-гидроксибензотриазол (HOBt) (0,019 г, 0,14 ммоль). Полученную смесь перемешивали в течение 5 минут и добавляли трет-бутиловый эфир глицина·HCl (0,36 г, 2,9 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 3 дней, затем концентрировали при пониженном давлении. Реакционную смесь разбавляли EtOAc, затем промывали 1M HCl, насыщенным NaCl и органический слой сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением сырого масла, которое очищали на силикагеле (EtOAc/гептан 1:4) с получением 0,078 г (22% выход) желаемого соединения в виде твердого вещества не совсем белого цвета.1H ЯМР (400 МГц, CDCl3) δ м.д. 11,80 (1H, с), 8,39 (1H, ушир. с), 8,02 (1H, дд, J=4,4, 1,5 Гц), 7,27 (1H, дд, J=8,8, 4,4 Гц), 7,25 (1H, дд, J=8,4, 1,5 Гц), 4,06 (2H, д, J=5,5 Гц), 1,44 (9H, с). ВЭЖХ-МС: m/z 197 [M-tBu]+.
Получение [(3-гидроксипиридин-2-карбонил)амино]уксусной кислоты (30): к раствору трет-бутилового эфира [(3-гидроксипиридин-2-карбонил)амино]уксусной кислоты, 29, (0,070 г, 0,277 ммоль) в CH2Cl2 (4 мл) добавляли ТФУ (1 мл). Полученный раствор перемешивали в течение 5 часов, затем концентрировали при пониженном давлении с получением 0,054 г (99% выход) желаемого соединения в виде бесцветного твердого вещества.1H ЯМР (400 МГц, MeOD) δ м.д. 8,09 (1H, д, J=3,3 Гц), 7,36-7,59 (2H, м), 4,08 (2H, с). ВЭЖХ-МС: m/z 197 [M+H]+.
Категория VII по настоящему изобретению относится к соединениям, имеющим формулу

где не ограничивающие объем настоящего изобретения примеры R и R6 дополнительно описаны в настоящем документе ниже в таблице XIII.
Соединения, которые входят в категорию VII по настоящему изобретению, могут быть получены способами, представленными на схемах XVII и XVIII и описанными в примерах 15 и 16 в настоящем документе ниже.

Реагенты и условия: (a) (4-ClC6H4)B(OH)2, Pd(dppf)Cl2, K3PO4, 1,4-диоксан, MeOH; 80°C, 3 часа.

Реагенты и условия: (b) LiOH, ТГФ, H2O; нагревание с обратным холодильником,

Реагенты и условия: (c) GlyOEt·HCl, EDCI, HOBt, DIPEA, ДМФ, CH2Cl2; комнатная температура,
ПРИМЕР 15
Метиловый эфир 3-метокси-4'-метил-бифенил-4-карбоновой кислоты (30)
Получение метилового эфира 4'-хлор-3-метокси-бифенил-4-карбоновой кислоты (28): к дегазированному раствору метил 4-бром-2-метоксибензоата (0,70 г, 2,86 ммоль) в 1,4-диоксане (10 мл) и MeOH (2,5 мл) добавляли 4-фторфенилбороновую кислоту (0,536 г, 3,43 ммоль), Pd(dppf)Cl2 (0,233 г, 0,286 ммоль) и K3PO4 (0,728 г, 3,43 ммоль). Полученную суспензию нагревали до 80°C и перемешивали в течение 3 часов. Потом реакционную смесь охлаждали до комнатной температуры и фильтровали через Celite™. Полученные твердые вещества объединяли и промывали дополнительным количеством MeOH, затем фильтрат концентрировали при пониженном давлении. Сырое вещество очищали на силикагеле (гексан:EtOAc; 6:1-4:1) с получением 0,615 г (78% выход) желаемого соединения в виде кристаллического вещества оранжевого цвета.1H ЯМР (400 МГц, CDCl3) δ м.д. 7,89 (1H, д, J=8,0 Гц), 7,52-7,56 (2H, м), 7,44 (2H, д, J=8,7 Гц), 7,17 (1H, д, J=8,0 Гц), 7,12 (1H, д, J=1,6 Гц), 3,99 (3H, с), 3,92 (3H, с). ВЭЖХ-МС: m/z 277 [M+H]+.

Реагенты и условия: (a) LiOH, ТГФ, H2O; нагревание с обратным холодильником, 2 часа.
ПРИМЕР 16
4'-Хлор-3-метокси-бифенил-4-карбоновая кислота
Получение 4'-хлор-3-метокси-бифенил-4-карбоновой кислоты (31): к раствору метилового эфира 4'-хлор-3-метокси-бифенил-4-карбоновой кислоты, 30, (0,615 г, 2,22 ммоль) в ТГФ (20 мл) и H2O (5 мл) добавляли LiOH (0,932 г, 22,2 ммоль). Полученную суспензию нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Сырой продукт подкисляли, используя концентрированную HCl, и полученное твердое вещество собирали фильтрованием, промывали H2O с получением 0,532 г (91% выход) желаемого соединения в виде твердого вещества серого цвета.1H ЯМР (400 МГц, CDCl3) δ м.д. 10,69 (1H, ушир. с), 8,26 (1H, д, J=8,1 Гц), 7,53-7,58 (2H, м), 7,44-7,50 (2H, м), 7,33 (1H, дд, J=8,1, 1,6 Гц), 7,20 (1H, д, J=1,3 Гц), 4,17 (3H, с). ВЭЖХ-МС: m/z 263 [M+H]+.
Следующими являются не ограничивающие объем настоящего изобретения примеры дополнительных соединений формулы (I)

Метиловый эфир 3-метокси-4'-метилбифенил-4-карбоновой кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 7,89 (1H, д, J=7,9 Гц), 7,52 (2H, д, J=8,2 Гц), 7,25-7,32 (2H, м), 7,15-7,24 (2H, м), 3,99 (3H, с), 3,92 (3H, с), 2,42 (3H, с). ВЭЖХ-МС: m/z 257 [M+H]+.
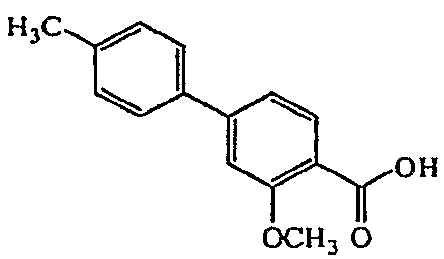
3-Метокси-4'-метилбифенил-4-карбоновая кислота:1H ЯМР (400 МГц, CDCl3) δ м.д. 10,74 (1H, ушир. с), 8,24 (1H, д, J=8,1 Гц), 7,52 (2H, д, J=8,1 Гц), 7,36 (1H, дд, J=8,1, 1,5 Гц), 7,30 (2H, д, J=7,9 Гц), 7,23 (1H, д, J=1,4 Гц), 4,16 (3H, с), 2,43 (3H, с). ВЭЖХ-МС: m/z 243 [M+H]+.
Дополнительные соединения формулы (I), имеющие формулу
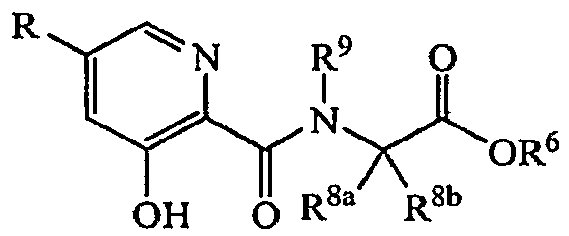
где не ограничивающие объем настоящего изобретения примеры R8a, R8b, R9 и R6 также описаны в настоящем документе в таблице ниже.
Соединения, описанные выше, могут быть получены способами, представленными в настоящем документе ниже на схемах XIX и XX и описанными в примерах 17 и 18 в настоящем документе ниже.
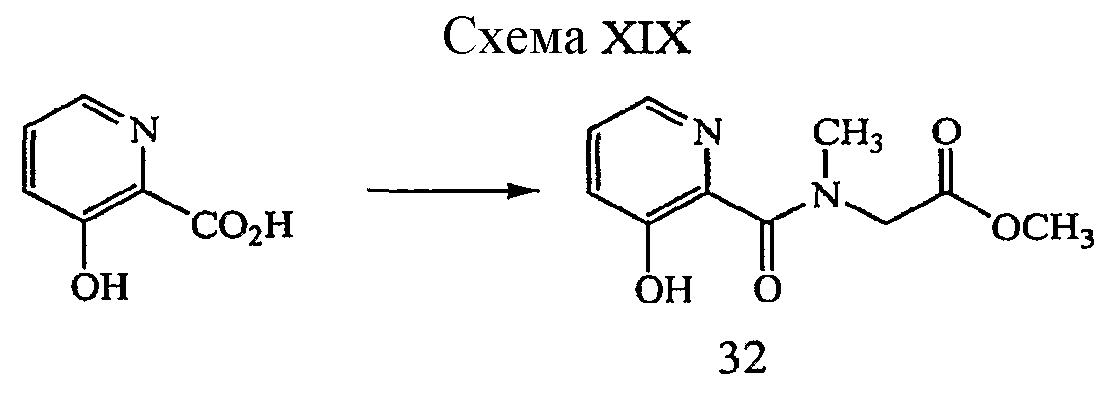
Реагенты и условия: (a) эфир 2-(N-метиламино)уксусной кислоты·HCl, EDCI, HOBt, DIPEA, ДМФ; комнатная температура, 32 часа.
ПРИМЕР 17
Этиловый эфир [(3-гидроксипиридин-2-карбонил)метиламино]уксусной кислоты (32)
Получение этилового эфира [(3-гидроксипиридин-2-карбонил)метиламино]уксусной кислоты (31): к раствору 3-гидроксипиколиновой кислоты (0,40 г, 2,88 ммоль) в ДМФ (5 мл) добавляли диизопропилэтиламин (DIPEA) (1,50 мл, 8,63 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,825 г, 4,31 ммоль) и 1-гидроксибензотриазол (HOBt) (0,039 г, 0,29 ммоль). Реакционную смесь перемешивали в течение 5 минут, затем добавляли гидрохлорид эфира метиламиноуксусной кислоты (0,663 г, 4,31 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 32 часов, после чего растворитель удаляли при пониженном давлении. Остаток распределяли между EtOAc и 1M HCl и органический слой отделяли, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Сырое вещество очищали на силикагеле (EtOAc:гексан 1:1) с получением 0,10 г (15% выход) желаемого соединения в виде бесцветного твердого вещества. ВЭЖХ-МС: m/z 240 [M+H]+.
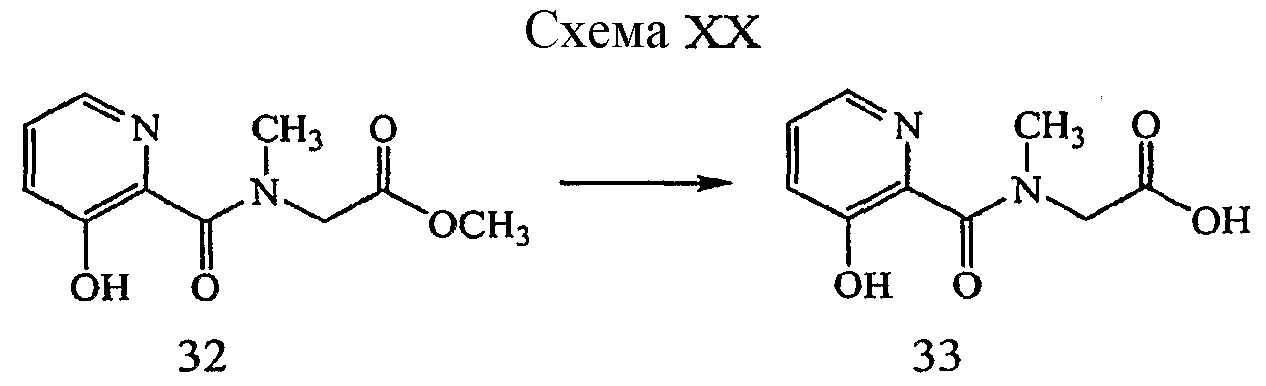
Реагенты и условия: (a) NaOH, ТГФ, H2O; нагревание с обратным холодильником, 3 часа.
ПРИМЕР 18
[(3-Гидроксипиридин-2-карбонил)метиламино]уксусная кислота (33)
Получение [(3-гидроксипиридин-2-карбонил)метиламино]уксусной кислоты (33): к раствору этилового эфира [(3-гидроксипиридин-2-карбонил)метиламино]уксусной кислоты, 32, (0,10 г, 0,42 ммоль) в ТГФ (4 мл) добавляли H2O (1 мл) и NaOH (0,90 г, 2,25 ммоль). Реакционную смесь перемешивали в течение 3 часов, затем концентрировали при пониженном давлении. Оставшееся масло подкисляли до pH ~1 с помощью 1M HCl и раствор концентрировали при пониженном давлении с получением не совсем белого твердого вещества. Твердое вещество суспендировали в смеси CHCl3:изопропанол (1:1), затем собирали фильтрованием. Твердое вещество промывали дополнительным количеством смеси CHCl3:изопропанол (1:1), затем помещали в сосуд и растирали в Et2O с получением 0,075 г (85% выход) желаемого соединения в виде твердого вещества светло-желтого цвета.1H ЯМР (250 МГц, MeOD) δ м.д. (ротамеры) 8,26 (1H, ушир. с), 7,63-7,74 (1H, м), 7,56-7,63 (1H, м), 4,38 (1H, с), 4,32 (1H, с), 3,20 (1,5H, с), 3,12 (1,5H, с). ВЭЖХ-МС: m/z 211 [M+H]+.
Далее представлены не ограничивающие объем настоящего изобретения примеры описанных выше соединений.

Метиловый эфир 2-(S)-[(3-гидроксипиридин-2-карбонил)амино]пропионовой кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. 11,86 (1H, с), 8,47 (1H, ушир. с), 8,10 (1H, дд, J=4,1, 1,7 Гц), 7,28-7,43 (2H, м), 4,63-4,84 (1H, м), 3,81 (3H, с), 1,57 (3H, д, J=7,3 Гц). ВЭЖХ-МС: m/z 225 [M+H]+.
Метиловый эфир 1-(3-гидроксипиридин-2-карбонил)пирролидин-2-карбоновой кислоты:1H ЯМР (250 МГц, CDCl3) δ м.д. (ротамеры) 12,86 (0,67H, ушир. с), 12,44 (0,33H, ушир. с), 8,14 (0,33H, т, J=2,9 Гц), 7,98 (0,67H, дд, J=3,7, 2,1 Гц), 7,24-7,31 (2H, м), 5,38 (0,67H, дд, J=8,5, 3,4 Гц), 4,63-4,75 (0,33H, м), 4,37 (0,67H, т, J=6,7 Гц), 3,80-4,01 (1,33H, м), 3,79 (1H, с), 3,70 (2H, с), 1,87-2,44 (4H, м). ВЭЖХ-МС: m/z 251 [M+H]+.
2S-[(3-Гидроксипиридин-2-карбонил)амино]пропионовая кислота:1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 12,87 (1H, ушир. с), 12,28 (1H, с), 9,19 (1H, д, J=7,5 Гц), 8,19 (1H, дд, J=4,3, 1,4 Гц), 7,50-7,65 (1H, м), 7,37-7,49 (1H, м), 3,95-4,95 (1H, м), 1,45 (3H, д, J=7 Гц). ВЭЖХ-МС: m/z 211 [M+H]+.
Введение одного или нескольких соединений формулы (I), самостоятельно, в форме фармацевтических композиций, необязательно в сочетании с другими фармацевтически активными соединениями или композициями, может быть эффективно в лечении следующих заболеваний или состояний:
i) в качестве ингибиторов пролилгидроксилазы белка HIF-1α человека; и таким образом обеспечивая средство кровотока, доставки кислорода и утилизации энергии в ишемизированных тканях;
ii) соединения по настоящему изобретению являются эффективными в регулировании кровотока, доставке кислорода и утилизации энергии в ишемизированных тканях и
iii) соединения по настоящему изобретению обеспечивают стабильное количество HIF-1α, блокируя деградацию, опосредованную HIF пролилгидроксилазой.
Для каждого из заболеваний или состояний, которое разработчик рецептур желает лечить, для достижения терапевтического эффекта могут потребоваться различные уровни или количества соединений, описанных в настоящем документе. Разработчик рецептур может определить это количество любым способом тестирования, известным изобретателю или рядовому специалисту в данной области.
Соединения по настоящему изобретению могут представлять собой ингибиторы HIF-1α пролилгидроксилазы при введении в фармацевтически эффективных количествах и таким образом обеспечивать повышенный ангиогенный ответ или клеточные ответы, которые активируются факторами транскрипции, которые непосредственно или косвенно находятся под влиянием повышения концентрации HIF-1α в клетке. Не ограничивающие объем настоящего изобретения примеры этих заболеваний или болезненных состояний перечислены в настоящем документе ниже, в частности заболевание периферических сосудов (PVD), заболевание коронарной артерии (CAD), сердечная недостаточность, ишемия и анемия. Соединения, описанные в настоящем документе, эффективны, в частности, в лечении анемии.
Стимуляция выработки EPO: анемия
HIF-I представляет собой фактор транскрипции, который также регулирует индуцируемый гипоксией ген EPO. HIF-1 связывание необходимо для активации транскрипции EPO в ответ на гипоксию (Semenza, G. L.," Regulation of erythropoietin production: New insights into molecular mechanisms of oxygen homeostasis", Hematol. Oncol Clin. North Am., Vol. 8, pp. 863-884 (1994)). В частности, HIF-1α связывается с 3' гипоксия-реагирующим элементом гена EPO, что приводит к заметному усилению транскрипции EPO (Semenza, G. L., et al. "Transcriptional regulation of genes encoding glycolytic enzymes by hypoxia-inducible factor 1", J. Biol. Chem. Vol. 269, pp. 23757-63 (1994)). EPO, в свою очередь, является существенным для поддержания эритроцитов, контролируя пролиферацию и дифференциацию эритроидных клеток-предшественников в эритроцитах (Krantz, S. B., "Erythropoietin", Blood, Vol. 77, pp 419-434 (1991)). Во время эмбрионального развития печень служит первичным источником EPO. Незадолго до рождения выработка EPO в печени уменьшается и почки становятся первичным источником EPO. Однако во взрослом организме другие органы, такие как печень и мозг, производят небольшое, но существенное количество EPO. Дефицит эритропоэтина связан с анемией. У человека самая распространенная форма анемии связана с почечной недостаточностью. EPO был описан при лечении анемии, связанной с проведением химиотерапии, возникающей вследствие заболевания СПИДом и из-за недоношенности и аутогемотрансфузии. EPO был даже предложен как средство общего использования в дооперационной элективной хирургии.
Ангиогенез
Ангиогенез, образование новых кровеносных сосудов из ранее существовавшей сосудистой системы, играет ключевую роль широкого ряда физиологических и патологических процессов (Nguyen, L. L. et al., Int. Rev. Cytol, 204, 1-48, (2001). Ангиогенез является сложным процессом, опосредованным коммуникацией между эндотелиальными клетками, которые восстанавливают кровеносные сосуды, и окружающей их средой. На ранних стадиях ангиогенеза ткань или опухолевые клетки вырабатывают и секретируют про-ангиогенные факторы роста в ответ на внешнее раздражение, например гипоксию. Эти факторы распространяются на соседние эндотелиальные клети и стимулируют рецепторы, что приводит к выработке и секреции протеаз, разрушающих окружающий клетки внеклеточный матрикс. Активированные эндотелиальные клетки начинают мигрировать и пролиферировать в окружающую ткань к источнику этих факторов роста (Bussolino, F., Trends Biochem. Sci, 22, 251-256, (1997)). Затем эндотелиальные клетки прекращают пролиферировать и дифференцируются в трубчатые структуры, которые является первой стадией в формировании устойчивых, зрелых кровеносных сосудов. Затем периэндотелиальные клетки, такие как перициты и гладкие мышечные клетки, укрепляют недавно образованный сосуд в следующей стадии развития сосудов.
Ангиогенез контролируется балансом естественных про- и анти-ангиогенных факторов. Сосудистый фактор эндотелиального роста, фактор роста фибробластов и ангиопоэтический представляют некоторые из многих потенциальных про-ангиогенных факторов роста. Эти лиганды связываются со своими соответствующими рецепторами тирозинкиназы на поверхности эндотелиальных клеток и преобразуют сигналы, которые способствуют клеточной миграции и пролиферации. Несмотря на то что большинство регулирующих факторов было идентифицировано, молекулярные механизмы этого процесса полностью все еще не поняты. Существует множество болезненных состояний, вызываемых персистирующим неконтролируемым или ненадлежащим образом контролируемым ангиогенезом. При таких болезненных состояниях неконтролируемый или ненадлежащим образом контролируемый ангиогенез может или вызвать конкретное заболевание, или ухудшить существующее патологическое состояние. Например, глазная неоваскуляризация является самой распространенной причиной слепоты и лежит в основе патологии приблизительно 20 глазных болезней. В некоторых ранее имеющих место быть состояниях, таких как артрит, недавно сформированные капиллярные кровеносные сосуды внедряются в суставы и разрушают хрящи. При диабете новые капилляры, сформированные в сетчатке глаза, внедряются в стекловидное тело, вызывая кровотечение и слепоту. И рост и метастазирование твердых опухолей также являются ангиогенез-зависимыми (Folkman et al., “Tumor Angiogenesis”, Chapter 10, 206-32, in The Molecular Basis of Cancer Mendelsohn et al., eds., W. B. Saunders, (1995)). Было показано, что опухоли, которые увеличиваются до размера больше чем 2 мм в диаметре, должны получать свое собственное кровоснабжение путем стимулирования роста новых капиллярных кровеносных сосудов. После того как эти новые кровеносные сосуды внедряются в опухоль, они обеспечивают питательные вещества и факторы роста, необходимые для роста опухоли, а также средства для клеток опухоли для попадания в кровоток и метастазирования к отдаленным участкам, таким как печень, легкие или кости (Weidner, New Eng. J. Med, 324, 1, 1-8 (1991). При использовании в качестве лекарственных препаратов в имеющих опухоль животных естественные ингибиторы ангиогенеза могут предотвратить рост небольших опухолей (O'Reilly el al., Cell, 79, 315-28 (1994). В некоторых протоколах отмечено, что применение таких ингибиторов приводит к регрессу опухоли и неактивному состоянию даже после прекращения лечения (O'Reilly el al., Cell, 88, 277-85 (1997)). Кроме того, применение ингибиторов ангиогенеза к определенным опухолям может усилить их реакцию на другие лечебные режимы (Teischer et al., Int. J. Cancer, 57, 920-25 (1994)).
Заболевание периферических сосудов
Термин “заболевание периферических сосудов (PVD)” используют для описания клинического синдрома сосудистой недостаточности за пределами коронарного кровообращения, обычно, включая кровообращение в нижних конечностях. В США живет приблизительно 8-12 миллионов пациентов с заболеванием периферических сосудов; еще не диагностированных 16,5 миллионов. Атеросклероз является, безусловно, основной причиной заболевания периферических сосудов (PVD), хотя ряд дискретных болезненных процессов может способствовать ее развитию и прогрессии (то есть диабет, иммунная невосприимчивость и травма). Атеросклеротическое PVD может быть представлено тремя способами:
1) бессимптомное PVD, диагностированное на основе неинвазивного метода обследования (обычно физикальное обследование);
2) перемежающаяся хромота с болевыми признаками в мышцах нижних конечностей при ходьбе и
3) критическая ишемия с болевыми признаками в мышцах нижних конечностей в состоянии покоя и ишемическими изменениями с угрозой ампутации конечностей (обычно не поддающиеся лечению или инфицированные кожные изъязвления).
Возрастная частота PVD у населения США (средний возраст 66 лет) составляет приблизительно 12%. В числе пациентов с перемежающейся хромотой 20-30% будут иметь прогрессирующие признаки, а 10% потребуется ампутация конечностей при критической ишемии. Хотя пациенты с симптоматическим PVD страдают существенным снижением подвижности, мышечной массы, костной плотности и качества жизни, в настоящее время отсутствуют эффективные способы лечения. Настоящее изобретение относится к соединениям, которые при введении in vivo ингибируют HIF-1α пролилгидроксилазу, что приводит к повышенной экспрессии HIF-контролируемых генов, в частности ангиогенные факторы, эритропоэтин и гликолитические ферменты, тем самым приводя к улучшению кровотока, кислородной доставке и использования энергии в ишемизированных тканях. Хотя множество болезненных состояний вызывается персистирующим неконтролируемым или ненадлежащим образом контролируемым ангиогенезом, некоторые болезненные состояния могут быть излечены путем усиленного ангиогенеза. Рост и восстановление ткани - это биологические процессы, в которых происходят клеточная пролиферация и ангиогенез. Таким образом, важным аспектом заживления ран является реваскуляризация поврежденной ткани путем ангиогенеза.
Раны
Хронические язвы, незаживающие раны являются основной причиной продолжительной заболеваемости у людей старшего возраста. Это, в частности, имеет место быть у прикованных к постели или страдающих диабетом пациентов, у которых выявлены серьезные незаживающие язвы кожи. Во многих из этих случаев задержка заживления - это результат неудовлетворительного кровоснабжения или результат непрерывного давления или сосудистой блокады. Плохое капиллярное кровообращение вследствие небольшого атеросклероза артерии или венозного застоя способствует задержке заживления поврежденной ткани. Такие ткани часто инфицированы микроорганизмами, которые распространяются без сопротивления со стороны собственных защитных систем организма, которому необходима хорошо васкуляризированная ткань, для эффективного устранения патогенных организмов. В результате большая часть терапевтического вмешательства сосредотачивается на восстановлении кровотока к ишемизированным тканям, обеспечивая таким образом доступ питательных веществ и иммунологических факторов к участку раны.
Атеросклеротические изменения
Атеросклеротические повреждения в больших сосудах могут вызвать ишемию ткани, которая может быть вылечена, модулируя рост кровеносных сосудов в пораженной ткани. Например, атеросклеротические повреждения в коронарных артериях могут вызвать ангину и инфаркт миокарда, который может быть предотвращен, если можно было бы восстановить кровоток, стимулируя рост коллатериальных артерий. Аналогично, атеросклеротические повреждения больших артерий, которые снабжают нижние конечности, могут вызвать ишемию скелетных мышц, что ограничивает подвижность и в некоторых случаях требует ампутации, которая также может быть предотвращена путем улучшения кровотока ангиогенной терапией.
Диабет/Гипертония
Заболевания, такие как диабет и гипертония, характеризуются снижением количества и плотности небольших кровеносных сосудов, таких как артериолы и капилляры. Эти небольшие кровеносные сосуды являются важными для доставки кислорода и питательных веществ. Снижение количества и плотности этих сосудов способствует неблагоприятным последствиям гипертонии и диабета, включая хромоту, ишемическую язву, злокачественную гипертонию и почечную недостаточность. Эти обычные расстройства и множество других менее распространенных заболеваний, таких как болезнь Бюргера, могли бы быть вылечены путем повышения количества и плотности небольших кровеносных сосудов, используя ангиогенную терапию.
Настоящее изобретение также относится к формам соединений по настоящему изобретению, которые в нормальных физиологических состояниях человека или высшего млекопитающего высвобождают соединения, описанные в настоящем документе. Одна из сторон этого аспекта включает фармацевтически приемлемые соли аналогов, описанные в настоящем документе. Разработчик рецептур, с целью совместимости со способом доставки, наполнителями и тому подобное, может заменить одну форму соли из аналогов по настоящему изобретению на другую, так как соединения сами по себе являются активными видами, которые ослабляют развития заболеваний, описанных в настоящем документе.
Композиции
Также настоящее изобретение относится к композициям или препаратам, которые содержат ингибиторы пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением. Обычно, композиции по настоящему изобретению содержат:
a) эффективное количество одного или нескольких ингибиторов пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением, которые эффективны для лечения PVD CAD, сердечной недостаточности, ишемии и анемии и
b) один или несколько наполнителей.
Для целей по настоящему изобретению термины "наполнитель" и "носитель" используют взаимозаменяемо по всему объему описания настоящего изобретения, и указанные термины определены в настоящем документе как "ингредиенты, которые используют в практике для получения безопасной и эффективной фармацевтической композиции".
Разработчик рецептур поймет, что наполнители используют прежде всего для доставки безопасного, стабильного и функционального фармацевтического препарата, используемого не только как часть носителя для доставки, но также как средство для достижения эффективного поглощения получателем активного ингредиента. Наполнитель может выполнять столь же простую и непосредственную роль, как инертный наполнитель, или наполнитель, используемый в настоящем документе, может быть частью стабилизирующей pH - системы или покрытия для обеспечения безопасной доставки ингредиентов в желудок. Также разработчик рецептур может воспользоваться преимуществом обстоятельства, что соединения по настоящему изобретению имеют улучшенную клеточную активность, фармакокинетические свойства, а также улучшенную преоральную биодоступность.
Не ограничивающие объем настоящего изобретения примеры композиций в соответствии с настоящим изобретением включают:
a) от около 0,001 мг до около 1000 мг одного или нескольких ингибиторов пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением и
b) один или несколько наполнителей.
Другой пример в соответствии с настоящим изобретением относится к следующим композициям:
a) от около 0,01 мг до около 100 мг одного или нескольких ингибиторов пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением и
b) один или несколько наполнителей.
Дальнейший пример в соответствии с настоящим изобретением относится к следующим композициям:
a) от около 0,1 мг до около 10 мг одного или нескольких ингибиторов пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением и
b) один или несколько наполнителей.
Используемый в настоящем документе термин "эффективное количество" обозначает "количество одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, эффективное в дозах и в течение промежутков времени, необходимых для достижения желаемого или терапевтического эффекта". Эффективное количество может изменяться в зависимости от факторов, известных в данной области, таких как болезненное состояние, возраст, пол и вес человека или животного, подвергаемого лечению. Хотя конкретные режимы дозирования могут быть описаны в примерах в настоящем документе, специалисту в данной области понятно, что для обеспечения оптимального терапевтического ответа режим дозирования может быть изменен. Например, некоторые раздельные дозы могут вводиться ежедневно, или доза может быть пропорционально уменьшена в соответствии с требованиями терапевтической ситуации. Кроме того, композиции по настоящему изобретению могут вводиться так часто, как необходимо для достижения терапевтического количества.
Настоящее изобретение также относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения анемии.
Кроме того, настоящее изобретение относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения ангиогенез.
Настоящее изобретение также относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения заболевания периферических сосудов.
Кроме того, настоящее изобретение относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения ранений.
Также настоящее изобретение относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения атеросклеротических изменений.
Настоящее изобретение также относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения диабета.
Настоящее изобретение также относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения гипертонии.
Кроме того, настоящее изобретение относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения заболевания, связанного с уровнем VEGF, GAPDH и эритропоэтина.
Настоящее изобретение также относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения расстройства, такого как болезнь Крона и язвенный колит, псориаз, саркоидоз, ревматоидный артрит, гемангиома, Рандю-Вебера-Ослера или наследственная геморрагическая телангиэктазия, твердая или передаваемые через кровь опухоли и синдром приобретенного иммунодефицита.
Кроме того, настоящее изобретение относится к использованию одного или нескольких ингибиторов HIF-1α пролилгидроксилазы, описанных в настоящем документе, для получения лекарственного препарата для лечения расстройства, такого как диабетическая ретинопатия, дегенерация желтого пятна, рак, серповидноклеточная анемия, саркоид, сифилис, эластическая псевдоксантома, болезнь Педжета, окклюзия вен, окклюзия артерий, закупорка сонной артерии, хронический увеит/витрит, микобактериальные инфекции, болезнь Лайма, системная красная волчанка, ретролентальная фиброплазия, болезнь Ильза, болезнь Бехчета, инфекции, вызывающие ренит или хориоидит, предполагаемый гистоплазмоз глаз, врожденная дегенерация желтого пятна, миопия, врожденные ямки диска зрительного нерва, дегенерация желтого пятна Штаргардта, периферический увеит, хроническое отслоение сетчатки, синдром повышенной вязкости крови, токсоплазмоз, посттравматические осложнения и осложнения после лечения лазером, заболевания, связанные с покраснением радужки, и пролиферативная витреоретинопатия.
Способ применения
Усиливая транскрипцию этих HIF-1 целевых генов, HIF-1α ингибиторы пролилгидроксилазы по настоящему изобретению обеспечивают способ повышения васкуляризации ткани у человека. Используемый в настоящем документе термин "васкуляризация ткани" обозначает про-ангиогенный ответ, посредством чего кровеносные сосуды, или другие сосуды, или капилляры развиваются в или около пораженной ткани. Пораженная ткань не должна быть гипоксичной или ишемизированной per se, но иногда ингибиторы пролилгидроксилазы HIF-1α помогают переносить или дополнительно стимулировать про-ангиогенный ответ организма на гипоксию. Неограничивающий пример "васкуляризации" включает капиллярную пролиферацию в незаживающей ране или вдоль границы ишемизированной ткани. Таким образом, эти соединения усиливают способность организма к реваскуляризации поврежденных тканей или расширяют сосудистую систему (например, для профилактики гипоксического поражения). Не ограничивающие объем настоящего изобретения примеры "ткани" включают: сердечную ткань, такую как миокард и желудочки сердца; скелетные мышцы; нервную ткань, такую как ткань мозжечка; внутренние органы, такие как желудок, кишечник, поджелудочная железа, печень, селезенка и легкое; и периферические отростки, такие как пальцы рук и ног.
Стимулируемый увеличением клеточной концентрации HIF-1α - выработка фактора роста эндотелия сосудов (VEGF), который известен своей способностью вызывать сосудистую утечку. Парциальное давление кислорода, как было показано, было основным регулятором экспрессии гена VEGF как in vitro, так и in vivo. В процессе индукции VEGF продемонстрировано, что VEGF вызывает формирование функциональных нео-сосудов в роговой оболочке глаза мыши и усиленный кровоток в модели собаки с заболеванием коронарной артерии.
Ингибиторы HIF-1α пролилгидроксилазы по настоящему изобретению обеспечивают усиление экспрессии множественных гипоксия-индуцируемых генов, включая VEGF, GAPDH и эритропоэтин (EPO). Кроме того, ингибиторы HIF-1α пролилгидроксилазы по настоящему изобретению обеспечивают повышение концентрации HIF-1α в цитоплазме и ядре.
Трансгенная мышь с экспрессией в кожном слое конститутивно активного HIF-1α демонстрировала повышенную васкуляризацию дермального слоя и 13-кратное увеличение уровней VEGF.
Также настоящее изобретение относится к способу контролирования пролилгидроксилазы белка HIF-1α человека. Настоящий способ включает стадию введения человеку или высшему млекопитающему эффективного количества композиции, содержащей один или несколько ингибиторов пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением. Также настоящее изобретение относится к использованию ингибиторов пролилгидроксилазы HIF-1α белка человека в соответствии с настоящим изобретением в получении лекарственного препарата для лечения предсердной аритмии и связанных расстройств.
Также настоящее изобретение относится к ингибированию пролилгидроксилазы индуцируемого гипоксией фактора HIF-1α в ремоделировании и функционировании миокарда, таким образом обеспечивая средство для стимулирования ангиогенеза у пациента, страдающего ишемией.
Настоящее изобретение относится к способу лечения анемии, включающему введение человеку или млекопитающему, нуждающемуся в лечении, эффективного количества одного или нескольких ингибиторов пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением.
Настоящее изобретение относится к способу контролирования анемии, включающему введение человеку или млекопитающему, нуждающемуся в лечении, эффективного количества одного или нескольких ингибиторов пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением.
Настоящее изобретение относится к способу профилактики анемии, включающему введение человеку или млекопитающему, нуждающемуся в лечении, эффективного количества одного или нескольких ингибиторов пролилгидроксилазы белка HIF-1α человека в соответствии с настоящим изобретением.
Проведение анализов
Анализ активности EGLN-1
Ферментную активность EGLN-1 (или EGLN-3) определяли, используя масс-спектрометрию (ионизация лазерной десорбцией с использованием матрицы, время прохождения MS, MALDI-TOF MS - подробное описание исследования дано в ссылке (Greis et al., 2006). Рекомбинантный EGLN-1-179/426 человека получали описанным выше способом и в разделе «Дополнительные данные». Рекомбинантный полноразмерный EGLN-3 человека получали аналогичным образом, хотя это необходимо для использования His-MBP-TVMV-EGLN-3 слияния для исследования вследствие нестабильности расщепленного белка. Для обоих ферментов HIF-1α пептид, соответствующий остаткам 556-574 (DLDLEALAPYIPADDDFQL), использовали в качестве субстрата. Взаимодействие проводили в общем объеме, равном 50 мкл, содержащем Tris Cl (5 мМ, pH 7,5), аскорбат (120 мкМоль), 2-оксоглутарат (3,2 мкМоль), HIF-1α (8,6 мкМоль) и альбумин бычьей сыворотки (0,01%). Для начала реакции добавляли фермент в количестве, заранее определенном для гидроксилата 20% субстрата в течение 20 минут. При использовании ингибиторы соединения получали в диметилсульфоксиде при 10-кратной конечной анализируемой концентрации. Через 20 минут при комнатной температуре реакцию останавливали переносом 10 мкл реакционной смеси в 50 мкл матричный раствор для масс-спектрометрии (α-циано-4-гидроксикоричная кислота, 5 мг/мл в 50% ацетонитрил/0,1% ТФУ, 5 мм NH4PO4). Два мкл смеси наносили на MALDI-TOF MS мишеневый планшет для анализа с помощью Applied Biosystems (Foster City, CA) 4700 Proteomics Analyzer MALDI-TOF MS, оборудованный Nd: лазер YAG (355 нм, 3 нс длительность импульса, 200 Гц частота импульсов). Гидроксилированный пептидный продукт идентифицировали из субстрата с увеличением 16 Да. Данные, определенные как выраженное в процентах преобразование субстрата в продукт, анализировали на GraphPad Prism 4 для подсчета IC50 величин.
Анализ VEGF ELISA
HEK293 клетки высевали в 96-луночных покрытых полилизином планшетах при 20000 клеток на лунку в DMEM (10% FBS, 1% NEAA, 0,1% глутамин). После инкубации в течение ночи для удаления сыворотки клетки промывали 100 мкл Opti-MEM (Gibco, Carlsbad, CA). Соединение в ДМСО последовательно разбавляли (начиная со 100 мкмоль) в Opti-MEM и добавляли к клеткам. В обработанной среде определяли уровни VEGF с помощью набора для иммунологического анализа “Quantikine human VEGF” (R&D Systems, Minneapolis, MN). Измерения оптической плотности регистрировали при 450 нм, используя прибор Spectra Max 250 (Molecular Devices, Sunnyvale, CA). Данные, определенные как % от DFO стимулирования, использовали для подсчета величин EC50 с помощью программного обеспечения GraphPad Prism 4 (San Diego, CA).
Исследование ишемизированной задней конечности мыши
Все операции с животными проводили в соответствии с Guide for the Care and Use of Laboratory Animals (National Academy of Sciences; Copyright ©1996) и the Institutional Animal Care и Use Committee guidelines at Procter and Gamble Pharmaceuticals. Наблюдали взрослого, 9-10 недель, самца мыши C57B1/6 из Charles River Laboratory (Portage, MI). Дозу мыши вводили перорально с носителем (водный карбонатный буфер, 50 мм; pH 9,0) или соединение 1 в носителе при 50 мг/кг или 100 мг/кг. Дозы препарата вводили животным три раза: день 1 - в 8 часов до полудня и 5 после полудня, день 2 - в 8 часов до полудня. Через час после приема первой дозы осуществляли одностороннее артериальное лигирование под анестезией, используя изофлуран. Бедренную артерию лигировали непосредственно у начала подколенной артерии. Контралатеральную конечность подвергали хирургической операции. Лигирование выполняли чередующимся способом между правой и левой задними конечностями. Через два часа после приема дозы в 8 часов утра на 2 день забирали образец крови с помощью вентрикулярного стержня, мышь находилась под анестезией изофлураном. Образцы сыворотки для анализа EPO забирали, используя пробирки для разделения сыворотки и клеток крови. Брали сердце, печень и икроножную мышцы, мгновенно замораживали в жидком азоте и хранили в -80°C перед использованием.
EPO анализ сыворотки мыши
Содержание EPO в сыворотке мыши определяли с помощью набора Mouse Quantikine EPO ELISA от фирмы R&D Systems в соответствии с инструкциями производителя.
Mouse tissue HIF Western блот-анализ
Ткани мыши, хранящиеся при -80°C, измельчали с помощью ступки и пестика, охлажденных в жидком азоте. Получали ядерные экстракты, используя набор NE-PER (Pierce Biotechnology). Для иммунопреципитации ядерный экстракт добавляли к моноклональному антителу против HIF-1α (Novus, Littleton, CO) в пропорции ткань:антитело, равной 200:1. Суспензию инкубировали в конической микроцентрифужной пробирке в течение 4 часов при 4°C. Затем в сосуд добавляли белок A/G-слитый с агарозными бусами (40 мкл 50% суспензии). После перемешивания в течение ночи при 4°C бусы промывали 3 раза охлажденным на льду физиологическим раствором с фосфатным буфером. Затем бусы готовили к SDS-PAGE в 40 мкл буфере Laemmli для образца. Белки, отделенные на SDS-PAGE, переносили на листы из нитроцеллюлозы с XCell-II Blot Module system (Invitrogen, Carlsbad, CA). Блоты блокировали 5% BSA перед инкубацией с кроличьим антителом против HIF-1α при разведении 1:100 (Novus). Затем блоты промывали смесью трис-буферный физиологический раствор/буфер Tween 20 и инкубировали с пероксидазой хрена, конъюгированной с антикроличьими вторичными антителами (Pierce, Rockford, IL). Блоты проявляли реагентом ECL (Amersham, Piscataway, NJ). Изображения блотов регистрировали с помощью сканера Epson Expression 1600.
В таблице XV ниже приведены не ограничивающие объем настоящего изобретения примеры in vivo ответа на соединения по настоящему изобретению.
Описанные в настоящем документе параметры и величины не подразумевают строгого ограничения указанных точных количественных величин. Кроме того, если не определено иначе, каждый такой параметр предполагает значение как указанной величины, так и функционально эквивалентного диапазона, окружающего эту величину. Например, параметр, указанный как "40 мм", предполагает значение "около 40 мм".
Все документы, приведенные в разделе Подробное описание изобретения, в релевантной части, включены в настоящем документе в качестве ссылки; ссылка на любой документ не должна рассматриваться как допущение того, что этот документ является известным уровнем техники в отношении настоящего изобретения. В том случае, когда любое значение или определение термина в настоящем документе противоречит любому значению или определению этого же самого термина в документе, включенном в качестве ссылки, значение или определение термина в настоящем документе будет определяющим.
После иллюстрации и описания конкретных вариантов осуществления по настоящему изобретению специалисту в данной области будет очевидно, что могут быть выполнены различные другие изменения и модификации без отхода от сущности и объема изобретения. Таким образом предусматривается, что прилагаемая формула изобретения охватывает все такие изменения и модификации, которые включены в объем настоящего изобретения.
Реферат
Настоящее изобретение относится к соединению, имеющему формулугде R и R, каждый, представляет собой, независимо, звено, выбранное из: i) водорода; ii) замещенного или незамещенного фенила и iii) замещенного или незамещенного 5- или 6-членного гетероарила, в котором гетероатомы выбраны из азота, кислорода, серы и их комбинаций; указанные заместители выбраны из: i) C-Cлинейного, С-Сразветвленного или С-Сциклического алкила; ii) C-Cлинейного, С-Сразветвленного или С-Сциклического алкокси; iii) C-Cлинейного, С-Сразветвленного или С-Сциклического галогеналкила; iv) галогена; v) -CN; vi) -NHC(O)Rvii) -C(O)NRR; viii) 5- или 6-членного гетероарила, в котором гетероатомы выбраны из азота, кислорода, серы и их комбинаций; или ix) два заместителя могут быть взяты вместе с образованием конденсированного кольца, содержащего от 5 до 7 атомов; Rпредставляет собой C-Cлинейный, С-Сразветвленный или С-Сциклический алкил; Rи R, каждый, представляют собой, независимо: 1) водород; ii) C-Cлинейный, С-Сразветвленный или С-Сциклический алкил; или iii) Rи Rмогут быть взяты вместе с образованием кольца, содержащего от 3 до 7 атомов; Rвыбран из: i) -OR; или ii) -HRR; Rпредставляет собой водород или C-Cлинейный, С-Сразветвленный или С-Сциклический алкил; Rи R, каждый, представляют собой, независимо: i) водород; ii) C-Cлинейный, С-Сразветвленный или С-Сциклический алкил; или iii) Rи Rмогут быть взяты вместе с образованием кольца, содержащего от 3 до 7 кольцевых атомов; Rпредставляет собой водород, метил или этил; L представляет собой связывающее звено, имеющее формулу -[C(RR)]- Rи R, каждый, представляют собой, независимо, водород, метил или этил; индекс n равен от 1 до 3; Rпредставляет собой водород или метил; или его фармацевт�
Формула

где R и R1 каждый представляет собой независимо звено, выбранное из:
i) водорода;
ii) замещенного или незамещенного фенила и iii) замещенного или незамещенного 5- или 6-членного гетероарила, в котором гетероатомы выбраны из азота, кислорода, серы и их комбинаций;
указанные заместители выбраны из:
i) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического алкила;
ii) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического алкокси;
iii) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического галогеналкила;
iv) галогена;
v) -CN;
vi) -NHC(O)R4
vii) -C(O)NR5aR5b;
viii) 5- или 6-членного гетероарила, в котором гетероатомы выбраны из азота, кислорода, серы и их комбинаций; или
ix) два заместителя могут быть взяты вместе с образованием конденсированного кольца, содержащего от 5 до 7 атомов;
R4 представляет собой C1-C4 линейный, С3-С4 разветвленный или С3-С4циклический алкил;
R5a и R5b, каждый, представляют собой независимо:
1) водород;
ii) C1-C4 линейный, С3-С4 разветвленный или С3-С4 циклический алкил; или
iii) R5a и R5b могут быть взяты вместе с образованием кольца, содержащего от 3 до 7 атомов;
R2 выбран из:
i) -OR6; или
ii) -NR7aR7b;
R6 представляет собой водород или C1-C4 линейный, С3-С4 разветвленный или С3-С4 циклический алкил;
R7a и R7b, каждый, представляют собой независимо:
i) водород;
ii) C1-C4 линейный, С3-С4 разветвленный или С3-С4 циклический алкил; или
iii) R7a и R7b могут быть взяты вместе с образованием кольца, содержащего от 3 до 7 кольцевых атомов;
R3 представляет собой водород, метил или этил;
L представляет собой связывающее звено, имеющее формулу
-[C(R8aR8b)]n-,
R8a и R8b, каждый, представляют собой независимо водород, метил или этил;
индекс n равен от 1 до 3;
R9 представляет собой водород или метил;
или его фармацевтически приемлемая соль;
при условии, что R и R1 оба не являются водородами.
а) 2-фторфенила, 3-фторфенила, 4-фторфенила, 2-хлорфенила, 3-хлорфенила, 4-хлорфенила, 2-метоксифенила, 3-метоксифенила, 4-метоксифенила, 2-этоксифенила, 3-этоксифенила, 4-этоксифенила, 2-изопропоксифенила, 3-изопропоксифенила, 4-изопропоксифенила, 2-цианофенила, 3-цианофенила и 4-цианофенила, 2-метоксифенила, 3-метоксифенила, 4-метоксифенила, 2-этоксифенила, 3-этоксифенила, 4-этоксифенила, 2-изопропоксифенила, 3-изопропоксифенила, 4-изопропоксифенила, 2-цианофенила, 3-цианофенила и 4-цианофенила;
b) R представляет собой звено, имеющее формулу

где R10 представляет собой:
i) -C(O)NR5aR5b; R5a и R5b, каждый, представляют собой водород, или R5a и R5b взяты вместе с образованием кольца, содержащего 5 или 6 атомов, ii) где R5a и R5b взяты вместе с образованием пирролидин-1-ильного кольца,
iii) -NHC(O)R4; R4 представляет собой звено, выбранное из метила, этила, н-пропила, изо-пропила и циклопропила; и iv) звено, выбранное из 1,2,3,4-тетразол-5-ила, [1,2,4]триазол-5-ила, имида-зол-2-ила, фуран-2-ила, фуран-3-ила, тиофен-2-ила, тиофен-3-ила, пиридин-2-ила, пиридин-3-ила, пиридин-4-ила, пиримидин-2-ила, пиримидин-4-ила, пиримидин-5-ила, изохинолин-1-ила, изохинолин-3-ила, изохинолин-4-ила, тиазол-2-ила, тиазол-4-ила, 1,2,3,4-тетразол-5-ила, [1,2,4] триазол-5-ила, имидазол-2-ила, фуран-2-ила, фуран-3-ила, тиофен-2-ила и тиофен-3-ила.

где R представляет собой замещенный или незамещенный фенил;
указанные заместители выбраны из:
i) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического алкила;
ii) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического алкокси;
iii) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического галогеналкила;
iv) галогена;
v) -CN;
vi) -NHC(O)R4;
vii) -C(O)NR5aR5b;
viii) 5- или 6-членного гетероарила, в котором гетероатомы выбраны из азота, кислорода, серы и их комбинаций; или ix) два заместителя могут быть взяты вместе с образованием конденсированного кольца, имеющего от 5 до 7 атомов;
R4 представляет собой C1-C4 линейный, С3-С4 разветвленный или С3-С4циклический алкил;
R5a и R5b, каждый, представляют собой независимо:
i)водород;
ii) C1-C4 линейный, С3-С4 разветвленный или С3-С4 циклический алкил или
iii) R5a и R5b могут быть взяты вместе с образованием кольца, содержащего от 3 до 7 атомов.

где R представляет собой замещенный или незамещенный фенил;
указанные заместители выбраны из:
i) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического алкила;
ii) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического алкокси;
iii) C1-C4 линейного, С3-С4 разветвленного или С3-С4 циклического галогеналкила;
iv) галогена;
v) -CN;
vi) -NHC(O)R4;
vii) -C(O)NR5aR5b;
viii) 5- или 6-членного гетероарила, в котором гетероатомы выбраны из азота, кислорода, серы и их комбинаций; или ix) два заместителя могут быть взяты вместе с образованием конденсированного кольца, содержащего от 5 до 7 атомов;
R4 представляет собой C1-C4 линейный, С3-С4 разветвленный или С3-С4циклический алкил;
R5a и R5b, каждый, представляют собой независимо:
i)водород;
ii) C1-C4 линейный, С3-С4 разветвленный или С3-С4 циклический алкил; или
iii) R5a и R5b могут быть взяты вместе с образованием кольца, содержащего от 3 до 7 атомов.
метилового эфира {[5-(3-хлор-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[5-(4-хлор-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[5-(2-хлор-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[5-(4-фтор-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира [(3-гидрокси-5-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты;
метилового эфира {[3-гидрокси-5-(4-изопропил-фенил)пиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[5-(4-этил-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[3-гидрокси-5-(3-трифторметилфенил)пиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[5-(4-циано-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[5-(3-циано-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[5-(3-карбамоил-фенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира ({3-гидрокси-5-[3-(пирролидин-1-карбонил)фенил] пиридин-2-карбонил}амино)уксусной кислоты;
метилового эфира ({5-[3-(пиклопропанкарбониламино)фенил]-3-гидроксипиридин-2-карбонил}амино)уксусной кислоты;
метилового эфира ({3-гидрокси-5-[3-(2Н-тетразол-5-ил)фенил]пиридин-2-карбонил} амино)уксусной кислоты;
метилового эфира [(5-гидрокси-[3,3']бипиридинил-6-карбонил)амино]уксусной кислоты;
метилового эфира [(5'-гидрокси-[2,3']бипиридинил-6'-карбонил)амино]уксусной кислоты;
метилового эфира [(3-гидрокси-5-пиримидин-5-илпиридин-2-карбонил)амино]уксусной кислоты;
метилового эфира [(3-гидрокси-5-изохинолин-4-илпиридин-2-карбонил)амино]уксусной кислоты;
метилового эфир, [(3-гидрокси-5-тиазол-2-илпиридин-2-карбонил)амино]уксусной кислоты;
{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
{[5-(4-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
{[5-(2-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
{[5-(4-фторфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
[(3-гидрокси-5-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты;
{[5-(4-этилфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
{[3-гидрокси-5-(4-изопропилфенил)пиридин-2-карбонил]амино}уксусной кислоты;
{[3-гидрокси-5-(3-трифторметилфенил)пиридин-2-карбонил]амино}уксусной кислоты;
{[5-(4-цианофенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
{[5-(3-цианофенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
{[5-(5-хлор-2-метилфенил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
{[3-гидрокси-5-(4-изопропоксифенил)пиридин-2-карбонил]амино}уксусной кислоты;
({5-[3-(циклопропанкарбониламино)фенил]-3-гидроксипиридин-2-карбонил}амино)уксусной кислоты;
({3-гидрокси-5-[3-(пирролидин-1-карбонил)фенил]пиридин-2-карбонил)амино)уксусной кислоты;
({3-гидрокси-5-[3-(2Н-тетразол-5-ил)фенил]пиридин-2-карбонил}амино)уксусной кислоты;
[(5'-гидрокси-[2,3']бипиридинил-6'-карбонил)амино]уксусной кислоты;
[(5-гидрокси-[3,3']бипиридинил-6-карбонил)амино]уксусной кислоты;
[(3-гидрокси-5-пиримидин-5-илпиридин-2-карбонил)амино]уксусной кислоты;
[(3-гидрокси-5-изохинолин-4-илпиридин-2-карбонил)амино]уксусной кислоты;
[(3-гидрокси-5-тиазол-2-илпиридин-2-карбонил)амино]уксусной кислоты;
{[5-(2,3-дигидро-бензо[1,4]диоксин-6-ил)-3-гидроксипиридин-2-карбонил]амино}уксусной кислоты;
диметилкарбамоилметиламида 5-(3-хлорфенил)-3-гидроксипиридин-2-карбоновой кислоты;
карбамоилметиламида 5-(3-хлорфенил)-3-гидроксипиридин-2-карбоновой кислоты;
карбамоилметиламида 5-(3-хлор-фенил)-3-гидроксипиридин-2-карбоновой кислоты;
(изопропилкарбамоилметил)амида 5-(3-хлорфенил)-3-гидроксипиридин-2-карбоновой кислоты;
метилкарбамоилметиламида 3-гидрокси-5-(4-метилфенил)пиридин-2-карбоновой кислоты;
метилкарбамоилметиламида 5-(3-хлор-фенил)-3-гидроксипиридин-2-карбоновой кислоты;
метилового эфира 2-{[5-(3-хлор-фенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовой кислоты;
2-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовой кислоты;
этилового эфира 3-[(3-гидрокси-5-(4-метилфенил)пиридин-2-карбонил)амино]пропионовой кислоты;
этилового эфира 3-[(3-гидрокси-5-(3-хлорфенил)пиридин-2-карбонил)амино]пропионовой кислоты;
3-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}пропионовой кислоты;
3-[(3-гидрокси-5-(4-метилфенил)пиридин-2-карбонил)амино]пропионовой кислоты;
2-{[5-(3-хлорфенил)-3-гидроксипиридин-2-карбонил]амино}-2-метилпропионовой кислоты;
(1-метил-1-метилкарбамоил-этил)амида 5-(3-хлорфенил)-3-гидроксипиридин-2-карбоновой кислоты;
метилового эфира [(4-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты;
метилового эфира {[4-(4-цианофенил)пиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[4-(4-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[4-(3-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты;
метилового эфира {[4-(2-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты;
[(4-(4-метилфенил)пиридин-2-карбонил)амино]уксусной кислоты;
{[4-(4-цианофенил)пиридин-2-карбонил]амино}уксусной кислоты;
{[4-(4-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты;
{[4-(3-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты;
и
{[4-(2-хлорфенил)пиридин-2-карбонил]амино}уксусной кислоты.
A) одно или несколько соединений по пп.1-11; и
B) один или несколько эксципиентов или носителей;
для лечения анемии или способствования заживления ран.
Документы, цитированные в отчёте о поиске
Замещенные бензамиды, способ их получения, промежуточные соединения, композиция и способ борьбы с заболеванием выпревания растений

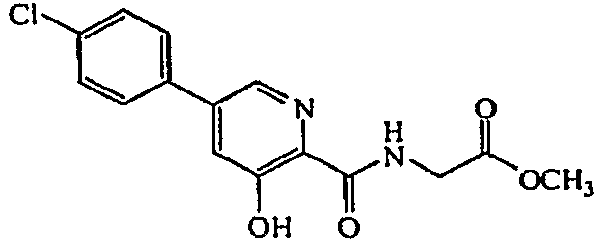

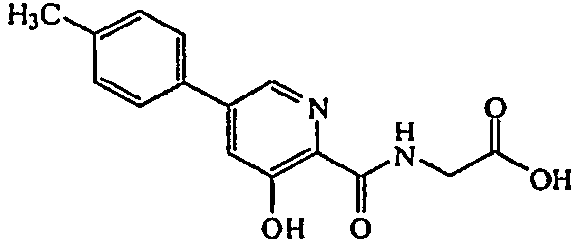
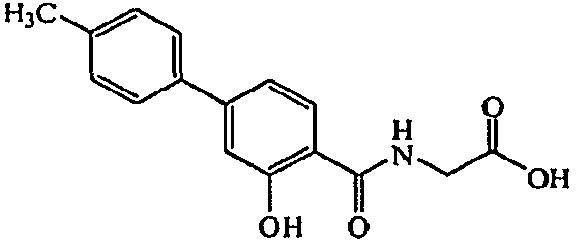
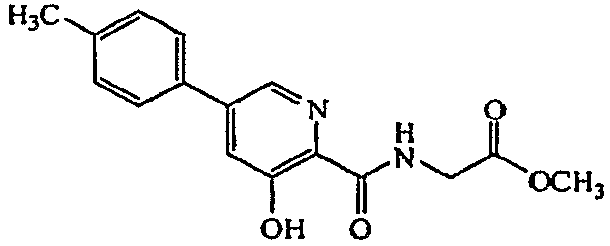


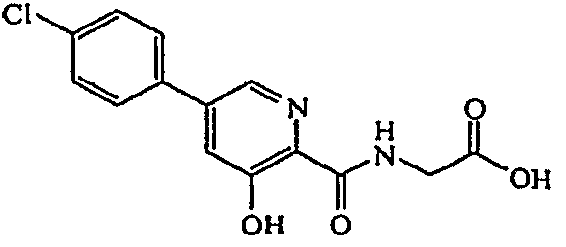








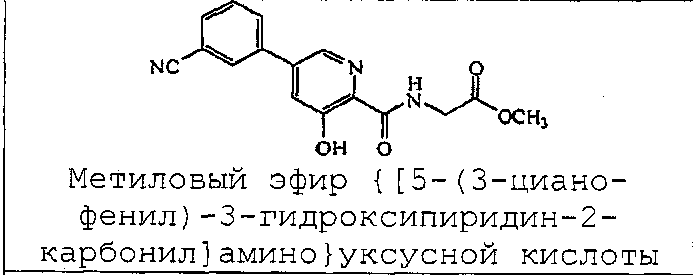





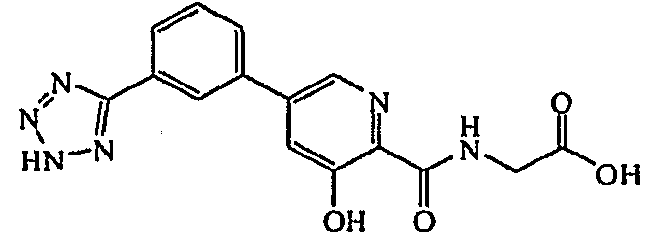


Комментарии