Четвертичные аммониевые соли на основе производных витамина в6 - RU2607522C1
Код документа: RU2607522C1
Описание
Изобретение относится к химии органических гетероциклических соединений, а именно к новым четвертичным аммониевым солям, содержащим фрагмент производных витамина В6 общей формулы (I), проявляющим антибактериальные свойства. Соединения могут найти применение в медицине и ветеринарии.
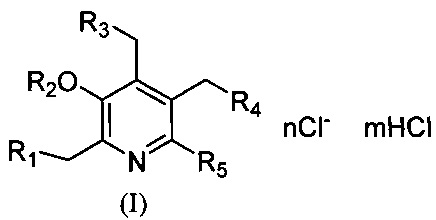
при R1=R4=N+(CH3)2C8H17, R2+R3=-С(СН3)2O-, R5=Н, n=2, m=0;
при R1=R4=N+(CH3)2C12H25, R2+R3=-С(СН3)2O-, R5=Н, n=2, m=0;
при R1=R4=N+(СН3)2С18Н37, R2+R3=-C(CH3)2O-, R5=H, n=2, m=0;
при R1=R4=N+(СН3)2С8Н17, R2=R5=H, R3=OH, n=2, m=1;
при R1=R4=N+(СН3)2C12H25, R2=R5=H, R3=OH, n=2, m=1;
при R1=R4=N+(СН3)2С18Н37, R2=R5=H, R3=OH, n=2, m=1;
при R1=R5=H, R2+R3=-CH(C2H5)O-, R4=N+(СН3)2С18Н37, n=1, m=0;
при R1=R5=H, R2+R3=-CH(C3H7)O-, R4=N+(CH3)2C18H37, n=1, m=0;
при R1=R5=H, R2+R3=-CH(C4H9)O-, R4=N+(СН3)2С18Н37, n=1, m=0;
при R1=R5=H, R2+R3=-CH(C(CH3)3)O-, R4=N+(CH3)2C18H37, n=1, m=0;
при R1=R5=H, R2+R3=-CH(C8H17)O-, R4=N+(CH3)2C18H37, n=1, m=0;
при R1=R5=H, R2+R3=-CH(CH2CH(CH3)C9H19)O-, R4=N+(CH3)2C18H37, n=1, m=0;
при R1=R5=H, R2+R3=-CH2O-, R4=N+(СН3)2C18H37 n=1, m=0;
при R1=R5=H, R2+R3=-С(цикло-С4Н8)О-, R4=N+г(СН3)2C18H37, n=1, m=0;
при R1=R5=H, R2+R3=-CH(C3H7)O-, R4=N+(CH3)2C8H17, n=1, m=0;
при R1=R5=H, R2+R3=-CH(C3H7)O-, R4=N+(CH3)2C12H25, n=1, m=0;
при R1=R5=H, R2+R3=-CH2O-, R4=N+(CH3)2C8H17, n=1, m=0;
при R1=R5=H, R2+R3=-CH2O-, R4=N+(CH3)2C12H25, n=1, m=0;
при R1=R5=H, R2+R3=-C(CH3)2O-, R4=N+(СН3)2С12Н25, n=1, m=0;
при R1=R2=R5=H, R3=OH, R4=N+(СН3)2С12Н25, n=1, m=1;
при R1=R3=R5=H, R2=C(O)CH3, R4=N+(CH3)2C8H17, n=1, m=0;
при R1=R3=R5=H, R2=C(O)CH3, R4=N+(CH3)2C12H25, n=1, m=0;
при R1=R3=R5=H, R2=C(O)CH3, R4=N+(CH3)2C18H37, n=1, m=0;
при R1=R2=R3=R5=H, R4=N+(CH3)2C8H17, n=1, m=1;
при R1=R2=R3=R5=H, R4=N+(CH3)2C12H25, n=1, m=1;
при R1=R2=R3=R5=H, R4=N+(CH3)2Cl8H37, n=1, m=1;
при R1=N+(CH3)2C8H17, R2+R3=-С(СН3)2О-, R4+R5=-OC(CH3)2OCH2-, n=1, m=0;
при R1=N+(CH3)2C18H37, R2+R3=-C(CH3)2O-, R4+R5=-OC(CH3)2OCH2-, n=1, m=0;
при R1=N+(CH3)2C8H17, R2+R3=-C(CH3)2O-, R4=OH, R5=CH2OH, n=1, m=1;
при R1=N+(CH3)2C18H37, R2=H, R3=R4=OH, R5=CH2OH, n=1, m=1.
Поиск и направленный синтез высокоэффективных и безопасных противомикробных средств является одной из важнейших задач современного здравоохранения. В последние годы в России и в мире наблюдается заметный рост числа и распространенности локальных и системных инфекционных заболеваний, вызываемых полирезистентными микроорганизмами, которые зачастую не поддаются лечению существующими антибиотиками и антисептическими средствами. Все это обуславливает необходимость создания принципиально новых эффективных и селективных антибактериальных средств для терапии внутри- и внебольничных инфекций.
Четвертичные аммониевые соединения (ЧАС) являются одним из важнейших классов антисептических средств и имеют широкую область применения, в частности, в терапии местных гнойно-воспалительных процессов, в дезинфекции неповрежденной кожи перед операциями, консервировании глазных капель, инъекционных растворов, зубных паст, косметических средств, дезинфекции и очистке поверхностей. Современные ЧАС характеризуются широким спектром антимикробной активности по отношению к грамположительным и грамотрицательным микроорганизмам, а также грибам. Механизм антибактериального действия ЧАС заключается в их адсорбции и проникновении через клеточную стенку бактерий с последующим взаимодействием с фосфолипидами цитоплазматической мембраны, что приводит к полной структурной дезорганизации и последующей гибели бактериальной клетки.
Недостатками используемых ЧАС являются неэффективность в отношении спор и простых вирусов, а также недостаточная активность по отношению к грамотрицательным бактериям и микобактериям.
Среди лекарственных препаратов, содержащих фрагменты четвертичных аммониевых солей следует выделить:
Мирамистин ((бензилдиметил[3-(миристоиламино)пропил]-аммонийхлорид моногидрат) - разработанный в СССР антисептик, обладающий широким спектром бактерицидного действия в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp. и др.), аэробных и анаэробных бактерий, патогенных грибов и вирусов, включая клинические штаммы с полирезистентностью к антибиотикам. Применяется в профилактике нагноений и лечении гнойных ран, лечении и профилактике кандидозов кожи и слизистых оболочек, комплексном лечении острых и хронических отитов, лечении и профилактике инфекционно-воспалительных заболеваний полости рта (стоматитов, гингивитов, пародонтитов, периодонтитов), индивидуальной профилактике заболеваний, передаваемых половым путем (сифилиса, гонореи, хламидиоза, генитального герпеса и др.).
Флуомизин (хлорид деквалиния) - антисептик широкого спектра действия, активен в отношении большинства грамположительных бактерий Streptococcus spp, Staphylococcus aureus, Listeria spp.; анаэробов Peptostreptococcus (группы D), грибов рода Candida (Candida tropicalis, Candida aMXicans, Candida glabrata), грамотрицательных бактерий Gardnerella vaginalis, Escherichia coli, Serratia spp., Klebsiella spp., Pseudomonas spp., Proteus spp., и простейших (Trichomonas vaginalis). Используется при бактериальном вагинозе, кандидозе кожи, ногтевых валиков, слизистой оболочки полости рта, воспалительных процессах в полости рта и глотки (тонзиллит, стоматит, в т.ч. афтозный, глоссит, фарингит).
Бензалкония хлорид (алкилдиметил(фенилметил)аммония хлорид) - антисептическое средство активное в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp. и др.) и анаэробных бактерий, грибов и плесеней. Применяется при первичной и первично-отсроченной обработке ран, профилактике вторичного инфицирования ран госпитальными штаммами микроорганизмов, бактериальном вагинозе, дренировании костных полостей после операции при остеомиелите.
Следует отметить, что описанные выше лекарственные препараты, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному техническому решению вследствие того, что они не совпадают с заявляемыми соединениями по химической структуре, хотя и обладают антибактериальной активностью (совпадают по назначению) сопоставимой с заявленным техническим решением в большей или меньшей степени.
Наиболее близким аналогом, выбранным заявителем в качестве прототипа, являются производные пиридоксина на основе четвертичных аммониевых солей формулы II, содержащие в своем составе как фрагмент природного соединения (витамина В6), так и четвертичный аммониевый фрагмент. [Антибактериальные средства на основе четвертичных аммониевых солей / Ю.Г. Штырлин, С.В Сапожников, А.Г. Иксанова, Е.В. Никитина, Н.В. Штырлин, А.Р. Каюмов / Патент РФ. №2561281 опубл. 27.08.2015]. Несмотря на выраженную антибактериальную активность, эти соединения обладают весьма существенными для лекарственных средств побочными эффектами, в частности, достаточно высокой токсичностью.

Задачей изобретения являются новые соединения, обладающие одновременно высокой антибактериальной активностью и низкой токсичностью, расширяющие арсенал известных средств указанного назначения.
Заявленное техническое решение иллюстрируется схемами 1-8 (схемы синтеза соединений), а также Таблицами 1 и 2, на которых представлены результаты по исследованию антибактериальной активности и цитотоксичности в сравнении с ранее полученными соединениями II, а так же с известными как таковыми из уровня техники антибактериальными препаратами.
Техническим результатом заявленного изобретения является получение новых соединений общей формулы (I), содержащих в своем составе как фрагмент природного соединения (витамина В6), так и четвертичный аммониевый фрагмент, обладающие низкой цитотоксичностью с сохранением антибактериальных свойств.
Задача решается, и указанный технический результат достигается получением заявляемых новых производных витамина В6 общей формулы (I):

согласно нижеприведенным схемам 1-8, где заявляемые соединения обозначены номерами I-1 - I-30.

Схема 1. (a) NaHCO3, (CH3)2NR, ДМФА, 70°С, 8 ч.; (b) H2O/С2Н5ОН, HCl, 60°С, 24 ч.

Схема 2. (a) RC(O)H, TsOH*H2O, С6Н6, кипячение, 8 ч.; (b) SOCl2, CHCl3, 3 ч., (с) NaHCO3, (CH3)2NC18H37, С2Н5ОН, 60°С, 8 ч

Схема 3. (а) циклопентанон, TsOH*H2O, С6Н6, кипячение, 8 ч.; (b) SOCl2, CHCl3, 3 ч., (с) NaHCO3, (CH3)2NC18H37, С2Н5ОН, 60°С, 8 ч

Схема 4. (a) NaHCO3, (CH3)2NR, С2Н5ОН, 60°С, 8 ч

Схема 5. (a) NaHCO3, (CH3)2NR, С2Н5ОН, 60°С, 8 ч

Схема 6. (a) NaHCO3, (CH3)2NC12H25, С2Н5ОН, 60°С, 8 ч.; (b) H2O, HCl, 60°С, 24 ч.

Схема 7. (а) СН3С(O)Cl, N(C2H5)3, CH2Cl2, (b) (CH3)2NR, ДМФА, 50°С, 20 ч; (c) H2O/С2Н5ОН, HCl, 60°С, 24 ч.

Схема 8. (a) (CH3)2NR, ДМФА, 50°С, 20 ч; (b) H2O/С2Н5ОН, HCl, 60°С, 1 ч. MW, (с) H2O/С2Н5ОН, HCl, 60°С, 24 ч.
Характеристики новых соединений приведены далее в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами1Н и13С ЯМР-спектроскопии и масс-спектрометрии. Спектры ЯМР регистрировали на приборе Bruker AVANCE-400. Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1Н и13С). Температуры плавления определялись с помощью прибора Stanford Research Systems MP А-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates.
HRMS-эксперимент был проведен с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 еВ.
Примеры конкретного выполнения заявленного технического решения
Пример 1
5,8-Бис(метилен(N,N-диметил-N-октиламмоний))-2,2-диметил-4Н-[1,3]диоксино[4,5-c]пиридин дихлорид (I-1).
К раствору 0.21 г (0.7 ммоль) соединения 1 [Iwata М., Kuzuhara H., Functionalized dithia(2,5)nupidinophanes as vitamin B6 analogues. Synthesis, properties, and catalytic activity for racemization reaction. // Bull. Chem. Soc. Jpn. - 1985. - V. 58, N. 9. - P. 2502-2514] в 20 мл этанола прибавляют порционно раствор 0.06 г (0.7 ммоль) гидрокарбоната натрия в 20 мл воды. Полученный раствор отгоняют в вакууме. Сухой остаток заливают 30 мл хлороформа и отфильтровывают нерастворимую часть. Растворитель отгоняют в вакууме и растворяют остаток в ДМФА. К раствору добавляют 0.29 мл (1.4 ммоль) N,N-диметилоктиламина. Реакционную смесь перемешивают 8 ч при 70°С. Растворитель отгоняют в вакууме. Полученный остаток перекристализовывают из смеси ацетон/хлороформ (5:1). Выход 0.35 г (86%); белое кристаллическое вещество; т.пл. 131°С (разл). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.81-0.85 м (6Н, 2CH3C7H14), 1.23-1.32 м (20Н, 10СН2), 1.56 с (3Н, СН3), 1.57 с (3Н, СН3), 1.77 уш.с (4Н, 2СН2), 3.32 с (6Н, 2CH3N+), 3.37 с (6Н, 2CH3N+), 3.59 уш.с (2Н, CH2N+), 3.78 уш.с (2Н, CH2N+), 4.68 с (2Н, CH2O), 5.20 с (4Н, CH2N+), 8.59 с (1Н, СНпир). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.13 с (СН3), 22.66 с (СН2), 23.12 с (СН2), 25.52 с (СН2), 26.44 с (СН2), 29.15 с (СН2), 29.40 с (СН2), 31.76 с (СН2), 49.53 с (CH3N+), 51.17 с (CH3N+), 59.63 с (CH2O), 62.23 с (CH2N+), 62.38 с (CH2N+), 65.28 с (CH2N+), 65.91 с (CH2N+), 102.08 с (С(СН3)2), 122.69 с (Спир), 132.15 с (Спир), 137.71 с (Спир), 146.32 с (Спир), 149.27 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 252.7297 C31H59Cl2N3O2. Вычислено [M-2Cl]2+ 252.7298.
Пример 2
5,8-Бис(метилен(N,N-диметил-N-додециламмоний))-2,2-диметил-4Н-[1,3]диоксино[4,5-с]пиридин дихлорид (I-2).
Синтезируют и разрабатывают аналогично соединению I-1 из 0.21 г (0.7 ммоль) соединения 1 и 0.38 мл (1.4 ммоль) N,N-диметилдодециламина. Выход 0.23 г (48%); белое кристаллическое вещество; т.пл. 144°С (разд.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.85 т (6Н,3JHH=6.8 Гц, СН3С11Н14), 1.22-1.33 м (36Н, 18СН2), 1.58 с (6Н, СН3), 1.78 уш.с (4Н, 2СН2), 3.32 с (6Н, 3CH3N+), 3.37 с (6Н, СН3), 3.57-3.60 м (2Н, CH2N+), 3.74-3.78 с (2Н, CH2N+), 4.68 с (2Н, CH2O), 5.17 с (2Н, CH2N+), 5.20 с (2Н CH2N+), 8.56 с (1H, СНпир). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.21 с (СН3), 22.77 с (СН2), 23.15 с (СН2), 25.53 с (СН2), 26.47 с (СН2), 29.42 с (СН2), 29.50 с (СН2), 29.54 с (СН2), 29.63 с (СН2), 29.70 с (СН2), 31.99 с (СН2), 49.59 с (CH3N+), 51.11 с (CH3N+), 59.59 с (CH2O), 62.29 с (CH2N+), 62.42 с (CH2N+), 65.38 с (CH2N+), 66.04 с (CH2N+), 102.12 с (С(СН3)2), 122.72 с (Спир), 132.18 с (Спир), 137.67 с (Спир), 146.28 с (Спир), 149.33 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 308.7924 C39H75Cl2N3O2Cl2. Вычислено [М-2Cl]2+ 308.7924
Пример 3
5,8-Бис(метилен(N,N-диметил-N-октадециламмоний))-2,2-диметил-4Н-[1,3]диоксино[4,5-c]пиридин дихлорид (I-3).
Синтезируют и разрабатывают аналогично соединению I-1 из 0.21 г (0.7 ммоль) соединения 1 и 0.52 мл (1.4 ммоль) N,N-диметилоктадециламина. Выход 0.23 г (48%); белое кристаллическое вещество; т.пл. 161-163°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.85 т (6Н,3JHH=6.8 Гц, СН3С17Н34), 1.23-1.33 м (60Н, 30СН2), 1.58 с (6Н, СН3), 1.78 уш.с (4Н, 2СН2), 3.31 с (6Н, 3CH3N+), 3.37 с (6Н, СН3), 3.57-3.60 м (2Н, CH2N+), 3.74-3.78 с (2Н, CH2N+), 4.68 с (2Н, CH2O), 5.17 с (2Н, CH2N+), 5.20 с (2Н, CH2N+), 8.55 с (1H, СНпир). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.22 с (СН3), 22.78 с (СН2), 23.15 с (СН2), 25.54 с (СН2), 26.48 с (СН2), 29.46 с (СН2), 29.51 с (СН2), 29.56 с (СН2), 29.66 с (СН2), 29.81 с (СН2), 32.02 с (СН2), 49.58 с (CH3N+), 51.09 с (CH3N+), 59.58 с (CH2O), 62.31 с (CH2N+), 62.42 с (CH2N+), 65.40 с (CH2N+), 66.03 с (CH2N+), 102.11 с (С(СН3)2), 122.70 с (Спир), 132.15 с (Спир), 137.67 с (Спир), 146.29 с (Спир), 149.32 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 392.8863 C51H99N3O2Cl2. Вычислено [М-2Cl]2+ 392.8863
Пример 4
2,5-Бис((диметил(октил)аммонио)метил)-3-гидрокси-4-(гидроксиметил)пиридиний трихлорид (I-4)
К раствору 0.10 г (0.2 ммоль) соединения I-1 в 30 мл воды добавляют 1 мл конц. HCl, после чего реакционную смесь перемешивают в течение 24 часов при температуре 60°С. Затем растворитель отгоняют в вакууме. Выход 0.10 г (количественный); белое кристаллическое вещество; т.пл. 104-105°С (разл.). Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.87 м (6Н,3JHH=6.8 Гц, 2СН3С7Н14), 1.27-1.29 м (20Н, 10СН2), 1.80 уш.с (4Н, 2СН2), 3.02 с (6Н, 2CH3N+), 3.10 с (6Н, 2CH3N+), 3.41-3.45 м (2Н, CH2N+), 3.55-3.59 м (2Н, CH2N+), 4.71 с (2Н, CH2O), 4.82 с (4Н, CH2N+), 8.33 с (1Н, СНпир), 10.52 (1H, ОН). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м.д.: 14.00 с (СН3), 21.93 с (СН2), 22.09 с (СН2), 25.88 с (СН2), 28.52 с (СН2), 31.21 с (СН2), 48.95 с (CH3N+), 50.14 с (CH3N+), 55.55 с (CH2O), 60.54 с (CH2N+), 61.44 с (CH2N+), 63.76 с (CH2N+), 64.30 с (CH2N+), 124.81 с (Спир), 138.82 с (Спир), 139.85 с (Спир), 145.46 с (Спир), 153.16 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Н-3Cl]2+ 232.7142 C28H56N3O2Cl3. Вычислено [М-Н-3Cl]2+ 232.7142
Пример 5
2,5-Бис((диметил(додецил)аммонио)метил)-3-гидрокси-4-(гидроксиметил)пиридиний трихлорид (I-5).
Синтезируют и разрабатывают аналогично соединению I-4 из 0.10 г (0.2 ммоль) соединения I-2. Выход 0.10 г (количественный); белое кристаллическое вещество; т.пл. 103-104°С (разл.). Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.85 т (6Н,3JHH=6.7 Гц, 2СН3С11Н22), 1.25-1.29 м (36Н, 18СН2), 1.80 уш.с (4Н, 2СН2), 3.02 с (6Н, 2CH3N+), 3.10 с (6Н, 2CH3N+, 3.35-3.39 м (2Н, CH2N+), 3.41-3.45 м (2Н, CH2N+), 4.71 с (2Н, CH2O), 4.82 с (4Н, CH2N+), 8.33 с (1H, СНпир). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м.д.: 14.00 с (СН3), 21.95 с (СН2), 22.14 с (СН2), 25.89 с (СН2), 28.59 с (СН2), 28.61 с (СН2), 28.77 с (СН2), 28.90 с (СН2), 29.02 с (СН2), 29.07 с (СН2), 31.34 с (СН2), 48.98 с (CH3N+), 50.17 с (CH3N+), 55.58 с (CH2O), 60.52 с (CH2N+), 61.37 с (CH2N+), 63.77 с (CH2N+), 64.26 с (CH2N+), 124.88 с (Спир), 138.69 с (Спир), 140.04 с (Спир), 145.34 с (Спир), 153.24 с (Спир). Масс-спектр (HRMS-ESI): Найдено [M-H-3Cl]2+ 288.7766 C31H72N3O2Cl3. Вычислено [М-Н-3l]2+ 288.7768
Пример 6
2,5-Бис((диметил(октадецил)аммонио)метил)-3-гидрокси-4-(гидроксиметил)пиридиний трихлорид (I-6).
Синтезируют и разрабатывают аналогично соединению I-4 из 0.1 г (0.2 ммоль) соединения I-3. Выход 0.10 г (количественный); белое кристаллическое вещество; т.пл. 110-111°С (разл.). Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.85 м (6Н,3JHH=6.7 Гц, 2CH3C16H32), 1.23-1.28 м (60Н, 30СН2), 1.80 уш.с (4Н, 2СН2), 3.00 с (6Н, 2CH3N+), 3.09 с (6Н, 2CH3N+), 3.33-3.38 м (4Н, 2CH2N+), 4.68 с (2Н, CH2O), 4.77 с (2Н, CH2N+), 4.83 с (2Н, CH2N+), 8.29 с (1Н, СНпир), 10.47 с (1H, ОН). Спектр ЯМР13С {1H} (100 МГц, ДМСО-d6) δ, м.д.: 13.95 с (СН3), 21.90 с (СН2), 22.09 с (СН2), 28.56 с (СН2), 28.70 с (СН2), 28.87 с (СН2), 29.05 с (СН2), 31.29 с (СН2), 49.04 с (CH3N+), 50.26 с (CH3N+), 55.74 с (CH2O), 60.57 с (CH2N+), 61.33 с (CH2N+), 63.65 с (CH2N+), 64.16 с (CH2N+), 124.65 с (Спир), 138.83 с (Спир), 139.59 с (Спир), 145.35 с (Спир), 153.16 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Н-3Cl]2+ 372.8706 C48H96N3O2Cl2. Вычислено [М-Н-3Cl]+ 372.8707
Пример 7
N-((2-Этил-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)-N,N-диметилоктадекан-1-аммоний хлорид (I-7)
Получение 5-гидроксиметил-2-этил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридина (промежуточное вещество 3-7): В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 20.00 г (97.0 ммоль) пиридоксин гидрохлорида 2, 27.70 г (146.0 ммоль) моногидрата п-толуолсульфокислоты и 11.34 г (195.0 ммоль) пропаналя в 150 мл бензола. Реакционную массу кипятят 6 ч, затем растворитель отгоняют в вакууме. К полученной смеси добавляют раствор 10.7 г (267.5 ммоль) гидроксида натрия в 150 мл воды и нейтрализуют до pH 7 разбавленной соляной кислотой. Выпавший осадок отфильтровывают, промывают петролейным эфиром. Выход 12.40 г (61%); кристаллическое вещество серого цвета; т.пл. 111-112°С. Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 1.00 т (3Н,3JHH=7.7 Гц, СН3), 1.77-1.83 м (2Н, СН2), 2.30 с (3Н, СН3), 4.38 д (2Н,3JHH=4.3 Гц, СН2), 4.95 с (2Н, СН2), 5.06 т (1Н,3JHH=4.0 Гц, СН), 5.18 уш т (1H,3JHH=4.3 Гц, ОН), 7.93 с (1H, СН). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м.д.: 7.78 с (СН3), 18.16 с (СН3), 27.06 с (СН2), 58.21 с (СН2), 63.43 с (СН2), 100.02 с (С), 126.88 с (Спир), 130.94 с (Спир), 138.95 с (Спир), 145.09 с (Спир), 146.91 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 210.1125 C11H16NO3. Вычислено [М+Н]+ 210.1125.
Получение 5-(хлорметил)-2-этил-8-метал-4Н-[1,3]диоксино[4,5-с]пиридин гидрохлорида (промежуточное вещество 4-7): В раствор 1.00 г (4.8 ммоль) соединения 3-7 в 20 мл хлороформа добавляют 2 мл (27.5 ммоль) хлористого тионила. Полученную реакционную смесь перемешивают в течение 3 ч. Растворитель удаляют в вакууме. Выход 1.26 г (количественный); белое кристаллическое вещество; т.пл. 144-149°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 1.09 т (3Н,3JHH=7.5 Гц, СН3), 1.94-2.00 м (2Н, СН2), 2.79 с (3Н, СН3), 4.59 с (2Н, СН2), 5.15 т (1Н,3JHH=4.4 Гц СН), 5.17 с (2Н, СН2), 8.29 с (1Н, СН), 17.96 уш с (1H, NH). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 7.58 с (СН3), 14.14 с (СН3), 27.25 с (СН2), 38.57 с (СН2пир.), 63.92 с (СН2), 102.61 с (С), 130.98 с (Спир), 131.49 с (Спир), 136.38 с (Спир), 144.14 с (Спир), 150.63 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 228.0786 C11H15Cl2NO2. Вычислено [М-Cl]+ 228.0786.
Получение N-((2-этил-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)-N,N-диметилоктадекан-1-аммоний хлорида: К раствору 0.30 г соединения 4-7 (1.1 ммоль) в 30 мл этанола добавляют 0.09 г гидрокарбоната натрия (1.1 ммоль) и 0.44 мл N,N-диметалоктадециламина (1.1 ммоль). Реакционную смесь перемешивают в течение 8 часов при температуре 60°С. Растворитель удаляют в вакууме. К полученному осадку приливают 10 мл хлороформа и отфильтровывают. Растворитель удаляют в вакууме, продукт перекристаллизовывают из ацетона. Выход 0.37 г (66%); коричневое кристаллическое вещество; т.пл. 141-144°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.86 т (3Н,3JHH=6.6 Гц, CH3C17H34), 1.03 т (3Н,3JHH=7.5 Гц, CH3CH2), 1.17-1.41 м (30Н, 15СН2), 1.70-1.91 м (4Н, СН2), 2.45 с (3Н, СН3), 3.31 с (3Н, CH3N+), 3.38 с (3Н, CH3N+), 3.56-3.66 уш м (2Н, CH2N+), 5.07 т (1Н,3JHH=4.8 Гц), 5.08, 5.16 АВ-система (2Н,2JHH=-12.8 Гц, СН2), 5.16, 5.51 АВ-система (2Н,2JHH=-16.4 Гц, СН2), 8.21 (1Н, СН). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 7.81 с (СН3), 14.24 с (СН3), 18.39 с (СН3), 22.81 с (СН2), 23.16 с (СН2), 26.49 с (СН2), 27.58 с (СН2), 29.44 с (СН2), 29.49 с (СН2), 29.59 с (СН2), 29.71 с (СН2), 29.83 с (СН2), 32.05 с (СН2), 49.52 с (CH3N+), 49.86 с (CH3N+), 62.30 с (СН2), 64.12 с (СН2), 65.82 с (СН2), 101.60 с (СН), 118.13 с (Спир), 131.59 с (Спир), 143,74 с (Спир), 148,69 с (Спир), 150.12 с (Спир). Масс-спектр (HRMS-ESI): Найдено [M-Cl]+ 489.4415, C31H57ClN2O2 Вычислено [М-Cl]+ 489.4415.
Пример 8
N,N-диметил-N-((8-метил-2-пропил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октадекан-1-аммоний хлорид (I-8)
Получение 5-гидроксиметил-2-пропил-8-метил-4H-[1,3]диоксино[4,5-с]пиридина (промежуточное вещество 3-8): В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 7.00 г (34.4 ммоль) пиридоксин гидрохлорида 2, 13.70 г (72.1 моль) моногидрата п-толуолсульфокислоты и, 6.5 мл (72.2 ммоль) масляного альдегида в 120 мл бензола. Реакционную массу кипятят 8 ч, затем растворитель отгоняют в вакууме. Остаток нейтрализуют до pH 7 водным раствором гидрокарбоната натрия. Выпавший осадок отфильтровывают и промывают бензолом. Выход 5.58 г (73%); белое кристаллическое вещество; т.пл. 101°С. Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.99 т (3Н,3JHH=7.4 Гц, СН3), 1.52-1.58 м (2Н, СН2), 1.80-1.87 м (2Н, СН2), 2.34 с (3Н, СН3), 4.25 уш с (1Н, ОН), 4.48 с (2Н, СН2), 4.96 с (2Н, СН2), 4.97 т (1H,3JHH=4.8 Гц, СН), 7.75 с (1Н, СН). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.01 с (СН3), 17.08 с (СН2), 18.17 с (СН3), 36.41 с (СН2), 60.04 с (СН2), 64.27 с (СН2), 99.97 с (С), 127.76 с (Спир), 130.11 с (Спир), 139.17 с (Спир), 147.31 с (Спир), 147.99 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М+Н]+: 224.1287, C12H18NO3. Вычислено [М+Н]+: 224.1287.
Получение 5-(хлорметил)-2-пропил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин гидрохлорида (промежуточное вещество 4-8): В раствор 1.00 г (4.5 ммоль) соединения 3-8 в 20 мл хлороформа добавляют 2 мл (27.5 ммоль) хлористого тионила. Полученную реакционную смесь перемешивают в течение 3 ч. Растворитель удаляют в вакууме. Выход 1.25 г (количественный); белое кристаллическое вещество; т.пл. 166-169°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 1.02 т (3Н,3JH-H=7.2 Гц, СН3), 1.53-1.62 м (2Н, СН2), 1.90-1.96 м (2Н, СН2), 2.79 с (3Н, СН3), 4.56 с (2Н, СН2), 5.16 с (2Н, СН2), 5.20 т (1Н,2JHH=5.1 Гц, СН), 8.28 с (1Н, СН), 17.94 уш с (1H, NH). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 13.92 с (СН3), 14.18 с (СН3), 16.77 с (СН2), 35.89 с (СН2), 38.53 с (СН2), 63.91 с (СН2), 101.83 с (С), 130.92 с (Спир), 131.47 с (Спир), 136.35 с (Спир), 144.25 с (Спир), 150.66 с (Спир). Масс-спектр (HRMS-ESI): Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 242.0942 C12H17Cl2NO2. Вычислено [М-Cl]+ 242.0942.
Получение N,N-диметил-N-((8-метил-2-пропил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)октадекан-1-аммоний хлорида: К раствору 0.20 г соединения 4-8 (0.7 ммоль) в 30 мл этанола добавляют 0.06 г гидрокарбоната натрия (0.7 ммоль) и 0.31 мл N,N-диметилоктадециламина (0.7 ммоль). Реакционную смесь перемешивают в течение 8 часов при температуре 60°С. Растворитель удаляют в вакууме. К полученному осадку приливают 10 мл хлороформа и не растворившуюся часть отфильтровывают. Растворитель удаляют в вакууме, продукт перекристаллизовывают из ацетона. Выход 0.23 г (60%); коричневое кристаллическое вещество; т.пл. 158-160°С (разл.). Спектр1Н ЯМР (400 МГц, CDCl3) δ, м.д.: 0.86 т (3Н,3JHH=6.8 Гц, СН3С17Н34), 0.97 т (3Н,3JHH=7.4 Гц, СН3СН2), 1.08-1.36 м (30Н, 15СН2), 1.44-1.57 м (2Н, СН2), 1.69-1.84 (2Н, СН2), 2.45 с (3Н, СН3), 3.30 с (3Н, CH3N+), 3.37 с (3Н, CH3N+), 3.56-3.67 уш.м (2Н, CH2N+), 5.03-5.22 м (3Н, СН2, СН), 5.16, 5.50 АВ-система (2Н,2JHH=-16.8 Гц, СН2), 8.22 (1H, СН). Спектр ЯМР13С {1H} (400 МГц, CDCl3) δ, м.д.: 14.04 с (СН3), 14.23 с (СН3), 16.93 с (СН2), 18.37 с (СН3), 22.80 с (СН2), 23.15 с (СН2), 26.48 с (СН2), 29.44 с (СН2), 29.50 с (СН2), 29.58 с (СН2), 29.71 с (СН2), 29.82 с (СН2), 32.04 с (СН2), 36.35 с (СН2), 49.48 с (CH3N+), 49.82 с (CH3N+), 62.25 с (СН2), 64.06 с (СН2), 65.80 с (СН2), 100.72 с (СН), 118.20 (Спир), 131.63 (Спир), 143.72 (Спир), 148.67 (Спир), 150.02 (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 503.4571 C32H59ClN2O2 Вычислено [М-Cl]+ 503.4571.
Пример 9
N-((2-Бутил-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)-N,N-диметилоктодекан-1-аммоний хлорид (I-9)
Получение 5-Гидроксиметил-2-бутил-8-метил-4H-[1,3]диоксино[4,5-с]пиридина (промежуточное вещество 3-9): В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 7.00 г (34.0 ммоль) пиридоксин гидрохлорида 2, 13.60 г (71.0 ммоль) моногидрата п-толуолсульфокислоты и 5.90 г (68.0 ммоль) пентаналя в 120 мл толуола. Реакционную массу кипятят 2 ч, затем растворитель отгоняют в вакууме. К полученной смеси добавляют раствор 4.64 г (116.0 ммоль) гидроксида натрия в 100 мл воды и нейтрализуют до pH 7 разбавленной соляной кислотой. Выпавший осадок отфильтровывают, промывают петролейным эфиром. Выход 6.20 г (77%), бесцветное кристаллическое вещество, т.пл. 123-124°С. Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.95 т (3Н, 3JHH=7.1 Гц, СН3), 1.36-1.45 м (2Н, СН2), 1.47-1.55 м (2Н, СН2), 1.82-1.92 м (2Н, СН2), 2.39 с (3Н, СН3), 4.52 с (2Н, СН2), 4.99 с (2Н, СН2), 4.99 т (1Н,3JHH=5.1 Гц, СН), 7.84 с (1H, СН). Спектр ЯМР13С (100 МГц, CDCl3) δ, м.д.: 14.10 с (СН3), 18.09 с (СН3), 22.59 с (СН2), 25.82 с (СН2), 34.11 с (СН2), 60.19 с (СН2), 64.30 с (СН2), 100.27 с (С), 128.16 с (Спир), 130.19 с (Спир), 138.84 с (Спир), 147.22 с (Спир), 148.12 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 238.1438 C13H20ClNO2. Вычислено [М+Н]+ 238.1438.
Получение 5-(хлорметил)-2-бутил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин гидрохлорида (промежуточное вещество 4-9): В раствор 1.00 г (4.2 ммоль) соединения 3-9 в 20 мл хлороформа добавляют 2 мл (27.5 ммоль) хлористого тионила. Полученную реакционную смесь перемешивают в течение 3 ч. Растворитель удаляют в вакууме. Выход 1.23 г (количественный); белое кристаллическое вещество; т.пл. 156-160°С (разл.). Спектр ЯМР1H {1Н} (400 МГц, ДМСО-d6) δ, м.д.: 0.90 т (3Н,3JHH=6.8 Гц, СН3), 1.32-1.41 м (2Н, СН2), 1.43-1.50 м (2Н, СН2), 1.80-1.88 м (2Н, СН2), 2.57 с (3Н, СН3), 4.88, 4.94 АВ (2Н,2JHH=-12 Гц, СН2), 5.21, 5.30 АВ (2Н,2JHH=-16 Гц, СН2), 5.34-5.40 м (1Н, СН), 8.46 с (1Н, СН). Спектр ЯМР13C {1H} (100 МГц, ДМСО-d6) δ, м.д.: 13.82 с (СН3), 14.04 с (СН2), 21.77 с (СН3), 24.95 с (СН2), 32.96 с (СН2), 38.90 с (СН2), 63.37 с (СН2), 100.72 с (С), 130.72 с (Спир), 132.32 с (Спир), 136.11 с (Спир), 143.44 с (Cпиp), 149.46 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 256.1099 C13H19Cl2NO2. Вычислено [М-Cl]+ 256.1099.
Получение N-((2-Бутил-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)-N,N-диметилоктодекан-1-аммоний хлорида: К раствору 0.30 г соединения 4-9 (1.0 ммоль) в 30 мл этанола добавляют 0.09 г гидрокарбоната натрия (1.0 ммоль) и 0.28 мл N,N-диметилоктадециламина (1.0 ммоль). Реакционную смесь перемешивают в течение 8 часов при температуре 60°С. Растворитель удаляют в вакууме. К полученному осадку приливают 10 мл хлороформа, не растворившуюся часть отфильтровывают. Растворитель удаляют в вакууме, продукт перекристаллизовывают из ацетона. Выход 0.23 г (40%); белое кристаллическое вещество; т.пл. 155-158°С (разл.). Спектр1Н ЯМР (400 МГц, ДМСО-d6) δ, м.д.: 0.78-0.96 м (6Н, 2СН3), 1.11-1.50 м (30Н, 15СН2), 1.68-1.90 м (6Н, 3СН2), 2.36 с (3Н, СН3), 2.98 с (6Н, 2CH3N+), 3.30-3.44 м (2Н, CH2N+), 4.41-4.59 м (2Н, СН2), 4.95-5.05 д (1H, СН), 5.13-5.31 м (2Н, СН2). 8.16 с (1H, СН). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м. д.: 13.81 с (СН3), 13.89 с (СН3), 18.38 с (СН3), 21.79 с (СН2), 22.04 с (СН2), 25.20 с (СН2), 25.79 с (СН2), 28.50 с (СН2), 28.65 с (СН2), 28.75 с (СН2), 28.90 с (СН2), 29.00 с (СН2), 31.24 с (СН2), 33.26 с (СН2), 48.75 с (CH3N+), 48.94 с (CH3N+), 60.93 с (СН2), 63.93 с (СН2), 64.33 с (СН2), 99,60 с (СН), 118.38 с (Спир), 130.33 с (Спир), 144.90 с (Спир), 147.20 с (Спир), 148.06 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 517.4728 C33H59ClN2O2. Вычислено [М-Cl]+ 517.4728.
Пример 10
N-((2-(Трет-бутил)-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)-N,N-диметилоктадекан-1-аммоний хлорид (I-10)
Получение 5-Гидроксиметил-2-трет-бутил-8-метил-4H-[1,3]диоксино[4,5-с]пиридина (промежуточное вещество 3-10): В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 20.00 г (97.0 ммоль) пиридоксин гидрохлорида 2, 27.70 г (146.0 ммоль) моногидрата п-толуолсульфокислоты и 11.34 г (117.7 ммоль) пивальдегида в 150 мл бензола. Реакционную массу кипятят 6 ч, затем растворитель отгоняют в вакууме. К полученной смеси добавляют раствор 10.70 г (267.5 ммоль) гидроксида натрия в 150 мл воды и нейтрализуют до pH 7 разбавленной соляной кислотой. Выпавший осадок отфильтровывают и промывают водой. Выход 20.00 г (87%); белое кристаллическое вещество; т.пл. 158-159°С. Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 1.01 с (9Н, СН3), 2.30 с (3Н, СН3), 4.38 д (2Н,3JHH=3.6 Гц, СН2), 4.74 с (1Н, СН), 4.94, 4.98 АВ (2Н,2JHH=-16.0 Гц, СН2), 5.16 уш т (1H, ОН), 7.92 с (1Н, СН). Спектр ЯМР13С (100 МГц, CDCl3) δ, м.д.: 17.90 с (СН3), 24.09 с (СН3), 34.58 с (С), 58.17 с (СН2), 63.84 с (СН2), 103.98 с (С), 126.67 с (Спир), 130.85 с (Спир), 138.77 с (Спир), 145.07 с (Спир), 147.07 с (Спир). Масс-спектр (HRMS-ESI): найдено [М+Н]+: 238.1443, Вычислено [М+Н]+: C13H20NO3 [М+Н]+: 238.1443.
Получение 5-(хлорметил)-2-трет-бутил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин гидрохлорида (промежуточное вещество 4-10): В раствор 1 г (4.2 ммоль) соединения 3-10 в 20 мл хлороформа добавляют 2 мл (27.5 ммоль) хлористого тионила. Полученную реакционную смесь перемешивают в течение 3 ч. Растворитель удаляют в вакууме. Выход 1.23 г (количественный); белое кристаллическое вещество; т.пл. 132-134°С. Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 1.08 с (9Н, 3СН3), 2.80 с (3Н, СН3), 4.56 с (2Н, СН2), 4.82 с (1H, СН), 5.19, 5.16 АВ (2Н,2JHH=-16 Гц, СН2), 8.26 с (1H, СН), 18.01 уш с (1H, NH). Спектр ЯМР13С (100 МГц, CDCl3) δ, м.д.: 14.08 с (СН3), 24.16 с (СН3), 35.31 с (С), 38.56 с (СН2), 64.29 с (СН2), 106.87 с (С), 130.85 с (Спир), 131.30 с (Спир), 136.36 с (Спир), 144.22 с (Cпиp), 150.95 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 256.1099, C13H19Cl2NO2. Вычислено [М-Cl]+ 256.1099.
Получение N-((2-(трет-бутил)-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)-N,N-диметилоктадекан-1-аммоний хлорида: К раствору 0.30 г соединения 4-10 (1.0 ммоль) в 30 мл этанола добавляют 0.09 г гидрокарбоната натрия (1.0 ммоль) и 0.38 мл N,N-диметилоктадециламина (1.0 ммоль). Реакционную смесь перемешивают в течение 8 часов при температуре 60°С. Растворитель удаляют в вакууме. К полученному осадку приливают 10 мл хлороформа и отфильтровывают. Растворитель удаляют в вакууме, продукт перекристаллизовывают из ацетона. Выход 0.12 г (20%); белое кристаллическое вещество; т.пл. 150-151°С (разл.). Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.85 т (3Н,3JHH=6.7 Гц, СН3С17Н34), 1.02 с (9Н, 3СН3), 1.17-1.39 м (30Н, 15СН2), 1.68-1.81 м (2Н, СН2), 2.37 (3Н, СН3), 2.98 (6Н, 2CH3N+), 3.32-3.42 (2Н, CH2N+), 4.49, 4.53 АВ-система (2Н,2JHH=-13.6 Гц, СН2), 4.91 с (1H, СН), 4.99, 5.25 АВ-система (2Н,2JHH=-16.0 Гц, СН2), 8.15 (1H, СН). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м.д.: 13.93 с (СН3), 18.24 с (СН3), 21.84 с (СН2), 22.08 с (СН2), 23.99 с (СН3), 25.83 с (СН2), 28.54 с (СН2), 28.69 с (СН2), 28.78 с (СН2), 28.94 с (СН2), 29.03 с (СН2), 31.28 с (СН2), 34.58 с (СН2), 48.78 с (CH3N+), 48.96 с (CH3N+), 60.95 с (СН2), 63.96 с (СН2), 64.77 с (СН2), 104.32 с (СН), 118.38 (Спир), 130.29 (Спир), 144.81 (Спир), 147.38 (Спир), 148.10 (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 517.4728 C33H61ClN2O2. Вычислено [М-cl]+ 517.4728.
Пример 11
N,N-Диметил-N-((8-метил-2-октил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)октадекан-1-аммоний хлорид (I-11)
Получение (8-метил-2-октил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метанола (промежуточное вещество 3-11): В круглодонной колбе, снабженной насадкой Дина-Старка, готовят суспензию 7.00 г (34.4 ммоль) гидрохлорида пиридоксина 2, 13.70 г (72.1 моль) моногидрата n-толуолсульфокислоты и 5.9 мл (34.4 ммоль) нонилового альдегида в 120 мл бензола. Реакционную массу кипятят 8 ч, затем растворитель удаляют в вакууме. Остаток нейтрализуют до pH 7 водным раствором гидрокарбоната натрия, выпавший осадок отфильтровывают и промывают петролейным эфиром. Выход 8.26 г (82%); белые кристаллы; т.пл. 175°С. Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.88 т (3Н,3J=6.6 Гц, СН3), 1.28-1.38 м (10Н, 5СН2), 1.49-1.57 м (2Н, СН2), 1.80-1.94 м (2Н,СН2), 2.39 с (3Н, СН3), 3.30 уш с (1Н, ОН), 4.53 с (2Н, СН2), 4.99 с (2Н, СН2), 5.00 к (1H,2J=5.2 Гц, СН), 7.83 с (1H, СН). Спектр ЯМР13С {1Н} (400 МГц, CDCl3) δ, м.д.: 14.25 с (СН3), 18.33 с (СН3), 22.80 с (СН2), 23.71 с (СН2), 29.35 с (СН2), 29.51 с (СН2), 29.60 с (СН2), 31.99 с (СН2), 34.42 с (СН2), 60.38 с (СН2), 64.32 с (СН2), 100.21 с (С), 127.79 с (Спир), 129.81 с (Спир), 139.31 с (Спир), 147.59 с (Спир), 148.05 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 294.2069. C17H28NO3 Вычислено [М+Н]+ 294.2069.
Получение 5-(хлорметил)-8-метил-2-октил-4H-[1,3]диоксино[4,5-c]пиридин гидрохлорида (промежуточное вещество 4-11): К раствору 1.00 г соединения 3-11 (3.4 ммоль) в 20 мл хлороформа добавляют 2 мл (27.5 ммоль) хлористого тионила. Полученную реакционную смесь перемешивают в течение 3 ч. Растворитель удаляют в вакууме. Выход 1.19 г (количественный); белое кристаллическое вещество; т.пл. 156-160°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.88 т (3Н,3JHH=7.8 Гц, СН3), 1.21-1.41 (10Н, (СН2)5), 1.49-1.57 м (2Н, СН2), 1.91-1.97 м (2Н, СН2), 2.80 с (3Н, СН3), 4.54 с (2Н, СН2), 5.15 с (2Н, СН2), 5.19 т (1H,3JHH=5.7 Гц, СН), 8.26 с (1Н, СН). Спектр ЯМР13С {1Н} (400 МГц, CDCl3) δ, м.д.: 14.20 с (СН3), 14.23 с (СН3), 22.77 с (СН2), 23.32 с (СН2), 29.28 с (СН2), 29.34 с (СН2), 29.49 с (СН2), 31.94 с (СН2), 33.92 с (СН2), 38.52 с (СН2), 63.91 с (СН2), 102.04 с (С), 130.87 с (Спир), 131.46 с (Спир), 136.29 с (Спир), 144.32 с (Спир), 150.69 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 312.1725. C17H27Cl2NO2. Вычислено [М-Cl]+ 312.1725.
Получение N,N-диметил-N-((8-метил-2-октил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)октадекан-1-аммоний хлорида: К раствору 0.30 г соединения 4-11 (0.9 ммоль) в 30 мл этанола добавляют 0.07 г гидрокарбоната натрия (0.9 ммоль) и 0.9 мл N,N-диметилоктадециламина (0.9 ммоль). Реакционную смесь перемешивают в течение 8 часов при температуре 60°С. Далее растворитель удаляют в вакууме. К полученному осадку приливают 10 мл хлороформа и отфильтровывают, растворитель удаляют в вакууме. Продукт перекристаллизовывают из ацетона. Выход 0.30 г (74%); коричневое кристаллическое вещество; т.пл. 153-156°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.85 т (3Н,3JHH=7.0 Гц, СН3), 0.87 т (3Н,3JHH=6.5 Гц, СН3), 1.17-1.37 м (40Н, 20СН2), 1.41-1.53 м (2Н, СН2), 1.68-1.88 м (4Н, 2СН2), 2.43 с (3Н, СН3), 3.30 с (3Н, CH3N), 3.37 с (3Н, CH3N+), 3.54-3.69 м (2Н, CH2N+), 5.04-5.20 м (4Н, СН2, НСН, СН), 5.48 АВ (1H,2JHH=-16.7 Гц, НСН), 8.18 с (1H, СН). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.22 с (СН3), 18.58 с (СН3), 22.78 с (СН2), 23.14 с (СН2), 23.54 с (СН2), 26.47 с (СН2), 29.34 с (СН2), 29.44 с (СН2), 29.47 с (СН2), 29.50 с (СН2), 29.58 (с, СН2), 29.71 с (СН2), 29.77 с (СН2), 29.82 с (СН2), 31.98 с (СН2), 32.03 с (СН2), 34.34 с (СН2), 49.46 с (CH3N+), 49.78 с (CH3N+), 62.29 с (СН2), 63.96 с (СН2), 65.79 с (СН2), 100.84 с (C(C8H17)H), 117.94 с (Спир), 131.15 с (Спир), 144.10 с (Спир), 148.52 с (Спир), 150.24 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 573.5354. C37H69ClN2O2 Вычислено [М-Cl]+ 573.5354.
Пример 12
N,N-Диметил-N-((8-метил-2-(ундекан-2-ил)-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октадекан-1-аммоний хлорид (I-12)
Получение (8-метил-2-(ундекан-2-ил)-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метанола (промежуточное вещество 3-12): В круглодонной колбе, снабженной насадкой Дина-Старка, готовят суспензию 10.00 г (48.6 ммоль) пиридоксин гидрохлорида 2, 13.8 г (72.9 ммоль) моногидрата n-толуолсульфокислоты и 8.05 г (43.7 ммоль) (S)-2-метилундеканаля в 150 мл бензола. Реакционную массу кипятят 16 ч, затем растворитель удаляют в вакууме. К полученной смеси добавляют раствор 2.90 г (72.9 ммоль) гидроксида натрия в 100 мл воды и нейтрализуют до pH 7 разбавленной соляной кислотой. Далее в полученный раствор приливают хлороформ, экстрагируют и отделяют органическую часть с помощью делительной воронки. Растворитель удаляют в вакууме. Полученный продукт перекристаллизовывают из смеси этанол/вода (9/1). Выход 1.20 г (9%); бесцветное кристаллическое вещество; т.пл. 70°С. Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.85 т (3Н,3JHH=6.6 Гц, CH3C8H15). 0.95-1.02 м (3Н, СН3), 1.19-1.34 м (16Н, 8СН2), 1.54-1.65 м (1H, СН), 1.80-1.90 м (1H, СН), 2.29 с (3Н, СН3), 4.38 с (2Н, CH2O), 4.89-5.00 м (3Н, СН2, СН), 5.16 уш с (1Н, ОН), 7.92 с (1Н, CH). Спектр ЯМР13С {1H} (100 МГц, ДМСО-d6) δ, м.д.: 13.47 с (СН3), 13.59 с (СН3), 13.92 с (СН3), 17.93 с (СН3), 17.99 с (СН3), 22.09 с (СН2), 26.25 с (СН2), 28.72 с (СН2), 28.97 с (СН2), 29.25 с (СН2), 29.28 с (СН2), 30.49 с (СН2), 30.59 с (СН2), 31.30 с (СН2), 36.57 с (СН2), 58.17 с (CH2O), 63.58 с (CH2O), 101.66 с (СН), 126.78 с (Спир), 130.85 с (Спир), 138.82 с (Спир), 145.01 с (Спир), 146.96 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М+H]+ 336.2533 C20H33NO3. Вычислено [М+H]+ 336.2533.
Получение 5-(хлорометил)-8-метио-2-(ундекан-2-ил)-4H-[1,3]диоксино[4,5-с]пиридин-7-иум хлорида (промежуточное вещество 4-12): К раствору 0.40 г соединения 3-12 (1.2 ммоль) в 20 мл хлороформа добавляют 0.5 мл хлористого тионила (6.9 ммоль). Полученную реакционную смесь перемешивают в течение 3 ч. Растворитель удаляют в вакууме. Выход 1.30 г (количественный), белое кристаллическое вещество, т.пл. 139-140°С (разл). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.86 т (3Н,3JHH=6.7 Гц, CH3C8H15), 1.03-1.06 м (т (3Н,3JHH=6.0 Гц, СН3), 1.17-1.45 м (16Н, 8СН2), 1.53-1.67 м (1H, СН), 2.00 уш с (1Н, СН), 2.78 с (3Н, СН3), 4.61 с (2Н, СН2), 5.02 уш с (1Н, СН), 5.17 с (2Н, СН2), 8.31 с (1H, СН). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 13.40 с (СН3), 13.49 с (СН3), 14.08 с (СН3), 14.20 с (СН3), 22.76 с (СН2), 22.09 с (СН2), 26.92 с (СН2), 29.30 с (СН2), 29.66 с (СН2), 29.81 с (СН2), 30.82 с (СН2), 31.97 с (СН2), 37.08 с (СН2), 37.14 с (СН2), 38.68 с (СН2), 64.16 с (CH2O), 104.50 с (СН), 131.07 с (Спир), 131.50 с (Спир), 136.51 с (Спир), 144.01 с (Спир), 150.81 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 354.2194 C20H33Cl2NO2 Вычислено [М-Cl]+ 354.2194.
Получение N,N-диметил-N-((8-метил-2-(ундекан-2-ил)-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октадекан-1-аммоний хлорида: К раствору 0.33 г соединения 4-12 (0.8 ммоль) в 30 мл этанола добавляют 0.07 г (0.8 ммоль) гидрокарбоната натрия и 0.31 мл N,N-диметилоктадециламина (0.8 ммоль). Реакционную смесь перемешивают в течение 8 часов при температуре 60°С. Растворитель удаляют в вакууме. К полученному осадку приливают 10 мл хлороформа, нерастворившуюся часть отфильтровывают. Растворитель удаляют в вакууме, продукт перекристаллизовывают из ацетона. Выход 0.27 г (48%); белое кристаллическое вещество; т.пл. 162-165°С (разл.). Спектр1Н ЯМР (CDCl3) δ, м.д.: 0.82-0.88 м (3Н, СН3), 0.96-1.02 м (3Н, СН3), 1.16-1.41 м (48Н, 24СН2), 1.54-1.65 м (1H, СН), 1.69-1.80 м (2Н, СН2), 1.82-1.92 (1Н, СН), 2.43 с (3Н, СН3), 3.31 (3Н, CH3N+), 3.37 (3Н, CH3N+), 3.55-3.70 м (2Н, CH2N+), 4.87-4.91 м (1H, НСН), 5.02-5.21 м (3Н, НСН, НСН СН), 5.47-5.55 м (1H, НСН), 8.16 (1Н, СН). Спектр13С {1H} ЯМР (CDCl3) δ, м.д.: 13.59 с (СН3), 13.71 с (СН3), 14.22 с (СН3), 18.59 с (СН3), 22.79 с (СН2), 23.14 с (СН2), 26.47 с (СН2), 27.07 с (СН2), 29.46 с (СН2), 29.58 с (СН2), 29.70 с (СН2), 29.75 с (СН2), 29.81 с (СН2), 29.94 с (СН2), 30.99 с (СН2), 32.02 с (СН2), 37.38 с (СН2), 49.47 (CH3N+), 49.75 (CH3N+), 62.34 с (СН2), 63.91 с (СН2), 65.91 с (СН2), 103.43 с (СН), 117.85 с (Спир), 131.06 с (Спир), 144.15 с (Спир), 148.65 с (Спир), 150.36 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 615.5823 C40H75ClN2O2. Вычислено [М-Cl]+ 615.5823.
Пример 13
N,N-Диметил-N-((8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)октадекан-1-аммоний хлорид (I-13)
Получение 5-Гидроксиметил-8-метил-4H-[1,3]диоксино[4,5-с]пиридина (промежуточное вещество 3-13): В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 20.00 г (97.0 ммоль) пиридоксин гидрохлорида 2, 92.5 г (486.8 ммоль) моногидрата п-толуолсульфокислоты и 5.84 г (194.6 ммоль) параформа в 150 мл бензола. Реакционную массу кипятят 6 ч, затем растворитель отгоняют в вакууме. К полученной смеси добавляют раствор 24.50 г (267.5 ммоль) гидроксида натрия в 150 мл воды и нейтрализуют до pH 7 разбавленной соляной кислотой. Продукт экстрагируют этилацетатом, который затем отгоняют, а осадок сначала промывают водой и затем диэтиловым эфиром. Выход 1.10 г (6%); кристаллическое вещество серого цвета; т.пл. 112-113°С. Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 2.44 с (3Н, СН3.), 4.48 с (2Н, СН2), 4.71 уш с (1H, ОН), 4.93 с (2Н, СН2), 5.29 с (2Н, СН2), 7.99 с (1H, СНпир.). Спектр ЯМР13С (100 МГц, ДМСО-d6) δ, м.д.: 18.69 с (СН3.), 64.02 с (СН2), 64.96 с (СН2), 91.21 с (СН2), 93.73 с (СН2), 126.31 с (Спир), 127.91 с (Спир.), 140.89 с(Спир.), 147.54 с (Спир.), 148.41 с (Спир.).
Получение 5-(хлорметил)-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин гидрохлорида (промежуточное вещество 4-13): В раствор 1.00 г (6.0 ммоль) соединения 3-13 в 20 мл хлороформа добавляют 2.5 мл. (34.4 ммоль) хлористого тионила. Полученную реакционную смесь перемешивают в течение 3 ч. Растворитель удаляют в вакууме. Выход количественный; белое кристаллическое вещество; т.пл. 190-192°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 2.83 с (3Н, СН3.), 4.53 с (2Н, СН2), 5.16 с (2Н, СН2), 5.46 с (2Н, СН2), 8.27 с (1H, СНпир.), 18.14 уш с (1H, NH). Спектр ЯМР13С (100 МГц, ДМСО-d6) δ, м.д.: 14.26 с (СН3), 38.63 с (СН2), 63.69 с (СН2), 86.52 с (СН2), 92.23 с (СН2), 128.59 с (Спир), 131.01 с (Спир.), 131.79 c (Cпиp.), 136.52 с (Спир.), 144.74 с (Спир.). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 200.0473 C9H11ClNO2. Вычислено [М-Cl]+ 200.0473.
Получение N,N-диметил-N-((8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)октадекан-1-аммоний хлорида: К раствору 0.24 г (1.0 ммоль) соединения 4-13 в 20 мл этанола прибавляют порционно раствор 0.09 г (1.0 ммоль) гидрокарбоната натрия в 20 мл воды. Полученный раствор отгоняют в вакууме. Сухой остаток заливают 30 мл этилового спирта и отфильтровывают нерастворимую часть. К раствору добавляют 0.28 мл (1.0 ммоль) N,N-диметилоктадециламина. Реакционную смесь перемешивают 8 ч при 70°С. Растворитель отгоняют в вакууме. Полученный остаток перекристализовывают из ацетона. Выход 0.39 г (76%); белое кристаллическое вещество; т.пл. 159-160°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.84 т (6Н,3JHH=6.8 Гц, CH3C17H34), 1.20-1.28 м (30Н, 15СН2), 1.75 уш.с (2Н, СН2), 2.39 с (3Н, СН3), 3.31 с (6Н, 2CH3N+), 3.56-3.60 м (2Н, CH2N+), 5.06 с (2Н, СН2), 5.30 с (2Н, СН2), 5.31 с (2Н, СН2), 8.16 с (1Н, СНпир). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.09 с (СН3), 18.72 с (СН3), 22.66 с (СН2), 23.00 с (СН2), 26.34 с (СН2), 29.33 с (СН2), 29.37 с (СН2), 29.44 с (СН2), 29.57 с (СН2), 29.63 с (СН2), 29.68 с (СН2), 31.89 с (СН2), 49.54 с (CH3N+), 62.12 с (CH2O), 63.80 с (CH2N+), 65.37 с (CH2N+), 91.49 с (СН2), 117.80 с (Спир), 130.81 с (Спир), 144.85 с (Спир), 147.63 с (Спир), 150.50 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 615.5823 C40H75ClN2O2 Вычислено [М-Cl]+ 615.5823.
Пример 14
N,N-Диметил-N-((8'-метил-4'H-спиро[циклопентан-1,2'-[1,3]диоксино[4,5-с]пиридин]-5'-ил)метил)октадекан-1-аммоний хлорида (I-14)
Получение (8-метил-4Н-спиро[[1,3]диоксепино[4,5-с]пиридин-2,1'-циклопентан]-5-ол)метанола (промежуточное вещество 5): В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 5.00 г (24.0 ммоль) пиридоксин гидрохлорида 2, 4.50 г (24.0 ммоль) моногидрата п-толуолсульфокислоты и 2.00 г (24.0 ммоль) циклопентанона в 120 мл бензола. Реакционную массу кипятят 2 ч, затем растворитель отгоняют в вакууме. К полученной смеси добавляют раствор 1 г (49.0 ммоль) гидроксида натрия в 100 мл воды и нейтрализуют до pH 7 разбавленной соляной кислотой. Выпавший осадок отфильтровывают и перекристаллизовывают из ацетона. Выход 3.39 г (60%), бесцветное кристаллическое вещество, т.пл. 108-109°С. Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 1.66-1.79 уш с (4Н, 2СН2), 1.81-1.95 м (4Н, 2СН2), 2.28 с (3Н, СН3), 4.41 с (2Н, СН2), 4.91 с (2Н, СН2), 5.20 уш с (1H, ОН), 7.92 с (1H, СНпир.). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м.д.: 18.13 с (СН3), 23.03 с (СН2), 36.50 с (СН2), 58.20 с (СН2), 59.24 с (СН2), 110.48 с (С), 125.85 с (Спир.), 130.68 с (Спир), 138.64 с (Спир.), 145.52 с (Спир.), 145.59 с (Спир.). Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 236.1287 C13H18NO3. Вычислено [М+Н]+ 236.1287.
Получение 5-(хлорметил)-8-метил-4Н-спиро[[1,3]диоксино[4,5-с]пиридин-2.1-циклопентан]гидрохлорида (промежуточное вещество 6): В раствор 1.00 г (4.3 ммоль) соединения 5 в 20 мл хлороформа добавляют 2 мл. (27.5 ммоль) хлористого тионила. Полученную реакционную смесь перемешивают в течение 3 ч. Растворитель удаляют в вакууме. Выход количественный, белое кристаллическое вещество, т.пл. 177-182°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 1.79-1.91 м (4Н, 2СН2), 1.99-2.06 м (4Н, 2СН2), 2.79 с (3Н, СН3), 4.60 с (2Н, СН2), 5.11 с (2Н, СН2), 8.26 с (1H, СН), 17.91 уш с (1H, NH). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.17 с (СН3), 23.57 с (СН2), 33.40 с(СН2), 38.59 с (СН2), 59.82 с (СН2), 103.32 с (С), 114.06 с (Спир.), 131.01 с (Спир.), 135.43 с (Спир), 144.46 с (Спир.), 149.57 с (Спир.). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 254.0942 C13H17Cl2NO2. Вычислено [М-Cl]+ 254.0942.
Получение N,N-диметил-N-((8'-метил-4'H-спиро[циклопентан-1,2'-[1,3]диоксино[4,5-с]пиридин]-5'-ил)метил)октадекан-1-аммоний хлорида: К раствору 0.30 г соединения 6 (1.0 ммоль) в 30 мл этанола добавляют 0.07 г (1.0 ммоль) гидрокарбоната натрия и 0.28 мл (1.0 ммоль) N,N-диметилоктадециламина. Реакционную смесь перемешивают в течение 8 часов при температуре 60°С. Растворитель удаляют в вакууме. К полученному осадку приливают 10 мл хлороформа, не растворившуюся часть отфильтровывают. Фильтрат высушивают и перекристализовывают из ацетона. Выход 0.30 г (63%); коричневое кристаллическое вещество; т.пл. 142-145°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.83 т (3Н,3JHH=6.4 Гц, СН3С17Н34), 1.11-1.35 м (30Н, 15СН2), 1.67-1.83 м (6Н, 3СН2), 1.83-1.95 м (4Н, 2СН2), 2.38 с (3Н, СН3), 3.32 с (6Н, 2CH3N+), 3.55-3.64 м (2Н, CH2N+), 5.04 с (2Н, СН2), 5.18 с (2Н, СН2), 8.12 с (1Н, СНпир). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.19 с (СН3), 18.89 с (СН3), 22.75 с (СН2), 23.07 с (СН2), 23.56 с (СН2), 24.30 с (СН2), 26.72 с (СН2), 29.11 с (СН2), 29.39 с (СН2), 29.43 с (СН2), 29.47 с (СН2), 29.55 с (СН2), 29.66 с (СН2), 29.77 с (СН2), 31.98 с (СН2), 36.28 с (СН2), 42.84 с (СН2), 49.51 с (CH3N+), 61.23 с (СН2), 62.25 с (СН2), 63.70 с (СН2), 111,72 с (С), 117.41 с (Спир), 129.43 с (Спир), 144.28 с (СНпир), 147.16 с (Спир), 150.99 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 515.4571 C33H59ClN2O2. Вычислено [М-Cl]+ 515.4571.
Пример 15
N,N-Диметил-N-((8-метил-2-пропил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октил-1-аммоний хлорид (I-15)
Синтезируют и разрабатывают аналогично соединению 1-8 из 0.67 г (0.2 ммоль) соединения 4-8 и 0.49 мл (0.2 ммоль) N,N-диметилоктиламина. Выход 0.61 г (64%); белое кристаллическое вещество; т.пл. 172-173°С (разл.). Спектр1Н ЯМР (400 МГц, CDCl3) δ, м.д.: 0.85 т (3Н,3JHH=6.8 Гц, СН3С7Н14), 0.97 т (3Н,3JHH=7.4 Гц, СН3СН2СН2), 1.22-1.30 м (10Н, 5СН2), 1.48-1.54 м (2Н, CH3CH2CH2), 1.74-1.82 (4Н, 2СН2), 2.42 с (3Н, СН3), 3.30 (3Н, CH3N+), 3.37 (3Н, CH3N+), 3.59-3.66 м (2Н, CH2N+), 5.03-5.22 м (3Н, СН2, СН), 5.06, 5.48 АВ-система (2Н,2JHH=-16.6 Гц, СН2), 8.16 (1H, CHпир). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.04 с (СН3), 14.15 с (СН3), 16.95 с (СН2), 18.76 с (СН3), 22.66 с (СН2), 23.14 с (СН2), 26.46 с (СН2), 29.12 с (СН2), 29.36 с (СН2), 31.17 с (СН2), 36.37 с (СН2), 49.45 с (CH3N+), 49.77 с (CH3N+), 62.36 с (СН2), 63.95 с (СН2), 65.79 с (СН2), 100.60 с (СН), 117.73 (Спир), 130.79 (Спир), 144.42 (Спир), 148.42 (Спир), 150.50 (Спир). Масс-спектр (HRMS-ESI): Найдено [M-Cl]+ 363.3006 C22H39ClN2O2. Вычислено [М-Cl]+ 363.3006.
Пример 16
N,N-Диметил-N-((8-метил-2-пропил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)додецил-1-аммоний хлорид (I-16)
Синтезируют и разрабатывают аналогично соединению I-8 из 0.67 г (0.2 ммоль) соединения 4-8 и 0.67 мл (0.2 ммоль) N,N-диметилдодециламина. Выход 0.57 г (53%); белое кристаллическое вещество; т.пл. 163-164°С (разл.). Спектр1Н ЯМР (400 МГц, CDCl3) δ, м.д.: 0.85 т (3Н,3JHH=6.8 Гц, CH3C11H22), 0.97 т (3Н,3JHH=7.4 Гц, CH3CH2CH2), 1.20-1.28 м (18Н, 9СН2), 1.47-1.52 м (2Н, CH3CH2CH2), 1.73-1.78 (4Н, 2СН2), 2.40 с (3Н, СН3), 3.29 (3Н, CH3N+), 3.36 (3Н, CH3N+), 3.54-3.66 м (2Н, CH2N+), 5.04, 5.15 АВ-система (2Н,2JHH=-13.6 Гц, СН2), 5.10, 5.46 АВ-система (2Н,2JHH=-16.8 Гц, СН2), 5.06 (1Н,3JHH=5.0 Гц, СН), 8.14 (1H, СНпир). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.02 с (СН3), 14.20 с (СН3), 16.92 с (СН2), 18.79 с (СН3), 22.76 с (СН2), 23.11 с (СН2), 26.45 с (СН2), 29.40 с (СН2), 29.45 с (СН2), 29.53 с (СН2), 29.65 с (СН2), 31.97 с (СН2), 36.35 с (СН2), 49.40 с (CH3N+), 49.72 с (CH3N+), 62.31 с (СН2), 63.84 с (СН2), 65.74 с (СН2), 100.53 с (СН), 117.67 с (Спир), 130.59 с (Спир), 144.57 с (Спир), 148.32 с (Спир), 150.48 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 419.3632 C26H47ClN2O2. Вычислено [М-Cl]+ 419.3632.
Пример 17
N,N-Диметил-N-((8-метил-4H-[1,3]диоксино[4,-c]пиридин-5-ил)метил)октан-1-аммоний хлорид (I-17)
Синтезируют и разрабатывают аналогично соединению I-13 из 0.24 г (1.0 ммоль) соединения 4-13 и 0.21 мл (1.0 ммоль) N,N-диметилоктиламина. Выход 0.25 г (68%); белое кристаллическое вещество; т.пл. 160-162°С (разл.). Спектр ЯМР1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (6Н,3JHH=6.8 Гц, СН3С7Н14), 1.21-1.30 м (10Н, 5СН2), 1.75 уш.с (2Н, СН2), 2.40 с (3Н, СН3), 3.32 с (6Н, 2CH3N+), 3.58-3.62 м (2Н, CH2N+), 5.09 с (2Н, СН2), 5.31 с (2Н, СН2), 5.32 с (2Н, СН2), 8.17 с (1H, СНпир). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.12 с (СН3), 18.79 с (СН3), 22.63 с (СН2), 23.10 с (СН2), 26.43 с (СН2), 29.10 с (СН2), 29.33 с (СН2), 31.68 с (СН2), 49.62 с (CH3N+), 62.21 с (CH2O), 63.96 с (CH2N+), 65.51 с (CH2N+), 91.62 с (СН2), 117.94 с (Спир), 131.03 с (Спир), 144.85 с (Спир), 147.79 с (Спир), 150.58 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 321.2537 C19H33N2O2Cl. Вычислено [M-Cl]+ 321.2537.
Пример 18
N,N-Диметил-N-((8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)додекан-1-аммоний хлорид (I-18)
Синтезируют и разрабатывают аналогично соединению I-13 из 0.24 г (1.0 ммоль) соединения 4-13 и 0.28 мл (1.0 ммоль) N,N-диметилдодециламина. Выход 0.27 г (64%); белое кристаллическое вещество; т.пл. 155-156°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.85 т (6Н,3JHH=6.8 Гц, СН3С11Н22), 1.21-1.30 м (18Н, 9СН2), 1.76 уш.с (2Н, СН2), 2.41 с (3Н, СН3), 3.32 с (6Н, 2CH3N+), 3.57-3.61 м (2Н, CH2N+), 5.08 с (2Н, СН2), 5.32 с (2Н, СН2), 5.33 с (2Н, СН2), 8.17 с (1H, СНпир). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.09 с (СН3), 18.66 с (СН3), 22.65 с (СН2), 23.01 с (СН2), 26.34 с (СН2), 29.29 с (СН2), 29.35 с (СН2), 29.42 с (СН2), 29.55 с (СН2), 31.87 с (СН2), 49.55 с (CH3N+), 62.13 с (CH2O), 63.86 с (CH2N+), 65.40 с (CH2N+), 91.52 с (СН2), 117.85 с (Спир), 130.99 с (Спир), 144.68 с (Спир), 147.72 с (Спир), 150.47 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 377.3163 C23H41N2O2Cl. Вычислено [М-Cl]+ 377.3163.
Пример 19
N,N-диметил-N-((2,2,8-триметил-4H-[1,3]диоксиноо[4,5-c]пиридин-5-ил)метил)додекан-1-аммоний хлорид (I-19)
К раствору 0.38 г (1.4 ммоль) соединения 7 [Tomita I., Brooks H.G., Metzler D.E. Synthesis of vitamin derivatives. II. 3-Hydroxy-4-hydroxymethyl-2-methyl-5-nupidine acetic acid and related substances // J. Heter. Chem. - 1966. - V. 3, Iss. 2 - P. 178-183]) в 20 мл этанола прибавляют порционно раствор 0.12 г (1.4 ммоль) гидрокарбоната натрия в 20 мл воды. Полученный раствор отгоняют в вакууме. Сухой остаток заливают 30 мл этилового спирта и отфильтровывают нерастворимую часть. К раствору добавляют 0.39 мл (1.4 ммоль) N,N-диметилоктадециламина. Реакционную смесь перемешивают 8 ч. при 70°С. Растворитель отгоняют в вакууме. Полученный остаток перекристаллизовывают из ацетона. Выход 0.34 г (54%); белое кристаллическое вещество; т.пл. 169-170°С (разл.). Спектр ЯМР1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (3Н,3JHH=6.8 Гц, СН3С11Н22), 1.19-1.27 м (18Н, 9СН2), 1.47 с (6Н, 2СН3), 1.75 уш.с (2Н, СН2), 2.38 с (3Н, СН3), 3.34 с (6Н, 2CH3N+), 3.60-3.65 м (2Н, CH2N+), 5.08 с (2Н, СН2), 5.17 с (2Н, СН2), 8.12 с (1H, СНпир). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.19 с (СН3), 18.94 с (СН3), 22.74 с (СН2), 23.08 с (СН2), 24.93 с (С(СН3)2), 26.42 с (СН2), 29.38 с (СН2), 29.44 с (СН2), 29.51 с (СН2), 29.63 с (СН2), 31.95 с (СН2), 49.50 с (CH3N+), 59.76 с (CH2O), 62.22 с (CH2N+), 63.72 с (CH2N+), 100.47 с (С(СН3)2), 117.32 с (Спир), 128.91 с (Спир), 144.09 с (Спир), 146.79 с (Спир), 150.93 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 405.3476 C25H45N2O2Cl. Вычислено [М-Cl]+ 405.3476.
Пример 20
5-((Додецилдиметиламмонио)метил)-3-гидрокси-4-(гидроксиметил)-2-метилпиридин-1-ий дихлорид (I-20)
К раствору 0.10 г (0.2 ммоль) соединения I-19 в 30 мл воды добавляют 1 мл конц. HCl, после чего реакционную смесь перемешивают в течение 24 часов при температуре 60°С. Затем растворитель отгоняют в вакууме. Выход 0.10 г (количественный); белое кристаллическое вещество; т.пл. 169-170°С (разл.). Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.84 т (3Н,3JHH=6.6 Гц, CH3C11H22). 1.24-1.28 м (18Н, 9СН2), 1.76 уш.с (2Н, СН2), 2.70 с (3Н, СН3), 3.02 с (6Н, 2CH3N+), 3.43-3.47 м (2Н, CH2N+), 4.89 с (2Н, СН2), 4.94 с (2Н, СН2), 8.52 с (1Н, СНпир). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м.д.: 14.01 с (СН3), 15.03 с (СН3), 21.95 с (СН2), 22.14 с (СН2), 25.87 с (СН2), 28.60 с (СН2), 28.76 с (СН2), 28.86 с (СН2), 29.00 с (СН2), 29.07 с (СН2), 31.34 с (СН2), 48.83 с (СН3Ю, 55.75 с (CH2O), 59.59 с (CH2N+), 64.83 с (CH2N+), 124.74 с (Спир), 135.66 с (Спир), 143.80 с (Спир), 145.93 с (Спир), 153.22 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Н-2Cl]+ 365.3163 C22H42N2O2Cl2. Вычислено [М-Н-2Cl]+ 365.3163.
Пример 21
N-((5-Ацетокси-4,6-диметилпиридин-3-ил)метил)-N,N-диметил октан-1-аммоний хлорид (I-21)
Получение 3-ацетокси-5-хлорометил-2,4-диметилпиридин (промежуточное вещество 9): В 30 мл абсолютного дихлорметана при перемешивании добавляют 1.00 г (4.8 ммоль) 3-гидрокси-5-хлорометил-2,4-диметилпиридиний хлорида 8 [Wilson Е., Tishler М. Nitrogen Mustards // J.Am. Chem. Soc. - 1951. - V. 73, N.8. - P. 3635-3641] и последовательно 1.54 мл (11.1 ммоль) триэтиламина и 0.44 мл (6.2 ммоль) ацетилхлорида. Реакционную массу кипятят 3 часа. Раствор концентрируют до 10 мл и промывают водой. Водный слой дополнительно промывают дихлорметаном. Объединенные органические части высушивают в вакууме и очищают с помощью колоночной хроматографии (элюент: этилацетат-дихлорметан (1:2)). Выход: 0.93 г (90%), красное кристаллическое вещество, т.пл. 59°С. Спектр1Н ЯМР (400 МГц, CDCl3) δ, м.д: 2.22 с (3Н, СН3), 2.37 с (3Н, СН3), 2.39 с (3Н, СН3), 4.62 с (2Н, СН2), 8.29 с (1H, CHPyr). Спектр ЯМР13С (100 МГц, CDCl3) δ, м.д: 12.00 с (СН3), 19.65 с (СН3), 20.57 с (СН3), 41.56 с (СН2), 130.93 с (Cpyr), 139.44 с (Cpyr), 145.15 с (Cpyr), 146.75 с (Cpyr), 152.12 с (Cpyr), 168.36 с (С=O). Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 214.0629. C10H12ClNO2. Вычислено [М+Н]+ 214.0635.
Получение N-((5-ацетокси-4,6-диметилпиридин-3-ил)метил)-N,N-диметилоктан-1-аммоний хлорида: К раствору 0.15 г (0.7 ммоль) соединения 9 в 30 мл ДМФА добавляют 0.20 мл (0.7 ммоль) N,N-диметилоктиламина и перемешивают 20 ч при 50°С. Растворитель отгоняют в вакууме. Полученный остаток перекристаллизовывают из смеси ацетон/диэтиловый эфир (5:1). Выход 0.14 г (47%); белое кристаллическое вещество; т.пл. 169-170°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.82 т (3Н,3JHH=6.8 Гц, СН3С7Н14), 1.18-1.26 м (10Н, 5СН2), 1.72 уш.с (2Н, СН2), 2.34 с (3Н, СН3), 2.36 (3Н, СН3), 2.43 (3Н, СН3), 3.27 с (6Н, 2CH3N+), 3.57-3.61 м (2Н, CH2N+) 5.29 с (2Н, CH2N+), 8.51 с (1H, СНпир). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.08 с (СН3), 14.43 с (СН3), 19.68 с (СН3), 20.50 с (СН2), 22.59 с (СН2), 23.00 с (СН2), 26.39 с (СН2), 29.05 с (СН2), 29.26 с (СН2), 31.64 с (СН2), 49.26 с (CH3N+), 62.97 с (CH2N+), 63.72 с (CH2N+), 122.04 с (Спир), 143.03 с (Спир), 145.55 с (Спир), 151.19 с (Спир), 153.83 с (Спир), 168.20 с (С=O). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 335.2693 C20H35N2O2Cl. Вычислено [М-Cl]+ 335.2693.
Пример 22
N-((5-Ацетокси-4,6-диметилпиридин-3-ил)метил)-N,N-диметилдодекан-1-аммоний хлорид (I-22)
Синтезируют и разрабатывают аналогично соединению I-21 из 0.18 г (0.9 ммоль) соединения 9 и 0.17 мл (0.9 ммоль) N,N-диметилдодециламина. Выход 0.15 г (50%); белое кристаллическое вещество; т.пл. 169-170°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.84 т (3Н,3JHH=6.8 Гц, CH3C11H22), 1.20-1.28 м (20Н, 10СН2), 1.73 уш. с (2Н, СН2), 2.35 с (3Н, СН3), 2.37 (3Н, СН3), 2.44 (3Н, СН3), 3.28 с (6Н, 2CH3N+), 3.57-3.61 м (2Н, CH2N+) 5.29 с (2Н, CH2N+), 8.51 с (1Н, СНпир). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.19 с (СН3), 14.46 с (СН3), 19.72 с (СН3), 20.52 с (СН2), 22.74 с (СН2), 23.04 с (СН2), 26.42 с (СН2), 29.35 с (СН2), 29.38 с (СН2), 29.43 с (СН2), 29.50 с (СН2), 29.64 с (СН2), 49.31 с (CH3N+), 63.03 с (CH2N+), 63.74 с (CH2N+), 122.01 с (Спир), 143.06 с (Спир), 145.59 с (Спир), 151.20 с (Спир), 153.91 с (Спир), 168.23 с (С=O). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 391.3319 C25H43N2O2Cl. Вычислено [М-Cl]+ 391.3319.
Пример 23
N-((5-Ацетокси-4,6-диметилпиридин-3-ил)метил)-N,N-диметилоктадекан-1-аммоний хлорид (I-23)
Синтезируют и разрабатывают аналогично соединению I-21 из 0.18 г (0.9 ммоль) соединения 9 и 0.26 мл (0.9 ммоль) N,N-диметилоктадециламина. Выход 0.19 г (53%); белое кристаллическое вещество; т.пл. 159-160°С (разл.). Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.85 т (3Н,3JHH=6.7 Гц, CH3C16H32), 1.21-1.29 м (30Н, 15СН2), 1.74 уш.с (2Н, СН2), 2.36 с (3Н, СН3), 2.39 (3Н, СН3), 2.46 (3Н, СН3), 3.29 с (6Н, 2CH3N+), 3.57-3.61 м (2Н, CH2N+) 5.30 с (2Н, CH2N+), 8.50 с (1H, СНпир). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.22 с (СН3), 14.51 с (СН3), 19.75 с (СН3), 20.55 с (СН2), 22.79 с (СН2), 23.07 с (СН2), 26.44 с (СН2), 29.39 с (СН2), 29.46 с (СН2), 29.55 с (СН2), 29.69 с (СН2), 29.76 с (СН2), 29.80 с (СН2), 32.02 с (СН2), 49.36 с (CH3N+), 63.10 с (CH2N+), 63.79 с (CH2N+), 122.01 с (СН3С(O)), 143.13 с (Спир), 145.64 с (Спир), 153.18 с (Спир), 153.98 с (Спир), 168.26 с (С=O). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 475.4258 C30H55N2O2Cl. Вычислено [M-Cl]+ 475.4258.
Пример 24
5-((Диметил(октил)аммонио)метил)-3-гидрокси-2,4-диметил-1-пиридиний дихлорид (I-24)
К раствору 0.10 г (0.3 ммоль) соединения I-21 в 30 мл воды добавляют 1 мл конц. HCl, после чего реакционную смесь перемешивают в течение 24 часов при температуре 60°С. Затем растворитель отгоняют в вакууме. Выход 0.98 г (количественный), белое кристаллическое вещество; т.пл. 186-188°С (разл.). Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.87 т (3Н,3JHH=6.8 Гц, CH3C11H22), 1.27-1.31 м (10Н, 5СН2), 1.77 уш. с (2Н, СН2), 2.50 с (3Н, СН3), 2.68 (3Н, СН3), 2.99 с (6Н, 2CH3N+), 3.42-3.46 м (2Н, CH2N+) 4.78 с (2Н, CH2N+), 8.49 с (1H, СНпир), 10.96 с (1H, ОН). Спектр ЯМР13С {1H} (100 МГц, ДМСО-d6) δ, м.д.: 13.94 с (СН3), 14.87 с (СН3), 15.43 с (СН3), 21.83 с (СН2), 22.03 с (СН2), 25.84 с (СН2), 28.41 с (СН2), 28.48 с (СН2), 31.14 с (СН2) 48.66 с (CH3N+), 60.43 с (CH2N+), 64.48 с (CH2N+), 124.81 с (Спир), 136.27 с (Спир), 142.15 с (Спир), 152.87 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Н-2Cl]+ 293.2587 C18H34N2OCl. Вычислено [М-Н-2Cl]+ 293.2587.
Пример 25
5-((Диметил(додецил)аммонио)метил)-3-гидрокси-2,4-диметил-1-пиридиний дихлорид (I-25)
К раствору 0.10 г (0.2 ммоль) соединения I-22 в 30 мл воды и 10 мл этилового спирта добавляют 1 мл конц. HCl, после чего реакционную смесь перемешивают в течение 24 часов при температуре 60°С. Затем растворитель отгоняют в вакууме. Выход 0.99 г (количественный); белое кристаллическое вещество; т.пл. 187-188°С (разл.). Спектр ЯМР1Н (400 МГц, CD3OD) δ, м.д.: 0.88 т (3Н,3JHH=6.7 Гц, CH3C11H22), 1.28-1.42 м (9Н, 18СН2), 1.90 уш.с (2Н, СН2), 2.60 с (3Н, СН3), 2.70 (3Н, СН3), 3.09 с (6Н, 2CH3N+), 3.50 уш.с (2Н, CH2N+) 4.82 с (2Н, CH2N+), 8.49 с (1Н, СНпир). Спектр ЯМР13С {1Н} (100 МГц, CD3OD) δ, м.д.: 14.43 с (СН3), 15.47 с (СН3), 15.63 с (СН3), 23.73 с (СН2), 23.81 с (СН2), 27.50 с (СН2), 30.32 с (СН2), 30.46 с (СН2), 30.58 с (СН2), 30.65 с (СН2), 30.74 с (СН2), 33.06 с (СН2), 50.29 с (CH3N+), 62.69 с (CH2N+), 67.40 с (CH2N+), 126.59 с (Спир), 136.93 с (Спир), 143.83 с (Спир), 148.57 с (Спир), 155.46 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Н-2Cl]+349.3213 C22H42N2OCl2. Вычислено [M-H-2Cl]+ 349.3213.
Пример 26
5-((Диметил(октадецил)аммонио)метил)-3-гидрокси-2,4-диметил-1-пиридиний дихлорид (I-26)
К раствору 0.10 г (0.2 ммоль) соединения 1-23 в 30 мл воды и 10 мл этилового спирта добавляют 1 мл конц. HCl, после чего реакционную смесь перемешивают в течение 24 часов при температуре 60°С. Затем растворитель отгоняют в вакууме. Выход 0.99 г (количественный); белое кристаллическое вещество; т.пл. 185-187°С (разл.). Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.85 т (3Н,3JHH=6.7 Гц, СН3С17Н34), 1.23-1.33 м (30Н, 15СН2), 1.77 уш.с (2Н, СН2), 2.50 с (3Н, СН3), 2.68 (3Н, СН3), 2.99 с (6Н, 2CH3N+), 3.42-3.46 м (2Н, CH2N+) 4.77 с (2Н, CH2N+), 8.49 с (1Н, СНпир), 10.94 с (1Н, ОН). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м.д.: 13.94 с (СН3), 14.86 с (СН3), 15.46 с (СН3), 21.85 с (СН2), 22.08 с (СН2), 25.85 с (СН2), 28.56 с (СН2), 28.68 с (СН2), 28.79 с (СН2), 29.03 с (СН2), 31.27 с (СН2) 48.66 с (CH3N+), 60.42 с (CH2N+), 64.50 с (CH2N+). 124.81 с (Спир), 136.29 с (Спир), 142.17 с (Спир), 152.87 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Н-2Cl]+ 433.4152 C28H54N2OCl2. Вычислено [М-Н-2Cl]+ 433.4152.
Пример 27
N,N-Диметил-N-((3,3,9,9-тетраметил-7,11-дигидро-1H-[1,3]диоксепино[5,6-b][1,3]диоксо[5,4-d]пиридин-5-ил)метил)октан-1-аммониум хлорид (I-27)
К раствору 0.30 г соединения 10 [Pugachev M.V., Shtyrlin N.V., Nikitina E.V., Sysoeva LP., Abdullin T.I., Iksanova A.G., Ilaeva A.A., Berdnikov E.A., Musin R.Z., Shtyrlin Yu.G. Synthesis and antibacterial activity of novel phosphonium salts on the basis of pyridoxine // Bioorg. Med Chem. - 2013. - V. 21, Iss. 14. - P. 4388-4395] (1.0 ммоль) в 30 мл этанола добавляют 0.2 мл (1.0 ммоль) N,N-диметилоктиламина. Реакционную смесь перемешивают при 50°С в течение 8 часов, далее растворитель удаляют в вакууме. Полученную массу кипятят в петролейном эфире 30 мин. Осадок отделяют и сушат в вакууме. Выход 0.49 г (93%); маслообразное вещество. Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.82 т (3Н,3JHH=6.8 Гц, СН3С7Н14), 1.21-1.29 м (10Н, 5СН2), 1.45 с (6Н, 2СН3), 1.51 с (6Н, 2СН3), 1.78-1.88 м (2Н, СН2), 3.35 с (6Н, 2CH3N+), 3.46-3.51 м (2Н, CH2N+), 4.50 с (2Н, СН2), 4.60 с (2Н, СН2), 4.69 с (2Н, СН2), 4.75 с (2Н, СН2). Спектр ЯМР13С {1Н} (100 МГц, CDCl3) δ, м.д.: 14.08 с (СН3), 22.57 с (СН2), 22.97 с (СН2), 23.50 с (СН3), 24.61 с (СН3), 26.23 с (СН2), 29.07 с (СН2), 29.20 с (СН2), 31.67 с (СН2), 51.73 с (CH3N+), 58.10 с (CH2N+), 58.29 с (CH2N+), 60.56 с (CH2O), 64.35 с (CH2O), 66.16 с (CH2O), 101.10 с (С), 102.66 с (С), 125.95 с (Спир), 131.61 с (Спир), 133.25 с (Спир), 146.69 с (Спир), 149.92 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 435.3217 C25H43N2O4Cl. Вычислено [М-Cl]+ 435.3217.
Пример 28
N,N-Диметил-N-((3,3,9,9-тетраметил-7,11-дигидро-1H-[1,3]диоксепино[5,6-b][1,3]диоксо[5,4-d]пиридин-5-ил)метил)октадекан-1-аммониум хлорид (I-28)
Синтезируют и разрабатывают аналогично соединению I-27 из 0.30 г (1.0 ммоль) соединения 10 и 0.36 мл (1.0 ммоль) N,N-диметилоктодециламина. Выход 0.56 г (95%); маслообразное вещество. Спектр ЯМР1Н (400 МГц, CDCl3) δ, м.д.: 0.85 т (3Н,3JHH=6.8 Гц, СН3С17Н34), 1.23-1.33 м (30Н, 15СН2), 1.49 с (6Н, 2СН3), 1.56 с (6Н, 2СН3), 1.78-1.91 м (2Н, СН2), 3.39 с (6Н, 2CH3N+), 3.51-3.55 м (2Н, CH2N+), 4.54 с (2Н, СН2), 4.63 с (2Н, СН2), 4.73 с (2Н, СН2), 4.79 с (2Н, СН2). Спектр ЯМР13С {1H} (100 МГц, CDCl3) δ, м.д.: 14.22 с (СН3), 22.77 с (СН2), 23.07 с (СН2), 23.58 с (СН3), 24.69 с (СН3), 26.32 с (СН2), 29.36 с (СН2), 29.44 с (СН2), 29.52 с (СН2), 29.60 с (СН2), 29.69 с (СН2), 29.75 с (СН2), 29.79 с (СН2), 32.00 с (СН2), 51.80 с (CH3N+), 58.17 с (CH2N+), 58.37 с (CH2N+), 60.63 с (СН2О), 64.47 с (CH2O), 66.22 с (CH2O), 101.21 с (С), 102.75 с (С), 126.06 с (Спир), 131.72 с (Спир), 133.28 с (Спир), 146.80 с (Спир), 150.01 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 575.4782 C35H63N2O4Cl Вычислено [М-Cl]+ 575.4782.
Пример 29
8-((Диметил(октил)аммонио)метил)-5,6-бис(гидроксиметил)-2,2-диметил-4Н-[1,3]диоксино[4,5-с]пиридин-7-иум дихлорида (I-29)
К 0.10 г (0.2 ммоль) соединения 1-27 в 4 мл воды и 1 мл этанола добавляют 0.1 мл конц. HCl. Реакционную смесь перемешивают под действием микроволнового излучения в течение 1 часа при температуре 60°С. Растворитель удаляют в вакууме. Выход 0.1 г (количественный), желтое маслообразное вещество. Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.87 т (3Н,3JHH=6.5 Гц, СН3С7Н14), 1.27-1.29 м (10Н, 5СН2), 1.53 с (6Н, 2СН3), 1.74-1.86 м (2Н, СН2), 3.06 с (6Н, 2CH3N+), 3.26-3.31 м (2Н, CH2N+), 4.46 с (2Н, СН2), 4.56 с (2Н, СН2), 4.60 с (2Н, СН2), 5.07 с (2Н, СН2). Спектр ЯМР13С {1H} (100 МГц, ДМСО-d6) δ, м.д.: 13.95 с (СН3), 21.93 с (СН2), 22.04 с (СН2), 24.38 с (СН2), 25.79 с (СН2), 28.49 с (СН2), 31.16 с (СН2), 50.33 с (CH3N+), 55.68 с (CH2N+), 58.57 с (CH2N+), 60.58 с (CH2O), 62.85 с (CH2O), 63.54 с (CH2O), 100.42 с (С(СН3)2), 129.19 с (Спир), 132.99 с (Спир), 133.90 с (Спир), 147.37 с (Спир), 149.77 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-2Cl-H]+ 395.2904 C22H40Cl2N2O4. Вычислено [М-2Cl-Н]+ 395.2899.
Пример 30
2-((Диметил(октадецил)аммоние)метил)-3-гидрокси-4,5,6-трис(гидроксиметил)пиридин-1-иум дихлорид (I-30)
К 0.10 г (0.2 ммоль) соединения I-28 в 30 мл воды и 5 мл этанола добавляют 1 мл конц. HCl. Реакционную смесь перемешивают в течение 24 часов при температуре 60°С. Растворитель удаляют в вакууме. Выход 0.1 г (количественный), желтое маслообразное вещество. Спектр ЯМР1Н (400 МГц, ДМСО-d6) δ, м.д.: 0.85 т (3Н,3JHH=6.8 Гц, CH3C17H34), 1.23-1.29 м (30Н, 15СН2), 1.76-1.86 м (2Н, СН2), 3.06 с (6Н, 2CH3N+), 3.29-3.33 м (2Н, CH2N+), 4.58 с (2Н, СН2), 4.62 с (2Н, СН2), 4.63 с (2Н, СН2), 4.86 с (2Н, СН2). Спектр ЯМР13С {1Н} (100 МГц, ДМСО-d6) δ, м.д.: 13.96 с (СН3), 22.00 с (СН2), 22.10 с (СН2), 25.83 с (СН2), 28.59 с (СН2), 28.71 с (СН2), 28.86 с (СН2), 29.05 с (СН2), 31.30 с (СН2), 50.27 с (CH3N+), 55.67 с (CH2N+), 56.59 с (CH2N+), 61.05 с (CH2O), 62.80 с (CH2O), 63.76 с (CH2O), 134.34 с (Спир), 135.53 с (Спир), 136.67 с (Спир), 150.24 с (Спир), 152.40 с (Спир). Масс-спектр (HRMS-ESI): Найдено [М-2Cl-H]+ 495.4156 C29H56Cl2N2O4. Вычислено [М-2Cl-Н]+ 495.4151.
Исследование антибактериальной активности четвертичных аммониевых солей на основе производных витамина В6
Антибактериальная активность новых соединений оценивают на штаммах Staphylococcus aureus subsp. aureus (АТСС® 29213™), Staphylococcus epidermidis (Клинический изолят, предоставлен Институтом эпидемиологии и микробиологии, Казань, Россия), Micrococus luteus (Клинический изолят предоставлен Институтом эпидемиологии и микробиологии, Казань, Россия), Escherichia coli Escherichia coli (АТСС® 25922™), Salmonella typhimurium TA100 и Pseudomonas aeruginosa (ATCC® 27853™). МПК (Минимальную подавляющую концентрацию) определяют на 96-луночных культуральных планшетах с помощью метода серийных разведений в питательной среде Мюллера-Хинтон (далее - среда МХ-бульон). Для инокуляции используют стандартную микробную взвесь, эквивалентную 0.5 по стандарту МакФарланда, полученную путем разведения в 100 раз 18-часовой культуры питательным бульоном MX, после чего концентрация микроорганизма в ней составляет 1-9×106 КОЕ/мл. Полученную суспензию порциями по 0.1 мл инокулируют в 0.1 мл раствора тестируемого вещества. Начальный раствор с концентрацией соединения 2 мг/мл получают путем растворения/внесения в 100 мкл МХ-бульона 2 (двух) мкл раствора соединения с концентрацией 100 мг/мл в ДМСО. Растворы тестируемых соединений с более низкими концентрациями готовят последовательным разбавлением питательной средой (МХ-бульоном) начального раствора соединений в МХ-бульоне с концентрацией 2 мг/мл. Конечная концентрация тестируемых веществ после инокуляции варьируется от 1000 до 0.5 мкг/мл. Инкубирование проводят при 37°С в течение 24 ч, в качестве контроля используют питательную среду без инокулированной культуры бактерий. Измерение оптической плотности проводят фотометрически на спектрофотометре СФ-2000 при 600 нм. Минимальную подавляющую концентрацию определяют как наименьшую концентрацию тестируемого вещества, при которой отсутствует видимый рост микроорганизма. В качестве препаратов сравнения используют мирамистин, бензалкония хлорид и ванкомицин в тех же концентрациях, а также наиболее активные из запатентованных ранее четвертичных аммониевых солей пиридоксина формулы II-1 и II-2 [Патент РФ. №2561281, опубл. 27.08.2015].

Как видно из представленных далее в Таблице 1 данных, большинство из заявленных соединений обладают выраженной антибактериальной активностью по отношению к исследуемым штаммам грамположительных микроорганизмов. При этом наиболее активными оказались соединения I-2, I-13, I-16, I-18, I-19 и I-26, антибактериальное действие которых по отношению к исследуемым микроорганизмам оказалось сопоставимым или превосходящим исследуемые препараты сравнения и соединения-аналоги II-1 и II-2. Основываясь на указанной таблице, возможно сделать вывод о том, что заявленное техническое решение обеспечивает реализацию заявленных целей.


Исследование токсичности in vitro четвертичных аммониевых солей на основе производных витамина В6
Цитотоксичность наиболее активных из заявляемых соединений оценивают с использованием пролиферативного МТТ-теста на клетках HEK-293. Линию клеток HEK-293 получают из АТСС (cat. # CRL-1573) и культивируют согласно рекомендациям АТСС в 75 см флаконах при 37°С и 5% CO2. Клетки пересевают 1 раз в неделю в отношении 1:10. Клетки культивируют в среде α-МЕМ с добавлением 10%-ной эмбриональной телячьей сыворотки, L-глутамина и 1% пенициллина-стрептомицина до образования монослоя. Для получения клеточной суспензии монослой клеток трипсинизируют раствором Трипсина-ЭДТА с последующей инактивацией трипсина добавлением среды α-МЕМ с сывороткой. Далее клетки осаждают центрифугированием при 500 g. Осадок ресуспендируют в фосфатно-солевом буфере. Оценку жизнеспособности и подсчет плотности производят после окраски клеток 0.4%-ным раствором трипанового синего в камере Нойбауэра. В эксперименте использовали суспензии с количеством жизнеспособных клеток не менее 90%.
Клетки (2 тыс. клеток в лунке) культивируют в 90 мкл среды α-МЕМ в стандартных условиях в 96-луночном культуральном планшете в течение суток (для их прикрепления к поверхности дна лунки). Далее добавляют 10 мкл стокового раствора каждого соединения и инкубируют в стандартных условиях в течение 72 часов. Концентрации стоковых растворов составляли 10 мг/мл в воде. Далее среду с препаратами заменяют на чистую среду α-МЕМ 80 мкл и добавляют по 20 мкл МТТ-реагента (5 мг/мл), инкубируют в CO2-инкубаторе при температуре 37°С в течение 3.5 часов, затем убирают среду и добавляют 100 мкл ДМСО. По истечении 10 минут измеряют оптическую плотность клеточных растворов при 555 нм (референтная длина волны - 650 нм) на планшетном анализаторе TECAN (Швейцария).
Результаты обрабатывают с помощью программного обеспечения OriginPro 8. Данные для исследуемых соединений представляют в процентном отношении к контролю, не подвергавшемся действию препаратов. Строят график зависимости процентного соотношения от логарифма концентраций. Далее зависимость доза-эффект подвергают анализу "DoseResp" в программном обеспечении OriginPro 8 и находят обратный логарифм концентрации в точке 50%. По обратному логарифму находят концентрацию полумаксимального ингибирования роста (IC50).
Как видно из представленных далее в Таблице 2 данных, большинство из протестированных соединений являются менее токсичными, чем препараты бензалкония хлорид и мирамистин, а также ранее исследованные соединения-аналоги II-1 и II-2. Соединение I-4 оказалось менее токсичным в 15 раз, чем ранее полученные прототипы II-1 и II-2. Таким образом, использование четвертичных аммониевых солей на основе производных витамина В6 представляет интерес при разработке новых высокоактивных и малотоксичных противомикробных препаратов, и является доказательством достижения заявленных целей предполагаемого изобретения.

Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, т.к. из исследованного заявителем уровня техники не выявлены технические решения, характеризующиеся заявленной совокупностью признаков, приведенных в независимом пункте формулы изобретения, которые обеспечивают достижение заявленных целей.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. оно не является очевидным для специалистов в указанной области техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, т.к. может быть реализовано в промышленности с применением известных веществ и известных методов синтеза.
Реферат
Изобретение относится к новым производным витамина Вобщей формулы (I), обладающим высокой антибактериальной активностью.где при R=R=N(CH)CH, R+R=-С(СН)O-, R=Н, n=2, m=0; при R=R=N(CH)CH, R+R=-C(CH)O-, R=H, n=2, m=0; при R=R=N(CH)CH, R+R=-C(CH)O-, R=H, n=2, m=0; при R=R=N(CH)CH, R=R=H, R=OH, n=2, m=1; при R=R=N(CH)CH, R=R=H, R=OH, n=2, m=1; при R=R=N(СН)CH, R=R=H, R=OH, n=2, m=1; при R=R=H, R+R=-CH(CH)O-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CH(CH)O-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CH(CH)O-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CH(C(CH))O-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CH(CH)O-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CH(CHCH(CH)CH)O-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CHO-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-С(цикло-СН)О-, R=N(СН)СН, n=1, m=0; при R=R=H, R+R=-CH(CH)O-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CH(CH)O-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CHO-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-CHO-, R=N(CH)CH, n=1, m=0; при R=R=H, R+R=-C(CH)O-, R=N(CH)CH, n=1, m=0; при R=R=R=H, R=OH, R=N(CH)CH, n=1, m=1; при R=R=R=H, R=C(O)CH, R=N(СН)СН, n=1, m=0; при R=R=R=H, R=C(O)CH, R=N(СН)СН, n=1, m=0; при R=R=R=H, R=C(O)CH, R=N(СН)СН, n=1, m=0; при R=R=R=R=H, R=N(CH)CH, n=1, m=1; при R=R=R=R=H, R=N(CH)CH, n=1, m=1; при R=R=R=R=H, R=N(CH)CH, n=1, m=1; при R=N(СН)СН, R+R=-C(CH)O-, R+R=-OC(CH)OCH-, n=1, m=0; при R=N(CH)CH, R+R=-C(CH)O-, R+R=-OC(CH)OCH-, n=1, m=0; при R=N(CH)CH, R+R=-C(CH)O-, R=OH, R=CHOH, n=1, m=1; при R=N(СН)СН, R=H, R=R=OH, R=CHOH, n=1, m=1. Изобретение может найти применение в медицине и ветеринарии. 1 з.п. ф-лы, 2 табл., 30 пр.
Формула


Комментарии