Противотуберкулезное средство на основе производного пиридоксина - RU2772219C1
Код документа: RU2772219C1
Чертежи



Описание
Изобретение относится к химии органических гетероциклических соединений, а именно - к новому производному пиридоксина формулы I в виде смеси E и Z-изомеров, проявляющему противотуберкулезную активность. Соединение может найти применение в медицине и ветеринарии.

Туберкулез - инфекционное заболевание, с которым человечество борется уже не одно тысячелетие. В настоящее время туберкулез занимает девятое место среди основных причин смертности в мире. Согласно оценкам ВОЗ, в 2020 году число умерших от туберкулеза составило 1.2 миллиона человек, а число вновь заболевших около 10 миллионов, причем порядка 500 тысяч из них заболели туберкулезом с множественной лекарственной устойчивостью (МЛУ-ТБ) - формой туберкулеза, вызываемой бактериями, нечувствительными к самым эффективным препаратам первого ряда - изониазиду и рифампицину - одновременно. Успех лечения МЛУ-ТБ составляет лишь около 50% и требует длительной терапии (от 12 месяцев и более) с использованием большого количества препаратов первого и второго ряда [World Health Organization. Global Tuberculosis Report. - Geneva, Switzerland, 2020. - 232 р.].
Важнейшим противотуберкулезным препаратом первого ряда является изониазид. Изониазид обладает высокой бактерицидной активностью (МИК = 0.05 мкг/мл) в отношении штаммов M. tuberculosis, превосходя все другие противотуберкулезные препараты. Изониазид является пролекарством и, проникнув в микобактерию путем пассивной диффузии, подвергается окислению ферментом каталазой-пероксидазой (синтез этого фремента контролирует ген katG) [C. Vilchèze, W.R. Jacobs Jr. The mechanism of isoniazid killing: clarity through the scope of genetics / Annu. Rev. Microbiol. - 2007. - V. 61. - P. 35-50.].
Важнейшими недостатками изониазида являются его гепатотоксическое и нейротоксическое действие. Кроме того, в настоящее время многие штаммы микобактерий выработали к нему устойчивость [P. Preziosi. Isoniazid: Metabolic Aspects and Toxicological Correlates / Curr. Drug Metab. - 2007. - V. 8, N. 8. - P. 839-851.].
Изоникотиноилгидразоны являются самым обширным классом производных изониазида, относящихся к классу гидразонов. Во-первых, их популярность объясняется легкостью образования иминной связи через конденсацию изониазида с карбонильными соединениями. Во-вторых, замещение терминального атома азота изониазида относительно лабильным фрагментом позволяет контролировать метаболизм и распределение [B. Mathew, J. Suresh, M.J. Ahsan, G.E. Mathew, D. Usman, P.N.S. Subramanyan, K.F. Safna, S. Maddela. Hydrazones as a Privileged Structural Linker in Antitubercular Agents: A Review / Infect. Disord. Drug Targets. - 2015. - V. 15, N. 2. -P. 76-88.].
Фтивазид (изоникотиноилгидразон 3-метокси-4-оксибензальдегида) - изоникотиноилгидразон, разработанный еще во времена СССР [М.Н. Щукина, Г.Н. Першин, Е.Д. Сазонова, О.О. Макеева Ароматические изоникотиноилгидразоны - новый класс химиотерапевтических противотуберкулезных веществ / Проблемы туберкулеза. - 1954. - №. 2. - С. 44-50.]. Фтивазид применяется при лечении лекарственно-чувствительного туберкулеза у людей с ослабленным иммунитетом, когда применение изониазида нежелательно [Машковский, М.Д. Лекарственные средства / М.Д. Машковский. 16 - е изд., перераб., испр. и доп. - М.: Новая волна: Издатель Умеренков, 2014. - 1216 с.]. Недостатками фтивазида являются, во-первых, его меньшая, по сравнению с изониазидом, противотуберкулезная активность (МИК = 1 мкг/мл) [А.В. Сыроешкин, Н.А. Степанова, П.И. Попов, А.В. Балышев, Т.В. Плетнева. Прогнозирование токсичности химических соединений группы противотуберкулезных лекарственных средств методом количественных корреляций структура-активность / Судебно-медицинская экспертиза - 2009. - №4. - С. 28-31], а во-вторых, быстрая выработка к нему устойчивости у микобактерий туберкулеза.
Салюзид (изоникотиноилгидразон 2-карбокси-3,4-диметоксибензальдегида) - еще один изоникотиноилгидразон, применяемый в клинической практике. Применение салюзида, также как и фтивазида, основано на его меньшей токсичности, которая позволяет проводить лечение больных с ослабленным иммунитетом [Машковский, М.Д. Лекарственные средства / М.Д. Машковский. 16 - е изд., перераб., испр. и доп. - М.: Новая волна: Издатель Умеренков, 2014. - 1216 с.]. Как и в случае с фтивазидом, салюзид проявляет более низкую противотуберкулезную активность и формирует устойчивость к нему у микобактерий туберкулеза.
Изоникотиноилгидразон пиридоксаля (PIH) - соединение, полученное конденсацией пиридоксаля (активной формы витамина В6) и изониазида - в 50-60-ых годах прошлого века рассматривался как перспективный противотуберкулезный препарат [Patent US2810725; C07D213/86. Pyridoxal derivatives of isonicotinic acid hydrazide / B. Jack; Olin Mathieson Chemical Corporation. - Опубл. - 22.10.1957.]. Однако в 1979 году выяснилось, что изоникотиноилгидразон пиридоксаля имеет сильное сродство к ионам железа, которое вызывает железодефицитную анемию [P. Ponka, J. Borova, J. Neuwirt, O. Fuchs Mobilization of iron from reticulocytes: Identification of pyridoxal isonicotinoyl hydrazone as a new iron chelating agent / FEBS Lett. - 1979. - V. 97, N. 2. - P. 317-321.]. По этой причине дальнейшая разработка этого соединения как противотуберкулезного препарата была прекращена.
Другой ближайший аналог заявленного изобретения - изоникотиноилгидразон 2-пиридилкарбальдегид [S. Ellis, D.S. Kalinowski, L. Leotta, M.L.H. Huang, P. Jelfs, V. Sintchenko, D.R. Richardson, J.A. Triccas Potent Antimycobacterial Activity of the Pyridoxal Isonicotinoyl Hydrazone Analog 2-Pyridylcarboxaldehyde Isonicotinoyl Hydrazone: A Lipophilic Transport Vehicle for Isonicotinic Acid Hydrazide / /Mol. Pharmacol. - 2014. - V. 85, N. 2. - P. 269-278.] хоть и проявляет высокую в сравнении с изониазидом противотуберкулезную активность, но также склонен к комплексообразованию с ионами железа, и поэтому вызывает аналогичные изоникотиноилгидразон пиридоксалю побочные эффекты [E. Becker, D.R. Richardson. Development of novel aroylhydrazone ligands for iron chelation therapy: 2-pyridylcarboxaldehyde isonicotinoyl hydrazone analogs / Transl. Res. - 1999. - V.134, N. 5. - P. 510-521.].
Следует отметить, что описанные выше лекарственные средства, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному изобретению вследствие того, что они не совпадают с заявляемым соединением по химической структуре, хотя и обладают сходной в целом противотуберкулезной активностью (совпадают по назначению), сопоставимой с заявленным техническим решением в большей или меньшей степени.
Задачей заявленного технического решения является создание нового высокоактивного и малотоксичного противотуберкулезного средства на основе производного пиридоксина, с целью расширения арсенала известных средств указанного назначения.
Техническим результатом заявленного технического решения является получение нового соединения формулы I, содержащего в своем составе как фрагмент природного соединения (пиридоксина), так и фрагмент противотуберкулезного препарата изониазида.
Задача решается, и указанный технический результат достигается посредством синтеза нового производного пиридоксина формулы I: (E, Z) - изоникотиноилгидразона 3-гидрокси-4,5-бис(гидроксиметил)-2-метилпиридин-6-карбальдегида:

Сущностью заявленного технического решения является производное пиридоксина I, обладающее противотуберкулезной активностью:

Заявленное техническое решение иллюстрируется Фиг.1 - Фиг.8.
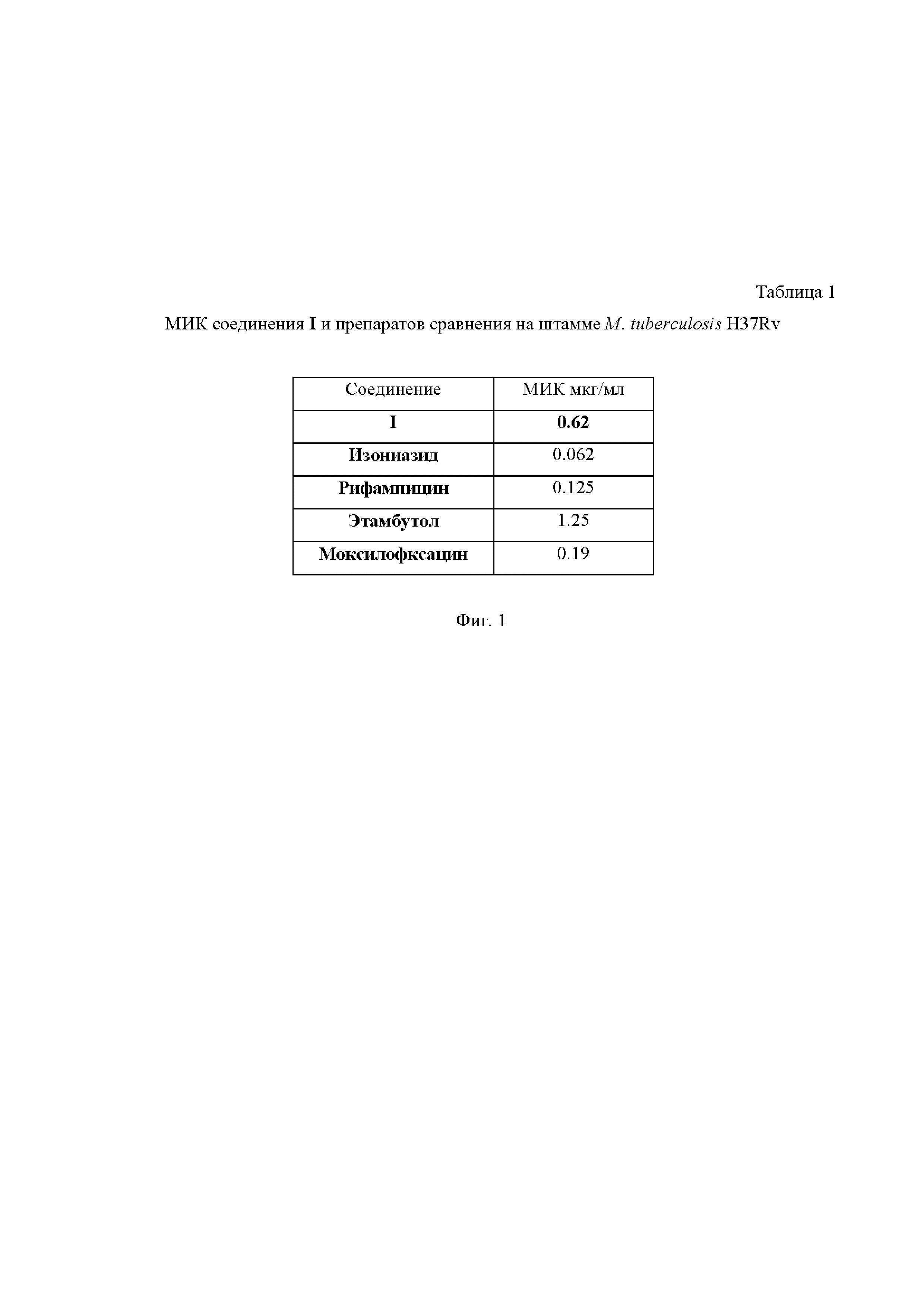
На Фиг. 1 приведена Таблица 1, в которой представлены значения минимальной ингибирующей концентрации (МИК) (в мкг/мл) для соединения I, а также препаратов сравнения на штамме M. Tuberculosis H37Rv.
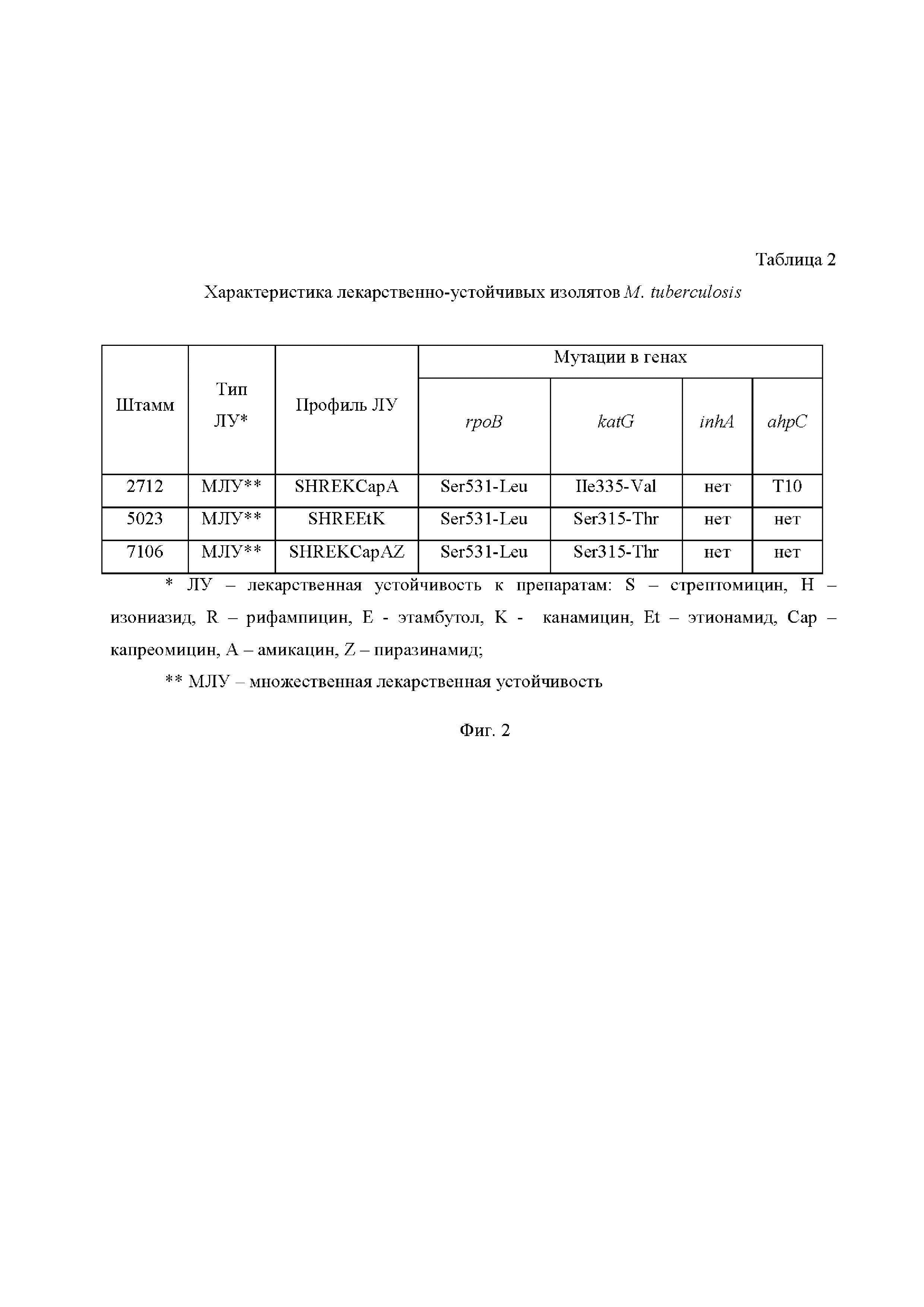
На Фиг. 2 приведена Таблица 2, в которой представлены характеристики лекарственно-устойчивых изолятов M. Tuberculosis, где:
ЛУ - лекарственная устойчивость к препаратам: S - стрептомицин, H - изониазид, R - рифампицин, E - этамбутол, K - канамицин, Et - этионамид, Cap - капреомицин, A - амикацин, Z - пиразинамид;
МЛУ - множественная лекарственная устойчивость.
На Фиг. 3 приведена Таблица 3, в которой представлены значения минимальной ингибирующей концентрации (МИК) (в мкг/мл) для соединения I на лекарственно-устойчивых изолятах M. Tuberculosis.
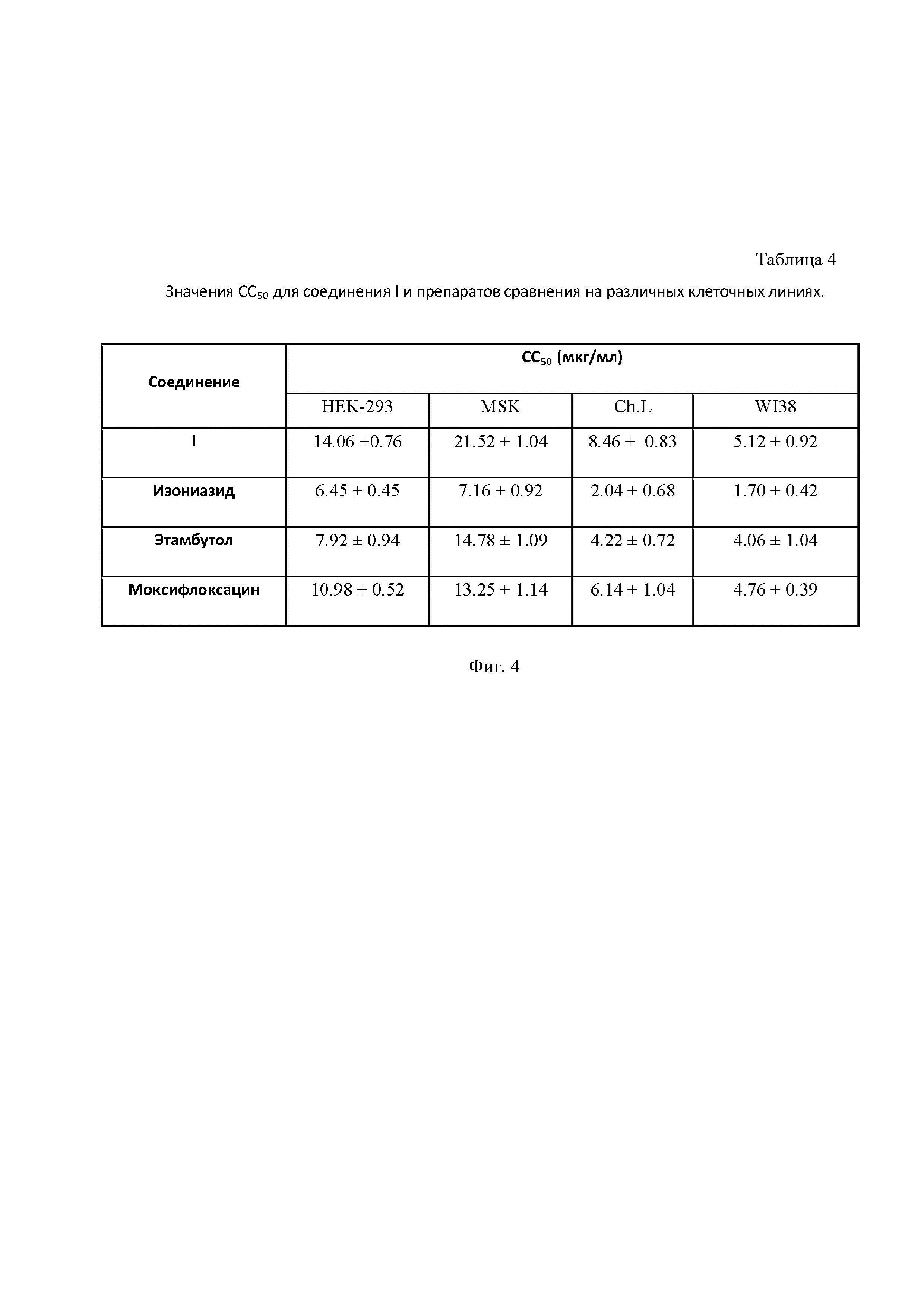
На Фиг. 4 приведена Таблица 4, в которой представлены значения СС50 для соединения I и препаратов сравнения на различных клеточных линиях.
На Фиг. 5 приведена Таблица 5, в которой представлены результаты исследования острой токсичности соединения I при внутрижелудочном введении мышам.
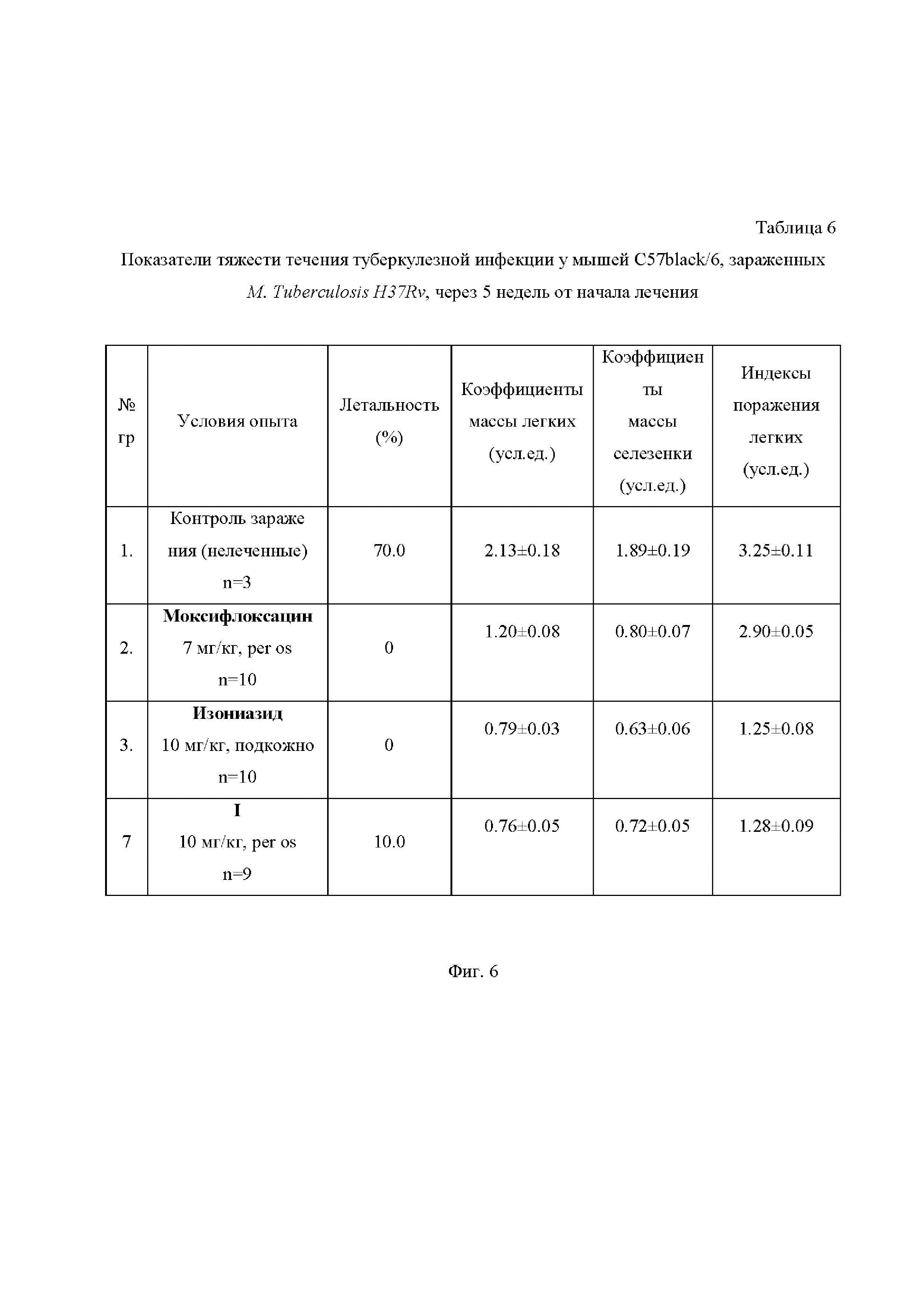
На Фиг. 6 приведена Таблица 6, в которой представлены показатели тяжести течения туберкулезной инфекции у мышей C57black/6, зараженных M. Tuberculosis H37Rv, через 5 недель от начала лечения.
На Фиг. 7 приведена Таблица 7, в которой представлена высеваемость микобактерий туберкулеза из легочной ткани мышей C57black/6, зараженных M. Tuberculosis H37Rv, через 5 недель от начала лечения.
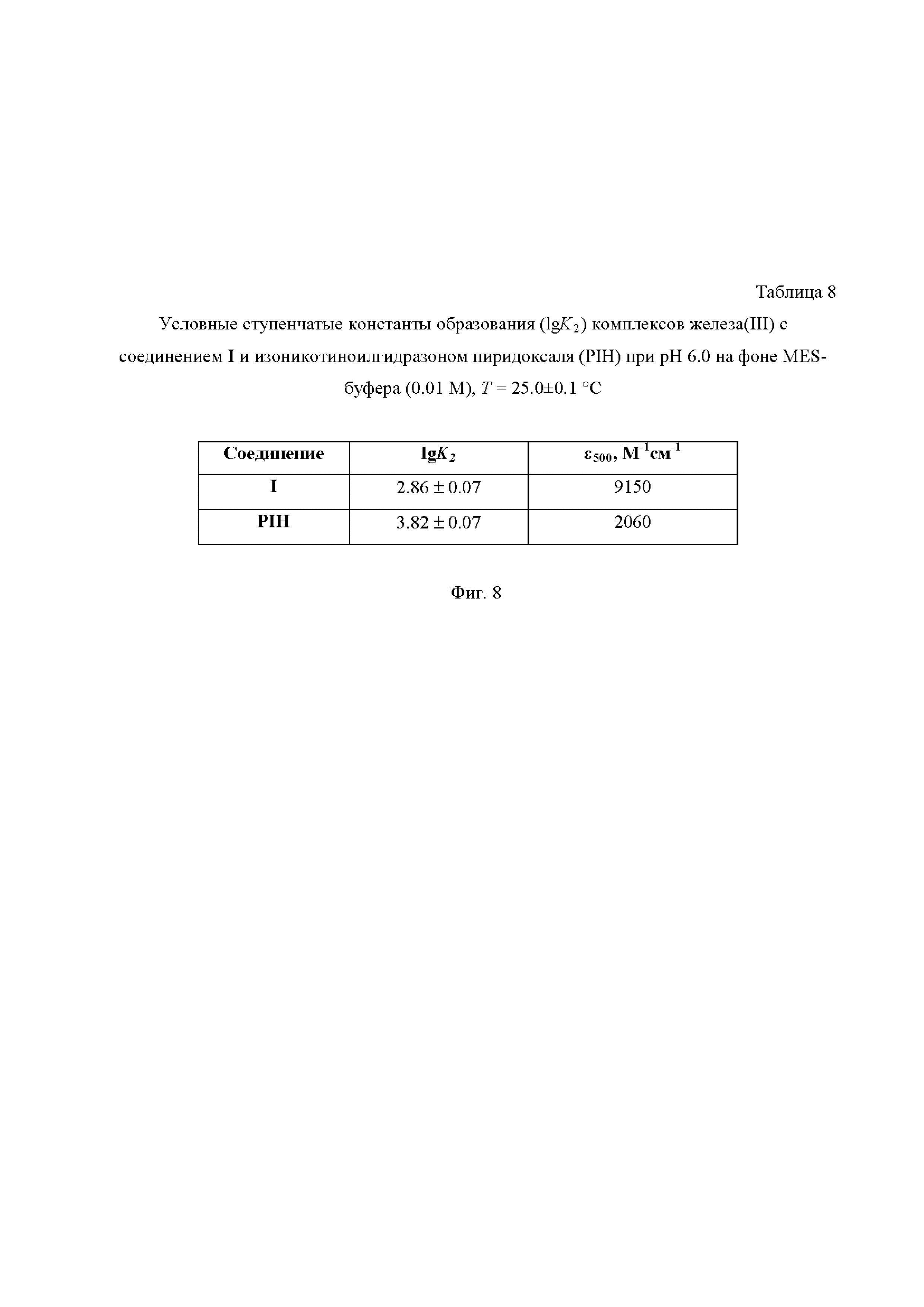
На Фиг. 8 приведена Таблица 8, в которой представлены условные ступенчатые константы образования (lgK2) комплексов железа(III) c соединениями I и изоникотиноилгидразоном пиридоксаля (PIH) при pH 6.0 на фоне MES-буфера (0.01 М), T = 25.0±0.1°C.
Далее заявителем приведено описание заявленного технического решения.
Заявленное соединение I получают по нижеприведенной Схеме 1:

Схема 1
Характеристики нового соединения, а также описание его синтеза, приведены далее в примерах конкретного выполнения.
Структура полученного соединения подтверждена методами масс-спектрометрии,1Н и13С ЯМР-спектроскопии. Спектры ЯМР регистрировали на приборе Bruker AVANCE-400. Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1H и13С). Температуру плавления определяли с помощью прибора Stanford Research Systems MPA-100 OptiMelt. ВЭЖХ/МС-эксперимент был проведен с использованием масс-спектрометра TripleTOF 5600, AB Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 еВ.
Далее заявителем приведены примеры конкретного выполнения заявленного технического решения.
Пример 1. Получение соединения формулы (I) - (E, Z) - изоникотиноилгидразона 3-гидрокси-4,5-бис(гидроксиметил)-2-метилпиридин-6-карбальдегида (см. Схему 1).
Раствор альдегида 1 (0.45 г, 1.89 ммоль) [N.V. Shtyrlin, O.A. Lodochnikova, Yu.G. Shtyrlin Regioisomeric oximes and thiosemicarbazones derived from 6-substituted pyridoxines / Mendeleev Commun. - 2012. - V. 22, N. 3. - P. 169-170.] в 3 мл смеси H2O/HOAc (10:1) перемешивают в течение 5 часов при 60 °C. Затем добавляют изониазид (0.26 г, 1.89 ммоль) и реакционную смесь перемешивают еще 2 часа при той же температуре. Далее растворитель удаляют в вакууме, остаток заливают водой, нерастворившийся осадок отфильтровывают и промывают водой и метанолом.
Выход: 73% (0.43 г); смесь E:Z изомеров = 7:3; желтое кристаллическое вещество; т.пл. 198-205 °С (разл.).
Спектр1H ЯМР (ДМСО-d6) Е-изомер, δ, м.д.: 2.40 (c, 3H, CH3), 4.72 (c, 2H, CH2OH), 4.81 (c, 2H, CH2OH), 5.16 (т, 1Н,3JHH = 6.7 Гц, CH2OH), 7.77 (AA’ часть AA’XX’ системы, 2Н,3JHH= 6.0 Гц), 8.41 (с, 1Н, СН=N), 8.81 (XX’ часть AA’XX’ системы, 2Н,3JHH= 6.0 Гц), 12.26 (уш.с, 1H, NH).Спектр1H ЯМР (ДМСО-d6) Z-изомер, δ, м.д.: 2.49 (c, 3H, CH3), 4.72 (c, 2H, CH2OH), 4.81 (c, 2H, CH2OH), 5.35 (т, 1Н,3JHH = 5.1 Гц, CH2OH), 7.82 (д, AA’ часть AA’XX’ системы, 2Н,3JHH=6 Гц), 7.77 (с, 1Н, СН=N), 8.85 (д, XX’ часть AA’XX’ системы, 2Н,3JHH= 6 Гц), 15.96 (с, 1H, NH).
Спектр13C {1H} ЯМР (ДМСО-d6) смесь Е- и Z-изомеров, δ, м.д.: 19.54 (CH3), 19.57 (CH3), 54.95 (c, CH2), 55.66 (CH2), 55.85 (CH2), 55.87 (CH2), 121.11, 121.27, 121.56, 123.02, 133.06, 133.94, 134.31, 136.08, 137.93, 140.90, 140.79, 141.21, 141.55, 144.48, 146.09, 149.57, 149.97, 150.20, 150.44, 150.57, 150.81, 150.85 (Спир+С=N), 161.71 (C=O), 161.94 (C=O).
Масс-спектр (HRMS-ESI): Найдено 317.1252 [М+H]+. Вычислено для [C11H14NO4]+-317.1244.
Пример 2. Исследование противотуберкулезной активности соединения формулы I in vitro
Первоначально исследование противотуберкулезной активности соединения I проводили на чувствительном референтном штамме Mycobacterium tuberculosis H37Rv TBC # 1/47.
Минимальную ингибирующую концентрацию (МИК) определяли с помощью метода REMA [A. Martin, M. Camacho, F. Portaels, J.C. Palomino. Resazurin microtiter assay plate testing of Mycobacterium tuberculosis susceptibilities to second-line drugs: rapid, simple, and inexpensive method / Antimicrob. Agents Chemother. - 2003. - V. 47, N. 11. - P. 3616-3619.].
В качестве препаратов сравнения использовали широко используемые в клинической практике противотуберкулезные препараты изониазид, рифампицин, этамбутол, а также моксифлоксацин.
Трехнедельную культуру M. tuberculosis H37Rv TBC # 1/47 (источник - Институт гигиены и эпидемиологии, Прага. 1976 г., получен 03.10.2018 из ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России), выращенную на плотной яичной среде Левенштейна-Йенсена, вносили в сухую стерильную пробирку и затем дробно добавляли 5 мл бульона Миддлбрука 7Н9. Взвесь клеток оставляли для осаждения крупных конгломератов на 40 мин.
Стоковые растворы тестируемых соединений с концентрацией 10 мг/мл в диметилсульфоксиде в день опыта доводили до концентрации 10 мкг/мл бульоном Миддлбрука 7Н с ростовой добавкой OADC. Раствор исследуемого вещества вносили в 96-луночные стерильные планшеты и производили последовательное двукратное разведение. Конечные концентрации препарата: 0.02-0.04-0.08-0.16-0.31-0.62-1.25-2.5-5.0 мкг/мл.
Во все лунки вносили рабочую суспензию M. tuberculosis в объеме 100 мкл, после чего планшеты инкубировали в течение 7 дней в термостате при температуре +35 °С.
На 7 сутки инкубации во все лунки добавляли по 30 мкл водного раствора резазурина с концентрацией 0.01 %. Планшеты повторно инкубировали 18 ч при +35 °С. Рост бактерий регистрировали как визуально по изменению цвета индикатора резазурина (с голубого на розовый), так и с помощью планшетного флуориметра FLUOstarOptima (длина волны возбуждения - 520 нм, излучения - 590 нм). Величину МИК вычисляли как средние значения интенсивности свечения индикатора роста (резаруфина, в который превращается резазурин при воздействии комплекса редуктаз микроорганизмов). Минимальной ингибирующей концентрацией считали концентрацию препарата, в которой среднее значение флуоресценции значимо не превышало среднего значения 1 % контроля роста и/или точку выхода кривой на «плато». Полученные результаты представлены в Таблице 1 на Фиг.1.
Как видно из представленных данных, соединение I существенно превосходит по своей активности этамбутол, но несколько уступает рифампицину, моксифлоксацину и изониазиду по своей активности.
Далее для соединения I было проведено исследование противотуберкулезной активности на 3 клинических штаммах Mycobacterium tuberculosis с множественной лекарственной устойчивостью и различными сочетаниями мутаций в генах rpoB (резистентность к рифампицину), katG, inhA, ahpC (устойчивость к изониазиду). Штаммы были выделены из респираторного материала больных впервые выявленным инфильтративным туберкулезом легких, проходивших лечение в клинике ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии» Минздрава России в период с 2009 по 2011 годы (штамм 5023 - в 2009 г.; штамм 7126 - в 2010 г.; штамм 2712 - в 2011 г.). Характеристика штаммов приведена в Таблице 2 на Фиг.2.
Данные по исследованию представлены в Таблице 3 на Фиг.3. Для соединения I величина МИК на всех клинических штаммах составила 2.5 мкг/мл, что представляет особенный интерес, поскольку все эти штаммы устойчивы к изониазиду.
Пример 3. Исследование цитотоксичности соединения I in vitro
Для соединения I была проведена оценка токсичности in vitro на 4 условно-нормальных клеточных линиях (WI38 - эмбриональные клетки легкого человека, HEK 293 - эмбриональные клетки почки человека, Ch.L -клетки печени, MSK-мультипатентные клетки)) с использованием МТT-теста в сравнении с изониазидом, этамбутолом и моксифлоксацином.
Клетки (3 тыс. клеток в лунке) культивировали в 90 мкл среды α-MEM в стандартных условиях в 96-луночном культуральном планшете в течение суток (для их прикрепления к поверхности дна лунки). Далее добавляли 10 мкл раствора тестируемого соединения и инкубировали в стандартных условиях в течение 72 часов. Концентрация стокового раствора составляла 10 мг/мл. Далее среду с препаратами заменяли на чистую среду α-MEM 80 мкл и добавляли по 20 мкл МТТ-реагента (5 мг/мл), инкубировали в CO2-инкубаторе при температуре 37 °С в течение 3.5 часов, затем убирали среду и добавляли 100 мкл ДМСО. По истечении 10 минут измеряли оптическую плотность клеточных растворов при 555 нм (референтная длина волны - 650 нм) на планшетном ридере TECAN (Швейцария). Результаты представляли в процентном отношении к контролю, не подвергавшемся действию препаратов. Результаты исследования представлены в Таблице 4 на Фиг. 4.
Как видно из представленных данных, соединение I in vitro является существенно менее токсичным (в 1.5-3 раза) в сравнении с референсными противотуберкулезными препаратами, что позволяет предполагать его меньшую нефро- и гепатотоксичность в экспериментах in vivo.
Пример 4. Исследование острой токсичности соединения I в эксперименте in vivo на мышах
Исследование острой токсичности соединения I проводилось на мышах линии ICR (CD-1) (6-8 недель, 20-25 г) обоего пола, по 6 голов в группе. Использовалось однократное внутрижелудочное введение каждого из тестируемых соединений в объеме не более 1.0 мл на 25 г массы тела мыши. После введения тестируемого вещества животные наблюдались индивидуально на протяжении 30 минут, затем не реже раза в час на протяжении 4-х часов, далее ежедневно 1 раз в день в течение 14 дней. Расчет токсических доз ЛД10, ЛД16, ЛД50 и ЛД84 производился с использованием пробит-анализа в программном обеспечении IBM SPSS Statistics. Результаты исследования представлены в Таблице 5 на Фиг.5.
Обобщая данные по исследованию острой токсичности соединения I необходимо отметить, что при внутрижелудочном введении мышам в дозе 2000 мг/кг не наблюдалось гибели животных и величина ЛД50для него составляет более 2000 мг/кг. Таким образом, соединение I существенно менее токсично, чем изониазид (ЛД50 при внутрижелудочном введении мышам составляет 170 мг/кг [Brennan, P.J. Isoniazid / P.J. Brennan, D.B. Young // Tuberculosis. - 2008. - V. 88, Iss. 2. - P. 112-116.]) и моксифлоксацин (ЛД50 при внутрижелудочном введении мышам составляет 500 мг/кг [von Keutz, E. Preclinical safety evaluation of moxifloxacin, a novel fluoroquinolone / E. von Keutz, G. Schlüter // J. Antimicrob. Chemother. - 1999. - V. 43, Iss. 2. - P. 91-100.]).
Пример 5. Исследование противотуберкулезной активности соединения I в релевантных моделях in vivo на мышах
Оценка терапевтической эффективности соединения I была исследована в релевантной модели in vivo на мышах-самцах линии C57black/6.
Введение изучаемых соединений модельным животным начинали на четвертый день после заражения.
Препаратами сравнения служили противотуберкулезные препараты в средних терапевтических дозах: изониазид в дозе 10 мг/кг и моксифлоксацин в дозе 7 мг/кг. Соединение I вводили в дозе 10 мг/кг (сопоставимой с изониазидом).
Длительность курса лечения составила 5 недель, когда в контрольной (зараженные, без лечения) группе смертность достигла 70%.
Эффективность оценивалась по следующим критериям (Таблицы 6 и 7 на Фиг. 6 и 7): летальность мышей, биометрические показатели легких и селезенки (в условных единицах), макроскопическая регистрация пораженности легких (в условных единицах), оценка массивности роста микобактерий в дозированных посевах гомогенатов легких на плотную яичную среду Левенштейна-Йенсена (в пересчете на массу легких).
При анализе показателей терапевтической эффективности исследуемых соединений необходимо отметить, что для всех соединений, в сравнении с контролем, наблюдалось значительное уменьшение летальности (10-30 % в сравнении с 70%). Эффективность соединения I значительно превосходила таковую для моксифлоксацина и лишь немного уступала изониазиду.
Пример 6. Исследование комплексообразующих свойств соединения I
Исследование комплексообразующей способности соединения I с ионами железа (III) было проведено в сравнении с изоникотиноилгидразоном пиридоксаля (PIH) в системах Fe(III) - L (L = PIH) и Fe(III) - L’ (L’ = I).
Спектры поглощения водных растворов соединения I и изоникотиноилгидразона пиридоксаля регистрировали на спектрофотометре Perkin-Elmer Lambda EZ-210 в диапазоне длин волн от 340 до 1100 нм с контролем температуры 25.0±0.1 °C в кварцевых кюветах длиной 1 см. Наиболее интенсивное поглощение в обеих системах наблюдалось около 500 нм. Солевой фон и постоянное значение pH 6.0 поддерживались с использованием буфера MES (MES⋅H2O, Fluka). Значения pH растворов определяли на автоматическом титраторе Metrohm Titrando 907 с использованием электрода Metrohm 6.0228.000 с точностью ±0.01. В экспериментах использовали нитрат железа(III) с концентрацией 1.00⋅10-4 М, причем концентрации обоих лигандов варьировали в диапазоне от 1.00⋅10-4 до 9.00⋅10-4 М.
Зависимости оптической плотности (А) от концентрации лигандов L (PIH) и L’ (I) при постоянной концентрации железа(III) 1.00⋅10-4 М и длине волны 500 нм представлены в Таблице 8 на Фиг. 8. Из этих зависимостей с помощью модифицированной программы STALABS [A.A. Krutikov, V.G. Shtyrlin, A.O. Spiridonov, N.Yu. Serov, A.N. Il’yin, E.M. Gilyazetdinov, M.S. Bukharov New program for computation of the thermodynamic, spectral, and NMR relaxation parameters of coordination compounds in complex systems / Journal of Physics: Conference Series. - 2012. - V. 394. - 012031 (6 p).] выполнены расчёты условных констант равновесий (не учитывающих явно участия протонов).
Относительная стабильность комплексов I и PIH c Fe(III) четко выражается путем сравнения условных констант образования второй ступени (lgK2). Таким образом, соединение I имеет на порядок меньшую комплексообразующую способность с ионами Fe3+ по сравнению с PIH, что позволяет предположить минимизацию негативного воздействия на пациента и, как следствие, сведение к минимуму развития анемии у пациентов при его клиническом использовании.
Таким образом, из описанного выше можно сделать вывод, что заявителем достигнуты поставленные цели и заявленный технический результат, а именно: создано новое высокоактивное и малотоксичное противотуберкулезное средство -соединение формулы I, содержащее в своем составе как фрагмент природного соединения (пиридоксина), так и фрагмент противотуберкулезного препарата изониазида, что расширяет арсенал известных средств указанного назначения.
Соединение I эффективно (МИК 2.5 мкг/мл) на клинических штаммах Mycobacterium tuberculosis с множественной лекарственной устойчивостью, в т.ч. к изониазиду.
Соединение I является существенно менее токсичным (в 1.5-3 раза) на условно-нормальных клеточных линиях in vitro в сравнении с референсными противотуберкулезными препаратами изониазидом и моксифлоксацином, что позволяет предполагать его меньшую нефро- и гепатотоксичность в экспериментах in vivo.
При внутрижелудочном введении мышам in vivo соединение I оказалось менее токсично (ЛД50 >2000 мг/кг) чем изониазид (ЛД50 170 мг/кг) и моксифлоксацин (ЛД50 500 мг/кг).
В эксперименте по исследованию противотуберкулезной активности in vivo на мышах соединение I показало значительное уменьшение летальности (10 %) в сравнении с контрольной группой (70%). При этом эффективность соединения I значительно превосходила таковую для моксифлоксацина и лишь немного уступала изониазиду.
Кроме того, соединение I имеет на порядок меньшую комплексообразующую способность с ионами Fe3+ по сравнению с изоникотиноилгидразоном пиридоксаля, что позволяет предположить минимизацию или отсутствие развития анемии у пациентов при его клиническом использовании.
Заявленное техническое решение соответствует условию патентоспособности «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует условию патентоспособности «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует условию патентоспособности «промышленная применимость», т.к. может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных реактивов и технологий.
Реферат
Изобретение относится к химии органических гетероциклических соединений, а именно к новому производному пиридоксина формулы I, проявляющему противотуберкулезную активность. Изобретение может найти применение в медицине и ветеринарии. 8 ил., 6 пр.

Формула


Комментарии