Азотсодержащие гетероциклические производные и их применение в фармацевтических препаратах - RU2701156C9
Код документа: RU2701156C9
Описание
СВЯЗАННЫЕ ПАТЕНТНЫЕ ЗАЯВКИ
[0001] В настоящей заявке используется патентная публикация Китая №201210250660.6, поданная 18 июля 2012, полностью включенная для справки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящая заявка относится к области медицины. Заявляются неизвестные ранее азотсодержащие гетероциклические химические соединения, способы их приготовления и применения в качестве лекарственных средств, а именно для лечения и профилактики фиброза тканей.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0003] Легкие фиброзы органа или ткани называются фиброзами, тяжелый фиброз может повредить ткани с последующим рубцеванием органа. Тканевым фиброзам подвержены не только легкие и печень, но и все органы и системы человеческого тела. Разнообразные факторы (такие как воспаление, иммунная реакция, отравление, ишемия и изменения гемодинамики, и так далее) вызываю паренхиматозное повреждение клетки. Это приводит к паренхиматозному воспалению клетки, деформации, некрозу, и активизации соответствующих макрофагоцитов, высвобождающих цитокины и факторы роста, что, в свою очередь, активизирует находящуюся в покое внеклеточную матрицу (ЕСМ) на формирование клеток, и затем трансформирует клетки в миофибробласты. Миофибробласты быстро размножают и секретируют цитокины, воздействующие на макрофагоцитов через паракрин. Миофибробласты способны синтезировать множество коллагенов ЕСМ. Распад ЕСМ снижается, одновременно вызывая фиброз органа или ткани. Таким образом, существование и развитие фиброза органа или ткани является результатом взаимодействия множества факторов, таких как клетка, цитокин и ЕСМ. Клетка, сформированная ЕСМ, важна для образования фиброза органа или ткани. Поэтому одной из целей лекарственного средства для лечения фиброза органа или ткани является клетка, сформированная ЕСМ. Терапевтическая цель может быть достигнута подавлением быстрого размножения клетки, активированием и стимулированием клеточного апоптоза.
[0004] Причина этого заключается в различных функциях каждого органа или ткани, морфологии и различных клетках главных компонентов, фиброзы разных органов и тканей обладают общими чертами и индивидуальными свойствами в части патогенеза. Клетки могут формироваться ЕСМ, в то время как печеночные звездчатые клетки формируются в печени, гломерулярные мезангийные клетки формируются в glomerulus, почечные интерстициальные фибробласты формируются в почечной соединительной ткани, пульмональные фибробласты формируются в легких, кардиальные ибробласты формируются в сердце и перитонеальные мезотелиальные клетки формируются в брюшной полости. Поэтому существуют некоторые различия в патогенезе и терапевтических целях для фиброзов разных органов или тканей.
[0005] Антифиброзное лекарственное средство под названием пирфенидон (PFD, 5-метил-1-фенил-2-(1Н)-пиридон) было заявлено в патенте ЕР 1138329 А. Эксперименты в показывают, что PFD способен предотвратить накопление ЕСМ, или даже обратить его вспять (почечный фиброз животных, пульмональный фиброз и клинические испытания на пациентах со специфическим пульмональным фиброзом).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Заявляются новые химические соединения или фармацевтические лекарственные препараты, которые могут быть более эффективными для профилактики или лечения фиброза тканей человека или животных. Заявляются химические соединения с формулой (I), приведенной ниже:

или стереоизомер, геометрический изомер, таутомер, N-оксид, гидрат, сольват, метаболит, фармацевтически приемлемая соль или их продукт, где каждый V1, V2, V3, V4, А, В, X и Y определи в настоящей заявке.
[0007] В некоторых реализациях, V1 представляет собой N или CR1, V2 представляет собой N ли CR2, V3 представляет собой N или CR3, и V4 представляет собой N ли CR4, где по меньшей мере один из V1, V2, V3 и V4 представляет собой N;
X представляет собой связь, NR5, О, S, С1-10 алкилен, С2-10 алкенилен, С2-10 алкинилен, -R6-C(=Y)-, -R6-C(=Y)-O-, -R6-C(=Y)-N(R5)-, -R6-S(=O)t, -R6-S(=O)t-N(R7)-, или -R6-Y-, где каждый t представляет собой 1 или 2;
Y представляет собой О или S;
А представляет собой гетероциклилен, карбоциклилен, сплавленный бициклилен, сплавленный гетеробициклилен, спиро бициклилен, спиро гетеробициклилен, арилен или гетероарилен;
В представляет собой алкокси, гидрокси-замещенный алкокси, -NR7R7a, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t, R7S(=O)t, R7-S(=O)tN(R7a)-, C4-12 карбоциклил, C4-12 циклоалкил, гетероциклил, арил, гетероарил, сплавленный биелил, сплавленный гетеробициклил, спиро биелил, или спиро гетеробициклил;
или А, X и В вместе, формирующие группу с формулой (II):
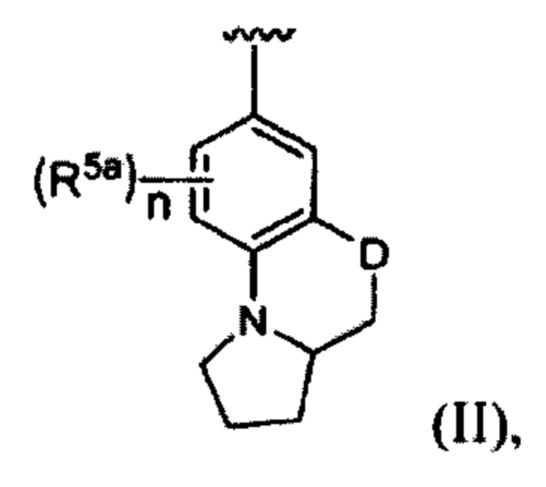
где D представляет собой NR5, О, S, или CR7R7a;
R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t, R7S(=O), -R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)t-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)t-алкокси, R7R7aN-C(=O)-алкокси, алифатический, галогеналкил, алкокси, гидроалкокси, аминалкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, циколалкилокси, арилалкокси, арилалкиламино, гетероарилалкокси, гетероарилалкиламино, гетероциклилалкиламино, циклоалкиламино, гетероциклилалкокси, карбоциклилалкокси, карбоциклилалкиламино, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, арилокси, гетероарилокси, гетероарилоксиалкокси, гетероциклилоксиалкокси, карбоциклилоксиалкокси, гетероциклилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиамино, сплавленный гетеробициклиамино, сплавленный бициклиалкокси, сплавленный гетеробициклиалкокси, сплавленный бициклиалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробициклиламино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокс, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, гетероциклил, циклоалкил, арил, гетероарил, гетероциклил алифатический, циклоалкил алифатический, арил алифатический, гетероарил алифатический, арил-(СН2)р-G-(СН2)m-, гетероарил-(СН2)р-G-(СН2)m-, гетероциклил-(СН2)р-G-(СН2)m-, или циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)N(R7)-, -OC(=O)N(R7)-, -ОС(=O)-, -N(R7)C(=O)N(R7)-, -(R7)N-S(=O)t, -OS(=O)t, или -OS(=O)tN(R7)-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- дополнительно замещен одним ил более F, Cl, Br, I, C1-6 алкил, С2-6 алкинил, C1-6 алкокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циаоно, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a,
-OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t, R7S(=O)t, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)t-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)t-алкокси, R7R7aN-C(=O)-алкокси, алифатический, галоалкил, алкокси, гидроксиалкокси, аминоалкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиаминогалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, арилалкокси, арилалкиламино, гетероарилалкокси, гетероарилалкилаимно, гетероциклилалкиламино, циклоалкокси, циклоалкиламино, гетероциклилалкокси, карбоциклилалкокси, карбоциклилалкиламино, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, арилокси, гетероарилокси, гетероарилоксиалкокси, гетероциклилоксиалкокси, карбоциклилоксиалкокси, гетероциклилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробицилилкамино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробицициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклиил-С(=O)N(R7)-, гетероциклил, циклоалкил, арил, С1-4гетероарил, гетероциклил алифатический, циклоалкил алифатический, арил алифатический, гетероарил алифатический, арил-(СН2)р-G-(СН2)m-, гетероарил-(СН2)р-G-(СН2)m-, гетероциклил-(СН2)р-G-(СН2)m-, или циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, C(=O), -C(=O)N(R7)-, -OC(=O)N(R7)-, -OC(=O)-, -N(R7)C(=O)N(R7)-, -(R7)N-S(=O)t, -OS(=O)t, или -OS(=O)tN(R7)-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, R7R7aN-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t, R7S(=O)t, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)t-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O), -алкокси, R7R7aN-C(=O)-алкокси, алифатический, С2-10 галоалкил, арил-С2-10 алкокси, гетероарил-C3-10 алкокси, циклоалкил-С2-10 алкокси, сплавленный бициклил-С2-10 алкокси, C1-4 гетероарил, замещенный арил, гетероциклил, циклоалкил, гетероциклил алифатический, циклоалкил алифатический, С1-4 гетероарил алифатический, замещенный арил С3-10 алкил, гетероциклилалкил, алкокси, гидроксиалкокси, аимноалкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, арил-С2-10 алкокси, гетероциклилалкокси, карбоциклилалкокси, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, ариламиноалкокси, арилокси, гетероарилоксиалкокси, гетероциклилоксиалкокси, карбоциклилоксиалкокси, гетероциклиокси, циклоалкилокси, азидоалкокси, сплавленный бициклил, сплавленный гееробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(:=O)-, сплавленный гетеробициклиламино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-C(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклилаимноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, арил-(СН2)р-G-(СН2)m-, гетероарил-(СН2)р-G-(СН2)m-, гетероциклил-(СН2)р-G-(СН2)m-, или циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)N(R7)-, -OC(=O)N(R7)-, -ОС(=O)-, -N(R7)C(=O)N(R7)-, -(R7)N-S(=O)t, -OS(=O)t, или -OS(=O)tN(R7)-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t-, R7S(=O)t-, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)t-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)tалкокси, R7R7aN-C(=O)-алкокси, алифатический, галоалкил, С2-10 алкокси, гидроксиалкокси, аминоалкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, С3-5 циклоалкилокси, арилалкокси, гетероарилалкокси, гетероарилалкиламино, гетероциклилалкиламино, С7-10 циклоалкокси, циклоалкиамино, гетероциклилалкокси, карбоциклилалкокси, карбоциклилалкиламино, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, арилокси, гетероарилокси, гетероарилоксиалкокси, гетероциклилоксиалкокси, карбоциклилоксиалкокси, гетероциклилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробицилиламино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклилминоалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, гетероциклил, циклоалкил, арил, гетероарил, гетероциклил алифатический, циклоалкил алифатический, арил С2-10 алифатический, гетероарил алифатический, арил-(СН2)р-G-(СН2)m-, гетероарил-(СН2)р-G-(СН2)m-, гетероциклил-(СН2)р-G-(СН2)m-, или циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)N(R7)-, -OC(=O)N(R7)-, -ОС(=O)-, -N(R7)C(=O)N(R7)-, -(R7)N-S(=O)t, -OS(=O)t, или -OS(=O)tN(R7)-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, алифатический, галоалифатический, гидроксиалифатический, аминоалифатический, алкоксиалифатический, алкиламиноалифатический, алкилтиоалифатический, ариалифатический, гетероалифатический, гетероциклилалифатический, циклоалкилалифатический, арилоксиалифатический, гетероциклилоксиалифатический, циклоалкилоксиалифатический, ариламиноалифатический, гетероциклиламиноалифатический, циклоалкиламиноалифатический, арил, гетероарил, гетероциклил или карбоциклил;
каждый R5a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, оксо (=O), R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-алкил, R7S(=O)-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)-алкокси, R7R7aN-C(=O)-алкокси, арил, гетероарил, алкокси, алкил, алкенил, алкинил, гетероциклил, меркапто, нитро, аралкил, ариламино, гетероариламино, арилалкиламино, гетероарилалкиламино, гетероарил окси, гетероарилалкил, арилалкокси, гетероарил алкокси, гетероциклилокси, гетероциклилалкокси, гетероциклиламино, гетероциклилалкиламино или арилокси;
каждый R6 представляет собой независимо связь, С1-10 алкилен, С2-10 алкенилен или С2-10 алкинилен; и
каждый R7 и R7a представляет собой независимо Н, алифатический, галоалифатический, гидроксиалифатический, аминоалифатический, алкоксиалифатический, алкиламиноалифатический, алкилтиоалифатический, арилалифатический, гетероарилалифатический, гетероциклилалифатический, циклоалкилалифатическийс, арилоксиалифатический, гетероциклилоксиалифатический, циклоалкиоксиалифатический, ариламиноалифатический, гетероциклиламиноалифатический, циклоалкиламиноалифатический, арил, гетероарил, гетероциклил или карбоциклил; при условии, что R7 и R7a связаны с тем же самым атомом азота, R7 и R7a, вместе с атомом азота связаны с, дополнительно создавая замещенное или незамещенное 3…8-звенное кольцо, или замещенное или незамещенное спиро бицикличное или сплавленное бициклическое кольцо;
где каждый из NR5, -R6-C(=Y)-, -R6-C(=Y)-O-, -R6-C(=Y)-N(R5)-, -R6-S(=O)t-, -R6-S(=O)t-N(R7)-, -R6-Y-, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t, R7S(=O)t, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)taлкил, R7R7aN-C(=O)-C1-6алкил, R7aR7N-C1-6алкокси, R7S(=O)-алкокси, R7R7aN-C(=O)-алкокси, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, R7aR7N-алифатический, арил-(СН2)р-G-(СН2)m-, гетероарил-(CH2)p-G-(CH2)m-, гетероциклил-(СН2)р-O-(СН2)m-, циклоалкил-(СН2)р-С-(СН2)m-, гидрокси-замещенный C1-6 алкил-С(=O)-, C1-6 алкил-С(=O)-, C1-6 алкил-S(=O)-, C1-6 алкил-S(=O)2-, гидрокси-замещенный C1-6 алкил-S(=O)-, гидрокси-замещенный C1-6 алкил-S(=O)2-, карбокси C1-6 алкокси, галоалкил, гетероциклоалкил, гетероциклоалкокси, гетероциклилалкиламино, гетероциклиламино, циклоалкил, циклоалкил алифатический, циклоалкиламино, циклоалкилокси алифатический, циклоалкилалкокси, циклоалкилалкиламино, карбоциклилал алифатический, аралкил, арилоксиалкил, гетероарилоксиалифатический, алифатический, алкокси, гидроксиалкокси, аминоалкокси, гидрокси-замещенный C1-6 алкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, арилалкокси, арилалкиламино, гетероциклилалкокси, карбоциклилалкокси, гетероциклил(гидроалкокси), карбоциклил(гидроалкокси), арил(гидроксиалкокси), арилоксиалкокси, гетероарилоксиалкокси, арилокси, ариламино, гетероциклилоксиалкокси, карбоциклилоксиалкокси, циклоалкилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробициклиламино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, арил, гетероарил, арилалифатический, гетероарилалифатический, гетероарилокси, гетероариламино, гетероарилалкокси, гетероарилалкиламино, галоалифатический, гидроксиалифатический, аминоалифатический, алкоксиалифатический, алкиламиноалифатический, алкилтиоалифатический, циклоалкил, гетероциклилалифатический, арилоксиалифатический, гетероциклилоксиалифатический, циклоалкилоксиалифатический, ариламиноалифатический, гетероциклиламиноалифатический, циклоалкиламиноалифатический, гетероциклил, карбоциклил, гетероциклилепе, карбоциклилен, сплавленный бициклилен, сплавленный гетеробициклилен, спиро бициклилен, спиро гетеробициклилен, арилен и гетероарилен представляет собой незамещенный или замещенный ка минимму одним заместителем, где заметисель представляет собой галоалкил, оксо (=O), гидрокси, амино, F, Cl, Br, I, циано, С1-10 алкокси, С1-10 алкиламино, С1-10 алкилтио, С1-10 алкил, С2-10 алкенил, С2-10 алкинил, меркапто, нитро, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил, С6-10 арилокси, карбокси, гидрокси-замещенный C1-6 алкокси, гидрокси-замещенный С1-6 алкил-С(=O)-, C1-6 алкил-С(=O)-, С1-6 алкил-S(=O)-, С1-6 алкил-S(=O)2-, гидрокси-замещенный С1-6 алкил-S(=O)-, гидрокси-замещенный C1-6 алкил-S(=O)2-, или карбокси С1-6 алкокси.
[0008] В некоторых реализациях А представляет собой С2-10 гетероциклилен, С3-10 карбоциклилен, С5-12 сплавленный бициклилен, С5-12 сплавленный гетеробициклилен, С5-12 спиро бициклилен, С5-12 спиро гетеробициклилен, С6-10 арилен, или С1-9 гетероарилен.
[0009] В некоторых реализациях А представляет собой

где каждый Q1, Q2, Q3, Q4, Q5 и Q6 представляет собой независимо N, NR5, О, S, CR7R или CR8, и как минимум четыре из Q1, Q2, Q3, Q4, Q5 и Q6 являются N или NR5;
W1 представляет собой NR3, О, S, или CR7R; каждый W2, W3, W4 и W5 представляет собой независимо N, NR5, О, S, CR7R7a, или CR8; и как минимум четыре из W1, W2, W3, W4 и W5 являются N или NR5; и
каждый R8 представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-алкил, R7S(=O)-алкил, R7R7aN-C(=O)-алкил,, R7aR7N-алкокси, R7S(=O)-алкокси, R7R7aN-C(=O)-алкокси, арил, гетероарил, алкокси, алкил, алкенил, алкинил, гетероциклил, меркапто, нитро, аралкил, ариламино, гетероариламино, арилалкиламино, гетероарилалкиламино, гетероарилокси, гетероарилалкил, арилалкокси, гетероарилалкокси, гетероциклилокси, гетероциклилалкокси, гетероциклиламино, гетероциклилалкиламино или арилокси.
[0010] В некоторых реализациях А представляет собой
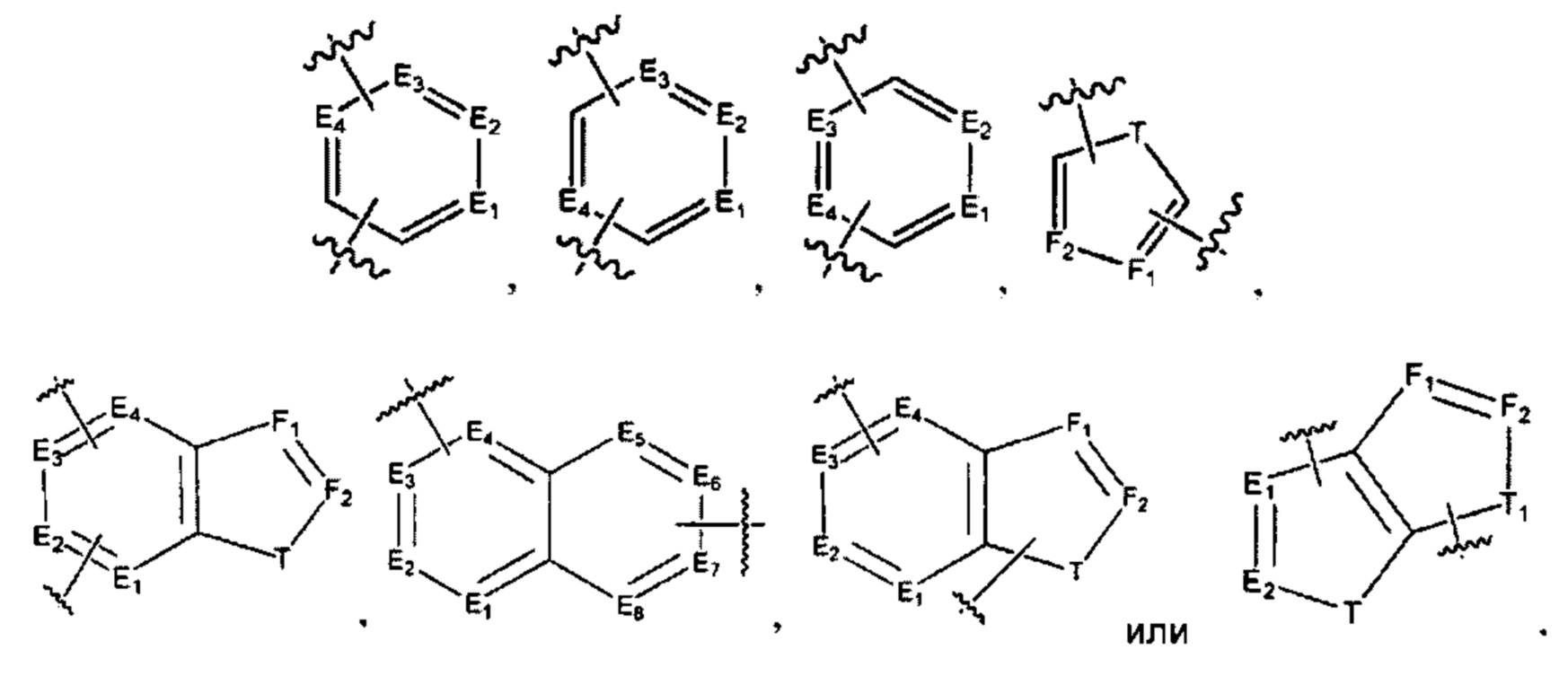
где каждый E1, Е2, Е3, Е4, Е5, Е6, E7, Е8, F1 и F2 представляет собой независимо N или CR9;
каждый Т и T1 представляет собой независимо NR5, О, S или CR9R9a; и
каждый R9 и R9a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-C1-6 алкокси, С6-10 арил, C1-9гетероарил, C1-6 алкокси, С1-6 алкил, С2-6алкенил, С2-6алкинил, С2-10 гетероциклил, меркапто, нитро, С6-10 арил-С1-6-алкил, С6-10 ариламино, C1-9 гетероариламино, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкиламино, С1-9 гетероарилокси, С1-9 гетероарил-С1-6-алкил, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, С2-10 гетероциклилокси, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклиламино, С2-10 гетероциклил-С1-6-алкиламино, или С6-10 арилокси.
[0011] В других реализациях А представляет собой

где каждый n представляет собой независимо 0, 1, 2 или 3; и
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, циано, нитро, меркапто, C1-4 алкил, C1-4 галоалкил, С1-4 алкокси, C1-4 алкиламино, C1-4 алкилтио, С6-10 арил или С1-9 гетероарил.
[0012] В некоторых реализациях В представляет собой C1-6 алкокси, гидрокси-замещенный C1-6 алкокси, -NR7R7a, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, C4-12 карбоциклил, C4-12 циклоалкил, C2-10 гетероциклил, C6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 спиро бициклил, или С5-12 спиро гетеробициклил.
[0013] В некоторых реализациях R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-С1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, С1-6 алкокси, С1-12 гидроксиалкокси, С1-6 аминоалкокси, гидрокси-замещенный C1-6 аминоалкокси, C1-12 галоалкокси, амино-замещенный С1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, гидрокси-замещенный С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С2-10 гетероциклил (С1-6 гидроксиалкокси), С3-10 карбоциклил(С1-6 гидроксиалкокси), С6-10 арил(С1-6 гидроксиалкокси), С6-10 арилокси-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарил окси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклилокси-С1-6-алкокси, С3-10 карбоциклилокси-С1-6-алкокси, С2-10 гетероциклилокси, C1-6 азидоалкокси, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 сплавленный бициклил-С1-6-алифатический, С5-12 сплавленный гетеробициклил-С1-6-алифатический, С5-12 сплавленный бициклокси, С5-12 сплавленный гетеробициклокси, С5-12 сплавленный бициклиламино, С5-12 сплавленный гетеробициклиламино, С5-12 сплавленный бициклил-С1-6-алкокси, С5-12 сплавленный гетеробициклил-С1-6-алкокси, С5-12 сплавленный бициклил-С1-6-алкиламино, С5-12 сплавленный гетеробициклил-С1-6-алкиламино, С5-12 сплавленный бициклокси-С1-6-алкокси, С5-12 сплавленный гетеробициклокси-С1-6-алкокси, С5-12 сплавленный бициклиламино-С1-6-алкокси, С5-12 сплавленный гетеробициклиламино-С1-6-алкокси, С5-12 сплавленный бициклил-С(=O)-, С5-12 сплавленный бициклил-С(=O)O-, С5-12 сплавленный гетеробициклил-С(-О)-, С5-12 сплавленный гетеробициклил-С(=O)O-, С5-12 сплавленный бициклиламино-С(=O)-, С5-12 сплавленный гетеробициклиламино-С(=O)-, С5-12 сплавленный бициклил-С(=O)N(R7)-, С5-12 сплавленный гетеробицикпил-С(=O)N(R7)-, С5-12 спиро бициклил, С5-12 спиро гетеробициклил, С5-12 спиро бициклил-С1-6-алифатический, С5-12 спиро гетеробициклил-С1-6-алифатический, С5-12 спиро бициклокси, С5-12 спиро гетеробициклокси, С5-12 спиро бициклиламино, С5-12 спиро гетеробициклиламино, С5-12 спиро бициклил-С1-6-алкокси, С5-12 спиро гетеробициклил-С1-6-алкокси, С5-12 спиро бициклил-С1-6-алкиламино, С5-12 спиро гетеробициклил-С1-6-алкиламино, С5-12 спиро бициклокси-С1-6-алкокси, С5-12 спиро гетеробициклокси-С1-6-алкокси, С5-12 спиро бициклиламино-С1-6-алкокси, С5-12 спиро гетеробициклиламино-С1-6-алкокси, С5-12 спиро бициклил-С(=O)-, С5-12 спиро бициклил-С(=O)O-, С5-12 спиро гетеробициклил-С(=O)-, С5-12 спиро гетеробициклил-С(=O)O-, С5-12 спиро бициклиламино-С(=O)-, С5-12 спиро гетеробициклиламино-С(=O)-, С5-12 спиро бициклил-С(=O)N(R7)-, С5-12 спиро гетеробициклил-С(=O)N(R7)-, С2-10 гетероциклил, С3-10 циклоалкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-1 или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, С1-6 алкил, С2-6алкинил, С1-12 алкокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-C1-6 алкокси, C1-6 алифатический, С1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, гидрокси-замещенный С1-6 аминоалкокси, С1-6 галоалкокси, амино-замещенный С1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, гидрокси-замещенный С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С2-10 гетероциклил(С1-6 гидроксиалкокси), С3-10 карбоциклил(С1-6 гидроксиалкокси), С6-10 арил(С1-6 гидроксиалкокси), С6-10 арилокси-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклилокси-С1-6-алкокси, С3-10 карбоциклилокси-С1-6-алкокси, С2-10 гетероциклилокси, С1-6 азидоалкокси, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 сплавленный бициклил-С1-6-алифатический, С5-12 сплавленный гетеробициклил-С1-6-алифатический, С5-12 сплавленный бициклокси, С5-12 сплавленный гетеробициклокси, С5-12 сплавленный бициклиламино, С5-12 сплавленный гетеробициклиламино, С5-12 сплавленный бициклил-С1-6-алкокси, С5-12 сплавленный гетеробициклил-С1-6-алкокси, С5-12 сплавленный бициклил-С1-6-алкиламино, С5-12 сплавленный гетеробициклил-С1-6-алкиламино, С5-12 сплавленный бициклокси-С1-6-алкокси, С5-12 сплавленный гетеробициклокси-С1-6-алкокси, С5-12 сплавленный бициклиламино-С1-6-алкокси, С5-12 сплавленный гетеробициклиламино-С1-6-алкокси, С5-12 сплавленный бициклил-С(=O)-, С5-12 сплавленный бициклил-С(=O)O-, С5-12 сплавленный гетеробициклил-С(=O)-, С5-12 сплавленный гетеробициклил-С(=O)O-, С5-12 сплавленный бициклиламино-С(=O)-, С5-12 сплавленный гетеробициклиламино-С(=O)-, С5-12 сплавленный бициклил-С(=O)N(R7)-, С5-12 сплавленный гетеробициклил-С(=O)N(R7)-, С5-12 спиро бициклил, С5-12 спиро гетеробициклил, С5-12 спиро бициклил-С1-6-алифатический, С5-12 спиро гетеробициклил-С1-6-алифатический, С5-12 спиро бициклокси, С5-12 спиро гетеробициклокси, С5-12 спиро бициклиламино, С5-12 спиро гетеробициклиламино, С5-12 спиро бициклил-С1-6-алкокси, С5-12 спиро гетеробициклил-С1-6-алкокси, С5-12 спиро бициклил-С1-6-алкиламино, С5-12 спиро гетеробициклил-С1-6-алкиламино, С5-12 спиро бициклокси-С1-6-алкокси, С5-12 спиро гетеробициклокси-С5-12-алкокси, С5-12 спиро бициклиламино-С1-6-алкокси, С5-12 спиро гетеробициклиламино-С1-6-алкокси, С5-12 спиро бициклил-С(=O)-, С5-12 спиро бициклил-С(=O)O-, С5-12 спиро гетеробициклил-С(=O)-, С5-12 спиро гетеробициклил-С(=O)O-, С5-12 спиро бициклиламино-С(=O)-, С5-12 спиро гетеробициклиламино-С(=O)-, С5-12 спиро бициклил-С(=O)N(R7)-, С5-12 спиро гетеробициклил-С(=O)N(R7)-, С2-10 гетероциклил, С3-10 циклоалкил, С6-10 арил, С1-4 гетероарил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, C1-6 алифатический, С2-10 галоалкил, С6-10 арил-С2-10-алкокси, C1-9 гетероарил-С3-6-алкокси, С3-10 циклоалкил-С2-10-алкокси, С5-10 сплавленный бициклил-С2-10-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С1-4 гетероарил, замещенный С6-10 арил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С1-4 гетероарил-С1-6-алифатический, C1-9 гетероарилокси-С1-6-алкокси, замещенный С6-10 арил-С3-6-алкил, С2-10 гетрероциклил-С1-6-алкил, С1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, гидрокси-замещенный С1-6 аминоалкокси, С1-6 галоалкокси, амино-замещенный С1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, гидрокси-замещенный С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С6-10 арил-С2-10-алкокси, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С2-10 гетероциклил(С1-6 гидроксиалкокси), С3-10 карбоциклил(С1-6 гидроксиалкокси), С6-10 арил(С1-6 гидроксиалкокси), С6-10 арилокси-С1-6-алкокси, С6-10 ариламино-С1-6-алкокси, С6-10 арилокси, С2-10 гетероциклилокси-С1-6-алкокси, С3-10 карбоциклилокси-С1-6-алкокси, С2-10 гетероциклилокси, С3-10 циклоалкилокси, С1-6 азидоалкокси, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 сплавленный бициклил-С1-6-алифатический, С5-12 сплавленный гетеробициклил-С1-6-алифатический, С5-12 сплавленный бициклокси, С5-12 сплавленный гетеробициклокси, С5-12 сплавленный бициклиламино, С5-12 сплавленный гетеробициклиламино, С5-12 сплавленный бициклил-С1-6-алкокси, С5-12 сплавленный гетеробициклил-С1-6-алкокси, С5-12 сплавленный бициклил-С1-6-алкиламино, С5-12 сплавленный гетеробициклил-С1-6-алкиламино, С5-12 сплавленный бициклокси-С1-6-алкокси, С5-12 сплавленный гетеробициклокси-С1-6-алкокси, С5-12 сплавленный бициклиламино-С1-6-алкокси, С5-12 сплавленный гетеробициклиламино-С1-6-алкокси, С5-12 сплавленный бициклил-С(=O)-, С5-12 сплавленный бициклил-С(=O)O-, С5-12 сплавленный гетеробициклил-С(=O)-, С5-12 сплавленный гетеробициклил-С(=O)O-, С5-12 сплавленный бициклиламино-С(=O)-, С5-12 сплавленный гетеробициклиламино-С(=O)-, С5-12 сплавленный бициклил-С(=O)NR7-, С5-12 сплавленный гетеробициклил-С(=O)NR7-, С5-12 спиро бициклил, С5-12 спиро гетеробициклил, С5-12 спиро бициклил-С1-6-алифатический, С5-12 спиро гетеробициклил-С1-6-алифатический, С5-12 спиро бициклокси, С5-12 спиро гетеробициклокси, С5-12 спиро бициклиламино, С5-12 спиро гетеробициклиламино, C5-12 спиро бициклил-С1-6-алкокси, С5-12 спиро гетеробициклил-С1-6-алкокси, С5-12 спиро бициклил-С1-6-алкиламино, С5-12 спиро гетеробициклил-С1-6-алкиламино, С5-12 спиро бициклокси-С1-6-алкокси, С5-12 спиро гетеробициклокси-С1-6-алкокси, С5-12 спиро бициклиламино-С1-6-алкокси, С5-12 спиро гетеробициклиламино-С1-6-алкокси, С5-12 спиро бициклил-С(=O)-, С5-12 спиро бициклил-С(=O)O-, С5-12 спиро гетеробициклил-С(=O)-, С5-12 спиро гетеробициклил-С(=O)O-, С5-12 спиро бициклиламино-С(=O)-, С5-12 спиро гетеробициклиламино-С(=O)-, С5-12 спиро бициклил-С(=O)NR7-, С5-12 спиро гетеробициклил-С(=O)NR7-, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; и
R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)-, R7S(=O)-, R7S(=O)N(R7a)-, R7aR7N-С1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, C1-6 алифатический, С2-10 алкокси, С1-6 гидроксиалкокси, С1-12 аминоалкокси, гидрокси-замещенный C1-6 аминоалкокси, C1-6 галоалкокси, амино-замещенный С1-6 галоалкокси, C1-6 алкиламино-С1-6-галоалкокси, гидрокси-замещенный C1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С3-5 циклоалкилокси, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С7-10 циклоалкилокси, С3-10 циклоалкиламино, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С2-10 гетероциклил(С1-6 гидроксиалкокси), С3-10 карбоциклил(С1-6 гидроксиалкокси), С6-10 арил(С1-6 гидроксиалкокси), С6-10 арилокси-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклилокси-С1-6-алкокси, С3-10 карбоциклилокси-С1-6-алкокси, С2-10 гетероциклилокси, С1-6 азидоалкокси, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 сплавленный бициклил-С1-6-алифатический, С5-12 сплавленный гетеробициклил-С1-6-алифатический, С5-12 сплавленный бициклокси, С5-12 сплавленный гетеробициклокси, С5-12 сплавленный бициклиламино, С5-12 сплавленный гетеробициклиламино, С5-12 сплавленный бициклил-С1-6-алкокси, С5-12 сплавленный гетеробициклил-С1-6-алкокси, С5-12 сплавленный бициклил-С1-6-алкиламино, С5-12 сплавленный гетеробициклил-С1-6-алкиламино, С5-12 сплавленный бициклокси-С1-6-алкокси, С5-12 сплавленный гетеробициклокси-С1-6-алкокси, С5-12 сплавленный бициклиламино-С1-6-алкокси, С5-12 сплавленный гетеробициклиламино-С1-6-алкокси, С5-12 сплавленный бициклил-С(=O)-, С5-12 сплавленный бициклил-С(=O)O-, С5-12 сплавленный гетеробициклил-С(=O)-, С5-12 сплавленный гетеробициклил-С(=O)O-, С5-12 сплавленный бициклиламино-С(=O)-, С5-12 сплавленный гетеробициклиламино-С(=O)-, С5-12 сплавленный бициклил-С(=O)NR7-, С5-12 сплавленный гетеробициклил-С(=O)NR7-, С5-12 спиро бициклил, С5-12 спиро гетеробициклил, С5-12 спиро бициклил-С1-6-алифатический, С5-12 спиро гетеробициклил-С1-6-алифатический, С5-12 спиро бициклокси, С5-12 спиро гетеробициклокси, С5-12 спиро бициклиламино, С5-12 спиро гетеробициклиламино, С5-12 спиро бициклил-С1-6-алкокси, С5-12 спиро гетеробициклил-С1-6-алкокси, С5-12 спиро бициклил-С1-6-алкиламино, С5-12 спиро гетеробициклил-С1-6-алкиламино, С5-12 спиро бициклокси-С1-6-алкокси, С5-12 спиро гетеробициклокси-С1-6-алкокси, С5-12 спиро бициклиламино-С1-6-алкокси, С5-12 спиро гетеробициклиламино-С1-6-алкокси, С5-12 спиро бициклил-С(=O)-, С5-12 спиро бициклил-С(=O)O-, С5-12 спиро гетеробициклил-С(=O)-, С5-12 спиро гетеробициклил-С(=O)O-, С5-12 спиро бициклиламино-С(=O)-, С5-12 спиро гетеробициклиламино-С(=O)-, С5-12 спиро бициклил-С(=O)N(R7)-, С5-12 спиро гетеробициклил-С(=O)N(R7)-, С2-10 гетероциклил, С3-10 циклоалкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил-С2-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(CH2)p-G-(CH2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4.
[0014] В некоторых реализациях каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, C1-6 алифатический, C1-6 галоалифатический, С1-6 гидроксиалифатический, C1-6 аминоалифатический, С1-6 алкокси-С1-6-алифатический, C1-6 алкиламино-С1-6-алифатический, C1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-12-алифатический, С6-10 арилокси-С1-12-алифатический, С2-10 гетероциклилокси-С1-6-алифатический, С3-10 циклоалкилокси-С1-6-алифатический, С6-10 ариламино-С1-6-алифатический, С2-10 гетероциклиламино-С1-6-алифатический, С3-10 циклоалкиламино-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил.
[0015] В некоторых реализациях каждый R5a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, оксо (-О), R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С6-10 арил, С1-9 гетероарил, C1-6 алкокси, С1-6 алкил, С2-6алкенил, С2-6алкинил, С2-10 гетероциклил, меркапто, нитро, С6-10 арил-С1-6-алкил, С6-10 ариламино, С1-9 гетероариламино, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкиламино, С1-9 гетероарилокси, С1-9 гетероарил-С1-6-алкил, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, С2-10 гетероциклилокси, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклиламино, С2-10 гетероциклил-С1-6-алкиламино или С6-10 арилокси.
[0016] В некоторых реализациях каждый R7 и R7a представляет собой независимо Н, С1-6 алифатический, С1-6 галоалифатический, С1-6 гидроксиалифатический, C1-6 аминоалифатический, С1-6 алкокси-С1-6-алифатический, С1-6 алкиламино-С1-6-алифатический, С1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арилокси-С1-6-алифатический, С2-10 гетероциклилокси-С1-6-алифатический, С3-10 циклоалкилокси-С1-6-алифатический, С6-10 ариламино-С1-6-алифатический, С2-10 гетероциклиламино-С1-6-алифатический, С3-10 циклоалкиламино-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил; с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо, или замещенное или незамещенное С5-12 спиро бициклическое или С5-12 сплавленное бициклическое кольцо.
[0017] В некоторых реализациях N, V1, V2, V3, V4 и C(=Y) формулы (I) определяют группу с формулой (III):

каждый R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, С1-6 алифатический, C1-6 галоалкил, С1-6 алкокси, C1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, C6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, C1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, C1-9 гетероарилокси, C1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, С1-6 алкил, С2-6алкинил, С1-6 алкокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, C1-6 алифатический, С1-6 галоалкил, С1-6 алкокси, C1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С-310циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарил окси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-4 гетероарил, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R3 представляет собой Н, F, Cl, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, С2-6галоалкил, С6-10 арил-С2-6-алкокси, С1-9 гетероарил-С3-6-алкокси, С1-9 гетероарилокси-С1-6-алкокси, С3-10 циклоалкил-С2-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С1-4 гетероарил, замещенный С6-10 арил, С1-4 гетероарил-С1-6-алифатический, замещенный С6-10 арил-С3-6-алкил, С2-10 гетрероциклил-С1-6-алкил, С1-6 алкокси, C1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, C1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С6-10 арил-С2-10-алкокси, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С2-10 гетероциклилокси, С3-10 циклоалкилокси, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; и
каждый R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-C1-6 алкокси, C1-6 алифатический, C1-6 галоалкил, С2-10 алкокси, С1-6 гидроксиалкокси, C1-6 аминоалкокси, С1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, C3-5 циклоалкилокси, C6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, C1-9 гетероарилокси-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, C6-10 арилокси, C1-10 гетероарилокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С6-10 арил-С2-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(CH2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или.
[0018] В некоторых реализациях

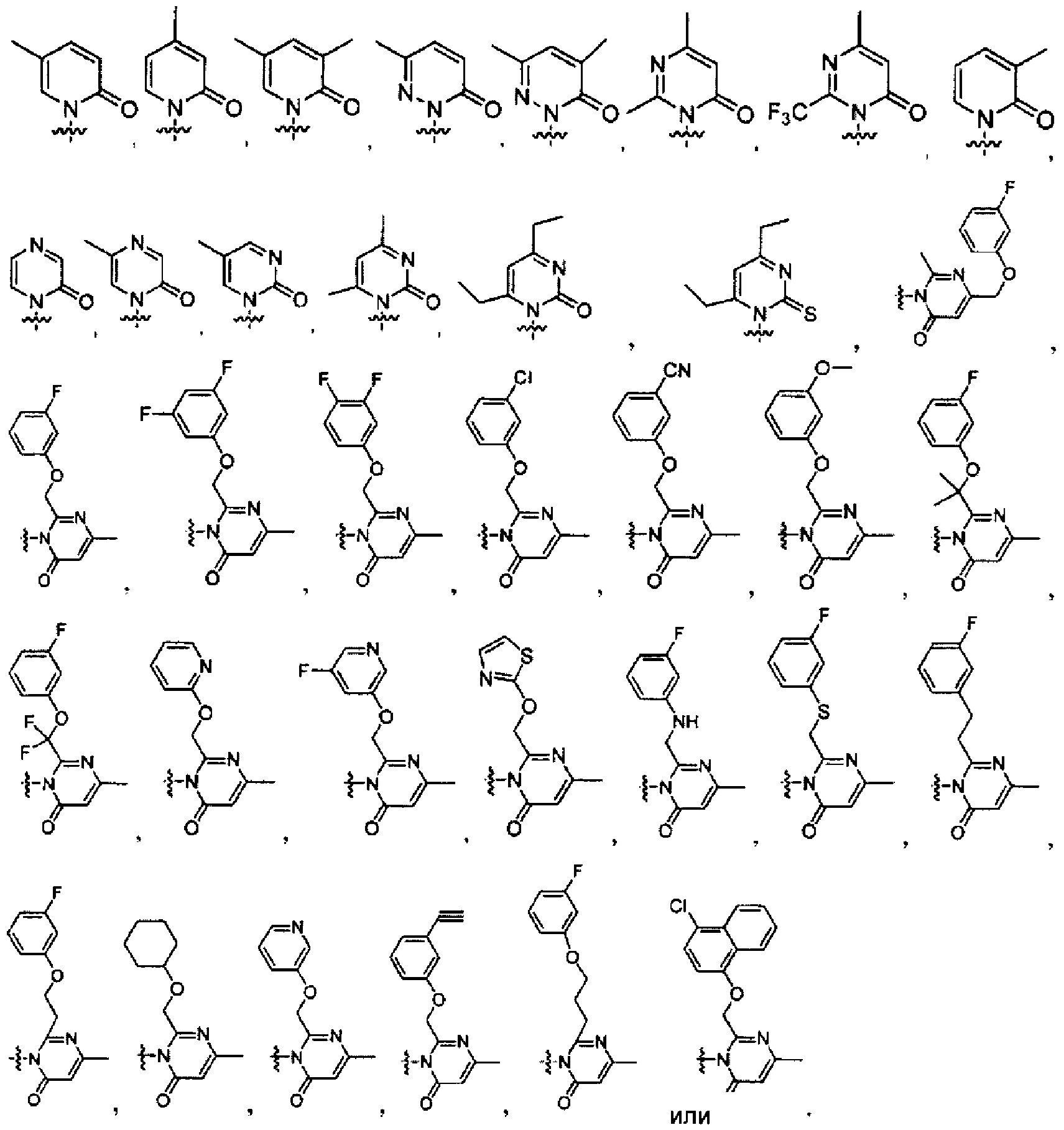
[0019] В некоторых реализациях А представляет собой:

X представляет собой связь, NR5, О, S, -(CH2)m-, -(CH2)m-C(=Y)-, -(CH2)m-C(=Y)-O-, -(CH2)m-C(=Y)-N(R5)-, -(CH2)m-S(=O)t-, -(CH2)m-S(=O)t-N(R7)-, -(CH2)m-Y-, -CH=CH-, или -C=C-, где каждый t является 1 или 2; каждый m является 0, 1, 2 или 3;
Y представляет собой О;
В представляет собой -NR7R7a, C4-12 карбоциклил, C4-12 циклоалкил, С2-10 гетероциклил, С6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 спиро бициклил, или С5-12 спиро гетеробициклил; где каждый из С5-12 карбоциклил, C4-12 циклоалкил, С2-10 гетероциклил, С6-10 арил, C1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 спиро бициклил и С5-12 спиро гетеробициклил представляет собой дополнительно замещенный на оксо (=O), гидрокси, амино, гало, циано, С6-10 арил, С1-9 гетероарил, С1-6 алкокси, С1-6 алкиламино, C1-6 алкил, С2-6алкенил, С2-6алкинил, С2-10 гетероциклил, меркапто, нитро, С6-10 арилокси, карбокси, гидрокси-замещенный С1-6 алкокси, гидрокси-замещенный С1-6 алкил-С(=O)-, C1-6 алкил-С(=O)-, С1-6 алкил-S(=O)-, С1-6 алкил-S(=O)2-, гидрокси-замещенный С1-6 алкил-S(=O)-, гидрокси-замещенный С1-6 алкил-S(=O)2-, или карбокси С1-6 алкокси;
R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, C1-6 алифатический, С1-6 галоалкил, С1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, C1-12 галоалкокси, C1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, C3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, C1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, C1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-C1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, C2.I0 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, C1-6 алифатический, С1-6 галоалкил, С1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-4 гетероарил, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-С1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, С2-6галоалкил, С6-10 арил-С2-6-алкокси, C1-9 гетероарил-С3-6-алкокси, C1-9 гетероарилокси-С1-6-алкокси, С3-10 циклоалкил-С2-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С1-4 гетероарил, замещенный С6-10 арил, С1-4 гетероарил-С1-6-алифатический, замещенный С6-10 арил-С3-6-алкил, С2-10 гетероциклил-С1-6-алкил, C1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С6-10 арил-С2-10-алкокси, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С2-10 гетероциклилокси, С3-10 циклоалкилокси, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, C1-4 галоалкил, С2-10 алкокси, C1-6 гидроксиалкокси, С1-6 аминоалкокси, C1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, C3-5 циклоалкилокси, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарилокси-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С6-10 арилокси, С1-10 гетероарил окси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С6-10 арил-С2-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, C1-3 алкил, C1-3 галоалкил, C1-3 гидроксиалкил, C1-3 аминоалкил, C1-3 алкокси-C1-3-алкил, C1-3 алкиламино-C1-3-алкил, C1-3 алкилтио-C1-3-алкил, С6-10 арил-С1-6-алкил, С1-9 гетероарил-C1-3-алкил, С2-10 гетероциклил-C1-3-алкил, С3-10 циклоалкил-C1-3-алкил, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил; и
каждый R7 и R7a представляет собой независимо Н, С1-6 алифатический, С1-6 галоалифатический, C1-6 гидроксиалифатический, С1-6 аминоалифатический, C1-6 алкокси-С1-6-алифатический, C1-6 алкиламино-С1-6-алифатический, С1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил; с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7aR7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо.
[0020] В некоторых реализациях А, X и В с группой по формуле (II) представляют собой:

где D представляет собой О; n является 0, 1 или 2; и
каждый R5a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7aR7aR7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, циано, нитро, меркапто, C1-4 алкил, C1-4 алкокси, C1-4 алкиламино, С1-4 алкилтио, С6-10 арил, или С1-9 гетероарил.
[0021] В некоторых реализациях формула (IV) представляет собой

где V представляет собой N или CR1, V2 представляет собой N или CR2, V3 представляет собой N или CR3, и V4 представляет собой N или CR4, где как минимум один из V1, V2, V3 и V4 представляет собой N;
Т2 представляет собой N или CR10;
X представляет собой связь, NR5, О, S, -(CH2)m-, -(CH2)m-Y-, -С(=O)-, -C(=O)NH-, -СН=СН-, или -С=С-, где каждый т представляет собой независимо 0, 1, 2 или 3;
В представляет собой -NR7R7a, C4-12 карбоциклил, C4-12 циклоалкил, С2-10 гетероциклил, С6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, C5-12 спиро бициклил, или C5-12 спиро гетеробициклил; где каждый из C4-12 карбоциклил, С4-12 циклоалкил, С2-10 гетероциклил, С6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 спиро бициклил и С5-12 спиро гетеробициклил дополнительно замещен оксо (=O), гидрокси, амино, гало, циано, С6-10 арил, С1-9 гетероарил, С1-6 алкокси, С1-6 алкиламино, С1-6 алкил, С2-6алкенил, С2-6алкинил, С2-10 гетероциклил, меркапто, нитро, С6-10 арилокси, карбокси, гидрокси-замещенный C1-6 алкокси, гидрокси-замещенный С1-6 алкил-С(=O)-, С1-6 алкил-С(=O)-, С1-6 алкил-S(=O)-, С1-4 алкил-S=O)2-, гидрокси-замещенный С1-6 алкил-S(=O)-, гидрокси-замещенный С1-6 алкил-S(=O)2-, или карбокси С1-6 алкокси;
R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -0C(O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, C1-6 алифатический, С1-6 галоалкил, С1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-12 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, C1-6 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m-представляет собой дополнительно замещенный одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, С1-6 алифатический, С1-6 галоалкил, С1-6 алкокси, С1-6 гидроксиалкокси, C1-6 аминоалкокси, C1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, C1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-4 гетероарил, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, C1-6 алифатический, С2-6 галоалкил, С6-10 арил-С2-6-алкокси, C1-9 гетероарил-С3-6-алкокси, C1-9 гетероарилокси-С1-6-алкокси, С3-10 циклоалкил-С2-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С1-4 гетероарил, замещенный C6-10 арил, C1-4 гетероарил-С1-6-алифатический, замещенный С6-10 арил-С3-6-алкил, С2-10 гетероциклил-С1-6-алкил, С1-6 алкокси, С1-6 гидроксиалкокси, C1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С6-10 арил-С2-10-алкокси, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С2-10 гетероциклилокси, С3-10 циклоалкилокси, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, C1-6 галоалкил, С2-10 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, C3-5 циклоалкилокси, С6-10 арил-С1-6-алкокси, C1-9 гетероарил-С1-6-алкокси, C1-9 гетероарилокси-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С6-10 арилокси, С1-10 гетероарилокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил С1-9 гетероарил, С6-10 арил-С2-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, C1-3 алкил, C1-3 галоалкил, C1-3 гидроксиалкил, C1-3 аминоалкил, C1-3 алкокси-C1-3-алкил, C1-3 алкиламино-C1-3-алкил, C1-3 алкилтио-C1-3-алкил, С6-10 арил-C1-3-алкил, С1-9 гетероарил-C1-3-алкил, С2-10 гетероциклил-C1-3-алкил, С3-10 циклоалкил-C1-3-алкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
каждый R7 и R7a представляет собой независимо Н, С1-6 алифатический, С1-6-(, галоалифатический, С1-6 гидроксиалифатический, С1-6 аминоалифатический, С1-6 алкокси-С1-6-алифатический, С1-6алкиламино-С1-6-алифатический, С1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил; с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо;
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(CH3)2, -C(=O)NH-C1-4 алкил, -ОС(=O)NH-С1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, C1-4 алкил-S(=O)2-, C1-4 алкил-S(=O)2NH-, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или С1-9 гетероарил;
n представляет собой независимо 0, 1, 2 или 3; и
каждый R10 представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, нитро, меркапто, C1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, или С1-4 алкилтио.
[0022] В некоторых реализациях В представляет собой -N(СН3)2, -N(CH2CH3)2, -N(CH2CH2CH3)2, -N(CH2CH2CH2CH3)2,


R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, -N(СН3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -OC(=O)O-C1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, C1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, пиридил-(СН2)р-G-(СН2)m-, фенилэтил, циклогексил-(СН2)р-G-(СН2)m-, нафтил-(СН2)р-G-(СН2)m-, или морфолинил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, пиридил-(СН2)р-G-(СН2)m-, фенилэтил, циклогексил-(СН2)р-G-(СН2)m-, нафтил-(СН2)р-G-(СН2)m-, и морфолинил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним ии более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -OC(=O)O-C1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, или морфолинил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, или морфолинил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R4 представляет собой Н, F, I, циано, гидрокси, -N(СН3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, C1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, или морфолинил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -FTN-S(=O)t, -OS(=O)t, или -OS(=O)tNH-; каждый t является 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R5 представляет собой независимо Н, C1-3 алкил, фенил, бензил, пиридил или морфолино метил;
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -OC(=O)O-C1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или С1-9 гетероарил;
n представляет собой независимо 0, 1, 2 или 3; и
каждый R10 представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, нитро, меркапто, алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, или С1-4 алкилтио.
[0023] В некоторых реализациях формула (V) представляет собой

где Vi представляет собой N или CR1, V2 представляет собой N или CR2, V3 представляет собой N или CR3, и V4 представляет собой N или CR4, где как минимум один из V1, V2, V3 и V4 представляет собой N;
Т2 представляет собой N или CR10;
Т4 представляет собой NR5, О, S или CR11R11a;
X представляет собой связь, NR5, О, S, -(CH2)m-, -(CH2)m-Y-, -С(=O)-, -C(=O)NH-, -СН=СН-, или -С=С-, где каждый т представляет собой независимо 0, 1, 2 или 3;
В представляет собой -N(CH3)2, -N(CH2CH3)2, -N(CH2CH2CH3)2, -N(CH2CH2CH2CH3)2,


R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, C1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, C1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, или С6-10 арил-(СН2)р-G-(СН2)m-, где G представляет собой О, S, NR5, S(=O), S(=O)2, или С(=O); каждый р и m представляет собой независимо 0, 1, 2 или 3; или где С6-10 арил-(CH2)p-G-(CH2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -OC(=O)O-C1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, C1-4 алкил-NH-S(=O)2-, алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, или С6-10 арил-(СН2)р-G-(СН2)m-, где G представляет собой О, S, NR5, S(=O), S(=O)2, или С(=O); каждый р и m представляет собой независимо 0, 1, 2 или 3;
R3 представляет собой Н, F, Cl, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, или С6-10 арил-(СН2)р-G-(СН2)m-, где G представляет собой О, S, NR5, S(=O), S(=O)2, или С(=O); каждый р и m представляет собой независимо 0, 1, 2 или 3;
R4 представляет собой Н, F, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -OC(=O)O-C1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, C1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, или С6-10 арил-(СН2)р-G-(СН2)m-, где G представляет собой О, S, NR5, S(=O), S(=O)2, или С(=O); каждый р и m представляет собой независимо 0, 1, 2 или 3;
каждый R5 представляет собой независимо Н, С1-4 алкил, фенил, бензил, пиридил или морфолино метил; и
каждый R8a, R10, R11, и R11a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -OC(=O)O-C1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, циано, нитро, меркапто, С1-4 алкил, трифторметил, C1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или С1-9 гетероарил.
[0024] В некоторых реализациях формула (VI) представляет собой

где Е представляет собой N или CR10;
J представляет собой О, S, S(=O), S(=O)2, NR13 или CR14R14a;
k представляет собой O, 1, 2, 3 или 4;
q представляет собой 0, 1 или 2;
R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, C1-6 алкил, С1-6 галоалкил, C1-6 алкокси, С1-6 гидроксиалкокси, С1-12 аминоалкокси, C1-6 галоалкокси, С6-10 арил-С1-6 алкил, С6-10 арил-(CH2)p-G-(CH2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)- или -NHC(=O)NH-; каждый р и m представляет собой независимо 0, 1, 2 или 3; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, С6-10 арил-С1-6 алкил, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси, или циано;
R3 представляет собой Н, F, Cl, I, циано, гидрокси, C1-6 алкил, C1-6 галоалкил, С1-6 алкокси, С1-6 гидроксиалкокси, C1-6 аминоалкокси, C1-6 галоалкокси, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, С(=O), -C(=O)NH-, -OC(=O)NH-, -OC(=O)- или -NHC(=O)NH-; каждый р и m представляет собой независимо 0, 1, 2 или 3;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, C1-3 алкил, C1-3 галоалкил, C1-3 гидроксиалкил, C1-3 аминоалкил, C1-3 алкокси-C1-3-алкил, C1-3 алкиламино-C1-3-алкил, C1-3 алкилтио-C1-3-алкил, С6-10 арил-C1-3-алкил, С1-9 гетероарил-C1-3-алкил, С2-10 гетероциклил-C1-3-алкил, С3-10 циклоалкил-C1-3-алкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(СН3)2, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или C1-9 гетероарил;
n представляет собой 0, 1, 2 или 3;
каждый R представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, нитро, меркапто, алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, или С1-4 алкилтио;
каждый R12 представляет собой оксо (=O), гидрокси, амино, гало, циано, С1-10 алкокси, С1-10 алкиламино, С1-10 алкилтио, С1-10 алкил, С2-10 алкенил, С2-10 алкинил, меркапто, нитро, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил, С6-10 арилокси, карбокси, гидрокси-замещенный C1-6 алкокси, гидрокси-замещенный С1-6 алкил-С(=O)-, С1-6 алкил-С(=O)-, C1-6 алкил-S(=O)-, С1-6 алкил-S(=O)2-, гидрокси-замещенный С1-6 алкил-S(=O)-, гидрокси-замещенный C1-6 алкил-S(=O)2-, или карбокси С1-6 алкокси;
R13 представляет собой Н, С1-4 алкил, С2-4 алкинил, С1-4 алкокси, гидрокси-замещенный С1-4 алкокси, С1-4 карбоксиалкокси, С1-4 алкилкарбонил или гидрокси-замещенный С1-4 алкилкарбони; и
каждый R14 и R14a представляет собой независимо Н, гидрокси, карбокси, С1-4 алкил, С1-4 алкокси или С1-4 алкиламино.
[0025] В некоторых реализациях формула R1 представляет собой независимо Н, F, Cl, Br, I, циано, гидрокси, метил, этил, пропил, изопропил, бутил, тер-бутил, С6-8 арил-(СН2)р-G-(СН2)m- или С4-6 гетероарил-(СН2)р-G-(СН2)m-, где каждый G представляет собой NR5, О или S, каждый р и m представляет собой независимо 0, 1, 2 или 3; или где каждый из С6-8 арил-(СН2)р-G-(СН2)m- и С4-6 гетероарил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, метил, этил, пропил, этинил, пропинил, бутинил, метокси, или циано; и
R3 представляет собой независимо Н, F, Cl, I, циано, гидрокси, метил, этил, пропил, изопропил, бутил, тер-бутил, С6-8 арил-(СН2)р-G-(СН2)m- или С4-6 гетероарил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О или S, каждый р и m представляет собой независимо 0, 1, 2 или 3.
[0026] В некоторых реализациях формула (VI) представляет собой

где R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, C1-6 алкил, С1-6 галоалкил, C1-6 алкокси, C1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)- или -NHC(=O)NH-; каждый р и m представляет собой независимо 0, 1, 2 или 3; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, метил, этил, пропил, циано, этинил, метокси, этокси, или пропинил;
R3 представляет собой Н, F, Cl, I, циано, гидрокси, C1-6 алкил, С1-6 галоалкил, С1-6 алкокси, С1-6 гидроксиалкокси, C1-6 аминоалкокси, С1-6 галоалкокси, С6-10 арил-(CH2)p-G-(CH2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, С(=O), -C(=O)NH-, -OC(=O)NH-, -OC(=O)- или -NHC(=O)NH-; каждый р и m представляет собой независимо 0, 1, 2 или 3;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, С1-63 алкил, C1-3 галоалкил, C1-3 гидроксиалкил, C1-3 аминоалкил, C1-3 алкокси-С1-3-алкил, C1-3 алкиламино-C1-3-алкил, C1-3 алкилтио-С1-3-алкил, С6-10 арил-С1-3-алкил, С1-9 гетероарил-C1-3-алкил, С2-10 гетероциклил-С1-6-алкил, С3-10 циклоалкил-С1-3-алкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
каждый R представляет собой независимо Н, С1-6 алкил, C1-6 галоалифатический, С1-6 гидрокси алифатический, C1-6 аминоалифатический, С1-6 алкокси-С1-6-алифатический, С1-6 алкиламино-С1-6-алифатический, C1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, С2-10гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
каждый R7a представляет собой независимо С1-6 алкил, С1-6 галоалифатический, С1-6 гидроксиалифатический, С1-6 аминоалифатический, С1-6 алкокси-С1-6-алифатический, С1-6 алкиламино-С1-6-алифатический, С1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо;
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(СН3)2, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или С1-9 гетероарил; и
n представляет собой 0, 1, 2 или 3.
[0027] В некоторых реализациях каждый R7 представляет собой независимо Н, С1-6 алкил, С1-4 алкокси-С1-6-алкил,

каждый R7a представляет собой независимо С1-12 алкил, С1-4 алкокси-С1-6-алкил,
[0028] Заявляются фармацевтические лекарственные препараты, содержащие заявляемое лекарственное средство, или стереоизомер, геометрический изомер, таутомер, окись азота, гидрат, сольват, фармацевтически приемлемую соль или их прототипное лекарственное средство, и дополнительный фармацевтически приемлемый носитель, инертный наполнитель, разбавитель, активатор, основу или их сочетание.
[0029] Заявляются также способы профилактики, сопровождения, лечения или снижения тяжести фиброзного заболевания ткани или органа пациента, заключающиеся в приеме фармацевтически эффективного количества заявляемого лекарственного препарата.
[0030] Заявляются способы профилактики, сопровождения, лечения или снижения тяжести фиброзного заболевания ткани или органа пациента, заключающиеся в приеме фармацевтически эффективного количества заявляемого химического соединения.
[0031] Заявляется также использование заявляемого химического соединения в производстве лекарственного средства для профилактики, сопровождения, лечения или снижения тяжести фиброзного заболевания ткани или органа пациента.
[0032] Заявляется использование заявляемого лекарственного препарата в производстве лекарственного средства для профилактики, сопровождения, лечения или снижения тяжести фиброзного заболевания ткани или органа пациента.
[0033] Заявляется также использование заявляемого химического соединения или лекарственного препарата для профилактики, сопровождения, лечения или снижения тяжести фиброзного заболевания ткани или органа человека или животного, заключающееся в приеме пациентом фармацевтически эффективного количества (а) заявляемого химического соединения или лекарственного препарата.
[0034] В некоторых реализациях фиброзное заболевание ткани или органа представляет собой почечный интерстициальный фиброз, клубочковый склероз, фиброз печени, пульмональный фиброз, перитонеальный фиброз, миокардиальный фиброз, дерматофиброз, послеоперационные спайки, доброкачесвенную гипертрофию простаты, фиброз скелетных мышц, дерматосклероз, рассеянный склероз, панкреатический фиброз, цирроз печени, миосаркому, нейрофиброму, пульмональный интерстициальный фиброз, диабетическую нефропатию, болезнь Альцгеймера или васкулярный фиброз. В других реализациях послеоперационные спайки представляют собой заживляемые рубцы.
[0035] Заявляются также способы приготовления, способы сепарации и способы очистки химических веществ с химической формулой (I), (IV), (V), (VI) или (VII).
[0036] Предшествующее изложение представляет собой лишь реферат заявляемых позиций, не ограничивая суть заявки. Эти и другие аспекты, и реализации более подробно рассматриваются ниже.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ И ОСНОВНАЯ ТЕРМИНОЛОГИЯ
[0037] Будут приведены подробные ссылки на конкретные реализации настоящей заявки, иллюстрируемые на примерах прилагаемыми структурами и формулами. Заявляемое изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут попасть в область настоящей заявки, что определяется пунктами формулы изобретения. Специалист обнаружит многие известные ему способы и материалы, сходные или эквивалентные заявляемым, которые могут быть использованы в заявляемых практических способах. Приведенное описание никоим образом не ограничивает способы и материалы. Настоящая заявка является приоритетной в случае отличия или противоречия настоящей заявке одной или более позиций упоминаемой литературы, патентов или аналогичных материалов, включая, но не ограничиваясь установленными терминами, правилами применения, рассмотренными технологиями или подобными моментами.
[0038] При отсутствии иных указаний в настоящей заявке приняты приведенные ниже определения. В настоящей заявке химические элементы приводятся согласно Периодической системе химических элементов, вариант CAS, и «Справочнику по химии и физике», 75-е издание, 1994. Коме того, основы органической химии изложены Соррелом и соавторами в монографии «Органическая химия», издательство University Science Books, Sausalito: 1999, и Смитом с соавторами в монографии «Курс органической химии повышенной сложности Марша», издательство John Wiley & Sons, Inc., New York: 2007, на все упомянутые монографии имеются ссылки в настоящей заявке.
[0039] В настоящей заявке химические соединения могут быть дополнительно замещены одним или более заместителей, такими, как приведенные выше, или, например, относящимися к конкретным классам, подклассам и типам, приведенным в настоящей заявке. В дальнейшем изложении фраза «дополнительно замещенный» будет использоваться взаимозаменимо с фразой «замещенный или незамещенный». В общем, термин «замещенный», независимо от наличия термина «дополнительно», относится к замене одного или более водородных радикалов данной структуры радикалом заданного заместителя. В отсутствие иных указаний дополнительно замещенная группа может содержать заместитель на каждой замещаемой позиции группы. В случае замены более чем одной позиции данной структуры более чем одним заместителем, выбранным из указанной группы, на каждой позиции может находиться тот же самый или другой заместитель. Причем к заместителям относятся, не ограничиваясь перечисленным далее, гидрокси, амино, гало, циано, арил, гетероарил, алкокси, алкиламино, алкилтио, алкил, галоалкил, алкенли, алкинил, гетероциклил, тиол, нитро, арилокси, гетероарилокси, оксо (O=), карбокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(=O)-, алкил-С(=O)-, алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбоксиалкокси, и аналогичные вещества.
[0040] Термин «алифатический» или «алифатическая группа» относится к прямой цепочке (т.е. неразветвленной) или разветвленной, замещенный или незамещенный углеводородной цепочке, полностью насыщенной или содержащей один или более элементов ненасыщения. В отсутствие иных указаний алифатическая группа содержит 1-20 атомов углерода. В некоторых реализациях алифатическая группа содержит 1-10 атомов углерода.
В других реализациях алифатическая группа содержит 1-8 атомов углерода. В других реализациях алифатическая группа содержит 1-6 атомов углерода. В других реализациях алифатическая группа содержит 1-4 атома углерода, и в других реализациях алифатическая группа содержит 1-3 атома углерод. Подходящая алифатическая группа содержит, не ограничиваясь перечисленным далее, линейные или разветвленные, замещенные или незамещенные алкильные, алкенильные, или алкинильные группы, такие как метил, этил, пропил, изопропил, бутил, трет-бутил, гексил, изобутил, сек-бутил, этенил и подобные.
[0041] Термин «галоалифатический» относится к алифатической группе, замещенной одним или более тех же самых или других галогенных атомов, где алифатическая группа определена в настоящей заявке, галогенными атомами считаются F, Cl, Br или I. К некоторым неограничительным примерам относятся трифторметил, трифторэтил, хлорметил, 2-хлорэтилен, и аналогичные.
[0042] Термин «гидроксиалифатический» относится к алифатической группе, замещенной одной или более гидрокси группой, где алифатическая группа определена в настоящей заявке. некоторым неограничительным примерам относятся гидроксиэтил, 2-гидроксипропил, гидроксиметил, и аналогичные.
[0043] Термин «аминоалифатический» относится к алифатической группе, замещенной одной или более амино группой, где алифатическая группа определена в настоящей заявке. К некоторым неограничительным примерам относятся аминометил, 2-аминоэтил, 2-аминоизопропил, и аналогичные.
[0044] Термин «алкил» относится к насыщенному линейному или разветвленно-цепному моновалентному углеводородному радикалу из 1-20 атомов углерода, 1-10 атомов углерода, 1-6 атомов углерода, 1-4 атомов углерода, или 1-3 атомов углерода, где алкильный радикал может быть дополнительно замещен независимо одним или более заместителями по настоящей заявке. К дополнительным примерам алкильных групп относятся, не ограничиваясь перечисленным далее, метил (Me, -СН3), этил (Et, -CH2CH3), 1-пропил (n-Pr, n-пропил, -CH2CH2CH3), 2-пропил (i-Pr, i-пропил, -СН(СН3)2), 1-бутил (n-Bu, n-бутил, -CH2CH2CH2CH3), 2-метил-1-пропил (i-Bu, i-бутил, -CH2CH(СН3)2), 2-бутил (s-Bu, s-бутил, -СН(СН3)CH2CH3), 2-метил-2-пропил (t-Bu, t-бутил, -С(СН3)3), 1-пентил (n-пентил, -CH2CH2CH2CH2CH3), 2-пентил (-СН(СН3)CH2CH2CH3), 3-пентил (-СН(CH2CH3)2), 2-метил-2-бутил (-С(СН3)2CH2CH3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-CH2CH2CH(СН3)2), 2-метил-1-бутил (-CH2CH(СН3)CH2CH3), 1-гексил(-CH2CH2CH2CH2CH2CH3), 2-гексил (-СН(СН3)CH2CH2CH2CH3), 3-гексил (-СН(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-С(СН3)2CH2CH2CH3), 3-метил-2-пентил (-СН(СН3)СН(СН3)CH2CH3), 4-метил-2-пентил (-СН(СН3)CH2CH(СН3)2), 3-метил-3-пентил (-С(СН3)(CH2CH3)2), 2-метил-3-пентил (-СН(CH2CH3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)3, 1-гептил, 1-октил, и аналогичные. Термин «алкил» и приставка «алк-» охватывают как прямую, так и разветвленную углеродную цепочку. Термин «алкилен» в настоящей заявке представляет насыщенную дивалентную углеводородную группу, полученную из прямой или разветвленной цепочки насыщенного углеводорода удалением двух атомов водорода, примерами может служить метилен, этилен, изопропилен, и аналогичные.
[0045] Термин «алкилен» относится к алкильной системе с двумя соединительными точками, соединенной с остатками молекулы, где алкильный радикал определен в настоящей заявке.
[0046] Термин «алкенил» относится к линейному или разветвленному моновалентному углеводородному радикалу из 2-12 атомов углерода, 2-8 атомов углерода, 2-6 атомов углерода, или 2-4 атомов углерода, имеющим как минимум одну зону ненасыщения, например, углерод-углерод, sp2 двойная связь, где алкенильный радикал может быть дополнительно замещен независимо одним или более заместителями по настоящей заявке, и включает в себя радикалы ориентации «cis» и «trans», или, как альтернативный вариант, ориентации «Е» и «Z». К некоторым неограничительным примерам относятся этенил или винил (-СН=CH2), аллил (-CH2CH=CH2), и аналогичные.
[0047] Термин «алкенилен» относится к алкенильной системе с двумя соединительными точками, соединенной с остатками молекулы, где алкенильный радикал определен в настоящей заявке.
[0048] Термин «алкинил» относится к линейному или разветвленно-цепному моновалентному углеводородному радикалу из 2-12 атомов углерода, 2-8 атомов углерода, 2-6 атомов углерода, или 2-4 атомов углерода, имеющим как минимум одну зону ненасыщения, например, углерод-углерод, sp тройная связь, где алкинильный радикал может быть дополнительно замещен независимо одним или более заместителями по настоящей заявке. К некоторым неограничительным примерам относятся этинил (-С=СН), 2-пропинил (-CH2C=СН), и аналогичные.
[0049] Термин «алкинилен» относится к алкинильной системе с двумя соединительными точками, соединенной с остатком молекулы, где алкинильный радикал определен в настоящей заявке.
[0050] Термин «гидрокси-замещенный алкил» относится к алкильной группе, замещенной одной или более гидрокси группами, где алкильная группа определена в настоящей заявке. К некоторым неограничительным примерам относятся гидроксиметил, гидроксиэтил, 1,2-дигидроксиэтил, и аналогичные.
[0051] Термин «карбокси-замещенный алкил» относится к алкильной группе, замещенной одной или более карбокси группами, где алкильная группа определена в настоящей заявке. К некоторым неограничительным примерам относятся карбоксиметил, карбоксиэтил, и аналогичные.
[0052] Термин «циклоалифатический», «карбоциклический», «карбоциклил» или «циклоалкил» отеносится к моновалентному или многовалентному, неароматическому, насыщенному или частично ненасыщенному кольцу, не содержащему гетероатомов, при наличии от 3 до 12 атомов углерода в качестве моноциклического кольца или от 7 до 12 атомов углерода в качестве бициклического или трициклического кольца. Бицилические карбоциклы с 7…12 атомами можно компоновать, например, как бицикло [4, 5], [5, 5], [5, 6] или [6, 6] систему, и бициклические карбоциклы 9…10-атомными кольцами можно компоновать как бицикло [5, 6] или [6, 6] систему. К некоторым неограничительным примерам циклоалифатических групп относятся циклоалкил, циклоалкенил, и циклоалкинил. Дополнительными примерами циклоалифатических групп являются циклопропил, циклобутил, циклопентил, 1-циклопент-1-энил, 1-циклопент-2-энил, 1-циклопент-3-энил, циклогексил, 1-циклогекс-1-энил, 1-циклогекс-2-энил, 1-циклогекс-3-энил, циклогексадиэнил, циклогептил, циклооктил, циклононил, циклодецил, циклоандецил, циклододецил, адамантил, и аналогичные. И «циклоалифатический», «карбоциклический», «карбоциклил», или «циклоалкил» может быть замещенным или незамещенным, где заместителем может выступать, не ограничиваясь перечисленным далее, гидрокси, амино, гало, циано, арил, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный -С(=O)-, алкил-С(=O)-, алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбоксиалкокси, и аналогичные.
[0053] Термин «карбоциклилен» относится к карбоциклильной системе с двумя соединительными точками, соединенной с остатками молекулы, где карбоциклильный радикал определен в настоящей заявке.
[0054] Термин «карбоциклил (гидроксиалкокси)» относится к гидроксиалкоксильной группе, замещенной одной или более карбоциклильной группой, где карбоциклильная и гидроксиалкоксильная группы определены в настоящей заявке. К некоторым неограничительным примерам относятся циклопропил гидрокси метил, циклопропил гидроксиэтил, циклопропил гидроксипропил, циклогексил гидроксипропил, циклогексил гидроксиметил, и аналогичные.
[0055] Термин «циклоалкилокси» или «карбоциклилокси» относится к дополнительно замещенному циклоалкильному радикалу или карбоциклильному радикалу, определенному в настоящей заявке, прикрепленному к атому кислорода, который соединен с остатком молекулы. К некоторым неограничительным примерам относятся циклопропилокси, циклопентилокси, циклогексилокси, гидрокси-замещенный циклопропилокси, и аналогичные.
[0056] Термин «циклоалкиламино» относится к амино группе, замещенной одной или двумя циклоалкильными группами, где циклоалкильная группа определена в настоящей заявке. К некоторым неограничительным примерам относятся циклопропиламино, циклопентиламино, циклогексиламино, гидрокси-замещенный циклопропиламино, дициклогексиламино, дициклопропиламино, и аналогичные.
[0057] Термин «карбоциклилоксиалкокси» относится к алкокси группе, замещенной одной или более карбоциклилокси группами, где алкокси группа и карбоциклилокси группа определена в настоящей заявке. К некоторым неограничительным примерам относятся циклопропилоксиметокси, циклопропилоксизтокси, циклопентилоксиэтокси, циклогексилоксиэтокси, циклогексенил-3-оксиэтокси, и аналогичные.
[0058] Термин «циклоалкилоксиалифатический» относится к алифатической группе, замещенной одной или более циклоалкилокси группами, где алифатическая группа и циклоалкилокси группа определена в настоящей заявке. К некоторым неограничительным примерам относятся циклопропилоксиметил, циклопропилоксиэтил, циклопентилоксиметил, циклопентилоксиэтил, циклогексилоксиэтил, галоциклопропилоксиэтил, и аналогичные.
[0059] Термин «циклоалкиламиноалифатический» относится к алифатический группе, замещенной одной или более циклоалкиламино группами, где алифатическая группа и циклоалкиламино группа определена в настоящей заявке. К некоторым неограничительным примерам относятся циклопропиламинометил, циклопропиламиноэтил, циклопентиламинометил, циклопентиламиноэтил, циклогексиламиноэтил, галоциклопропиламиноэтил, и аналогичные.
[0060] Термин «циклоалкилалифатический» или «карбоциклилалифатический» относится к алифатической группе, замещенной одной или более циклоалкильными группами или карбоциклильными группами, где карбоциклильная группа, циклоалкильная группа и алифатическая группа определены в настоящей заявке. К некоторым неограничительным примерам относятся циклопропилметил, циклопропилэтил, циклопропилпропил, циклопентилметил, циклогексилэтил, и аналогичные.
[0061] Термин «циклоалкилалкокси» («карбоциклилалкокси») относится к алкокси группе, группе, замещенной одной или более циклоалкильными группами или карбоциклильными группами, где карбоциклильная группа, циклоалкильная группа и алкокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся циклопропилметокси, циклопропилэтокси, циклопентилэтокси, циклогексилэтокси, циклогексилметокси, циклопропилпропокси, и аналогичные.
[0062] Термин «циклоалкилалкиламино» («карбоциклилалкиламино») относится к алкиламино группе, замещенной одной или более циклоалкилными группами или карбоциклильными группами, где карбоциклильная группа, циклоалкильная группа и алкиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся циклопропилметиламино, циклопропилэтиламино, циклопентилэтиламино, циклогексилэтиламино, циклогексилметиламино, циклопропилпропиламино, и аналогичные.
[0063] Термин «гетероцикл», «гетероциклил», «гетероциклоалифатический», или «гетероциклический», используемый взаимозаменяемо в настоящей заявке, относится к моноцикличной, бицикличной, или трицикличной кольцевой системе, в которой одно или более звеньев кольца представляют собой независимо выбранный гетероатом, и которая полностью насыщена или содержит один или более модулей ненасыщения, но не ароматических, с единственной точкой крепления к остатку молекулы. Один или более кольцевых атомов дополнительно замещены независимо одним или более заместителей, приведенных в настоящей заявке. В некоторых реализациях «гетероцикл», «гетероциклил», «гетероциклоалифатическая» или «гетероциклическая» группа представляет собой моноцикл с 3…7 звеньями кольца (т.е. от 1 до 6 атомов углерода и от 1 до 3
гетероатомов, отобранных из N, О, Р или S, где S или Р дополнительно замещен одним или более оксо для создания группы SO или SO2, РО или PSO2, с оговоркой, что там, где кольцо состоит из 3 звеньев, имеется только один гетероатом или бицикл с 7…10 звеньями кольца (т.е. от 4 до 9 атомов углерода и от 1 до 3 гетероатомов, отобранных из N, О, Р или S, где S или Р дополнительно замещен одним или более оксо для формирования группы SO или SO2, РО или PSO2).
[0064] Гетероциклилом может быть углеродный радикал или гетероатомный радикал. «Гетероциклил» также включает радикалы, где гетероциклические радикалы сплавленные с насыщенным, частично ненасыщенным кольцом, или гетероциклическим кольцом. К некоторым неограничительным примерам гетероциклических колец относится пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиэнил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, пиперидино, гомопиперидинул, эпоксипропил, азепанил, оксепанил, тиепанил, 4-метокси-пиперидин-1-ил, 1,2,3,6-тетрагидропиридин-1-ил, оксазепинил, диазепинил, тиазепинил, пирролин-1-ил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксанил, пиразолинил, дитианил, дитиоланил, дигидротиенил, пиразолидинилимидазолинил, имидазолидинил, 1,2,3,4-тетрагидроизоквинолинил, 1,2,6-тиадиазан-1-1-диоксо-2-ил, 4-гидрокси-1,4-азафосфин-4-оксид-1-ил, 2-гидрокси-1-(пиперазин-1-ил)этанон-4-ил, 2-гидрокси-1-(5,6-дигидро-1,2,4-триазин-1(4Н)-ил)этанон-4-ил, 5,6-дигидро-4Н-1,2,4-оксадиазин-4-ил, 2-гидрокси-1-(5,6-дигидропиридин-1(2Н)-ил)этанон-4-ил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 2-метил-5,6,7,8-татрегидро-[1,2,4]триазоло[1,5-с]пиримидин-6-ил, 4,5,6,7-тетрагидроизоксазол[4,3-с]пиридин-5-ил, 3Н-индолил-2-оксо-5-азабицикло[2.2.1]гептан-5-ил, 2-оксо-5-азабицикло[2.2.2]октан-5-ил, квинолизинил и N-пиридил карбамид. К некоторым неограничительным примерам гетероциклического кольца относятся 1,1-диоксо-тиоморфолинил и гетероциклическая группа, где 2 атома углерода в кольце, замещенные оксо (=O) молекулами, пиримидиндионил. Гетероциклическая группа по настоящей заявке может быть замещенной или незамещенной, где в качестве заместителя может выступать, не ограничиваясь перечисленным далее, оксо (=O), гидрокси, амино, гало, циано, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(О)-, алкил-С(=O)-, алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбоксиалкокси, и аналогичные.
[0065] Термин «гетероциклилен» относится к гетероциклильной системе с двумя соединительными точками, соединенной с остатками молекулы, где гетероциклильный радикал определен в настоящей заявке.
[0066] Термин «гетероциклилалкил» относится к гетероциклически-замещеннному алкильному радикалу. Термин «гетероциклилалкокси» относится к гетероциклически-замещенному алкокси радикалу, где атом кислорода выполняет роль соединительной точки с остатком молекулы. Термин «гетероциклилалкиламино» относится к гетероциклически-замещенному алкиламино радикалу, де атом водорода выполняет роль соединительной точки с остатком молекулы. К некоторым неограничительным примерам гетероциклила, алкила, алкокси и алкиламино относятся пиррол-2-илметил, морфолин-4-илэтил, морфолин-4-илэтокси, пиперазин-4-илэтокси, пиперидин-4-илэтиламино, и аналогичные.
[0067] Термин «гетероциклилалифатический» относится к гетероциклически-замещенной алифатической группе, где гетероциклический радикал и алифатическая группа определены в настоящей заявке. К некоторым неограничительным примерам относятся пиррол-2-илметил, пиперидин-2-илэтил, пиперазин-2-илэтил, пиперидин-2-илметил, и аналогичные.
[0068] Термин «гетероциклилокси» относится к дополнительно замещенному гетероциклильному радикалу, определенному в настоящей заявке, соединенному с атомом кислорода, и атом кислорода служит соединительной точкой с отстатком молекулы. К некоторым неограничительным примерам относятся пиррол-2-илокси, пиррол-3-илокси, пиперидин-2-илокси, пиперидин-3-илокси, пиперазин-2-илокси, пиперидин-4-илокси, и аналогичные.
[0069] Термин «гетероциклиламино» относится к амино группе, замещенной одним или двумя гетероциклильными группами, где гетероциклильная группа определена в настоящей заявке. К некоторым неограничительным примерам относятся пиррол-2-иламино, пиррол-3-иламино, пиперидин-2-иламино, пиперидин-3-иламино, пиперидин-4-иламино, пиперазин-2-иламино, дипиррол-2-иламино, и аналогичные.
[0070] Термин «гетероциклилоксиалкокси» относится к алкокси радикалу, замещенному одной или более гетероциклилокси группами, где алкокси радикал и гетероциклилокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся пиррол-2-илоксиметокси, пиррол-3-илоксиэтокси, пиперидин-2-илоксиэтокси, пиперидин-3-илоксиэтокси, пиперазин-2-илоксиэтокси, пиперидин-4-илоксиэтокси, и аналогичные.
[0071] Термин «гетероциклилоксиалифатический» относится к алифатический группе, замещенной одной или более гетероциклилокси группами, где алифатическая группа и гетероциклилокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся пиррол-2-илоксиметил, пиперазин-3-илокси этил, пиперазин-2-илоксиэтил, морфолин-2-илоксиметил, пиперидин-2-илоксиэтил, и аналогичные.
[0072] Термин «гетероциклиламиноалифатический» относится к алифатической группе, замещенной одной или более гетероциклиламино группами, где алифатическая группа и гетероциклиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся пиррол-2-иламинометил, пиперазин-3-лиаминоэтил, пиперазин-2-лиаминоэтил, пиперидин-2-лиаминоэтил, морфолин-2-лиаминометил, и аналогичные.
[0073] Термин «гетероциклил(гидроксиалкокси)» относится к гидроксиалкокси группе, замещенной одной или более гетероциклил группами, где гетероциклил группа и гидроксиалкокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся пиррол-2-илгидроксиметокси и морфолин-4-илгидроксиметокси.
[0074] Термин «гетероаом» относится к одному или более из перечисленных далее: кислород, сера, азот, фосфор, иил кремний, включая любую окисленную форму азота, серы, или фосфора; кватернизированную форму любого основного азота; или замещаемый азот гетероциклического кольца, например, N (как в 3,4-дигидро-2Н-пирролил), NH (как в пирролидинил) или NR (как в N-замещенном пирролидиниле).
[0075] Термин «галоген» относится к F, Cl, Br или I.
[0076] Термин «ненасыщенный» относится к молекуле с одним или более элементами ненасыщения.
[0077] Термин «алкокси» относится к алкильной группе, определенной ранее, прикрепленной к основной углеродной цепочке посредтсвом атома кислорода («алкокси»). К некоторым неограничительным примерам относятся метокси, этокси, пропокси, бутокси, и аналогичные. И алкокси, определение которого приведено выше, может быть замещенным или незамещенным, где в качестве заместителя может выступать, не ограничиваясь перечисленным далее, гидрокси, амино, гало, циано, алкокси, алкил, алкенил, алкинил, тиол, нитро, и аналогичные.
[0078] Термин «гидрокси-замещенный алкокси» или «гидроксиалкокси» относится к алкокси группе, замещенной одной или более гидрокси группами, где определение алкокси группы приведено выше. К некоторым неограничительным примерам относятся гидроксиметокси, 2-гидроксиэтокси, 2-гидроксипропокси, 2-гидроксиизопропокси, и аналогичные.
[0079] Термин «аминоалкокси» относится к алкокси группе, замещенной одной или более амино группами, где определение алкокси группы приведено выше. К некоторым неограничительным примерам относятся аминометокси, 2-аминоэтокси, 2-аминопропокси, 2-аминоизопропокси, и аналогичные.
[0080] Термин «гидрокси-замещенный аминоалкокси» относится к аминоалкокси группе, замещенной одной или более гидрокси группами, где определение аминоалкокси группы приведено выше. К некоторым неограничительным примерам относятся гидроксиаминометокси, 2-гидрокси-2-аминоэтокси, и аналогичные.
[0081] Термин «азидоалкокси» относится к алкокси группе, замещенной одной или более азидо группами, где определение алкокси группы приведено выше. К некоторым неограничительным примерам относятся 2-азидоэтокси, 3-азидопропокси, 2-азидопропокси, и аналогичные.
[0082] Термин «алкоксиалкокси» относится к алкокси группе, замещенной одной или более алкокси группами, где определение алкокси группы приведено выше. К некоторым неограничительным примерам относятся метоксиметокси, метоксиэтокси, этоксиметокси, этоксиэтокси, этоксипропокси, и аналогичные.
[0083] Термин «алкоксиалифатический» относится к алифатической группе, замещенной одной или более алкокси группами, где алифатическая группа и алкокси группа определены в настоящей заявке.
К некоторым неограничительным примерам относятся метоксиметил, этоксиметил, этоксиэтил, этоксиргорепил, и аналогичные.
[0084] Термин «алкиламиноалифатический» относится к алифатической группе, замещенной одной или более алкиламино группами, где алифатический группа и алкиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся диметиламиноэтил, метиламиноэтил, диэтиламинометил, диэтиламиноэтил, и аналогичные.
[0085] Термин «алкилтиоалифатический» относится к алифатической группе, замещенной одной или более алкилтио группами, где алифатический группа и алкилтио группа определены в настоящей заявке. К некоторым неограничительным примерам относятся метилтиоэтил, метилтиопропил, этилтиоэтил, метилтиоргорепил, и аналогичные.
[0086] Термин «галоалкил», «галоалкенил» или «галоалкокси» относится к алкильной группе, алкенильной группе или алкокси группе, замещенной одной или более галогенными атомами. К некоторым неограничительным примерам относятся трифторметил, 2-хлор-этенил, трифторметокси, и аналогичные.
[0087] Термин «амино-замещенный галоалкокси» относится к галоалкокси группе, замещенной одной или более амино группами, где определение галоалкокси приводится в настоящей заявке. К некоторым неограничительным примерам относятся 3-амино-2-хлорпропокси, и аналогичные.
[0088] Термин «алкиламиноалкокси» относится к алкокси группе, замещенной одной или более алкиламино группами, где алкокси группа и алкиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 3-метиламино-2-пропокси, и аналогичные.
[0089] Термин «алкиламиногалоалкокси» относится к а галоалкокси группе, замещенной одной или более алкиламино группами, где галоалкокси группа и алкиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 3-метиламино-2-хлорпропокси, и аналогичные.
[0090] Термин «гидрокси-замещенный галоалкокси» относится к а галоалкокси группе, замещенный одной или более гидрокси группами, где определение галоалкокси приводится в настоящей заявке.
К некоторым неограничительным примерам относятся 3-гидрокси-2-фторпропокси, гидроксиметил трифторметокси, и аналогичные.
[0091] Термин «арил» используется самостоятельно или как часть составного определенения, такого как «аралкил», «арилалкокси» или «арилоксиалкил» и относится к моноцикличным, бицикличным и и трицикличным углеродным кольцевым системам, содержащим в целом от шести до четырнадцати звеньев кольца, где как минимум одно кольцо системы является ароматическим, где каждое кольцо системы содержит от 3 до 7 звеньев и крепится к остатку молекулы в единственной точке. Термин «арил» может использоваться взаимозаменяемо с термином «ариловое кольцо». К некоторым неограничительным примерам ариловых колец относятся фенил, нафтил, и антрацен. И арил, определенный в настоящей заявке, может быть замещенным или незамещенным, где заместителем може являться, не ограничиваясь перечисленным далее, гидрокси, амино, галоген, циано, арил, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(=O)-, алкил-С(=O)-, алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбоксиалкокси, и аналогичные.
[0092] Термин «фторфенил» или «фтор-замещенный фенил» относится к фенильной группе, замещенной одним или более атомом фтора.
[0093] Термин «арилен» относится к арильной системе с двумя соединительными точками, соединенной с остатками молекулы, где арильный радикал определен в настоящей заявке.
[0094] Термин «арилалифатический» относится к алифатической группе, замещенной одной или более арильной группе, где алифатическая группа и арильная группа определены в настоящей заявке. К некоторым неограничительным примерам относятся фенилэтил, фенилметил, (п-толил)этил, стирил, и аналогичные.
[0095] Термин «арилокси» относится к дополнительно замещенным арильным радикалам, определенным в настоящей заявке, прикрепленным к атому кислорода, где атом кислорода служит соединительной точкой с остатком молекулы. Где арильный радикал определен в настоящей заявке. К некоторым неограничительным примерам относятся фенилокси, метилфенилокси, этилфенилокси, и аналогичные.
[0096] Термин «ариламино» относится к амино группе, замещенной одной или двумя арильными группами, где арильная группа определена в настоящей заявке.
К некоторым неограничительным примерам относятся фениламино, (р-фторфенил)амино, дифениламино, дитолиламино, (ди-п-тоилил)амино, и аналогичные.
[0097] Термин «арилоксиалкокси» относится к алкокси группе, замещенной одной или более арилокси группой, где алкокси группа и арилокси группа определены в настоящей заявке. В качестве примеров можно привести фенилоксиметокси, фенилоксиэтокси, фенилоксипропокси, и аналогичные.
[0098] Термин «гетероарилоксиалкокси» относится к алкокси группе, замещенной одной или более гетероарилокси группами, где алкокси группа и гетероарилокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся пиридилоксиметокси, пиримидинилоксиэтокси, триазолоксипропокси, и аналогичные.
[0099] Термин «арилоксиалифатический» относится к алифатический группе, замещенной одной или более арилокси группами, где арилокси группа и алифатическая группа определены в настоящей заявке. К некоторым неограничительным примерам относятся фенилоксиметил, фенилоксиэтил, фенилоксипропил, и аналогичные.
[00100] Термин «гетероарилоксиалифатический» относится к алифатический группе, которая может быть замещена одной или более гетероарилокси группами, где гетероарилокси группа и алифатическая группа определены в настоящей заявке. К некоторым неограничительным примерам относятся фуранилоксиметил, пиримидинилоксиэтил, и аналогичные.
[00101] Термин «ариламиноалифатический» относится к алифатический группе, замещенной одной или более ариламино группами, где ариламино группа и алифатическая группа определены в настоящей заявке. К некоторым неограничительным примерам относятся фениламинометил, фениламиноэтил, толиламиноэтил, фениламинопропил, фениламиноаллил, и аналогичные.
[00102] Термин «арил(гидроксиалкокси)» относится к гидроксиалкокси группе, замещенной одной или более арильными группами, где арильная группа и гидроксиалкокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся фенилгидроксиметил, фенилгидроксиэтил, (п-толил)гидроксиэтил, и аналогичные.
[00103] Термин «арилалкокси» относится к алкокси группе, замещенноый одной или более арильными группами, где арильная группа и алкокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся фенилметокси, фенилэтокси, (п-толил)метокси, фенилпропокси, и аналогичные. Арил, определенный в настоящей заявке, может быть замещенным или незамещенным, причем в качестве заместителя может выступать, не ограничиваясь перечисленным далее, гидрокси, амино, галоген, циано, арил, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(=O)-, алкил-С(=O)-, алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбоксиалкокси, и аналогичные.
[00104] Термин «арилалкиламино» относится к алкиламино группе, замещенной одной или более арильными группами, где арильная группа и алкиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся фенилметиламино, фенилэтиламино, фенилпропиламино, (п-толил)метиламино, и аналогичные.
[00105] Термин «гетероарил», используемый самостоятельно или как часть составного определения, такого как «гетероагалкил» или «гетероарилалкокси» относится к моноцикличным, бицикличным и трицикличным углеродным кольцевым системам, содержащим в целом от шести до четырнадцати звеньев кольца, где как минимум одно кольцо системы является ароматическим, как минимум одно кольцо системы содержит один или более гетероатомов, где каждое кольцо системы содержит от 3 до 7 звеньев и крепится к остатку молекулы в единственной точке. Термин «гетероарил» может использоваться взаимозаменяемо с термином «гетероарильное кольцо» или с термином «гетероароматический». И гетероарил, определенный в настоящей заявке, может быть замещенным или незамещенным, причем в качестве заместителя может выступать, не ограничиваясь перечисленным далее, гидрокси, амино, галоген, циано, арил, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(=O)-, алкил-С(=O), алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбоксиалкокси, и аналогичные.
[00106] В качестве некоторых неограничительных примеров подходящих гетероарильных колец можно привести следующие моноциклы:
2-фуранил, 3-фуранил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 4-метилизоксазол-5-ил, N-пирролил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, пирадазинил (например, 3-пирадазинил), 2-тиазолил, 4-тиазолил, 5-тиазолил, тетразолил (например, 5-тетразолил), триазолил (например, 2-триазолил и 5-триазолил), 2-тиенил, 3-тиенил, пиразолил (например, 2-пиразолил), изотиазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, 1,2,4-оксадиазолил, 1,2,3-триазолил, 1,2,3-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазол-2-ил, пиразинил, 2-пиразинил, 1,3,5-триазинил, бензо[д]тиазол-2-ил, имидазо[1,5-а]пиридил и следующие бициклы, включая: бензимидазолил, бензофурил, бензотиофенил, бензотиазолил, индолил (например, 2-индолил), пуринил, квинолинил (например, 2-квинолинил, 3-квинолинил, 4-квинолинил), или изоквинолинил (например, 1-изоквинолинил, 3-изоквинолинил, или 4-изоквинолинил).
[00107] Термин «гетероарилен» относится к гетероарильной системе с двумя соединительными точками, соединенной с остатками молекулы, где гетероарильный радикал определен в настоящей заявке.
[00108] Термин «гетероарилокси» относится к дополнительно замещенным арильным радикалам, определенным в настоящей заявке, прикрепленным к атому кислорода, где атом кислорода служит соединительной точкой с остатком молекулы. К некоторым неограничительным примерам относятся прид-2-илокси, тиазол-2-илокси, имидазол-2-илокси, пиримидин-2-илокси, и аналогичные.
[00109] Термин «гетероарилоксиалифатический» относится к алифатический группе, замещенной одной или более гетероарилокси группами, где алифатическая группа и гетероарилокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся пирид-2-илоксиэтил, тиазол-2-илоксиметил, имидазол-2-илоксиэтил, пиримидин-2-илоксипропил, и аналогичные. Термин «сульфонил», используемый или самостоятельно, или в связи с другими терминами, такими, как алкилсульфонил, относится к соответственно дивалентным радикалам -SO2-. Термин «алкилсульфонил», относится к сульфонил радикалу, замещенному алкильным радикалом, с образованием алкилсульфонила (-SO2CH3).
[00110] Термин «сульфамил», «аминосульфопил» или «сульфонамидил» относится к а сульфонил радикалу, замещенному аминным радикалом, с образованием сульфонамида (-SO2NH2).
[00111] Термин «карбокси» или «карбоксил», используемый самостоятельно или как часть составного определения, такого как "карбоксиалкил", относится к -CSO2H. Термин «карбонил», используемый или самостоятельно, или в связи с другими терминами, такими, как «аминокарбонил» или «карбонилокси», относится к -(С=O)-.
[00112] Термин «карбоксиалкокси» относится к алкокси группе, замещенный одной или более карбокси группами, где алкокси группа и карбокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся карбоксиметокси, карбоксиэтокси, и аналогичные.
[00113] Термин «алкилкарбонил» относится к дополнительно замещенному алкилу, связанному с карбонильным радикалом, и карбонильный радикал соединен с остатком молекулы, причем определение алкила приведено выше. К некоторым неограничительным примерам относятся метилкарбонил, этилкарбонил, и аналогичные.
[00114] Термин «гидроксиалкилкарбонил» относится к гидрокси-замещенному алкилу, связанному с карбонильным радикалом, и карбонильный радикал соединен с остатком молекулы, причем определение алкила приведено выше. К некоторым неограничительным примерам относятся гидроксиметилкарбонил, 1,2-дигидроксиэтилкарбонил, и аналогичные.
[00115] Термин «аралкил» или «арилалкил» относится к арил-замещенным алкильным радикалам. В некоторых реализациях аралкильные радикалы представляют собой «нижние аралкильные» радикалы с арильными радикалами, связанными с алкильными радикалами, имеющими от одного до шести атомов углерода. В других реализациях аралкильные радикалы представляют собой «фенилалкиленил», связанный с алкильными частями, имеющим от одного до трех атомов углерода. К некоторым неограничительным примерам таких радикалов относится бензил, дифенилметил и фенилэтил. Арил в упомянутом аралкиле может быть дополнительно замещен гало, алкилом, алкокси, галоалкилом или галоалкокси.
[00116] Термин «алкилтио» относится к радикалам, содержащим линейный или разветвленный алкильный радикал, имеющим от одного до десяти атомов углерода, связанных с дивалентным атомом серы. В других реализациях, алкилтио радикалы представляют собой нижние алкилтио радикалы, где имеются от одного до трех атомов углерода. К некоторым неограничительным примерам «алкилтио» относится метилтио (CH3S-).
[00117] Термин «галоалкилтио» относится к радикалам, содержащим галоалкильный радикал, с наличием от одного до десяти атомов углерода, связанный с дивалентным атомом серы. В других реализациях галоалкилтио радикалы представляют собой нижние галоалкилтио радикалы с наличием от одного до трех атомов углерода. К некоторым неограничительным примерам «галоалкилтио» относится трифторметилтио.
[00118] Термин «алкиламино» относится к «N-алкиламино» и «N.N-диалкиламино», где амино группы независимо замещены одним алкильным радикалом или двумя алкильными радикалами, соответственно. В других реализациях алкиламино радикалы представляют собой «нижние алкиламино» радикалы с одним или двумя алкильными радикалами от одного до шести атомов углерода, связанными с атомом азота. Существуют реализации, где алкиламино радикалы представляют собой нижние алкиламино радикалы с наличием от одного до трех атомов углерода. К некоторым неограничительным примерам подходящих алкиламино радикалов относятся моно или диалкиламино, такие как N-метиламино, N-этиламино, N,N-диметиламино, N,N-диэтиламино, и аналогичные.
[00119] Термин «алкиламиногалоалкокси» относится к а галоалкокси группе, замещенной одной или более алкиламино групп, где галоалкокси группа и алкиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся метиламинодифторметокси, этиламинотрифторметокси, и аналогичные.
[00120] Термин «гетероариламино» относится к амино группам, замещенным одним или двумя гетероарильными радикалами, причем определение гетероарильного радикала приводится в настоящей заявке. К некоторым неограничительным примерам гетероариламино относится N-тиениламино, и аналогичные. В других реализациях «гетероариламино» включают замещенную часть гетероарильного кольца радикала.
[00121] Термин «гетероарилалифатический» относится к алифатическим группам, замещенным одним или более гетероарильным радикалом, где понятия гетероарильного радикала и алифатической группы определены в настоящей заявке. К некоторым неограничительным примерам гетероарилалифатического относятся тиофен-2-илпропепил, пиридин-4-илэтил, имидазол-2-метил, фуран-2-этил, индол-3-метил, и аналогичные.
[00122] Термин «гетероарилалкил» относится к алкил группам, замещенным одним или более гетероарильным радикалом, где понятия гетероарильного радикала и алкил группы определены в настоящей заявке. К некоторым неограничительным примерам гетероарилалкила относятся имидазол-2-метил, фуран-2-этил, индол-3-метил, и аналогичные.
[00123] Термин «гетероарилалкиламино» относится к азот-содержащим гетероарилалкильным радикалам, связанным посредством атома азота с другими радикалами, где гетероарилалкил радикалы определены в настоящей заявке. К некоторым неограничительным примерам гетероарилалкиламино относятся пиридин-2-метиламино, тиазол-2-этиламино, имидазол-2-этиламино, пиримидин-2-пропиламино, пиримидин-2-метиламино, и аналогичные.
[00124] Термин «аминоалкил» относится к линейному или разветвленному алкильному радикалу с наличием от одного до десяти атомов углерода, замещенному одним или более амино радикалами. В некоторых реализациях аминоалкил радикалы представляют собой «нижние аминоалкил» радикалы с наличием от одного до шести атомов углерода и один или более амино радикалов. К некоторым неограничительным примерам таких радикалов относятся аминометил, аминоэтил, аминопропил, аминобутил или аминогексил.
[00125] Термин «алкиламиноалкил» относится к алкил радикалам, замещенным алкиламино радикалами. В некоторых реализациях алкиламиноалкил радикалы представляют собой «нижние алкиламиноалкил» радикалы с наличием алкил радикалов от одного до шести атомов углерода. В других реализациях алкиламиноалкил радикалы представляют собой нижние алкиламиноалкил радикалы с наличием алкил радикалов от одного до трех атомов углерода. К некоторым неограничительным примерам подходящих алкиламиноалкил радикалов относятся моно или диалкил замещенные, такие как N-метиламинометил, N,N-диметил-аминоэтил, N,N-диэтиламинометил, и аналогичные.
[00126] Термин «алкиламиноалкокси» относится к алкокси радикалам, замещенным алкиламино радикалами. К некоторым неограничительным примерам подходящих алкиламиноалкокси радикалов относятся моно или диалкил замещенные, такие как N-метиламиноэтокси, N,N-диметиламиноэтокси N,N-диэтиламиноэтокси, и аналогичные.
[00127] Термин «алкиламиноалкоксиалкокси» относится к алкокси радикалам, замещенным алкиламиноалкокси радикалами. К некоторым неограничительным примерам подходящих алкиламиноалкоксиалкокси градикалов относятся моно или диалкил замещенные, такие как N-метиламинометоксиэтокси, N-метиламиноэтоксиэтокси, N,N-диметиламиноэтоксиэтокси, N,N-диэтиламинометоксиметокси, и аналогичные.
[00128] Термин «карбоксиалкил» относится к линейному или разветвленному алкил радикалу с наличием от одного до десяти атомов углерода, замещенному одним или более карбокси радикалов. К некоторым неограничительным примерам таких радикалов относятся карбоксиметил, карбоксипропил, и аналогичные.
[00129] Термин «гетероарилалкокси» относится к окси-содержащим гетероарилалкил радикалам, связанным посредством атома кислорода с другими радикалами, где понятие гетероарилалкил радикала приводится в настоящей заявке. К некоторым неограничительным примерам таких радикалов относятся пиридин-2-илметокси, тиазол-2-илэтокси, имидазол-2-илэтокси, пиримидин-2-илпропокси, пиримидин-2-илметокси, и аналогичные.
[00130] Термин «циклоалкилалкил» относится к циклоалкил-замещенным алкил радикалам. К некоторым неограничительным примерам таких радикалов относится циклогексилметил. Циклоалкил в радикалах может быть дополнительно замещен гало, алкил, алкокси или гидрокси.
[00131] Термин «сплавленный бициклический», «сплавленный циклический», «сплавленный бициклил» или «сплавленный циклил» относится к насыщенной или ненасыщенной мостиковой кольцевой системе, которая относится к бициклической кольцевой системе, не являющейся ароматической. Такая система может содержать изолированное или сопряженное ненасыщение, но не ароматические или гетероароматические кольца в своей основной структуре (но вслед за этим возможно наличие ароматического замещения). Каждое циклическое кольцо в сплавленном бициклиле может быть или карбоциклическим или а гетероалициклическим. К некоторым неограничительным примерам сплавленной бициклической кольцевой системы относятся гексагидро-фуро[3,2-b]фуран, 2,3,3а,4,7,7а-гексагидро-1Н-инден, 7-азабицикло[2.3.0]гептан, сплавленный бицикло[3.3.0]октан, сплавленный бицикло[3.1.0]гексан, 1,2,3,4,4а,5,8,8а-октагидро-нафталин, и аналогичные. И сплавленный бициклил, определенный в настоящей заявке, может быть замещенным или незамещенным, где заместители включают в себя, не ограничиваясь перечисленным далее, оксо (=O), гидрокси, амино, галоген, циано, арил, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(=O)-, алкил-С(=O)-, алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбокси алкокси, и аналогичные.
[00132] Термин «сплавленный бициклилен» относится к сплавленной бициклил системе с двумя соединительными точками, соединенной с остатками молекулы, где определение сплавленного бициклил радикала приводится в настоящей заявке.
[00133] Термин «сплавленный гетеробициклил» относится к насыщенной или ненасыщенной мостиковой кольцевой системе, которая относится к бициклической кольцевой системе, не являясь ароматической. Такая система может содержать изолированное или сопряженное ненасыщение, но не ароматические или гетероароматические кольца в своей основной структуре (но вслед за этим возможно наличие ароматического замещения). Где как минимум одно кольцо системы содержит один или более гетероатомов, где каждое кольцо системы содержит от 3 до 7 звеньев кольца и которое содержит от одного до шести атомов углерода и от одного до трех гетероатомов, отобранных из N, О, Р, S, где S или Р дополнительно замещены одним или более оксо для создания группы SO, SO2, РО или PSO2. К некоторым неограничительным примерам сплавленной гетеробициклической кольцевой системы относятся гексагидро-фуро[3,2-b]фуран, 7-азабицикло[2.3.0]гептан, и аналогичные. И сплавленный гетеробициклил, определение которого дано в настоящей заявке, может быть замещенным или незамещенным, где в число заместителей входят, не ограничиваясь перечисленным далее, оксо (=O), гидрокси, амино, галоген, циано, арил, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(=O)-, алкил-С(=O)-, алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбоксиалкокси, и аналогичные.
[00134] Термин «сплавленный гетеробициклилен» относится к сплавленной гетеробициклил системе с двумя соединительными точками, соединенной с остатками молекулы, где сплавленный гетеробициклил радикал определен в настоящей заявке.
[00135] Термин «сплавленный бициклилалифатический» относится к алифатическим группам, замещенным одной или более сплавленной бициклил группой, где алифатическая группа и сплавленная бициклил группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 1,2,3,4,4а,5,8,8а-октагидро-нафтилэтил, 1,2,3,4,4а,5,8,8а-октагидро-нафтилметил, 1,2,3,4,4а,5,8,8а-октагидро-нафтилпропил, сплавленный бицикло[3.3.0]октилметил, сплавленный бицикло[3.1.0]гексилэтил, и аналогичные.
[00136] Термин «сплавленный гетеробициклилалифатический» относится к алифатическим группам, замещенным одной или более сплавленной гетеробициклил группой, где алифатическая группа и сплавленная гетеробициклил группа определены в настоящей заявке.
К некоторым неограничительным примерам относятся гексагидро-фуро[3,2-b]фуран-2-илэтил, гексагидро-фуро[3,2-b]фуран-2-илметил, 7-азабицикло [2.3.0]гепт-2-илметил, 7-азабицикло[2.3.0]гепт-2-илэтил, 7-азабицикло[2.3.0]гепт-4-илметил, и аналогичные.
[00137] Термин «сплавленный бициклокси» относится к дополнительно замещенным сплавленным бициклил радикалам, определенным в настоящей заявке, окси-содержащим сплавленным бициклил радикалам, связанным посредством атома кислорода с другими радикалами, где сплавленный бициклил радикал определен в настоящей заявке. К некоторым неограничительным примерам относятся 1,2,3,4,4а,5,8,8а-октагидро-нафтилокси, сплавленный бицикло[3.3.0]окт-2-илокси, сплавленный бицикло[3.1.0]гекс-2-илокси, и аналогичные.
[00138] Термин «сплавленный гетеробициклокси» относится к дополнительно замещенным сплавленным гетеробициклил радикалам, определенным в настоящей заявке, окси-содержащим сплавленным гетеробициклил радикалам, связанным посредством атома кислорода с другими радикалами. К некоторым неограничительным примерам относятся гексагидро-фуро[3,2-b]фуран-2-илокси, 7-азабицикло[2.3.0]гепт-2-илокси, 7-азабицикло[2.3.0]гепт-4-илокси, и аналогичные.
[00139] Термин «сплавленный бициклиламино» относится к амино группе, замещенной одной или двумя сплавленными бициклил группами, где определение сплавленной бициклил группы приводится в настоящей заявке. К некоторым неограничительным примерам относятся 1,2,3,4,4а,5,8,8а-октагидро-нафтиламино, ди(1,2,3,4,4а,5,8,8а-октагидро-нафтил)амино, сплавленный бицикло[3.3.0]октиламино, сплавленный бицикло[3.1.0]гексиламино, и аналогичные.
[00140] Термин «сплавленный гетеробициклиламино» относится к амино группе, замещенной одной или двумя сплавленными гетеробициклил группами, где определение сплавленной гетеробициклил группы приводится в настоящей заявке. К некоторым неограничительным примерам относятся гексагидро-фуро[3,2-b]фуран-2-иламино, 7-азабицикло[2.3.0]гепт-2-иламино, 7-азабицикло[2.3.0]гепт-4-иламино, и аналогичные.
[00141] Термин «сплавленный бициклилалкиламино» относится к алкиламино группам, замещенным одной или более сплавленной бициклил группой, где сплавленная бициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся 1,2,3,4,4а,5,8,8а-октагидро-нафтилметиламино, ди(1,2,3,4,4а,5,8,8а-октагидро-нафтил) метиламино, сплавленный бицикло[3.3.0]октилметиламино, сплавленный бицикло[3.1.0]гексилметиламино, и аналогичные.
[00142] Термин «сплавленный гетеробициклилалкиамино» относится к алкиламино группам, замещенным одной или более сплавленной гетеробициклил группой, где сплавленная гетеробициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся гексагидро-фуро[3,2-b]фуран-2-илметиламино, 7-азабицикло[2.3.0]гепт-2-илметиламино, 7-азабицикло[2.3.0]гепт-4-илметиламино, и аналогичные.
[00143] Термин «сплавленный бициклилалкокси» относится к алкокси группам, замещенным одной или более сплавленной бициклил группой, где сплавленная бициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся 1,2,3,4,4а,5,8,8а-октагидро-нафтилметокси, 1,2,3,4,4а,5,8,8а-октагидро-нафтилэтокси, сплавленный бицикло[3.3.0]октилэтокси, сплавленный бицикло[3.1.0]гексилпропокси, и аналогичные.
[00144] Термин «сплавленный гетеробициклилалкокси» относится к алкокси группам, замещенным одной или более сплавленной гетеробициклил группой, где сплавленная гетеробициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся гексагидро-фуро[3,2-b]фуран-2-илпропокси, 7-азабицикло[2.2.1]гепт-2-илэтокси, 7-азабицикло[2.3.0]гепт-4-илпропокси, гексагидро-фуро[3,2-b]фуран-2-илэтокси, 7-азабицикло[2.3.0]гепт-4-илпропокси, 7-азабицикло[2.3.0]гепт-4-илэтокси, и аналогичные.
[00145] Термин «сплавленный бициклоксиалкокси» относится к алкокси группам, замещенным одной или более сплавленной бициклокси группой, где алкокси группа и сплавленная бициклокси группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 1,2,3,4,4а,5,8,8а-октагидро-нафтилоксиметокси, 1,2,3,4,4а,5,8,8а-октагидро-нафтилоксиметокси, 1,2,3,4,4а,5,8,8а-октагидро-нафтилоксиэтокси, сплавленный бицикло[3.3.0]окт-2-илоксиэтокси, сплавленный бицикло[3.1.0]гекс-2-илоксипропокси, и аналогичные.
[00146] Термин «сплавленный гетеробициклоксиалкокси» относится к алкокси группам, замещенным одной или более сплавленной гетеробициклокси группой, где алкокси группа и сплавленная гетеробициклил группа определены в настоящей заявке. К некоторым неограничительным примерам относятся гексагидро-фуро [3,2-b]фуран-2-илоксипропокси, 7-азабицикло[2.2.1]гепт-2-илоксиэтокси, 7-азабицикло[2.3.0]гепт-4-илоксипропокси, гексагидро-фуро[3,2-b]фуран-2-илоксиэтокси, 7-азабицикло[2.3.0]гепт-2-илоксипропокси, 7-азабицикло[2.3.0]гепт-4-илоксиэтокси, и аналогичные.
[00147] Термин «сплавленный бициклиламиноалкокси» относится к алкокси группам, замещенным одной или более сплавленной бициклиламино группой, где алкокси группа и сплавленная бициклиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 1,2,3,4,4а,5,8,8а-октагидро-нафтиламиноэтокси, 1,2,3,4,4а,5,8,8а-октагидро-нафтиламинопропокси, ди(1,2,3,4,4а,5,8,8а-октагидро-нафтил)аминопропокси, сплавленный бицикло[3.3.0]окт-2-иламиноэтокси, сплавленный бицикло[3.1.0]гекс-2-иламинопропокси, и аналогичные.
[00148] Термин «сплавленный гетеробициклиламиноалкокси» относится к алкокси группам, замещенным одной или более сплавленной гетеробициклиламино группой, где алкокси группа и сплавленная гетеробициклиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 7-азабицикло[2.2.1]гепт-2-иламиноэтокси, 7-азабицикло[2.3.0]гепт-4-иламинопропокси, гексагидро-фуро[3,2-b]фуран-2-иламиноэтокси, гексагидро-фуро[3,2-b]фуран-2-иламинопропокси, гексагидро-фуро[3,2-b]фуран-2-иламинометокси, и аналогичные.
[00149] Термин «спироциклил», «спироциклический», «спиро бициклил» или «спиро бициклический» относится к кольцу, возникшему из конкретного кольцевого углерода другого кольца. Например, как следует из приведенного ниже описания, насыщенная мостиковая кольцевая система (кольцо В и В') трактуется как «сплавленная бициклическая», где у колец А и В имеется общий атом между двумя насыщенными кольцевыми системами, трактуемыми как «спироциклил» или «спиро бициклил». Каждое циклическое кольцо в спироциклиле или спиро бициклиле может быть или карбоциклическим или гетероалициклическим. К некоторым неограничительным примерам относятся 2,7-диаза-спиро[4.4]нон-2-ил, 7-оксо-2-азаспиро[4.5]дек-2-ил, 4-азаспиро[2.4]гепт-5-ил, 4-оксаспиро[2.4]гепт-5-ил, 5-азаспиро[2.4]гепт5-ил, спиро[2.4]гептил, спиро[4.4]нонил, 7-гидрокси-5-азаспиро[2.4]гепт-5-ил, и аналогичные. Спироциклил или спиро бициклил может быть дополнительно замещенным, где в качестве заместителей могут выступать, не ограничиваясь перечисленным далее, оксо (=O), гидрокси, амино, галоген, циано, арил, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(=O)-, алкил-С(=O)-,алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбокси алкокси, и аналогичные.

[00150] Термин «спиро бициклилен» относится к спиро бициклил системе с двумя соединительными точками, соединенной с остатками молекулы, где спиро бициклил радикал определен в настоящей заявке.
[00151] Термин «спиро гетеробициклил» относится к кольцу, возникшему из конкретного кольцевого углерода другого кольца. Например, как следует из приведенного ниже описания, насыщенная мостиковая кольцевая система (кольцо В и В') трактуется как «сплавленная бициклическая», где у колец А и В имеется общий атом между двумя насыщенными кольцевыми системами, трактуемыми как «спироциклил» или «спиро бициклил». Где как минимум одно кольцо в системе содержит один или более гетероатомов, причем каждое кольцо в системе содержит от 3 до 7 звеньев, каждое звено содержит от одного до шести атомов углерода и от одного до трех гетероатомов, отобранных из N, О, Р, S, где S или Р дополнительно замещены одним или более оксо для создания группы SO, SO2, РО или PSO2. К некоторым неограничительным примерам спиро гетеробициклил кольцевой системы относится 4-азаспиро[2.4]гепт-5-ил, 4-оксаспиро[2.4]гепт-5-ил, 5-азаспиро[2.4]гепт-5-ил, 7-гидрокси-5-азаспиро[2.4]гепт-5-ил, и аналогичные. И спиро гетеробициклил, определенный в настоящей заявке, может быть замещенным или незамещенным, где в качестве заместителей могут выступать, не ограничиваясь перечисленным далее, оксо (=O), гидрокси, амино, галоген, циано, арил, гетероарил, алкокси, алкиламино, алкил, галоалкил, алкенил, алкинил, гетероциклил, тиол, нитро, арилокси, гидрокси-замещенный алкокси, гидрокси-замещенный алкил-С(=O)-, алкил-С(=O)-, алкил-S(=O)-, алкил-S(=O)2-, гидрокси-замещенный алкил-S(=O)-, гидрокси-замещенный алкил-S(=O)2-, карбоксиалкокси, и аналогичные.
[00152] Термин «спиро гетеробициклилен» относится к спиро гетеробициклил системе с двумя соединительными точками, соединенной с остатками молекулы, где спиро гетеробициклил радикал определен в настоящей заявке.
[00153] Термин «спиро бициклилалифатический» относится к алифатическим группам, замещенным одной или более спиро бициклил группами, где алифатическая группа и спиро бициклил группа определены в настоящей заявке. К некоторым неограничительным примерам относятся спиро[2.4]гептилметил, спиро[2.4]гептилэтил, спиро[2.4]гептилпропил, спиро[4.4]нонилметил, спиро[4.4]нонилэтил, 4-азаспиро[2.4]гепт-5-ил-метил, 4-азаспиро[2.4]гепт-5-ил-этил, 4-оксаспиро[2.4]гепт-5-ил-этил, 5-азаспиро[2.4]гепт-5-ил-пропил, 7-гидрокси-5-азаспиро[2.4]гепт-5-ил-пропил, и аналогичные.
[00154] Термин «спиро гетеробициклилалифатический» относится к алифатическим группам, замещенным одной или более спиро гетеробициклил группами, где алифатическая группа и сплавленная гетеробициклил группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 4-азаспиро[2.4]гепт-5-ил-метил, 4-азаспиро[2.4]гепт-5-ил-этил, 4-оксаспиро[2.4]гепт-5-ил-этил, 5-азаспиро[2.4]гепт-5-ил-пропил, 7-гидрокси-5-азаспиро[2.4]гепт-5-ил-пропил, и аналогичные.
[00155] Термин «спиро бициклокси» относится к дополнительно замещенным спиро бициклил радикалам, определенным в настоящей заявке, окси-содержащим спиро бициклил радикалам, связанным с другими радикалами посредством атома кислорода, где спиро бициклил радикал определен в настоящей заявке. К некоторым неограничительным примерам относятся спиро[2.4]гептил-2-окси, спиро[2.4]гептил-3-окси, спиро[2.4]гептил-4-окси, спиро[4.4]нонил-2-окси, спиро[4.4]нонил-4-окси, 4-азаспиро[2.4]гепт-5-окси, и аналогичные.
[00156] Термин «спиро гетеробициклокси» относится к дополнительно замещенным спиро гетеробициклил радикалам, определенным в настоящей заявке, окси-содержащим спиро гетеробициклил радикалам, связанным с другими радикалами посредством атома кислорода. К некоторым неограничительным примерам относятся 4-азаспиро[2.4]гепт-5-илокси, 4-оксаспиро[2.4]гепт-5-илокси, 5-азаспиро[2.4]гепт-5-илокси, и аналогичные.
[00157] Термин «спиро бициклиламино» относится к амино группе, замещенной одной или двумя спиро бициклил группами, где спиро бициклил определена в настоящей заявке. К некоторым неограничительным примерам относятся спиро[2.4]гептил-2-амино, спиро[2.4]гептил-3-амино, спиро[2.4]гептил-4-амино, спиро[4.4]нонил-2-амино, спиро[4.4]нонил-4-амино, 4-азаспиро[2.4]гепт-5-амино, и аналогичные.
[00158] Термин «спиро гетеробициклиламино» относится к амино группе, замещенной одной или двумя спиро гетеробициклил группами, где спиро гетеробициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся 4-азаспиро[2.4]гепт-5-иламино, 4-оксаспиро[2.4]гепт-2-иламино, 4-оксаспиро[2.4]гепт-5-иламино, 5-азаспиро[2.4]гепт-5-иламино, и аналогичные.
[00159] Термин «спиро бициклилалкокси» относится к алкокси группам, замещенным одной или более спиро бициклил группами, где спиро бициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся спиро[2.4]гептил-2-метокси, спиро[2.4]гептил-3-этокси, спиро[2.4]гептил-4-этокси, спиро[4.4]нонил-2-метокси, спиро[4.4]нонил-4-пропокси, 4-азаспиро[2.4]гепт-5-метокси, и аналогичные.
[00160] Термин «спиро гетеробициклилалкокси» относится к алкокси группам, замещенным одной или более спиро гетеробициклил группами, где спиро гетеробициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся 4-азаспиро[2.4]гепт-5-ил-метокси, 4-азаспиро[2.4]гепт-2-ил-этокси, 4-оксаспиро[2.4]гепт-5-ил-этокси, 5-азаспиро[2.4]гепт-5-ил-пропокси, и аналогичные.
[00161] Термин «спиро бициклилалкиамино» относится к алкиламино группам, замещенным одной или более спиро бициклил группами, где спиро бициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся спиро[2.4]гептил-2-метиламино, спиро[2.4]гептил-3-этиламино, спиро[2.4]гептил-4-этиламино, спиро[4.4]нонил-2-метиламино, спиро[4.4]нонил-4-пропиламино, 4-азаспиро[2.4]гепт-5-метиламино, и аналогичные.
[00162] Термин «спиро гетеробициклилалкиамино» относится к алкиламино группам, замещенным одной или более спиро гетеробициклил группами, где спиро гетеробициклил группа определена в настоящей заявке. К некоторым неограничительным примерам относятся 4-азаспиро[2.4]гепт-5-ил-метиламино, 4-азаспиро[2.4]гепт-2-ил-этиламино, 4-оксаспиро[2.4]гепт-5-ил-этиламино, 5-азаспиро[2.4]гепт-5-ил-пропиламино, и аналогичные.
[00163] Термин «спиро бициклоксиалкокси» относится к алкокси группам, замещенным одной или более спиро бициклокси группами, где алкокси группа и спиро бициклил группа определены в настоящей заявке. К некоторым неограничительным примерам относятся спиро[2.4]гептил-2-оксиэтокси, спиро[2.4]гептил-3-оксипропокси, спиро[2.4]гептил-4-оксипропокси, спиро[4.4]нонил-2-оксиэтокси, спиро[4.4]нонил-4-оксипропокси, 4-азаспиро[2.4]гепт-5-оксипропокси, и аналогичные.
[00164] Термин «спиро гетеробициклоксиалкокси» относится к алкокси группам, замещенным одной или более спиро гетеробициклокси группами, где алкокси группа и спиро гетеробициклил группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 4-азаспиро[2.4]гепт-5-илоксиэтокси, 4-оксаспиро[2.4]гепт-5-илоксиэтокси, 5-азаспиро[2.4]гепт-5-илоксиэтокси, 4-азаспиро[2.4]гепт-5-илоксипропокси, 4-оксаспиро[2.4]гепт-5-илоксипропокси, 5-азаспиро[2.4]гепт-5-илоксипропокси, и аналогичные.
[00165] Термин «спиро бициклиламиноалкокси» относится к алкокси группам, замещенным одной или более спиро бициклиламино группами, где алкокси группа и спиро бициклиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся спиро [2.4]гептил-2-аминоэтокси, спиро [2.4]гептил-3-аминопропокси, спиро[2.4]гептил-4-аминоэтокси, спиро[4.4]нонил-2-аминоэтокси, спиро[4.4]нонил-4-аминопропокси, 4-азаспиро[2.4]гепт-5-аминопропокси, и аналогичные.
[00166] Термин «спиро гетеробициклиламиноалкокси» относится к алкокси группам, замещенным одной или более спиро гетеробициклиламино группами, где алкокси группа и спиро гетеробициклиламино группа определены в настоящей заявке. К некоторым неограничительным примерам относятся 4-азаспиро[2.4]гепт-5-иламиноэтокси, 4-оксаспиро[2.4]гепт-2-иламинопропокси, 4-оксаспиро[2.4]гепт-5-иламиноэтокси, 5-азаспиро[2.4]гепт-5-иламинопропокси, и аналогичные.
[00167] В настоящей заявке связь, начерченная от заместителя к центру одного кольца в пределах кольцевой системы (как показано ниже) представляет замещение заместителя на любой замещаемой позиции кольца А и кольца В. Например, фиг. а иллюстрирует возможное замещение на любой из позиций колец А и В, показанных на фиг. b.

[00168] В настоящей заявке точечная линия, прочерченная вместе со связью в пределах кольцевой системы (как показано на фиг. с) представляет либо двойную, либо одинарную связь. Например, структура на фиг. с иллюстрирует любые структуры, отобранные с фиг. d.


[00169] В настоящей заявке две соединительные точки, Е или Е', в пределах кольцевой системы (как показано на фиг. е), крепятся к остатку молекулы, т.е. Е и Е' могут использоваться взаимообразно.
[00170] В отсутствие иных указаний подразумевается, что изображенные структуры включают в себя все изометрические (т.е. энантиометрические, диастереометрические и геометрические (или конформационные)) формы структуры, например, R и S конфигурации для каждого асимметричного центра, изомеры двойной связи (Z) и (Е), и конформационные изомеры (Z) и (Е). Поэтому одиночные стереохимические изомеры, равно как и энантиометрические, диастереометрические или геометрические (или конформационные) смеси представленных химических соединений относятся к облети настоящей заявки.
[00171] Термин «прототипное лекарственное средство» относится к химическому соединению, которое преобразовано in vivo в химическое соединение с формулой (I). На такое преобразование может повлиять, например, гидролиз в крови или энзиматическое преобразование формы прототипного лекарственного средства в исходную форму в крови или ткани. Прототипами заявляемых химических соединений могут являться, например, эфиры. К эфирам, которые могут использоваться в качестве прототипов настоящей заявки, относятся фенильные эфиры, алифатические (С1-С24) эфиры, ацилоксиметиловые эфиры, карбонаты, карбаматы, и амино кислотные эфиры. Например, заявляемое химическое соединение, содержащее группу ОН, может быть ацилировано на этой позиции в его прототипную форму. К прочим формам прототипов относятся фосфаты, такие, например, как фосфаты, образующиеся в результате фосфатирования группы ОН исходного химического соединения. Прототипные химические соединения подробно рассматриваются в работе Хигачи и соавторов, Прототипные лекарственные средства как новаторские системы доставки, Том 14, Серия симпозиумов A.C.S.; Роч и соавторы, ред., Биореверсируемые носители в разработке лекарственных средств, Американская фармацевтическая ассоциация и издательство Pergamon PreS, 1987; Раутио и соавторы, Прототипные лекарственные средства: Разработка и клиническое применение, Nature Reviews Drug discovery, 2008, 7, 255-270, и Хеклер и соавторы, Прототипы фосфатов и фосфонатов, J Med. Chem., 2008, 51, 2328-2345, все упомянутые источники включены в список литературы настоящей заявки.
[00172] В отсутствие иных указаний все таутомерические формы заявляемых химических соединений попадают в область действия настоящей заявки. Кроме того, в отсутствие иных указаний, в изображенных в настоящей заявке структурах подразумевается также наличие химических соединений, отличающихся только присутствием одного или более изотропно обогащенных атомов.
[00173] Термин «метаболит» означает продукт, образующийся в результате метаболизма в теле определенного химического соединения или его соли. Метаболиты химических соединений можно установить, пользуясь традиционными способами, известными специалистам, а их деятельность определяется тестами, такими, например, как в настоящей заявке. Такие продукты могут образовываться, например, в результате окисления, концентрирования, гидролиза, амидирования, деамидирования, эстерификации, деэстерификации, ферментативного расщепления, и аналогичных процессов, происходящих с принимаемым химическим соединением. Соответственно, в заявку включены метаболиты заявляемых химических соединений, включая химические соединения, образовавшиеся в результате всестороннего контактирования заявляемого химического соединения с млекопитающим в течение времени, достаточного для образования его метаболического продукта.
[00174] Стереохимические определения и условные обозначения, используемые в настоящей заявке, в основном соответствуют следующим изданиям: Паркер и соавторы, Издательство McGraw-Hill, Словарь химических терминов (1984) McGraw-Hill Book Company, Нью-Йорк и Элиел и соавторы, «Стереохимия органических химических соединений», издательство John Wiley & Sons, Inc., Нью-Йорк, 1994. Заявляемые химические соединения могут содержать асимметричные или хиральные центры, и поэтому существуют в различных стереоизометрических формах. Имеется в виду, что все стереоизометрические формы заявляемых химических соединений, включая, но не ограничиваясь диасереомерами, энантиомерами и антропизомерами, а также их смеси, такие как рацемические смеси, являются частью заявляемого изобретения. Многие органические химические соединения существуют в оптически активных формах, например, они обладают способностью поворачивать плоскость поляризации света. В описании оптически активных химических соединений приставки D и L, или R и S используются для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (центров). Приставки d и I или (+) и (-) служат для обозначения знака направления поворота плоскополяризованного света химическим соединением, где (-) или I означает поворот влево, создаваемый химическим соединением. Обозначение химического соединения, предваряемое приставкой (+) или d означает поворот плоскости поляризации вправо. С точки зрения данной химической структуры эти стереоизомеры идентичны, за исключением того, что они являются зеркальным отображением друг друга. Конкретный стреоизомер может также называться энантиомером, и смесь таких изомеров часто называется энантиомерической смесью. Смесь энантиомеров в пропорции 50:50 называется или рацемической смесью или рацематом, который может возникнуть при отсутствии стреоселекции или стереоспециализации в химической реакции или процессе. Термин «рацемическая смесь» или «рацемат» относится к эквимолярной смеси двух энентиомерических образцов, лишенных оптической активности.
[00175] Выражение «таутомер» или «таутомерическая форма» относится к структурным изомерам различной энергии, между которыми происходит взаимное преобразование через низкоэнергетический барьер. К некоторым неограничительным примерам протонных таутомеров (известных также как прототипные таутомеры) относится взаимное преобразование посредством миграции протона, такого как кето-энольная и эмин-энаминная изомеризации. Валентные таутомеры включают в себя взаимные преобразования путем реорганизации некоторых связующих электронов.
[00176] Выражение «фармацевтически приемлемые соли» относится к органическим или неорганическим солям заявляемого химического соединения. Фармацевтически приемлемые соли хорошо известны специалистам. Например, Берге и соавторы подробно описывает фармацевтически приемлемую соль в периодическом издании J. Pharmacol Sci, 1977, 66, 1-19, ссылка на которое включена в список литературы настоящей заявки. К некоторым неограничительным примерам фармацевтически приемлемых солей относятся соли амино группы, созданные неорганическими кислотами, таким как соляная кислота, бромисто-водородная кислота, фосфорная кислота, серная кислота и хлорная кислота или органическими кислотами, такими, как уксусная кислота, щавелевая кислота, малеиновая кислота, виннокаменная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или другими известными способами, такими, как ионный обмен. К другим фармацевтически приемлемым солям относятся соль адипиновой кислоты, соли оксиянтарной кислоты, соль 2-гидракриловой кислоты, альгинат, аскорбат, соль аминоянтарной кислоты, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, соль муравьиной кислоты, соль фумаровой кислоты, глюкогептонат, глицерофосфат, соль глюконовой кислоты, гемисульфат, гептаноат, гексаноат, йодистоводородная соль, 2-гидрокси-этансульфонат, лактобионат, соль молочной кислоты, эфир лауриновой кислоты, лаурил сульфат, соль яблочной кислоты, соль малоновой кислоты, метансульфонат, 2-нафталинсульфонат, соль никотиновой кислоты, соль азотной кислоты, соль олеиновой кислоты, эфир пальмитиновой кислоты, памоат, пектинат, соль надсерной кислоты, 3-фенилпропиноат, соль пикриновой кислоты, пивалат, пропионат, соль стеариновой кислоты, соль тиоциановой кислоты, р-толуолсульфонат, ундеканоат, соли валериановой кислоты, и аналогичные. Соли, полученные из соответствующих оснований, включают щелочной металл, щелочноземельный металл, аммоний и соли N+(C1-4 алкил)4. Заявляемым изобретением также предусматривается кватернизация любых основных азот-содержащих групп заявляемых химических соединений. Такой кватернизацией может быть получена вода, или растворимые в масле, или распыенные продукты. К показательным солям щелочных или щелочноземельных металлов относятся натрий, литий, калий, кальций, магний, и аналогичные. К другим фармацевтически приемлемым солям относятся, когда это целесообразно, нетоксичный аммоний, кватернарный аммоний, и амин катионы, сформированные с помощью противоионов, таких как галид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, С1-8сульфонат или арил сульфонат.
[00177] Выражение «сольват» относится к сообществу или комплексу одной или более молекул растворителя и заявляемого химического соединения. К некоторым неограничительным примерам растворителей, которые создают сольваты, относится вода, изопропанол, этанол, метанол, DMSO, этил ацетат, уксусная кислота и этаноламин. Термин «гидрат» относится к комплексу, где молекулой растворителя является вода.
[00178] Термин «защитная группа» или «Pg» относится к заместиею, который обычно используется для блокирования и защиты определенной функциональности при реакции с другими функциональными группами в химическом соединении. Например, «амино-защитная группа» представляет собой заместитель, прикрепленный к амино группе для защиты амино-функциональности химического соединения. К некоторым неограничительным примерам подходящих амино-защитных групп относятся ацетил, трифторацетил, t-бутоксикарбонил (Boc), бензилоксикарбонил (Cbz) и 9-фторэнилметиленоксикарбонил (Fmoc). Аналогично, «гидрокси-защитная группа» относится к заместителю гидрокси группы, блокирующему или защищающему гидрокси-функциональность. К некоторым неограничительным примерам подходящих гидрокси-защитных групп относится ацетил и силил. Выражение «карбокси-защитная группа» относится к заместителю карбокси группы, блокирующему или защищающему карбокси-функциональность. К некоторым неограничительным примерам распространенных карбокси-защитных групп относятся-CH2CH2SO2Ph, цианоэтил, 2-(триметилслил) этил, 2-(триметилслил) этоксиметил, 2-(р-толуолсульфонил) этил, 2-(р-нитрофенилсульфонил) этил, 2-(дифенил фосфино)-этил, нитроэтил, и аналогичные. Общее описание защитных групп и их использование приводтся в монографиях: Грин и соавторы, Защитные группы в органическом синтезе, Издательство ohn Wiley & Sons, Нью-Йоркк, 1991 и Коцинский и соавторы, Защитные группы, Издательство Thieme, Штутгарт, 2005.
ОПИСАНИЕ ХИМИЧЕСКИХ СОЕДИНЕНИЙ ИЗОБРЕТЕНИЯ
[00179] Заявляются новые химические соединения или фармацевтические лекарственные препараты, которые могут быть более эффективными для профилактики или лечения фиброза тканей человека или животных. Заявляются химические соединения с формулой (I), приведенной ниже:

или стереоизомер, геометрический изомер, таутомер, N-оксид, гидрат, сольват, метаболит, фармацевтически приемлемая соль или их прототипное соединение, где каждый V1, V2, V3, V4, А, В, X и Y определен в настоящей заявке.
[00180] В некоторых реализациях V1 представляет собой N или CR1, V2 представляет собой N или CR2, V3 представляет собой N или CR3 и V4 представляет собой N или CR4, где как миниму один из V1, V2, V3 и V4 представляет собой N;
X представляет собой связь, NR5, О, S, С1-10 алкилен, С2-10 алкенилен, С2-10 алкенилен, -R6-C(=Y)-, -R6-C(=Y)-O-, -R6-C(=Y)-N(R5)-, -R6-S(=O)t-, -R6-S(=O)t-N(R7)-, или -R6-Y-, где каждый t представляет собой 1 или 2;
Y представляет собой О или S;
А представляет собой гетероциклилен, карбоциклилен, сплавленный бициклилен, сплавленный гетеробициклилен, спиро бициклилен, спиро гетеробициклилен, арилен и гетероарилен;
В представляет собой алкокси, гидрокси-замещенный алкокси, -NR7R7a, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t-, R7S(=O)t-, R7S(=O)tN(R7a)-, C4-12 карбоциклил, C4-12 циклоалкил, гетероциклил, арил, гетероарил, сплавленный бициклил, сплавленный гетеробициклил, спиро бициклил, или спиро гетеробициклил;
или А, X и В вместе, формирующие группу с формулой (II):

где D представляет собой NR5, О, S, или CR7R7a;
R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t-, R7S(=O)t-, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)tалкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)t-алкокси, R7R7aN-C(=O)-алкокси, алифатический, галоалкил, алкокси, гидроксиалкокси, аминоалкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, циклоалкилокси, арилалкокси, арилалкиламино, гетероарилалкокси, гетероарилалкиламино, гетероциклилалкиламино, циклоалкиламино, гетероциклилалкокси, карбоциклилалкокси, карбоциклилалкиламино, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, арилокси, гетероарилокси, гетероарилоксиалкокси, гетероциклилоксиалкокси, карбоциклилоксиалкокси, гетероциклилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробициклиламино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, гетероциклил, циклоалкил, арил, гетероарил, гетероциклил алифатический, циклоалкил алифатический, арил алифатический, гетероарил алифатический, арил-(CH2)р-G-(CH2)m-, гетероарил-(CH2)р-G-(CH2)m-, гетероциклил-(CH2)р-G-(CH2)m-, или циклоалкил-(CH2)р-G-(CH2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)N(R7)-, -OC(=O)N(R7)-, -ОС(=O)-, -N(R7)C(=O)N(R7)-, -(R7)N-S(=O)t, -OS(=O)t, или -OS(=O)tN(R7)-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(CH2)р-G-(CH2)m-, С1-9 гетероарил-(CH2)р-G-(CH2)m-, С2-10 гетероциклил-(CH2)р-G-(CH2)m-, и С3-10 циклоалкил-(CH2)р-G-(CH2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, C1-6 алкил, С2-6алкинил, C1-6 алкокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(O)-R7a, R7R7aN-S(=O)t, R7S(=O)t, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)tалкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)t-алкокси, R7R7aN-C(=O)-алкокси, алифатический, галоалкил, алкокси, гидроксиалкокси, аминоалкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, арилалкокси, арилалкиламино, гетероарилалкокси, гетероарилалкиламино, гетероциклилалкиламино, циклоалкилокси, циклоалкиламино, гетероциклилалкокси, карбоциклилалкокси, карбоциклилалкиламино, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, арилокси, гетероарилокси, гетероарилоксиалкокси, гетероциклилоксиалкокси, карбоциклилоксиалкокси, гетероциклилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробициклиламино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, гетероциклил, циклоалкил, арил, С1-4 гетероарил, гетероциклил алифатический, циклоалкил алифатический, арил алифатический, гетероарил алифатический, арил-(CH2)р-G-(CH2)m-, гетероарил-(CH2)р-G-(CH2)m-, гетероциклил-(CH2)р-G-(CH2)m-, или циклоалкил-(CH2)р-G-(CH2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)N(R7)-, -OC(=O)N(R7)-, -ОС(=O)-, -N(R7)C(=O)N(R7)-, -(R7)N-S(=O)t, -OS(=O)t, или -OS(=O)tN(R7)-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, R7R7aN-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t-, R7S(=O)t-, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)t-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)t-алкокси, R7R7aN-C(=O)-алкокси, алифатический, С2-10 галоалкил, арил-С2-10 алкокси, геретоарил-С3-10 алкокси, циклоалкил-С2-10 алкокси, сплавленный бициклил-С2-10 алкокси, С1-4 гетероарил, замещенный арил, гетероциклил, циклоалкил, гетероциклил алифатический, циклоалкил алифатический, С1-4 гетероарил алифатический, замещенный арил С3-10 алкил, гетероциклилалкил, алкокси, гидроксиалкокси, аминоалкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, арил-С2-10 алкокси, гетероциклилалкокси, карбоциклилалкокси, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, ариламиноалкокси, арилокси, гетероарилоксиалкокси, гетероциклилоксиалкокси, карбоциклилоксиалкокси, гетероциклилокси, циклоалкилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробициклиламино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, арил-(CH2)р-G-(CH2)m-, гетероарил-(CH2)р-G-(CH2)m-, гетероциклил-(CH2)р-G-(CH2)m-, или циклоалкил-(CH2)р-G-(CH2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)N(R7)-, -OC(=O)N(R7)-, -ОС(=O)-, -N(R7)C(=O)N(R7)-, -(R7)N-S(=O)t-, -OS(=O)t-, или -OS(=O)tN(R7)-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t-, R7S(=O)t-, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)t-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)t-aлкокси, R7R7aN-C(=O) -алкокси, алифатический, галоалкил, С2-10 алкокси, гидроксиалкокси, аминоалкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, С3-5 циклоалкилокси, арилалкокси, гетероарилалкокси, гетероарилалкиламино, гетероциклилалкиламино, С7-10 циклоалкокси, циклоалкиламино, гетероциклилалкокси, карбоциклилалкокси, карбоциклилалкиламино, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, арилокси, гетероарилокси, гетероарилоксиалкокси, гетероциклилоксиалкокси, карбоциклилоксиалкокси, гетероциклилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробициклиламино-С(=O)-,сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, гетероциклил, циклоалкил, арил, гетероарил, гетероциклил алифатический, циклоалкил алифатический, арил С2-10 алифатический, гетероарил алифатический, арил-(CH2)р-G-(CH2)m-, гетероарил-(CH2)р-G-(CH2)m-, гетероциклил-(CH2)р-G-(CH2)m-, или циклоалкил-(CH2)р-G-(CH2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)N(R7)-, -OC(=O)N(R7)-, -ОС(=O)-, -N(R7)C(=O)N(R7)-, -(R7)N-S(=O)t-, -OS(=O)t-, или -OS(=O)tN(R7)-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, алифатический, галоалифатический, гидроксиалифатический, аминоалифатический, алкоксиалифатический, алкиламиноалифатический, алкилтиоалифатический, ариалифатический, гетероалифатический, гетероциклилалифатический, циклоалкилалифатический, арилоксиалифатический, гетероциклилоксиалифатический, циклоалкилоксиалифатический, ариламиноалифатический, гетероциклиламиноалифатический, циклоалкиламиноалифатический, арил, гетероарил, гетероциклил или карбоциклил;
каждый R5a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, оксо (=O), R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-алкил, R7S(=O)-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)-алкокси, R7R7aN-C(=O)-алкокси, арил, гетероарил, алкокси, алкил, алкенил, алкинил, гетероциклил, меркапто, нитро, аралкил, ариламино, гетероариламино, арилалкиламино, гетероарилалкиламино, гетероарилокси, гетероарилалкил, арилалкокси, гетероарилалкокси, гетероциклилокси, гетероциклилалкокси, гетероциклиламино, гетероциклилалкиламино или арилокси;
каждый R6 представляет собой независимо связь, С1-10 алкилен, С2-10 алкенилен или С2-10 алкинилен; и
каждый R7 и R7a представляет собой независимо Н, алифатический, галоалифатический, гидроксиалифатический, аминоалифатический, алкоксиалифатический, алкиламиноалифатический, алкилтиоалифатический, арилалифатический, гетероарилалифатический, гетероциклилалифатический, циклоалкилалифатический, арилоксиалифатический, гетероциклилоксиалифатический, циклоалкилоксиалифатический, ариламиноалифатический, гетероциклиламиноалифатический, циклоалкиламиноалифатический, арил, гетероарил, гетероциклил или карбоциклил; с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо, или замещенное или незамещенное спиро бициклическое или сплавленное бициклическое кольцо;
где каждый из NR5, -R6-C(=Y)-, -R6-C(=Y)-O-, -R6-C(=Y)-N(R5)-, -R6-S(=O)t, -R6-S(=O)t-N(R7)-, -R6-Y-, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)t-, R7S(=O)t-, R7S(=O)tN(R7a)-, R7aR7N-алкил, R7S(=O)t-алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-алкокси, R7R7aN-C(=O)-алкокси, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, R7aR7N-алифатический, арил-(CH2)р-G-(CH2)m-, гетероарил-(CH2)р-G-(CH2)m-, гетероциклил-(CH2)р-G-(CH2)m-, циклоалкил-(CH2)р-G-(CH2)m-, гидрокси-замещенный C1-6 алкил-С(=O)-, C1-6 алкил-С(=O)-, C1-6 алкил-S(=O)-, C1-6 алкил-S(=O)2-, гидрокси-замещенный C1-6 алкил-S(=O)-, гидрокси-замещенный C1-6 алкил-S(=O)2-, карбокси C1-6 алкокси, галоалкил, гетероциклилалкил, гетероциклилалкокси, гетероциклилалкиламино, гетероциклиламино, циклоалкил, циклоалкилалифатический, циклоалкиламино, циклоалкилоксиалифатический, циклоалкилалкокси, циклоалкилалкиламино, карбоциклилалифатический, агалкил, арилоксиалкил, гетероарилоксиалифатический, алифатический, алкокси, гидроксиалкокси, аминоалкокси, гидрокси-замещенный C1-6 алкокси, гидрокси-замещенный аминоалкокси, галоалкокси, амино-замещенный галоалкокси, алкиламиногалоалкокси, гидрокси-замещенный галоалкокси, алкиламиноалкокси, алкоксиалкокси, арилалкокси, арилалкиламино, гетероциклилалкокси, карбоциклилалкокси, гетероциклил(гидроксиалкокси), карбоциклил(гидроксиалкокси), арил(гидроксиалкокси), арилоксиалкокси, гетероарилоксиалкокси, арилокси, ариламино, гетероциклилоксиалкокси, карбоциклилоксиалкокси, циклоалкилокси, азидоалкокси, сплавленный бициклил, сплавленный гетеробициклил, сплавленный бициклил алифатический, сплавленный гетеробициклил алифатический, сплавленный бициклокси, сплавленный гетеробициклокси, сплавленный бициклиламино, сплавленный гетеробициклиламино, сплавленный бициклилалкокси, сплавленный гетеробициклилалкокси, сплавленный бициклилалкиламино, сплавленный гетеробициклилалкиламино, сплавленный бициклоксиалкокси, сплавленный гетеробициклоксиалкокси, сплавленный бициклиламиноалкокси, сплавленный гетеробициклиламиноалкокси, сплавленный бициклил-С(=O)-, сплавленный бициклил-С(=O)O-, сплавленный гетеробициклил-С(=O)-, сплавленный гетеробициклил-С(=O)O-, сплавленный бициклиламино-С(=O)-, сплавленный гетеробициклиламино-С(=O)-, сплавленный бициклил-С(=O)N(R7)-, сплавленный гетеробициклил-С(=O)N(R7)-, спиро бициклил, спиро гетеробициклил, спиро бициклил алифатический, спиро гетеробициклил алифатический, спиро бициклокси, спиро гетеробициклокси, спиро бициклиламино, спиро гетеробициклиламино, спиро бициклилалкокси, спиро гетеробициклилалкокси, спиро бициклилалкиламино, спиро гетеробициклилалкиламино, спиро бициклоксиалкокси, спиро гетеробициклоксиалкокси, спиро бициклиламиноалкокси, спиро гетеробициклиламиноалкокси, спиро бициклил-С(=O)-, спиро бициклил-С(=O)O-, спиро гетеробициклил-С(=O)-, спиро гетеробициклил-С(=O)O-, спиро бициклиламино-С(=O)-, спиро гетеробициклиламино-С(=O)-, спиро бициклил-С(=O)N(R7)-, спиро гетеробициклил-С(=O)N(R7)-, арил, гетероарил, арилалифатический, гетероарилалифатический, гетероарилокси, гетероариламино, гетероарилалкокси, гетероарилалкиламино, галоалифатический, гидроксиалифатический, аминоалифатический, алкоксиалифатический, алкиламиноалифатический, алкилтиоалифатический, циклоалкил, гетероциклилалифатический, арилоксиалифатический, гетероциклилоксиалифатический, циклоалкилоксиалифатический, ариламиноалифатический, гетероциклиламиноалифатический, циклоалкиламиноалифатический, гетероциклил, карбоциклил, гетероциклилепе, карбоциклилен, сплавленный бициклилен, сплавленный гетеробициклилен, спиро бициклилен, спиро гетеробициклилен, арилен и гетероарилен представляет собой незамещенный или замещенный одним или более заместителем, где где заместитель представляет собой галоалкил, оксо (=O), гидрокси, амино, F, CI, Br, I, циано, C1-10 алкокси, C1-10 алкиламино, С1-10 алкилтио, С1-10 алкил, С2-10 алкенил, С2-10 алкинил, меркапто, нитро, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил, С6-10 арилокси, карбокси, гидрокси-замещенный С1-6 алкокси, гидрокси-замещенный C1-6 алкил-С(=O)-, C1-6 алкил-С(=O)-, С1-6 алкил-S(=O)-, С1-6 алкил-S(=O)2-, гидрокси-замещенный С1-4 алкил-S(=O)-, гидрокси-замещенный C1-6 алкил-S(=O)2-, или карбоксиС1-6 алкокси.
[00181] В некоторых реализациях А представляет собой С2-10 гетероциклилен, C3-10 карбоциклилен, С5-12 сплавленный бициклилен, С5-12 сплавленный гетеробициклилен, С5-12 спиро бициклилен, С5-12 спиро гетеробициклилен, С6-10 арилен, и С1-9 гетероарилен.
[00182] В некоторых реализациях А представляет собой

где каждый Q1, Q2, Q3, Q4, Q5 и Q6 представляет собой независимо N, NR5, О, S, CR7R7a или CR8, и как минимум четыре из Q1, Q2, Q3, Q4, Q5 и Q6 являются N или NR5;
W1 представляет собой NR5, О, S, или CR7R7a, каждый W2, W3, W4 и W5 представляет собой независимо N, NR5, О, S, CR7R7a, или CR8, и и как минимум четыре из W1, W2, W3, W4 и W5 являются N или NR5; и
каждый R8 представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-алкил, R7S(=O)-алкил, R7R7aN-C(=O)-алкил, R7aR7N-алкокси, R7S(=O)-алкокси, R7R7aN-C(=O)-алкокси, арил, гетероарил, алкокси, алкил, алкенил, алкинил, гетероциклил, меркапто, нитро, агалкил, ариламино, гетероариламино, арилалкиламино, гетероарилалкиламино, гетероарилокси, гетероарилалкил, арилалкокси, гетероарилалкокси, гетероциклилокси, гетероциклилалкокси, гетероциклиламино, гетероциклилалкиламино или арилокси.
[00183] В некоторых реализациях А представляет собой

где каждый E1, Е2, Е3, Е4, Е5, Е6, Е7, Е8, F1 и F2 представляет собой независимо N или CR9; каждый Т и T1 представляет собой независимо NR5, О, S или CR9R9a; и
каждый R9 и R9a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-C1-6 алкокси, С6-10 арил, C1-9гетероарил, C1-6 алкокси, C1-6 алкил, С2-6алкенил, С2-6алкинил, C2-10 гетероциклил, меркапто, нитро, С6-10 арил-С1-6-алкил, С6-10 ариламино, С1-9 гетероариламино, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкиламино, С1-9 гетероарилокси, С1-9 гетероарил-С1-6-алкил, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, С2-10 гетероциклилокси,2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклиламино, C2-10 гетероциклил-С1-6-алкиламино, или С6-10 арилокси.
[00184] В некоторых реализациях А представляет собой

где каждый n представляет собой независимо 0, 1, 2 или 3; и
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, циано, нитро, меркапто, C1-4 алкил, С1-4 галоалкил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, или С1-9 гетероарил.
[00185] В некоторых реализациях В представляет собой С1-12 алкокси, гидрокси-замещенный C1-6 алкокси, -NR7R7a, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, C4-12 карбоциклил, C4-12 циклоалкил, C2-10 гетероциклил, С6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, C5-12 сплавленный гетеробициклил, С5-12 спиро бициклил, или C5-12 спиро гетеробициклил.
[00186] В некоторых реализациях R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-C1-6 алкокси, C1-6 алифатический, C1-6 алкокси, C1-6 гидроксиалкокси, C1-6 аминоалкокси, гидрокси-замещенный C1-6 аминоалкокси, C1-6 галоалкокси, амино-замещенный С1-6 галоалкокси, C1-6 алкиламино-С1-6-галоалкокси, гидрокси-замещенный C1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С3-10 карбоциклил-С1-6-алкокси, C3-10 карбоциклил-С1-6-алкиламино, С2-10 гетероциклил(C1-6 гидроксиалкокси), С3-10 карбоциклил(С1-6 гидроксиалкокси), С6-10 арил(С1-6 гидроксиалкокси), С6-10 арилокси-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклилокси-С1-6-алкокси, С3-10 карбоциклилокси-С1-6-алкокси, С2-10 гетероциклилокси, C1-6 азидоалкокси, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 сплавленный бициклил-С1-6-алифатический, С5-12 сплавленный гетеробициклил-С1-6-алифатический, С5-12 сплавленный бициклокси, С5-12 сплавленный гетеробициклокси, С5-12 сплавленный бициклиламино, С5-12 сплавленный гетеробициклиламино, С5-12 сплавленный бициклил-С1-6-алкокси, С5-12 сплавленный гетеробициклил-С1-6-алкокси, С5-12 сплавленный бициклил-С1-6-алкиламино, С5-12 сплавленный гетеробициклил-С1-6-алкиламино, С5-12 сплавленный бициклокси-C1-6-алкокси, С5-12 сплавленный гетеробициклокси-С1-6-алкокси, С5-12 сплавленный бициклиламино-С1-6-алкокси, С5-12 сплавленный гетеробициклиламино-С1-6-алкокси, С5-12 сплавленный бициклил-С(=O)-, С5-12 сплавленный бициклил-С(=O)O-, С5-12 сплавленный гетеробициклил-С(=O)-, С5-12 сплавленный гетеробициклил-С(=O)O-, С5-12 сплавленный бициклиламино-С(=O)-, С5-12 сплавленный гетеробициклиламино-С(=O)-, С5-12 сплавленный бициклил-С(=O)N(R7)-, С5-12 сплавленный гетеробициклил-С(=O)N(R7)-, С5-12 спиро бициклил, С5-12 спиро гетеробициклил, С5-12 спиро бициклил-С1-6-алифатический, С5-12 спиро гетеробициклил-С1-6-алифатический, С5-12 спиро бициклокси, С5-12 спиро гетеробициклокси, С5-12 спиро бициклиламино, С5-12 спиро гетеробициклиламино, С5-12 спиро бициклил-С1-6-алкокси, С5-12 спиро гетеробициклил-С1-6-алкокси, С5-12 спиро бициклил-С1-6-алкиламино, С5-12 спиро гетеробициклил-С1-6-алкиламино, С5-12 спиро бициклокси-С1-6-алкокси, С5-12 спиро гетеробициклокси-С1-6-алкокси, С5-12 спиро бициклиламино-С1-6-алкокси, С5-12 спиро гетеробициклиламино-С1-6-алкокси, С5-12 спиро бициклил-С(=O)-, С5-12 спиро бициклил-С(=O)O-, С5-12 спиро гетеробициклил-С(=O)-, С5-12 спиро гетеробициклил-С(=O)O-, С5-12 спиро бициклиламино-С(=O)-, С5-12 спиро гетеробициклиламино-С(=O)-, С5-12 спиро бициклил-С(=O)N(R7)-, С5-12 спиро гетеробициклил-С(=O)N(R7)-, С2-10 гетероциклил, С3-10 циклоалкил, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-6 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- является дополнительно замещенным одним или более F, Cl, Br, I, С1-6 алкил, С2-6алкинил, С1-6 алкокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-С1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, С1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, гидрокси-замещенный С1-6 аминоалкокси, С1-6 галоалкокси, амино-замещенный C1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, гидрокси-замещенный С1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, C1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С2-10 гетероциклил(С1-6 гидроксиалкокси), С3-10 карбоциклил(С1-6 гидроксиалкокси), С6-10 арил(С1-6 гидроксиалкокси), С6-10 арилокси-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклилокси-С1-6-алкокси, С3-10 карбоциклилокси-С1-6-алкокси, С2-10 гетероциклилокси, C1-6 азидоалкокси, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 сплавленный бициклил-С1-6-алифатический, С5-12 сплавленный гетеробициклил-С1-6-алифатический, С5-12 сплавленный бициклокси, С5-12 сплавленный гетеробициклокси, С5-12 сплавленный бициклиламино, С5-12 сплавленный гетеробициклиламино, С5-12 сплавленный бициклил-С1-6-алкокси, С5-12 сплавленный гетеробициклил-С1-6-алкокси, С5-12 сплавленный бициклил-С1-6-алкиламино, С5-12 сплавленный гетеробициклил-С1-6-алкиламино, С5-12 сплавленный бициклокси-С1-6-алкокси, С5-12 сплавленный гетеробициклокси-С1-6-алкокси, С5-12 сплавленный бициклиламино-С1-6-алкокси, С5-12 сплавленный гетеробициклиламино-С1-6-алкокси, С5-12 сплавленный бициклил-С(=O)-, С5-12 сплавленный бициклил-С(=O)O-, С5-12 сплавленный гетеробициклил-С(=O)-, С5-12 сплавленный гетеробициклил-С(=O)O-, С5-12 сплавленный бициклиламино-С(=O)-, С5-12 сплавленный гетеробициклиламино-С(=O)-, С5-12 сплавленный бициклил-С(=O)N(R7)-, С5.i2 сплавленный гетеробициклил-С(=O)N(R7)-, С5-12 спиро бициклил, С5-12 спиро гетеробициклил, С5-12 спиро бициклил-С1-6-алифатический, С5-12 спиро гетеробициклил-С1-6-алифатический, С5-12 спиро бициклокси, С5-12 спиро гетеробициклокси, С5-12 спиро бициклиламино, С5-12 спиро гетеробициклиламино, С5-12 спиро бициклил-С1-6-алкокси, С5-12 спиро гетеробициклил-С1-6-алкокси, С5-12 спиро бициклил-С1-6-алкиламино, С5-12 спиро гетеробициклил-С1-6-алкиламино, С5-12 спиро бициклокси-С1-6-алкокси, С5-12 спиро гетеробициклокси-С5-12-алкокси, С5-12 спиро бициклиламино-С1-6-алкокси, С5-12 спиро гетеробициклиламино-С1-6-алкокси, С5-12 спиро бициклил-С(=O)-, С5-12 спиро бициклил-С(=O)O-, С5-12 спиро гетеробициклил-С(=O)-, С5-12 спиро гетеробициклил-С(=O)O-, С5-12 спиро бициклиламино-С(=O)-, С5-12 спиро гетеробициклиламино-С(=O)-, С5-12 спиро бициклил-С(=O)N(R7)-, С5-12 спиро гетеробициклил-С(=O)N(R7)-, С2-10 гетероциклил, С3-10 циклоалкил, С6-10 арил, С1-4 гетероарил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, С2-10 галоалкил, С6-10 арил-С2-10-алкокси, C1-9 гетероарил-С3-6-алкокси, С3-10циклоалкил-С2-10-алкокси, С5-10 сплавленный бициклил-С2-10-алкокси, С2-10 гетероциклил, С3-10циклоалкил, С1-4 гетероарил, замещенный С6-10 арил, С2-10 гетероциклил-С1-6-алифатический, С3-10циклоалкил-С1-6-алифатический, С1-4 гетероарил-С1-6-алифатический, С1-9 гетероарилокси-С1-6-алкокси, замещенный С6-10 арил-С3-6-алкил, С2-10 гетрероциклил-С1-6-алкил, С1-6 алкокси, С1-6 гидроксиалкокси, C1-6 аминоалкокси, гидрокси-замещенный C1-6 аминоалкокси, C1-6 галоалкокси, амино-замещенный С1-12 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, гидрокси-замещенный С1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С6-10 арил-С2-10-алкокси, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-Ci.6-алкокси, С2-10 гетероциклил(С1-6 гидроксиалкокси), С3-10 карбоциклил(С1-6 гидроксиалкокси), С6-10 арил(С1-6 гидроксиалкокси), С6-10 арилокси-С1-6-алкокси, С6-10 ариламино-С1-6-алкокси, С6-10 арилокси, С2-10 гетероциклилокси-С1-6-алкокси, С3-10 карбоциклилокси-С1-6-алкокси, С2-10 гетероциклилокси, С3-10 циклоалкилокси, С1-6 азидоалкокси, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 сплавленный бициклил-С1-6-алифатический, С5-12 сплавленный гетеробициклил-С1-6-алифатический, С5-12 сплавленный бициклокси, С5-12 сплавленный гетеробициклокси, С5-12 сплавленный бициклиламино, С5-12 сплавленный гетеробициклиламино, С5-12 сплавленный бициклил-С1-6-алкокси, С5-12 сплавленный гетеробициклил-С1-6-алкокси, С5-12 сплавленный бициклил-С1-6-алкиламино, С5-12 сплавленный гетеробициклил-С1-6-алкиламино, С5-12 сплавленный бициклокси-С1-6-алкокси, С5-12 сплавленный гетеробициклокси-С1-6-алкокси, С5-12 сплавленный бициклиламино-С1-6-алкокси, С5-12 сплавленный гетеробициклиламино-С1-6-алкокси, С5-12 сплавленный бициклил-С(=O)-, С5-12 сплавленный бициклил-С(=O)O-, С5-12 сплавленный гетеробициклил-С(=O)-, С5.i2 сплавленный гетеробициклил-С(=O)O-, С5-12 сплавленный бициклиламино-С(=O)-, С5-12 сплавленный гетеробициклиламино-С(=O)-, С5-12 сплавленный бициклил-С(=O)NR7-, С5-12 сплавленный гетеробициклил-С(=O)NR7-, С5-12 спиро бициклил, С5-12 спиро гетеробициклил, С5-12 спиро бициклил-С1-6-алифатический, С5-12 спиро гетеробициклил-С1-6-алифатический, С5-12 спиро бициклокси, С5-12 спиро гетеробициклокси, С5-12 спиро бициклиламино, С5-12 спиро гетеробициклиламино, С5-12 спиро бициклил-С1-6-алкокси, С5-12 спиро гетеробициклил-С1-6-алкокси, С5-12 спиро бициклил-С1-6-алкиламино, С5-12 спиро гетеробициклил-С1-6-алкиламино, С5-12 спиро бициклокси-С1-6-алкокси, С5-12 спиро гетеробициклокси-С1-6-алкокси, С5-12 спиро бициклиламино-С1-6-алкокси, С5-12 спиро гетеробициклиламино-С1-6-алкокси, С5-12 спиро бициклил-С(=O)-, С5-12 спиро бициклил-С(=O)O-, С5-12 спиро гетеробициклил-С(=O)-, С5-12 спиро гетеробициклил-С(=O)O-, С5-12 спиро бициклиламино-С(=O)-, С5-12 спиро гетеробициклиламино-С(=O)-, С5-12 спиро бициклил-С(=O)NR7-, С5-12 спиро гетеробициклил-С(=O)NR7-, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; и
R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)-, R7S(=O)-, R7S(=O)N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, C1-6 алифатический, C2-10 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, гидрокси-замещенный С1-6 аминоалкокси, С1-6 галоалкокси, амино-замещенный С1-6 галоалкокси, C1-6 алкиламино-С1-6-галоалкокси, гидрокси-замещенный С1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С3-5 циклоалкилокси, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С7-10 циклоалкилокси, С3-10 циклоалкиламино, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С2-10 гетероциклил(С1-6 гидроксиалкокси), С3-10 карбоциклил(С1-6 гидроксиалкокси), С6-10 арил(С1-6 гидроксиалкокси), С6-10 арилокси-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклилокси-С1-6-алкокси, С3-10 карбоциклилокси-С1-6-алкокси, С2-10 гетероциклилокси, С1-6, азидоалкокси, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 сплавленный бициклил-С1-6-алифатический, С5-12 сплавленный гетеробициклил-С1-6-алифатический, С5-12 сплавленный бициклокси, С5-12 сплавленный гетеробициклокси, С5-12 сплавленный бициклиламино, С5-12 сплавленный гетеробициклиламино, С5-12 сплавленный бициклил-С1-6-алкокси, С5-12 сплавленный гетеробициклил-С1-6-алкокси, С5-12 сплавленный бициклил-С1-6-алкиламино, С5-12 сплавленный гетеробициклил-С1-6-алкиламино, С5-12 сплавленный бициклокси-С1-6-алкокси, С5-12 сплавленный гетеробициклокси-С1-6-алкокси, С5-12 сплавленный бициклиламино-С1-6-алкокси, С5-12 сплавленный гетеробициклиламино-С1-6-алкокси, С5-12 сплавленный бициклил-С(=O)-, С5-12 сплавленный бициклил-С(=O)O-, С5-12 сплавленный гетеробициклил-С(=O)-, С5-12 сплавленный гетеробициклил-С(=O)O-, С5-12 сплавленный бициклиламино-С(=O)-, С5-12 сплавленный гетеробициклиламино-С(=O)-, С5-12 сплавленный бициклил-С(=O)NR7-, С5-12 сплавленный гетеробициклил-С(=O)NR7-, С5-12 спиро бициклил, С5-12 спиро гетеробициклил, С5-12 спиро бициклил-С1-6-алифатический, С5-12 спиро гетеробициклил-С1-6-алифатический, С5-12 спиро бициклокси, С5-12 спиро гетеробициклокси, С5-12 спиро бициклиламино, С5-12 спиро гетеробициклиламино, С5-12 спиро бициклил-С1-6-алкокси, С5-12 спиро гетеробициклил-С1-6-алкокси, С5-12 спиро бициклил-С1-6-алкиламино, С5-12 спиро гетеробициклил-С1-4-алкиламино, С5-12 спиро бициклокси-С1-6-алкокси, С5-12 спиро гетеробициклокси-С1-6-алкокси, С5-12 спиро бициклиламино-С1-6-алкокси, С5-12 спиро гетеробициклиламино-С1-6-алкокси, С5-12 спиро бициклил-С(=O)-, С5-12 спиро бициклил-С(=O)O-, С5-12 спиро гетеробициклил-С(=O)-, С5-12 спиро гетеробициклил-С(=O)O-, С5-12 спиро бициклиламино-С(=O)-, С5-12 спиро гетеробицикпиламино-С(=O)-, С5-12 спиро бициклил-С(=O)N(R7)-, С5-12 спиро гетеробициклил-С(=O)N(R7)-, С2-10 гетероциклил, С3-10 циклоалкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил-С2-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый p и m представляет собой независимо 0, 1, 2, 3 или 4.
[00187] В некоторых реализациях каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, C1-6 алифатический, C1-6 галоалифатический, C1-6 гидроксиалифатический, C1-6 аминоалифатический, С1-6 алкокси-С1-6-алифатический, C1-6 алкиламино-С1-6-алифатический, С1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, C2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арилокси-С1-6-алифатический, C2-10 гетероциклилокси-С1-6-алифатический, С3-10 циклоалкилокси-С1-6-алифатический, С6-10 ариламино-С1-6-алифатический, С2-10 гетероциклиламино-С1-6-алифатический, С3-10 циклоалкиламино-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил.
[00188] В некоторых реализациях каждый R5a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, оксо (=O), R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-C1-6 алкокси, С6-10 арил, C1-6 гетероарил, C1-6 алкокси, C1-6 алкил, С2-6алкенил, С2-6алкинил, С2-10 гетероциклил, меркапто, нитро, С6-10 арил-С1-6-алкил, С6-10 ариламино, С1-9 гетероариламино, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкиламино, C1-9 гетероарилокси, C1-9 гетероарил-С1-6-алкил, С6-10 арил-С1-6-алкокси, C1-9 гетероарил-С1-6-алкокси, С6-10 гетероциклилокси, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклиламино, С2-10 гетероциклил-С1-6-алкиламино или С6-10 арилокси.
[00189] В некоторых реализациях каждый R7 и R7a представляет собой независимо Н, С1-6 алифатический, С1-6 галоалифатический, С1-6 гидроксиалифатический, C1-6 аминоалифатический, С1-6-(, алкокси-С1-6-алифатический, С1-6 алкиламино-С1-6-алифатический, C1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арилокси-С1-6-алифатический, С2-10 гетероциклилокси-С1-6-алифатический, С3-10 циклоалкилокси-С1-6-алифатический, С6-10 ариламино-С1-6-алифатический, С2-10 гетероциклиламино-С1-6-алифатический, С3-10 циклоалкиламино-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил; с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо, или замещенное или незамещенное С5-12 спиро бициклическое или C5-12 сплавленное бициклическое кольцо.
[00190] В некоторых реализациях N, V1, V2, V3, V4 и C(=Y) из формулы (I) определяют группу с формулой (III):

каждый R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a,
-OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, С1-6 алифатический, C1-6 галоалкил, С1-6 алкокси, C1-6 гидроксиалкокси, C1-6 аминоалкокси, С1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, C1-6 гетероарил-С1-6-алкокси, C1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, C1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-C1-6-алифатический, С6-10 арил, C1-9 гетероарил, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, С1-6 алкил, С2-6алкинил, С1-6 алкокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, C1-6 алифатический, C1-6 галоалкил, C1-6 алкокси, C1-6 гидроксиалкокси, C1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, C1-9 гетероарилокси, C1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-4 гетероарил, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собойО, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R3 представляет собой Н, F, Cl, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-С1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, C1-6 алифатический, С2-6 галоалкил, С6-10 арил-С2-6-алкокси, C1-9 гетероарил-С3-6-алкокси, C1-9 гетероарилокси-С1-6-алкокси, С3-10 циклоалкил-С2-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С1-4 гетероарил, замещенный С6-10 арил, С1-4 гетероарил-С1-6-алифатический, замещенный С6-10 арил-С3-6-алкил, С2-10 гетрероциклил-С1-6-алкил, С1-6 алкокси, C1-6 гидроксиалкокси, C1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С6-10 арил-С2-10-алкокси, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С2-10 гетероциклилокси, С3-10 циклоалкилокси, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; и
каждый R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, С1-6 галоалкил, С2-10 алкокси, С1-6 гидроксиалкокси, C1-6 аминоалкокси, C1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, C3-5 циклоалкилокси, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, C1-9 гетероарилокси-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С6-10 арилокси, С1-10 гетероарилокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С6-10 арил-С2-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4.
[00191] В некоторых реализациях

представляет собой

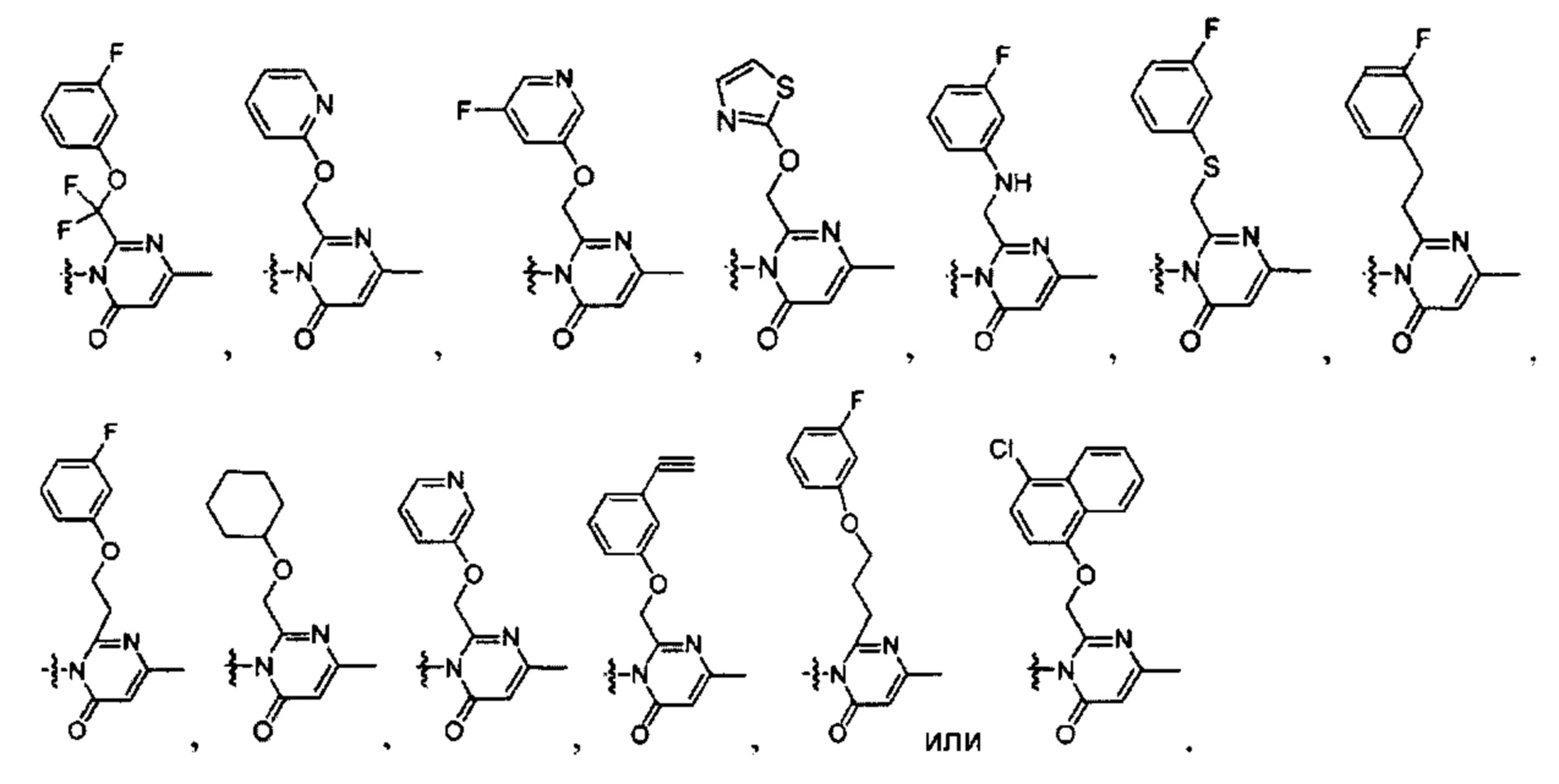
[00192] В некоторых реализациях А представляет собой

X представляет собой связь, NR5, О, S, -(CH2)m-, -(CH2)m-C(=Y)-, -(CH2)m-C(=Y)-O-, -(CH2)m-C(=Y)-N(R5)-, -(CH2)m-S(=O)t, -(CH2)m-S(=O)t-N(R7)-, -(CH2)m-Y-, -CH=CH-, или -C=C-, где каждый t представляет собой 1 или 2; каждый m представляет собой 0, 1, 2 или 3;
Y представляет собой О;
В представляет собой -NR7R7a, С4-12 карбоциклил, С4-12 циклоалкил, С2-10 гетероциклил, С6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 спиро бициклил, или С5-12 спиро гетеробициклил; где каждый из С4-12 карбоциклил, C4-12 циклоалкил, С2-10 гетероциклил, С6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 спиро бициклил и С5-12 спиро гетеробициклил представляет собой дополнительно замещенный оксо (=O), гидрокси, амино, гало, циано, С6-10 арил, C1-9 гетероарил, С1-6 алкокси, С1-6 алкиламино, С1-12 алкил, С2-6 алкенил, С2-6 алкинил, С2-10 гетероциклил, меркапто, нитро, С6-10 арилокси, карбокси, гидрокси-замещенный С1-6 алкокси, гидрокси-замещенный С1-6 алкил-С(=O)-, С1-6 алкил-С(=O)-, С1-6 алкил-S(=O)-, С1-6 алкил-S(=O)2-, гидрокси-замещенный C1-6 алкил-S(=O)-, гидрокси-замещенный C1-6 алкил-S(=O)2-, или карбокси С1-6 алкокси;
R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, C1-6 алифатический, C1-6 галоалкил, C1-6 алкокси, C1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, C1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, C6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- дополнительно замещен одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, C1-6 алифатический, C1-6 галоалкил, C1-6 алкокси, C1-6 гидроксиалкокси, С1-6 аминоалкокси, C1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, C1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, C1-9 гетероарилокси, C1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-4 гетероарил, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, C1-6 алифатический, С2-6галоалкил, С6-10 арил-С2-6-алкокси, C1-9 гетероарил-С3-6-алкокси, C1-9 гетероарилокси-С1-6-алкокси, С3-10 циклоалкил-С2-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С1-4 гетероарил, замещенный С6-10 арил, С1-4 гетероарил-С1-6-алифатический, замещенный С6-10 арил-С3-6-алкил, С2-10 гетероциклил-С1-6-алкил, C1-6 алкокси, С1-6 гидроксиалкокси, C1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С6-10 арил-С2-10-алкокси, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С2-10 гетероциклилокси, С3-10 циклоалкилокси, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-С1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-С1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, С1-6 галоалкил, C2-10 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, C3-5 циклоалкилокси, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарилокси-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С6-10 арилокси, С1-10 гетероарилокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С6-10 арил-С2-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -OC(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1,2, 3 или 4;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, C1-3 алкил, C1-3 галоалкил, C1-3 гидроксиалкил, C1-3 аминоалкил, C1-3 алкокси-C1-3-алкил, C1-3 алкиламино-С1-3-алкил, C1-3 алкилтио-С1-6-алкил, С6-10 арил-С1-3-алкил, С1-9 гетероарил-C1-3-алкил, С2-10 гетероциклил-C1-3-алкил, С3-10 циклоалкил-С1-3-алкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил; и
каждый R7 и R7a представляет собой независимо Н, C1-6 алифатический, С1-6 галоалифатический, С1-6 гидроксиалифатический, С1-6 аминоалифатический, C1-6 алкокси-С1-6-алифатический, С1-6 алкиламино-С1-6-алифатический, С1-6 алкил тио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил; с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо.
[00193] В некоторых реализациях А, X и В определяют группу с формулой (II):

где D представляет собой О; n является 0, 1 или 2; и
каждый R5a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, циано, нитро, меркапто, C1-4 алкил, C1-4 алкокси, С1-4 алкиламино, C1-4 алкилтио, С6-10 арил, или С1-9 гетероарил.
[00194] В некоторых реализациях формула (IV) представляет собой
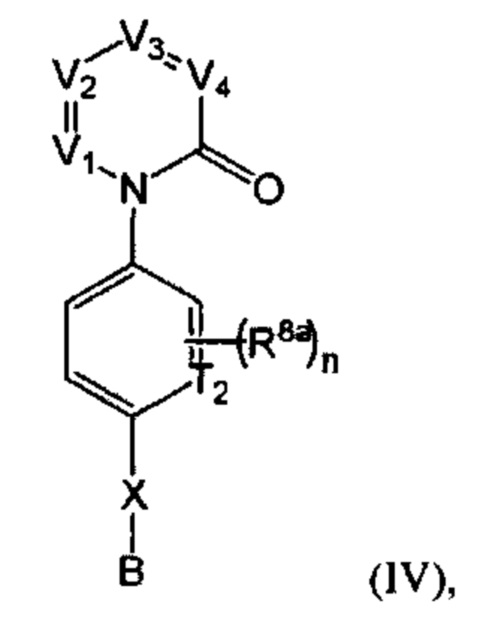
где V1 представляет собой N или CR1, V2 представляет собой N или CR2, V3 представляет собой N или CR3, и V4 представляет собой N или CR4, где как минимум один из V1, V2, V3 и V4 представляет собой N; Т2 представляет собой N или CR10;
X представляет собой связь, NR5, О, S, -(CH2)m-, -(CH2)m-Y-, -С(=O)-, -C(=O)NH-, -СН=СН-, или -С=С-, где каждый m представляет собой независимо 0, 1, 2 или 3;
В представляет собой -NR7R7a, C4-12 карбоциклил, С4-12 циклоалкил, С2-10 гетероциклил, С6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 спиро бициклил, или С5-12 спиро гетеробициклил; где каждый из С4-12 карбоциклил, С4-12 циклоалкил, С2-10 гетероциклил, С6-10 арил, С1-9 гетероарил, С5-12 сплавленный бициклил, С5-12 сплавленный гетеробициклил, С5-12 спиро бициклил и С5-12 спиро гетеробициклил дополнительно замещен оксо (=O), гидрокси, амино, гало, циано, С6-10 арил, С1-9 гетероарил, С1-6 алкокси, С1-6 алкиламино, C1-6 алкил, С2-6алкенил, С2-6алкинил, С2-10 гетероциклил, меркапто, нитро, С6-10 арилокси, карбокси, гидрокси-замещенный С1-6алкокси, гидрокси-замещенный С1-6 алкил-С(=O)-, C1-6 алкил-С(=O)-, алкил-S(=O)-, C1-6 алкил-S=O)2-, гидрокси-замещенный С1-6 алкил-S(=O)-, гидрокси-замещенный С1-6 алкил-S(=O)2-, или карбокси С1-12 алкокси;
R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, С1-6 алифатический, С1-6 галоалкил, C1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, С1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собойО, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый p и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- дополнительно замещен одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR5a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, C1-6 алифатический, С1-6 галоалкил, C1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, C1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С3-10 циклоалкилокси, С6-10 арил-С1-6-алкокси, С6-10 арил-С1-6-алкиламино, C1-9 гетероарил-С1-6-алкокси, C1-9 гетероарил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С6-10 арилокси, С1-9 гетероарилокси, C1-9 гетероарилокси-С1-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-4 гетероарил, С6-10 арил-С1-6-алифатический, C1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-C1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-С1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, С2-6галоалкил, С6-10 арил-С2-6-алкокси, С1-9 гетероарил-С3-6-алкокси, С1-9 гетероарилокси-С1-6-алкокси, С3-10 циклоалкил-С2-6-алкокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С1-4 гетероарил, замещенный С6-10 арил, С1-4 гетероарил-С1-6-алифатический, замещенный С6-10 арил-С3-6-алкил, С2-10 гетероциклил-С1-6-алкил, С1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, C1-6 алкиламино-С1-6-галоалкокси, С1-6 алкиламино-С1-6-алкокси, C1-6 алкокси-С1-6-алкокси, С6-10 арил-С2-10-алкокси, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С2-10 гетероциклилокси, С3-10 циклоалкилокси, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R4 представляет собой Н, F, I, циано, гидрокси, R7aR7N-, -C(=O)NR7R7a, -OC(=O)NR7R7a, -OC(=O)OR7, -N(R7)C(=O)NR7R7a, -N(R7)C(=O)OR7a, -N(R7)C(=O)-R7a, R7R7aN-S(=O)2-, R7S(=O)2-, R7S(=O)2N(R7a)-, R7aR7N-C1-6 алкил, R7S(=O)-С1-6 алкил, R7R7aN-C(=O)-C1-6 алкил, R7aR7N-C1-6 алкокси, R7S(=O)-C1-6 алкокси, R7R7aN-C(=O)-С1-6 алкокси, С1-6 алифатический, C1-6 галоалкил, С2-10 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, C1-6 галоалкокси, С1-6 алкиламино-С1-6-алкокси, С1-6 алкокси-С1-6-алкокси, C3-5 циклоалкилокси, С6-10 арил-С1-6-алкокси, С1-9 гетероарил-С1-6-алкокси, С1-9 гетероарилокси-С1-6-алкокси, C1-9 гетероарил-С1-6-алкиламино, С2-10 гетероциклил-С1-6-алкокси, С2-10 гетероциклил-С1-6-алкиламино, С3-10 циклоалкиламино, С2-10 гетероциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкокси, С3-10 карбоциклил-С1-6-алкиламино, С6-10 арилокси, С1-10 гетероарилокси, С2-10 гетероциклил, С3-10 циклоалкил, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С6-10 арил-С2-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, R7R7aNS(=O)-, R7OS(=O)-, R7S(=O)-, R7R7aNS(=O)2-, R7OS(=O)2-, R7S(=O)2-, C1-3 алкил, C1-3 галоалкил, C1-3 гидроксиалкил, C1-3 аминоалкил, C1-3 алкокси-C1-3-алкил, С1-3 алкиламино-C1-3-алкил, С1-3 алкилтио-C1-3-алкил, С6-10 арил-С1-6-алкил, C1-9 гетероарил-С1-3-алкил, С2-10 гетероциклил-C1-3-алкил, С3-10 циклоалкил-C1-3-алкил, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
каждый R7 и R7a представляет собой независимо Н, С1-6 алифатический, С1-6 галоалифатический, С1-6 гидроксиалифатический, С1-6 аминоалифатический, С1-12 алкокси-С1-6-алифатический, С1-6 алкиламино-С1-6-алифатический, С1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил; с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо;
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, C1-4 алкил-NH-S(=O)2-, C1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4~алкил или С1-9 гетероарил; n представляет собой 0, 1, 2 или 3; и
каждый R10 представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, нитро, меркапто, алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, или С1-4 алкилтио.
[00195] В некоторых реализациях В представляет собой -N(CH3)2, -N(CH2CH3)2, -N(CH2CH2CH3)2, -N(CH2CH2CH2CH3)2,


R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, -N(СН3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, C1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, пиридил-(СН2)р-G-(СН2)m-, фенилэтил, циклогексил-(СН2)р-G-(СН2)m-, нафтил-(СН2)р-G-(СН2)m-, или морфолинил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый p и m представляет собой независимо 0, 1, 2, 3 или 4; или где каждый из фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, пиридил-(СН2)р-G-(СН2)m-, фенилэтил, циклогексил-(СН2)р-G-(СН2)m-, нафтил-(СН2)р-G-(СН2)m-, и морфолинил-(СН2)р-G-(СН2)m- дополнительно замещен одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, C1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, или морфолинил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R3 представляет собой Н, F, Cl, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, или морфолинил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
R4 представляет собой Н, F, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, фенил-(СН2)р-G-(СН2)m-, (фтор-замещенный фенил)-(СН2)р-G-(СН2)m-, тиазолил-(СН2)р-G-(СН2)m-, или морфолинил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, S(=O), S(=O)2, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)-, -NHC(=O)NH-, -HN-S(=O)t-, -OS(=O)t-, или -OS(=O)tNH-; каждый t представляет собой 1 или 2; каждый р и m представляет собой независимо 0, 1, 2, 3 или 4;
каждый R5 представляет собой независимо Н, C1-3 алкил, фенил, бензил, пиридил или морфолино метил;
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, C1-4 алкил-S(=O)2NH-, циано, нитро, меркапто, C1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или С1-9 гетероарил;
n представляет собой 0, 1, 2, или 3; и
каждый R10 представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, или С1-4 алкилтио.
[00196] В некоторых реализациях формула (V) представляет собой

где V1 представляет собой N или CR1, V2 представляет собой N или CR2, V3 представляет собой N или CR3, и V4 представляет собой N или CR4, где как минимум один из V1, V2, V3 и V4 представляет собой N;
Т2 представляет собой N или CR10;
Т4 представляет собой NR5, О, S или CR11R11a;
X представляет собой связь, NR5, О, S, -(CH2)m-, -(CH2)m-Y-, -С(=O)-, -C(=O)NH-, -СН=СН-, или -С=С-, где каждый т представляет собой независимо 0, 1, 2 или 3;
В представляет собой -N(CH3)2, -N(CH2CH3)2, -N(CH2CH2CH3)2, -N(CH2CH2CH2CH3)2,


R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, или С6-10 арил-(СН2)р-G-(СН2)m-, где G представляет собой О, S, NR5, S(=O), S(=O)2, или С(=O); каждый р и m представляет собой независимо 0, 1, 2 или 3; или где С6-10 арил-(СН2)р-G-(СН2)m- представляет собой дополнительно замещенный одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси или циано;
R2 представляет собой Н, F, Cl, Br, I, циано, гидрокси, -N(СН3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -OC(=O)O-C1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, C1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, или С6-10 арил-(СН2)р-G-(СН2)m-, где G представляет собой О, S, NR5, S(=O), S(=O)2, или С(=O); каждый р и m представляет собой независимо 0, 1, 2 или 3;
R3 представляет собой Н, F, Cl, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, C1-4 алкил-NH-S(=O)2-, C1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, или С6-10 арил-(СН2)р-G-(СН2)m-, где G представляет собой О, S, NR5, S(=O), S(=O)2, или С(=O); каждый р и m представляет собой независимо 0, 1, 2 или 3;
R4 представляет собой Н, F, I, циано, гидрокси, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -ОС(=O)O-С1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, C1-4 алкил-S(=O)2-, С1-4 алкил-S(=O)2NH-, метил, этил, пропил, изопропил, бутил, тер-бутил, трифторметил, или С6-10 арил-(СН2)р-G-(СН2)m-, где G представляет собой О, S, NR5, S(=O), S(=O)2, или С(=O); каждый р и m представляет собой независимо 0, 1, 2 или 3;
каждый R5 представляет собой независимо Н, С1-4 алкил, фенил, бензил, пиридил или морфолино метил; и
каждый R8a, R10, R11, и R11a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(CH3)2, -C(=O)NH-C1-4 алкил, -OC(=O)NH-C1-4 алкил, -OC(=O)O-C1-4 алкил, -NHC(=O)NH-C1-4 алкил, -NHC(=O)O-C1-4 алкил, -NHC(=O)-C1-4 алкил, С1-4 алкил-NH-S(=O)2-, С1-4 алкил-S(=O)2-, Cj.4 алкил-S(=O)2NH-, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или C1-9 гетероарил.
[00197] В некоторых реализациях формула (VI) представляет собой

где Е представляет собой N или CR10;
J представляет собой О, S, S(=O), S(=O)2, NR13 или CR14R14a;
k представляет собой О, 1, 2, 3 или 4; q представляет собой 0, 1 или 2;
R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, С1-6 алкил, C1-6 галоалкил, С1-6 алкокси, С1-6 гидроксиалкокси, С1-6 аминоалкокси, С1-6 галоалкокси, С6-10 арил-С1-12 алкил, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)- или -NHC(=O)NH-; каждый р и m представляет собой независимо 0, 1, 2 или 3; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, С6-10 арил-С1-6 алкил, и С3-10 циклоалкил-(СН2)р-G-(СН2)m- дополнительно замещен одним или более F, Cl, Br, I, метил, этил, пропил, этинил, пропинил, бутинил, метокси, этокси, или циано;
R3 представляет собой Н, F, Cl, I, циано, гидрокси, С1-6 алкил, C1-6 галоалкил, С1-6 алкокси, С1-6 гидроксиалкокси, C1-12 аминоалкокси, C1-6 галоалкокси, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, С(=O), -C(=O)NH-, -OC(=O)NH-, -OC(=O)- или -NHC(=O)NH-; каждый р и m представляет собой независимо 0, 1, 2 или 3;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, C1-3 алкил, C1-3 галоалкил, С1-3 гидроксиалкил, С1-3 аминоалкил, C1-3 алкокси-C1-3-алкил, С1-3 алкиламино-С1-3-алкил, C1-3 алкилтио-C1-3-алкил, С6-10 арил-С1-3-алкил, С1-9 гетероарил-С1-3-алкил, С2-10 гетероциклил-С1-3-алкил, С3-10 циклоалкил-С1-3-алкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(CH3)2, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или С1-9 гетероарил;
n представляет собой 0, 1, 2 или 3;
R10 представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, или С1-4 алкилтио;
каждый R12 представляет собой оксо (=O), гидрокси, амино, гало, циано, С1-4o алкокси, С1-4o алкиламино, С1-4o алкилтио, С1-4о алкил, С2-10 алкенил, С2-10 алкинил, меркапто, нитро, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил, С6-10 арилокси, карбокси, гидрокси-замещенный С1-6 алкокси, гидрокси-замещенный C1-6e алкил-С(=O)-, С1-6 алкил-С(=O)-, C1-6 алкил-S(=O)-, С1-6 алкил-S(=O)2-, гидрокси-замещенный C1-6 алкил-S(=O)-, гидрокси-замещенный C1-6 алкил-S(=O)2-, или карбокси С1-6 алкокси;
R13 представляет собой Н, С1-4 алкил, С2-4 алкинил, С1-4 алкокси, гидрокси-замещенный С1-4 алкокси, С1-4 карбоксиалкокси, С1-4 алкилкарбонил или гидрокси-замещенный С1-4 алкилкарбони; и
каждый R14 и R14a представляет собой независимо Н, гидрокси, карбокси, С1-4 алкил, С1-4 алкокси или С1-4 алкиламино.
[00198] В некоторых реализациях R1 представляет собой независимо Н, F, Cl, Br, I, циано, гидрокси, метил, этил, пропил, изопропил, бутил, тер-бутил, С6-8 арил-(СН2)р-G-(СН2)m- или С4-6 гетероарил-(СН2)р-G-(СН2)m-, где каждый G представляет собой NR5, О или S, каждый р и m представляет собой независимо 0, 1, 2 или 3; или где каждый из С6-8 арил-(СН2)р-G-(СН2)m- и С4-6 гетероарил-(СН2)р-G-(СН2)m- дополнительно замещен одним или более F, Cl, Br, метил, этил, пропил, этинил, пропинил, бутинил, метокси, или циано; и
R представляет собой независимо Н, F, Cl, I, циано, гидрокси, метил, этил, пропил, изопропил, бутил, тер-бутил, С6-g арил-(СН2)р-G-(СН2)m- или С4.6 гетероарил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О или S, каждый р и m представляет собой независимо 0, 1, 2 или 3.
[00199] В некоторых реализациях формула (VI) представляет собой

где R1 представляет собой Н, F, Cl, Br, I, циано, гидрокси, С1-6 алкил, C1-6 галоалкил, С1-6 алкокси, С1-12 гидроксиалкокси, C1-6 аминоалкокси, С1-6 галоалкокси, С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)- или -NHC(=O)NH-; каждый р и m представляет собой независимо 0, 1, 2 или 3; или где каждый из С6-10 арил-(СН2)р-G-(СН2)m-, С1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, и С3-10 циклоалкил-(СН2)р-G-(СН2)m-дополнительно замещен одним или более F, Cl, Br, I, метил, этил, пропил, циано, этинил, метокси, этокси, или пропинил;
R3 представляет собой Н, F, Cl, I, циано, гидрокси, С1-6 алкил, C1-6 галоалкил, C1-6 алкокси, C1-6 гидроксиалкокси, С1-6 аминоалкокси, C1-6 галоалкокси, С6-10 арил-(СН2)р-G-(СН2)m-, C1-9 гетероарил-(СН2)р-G-(СН2)m-, С2-10 гетероциклил-(СН2)р-G-(СН2)m-, или С3-10 циклоалкил-(СН2)р-G-(СН2)m-, где каждый G представляет собой О, S, NR5, С(=O), -C(=O)NH-, -OC(=O)NH-, -ОС(=O)- или -NHC(=O)NH-; каждый р и m представляет собой независимо 0, 1, 2 или 3;
каждый R5 представляет собой независимо Н, R7R7aNC(=O)-, R7OC(=O)-, R7C(=O)-, С1-3 алкил, С1-3 галоалкил, C1-3 гидроксиалкил, C1-3 аминоалкил, С1-3 алкокси-С1-3-алкил, C1-3 алкиламино-С1-3-алкил, C1-3 алкилтио-C1-3-алкил, С6-10 арил-С1-3-алкил, C1-9 гетероарил-С1-3-алкил, С2-10 гетероциклил-С1-3-алкил, С3-10 циклоалкил-С1-3-алкил, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
каждый R7 представляет собой независимо Н, С1-6 алкил, С1-6 галоалифатический, С1-6 гидроксиалифатический, С1-6 аминоалифатический, С1-6 алкокси-С1-6-алифатический, С1-6 алкиламино-С1-6-алифатический, С1-4 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10
гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, C1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
каждый R7a представляет собой независимо С1-6 алкил, С1-6 галоалифатический, С1-6 гидроксиалифатический, C1-6 аминоалифатический, С1-6 алкокси-С1-6-алифатический, С1-6 алкиламино-С1-6-алифатический, С1-6 алкилтио-С1-6-алифатический, С6-10 арил-С1-6-алифатический, С1-9 гетероарил-С1-6-алифатический, С2-10 гетероциклил-С1-6-алифатический, С3-10 циклоалкил-С1-6-алифатический, С6-10 арил, С1-9 гетероарил, С2-10 гетероциклил или С3-10 карбоциклил;
с оговоркой, что там, где R7 и R7a связаны с одним и тем же атомом водорода, R7 и R7a, вместе с атомом водорода, с которым они связаны, дополнительно формируют замещенное или незамещенное 3…8-звенное кольцо;
каждый R8a представляет собой независимо Н, гидрокси, амино, F, Cl, Br, I, -N(CH3)2, циано, нитро, меркапто, С1-4 алкил, трифторметил, С1-4 алкокси, С1-4 алкиламино, С1-4 алкилтио, С6-10 арил, С6-10 арил-С1-4-алкил или С1-9 гетероарил; и
n представляет собой 0, 1, 2 или 3.
[00200] В некоторых реализациях каждый R7 представляет собой независимо Н, С1-6 алкил, С1-4 алкокси-С1-6-алкил,
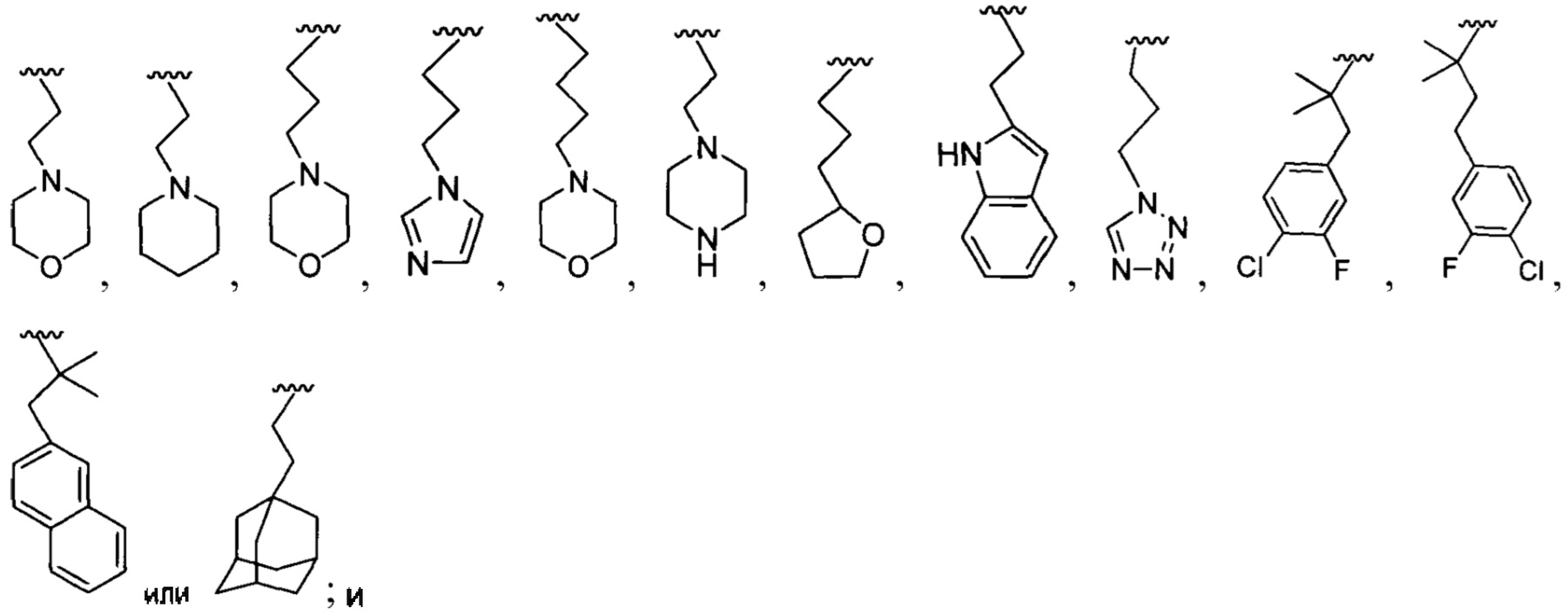
каждый R7а представляет собой независимо С1-6 алкил, С1-4 алкокси-С1-6-алкил,

[00201] Объектом заявки является также одно из приведенных ниже химических соединений, или стереоизомер, геометрический изомер, таутомер, оксид азота, гидрат, сольват, или их фармацевтически приемлемая соль, не ограничиваясь перечисленным далее:


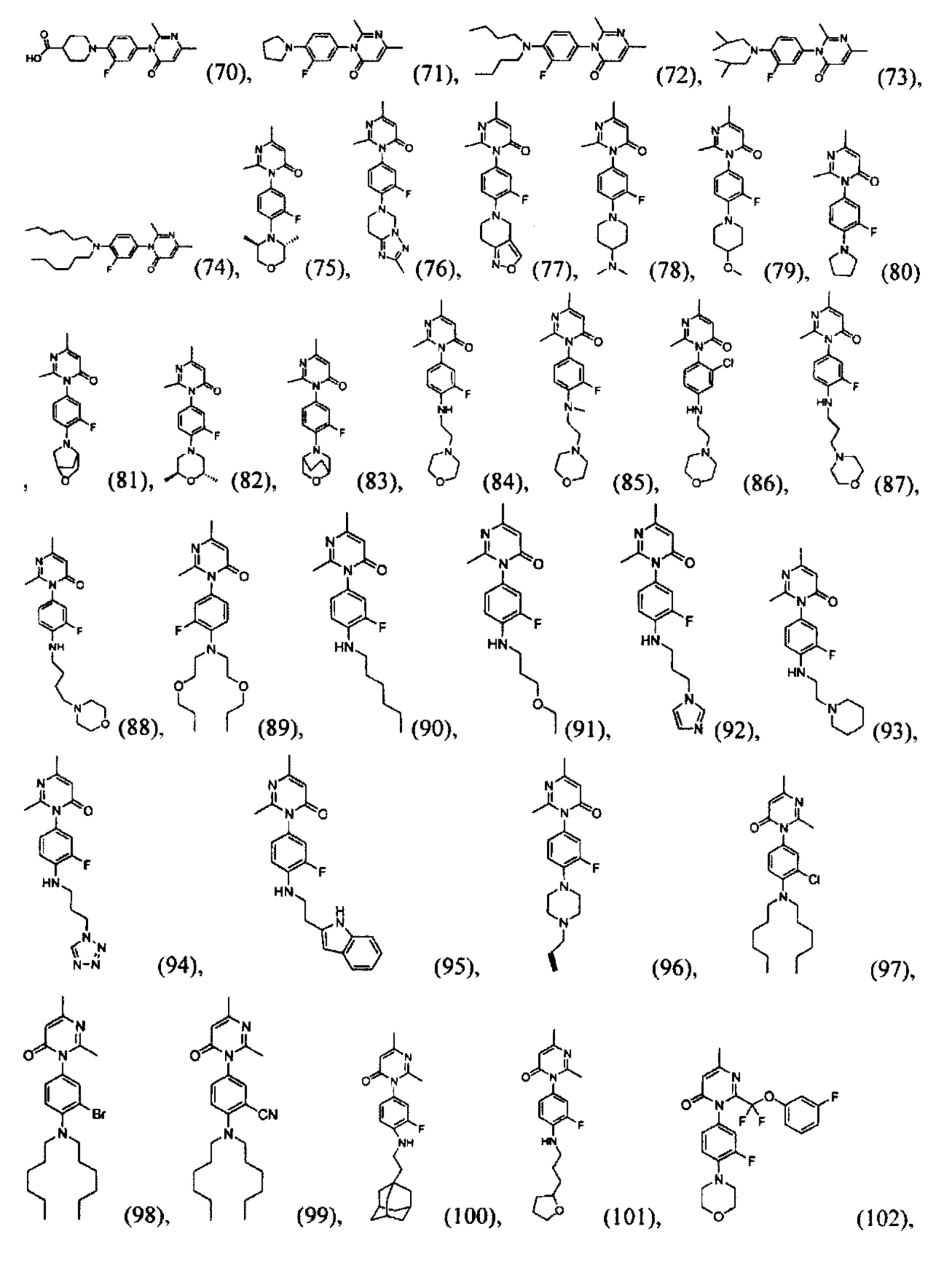

или

[00202] Заявляется также применение заявляемых химических соединений, или их фармацевтически приемлемой соли, в производстве лекарственных препаратов для лечения фиброзного заболевания ткани или органа пациента, включая представленные в настоящей заявке. Заявляется фармацевтический препарат, содержащий терапевтически эффективное количество химического соединения с формулой (I), (V), (VI), (VII) или (IV) совместно с как минимум одним фармацевтически приемлемым носителем, инертным наполнителем, разбавителем, активатором или основой.
[00203] Заявляются фармацевтические препараты, содержащие заявляемое химическое соединение, или а стереоизомер, геометрический изомер, таутомер, оксид азота, гидрат, сольват, или их фармацевтически приемлемая соль или их прототип; и дополнительно фармацевтически приемлемый носитель, инертный наполнитель, разбавитель, активатор или основа или их сочетание.
[00204] Также заявляется способ лечения фиброзного заболевания ткани или органа пациента или подозрения на такой фиброз, способ заключается в лечении объекта терапевтически эффективным количеством химического соединения с формулой (I), (V), (VI), (VII) или (IV).
[00205] В настоящей заявке фиброзное заболевание ткани или органа представляет собой почечный интерстициальный фиброз, клубочковый склероз, фиброз печени, пульмональный фиброз, перитонеальный фиброз, миокардиальный фиброз, дерматофиброз, послеоперационные спайки, доброкачесвенную гипертрофию простаты, фиброз скелетных мышц, дерматосклероз, рассеянный склероз, панкреатический фиброз, цирроз печени, миосаркому, нейрофиброму, пульмональный интерстициальный фиброз, диабетическую нефропатию, болезнь Альцгеймера или васкулярный фиброз. В других реализациях послеоперационные спайки представляют собой заживляемые рубцы.
[00206] В отсутствие иных указаний все стереоизомеры, геометрические изомеры, таутомеры, оксиды азота, гидраты, сольваты, метаболиты, соли и и фармацевтически приемлемые прототипы заявляемых химических соединений попадают в область заявляемого изобретения.
[00207] В отдельных реализациях соль представляет собой фармацевтически приемлемую соль. Фраза «фармацевтически приемлемый» подразумевает химическую и/или токсикологическую совместимость вещества или лекарственного препарата с другими ингредиентами состава, и/или с млекопитающим, подвергаемым лечению этим веществом или препаратом.
[00208] Заявляемые химические соединения содержат соли таких химических соединений, которые не обязательно являются фармацевтически приемлемыми солями, и которые могут оказаться полезными в качестве промежуточных элементов для приготовления и/или очистки химических соединений с формулой (I), (V), (VI), (VII) или (IV) и/или для сепарирования энантиомеров химических соединений с формулой (I), (V), (VI), (VII) или (IV).
[00209] Если заявляемое химическое соединение является основанием, желаемая соль может быть приготовлена любым подходящим известным способом, например, обработкой свободного основания неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, и аналогичными. Или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота; пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота; альфа гидрокси кислота, такая как лимонная кислота или виннокаменная кислота; амино кислота, такая как аспарагиновая кислота или глютаминовая кислота; кислота ароматического ряда, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как р-толуолсульфоновая кислота или этансульфоновая кислота, и аналогичные.
[00210] Если заявляемое химическое соединение является кислотой, желаемая соль может быть приготовлена любым подходящим известным способом, например, обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочно-земельного металла, и аналогичным. К некоторым неограничительным примерам подходящих солей относятся органические соли, полученные из аминокислот, таких как аминоуксусная кислота и гуанидинон-аминовалериановая кислота, аммиак, первичные, вторичные и третичные амины, и циклические амины, такие как пиперидин, морфолин и пиперазин, и органические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия, лития, и аналогичных.
СОСТАВ, ПРИГОТОВЛЕНИЕ И ПРИМЕНЕНИЕ ХИМИЧЕСКИХ ВЕЩЕСТВ ИЗОБРЕТЕНИЯ
[00211] Настоящая заявка отличается фармацевтическими препаратами, содержащими химическое соединение с формулой (I), (V), (VI), (VII) или (IV), химическое соединение перечисляется в настоящей заявке, или химическим соединением, упоминаемым в примерах 1-72, и фармацевтически приемлемым носителем, активатором или основой. Количество химического соединения в заявляемом лекарственном препарате обеспечивает очевидное лечение или снижение тяжести фиброзного заболевания ткани или органа пациента
[00212] Признается также существование заявляемых химических соединений в свободной форме для лечения, или, где уместно, в форме их фармацевтически приемлемых производных. К некоторым неограничительным примерам фармацевтически приемлемого производного относятся фармацевтически приемлемые прототипные лекарственные средства, соли, эфиры, соли таких эфиров или другие продукт присоединения или производные, которые, будучи приняты пациентом, способны обеспечить формирование, прямо или косвенно, иным образом, заявляемого химического соединения, или его метаболита, или его радикала.
[00213] Согласно приведенному выше описанию, заявляемые фармацевтически приемлемые лекарственные препараты дополнительно содержат фармацевтически приемлемый носитель, активатор или основу, которая, по настоящей заявке, включает в себя любые растворители, разбавители или любую жидкую основу, средства для растворения или создания взвеси, поверхностно-активные вещества, изотонические вещества, загустители или эмульсификаторы, консерванты, жидкие связующие вещества, увлажнители и аналогичные, соответствующие конкретной ребуемой дозировочной форме. Трой и соавторы, Ремингтон: Фармакология. Наука и практика, 21-е издание, 2005, Издательство Lippincott Williams & Wilkins, Филадельфия, и Суорбрик и соавторы, Энциклопедия фармацевтической технологии, ред., 1988-1999, Издательство Marcel Dekker, Нью-Йорк, все эти издания включены в список источников настоящей заявки, в них приводятся разнообразные носители, используемые для составления фармацевтически приемлемых лекарственных препаратов, а также известные технологии их приготовления. Исключая предельный случай несовместимости традиционного носителя с заявляемыми химическими соединениями, например, создание нежелательного биологического эффекта или иного вредоносного взаимодействия с любым другим компонентом (компонентами) фармацевтически приемлемого лекарственного препарата, его применение предполагается в области действия настоящей заявки.
[00214] К некоторым неограничительным примерам материалов, которые могут служить фармацевтически приемлемыми носителями, относятся ионные обменники, окись алюминия, стеарат алюминия, лецитин, сывороточный белок, такой как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, или сорбат калия, частичные глицеридовые смеси концентрированных растительных жирных кислот, вода, соли или электролиты, такие как протаминсульфат, вторичный кислый фосфат натрия, вторичный кислый фосфат калия, хлористый натрий, соли цинка, коллоидный кремнезем, трисиликат магния, поливинилпирролидон, полиакрилаты, воск, полиэтилен-полиоксипропилен-блочные полимеры, ланолин, сахар, такой как лактоза, глюкоза и сахароза; крахмал, такой как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натриевая карбоксиметилцеллюлоза, этилцеллюлоза и ацетатцеллюлоза; порошковый трагакант; солод; желатин; тальк; инертные наполнители, такие как какао-масло и суппозиторный воск; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль или полиэтиленгликоль; эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроокись магния и гидроокись алюминия; альгиновая кислота; апирогенная вода; изотонический раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие нетоксичные совместимые смягчающие компоненты, такие как лаурилсульфат натрия и стеарат магния, а также окрашивающие вещества, разделительные вещества, покрывающие вещества, подсластители, ароматизирующие добавки, консерванты и антиоксиданты.
[00215] Прием заявляемых лекарственных препаратов может осуществляться орально, парэнтерально, ингаляционным спреем, местно, ректально, назально, суббуккально, вагинально или через имплантированный резервуар. Заявляемые фармацевтически приемлемые лекарственные препараты включают в себя оральный приме в любой приемлемой оральной дозировочной форме, не ограничиваясь перечисленным далее: капсулы, таблетки, пилюли, порошки, гранулы, водные суспензии или растворы.
[00216] Прием заявляемых лекарственных препаратов может осуществляться в различных дозировочных формах: таблетки, пилюли, капсулы, растворяемые порошки, измельченные частицы или взвеси, сироп и эликсиры. Как альтернативный вариант, заявляемые лекарственные препараты могут применяться наружно в форме мазей, геля, или или медицинского пластыря; или парэнтерально в форме стерильного раствора для инъекций или взвеси.
[00217] Прием заявляемых химических соединений может осуществляться парэнтерально или интерперитониально. Заявляемые химические соединения (в виде свободных оснований или фармацевтически приемлемой соли) могут быть приготовлен в растворах или взвесях в воде, подходящим образом перемешанными с поверхностно-активным веществом (таким как гидроксипропил целлюлозы, поливинилпирролидон). Эмульсию можно приготовить также из смеси активных химических соединений в глицерине, жидкости, полиэтиленгликоле и масле. В нормальных условиях хранения и использования эти составы могут содержать консерванты для предотвращения размножения бактерий.
[00218] К фармацевтическим формам, приемлемым для инъекций, относятся стерильная вода или эмульсия и стерильный порошок (используется для временного приготовления стерильных растворов или эмульсий для инъекций). В любом случае, эти формы должны быть стерильными и текучими, чтобы их можно было применять с помощью инъекционного шприца. Эти формы должны находиться в стабильном состоянии изготовления и хранения, их следует предохранять от загрязнения микроорганизмами (такими, как бактерии и грибки). Носители должны представлять собой растворители или эмульсионную среду, включая, например, воду, спирты (такие как глицерин, пропилен гликоль и жидкий полиэтиленгликоль), растительное масло и их сочетания.
[00219] Заявляемые химические соединения предпочтительно применять местно, а не системно, например, посредством инъекции химического соединения непосредственно в орган, чаще с расчетом на пролонгированное действие или по устоявшейся технология приготовления лекарственного средства. Кроме того, фармацевтический препарат, содержащий заявляемое химическое соединение, можно принимать посредством специализированной системы доставки лекарственных средств, например, в липосоме, покрытой антителом, специфичным для органа. Липосомы могут быть ориентированы на орган и селективно восприниматься им. Кроме того, фармацевтические препараты, содержащие заявляемое химическое соединение, могут быть представлены в быстродействующей форме, в форме длительного действия, или в форме промежуточного быстродействия.
[00220] Для ингаляции заявляемые химические соединения могут быть представлены в форме аэрозоля, капельно-воздушной взвеси или порошка.
Фармацевтические препараты, содержащие заявляемое химическое соединение, по соображениям удобства могут поставляться в форме аэрозольного спрея, распыляемого из контейнера под давлением или аэрозольного аппарата с использованием подходящего носителя, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, двуокиси углерода или другого подходящего газа. Для аэрозоля под давлением отмеренное количество обеспечивается дозирующим устройством. Капсулы и картриджи, скажем, желатиновые - исключительно для примера, для применения в ингаляторе или инсуффляторе, могут содержать порошкообразную смесь заявляемого химического соединения и подходящий носитель порошка, такой как лактоза или крахмал.
[00221] Заявляемые химические соединения могут быть также оформлены в виде лекарственных препаратов для ректального приема, например, посредством клизмы, в форме ректальных гелей, ректальных пен, ректальных аэрозолей, суппозиториев, желеобразных суппозиториев, или удерживающих клизм, с наличием распространенных оснований суппозиториев, таких как какао-масло или другие глицериды, а также любые синтетические полимеры, пригодные для создания оснований суппозиториев, такие как поливинилпирролидон, PEG; и аналогичные. В суппозиторной форме лекарственных препаратов используется воск с низкой температурой плавления, например, не ограничиваясь перечисленным далее, смесь жирнокислотных глицеридов, дополнительно в сочетании с какао-маслом, которое плавится первым.
[00222] Кроме того, заявляемое химическое соединение может использоваться в сочетании с другими веществами для лечения фиброза, например, не ограничиваясь перечисленным далее: ивакафтор, рофлумиласт, пирфенидон, миглустат, лосатран, ACTIMMUNE® (интерферон гамма-IB), дорнас альфа, VELDONA® (интерферон альфа), аталурен, кортикальный гормон, метотрексат, такролимус и их сочетания.
[00223] Заявляемые фармацевтические лекарственные препараты могут быть составлены общепринятым способом с использованием одного или более физиологически приемлемых носителей, содержащих инертные наполнители и вспомогательные вещества, облегчающие переработку активных химических соединений в препараты, пригодные к фармацевтическому применению. Надлежащее приготовление зависит от избранного способа приема. Допускается использование в качестве пригодных и понятных специалистам любых хорошо известных технологий, носителей и инертных наполнителей. Фармацевтические лекарственные препараты, содержащие заявляемое химическое соединение, могут изготовляться общепринятым способом, скажем, в качестве примера, обычным смешиванием, растворением, гранулированием, изготовлением драже, растиранием в порошок, эмульгированием, капсулированием, захватыванием или давлением.
[00224] В состав заявляемых фармацевтических лекарственных препаратов входит как минимум один фармацевтически приемлемый носитель, разбавитель или инертный наполнитель и заявляемое химическое соединение как активный ингредиент в форме свободной кислоты или свободного основания, или в форме фармацевтически приемлемой соли. Кроме того, в состав заявляемых фармацевтических лекарственных препаратов входят другие лекарственные или фармацевтические вещества, носители, активаторы, такие как консерванты, стабилизаторы, увлажнители или эмульгаторы, катализаторы раствора, соли для регулирования осмотического давления, и/или буферы. Помимо этого, фармацевтические лекарственные препараты содержат другие фармацевтически ценные вещества.
[00225] Способы приготовления заявляемых фармацевтических лекарственных препаратов включают в себя составление заявляемых химических соединений с одним или более фармацевтически приемлемым инертным наполнителем или носителем в твердой, полумягкой или жидкой форме. К некоторым неограничительным примерам твердых химических соединений относятся порошки, таблетки, растворимые гранулы, капсулы, облатки и суппозитории. К некоторым неограничительным примерам жидких химических соединений относятся растворы, где растворено химическое соединение, эмульсии, содержащие химическое соединение, или растворы, содержащие липосомы, мицеллы или наночастицы заявляемого химического соединения. К некоторым неограничительным примерам полужидких химических соединений относятся гели, суспензии и кремы. Лекарственный препарат может быть представлен в форме жидких растворов или суспензий, в твердых формах, пригодных для растворения или создания суспензии в жидкости перед применением, или в форме эмульсий. Заявляемые фармацевтические лекарственные препараты могут также содержать незначительные количества нетоксичных вспомогательных веществ, таких как увлажнители или эмульгаторы, буферы рН и так далее.
[00226] Заявляемые химические соединения приготовляются предпочтительно в дискретной дозировочной форме для упрощения приема и единообразия дозировки. Выражение «дискретная дозировочная форма» относится к физической дискретной единице вещества, пригодного для лечения пациента. Тем не менее, следует отметить, что общий объем ежедневного приема заявляемых химических соединений и лекарственных препаратов будет определять лечащий врач с учетом медицинской целесообразности. Специфическая эффективная доза для конкретного пациента или организма будет зависеть от множества факторов, включая заболевание, подвергаемое лечению, и степень тяжести заболевания; активность специфического используемого химического соединения; специфический используемый лекарственный препарат; возраст, вес, общее состояние, пол и диету пациента; время приема, способ приема, и норматив выведения из организма специфического используемого химического соединения; продолжительность лечения; лекарственные средства, используемые в сочетании или в соответствии с используемым специфическим химическим соединением, и подобные факторы, хорошо известные специалистам.
[00227] Эффективная доза активных ингредиентов моет изменяться в зависимости от используемого химического соединения, режима приема и тяжести заболевания. Однако в большинстве случаев желаемый результат может быть достигнут при ежедневной дозировке заявляемого химического соединения около 0,25-1000 мг/кг живого веса. Наиболее предпочтительна схема приема 2-4 отдельными дозами в день, или в форме медленного действия. Для большинства крупных млекопитающих общая дневная доза равна 1-100 мг/кг, наиболее предпочтительно 2-80 мг/кг. Дозировочная форма, пригодная для прием внутрь, содержит около 0,25-500 мг активного химического соединения, достаточно смешанного с твердым или жидким фармацевтически приемлемым носителем. Дозировка может регулироваться для обеспечения наилучшего результата лечения. Кроме того, по неотложным требованиям состояния, подвергающегося лечению, могут быть назначены несколько отдельных ежедневных доз, или изменена пропорция дозировки.
[00228] Отдельные биологические свойства химических соединений могут быть улучшены за счет модификации дополнительными подходящими функциональными группами. Такие модификации известны в заявляемой области, и заключаются в модификации проникновения в биологические полости (такие как кровь, лимфатическая система, центральная нервная система), они улучшают оральную эффективность и растворимость так, что создается возможность приема путем инъекций, изменения метаболизма и выделения.
[00229] Заявляемое химическое соединение или фармацевтически приемлемая соль, или гидрат может использоваться для профилактики, сопровождения, лечения или снижения тяжести фиброзного заболевания ткани или органа пациента, а именно почечного интерстициального фиброза, клубочкового склероза, фиброза печени, пульмонального фиброза, перитонеального фиброза, миокардиального фиброза, дерматофиброза, послеоперационных спаек, доброкачественной гипертрофии простаты, фиброза скелетных мышц, дерматосклероза, рассеянного склероза, панкреатического фиброза, цирроза печени, миосаркомы, нейрофибромы, пульмонального интерстициального фиброза, диабетической нефропатии, болезни Альцгеймера или васкулярного фиброза.
ПРОЦЕДУРЫ ОБЩЕГО СИНТЕЗА
[00230] В основном, заявляемые химические соединения могу быть приготовлены способами, изложенными в настоящей заявке, где заместители определены приведенными выше формулами (I), (V), (VI), (VII) или (IV), за исключением дополнительных примечаний. Представленные ниже неограничительные схемы и примеры предназначены для дальнейшего упрощения изложения настоящей заявки.
[00231] Специалистам будет очевидна несложность использования приведенных химических реакций для приготовления некоторого количества заявляемых химических соединений, и альтернативные способы приготовления заявляемых химических соединений предполагаются в области действия настоящей заявки. Например, синтез неупрощенных заявляемых химических соединений может быть успешно совершен путем модификаций, известных специалистам, например, соответствующей защитой взаимодействующих групп, применением других подходящих реагентов, известных специалистам, отличающихся от приведенных в настоящей заявке и/или путем стандартного изменения условий реакции. С другой стороны, другие реакции, изложенные в настоящей заявке или известные специалистам, будут признаны пригодными для приготовления заявляемых химических соединений.
[00232] В приведенных ниже примерах все температуры указаны в градусах Цельсия при отстутвии иных указаний. Реагенты были приобретены у рыночных поставщиков, таких как Aldrich Chemical Company, Arco Chemical Company и Alfa Chemical Company, и использовались без дополнительной очистки при отсутствии иных указаний. Общераспространенные растворители были приобретены у рыночных поставщиков, таких как Shantou XiLong Chemical Factory, Guangdong Guanghua Reagent Chemical Factory Co. Ltd., Guangzhou Reagent Chemical Factory, Tianjin YuYu Fine Chemical Ltd., Qingdao Tenglong Reagent Chemical Ltd., и Qingdao Ocean Chemical Factory.
[00233] Безводный THF, диоксан, толуол, и эфир были получены перегонкой с обратным холодильником раствора с натрием. Безводные CH2Cl2 и CHCl3 получены перегонкой с обратным холодильником раствора с СаН2. EtOAc, РЕ, гексан, DMAC и DMF были обработаны безводным Na2SO4 перед применением.
[00234] Изложенные ниже реакции обычно проводились при положительном давлении в атмосфере азота или аргона с осушительной трубкой (в отсутствие иных указаний) в безводных растворах, и реакционные колбы обычно оснащались резиновой мембраной для ввода веществ и реагентов посредством шприца. Стеклянную лабораторную посуду сушили в печи и/или посредством нагревания.
[00235] Колоночная хроматография производилась посредством силикагелевой колонны. Силикагель (типоразмер 300-400 меш) был приобретен на химическом заводе Qingdao Ocean. 1Н NMR спектр записывался спектрометром Bruker 400 МГц при комнатной температуре. 1Н NMR спектр был получен как CDCl3, d6-DMSO, CD30D или d6-ацетон растворы (единица измерения - миллионные доли, мд или ppm), с использованием в качестве эталонного стандарта TMS (0 ppm) или хлороформа (7,25 ppm). При записи множественных пиков использовались следующие аббревиатуры: s (синглет), d (дублет), t (триплет), m (мультиплет), br (расширенный), dd (дублет дублетов), dt (дублет триплетов). Константа взаимодействия, при наличии таковых, указываются в герцах (Гц).
[00236] Масс-спектральные данные низкой разрешающей способности (MS) определялись посредством спектрометра Agilent 6320 серии LC-MS, оснащенном бинарными насосами G1312A, регулятором G1316A ТСС (регулирование температуры колонны, поддерживалась температура 30°С), устройством автоматического отбора проб G1329A и детектором G1315B DAD, на спектрометре LC-MS использовался источник ESI.
[00237] Масс-спектральные данные низкой разрешающей способности (MS) определялись также посредством спектрометра Agilent 6120 серии LC-MS, оснащенном счетверенным насосом G1311A, регулятором G1316A ТСС (регулирование температуры колонны, поддерживалась температура 30°С), устройством автоматического отбора проб G1329A и детектором G1315D DAD, на спектрометре LC-MS использовался источник ESI.
[00238] Оба спектрометра LC-MS были оснащены колонной Agilent Zorbax SB-C18, 2,1×30 мм, 5 мкм. Объем инъекции определялся концентрацией пробы.
Номинальный расход равнялся 0,6 мл/мин. Пики HPLC регистрировались в диапазоне UV-Vis на длине волны 210 нм и 254 нм. Мобильная фаза составляла 0,1% муравьиной кислоты в ацетонитриле (фаза А) и 0,1% муравьиной кислоты в особо чистой воде (фаза В). Градиент приведен в таблице 1:

[00240] Степень чистоты химических соединении оценивалась прибором серии Agilent 1100 для высокопроизводительной жидкостной хроматографии (HPLC) с УФ-детектированием на длинах волн 210 нм и 254 нм (Zorbax SB-C18, 2,1×30 мм, 4 микрона, 10 мин, номинальный расход 0,6 мд/мин, от 5 до 95% (0,1% муравьиная кислота в CH3CN) в (0,1% муравьиная кислота в Н2О). Колонна работал при 40°С.
[00241] Для параметров используются следующие аббревиатуры:
ВРО бензоил пероксид
NH4Cl хлорид аммония
ВОС, Воc терт-бутилоксикарбонил
Вос2О Ди-терт-бутил дикарбонат
CS2CO3 карбонат цезия
CHCl3 хлороформ
CCl4 четыреххлористый углерод
CDCl3 хлороформ дейтерированный
Cul медь (I) йодид
DMAC N,N-Диметилацетамид
DMF диметилформамид
DMAP 4-диметиламинопиридин
DMSO диметилсульфоксид
EtOAc этил ацетат
g грамм
h час (часов)
мин минута (минуты)
HCl соляная кислота
Н2 водород
МеОН, СН3ОН метанол
EtOH этанол
CH2Cl2, DCM дихлорметан
мл, мл миллилитр
N2 азот
Pd/C палладий на углероде
РЕ петролейный эфир (60-90°С)
K2CO3 углекислый калий
RT, rt, комнатная температура
NaHCO3 углекислый натрий
NaCl хлористый натрий
Na2SO4 сернокислый натрий
NaOH едкий натр
THF тетрагидрофуран
Et3N, TEA триэтиламин
NBS N-бромоянтарномид
H2O вода
AIME3 триметилалюминий
Реагент Лоуссона 1,3,2,4-дитиадифосфетан, 2,4-бис(4-метоксифенил)-,2,4-дисульфид
ТВАВ тетрабутил аммония бромид
RH2(OAc)2 Родия (II) ацетат
PFD пирфенидон
[00242]

Химическое соединение 3, где каждый из V1, V2, V3, V4, А, В и X определен в настоящей заявке, можноо приготовить, пользуясь процессом, изображенным на схеме 1. Смесь химического соединения 1, химического соединения 2, основания (такого как углекислый калий, углекислый цезий, фосфат калия, и т.д.) и лиганд (такой как 8-гидроксиквинолин, этил 2-оксоциклогексанкарбоксилат, N,N'-диметилэтан-1,2-диамин, и т.д.) разведенный в растворителе (таком как диоксан, N,N-диметил форммид или диметил сульфоксид) нагревается до подходящей температуры (например, 50-140°С) в атмосфере азота для получения желаемого химического соединения 3.
[00243]


Химическое соединение 6, где каждый из R2, R4, X и В определен выше, может быть приготовлено по процессу, показанному на схеме 2. Смесь йодосодержащей производной 4, производной пиридона 5, основания (такого как углекислый калий, углекислый цезий, фосфат калия и т.д.) и лиганда (такого как 8-гидроксиквинолин, этил 2-оксоциклогексанкарбоксилат, N,N'-диметил этан-1,2-диамин, т.д.), растворенная в растворителе (таком как диоксан, N,N-диметил формамид или диметил сульфоксид) была нагрета до соответствующей температуры (такой как 50-140°С) в атмосфере азота для получения химического соединения 6.
[00244]
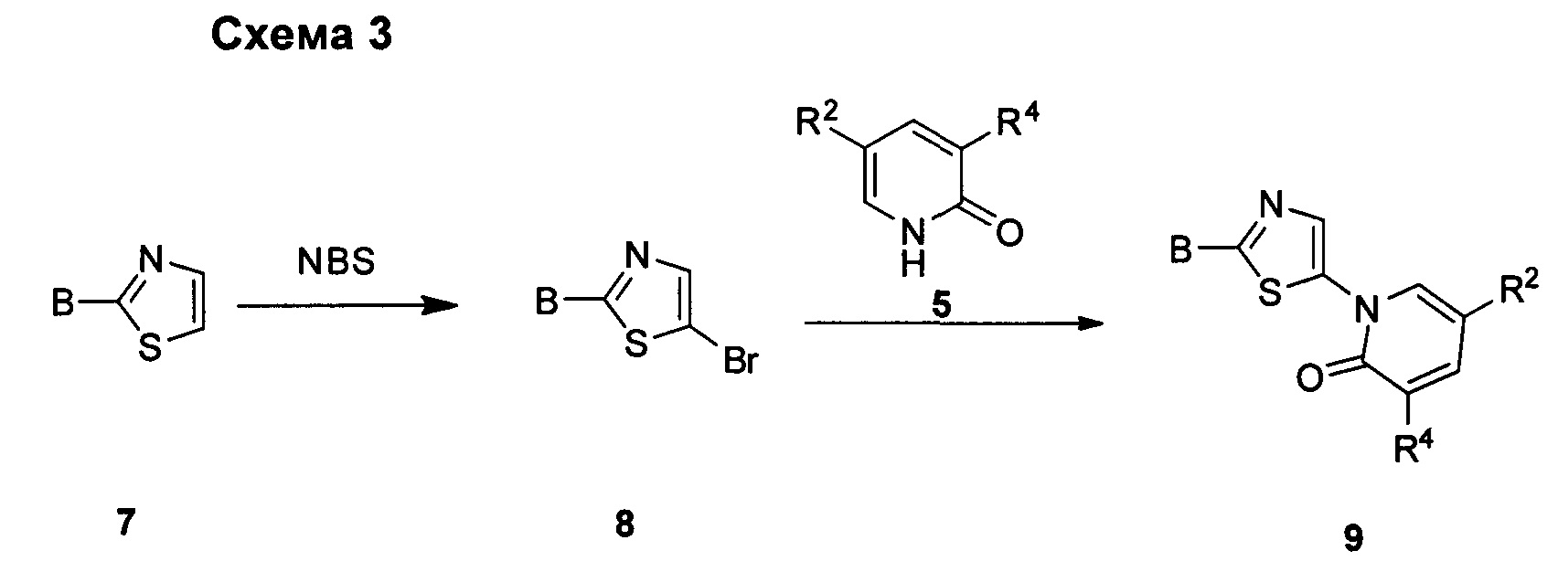
Химическое соединение 9, где каждый из R2, R4 и В определен выше, может быть приготовлено по процессу, показанному на схеме 3. Тиазол-производная 7 реагирует с NBS для получения бромин-содержащей производной 8. Смесь бромин-содержащей производной 8, производных пиридона 5, основания (такого как углекислый калий, углекислый цезий, фосфат калия и т.д.) и лиганда (такого как 8-гидроксиквинолин, этил 2-оксоциклогексанкарбоксилат, N,N'-диметил этан-1,2-диамин, т.д.), растворенная в растворителе (таком как диоксан, N,N-диметил формамид или диметил сульфоксид) была нагрета до соответствующей температуры (такой как 50-140°С) в атмосфере азота для получения химического соединения 9.
[00245]

Химическое соединение 13, где каждый из R1, R3 и В определен в настоящей заявке, может быть может быть приготовлено по процессу, показанному на схеме 4. Амины 11 могут быть приготовлены каталитической гидрогенерацией нитропроизводной 10. Затем амины 11 прореагировали с химическим соединением 12 под воздействием триметилалюминия в органическом растворителе (таком как дихлорметан и т.д.) для получения желаемого химического соединения 13.
[00246]

Химическое соединение 16, где каждый из R1, R3 и В определен в настоящей заявке, может быть приготовлено по процессу, показанному на схеме 5. Тиазол-производная 7 может быть преобразована в нитропроизводную 14 под воздействием сильной кислоты (такой как концентрированная азотная кислота, концентрированная серная кислота и т.д.). Затем нитропроизводная 14 была восстановлена каталитической гидрогенерацией для получения амина 15, после чего последовала реакция с химическим соединением 12 под воздействием триметилалюминия в органическом растворителе (таком как дихлорметан и т.д.) для получения желаемого химического соединения 16.
[00247] Схема 6

Химическое соединение 18, где каждый из R1, R3, R5a, n и D определен в настоящей заявке, может быть может быть приготовлено по процессу, показанному на схеме 6. Сплавленное трициклическое химическое соединение 17 реагирует с химическим соединением 12 под воздействием триметилалюминия в органическом растворителе (таком как дихлорметан и т.д.) для получения желаемого химического соединения 18.
[00248] ПРИМЕРЫ
[00249] Пример 1
1-(3-фторо-4-(морфолинометил)фенил)-5-метил пиридин-2(1Н)-один

[00250] Шаг 1) 4-(2-фтор-4-йодбензил)морфолин
К раствору 2-фтор-4-йодтолуола (23,60 г; 0,10 моль) в CHCl3 (1000 мл) был добавлен ВРО (0,55 г; 2,27 ммоль) и NBS (24,92 г; 0,14 моль) моль в атмосфере N2. Возгонка реакционной смеси с обратным охлаждением производилась в течение 6 ч, затем смесь охладили и профильтровали. Фильтрат был сконцентрирован in vacuo. Осадок был добавлен к раствору морфолина (43,56 г; 0,50 моль) в EtOH (1000 мл) в атмосфере N2. Полученная смесь перемешивалась в течение суток при rt, и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:1) для получения названного химического соединения в виде твердого вещества белого цвета (4,82 г; 15%).
[00251] Шаг 2) 1-(3-фтор-4-(морфолинометил)фенил)-5-метилпиридин-2(1Н)-один. Смесь Cul (0,19 г; 1 ммоль), Cs2CO3 (6,85 г; 20 ммоль) и этил 2-оксоциклогексанекарбоксилат (0.34 г; 2 ммоль) в DMSO (10 мл) перемешивалась в течение 30 мин в атмосфере N2. Затем к реакционной смеси был добавлен шприцом раствор 5-метилпиридона (1,09 г; 10 ммоль) и 4-(2-фтор-4-йодбензил) морфолина (3,21 г; 10 ммоль) в DMSO (12 мл). Реакционная смесь нагревалась сутки до 100°С, затем была охлаждена до rt и профильтрована. Фильтрат, разбавленный H2O (50 мл) был извлечен с помощью CH2Cl2 (50 мл × 3). Комбинированные органические фазы были сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V) - 10:1) для получения названного химического соединения в виде твердого вещества белого цвета (0,70 г; 23%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 303,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,06 (s, 3Н), 3,16-3,32 (m, 4Н), 3,86-3,97 (m, 4Н), 4,44 (s, 2Н), 6,47 (d, 1Н, J=9,6 Гц), 7,39-7,44 (m, 2Н), 7,48 (s, 1Н), 7,52-7,55 (m, 1Н), 7,99 (t, 1Н, J=8,2 Гц),
[00252] Пример 2
1-(3-фтор-4-(морфолинометил)фенил)-3,5-диметилпиридин-2(Н)-один

Смесь 3,5-диметилпиридина-2(Н)-один (0,22 г; 1,80 ммоль), 4-(2-фтор-4-йодбензил)морфолин (0,58 г; 1,80 ммоль), K2CO3 (2,48 г; 18 ммоль), Cul (0,02 г; 0,1 ммоль) и DMF (3 мл) была подвергнута возгонке с обратным холодильником в атмосфере N2. Ход реакции контролировался посредством TLC. Реакционная смесь была охлаждена до rt и профильтрована. К фильтрату была добавлена H2O (10 мл) и CH2Cl2 (20 мл). Слой CH2Cl2 был отсепарирован, и влагосодержащий слой был извлечен посредством CH2Cl2 (20 мл × 2). Комбинированные органические фазы были высушены над Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (0,28 г; 50%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 317,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,06 (s, 3Н), 2,16 (s, 3Н), 2,61 (s, 2Н), 4,10 (m, 4Н), 4,32 (m, 4Н), 6,97 (s, 1Н), 7,09 (s, 1Н), 7,24 (d, 1Н), 7,31 (d, 1Н), 8,1 (s, 1Н),
[00253] Пример 3
1-(3-фтор-4-((4-метилпиперазин-1-ил)метил)фенил)-3,5-диметилпиридин-2(Н)-один

[00254] Шаг 1) 1-(2-фтор-4-йодбензил)-4-метилпиперазин
К смеси 2-фтор-4-йодтолуола (0,94 г; 4,0 ммоль) в CCl4 (40 мл) были добавлены ВРО (0,02 г; 0,08 ммоль) и NBS (0.78 г; 4.4 ммоль) в атмосфере N2. Реакционная смесь подвергалась была подвергнута возгонке с обратным холодильником на протяжении 5 ч, затем была охлаждена и сконцентрирована in vacuo. К остатку был добавлен раствор метилпиперазина (2,00 г; 20 ммоль) в EtOH (40 мл) в атмосфере N2. Смесь перемешивалась в течение суток и и была сконцентрирована in vacuo. Получившийся остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде твердого вещества белого цвета (0,69 г; 52%).
[00255] Шаг 2)
1-(3-фтор-4-((4-метилпиперазин-1-ил)метил)фенил)-3,5-диметил пиридин-2(1N)-один
Смесь 3,5-диметилпиридина-2(H)-один (0,07 г; 0,57 ммоль), 1-(2-фтор-4-йодбензил)-4-метилпиперазине (0,19 г; 0,57 ммоль), K2CO3 (0,08 г; 0,58 ммоль), Cul (0,005 г; 0,026 ммоль) и DMF (1 мл) была подвергнута возгонке с обратным холодильником в атмосфере N2. Ход реакции контролировался посредством TLC. После завершения реакции смесь была охлаждена до rt. К полученной смеси была добавлена H2O (5 мл) и CH2Cl2 (10 мл × 3). Органическая фаза была отсепарирована, высушена над Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,07 г; 37%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 317,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,08 (s, 3Н), 2,17 (s, 3Н), 2,29 (s, 3Н), 2,46-2,54 (m, 8 Н), 3,61 (s, 2Н), 6,97 (s, 1Н), 7,11-7,15 (m, 3Н), 7,47-7,511 (m, 1Н),
[00256] Пример 4
1-(4-((диэтиламино)метил)-3-фторфенил)-3,5-диметилпиридин-2(1H)-один

[00257] Шаг 1) 1-(бромометил)-2-фтор-4-йодбензол
К раствору 2-фтор-4-йодтолуола (2,83 г; 12 ммоль) в CCl4 (120 мл) были добавлены NBS (2,24 г; 12,6 ммоль) и ВРО (0,06 г; 0,24 ммоль). Реакционная смесь была подвергнута возгонке с обратным холодильником в течение 9 ч в атмосфере N2, затем охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ) для получения названного химического соединения в виде твердого вещества белого цвета (2,16 г; 57%).
[00258] Шаг 2) N-этил-N-(2-фтор-4-йодбензил)этанамин
Смесь 1-(бромометил)-2-фтор-4-йодбензол (1,89 г; 6,0 ммоль) и раствор диэтиламина (2,19 г; 30 ммоль) в EtOH (60 мл) перемешивалась в течение суток в атмосфере N2, затем была сконцентрирована in vacuo. Остаток был разведен в EtOAc (100 мл), и промыт водой (100 мл × 3), а затем насыщенным раствором (100 мл). Органическая фаза была сконцентрирована in vacuo для получения названного химического соединения в виде бесцветного масла (1,72 г; 94%).
[00259] Шаг 3) 1-(4-((диэтиламино)метил)-3-фторфенил)-3,5-диметилпиридин-2(1N)-один
К раствору N-этил-N-(2-фтор-4-йодбензил)этанамина (1.72 г; 5.60 ммоль) в диоксане (50 мл) было добавлено 3,5-диметил-пиридона (0,69 г; 5,60 ммоль), TV,TV-диметил этан-1,2-диамин (0,20 г; 2,24 ммоль), Cul (0,21 г; 1,12 ммоль) и фосфат калия (2.38 г; 11.20 ммоль) в атмосфере N2. Реакционная смесь поддерживалась нагретой до 110°С в течение 9 ч, затем была охлаждена до rt и влита в CH2Cl2 (200 мл). Смесь была профильтрована, и фильтрат был промыт водой (200 мл × 3) и насыщенным раствором (200 мл). Органическая фаза была сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (CH2Cl2/МеОН (V/V)=10:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,23 г; 14%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 303,7 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,06 (t, 6H, J=7,2 Гц), 2,07 (s, 3H), 2,17 (s, 3H), 2,53-2,58 (m, 4H), 3,65 (s, 2H), 6,98 (s, 1H), 7,15-7,09 (m, 3H), 7,55 (t, 1H, J=8,2 Гц),
[00260] Пример 5
3-(3-фтор-4-(морфолинометил)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00261] Шаг 1) 1-(бромометил)-2-фтор-4-нитробензол
К раствору 1-метил-2-фтор-4-нитробензол (4,96 г; 32 ммоль) и NBS (6,05 г; 34 ммоль) в CCl4 (80 мл) был добавлен ВРО (0,39 г; 1,6 ммоль). Смесь поддерживалась нагретой до 68°С в течение 5 ч, затем была профильтрована и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=20:1) для получения названного химического соединения в виде твердого вещества желтого цвета (4.53 г; 60%).
[00262] Шаг 2) 4-(2-фтор-4-нитробензил)морфолин
К раствору 1-(бромометил)-2-фтор-4-нитробензол (3.04 г; 13 ммоль) в CH2Cl2 (50 мл) были добавлены морфолин (1,74 г; 20 ммоль) и Et3N (2,63 г; 26 ммоль). Реакция производилась в течение суток возгонкой с обратным холодильником, и затем было произведено концентрирование in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества желтого цвета (2,05 г; 65%).
[00263] Шаг 3) 3-фтор-4-(морфолинометил) анилин
К раствору 4-(2-фтор-4-нитробензил) морфолина (14,80 г; 62 ммоль) в МеОН (100 мл) был добавлен Pd/C (4,0 г). Реакционная смесь перемешивалась при rt в среде Н2 в течение суток, и затем была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества светло-бурого цвета (11,27 г; 87%).
[00264] Шаг 4) 3-(3-фтор-4-(морфолинометил)фенил)-2,6-диметилпиримидин-4(3Н)-один
Смесь из 3-фтор-4-(морфолинометил)анилина (0,21 г; 1,00 ммоль), обезвоженного CH2Cl2 (10 мл) и триметилалюминия (4,5 мл, 4,5 ммоль, 1,0 М в гептане) перемешивалась при rt в течение 20 мин в атмосфере N2, затем был добавлен раствор метил 3-ацетаминокротоната (0,19 г; 1,20 ммоль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt в течение 10 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и извлечена посредством CH2Cl2. Комбинированные органические фазы были промыты насыщенным водосодержащим раствором NaHCO3 и насыщенным раствором, высушены над обезвоженной Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,105 г; 30%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 318,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,18 (s, 3Н), 2,31 (s, 3Н), 2,53 (s, 4Н), 3,62 (m, 2Н), 3,74 (s, 4Н), 6,3 (s, 1Н), 6,96 (m, 2Н), 7,61 (s, 1Н),
[00265] Пример 6
1-(2-(4-этоксифенил)тиазол-5-ил)-3,5-диметилпиридин-2(1Н)-один

[00266] Шаг 1) 2-(4-гидроксифенил)тиазол
К смеси 4-гидроксибензотиоамида (30,64 г; 0,20 моль) и
2-бромо-1,1-диметоксиэтана (31,00 г; 0,20 моль) в EtOH (600 мл) была добавлена 4-метилбензолсульфоновая кислота (34,44 г; 0,20 моль) с перемешиванием при rt. Реакционная смесь нагревалась до 90°С в течение 24 ч, затем была охлаждена до rt и сконцентрирована in vacuo. Смесь была разбавлена Н2О (200 мл), доведена до рН 10 с насыщенным водосодержащим раствором NaHCO3 и экстрактирована DCM (200 мл × 3). Комбинированные органические фазы были сконцентрированы in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (21,3 г; 60%).
[00267] Шаг 2) 2-(4-этоксифенил)тиазол
К смеси 2-(4-гидроксифенил)тиазол (21,27 г; 0,12 моль) и K2CO3 (82,93 г; 0,60 моль) в ацетоне (1000 мл) был добавлен бромэтан (39,24 г; 0,36 моль) с перемешиванием при rt. Реакционная смесь нагревалась до 60°С в течение 11 ч, затем была охлаждена до rt, профильтрована и сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества белого цвета (24,54 г; 100%).
[00268] Шаг 3) 5-бромо-2-(4-этоксифенил)тиазол
К раствору 2-(4-этоксифенил) тиазол (1,03 г; 5,00 ммоль) в DCM (30 мл) был добавлен NBS (0,98 г; 5,50 ммоль) и и уксусная кислота (0.3 мл) с перемешиванием при rt в атмосфере N2. Реакционная смесь перемешивалась при 48°С в течение 3 ч, затем была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,34 г; 94%).
[00269] Шаг 4) 1-(2-(4-этоксифенил)тиазол-5-ил)-3,5-диметил пиридин-2(1Н)-один
Смесь Cul (0,038 г; 0,20 ммоль), Cs2CO3 (0,98 г; 3.00 ммоль) и 8-гидроксиквинолин лиганда (0,029 г; 0,20 ммоль) в DMSO (2 мл) перемешивалась при rt в течение 30 мин в атмосфере N2. Затем к реакционной смеси посредством шприца был добавлен раствор 3,5-диметилпиридин-2(1Н)-один (0,30 г; 2,40 ммоль) и 5-бромо-2-(4-этоксифенил)тиазол (0,57 г; 2,00 ммоль) в DMSO (2 мл). Реакционная смесь поддерживалась нагретой до 130°С в течение 12 ч, затем была охлаждена охлаждена до rt и профильтрована. Фильтрат был разведен H2O (10 мл) и экстрактирован посредством CH2Cl2 (20 мл × 3). Комбинированные органические фазы были сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:10) для получения названного химического соединения (0,17 г; 26%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 327 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,44 (t, 3Н, J=7,0 Гц), 2,15 (s, 3Н), 2,21 (s, 3Н), 4,07-4,12 (m, 2Н), 6,95 (d, 2Н, J=8,8 Гц), 7,16 (s, 1Н), 7,36 (s, 1Н), 7,82 (s, 1Н), 7,88 (d, 2H, J=8,8 Гц),
[00270] Пример 7
3-(3-фтор-4-морфолинофенил)-2,6-диметилпиримидин-4(3Н)-один

[00271] Шаг 1)4-(2-фтор-4-нитрофенил)морфолин
К раствору морфолина (12,04 г; 0,14 моль) и Et3N (13.97 г; 0.14 моль) в EtOAc был по каплям в ледяной ванне добавлен 3,4-дифторнитробензол (20,0 г; 0,13 моль). Реакционная смесь была медленного нагрета до rt, перемешивалась при rt в течение суток, и затем профильтрована. Осадок с фильтра был промыт водой, высушен in vacuo для получения 1-го выхода продукта. Органическая фаза была отсепарирована от фильтрата, и водная фаза была промыта EtOAc. Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения 2-го выхода продукта. Твердые вещества 1-го и 2-го выхода продукта объединили для получения названного химического соединения в виде твердого вещества желтого цвета (28,0 г; 99%).
[00272] Шаг 2) 3-фтор-4-морфолиноанилин
К раствору 4-(2-фтор-4-нитрофенил) морфолина (15,0 г; 66 ммоль) в THF (100 мл) был добавлен Pd/C (3,0 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение 12 ч. Смесь была профильтрована через целитовую проклдку, и фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества белого цвета (11,55 г; 89%).
[00273] Шаг 3) метил 3-ацетаминокротонат
К уксусному ангидриду (300 мл, 3,04 моль) был добавлен метил-2-аминокротонат (100 г; 0,87 моль). Смесь перемешивалась при 75°С в течение 3 ч, была охлаждена до rt и сконцентрирована in vacuo. Необработанный продукт был рекристаллизован из EtOH (150 мл) для получения названного химического соединения в виде твердого вещества белого цвета (46 г; 34%).
[00274] Шаг 4) 3-(3-фтор-4-морфолинофенил)-2,6-диметилпиримидин-4(3H)-один
К раствору 3-фтор-4-морфолиноанилина (11,0 г; 56 ммоль) в CH2Cl2 (200 мл) был осторожно по каплям добавлен триметилалюминий (168 мл, 168 ммоль, 1 M в гептане) в атмосфере N2. Смесь перемешивалась при rt в течение 20 мин, затем был добавлен раствор метил 3-ацетаминокротоната (10,57 г; 67 ммоль) в CH2Cl2 (30 мл). Реакционная смесь перемешивалась при rt в течение 5 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2. Комбинированные органические фазы были промыты водой, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был рекристаллизован из EtOAc для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (11,39 г; 67%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 304,2(М+1);
1H-NMR (400 МГц, CDCl3): δ 2,19 (s, 3Н), 2,30 (s, 3Н), 3,09-3,22 (m, 4Н), 3,88 (t, 4Н, J=4,6 Гц), 6,28 (s, 1Н), 6,90-6,94 (m, 2Н), 7,01-7,06 (m, 1Н),
[00275] Пример 8
3-(4-(диэтиламино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один

[00276] Шаг 1) N,N-диэтил-2-фтор-4-нитроанилин
К раствору диэтиламина (2,53 г; 34,59 ммоль) и Et3N (3,82 г; 37,75 ммоль) в EtOAc (40 мл) был по каплям добавлен 3,4-дифторнитробензол (5,00 г; 31,43 ммоль) в течение 30 мин в ледяной ванне. По конец добавления реагирующая смесь была медленно нагрета до rt, и началось выделение твердого вещества.. Смесь была профильтрована. Осадок с фильтра был промыт соответствующим количеством воды и высушен in vacuo для получения 1-го выхода продукта. Фильтрат был экстрактирован посредством EtOAc. Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения 2-го выхода продукта. Твердые вещества 1-го и 2-го выхода продукта объединили для получения названного химического соединения в виде твердого вещества желтого цвета (7,20 г; 99%).
[00277] Шаг 2) N',N'-диэтил-2-фторбензол-1,4-диамин
К раствору N,N-диэтил-2-фтор-4-нитроанилина (4,00 г; 18,84 ммоль) в THF (50 мл) был добавлен Pd/C (1,50 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение 12 ч. Смесь была профильтрована, и фильтра был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества грязно-белого цвета (3,20 г; 93%).
[00278] Шаг 3) 3-(4-(диэтиламино)-3-фторфенил)-2,6-диметилпиримидин-4(3H)-один
К раствору N,N-диэтил-2-фторбензол-1,4-диамина (1,50 г; 8,23 ммоль) в обезвоженном CH2Cl2 (60 мл) был по каплям медленно добавлен триметилалюминий (33 мл, 33 ммоль, 1 M в гептане) в атмосфере N2. По конец добавления смесь перемешивалась при rt в течение 40 мин. К этой смеси был добавлен раствор метил 3-ацетаминокротоната (2,58 г; 16,40 ммоль) в обезвоженном CH2Cl2 (20 мл). Получившаяся реакционная смесь перемешивалась при rt в течение еще 6 ч, затем была резко охлаждена водой. Органическая фаза была промыта насыщенным раствором, высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Необработанный продукт был рекристаллизован из EtOAc для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (1,60 г; 67%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 290,2 (М+1);
1H-NMR (400 МГц, DMSO): δ 1,07 (t, 6U, J=7,04 Гц), 2,08 (s, 3H), 2,19 (s, 3H), 3,22-3,27 (m, 4H), 6,22 (s, 1H), 6,98-7,06 (m, 2H), 7,16-7,20 (m, 1H),
[00279] Пример 9
3-(3-фтор-4-тиоморфолинофенил)-2,6-диметилпиримидин-4(3H)-один

[00280] Шаг 1) 4-(2-фтор-4-нитрофенил)тиоморфолин
К раствору тиоморфолина (3,57 г; 34,56 ммоль) и Et3N (3,50 г; 34,56 ммоль) в EtOAc был по каплям в ледяной ванне добавлен 3,4-дифторнитробензол (5,00 г; 31,43 ммоль) в течение 30 мин. По конец добавления реакционная смесь была медленно нагрета до rt, и началось выделение твердого вещества. Смесь была профильтрована. Осадок с фильтра был промыт соответствующим количеством воды и высушен in vacuo для получения 1-го выхода продукта. Фильтрат был экстрактирован посредством EtOAc. Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения 2-го выхода продукта. Твердые вещества 1-го и 2-го выхода были объединены для получения названного химического соединения в виде твердого вещества желтого цвета (5,50 г; 72%).
[00281] Шаг 2) 3-фтор-4-тиоморфолиноанилин
К раствору 4-(2-фтор-4-нитрофенил) тиоморфолина (4,00 г; 16,51 ммоль) в THF (50 мл) был добавлен Pd/C (1,30 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение 12 h. Смесь была профильтрована, и фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества грязно-белого цвета (3,40 г; 97%).
[00282] Шаг 3) 3-(3-фтор-4-тиоморфолинофенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 3-фтор-4-тиоморфолиноанилина (1,20 г; 5,65 ммоль) в обезвоженном CH2Cl2 (60 мл) был осторожно по каплям добавлен триметилалюминий (28,5 мл, 28,5 ммоль, 1 M в гептане) в защитной атмосфере N2. По конец добавления смесь перемешивалась при rt в течение 40 мин, затем был добавлен раствор метил 3-ацетаминокротоната (2,66 г; 16,92 ммоль) в обезвоженном CH2Cl2 (20 мл). По конец добавления реакционная смесь перемешивалась при rt еще 6 ч, затем была резко охлаждена водой и экстрактирована посредством CH2Cl2.
Комбинированные органические фазы были промыты насыщенным раствором, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,91 г; 67%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 320,2 (М+1);
1Н-NMR (400 МГц, CDCl3): δ 2.07 (s, 3Н), 2.19 (s, 3Н), 2.77 (t, 4Н, J=4.76 Гц), 3.33 (d, 4Н, J=4.12 Гц), 6.23 (s, 1Н), 7.08-7.11 (m, 1Н), 7.16-7.20 (m, 1Н), 7.25-7.29 (m, 1Н).
[00283] Пример 10
3-(4-(1,1-диоксидотиоморфолино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один

[00284] Шаг 1) 4-(2-фтор-4-нитрофенил) 1,1-диоксидотиоморфолин
К взвеси K2CO3 (5,53 г; 40 ммоль) и 1,1-диоксо-тио-морфолингидрохлорида (3,60 г; 21 ммоль) в DMSO (50 мл) был добавлен 3,4-дифторнитробензол (3,18 г; 20 ммоль). Реакция происходила при нагревании до 100°С в течение 12 ч. Смесь была разведена водой (150 мл) и экстрактирована посредством CH2Cl2 (100 мл × 2). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (6,04 г; 70%).
[00285] Шаг 2) 4-(4-амино-2-фторфенил)1,1-диоксидотиоморфолин
К раствору 4-(2-фтор-4-нитрофенил)1,1-диоксидотиоморфолина (4,00 г; 14,58 ммоль) в THF (50 мл) был добавлен Pd/C (1,30 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение 12 ч. Смесь была профильтрована, и фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества грязно-белого цвета (2,40 г; 67%).
[00286] Шаг 3) 3-(4-(1,1-диоксидотиоморфолино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 4-(4-амино-2-фторфенил)1,1-диоксидотиоморфолина (1,20 г; 4,91 ммоль) в обезвоженном CH2Cl2 (100 мл) был осторожно по каплям добавлен триметилалюминий (28,5 мл, 28,5 ммоль, 1 М в гептане) в атмосфере N2. По окончанию добавления смесь перемешивалась при rt в течение 20 мин, затем был добавлен раствор метил 3-ацетаминокротонат (2,32 г; 14,76 ммоль) в обезвоженном CH2Cl2 (30 мл). По окончанию добавления реакционная смесь перемешивалась при rt еще в течение 15 ч, затем последовало резкое охлаждение соответствующим количеством воды и экстракция посредством CH2Cl2. Комбинированные органические фазы были промыты насыщенным раствором, высушены и сконцентрированы in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (0,81 г; 47%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 352,1 (М+1);
1Н-NMR (400 МГц, DMSO-d6): δ 2,07 (s, 3Н), 2,20 (s, 3Н), 3,29 (t, 4Н, J=4,4 Гц), 3,58 (d, 4Н, J=4,4 Гц), 6,23 (s, 1Н), 7,13-7,11 (m, 1Н), 7,26-7,28 (m, 1Н), 7,31-7,35 (m, 1Н),
[00287] Пример 11
3-(3-фтор-4-(пиперидин-1-ил)фенил)-2,6-диметилпиримидин-4(3H)-один

[00288] Шаг 1) 1-(2-фтор-4-нитрофенил)пиперидин
К раствору пиперидина (5,88 г; 69 ммоль) и Et3N (6,98 г; 69 ммоль) в EtOAc (60 мл) был по каплям добавлен 1,2-дифтор-4-нитробензол (10,00 г; 63 ммоль). Смесь перемешивалась при rt в течение суток. Полученная смесь была промыта насыщенным раствором, высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (14.00 г; 99%).
[00289] Шаг 2) 3-фтор-4-(пиперидин-1-ил)анилин
К раствору 1-(2-фтор-4-нитрофенил) пиперидина (14,00 г; 62 ммоль) в THF (80 мл) был добавлен Pd/C (3,00 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была профильтрована, и фильтрат был сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества светло-бурого цвета (11,00 г; 87%).
[00290] Шаг 3) 3-(3-фтор-4-(пиперидин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 3-фтор-4-(пиперидин-1-ил) анилина (10,00 г; 51 ммоль) в обезвоженном CH2Cl2 (100 мл) был добавлен триметилалюминий (155 мл, 155 ммоль, 1,0 М в толуоле) в атмосфере N2. Смесь перемешивалась при rt в течение 20 мин, затем был добавлен раствор метил 3-ацетаминокротонат (9,72 г; 62 ммоль) в обезвоженном CH2Cl2 (20 мл). Реакционная смесь перемешивалась при rt в течение 5 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и извлечена посредством CH2Cl2. Комбинированные органические фазы были промыты насыщенным раствором, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (11.02 г; 71%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 302,2 (M+1);
1H-NMR (400 МГц, CDCl3): δ 1,57-1,63 (m, 2Н), 1,78-1,72 (m, 4Н), 2,18 (s, 3Н), 2,29 (s, 3Н), 3,07-3,01 (m, 2Н), 3,11-3,16 (m, 2Н), 6,28 (s, 1Н), 6,86-6,88 (m, 1Н), 6,89-6,90 (m, 1Н), 7,02-7,06 (m, 1Н),
[00291] Пример 12
3-(3-фтор-4-(4-метилпиперазин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один
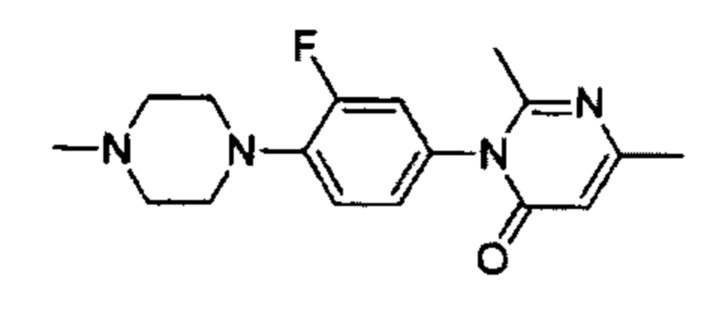
[00292] Шаг 1) 1-(2-фтор-4-нитрофенил)-4-метилпиперазин
К раствору 1-метилпиперазина (6,91 г; 69 ммоль) и Et3N (6,98 г; 69 ммоль) в EtOAc (60 мл) был по каплям с перемешиванием добавлен 1,2-дифтор-4-нитробензол (10,02 г; 63 ммоль) и смесь перемешивалась при rt в течение суток. Реакционная смесь была промыта насыщенным раствором, высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (14.75 г; 98%).
[00293] Шаг 2) 3-фтор-4-(4-метилпиперазин-1-ил)анилин
К раствору 1-(2-фтор-4-нитрофенил)-4-метилпиперазина (14,76 г; 61,70 ммоль) в THF (80 мл) был добавлен Pd/C (3,00 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была профильтрована, и фильтрат был сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества грязно-белого цвета (11,99 г; 93%).
[00294] Шаг 3) 3-(3-фтор-4-(4-метилпиперазин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 3-фтор-4-(4-метилпиперазин-1-ил)анилина (11,01 г; 52,60 моль) в обезвоженном CH2Cl2 (200 мл) был медленно добавлен триметилалюминий (158 мл, 158 ммоль, 1,0 М в толуоле) в атмосфере N2. Смесь перемешивалась при rt в течение 20 мин, затем был добавлен раствор метил 3-ацетаминокротоната (9,92 г; 63,10 ммоль) в обезвоженном CH2Cl2 (20 мл). Реакционная смесь перемешивалась при rt дополнительные 5 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2. Комбинированные органические фазы были промыты насыщенным раствором, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (CH2Cl2/МеОН (V/V)=5:1) для получения названного химического соединения в виде твердого вещества белого цвета (11,31 г; 68%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 317,2(М+1);
1H-NMR (400 МГц, CDCl3): δ 2,19 (s, 3Н), 2,29 (s, 3Н), 2,37 (s, 3Н), 2,61 (s, 4Н), 3,14-3,24 (m, 4Н), 6,28 (s, 1Н), 6,88-6,91 (m, 2Н), 7,05 (t, 1Н, J=8,8 Гц),
[00295] Пример 13
3-(9-фтор-2,3,3а,4-тетрагидро-1Н-бензо[6]пирроло[1,2-d][1,4]оксазин-7-ил)-2,6-диметилпиримидин-4(3Н)-один

[00296] Шаг 1) 9-фтор-7-нитро-2,3,3а,4-тетрагидро-1Н-бензо[b]пирроло[1,2-d[1,4]оксазин
К взвеси пролинола (2,74 г; 27,11 ммоль) и KOH (3,17 г; 56,47 ммоль) в DMSO (30 мл) был добавлен 1,2,3-трифтор-5-нитробензол (4,00 г; 22,59 ммоль) при rt. Реакционная смесь нагревалась до 65°С в течение 4 ч. Смесь была разведена водой (150 мл) и экстрактирована посредством CH2Cl2 (100 мл × 2). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (5,00 г; 93%).
[00297] Шаг 2) 9-фтор-2,3,3а,4-тетрагидро-1H-бензо[6]пирроло[1,2-d][1,4]оксазин-7-амин
К раствору 9-фтор-7-нитро-2,3,3а,4-тетрагидро-1Н-бензо[6]пирроло[1,2-d][1,4]оксазин (4,00 г; 16,79 ммоль) в THF (40 мл) был добавлен Pd/C (1,50 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение 12 ч. Смесь была профильтрована через целитовую проклдку, и фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества грязно-белого цвета (3.00 г; 85%).
[00298] Шаг 3) 3-(9-фтор-2,3,3а,4-тетрагидро-1Н-бензо[b]пирроло[1,2-d][1,4]оксазин-7-ил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 9-фтор-2,3,3а,4-тетрагидро-1H-бензо[b]пирроло[1,2-d][1,4]оксазин-7-амин (200 г; 961 ммоль) в обезвоженном CH2Cl2 (50 мл) был медленно добавлен триметилалюминий (48 мл, 48 ммоль, 1 М в гептане) в атмосфере N2. По окончанию добавления смесь перемешивалась при rt в течение 40 мин, затем был по каплям добавлен раствор метил 3-ацетаминокротоната (2,66 г; 16,92 ммоль) в обезвоженном CH2Cl2 (30 мл).
Реакционная смесь перемешивалась при rt еще 5 ч, затем была резко охлаждена соответствующим количеством воды. Органическая фаза была промыта насыщенным раствором, высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества белого цвета (1,00 г; 33,0%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 316,2 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 1,52-1,56 (m, 1Н), 1,88-1,90 (m, 2Н), 2,10 (s, 3Н), 2,18 (s, 3Н), 2,31 (s, 1Н), 3,12-3,18 (q, 1Н), 3,37-3,40 (m, 2Н), 3,79-3,84 (m, 1Н), 4,35 (d, 1Н, J=9,5 Гц), 6,20 (s, 1Н), 6,71 (s, 1Н), 6,82 (d, 1Н, J=1,7 Гц),
[00299] Пример 14
3-(2-(4-(диэтиламино)фенил)тиазол-5-ил)-2,6-диметилпиримидин-4(3Н)-один

[00300] Шаг 1) 4-(диэтиламино)бензамид
К раствору 4-аминобензамида (6,81 г; 50 ммоль) в DMF (70 мл) были добавлены Nal (22,48 г; 150 ммоль) и K2CO3 (13,82 г; 100 ммоль), затем при перемешивании бромэтан (13,62 г; 125 ммоль). Реакционная смесь нагревалась до 110°С в течение суток, затем был добавлен бромэтан (13,62 г; 125 ммоль). Реакционная смесь дополнительно перемешивалась при 110°С еще 6 ч, затем была охлаждена до rt. DMF был удален in vacuo. К остатку была добавлена вода (100 мл). Смесь перемешивалась в течение 10 мин, была профильтрована, и осадок с фильтра был высушен in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (7,40 г; 77%).
[00301] Шаг 2) 4-(диэтиламино)бензотиоамид
К раствору 4-(диэтиламино)бензамида (5,66 г; 29,43 ммоль) в THF (80 мл) был добавлен P2S5 (9,81 г; 44,14 ммоль) при 50°С в течение 1 ч. Смесь поддерживалась нагретой до 55°С в течение 8 ч, затем охлаждена до rt, профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества желтого цвета (1.23 г; 20%).
[00302] Шаг 3) N,N-диэтил-4-(тиазол-2-ил)анилин
К раствору 4-(диэтиламино)бензотиамида (2,29 г; 11 ммоль) в EtOH (60 мл) были добавлены 2-бромо-1,1-диметоксиэтан (1,86 г; 11 ммоль) и р-толуолсульфонная кислота (1,89 г; 11 ммоль). Реакционная смесь нагревалась до 95°С в течение суток, затем охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc/Et3N (V/V/V)=2:1:0,05) для получения названного химического соединения в виде твердого вещества белого цвета (1.40 г; 55%).
[00303] Шаг 4) N,N-диэтил-4-(5-нитротиазол-2-ил)анилин
К смеси N,N-диэтил-4-(тиазол-2-ил)анилин (1,39 г; 6,00 ммоль) и концентрированной серной кислоты (10 мл) была добавлена концентрированная азотная кислота (0,45 мл) при -10°С. Реакционная смесь перемешивалась при 0°С в течение 3 ч, затем перелит в ледяную ванну и экстрактирована посредством CH2Cl2 (30 мл × 3). Органическая фаза была высушена над Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/CH2Cl2 (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,73 г; 44%).
[00304] Шаг 5) 2-(4-(диэтиламино)фенил)тиазол-5-амин
К раствору N,N-диэтил-4-(5-нитротиазол-2-ил)анилин (0,73 г; 2.64 ммоль) в МеОН (30 мл) был добавлен Pd/C (73 мг). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, затем была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=5:1) для получения названного химического соединения в виде твердого вещества белого цвета (0,45 г; 69%).
[00305] Шаг 6) 3-(2-(4-(диэтиламино)фенил)тиазол-5-ил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-(4-(диэтиламино)фенил)тиазол-5-амин (0,45 г; 1,82 ммоль) в CH2Cl2 (20 мл) был по каплям добавлен триметилалюминий (4,5 мл; 9,0 ммоль, 2 М в толуоле) при rt. Реакционная смесь перемешивалась при rt в течение 1 ч, затем был добавлен раствор метил 3-ацетаминокротонат ((315 мг; 2 ммоль) в обезвоженном CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt в течение 3 дней, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были высушены над Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии для получения названного химического соединения в виде твердого вещества желтого цвета (22 мг; 3%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 355,2 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 0,89 (t, 6 Н, J=12,0 Гц), 2,08 (s, 3Н), 2,23 (s, 3Н), 2,95-3,02 (m, 4Н), 6,33 (s, 1Н), 7,29 (d, 1Н, J=12,0 Гц), 7,72-7,74 (m, 2Н), 7,87 (d, 1Н, J=4,0 Гц), 7,95-7,98 (m, 1Н),
[00306] Пример 15
2,6-диметил-3-(2-(4-морфолинофенил)тиазол-5-ил)пиримидин-4(3Н)-один

[00307] Шаг 1) 4-морфолинобензамид
К раствору 4-аминобензамида (6,81 г; 50 ммоль) в DMF (70 мл) были добавлены Nal (22,48 г; 150 ммоль) и K2CO3 (13,82 г; 100 ммоль). Смесь была нагрета до 140°С и был добавлен 2,2'-дихлордиэтил эфир (14,30 г; 100 ммоль). Реакционная смесь нагревалась до 150°С в течение 5 ч, и была остужена до rt. Смесь была разбвлена водой (100 мл), перемешивалась в течение 10 мин, и была профильтрована. Осадок с фильтра был промыт водой и высушен для получения названного химического соединения в виде твердого вещества желтого цвета (6,60 г; 64%).
[00308] Шаг 2) 4-морфолинобензотиамид
К раствору 4-морфолинобензотиамида (4,91 г; 23,80 ммоль) в THF (70 мл) был добавлен реагент Лоуссона (10,60 г; 26,20 ммоль) при перемешивании. Смесь поддерживалась нагретой до 70°С в течение 4 ч, затем охлаждена до rt и сконцентрирована in vacuo. К осадку были добавлены CH2Cl2 (30 мл) и вода (100 мл). Затем смесь была профильтрована и осадок с фильтра был промыт водой и высушен для получения названного химического соединения в виде твердого вещества желтого цвета (4.41 г; 83.3%).
[00309] Шаг 3) 4-(4-(тиазол-2-ил)фенил)морфолин
К раствору 4-морфолинобензотиамида (2,22 г; 10 ммоль) в EtOH (50 мл) были добавлены 2-бромо-1,1-диметоксиэтан (1,69 г; 10 ммоль) и р>-толуолсульфоновая кислота (1,90 г; 10 ммоль). Реакционная смесь нагревалась до 95°С в течение суток, затем охлаждена до rt и была профильтрована. Осадок с фильтра был высушен для получения названного химического соединения в виде твердого вещества желтого цвета (2,00 г; 81%).
[00310] Шаг 4) 4-(4-(5-нитротиазол-2-ил)фенил)морфолин
К смеси 4-(4-(тиазол-2-ил)фенил)морфолина (2,00 г; 8.13 ммоль) и концентрированной серной кислоты (25 мл) была добавлен концентрированная азотная кислота (0,60 мл) при -10°С. Реакционная смесь перемешивалась при 0°С в течение 4,5 ч, затем была перелита в ледяную ванну, и экстрактирована посредством CH2Cl2 (60 мл × 3). Органическая фаза была высушена над Na2SO4 и сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (0,70 г; 30%).
[00311] Шаг 5) 2-(4-морфолинофенил) тиазол-5-амин
К раствору 4-(4-(5-нитротиазол-2-ил) фенил) морфолина (0.70 г; 2.44 ммоль) в CH2Cl2 (20 мл) был добавлен Pd/C (70 мг). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества грязно-белого цвета (0,20 г; 32%).
[00312] Шаг 6) 2,6-диметил-3-(2-(4-морфолинофенил)тиазол-5-ил)пиримидин-4(3Н)-один
К раствору 2-(4-морфолинофенил)тиазол-5-амина (0,20 г; 0,77 ммоль) в CH2Cl2 (20 мл) был добавлен по каплям триметилалюминий (2,3 мл, 4,6 ммоль, 2 M в толуоле) при rt. Реакционная смесь перемешивалась при rt в течение 1 ч, затем был добавлен раствор метил 3-ацетаминокротоната (132 мг; 0,84 ммоль) в обезвоженном CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt в течение суток, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством подготовительного TLC для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (20 мг; 7%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 369,1 (М+1);
1H-NMR (400 МГц, DMSO-с/6): δ 2,20 (s, 3Н), 2,34 (s, 3Н), 2,62-2,84 (m, 2Н), 3,06-3,10 (s, 2Н), 3,63-3,66 (m, 4Н), 6,32 (s, 1Н), 7,26 (d, 1Н, J=4,2 Гц), 7,32 (d, 2Н, J=3,2 Гц), 7,77 (d, 1Н, J=2,4 Гц), 7,84 (d, 1Н, J=3,6 Гц), 8,02-8,05 (m, 1Н),
[00313] Пример 16
2,6-диметил-3-(3-морфолинофенил)пиримидин-4(3Н)-один

[00314] Шаг 1) трет-бутил(3-нитрофенил)карбамат
К раствору 3-нитроанилин (6,91 г; 50 ммоль) in THF (150 мл) были добавлены при перемешивании BOC2O (13,10 г; 60 ммоль) и DMAP (1,53 г; 12,5 ммоль). Реакционная смесь была подвергнута возгонке с обратным холодильником в течение суток в атмосфере N2, затем охлаждена до rt и сконцентрирована in vacuo. Остаток был разведен в CH2Cl2 (200 мл). Затем раствор был промыт водой (200 мл × 3) и насыщенным раствором (200 мл), высушен над обезвоженным Na2SO4 и сконцентрирован in vacuo. Необработанный продукт был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (10.75 г; 90%).
[00315] Шаг 2) трет-бутил(3-аминофенил)карбамат
К раствору трет-бутил(3-нитрофенил)карбамата (10,75 г; 45,12 ммоль) в МеОН (150 мл) был добавлен катализатор -10% Pd/C (0,48 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (7.59 г; 81%).
[00316] Шаг 3) трет-бутил(3-морфолинофенил)карбамат
К взвеси трет-бутил(3-аминофенил)карбамата (7,59 г; 36,40 ммоль), K2CO3 (10,06 г; 72,80 ммоль) и Nal (16,37 г; 109,20 ммоль) в DMF (300 мл) был медленно добавлен 2,2'-дихлордиэтил эфир (5,73 г; 40,1 ммоль) при 150°С в атмосфере N2. Реакционная смесь перемешивалась при 150°С в течение суток, затем охлаждена до rt, влита в воду (700 мл) и экстрактирована посредством CH2Cl2 (200 мл × 3). Комбинированные органические фазы были промыты водой (200 мл × 3) и brine (200 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества желтого цвета (5.91 г; 58%).
[00317] Шаг 4) 3-морфолиноанилин
Раствор трет-бутил(3-морфолинофенил)карбамата (5,91 г; 21,20 ммоль) в растворе HCl (106 мл, 106,0 ммоль, 1 M в МеОН) перемешивался при rt в течение суток, затем был сконцентрирован in vacuo. Остаток был разведен в воде (100 мл). Щелочные свойства раствора были усилены посредством насыщенного водосодержащего раствора Na2CO3, затем произведена экстракция посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором (150 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения названного химического соединения в виде твердого вещества светло-коричневого цвета (3,42 г; 91%).
[00318] Шаг 5) 2,6-диметил-3-(3-морфолинофенил)пиримидин-4(3Н)-один
К раствору 3-морфолиниланилин (3.42 г; 19.20 ммоль) in CH2Cl2 (100 мл) был осторожно добавлен триметилалюминий (96 мл, 96 ммоль, 1 M в толуоле) в атмосфере N2. Реакционная смесь перемешивалась при rt в течение 30 мин, затем был добавлен раствор метил 3-ацетаминокротоната (3.29 г; 19.20 ммоль) в обезвоженном CH2Cl2 (50 мл). Реакционная смесь перемешивалась при rt в течение суток, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl (200 мл) и экстрактирована посредством CH2Cl2 (200 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором (300 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0.73 г; 13%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 286,3(M+1);
1H-NMR (400 МГц, CDCl3): δ 2,19 (s, 3H), 2,29 (s, 3H), 3,17-3,19 (m, 4H), 3,84 (t, 4H, J=4,8 Гц), 6,28 (s, 1H), 6,66 (d, 2H, J=8,0 Гц), 6,98 (d, 1H, J=9,3 Гц), 7,40 (t, 1H, J=8,2 Гц).
[00319] Пример 17
3-(2-фтор-5-морфолинофенил)-2,6-диметилпиримидин-4(3Н)-один

[00320] Шаг 1) трет-бутил(2-фтор-5-нитрофенил)карбамат
К раствору 2-фтор-5-нитроанилин (4.68 г; 30 ммоль) в THF (150 мл) были добавлены BOC2O (9,82 г; 45 ммоль) и DMAP (7,33 г; 60 ммоль). Реакционная смесь была подвергнута возгонке с обратным холодильником в течение суток в атмосфере N2, затем охлаждена до rt и сконцентрирована in vacuo. Остаток был растворен в EtOAc (250 мл), и органическая фаза была промыта водой (200 мл × 3) и насыщенным раствором (200 мл), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Необработанный продукт был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=8:1) для получения химического соединения в виде твердого вещества желтоватого цвета (3,54 г; 40%).
[00321] Шаг 2) трет-бутил(2-фтор-5-аминофенил)карбамат
К раствору трет-бутил(2-фтор-5-нитрофенил)карбамата (3,54 г; 13.8 ммоль) в МеОН (100 мл) был добавлен катализатор - 10% Pd/C (0,15 г). Реакционная смесь перемешивалась в течение rt в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества желтоватого цвета (2,02 г; 65%).
[00322] Шаг 3) трет-бутил(2-фтор-5-морфолинофенил)карбамат
К смеси трет-бутил(2-фтор-5-аминофенил)карбамат (2,02 г; 8,93 ммоль), K2CO3 (2,47 г; 17,86 ммоль) и Nal (4,02 г; 26,79 ммоль) in DMF (60 мл) был медленно добавлен 2,2'-дихлордиэтил эфир (1,28 г; 8,93 ммоль) при 150°С в атмосфере N2. Реакционная смесь нагревалась до 150°С в течение суток, затем охлаждена до rt, вылита в воду (200 мл) и экстрактирована посредством CH2Cl2 (200 мл × 2). Комбинированные органические фазы были промыты водой (200 мл × 2) и насыщенным раствором (200 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,93 г; 35%).
[00323] Шаг 4) 2-фтор-5-морфолиноанилин
Смесь трет-бутил(2-фтор-5-морфолинофенил) карбамата (0,93 г; 3,14 ммоль) и раствора HCl (31 мл, 31 ммоль, 1 M в МеОН) перемешивалась при rt в течение суток, затем сконцентрирована in vacuo. Остаток был разведен в воде (150 мл). Щелочные свойства раствора были усилены посредством насыщенного водосодержащего раствора Na2CO3, затем произведена экстракция посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором (150 мл), высушены над обезвоженным и сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества светло-желтого цвета (0,35 г; 57%).
[00324] Шаг 5) 3-(2-фтор-5-морфолинофенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-фтор-5-морфолиноанилина (0,35 г; 1,78 ммоль) в CH2Cl2 (20 мл) был добавлен по каплям триметилалюминий (3,3 мл, 6,6 ммоль, 2 M в толуоле). Реакционная смесь перемешивалась при rt в течение 20 мин, затем был добавлен раствор метил 3-ацетаминокротоната (0,30 г; 1,78 ммоль) в обезвоженном CH2Cl2 (10 мл). Реакционная смесь перемешивалась при rt в течение суток, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl (80 мл) и экстрактирована посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором (150 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:2) для получения названного химического соединения в виде твердого вещества желтого цвета (0.37 г; 69%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 304,2 (М+1);
1H-NMR(400 МГц, CDCl3): δ 2,23 (s, 3Н), 2,30 (s, 3Н), 3,11-3,14 (m, 4Н), 3,85 (t, 4Н, J=4,8 Гц), 6,29 (s, 1Н), 6,70-6,71 (m, 1Н), 6,96-7,00 (m, 1Н), 7,18 (t, 1Н, J=9,0 Гц).
[00325] Пример 18
3-(3-фтор-4-(1Н-пиррол-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один
[00326] Шаг 1) 1-(2-фтор-4-нитрофенил)-1Н-пиррол
К раствору 1,2-дифтор-4-нитробензол (1,59 г; 10 ммоль) в DMSO (15 мл) были добавлены при перемешивании K2CO3 (3,04 г; 22 ммоль) и пиррол (0,74 г; 11 ммоль). Реакционная смесь нагревалась до 90°С в течение 18 ч, и была остужена до rt. Смесь была разведена водой (50 мл), профильтрована и осадок с фильтра был высушен для получения названного химического соединения в виде твердого вещества желтого цвета (2.00 г; 97%).
[00327] Шаг 2) 3-фтор-4-(1Н-пиррол-1-ил)анилин
К раствору 1-(2-фтор-4-нитрофенил)-1Н-пиррол (2,00 г; 9,70 ммоль) в CH2Cl2 (35 мл) был добавлен катализатор - Pd/C (0,20 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение 5 ч, и была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/CH2Cl2 (V/V)=3:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,30 г; 76%).
[00328] Шаг 3) 3-(3-фтор-4-(1H-пиррол-1-ил)фенил)-2,6-диметилпиримидин-4(3Н-один
К раствору 3-фтор-4-(1Н-пиррол-1-ил) анилина (0,80 г; 4,55 ммоль) в CH2Cl2 (30 мл) был медленно добавлен триметилалюминий (23 мл, 23 ммоль, 1 М в гептане). Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (785 мг; 5.0 ммоль) в CH2Cl2 (10 мл). Реакционная смесь перемешивалась при rt в течение 3 дней, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:2) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (450 мг; 35%). Спектроскопические данные химического соединения:
MS (ESI, пол, ион) m/z: 284,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,25 (s, 3Н), 2,32 (s, 3Н), 6,32 (s, 1Н), 6,40 (t, 2Н, J=2,2 Гц), 7,08-7,11 (m, 3Н), 7,13 (dd, 1Н, J1=2,2 Гц, J2=10,8 Гц), 7,54 (t, 1U, J=8,4 Гц).
[00329] Пример 19
3-(3-фтор-4-(1Н-пиразол-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00330] Шаг 1) 1-(2-фтор-4-нитрофенил)-1Н-пиразол
К раствору 1,2-дифтор-4-нитробензола (3,18 г; 20 ммоль) в DMSO (35 мл) были добавлены при перемешивании K2CO3 (6,08 г; 44 ммоль) и пиразол (1,50 г; 22 ммоль). Реакционная смесь нагревалась до 90°С в течение 18 ч, и была остужена до rt. Смесь была разведена водой (50 мл) и профильтрована. Фильтрат был экстрактирован посредством DCM (50 мл × 3), комбинированные органические фазы были сконцентрированы in vacuo. Необработанный продукт был очищен посредством силикагельной колоночной хроматографии (РЕ/CH2Cl2 (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (3,31 г; 80%).
[00331] Шаг 2) 3-фтор-4-(1Н-пиразол-1-ил)анилин
К раствору 1-(2-фтор-4-нитрофенил)-1Н-пиразола (3,31 г; 16 ммоль) в CH2Cl2 (60 мл) был добавлен катализатор - Pd/C (0,33 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/CH2Cl2 (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,30 г; 46%).
[00332] Шаг 3) 3-(3-фтор-4-(1Н-пиразол-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 3-фтор-4-(1Н-пиразол-1-ил) анилина (0,65 г; 3,68 ммоль) в CH2Cl2 (30 мл) был медленно добавлен триметилалюминий (18,4 мл, 36,8 ммоль, 2 M в гептане). Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (634 мг; 4,04 ммоль) в CH2Cl2 (10 мл). Реакционная смесь перемешивалась в течение rt в течение 3 дней, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:2) для получения названного химического соединения в виде твердого вещества белого цвета (400 мг; 38%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 285,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,23 (s, 3Н), 2,32 (s, 3Н), 6,32 (s, 1Н), 6,54 (t, 1Н, J=2,0 Гц), 7,13-7,19 (m, 2Н), 7,78 (d, 1H, J=4,0 Гц), 8,08 (t, 1Н, J=2,0 Гц), 8,12-8,16 (m, 1Н).
[00333] Пример 20
3-(3-фтор-4-морфолинофенил)-2-((3-фторфенокси)метил)-6-метилпиримидин-4(3Н)-один

[00334] Шаг 1) метил 3-(2-бромоацетамидо)кротонат
Смесь метил 3-аминокротоната (3,20 г; 27,79 ммоль) и пиридина (2,64 г; 33,33 ммоль) в CH2Cl2 (60 мл) перемешивалась при -20°С в течение 20 мин. К смеси был добавлен по каплям раствор бромоацетил бромида (5,61 г; 27,79 ммоль) в CH2Cl2 (20 мл). Смесь перемешивалась при rt в течение 2 ч. Органическая фаза была промыта насыщенным раствором (100 мл × 3), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=5:1) для получения названного химического соединения в виде твердого вещества красноватого цвета (0,99 г; 15%).
[00335] Шаг 2) метил 3-(2-(3-фторфенокси)ацетамидо)кротонат
К взвеси K2CO3 (0,37 г; 2,68 ммоль) в ацетоне (10 мл) были добавлены 3-фторфенол (0,30 г; 2,68 ммоль) и метил 3-(2-бромоацетамидо)кротонат (0,76 г; 3,22 ммоль), Смесь была подвергнута возгонке с обратным холодильником в течение 5 ч и охлаждена до rt. Смесь была сконцентрирована in vacuo и остаток был разведен в CH2Cl2 (40 мл), промыт насыщенным раствором (40 мл × 3). Органическая фаза была высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде твердого вещества желтоватого цвета (0,50 г; 70%).
[00336] Шаг 3) 3-(3-фтор-4-морфолинофенил)-2-((3-фторфенокси)метил)-6-метил-пиримидин-4(3Н)-один
К раствору 3-фтор-4-морфолиноанилина (0,55 г; 2,80 ммоль) в обезвоженном CH2Cl2 (40 мл) был осторожно добавлен триметилалюминий (2,0 мл, 4 ммоль, 2 M в гептане) в атмосфере N2 при rt. Смесь перемешивалась при rt в течение 30 мин, затем был добавлен раствор метил 3-(2-(3-фторфенокси)ацетамидо)кротоната (0,75 г; 2.80 ммоль) в обезвоженном CH2Cl2 (10 мл). Реакционная смесь перемешивалась еще 7 ч, затем была резко охлаждена соответствующим количеством воды и дважды промыта насыщенным раствором. Органическая фаза была высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Необработанный продукт был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (0.24 г; 62%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 414,3 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,34 (s, 3Н), 3,03-3,14 (m, 4Н), 3,85 (t, 4Н, J=4,8 Гц), 4,67 (s, 2Н), 6,38 (s, 1Н), 6,45-6,49 (m, 1Н), 6,53-6,55 (m, 1Н), 6,64-6,68 (m, 1Н), 6,95-6,98 (m, 3Н), 7,13-7,19 (m, 1Н).
[00337] Пример 21
3-(3-фтор-4-(пирролидин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00338] Шаг 1) 1-(2-фтор-4-нитрофенил)пирролидин
К раствору пирролидина (0,78 г; 11 ммоль) в EtOAc (15 мл) и Et3N (1,52 г; 15 ммоль) был добавлен в ледяной ванне 1,2-дифтор-4-нитробензол (1,59 г; 10 ммоль). Смесь перемешивалась при rt в течение суток и была профильтрована. Осадок с фильтра был промыт водой и высушен для получения названного химического соединения в виде твердого вещества желтого цвета (1,60 г; 76%).
[00339] Шаг 2) 3-фтор-4-(пирролидин-1-ил)анилин
К раствору 1-(2-фтор-4-нитрофенил) пирролидина (1,60 г; 7,62 ммоль) в перемешанных растворах CH2Cl2 (20 мл) и МеОН (20 мл) был добавлен катализатор - Pd/C (0,16 г). Реакционная смесь перемешивалась в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=5:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,20 г; 88%).
[00340] Шаг 3)
3-(3-фтор-4-(пирролидин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 3-фтор-4-(пирролидин-1-ил)анилин (0,50 г; 2,78 ммоль) в CH2C12 (20 мл) был медленно добавлен триметилалюминий (14 мл, 14 ммоль, 1 М в гептане) при rt. Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротонат (480 мг; 3,06 ммоль) в CH2Cl2 (10 мл). Реакционная смесь перемешивалась при rt в течение 3 дней, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (300 мг; 38%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 288,3 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,96-1,99 (m, 4Н), 2,21 (s, 3Н), 2,29 (s, 3Н), 3,43-3,48 (m, 4Н), 6,28 (s, 1Н), 6,71 (t, 1Н, J=8,8 Гц), 6,78-6,84 (m, 2Н).
[00341] Пример 22
3-(4-(ди-n-бутиламино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
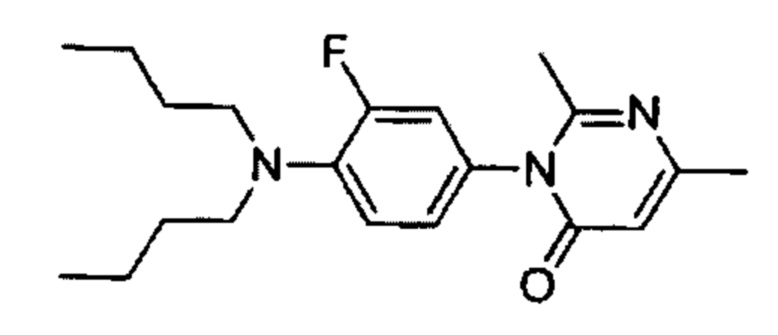
[00342] Шаг 1) N,N-ди-n-бутил-2-фтор-4-нитроанилин
К раствору 3,4-дифторнитробензола (3,18 г; 20 ммоль) в DMSO (25 мл) были добавлены при перемешивании K2CO3 (6,08 г; 44 ммоль) и ди-n-бутиламин (2,84 г; 22 ммоль). Смесь поддерживалась нагретой до 90°С в течение суток, затем охлаждена до rt, разведена водой (100 мл) и экстрактирована посредством CH2Cl2 (80 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/CH2Cl2 (V/V)=10:1) для получения названного химического соединения в виде масла желтого цвета (4,03 г; 75%).
[00343] Шаг 2) N',N'-ди-n-бутил-2-фторбензол-1,4-диамин
К раствору N,N-ди-n-бутил-2-фтор-4-нитроанилина (4,03 г; 15 ммоль) в перемешанных растворах CH2C12 (70 мл) и МеОН (20 мл) был добавлен катализатор - Pd/C (0,40 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/CH2C12 (V/V)=8:1) для получения названного химического соединения в виде бесцветного масла (2,32 г; 65%).
[00344] Шаг 3) 3-(4-(ди-n-бутиламино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору N,N-ди-n-бутил-2-фторбензол-1,4-диамин (1,10 г; 4,62 ммоль) в CH2Cl2 (20 мл) был медленно добавлен триметилалюминий (23 мл, 23 ммоль, 1 M в гептане) при rt. Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (798 мг; 5.08 ммоль) в CFL-Cl2 (10 мл). Реакционная смесь перемешивалась в течение rt в течение 3 дней, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:2) для получения названного химического соединения в виде светло-желтого масла (800 мг; 50%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 346,3 (М+1);
1H-NMR (400 МГц, CDCl3): δ 0,93 (t, 6Н, J=7,4 Гц), 1,26-1,36 (m, 4Н), 1,55 (t, 4Н, J=8,0 Гц), 2,20 (s, 3Н), 2,29 (s, 3Н), 3,21 (t, 4Н, J=7,6 Гц), 6,28 (s, 1Н), 6,80-6,85 (m, 2Н), 6,88-6,93 (m, 1Н).
[00345] Пример 23
3-(4-(диизобутиламино)-3-фторфенил)-2,6-диметилпиримидин-4(3H)-один

[00346] Шаг 1) 2-фтор-N,N-диизобутил-4-нитроанилин
К раствору 3,4-дифторнитробензола (1,59 г; 10 ммоль) в DMSO (15 мл) были добавлены K2CO3 (3,04 г; 22 ммоль) и диизобутиламин (1,42 г; 11 ммоль). Смесь поддерживалась нагретой до 90°С в течение суток, затем охлаждена до rt, разведена водой (50 мл) и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде светло-желтого масла (0,80 г; 30%).
[00347] Шаг 2) 2-фтор-N',N'-диизобутилбензол-1,4-диамин
К раствору 2-фтор-N,N-диизобутил-4-нитроанилина (0,8 г; 3 ммоль) в перемешанных растворах CH2Cl2 (15 мл) и МеОН (15 мл) был добавлен катализатор - Pd/C (80 мг). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=8:1) для получения названного химического соединения в виде светло-желтого масла (0,40 г; 56%).
[00348] Шаг 3) 3-(4-(диизобутиламино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-фтор-N',N'-диизобутилбензол-1,4-диамин (0.40 г; 1.68 ммоль) в CH2Cl2 (20 мл) был медленно добавлен триметилалюминий (8,4 мл; 8,4 ммоль, 1 M в гептане) при rt.
Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (290 мг; 1,85 ммоль) в CH2Cl2 (10 мл). Реакционная смесь перемешивалась при rt в течение 3 дней, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде светло-желтого масла (280 мг; 48%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 346,4 (М+1);
1H-NMR (400 МГц, CDCl3): δ 0,88-0,90 (m, 12Н), 1,87-1,94 (m, 2Н), 2,20 (s, 3Н), 2,29 (s, 3Н), 3,00-3,10 (m, 4Н), 6,28 (s, 1Н), 6,80-6,84 (m, 2Н), 6,95 (t, 1U, J=12,9 Гц).
[00349] Пример 24
3-(4-(ди-n-гексиламино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один

[00350] Шаг 1) 2-фтор-N,N-ди-n-гексил-4-нитроанилин
К раствору 3,4-дифторнитробензола (1,59 г; 10 ммоль) в DMSO (15 мл) были добавлены K2CO3 (3,04 г; 22 ммоль) и ди-w-гексиламин (2,04 г; 11 ммоль). Смесь поддерживалась нагретой до 90°С в течение суток, затем охлаждена до rt, разведена водой (50 мл) и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/CH2Cl2 (V/V)=10:1) для получения названного химического соединения в виде светло-желтого масла (2,79 г; 86%).
[00351] Шаг 2) 2-фтор-N',N'-ди-n-гексилбензол-1,4-диамин
К раствору 2-фтор-N,N-ди-n-гексил-4-нитроанилин (2,79 г; 8,64 ммоль) в МеОН (50 мл) был добавлен катализатор Pd/C (0,28 г).
Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде светло-желтого масла (1,60 г; 63%).
[00352] Шаг 3) 3-(4-(ди-n-гексиламино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-фтор-N',N'-ди-n-гексил бензол-1,4-диамина (0,58 г; 1,97 ммоль) в CH2Cl2 (20 мл) был медленно добавлен триметилалюминий (9,9 мл, 19,8 ммоль, 2 M в гептане) при rt. Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротонат (341 мг; 2,17 ммоль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt в течение 3 дней, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде светло-желтого масла (500 мг; 63%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 402,3 (М+1);
1H-NMR (400 МГц, CDCl3): δ 0,89 (t, 6Н, J=7,0 Гц), 1,31 (t, 12Н, J=7,8 Гц), 1,55 (t, 4Н, J=7,2 Гц), 2,20 (s, 3Н), 2,29 (s, 3Н), 3,18-3,21 (m, 4Н), 6,28 (s, 1Н), 6,79-6,82 (m, 2Н), 6,84-6,92 (m, 1Н),
[00353] Пример 25
2,6-диметил-3-(6-морфолинопиридин-3-ил)пиримидин-4(3Н)-один

[00354] Шаг 1) 4-(5-нитропиридин-2-ил)морфолин
Смесь 2-хлор-5-нитропиридин (3,17 г; 20 ммоль), морфолин (2,00 г; 23 ммоль) и Et3N (2,43 г; 24 ммоль) в EtOAc (200 мл) была подвергнута возгонке с обратным холодильником в течение 3 ч, затем охлаждена до rt, и промыта водой (100 мл × 3). Органическая фаза была высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (3,89 г; 93%).
[00355] Шаг 2) 6-морфолинопиридин-3-амин
К раствору 4-(5-нитропиридин-2-ил) морфолин (3,89 г; 18,60 ммоль) в THF (100 мл) был добавлен катализатор Pd/C (0,5 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, и была профильтрована. Фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества красно-коричневого цвета (3,30 г; 99%).
[00356] Шаг 3) 2,6-диметил-3-(6-морфолинопиридин-3-ил)пиримидин-4(3Н)-один
К раствору 6-морфолинопиридин-3-амина (1,79 г; 10 ммоль) в CH2Cl2 (100 мл) был осторожно добавлен триметилалюминий (40 мл, 40 ммоль, 1 M в гептане) в атмосфере N2. Смесь перемешивалась при rt в течение 30 мин, затем был добавлен раствор метил 3-ацетаминокротонат (1,89 г; 12 ммоль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt в течение 6 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl (100 мл). Органическая фаза была высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен рекристаллизацией из EtOAc для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (1,11 г; 39%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 287,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,22 (s, 3Н), 2,30 (s, 3Н), 3,54-3,60 (m, 4Н), 3,83 (t, 4Н, J=4,9 Гц), 6,29 (s, 1Н), 6,74 (d, 1Н, J=8,8 Гц), 7,33 (dd, 1Н, J1=2,1 Гц, J2=8,8 Гц), 8,00 (d, 1Н, 7=2,6 Гц).
[00357] Пример 26
3-(3-фтор-4-(4-гидроксипиперидин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00358] Шаг 1) 1-(2-фтор-4-нитрофенил)пиперидин-4-ол
К раствору пиперидин-4-ол (11,11 г; 0,11 моль) и EtaN (12.14 г; 0.12 моль) в EtOAc (500 мл) был добавлен 1,2-дифтор-4-нитробензол (15,91 г; 0,10 моль). Смесь перемешивалась при rt в течение 24 ч, и была промыта водой (200 мл × 4). Органическая фаза была высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo для получения названного химического соединения в виде оранжевого масла (19,35 г; 80%).
[00359] Шаг 2) 1-(4-амино-2-фторфенил)пиперидин-4-ол
К раствору 1-(2-фтор-4-нитрофенил) пиперидин-4-ол (2,67 г; 11 ммоль) в МеОН (100 мл) был добавлен катализатор Pd/C (1,00 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение 6 ч, затем была профильтрована. Фильтрат был сконцентрирован in vacuo для получения необработанного продукта (2,50 г) для следующего шага без дальнейшей очистки.
[00360] Шаг 3) 3-(3-фтор-4-(4-гидроксипиперидин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 1-(4-амино-2-фторфенил)пиперидин-4-ол (1,68 г; 8,00 ммоль) in CH2Cl2 (20 мл) был осторожно добавлен триметилалюминий (32 мл, 64 ммоль, 2 M в гептане) в атмосфере N2. Смесь перемешивалась при rt в течение 30 мин, затем был добавлен раствор метил 3-ацетаминокротоната (1,40 г; 8,90 моль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt еще 5 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl (100 мл). Органическая фаза была высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен рекристаллизацией из EtOAc для получения названного химического соединения в виде твердого вещества желтого цвета (1,25 г; 50%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 318,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,74-1,77 (m, 2Н), 2,02-2,05 (m, 2Н), 2,18 (s, 3Н), 2,29 (s, 3Н), 2,85-2,99 (m, 2Н), 3,36-3,48 (m, 2Н), 3,84-3,92 (m, 1Н), 6,28 (s, 1Н), 6,90 (d, 1Н, J=1,2 Гц), 7,05 (t, 1Н, J=0,8 Гц).
[00361] Пример 27
3-(3-фтор-4-((2-морфолиноэтил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00362] Шаг 1) 2-морфолиноацетонитрил
К взвеси K2CO3 (6,50 г; 47 ммоль) и морфолина (3,75 г; 43 ммоль) в ацетонитриле (30 мл) был добавлен одной порцией 2-бромоацетонитрил (5,16 г; 43 ммоль) в защитной атмосфере N2 в ледяной ванне. Смесь перемешивалась при rt в течение 2 ч, зтем была профильтрована. Фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (5,41 г; 100%).
[00363] Шаг 2) 2-морфолиноэтанамин
К обезвоженному THF (35 мл) был добавлен одной порцией LiAlH4 (3.19 г; 84 ммоль) в ледяной ванне. Смесь перемешивалась при 0°С в течение 20 мин, и по каплям был добавлен раствор 2-морфолиноацетонитрила (3,50 г; 28 ммоль) в обезвоженном THF (10 мл). По окончанию добавления смесь была подвергнута возгонке с обратным холодильником в течение 3 ч, затем охлаждена до rt, разведена водой (20 мл), профильтрована и сконцентрирована in vacuo для получения названного химического соединения в виде масла желтого цвета (2,62 г; 72%).
[00364] Шаг 3) 2-фтор-N-(2-морфолиноэтил)-4-нитроанилин
Раствор 2-морфолиноэанамин (0,90 г; 6,91 ммоль), 1,2-дифтор-4-нитробензол (1,10 г; 6,91 ммоль) и Et3N (1,40 г; 13,82 ммоль) в EtOAc (10 мл) был подвергнута возгонке с обратным холодильником в атмосфере N2 в течение 24 ч, затем охлажден до rt и сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде масла желтого цвета (1,57 г; 84%).
[00365] Шаг 4) 2-фтор-N'-(2-морфолиноэтил)бензол-1,4-диамин
К раствору 2-фтор-N-(2-морфолиноэтил)-4-нитроанилин (0,60 г; 2.23 ммоль) в THF (8,0 мл) был добавлен катализатор Pd/C (0,03 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, затем была профильтрована. Фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде масла желтого цвета (0,50 г; 94%).
[00366] Шаг 5) 3-(3-фтор-4-((2-морфолиноэтил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-фтор-N'-(2-морфолиноэтил)бензол-1,4-диамин (0.50 г; 2.09 ммоль) в CH2Cl2 (20 мл) был медленно добавлен триметилалюминий (3,2 мл, 6,40 ммоль, 2 M в толуоле) при rt. Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (0,65 г; 4,13 ммоль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt в течение 36 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (100 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc/МеОН (V/V)=30: 1) для получения названного химического соединения в виде твердого вещества белого цвета (0,50 г; 24%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 347,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,08 (s, 3Н), 2,18 (m, 3Н), 2,43 (s, 4Н), 2,57 (s, 2Н), 3,25 (m, 2Н), 3,58 (t, 4Н, J=4,32 Гц), 5,52 (s, 1Н), 6,20 (s, 1Н), 6,79-6,83 (m, 1Н), 6,91-6,93 (m, 1Н), 7,08-7,12 (m, 1Н).
[00367] Пример 28
3-(3-фтор-4-(метил(2-морфолиноэтил)амино)фенил)-2,6-диметилпирими дин-4(3Н)-один

К взвеси 3-(3-фтор-4-((2-морфолиноэтил)амино)фенил)-2,6-диметилпиримидин-4(3H)-один (0,24 г; 0,69 ммоль) и K2CO3 (0,48 г; 3,47 ммоль) в ацетонитриле (15 мл) был добавлен CH3I (0,30 г; 2,11 ммоль). Смесь перемешивалась при rt в течение 36 ч, затем была профильтрована и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc/МеОН (V/V)=50:1) для получения названного химического соединения в виде твердого вещества белого цвета (50 мг; 20%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 361,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,26 (s, 3Н), 2,16 (s, 3Н), 2,26 (s, 3Н), 2,62 (m, 4Н), 3,48 (m, 2Н), 3,69-3,74 (m, 2Н), 4,00 (m, 4Н), 6,17 (s, 1Н), 6,755-6,84 (m, 2Н), 7,03 (m, 1Н).
[00368] Пример 29
3-(2-хлор-4-((2-морфолиноэтил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00369] Шаг 1) 3-хлор-N-(2-морфолиноэтил)-4-нитроанилин
Взвесь 2-морфолиноэтанамин (5,34 г; 41 ммоль), 2,4-дихлор-1-нитробензол (7,87 г; 41 ммоль) и CS2CO3 (26,73 г; 82 ммоль) в ацетонитрил (100 мл) была подвергнута возгонке с обратным холодильником в течение 6 ч в атмосфере N2, затем охлаждена до rt, профильтрована и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества желтого цвета (5,90 г; 50%).
[00370] Шаг 2) 3-хлор-N'-(2-морфолиноэтил)бензол-1,4-диамин
К раствору 3-хлор-N-(2-морфолиноэтил)-4-нитроанилин (3.50 г; 12.25 ммоль) в EtOAc (60 мл) был добавлен катализатор Pd/C (0,73 г). Реакционная смесь перемешивалась в течение rt в атмосфере Н2 в течение суток, затем была профильтрована. Фильтрат был сконцентрирован in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки.
[00371] Шаг 3) 3-(3-фтор-4-((2-морфолиноэтил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 3-хлор-N'-(2-морфолиноэтил)бензол-1,4-диамин (0,70 г; 1,93 ммоль) в CH2Cl2 (20 мл) был медленно добавлен триметилалюминий (6,8 мл, 13,6 ммоль, 2 M в толуоле) при rt. Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротонат (0,43 г; 2,74 ммоль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt еще 72 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc/МеОН (V/V)=30:1) для получения названного химического соединения в виде твердого вещества желтоватого цвета (0,33 г; 47%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 363,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,17 (s, 3Н), 2,33 (s, 3Н), 2,42-2,43 (m, 4Н), 2,50-2,64 (m, 2Н), 3,09-3,13 (m, 2Н), 3,59-3,63 (m, 4Н), 4,55-4,57 (t, 1Н), 6,32 (s, 1Н), 6,76-6,81 (m, 1Н), 6,80-6,81 (m, 1Н), 6,89-6,91 (m, 1Н).
[00372] Пример 30
3-(3-фтор-4-((3-морфолинопропил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00373] Шаг 1)4-(3-хлорпропил)морфолин
К взвеси 1-бромо-3-хлорпропана (0,79 г; 5,00 ммоль) и K2CO3 (1,38 г; 10,00 ммоль) в EtOAc (20 мл) был по каплям добавлен раствор морфолина (0,44 г; 5,05 ммоль) в EtOAc (20 мл) при rt в атмосфере N2. Смесь перемешивалась при rt в течение суток, затем была профильтрована и сконцентрирована in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки.
[00374] Шаг 2) 2-фтор-N-(3-морфолинопропил)-4-нитроанилин
К взвеси 4-(3-хлорпропил) морфолина (1,64 г; 10 ммоль) и K2CO3 (4,14 г; 30 ммоль) в ацетонитриле (20 мл) был по каплям добавлен 2-фтор-4-нитроанилин (1,56 г; 10 ммоль). Смесь перемешивалась при rt в течение 24 ч, затем была профильтрована и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде масла желтого цвета (1,78 г; 63%).
[00375] Шаг 3) 2-фтор-N'-(3-морфолинопропил)бензол-1,4-диамин
К раствору 2-фтор-N-(3-морфолинопропил)-4-нитроанилина (1,78 г; 6,28 ммоль) в перемешанных растворах EtOAc (15 мл) и МеОН (15 мл) был добавлен катализатор Pd/C (0,30 г). Реакционная смесь перемешивалась в течение rt в атмосфере Н2 в течение 2 ч, затем была профильтрована. Фильтрат был сконцентрирован in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки.
[00376] Шаг 4) 3-(3-фтор-4-((3-морфолинопропил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-фтор-N'-(3-морфолинопропил)бензол-1,4-диамина (1,60 г; 6,23 ммоль) в CH2Cl2 (30 мл) был медленно добавлен триметилалюминий (22 мл, 44 ммоль, 2 M в толуоле) при rt. Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (1,98 г; 12,59 ммоль) в CH2Cl2 (10 мл). Реакционная смесь перемешивалась в течение rt в течение суток, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,60 г; 27%).
Спектроскопические данные химического соединения: MS (ESI, пол. ион) m/z: 361,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,85-1,88 (m, 2Н), 2,21 (s, 3Н), 2,29 (s, 3Н), 2,49 (m, 4Н), 2,53-2,56 (t, 2Н), 3,20-3,31 (m, 2Н), 3,75-3,77 (t, 4Н), 6,28 (s, 1Н), 6,70-6,74 (t, 1Н), 6,81-6,84 (m, 2Н).
[00377] Пример 31
3-(3-фтор-4-((4-морфолинобутил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00378] Шаг 1) 4-морфолинобутаннитрил
К взвеси K2CO3 (8,28 г; 60 ммоль) и морфолина (4,35 г; 50 ммоль) в ацетонитриле (50 мл) был по каплям добавлен 4-бромобутиронитрил (7,40 г; 50 ммоль) при rt в атмосфере N2. Смесь перемешивалась при rt в течение 6 ч, была профильтрована и сконцентрирована in vacuo для получения названного химического соединения (7,26 г; 94,2%).
[00379] Шаг 2) 4-морфолинобутан-1-амин
К обезвоженному THF (70 мл) был добавлен одной порцией LiAlH4; (5,37 г; 142 ммоль)n. Смесь перемешивалась при 0°С в течение 20 мин, и по каплям был добавлен раствор 4-морфолинобутаннитрила (7,26 г; 47 ммоль) в обезвоженном THF (40 мл). По окончанию добавления смесь была подвергнута возгонке с обратным холодильником в течение 4 ч, затем охлаждена до 0°С, разведена водой (20 мл) и профильтрована. Фильтрат был сконцентрирован in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки.
[00380] Шаг 3) 2-фтор-N-(4-морфолинобутил)-4-нитроанилин
Взвесь 4-морфолинобутан-1-амин (0,63 г; 4,00 ммоль), 1,2-дифтор-4-нитробензол (0,64 г; 4,00 ммоль) и K2CO3 (1,10 г; 8,00 ммоль) в ацетонитриле (20 мл) перемешивалась при rt в течение 19 ч в атмосфере N2, затем была профильтрована. Фильтрат был сконцентрирован in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки.
[00381] Шаг 4) 2-фтор-N'-(4-морфолинобутил)бензол-1,4-диамин
К раствору 2-фтор-N-(4-морфолинобутил)-4-нитроанилин (1,19 г; 4,00 ммоль) в перемешанных растворах EtOAc (20 мл) и МеОН (20 мл) был добавлен катализатор Pd/C (0,30 г). Реакционная смесь перемешивалась в течение rt в атмосфере Н2 в течение 2 ч, затем была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc/МеОН (V/V)=10:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,07 г; 100%).
[00382] Шаг 5) 3-(3-фтор-4-((4-морфолинобутил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-фтор-N'-(4-морфолинобутил)бензол-1,4-диамин (1,07 г; 4,00 ммоль) в CH2Cl2 (30 мл) был медленно добавлен триметилалюминий (14 мл, 28 ммоль, 2 M в толуоле) при rt. Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (1,30 г; 8,27 ммоль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt в течение суток, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества желтоватого цвета (0,26 г; 17%). Спектроскопические данные химического соединения:
MS (ESI, пол, ион) m/z: 375,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,63-1,74 (m, 4Н), 2,20 (s, 3Н), 2,29 (s, 3Н), 2,39-2,43 (t, 2Н), 2,47 (t, 4Н), 3,19-3,22 (m, 2Н), 3,73-3,75 (t, 4Н), 6,28 (s, 1Н), 6,72-6,76 (t, 1Н), 6,81-6,83 (d, 2Н).
[00383] Пример 32
3-(4-(бис(2-пропоксиэтил)амино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
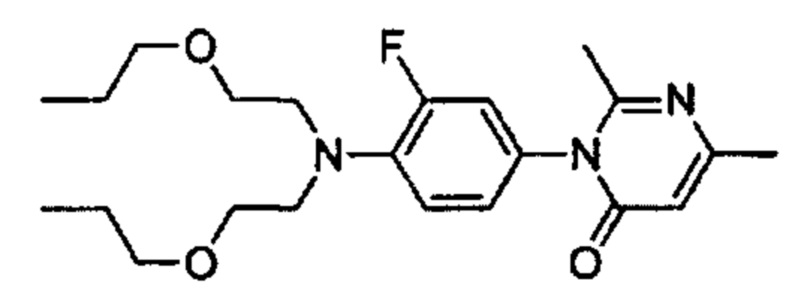
[00384] Шаг 1) трет-бутил бис(2-гидроксиэтил)карбамат
К раствору 2,2'-азанедиилдиэтанола (4,21 г; 40 ммоль) в ацетонитриле (50 мл) был добавлен раствор BOC2O (9,60 г; 44 ммоль) в ацетонитриле (50 мл) в атмосфере N2. Реакционная смесь перемешивалась при rt в течение 3,5 ч, и сконцентрирована in vacuo для получения названного химического соединения в виде бесцветного масла (8,20 г; 100%).
[00385] Шаг 2) трет-бутил бис(2-пропоксиэтил)карбамат
К раствору трет-бутил бис(2-гидроксиэтил)карбамата (8,20 г; 40 ммоль) в гексане (30 мл) был добавлен раствор NaOH (8,00 г; 200 ммоль) в воде (30 мл), 1-бромопропан (9,84 г; 80 ммоль) и ТВАВ (1,00 г) в атмосфере N2. Реакционная смесь была подвергнута возгонке с обратным холодильником в течение суток, затем охлаждена до rt и влиа в CH2Cl2 (100 мл). Органическая фаза была промыта водой (100 мл × 3), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде бесцветного масла (1,78 г; 15%).
[00386] Шаг 3) бис(2-пропоксиэтил)амин
К раствору HCl в EtOAc (15 мл, 30 ммоль, 2 М) был добавлен трет-бутил бас(2-пропоксиэтил)карбамат (1,78 г; 6,15 ммоль). Реакционная смесь перемешивалась при rt в течение суток, затем была сконцентрирована in vacuo для получения названного химического соединения в виде бесцветного масла (1,16 г; 100%).
[00387] Шаг 4) 2-фтор-4-нитро-N,N-бис(2-пропоксиетил)анилин
К раствору 1,2-дифтор-4-нитробензола (2,94 г; 18,45 ммоль) в DMF (30 мл) были при перемешивании добавлены Et3N (3,11 г; 30,75 ммоль) и бис(2-пропоксиэтил)амин (1,16 г; 6,15 ммоль).
Реакционная смесь нагревалась до 90°С в течение суток, затем охлаждена до rt и была влита в CH2Cl2 (100 мл). Органическая фаза была промыта водой (100 мл × 3), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде масла желтого цвета (1,47 г; 73%).
[00388] Шаг 5) 2-фтор-N',N'-бис(2-пропоксиэтил)бензол-1,4-диамин
К раствору 2-фтор-4-нитро-N,N бис(2-пропоксиэтил) анилин (1,47 г; 4,48 ммоль) в МеОН (50 мл) был добавлен катализатор Pd/C (0,15 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток, затем была профильтрована. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде черноватого масла (0,50 г; 34%).
[00389] Шаг 6) 3-(4-(бис(2-пропоксиэтил)амино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-фтор-N',N'-бис(2-пропоксиэтил)бензол-1,4-диамин (0,50 г; 1,68 ммоль) в CH2Cl2 (10 мл) был медленно добавлен триметилалюминий (3,4 мл, 6,8 ммоль, 2 M в толуоле). Реакционная смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (0,32 г; 2,02 ммоль) в CH2Cl2 (2 мл). Реакционная смесь перемешивалась при rt в течение 72 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде светло-желтого масла (0,53 г; 78%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 406,2 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 0,83 (t, 6Н, J=7,4 Гц), 1,42-1,51 (m, 4Н), 2,38 (t, 3Н, J=4,4 Гц), 2,50-2,51 (m, 3Н), 3,32 (t, 4Н, J=6,5 Гц), 3,50-3,54 (m, 8 Н), 6,53 (s, 1Н), 7,07-7,09 (m, 1Н), 7,15 (t, 1Н, J=9,2 Гц), 7,20-7,24 (m, 1Н).
[00390] Пример 33
3-(3-фтор-4-(гексиламино)фенил)-2,6-диметилпиримидин-4(3H)-один

[00391] Шаг 1) 2-фор-N-гексил-4-нитроанилин
К раствору 3,4-дифторнитробензола (3,18 г; 20 ммоль) в EtOAc (50 мл) были добавлены Et3N (2,43 г; 24 ммоль) и гексан-1-амин (2,02 г; 20 ммоль). Реакционная смесьбыла подвергнута возгонке с обратным холодильником в течение суток, затем охлаждена до rt и сконцентрирована in vacuo для получения названного химического соединения в виде масла желтого цвета (4,37 г; 91%).
[00392] Шаг 2) 2-фтор-N'-гексилбензол-1,4-диамин
К раствору 2-фтор-N-гексил-4-нитроанилина (4,37 г; 18,2 ммоль) в МеОН (50 мл) был добавлен катализатор Pd/C (0,50 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде черноватого масла (3,36 г; 88%).
[00393] Шаг 3) 3-(3-фтор-4-(гексиламино)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-фтор-N'-гексилбензол-1,4-диамина (3,36 г; 16 ммоль) в CH2Cl2 (20 мл) был медленно добавлен триметилалюминий (40 мл, 80 ммоль, 2 М в толуоле). Смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (3,02 г; 19,2 ммоль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась при rt в течение 72 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (150 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде светло-желтого масла (1,57 г; 31%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 318,2 (М+1);
1H-NMR (400 МГц, MeOD): δ 0,92 (t, 3Н, J=7,0 Гц), 1,17 (t, 1Н, J=7,1 Гц), 1,35-1,37 (m, 4Н), 1,63-1,70 (m, 2Н), 2,45 (s, 3Н), 2,49 (s, 3Н), 3,22 (t, 2H, J=7,2 Гц), 3,30-3,31 (m, 3Н), 3,58-3,63 (m, 1Н), 6,54 (s, 1Н), 6,89 (t, 1Н, J=8,7 Гц), 7,00-7,07 (m, 2Н).
[00394] Пример 34
3-(4-((3-этоксипропил)амино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один

[00395] Шаг 1) N-(3-этоксипропил)-2-фор-4-нитроанилин
К раствору 3,4-дифторнитробензола (6,36 г; 40 ммоль) в EtOAc (60 мл) были добавлены Et3N (12,14 г; 120 ммоль) и 3-этоксипропан-1-амин (4,54 г; 44 ммоль). Реакционная смесь была подвергнута возгонке с обратным холодильником в течение суток, затем охлаждена до rt и сконцентрирована in vacuo для получения названного химического соединения в виде масла желтого цвета (8,68 г; 90%).
[00396] Шаг 2) N'-(3-этоксипропил)-2-фторбензол-1,4-диамин
К раствору N-(3-этоксипропил)-2-фтор-4-нитроанилина (8,68 г; 36 ммоль) в МеОН (50 мл) был добавлен катализатор Pd/C (0,87 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде черноватого масла (5,52 г; 72%).
[00397] Шаг 3) 3-(4-((3-этоксипропил)амино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору N'-(3-этоксипропил)-2-фторбензол-1,4-диамина (5,52 г; 26 ммоль) в CH2Cl2 (40 мл) был медленно добавлен триметилалюминий (52 мл, 104 ммоль, 2 M в толуоле).
Смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (4,87 г; 31 ммоль) в CH2Cl2 (10 мл). Реакционная смесь перемешивалась при rt в течение 72 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (150 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде светло-желтого масла (2,22 г; 27%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 320,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,23 (t, 3Н, J=7,0 Гц), 1,91-1,97 (m, 2Н), 2,20 (s, 3Н), 2,28 (s, 3Н), 3,26-3,33 (m, 2Н), 3,47-3,52 (m, 2Н), 3,55-3,61 (m, 2Н), 4,74 (brs, 1Н), 6,27 (s, 1Н), 6,75 (t, 1Н, J=8,5 Гц), 6,82 (d, 2Н, J=9,3 Гц).
[00398] Пример 35
3-(4-((3-(1Н-имидазол-1-ил)пропил)амино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один

[00399] Шаг 1) 1-(3-хлорпропил)-1Н-имидазол
Обезвоженный THF (25 мл) был охлажден в ледяной ванне. После этого к THF был добавлен одной порцией NaH (1,40 г; 35 ммоль, 60%), смесь перемешивалась при rt в течение 30 мин и была охлаждена в ледяной ванне. Затем по каплям был добавлен раствор 1H-имидазола (2,00 г; 30 ммоль) в обезвоженном THF (6 мл). Реакционная смесь была затем нагрета до rt и перемешивалась при rt в течение 1,5 h. К смеси был добавлен по каплям 1-бромо-3-хлорпропан (4,60 г; 30 ммоль), и перемешивание производилось при rt в течение суток. К полученной смеси был одной порцией добавлен МеОН (5 мл). Полученная смесь была профильтрована и фильтра был концентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (DCM/МеОН (V/V)=30: 1) для получения названного химического соединения в виде светло-желтого масла (3,10 г; 73%).
[00400] Шаг 2) N-(3-(1Н-имидазол-1-ил)пропил)-2-фтор-4-нитроанилин
К раствору 1-(3-хлорпропил)-1Н-имидазола (1,90 г; 13,14 ммоль), карбоната цезия (4,28 г; 13,14 ммоль) и а катализатора KI в DMF (30 мл), охлажденному в ледяной ванне, был одной порцией добавлен 2-фтор-4-нитроанилин (1,38 г; 8,84 ммоль). По окончанию добавления смесь была подвергнута возгонке с обратным холодильником и дополнительно перемешивалась в течение 36 ч. Реакционная смесь была охлаждена до rt и профильтрована. Фильтрат был сконцентрирован in vacuo. К остатку была добавлена вода (50 мл) и полученная смесь была экстрактирована посредством DCM (20 мл × 2). Комбинированные органические слои были промыты насыщенным раствором (20 мл × 2) и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (DCM/МеОН (V/V)=15:1) для получения названного химического соединения в виде масла желтого цвета (2,85 г; 82%).
[00401] Шаг 3) N'-(3-(IН-имидазол-1-ил)пропил)-2-фторбензол-1,4-диамин
К раствору N(3-(1Н-имидазол-1-ил)пропил)-2-фтор-4-нитроанилин (1,20 г; 4,54 ммоль) в THF (20 мл) был добавлен катализатор Pd/C (0,30 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была профильтрована, и фильтрат был сконцентрирована in vacuo для получения названного химического соединения в виде масла желтого цвета (1,00 г; 94%).
[00402] Шаг 4) 3-(4-((3-(7Н-имидазол-1-ил)пропил)амино)-3-фторфенил)-2,6-диметил-пиримидин-4(1Н)- один
К раствору N'-(3-(1Н-имидазол-1-ил)пропил)-2-фторбензол-1,4-диамина (1,00 г; 4,27 ммоль) в CH2Cl2 (30 мл) был медленно добавлен триметилалюминий (16,4 мл, 32,8 ммоль, 2 M в толуоле). Смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (1,00 г; 6.36 ммоль) в CH2Cl2 (8 мл). Реакционная смесь перемешивалась при rt в течение 24 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (DCM/МеОН (V/V)=20:1) для получения названного химического соединения в виде светло-желтого масла (0,22 г; 15%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 342,2 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 2,01 (m, 2Н), 2,07 (s, 3Н), 2,18 (s, 3Н), 3,07 (t, 2Н, J=6,6 Гц), 4,07 (t, 2Н, J=7,0 Гц), 6,19 (s, 1Н), 6,69-6,74 (m, 1Н), 6,89-6,91 (m, 2Н), 7,07-7,11 (m, 1Н), 7,20-7,21 (m, 1Н), 7,65 (s, 1Н).
[00403] Пример 36
3-(3-фтор-4-((2-(пиперидин-1-ил)этил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00404] Шаг 1) 2-фтор-4-нитро-N-(2-(пиперидин-1-ил)этил)анилин
К взвеси 2-(пиперидин-1-ил) этанамина (0,90 г; 7,02 ммоль) и K2CO3 (0,97 г; 7,02 ммоль) в ацетоне (30 мл) был добавлен одной порцией 1,2-дифтор-4-нитробензол (1,11 г; 6,98 ммоль) в ледяной ванне и смесь была подвергнута возгонке с обратным холодильником в течение суток, охлаждена до rt и профильтрована. Фильтрат был сконцентрирован in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки.
[00405] Шаг 2) 2-фтор-N'-(2-(пиперидин-1-ил)этил)бензол-1,4-диамин
К раствору 2-фтор-4-нитро-N-(2-(пиперидин-1-ил)этил)анилин (1,87 г; 7,00 ммоль) в THF (20 мл) был добавлен катализатор Pd/C (0,50 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была профильтрована, и фильтрат был сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (DCM/МеОН (V/V)=15:1) для получения названного химического соединения в виде масла желтого цвета (1,50 г; 90%).
[00406] Шаг 3) 3-(3-фтор-4-((2-(пиперидин-1-ил)этил)амино)фенил)-2,6-диметил-пиримидин-4(3Н)-один
К раствору 2-фтор-N'-(2-(пиперидин-1-ил)этил)бензол-1,4-диамина (1,00 г; 4.21 ммоль) in CH2Cl2 (30 мл) был медленно добавлен триметилалюминий (6,3 мл, 12,6 ммоль, 2 M в толуоле). Смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (1,6 г; 10,18 ммоль) в CH2Cl2 (8 мл). Реакционная смесь перемешивалась при rt в течение 24 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo.
Остаток был очищен посредством силикагельной колоночной хроматографии (DCM/МеОН (V/V)=20:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,07 г; 5%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 345,3 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 1,43 (s, 2Н), 1,57 (s, 4Н), 2,08 (s, 3Н), 2,19 (s, 3Н), 2,45 (m, 4Н), 2,60 (m, 2Н), 3,35 (m, 2Н), 6,20 (s, 1Н), 6,81-6,86 (m, 1Н), 6,92-6,95 (m, 1Н), 7,10-7,13 (m, 1Н).
[00407] Пример 37
3-(4-((3-(1H-тетразол-1-ил)пропил)амино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один

[00408] Шаг 1) 1-(3-хлорпропил)-1N-тетразол
К обезвоженному DMF (25 мл) был добавлен одной порцией NaH (0,70 г; 17,50 ммоль, 60%) в ледяной ванне, и смесь была нагрета до rt и перемешивалась при rt в течение 30 мин. Затем к смеси, охлажденной в ледяной ванне, был по каплям добавлен раствор 1Н-тетразола (1.00 г; 14.28 ммоль) в обезвоженном DMF (6 мл). Реакционная смесь была затем нагрета до rt и перемешивалась в течение 1,5 ч, при добавлении к смеси по каплям 1-бромо-3-хлорпропана (2,35 г; 14,93 ммоль). Реакционная смесь дополнительно перемешивалась при rt в течение суток. МеОН (1 мл) был добавлен одной порцией, и смесь была профильтрована. Фильтрат был концентрирован in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки.
[00409] Шаг 2) N-(3-(1Н-тетразол-1-ил)пропил)-2-фтор-4-нитроанилин
К смеси 1-(3-хлорпропил)-1Н-тетразола (2,10 г; 14,33 ммоль), карбоната цезия (4,66 г; 14,33 ммоль) и а некоторого количества катализатора KI в DMF (30 мл) в ледяной ванне был одной порцией добавлен 2-фтор-4-нитроанилин (1,50 г; 9,61 ммоль). Затем была подвергнута возгонке с обратным холодильником в течение 35 ч, смесь была охлаждена до rt и профильтрована Фильтрат был сконцентрирован in vacuo. К остатку была добавлена вода (50 мл) и полученная смесь была экстрактирована посредством DCM (20 мл × 2).
Комбинированные органические слои были промыты насыщенным раствором (20 мл × 2) и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде масла (0,36 г; 10%).
[00410] Шаг 3) N'-(3-(1Н-тетразол-1-ил)пропил)-2-фторбензол-1,4-диамин
К раствору N-(3-(1Н-тетразол-1-ил)пропил)-2-фтор-4-нитроанилин (0,36 г; 1,35 ммоль) в THF (10 мл) был добавлен катализатор Pd/C (0,12 г). Реакционная смесь перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде красного масла (0,20 г; 63%).
[00411] Шаг 4) 3-(4-((3-(1Н-тетразол-1-ил)пропил)амино)-3-фторфенил)-2,6-диметил-пиримидин-4(3Н)-один
К раствору N'-(3-(1H-имидазол-1-ил)пропил)-2-фторбензол-1,4-диамина (0,20 г; 0,85 ммоль) в CH2Cl2 (20 мл) был медленно добавлен триметилалюминий (1,3 мл, 2,6 ммоль, 2 M в толуоле). Смесь перемешивалась при rt в течение 0,5 ч, затем был добавлен раствор метил 3-ацетаминокротоната (0,20 г; 1,27 ммоль) в CH2Cl2 (5 мл). Реакционная смесь перемешивалась дополнительно при rt в течение 24 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (20 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (20 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,16 г; 55%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 344,1 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 2,08 (s, 3Н), 2,18 (s, 3Н), 2,24 (m, 2Н), 3,18 (t, 2Н, J=6,60 Гц), 4,83 (t, 2Н, J=6,96 Гц), 6,20 (s, 1Н), 6,74-6,78 (m, 1Н), 6,89-6,91 (m, 1Н), 7,08-7,12 (m, 1Н), 8,97 (s, 1Н).
[00412] Пример 38
3-(4-((2-(1Н-индол-2-ил)этил)амино)-3-фторфенил)-2,6-диметилпиримидин-4(3Н)-один
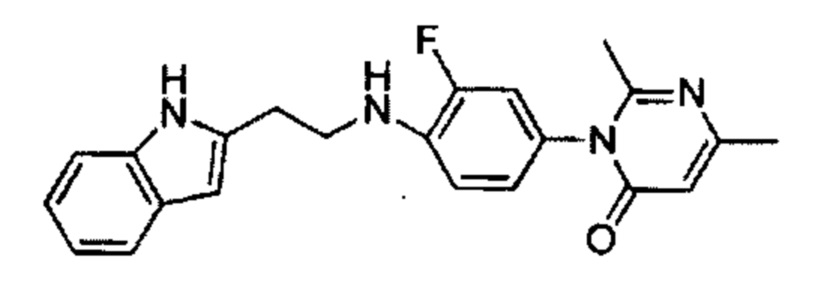
[00413] Шаг 1) N(2-(1Н-индол-2-ил)этил)-2-фтор-4-нитроанилин
К взвеси 1,2-дифтор-4-нитробензола (1,59 г; 10 ммоль) и K2CO3 (6,90 г; 50 ммоль) в DCM (40 мл) был добавлен одной порцией 2-(1Н-индол-2-ил)этанамин (1,96 г; 10 ммоль) в атмосфере N2 и смесь перемешивалась при rt в течение 24 ч. Смесь была затем профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде твердого вещества желтого цвета (2,32 г; 78%).
[00414] Шаг 2) N'-(2-(1Н-индол-2-ил)этил)-2-фторбензол-1,4-диамин
Смесь N-(2-(1H-индол-2-ил)этил)-2-фтор-4-нитроанилин (2,32 г; 7,75 ммоль) и Pd/C (0,60 г) в перемешанных растворах EtOAc (25 мл) и МеОН (25 мл) перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была затем профильтрована, и фильтрат был сконцентрирован in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки.
[00415] Шаг 3) 3-(4-((2-(1Н-индол-2-ил)этил)амино)-3-фторфенил)-2,6-диметил-пиримидин-4(3Н)-один
К раствору N'-(2-(1Н-индол-2-ил)этил)-2-фторбензол-1,4-диамин (2,09 г; 7,76 ммоль) в CH2Cl2 (30 мл) был медленно добавлен триметилалюминий (19,4 мл, 38,8 ммоль, 2 M в толуоле). Смесь перемешивалась при rt в течение 1 ч, затем был добавлен раствор метил 3-ацетаминокротоната (2,44 г; 15,52 ммоль) в CH2Cl2 (10 мл). Реакционная смесь перемешивалась дополнительно при rt в течение 72 ч, затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (50 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,95 г; 33%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 377,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,18 (s, 3Н), 2,28 (s, 3Н), 3,10-3,14 (m, 2Н), 3,48-3,53 (m, 2Н), 4,21-4,22 (m, 1Н), 6,28 (s, 1Н), 6,74-6,81 (m, 3Н), 7,03-7,04 (d, 1Н), 7,11-7,15 (m, 1Н), 7,18-7,23 (m, 1Н), 7,35-7,37 (m, 1Н), 7,60-7,62 (d, 1Н).
[00416] Пример 39
3-(3-фтор-4-(4-(prop-2-yn-1-ил)пиперазин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один
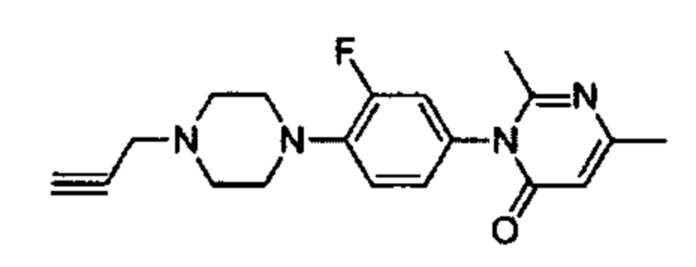
К взвеси 3-(3-фтор-4-(пиперазин-1-ил)фенил)-2,6-диметилпиримидин-4(3Н)-один (0,30 г; 1,00 ммоль) и K2CO3 (0,69 г; 5,00 ммоль) в CH3CN (15 мл) был добавлен 3-бромопроп-1-ин (0,12 г; 1,01 ммоль) и смесь перемешивалась при rt в течение 36 ч. Смесь была затем профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (0,15 г; 44%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 341,3 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,18 (s, 3Н), 2,29 (s, 3Н), 2,29 (s, 1Н), 2,76-2,78 (t, 4Н), 3,17-3,38 (m, 4Н), 3,38 (s, 2Н), 6,28 (s, 1Н), 6,89-6,92 (m, 2Н), 7,03-7,05 (m, 1Н).
[00417] Пример 40
3-(3-хлор-4-(дигексиламино)фенил)-2,6-диметилпиримидин-4(3Н)-один
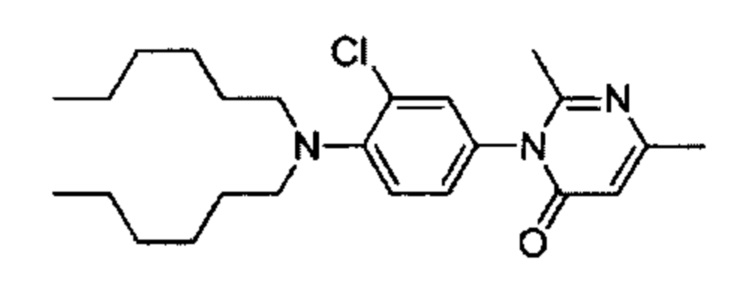
[00418] Шаг 1) 2-хлор-N,N-дигексил-4-нитроанилин
К раствору 2-хлор-4-фтор-1-нитробензол (17,55 г; 0,10 моль) в DMF (100 мл) были добавлены K2CO3 (27,64 г; 0,20 моль) и дигексиламин (18,54 г; 0,10 моль) и смесь перемешивалась при 90°С в течение 72 ч. Смесь была охлаждена до rt и профильтрована. Фильтрат был концентрирован до 50 мл. Полученный раствор был влит в 150 мл DCM и промыт водой (150 мл × 3), насыщенным раствором (150 мл), высушен над обезвоженным Na2SO4 и сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде масла желтого цвета (2364 г; 69%).
[00419] Шаг 2) 2-хлор-N',N'-дигексилбензол-1,4-диамин
Смесь концентрированной соляной кислоты (1,0 мл), воды (50 мл) и порошка железа (5,58 г; 100 ммоль) перемешивалась при 65°С в течение 15 мин. Водосодержащий слой смеси был слит, и раствор 2-хлор-N,N-дигексил-4-нитроанилин (3,41 г; 10 ммоль) в МеОН (100 мл) был добавлен к обработанному ранее порошку железа. Кислотность смеси была доведена до рН 3 соляной кислотой и перемешивание производилось при 65°С в течение 45 мин. Смесь была затем охлаждена до rt, доведена до значения рН 10 посредством Et3N и профильтрована. Фильтрат был концентрирован сконцентрирована in vacuo и остаток был разведен в 150 мл DCM. Раствор был промыт водой (100 мл × 3) и насыщенным раствором (100 мл), высушен над обезвоженным Na2SO4 и сконцентрирован in vacuo для получения названного химического соединения в виде бесцветного масла (3,00 г; 97%).
[00420] Шаг 3) N-(3-хлор-4-(дигексиламино)фенил)-3-оксобутанамид
К раствору 2-хлор-N',N'-дигексилбензол-1,4-диамин (3,11 г; 10 ммоль) в толуоле (50 мл) был добавлен ацетил кетен (1,68 г; 20 ммоль) и смесь перемешивалась при 80°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo для получения названного химического соединения в виде черноватого масла (3,94 г; 100%).
[00421] Шаг 4) (Z)-3-амино-N-(3-хлор-4-(дигексиламино)фенил)бут-2-энамид
Смесь N-(3-хлор-4-(дигексиламино)фенил)-3-оксобутанамид (3,94 г; 10 ммоль), МеОН (50 мл) и аммония (50 мл) перемешивалась при rt в течение суток. Смесь была затем сконцентрирована in vacuo для получения названного химического соединения в виде черного масла (3,94 г; 100%).
[00422] Шаг 5) 3-(3-хлор-4-(дигексиламино)фенил)-2,6-диметилпиримидин-4(3Н)-один
Смесь (Z)-3-амино-N-(3-хлор-4-(дигексиламино)фенил)бут-2-энамид (3,94 г; 10 ммоль) и триэтил ортоацетата (80 мл) перемешивалась при 150°С в течение суток.
Смесь была затем охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде светло-желтого масла (1,36 г; 33%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 418,3 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 0,83-0,89 (m, 6Н), 1,24-1,31 (m, 12Н), 1,46-1,51 (m, 4Н), 2,19 (s, 3Н), 2,29 (s, 3Н), 3,08-3,12 (m, 4Н), 6,28 (s, 1Н), 6,98-7,01 (m, 1Н), 7,14-7,19 (m, 1Н), 7,19 (d, 1Н, J=2,5 Гц).
[00423] Пример 41
3-(3-бромо-4-(дигексиламино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00424] Шаг 1) 2-бромо-4-фтор-1-нитробензол
К смеси 2-фтор-5-нитроанилин (9,45 г; 60,5 ммоль) и CuBR2 (16,22 г; 72,6 ммоль) в CH3CN (200 мл) был по каплям добавлен терт-бутил нитрит (10,8 мл, 90,1 ммоль) и смесь была подвергнута возгонке с обратным холодильником в течение 3,5 ч. Смесь была затем охлаждена до rt и влита в 200 мл EtOAc. Полученная смесь был промыта разведенной соляной кислотой (150 мл × 2, 2 М), водой (150 мл) и насыщенным раствором (150 мл × 2), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00425] Шаг 2) 2-бромо-N,N-дигексил-4-нитроанилин
К раствору 2-бромо-4-фтор-1-нитробензол (13,30 г; 60,5 ммоль) в DMF (100 мл) были добавлены K2CO3 (16,78 г; 121 ммоль) и дигексиламин (11,22 г; 60,5 ммоль), и смесь перемешивалась при 90°С в течение 48 ч. Смесь была охлаждена до rt и профильтрована, и фильтрат был концентрирован до 30 мл. Полученный раствор был влит в 150 мл DCM и промыт водой (150 мл × 3), насыщенным раствором (150 мл), высушен над обезвоженным Na2SO4 и сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде масла желтого цвета (9,28 г; 40%).
[00426] Шаг 3) 2-бромо-N',N'-дигексилбензол-1,4-диамин
Смесь концентрированной соляной кислоты (4,0 мл), воды(100 мл) и порошка железа (13,44 г; 241 ммоль) перемешивалась при 65°С в течение 15 мин. Водосодержащий слой смеси был слит, и раствор 2-бромо-N,N-дигексил-4-нитроанилина (9,28 г; 24,1 ммоль) в МеОН (150 мл) был добавлен обработанному ранее порошку железа. Кислотность смеси была доведена до рН 3 соляной кислотой с перемешиванием при 65°С в течение 30 мин. Смесь была затем охлаждена до rt, доведена до рН 10 посредством Et3N и профильтрована, и фильтрат был концентрирован. Остаток был разведен в 150 мл DCM, и раствор был промыт водой (100 мл × 3) и насыщенным раствором (100 мл), высушен над обезвоженным Na2SO4 и сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=20:1) для получения названного химического соединения в виде бесцветного масла (4,40 г; 51%).
[00427] Шаг 4) N-(3-бромо-4-(дигексиламино)фенил)-3-оксобутанамид
К раствору 2-бромо-N',N'-дигексилбензол-1,4-диамин (4,40 г; 12,4 ммоль) в EtOAc (120 мл) был добавлен ацетил кетен (1,57 г; 18,7 ммоль), и смесь перемешивалась при 80°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде бесцветного масла (5,10 г; 94%).
[00428] Шаг 5) (Z)-3-амино-N-(3-бромо-4-(дигексиламино)фенил)бут-2-энамид
Смесь N-(3-бромо-4-(дигексиламино)фенил)-3-окосбутанамид (5,10 г; 11,6 ммоль), МеОН (60 мл) и аммония (60 мл) перемешивалась при rt в течение суток. Смесь была затем сконцентрирована in vacuo для получения названного химического соединения в виде черного масла (5,10 г; 100%).
[00429] Шаг 6) 3-(3-бромо-4-(дигексиламино)фенил)-2,6-диметилпиримидин-4(3Н)-один
Смесь (Z)-3-амино-N-(3-бромо-4-(дигексиламино)фенил)бут-2-энамид (5,10 г; 11,6 ммоль) и триэтил ортоацетата (100 мл) перемешивалась при 150°С в течение суток. Смесь была затем охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде светло-желтого масла (1,74 г; 33%).
Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 464,3 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 0,81-0,84 (m, 6Н), 1,22-1,25 (m, 12Н), 1,40-1,42 (m, 4Н), 2,01 (s, 3Н), 2,19 (s, 3Н), 3,02-3,07 (m, 4Н), 6,23 (s, 1Н), 7,26-7,33 (m, 2Н), 7,61 (d, 1Н, 7=2,32 Гц).
[00430] Пример 42
2-(дигексиламино)-5-(2,4-диметил-6-оксопиримидин-1(6Н)-ил)бензонитрил

[00431] Шаг 1) 2-циано-N,N-дигексил-4-нитроанилин
К раствору 2-фтор-5-нитробензонитрила (1,83 г; 10,0 ммоль) в CH3CN (20 мл) были добавлены K2CO3 (2,76 г; 20,0 ммоль) и дигексиламин (1,85 г; 9,98 ммоль) и смесь перемешивалась при 80°С в течение 40 ч. Смесь была охлаждена до rt, влита в 100 мл DCM и промыта водой (100 мл × 3), насыщенным раствором (100 мл), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=125: 2) для получения названного химического соединения в виде масла желтого цвета (2,89 г; 87%).
[00432] Шаг 2) 2-циано-N',N'-дигексилбензол-1,4-диамин
Смесь 2-циано-N,N-дигексил-4-нитроанилин (2,89 г; 8,72 ммоль) и Pd/C (0,30 г) в МеОН (30 мл) в атмосфере Н2 перемешивалась при rt в течение суток. Смесь была профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=5:1) для получения названного химического соединения в виде бесцветного масла (1,55 г; 59%).
[00433] Шаг 3) N-(3-циано-4-(дигексиламино)фенил)-3-оксобутанамид
К раствору 2-циано- N',N'-дигексилбензол-1,4-диамин (1,55 г; 5,14 ммоль) в EtOAc (30 мл) был при перемешивании добавлен ацетил кетен (0,52 г; 6,19 ммоль) и смесь перемешивалась при 80°С в течение суток. Смесь была затем охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде масла желтого цвета (1,47 г; 74%).
[00434] Шаг 4) (Z)-3-амино-N-(3-циано-4-(дигексиламино)фенил)бут-2-энамид
Смесь N-(3-циано-4-(дигексиламино)фенил)-3-окосбутанамид (1,47 г; 3,81 ммоль), МеОН (15 мл) и аммония (15 мл) перемешивалась при rt в течение суток. Смесь была сконцентрирована in vacuo для получения названного химического соединения в виде черного масла (1,30 г; 88%).
[00435] Шаг 5) 2-(дигексиламино)-5-(2,4-диметил-6-оксопиримидин-1(6H)-ил)бензонитрил
Смесь (Z)-3-амино-N-(3-циано-4-(дигексиламино)фенил)бут-2-энамид (1,30 г; 3,38 ммоль) и триэтил ортоацетата (30 мл) перемешивалась при 150°С в течение суток. Смесь была затем охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=50:1) для получения названного химического соединения в виде светло-желтого масла (60 мг; 4%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 409,3 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 0,88-0,91 (m, 6Н), 1,26-1,36 (m, 12Н), 1,63-1,67 (m, 4Н), 2,20 (s, 3Н), 2,29 (s, 3Н), 3,43 (t, 4Н, J=7,8 Гц), 6,28 (s, 1Н), 6,90 (d, 1Н, J=9,16 Гц), 7,14 (dd, 1Н, J1=2,68 Гц, J2=9,12 Гц), 7,29 (d, 1Н, J=2,64 Гц).
[00436] Пример 43
3-(4-((2-(адамантан-1-ил)этил)амино)-3-фторфенил)-2,6-диметилпиримидин-4(3H)-один

[00437] Шаг 1) N-(2-(адамантан-1-ил)этил)-2-фтор-4-нитроанилин
К раствору 2-фтор-4-нитроанилина (2,34 г; 15,0 ммоль) в DMF (30 мл) были добавлены K2CO3 (4,2 г; 30,4 ммоль), KI (0,5 г; 3,01 ммоль) и 1-(2-бромоэтил) адамантан (3,65 г; 15,0 ммоль) и Смесь перемешивалась при 140°С в течение 12 ч.
Смесь была затем охлаждена до rt и профильтрована. Фильтрат был разведен 150 мл DCM и промыт водой (50 мл × 3), насыщенным раствором (150 мл), высушен над обезвоженным Na2SO4 и сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=8:1) для получения названного химического соединения в виде твердого вещества желтого цвета (477 мг; 10%).
[00438] Шаг 2) N'-(2-(адамантан-1-ил)этил)-2-фторбензол-1,4-диамин
К смеси воды (50 мл) и порошка железа (0,88 г; 15,8 ммоль) при 65°С была по каплям добавлена концентрированная соляная кислота (1 мл) и смесь перемешивалась в течение 15 мин. Водосодержащий слой смеси был слит, и обработанному ранее порошку железа была добавлена смесь N-(2-(адамантан-1-ил)этил)-2-фтор-4-нитроанилин (0,5 г; 1,57 ммоль) в МеОН (50 мл). Смесь была дополнительно перемешана при 65°С в течение 30 мин. Смесь была затем охлаждена до rt и профильтрована. Фильтрат был концентрирован и остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества белого цвета (382 мг; 84%).
[00439] Шаг 3) N-(4-((2-(адамантан-1-ил)этил)амино)-3-фторфенил)-3-оксобутан амид
К раствору N'-(2-(адамантан-1-ил)этил)-2-фторбензол-1,4-диамин (0,38 г; 1,32 ммоль) в EtOAc (20 мл) был добавлен ацетил кетен (0,22 г; 2,62 ммоль) и смесь перемешивалась при 90°С в течение суток. Смесь была затем охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества белого цвета (317 мг; 64%).
[00440] Шаг 4) (Z)-N-(4-((2-(-адамантан-1-ил)этил)амино)-3-фторфенил)-3-амино бут-2-энамид
Смесь N-(4-((2-(-адамантан-1-ил)этил)амино)-3-фторфенил)-3-окосбутанамида (0,31 г; 0,83 ммоль), МеОН (10 мл) и аммония (10 мл) перемешивалась при rt в течение суток. Смесь была затем сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00441] Шаг 5) 3-(4-((2-(адамантан-1-ил)этил)амино)-3-фторфенил)-2,6-диметил-пиримидин-4(3Н)-один
Смесь (Z)-N-(4-((2-(адамантан-1-ил)этил)амино)-3-фторфенил)-3-аминобут-2-энамид (0,31 г; 0,83 ммоль) и триэтил ортоацетат (20 мл) перемешивалась при 150°С в течение 12 ч. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде твердого вещества красно-коричневого цвета (10 мг; 3%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 396,2 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 1,57 (d, 2Н), 1,58 (m, 6Н), 1,98 (m, 6Н), 2,22 (m, 6Н), 2,28 (s, 3Н), 3,17 (d, 2Н), 3,97 (s, 1Н), 6,28 (s, 1Н), 6,74-6,83 (m, 3Н).
[00442] Пример 44
3-(3-фтор-4-((3-(тетрагидрофуран-2-ил)пропил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00443] Шаг 1) 3-(тетрагидрофуран-2-ил)пропаноидная кисота
Смесь 3-(фуран-2-ил)пропаноидной кислоты (11,0 г; 80,0 ммоль) и Pd/C (1,1 г; 10%) в МеОН (110 мл) перемешивалась при 60°С под давлением 30 бар в среде Н2 в течение суток. Смесь была затем профильтрована и фильтрат сконцентрирован in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00444] Шаг 2) 3-(тетрагидрофуран-2-ил)пропан-1-ол
К раствору 3-(тетрагидрофуран-2-ил)пропаноидной кислоты (11,5 г; 80,0 ммоль) в обезвоженном THF (200 мл) был по каплям добавлен боран (160 мл, 160 ммоль, 1 моль/л в THF) в атмосфере N2 и смесь перемешивалась при rt в течение суток. Реакционная смесь резко охлаждена посредством МеОН и сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00445] Шаг 3) 2-(3-хлорпропил)тетрагидрофуран
К 3-(тетрагидрофуран-2-ил)пропан-1-ол (3,90 г; 30,0 ммоль) был по каплям добавлен дихлорсульфоксид (15 мл) в атмосфере N2 и смесь была подвергнута возгонке с обратным холодильником в течение 3,5 ч. Затем она была охлаждена до rt и сконцентрирована in vacuo. К остатку была добавлена вода (30 мл) и полученная смесь была экстрактирована посредством DCM (30 мл × 4). Комбинированные органические слои были промыты насыщенным раствором (40 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения названного химического соединения в виде желтой жидкости, которая была использована для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00446] Шаг 4) 2-фтор-4-нитро-N-(3-(тетрагидрофуран-2-ил)пропил)анилин
К смеси 2-фтор-4-нитроанилин (7,02 г; 45,0 ммоль), Cs2CO3 (29,3 г; 90,0 ммоль), KI (16,6 г; 100 ммоль) и DMF (100 мл) был по каплям добавлен 2-(3-хлорпропил)тетрагидрофуран (7,43 г; 50,0 ммоль) в атмосфере N2 и смесь перемешивалась при 140°С в течение 48 ч. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. К остатку была добавлена вода (30 мл) и смесь была экстрактирована посредством DCM (30 мл × 4). Комбинированные органические слои были промыты насыщенным раствором (40 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=20:1) для получения названного химического соединения в виде твердого вещества желтого цвета (3,74 г; 31%).
[00447] Шаг 5) 2-фтор-N'-(3-(тетрагидрофуран-2-ил)пропил)бензол-1,4-диамин
Смесь 2-фтор-4-нитро-N-(3-(тетрагидрофуран-2-ил)пропил)анилин (480 мг; 1,79 ммоль), МеОН (40 мл), вода (20 мл), порошок железа (504 мг; 9,03 ммоль) и NH4Cl (193 мг; 3,61 ммоль) перемешивалась при 60°С в течение суток. Смесь была затем охлаждена до rt и был добавлен насыщенный водосодержащий раствор NaHCO3. Полученная смесь была профильтрована, и фильтрат был экстрактирован посредством DCM (30 мл × 4). Комбинированные органические слои были промыты насыщенным раствором (40 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде красной жидкости (260 мг; 61%).
[00448] Шаг 6) N-(3-фтор-4-((3-(тетрагидрофуран-2-ил)пропил)амино)фенил)-3-оксобутан-амид
К раствору 2-фтор-N'-(3-(тетрагидрофуран-2-ил)пропил)бензол-1,4-диамин (260 мг; 1,09 ммоль) в EtOAc (10 мл) был добавлен ацетил кетен (110 мг; 1,31 ммоль) и смесь перемешивалась при 80°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде желтой жидкости (83 мг; 24%).
[00449] Шаг 7) 3-(3-фтор-4-((3-(тетрагидрофуран-2-ил)пропил)амино)фенил)-2,6-диметил-пиримидин-4(3Н)-один
Смесь N-(3-фтор-4-((3-(тетрагидрофуран-2-ил)пропил)амино)фенил)-3-оксобутанамид (250 мг; 0,78 ммоль), ацетамид (92 мг; 1,56 ммоль), титана тетраизопропанолат (1,9 мл) и ксиле (10 мл) перемешивалась при 165°С в течение 24 ч. Смесь была затем охлаждена до rt. К полученному раствору было добавлено 60 мл толуола и 60 мл насыщенного водосодержащего раствора NH4Cl и полученная смесь дополнительно перемешивалась при rt в течение суток. Смесь была затем профильтрована и фильтрат был экстрактирован посредством DCM (15 мл × 3). Комбинированные органические слои были промыты насыщенным раствором (15 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:2) для получения названного химического соединения в виде твердого вещества желтого цвета (80 мг; 29%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 346,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,52-1,43 (m, 2Н), 1,81-1,75 (m, 2Н), 1,94-1,87 (m, 2Н), 2,04-2,09 (m, 2Н), 2,20 (s, 3Н), 2,28 (s, 3Н), 3,23-3,19 (t, 2Н, J=6,6 Гц), 3,76-3,73 (m, 1Н), 3,89-3,83 (m, 2Н), 4,29 (brs, 1Н), 6,27 (s, 1Н), 6,76-6,72 (t, 1Н, J=8,7 Гц), 6,82-6,80 (d, 2Н, 7=9,1 Гц).
[00450] Пример 45
3-(3-хлор-4-((2-метил-1-(нафталин-2-ил)пропан-2-ил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00451] Шаг 1) 2-хлор-N-(2-метил-1-(нафталин-2-ил)пропан-2-ил)-4-нитроанилин
Смесь 2-метил-1-(нафталин-2-ил)пропан-2-амин гидрохлорид (5,9 г; 25,0 ммоль), 3-хлор-4-фтор-1-нитробензол (5,27 г; 30,0 ммоль) и K2CO3 (6,9 г; 50,0 ммоль) в DMSO (50 мл) перемешивалась при 140°С в течение суток. Смесь была охлаждена до rt и влита в 150 мл воды. Смесь была затем экстрактирована посредством EtOAc (50 мл × 3). Комбинированные органические слои были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (PE/DCM (V/V)=10:1) для получения названного химического соединения в виде желтой пены (3,78 г; 43%).
[00452] Шаг 2) 2-хлор-N'-(2-метил-1-(нафталин-2-ил)пропан-2-ил)бензол-1,4-диамин
К смеси воды (50 мл) и порошка железа (3,78 г; 67,7 ммоль) при 65°С была по каплям добавлена концентрированная соляная кислота (1,0 мл) и смесь перемешивалась в течение 15 мин. Водосодержащий слой смеси был слит и а раствор 2-хлор-N-(2-метил-1-(нафталин-2-ил)пропан-2-ил)-4-нитроанилин (2,4 г; 6,76 ммоль) в THF (50 мл) был добавлен к ранее обработанному порошку железа. Смесь была перемешана дополнительно при 65°С в течение 30 мин. Смесь была затем охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=8:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,86 г; 84%).
[00453] Шаг 3) N-(3-хлор-4-((2-метил-1-(нафталин-2-ил)пропан-2-ил)амино)фенил)-3-оксобутанамид
К раствору 2-хлор-N'-(2-метил-1-(нафталин-2-ил)пропан-2-ил)бензол-1,4-диамин (2,0 г; 6,16 ммоль) в EtOAc (30 мл) был добавлен ацетил кетен (1,55 г; 1,84 ммоль) и смесь перемешивалась при 90°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (2,00 г; 79%).
[00454] Шаг 4) (Z)-3-амино-N-(3-хлор-4-((2-метил-1-(нафталин-2-ил)пропан-2-ил)амино)фенил)бут-2-энамид
Смесь N-(3-хлор-4-((2-метил-1-(нафталин-2-ил)пропан-2-ил)амино) фенил)-3-окосбутанамид (2,0 г; 4,89 ммоль), МеОН (15 мл) и аммония(15 мл) перемешивалась при rt в течение суток. Смесь была затем сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00455] Шаг 5) 3-(3-хлор-4-((2-метил-1-(нафталин-2-ил)пропан-2-ил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один
Смесь (Z)-3-амино-N-(3-хлор-4-((2-метил-1-(нафталин-2-ил)пропан-2-ил) амино)фенил)бут-2-энамид (2,0 г; 4.90 ммоль) и триэтил ортоацетат (20 мл) перемешивалась при 150°С в течение 12 ч. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (1,59 г; 76%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 432,3 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,43 (s, 6Н), 2,11 (s, 3Н), 2,19 (s, 3Н), 3,20 (d, 2Н), 4,63 (s, 1Н), 6,23 (s, 1Н), 7,11-7,83 (m, 10 Н).
[00456] Пример 46
3-(3-хлор-4-морфолинофенил)-2,6-диметилпиримидин-4(3H)-один
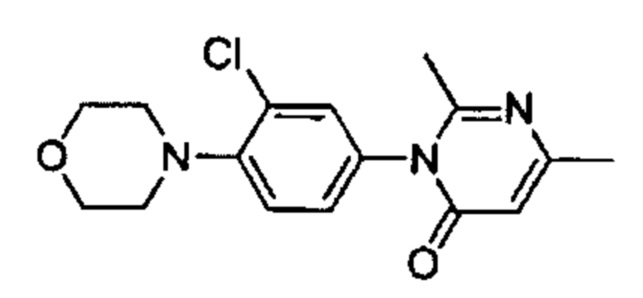
[00457] Шаг 1) 4-(2-хлор-4-нитрофенил)морфолин
К раствору морфолина (1,1 мл, 12,6 ммоль) в DMF (30 мл) при перемешивании были добавлены 2-хлор-1-фтор-4-нитробензол (1,76 г; 10,0 ммоль) и Et3N (4,2 мл, 30,1 ммоль) и смесь перемешивалась при rt в течение суток. Смесь была затем отфильтрована и органическая фаза была влита в 150 мл DCM, промыта водой (150 мл × 3) и насыщенным раствором (150 мл), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo.
Остаток был очищен посредством силикагельной колоночной хроматографии (PE/DCM (V/V)=10:1) для получения названного химического соединения в виде твердого вещества желтого цвета (1,53 г; 63%).
[00458] Шаг 2) 3-хлор-4-морфолиноанилин
К смеси концентрированной соляной кислоты (1,0 мл) и воды (50 мл) был добавлен одной порцией порошок железа (7,55 г; 135 ммоль) и смесь перемешивалась при 65°С в течение 15 мин. Водосодержащий слой смеси был слит и а раствор 4-(2-хлор-4-нитрофенил) морфолина (3,28 г; 13,5 ммоль) в МеОН (50 мл) был добавлен к обработанному ранее порошку железа. Кислотность смеси была доведена до рН 3 посредством соляной кислоты и производилось дополнительное перемешивание при 65°С в течение 45 мин. Смесь была затем охлаждена до rt, доведена до рН 10 посредством Et3N и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был растворен в DCM (150 мл) и и раствор был промыт водой (100 мл × 3) и насыщенным раствором (100 мл), высушен над обезвоженным Na2SO4 и сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества белого цвета (2,05 г; 71%).
[00459] Шаг 3) N-(3-хлор-4-морфолинофенил)-3-оксобутанамид
К раствору 3-хлор-4-морфолиноанилина (2,05 г; 9,64 ммоль) в EtOAc (30 мл) при перемешивании был добавлен ацетил кетен (1,62 г; 19,3 ммоль) и смесь перемешивалась при 80°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (2,59 г; 91%).
[00460] Шаг 4) (Z)-3-амино-N-(3-хлор-4-морфолинофенил)бут-2-энамид
Смесь N-(3-хлор-4-морфолинофенил)-3-оксобутанамида (2,0 г; 6,74 ммоль), МеОН (15 мл) и аммония (15 мл) перемешивалась при rt в течение суток. Смесь была затем сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00461] Шаг 5) 3-(3-хлор-4-морфолинофенил)-2,6-диметилпиримидин-4(3Н)-один
Смесь (Z)-3-амино-N-(3-хлор-4-морфолинофенил)бут-2-энамид (2,0 г; 6,76 ммоль) и триэтил ортоацетата (20 мл) перемешивалась при 150°С в течение 12 ч.
Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (1,63 г; 76%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 320,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,19 (s, 3Н), 2,30 (s, 3Н), 3,06 (m, 4Н), 3,88 (t, 4Н), 6,28 (s, 1Н), 7,07-7,28 (m, 3Н).
[00462] Пример 47
2,6-диметил-3-(4-морфолино-3-(трифторметил)фенил)пиримидин-4(3Н)-один

[00463] Шаг 1) 4-(4-нитро-2-(трифторметил)фенил)морфолин
Смесь 1-фтор-4-нитро-2-(трифторметил)бензола (4,18 г; 20,0 ммоль), морфолина (2,09 г; 24,0 ммоль), Et3N (6,07 г; 60,0 ммоль) и EtOAc (30 мл) перемешивалась при rt в течение 5 ч. Смесь была затем сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (5,0 г; 91%).
[00464] Шаг 2) 3-трифторметил-4-морфолиноанилин
Смесь 4-(4-нитро-2-(трифторметил)фенил)морфолин (5,0 г; 18,1 ммоль), МеОН (20 мл) и Pd/C (500 мг; 10%) в атмосфере Н2 перемешивалась при rt в течение суток. Смесь была затем профильтрована и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (4,01 г; 90%).
[00465] Шаг 3) N-(3-трифторметил-4-морфолинофенил)-3-оксобутанамид
Смесь 3-трифторметил-4-морфолинанилин (4,0 г; 16,2 ммоль), EtOAc (30 мл) и ацетил кетен (2,73 г; 32,5 ммоль) перемешивалась при 90°С в течение суток.
Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (4,0 г; 75%).
[00466] Шаг 4) (Z)-3-амино-N-(3-трифторметил-4-морфолинофенил)бут-2-энамид
Смесь N-трифторметил-4-морфолинофенил)-3-оксобутанамида (4,0 г; 12,1 ммоль), МеОН (20 мл) и аммония (20 мл) перемешивалась при rt в течение суток. Смесь была затем сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00467] Шаг 5) 3-(3-трифторметил-4-морфолинофенил)-2,6-диметилпиримидин-4(3Н)-один
Смесь (Z)-3-амино-N-(3-трифторметил-4-морфолинофенил)бут-2-энамида (4,0 г; 12,1 ммоль) и триэтил ортоацетата(10 мл) перемешивалась при 150°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (3,00 г; 70%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 354,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,05 (s, 3Н), 2,21 (s, 3Н), 2,92 (t, 4Н), 3,72 (m, 4Н), 6,26 (s, 1Н), 7,66-7,77 (m, 3Н).
[00468] Пример 48
3-((6-(2,4-диметил-6-оксопиримидин-1(6Н)-ил)-1Н-индол-1-ил)метокси)бензонитрил

[00469] Шаг 1) 3-((6-нитро-1Н-индол-1-ил)метокси)бензонитрил
К смеси NaH (3,0 г; 75,0 ммоль, 60%) в DMF (20 мл) были добавлены раствор 6-нитро-1Н-индол (4,86 г; 30,0 ммоль) в DMF (10 мл) и раствор 3-гидроксибензонитрила (3,57 г; 30,0 ммоль) в DMF (10 мл) при 0°С и Смесь перемешивалась при rt в течение 2 ч. К реакционной смеси был медленно, в отсутствие света, добавлен раствор дийодметана (7,5 мл, 90,0 ммоль) в DMF (10 мл) и смесь перемешивалась при rt в течение 20 ч. Смесь была затем резко охлаждена водой и профильтрована. Фильтрат был экстрактирован посредством DCM (30 мл × 6) и комбинированные органические слои были промыты насыщенным раствором (50 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (4,47 г; 51%).
[00470] Шаг 2) 3-((6-амино-1Н-индол-1-ил)метокси)бензонитрил
К смеси 3-((6-нитро-1Н-индол-1-ил)метокси)бензонитрил (3,0 г; 10,2 ммоль), THF (80 мл) и воды (40 мл) были добавлены порошок железа (2,86 г; 51,2 ммоль) и NH4Cl (1,09 г; 20,4 ммоль) и смесь перемешивалась при 64°С в течение суток. Смесь была затем охлаждена до rt и к полученной смеси был добавлен водосодержащий насыщенный раствор NaHCO3. Смесь была профильтрована и фильтрат был экстрактирован посредством EtOAc (30 мл × 4). Комбинированные органические слои были промыты насыщенным раствором (40 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества желтого цвета (1,76 г; 65%).
[00471] Шаг 3) N-(1-((3-цианофенокси)метил)-1Н-индол-6-ил)-3-оксобутанамид
К раствору 3-((6-амино-1Н-индол-1-ил)метокси)бензонитрил (2,62 г; 9,95 ммоль) в EtOAc (20 мл) был добавлен ацетил кетен (1,0 г; 11,9 ммоль) и смесь перемешивалась при 80°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (2,70 г; 78%).
[00472] Шаг 4) (Z)-3-амино-N-(1-((3-цианофенокси)метил)-1H-индол-6-ил)бут-2-энамид
Смесь N-(1-((3-цианофепокси)метил)-1H-индол-6-ил)-3-оксобутанамид (1,04 г; 2,99 ммоль), МеОН (20 мл) и аммония (20 мл) перемешивалась при rt в течение суток. Смесь была сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00473] Шаг 5) 3-((6-(2,4-диметил-6-оксопиримидин-1(6Н)-ил)-1Н-индол-1-ил)метокси)бензонитрил
Смесь (Z)-3-амино-N-(1-((3-цианофенокси)метил)-1Н-индол-6-ил)бут-2-энамид (1.04 г; 3.00 ммоль) и триэтил ортоацетата (20 мл) перемешивалась при 130°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (272 мг; 25%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 371,1 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 2,05 (s, 3Н), 2,21 (s, 3Н), 6,25 (s, 1Н), 6,29 (s, 2Н), 6,64-6,63 (d, 1Н, J=3,2 Гц), 7,01-6,99 (dd, 1H, J,=1,4 Гц, J2=8,3 Гц), 7,39-7,37 (m, 1Н), 7,51-7,44 (m, 2Н), 7,63 (s, 1Н), 7,72-7,68 (m, 3Н).
[00474] Пример 49
2-((3,4-дифторфенокси)метил)-3-(3-фтор-4-морфолинофенил)-6-метилпиримидин-4(3Н)-один

[00475] Шаг 1) (Z)-метил 3-(2-(3,4-дифторфенокси)ацетамидо)бут-2-эноат
К взвеси K2CO3 (1,38 г; 10,0 ммоль) в ацетоне (50 мл) были добавлены 3,4-дифторфенол (0,78 г; 6,00 ммоль) и (Z)-метил-3-(2-бромоацетамидо)бут-2-эноат (1,18 г; 5,00 ммоль) и смесь была подвергнута возгонке с обратным холодильником в течение 5 ч. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. К остатку был добавлен DCM (100 мл)
и смесь была промыта водой (100 мл × 2) и насыщенным раствором (100 мл), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=5:1) для получения названного химического соединения в виде твердого вещества белого цвета (0,85 г; 59%).
[00476] Шаг 2) 2-((3,4-дифторфенокси)метил)-3-(3-фтор-4-морфолинофенил)-6-метил-пиримидин-4(3Н)-один
К раствору 3-фтор-4-морфолиноанилина (0,39 г; 2,00 ммоль) в DCM (15 мл) был добавлен триметилалюминий (3,5 мл, 7,0 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 0,5 ч. Был медленно добавлен раствор (Z)-метил-3-(2-(3,4-дифторфенокси)ацетамидо)бут-2-эноат (0,57 г; 2,00 ммоль) в DCM (5 мл) и полученная смесь перемешивалась при rt в течение 12 ч. Смесь была затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (100 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества светло-коричневого цвета (0,50 г; 58%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 432,1 (М+1);
1H-NMR(400 МГц, CDCl3): δ 2,35 (s, 3Н), 3,04-3,17 (m, 4Н), 3,86 (t, 4Н, J=4,7 Гц), 4,65 (s, 2Н), 6,39 (s, 1Н), 6,46-6,51 (m, 1Н), 6,58-6,64 (m, 1Н), 6,95-6,98 (m, 3Н), 7,03 (t, 1Н, J=9,4 Гц).
[00477] Пример 50
2-((3,5-дифторфенокси)метил)-3-(3-фтор-4-морфолинофенил)-6-метилпиримидин-4(3Н)-один

[00478] Шаг 1) (Z)-метил-3-(2-(3,5-дифторфенокси)ацетамидо)бут-2-эноат
К взвеси K2CO3 (1,38 г; 10,0 ммоль) в ацетоне (50 мл) были добавлены 3,5-дифторфенол (0,78 г; 6,00 ммоль) и (Z)-метил-3-(2-бромоацетамидо)бут-2-эноат (1,18 г; 5,00 ммоль) и смесь была подвергнута возгонке с обратным холодильником в течение 5 ч. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. К остатку был добавлен DCM (100 мл) и смесь была промыта водой (100 мл × 2) и насыщенным раствором (100 мл), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=5:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,18 г; 83%).
[00479] Шаг 2) 2-((3,5-дифторфенокси)метил)-3-(3-фтор-4-морфолинофенил)-6-метил-пиримидин-4(3/Н)-один
К раствору 3-фтор-4-морфолиноанилина (0,81 г; 4,13 ммоль) в DCM (15 мл) был добавлен триметилалюминий (6,2 мл, 12,4 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 0,5 ч. Был медленно добавлен раствор (Z)-метил-3-(2-(3,5-дифторфенокси)ацетамидо)бут-2-эноат (1,18 г; 4,14 ммоль) в DCM (5 мл) и полученная смесь перемешивалась при rt в течение 12 ч. Смесь была резко охлаждена водосодержащим насыщенным раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (100 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) to give the title compound as a pale brown solid (1,08 г; 61%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 432,0 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,35 (s, 3Н), 3,05-3,16 (m, 4Н), 3,86 (t, 4Н, J=4,6 Гц), 4,67 (s, 2Н), 6,30-6,33 (m, 2Н), 6,39 (s, 1Н), 6,39-6,45 (m, 1Н), 6,95-6,98 (m, 3Н).
[00480] Пример 51
3-(3-фтор-4-морфолинофенил)-2-(((3-фторфенил)тио)метил)-6-метилпиримидин-4(3Н)-один

[00481] Шаг 1) (Z)-метил 3-(2-(3-фторфенил)тио)ацетамидо)бут-2-эноат
К взвеси K2CO3 (1.38 г; 10.0 ммоль) в ацетоне (50 мл) были добавлены 3-фторбензолтиол (0,77 г; 6,01 ммоль) и (Z)-метил-3-(2-бромоацетамидо)бут-2-эноат (1,18 г; 5,00 ммоль) и смесь была была подвергнута возгонке с обратным холодильником в течение 5 ч. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. К остатку был добавлен DCM (100 мл) и смесь была промыта водой (100 мл × 2) и насыщенным раствором (100 мл), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=5:1) для получения названного химического соединения в виде твердого вещества белого цвета (0,78 г; 55%).
[00482] Шаг 2) 2-(((3-фторфенил)тио)метил)-3-(3-фтор-4-морфолинофенил)-6-метил-пиримидин-4(3Н)-один
К раствору 3-фтор-4-морфолиноанилина (0,54 г; 2,75 ммоль) в DCM (15 мл) был добавлен триметилалюминий (4,8 мл, 9,60 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 0,5 h. Был медленно добавлен раствор (Z)-метил-3-(2-((3-фторфенил)тио)ацетамидо)бут-2-эноат (0,78 г; 2,75 ммоль) в DCM (5 мл) и полученная смесь перемешивалась при rt в течение 12 ч. Смесь была резко охлаждена водосодержащим насыщенным раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (100 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества светло-коричневого цвета (0,79 г; 67%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 430,3 (M+1);
1H-NMR (400 МГц, CDCl3): [d} 2,26 (s, 3H), 3,09-3,21 (m, 4H), 3,81 (s, 2H), 3,89 (t, 4H, J=4,7 Гц), 6,30 (s, 1H), 6,91-7,03 (m, 4H), 7,06-7,10 (m, 2H), 7,20-7,24 (m, 1H).
[00483] Пример 52
3-(3-фтор-4-морфолинофенил)-2-(3-фторфенэтил)-6-метилпиримидин-4(3Н)-один

[00484] Шаг 1) 3-(3-фторфенил)пропаноил хлорид
Смесь 3-(3-фторфенил)пропановой кислоты (2,50 г; 14,9 ммоль) и дихлорсульфана (10 мл) в атмосфере N2 была подвергнута возгонке с обратным холодильником в течение 3 ч. Смесь была охлаждена до rt и сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00485] Шаг 2) (Z)-метил 3-(3-(3-фторфенил)пропанамидо)бут-2-эноат
К раствору (Z)-метил 3-аминобут-2-эноат (1,70 г; 14,8 ммоль) и пиридина (1,30 г; 16,4 ммоль) в DCM (25 мл) по каплям с перемешиванием был добавлен а раствор 3-(3-фторфенил) пропаноил хлорида (2,77 г; 14,8 ммоль) в DCM (5 мл). Под конец добавления смесь была дополнительно перемешана при rt в течение 1 ч. Затем она была промыта насыщенным раствором (50 мл × 3), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:1) для получения названного химического соединения в виде твердого вещества белого цвета (2,00 г; 51%).
[00486] Шаг 3) 3-(3-фтор-4-морфолинофенил)-2-(3-фторфенэтил)-6-метил-пиримидин-4(3Н)-один
К раствору 3-фтор-4-морфолиноанилина (1,10 г; 5,61 ммоль) в DCM (20 мл) был добавлен триметилалюминий (5,7 мл, 11,4 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 0,5 ч. Был медленно добавлен раствор (Z)-метил-3-(3-(3-фторфенил)пропанамидо)бут-2-эноат (1,00 г; 3,77 ммоль) в DCM (8 мл) и полученная смесь перемешивалась при rt в течение 24 ч. Смесь была затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (100 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc) для получения названного химического соединения в виде твердого вещества оранжевого цвета (1,10 г; 71%).
Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 412,3 (М+1);
1Н -NMR (400 МГц, CDCl3): δ 2,25 (s, 3Н), 2,57 (t, 3H, J=7,5 Гц), 2,91 (t, 3H, J=7,8 Гц), 3,02-3,06 (m, 4Н), 3,75 (t, 4Н, J=4,6 Гц), 6,26 (s, 1Н), 6,88-6,91 (m, 2Н), 6,96-7,01 (m, 1Н), 7,04-7,06 (m, 1Н), 7,10-7,14 (m, 1Н), 7,17-7,21 (m, 1Н), 7,24-7,29 (m, 1Н).
[00487] Пример 53
3-(3-фтор-4-морфолинофенил)-2-(3-(3-фторфенокси)пропил)-6-метилпиримидин-4(3Н)-один

[00488] Шаг 1) этил 4-(3-фторфенокси)бутаноат
Смесь 3-фторфенол (6,00 г; 53,5 ммоль), этил 4-бромобутаноат (15,70 г; 80,5 ммоль) и CS2CO3 (26,20 г; 80,4 ммоль) в DMF (25 мл) в атмосфере N2 была подвергнута возгонке с обратным холодильником в течение суток. Смесь была затем охлаждена до rt и было добавлено 150 мл воды. Полученная смесь бвла экстрактирована посредством DCM (100 мл × 2) и комбинированные органические фазы были промыты насыщенным раствором (100 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде бесцветного масла (12,0 г; 99%).
[00489] Шаг 2) 4-(3-фторфенокси)бутановая кислота
К раствору KOH (0.24 г; 4.28 ммоль) в смешанных растворах воды (3 мл) и эанола (3 мл) в атмосфере N2 был добавлен одной порцией этил 4-(3-фторфенокси)бутаноат (0,30 г; 1,33 ммоль) и смесь перемешивалась при 40°С в течение 4 ч. Она была затем охлаждена до rt и было добавлено 20 мл DCM. Органический слой был промыт насыщенным раствором (20 мл × 2), высушен над обезвоженным Na2SO4 и сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества белого цвета (0..25 г; 96%).
[00490] Шаг 3) 4-(3-фторфенокси)бутаноил хлорид
Раствор 4-(3-фторфенокси) бутановой кислоты (3,00 г; 15,1 ммоль) в дихлорсульфане (15 мл) в атмосфере N2 был подвергнута возгонке с обратным холодильником в течение 3 ч. Смесь была охлаждена до rt и сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00491] Шаг 4) (Z)-метил 3-(4-(3-фторфенокси)бутанамидо)бут-2-эноат
К раствору (Z)-метил-3-аминобут-2-эноат (1,70 г; 14,8 ммоль) и пиридина (1,20 г; 15,2 ммоль) в DCM (25 мл) при помешивании был добавлен раствор 4-(3-фторфенокси)бутапоил хлорида (3,28 г; 15,1 ммоль) в DCM (5 мл) и смесь перемешивалась в течение 1 ч. Затем она была промыта насыщенным раствором (50 мл × 3), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,20 г; 28%).
[00492] Шаг 5) 3-(3-фтор-4-морфолинофенил)-2-(3-(3-фторфенокси)пропил)-6-метил-пиримидин-4(3Н)-один
К раствору 3-фтор-4-морфолиноанилина (0,36 г; 1,83 ммоль) в DCM (20 мл) был добавлен триметилалюминий (2,7 мл, 5,40 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 0,5 ч. Был медленно добавлен раствор (Z)-метил-3-(4-(3-фторфенокси)бутанамидо)бут-2-эноат (0,80 г; 2,71 ммоль) в DCM (4 мл) и полученная смесь перемешивалась при rt в течение 24 ч. Смесь была резко охлаждена водосодержащим насыщенным раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (100 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,40 г; 49%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 442,3 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,00 (m, 2Н), 2,22 (s, 3Н), 2,44 (m, 2Н), 3,07 (m, 4Н), 3,76 (t, 4Н, J=4,6 Гц), 3,95 (t, 2Н, J=6,4 Гц), 6,22 (s, 1Н), 6,73-6,74 (m, 3Н), 7,07-7,08 (m, 2Н), 7,12-7,28 (m, 2Н).
[00493] Пример 54
3-(3-фтор-4-морфолинофенил)-6-((3-фторфенокси)метил)-2-метилпиримидин-4(3Н)-один

[00494] Шаг 1) 4-бромо-N-(3-фтор-4-морфолинофенил)-3-оксобутанамид
К раствору N-(3-фтор-4-морфолинофенил)-3-оксобутанамида (11,2 г; 40,0 ммоль) и АсОН (100 мл) в атмосфере N2 был добавлен BR2 (2,4 мл) при rt. Под конец добавления смесь была дополнительно перемешана при rt в течение 24 ч. Смесь была затем сконцентрирована in vacuo и было добавлено 40 мл воды. Полученная смесь была экстрактирована посредством EtOAc (30 мл × 4). Комбинированные органические фазы были промыты насыщенным раствором (40 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества желтого цвета (6,80 г; 47%).
[00495] Шаг 2) N-(3-фтор-4-морфолинофенил)-4-(3-фторфенокси)-3-оксобутан амид
К раствору 3-фторфенола (2,33 г; 20,8 ммоль) в обезвоженном THF (20 мл) был добавлен NaH (909 мг; 22,7 ммоль, 60%) и смесь перемешивалась при rt в течение 3 ч. Был добавлен раствор
4-бромо-N-(3-фтор-4-морфолинофенил)-3-оксобутанамид (6,8 г; 18,9 ммоль) в THF (40 мл). Полученная смесь перемешивалась при rt в течение суток. Реакционная смесь была затем влита в 100 мл воды и смесь была экстрактирована посредством EtOAc (30 мл × 5). Комбинированные органические фазы были промыты насыщенным раствором (50 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,16 г; 2%).
[00496] Шаг 3) 3-(3-фтор-4-морфолинофенил)-6-((3-фторфенокси)метил)-2-метил-пиримидин-4(3Н)-один
Смесь N-(3-фтор-4-морфолинофенил)-4-(3-фторфенокси)-3-оксобутанамид (510 мг; 1,31 ммоль), ацетамида (154 мг; 2,61 ммоль) и титана тетраизопропанолата (3,2 мл) в ксилене (10 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и были добавлены 60 мл толуола и 60 мл насыщенного водосодержащего раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток. Смесь была затем профильтрована и фильтрат был экстрактирован посредством DCM (20 мл × 4). Комбинированные органические фазы были промыты насыщенным раствором (30 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,09 г; 17%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 414,1 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 2,12 (s, 3H), 3,07 (d, 4H, J=5,4 Гц), 3,76 (t, 4H, J=4,5 Гц), 4,97 (s, 2H), 6,41 (s, 1H), 6,84-6,80 (m, 1H), 6,99-6,91 (m, 2H), 7,16-7,14 (m, 2H), 7,38-7,3 l(m, 2 H).
[00497] Пример 55
3-(3-фтор-4-(4-метилпиперазин-1-ил)фенил)-2-((3-фторфенокси)метил)-6-метилпиримидин-4(3Н)-один

К раствору 3-фтор-4-(4-метилпиперазин-1-ил)анилина (0,63 г; 3,01 ммоль) в DCM (15 мл) был добавлен триметилалюминий (5,3 мл, 10,6 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 0,5 ч. Был медленно добавлен раствор (Z)-метил-3-(2-(3-фторфенокси)ацетамидо)бут-2-эноат (0,80 г; 2,99 ммоль) в DCM (5 мл) и полученная смесь перемешивалась при rt в течение 12 ч. Смесь была затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (100 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,94 г; 73%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 427,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,34 (s, 3Н), 2,35 (s, 3Н), 2,58 (t, 4Н, J=4,8 Гц), 3,08-3,16 (m, 4Н), 4,68 (s, 2Н), 6,38 (d, 1Н, J=0,8 Гц), 6,49 (tt, 1H, J,=2,4 Гц, J2=10,6 Гц), 6,54 (dd, 1Н, J1=2,3 Гц, J2=5,3 Гц), 6,64-6,60 (m, 1Н), 6,94-6,98 (m, 3Н), 7,14-7,20 (m, 1Н).
[00498] Пример 56
3-(3-фтор-4-(2-морфолиноэтокси)фенил)-2-((3-фторфенокси)метил)-6-метилпиримидин-4(3Н)-один

[00499] Шаг 1) 2-морфолиноэтанол
Смесь 2-бромоэтанола (27,9 г; 223 ммоль), морфолина (40 г; 459 ммоль) и K2CO3 (48,4 г; 350 ммоль) в CH3CN (30 мл) была подвергнута возгонке с обратным холодильником в течение 3 ч. Смесь была затем охлаждена до rt и профильтрована. Фильтрат был сконцентрирован in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (24.40 г; 83%), которое было использовано для следующего шага без дальнейшей очистки.
[00500] Шаг 2) 4-(2-(2-фтор-4-нитрофенокси)этил)морфолин
Смесь 1,2-дифтор-4-нитробензол (1,0 г; 6,29 ммоль), 2-морфолиноэтанол (1,0 г; 7,62 ммоль) и Cs2CO3 в DMF (10 мл) перемешивалась при 75°С в течение 12 ч. Затем было добавлено 30 мл воды и полученная смесь была экстрактирована посредством DCM (30 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (30 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрирована in vacuo.
Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде масла желтого цвета (1,30 г; 76%).
[00501] Шаг 3) 3-фтор-4-(2-морфолиноэтокси)анилин
Смесь 4-(2-(2-фтор-4-нитрофенокси)этил)морфолин (1.3 г; 4.81 ммоль) и Pd/C (0.4 г; 10%) в THF (12 мл) в атмосфере Н2 перемешивалась при rt в течение суток. Смесь была затем профильтрована, и фильтрат был сконцентрирована in vacuo для получения названного химического соединения в виде масла желтого цвета (1.00 г; 86%), необработанный продукт был использован для следующего шага без дальнейшей очистки.
[00502] Шаг 4) 3-(3-фтор-4-(2-морфолиноэтокси)фенил)-2-((3-фторфенокси)метил)-6-метил-пиримидин-4(3Н)-один
К раствору 3-фтор-4-(2-морфолиноэтокси)анилин (0,33 г; 1,37 ммоль) в DCM (20 мл) был добавлен триметилалюминий (2,7 мл, 5,40 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 0,5 ч. Был медленно добавлен раствор (Z)-метил-3-(2-(3-фторфенокси)ацетамидо)бут-2-эноат (0,37 г; 1,38 ммоль) в DCM (5 мл) и поученная смесь перемешивалась при rt в течение 24 ч. Смесь была резуо охлаждена водосодержащим насыщенным раствором NH4Cl и экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (100 мл), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=30:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0.19 г; 30%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 458,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,24 (s, 3Н), 2,45 (t, 4Н, J=4,34 Гц), 2,66 (t, 2Н, J=5,58 Гц), 3,55 (t, 4Н, J=4,56 Гц), 4,15 (m, 2Н), 4,72 (s, 2Н), 6,37 (s, 1Н), 6,63-6,75 (m, 3Н),7,17-7,27 (m, 3Н), 7,38-7,41 (m, 1Н).
[00503] Пример 57
3-(3-фтор-4-((2-морфолиноэтил)амино)фенил)-2-((3-фторфенокси)метил)-6-метилпиримидин-4(3Н)-один

К раствору 2-фтор-N'-(2-морфолиноэтил)бензол-1,4-диамин (0,33 г; 1,38 ммоль) в DCM (20 мл) был медленно добавлен триметилалюминий (2,1 мл, 4,2 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 0,5 ч. Был медленно добавлен раствор (Z)-метил-3-(2-(3-фторфенокси)ацетамидо)бут-2-эноат (0,37 г; 1,38 ммоль) в DCM (5 мл) и полученная смесь перемешивалась при rt в течение 24 ч. Зтем к смеси было медленно добавлено 50 мл воды и смесь была экстрактирована посредством CH2Cl2 (50 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (100 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,5 г; 79%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 457,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,22 (s, 3Н), 2,44 (m, 4Н), 3,19 (t, 2Н, J=3,19 Гц), 3,76 (t, 4H, J=2,24 Гц), 4,70 (s, 2Н), 6,34 (s, 1Н), 6,52-6,64 (m, 2Н), 6,53-6,56 (m, 1Н), 6,69-6,81 (m, 3Н), 6,98-7,01 (m, 1Н), 7,14-7,21 (m, 1Н), 7,21-7,28 (m, 1Н).
[00504] Пример 58
2-((циклогексилокси)метил)-3-(3-фтор-4-морфолинофенил)-6-метилпири мидин-4(3Н)-один

[00505] Шаг 1) этил 2-(циклогексилокси)ацетат
К смеси циклогексанола (2,40 г; 24,0 ммоль) и RH2(OAc)4 (50 мг; 0,11 ммоль) в DCM (50 мл) был добавлен этил 2-диазоацетат (2,73 г; 23,9 ммоль) и смесь перемешивалась при rt в течение 5 мин. Затем она была профильтрована профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=15:1) для получения названного химического соединения в виде бесцветного масла (3,8 г; 85%).
[00506] Шаг 2) 2-(циклогексилокси) уксусная кислота
К раствору NaOH (4.89 г; 122 ммоль) в смеси воды (20 мл) и МеОН (20 мл) в ледяной ванне был медленно добавлен раствор этил 2-(циклогексилокси)ацетата (3,8 г; 20,4 ммоль) в МеОН (10 мл) и смесь перемешивалась при rt в течение 2 ч. затем ее кислотность была повышена до рН 4 концентрированной соляной кислотой и смесь была экстрактирована посредством DCM (20 мл × 2). Комбинированные органические слои были промыты насыщенным раствором (40 мл × 2), высушены над обезвоженным NaiSC1-4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc) для получения названного химического соединения в виде светло-желтого масла (2,7 г; 84%).
[00507] Шаг 3) 2-(циклогексилокси)ацетил хлорид
Смесь 2-(циклогексилокси) уксусной кислоты (0,90 г; 5,69 ммоль) и дихлорсульфана (10 мл) была подвергнута возгонке с обратным холодильником в течение 2 ч. Смесь была охлаждена до rt и сконцентрирована in vacuo для получения названного химического соединения в виде масла желтого цвета, которое было использовано для следующего шага без дальнейшей очистки.
[00508] Шаг 4) 2-(циклогексилокси)ацетамид
К 15 мл of NH4OH (25-28%) был добавлен раствор 2-(циклогексилокси) ацетил хлорида (1,01 г; 5,72 ммоль) в DCM (2 мл) ледяной ванне и смесь перемешивалась при rt в течение 5 мин и экстрактирована посредством DCM (20 мл × 3). Комбинированные органические слои были промыты насыщенным раствором (20 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo для получения названного химического соединения в виде твердого вещества белого цвета (0.5 г; 56%).
[00509] Шаг 5) 3-(3-фтор-4-морфолинофенил)-2-(3-(3-фторфенокси)пропил)-6-метил-пиримидин-4(3Н)-один
Смесь 2-(циклогексилокси)ацетамида (0,4 г; 2,54 ммоль), N-(3-фтор-4-морфолинофенил)-3-оксобутанамида (0,7 г; 2,50 ммоль) и титана тетраизопропанолат (5,8 г; 20,4 ммоль) в ксилене (16 мл) перемешивалась при 165°С в течение 30 ч. Смесь была затем охлаждена до rt и было добавлено 60 мл EtOAc и 60 мл воды.
Полученная смесь была профильтрована, и фильтрат был сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде масла желтого цвета (0,16 г; 16%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 402,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 1,04 (m, 6Н), 1,23 (m, 4Н), 2,21 (s, 3Н), 2,9 (m, 1Н), 3,05 (m, 4Н), 3,76 (t, 4Н, J=4,60 Гц), 4,07 (s, 2Н), 6,32 (s, 1Н), 7,08-7,15 (m, 2Н), 7,21-7,24 (m, 1Н),
[00510] Пример 59
3-(3-фтор-4-морфолинофенил)-6-метил-2-((пиридин-3-илокси)метил)пиримидин-4(3Н)-один

[00511] Шаг 1) 2-(пиридин-3-илокси)ацетонитрил
К смеси пиридин-3-ол (4,0 г; 42,1 ммоль) и K2CO3 (6,96 г; 50,4 ммоль) в CH3CN (6 мл) был добавлен по каплям 2-бромоацетонирил (2,52 г; 21,0 ммоль) при rt и смесь перемешивалась при rt в течение 40 ч. Смесь была профильтрована, и фильтрат был сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,45 г; 16%).
[00512] Шаг 2) 2-(пиридин-3-илокси)ацетамид
К смеси 2-(пиридин-3-илокси)ацетонитрила (100 мг; 0,75 ммоль), K2CO3 (103 мг; 0,75 ммоль) и DMSO (0,1 мл) в H2O (2 мл) был по каплям добавлен H2SO2 (0,1 мл, 30%) в ледяной ванне и смесь перемешивалась при rt в течение 5 мин. Затем она была сконцентрирована in vacuo и остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc) для получения названного химического соединения в виде твердого вещества белого цвета (62,2 мг; 55%).
[00513] Шаг 3) 3-(3-фтор-4-морфолинофенил)-6-метил-2-((пиридин-3-илокси)метил)пиримидин-4(3Н)-один
Смесь 2-(пиридин-3-илокси) ацетамид (120 мг; 0,79 ммоль), N-(3-фтор-4-морфолинофенил)-3-оксобутанамид (221,1 мг; 0,79 ммоль) и титана тетраизопропанолат (1,79 г; 6,30 ммоль) в ксилене (16 мл) перемешивалась при 165°С в течение 50 ч. Смесь была затем охлаждена до rt и было добавлено 30 мл EtOAc и 5 мл воды. Полученная смесь была профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc) для получения названного химического соединения в виде твердого вещества желтого цвета (0,90 г; 29%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 397,2 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,21 (s, 3Н), 2,97 (пл, 4Н), 3,72 (t, 4Н, 7=4,62 Гц), 4,79 (s, 2Н), 6,37 (s, 1Н), 7,04-7,08 (m, 1Н), 7,17-7,20 (m, 1Н), 7,23-7,27 (m, 2Н), 7,32-7,35 (m, 1Н), 7,67-7,74 (m, 1Н), 8,14-8,15 (m, 2Н).
[00514] Пример 60
3-(3-фтор-4-морфолинофенил)-2-(((5-фторпиридин-3-ил)окси)метил)-6-метилпиримидин-4(3Н)-один

[00515] Шаг 1) 2-((5-фторпиридин-3-ил)окси)ацетонитрил
К смеси 5-фторпиридин-3-ол (0,95 г; 8,40 ммоль) и K2CO3 (1,16 г; 8,40 ммоль) в CH3CN (6 мл) был добавлен по каплям 2-бромоацетонитрил (1,01 г; 8,42 ммоль) при rt и по окончанию добавления смесь перемешивалась при rt в течение 40 ч. Смесь была профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,55 г; 43%).
[00516] Шаг 2) 2-((5-фторпиридин-3-ил)окси)ацетамид
К смеси 2-((5-фторпиридин-3-ил)окси)ацетонитрила (0,55 г; 3,62 ммоль), K2CO3 (0,60 г; 4,34 ммоль) и DMSO (0,55 мл) в H2O (8 мл) был по каплям добавлен H2SO2 (0,55 мл, 30%) в ледяной ванне и смесь перемешивалась при rt в течение 5 мин. Затем она была сконцентрирована in vacuo и остаток был очищен посредством силикагельной колоночной хроматографии (EtOAc) для получения названного химического соединения в виде твердого вещества белого цвета (0,37 г; 60%).
[00517] Шаг 3) 3-(3-фтор-4-морфолинофенил)-2-(((5-фторпиридин-3-ил)окси)метил)-6-метил-пиримидин-4(3Н)-один
К смеси 2-((5-фторпиридин-3-ил)окси)ацетамида (200 мг; 1,18 ммоль) и N-(3-фтор-морфолинофенил)-3-оксобутанамида (330 мг; 1.18 ммоль) в ксилене (10 мл) был добавлен титана тетраизопропанолат (2,7 мг; 9,5 ммоль) и смесь была подвергнута возгонке с обратным холодильником в течение 50 ч. Смесь была охлаждена до rt и было добавлено 60 мл EtOAc и 10 мл воды. Полученная смесь была профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (130 мг; 27%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 415,2 (М+1);
1H-NMR (400 МГц, DMSO-flfe): δ 2,21 (s, 3Н), 2,98 (m, 4Н), 3,73 (t, 4Н, J=4,62 Гц), 4,84 (s, 2Н), 6,37 (s, 1Н), 7,04-7,08 (m, 1Н), 7,18-7,21 (m, 1Н), 7,32-7,37 (m, 2Н), 8,07-8,08 (m, 1Н), 8,16 (m, 1Н).
[00518] Пример 61
3-(3-фтор-4-морфолинофенил)-2-(2-(3-фторфенокси)пропан-2-ил)-6-метилпиримидин-4(3Н)-один

[00519] Шаг 1) этил 2-(3-фторфенокси)-2-метилпропаноат
Смесь 3-фторфенола (3,36 г; 30,0 ммоль), этил 2-бромо-2-метилпропаноата (8,78 г; 45,0 ммоль) и K2CO3 (6,22 г; 45,0 ммоль) в ацетоне (50 мл) была подвергнута возгонке с обратным холодильником в течение суток. Смесь была охлаждена до rt и было добавлено 60 мл воды. Полученная смесь была экстрактирована посредством DCM (40 мл × 2). Комбинированные органические фазы были промыты насыщенным раствором (40 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=4:1) для получения названного химического соединения в виде бесцветной жидкости (3,20 г; 47%).
[00520] Шаг 2) 2-(3-фторфенокси)-2-метилпропановая кислота
К раствору KOH (2,38 г; 42,4 ммоль) в смешанных растворах воды (50 мл) и этанола (70 мл) был добавлен одной порцией этил-2-(3-фторфенокси)-2-метилпропаноат (3,20 г; 14,1 ммоль) и смесь перемешивалась при 40°С в течение 2 ч. Смесь была охлаждена до 0°С, кислотность увеличена до рН 3 концентрированной соляной кислотой и смесь была экстрактирована посредством DCM (20 мл × 2). Комбинированные органические слои были промыты насыщенным раствором (20 мл × 2), высушены над обезвоженным и сконцентрированы in vacuo для получения названного химического соединения в виде твердого вещества белого цвета (1,70 г; 61%).
[00521] Шаг 3) 2-(3-фторфенокси)-2-метилпропаноил хлорид
К 2-(3-фторфенокси)-2-метилпропановой кислоте (1,70 г; 8,58 ммоль) был по каплям добавлен дихлорсульфан (15 мл) в атмосфере N2 и смесь была подвергнута возгонке с обратным холодильником в течение 3 ч. Смесь была охлаждена до rt и сконцентрирована in vacuo для получения названного химического соединения в виде масла желтого цвета, которое было использовано для следующего шага без дальнейшей очистки.
[00522] Шаг 4) (Z)-метил 3-(2-(3-фторфенокси)-2-метилпропанамидо)бут-2-эноат К раствору (Z)-метил-3-аминобут-2-эноат (0,90 г; 7,82 ммоль) и пиридина (0,80 г; 10,1 ммоль) в DCM (20 мл) был добавлен раствор 2-бромо-2-метилпропаноил хлорида (1,86 г; 8,59 ммоль) в DCM (5 мл) в атмосфере N2 и смесь перемешивалась при rt в течение суток.
Затем она была промыта насыщенным раствором (20 мл × 3), высушена над обезвоженным Na2SO4 и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=20:1) для получения названного химического соединения в виде твердого вещества желтого цвета (1,13 г; 49%).
[00523] Шаг 5) 3-(3-фтор-4-морфолинофенил)-2-(3-(3-фторфенокси)пропил)-6-метил-пиримидин-4(3Н)-один
К раствору 3-фтор-4-морфолиноанилина (0,50 г; 2,55 ммоль) в обезвоженном DCM (40 мл) был добавлен триметилалюминий (3,9 мл, 7,8 ммоль, 2 M в толуоле) в атмосфере N2 и смесь перемешивалась при rt в течение 0,5 ч. Медленно по каплям был добавлен раствор (Z)-метил-3-(2-(3-фторфенокси)-2-метилпропанамидо)бут-2-эноат (1,13 г; 3,83 ммоль) в DCM (5 мл) и полученная смесь перемешивалась при rt в течение 3 дней. Смесь была затем была резко охлаждена насыщенным водосодержащим раствором NH4Cl (50 мл) и экстрактирована посредством CH2Cl2 (30 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором (30 мл × 3), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:1) для получения названного химического соединения в виде твердого вещества бледно-желтого цвета (0,17 г; 15%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 442,2 (М+1);
1H-NMR (400 МГц, CDCb): δ 1,55 (s, 3Н), 1,68-1,65 (d, 3H, J=12,8 Гц), 2,35 (s, 3Н), 3,17-3,06 (m, 4Н), 3,88-3,85 (m, 4Н), 6,24-6,20 (dt, 1Н, Jj=10,8 Гц, J2=2,4 Гц), 6,31-6,28 (dd, 1Н, J,=8,2 Гц, J2=2,2 Гц), 6,35 (s, 1Н), 6,60-6,56 (dd, 1H, J,=12,9 Гц, 7,2=2,4 Гц), 6,71-6,65 (m, 2Н), 6,85-6,80 (t, 1H, J=8,8 Гц), 7,17-7,11 (m, 1H).
[00524] Пример 62
3-(4-(дигексиламино)-3-фторфенил)-2-((3-фторфенокси)метил)-6-метилпиримидин-4(3Н)-один

[00525] Шаг 1) N-(4-(дигексиламино)-3-фторфенил)-3-оксобутанамид
К раствору 2-фтор-N',N'-дигексилбензол-1,4-диамина (2,94 г; 10.0 ммоль) в толуоле (50 мл) был добавлен ацетил кетен (0,84 г; 10,0 ммоль) и смесь перемешивалась при 80°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:4) для получения названного химического соединения в виде масла желтого цвета (2,67 г; 70%).
[00526] Шаг 2) 2-(3-фторфенокси)ацетамид
Смесь 3-фторфенола (11,2 г; 100 ммоль), 2-бромоацетамида (13,8 г; 100 ммоль), K2CO3 (13,82 г; 100 ммоль) и Cs2CO3 (32,58 г; 100 ммоль) в ацетоне (150 мл) была подвергнута возгонке с обратным холодильником в течение суток. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (5,06 г; 30%).
[00527] Шаг 3) 3-(4-(дигексиламино)-3-фторфенил)-2-((3-фторфенокси)метил)-6-метил-пиримидин-4(3Н)-один
К смеси N-(4-(дигексиламино)-3-фторфенил)-3-оксобутанамида (2,67 г; 7,05 ммоль), и 2-(3-фторфенокси)ацетамида (2,37 г; 14,0 ммоль) в ксилене (20 мл) был добавлен титана тетраизопропанолат (5,97 г; 21,0 ммоль) и смесь перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 120 мл толуола и 150 мл водосодержащего насыщенного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (150 мл × 3). Комбинированные органические слои были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,95 г; 26%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 512,3(М+1);
1H-NMR (400 МГц, DMSO-d6): δ 0,88 (t, 6 Н, J=7,2 Гц), 1,25-1,30 (m, 16 Н), 2,42 (s, 3 Н), 3,62 (t, 4 Н, J=7,8 Гц), 4,84 (s, 2 Н), 6,54 (s, 1 Н), 6,54 (s, 1 Н), 6,58-6,60 (m, 1 Н), 6,64-6,66 (m, 1 Н), 6,68-6,73 (m, 1 Н), 7,21-7,27 (m, 1 Н), 7,60 (d, 1 Н, J=8,6 Гц), 7,74-7,77 (m, 1 Н), 7,96 (t, 1 Н, J=8,3 Гц).
[00528] Пример 63
3-(3-хлор-4-морфолинофенил)-2-((3-фторфенокси)метил)-6-метилпиримидин-4(3Н)-он.
Смесь N-(3-хлор-4-морфолинофенил)-3-оксобутанамида (0,89 г; 3,00 ммоль), 2-(3-фторфенокси) ацетамида (1,01 г; 5,97 ммоль) и титана тетраизопропанолата (7,2 мл) в ксилене (20 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 45 мл толуола и 60 мл водосодержащего насыщенного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (60 мл х 3). Комбинированные органические слои были промыты насыщенным раствором, высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,29 г; 23%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 430,1 (М+1);
1H-NMR (400 МГц, DMSO-d6): δ 2,35 (s, 3 Н), 3,00-3,06 (m, 4 Н), 3,85-3,87 (m, 4 Н), 4,68 (d, 2 Н, J=5,12 Гц), 6,39 (s, 1 Н), 6,45-6,49 (m, 1 Н), 6,54 (dd, 1 Н, J1=2,32 Гц, J2=8,34 Гц), 6,64-6,68 (m, 1 Н), 7,07 (s, 1 Н), 7,11-7,19 (m, 2 Н), 7,29 (d, 1 Н, J=2,4 Гц).
[00529] Пример 64
3-(3-хлор-4-морфолинофенил)-2-((3-хлорфенокси)метил)-6-метилпирими дин-4(3H)-один
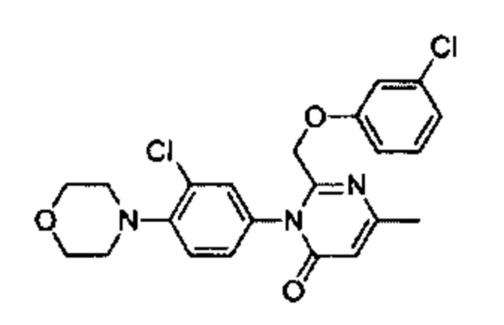
[00530] Шаг 1) 2-(3-хлорфенокси)ацетамид
Смесь 3-хлорфенола (2,57 г; 20,0 ммоль), 2-бромоацетамида (2,76 г; 20,0 ммоль) и K2CO3 (5,53 г; 40,0 ммоль) в ацетоне (40 мл) перемешивалась при 70°С в течение суток. Смесь была затем охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (3,22 г; 87%).
[00531] Шаг 2) 3-(3-хлор-4-морфолинофенил)-2-((3-хлорфенокси)метил)-6-метил-пиримидин-4(3Н)-один
Смесь N-(3-хлор-4-морфолинофенил)-3-оксобутанамид (0,48 г; 1,62 ммоль), 2-(3-хлорфенокси) ацетамид (0,60 г; 3,24 ммоль) и титана тетраизопропанолата (2,4 мл) в ксилене (10 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 60 мл толуола и 60 мл водосодержащего насыщенного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (20 мл × 4). Комбинированные органические слои были промыты насыщенным раствором (30 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,46 г; 64%). Спектроскопические данные химического соединения:
MS (ESI, пол, ион) m/z: 446,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,35 (s, 3H), 3,08-2,99 (m, 4H), 3,87-3,85 (t, 4H, J=4,6 Гц), 4,69-4,68 (d, 2H, J=6,2 Гц), 6,39 (s, 1H), 6,67-6,64 (m, 1H), 6,75-6,74 (t, 1H, J=2,2 Гц), 6,95-6,92 (m, 1H), 7,07-7,05 (d, 1H, J=8,5 Гц), 7,16-7,11 (m, 2H), 7,29 (s, 1H).
[00532] Пример 65
3-((1-(3-хлор-4-морфолинофенил)-4-метил-6-оксо-1,6-дигидропиримидин-2-ил)метокси)бензонитрил

[00533] Шаг 1) 2-(3-цианофенокси)ацетамид
Смесь 3-гидроксибензонитрила (2,38 г; 20,0 ммоль), 2-бромоацетамида (3,04 г; 22,0 ммоль) и K2CO3 (5,53 г; 40,0 ммоль) в ацетоне (20 мл) перемешивалась при 70°С в течение 17,5 ч. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (2,70 г; 77%).
[00534] Шаг 2) 3-((1-(3-хлор-4-морфолинофенил)-4-метил-6-оксо-1,6-дигидропиримидин-2-ил)метокси)бензонитрил
Смесь N-(3-хлор-4-морфолинофенил)-3-оксобутанамида (0,59 г; 2,00 ммоль), 2-(3-цианофенокси) ацетамида (0,71 г; 4,03 ммоль) и титана тетраизопропанолата (4,8 мл) в ксилене (20 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 30 мл толуола и 40 мл водосодержащего насыщенного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (50 мл × 3). Комбинированные органические слои были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,51 г; 59%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 437,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,35 (s, 3Н), 2,98-3,11 (m, 4Н), 3,85-3,87 (m, 4Н), 4,68-4,76 (m, 2Н), 6,39 (d, 1Н, J=0,84 Гц), 7,02-7,05 (m, 3Н), 7,13 (dd, 1Н, J1=2,36 Гц, J2=8,52 Гц), 7,25-7,34 (m, 3Н).
[00535] Пример 66
4-(2-фтор-4-(2-((3-фторфенокси)метил)-4-метил-6-оксопиримидин-1(6Н)-ил)фенил)морфолин-3-один

[00536] Шаг 1) 2-(3-фторфенокси)ацетамид
Смесь 3-фторфенола (5,61 г; 50,0 ммоль), 2-бромоацетамида (7,59 г; 55,0 ммоль) и K2CO3 (13,82 г; 100 ммоль) в ацетоне (80 мл) перемешивалась при 70°С в течение суток. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета. (7,89 г; 93%)
[00537] Шаг 2) 4-(2-фтор-4-нитрофенил)морфолин-3-один
Смесь 1,2-дифтор-4-нитробензола (7,95 г; 50,0 ммоль), морфолин-3-один (5,06 г; 50,0 ммоль) и K2CO3 (13,82 г; 100 ммоль) в DMF (80 мл) перемешивалась при 140°С в течение суток. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=3:1) для получения названного химического соединения в виде твердого вещества желтого цвета (5,00 г; 42%).
[00538] Шаг 3) 4-(4-амино-2-фторфенил)морфолин-3-один
Смесь порошка железа (8,8 г; 158 ммоль), воды (60 мл) и соляной кислоты (2 мл) перемешивалась при 65°С в течение 20 мин. Затем она была охлаждена до rt и водосодержащий слой был слит. Был добавлен раствор 4-(2-фтор-4-нитрофенил)морфоин-3-один (3,8 г; 15,8 ммоль) в МеОН (100 мл) и и кислотность полученной смеси была увеличена до рН 2 соляной кислотой, перемешивание производилось при 65°С в течение 4 ч. Смесь была охлаждена до rt, доведена до рН 8 насыщенным водосодержащим раствором NaHCO3 и профильтрована. МеОН был удален in vacuo и смесь была экстрактирована посредством EtOAc (20 мл × 3). Комбинированные органические слои были промыты насыщенным раствором (20 мл × 4), высушены над обезвоженным Na2SO4 и сконцентрированаы in vacuo.
Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:2) для получения названного химического соединения в виде твердого вещества белого цвета (1,89 г; 57%).
[00539] Шаг 4) N-(3-фтор-4-(3-оксоморфолино)фенил)-3-оксобутанамид
Смесь 4-(4-амино-2-фторфенил)морфолин-3-один (2,51 г; 11,9 ммоль) и ацетил кетен (2,51 г; 29,9 ммоль) в EtOAc (40 мл) перемешивалась при 80°С в течение 24 ч. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:4) для получения названного химического соединения в виде твердого вещества желтого цвета (2,15 г; 61%).
[00540] Шаг 5)
4-(2-фтор-4-(2-((3-фторфенокси)метил)-4-метил-6-оксопиримидин-1(6Н)-ил)фенил)morpholin-3-один
Смесь N-(3-фтор-4-(3-оксоморфолино)фенил)-3-оксобутанамид (0,59 г; 2,00 ммоль), 2-(3-фторфенокси)ацетамид (0,94 г; 5,56 ммоль) и титана тетраизопропанолата (4,8 мл) в ксилене (10 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 60 мл толуола и 60 мл водосодержащего насыщенного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (20 мл × 4). Комбинированные органические слои были промыты насыщенным раствором (30 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:2) для получения названного химического соединения в виде твердого вещества желтого цвета (0,06 г; 7%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 428,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,36 (s, 3Н), 3,70 (d, 2Н, J=3,12 Гц), 4,03 (t, 2U, J=4,6 Гц), 4,35 (s, 2Н), 4,73 (s, 2Н), 6,38 (s, 1Н), 6,55-6,53 (m, 2Н), 6,67 (t, 1Н, J=7,3 Гц), 7,21-7,11 (m, 3Н), 7,44 (t, 1Н, J=8,2 Гц),
[00541] Пример 67
3-(3-хлор-4-морфолинофенил)-2-(((4-хлорнафталин-1-ил)окси)метил)-6-метилпиримидин-4(3Н)-один

[00542] Шаг 1) 2-((4-хлорнафталин-1-ил)окси)ацетамид
Смесь 4-хлорнафталин-1-ол (3,57 г; 20,0 ммоль), 2-бромоацетамида (2,76 г; 20,0 ммоль) и K2CO3 (5,53 г; 40,0 ммоль) в ацетоне (40 мл) перемешивалась при 70°С в течение суток. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (2,32 г; 49%).
[00543] Шаг 2) 3-(3-хлор-4-морфолинофенил)-2-(((4-хлорнафталин-1-ил)окси)метил)-6-метилпиримидин-4(3H)-один
Смесь N-(3-хлор-4-морфолинофенил)-3-оксобутанамид (0,59 г; 2,0 ммоль), 2-((4-хлорнафталин-1-ил)окси)ацетамид (0,94 г; 4,0 ммоль) и титана тетраизопропанолата (4,8 мл) в ксилене (10 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 60 мл толуола и 60 мл водосодержащего насыщенного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (20 мл × 4). Комбинированные органические слои были промыты насыщенным раствором (30 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,56 г; 56%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 496,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,37 (s, 3Н), 2,96-2,86 (m, 4Н), 3,83-3,80 (t, 4Н, J=4,6 Гц), 4,93-4,92 (d, 2Н, J=4,9 Гц), 6,41 (s, 1Н), 6,62-6,60 (d, 1Н, J=8,3 Гц), 6,89-6,87 (d, 1Н, J=8,5 Гц), 7,09-7,07 (dd, 1Н, J1=2,5 Гц, J2=8,5 Гц), 7,27-7,26 (m, 1Н), 7,35-7,33 (d, 1Н, J=8,2 Гц), 7,55-7,51 (m, 1Н), 7,64-7,60 (m, 1Н), 8,04-8,02 (d, 1Н, J=8,3 Гц), 8,18-8,16 (d, 1Н, J=8,2 Гц).
[00544] Пример 68
3-(3-хлор-4-морфолинофенил)-2-((3-этинилфенокси)метил)-6-метилпиримидин-4(3Н)-один

[00545] Шаг 1) 2-(3-этинилфенокси)ацетамид
Смесь 3-этинилфенола (3,31 г; 28,0 ммоль), 2-бромоацетамида (2,36 г; 17,1 ммоль) и K2CO3 (5,53 г; 40.0 ммоль) в ацетоне (50 мл) перемешивалась при 70°С в течение 7 ч. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (2,70 г; 90%).
[00546] Шаг 2) 3-(3-хлор-4-морфолинофенил)-2-((3-этинилфенокси)метил)-6-метил-пиримидин-4(3Н)-один
Смесь N-(3-хлор-4-морфолинофенил)-3-оксобутанамид (0,80 г; 2,85 ммоль), 2-(3-этинилфенокси) ацетамида (1,0 г; 5,71 ммоль) и титана тетраизопропанолата (6,76 мл) в ксилене (20 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 50 мл толуола и 60 мл водосодержащего насыщенного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (150 мл × 3). Комбинированные органические слои были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,60 г; 50%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 420,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,34 (s, 3Н), 3,03-3,11 (m, 5Н), 3,83 (t, 4Н), 4,68 (s, 2Н), 6,38 (s, 1Н), 6,76-7,19 (m, 7Н).
[00547] Пример 69
2-(дифтор(3-фторфенокси)метил)-3-(3-фтор-4-морфолинофенил)-6-метилпиримидин-4(3Н)-один

[00548] Шаг 1) этил 2,2-дифтор-2-(3-фторфенокси)ацетат
Смесь 3-фторфенол (2,24 г; 20,0 ммоль), этил 2-бромо-2,2-дифторацетат (8,12 г; 40,0 ммоль) и K2CO3 (6,91 г; 50,0 ммоль) в МеОН (20 мл) перемешивалась при 70°С в течение суток. Затем она была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00549] Шаг 2) 2,2-дифтор-2-(3-фторфенокси)ацетамид
Смесь этил 2,2-дифтор-2-(3-фторфенокси)ацетата (3,5 г; 14,9 ммоль), МеОН (10 мл) и аммония (5,09 г) в 20 мл герметичной пробирке перемешивалась при 100°С в течение 24 ч. Смесь была охлаждена до rt и сконцентрирована in vacuo для получения названного химического соединения для следующего шага без дальнейшей очистки.
[00550] Шаг 3) 2-(дифтор(3-фторфенокси)метил)-3-(3-фтор-4-морфолинофенил)-6-метил-пиримидин-4(3Н)-один
Смесь N-(3-фтор-4-морфолинофенил)-3-оксобутанамид (0,60 г; 2,14 ммоль), 2,2-дифтор-2-(3-фторфенокси)ацетамида (0,88 г; 4,29 ммоль) и титана тетраизопропанолата (4,87 г; 17,1 ммоль) в ксилене (20 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 60 мл толуола и 80 мл водосодержащего насыщенного раствора NH4C1.
Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (150 мл × 3). Комбинированные органические слои были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,38 г; 40%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 450,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,43 (s, 3Н), 3,15 (t, 4Н), 3,85 (m, 4Н), 6,36-7,27 (m, 8Н).
[00551] Пример 70
3-((1-(3,5-дифтор-4-морфолинофенил)-4-метил-6-оксо-1,6-дигидропиримидин-2-ил)метокси)бензонитрил

[00552] Шаг 1) 4-(2,6-дифтор-4-нитрофенил)морфолин
Смесь 1,2,3-трифтор-5-нитробензола (3,54 г; 20,0 ммоль), морфолина (2,0 мл, 23,0 ммоль) и Et3N (8,5 мл, 61,0 ммоль) в EtOAc (30 мл) перемешивалась при rt в течение 5 ч. Смесь была сконцентрирована in vacuo, и остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=8:1) для получения названного химического соединения в виде твердого вещества желтого цвета (4,76 г; 98%).
[00553] Шаг 2) 3,5-дифтор-4-морфолиноанилин
Смесь 4-(2,6-дифтор-4-нитрофенил)морфолина (4,71 г; 19,3 ммоль), THF (30 мл), этанола (30 мл) и Pd/C (2.0 г; 10%) перемешивалась при rt в атмосфере Н2 в течение суток. Смесь была профильтрована и сконцентрирована in vacuo и остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=8:1) для получения названного химического соединения в виде твердого вещества желтого цвета (3,62 г; 88%).
[00554] Шаг 3) N-(3,5-дифтор-4-морфолинофенил)-3-оксобутанамид
Смесь 3,5-дифтор-4-морфолиноанилин (3,42 г; 16,0 ммоль) и ацетил кетен (1,61 г; 19.2 ммоль) в EtOAc (20 мл) перемешивалась при 83°С в течение суток. Смесь была охлаждена до rt и сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (3,10 г; 65%).
[00555] Шаг 4) 2-(3-цианофенокси)ацетамид
Смесь 3-гидроксибензонитрил (2,38 г; 20,0 ммоль), 2-бромоацетамид (3,04 г; 22,0 ммоль) и K2CO3 (5,53 г; 40,0 ммоль) в ацетоне (30 мл) перемешивалась при 75°С в течение суток. Затем она была охлаждена до rt и профильтрована, и фильтрат был сконцентрирована in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (1,00 г; 28%).
[00556] Шаг 5) 3-((1-(3,5-дифтор-4-морфолинофенил)-4-метил-6-оксо-1,6-дигидро-пиримидин-2-ил)метокси)бензонитрил
Смесь N-(3,5-дифтор-4-морфолинофенил)-3-оксобутанамид (0,79 г; 2,65 ммоль), 2-(3-цианофенокси)ацетамид (0,93 г; 5,28 ммоль) и титана тетраизопропанолата (6,3 мл) в ксилене (25 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 60 мл толуола и 60 мл водосодержащего насыщеного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (20 мл × 4). Комбинированные органические слои были промыты насыщенным раствором (30 мл × 2), высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:2) для получения названного химического соединения в виде твердого вещества желтого цвета (0,29 г; 25%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 439,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,34 (s, 3Н), 3,20 (s, 4Н), 3,80-3,77 (t, 4Н, J=4,4 Гц), 4,77 (s, 2Н), 6,37 (s, 1Н), 6,83-6,81 (d, 2Н, J=8,9 Гц), 7,08-7,06 (dd, 2Н, J1=7,5 Гц, J2=1,0 Гц), 7,29-7,27 (d, 1Н, J=6,4 Гц), 7,39-7,35 (m, 1Н).
[00557] Пример 71
3-(3-фтор-4-морфолинофенил)-2-((3-метоксифенокси)метил)-6-метилпиримидин-4(3Н)-один

[00558] Шаг 1) 2-(3-метоксифенокси)ацетамид
Смесь 3-метоксифенол (2,48 г; 20,0 ммоль), 2-бромоацетамид (3,31 г; 24,0 ммоль) и K2CO3 (5,53 г; 40,0 ммоль) в ацетоне (30 мл) перемешивалась при 70°С в течение 9 ч. Смесь была охлаждена до rt и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества белого цвета (3,0 г; 83%).
[00559] Шаг 2) 3-(3-фтор-4-морфолинофенил)-2-((3-метоксифенокси)метил)-6-метил-пиримидин-4(3Н)-один
Смесь N-(3-фтор-4-морфолинофенил)-3-оксобутанамид (1,0 г; 3,57 ммоль), 2-(3-метоксифенокси) ацетамид (1,29 г; 7,12 ммоль) и титана тетраизопропанолата (8,11 г; 28,5 ммоль) в ксилене (30 мл) перемешивалась при 165°С в течение 24 ч. Смесь была охлаждена до rt и было добавлено 80 мл толуола и 100 мл водосодержащего насыщенного раствора NH4Cl. Полученная смесь перемешивалась при rt в течение суток и была профильтрована, и фильтрат был экстрактирован посредством DCM (150 мл × 3). Комбинированные органические слои были высушены над обезвоженным Na2SO4 и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=1:1) для получения названного химического соединения в виде твердого вещества желтого цвета (0,61 г; 40%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 426,1 (М+1);
1H-NMR (400 МГц, CDCl3): δ 2,25 (s, 3Н), 2,97 (t, 4Н), 3,69 (s, 3Н), 3,71 (m, 4Н), 4,69 (s, 2Н), 6,33-7,31 (m, 8Н).
[00560] Пример 72
3-(3-хлор-4-((1-(4-хлор-3-фторфенил)-2-метилпропан-2-ил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один

[00561] Шаг 1) 1-(4-хлор-3-фторфенил)пропан-2-один
К смеси 4-бромо-1-хлор-2-фторбензол (20,90 г; 100,0 ммоль) и ацетилацетона (30 мл, 300,0 ммоль) в DMSO (100 мл) были добавлены трифосфат калия (63,70 г; 300,0 ммоль) и Cul (3,00 г; 15,80 ммоль) в атмосфере N2 и смесь перемешивалась при 110°С в течение 23 ч. Смесь была охлаждена до rt и была добавлена соляная кислота (300 мл, 2 М). Полученная смесь была экстрактирована посредством EtOAc (100 мл × 3) и комбинированные органические фазы были промыты насыщенным раствором (100 мл × 2), высушены над обезвоженным Na2SO4 (50 г), и профильтрованы. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=10:1) для получения названного химического соединения в виде желтой жидкости (9,02 г; 48.2%).
[00562] Шаг 2) 1-(4-хлор-3-фторфенил)-2-метилпропан-2-ол
К раствору метилмагниевого бромида (100 мл, 100,0 ммоль, 1.0 М в THF) был по каплям добавлен раствор 1-(4-хлор-3-фторфенил)пропан-2-один (9,00 г; 48,20 ммоль) в THF (20 мл) при 0°С в атмосфере N2 и реакционная смесь нагревалась до 76°С в течение 12 ч Затем она была охлаждена до rt и резко охлаждена водосодержащим насыщенным раствором NH4Cl (50 мл) и смесь была влита в воду (200 мл). Полученная смесь была экстрактирована посредством EtOAc (100 мл × 4) и комбинированные органические фазы были промыты насыщенным раствором (100 мл × 2), высушены над обезвоженным Na2SO4 (50 г) и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=8:1) для получения названного химического соединения в виде желтой жидкости (8,61 г; 88,2%).
[00563] Шаг 3) N-(1-(4-хлор-3-фторфенил)-2-метилпропан-2-ил)ацетамид
К смеси 1-(4-хлор-3-фторфенил)-2-метилпропан-2-ол (8.61 г; 42.50 ммоль), ацетонитрила (13 мл, 255,0 ммоль) и уксусной кислоты (80 мл) была по каплям добавлена серная кислота (13 мл) и смесь поддерживалась нагретой до 65°С в течение 5 ч. Смесь была охлаждена до rt и влита в ледяную ванну (400 мл) и полученная смесь была доведена до рН>11 посредством NaOH, и экстрактирована посредством EtOAc (150 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором (150 мл × 2), высушены над обезвоженным Na2SO4 (40 г) и профильтрованы. Фильтрат был сконцентрирован in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:1) для получения названного химического соединения в виде твердого вещества желтого цвета (4,38 г; 42,1%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 244,2 (М+1);
1H-NMR (400 МГц, CDCl3) δ 7,29 (dd, 1Н, J1=10,7 Гц, J2=5,2 Гц), 6,94 (dd, 1Н, J1=10,2 Гц, J2=1,9 Гц), 6,87 (dd, 1H, J1=8,1 Гц, J2=1,5 Гц), 5,21 (s, 1Н), 3,08 (s, 2Н), 1,95 (s, 3Н), 1,32 (s, 6Н),
[00564] Шаг 4) 1-(4-хлор-3-фторфенил)-2-метилпропан-2-амин
Смесь N-(1-(4-хлор-3-фторфенил)-2-метилпропан-2-ил) ацетамид (3,36 г; 13,80 ммоль) и концентрированная соляная кислота (60 мл) нагревалась до 120°С в течение 16,5 ч. Смесь была охлаждена до rt и влита в ледяную ванну, и полученная смесь была доведена до рН>12 посредством NaOH и экстрактирована посредством EtOAc (80 мл × 5). Комбинированные органические фазы были промыты насыщенным раствором (100 мл × 2), высушены над обезвоженным Na2SO4 и провильтрованы. Фильтрат был сконцентрирован in vacuo. Остаток был разведен в концентрированной соляной кислоте (60 мл) и смесь перемешивалась при 120°С в течение 20 ч. Реакционная смесь была охлаждена до rt и было добавлено 100 мл воды. Полученная смесь была промыта EtOAc (50 мл × 3). Водосодержащая фаза была доведена до рН>11 посредством NaOH и экстрактирована посредством EtOAc (50 мл × 3). Комбинированные органические фазы были промыты насыщенным раствором (80 мл × 2), высушены над обезвоженным Na2SO4 (20 г) и сконцентрирована in vacuo для получения названного химического соединения в виде твердого вещества желтого цвета (0,484 г; 17,4%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 202,1 (М+1);
[00565] Шаг 5) 2-хлор-N-(1-(4-хлор-3-фторфенил)-2-метилпропан-2-ил)-4-нитро-анилин
Смесь 3-хлор-4-фтор-1-нитробензол (421 мг; 2,40 ммоль) и 1-(4-хлор-3-фторфенил)-2-метилпропан-2-амин (484 мг; 2,40 ммоль) в DMSO (10 мл) нагревалась до 90°С в атмосфере N2 в течение 3 ч. Смесь была охлаждена до rt и перемешивалась при rt в течение 38,5 ч. Затем она была нагрета и перемешивалась дополнительно до 90°С в течение 81,5 ч. Смесь была охлаждена до rt и было добавлено 80 мл воды. Полученная смесь была экстрактирована посредством EtOAc (30 мл × 3). Комбинированные органические слои были высушены над обезвоженным Na2SO4 (10 г) и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (PE/DCM (V/V)=20:1) для получения названного химического соединения в виде масла желтого цвета (490 мг; 57,2%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 357,2 (М+1);
1H-NMR (400 МГц, CDCl3) δ 8,24 (d, 1Н, J=2,6 Гц), 8,10 (dd, 1Н, J1=9,2 Гц, J2=2,6 Гц), 7,34-7,26 (m, 1H), 7,04-6,98 (m, 1H), 6,86 (dd, 1Н, J1=9,9 Гц, J2=2,0 Гц), 6,77 (dd, 1Н, J1=8,2 Гц, J2=1,5 Гц), 5,00 (s, 1Н), 3,04 (s, 2Н), 1,48 (s, 6Н),
[00566] Шаг 6) 2-хлор-N'-(1-(4-хлор-3-фторфенил)-2-метилпропан-2-ил)бензол-1,4-диамин
К смеси воды (20 мл) и порошка железа (697 мг; 12,50 ммоль) при 65°С была по каплям добавлена концентрированная соляная кислота (0,2 мл) и смесь перемешивалась в течение 15 мин. Водосодержащий слой смеси был слит и к обработанному ранее порошку железа был добавлен раствор 2-хлор-N-(1-(4-хлор-3-фторфенил)-2-метилпропан-2-ил)-4-нитроанилин (446 мг; 1,25 ммоль) в МеОН (20 мл). Смесь была доведена до рН 2-3 и перемешивалась при 65°С в течение 20 мин. Смесь была затем охлаждена до rt, доведена до рН 11 посредством Et3N, и профильтрована, и фильтрат был сконцентрирован in vacuo. Остаток был разведен в EtOAc (100 мл) и раствор был промыт водой (30 мл × 3) и насыщенным раствором (30 мл × 2), высушен над обезвоженным Na2SO4 (10 г) и сконцентрирован in vacuo для получения необработанного продукта для следующего шага без дальнейшей очистки. Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 327,1 (М+1);
[00567] Шаг 7) 3-(3-хлор-4-((1-(4-хлор-3-фторфенил)-2-метилпропан-2-ил)амино)фенил)-2,6-диметилпиримидин-4(3Н)-один
К раствору 2-хлор-N'-(1-(4-хлор-3-фторфенил)-2-метилпропан-2-ил) бензол-1,4-диамин (408 мг; 1,25 ммоль) в толуоле (15 мл) был добавлен по каплям триметилалюминий (2,5 мл, 5,00 ммоль, 2.0 М в толуоле) в атмосфере N2 и смесь перемешивалась при rt в течение 30 мин после добавления. Был медленно добавлен раствор (Z)-метил 3-(2-(3-фторфенокси)ацетамидо)бут-2-эноат (295 мг; 1,88 ммоль) в толуоле (5 мл) и полученная смесь перемешивалась при rt в течение 22 ч. Затем был добавлен по каплям триметилалюминий (2,0 мл, 4,00 ммоль, 2 M в толуоле) и смесь перемешивалась при rt в течение 30 мин. Был добавлен раствор (Z)-метил 3-(2-(3-фторфенокси)ацетамидо)бут-2-эноат (295 мг; 1,88 ммоль) в толуоле (3 мл) и смесь перемешивалась еще 18 ч. Смесь была резко охлаждена водосодержащим насыщенным раствором NH4Cl (50 мл) и профильтрована, и органическая фаза была отделена от фильтрата. Водосодержащая фаза была экстрактирована посредством EtOAc (30 мл × 3). Комбинированные органические слои были промыты насыщенным раствором (30 мл × 2), высушены над обезвоженным Na2SO4 (15 г) и сконцентрированы in vacuo. Остаток был очищен посредством силикагельной колоночной хроматографии (РЕ/EtOAc (V/V)=2:3) для получения названного химического соединения в виде твердого вещества желтого цвета (183 мг; 33,7%). Спектроскопические данные химического соединения:
MS (ESI, пол. ион) m/z: 434,2(М+1);
1H-NMR (400 МГц, CDCl3) δ 7,31 (t, 1Н, J=8,0 Гц), 7,16 (d, 1Н, J=2,5 Гц), 7,11 (d, 1Н, J=8,7 Гц), 6,98 (dd, 1Н, J1=8,7 Гц, J2=2,5 Гц), 6,90 (dd, 1Н, J1=10,1 Гц, J2=1,9 Гц), 6,83 (dd, 1Н, J1=8,2 Гц, J2=1,5 Гц), 6,30 (d, 1Н, J=9,9 Гц), 4,48 (s, 1Н), 3,01 (dd, 2Н, J1=32,3 Гц, J2=13,6 Гц), 2,33 (s, 3Н), 2,27 (s, 3Н), 1,44 (s, 3Н), 1,42 (s, 3Н),
ЭКСПЕРИМЕНТАЛЬНЫЙ СПОСОБ НА КЛЕТКАХ
[00568] 1. Посев клеток
Взяв клетки BHK-21 в фазе экспоненциального роста, собирая и подсчитывая клетки с дигестивной переходной культурой после прироста сплавления 85-95%, регулирую плотность клеток в пределах 2×104 клеток на миллиметр, производя посев клеток на 96-канальные пластины, 100 мкл/канал, клетки были помещены в инкубатор 5% CSO2 при 37°С.
[00569] 2. Дозы для клеток
Верхняя прозрачная жидкость была удалена с 96-канальных пластин после приклеивания клеток на стенку 24 часа. Упомянутые выше химические соединения были законсервированы в растворах различных концентраций, и растворы были введены в каналы, 100 мкл/канал. Каждый концентрированный раствор в 3 пробах, клетки были субкультурированы 48 спустя после применения дозы.
[00570] 3. Тестирование оптической плотности
10 мкл раствора CCK-8 было введено в каждый канал спустя 48 часов после введения дозы; и инкубировано на 2 часа. Оптическая плотность (А) каждого канала определялась микропластиночным считывателем на длине волны 450 нм. Вычисление степени подавления разрастания клетки каждым химическим соединением было основано на величине А, пропорция подавления разрастания клетки (пропорция подавления, IR) = (1 значение экспериментальной группы (А1)/значение контрольной группы (АО))×100% и IC50 каждого химического соединения при 48 часах было вычислено программой обработки данных.
[00571]

[00572] НЕ ПРИМЕНЯЕТСЯ: Отсутствует активность подавления в диапазоне тестируемой концентрации химического соединения, при этом активность подавления не увеличивается с повышением тестируемой концентрации.
[00573] Отношение к PFD (множитель): Представляет собой отношение к пирфенидону IC50 химического соединения IC50; чем больше множитель, тем лучше vitro активность подавления химического соединения.
[00574] Общие характеристики органического фиброза расширяют внеклеточную матрицу (ЕС1-4) и структурное ремоделирование органов и тканей, где многие цитокины (CK) участвуют в процессе. Показано, что в экспериментальном посеве in vitro, заявляемые химические соединения гораздо активнее пирфенидона, и часть химических соединений более чем в 20 раз активнее пирфенидона. Заявляемые химические соединения могут избежать фототоксической реакции, вызываемой пирфенидоном, они эффективны как антифиброзное средство.
Реферат
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I), где Vпредставляет собой CR, Vпредставляет собой N, Vпредставляет собой CR, и Vпредставляет собой CR; X представляет собой связь или Cалкилен; Y представляет собой О; А представляет собойгде каждый n независимо принимает значения 0, 1 или 2; и каждый Rпредставляет собой независимо Н, F, Cl, Br, циано или Сгалоалкил; В представляет собой -NRR; Rпредставляет собой Cалкил, Сарил-С-алкил, Сарил-(CH)-G-(CH)-, пиридил-(CH)-G-(CH)- или Сциклоалкил-(CH)-G-(CH)-, где каждый G является О или S, где каждый p равен 0, и m принимает значения 1, 2 или 3; или где каждый из Сарил-(CH)-G-(CH)-, пиридил-(CH)-G-(CH)- и Сциклоалкил-(CH)-G-(CH)- представляет собой факультативно замещенные одним или двумя F, Cl, Br, Салкинил, Cалкокси или циано; где Сарил-С-алкил является незамещенным или замещенным F, Cl, Br; Rпредставляет собой Cалкил; Rпредставляет собой Н; каждый Rнезависимо представляет собой Н, Cалкил или Cалкокси-С-алкил; и каждый Rпредставляет собой независимо Cалкил, Cалкокси-С-алкил, Сарил-С-алкил, Cгетероарил-С-алкил, Сгетероциклил-С-алкил или Сциклоалкил-С-алкил; где Сгетероарил выбирается из имидазола, тетразола и индола; и Сгетероциклил выбирается из морфолина, пиперидина и тетрагидрофурана; или Rи R, вместе с атомом азота, к которому они прикреплены, факультативно создают замещенное или незамещенное 3-8-членное кольцо, которое выбрано из морфолина, тиоморфолина, пиперазина, пиперидина, пирролидинила, пиррола и пиразола; где замещенное 3-8-членное кольцо замещено 1 или 2 заместителями, выбранными из оксо, Cалкила, гидроксила и Салкинила. Технический результат: получены новые производные пиримидинона, полезные для профилактики, регулирования или лечения фиброза ткани или органа или для облечения степени тяжести фиброза ткани или органа в организме пациента. 9 з.п. ф-лы, 2 табл., 72 пр.
Формула


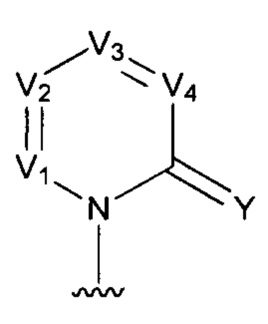



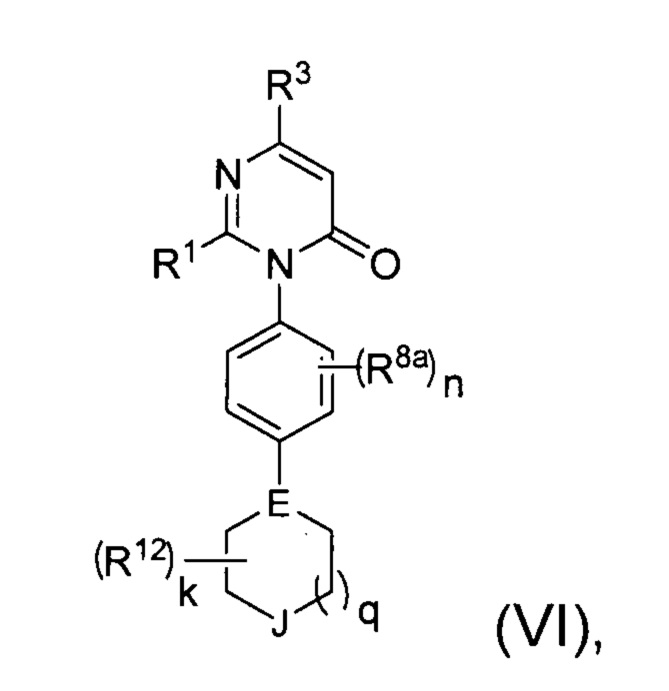
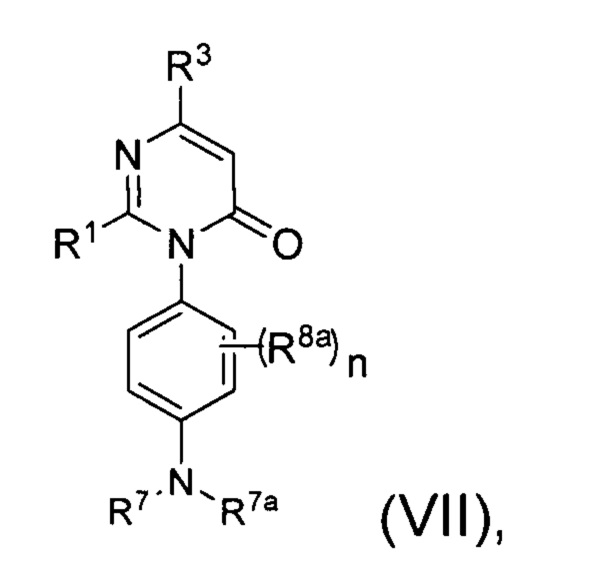





Комментарии