Кристаллическая форма 4-[2-(2-фторфеноксиметил)фенил]пиперидинового соединения - RU2503662C2
Код документа: RU2503662C2
Чертежи





Описание
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новой кристаллической форме 4-[2-(2-фторфеноксиметил)фенил]пиперидинового соединения, обладающего активностью ингибитора обратного захвата серотонина (5-HT) и норэпинефрина (NE). Настоящее изобретение также относится к фармацевтическим композициям, содержащим кристаллическое соединение или полученным из таких соединений, способам и промежуточным соединениям для получения кристаллического соединения и способам применения такого соединения для лечения болевого нарушения, такого как нейропатическая боль и другие заболевания.
СУЩЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Боль представляет собой неприятное сенсорное и эмоциональное ощущение, ассоциированное с фактическим или потенциальным повреждением ткани или описанное в отношении такого повреждения (International Association for the Study of Pain (IASP), Pain Terminology). Хроническая боль существует после острой боли или после ожидаемого времени заживления повреждения (American Pain Society. "Pain Control in the Primary Care Setting." 2006:15). Нейропатическая боль представляет собой боль, инициируемую или вызываемую первичным повреждением или дисфункцией нервной системы. Периферическая нейропатическая боль возникает, когда повреждение или дисфункция происходят в периферической нервной системе, и центральная нейропатическая боль - когда повреждение или дисфункция происходят в центральной нервной системе (IASP).
Для лечения нейропатической боли в настоящее время используют несколько типов терапевтических средств, включая, например, трициклические антидепрессанты, ингибиторы обратного захвата серотонина и норэпинефрина, лиганды кальциевых каналов (например, габапентин и прегабалин), топический лидокаин и агонисты опиоидов (например, морфин, оксикодон, метадон, леворфанол и трамадол).
4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин, описываемый в настоящем документе, ингибирует обратный захват и серотонина, и норэпинефрина, связывая транспортеры серотонина и норэпинефрина. При получении соединений для долговременного хранения и при получении фармацевтических композиций и составов часто желательно получать кристаллическую форму терапевтического средства, которая не является ни гигроскопичной, ни растворяющейся за счет поглощения влаги. Также удобно иметь кристаллическую форму с относительно высокой температурой плавления (т.е. больше, чем приблизительно 150°C), которая позволяет обрабатывать вещество, например тонко измельчать, без значительного разрушения. Таким образом, существует необходимость в стабильной не растворяющейся за счет поглощения влаги форме 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина с приемлемым уровнем гигроскопичности и относительно высокой температурой плавления.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к кристаллическому гидрохлориду 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина.
Один из аспектов изобретения относится к способам получения кристаллического гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина. В одном из вариантов осуществления способ получения кристаллического гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина включает этапы a) обработки гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина этилацетатом и этанолом до полного растворения; b) охлаждения для проведения кристаллизации; c) выделения полученных твердых веществ с получением кристаллического гидрохлорида по изобретению. В другом варианте осуществления этот кристаллический гидрохлорид дополнительно d) обрабатывают изопропанолом и водой до полного растворения; e) охлаждают для проведения кристаллизации и f) выделяют полученные твердые вещества с получением кристаллического гидрохлорида по изобретению.
Другой аспект изобретения относится к способу очистки 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина. В одном из вариантов осуществления этот способ включает получение кристаллического гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина. Изобретение также относится к продуктам, получаемым способами, описываемыми в настоящем документе.
Один из аспектов изобретения относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и кристаллический гидрохлорид 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина. Такие композиции необязательно могут содержать другие активные средства, такие как средства против болезни Альцгеймера, противосудорожные средства, антидепрессанты, средства против болезни Паркинсона, двойные ингибиторы обратного захвата серотонина-норэпинефрина, нестероидные противовоспалительные средства, ингибиторы обратного захвата норэпинефрина, агонисты опиоидов, антагонисты опиоидов, селективные ингибиторы обратного захвата серотонина, блокаторы натриевых каналов, симпатолитики и их сочетания. Таким образом, в еще одном аспекте по изобретению фармацевтическая композиция содержит кристаллическую соль по изобретению, второе активное средство и фармацевтически приемлемый носитель. Другой аспект изобретения относится к комбинации активных средств, содержащих кристаллическую соль по изобретению и второе активное средство. Кристаллическую соль по изобретению можно формулировать совместно или раздельно с дополнительным средством(ами). При формулировании раздельно фармацевтически приемлемый носитель можно включать с дополнительным средством(ами). Таким образом, другой аспект изобретения относится к комбинации фармацевтических композиций, где комбинация, содержит первую фармацевтическую композицию, содержащую кристаллическую соль по изобретению и первый фармацевтически приемлемый носитель; и вторую фармацевтическую композицию, содержащую второе активное средство и второй фармацевтически приемлемый носитель. Изобретение также относится к набору, содержащему такие фармацевтические композиции, например, когда первая и вторая фармацевтические композиции являются раздельными фармацевтическими композициями.
4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин обладает активностью ингибитора обратного захвата серотонина и активностью ингибитора обратного захвата норэпинефрина. Полагают, что кристаллический гидрохлорид этого соединения обладает такой же активностью и, таким образом, такой же пригодностью в качестве терапевтического средства для лечения пациентов, страдающих от заболевания или нарушения, которые лечат ингибированием транспортеров серотонина и/или норэпинефрина. Таким образом, один из аспектов изобретения относится к способу лечения болевого нарушения, такого как нейропатическая боль или фибромиалгия; депрессивного расстройства, такого как глубокая депрессия; аффективного расстройства, такого как тревожное расстройство; синдрома дефицита внимания с гиперактивностью; когнитивного расстройства, такого как деменция; недержания мочи при напряжении; синдрома хронической усталости; ожирения или вазомоторных симптомов, ассоциированных с менопаузой, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению.
Другой аспект изобретения относится к применению кристаллического соединения по изобретению для получения лекарственных средств, особенно для получения лекарственных средств, пригодных для лечения болевых нарушений, депрессивных расстройств, аффективных расстройств, синдрома дефицита внимания с гиперактивностью, когнитивных расстройств, недержания мочи при напряжении, для ингибирования обратного захвата серотонина у млекопитающего или для ингибирования обратного захвата норэпинефрина у млекопитающего. В настоящем документе описаны другие аспекты и варианты осуществления изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Различные аспекты настоящего изобретения проиллюстрированы посредством приложенных фигур.
На фиг.1 представлен профиль порошковой рентгеновской дифракции (PXRD) кристаллического гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина.
На фиг.2 представлена термограмма дифференциальной сканирующей калориметрии (DSC) и кривая термогравиметрического анализа (TGA).
На фиг.3 представлен профиль динамической сорбции влаги (DMS).
Фиг.4 представляет собой микрографическое изображение.
Фиг.5 представляет собой микроскопическое изображение кристалла из элементарной ячейки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к кристаллическому гидрохлориду 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина. Неожиданно оказалось, что это кристаллическое соединение не растворяется за счет поглощения влаги, даже при действии атмосферной влажности. Дополнительно это кристаллическое соединение обладает приемлемым уровнем гигроскопичности и высокой температурой плавления.
Монокристалл из молекул лекарственного средства демонстрирует моноклинную симметрию (группа симметрии кристаллической решетки P21C), со следующими параметрами элементарной ячейки: A=C=90°, B=104,595°; a=11,631 Å, b=7,057 Å, c=42,532 Å. Не связывая себя какой-либо теорией, на основе рентгенокристаллографических данных полагают, что кристалл построен вокруг молекулы воды, и содержание воды определяли на основе фактора заполнения воды в элементарной ячейке с использованием параметров теплового движения атомов и общих наблюдаемых структурных факторов.
Таким образом, в одном из вариантов осуществления кристаллический гидрохлорид 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина может содержать определенное количество воды, которое абсорбируется на поверхности кристаллического вещества или составляет часть структуры кристалла.
В одном конкретном варианте осуществления кристаллический гидрохлорид может содержать количество воды, которое абсорбировано на поверхности кристалла, в диапазоне от приблизительно 0,2% масс. до приблизительно 0,8% масс.; а в другом варианте осуществления - от приблизительно 0,4% масс. до приблизительно 0,6% масс.
В еще одном конкретном варианте осуществления кристаллический гидрохлорид может содержать от приблизительно 0,25 до приблизительно 0,50 моль воды, составляющей часть кристаллической структуры; а в другом варианте осуществления - от приблизительно 0,30 до приблизительно 0,40 моль. В одном иллюстративном варианте осуществления на один моль гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина приходится приблизительно 0,32 моль воды.
ОПРЕДЕЛЕНИЯ
При описании соединений, композиций, способов и процессов по изобретению, если не указано иначе, приведенные ниже термины имеют приведенные ниже значения. Кроме того, как применяют в настоящем документе, формы единственного числа включают соответствующие формы множественного числа, если в контексте использования четко не продиктовано иначе. Полагают, что термины "содержащий", "включающий" и "имеющий" являются инклюзивными и означающими, что могут существовать дополнительные элементы, отличающиеся от перечисленных элементов. Если не указано иначе, все числа, выражающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакции и т.д., используемые в настоящем документе, во всех случаях следует понимать как модифицируемые выражением "приблизительно". Таким образом, количества, указанные в настоящем документе, являются приближениями, которые могут варьировать в зависимости от желаемых свойств, которые желательно получать по настоящему изобретению. По меньшей мере, а не в попытке ограничить применимость принципов эквивалентов областью формулы изобретения, каждое число следует рассматривать с учетом указанных значимых цифр и применяя обычные способы округления.
Как применяют в настоящем документе, термин "формулы", "с формулой" или "со структурой" не предназначен для ограничения, и его используют таким же образом, как обычно используют термин "содержащий".
Как применяют в настоящем документе, термин "температура плавления" означает температуру, при которой посредством дифференциальной сканирующей калориметрии наблюдают максимум эндотермической теплоотдачи для температурного перехода, соответствующего переходу из твердой в жидкую фазу.
Термин "фармацевтически приемлемый" относится к веществу, которое не является биологически или иным образом неприемлемым при использовании по изобретению. Например, термин "фармацевтически приемлемый носитель" относится к веществу, которое можно добавлять в композицию и вводить пациенту, не обуславливая неприемлемых биологических эффектов или неприемлемого взаимодействия с другими компонентами композиции. Такие фармацевтически приемлемые вещества, как правило, удовлетворяют требуемым стандартам токсикологического и производственного тестирования и включают вещества, определяемые в U.S. Food and Drug Administration в качестве подходящих неактивных ингредиентов.
Термин "терапевтически эффективное количество" означает количество, достаточное для осуществления лечения при введении нуждающемуся в этом пациенту, т.е. количество лекарственного средства, необходимое для получения желаемого терапевтического эффекта. Например, терапевтически эффективное количество для лечения нейропатической боли представляет собой количество соединения, необходимое, например, для уменьшения, подавления, устранения или предотвращения симптомов нейропатической боли или для лечения первопричины нейропатической боли. С другой стороны, термин "эффективное количество" означает количество, достаточное для получения желаемого результата, который может необязательно представлять собой терапевтический результат. Например, при исследовании системы, содержащей транспортер норэпинефрина, "эффективное количество" может представлять собой количество, необходимое для ингибирования обратного захвата норэпинефрина.
Как применяют в настоящем документе, термин "лечение" означает лечение заболевания или медицинского состояния (такого как нейропатическая боль) у пациента, такого как млекопитающее (в частности человек), которое включает одно из следующих: (a) предотвращение возникновения заболевания или медицинского состояния, т.е. профилактическое лечение пациента; (b) улучшение при заболевании или медицинском состоянии, т.е. устранение или обеспечение регресса заболевания или медицинского состояния у пациента; (c) подавление заболевания или медицинского состояния, т.е. замедление или остановка развития заболевания или медицинского состояния у пациента; или (d) облегчение симптомов заболевания или медицинского состояния у пациента. Например, термин "лечение нейропатической боли" может включать предотвращение возникновения нейропатической боли, улучшение при нейропатической боли, подавление нейропатической боли и облегчение симптомов нейропатической боли. Термин "пациент" предназначен для включения таких млекопитающих, как люди, нуждающиеся в лечении или предотвращении заболевания, которые в настоящее время проходят лечение или профилактику конкретного заболевания или медицинского состояния, а также тестируемые индивидуумы, у которых соединения по изобретению оценивают или используют в анализе, например модель на животных.
Полагают, что все другие термины, используемые в настоящем документе, имеют их обычное значение, как понимают специалисты в данной области.
Кристаллическое соединение по изобретению можно синтезировать из легкодоступных исходных материалов, как описано ниже, и в примерах. Следует понимать, что когда приведены типичные или предпочтительные условия процесса (т.е. температуры реакций, время, молярные отношения реагентов, растворители, давления и т.д.), если не указано иначе, также можно использовать другие условия процесса. Следует понимать, что когда приведены конкретные условия процесса (т.е. температуры кристаллизации, время, молярные отношения реагентов, растворители, давления и т.д.), если не указано иначе, также можно использовать другие условия процесса. В некоторых случаях реакции или кристаллизацию проводили при комнатной температуре и фактических измерений температуры не проводили. Следует понимать, что комнатная температура может означать среднюю температуру в диапазоне, как правило, ассоциированном с температурой окружающей среды в лабораторных условиях и, как правило, находиться в диапазоне от приблизительно 25°C до приблизительно 50°C. В других случаях реакции или кристаллизацию проводили при комнатной температуре и температуру действительно измеряли и записывали.
Как правило, кристаллизацию проводят в подходящей системе инертного разбавителя или растворителя, примеры которых в качестве неограничивающих примеров включают метанол, этанол, изопропанол, изобутанол, этилацетат, ацетонитрил, дихлорметан, метил-трет-бутиловый эфир и т.п. и их смеси, необязательно содержащие воду. После завершения кристаллизации кристаллическое соединение можно выделять из реакционной смеси любыми общепринятыми способами, такими как осаждение, концентрирование, центрифугирование и т.п.
4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин, применяемый по изобретению, можно легко получать из коммерчески доступных исходных веществ и реагентов с применением описанных в примерах способов. Молярные отношения, описанные в способах по изобретению, можно легко определять различными способами, доступными специалистам в данной области. Например, такие молярные отношения можно легко определять посредством1H ЯМР. Альтернативно, для определения молярного отношения можно использовать способы элементного анализа и ВЭЖХ.
В основном, кристаллическое соединение по изобретению можно получать обработкой 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина инертным разбавителем до полного растворения. Подходящие инертные разбавители в качестве иллюстрации, а не ограничения, включают ацетон, ацетонитрил, этилацетат, метилэтилкетон, метанол, этанол, изопропанол, воду и т.д. Другие подходящие инертные разбавители в качестве иллюстрации, а не ограничения, включают комбинации инертных разбавителей, такие как ацетон с водой, ацетонитрил с водой, этанол и этилацетат, метанол и вода и изопропанол и вода. В одном конкретном варианте осуществления инертный разбавитель представляет собой этилацетат или комбинацию изопропанола с водой. Как правило, растворение проводят при температуре в диапазоне от приблизительно 50°C до приблизительно 90°C, в одном из вариантов осуществления при температуре в диапазоне приблизительно 60-80°C, а в другом варианте осуществления при температуре в диапазоне приблизительно 65-75°C. Затем раствор охлаждают с получением кристаллического соединения по изобретению. В одном конкретном варианте осуществления раствор охлаждают до приблизительно 20-30°C, например, до 25°C. После подходящего количества времени появляются кристаллы. В одном из вариантов осуществления кристаллы появляются приблизительно через 1 час. После того как появляются кристаллы, объем исходного раствора можно уменьшать, а кристаллы выделять и сушить. В одном из вариантов осуществления после появления кристаллов кристаллам до выделения позволяют расти в течение приблизительно 12-24 часов.
В одном из вариантов осуществления кристаллическое соединение по изобретению получают, обрабатывая гидрохлорид 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина этилацетатом и этанолом до полного растворения и охлаждая для проведения кристаллизации. Затем кристаллы выделяют с получением кристаллического гидрохлорида с чистотой, как правило, более 99%. Как правило, этот процесс можно проводить при любой температуре из указанного выше диапазона. Например, растворение можно проводить приблизительно при 65-70°C с последующим охлаждением до комнатной температуры.
Ту же кристаллическую форму можно получать с немного большей чистотой и лучшими водопоглощающими свойствами посредством перекристаллизации. Таким образом, в другом варианте осуществления кристаллический гидрохлорид, получаемый с применением этилацетата и этанола, перекристаллизовывают с изопропанолом и водой, т.е. обрабатывают изопропанолом и водой до полного растворения и охлаждают для проведения кристаллизации. Полученные твердые вещества затем можно выделять и сушить с получением кристаллического соединения по изобретению. Как правило, этот процесс можно проводить при любом диапазоне температур из указанных выше. Например, растворение можно проводить приблизительно при 75°C с последующим охлаждением до комнатной температуры. Отношение объемов изопропанола к воде, как правило, находится в диапазоне от приблизительно 9:1 до приблизительно 21:1, например, в одном из вариантов осуществления приблизительно 10:1, а в другом варианте осуществления приблизительно 20:1.
Исходное вещество гидрохлорида можно получать способами, хорошо известными в данной области, и примеры предоставлены в разделе Примеры настоящего описания. Например, у трет-бутилового эфира 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин-1-карбоновой кислоты можно снимать защиту с применением соляной кислоты в этаноле с получением гидрохлорида.
СВОЙСТВА КРИСТАЛЛОВ
Среди других преимуществ выявлено, что образование кристаллического гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина полезно для очистки самого соединения. Например, кристаллический гидрохлорид по изобретению обладает чистотой более 99,0%.
Как хорошо известно в области порошковой рентгеновской дифракции, относительные высоты пиков в спектрах PXRD зависят от ряда факторов, связанных с получением образца и геометрией устройства, тогда как положения пиков являются относительно нечувствительными к деталям эксперимента. Профиль PXRD получали, как указано в примере 4. Таким образом, в одном из вариантов осуществления кристаллическое соединение по изобретению характеризуется профилем PXRD с определенными положениями пиков.
Кристаллическое соединение характеризуется профилем PXRD, в котором положения пиков по существу соответствуют положениям пиков, приведенным на фиг.1. Эти пики перечислены ниже в порядке снижения относительной интенсивности. Все интенсивности пиков PXRD скорректированы посредством вычитания из каждого пика соответствующей интенсивности фона.
Таким образом, в одном из вариантов осуществления кристаллическое соединение характеризуется профилем порошковой рентгеновской дифракции (PXRD), содержащим дифракционные пики при значениях 2θ 4,44±0,20, 10,22±0,20, 17,16±0,20 и 21,78±0,20; и дополнительно характеризующимся наличием одного или нескольких дополнительных дифракционных пиков при значениях 2θ, выбранных из 8,11±0,20, 13,18±0,20, 16,06±0,20, 18,38±0,20, 23,76±0,20, 26,32±0,20, 27,24±0,20, 29,60±0,20 и 31,94±0,20.
Кривую дифференциальной сканирующей калориметрии (DSC) получали, как указано в примере 5. Таким образом, в одном из вариантов осуществления кристаллическое соединение характеризуется его термограммой DSC. В одном из вариантов осуществления, как видно на фиг.2, кристаллическое соединение характеризуется термограммой DSC, демонстрирующей температуру плавления приблизительно 196,9°C, без значительного пиролиза ниже, чем приблизительно 200,0°C.
Термогравиметрический анализ (TGA) проводили на кристаллическом соединении, как описано в примере 5. Таким образом, в одном из вариантов осуществления кристаллическое соединение характеризуется его кривой TGA. В одном из вариантов осуществления, как видно на фиг.2, кристаллическое соединение характеризуется кривой TGA, демонстрирующей потерю растворителей и/или воды (приблизительно 0,5%) при температурах ниже, чем приблизительно 150,0°C.
Показано, что кристаллическое соединение по изобретению обладает обратимым профилем сорбции/десорбции с приемлемыми уровнями гигроскопичности. Например, кристаллическое соединение не обладает или обладает минимальной склонностью к гигроскопичности, и продемонстрировало менее чем приблизительно 2,0% увеличение массы при воздействии до 90% относительной влажности, как видно на фиг.3.
Эти свойства кристаллического соединения по изобретению дополнительно проиллюстрированы в примерах ниже.
ПОЛЕЗНОСТЬ
4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин обладает активностью ингибитора обратного захвата серотонина и норэпинефрина. Таким образом, полагают, что это соединение, а также кристаллическое соединение по изобретению, обладают терапевтической полезностью в качестве комбинированного ингибитора обратного захвата серотонина и норэпинефрина (SNRI).
Константа ингибирования (Ki) соединения представляет собой концентрацию конкурирующего лиганда в конкурентном анализе, которая может занимать 50% переносчиков при отсутствии радиоактивных лигандов. Значения Ki можно определять из исследований конкурентного связывания радиоактивного лиганда с3H-низоксетином (для переносчика норэпинефрина, NET) и3H-циталопрамом (для переносчика серотонина, SERT), как описано в анализе 1. Эти значения Ki получают на основании значений IC50 в анализе связывания с применением уравнения Ченга-Прусоффа и радиоактивного лиганда Kd (Cheng & Prusoff (1973) Biochem. Pharmacol. 22(23): 3099-3108). Функциональные значения IC50 можно определять в анализах функционального ингибирования захвата, описанных в анализе 2. Эти значения IC50 можно преобразовывать в значения Ki с применением уравнения Ченга-Прусоффа и Km переносчика для транспортера. Однако следует отметить, что условия анализа захвата, описанные в анализе 2, являются такими, что значения IC50 являются очень близкими к значениям Ki, что желательным может являться математическое преобразование, так как концентрация нейромедиатора (5-HT или NE), используемая в анализе, находится значительно ниже его Km для соответствующего транспортера.
Иллюстративные анализы для определения активности ингибирования обратного захвата серотонина и/или норэпинефрина кристаллическим соединением по изобретению, в качестве иллюстрации, а не ограничения, включают анализы, где измеряют связывание SERT и NET, например, как описано в анализе 1. Кроме того, в анализе, таком как анализ, описанный в анализе 1, полезно знать уровень связывания и захвата DAT. Пригодные вторичные анализы включают анализы захвата нейротрансмиттера для измерения конкурентного ингибирования захвата серотонина и норадреналина в клетки, экспрессирующие соответствующий рекомбинантный транспортер человека или крысы (hSERT, hNET или hDAT), как описано в анализе 2, и анализы связывания радиоактивного лиганда и захвата нейромедиатора ex vivo, которые используют для определения занятости SERT, NET и DAT в ткани in vivo, как описано в анализе 3. Другие анализы, пригодные для оценки фармакологических свойств, включают анализы, перечисленные в анализе 4. Иллюстративные анализы in vivo включают тест с введением в лапу формалина, описанный в анализе 5, который представляет собой надежное средство прогноза клинической эффективности для лечения нейропатической боли, и модель лигатуры спинального нерва, описанную в анализе 6. Указанные выше анализы пригодны для определения терапевтической полезности кристаллического соединения по изобретению, например, активности снижения нейропатической боли. С применением различных анализов in vitro и in vivo, хорошо известных специалистам в данной области, можно продемонстрировать другие свойства и применения кристаллического соединения по изобретению.
Полагают, что кристаллическое соединение по изобретению пригодно для лечения и/или предотвращения медицинских состояний в которые вовлечена регуляция функционирования транспортеров моноаминов, в частности состояния, опосредованные ингибированием обратного захвата серотонина и норэпинефрина или отвечающие за него. Таким образом, полагают, что пациентов, страдающих от заболевания или нарушения, лечение которых проводят ингибированием транспортера серотонина и/или нораэпинефрина, можно лечить введением терапевтически эффективного количества кристаллического соединения по изобретению. Такие медицинские состояния в качестве примера включает болевые нарушения, такие как нейропатическая боль, фибромиалгия и хроническая боль, депрессивные расстройства, такие как глубокая депрессия, аффективные расстройства, такие как тревожное расстройство, синдром дефицита внимания с гиперактивностью, когнитивные расстройства, такие как деменция, и недержание мочи при напряжении.
Количество активного средства, вводимого на дозу, или общее количество, вводимое в сутки, можно предопределять или его можно определять относительно индивидуального пациента, принимая в расчет многочисленные факторы, включающие характер и тяжесть состояния пациента, подлежащее лечению состояние, возраст, массу и общее состояние здоровья пациента, переносимость пациентом активного средства, способ введения, фармакологические факторы, такие как активность, эффективность, фармакокинетика и токсикологические профили активного средства и любые вводимые вторичные средства и т.п. Лечение пациента, страдающего от заболевания или медицинского состояния (такого как нейропатическая боль), можно начинать с предопределенной дозы или дозы, определенной лечащим врачом, и продолжать в течение периода времени, необходимого для предотвращения, улучшения, подавления или облегчения симптомов заболевания или медицинского состояния. За пациентами, подвергаемыми такому лечению для определения эффективности терапии, как правило, наблюдают стандартными способами. Например, при лечении нейропатической боли измерение эффективности лечения может включать оценку качества жизни пациента, например, улучшения качества сна, выход на работу, способность к физической нагрузке и к хождению и т.д. Также для помощи в оценке уровня боли пациента можно использовать шкалы оценки боли, действующие на точечной основе. Индикаторы для других заболеваний и состояний, описываемых в настоящем документе, хорошо известны специалистам в данной области и легкодоступны лечащему врачу. Непрерывное наблюдение лечащим врачом гарантирует, что в любой момент времени будет вводиться оптимальное количество активного средства, а также облегчит определение длительности лечения. Особое значение представляет также введение вторичных средств, так как их выбор, дозировка и длительность лечения также может требовать регулирования. Таким образом, схему лечения и режим дозирования можно регулировать в течение курса лечения так, чтобы происходило введение наименьшего количества активного средства, которое демонстрирует желаемую эффективность, и, кроме того, чтобы продолжать введение только столько, сколько необходимо для успешного лечения заболевания или медицинского состояния.
Болевые нарушения
Показано, что SNRI оказывают положительное воздействие на боль, такую как болезненная диабетическая нейропатия (дулоксетин, Goldstein et al. (2005) Pain 116: 109-118; венлафаксин, Rowbotham et al. (2004) Pain 110: 697-706), фибромиалгия (дулоксетин, Russell et al. (2008) Pain 136(3): 432-444; милнаципран, Vitton et al. (2004) Human Psychopharmacology 19: S27-S35) и мигрень (венлафаксин, Ozyalcin et al. (2005) Headache 45(2): 144-152). Таким образом, один из вариантов осуществления изобретения относится к способу лечения болевого нарушения, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению. Как правило, терапевтически эффективное количество представляет собой количество, которого достаточно для ослабления боли. Иллюстративные болевые нарушения в качестве иллюстрации включают острую боль, постоянную боль, хроническую боль, воспалительную боль и нейропатическую боль. Более конкретно они включают боль, ассоциированную с артритом; позвоночной болью, включающей хроническую боль в нижней части спины; раком, включающим связанную с опухолью боль (например, боль в костях, головную боль, лицевую боль или висцеральную боль) и боль, ассоциированную с лечением злокачественных опухолей (например, постхимиотерапевтический синдром, синдром хронической послеоперационной боли и послерадиационный синдром); синдромом запястного канала; фибромиалгией; головными болями, включая хронические головные боли напряжения; воспалением, ассоциированным с полимиалгией, ревматоидным артритом и остеоартритом; мигренью; нейропатической болью, включая комплексный регионарный болевой синдром; общей болью; послеоперационной болью; болью в плече; синдромами центральных болей, включая постинсультную боль и боль, ассоциированную с повреждением спинного мозга и рассеянным склерозом; фантомными болями в ампутированных конечностях; болью, ассоциированной с болезнью Паркинсона и висцеральной болью (например, синдром раздраженного кишечника), или вызываемую ими. Особый интерес представляет лечение нейропатической боли, которая включает диабетическую периферическую нейропатию (DPN), связанную с ВИЧ нейропатию, постгерпетическую невралгию (PHN) и индуцированную химиотерапией периферическую нейропатию. Когда их применяют для лечения болевых нарушений, таких как нейропатическая боль, соединения по изобретению можно вводить в комбинации с другими терапевтическими средствами, включая противосудорожные средства, антидепрессанты, миорелаксанты, NSAID, агонисты опиоидов, антагонисты опиоидов, селективные ингибиторы обратного захвата серотонина, блокаторы натриевых каналов и симпатолитики. В настоящем документе описаны иллюстративные соединения в этих классах.
Депрессивные расстройства
Другой вариант осуществления изобретения относится к способу лечения депрессивного расстройства, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению. Как правило, терапевтически эффективное количество представляет собой количество, которого достаточно для уменьшения депрессии и обеспечения чувства общего благополучия. Иллюстративные депрессивные расстройства в качестве иллюстрации, а не ограничения, включают депрессию, ассоциированную с болезнью Альцгеймера, биполярное расстройство, рак, жестокое обращение с детьми, бесплодие, болезнь Паркинсона, состояние после инфаркта миокарда и психоз; дистимию; синдром брюзгливости или раздражительности у старых людей; индуцированную депрессию; глубокую депрессию; детскую депрессию; постклимактерическую депрессию; послеродовую депрессию; рецидивирующую депрессию; одиночные эпизоды депрессии; и субсиндромальную симптоматическую депрессию. Особый интерес представляет лечение глубокой депрессии. При использовании для лечения депрессивных расстройств соединения по изобретению можно вводить в комбинации с другими терапевтическими средствами, включающими антидепрессанты и двойные ингибиторы обратного захвата серотонина-норэпинефрина. В настоящем документе описаны иллюстративные соединения в этих классах.
Аффективные расстройства
Другой вариант осуществления изобретения относится к способу лечения аффективного расстройства, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению. Иллюстративные аффективные расстройства в качестве иллюстрации, а не ограничения, включают тревожные расстройства, такие как общее тревожное расстройство; тревожное расстройство личности; расстройство пищевого поведения, такое как нервная анорексия, нейрогенная булимия и ожирение; обсессивно-компульсивное расстройство; паническое расстройство; расстройства личности, такие как тревожное расстройство личности и синдром дефицита внимания с гиперактивностью (ADHD); синдром посттравматического стресса; фобии, такие как агорафобия, а также простые и другие специфические фобии и социофобия; предменструальный синдром; психотические расстройства, такие как шизофрения и мания; сезонное аффективное расстройство; сексуальная дисфункция, включая преждевременную эякуляцию, мужскую импотенцию и женскую сексуальную дисфункцию, такую как расстройство женского сексуального возбуждения; социальное тревожное расстройство и нарушение в виде злоупотребления психоактивными веществами, включая химические зависимости, такие как склонность к потреблению спирта, бензодиазепинов, кокаина, героина, никотина и фенобарбитала, а также синдромы отмены, которые могут возникать вследствие этих зависимостей. При использовании для лечения аффективных расстройств соединения по изобретению можно вводить в комбинации с другими терапевтическими средствами, включая антидепрессанты. В настоящем документе описаны иллюстративные соединения в этих классах.
Для лечения синдрома дефицита внимания с гиперактивностью (ADHD) одобрен атомоксетин, который в 10 раз более селективен в отношении NET, и клинические исследования показали, что SNRI, венлафаксин, также оказывает положительное воздействие при лечении ADHD (Mukaddes et al. (2002) Eur. Neuropsychopharm. 12(Supp 3):421). Таким образом, также полагают, что кристаллическое соединение по изобретению будет пригодно в способах лечения синдрома дефицита внимания с гиперактивностью при введении пациенту терапевтически эффективного количества кристаллического соединения по изобретению. При использовании для лечения депрессии кристаллическое соединение по изобретению можно вводить в комбинации с другими терапевтическими средствами, включая антидепрессанты. В настоящем документе описаны иллюстративные соединения в этих классах.
Когнитивные расстройства
Другой вариант осуществления изобретения относится к способу лечения когнитивного расстройства, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению. Иллюстративные когнитивные расстройства в качестве иллюстрации, а не ограничения, включают: деменцию, которая включает дегенеративную деменцию (например, болезнь Альцгеймера, болезнь Крейтцфельдта-Якоба, хорея Хантингтона, болезнь Паркинсона, болезнь Пика и сенильная деменция), сосудистую деменцию (например, мультиинфарктная деменция) и деменцию, ассоциированную с занимающими интракраниальное пространство очагами повреждения, с травмой, инфекциями и связанными состояниями (включая инфекцию ВИЧ), с метаболизмом, токсинами, гипоксией и витаминной недостаточностью; и умеренное когнитивное нарушение, ассоциированное со старением, такое как ассоциированное с возрастом нарушение памяти, амнезийное расстройство и связанное с возрастом снижение когнитивной функции. При использовании для лечения когнитивных расстройств кристаллическое соединение по изобретению можно вводить в комбинации с другими терапевтическими средствами, включая средства против болезни Альцгеймера и средства против болезни Паркинсона. В настоящем документе описаны иллюстративные соединения в этих классах.
Другие нарушения
Также показано, что SNRI эффективны для лечения недержания мочи при напряжении (Dmochowski (2003) Journal of Urology 170(4): 1259-1263). Таким образом, другой вариант осуществления изобретения относится к способу лечения недержание мочи при напряжении, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению. При использовании для лечения недержания мочи при напряжении соединения по изобретению можно вводить в комбинации с другими терапевтическими средствами, включая противосудорожные средства. В настоящем документе описаны иллюстративные соединения в этих классах.
Дулоксетин, SNRI, проходит клинические испытания для оценки его эффективности при лечении синдрома хронической усталости, и недавно показано, что он эффективен при лечении фибромиалгии (Russell et al. (2008) Pain 136(3): 432-444). Полагают, что пригодным для этого также будет кристаллическое соединение по изобретению, вследствие его ожидаемой способности ингибировать SERT и NET, и другой вариант осуществления изобретения относится к способу лечения синдрома хронической усталости, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению.
Показано, что сибутрамин, ингибитор обратного захвата норэпинефрина и допамина, пригоден для лечения ожирения (Wirth et al. (2001) JAMA 286(11): 1331-1339). Полагают, что пригодным для этого также будет кристаллическое соединение по изобретению вследствие его ожидаемой способности ингибировать NET, и другой вариант осуществления изобретения относится к способу лечения ожирения, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению.
Показано, что десвенлафаксин, SNRI, ослабляет вазомоторные симптомы, ассоциированные с менопаузой (Deecher et al. (2007) Endocrinology 148(3): 1376-1383). Полагают, что пригодным для этого также будет кристаллическое соединение по изобретению, вследствие его ожидаемой способности ингибировать SERT и NET, и другой вариант осуществления изобретения относится к способу лечения вазомоторных симптомов, ассоциированных с менопаузой, включающему введение пациенту терапевтически эффективного количества кристаллического соединения по изобретению.
Средства исследования
Так как полагают, что кристаллическое соединение по изобретению обладает и активностью ингибирования обратного захвата серотонина и активностью ингибирования обратного захвата норэпинефрина, также полагают, что это соединение найдет применение в качестве средства исследования для изучения и исследования биологических систем или образцов, содержащих транспортеры серотонина или норэпинефрина. В таких исследованиях, которые можно проводить in vitro или in vivo, можно использовать любые подходящие биологическую систему или образец, содержащие транспортеры серотонина и/или норэпинефрина. Характерные биологические системы или образцы, подходящие для таких исследований, в качестве неограничивающих примеров включают клетки, экстракты клеток, плазматические мембраны, образцы тканей, выделенные органы, млекопитающих (таких как мыши, крысы, морские свинки, кролики, собаки, свиньи, люди и т.д.) и т.п., где особый интерес представляют млекопитающие. В одном конкретном варианте осуществления изобретения у млекопитающего ингибируют обратный захват серотонина посредством введения ингибирующего обратный захват серотонина количества кристаллического соединения по изобретению. В одном конкретном варианте осуществления изобретения у млекопитающего ингибируют обратный захват норэпинефрина посредством введения ингибирующего обратный захват норэпинефрина количества кристаллического соединения по изобретению. Кристаллическое соединение по изобретению также можно использовать в качестве средства исследования, проводя биологические анализы с использованием такого соединения.
При использовании в качестве средства исследования биологическую систему или образец, содержащие транспортер серотонина и/или транспортер норэпинефрина, как правило, приводят в контакт с ингибирующим обратный захват серотонина или ингибирующим обратный захват норэпинефрина количеством кристаллического соединения по изобретению. После того как биологическую систему или образец подвергают воздействию соединения, с применением обычных способов и оборудования определяют эффекты ингибирования обратного захвата серотонина и/или обратного захвата норэпинефрина. Воздействие включает приведение клеток или ткани в контакт с соединением, введение соединения млекопитающему, например посредством i.p. или i.v. введения и т.д. Этот определяющий этап может включать измерение ответа, т.е. количественный анализ, или может включать наблюдение, т.е. качественный анализ. Измерение ответа включает, например, определение действия соединения на биологическую систему или образец с применением общепринятых способов и оборудования, таких как анализы обратного захвата серотонина и норэпинефрина. Результаты анализов можно использовать для определения уровня активности, а также количества соединения, необходимого для достижения желаемого результата, т.е. количества, ингибирующего обратный захват серотонина и ингибирующего обратный захват норэпинефрина.
Кроме того, кристаллическое соединение по изобретению можно использовать в качестве средства исследования для оценки других химических соединений, и, таким образом, оно также пригодно в скринирующих анализах, например, для поиска новых соединений с активностью ингибирования обратного захвата серотонина и активностью ингибирования обратного захвата норэпинефрина. Таким образом, кристаллическое соединение по изобретению применяют в качестве стандарта при анализе для обеспечения сравнения результатов, полученных с тестируемым соединением и с кристаллическим соединением по изобретению с идентификацией тестируемых соединений с приблизительно равной или более высокой активностью ингибирования обратного захвата, если она вообще существует. Например, данные по обратному захвату для тестируемого соединения или группы тестируемых соединений сравнивают с данными по обратному захвату для кристаллического соединения по изобретению с идентификацией тех тестируемых соединений, которые обладают желаемыми свойствами, например, тестируемых соединений с активностью ингибирования обратного захвата, приблизительно равной или более высокой, чем у кристаллического соединения по изобретению, если она вообще существует. Этот аспект изобретения в качестве отдельных вариантов осуществления включает получение данных сравнения (с применением соответствующих анализов) и анализ тестовых данных с идентификацией представляющих интерес тестируемых соединений. Таким образом, тестируемое соединение можно оценивать в биологическом анализе способом, включающим стадии (a) проведения биологического анализа с тестируемым соединением с получением первого значения анализа; (b) проведения биологического анализа с кристаллическим соединением по изобретению с получением второго значения анализа; где стадию (a) проводят до, после или одновременно со стадией (b); и (c) сравнения первого значения анализа со стадии (a) со вторым значением анализа со стадии (b). Иллюстративные биологические анализы включают анализы обратного захвата серотонина и норэпинефрина.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СОСТАВЫ
Кристаллическое соединение по изобретению, как правило, вводят пациенту в форме фармацевтической композиции или состава. Такие фармацевтические композиции можно вводить пациенту любым приемлемым способом введения, включая в качестве неограничивающих примеров пероральный, ректальный, вагинальный, назальный, ингаляционный, топический (включая трансдермальный) и парентеральный способы введения. Однако специалистам в данной области следует понимать, что после формулирования кристаллического соединения по изобретению оно может больше не находиться в кристаллической форме, т.е. оно может быть растворено в подходящем носителе. Кроме того, кристаллическое соединение по изобретению можно вводить, например, перорально, несколькими дозами в сутки (например, дважды, трижды или четырежды в сутки), одной суточной дозой или дозой для введения дважды в сутки, одной еженедельной дозой и т.д.
Таким образом, в одном из вариантов осуществления изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и кристаллическое соединение по изобретению. При желании композиции могут содержать другие терапевтические и/или формулирующие средства. При обсуждении композиций "кристаллическое соединение по изобретению" в настоящем документе для отличения его от других компонентов состава, таких как носитель, также может быть указано как "активное средство".
Фармацевтические композиции по изобретению, как правило, содержат терапевтически эффективное количество кристаллического соединения по изобретению. Однако специалисты в данной области понимают, что фармацевтическая композиция может содержать большее, чем терапевтически эффективное количество, т.е. валовые композиции, или меньшее, чем терапевтически эффективное количество, т.е. индивидуальные стандартные дозы, предназначенные для многократного введения с достижением терапевтически эффективного количества. Как правило, композиция содержит приблизительно от 0,01-95% масс. активного средства, включая, приблизительно 0,01-30% масс., такие как приблизительно 0,01-10% масс., с фактическим количеством, зависящим от самого состава, способа введения, частоты дозирования и т.д. Например, в одном из вариантов осуществления композиция, подходящая для пероральной лекарственной формы, может содержать приблизительно 5-70% масс. или приблизительно 10-60% масс. активного средства. В одном иллюстративном варианте осуществления фармацевтическая композиция содержит приблизительно от 1 до 20 мг активного средства, включая приблизительно от 1 до 15 мг активного средства и приблизительно от 1 до 10 мг активного средства. В другом иллюстративном варианте осуществления фармацевтическая композиция содержит приблизительно от 5 до 20 мг активного средства, включая приблизительно от 7,5 до 15 мг активного средства. Например, активное средство можно формулировать в стандартных дозах 1 мг и 10 мг.
В фармацевтических композициях по изобретению можно использовать любой общепринятый носитель или эксципиент. Выбор конкретного носителя или эксципиента или комбинаций носителей или эксципиентов зависит от способа введения, используемого для лечения конкретного пациента или типа медицинского состояния или болезненного состояния. В этом отношении получение подходящей композиции для конкретного способа введения полностью находится в объеме знаний специалистов в области фармацевтики. Кроме того, носители или эксципиенты, используемые в таких композициях, являются коммерчески доступными. В качестве дополнительной иллюстрации общепринятые способы формулирования описаны в Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); и H. C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, Maryland (1999).
Характерные примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, в качестве неограничивающих примеров включают следующее: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу, такую как микрокристаллическая целлюлоза, и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и целлюлозоацетат; порошковый трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные средства, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; растворы с фосфатным буфером; сжатые газы-пропелленты, такие как хлорфторуглероды и гидрофторуглероды; и другие нетоксичные сочетаемые вещества, применяемые в фармацевтических композициях.
Фармацевтические композиции, как правило, получают посредством тщательного и однородного смешивания или перемешивания активного средства с фармацевтически приемлемым носителем и одним или несколькими необязательными ингредиентами. Затем полученную однородно перемешанную смесь с применением общепринятых способов и оборудования можно формовать или помещать в таблетки, капсулы, пилюли, контейнеры, картриджи, раздаточные устройства и т.п.
В одном из вариантов осуществления фармацевтические композиции являются подходящими для перорального введения. Одна иллюстративная схема дозирования может представлять собой пероральную лекарственную форму, вводимую один раз или дважды в сутки. Подходящие композиции для перорального введения могут находиться в форме капсул, таблеток, пилюль, таблеток-леденцов, крахмальных капсул, драже, порошков, гранул; растворов или суспензий в водной или неводной жидкости; жидких эмульсий масло-в-воде или вода-в-масле; эликсиров или сиропов и т.п.; где каждый содержит предопределенное количество активного средства.
Когда она предназначена для перорального введения в твердой лекарственной форме (т.е. в виде капсул, таблеток, пилюль и т.п.), композиция, как правило, содержит активное средство и один или несколько фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат. Твердые лекарственные формы также могут содержать наполнители или сухие разбавители, такие как крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; связующие средства, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; увлажнители, такие как глицерин; дезинтегрирующие средства, такие как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, определенные силикаты и/или карбонат натрия; замедляющие растворение средства, такие как парафин; ускорители всасывания, так как четвертичные аммонийные соединения; увлажнители, такие как цетиловый спирт и/или глицерилмоностеарат; абсорбенты, такие как каолин и/или бентонитовая глина; смазочные средства, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и/или их смеси; красители и буферные средства.
Также в фармацевтических композициях могут присутствовать средства контроля высвобождения, увлажнители, покрывающие средства, подсластитель, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты. Иллюстративные покрывающие средства для таблеток, капсул, пилюль и т.п. включают средства, применяемые для растворяющихся в кишечнике покрытий, такие как ацетат фталат целлюлозы, фталат поливинилацетата, фталат гидроксипропилметилцеллюлозы, сложноэфирные сополимеры метакриловой кислоты-метакриловой кислоты, тримеллитат ацетилцеллюлозы, карбоксиметилэтилцеллюлоза, ацетат сукцинат гидроксипропилметилцеллюлозы и т.п. Примеры фармацевтически приемлемых антиоксидантов включают водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфаты натрия, сульфит натрия и т.п.; маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, лецитин, пропилгаллат, альфа-токоферол и т.п.; и хелатирующие металлы средства, такие как лимонная кислота, этилендиаминтетрауксусная кислота, сорбит, винная кислота, фосфорная кислота и т.п.
Композиции также можно формулировать для обеспечения замедленного или контролируемого высвобождения активного средства с применением в качестве примера гидроксипропилметилцеллюлозы в различных пропорциях или других полимерных матриксов, липосом и/или микросфер. Кроме того, фармацевтические композиции по изобретению могут содержать средства, снижающие прозрачность, и их можно формулировать так, чтобы они высвобождали активное средство только, или преимущественно, в определенной части желудочно-кишечного тракта, необязательно, замедленным способом. Примеры включающих композиций, которые можно использовать, включают полимерные вещества и воски. Активное средство при необходимости также может находиться в микрокапсулированной форме с одним или несколькими из описанных выше эксципиентов.
Подходящие жидкие лекарственные формы для перорального введения в качестве иллюстрации включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Жидкие лекарственные формы, как правило, содержат активное средство и инертный разбавитель, такой как, например, вода или другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (например, хлопковое масло, арахисовое, кукурузное, зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные сорбитановые эфиры жирных кислот и их смеси. Суспензии могут содержать суспендирующие средства, такие как, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси.
Когда они предназначены для перорального введения, фармацевтические композиции по изобретению можно упаковывать в виде стандартной лекарственной формы. Термин "стандартная лекарственная форма" относится к физически дискретной единице, подходящей для дозирования пациенту, т.е. к каждой единице, содержащей предопределенное количество активного средства, рассчитанное на получение желаемого терапевтического эффекта отдельно или в комбинации с одной или несколькими дополнительными единицами. Например, такие стандартные лекарственные формы могут представлять собой капсулы, таблетки, пилюли и т.п.
В другом варианте осуществления композиции по изобретению являются подходящими для введения посредством ингаляции и, как правило, находятся в форме аэрозоля или порошка. Такие композиции, как правило, вводят с применением хорошо известных средств доставки, таких как распылитель, ингалятор сухих порошков или мерных доз. Распылители создают поток воздуха с высокой скоростью, что вызывает распыление композиции в виде аэрозоля, который доставляется в дыхательные пути пациента. Иллюстративный состав для распылителя содержит активное средство, растворенное в носителе с образованием раствора, или тонкоизмельченное и комбинированное с носителем с образованием суспензии тонкоизмельченных частиц пригодного для вдыхания размера. Ингаляторы сухих порошков вводят активное средство в виде легкосыпучего порошка, который диспергируется в потоке воздуха у пациента при вдохе. Иллюстративный состав сухого порошка содержит активное средство в сухой смеси с эксципиентом, таким как лактоза, крахмал, маннит, декстроза, полимолочная кислота, сополимер полилактида и гликолида и их сочетания. Ингаляторы мерных доз выпускают мерное количество активного средства с использованием сжатого газа-пропеллента. Иллюстративный состав мерной дозы содержит раствор или суспензию активного средства в сжиженном пропелленте, таком как хлорфторуглерод или гидрофторалкан. Необязательные компоненты таких составов включают сорастворители, такие как этанол или пентан, и поверхностно-активные вещества, такие как триолеат сорбитана, олеиновая кислота, лецитин и глицерин. Такие композиции, как правило, получают добавлением охлажденного или сжатого гидрофторалкана в подходящий контейнер, содержащий активное средство, этанол (если присутствует) и поверхностно-активное вещество (если присутствует). Для получения суспензии активное средство тонко измельчают, а затем комбинируют с пропеллентом. Альтернативно суспензионный состав можно получать посредством сушки распылением покрытия из поверхностно-активного вещества на тонкоизмельченных частицах активного средства. Затем состав помещают в аэрозольный баллон, составляющий часть ингалятора.
Кристаллическое соединение по изобретению также можно вводить парентерально (например, посредством подкожной, внутривенной, внутримышечной или интраперитонеальной инъекции). Для такого введения активное средство предоставляют в стерильных растворе, суспензии или эмульсии. Иллюстративные растворители для получения таких составов включают воду, физиологический раствор, низкомолекулярные спирты, такие как пропиленгликоль, полиэтиленгликоль, масла, желатин, сложные эфиры жирных кислот, такие как этилолеат и т.п. Типичный парентеральный состав представляет собой стерильный водный раствор активного средства с pH 4-7. Парентеральные составы также могут содержать один или несколько солюбилизаторов, стабилизаторов, консервантов, увлажнителей, эмульгаторов и диспергирующих средств. Эти составы можно делать стерильными, используя стерильную среду для инъекций, стерилизующее средство, фильтрацию, облучение или нагревание.
Кристаллическое соединение по изобретению также можно вводить трансдермально с использованием известных систем и эксципиентов для трансдермальной доставки. Например, соединение можно смешивать с усилителями проницаемости, такими как пропиленгликоль, монолаурат полиэтиленгликоля, азациклоалкан-2-оны и т.п., и вводят в пластырь или подобную систему доставки. В таких трансдермальных композициях при желании можно использовать дополнительные эксципиенты, включая гелеобразующие средства, эмульгаторы и буферы.
При желании кристаллическое соединение по изобретению можно вводить в комбинации с одним или несколькими другими терапевтическими средствами. Таким образом, в одном из вариантов осуществления композиции по изобретению могут необязательно содержать другие лекарственные средства, которые совместно вводят с кристаллическим соединением по изобретению. Например, композиция может дополнительно содержать одно или несколько лекарственных средств (также обозначаемых как "вторичные средства"), выбранных из группы средств против болезни Альцгеймера, противосудорожных средств (противоэпилептических средств), антидепрессантов, средств против болезни Паркинсона, двойных ингибиторов обратного захвата серотонина-норэпинефрина (SNRI), нестероидных противовоспалительных средств (NSAID), ингибиторов обратного захвата норэпинефрина, агонистов опиоидов (опиоидных анальгетиков), антагонистов опиоидов, селективных ингибиторов обратного захвата серотонина, блокаторов натриевых каналов, симпатолитиков и их сочетаний. Многочисленные примеры таких терапевтических средств хорошо известны в данной области, а примеры описаны в настоящем документе. Комбинируя кристаллическое соединение по изобретению со вторичными средствами, можно достигать тройного лечения, т.е. активности ингибитора обратного захвата серотонина, активности ингибитора обратного захвата норэпинефрина и активности, ассоциированной со вторичными средствами (например, противодепрессивной активности), используя только два активных компонента. Так как фармацевтические композиции, содержащие два активных компонента, как правило, легче формулировать, чем композиции, содержащие три активных компонента, такие двухкомпонентные композиции обеспечивают значительное преимущество по сравнению с композициями, содержащими три активных компонента. Таким образом, в еще одном аспекте по изобретению фармацевтическая композиция содержит кристаллическое соединение по изобретению, второе активное средство и фармацевтически приемлемый носитель. Также в композицию можно включать третье, четвертое и т.д. активные средства. При комбинированном лечении вводимое количество соединения по изобретению, а также количество вторичных средств может быть меньше количества, обычно вводимого при монотерапии.
Кристаллическое соединение по изобретению можно физически смешивать со вторым активным средством с получением композиции, содержащей оба средства; или каждое средство может находиться в отдельной и индивидуальной композиции, которые вводят пациенту одновременно или последовательно. Например, кристаллическое соединение по изобретению можно комбинировать со вторым активным средством с применением общепринятых способов и оборудования с получением комбинации активных средств, содержащей кристаллическое соединение по изобретению и второе активное средство. Кроме того, активные средства можно комбинировать с фармацевтически приемлемым носителем с получением фармацевтической композиции, содержащей кристаллическое соединение по изобретению, второе активное средство и фармацевтически приемлемый носитель. В этом варианте осуществления компоненты композиции, как правило, смешивают или перемешивают с получением физической смеси. Затем физическую смесь вводят в терапевтически эффективном количестве с использованием любого из способов, описываемых в настоящем документе.
Альтернативно активные средства до введения пациенту можно оставлять раздельными и индивидуальными. В этом варианте осуществления средства перед введением не физически смешивают, а вводят одновременно или в разные моменты времени в виде разных композиций. Такие композиции можно упаковывать раздельно или можно упаковывать вместе в наборе. При введении в разные моменты времени вторичные средства, как правило, вводят менее чем через 24 часа после введения соединения по изобретению, в любой момент в диапазоне от момента, одновременного с введением соединения по изобретению, до момента приблизительно через 24 часа после дозирования. Это также обозначают как последовательное введение. Таким образом, кристаллическое соединение по изобретению можно вводить перорально одновременно или последовательно с другим активным средством с использованием двух таблеток, с одной таблеткой для каждого активного средства, где последовательно может означать вводимое непосредственно после введения соединения по изобретению или через какое-либо предопределенное время позже (например, через один час или через три часа). Альтернативно комбинацию можно вводить различными способами введения, т.е. одно средство вводить перорально, а другое посредством ингаляции.
В одном из вариантов осуществления набор содержит первую лекарственную форму, содержащую кристаллическое соединение по изобретению, и по меньшей мере одну дополнительную лекарственную форму, содержащую одно или несколько вторичных средств, указанных в настоящем документе, в количествах, достаточных для осуществления способов по изобретению. Первая лекарственная форма и вторая (или третья и т.д.) лекарственная форма совместно содержат терапевтически эффективное количество активных средств для лечения или предотвращения заболевания или медицинского состояния у пациента.
Когда включено вторичное средство(а), оно присутствует в терапевтически эффективном количестве, т.е., как правило, его вводят в количестве, обеспечивающем положительное терапевтическое воздействие при совместном введении с кристаллическим соединением по изобретению. Вторичные средства могут находиться в форме фармацевтически приемлемой соли, сольвата, оптически чистого стереоизомера и т.д. Таким образом, подразумевается, что вторичные средства, перечисленные ниже, включают все такие формы, и они являются коммерчески доступными, или их можно получать с использованием общепринятых способов и реагентов.
Характерные средства против болезни Альцгеймера включают в качестве неограничивающих примеров донепезил, галантамин, мемантин, ривастигмин, селегилин, такрин и их сочетания.
Характерные противосудорожные средства (противоэпилептические средства) включают в качестве неограничивающих примеров ацетазоламид, албутоин, 4-амино-3-гидроксимасляную кислоту, бекламид, карбамазепин, цинромид, клометиазол, клоназепам, диазепам, диметадион, этеробарб, этадион, этосуксимид, этотоин, фелбамат, фосфенитоин, габапентин, лакозамид, ламотригин, лоразепам, бромид магния, сульфат магния, мефенитоин, мефобарбитал, метсуксимид, мидазолам, нитразепам, оксазепам, окскарбазепин, параметадион, фенацетамид, фенетурид, фенобарбитал, фенсукцимид, фенитоин, бромид калия, прегабалин, примидон, прогабид, бромид натрия, вальпроат натрия, султиам, тиагабин, топирамат, триметадион, вальпроевую кислоту, вальпромид, вигабатрин, зонизамид и их сочетания. В конкретном варианте осуществления противосудорожное средство выбрано из карбамазепина, габапентина, прегабалина и их сочетаний.
Характерные антидепрессанты включают в качестве неограничивающих примеров адиназолам, амитриптилин, кломипрамин, дезипрамин, дотиепин (например, гидрохлорид дотиепина), доксепин, имипрамин, лофепрамин, митразапин, нортриптилин, протриптилин, тримипрамин, венлафаксин, зимелидин и их сочетания.
Характерные средства против болезни Паркинсона включают в качестве неограничивающих примеров амантадин, апоморфин, бензатропин, бромокриптин, карбидопу, дифенгидрамин, энтакапон, леводопу, перголид, прамипексол, ропинирол, селегилин, толкапон, тригексифенидил и их сочетания.
Характерные двойные ингибиторы обратного захвата серотонина-норэпинефрина (SNRI) включают в качестве неограничивающих примеров бицифадин, десвенлафаксин, дулоксетин, милнаципран, нефазодон, венлафаксин и их сочетания.
Характерные нестероидные противовоспалительные средства (NSAID) включают в качестве неограничивающих примеров ацеметацин, ацетаминофен, ацетилсалициловую кислоту, алклофенак, алминопрофен, амфенак, амиприлозу, амоксиприн, аниролак, апазон, азапропазон, бенорилат, беноксапрофен, бензиперилон, броперамол, буклоксовую кислоту, карпрофен, клиданак, диклофенак, дифлунизал, дифталон, эноликам, этодолак, эторикоксиб, фенбуфен, фенклофенак, фенклозовую кислоту, фенопрофен, фентиазак, фепразон, флуфенамовую кислоту, флуфенизал, флупрофен, флурбипрофен, фурофенак, ибуфенак, ибупрофен, индометацин, индопрофен, изоксепак, изоксикам, кетопрофен, кеторолак, лофемизол, лорноксикам, меклофенамат, меклофенамовую кислоту, мефенамовую кислоту, мелоксикам, месаламин, миропрофен, мофебутазон, набуметон, напроксен, нифлумовую кислоту, нимесулид, нитрофлурбипрофен, олсалазин, оксапрозин, окспинак, оксифенбутазон, фенилбутазон, пироксикам, пипрофен, пранопрофен, салсалат, судоксикам, сульфасалазин, сулиндак, супрофен, теноксикам, тиопинак, тиапрофеновую кислоту, тиоксапрофен, толфенамовую кислоту, толметин, трифлумидат, зидометацин, зомепирак и их сочетания. В конкретном варианте осуществления NSAID выбирают из этодолака, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, мелоксикама, напроксена, оксапрозина, пироксикама и их сочетаний. В конкретном варианте осуществления NSAID выбирают из ибупрофена, индометацина, набуметона, напроксена (например, напроксена натрия) и их сочетаний.
Характерные миорелаксанты включают в качестве неограничивающих примеров каризопродол, хлорзоксазон, циклобензаприн, дифлунизал, метаксалон, метокарбамол и их сочетания.
Характерные ингибиторы обратного захвата норэпинефрина включают в качестве неограничивающих примеров атомоксетин, бупроприон и метаболит бупроприона гидроксибупроприон, мапротилин, ребоксетин (например, (S,S)-ребоксетин), вилоксазин и их сочетания. В конкретном варианте осуществления ингибитор обратного захвата норэпинефрина выбран из атомоксетина, ребоксетина и их сочетаний.
Характерные агонисты опиоидов (опиоидные анальгетики) и антагонисты опиоидов включают в качестве неограничивающих примеров бупренорфин, буторфанол, кодеин, дигидрокодеин, фентанил, гидрокодон, гидроморфон, леваллорфан, леворфанол, меперидин, метадон, морфин, налбуфин, налмефен, налорфин, налоксон, налтрексон, налорфин, оксикодон, оксиморфон, пентазоцин, пропоксифен, трамадол и их сочетания. В определенных вариантах осуществления опиоидный агонист выбран из кодеина, дигидрокодеина, гидрокодона, гидроморфона, морфина, оксикодона, оксиморфона, трамадола и их сочетаний.
Характерные селективные ингибиторы обратного захвата серотонина (SSRI) включают в качестве неограничивающих примеров циталопрам и метаболит циталопрам дезметилциталопрам, дапоксетин, эсциталопрам (например, оксалат эсциталопрама), флуоксетин и десметилированный метаболит флуоксетина норфлуоксетин, флувоксамин (например, малеат флувоксамина), пароксетин, сертралин и метаболит сертралина деметилсертралин и их сочетания. В определенных вариантах осуществления SSRI выбран из циталопрама, пароксетина, сертралина и их сочетаний.
Характерные блокаторы натриевых каналов включают в качестве неограничивающих примеров карбамазепин, фосфенитоин, ламотригнин, лидокаин, мексилетин, окскарбазепин, фенитоин и их сочетания.
Характерные симпатолитики включают в качестве неограничивающих примеров атенолол, клонидин, доксазозин, гуанетидин, гуанфацин, модафинил, фентоламин, празозин, резерпин, толазолин (например, гидрохлорид толазолина), тамсулозин и их сочетания.
Приведенные ниже составы иллюстрируют характерные фармацевтические композиции по настоящему изобретению:
Иллюстративные твердые желатиновые капсулы для перорального введения
Кристаллическое соединение по изобретению (50 г), высушенную распылением лактозу (440 г) и стеарат магния (10 г) тщательно перемешивают. Затем полученную композицию помещают в твердые желатиновые капсулы (500 мг композиции на капсулу).
Альтернативно кристаллическое соединение (20 мг) тщательно перемешивают с крахмалом (89 мг), микрокристаллической целлюлозой (89 мг) и стеаратом магния (2 мг). Затем смесь пропускают через сито США No. 45 меш и помещают в твердую желатиновую капсулу (200 мг композиции на капсулу).
Иллюстративный состав желатиновой капсулы для перорального введения
Кристаллическое соединение по изобретению (100 мг) тщательно перемешивают с моноолеатом полиоксиэтиленсорбитана (50 мг) и порошком крахмала (250 мг). Затем смесь помещают в желатиновую капсулу (400 мг композиции на капсулу).
Альтернативно кристаллическое соединение (40 мг) тщательно перемешивают с микрокристаллической целлюлозой (авицел PH 103; 259,2 мг) и стеаратом магния (0,8 мг). Затем смесь помещают в желатиновую капсулу (размер № 1, белую, непрозрачную) (300 мг композиции на капсулу).
Иллюстративный состав таблетки для перорального введения
Кристаллическое соединение по изобретению (10 мг), крахмал (45 мг) и микрокристаллическую целлюлозу (35 мг) пропускают через сито США No. 20 меш и тщательно смешивают. Полученные таким образом гранулы сушат при 50-60°C и пропускают через сито США No. 16 меш. Раствор поливинилпирролидона (4 мг в виде 10% раствора в стерильной воде) смешивают с карбоксиметилкрахмалом натрия (4,5 мг), стеаратом магния (0,5 мг) и тальком (1 мг), а затем эту смесь пропускают через сито США No. 16 меш. Затем в гранулы добавляют карбоксиметилкрахмал натрия, стеарат магния и тальк. После смешивания смесь прессуют на таблетирующем устройстве с получением таблетки массой 100 мг.
Альтернативно кристаллическое соединение (250 мг) тщательно перемешивают с микрокристаллической целлюлозой (400 мг), дымящимся диоксидом кремния (10 мг) и стеариновой кислотой (5 мг). Затем смесь прессуют с получением таблеток (665 мг композиции на таблетку).
Альтернативно кристаллическое соединение (400 мг) тщательно перемешивают с кукурузным крахмалом (50 мг), кроскармеллозой натрия (25 мг), лактозой (120 мг) и стеаратом магния (5 мг). Затем смесь прессуют с получением одиночной таблетки с насечкой (600 мг композиции на таблетку).
Иллюстративный состав суспензии для перорального введения
Приведенные ниже ингредиенты смешивают с получением суспензии, содержащей 100 мг активного средства на 10 мл суспензии:
Иллюстративный инъецируемый состав для введения посредством инъекции
Кристаллическое соединение по изобретению (0,2 г) перемешивают с буферным раствором 0,4 М ацетата натрия (2,0 мл). pH полученного раствора доводят до pH 4 с использованием по мере необходимости 0,5 N водной соляной кислоты или 0,5 N водного гидроксида натрия, а затем добавляют достаточное количество воды для инъекций для обеспечения общего объема 20 мл. Затем смесь фильтруют через стерильный фильтр (0,22 микрон) с получением стерильного раствора, подходящего для введения посредством инъекции.
Иллюстративные композиции для введения посредством ингаляции
Кристаллическое соединение по изобретению (0,2 мг) тонко измельчают, а затем перемешивают с лактозой (25 мг). Затем эту перемешанную смесь помещают в желатиновый ингаляционный картридж. Содержимое картриджа вводят, например, с использованием ингалятора сухих порошков.
Альтернативно тонкоизмельченное соединение по изобретению (10 г) диспергируют в растворе, полученном растворением лецитина (0,2 г) в деминерализованной воде (200 мл). Полученную суспензию сушат распылением, а затем тонко измельчают с получением тонкоизмельченной композиции, содержащей частицы со средним диаметром менее чем приблизительно 1,5 мкм. Затем тонкоизмельченную композицию помещают в картриджи для ингалятора мерных доз, содержащие сжатый 1,1,1,2-тетрафторэтан в количестве, достаточном для обеспечения приблизительно от 10 мкг до приблизительно 500 мкг соединения по изобретению на дозу при введении посредством ингалятора.
Альтернативно кристаллическое соединение (25 мг) растворяют в забуференном цитратом (pH 5) изотоническом растворе (125 мл). Смесь перемешивают и обрабатывают ультразвуком до растворения соединения. pH раствора проверяют и, если необходимо, доводят до pH 5 медленным добавлением водного 1 N гидроксида натрия. Раствор вводят с использованием распыляющего устройства, обеспечивающего от приблизительно 10 мкг до приблизительно 500 мкг кристаллического соединения на дозу.
ПРИМЕРЫ
Приведенные ниже препараты и примеры предоставлены для иллюстрации конкретных вариантов осуществления изобретения. Однако эти конкретные варианты осуществления никоим образом не предназначены для ограничения объема изобретения, если конкретно не указано иначе.
Приведенные ниже сокращения, если не указано иначе, имеют указанные ниже значения, а любые другие сокращения, используемые и не определенные в настоящем документе, имеют их стандартное значение:
Любые другие сокращения, используемые в настоящем документе, но не определенные в нем, имеют их стандартные общепринятые значения. Если не указано иначе, все вещества, такие как реагенты, исходные вещества и растворители, приобретали у коммерческих поставщиков (таких как Sigma-Aldrich, Fluka Riedel-de Haën и т.п.) и использовали без дополнительной очистки.
Приготовление 1
Трет-бутиловый эфир 4-(2-метансульфонилоксиметилфенил)пиперидин-1-карбоновой кислоты
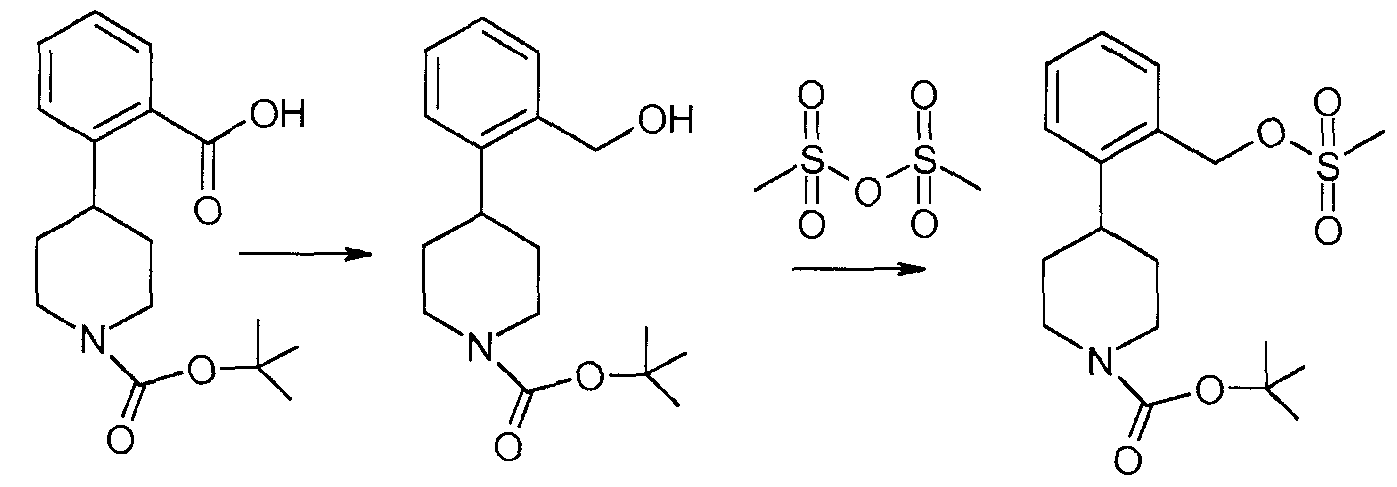
При комнатной температуре в атмосфере азота комбинировали трет-бутиловый эфир 4-(2-карбоксифенил)пиперидин-1-карбоновой кислоты (5,0 г, 160 ммоль, 1,0 экв.) и THF (100 мл, 1,0 моль). По каплям в течение 10 минут добавляли 1,0 М комплекс боран-THF в THF (32,7 мл, 32,7 ммоль, 2,0 экв.) (экзотермический процесс на 5°C, выделение газа). Смесь перемешивали при комнатной температуре в течение 5 минут, затем нагревали при 50°C в течение 1 часа. Смесь охлаждали до комнатной температуры и реакцию медленно гасили MeOH (30 мл) (умеренный экзотермический процесс, значительное выделение газа), затем концентрировали посредством испарения с применением роторного испарителя. Получали азеотропную смесь вещества с MeOH (2×50 мл). Неочищенный продукт растворяли в EtOAc (100 мл, 1 моль), отмывали NaHCO3 (50 мл), затем насыщенным водным NaCl (50 мл). Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали in vacuo с выходом трет-бутилового эфира 4-(2-гидроксиметилфенил)пиперидин-1-карбоновой кислоты (4,4 г) в виде прозрачного светло-желтого масла, которое затвердевает при перемешивании.
Трет-бутиловый эфир 4-(2-гидроксиметилфенил)пиперидин-1-карбоновой кислоты (50,0 г, 172 ммоль, 1,0 экв.) растворяли в DCM (500 мл, 8000 ммоль). Смесь охлаждали при 0°C в атмосфере азота и одной порцией добавляли метансульфоновый ангидрид (44,8 г, 257 ммоль, 1,5 экв.). По каплям в течение 5 минут добавляли DIPEA (47,8 мл, 274 ммоль, 1,6 экв.) и смесь перемешивали при 0°C в течение 90 минут. Добавляли воду (400 мл, 20 моль) и смесь перемешивали в течение 5 минут. Разделяли фазы и органический слой промывали водой (300 мл), сушили над Na2SO4 и удаляли растворитель с выходом указанного в заголовке соединения (70 г) в виде густого масла, которое использовали без дополнительной очистки.
lH ЯМР (400 МГц, DMSO-d6) δ (м.д.) 7,37-7,43 (м, 3H), 7,31 (д, 1H), 7,22 (м, 2H), 5,38 (с, 2H), 4,28 (м, 2H), 2,92-3,10 (м, 1H), 2,92 (с, 3H), 2,80-2,92 (м, 2H), 1,63-1,81 (м, 4H), 1,51 (с, 9H).
ПРИМЕР 1
Кристаллический гидрохлорид 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина

Трет-бутиловый эфир 4-(2-метансульфонилоксиметилфенил)пиперидин-1-карбоновой кислоты (27,0 г, 60,6 ммоль, 1,0 экв.) растворяли в MeCN (540 мл) и добавляли в K2CO3 (25 г, 180 ммоль, 3,0 экв.) и 2,4,6-трифторфенол (13,5 г, 90,9 ммоль, 1,5 экв.). Смесь энергично перемешивали при 50°C в течение 6 часов, прекращали нагревание и перемешивали в течение ночи. Смесь охлаждали при комнатной температуре и разбавляли EtOAc (700 мл) и водой (700 мл). Разделяли фазы и органический слой дважды промывали 1,0 М NaOH в воде (2×400 мл) и насыщенным водным NaCl (1×400 мл), затем сушили над Na2SO4 и растворитель удаляли с выходом неочищенного трет-бутилового эфира 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин-1-карбоновой кислоты (25,0 г). Неочищенный продукт объединяли с партиями в меньшем масштабе в совокупности 30 г и очищали посредством хроматографии (0-10% EtOAc в гексане) с выходом трет-бутилового эфира 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин-1-карбоновой кислоты (22,0 г).
Трет-бутиловый эфир (22,0 г, 31,3 ммоль, 1,0 экв.) объединяли с 1,25M HCl в EtOH (250 мл, 310 ммоль, 10,0 экв.). Смесь перемешивали при комнатной температуре в течение 8 часов, затем хранили при -10°C в течение приблизительно 48 часов. Большую часть растворителя удаляли посредством испарения с применением роторного испарителя. К полученному сгущенному осадку добавляли EtOAc (80 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Первую часть выделяли посредством фильтрации, а осадок на фильтре промывали EtOAc (20 мл) и сушили с выходом указанного в заголовке соединения в виде белого твердого вещества гидрохлорида (8,5 г, чистота >99%). ВЭЖХ фильтрата продемонстрировал ~25% площади продукта. Для второй части растворитель удаляли посредством испарения с применением роторного испарителя и полученное твердое вещество (~10 г) суспендировали в EtOAc (40 мл) сначала при комнатной температуре, затем при 60°C и снова при комнатной температуре с выходом указанного в заголовке соединения в виде гидрохлорида (1,7 г, чистота >99%).
Две партии гидрохлорида (18,5 г, 51,7 ммоль) объединяли с EtOAc (75 мл, 770 ммоль). Полученную густую, но свободнотекущую смесь нагревали при 65°C в течение 30 минут, охлаждали до комнатной температуры и фильтровали. Колбу и осадок на фильтре промывали EtOAc (20 мл) и твердые вещества сушили в высоком вакууме при комнатной температуре в течение ночи с выходом кристаллического гидрохлорида (18,2 г, чистота 99,3%).
При XRPD наблюдали хорошую степень кристалличности. Выявлено, что LC-MS (2 мг в 2 мл 1:1 MeCN:1 М водн. HCl; система LC/MS API 150EX LC/MS System) согласуется со структурой. Выявлено, что ЯМР (DMSO-d6, Varian VnmrJ 400) согласуется со структурой и формой соли.
ПРИМЕР 2
Кристаллический гидрохлорид 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина
В EtOH (140 мл, 2,4 моль) медленно добавляли ацетилхлорид (83,5 мл, 1170 ммоль). Добавляли трет-бутиловый эфир 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин-1-карбоновой кислоты (55,0 г, 117 ммоль), растворенный в EtOH (100 мл, 2,0 моль) и полученную смесь перемешивали при комнатной температуре в течение 6 часов. Большинство растворителя удаляли посредством испарения с применением роторного испарителя. К полученному сгущенному осадку добавляли EtOAc (300 мл) с последующим частичным удалением растворителя до ~100 мл. Добавляли свежий EtOAc (200 мл) и полученную взвесь перемешивали в течение 1 часа, фильтровали и сушили с выходом гидрохлорида (28,0 г, чистота ~99%). Фильтрат концентрировали до густой пасты и добавляли IPAc (100 мл), перемешивали в течение 1 часа, фильтровали и сушили с дополнительным выходом 5,0 г гидрохлорида (чистота ~99%).
Два партии гидрохлорида (83,0 г, 230 ммоль, чистота ~99%) объединяли с EtOAc (250 мл, 2,6 моль). Полученную суспензию нагревали при 70°C, а затем медленно охлаждали до комнатной температуры, с последующим перемешиванием в течение ночи. Полученную свободнотекущую суспензию фильтровали и осадок на фильтре промывали EtOAc (50 мл), затем сушили в высоком вакууме в течение приблизительно 48 часов с выходом кристаллического гидрохлорида (81,0 г, чистота >99%). Выявлено, что1H ЯМР (DMSO-d6, 400 Гц) согласуется со структурой и формой соли из примера 1.
Кристаллический гидрохлорид (50,0 г, 1,40 моль, чистота >99%) растворяли в IPA (250 мл, 3,3 моль) и полученную суспензию нагревали до 75°C. Добавляли воду (25 мл, 1,4 моль). Полное растворение наблюдали в течение 5 минут, и внутренняя температура раствора составляла 65°C. Раствор медленно охлаждали до комнатной температуры, а затем перемешивали при комнатной температуре в течение ночи. Полученные твердые вещества фильтровали и сушили на воздухе в течение 2 часов с выходом полутвердого продукта. Затем твердые вещества сушили в высоком вакууме при комнатной температуре в течение приблизительно 48 часов с выходом указанного в заголовке кристаллического гидрохлорида (44,1 г, чистота 99,5%). Вещество демонстрировало хорошую степень кристалличности при XRPD и DSC.
ПРИМЕР 3
Кристаллический гидрохлорид 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина
Также сходным образом получали указанный в заголовке кристаллический гидрохлорид (151,1 г, чистота 99,5%) с использованием 175,0 г гидрохлорида и 10 объемов 5% воды в IPA (всего 90 мл воды и 1,8 л IPA).
ПРИМЕР 4
Порошковая рентгеновская дифракция
Профили порошковой рентгеновской дифракции получали на дифрактометре для PXRD Rigaku Miniflex с использованием излучения Cu Kα (30,0 кВ, 15,0 мА). Анализ проводили с гониометром, действующем в режиме непрерывного сканирования 2° (2θ) в минуту с размером шага 0,03° в диапазоне изменения угла два-тэта от 2 до 40°. Образцы получали на кварцевых держателях для образца в виде тонкого слоя порошкового вещества. Устройство калибровали со стандартом из металлического кремния, в диапазоне угла два-тэта ±0,02°. Характерный профиль PXRD для кристаллического гидрохлорида из примера 2 представлен на фиг.1. Образцы до тестирования измельчали вручную для уменьшения воздействия размера частиц на относительные интенсивности.
Многочисленные интенсивные дифракционные пики порошка и относительно гладкая фоновая линия, изображенные на фиг.1, убедительно показывают, что кристаллический гидрохлорид из примера 2 обладает хорошей степенью кристалличности.
Профили порошковой рентгеновской дифракции также получали для кристаллического гидрохлорида из примера 1 и выявили, что они согласуются с профилями кристаллического гидрохлорида из примера 2.
ПРИМЕР 5
Термический анализ
Дифференциальную сканирующую калориметрию (DSC) проводили с применением модуля TA Instruments Model Q-100 с контроллером Thermal Analyst. Данные собирали и анализировали с применением программного обеспечения TA Instruments Thermal Solutions. 2,8 мг образца кристаллического гидрохлорида из примера 2 тщательно взвешивали в закрытой алюминиевой ванне. Через 5 минут периода изотермического уравновешивания при 22°C образец нагревали с использованием нагревания по линейному закону при 10°C/мин от 22°C до 250°C. Характерная термограмма DSC приведена на фиг.2.
Термограмма DSC демонстрирует, что кристаллическое соединение по изобретению обладает превосходной термостабильностью с температурой плавления приблизительно при 196,9°C и отсутствием пиролиза ниже 200,0°C.
Характерная кривая TGA представлена на фиг.2 и демонстрирует, что образец кристаллической формы примера 2 теряет небольшое количество (приблизительно 0,5%) массы в диапазоне от комнатной температуры до 150,0°C, что согласуется с потерей остаточной влаги или растворителя.
Термограмму DSC и кривую TGA также получали для кристаллического гидрохлорида из примера 1 и выявили, что они согласуются с термограммой DSC и кривой TGA кристаллического гидрохлорида из примера 2.
ПРИМЕР 6
Анализ динамической сорбции влаги
Анализ динамической сорбции влаги (DMS) (также известный как профиль сорбции-десорбции влаги) проводили для кристаллического гидрохлорида из примера 2 с использованием системы атмосферного микробаланса VTI, SGA-100 (VTI Corp., Hialeah, FL 33016). Использовали образец размером приблизительно 7,3 мг, а влажность в начале анализа устанавливали на влажность окружающей среды. Анализ DMS включал частоту сканирования 5% относительной влажности/шаг на всем диапазоне влажности от 2% относительной влажности до 90% относительной влажности. Анализ DMS проводили изотермически при 25°C. Характерный профиль DMS представлен на фиг.3.
Профиль DMS демонстрирует, что кристаллическое соединение по изобретению обладает обратимым профилем сорбции/десорбции с незначительной гигроскопичностью. Кристаллическое соединение демонстрирует незначительное увеличение массы при воздействии влажности в широком диапазоне от 2% относительной влажности до 90% относительной влажности и менее чем приблизительно 2,0% увеличение массы при воздействии до 90% относительной влажности, что указывает, что кристаллическая форма обладает только минимальным риском гигроскопичности при условиях окружающей среды.
ПРИМЕР 7
Анализ стабильности твердой фазы
Исследование стабильности твердой фазы предпринимали с типичным количеством кристаллического гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина в условиях хранения при -20°C, 5°C, 25°C/60% относительной влажности (открытый контейнер) и 40°C/75% относительной влажности (закрытый и открытый контейнеры) в стекле. Через 28 суток хранения у образцов, хранимых во всех условиях, детектируемых изменений химической чистоты, хиральной чистоты, профилей PXRD, DSC и TGA не наблюдали.
ПРИМЕР 8
Рентгеноструктурный анализ монокристаллического гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина
Кристаллический гидрохлорид (105,0 мг, чистота >99%) получали из EtOAc, как описано в примере 2. Затем кристаллический гидрохлорид комбинировали с 5 мл раствора IPA/вода (10% вода). Смесь перемешивали при комнатной температуре (приблизительно 23°C) до растворения большинства вещества в растворе. Затем раствор помещали на термоплиту, предварительно нагретую до 60°C. Через 5 минут раствор становился прозрачным, что указывало на отсутствие какого-либо твердого осадка в растворе нагреваемого образца. Затем нагревающее устройство выключали (общее время нагревания составляло приблизительно 10 минут). Раствору позволяли стоять в течение двух часов для обеспечения медленного достижения раствором комнатной температуры, в результате чего раствор становился белым и мутным. Затем раствор охлаждали при 4°C. Приблизительно через 7 суток наблюдали большие кристаллы. Затем кристаллы выделяли и сушили.
Структуру кристалла определяли с применением рентгенодифрактометра монокристаллов (Nonius Kappa-CCD Diffractometer, оборудованного Oxford Cryostream Liquid Nitrogen Cooler с применением излучения Mo Kα). Размер кристаллического блока составлял 0,45×0,25×0,20 мм. Большой кристалл разрезали по линии кристаллографического измерения с получением соответствующего размера кристалла для анализа (фиг.5). Данные собирали при температуре 294°K и 120°K.
Кристалл демонстрировал моноклинную симметрию (пространственная группа P21/C) со следующими параметрами элементарной ячейки:
Ось (Å): a=11,631, b=7,057, c=42,532
Угол (°): B=104,595, A=C=90
V (Å3): 3378,4
Расчетная плотность (г/см3): 1,430
Количество рефлексов: 20143.
Выявлено, что кристаллы состоят из катиона 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина, аниона хлорида и молекул воды. В каждой элементарной ячейке находится 2,56 молекулы воды, ассоциированных с восемью молекулярными парами лекарственного средства (восемь катионов 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина и восемь анионов хлорида), т.е. присутствовала приблизительно одна молекула воды на каждые три молекулярные пары лекарственного средства, где каждая молекулярная пара состояла из одного катиона 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина и одного аниона хлорида. Таким образом, в одном из вариантов осуществления изобретения на каждый моль гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)-фенил]пиперидина приходится приблизительно 0,32 моль воды; формулу для такого кристалла можно записать как 1 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин•1 HCl•0,32 H2O.
Кристалл построен вокруг молекулы воды, и содержание воды определяли на основании фактора заполнения воды в элементарной ячейке. Фактор заполнения воды рассчитывали с использованием параметров теплового движения атомов и общих наблюдаемых показателей структуры.
АНАЛИЗ 1
Анализы связывания hSERT, hNET и hDAT
Для измерения конкурентного ингибирования связывания меченого лиганда (3H-циталопрама, или3H-низоксетина, или3H-WIN35428) с мембранами, получаемыми из клеток, экспрессирующих соответствующий рекомбинантый транспортер человека (hSERT, или hNET, или hDAT), для определения значений pKi тестируемых соединений для транспортеров использовали анализы связывания радиоактивных лигандов с мембранами.
Препараты мембран из клеток, экспрессирующих hSERT, hNET или hDAT
Полученные из эмбриональной почки человека рекомбинантные клеточные линии (HEK-293), стабильно трансфицированные hSERT или hNET, соответственно, выращивали в среде DMEM, дополненной 10% диализованной FBS (для hSERT) или FBS (для hNET), 100 мкг/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ L-глутамином и 250 мкг/мл аминогликозидного антибиотика G418, во влажном инкубаторе с 5% CO2 при 37°C. При достижении культурами конфлюентности 80% клетки тщательно промывали в PBS (без Ca2+ и Mg2+) и снимали 5 мМ ЭДТА в PBS. Клетки осаждали посредством центрифугирования, ресуспендировали в лизирующем буфере (10 мМ Tris-HCl, pH 7,5, содержит 1 мМ ЭДТА), гомогенизировали, осаждали посредством центрифугирования, затем ресуспендировали в 50 мМ Tris-HCl, pH 7,5 и 10% сахарозе при 4°C. Концентрацию белка суспензии мембран определяли с применением набора для анализа белков Bio-Rad Bradford Protein Assay. Мембраны подвергали быстрому замораживанию и хранили при -80°C. Мембраны клеток яичника китайского хомяка, экспрессирующих hDAT (CHO-DAT) приобретали в PerkinElmer и хранили при -80°C.
Анализы связывания
Анализы связывания проводили в 96-луночном планшете для анализов в общем объеме буфера для анализа 200 мкл (50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, pH 7,4) с 0,5, 1 и 3 мкг мембранного белка, для SERT, NET и DAT, соответственно. Исследования насыщающего связывания для определения значений Kd радиоактивного лиганда для3H-циталопрама,3H-низоксетина или3H-WIN35428, соответственно, проводили с использованием 12 различных концентраций радиоактивных лигандов в диапазоне 0,005-10 нМ (3H-циталопрам); 0,01-20 нМ (3H-низоксетин) и 0,2-50 нМ (3H-WIN35428). Анализы замены для определения значений pKi тестируемых соединений проводили с 1,0 нМ3H-циталопрама, 1,0 нМ3H-низоксетина или 3,0 нМ3H-WIN35428 с 11 различными концентрациями тестируемого соединения в диапазоне от 10 пМ до 100 мкМ.
Получали исходные растворы (10 мМ в DMSO) тестируемого соединения и проводили серийные разведения с использованием буфера для разведений (50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, pH 7,4, 0,1% BSA, 400 мкМ аскорбиновая кислота). Определяли неспецифическое связывание радиоактивного лиганда в присутствии 1 мкМ дулоксетина, 1 мкМ дезипрамина или 10 мкМ GBR12909 (каждый в буфере для разведений) для анализов hSERT, hNET или hDAT, соответственно.
После 60 минут инкубации при 22°C (или периода, достаточного для достижения равновесия) мембраны собирали посредством быстрой фильтрации через 96-луночный планшет UniFilter GF/B, обработанный 0,3% полиэтиленимином, и 6 раз отмывали 300 мкл отмывочного буфера (50 мМ Tris-HCl, 0,9% NaCl, pH 7,5 при 4°C). Планшеты сушили в течение ночи при комнатной температуре, добавляли ≈45 мкл MicroScint™-20 (Perkin Elmer) и посредством жидкостной сцинтилляционной спектроскопии количественно определяли связанную радиоактивность. Кривые конкурентного ингибирования и изотермы насыщения анализировали с использованием пакета программного обеспечения GraphPad Prism (GraphPad Software, Inc., San Diego, CA). Значения IC50 получали на основе кривых концентрация-ответ с использованием алгоритма сигмовидной кривой дозы-ответа (переменной крутизны) в GraphPad Prism. Значения Kd и Bmax для радиоактивного лиганда получали на основе изотерм насыщения с применением алгоритма глобального соответствия насыщающего связывания в GraphPad Prism. pKi (отрицательный десятичный логарифм значений Ki) для тестируемых соединений рассчитывали на основании значений IC50 по методу наилучшего приближения и значения Kd радиоактивного лиганда с использованием уравнения Ченга-Прусоффа (Cheng & Prusoff (1973) Biochem. Pharmacol. 22(23): 3099-3108): Ki=IC50/(1+[L]/Kd), где [L] = концентрация радиоактивного лиганда.
В этом анализе тестировали соединение из примера 1 (TFA соль) и выявили, что оно демонстрирует pKi SERT≥7,9 и pKi NET≥8,0.
АНАЛИЗ 2
Анализы захвата нейротрансмиттеров hSERT, hNET и hDAT
Анализы захвата нейротрансмиттеров использовали для измерения конкурентного ингибирования захвата3H-серотонина (3H-5-HT),3H-норэпинефрина (3H-NE) и3H-дофамина (3H-DA) в клетки, экспрессирующие соответствующий транспортер (hSERT, hNET или hDAT) для определения значений pIC50 тестируемых соединений для транспортеров.
Анализы захвата3H-5-HT,3H-NE и3H-DA
Полученные из HEK-293 клеточные линии, стабильно трансфицированные hSERT, hNET или hDAT, соответственно, выращивали в среде DMEM, дополненной 10% диализованной FBS (для hSERT) или FBS (для hNET и hDAT), 100 мкг/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ L-глутамином и 250 мкг/мл (для hSERT и hNET) или 800 мкг/мл (для hDAT) аминогликозидного антибиотика G418, во влажном инкубаторе с 5% CO2 при 37°C. При достижении культурами конфлюентности 80% клетки тщательно промывали в PBS (без Ca2+ и Mg2+) и снимали 5 мМ ЭДТА в PBS. Клетки собирали посредством центрифугирования при 1100 об./мин в течение 5 минут, однократно отмывали посредством ресуспендирования в PBS, затем центрифугировали. Удаляли супернатант и клеточный осадок ресуспендировали посредством осторожного ресуспендирования в бикарбонатном буфере Кребса-Рингера, содержащем HEPES (10 мМ), CaCl2 (2,2 мМ), аскорбиновую кислоту (200 мкМ) и паргилин (200 мкМ), pH 7,4, при комнатной температуре. Конечная концентрация клеток в клеточной суспензии для клеточных линий SERT, NET и DAT составляла 7,5×104 клеток/мл, 1,25×105 клеток/мл и 5,0×104 клеток/мл, соответственно.
Анализы захвата нейротрансмиттеров проводили в 96-луночном планшете для анализа в общем объеме буфера для анализа (бикарбонатный буфер Кребса-Рингера, содержащий HEPES (10 мМ), CaCl2 (2,2 мМ), аскорбиновую кислоту (200 мкМ) и паргилин (200 мкМ), pH 7,4) 400 мкл с 1,5×104 и 2,5×104 клетками, для SERT и NET, соответственно. Конкурентные анализы определения значений pIC50 тестируемых соединений проводили с 11 различными концентрациями в диапазоне от 10 пМ до 100 мкМ. Получали исходные растворы (10 мМ в DMSO) тестируемого соединения и получали серийные разведения с использованием 50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, pH 7,4, 0,1% BSA, 400 мкМ аскорбиновой кислоты. Тестируемые соединения инкубировали в течение 30 минут при 37°C с соответствующими клетками до добавления радиоактивно меченного нейротрансмиттера3H-5-HT (конечная концентрация 20 нМ),3H-NE (конечная концентрация 50 нМ) или3H-DA (конечная концентрация 100 нМ). Неспецифический захват нейротрансмиттера для анализов hSERT, hNET или hDAT определяли в присутствии 2,5 мкМ дулоксетина или 2,5 мкМ дезипрамина (каждый в буфере для разведения), соответственно.
Через 10 минут инкубирования с радиоактивным лигандом при 37°C клетки собирали посредством быстрой фильтрации через 96-луночный планшет UniFilter GF/B, предварительно обрабатывали 1% BSA и 6 раз отмывали 650 мкл отмывочного буфера (ледяной PBS). Планшеты сушили в течение ночи при 37°C, добавляли ~45 мкл MicroScint™-20 (Perkin Elmer) и посредством жидкостной сцинтилляционной спектроскопии количественно определяли включившуюся радиоактивность. Кривые конкурентного ингибирования анализировали с применением пакета программного обеспечения GraphPad Prism (GraphPad Software, Inc., San Diego, CA). Значения IC50 получали на основании кривых концентрация-ответ с использованием алгоритма сигмовидной кривой дозы-ответа (переменной крутизны) в GraphPad Prism.
АНАЛИЗ 3
Исследования занятости транспортеров SERT и NET ex vivo
Для определения занятости SERT и NET in vivo в выбранных областях головного мозга после введения (однократного или длительного) тестируемых соединений in vivo использовали анализы связывания радиоактивных лигандов и захвата нейротрансмиттера ex vivo. После введения тестируемого соединения (внутривенным, интраперитонеальным, пероральным, подкожным или другим способом) в соответствующей дозе (0,0001 до 100 мг/кг) крыс (≥n=4 на группу) подвергали эвтаназии в конкретные моменты времени (от 10 минут до 48 часов) посредством декапитации и на льду вырезали головной мозг. Нужные области головного мозга вырезали, замораживали и хранили при -80°C до использования.
Анализы связывания радиоактивных лигандов SERT и NET ex vivo
Для анализов связывания радиоактивных лигандов ex vivo измеряли исходную степень связывания селективных радиоактивных лигандов SERT (3H-циталопрам) и NET-(3H-низоксетин) с неочищенными гомогенатами головного мозга крыс, получаемыми с использованием носителя и обработанных тестируемыми соединениями животных (см. Hess et al. (2004) J. Pharmacol. Exp. Ther. 310(2): 488-497). Неочищенные гомогенаты ткани головного мозга получали посредством гомогенизации замороженных образцов тканей в 0,15 мл (на мг сырой массы) буфера с 50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, pH 7,4. Анализы связывания радиоактивных лигандов проводили в 96-луночном планшете для анализа в общем объеме буфера для анализа (50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, 0,025% BSA, pH 7,4) 200 мкл с 650 мкг сырой массы ткани (эквивалентной 25 мкг белка). Перед завершением анализа посредством быстрой фильтрации через 96-луночный планшет UniFilter GF/B, предварительно обработанный 0,3% полиэтиленимином, гомогенаты инкубировали в течение периода до 5 минут с3H-циталопрамом (3 нМ) и3H-низоксетином (5 нМ), соответственно. Затем фильтраты 6 раз промывали 300 мкл отмывочного буфера (50 мМ Tris-HCl, 0,9% NaCl, pH 7,4 при 4°C). Неспецифическое связывание радиоактивных лигандов для3H-циталопрама или3H-низоксетина определяли в присутствии 1 мкМ дулоксетина или 1 мкМ деспирамина, соответственно. Планшеты сушили в течение ночи при комнатной температуре, добавляли ~45 мкл MicroScint™-20 (Perkin Elmer) и посредством жидкостной сцинтилляционной спектроскопии количественно определяли связанную радиоактивность. Исходную степень связывания3H-циталопрама и3H-низоксетина определяли посредством линейной регрессии с использованием пакета программного обеспечения GraphPad Prism (GraphPad Software, Inc., San Diego, CA). Определяли среднюю степень связывания радиоактивного лиганда с гомогенатами ткани головного мозга у обработанных носителем животных. Затем определяли % занятости тестируемых соединений с использованием следующего уравнения:
% занятости = 100×(1-(исходная степень связывания для обработанной тестируемым соединением ткани/средняя степень связывания для обработанной носителем ткани))
Значения ED50 определяли, строя график зависимости десятичного логарифма дозы тестируемого соединения от % занятости. Значения ED50 получали на основе кривых концентрация-ответ с использованием алгоритма сигмовидной кривой дозы-ответа (переменной крутизны) в GraphPad Prism.
Анализы захвата SERT и NET ex vivo
Для измерения занятости транспортеров SERT и NET in vivo (см. Wong et al. (1993) Neuropsychopharmacology 8(1): 23-33) использовали анализы захвата нейротрансмиттеров ex vivo, в которых анализировали захват3H-5-HT или3H-NE в неочищенных гомогенатах головного мозга крыс, полученных с использованием носителя и обработанных тестируемыми соединениями животных. Неочищенные гомогенаты ткани головного мозга получали посредством гомогенизации замороженных образцов тканей в 0,5 мл (на мг сырой массы) 10 мМ буфера HEPES pH 7,4, содержащего 0,32 М сахарозу, 200 мкМ аскорбиновую кислоту и 200 мкМ паргилин, при 22°C. Анализы захвата нейротрансмиттеров проводили в 96-луночном планшете Axygen в общем объеме буфера для анализа (бикарбонатный буфер Кребса-Рингера с 10 мМ HEPES, 2,2 мМ CaCl2, 200 мкМ аскорбиновой кислотой и 200 мкМ паргилином, pH 7,4) 350 мкл с 50 мкг белка. Перед завершением анализа посредством быстрой фильтрации через 96-луночный планшет UniFilter GF/B, предварительно обработанный 1% BSA, гомогенаты инкубировали в течение 5 минут при 37°C с3H-5-HT (20 нМ) и3H-NE (50 нМ), соответственно. Планшеты 6 раз промывали 650 мкл отмывочного буфера (ледяной PBS) и перед добавлением ~45 мкл MicroScint™-20 (Perkin Elmer) сушили в течение ночи при 37°C. Включившуюся радиоактивность количественно определяли посредством жидкостной сцинтилляционной спектроскопии. Неспецифический захват нейротрансмиттеров определяли в параллельных анализах, в которых гомогенаты тканей инкубировали с3H-5-HT (20 нМ) или3H-NE (50 нМ) в течение 5 минут при 4°C.
АНАЛИЗ 4
Другие анализы
Другие анализы, которые использовали для оценки фармакологических свойств тестируемых соединений, включают в качестве неограничивающих примеров анализы кинетики связывания холодных лигандов (Motulsky and Mahan (1984) Molecular Pharmacol. 25(1): 1-9) с мембранами, получаемыми из клеток, экспрессирующих hSERT или hNET; обычные анализы связывания радиоактивных лигандов с мембранами с использованием радиоактивно меченного, например тритием, тестируемого соединения; анализы связывания радиоактивных лигандов с использованием исходной ткани, например, грызунов или головного мозга человека; анализы захвата нейротрансмиттеров с использованием тромбоцитов человека или грызунов; анализы захвата нейротрансмиттеров с использованием неочищенных или чистых препаратов синаптосом головного мозга грызунов.
АНАЛИЗ 5
Тест с введением в лапу формалина
У соединений оценивали их способность ингибировать поведенческую реакцию, вызываемую инъекцией 50 мкл формалина (5%). На левую заднюю лапу самцов крыс Sprague-Dawley (200-250 г) прикрепляют металлическую ленту и каждой крысе дают привыкнуть к ленте в течение 60 минут в пластиковом цилиндре (диаметром 15 см). Соединения получают в фармацевтически приемлемых носителях и системно вводят (i.p., p.о.) в предопределенные моменты времени до введения формалина. В течение 60 минут непрерывно подсчитывают произвольные болевые действия, заключающиеся в подергивании задней лапы, в которую была проведена инъекция (окольцованной), с использованием автоматического ноцицептивного анализатора (UCSD Anesthesiology Research, San Diego, CA). Противоболевые свойства тестируемых препаратов определяют, сравнивая количество подергиваний у крыс, обработанных носителем и соединениями (Yaksh et al., "An automated flinch detecting system for use in the formalin nociceptive bioassay" (2001) J. Appl. Physiol. 90(6): 2386-2402).
АНАЛИЗ 6
Модель с лигатурой спинального нерва
У соединений оценивают их способность обращать тактильную аллодинию (увеличенная чувствительность к нейтральным механическим раздражителям), индуцированную повреждением нерва. Самцов крыс Sprague-Dawley хирургически подготавливали, как описано в Kim and Chung "An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat" (1992) Pain 50(3): 355-363. Механическую чувствительность определяют как 50% ответ отдергиванием на нейтральные механические раздражители (Chaplan et al., "Quantitative assessment of tactile allodynia in the rat paw" (1994) J. Neurosci. Methods 53(1): 55-63) перед повреждением нерва и после него. Через период от одной до четырех недель после операции соединения получают в фармацевтически приемлемых носителях и системно вводят (i.p., p.о.). Степень индуцированной повреждением нерва механической чувствительности перед обработкой и после нее служит в качестве показателя противоболевых свойств соединений.
Хотя настоящее изобретение описано в отношении его конкретных аспектов или вариантов осуществления, специалистам в данной области следует понимать, что можно осуществлять различные изменения или можно заменять эквиваленты без отклонения от сущности и объема изобретения. Кроме того, в рамках применимых законов и нормативно-правовых актов в области патентов все публикации, патенты и патентные заявки, цитируемые в настоящем документе, таким образом, в полном объеме включены в качестве ссылки в той степени, как если бы каждый документ был индивидуально включен в настоящий документ в качестве ссылки.
Реферат
Изобретение относится к кристаллическому гидрохлориду 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина, характеризующемуся профилем порошковой рентгеновской дифракции, содержащим дифракционные пики при следующих значениях 2θ: 4,44±0,20, 10,22±0,20, 17,16±0,20 и 21,78±0,20. Данное изобретение также относится к фармацевтической композиции, содержащей кристаллический гидрохлорид 4-[2-(2,4,6-трифторфеноксиметил)фенил] пиперидина, и обладающей активностью ингибитора обратного захвата серотонина и норэпинефрина, к способам получения указанной выше кристаллической соли и, кроме того, к применению кристаллической соли для лечения заболеваний, например болевого синдрома и т.д. Технический результат: получена и описана новая кристаллическая форма гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил] пиперидина, которая может быть применима в лечении ряда заболеваний, например болевого нарушения, депрессивного расстройства, синдрома хронической усталости и др. 5 н. и 6 з.п. ф-лы, 8 пр., 5 ил.
Формула
а) обработки гидрохлорида 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина этилацетатом и этанолом до полного растворения;
b) охлаждения для проведения кристаллизации и
c) выделения образовавшихся твердых веществ с получением кристаллического гидрохлорида по п.1.
d) обработки кристаллического гидрохлорида изопропанолом и водой до полного растворения;
e) охлаждения для проведения кристаллизации и
f) выделения образовавшихся твердых веществ с получением кристаллического гидрохлорида по п.1.
Документы, цитированные в отчёте о поиске
4-замещенные пиперидины, фармацевтическая композиция на их основе и способ лечения заболеваний центральной нервной системы

Комментарии