Способы и композиции для лечения опухолей - RU2741786C2
Код документа: RU2741786C2
Чертежи

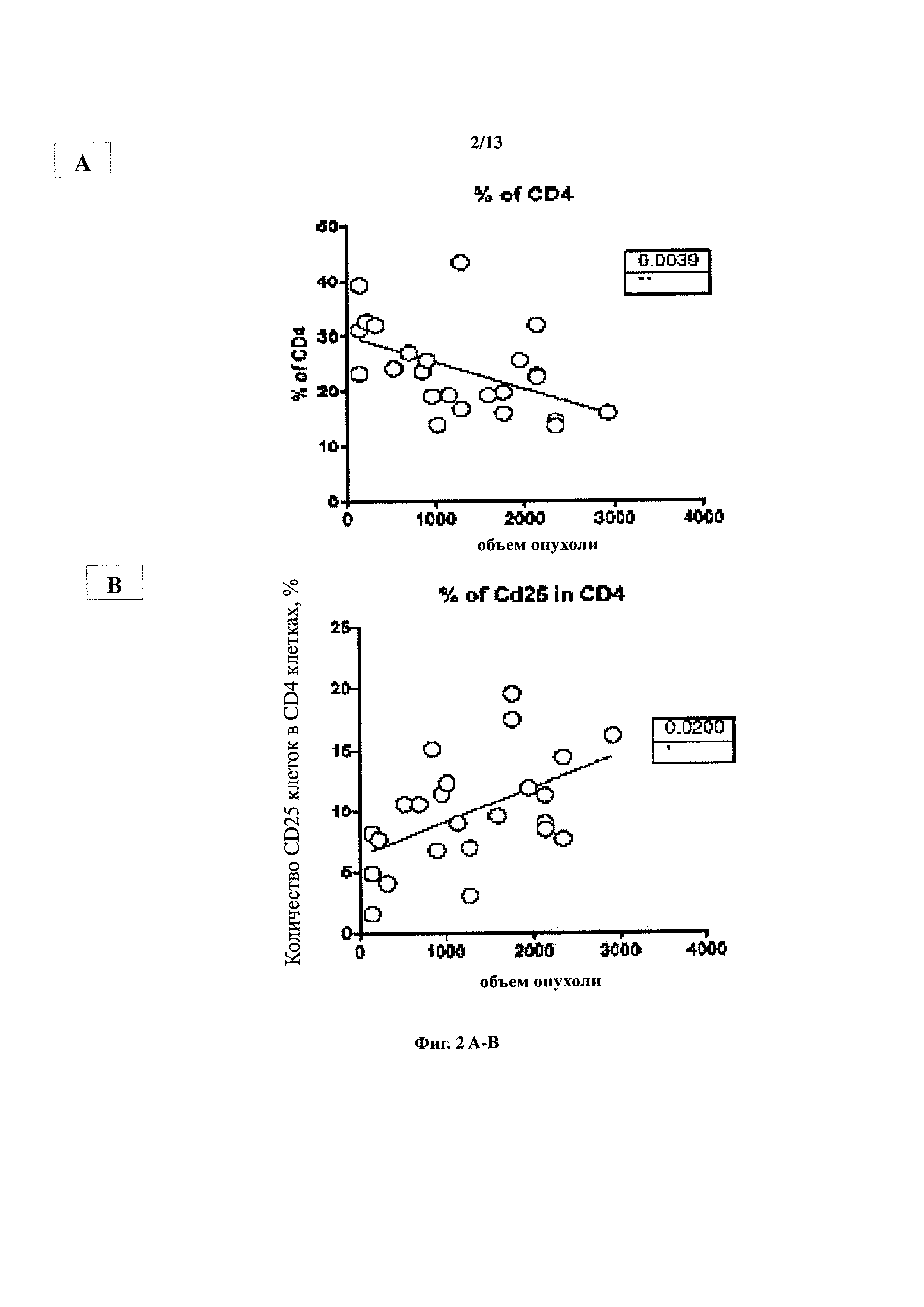







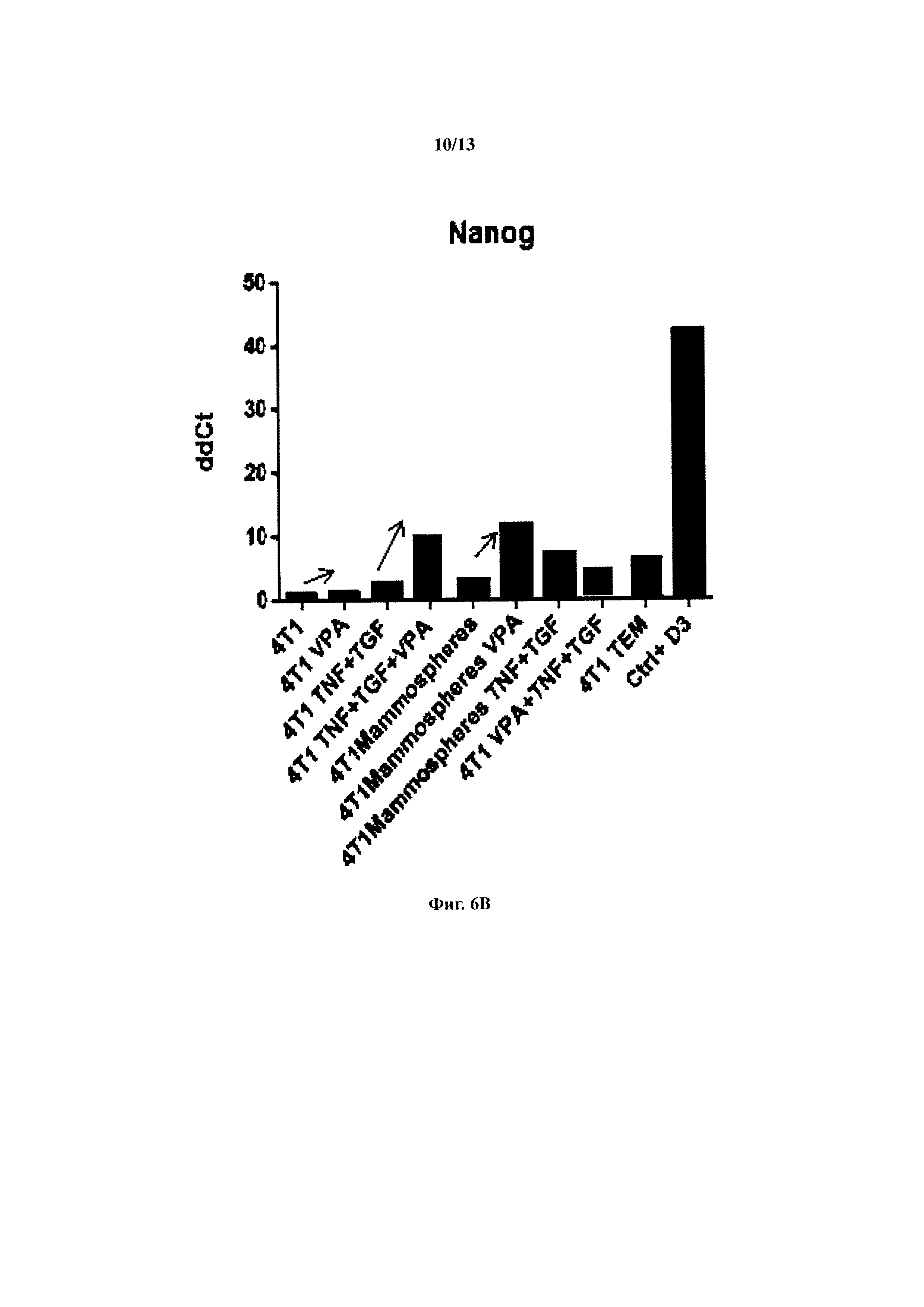



Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области онкологии, и более конкретно, изобретение относится к комбинированной терапии противораковой вакциной.
Более конкретно, изобретение относится к способам получения композиции, содержащей плюрипотентные клетки, представляющие собой многочисленные неоантигены и таким образом пригодные для приготовления противораковых клеточных вакцин.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Большинство раковых образований являются результатом случайных мутаций, возникающих при репликации ДНК в нормальных стволовых клетках, необходимых для развития и поддержании тканей. Раковые стволовые клетки (CSC) являются гетерогенными и эпигенетически пластичными в динамическом состоянии. Опухолевые клетки, возникающие из CSC, обусловлены одновременным накоплением мутаций, присутствующих в онкогенах, генах супрессоров опухолей и сигнальных путей, ведущих к клональным волнам эволюции опухоли. В «модели клональной эволюции» типы мутаций будут варьироваться по мере развития рака, так что отдельные раковые клетки становятся все более трансформированными и агрессивными. Мутации, полученные при раннем развитии опухоли, поддерживаются при развившемся заболевании.
С течением времени эти мутации приводят к увеличению олигоклональной опухоли и устойчивости раковой клетки в сочетании с прогрессивным иммунным редактированием и истощением. Мутационная сигнатура рака сильно связана с геномной нестабильностью. Мутации приводят к появлению новых не-собственных нео-антигенов с иммуногенным эпитопом. Однако, поскольку микроокружение опухолей обычно является иммунодепрессантным, иммунная система хозяина обычно не может правильно разрушать эти клетки и бороться с этими раковыми заболеваниями. Клинические преимущества, полученные с помощью реакции Т-клеток с ингибиторами иммунной контрольной точки, хорошо коррелируют с частотой мутаций и мутационным ландшафтом опухолей.
Раковые стволовые клетки (CSC) представляют собой незначительную популяцию самовосстанавливающихся раковых клеток, которые способствуют сохранению и рецидиву опухоли, поскольку они часто устойчивы к традиционным методам лечения. CSC, первоначально обнаруженные при гемопоэтических злокачественных новообразованиях, были описаны в солидных опухолях различного происхождения, включая рак груди, глиобластому, рак простаты, рак толстой кишки и плоскоклеточный рак голени, рак яичников, рак мочевого пузыря, рак легких, рак поджелудочной железы. CSC имеют характеристику образования ксенографических опухолей у мышей и способности к инициации опухоли. Кроме того, они обладают радио- и химиорезистентностью, что способствует отсутствию терапевтического ответа у пациентов. Таким образом, стойкость CSC вызывает рецидив опухоли и/или метастазирование после завершения терапии. В нескольких публикациях показана молекулярная связь между патогенезом опухолей и состоянием эмбриональной стволовой клетки (ESC). CSC экспрессируют большое количество эмбриональных антигенов, которые также экспрессируются человеческими эмбриональными стволовыми клетками (hESCs) и человеческими индуцированными плюрипотентными стволовыми клетками (hiPSCs).
В основном, транскрипционные факторы ОСТ4, NANOG и SOX2 являются главными регуляторами и работают вместе как часть высокоинтегрированной сети (связанной с сетью с-myc и polycomb) для перехода от соматической клетки к CSC или iPSC с использованием эпигенетических механизмов для ремоделирования хроматина посредством модификации гистонов и метилирования ДНК. Эти факторы отсутствуют в нормальных взрослых стволовых клетках. Экспрессия генов по типу эмбриональных стволовых клеток и недостаточная экспрессия генов, регулируемых Polycomb, определяющих идентичность человеческих плюрипотентных стволовых клеток (ESC/IPSC), связаны с плохо дифференцированными опухолями человека с плохим клиническим исходом и отдаленным рецидивом после химиолучевой терапии независимо от происхождения рака (молочной железы, поджелудочной железы, мочевого пузыря, легких, предстательной железы, медуллобластома). Плохо дифференцированные опухоли со «стволовым» профилем связаны с мезенхимальными признаками на клетках карциномы с эпителиально-мезенхимальными маркерами «ЕМТ», низкими уровнями экспрессии MHC-I, микроокружением иммуносупрессивных опухолей с про-опухолевыми воспалительными лейкоцитами, стромальными клетками и макрофагами. Опухолевые клетки, проходящие ЕМТ, приобретают свойства стволовых клеток и становятся CSC, способными мигрировать очень рано во всем организме и сохраняться на спящем этапе в течение длительных периодов времени. CSC действуют как резервуар для посева и пополнения опухолевого компартмента. Они также расширяются путем самообновления, распространения в разных тканях, создания метастазов. Эти CSC имеют плюрипотентные эмбриональные сигнатуры генов и устойчивы к противораковым препаратам и лучевой терапии. Они также избегают иммунной противоопухолевой защиты по причинам, указанным выше (иммунодепрессивное микроокружение).
Сообщалось, что эмбриональные ткани могут использоваться для иммунизации мышей и что это может вызвать отторжение трансплантированных опухолей, включая рак кожи, печени и желудочно-кишечного тракта. Этот ответ объясняется тем фактом, что эти опухолевые клетки экспрессируют большое количество онкофетальных антигенов.
На сегодняшний день было начато несколько исследований рака человека с целью таргетирования эмбриональных антигенов, таких как карциноэмбрионального антиген (СЕА), альфа-фетопротеин или антигены рака семенников. Было показано, что таргетирование на один антиген не является достаточно эффективным для создания сильных противоопухолевых иммунных реакций для опосредования отторжения опухоли из-за быстрого появления белковых мутантов, приводящих к общей неэффективности моновалентных противораковых вакцин.
Недавняя заинтересованность в потенциале стволовых клеток в регенеративной медицине позволила получить хорошо известные линии ESC, а также iPSCs, которые фенотипически и функционально похожи на ESC.
Связанные с раком эпигенетические аберрации являются характерной чертой раковых стволовых клеток с участием каждого компонента эпигенетических механизмов (метилирование ДНК, модификации гистонов, некодирующие РНК, в частности экспрессия микроРНК).
Несколько эпигенетических модифицирующих препаратов с ингибирующим опухоль действием в настоящее время находятся в клиническом применении в онкологии, включая гипометилирующие агенты, такие как азацитидин или децитабин, и ингибиторы дезацетилазы гистонов, такие как вориностат или ромадипсин.
Используя такие препараты, можно было перепрограммировать раковые клетки. Кроме того, эпигенетическое перепрограммирование микроорганизмов опухолей эпигенетическими препаратами является привлекательным манипулирующим подходом к терапии рака, поскольку есть явные доказательства взаимодействия рака с стромой в развитии рака.
Таким образом, по-прежнему существует потребность в новых подходах к профилактике и/или лечению рака, имеющего сигнатуру стволовых клеток. Эти виды рака экспрессируют набор эмбриональных генов (т.е. также называемых неоантигенами), совместно с ESC/IPSC, и включают, в частности, рак поджелудочной железы, рак молочной железы, рак яичника, рак толстой кишки, рак почек, рак легких, карциному предстательной железы, медуллобластому, холангиокарциному, рак печени, хронические и острые лейкозы и миелому. Этот класс рака в основном связан с мезенхимально-подобными сигнатурами, для которых нужно разрабатывать терапию, таргетированную специально на CSC для улучшения выживаемости и повышения качества жизни больных раком. В частности, такие стратегии должны приводить к восстановлению разрешающего противоопухолевого микроокружения (микроокружение опухоли обычно является иммуносупрессивным и, следовательно, должно быть сделано иммунокомпетентным) в сочетании с иммунным анти-CSC-ответом. Эта и другие потребности рассматриваются полностью или частично в соответствии с описываемым в настоящее время предметом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение основано на определении авторами того, что HDACi (ингибиторы деацетилазы гистонов) могут быть использованы для стимуляции иммунного ответа у пациента против антигена, представляющего интерес, когда иммуногенная композиция, содержащая указанный представляющий интерес антиген, или таргитированная против указанного антигена, вводится пациенту в сочетании с HDACi, необязательно с последующим лечением с помощью HDACi. Иммуногенная композиция предназначена для того, чтобы позволить возникновение иммунного ответа против антигена(ов), представляющего интерес. Использование HDACi в качестве адъюванта особенно интересно для лечения рака, в частности, рака, имеющего сигнатуру стволовых клеток. Настоящее изобретение, в частности, определяется формулой изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения показали, что использование HDACi вместе с популяцией плюрипотентных клеток привело к синергии и эффективному ответу иммунной системы на опухолевые клетки.
Действительно, авторы изобретения предположили, что плюрипотентные стволовые клетки, такие как hESC или hiPSC, могут быть использованы в качестве вакцины для создания иммунного ответа против множества эмбриональных антигенов, которые имеют опухолевые клетки. Они обнаружили, что вакцинация мышей hESC или hiPSC в сочетании с соединением, способным индуцировать МНС I, таким как вальпроевая кислота, способна индуцировать эффективные иммунные и противоопухолевые реакции против карциномы молочной железы без признаков побочных эффектов и аутоиммунных заболеваний. Кроме того, они обнаружили, что этот комбинированный режим был связан со значительным ингибированием метастазов в легкие. Удивительно, но они установили, что эти ответы значительно улучшаются за счет добавления HDACI и, в частности, вальпроевой кислоты в терапевтическом режиме по сравнению с использованием только ESC или iPSC.
HDACi для улучшения иммунного ответа
Изобретение относится к способу повышения эффективности у пациента композиции вакцины, включающему стадию введения HDACi пациенту вместе с композицией вакцины. В частности, HDACi может быть добавлен в состав вакцины.
Повышенная эффективность может быть понята как увеличение иммуногенности композиции вакцины, увеличение иммунного ответа против композиции вакцины или увеличение иммунного ответа, создаваемого композицией вакцины. Это можно сравнять с иммунным ответом, возникающим в отсутствие HDACi.
Композиция вакцины содержит иммуногенный элемент, предназначенный для того, чтобы у пациента развился иммунный ответ на один или несколько интересующих антигенов. Предшествующий антиген представляет собой любой антиген, против которого требуется иммунный ответ, и включает любой пептид, белок либо собственный (например, антигены из раковых клеток), либо экзогенный, такой как бактериальный, вирусный или паразитический белок, другие антигены, такие как нуклеиновые кислоты, сахара, липополисахариды и тому подобное.
Таким образом, изобретение относится к применению HDACi в качестве адъюванта, в частности для повышения иммунного ответа против композиции вакцины, а также против HDACi для его использования в качестве адъюванта или для усиления иммунного ответа против композиции вакцины. Изобретение также относится к применению HDACi для изготовления композиции вакцины, содержащей один или несколько представляющих интерес антигенов, предназначенных для того, чтобы у пациента развился иммунный ответ против представляющего интерес антигена(ов).
Способ и применение, описанные здесь, особенно интересны, когда композиция вакцины представляет собой противоопухолевую вакцину, то есть содержит антиген(ы), представляющий интерес, который экспрессируется раковыми клетками. В частности, способ и применение очень адаптированы для лечения раковых опухолей. Действительно, при этих типах рака иммунное микроокружение особенно иммуносупрессорно (т.е. существует экспрессия цитокинов и молекулярных сигналов и рекрутирование таких CD4-клеток, что эффективность иммунных клеток против раковых антигенов снижается); не будучи связанными этой теорией, постулируется, что присутствие HDACi изменит микроокружение и позволит иммунным клеткам потенцироваться для борьбы с раковыми клетками, возможно, путем модификации экспрессии генов, обладающих иммунодепрессивным эффектом в клетках которые присутствуют в опухоли вблизи или вокруг нее.
Описанный здесь способ может также включать стадию введения HDACi в течение нескольких дней после введения композиции вакцины. Это непрерывное введение HDACi может быть полезно для поддержания модификации микроокружения в течение времени, достаточного для того, чтобы иммунные клетки могли «захватить» опухоль. Как правило, это дальнейшее непрерывное введение HDACi будет состоять в ежедневном введении адекватной дозы HDACi в течение как минимум трех дней после введения вакцины и до одного месяца. Однако предпочтительно, когда дальнейшее введение HDACi проводят в течение по меньшей мере одной недели, более предпочтительно, по меньшей мере или примерно две недели.
Композиция вакцины содержит иммуногенный элемент (соединение), предназначенный для того, чтобы у пациента развился иммунный ответ на один или несколько интересующих антигенов.
Этот иммуногенный элемент может быть антигеном (или несколькими антигенами). Этот антиген может быть, как видно выше, любой формы, в зависимости от клеток-мишеней (что первоначально включает клетки-хозяева, а также бактериальные клетки, паразитарные патогены или вирусные частицы). Его также можно сформулировать с помощью любого адъюванта (иммуностимулирующего средства), известного в данной области, такого как квасцы или полные или неполные адъюванты Фрейнда.
В другом варианте осуществления иммуногенное соединение представляет собой экстракт из клеточной композиции, где клетки указанной композиции экспрессируют представляющий интерес антиген. Клеточный экстракт может быть лизированным клетками, которые были центрифугированы для удаления нерастворимого вещества, такого как мембранные фрагменты, везикулы и ядра, и, таким образом, состоят в основном из цитозоля. В другом варианте осуществления экстракт может быть изготовлен с использованием конкретных методов для истощения или обогащения конкретных компонентов (например, обработка ультразвуком может быть использована для разрыва крупных мембранных фрагментов на мелкие частицы, которые остаются в экстракте, или высокоскоростное центрифугирование для удаления самых мелких нерастворимых компонентов). Экстракт клеток получают любым химическим или механическим действием, таким как давление, дистилляция, испарение и тому подобное.
В другом варианте осуществления иммуногенный элемент представляет собой клеточную композицию, где клетки указанной композиции экспрессируют представляющий интерес антиген. В этом варианте осуществления предпочтительно, когда мембрана клеток сохраняется (так, что представление антигена осуществляется через путь MHC-I). Предпочтительно, когда клетки инактивируются, как описано ниже.
В этих вариантах осуществления клетки могут быть плюрипотентными клетками, как описано ниже, раковыми клетками, инфицированными вирусом клетками или бактериальными клетками.
В другом варианте осуществления иммуногенный элемент представляет собой клеточную композицию, содержащую антиген-презентирующие клетки (АРС), которые были примированы in vitro представляющим и интерес антигенами. Эта композиция представляет собой антигенпрезентирующую клеточную вакцину, состоящую из антигенов и антигенпрезентирующих клеток (АРС). Антигенпрезентирующие клетки представляют собой клетки, которые проявляют антиген, комплексованный с главными комплексами гистосовместимости (МНС) на их поверхностях. Можно привести дендритные клетки (DC), которые являются предпочтительными в контексте изобретения, поскольку они способны представлять антиген как для хелперных, так и для цитотоксических Т-клеток, макрофагов или В-клеток. Эти АРС могут быть естественными клетками или сконструированными клетками. Можно, в частности, привести Eggermont et al (Trends in Biotechnology, 2014, 32, 9, 456-465), где анализируются успехи в разработке искусственных антигенпрезентирующих клеток. Способы разработки противораковых вакцин с использованием АРС были широко предложены в данной области и известны специалисту в данной области техники.
В другом варианте осуществления иммуногенный элемент фактически не содержит антиген, но состоит из композиции Т-клеточных лимфоцитов, которые были примированы in vitro против представляющего интерес антигена, например, путем воздействия антигенпрезентирующих клеток, презентирующих представляющий интерес антиген. Следовательно, этот состав способен инициировать иммунный ответ in vivo против представляющего интерес антигена. Эту стратегию можно назвать «приемной передачей Т-клеток», и известно, что такие адаптивно переносимые Т-клетки сохраняются в течение длительного периода времени in vivo и легко мигрируют между лимфоидным и сосудистым компартментами (Bear et al, J Biomed Biotechnol. 2011; 2011:417403; Melief et al, J Clin Invest. 2015; 125(9):3401-3412).
Во всех этих вариантах осуществления HDACi вводят в комбинации с композицией вакцины, содержащей иммуногенный элемент. Указанное введение может быть одновременным, раздельным или последовательным, как описано ниже для варианта осуществления, где иммуногенный элемент представляет собой состав плюрипотентных клеток. Следует отметить, что все описания ниже, которые описаны для состава плюрипотентных клеток, одинаково применимы к вакцинам, содержащим любой иммуногенный элемент, как описано выше.
В настоящей спецификации подчеркивается ингибитор HDAC (в частности, вальпроевая кислота) вместе с композицией плюрипотентных клеток, поскольку такие плюрипотентные клетки экспрессируют неоантигены, которые также встречаются в очень агрессивных раковых опухолях, как напомнили выше. Следовательно, независимо от иммуногенного элемента, предпочтительно, когда представляющим интерес антигеном является неоантиген, который экспрессируется раковыми клетками, как описано выше, а также ниже.
В частности, иммуногенный элемент представляет собой клеточную композицию, где клеточная композиция была получена путем расширения и инактивации плюрипотентных клеток, как подробно описано ниже.
Способ лечения субъекта, страдающего раком, комбинированным препаратом
Настоящее изобретение относится к способу лечения субъекта, страдающего раком, включающему стадию одновременного, отдельного или последовательного введения указанному субъекту терапевтического количества I) популяции плюрипотентных клеток и II) соединения, выбранного из группы, которая активирует экспрессию МНС и/или иммунный ответ, как комбинированный препарат.
В предпочтительной среде клетки культивируют таким образом, чтобы презентировать неоантигены через путь МНС I и, в частности, некоторые клетки присутствующей мутации. Соединение, используемое в комбинации с клетками, также может сохранять плюрипотентность клеток. Очень предпочтительно, когда после введения клеток следует введение соединения, которое активирует экспрессию МНС и/или иммунный ответ (предпочтительно того же, которое было первоначально введено в комбинации, но потенциально другое) для усиления иммунного ответа,
Используемые здесь термины «лечить» или «лечение» относятся как к профилактическому лечению, так и к излечению, а также к лечению с модификацией заболевания, в том числе к лечению субъекта при высоком предрасположенном риске заболевания раком, таком как наследственные раковые синдромы в семье, или, как предполагается, болел раком, а также субъектом, больным или диагностированным как страдающий раком или заболеванием, и включает подавление клинического рецидива. Лечение может быть назначено субъекту, болеющему раком, или который в конечном итоге может заболеть раком, чтобы предотвратить, вылечить, задержать начало заболевания, уменьшить тяжесть или улучшить один или несколько симптомов рака или рецидивирующего рака или чтобы продлить выживание субъекта, превышающего ожидаемое в отсутствие такого лечения. Под «терапевтическим режимом» понимается схема лечения болезни, например, схема дозирования, используемая во время терапии. Терапевтический режим может включать режим индукции и режим поддерживания. Фраза «режим индукции» или «период индукции» относится к терапевтическому режиму (или к части терапевтического режима), который используется для первоначального лечения заболевания. Общая цель режима индукции заключается во введении высокого уровня лекарственного средства субъекту в течение начального периода лечения. Режим индукции может использовать (частично или полностью) «режим загрузки», который может включать в себя введение большей дозы лекарственного средства, чем врач применял бы во время режима поддерживания, назначая лекарство чаще, чем врач вводил бы препарат во время режима поддерживания, или в оба случая. Фраза «режим поддерживания» или «период поддерживания» относится к терапевтическому режиму (или к части терапевтического режима), который используется для поддержания субъекта во время лечения болезни, например, чтобы длительное пребывание субъекта в состоянии ремиссии периоды времени (месяцы или годы). Режим поддерживания может использовать непрерывную терапию (например, введение препарата через регулярные промежутки времени (например, еженедельно, ежемесячно, ежегодно и т.д.) или прерывистую терапию (например, прерывание лечения, прерывистое лечение, лечение при рецидиве или лечение после достижения заранее определенных критериев (например, боли, проявления болезни и т.д.).
Используемый здесь термин «одновременное введение» относится к введению 2 активных ингредиентов одним путем и в то же время или по существу в одно и то же время. Термин «отдельное введение» относится к введению 2 активных ингредиентов одновременно или практически в одно и то же время различными путями. Термин «последовательное введение» относится к введению 2 активных ингредиентов в разное время, причем путь введения идентичен или различен.
Используемый здесь термин «субъект» относится к любым млекопитающим, таким как грызун, кошка, собака и не человекообразный примат и человекообразный примат. В частности, в настоящем изобретении субъект представляет собой человека, страдающего или подверженного поражению раковыми заболеваниями, которые имеют экспрессию плюрипотентных эмбрионально-подобных антигенов стволовых клеток.
Используемый здесь термин «популяция» относится к популяции клеток, где большинство (например, по меньшей мере, около 20%, предпочтительно по меньшей мере, около 50%, более предпочтительно, по меньшей мере, около 70% и еще более предпочтительно, по меньшей мере, около 80% и даже более предпочтительно, по меньшей мере, около 90%) от общего числа клеток имеют указанные характеристики интересующих клеток (например, маркеры плюрипотентности для iPSC, ESC, определенные международной инициацией стволовых клеток, включая по меньшей мере 96 маркеров (Adewumi et al, Nat Biotech 2007) и анализом на основе генной экспрессии (PluriTest) (FJ Muller, Nature Methods 2011).
В частности, термин «популяция плюрипотентных клеток» относится к популяции клеток, где характеристики клеток являются выражением плюрипотентных маркеров для iPSC или ESC. Эти клетки предпочтительно выбирают из группы, состоящей из эмбриональных стволовых клеток человека (hESC), индуцированных человеческих плюрипотентных стволовых клеток (hiPSC), аллогенных, ксеногенных или сингенных/аутологичных стволовых клеток.
Используемый здесь термин «плюрипотентный» относится к клеткам, обладающим способностью генерировать потомство, которое в соответствующих условиях может дифференцироваться во все типы клеток, происходящие из трех зародышевых слоев (эндодерма, мезодермы и эктодермы) со специфическими характеристиками клеточных линий. Термин «плюрипотентный» включает нормальные эмбриональные стволовые клетки (ESC) или очень маленькие эмбриональноподобные стволовые клетки (VSEL) или модифицированные индуцированные плюрипотентные стволовые клетки (iPSC), перепрограммированные из всех источников и точек происхождения взрослых соматических клеток (ASC).
Плюрепотентные стволовые клетки способствуют тканям пренатального, постнатального или взрослого организма. Стандартные принятые в области техники тесты используются для установления плюрипотентности популяции клеток, такой как способность образовывать тератому у 8-12-недельных SCID-мышей и различные характеристики плюрипотентных стволовых клеток. Более конкретно, человеческие плюрипотентные стволовые клетки экспрессируют по меньшей мере некоторые (по меньшей мере, три, более обычно, по меньшей мере, четыре или пять) и, необязательно, все маркеры из следующего неограничивающего списка: SSEA-3, SSEA-4, TRA-1-60, TRA-1-81, TRA-2-49/6E, щелочной фосфатазы (ALP), Sox2, E-cadherin, UTF-I, Oct4, Lin28, Rexl, Nanog, TERC, TERT.
Плюрепотентные стволовые клетки традиционно возникают на этапе бластоцисты эмбрионального развития и обладают способностью развиваться во все типы эмбриональных и взрослых клеток, за исключением, возможно, плаценты. Эмбриональные плюрипотентные стволовые клетки (ESC) обычно могут быть выделены из 50-150-клеточной, 4-5-дневной пост-оплодотворной бластоцисты. В то время как ESC способны к неопределенному распространению ex vivo, они существуют только временно in vivo во время эмбриогенеза. Различные животные линии (в том числе человека) ESC, такие как, например, одобренные NIH клеточные линии WAO9 человеческих ESC, могут быть коммерчески получены от Научно-исследовательского института WiCell в Мэдисоне, штат Висконсин. Линии ESC человека, такие как Сесоl-14, могут быть коммерчески получены, например, из Секольфа, Богота, Колумбия. Конечно, при необходимости можно использовать другие линии эмбриональных стволовых клеток.
Используемый здесь термин «эмбриональная стволовая клетка» относится к плюрипотентным клеткам человека (то есть hESC). HESC изолированы из эмбрионального этапа до этапа бластоцисты. В другом варианте осуществления клетки hES получают дедифференцировкой, по меньшей мере, частично дифференцированных клеток (например, мультипотентных клеток) и являются тотипотентными на практике. Способы получения hESC хорошо известны и изучены, например, в патентах США №№5,843,780, 6,200,806, 7,029,913, 5,453,357, 5,690,926, 6,642,048, 6,800,480, 5,166,065, 6,090,622, 6,562,619, 6,921,632 и 5,914,268, опубликованной заявке США №2005/0176707, международной заявке № WO 2001085917. В контексте изобретения эмбриональная стволовая клетка человека (hESC) генерируется без разрушения эмбрионов в соответствии с технологией, описанной у Chung et al 2008.
Используемый здесь термин «индуцированная плюрипотентная стволовая клетка» относится к плюрипотентной стволовой клетке, искусственно полученной из не-плюрипотентной клетки, посредством процедуры перепрограммирования с использованием способов, известных в данной области и первоначально описанных Yamanaka (в частности, WO 02012/060473, PCT/JP2006/324881, PCT/JP02/05350, US 9,499,797, US 9,637,732, US 8,158,766, US 8,129,187, US 8,058,065, US 8,278,104. Говоря короче, соматические клетки перепрограммируются на индуцированные плюрипотентные стволовые клетки (iPSC) посредством эктопической экспрессии определенных факторов такие как Oct4, Sox2, Klf4 и с-Му или Oct4, Sox2, Lin28 и Nanog. В конкретном варианте осуществления индуцированные плюрипотентные стволовые клетки производны от млекопитающих, в частности (но не ограничиваясь ими) грызунов, свиней, кошек, собак, и нечеловекообразных приматов, и человека.
iPSC были успешно созданы из соматических клеток различного происхождения (фибробласт, клетки крови, кератиноциты …) и с использованием переменных технологий (таких как интегративный лентивирус/ретровирус и неинтегративные векторы, такие как вирус sendai, эписомальные векторы, синтетическая мРНК, аденовирус, rAAV, рекомбинантные белки …) с небольшими химическими соединениями или без них.
Малые молекулы можно использовать для усиления индукции и качества мышиных и человеческих iPSC, они действуют как эпигенетические модификаторы (то есть модифицируют экспрессию некоторых генов). В качестве иллюстрации можно привести BIX01294 (BIX, G9a-ингибитор метилтрансферазы гистонов), бутират натрия (NaB, ингибитор HDAC гистондезацетилазы) или S-аденозилгомоцистеин (SAH, агент деметилирования ДНК), 5-азацитидин (5-AZA, ингибитор метилтрансферазы ДНК), вальпроевая кислота (VPA, еще один ингибитор гистондезацетилазы) также улучшает перепрограммирование и качество нормальных iPSC.
Полностью перепрограммированные bona-fide iPSC экспрессируют аналогичные плюрипотентные гены, как эмбриональные стволовые клетки со способностью к самообновлению, и представляет собой неограниченный ресурс стволовых клеток (или клеток, подобных стволовым).
ESC и IPSC могут быть усилены итеративно во время многочисленных и безграничных проходов, позволяющих масштабировать ресурсы стволовых клеток. Плюрепотентный потенциал активно поддерживается в условиях разрешительной культуры, сохраняя высокую экспрессию генов плюрипотентности высокого уровня. Эти способы известны в данной области техники.
Конкретные условия и методы культивирования позволяют реплицировать стабильный геном, но некоторые экзомные мутации и эпигеномные модификации, тем не менее, были описаны (Gore A and al. Nature 2011).
Используемый здесь термин «соматическая клетка» относится к любой клетке организма, кроме клеток зародышевой линии (сперматозоидов и яйцеклеток).
Используемый здесь термин «аллогенные клетки» относится к клеткам одного и того же вида, но генетически различных.
Используемый здесь термин «сингенные или аутологичные клетки» относится к клеткам одного и того же вида и одного и того же генетического фона.
Используемый здесь термин «ксеногенные клетки» относится к клеткам разных видов и генетически различным.
В конкретном варианте осуществления стволовые клетки могут быть получены из млекопитающих, но не ограничиваясь ими, грызунов, свиней, кошек, собак и приматов, включая людей.
Способ получения популяции плюрипотентных клеток
В первом аспекте изобретение относится к способу получения клеточной композиции, включающему стадии
I) размножение плюрипотентных клеток при наличии таких условий, чтобы поддерживать плюрипотентную способность клеток, в присутствии агента, который индуцирует MHC-I представление антигенов у указанной популяции во время стадии размножения
II) экспозиция размноженных клеток инактивирующему агенту, который будет инактивировать клетки,
III) восстановление и консервация размноженных инактивированных клеток.
В конкретном варианте осуществления целостность оболочки клетки поддерживается на стадии II).
В другом варианте осуществления клетки инактивируются и получают продукт, полученный из клеток, такой как клеточные экстракты.
Клеточная композиция, полученная в соответствии с вышеописанным способом, может быть использована для лечения рака в соответствии с описанными здесь способами.
Агент для МНС I презентации антигена
Плюропотентные клетки размножаются в присутствии агента, который улучшит презентацию антигенов через путь МНС I. Такая улучшенная экспрессия может быть проверена путем сравнения количества молекул МНС I на поверхности клеток в присутствии или в отсутствие агента.
Такие агенты известны в данной области техники, и можно привести, в частности, ингибиторы гистондезацетилазы (HDAC). Многочисленные продукты, обладающие этой активностью, известны в данной области, среди этих HDAC, можно привести, в частности, вальпроат (VPA или вальпроевая кислота, номер CAS 99-66-1). Другие HDAC, которые могут использоваться (поскольку они имеют тот же способ действия, что и VPA), включают, вориностат, ромадипсин хидамид, панобиностат, белиностат, моцетиностат, абексиностат, энтиностат, SB939, ресминостат, гивиностат или квизиностат.
Эти агенты присутствуют в среде клеточной культуры (экспансии) во время размножения плюрипотентных клеток.
Поддержание плюрипотентности клеток
Размножение клеток проводят в таких условиях, чтобы поддерживать плюрипотентную способность клеток (среда, температура). Эти условия культивирования известны в данной области техники. Поддержание плюрипотентной способности клеток гарантирует, что такие клетки будут экспрессировать (и, следовательно, презентировать) все эмбриональные антигены, тем самым увеличивая способность клеток презентировать такой антиген на их поверхности через путь МНС I.
Чем больше эмбриональных антигенов, представленных на поверхности плюрипотентных клеток, тем больше вероятность того, что, по крайней мере, один из этих антигенов будет присутствовать на поверхности раковых клеток, и которые будут распознаны и таргетированы иммунной системой, которые были примированы композицией вакцины согласно изобретению.
Следовательно, поддержание плюрипотентности клеток композиции в соответствии с изобретением, полученной описанными здесь способами, приводит к презентации широкого спектра эмбриональных антигенов и, следовательно, к вездесущей активности композиции вакцины согласно изобретению в описанных здесь способах лечения.
Размножение клеток в таких условиях, как поддержание плюрипотентности, известно в данной области техники. Это описано, в частности, во всех протоколах размножения iPSC, описанных на сегодняшний день (Shi Y and al, Nat Rev Drug Discovery 2017, Chen KG and al Cell Stem Cell 2014). Предпочтительно, когда используются следующие условия:
- Использование среды Е8 или всей культуральной среды ES/iPSC, необязательно дополненной VPA и/или мутагенными агентами (например, ENU, см. ниже).
- Температура 37°C с или без условий гипоксии
- Смена среды каждый день с использованием той же среды с добавлением VPA (от 0,1 мМ до 5 мМ) и/или ENU (от 0,1 мкг/мл до 100 мкг/мл) и/или ингибитора р53 и/или соединения, которые усиливают выживание клеток, такие как ингибитор гормона Y-27632.
Клетки обычно культивируют в течение 8 недель с оптимальной плотностью 90%, поддерживаемой регулярными пассажами один раз в неделю, с использованием ферментативной отслойки (коллагеназы, трипсина).
Инактивация клеток
В предпочтительном варианте осуществления плюрипотентные клетки, которые используются в описанном здесь способе лечения, инактивируются. Термин «инактивированный» и его грамматические варианты используются здесь для обозначения клетки (например, плюрипотентной клетки), которая является живой, но была сделана неспособной к пролиферации (то есть митотически инактивированной). Специалисты в данной области техники могут использовать методы, известные в данной области, включая, но не ограничиваясь ими, воздействие химических агентов, облучение и/или лиофилизацию. Плюрепотентные клетки могут быть инактивированы таким образом, что при введении субъекту плюрипотентные клетки неспособны делиться и, следовательно, не могут образовывать тератомы у субъекта. Понятно, что в контексте множества клеток не каждая клетка должна быть неспособна к размножению. Таким образом, как используется здесь, фраза «инактивированная до степени, достаточной для предотвращения образования тератомы у субъекта», относится к степени инактивации в популяции в целом, так что после введения субъекту тератома не образуется, после облучения плюрипотентные стволовые клетки больше не делятся, как подтверждается культурой in vitro. Следует отметить, что даже если одна или несколько клеток во множестве клеток фактически способны к пролиферации у субъекта, гипотетически иммунная система хозяина разрушит эти клетки до образования тератомы. Такая неспособность к пролиферации и образованию тератомы может быть подтверждена тестированием на мышах, имеющих функциональную и нефункциональную иммунную систему.
В некоторых вариантах осуществления «инактивированная» клетка представляет собой убитую клетку, а в некоторых вариантах осуществления инактивированная клетка представляет собой цельноклеточный лизат, полученные из плюрипотентных стволовых клеток экзосомы, обогащенные неоантигены раковых стеблей, полностью очищенные неоантигены раковых стволовых клеток, ДНК-РНК и белковые экстракты, цельноклеточную суспензию, которая была лиофилизирована, часть клеточного лизата, такая как мембранная фракция, цитоплазматическая фракция или их комбинацию. Инактивированные плюрипотентные стволовые клетки остаются способными стимулировать иммунный ответ, когда вакцинацию мышей проводят с помощью hESC или hiPSC в сочетании с вальпроевой кислотой или другим HDACi. Эта вакцинация способна вызывать эффективные иммунные и противоопухолевые реакции против карциномы молочной железы 4Т1 без признаков побочных эффектов и аутоиммунных заболеваний.
Как правило, для инактивации стволовых клеток они могут подвергаться воздействию летальных доз облучения (например, от 5 до 100 Гр на отдельную фракцию). Точная доза облучения, получаемая клетками и длительность дозы не является критичной, если клетки оказываются нежизнеспособными.
Восстановление и консервация клеток
Стадия восстановления способа включает в себя одну (или множественную) стадию (и) промывки клеточной культуры и ресуспендирования клеток в любой подходящей среде, такой как среда X-Vivo/Stemflex или любые другие клеточные среды клинического класса.
Консервация клеток может включать замораживание или лиофилизацию клеток, чтобы иметь возможность хранить клеточную композицию перед использованием.
Мутирование плюрипотентных клеток и экспрессия нео-антигенов
Напомним, что плюрипотентные клетки представляют собой клетки, которые генетически очень стабильны. Действительно, поскольку они присутствуют очень рано в процессе развития эмбрионов, и они должны размножаться для развития эмбриона, важно, чтобы эти клетки не были слишком склонны к мутациям, чтобы иметь однородность в эмбрионе.
Следовательно, клетки, присутствующие в популяции плюрипотентных клеток, как правило, очень гомогенны при рассмотрении их генетического содержания (то есть более 95% клеток популяции представляют один и тот же генетический фон).
При подготовке iPSC селективное преимущество некоторых клеток происходит во время нескольких пассажей, что приводит к популяции клонов iPSCs, которые представляют определенные мутации на поздних проходах, но последовательность клеточных геномов близка к 100%.
Однако после нескольких пассажей iPSC стабильны как hESC (Hussein SM and al, Nature 2011). Культурные (адаптивные) мутации будут получены с очень небольшим генетическим изменением при длительной культуре (Hussein SM and al, Bioessays, 2012).
Однако благоприятно иметь возможность индуцировать мутации в клетках, чтобы повысить изменчивость эмбриональных неоантигенов на обработанном клеточном материале, который обнаружен при агрессивных раковых опухолях. Таким образом, это увеличит вероятность того, что иммунная система будет генерировать Т-клетки против этих мутированных клеток и сможет бороться с раковыми клетками, а также с теми, которые будут подвергаться более поздним изменениям во время роста опухоли.
Это поможет бороться с раком, который возникает в результате накопления генетических изменений, вызванных ошибками репликации ДНК и/или воздействиями окружения при пролиферации раковых стволовых клеток. Эти изменения включают мутации рака, которые инициируют канцерогенез, и дестабилизирующие генные мутации. Эта повышенная неустойчивость генома приводит к клональной эволюции, приводящей к выбору более агрессивных клонов с повышенной лекарственной устойчивостью.
Следовательно, в конкретном варианте осуществления клетки размножаются в условиях, которые будут вызывать мутации в генах указанных клеток.
Таким образом, клетки могут быть подвергнуты воздействию мутагенного агента, то есть физического или химического агента, который изменяет генетический материал, обычно ДНК, организма и, таким образом, увеличивает частоту мутаций выше естественного фонового уровня.
Мутаген может быть выбран из группы, состоящей из физических мутагенов и химических мутагенов.
Среди физических мутагенов можно привести
- ионизирующие излучения, такие как рентгеновские лучи, гамма-лучи и альфа-частицы, которые могут вызвать разрушение ДНК и другие повреждения. Можно, в частности, исходить из кобальта-60 и цезия-137. Уровень облучающего излучения должен быть значительно ниже, чем для инактивации клеток, и может быть разработан специалистом в данной области техники
- ультрафиолетовое излучение с длиной волны выше 260 нм, что может привести к ошибке при репликации, если она не исправлена
- или радиоактивный распад, такой как 14С в ДНК.
Среди химических мутагенов можно привести
- Реактивные формы кислорода (ROS), такие как супероксид, гидроксильные радикалы, перекись водорода.
- Деаминирующие агенты, такие как азотистая кислота, которые могут вызывать мутации перехода путем превращения цитозина в урацил.
- Полициклический ароматический углеводород (ПАУ), который может связываться с ДНК при активации до диол-эпоксидов.
- Алкилирующие агенты, такие как этилнитрозомочевина (ENU, CAS №759-73-9), горчичный газ или винилхлорид.
- Ароматические амины и амиды, такие как 2-ацетиламинофлуорен
- Алкалоид из растений, например, из видов Vinca
- Бром и некоторые соединения, которые содержат бром
- Азид натрия
- Блеомицин
- Псорален в сочетании с ультрафиолетовым излучением
- Бензол
- Базовые аналоги, которые могут заменить базы ДНК во время репликации и вызывать мутации перехода
- Интеркалирующие агенты, такие как бромид этидия, профлавин, даунорубицин
- Металлы, такие как мышьяк, кадмий, хром, никель и их соединения, которые могут быть мутагенными
В этом варианте осуществления будет получена популяция плюрипотентных стволовых клеток где клетки имеют случайные мутации (как правило, отличные от клетки к клетке, что приводит к гетерогенной популяции), в частности в отношении неоантигенов, связанных с раком.
Авторы показали, что можно разработать условия для культивирования, которые позволяют индуцировать ошибки репликации ДНК в плюрипотентных стволовых клетках, не вызывая зависимого от повреждений ДНК апоптоза.
Это особенно удивительно, поскольку, как указано выше, плюрипотентные клетки, естественно, очень стабильны, так как должно быть такое же количество возможных мутаций, которые были введены на ранних этапах эмбриогенеза. Из этого вытекает, что механизм восстановления ДНК очень эффективен в этих клетках, тем самым устраняет большинство дефектов и/или индуцирует апоптоз в случае, если невозможно устранить эти дефекты.
В одном варианте осуществления плюрипотентные клетки (такие как ESC или IPSC) исходной популяции размножаются и поддерживаются в плюрипотентных допустимых культуральных средах (как известно в данной области техники) для сохранения плюрипотентности на этапа итерационных проходов. В этих условиях обычно наблюдалось бы небольшое количество экзомных мутаций (5-10 мутаций на экзом).
Затем плюрипотентные клетки культивируют in vitro с мутагенными соединениями или методами, чтобы индуцировать и увеличивать геномную нестабильность внутри плюрипотентных стволовых клеток, таких как перечисленные выше. Повреждения ДНК хорошо подтверждаются фосфорилированием γН2АХ в качестве маркера для двухсторонних разрывов (DSB). Как доля положительных клеток γН2АХ, так и частота очагов γН2АХ увеличивались в ESC или IPSC, а также большее количество микроядер представляет собой маркер геномной нестабильности.
Предпочтительными агентами являются Блеомицин, ENU, алкилирующие агенты, Актиномицин D, ROS-модулирующие агенты, УФ, Н2O2, ионизирующие излучения (гамма-лучи, рентгеновские лучи), которые позволяют индуцировать и усиливать скорости мутаций в плюрипотентных стволовых клетках, которые накапливаются во время культивирования.
Было показано, что в предпочтительном варианте осуществления N-этил-N-нитрозомочевина (ENU) создает новые мутации и повышает уровень неоантигенов в обработанных плюрипотентных стволовых клетках в течение длительной культуры, по меньшей мере, от 7 до 60 дней в дозе <50 мкг/мл. Эти мутации аналогичны тем, которые были зарегистрированы при раке.
Таким образом, можно накопить разнообразие мутаций в ответ на повреждение ДНК во время пролиферации плюрипотентных клеток с высокой скоростью мутаций из селективного преимущества при длительной культуре, сохраняя при этом плюрипотентность клеток, в частности, когда клетки культивируют с помощью HDACi в среде. Присутствие HDACi в культуре сохраняет увеличение активных гистонов (H3K4me3 и H3K9ac) и эпигенетическую метку плюрипотентности в ответ на индуцирование повреждения ДНК, а также скорость репликации и пролиферации во время пассажей.
В другом варианте осуществления описанных здесь композиций и способов мутации индуцируются в плюрипотентных клетках посредством генетической модификации клеток генами, которые способствуют высокому уровню геномной нестабильности. В частности, можно удалить или уменьшить активность генов или сигнальных путей, участвующих в репарации ДНК и репликации, с использованием соответствующих ингибиторов, таких как ингибиторы NER/BER/DSBR/MMR. Эти методы, которые индуцируют геномную нестабильность, связанную с увеличением повреждения ДНК, могут быть выполнены с использованием «векторов» или «генетической модификации», которые инактивируют или дезактивируют гены, связанные с восстановлением ДНК, или сигнальные пути, такие как дельта-комплекс ДНК-полимеразы, ремонт рассогласования (MMR) восстановление эксцизии оснований (BER), восстановление эксцизии нуклеотидов (NER), гомологичная рекомбинация (HR), DSBR или NEJH. Другими примерами генов репарации ДНК являются DNApkC, Ku70, Rad 51, BRCA1 или Brca2.
В других вариантах осуществления плюрипотентные клетки модифицируют таким образом, чтобы подавлять связанные с апоптозом гены, такие как р53, генетической модификацией или химическим р53, таким как Pifithrin-mu, Nutlin-3 или с использованием соединений, которые повышают выживаемость клеток, таких как Y-27632, селективный ингибитор p160-Rho-связанной спиральной киназы (ROCK).
В конкретном варианте осуществления популяция плюрипотентных клеток состоит из индуцированных плюрипотентных стволовых клеток (iPSC), которые были получены из соматических клеток, таких как клетки, выделенные у пациента, которые уже содержали геномные изменения, привязанные к
I) к заболеваниям, связанным с репарацией ДНК, в том числе, например, при синдром атаксии-телеангиэктазии, синдроме Блума, синдроме Кокейна, анемии Фанкони, синдроме Вернера, пигментная ксеродерма, синдроме обрыва Неймегена;
II) к семейным наследственным раковым синдромам рака с геномной нестабильностью, таким как синдром Линча (наследственный неполипозный колоректальный рак с мутациями в генах MMR, включая MLH1, MSH2, MSH6, PMS1 и PMS2), синдром Ли-Фраумени с мутацией в гене ТР53 или CHEK2, наследственный синдром рака груди и яичников (НВОС) с делецией или мутацией в гене BRCA1/2, семейный аденоматозный полипоз (FAP) с мутациями в гене АРС;
III) соматическая онкогенная индуцированная геномная нестабильность, как в CML с транслокацией (Т9; 22).
В предпочтительном варианте осуществления популяция мутированных плюрипотентных клеток производится из индуцированных плюрипотентных стволовых клеток и генерируется из соматических клеток, содержащих геномные изменения, связанные с заболеванием. Как правило, геномные изменения могут быть транслокацией (Т9: 22), делецией (BRCA1/2) или мутациями (BRCA, RET).
В конкретном варианте осуществления популяция плюрипотентных стволовых клеток состоит из iPSC, полученных из раковых клеточных линий или специфичных для пациента раковых клеток.
В другом варианте осуществления популяция ESC или IPSC модифицирована генетически, чтобы чрезмерно экспрессировать множественные неоантигены, не связанные с раком, с использованием «векторов». В конкретном варианте осуществления популяция ESC или IPSC модифицируется генетически, чтобы экспрессировать множественные мутации и нео-антигены, специфичные к раковым стволовым клеткам (по меньшей мере 5) в плюрипотентных стволовых клетках с помощью технологии «редактирования генома». Настоящее изобретение относится к композициям и способам, обеспечивающим ESC или IPSC путем введения их многочисленных неоантигенов посредством редактирования, модификации, ингибирования экспрессии и других технологий на основе РНК.
Используемый здесь термин «редактирование генома» относится к генетической манипуляции, опосредуемой РНК, включая, в частности, направляющую РНК для модификации генома, опосредованного cas9. Эта гидовая РНК (гРНК) трансфицируется вместе с эндонуклеазой cas9. Гидовая РНК обеспечивает скаффлолд и спейсерную последовательность, комплиментарную мишени. В другом варианте осуществления последовательность генетического манипулирования может представлять собой последовательность сиРНК или микроРНК, предназначенную для сайленсинга генов, согласно стандартным методам в данной области, с использованием систем Crispr-Cas 9. Композиции и способы получения и использования систем Crispr-Cas известны в технике и описаны, в частности, в патенте США 8,697,359.
В конкретном варианте осуществления популяцию плюрипотентных клеток обрабатывают алкилирующими агентами. Используемый здесь термин «алкилирующие агенты» относится к веществу, которое добавляет одну или несколько алкильных групп от одной молекулы к другой. Эта обработка создает новые мутации в неоантигенах, обеспечивающих превосходные иммунные реакции, путем увеличения клонального размножения TIL и Th1/Th2 клеточного иммунитета.
В настоящем изобретении алкилирующий агент выбирают из группы, состоящей из азотных ипритов, нитрозомочевин, алкилсульфонатов, триазинов, этилениминов и их комбинаций. Неограничивающие примеры азотных ипритов включают в себя мехлорэтамин (Lundbeck), хлорамбуцил (GlaxoSmithKline), циклофосфамид (Mead Johnson Co.), бендамустин (Astellas), ифосфамид (Baxter International), мелфалан (Ligand), мелфалан флуфенамид (Oncopeptides) и фармацевтически приемлемые соли. Неограничивающие примеры нитрозомочевин включают стрептозоцин (Teva), кармустин (Eisai), ломустин (Sanofi) и их фармацевтически приемлемые соли. Неограничивающие примеры алкилсульфонатов включают бусульфан (Jazz Pharmaceuticals) и их фармацевтически приемлемые соли. Неограничивающие примеры триазинов включают дакарбазин (Bayer), темозоломид (Cancer Research Technology) и их фармацевтически приемлемые соли. Неограничивающие примеры этилениминов включают тиотепа (Bedford Laboratories), альтретамин (MGI Pharma) и их фармацевтически приемлемые соли. Другие алкилирующие агенты включают ProLindac (Access), Ас-225 ВС-8 (Actinium Pharmaceuticals), ALF-2111 (Alfact Innovation), трофосфамид (Baxter International), MDX-1203 (Bristol-Myers Squibb), тиоуреидобутиронитрил (CellCeutix), митобронитол (Chinoin), митолактол (Chinoin), нимустин (Daiichi Sankyo), глюфосфамид (Eleison Pharmaceuticals), комбинации HuMax-TAC и PBD ADC (Genmab), BP-C1 (Meabco), треосульфан (Medac), нифуртимокс (Metronomx), имсульфафан тосилат (Mitsubishi tanabe Pharma), ранимустин (Mitsubishi tanabe Pharma), ND-01 (NanoCarrier), HH-1 (Nordic Nanovector), 22P1G-клетки и комбинации ифосфамида (Nuvilex), эстрамустинфосфат (Pfizer), преднимустин (Pfizer), лурбитустедин (PharmaMar), трабестедин (PharmaMar), альтроатамин (Sanofi), SGN-CD33A (Seattle Genetics), фотермустин (Servier), недаплатин (Shionogi), гептаплатин (Sk Holdings), апазиквон (Spectrum Pharmaceuticals), SG-2000 (Spirogen), TLK-58747 (Telik), ларомустин (Vion Pharmaceuticals), прокарбазин (A lkem Laboratories Ltd.) и их фармацевтически приемлемые соли. В другом варианте алкилирующий агент выбирают из группы, включающей мехлорэтамин (Lundbeck), хлорамбуцил (GlaxoSmithKline), циклофосфамид (Mead Johnson Co.), стрептозоцин (Teva), дакарбазин (Bayer), тиотепа (Bedford Laboratories), альтретамин (MGI Pharma), их фармацевтически приемлемые соли и их комбинации. В другом варианте алкилирующий агент выбирают из группы, состоящей из ProLindac (Access), Ас-225 ВС-8 (Actinium Pharmaceuticals), ALF-2111 (Alfact Innovation), бендамустина (Astellas), ифосфамида (Baxter International), трофосфамида (Baxter International), MDX-1203 (Bristol-Myers Squibb), темозоломида (Cancer Research Technology), тиоуреидобутиронитрила (CellCeutix), митобронитола (Chinoin), митолактола (Chinoin), нимустина (Daiichi Sankyo), кармустина (Eisai), глюфосфамида (Elicon Pharmaceuticals), комбинации HuMax-TAC и PBD ADC (Genmab), бусульфана (Jazz Pharmaceuticals), мелфалана (Ligand), BP-C1 (Meabco), треоеульфана (Medac), нифуртимокса (Metronomx), имсульфафан тозилата (Mitsubishi tanabe Pharma), ранимустина (Mitsubishi tanabe Pharma), ND-01 (NanoCarrier), HH-1 (северный нановектор), 22P1 G-клеток и комбинации ифосфамида (Nuvilex), мелфалана флуфенамида (Oncopeptides), эстрамустинфосфата (Pfizer), преднимустина (Pfizer) лурбитустедина (PharmaMar), трабестедина (PharmaMar), альтроамина (Sanofi), ломустина (Sanofi), SGN-CD33A (Seattle Genetics), фотемустина (Servier), недаплатина (Shionogi), гептаплатина (Sk Holdings), апазиклона (Spectrum Pharmaceuticals), SG-2000 (Spirogen), TLK-58747 (Telik), ларомустина (Vion Pharmaceuticals), прокарбазина (Alkem Laboratories Ltd.), их фармацевтически приемлемых солей и их комбинаций.
В конкретном варианте осуществления популяцию плюрипотентных клеток обрабатывают N-этил-N-нитрозомочевиной (ENU, номер CAS 759-73-9). ENU имеет следующую химическую формулу C3H7N3O2, является сильнодействующим мутагеном перенося этильную группу в нуклеиновые основания в нуклеиновых кислотах.
Как указано выше, целью мутагенного агента является введение случайных мутаций в гены плюрипотентных клеток во время размножения (введение мутаций происходит во время репликации и деления клеток). Популяция плюрипотентных стволовых клеток приобретает мутации, которые могут обеспечить преимущество роста и быть выбраны для содействия адаптации культуры. Пассажи ESC или iPSCs подвергаются высокому уровню давления отбора, а при размножении множественная клонированная мутантная популяция может быть выгодно отобрана.
Следует отметить, что, поскольку плюрипотентные клетки очень стабильны, применение мутагена может потребоваться в течение длительного периода времени. В качестве иллюстрации, когда используется ENU, его можно применять в течение по меньшей мере 7 дней, более предпочтительно, по меньшей мере, 15 дней, более предпочтительно, по меньшей мере, 20 дней, более предпочтительно, по меньшей мере, 30 дней, более предпочтительно, по меньшей мере, 40 дней, более предпочтительно, по меньшей мере, 50 дней или даже, по меньшей мере, 60 дней. После применения мутагена клетки промывают (если мутаген представляет собой химический агент) и могут быть дополнительно расширены в присутствии агента, который благоприятствует экспрессии MHC-I, в частности, HDACi. Этот агент предпочтительно также присутствует во время нанесения мутагенного агента.
Таким образом, можно наблюдать и проверять, что мутаген будет вызывать мутации (то есть не синонимичные, бессмысленные, сдвиг фрейма, StopGain, вариант сплайса, CNV, SNV) в некоторых эмбриогенных генах, которые экспрессируются плюрипотентными клетками и, следовательно, увеличивают разнообразие из этих антигенов (новые нео-антигены во всем геноме). Это, таким образом, увеличит возможность создания композиции вакцины с повышенной иммуногенностью, способной стимулировать широкий иммунный ответ против агрессивных форм рака, где бывают быстрые и частые мутации.
Эффективный иммунный ответ действительно может быть труднополучаемым для некоторых раковых опухолей, где клональное размножение раковых клеток происходит с мутациями в антигенах, экспрессируемых опухолевыми клетками. Таким образом, иммунный ответ зависит от мутационной нагрузки рака. Генерация случайных мутаций в популяции плюрипотентных клеток с помощью мутагена привела бы таким образом к экспрессии мутированных эмбриональных антигенов и увеличению разнообразия антигенов, представленных иммунной системе при вакцинации.
Следовательно, уже были бы Т-клетки, примированные против мутированных антигенов, которые появлялись бы в раковых клетках во время деления таких клеток, что ускоряло бы и улучшало бы иммунный ответ против этих клеток.
Модификация плюрипотентных клеток
В конкретном варианте осуществления популяция плюрипотентных стволовых клеток модифицируется генетически для сверхэкспрессируемых соединений, которые стимулируют иммунный ответ, используя интеграцию генов в геноме плюрипотентных клеток. Как правило, на первой стадии популяция стволовых клеток выделяется и размножается. На второй стадии гены, представляющие интерес, упаковываются в интегративные вирусные векторы, такие как ретровирусы или лентивирусы. На третьей стадии интегрирующие вирусные векторы, содержащие ген, представляющий интерес, переносят в популяцию стволовых клеток.
В конкретном варианте осуществления популяция плюрипотентных клеток модифицируется генами белков, которые стимулируют экспрессию МНС и/или иммунный ответ. Эти соединения выбраны из группы, включающей интерферон альфа (IFN-α), интерферон гамма (IFN-γ), интерлейкин 2 (IL-2), интерлейкин 4 (IL-4), интерлейкин 6 (IL-6), интерлейкин 12 (IL-12), факторы некроза опухоли (TNF) и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), их функциональные фрагменты и их комбинации.
Интерфероны (IFN), предусмотренные настоящим изобретением, включают в себя общие типы IFN, IFN-альфа (IFN-α), IFN-бета (IFN-β) и IFN-гамма (IFN-γ). IFN могут действовать непосредственно на раковые клетки, например, замедляя их рост, способствуя их развитию в клетки с более нормальным поведением и/или увеличивая их производство антигенов, тем самым облегчая распознавание и уничтожение раковых клеток для иммунной системы. IFN также могут косвенно воздействовать на раковые клетки, например, путем замедления ангиогенеза, усиления иммунной системы и/или стимуляции клеток-киллеров (NK), Т-клеток и макрофагов. Рекомбинантный IFN-альфа доступен коммерчески как Roferon (Roche Pharmaceuticals) и Intron A (Schering Corporation).
Интерлейкины, предусмотренные настоящим изобретением, включают IL-2, IL-4, IL-11 и IL-12. Примеры коммерчески доступных рекомбинантных интерлейкинов включают Proleukin® (IL-2, Chiron Corporation) и Neumega® (IL-12, Wyeth Pharmaceuticals). В настоящее время Zymogenetics, Inc. (Сиэтл, Вашингтон) тестирует рекомбинантную форму IL-21, которая также предназначена для использования в комбинациях настоящего изобретения.
Колониестимулирующие факторы (CSF), предусмотренные настоящим изобретением, включают гранулоцитарный колониестимулирующий фактор (G-CSF или филграстрим), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF или саррагостим) и эритропоэтин (эпоэтин альфа, дарбепоэтин). Лечение одним или несколькими факторами роста может помочь стимулировать генерацию новых клеток крови у пациентов, проходящих традиционную химиотерапию. Соответственно, лечение CSF может помочь уменьшить побочные эффекты, связанные с химиотерапией, и может позволить использовать более высокие дозы химиотерапевтических агентов. Различные рекомбинантные колониестимулирующие факторы доступны коммерчески, например, Neupogen® (G-CSF; Amgen), Neulasta (пелфиграстим; Amgen), Leukine (GM-CSF; Berlex), Procrit (эритропоэтин; Ortho Biotech), Epogen (эритропоэтин; Amgen), Arnesp (эритропоэтин).
В самом широком смысле «вектор» представляет собой любое средство, способное облегчать перенос олигонуклеотидов в клетки. Предпочтительно вектор переносит нуклеиновую кислоту в клетки с пониженной деградацией относительно степени деградации, к которой приведет отсутствие вектора. В общем, векторы, полезные в изобретении, включают, но не ограничиваются ими, голые плазмиды, невирусные системы доставки (электропорация, ультразвуковая обработка, катионные трансфекционные агенты, липосомы и т.д.), фагемиды, вирусы, другие носители, полученные из вирусных или бактериальных источников, над которыми проведена манипуляция с введением или включением последовательностей нуклеиновых кислот. Вирусные векторы являются предпочтительным типом вектора и включают, но не ограничиваются ими, последовательности нуклеиновых кислот из следующих вирусов: РНК-вирусы, такие как ретровирус (как, например, вирус мышиного лейкоза Молоуни и векторы, полученные из лентивируса), вирус мышечной саркомы, мышиный вирус опухоли молочной железы и вирус саркомы rous; аденовирус, адено-ассоциированный вирус; вирусы типа SV40; полиомы; вирусы Эпштейна-Барра; вирусы папилломы; вирус герпеса; вирус коровьей оспы; вирус полиомиелита. Можно легко использовать другие векторы, не названные, но известные в данной области техники.
Как правило, в контексте изобретения вирусные векторы включают аденовирусы и аденоассоциированные (AAV) вирусы, которые являются ДНК-вирусами, которые уже были одобрены для использования человеком в генной терапии. На самом деле известно 12 различных серотипов AAV (AAV1-12), каждый из которых имеет различные тканевые тропины (Wu, Z Mol Ther 2006, 14: 316-27). Рекомбинантный AAV получают из зависимого парвовируса AAV (Choi, VW J Virol 2005, 79: 6801-07). Адено-ассоциированный вирус типа 1-12 может быть спроектирован с недостаточной репликацией и способен заражать широкий диапазон типов и видов клеток (Wu, Z Mol Ther 2006, 14: 316-27). Он также имеет такие преимущества, как тепловая стабильность и стабильность в липидном растворителе; высокие частоты трансдукции в клетках различных линий, включая гемопоэтические клетки; и отсутствие ингибирования суперинфекции, таким образом позволяя несколько серий трансдукций. Кроме того, в культуре тканей наблюдались аллергические инфекции, связанные с диким типом, при более чем 100 проходах в отсутствие избирательного давления, что подразумевает, что адено-ассоциированная вирусная геномная интеграция является относительно стабильным событием. Адено-ассоциированный вирус также может функционировать внехромосомным образом.
Другие векторы включают плазмидные векторы. Плазмидные векторы широко описаны в данной области техники и хорошо известны специалистам в данной области. См. Sambrook et al., 1989. В последние несколько лет плазмидные векторы использовались в качестве ДНК-вакцин для доставки генов, кодирующих антиген, в клетки in vivo. Они особенно выгодны для этого, потому что у них нет одинаковых проблем безопасности, как со многими вирусными векторами. Эти плазмиды, однако, имеющие промотор, совместимый с клеткой-хозяином, могут экспрессировать пептид из гена, функционально кодируемого внутри плазмиды. Некоторые обычно используемые плазмиды включают pBR322, pUC18, pUC19, pRC/CMV, SV40 и pBlueScript. Другие плазмиды хорошо известны специалистам в данной области техники. Кроме того, плазмиды могут быть изготовлены на заказ с использованием рестрикционных ферментов и реакций лигирования для удаления и добавления определенных фрагментов ДНК. Плазмиды могут быть доставлены различными путями, а именно парентеральным, через слизистые и местно. Например, плазмиду ДНК можно вводить внутримышечным, внутрикожным, подкожным или другим путем. Его также можно вводить с помощью интраназальных спреев или капель, ректального суппозитория и перорально. Предпочтительно, указанную ДНК-плазмиду вводят через внутриглазный путь (внутривиреальный, субретинальный, супрахориоидальный…). Ее также можно вводить в эпидермис или поверхность слизистой оболочки, используя генную пушку. Плазмиды могут быть даны в водном растворе, высушены на золотых частицах или в сочетании с другой системой доставки ДНК, включая, но не ограничиваясь ими, липосомы, дендримеры, cochleate и микрокапсулирование.
В конкретном варианте осуществления популяция стволовых клеток модифицируется путем введения трансгена, такого как siRNA, в локус AAVS1 хромосомы 19 путем гомологичной рекомбинации.
Используемый здесь термин «гомологичная рекомбинация» относится к средству для таргетирования гена для искусственной модификации определенного гена на хромосоме или геноме. Когда в клетки вводят геномный фрагмент, имеющий гомологичную часть последовательности мишени на хромосоме, этот термин относится к рекомбинации, которая имеет место на основе гомологии нуклеотидной последовательности между введенным геномным фрагментом и соответствующим ему локусом на хромосоме.
Кроме того, термин «генетическая модификация» относится к локусу желаемого гена на хромосоме, введению экзогенной ДНК, замене части или всего гена экзогенной ДНК или делеции гена. Более конкретно, генетическая модификация относится к вставке (то есть «нок-ин») экзогенного фрагмента ДНК, в то время как эндогенная последовательность ДНК сохраняется таким образом, что фрагмент экспрессируется в сочетании с экспрессией гена при или выражается конститутивно, или замещению, делеции или нарушению (то есть «нокаут») части или всей последовательности гена, с тем чтобы модифицировать эндогенную последовательность ДНК.
Примеры методов введения искусственной хромосомы в клетки включают способ осаждения фосфатом кальция (Graham et al., (1978) Virology 52: 456-457, Wigler et al., (1979) Proc. Natl. Acad. Sci. USA 76 1373-1376 и Current Protocols in Molecular Biology Vol.1, Wiley Inter-Science, Supplement 14, Unit 9.1.1-9.1.9 (1990)), способ слияния с использованием полиэтиленгликоля (патент США 4684611), способ, использующий липидные носители, такие как липофекция (Teifel et al., (1995) Biotechniques 19: 79-80, Albrecht et al., (1996) Ann. Hematol. 72: 73-79; Holmen et al., (1995) In Vitro Cell Dev. Biol. Anim. 31: 347-351, Remy et al., (1994) Bioconjug. Chem. 5: 647-654, Le Bolc'het al., (1995) Tetrahedron Lett. 36: 6681-6684, Loeffler et al., (1993) Meth. Enzymol, 217: 599-618 and Strauss (1996) Meth. Mol. Biol. 54: 307-327), электропорация и способы слияния с микроэлементами (US No. 5,240,840, 4,806,476, 5,298,429 и 5,396,767, Fournier (1981) Proc. Natl. Acad. Sci. USA 7 8: 6349-6353 и Lambert et al., (1991) Proc. Natl. Acad. Sci. U.S.A. 88: 5907-59).
Популяция клеток
Таким образом, с помощью способов, описанных выше, авторы получили популяцию плюрипотентных клеток, экспрессирующих новые эмбриональные эпитопы в части или всех эмбриональных генах, которые будут вызывать более эффективный противоопухолевый иммунитет. Более конкретно, авторы показали, что популяция плюрипотентных клеток, обработанных N-этил-N-нитрозомочевиной (ENU), представляет случайные мутации по сравнению с популяцией плюрипотентных клеток без лечения ENU. Соответственно, эта популяция также является предметом изобретения.
Таким образом, изобретение относится к композиции клеток, содержащей плюрипотентные клетки, причем клетки в указанной популяции имеют скорость мутаций, по меньшей мере, 0,1%, предпочтительно, по меньшей мере, 1%, более предпочтительно, по меньшей мере, 2%, более предпочтительно, по меньшей мере, 5%, более предпочтительно, по меньшей мере, 10%, более предпочтительно, по меньшей мере, 15%, более предпочтительно, по меньшей мере, 20%, более предпочтительно, по меньшей мере, 30%, более предпочтительно, по меньшей мере, 40% или даже, по меньшей мере, 50%, по меньшей мере, в трех генах, более предпочтительно, по меньшей мере, в четырех генах, более предпочтительно, по меньшей мере, в пяти генах, более предпочтительно, по меньшей мере, в шести генах, более предпочтительно, по меньшей мере, в семи генах, выбранных из следующей группы, состоящей из ТР53, P2RY8, CRLF2, CRTC3, BLM, ASXL1, IDH2, NTRK3, MALAT1, ЕХТ1, NCOA2, IKF1, PIK3R1, ЕР300, АКТ2, PPP2R1A, CDK12, BRCA1, ERB2, CDH1, ТВХ3, SMARCD1, HSP90AA1, EZH2, SUZ12, STAT5B и POUF5F1.
Эта скорость мутации генов изучается в популяции клеток после воздействия мутагенного агента до или после дальнейшего размножения, если такое дальнейшее размножение выполняется.
Из-за того, что плюрипотентные клетки генетически очень стабильны, наличие большого количества мутаций по меньшей мере в трех генах, как указано выше, демонстрирует наличие новой популяции плюрипотентных клеток, которые не существовали ранее и не наблюдались в отсутствие мутагенных условий.
Экспозиция клеток мутагенному агенту вызывает появление случайных мутаций в геноме таких клеток. Таким образом, популяция, являющаяся результатом такого воздействия, будет гетерогенной по сравнению с популяцией плюрипотентных клеток, которая является по существу гомогенной, из-за низкой скорости естественных мутаций при длительном размножении и культуре.
Таким образом, полученная здесь популяция характеризуется, в частности, тем, что:
- Клетки являются плюрипотентными (то есть несут маркеры плюрипотентности);
- Существует несколько различий в геноме клеток в популяции, как указано выше, то есть можно определить скорость (как указано выше) мутированных генов, перечисленных выше, в клетках популяции.
В качестве иллюстрации, скорость мутации 5% гена ТР53 означает, что 95% последовательностей ТР53 в популяции клеток идентичны (так называемая контрольная последовательность ТР53), а последние 5% последовательности ТР53 отличаются от ТР53.
В следующем варианте осуществления изобретение, таким образом, относится к композиции клеток, содержащей плюрипотентные клетки, причем клетки в указанной популяции представляют мутационный ландшафт в популяции ESC или IPSC, содержащий одну или несколько из следующих характеристик:
I) По крайней мере, 3 (или более, как показано выше) мутации неоантигена, связанные с раком, введенные генетически в ESC или BPSC путем геномной модификации;
II) Сочетание типов мутаций, ограниченных геномом рака, индуцированных мутагенными агентами и обогащенных селективным преимуществом в культивируемых эмбриональных плюрипотентных стволовых клетках.
Мутагенный процесс вызывает повышенные уровни новых геномных мутаций и генетического мозаицизма в результирующих клеточных линиях iPS-клеток позднего прохода.
Анализ мутаций в генах предпочтительно выполняется крупномасштабным геномным анализом «мутаномной» сигнатуры, связанной с индукцией рака, в каждой популяции ESC и IPSC, с помощью NGS (Exome, RNAseq или цельного генома), массива CGH, массивов SNP. Секвенирование целых экзонов в сочетании с профилированием транскриптомов позволяет описать мутаном, кодирующий экспрессированный белок.
Геномные аберрации идентифицируются с использованием, по меньшей мере, двух алгоритмов для биоинформационного анализа, известных в данной области техники. Распространенность полных мутаций во всем геноме после применения мутагенных агентов подтвердит более высокую мутационную и/или CNV нагрузку в выходных ESC или IPSC.
Качественные и количественные критерии позволят определить каждую популяцию клеток в рамках генетического мозаицизма в ESC или IPSC, как описано:
К качественным критериям относятся:
- Идентификация приобретенных новых молекулярных соматических изменений (мутации, CNV или SNV), определяемые относительно их присутствия в геноме ESC или IPS после мутагенеза и их отсутствия в ESC или IPSC без мутагенеза в подобных культивируемых пассажах;
- Классификация каждой из новых мутаций (то есть несинонимичных, нонсенс, сплайс-вариант, CNV, SNV) и подтверждение их перекрывающегося обнаружения в геноме рака (из базы данных, то есть TCGA, ICGC, COSMIC) и присутствия в плюрипотентных генах и эмбриональных путях (согласно плюрипотентным геам, т.е. Plurinet gene).
К количественным критериям относятся:
- Распространенность этих новых соматических мутаций (с достоверным значением достоверности обнаружения FDR ≤0,05%) и новых CNV/SNV (с FDR <10%) во всем геноме определена для каждого ESC или IPS;
- Наличие валидированной мутации по меньшей мере более, чем в 3 разных генах;
- Частота мутаций каждой новой и стабильной соматической мутации с аллельной частотой от, по крайней мере, >0,1% или других процентов, как видно выше, до 50% после отбора и размножения клона или относительно количества пассажей (глубина от 50Х до 100Х и охват целевого исключения 80-98%);
- Экспрессия маркеров плюрипотентности и анализ на основе генной экспрессии (PluriTest) с, по меньшей мере, >90% скорости экспрессии по сравнению с входными ESC или IPSC до мутагенеза или генетической модификации;
- Экспрессия молекул МНС I на поверхностях клеток (например, по данным FACS) увеличивается не менее чем на 50% и, как правило, до 90% по сравнению с популяцией клеток, размноженной в отсутствие HDACi, в частности VPA.
Настоящее изобретение относится к композиции вакцины, которая включает популяцию плюрипотентных клеток, как описано выше, и агент, который стимулирует иммунный ответ и/или экспрессию МНС I.
В частности, такими плюрипотентными клетками являются ESC или IPSC, предпочтительно инактивированные и необязательно мутированные, как описано выше.
Агент, который стимулирует иммунный ответ, может быть адъювантом (иммуностимулятором), как известно в данной области техники. Он предпочтительно представляет собой HDACi (используемый в диапазоне доз от 0,2 до 4 мМ). Когда такой HDACi используется, может также использоваться другой адъювант.
Изобретение также относится к устройству (например, шприцу), содержащему такую композицию вакцины, которая может использоваться для одновременного введения HDACi соединения и состава клеток.
Такая композиция вакцины может использоваться в качестве терапевтической вакцины против рака стволовых клеток (рак, клетки которого экспрессируют неоантигены) для лечения пациента или в качестве профилактической вакцины для предотвращения возникновения таких видов рака, особенно у пациентов, подверженных к этим ракам.
Например, гены предрасположенности (см. также Lindor et al, 2008 Journal of the National Cancer Institute Monographs, No. 38, Concise Handbook of Familial Cancer Susceptibility Syndromes, Second Edition):
Грудь/яичники: BRCA1, BRCA2, PALB2, RAD51;
Синдром Линча: MLH1, MSH2, MSH6, PMS2, EPCAM;
Наследственная папиллярная почечная клеточная карцинома: FH, МЕТ;
Болезнь Каудена: PTEN, PIK3CA;
Болезнь Фанкони: FANC;
Болезнь фон Хиппель-Линдау: VHL;
Злокачественная меланома: CDKN2A, MITF, ВАР1, CDK4;
Эндокринная неоплазия: MEN1, RET, CDKN1B;
Нейрофиброматоз: NF1, NF2, LZTR1, SMARCB1, SPRED1;
Наследственная ферохромоцитома параганглиома: SDH, ТМЕМ127, MAX, EPAS1;
Семейный аденоматозный полипоз: АРС, MUTYH;
Ретинобластома: RB1;
Синдром

Синдром Блума: BLM;
Синдром Карни: PRKAR1A;
Синдром Горлина: РТСН1;
Синдром Ли-Фраумени: ТР53, CHEK2;
Синдром Неймегена: NBN;
Синдром Питса-Джегерса: STK11;
Семейный ювенильный полипоз: BMPR1A, SMAD4;
Xeroderma pigmentosum: ХР;
Этот список не является ограничивающим.
В определенном варианте осуществления противоопухолевый продукт вакцины включает смесь клеточного лизата после лиофилизации, смесь обогащенных стволовых неоантигенов множества видов рака, очищенных неоновых антигенов рака, экзосомы, полученные из ESC или IPSC, ДНК, РНК-протеинов или множественных пептидов из инженерии ESC или IPSC. Это иммуногенный агент, как описано выше, которые сформулированы в присутствии HDACi.
В другом варианте осуществления продукт вакцины против раковых стволовых клеток смешивают с супернатантной средой GMP из искусственных облученных ESC или IPSC, используемых в качестве адъювантного эффектора.
В предпочтительном варианте осуществления клетки в этой композиции инактивируются (то есть больше не могут делиться).
Композиция клеток согласно изобретению может быть получена любым из способов, описанных выше.
Следует отметить, что клетки в этой композиции являются гетерогенными по своей природе, когда мутаген использовался и, следовательно, отличается от плюрипотентной клеточной композиции, которая была культивирована в соответствии с известными в данной области техники способами и которая является гомогенной.
Когда они культивируются в отсутствие мутагена, популяция клеток отличается от популяции клеток, которые культивировали в соответствии со способами, известными в данной области техники, поскольку присутствие агента, поддерживающего экспрессию плюрипотентных генов и увеличение представления МНС I, в культуральной среде приведет к образованию клеток, которые имеют больше этих молекул МНС I на их поверхности.
Используемый здесь термин «соединение, выбранное из группы, которое активирует экспрессию МНС и/или иммунный ответ» относится к соединениям, которые способны стимулировать иммуногенность. Такое соединение называют активатором экспрессии МНС и/или иммунного ответа. Термин «МНС» относится к главному комплексу гистосовместимости, который присутствует на поверхности клетки для распознавания чужеродных молекул, называемых антигенами. МНС связывается с антигенами и презентирует их иммунным молекулам, таким как лимфоциты Т и В. Термин «иммунный ответ» относится к иммунологическому ответу иммунной системы на антиген. Путем активации иммунного ответа популяция субпопуляции FoxP3 и супрессорных миелоидных клеток (MDSC) уменьшаются и, наоборот, популяция NK увеличивается. В контексте изобретения иммунный ответ против опухолей включает цитотоксический ответ Т-клеток против антигена, присутствующего в клетке опухоли или на ней. В некоторых вариантах осуществления цитотоксический ответ Т-клеток опосредуется CD8+ T-клетками. Как правило, в контексте изобретения антиген, который активирует экспрессию МНС и/или иммунный ответ, соответствует молекулам, присутствующим в популяции плюрипотентных клеток, как описано выше. Соединение, которое активирует экспрессию МСН и/или иммунную систему, представляет собой неоантиген. Термин «неоантиген» или «неоантигенный» означает класс антигенов, который возникает, по меньшей мере, из одной мутации, которая изменяет аминокислотную последовательность кодируемых геномом белков.
В контексте изобретения соединения выбраны из группы, состоящей из: цитокинов, ингибиторов гистондезацетилазы, ингибиторов метилтрансферазы ДНК и ингибиторов фермента гистон-лизиновой N-метилтрансферазы.
В конкретном варианте осуществления активатор экспрессии МНС и/или иммунного ответа представляет собой ингибитор гистондезацетилазы.
Используемый здесь термин «ингибитор гистондезацетилазы», называемый также HDACi, относится к классу соединений, которые влияют на функцию гистондезацетилазы. Гистондеацетилазы (HDAC) играют важную роль в регуляции транскрипции и патогенезе рака. Как правило, ингибиторы HDAC модулируют транскрипцию и индуцируют остановку роста клеток, дифференцировку и апоптоз. HDAC также усиливают цитотоксические эффекты терапевтических средств, используемых при лечении рака, включая облучение и химиотерапевтические препараты.
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой вальпроевую кислоту (VPA).
Термин «вальпроевая кислота» относится к 2-пропилпентановой кислоте (С8Н16О2), которая имеет следующее число CAS и формулу 99-66-1 в данной области техники:

Биологические активности вальпроевой кислоты многочисленны (Chateauvieux et al., J. Biomed. Biotechnol, 2010, pii: 479364. doi: 10.1155/2010/479364). Вальпроевая кислота влияет на ингибирующую активность нейротрансмиттера GABA (гамма-аминобутират). Предлагаются несколько механизмов действия. Вальпроевая кислота является, в частности, метаболизмом GABA: ингибирует деградацию GABA, GABA Трансаминобутиратр ((LAMP), акроизменение синтеза GABA и изменяет его оборот. Кроме того, вальпроевая кислота блокирует определенные ионные каналы, уменьшает возбуждение, опосредованное N-метил-D-аспартатом, и блокирует активность ионных каналов, включая Na+ и Са2+ (зависимый от напряжения L-тип CACNA1 типа С, D, N, и F).
В контексте изобретения вальпроевая кислота используется в качестве иммуностимулятора для усиления иммунного ответа против рака, экспрессирующего плюрипотентные антигены, совместно с эмбриональными стволовыми клетками человека (ESC) или индуцированными плюрипотентными стволовыми клетками (IPSC).
Более конкретно, VPA используют для стимуляции и усиления экспрессии MHC-I в компартменте стволовых клеток рака, увеличивая содержание неоантигена в компартменте CSC. Более высокая экспрессия МНС I в ESC и IPSC и в CSC позволяет улучшить представление неоантигенов, связанных с MHC-I, с АРС/дендритными клетками, чтобы индуцировать иммунный ответ ТН1. Более высокий уровень хемокинов (CXCL9, CXCL10 …) позволяет усилить рекрутирование Т-клеток в опухоль.
Настоящее изобретение относится к способам увеличения содержания неоантигена в экспрессии CSC компартмента эмбриональных антигенов в CSC-клетках и опухолевых клетках посредством ремоделирования хроматина, а также экспрессии хемокинов (CXCL9, CXCL10 …) путем размножения плюрипотентных клеток в присутствии HADCi, таких как VPA и/или 5 азацитидин.
В частности, при использовании для лечения пациента in vivo настоящие композиции и вакцины позволяют модифицировать микроокружение опухоли и способствовать рекрутингу Т-клеток в опухоль, чтобы получить долгосрочное долговременное уменьшение объема опухоли.
Это связано с синергическим эффектом вакцины с плюрипотентной клеточной вакциной и совместным введением VPA, которая далее улучшается, когда HDACi дополнительно вводится пациенту в течение определенного периода времени (например, по меньшей мере, 15 дней) после инъекции вакцины.
Примеры показывают, что комбинированное лечение как раковыми стволовыми клетками, так и VPA, обеспечивает превосходный противоопухолевый ответ путем увеличения TIL с клеточным иммунитетом Th1/Th2, уменьшением субпопуляции FoxP3 TReg, активированием NK-клеток и снижением супрессивного действия MDSC, (в опухоли и селезенке) и рекрутированием Т CD4+ и CD8+ лимфоцитов в опухоль с меньшей долей Т CD4 и CD8, экспрессирующих PD-1.
VPA может снизить регуляторный уровень экспрессии с-Мус и потенциально индуцировать апоптоз и аутофагию раковых клеток и CSC. VPA может усилить адаптивный иммунный ответ посредством кросс-презентации аутофагосом.
Другим известным действием VPA является снижение воспалительных цитокинов, таких как IL-6, IL8, TNFa интерлейкин (IL) -1-бета, IL-17 в лимфатических узлах.
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой субероанилинид-гидроксамовую кислоту, также называемую Vorinostat (N-гидрокси-N'-фенилоктандиамид), был первым ингибитором гистондеацетилазы, одобренным Управлением по контролю за продуктами и лекарствами США (FDA) в 2006 году (Marchion DC et al 2004, Valente et al., 2014).
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Panobinostat (LBH-589), получивший одобрение FDA в 2015 году и имеющий структуру, описанную у Valente et al., 2014.
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Givinostat (ITF2357), который был предоставлен в качестве орфанного препарата в Европейском союзе (Leoni et al 2005, Valente et al., 2014).
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Belinostat, также называемый Beleodaq (PXD-101), получил одобрение FDA на 2014 год (Ja et al., 2003, Valente et al., 2014).
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Entinostat (как SNDX-275 или MS-275). Эта молекула имеет следующую химическую формулу (C21H20N4O3) и имеет структуру, как описано в Valente et al., 2014.
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Mocetinostat (MGCD01030), имеющий следующую химическую формулу (C23H20N6O) (Valente et al., 2014).
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Practinostat (SB939), имеющий следующую химическую формулу (C20H30N4O2) и структуру, как описано в Diermayr et al., 2012.
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Chidamide (CS055/HBI-8000), имеющий следующую химическую формулу (C22H19FN4O2).
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Quisinostat (JNJ-26481585), имеющий следующую химическую формулу (C21H26N6O2).
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой Abexinostat (PCI24781), имеющий следующую химическую формулу (C21H23N3O5) (Valente et al., 2014).
В конкретном варианте осуществления ингибитор тетовдезацетилазы представляет собой CHR-3996, имеющий следующую химическую формулу (C20H19FN6O2) (Moffat D et al., 2010; Banerji et al., 2012).
В конкретном варианте осуществления ингибитор гистондезацетилазы представляет собой AR-42, имеющий следующую химическую формулу (C18H20N2O3) (Lin et al., 2012).
В конкретном варианте осуществления активатор экспрессии МНС представляет собой ингибиторы метилтрансферазы ДНК.
Используемый здесь термин «ингибиторы метилтрансферазы ДНК» относится к соединениям, которые способны взаимодействовать с ДНК-метилтрансферазой (DNMT) и ингибировать их активность. DNMT являются ферментами, которые катализируют перенос метальной группы в ДНК. Метилирование ДНК служит для широкого спектра биологических функций. Все известные ДНК-метилтрансферазы используют S-аденозилметионин (SAM) в качестве донора метила.
В конкретном варианте осуществления ингибитор метилтрансферазы ДНК представляет собой азацитидин, также известный как 5-аза-2-дезоксицитидин, имеющий следующую химическую формулу (C8H12N4O5) и структуру в данной области техники (Kaminskas et al., 2004, Estey et al., 2013).
В конкретном варианте осуществления ингибитор метилтрансферазы ДНК представляет собой децитабин, также известный как 5-аза-2'-дезоксицитидин, имеющий следующую формулу (C8H12N4O4) (Kantarjian et at 2006).
В конкретном варианте осуществления активатор экспрессии МНС и/или иммунного ответа представляет собой ингибитор фермента гистон-лизиновой нитрометилтрансферазы или ингибитор метилтрансферазы ДНК. Используемый здесь термин «ингибитор фермента гистон-лизин-N-метилтрансферазы» относится к соединениям, которые способны взаимодействовать с ферментом гистон-лизинаовой N-метилтрансферазы, кодированным энхансером гена zeste гомолога 1 (EZH1) и 2 (EZH2), который участвует в метилировании ДНК. EZH2 катализирует добавление метильных групп к гистону Н3 в лизине 27 с использованием кофактора S-аденозил-L-метионина.
В конкретном варианте осуществления ингибитор фермента гистон-лизиновой N-метилтрансферазы представляет собой 3-дезазанпланоцин A (DZNep, C-c3Ado). DZNep, С-c3Ado имеет следующую химическую формулу C12H14N4O3 и номер CAS 102052-95-9 в данной области техники.
В конкретном варианте осуществления ингибитор фермента гистон-лизиновой N-метилтрансферазы представляет собой UNC1999 и неактивное аналоговое соединение. UNC1999 имеет следующую химическую формулу C33H43N7O2 и номер CAS 1431612-23-5 в данной области техники.
В конкретном варианте осуществления ингибитор фермента гистон-лизиновой N-метилтрансферазы представляет собой UNC2400 и неактивное аналоговое соединение. UNC2400 имеет следующую химическую формулу C35H47N7O2 и номер CAS 1433200-49-7 в данной области техники.
В конкретном варианте осуществления ингибитор фермента гистон-лизиновой N-метилтрансферазы представляет собой таземетостат (EPZ6438, Е7438). Таземетостат имеет следующую химическую формулу C34H44N4O4 и номер CAS 1403254-99-8 в данной области.
В конкретном варианте осуществления ингибитор фермента гистон-лизин N-метилтрансферазы представляет собой трифторацетат (EPZ011989). Трифторацетат имеет следующую химическую формулу CF3COONa и номер CAS 2923-18-4 в данной области техники.
В конкретном варианте осуществления ингибитор фермента гистон-лизин N-метилтрансферазы представляет собой EPZ005687. EPZ005687 имеет следующую химическую формулу C32H37N5O3 и номер CAS 1396772-26-1 в данной области техники.
В конкретном варианте осуществления ингибитор фермента гистон-лизиной N-метилтрансферазы представляет собой GSK343. GSK343 имеет следующую химическую формулу C31H39N7O2 и номер CAS 1346704-33-3 в данной области техники.
В конкретном варианте осуществления ингибитор фермента гистон-лизиновой N-метилтрансферазы представляет собой GSK126. GSK126 имеет следующую химическую формулу C31H38N6O2 и номер CAS 1346574-57-9 в данной области техники.
В конкретном варианте осуществления ингибитор фермента гистон-лизиновой N-метилтрансферазы представляет собой GSK2816126. GSK2816126 имеет следующую химическую формулу C31H38N6O2 и номер CAS 1346574-57-9 в данной области.
В конкретном варианте осуществления ингибитор фермента гистона-лизиновой N-метилтрансферазы представляет собой ZLD1039. ZLD1039 имеет следующую химическую формулу C36H48N6O3 и номер CAS 1826865-46-6 в данной области техники.
Также предполагается использовать как HDACi, так и ингибитор метилтрансферазы ДНК.
Действительно, было показано, что совместное использование VPA и 5-азацитидина (аналог нуклеозидного цитидина, который может быть включен в ДНК и РНК) приводит к синергетическому эффекту на повторную экспрессию нео-антиэмбриональных антигенов.
HDACi вводят в терапевтически эффективном количестве. Для VPA оно может составлять от 10 до 15 мг/кг/день, до 60 мг/кг/день. Уровень плазмы VPA предпочтительно должен находиться в обычно принимаемом терапевтическом диапазоне (от 50 до 100 мкг/мл).
В следующем аспекте способ согласно изобретению подходит для лечения рака, экспрессирующего большое количество эмбриональных антигенов, которые делят экспрессию с эмбриональными стволовыми клетками человека (hESC) или индуцированными человеческими плюрипотентными стволовыми клетками (hiPSC). (например, эмбриональный антиген-3 (SSEA3), SSEA4, TRA-1-60, TRA-1-81, Oct4, Sox2, Klf4, Nanog, Lin28 …).
Используемые здесь термины «раковые опухоли, экспрессирующие стволовые клетки человека», представляют собой раковые опухоли, которые предпочтительно таргетированы на способы, вакцины и композиции, описанные здесь, относятся к раковым стволовым клеткам, экспрессирующим большое количество эмбриональных антигенов, которые разделяют экспрессию с человеческими эмбриональными стволовыми клетками (hESC) или индуцированными плюрипотентными стволовыми клетками (iPSCs). Как правило, рак выбирают из группы, состоящей из карциномы мочевого пузыря, карциномы молочной железы, карциномы шейки матки, холангиокарциномы, колоректальной карциномы, желудочной саркомы, глиомы, карциномы легких, лимфомы, острых и хронических лимфоидных и миелоидных лейкозов, меланомы, множественной миеломы, остеосаркомы, карциномы яичников, карциномы поджелудочной железы, карциномы предстательной железы, карциномы желудка, карциномы почек, опухоли головы и шеи и солидной опухоли.
Используемые здесь термины «вводить» или «введение» относятся к акту инъекции или физической доставки вещества иным образом, как оно существует вне организма (например, комбинированный препарат), к субъекту, например, через слизистую, внутрикожную, внутривенную, подкожную, внутримышечную доставку и/или любой другой способ физической доставки, описанный здесь или известный в данной области техники. Когда заболевание или его симптом лечат, введение этого вещества обычно происходит после начала заболевания или его симптомов. Когда болезнь или ее симптомы предотвращаются, введение этого вещества обычно происходит до начала заболевания или его симптомов.
В предпочтительном варианте осуществления композиция вакцины (плюрипотентные клетки + агент, стимулирующий презентацию МНС) вводится подкожно. Инъекция может быть одновременной, последовательной, отдельной, в той же точке инъекции или в разных точках инъекции, в одном шприце или в отдельных шприцах.
В предпочтительном варианте осуществления последующее лечение (введение соединения, которое стимулирует МНС I и/или иммунную систему, такое как HDACi, в частности VPA) вводят пероральным путем.
Под «терапевтически эффективным количеством» понимается минимальное количество активного агента, которое необходимо для придания терапевтического преимущества субъекту. Например, «терапевтически эффективное количество» для субъекта представляет собой такое количество, которое индуцирует, улучшает или иным образом вызывает улучшение патологических симптомов, прогрессирования заболевания или физиологических состояний, связанные с сопротивлением или неустойчивостью к расстройству. Понятно, что общее ежедневное использование соединений согласно настоящему изобретению будет решаться лечащим врачом в рамках здравого медицинского суждения. Конкретный терапевтически эффективный уровень дозы для любого конкретного субъекта будет зависеть от множества факторов, включая расстройство, подвергающееся лечению, и тяжесть расстройства; активность используемого конкретного соединения; конкретный состав, возраст, вес тела, общее состояние здоровья, пол и диета субъекта; время введения, способ введения и скорость экскреции конкретного используемого соединения; продолжительность лечения; препараты, используемые в комбинации или совпадающие с используемым конкретным соединением; и подобные факторы, хорошо известные в медицине. Например, специалисту в данной области техники хорошо начать вводить дозы соединения на уровнях ниже, чем требуемые для достижения желаемого терапевтического эффекта, и постепенно увеличивать дозировку до достижения желаемого эффекта. Однако суточная доза продуктов может варьироваться в широких пределах от 0,01 до 1000 мг на взрослого человека в день. Как правило, композиции содержат 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 250 и 500 мг активного ингредиента для симптоматического регулирования дозы для подлежащего лечению субъекта. Лекарственное средство обычно содержит от примерно 0,01 до примерно 500 мг активного ингредиента, предпочтительно от 1 до примерно 100 мг активного ингредиента. Эффективное количество лекарственного средства обычно подается на уровне дозировки от 0,0002 мг/кг до около 20 мг/кг массы тела в день, особенно от примерно 0,001 мг/кг до 7 мг/кг массы тела в день.
В конкретном варианте осуществления способ в соответствии с изобретением включает в себя еще одну или более лучевой терапии, целенаправленной терапии, иммунотерапии или химиотерапии. Как правило, врач мог выбрать введение субъекту I) популяции плюрипотентных клеток и II) соединения, выбранного из группы, которая активирует экспрессию МНС и/или иммунный ответ, в виде комбинированного препарата с лучевой терапией, целенаправленной терапией, иммунотерапией, или химиотерапии.
В некоторых вариантах осуществления субъекту вводят I) популяцию плюрипотентных клеток и II) соединение, выбранное из группы, которая активирует экспрессию МНС и/или иммунный ответ, в виде комбинированного препарата и химиотерапевтического агента.
Термин «химиотерапевтический агент» относится к химическим соединениям, которые эффективны в ингибировании роста опухоли. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, имсульфан и пироссульфан; азиридины, такие как бензодопа, карбокон, метудопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфанарнайд и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); карнптотецин (включая синтетический аналог топотекана); бриостатин; каллистатин; СС-1065 (включая синтетические аналоги адозелезина, карцелезина и бизелезина); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CBI-TMI); элейтеробин; панкратистатин; саркодиктин; спонгистатин; азотные иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрарнустин, ифосфамид, мехлорэтамин, гидрохлорид мехлорэтамин оксида, мелфалан, новемчин, фенстерин, преднимус, трофосфамид, урацил-иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как антибиотик энедиин (например, калиемицин, особенно калихемицин (11 и calicheamicin 211, см., например, Agnew Chem Intl. Ed., Eng. 33: 183-186 (1994)), динемицин, включая динемицин А, эсперамицин, а также как хромофоры неокарзиностатина и связанные с ними хромофофоры хромопротеинов энедиин антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, канниномицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидокорубицин), эпирубицин, эзорубицин, иданрибицин, марцелломицин, митомицины, микофенольную кислоту, ногаларцицин, оливомицины, пепломицин, potfiromycin, пуромицин, келамицин, родорубицин, стрептоггрин, стрептозоцин, туберцидин, убенимекс, циностатин, зорубицин, антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ), аналоги фолиевой кислоты, такие как деноптер в, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флуксуридин, 5-ФУ; андрогены, такие как каластоун, пропионат дромоностанола, эпитиотонол, мепитиостан, тестолактон; антиадреналы, такие как аминоглютетимид, митотан, трилостан; заменитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфанидгликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиний ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопидамол; nitracrine; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; ризоксин; сизофиран; spirogennanium; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламина, трихотецены (особенно токсин Т-2, верракурин А, роридин А и ангидин), уретан, виндезин, дакарбазин, манномустин, митобромтол, митолактол, пипроброман, гацитозин, арабинозид («Ара-С»), циклофосфамид, тиотепа, таксоиды, например паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, N.]) и доксетаксел (TAXOTERE®, Rhone-Poulenc Rorer, Antony, Франция); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; платиновые аналоги, такие как цисплатин и карбоплатин; винбластин; платины; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; Кселода; ибандронат; СРТ-1 1; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных. Также в это определение включены антигормональные агенты, которые действуют, чтобы регулировать или ингибировать действие гормонов на опухоли, таких как антиэстрогены, включая, например, тамоксифен, ралоксифен, ароматазу, ингибирующие 4(5)-имидазояы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онпристон, и торемифен (Fareston); и антиандрогены, такие как флутамид, нилутамид, бикалютамид, лейпролид и госерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных.
В некоторых вариантах осуществления субъекту вводят I) популяцию плюрипотентных клеток и II) соединение, выбранное из группы, которая активирует экспрессию МНС и/или иммунный ответ, в виде комбинированного препарата и таргетированной терапии рака.
Таргетированная терапия рака представляет собой препараты или другие вещества, которые блокируют рост и распространение рака, мешая определенным молекулам («молекулярные мишени»), которые участвуют в росте, прогрессировании и распространении рака. Таргетированную терапию рака иногда называют «молекулярив-таргетированные лекарства», «молекулярно-таргетированные терапии», «прецизионные лекарства» или подобными им названиями. В некоторых вариантах осуществления таргетированная терапия заключается в назначении субъекту ингибитоа тирозинкиназы. Термин «ингибитор тирозинкиназы» относится к любому из множества терапевтических агентов или лекарств, которые действуют как селективные или неселективные ингибиторы рецепторных и/или нерецепторных тирозинкиназ. Ингибиторы тирозинкиназы и родственные соединения хорошо известны в данной области техники и описаны в публикации патента США 2007/0254295, которая полностью включена в настоящее описание посредством ссылки. Специалисту в данной области техники будет понятно, что соединение, связанное с ингибитором тирозинкиназы, будет повторять эффект ингибитора тирозинкиназы, например, связанное соединение будет действовать на другой член пути сигнализации тирозинкиназы для получения такой же эффект, как и ингибитор тирозинкиназы этой тирозинкиназы. Примеры ингибиторов тирозинкиназы и родственных соединений, подходящих для использования в способах осуществления настоящего изобретения, включают, но не ограничиваются ими, дазатиниб (BMS-354825), РР2, BEZ235, саракатиниб, гефитиниб (Iressa), сунитиниб (Sutent, SU11248), эрлотиниб (Tarceva, OSI-1774), лапатиниб (GW572016, GW2016), канертиниб (CI 1033), семаксиниб (SU5416), ваталаниб (PTK787/ZK222584), сорафениб (BAY 43-9006), иматиниб (Gleevec; STI571), лефлуномид (SU101), вандетаниб (Zactima, ZD6474), бевацизумаб (авастин), MK-2206 (8-[4-аминоциклобутил) фенил]-9-фенил-1,2,4-триазоло [3,4-f] [1,6] нафтиридин-3(2Н)-она гидрохлорид), его аналогов и их комбинаций. Дополнительные ингибиторы тирозинкиназы и родственные соединения, подходящие для использования в настоящем изобретении, описаны, например, в публикациях патентов США 2007/0254295,патентах США 5618829, 5639757, 5728868, 5804396, 6100254, 6127374, 6245759, 6306874, 6313138, 6316444, 6329380, 6344459, 6420382, 6479512, 6498165, 6544988, 6562818, 6586423, 6586424, 6740665, 6794393, 6875767, 6927293 и 6958340, все из которых включены в настоящее описание посредством ссылки во всей их полноте. В некоторых вариантах осуществления ингибитор тирозинкиназы представляет собой ингибитор небольшой молекулы киназы, который вводили перорально и который был предметом по меньшей мере одного клинического испытания фазы I, более предпочтительно, по меньшей мере, одной клинической стадии II фазы, еще более предпочтительно по меньшей мере одной фазы III, и наиболее предпочтительно одобрен FDA, по меньшей мере, для одного гематологического или онкологического показания. Примеры таких ингибиторов включают, но не ограничиваются ими, Gefitinib, Erlotinib, Lapatinib, Canertinib, BMS-599626 (AC-480), Neratinib, KRN-633, CEP-11981, Imatinib, Nilotinib, Dasatinib, AZM-475271, CP-724714, TAK-165, Sunitinib, Vatalanib, CP-547632, Vandetanib, Bosutinib, Lestaurtinib, Tandutinib, Midostaurin, Enzastaurin, AEE-788, Pazopanib, Axitinib, Motasenib, OSI-930, Cediranib, KRN-951, Dovitinib, Seliciclib, SNS-032, PD-0332991, MKC-I (Ro-317453, R-440), Sorafenib, ABT-869, Brivanib (BMS-582664), SU-14813, Telatinib, SU-6668, (TSU-68), L-21649, MLN-8054, AEW-541 и PD-0325901.
В некоторых вариантах осуществления субъекту вводят I) популяцию плюрипотентных клеток и II) соединение, выбранное из группы, которая активирует экспрессию МНС и/или иммунный ответ, в виде комбинированного препарата и ингибитора иммунной контрольной точки.
Используемый здесь термин «ингибитор иммунной контрольной точки» относится к молекулам, которые полностью или частично уменьшают, ингибируют, мешают или модулируют один или несколько контрольных белков. Белки контрольной точки регулируют активацию или функцию Т-клеток. Известны многочисленные белки контрольных точек, такие как CTLA-4 и его лиганды CD80 и CD86; и PD1 с его лигандами PDL1 и PDL2 (Pardoll, Nature Reviews Cancer 12: 252-264, 2012). Эти белки ответственны за ко-стимулирующие или ингибирующие взаимодействия Т-клеточных реакций. Белки иммунной контрольной точки регулируют и поддерживают самодопустимость, а также продолжительность и амплитуду физиологических иммунных реакций. Ингибиторы иммунной контрольной точки включают антитела или получены из антител. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело, выбранное из группы, состоящей из антител против CTLA4 (например, Ipilimumab), антител против PD1 (например, Nivolumab, Pembrolizumab), антител против PDL1, антител против TIM3, антител против LAG3, антител против В7Н3, антител против В7Н4, антител против BTLA и антитела против В7Н6. Примеры антител против CTLA-4 описаны в патентах США №5,811,097; 5811097; 5855887; 6051227; 6207157; 6682736; 6984720; и 7605,238. Одно антитело против CTLA-4 представляет собой тремилимумаб, (тицилимумаб, СР-675,206). В некоторых вариантах осуществления антитело против CTLA-4 представляет собой ипилимумаб (также известный как 10D1, MDX-D010) полностью человеческое моноклональное IgG-антитело, которое связывается с CTLA-4. Другим белком иммуной контрольной точки является запрограммированная гибель клеток 1 (PD-1). Примеры блокаторов PD-1 и PD-L1 описаны в патентах США №7,488,802; 7943743; 8008449; 8168757; 8,217,149 и опубликованные патентные заявки РСТ № WO 03042402, WO 2008156712, WO 2010089411, WO 2010036959, WO 2011066342, WO 2011159877, WO 2011082400 и WO 201H61699. В некоторых вариантах осуществления блокаторы PD-1 включают антитела против PD-L1. В некоторых других вариантах блокаторы PD-1 включают антитела против PD-1 и аналогичные связывающие белки, такие как ниволумаб (MDX 1106, BMS 936558, ONO 4538), полностью человеческое IgG4-антитело, которое связывает и блокирует активацию PD-1 его лигандами PD-L1 и PD-L2; ламбролизумаб (MK-3475 или SCH 900475), гуманизированное моноклональное антитело IgG4 против PD-1; CT-011, гуманизированное антитело, которое связывает PD-1; АМР-224 представляет собой фьюжн-белок B7-DC; часть Fc антитела; BMS-936559 (MDX-1105-01) для блокады PD-L1 (В7-Н1). Другие ингибиторы иммунной контрольной точки включают ингибиторы гена-активатора лимфоцитов (LAG-3), такие как IMP321, растворимый слитый белок Ig (Brignone et al., 2007, J. Immunol., 179: 4202-4211). Другие ингибиторы иммунной контрольной точки включают ингибиторы В7, такие как ингибиторы В7-Н3 и В7-Н4. В частности, антитело против В7-Н3 MGA271 (Loo et al., 2012, Clin. Cancer Res., 15 июля (18) 3834). Также включены ингибиторы TIM3 (Т-клеточный иммуноглобулин и мециновый домен 3) (Fourcade et al., 2010, J. Exp. Med. 207: 2175-86 и Sakuishi et al., 2010, J. Exp. Med. 207: 2187-94). В некоторых вариантах осуществления иммунотерапевтическое лечение состоит из приемной иммунотерапии, описанной Николасом П. Рестифо, Марком Э. Дадли и Стивеном А. Розенбергом ("Adoptive immunotherapy for cancer: harnessing the T cell response, Nature Reviews Immunology, том 12, Апрель 2012 г.). В приемной иммунотерапии циркулирующие лимфоциты пациента или инфильтрационные лимфоциты опухоли выделяются in vitro, активируемые лимфокинами, такими как IL-2 и повторно вводятся (Rosenberg et al., 1988, 1989). Активированные лимфоциты наиболее предпочтительно представляют собой собственные клетки пациента, которые ранее были выделены из образца крови и активированы (или «размножены») in vitro.
В некоторых вариантах осуществления субъекту вводят I) популяцию плюрипотентных клеток и II) соединение, выбранное из группы, которая активирует экспрессию МНС и/или иммунный ответ, в виде комбинированного препарата и радиотерапевтического агента.
Используемый здесь термин «радиотерапевтический агент» предназначен для обозначения любого лучевого терапевтического агента, известного специалисту в данной области техники, для эффективного лечения или улучшения течения рака без ограничений. Например, радиотерапевтический агент может быть агентом, таким как те, которые применяются при брахитерапии или радионуклидной терапии. Такие способы могут дополнительно включать введение одного или нескольких дополнительных методов лечения рака, таких как, но не ограничиваясь ими, химиотерапия и/или другая лучевая терапия.
Фармацевтические композиции и композиции вакцины
Соединения, которые активируют экспрессию МНС и/или иммунный ответ, и популяция плюрипотентных клеток, как описано выше, могут быть объединены с фармацевтически приемлемыми эксципиентами и, возможно, матрицами с замедленным высвобождением, такими как биоразлагаемые полимеры, с образованием фармацевтических композиций.
«Фармацевтически» или «фармацевтически приемлемые» относятся к молекулярным объектам и композициям, которые не вызывают неблагоприятную, аллергическую или другую неблагоприятную реакцию при введении млекопитающему, особенно человеку, в зависимости от ситуации. Фармацевтически приемлемый носитель или эксципиент относится к нетоксичному твердому, полутвердому или жидкому наполнителю, разбавителю, инкапсулирующему материалу или вспомогательному составу препарата любого типа. Фармацевтические композиции согласно настоящему изобретению для перорального, подъязычного, подкожного, внутримышечного, внутривенного, трансдермального, локального или ректального введения, активное начало, отдельно или в сочетании с другим активным началом, можно вводить в форме введения в виде смеси в виде смеси с обычными фармацевтическими носителями, животным и людям. Подходящие формы для введения в организм включают формы для перорального введения, такие как таблетки, гелевые капсулы, порошки, гранулы и пероральные суспензии или растворы, сублингвальные и буккальные формы для введения, аэрозоли, имплантаты, подкожные, трансдермальные, местные, внутрибрюшинные, внутримышечные, внутривенные, подкожные, трансдермальные, интратекальные и интраназальные формы введения и формы ректального введения. Как правило, фармацевтические композиции содержат носители, которые являются фармацевтически приемлемыми для композиции, пригодной для инъекции. Это могут быть, в частности, изотонические, стерильные, солевые растворы (мононатрий или динатрийфосфат, натрий, калий, кальций или магний хлорид и тому подобное или смеси таких солей) или сухие, особенно лиофилизированные композиции, которые после добавления, в зависимости от случая стерилизованной воды или физиологического раствора, разрешают введение инъекционных растворов. Фармацевтические формы, пригодные для инъекционного применения, включают стерильные водные растворы или дисперсии; составы, включая кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные порошки для немедленной подготовки стерильных растворов или дисперсий для инъекций. Во всех случаях форма должна быть стерильной и должна быть текучей в той степени, где существует легкая сшивка. Она должна быть стабильной в условиях производства и хранения и должна быть сохранена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Растворы, содержащие соединения согласно изобретению в виде свободного основания или фармакологически приемлемых солей, могут быть получены в воде, подходящим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии также могут быть получены в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. В обычных условиях хранения и использования эти препараты содержат консервант для предотвращения роста микроорганизмов. Полипептид (или его кодирующая нуклеиновая кислота) может быть составлен в виде композиции в нейтральной или солевой форме. Фармацевтически приемлемые соли включают кислотно-аддитивные соли (образованные со свободными аминогруппами белка) и которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная, миндальная, и тому подобное. Соли, образованные с помощью свободных карбоксильных групп, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или трехвалентного железа, и такие органические основания, как изопропиламин, триметиламин, гистидин, прокаин и тому подобное. Носитель также может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), подходящие их смеси и растительные масла. Правильную текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и с использованием поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть превнесено различными антибактериальными и противогрибковыми агентами, например парабенами, хлорбутанолом, фенолом, сорбиновой кислотой, тимеросалом и тому подобным. Во многих случаях предпочтительно включать изотонические агенты, например, сахара или хлорид натрия. Длительное поглощение инъекционных композиций может быть вызвано использованием в композициях агентов, замедляющих абсорбцию, например, моностеарат алюминия и желатин. Стерильные растворы для инъекций получают путем включения активных полипептидов в требуемом количестве в подходящем растворителе с несколькими другими ингредиентами, перечисленными выше, с последующей отфильтрованной стерилизацией. Как правило, дисперсии получают путем включения различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами получения являются способы вакуумной сушки и сушки вымораживанием, которые дают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из ранее стерильно-фильтрованного раствора. После приготовления растворы вводят способом, совместимым с лекарственным средством, и в таком количестве, которое терапевтически эффективно. Композиции легко вводятся в различных лекарственных формах, таких как тип растворов для инъекций, описанных выше, но также могут быть использованы капсулы для высвобождения лекарственного средства и тому подобное. Для парентерального введения в водном растворе, например, раствор должен быть соответствующим образом забуферирован, если необходимо, и жидкий разбавитель сначала подвергается изотоническому воздействию с достаточным количеством солевого раствора или глюкозы. Эти конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В связи с этим, стерильные водные среды, которые могут быть использованы, будут известны специалистам в данной области техники в свете настоящего описания. Например, одну дозу можно растворить в 1 мл изотонического раствора NaCl и либо добавить в 1000 мл жидкости для гиподермолиза, либо ввести в предлагаемый сайт инфузии. Некоторое изменение дозировки обязательно произойдет в зависимости от состояния подлежащего лечению субъекта. Лицо, ответственное за введение, в любом случае определяет соответствующую дозу для отдельного субъекта.
Более конкретно, популяция плюрипотентных клеток и соединение, которое активирует экспрессию МНС и/или иммунный ответ, сформулированы на основе композиции вакцины. Соответственно, изобретение относится к композиции вакцины, содержащей I) популяцию плюрипотентных клеток и II) соединение, выбранное из группы, которая активирует экспрессию МНС и/или иммунный ответ.
В конкретном варианте осуществления композиция вакцины согласно изобретению включает I) эмбриональные стволовые клетки человека и II) вальпроевую кислоту.
В конкретном варианте осуществления композиция вакцины согласно изобретению включает I) индуцированные плюрипотентные стволовые клетки (iPSC), экспрессирующие неоантигены, в частности, улучшенные мутагенными агентами или генетической модификацией и II) вальпроевую кислоту.
Композиция может также содержать 5 азацитидин.
Кроме того, композиция вакцины согласно настоящему изобретению может использоваться у субъекта, страдающего от рака, как описано выше.
Композицию вакцины согласно изобретению можно приготовить с физиологическими эксципиентами, указанными выше, таким же образом, как и в иммуногенных композициях. Например, фармацевтически приемлемые носители включают, но не ограничиваются ими, забуференные фосфатом солевые растворы, дистиллированную воду, эмульсии, такие как эмульсии масло/вода, различные типы смачивающих агентов, стерильные растворы и тому подобное. В вакцинах могут быть использованы адъюванты, такие как мурамиловые пептиды, такие как MDP, IL-12, фосфат алюминия, гидроксид алюминия, Alum и/или Montanide (R).
Композицию вакцины согласно изобретению можно вводить подкожно (s.c), внутрикожно (i.d.), внутримышечно (i.m.) или внутривенно (i.v) инъекцию, пероральным введением и интраназальным введением или ингаляцией. Введение вакцины обычно находится в разовой дозе. Альтернативно, введение вакцины согласно изобретению производится впервые (первоначальная вакцинация), за которой следуют 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 (последующее введение) с той же совокупностью стволовых клеток, которое стимулирует иммунную систему или их комбинацией/или с последующей одной или более лучевой терапией, таргетированной терапией, иммунотерапией или химиотерапией.
Состав вакцины также предоставляется в наборе. Набор включает в себя состав вакцины и информационный буклет, содержащий инструкции по иммунизации. Набор включает также все материалы для введения продуктов.
Изобретение будет дополнительно проиллюстрировано следующими рисунками и примерами. Однако эти примеры и цифры никоим образом не должны истолковываться как ограничивающие объем настоящего изобретения.
РИСУНКИ:
Фиг. 1: Исследование вакцинации mESC, hESC, miPSC и клетками 4Т1 на модели опухоли груди 4Т1. План исследования: мыши (n=5 на группу), полученные для усиления вакцины 7 и 14 дней с 105 облученными клетками; мышиные эмбриональные стволовые клетки (mESC), мышиные индуцированные плюрипотентные стволовые клетки (miPSC), человеческие эмбриональные стволовые клетки (hESC) или клетки 4Т1. Через 14 дней клетки молочной железы мышеи вводили 5×104 4Т1 клеток. Мышам Fiver вводили 4Т1-CSC (рост клеток 4Т1 с дополнительными цитокинами, такими как TGFbeta и TNFalpha, чтобы генерировать CSC, растущее в форме маммосфер)
Фиг. 2: Иммунная защита после вакцинации. А; Количественная оценка CD4-положительных опухолевых инфильтрирующих лимфоцитов (TIL) проточной цитометрией. В; Количественная оценка СВ25-положительных регуляторных Т-клеток методом проточной цитометрии в CD4+ TIL. С; Количественная оценка регуляторных Т-клеток PD1 с помощью проточной цитометрии в CD8+ Т-клетках относительно группы мышей.
Фиг. 3: Исследование вакцинации hESC в сочетании с VPA на модели мышей 4Т1. План исследования: Мыши (n=5 на группу), полученные для усиления вакцины 7 и 14 дней с 105облученными клетками hESC с или без VPA. Через 14 дней клетки молочной железы мышей вводили 5×104 4Т1 клеток. А; Объемы опухолей для каждой группы: 1/контроль (PBS), 2/вакцинация hESC 3/вакцинация hESC сочетается с VPA, 4/мыши, получающие только VPA. В: вес опухоли на 44 день.
Фиг. 4: Иммунная защита после вакцинации hESC и VPA: А; уменьшение клеток PD1 в селезенке в популяциях CD4 и CD8. В, увеличение CD4+ и CD8+ Т-клеток в опухолях. С: увеличение CD4+ и CD8+ Т-клеток в селезенке
Фиг. 5: Количественная оценка репортерного гена люциферазы системой IVIS-Spectrum на легких после вскрытия для каждого животного из 4 групп (контроль, hESC, hESC + VPA, VPA).
Фиг. 6: Экспрессия плюрипотентного гена в реальном времени ПЦР на клетках 4Т1 и 4Т1 CSC (маммосферы), обработанных 0,5 мМ VPA в течение 5 дней.
Фиг. 7: Экспрессия Oct4 в 4Т1, обработанных VPA и 5Aza, с помощью ПЦР RT и ПЦР в реальном времени.
Фиг. 8: Обнаружение секвенированием экзома генетических вариантов, изменяющих белковые последовательности неоантигенов в iPSC, обработанных или нет с помощью ENU. Количественная оценка вариантов в iPSC, обработанных ENU, и не обработанных iPSC. (NS = Non Synonymous, FS = frameshift, SG = Stop Gained).
Фиг. 9: Схематическое представление способа согласно изобретению.
Примеры
Пример 1
Сообщалось, что ткани плода можно использовать для иммунизации мышей, которые способны отбрасывать трансплантируемые опухоли, включая рак кожи, печени и желудочно-кишечного тракта. Этот ответ объясняется тем, что эти опухолевые клетки экспрессируют большое количество онкофетальных антигенов. На сегодняшний день было создано несколько исследований рака человека с целью таргетирования эмбриональных антигенов, таких как антигены карциноэмбриональногр антигена (СЕА) и альфа-фетопротеина или рака яичек. Было показано, что, к сожалению, таргетирование на один антиген недостаточно эффективно для создания сильных противоопухолевых иммунных реакций для опосредования отторжения опухоли из-за быстрого появления белковых мутантов и общей неэффективности моновалентных противораковых вакцин. Недавняя заинтересованность в потенциале стволовых клеток в регенеративной медицине позволила получить четко определенные недифференцированные линии ESC, а также недифференцированные iPSC, которые фенотипически и функционально похожи на ESC. В нашем исследовании мы предположили, что недифференцированные стволовые клетки могут быть использованы в качестве поливалентной вакцины для генерации иммунного ответа против множества эмбриональных антигенов, которые имеют опухолевые клетки и CSC. Мы впервые обнаружили, что ESC или iPSC способны индуцировать иммунные и клинические ответы на карциному молочной железы. Неожиданно мы обнаружили, что добавление вальпроевой кислоты в терапевтическом режиме может вызывать более высокие иммунные и противоопухолевые ответы по сравнению с использованием только ESC или iPSC.
Материал и Методы
Мы разработали метастазирующую опухолевую модель 4Т1 у мышей BALB/c. Чтобы проверить эмбриональные ES-подобные маркеры в клеточных линиях TNBC мышиных клеток TNT 4Т1, проводили метаанализ с образцами эмбриональных клеток (стволовая клетка D3 - GSE51782, аннотированная платформой Affymetrix GPL16570) и с интеграцией разных наборов данных: линия клеток TNT 4Т1 культивировали in vitro (GSE73296, аннотированный пластинкой Affymetrix GPL6246), клеточную линию TNT 4Т1, ксенотрансплантированную в мышиной модели (GSE69006, аннотированную патформой Affymetrix GPL6246) и образцы молочной железы (GSE14202, аннотированные платформой GLP339). Для этой модели 4Т1 было показано микро-массивное исследование, где трансплантированные 4Т1 у мышей balb/c имеются 1304 разных гена, таких же, как у мышиных ESC, включая TRAP1A, ТЕТ1, TSLP, FAM169A, ETV5, MOXD1, PHLDA2, CRJP1, ADAMDEC1, NIDI, EPCAM, H2-EA-PS, GPA33, IBSP, KANK3, MEST, MMP9, SPRY4, CLDN4, PRSS22, DDAH2, SPRY2, USP11, CTNNAL1, ZFP532, GRB10, CACNG7, ST14, CTH, RCN1, PECAM1, TMEFF1, PPP1R1A, GPR97, KIF2C, BRCA2, SLAIN1, CSRP2, DOCK6, HUNK, RAD51, ESYT3, SKP2, CCL24, SFRP1, HMGB2, ITM2A, ASPN, MSH2, SUGT1, ARHGAP8 и т.д. Таким образом, все эти гены обычно поддерживались в 4Т1 и mESC по сравнению с нормальной мышей молочной железы. Было также показано, что ксенотрансплантированные 4Т1 высоко экспрессировали маркеры CSC, такие как CD44, по сравнению с клетками, которые собирали in vitro (39% против 0,27% CD44highCD24low) (не показано).
Таким же образом анализы профиля экспрессии целого генома проводились на тройном негативном раке молочной железы (TNBC) у пациентов. Чтобы проверить эмбриональные ES-подобные маркеры у пациентов с TNBC, метаанализ, проведенный с образцами эмбриональных клеток и образцами молочной железы человека, был выполнен путем слияния выборочных данных из разных наборов данных: набор данных GSE18864, содержащий 84 образца рака молочной железы и аннотированный с помощью платформы Affymetrix GPL570, набор данных GSE20437, состоящий из 42 образцов нормальной молочной железы человека и аннотированных платформой Affymetrix GPL96, набор данных GSE23402, содержащий 42 образца эмбриональных стволовых клеток человека и индуцированных плюрипотентных стволовых клеток и аннотированный с помощью платформы Affymetrix GPL570, набор данных линий клеток рака молочной железы и набор данных GSE36953, содержащих образцы культуры клеток клеточных линий TNBC и аннотируемых платформой Affymetrix GPL570. Контролируемый односторонний анализ ANOVA, проведенный между 3 группами рака молочной железы, выявил 4288 значительных генов, которые позволили классифицировать большинство тройного отрицательного рака молочной железы TNBC III класса с образцами IPS и ES, включая CDC20, KRT81, NCAPG, MELK, DLGAP5, AURKA, ADAM8, CCNB1, RRM2. QPRT, SLAMF8, EZH2, CENPF, HN1, CENPA, SLC19A1, SLC39A4, CDK1, SEPHS1, GMDS, TUBB, SCRIB, DDX39A, YBX1, MKI67, ТКТ, WDR1, SKP2, ISG20, NRTN, SEC14L1, GAPDH, ILF2, PSMB2, DHTKD1, ТРХ2, CCNB2, IL27RA, NADK, H2AFX, MRPS18A, AURKA, МСМ7, МСАМ, NOP2, KIF23, JMJD4, YIPF3, CDH3, TALDO1, BID, C16orf59, HMMR, BIRC5, ZNF232, RANBP1, CDK1, SHMT2, KIF20A, EPHB4, SPAG5, PPARD, ORC6, TUBB4B, LYZ, TK1, PDXK, NAA10, BAG6, SF3B3, MARCKSL1, MCM3, PSRC1, NUSAP1 и т.д. Таким образом, все эти гены обычно регулировались в опухолях TNBC и hESC по сравнению с нормальной молочной железой человека.
Результаты
Результат 1. Вакцинация ксеногенными эмбриональными стволовыми клетками генерирует иммунологический и противоопухолевый ответ против рака молочной железы.
Сначала мы исследовали, была ли вакцинация облученными мышиными ESC (mESC), мышиными индуцированными клетками-плюрипотентными стволовыми клетками (мышиными iPSC), эмбриональными стволовыми клетками человека (hESC) или клетками 4Т1 эффективной против рака молочной железы в сингенной модели мышей 4Т1. После этой вакцинации испытывали мышей с двумя различными типами клеток 4Т1: 4Т1, обычно культивированные а DMEM 10% клеток SVF или 4Т1, которые выращивались с дополнительными цмтокннами, такими как TGFbeta и TNFalpha, для получения стволовых клеток рака (CSC) растущих в форме маммосфер. Мы обнаружили, что в отличие от невакцинированных мышей мыши, вакцинированные hESC, mESC, мышиными iPSCS и 4Т1, генерировали последовательные клеточные иммунные ответы против 4Т1-карциномы, что коррелировало со значительным снижением объема опухоли молочной железы (р<0,05) (Фиг. 1). Мы обнаружили, что опухоли постепенно прогрессировали в контрольной группе PBS, тогда как, по-видимому, иммунизация с mESC, miPS или hESC приводила к замедлению роста опухоли со статистически значимыми различиями в среднем размере опухоли в каждой группе по сравнению с группой PBS (Фиг. 1). Мы наблюдали резкое ингибирование роста опухоли, когда мышей испытывали CSC-производными -4Т1 по сравнению с мышами с 4Т1, которые были испытаны ростом в нормальном состоянии, что свидетельствует о том, что вакцинация сингеными mESC преимущественно таргетирована на CSC. Для дальнейшего изучения клеточного иммунного механизма, опосредующего противоопухолевый эффект, мы проанализировали фенотип лимфоцитов инфильтрирующих опухолей из разных групп и количественно определили субпопуляции CD4, CD8, CD25 и PD1. Противоопухолевый эффект коррелировал с 1) увеличением CD4+ TIL, которое достоверно (р=0,0039) коррелировало с размером опухоли (Фиг. 2А), 2) уменьшением процента CD25-положительных клеток, которое обратно коррелировано с размером опухоли (Фиг. 2В), 3) уменьшением PD1-положительных клеток, которое было более выраженным у мышей, которые лучше отдыхали до режима вакцинии (вакцинация hECS, 4Т1 или mESC) (Фиг. 2С).
Результат 2. Вакцинация ксеногенными эмбриональными стволовыми клетками в сочетании с вальпроевой кислотой (VPA) вызывает более высокий противоопухолевый ответ против рака молочной железы и препятствует развитию метастазов.
Для оценки метастатических сайтов в моделях груди 4Т1 клетки 4Т1 были генетически модифицированы, так что они экспрессировали как GFP, так и репортерный белок люциферазы (4T1Luc-GFP), что позволяет отслеживать их in vivo с использованием биолюминесцентной визуализации (спектр Ivis) в более глубоких органах (селезенка, легкие, кости, печень). Эксперимент проводили, как описано ранее, но используя только облученные hESC в качестве вакцины; 5 мышей в группе получали два стимула вакцины 7 и 14 дней с 105 облученных клетками hESC с или без VPA в дозе 0,40 мМ в питьевой воде. Через 14 дней клетки молочной железы мышей вводили 5⋅104 4T1Luc-GFP-KneTicaM. Мы обнаружили, что в отличие от невакцинированных мышей мыши, вакцинированные hESC в сочетании с VPA, генерировали более высокие клеточные иммунные ответы против 4Т1-карциномы, что коррелировало со значительным снижением объема опухоли молочной железы (р<0,05) (Фиг. 3А) и уменьшением массы опухоли (Фиг. 3В). Противоопухолевый ответ коррелировал с резким уменьшением экспрессии PD-1 как на CD4+ T-клетках, так и на CD8+ Т-клетках у мышей, получавших hESC и VPA (Фиг. 4А). Кроме того, противоопухолевый ответ коррелировал со значительным увеличением процента CD4+ T и CD8+ Т-клеток в опухоли (Фиг. 4В) и внутри селезенки (Фиг. 4С) исключительно для мышей, получавших комбинированное лечение (hESC и VPA) по сравнению с контрольной группой (PBS). Мы также обнаружили, что у всех мышей были значительно уменьшены мыши с метастазами в легкие, обработанные вакциной hESC и VPA (Фиг. 5). В совокупности эти результаты показывают, что ксеногенная эмбриональная вакцинация на основе стволовых (hESC) с VPA обладает самой сильной эффективностью по сравнению с использованием только hESC и VPA. Эти результаты показывают, что ксеногенная эмбриональная вакцинация на основе стволовых клеток может быть эффективным средством для уменьшения рецидива опухоли при карциноме молочной железы.
Пример 2
Вальпроевая кислота модулирует экспрессию МНС класса 1 и экспрессию эмбриональных генов
Главный комплекс гистосовместимости (МНС) представляет собой набор белков клеточной поверхности, необходимых для того, чтобы приобретенная иммунная система распознавала чужеродные молекулы, которые играют важную роль в приобретенной иммунной системе. Основная функция молекул МНС состоит в том, чтобы связываться с новыми и чужеродными антигенами и презентировать их на поверхности клетки для распознавания соответствующими Т-клетками: взаимодействуя с молекулами CD4 на поверхностях хелперных Т-клеток, МНС класса II опосредует установление специфического иммунитета, называемого приобретенным иммунитетом или адаптивным иммунитетом. Взаимодействуя с молекулами CD8 на поверхностях цитотоксических Т-клеток, МНС класса I опосредует разрушение инфицированных или злокачественных клеток-хозяев.
Иммунная толерантность является важным средством, с помощью которого растущие опухоли, которые имеют мутированные белки и измененную экспрессию антигена, предотвращают элиминацию иммунной системой хозяина. Опухолевая иммунная толерантность может быть частично объяснена отсутствием β2-m на поверхности клетки и отсутствием МНС класса I в опухолевой клетке. Было показано, что VPA способен увеличить экспрессию МНС класса I на клетках 4Т1 в дозе от 0,2 мМ до 2 мМ.
Экспрессия МНС класса I на 4Т1 и 4Т1 маммосфере (CSC, индуцированная обработкой TNFa и TGFb) увеличивается в 2-3 раза после 24 часов до 72 часов воздействия с 2 мМ VPA.
В частности, было показано, что VPA может увеличить экспрессию HLA ABC МНС класса I на iPSCs (63% по сравнению с 92%) и экспрессию плюрипотентных маркеров, таких как SSEA4 и Tra1-60 (55% против 72%) при дозе 0,5 мМ.
Эти маркеры были уменьшены после воздействия ENU (60 дней лечения) и были восстановлены, когда клетки обрабатывали 0,5 мМ VPA (от 28 до 92% HLA ABC положительных iPSCs-ENU и iPSC соответственно) и (от 48% до 69% SSEA4/Tra-1-60 положительных iPSCs-ENU и iPSC соответственно).
Ингибиторы HDAC, такие как VPA, могут избирательно изменять транскрипцию генов, в частности, путем ремоделирования хроматина и изменениями структуры белков в транскрипционном факторе. Было изучено, может ли VPA модулировать экспрессию плюрипотентного гена в опухолевых клетках молочной железы. Для этой цели мы обработали маммосферы 4Т1 и 4Т1 (CSC, индуцированные обработкой TNFa и TGFb) с 1 мМ до 2 мМ VPA. Во всех случаях VPA увеличили в 2-3 раза экспрессию трех различных важных транскрипционных факторов, которые высоко экспрессировались в ESC или iPSC, такие как Oct 4, Sox2 и Nanog (Фиг. 6). Важно отметить, что важный синергический эффект экспрессии этих транскрипционных факторов был продемонстрирован, когда опухолевые клетки обрабатывали комбинацией VPA и 5-азацитидина (5aza) при использовании в дозах, которые ингибируют ДНК-метилтрансферазу, вызывая гипометилирование ДНК. В частности, было показано 7-кратное увеличение транскрипта Oct 4, когда клетки 4Т1 обрабатывали VPA и 5aza (Фиг. 7А и В).
Пример 3. Индуцирование повреждений ДНК и ошибок восстановления ДНК с помощью геномной нестабильности в iPSC, подвергнутых воздействию мутагенного лекарственного средства, такого как N-этил-N-нитрозомочевина (ENU)
Этил-N-нитрозомочевина (ENU) представляет собой мутагенный алкилирующий агент, который создает базовые трансверсии, но также одноточечные мутации и разрывы двойной цепи ДНК (DSB).
Можно было подтвердить, что ENU допускает повреждение ДНК в iPSC.
Было оценено количество фосфорилированного гамма-Н2АХ, притягиваемого к сайтам DSB, присутствующим в клетках. В этом эксперименте iPSC отделяли от стромальных культур с помощью коллагеназы и обрабатывали in vitro с помощью ENU в указанных концентрациях (50 мкг/мл) и раз с последующим вестерн-блот-анализом с использованием антитела против фосфо-гамма-Н2АХ. Было показано увеличение уровней гамма-Н2АХ в ранние моменты времени через 2 минуты-10 минут с последующим возвратом к базальным уровням.
Был разработан протокол для индукции геномной нестабильности в iPSC путем последовательной обработки IPSC с помощью ENU с целью накопления ошибок восстановления ДНК во время обширной пролиферации. Клетки обрабатывали в течение 60 дней ежедневными изменениями среды с ежедневным добавлением ENU в концентрации 10 мкг/мл. VPA был добавлен во время культуры.
После 61 дня iPSCs оценивают геномное следствие процедуры мутагенеза в iPSC с помощью Karyotype, секвенирования РНК, массивов CGH, секвенирования экзома, WGS. Геномные изменения, накопленные в культивируемых iPSC, сравниваются с iPSC, не обработанным ENU.
После экспозиции ENU мутированный iPSC поддерживали и размножали в культуре с помощью VPA. Массивы CGH и секвенирование экзома выполняются последовательно в разных пассажах, чтобы подтвердить генокопию распространенности соматических мутаций в ENU-iPSC во время их размножения. Фенотип iPSC выполняется путем оценки плюрипотентности Pluritest и экспрессии Oct4, Sox2, Nanog, Tra-1 60, SSEA4. Мы обнаружили, что скорость репликации и удвоение популяции аналогичны iPSC без экспозиции ENU.
iPSC обрабатывали 10 мкг/мл ENU и выполняли секвенирование экзома для обнаружения мутированных нео-антигенов. 48 изменений в обработанном ENU-iPSC найдено по сравнению с 8 изменениями в iPSC без ENU (Фиг. 8). Эти локусы были объединены программой cBioPortal (http://www.cbioportal.org), позволяющей получить доступ к наборам данных геномики рака от образцов опухоли человека из разных исследований рака. Используя программу cBioPortal, было показано, что от 10 до 75% этих изменений были найдены также дерегулированными при карциноме (поджелудочная железа, легкая простата …). Для всех последовательностей экзома мы оцениваем глубину охвата от 30 до 400 считываний для всех мутаций, которые могут быть обнаружены в iPSC, обработанном ENU.
Пример 4. Гаплоинтенсивность для BRCA1 приводит к изменению ДНК-репарации и геномной нестабильности при накоплении CNV в iPSC во время культивирования.
Изменение BRCA1/2 связано с синдромом наследственного рака молочной железы и яичников (HBOC). BReast CAncerl (BRCA1) является геном-супрессором опухолей и играет ключевую роль в поддержании геномной стабильности путем контроля репарации ДНК в гомологичной рекомбинации, восстановлении двухнитевого разрыва, фазе S и G2/M, контрольных точках и в центросомального регулирования.
Фибробласт, содержащий делецию экзона 17 в BRCA1, был перепрограммирован с помощью вирусов Sendai, содержащих Oct3/4, Sox2, Klf4 и сМус (CytoTune®-iPS Sendai Reprogramming Kit, Life technologies). Клетки культивировали в среде плюрипотентных стволовых клеток человека (hPSC-среда) на основе DMEM/F12, дополненной 20% Knock Out Serum Replacer, 1 мМ L-глутамина, 1% пенициллина/стрептомицина, 100 мкМ 2-меркаптоэтанола (Life technologies) и 12,5 нг/мл основного FGF (Miltenyi Biotech). На 26-й день полностью перепрограммированные колонии были вручную выбраны на основе их морфологических и плюрипотентных маркеров с помощью анализа FACS, Q RT-PCR Nanog, Oct4 Sox2, образования тератомы у мышей NOD-SCID и Pluritest Karyotype был нормальным.
Сравнивали уровни и активность ответа на повреждение ДНК (DDR) в нормальных (WT) и BRCA1+/-iPSC. Фрагменты гамма-Н2АХ определяли с помощью иммунофлуоресценции в пролиферирующем iPSC после облучения или экспозиции ЕНУ. IPSC BRCA1+/- продемонстрировали значительно более высокие уровни фосфорилированных субстратов ATM/ATP, а также вербовку гамма-Н2АХ в ДНК по сравнению с обычным WT-iPSC, что указывает на то, что пролиферация IPSC BRCA1+/-страдает увеличением повреждения ДНК по сравнению с WT-IPSC.
Так как iPSC BRCA1+/- показал повышенные уровни DDR на ранних проходах, было выяснено, может ли это быть связано с накоплением геномных изменений во время итеративных пассажей и пролиферации.
Массив CGH в пролиферирующих плюрипотентных стволовых клетках анализировали после длительного прохождения iPSC в среде, дополненной HDACi (VPA). С этой целью эксперименты Agilent CGHarray проводились на ДНК из образцов IPSC платформой aHGH Roche-Nimbelgen. Выделение сигнала и геномные интервалы были идентифицированы с помощью цитогенетических препаратов Agilent и программного обеспечения Nexus Roche-Nimbelgen на HG18 генома человека. Локусы генов были преобразованы в координаты HG19 с помощью аннотаций Roche-Nimbelgen (Genes_July_2010_hg19, сайт Roche-Nimbelgen). Полиморфизм европейских копий (CNV) был исключен из экспериментов с базой данных scaedb. Отношения массивов CGH CNV были отобраны как тепловая карта с автономным программным обеспечением MEV версии 4.9.0 (красный: коэффициент усиления, зеленый: потеря и темный ноль). Локусы генов, обнаруженные в предковой клетке, были вычтены из локусов генов, затронутых в соответствующем образце IPSC. Результирующая фильтрованная CNV, специфичная для каждого iPSC, была объединена с базой данных COSMIC. Геномный Circosplot на HG19 проводился с генами рака, которые были обнаружены в каждом IPSC после фильтрации. Эта геномная кривая была выполнена с использованием R-пакета OmicCircos в среде R.0 версии 3.0.2.
Было показано, что культура iPSC BRCA1+/- (>100 дней) приводит к поздним пассажам к накоплению геномных аномалий, связанных с повышенной геномной нестабильностью без экспозиции ENU. Кариотип при позднем проходе является нормальным. Эксперименты Agilent aCGH проводили на ДНК-экстракте из клеток iPSC и из их соответствующей предковой клетки Геномное картирование интервалов, затронутых в ходе этих плюрипотентных индукций, показало, что на BRCA1+/-IPSC влияло значительное количество локусов генов по сравнению с WT. После фильтрования европейского полиморфизма CNV на WT iPSC все еще были обнаружены только 58 локусов генов (полиморфизм составляет 1,69% от общего количества локусов), аналогично на локусах гена BRCA1-/+iPSC 5273 все еще были обнаружены пораженными после фильтрации полиморфизма. Большинство локусов генов, затронутых в BRCA1+/-iPSC, связано с приростом ДНК.
Среди этих локусов генов, пораженных геномной нестабильностью, некоторые из них известны как ген рака в базе данных COSMIC. WT iPSCs показали только один локус гена рака, затронутый в aCGH (CDK4). BRCA1-/+IPSC подвержены изменениям в отношении 131 локуса генов рака, и среди них известно, что у генов рака рак обнаружены 11 генов: MSH2, SMARCD1, ТВХ3, CDH1, ТР53, ERBB2, CDK12, BRCA1, PPP2R1A, AKT2, ЕР300. Эти изменения были обнаружены, в частности, чрезмерно представлены на небольших хромосомах 19 и 17: хромосоме 17, которая является хромосомой локусов гена BRCA1.
В целом большинство iPSC BRCA1+/- продемонстрировали большее количество индексов (делеция или амплификация) по сравнению с WT-IPSC. Определяли и проверяли скорость 8% CNV на 5273 генах. Биоинформационный анализ выявил экспрессию 131 гена, идентифицированного в базе данных COSMIC, для участия в развитии рака, в основном в лейкозах, эпителиальных опухолях и в мезенхимальных опухолевых клетках. Некоторые измененные гены аналогичным образом наблюдаются при раке молочной железы и яичников.
Скорость репликации, ген плюрипотентности (Pluritest, маркеры поверхности клеток) и МНС I поддерживаются и стабильны в течение всего времени культивирования в присутствии VPA.
В заключение, делеция или инактивация генов, связанных с репарацией ДНК, таких как BRCA-1, позволяет индуцировать геномную нестабильность, приводящую к генерации множественных CNV, индивидуальных и мутаций, связанных с МНС I.
Пример 5. N-этил-N-нитрозомочевина (ENU) увеличивает нагрузку мутированных неоантигенов в CML-iPSC
Характеристика iPSC, полученная из лейкозных клеток крови пациента с филадельфий-положительной хронической миелоидной лейкемией (CML). iPSC генерировали с помощью опосредованного

ДНК CML iPSC была проанализирована с помощью массива CGH. Несколько геномных аберраций наблюдались в донных колониях, полученных от обработанных ENU iPSC, с обнаружением потери гетерогенности среди геномных аберраций, выбранных давлением ENU на CML IPSC (СВ32). Сюда включались вариации количества копий CNV, которые включали 332 генов). После фильтрации в базе данных европейского кавказского геномного полиморфизма в этих геномных аберрациях все еще присутствовали 255 генных локусов. Большинство геномных аномалий включало потерю геномной ДНК (71%) с потерей гетерозиготности (23%). Согласование этих геномных аберраций с базой данных транскрипции, базой данных генов рака и базой данных генов плюрипотентности позволили заметить, что эти важным дерегулированным акторам в основном подвержены хромосомам 7, 8, 15, Y и X. A Circosplot также позволил определить, что большинство этих аномалий связаны с факторами транскрипции, такими как MESP, участвующим в миграции мезодермальных клеток, и IKZF1. Были затронуты некоторые гены плюрипотентности, а также некоторые раковые гены, такие как IDH2, NCOA2, IKZF1, BLM, которые уже описаны для участия в Ph1-положительных лейкозах, что указывает на актуальность аномалий, вызванных мутагенезом, вызванным ENU.
Этот анализ показывает, что было обнаружено, что несколько генных изменений, таких как коэффициенты усиления и потери, а также некоторые из выявленных аномалий являются генами рака, идентифицированными в базе данных Cosmic.
Сравнение аномалий, выявленных в ENU-iPSC, позволило воспроизвести агрессивные аномалии фазы острой лейкемии, уже выявленные у пациентов с CML в фазе острой лейкемии, что указывает на то, что ENU-CML iPSC является уникальным инструментом для воспроизведения in vitro этих геномных аномалий при этом специфическом раке.
Во всем этом приложении различные ссылки описывают уровень техники, к которому относится настоящее изобретение. Описание этих ссылок включено в настоящее описание посредством ссылки в настоящее описание.
ССЫЛКИ:
Graham, K., A. de las Morenas, A. Tripathi, С. King, М. Kavanah, J. Mendez, M. Stone, et al. 2010. «Gene Expression in Histologically Normal Epithelium from Breast Cancer Patients and from Cancer-Free Prophylactic Mastectomy Patients Shares a Similar Profile». British Journal of Cancer 102 (8): 1284-93. doi:10.1038/sj.bjc.6605576.
Guenther, Matthew G, Garrett M. Frampton, Frank Soldner, Dirk Hockemeyer, Maya Mitalipova, Rudolf Jaenisch, et Richard A. Young. 2010. «Chromatin Structure and Gene Expression Programs of Human Embryonic and Induced Pluripotent Stem Cells». Cell Stem Cell 7 (2): 249-57. doi:10.1016/j.stem.2010.06.015.
Maire, Virginie, Fariba


Padovani, Michela, Jackie A. Lavigne, Gadisetti V.R. Chandramouli, Susan N. Perkins, J. Carl Barrett, Stephen D. Hursting, L. Michelle Bennett, et David Berrigan. 2009. «Distinct Effects of Calorie Restriction and Exercise on Mammary Gland Gene Expression in C57BL/6 Mice». Cancer Prevention Research (Philadelphia, Pa.) 2 (12): 1076-87. doi: 10.1158/1940-6207.CAPR-09-0034.
Silver, Daniel P., Andrea L. Richardson, Aron C. Eklund, Zhigang C. Wang, Zoltan Szallasi, Qiyuan Li, Nicolai Juul, et al. 2010. «Efficacy of Neoadjuvant Cisplatin in Triple-Negative Breast Cancer». Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology 28 (7): 1145-53. doi:10.1200/JCO.2009.22.4725.
Yotsumoto, Fusanori, Eriko Tokunaga, Eiji Oki, Yoshihiko Maehara, Hiromi Yamada, Kyoko Nakajima, Sung Ouk Nam, et al. 2013. «Molecular Hierarchy of Heparin-Binding EGF-like Growth Factor-Regulated Angiogenesis in Triple-Negative Breast Cancer». Molecular Cancer Research: MCR 11 (5): 506-17. doi:10.1158/1541-7786.MCR-12-0428.
Futreal, P. Andrew, Lachlan Coin, Mhairi Marshall, Thomas Down, Timothy Hubbard, Richard Wooster, Nazneen Rahman, et Michael R. Stratton. 2004. «A Census of Human Cancer Genes ». Nature Reviews. Cancer 4 (3): 177-83. doi:10.1038/nrc1299.
Gamazon, Eric R., Wei Zhang, Anuar Konkashbaev, Shiwei Duan, Emily O. Kistner, Dan L. Nicolae, M. Eileen Dolan, et Nancy J. Cox. 2010. «SCAN: SNP and Copy Number Annotation». Bioinformatics (Oxford, England) 26 (2): 259-62. doi: 10.1093/bioinformatics/btp644.
Hu, Ying, Chunhua Yan, Chih-Hao Hsu, Qing-Rong Chen, Kelvin Niu, George A. Komatsoulis, et Daoud Meerzaman. 2014. «OmicCircos: A Simple-to-Use R Package for the Circular Visualization of Multidimensional Omics Data». Cancer Informatics 13: 13-20. doi:10.4137/CIN.S13495.
Saeed, A.I., V. Sharov, J. White, J.Li, W. Liang, N. Bhagabati, J. Braisted, et al. 2003. «TM4: A Free, Open-Source System for Microarray Data Management and Analysis ». BioTechniques 34 (2): 374-78.
Loek J. Eggermont, Leonie E. Paulis, Jurjen Tel, Carl G Figdor et al 2014 Trends in Biotechnology, 2014. Towards efficient cancer immunotherapy: advances in developing artificial antigen-presenting cells. Adham S. Bear, Conrad R. Cruz, and Aaron E. Foster et al, 2011. T Cells as Vehicles for Cancer Vaccination. J Biomed Biotechnol. 2011; 2011:417403
Cornelis J.M. Melief, Thorbald van Hall, Ramon Arens, Ferry Ossendorp, and Sjoerd H. van der Burg, Therapeutic cancer vaccines J Clin Invest. 2015; 125(9):3401-3412
Oluseun Adewumi, Behrouz Aflatoonian, Lars Ahrlund-Richter, Michal Amit, Peter W Andrews, Gemma Beighton, Paul A Bello, Nissim Benvenisty, Lorraine S Berry, Simon Bevan, Barak Blum, Justin Brooking, Characterization of human embryonic stem cell lines by the International Stem Cell Initiative, Nature Biotechnology 25, 803-816 (2007)
Franz-Josef Miiller, Bernhard M Schuldt, Roy Williams, Dylan Mason, Gulsah Altun,
Eirini P Papapetrou, Sandra Danner, Johanna E Goldmann, Arne Herbst, Nils О Schmidt, Josef В Aldenhoff, Louise С Laurent & Jeanne F Loring A bioinformatic assay for pluripotency in human cells; Nature Methods 8, 315-317 (2011)
Shi Y and al, Nat Rev Drug Discov. 2017 Feb; 16(2): 115-130.
Chen KG and al Human pluripotent stem cell culture: considerations for maintenance, expansion, and therapeutics. Cell Stem Cell. 2014 Jan 2; 14(1):13-26
Hussein SM and al, Copy number variation and selection during reprogramming to pluripotency. Nature. 2011 Mar 3; 471(7336):58-62.
Hussein SM and al, Genome damage in induced pluripotent stem cells: assessing the mechanisms and their consequences. Bioessays. 2013 Mar; 35(3): 152-62.
Wu, Z et al, Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol Ther 2006; 14:316-27
Choi, VW et al, Effects of adeno-associated virus DNA hairpin structure on recombination. J Virol 2005; 79:6801-07
Graham et al., A new technique for the assay of infectivity of human adenovirus 5 DNA (1978) Virology 52: 456-457
Wigler et al., (1979) Proc. Natl. Acad. Sci. U.S.A. 76 1373-1376 and Current Protocols in Molecular Biology Vol.1, Wiley Inter-Science, Supplement 14, Unit 9.1.1-9.1.9 (1990)
Lindor et al, 2008 Journal of the National Cancer Institute Monographs, No. 38, Concise Handbook of Familial Cancer Susceptibility Syndromes, Second Edition
Chateauvieux et al, J. Biomed. Biotechnol, 2010, pii: 479364. doi: 10.1155 / 2010/479364
Nicholas P. Restifo, Mark E. Dudley and Steven A. Rosenberg ("Adoptive immunotherapy for cancer: harnessing the T cell response, Nature Reviews Immunology, Volume 12, April 2012
Teifel et al., (1995) Biotechniques 19: 79-80,
Albrecht et al., (1996) Ann. Hematol. 72: 73-79
Holmen et al., (1995) In Vitro Cell Dev. Biol. Anim. 31: 347-351
Remy et al., (1994) Bioconjug. Chem. 5: 647-654
Le Bolc'h et al., (1995) Tetrahedron Lett. 36: 6681-6684
Loeffler et al., (1993) Meth. Enzymol, 217: 599-618
Strauss (1996) Meth. Mol. Biol. 54: 307-327
U.S. Pat. Nos. 5,240,840,4,806,476, 5,298,429, and 5,396,767
Fournier (1981) Proc. Natl. Acad. Sci. U.S.A. 78: 6349-6353
Lambert et al., (1991) Proc. Natl. Acad. Sci. U.S.A. 88: 5907-59
Marchion DC et al J Cell Biochem. 2004 May 15; 92(2):223-37.
Valente et al 2014 J Med Chem. 2014 Jul 24; 57(14):6259-65 and
Valente et al 2014 Expert Opin Ther Pat. 2014 Apr; 24(4):401-15.
Leoni et al Expert Opin Ther Pat. 2016; 26(2):149-73
Ja et al 2003
Diermayr et al Blood Cancer J. 2012 May; 2(5):e69
Moffat D et al J Med Chem. 2010 Dec 23; 53(24):8663-78
Banerji et al Clin Cancer Res. 2012 May 1; 18(9):2687-94
Lin et al 2012).
Kaminskas et al Org Biomol Chem. 2004 Sep 21; 2(18):2578-84.
Estey et al Leukemia. 2013 Sep; 27(9):1803-12.
Kantarjian et al Blood. 2007 Jan l; 109(1):52-7
Agnew Chem Intl. Ed. Engl. 33:183-186 (1994)
Pardoll, Nature Reviews Cancer 12: 252-264, 2012
Brignone et al., 2007, J. Immunol. 179:4202-4211
Loo et al., 2012, Clin. Cancer Res. July 15 (18) 3834
Fourcade et al., 2010, J. Exp. Med. 207:2175-86
Sakuishi et al., 2010, J. Exp. Med. 207:2187-94
Rosenberg et al., N Engl J Med. 1988 Dec 22; 319(25): 1676-80.
Rosenberg Cancer Treat Rev. 1989 Jun; 16 Suppl A:115-21.
Реферат
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения субъекта, страдающего от рака. Для этого применяют комбинацию ингибитора гистондезацетилазы (HDACi) и композицию вакцины, содержащей популяцию плюрипотентных клеток, которые были инактивированы, для получения лекарственного средства для одновременного, раздельного или последовательного введения. Группа изобретений также относится к способу получения популяции плюрипотентных клеток, которые были инактивированы. Использование данной группы изобретений показало, что вакцинация ксеногенными эмбриональными стволовыми клетками в сочетании с ингибитором гистондезацетилазы (вальпроевой кислотой) вызывает более высокий противоопухолевый ответ. 4 н. и 20 з.п. ф-лы, 9 ил., 4 пр.

Комментарии