Производные индол-3-ил-карбонил-спиро-пиперидина - RU2420529C2
Код документа: RU2420529C2
Описание
Настоящее изобретение относится к соединениям формулы (I):

где
А выбран из следующих групп (а), (b), (с), (d), (e) и (f):






Х могут являться одинаковыми или разными и представляют собой CRiiiRiv, NRiii или О, где в (а) только один Х может представлять собой О, а другой представляет собой CRiiiRiv или NRiii;
R1 представляет собой Н,
C1-6-алкил, возможно замещенный CN,
или представляет собой арил, 5- или 6-членный гетероарил или сульфониларил, которые возможно замещены одним или более чем одним В,
или представляет собой -(CH2)m-Ra, где Ra представляет собой:
ORi,
NRiRii,
С3-6-циклоалкил, 4-7-членный гетероциклоалкил, арил, или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В,
или представляет собой -(CH2)n-(CO)-Rb или -(CH2)n-(SO2)-Rb, где Rb представляет собой:
C1-6-алкил,
С1-6-алкокси,
С3-6-циклоалкил,
-(СН2)m-NRiiiRiv,
NRiRii,
С3-6-циклоалкил, 4-7-членный гетероциклоалкил, арил, или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В,
или R1 и R3 вместе с индольным кольцом, к которому они присоединены, образуют 5- или 6-членный гетероциклоалкил, который может быть замещен (СО);
R2 представляет собой один или более чем один остаток, выбранный из Н, ОН, галогено, CN, нитро, C1-6-алкила, возможно замещенного -NRiiiRiv, C1-6-алкокси, -O-СН2-С2-6-алкенила, бензилокси или C1-6-галогеноалкила,
или два R2 могут образовывать оксо- или диоксомостик вместе с индольным кольцом, к которому они присоединены;
R3 представляет собой Н,
или представляет собой галогено,
или представляет собой: -(CO)-Rc, где Rc представляет собой:
C1-6-алкил,
-(CH2)n-NRiRii,
-(СН2)n-NRiiiRiv,
5- или 6-членный гетероциклоалкил, возможно замещенный C1-6-алкилом, или представляет собой C1-6-алкил или арил, которые возможно замещены
галогено,
-O(СО)-С1-6-алкилом
или -NH(CO)Rd, где Rd представляет собой С1-6-алкил, возможно замещенный галогено или нитро, или Rd представляет собой арил или 5- или 6-членный гетероарил, которые возможно замещены галогено, нитро, C1-6-алкилом или C1-6-галогеноалкилом;
R4 представляет собой один или более чем один остаток, выбранный из Н, галогено, C1-6 алкила или C1-6-алкокси, CN, или два R4 могут образовывать оксо- или диоксомостик вместе с фенильным кольцом, к которому они присоединены;
В представляет собой галогено, CN, NRiRii, C1-6-алкил, возможно замещенный CN, галогено или C1-6-алкокси, C1-6-алкокси, С3-6-галогеноалкокси, С3-6-циклоалкил, -С(O)O-С1-6-алкил, -C(O)ii, -С(O)-С1-6-алкил, -S(O)2-C1-6-алкил, -S(O)2-NRiRii, (CRiiiRiv)n-фенил или (CRiiiRiv)n-5- или 6-членный гетероарил, где фенильная или 5- или 6-членная гетероарильная группировка возможно замещена одним или более чем одним заместителем, выбранным из группы, состоящей из:
галогено, CN, NRiRii, C1-6-алкила, возможно замещенного CN или C1-6-алкокси, C1-6-алкокси, C1-6-галогеноалкокси, С3-6-циклоалкила, -C(O)O-C1-6-алкила, -C(O)-NRiRii, -С(O)-С1-6-алкила, -S(O)2-С1-6-алкила, -S(O)2-NRiRii;
Ri и Rii представляют собой Н, C1-6-алкил, С1-6-алкилен-NRiiiRiv, -(СО)O-С1-6-алкил, -С(O)-NRiRii, -С(O)-С1-6-алкил, S(O)2-NRiiiRiv-алкил или -S(O)2-NRiiiRiv;
Riii представляет собой Н, C1-6-алкил или C1-6-алкилен-N(Riv)2;
Riv представляет собой Н или C1-6-алкил;
m имеет значение 1 до 6;
n имеет значение 0 до 4;
а также к их фармацевтически приемлемым солям.
Соединения формулы (I) могут содержать асимметрические атомы углерода. Соответственно настоящее изобретение включает все стереоизомерные формы соединений формулы (I), включая каждый отдельный энантиомер и их смеси.
Установлено, что соединения формулы (I) проявляют значительную активность по отношению к V1a-рецептору. Поэтому в изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарств для лечения дисменорреи, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, цирроза печени, нефротического синдрома, обсессивно-компульсивного расстройства, тревожных и депрессивных расстройств.
Вазопрессин представляет собой пептид, состоящий из 9 аминокислот, который синтезируется, главным образом, паравентрикулярными ядрами гипоталамуса. Известно три рецептора вазопрессина, все из которых принадлежат классу I G-белок-сопряженных рецепторов. V1a-рецептор экспрессируется в головном мозге, печени, гладких мышцах сосудов, легких, матке и яичках. V1b (или V3)-рецептор экспрессируется в головном мозге и гипофизе, V2-рецептор экспрессируется в почках, где он регулирует экскрецию воды и опосредует антидиуретическое действие вазопрессина.
На периферии вазопрессин действует как нейрогормон и стимулирует вазоконстрикцию, гликогенолиз и антидиурез. В головном мозге вазопрессин действует как нейромодулятор, и его уровень повышается в мозжечковой миндалине во время стресса (Ebner, K., С.Т.Wotjak, et at. (2002). "Forced swimming triggers vasopressin release within the amygdala to modulate stress-coping strategies in rats" Eur J Neurosci 15(2): 384-8). V1a-рецептор экспрессируется во многих областях головного мозга, и в особенности в лимбических областях, таких как мозжечковая миндалина, латеральная перегородка и гиппокамп, которые играют важную роль в регуляции тревожности. Действительно, у V1a-нокаутных мышей наблюдается уменьшение уровня тревожности в тестах "крестообразный лабиринт", "открытое поле" и "темно-светлая камера" (Bielsky, I.F., S.В.Hu, et al. (2003). "Profound Impairment in Social Recognition and Reduction in Anxiety-Like Behavior in Vasopressin V1a Receptor Knockout Mice" Neuropsychopharmacology). Подавление экспрессии V1a-рецептора с использованием инъекции антисмыслового олигонуклеотида в перегородку также вызывает уменьшение уровня тревожности (Landgraf, R., R.Gerstberger, et at. (1995). “V1 vasopressin receptor antisense oligodeoxynucleotide into septum reduces vasopressin binding, social discrimination abilities, and anxiety-related behavior in rats" Reaul Pept 59(2): 229-39).
V1a-рецептор также опосредует сердечно-сосудистое действие вазопрессина в головном мозге путем центральной регуляции артериального давления и частоты сердечных сокращений в ядре одиночного пути (Michelini, L.С. and M. Morris (1999). "Endogenous vasopressin modulates the cardiovascular responses to exercise" Ann N Y Acad Sci 897: 198-211). На периферии он индуцирует сокращение гладких мышц сосудов, и продолжительное ингибирование V1a-рецептора улучшает гемодинамические характеристики у крыс с экспериментальным инфарктом миокарда (Van Kerckhoven, R., I. Lankhuizen, et at. (2002). "Chronic vasopressin V(1A) but not V(2) receptor antagonism prevents heart failure in chronically infarcted rats" Eur J Pharmacol 449(1-2): 135-41).
Соответственно антагонисты рецепторов вазопрессина являются полезными в качестве лекарств при дисменоррее, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, циррозе печени, нефротическом синдроме, обсессивно-компульсивном расстройстве, тревожных и депрессивных расстройствах.
Предпочтительными показаниями в соответствии с настоящим изобретением являются тревожные и депрессивные расстройства.
В контексте данного описания термин "арил" означает одновалентную циклическую ароматическую углеводородную группировку, состоящую из моно-, би- или трициклического ароматического кольца. Примеры арильных группировок включают возможно замещенные фенил, нафтил, фенантрил, флуоренил, инденил, пенталенил, азуленил, оксидифенил, бифенил, метилендифенил, аминодифенил, дифенилсульфидил, дифенилсульфонил и дифенилизопропилиденил, а также арильные группировки, проиллюстрированные на конкретных примерах в данном описании ниже, но не ограничены ими. Заместители арила включают галоген, C1-6-алкил и C1-6-алкокси, но не ограничены ими. Предпочтительно арил представляет собой фенил и нафтил, и еще более предпочтительно - фенил. Арильные группировки по изобретению дополнительно могут быть ортозамещены двумя заместителями, которые вместе с атомами углерода арильной группировки образуют конденсированное, насыщенное или частично насыщенное 5-6-членное кольцо, содержащее один или два гетероатома, выбранные из О и N. Предпочтительно данное дополнительное кольцо представляет собой 5-6-членное кольцо, содержащее два атома кислорода. Примеры таких замещенных арильных группировок включают бензодиоксанил, дигидробензофуранил, бензодиоксолил, бензопиранил, бензоксазинил, бензоксазинонил, бензопиперидинил, бензопиперазинил, бензопирролидинил, бензоморфолинил, метилендиоксифенил, этилендиоксифенил, а также замещенные арильные группировки, проиллюстрированные на конкретных примерах в данном описании ниже, но не ограничены ими.
Термин "C1-6-алкил" означает группу, представляющую собой насыщенную нормальную или разветвленную углеводородную цепь, содержащую от 1 до 6 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изо-бутил, 2-бутил, изо-бутил и тому подобное. Предпочтительными С1-6-алкильными группами являются C1-4-группы, то есть группы, содержащие 1-4 атома углерода.
Термин "C1-6-алкокси" означает группу, где алкильные остатки являются такими, как определено выше, и которая присоединена через атом кислорода. Предпочтительными С1-6-алкокси-группами являются метокси и этокси, а также C1-6-алкокси-группы, проиллюстрированные на конкретных примерах в данном описании ниже.
Термин "С2-6-алкенил" означает углеродную цепь из 2-6 атомов углерода, содержащую двойную связь в цепь. С2-6-алкенильные группы включают этенил, пропен-1-ил, пропен-2-ил, бутен-1-ил, бутен-3-ил, пентен-1-ил, пентен-2-ил, пентен-3-ил, пентен-4-ил, гексен-1-ил, гексен-2-ил, гексен-3-ил, гексен-4-ил и гексен-5-ил, а также С2-6-алкенильные группы, проиллюстрированные на конкретных примерах в данном описании ниже.
Термин "бензилокси" означает бензильную группу, присоединенную через атом кислорода.
Термин "галоген" или "галогено" означает хлор (Cl), иод (I), фтор (F) и бром (Br).
Термин "C1-6-галогеноалкил" означает C1-6-алкильную группу, такую как определено выше, которая замещена одним или более чем одним атомом галогена. Примеры C1-6-галогеноалкила включают метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил или н-гексил, замещенные одним или более чем одним атомом Cl, F, Br или I, а также C1-6-галогеноалкильные группы, проиллюстрированные на конкретных примерах в данном описании ниже, но не ограничены ими. Предпочтительный C1-6-галогеноалкил представляет собой дифтор- или трифтор-метил или этил.
"C1-6-галогеноалкокси" означает C1-6-алкокси-группу, такую как определено выше, которая замещена одним или более чем одним атомом галогена. Примеры C1-6-галогеноалкокси включают метокси или этокси, замещенные одим или более чем одним атомом Cl, F, Br или I, а также C1-6-галогеноалкокси-группы, проиллюстрированные на конкретных примерах в данном описании ниже, но не ограничены ими. Предпочтительный C1-6-галогеноалкокси представляет собой дифтор- или трифтор-метокси или этокси.
Термин "С3-6-циклоалкил" означает одновалентную или двухвалентную насыщенную карбоциклическую группировку, состоящую из моноциклического кольца. Циклоалкил может быть возможно замещен одним, двумя, тремя или четырьмя заместителями, где каждый заместитель независимо представляет собой гидрокси, C1-6-алкил, С1-6-алкокси, атом галогена, амино, если особо не указано иное. Примеры циклоалкильных группировок включают возможно замещенный циклопропил, возможно замещенный циклобутил, возможно замещенный циклопентил и возможно замещенный циклогексил а также циклоалкильные группировки, проиллюстрированные на конкретных примерах в данном описании ниже.
Термин "4-7-членный гетероциклоалкил" означает одновалентную насыщенную группировку, состоящую из одного кольца, содержащего 4-7 кольцевых атомов, один, два или три из которых представляют собой гетероатомы, выбранные из азота, кислорода или серы, а остальные представляют собой атомы углерода. 4-7-членный гетероциклоалкил может быть возможно замещен одним, двумя, тремя или четырьмя заместителями, где каждый заместитель независимо представляет собой гидрокси, C1-6-алкил, C1-6-алкокси, С1-6-тиоалкил, галогено, C1-6-галогеноалкил, C1-6-гидроксиалкил, алкоксикарбонил, амино, C1-6-алкиламино, ди(С1-6)алкиламино, аминокарбонил или карбониламино, если особо не указано иное. Примеры гетероциклических группировок включают возможно замещенный оксетан, возможно замещенный тетрагидрофуранил, возможно замещенный пиперидинил, возможно замещенный пирролидинил, возможно замещенный морфолинил, возможно замещенный пиперазинил и тому подобное или гетероциклические группировки, которые проиллюстрированы на конкретных примерах, приведенных в данном описании, но не ограничены ими. Заместители могут быть выбраны из C1-6-алкила, C1-6-алкокси, C1-6-галогеноалкила, галогено, CN, ОН, NH2, а также из заместителей, которые проиллюстрированы на конкретных примерах в данном описании ниже.
Термин "5- или 6-членный гетероарил" означает ароматическое кольцо из 5 или 6 кольцевых атомов (в качестве членов кольца), содержащее один, два или три кольцевых гетероатома, выбранные из N, О или S, и атомы углерода (остальные кольцевые атомы). 5- или 6-членный гетероарил может быть возможно замещен одним, двумя, тремя или четырьмя заместителями, где каждый заместитель независимо представляет собой гидрокси, C1-6-алкил, C1-6-алкокси, C1-6-тиоалкил, галогено, C1-6-галогеноалкил, C1-6-гидроксиалкил, алкоксикарбонил, амино, C1-6-алкиламино, ди(С1-6)алкиламино, аминокарбонил или карбониламино, если особо не указано иное. Примеры гетероарильных группировок включают возможно замещенный имидазолил, возможно замещенный оксазолил, возможно замещенный тиазолил, возможно замещенный пирролил, возможно замещенный пиразинил, возможно замещенный пиридинил, возможно замещенный пиримидинил, возможно замещенный фуранил и гетероарильные группировки, которые проиллюстрированы на конкретных примерах, приведенных в данном описании, но не ограничены ими.
Термин "сульфониларил" означает арильную группу, такую, как определено в данном описании выше, которая присоединена через сульфонильную группу.
Термин "один или более чем один", когда он относится к R2 и R4, означает от одного до четырех остатков, которые могут быть независимо выбраны из нижеприведенных групп. Предпочтительно "один или более чем один" в данном контексте означает один или два остатка R2 и R4 соответственно, остальные представляют собой водород.
Выражение "два R2 вместе с индольным кольцом, к которому они присоединены, могут образовывать оксо- или диоксомостик " означает оксо- или диоксомостик следующих формул:


который связывает два соседних атома углерода фенильного или индольного кольца соединения формулы (I), с которыми связан каждый R2.
Примерами групп, иллюстрирующих выражение "R1 и R3 вместе с индольным кольцом, к которому они присоединены, образуют 5- или 6-членный гетероциклоалкил, который возможно замещен =О", являются:


Термин "фармацевтически приемлемые соли (присоединения) кислот" включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, паратолуолсульфоновая кислота, а также соли (присоединения) кислот, проиллюстрированные на конкретных примерах в данном описании ниже.
Конкретно, одно из воплощений настоящего изобретения относится к соединениям общей формулы (I):

где
А выбран из следующих групп (а), (b), (с), (d), (e) и (f):






Х могут являться одинаковыми или разными и представляют собой CRiiiRiv, NRiii или О, где в (а) только один Х может представлять собой О, а другой представляет собой CRiiiRiv или NRiii;
R1 представляет собой Н,
C1-6-алкил, возможно замещенный CN,
или представляет собой арил, 5- или 6-членный гетероарил или сульфониларил, которые возможно замещены одним или более чем одним В,
или представляет собой -(CH2)m-Ra, где Ra представляет собой:
ORi,
NRiRii,
С3-6-циклоалкил, 4-7-членный гетероциклоалкил, арил или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В,
или представляет собой -(CH2)n(CO)-Rb или -(CH2)n-(SO2)-Rb, где Rb представляет собой:
C1-6-алкил,
C1-6-алкокси,
С3-6-циклоалкил,
-(CH2)m-NRiiiRiv,
NRiRii,
С3-6-циклоалкил, 4-7-членный-гетероциклоалкил, арил, или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В,
или R1 и R3 вместе с индольным кольцом, к которому они присоединены, образуют 5- или 6-членный гетероциклоалкил, который может быть замещен (СО);
R2 представляет собой один или более чем один остаток, выбранный из Н, ОН, галогено, CN, нитро, C1-6-алкила, возможно замещенного -NRiiiRiv, C1-6-алкокси, -О-СН2-С2-6-алкенила, бензилокси,
или два R2 могут образовывать оксо- или диоксомостик вместе с индольным кольцом, к которому они присоединены;
R3 представляет собой Н,
или представляет собой галогено,
или представляет собой -(CO)-Rc, где Rc представляет собой:
C1-6-алкил,
-(CH2)n-NRiRii,
-(СН2)n-NRiiiRiv,
5- или 6-членный гетероциклоалкил, возможно замещенный C1-6-алкилом, или представляет собой C1-6-алкил или арил, которые возможно замещены
галогено,
-O(СО)-С1-6-алкилом
или -NH(СО)Rd, где Rd представляет собой C1-6-алкил, возможно замещенный галогено или нитро, или Rd представляет собой арил или 5-или 6-членный гетероарил, которые возможно замещены галогено, нитро, C1-6-алкилом или C1-6-галогеноалкилом;
R4 представляет собой один или более чем один остаток, выбранный из Н, галогено, C1-6алкила или C1-6алкокси, CN, или два R4 могут образовывать оксо- или диоксомостик вместе с фенильным кольцом, к которому они присоединены;
В представляет собой галогено, CN, NRiRii, C1-6-алкил, возможно замещенный CN, галогено или С1-6-алкокси, C1-6-алкокси, C1-6-галогеноалкокси, С3-6-циклоалкил, -С(O)О-С1-6-алкил, -C(O)NRiRii, -С(O)-С1-6-алкил, -S(O)2-С1-6-алкил, -S(O)2-NRiRii, (CRiiiRiv)n-фенил или (CRiiiRiv)n-5- или 6-членный гетероарил, где фенильная или 5- или 6-членная гетероарильная группировка возможно замещена одним или более чем одним заместителем, выбранным из группы, состоящей из:
галогено, CN, NRiRii, С1-6-алкила, возможно замещенного CN или C1-6-алкокси, C1-6-алкокси, C1-6-галогеноалкокси, С3-6-циклоалкила, -C(O)O-C1-6-алкила, -C(O)-NRiRii, -C(O)-C1-6-алкила, -S(O)2-С1-6-алкила, -S(O)2-NRiRii;
Ri и Rii представляют собой Н, С1-6-алкил, С1-6-алкил-NRiiiRiv, -(СО)O-С1-6-алкил, -C(O)-NRiiiRiv, -С(O)-С1-6-алкил, -S(O)2-С1-6-алкил или -S(O)2-NRiiiRiv;
Riii и Riv представляют собой Н или C1-6-алкил;
m имеет значение 1 до 6;
n имеет значение 0 до 4;
а также к их фармацевтически приемлемым солям.
В одном из воплощений изобретения А, X, R1-R4, Ra, Rb, Rc, Rd, В, Ri, Rii, m и n являются такими, как описано выше, и
Riii представляет собой Н, C1-6-алкил или С1-6-алкилен-N(Riv)2, и
Riv представляет собой Н или C1-6-алкил.
В некоторых воплощениях изобретения R1 выбран из группы, состоящей из Н,
C1-6-алкила, возможно замещенного CN,
или представляет собой арил или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В,
или представляет собой -(СН2)m-Ra, где Ra представляет собой:
4-7-членный гетероциклоалкил или арил, которые возможно замещены одним или более чем одним В,
или представляет собой -(CH2)n-(CO)-Rb, где Rb представляет собой:
C1-6-алкокси,
NRiRii,
4-7-членный гетероциклоалкил, арил или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В;
В представляет собой галогено, C1-6-алкил или фенил;
Ri и Rii независимо представляют собой Н или C1-6-алкил.
В некоторых воплощениях изобретения R2 представляет собой один или более чем один остаток, выбранный из группы, состоящей из Н, галогено, C1-6-алкила или C1-6-алкокси. Предпочтительно R2 находится в 5-й и/или 6-й позиции индола. Более предпочтительно, когда R2 представляет собой -ОМе в 5-й позиции; или F в 5-й позиции и Cl в 6-й позиции; или Me в 5-й позиции и Cl в 6-й позиции; или Н в 6-й позиции; или Cl в 6-й позиции индола. Еще более предпочтительно, когда R2 представляет собой Cl в 6-й позиции индола или Н в 6-й позиции индола. Наиболее предпочтительно, когда R2 представляет собой Cl в 6-й позиции индола.
В некоторых воплощениях изобретения R3 представляет собой атом водорода или C1-6-алкил.
Предпочтительно R4 представляет собой атом водорода.
Другое воплощение изобретения включает соединения формулы (I), такие, как приведено в данном описании, или их фармацевтически приемлемые соли при условии, что одновременно не все R1, R2 и R3 представляют собой Н.
Другое воплощение изобретения включает соединения формулы (I), такие, как приведено в данном описании, или их фармацевтически приемлемые соли, при условии, что одновременно не все R1, R2, R3 и R4 представляют собой Н.
В некоторых воплощениях изобретения группа (а) соединения формулы (I) выбрана из (а') и (а"):


где Riii представляет собой Н, С1-6-алкил или С1-6-алкилен-N(Riv)2 и Riv представляет собой Н или C1-6-алкил; предпочтительно Riii представляет собой Н или C1-6-алкил; наиболее предпочтительно Riii представляет собой Н.
Как можно видеть из определения А в соединениях формулы (I), указанные соединения формулы (I) включают следующие соединения формул (I-а), (I-b), (I-c), (I-d), (I-е) и (I-f):






где R1-R4 и X являются такими, как определено в данном описании выше применительно к формуле (I).
В одном из воплощений соединения по изобретению представляют собой те соединения формулы (I-а):

где
X могут являться одинаковыми или разными и представляют собой CRiiiRiv, NRiii или О, где только один Х может представлять собой О, а другой представляет собой CRiiiRiv или NRiii;
R1 представляет собой Н,
C1-6-алкил, возможно замещенный CN,
или представляет собой арил, возможно замещенный одним или более чем одним В,
или представляет собой -(CH2)m-Ra, где Ra представляет собой:
NRiRii,
арил, возможно замещенный одним или более чем оним В,
или представляет собой -(CH2)n-(CO)-Rb или -(CH2)n-(SO2)-Rb, где Rb представляет собой:
C1-6-алкокси,
NRiRii,
4-7-членный гетероциклоалкил, арил или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В,
R2 представляет собой один или более чем один остаток, выбранный из Н или галогено, например Cl,
R3 представляет собой Н
или представляет собой С1-6-алкил,
R4 представляет собой один или более чем один остаток, выбранный из Н, галогено, C1-6алкила или C1-6алкокси или CN;
В представляет собой галогено, CN, NRiRii, C1-6-алкил, возможно замещенный CN, галогено или C1-6-алкокси, C1-6-алкокси, C1-6-галогеноалкокси, С3-6-циклоалкил, -С(O)O-С1-6-алкил, -C(O)NRiRii, -С(O)-С1-6-алкил, -S(O)2-С1-6-алкил, -S(O)2-NRiRii, (CRiiiRiv)n-фенил или (CRiiiRiv)n-5- или 6-членный гетероарил, где фенильная или 5- или 6-членная гетероарильная группировка возможно замещена одним или более чем одним заместителем, выбранным из группы, состоящей из:
галогено, CN, NRiRii, C1-6-алкила, возможно замещенного CN или C1-6-алкокси, C1-6-алкокси, C1-6-галогеноалкокси, С3-6-циклоалкила, -C(O)O-C1-6-алкила, -C(O)-NRiRii, -С(O)-С1-6-алкила, -S(O)2-С1-6-алкила, -S(O)2-NRiRii;
Ri и Rii представляют собой Н, C1-6-алкил, С1-6-алкилен-NRiiiRiv, -(СО)O-С1-6-алкил, -C(О)-NRiiiRiv, -С(O)-С1-6-алкил, -S(O)2-С1-6-алкил или -S(O)2-NRiiiRiv;
Riii представляет собой Н, С1-6-алкил или С1-6-алкилен-N(Riv)2;
Riv представляет собой Н или C1-6-алкил;
m имеет значение 1 до 6;
n имеет значение 0 до 4;
а также их фармацевтически приемлемые соли.
В данном воплощении (а) предпочтительно выбран из (а') и (а").
В одном из воплощений соединения формулы (I-а) представляет собой те соединения, где R1 представляет собой Н, например следующие соединения:
1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
6'-бром-1-(1Н-индол-3-илкарбонил)-1Н-спиро[пиперидин-4,4'-хинолин]-2'(3'Н)-он;
6-хлор-1'-[(6-хлор-1Н-индол-3-ил)карбонил]-1-[2-(диметиламино)этил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он и
6-хлор-1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он.
В одном из воплощений соединения формулы (I-а) представляет собой те соединения, где R1 представляет собой арил, возможно замещенный одним или более чем одним В, и В является таким, как определено здесь выше в описании формулы (I-а), например следующее соединение: 1'-{[6-хлор-1-(3,5-дифторфенил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он.
В одном из воплощений соединения формулы (I-а) представляют собой те соединения, где R1 представляет собой -(СН2)m-Ra, где Rа представляет собой CN, NRiRii или арил, возможно замещенный одним или более чем одним В, и m, Ri, Rii и В являются такими, как определено здесь выше в описании формулы (I-а), например следующие соединения:
1'-{[6-хлор-1-(3,5-дифторбензил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-{[6-хлор-1-(3-фторбензил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
3-{6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}пропаннитрил и
2-{6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}пропаннитрил.
В одном из воплощений соединения формулы (I-а) представляют собой те соединения, где R1 представляет собой -(CH2)n-(CO)-Rb или -(CH2)n-(SO2)-Rb, где Rb представляет собой C1-6-алкокси, NRiRii, 4-7-членный гетероциклоалкил, арил или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В, и n, Ri, Rii и В являются такими, как определено здесь выше в описании формулы (I-а), например следующие соединения:
1'-{[6-хлор-1-(3-фторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-{[6-хлор-1-(2-фторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-{[6-хлор-1-(2,3-дифторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-({6-хлор-1-[(3,5-дифторфенил)сульфонил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-({6-хлор-1-[2-(3-фторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-({6-хлор-1-[2-(3,4-дифторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-{[1-(бифенил-3-илкарбонил)-6-хлор-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-{[6-хлор-1-(2-оксо-2-пиперидин-1-илэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-{[6-хлор-1-(2-морфолин-4-ил-2-оксоэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
2-{6-хлор-3-[(2-оксо-1,2-дигидро-1Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1-ил)карбонил]-1Н-индол-1-ил}-N,N-диметилацетамид;
2-{6-хлор-3-[(2-оксо-1,2-дигидро-1Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1-ил)карбонил]-1Н-индол-1-ил}-N,N-диэтилацетамид;
1'-{[6-хлор-1-(пиперидин-1-илкарбонил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
трет-бутил {6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}ацетат;
1'-{[6-хлор-1-(3,5-дифторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-({6-хлор-1-[2-(3,5-дифторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-({6-хлор-1-[2-(2-фторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он;
1'-{[6-хлор-1-(2-оксо-2-пиридин-2-илэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он и
1''-({6-хлор-1-[2-(5-метил-2-фенил-1,3-оксазол-4-ил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он.
В соединениях формулы (I-а), независимо от определений R1-R4, один Х может представлять собой NH, а другой О.
В одном из воплощений изобретения формула (I) включает соединения формулы (I-b), где Х и R1-R4 являются такими, как определено выше, предпочтительно
Х представляет собой NH;
R1 представляет собой Н,
C1-6-алкил, возможно замещенный CN,
или представляет собой арил или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В,
или представляет собой -(CH2)m-Ra, где Ra представляет собой:
4-7-членный гетероциклоалкил или арил, которые возможно замещены одним или более чем одним В,
или представляет собой -(CH2)n-(CO)-Rb, где Rb представляет собой:
C1-6-алкокси,
NRiRii,
4-7-членный гетероциклоалкил, арил или 5- или 6-членный гетероарил, которые возможно замещены одним или более чем одним В;
В представляет собой галогено, C1-6-алкил или фенил;
Ri и Rii независимо представляют собой Н или C1-6-алкил;
более предпочтительно R1 представляет собой -(CH2)n-(CO)-Rb, где Rb представляет собой NRiRii и Ri и Rii независимо представляют собой Н или C1-6-алкил.
R2 представляет собой Н или галогено;
R3 представляет собой Н;
R4 представляет собой Н.
Примером соединения формулы (I-b) является 2-{6-хлор-3-[(1-оксо-2,3-дигидро-1Н,1'Н-спиро[изохинолин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}-N-метилацетамид.
Изобретение также включает соединения формулы (I), (I-a), (I-b), (I-е), (I-d), (I-е) или (I-f) для применения в предупреждении или лечении дисменорреи, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, цирроза печени, нефротического синдрома, обсессивно-компульсивного расстройства, тревожных и депрессивных расстройств.
Изобретение также включает фармацевтическую композицию, содержащую соединение формулы (I), (I-a), (I-b), (I-е), (I-d), (I-е) или (I-f), которая является полезной при дисменоррее, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, циррозе печени, нефротическом синдроме, обсессивно-компульсивном расстройстве, тревожных и депрессивных расстройствах.
Изобретение дополнительно включает применение соединения формулы (I), (I-a), (I-b), (I-е), (I-d), (I-е) или (I-f) в приготовлении лекарства, которое является полезным при дисменоррее, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, циррозе печени, нефротическом синдроме, обсессивно-компульсивном расстройстве, тревожных и депрессивных расстройствах.
В одном из воплощений соединения формулы (I) по изобретению, где R1представляет собой Н, могут быть получены в соответствии со способом, включающим стадию взаимодействия соединения формулы (II-а):

с соединением формулы А-Н с получением соединения формулы (I), где R1представляет собой Н и А, R2 и R3 являются такими, как определено в данном описании выше.
В другом воплощении соединения формулы (I) по изобретению могут быть получены в соответствии со способом, включающим стадию взаимодействия соединения формулы (I-1):

с электрофильным соединением формулы R1-Z с получением соединения формулы (I), где A, R1, R2 и R3 являются такими, как определено в данном описании выше, и Z представляет собой галогено, предпочтительно Br или Cl.
В еще одном воплощении соединения формулы (I) по изобретению могут быть получены в соответствии со способом, включающим стадию взаимодействия соединения формулы (II-b):

с соединением формулы А-Н с получением соединения формулы (I), где R1, R2, R3 и А являются такими, как определено в данном описании выше.
Получение соединений по изобретению формул (I), (I-a), (I-b), (I-е), (I-d), (I-е) и (I-f) более подробно описано на нижеприведенных общих схемах А, Б и В, где R1, R2, R3 и А являются такими, как определено в данном описании выше.
Общая схема А

Общая методика А
Соединения формулы (I-1) (соединения формулы (I), где R1 представляет собой Н) могут быть получены путем синтеза амида из индол-3-карбоновой кислоты (II-а) и спиропиперидина (А-Н), смотри, например, общую методику синтеза амида, приведенную в данном описании ниже. Индол-3-карбоновые кислоты (II-а) либо имеются в продаже, либо легко могут быть получены с использованием методики, описанной в J. Med. Chem. 1991, 34, 140. Альтернативно соединеия (II-a) могут быть получены в соответствии со схемой В. Производные спиропиперидина А-Н либо имеются в продаже, либо могут быть получены с использованием опубликованных методик, либо могут быть получены с использованием методик, приведенных в данном описании ниже в примерах.
Общая схема Б

Общая методика Б
Соединения формулы (I), где R1 отличается от Н, могут быть получены путем алкилирования индольного производного (I-1) электрофилом R1-Z, где Z представляет собой галогено, (имеется в продаже) с использованием стандартных методик. Производные (I-1) получают с использованием методики, приведенной на общей схеме А.
Общая схема В

Общая методика В
В результате обработки индола (III) трифторуксусным ангидридом получают соединение (IV), которое может быть гидролизовано с получением соответствующей индол-3-карбоновой кислоты (II-а). Альтернативно соединение (IV) можно дополнительно превратить в соединение (V) путем взаимодействия с реагентом R1-Z, где Z представляет собой галогено, с использованием общеизвестной методики. В результате гидролиза соединения (V) получают соединение (II-b), из которого путем стандартного синтеза амида с использованием А-Н получают производные (I).
Общие схемы и соответствующие методики, представленные в данном описании выше, дополнительно проиллюстрированы нижеприведенными примерами получения соединений по изобретению.
Результаты: V1a-активность
Материалы и Методики
V1a-рецептор человека клонировали путем ОТ-ПЦР (полимеразной цепной реакции с участием обратной транскриптазы) из суммарной РНК печени человека. После секвенирования, подтверждающего идентичность амплифицированной последовательности, кодирующую последовательность субклонировали в экспрессирующий вектор. Для доказательства аффинности соединений по настоящему изобретению к V1a-рецептору человека выполняли анализ связывания. Клеточные мембраны получали из клеток HEK293, временно трансфицированных полученным экспрессирующим вектором и выращенных в 20-литровом ферментаторе в соответствии со следующим протоколом.
50 г клеток ресуспендируют в 30 мл свежеприготовленного и охлажденного до 0°С буфера для лизиса (50 мМ HEPES (гидроксиэтилпиперазин-N'-2-этансульфоновая кислота), 1 мМ ЭДТА (этилендиаминтетраацетат), 10 мМ MgCl2 (рН доведен до рН 7,4)+ полная смесь ингибиротов протеаз (Roche Diagnostics)). Гомогенизируют с помощью POLYTRON в течение 1 мин и разрушают ультразвуком на льду 2×2 мин при интенсивности 80% (ультразвуковой аппарат Vibracell). Данный препарат центрифугируют 20 мин при 500 g при 4°С, осадок удаляют и супернатант центрифугируют 1 час при 43000 g при 4°С (19000 об/мин). Осадок ресуспендируют в смеси 12,5 мл буфера для лизиса +12,5 мл 20% сахарозы и гомогенизируют с использованием POLYTRON в течение 1-2 мин. Концентрацию белка определяют методом Бредфорда и до использования аликвоты хранят при -80°С. Для анализа связывания 60 мг SPA-шариков с ядром из силиката иттрия (Amersham) смешивают с аликвотой мембран в буфере для связывания (50 мМ Трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 10 мМ MgCl2 в течение 15 минут при перемешивании. Затем в каждую лунку 96-луночного планшета добавляют по 50 мкл смеси шариков/мембран и затем по 50 мкл 4 нМ 3Н-вазопрессина (American Radiolabeled Chemicals). Для измерения общего связывания в соответствующие лунки добавляют 100 мкл буфера для связывания, для измерения неспецифического связывания - 100 мкл 8,4 мМ холодного вазопрессина и для измерения связывания исследуемых соединений - 100 мкл из последовательных разведений каждого соединения в 2% ДМСО (диметилсульфоксиде). Планшет инкубируют 1 ч при комнатной температуре, центрифугируют 1 мин при 1000 g и подсчитывают на счетчике Packard Top-Count. Из значений, полученных для каждой лунки, вычитают значение неспецифического связывания и полученные значения нормируют на значение максимального специфического связывания, принятое за 100%. Значение ИК50 (концентрации, требуемой для 50% ингибирования связывания) рассчитывают путем подгонки кривой с использованием модели нелинейной регрессии (XLfit), и значение Ki рассчитывают с использованием уравнения Cheng-Prussoff.
Соединения формулы (I), а также их фармацевтически приемлемые соли присоединения кислот можно применять в качестве лекарств, например, в форме фармацевтических препаратов. Данные фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение также можно выполнять ректально, например, в форме суппозиториев, или парентерально, например, в форме инъекционных растворов.
Изготовление таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул может включать обработку соединений формулы (I) и их фармацевтически приемлемых солей присоединения кислот вместе с фармацевтически инертными, неорганическими или органическими эксципиентами. В качестве таких эксципиентов, например, для таблеток, драже и твердых желатиновых капсул могут быть использованы лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и так далее.
Эксципиентами, подходящими для мягких желатиновых капсул, являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и так далее.
Эксципиентами, подходящими для изготовления растворов и сиропов, являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и так далее.
Эксципиентами, подходящими для инъекционных растворов, являются, например, вода, спирты, полиолы, глицерин, растительные масла и так далее.
Эксципиентами, подходящими для суппозиториев, являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и так далее.
Кроме того, данные фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красящие вещества, корригенты, соли для изменения осмотического давления, буферные агенты, маскирующие агенты или антиоксиданты. Они также могут дополнительно содержать другие терапевтически полезные вещества.
Доза может меняться в широких пределах и в каждом конкретном случае, конечно, соответствует индивидуальным требованиям. Обычно в случае перорального введения подходящая суточная доза для человека должна составлять приблизительно от 10 до 1000 мг соединения общей формулы (I), хотя при необходимости вышеупомянутый верхний предел может быть также превышен.
Настоящее изобретение проиллюстрировано следующими не ограничивающими его примерами. Все значения температуры приведены в градусах Цельсия.
Пример А
Таблетки, имеющие следующую композицию, изготавливают обычным способом:
Пример Б
Изготовление капсул, имеющих следующую композицию:
Активное вещество, лактозу и кукурузный крахмал сначала смешивают в смесителе и затем в измельчителе. Смесь снова переносят в смеситель, к ней добавляют тальк и тщательно перемешивают. Данной смесью с помощью специального устройства наполняют твердые желатиновые капсулы.
Пример В
Изготовление суппозиториев, имеющих следующую композицию:
Массу для суппозиториев плавят в стеклянном или стальном сосуде, тщательно перемешивают и охлаждают до 45°С. Затем к этой смеси добавляют тонкоизмельченное активное вещество и перемешивают до тех пор, пока оно не будет полностью диспергировано. Данную смесь заливают в формы для суппозиториев подходящего размера, оставляют охлаждаться, затем суппозитории извлекают из форм и по отдельности упаковывают в вощеную бумагу или металлическую фольгу.
ПРИМЕРЫ
Примеры соединений формулы (I-1)
Общая методика синтеза амида
К перемешиваемому раствору производного индол-3-карбоновой кислоты (1 ммоль) в 10 мл CH2Cl2 добавляли (1,3 ммоль) EDC (этилдиметиламинопропилкарбодиимид), (1,3 ммоль) HOBt, (1,3 ммоль) Et3N и (1 ммоль) производное амина. Данную смесь перемешивали в течение ночи при комнатной температуре и затем вливали в воду и экстрагировали CH2Cl2. Объединенные органические фазы сушили над Na2SO4 и концентрировали под вакуумом. После флэш-хроматографии или препаративной ЖХВД получали указанное в заголовке соединение.
Там, где в примерах указаны ссылки, пример выполняли с использованием условий и исходного вещества, указанного в перечне реагентов, которые приведены в ссылке. Все методики, приводимые в таких ссылках, хорошо известны средним специалистам в данной области техники. Все журнальные ссылки, цитированные в данном описании, включены посредством ссылки.
Пример 1
1'-[(6-Хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

Синтез амида: - Амин: спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он (J. Med. Chem., 1983, 26(5), 657)
- Кислота: 6-хлор-1Н-индол-3-карбоновая кислота
ES-MS (масс-спектрометрия с электрораспылением) масса/заряд (%): 396,1 (M+H+).
6-Хлор-1Н-индол-3-карбоновая кислота
С использованием методики, описанной в J. Med. Chem. 1991, 34, 140, из 7,0 г (0,046 ммоль) 6-хлор-1Н-индола получали 5,80 г (64%) 6-хлор-1Н-индол-3-карбоновой кислоты в виде светло-коричневого твердого вещества. ES-MS масса/заряд (%): 194 (M-H+).
Пример 2
6'-Бром-1-(1Н-индол-3-илкарбонил)-1'Н-спиро[пиперидин-4,4'-хинолин]-2'(3'Н)-он

Синтез амида: - Амин: 6'-бром-1'Н-спиро[пиперидин-4,4'-хинолин]-2'(3'Н)-он
- Кислота: 1Н-индол-3-карбоновая кислота (коммерческий реактив) ES-MS масса/заряд (%): 439,1 (M+H+).
6'-Бром-1'Н-спиро[пиперидин-4,4'-хинолин']-2'(3'Н)-он
Перемешиваемый раствор 1'Н-спиро[пиперидин-4,4'-хинолин]-2'(3'Н)-она (описан в US 6013652) обрабатывали твердым бикарбонатом натрия (7 г), ди-трет-бутил-пирокарбонатом (7,2 г) в 250 мл метиленхлорида и перемешивали в течение 2 часов при температуре окружающей среды. Органический слой отделяли и водную часть промывали метиленхлоридом (2×50 мл). Объединенные органический экстракт и органические фракции, полученные при промывке, промывали рассолом, сушили (безводным Na2SO4), концентрировали под вакуумом с получением пенистого вещества, которое хроматографировали на силикагеле (1:3 этилацетат-гексан, затем 1:1 этилацетат-гексан) с получением 1'-(трет-бутилоксикарбонил)спиро(тетрагидрохинол-2-он)-4'-пиперидина в виде кремообразного белого твердого вещества, т.пл. (температура плавления) 198°С; ГХ-МС (ЭИ) (газовая хроматография/масс-спектрометрия с электронной ионизацией) масса/заряд: 316.
Раствор данного соединения (10 г, 31,6 ммоль) в сухом ацетонитриле (250 мл) охлаждали до -10°С и порциями при перемешивании добавляли N-бромсукцинимид (5,62 г, 31,6 ммоль). Данную реакционную смесь перемешивали в течение 1 ч при -10°С, 2 ч при 0°С и затем в течение 24 ч при температуре окружающей среды. Растворитель удаляли и остаток растворяли в метиленхлориде (500 мл), органический экстракт промывали смесью рассол-вода (1:1) (3×50 мл), сушили (безводным Na2SO4), концентрировали под вакуумом с получением кремообразного белого твердого вещества, которое хроматографировали на силикагеле (1:3 этилацетат-гексан, затем 1:1 этилацетат-гексан) с получением 6-бром-1'-(трет-бутилоксикарбонил)спиро(тетрагидрохинол-2-он)-4'-пиперидина (11,8 г, 94%) в виде белого твердого вещества; т.пл. 226°С; ГХ-МС (ЭИ) масса/заряд (М-100): 294.
Через метанол (750 мл), содержащий данное соединение (10 г, 25,3 ммоль), пропускали сухой HCl в течение 10 часов и перемешивание продолжали в течение ночи. Реакционную смесь нейтрализовали водным аммиаком (75 мл) при 0°С. Метанол и избыток аммиака удаляли под вакуумом и остаток растворяли в метиленхлориде (500 мл), затем добавляли 25 мл водного аммиака для растворения оставшегося твердого вещества. Органический слой отделяли и водную часть промывали/экстрагировали метиленхлоридом (3×150 мл), сушили (безводным Na2SO4), концентрировали под вакуумом с получением указанного в заголовке соединения в виде кремообразного белого твердого вещества (7,0 г, 94%); т.пл. 218°С; ГХ-МС (ЭИ) масса/заряд: 294.
Пример 3
6-Хлор-1-[(6-хлор-1'Н-индол-3-ил)карбонил]-1-[2-(диметиламино)этил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

Синтез амида: - Амин: 6-хлор-1-[2-(диметиламино)этил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он (описан ниже)
- Кислота: 6-хлор-1Н-индол-3-карбоновая кислота (описана в примере 2)
ES-MS масса/заряд (%): 501,2 (M+H+).
6-Хлор-1-[2-(диметиламино)этил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он
К раствору 0,100 г (0,283 ммоль) трет-бутил 6-хлор-2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-карбоксилата (описанного в WO 0122919 А2 и полученного также с помощью методики, описанной в J. Med. Chem., 1983, 26(5), 657, с использованием в качестве исходного вещества 4-хлоранилина) в 7 мл ТГФ добавляли 0,025 г (0,566 ммоль) NaH. После выдерживания в течение 30 минут при комнатной температуре добавляли 0,063 г (0,566 ммоль) (2-хлор-этил)-диметил-амина. Данную реакционную смесь перемешивали при 60°С в течение ночи, затем вливали в водный раствор NH4Cl и дважды экстрагировали EtOAc. Объединенные органические фазы сушили над Na2SO4 и концентрировали под вакуумом с получением 60 мг белого твердого вещества. Затем это неочищенное вещество растворяли в 5 мл CH2Cl2 и добавляли 1 мл ТФУ. После выдерживания в течение 2 часов при комнатной температуре растворитель удаляли под вакуумом и полученное масло переносили в CH2Cl2 и промывали водным раствором NaHCO3. Органическую фазу сушили над Na2SO4 и концентрировали под вакуумом с получением 6-хлор-1-[2-(диметиламино)этил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она в виде белого твердого вещества.
Пример 4
6-Хлор-1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

Синтез амида: - Амин: 6-хлорспиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он (описан в WO 0122919 А2 и получен также с помощью методики, описанной в J. Med. Chem., 1983, 26(5), 657, с использованием в качестве исходного вещества 4-хлор-анилина)
- Кислота: 6-хлор-1Н-индол-3-карбоновая кислота (описана в примере 2)
ES-MS масса/заряд (%): 431,4 (M+H+).
Пример 5
1'-{[6-Хлор-1-(3,5-дифторфенил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

Синтез амида: - Амин: спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он (J. Med. Chem., 1983, 26(5), 657)
- Кислота: 6-хлор-1-(3,5-дифторфенил)-1Н-индол-3-карбоновая кислота
ES-MS масса/заряд (%): 508,0 (M+H+).
6-Хлор-1-(3,5-дифторфенил)-1Н-индол-3-карбоновая кислота
К раствору 200 мг (0,807 ммоль) 1-(6-хлор-1Н-индол-3-ил)-2,2,2-трифтор-этанона (полученного из 6-хлор-индола и трифторуксусного ангидрида в соответствии с тем, как описано в US 2004067939 А1) в 8 мл CH2Cl2 добавляли 293 мг (1,615 ммоль) Cu(ОАс)2, 0,26 мл (3,23 ммоль) пиридина и 383 мг (2,42 ммоль) 3,5-дифторфенилборной кислоты. Данную реакционную смесь перемешивали при комнатной температуре в течение ночи, фильтровали через декалит и концентрировали под вакуумом. В результате колоночной хроматографии на силикагеле (гексан, затем 1:9 этилацетат-гексан) получали 206 мг (71%) 1-[6-хлор-1-(3,5-дифторфенил)-1Н-индол-3-ил]-2,2,2-трифтор-этанона в виде светло-коричневого твердого вещества. К суспензии данного соединения в 10 мл Н2О добавляли 1,2 г NaOH. Эту реакционную смесь перемешивали при 70°С в течение 2 суток, охлаждали до комнатной температуры и подкисляли водной HCl (1 н.) до рН 1. Данный продукт экстрагировали CH2Cl2 и органическую фазу сушили над Na2SO4. В результате выпаривания растворителя под вакуумом получали 120 мг (70%) 6-хлор-1-(3,5-дифтор-фенил)-1Н-индол-3-карбоновой кислоты в виде белого твердого вещества.
Пример 6
1'-{[6-Хлор-1-(3-фторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

К раствору 100 мг (0,252 ммоль) 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) в сухом ДМФА (5 мл) добавляли 10 мг NaH (0,25 ммоль, 60% в масле). После выдерживания в течение 15 минут при комнатной температуре добавляли 43,9 мг (0,277 ммоль) 3-фтор-бензоилхлорида и перемешивание продолжали в течение ночи. Реакционную смесь вливали в водный раствор хлорида аммония и данный продукт дважды экстрагировали этилацетатом. Объединенные органические фазы сушили над Na2SO4, и растворитель выпаривали при пониженном давлении. В результате очистки путем препаративной ЖХВД получали 1'-{[6-хлор-1-(3-фторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он.
ES-MS масса/заряд (%): 518,4 (M+H+).
Пример 7
1'-{[6-Хлор-1-(2-фторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(2-фторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил) карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-фтор-бензоилхлорида с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 518,4 (M+H+).
Пример 8
1'-{[6-Хлор-1-(2,3-дифторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(2,3-дифторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2,3-дифтор-бензоилхлорида с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 536,4 (М+H+).
Пример 9
1'-({6-Хлор-1-[(3,5-дифторфенил)сульфонил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1-({6-Хлор-1-[(3,5-дифторфенил)сульфонил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 3,5-дифтор-бензолсульфонилхлорида с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 572,3 (M+H+).
Пример 10
1'-{[6-Хлор-1-(3,5-дифторбензил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(3,5-дифторбензил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 1-бромметил-3,5-дифторбензола с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 522,4 (M+H+).
Пример 11
1'-{[6-Хлор-1-(3-фторбензил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-5-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(3-фторбензил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 1-бромметил-3,5-дифтор-бензола с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 504,4 (М+Н+).
Пример 12
1'-({6-Хлор-1-[2-(3-фторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-({6-Хлор-1-[2-(3-фторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-бром-1-(3-фтор-фенил)-этанона с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 532,4 (М+Н+).
Пример 13
1'-({6-Хлор-1-[2-(3,4-дифторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-({6-Хлор-1-[2-(3,4-дифторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-бром-1-(3,4-дифторфенил)-этанона с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 550,4 (M+H+).
Пример 14
1'-{[1-(Бифенил-3-илкарбонил)-6-хлор-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[1-(Бифенил-3-илкарбонил)-6-хлор-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и бифенил-3-карбонилхлорида с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 576,4 (M+H+).
Пример 15
1'-{[6-Хлор-1-(2-оксо-2-пиперидин-1-илэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(2-оксо-2-пиперидин-1-илэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-хлор-1-пиперидин-1-ил-этанона с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 521,1 (М+Н+).
Пример 16
1'-{[6-Хлор-1-(2-морфолин-4-ил-2-оксоэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(2-морфолин-4-ил-2-оксоэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-хлор-1-морфолин-4-ил-этанона с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 523,2 (M+H+).
Пример 17
2-{6-Хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}-N,N-диметилацетамид

2-{6-Хлор-3-[(2-оксо-1,2-дигидро-1Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}-N,N-диметилацетамид получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-хлор-N,N-диметил-ацетамида с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 481,0 (M+H+).
Пример 18
2-{6-Хлор-3-[(2-оксо-1,2-дигидро-1Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}-N,N-диэтилацетамид

2-{6-Хлор-3-[(2-оксо-1,2-дигидро-1Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}-N,N-диэтилацетамид получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-хлор-N,N-диэтил-ацетамида с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 509,1 (М+Н+).
Пример 19
1'-{[6-Хлор-1-(пиперидин-1-илкарбонил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(пиперидин-1-илкарбонил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и пиперидин-1-карбонилхлорида с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 507,1 (M+Н+).
Пример 20
трет-Бутил{6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}ацетат
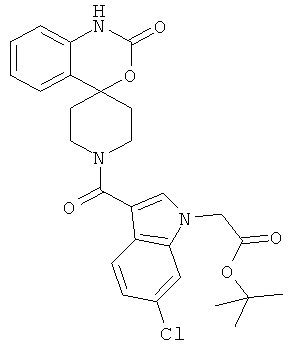
трет-Бутил{6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}ацетат получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и бром-уксусной кислоты трет-бутилового эфира с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 510,5 (M+Н+).
Пример 21
1'-{[6-Хлор-1-(3,5-дифторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(3,5-дифторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 3,5-дифторбензоилхлорида с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 536,3 (М+H+).
Пример 22
1'-({6-Хлор-1-[2-(3,5-дифторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-({6-Хлор-1-[2-(3,5-дифторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-бром-1-(3,5-дифторфенил)-этанона с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 550,3 (М+Н+).
Пример 23
1'-({6-Хлор-1-[2-(2-фторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-({6-Хлор-1-[2-(2-фторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-бром-1-(2-фторфенил)-этанона с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 532,3 (М+Н').
Пример 24
3-{6-Хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}пропаннитрил

3-{6-Хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}пропаннитрил получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 3-хлор-пропионитрила с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 449,0 (M+H+).
Пример 25
2-{6-Хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}пропаннитрил

2-{6-Хлор-3-[(2-оксо-1,2-дигидро-1Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}пропаннитрил получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-хлор-пропионитрила с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 449,0 (M+H+).
Пример 26
1'-{[6-Хлор-1-(2-оксо-2-пиридин-2-илэтил)-1Н-индол-3-ил]карбонил}спиро[3,1бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-{[6-Хлор-1-(2-оксо-2-пиридин-2-илэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-бром-1-пиридин-2-ил-этанона с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 515,4 (M+H+).
Пример 27
1'-({6-Хлор-1-[2-(5-метил-2-фенил-1,3-оксазол-4-ил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он

1'-({6-Хлор-1-[2-(5-метил-2-фенил-1,3-оксазол-4-ил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-он получали из 1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она (описанного в примере 1) и 2-бром-1-(5-метил-2-фенил-оксазол-4-ил)-этанона (описанного в J. Med. Chem. 1992, 35(14), 2617) с использованием методики, описанной в примере 6.
ES-MS масса/заряд (%): 595,0 (М+H+).
Пример 28
2-{6-Хлор-3-[(1-оксо-2,3-дигидро-1Н,1'Н-спиро[изохинолин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}-N-метилацетамид

К перемешиваемому раствору 6-хлор-1-метилкарбамоилметил-1Н-индол-3-карбоновой кислоты (описана ниже) (1 экв.) в ДМФА добавляли HATU (2-(7-аза-1Н-бензотриазол-1-yl)-1,1,3,3-тетраметилурония гексафторфосфат) (1,1 экв.), Et3N (2 экв.) и (2 экв.) 2,3-дигидро-1Н-спиро[изохинолин-4,4'-пиперидин]-1-она (описан ранее в WO 9909984). Данную смесь перемешивали в течение ночи при комнатной температуре и затем вливали в воду и экстрагировали CH2Cl2. Объединенные органические фазы сушили над Na2SO4 и концентрировали под вакуумом. В результате препаративной ЖХВД получали указанное в заголовке соединение. ES-MS масса/заряд (%): 465,3 (М+H+).
6-Хлор-1-метилкарбамоилметил-1Н-индол-3-карбоновая кислота
а) 2-[6-Хлор-3-(2,2,2-трифторацетил)-индол-1-ил]-N-метил-ацетамид
К перемешиваемому раствору 1-(6-хлор-1Н-индол-3-ил)-2,2,2-трифтор-этанона (описан ранее в US 2004067939) в ДМФА добавляли 2,1 экв. NaH (60%, в масле). Данную смесь перемешивали при комнатной температуре в течение 30 мин и затем добавляли (имеющийся в продаже) 2-хлор-N-метил-ацетамид (1,1 экв.). Эту смесь перемешивали дополнительно в течение 14 часов при 60°С и затем вливали в воду и экстрагировали этилацетатом. Объединенные органические фазы сушили над Na2SO4 и концентрировали под вакуумом. В результате очистки путем препаративной ЖХВД получали указанное в заголовке соединение.
ES-MS масса/заряд (%): 319,3 (M+H+).
б) 6-Хлор-1-метилкарбамоилметил-1Н-индол-3-карбоновая кислота
2-[6-Хлор-3-(2,2,2-трифтор-ацетил)-индол-1-ил]-N-метил-ацетамид суспендировали в DCE и обрабатывали (2,2 экв.) триметилсиланолатом натрия. После взбалтывания при комнатной температуре в течение 20 мин смесь концентрировали под вакуумом и очищали путем препаративной ЖХВД с получением указанного в заголовке соединения.
ES-MS масса/заряд (%): 265,0 (M-H+).
Реферат
Данное изобретение относится к индол-3-ил-карбонил-спиропиперидиновым производным, которые действуют в качестве антагонистов V1a-рецептора и которые представлены Формулой I: ! ! где головная спиропиперидиновая группа А и остатки R1, R2 и R3 являются такими, как определено в формуле изобретения. Изобретение дополнительно относится к фармацевтическим композициям, содержащим такие соединения, их применению в лекарствах, полезных при дисменоррее, гипертензии, хронической сердечной недостаточности, неадекватной секреции вазопрессина, циррозе печени, нефротическом синдроме, обсессивно-компульсивном расстройстве, тревожных и депрессивных расстройствах. 3 н. и 19 з.п. ф-лы.
Формула

где А выбран из следующих групп (а), (b), (е) и (f):




Х могут являться одинаковыми или разными и представляют собой CRiiiRiv, NRiii или О, где в (а) только один Х может представлять собой О, а другой представляет собой CRiiiRiv или NRiii;
R1 представляет собой Н,
С1-6-алкил, возможно замещенный группой CN,
или представляет собой фенил, который возможно замещен одним или более чем одним В,
или представляет собой -(СН2)m-Ra, где Ra представляет собой:
NRiRii,
фенил, который возможно замещен одним или более чем одним В,
или представляет собой -(CH2)n-(CO)-Rb или -(CH2)n-(SO2)-Rb, где Rbпредставляет собой:
С1-6-алкокси,
NRiRii,
фенил или пиперидинил, морфолинил, пиридинил, 1,3-оксазолил, которые возможно замещены одним или более чем одним В,
R2 представляет собой Н или галогено,
R3 представляет собой Н,
R4 представляет собой один или более чем один остаток, выбранный из Н, галогено, С1-6-алкокси,
В представляет собой галогено, С1-6-алкил, (CRiiiRiv)n-фенил,
Ri и Rii представляют собой Н, C1-6-алкил, -(СО)O-С1-6-алкил,
Riii представляет собой Н, С1-6-алкил или С1-6-алкилен-N(Riv)2;
Riv представляет собой Н или C1-6-алкил;
m имеет значение 1, 2;
n имеет значение 0, 1;
а также их фармацевтически приемлемые соли.
R2 представляет собой Н или галогено, и
Riii и Riv представляют собой Н или C1-6-алкил.

где Х могут являться одинаковыми или разными и представляют собой CRiiiRiv, NRiii или О, где только один Х может представлять собой О, а другой представляет собой CRiiiRiv или NRiii;
R1 представляет собой Н,
C1-6-алкил, возможно замещенный CN,
или фенил, возможно замещенный одним или более чем одним В,
или представляет собой -(СН2)m-Ra, где Ra представляет собой:
NRiRii,
фенил, возможно замещенный одним или более чем оним В,
или представляет собой -(CH2)n-(СО)-Rb или -(CH2)n-(SO2)-Rb, где Rbпредставляет собой:
С1-6-алкокси,
NRiRii,
фенил или пиперидинил, морфолинил, пиридинил, 1,3-оксазолил, которые возможно замещены одним или более чем одним В,
R2 представляет собой Н или галогено,
R3 представляет собой Н,
R4 представляет собой один или более чем один остаток, выбранный из Н, галогено, C1-6 алкокси;
В представляет собой галогено, C1-6-алкил, (CRiiiRiv)n-фенил,
Ri и Rii представляют собой Н, С1-6-алкил, -(СО)O-С1-6-алкил,
Riii представляет собой Н, C1-6-алкил или С1-6-алкилен-N(Riv)2;
Riv представляет собой Н или С1-6-алкил;
m имеет значение 1, 2;
n имеет значение 0,1;
а также его фармацевтически приемлемые соли.


где Riii представляет собой Н, C1-6-алкил или С1-6-алкилен-N(Riv)2 и Riv представляет собой Н или С1-6-алкил.
1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
6'-бром-1-(1H-индол-3-илкарбонил)-1'Н-спиро[пиперидин-4,4'-хинолин]2'(3'H)-она;
6-хлор-1'-[(6-хлор-1Н-индол-3-ил)карбонил]-1-[2-(диметиламино)этил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она и
6-хлор-1'-[(6-хлор-1Н-индол-3-ил)карбонил]спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она.
1'-{[6-хлор-1-(3,5-дифторбензил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-{[6-хлор-1-(3-фторбензил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
3-{6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}пропаннитрила и
2-{6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}пропаннитрила.
1'-{[6-хлор-1-(3-фторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-{[6-хлор-1-(2-фторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-{[6-хлор-1-(2,3-дифторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-({6-хлор-1-[(3,5-дифторфенил)сульфонил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-({6-хлор-1-[2-(3-фторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-({6-хлор-1-[2-(3,4-дифторфенил)-2-оксоэтил]-1H-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-{[1-(бифенил-3-илкарбонил)-6-хлор-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-{[6-хлор-1-(2-оксо-2-пиперидин-1-илэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-{[6-хлор-1-(2-морфолин-4-ил-2-оксоэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
2-{6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}-N,N-диметилацетамида;
2-{6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}-N,N-диэтилацетамида;
1'-{[6-хлор-1-(пиперидин-1-илкарбонил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
трет-бутил {6-хлор-3-[(2-оксо-1,2-дигидро-1'Н-спиро[3,1-бензоксазин-4,4'-пиперидин]-1'-ил)карбонил]-1Н-индол-1-ил}ацетата;
1'-{[6-хлор-1-(3,5-дифторбензоил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-({6-хлор-1-[2-(3,5-дифторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-({6-хлор-1-[2-(2-фторфенил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она;
1'-{[6-хлор-1-(2-оксо-2-пиридин-2-илэтил)-1Н-индол-3-ил]карбонил}спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она и
1'-({6-хлор-1-[2-(5-метил-2-фенил-1,3-оксазол-4-ил)-2-оксоэтил]-1Н-индол-3-ил}карбонил)спиро[3,1-бензоксазин-4,4'-пиперидин]-2(1Н)-она.



Документы, цитированные в отчёте о поиске
Производные индолин-2-она, способ их получения и содержащие их фармацевтические композиции










Комментарии