Получение дгк и других дц-пнжк в растениях - RU2644241C2
Код документа: RU2644241C2
Чертежи





































































































































































































































































































































































































































































































































































































































































































































































Описание
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Настоящее изобретение, в общем, относится к рекомбинантным организмам-хозяевам (например, растениям), генетически модифицированным системой синтазы полиненасыщенных жирных кислот (ПНЖК) и одним или несколькими вспомогательными белками, которые обеспечивают возможность и/или улучшают продуцирование ПНЖК в организме-хозяине. Настоящее изобретение также относится к способам получения и применения таких организмов (например, для получения ПНЖК), а также продуктам, получаемым из таких организмов (например, маслу и семени).
Уровень техники
Полиненасыщенные жирные кислоты (ПНЖК) считаются полезными для применений в пищевых продуктах, фармацевтических применений, промышленных применений и других целей. Однако, в настоящее время обеспечение ПНЖК за счет природных источников (например, рыбьего жира) и химического синтеза не достаточно для долгосрочных коммерческих нужд.
Растительные масла, получаемые из растений (например, масличных культур), относительно недороги и не имеют проблем, связанных с загрязнением, как в случае рыбьего жира. Однако ПНЖК, обнаруженные во внедренных для коммерческих целей растениях и растительных маслах, обычно не содержат более насыщенные или длинноцепочечные ПНЖК и обычно содержат только такие жирные кислоты, как линолевая кислота (восемнадцать атомов углерода с 2 двойными связями в дельта 9- и 12-положениях - 18:2 дельта 9,12) и линолевая кислота (18:3 дельта 9,12,15).
Было описано получение более ненасыщенных или длинноцепочечных ПНЖК в растениях с использованием модификации жирных кислот, эндогенно продуцируемых растениями. Например, было описано, что генетическая модификация растений различными отдельными генами, кодирующими элонгазы и/или десатуразы жирных кислот, приводит к образованию листьев и семян, содержащих значительные уровни длинноцепочечных и более ненасыщенных ПНЖК, таких как эйкозапентаеновая кислота (ЭПК), а также содержащих значительные уровни смешанных имеющих более короткие цепи и менее ненасыщенных ПНЖК
публикация заявки на выдачу патента США № 2004/0172682, заявка на выдачу патента США № 61/345537, поданная 17 мая 2010).
Fabaceae (или Leguminosae) представляют собой большое и экономически важное семейство цветковых растений, которые обычно известны как семейство бобовых (фасоль, горох, бобы или зернобобовые). Род Glycine является родом в семействе Fabaceae и включает, например, Glycine albicans, Glycine aphyonota, Glycine arenari, Glycine argyrea, Glycine canescens, Glycine clandestine, Glycine curvata, Glycine cyrtoloba, Glycine falcate, Glycine gracei, Glycine hirticaulis, Glycine hirticaulis подвид leptosa, Glycine lactovirens, Glycine latifolia, Glycine latrobeana, Glycine microphylla, Glycine montis-douglas, Glycine peratosa, Glycine pescadrensis, Glycine pindanica, Gycine pullenii, Glycine rubiginosa, Glycine stenophita, Glycine syndetika, Glycine tabacina, Glycine tomentella, Glycine soja и Glycine max (соя). Семейство Fabaceae также включает арахис, фасоль (Phaseolus vulgaris), кормовые бобы (Vicia faba) или горох (Pisum sativum).
Большая часть соевого масла производится в форме растительных масел, получаемых для потребления человеком. Также растет рынок, обеспечивающий применение соевого масла в промышленности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данной области существует потребность в относительно недорогом способе рационального и эффективного получения определенных количеств (например, коммерческих количеств) длинноцепочечных или более ненасыщенных ПНЖК в растениях, семенах растений или растительном масле, а также определенных количеств липидов (например, триацилглицерина (ТАГ) и фосфолипида (ФЛ)), которыми обогащают ПНЖК в растениях, семенах растений или растительном масле. Система получения и улучшения продуцирования ПНЖК в организмах-хозяевах (например, растениях) в результате получения рекомбинантных организмов-хозяев, генетически модифицированных синтазой полиненасыщенных жирных кислот (ПНЖК) и одним или несколькими вспомогательными белками, которые описаны в настоящей публикации, является значимой альтернативой способам, известным в данной области.
Настоящее изобретение относится к генетически модифицированным растениям (например, растениям семейства Fabaceae или рода Glycine, таким как соя), потомкам, семенам, клеткам, тканям или их частям, содержащим (i) последовательность нуклеиновой кислоты, кодирующую синтазу полиненасыщенных жирных кислот (ПНЖК) (например, ПНЖК-синтазу водорослей), которая продуцирует, по меньшей мере, одну ПНЖК; и (ii) последовательность нуклеиновой кислоты, кодирующую фосфопантетеинилтрансферазу (PPT-азу), которая переносит кофактор фосфопантетеинил на АПБ-домен системы ПНЖК-синтазы (например, системы ПНЖК-синтазы водорослей).
В некоторых вариантах осуществления настоящего изобретения ПНЖК-синтаза содержит аминокислотную последовательность, которая на 80-99% идентична аминокислотной последовательности SEQ ID NO: 1 или содержит аминокислотную последовательность SEQ ID NO: 1. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, содержит последовательность нуклеиновой кислоты, идентичную на 80-99% последовательности нуклеиновой кислоты SEQ ID NO: 6, или содержит последовательность нуклеиновой кислоты SEQ ID NO: 6. В некоторых вариантах ПНЖК-синтаза содержит аминокислотную последовательность, которая на 80-99% идентична аминокислотной последовательности SEQ ID NO: 2 или содержит аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, содержит последовательность нуклеиновой кислоты, идентичную на 80-99% последовательности нуклеиновой кислоты SEQ ID NO: 7, или содержит последовательность нуклеиновой кислоты SEQ ID NO: 7. В некоторых вариантах ПНЖК-синтаза содержит аминокислотную последовательность, которая на 80-99% идентична аминокислотной последовательности SEQ ID NO: 3, или содержит аминокислотную последовательность SEQ ID NO: 3. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, содержит последовательность нуклеиновой кислоты, которая на 80-99% идентична последовательности нуклеиновой кислоты SEQ ID NO: 8, или содержит последовательность нуклеиновой кислоты SEQ ID NO: 8. В некоторых вариантах ПНЖК-синтаза содержит аминокислотную последовательность SEQ ID NO: 1, 2 или 3 или любое их сочетание. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, содержит последовательность нуклеиновой кислоты SEQ ID NO: 6, 7 или 8, или любое их сочетание.
В некоторых вариантах PPT-аза содержит аминокислотную последовательность, которая на 80-99% идентична последовательности SEQ ID NO: 5, или содержит аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая PPT-азу, на 80-99% идентична последовательности нуклеиновой кислоты SEQ ID NO: 10 или содержит последовательность нуклеиновой кислоты SEQ ID NO: 10.
В некоторых вариантах последовательности нуклеиновых кислот (i) и (ii) находятся в одном рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислот (i) и (ii) находятся в разных рекомбинантных экспрессирующих векторах. В некоторых вариантах последовательности нуклеиновой кислоты (i) и/или (ii) оперативно связаны со специфичным для семян промотором. В некоторых вариантах последовательности нуклеиновой кислоты (i) и/или (ii) оперативно связаны с промотором, выбранным из PvDlec2, PvPhaseolin, LfKCS3, FAE 1, BoACP и BnaNapinC. В некоторых вариантах последовательности нуклеиновой кислоты (i) и/или (ii) оперативно связаны со специфичным для листьев промотором. В некоторых вариантах последовательности нуклеиновой кислоты (i) и/или (ii) оперативно связаны с промотором убиквитина или CsVMV.
В некоторых вариантах генетически модифицированное растение, его потомок, семя, клетка, ткань или часть дополнительно содержит (iii) последовательность нуклеиновой кислоты, кодирующую ацил-CoA-синтетазу (ACoAS), которая катализирует превращение свободных жирных кислот длинноцепочечных ПНЖК (ПСЖК), в ацил-CoA. В некоторых вариантах ACoAS содержит аминокислотную последовательность, которая на 80-99% идентична последовательности SEQ ID NO: 4, или содержит аминокислотную последовательность SEQ ID NO: 4. В некоторых вариантах ACoAS содержит последовательность нуклеиновой кислоты, которая на 80-99% идентична последовательности нуклеиновой кислоты SEQ ID NO: 9, или содержит последовательность нуклеиновой кислоты SEQ ID NO: 9. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ACoAS, содержит последовательность нуклеиновой кислоты SEQ ID NO: 34. В некоторых вариантах последовательности нуклеиновых кислот (i), (ii) и/или (iii) находятся в одном рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислот (i), (ii) и (iii) находятся в разных рекомбинантных экспрессирующих векторах. В некоторых вариантах последовательности нуклеиновых кислот (i) и (ii) находятся в одном рекомбинантном экспрессирующем векторе, а последовательность нуклеиновой кислоты (iii) находится в другом рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислоты (i) и (iii) находятся в одном рекомбинантном экспрессирующем векторе, а последовательность нуклеиновой кислоты (ii) находится в другом рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислот (ii) и (iii) находятся в одном рекомбинантном экспрессирующем векторе, а последовательность нуклеиновой кислоты (i) находится в другом рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислот (i), (ii) и/или (iii) оперативно связаны со специфичным для семян промотором. В некоторых вариантах последовательности нуклеиновых кислот (i), (ii) и/или (iii) оперативно связаны с промотором, выбранным из PvDlec2, LfKCS3, FAE 1, BoACP и BnaNapinC. В некоторых вариантах последовательности нуклеиновых кислот (i), (ii) и/или (iii) оперативно связаны со специфичным для листьев промотором. В некоторых вариантах последовательности нуклеиновых кислот (i), (ii) и/или (iii) оперативно связаны с промотором убиквитина или CsVMV.
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань или часть дополнительно содержит последовательность нуклеиновой кислоты, кодирующую ацетил-CoA-карбоксилазу (ACC-азу), и/или последовательность нуклеиновой кислоты, кодирующую диацилглицеринацилтрансферазу типа 2 (DGAT2).
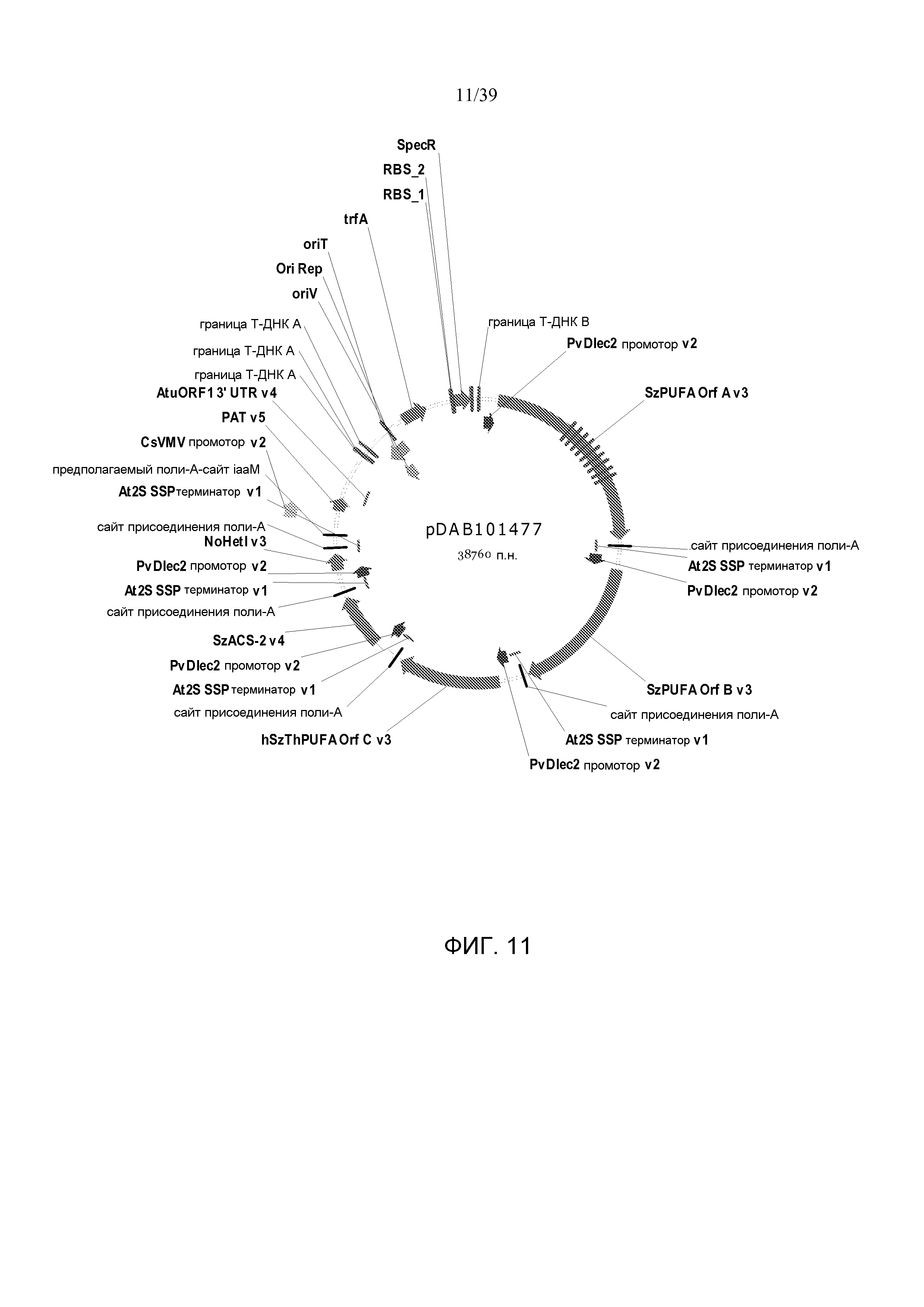
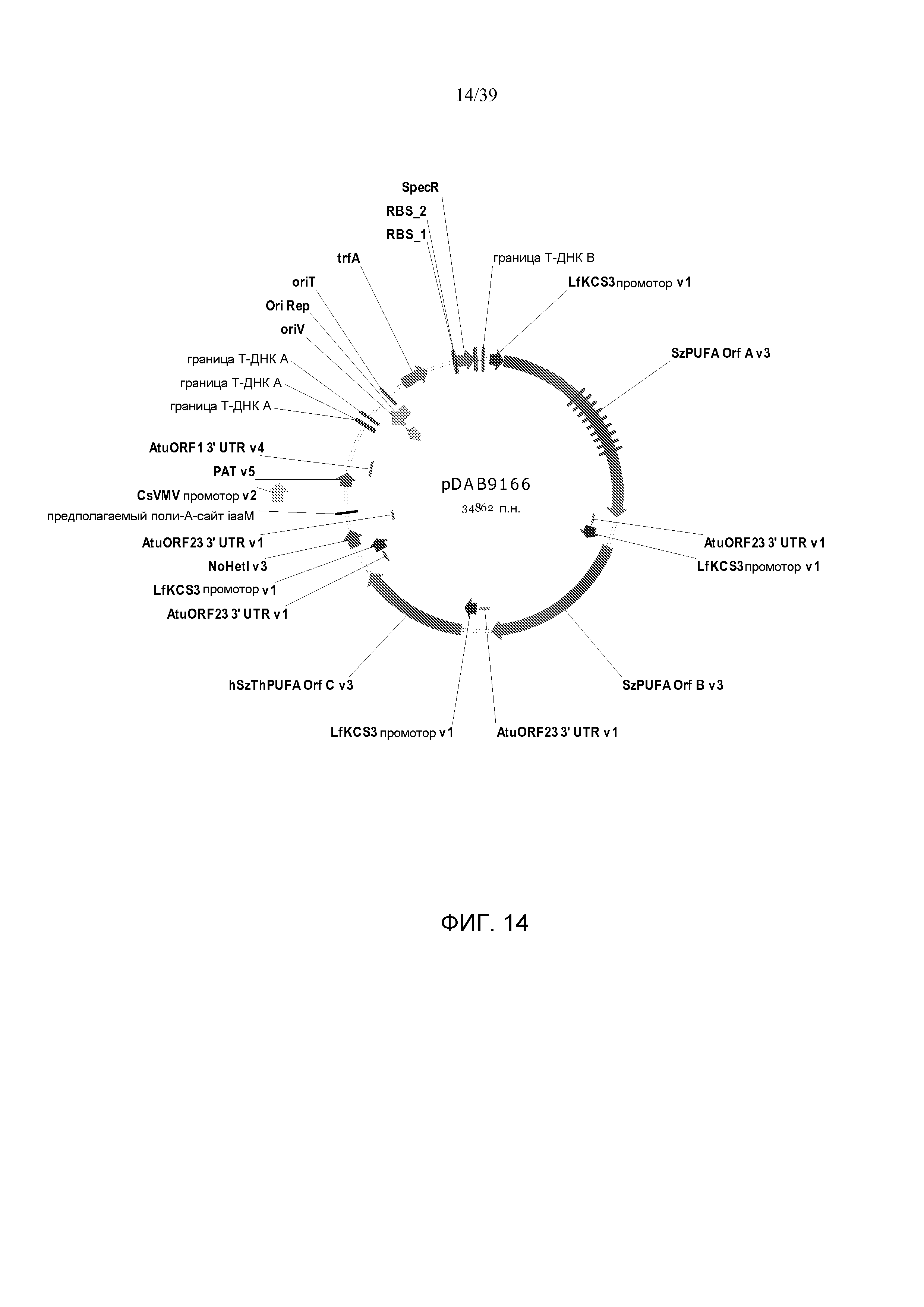
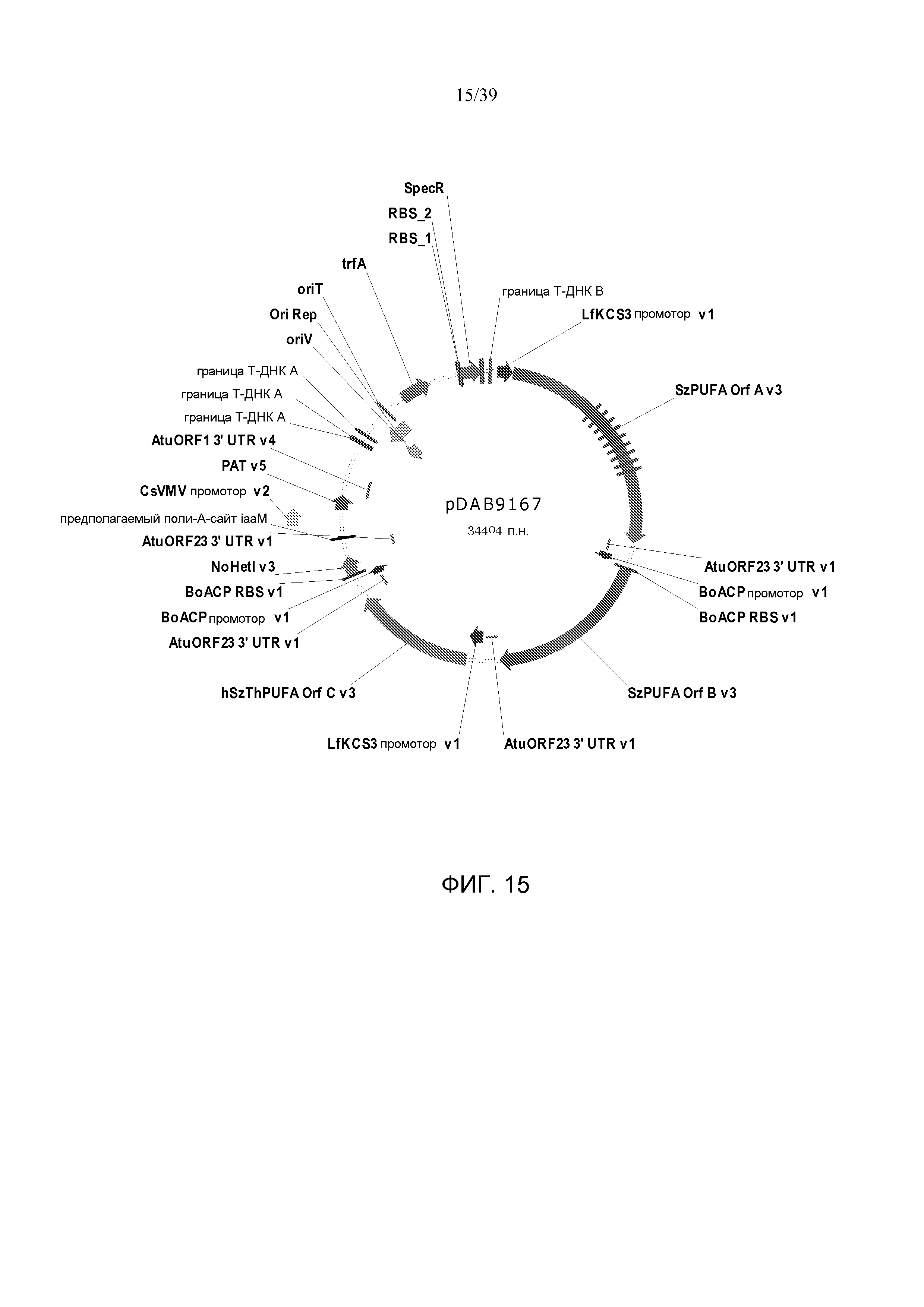
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань, семя или часть содержит, по меньшей мере, одну из плазмид pDAB7361, pDAB7362, pDAB7363, pDAB7368, pDAB7369, pDAB7370, pDAB100518, pDAB101476, pDAB101477, pDAB9166, pDAB9167, pDAB7379, pDAB7380, pDAB9323, pDAB9330, pDAB9337, pDAB9338, pDAB9344, pDAB9396, pDAB101412, pDAB7733, pDAB7734, pDAB101493, pDAB109507, pDAB109508, pDAB109509, pDAB9151, pDAB108207, pDAB108208, pDAB108209, pDAB9159, pDAB9147, pDAB108224 и pDAB108225.
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань, семя или часть или масло (например, масло из семян), полученное из генетически модифицированного растения, его потомка, семени, клетки, ткани или части, содержит регистрируемые количества ДГК (докозагексаеновой кислоты (C22:6, n-3)), ДПК(n-6) (докозапентаеновой кислоты (C22:5, n-6)) и/или ЭПК (эйкозапентаеновой кислоты (C20:5, n-3)). В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань, семя или часть или масло (например, масло из семян), полученное из генетически модифицированного растения, его потомка, семени, клетки, ткани или части, содержит от 0,01% до 15% масс. ДГК от общего количества жирных кислот, от 0,05% до 10% масс. ДГК от общего количества жирных кислот или от 0,05% до 5% масс. ДГК от общего количества жирных кислот. В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань, семя или часть или масло (например, масло из семян), полученное из генетически модифицированного растения, его потомка, семени, клетки, ткани или части, содержит от 0,01% до 10% масс. ЭПК от общего количества жирных кислот, от 0,05% до 5% масс. ЭПК от общего количества жирных кислот или от 0,05% до 1% масс. ЭПК от общего количества жирных кислот. В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань, семя или часть или масло (например, масло из семян), полученного из генетически модифицированного растения, его потомка, семени, клетки, ткани или части, содержит от 0,01% до 10% масс. ДПК(n-6) от общего количества жирных кислот, от 0,01% до 5% масс. ДПК(n-6) от общего количества жирных кислот или от 0,01% до 1% масс. ДПК(n-6) от общего количества жирных кислот. В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань, семя или часть или масло (например, масло из семян), полученное из генетически модифицированного растения, его потомка, семени, клетки, ткани или части, содержит соотношение ЭПК:ДГК от 1:1 до 1:30 или от 1:1 до 1:3 по массе в общей массе жирных кислот. В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань, семя или часть или масло (например, масло из семян), полученное из генетически модифицированного растения, его потомка, семени, клетки, ткани или части, содержит соотношение ДПК(n-6):ДГК от 1:1 до 1:10 или от 1:1 до 1:3 по массе в общей массе жирных кислот. В некоторых вариантах масло (например, масло из семян), полученное из генетически модифицированного растения, его потомка, клетки, ткани, семени или части, содержит от 70% до 99% масс. триглицеридов от общей массы масла.
В некоторых вариантах регистрируемые количества ДГК, ДПК(n-6) и/или ЭПК также выявляют в зерне и/или муке, полученной из генетически модифицированного растения, его потомка, ткани, семени или части.
Настоящее изобретение относится к маслу (например, масло из семян) или семени, полученным из генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации. Настоящее изобретение относится к продукту питания, содержащему масло (например, масло из семян), полученное из генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации. Настоящее изобретение также относится к функциональному пищевому продукту, содержащему масло (например, масло из семян), или семя, полученное из генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации. Настоящее изобретение относится к фармацевтическому продукту, содержащему масло (например, масло из семян) или семя, полученное из генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации.
Настоящее изобретение относится к способу получения масла, содержащего, по меньшей мере, одну ДЦ-ПНЖК, включающему в себя извлечение масла из генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации, или семени генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации. Настоящее изобретение также относится к способу получения масла, содержащего, по меньшей мере, одну ДЦ-ПНЖК, включающему в себя выращивание генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации. Настоящее изобретение также относится к способу получения, по меньшей мере, одной ДЦ-ПНЖК в масле из семян, включающему в себя извлечение масла из семени генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации.
Настоящее изобретение относится к способу получения, по меньшей мере, одной ПНЖК в масле из семян, включающему в себя выращивание генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации. Настоящее изобретение также относится к способу предоставления индивидууму добавки или терапевтического продукта, содержащего, по меньшей мере, одну ПНЖК, включающему в себя предоставление индивидууму генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации, масла, описанного в настоящей публикации, семени, описанного в настоящей публикации, продукта питания, описанного в настоящей публикации, функционального продукта питания, описанного в настоящей публикации, или фармацевтического продукта, описанного в настоящей публикации. В некоторых вариантах ПНЖК, входящей в состав указанных вариантов, является ДГК, ДПК(n-6) и/или ЭПК.
Настоящее изобретение относится к способу получения генетически модифицированного растения (например, сои), его потомка, клетки, ткани или части, описанных в настоящей публикации, включающему в себя трансформацию растения или растительной клетки (i) последовательностью нуклеиновой кислоты, кодирующей синтазу ПНЖК (например, ПНЖК-синтазу водорослей), которая продуцирует, по меньшей мере, одну полиненасыщенную жирную кислоту (ПНЖК); и (ii) последовательностью нуклеиновой кислоты, кодирующей фосфопантетеинилтрансферазу (PPT-азу), которая переносит кофактор фосфопантетеинил на АПБ-домен системы ПНЖК-синтазы (например, системы ПНЖК-синтазы водорослей). В некоторых вариантах способ дополнительно включает в себя трансформацию растения или растительной клетки (iii) последовательностью нуклеиновой кислоты, кодирующей ацил-CoA-синтетазу (ACoAS), которая катализирует превращение свободных жирных кислот (СЖК) длинноцепочечных ПНЖК в ацил-CoA.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Различные варианты осуществления изобретения можно более полно понять из следующего подробного описания, фигур и прилагаемого описания последовательностей, которые составляют часть настоящей заявки.
На фиг. 1 изображены выравнивания Clustal W (выравнивания в векторе NTI) реконструированных последовательностей ДНК, кодирующих каждый из 9 повторяющихся доменов PUFA OrfA.
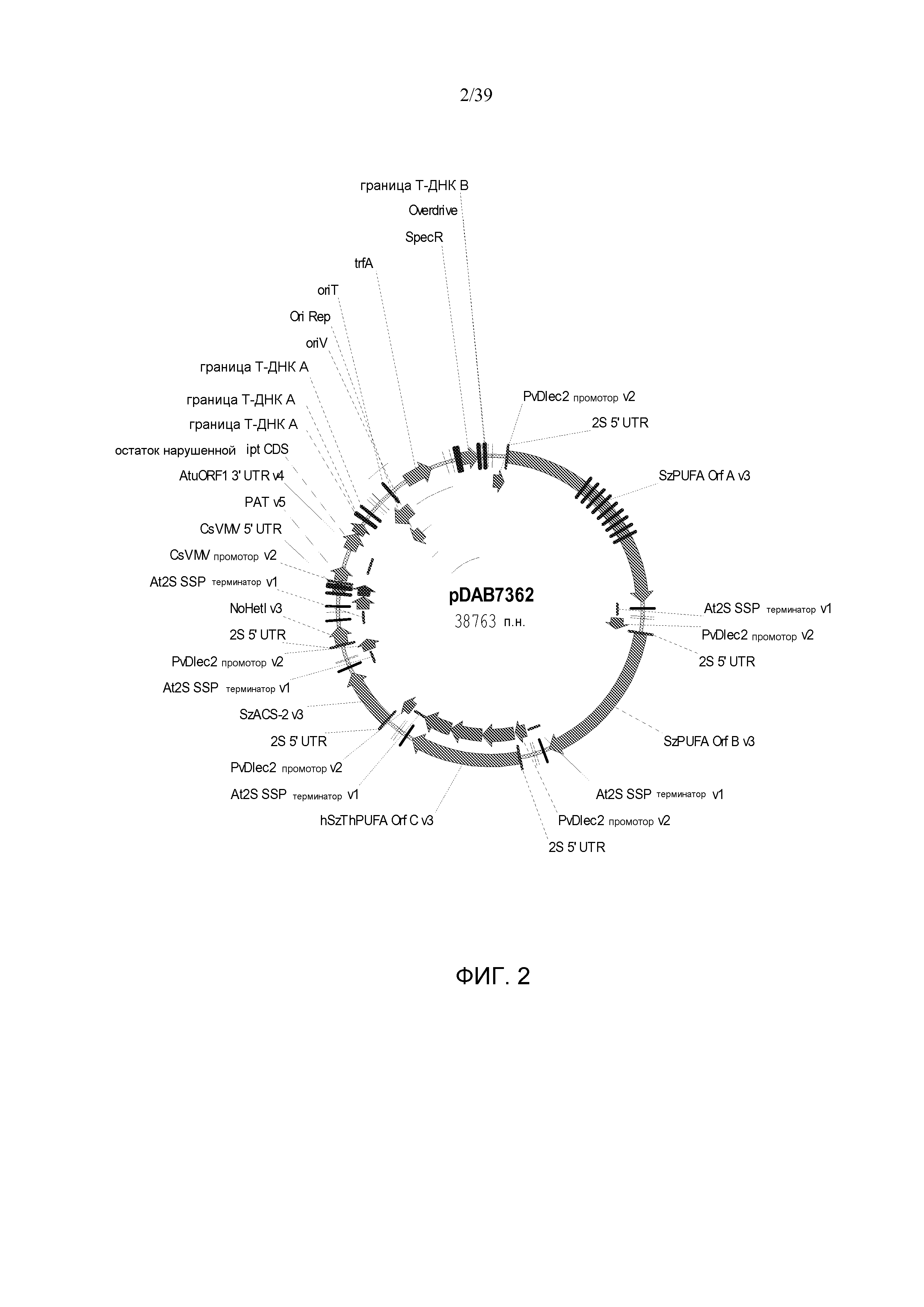
Фиг. 2 представляет собой карту плазмиды pDAB7362.
Фиг. 3 представляет собой карту плазмиды pDAB7361.
Фиг. 4 представляет собой карту плазмиды pDAB7363.
Фиг. 5 представляет собой карту плазмиды pDAB7365.
Фиг. 6 представляет собой карту плазмиды pDAB7368.
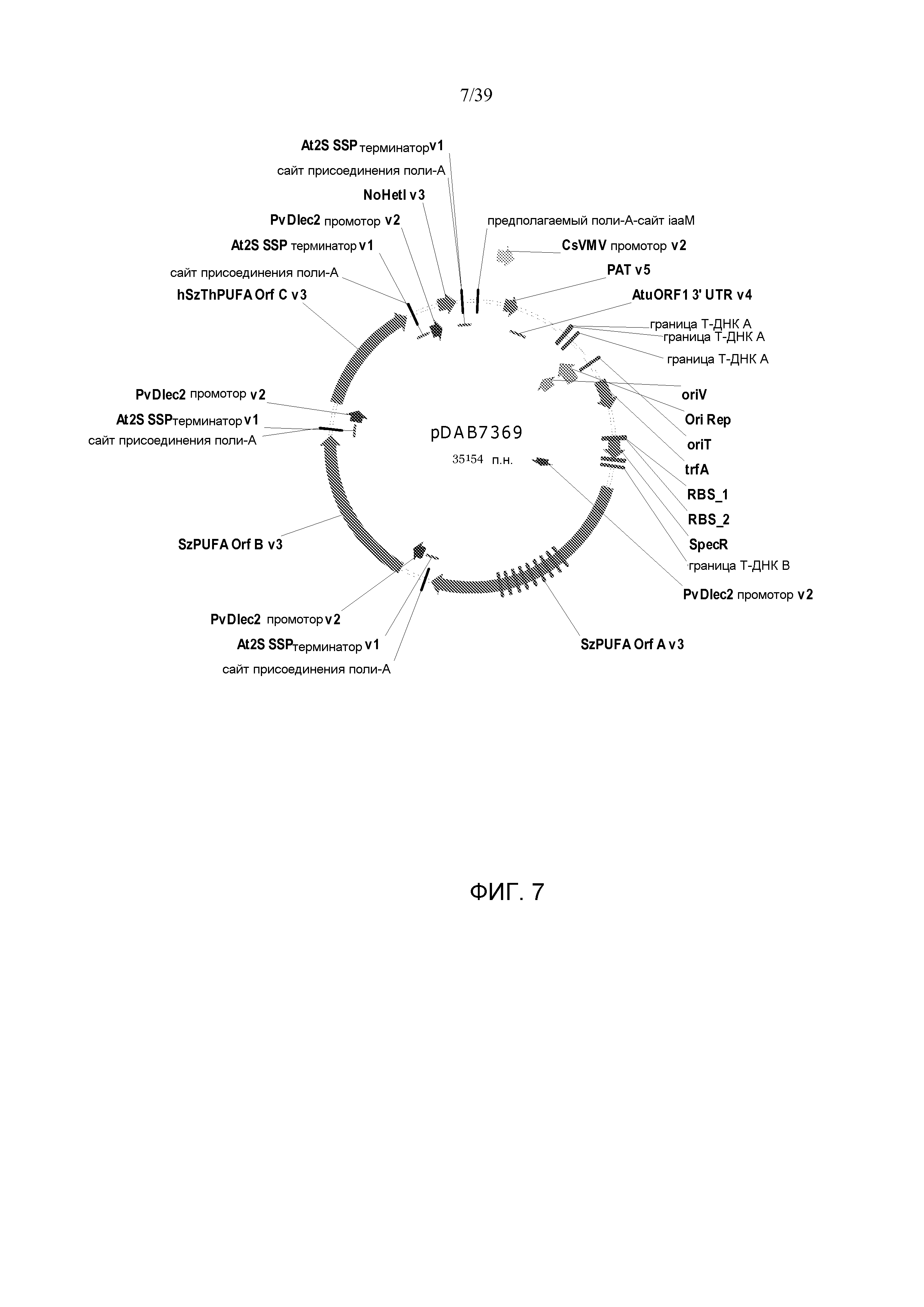
Фиг. 7 представляет собой карту плазмиды pDAB7369.
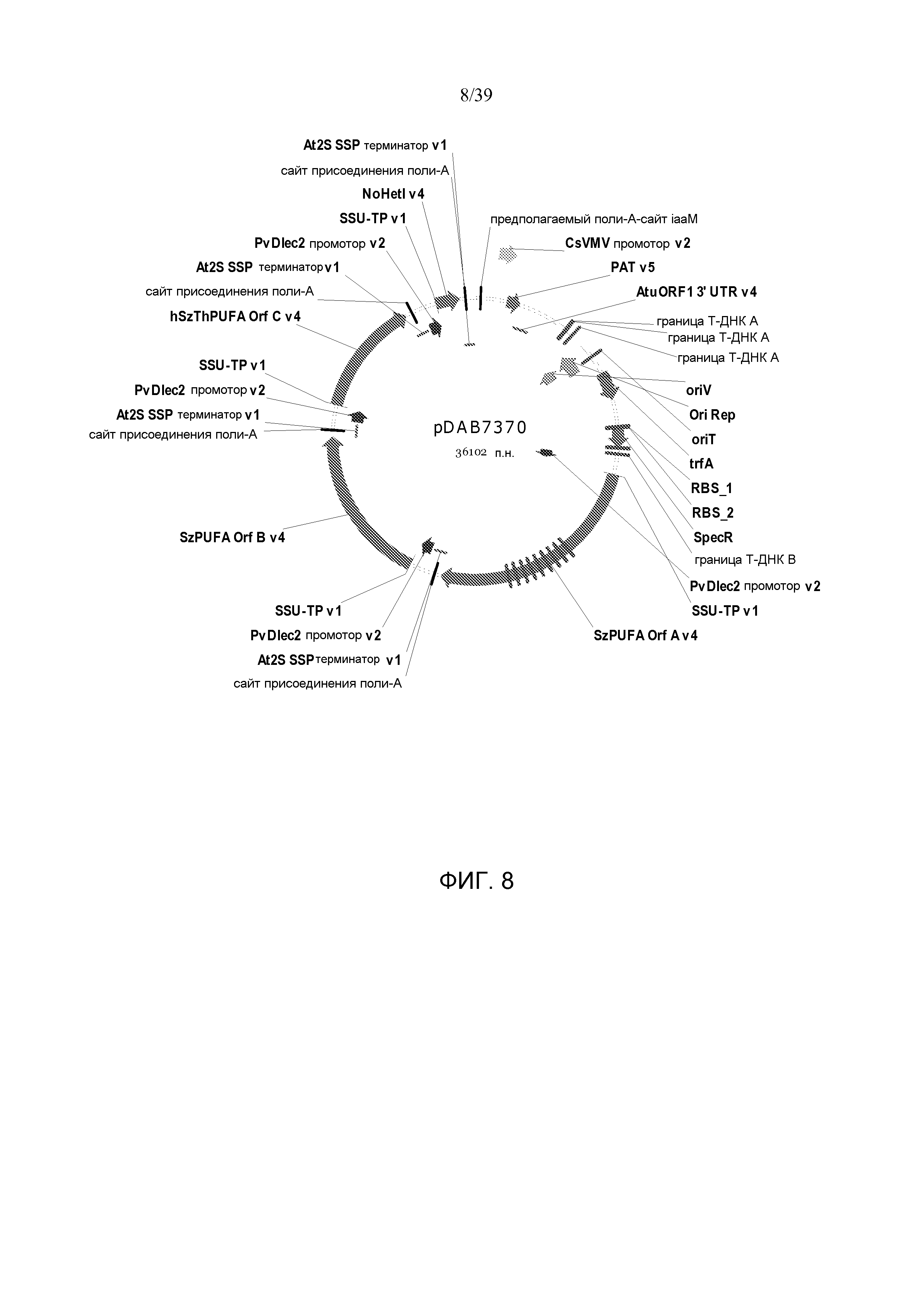
Фиг. 8 представляет собой карту плазмиды pDAB7370.
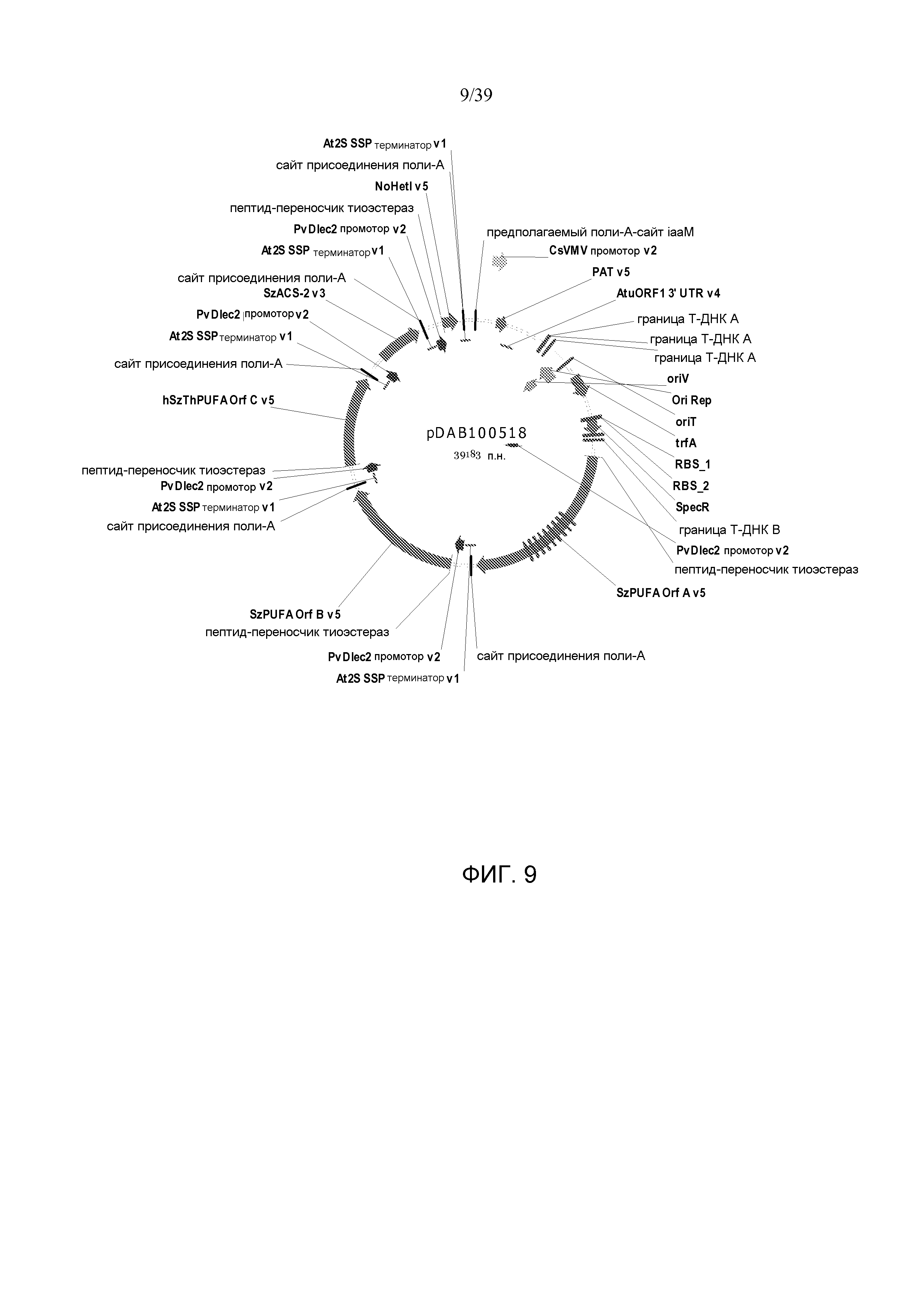
Фиг. 9 представляет собой карту плазмиды pDAB100518.
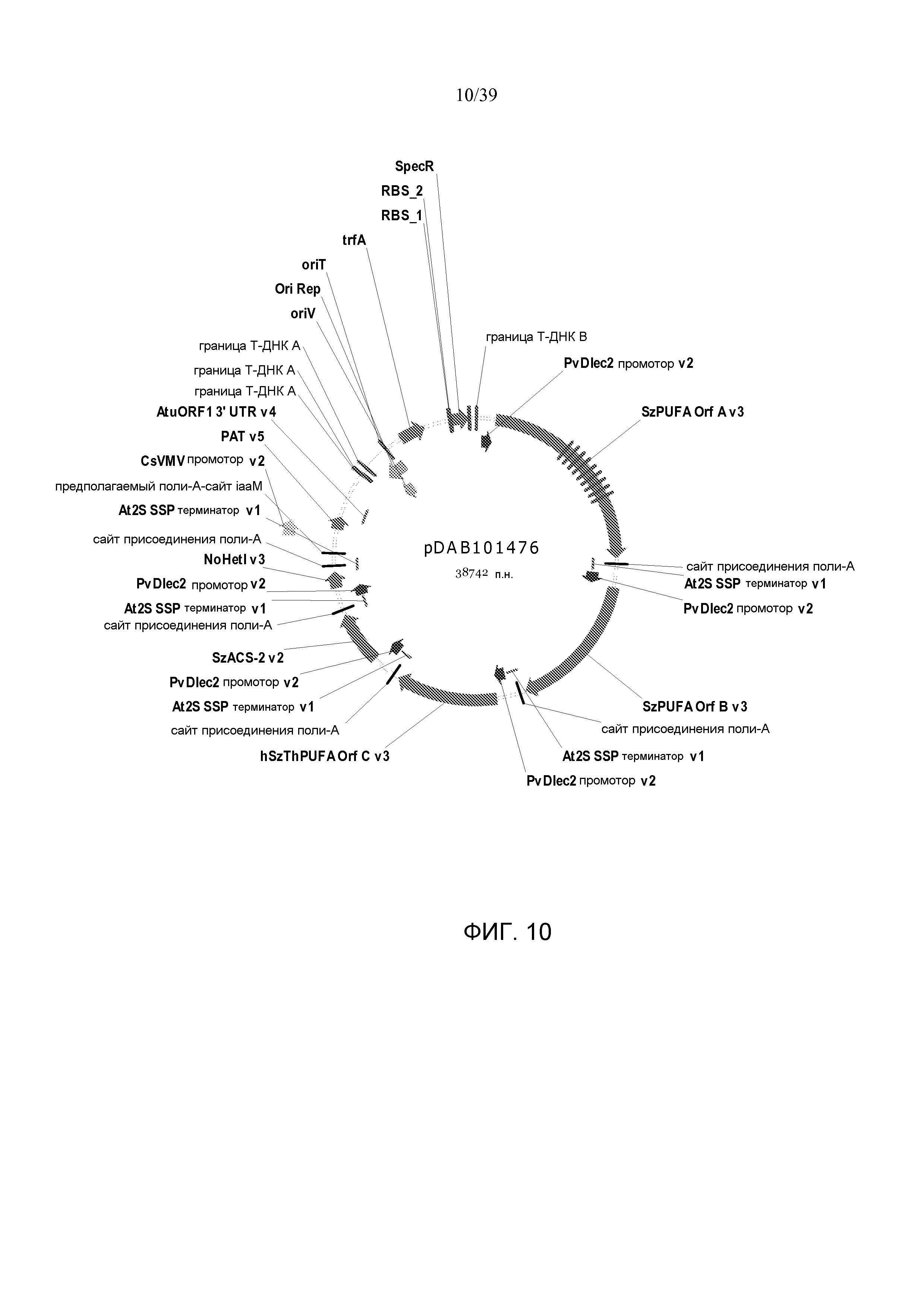
Фиг. 10 представляет собой карту плазмиды pDAB101476.
Фиг. 11 представляет собой карту плазмиды pDAB101477.
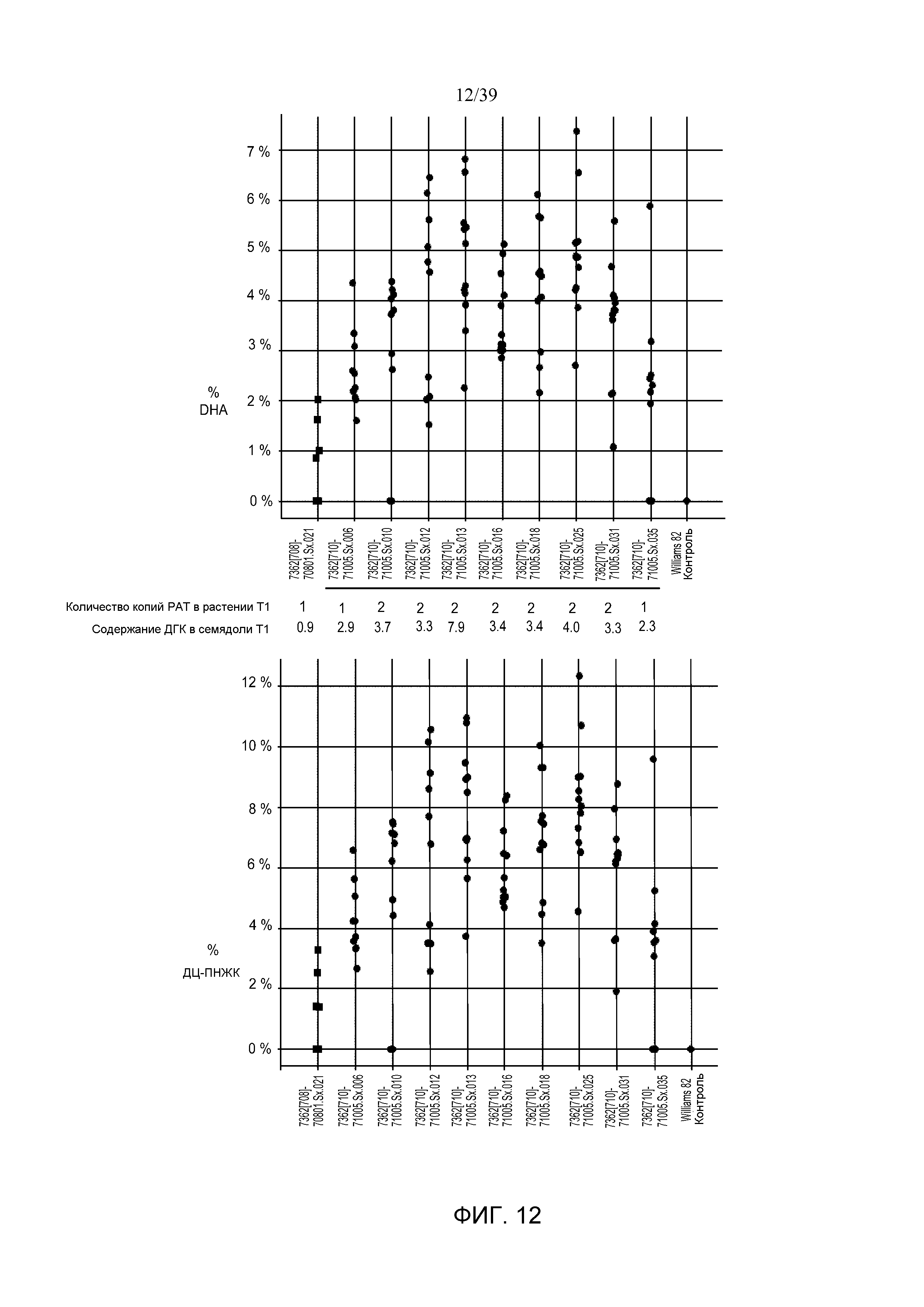
На фиг. 12 показано содержание ДГК и ДЦ-ПНЖК в отдельных семенах сои T2 от растений T1, полученных в результате двух событий трансформации сои с использованием pDAB7362.
На фиг. 13 показано выявление на Вестерн-блотах ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB и химерной ПНЖК-синтазы OrfC в экстрактах белков семян сои T2.
Фиг. 14 представляет собой карту плазмиды pDAB9166.
Фиг. 15 представляет собой карту плазмиды pDAB9167.
Фиг. 16 представляет собой карту плазмиды pDAB7379.
Фиг. 17 представляет собой карту плазмиды pDAB7380.
Фиг. 18 представляет собой карту плазмиды pDAB9323.
Фиг. 19 представляет собой карту плазмиды pDAB9330.
Фиг. 20 представляет собой карту плазмиды pDAB9337.
Фиг. 21 представляет собой карту плазмиды pDAB9338.
Фиг. 22 представляет собой карту плазмиды pDAB9344.
Фиг. 23 представляет собой карту плазмиды pDAB9396.
Фиг. 24 представляет собой карту плазмиды pDAB101412.
Фиг. 25 представляет собой карту плазмиды pDAB7733.
Фиг. 26 представляет собой карту плазмиды pDAB7734.
Фиг. 27 представляет собой карту плазмиды pDAB101493.
Фиг. 28 представляет собой карту плазмиды pDAB109507.
Фиг. 29 представляет собой карту плазмиды pDAB109508.
Фиг. 30 представляет собой карту плазмиды pDAB109509.
Фиг. 31 представляет собой карту плазмиды pDAB9151.
Фиг. 32 представляет собой карту плазмиды pDAB108207.
Фиг. 33 представляет собой карту плазмиды pDAB108208.
Фиг. 34 представляет собой карту плазмиды pDAB108209.
Фиг. 35 представляет собой карту плазмиды pDAB9159.
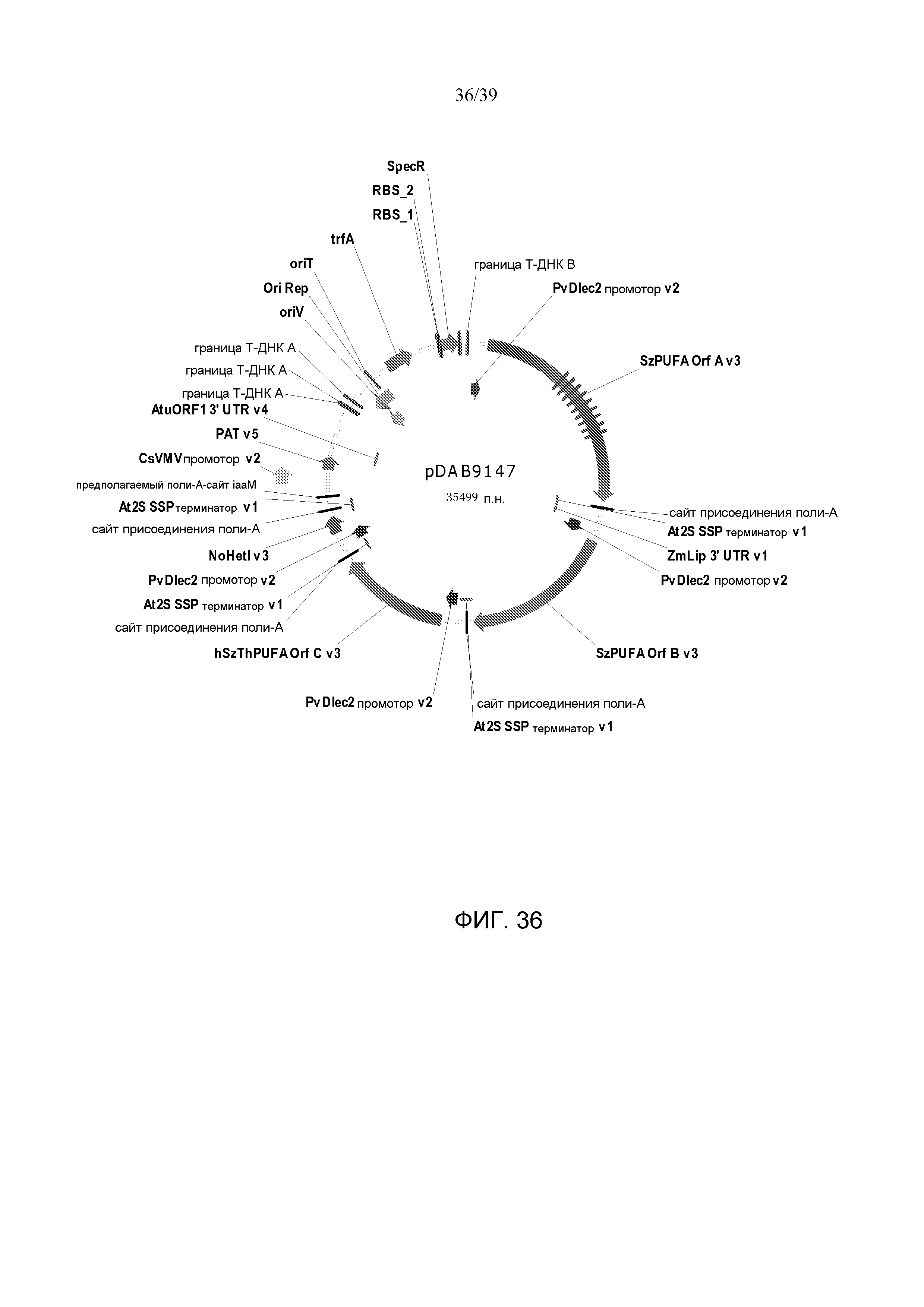
Фиг. 36 представляет собой карту плазмиды pDAB9147.
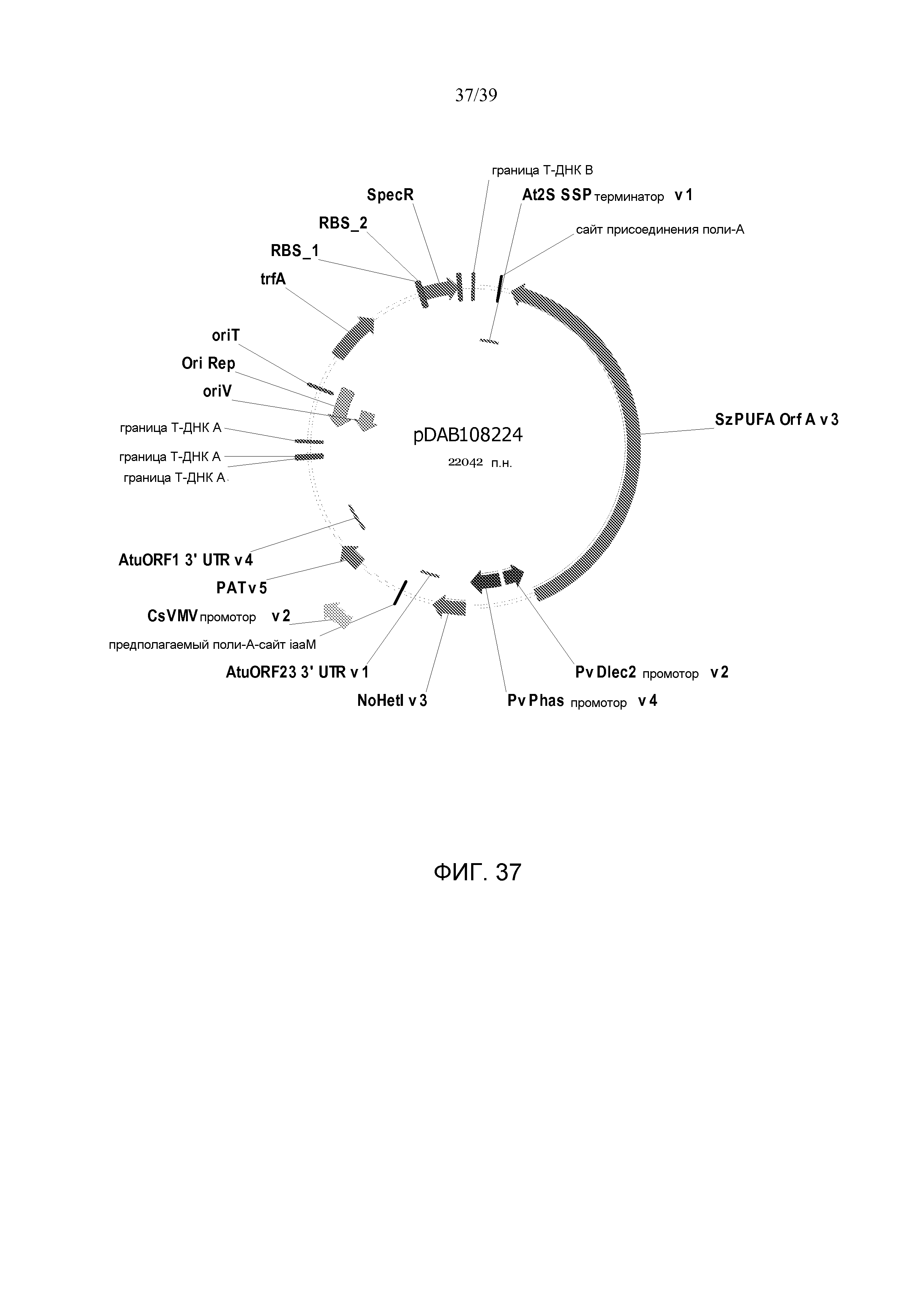
Фиг. 37 представляет собой карту плазмиды pDAB108224.
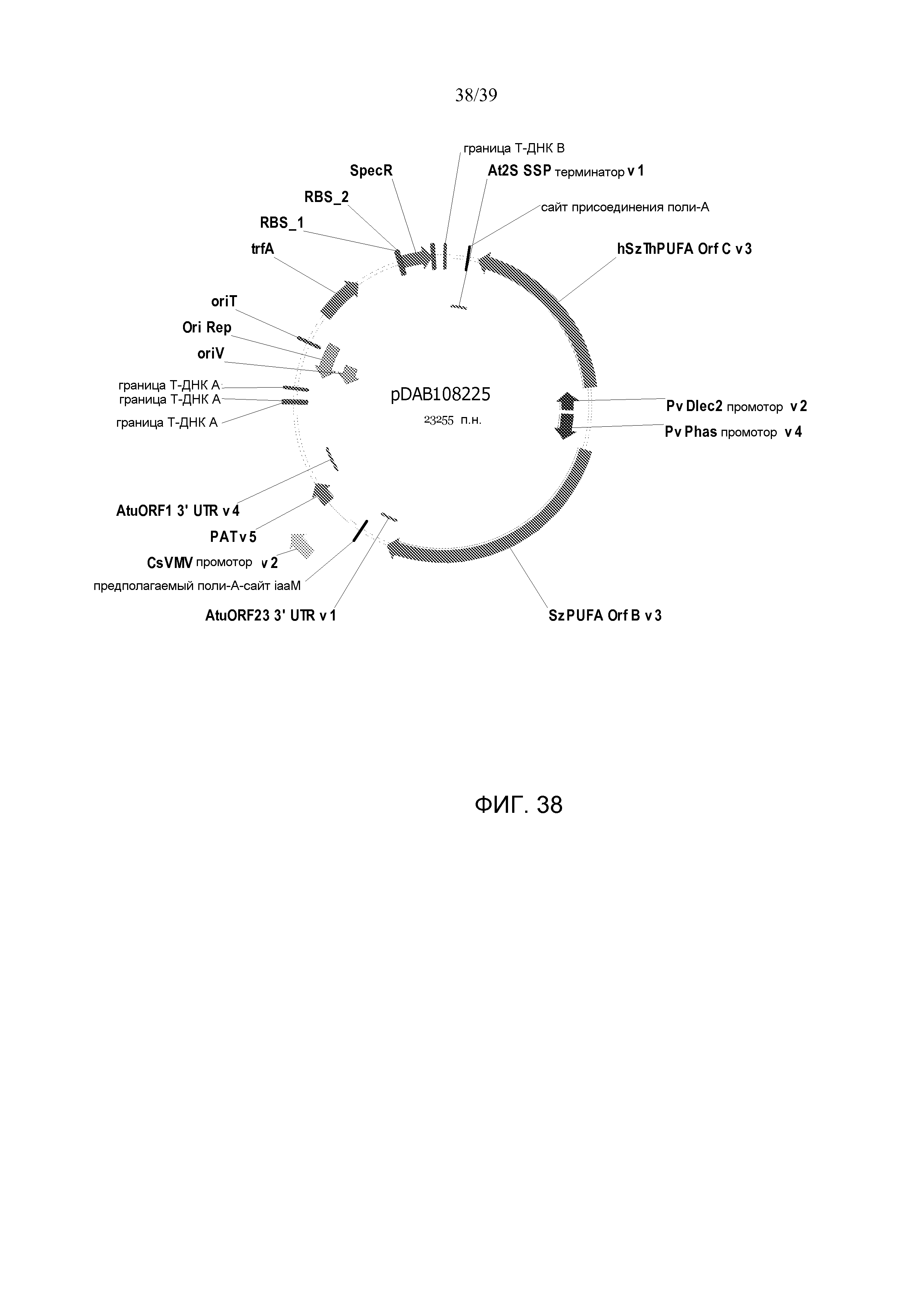
Фиг. 38 представляет собой карту плазмиды pDAB108225.
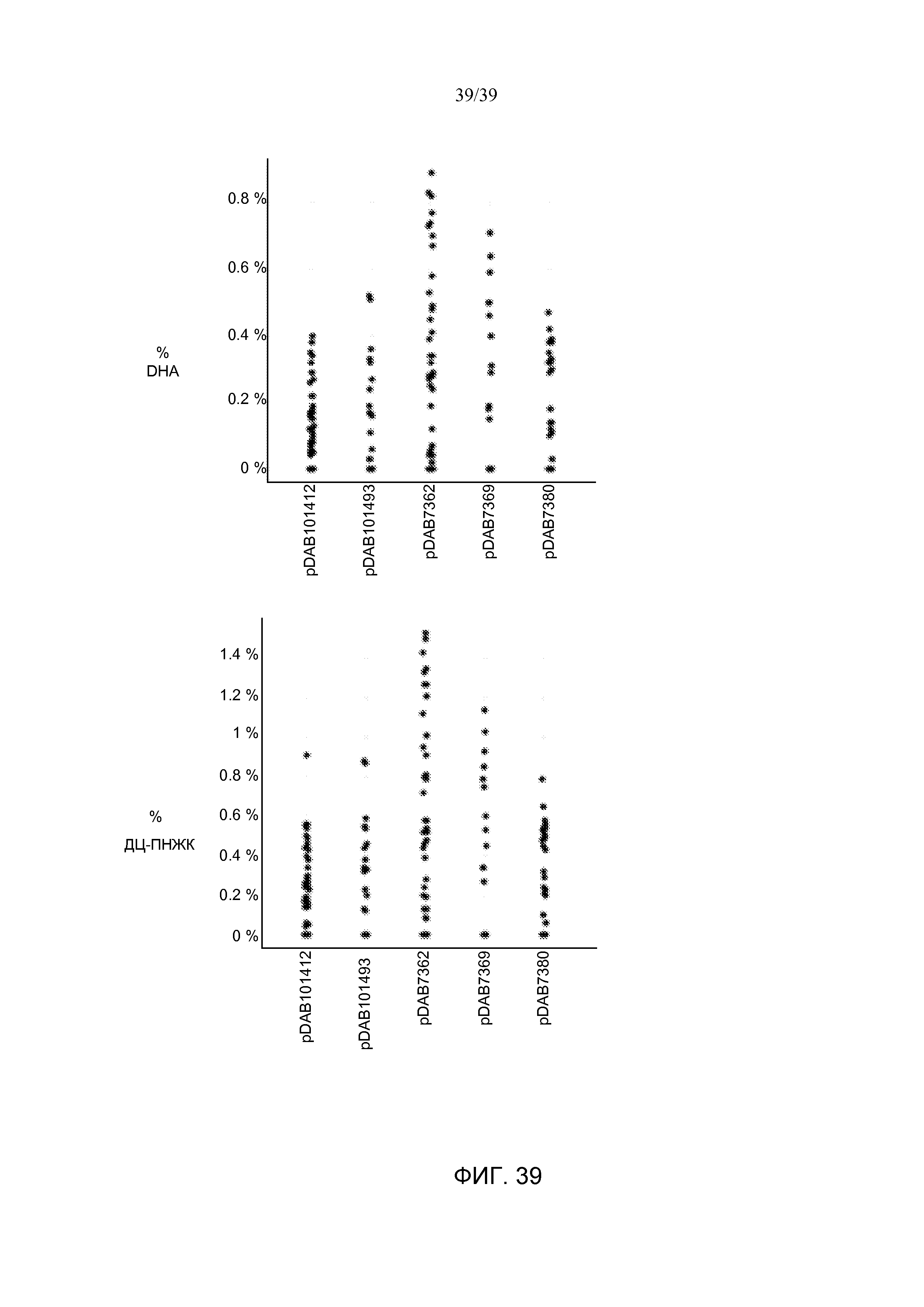
На фиг. 39 показано содержание ДГК и ДЦ-ПНЖК в семенах T2 от отдельных трансгенных растений Arabidopsis, полученных в результате событий трансформации с использованием pDAB101493, pDAB7362, pDAB7369, pDAB101412 или pDAB7380.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин «полиненасыщенная жирная кислота» или «ПНЖК» в используемом в настоящем описании смысле относится к жирным кислотам с длиной углеродной цепи, составляющей по меньшей мере, 16 атомов углерода, по меньшей мере, 18 атомов углерода, по меньшей мере, 20 атомов углерода или 22 или больше атомов углерода, по меньшей мере, с 3 или большим количеством двойных связей, 4 или большим количеством двойных связей, 5 или большим количеством двойных связей или 6 или большим количеством двойных связей, при этом все двойные связи находятся в цис-конфигурации.
Термин «длинноцепочечные полиненасыщенные жирные кислоты» или «ДЦ-ПНЖК» в используемом в настоящем описании смысле относится к жирным кислотам с длиной цепи 20 и больше атомов углерода, содержащим 3 или больше двойных связей, или 22 или больше атомов углерода, по меньшей мере, с 3 или большим количеством двойных связей, 4 или большим количеством двойных связей, 5 или большим количеством двойных связей или 6 или большим количеством двойных связей. ДЦ-ПНЖК из ряда омега-6 включают без ограничения дигомо-гамма-линоленовую кислоту (C20:3n-6), арахидоновую кислоту (C20:4n-6), адреновую кислоту (также называемую докозатетраеновой кислотой или ДТК) (C22:4n-6) и докозапентаеновую кислоту (C22:5n-6). ДЦ-ПНЖК из ряда омега-3 включают без ограничения эйкозатриеновую кислоту (C20:3n-3), эйкозатетраеновую кислоту (C20:4n-3), эйкозапентаеновую кислоту (C20:5n-3), докозапентаеновую кислоту (C22:5n-3) и докозагексаеновую кислоту (C22:6n-3). ДЦ-ПНЖК также включают жирные кислоты более чем с 22 атомами углерода и 4 или большим количеством двойных связей включая без ограничения C28:8(n-3).
Термин «ПНЖК-синтаза» в используемом в настоящем описании смысле относится к ферменту, который продуцирует полиненасыщенные жирные кислоты (ПНЖК), и в частности, длинноцепочечные ПНЖК (ДЦ-ПНЖК), а также к любому домену такого фермента в комплексе. Термин ПНЖК-синтаза включает без ограничения PKS-системы ПНЖК или PKS-подобные системы для получения ПНЖК. Некоторые конкретные ПНЖК-синтазы указаны в настоящем описании с использованием дополнительного обозначения, например, «SzPUFA»-синтаза или «hSzThPUFA»-синтаза, как определено в настоящей заявке. Термин «система ПНЖК-синтазы» включает ПНЖК-синтазу и любые вспомогательные ферменты, которые могут влиять на функцию ПНЖК-синтазы при экспрессии в гетерологичном организме (например, PPT-азу или ACS).
Термины «фосфопантетеинилтрансфераза» и «PPT-аза» в используемом в настоящем описании смысле относятся к ферменту, который активирует ПНЖК-синтазу в результате переноса кофактора (например, 4-фосфопантетеина) от кофермента A (CoA) на один или несколько доменов АПБ, присутствующих в ПНЖК-синтазе. Одним примером PPT-азы, которая может активировать один или несколько доменов ПНЖК-синтазы, описанной в настоящей публикации, является белок Het I вида Nostoc PCC 7120 (ранее называемого Anabaena sp. PCC 7120), обозначаемый в настоящем описании «NoHetI».
Термины «ацил-CoA-синтетаза», «ACoAS» и «ACS» в используемом в настоящем описании смысле относятся к ферменту, который катализирует превращение длинноцепочечных полиненасыщенных свободных жирных кислот (СЖК) в ацил-CoA. Некоторые конкретные ацил-CoA-синтетазы названы в настоящем описании с использованием дополнительного обозначения, например, «SzACS-2», как определено в настоящей заявке.
Термин «растение» в используемом в настоящем описании смысле включает любого его потомка, клетку, ткань, семя, масло из семян или часть.
«Нутрицевтик» означает продукт, выделенный, очищенный, сконцентрированный или полученный из растений, который полезен с физиологической точки зрения или обеспечивает защиту от заболевания, включая обработанные продукты питания с добавлением таких продуктов, а также продукты питания, полученные из культур, которые были генетически сконструированы так, чтобы они содержали повышенные уровни физиологически активных компонентов.
«Функциональный продукт питания» означает продукт питания, который (a) сходен по виду или может представлять собой обычный продукт питания, который потребляют в виде части обычной диеты и (b) обладает повышенной пищевой ценностью и/или специфической пищевой ценностью в результате модификации соотношения компонентов, которые обычно присутствуют в немодифицированном пищевом продукте.
Подразумевается, что термины «полинуклеотид» и «нуклеиновая кислота» охватывают одну нуклеиновую кислоту, а также множество нуклеиновых кислот, молекулу нуклеиновой кислоты или ее фрагмент, вариант или производное, или конструкцию, например, матричную РНК (мРНК) или плазмидную ДНК (пДНК). Полинуклеотид или нуклеиновая кислота может содержать нуклеотидную последовательность полноразмерной последовательности кДНК или ее фрагмент, включая нетранслируемые 5'- и 3'-последовательности и кодирующие последовательности. Полинуклеотид или нуклеиновая кислота могут состоять из любого полирибонуклеотида или полидезоксирибонуклеотида, которые могут представлять собой немодифицированную РНК или ДНК или модифицированную РНК или ДНК. Например, полинуклеотид или нуклеиновая кислота может состоять из однонитевой и двунитевой ДНК, из ДНК, которая является смесью однонитевых и двунитевых областей, одно- и двунитевой РНК и РНК, которая является смесью одно- и двунитевых областей, гибридных молекул, содержащих ДНК и РНК, которые могут быть однонитевыми или чаще двунитевыми, или смесью одно- и двунитевых областей. Указанные термины также охватывают химически, ферментативно или метаболически модифицированные формы полинуклеотида или нуклеиновой кислоты.
Полинуклеотид или последовательность нуклеиновой кислоты могут быть названы «изолированными», при этом они извлечены из своего природного окружения. Например, гетерологичный полинуклеотид или нуклеиновая кислота, кодирующая полипептид или полипептидный фрагмент, обладающий активностью дегидратазы дигидроксикислоты, находящаяся в векторе, считается изолированной в целях настоящего изобретения. Дополнительные примеры изолированного полинуклеотида или нуклеиновой кислоты включают рекомбинантные полинуклеотиды, находящиеся в гетерологичных клетках-хозяевах, или очищенный (частично или по существу) полинуклеотид или нуклеиновую кислоту в растворе. Изолированный полинуклеотид или нуклеиновая кислота согласно настоящему изобретению дополнительно включают такие молекулы, полученные в результате синтеза. Изолированный полинуклеотид или нуклеиновая кислота в форме полимера ДНК может состоять одного или нескольких участков кДНК, геномной ДНК или синтетической ДНК.
Термин «ген» относится к нуклеиновой кислоте или ее фрагменту, который способен экспрессироваться, давая конкретный белок, и необязательно содержит регуляторные последовательности, предшествующие (5'-некодирующие последовательности) и следующие (3'-некодирующие последовательности) за кодирующей последовательностью.
В используемом в настоящем описании смысле термин «кодирующая область» относится к последовательности ДНК, которая кодирует конкретную аминокислотную последовательность. «Подходящие регуляторные последовательности» относятся к нуклеотидным последовательностям, расположенным выше (5'-некодирующие последовательности), в пределах или ниже (3'-некодирующие последовательности) кодирующей последовательности, которые влияют на транскрипцию, процессинг или стабильность РНК или на трансляцию ассоциированной кодирующей последовательности. Регуляторные последовательности могут включать промоторы, лидерные последовательности трансляции, интроны, последовательности распознавания для полиаденилирования, участки процессинга РНК, участок связывания эффектора и структуру стебель-петля.
В используемом в настоящем описании смысле подразумевается, что термин «полипептид» охватывает отдельный «полипептид», а также множество «полипептидов» и их фрагменты, и относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термин «полипептид» относится к любой цепи или цепям из двух или более аминокислот и не относится к конкретной длине продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды, белок, цепь аминокислот или любой другой термин, используемый по отношению к цепи или цепям из двух или более аминокислот, включены в определение «полипептид», и термин «полипептид» может быть использован вместе или взаимозаменяемо с любым из указанных терминов. Полипептид может быть получен из природного биологического источника или может быть получен основанным на рекомбинации способом, но не обязательно транслирован с определенной последовательности нуклеиновой кислоты. Он может быть создан любым способом, включая химический синтез.
Под «изолированным» полипептидом или его фрагментом, вариантом или производным подразумевают полипептид, который не находится в своей природной среде. При этом не требуется конкретного уровня очистки. Например, изолированный полипептид может быть извлечен из нативного или природного окружения. Рекомбинантно полученные полипептиды и белки, экспрессированные в клетках-хозяевах, считают изолированными в целях настоящего изобретения, также как нативные или рекомбинантные полипептиды, которые были отделены, фракционированы или частично или по существу полностью очищены любым подходящим способом.
В используемом в настоящем описании смысле «нативный» относится к форме полинуклеотида, гена или полипептида, которые встречаются в природе, с их собственными регуляторными последовательностями, если таковые присутствуют.
В используемом в настоящем описании смысле «эндогенный» относится к нативной форме полинуклеотида, гена или полипептида в его природном окружении в организме или в геноме организма. «Эндогенный полинуклеотид» включает нативный полинуклеотид в его природном положении в геноме организма. «Эндогенный ген» включает нативный ген в его природном положении в геноме организма. «Эндогенный полипептид» включает нативный полипептид в его природном положении в организме.
В используемом в настоящем описании смысле «гетерологичный» относится к полинуклеотиду, гену или полипептиду, в норме не встречающемуся в организме хозяина, но который введен в организм хозяина. «Гетерологичный полинуклеотид» включает нативную кодирующую область или ее часть, которую повторно вводят в исходный организм в форме, которая отличается от соответствующего нативного полинуклеотида. «Гетерологичный ген» включает нативную кодирующую область или ее часть, которую повторно вводят в исходный организм в форме, которая отличается от соответствующего нативного гена. Например, гетерологичный ген может включать нативную кодирующую область, которая представляет собой часть химерного гена, включая ненативные регуляторные области, который повторно вводят в нативного хозяина. «Гетерологичный полипептид» включает нативный полипептид, который повторно вводят в исходный организм в форме, которая отличается от соответствующего нативного полипептида.
В используемом в настоящем описании смысле термин «модификация» относится к изменению полинуклеотида, раскрытого в настоящем описании, которое приводит к пониженной, по существу исключенной или исключенной активности полипептида, кодируемого полинуклеотидом, а также к изменению полипептида, раскрытого в настоящем описании, которое приводит к пониженной, по существу исключенной или исключенной активности полипептида. Такие изменения могут быть осуществлены способами, хорошо известными в данной области, включая без ограничения делецию, мутацию (например, спонтанный мутагенез, случайный мутагенез, мутагенез, вызываемый генами-мутаторами, или мутагенез, вызванный транспозонами), замену, инсерцию, понижающую регуляцию, изменение положения в клетке, изменение состояния полинуклеотида или полипептида (например, метилирование, фосфорилирование или убиквитинилирование), удаление кофактора, введение антисмысловой РНК/ДНК, введение интерферирующей РНК/ДНК, химическую модификацию, ковалентную модификацию, облучение УФ или рентгеновским излучением, гомологичную рекомбинацию, митотическую рекомбинацию, способы замены промоторов и/или сочетания указанных способов. Принципы определения того, какие нуклеотиды или аминокислотные остатки могут быть модифицированы, можно установить посредством сравнения последовательности конкретного полинуклеотида или полипептида с последовательностью гомологичных полинуклеотидов или полипептидов, например, дрожжевых или бактериальных, и максимизации количества модификаций, осуществляемых в областях с высокой гомологией (консервативных областях) или консенсусных последовательностях.
Термин «производное» в используемом в настоящем описании смысле относится к модификации последовательности, раскрытой в настоящем изобретении. Иллюстративными примерами таких модификаций могут быть замена, инсерция и/или делеция одного или нескольких оснований по сравнению с последовательностью нуклеиновой кислоты кодирующей последовательности, раскрытой в настоящем описании, которые сохраняют, в небольшой степени изменяют или повышают функцию кодирующей последовательности, раскрытой в настоящем описании, в данном виде масличной культуры. Такие производные легко могут быть определены специалистом в данной области, например, с использованием способов компьютерного моделирования для прогнозирования и оптимизации структуры последовательности. Термин «производное» также охватывает последовательности нуклеиновой кислоты, имеющие высокую гомологию последовательности с раскрытыми в настоящем описании кодирующими последовательностями, так чтобы они были способны выполнять описанные функции с целью применения для получения ДЦ-ПНЖК согласно настоящему изобретению.
В используемом в настоящем описании смысле термин «вариант» относится к полипептиду, отличающемуся от конкретно указанного полипептида согласно изобретению инсерциями, делециями, мутациями и заменами аминокислот, созданному с использованием, например, методики рекомбинантной ДНК, такой как мутагенез. Принципы определения того, какие аминокислотные остатки могут быть заменены, добавлены или делетированы без нарушения представляющих интерес активностей, можно установить посредством сравнения последовательности конкретного полипептида с последовательностью гомологичных полипептидов и максимизации количества аминокислотных изменений, осуществляемых в областях с высокой гомологией (консервативных областях), или замены аминокислот консенсусными последовательностями.
Альтернативно рекомбинантные варианты полинуклеотида, кодирующие такие же или сходные полипептиды, могут быть синтезированы или отобраны с использованием «вырожденности» генетического кода. Могут быть введены различные замены кодонов, такие как молчащие изменения, которые приводят к появлению различных сайтов рестрикции, чтобы оптимизировать клонирование в плазмидном или вирусном векторе для экспрессии. Мутации в полинуклеотидной последовательности могут быть отражены в виде добавления к полипептиду другого полипептида или доменов других пептидов, чтобы модифицировать свойства любой части полипептида.
Аминокислотные «замены» могут быть результатом замены одной аминокислоты другой аминокислотой, имеющей сходные структурные и/или химические свойства, т.е. результатом консервативных аминокислотных замен, или они могут быть результатом замены одной аминокислоты аминокислотой, имеющей другие структурные и/или химические свойства, т.е. результатом неконсервативных аминокислотных замен. «Консервативные» аминокислотные замены могут быть осуществлены на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности или амфипатической природы используемых остатков. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Альтернативно «неконсервативные» аминокислотные замены могут быть осуществлены в результате отбора различий в полярности, заряде, растворимости, гидрофобности гидрофильности или амфипатической природы любой из таких аминокислот. «Инсерции» или «делеции» могут быть осуществлены в определенных пределах изменений, которые структурно или функционально допустимы в случае рекомбинантных белков. Допустимое изменение можно определить экспериментально в результате системного получения инсерций, делеций или замен аминокислот в молекуле полипептида с использованием методики рекомбинантной ДНК и анализа полученных рекомбинантных вариантов в отношении активности.
Термин «промотор» относится к последовательности ДНК, способной регулировать экспрессию кодирующей последовательности или функциональной РНК. В общем, кодирующая последовательность расположена с 3'-стороны от последовательности промотора. Промоторы могут быть получены полностью из нативного гена или могут состоять их разных элементов, полученных из разных промоторов, встречающихся в природе, или даже могут содержать участки синтетической ДНК. Специалистам в данной области понятно, что разные промоторы могут управлять экспрессией гена в разных тканях или типах клеток или на разных стадиях развития или в ответ на разные условия окружающей среды или физиологические условия. Промоторы, которые вызывают экспрессию гена в большинстве типов клеток обычно называют «конститутивными промоторами». Кроме того, известно, что поскольку в большинстве случаев точные границы регуляторных последовательностей определены не полностью, фрагменты ДНК разной длины могут обладать идентичной промоторной активностью.
Термин «оперативно связанный» относится к ассоциации последовательностей нуклеиновых кислот в одном фрагменте нуклеиновой кислоты, так что функции одной из них находятся под влиянием другой. Например, промотор оперативно связан с кодирующей последовательностью, когда он способен влиять на экспрессию такой кодирующей последовательности (например, такая кодирующая последовательность находится под транскрипционным контролем промотора). Кодирующие последовательности могут быть оперативно связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации.
Термин «экспрессия» в используемом в настоящем описании смысле относится к транскрипции и стабильному накоплению смысловой (мРНК) или антисмысловой РНК, получаемой на фрагменте нуклеиновой кислоты согласно изобретению. Экспрессия также может относиться к трансляции мРНК в полипептид.
Термин «сверхэкспрессия» в используемом в настоящем описании смысле относится к экспрессии, которая выше, чем эндогенная экспрессия такого же или родственного гена. Гетерологичный ген сверхэкспрессируется, если его экспрессия выше, чем экспрессия сравнимого эндогенного гена.
В используемом в настоящем описании смысле термин «трансформация» относится к переносу нуклеиновой кислоты или фрагмента в организм хозяина с получением в результате генетически стабильного наследования. Организмы-хозяева, содержащие перенесенные в результате трансформации фрагменты нуклеиновой кислоты, называют «трансгенными» или «рекомбинантными» или «трансформированными» организмами.
Термины «плазмида» и «вектор» в используемом в настоящем описании смысле относится в внехромосомному элементу, часто несущему гены, которые не являются частью центрального метаболизма клетки, и обычно элемент имеет форму кольцевой двунитевой молекулы ДНК. Такие элементы могут представлять собой автономно реплицирующиеся последовательности, интегрируемые в геном последовательности, фаговые или нуклеотидные последовательности, линейные или кольцевые, одно- или двунитевой ДНК или РНК, полученные из любого источника, в которых несколько нуклеотидных последовательностей были связаны или рекомбинированы в виде уникальной конструкции, которая способна вводить в клетку фрагмент промотора и последовательность ДНК для выбранного генного продукта вместе с подходящей 3'-нетранслируемой последовательностью.
В используемом в настоящем описании смысле термин «вырожденность кодонов» относится к природе осуществляемого в генетическом коде изменения нуклеотидной последовательности, не влияющего на аминокислотную последовательность кодируемого полипептида. Специалисту в данной области хорошо известно «смещение частоты использования кодонов», наблюдаемое в конкретной клетке-хозяине в отношении использования нуклеотидных кодонов, определяющих данную аминокислоту. Следовательно, в случае синтеза гена для улучшенной экспрессии в клетке-хозяине желательно конструировать ген таким образом, чтобы частота использования кодона приближалась к частоте предпочтительного использования кодонов в клетке-хозяине.
Термин «оптимизированный по кодонам» по отношению к генам или кодирующим областям молекул нуклеиновых кислот для трансформации различных хозяев относится к изменению кодонов в гене или кодирующих областях молекул нуклеиновых кислот, в которых отражено типичное использование кодонов организмом-хозяином без изменения полипептида, кодируемого ДНК. Такая оптимизация включает в себя замену, по меньшей мере, одного, больше одного или большого количества кодонов одним или несколькими кодонами, которые более часто использованы в генах данного организма.
Отклонения в нуклеотидной последовательности, которая содержит кодоны, кодирующие аминокислоты любой полипептидной цепи, обеспечивают возможность изменений последовательности, кодирующей данный ген. Так как каждый кодон состоит из трех нуклеотидов, и нуклеотиды, составляющие ДНК, ограничены четырьмя конкретными основаниями, существует 64 возможных сочетания нуклеотидов, 61 из которых кодируют аминокислоты (остальные три кодона кодируют сигналы окончания трансляции). «Генетический код», который показывает, какие кодоны кодируют какие аминокислоты, представлен в настоящем описании в виде таблицы 1. В результате многие аминокислоты определяются более чем одним кодоном. Например, аминокислоты аланин и пролин кодируются четырьмя триплетами серин и аргинин кодируются шестью триплетами, тогда как триптофан и метионин кодируются только одним триплетом. Такая вырожденность обеспечивает возможность варьирования состава оснований ДНК в широком диапазоне без изменения аминокислотной последовательности белков, кодируемых ДНК.
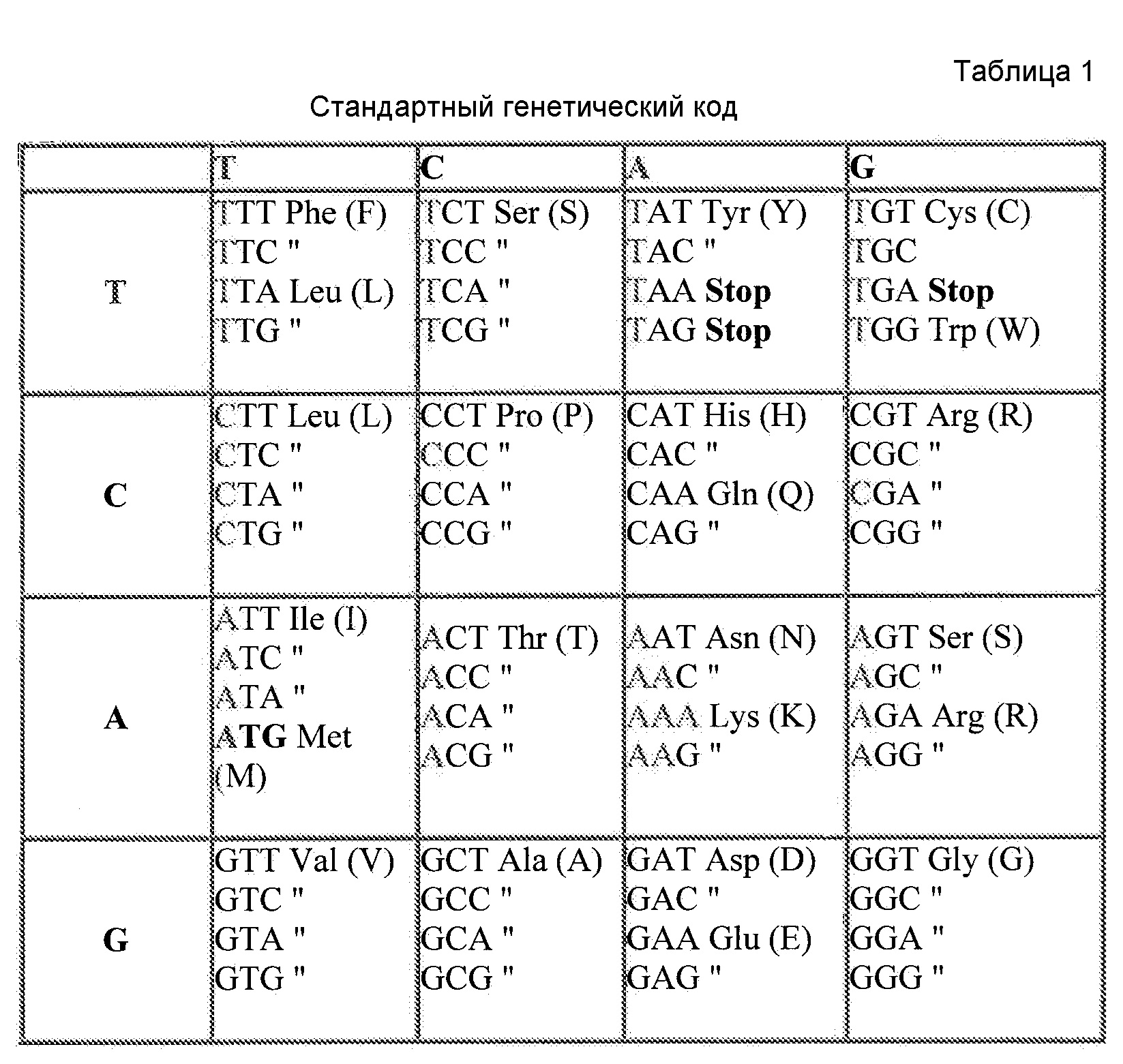
У многих организмов наблюдается смещение с использованием конкретных кодонов для кодирования встраивания конкретной аминокислоты в растущую пептидную цепь. Предпочтительное использование кодонов или смещение кодонов, различия в использовании кодонов между организмами, обеспечивается вырожденностью генетического кода и убедительно документально подтверждено для многих организмов. Смещение частоты использования кодонов часто коррелирует с эффективностью трансляции матричной РНК (мРНК), которая в свою очередь, как полагают, зависит наряду с прочим от свойств кодонов, подвергаемых трансляции, и доступности молекул транспортной РНК (тРНК). Преобладание выбранных тРНК в клетке обычно является отражением кодонов, наиболее часто используемых в синтезе пептидов. Соответственно, гены могут быть специально получены для оптимальной генной экспрессии в данном организме на основе оптимизации кодонов.
При наличии большого количества генных последовательностей, имеющихся для широкого круга видов животных, растений и микроорганизмов, можно рассчитать относительные частоты использования кодонов. Таблицы использования кодонов общедоступны и могут быть применены разными способами. См. публикацию Nakamura с соавторами, Nucl. Acids Res. 28: 292 (2000). Используя указанную или сходные таблицы, специалист в данной области может применить частоты по отношению к любой данной полипептидной последовательности и получить фрагмент нуклеиновой кислоты оптимизированной по кодонам кодирующей области, которая кодирует данный полипептид, но которая использует кодоны, оптимальные для данного вида. Настоящее изобретение относится к оптимизированным по кодонам формам OrfA, OrfB, химерной OrfC, PPT-азы и/или других вспомогательных белков согласно изобретению, которые описаны в настоящей публикации далее.
Термин «идентичность в процентах», который известен в данной области, означает взаимосвязь между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, которую определяют при сравнении последовательностей. В данной области «идентичность» также означает степень последовательности родства между полипептидными или полинуклеотидными последовательностями, в каждом соответствующем случае, которое определяют по совпадению между цепями таких последовательностей. «Идентичность» и «сходство» легко можно вычислить известными способами, включая без ограничения способы, раскрытые в публикациях:

Способы определения идентичности предназначены для получения наилучшего совпадения между тестируемыми последовательностями. Способы определения идентичности и сходства использованы в общедоступных компьютерных программах. Выравнивания последовательностей и вычисления идентичности в процентах можно осуществлять, например, используя программу AlignX в пакете Vector NTI® (Invitrogen, Carlsbad, CA) или программу MegAlign™ в комплекте вычислительных программ для биоинформатики LASERGENE (DNASTAR Inc., Madison, WI). Множественное выравнивание последовательностей осуществляют, используя «способ выравнивания Clustal», который включает в себя несколько вариантов алгоритма, включая «способ выравнивания Clustal V», соответствующий способу выравнивания, обозначаемому Clustal V (раскрыт Higgins и Sharp, CABIOS. 5: 151-153 (1989); Higgins, D.G. с соавторами, Comput. Appl. Biosci., 8: 189-191 (1992)); и входящему в программу MegAlignTM комплекта вычислительных программ для биоинформатики LASERGENE (DNASTAR Inc.). В случае множественных выравниваний значения по умолчанию соответствуют штрафу за пробел GAP PENALTY=10 и штрафу за длину пробела GAP LENGTH PENALTY=10. Параметры по умолчанию для попарных выравниваний и вычисления процента идентичности белковых последовательностей с использованием способа Clustal равны: KTUPLE=1, GAP PENALTY=3, WINDOW=5 и DIAGONALS SAVED=5. В случае нуклеиновых кислот такие параметры равны: KTUPLE-2, GAP PENALTY-5, WINDOW=4 и DIAGONALS SAVED=4. После выравнивания последовательностей с использованием программы Clustal V можно получить «идентичность в процентах», просматривая таблицу «расстояний последовательностей» в той же программе. Кроме того, доступен «способ выравнивания Clustal W», который соответствует способу выравнивания, названному Clustal W (описанному Higgins и Sharp, CABIOS. 5:151-153 (1989); Higgins, D.G. с соавторами, Comput. Appl. Biosci. 8: 189-191(1992)) и входящему в программу MegAlignTM v6.1 комплекта вычислительных программ для биоинформатики LASERGENE (DNASTAR Inc.). Параметры по умолчанию для множественного выравнивания (GAP PENALTY=10, GAP LENGTH PENALTY=0,2, Delay Divergen Seqs(%)=30, DNA Transition Weight=0,5, Protein Weight Matrix = Gonnet Series, DNA Weight Matrix = IUB). После выравнивания последовательностей с использованием программы Clustal W можно получить «идентичность в процентах», просматривая таблицу «расстояний последовательностей» в той же программе.
Термин «компьютерная программа для анализа последовательностей» относится к любому компьютерному алгоритму или компьютерной программе, которая применима для анализа нуклеотидных или аминокислотных последовательностей. «Компьютерная программа для анализа последовательностей» может быть коммерчески доступной или разработанной независимо. Типичная компьютерная программа для анализа последовательностей может включать без ограничения: 1) пакет программ GCG (Wisconsin Package Version 9,0, Genetics Computer Group (GCG), Madison, WI); 2) BLASTP, BLASTN, BLASTX (Altschul с соавторами, J. Mol. Biol, 215: 403-410 (1990)); 3) DNASTAR (DNASTAR, Inc. Madison, WI); 4) Sequencher (Gene Codes Corporation, Ann Arbor, MI); и 5) программу FASTA, включающую в себя алгоритм Смита-Ватермана
В контексте настоящей заявки будет понятно, что в том случае, когда компьютерную программу для анализа последовательностей используют для анализа, то результат такого анализа будет основан на «значениях по умолчанию» упоминаемой программы, если не указано иное. В используемом в настоящем описании смысле «значения по умолчанию» будут означать любой набор значений или параметров, которые исходно введены при первой установке компьютерной программы.
Стандартные методики рекомбинантной ДНК и молекулярного клонирования, используемые в настоящем изобретении, хорошо известны в данной области и описаны, например, в публикациях Sambrook с соавторами, Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (2000); и Silhavy с соавторами, Experiments with Gene Fusions, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1984); и Ausubel с соавторами, Current Protocols in Molecular Biology, опубликованной Greene Publishing Assoc. и Wiley-Interscience (1987 до настоящего времени).
Генетические манипуляции с рекомбинантными хозяевами, раскрытые в настоящем описании, можно осуществлять, используя стандартные генетические методики и скрининг, и можно осуществлять в любой клетке-хозяине, которая подходит для генетической обработки. В некоторых вариантах рекомбинантным хозяином может быть без ограничения любое высшее растение, включая как двудольные, так и однодольные растения, и потребляемые растения, включая культурные растения, и растения, используемые для получения масел. Таким образом, можно выбрать любой вид растения или растительную клетку, которые дополнительно описаны ниже.
Масла согласно настоящему изобретению также можно применять в некулинарных или не связанных с питанием способах и композициях. Некоторые из таких применений могут быть промышленными, косметическими или медицинскими. Масла согласно настоящему изобретению также можно использовать для любого применения, в котором масла согласно настоящему изобретению являются подходящими. В общем, масла согласно настоящему изобретению можно применять, например, с целью замены минеральных масел, сложных эфиров, жирных кислот или животных жиров в различных применениях, например, в качестве смазочных материалов, присадок к смазкам, смазочно-охлаждающих жидкостей, жидкостей для гидравлических систем и огнестойких жидкостей для гидравлических систем. Масла согласно настоящему изобретению также можно применять в качестве материалов в способе получения модифицированных масел. Примеры способов модификации масел согласно настоящему изобретению включают фракционирование, гидрогенизацию, изменение содержания олеиновой кислоты или линоленовой кислоты в маслах и другие способы модификации, известные специалистам в данной области.
Примеры косметических применений масел согласно настоящему изобретению включают применение в качестве смягчающего средства в косметических композициях; в качестве замены вазелинового масла; в качестве составляющей части мыла или в качестве материала в способе получения мыла; в качестве составляющей части раствора для обработки ротовой полости; в качестве составляющей части композиции для обработки, предотвращающей старение; и в качестве составляющей части аэрозольного пенообразующего препарата для кожи и волос.
Кроме того, масла согласно настоящему изобретению можно использовать для медицинских применений. Например, масла согласно настоящему изобретению можно использовать для обеспечения защитного барьера для инфекции, и масла с высоким содержанием омега-9 жирных кислот можно применять для повышения приживаемости трансплантатов (патент США № 6210700).
Следует понимать, что вышесказанное представляет собой не ограничивающие примеры некулинарных применений, для которых масла согласно настоящему изобретению являются подходящими. Как указано ранее, масла и модифицированные масла согласно настоящему изобретению можно использовать, например, для замены минеральных масел, сложных эфиров, жирных кислот или животных жиров в случае всех применений, известных специалистам в данной области.
ПНЖК-синтаза
«Стандартный» или «классический» путь синтеза длинноцепочечных ПНЖК (ДЦ-ПНЖК) в эукариотических организмах заключается в элонгации и десатурации насыщенных жирных кислот со средней длиной цепи или мононенасыщенных жирных кислот, и такой путь был описан. Путь синтеза длинноцепочечных ПНЖК посредством ПНЖК-синтазы также был описан, и он сильно отличается от «стандартного» пути. В частности, ПНЖК-синтазы используют малонил-CoA в качестве источника углерода и продуцируют конечную ПНЖК без высвобождения промежуточных продуктов в каком-либо значимом количестве. Также в случае ПНЖК-синтаз соответствующие двойные связи в цис-конфигурации добавляются во время синтеза с использованием механизма, который не требует кислорода. В некоторых вариантах используют NADPH в качестве восстановителя во время циклов синтеза.
Настоящее изобретение относится к организмам-хозяевам (например, растениям, таким как соя), которые были генетически модифицированы для экспрессии ПНЖК-синтазы (либо эндогенно, либо в результате генетической обработки). В некоторых вариантах организм, который был генетически модифицирован для экспрессии ПНЖК-синтазы, при этом организм в природе (эндогенно без генетической модификации) не экспрессирует такой фермент, или, по меньшей мере, такую конкретную ПНЖК-синтазу или ее часть, с использованием которой организм подвергают генетической модификации, может быть назван в настоящем описании «гетерологичным» организмом-хозяином по отношению к модификации организма ПНЖК-синтазой или другим белком, который эндогенно не экспрессируется организмом. Генетические модификации согласно настоящему изобретению можно использовать для улучшения продукции ПНЖК в организме-хозяине, который эндогенно экспрессирует ПНЖК-синтазу, при этом организм дополнительно не модифицируют другой ПНЖК-синтазой или ее частью.
ПНЖК-синтаза согласно настоящему изобретению может содержать несколько многофункциональных белков (и может включать белки с одной функцией, в частности в случае ПНЖК-синтазы из морских бактерий), которые могут действовать вместе, осуществляя итеративный процессинг цепи жирной кислоты, а также неитеративный процессинг, включая транс-цис-изомеризацию и реакции восстановления еноила в выбранных циклах. Такие белки также могут быть названы в настоящем описании ферментным комплексом коровой ПНЖК-синтазы или коровой ПНЖК-синтазой. Общие функции отдельных доменов и мотивов, входящих в такие белки, известны в данной области и подробно описаны для разных ПНЖК-синтаз из морских бактерий и эукариотических организмов (см., например, патент США № 6140486, патент США № 6566583; Metz с соавторами, Science 293: 290-293 (2001); публикацию заявки на выдачу патента США № 2002/0194641; публикацию заявки на выдачу патента США № 2004/0235127; публикацию заявки на выдачу патента США № 2005/0100995 и WO 2006/135866). Домены могут встречаться в виде отдельного белка (например, домен и белок являются синонимами) или в виде двух или более (множества) доменов в одном белке, как описано выше. Доменная архитектура различных ПНЖК-синтаз из морских бактерий и представителей Thraustochytrium и структурные и функциональные характеристики генов и белков, составляющих такие ПНЖК-синтазы, были описаны (см., например, патент США № 6140486, патент США № 6566583, Metz с соавторами, Science 293: 290-293 (2001), публикацию заявки на выдачу патента США № 2002/0194641, публикацию заявки на выдачу патента США № 2004/0235127, публикацию заявки на выдачу патента США № 2005/0100995 и WO 2006/135866).
Многочисленные примеры полинуклеотидов, генов и полипептидов, обладающих активностью ПНЖК-синтазы, известны в данной области и могут быть использованы в генетически модифицированном хозяине, раскрытом в настоящем описании. Белки или домены ПНЖК-синтаз, которые применимы в настоящем изобретении, могут включать как бактериальные, так и небактериальные ПНЖК-синтазы. Небактериальная ПНЖК-синтаза представляет собой систему, которая происходит или получена из организма, который не является бактерией, такого как эукариот. Бактериальные ПНЖК-синтазы описаны, например, в публикации заявки на выдачу патента США № 2008/0050505. Могут быть получены генетически модифицированные растения согласно изобретению, которые включают функциональные домены небактериальных ПНЖК-синтаз с функциональными доменами бактериальных ПНЖК-синтаз, а также функциональными доменами или белками ПНЖК-синтаз из других систем PKS (содержащий повторы или модульный тип I, тип II или тип III) или систем FAS.
В некоторых вариантах ПНЖК-синтаза согласно настоящему изобретению содержит, по меньшей мере, следующие биологически активные домены, которые обычно содержатся в трех, четырех или большем количестве белков: (a) по меньшей мере, один домен еноил-АПБ-редуктазы (ER); (b) множественный домен (домены) ацилпереносящего белка (АПБ), (например, по меньшей мере, из одного-четырех или, по меньшей мере, пяти доменов АПБ, и в некоторых вариантах до шести, семи, восьми, девяти, десяти или больше десяти доменов АПБ); (c) по меньшей мере, два домена β-кетоацил-АПБ-синтазы (KS); (d) по меньшей мере, один домен ацилтрансферазы (AT); (e) по меньшей мере, один домен β-кетоацил-АПБ-редуктазы (KR); (f) по меньшей мере, два домена FabA-подобной β-гидроксиацил-АПБ-дегидразы (DH); (g) по меньшей мере, один домен фактора, регулирующего длину цепи (CLF); и/или (h) по меньшей мере, один домен малонил-CoA:АПБ-ацилтрансферазы (MAT). В некоторых вариантах, ПНЖК-синтаза согласно настоящему изобретению также содержит, по меньшей мере, одну область, содержащую консервативный мотив активного сайта дегидратазы (DH).
В некоторых вариантах ПНЖК-синтаза содержит, по меньшей мере, следующие биологические активные домены: (a) по меньшей мере, один домен еноил-АПБ-редуктазы (ER); (b) по меньшей мере, пять доменов ацилпереносящего белка (АПБ); (c) по меньшей мере, два домена β-кетоацил-АПБ-синтазы (KS); (d) по меньшей мере, один домен ацилтрансферазы (AT); (e) по меньшей мере, один домен β-кетоацил-АПБ-редуктазы (KR); (f) по меньшей мере, два домена FabA-подобной β-гидроксиацил-АПБ-дегидразы (DH); (g) по меньшей мере, один домен фактора, регулирующего длину цепи (CLF); и (h) по меньшей мере, один домен малонил-CoA:АПБ-ацилтрансферазы (MAT). В некоторых вариантах ПНЖК-синтаза согласно настоящему изобретению также содержит, по меньшей мере, одну область или домен, содержащий консервативный мотив активного сайта дегидратазы (DH), который не является частью домена FabA-подобной DH. Структурные и функциональные характеристики каждого из таких доменов подробно описаны в публикации заявки на выдачу патента США № 2002/0194641, публикации заявки на выдачу патента США № 2004/0235127, публикации заявки на выдачу патента США № 2005/0100995, публикации заявки на выдачу патента США № 2007/0245431 и WO 2006/135866.
Существует три открытых рамки считывания, которые образуют коровую ПНЖК-синтазу Schizochytrium и которые были описаны ранее, например, в публикации заявки на выдачу патента США № 2007/0245431. Открытая рамка считывания имеет следующую доменную структуру.
Открытая рамка считывания A Schizochytrium (OrfA или Pfa1): OrfA представляет собой последовательность 8730 нуклеотидов (не включая стоп-кодон), которая кодирует последовательность 2910 аминокислот. В OrfA присутствуют двенадцать доменов: (a) один домен β-кетоацил-АПБ-синтазы (KS); (b) один домен малонил-CoA:АПБ-ацилтрансферазы (MAT); (c) девять доменов ацилпереносящего белка (АПБ); и (d) один домен кеторедуктазы (KR). Были выделены и секвенированы клоны геномной ДНК (плазмиды), кодирующие OrfA Schizochytrium sp. ATCC 20888 и дочернего штамма ATCC 20888, названного штаммом N230D Schizochytrium sp.
Геномный клон pJK1126 (названный геномным клоном pJK1126 OrfA, в форме плазмидного вектора E. coli, содержащего ген «OrfA» из Schizochytrium ATCC 20888) депонировали в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 8 июня 2006, и получил номер доступа ATCC PTA-7648.
Геномный клон pJK306 (названный геномным клоном pJK306 OrfA, в форме плазмиды E. coli, содержащей 5'-часть гена OrfA Schizochytrium sp. N230D (2,2 т.п.н. перекрываются с pJK320)) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 8 июня 2006 и получил номер доступа ATCC PTA-7641.
Геномный клон pJK320 (названный геномным клоном pJK320 OrfA, в форме плазмиды E. coli, содержащей 3'-часть гена OrfA и Schizochytrium sp. N230D (2,2 т.п.н. перерываются с pJK306)) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 8 июня 2006 и получил номер доступа ATCC PTA-7644.
Открытая рамка считывания B Schizochytrium (OrfB или Pfa2): OrfB представляет собой последовательность 6177 нуклеотидов (не включая стоп-кодон), которая кодирует последовательность 2059 аминокислот. В OrfB присутствуют четыре домена: (a) один домен кетоацил-АПБ-синтазы (KS); (b) один домен фактора, регулирующего длину цепи (CLF); (c) один домен ацилтрансферазы (AT); и (d) один домен еноил-АПБ-редуктазы (ER). Выделены и секвенированы геномные клоны ДНК (плазмиды), кодирующие OrfB из Schizochytrium sp. ATCC 20888 и дочернего штамма ATCC 20888, называемого штаммом N230D Schizochytrium sp.
Геномный клон pJK1129 (названный геномным клоном pJK1129 OrfB, в форме плазмидного вектора E. coli, содержащего ген «OrfB» из Schizochytrium ATCC 20888) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 8 июня 2006, и получил номер доступа ATCC PTA-7649.
Геномный клон pJK324 (названный геномным клоном pJK324 OrfB, в форме плазмиды E. coli, содержащей последовательность гена OrfB из Schizochytrium sp. N230D) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 8 июня 2006 и получил номер доступа ATCC PTA-7643.
Открытая рамка считывания C Schizochytrium (OrfC или Pfa3): OrfC представляет собой последовательность 4506 нуклеотидов (не включая стоп-кодон), которая кодирует последовательность 1502 аминокислот. В OrfC присутствуют три домена: (a) два домена FabA-подобной гидроксиацил-АПБ-дегидразы (DH); и (b) один домен еноил-АПБ-редуктазы (ER). Были выделены и секвенированы клоны геномной ДНК (плазмиды), кодирующие OrfC из Schizochytrium sp. ATCC 20888 и дочернего штамма ATCC 20888, названного штаммом N230D Schizochytrium sp.
Геномный клон pJK1131 (названный геномным клоном pJK1131 OrfC, в форме плазмидного вектора E. coli, содержащего ген «OrfC» из Schizochytrium ATCC 20888) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 8 июня 2006 и получил номер доступа ATCC PTA-7650.
Геномный клон pBR002 (названный геномным клоном pBR002 OrfC, в форме плазмидного вектора E. coli, содержащего последовательность гена OrfC из Schizochytrium sp. N230D) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 8 июня 2006 и получил номер доступа ATCC PTA-7642.
Кроме того, существуют три открытых рамки считывания, которые образуют коровую ПНЖК-синтазу Thraustochytrium, которые были описаны ранее. Каждая открытая рамка считывания имеет следующую доменную структуру.
Открытая рамка считывания A Thraustochitrium 23B (OrfA): OrfA представляет собой последовательность 8433 нуклеотидов (не включая стоп-кодон), которая кодирует последовательность 2811 аминокислот. Следующие домены присутствуют в OrfA Th. 23B: (a) один домен β-кетоацил-АПБ-синтазы (KS); (b) один домен малонил-CoA:АПБ-ацилтрансферазы (MAT); (c) восемь доменов ацилпереносящего белка (АПБ); и (d) один домен β-кетоацил-АПБ-редуктазы (KR).
Геномный клон Th23BOrfA_pBR812.1 (названный геномным клоном Th23BOrfA_pBR812.1, в форме плазмидного вектора E. coli, содержащего последовательность гена OrfA из Thraustochytrium 23B) был депонирован в Американской коллекции типов культур (ATCC), University Boulevard, Manassas, Va. 20110-2209 USA, 1 марта 2007 и получил номер доступа ATCC PTA-8232. Геномный клон Th23BOrfA_pBR811 (названный геномным клоном Th23BOrfA_pBR811, в форме плазмидного вектора E. coli, содержащего последовательность гена OrfA из Thraustochytrium 23B) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 1 марта 2007 и получил номер доступа ATCC PTA-8231.
Открытая рамка считывания B Thraustochytrium 23B (OrfB): OrfB представляет собой последовательность 5805 нуклеотидов (не включая стоп-кодон), которая кодирует последовательность 1935 аминокислот. В OrfB Th. 23B присутствуют следующие домены: (a) один домен β-кетоацил-АПБ-синтазы (KS); (b) один домен фактора, регулирующего длину цепи (CLF); (c) один домен ацилтрансферазы (AT); и (d) один домен еноил-АПБ-редуктазы (ER) домен. Геномный клон Th23BOrfB_pBR800 (названный геномным клоном Th23BOrfB_pBR800, в форме плазмидного вектора E. coli, содержащего последовательность гена OrfB из Thraustochytrium 23B) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 1 марта 2007 и получил номер доступа ATCC PTA-8227.
Открытая рамка считывания C Thraustochytrium 23B (OrfC): OrfC представляет собой последовательность 4410 нуклеотидов (не включая стоп-кодон), которая кодирует последовательность 1470 аминокислот. В OrfC Th. 23B присутствуют следующие домены: (a) два домена FabA-подобной β-гидроксиацил-АПБ-дегидразы (DH), при этом оба домена гомологичны белку FabA (ферменту, который катализирует синтез транс-2-деценоил-АПБ и обратимую изомеризацию такого продукта в цис-3-деценоил-АПБ); и (b) один домен еноил-АПБ-редуктазы (ER), гомологичный домену ER OrfB Schizochytrium. Геномный клон Th23BOrfC_pBR709A (названный геномным клоном Th23BOrfC_pBR709A, в форме плазмидного вектора E. coli, содержащего последовательность гена OrfC из Thraustochytrium 23B) был депонирован в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 1 марта 2007 и получил номер доступа ATCC PTA-8228.
Химерная или гибридная ПНЖК-синтаза: В некоторых вариантах ПНЖК-синтаза содержит домены, выбранные из любых доменов, описанных в настоящей публикации, при этом домены объединены (например, смешаны и сочетаются) с образованием полной ПНЖК-синтазы, удовлетворяющей минимальным требованиям, описанным в настоящей публикации. В некоторых вариантах генетически модифицированный организм согласно изобретению может быть дополнительно модифицирован с использованием, по меньшей мере, одного домена или биологически активного фрагмента другой ПНЖК-синтазы. В некоторых вариантах любой из доменов ПНЖК-синтазы может быть модифицирован по сравнению с его природной структурой с целью модификации или усиления функции такого домена в системе ПНЖК-синтазы (например, чтобы модифицировать типы ПНЖК или соотношения, продуцируемые системой). Такое смешивание доменов с получением химерной ПНЖК-синтазы описано в патентах и публикациях, упоминаемых в настоящем описании.
В некоторых вариантах ПНЖК-синтаза содержит ПНЖК-синтазу Schizochytrium, в которой OrfC из ПНЖК-синтазы Schizochytrium заменена OrfC из Thraustochytrium 23B. В некоторых вариантах такая химерная OrfC из Thraustochytrium 23B кодируется последовательностью нуклеиновой кислоты, которая оптимизирована в отношении использования кодонов Schizochytrium. В качестве не ограничивающего примера такой химерной OrfC плазмиду pThOrfC-synPS (названную pThOrfC-synPS, в форме плазмидного вектора E. coli, содержащего синтетическую «превосходно сшитую» OrfC PKS ПНЖК Thraustochytrium 23B, оптимизированную по кодонам для экспрессии в Schizochytrium или других гетерологичных хозяевах) депонировали в Американской коллекции типов культур (ATCC), 10801 University Boulevard, Manassas, Va. 20110-2209 USA, 1 марта 2007 и присвоили номер доступа ATCC PTA-8229 (также см. публикацию заявки на выдачу патента США № 2008/0022422).
Другие примеры генов и полипептидов ПНЖК-синтаз, которые можно использовать в генетически модифицированном организме согласно изобретению, включают без ограничения следующие оптимизированные по кодонам последовательности, созданные способами, описанными в настоящей публикации далее: SEQ ID NO: 1 (белок SzPUFA OrfA v3); SEQ ID NO: 2 (белок SzPUFA OrfB v3); SEQ ID NO: 3 (белок hSzThPUFA OrfC v3); SEQ ID NO: 6 (ген SzPUFA OrfA); SEQ ID NO: 7 (ген SzPUFA OrfB v3); и SEQ ID NO: 8 (ген hSzThPUFA OrfC v3), а также активный вариант, часть, фрагмент, или производное таких последовательностей, при этом такой ген кодирует или такой полипептид или белок обладает активностью ПНЖК-синтазы. Настоящее изобретение включает изолированный полинуклеотид или полипептид, содержащий или состоящий из одной или нескольких таких последовательностей.
Другие примеры генов и полипептидов ПНЖК-синтаз, которые можно использовать в изобретении, включают без ограничения гены или полипептиды ПНЖК-синтаз, имеющие, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичность последовательности с любым из геном или полипептидов ПНЖК-синтаз, описанных в настоящей публикации. Могут быть выбраны подходящие диапазоны между любыми из указанных значений (например, идентичность от 80% до 100%, идентичность от 85% до 100%, идентичность от 90% до 100%, идентичность от 95% до 100%, идентичность от 80% до 99%, идентичность от 85% до 99%, идентичность от 90% до 99% или идентичность от 95% до 99%). Следующие примеры генов и полипептидов ПНЖК-синтаз, которые можно использовать в генетически модифицированном организме согласно изобретению, включают без ограничения активный вариант, часть, фрагмент или производное любой из ПНЖК-синтаз или последовательностей, описанных в настоящей публикации, при этом такой ген кодирует или такой полипептид обладает активностью ПНЖК-синтазы.
В некоторых вариантах ПНЖК-синтаза может представлять собой ПНЖК-синтазу водорослей. В некоторых вариантах ПНЖК-синтаза может содержать аминокислотную последовательность, которая идентична на 80-100%, идентична на 85-100%, идентична на 90-100%, идентична на 95-100%, идентична на 80-99%, идентична на 85-99%, идентична на 90-99% или идентична на 95-99% аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах ПНЖК-синтаза может содержать аминокислотную последовательность SEQ ID NO: 1. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, может содержать последовательность нуклеиновой кислоты, идентичную на 80-100%, идентичную на 85-100%, идентичную на 90-100%, идентичную на 95-100%, идентичную на 80-99%, идентичную на 85-99%, идентичную на 90-99% или идентичную на 95-99% последовательности нуклеиновой кислоты SEQ ID NO: 6. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, может содержать последовательность нуклеиновой кислоты SEQ ID NO: 6. В некоторых вариантах ПНЖК-синтаза может содержать аминокислотную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична аминокислотной последовательности SEQ ID NO: 2. В некоторых вариантах ПНЖК-синтаза может содержать аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, может содержать последовательность нуклеиновой кислоты, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична последовательности нуклеиновой кислоты SEQ ID NO: 7. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, может содержать последовательность нуклеиновой кислоты SEQ ID NO: 7. В некоторых вариантах ПНЖК-синтаза может содержать аминокислотную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична аминокислотной последовательности SEQ ID NO: 3. В некоторых вариантах ПНЖК-синтаза содержит аминокислотную последовательность SEQ ID NO: 3. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, содержит последовательность нуклеиновой кислоты, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична последовательности нуклеиновой кислоты SEQ ID NO: 8. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ПНЖК-синтазу, содержит последовательность нуклеиновой кислоты SEQ ID NO: 8.
В некоторых вариантах ПНЖК-синтаза содержит аминокислотную последовательность SEQ ID NO: 1, 2 или 3 или любое их сочетание. В некоторых вариантах ПНЖК-синтаза содержит последовательность нуклеиновой кислоты SEQ ID NO: 6, 7 или 8 или любое их сочетание. В некоторых вариантах последовательность нуклеиновой кислоты кодирует аминокислотную последовательность SEQ ID NO: 1, 2 или 3 или любые сочетания или последовательности с любым процентом идентичности, описанным в настоящей публикации.
В некоторых вариантах последовательности других генов и/или полипептидов ПНЖК-синтаз можно найти в литературе и в биоинформационных базах данных, хорошо известных специалисту, с использованием последовательностей, раскрытых в настоящем описании и доступных в данной области. Например, такие последовательности можно идентифицировать при BLAST-поиске в общедоступных базах с известными последовательностями генов и полипептидов ПНЖК-синтаз. В таком способе идентификация может быть основана на способе выравнивания Clustal W с использованием параметров по умолчанию: штраф за пробел = 10, штраф за длину пробела = 0,1, и матрица весов для белков Gonnet серии 250.
Кроме того, последовательности генов или полипептидов ПНЖК-синтаз, раскрытые в настоящем описании или известные в данной области, можно применять для идентификации других гомологов ПНЖК-синтаз в природе. Например, каждый из фрагментов нуклеиновой кислоты ПНЖК-синтазы, раскрытый в настоящем описании, можно применять для выделения генов, кодирующих гомологичные белки. Выделение гомологичных генов с использованием зависимых от последовательностей протоколов хорошо известно в данной области. Примеры зависимых от последовательностей протоколов включают без ограничения (1) способы гибридизации нуклеиновых кислот; (2) способы амплификации ДНК и РНК, примерами которых являются различные применения методики амплификации нуклеиновых кислот (например, полимеразная цепная реакция (ПЦР), Mullis с соавторами, патент США № 4683202; лигазная цепная реакция (LCR), Tabor, S. с соавторами, Proc. Acad. Sci. USA 82:1074 (1985); или амплификация с замещением цепей (SDA), Walker с соавторами, Proc. Natl. Acad. Sci. U.S.A., 89: 392 (1992)); и (3) способы конструирования библиотек и скрининга посредством комплементации.
Все указанные способы легко могут быть осуществлены на практике специалистом в данной области с использованием известных или идентифицированных последовательностей, кодирующих целевые белки. В некоторых вариантах последовательности ДНК, окружающие целевую кодирующую последовательность ПНЖК-синтазы, также применимы в некоторых способах модификации и легко могут быть найдены специалистом в данной области в общедоступных базах данных. Способы создания генетических мутаций доступны и хорошо известны в данной области и могут быть использованы для создания мутантов.
Фосфопантетеинилтрансфераза
Фосфопантетеинилтрансферазы (PPT-азы) представляют собой семейство ферментов, которые были хорошо охарактеризованы в отношении синтеза жирных кислот, синтеза поликетидов и нерибосомного синтеза пептидов. В частности, домены АПБ, присутствующие в ферментах ПНЖК-синтазах, требуют активации в результате связывания кофактора (4-фосфопантетеина) от кофермента A с ацилпереносящим белком (АПБ). Связывание такого кофактора осуществляют PPT-азы. Если эндогенные PPT-азы организма-хозяина неспособны активировать АПБ-домены ПНЖК-синтаз, то необходимо обеспечение PPT-азой, которая способна осуществлять такую функцию. Последовательности многих PPT-аз известны, и определены кристаллические структуры (например, Reuter с соавторами, EMBO J. 18: 6823-31 (1999)), а также поведен мутационных анализ аминокислотных остатков, которые важны для активности (Mofid с соавторами, Biochemistry 43: 4128-36 (2004)).
Одним из примеров гетерологичной PPT-азы, которая, как было показано ранее, узнает АПБ-домены OrfA, описанные в настоящей публикации, в качестве субстратов, является белок Het I Nostoc sp. PCC 7120 (ранее называемого Anabaena sp. PCC 7120). Het I присутствует в кластере генов у бактерий Nostoc, и, как известно отвечает за синтез длинноцепочечных жирных гидроксикислот, которые являются компонентом гликолипидного слоя, присутствующего в гетероцистах такого организма
Het I вероятно активирует АПБ-домены белка Hgl E, присутствующего в таком кластере. Два АПБ-домена Hgl E имеют высокую степени гомологии последовательностей с АПБ-доменами, найденными в OrfA Schizochytrium и других ПНЖК-синтаз.
В некоторых вариантах можно полагать, что ПНЖК-синтаза содержит, по меньшей мере, один домен 4'-фосфопантетеинилтрансферазы (PPT-азы), или можно считать, что такой домен является вспомогательным доменом или белком для ПНЖК-синтазы. Структурные и функциональные характеристики PPT-аз подробно описаны, например, в публикации заявки на выдачу патента США № 2002/0194641, публикации заявки на выдачу патента США № 2004/0235127 и публикации заявки на выдачу патента США № 2005/0100995.
Многочисленные примеры генов и полипептидов, обладающих активностью PPT-азы, известны в данной области и могут быть использованы в генетически модифицированном организме согласно изобретению, если они способны активировать АПБ-домены конкретной используемой ПНЖК-синтазы. Примеры генов и полипептидов, которые можно использовать в генетически модифицированном организме согласно изобретению, могут включать без ограничения следующие оптимизированные по кодонам последовательности, описанные в настоящей публикации далее: SEQ ID NO: 5 (белок NoHetI v3) и SEQ ID NO: 10 (ген NoHetI v3).
Другие примеры генов и полипептидов PPT-аз, которые можно использовать в генетически модифицированном организме согласно изобретению, включают без ограничения гены и полипептиды PPT-аз, имеющие, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичность последовательностей с любой одной из PPT-аз или последовательностей, описанных в настоящей публикации. Могут быть выбраны применимые диапазоны между указанными значениями (например, идентичные на 80-100%, идентичные на 85-100%, идентичные на 90-100%, идентичные на 95-100%, идентичные на 80-99%, идентичные на 85-99%, идентичные на 90-99% или идентичные на 95-99%). Следующие примеры генов и полипептидов PPT-аз, которые можно использовать в генетически модифицированном организме согласно изобретению, включают без ограничения активный вариант, фрагмент, часть или производное любой из последовательностей PPT-аз, описанных в настоящей публикации, при этом такой ген кодирует или такой полипептид обладает активностью PPT-азы.
В некоторых вариантах PPT-аза может представлять собой PPT-азу водорослей. В некоторых вариантах PPT-аза может содержать аминокислотную последовательность, которая идентична на 80-100%, идентична на 85-100%, идентична на 90-100%, идентична на 95-100%, идентична на 80-99%, идентична на 85-99%, идентична на 90-99%, или идентична на 95-99% аминокислотной последовательности SEQ ID NO: 5. В некоторых вариантах PPT-аза может содержать аминокислотную последовательность SEQ ID NO: 5. В некоторых вариантах последовательность нуклеиновой кислоты кодирующая PPT-азу, может содержать последовательность нуклеиновой кислоты, идентичную на 80-100%, идентичную на 85-100%, идентичную на 90-100%, идентичную на 95-100%, идентичную на 80-99%, идентичную на 85-99%, идентичную на 90-99% или идентичную на 95-99% последовательности нуклеиновой кислоты SEQ ID NO: 10. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая PPT-азу, может содержать последовательность нуклеиновой кислоты SEQ ID NO: 10. В некоторых вариантах последовательность нуклеиновой кислоты кодирует аминокислотную последовательность SEQ ID NO: 5 или последовательность с любым процентом идентичности с такой последовательностью, указанным в настоящем описании.
В некоторых вариантах осуществления настоящего изобретения PPT-аза может быть получена для продуцирования и/или накопления PPT-азы в гетерологичном хозяине.
В некоторых вариантах ген и/или полипептид, кодирующий PPT-азу, можно применять для идентификации других последовательностей генов и/или полипептидов PPT-аз и/или можно применять для идентификации гомолога PPT-азы в других клетках. Такие последовательности, кодирующие PPT-азу, можно найти, например, в литературе и/или в биоинформационных базах данных, хорошо известных специалисту. Например, идентификацию последовательности, кодирующей PPT-азу в другом типе клеток, с использованием биоинформатики можно осуществить при BLAST-поиске (как описано выше) в общедоступных базах с использованием известной последовательности ДНК и полипептида PPT-азы, такой как любая из последовательностей, указанных выше. Идентификация основана на способе выравнивания Clustal W с использованием параметров по умолчанию: штраф за пробел = 10, штраф за длину пробела = 0,1, и матрица весов для белков Gonnet серии 250.
В некоторых вариантах генетически модифицированное растение (например, соя), его потомок, клетка, ткань или часть содержит ПНЖК-синтазу и PPT-азу. В некоторых вариантах генетически модифицированное растение (например, соя), его потомок, клетка, ткань или часть содержит последовательности нуклеиновых кислот (i) и (ii) в одном рекомбинантном экспрессирующем векторе. В некоторых вариантах генетически модифицированное растение (например, соя), его потомок, клетка, ткань или часть содержит последовательности нуклеиновых кислот (i) и (ii) в разных рекомбинантных экспрессирующих векторах.
Ацил-CoA-синтетаза
Настоящее изобретение относится к белкам ацил-CoA-синтетазам (ACoAS), которые катализируют превращение свободных жирных кислот (СЖК) длинноцепочечных ПНЖК в ацил-CoA. Организм с эндогенной продукцией ПНЖК ПНЖК-синтазой Schizochytrium, имеет одну или несколько ACoAS, которые способны превращать свободные жирные кислоты, являющиеся продуктами ПНЖК-синтазы, в ацил-CoA. Таким образом, Schizochytrium, а также другие организмы, которые эндогенно содержат ПНЖК-синтазу (например, другие Thraustochytrids) или другие организмы, которые превращают ПНЖК-СЖК в ацил-CoA (такие как Thalassiosira pseudonana или Crypthecodinium cohnii), могут являться источниками генов, кодирующих ферменты, которые применимы для обеспечения или повышения накопления продуктов ПНЖК-синтазы, экспрессированной в гетерологичном хозяине. Другие последовательности ACoAS были описаны в публикации заявки на выдачу патента США № 2007/0245431.
Многочисленные примеры генов и полипептидов, обладающих активностью ACoAS, известны в данной области и могут быть использованы в генетически модифицированном организме согласно изобретению. Примеры генов и полипептидов, которые можно использовать в генетически модифицированном организме согласно изобретению, могут включать без ограничения следующие оптимизированные по кодонам последовательности, описанные в настоящей публикации ниже: SEQ ID NO: 4 (белок SzACS-2 v3) и SEQ ID NO: 9 (ген hSzThACS-2 v3).
Другие примеры генов и полипептидов ACoAS, которые можно использовать в генетически модифицированном организме согласно изобретению, включают без ограничения гены и полипептиды ACoAS, имеющие, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичность последовательности с любой из ACoAS или последовательностей, описанных в настоящей публикации. Могут быть выбраны применимые диапазоны между любыми из таких значений (например, идентичные на 80-100%, идентичные на 85-100%, идентичные на 90-100%, идентичные на 95-100%, идентичные на 80-99%, идентичные на 85-99%, идентичные на 90-99% или идентичные на 95-99%). Другими примерами генов и полипептидов ACoAS, которые можно использовать в генетически модифицированном организме согласно изобретению, включают без ограничения активный вариант, фрагмент, часть или производное любой из последовательностей ACoAS, описанных в настоящей публикации, при этом такой ген кодирует или такой полипептид обладает активностью ACoAS.
В некоторых вариантах ACoAS может представлять собой ACoAS водорослей. В некоторых вариантах ACoAS может содержать аминокислотную последовательность, которая идентична на 80-100%, идентична на 85-100%, идентична на 90-100%, идентична на 95-100%, идентична на 80-99%, идентична на 85-99%, идентична на 90-99% или идентичную на 95-99% аминокислотной последовательности SEQ ID NO: 4. В некоторых вариантах ACoAS может содержать аминокислотную последовательность SEQ ID NO: 4. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ACoAS, может содержать последовательность нуклеиновой кислоты, идентичную на 80-99%, идентичную на 85-99%, идентичную на 90-99%, идентичную на 80-95% или идентичную на 85-95% последовательности нуклеиновой кислоты SEQ ID NO: 9. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ACoAS, может содержать последовательность нуклеиновой кислоты SEQ ID NO: 9. В некоторых вариантах последовательность нуклеиновой кислоты, кодирующая ACoAS, содержит последовательность нуклеиновой кислоты SEQ ID NO: 34. В некоторых вариантах последовательность нуклеиновой кислоты кодирует аминокислотную последовательность SEQ ID NO: 4 или последовательность с любым процентом идентичности с такой последовательностью, указанным в настоящем описании.
В некоторых вариантах осуществления настоящего изобретения ACoAS может быть получена в случае продуцирования и/или накопления ACoAS в гетерологичном хозяине, а также в случае улучшенной продукции и/или накопления ACoAS в эндогенном хозяине.
В некоторых вариантах ген и/или полипептид, кодирующий ACoAS, может быть использован для идентификации других последовательностей генов и/или полипептидов ACoAS и/или может быть использован для идентификации гомолога ACoAS в других клетках. Такие последовательности, кодирующие ACoAS, могут быть найдены, например, в литературе и/или в биоинформационных базах данных, хорошо известных специалисту. Например, идентификация последовательности, кодирующей ACoAS, в другом типе клеток с использованием биоинформатики может быть осуществлена посредством BLAST-поиска (который описан выше) в общедоступных базах данных с использованием известной последовательности ДНК и полипептида, кодирующей ACoAS, такой как любая из последовательностей, приведенных в настоящем описании. Идентификация основана на способе выравнивания Clustal W с использованием параметров по умолчанию: штраф за пробел = 10, штраф за длину пробела = 0,1 и матрица весов для белков Gonnet серии 250.
В некоторых вариантах генетически модифицированное растение (например, соя), его потомок, клетка, ткань или часть содержит ПНЖК-синтазу и ACoAS или ПНЖК-синтазу, PPT-азу и ACoAS. В некоторых вариантах генетически модифицированное растение (например, соя), его потомок, клетка, ткань или часть содержит последовательности нуклеиновых кислот (i), (ii) или (iii) или любое их сочетание, находятся в одном рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислот (i), (ii) и (iii) находятся в разных рекомбинантных экспрессирующих векторах. В некоторых вариантах последовательности нуклеиновых кислот (i) и (ii) находятся в одном рекомбинантном экспрессирующем векторе, а последовательность нуклеиновой кислоты (iii) находится в другом рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислот (i) и (iii) находятся в одном рекомбинантном экспрессирующем векторе, а последовательность нуклеиновой кислоты (ii) находится в другом рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислот (ii) и (iii) находятся в одном рекомбинантном экспрессирующем векторе, а последовательность нуклеиновой кислоты (i) находится в другом рекомбинантном экспрессирующем векторе. В некоторых вариантах последовательности нуклеиновых кислот (i), (ii) или (iii) или любое их сочетание находятся под контролем одного или нескольких специфичных для семян промоторов.
Способы получения генетически модифицированных организмов
Чтобы получить значимо высокие уровни одной или нескольких требуемых полиненасыщенных жирных кислот, растение может быть генетически модифицировано с целью введения ПНЖК-синтазы в растение. Настоящее изобретение также относится к способам улучшения или повышения эффективности такой генетической модификации и, в частности, улучшения или усиления продукции и/или накопления конченого продукта ПНЖК-синтазы, например, ПНЖК.
Способы экспрессии генов в генетически модифицированном организме, включая без ограничения растения, известны в данной области. В некоторых вариантах кодирующая область генов ПНЖК-синтазы, которые необходимо экспрессировать, могут быть оптимизированы по кодонам для клетки-хозяина, являющейся мишенью, как описано ниже. Экспрессия генов в рекомбинантных клетках-хозяевах, включая без ограничения растительные клетки, может требовать наличия промотора, оперативно связанного с представляющей интерес кодирующей областью, и/или терминатора транскрипции. Ряд промоторов можно использовать для конструирования векторов для генов, включая без ограничения специфичный для семян промотор (например, PvDlec2, LfKCS3, FAE 1, ВоАПБ или BnaNapinC) или специфичный для листьев промотор (например, промотор убиквитина или CsVMV). Другие не ограничивающие примеры промоторов, которые можно использовать в настоящем изобретении, включают промотор ацилпереносящего белка, раскрытый в WO 1992/18634, промотор бета-фазеолина Phaseolus vulgaris и укороченные варианты, раскрытые Slightom с соавторами (Proc. Natl. Acad. Sci. U.S.A. 80: 1897-1901; 1983); Sengupta-Gopalan с соавторами (Proc. Nat. Acad. Sci. 82: 3320-3324; 1985); van der Geest с соавторами (Plant Mol. Biol. 33: 553-557; 1997) и Bustos с соавторами (EMBO J. 10: 1469-1479; 1991).
В некоторых вариантах осуществления настоящего изобретения рекомбинантный вектор представляет собой сконструированную (например, искусственно полученную) молекулу нуклеиновой кислоты, которую применяют в качестве средства для обработки выбранной последовательности нуклеиновой кислоты и для введения такой последовательности нуклеиновой кислоты в клетку-хозяина. Таким образом, рекомбинантный вектор подходит для применения при клонировании, секвенировании и/или другой обработке выбранной последовательности нуклеиновой кислоты, такой как экспрессия и/или доставка выбранной последовательности нуклеиновой кислоты в клетку-хозяина с образованием рекомбинантной клетки. Такой вектор обычно содержит гетерологичные последовательности нуклеиновых кислот, то есть последовательности нуклеиновых кислот, которые не встречаются в природе вблизи последовательности нуклеиновой кислоты, которые необходимо клонировать или доставить, хотя вектор также может содержать регуляторные последовательности нуклеиновой кислоты (например, промоторы, нетранслируемые области), которые встречаются в природе вблизи молекул нуклеиновых кислот согласно настоящему изобретению или которые применимы для экспрессии молекул нуклеиновых кислот согласно настоящему изобретению. Вектор может быть либо в виде РНК, либо в виде ДНК, либо прокариотическим, либо эукариотическим, и обычно представляет собой плазмиду. Вектор может поддерживаться в виде внехромосомного элемента (например, плазмиды), или он может быть интегрирован в хромосому рекомбинантного организма (например, микроорганизма или растения). Полный вектор может сохраняться в клетке-хозяине или в определенных условиях плазмидная ДНК может быть делетирована, при этом остается молекула нуклеиновой кислоты согласно настоящему изобретению. Интегрированная молекула нуклеиновой кислоты может быть под контролем хромосомного промотора, под контролем нативного или плазмидного промотора или под контролем сочетания нескольких промоторов. В хромосому может быть интегрирована одна или множество копий молекулы нуклеиновой кислоты. Рекомбинантный вектор согласно настоящему изобретению может содержать, по меньшей мере, один селектируемый маркер.
В некоторых вариантах рекомбинантный вектор используемый в рекомбинантной молекуле нуклеиновой кислоты согласно настоящему изобретению является экспрессирующим вектором. В таких вариантах последовательность нуклеиновой кислоты, кодирующую продукт, который необходимо получить (например, ПНЖК-синтазу), встраивают в рекомбинантный вектор, чтобы получить рекомбинантную молекулу нуклеиновой кислоты. Последовательность нуклеиновой кислоты, кодирующую белок, который необходимо получить, встраивают в вектор таким образом, чтобы оперативно связать последовательность нуклеиновой кислоты с регуляторными последовательностями в векторе, которые обеспечивают возможность транскрипции и трансляции последовательности нуклеиновой кислоты в рекомбинантной клетке-хозяине.
Векторы, применимые для трансформации различных организмов-хозяев и клеток-хозяев, являются обычными векторами и описаны в литературе. Обычно вектор содержит селектируемый маркер и последовательности, обеспечивающие возможность автономной репликации или хромосомной интеграции в требуемом хозяине. Кроме того, подходящие векторы могут содержать область промотора, который несет регуляторные элемента инициации транскрипции, и область регуляции терминации транскрипции, между которыми может быть встроен фрагмент ДНК кодирующей области, чтобы обеспечить экспрессию встроенной кодирующей области. Обе регуляторные области могут быть получены из генов, гомологичных для трансформированной клетки-хозяина, хотя следует понимать, что такие регуляторные области также могут быть получены из генов, которые не являются нативными для конкретного вида, выбранного в качестве хозяина для продуцирования.
Настоящее изобретение относится к экспрессии одной или нескольких ацил-CoA-синтетаз, которые описаны и приведены в качестве примеров в настоящей публикации, с ПНЖК-синтазой, которая описана в настоящей публикации, и в экзогенной PPT-азой, которую используют отдельно или в сочетании с любой одной или несколькими методиками, описанными в настоящей публикации (например, любой одной, двумя, тремя или четырьмя методиками: оптимизацией кодонов, таргетингом в органеллы, усилением конкуренции ПНЖК-синтазы за малонил-CoA (например, благодаря ингибированию FAS) и/или экспрессией одной или нескольких ацилтрансфераз или родственных ферментов), чтобы повысить продукцию и/или накопление ПНЖК в гетерологичном хозяине.
Некоторые варианты осуществления изобретения относятся к направлению (таргетингу) экспрессии ферментов ПНЖК-синтаз, PPT-азы и/или любого одного или нескольких вспомогательных белков и/или направленных генетических модификаций в одну или несколько органелл хозяина. Например, в некоторых вариантах экспрессия системы ПНЖК-синтазы и PPT-азы может быть направлена в пластиду растения. В некоторых вариантах экспрессию ПНЖК-синтазы и PPT-азы направляют в цитозоль. В некоторых вариантах экспрессию ПНЖК-синтазы и PPT-азы направляют как в пластиду, так и в цитозоль растения. В любых таких вариантах другие мишени могут быть направлены в пластиду или цитозоль.
В некоторых вариантах ацил-CoA-синтетазы экспрессируются в цитозоле, превращая ДГК и/или другие свободные жирные кислоты ДЦ-ПНЖК в ацил-CoA, который, в свою очередь, может быть использован ацилтрансферазами.
В данной области известно множество последовательностей, направляющих в пластиды, и они могут быть использованы в вариантах, в которых гетерологичным хозяином является растение или растительная клетка и когда требуется таргетинг в пластиды.
Настоящее изобретение относится к применению таргетинга в органеллы (например, в пластиду или хлоропласт в растениях) с использованием экспрессии ПНЖК-синтаз, которые описаны в настоящей публикации, и экзогенной PPT-азы, который применяют отдельно или в сочетании с любой одной или несколькими методиками, описанными в настоящей публикации (например, любой одной, двумя, тремя или четырьмя методиками: оптимизацией кодонов, усилением конкуренции ПНЖК-синтазы за малонил-CoA (например, благодаря ингибированию FAS), экспрессией одной или нескольких ацил-CoA-синтетаз и/или экспрессией одной или нескольких ацилтрансфераз или родственных ферментов), чтобы увеличить продукцию и/или накопление ПНЖК в гетерологичном хозяине.
Таргетинг генных продуктов в пластиду или хлоропласт находится под контролем сигнальной последовательности, находящейся на амино-конце различных белков, которые отщепляются во время импорта с получением в результате зрелого белка (например, описание, относящееся к таргетингу в хлоропласты, см. в публикации Comai с соавторами, J. Biol. Chem. 263: 15104-15109 (1988)). Такие сигнальные последовательности могут быть слиты с гетерологичными генными продуктами, чтобы оказать влияние на импорт гетерологичных продуктов в хлоропласт (van den Broeck с соавторами, Nature 313: 358-363 (1985)). ДНК, кодирующая подходящие сигнальные последовательности, может быть выделена из кДНК, кодирующей белок RUBISCO, белок CAB, фермент EPSP-синтазу, белок GS2 и многие другие белки, которые, как известно, локализованы в хлоропластах.
В некоторых вариантах осуществления изобретения локализация белков, используемых в изобретении направлена в субклеточный компартмент, например, в пластиду или хлоропласт. Белки могут быть направлены в хлоропласт благодаря введению в их амино-конец транзитного пептида хлоропластов (CTP). Подобным образом, белки могут быть направлены в пластиду благодаря включению в их N-конец транзитного или сигнального пептида хлоропластов.
Встречающиеся в природе направляемые в хлоропласт белки, синтезируемые в виде более крупных белков-предшественников, содержащих амино-концевой направляющий в хлоропласты пептид, который направляет предшественник в аппарат импорта в хлоропласты, хорошо известны в данной области. Направляющие в хлоропласт пептиды обычно отщепляются специфичными эндопротеазами, локализованными в органеллах хлоропластах, с высвобождением при этом направляемого зрелого активного белка из предшественника в среду хлоропласта. Примеры последовательностей, кодирующих пептиды, которые подходят для управления таргетингом гена или генного продукта в хлоропласт или пластиду растительной клетки, включают CTP EPSPS петунии, CTP2 EPSPS и интрон Arabidopsis и другие, известные специалистам в данной области. Такие направляющие к мишени последовательности обеспечивают перенос требуемого экспрессируемого белка в структуру клетки, в которой он наиболее эффективно функционирует, или перенос требуемого экспрессируемого белка в области клетки, в которых сконцентрированы клеточные процессы, необходимые для требуемой фенотипической функции. Конкретные примеры направляющих в хлоропласт пептидов хорошо известными в данной области и включают транзитный пептид малой субъединицы рибулезобисфосфаткарбоксилазы Arabidopsis thaliana ats1A, транзитный пептид EPSPS Arabidopsis thaliana и транзитный пептид малой субъединицы рибулезобисфосфаткарбоксилазы Zea maize.
Оптимизированный транзитный пептид описан, например, van den Broeck с соавторами, Nature, 313: 358-363 (1985). Прокариотические и эукариотические сигнальные последовательности раскрыты, например, Michaelis с соавторами, Ann. Rev. Microbiol. 36: 425 (1982). Дополнительные примеры транзитных пептидов, которые можно использовать в изобретении, включают транзитные пептиды хлоропластов, такие как пептиды, описанные в
Chen и Jagendorf (J. Biol. Chem. 268: 2363-2367 (1993)) описали применение транзитного пептида хлоропластов для импорта гетерологичного трансгена. Такой применяемый пептид представляет собой транзитный пептид из гена rbcS Nicotiana plumbaginifolia (Poulsen с соавторами, Mol. Gen. Genet. 205: 193-200 (1986)). Один CTP, который функционировал в данном случае для локализации гетерологичных белков в хлоропласт, был получен из ацил-АПБ-тиоэстеразы Brassica napus.
Альтернативные способы локализации генов в хлоропласте или пластиде включает в себя трансформацию хлоропластов или пластид. Могут быть получены рекомбинантные растения, в которых только ДНК хлоропластов была изменена так, чтобы включить молекулы, описанные в настоящей публикации. Промоторы, которые функционируют в хлоропластах, известны в данной области (Hanley-Bowden с соавторами, Trends in Biochemical Sciences 12: 67-70 (1987)). Способы и композиции для получения клеток, содержащих хлоропласты, в которые была встроена гетерологичная ДНК, были описаны, например, Daniell с соавторами (патент США № 5693507) и Maliga с соавторами (патент США № 5451513).
Сочетания методик
Согласно настоящему изобретению при получении гетерологичного хозяина для продуцирования и накопления одной или нескольких целевых ПНЖК можно применять любую одну или несколько (любое сочетание) методик, описанных в настоящей публикации, для улучшения продуцирования и/или накопления ПНЖК в хозяине. Действительно, предполагается, что различные сочетания методик могут быть аддитивными или синергетическими и могут обеспечить улучшенное продуцирование и/или накопление ПНЖК, по сравнению с отсутствием одной или нескольких таких методик. Действительно, в примерах приведены иллюстративные методики получения ПНЖК в организме-хозяине.
Любое растение или растительная клетка, использующие такие сочетания модификаций или любую другую модификацию или сочетание модификаций, описанных в настоящей публикации, входит в объем изобретения. В некоторых вариантах такое растение дополнительно генетически модифицировано для экспрессии вспомогательного белка, как описано в настоящей публикации, для улучшения продуцирования и/или накопления ПНЖК (или других биологически активных продуктов ПНЖК-синтазы) хозяином (например, ACoAS, GPAT, LPAAT, DAGAT или ацетил-CoA-карбоксилазы (ACC-азы)). Кроме того, любая клетка-хозяин или организм-хозяин, использующий любые модификации или сочетание модификаций, описанных в настоящей публикации, входит в объем изобретения, так же как любые продукты, полученные из таких клеток или организмов, включая семена и масло, содержащие целевые ПНЖК.
В некоторых вариантах растения, которые генетически модифицируют согласно настоящему изобретению (например, растительные клетки-хозяева), включают без ограничения любые высшие растения, включая как двудольные, так и однодольные растения, и в частности, потребляемые растения, включая культурные растения, и особенно растения, используемые для получения масел. Такие растения могут включать без ограничения, например: сою, рапс, лен, кукурузу, сафлор, подсолнечник и табак. Таким образом, может быть выбран любой вид растения или растительная клетка. В некоторых вариантах растение относится к семейству Fabaceae (Leguminosae, семейство бобовых). В некоторых вариантах растение относится к роду Glycine. В некоторых вариантах растением является растением Glycine albicans, Glycine aphyonota, Glycine arenari, Glycine argyrea, Glycine canescens, Glycine clandestine, Glycine curvata, Glycine cyrtoloba, Glycine falcate, Glycine gracei, Glycine hirticaulis, Glycine hirticaulis subsp. leptosa, Glycine lactovirens, Glycine latifolia, Glycine latrobeana, Glycine microphylla, Glycine montis-douglas, Glycine peratosa, Glycine pescadrensis, Glycine pindanica, Gycine pullenii, Glycine rubiginosa, Glycine stenophita, Glycine syndetika, Glycine tabacina, Glycine tomentella, Glycine soja или Glycine max (соя). В некоторых вариантах растением является арахис, фасоль (Phaseolus vulgaris), кормовые бобы (Vicia faba) или горох (Pisum sativum).
«Части растения» в используемом в настоящем описании смысле включают любые части растения, включая без ограничения семена (включая зрелые семена и незрелые семена), пыльцу, зародыши, цветки, плоды, побеги, листья, корни, стволы, эксплантаты и т.д. В некоторых вариантах генетически модифицированное растение имеет геном, который модифицирован (например, мутирован или изменен) по сравнению с его нормальной (например, дикого типа или встречающейся в природе) формой, при этом достигается требуемый результат (например, улучшенная или модифицированная ПНЖК-синтаза и/или продуцирование и/или накопление требуемого продукта с использованием ПНЖК-синтазы). В некоторых вариантах генетическая модификация растения может быть осуществлена с использованием классического способа разработки линий и/или молекулярно-генетической методики. Способы получения трансгенного растения, посредством которых рекомбинантную молекулу нуклеиновой кислоты, кодирующую требуемую аминокислотную последовательность, включают в геном растения, известны в данной области. В некоторых вариантах растением, которое генетически модифицируют согласно настоящему изобретению, является растение, подходящее для потребления животными, включая человека.
Могут быть получены, отобраны или идентифицированы линии растений из описанных растений, оптимизированные в отношении особенно необходимого признака, например, устойчивости к заболеваниям, простоты трансформации растения, содержания и профиля масла и т.д. В некоторых вариантах линии растений могут быть отобраны в результате селекции растений или такими способами, как скрещивание с использованием маркера и культивирование. В некоторых вариантах могут быть использованы культуры растительных клеток, и их, например, не выращивают до дифференцированных растений и не культивируют с использованием обычных агротехнических приемов, а вместо этого выращивают и поддерживают в жидкой среде.
В некоторых вариантах растением может быть масличное растение, при этом масличные семена и/или масло в семенах масличного растения содержат ПНЖК, продуцируемые ПНЖК-синтазой. В некоторых вариантах такие масла могут содержать регистрируемое количество, по меньшей мере, одной целевой или основной ПНЖК, которая является продуктом ПНЖК-синтазы. В некоторых вариантах такие масла по существу могут не содержать промежуточных или побочных продуктов, которые не являются целевыми или основными ПНЖК-продуктами и которые не продуцируются в природе эндогенной системой FAS в растениях дикого типа (например, растения дикого типа продуцируют некоторые ПНЖК с более короткими или имеющими среднюю длину цепями, такие как 18-углеродные ПНЖК, посредством системы FAS, но при этом будут новые или дополнительные жирные кислоты, продуцируемые в растении в результате генетической модификации ПНЖК-синтазой).
Что касается получения генетически модифицированных растений, то способы генетического конструирования растений хорошо известны в данной области. Например, были разработаны многочисленные способы трансформации растений, включая протоколы биологической и физической трансформации двудольных растений, а также однодольных растений (например,

Кроме того, доступны векторы и способы культивирования in vitro растительных клеток или трансформации тканей и регенерации растений, см., например, публикации
Настоящее изобретение относится к изолированной молекуле нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, выбранную из последовательностей SEQ ID NO: 6-10, а также к изолированной молекуле нуклеиновой кислоты, содержащей модификацию или мутацию такой последовательности, которая описана в настоящей публикации. Настоящее изобретение относится к изолированным полипептидам, содержащим аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 1-5, а также к изолированному полипептиду, содержащему модификацию или мутацию такой последовательности, которая описана в настоящей публикации.
Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7361. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7362. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7363. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7365. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7368. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7369. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7370. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB100518. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB101476. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9166. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9167. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7379. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7380. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9323. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9330. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9337. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9338. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9344. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9396. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB101412. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7733. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB7734. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB101493. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB109507. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB109508. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB109509. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9151. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB108207. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB108208. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB108209. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9159. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB9147. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB108224. Настоящее изобретение относится к рекомбинантному экспрессирующему вектору pDAB108225.
Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7361. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7362. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7363. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7365. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7368. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7369. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7370. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB100518. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB101476. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9166. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9167.
Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7379. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7380. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9323. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9330. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9337. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9338. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9344. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9396. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB101412. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7733. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB7734.
Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB101493. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB109507. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB109508. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB109509. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9151. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB108207. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB108208. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB108209. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9159. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB9147. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB108224. Настоящее изобретение относится к растению сои, его потомку, клетке, ткани, семени или части, содержащей рекомбинантный экспрессирующий вектор pDAB108225.
В используемом в настоящем описании смысле термин «трансфекция» применяют по отношению к любому способу, посредством которого экзогенная молекула нуклеиновой кислоты (например, рекомбинантная молекула нуклеиновой кислоты) может быть встроена в клетку. Термин «трансформация» может быть использован взаимозаменяемо с термином «трансфекция», когда такой термин используют по отношению к введению молекул нуклеиновых кислот в клетки микроорганизмов, такие как клетки водорослей, бактерий и дрожжей, или в растительные клетки. В случае систем микроорганизмов и растительных систем термин «трансформация» используют для описания наследуемого изменения вследствие приобретения экзогенных нуклеиновых кислот микроорганизмом или растением, и термин по существу является синонимом термина «трансфекция». В некоторых вариантах способы трансфекции включают без ограничения трансформацию, бомбардировку частицами, диффузию, активный транспорт, обработку в ультразвуковой бане, электропорацию, микроинъекцию, липофекцию, адсорбцию, инфекцию и слияние протопластов.
Широко применяемый способ введения экспрессирующего вектора в растения основан на природной системе трансформации Agrobacterium. Horsch с соавторами, Science 227: 1229 (1985). A. tumefaciens и A. rhizogenes являются почвенными патогенными бактериями растений, которые, как известно, применимы для генетической трансформации растительных клеток. Плазмиды Ti и Ri A. tumefaciens и A. rhizogenes, соответственно, несут гены, отвечающие за генетическую трансформацию растения. Kado, C. I., Crit. Rev. Plant. Sci. 10: 1 (1991). Описания векторных систем Agrobacterium и способов опосредованного Agrobacterium переноса генов также доступны, например, в публикациях Gruber с соавторами, выше, Miki с соавторами, выше, Moloney с соавторами, Plant Cell Reports 8: 238 (1989) и патентах США № 4940838 и 5464763.
Другим известным способом трансформации растений является опосредованная микрочастицами трансформация, при которой ДНК наносят на поверхность микрочастиц. В таком способе экспрессирующий вектор вводят в растительные ткани с помощью баллистического устройства, которое ускоряет микрочастицы до скоростей, достаточных для проникновения через стенки и мембраны растительных клеток.

Еще одним способом физической доставки ДНК в растения является обработка клеток-мишеней ультразвуком. Zhang с соавторами, Bio/Technology 9:996 (1991). Также, использовали липосомы или слияние сферопластов для введения экспрессирующих векторов в растения. Deshayes с соавторами, EMBO J., 4: 2731 (1985), Christou с соавторами, Proc. Natl. Acad. Sci. USA 84: 3962 (1987). Также сообщалось о прямом захвате ДНК в протопласты с использованием преципитации CaCl2, поливинилового спирта или поли-L-орнитина. Hain с соавторами, Mol. Gen. Genet. 199: 161 (1985) и Draper с соавторами, Plant Cell Physiol. 23: 451 (1982). Также была описана электропорация протопластов и целых клеток и тканей.

Кроме того, также можно использовать «усы» карбида кремния (Kaepler с соавторами, 1990, Plant Cell Reports) в трансформации растений с применением, например, методики пропитывания цветков погружением (Clough and Bent, Plant J. 16: 735-743 (1998)). Конкретная методика трансформации растений может варьировать в определенной степени в зависимости от выбранного вида растения и выбранного типа растительной клетки для трансформации (например, типов клеток, полученных из проростков, например, из гипокотилей и семядолей или ткани зародыша).
После введения генетической конструкции в растительные клетки такие растительные клетки могут быть выращены, и после появления дифференцирующейся ткани, такой как ткань побегов и корней, могут быть регенерированы взрослые растения. В некоторых вариантах можно регенерировать множество растений. Методики регенерации растений известны специалистам в данной области, и их можно найти, например, в:

В некоторых вариантах генетически модифицированное растение, описанное в настоящей публикации, можно культивировать в среде для ферментации или выращивать в подходящей среде, такой как почва. В некоторых вариантах подходящая ростовая среда для высших растений может включать любую ростовую среду для растений, включая без ограничения почву, песок, любую другую состоящую из частиц среду, которая поддерживает рост корней (например, вермикулит, перлит и т.д.) или гидропонную культуру, а также с использованием подходящего освещения, воды и питательных добавок, которые оптимизируют рост высшего растения.
Специалисту в данной области будет понятно, что применение методики рекомбинантной ДНК может улучшить регуляцию экспрессии трансфицированных молекул нуклеиновых кислот за счет обработки, изменяющей, например, количество копий молекул нуклеиновых кислот в клетке-хозяине, эффективность, с которой такие молекулы нуклеиновых кислот транскрибируются, эффективность, с которой полученные в результате транскрипты транслируются, и эффективность посттрансляционных модификаций. Кроме того, посредством генной инженерии может быть получена последовательность промотора с целью повышения уровня экспрессии по сравнению с нативным промотором. Основанные на рекомбинации методики, применимые для регуляции экспрессии молекул нуклеиновых кислот, включают без ограничения интеграцию молекул нуклеиновых кислот в одну или несколько хромосом клетки-хозяина, добавление к плазмиде последовательностей для стабилизации вектора, замены или модификации сигналов регуляции транскрипции (например, промоторов, операторов, энхансеров), замены или модификации сигналов регуляции трансляции (например, участков связывания с рибосомой, последовательностей Шайна-Далгарно), модификацию молекул нуклеиновых кислот так, чтобы они соответствовали использованию кодонов в клетке-хозяине, и делецию последовательностей, которые дестабилизируют транскрипты.
В некоторых вариантах растение может включать такие растения, которые, как известно, продуцируют соединения, применяемые в качестве фармацевтических средств, корригентов, нутрицевтиков, функциональных пищевых ингредиентов или косметически активных средств, или растения, которые сконструированы генетически с целью продуцирования таких соединений/средств.
Все указанные варианты осуществления изобретения применимы к обсуждению любого из генетически модифицированных организмов и способов получения и применения таких организмов, которые описаны в настоящей публикации.
Продукты генетически модифицированных организмов
В некоторых вариантах генетически модифицированный организм согласно изобретению продуцирует одну или несколько полиненасыщенных жирных кислот, включая без ограничения ЭПК (C20:5, n-3), ДГК (C22:6, n-3), ДПК (C22:5, n-6 или n-3), АРК (C20:4, n-6), ГЛК (C18:3, n-6), АЛК (C18:3, n-3) и/или СДК (C18:4, n-3)), и в некоторых вариантах одну или несколько ПНЖК с более длинными цепями, включая без ограничения ЭПК (C20:5, n-3), ДГК (C22:6, n-3), ДПК (C22:5, n-6 или n-3) или ДТК (C22:4, n-6) или любое их сочетание. В некоторых вариантах генетически модифицированное растение согласно изобретению продуцирует одну или несколько полиненасыщенных жирных кислот, включая без ограничения ЭПК (C20:5, n-3), ДГК (C22:6, n-3) и/или ДПК (C22:5, n-6 или n-3), или любое их сочетание. В некоторых вариантах генетически модифицированное растение согласно изобретению не имеет высокого олеинового фона.
В некоторых вариантах генетически модифицированным организмом является растение, которое было генетически модифицировано, чтобы оно рекомбинантно экспрессировало ПНЖК-синтазу и PPT-азу, которые описаны в настоящей публикации. В некоторых вариантах такое растение было дополнительно генетически модифицировано для экспрессии вспомогательного белка, который описан в настоящей публикации, с целью улучшения продуцирования и/или накопления ПНЖК (или других биологически активных продуктов ПНЖК-синтазы) хозяином (например, ACoAS, GPAT, LPAAT, DAGAT или ACC-азы).
Некоторые варианты осуществления настоящего изобретения относятся к получению полиненасыщенных жирных кислот с требуемой длиной цепи и с необходимым количеством двойных связей и также получению из масличных семян и масел, получаемых из генетически модифицированных растений, описанных в настоящей публикации (например, получению из масла и семян таких растений), содержащих такие ПНЖК. Примеры ПНЖК, которые можно получать согласно настоящему изобретению, включают без ограничения ДГК (докозагексаеновую кислоту (C22:6, n-3)), АРК (эйкозатетраеновую кислоту или арахидоновую кислоту (C20:4, n-6)), ДПК (докозапентаеновую кислоту (C22:5, n-6 или n-3)) и ЭПК (эйкозапентаеновую кислоту (C20:5, n-3)) и любые их сочетания. Настоящее изобретение позволяет получать коммерчески ценные липиды, обогащенные одной или несколькими требуемыми (целевыми или основными) ПНЖК посредством разработки генетически модифицированных растений с применением ПНЖК-синтазы, которая продуцирует ПНЖК.
В некоторых вариантах данная ПНЖК-синтаза, полученная из конкретного организма, будет продуцировать конкретную ПНЖК (конкретные ПНЖК), так что отбор ПНЖК-синтазы из конкретного организма будет приводить к продуцированию конкретных целевых или основных ПНЖК. В некоторых вариантах соотношение ПНЖК может отличаться в зависимости от выбора конкретной ПНЖК-синтазы и от того, как такая система отвечает на конкретные условия, в которых она экспрессируется. Например, применение ПНЖК-синтазы из Thraustochytrium 23B (ATCC № 20892) также может приводить к получению ДГК и ДПК(n-6) в качестве целевых или основных ПНЖК; однако в случае Thraustochytrium 23B отношение ДГК к ДПК(n-6) составляет 10:1 (и может быть в диапазоне от 8:1 до 40:1), тогда как у Schizochytrium соотношение обычно составляет 2,5:1. В некоторых вариантах данная ПНЖК-синтаза может быть модифицирована за счет получения смеси белков и доменов из разных ПНЖК-синтаз, или можно модифицировать домен или белок данной ПНЖК-синтазы, чтобы изменить целевой ПНЖК-продукт и/или соотношения.
В некоторых вариантах упоминание «промежуточных продуктов» или «побочных продуктов» ферментной системы, которая продуцирует ПНЖК, относится к любым продуктам, и в частности, продуктам в виде жирных кислот, которые продуцируются ферментной системой в ходе образования целевых или основных ПНЖК системы, но которые не являются основными или целевыми ПНЖК. В некоторых вариантах промежуточные и побочные продукты могут включать нецелевые жирные кислоты, которые продуцируются в природе растением дикого типа или исходным растением, используемым в качестве реципиента для указанной генетической модификации, но в данном случае расцениваются как промежуточные или побочные продукты, поскольку они продуцируются на более высоких уровнях в результате генетической модификации, по сравнению с уровнями, продуцируемыми растением дикого типа или исходным растением, используемым в качестве реципиента для указанной генетической модификации. В некоторых вариантах основная или целевая ПНЖК одной ферментной системы может быть промежуточным продуктом другой ферментной системы, в которой основным или целевым продуктом является другая ПНЖК. Например, при использовании стандартного пути получения ЭПК, такие жирные кислоты, как ГЛК, ДГЛК и СДК, в значительных количествах продуцируются в виде промежуточных продуктов (например, см, публикацию заявки на выдачу патента США № 2004/0172682). Подобным образом, и как проиллюстрировано в публикации заявки на выдачу патента США № 2004/0172682, при использовании стандартного пути получения ДГК кроме указанных выше жирных кислот в значительных количествах могут быть получены ЭТК и ЭПК (т.е. целевая ПНЖК в первом примере, указанном выше), и они могут присутствовать в значительно больших количествах в общем продукте, представленном жирными кислотами, чем сама целевая ПНЖК.
В некоторых вариантах, чтобы получить значимо высокие выходы одной или нескольких требуемых полиненасыщенных жирных кислот, растение может быть генетически модифицировано для введения системы ПНЖК-синтазы в растение. Известно, что растения не содержат эндогенную ПНЖК-синтазу, и поэтому настоящее изобретение предоставляет возможность получать растения с уникальными способностями продуцировать жирные кислоты. Настоящее изобретение относится к генетически сконструированным растениям для получения одной или нескольких ПНЖК в одном и том же растении, включая без ограничения ЭПК, ДГК, ДПК (n3 или n6), АРК, ГЛК, СДК и другие, включая любое их сочетание. Настоящее изобретение позволяет создавать любое из ряда «дизайнерских масел» в разных соотношениях и формах. В некоторых вариантах применение ПНЖК-синтазы из конкретных морских организмов, описанных в настоящей публикации, может расширить диапазон получения ПНЖК и успешно получать такие ПНЖК в температурных диапазонах, используемых для выращивания большинства культурных растений.
В некоторых вариантах «по существу не содержит» промежуточных или побочных продуктов системы синтеза ПНЖК или не имеет промежуточных или побочных продуктов, присутствующих в значимых количествах, означает, что любые жирные кислоты, являющиеся промежуточными или побочными продуктами (нецелевые ПНЖК), которые образуются в генетически модифицированном растении (и/или частях растений и/или фракции масла, полученного из семян) в результате введения или присутствия ферментной системы для продуцирования ПНЖК (например, таких, которые не продуцируются в растении дикого типа или исходном растении, используемом в качестве реципиента для указанной генетической модификации), могут присутствовать в количестве, которое составляет менее 10% масс. от общего количества жирных кислот, менее 9% масс. от общего количества жирных кислот, менее 8% масс. от общего количества жирных кислот, менее 7% масс. от общего количества жирных кислот, менее 6% масс. от общего количества жирных кислот, менее 5% масс. от общего количества жирных кислот, менее 4% масс. от общего количества жирных кислот, менее 3% масс. от общего количества жирных кислот, менее 2% масс. от общего количества жирных кислот, менее 1% масс. от общего количества жирных кислот или менее 0,5% масс. от общего количества жирных кислот.
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань или часть согласно изобретению или масло или семя, полученное из генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению содержит регистрируемые количества ДГК (докозагексаеновую кислоту (C22:6, n-3)), ДПК(n-6) (докозапентаеновую кислоту (C22:5 n-6)) или ЭПК (эйкозапентаеновую кислоту (C20:5, n-3)). В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань или часть согласно изобретению или масло или семя, полученное из генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению содержит, по меньшей мере 0,01%, по меньшей мере 0,02%, по меньшей мере 0,03%, по меньшей мере 0,04%, по меньшей мере 0,05%, по меньшей мере 0,06%, по меньшей мере 0,07%, по меньшей мере 0,08%, по меньшей мере 0,09%, по меньшей мере 0,1%, по меньшей мере 0,2%, по меньшей мере 0,3%, по меньшей мере 0,4%, по меньшей мере 0,5%, по меньшей мере 0,6%, по меньшей мере 0,7%, по меньшей мере 0,8%, по меньшей мере 0,9%, по меньшей мере 1%, по меньшей мере 1,5%, по меньшей мере 2%, по меньшей мере 2,5%, по меньшей мере 3%, по меньшей мере 3,5%, по меньшей мере 4%, по меньшей мере 4,5%, по меньшей мере 5%, по меньшей мере 5,5%, по меньшей мере 6%, по меньшей мере 6,5%, по меньшей мере 7%, по меньшей мере 7,5%, по меньшей мере 8%, по меньшей мере 8,5%, по меньшей мере 9%, по меньшей мере 9,5%, по меньшей мере 10%, по меньшей мере 10,5%, по меньшей мере 11%, по меньшей мере 11,5%, по меньшей мере 12%, по меньшей мере 12,5%, по меньшей мере 13%, по меньшей мере 13,5%, по меньшей мере 14%, по меньшей мере 14,5% или по меньшей мере 15% масс. ДГК от общего количества жирных кислот. Применимые диапазоны могут быть выбраны между любыми указанными значениями, например, от 0,01% до 15%, от 0,05% до 10% и от 1% до 5% масс. ДГК от общего количества жирных кислот.
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань или часть согласно изобретению или масло или семя, полученное из генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению, содержит, по меньшей мере 0,01%, по меньшей мере 0,02%, по меньшей мере 0,03%, по меньшей мере 0,04%, по меньшей мере 0,05%, по меньшей мере 0,06%, по меньшей мере 0,07%, по меньшей мере 0,08%, по меньшей мере 0,09%, по меньшей мере 0,1%, по меньшей мере 0,2%, по меньшей мере 0,3%, по меньшей мере 0,4%, по меньшей мере 0,5%, по меньшей мере 0,6%, по меньшей мере 0,7%, по меньшей мере 0,8%, по меньшей мере 0,9%, по меньшей мере 1%, по меньшей мере 1,5%, по меньшей мере 2%, по меньшей мере 2,5%, по меньшей мере 3%, по меньшей мере 3,5%, по меньшей мере 4%, по меньшей мере 4,5%, по меньшей мере 5%, по меньшей мере 5,5%, по меньшей мере 6%, по меньшей мере 6,5%, по меньшей мере 7%, по меньшей мере 7,5%, по меньшей мере 8%, по меньшей мере 8,5%, по меньшей мере 9%, по меньшей мере 9,5%, или по меньшей мере 10% масс. ЭПК от общего количества жирных кислот. Применимые диапазоны могут быть выбраны между любыми указанными значениями, например, от 0,01% до 10%, от 0,05% до 5% и от 0,1% до 5% масс. ЭПК от общего количества жирных кислот.
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань или часть согласно изобретению или масло или семя, полученное из генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению, содержит, по меньшей мере 0,01%, по меньшей мере 0,02%, по меньшей мере 0,03%, по меньшей мере 0,04%, по меньшей мере 0,05%, по меньшей мере 0,06%, по меньшей мере 0,07%, по меньшей мере 0,08%, по меньшей мере 0,09%, по меньшей мере 0,1%, по меньшей мере 0,2%, по меньшей мере 0,3%, по меньшей мере 0,4%, по меньшей мере 0,5%, по меньшей мере 0,6%, по меньшей мере 0,7%, по меньшей мере 0,8%, по меньшей мере 0,9%, по меньшей мере 1%, по меньшей мере 1,5%, по меньшей мере 2%, по меньшей мере 2,5%, по меньшей мере 3%, по меньшей мере 3,5%, по меньшей мере 4%, по меньшей мере 4,5%, по меньшей мере 5%, по меньшей мере 5,5%, по меньшей мере 6%, по меньшей мере 6,5%, по меньшей мере 7%, по меньшей мере 7,5%, по меньшей мере 8%, по меньшей мере 8,5%, по меньшей мере 9%, по меньшей мере 9,5%, или по меньшей мере 10% масс. ДПК(n-6) от общего количества жирных кислот. Применимые диапазоны могут быть выбраны между любыми указанными значениями, например, от 0,01% до 10%, от 0,01% до 5%, от 0,01% до 1%, от 0,01% до 0,05%, от 0,05% до 5% и от 0,1% до 5% масс. ДПК(n-6) от общего количества жирных кислот.
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань или часть согласно изобретению или масло или семя, полученное из генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению, содержат соотношение ЭПК:ДГК, составляющее, по меньшей мере 1:1, по меньшей мере 1:1,5, по меньшей мере 1:2, по меньшей мере 1:2,5, по меньшей мере 1:3, по меньшей мере 1:3,5, по меньшей мере 1:4, по меньшей мере 1:4,5, по меньшей мере 1:5, по меньшей мере 1:5,5, по меньшей мере 1:6, по меньшей мере 1:6,5, по меньшей мере 1:7, по меньшей мере 1:7,5, по меньшей мере 1:8, по меньшей мере 1:8,5, по меньшей мере 1:9, по меньшей мере 1:10, по меньшей мере 1:11, по меньшей мере 1:12, по меньшей мере 1:13, по меньшей мере 1:14, по меньшей мере 1:15, по меньшей мере 1:16, по меньшей мере 1:17, по меньшей мере 1:18, по меньшей мере 1:19, по меньшей мере 1:20, по меньшей мере 1:21, по меньшей мере 1:22, по меньшей мере 1:23, по меньшей мере 1:24, по меньшей мере 1:25, по меньшей мере 1:26, по меньшей мере 1:27, по меньшей мере 1:28, по меньшей мере 1:29 или по меньшей мере 1:30 по массе в общей массе жирных кислот. Применимые диапазоны могут быть выбраны между любыми указанными значениями, например, соотношение ЭПК:ДГК может составлять от 1:1 до 1:30, от 1:1 до 1:25, от 1:1 до 1:20, от 1:1 до 1:15, от 1:1 до 1:10, от 1:1 до 1:5, от 1:1 до 1:3 и от 1:1 до 1:2 по массе в общей массе жирных кислот.
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань или часть согласно изобретению или масло или семя, полученное из генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению, содержит соотношение ДПК(n-6):ДГК, составляющее, по меньшей мере 1:1, по меньшей мере 1:1,5, по меньшей мере 1:2, по меньшей мере 1:2,5, по меньшей мере 1:3, по меньшей мере 1:3,5, по меньшей мере 1:4, по меньшей мере 1:4,5, по меньшей мере 1:5, по меньшей мере 1:5,5, по меньшей мере 1:6, по меньшей мере 1:6,5, по меньшей мере 1:7, по меньшей мере 1:7,5, по меньшей мере 1:8, по меньшей мере 1:8,5, по меньшей мере 1:9 или по меньшей мере 1:10 по массе в общей массе жирных кислот. Применимые диапазоны могут быть выбраны между любыми указанными значениями, например, соотношение ДПК(n-6):ДГК может составлять от 1:1 до 1:10, от 1:1 до 1:5, от 1:1 до 1:3 и от 1:1 до 1:2 по массе в общей массе жирных кислот.
В некоторых вариантах масло, полученное из генетически модифицированного растения, его потомка, клетки, ткани или части или семени согласно изобретению, содержит, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% масс. триглициридов от общей массы масла. В некоторых вариантах масло, полученное из генетически модифицированного растения, его потомка, клетки, ткани или части или семени согласно изобретению, содержит от 70% до 99% масс. триглицеридов от общей массы масла, от 75% до 99% масс. триглицеридов от общей массы масла, от 80% до 99% масс. триглицеридов от общей массы масла, от 85% до 99% масс. триглицеридов от общей массы масла или от 90% до 99% масс. триглицеридов от общей массы масла. Способы очистки и анализа триглицеридов описаны (например, Ruiz-Gutierrez V. and Barron LJ, J. Chromatogr. B. Biomed. Appl., 671: 133-168, 1995).
В некоторых вариантах, когда целевым продуктом системы ПНЖК-синтазы является длинноцепочечная ПНЖК, такая как ДГК, ДПК (n-6 или n-3) или ЭПК, промежуточные продукты и побочные продукты, которые не присутствуют в значимых количествах в общей массе липидов растений, генетически модифицированных такой системой ПНЖК-синтазы, могут включать без ограничения: гамма-линоленовую кислоту (ГЛК; 18:3, n-6); стеаридоновую кислоту (СТК или СДК; 18:4, n-3); дигомо-гамма-линоленовую кислоту (ДГЛК или HGLA; 20:3, n-6), арахидоновую кислоту (АРК, C20:4, n-6); эйкозатриеновую кислоту (ЭТК; 20:3, n-9) и различные другие промежуточные или побочные продукты, такие как 20:0; 20:1 (Δ5); 20:1 (Δ11); 20:2 (Δ8,11); 20:2 (Δ11,14); 20:3 (Δ5,11,14); 20:3 (Δ11,14,17); мидовую кислоту (20:3; Δ5,8,11); или 20:4 (Δ5,1,14,17).
Генетическая модификация растения согласно настоящему изобретению может приводить к продуцированию в растении одной или нескольких ПНЖК. В некоторых вариантах профиль ПНЖК и соотношение ПНЖК, продуцируемых растением, не обязательно являются такими же, как профили ПНЖК или соотношение ПНЖК, продуцируемых организмом, из которого получена ПНЖК-синтаза.
В некоторых вариантах может быть сконструировано генетически модифицированное растение, его потомок, клетка, ткань или часть согласно настоящему изобретению для получения ПНЖК посредством активности ПНЖК-синтазы. В некоторых вариантах ПНЖК могут быть извлечены с применением способов очистки, посредством которых экстрагируют соединения из растения, его потомка, клетки, ткани или части. В некоторых вариантах ПНЖК могут быть извлечены в результате сбора растения, его потомка, клетки, ткани или части. В некоторых вариантах ПНЖК могут быть извлечены в результате сбора масла из растения, его потомка, клетки, ткани или части (например, и масличных семян), или семян из растения, его потомка, клетки, ткани или части. В некоторых вариантах растение, его потомок, клетка, ткань или часть также можно употреблять в их естественном состоянии или можно дополнительно обрабатывать с получением употребляемых продуктов.
В некоторых вариантах генетически модифицированное растение, его потомок, клетка, ткань или часть согласно изобретению могут продуцировать одну или несколько полиненасыщенных жирных кислот. В некоторых вариантах растение, его потомок, клетка, ткань или часть могут продуцировать (например, в зрелых семенах, в случае масличного растения, или в масле семян масличного растения), по меньшей мере, одну ПНЖК (целевую ПНЖК), и при этом в общем профиле жирных кислот в растении или части растения, которая накапливает ПНЖК (например, в зрелых семенах, если растение является масличным растением, или в масле семян масличного растения), содержится регистрируемое количество такой ПНЖК или таких ПНЖК-кислот. В некоторых вариантах целевая ПНЖК является, по меньшей мере, 20-углеродной ПНЖК и содержит, по меньшей мере, 3 двойных связи, по меньшей мере, 4 двойных связи или, по меньшей мере, 5 двойных связей. В некоторых вариантах целевая ПНЖК может представлять собой ПНЖК, которая в природе не образуется в растении. В некоторых вариантах общий профиль жирных кислот в растении или в части растения, которая накапливает ПНЖК (включая масло из семян растения) содержит, по меньшей мере, 0,1% масс. целевой ПНЖК (целевых ПНЖК) от общего количества жирных кислот, по меньшей мере 0,2%, по меньшей мере 0,3%, по меньшей мере 0,4%, по меньшей мере 0,5%, по меньшей мере 1%, по меньшей мере 1,5%, по меньшей мере 2%, по меньшей мере 2,5%, по меньшей мере 3%, по меньшей мере 3,5%, по меньшей мере 4%, по меньшей мере 4,5%, по меньшей мере 5%, по меньшей мере 5,5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, больше 75% масс., по меньшей мере, одной полиненасыщенной жирной кислоты (целевой ПНЖК или целевых ПНЖК) от общего количества жирных кислот, или любой процент от 0,1% до 75% или больше 75% (до 100% или 100%), с приращениями по 0,1% целевой ПНЖК (целевых ПНЖК).
В используемом в настоящем описании смысле упоминание количества ПНЖК в процентах означает процентное содержание по массе от общего количества экстрагируемых жирных кислот, если не указано иное. В некоторых вариантах суммарные жирные кислоты определяют в анализе препарата метиловых эфиров жирных кислот (FAME) с использованием газовой хроматографии (ГХ), хотя определение суммарных жирных кислот не ограничено указанным способом.
В некоторых вариантах суммарные жирные кислоты в растении согласно изобретению (и/или его потомке, клетке, ткани или части или фракции масла из семян) могут содержать менее 10% масс. от общего количества жирных кислот, продуцируемых растением, менее 9% масс. от общего количества жирных кислот, продуцируемых растением, менее 8% масс. от общего количества жирных кислот, продуцируемых растением, его потомком, клеткой, тканью или частью, менее 7% масс. от общего количества жирных кислот, продуцируемых растением, его потомком, клеткой, тканью или частью, менее 6% масс. от общего количества жирных кислот, продуцируемых растением, его потомком, клеткой, тканью или частью, менее 5% масс. от общего количества жирных кислот, продуцируемых растением, его потомком, клеткой, тканью или частью, менее 4% масс. от общего количества жирных кислот, продуцируемых растением, его потомком, клеткой, тканью или частью, менее 3% масс. от общего количества жирных кислот, продуцируемых растением, его потомком, клеткой, тканью или частью, менее 2% масс. от общего количества жирных кислот, продуцируемых растением, его потомком, клеткой, тканью или частью, менее 1% масс. от общего количества жирных кислот, продуцируемых растением, его потомком, клеткой, тканью или частью, жирной кислоты, выбранной из гамма-линоленовой кислоты (ГЛК; 18:3, n-6); стеаридоновой кислоты (СТК или СДК; 18:4, n-3); дигомо-гамма-линоленовой кислоты (ДГЛК или HGLA; 20:3, n-6), арахидоновой кислоты (АРК, C20:4, n-6); эйкозатриеновой кислоты (ЭТК; 20:3, n-9) и различных других жирных кислот, таких как 20:0; 20:1 (Δ5); 20:1 (Δ11); 20:2 (Δ8,11); 20:2 (Δ11,14); 20:3 (Δ5,11,14); 20:3 (Δ11,14,17); мидовой кислоты (20:3; Δ5,8,11) или 20:4 (Δ5,1,14,17).
Настоящее изобретение относится к любому семени, образуемому растениями, их потомками, клетками, тканями или частями, описанными в настоящей публикации, а также любому маслу, продуцируемому растением, его потомком, клеткой, тканью или частью или семенем согласно настоящему изобретению. Настоящее изобретение также относится к любым продуктам, получаемым с использованием растений, их потомков, клеток, тканей или частей, семян или масел, которые описаны в настоящей публикации.
Применения и продукты, полученные с использованием генетически модифицированных организмов согласно изобретению
Настоящее изобретение относится к способу получения ПНЖК в результате выращивания или культивирования генетически модифицированного растения, его потомка, клетки, ткани или части (например, сои) согласно настоящему изобретению, подробно описанных выше. В некоторых вариантах такой способ включает в себя, например, выращивание в подходящей среде, такой как почва, растения, которое имеет генетическую модификацию, которая описана выше в настоящей публикации, согласно настоящему изобретению.
Настоящее изобретение относится к способу получения масла, содержащего, по меньшей мере, одну ПНЖК, включающему в себя извлечение масла из генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению или из семени генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению.
Настоящее изобретение относится к способу получения масла, содержащего, по меньшей мере, одну ПНЖК, включающему в себя выращивание генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению. Настоящее изобретение относится к способу получения, по меньшей мере, одной ПНЖК в масле из семян, включающему в себя извлечение масла из семени генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению. Настоящее изобретение относится к способу получения, по меньшей мере, одной ПНЖК в масле из семян, включающему в себя выращивание генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению.
Настоящее изобретение относится к способу предоставления добавки или терапевтического продукта, содержащего, по меньшей мере, одну ПНЖК, индивидууму, нуждающемуся в такой добавке или терапевтическом продукте, включающему в себя предоставление индивидууму, которому это необходимо, генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению, масла согласно изобретению, семени согласно изобретению, пищевого продукта согласно изобретению, функционального пищевого продукта согласно изобретению или фармацевтического продукта согласно изобретению. Настоящее изобретение также относится к способу получения генетически модифицированного растения, его потомка, клетки, ткани или части согласно изобретению, включающему в себя трансформацию растения или растительной клетки (i) последовательностью нуклеиновой кислоты, кодирующей систему ПНЖК-синтазы водорослей, которая продуцирует, по меньшей мере, одну полиненасыщенную жирную кислоту (ПНЖК); и (ii) последовательностью нуклеиновой кислоты, кодирующей фосфопантетеинилтрансферазу (PPT-азу), которая переносит кофактор фосфопантетеинил на АПБ-домен системы ПНЖК-синтазы водорослей. В некоторых вариантах способ дополнительно включает в себя трансформацию растения или растительной клетки (iii) последовательностью нуклеиновой кислоты, кодирующей ацил-CoA-синтетазу (ACoAS), которая катализирует превращение свободных жирных кислот (СЖК) длинноцепочечных ПНЖК в ацил-CoA.
В некоторых вариантах ПНЖК, получаемые такими способами согласно изобретению, являются ДГК, ДПК(n-6) и/или ЭПК. В некоторых вариантах масло, получаемое такими способами согласно изобретению, представляет собой соевое масло. В некоторых вариантах масло, получаемое такими способами согласно изобретению, содержит от 0,05% до 15% масс. ДГК от общего количества жирных кислот или любое количество или диапазон, описанные в настоящей публикации далее. В некоторых вариантах масло, полученное такими способами согласно изобретению, дополнительно содержит от 0,01% до 5% масс. ЭПК от общего количества жирных кислот или любое количество или диапазон, описанные в настоящей публикации далее. В некоторых вариантах, масло, полученное такими способами согласно изобретению, дополнительно содержит от 0,01% до 5% масс. ДПК(n-6) от общего количества жирных кислот или любое количество или диапазон, описанные в настоящей публикации далее. В некоторых вариантах масло, полученное такими способами согласно изобретению, содержит соотношение ЭПК:ДГК, составляющее от 1:1 до 1:30 по массе в общей массе жирных кислот, соотношение ЭПК:ДГК от 1:1 до 1:3 по массе в общей массе жирных кислот или любое количество или диапазон, описанные в настоящей публикации далее. В некоторых вариантах, масло, полученное такими способами согласно изобретению, дополнительно содержит соотношение ДПК(n-6):ДГК 1:1 или 1:10 по массе в общей массе жирных кислот, соотношение ДПК(n-6):ДГК от 1:1 до 1:3 по массе в общей массе жирных кислот или любое количество или диапазон, описанные в настоящей публикации далее.
Настоящее изобретение, кроме того, относится к любым организмам или их частям, описанным в настоящей публикации (например, растениям, их потомкам, клеткам, тканям, семенам или частям (например, маслосодержащим семенам) или их препаратам или фракциям), а также в любым маслам, продуцируемым организмами, описанными в настоящей публикации. Изобретение также относится к любым продуктам, полученным с использованием таких организмов, их частей или масел, описанных в настоящей публикации.
Настоящее изобретение относится к способу модификации продукта, содержащего, по меньшей мере, одну жирную кислоту, включающему в себя добавление к продукту организма, его части или масла, продуцируемого генетически модифицированным организмом согласно изобретению, который описан в настоящей публикации (например, растением, его потомком, клеткой, семенем, тканью или частью, которые были генетически модифицированы как описано в настоящей публикации). Любые продукты, полученные таким способом, или содержащие любые организмы, их части или масла из организмов, описанных в настоящей публикации, также входят в объем изобретения.
В некоторых вариантах продукт выбран из биологически активной пищевой добавки, фармацевтического препарата, гуманизированного молока животных, детской смеси, нутрицевтика и функционального пищевого продукта. Подходящие фармацевтические препараты включают без ограничения противовоспалительный препарат, химиотерапевтический препарат, активный эксципиент, лекарственное средством против остеопороза, антидепрессант, противосудорожное средство, лекарственное средство против Helicobacter pylori, лекарственное средство для лечения нейродегенеративного заболевания, лекарственное средство для лечения дегенеративного заболевания печени, антибиотик и препарат, снижающий уровень холестерина. В некоторых вариантах продукт применяют для лечения состояния, выбранного из хронического воспаления, острого воспаления, расстройства желудочно-кишечного тракта, злокачественной опухоли, кахексии, рестеноза сердца, нейродегенеративного расстройства, дегенеративного заболевания печени, липидного расстройства крови, остеопороза, остеоартрита, аутоиммунного заболевания, предэклампсии, преждевременных родов, возрастной макулопатии, заболевания легких и пероксисомного нарушения.
В некоторых вариантах продуктом является пищевой продукт или функциональный пищевой продукт. Подходящие пищевые продукты включают без ограничения сдобные хлебопекарные изделия, хлеб и булочки, готовые зерновые завтраки, плавленый и необработанный сыр, приправы (кетчуп, майонез и т.д.), молочные продукты (молоко, йогурт), пудинги и желатиновые десерты, газированные напитки, чай, порошковые смеси для приготовления напитков, переработанные продукты из рыбы, напитки на основе фруктов, жевательную резинку, карамель, замороженные молочные продукты, переработанные мясные продукты, орехи и ореховые пасты, макаронные изделия, продукты переработки птицы, подливки и соусы, картофельные чипсы и другие чипсы, шоколад и другие кондитерские изделия, супы и суповые смеси, продукты на основе сои (например, молоко, напитки, кремы, отбеливатели), спреды на основе растительных масел и овощные напитки.
В некоторых вариантах согласно изобретению продукт представляет собой корм или пищевую композицию или добавка в корм или пищевую композицию для животных. Термин «животное» включает человека и животных, отличных от человека. Не ограничивающими примерами животных являются нежвачные (например, свиньи, домашняя птица или рыба) и жвачные (например, коровы, овцы и лошади). Термин корм или пищевая композиция означает любое соединение, препарат, смесь или композицию, подходящую или предназначенную для приема в качестве пищи животным.
В некоторых вариантах изобретение относится к смеси масел, содержащей масло, полученное из генетически модифицированного растения, его потомка, ткани или части, описанных в настоящей публикации, и другое масло. В некоторых вариантах другим маслом является масло из семян, растительное масло, рыбий жир, масло их микроорганизмов или их смесь.
В некоторых вариантах масло, полученное из генетически модифицированного растения, его потомка, ткани или части описанных в настоящей публикации, может быть подвергнуто дополнительной обработке, чтобы модифицировать ДЦ-ПНЖК в масле, например, чтобы образовать сложные эфиры и/или очистить ДЦ-ПНЖК для медицинских целей.
Некоторые варианты осуществления настоящего изобретения относятся к соевому маслу, содержащему от 0,05% до 15% масс. ДГК от общего количества жирных кислот или ДГК в любом количестве в диапазоне, описанном в настоящей публикации. В некоторых вариантах соевое масло дополнительно содержит от 0,05% до 5% масс. ЭПК от общего количества жирных кислот. В некоторых вариантах соевое масло дополнительно содержит от 0,01% до 5% масс. ДПК(n-6) от общего количества жирных кислот. В некоторых вариантах соевое масло имеет профиль жирных кислот с содержанием более чем 3,5% масс. альфа-линоленовой кислоты от общего количества жирных кислот или любой диапазон, описанный дополнительно в настоящей публикации. Некоторые варианты осуществления настоящего изобретения относятся к композиции, содержащей соевое масло, описанное в настоящей публикации. В некоторых вариантах композиция, содержащая соевое масло, содержит одно или несколько масел. В некоторых вариантах композиция не содержит ПНЖК (например, ДГК) из другого источника, отличного от сои.
Дополнительные цели, преимущества и новые признаки настоящего изобретения буду понятны специалистам в данной области после изучения следующих примеров, которые не предназначены для ограничения.
ПРИМЕРЫ
ПРИМЕР 1
Оптимизация кодонов ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI
Анализ последовательностей ДНК, кодирующих ПНЖК-синтазу OrfA из Schizochytrium sp. ATCC_20888 (GenBank ID: AF378327, GI: 158518688), ПНЖК-синтазу OrfB из Schizochytrium sp. ATCC_20888 (GenBank ID: AF378328, GI: 158518690), химерную ПНЖК-синтазу OrfC из Schizochytrium sp. ATCC_20888 и Thraustochytrium (публикация заявки на выдачу патента США № 2008/0022422) (также описанную как «гибридная OrfC»), ацил-CoA-синтетазу из Schizochytrium sp. ATCC_20888 (публикация заявки на выдачу патента США 2007/0245431) и 4'-фосфопантетеинилтрансферазу HetI из Nostoc sp. PCC 7120 (GenBank ID: P37695, GI:20141367) показал присутствие нескольких мотивов последовательностей, содержащих неоптимальные составы кодонов, которые могут быть неблагоприятными для оптимальной экспрессии в растениях. Дизайн гена(ов), кодирующего белки ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI, оптимизировали, чтобы создать последовательность ДНК, которая больше «похожа на растительную» по своей природе, и в которой модификации последовательности не мешают трансляции или не приводят к нестабильности мРНК в результате неоптимального состава кодонов.
Благодаря пластичности, обеспечиваемой избыточностью/вырожденностью генетического кода (например, некоторые аминокислоты определяются более чем одним кодоном), эволюция геномов в разных организмах или классах организмов привела к разному использованию синонимичных кодонов. Такое «смещение кодонов» отражается в среднем составе оснований кодирующих белки областей. Например, организмы, имеющие геномы с относительно низким содержанием G+C, используют больше кодонов, имеющих A или T в третьем положении синонимичных кодонов, тогда как организмы, имеющие более высокое содержание G+C, используют больше кодонов, имеющих G или C в третьем положении. Кроме того, считается, что присутствие «минорных» кодонов в мРНК может снижать абсолютную скорость трансляции такой мРНК, особенно когда относительное содержание нагруженных тРНК, соответствующих минорному кодону, низкое. В продолжение такого рассуждения, снижение скорости трансляции за счет отдельных минорных кодонов может, по меньшей мере, добавляться к действию множества минорных кодонов. Таким образом, мРНК, имеющие относительно высокое содержание минорных кодонов, может, соответственно, иметь низкую скорость трансляции. Такая скорость может быть отражена соответственно низкими уровнями кодируемого белка.
При конструировании генов, кодирующих белок ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI, для экспрессии в двудольных растениях (таких как табак, соя, хлопок или канола), данные об использовании кодонов у канолы получали из общедоступных баз данных (таблица 1).
Чтобы сбалансировать распределение вариантов выбора остальных кодонов для аминокислоты, вычисляли средневзвешенное представительство для каждого кодона (таблица 1), используя формулу: средневзвешенный %C1=1/(%C1+%C2+%C3+и т.д.)×%C1×100, где C1 означает рассматриваемый кодон и %C2, %C3 и т.д. означают средние значения % остальных синонимичных кодонов для канолы (средние значения % соответствующих кодонов взяты из колонок C и G) из таблицы 1. Средневзвешенное значение % для каждого кодона приведено в колонках D и H в таблице 1.
При конструировании кодирующих областей для экспрессии в растениях определяли основные («первый вариант выбора») кодоны, предпочитаемые растением, а также второй, третий, четвертый и т.д. варианты выбора предпочтительных кодонов в том случае, когда существует несколько вариантов выбора. Затем конструировали новую последовательность ДНК, которая кодировала по существу такую же аминокислотную последовательность ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI, но которая отличалась от исходной последовательности ДНК (кодирующей ПНЖК-синтазу OrfA, ПНЖК-синтазу OrfB, химерную ПНЖК-синтазу OrfC, ацил-CoA-синтетазу и 4'-фосфопантетеинилтрансферазу HetI) заменой кодонами растений (первым предпочтительным, вторым предпочтительным, третьим предпочтительным или четвертым предпочтительным и т.д.), определяющими аминокислоту в каждом положении в аминокислотной последовательности.
Затем новые последовательности анализировали в отношении сайтов для ферментов рестрикции, создаваемых в последовательности в результате модификаций. Затем выявленные сайты модифицировали заменой кодонов первым, вторым, третьим или четвертым предпочтительными кодонами. Затем последовательность дополнительно анализировали и модифицировали, чтобы уменьшить частоту пар TA или GC.
Анализ таких последовательностей показал, что новые последовательности ДНК фактически кодировали аминокислотную последовательность белков ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI, но были соответствующим образом сконструированы для оптимальной экспрессии в двудольных растениях с использованием сбалансированного распределения кодонов, часто используемых в генах канолы. В частности, новые последовательности ДНК отличались от исходных последовательностей ДНК, кодирующих ПНЖК-синтазу OrfA, ПНЖК-синтазу OrfB, химерную ПНЖК-синтазу OrfC, ацил-CoA-синтетазу и 4'-фосфопантетеинилтрансферазу HetI заменой кодонами растений (первым предпочтительным, вторым предпочтительным, третьим предпочтительным или четвертым предпочтительным), определяющими соответствующую аминокислоту в каждом положении в аминокислотной последовательности белка.
Конструирование оптимизированных для растений последовательностей ДНК начинали с обратной трансляции белковых последовательностей ПНЖК-синтазы OrfA (SEQ ID NO: 1), ПНЖК-синтазы OrfB (SEQ ID NO: 2), химерной ПНЖК-синтазы OrfC (SEQ ID NO: 3), ацил-CoA-синтетазы (SEQ ID NO: 4) и 4'-фосфопантетеинилтрансферазы HetI (SEQ ID NO: 5), используя таблицу смещения частоты использования кодонов у канолы, представленную в таблице 1, колонки D и H. Белковую последовательность ацил-CoA-синтетазы (SEQ ID NO: 4) изменяли по сравнению с исходной последовательностью; при этом вторую аминокислоту аланин удаляли из белка. Затем начальные последовательности модифицировали, компенсируя варианты выбора кодонов (при этом сохраняя средневзвешенное представительство кодонов) так, чтобы удалить или добавить сайты узнавания ферментами рестрикции, удалить высокостабильные внутрицепочечные вторичные структуры и удалить другие последовательности, которые могут быть неблагоприятными для операций клонирования или экспрессии сконструированного гена в растениях. Затем последовательности ДНК дополнительно анализировали в отношении сайтов узнавания ферментами рестрикции, которые могли быть созданы в результате модификаций. Идентифицированные сайты дополнительно модифицировали заменой соответствующих кодонов первым, вторым, третьим или четвертым предпочтительными вариантами кодонов. Другие сайты в последовательностях, которые могут влиять на транскрипцию или трансляцию представляющего интерес гена, включают соединения экзон:интрон (5' или 3'), сигналы добавления поли-A или сигналы терминации для РНК-полимеразы. Модифицированные последовательности дополнительно анализировали и дополнительно модифицировали, чтобы уменьшить частоту пар TA или CG и чтобы повысить частоту пар TG или CT. Кроме таких пар на транскрипцию или трансляцию последовательности могут влиять блоки последовательностей, которые содержат более шести следующих друг за другом остатков [G+C] или [A+T]. Поэтому такие блоки последовательностей также модифицировали, заменяя кодоны первого или второго варианта выбора и т.д. другими предпочтительными вариантами кодонов. Редко используемые кодоны не включали в значительной степени в конструкцию гена, используя их только при необходимости удовлетворения другого критерия конструкции, отличного от состава кодонов как такового (например, добавление или удаление сайтов узнавания ферментами рестрикции).
Белок, кодируемый OrfA ПНЖК-синтазы, содержит 10 повторяющихся доменов «пролин-аланин» размером в диапазоне от 17 до 29 аминокислот. Между повторами пролин-аланин расположены 9 более длинных доменов повторяющихся последовательностей, содержащих 87 аминокислот. Аминокислотные последовательности таких повторов варьируют только в 4 положениях, и было только два варианта кодонов в каждом из вариантов положений. Анализы аминокислотных последовательностей 9 повторов с использованием компьютерной программы Clustal W давали значение гомологии 100% и значение идентичности 95,4%. На уровне ДНК последовательности, кодирующие 9 повторов, гомологичны на 100%, идентичны на 89,7% варьируя только в 27 положениях по 261 основанию, кодирующим каждый повтор (23 из 27 изменений были «молчащими» отличиями, в которых была произведена взаимная замена синонимичных кодонов для одной и той же аминокислоты).
Стандартные способы конструирования генов нельзя просто приспособить для разработки новых последовательностей ДНК со смещением частоты использования кодонов в случае множественных повторов такого размера, так как необходимо постоянно сопоставлять все варианты кодонов в отдельном повторе с вариантами кодонов, полученных в том же положении в 8 других повторах, чтобы избежать последовательностей ДНК с высокой степенью родства. Для каждого из повторов, состоящих из 87 остатков, существует более 4,5×1043 возможных последовательностей ДНК, кодирующих одну и ту же аминокислотную последовательность (рассчитано в виде произведения количества синонимичных кодонов для каждой аминокислоты в последовательности). Таким образом, существует очень большая вычислительная среда, доступная для создания идентично кодирующих последовательностей ДНК. В следующем протоколе описан способ, используемый для создания (in silico) множества конструкций последовательностей для каждого отдельного повтора с последующим сравнением всех вариантов последовательности в общей массе, чтобы идентифицировать набор, который представляет в высокой степени дивергированные последовательности, кодирующие повторы:
Стадия 1: Выделение нативной последовательности ДНК, кодирующей каждый домен из повторяющихся аминокислот, в виде отдельной последовательности.
Стадия 2: Импорт отдельных повторяющихся последовательностей ДНК в виде отдельных последовательностей в программу конструирования гена (например, OPTGENETM, Ocimum Biosolutions, Hyderabad, India). Стадии 3-5 осуществляют для каждой последовательности отдельно.
Стадия 3: Трансляция последовательности ДНК с использованием стандартного генетического кода.
Стадия 4: Обратная трансляция транслированной последовательности белка с использованием стандартного генетического кода и соответствующей таблицы смещения частоты использования кодонов. В данном примере использовали таблицу смещенных кодонов, составленную на основании 530 кодирующих белки областей Brassica napus, и каждой созданной последовательности давали кодовое название «nap» (в случае «napus») плюс номер варианта. Таким образом, первая обратно транслированная последовательность со смещением кодонов для повтора 1 была названа «rpt1l nap1». В данном иллюстративном примере такой процесс осуществляли 10 раз, чтобы создать 10 вариантов последовательности ДНК, кодирующей последовательность белка повтора 1.
Стадия 5: Экспорт 10 вариантов последовательности в соответствующее количество текстовых файлов.
Стадия 6: Повторение стадий 3-5 для каждого из других доменов с повторяющимися последовательностями. В данном иллюстративном примере было создано всего 90 вариантов последовательностей «nap» (10 для каждого повторяющегося элемента).
Стадия 7: Импорт 90 файлов последовательностей в программу Clustal W Mega 3.1 (доступна из Megasoftware) и осуществление множественного выравнивания последовательностей с использованием всех 90 последовательностей в качестве вводимых данных. Поскольку такие последовательности являются участками кодирующих белки областей, выравнивание осуществляют, не допуская пробелов. После выравнивания Clustal W осуществляют сборку и визуализацию дерева способом ближайшего соседа, и визуально отбирают одну из десяти оптимизированных по кодонам последовательностей для каждого из девяти повторяющихся доменов в белке. Каждый отбираемый вариант последовательности выбирают из участка дерева, который наиболее глубоко разветвлен.
Стадия 8: Выбранную последовательность для каждого повторяющегося домена включают в оптимизированную по кодонам последовательность ДНК, кодирующую полный белок, в правильное положение для каждого конкретного повтора.
Стадия 9: Осуществляют конечные анализы полной оптимизированной по кодонам последовательности, включая отдельно сконструированные дивергированные элементы, чтобы убедиться в отсутствии нежелательных мотивов, сайтов узнавания ферментами рестрикции и т.д.
Применение такого способа с оптимизацией кодонов кодирующей последовательности ПНЖК-синтазы OrfA привело к отбору повторяющихся последовательностей пролин-аланин, которые достаточно дивергированы, чтобы избежать нестабильности повторяющихся последовательностей. Такие последовательности были выбраны из наиболее глубоких ветвей дерева, полученного способом ближайшего соседа (т.е. являются наиболее далекими родственниками по отношению друг к другу в данном наборе последовательностей). Осуществляли глобальное выравнивание Смита-Ватермана для всех попарных сочетаний, и диапазон гомологии составлял 74-81% с вероятной медианой 76-77% (таблица 2).
Выравнивание Clustal W (Vector NTI, Invitrogen, Carlsbad, CA) выбранных 9 заново сконструированных кодирующих областей для 9 повторяющихся доменов показано на фиг. 1. В общем, последовательности гомологичны на 93,1%, идентичны на 61,7% при сравнении с исходными последовательностями, которые были гомологичны на 100% и идентичны на 89,7%. Более высокая дивергенция последовательностей может быть достигнута с использованием более чем 10 итераций последовательностей и с использованием компьютерной программы или математического алгоритма, чтобы осуществить отбор из таких последовательностей (вместо выбора последовательностей визуально). Тем не менее, приведенные в качестве примеров последовательности являются в высокой степени дивергированными, и получены стабильные полинуклеотидные фрагменты.
Вновь сконструированные оптимизированные для канолы последовательности ДНК ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI указаны в списке, соответственно, в виде SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10. Такие оптимизированные по кодонам последовательности указаны в описании как вариант 3 (v3), тогда как последовательности, которые не оптимизированы по кодонам, указаны в описании как вариант 2 (v2).
Полученные последовательности ДНК имеют более высокую степень разнообразия кодонов, требуемый состав кодонов, содержат стратегически размещенные сайты узнавания ферментами рестрикции и не имеют последовательностей, которые могут мешать транскрипции гена или трансляции продукта мРНК. В таблице 3, таблице 4, таблице 5, таблице 6 и таблице 7 представлены сравнения составов кодонов кодирующих областей для белков ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинил-трансферазы HetI, обнаруженных в исходном гене, в оптимизированных для растений вариантах, и рекомендации по составу кодонов для оптимизированной для растений последовательности, основанных на расчетах, представленных в таблице 1, в колонках D и H.
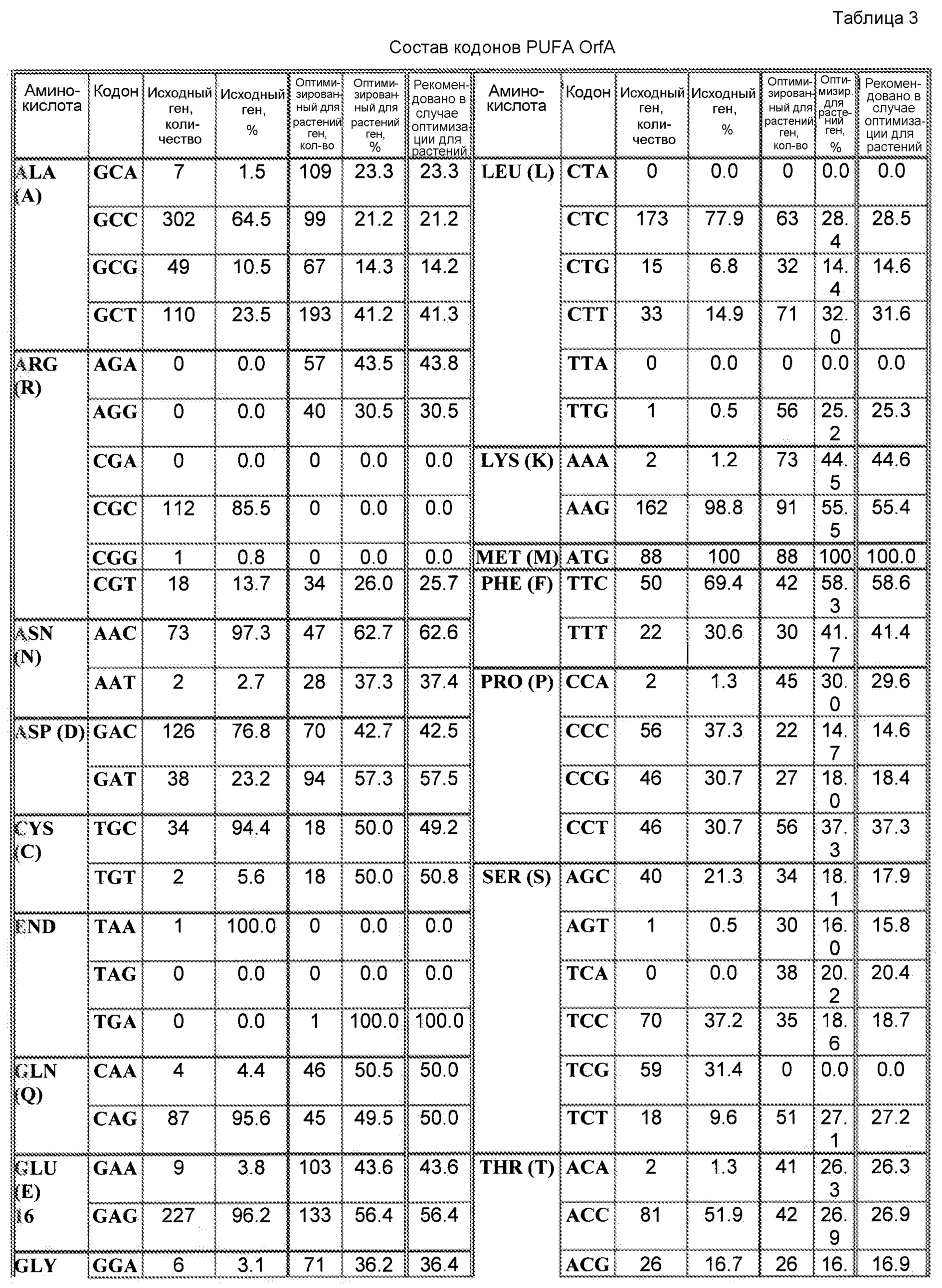
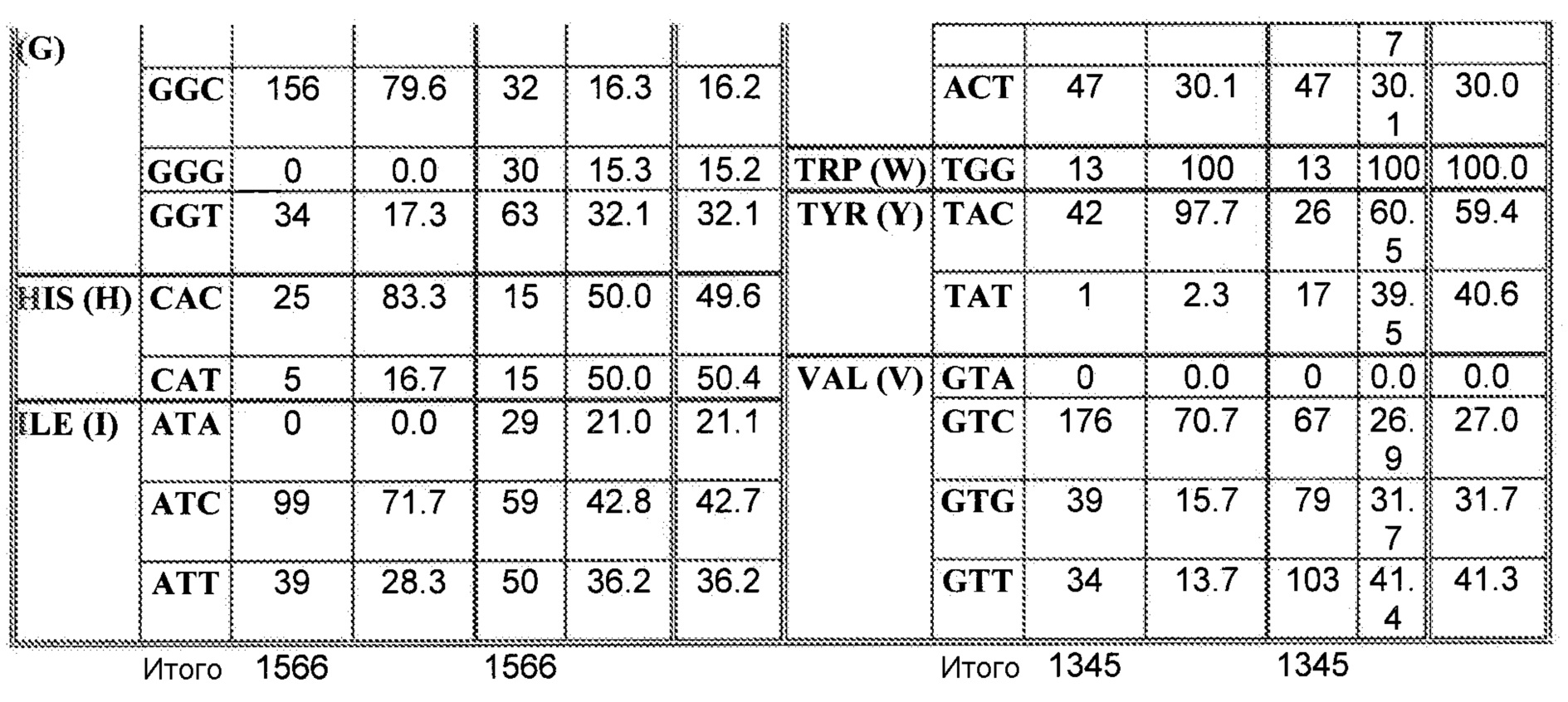
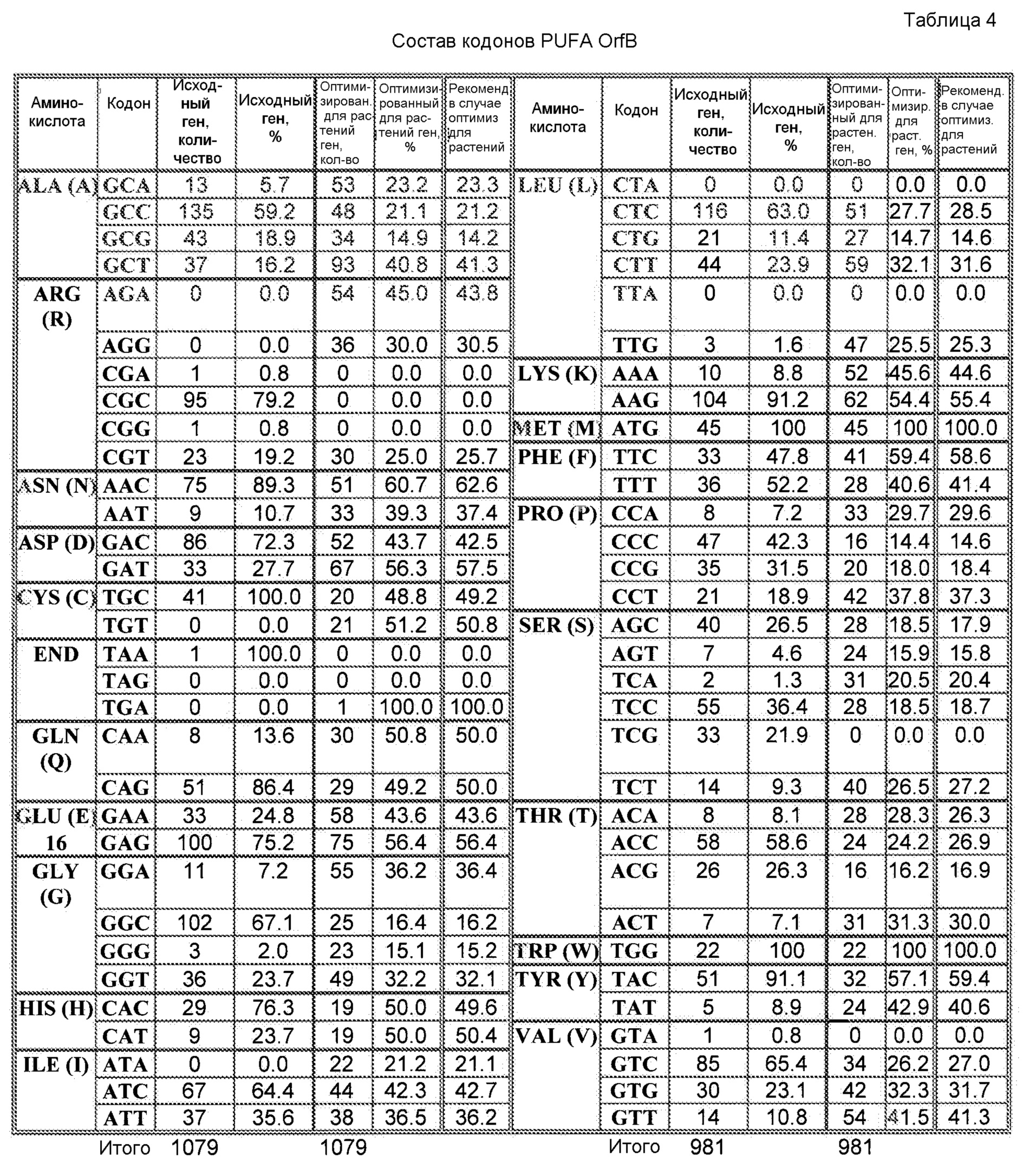
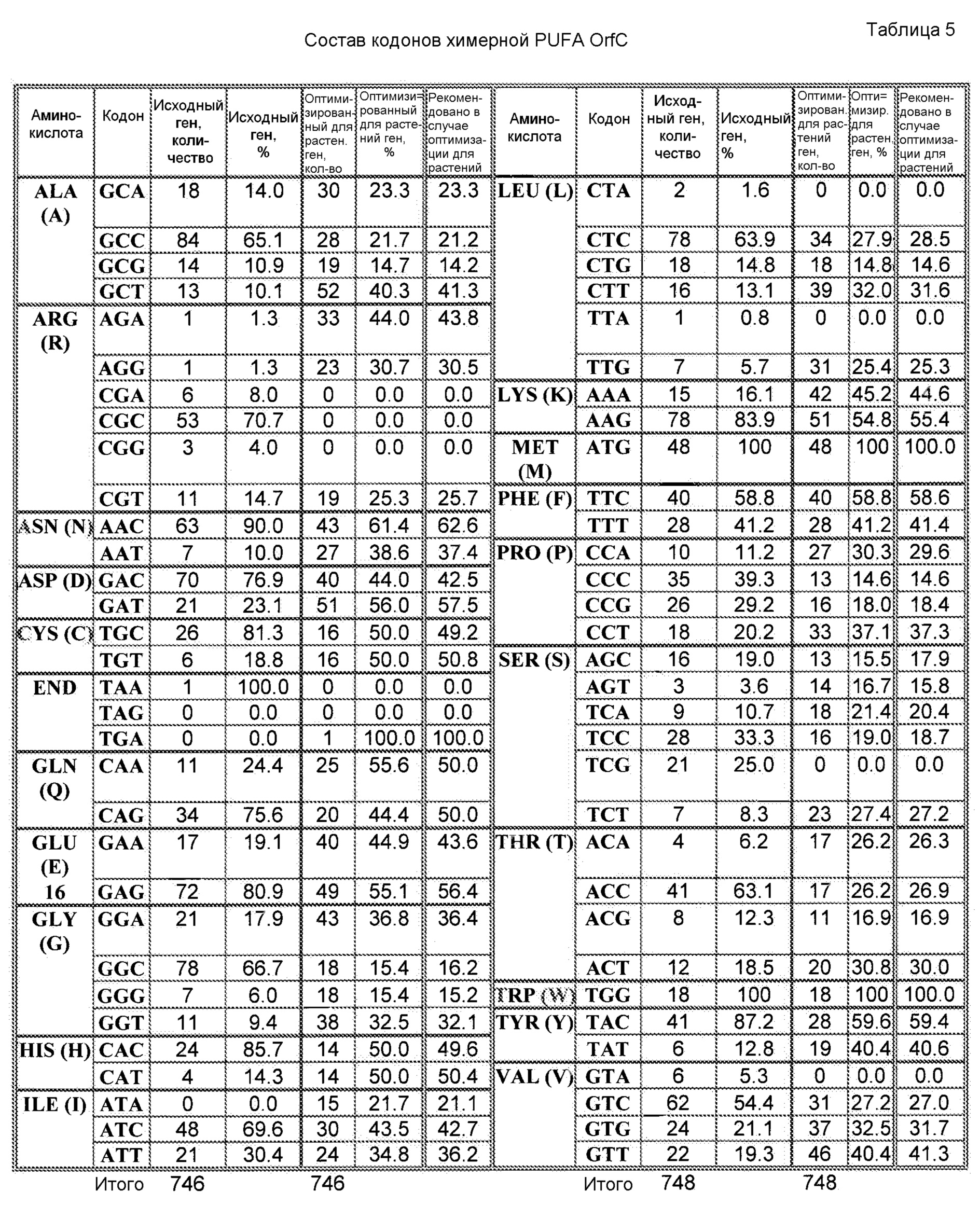
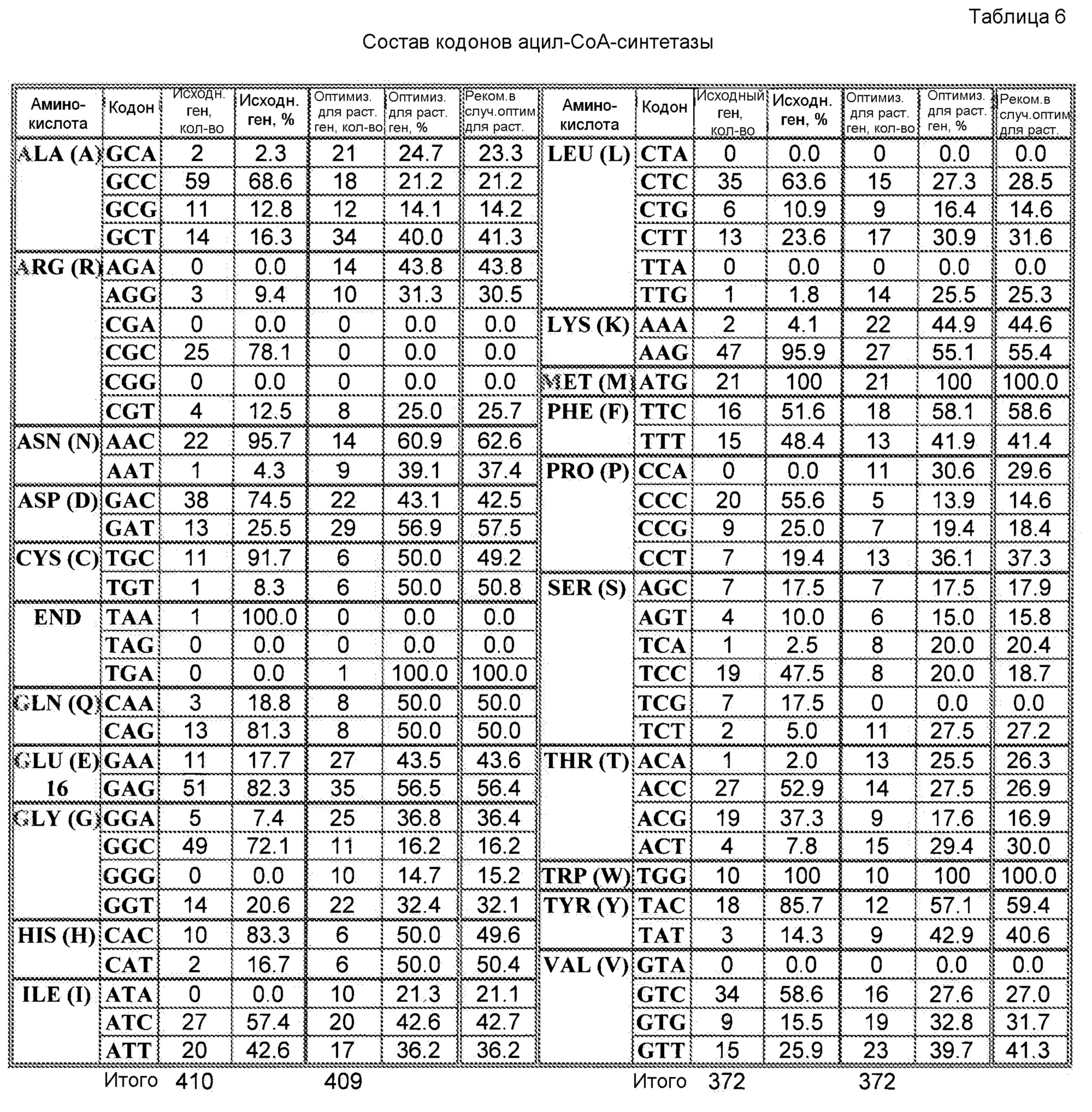
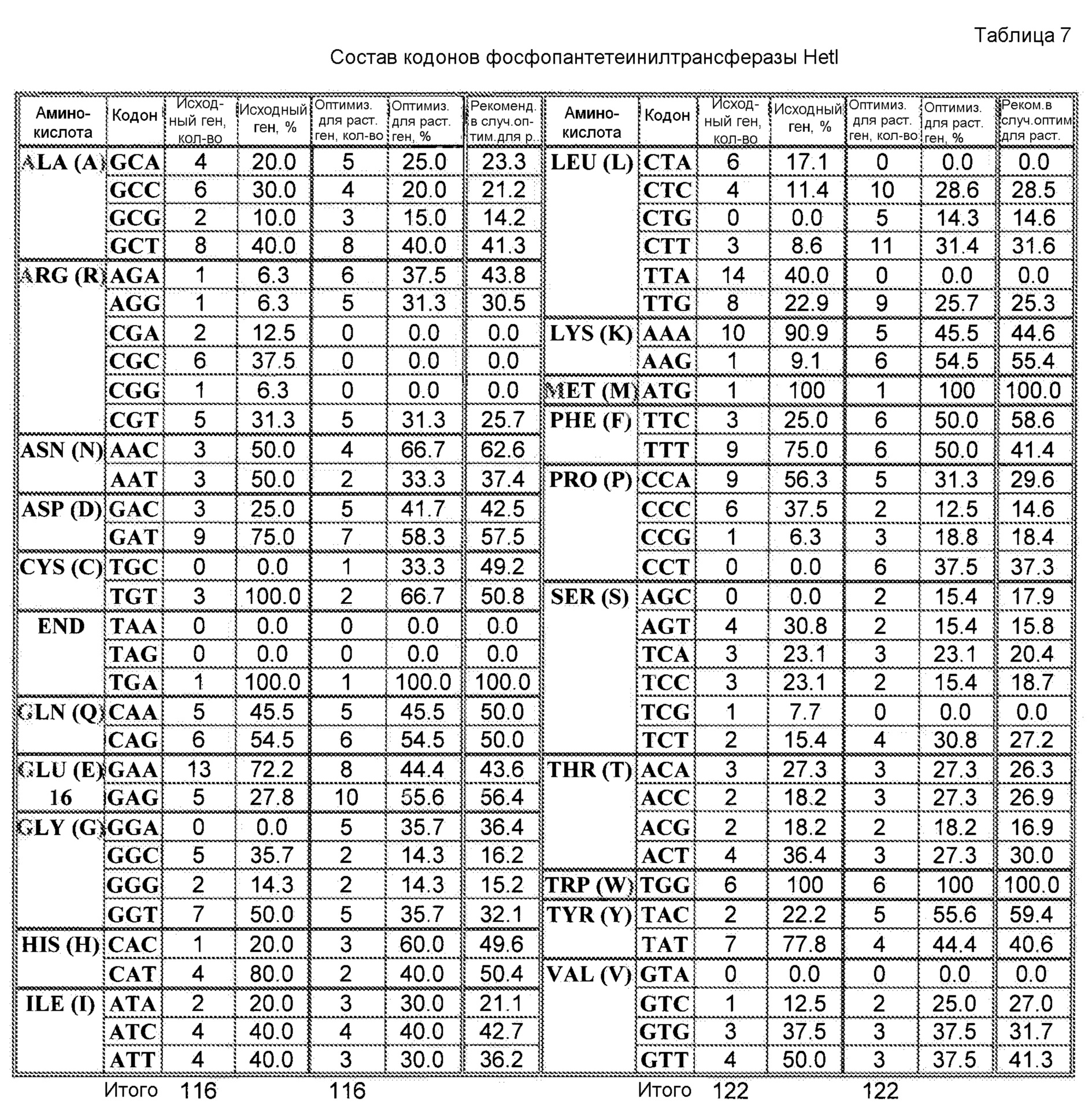
После завершения оптимизации кодонов последовательностей кодирующих областей добавляли дополнительные нуклеотидные последовательности к оптимизированной последовательности кодирующей области. К оптимизированной кодирующей последовательности растения добавляли сайты рестрикции для облегчения клонирования, последовательность Козака и дополнительные стоп-кодоны. Кроме того, конструировали вторую серию кодирующих последовательностей ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и фосфопантетеинилтрансферазы HetI, которые содержали направляющую в хлоропласт последовательность из малой цепи 1A рибулезобисфосфаткарбоксилазы Arabidopsis thaliana (GenBank ID: NM_202369.2). Такую последовательность, SEQ ID NO: 28, добавляли к ранее описанным кодирующим последовательностям ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC и фосфопантетеинилтрансферазы HetI. Начальный метионин из последовательностей SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 10 удаляли и заменяли направляющей в хлоропласт последовательностью. Последовательности, которые содержат направляющую в хлоропласт последовательность, указаны в описании как вариант 4 (v4).
Добавляли второй транзитный пептид хлоропласта к кодирующим последовательностям ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и фосфопантетеинилтрансферазы HetI. Такие кодирующие последовательности были сконструированы так, что они содержали направляющую в хлоропласт последовательность из ацил-АПБ-тиоэстеразы (GenBank ID: X73849.1). Такая последовательность, SEQ ID NO: 29, была добавлена к ранее описанным кодирующим последовательностям ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC и фосфопантетеинилтрансферазы HetI. Начальный метионин из последовательностей SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 и SEQ ID NO: 10 удаляли и заменяли направляющей в хлоропласт последовательностью. Последовательности, которые содержат направляющую в хлоропласт последовательность, обозначены в настоящем описании как вариант 5 (v5).
Альтернативный вариант гена ацил-CoA-синтетазы из Schizochytrium sp. создавали, модифицируя нативную последовательность гена так, чтобы удалить ненужные открытые рамки считывания. Такой вариант обозначен «SzACS-2 v4» и указан в виде SEQ ID NO: 30. Полученный ген используют для замены последовательности гена, экспрессирующей ацил-CoA-синтетазу, описанной выше как «SzACS-2 v3».
После конструирования оптимизированной для растений последовательности ДНК на бумаге или in silico, в лаборатории могут быть синтезированы реальные молекулы ДНК, точно соответствующие по последовательности требуемой последовательности. Такие синтетические молекулы ДНК могут быть клонированы и подвергнуты другим обработкам точно так же, как и в случае, если бы они были получены из естественных или природных источников. Синтез фрагментов ДНК, содержащих последовательности SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10, которые содержат дополнительные последовательности, описанные выше, осуществляли коммерческие поставщики (Geneart Ag, Регенсбург, Германия). Затем синтетическую ДНК клонировали в экспрессирующих векторах и трансформировали Agrobacterium и сою, как описано в примерах 2 и 3.
ПРИМЕР 2
Конструирование плазмиды pDAB7362
Бинарную плазмиду pDAB7362 (фиг. 2; SEQ ID NO: 11) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB7362 содержит три PTU ПНЖК-синтазы (которые экспрессируют гены ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, описанные выше), одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы HetI и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит укороченный промотор гена фитогемагглютинина-L Phaseolus vulgaris (промотор PvDlec2 v2; номер доступа в GenBank X06336), 5'-нетранслируемую область гена AT2S3 Arabidopsis thaliana (5'-UTR 2S; номер доступа в GenBank NM_118850), открытую рамку считывания A синтазы полиненасыщенных жирных кислот Schizochytrium sp. (SzPUFA OrfA v3) и терминатор 3'-нетранслируемой области гена альбумина 2S Arabidopsis thaliana 2S (терминатор At2S SSP v1; номер доступа в GenBank M22035). Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, открытую рамку считывания B синтезы полиненасыщенных жирных кислот Schizochytrium sp. (SzPUFA OrfB v3) и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, открытую рамку считывания C синтазы полиненасыщенных жирных кислот Schizochytrium и Thraustochytrium sp. (hSzThPUFA OrfC v3) и терминатор At2S SSP v1. PTU ацил-CoA-синтетазы PTU содержит промотор PvDlec2 промотор v2, 5'-UTR 2S, ацил-CoA-синтетазу Schizochytrium sp. (SzACS-2 v3) и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, 4'-фосфопантетеинилтрансферазу HetI Nostoc sp. (NoHetI v3) и терминатор At2S SSP v1.
Плазмиды pDAB7334, pDAB7335, pDAB7336, pDAB7339 и pDAB7333 подвергали рекомбинации с образованием pDAB7362. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, SzACS-2 v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор вируса мозаики прожилок маниока (промотор CsVMV v2; Verdaguer с соавторами, Plant Molecular Biology 31: 1129-1139; 1996), фосфинотрицинацетилтрансферазу (PAT v5; Wohlleben с соавторами, Gene 70: 25-37; 1988) и 3'-нетранслируемую область ORF1 Agrobacterium tumefaciens (AtuORFl 3' UTR v4; Huang с соавторами, J. Bacteriol. 172: 1814-1822; 1990), в добавление к другим регуляторным элементам, таким как Overdrive (Toro с соавторами, PNAS 85(22): 8558-8562; 1988) и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК; Gardner с соавторами, Science 231: 725-727; 1986 и международная публикация № WO 2001/025459 A1). Затем рекомбинантные плазмиды, содержащие пять PTU, были выделены и подвергнуты тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.1: Конструирование дополнительных плазмид с использованием промотора PvDlec2 для управления экспрессией
Конструировали и создавали дополнительные конструкции, в которых использовали промотор PvDlec2 для управления экспрессией трансгенов ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI. В таких конструкциях были осуществлены различные изменения, чтобы повысить уровни экспрессии. Такие изменения включают использование оптимизированных по стоп-кодонам генных последовательностей, введение транзитных пептидов хлоропластов и удаление PTU ацил-CoA-синтетазы.
Вновь сконструированные плазмиды использовали для стабильной трансформации растений сои. Трансгенные растения сои выделяли и подвергали молекулярной характеристике. Применение таких измененных конструкций приводит к получению растений сои, которые содержат большие количества ДГК и ДЦ-ПНЖК. Определяли получаемое накопление ДЦ-ПНЖК и идентифицировали растения сои, которые продуцировали от 0,01% до 15% ДГК или от 0,01% до 15% ДЦ-ПНЖК.
ПРИМЕР 2.2: Конструирование pDAB7361
pDAB7361 представляет собой бинарную плазмиду, которую конструировали так, чтобы она содержала нативный не оптимизированный по кодонам вариант SzPUFA OrfA v2, остальные генные последовательности оптимизировали по кодонам (SzPUFA OrfB v3, hSzThPUFA OrfC v3, SzACS-2 v3 и NoHetI v3). Плазмиду pDAB7361 (фиг. 3; SEQ ID NO: 31) конструировали с использованием реакции рекомбинации во множественных сайтах Gateway L-R. pDAB7361 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы PTU. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v2 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1l PTU ацил-CoA-синтетазы содержит промотор PvDlec2 v2, 5'-UTR 2S, ген SzACS-2 v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB7355, pDAB7335, pDAB7336, pDAB7339 и pDAB7333 подвергали рекомбинации с образованием pDAB7361. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v2, SzPUFA OrfB v3, hSzThPUFA OrfC v3, SzACS-2 v3 NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и Последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие шесть PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.3: Конструирование pDAB7363
pDAB7363 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA v4, SzPUFA OrfB v4, hSzThPUFA OrfC v4 и NoHetI v4, которые все содержат малую цепь 1A рибулезобисфосфаткарбоксилазы (обозначаемую как SSU-TP v1), которая слита с амино-концом кодирующей последовательности. Кроме того, такая плазмида содержит перестроенный, оптимизированный по кодонам вариант SzACS-2 v3. Плазмиду pDAB7363 (фиг. 4; SEQ ID NO: 32) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB7363 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v4 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v4 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v4 и терминатор At2S SSP v1. PTU ацил-CoA-синтетазы содержит промотор PvDlec2 v2, 5'-UTR 2S, ген SzACS-2 v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v4 и терминатор At2S SSP v1.
Плазмиды pDAB7340, pDAB7341, pDAB7342, pDAB7344 и pDAB7333 подвергали рекомбинации с образованием pDAB7363. В частности, пять PTU описанных выше помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v4, SzPUFA OrfB v4, hSzThPUFA OrfC v4, SzACS-2 v3, NoHetI v4. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие шесть PTU, выделяли и подвергали тестированию в отношении включения шести PTU c использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.4: Конструирование pDAB7365
pDAB7365 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала нативные, не оптимизированные по кодонам варианты SzPUFA OrfA v2, SzPUFA OrfB v2, hSzThPUFA OrfC v2, SzACS-2 v2 и NoHetI v2. Плазмиду pDAB7365 плазмида (фиг. 5; SEQ ID NO: 33) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB7365 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v2 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v2 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfC v2 и терминатор At2S SSP v1. PTU ацил-CoA-синтетазы содержит промотор PvDlec2 v2, 5'-UTR 2S, ген SzACS-2 v2 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v2 и терминатор At2S SSP v1.
Плазмиды pDAB7355, pDAB7356, pDAB7357, pDAB7360 и pDAB7333 подвергали рекомбинации с образованием pDAB7365. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v2, SzPUFA OrfB v2, SzPUFA OrfC v2, SzACS-2 v2, NoHetI v2. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.5: Конструирование pDAB7368
pDAB7368 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала нативные, не оптимизированные по кодонам варианты SzPUFA OrfA v2, SzPUFA OrfB v2, hSzThPUFA OrfC v2 и NoHetI v2. Такая конструкция не содержит кодирующей последовательности SzACS-2. Плазмиду pDAB7368 (фиг. 6; SEQ ID NO: 34) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB7368 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v2 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v2 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfC v2 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v2 и терминатор At2S SSP v1.
Плазмиды pDAB7355, pDAB7356, pDAB7357, pDAB7359 и pDAB7333 подвергали рекомбинации с образованием pDAB7368. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v2, SzPUFA OrfB v2, SzPUFA OrfC v2, NoHetI v2. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Заем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.6: Конструирование pDAB7369
pDAB7369 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3 и NoHetI v3. Такая конструкция не содержит PTU кодирующей последовательности SzACS-2. Плазмиду pDAB7369 (фиг. 7; SEQ ID NO: 35) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB7369 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB7334, pDAB7335, pDAB7336, pDAB7338 и pDAB7333 подвергали рекомбинации с образованием pDAB7369. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5,3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.7: Конструирование pDAB7370
pDAB7370 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA v4, SzPUFA OrfB v4, hSzThPUFA OrfC v4 и NoHetI v4, которая содержит малую цепь 1A рибулезобисфосфаткарбоксилазы (обозначаемую как SSU-TP v1), которая слита с амино-концом кодирующей последовательности. Такая конструкция не содержит PTU кодирующей последовательности SzACS-2. Плазмиду pDAB7370 (фиг. 8; SEQ ID NO: 36) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB7370 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v4 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v4 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'UTR 2S, hSzThPUFA OrfC v4 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'UTR 2S, NoHetl v4 и терминатор At2S SSP v1.
Плазмиды pDAB7340, pDAB7341, pDAB7342, pDAB7343 и pDAB7333 подвергали рекомбинации с образованием pDAB7370. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v4, SzPUFA OrfB v4, hSzThPUFA OrfC v4, NoHetI v4. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.8: Конструирование pDAB100518
pDAB100518 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA v5, SzPUFA OrfB v5, hSzThPUFA OrfC v5 и NoHetI v5, которая содержит транзитный пептид хлоропластов из ацил-АПБ-тиоэстеразы (называемый транзитным пептидом тиоэстеразы), который слит с амино-концом кодирующей последовательности. Кроме того, плазмида содержит PTU кодирующей последовательности SzACS-2 v3, которая не имеет транзитного пептида хлоропластов. Плазмиду pDAB100518 (фиг. 9; SEQ ID NO: 37) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB100518 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v5 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v5 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v5 и терминатор At2S SSP v1. PTU ацил-CoA-синтетазы содержит промотор PvDlec2 v2, 5'-UTR 2S, ген SzACS-2 v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v5 и терминатор At2S SSP v1.
Плазмиды pDAB100517, pDAB100514, pDAB100511, pDAB100515 и pDAB7333 подвергали рекомбинации с образованием pDAB100518. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v5, SzPUFA OrfB v5, hSzThPUFA OrfC v5, SzACS-2 v3, NoHetI v5. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие шесть PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.9: Конструирование pDAB101476
pDAB101476 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3 и NoHetI v3. Последовательность гена SzACS-2 v2 представляет собой нативный, не оптимизированный по кодонам вариант. Плазмиду pDAB101476 (фиг. 10; SEQ ID NO: 38) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB101476 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU ацил-CoA-синтетазы содержит промотор PvDlec2 v2, 5'-UTR 2S, ген SzACS-2 v2 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB7334, pDAB7335, pDAB7336, pDAB101471 и pDAB7333 подвергали рекомбинации с образованием pDAB101476. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, SzACS-2 v2, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие шесть PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 2.10: Конструирование pDAB101477
pDAB101477 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3 и NoHetI v3. Плазмиду pDAB101477 (фиг. 11; SEQ ID NO: 39) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB101477 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU ацил-CoA-синтетазы содержит промотор PvDlec2 v2, 5'-UTR 2S, ген SzACS-2 v4 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB7334, pDAB7335, pDAB7336, pDAB101472 и pDAB7333 подвергали рекомбинации с образованием pDAB101477. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, SzACS-2 v4, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие шесть PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 3
Трансформация сои
Трансгенную сою (Glycine max) создавали, используя опосредованную Agrobacterium трансформацию эксплантатов семядольного узла сои. Обезоруженный штамм Agrobacterium DA2552 (заявка на выдачу патента США № 61/368965, поданная 29 июля 2010), несущий бинарные векторы, описанные выше, такие как pDAB7362, использовали для инициации трансформации.
Опосредованную Agrobacterium трансформацию осуществляли с помощью модифицированного способа, описанного Zeng с соавторами, используя семядольные узлы 1/2 (Zeng P., Vadnais D.A., Zhang Z., Polacco J.C., (2004), Plant Cell Rep., 22(7): 478-482). Коротко, семена сои (сорт Maverick) проращивали на базовой среде, и семядольные узлы выделяли и инфицировали Agrobacterium. В среды для инициации побегов, роста побегов в длину и образования корней добавляли цефотаксим, тиментин и ванкомицин для удаления Agrobacterium. Селекцию на глюфосинате использовали для ингибирования роста нетрансформированных побегов. Отобранные побеги переносили в среду для образования корней, чтобы развивались корни, и затем переносили в почвенную смесь для акклиматизации проростков.
Концевые листочки отобранных проростков местно обрабатывали (способ нанесения на листья намазыванием) глюфосинатом, чтобы провести скрининг в отношении предполагаемых трансформантов. Отобранные саженцы переносили в теплицу, давали возможность акклиматизироваться и затем наносили на листья глюфосинат, чтобы повторно подтвердить устойчивость. Брали образцы таких предполагаемых трансформированных растений T0 и использовали молекулярные анализы для подтверждения присутствия трансгенов PAT и ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI. Растениям T0 обеспечивали возможность самоопыления, чтобы получить семена T1.
Второй способ трансформации сои использовали для получения дополнительных трансгенных растений сои. Обезоруженный штамм Agrobacterium DA2552 (предварительная заявка на выдачу патента США № 61/368965), несущий бинарный вектор, описанный выше как pDAB7362, использовали для инициации трансформации.
Опосредованную Agrobacterium трансформацию осуществляли с помощью модифицированного способа Paz с соавторами на половинках семян (Paz M., Martinez J., Kalvig A., Fonger T., and Wang K., (2005) Plant Cell Rep., 25: 206-213). Коротко, зрелые семена сои стерилизовали в течение ночи газообразным хлором и пропитывали стерильной H2O за двадцать часов до опосредованной Agrobacterium трансформации растений. Семена разрезали пополам, делая продольный разрез вдоль рубчика, чтобы отделить семя и удалить семенную оболочку. Зародышевую ось вырезали и все аксиальные побеги/почки удаляли из семядольного узла. Полученные эксплантаты половинок семян инфицировали Agrobacterium. В среды для инициации побегов, роста побегов в длину и образования корней добавляли цефотаксим, тиментин и ванкомицин для удаления Agrobacterium. Селекцию на глюфосинате использовали для ингибирования роста нетрансформированных побегов. Отобранные побеги переносили в среду для образования корней, чтобы развивались корни, и затем переносили в почвенную смесь для акклиматизации проростков.
Концевые листочки отобранных проростков местно обрабатывали (способ нанесения на листья намазыванием) глюфосинатом, чтобы провести скрининг в отношении предполагаемых трансформантов. Отобранные саженцы переносили в теплицу, давали возможность акклиматизироваться и затем наносили на листья глюфосинат, чтобы повторно подтвердить устойчивость. Брали образцы таких предполагаемых трансформированных растений T0 и использовали молекулярные анализы для подтверждения присутствия трансгенов PAT и ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI. Было идентифицировано семь событий присутствия трансгенов из pDAB7362. Такие растения T0 выращивали для дальнейшего анализа и обеспечивали возможность для самоопыления в теплице, чтобы получить семена T1.
ПРИМЕР 4
Молекулярный анализ событий трансформации сои
Количество копий трансгенов в случае отобранных растений сои с событиями трансформации pDAB7362 оценивали, используя сравнительный способ количественной ПЦР в реальном времени (кПЦР). Образцы листовой ткани брали из верхних и нижних листьев зрелого растения сои, такие образцы объединяли и выделяли геномную ДНК. Геномную ДНК выделяли, используя набор для выделения ДНК растений BioSprint 96 и автоматизированную платформу для обработки магнитными частицами BioSprint 96 (Qiagen, Valencia, CA), следуя инструкциям производителя. Экстрагированную геномную ДНК разбавляли 1:5, используя ddH2O, для применения в качестве матрицы в реакциях количественной ПЦР в реальном времени (кПЦР).
Анализы кПЦР планировали так, чтобы выявить трансгены SzPUFA OrfA v3, SzPUFA OrfB v3, hThSzPUFA OrfC v3, SzACS-2 v3, NoHetI v3 и PAT v5 в pDAB7362-растениях сои, используя Roche Assay Design Center (www.universalprobelibrary.com). Праймеры и зонды, используемые в анализах, описаны в таблице 8. Присутствие генов-мишеней выявляли, используя меченые флуоресцеин-амидитом (FAM) зонды UPL (Roche Diagnostics, Indianapolis, IN). Такие анализы проводили, осуществляя реакции в двух повторах с использованием в качестве внутреннего стандарта GMFL01-25-J19 сои, GenBank: AK286292.1 (указанный в таблице 8 как GMS116), который метили флуоресцентным красителем цианином-5 (Cy-5).

Реакции ПЦР в реальном времени проводили в термоциклере для ПЦР в реальном времени LC480II (Roche, Indianapolis, IN), используя стандартные протоколы. Данные для анализов SzPUFA OrfA v3, SzPUFA OrfB v3, hThSzPUFA OrfC v3, SzACS-2 v3, NoHetI v3 и PAT v5 в случае мечения FAM собирали, используя эмиссионный фильтр 533 нм и сигнал возбуждения 483 нм. Данные для анализа Cy5-меченого стандарта GMS116 собирали, используя фильтр 660 нм и сигнал возбуждения 618 нм. Значения точек пересечения (Cp-значения) и соотношения мишень-эталон вычисляли автоматически, используя рабочий поток для «усовершенствованного относительного количественного» анализа («Advanced Relative Quantification») компьютерной программы LC480II. Соотношение мишень-эталон для каждого образца вычисляли, используя стандартный способ «дельта-дельта-Ct». Оцениваемое количество копий определяли с использованием нормализации соотношений мишень-эталон в образце относительно соотношения мишень-эталон для внутреннего стандарта сои GMFL01-25-J19.
Оцениваемое количество копий селектируемого маркера PAT v5 и трансгенов докозагексаеновой кислоты (ДГК) (SzPUFA OrfA v3, SzPUFA OrfB v3, hThSzPUFA OrfC v3, SzACS-2 v3 и NoHetI v3) определяли в растениях T1 в случае семи событий pDAB7362. Растения, полученные в результате двух событий, 7362[710]-71006 и 7362[710]-71010, не содержали ни селектируемого маркера PAT v5, ни последовательностей генов-мишеней ДГК. Растения, полученные в результате остальных событий: 7362[710]-70903, 7362[710]-71005, 7362[710]-71008, и 7362[710]-71009, содержали селектируемый маркер PAT v5 и пять трансгенов ДГК с количеством копий в диапазоне 1-10. Событие 7362[708]-70801 давало растения T1, имеющие 0, 1 или 2 копии гена PAT v5, что свидетельствует об одном сегрегирующем локусе, а событие 7362[710]-71005 давало растения T1, имеющие количество копий PAT v5 от 0 до 4, что свидетельствует о сегрегации по двум несцепленным локусам.
ПРИМЕР 5
Анализ липидов в семядолях T1 трансгенных растений сои
Чтобы избежать осуществления связанного с разрушением образцов анализа ограниченного количества семян T1, осуществляли анализ метиловых эфиров жирных кислот (FAME), используя зеленые семядоли растений T1 после всходов. Способы очистки и анализа FAME описаны (например,

Характеристика профиля масла в семядолях T1 является показателем профиля масла в сухих семенах T1

ПРИМЕР 5.1: Подтверждение послевсходового выявления ДГК в семядолях T1 с использованием анализа трансгенной канолы
Подтверждение и выявление длинноцепочечных полиненасыщенных жирных кислот (ДЦ-ПНЖК) в зеленых семядолях после всходов осуществляли с использованием семян ДГК-продуцирующей канолы, чтобы оценить, является ли характеристика профиля масла в семядолях T1 показателем наличия профиля масла в зрелых семенах T1. Трансгенные семена канолы, несущие бинарную плазмиду pDAB7362, проращивали при комнатной температуре на насыщенных водой бумажных полотенцах и собирали через 3 дня, и в этот момент ткань подвергали лиофилизации. Ткань непосредственно трансметилировали без предварительной экстракцией гексаном. Рассчитывали содержание ДЦ-ПНЖК (% масс. FAME) и сравнивали со зрелыми семенами. Среднее содержание ДГК в 30 взошедших семядолях канолы составляло 0,71% (суммарные ДЦ-ПНЖК = 0,97%) с содержанием масла 53,0%. Среднее содержание ДГК для 48 зрелых семян канолы до всходов составляло 0,49% (суммарные ДЦ-ПНЖК = 0,73%) с содержанием масла 44,3%. Настоящее исследование показывает, что ДЦ-ПНЖК могут быть выявлены после всходов в появляющихся зеленых семядолях, и такое выявление ДЦ-ПНЖК в появляющихся зеленых семядолях показывает, что ДЦ-ПНЖК присутствуют в семенах.
ПРИМЕР 5.2: Послевсходовое выявление ДГК в семядолях сои T1
Анализ FAME осуществляли на одной срезанной зеленой семядоли на проросток сои, взятой в качестве образца на 3-5 день после посева. Растительный материал лиофилизировали, гомогенизировали, используя стальной шар и шаровую мельницу, и 3 раза обезжиривали гексаном. Объединенную гексановую фракцию упаривали и сухой остаток взвешивали и перерастворяли в гептане. Известное количество масляного остатка трансметилировали с использованием 0,25 М свежеприготовленного метилата натрия (Sigma-Aldrich, St. Louis, MO) в метаноле в присутствии заместителя, тригептадеканоина (Nu-Chek Prep, Elysian, MN). Реакцию проводили при умеренном нагревании (40°C) и постоянном встряхивании и полученные FAME экстрагировали гептаном. Завершение реакции подтверждали извлечением прореагировавшего заменителя сложного метилового эфира гептадеканоата. Экстракты FAME анализировали посредством ГХ-ПИД, используя газовый хроматограф Agilent 6890 (Agilent Technologies, Santa Clara, CA) и капиллярную колонку 15 м × 0,25 мм × 0,25 мкм BPX 70 из SGE (Austin, TX). Каждый пик FAME идентифицировали по его времени удерживания и количественно оценивали посредством инъекции эталонной смеси рапсового масла из Matreya LLC (Pleasant Gap, PA). Калибровочный стандарт содержал отдельно добавляемые стандарты метиловых эфиров ДГК, ЭПК и ДПК(n-6) из Nu-Chek. Анализ данных осуществляли, используя компьютерную программу ChemStation4 (Agilent). Семядоли T1 растений, полученных в результате двух событий, содержали ДГК, pDAB7362[708]-70801.001 и pDAB7362[710]-71005.001 (таблица 9).
Сорок семян, полученных в результате события pDAB7362[708]-70801.001, проращивали и подвергали скринингу в отношения присутствия ДЦ-ПНЖК в срезанной зеленой семядоле. Семядоли от шести из сорока семян содержали ДЦ-ПНЖК в диапазоне от 0,78% до 1,58% (со средним значением 1,12%). Содержание ДГК было в диапазоне от 0,48% до 0,93% (со средним значением 0,68%), и содержание ДПК (n-6) было в диапазоне от 0,3% до 0,65% (со средним значением 0,44%).
Тридцать девять семян, полученных в результате события pDAB7362[710]-71005.001, проращивали и подвергали скринингу в отношении присутствия ДЦ-ПНЖК в срезанной зеленой семядоле. Семядоли от тридцати семи из тридцати девяти семян содержали ДЦ-ПНЖК в диапазоне от 0,70% до 11,98% (со средним значением 3,91%). Из всех суммарных ДЦ-ПНЖК содержание ДГК было в диапазоне от 0,36% до 8,00% (со средним значением 2,24%), и содержание ДПК(n-6) было в диапазоне от 0,34% до 3,98% (со средним значением 1,68%).
Идентификацию ДЦ-ПНЖК подтверждали, оценивая специфичную фрагментацию стандартных метиловых эфиров ПНЖК (Nu-Chek Prep, Elysian, MN) с использованием ГХ-TOF-МС Pegasus III (Leco, St. Joseph, MI) по сравнению с негативным контролем.
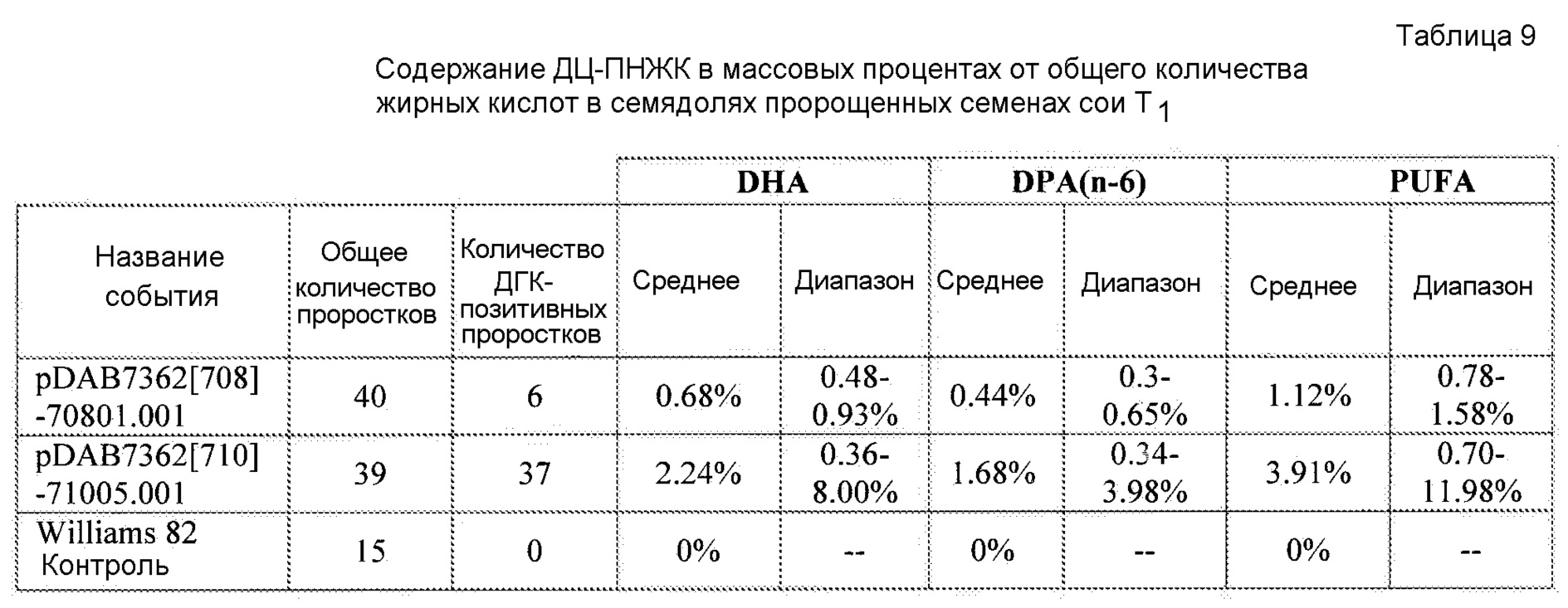
ПРИМЕР 6
Анализ липидов в зрелых семенах T2 от трансгенных растений сои
Растения T1, полученные в результате двух событий, 7362[708]-70801.001 и 7362[710]-71005.001, выращивали до зрелости в теплице. Отбирали растения, которые содержали высокие уровни ДЦ-ПНЖК в семядоле T1 и одну или две копии PAT v5 и сопутствующих пяти генов для продуцирования ДГК. Такие растения подвергали самоопылению и полученные семена T2 собирали в состоянии зрелости. Отдельные семена анализировали, используя ГХ-ПИД FAME, чтобы определить содержание ДЦ-ПНЖК и ДГК в семенах сои T2. Двенадцать целых зрелых семян на растение анализировали по отдельности, раздавливая семена прессом и гомогенизируя с использованием стального шара и шаровой мельницы. Ткань обезжиривали три раза гексаном, объединенные гексановые фракции упаривали досуха и остаток взвешивали и перерастворяли в гептане для анализа FAME, осуществляемого как описано в предыдущем примере.
Отдельные семена T2 от растения T1, полученного в результате события 7362[708]-70801.001 (описанного как 7362[708]- 70801.Sx.021 на фигуре 12), которое имело одну копию PAT v5, содержали от 0% до 0,73% ДГК (от 0% до 1,19% суммарных ДЦ-ПНЖК). Отдельные семена T2 от двух растений T1, полученных в результате события 7362[710]-71005.001 (описанных как 7362[710]-71005.Sx.006 и 7362[710]-71005.Sx.0.35 на фигуре 12), имеющих одну копию PAT v5, содержали от 0% до 2,08% ДГК (от 0% до 3,56% суммарных ДЦ-ПНЖК). Отдельные семена T2 от семи растений T1, подученных в результате события 7362[710]-71005.001 (описанных как 7362[710]-71005.Sx.010, 7362[710]-71005.Sx.012, 7362[710]-71005.Sx.013, 7362[710]-71005.Sx.016, 7362[710]-71005.Sx.018, 7362[710]-71005.Sx.025 и 7362[710]-71005.Sx.031 на фигуре 12), имеющих две копии PAT v5, содержали от 0% до 2,84% ДГК (от 0% до 4,77% суммарных ДЦ-ПНЖК). Среднее содержание ДГК в семенах T2 в линии с наиболее высокой продукцией ДГК (7362[710]- 71005.Sx.025) составляло 1,83% (3,11% суммарных ДЦ-ПНЖК). Содержание ДГК в каждом семени T2 от отдельных растений T1 показано на фигуре 12.
ДГК составляла 60% от общего содержания ДЦ-ПНЖК в таких семенах T2, которые содержали ДЦ-ПНЖК. Только две новых ДЦ-ПНЖК, ДГК и ДПК(n-6), были выявлены в семенах сои T2. Жирные кислоты, которые, как предполагалось, находятся в семенах сои, выявляли на нормальных уровнях, за исключением того, что содержание суммарных C18-жирных кислот было пропорционально ниже, вследствие присутствия ДЦ-ПНЖК. В таких трансгенных семенах сои не было выявлено никаких других жирных кислот, отличных от ДГК и ДПК(n-6). Содержание масла (сумма масс отдельных FAME, деленная на массу семян) в трансгенных семенах и количество семян, образуемых трансгенными линиями T1, значимо не отличались от таких показателей нетрансгенного контрольного сорта Williams 82, выращиваемого в теплице одновременно и в таких же условиях.
Полные профили FAME отдельных семян T2 от растений сои, полученных в результате событий 7362[708]-70801.001 и 7362[710]-71005.001, показаны в таблице 10.
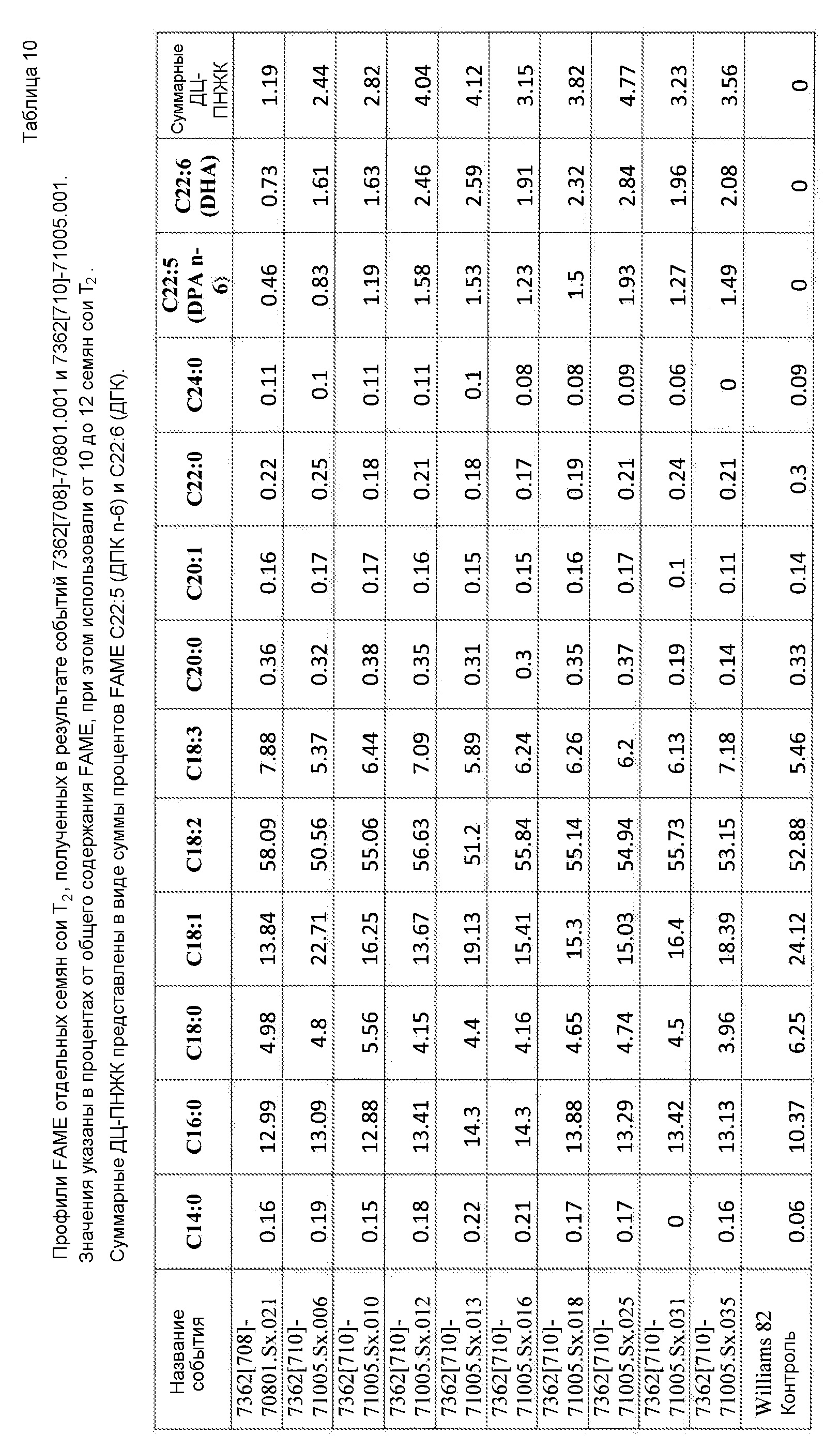
ПРИМЕР 6.1: Анализ липидов в зрелых семенах T3, полученных в результате двух трансгенных событий у сои
Растения сои T2, полученные двух событий, 7362[708]-70801.001 и 7362[710]-71005.001, выращивали до зрелости в теплице. В теплице выращивали множество растений, полученных в результате каждого события, и проводили скрининг, чтобы идентифицировать отдельные растения, которые продуцировали высокие уровни ДЦ-ПНЖК в семядоле T2 и содержали одну гомозиготную инсерцию трансгенов. Идентифицированные растения подвергали самоопылению и полученные семена T3 собирали, когда семена достигали зрелости. Отдельные зрелые семена T3 анализировали, используя ГХ-ПИД FAME, чтобы определить содержание ДГК и ДЦ-ПНЖК в семенах сои T3 (фигура 12a). Двенадцать целых зрелых семян на растение анализировали по отдельности, раздавливая семена прессом и гомогенизируя разрушенный семенной материал с использованием стального шара и шаровой мельницы. Ткань обезжиривали три раза гексаном, объединенные гексановые фракции упаривали досуха и остаток взвешивали и перерастворяли в гептане для анализа FAME, осуществляемого как описано в предыдущем примере. Уровни ДГК определяли в семенах T3 и сравнивали с уровнями ДГК в T2, которые анализировали ранее (таблица 11).
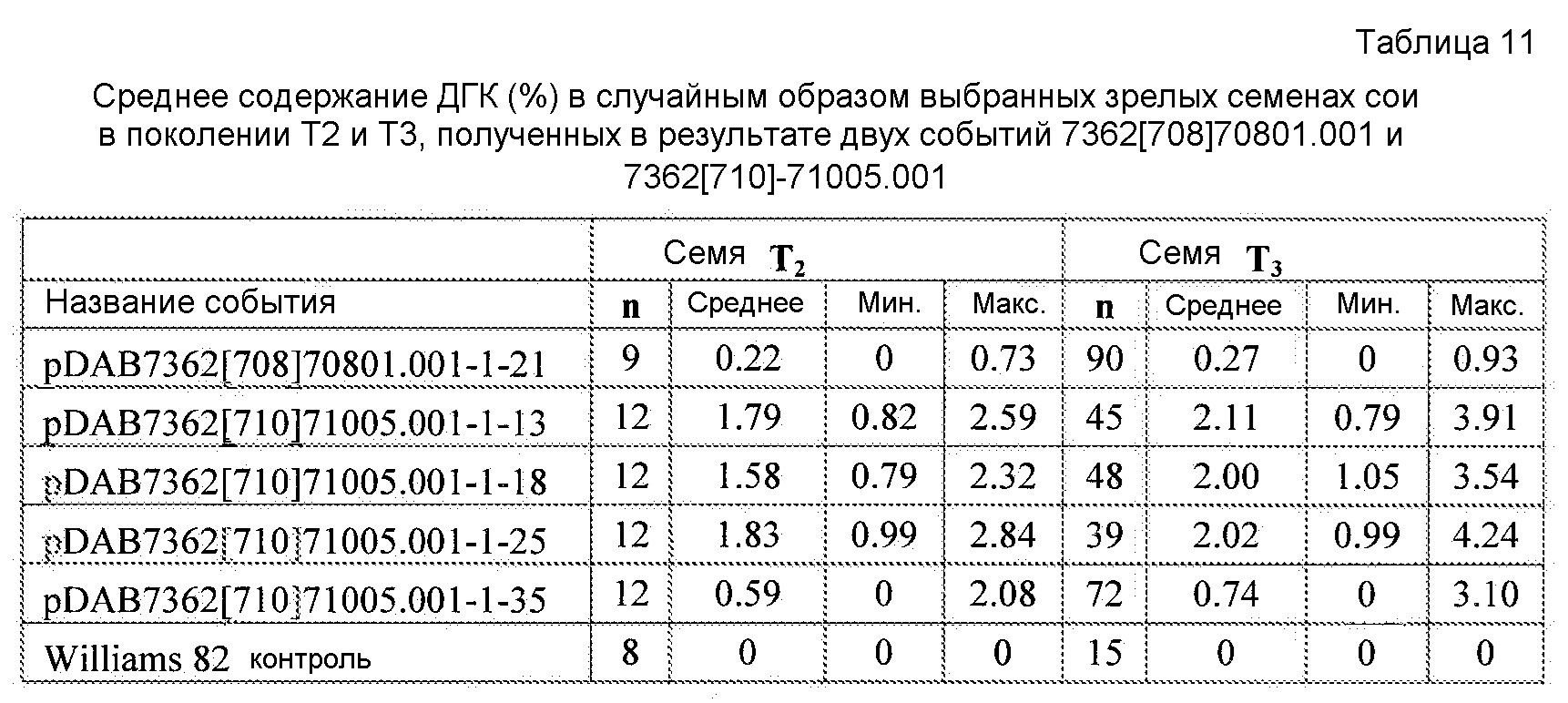
Как показано в таблице 11, относительное процентное содержание ДГК в семенах сои оставалось постоянным или увеличивалось в последующих поколениях сои (от T2 к T3). Отдельные семена T3, полученные в результате самоопыления растения T2 после события 7362[708]-70801.001 (указанную линию подвергали молекулярной характеристике и обнаружили, что она имеет одну гемизиготную копию PAT), анализировали, используя анализ FAME, и определили, что семена содержали от 0% до 0,93% ДГК (от 0% до 1,37% суммарных ДЦ-ПНЖК). Для сравнения, семена T2, полученные в результате события 7362[708]-70801.001, анализировали, используя анализ FAME, и определили, что семена содержали от 0% до 0,73% ДГК. Отдельные семена T3, полученные от самоопыления растения T2 после события 7362[710]-71005.001-1-35 (указанную линию подвергали молекулярной характеристике и обнаружили, что она имеет одну гемизиготную копию PAT) анализировали с использованием анализа FAME и определили, что семена содержали от 0% до 3,10% ДГК (от 0% до 5,45% суммарных ДЦ-ПНЖК). Для сравнения, семена T2, полученные в результате события 7362(710]-71005.001-1-35, анализировали с использованием анализа FAME и определили, что семена содержали от 0% до 2,84% ДГК. Кроме того, отдельные семена T3, полученные в результате событий 7362[710]-71005.001-1-13, 7362[710]-71005.001-1-18 и 7362[710]-71005.001-1-25 (в случае каждого события, как было определено, имелась одна гомозиготная копия PAT), содержали от 0,79% до 4,24% ДГК (от 1,26% до 6,5% суммарных ДЦ-ПНЖК). Для сравнения, семена T2, полученные в результате событий 7362[710]-71005.001-1-13, 7362[710]-71005.001-1-18 и 7362[710]-71005.001-1-25, анализировали с использованием анализа FAME и определили, что семена содержали от 0,79% до 2,84% ДГК. Трансгенные события сравнивали с контрольными растениями, при этом было обнаружено, что урожай на растение (количество семян) и общее содержание масла (%) были сходны с контролем Williams 82 в условиях, сходных с условиями для трансгенных линий.
В случае всех тестированных линий процентное содержание ДГК и ДЦ-ПНЖК, которые были продуцированы и содержание которых было измерено в семенах сои в поколениях T2 и T3, было либо постоянным, либо увеличивалось от поколения T2 к поколению T3. Полученные результаты показывают, что признаки наследуются, и что передача признаков следующим поколениям не приводит к уменьшению продуцирования ДГК.
ПРИМЕР 7
Выявление белков ПНЖК-синтазы в трансгенных семенах сои на Вестерн-блотах
ПНЖК-синтазу OrfA (кодируемую геном SzPUFA OrfA v3), ПНЖК-синтазу OrfB (кодируемую геном SzPUFA OrfB v3), химерную ПНЖК-синтазу OrfC (кодируемую геном hThSzPUFA OrfC v3) и HetI (из Nostoc sp. PCC 7120, GenBank ID: P37695, GL20141367) выявляли в образцах зрелых трансгенных семян в Вестер-блот-анализе. Остальные образцы семян сои T2 сохраняли после экстракции гексаном для анализа FAME. Порошкообразный жмых помещали в пробирку с одним шариком из нержавеющей стали размером 4,5 мм и добавляли буфер для экстракции (50 мМ трис, 10 мМ EDTA, 2% SDS). Пробирки с образцами осторожно встряхивали в течение 30 минут, центрифугировали в течение 15 минут при 3000 g и надосадок использовали для анализа. Количество общего растворимого белка в экстракте семян определяли в анализе белка при 660 нм (Thermo Fisher, Rockford, IL). Образцы нормализовали, доводя до 1,25 мг/мл общего растворимого белка и готовили в LDS-буфере для образцов (Invitrogen, Carlsbad, CA) с 50 мМ DTT для нормализованной загрузки 16,25 мкг общего растворимого белка на дорожку. Образцы подвергали электрофорезу в 3-8% трис-ацетатных гелях (Invitrogen, Carlsbad, CA) и переносили на нитроцеллюлозные мембраны для выявления ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB и химерной ПНЖК-синтазы OrfC. Образцы подвергали электрофорезу в 4-12% бис-трис-гелях (Invitrogen, Carlsbad, CA) и переносили на нитроцеллюлозные мембраны для выявления HetI.
Блоты инкубировали в блокирующем буфера, затем исследовали с использованием в качестве зондов антител против разных полипептидов ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC и HetI. Использовали кроличьи анти-A2-A, которые направлены против области A2 ПНЖК-синтазы OrfA Schizochytrium (SzPUFA-A), кроличьи анти-B3-A, которые направлены против области B3 ПНЖК-синтазы OrfB Schizochytrium (SzPUFA-B), и кроличьи анти-HetI, которые направлены против полноразмерного полипептида HetI. Область B3 включает в себя домен еноилредуктазы (ER) OrfB. Так как гомологичный домен ER также существует в химерной ПНЖК-синтазе OrfC, такая антисыворотка узнает как ПНЖК-синтазу OrfB, так и химерную ПНЖК-синтазу OrfC на Вестерн-блоте. Для выявления использовали второе антитело против Ig кролика, меченое флуоресцеином (антитело козы против AF 633 кролика (Invitrogen, Carlsbad, CA)). Блоты визуализировали на устройстве для получения флуоресцентных изображений Typhoon Trio Plus (GE Healthcare, New Brunswick NJ).
На Вестерн-блотах SDS-ПААГ белковых экстрактов из зрелых семян T2, полученных в результате событий 7362[708]-70801 и 7362 [710]-71005, выявлены полосы соответствующего размера при исследовании с использованием в качестве зондов специфичных антисывороток против ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC и HetI (фиг. 13). Полосы ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB и химерной ПНЖК-синтазы OrfC также можно обнаружить при прямом окрашивании Кумасси синим.
ПРИМЕР 8
Экспрессия набора генов ПНЖК-синтаз водорослей с использованием альтернативных промоторов
Использование дополнительных транскрипционных регуляторных элементов для экспрессии гена(ов), кодирующего белки ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, химерной ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI может дополнительно увеличивать содержание ДЦ-ПНЖК и ДГК в семенах сои. Идентификация и применение регуляторных элементов транскрипции, которые осуществляют экспрессию на ранних стадиях развития во время биосинтеза и отложения триацилглицерина и в течение более длительных периодов времени, могут повышать уровни ДЦ-ПНЖК и ДГК в семенах сои благодаря стимуляции транскрипции генов биосинтеза ДЦ-ПНЖК и ДГК на более ранних стадия развития семян (например, с 15 по 25 день после посева), и поэтому увеличивают период времени продуцирования ДЦ-ПНЖК и ДГК. Примеры таких областей регуляции транскрипции включают без ограничения промотор Lesquerella fendleri KCS (LfKCS3) (патент США № 7253337) и промотор FAE 1 (патент США № 6784342) и промотор ацилпереносящего белка Brassica oleracea (BoACP) (международная публикация № WO 1992/18634). Кроме того, можно использовать другие специфичные для семян промоторы, такие как промотор фазеолина Phaseolus vulgaris (патент США № 5504200) для надежного управления экспрессией гетерологичных генов в течение более длительных периодов времени во время развития семян чтобы повысить уровни ДЦ-ПНЖК и ДГК в семенах сои. Наконец, можно использовать сильные конститутивные промоторы, такие как промотор вируса мозаики прожилок маниока (промотор CsVMV v2) для управления экспрессией гетерологичных генов на всех стадиях развития, при этом повышая уровни ДЦ-ПНЖК и ДГК в семенах сои и других тканях растений.
Такие промоторы используют по отдельности или в сочетании для управления экспрессией кассет, экспрессирующих ПНЖК-синтазу OrfA, ПНЖК-синтазу OrfB, химерную ПНЖК-синтазу OrfC, ацил-CoA-синтетазу и 4'-фосфопантетеинилтрансферазу HetI, которые были описаны ранее, в плазмиде pDAB7362. Способы замены областей регуляции транскрипции в плазмиде хорошо известны в данной области. Соответственно, полинуклеотидный фрагмент, содержащий промотор PvDlec2 v2, удаляют из pDAB7362 (или предшествующих плазмид, используемых для создания pDAB7362) и заменяют новыми промоторными областями. Вновь сконструированные плазмиды используют для стабильной трансформации растений сои. Трансгенные растения сои выделяют и подвергают молекулярной характеристике. Накопление ДЦ-ПНЖК в результате такой обработки определяют в анализе профилей липидов (FAME) с применением способов, описанных в настоящей публикации, и идентифицируют растения сои, которые продуцируют от 0,01% до 15% масс. ДГК от общего количества жирных кислот, от 0,01% до 10% масс. ДПК(n-6) от общего количества жирных кислот или от 0,01% до 10% масс. ЭПК от общего количества жирных кислот.
Применение промоторов, которые осуществляют экспрессию на ранних стадиях развития семян
ПРИМЕР 8.1: Конструирование pDAB9166
Плазмиду pDAB9166 (фиг. 14; SEQ ID NO: 40) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB9166 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор LfKCS3 v1, SzPUFA OrfAv3 и 3' UTR AtuORF23 v1. Вторая PTU ПНЖК-синтазы содержит промотор LfKCS3 v1, SzPUFA OrfB v3 и 3' UTR AtuOrf23 v1. Третья PTU ПНЖК-синтазы содержит промотор Lf CS3 v1, hSzThPUFA OrfC v3 и 3' UTR AtuORF23 v1. PTU фосфопантетеинилтрансферазы содержит промотор LfKCS3 v1, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB9161, pDAB9162, pDAB9163, pDAB101484 и pDAB7333 подвергали рекомбинации с образованием pDAB9166. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.2: Конструирование pDAB9167
Плазмиду pDAB9167 (фиг. 15; SEQ ID NO: 41) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB9167 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор LfKCS3 v1, SzPUFA OrfAv3 и 3' UTR AtuORF23 v1. Вторая PTU ПНЖК-синтазы содержит промотор BoACP v1, 5' UTR BoACP v1, SzPUFA OrfB v3 и 3' UTR AtuOrf23 v1. Третья PTU ПНЖК-синтазы содержит промотор LfKCS3 v1, hSzThPUFA OrfC v3 и 3' UTR AtuORF23 v1. PTU фосфопантетеинилтрансферазы содержит промотор BoACP v1, 5' UTR BoACP v1, NoHetl v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB9161, pDAB9165, pDAB9163, pDAB101485 и pDAB7333 подвергал рекомбинации с образованием pDAB9167. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetl v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и тестировали в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
Плазмиды, содержащие промотор фазеолина
ПРИМЕР 8.3: Конструирование pDAB7379
pDAB7379 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC и NoHetI. Последовательность гена SzACS-2 не включена в такую конструкцию. Плазмиду pDAB7379 (фиг. 16; SEQ ID NO: 42) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R.
pDAB7379 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfAv3 и 3' UTR AtuORF23 v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfB v3 и 3' UTR AtuORF23 v1. Третья PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, hSzThPUFA OrfC v3 и 3' UTR AtuORF23 v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v3, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB7371, pDAB7372, pDAB7373, pDAB7374 и pDAB7333 подвергали рекомбинации с образованием pDAB7379. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.4: Конструирование pDAB7380
pDAB7380 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC и NoHetI. Последовательность гена SzACS-2 не входила в состав такой конструкции. Вариант промотора фазеолина, используемый в данной конструкции, модифицировали по существу как описано в публикации Bustos с соавторами, 1989 (The Plant Cell, Vol. 1; 839-853), при этом 5'-часть промотора укорачивали, а 5'-нетранслируемую область фазеолина оставляли интактной. Плазмиду pDAB7380 (фиг. 17; SEQ ID NO: 43) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R.
pDAB7380 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, SzPUFA OrfA v3 и 3' UTR AtuORF23 v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, SzPUFA OrfB v3 и 3' UTR AtuORF23 v1. Третья PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, hSzThPUFA OrfC v3 и 3' UTR AtuORF23 v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v5, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB7375, pDAB7376, pDAB7377, pDAB7378 и pDAB7333 подвергали рекомбинации с образованием pDAB7380. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.5: Конструирование pDAB9323
pDAB9323 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала нативные, не оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC, SzACS-2 и NoHetI. Плазмиду pDAB9323 (фиг. 18; SEQ ID NO: 44) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R.
pDAB9323 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfA v2, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfB v2, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Третья PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfC v2, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). PTU ацил-CoA-синтетазы содержит промотор PvPhas v3, 5' UTR PvPhas, ген SzACS-2 v2, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v3, 5' UTR PvPhas, NoHetI v2, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте).
Плазмиды pDAB9307, pDAB9311, pDAB9315, pDAB9322 и pDAB7333 подвергали рекомбинации с образованием pDAB9323. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v2, SzPUFA OrfB v2, SzPUFA OrfC v2, NoHetI v2. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие шесть PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.6: Конструирование pDAB9330
pDAB9330 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC, SzACS-2 и NoHetI. Плазмиду pDAB9330 (фиг. 19; SEQ ID NO: 45) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB9330 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfA v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfB v3, 3' UTR PvPhas и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Третья PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, hSzThPUFA OrfC v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). PTU ацил-CoA-синтетазы содержит промотор PvPhas v3, 5' UTR PvPhas, ген SzACS-2 v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v3, 5' UTR PvPhas, NoHetI v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте).
Плазмиды pDAB9324, pDAB9325, pDAB9326, pDAB9329 и pDAB7333 подвергали рекомбинации с образованием pDAB9330. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, SzACS-2 v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие шесть PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.7: Конструирование pDAB9337
pDAB9337 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC и NoHetI, экспрессия которых управляется промотором фазеолина. Плазмиду pDAB9337 (фиг. 20; SEQ ID NO: 46) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R.
pDAB9337 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfA v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfB v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Третья PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, hSzThPUFA OrfC v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v3, 5' UTR PvPhas, NoHetI v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте).
Плазмиды pDAB9324, pDAB9325, pDAB9326, pDAB9328 и pDAB7333 подвергали рекомбинации с образованием pDAB9337. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.8: Конструирование pDAB9338
pDAB9338 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC и NoHetI. Промотор фазеолина используют для управления экспрессией SzPUFA OrfA, а промотор PvDlec2 используют для управления другими трансгенами. Плазмиду pDAB9338 (фиг. 21; SEQ ID NO: 47) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R.
pDAB9338 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfA v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB9324, pDAB7335, pDAB7336, pDAB7338 и pDAB7333 подвергали рекомбинации с образованием pDAB9338. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.9: Конструирование pDAB9344
pDAB9344 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC и NoHetI, которые все содержат малую цепь 1A рибулезобисфосфаткарбоксилазы (обозначаемую как SSU-TP v1), которая слита с амино-концом кодирующей последовательности. Промотор фазеолина используют для управления экспрессией SzPUFA OrfA, а промотор PvDlec2 используют для управления другими трансгенами.
Плазмиду pDAB9344 (фиг. 22; SEQ ID NO: 48) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB9344 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfA v4, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfB v4, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Третья PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, hSzThPUFA OrfC v4, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v3, 5' UTR PvPhas, NoHetI v4, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте).
Плазмиды pDAB9343, pDAB9342, pDAB9340, pDAB9331 и pDAB7333 подвергали рекомбинации с образованием pDAB9344. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v4, SzPUFA OrfB v4, hSzThPUFA OrfC v4, NoHetI v4. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие шесть PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.10: Конструирование pDAB9396
pDAB9396 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC, SzACS-2 и NoHetI. Промотор фазеолина используют для управления экспрессией SzPUFA OrfA и SzPUFA OrfB. Промотор PvDlec2 используют для управления другими трансгенами; hSzThPUFA OrfC, SzACS-2 и NoHetI.
Плазмиду pDAB9396 (фиг. 23; SEQ ID NO: 49) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB9396 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfA v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU ацил-CoA-синтетазы содержит промотор PvPhas v3, 5' UTR PvPhas, ген SzACS-2 v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB9324, pDAB7335, pDAB7336, pDAB7339 и pDAB7333 подвергали рекомбинации с образованием pDAB9338. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, SzACS-2 v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 8.11: Конструирование pDAB101412
pDAB101412 представляет собой бинарную плазмиду, которая была сконструирована так, чтобы она содержала перестроенные, оптимизированные по кодонам варианты SzPUFA OrfA, SzPUFA OrfB, hSzThPUFA OrfC, SzACS-2 и NoHetI. Вариант промотора фазеолина, используемый в данной конструкции, модифицировали по существу как описано в публикации Bustos с соавторами, 1989 (The Plant Cell, Vol. 1; 839-853), при этом 5'-часть промотора укорачивали, а 5'-нетранслируемую область фазеолина оставляли интактной. Последовательности укороченного промотора фазеолина указаны в настоящей описании как вариант 4 (v4), вариант 5 (v5) и вариант 6 (v6). Плазмиду pDAB101412 (фиг. 24; SEQ ID NO: 50) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R.
pDAB101412 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, SzPUFA OrfA v3 и 3' UTR AtuORF23 v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, SzPUFA OrfB v3 и 3' UTR AtuORF23 v1. Третья PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, hSzThPUFA OrfC v3 и 3' UTR AtuORF23 v1. PTU ацил-CoA-синтетазы содержит промотор PvPhas v4, 5' UTR PvPhas, 5'-UTR 2S, ген SzACS-2 v3 и 5' UTR AtuORF23 v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v5, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB7375, pDAB7376, pDAB7377, pDAB7398 и pDAB7333 подвергали рекомбинации с образованием pDAB101412. В частности, пять PTU, описанных выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, SzACS-2 v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения шести PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
Трансформация сои промоторами, которые осуществляют экспрессию на ранних стадия развития семян
Плазмиды использовали для стабильной трансформации растений сои с использованием протоколов, описанных выше. Трансгенные растения сои выделяли и подвергали молекулярной характеристике. Использование альтернативных конструкций приводит к получению растений сои, которые содержат повышенные количества ДГК и ДЦ-ПНЖК. Определяют получаемое в результате накопление ДЦ-ПНЖК и идентифицируют растения сои, которые продуцируют от 0,01% до 15% ДГК или от 0,01% до 15% ДЦ-ПНЖК.
ПРИМЕР 9
Экспрессия набора генов ПНЖК-синтаз водорослей с использованием конструкций с альтернативным дизайном
Введение разнообразия промоторов для уменьшения дупликации регуляторных элементов
Сайленсинг генов представляет собой явление, которое наблюдали в поколениях потомков растений сои, в которых произошли трансгенные события. В нескольких обзорных статьях обсуждается транскрипционный сайленсинг генов (TGS) и посттранскрипционный сайленсинг генов (PTGS), таких как публикации

В растениях сайленсинг генов может запускаться в результате дупликации трансгенных полинуклеотидных последовательностей (тандемные повторяющие последовательности трансгенов, инвертированные повторяющиеся последовательности трансгенов или множественные инсерции в хромосому) или когда последовательность, гомологичная последовательностям гена-мишени переносится либо вирусом, инфицирующим растение, либо T-ДНК Agrobacterium tumefaciens.
Кроме того, дупликация полинуклеотидных последовательностей трансгенов может действовать в качестве пускового сигнала для нестабильности конструкции. Множественные последовательности трансгенов, которые имеют высокие уровни сходства последовательностей, могут складываться друг с другом. Могут происходить перегруппировки в результате гомологичной рекомбинации, при этом промежуточные последовательности ДНК вырезаются. В результате фрагменты ДНК, которые расположены между повторяющимися полинуклеотидными последовательностями трансгенов, вырезаются.
Одной из методик конструирования плазмидных векторов является введение разнообразия промоторов в конструкцию за счет включения нескольких уникальных специфичных для семян промоторов, которые поддерживают высокий уровень экспрессии каждого трансгена. Введение разнообразия последовательностей промоторов в плазмидные векторы может уменьшать сайленсинг генов и повышать стабильность плазмид. Множественные специфичные для семян промоторов включают промоторы PvDlec2, фазеолина и напина (патент США № 5608152). Такие промоторы относительно сравнимы по промоторной активности, тканевой специфичности, уровням экспрессии, продолжительности экспрессии и т.д.
ПРИМЕР 9.1: Конструирование pDAB7733
Бинарную плазмиду pDAB7733 (фиг. 25; SEQ ID NO: 51) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB7733 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, SzPUFA OrfA v3 и 3' UTR AtuORF23 v1. Вторая PTU ПНЖК-синтазы содержит промотор BnaNapinC v1, 5' UTR BnaNapinC, SzPUFA OrfB v3 и 3' UTR BnaNapinC v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v5, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB7375, pDAB7731, pDAB7336, pDAB7378 и pDAB7333 подвергали рекомбинации с образованием pDAB7733. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.2: Конструирование pDAB7734
Бинарную плазмиду pDAB7734 (фиг. 26; SEQ ID NO: 52) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB7734 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, SzPUFA OrfB v3 и 3' UTR AtuORF23 v1. Третья PTU ПНЖК-синтазы содержит промотор BnaNapinC v1, 5' UTR BnaNapinC, hSzThPUFA OrfC v3 и 3' UTR BnaNapinC v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB7334, pDAB7376, pDAB7732, pDAB7338 и pDAB7333 подвергали рекомбинации с образованием pDAB7734. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.3: Конструирование pDAB101493
Бинарную плазмиду pDAB101493 (фиг. 27; SEQ ID NO: 53) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB101493 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v4, 5' UTR PvPhas, SzPUFA OrfB v3 и 3' UTR AtuORF23 v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v5, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB7334, pDAB7376, pDAB7336, pDAB7378 и pDAB7333 подвергали рекомбинации с образованием pDAB101493. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.4: Конструирование pDAB109507
Плазмиду pDAB109507 (фиг. 28; SEQ ID NO: 54) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB109507 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfA v3 и 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор BnaNapinC v1, 5' UTR BnaNapinC, SzPUFA OrfB v3 и 3' UTR BnaNapinC v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор/5' UTR BoACP v1, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB9324, pDAB7731, pDAB7336, pDAB101485 и pDAB7333 подвергали рекомбинации с образованием pDAB109507. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.5: Конструирование pDAB109508
Плазмиду pDAB109508 (фиг. 29; SEQ ID NO: 55) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB109508 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfA v3 и 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор BnaNapinC v1, 5' UTR BnaNapinC, SzPUFA OrfB v3 и 3' UTR BnaNapinC v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB9324, pDAB7731, pDAB7336, pDAB7338 и pDAB7333 подвергали рекомбинации с образованием pDAB109508. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.6: Конструирование pDAB109509
Плазмиду pDAB109509 (фиг. 30; SEQ ID NO: 56) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB109509 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S5 SzPUFA OrfB v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор/5' UTR BoACP v1, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB7334, pDAB7335, pDAB7336, pDAB101485 и pDAB7333 подвергали рекомбинации с образованием pDAB109509. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
Изменение порядка расположения PTU в бинарной конструкции для уменьшения фрагментации длинных генных последовательностей
PTU SzPUFA OrfA помещали на 3'-конце бинарной конструкции для тестирования того, может ли порядок кассет PTU уменьшать фрагментацию и перегруппировку в случае выделенных трансгенных событий. SzPUFA OrfA является большой открытой рамкой считывания (~8700 т.п.н.), содержащей девять тандемных повторов ацилпереносящего белка. В первой серии полученных конструкций PTU SzPUFA OrfA располагали так, чтобы она первой была интегрирована в хромосому растения. Затем за PTU SzPUFA OrfA следуют остальные PTU связанных с синтезом ПНЖК генов, в порядке уменьшения их молекулярного размера. Молекулярный анализ кодирующей области SzPUFA OrfA показал, что в случае некоторых трансгенных событий у канолы и Arabidopsis thaliana имели место фрагментированные инсерции. Описаны альтернативные дизайны конструкций, в которых порядок PTU ПНЖК-синтаз был изменен с получением следующей конфигурации: PTU hSzThPUFA OrfC, PTU SzPUFA OrfB, PTU NoHetI, PTU SzPUFA OrfA и PTU PAT. Изменение положения PTU SzPUFA OrfA в бинарной конструкции осуществляли для уменьшения фрагментации и перегруппировки в случае выделенных трансгенных событий.
ПРИМЕР 9.7: Конструирование pDAB9151
Плазмиду pDAB9151 (фиг. 31; SEQ ID NO: 57) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB9151 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1. Конечная PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1.
Плазмиды pDAB9148, pDAB7335, pDAB9149, pDAB9150 и pDAB7333 подвергали рекомбинации с образованием pDAB9151. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: hSzThPUFA OrfC v3, SzPUFA OrfB v3, NoHetI v3, SzPUFA OrfA v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
Изменение направления транскрипции PTU в бинарной конструкции для введения разнообразия конструкций
Альтернативный дизайн конструкции включал изменение порядка PTU ПНЖК-синтаз и направления транскрипции экспрессирующих генных конструкций. В первой серии полученных конструкций каждую кассету экспрессии генов помещали в одном и том же направлении («голова к хвосту», при этом промотор одной кассеты экспрессии генов располагали вблизи 3' UTR второй кассеты экспрессии генов). При описании следующих конструкций показана методика, в случае которой кассеты экспрессии генов располагают в разных направлениях и используют альтернативные промоторы. В таких примерах кассету экспрессии гена располагают в транс-положении по отношению ко второй кассете экспрессии гена, так что промоторы обеих кассет экспрессии генов расположены в конструкции рядом друг с другом. Такую конфигурацию описывают как конфигурацию «голова к голове». Другие конфигурации описаны в примерах, при этом одну кассету экспрессии гена располагают в транс-положении по отношению ко второй кассете экспрессии гена, так что 3'UTR обеих кассет экспрессии генов оказываются в конструкции рядом друг с другом. Такую конфигурацию описывают как конфигурацию «хвост к хвосту». Чтобы уменьшить возможное прочитывание такой конструкции от начала до конца между такими двумя PTU помещен двунаправленный терминатор Orf 23/24. Предполагается, что такие конформации увеличивают экспрессию трансгенов, тем самым приводя к получению более высоких концентраций и содержания ДЦ-ПНЖК и жирной кислоты ДГК.
ПРИМЕР 9.8: Конструирование pDAB108207
Плазмиду pDAB108207 (фиг. 32; SEQ ID NO: 58) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB108207 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfAv3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v6, 5' UTR PvPhas, NoHetI v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте). Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3, терминатор At2S SSP v1 и 3' UTR AtuORF23 v1. Третья PTU ПНЖК-синтазы содержит промотор PvPhas v6, 5' UTR PvPhas, SzPUFA OrfB v3, 3' UTR PvPhas и 3' MAR PvPhas v2 (не отмечена на плазмидной карте) и 3' UTR AtuORF23 v1.
Плазмиды pDAB7334, pDAB101489, pDAB108205, pDAB108206 и pDAB7333 подвергали рекомбинации с образованием pDAB108207. В частности, SzPUFA OrfA v3 и NoHetI v3 помещают в ориентации хвост к хвосту; NoHetI v3 и hSzThPUFA OrfC v3 помещают в ориентации голова к голове; hSzThPUFA OrfC v3 и SzPUFA OrfB помещают в ориентации хвост к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, NoHetI v3, hSzThPUFA OrfC v3, SzPUFA OrfB v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.9: Конструирование pDAB108208
Плазмиду pDAB108208 (фиг. 33; SEQ ID NO: 59) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB108208 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v4, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvPhas v5, 5' UTR PvPhas, SzPUFA OrfB v3, 3' UTR PvPhas, 3' MAR PvPhas v2 (не отмечена на плазмидной карте) и 3' UTR AtuORF23 v1.
Плазмиды pDAB108200, pDAB101490, pDAB108201, pDAB108202 и pDAB7333 подвергали рекомбинации с образованием pDAB108208. В частности, SzPUFA OrfA v3 и NoHetI v3 помещали в ориентации голова к голове; NoHetI v3 и hSzThPUFA OrfC v3 помещали в ориентации хвост к хвосту; hSzThPUFA OrfC v3 и SzPUFA OrfB помещали в ориентации голова к голове между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, NoHetI v3, hSzThPUFA OrfC v3, SzPUFA OrfB v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.10: Конструирование pDAB108209
Плазмиду pDAB108209 плазмида (фиг. 34; SEQ ID NO: 60) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB108209 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5' UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v4, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvPhas v5, 5' UTR PvPhas, SzPUFA OrfB v3, 3' UTR PvPhas и 3' MAR PvPhas v2 (не отмечена на плазмидной карте) и произвольный спейсер ДНК.
Плазмиды pDAB108200, pDAB108204, pDAB108201, pDAB108202 и pDAB7333 подвергали рекомбинации с образованием pDAB108209. В частности, SzPUFA OrfA v3 и NoHetI v3 помещали в ориентации голова к голове; NoHetI v3 и hSzThPUFA OrfC v3 помещали в ориентации хвост к хвосту; hSzThPUFA OrfC v3 и SzPUFA OrfB помещали в ориентации голова к голове между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, NoHetI v3, hSzThPUFA OrfC v3, SzPUFA OrfB v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
Удвоение 3' UTR и включение спейсерной ДНК для того, чтобы минимизировать помехи для транскрипции
Препятствия для транскрипции могут возникать, когда несколько генов располагают друг за другом в виде ряда, что приводит к пониженной экспрессии расположенных ниже генов. Такое явление возникает в результате сплошного транскрипционного считывания через 3' UTR и терминатор, переходящего на следующий промотор-единицу транскрипции. Описаны альтернативные дизайны конструкций, включающие в себя две методики, минимизирующие препятствия для транскрипции и препятствия для трансляции. В первой методике используют два терминатора/3' UTR, которые состыкованы рядом между отдельными кассетами экспрессии генов ДГК, чтобы ограничить сплошное считывание, переходящее на следующую кассету генной экспрессии. В случае второй методики встраивают примерно тысячу пар нуклеотидов спейсерной ДНК между кассетами экспрессии генов, при этом минимизируя препятствия для транскрипции.
ПРИМЕР 9.11: Конструирование pDAB108207
Плазмиду pDAB108207 (фиг. 32; SEQ ID NO: 58) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB108207 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfB v3, 3' UTR PvPhas, 3' MAR PvPhas v2 (не отмечена на плазмидной карте) и 3' UTR AtuORF23 v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3, терминатор At2S SSP v1 и 3' UTR AtuORF23 v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v6, 5' UTR PvPhas, NoHetI v3, 3' UTR PvPhas v1 и 3' MAR PvPhas v2 (не отмечена на плазмидной карте).
Плазмиды pDAB7334, pDAB101489, pDAB108205, pDAB108206 и pDAB7333 подвергали рекомбинации с образованием pDAB108207. В частности, SzPUFA OrfA v3 и NoHetI v3 помещали в ориентации хвост к хвосту и 3' UTR AtuORF23 помещали между двумя PTU; NoHetI v3 и hSzThPUFA OrfC v3 помещали в ориентации голова к голове; hSzThPUFA OrfC v3 и SzPUFA OrfB помещали в ориентации голова к хвосту и 3' UTR AtuORF23 помещали между двумя PTU между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, NoHetI v3, hSzThPUFA OrfC v3, SzPUFA OrfB v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.12: Конструирование pDAB108208
Плазмиду pDAB108208 (фиг. 33; SEQ ID NO: 59) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB108208 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v5, 5' UTR PvPhas, SzPUFA OrfB v3, 3' UTR PvPhas, 3' MAR PvPhas v2 (не отмечена на плазмидной карте) и 3' UTR AtuORF23 v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v4, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB108200, pDAB101490, pDAB108201, pDAB108202 и pDAB7333 подвергали рекомбинации с образованием pDAB108208. В частности, SzPUFA OrfA v3 и NoHetI v3 помещали в ориентации голова к голове; NoHetI v3 и hSzThPUFA OrfC v3 помещали в ориентации хвост к хвосту, и 3' UTR AtuORF23 помещали между двумя PTU; hSzThPUFA OrfC v3 и SzPUFA OrfB помещали в ориентации голова к голове между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, NoHetI v3, hSzThPUFA OrfC v3, SzPUFA OrfB v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.13: Конструирование pDAB108209
Плазмиду pDAB108209 (фиг. 34; SEQ ID NO: 60) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB108209 содержит три PTU ПНЖК-синтазы, одну PTU ацил-CoA-синтетазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfAv3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v5, 5' UTR PvPhas, SzPUFA OrfB v3, 3' UTR PvPhas, 3' MAR PvPhas v2 (не отмечена на плазмидной карте) и случайный ДНК-спейсер. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v4, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB108200, pDAB108204, pDAB108201, pDAB108202 и pDAB7333 подвергали рекомбинации с образованием pDAB108209. В частности, SzPUFA OrfA v3 и NoHetI v3 помещали в ориентации голова к голове; NoHetI v3 и hSzThPUFA OrfC v3 помещали в ориентации хвост к хвосту и спейсер длиной в одну тысячу пар нуклеотидов помещали между двумя PTU; hSzThPUFA OrfC v3 и SzPUFA OrfB помещали в ориентации голова к голове между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, NoHetI v3, hSzThPUFA OrfC v3, SzPUFA OrfB v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (T-DNA Border A и T- DNA Border B). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
Использование альтернативного 3' UTR-терминатора, чтобы ограничить сплошное транскрипционное считывание
3' UTR-терминатор ORF23 Agrobacterium, главным образом, используют для терминации транскрипции во многих описанных выше конструкциях. Недавно было показано, что 3' UTR-терминатор ZmLipase является более эффективным в терминации сплошного транскрипционного считывания у Arabidopsis thaliana. В связи с этим, в одном варианте конструкций использовали 3' UTR-терминатор ZmLipase в сочетании с промотором PvDlec2, чтобы проверить, может ли такая 3' UTR снижать сплошное транскрипционное считывание выше распложенных генов, тем самым уменьшая препятствия для транскрипции.
ПРИМЕР 9.14: Конструирование pDAB9159
Плазмиду pDAB9159 (фиг. 35; SEQ ID NO: 61) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB9159 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и 3' UTR ZmLip v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v3, 5' UTR PvPhas, SzPUFA OrfB v3 и 3' UTR ZmLip v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и 3' UTR ZmLip v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v3, 5' UTR PvPhas, NoHetI v3 и 3' UTR ZmLip v1.
Плазмиды pDAB9152, pDAB9153, pDAB9154, pDAB9155 и pDAB7333 подвергали рекомбинации с образованием pDAB9159. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.15: Конструирование pDAB9147
Плазмиду pDAB9147 (фиг. 36; SEQ ID NO: 62) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB9147 содержит три PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfAv3, терминатор At2S SSP v1 и 3' UTR ZmLip v1. Вторая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfB v3 и терминатор At2S SSP v1. Третья PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, hSzThPUFA OrfC v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvDlec2 v2, 5'-UTR 2S, NoHetI v3 и терминатор At2S SSP v1.
Плазмиды pDAB9146, pDAB7335, pDAB7336, pDAB7338 и pDAB7333 подвергали рекомбинации с образованием pDAB9147. В частности, четыре PTU, описанные выше, помещали в ориентации голова к хвосту между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, SzPUFA OrfB v3, hSzThPUFA OrfC v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения пяти PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
Доставка генов ДГК в две отдельные T-ДНК
Альтернативный дизайн конструкции основан на конструировании двух отдельных бинарных векторов, при этом первый вектор содержит подгруппу генов ПНЖК-синтазы в одной T-ДНК, и второй бинарный вектор содержит остальные гены ПНЖК-синтазы во второй T-ДНК. Такие бинарные векторы по отдельности используют для трансформации растений, которые скрещивают, получая при этом потомство, которое содержит все конструкции, экспрессирующие гены ПНЖК-синтазы. Альтернативным способом получения трансгенных растений может быть котрансформация двумя бинарными векторами ткани сои и отбор и скрининг отдельных растений, которые содержат обе T-нити.
ПРИМЕР 9.16: Конструирование pDAB108224
Плазмиду pDAB108224 (фиг. 37; SEQ ID NO: 63) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB108224 содержит одну PTU ПНЖК-синтазы, одну PTU фосфопантетеинилтрансферазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2S, SzPUFA OrfA v3 и терминатор At2S SSP v1. PTU фосфопантетеинилтрансферазы содержит промотор PvPhas v4, 5' UTR PvPhas, NoHetI v3 и 3' UTR AtuORF23 v1.
Плазмиды pDAB108216, pDAB108221 и pDAB7333 подвергали рекомбинации с образованием pDAB108224. В частности, SzPUFA OrfA v3 и NoHetI v3 помещали в ориентации голова к голове между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfA v3, NoHetI v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3' UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения трех PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
ПРИМЕР 9.17: Конструирование pDAB108225
Плазмиду pDAB108225 (фиг. 38; SEQ ID NO: 64) конструировали, используя реакцию рекомбинации во множественных сайтах Gateway L-R. pDAB108225 содержит две PTU ПНЖК-синтазы и PTU фосфинотрицинацетилтрансферазы. В частности, первая PTU ПНЖК-синтазы содержит промотор PvDlec2 v2, 5'-UTR 2SS SzPUFA OrfB v3 и терминатор At2S SSP v1. Вторая PTU ПНЖК-синтазы содержит промотор PvPhas v4, SzPUFA OrfB v3 и 3' UTR Atu ORF23 v1.
Плазмиды pDAB108217, pDAB108222 и pDAB7333 подвергали рекомбинации с образованием pDAB108225. В частности, SzPUFA OrfB v3 и hSzThPUFA OrfC v3 помещали в ориентации голова к голове между областями границ нити T-ДНК бинарной плазмиды pDAB7333 для трансформации растений. Гены расположены в следующем порядке: SzPUFA OrfB v3, hSzThPUFA OrfC v3. pDAB7333 также содержит PTU фосфинотрицинацетилтрансферазы: промотор CsVMV v2, PAT v5, 3'-UTR AtuORF1 v4 в дополнение к другим регуляторным элементам, таким как Overdrive и последовательности границ T-нити (граница A T-ДНК и граница B T-ДНК). Затем рекомбинантные плазмиды, содержащие пять PTU, выделяли и подвергали тестированию в отношении включения трех PTU с использованием расщепления ферментами рестрикции и секвенирования ДНК.
Трансформация сои конструкциями, имеющими альтернативные дизайны
Полученные плазмиды используют для стабильной трансформации растений сои с использованием протоколов, описанных выше. Трансгенные растения сои выделяют и подвергают молекулярной характеристике. Применение альтернативных конструкций приводит к получению растений сои, которые содержат повышенные количества ДГК и ДЦ-ПНЖК. Определяют получаемое в результате накопление ДЦ-ПНЖК и идентифицируют растения сои, которые продуцируют от 0,01% до 15% ДГК или от 0,01% до 15% ДЦ-ПНЖК.
ПРИМЕР 10
Альтернативные дизайны конструкций, используемых для трансформации Arabidopsis thaliana и последующего получения ДЦ-ПНЖК и ДГК
Растения Arabidopsis thaliana трансформировали штаммами Agrobacterium tumefaciens, содержащими бинарные векторы pDAB101493, pDAB7362, pDAB7369, pDAB101412 или pDAB7380. Для трансформации использовали протокол трансформации путем погружения цветков погружением, описанный Clough и Bent (1998). Clough and Bent, «Floral dip: a simplified method for agrobacterium-mediated transformation of Arabidopsis thalia», Plant J., 16: 735-743, 1998. Получали трансформированные растения Arabidopsis и осуществляли молекулярную характеристику в отношении присутствия трансгена. Растения T1, полученные в результате трансгенных событий у Arabidopsis, выращивали до зрелости в теплице. Такие растения подвергали самоопылению и полученные семена T2 собирали в состоянии зрелости. Семена T2 (10 мг) анализировали, используя ГХ-ПИД FAME, чтобы определить содержание ДЦ-ПНЖК и ДГК в семенах Arabidopsis T2. Ткань анализировали способом ГХ-ПИД FAME, который описан в предыдущих примерах. Семена T2, полученные от растений Arabidopsis T1, содержали от 0% до 0,95% ДГК и от 0% до 1,50% суммарных ДЦ-ПНЖК. Содержание ДЦ-ПНЖК и ДГК в семенах T2 от отдельных растений T1 показано на фигуре 39.
ПРИМЕР 11
Коэкспрессия DGAT2 или ACC-азы с набором генов ПНЖК-синтаз водорослей в растениях сои
Содержание масла в растениях сои дополнительно модифицировали благодаря трансформации химерными молекулами ДНК, которые кодируют и экспрессируют ацетил-CoA-карбоксилазу (ACC-азу) или диацилглицеринацилтрансферазу типа 2 (DGAT2). Такие гены коэкспрессировали вместе с генами ПНЖК-синтаз водорослей, описанными выше, либо в результате скрещивания растений сои, содержащих кассету экспрессию ACC-азы или DGAT2, с растениями сои, содержащими гены ПНЖК-синтазы; либо в результате трансформации растений сои блоком генов, содержащим гены ACC-азы или DGAT2 и ПНЖК-синтазы. Регуляторные элементы, необходимые для экспрессии кодирующей последовательности ACC-азы или DGAT2, могут включать элементы, описанные выше. Можно использовать дополнительные последовательности элементов регуляции экспрессии, известные в данной области. Кассетами экспрессии ACC-азы и DGAT2 трансформируют растения сои, используя протоколы трансформации, описанные выше. Трансформация может происходить с использованием молекулярных блоков кассеты экспрессии ACC-азы или DGAT2, объединенной с кассетами экспрессии ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI; или с использованием независимых кассет экспрессии ACC-азы или DGAT2, связанных с селектируемым маркером, с последующим скрещиванием с растениями сои, которые содержат кассеты экспрессии ПНЖК-синтазы OrfA, ПНЖК-синтазы OrfB, ПНЖК-синтазы OrfC, ацил-CoA-синтетазы и 4'-фосфопантетеинилтрансферазы HetI. Позитивные трансформанты выделяют и подвергают молекулярной характеристике. Идентифицируют растения сои, которые имеют повышенное накопление ДЦ-ПНЖК в растении, семени растения или повышенные концентрации растительного масла по сравнению с нетрансформированным контрольными растениями сои. Такие повышения могут быть в диапазоне от 1,2 до 20-кратного увеличения.
Сверхэкспрессия ACC-азы в цитоплазме может приводить к более высоким уровням малонил-CoA. Растения или семена сои, содержащие повышенные уровни цитоплазматического малонил-CoA, могут продуцировать более высокие уровни длинноцепочечной полиненасыщенной жирной кислоты (ДЦ-ПНЖК) в случае присутствия и экспрессии генов ПНЖК-синтаз водорослей. Гены DGAT2, которые экспрессируются в растениях сои, могут быть способны предпочтительно включать значимые количества докозагексаеновой кислоты (ДГК) и эйкозапентаеновой кислоты (ЭПК) в триацилглицерин. Гены DGAT2 с субстратный предпочтением по отношению к ДЦ-ПНЖК (смотри, например, международную публикацию PCT WO 2009/085169 A2) может увеличивать включение таких жирных кислот в триацилглицерин (TAG). Такие гены DGAT применимы для управления включением ДЦ-ПНЖК, в частности ДГК, в TAG и для увеличения продуцирования TAG в растениях и других организмах.
ПРИМЕР 12
Продуцирование ДГК в семенах Arabidopsis, трансформированных конструкциями с альтернативным дизайном для экспрессии генов ПНЖК-синтаз
Растения Arabidopsis T1, полученные в результате событий трансформации с использованием Agrobacterium tumefaciens, несущими плазмиды, кодирующие гены ПНЖК-синтаз и HetI (и в некоторых случаях SzACS-2) под контролем различных элементов регуляции экспрессии у растений, создавали, используя способ пропитывания цветков погружением, по существу как описано Clough и Bent (Plant J., 1998 16(6): 735-43). Полученные семена T1 собирали в высевали. Трансформированные растения T1 подвергали селекции, используя опрыскивание фосфинотрицином, чтобы отобрать такие растения, которые содержат функциональный ген PAT в качестве селектируемого маркера. Брали образцы ткани листа выживших растений T1 и анализировали в реакциях количественной ПЦР, специфичных для гена PAT, чтобы идентифицировать такие растения, которые содержат одну копию селектируемого маркера (и ассоциированных трансгенов). Такие растения выращивали до зрелости, собирали семена T2 и анализировали в отношении содержания ДЦ-ПНЖК (в % от суммарных экстрагируемых FAME). Суммарные данные для событий, осуществляемых с использованием разных конструкций, кодирующих гены ПНЖК-синтазы, показаны в таблице 12.
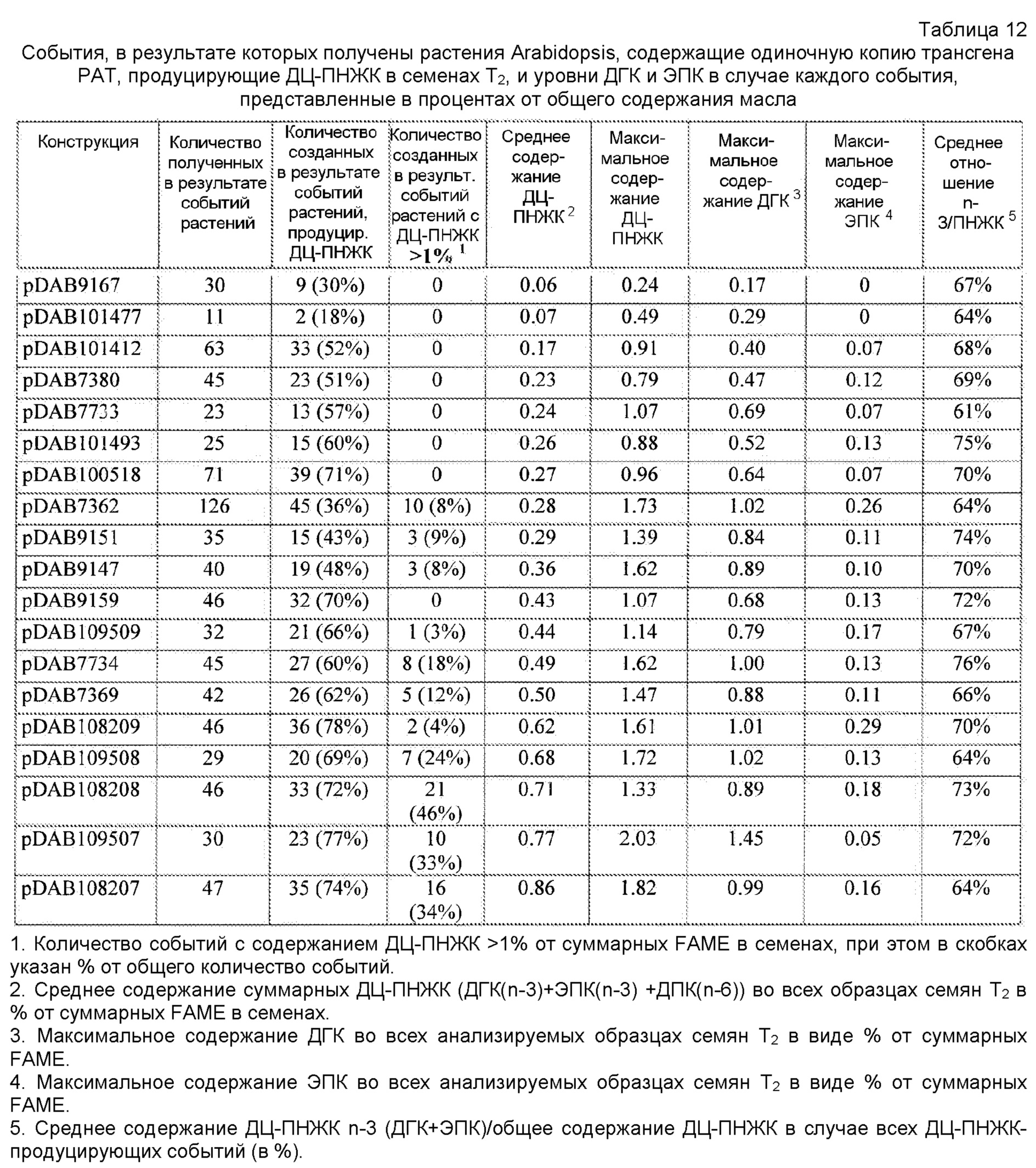
Полученные данные показывают, что некоторые конфигурации конструкций и сочетания промоторов позволяют получать более высокую долю событий, приводящих к наличию ДЦ-ПНЖК в семенах T2 (77% всех однокопийных событий в случае pDAB109507 давали ДГК, и 86% всех однокопийных событий в случае pDAB108207 давали ДГК). Также некоторые конструкции давали более высокую долю событий продуцирования ДЦ-ПНЖК с содержанием >1% (33% всех однокопийных событий в случае pDAB109507 и 34% всех однокопийных событий в случае pDAB108207). Максимальное содержание ДЦ-ПНЖК в семенах T2, полученных в результате разных событий, было в диапазоне 0,24-2,03% в случае разных конструкций. Подобным образом, некоторые конструкции дают более высокие уровни омега-3 ДЦ-ПНЖК. Максимальное содержание ДГК было в диапазоне 0-0,26% в случае всех конструкций и осуществленных событий. Полученные данные показывают, что изменение дизайна конструкции, в которой изменяли конфигурации промоторов, приводило к получению трансгенных растений, которые имеют повышенное содержание ДЦ-ПНЖК по сравнению с трансгенными растениями, которые трансформировали, используя pDAB7362. Соответственно, такие конструкции, в которых изменен дизайн конструкции, требуются для трансформации культурных растений.
Семена T2, полученные в результате событий, приводящих к высокой продукции ДЦ-ПНЖК, высевали и отбирали образцы ткани листа от выросших растений и использовали количественную ПЦР для анализа гена PAT и других трансгенов. Идентифицировали растения, содержащие две копии трансгенов (т.е., гомозиготы), и выращивали до зрелости. Полученные семена T3 собирали и анализировали в отношении содержания ДЦ-ПНЖК. Некоторые конструкции, такие как pDAB7362 и pDAB109509, которые содержали повторяющиеся элементы экспрессии промотор/3'UTR, обладали слабой стабильностью признака ДЦ-ПНЖК в последующем поколении семян T3. Однако, некоторые события трансформации конструкциями с разными конформациями и/или разнообразными элементами экспрессии (например, pDAB108207, 109508 и 7734) приводили к значимо повышенной стабильности признака ДЦ-ПНЖК в поколении семян T3, как показано в таблице 13. Полученные данные показывают, что некоторые конструкции может поддерживать стабильность признака ДГК в последующих поколениях, и что такие конструкции предпочтительны для трансформации культурных растений.
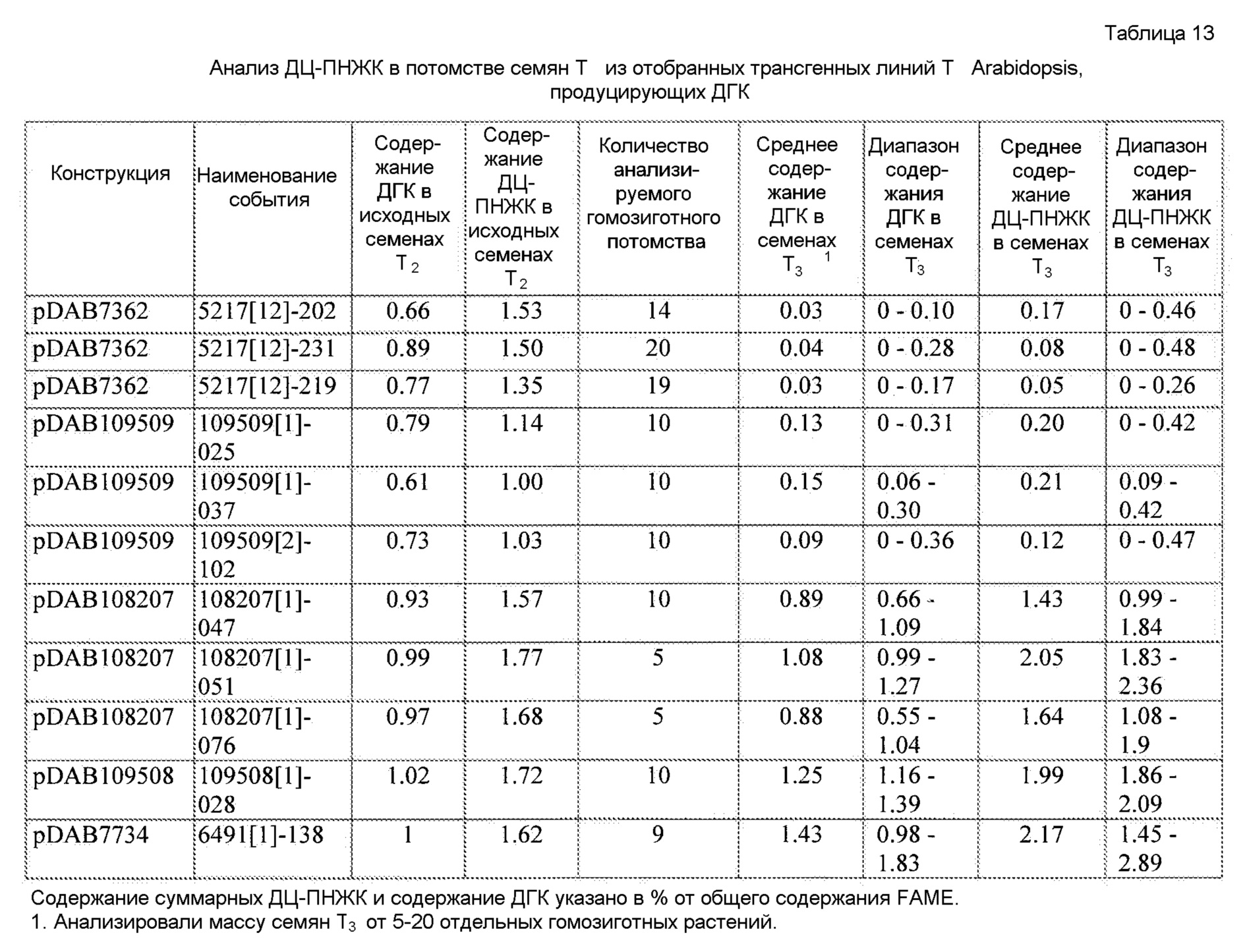
Приведенное выше описание изобретения представлено в целях иллюстрации и описания. Кроме того, описание не предназначено для ограничения изобретения формой, раскрытой в настоящем описании.
Все различные аспекты, варианты осуществления и версии, описанные в настоящей публикации, могут быть объединены в любом или всех вариантах.
Все публикации, патенты и заявки на выдачу патентов, упоминаемые в настоящем описании, включены в настоящую публикацию в виде ссылки в такой же степени, как в случае, когда специально и отдельно указано, что каждая отдельная публикация, патент или заявка на выдачу патента включены в виде ссылки.
Реферат
Изобретение относится к области биохимии, в частности к генетически модифицированной клетке растения сои, продуцирующей масло, содержащее 0,36-8,00% ДГК от общего количества жирных кислот и 0,30-3,98% ДПК(n-6) от общего количества жирных кислот, а также к способу ее получения. Также раскрыты генетически модифицированные растение и семя сои для получения масла сои, содержащего 0,36-8,00% ДГК от общего количества жирных кислот и 0,30-3,98% ДПК(n-6) от общего количества жирных кислот. Изобретение также относится к маслу сои, содержащему 0,36-8,00% ДГК от общего количества жирных кислот и 0,30-3,98% ДПК(n-6) от общего количества жирных кислот, а также к способу его получения. Изобретение позволяет эффективно получать масло сои, содержащее 0,36-8,00% ДГК от общего количества жирных кислот и 0,30-3,98% ДПК(n-6) от общего количества жирных кислот. 6 н. и 12 з.п. ф-лы, 39 ил., 14 табл., 12 пр.
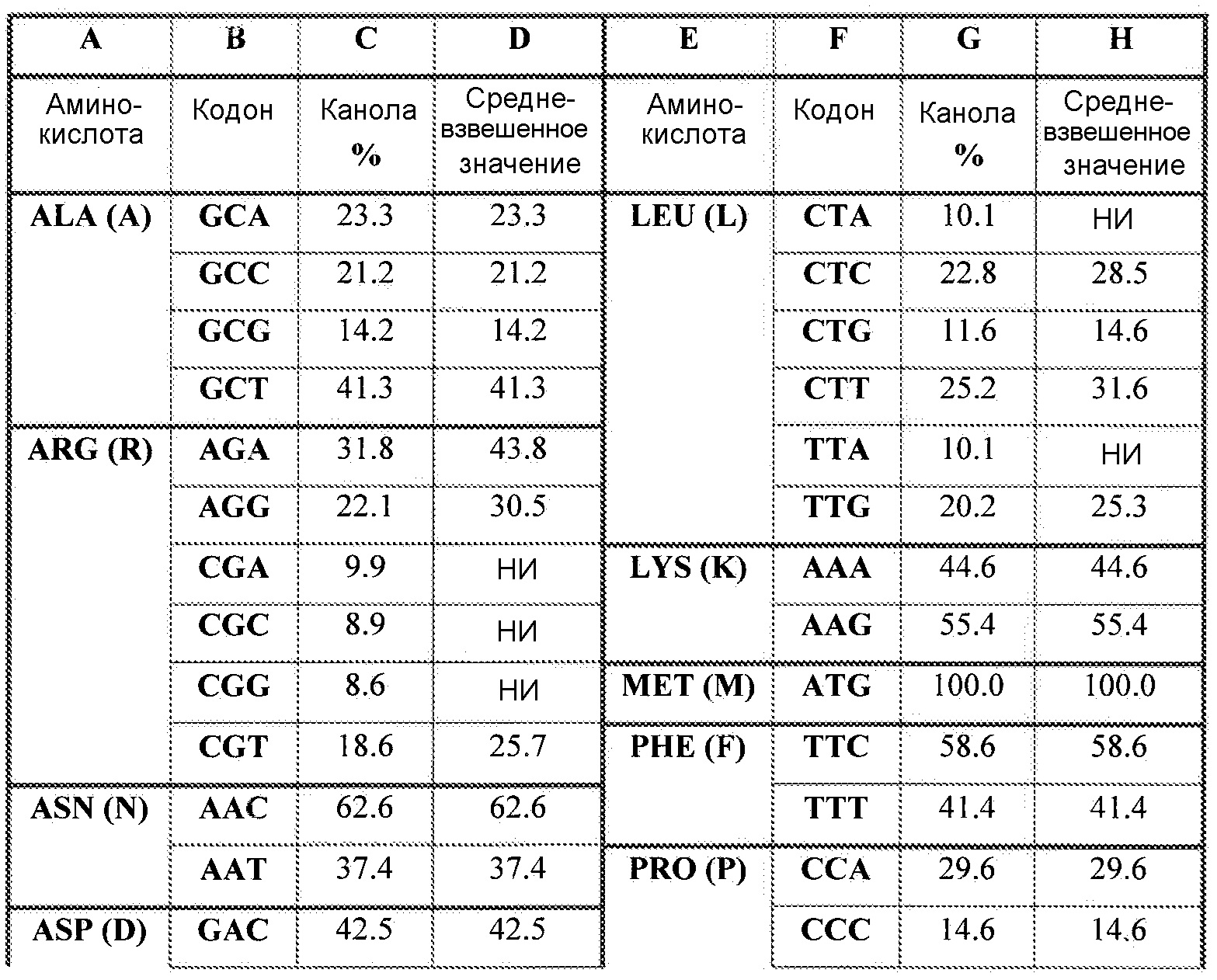
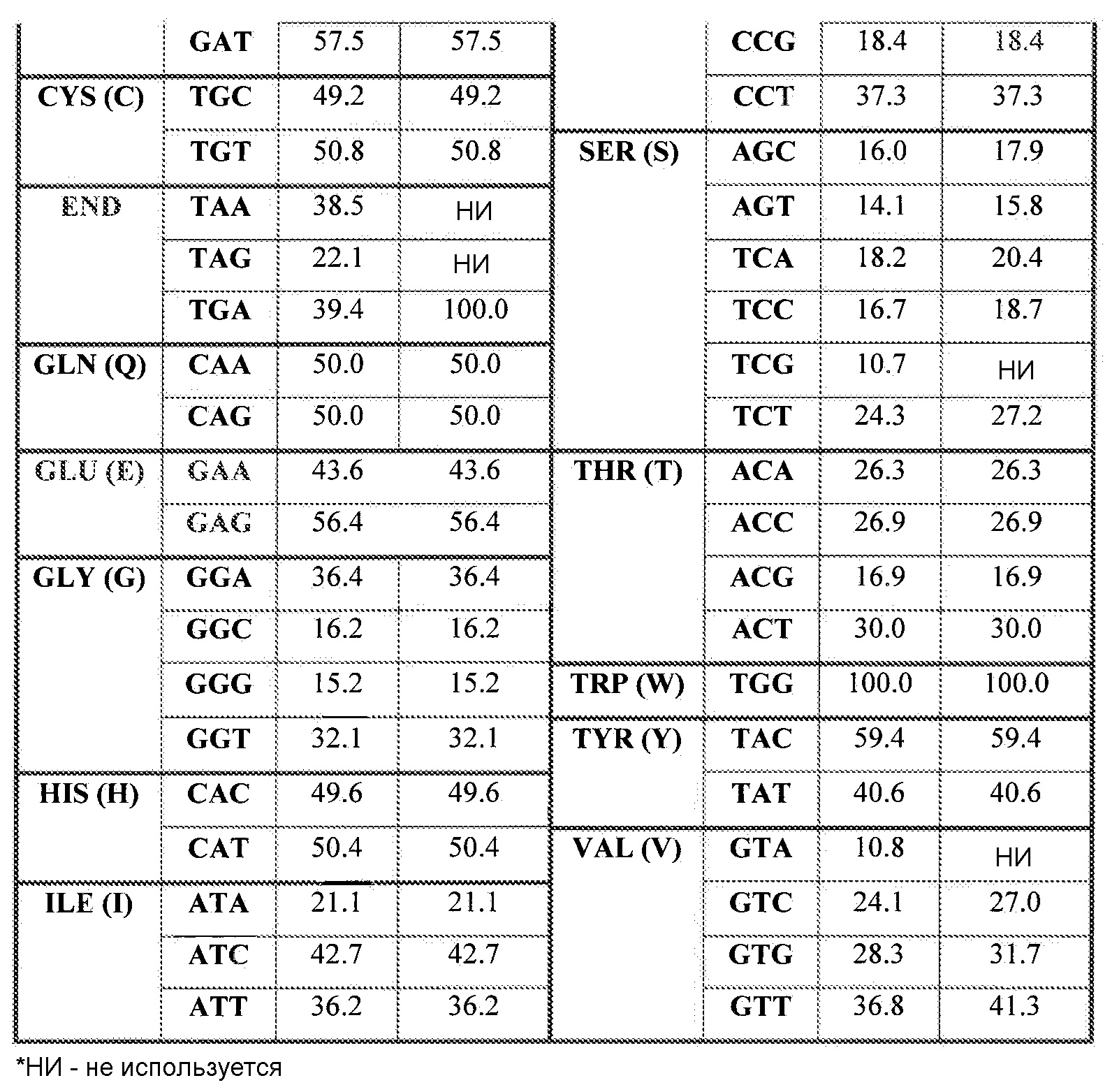


Комментарии