Замещенные бета-карболины - RU2277095C2
Код документа: RU2277095C2
Описание
Изобретение относится к новым замещенным бета-карболинам, способу их получения и их применению в качестве лекарственных средств.
В патенте США 4631149 описаны бета-карболины, которые могут использоваться в качестве противовирусных, противобактериальных и противоопухолевых агентов. В патенте США 5604236 описаны производные бета-карболинов, содержащие кислотную группу, используемые в качестве ингибиторов синтеза тромбоксана. В патенте Германии 19807993 А1 описаны производные бета-карболинов, используемые для лечения TNFα зависимых заболеваний.
NFkB представляет собой гетеродимерный фактор транскрипции, который может активировать большое число генов, кодирующих, помимо прочего, провоспалительные цитокины, такие как IL-1, IL-2, TNFα или IL-6. NFkB присутствует в цитозоле клеток, создавая комплекс с его существующим в природе ингибитором lkB. Стимуляция клеток, например, цитокинами приводит к пролиферации и последующей протеолитической деградации lkB. Такая протеолитическая деградация приводит к активации NFkB, который впоследствии мигрирует в ядро клетки и там активирует большое число провоспалительных генов.
При заболеваниях, таких как ревматоидный артрит (в случае воспаления), остеоартрит, астма, инфаркт миокарда, болезнь Альцгеймера или атеросклероз, NFkB активируется на уровне, превышающем нормальную степень. Ингибирование NFkB также успешно при лечении рака, поскольку здесь оно используется для усиления цитостатической терапии. Можно было продемонстрировать, что лекарственные средства, такие как глюкокортикоиды, салицилаты или соли золота, которые используют при ревматоидной терапии, вступают ингибирующим образом в различные точки в NFkB-активирующую сигнальную цепь или непосредственно вмешиваются в транскрипцию генов. Деградация lkB является первой стадией в указанном сигнальном каскаде. Такое фосфорилирование регулируется специфической lkB киназой. К настоящему времени не известны ингибиторы, которые специфически ингибируют lkB киназу.
При попытке получить активные соединения для лечения ревматоидного артрита (в случае воспаления), остеоартрита, астмы, инфаркта миокарда, болезни Альцгеймера, раковых заболеваний (усиление цитотоксического действия) или атеросклероза было установлено, что бензимидазолы согласно изобретению представляют собой сильные и очень избирательные ингибиторы lkB киназы.
Таким образом, изобретение относится к соединениям формулы I
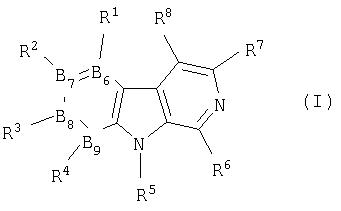
и/или стереоизомерным формам соединений формулы I, и/или физиологически приемлемым солям соединений формулы I, где B6, B7, B8 и В9 независимо выбраны из группы, состоящей из атома углерода и атома азота, где B6, B7, В8 и В9 вместе не представляют собой более двух атомов азота одновременно; где
в случае а)
заместители R1, R2 и R3, независимо один от другого, представляют собой
1.1 атом водорода,
1.2 галоген
1.3 -CN,
1.4 -СООН,
1.5 -NO2,
1.6 -NH2,
1.7 -О-(C1 -С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого,
1.7.1 фенилом, который является незамещенным или моно-пента-замещенным, галогеном или -О-(С1-С4)-алкилом,
1.7.2 галогеном,
1.7.3 -NH2,
1.7.4 -ОН,
1.7.5 -COOR16, где R16 представляет собой атом водорода или - (C1-С10)-алкил,
1.7.6 -NO2,
1.7.7 -S(O)y-R14, где у равно нулю, 1 или 2, R14представляет собой -(C1-С10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 1.7.1-1.7.11, амино или
-N(R13)2,
где R13 независимо один от другого представляют собой атом водорода, фенил, -(C1-С10)-алкил, -С(О)-(C1-С7)-алкил, -С(О)-фенил, -С(О)-NH-(C1-С7)-алкил, -С(O)-O-фенил, -С(О)-NH-фенил, -С(О)-O-(C1-С7)-алкил, -S(O)y -R14, где R14 и у являются такими, как определено выше, и где алкил или фенил в каждом случае являются незамещенным или моно-пента-замещенными, независимо один от другого, как определено выше в 1.7.1-1.7.11, или R13 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
1.7.8 -O-фенилом, где фенил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
1.7.9 радикалом, выбранным из пирролидина, тетрагидропиридина, пиперидина, пиперазина, имидазолина, пиразолидина, фурана, морфолина, пиридина, пиридазина, пиразина, оксолана, имидазолина, изоксазолидина, 2-изоксазолина, изотиазолидина, 2-изотиазолина, тиофена или тиоморфолина,
1.7.10 -(С3-С7)-циклоалкилом или
1.7.11 =O,
1.8 -N(R13)2, где R13 является таким, как определено выше в 1.7.7,
1.9 -NH-C(O)-R15, где R15 представляет собой
1.9.1 радикал, выбранный из пирролидина, тетрагидропиридина, пиперидина, пиперазина, имидазолина, пиразолидина, фурана, морфолина, пиридина, пиридазина, пиразина, оксолана, имидазолина, изоксазолидина, 2-изоксазолина, изотиазолидина, 2-изотиазолина, тиофена или тиоморфолина,
где указанный радикал является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, CF3, бензилом или -(С1-С10)-алкилом, где алкил является моно-три-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
1.9.2 -(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, или -O-(С1-С10)-алкилом, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
1.9.3 - (С3-С7)-циклоалкил,
1.9.4 -N(R13)2, где R13 является таким, как определено выше в 1.7.7,
1.9.5 фенил, где фенил является незамещенным или моно-пента-замещенным независимо один от другого, как определено выше в 1.7.1-1.7.11, -О-(C1-С10)-алкилом, CN, CF3, - (С1-С10)-алкилом, где алкил является моно-три-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, или два заместителя фенильного радикала образуют диоксолановое кольцо,
1.10 S(O)y-R14, где R14 и у являются такими, как определено в 1.7.7 выше,
1.11 -C(O)-R12, где R12 представляет собой фенил или -(C1-С7)алкил, где алкил или фенил являются незамещенным или моно-пента-замещенными, независимо один от другого, как определено выше в 1.7.1-1.7.11,
1.12 -C(O)-O-R12, где R12 является таким, как определено в 1.11 выше,
1.13 -(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
1.14 -О-(С1-С6)-алкил-O-(С1-С6)-алкил,
1.15 -О-(С0-С4)-алкил-(С3-С7) -циклоалкил,
1.16 -(C1-C4)-алкил-N(R13)2, где R13 является таким, как определено выше в 1.7.7
1.17 -CF3 или
1.18 -CF2-CF3,
R4 представляет собой
1. -(C1-C4)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
2. -CF3,
3. -CF2-CF3,
4. -CN,
5. -S(O)y-R14, где R14 и у являются такими, как определено в 1.7.7 выше,
6. -NH2,
7. -О-(C1-С10)-алкил, где алкил является моно-пента-замещенным, независимо один от другого,
7.1 фенилом, который является незамещенным или моно-пента-замещенным галогеном или -О-(C1-C4)-алкилом,
7.2 галогеном,
7.3 -NH2,
7.4 -ОН,
7.5 -COOR16, где R16 представляет атом водорода или -(C1 -С10)-алкил,
7.6 -NO2,
7.7 -S(O)y-R14, где у равно нулю, 1 или 2, R14 представляет собой -(C1-С10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 1.7.1-1.7.11, амино или -N(R13)2,
где R13, независимо один от другого, представляет собой атом водорода, фенил, -(C1-С10)-алкил, -С(O)-(С1-С7)-алкил, -С(О)-фенил, -С(О)-NH-(C1 -C7)-алкил, -С(O)-O-фенил, -С(O)-NH-фенил, -С(О)-О-(C1-C7)-алкил, -S(O)y-R14, где R14 и у являются такими, как определено выше,
и где алкил или фенил в каждом случае являются незамещенным или моно-пента-замещенными, независимо один от другого, как определено выше в 1.7.1-1.7.11, или
R13 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
7.8 -O-фенилом, где фенил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
7.9 радикалом, выбранным из пирролидина, тетрагидропиридина, пиперидина, пиперазина, имидазолина, пиразолидина, фурана, морфолина, пиридина, пиридазина, пиразина, оксолана, имидазолина, изоксазолидина, тиофена, 2-изоксазолина, изотиазолидина, 2-изотиазолина или тиоморфолина,
7.10 -(С3-С7)-циклоалкилом или
7.11 =O,
8. -N(R17)2, где R17, независимо один от другого, представляет собой атом водорода, фенил, -(C1-С10)-алкил, -С(О)-фенил, -С(О)-NH-(C1-C7)алкил, -С(O)-(С1-С10)-алкил, -С(О)-O-фенил, -С(O)-NH-фенил, -С(O)-O-(C1-С7 )-алкил, -S(O)y-R14, где R14 и у являются такими, как определено выше,
и где алкил или фенил в каждом случае являются незамещенным или моно-пента-замещенными, независимо один от другого, как определено выше в 1.7.1-1.7.11, или
R13 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
9. -NH-C(O)-R15, где R15 представляет собой
9.1 радикал, выбранный из пирролидина, тетрагидропиридина, пиперидина, пиперазина, имидазолина, пиразолидина, фурана, морфолина, пиридина, пиридазина, пиразина, оксолана, имидазолина, изоксазолидина, 2-изоксазолина, изотиазолидина, 2-изотиазолина, тиофена или тиоморфолина,
где указанный радикал является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, -CF3, бензилом или -(C1-С10)-алкилом, где алкил является моно-три-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
9.2 -(C1-С10 )-алкил, где алкил является моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, или -О-(C1-С10)-алкилом, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
9.3 -(С3-С7)-циклоалкил,
9.4 -N(R13)2, где R13 является таким, как определено выше в 1.7.7, при условии, что -N(R13)2 не является -NH2, или
9.5 фенил, где фенил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, -О-(C1-С10)-алкилом, -CN, -CF3, - (C1-С10 ) -алкилом, где алкил является моно-три-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, или два заместителя фенильного радикала образуют диоксолановое кольцо,
10. -C(O)-R12, где R12 представляет собой фенил или -(C1-С7)алкил, где алкил или фенил являются моно-пента-замещенными, независимо один от другого, как определено выше в 1.7.1-1.7.11,
11. -C(O)-O-R12, где R12 является таким, как определено в 10. выше,
12. -O-(С1-С6 )-алкил-O-(С1-С6)-алкил,
13. -О-(С0-С4)-алкил-(С3-С7)-циклоалкил, или
14. -(C1-C4 )-алкил-N(R13)2, где R13 является таким, как определено выше в 1.7.7,
R5 представляет собой
1. атом водорода,
2. -(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.4,
3. -C(O)-R9 , где R9 представляет собой
-NH2, -(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 7.1-7.4, или -N(R13)2, где R13 является таким, как определено выше в 1.7.7, или
4. -S(O)2-R9, где R9 является таким, как определено в 3 выше,
или
R4 и R5 вместе с атомом, к которому они присоединены, образуют гетероцикл, или
R3 и R5 вместе с атомом, к которому они присоединены, образуют гетероцикл, содержащий дополнительный атом кислорода в кольце, и
R6, R7 и R8 независимо один от другого представляют собой атом водорода или метил, или в случае b)
заместители R1, R2 и R4 независимо один от другого являются такими, как определено выше в 1.1-1.18 в случае а)
R3 представляет собой
1. -CF3
2. -CF2-CF3,
3. -CN,
4. -СООН,
5. -NO2,
6. -NH2,
7. -O-(C1-С10)-алкил, где алкил является моно-пента-замещенным, независимо один от другого,
7.1 фенилом, который является незамещенным или моно-пента-замещенным галогеном или -О-(C1-C4)-алкилом,
7.2 галогеном,
7.3 -NH2,
7.4 -ОН,
7.5 -COOR16, где R16 представляет собой атом водорода или
-(C1-С10)-алкил,
7.6 -NO2,
7.7 -S(O)y-R14, где у равно нулю, 1 или 2, R14 представляет собой -(C1-С10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 1.7.1.-1.7.11, амино или -N(R13)2,
где R13, независимо один от другого представляет собой атом водорода, фенил, -(C1-С10)-алкил, -С(O)-(C1-C7)-алкил, -С(О)-фенил, -С(О)-NH-(C1-C7)-алкил, -С(O)-O-фенил, -С(O)-NH-фенил, -С(О)-О-(C1-C7)-алкил,
-S(O)y-R14, где R14 и у являются такими, как определено выше,
и где алкил или фенил в каждом случае являются незамещенными или моно-пента-замещенными, независимо один от другого, как определено выше в 1.7.1-1.7.11
или
R13 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
7.8 -O-фенилом, где фенил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
7.9 радикалом, выбранным из пирролидина, тетрагидропиридина, пиперидина, пиперазина, имидазолина, пиразолидина, фурана, морфолина, пиридина, пиридазина, пиразина, оксолана, имидазолина, изоксазолидина, 2-изоксазолина, изотиазолидина, 2-изотиазолина, тиофена или тиоморфолина,
7.10 -(С3-С7)-циклоалкилом или
7.11 =O,
8. -N(R13)2, где R13 является таким, как определено в 1.7.7 выше,
9. -NH-C(O)-R15, где R15 представляет собой
9.1 радикал, выбранный из пирролидина, тетрагидропиридина, пиперидина, пиперазина, имидазолина, пиразолидина, фурана, морфолина, пиридина, пиридазина, пиразина, оксолана, имидазолина, изоксазолидина, 2-изоксазолина, изотиазолидина, 2-изотиазолина, тиофена или тиоморфолина,
где указанный радикал является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, -CF3, бензилом или -(C1-С10)-алкилом, где алкил является моно-три-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11
9.2 -(C1 -С10)-алкил, где алкил является моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, или -О-(С1-С10)-алкилом, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11
9.3 -(С3-С7)-циклоалкил,
9.4 -N(R13)2, где R13 является таким, как определено выше в 1.7.7, или
9.5 фенил, где фенил является незамещенным или моно-пента-эамещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, -О-(C1-С10)-алкилом, -CN, -CF3, -(C1-С10)-алкилом, где алкил является моно-три-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11, или два заместителя фенильного радикала образуют диоксолановое кольцо,
10. -S(O)y-R14, где R14 и у являются такими, как определено в 1.7.7 выше,
11. -C(O)-R12, где R12 представляет собой фенил или -(C1-С7) алкил, где алкил или фенил являются незамещенными или моно-пента-замещенными, независимо один от другого, как определено выше в 1.7.1-1.7.11,
12. -C(O)-O-R12, где R12 является таким, как определено выше в 11,
13. -(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11,
14. -О-(C1-C6)-алкил-O-(C1-C6)-алкил,
15. -О-(С0-С4)-алкил-(С3-С7 )-циклоалкил, или
16. -(C1-С4)-алкил-N(R13)2, где R13 является таким, как определено выше в 1.7.7,
R5 является таким, как R5 в случае а) выше,
R6, R7 и R8 независимо один от другого представляют собой атом водорода или метил.
Предпочтительными являются соединения формулы I, где в случае а)
каждый из B6, B7, B8 и В9 представляет собой атом углерода,
R1, R2 и R3 независимо один от другого представляют собой атом водорода, галоген, циано, нитро, амино, -О-(C1-C7)-алкил, где алкил является незамещенным или замещенным фенилом,
-CF2-CF3, -CF3, -N(R18)2,
где R18, независимо один от другого, представляет собой атом водорода, -(C1-C7)-алкил, фенил, -С(О)-фенил, -С(O)- пиридил, -С(O)-NH-фенил, -С(O)-O-фенил, -С(О)-O-(C1-C4)-алкил или -С(О)-(C1-C7)-алкил, где алкил, пиридил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого, как определено в 1.7.1.-1.7.11, или R18 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
S(O)y-R14,
где у равно нулю, 1 или 2, и R14 представляет собой -(C1-С10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 1.7.1-1.7.11, амино или -N(R18)2, где R18 является таким, как определено выше, где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 1.7.1-1.7.11, или
-C(O)-O-R12, где R12 является таким, как определено выше,
R4 представляет собой циано, амино, -О-(C1-C7 )-алкил, где алкил является замещенным фенилом; -CF2-CF3, -CF3, -N(R18)2,
где R18, независимо один от другого представляет собой атом водорода, -(C1-C7)-алкил, фенил, -С(О)-фенил, -С(О)-пиридил, -С(О)-NH-фенил, -С(О)-O-фенил, -С(О)-О-(C1-C4)-алкил или -С(O)-(C1-C7)-алкил, где алкил, пиридил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого, как определено в 1.7.1-1.7.11, или R18 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
S(O)y-R14,
где у равно нулю, 1 или 2, и R14 представляет собой -(C1-С10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 1.7.1-1.7.11, амино или -N(R18)2, где R18 является таким, как определено выше,
где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 1.7.1-1.7.11, или
-C(O)-O-R12, где R12 является таким, как определено выше,
R6, R7 и R8 независимо один от другого представляют собой атом водорода или метил,
R5 является таким, как определено в пункте 1 формулы изобретения,
или в случае b)
заместители R1, R2 и R4 независимо один от другого представляют собой атом водорода, галоген, циано, нитро, амино, -О-(C1-C7)-алкил, где алкил является незамещенным или замещенным фенилом,
-CF2-CF3, -CF3, -N(R18)2,
где R18, независимо один от другого, представляет собой атом водорода, -(C1-C7)-алкил, фенил, -С(О)-фенил, -С(O)-пиридил, -С(O)-NH-фенил, -С(О)-O-фенил, -С(О)-О-(C1-C4)-алкил или -С(О)-(C1-C7)-алкил, где алкил, пиридил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого, как определено в 1.7.1-1.7.11, или R18 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
S(O)y-R14,
где у равно нулю, 1 или 2, и R14 представляет собой -(C1-С10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 1.7.1-1.7.11, амино или -N(R18)2, где R18 является таким, как определено выше,
где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 1.7.1-1.7.11, или
-C(O)-O-R12, где R12 является таким, как определено выше, R3 представляет собой циано, нитро, амино, -О-(C1 -C7)-алкил, где алкил является замещенным фенилом;
-CF2-CF3, -CF3, -N(R18)2,
где R18, независимо один от другого, представляет собой атом водорода, - (C1-C7)-алкил, фенил, -С(О)-фенил, -С(O)-пиридил, -С(О)-NH-фенил, -С(О)-O-фенил, -С(О)-О-(C1-C4)-алкил или -С(О)-(C1-C7)-алкил, где алкил, пиридил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого, как определено в 1.7.1-1.7.11, или R18 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
S(O)y-R14,
где у равно нулю, 1 или 2, и R14 представляет собой -(C1-С10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 1.7.1-1.7.11, амино или -N(R18)2, где R18 является таким, как определено выше,
где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 1.7.1-1.7.11, или
-C(O)-O-R12, где R12 является таким, как определено выше,
R6, R7 и R8 независимо один от другого. представляют собой атом водорода или метил, и
R5 является таким, как определено выше.
Еще более предпочтительными являются соединения формулы (II)
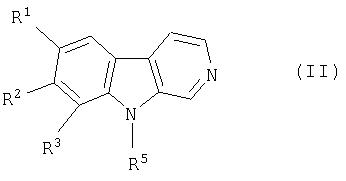
и/или стереоизомерная форма соединения формулы II, и/или физиологически приемлемая соль соединения формулы II, где
R1 и R2, независимо один от другого, представляют собой атом водорода, галоген, циано, амино, -О-(C1-C4)-алкил, нитро, -CF3, -CF2-CF3, S(O)y-R14, где у равно 1 или 2, R14 представляет собой амино, -(C1-C7)-алкил или фенил, который является незамещенным или моно-три-замещенным, как определено выше для заместителей в 1.7.1-1.7.11,
-N(R18)2, где R18, независимо один от другого, представляет собой атом водорода, - (C1-C7)-алкил-С(О)-(C1-C7)-алкил, -С(О)-фенил, -С(O)-пиридил, -С(O)-NH-(C1-C4)-алкил, -С(О)-О-фенил, -С(О)-О-(C1-C4)-алкил или -(C1-С10)-алкил, где пиридил, алкил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого, как определено в 1.7.1-1.7.11, или
R18 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
R3 представляет собой циано, амино, -О-(C1-C4)-алкил, нитро, -CF3, -CF2-CF3, S(O)y-R14, где у равно 1 или 2, R14 представляет собой амино, -(C1-C7)-алкил или фенил, который является незамещенным или моно-три-замещенным, как определено выше для заместителей в 1.7.1-1.7.11,
-N(R18)2, где R18, независимо один от другого, представляет собой атом водорода, -(C1-C7)-алкил-С(О)-(C1-C7)-алкил, -С(O)-фенил, -С(О)-пиридил, -С(О)-O-фенил, -С(О)-NH-(C1-C4)-алкил, -С(О)-О-(C1-C4)-алкил или -(C1-С10)-алкил, где пиридил, алкил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого, как определено в 1.7.1-1.7.11, или
R18 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
R5 представляетсобой атом водорода, -(C1 -С10)-алкил, где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 1.7.1-1.7.4,
-C(O)-R9 или -S(O)2-R9, где
R9 представляет собой -(C1-С10)-алкил, -О-(C1-С10)-алкил, где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 1.7.1-1.7.4, или фенил, который является незамещенным или моно-три-замещенным, как определено в 1.7.1-1.7.11, или -N(R18)2, где R18 является таким, как определено выше.
Наиболее предпочтительными являются соединения формулы (II), где
R1 представляет собой бром, -CF3 или хлор,
R2 представляет собой атом водорода или -О-(C1-C2) алкил,
R3 представляет собой -N(R18)2, где R18, независимо один от другого, представляет собой атом водорода, -N-C(О)-пиридил, -С(О)-фенил, (С1-С7)-алкил, -С(О)-(C1-C4)-алкил или -C(O)-O-(C1-C4)-алкил, где алкил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого галогеном или -О-(C1-C2) алкилом, и
R5 представляет собой атом водорода, метил или -S(O2)-СН3.
Конкретные предпочтительные соединения и все их фармацевтически приемлемые соли, представляющие собой иллюстрацию соединений изобретения, включают следующие:
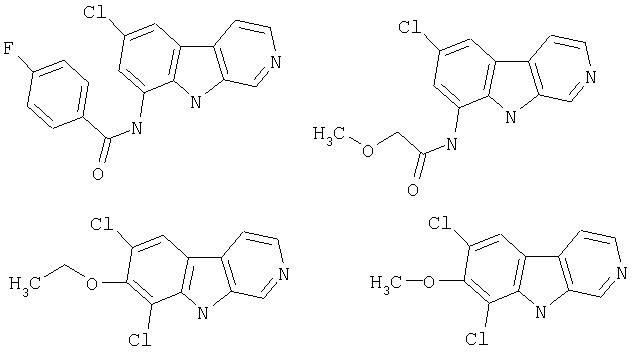
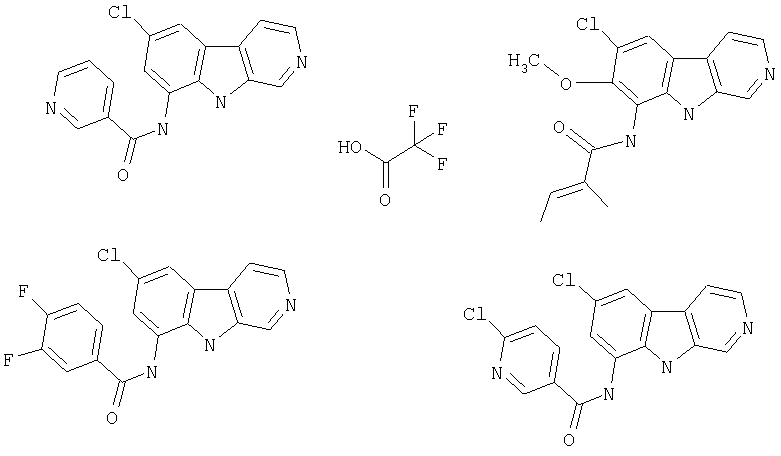
Особенно предпочтительными являются соединения
N-(6-Хлор-9Н-β -карболин-8-ил)никотинамид, а также бисмезилатная соль, бистрифторацетатная соль и бисгидрохлоридная соль N-(6-хлор-9Н-β-карболин-8-ил)никотинамида, N-(6-хлор-9Н-β-карболин-8-ил)-3, 4-дифторбензамид, а также гидрохлоридная соль N-(6-хлор-9Н-β-карболин-8-ил)-3,4-дифторбензамида, N-(6-хлор-7-метокси-9Н-β-карболин-8-ил)никотинамид, а также бистрифторацетатная соль и бисгидрохлоридная соль N-(6-хлор-7-метокси-9Н-β-карболин-8-ил)никотинамида и 6-хлор-N-(6-хлор-9Н-β-карболин-8-ил)никотинамид.
Термин «алкил» сам по себе или как часть другого заместителя, если не указано другого, означает линейный или разветвленный углеводородный радикал, имеющий от 1 до 10 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, третичный бутил, пентил, гексил, гептил, нонил, октил, деканил, или циклоалкил, имеющий от 3 до 7 атомов, такой как циклопропил, циклобутил, циклогексил или циклогептил.
Термин «алкокси» сам по себе или как часть другого заместителя, если не указано другого, означает -O-алкил или -O-замещенный алкил.
Термин «гетероцикл, имеющий от 5 до 7 кольцевых атомов» означает радикал моноциклической насыщенной системы, имеющий от 5 до 7 кольцевых членов, который содержит 1, 2 или 3 гетероатома в качестве кольцевых членов. Примерами гетероатомов являются N, О и S. Примерами термина «гетероцикл, имеющий от 5 до 7 кольцевых атомов» являются пирролидин, тетрагидропиридин, пиперидин, пиперазин, имидазолин, пиразолидин, фуран, морфолин, пиридин, пиридазин, пиразин, оксолан, имидазолин, изоксазолидин, 2-изоксазолин, изотиазолидин, 2-изотиазолин, тиофен или тиоморфолин.
Термин «арил» сам по себе или как часть другого заместителя, если не указано другого, относится к органическому радикалу, полученному из ароматической молекулы путем удаления одного атома; такому как фенил, пиридил, тиазолил, морфолинил и нафтил.
Термин «замещенный алкил» означает алкильный радикал, замещенный в одном или нескольких положениях одним или несколькими радикалами из группы, включающей галоген, нитро, сульфо, амино, замещенный амино, карбоксил, алкокси, -O-арил, -O-замещенный арил и гидроксил.
Термин «замещенный арил» означает арильный радикал, замещенный в одном или нескольких положениях одним или несколькими радикалами из группы, включающей галоген, алкил, замещенный алкил, нитро, сульфо, амино, алкокси, арил, замещенный арил, или гидроксильными группами, предпочтительным является арильный радикал, замещенный в 1-3 положениях 1-3 группами.
Термин «замещенный амино» относится к -N(R13)2, где R13, независимо один от другого представляет собой атом водорода, сульфо, алкил, арил, -С(О)-алкил, -С(О)-NH-арил, -С(О)-O-арил, -С(О)-O-алкил или -С(О)-O-арил, где каждый алкил или арил может быть независимо замещенным.
Термин «сульфо» относится к -S(O)y-R14, где R14 представляет собой алкил, арил, замещенный арил, замещенный алкил, амино или замещенный амино и у равно нулю, единице или двум.
Термин «галоген» следует понимать как означающий фтор, хлор, бром или иод.
Термин «-(C1-C4)-алкил» следует понимать как означающий углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и содержит от 1 до 4 атомов углерода.
Изобретение, кроме того, относится к способу получения соединений формулы I и/или стереоизомерных форм соединений формулы I и/или физиологически приемлемой соли соединений формулы I, который включает
а) взаимодействие соединения формулы III
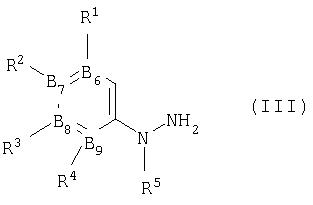
где каждый из R1, R2, R3, R4, B6, В7, B8 и В9 является таким, как определено в формуле I, с соединением формулы IV
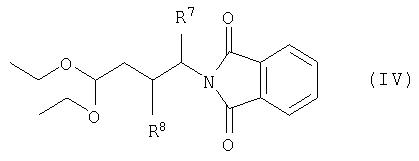
в присутствии кислоты, с преобразованием в соединение формулы V
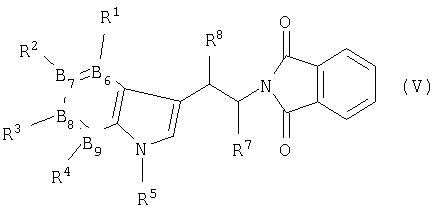
и взаимодействие его с гидразингидратом и затем с формальдегидом (R6 представляет Н) или R6CHO, с получением соединения формулы VI
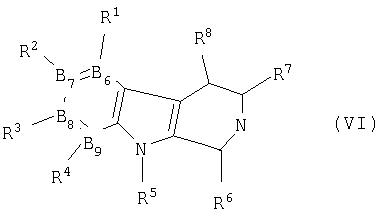
и окисление его с получением соединения формулы VII
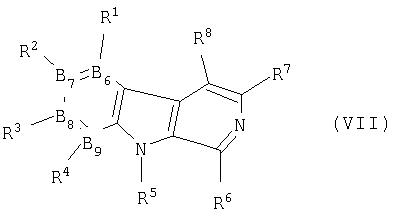
где R1-R4 и В6-В9 являются такими, как определено в формуле I, и R5 представляет собой атом водорода, или
b) взаимодействие соединения формулы VII с соединением формулы VIII
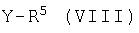
где Y представляет галоген или -ОН, и R5 является таким, как определено для формулы I, или
c) разделение полученного способами а) или b) соединения формулы I, которое на основании своей химической структуры существует в энантиомерных формах, на чистые энантиомеры путем образования соли с энантиомерно чистыми кислотами или основаниями и хроматографии на хиральных стационарных фазах, или образования производных с помощью хиральных энантиомерно чистых соединений, таких как аминокислоты, и разделения полученных таким образом диастереомеров и удаление хиральных вспомогательных групп, или
d) выделение соединения формулы I, полученного способами а), b) или с) либо в свободной форме, либо, в случае присутствия кислотных или основных групп, преобразования в физиологически приемлемые соли.
Получение физиологически приемлемых солей соединений формулы I, способных к солеобразованию, включая их стереоизомерные формы, осуществляют известным способом. С основными реагентами, такими как гидроксиды, карбонаты, гидрокарбонаты, алкоксиды, а также аммиак или органические основания, например, триметил- или триэтиламин, этаноламин или триэтаноламин или, альтернативно, основными аминокислотами, например, лизином, орнитином или аргинином, карбоновые кислоты образуют стабильные соли щелочных металлов, щелочноземельных металлов или необязательно замещенные соли аммония. Если соединения формулы I содержат основные группы, при использовании сильных кислот также могут быть получены стабильные кислотно-аддитивные соли. Для этого подходящими являются как неорганические, так и органические кислоты, такие как хлористоводородная, бромистоводородная, серная, фосфорная, метансульфоновая, бензолсульфоновая, п-толуолсульфоновая, 4-бромбензолсульфоновая, циклогексиламидосульфоновая, трифторметилсульфоновая, уксусная, щавелевая, винная, янтарная или трифторуксусная кислоты.
Изобретение также относится к лекарственным средствам, которые включают эффективное количество по крайней мере одного соединения формулы I, и/или физиологически приемлемой соли соединений формулы I, и/или необязательно стереоизомерной формы соединений формулы I вместе с фармацевтически подходящим и физиологически приемлемым эксципиентом, добавкой и/или другими активными соединениями и вспомогательными веществами.
На основании своих фармакологических свойств соединения согласно изобретению являются подходящими для профилактики и лечения всех таких заболеваний, в течение которых включена повышенная активность lkB киназы. Они включают, например, астму, ревматоидный артрит (в случае воспаления), остеоартрит, болезнь Альцгеймера, раковые заболевания (усиление действия цитотоксичной терапии) инфаркт миокарда или атеросклероз.
Лекарственные средства согласно изобретению обычно вводят перорально, парентерально или ректально, путем ингаляции или чрескожного введения.
Изобретение также относится к применению соединений формулы I

и/или стереоизомерных форм соединений формулы I, и/или физиологически приемлемых солей соединений формулы I, для получения лекарственных средств для профилактики и лечения заболеваний, в течение которых включена повышенная активность lkB киназы, где B6, В7, В8 и В9 независимо выбирают из группы, состоящей из атома углерода и атома азота, и где B6, В7, В8 и В9 вместе не представляют собой более двух атомов азота одновременно; где заместители R1, R2, R3, R4 и R8, независимо один от другого, представляют собой
1. атом водорода,
2. галоген,
3. -ОН,
4. -CN,
5. сульфо,
6. -NO2,
7. -NH2,
8. алкокси,
9. замещенный амино,
10. -NH-C(O)-R15, где R15 представляет собой гетероцикл, имеющий от 5 до 7 кольцевых атомов, алкил, арил, замещенный арил или замещенный алкил,
11. -СООН,
12. -O-R10, где R10 представляет собой алкил, замещенный алкил или арил,
13. -C(O)-R12, где R12 представляет собой алкил, замещенный алкил или арил,
14. -С(О)-O-R12, где R12 является таким, как определено выше,
15. арил,
16. -О-арил,
17. замещенный арил,
18. -O-замещенный арил,
19. алкил,
20. замещенный алкил,
21. -CF3 или
22. -CF2-CF3,
при условии, что по крайней мере один из R1, R2, R3, R4 и R8 не является атомом водорода,
R5 представляет собой
1. атом водорода,
2. алкил,
3. алкильный радикал, замещенный в одном или нескольких положениях одним или несколькими радикалами, галогеном, амино или гидроксилом,
4. -C(O)-R9 или
5. -S(O)2-R9, где
R9 представляет
a) алкил,
b) алкильные радикал, замещенный в одном или нескольких положениях одним или несколькими радикалами, галогеном, амино или гидроксилом,
c) арил,
d) арильный радикал, замещенный в одном или нескольких положениях одним или несколькими радикалами, галогеном, амино или гидроксилом,
e) -NH2,
f) алкокси или
д) замещенный амино, и
R6 и R7 независимо один от другого представляют
1. атом водорода,
2. галоген,
3. -ОН,
4. метил,
5. -O(C1-C10) алкил, где алкил является незамещенным или моно-три-замещенным, независимо один от другого
5.1. арилом,
5.2. галогеном,
5.3. -NO2,
5.4. сульфо,
5.5. -СООН,
5.6. -NH2,
5.7. -О-(C1-C4) алкилом или
5.8. -ОН или
6. -N(R13)2, где R13 независимо один от другого представляет собой атом водорода, арил, -С-(О)-(C1-C4)алкил или замещенный арил или алкил, где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 5.1-5.8, или R13 вместе с атомом азота, к которому он присоединен, гетероцикл, имеющий от 5 до 7 кольцевых атомов.
Предпочтительным является применение соединений формулы I, где
каждый из B6, В7, B8 и В9 представляет собой атом углерода, R1, R2, R3, R4 и R8, независимо один от другого, представляет собой
1. атом водорода,
2. галоген
3. -CN,
4. -СООН,
5. -NO2,
6. -NH2,
7. -О-(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого
7.1 фенилом, который является незамещенным или моно-пента-замещенным галогеном или -О-(C1-C4)-алкилом,
7.2 галогеном,
7.3 -NH2,
7.4 -ОН,
7.5 -COOR16, где R16 представляет собой атом водорода или -(C1 -С10)-алкил,
7.6 -NO2,
7.7 -S(O)y-R14, где у равно нулю, 1 или 2, R14представляет собой -(C1-C10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 7.1-7.11, амино или -N(R13)2,
где R13 независимо один от другого представляет собой атом водорода, фенил, -(C1-С10)-алкил, -С(О)-(C1-C7)-алкил, -С(О)-фенил, -С(О)-NH-(C1-C7 )-алкил, -С(O)-O-фенил, -С(O)-NH-фенил, -С(О)-О-(C1-C7)-алкил, -S(O)у-R14, где R14 и у являются такими, как определено выше, и где алкил или фенил в каждом случае являются незамещенным или моно-пента-замещенными, независимо один от другого, как определено выше в 7.1-7.11 или R13 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
7.8 -O-фенилом, где фенил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 1.7.1-1.7.11
7.9 радикалом, выбранным из пирролидина, тетрагидропиридина, пиперидина, пиперазина, имидазолина, пиразолидина, фурана, морфолина, пиридина, пиридазина, пиразина, оксолана, имидазолина, изоксазолидина, 2-изоксазолина, изотиазолидина, 2-изотиазолина, тиофена или тиоморфолина,
7.10 -(С3-С7)-циклоалкилом или
7.11 =O,
8. -N(R13)2, где R13 является таким, как определено в 7.7,
9. -NH-C(O)-R15, где R15 представляет собой
9.1 радикал, выбранный из пирролидина, тетрагидропиридина, пиперидина, пиперазина, имидазолина, пиразолидина, фурана, морфолина, пиридина, пиридазина, пиразина, оксолана, имидазолина, изоксазолидина, 2-изоксазолина, изотиазолидина, 2-изотиазолина, тиофена или тиоморфолина,
где указанный радикал является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 7.1-7.11, -CF3, бензилом или -(C1-С10)-алкилом, где алкил является моно-три-замещенным, независимо один от другого, как определено выше в 7.1-7.11
9.2. -(C1-С10)-алкил, где алкил является моно-пента-замещенным, независимо один от другого, как определено выше в 7.1-7.11 или -О-(C1-C10)-алкилом, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 7.1-7.11
9.3. -(С3-С7)-циклоалкил,
9.4. -N(R13)2, где R13 является таким, как определено выше в 7.7, или
9.5. фенил, где фенил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 7.1-7.11, -О-(C1-C10)-алкилом, -CN, -CF3, -(C1-С10)-алкилом, где алкил является моно-три-замещенным, независимо один от другого, как определено выше в 7.1-7.11, или два заместителя фенильного радикала образуют диоксолановое кольцо,
10. -S(O)y -R14, где R14 и у являются такими, как определено в 7.7 выше,
11. -C(O)-R12, где R12 представляет собой фенил или -(C1-С7)алкил, где алкил или фенил являются незамещенными или моно-пента-замещенными, независимо один от другого, как определено выше в 7.1-7.11
12. -C(O)-O-R12, где R12 является таким, как определено выше в 11,
13. -(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 7.1-7.11,
14. -О-(C1-С6)-алкил-O-(C1-C6)-алкил,
15. -О-(С0-С4)-алкил-(С3 -С7)-циклоалкил,
16. -(C1-C4)-алкил-N(R13)2, где R13 является таким, как определено выше в 7.7,
17. -CF3 или
18. -CF2-CF3,
при условии, что по крайней мере один из R1, R2, R3, R4 и R8не является атомом водорода,
R5 представляет собой
1. атом водорода,
2. -(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено выше в 7.1-7.4,
3. -C(O)-R9, где R9 представляет собой
-NH2, -(C1-С10)-алкил, где алкил является незамещенным или моно-пента-замещенным, независимо один от другого, как определено в 7.1-7.4, или -N(R13)2, где R13 является таким, как определено выше в 7.7, или
4. -S(O)2-R9, где R9 является таким, как определено выше в пункте 3;
или
R4 и R5 вместе с атомом, с которым они связаны, образует гетероцикл, или
R3 и R15 вместе с атомом, с которым они связаны, образует гетероцикл, содержащий в кольце дополнительный атом кислорода, и
R6 и R7 независимо один от другого представляют собой атом водорода или метил.
Более предпочтительно применение соединений формулы I для получения лекарственных средств для профилактики и лечения заболеваний, в течение которых вовлечена повышенная активность lkB киназы, где каждый из B6, В7, B8 и В9 представляет собой атом углерода,
R1, R2, R3 и R4 независимо один от другого представляют собой атом водорода, галоген, циано, нитро, амино, -O-(C1-C7)-алкил, фенил, -O-фенил, -CF2-CF3, -CF3, -N(R13 )2,
где R13 независимо один от другого представляют собой атом водорода, -(C1-C7)-алкил, фенил, -С(О)-фенил, -С(O)-пиридил, -С(O)-NH-фенил, -С(O)-O-фенил, -С(О)-О-(C1-C4)-алкил, -C(O)-(C1-С7)-алкил или -(C1-C10)-алкил, где алкил, пиридил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого, как определено в 7.1-7.11, или R13 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов,
S(O)y-R14,
где у равно нулю, 1 или 2, и R14 представляет собой -(C1-C10)-алкил, фенил, который является незамещенным или моно-пента-замещенным, как определено для заместителей в 7.1-7.11, амино или -N(R13)2, где R13 является таким, как определено выше,
где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 7.1-7.11, или
-C(O)-O-R12, где R12 является таким, как определено выше,
R6, R7 и R8 независимо один от другого представляют собой атом водорода или метил, амино, -N(R13)2, где R13 является таким, как определено выше, при условии, что по крайней мере один из R1, R2, R3, R4 и R8не является атомом водорода, и R5 является таким, как определено выше.
Еще более предпочтительно применение соединений формулы II

и/или стереоизомерной формы соединений формулы II и/или физиологически приемлемой соли соединения формулы II для получения лекарственных средств для профилактики и лечения заболеваний, в течение которых вовлечена повышенная активность lkB киназы, где
R1, R2 и R3 независимо один от другого представляют собой атом водорода, галоген, циано, амино, -О-(C1-C4)-алкил, нитро, -CF3, -CF2-CF3, -S(O)y-R14, где у равно 1 или 2, R14 представляет собой амино, -(C1-C7)-алкил, фенил, который является незамещенным или моно-три-замещенным, как определено выше для заместителей в 7.1-7.9, или -N(R13)2, где
R13 независимо один от другого представляют собой -С(O)-пиридил, атом водорода, -(C1-C7)-алкил-С(О)-(C1 -C7)-алкил, С(О)-фенил, -(C1-С10)-алкил, -С(О)-NH-(C1-C4)-алкил, -С(O)-O-фенил или -С (О)-О-(C1-C4)-алкил, где
пиридил, алкил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого, как определено в 7.1-7.11, или
R13 вместе с атомом азота, к которому он присоединен, образует гетероцикл, имеющий от 5 до 7 кольцевых атомов, при условии, что по крайней мере один из R1, R2 и R3 не является атомом водорода, и
R5 представляет собой атом водорода, -(C1-C10)-алкил,
где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 7.1-7.4, -C(O)-R9 или -S(O)2-R9, где
R9 представляет -(C1-С10)-алкил, -O-(C1-C10 )-алкил, где алкил является незамещенным или моно-три-замещенным, независимо один от другого, как определено в 7.1-7.4, фенил, который является незамещенным или моно-три-замещенным, как определено в 7.1-7.11, или -N(R13)2,
где R13 является таким, как определено выше.
Наиболее предпочтительно применение соединений формулы II для получения лекарственных средств для профилактики и лечения заболеваний, в течение которых вовлечена повышенная активность lkB киназы, где
R1, R2 и R3 независимо один от другого представляют собой атом водорода, галоген, циано, амино, -О-(C1-C4)-алкил, нитро, -CF3, или -N(R13)2, где
R13 независимо один от другого представляют собой атом водорода, -(C1-C7)-алкил, -С(О)-(C1-C7)-алкил, -С(О)-пиридил, -С(О)-фенил или -С(О)-О-(C1-C4)-алкил, где алкил или фенил являются незамещенными или моно-три-замещенными независимо один от другого галогеном или -О-(C1-C4)-алкилом, и
R5 представляет собой атом водорода, -С(O)-СН3, метил, -S(O)2-СН3, -С(O)-морфолинил, -СН2-СН2-ОН или -CH2 -C(O)-NH2, при условии, что не более двух из R1, R2, R3 и R5 представляют собой атом водорода.
Еще более предпочтительно применение соединений формулы II для получения лекарственных средств для профилактики и лечения заболеваний, в течение которых вовлечена повышенная активность lkB киназы, где
R1 представляет собой бром, -CF3 или хлор, R2 представляет собой атом водорода или -О-(C1-C2) алкил, R3 представляет собой атом водорода, бром, хлор или -N(R13)2,
где R13 независимо один от другого представляет собой атом водорода, -С(О)-фенил, (C1-C7)-алкил, -С(О)-(C1-C4)-алкил или -С(О)-О-(C1-C4)-алкил, где алкил или фенил являются незамещенными или моно-три-замещенными, независимо один от другого галогеном или -О-(C1-С2) алкилом, и
R5 представляет собой атом водорода, -С(O)-СН3, метил или -S(O2)-СН3,
при условии, что не более двух из R1, R2, R3 и R5 представляют собой атом водорода.
В частности, предпочтительным является применение соединений формулы II для получения лекарственных средств для профилактики и лечения заболеваний, в течение которых вовлечена повышенная активность lkB киназы, где
R1 представляет собой хлор, каждый из R2 и R3 представляет собой атом водорода, и R5 представляет собой -С(O)-СН3, или
R1 представляет собой бром, каждый из R2 и R3 представляет собой атом водорода, и R5 представляет собой -С(O)-СН3, или
R1 представляет собой хлор, R3 представляет собой -N-С(О)- СН2-О-СН3, и каждый из R2 и R5 представляет собой атом водорода, или
R1 представляет собой хлор, R3 представляет собой -N-C(O)-пара-фтор-фенил и каждый из R2 и R5 представляет собой атом водорода, или каждый из R1 и R3 представляет собой хлор, R2 представляет собой -С(O)-СН3, и R5 представляет собой атом водорода, или
каждый из R1 и R3 представляет собой хлор, R5 представляет собой атом водорода, и R2 представляет собой -С(О)-СН2-СН3.
С точки зрения фармакологических свойств соединения согласно изобретению являются подходящими для профилактики и лечения всех тех заболеваний, в течение которых вовлечена повышенная активность lkB киназы. Заболевания, в течение которых вовлечена повышенная активность lkB киназы, включают, например, лечение общего воспаления, включая артрит, ревматоидный артрит и другие артритные состояния, такие как ревматоидный спондилит, подагрический артрит, травматический артрит, артрит при коревой краснухе, псориатический артрит и остеоартрит. Кроме того, соединения можно использовать при лечении острого синовита, туберкулеза, атеросклероза, мышечной дистрофии, кахексии (истощения), синдрома Рейтера, эндотоксемии (наличие в крови эндотоксинов), сепсиса, септического шока, эндотоксического шока, грам-отрицательного сепсиса, подагры, синдрома токсического шока, хронических воспалительных заболеваний легких, включая астму и респираторный дистресс-синдром у взрослых, силикоз, саркоидоз легких, синдрома рассасывания костей, реперфузионного поражения, карциноза, лейкемии, саркомы, опухолей лимфатических узлов, карциноза кожи, лимфомы, апоптоза, реакции трансплантат-против-хозяина, отторжения трансплантата и проказы. Кроме того, соединения полезны при лечении инфекций, таких как вирусные инфекции, например ВИЧ (вирус иммунодефицита человека), цитомегаловирус (CMV), грипп, аденовирус и вирусы группы герпеса, паразитарных инфекций, например малярии, такой как церебральная малярия, и дрожжевых и грибковых инфекций, например грибкового менингита; лихорадки и миальгии (боль в мышцах) вследствие инфекции; синдрома приобретенного иммунодефицита (СПИДа); относящегося к СПИДу комплекса; вторичной кахексии вследствие инфекции или злокачественного опухолевого заболевания; вторичной кахексии вследствие синдрома приобретенного иммунодефицита (СПИДа) или рака; образования келоидных и зарубцевавшихся тканей; повышенной температуры; диабета и воспалительного заболевания кишечника, такого как болезнь Крона и язвенный колит. Соединения изобретения также полезны при лечении заболеваний или поражения мозга, в которые вовлечена сверх-экспрессия TNFα, таких как рассеянный склероз и травма головы. Соединения согласно изобретению также полезны при лечении псориаза, болезни Альцгеймера, карциноматодных нарушений (усиление действия цитотоксической терапии), инфаркта сердца, хронического обструктивного заболевания легких (COPD) и острого респираторного дистресс-синтрома (ARDS).
Изобретение также относится к способу получения лекарственного средства, который включает приведение по крайней мере одного соединения формулы I в подходящую форму введения с использованием фармацевтически подходящего и физиологически приемлемого эксципиента и, если является подходящим, дополнительных подходящих активных соединений, добавок или вспомогательных веществ.
Подходящими твердыми или фармацевтическими препаративными формами являются, например, гранулы, порошки, таблетки с оболочкой, таблетки (микро)капсулы, суппозитории, сиропы, соки, суспензии, эмульсии, капли или растворы для инъекций и препараты, имеющие продолжительное высвобождение активного соединения, в подобных препаратах используются обычные вспомогательные вещества, такие как эксципиенты, дезинтегрирующие агенты, связующие вещества, агенты покрытия, агенты набухания, глиданты или смазочные вещества, ароматизаторы, подсластители и солюбилизаторы. Часто применяемыми вспомогательными веществами, которые можно упомянуть, являются карбонат магния, диоксид титана, лактоза, маннит и другие сахара, тальк, лактопротеин, желатин, крахмал, целлюлоза и ее производные, животные и растительные масла, такие как масло печени трески, подсолнечное масло, арахисовое или кунжутное масло, полиэтиленгликоль и растворители, такие как, например, стерильная вода и одно- или многоатомные спирты, такие как глицерин.
Фармацевтические препараты предпочтительно получают и вводят в виде единичных препаративных лекарственных, форм, каждая единичная лекарственная форма содержит в качестве активного составляющего определенную дозу соединения формулы I согласно изобретению. В случае твердых единичных препаративных лекарственных форм, таких как таблетки, капсулы, покрытые оболочкой таблетки или суппозитории, такая доза может составлять приблизительно до 1000 мг, предпочтительно от примерно 50 мг до 300 мг, а в случае растворов для инъекций в форме ампулы вплоть до приблизительно 300 мг, предпочтительно от примерно 10 мг до 100 мг.
Для лечения взрослого пациента, весящего приблизительно 70 кг, в зависимости от эффективности соединения согласно формуле I показаны дневные дозы от примерно 20 мг до 1000 мг активного соединения, предпочтительно от примерно 100 мг до 500 мг. Однако при определенных обстоятельствах подходящими могут оказаться даже более высокие или более низкие дозы. Введение дневной дозы можно осуществлять как в виде единичного введения в виде индивидуальной препаративной лекарственной формы или, в противном случае, в виде ряда меньших единичных препаративных лекарственных форм или путем множественного введения подразделенных лекарственных форм через определенные интервалы.
Как правило, конечные продукты устанавливали масс-спектроскопическими методами (FAB- (бомбардировка быстрыми атомами), ESI-MS (электронный удар - масс-спектры). Температуры приведены в градусах Цельсия, КТ означает комнатную температуру (от 22°С до 26°С). Использованные сокращения либо объяснены, либо соответствуют общепринятым правилам.
Пример 1. 7-Бром-β-карболин
Раствор норхармана (600 мг, 3,57 ммоль) в тетрагидрофуране (ТГФ; 50 мл) обрабатывали бромом (0, 40 мл, 7,80 ммоль) при комнатной температуре при перемешивании. После перемешивания в течение 18 часов при комнатной температуре реакционную смесь концентрировали при пониженном давлении и полученный остаток обрабатывали ультразвуком в 10%-ном водном Na2CO3 (100 мл). Продукт отфильтровывали и промывали водой, получая 905 мг сырого (неочищенного) продукта. Сырой продукт кристаллизовали из ксилолов, получая 580 мг 7-бром-β-карболина в виде двух порций.
Пример 2. 1-Ацетил-7-бром-β-карболин
Раствор продукта примера 1 (25 мг, 0,1 ммоль) в диметилформамиде (ДМФ; 2 мл) обрабатывали 0,10 мл водного NaOH (0,10 ммоль). После перемешивания при комнатной температуре в течение 30 минут добавляли уксусный ангидрид (0,010 мл, 0,095 ммоль) и реакционную смесь перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь распределяли в EtOAc и 5%-ной лимонной кислоте и органический слой промывали водой, сушили (насыщенный раствор соли; MgSO4) и концентрировали, получая 23 мг сырого продукта. Сырой продукт хроматографировали (7:3 гексан-ацетон) на силикагеле, получая 10 мг 1-ацетил-7-бром-β -карболина.
Пример 3. 7-Фтор-β-карболин
Смесь гидрохлорида 5-фтортриптамина (200 мг, 0,93 ммоль) в EtOAc (4 мл) и воде (2 мл) обрабатывали гидратом глиоксалевой кислоты (90 мг, 0,98 ммоль), рН водного слоя доводили до 5 (5%-ным NaHCO3, затем 1М HCl) и смесь интенсивно перемешивали при комнатной температуре в течение 18 часов. Смесь затем разбавляли гексаном (4 мл) и продукт отфильтровывали и промывали водой и смесью (1:1) гексан-этилацетат. Полученный выше сырой продукт в 6н. HCl (3 мл) обрабатывали 3 раза концентрированной HCl (0,050 мл) каждые 15 минут при кипении с обратным холодильником. После нагревания при кипении с обратным холодильником всего в течение 45 минут реакционную смесь концентрировали, получая остаток. Вышеуказанный остаток суспендировали в ксилолах с триэтиламином (0,40 мл, 2,9 ммоль) и 10% Pd/C (200 мг). Смесь нагревали при кипении с обратным холодильником в течение 1 часа, а затем фильтровали горячей через целит. Фильтрат концентрировали и остаток хроматографировали (5:95 метанол-хлороформ) на силикагеле, получая 25 мг 7-фтор-β-карболина.
Пример 4. Гидрохлорид 7-изопропил-β -карболина
Смесь гидрохлорида 4-изопропилфенилгидразина (660 мг, 3,55 ммоль) и диэтилацеталя 4-фталимидобутаналя (1,15 г, 3,95 ммоль) в этаноле (EtOH; 30 мл) нагревали при температуре от 60°С до 65°С в течение 1 часа с водой (0,050 мл). Затем смесь обрабатывали концентрированной HCl (0,50 мл) и нагревали при кипении с обратным холодильником в течение 14 часов. После концентрирования реакционной смеси остаток распределяли между хлористым метиленом и насыщенным водным раствором NaHCO3. Водный раствор экстрагировали хлористым метиленом (3 раза) и объединенные органические растворы сушили (MgSO4) и концентрировали, получая после хроматографии (4:1 гексан-этилацетат) на силикагеле 146 мг продукта.
Вышеуказанный продукт обрабатывали гидразин гидратом (1 мл) в EtOH (4 мл) и воде (1 мл) и перемешивали при комнатной температуре в течение ночи. После концентрирования реакции до водной смеси продукт экстрагировали хлористым метиленом (3 раза). Объединенный органический раствор сушили (MgSO4) и концентрировали. Остаток повторно растворяли в хлористом метилене и обрабатывали 1М HCl в простом эфире. Осадок собирали и промывали простым эфиром и гексаном и сушили, получая 102 мг гидрохлоридной соли 6-изопропилтриптамина. Полученный выше триптамин преобразовывали в 7-изопропил-β-карболин в соответствии со способом, использованным в примере 3. Гидрохлоридную соль получали, обрабатывая раствор 7-изопропил-β-карболина в хлористом метилене 1М HCl в эфире и концентрируя, остаток растирали со смесью (1:1) хлористый метилен-гексан, получая 15 мг гидрохлорида 7-изопропил-β-карболина.
Пример 5. 7-Циано-β-карболин
Темный раствор продукта примера 1 (190 мг, 0,62 ммоль) и CuCN (110 мг, 1,22 ммоль)в N-метил-2-пирролидоне(1,5 мл) нагревали в запаянной реакционной трубке при 200°С в течение 48 часов. Смесь фильтровали и фильтрат разбавляли водой (50 мл). Выпавшее в осадок коричневое твердое вещество отфильтровывали, промывали водой, насыщенным водным раствором NaHCO3, а затем метанолом. Данное вещество растворяли в ДМСО и разбавляли водной HCl. Этот гомогенный темный раствор обесцвечивали активированным углем, фильтровали и концентрировали, получая концентрированный раствор в ДМСО. Этот раствор в ДМСО распределяли между смесью (1:1) EtOAc-ТГФ и насыщенным водным раствором NaHCO3. Органический раствор сушили (MgSO4) и концентрировали, получая 8 мг 7-циано-β -карболина.
Пример 6. Гидрохлорид 7-нитро-β-карболина
Норхарман (100 мг, 0,60 ммоль) обрабатывали концентрированной азотной кислотой (1,0 мл) и полученную суспензию нагревали при 65°С до тех пор, пока смесь не становилась гомогенной (от 3 до 4 минут). Раствор осторожно выливали в воду (20 мл), осадок отфильтровывали и промывали водой, затем метанолом. Твердое вещество повторно суспендировали в насыщенном водном растворе NaHCO3 и интенсивно перемешивали перед фильтрованием и промыванием водой. Твердое вещество помещали в горячий метанол и данный раствор обрабатывали 1М HCl в простом эфире (5 мл). Раствор концентрировали и остаток растирали с простым эфиром, получая 58 мг смеси 7:3 гидрохлорида 7-нитро-β -карболина и гидрохлорида 9-нитро-β-карболина.
Пример 7. Трифторацетат 7-карбокси-β-карболина
Сырой продукт из примера 5 (из 210 мг продукта примера 1, 0, 085 ммоль) обрабатывали 6М HCl в запаянной реакционной трубке в течение 15 часов при 110°С. Реакционную смесь упаривали, получая концентрированный раствор продукта в N-метил-2-пирролидоне. Порцию (половину) очищали препаративной ВЭЖХ с использованием набитой колонки C18 и элюируя с использованием градиента (от 5:95 до 50:50) смеси вода-ацетонитрил (с 0,1%-ной трифторуксусной кислотой). Чистые фракции объединяли и гидролизовали, получая 11 мг трифторацетата 7-карбокси-β-карболина
Пример 8. Гидрохлорид 7,9-дибром-β-карболина
Раствор продукта из примера 1 (140 мг, 0,58 ммоль) в ТГФ (2 мл) обрабатывали бромом (0,50 мл). Через 10 минут при комнатной температуре реакционную смесь разбавляли хлороформом и продукт отфильтровывали. Отфильтрованный продукт помещали в метанол и обрабатывали 1М HCl в простом эфире и концентрировали. Остаток растирали с простым эфиром, получая 160 мг гидрохлорида 7,9-дибром-β -карболина.
Пример 9. 7,9-Дихлор-β-карболин
К суспензии норхармана (84 мг, 0,50 ммоль) в воде (3 мл) при комнатной температуре добавляли 1М водную HCl (1,1 мл, 1, 1 ммоль). К этому гомогенному раствору добавляли порциями N-хлорсукцинимид (747 мг, 5,58 ммоль) и полученный раствор перемешивали при 60°С-70°С в течение 3 часов. Реакционную смесь распределяли между EtOAc и насыщенным водным раствором NaHCO3 и органический слой сушили (насыщенный раствор соли; MgSO4) и затем концентрировали. Остаток хроматографировали (2:3 ТГФ-гексан) на силикагеле, получая 24 мг 7,9-дихлор-β-карболина после растирания со смесью хлористый метилен-гексан (1:1), а затем с гексаном.
Пример 10. 1-Ацетил-7-бром-β -карболин
К суспензии NaH (95%, 14 мг, 0,60 ммоль) в ДМФ (1,0 мл) при 5°С-10°С добавляли продукт примера 1 (74 мг, 0,30 ммоль). Полученную смесь перемешивали в течение 15 минут при 5°С-10°С перед добавлением метансульфонилхлорида (0,030 мл, 0,38 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали 2 часа, после чего распределяли между насыщенным водным раствором NaHCO3 и EtOAc. После перемешивания смеси в течение ночи органический слой промывали водой, сушили (насыщенный раствор соли; MgSO4) и концентрировали. Остаток очищали хроматографией (1:1 гексан-этилацетат) на силикагеле, получая 23 мг 1-ацетил-7-бром-β-карболина.
Пример 11. 7-Бром-1-метил-β -карболин
К суспензии NaH (95%, 6 мг, 0,24 ммоль) в ДМФ (2,0 мл) при 5°С-10°С добавляли продукт примера 1 (50 мг, 0,20 ммоль). Полученную смесь перемешивали в течение 15 минут при 5°С-10°С перед добавлением иодистого метила (0,030 мл, 0,20 ммоль) при 0°С-5°С. Реакционную смесь перемешивали 12 часов при 0°С-5°С, затем распределяли между водой и EtOAc. Органический слой промывали водой, сушили (насыщенный раствор соли; MgSO4) и концентрировали. Остаток очищали хроматографией (градиентное элюирование, от 1:3 гексан-этилацетат до этилацетата) на силикагеле, получая 10 мг 7-бром-1-метил-β-карболина.
Пример 12. 7-Хлор-β-карболин
К раствору норхарамана (2,0 г, 11,9 ммоль) в воде (89 мл) и 1М водной HCl (29,8 мл, 29,8 ммоль) добавляли порциями N-хлорсукцинимид (3,17 г, 23,8 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 6 часов и затем при 0°С-5°С в течение 12 часов. Реакционную смесь разбавляли водой (100 мл) и осторожно подщелачивали твердым К2СО3 (4,3 г). После перемешивания при комнатной температуре в течение 1 часа продукт собирали и промывали водой. Сырой продукт нагревали при кипении с обратным холодильником в хлороформе в течение 1 часа и отфильтровывали после охлаждения до 15°С, получая 2,05 г 7-хлор-β-карболина.
Пример 13. 1-Ацетил-7-хлор-β-карболин
К раствору продукта примера 12 (104 мг, 0,50 ммоль) в ДМФ (2,0 мл) при 3°С-5°С добавляли NaH (95%, 15 мг, 0,625 ммоль). Полученную смесь перемешивали в течение 15 минут перед добавлением уксусного ангидрида (0,083 мл, 0,875 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 часов, после чего выливали в воду (25 мл). Суспензию перемешивали в течение 12 часов и продукт собирали, получая после хроматографии (1:3 гексан-этилацетат) на силикагеле 82 мг 1-ацетил-7-хлор-β-карболина.
Пример 14. 7-Хлор-9-нитро-β-карболин
Смесь продукта примера 12 (500 мг, 2,48 ммоль) в концентрированной азотной кислоте (20 мл) перемешивали при комнатной температуре в течение 22 часов. Реакционную смесь осторожно выливали в холодную (3°С-5°С) воду (50 мл) и после перемешивания в течение 2 часов собирали осадок. Твердое вещество суспендировали в насыщенном водном NaHCO3 (50 мл) и перемешивали при комнатной температуре в течение 12 часов. Продукт отфильтровывали и промывали водой, получая 550 мг 7-хлор-9-нитро-β-карболина.
Пример 15. 9-Амино-7-хлор-β-карболин
К суспензии продукта примера 14 (548 мг, 2,22 ммоль)в EtOH (14 мл) при 65°С-70°С добавляли дигидрат хлорида олова (2,5 г, 11,1 ммоль). После этого добавляли по каплям 6М водную HCl (14 мл). Смесь перемешивали при 70°С-80°С в течение 3,5 часов и затем медленно распределяли в смеси насыщенного водного раствора NaHCO3 (150 мл) и EtOAc (100 мл). Водную фазу экстрагировали (2 раза) и объединенные органические растворы сушили (насыщенный раствор соли; Na2SO4) и концентрировали, получая 484 мг 9-амино-7-хлор-β-карболина.
Пример 16. Трифторацетат 9-амино-7-хлор-β-карболина
К раствору продукта примера 15 (35 мг, 0,16 ммоль) в пиридине (0,80 мл) добавляли уксусный ангидрид (0,018 мл, 0,19 ммоль). Полученную смесь оставляли при комнатной температуре на 12 часов, затем выливали в воду (15 мл). Неочищенный продукт отфильтровывали и очищали препаративной ВЭЖХ с использованием C18-набитой колонки и элюируя с использованием градиента (от 5:95 до 60:40) смесью вода-ацетонитрил (с 0,1% трифторуксусной кислоты). Чистые фракции объединяли и лиофилизовали, получая 18 мг трифторацетата 9-амино-7-хлор-β-карболина.
Пример 17. 7-Бром-1-карбонил-(4'-морфолин)-β-карболин
Раствор продукта примера 1 (125 мг, 0,51 ммоль) в ДМФ (2 мл) обрабатывали 0,55 мл 1М водного раствора NaOH (0,55ммоль). После перемешивания при комнатной температуре в течение 30 минут добавляли 4-морфолинкарбонилхлорид (0,060 мл, 0,51 ммоль) и реакционную смесь перемешивали 18 часов при комнатной температуре. Реакционную смесь распределяли между EtOAc и 5%-ной лимонной кислотой и органический слой промывали водой, сушили (насыщенный раствор соли; MgSO4) и концентрировали. Остаток хроматографировали (7:3 гексан-ацетон) на силикагеле, получая 105 мг 7-бром-1-карбонил-(4'-морфолин)-β-карболина.
Пример 18. 1-(2'-Этилацетат)-7-хлор-β-карболин
К суспензии NaH (95%, 28 мг, 1,15 ммоль) в ДМФ (1,0 мл) при 5°С-10°С добавляли продукт примера 12 (202 мг, 1,0 ммоль) в ДМФ (3 мл). Полученную смесь перемешивали в течение 30 минут при 5°С-10°С перед добавлением этилбромацетата (0,116 мл, 1,05 ммоль). Реакционную смесь оставляли перемешиваться в течение 1,5 часов, а затем реакционную смесь разбавляли насыщенным водным раствором NaHCO3 (30 мл). Продукт экстрагировали EtOAc (30 мл, 2 раза по 15 мл каждый) и объединенные органические экстракты сушили (насыщенный раствор соли; MgSO4) и концентрировали. Остаток очищали хроматографией (1:3 гексан-этилацетат) на силикагеле, получая 270 мг 1-(2'-этилацетат)-7-хлор-β -карболин.
Пример 19. 1-(2'-Этаноил)-7-хлор-β-карболин
К раствору продукта примера 18 (50 мг, 0,17 ммоль) в ТГФ (1,7 мл) при 5°С-10°С добавляли 1М LAH в ТГФ (0,17 мл, 0,17 ммоль). Полученную смесь перемешивали в течение 2 часов при 5°С-10°С, после чего добавляли EtOAc (0,10 мл). Затем смесь разбавляли EtOAc (5 мл) и медленно обрабатывали насыщенным водным раствором NaHCO3 (5 мл). После разбавления водой (10 мл) и насыщенным раствором соли (10 мл) смесь экстрагировали EtOAc. Органический раствор сушили (насыщенный раствор соли; MgSO4), затем концентрировали, получая 42 мг 1-(2'-этаноил)-7-хлор-β-карболина.
Пример 20. 1-(2'-Ацетил)-7-хлор-β-карболин
К раствору продукта примера 18 (107 мг, 0,37 ммоль) в МеОН (3,7 мл) при комнатной температуре добавляли воду (3,7 мл) с последующей обработкой 1М водным раствором NaOH (0,41 мл, 0,41 ммоль). Полученную смесь перемешивали в течение 2 часов и летучие компоненты удаляли при пониженном давлении. Затем смесь разбавляли водой (5 мл) и рН доводили до 5-6. Осадок отфильтровывали и промывали водой, получая 96 мг 1-(2'-ацетил)-7-хлор-β-карболина.
Пример 21. 8-Метокси-β-карболин
Получали из 6-метокситриптамина с использованием методики примера 3.
Пример 22. Структуру смотри в таблице 1
К раствору продукта примера 20 (59 мг, 0,23 ммоль) в ДМФ (2,8 мл) при комнатной температуре добавляли п-нитрофенол (40 мг, 0,29 ммоль), после чего 1-этил-3-(3-диметиламинопропил)карбодиимид (48 мл, 0,25 ммоль). Полученную смесь перемешивали в течение 1,5 часов при комнатной температуре и затем добавляли бикарбонат аммония (55 мг, 0,69 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и затем выливали в воду (20 мл). Водную смесь подщелачивали К2СО3 до рН примерно 10. Осадок отфильтровывали и промывали водой, получая 47 мг указанного в заголовке соединения.
Пример 23. 8-Метокси-2-метил-β-карболин
Раствор хармина (616 мг, 2,9 ммоль) в дихлорэтане (20 мл) обрабатывали 2,0 мл 1М BBr3 (4 ммоль) в дихлорэтане. Реакционную смесь перемешивали при 60°С в течение 48 часов и затем охлаждали до 0°С, затем гасили МеОН (5 мл). Реакционную смесь концентрировали и остаток растирали с метанолом, получая 413 мг 8-метокси-2-метил-β-карболина.
Пример 24. 6,8-Дибром-7-метокси-β -карболин
Раствор продукта примера 30 (90 мг, 0,45 ммоль) в уксусной кислоте (8 мл) обрабатывали бромом (0,025 мл, 0,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, затем концентрировали. Остаток распределяли в смеси EtOAc и водном NaHCO3. Органический слой сушили (насыщенный раствор соли; MgSO4) и концентрировали. Остаток очищали хроматографией (5:4 гексан-ацетон) на силикагеле, получая 3 мг 6,8-дибром-7-метокси-β-карболина.
Пример 25. Структуру смотри в таблице 1
Раствор продукта примера 23 (60 мг, 0,30 ммоль) в ДМФ (3 мл) обрабатывали К2СО3 (100 мг) и трет-бутил-бромацетатом (0,040 мл, 0,27 ммоль). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь распределяли в EtOAc и воде. Органический слой сушили (насыщенный раствор соли; MgSO4) и затем концентрировали. Остаток хроматографировали (1:1 гексан-EtOAc) на силикагеле, получая 20 мг указанного в заголовке соединения.
Пример 26. Структуру смотри в таблице 1
Раствор продукта примера 23 (50 мг, 0,25 ммоль) в ДМФ (3 мл) обрабатывали К2СО3 (100 мг) и бромистым бензилом (0,030 мл, 0,25 ммоль). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь распределяли в EtOAc и воде. Органический слой сушили (насыщенный раствор соли; MgSO4) и затем концентрировали. Остаток хроматографировали (1:1 гексан-EtOAc) на силикагеле, получая 12 мг указанного в заголовке соединения.
Пример 27. 7-Этокси-2-метил-β-карболин
Раствор продукта примера 23 (60 мг, 0,30 ммоль) в ДМФ (3 мл) обрабатывали К2 СО3 (100 мг) и иодистым этилом (0,029 мл, 0,36 ммоль). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь распределяли в EtOAc и воде. Органический слой сушили (насыщенный раствор соли; MgSO4) и затем концентрировали. Остаток хроматографировали (1:1 гексан-EtOAc) на силикагеле, получая 20 мг 7-этокси-2-метил-β-карболина
Пример 28. 7-Бром-2-метил-β-карболин
Получали из хармана, используя тот же способ, как в примере 1.
Пример 29. Структуру смотри в таблице 1
Раствор продукта примера 23 (60 мг, 0,30 ммоль) в ДМФ (3 мл) обрабатывали К2СО3 (100 мг) и уксусным ангидридом (0,034 мл, 0,36 ммоль). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь распределяли в EtOAc и воде. Органический слой сушили (насыщенный раствор соли; MgSO4) и затем концентрировали. Остаток хроматографировали (1:1 гексан-EtOAc) на силикагеле, получая 18 мг указанного в заголовке соединения.
Пример 30. 7-Метокси-β-карболин
Получали из 5-метокситриптамина с использованием способа примера 3.
Пример 31. 8-Фтор-β-карболин
Получали из 6-фтортриптамина, используя тот же способ, как в примере 3.
Пример 32. 7-Бром-2-метил-8-метокси-β-карболин
Получали из хармана, используя тот же способ, как в примере 1.
Пример 33. 7-Гидрокси-β-карболин
Получали из продукта примера 30 с использованием способа примера 23.
Пример 34. 7-Хлор-8-фтор-β-карболин
Получали из продукта примера 31 с использованием способа примера 12.
Пример 35. 7-Метокси-1-метил-β-карболин
Получали из продукта примера 30 с использованием способа примера 11.
Пример 36. Трифторацетат 9-хлор-8-метокси-β-карболина и
Пример 37 Трифторацетат 7,9-дихлор-8-метокси-β-карболина
Раствор продукта примера 21 (195 мг, 1,0 ммоль) в 1М HCl (3 мл) обрабатывали порциями N-хлорсукцинимидом (270 мг, 2 ммоль) и полученный раствор перемешивали при температуре 60°С-70°С в течение 3 часов. Реакционную смесь упаривали и сырой продукт очищали ВЭЖХ с использованием C18-набитой колонки и градиентного элюирования (от 5:95 до 50:50) смесью вода-ацетонитрил (с 0,1% трифторуксусной кислоты). Чистые фракции каждого продукта объединяли и лиофилизовали, получая 78 мг трифторацетата 9-хлор-8-метокси-β-карболина и 51 мг трифторацетата 7,9-дихлор-8-метокси-β-карболина.
Пример 38. 7, 9-Дихлор-8-гидрокси-β-карболин
Смесь продукта примера 37 (590 мг, 2,21 ммоль) в хлористом метилене (25 мл) при 35°С обрабатывали раствором BBr3 в хлористом метилене (1М, 6 мл, 6 ммоль). После нагревания при кипении с обратным холодильником в течение 3 часов реакционную смесь гасили метанолом (5 мл) и затем концентрировали. Остаток суспендировали в 60%-ном растворе NaHCO3, продукт отфильтровывали и промывали водой, получая 500 мг 7,9-дихлор-8-гидрокси-β-карболина.
Пример 39. 7,9-Дихлор-8-этокси-β -карболин
Смесь продукта примера 38 (35 мг, 0,14 ммоль), К2СО3 (100 мг) и иодистого этила (0,014 мл, 0,17 ммоль) в ацетоне (5 мл) перемешивали в закрытой реакционной ампуле при комнатной температуре в течение 3 дней. После концентрирования реакционной смеси остаток распределяли в этилацетате и воде, органический слой сушили (MgSO4) и концентрировали, получая сырой продукт. Сырой продукт хроматографировали (5% метанола в хлороформе) на силикагеле, получая 8 мг 7,9-дихлор-8-этокси-β-карболина.
Пример 40. Трифторацетат 7-хлор-8-фтор-β-карболина
Раствор продукта примера 31 (78 мг, 0,42 ммоль) в 1М HCl (1 мл) обрабатывали порциями N-хлорсукцинимидом (115 мг, 0,9 ммоль) и полученную смесь перемешивали при 60°С-70°С в течение 3 часов. Реакционную смесь упаривали и сырой продукт очищали препаративной ВЭЖХ с использованием С18-набитой колонки и градиентного элюирования (от 5:95 до 50:50) смесью вода-ацетонитрил (с 0,1% трифторуксусной кислотой). Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 33 мг указанного в заголовке соединения.
Пример 41. 1-Гидрокси-7-трифторметил-β-карболин и
Пример 42. 7-Трифторметил-β-карболин
Раствор 3-гидрокси-2-пиперидона (96 мг, 0,83 ммоль) в хлористом метилене (5 мл) обрабатывали реагентом Десс-Мартина (Dess Martin) (352 мг, 0,85 ммоль) при комнатной температуре и полученную смесь перемешивали в течение 1 часа. После отфильтровывания солей из реакционной смеси кетон в растворе обрабатывали 4-трифторметил-фенилгидразином (145 мг, 0,83 ммоль). Через 15 минут добавляли гексан (20 мл) и гидразон собирали фильтрованием. Этот неочищенный гидразон нагревали при 95°С в муравьиной кислоте (70%, 10 мл) в течение 1 часа. Реакционную смесь упаривали и остаток хроматографировали (этилацетат) на силикагеле, получая 60 мг дигидро-1-гидрокси-7-трифторметил-β-карболина.
Порцию дигидро-1-гидрокси-7-трифторметил-β-карболина (6 мг) в ксилолах (1 мл) обрабатывали Pd/C (10%, 7 мг) и смесь нагревали при 50°С в течение одной недели. Реакционную смесь концентрировали после фильтрования через целит и остаток хроматографировали (1:1 гексан-этилацетат) на силикагеле, получая 1 мг 1-гидрокси-7-трифторметил-β-карболина.
Порцию дигидро-1-гидрокси-7-трифторметил-β-карболина (25 мг) в ТГФ (1 мл) обрабатывали раствором литийалюминийгидрида в ТГФ (1М, 0,5 мл). Реакционную смесь перемешивали при 60°С в течение 6 часов, затем гасили водой (5 мл) и экстрагировали этилацетатом (3 раза по 10 мл). Объединенные органические слои сушили (MgSO4) и концентрировали, получая тетрагидро-7-трифторметил-β-карболин. Это вещество помещали в ксилолы (5 мл) и обрабатывали Pd/C (10%, 15 мг). Смесь перемешивали при 150°С в течение 48 часов, затем фильтровали через целит и концентрировали. Остаток хроматографировали (этилацетат) на силикагеле, получая 5 мг 7-трифторметил-β -карболина.
Пример 43. Трифторацетат 7-хлор-9-(метиламино)-β-карболина
Раствор продукта примера 15 (50 мг, 0,23 ммоль) в смеси АсОН/метанол (1%, 3 мл) обрабатывали цианоборгидридом натрия (30 мг, 0,46 ммоль), после чего формальдегидом (37%, 0,017 мл, 0,23 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 36 часов и затем разбавляли насыщенным раствором NaHCO3 (9 мл). После перемешивания в течение 15 минут сырой (неочищенный) продукт отфильтровывали и промывали водой. Сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 13 мг указанного в заголовке соединения.
Пример 44. Трифторацетат 7-хлор-9-(диметиламино)-β -карболина
Раствор продукта примера 15 (50 мг, 0,23 ммоль) в смеси АсОН/метанол (1%, 3 мл) обрабатывали цианоборгидридом натрия (30 мг, 0,46 ммоль), после чего формальдегидом (37%, 0, 060 мл, 0,69 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 36 часов и затем разбавляли насыщенным раствором NaHCO3 (9 мл). После перемешивания в течение 15 минут сырой продукт отфильтровывали и промывали водой. Сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 40 мг указанного в заголовке соединения.
Пример 45. Трифторацетат 7-хлор-9-(метилсульфониламино)-β-карболина
Раствор продукта примера 15 (30 мг, 0,14 ммоль) в пиридине (0,5 мл) обрабатывали метансульфонилхлоридом (0,024 мл, 0,30 ммоль) двумя порциями в течение 30 часов. Реакционную смесь разбавляли водой (5 мл) и сырой продукт собирали и промывали водой (несколько раз). Сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 16 мг указанного в заголовке соединения.
Пример 46. Трифторацетат 7-хлор-9-(пропиониламино)-β-карболина
Раствор продукта примера 15 (30 мг, 0,14 ммоль) в пиридине (1,0 мл) обрабатывали пропионилхлоридом (0,015 мл, 0,17 ммоль). После перемешивания при комнатной температуре в течение 4 часов реакционную смесь разбавляли водой (9 мл) и насыщенным раствором NaHCO3 (1 мл). Сырой продукт собирали и промывали водой (несколько раз). Сырой продукт очищали препаративной ВЭЖХ с использованием C18-набитой колонки и градиентного элюирования (от 5:95 до 50:50) смесью вода-ацетонитрил (с 0,1% трифторуксусной кислоты). Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 21 мг указанного в заголовке соединения.
Пример 47. Трифторацетат 7-хлор-9-(бензоиламино)-β -карболина
Раствор продукта примера 15 (30 мг, 0,14 ммоль) в пиридине (1,0 мл) обрабатывали бензоилхлоридом (0,020 мл, 0,17 ммоль). После перемешивания при комнатной температуре в течение 4 часов реакционную смесь разбавляли водой (9 мл) и насыщенным раствором NaHCO3 (1 мл). Сырой продукт собирали и промывали водой (несколько раз). Сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 12 мг трифторацетата 7-хлор-9-(бензоиламино)-β-карболина.
Пример 48. Трифторацетат 7-хлор-9-(ацетилметиламино)-β-карболина
Раствор продукта примера 43 (19 мг, 0,082 ммоль) в пиридине (0,40 мл) обрабатывали уксусным ангидридом (0,037 мл, 0,36 ммоль) двумя порциями в течение 48 часов. Реакционную смесь впоследствии концентрировали досуха и остаток совместно упаривали с АсОН при пониженном давлении. Сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 9 мг указанного в заголовке соединения.
Пример 49. Трифторацетат 7-хлор-9-(фторбензоиламино)-β-карболина
Раствор продукта примера 15 (30 мг, 0,14 ммоль) в пиридине (1,0 мл) обрабатывали 4-фторбензоилхлоридом (0,018 мл, 0,17 ммоль). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь разбавляли водой (10 мл). Сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 13 мг указанного в заголовке соединения.
Пример 50.
Охлажденный (от 3°С до 5°С) раствор продукта примера 15 (30 мг, 0,14 ммоль) и пиридина (0,014 мл, 0,17 ммоль) в ТГФ (0,7 мл) обрабатывали фенилхлорформиатом (0,018 мл, 0,145 ммоль). После перемешивания при комнатной температуре в течение 2 часов реакционную смесь распределяли в этилацетате и буфере (рН 7.2). Органический слой сушили (насыщенный раствор соли, Na2SO4) и концентрировали, получая 43 мг фенилкарбамата. К раствору фенилкарбамата (30 мг, 0,089 ммоль) в ДМСО (0,5 мл) добавляли 2-метоксиэтиламин (0,010 мл, 0/10 ммоль). После перемешивания при комнатной температуре в течение 30 минут сырую реакционную смесь очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 21 мг указанного в заголовке соединения.
Пример 51. Трифторацетат 7-хлор-9-(метоксиацетиламино)-β-карболина
Раствор продукта примера 15 (35 мг, 0,16 ммоль) в пиридине (1,0 мл) обрабатывали метоксиацетилхлоридом (0,016 мл, 0,18 ммоль). После перемешивания при комнатной температуре в течение 2 часов реакционную смесь разбавляли водой (10 мл). Сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 32 мг указанного в заголовке соединения.
Пример 52. Трифторацетат 7-хлор-9-β-метокси-бензоксиламино)-β-карболина
Раствор продукта примера 15 (30 мг, 0,14 ммоль) в пиридине (1,0 мл) обрабатывали м-анизоилхлоридом (0,027 мл, 0,19 ммоль) двумя порциями в течение 6 часов. Реакционную смесь впоследствии разбавляли водой (10 мл) и сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 33 мг указанного в заголовке соединения.
Пример 53. Трифторацетат 7-хлор-9-(4-метокси-бензоксиламино)-β-карболина
Раствор продукта примера 15 (30 мг, 0,14 ммоль) в пиридине (1,0 мл) обрабатывали п-анизоилхлоридом (37 мг, 0,22 ммоль) двумя порциями в течение 24 часов. Реакционную смесь впоследствии разбавляли водой (10 мл) и сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 24 мг указанного в заголовке соединения.
Пример 54. Трифторацетат 7-хлор-9-(метилкарбамиламино)-β-карболина
Раствор продукта примера 15 (30 мг, 0,14 ммоль) в пиридине (1,0 мл) обрабатывали п-анизоилхлоридом (0,017 мл, 0,21 ммоль) двумя порциями в течение 4 часов. Реакционную смесь впоследствии разбавляли водой (10 мл) и сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 35 мг указанного в заголовке соединения.
Пример 55. Трифторацетат 7-хлор-9-(изовалериламино)-β-карболина
Раствор продукта примера 15 (35 мг, 0,16 ммоль) в пиридине (1,0 мл) обрабатывали изовалерилхлоридом (0,033 мл, 0,28 ммоль) двумя порциями в течение 24 часов. Реакционную смесь впоследствии разбавляли водой (10 мл) и сырой продукт очищали, как описано в примере 46. Чистые фракции, содержащие продукт, объединяли и лиофилизовали, получая 52 мг указанного в заголовке соединения.
Пример 60. N-(6-Хлор-9Н-β-карболин-8-ил)никотинамид
К раствору норхармана (2,0 г, 11,9 ммоль) в воде (89 мл) и 1М водной HCl (29,8 мл, 29,8 ммоль) добавляли порциями N-хлорсукцинимид (3,17 г, 23,8 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 6 часов и затем при 0°С-5°С в течение 12 часов. Реакционную смесь разбавляли водой (100 мл) и осторожно подщелачивали твердым К2СО3 (4,3 г). После перемешивания при комнатной температуре в течение 1 часа продукт собирали и промывали водой. Сырой продукт нагревали при кипении с обратным холодильником в хлороформе в течение 1 часа и фильтровали после охлаждения до 15°С, получая 2,05 г 7-хлор-β-карболина.
Смесь 7-хлор-β-карболина (500 мг, 2,48 ммоль) в концентрированной азотной кислоте (20 мл) перемешивали при комнатной температуре в течение 22 часов. Реакционную смесь осторожно выливали в холодную (3°С-5°С) воду (50 мл) и после перемешивания в течение 2 часов собирали осадок. Твердое вещество суспендировали в насыщенном водном растворе NaHCO3(50 мл) и перемешивали при комнатной температуре в течение 12 часов. Продукт отфильтровывали и промывали водой, получая 550 мг 7-хлор-9-нитро-β-карболина.
К суспензии 7-хлор-9-нитро-β-карболина (548 мг, 2,22 ммоль) в EtOH (14 мл) при 65°С-70°С добавляли дигидрат хлорида олова (2,5 г, 11,1 ммоль). После этого добавляли по каплям 6М водную HCl (14 мл). Смесь перемешивали при 70°С-80°С в течение 3,5 часов и затем медленно распределяли в насыщенном водном растворе NaHCO3 (150 мл) и EtOAc (100 мл). Водную фазу экстрагировали (2 раза) и объединенные органические растворы сушили (насыщенный раствор соли; Na2SO4) и концентрировали, получая 484 мг 9-амино-7-хлор-β-карболина.
К охлажденному (3°С-5°С) раствору 9-амино-7-хлор-β-карболина (2,75 г, 12,7 ммоль) в пиридине (150 мл) добавляли гидрохлорид никотиноилхлорида (2,82 г, 15,8 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 20 часов перед разбавлением реакционной смеси водой (100 мл) и 1М NaOH (25 мл). После перемешивания в течение 1 часа при комнатной температуре реакционную смесь выливали в воду (200 мл). Смесь оставляли на 1 час и продукт отфильтровывали, получая 3,80 г указанного в заголовке соединения после промывки водой и сушки при пониженном давлении при комнатной температуре.
Пример 68. N-(6-Хлор-7-метокси-9Н-β-карболин-8-ил)-никотинамид
Смесь 6-метокситриптамина (9,10 г, 47,8 ммоль) в EtOAc (40 мл) и NaOAc буфере с рН 4, 5 (40 мл) обрабатывали гидратом глиоксалевой кислоты (5,30 г, 57,6 ммоль). Смесь интенсивно перемешивали в течение 2 дней и затем разбавляли гексаном (40 мл). Продукт отфильтровывали и промывали водой и смесью (1:1) гексан-этилацетат. Сырой продукт кристаллизовали из метанола после фильтрования горячего метанольного раствора.
Полученный выше неочищенный продукт (11,5 г) в 6н. HCl (100 мл) обрабатывали 3 раза концентрированной HCl (5,0 мл) каждые 15 минут при кипении с обратным холодильником. После нагревания при кипении с обратным холодильником в целом в течение 1 часа реакционную смесь концентрировали, получая остаток. Этот остаток суспендировали и обрабатывали ультразвуком вместе с 10%-ным раствором Na2СО3 (300 мл) и фильтровали, получая свободный амин (7,20 г). Вышеуказанный амин нагревали при кипении с обратным холодильником в ксилолах (200 мл) и пиридине (100 мл) с 10%Pd/C (3 г) в течение 5 часов. Горячую реакционную смесь фильтровали через целит и фильтрат концентрировали, получая 6,38 г 8-метокси-β-карболина.
К смеси 8-метокси-β-карболина (1,0 г, 5 ммоль) в ТГФ (100 мл) добавляли N-хлорсукцинимид (0,70 г, 5,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, затем концентрировали и промывали остаток смесью 1:1:1 10% Na2СО3 , гексан и EtOAc (400 мл). Полученный остаток растирали с ксилолами, получая 677 мг 7-хлор-8-метокси-β-карболина.
Раствор 7-хлор-8-метокси-β-карболина (677 мг, 2,9 ммоль) в трифторуксусной кислоте (10 мл) обрабатывали NaNO3 (260 мг, 3,06 ммоль). Реакционную смесь перемешивали в течение 3 часов при комнатной температуре и затем концентрировали. Сырой продукт хроматографировали на силикагеле, градиентно элюируя от 5% до 10% метанола в хлороформе, получая 463 мг 7-хлор-8-метокси-9-нитро-β-карболина.
Раствор 7-хлор-8-метокси-9-нитро-β-карболина (460 мг, 1,66 ммоль) в EtOH(25 мл) обрабатывали SnCl2-2H2O (450 мг, 2,00 ммоль). Реакционную смесь перемешивали в течение 5 часов при 60°С и затем концентрировали. Сырой продукт хроматографировали на силикагеле, градиентно элюируя от 5% до 10% метанола в хлороформе, получая 410 мг 7-хлор-8-метокси-9-нитро-β -карболина.
Раствор 7-хлор-8-метокси-9-нитро-β-карболина (21 мг, 0,085 ммоль) в пиридине (1 мл) обрабатывали гидрохлоридом никотинилхлорида (54 мг, 0,30 ммоль) и 4-диметиламинопиридином (5 мг). После перемешивания при 95°С-100°С в течение 7 часов реакционную смесь концентрировали, остаток суспендировали с 10%-ным Na2СО3 и затем хроматографировали на диоксиде кремния, градиентно элюируя от 5% до 10% метанола в хлороформе, получая 4,7 мг указанного в заголовке соединения.
Пример 82. N-(6-Хлор-9Н-β -карболин-8-ил)-3,4-дифторбензамид К охлажденному (3°С-5°С) раствору 9-амино-7-хлор-β-карболина (2,50 г, 11,5 ммоль, полученного выше в примере 60) в пиридине (130 мл) добавляли 3, 4-дифторбензоилхлорид (1,67 мл, 13,25 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 20 часов перед разбавлением реакционной смеси водой (60 мл) и 1М NaOH (15 мл). После перемешивания в течение 3 часов при комнатной температуре рН смеси доводили до 8-9 1М HCl и затем выливали в воду (250 мл). Смесь оставляли на 30 минут и продукт отфильтровывали, получая 3,95 г указанного в заголовке соединения после промывания водой и сушки при пониженном давлении при 55°С-60°С.
Пример 83. 6-Хлор-N-(6-хлор-9Н-β -карболин-8-ил)никотинамид
К охлажденному (3°С-5°С) раствору 9-амино-7-хлор-β-карболина (1,40 г, 6,45 ммоль, полученного выше в примере 60) в пиридине (72 мл) добавляли 6-хлор-никотинилхлорид (1,30 г, 7,42 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 16 часов перед разбавлением реакционной смеси водой (60 мл) и 1М NaOH (8 мл). После перемешивания в течение 40 минут при комнатной температуре смесь выливали в воду (200 мл). Смесь оставляли на 30 минут и продукт отфильтровывали, получая 2,20 г указанного в заголовке соединения после промывки водой и сушки при пониженном давлении при комнатной температуре.
На примерах в таблице 1 показаны структуры полученных соединений, которые были получены в соответствии с предшествующими примерами.
Фармакологические примеры
lkB-киназа ELISA (твердофазный иммуноферментный анализ)
В анализе in vitro для обнаружения и измерения ингибирующей активности предполагаемых фармакологических агентов по отношению к lkBα -киназному комплексу используют биотинилированное полипептидное связывание как Ser32, так и Ser36 в lkBα и специфическое связывание антитела только с фосфорилированной формой полипептида, который является либо моноклональным, либо поликлональным (такой как коммерчески доступные антитела к анти-фосфо-серин32 lkBα от New England Biolabs, Beverly, MA, США, № по каталогу 9240). После образования комплекса антитело-фосфо-полипептид, комплекс может быть обнаружен с помощью множества аналитических методов с использованием радиоактивности, люминесценции, флюоресценции или оптического поглощения. Для применения метода ELISA комплекс может быть иммобилизован либо на биотин-связывающем планшете (таком как планшет, покрытый нейтравидином (Neutravidin), и обнаружен с помощью вторичного антитела, конъюгированного с пероксидазой хрена (HRP), либо на антитело-связывающем планшете (таком как планшет, покрытый Протеином-А) и обнаружен с помощью биотин-связывающего белка, конъюгированного с пероксидазой хрена (такой как стрептавидин-HRP). Уровень активности можно коррелировать по стандартной кривой с использованием синтетических полипептидов, соответствующих полипептиду субстрата.
Экспериментальная часть
lkBα-киназный комплекс получали первоначальным разведением 10 мл S100 фракции клеточных экстрактов HeLa S3 40 мл 50 мМ HEPES с рН 7,5. Затем добавляли 40% сульфат аммония и инкубировали на льду в течение 30 минут. Выпавший осадок после центрифугирования повторно растворяли в 5 мл SEC буфера (50 мМ HEPES с рН 7,5, 1 мМ DTT, 0,5 мМ EDTA, 10 мМ 2-глицерофосфата), очищали центрифугированием при 20000g в течение 15 минут и фильтрованием через фильтрующее устройство 0,22 мкм. Образец загружали в колонку Superose-6. FPLC емкостью 320 мл (Amersham Pharmacia Biotech АВ, Uppsala, Швеция), уравновешенную SEC буфером и функционирующую при скорости потока 2 мл/мин при 4°С. Фракции, связывающие маркер с молекулярной массой 670 кДа, объединяли для активации. Затем киназа-содержащий пул активировали посредством инкубации с 100 нМ МЕКК1Δ, 250 мкМ MgАТФ, 10 мМ MgCl2, 5 мМ DTT, 10 мМ 2-глицерофосфата, 2,5 мкМ Microcystin-LR в течение 45 минут при 37°С. Активированный фермент хранили при -80°С до последующего применения. В лунках 96-луночного планшета соединения в различных концентрациях в 2 мкл ДМСО предварительно инкубировали в течение 30 минут при 25°С с 43 мкл активированного фермента, разведенного [1:25] буфером для анализа (50 мМ HEPES с рН 7,5, 5 мМ DTT, 10 мМ MgCl2, 10 мМ 2-глицерофосфата, 2,5 мкМ Microcystin-LR). Пять микролитров пептидного субстрата (биотин-(СН2)6-DRHDSGLDSMKD-CONH2) в 200 мкМ исходного раствора добавляли в каждую лунку и инкубировали в течение 1 часа перед блокированием 150 мкл 50 мМ НЕРЕ5 с рН 7,5, 0,1% БСА, 50 мМ EDTA плюс [1:200] антитело. Блокированные образцы киназной реакции и фосфопептидные калибровочные стандарты (биотин-(CH2)6-DRHDS [РО3] GLDSMKD-CONH2, серийно разведенные в буфере для анализа) из расчета 100 мкл на лунку переносили на Протеин-А планшет (Pierce Chemical Co., Rockford, IL, США) и инкубировали в течение 2 часов при встряхивании. После 3 промывок PBS (забуференным фосфатом физиологическим раствором) добавляли на 30 минут 100 мкл 0,5 мкг/мл стрептавидина, конъюгированного с HRP (пероксидаза хрена), разведенного 50 мМ HEPES/0,1% БСА. После 5 промывок PBS добавляли 100 мкл ТМВ субстрата (Kirkegaard & Perry Laboratories, Gaithersburg, MD, США) и развитие окрашивания останавливали добавлением 100 мкл 0,18М H2SO4. Сигналы поглощения регистрировали при 450 нм. Стандарты калибровочной кривой приспосабливали путем линейной регрессии с использованием 4-параметрового уравнения доза-ответная реакция. На основе данной стандартной кривой рассчитывали уровни киназной активности для определения ингибирующей активности предполагаемых фармакологических агентов.
Результаты представлены далее в таблице 2.
Соединение примера 121 продемонстрировало IC50, равное 1,7.
Мышиная гетеротопная модель сердечного трансплантата
В мышиной гетеротопной модели сердечного трансплантата через барьеры полной гистосовместимости (BALB/c->C57BL/6 или В6/129) долговечность трансплантата обычно ограничена 7,3±0,4 дня (среднее значение ± стандартная девиация, n0 аллотрансплантат) (смотри, например в Hancock WW, Sayegh MH, Zheng XG, Peach R, Linsley PS, Turka LA. Costimulatory function and expression of CD40-ligand, CD80 and CD86 or in vascularized murine cardiac allograft rejection (Co-стимуляторная функция и экспрессия СD40-лиганда, CD80 и CD86 или в сосудистой реакции отторжения сердечного аллотрансплантата у мышей). Proc. Natl.Acad. Sci (USA), 93, 1996, 13967-13972; и Hancock W.W., Buelow R., Sayegh MH, Turka LA. Antibody-induced transplant arterosclerosis is prevented by graft expression of anti-oxidant and anti-apoptotic genes (Предотвращение антитело-индуцированного атеросклероза трансплантата путем экспрессии трансплантатом антиоксидантных и антиапоптозных генов). Nature Med., 4, 1998, 1392-1396).
На указанной животной модели исследовали влияние перорального введения соединений по примерам 49 и 60 с использованием 25 мг/кг/день в течение 14 дней начиная с момента трансплантации.
Несмотря на то что трансплантаты у животных, получавших только носитель - метилцеллюлозу, отторгались в течение 7 дней (6,7±0,8), трансплантаты у мышей, получавших соединение 49, сохранялись 15 дней (15,3±0,6), а трансплантаты у животных, которым давали соединение 60, сохранялись в течение 20 дней (20±1). Используемая в настоящее время при трансплантации иммуносупрессорная терапия имеет ограниченную эффективность и/или существенную токсичность. Целевое действие на lkB-киназу данных агентов значительно увеличивает продолжительность сохранения аллотрансплантата в отсутствие связанной с этим токсичности.
Реферат
Изобретение относится к производным карболина общей формулы I
где R3-H, -OH, -O-(С1-С6)-алкил, R4-N(R17)2, где R17-H, -(С1 -С6)-алкил, -С(O)-фенил, -С(O)-(С1-С10)-алкил, -С(O)-O-(С1-С6)-алкил, -S(O)y-R14, где у=0, 1 или 2, R14 -(С1-С6)-алкил, фенил, замещенный галогеном, или R4-NH2, -NH-C(O)-R15, где R15 - пирролидин, пиразолидин, фуран, пиридин, пиразин, имидазолин, изоксазолидин, 2-изоксазолин, тиофен, возможно замещенный CF3 или -(С1-С6)-алкилом; -(С3-С7)-циклоалкил, -N((R13)2, где R13-H или фенил при условии, что N(R13)2 не означает NH2; фенил, возможно замещенный -(С1-С6)-алкилом, -CF3, или два заместителя у фенила образуют диоксолановое кольцо, R5-H, или R4 и R5 вместе с атомом N образуют гетероцикл. Описан способ их получения. Соединения формулы I являются подходящими для получения лекарственных средств для профилактики и лечения заболеваний, в процесс развития которых вовлечена повышенная активность lkB. 2 н. и 4 з.п.ф-лы, 2 табл.
Формула

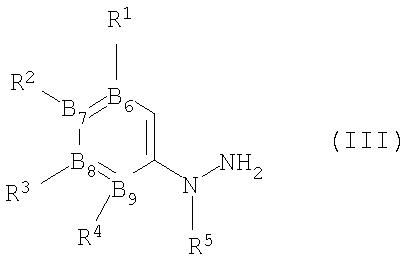
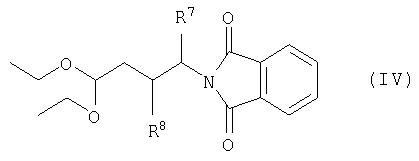
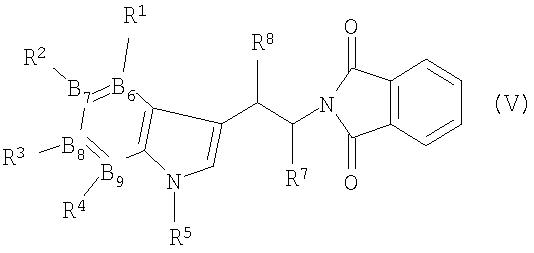

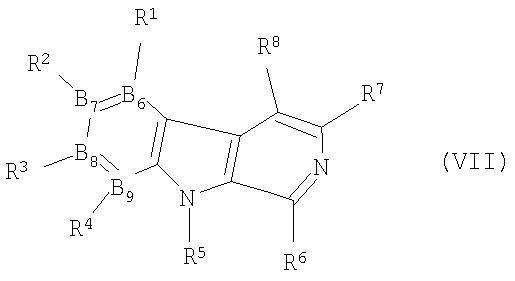
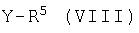
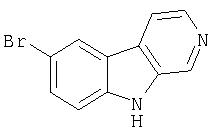

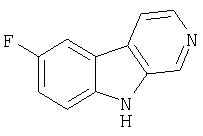
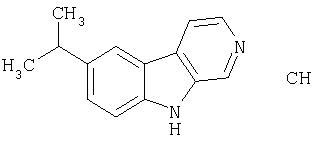
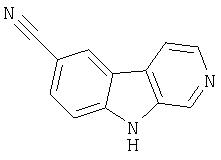
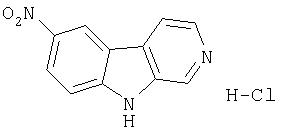
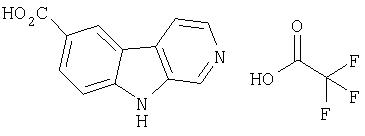
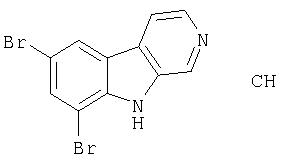
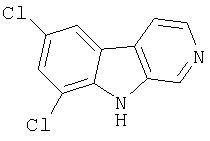
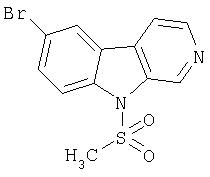
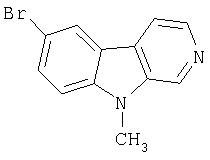
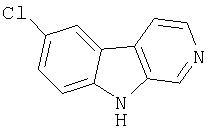
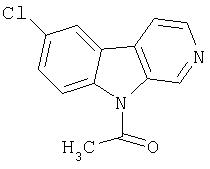
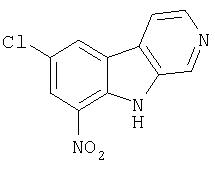
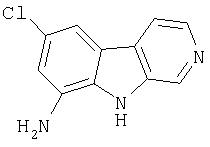
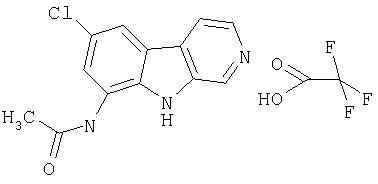
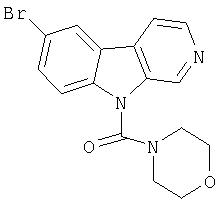
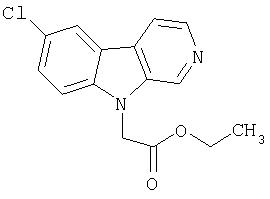
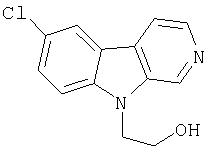
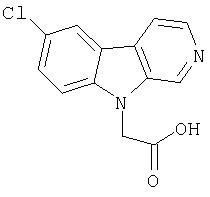

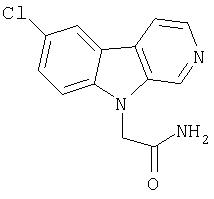
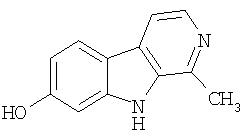
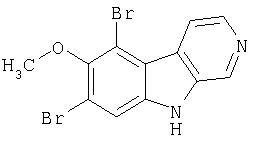

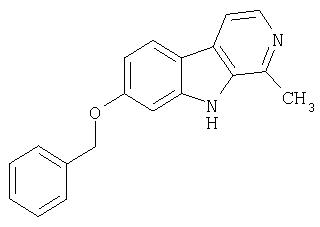
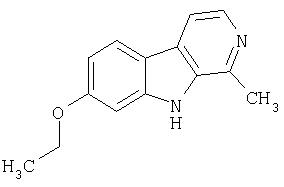

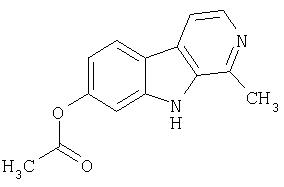
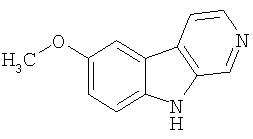
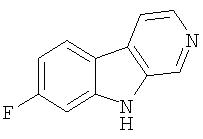
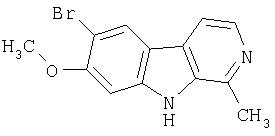
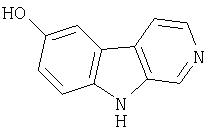
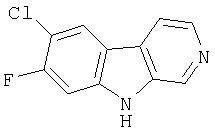
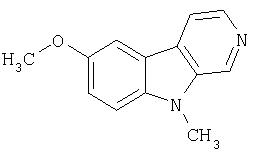
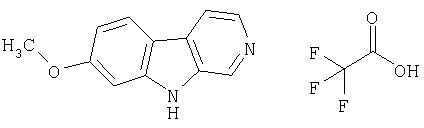
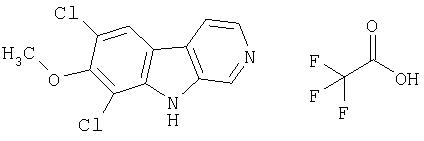
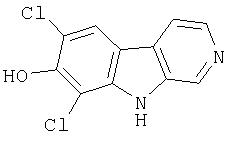
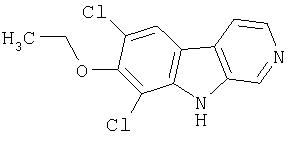
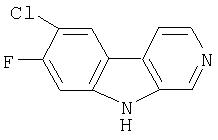
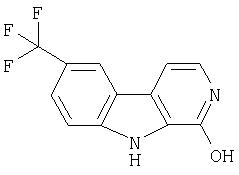
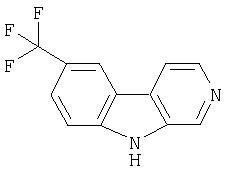
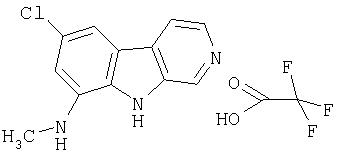
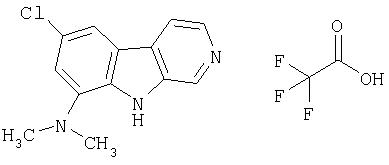
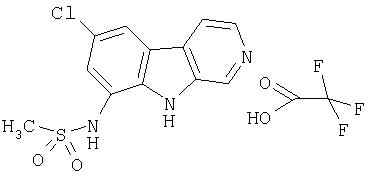
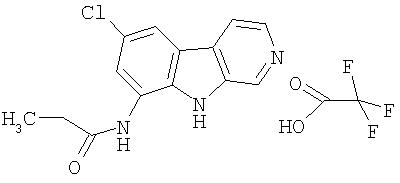
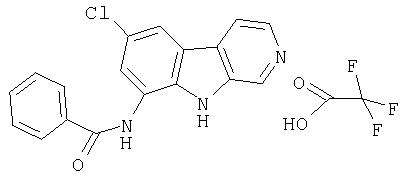
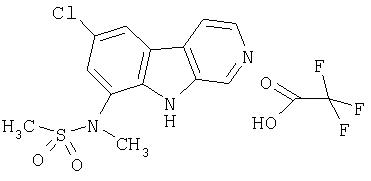
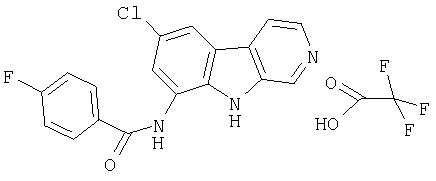
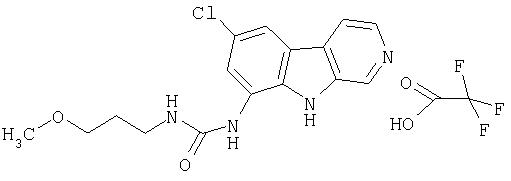
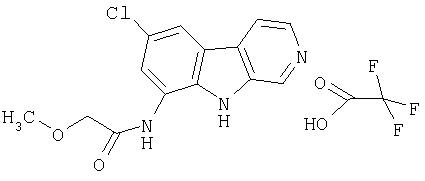
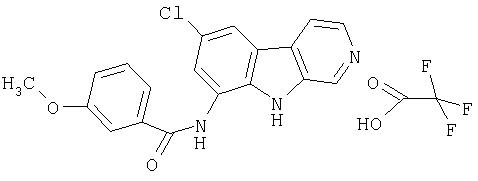
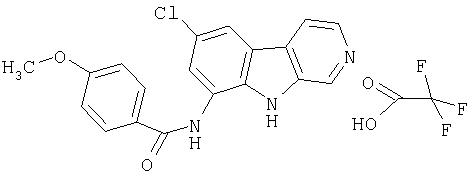

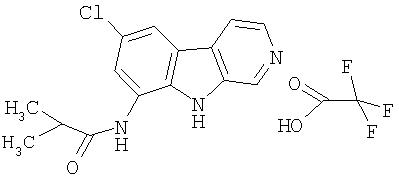

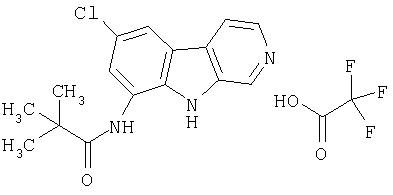
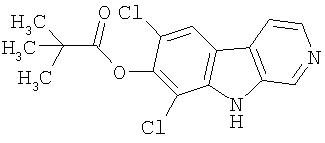
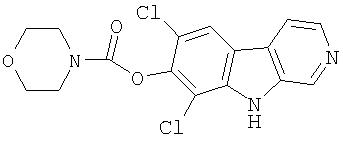
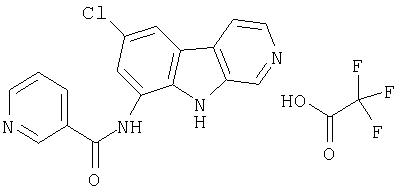
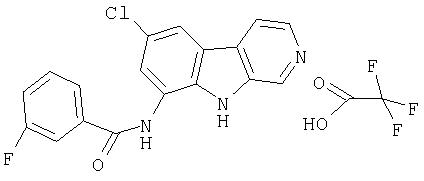
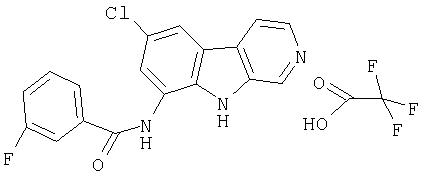
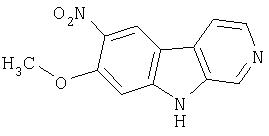


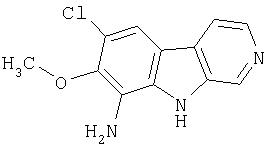
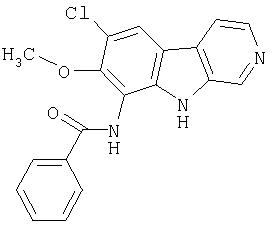
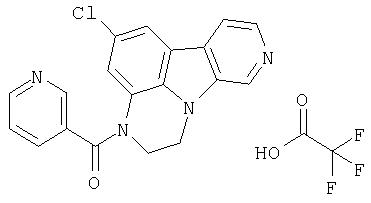
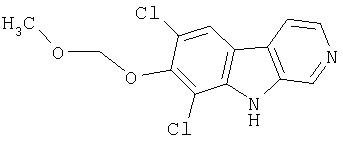
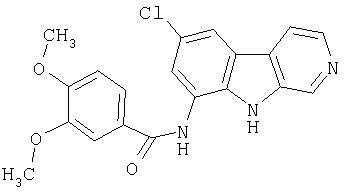
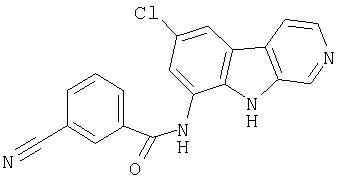
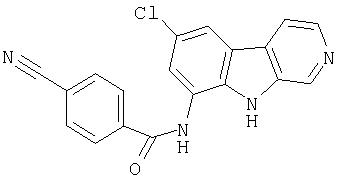


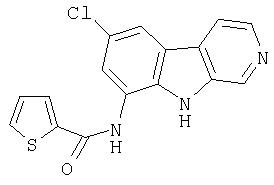

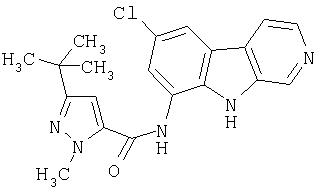
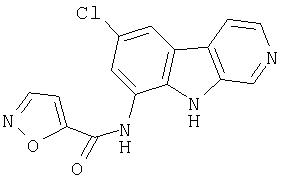
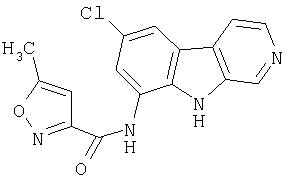

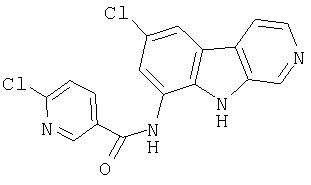
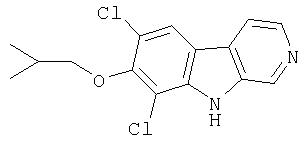
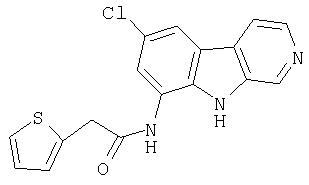
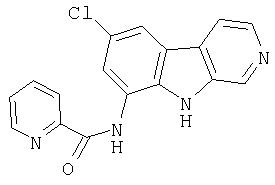
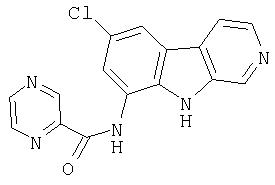

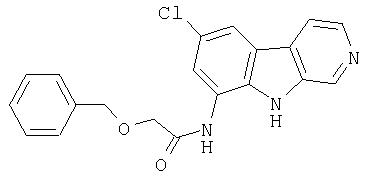
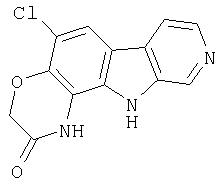
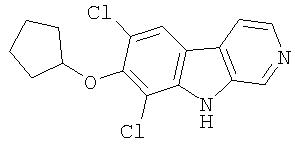
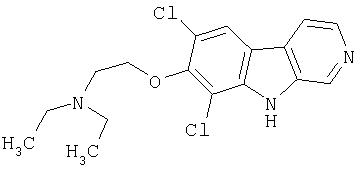

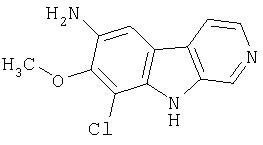
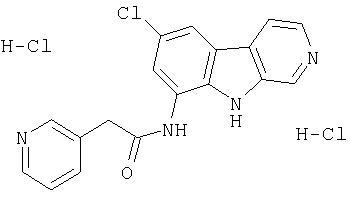
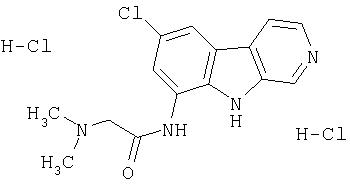

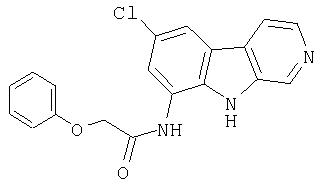

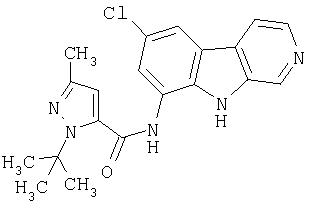
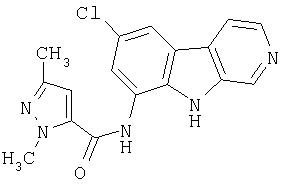
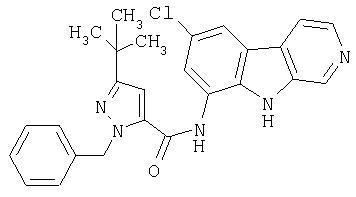
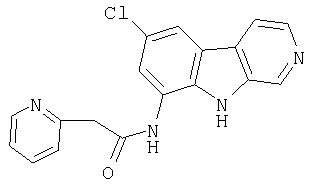
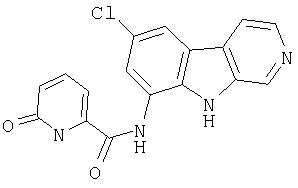
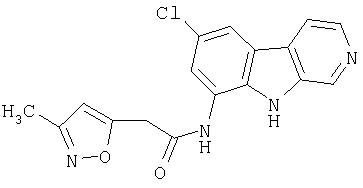
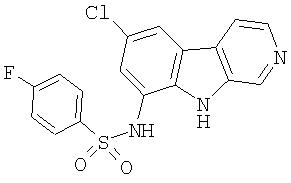
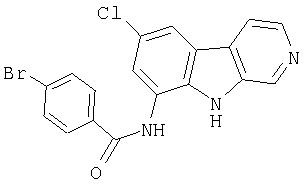
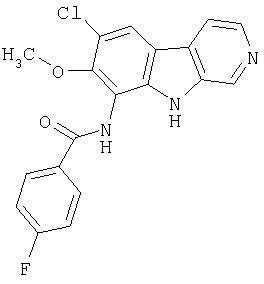
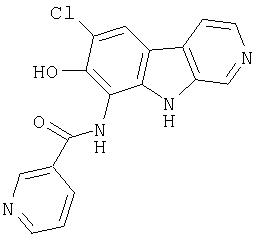


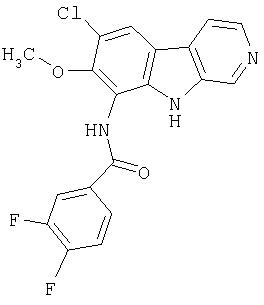
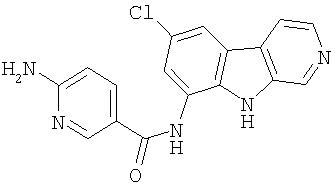

Комментарии