Бициклические соединения для диагностики и лечения - RU2766139C2
Код документа: RU2766139C2
Описание
Область техники
Данное изобретение относится к новым соединениям, которые могут быть использованы для диагностики, отслеживания развития заболевания или отслеживания активности лекарственных средств, группы расстройств или аномалий, связанных с агрегатами альфа-синуклеина (α-синуклеин, A-синуклеин, aСинуклеин, A-syn, α-syn, aSyn), включающими, но не ограниченными ими, тельца Леви и/или Нейриты Леви, таких как болезнь Паркинсона. Соединения согласно настоящему изобретению особенно полезны для определения предрасположенности к такому расстройству, отслеживания остаточного расстройства или прогнозирования реакции пациента, который страдает таким заболеванием, на лечение определенным лекарственным средством. Заявленные соединения также могут применяться для лечения, облегчения или профилактики расстройства или аномалии, связанных с агрегатами альфа-синуклеина.
Уровень техники
Многие возрастные заболевания основаны или связаны с внеклеточными или внутриклеточными отложениями амилоидных или амилоидоподобных белков, которые способствуют патогенезу, а также развитию заболевания. Наиболее охарактеризованным амилоидным белком, который образует внеклеточные агрегаты, является амилоид бета (Aβ).
Амилоидоподобные белки, которые образуют в основном внутриклеточные агрегаты, включают, но не ограничены ими, тау, альфа-синуклеин и хантингтин (htt). Болезни включают, включающие агрегаты альфа-синуклеина, обычно называют синуклеинопатиями (или α-синуклеинопатиями) и включают, но не ограничены ими, болезнь Паркинсона (БП). Синуклеинопатии включают болезнь Паркинсона (спорадическую, семейную с альфа-синуклеиновыми мутациями, семейную с мутациями, отличными от мутаций альфа-синуклеина, истинную вегетативную недостаточность и дисфагию телец Леви), слабоумие с тельцами Леви (ʺчистоеʺ слабоумие с тельцами Леви), спорадическую болезнь Альцгеймера, семейную болезнь Альцгеймера с мутациями APP, семейную болезнь Альцгеймера с PS-1, PS-2 или другими мутациями, семейную британскую деменцию, вариант с тельцами Леви болезни Альцгеймера и обычным старением (синдром Дауна). Синуклеинопатии с нейронными и глиальными агрегатами альфа-синуклеина включают множественную системную атрофию (синдром Шая-Дрейджера, стрианигральную дегенерацию и оливопонтоцеребеллярную атрофию). Другие заболевания, которые могут иметь альфа-синуклеин-иммунореактивные очаги, включают травматическое повреждение мозга, хроническую травматическую энцефалопатию, таупатии (болезнь Пика, лобно-височную деменцию, прогрессирующий надъядерный паралич, кортико-базальную дегенерацию и болезнь Ниманна-Пика типа C1), болезнь двигательного нейрона, амиотрофический боковой склероз (спорадический, семейный и комплекс Гуама ALS-деменция), нейроаксональную дистрофию, нейродегенерацию с аккумуляцией железа в мозге 1 типа (синдром Галлервордена-Шпатца), прионные болезни, атаксию-телеангиэктазию, синдром Мейжа, подострый склерозирующий панэнцефалит, болезнь Гоше, а также другие лизосомные болезни накопления (включая синдром Куфора-Ракеба и синдром Санфилиппо) и расстройство поведения в фазе сна с быстрыми движениями глаз (БДГ) (Jellinger, Mov Disord 2003, 18 Suppl. 6, S2-12; Galvin et al. JAMA Neurology 2001, 58 (2), 186-190; Kovari et al., Acta Neuropathol. 2007, 114(3), 295-8; Saito et al., J Neuropathol Exp Neurol. 2004, 63(4), 323-328; McKee et al., Brain, 2013, 136(Pt 1), 43-64; Puschmann et al., Parkinsonism Relat Disord 2012, 18S1, S24-S27; Usenovic et al., J Neurosci. 2012, 32(12), 4240-4246; Winder-Rhodes et al., Mov Disord. 2012, 27(2), 312-315; Ferman et al., J Int Neuropsychol Soc. 2002, 8(7), 907-914).
Альфа-синуклеин является 140-аминокислотным нативно развернутым белком (Iwai et al., Biochemistry 1995, 34(32), 10139-10145). Последовательность альфа-синуклеина может быть поделена на три основных домена: 1) N-концевая область, содержащая остатки 1-60, которая содержит 11-мерные амфипатические несовершенные повторяющиеся остатки с высококонсервативным гексамером (KTKEGV). Эта область вовлечена в регулирование связывания альфа-синуклеина с мембранами и его интернализацию; 2) домен со спиральными остатками 61-95 с гидрофобными не бета-амилоидными компонентами (NAC); который необходим для фибриллизации альфа-синуклеина; и 3) спиральные остатки 96-140 C-концевой области, которые являются высококислотными и насыщены пролином, не имеют явной структурной предрасположенности. Было показано, что альфа-синуклеин проходит несколько пост-трансляционных модификаций, включая укорочения, фосфорилирование, убихитинилирование, окисление и/или ковалентное поперечное сшивание трансглутаминазы (Fujiwara et al., Nat Cell Biol 2002, 4(2); 160-164; Hasegawa et al., J Biol Chem 2002, 277(50), 49071-49076; Li et al., Proc Natl Acad Sci U S A 2005, 102(6), 2162-2167; Oueslati et al, Prog Brain Res 2010, 183, 115-145; Schmid et al., J Biol Chem 2009, 284(19), 13128-13142). Интересно, что большинство этих модификаций включают остатки в C-концевой области.
Несколько мест фосфорилирования было определено в карбоксил-концевой области Tyr-125, -133 и -136, и на Ser-129 (Negro et al., FASEB J 2002, 16(2), 210-212). Остатки Tyr-125 могут быть фосфорилированы двумя тирозинкиназами белка семейства Src, c-Src и Fyn (Ellis et al., J Biol Chem 2001, 276(6), 3879-3884; Nakamura et al., Biochem Biophys Res Commun 2001, 280(4), 1085-1092). Фосфорилирование киназами семейства Src не подавляет и не усиливает тенденцию к полимеризации альфа-синуклеина. Оказалось, что альфа-синуклеин является прекрасным субстратом для белковой тирозинкиназы p72syk (Syk) in vitro; как только он в больших количествах Tyr-фосфорилирован Syk или тирозинкиназами с похожей специфичностью, он теряет способность образовывать олигомеры, что позволяет предположить гипотетическую анти-нейродегенеративную роль этих тирозинкиназ (Negro et al., FASEB J 2002, 16(2), 210-212). Альфа-синуклеин может быть Ser-фосфорилирован протеинкиназами CKI и CKII (Okochi et al., J Biol Chem 2000, 275(1), 390-397). Остаток Ser-129 также фосфорилирован протеинкиназами G-белок сопряженного рецептора (Pronin et al., J Biol Chem 2000, 275(34), 26515-26522). Значительное и селективное фосфорилирование альфа-синуклеина на Ser-129 очевидно в очагах синуклеинопатии, включая тельца Леви (Fujiwara et al., Nat Cell Biol 2002, 4(2); 160-164). Другие пост-трансляционные модификации в карбоксильном окончании, включая гликозилирование на Ser-129 (McLean et al., Neurosci Lett 2002, 323(3), 219-223) и нитрование на Tyr-125, -133 и -136 (Takahashi et al., Brain Res 2002, 938(1-2), 73-80), могут влиять на агрегацию альфа-синуклеина. Было показано, что укорочение карбоксил-концевой области протеолизом играет роль в фибриллогенезе альфа-синуклеина при различных нейродегенеративных заболеваниях (Rochet et al., Biochemistry 2000, 39(35), 10619-10626). Полноцепные, а также частично укороченные и нерастворимые агрегаты альфа-синуклеина определены в высокоочищенных тельцах Леви (Crowther et al., FEBS Lett 1998, 436(3), 309-312).
Аномальная агрегация белка является общей характеристикой при старении мозга и в нескольких нейродегенеративных заболеваниях, хотя четкая роль в болезненных процессах остается не определена. В моделях in vitro, альфа-синуклеин (или некоторые его структурные формы) легко собираются в волокна, подобные тем, которые выделяют из мозга пациентов с LB деменцией и семейной БП (Crowther et al., FEBS Lett 1998, 436(3), 309-312). Альфа-синуклеин и его мутированные формы (A53T и A30P) имеют неупорядоченную конформацию и не образуют значительные вторичные структуры в водном растворе при низких концентрациях; однако, при высоких концентрациях они подвержены самоагрегации, образуя амилоидные фибриллы (Wood et al., J Biol Chem 1999, 274(28), 19509-19512). Некоторые различия в агрегационном поведении БП-связанных мутантов и дикого белка были задокументированы. Мономерные альфа-синуклеиновые агрегаты in vitro образуют стабильные фибриллы через метастабильное олигомерное (т.е. протофибрильное) состояние (Volles et al., Biochemistry 2002, 41(14), 4595-4602).
Болезнь Паркинсона (БП) является наиболее частным нейродегенеративным двигательным расстройством. БП является в основном идиопатическим заболеванием, хотя у, по меньшей мере, 5% пациентов с БП патология связана с мутациями в одном или нескольких специфических генах (Lesage et al., Hum. Mol. Genet., 2009, 18, R48-59). Патогенез БП остается неясным, однако растущее число фактов позволяет предположить роль патогенного сворачивания альфа-синуклеинового белка, которое приводит к образованию амилоидоподобных фибрилл. Более того, характерными признаками БП являются присутствие внутриклеточных альфа-синуклеиновых агрегированных структур, называемых тельца Леви, в нейронах черного вещества, а также смерть допаминергических нейронов в черном веществе и других местах. Альфа-синуклеин является природно развернутым пресинаптическим белком, который может неправильно сворачиваться и агрегироваться в большие олигомерные и фибриллярные формы, которые связаны с патогенезом БП. Недавние исследования имеют отношение к небольшим растворимым олигомерным и протофибриллярным формам альфа-синуклеина в большинстве нейротоксичных видах (Lashuel et al., J. Mol. Biol., 2002, 322, 1089-102), однако точная роль альфа-синуклеина в токсичности нейронной клетки остается неясной (обзор: Cookson, Annu. Rev. Biochem., 2005, 74, 29-52).
Диагностика болезни Паркинсона в основном клиническая и зависит от присутствия определенного набора симптомов и признаков (исходной ключевой особенностью является брадикинезия, ригидность, дрожание в состоянии покоя и постуральная неустойчивость), отсутствие атипичных признаков, медленно прогрессирующего курса и реакции на лекарственную терапию. Диагностика требует клинических навыков, но допускает степень субъективности и ошибку, так как несколько других дегенеративных и не дегенеративных заболеваний могут имитировать БП (МСА, прогрессирующий надъядерный паралич (ПНП), БА, эссенциальное дрожание, дистоническое дрожание), (Guideline No. 113: Diagnosis and pharmacological management of Parkinson Disease, January 2010. SIGN). Финальное подтверждение диагноза проводится при посмертном нейропатологическом анализе.
Компьютерная томография (КТ) и обычная магнитно-резонансная томография (МРТ) мозга людей с БП обычно выглядит нормальной. Эти методики, тем не менее, применяют для исключения других заболеваний, которые могут быть вторичными причинами паркинсонизма, таких как опухоли базального ядра, сосудистая патология и гидроцефалия. Определенная методика МРТ, диффузионная МРТ, была описана как полезная при распознавании типового и атипичного паркинсонизма, хотя ее точная диагностическая ценность все еще исследуется. Допаминергическая функция базального ядра может быть измерена различными радиоактивными метками ПЭТ и ОФЭКТ. Примеры включают иофлупан (123I) (торговое наименование DaTSCAN) и иометопан (Dopascan) для ОФЭКТ или фтордеоксиглюкозу (18F) и DTBZ для ПЭТ. Шаблон пониженной допаминергической активности в базальном ядре может помочь при диагностике БП (Brooks, J. Nucl. Med., 2010, 51, 596-609; Redmond, Neuroscientist, 2002, 8, 457-88; Wood, Nat. Rev. Neurol., 2014, 10, 305).
Разрабатываются стратегии для применения последних достижений причин болезни Паркинсона для развития биохимических биомаркеров (Schapira Curr Opin Neurol 2013; 26(4):395-400). Такие биомаркеры, которые были исследованы в различных жидкостях тела (спинномозговая жидкость (СМЖ), плазма, слюна), включают уровни альфа-синуклеина, но также DJ-1, Tau и Abeta, а также белки протонейрофибрилл, интерлейкины, остеопонтин и гипокронтин (Schapira Curr Opin Neurol 2013; 26(4):395-400), но до сих пор ни один из этих биомаркеров, отдельно или в сочетании, не может применяться в качестве определяющего диагностического теста. По нашим данным, ни одного одобренного альфа-синуклеинового агента в настоящее время не присутствует на рынке или не доступно для клинических исследований, несмотря на крайнюю потребность в исследовании болезни Паркинсона и разработке лекарственных средств (Eberling et al., J Parkinsons Dis. 2013; 3(4):565-7).
Способность получать изображение отложений альфа-синуклеина в мозге будет огромным прорывом в исследовании болезни Паркинсона и разработке лекарственных средств. Аккумулирование агрегированного альфа-синуклеина в мозге является патологическим признаком БП и приоритетной целью для разработки лекарственных средств, принимая во внимание его гипотетической роли в нейродегенерации. Получение изображения патологии альфа-синуклеина in vivo может быть полезным в качестве биомаркера присутствия заболевания и развития заболевания, и в качестве инструмента фармакодинамики для разработки лекарственного средства. Разработка агента для получения ПЭТ изображения альфа-синуклеина считается очень важным для диагностики и отслеживания действия терапевтического таргетирования альфа-синуклеина (Eberling, Dave and Frasier, J. Parkinson's Disease, 3, 565-567 (2013)). Несмотря на множество попыток идентифицировать альфа-Синуклеин ПЭТ лиганд, до сих пор соединения, которые связываются с разумно высоким сродством с искусственными альфа-синуклеиновыми фибриллами идентифицированы, но не являются оптимальными по множеству причин: низкое или отсутствующее сродство с патологическими агрегатами альфа-синуклеина, присутствующими в больных мозгах, низкая или отсутствующая селективность к альфа-синуклеину по сравнению с другими агрегированными белками и неподходящие физико-химические свойства (Eberling et al., J Parkinsons Dis. 2013; 3(4):565-7; Neal et al., Mol Imaging Biol. 2013; 15:585-595; Bagchi et al., PLoS One 2013;8(2):e55031; Yu et al., Bioorganic and Medicinal chemistry 2012;20:4625-4634; Zhang et al., Appl Sci (Basel) 2014;4(1):66-78; Chu et al., J Med Chem, 2015, 58 (15):6002-17).
Для достижения высокой селективности к альфа-синуклеину, были использованы молекулярные пробы, которые распознают и связываются с патологическим альфа-синуклеином. Для снижения помех фонового сигнала, возникающих при не специфическом нецелевом связывании, и для снижения требований к дозировке, соединения для получения изображения альфа-синуклеина должны связываться с высоким сродством и селективностью с их целью. Для получения изображений агрегатов альфа-синуклеина, связанных с неврологическими расстройствами, такими как болезнь Паркинсона, соединения для получения изображений должны проходить через гематоэнцефалический барьер и проходить в соответствующие области мозга. Для направленного воздействия на внутриклеточные амилоидоподобные включения, такие как альфа-синуклеин, проницаемость клеток является еще одним требованием к соединениям для получения изображений. Другим предварительным условием для избегания ненужного аккумулирования соединения, которое может повысить риск нежелательных побочных эффектов, является быстрое выведение соединения из мозга (или другого целевого органа).
WO 2011/128455 относится к определенным соединениям, которые подходят для лечения расстройств, связанных с амилоидными белками или амилоидоподобными белками. US 2012/0302755 относится к определенным визуализирующим агентам для определения неврологической дисфункции. Другие соединения для диагностики нейродегенеративных расстройств на обонятельном эпителии обсуждаются в WO 2012/037928.
WO 2010/063701 относится к определенным in vivo визуализирующим агентам для применения в способе определения присутствия, или подверженности, болезни Паркинсона, где in vivo визуализирующий агент содержит α-синуклеиновый связующий агент, меченный in vivo визуализирующей группой, и где in vivo визуализирующий агент связывается с α-синуклеином со связывающей способностью.
US 2014/0142089 относится к способу профилактики или лечения дегенеративного заболевания мозга, где способ включает введение субъекту, нуждающемуся в таковом, эффективного количества фармацевтической композиции, содержащей определенное соединение, его фармацевтически приемлемую соль, изомер, сольват, гидрат или сочетание.
В WO 2009/155017 описаны арил- или гетероарилзамещенные производные азабензоксазола, которые считаются полезными в качестве радиоактивных индикаторов при позитронно-эмиссионной томографии (ПЭТ) для изучения амилоидных отложений в мозге in vivo для диагностики болезни Альцгеймера.
WO 2016/033445 относится к определенным соединениям для визуализации белка хантингтина.
Сущность изобретения
Объектом данного изобретения является получение соединений, которые могут применяться для диагностики, отслеживания развития заболевания, отслеживания активности лекарственного средства, расстройства или аномалии, связанной с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, такого как болезнь Паркинсона. В частности, соединения должны быть применимы для определения предрасположенности к такому расстройству, отслеживания остаточного расстройства или прогнозирования реакции пациента, который страдает таким расстройством, на лечения определенным лекарственным средством.
Более того, существует необходимость в данной области техники в соединениях, которые могут применяться в качестве визуализирующих агентов для альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви. В частности, объектом данного изобретения является получение соединений, которые подходят в качестве диагностической композиции для позитронно-эмиссионной томографии синуклеинопатий, например, где соединения определимо мечены18F. Авторы данного изобретения неожиданно обнаружили, что эти объекты могут быть достигнуты с помощью соединений формул (I) и (II), описанных ниже.
В другом аспекте, объектом данного изобретения является получение соединений, которые могут применяться для лечения, облегчения или профилактики расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, такого как болезнь Паркинсона.
Соединения формул (I) и (II) обладают высоким сродством связывания с различными альфа-синуклеиновыми агрегатами в тканях человека. Более того, соединения формул (I) и (II) демонстрируют высокую селективность для aSyn по сравнению с Aβ и тау патологическими отложениями, что позволяет отличить БП от других патологий, которые имеют общие клинические и патологические признаки. Благодаря уникальным конструктивным признакам, эти соединения обладают свойствами, такими как подходящая липофильность и молекулярная масса, усвоение в мозге и фармакокинетика, проницаемость клетки, растворимость и аутофлуоресценция для того, чтобы являются успешными визуализационными датчиками для определения и количественного анализа альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, при загрузке in vivo, ex vivo и in vitro.
В данном изобретении описаны новые соединения формул (I) и (II), имеющие улучшенные свойства связывания с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви. Соединения в соответствии с данным изобретением могут быть мечены (например, радиомечены), так, что они могут применяться для ex vivo и in vivo визуализации для определения альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви. В данном изобретении представлены способы определения альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, ex vivo с применением соединения формул (I) и (II) или их фармацевтической композиции. В данном изобретении представлены соединения формул (I) и (II) для применения в качестве диагностических визуализирующих агентов, в частности, для предсимптоматического определения болезни Паркинсона и/или других α-синуклеинопатий, например, с применением позитронно-эмиссионной томографии (ПЭТ). Изобретение может служить в качестве биомаркера для отслеживания топографического развития патологии, позволяя улучшать клиническую диагностику и планы клинических исследований. В данном изобретении также представлена фармацевтическая композиция, содержащая соединение формулы (I) или (II) и фармацевтически приемлемый носитель или эксципиент.
Данное изобретение суммировано в следующих пунктах:
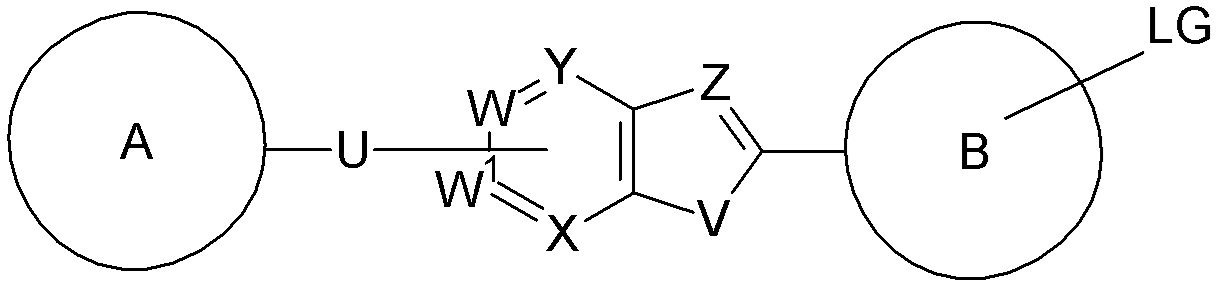
1. Соединение формулы (I):

(I)
и все его определяемо меченые производные, стереоизомеры, рацемические смеси, фармацевтически приемлемые соли, гидраты, сольваты, пролекарства и полиморфы;
где






где






V выбирают из группы, состоящей из S, NRa и CRbRb,
Z выбирают из группы, состоящей из N и CRc,
W выбирают из группы, состоящей из N и CRc, или W является C, если W присоединен к U;
W1 выбирают из группы, состоящей из N и CRc, или W1 является C, если W1 присоединен к U;
X выбирают из группы, состоящей из N и CRc, или X является C, если X присоединен к U;
Y выбирают из группы, состоящей из N и CRc, или Y является C если Y присоединен к U;
U выбирают из группы, состоящей из -NRa-, -CH=CH-, -С≡С- и связи;
в каждом случае, Ra независимо выбирают из группы, состоящей из водорода, алкила и галогеналкила;
в каждом случае, Rb независимо выбирают из группы, состоящей из водорода, алкила, галогеналкила и галогена;
в каждом случае, Rc независимо выбирают из группы, состоящей из водорода, алкила, галогеналкила и галогена;
в каждом случае, Rd независимо выбирают из группы, состоящей из галогена, -OH, -O-алкила и водорода;
в каждом случае, Re независимо выбирают из группы, состоящей из водорода, -(CH2CH2-O)n-Rf, -(CH2CH2-O)n- (CH2CH2)- Rd, алкила, карбоциклила и гетероциклила, где алкил, карбоциклил и гетероциклил могут быть необязательно замещены,
в каждом случае, Rf независимо выбирают из группы, состоящей из водорода и алкила, где алкил могут быть необязательно замещены;
в каждом случае, RA независимо выбирают из группы, состоящей из галогена, CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)- C(O)- R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, алкенил и алкинил могут быть необязательно замещены, или если присутствует более одной группы RA и две из групп RA являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп, и где 5-8-членное кольцо может быть замещено;
в каждом случае, RB независимо выбирают из группы, состоящей из галогена, CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)- C(O)- R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, алкенил и алкинил могут быть необязательно замещены или если присутствует более одной группы RB и две из групп RB являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп, и где 5-8-членное кольцо может быть замещено;
в каждом случае, R10независимо выбирают из группы, состоящей из: водорода, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил и гетероциклилалкил могут быть необязательно замещены;
в каждом случае, R11 независимо выбирают из группы, состоящей из: водорода, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил и гетероциклилалкил могут быть необязательно замещены;
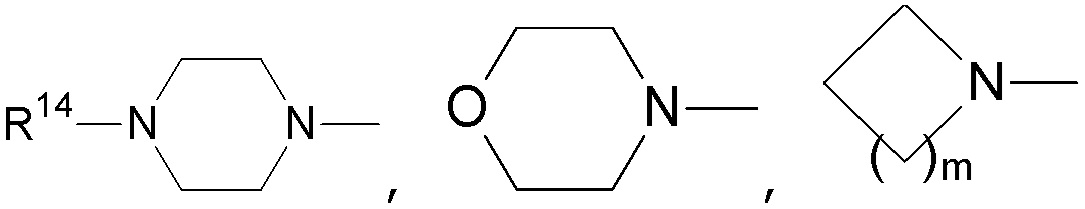
в каждом случае, R14 независимо выбирают из группы, состоящей из водорода, -(CH2CH2-O)n-Rf, -(CH2CH2-O)n- (CH2CH2)- Rd, алкила, карбоциклила и гетероциклила, где алкил, карбоциклил и гетероциклил могут быть необязательно замещены;
в каждом случае, n независимо равен от 1 до 4; и
в каждом случае, m независимо равен от 1 до 4.
2. Соединение по пункту 1, которое является соединением формулы (Ia):

(Ia)
где A, U, B, X, Y, W, W1 и Z такие, как определены в пункте 1.
3. Соединение по пункту 1, которое является соединением формулы (Ib) или (Ic):

(Ib)
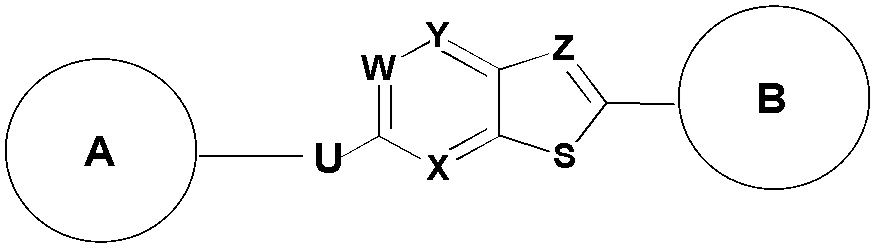
(Ic)
где A, U, B, X, Y, W, W1 и Z такие, как определены в пункте 1.
4. Соединение по пункту 1, которое является соединением формулы (Id), (Ie), (If), (Ig), (Ih) или (Ii):

(Id)

(Ie)

(If)

(Ig)

(Ih)

(Ii)
где A and B такие, как определены в пункте 1.
5. Соединение по любому из пунктов 1-4, где




6. Соединение формулы (II):

(II)
и все его определяемо меченые производные, стереоизомеры, рацемические смеси, фармацевтически приемлемые соли, гидраты, сольваты, пролекарства и полиморфы;
где





где






V2 выбирают из группы, состоящей из S, NRa и CRbRb,
Z2 выбирают из группы, состоящей из N и CRc,
в каждом случае, Ra независимо выбирают из группы, состоящей из водорода, алкила и галогеналкила;
в каждом случае, Rb независимо выбирают из группы, состоящей из водорода, алкила, галогеналкила и галогена;
в каждом случае, Rc независимо выбирают из группы, состоящей из водорода, алкила, галогеналкила и галогена;
в каждом случае, Rd независимо выбирают из группы, состоящей из галогена, -OH, -O-алкила и водорода;
в каждом случае, Re независимо выбирают из группы, состоящей из водорода, -(CH2CH2-O)n-Rf, -(CH2CH2-O)n- (CH2CH2)- Rd, алкила, карбоциклила и гетероциклила, где алкил, карбоциклил и гетероциклил могут быть необязательно замещены,
в каждом случае, Rf независимо выбирают из группы, состоящей из водорода и алкила, где алкил может быть необязательно замещен;
в каждом случае, RD независимо выбирают из группы, состоящей из галогена, CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)- C(O)- R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, алкенил и алкинил могут быть необязательно замещены, или если присутствует более одной группы RD и две из групп RD являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп, и где 5-8-членное кольцо может быть замещено;
в каждом случае, RE независимо выбирают из группы, состоящей из галогена, CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)- C(O)- R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, алкенил и алкинил могут быть необязательно замещены, или если присутствует более одной группы RE и две из групп RE являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп, и где 5-8-членное кольцо может быть замещено;
в каждом случае, R10независимо выбирают из группы, состоящей из: водорода, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил и гетероциклилалкил могут быть необязательно замещены;
в каждом случае, R11 независимо выбирают из группы, состоящей из: водорода, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил и гетероциклилалкил могут быть необязательно замещены;
в каждом случае, R14 независимо выбирают из группы, состоящей из водорода, -(CH2CH2-O)n-Rf, -(CH2CH2-O)n- (CH2CH2)- Rd, алкила, карбоциклила и гетероциклила, где алкил, карбоциклил и гетероциклил могут быть необязательно замещены;
в каждом случае, n независимо равен от 1 до 4; и
в каждом случае, m независимо равен от 1 до 4.
7. Соединение по пункту 6, которое является соединением формулы (IIa):

(IIa)
где D и E такие, как определены в пункте 6.
8. Соединение по любому из пунктов 1-7, где соединение является определяемо меченым, предпочтительно2H,3H,18F,123I,124I,125I,131I,11C,13N,15O и77Br, более предпочтительно,18F.
9. Диагностическая композиция, содержащая соединение по любому из пунктов 1-8 и фармацевтически приемлемый носитель, разбавитель, адъювант и/или эксципиент.
10. Соединение по любому из пунктов 1-8 для применения в диагностике.
11. Соединение по любому из пунктов 1-8 для применения в визуализации альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви.
12. Соединение для применения по пункту 11, где соединение применяется в позитронно-эмиссионной томографии, визуализации альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви.
13. Соединение по любому из пунктов 1-8 для применения в диагностике расстройства или аномалии, связанной с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, или предрасположенности к нему.
14. Соединение для применения по пункту 13, где расстройство выбирают из болезни Паркинсона (спорадической, семейной с альфа-синуклеиновыми мутациями, семейной с мутациями, отличными от мутаций альфа-синуклеина, истинной вегетативной недостаточности и дисфагии телец Леви), слабоумия с тельцами Леви (включая ʺчистоеʺ слабоумие с тельцами Леви), спорадической болезни Альцгеймера, семейной болезни Альцгеймера с мутациями APP, семейной болезни Альцгеймера с PS-1, PS-2 или другими мутациями, семейной британской деменции, варианта болезни Альцгеймера с тельцами Леви, обычного старения (синдрома Дауна), множественной системной атрофии (включая синдром Шая-Дрейджера, стрианигральную дегенерацию и оливопонтоцеребеллярную атрофию), травматическое повреждение мозга, хроническую травматическую энцефалопатию, таупатии (включая болезнь Пика, лобно-височную деменцию, прогрессирующий надъядерный паралич, кортико-базальную дегенерацию и болезнь Ниманна-Пика типа C1), болезнь двигательного нейрона, амиотрофический боковой склероз (включая спорадическый, семейный и комплекс Гуама ALS-деменция), нейроаксональную дистрофию, нейродегенерацию с аккумуляцией железа в мозге 1 типа (включая синдром Галлервордена-Шпатца), прионные болезни, атаксию-телеангиэктазию, синдром Мейжа, подострый склерозирующий панэнцефалит, болезнь Гоше, лизосомные болезни накопления (включая синдром Куфора-Ракеба и синдром Санфилиппо) и расстройство поведения в фазе сна с быстрыми движениями глаз (БДГ), предпочтительно, болезнь Паркинсона.
15. Способ визуализации альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, где эффективное количество соединение по любому из пунктов 1-8 вводят пациенту, нуждающемуся в таковом.
16. Способ по пункту 15, где способом является визуализация альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, с помощью позитронно-эмиссионной томографии.
17. Способ диагностики расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, или предрасположенности к ним у субъекта, где диагностически эффективное количество соединения по любому из пунктов 1-8 вводят пациенту, нуждающемуся в таковом.
18. Способ по пункту 17, где расстройство выбирают из болезни Паркинсона (включая спорадическую, семейную с альфа-синуклеиновыми мутациями, семейную с мутациями, отличными от мутаций альфа-синуклеина, истинную вегетативную недостаточность или дисфагию телец Леви), слабоумия с тельцами Леви (включая ʺчистоеʺ слабоумие с тельцами Леви), спорадической болезни Альцгеймера, семейной болезни Альцгеймера с мутациями APP, семейной болезни Альцгеймера с PS-1, PS-2 или другими мутациями, семейной британской деменции, варианта болезни Альцгеймера с тельцами Леви, обычного старения (синдрома Дауна), множественной системной атрофии (включая синдром Шая-Дрейджера, стрианигральную дегенерацию и оливопонтоцеребеллярную атрофию), травматическое повреждение мозга, хроническую травматическую энцефалопатию, таупатии (включая болезнь Пика, лобно-височную деменцию, прогрессирующий надъядерный паралич, кортико-базальную дегенерацию и болезнь Ниманна-Пика типа C1), болезнь двигательного нейрона, амиотрофический боковой склероз (включая спорадический, семейный и комплекс Гуама ALS-деменция), нейроаксональную дистрофию, нейродегенерацию с аккумуляцией железа в мозге 1 типа (включая синдром Галлервордена-Шпатца), прионные болезни, атаксию-телеангиэктазию, синдром Мейжа, подострый склерозирующий панэнцефалит, болезнь Гоше, лизосомные болезни накопления (включая синдром Куфора-Ракеба и синдром Санфилиппо) и расстройство поведения в фазе сна с быстрыми движениями глаз (БДГ), предпочтительно, болезни Паркинсона.
19. Способ сбора данных для диагностики расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, у пациента, включающий:
(a) контактирование образца или определенной части тела или области тела пациента, предположительно содержащего альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(c) определение соединения, связанного с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви; и
(d) необязательно корреляцию присутствия или отсутствия связывания соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела.
20. Способ сбора данных для определения предрасположенности к расстройству или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, у пациента, включающий определение специфического связывания соединения, определенного в любом из пунктов 1-8, с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела пациента, который включает стадии:
(a) контактирование образца или определенной части тела или области тела, предположительно содержащих альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(c) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(d) необязательную корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением.
21. Способ сбора данных для отслеживания остаточного расстройства у пациента, страдающего расстройством или аномалией, связанными с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, которого лечили лекарственным средством, где способ включает:
(a) контактирование образца или определенной части тела или области тела, предположительно содержащих альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(c) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(d) необязательно корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением.
22. Способ по пункту 21, где присутствует стадия (d), и где способ дополнительно включает стадии (i)-(vi) до стадии (a):
(i) контактирование образца или определенной части тела или области тела, предположительно содержащих альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(ii) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iii) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iv) корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(v) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением; и
(vi) лечение пациента лекарственным средством;
и где способ дополнительно включает стадию (A) после стадии (d) или стадии (e):
(A) сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенного на стадии (iv), с количеством комплекса соединение/(альфа-синуклеиновые агрегаты включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенного на стадии (d).
23. Способ по пункту 21 или 22, где стадии (a)-(c) и необязательные стадии (d) и (e) повторяют один или более раз.
24. Способ сбора данных для прогнозирования реакции пациента, страдающего расстройством или аномалией, связанными с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, и леченного лекарственным средством, включающий:
(a) контактирование образца или определенной части тела или области тела, предположительно содержащих альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(c) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(d) необязательно корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением.
25. Способ по пункту 24, где присутствует стадия (d), и где способ дополнительно включает стадии (i)-(vi) до стадии (a):
(i) контактирование образца или определенной части тела или области тела, предположительно содержащих альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(ii) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iii) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iv) корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(v) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением; и
(vi) лечение пациента лекарственным средством;
и где способ дополнительно включает стадию (A) после стадии (d) или стадии (e):
(A) сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенного на стадии (iv), с количеством комплекса соединение/(альфа-синуклеиновые агрегаты включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенным на стадии (d).
26. Способ по пункту 24 или 25, где стадии (a)-(c) и необязательные стадии (d) и (e) повторяют один или более раз.
27. Способ диагностики расстройства или аномалии, связанной с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, у пациента, включающий:
(a) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(c) определение связывания соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви; и
(d) необязательную корреляцию присутствия или отсутствия связывания соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела.
28. Способ определения предрасположенности к расстройству или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, у пациента, включающий определение специфического связывания соединения, определенного в любом из пунктов 1-8, с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела пациента, который содержит стадии:
(a) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(c) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(d) необязательную корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением.
29. Способ отслеживания остаточного расстройства у пациента, страдающего расстройством или аномалией, связанными с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, которого лечили лекарственным средством, где способ включает:
(a) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(c) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(d) необязательную корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением.
30. Способ по пункту 29, где присутствует стадия (d), и где способ дополнительно включает стадии (i)-(vi) до стадии (a):
(i) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(ii) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iii) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iv) корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(v) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением; и
(vi) лечение пациента лекарственным средством;
и где способ дополнительно включает стадию (A) после стадии (d) или стадии (e):
(A) сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенного на стадии (iv), с количеством комплекса соединение/(альфа-синуклеиновые агрегаты включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенным на стадии (d).
31. Способ по пункту 29 или 30, где стадии (a)-(c) и необязательные стадии (d) и (e) повторяют один или более раз.
32. Способ прогнозирования реакции пациента, страдающего расстройством или аномалией, связанными с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, и леченного лекарственным средством, включающий:
(a) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(c) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(d) необязательную корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением.
33. Способ по пункту 32, где присутствует стадия (d), и где способ дополнительно включает стадии (i)-(vi) до стадии (a):
(i) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(ii) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iii) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iv) корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(v) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением; и
(vi) лечение пациента лекарственным средством;
и где способ дополнительно включает стадию (A) после стадии (d) или стадии (e):
(A) сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенного на стадии (iv), с количеством комплекса соединение/(альфа-синуклеиновые агрегаты включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенным на стадии (d).
34. Способ по пункту 32 или 33, где стадии (a)-(c) и необязательные стадии (d) и (e) повторяют один или более раз.
35. Способ по любому из пунктов 19-34, где расстройство выбирают из болезни Паркинсона (включая спорадическую, семейную с альфа-синуклеиновыми мутациями, семейную с мутациями, отличными от мутаций альфа-синуклеина, истинную вегетативную недостаточность или дисфагию телец Леви), слабоумия с тельцами Леви (включая ʺчистоеʺ слабоумие с тельцами Леви), спорадической болезни Альцгеймера, семейной болезни Альцгеймера с мутациями APP, семейной болезни Альцгеймера с PS-1, PS-2 или другими мутациями, семейной британской деменции, варианта болезни Альцгеймера с тельцами Леви, обычного старения (синдрома Дауна), множественной системной атрофии (включая синдром Шая-Дрейджера, стрианигральную дегенерацию и оливопонтоцеребеллярную атрофию), травматическое повреждение мозга, хроническую травматическую энцефалопатию, таупатии (включая болезнь Пика, лобно-височную деменцию, прогрессирующий надъядерный паралич, кортико-базальную дегенерацию и болезнь Ниманна-Пика типа C1), болезнь двигательного нейрона, амиотрофический боковой склероз (включая спорадический, семейный и комплекс Гуама ALS-деменция), нейроаксональную дистрофию, нейродегенерацию с аккумуляцией железа в мозге 1 типа (включая синдром Галлервордена-Шпатца), прионные болезни, атаксию-телеангиэктазию, синдром Мейжа, подострый склерозирующий панэнцефалит, болезнь Гоше, лизосомные болезни накопления (включая синдром Куфора-Ракеба и синдром Санфилиппо) и расстройство поведения в фазе сна с быстрыми движениями глаз (БДГ), предпочтительно, болезни Паркинсона.
36. Способ определения количества альфа-синуклеиновых агрегатов, включающий, но не ограниченный ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела пациента, включающий:
(a) получение образца или определенной части тела или области тела;
(b) тестирование образца или определенной части тела или области тела на присутствие альфа-синуклеиновых агрегатов включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, с соединением, определенным в любом из пунктов 1-8;
(c) определение количества соединения, связанного с альфа-синуклеиновыми агрегатами, включающее, но не ограниченное ими, тельца Леви и/или нейриты Леви; и
(d) расчет количества альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела.
37. Способ по любому из пунктов 19-36, где образцом является ткань и/или жидкость тела, характерные для определенной исследуемой части тела или области тела.
38. Смесь, содержащая соединение по любому из пунктов 1-8 и, по меньшей мере, одно соединение, выбранное из визуализирующего агента, отличного от соединения по любому из пунктов 1-8, предпочтительно, абета или тау визуализирующего агента, фармацевтически приемлемый носитель, разбавитель или эксципиент.
39. Смесь, содержащая соединение по любому из пунктов 1-8 и, по меньшей мере, одно соединение, выбранное из терапевтического агента, отличного от соединения по любому из пунктов 1-8, фармацевтически приемлемый носитель, разбавитель или эксципиент.
40. Фармацевтическая композиция, содержащая соединение по любому из пунктов 1-8 и фармацевтически приемлемый носитель, разбавитель или эксципиент.
41. Соединение, определенное по любому из пунктов 1-8, для применения в лечении, облегчении или профилактике расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами.
42. Способ лечения, облегчения или профилактики расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, где терапевтически эффективное количество соединения по любому из пунктов 1-8, вводят пациенту, нуждающемуся в таковом.
43. Соединение для применения по пункту 41 или способ по пункту 42, где расстройство выбирают из болезни Паркинсона (включая спорадическую, семейную с альфа-синуклеиновыми мутациями, семейную с мутациями, отличными от мутаций альфа-синуклеина, истинную вегетативную недостаточность или дисфагию телец Леви), слабоумия с тельцами Леви (включая ʺчистоеʺ слабоумие с тельцами Леви), спорадической болезни Альцгеймера, семейной болезни Альцгеймера с мутациями APP, семейной болезни Альцгеймера с PS-1, PS-2 или другими мутациями, семейной британской деменции, варианта болезни Альцгеймера с тельцами Леви, обычного старения (синдрома Дауна), множественной системной атрофии (включая синдром Шая-Дрейджера, стрианигральную дегенерацию и оливопонтоцеребеллярную атрофию), травматическое повреждение мозга, хроническую травматическую энцефалопатию, таупатии (включая болезнь Пика, лобно-височную деменцию, прогрессирующий надъядерный паралич, кортико-базальную дегенерацию и болезнь Ниманна-Пика типа C1), болезнь двигательного нейрона, амиотрофический боковой склероз (включая спорадический, семейный и комплекс Гуама ALS-деменция), нейроаксональную дистрофию, нейродегенерацию с аккумуляцией железа в мозге 1 типа (включая синдром Галлервордена-Шпатца), прионные болезни, атаксию-телеангиэктазию, синдром Мейжа, подострый склерозирующий панэнцефалит, болезнь Гоше, лизосомные болезни накопления (включая синдром Куфора-Ракеба и синдром Санфилиппо) и расстройство поведения в фазе сна с быстрыми движениями глаз (БДГ), предпочтительно, болезни Паркинсона.
44. Соединение формулы (IIIa) или (IIIb)

(IIIa)
(IIIb)
где Re, R14, RA, m, B, U, Y, W, W1, X, Z и V такие, как определены в пункте 1,









LG является уходящей группой.
45. Соединение формулы (IVa) или (IVb)\

(IVa)

(IVb)
где Re, RD, E, V2 и Z2 такие, как определены в пункте 6;





LG является уходящей группой.
46. Соединение по пункту 44 или 45, где LG выбирают из нитро, галогена, триметиламмония, C1-4алкилсульфоната или C6-10 арилсульфоната.
47. Способ получения соединения по пункту 8, где соединение мечено18F, включающий взаимодействие соединения по пункту 44 или 45 с18F-фторирующим агентом так, что LG замещается18F.
48. Способ по пункту 47, где18F-фторирующий агент выбирают из K18F, H18F, Cs18F, Na18F и [18F]фторида тетрабутиламмония.
49. Применение соединения по любому из пунктов 1-8 в качестве in vitro аналитического стандарта или in vitro инструмента скрининга.
50. Аналитический набор для определения и/или диагностики расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, где аналитический набор содержит, по меньшей мере, одно соединение, определенное по любому из пунктов 1-8.
51. Аналитический набор по пункту 50, включающий, по меньшей мере, одно соединение по любому из пунктов 1-8 и инструкции для применения, по меньшей мере, одного соединения для целей связывания альфа-синуклеиновых агрегатов с образованием комплекса соединение/белок и определения образования комплекса соединение/белок, так, чтобы присутствие или отсутствие комплекса соединение/белок коррелировало с присутствием или отсутствием альфа-синуклеиновых агрегатов.
52. Набор для получения радиофармацевтического препарата, где набор содержит герметично закрытый флакон, содержащий, по меньшей мере, одно соединение по пункту 44 или 45.
Определение
В данном описании применяют следующее определения:
"Алкил" относится к насыщенной прямой или разветвленной органической группе, содержащей атомы углерода и водорода. Примеры подходящих алкильных групп включают 1-6 атомов углерода, предпочтительно, 1-4 атома углерода, и включают метил, этил, пропил, изопропил, н-бутил, т-бутил и изобутил.
"Карбоциклил" относится к циклической органической группе, содержащей атомы углерода и водорода. Примеры подходящих карбоциклильных групп содержат 3-10 атомов углерода, предпочтительно, 3, 4, 5 или 6 атомов углерода. Карбоциклильная группа может быть ненасыщенной или насыщенной. Термин "карбоциклил" также включает ароматические циклические органические группы (арильные группы), состоящие из атомов углерода и водорода. Примеры карбоциклильных групп включают циклопентил, циклогексил и фенил.
"Гетероциклил" относится к карбоциклильной группе, определенной выше, в которой, по меньшей мере, один атом углерода замещен гетероатомом, который, например, выбирают из N, O или S, или содержащей гетероатом (например, N, O и/или S) группой. Гетероциклильная группа может быть ненасыщенной или насыщенной. Она включает и гетероалкильные группы и гетероарильные группы. Гетероциклил также может быть аннелирован, связан мостиком или связан спиро связью, и включает, например, 6-членные бициклические кольца, 7-членные бициклические кольца, 8-членные бициклические кольца, 6-членные спироциклические кольца, 7-членные спироциклические кольца или 8-членные спироциклические кольца. Примеры включают азетидин, пирролидин, пиррол, тетрагидрофуран, фуран, тиолан, тиофен, имидазолидин, пиразолидин, имидазол, пиразол, оксазолидин, изоксазолидин, оксазол, изоксазол, тиазолидин, изотиазолидин, тиазол, изотиазол, диоксолан, дитиолан, триазол, фуразан, оксадиазолы, тиадиазол, дитиазол, тетразол, пиперидин, оксан, тиан, пиридин, пиран, тиопиран, пиперазин, диазин (включая пиразин и пиримидин), морфолин, оксазин, тиоморфолин, тиазин, диоксан, диоксин, дитиан, дитиин, триазин, триоксан, тетразин, азепан, азепин, оксепан, оксепин, тиепан, тиепин, 3-азабицикло[3.1.0]гексан, азаспиро[3.3]гептан, диазаспиро[3.3]гептан, азабицикло[3.2.1]октан и диазабицикло[3.2.1]октан.
Примеры предпочтительных гетероциклильных групп включают азетидин, морфолин, пиперазин, пирролидин, тетрагидрофуран, пиперидин, азаспиро[3.3]гептан и т.д. Примеры возможных гетероарильных групп включают пиридин, пиразол и т.д.
"Алкенил" относится к органической группе, содержащей атомы углерода и водорода, которая включает, по меньшей мере, одну двойную связь. Примеры подходящий алкенильных групп содержат 2-6 атома углерода, предпочтительно, 2-4 атомов углерода и включают пропенил и бутенил.
"Алкинил" относится к органической группе, содержащей атомы углерода и водорода, которая включает, по меньшей мере, одну тройную связь. Примеры подходящих алкинильных групп содержат 2-6 атома углерода, предпочтительно, 2-4 атомов углерода, и включают пропинил и бутинил.
"Арил" относится к гомоциклическим ароматическим органическим группам, содержащим 1 или 2 кольца, содержащих атомы углерода и водорода, которые предпочтительно содержат 6-12 атомов углерода, более предпочтительно, 5 или 6 атомов углерода. Примеры включают, но не ограничены ими, фенил, бифенил и нафтил.
"Гетероарил" относится к арильной группе, определенной выше, в которой, по меньшей мере, один атом углерода замещен гетероатомом, который, например, выбирают из N, O или S, или содержащей гетероатом (например, N, O и/или S) группы. Примеры возможных гетероарильных групп включают пиридин и т.д.
"Гал" или "галоген" относится к F, Cl, Br и I. Для диагностических и фармацевтических применений F (например,19F и18F) особенно предпочтителен.
"Карбоциклилалкил" относится к группе карбоциклилалкил-.
"Гетероциклилалкил" относится к группе гетероциклилалкил-.
"5-8-Членная циклическая система, содержащая атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп" относится к циклической системе, содержащей 5-8 атомов углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N, или, необязательно, одну или более групп, содержащих гетероатомы (например, N, O и/или S). Термин также включает моноциклические, бициклические и полициклические системы. Если присутствует более одного кольца, кольца могут быть аннелированы, соединены мостиком или соединены спиро. Кольца могут быть либо карбоциклическими, либо гетероциклическими, и могут быть насыщенными, ненасыщенными или ароматическими. Примеры таких гетероциклических групп включают, но не ограничены ими, азетидин (азациклобутан), пирролидин (азациклопентан), пиррол, имидазолидин, пиразолидин, имидазол, пиразол, оксазолидин, изоксазолидин, оксазол, изоксазол, тиазолидин, изотиазолидин, тиазол, изотиазол, триазол, фуразан, оксадиазолы, тиадиазол, дитиазол, тетразол, имидазолин, пиперидин (азациклогексан), пиридин, пиперазин, пирролидин, диазин (включая пиразин и пиримидин), морфолин, тиоморфолин, тиазин, триазин, тетразин, азепан и азепин. Предпочтительно, 5-8-членные кольца, содержащие атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп, выбирают из имидазолина, диоксолана, пиперидина, пиперазина, пирролидина, тетрагидрофурана, диоксана, фенила, пиридина, тиазола, диазинов (включая пиразин и пиримидин) и оксадиазолов, более предпочтительно, имидазолина, диоксолана, пиперидина, пиперазина, пирролидина, фенила и пиридина. 5-8-членные кольца, содержащие атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или , необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп, могут быть присоединены в любом доступном положении. Предпочтительно, "5-8-членной циклической системой, содержащей атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп" является "5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп", более предпочтительно, ей является 4-, 5- или 6-членное (предпочтительно, насыщенное) кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N. Конкретные примеры включают 5- или 6-членные кольца, содержащие атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N, перечисленные выше.
Если присутствует более одной группы RA, RB, RD или RE, соответственно, если присутствует, и две из групп RA, RB, RD или RE, соответственно, являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп. В этом варианте, 5-8-членным кольцом может быть любое 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или, необязательно, одну или более содержащих гетероатом (например, N, O и/или S) групп. Их примеры представлены в списке примеров, данных для "5-8-членной системы колец, содержащей атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп", а также в списках примеров карбоциклильных, арильных и гетероциклильных групп. Кольца, образованные двумя соседними группами RA, RB, RD или RE, соответственно, предпочтительно являются 5- или 6-членными, насыщенными или ненасыщенными кольцами, содержащими атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или, необязательно, одну или более содержащих гетероатом (например, N, O и/или S) групп. Конкретные примеры 5- или 6-членных насыщенных или ненасыщенных колец, содержащих атомы углерода и, необязательно, один или более гетероатомов, выбранных из N, O или S, или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп, даны в списке выше. Во всех этих вариантах гетероатомом предпочтительно является N и/или O. Во всех этих вариантах кольцо предпочтительно содержит 0, 1, 2 или 3 гетероатома. Во всех этих вариантах кольцо предпочтительно содержит 0 или 1 содержащую гетероатом (например, N, O и/или S) группу.
"Гетероатом-содержащие группы" включают группы, которые содержат, например, N, O и/или S. Примеры таких групп включают -C(O)-, -C(O)O-, -C(O)N(R50)- и -N(R50)-, в которых R50, в каждом случае, независимо выбирают из группы, состоящей из H или C1-4 алкила, где C1-4 алкил может быть необязательно замещен.
Термин ʺуходящая группаʺ (LG) в данном описании включает любую уходящую группу и означает атом или группу атомов, которые могут быть замещены другим атомом или группой атомов. Примеры даны, например, в Synthesis (1982), p. 85-125, таблица 2, Carey and Sundberg, Organische Synthese, (1995), страницы 279-281, таблица 5.8; или Netscher, Recent Res. Dev. Org. Chem., 2003, 7, 71-83, схема 1, 2, 10 и 15 и другие). (Coenen, Fluorine-18 Labeling Methods: Features and Possibilities of Basic Reactions, (2006), в: Schubiger P.A., Friebe M., Lehmann L., (eds), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, Berlin Heidelberg, pp.15-50, в явном виде: схема 4 стр. 25, схема 5 стр. 28, таблица 4 стр. 30, фигура 7 стр. 33). Предпочтительно, "уходящую группу" (LG) выбирают из нитро, галогена, триметиламмония, C1-4 алкилсульфоната и C6-10 арилсульфоната.
Если группа определена как "необязательно замещенная" (если не определено иначе), если химически применимо, она может иметь один или более заместителей, выбранных из -галогена, -CN, -OH, -(O-CH2CH2)n-R, -(CH2CH2-O)n-R*, -(CH2CH2-O)n- (CH2CH2)- R (где R=H или галоген и R*=H, (CH2CH2)nгалоген, Cгалоген3 или CH3), -C1-6 алкила, -C1-6 алкокси, -SO2-алкила, -NH2, -NH(C1-6 алкила) или -N(C1-6 алкила)2, предпочтительно, -галогена, -CN, -OH, -(O-CH2CH2)n-R, -(CH2CH2-O)n-R* или -(CH2CH2-O)n- (CH2CH2)- R, более предпочтительно, -галогена или -OH. Кроме того, типовые заместители арильной группы включают одну или более алкильных групп, например, 1 или 2 алкильные группы, в частности, 1 или 2 метильные группы. В этих определениях n равен 1-6.
Соединения в соответствии с данным изобретением, имеющие один или более оптических активных атома углерода, могут существовать в виде рацематов и рацемических смесей, стереоизомеров (включая диастереомерные смеси и отдельные диастереомеры, энантиомерные смеси и отдельные энантиомеры, смеси конформеров и отдельные конформеры), таутомеров, атропизомеров и ротамеров. Все изомерные формы включены в данное изобретение. Соединения, описанные в данном изобретении, содержащие олефиновые двойные связи, включают E и Z геометрические изомеры. Также включены в данное изобретение все соли, полиморфы, гидраты и сольваты.
Термин "полиморфы" относится к различным кристаллическим структурам соединений в соответствии с данным изобретением. Они могут включать, но не ограничены ими, кристаллические морфологии (и аморфные материалы) и все формы с кристаллической решеткой. Соли в соответствии с данным изобретением могут быть кристаллическими и могут существовать в виде более одного полиморфа. Сольваты, гидраты, а также безводные формы солей также включены в изобретение. Растворитель, включенный в сольваты, особенно не ограничен и может быть любым фармацевтически приемлемым растворителем. Примеры включают воду и C1-4 спирты (такие как метанол и этанол).
"Фармацевтически приемлемые соли" определены как производные описанных соединений, где исходное соединение модифицируют получением кислотной или основной соли. Примеры фармацевтически приемлемых солей включают, но не ограничены ими, минеральные или органические кислотные соли основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты; и подобные. Фармацевтически приемлемые соли включают обычные не токсичные соли или четвертичные аммониевые соли исходного полученного соединения, например, из не токсичных неорганических и органических солей. Например, такие обычные нетоксичные соли включают соли, полученные из неорганических кислот, таких как, но не ограниченных ими, хлористоводородная, бромистоводородная, серная, сульфаминовая, фосфорная, азотная и подобные; и соли, полученные из органических кислот, таких как, но не ограниченных ими, уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфанильная, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая и подобные. Фармацевтически приемлемые соли в соответствии с данным изобретением могут быть синтезированы из исходного соединения, которое содержит основную или кислотную группу, обычными химическими методами. Обычно такие соли могут быть получены взаимодействием свободной кислоты или основания этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе, или в смеси обоих. Органические растворители включают, но не ограничены ими, не водные среды, такие как простые эфиры, этилацетат, этанол, изопропанол или ацетонитрил. Списки подходящих солей можно найти в Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, Easton, PA, 1990, p. 1445, описание которой включено сюда в качестве ссылки.
"Фармацевтически приемлемыми" являются такие соединения, материалы, композиции и/или лекарственные формы, которые, с медицинской точки зрения, подходят для применения в контакте с тканями человека и животных без избыточной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соразмерных с разумным соотношением польза/риск.
Соединения в соответствии с данным изобретением также могут быть представлены в форме пролекарства, а именно соединения, которое метаболизируется in vivo в активный метаболит.
Пациентами или субъектами в данном изобретении обычно являются животные, особенно млекопитающие, более предпочтительно, человек.
Альфа-синуклеиновыми агрегатами являются мультимерные бета-складчатые обогащенные сборки альфа-синуклеиновых мономеров, которые могут образовывать либо растворимые олигомеры, либо растворимые/нерастворимые протофибриллы или зрелые фибриллы, которые коалесцируют во внутриклеточных отложениях, определенных как множество патологий Леви при болезни Паркинсона и других синуклеинопатиях. Альфа-синуклеиновые агрегаты, которые составляют патологии Леви, могут быть определены как имеющие следующие морфологии: тельца Леви, нейриты Леви, недозрелые тельца Леви или бескровные тельца, околоядерные отложения с диффузными, гранулярными, точечными или плеоморфными схемами. Более того, альфа-синуклеиновые агрегаты являются основным компонентом внутриклеточных фибриллярных включений, определенных в олигодендроцитах (также называемых глиальные цитоплазматические включения) и нейронных сомах, нейритах и ядрах (называемых нейронные цитоплазматические включения), которые являются гистологическими признаками множественной системной атрофии. Альфа-синуклеиновые агрегатов в патологиях Леви часто демонстрируют значительное повышение в пост-трансляционных модификациях, таких как фосфорилирование, убиквитинирование, нитрирование и укорочение.
Тельца Леви являются аномальными агрегатами белка, которые развиваются внутри нервных клеток при болезни Паркинсона (БП), слабоумии с тельцами Леви и других синуклеинопатиях. Тельца Леви проявляются как сферические массы, которые замещают другие компоненты клетки. Морфологически, тельца Леви могут быть классифицированы на стволомозговой или кортикальный тип. Классические стволомозговые тельца Леви являются эозинофильными цитоплазматическими включениями, состоящими из плотной сердцевины, окруженной оболочкой из расходящихся фибрилл шириной 5-10 нм, первичным структурным компонентом которого является альфа-синуклеин; кортикальные тельца Леви отличаются отсутствием оболочки. Присутствие телец Леви является признаком болезни Паркинсона.
Нейриты Леви являются аномальными нейронными процессами в больных нейронах, содержащими гранулированный материал, аномальные α-синуклеиновые волокна, такие как найдены в тельцах Леви, точкообразные варикозные структуры и аксональные сфероиды. Так же как и тельца Леви, нейриты Леви являются признаком α-синуклеинопатий, таких как слабоумие с тельцами Леви, болезнь Паркинсона и множественная системная атрофия.
Предпочтительные определения, данные в разделе "Определения", применяются ко всем вариантам, описанным ниже, если не указано иначе.
Подробное описание изобретения
Соединения в соответствии с данным изобретением описаны далее. Должно быть понятно, что все возможные сочетания следующих определений также рассматриваются.
В одном варианте, данное изобретение относится к соединению формулы (I):

(I)
и всем его определяемо меченым производным, стереоизомерам, рацемическим смесям, фармацевтически приемлемым солям, гидратам, сольватам, пролекарствам и полиморфам.
Предпочтительным вариантом соединения формулы (I) является

(Ia).
Предпочтительными соединениями являются также соединения формулы (Ib) или (Ic):

(Ib)

(Ic)
В другом варианте, предпочтительны соединения формулы (Id), (Ie), (If), (Ig), (Ih) или (Ii):

(Id)

(Ie)

(If)

(Ig)

(Ih)

(Ii).







В одном варианте,

В другом варианте







Более предпочтительно,







Даже более предпочтительно,



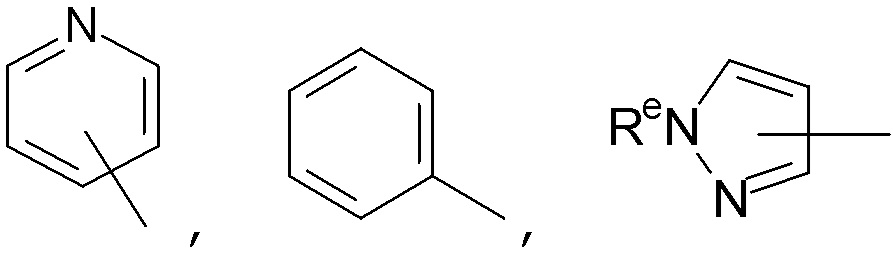

Примеры предпочтительных групп включают




более предпочтительно,

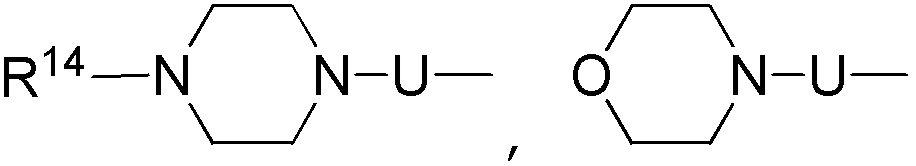











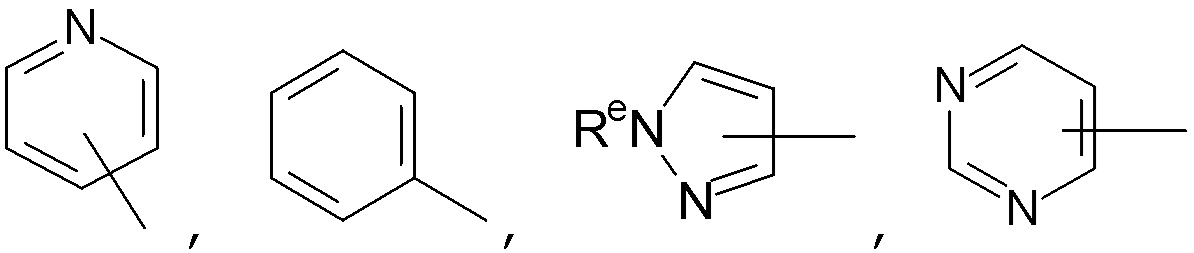







Примеры предпочтительных групп включают



Примеры более предпочтительных групп включают
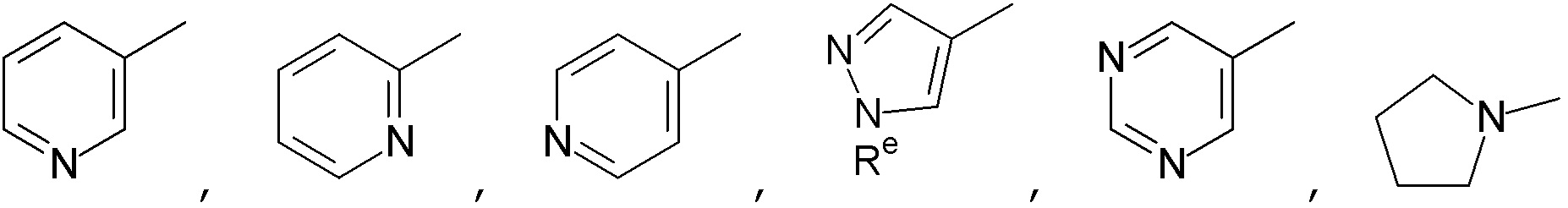


В одном варианте,




V выбирают из группы, состоящей из S, NRa и CRbRb. Предпочтительно, V является S.
Z выбирают из группы, состоящей из N и CRc. В одном варианте Z является N. В другом варианте, Z является CRc.
W выбирают из группы, состоящей из N и CRc, или W является C, если W присоединен к U.
W1 выбирают из группы, состоящей из N и CRc, или W1 является C, если W1 присоединен к U.
X выбирают из группы, состоящей из N и CRc, или X является C, если X присоединен к U.
Y выбирают из группы, состоящей из N и CRc, или Y является C, если Y присоединен к U.
U выбирают из группы, состоящей из -NRa-, -CH=CH-, -С≡С- и связи.
В предпочтительном варианте данного изобретения, по меньшей мере, один из Z, X, W1, W и Y является N. Более предпочтительно, V является S и, по меньшей мере, один из Z, X, W1, W и Y является N.
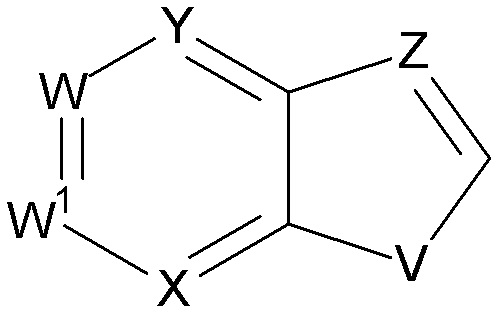

Более предпочтительно,


Даже более предпочтительно,


В предпочтительном варианте



В более предпочтительном варианте

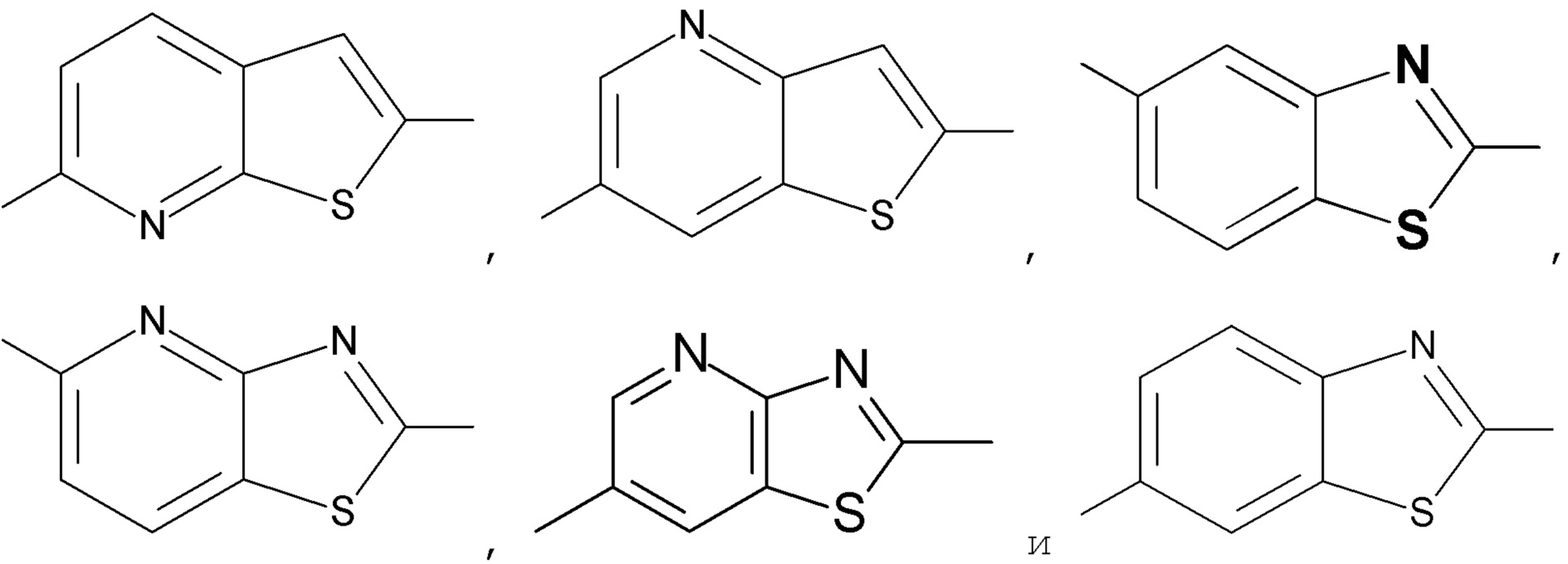
В более предпочтительном варианте



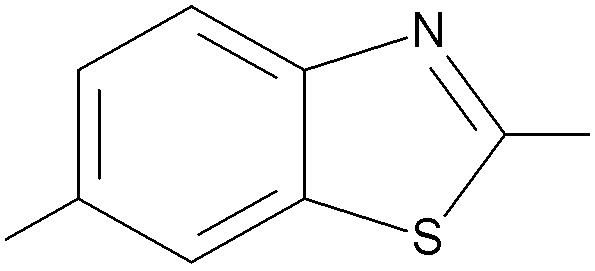
В каждом случае Ra независимо выбирают из группы, состоящей из водорода, алкила и галогеналкила. В каждом случае Ra предпочтительно независимо выбирают из группы, состоящей из водорода и алкила.
В каждом случае Rb независимо выбирают из группы, состоящей из водорода, алкила, галогеналкила и галогена. В каждом случае, Rb предпочтительно независимо выбирают из группы, состоящей из водорода и алкила.
В каждом случае, Rc независимо выбирают из группы, состоящей из водорода, алкила, галогеналкила и галогена. В каждом случае, Rc предпочтительно является водородом.
В каждом случае, Rd независимо выбирают из группы, состоящей из -галогена, -OH, -O-алкила и -водорода.
В каждом случае, Re независимо выбирают из группы, состоящей из водорода, -(CH2CH2-O)n-Rf, -(CH2CH2-O)n-(CH2CH2)-Rd, алкила, карбоциклила и гетероциклила, где алкил, карбоциклил и гетероциклил могут быть необязательно замещены. В каждом случае, Re предпочтительно независимо выбирают из группы, состоящей из водорода и алкила.
В каждом случае Rf независимо выбирают из группы, состоящей из водорода и алкила, где алкил может быть необязательно замещен. В каждом случае Rf предпочтительно независимо выбирают из группы, состоящей из водорода и алкила.
В каждом случае RA независимо выбирают из группы, состоящей из галогена, -CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)-C(O)-R11, -N(R10)-C(O)-O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила. В каждом случае RA предпочтительно, независимо выбирают из группы, состоящей из галогена, -CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)-C(O)-R11, -N(R10)-C(O)-O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила. В каждом случае RA более предпочтительно независимо выбирают из группы, состоящей из галогена, -CN, -O-R10, -NR10R11, -N(R10)-C(O)-O-R11, -(O-CH2CH2)n-Rd, =O, алкила и гетероциклила. В предпочтительном варианте RAвыбирают из галогена, -O(CH2)2F, -O(CH2)2OH, необязательно замещенного морфолино, необязательно замещенного пирролидина (такого как F-пирролидин) и необязательно замещенного пиперидина (такого как F-пиперидин), более предпочтительно, RA является необязательно замещенным пирролидином (таким как F-пирролидин) или необязательно замещенным пиперидином (таким как F-пиперидин). В предпочтительном варианте RA является необязательно замещенным пирролидином (таким как F-пирролидин).
Алкил, карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, алкенил и алкинил могут быть необязательно замещены. Примеры возможных заместителей алкильной группы включают -галоген, -CN, -OH, -O-алкил, -CF3 и -OCF3. Примеры возможных заместителей карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила включают -галоген, -CN, -OH, -O-алкил, -CF3, -OCF3 и алкил.
Если присутствует более одной группы RA и две из групп RA являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N или необязательно одну или более гетероатом (например, N, O и/или S)-содержащих групп, и где 5-8-членное кольцо может быть замещено. Примеры 5-8-членного кольца включают -O-CH2-CH2-O- и -O-CH2-O-.
В каждом случае, RB независимо выбирают из группы, состоящей из галогена, -CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)- C(O)- R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила. В каждом случае, RB предпочтительно, независимо выбирают из группы, состоящей из галогена, -CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)-C(O)-R11, -N(R10)-C(O)-O-R11, -(O-CH2CH2)n-Rd, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила. В каждом случае, RB более предпочтительно, независимо выбирают из группы, состоящей из галогена, -CN, -O-R10, -NR10R11, -N(R10)-C(O)-O-R11, -(O-CH2CH2)n-Rd, алкила и гетероциклила. В предпочтительном варианте, RB выбирают из галогена, -O-R10, -O(CH2)2F, -NR10R11, -N(R10)-C(O)-O-R11, необязательно замещенного пиперидина, необязательно замещенного пирролидона, необязательно замещенного тетрагидропирана и необязательно замещенного азаспиро[3.3]гептана (где R10 и R11 независимо являются водородом или алкилом). В более предпочтительном варианте RB является необязательно замещенным пирролидином и необязательно замещенным пиперидином.
Алкил, карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, алкенил и алкинил могут быть необязательно замещены. Примеры возможных заместителей алкильной группы включают -галоген, -CN, -OH, -O-алкил, -CF3 и -OCF3. Примеры возможных заместителей карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила включают -галоген, -CN, -OH, -O-алкил, -CF3, -OCF3 и алкил.
Если присутствует более одной группы RB и две из групп RB являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N или необязательно одну или более содержащих гетероатомы (например, N, O и/или S) групп, и где 5-8-членное кольцо может быть замещено. Примеры 5-8-членного кольца включают -O-CH2-CH2-O- и -O-CH2-O-.
В каждом случае, R10независимо выбирают из группы, состоящей из водорода, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил и гетероциклилалкил могут быть необязательно замещены. В каждом случае, R10предпочтительно, независимо выбирают из группы, состоящей из водорода и алкила. Примеры необязательных заместителей включают -OH, -O-алкил и галоген.
В каждом случае, R11 независимо выбирают из группы, состоящей из: водорода, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил и гетероциклилалкил могут быть необязательно замещены. В каждом случае, R11предпочтительно, независимо выбирают из группы, состоящей из водорода и алкила. Примеры необязательных заместителей включают -OH, -O-алкил и -галоген.
В каждом случае, R14 независимо выбирают из группы, состоящей из водорода, -(CH2CH2-O)n-Rf, -(CH2CH2-O)n- (CH2CH2)- Rd, алкила, карбоциклила и гетероциклила, где алкил, карбоциклил и гетероциклил могут быть необязательно замещены. В каждом случае, R14предпочтительно, независимо выбирают из группы, состоящей из водорода и алкила. Примеры необязательных заместителей включают -OH, -O-алкил и галоген.
В каждом случае, n независимо равен от 1 до 4; предпочтительно, в каждом случае n равен 1 или 2.
В каждом случае, m независимо равен от 1 до 4, предпочтительно, в каждом случае, m равен 2 или 3.
Предпочтительные соединения формулы (I) включают соединения, данные в разделе примеров данной заявки. Особенно предпочтительными соединениями являются
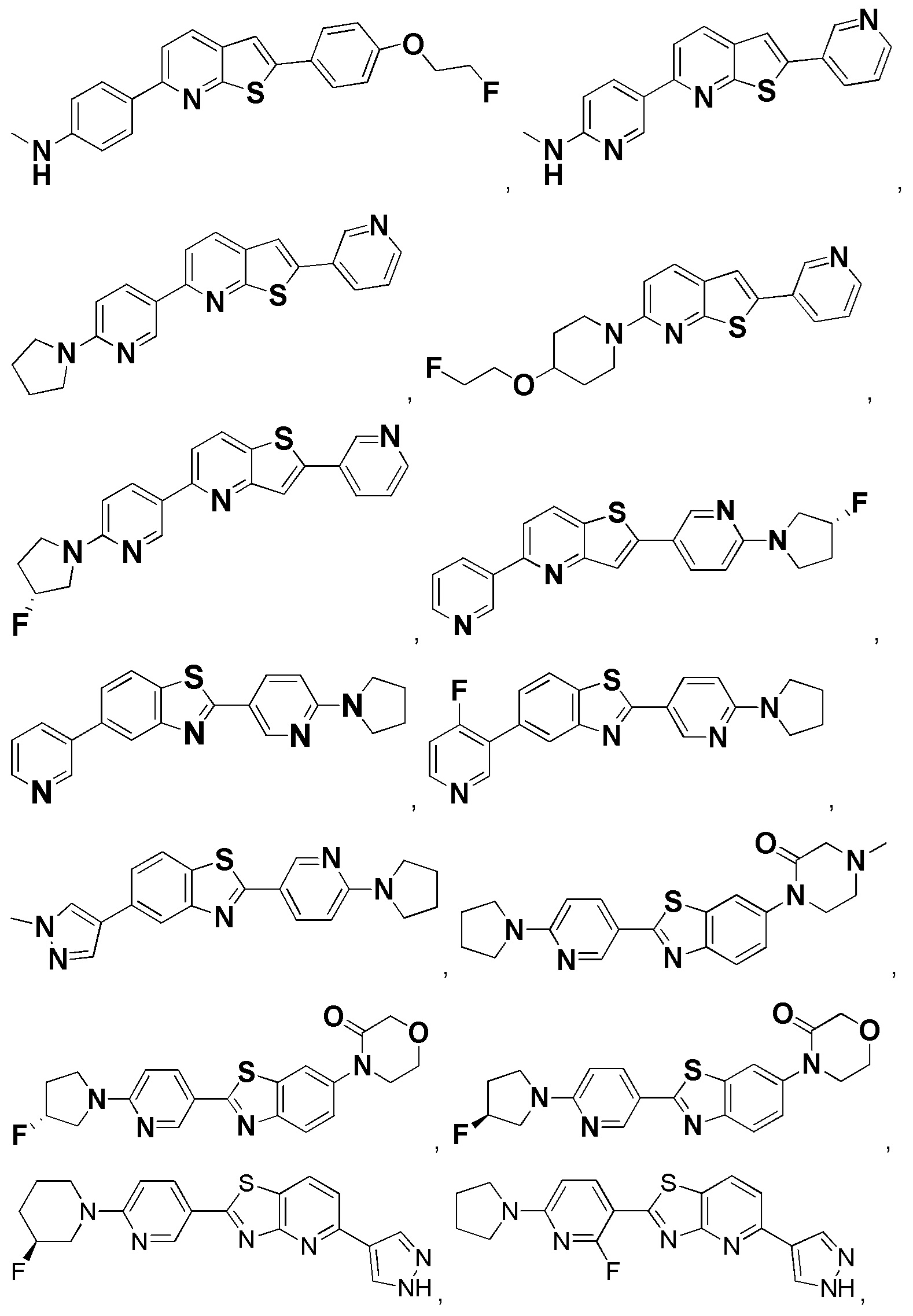

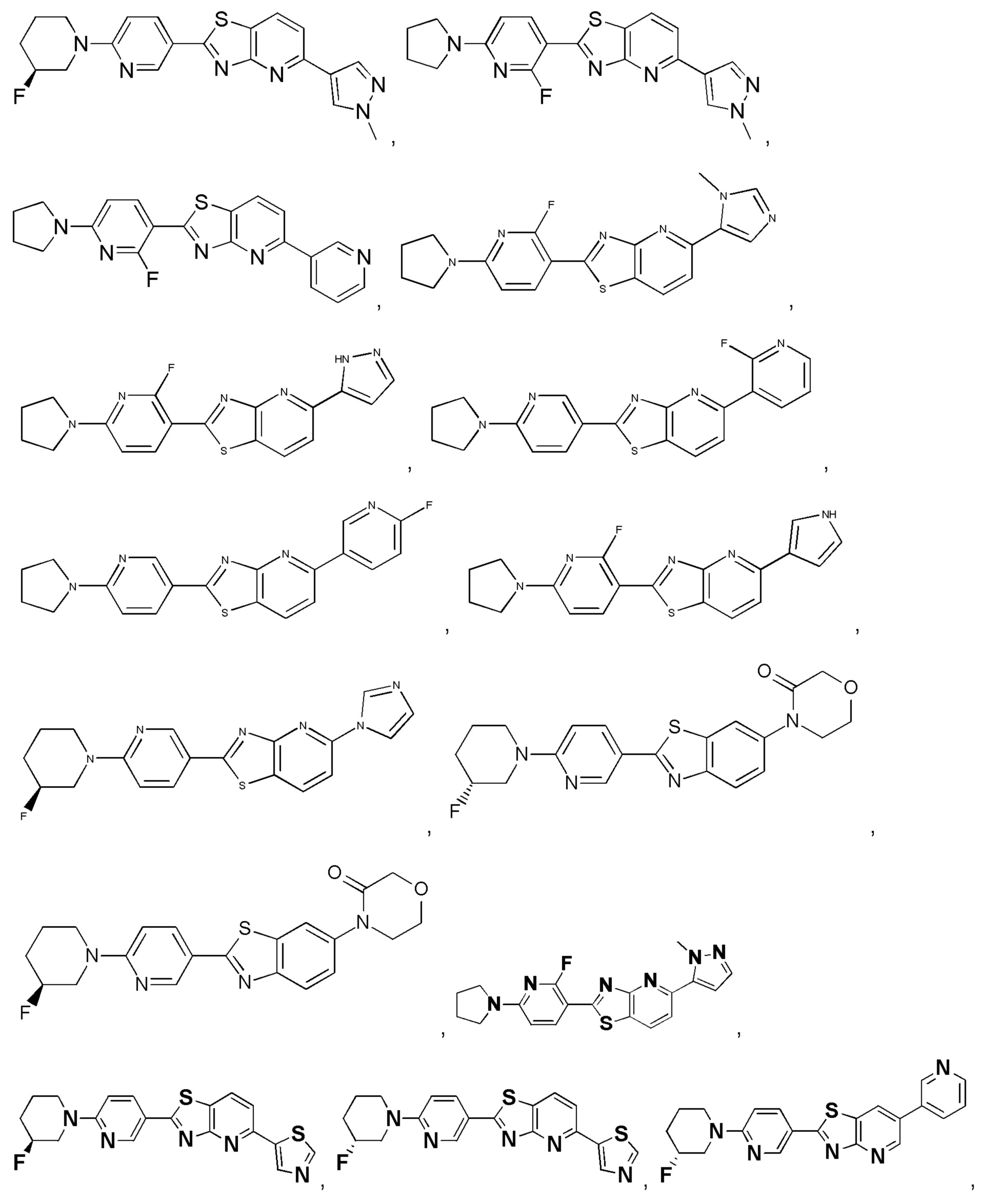
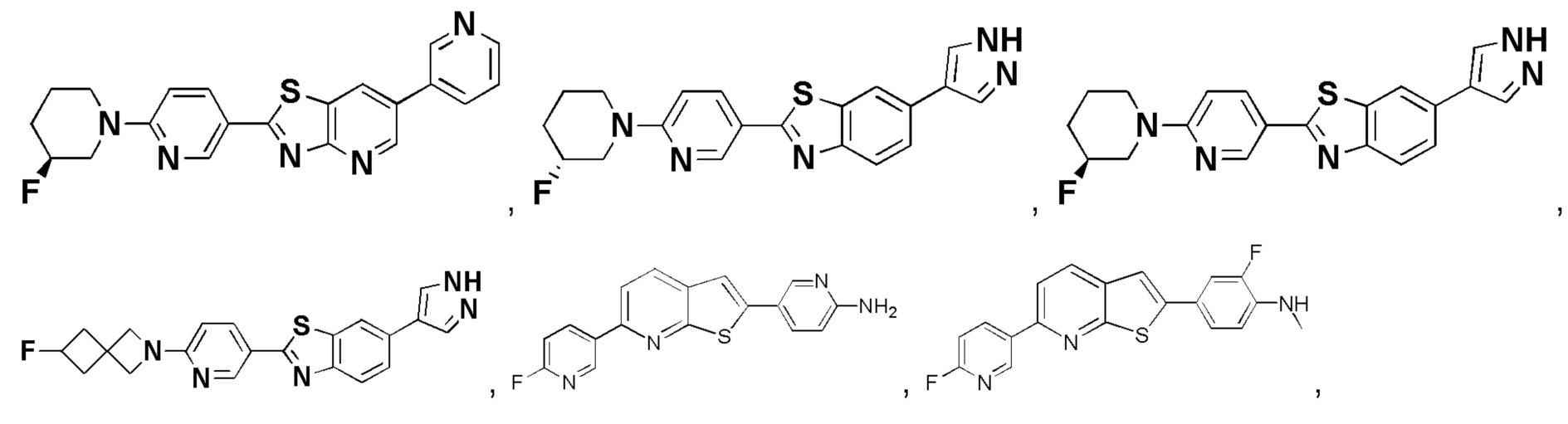

В другом варианте, данное изобретение относится к соединению формулы (II):

(II)
и все его определяемо меченые производные, стереоизомеры, рацемические смеси, фармацевтически приемлемые соли, гидраты, сольваты, пролекарства и полиморфы.
Другой предпочтительный вариант соединения формулы (II) выбирают из

(IIa)




В одном варианте,

В другом варианте,















Примеры предпочтительных групп включают


В одном варианте,




V2 выбирают из группы, состоящей из S, NRa и CRbRb. Предпочтительно, V2 является S.
Z2 выбирают из группы, состоящей из N и CRc. В одном варианте Z2 является N. В другом варианте, Z2 является CRc.
В каждом случае, Ra независимо выбирают из группы, состоящей из водорода, алкила и галогеналкила. В каждом случае, Ra предпочтительно независимо выбирают из группы, состоящей из водорода и алкила.
В каждом случае, Rb независимо выбирают из группы, состоящей из водорода, алкила, галогеналкила и галогена. В каждом случае, Rb предпочтительно независимо выбирают из группы, состоящей из водорода и алкила.
В каждом случае, Rc независимо выбирают из группы, состоящей из водорода, алкила, галогеналкила и галогена. В каждом случае, Rc предпочтительно является водородом.
В каждом случае, Rd независимо выбирают из группы, состоящей из галогена, -OH, -O-алкила и водорода.
В каждом случае, Re независимо выбирают из группы, состоящей из водорода, -(CH2CH2-O)n-Rf, -(CH2CH2-O)n- (CH2CH2)- Rd, алкила, карбоциклила и гетероциклила, где алкил, карбоциклил и гетероциклил могут быть необязательно замещены. В каждом случае, Re предпочтительно независимо выбирают из группы, состоящей из водорода и алкила.
В каждом случае, Rf независимо выбирают из группы, состоящей из водорода и алкила, где алкил может быть необязательно замещен. В каждом случае, Rf предпочтительно независимо выбирают из группы, состоящей из водород и алкил.
В каждом случае, RD независимо выбирают из группы, состоящей из галогена, CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)- C(O)- R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила.
Если



Если

Алкил, карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, алкенил и алкинил могут быть необязательно замещены. Примеры возможных заместителей алкильных групп включают -галоген, -CN, -OH, -O-алкил, -CF3 и -OCF3. Примеры возможных заместителей карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила включают -галоген, -CN, -OH, -O-алкил, -CF3, -OCF3 и алкил.
Если присутствует более одной группы RD и две из групп RD являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N или необязательно одну или более содержащих гетероатомы (например, N, O и/или S) групп, и где 5-8-членное кольцо может быть замещено.
В каждом случае, RE независимо выбирают из группы, состоящей из галогена, CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)- C(O)- R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, =O, алкила, карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила. В каждом случае, RE предпочтительно, независимо выбирают из группы, состоящей из галогена, -CN, -O-R10, -NR10R11, -CONR10R11, -N(R10)- C(O)- R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила. В каждом случае, RE более предпочтительно, независимо выбирают из группы, состоящей из галогена, -CN, -O-R10, -NR10R11, -N(R10)- C(O)- O-R11, -(O-CH2CH2)n-Rd, алкила и гетероциклила. Даже более предпочтительно, RE является галогеном и/или F-пирролидином.
Алкил, карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, алкенил и алкинил могут быть необязательно замещены. Примеры возможных заместителей алкильных групп включают -галоген, -CN, -OH, -O-алкил, -CF3 и -OCF3. Примеры возможных заместителей карбоциклила, карбоциклилалкила, гетероциклила, гетероциклилалкила, алкенила и алкинила включают -галоген, -CN, -OH, -O-алкил, -CF3, -OCF3 и алкил.
Если присутствует более одной группы RE, и две из групп RE являются соседними, они могут быть необязательно взяты вместе и могут образовывать 5-8-членное кольцо, содержащее атомы углерода и, необязательно, один или более гетероатомов, выбранных из O, S или N или, необязательно, одну или более гетероатом (например, N, O и/или S)-содержащих групп, и где 5-8-членное кольцо может быть замещено.
В каждом случае R10независимо выбирают из группы, состоящей из: водорода, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил и гетероциклилалкил могут быть необязательно замещены. В каждом случае, R10предпочтительно, независимо выбирают из группы, состоящей из водорода и алкила. Примеры необязательных заместителей включают -OH, -O-алкил и галоген.
В каждом случае R11 независимо выбирают из группы, состоящей из: водорода, алкила, карбоциклила, карбоциклилалкила, гетероциклила и гетероциклилалкила, где алкил, карбоциклил, карбоциклилалкил, гетероциклил и гетероциклилалкил могут быть необязательно замещены. В каждом случае R11предпочтительно независимо выбирают из группы, состоящей из водорода и алкила. Примеры необязательных заместителей включают -OH, -O-алкил и галоген.
В каждом случае R14 независимо выбирают из группы, состоящей из водорода, -(CH2CH2-O)n-Rf, -(CH2CH2-O)n- (CH2CH2)- Rd, алкила, карбоциклила и гетероциклила, где алкил, карбоциклил и гетероциклил могут быть необязательно замещены. В каждом случае, R14предпочтительно, независимо выбирают из группы, состоящей из водорода и алкила. Примеры необязательных заместителей включают -OH, -O-алкил и галоген.
В каждом случае n независимо равен от 1 до 4; предпочтительно, в каждом случае n равен 1 или 2.
В каждом случае m независимо равен от 1 до 4, предпочтительно, в каждом случае m равен 2 или 3.
Предпочтительными соединениями формулы (II) являются соединения, указанные в разделе примеров данной заявки. Особенно предпочтительными являются

Соединения в соответствии с данным изобретением могут быть определямо мечены. Тип метки особенно не ограничен и зависит от выбранного способа определения. Примеры возможных меток включают изотопы, такие как радионуклиды, позитронные излучатели, гамма излучатели, а также флуоресцентные, люминесцентные и хромогенные метки. Что касается определяемо меченых соединений в соответствии с данным изобретением, которые содержат радиоизотоп, позитронный излучатель или гамма излучатель, понятно, что радиоизотоп, позитронный излучатель или гамма излучатель должны присутствовать в количестве, которое не равно природному количеству соответствующего радиоизотопа, позитронного излучателя или гамма излучателя. Кроме того, применяемое количество должно позволять определение выбранным способом определения.
Примеры подходящих изотопов, таких как радиоизотопы, позитронные излучатели и гамма излучатели включают2H,3H,18F,123I,124I,125I,131I,11C,13N,15O и77Br, предпочтительно,2H,3H,11C,13N,15O и18F, более предпочтительно,2H,3H и18F, даже более предпочтительно,18F.
18F-меченые соединения особенно подходят для визуализации, такой как ПЭТ. Соответствующие соединения, которые содержат фтор, имеющие природный19F изотоп, также особенно интересны, так как они могут применяться в качестве аналитических стандартов и ссылок во время производства, контроля качества, выделения и клинического применения их18F аналогов.
Далее, замещение изотопами, такими как дейтерий, т.е.2H, может давать определенные диагностические и терапевтические преимущества благодаря большей метаболической стабильности через снижение, например, дефторирования, повышенный период полувыведения in vivo или пониженную дозировку, сохраняя или улучшая исходную эффективность соединения.
Изотопные варианты соединений в соответствии с данным изобретением обычно могут быть получены обычными методами, такими как иллюстративные методы, или способами получения, описанными в примерах и примерах получения, представленных ниже, с применением подходящих изотопных вариантов подходящих реагентов, коммерчески доступных или полученных известными методами синтеза.
Радионуклиды, позитронные излучатели и гамма излучатели могут быть включены в соединения в соответствии с данным изобретением способами, которые обычны в области органического синтеза. Обычно их вводят с применением соответствующе меченого исходного материала при получении желаемых соединений в соответствии с данным изобретением. Иллюстративные способы введения определяемых меток описаны, например, в US 2012/0302755.
Положение, в котором определяемая метка присоединяется к соединению в соответствии с данным изобретением, особенно не ограничено.
Радионуклиды, позитронные излучатели и гамма излучатели, например, могут быть присоединены в любом положении, где соответствующий не излучающий атом также может быть присоединен. Например,18F может быть присоединен в любом положении, которое подходит для присоединения F. То же самое применяется к другим радионуклидам, позитронным излучателям и гамма излучателям. Благодаря простоте синтеза, предпочтительно присоединять18F,123I,124I,125I,131I и77Br в качестве RA, RB, RD и RE или части RA, RB, RD и RE. Если3H применяют в качестве определяемой метки, его, предпочтительно, присоединяют в форме -C(3H)3 в любом положении, в котором может быть присоединена метильная группа. Альтернативно,3H per se может быть присоединен в любом доступном положении. Если2H применяют в качестве определяемой метки, его, предпочтительно, присоединяют в форме -C(2H)3 в любом положении, в котором может быть присоединена метильная группа. Легкодоступные положения включают Re и R14.11C,13N и15O могут быть введены в соединения в соответствии с данным изобретением в любом положении, где имеются C, N и O.
Диагностические композиции
Соединения в соответствии с данным изобретением особенно подходят для визуализации альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви. Что касается альфа-синуклеинового белка, соединения в соответствии с данным изобретением особенно подходят для связывания с различными типами альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейрит Леви.
Благодаря дизайну и связывающим характеристикам соединения в соответствии с данным изобретением подходят для применения в диагностике расстройств и аномалий, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви. Соединения в соответствии с данным изобретением особенно подходят для позитронно-эмиссионной томографии альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви. Заболевания, включающие альфа-синуклеиновые агрегаты, обычно перечислены как синуклеинопатии (или α-синуклеинопатии). Соединения в соответствии с данным изобретением подходят для применения в диагностике расстройств включающих, но не ограниченных ими, болезнь Паркинсона (БП). Синуклеинопатии включают болезнь Паркинсона (спорадическую, семейную с альфа-синуклеиновыми мутациями, семейную с мутациями, отличными от мутаций альфа-синуклеина, истинную вегетативную недостаточность или дисфагию телец Леви), слабоумие с тельцами Леви (ʺчистоеʺ слабоумие с тельцами Леви), спорадическую болезнь Альцгеймера, семейную болезнь Альцгеймера с мутациями APP, семейную болезнь Альцгеймера с PS-1, PS-2 или другими мутациями, семейную британскую деменцию, вариант с тельцами Леви болезни Альцгеймера и обычным старением (синдром Дауна). Синуклеинопатии с нейронными и глиальными агрегатами альфа-синуклеина включают множественную системную атрофию (синдром Шая-Дрейджера, стрианигральную дегенерацию и оливопонтоцеребеллярную атрофию). Другие заболевания, которые могут иметь альфа-синуклеин-иммунореактивные очаги, включают травматическое повреждение мозга, хроническую травматическую энцефалопатию, таупатии (болезнь Пика, лобно-височную деменцию, прогрессирующий надъядерный паралич, кортико-базальную дегенерацию и болезнь Ниманна-Пика типа C1), болезнь двигательного нейрона, амиотрофический боковой склероз (спорадический, семейный и комплекс Гуама ALS-деменция), нейроаксональную дистрофию, нейродегенерацию с аккумуляцией железа в мозге 1 типа (синдром Галлервордена-Шпатца), прионные болезни, атаксию-телеангиэктазию, синдром Мейжа, подострый склерозирующий панэнцефалит, болезнь Гоше, а также другие лизосомные болезни накопления (включая синдром Куфора-Ракеба и синдром Санфилиппо) и расстройство поведения в фазе сна с быстрыми движениями глаз (БДГ). (Jellinger, Mov Disord 2003, 18 Suppl. 6, S2-12; Galvin et al. JAMA Neurology 2001, 58 (2), 186-190; Kovari et al., Acta Neuropathol. 2007, 114(3), 295-8; Saito et al., J Neuropathol Exp Neurol. 2004, 63(4), 323-328; McKee et al., Brain, 2013, 136(Pt 1), 43-64; Puschmann et al., Parkinsonism Relat Disord 2012, 18S1, S24-S27; Usenovic et al., J Neurosci. 2012, 32(12), 4240-4246; Winder-Rhodes et al., Mov Disord. 2012, 27(2), 312-315; Ferman et al., J Int Neuropsychol Soc. 2002, 8(7), 907-914). Предпочтительно, соединения в соответствии с данным изобретением подходят для применения в диагностике болезни Паркинсона (БП).
В способах диагностики расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, такого как болезнь Паркинсона или предрасположенность к ней у субъекта, способ включает:
a) введение субъекту диагностически эффективного количества соединения в соответствии с данным изобретением;
b) распределение соединения в соответствии с данным изобретением в целевой ткани (такой как ткань мозга или жидкости тела, такие как спинномозговая жидкость (СМЖ)); и
c) визуализацию целевой ткани, где увеличение связывания соединения в соответствии с данным изобретением с целевой тканью по сравнению с нормальным контрольным уровнем связывания указывает на то, что субъект страдает или подвержен риску развития расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви.
Соединения в соответствии с данным изобретением могут применяться для визуализации альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в любом образце или определенной части тела или области тела пациента, который предположительно содержит альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви. Соединения в соответствии с данным изобретением способны проникать через гематоэнцефалический барьер. Следовательно, они особенно подходят для визуализации альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в мозге, а также в жидкостях тела, таких как спинномозговая жидкость (СМЖ).
При применении в диагностике, соединение в соответствии с данным изобретением предпочтительно вводят в диагностической композиции, содержащей соединение в соответствии с данным изобретением. "Диагностическая композиция" определена в данном изобретении как композиция, содержащая одно или более соединений в соответствии с данным изобретением в форме, подходящей для введения пациенту, например, млекопитающему, такому как человек, и которая подходит для применения в диагностике определенного расстройства или аномалии в ткани. Предпочтительно, диагностическая композиция также содержит физиологически приемлемый носитель, разбавитель, адъювант или эксципиент. Введение, предпочтительно, проводят, как описано ниже. Более предпочтительно, инъекцией композиции в водном растворе. Такая композиция может необязательно содержать другие ингредиенты, такие как буферы; фармацевтически приемлемые стабилизаторы (например, циклодекстрины или поверхностно-активные вещества, такие как Плуроник, Твин или фосфолипиды); и фармацевтически приемлемые стабилизаторы или антиоксиданты (такие как аскорбиновая кислота, гентизиновая кислота или пара-аминобензойная кислота). Доза соединения в соответствии с данным изобретением варьируется в зависимости от точного вводимого соединения, массы тела пациента и других переменных, которые очевидны терапевту, специализирующемуся в данной области.
Хотя возможно вводить соединения в соответствии с данным изобретением отдельно, предпочтительно составлять их в диагностическую композицию согласно стандартной фармацевтической практике. Таким образом, в изобретении также представлена диагностическая композиция, которая содержит диагностически эффективное количество соединения в соответствии с данным изобретением в смеси с фармацевтически приемлемым носителем, разбавителем, адъювантом и эксципиентом.
Фармацевтически приемлемые эксципиенты хорошо известны в области фармацевтики и описаны, например, в Remington's Pharmaceutical Sciences, 15th Ed., Mack Publishing Co., New Jersey (1975). Фармацевтический эксципиент может быть выбран в соответствии с предполагаемым способом введения и стандартной фармацевтической практикой. Эксципиент должен быть приемлем в том, что не должен вредить получателю.
Фармацевтически приемлемые эксципиенты, которые могут применяться в составе диагностической композиции в соответствии с данным изобретением, могут включать, например, носители, наполнители, разбавители, растворители, такие как одноатомные спирты, такие как этанол, изопропанол, и многоатомные спирты, такие как гликоли, и съедобные масла, такие как соевое масло, кокосовое масло, оливковое масло, сафлоровое масло, хлопковое масло, сложные масляные эфиры, такие как этилолеат, изопропилмиристат, связующие агенты, адъюванты, солюбилизаторы, загустители, стабилизаторы, разрыхлители, глиданты, смазывающие агенты, буферные агенты, эмульгаторы, смачивающие агенты, суспендирующие агенты, подсластители, красители, вкусовые добавки, покрытия, консерванты, антиоксиданты, эмульгаторы, модификаторы и улучшители доставки лекарства, такие как фосфат кальция, стеарат магния, тальк, моносахариды, дисахариды, крахмал, желатин, целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза натрия, декстроза, гидроксипропил-β-циклодекстрин, поливинилпирролидон, низкоплавкие воски и ионообменные смолы.
Способы введения (доставки) соединений в соответствии с данным изобретением включают, но не ограничены ими, один или более из: перорального (например, в виде таблетки, капсулы или проглатываемого раствора), местного, слизистого (например, в виде назального спрея или аэрозоля для ингаляций), назального, парентерального (например, в виде формы для инъекций), желудочно-кишечного, интраспинального, внутрибрюшинного, внутримышечного, внутривенного, внутриматочного, внутриглазного, чрезкожного, внутричерепного, внутритрахейного, внутривагинального, интрацеребровентрикулярного, интрацеребрального, подкожного, офтальмологического (включая интраветриальный или интракамеральный), чрезкожного, ректального, буккального, эпидурального и подъязычного.
Например, соединения могут вводиться перорально в форме таблеток, капсул, капсул, эликсиров, растворов или суспензий, которые могут содержать вкусовые или красящие добавки, для немедленного, отложенного, модифицированного, замедленного, импульсного или контролируемого выделения.
Таблетки могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двухосновный фосфат кальция и глицин, разрыхлители, такие как крахмал (предпочтительно, кукурузный, картофельный или тапиоковый крахмал), гликолят крахмала натрия, кроскармеллозу натрия и определенные комплексные силикаты и гранулирующие связующие агенты, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и аравийская камедь. Дополнительно могут быть включены смазывающие агенты, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Твердые композиции подобного типа также могут применяться в качестве наполнителей для желатиновых капсул. Предпочтительные эксципиенты для таких случаев могут включать лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. Для водных суспензий и/или эликсиров агент может быть объединен с различными подсластителями или вкусовыми добавками, красящими веществами или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как пропиленгликоль и глицерин, и их сочетания.
Предпочтительно, для диагностики соединения в соответствии с данным изобретением вводят парентерально. Если соединения в соответствии с данным изобретением вводят парентерально, то примеры такого введения включают одно или более из: внутривенного, внутриартериального, внутрибрюшинного, интратекального, интравентрикулярного, интрауретрального, интрастернального, внутричерепного, внутримышечного или подкожного введения соединений; и/или с применением инфузионных методов. Для парентерального введения соединения, предпочтительно, применяют в форме стерильного водного раствора, который может содержать другие вещества, например, достаточное количество соли или глюкозы для того, чтобы раствор был изотоничным к крови. Водные растворы должны быть подходящим образом буферированы (предпочтительно, до pH от 3 до 9), при необходимости. Получение подходящих парентеральных композиций в стерильных условиях легко проводится стандартными фармацевтическими методами, хорошо известными специалистам в данной области техники.
Как показано, соединения в соответствии с данным изобретением могут вводиться интраназально или ингаляцией, и обычно доставляют в виде сухого порошкового ингалятора или аэрозольного спрея из контейнера под давлением, помпы, спрея или небулайзера с применением подходящего газа-вытеснителя, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134AT) или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA), двуокись углерода или другой подходящий газ. В аэрозоли под давлением доза может быть определена нажатием клапана с получением отмеренного количества. Контейнер под давлением, помпа, спрей или небулайзер может содержать раствор или суспензию активного соединения, например, с применением смеси этанола и газа-вытеснителя в качестве растворителя, который может дополнительно содержать смазывающий агент, например, сорбитантриолеат. Капсулы и картриджи (например, желатиновые) для применения в ингаляторе или инсуффляторе могут содержать порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал.
Альтернативно, соединения в соответствии с данным изобретением могут вводиться в форме суппозитория или пессария, или могут наноситься местно в форме геля, гидрогеля, лосьона, раствора, крема, мази или присыпки. Соединения в соответствии с данным изобретением также могут вводиться кожно или чрезкожно, например, с применением пластыря.
Они также могут вводиться легочным или ректальным путем. Они также могут вводиться глазным путем. Для офтальмологического применения, соединения могут быть составлены в виде микронизированных суспензий в изотоническом, pH скорректированном стерильном физиологическом растворе или, предпочтительно, в виде растворов в изотоническом, pH скорректированном стерильном физиологическом растворе, необязательно в сочетании с консервантом, таким как хлорид бензалкония. Альтернативно, они могут быть составлены в виде мази, такой вазелин.
Для местного нанесения на кожу соединения в соответствии с данным изобретением могут быть составлены в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное в, например, смеси с одним или более из следующих: минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, эмульгирующий воск и вода. Альтернативно, они могут быть составлены в виде подходящего раствора или крема, суспендированного или растворенного в, например, смеси одного или более из следующих: минеральное масло, сорбитан моностеарат, полиэтиленгликоль, жидкий парафин, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и вода.
Обычно терапевт определяет точную дозу, которая наиболее подходит для конкретного субъекта. Определенный уровень дозы и частота введения для конкретного индивидуума может варьироваться и зависит от множества факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и длительность действия этого соединения, возврат, массу тела, общее состояние здоровья, пол, режим питания, способ и время введения, скорость выведения, сочетание лекарственных средств, тяжесть конкретного состояния и индивидуальная терапия.
Обычно доза, предпочтительно, составляет от 0,001 мкг/кг до 10 мкг/кг, предпочтительно, от 0,01 мкг/кг до 1,0 мкг/кг. Доза зависит от способа введения. Должно быть понятно, что необходимо проводить рутинные вариации дозы в зависимости от возраста и массы тела пациента, а также от тяжести расстройства или аномалии. Точная доза и способ введения находится исключительно в компетенции лечащего врача или ветеринара.
Диагностические композиции в соответствии с данным изобретением могут быть получены методом, известным per se специалисту в данной области техники, и описанным, например, в Remington's Pharmaceutical Sciences, 15th Ed., Mack Publishing Co., New Jersey (1975).
Соединения в соответствии с данным изобретением применяют в качестве in vitro аналитического стандарта или in vitro инструмента для скрининга. Их также применяют в in vivo диагностических способах.
Соединения в соответствии с данным изобретением также могут быть в виде смеси, содержащей соединение в соответствии с данным изобретением и, по меньшей мере, одного соединения, выбранного из визуализирующего агента, отличного от соединения в соответствии с данным изобретением, фармацевтически приемлемого носителя, разбавителя или наполнителя. Визуализирующий агента, отличный от соединения в соответствии с данным изобретением, предпочтительно, присутствует в диагностически эффективном количестве. Более предпочтительно, визуализирующим агентом, отличным от соединения в соответствии с данным изобретением, является абета или тау визуализирующий агент.
Диагностика расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, или предрасположенности к расстройству или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, у пациента может проводиться через определение специфического связывания соединения в соответствии с данным изобретением с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, в образце или in situ, которое включает:
(a) контактирование образца или определенной части тела или области тела пациента, предположительно содержащего альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением в соответствии с данным изобретением, которое связывает альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви,
(b) связывание соединения в соответствии с данным изобретением с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви или нейриты Леви)(далее "комплекс соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви)" называют "комплекс соединение/белковый агрегат"),
(c) определение образования комплекса соединение/белковый агрегат,
(d) необязательно корреляцию присутствия или отсутствия комплекса соединение/белковый агрегат с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела,
(e) необязательно сравнение количества комплекса соединение/белковый агрегат с нормальным контрольным значением, где увеличение количества комплекса соединение/белковый агрегат по сравнению с нормальным контрольным значением может показывать, что пациент страдает или подвержен риску развития расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви.
Соединение в соответствии с данным изобретением может контактировать с образцом или определенной частью тела или областью тела, которые предположительно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, подходящим способом. В in vitro способах соединение в соответствии с данным изобретением и жидкий образец могут быть просто смешаны. В in vivo тестах соединение в соответствии с данным изобретением обычно вводят пациенту любым подходящим способом. Эти способы введения включают, но не ограничены ими, один или более из: перорального (например, таблетка, капсула или съедобный раствор), местного, слизистого (например, в виде назального спрея или аэрозоля для ингаляций), назального, парентерального (например, в виде формы для инъекций), желудочно-кишечного, интраспинального, внутрибрюшинного, внутримышечного, внутривенного, внутриматочного, внутриглазного, чрезкожного, внутричерепного, внутритрахейного, внутривагинального, интрацеребровентрикулярного, интрацеребрального, подкожного, офтальмологического (включая интраветриальный или интракамеральный), чрезкожного, ректального, буккального, эпидурального и подъязычного. В некоторых случаях, предпочтительно парентеральное введение.
После контакта образца или определенной части тела или области тела с соединением в соответствии с данным изобретением, соединение связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви. Количество времени, необходимое для связывания, зависит от типа теста (например, in vitro или in vivo) и может быть определено специалистом в данной области техники обычными экспериментами.
Соединение, связанное с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, затем может быть определено любым подходящим способом. Определенный выбранный способ зависит от выбранной определяемой метки. Примеры возможных способов включают, но не ограничены ими, методику флуоресцентной визуализации или методику радионуклидной визуализации, такую как позитронно-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ), магнитно-резонансная томография (МРТ) и контрастная магнитно-резонансная томография (МРТ). Они описаны и позволяют визуализацию амилоидных биомаркеров. Методика флуоресцентной визуализации и/или методика радионуклидной визуализации может применяться для отслеживания и/или визуализации распределения определяемо меченого соединения в образце или определенной части тела или области тела.
Присутствие или отсутствие комплекса соединение/белковый агрегат затем необязательно коррелируют с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части или области тела. Наконец, количество комплексов соединение/белковый агрегат может сравниваться с нормальным контрольным значением, которое определено в образце или определенной части тела или области тела здорового субъекта, где повышение количества комплекса соединение/белковый агрегат по сравнению с нормальным контрольным значением может указывать на то, что пациент страдает от или подвержен риску развития расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви.
Данное изобретение также относится к способу определения количества альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в ткани и/или жидкости тела. Этот способ включает стадии:
(a) получения образца, типового для исследуемой ткани и/или жидкости тела;
(b) тестирования образца на присутствие альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, с соединением в соответствии с данным изобретением;
(c) определения количества соединения, связанного с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви; и
(d) расчета количества альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви,в ткани и/или жидкости тела.
Образец может тестироваться на присутствие альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, с соединением в соответствии с данным изобретением путем контакта с соединением в соответствии с данным изобретением, позволяя соединению в соответствии с данным изобретением связываться с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, сполучением комплекса соединение/белковый агрегат, и определяя образование комплекса соединение/белковый агрегат как объясняется выше.
Отслеживание минимального остаточного расстройства у пациента, страдающего расстройством или аномалией, связанными с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, которого лечили лекарственным средством, с соединением в соответствии с данным изобретением может быть достигнуто
(a) контактом образца или определенной части тела или области тела, предположительно содержащих альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением в соответствии с данным изобретением;
(b) связыванием соединения с альфа-синуклеиновыми агрегатами включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/белковый агрегат;
(c) определением образования комплекса соединение/белковый агрегат;
(d) необязательной корреляцией присутствия или отсутствия комплекса соединение/белковый агрегат с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательным сравнением количества комплекса соединение/белковый агрегат с нормальным контрольным значением, где повышение количества агрегата по сравнению с нормальным контрольным значением может указывать на то, что пациент может страдать минимальным остаточным заболеванием.
Порядок проведения стадий (a)-(e) уже объяснен выше.
В способе отслеживания минимального остаточного расстройства, способ может также содержать стадии (i)-(vi) до стадии (a):
(i) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(ii) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iii) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iv) корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(v) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением; и
(vi) лечение пациента лекарственным средством;
Необязательно способ может включать стадию (A) после стадии (d) или стадии (e):
(A) сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенного на стадии (iv), с количеством комплекса соединение/(альфа-синуклеиновые агрегаты включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенным на стадии (d).
Для отслеживания минимального остаточного расстройства в течение времени, стадии (a)-(c) и необязательные стадии (d) и (e) способа отслеживания минимального остаточного расстройства, могут повторяться один или более раз.
В способе отслеживания минимального остаточного расстройства количество комплексов соединение/белковый агрегат может необязательно сравниваться в различные моменты времени в течение лечения, например, до и после начала лечения, или в различные моменты времени после начала лечения. Изменение, особенно, понижение количества комплекса соединение/белковый агрегат, может указывать на снижение остаточного расстройства.
Прогнозирование реакции пациента, страдающего расстройством или аномалией, связанными с альфа-синуклеиновыми агрегатами включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, и леченного лекарственным средством, может проводиться
(a) контактом образца или определенной части тела или области тела, предположительно содержащих альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением в соответствии с данным изобретением;
(b) связыванием соединения с альфа-синуклеиновыми агрегатами включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/белковый агрегат;
(c) определением образования комплекса соединение/белковый агрегат;
(d) необязательной корреляцией присутствия или отсутствия комплекса соединение/белковый агрегат с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательным сравнением количества комплекса соединение/белковый агрегат с нормальным контрольным значением.
Порядок проведения стадий (a)-(e) уже объяснен выше.
В способе прогнозирования реакции, способ может также содержать стадии (i)-(vi) до стадии (a):
(i) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(ii) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iii) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(iv) корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(v) необязательное сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением; и
(vi) лечение пациента лекарственным средством;
Необязательно способ может включать стадию (A) после стадии (d) или стадии (e):
(A) сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенного на стадии (iv), с количеством комплекса соединение/(альфа-синуклеиновые агрегаты включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви), определенным на стадии (d).
Для определения реакции в течение времени, стадии (a)-(c) и необязательные стадии (d) и (e) способа определения реакции могут повторяться один или более раз.
В способе прогнозирования реакции количество комплексов соединение/белковый агрегат может необязательно сравниваться в различные моменты времени в течение лечения, например, до и после начала лечения, или в различные моменты времени после начала лечения. Изменение, особенно, понижение количества комплекса соединение/белковый агрегат, может указывать на то, что пациент с высокой вероятностью реагирует на соответствующее лечение.
Необязательно диагностическая композиция может применяться до, во время или после хирургического вмешательства (например, глубокой стимуляции головного мозга (DBS)) и не инвазивной стимуляции головного мозга (такой как периодическая транскраниальная магнитная стимуляция (пТМС)), для визуализации альфа-синуклеиновых агрегатов до, во время и после таких процедур. Хирургическое вмешательство, включая DBS, улучшают прогрессирующие симптомы БП наряду с наилучшей современной медицинской терапией. В течение 2 последних десятилетий, пТМС активно изучали в качестве возможного лечения БП (Ying-hui Chou et al. JAMA Neurol. 2015 April 1; 72(4): 432-440).
В другом варианте изобретения, диагностическая композиция может применяться в способе сбора данных для отслеживания остаточного расстройства у пациента, страдающего расстройством или аномалией, связанными с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, которого лечат хирургическим вмешательством или не инвазивными методами стимуляции, где способ включает:
(a) контактирование образца или определенной части тела или области тела, которые возможно содержат альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви, с соединением, определенным по любому из пунктов 1-8, где соединение специфически связывается с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви;
(b) связывание соединения с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, с получением комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(c) определение образования комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви);
(d) необязательную корреляцию присутствия или отсутствия комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви, в образце или определенной части тела или области тела; и
(e) необязательно сравнение количества комплекса соединение/(альфа-синуклеиновые агрегаты, включающие, но не ограниченные ими, тельца Леви и/или нейриты Леви) с нормальным контрольным значением.
Соединение в соответствии с данным изобретением также может вводиться в аналитический набор для определения альфа-синуклеиновых белковых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви. Аналитический набор обычно включает контейнер, содержащий одно или более соединений в соответствии с данным изобретением, и инструкции по применению соединения для цели связывания с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви, для образования комплекса соединение/белковый агрегат и определения образования комплекса соединение/белковый агрегат, так, чтобы присутствие или отсутствие комплекса соединение/белковый агрегат коррелировало с присутствием или отсутствием альфа-синуклеиновых агрегатов, включающих, но не ограниченных ими, тельца Леви и/или нейриты Леви.
Термин "аналитический набор" в общем относится к любому диагностическому набору, известному в данной области техники. Более конкретно, последний термин относится к диагностическому набору, описанному у Zrein et al., Clin. Diagn. Lab. Immunol., 1998, 5, 45-49.
Радиофармацевтические препараты
Соединения в соответствии с данным изобретением также могут применяться в наборах для получения радиофармацевтических препаратов. Из-за радиоактивного распада, радиофармацевтические средства обычно получают непосредственно перед применением. Набор содержит предшественник соединения в соответствии с данным изобретением и агент, который взаимодействует с предшественником для введения радиоактивной метки в соединение в соответствии с данным изобретением. Предшественник соединения в соответствии с данным изобретением может, например, быть соединением, имеющим формулу (IIIa), (IIIb), (IVa) или (IVb). Агентом может быть агент, который вводит радиоактивную метку, такую как18F.
Фармацевтические композиции
Соединения в соответствии с данным изобретением могут применяться для лечения, профилактики или облегчения расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами.
Благодаря их структуре и характеристикам связывания, соединения в соответствии с данным изобретением подходят для лечения, профилактики или облегчения расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, включающими, но не ограниченными ими, тельца Леви и/или нейриты Леви. Заболевания, включающие альфа-синуклеиновые агрегаты, обычно перечислены как синуклеинопатии (или α-синуклеинопатии). Соединения в соответствии с данным изобретением подходят для лечения, профилактики или облегчения расстройств, включающих, но не ограниченных ими, болезнь Паркинсона (спорадическую, семейную с альфа-синуклеиновыми мутациями, семейную с мутациями, отличными от мутаций альфа-синуклеина, истинную вегетативную недостаточность или дисфагию телец Леви), слабоумие с тельцами Леви (ʺчистоеʺ слабоумие с тельцами Леви), спорадическую болезнь Альцгеймера, семейную болезнь Альцгеймера с мутациями APP, семейную болезнь Альцгеймера с PS-1, PS-2 или другими мутациями, семейную британскую деменцию, вариант с тельцами Леви болезни Альцгеймера и обычным старением (синдром Дауна). Синуклеинопатии с нейронными и глиальными агрегатами альфа-синуклеина включают множественную системную атрофию (синдром Шая-Дрейджера, стрианигральную дегенерацию и оливопонтоцеребеллярную атрофию). Другие заболевания, которые могут иметь альфа-синуклеин-иммунореактивные очаги, включают травматическое повреждение мозга, хроническую травматическую энцефалопатию, таупатии (болезнь Пика, лобно-височную деменцию, прогрессирующий надъядерный паралич, кортико-базальную дегенерацию и болезнь Ниманна-Пика типа C1), болезнь двигательного нейрона, амиотрофический боковой склероз (спорадический, семейный и комплекс Гуама ALS-деменция), нейроаксональную дистрофию, нейродегенерацию с аккумуляцией железа в мозге 1 типа (синдром Галлервордена-Шпатца), прионные болезни, атаксию-телеангиэктазию, синдром Мейжа, подострый склерозирующий панэнцефалит, болезнь Гоше, а также другие лизосомные болезни накопления (включая синдром Куфора-Ракеба и синдром Санфилиппо) и расстройство поведения в фазе сна с быстрыми движениями глаз (БДГ). (Jellinger, Mov Disord 2003, 18 Suppl. 6, S2-12; Galvin et al. JAMA Neurology 2001, 58 (2), 186-190; Kovari et al., Acta Neuropathol. 2007, 114(3), 295-8; Saito et al., J Neuropathol Exp Neurol. 2004, 63(4), 323-328; McKee et al., Brain, 2013, 136(Pt 1), 43-64; Puschmann et al., Parkinsonism Relat Disord 2012, 18S1, S24-S27; Usenovic et al., J Neurosci. 2012, 32(12), 4240-4246; Winder-Rhodes et al., Mov Disord. 2012, 27(2), 312-315; Ferman et al., J Int Neuropsychol Soc. 2002, 8(7), 907-914). Предпочтительно, соединения в соответствии с данным изобретением подходят для лечения, профилактики или облегчения болезни Паркинсона (БП).
При фармацевтическом применении, соединение в соответствии с данным изобретением предпочтительно вводят в фармацевтической композиции, содержащей соединение в соответствии с данным изобретением. "Фармацевтическая композиция" определена в данном изобретении как композиций, содержащая одно или более соединений в соответствии с данным изобретением в форме, подходящей для введения пациенту, например, млекопитающему, такому как человек, и которая подходит для лечения, облегчения или профилактики определенного расстройства или аномалии в ткани. Предпочтительно, фармацевтическая композиция также содержит физиологически приемлемый носитель, разбавитель, адъювант или наполнитель. Доза соединения в соответствии с данным изобретением варьируется в зависимости от точного вводимого соединения, массы тела пациента и других переменных, что очевидно терапевту, специалисту в данной области техники.
Хотя возможно вводить соединения в соответствии с данным изобретением отдельно, предпочтительно составлять его в фармацевтическую композицию в соответствии со стандартной фармацевтической практикой. Таким образом, в изобретении также представлена фармацевтическая композиция, которая содержит терапевтически эффективное количество соединений формул (I) или (II) в смеси с фармацевтически приемлемым носителем, разбавителем, адъювантом или наполнителем.
Фармацевтически приемлемые наполнители хорошо известны в области фармацевтики и описаны, например, в Remington's Pharmaceutical Sciences, 15th Ed., Mack Publishing Co., New Jersey (1975). Фармацевтический наполнитель может быть выбран в соответствии с предполагаемым способом введения и стандартной фармацевтической практикой. Наполнитель должен быть приемлем в том, что не должен вредить реципиенту.
Фармацевтически полезные наполнители, которые могут применяться в составе фармацевтической композиции в соответствии с данным изобретением, могут содержать, например, носители, наполнители, разбавители, растворители, такие как такие как одноатомные спирты, такие как этанол, изопропанол, и многоатомные спирты, такие как гликоли, и съедобные масла, такие как соевое масло, кокосовое масло, оливковое масло, сафлоровое масло, хлопковое масло, сложные масляные эфиры, такие как этилолеат, изопропилмиристат, связующие агенты, адъюванты, солюбилизаторы, загустители, стабилизаторы, разрыхлители, глиданты, смазывающие агенты, буферные агенты, эмульгаторы, смачивающие агенты, суспендирующие агенты, подсластители, красители, вкусовые добавки, покрытия, консерванты, антиоксиданты, эмульгаторы, модификаторы и улучшители доставки лекарства, такие как фосфат кальция, стеарат магния, тальк, моносахариды, дисахариды, крахмал, желатин, целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза натрия, декстроза, гидроксипропил-β-циклодекстрин, поливинилпирролидон, низкоплавкие воски и ионообменные смолы.
Способы введения (доставки) соединений в соответствии с данным изобретением включают, но не ограничены ими, один или более из: перорального (например, в виде таблетки, капсулы или проглатываемого раствора), местного, слизистого (например, в виде назального спрея или аэрозоля для ингаляций), назального, парентерального (например, в виде формы для инъекций), желудочно-кишечного, интраспинального, внутрибрюшинного, внутримышечного, внутривенного, внутриматочного, внутриглазного, чрезкожного, внутричерепного, внутритрахейного, внутривагинального, интрацеребровентрикулярного, интрацеребрального, подкожного, офтальмологического (включая интраветриальный или интракамеральный), чрезкожного, ректального, буккального, эпидурального и подъязычного.
Например, соединения могут вводиться перорально в форме таблеток, капсул, капсул, эликсиров, растворов или суспензий, которые могут содержать вкусовые или красящие агенты, для немедленного, отложенного, модифицированного, замедленного, импульсного или контролируемого применения.
Таблетки могут содержать наполнители, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двухосновный фосфат кальция и глицин, разрыхлители, такие как крахмал (предпочтительно, кукурузный, картофельный или тапиоковый крахмал), гликолят крахмала натрия, кроскармеллозу натрия и определенные комплексные силикаты и гранулирующие связующие агенты, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и аравийская камедь. Дополнительно могут быть включены смазывающие агенты, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Твердые композиции подобного типа также могут применяться в качестве наполнителей для желатиновых капсул. Предпочтительные наполнители для таких случаев могут включать лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. Для водных суспензий и/или эликсиров агент может быть объединен с различными подсластителями или вкусовыми добавками, красящими веществами или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как пропиленгликоль и глицерин, и их сочетания.
Если соединения в соответствии с данным изобретением вводят парентерально, примеры такого введения включают один или более из: внутривенного, внутриартериального, внутрибрюшинного, интратекального, интравентрикулярного, интрауретрального, интрастернального, внутричерепного, внутримышечного или подкожного введения соединений; и/или с применением инфузионных методов. Для парентерального введения соединения, предпочтительно, применяют в форме стерильного водного раствора, который может содержать другие вещества, например, достаточное количество соли или глюкозы для того, чтобы раствор был изотоничным к крови. Водные растворы должны быть подходящим образом буферированы (предпочтительно, до pH от 3 до 9), при необходимости. Получение подходящих парентеральных композиций в стерильных условиях легко проводится стандартными фармацевтическими методами, хорошо известными специалистам в данной области техники.
Как показано, соединения в соответствии с данным изобретением могут вводиться интраназально или ингаляцией, и обычно доставляют в виде сухого порошкового ингалятора или аэрозольного спрея из контейнера под давлением, помпы, спрея или небулайзера с применением подходящего газа-вытеснителя, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134AT) или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA), двуокись углерода или другой подходящий газ. В аэрозоли под давлением доза может быть определена нажатием клапана с получением отмеренного количества. Контейнер под давлением, помпа, спрей или небулайзер может содержать раствор или суспензию активного соединения, например, с применением смеси этанола и газа-вытеснителя в качестве растворителя, который может дополнительно содержать смазывающий агент, например, сорбитантриолеат. Капсулы и картриджи (например, желатиновые) для применения в ингаляторе или инсуффляторе могут содержать порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал.
Альтернативно, соединения в соответствии с данным изобретением могут вводиться в форме суппозитория или пессария, или могут наноситься местно в форме геля, гидрогеля, лосьона, раствора, крема, мази или присыпки. Соединения в соответствии с данным изобретением также могут вводиться кожно или чрезкожно, например, с применением пластыря.
Они также могут вводиться легочным или ректальным путем. Они также могут вводиться глазным путем. Для офтальмологического применения, соединения могут быть составлены в виде микронизированных суспензий в изотоническом, pH скорректированном стерильном физиологическом растворе или, предпочтительно, в виде растворов в изотоническом, pH скорректированном стерильном физиологическом растворе, необязательно в сочетании с консервантом, таким как хлорид бензалкония. Альтернативно, они могут быть составлены в виде мази, такой вазелин.
Для местного нанесения на кожу соединения в соответствии с данным изобретением могут быть составлены в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное в, например, смеси с одним или более из следующих: минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, эмульгирующий воск и вода. Альтернативно, они могут быть составлены в виде подходящего раствора или крема, суспендированного или растворенного в, например, смеси одного или более из следующих: минеральное масло, сорбитан моностеарат, полиэтиленгликоль, жидкий парафин, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и вода.
Обычно терапевт определяет точную дозу, которая наиболее подходит для конкретного субъекта. Определенный уровень дозы и частота введения для конкретного индивидуума может варьироваться и зависит от множества факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и длительность действия этого соединения, возврат, массу тела, общее состояние здоровья, пол, режим питания, способ и время введения, скорость выведения, сочетание лекарственных средств, тяжесть конкретного состояния и индивидуальная терапия.
Предложенная доза соединений в соответствии с данным изобретением для введения человеку (с массой тела приблизительно 70 кг) составляет от 0,1 мг до 1 г, предпочтительно, от 1 мг до 500 мг активного ингредиента на одну дозу. Однократная доза может вводиться, например, от 1 до 4 раз в день. Доза зависит от способа введения. Должно быть понятно, что может быть необходимо проводить обычные изменения дозы в зависимости от возраста и массы тела пациента, а также от тяжести лечимого состояния. Точная доза и способ введения находится исключительно в компетенции лечащего врача или ветеринара.
Соединения в соответствии с данным изобретением также могут применяться в сочетании с одним или более терапевтическими агентами. Если соединение в соответствии с данным изобретением применяют в сочетании со вторым терапевтическим агентом, активным против того же заболевания, доза каждого соединения может отличаться от дозы соединения, применяемого отдельно.
Описанные выше сочетания обычно представлены в форме фармацевтической композиции. Отдельные компоненты таких сочетаний могут вводиться последовательно или одновременно, в отдельных или объединенных фармацевтических композициях любым удобным способом. При последовательном введении первым может вводиться соединение в соответствии с данным изобретением или второй терапевтический агент. При одновременном введении, композиция может вводиться в одной или разных фармацевтических композициях. При объединении в одной композиции, должно быть понятно, что два соединения должны быть стабильными и совместимыми друг с другом и другими компонентами композиции. При отдельных композициях, они могут быть представлены в любой удобной композиции, предпочтительно, такой форме, которая известна для таких соединений в данной области техники.
Фармацевтические композиции в соответствии с данным изобретением могут быть получены методами, известными специалистам в данной области техники, как описано, например, в Remington's Pharmaceutical Sciences, 15th Ed., Mack Publishing Co., New Jersey (1975).
Соединения в соответствии с данным изобретением также могут быть представлены в форме смеси с, по меньшей мере, одним соединением, выбранным из терапевтического агента, отличного от соединения в соответствии с данным изобретением, фармацевтически приемлемого носителя, разбавителя или эксципиента. Соединение и/или терапевтический агент, отличный от соединения в соответствии с данным изобретением, предпочтительно, присутствует в терапевтически эффективным количестве.
Природа терапевтического агента, отличного от соединения в соответствии с данным изобретением, зависит от предполагаемого применения смеси. Терапевтический агент, отличный от соединения в соответствии с данным изобретением, может оказывать биологическое действие через тот же или похожий механизм, как и соединение в соответствии с данным изобретением, или через неродственный механизм действия, или через множество родственных и/или не родственных механизмов действия.
В общем, терапевтический агент, отличный от соединения в соответствии с данным изобретением, может включать усилители распространения нейтронов, психотерапевтические лекарственные средства, ингибиторы ацетилхолинэстеразы, блокаторы кальциевых каналов, биогенные амины, бензодиазепиновые транквилизаторы, улучшители синтеза, хранения или выделения ацетилхолина, агонисты постсинаптического рецептора ацетилхолина, ингибиторы моноаминоксидазы-A или -B, антагонисты рецептора N-метил-D-аспартатглутамата, нестероидные противовоспалительные лекарственные средства, антиоксиданты и антагонисты серотонергического рецептора. В частности, терапевтический агент, отличный от соединения в соответствии с данным изобретением, может быть выбран из группы, включающей соединение, применяемое в лечении амилоидоза, соединения против окислительного стресса, антиапоптозные соединения, металлохелаторы, ингибиторы репарации ДНК, такие как пирензепин и метаболиты, 3-амино-1-пропансульфоновую кислоту (3APS), 1,3-пропандисульфонат (1,3PDS), активаторы α-секретазы, ингибиторы β- и γ-секретазы, тау белки, нейротрансмиттер, дробители β-пласта, приманки для амилоидных бета устраняющих/обедняющих клеточных компонентов, ингибиторы N-концевого срезанного амилоида бета, включая пироглутаматированный амилоид бета 3-42, противовоспалительные молекулы или ингибиторы холинестеразы (ChEIs), такие как такрин, ривастигмин, донепезил и/или галантамин, агонисты M1, другие лекарственные средства, включающие любые амилоидные или тау модифицирующие лекарственные средства и пищевые добавки, антитело, включая любое функционально эквивалентное антитело или его функциональные части.
В другом варианте, смеси в соответствии с данным изобретением могут содержать ниацин или мемантин вместе с соединением в соответствии с данным изобретением и, необязательно, фармацевтически приемлемый носитель и/или разбавитель и/или эксципиент.
В еще одном варианте изобретения представлены смеси, которые содержат в качестве терапевтического агента, отличного от соединения в соответствии с данным изобретением, ʺатипичные антипсихотические средстваʺ такие как, например, клозапин, зипразидон, рисперидон, арипипразол или оланзапин для лечения положительных и отрицательных психотических симптомов, включающих галлюцинации, бред, нарушения мышления (проявляющиеся заметной инкогерентностью, соскальзыванием, резонерством) и аномальное или дезорганизованное поведение, а также ангедонии, эмоциональной тупости, апатии и социального отчуждения, вместе с соединением в соответствии с данным изобретением и, необязательно, фармацевтически приемлемый носитель и/или разбавитель и/или эксципиент.
Предпочтительные соединения показаны в примерах.
Соединения в соответствии с данным изобретением могут быть синтезированы одним из общих способов, показанных на следующих схемах. Эти способы даны только в иллюстративных целях и не должны рассматриваться как ограничивающие.
Общие схемы синтеза для получения структурных элементов данного изобретения:
Схема 1

Схема 1a

Коммерчески доступные галогенированные аминопиридины подвергают взаимодействию с бензоилизотиоцианатом, таким как ацетон, с получением желаемых пиридиновых производных бензоилтиомочевины после очистки. Снятие защиты с бензоильных групп проводят в основных условиях. Затем тиомочевины циклизуют с применением медного катализатора. Альтернативный способ включает сначала циклизацию пиридиновых производных бензоилтиомочевины с последующим снятием защиты с амида в кислых условиях. Наконец, аминогруппы превращают в галоген в стандартных условиях.
Схема 2
5-Хлортиено[3,2-b]пиридин обрабатывают сильным основанием в подходящем растворителе с последюущим добавлением брома с получением желаемого структурного элемента после очистки.
Схема 3

Трет-бутил(5-бромтиофен-3-ил)карбамат обрабатывают в кислых условиях, и полученный продукт циклизуют 2-галомалональдегидом в растворителе с получением желаемых структурных элементов после очистки.
Общая схема синтеза для получения соединений в соответствии с данным изобретением:
Схема 4
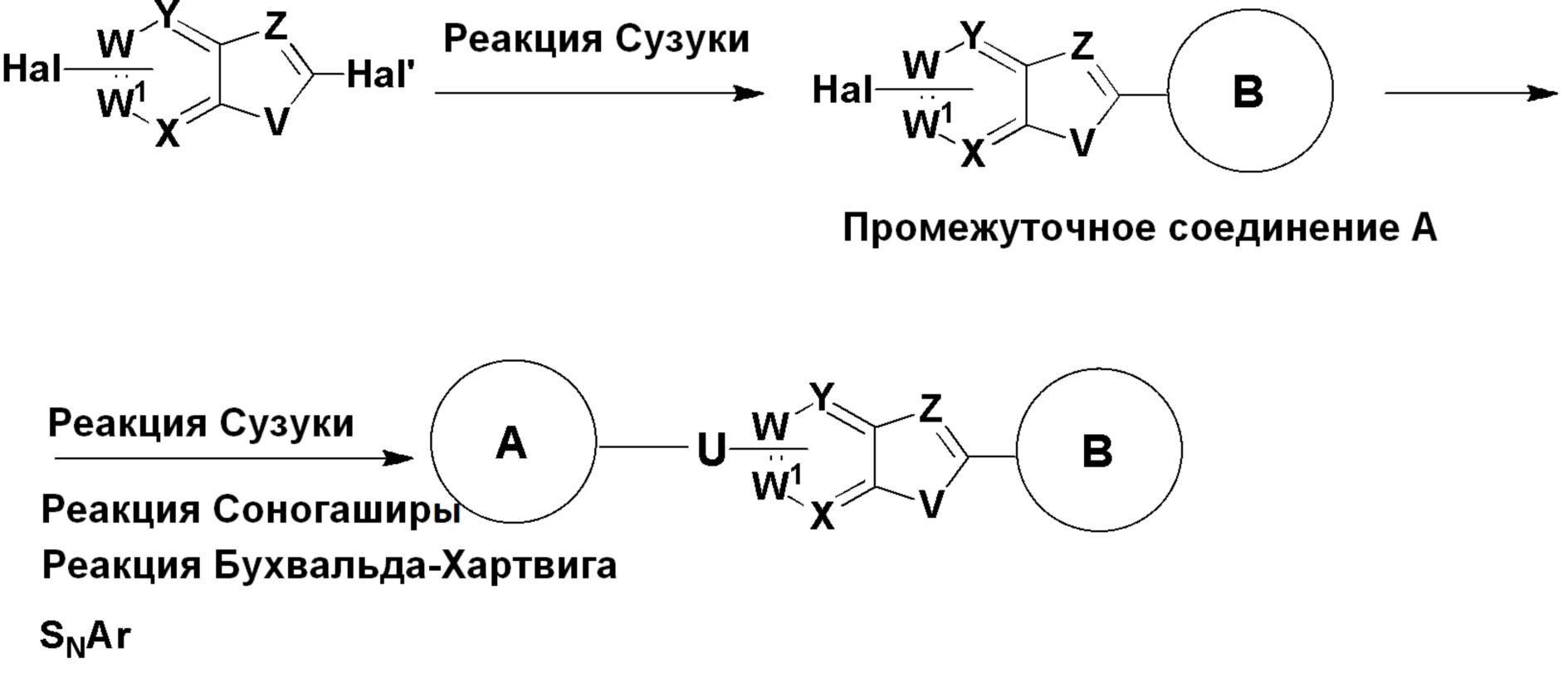
Бициклические структурные элементы (Hal, Hal'=Br, Cl) обрабатывают бороновыми кислотами или сложными эфирами в растворителе через катализируемое палладием поперечное сшивание (реакция Сузуки) с получением желаемого промежуточного соединения A после очистки. Промежуточное соединение A может быть далее функционализировано в условиях катализируемого палладием поперечного сшивания, такого как реакция Сузуки, реакция Бухвальда-Хартвига или реакция Соногаширы с получением желаемых соединений после очистки. В случае реакции Сузуки, конечные соединения также могут быть получены однореакторным способом последовательным добавлением бороновых кислот или сложного эфира. Наконец, промежуточное соединение A или даже конечное соединение, имеющее уходящую группу, такую как атом фтора, может помещаться в условия SNAr с получением желаемых конечных соединений после очистки.
Схема 5

Бициклические структурные элементы (Hal=Br, Cl) обрабатывают бороновой кислотой или сложным эфиром в растворителе в условиях катализируемого палладием поперечного сшивания (реакция Сузуки) с получением желаемого промежуточного соединения B после очистки. Промежуточное соединение B либо алкилируют с применением основания и электрофила, либо подвергают катализируемой медью реакции поперечного сшивания с галогенарилом с получением желаемых конечных соединений после очистки.
Общий синтез 18F-меченых соединений в соответствии с данным изобретением
Соединения формулы (I) или (II), меченые18F, могут быть получены взаимодействием предшественника, как описано ниже, с18F-фторирующим агентом так, чтобы LG предшественника замещалась18F.
Может применяться любой подходящий18F-фторирующий агент. Типовые примеры включают H18F, щелочные или щелочноземельные18F-фториды (например, K18F, Rb18F, Cs18F и Na18F). Необязательно,18F-фторирующий агент может применяться в сочетании с хелатирующим агентом, таким как криптанд (например: 4,7,13,16,21,24-гексаокса-1,10-диазабицикло[8.8.8]гексакозан - Kryptofix®) или краун-эфир (например: 18-краун-6). Альтернативно,18F-фторирующим агентом может быть тетраалкиламмониевая соль18F или тетраалкилфосфониевая соль18F; например, тетра(C1-6 алкил)аммониевая соль18F или тетра(C1-6 алкил)фосфониевая соль18F. Предпочтительно,18F-фторирующим агентом является K18F, H18F, Cs18F, Na18F или [18F]фторид тетрабутиламмония.
Общая схема синтеза для получения предшественника
Схема 6
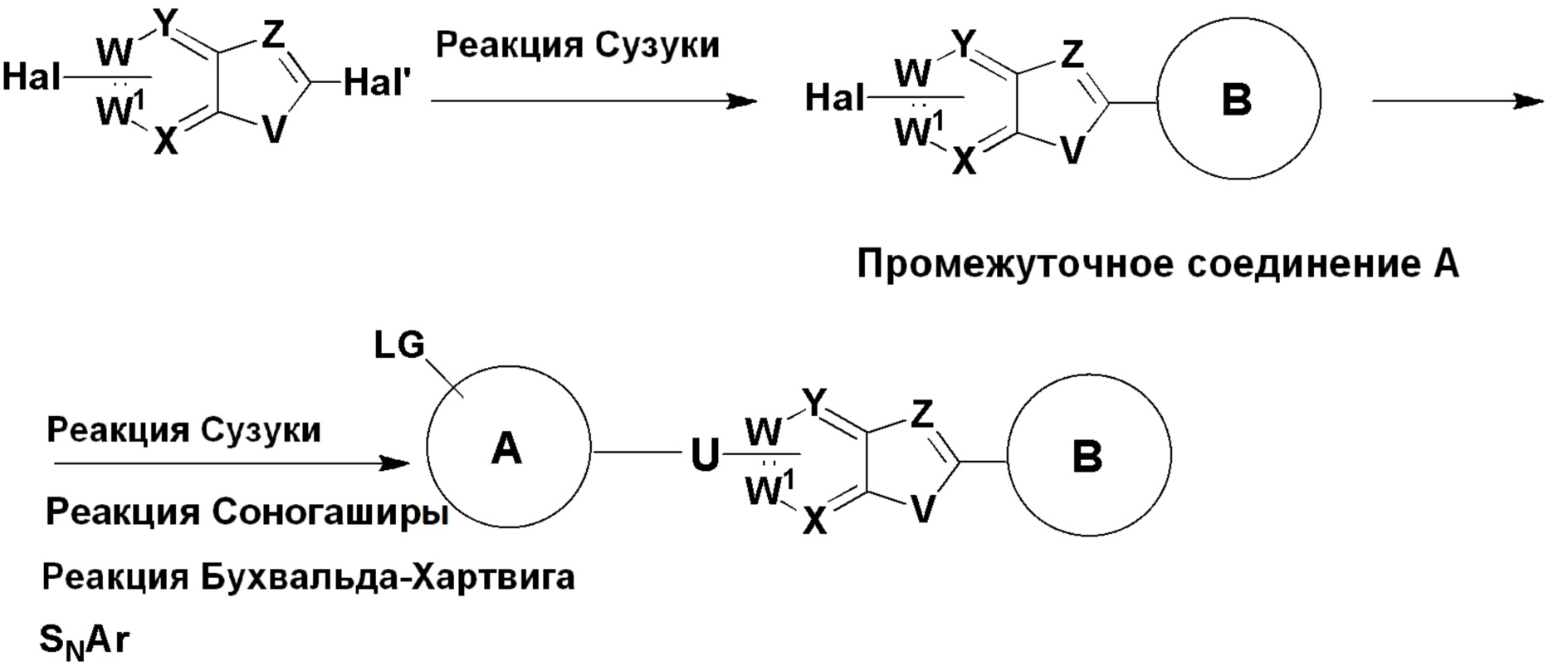
Бициклические структурные элементы (Hal, Hal'=Br, Cl) обрабатывают бороновыми кислотами или сложными эфирами в растворителе через катализируемое палладием поперечное сшивание (реакция Сузуки) с получением желаемого промежуточного соединения A после очистки. Промежуточное соединение A может быть далее функционализировано в условиях катализируемого палладием поперечного сшивания, такого как реакция Сузуки, реакция Бухвальда-Хартвига или реакция Соногаширы с получением желаемого предшественника, содержащего уходящую группу (LG) после очистки. В случае реакции Сузуки, конечные соединения также могут быть получены однореакторным способом последовательным добавлением бороновых кислот или сложных эфиров. Наконец, промежуточное соединение A или даже конечное соединение, имеющее уходящую группу (отличную от LG группы конечных предшественников), такую как атом фтора, может помещаться в условия SNAr с получением желаемых предшественников, содержащих еще одну LG после очистки. Производные, содержащие LG, являются предшественниками, позволяющими введение18F-метки на следующей стадии. Предпочтительными LG для введения18F включают: C1-4 алкилсульфонат, C6-10 арилсульфонат, нитро, триметиламмоний и галогены. Вместо LG также может применяться бороновый эфир. Кольца B, D и E, имеющие LG, могут быть получены по методике, такой как указана для кольца A выше.
Общая схема синтеза для получения 18F-меченых соединений
Схема 7

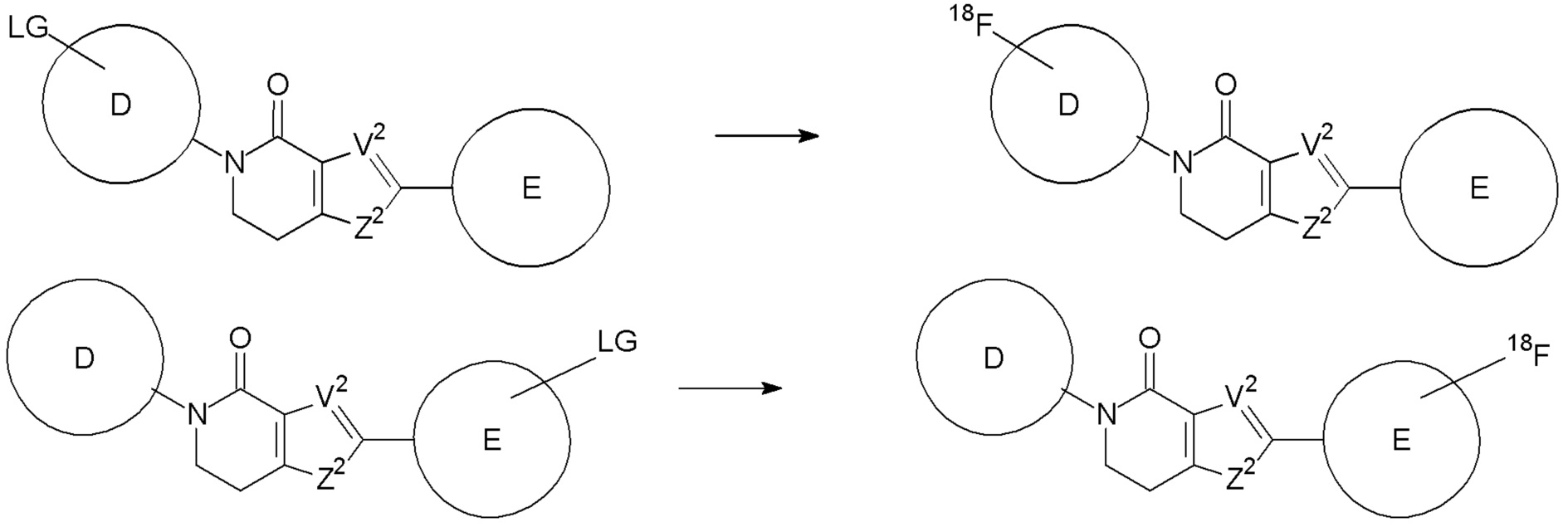
Реакции проходят в присутствии фторирующего агента и, обычно, растворителя.
18F меченые соединения могут быть получены взаимодействием предшественников, содержащих LG, с18F-фторирующим агентом, так, чтобы LG замещалась18F. Реагенты, растворители и условия, которые могут применяться для18F-фторирования, хорошо известны специалисту в данной области техники (L. Cai, S. Lu, V. Pike, Eur. J. Org. Chem 2008, 2853-2873; J. Fluorine Chem., 27 (1985):177-191; Coenen, Fluorine-18 Labeling Methods: Features and Possibilities of Basic Reactions, (2006), in: Schubiger P.A., Friebe M., Lehmann L., (eds), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, Berlin Heidelberg, pp,15-50). Предпочтительно, растворителями, применяемыми при18F-фторировании, включают ДМФ, ДМСО, ацетонитрил, ДМА или их смеси, предпочтительно, растворителем является ацетонитрил, ДМСО.
Хотя реакция показана выше для18F в качестве радиоактивной метки, другие радиоактивные метки могут быть введены похожими методами.
Изобретение иллюстрировано следующими примерами, которые, однако, не должны рассматриваться как ограничивающие.
Примеры
Все реагенты и растворители получают из коммерческих источников и применяют без дальнейшей очистки. Протонный (1H) спектр записывают на ЯМР спектрометре Bruker DRX-400 МГц или на ЯМР спектрометре Bruker AV-400 МГц в дейтерированных растворителях. Масс спектр (МС) записывают на масс-спектрометре Advion CMS. Хроматографию проводят с применением силикагеля (Fluka: Silica gel 60, 0,063-0,2 мм) и подходящих растворителей, таких как указаны в примерах. Флэш-очистку проводят на системе флэш-очистки Biotage Isolera One с применением картриджей HP-Sil или KP-NH SNAP (Biotage) и градиента растворителей, указанного в определенных примерах. Тонкослойную хроматографию (ТСХ) проводят на силикагельных пластинах с УФ определением.
Хотя некоторые из данных примеров не показывают, что соответствующие соединения являются определяемо мечеными, понятно, что подразумеваются соответствующие определяемо меченые соединения, которые могут быть легко получены, например, с применением определяемо меченых исходных материалов, таких как исходные материалы, содержащие C(3H)3, (11C)H3 или18F.
Препаративный пример 1

Стадия A
Раствор коммерчески доступного 5-хлортиено[3,2-b]пиридина (0,600 г, 3,537 ммоль) в тетрагидрофуране (15 мл) охлаждают до -78°C. Затем 2,5 M раствор н-бутиллития в гексане (3,3 мл, 5,305 ммоль) добавляют при -78°C. Температуру повышают до -40°C, и смесь перемешивают в течение 30 минут. Смесь охлаждают до -78°C и по каплям добавляют бром (0,362 мл, 7,07 ммоль). Смесь перемешивают при -78°C в течение 1 часа, и реакционную смесь гасят 50 мл воды. Водную смесь экстрагируют этилацетатом (3×50 мл), объединенные органические слои сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией на HP-Sil SNAP картриджах с применением системы очистки Isolera One с применением градиента этилацетат/н-гептан (0/100→10/90) с получением указанного в заголовке соединения (0,774 г, 88%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,52 (д, 1H), 7,80 (с, 1H), 7,50 (д, 1H).
МС (ИЭР); m/z=249,91 [M+H]+
Препаративный пример 2
К раствору трет-бутил(5-бромтиофен-3-ил)карбамата (1 г, 3,59 ммоль) в метаноле (5 мл) добавляют при комнатной температуре 4N HCl (2 мл, 65,8 ммоль). Через 4 часа при комнатной температуре реакционную смесь концентрируют при пониженном давлении досуха. Затем добавляют ледяную уксусную кислоту (10 мл), затем 2-хлормалональдегид (0,421 г, 3,95 ммоль) и реакционную смесь кипятят с обратным холодильником в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении и добавляют 1N NaOH (100 мл). Водную фазу экстрагируют несколько раз дихлорметаном (ДХМ). Объединенные органические фазы сушат над Na2SO4, фильтруют и сушат при пониженном давлении. Остаток очищают на HP-Sil SNAP картриджах с применением системы очистки Biotage Isolera One с применением элюента этилацетат/н-гептан (10/90) с получением указанного в заголовке соединения (320 мг, 36%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,65 (с, 2H), 7,82 (с, 1H)
МС (ИЭР); m/z=249,94 [M+H]+
Препаративный пример 3

Стадия A
Раствор 2-бром-5-хлорпиридин-3-амина (10 г, 48,2 ммоль) и бензоилизотиоцианата (8,87 мл, 67,5 ммоль) в ацетоне (20 мл) перемешивают при комнатной температуре в течение 18 часов. Твердое вещество фильтруют, промывают н-гептаном и сушат с получением желаемого продукта (15,9 г, 89%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 12,67 (с, 1H), 12,04 (с, 1H), 8,60-8,49 (м, 1H), 8,45 (д, 1H), 8,01 (д, 2H), 7,69 (т, 1H), 7,56 (т, 2H)
МС (ИЭР); m/z=НО
Стадия B
Суспензию N-((2-бром-5-хлорпиридин-3-ил)карбамоитоил)бензамида (15,89 г, 42,9 ммоль) в 6N NaOH (214 мл) и метаноле (150 мл) кипятят с обратным холодильником в течение 1 часа. Затем реакционную смесь охлаждают до 0°C. После перемешивания при 0°C в течение 30 мин твердое вещество фильтруют, промывают водой и сушат с получением желаемого продукта (4,4 г, 55%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,24-7,89 (м, 3H), 7,72 (с, 1H)
Стадия C
К раствору 3M H2SO4 (20 мл) при 0°C добавляют 6-хлортиазоло[5,4-b]пиридин-2-амин (200 мг, 1,077 ммоль). Затем очень медленно добавляют нитрит натрия (104 мг, 1,508 ммоль) в воде (2 мл). Через 1 час при 0°C добавляют хлорид меди(II) (203 мг, 1,508 ммоль), затем добавляют 2 мл концентрированной HCl. Затем реакционную смесь нагревают до комнатной температуры и перемешивают в течение 4 часов. Добавляют воду, и водную фазу экстрагируют несколько раз этилацетатом. Объединенные органические фазы промывают насыщенным водным раствором NH4Cl, сушат над Na2SO4, фильтруют и сушат при пониженном давлении. Водную фазу экстрагируют несколько раз ДХМ. Объединенные органические фазы сушат над Na2SO4, фильтруют и сушат при пониженном давлении. Остаток очищают на HP-Sil SNAP картриджах с применением системы очистки Biotage Isolera One с применением элюента метанол/дихлорметан (2/98) с получением указанного в заголовке соединения (128 мг, 58%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,75 (д, 1H), 8,67 (д,1H)
Препаративный пример 4

Стадия A
Раствор 5-бром-2-хлорпиридин-4-амина (5 г, 24,10 ммоль) и бензоилизотиоцианата (9,51 мл, 72,3 ммоль) в ацетоне (25 мл) перемешивают при комнатной температуре в течение 18 часов. Твердое вещество концентрируют до ~10 мл, фильтруют, промывают н-гептаном и сушат с получением желаемого продукта (6 г, 68%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 13,21 (с, 1H), 12,14 (с, 1H), 8,76 (с, 1H), 8,71 (с, 1H), 7,99 (д, 2H), 7,69 (т, 1H), 7,56 (т, 2H)
МС (ИЭР); m/z=НО
Стадия B
Суспензию N-((2-бром-5-хлорпиридин-3-ил)карбамоитоил)бензамида (15,89 г, 42,9 ммоль) в 6N NaOH (15 мл) и метаноле (50 мл) кипятят с обратным холодильником в течение 4 часов. Реакционную смесь охлаждают до комнатной температуры и добавляют насыщенный водный раствор NH4Cl до образования осадка. Через 1 час при комнатной температуре твердое вещество фильтруют, промывают водой (2×30 мл), сушат, промывают ДХМ и затем сушат с получением желаемого продукта (2,7 г, 92%).
Стадия C
Суспензию 1-(5-бром-2-хлорпиридин-4-ил)тиомочевины (1,39 г, 5,21 ммоль), L-пролина (0,120 г, 1,043 ммоль), йодида меди(I) (0,099 г, 0,521 ммоль) и Cs2CO3 (3,40 г, 10,43 ммоль) в ДМСО (3 мл) нагревают при 70°C в течение 1 дня. Реакционную смесь выливают в воду (50 мл). Твердое вещество фильтруют, промывают еще водой и сушат с получением желаемого продукта (435 мг, 45%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,56 (с, 1H), 8,32 (с, 2H), 7,31 (с, 1H).
МС (ИЭР); m/z=185,98 [M+H]+
Стадия D
К суспензии 6-хлортиазоло[5,4-c]пиридин-2-амина (500 мг, 2,69 ммоль) и хлорида меди(II) (471 мг, 3,50 ммоль) в ацетонитриле (50 мл) при 0°C добавляют нитрит изоамила (0,544 мл, 4,04 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Затем снова добавляют хлорид меди(II) (471 мг, 3,50 ммоль) и нитрит изоамила (0,544 мл, 4,04 ммоль) и нагревают при 65°C в течение 18 часов. Реакционную смесь охлаждают до комнатной температуры, и реакционную смесь фильтруют. Добавляют воду (50 мл), и водную фазу экстрагируют несколько раз дихлорметаном. Объединенные органические фазы сушат над Na2SO4, фильтруют и сушат при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента метанол/дихлорметан (2/98) с получением указанного в заголовке соединения (430 мг, 78%).
1H ЯМР (400 МГц, ДМСО-d6) δ 9,18 (с, 1H), 8,17 (с, 1H).
Препаративный пример 4a
Стадия A
Раствор 6-хлор-3-йодпиридин-2-амина (13,87 г, 54,5 ммоль) и бензоилизотиоцианата (9,32 мл, 70,9 ммоль) в ацетоне (150 мл) перемешивают при комнатной температуре в течение 18 часов. Твердое вещество фильтруют, промывают н-гептаном и сушат с получением желаемого продукта (22,8 г, 91%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 12,39 (с, 1H), 11,88 (с, 1H), 8,38 (д, 1H), 8,12-7,90 (м, 2H), 7,68 (т, 1H), 7,56 (т, 2H), 7,31 (д, 1H).
МС (ИЭР); m/z=417,82 [M+H]+
Стадия B
К раствору N-((6-хлор-3-йодпиридин-2-ил)карбамоитоил)бензамида (20,76 г, 49,7 ммоль) в 1,4-диоксане (250 мл) добавляют карбонат калия (13,74 г, 99 ммоль), L-пролин (1,145 г, 9,94 ммоль) и йодид меди(I) (0,947 г, 4,97 ммоль). Затем реакционную смесь перемешивают при 80°C в течение 6 часов. Реакционную смесь выливают в 500 мл воды и 500 мл водного насыщенного раствора NH4Cl. Суспензию перемешивают при комнатной температуре в течение 1 часа. Твердое вещество фильтруют, промывают водным насыщенным раствором NH4Cl (2×250 мл), водой (3×250 мл) и сушат с получением желаемого продукта (14,8 г, 100%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 13,32 (с, 1H), 8,55 (д, 1H), 8,17 (д, 2H), 7,70 (т, 1H), 7,59 (т, 2H), 7,45 (д, 1H).
МС (ИЭР); m/z=290,03 [M+H]+
Стадия C
Суспензию N-(5-хлортиазоло[4,5-b]пиридин-2-ил)бензамида (14,80 г, 51,1 ммоль) в 70% H2SO4 (50 мл) нагревают при 120°C в течение 4 часов. Реакционную смесь охлаждают до комнатной температуры, и реакционную смесь медленно выливают в 500 мл холодной воды (0°C). Затем реакционную смесь доводят до основного pH добавлением твердого NaOH. Затем твердое вещество фильтруют, промывают 1 NaOH (2×250 мл), водным насыщенным раствором NH4Cl (250 мл), водой (2×250 мл) и сушат досуха. Твердое вещество растворяют в ДХМ/MeOH и фильтруют через слой двуокиси кремния. Слой затем промывают 40% MeOH в ДХМ, и маточную жидкость концентрируют досуха с получением желаемого продукта (6,0 г, 64%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,19 (с, 2H), 8,08 (д, 1H), 7,05 (д, 1H).
МС (ИЭР); m/z=186,01 [M+H]+
Стадия D
К суспензии 5-хлортиазоло[4,5-b]пиридин-2-амина (7,90 г, 42,6 ммоль) в ацетонитриле (100 мл) при 0°C добавляют трет-бутилнитрит (8,44 мл, 63,8 ммоль) в течение более 30 мин шприцевой помпой. Затем порциями добавляют бромид меди(II) (11,41 г, 51,1 ммоль). Через 30 минут при 0°C, реакционную смесь нагревают до комнатной температуры и перемешивают в течение 6 часов. Добавляют воду и EtOAc, и смесь фильтруют. Затем твердое вещество промывают ДХМ/MeOH. Маточные жидкости разделяют, и водную фазу промывают несколько раз ДХМ/MeOH. Объединенные органические фазы промывают водой (2×200 мл), насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Твердое вещество растворяют в ДХМ/MeOH и фильтруют через слой двуокиси кремния. Слой затем промывают 5% MeOH в ДХМ, и маточную жидкость концентрируют досуха. Твердое вещество растирают в горячем EtOAc. После охлаждения твердое вещество фильтруют, и маточную жидкость концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента метанол/дихлорметан (2/98→5/95) с получением указанного в заголовке соединения (10,6 г, 70%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,76-8,59 (м, 1H), 7,65 (д, J=4,7 Гц, 1H).
МС (ИЭР); m/z=250,86 [M+H]+
Препаративный пример 4b

Стадия A
Раствор 5-бром-3-йодпиридин-2-амин (30,0 г, 100,36 ммоль) и бензоилизотиоцианата (16,1 мл, 120,44 ммоль, 1,2 экв.) в ацетоне (600 мл, 20 об.) перемешивают при 60°C в течение 12 часов, реакцию отслеживают ТСХ. Растворитель выпаривают, и твердое вещество фильтруют, промывают н-гексаном (500 мл) и сушат с получением желаемого продукта в виде беловатого твердого вещества (42,0 г, 91%).
1H-ЯМР (500 МГц, CDCl3) δ 12,55 (шс, 1H), 9,31 (шс, 1H), 8,58 (с, 1H), 8,37 (д, 1H), 7,93-7,92 (м, 2H), 7,68 (т, 1H), 7,57-7,52 (м, 2H).
МС (ИЭР); m/z=461,5 [M-H]+
Стадия B
К раствору N-((5-бром-3-йодпиридин-2-ил)карбамоитоил)бензамида (42,0 г, 90,91 ммоль) в 1,4-диоксане (630 мл, 15 об.) добавляют карбонат калия (18,81 г, 136,36 ммоль, 1,5 экв.), L-пролин (2,09 г, 18,18 ммоль, 0,2 экв.) и йодид меди(I) (3,45 г, 18,18 ммоль, 0,2 экв.). Затем реакционную смесь перемешивают при 80°C в течение 16 часов, реакцию отслеживают ТСХ. Реакционную смесь выливают в 1,0 л воды и 1,0 л водного насыщенного раствора NH4Cl. Суспензию перемешивают при комнатной температуре в течение 1 часа. Твердое вещество фильтруют, промывают водным насыщенным раствором NH4Cl (2×500 мл), водой (2×500 мл) и сушат с получением желаемого продукта в виде беловатого твердого вещества (28,6 г, 94%).
1H-ЯМР (500 МГц, ДМСО-d6) δ 8,76 (д, 1H), 8,63 (д, 1H), 8,16 (д, 2H), 7,68 (т,1H), 7,58 (т, 2H), 7,25 (шс, 1H).
МС (ИЭР); m/z=334,51 [M]+
Стадия C
Суспензию N-(6-бромтиазоло[4,5-b]пиридин-2-ил)бензамида(7,5 г, 22,45 ммоль) в 70% H2SO4 (22,5 мл, 3,0 об.) нагревают при 120°C в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры, и реакционную смесь медленно выливают в 500 мл холодной воды (0°C). Затем реакционную смесь доводят до щелочного pH добавлением твердого 50% водн. NaOH. Затем соединение экстрагируют EtOAc (6×250 мл). Объединенные органические слои сушат над Na2SO4 и фильтруют, затем растворитель концентрируют с получением желаемого продукта в виде светло-желтого твердого вещества (2,75 г, 53%).
1H-ЯМР (500 МГц, ДМСО-d6) δ 8,31 (д, 1H), 8,27 (шс, 2H), 8,08 (д, 1H).
МС (ИЭР); m/z=230,4 [M]+
Стадия D
К суспензии 6-бромтиазоло[4,5-b]пиридин-2-амина (13,0 г, 56,52 ммоль) в ацетонитриле (163 мл, 12,5 об.) при 0°C добавляют трет-бутилнитрит (10,1 мл, 84,78 ммоль, 1,5 экв.) в течение 10 мин шприцом. Затем порциями добавляют хлорид меди(II) (9,1 г, 67,82 ммоль, 1,2 экв.). Через 30 минут при 0°C, реакционную смесь нагревают до комнатной температуры в течение 1 часа и нагревают до 65°C, затем перемешивают в течение 4 часов. Развитие реакции отслеживают ТСХ. После завершения реакции растворитель выпаривают. Реакционную смесь разбавляют водой (100 мл) и 5% MeOH/ДХМ (3×200 мл). Объединенные органические фазы промывают насыщенным раствором соли (100 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента метанол/дихлорметан (1/99) в качестве элюента с получением указанного в заголовке соединения (10,6 г, 50%).
1H ЯМР (500 МГц, ДМСО-d6) δ 8,90 (д, 1H), 8,81 (д, 1H).
МС (ИЭР); m/z=249,3 [M]+
Препаративный пример 5 (EG 08 70)
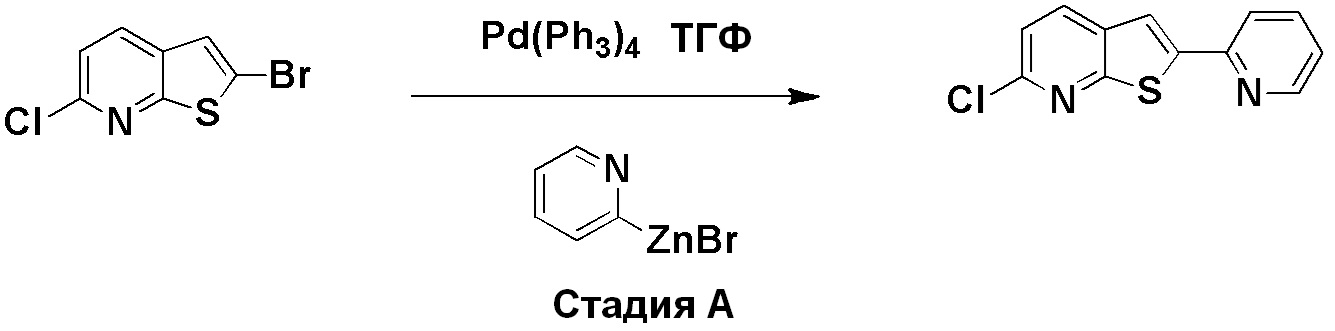
Стадия A
Смесь коммерчески доступного 2-бром-6-хлортиено[2,3-b]пиридина (0,15 г, 0,6 ммоль), раствора бромида 2-пиридилцинка в 0,5 M в тетрагидрофуране (1,8 мл, 0,9 ммоль) перемешивают при комнатной температуре и добавляют тетракис(трифенилфосфин)палладий(0). Реакционную смесь дегазируют потоком аргона в течение 10 минут и перемешивают при комнатной температуре в течение ночи. Затем смесь помещают в этилацетат (20 мл), промывают насыщенным раствором хлорида аммония (2×20 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента этилацетат/н-гептан (100/0→50/50) с получением указанного в заголовке соединения (110 мг, 74%).
1H ЯМР (400 МГц, Хлороформ-d) δ 8,67 (дт, 1H), 7,99 (д, 1H), 7,83-7,76 (м, 2H), 7,74 (с, 1H), 7,31 (д, 1H), 7,29-7,24 (м, 1H).
Препаративный пример 6 (ACI-1729)

Стадия A
Смесь коммерчески доступного 2-бром-6-хлортиено[2,3-b]пиридина (0,30 г, 1,207 ммоль), 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (0,295 г, 1,44 ммоль), карбоната цезия (0,780 г, 2,414 ммоль) и комплекс [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (0,05 г, 0,06 ммоль) добавляют в сухую пробирку под давлением, затем добавляют дегазированный диоксан (8 мл) и дегазированную воду (2 мл). Реакционную смесь дегазируют потоком аргона в течение 10 минут и нагревают при 70°C в течение 2 ч. Затем смесь охлаждают при комнатной температуре, помещают в этилацетат (20 мл), промывают водой (2×20 мл) и насыщенным раствором соли (10 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента этилацетат/н-гептан (20/80→50/50) с получением указанного в заголовке соединения (220 мг, 74%).
1H-ЯМР (400 МГц, Хлороформ-d) δ 8,99 (д, 1H), 8,64 (дд, 1H), 8,02 (д, 1H), 7,97 (дт, 1H), 7,53 (с, 1H), 7,41 (дд, 1H), 7,36 (д, 1H).
МС (ИЭР); m/z=246,74 [M+H]+
Препаративные примеры 7-28
По методике Pd-сочетания, описанной в Препаративном примере 6, с применением бром-хлорного исходного материала и подходящей бороновой кислоты или сложного эфира, показанных в таблице ниже, получают следующие соединения. Источник комплекса палладия [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном может быть замещен тетракис(трифенилфосфин)палладием(0). Карбонат цезия может быть замещен карбонатом калия.
Таблица 1





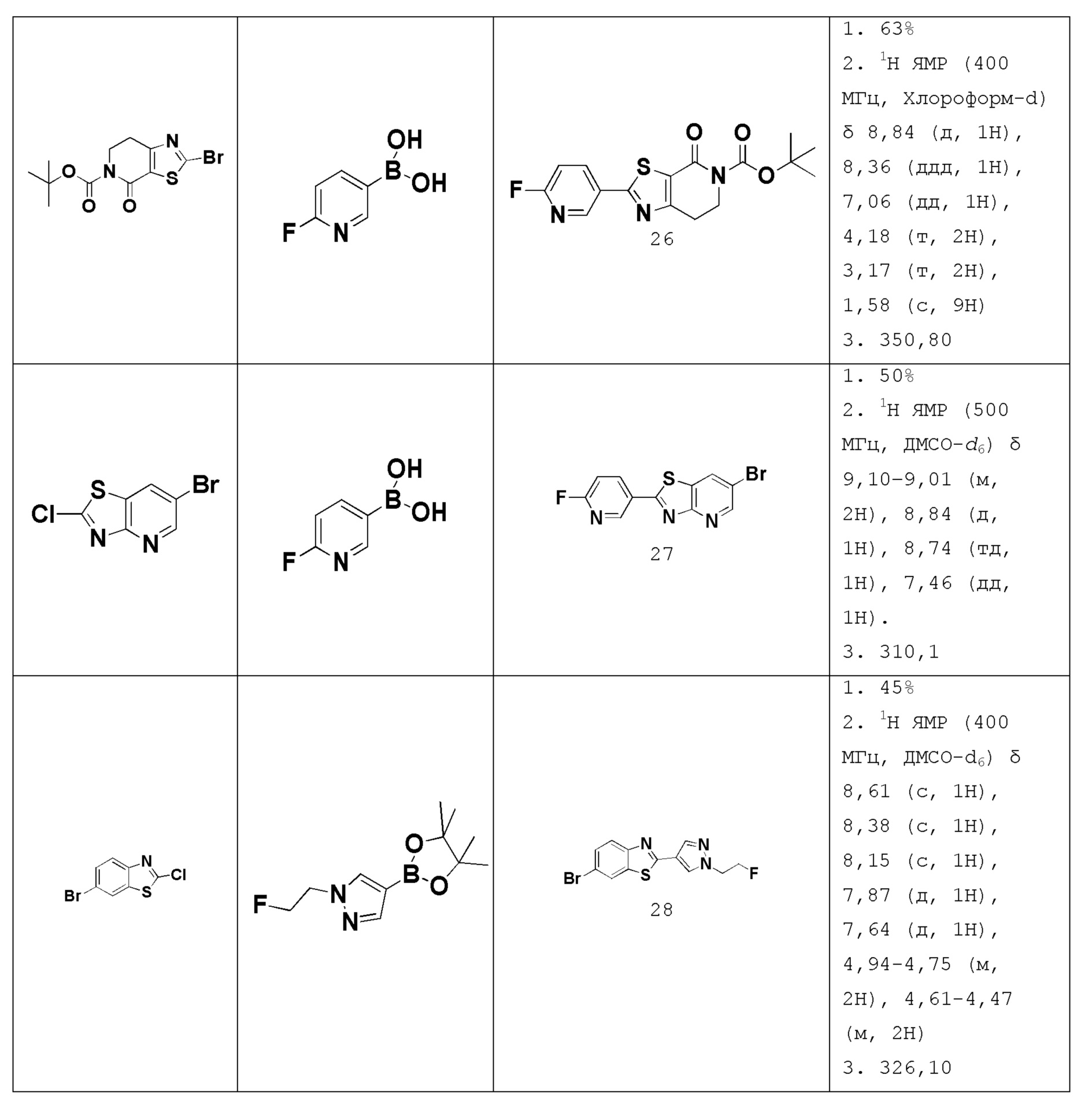
Пример 1 (eg 06 50)

Стадия A
Указанное в заголовке соединение из Препаративного примера 6 выше (0,05 г, 0,203 ммоль), трет-бутил(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)карбамат (0,078 г, 0,243 ммоль), карбонат цезия (0,13 г, 0,406 ммоль) и комплекс [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (0,08 г, 0,01 ммоль) добавляют в сухую пробирку под давлением, затем добавляют дегазированный диоксан (4 ил) и дегазированную воду (1 мл). Реакционную смесь дегазируют потоком аргона в течение 10 минут и нагревают при 100°C в течение 4 ч. Смесь затем охлаждают до комнатной температуры, помещают в этилацетат (20 мл), промывают водой (2×20 мл) и насыщенным раствором соли (10 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента этилацетат/н-гептан (50/50→90/10) с получением указанного в заголовке соединения (42 мг, 52%).
1H-ЯМР (400 МГц, Хлороформ-d) δ 9,02 (дд, 2H), 8,63 (дд, 1H), 8,42 (дд, 1H), 8,11 (дд, 2H), 8,01 (дт, 1H), 7,78-7,65 (м, 2H), 7,56 (с, 1H), 7,41 (дд, 1H), 1,57 (д, 9H).
МС (ИЭР); m/z=348,89 [M+H]+
Примеры 2-25, 81-87 и 94-104
По методике Pd-сочетания, описанной в Примере 1, с применением хлорного исходного материала и подходящей бороновой кислоты или сложного эфира, показанных в таблице ниже, получают следующие соединения. Источник комплекса палладия [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном может быть замещен тетракис(трифенилфосфин)палладием(0). Карбонат цезия может быть замещен карбонатом калия.
Таблица 2



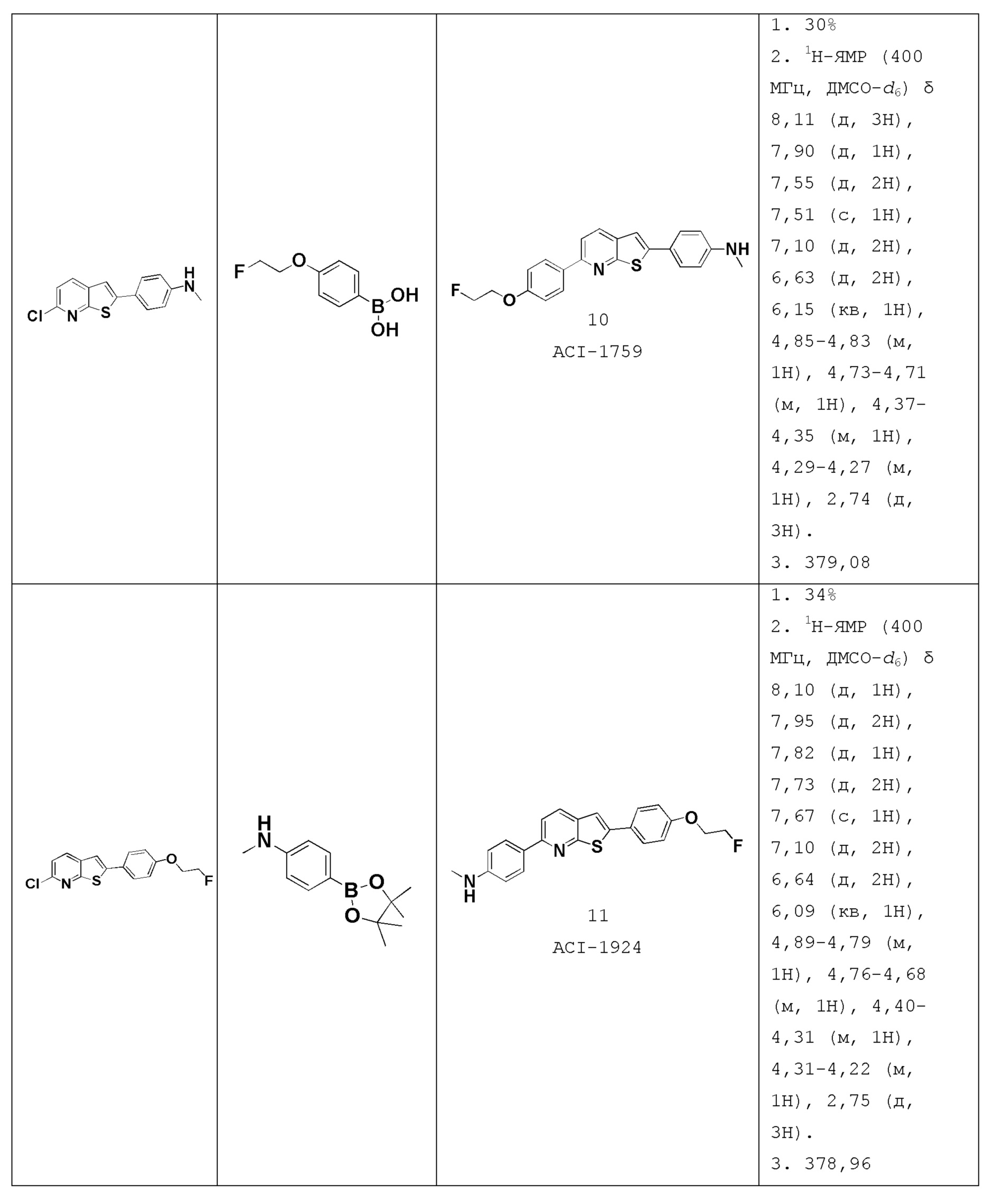












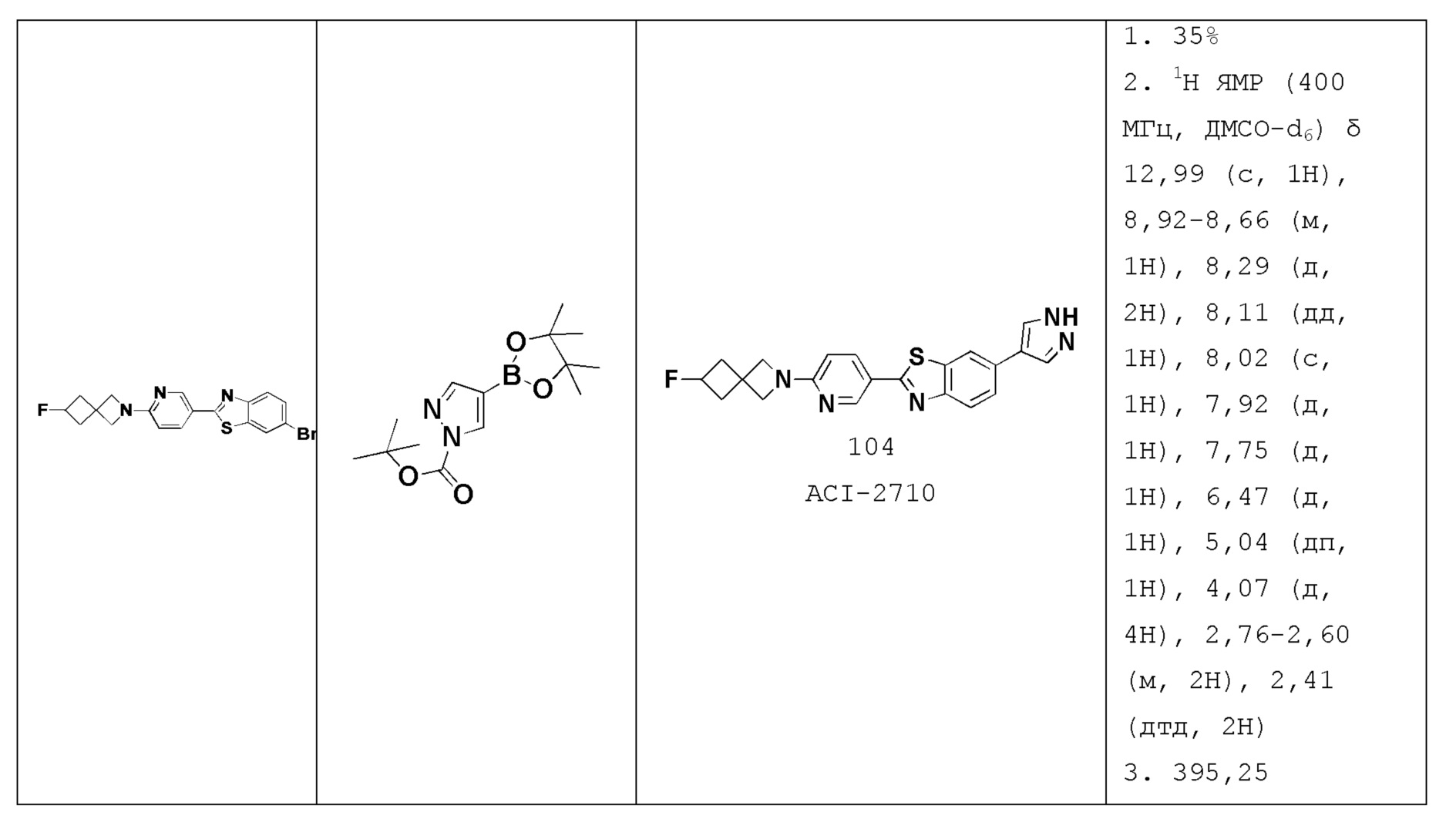
Пример 26 (ACI-2178)

Смесь 2-бром-6-хлортиено[2,3-b]пиридина из Препаративного примера 1 (0,08 г, 0,32 ммоль), 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (72,61 мг, 0,352 ммоль), карбоната цезия (0,209 г, 0,64 ммоль) и комплекса [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (0,013 г, 0,016 ммоль) добавляют в сухую пробирку под давлением, затем добавляют дегазированный диоксан (4 мл) и дегазированную воду (1 мл). Реакционную смесь дегазируют потоком аргона в течение 10 минут и нагревают при 70°C в течение 2 часов и охлаждают до комнатной температуры. Добавляют карбонат цезия (0,209 г, 0,64 ммоль), комплекс [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (0,013 г, 0,016 ммоль) и (6-фторпиридин-3-ил)бороновую кислоту (0,059 г, 0,41 ммоль), затем продувают дополнительным азотом. Реакционную смесь нагревают при 100°C в течение 3-4 часов. Затем смесь охлаждают при комнатной температуре, помещают в этилацетат (20 мл), промывают водой (2×20 мл) и насыщенным раствором соли (10 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента этилацетат/н-гептан (50/50→90/10) с получением указанного в заголовке соединения (0,09 г, 91%).
1H-ЯМР (400 МГц, Хлороформ-d) δ 9,06 (с, 1H), 8,94-8,84 (м, 1H), 8,67 (д, 1H), 8,57 (тд, 1H), 8,28 (д, 1H), 8,06 (д, 1H), 7,90 (с, 1H), 7,71 (д, 1H), 7,45 (дд, 1H), 7,10 (дд, 1H).
МС (ИЭР); m/z=308,37 [M+H]+
Примеры 27-43, 88 и 105-110
По однореакторной реакции сочетания Сузуки, описанной в примере 26, с применением бром-хлорного исходного материала, R1 бороновой кислоты или сложного эфира и R2 бороновой кислоты или сложного эфира, указанных в таблице ниже, получают следующие соединения. Источник комплекса палладия [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном может быть замещен тетракис(трифенилфосфин)палладием(0). Карбонат цезия может быть замещен карбонатом калия.
Таблица 3




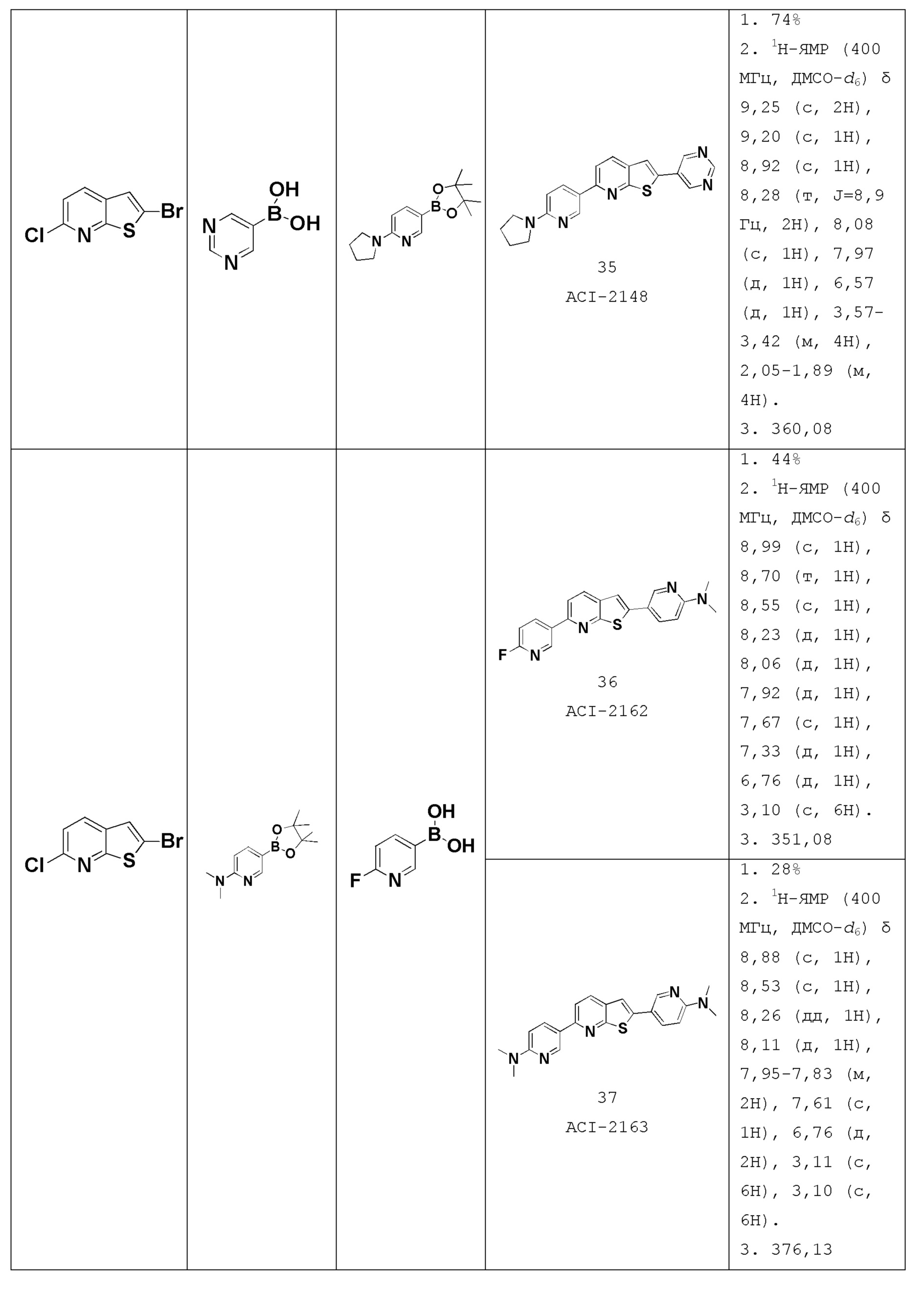

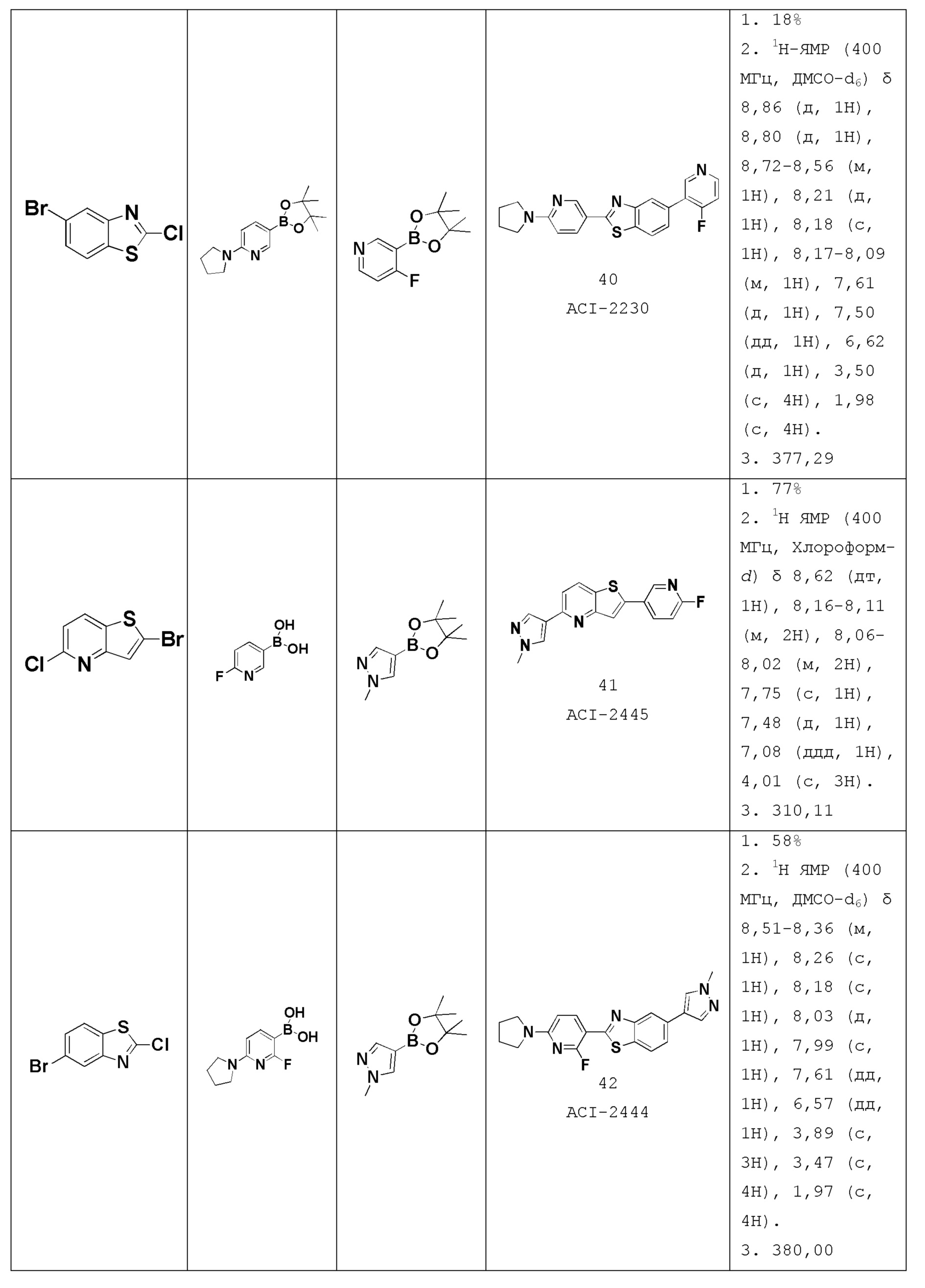


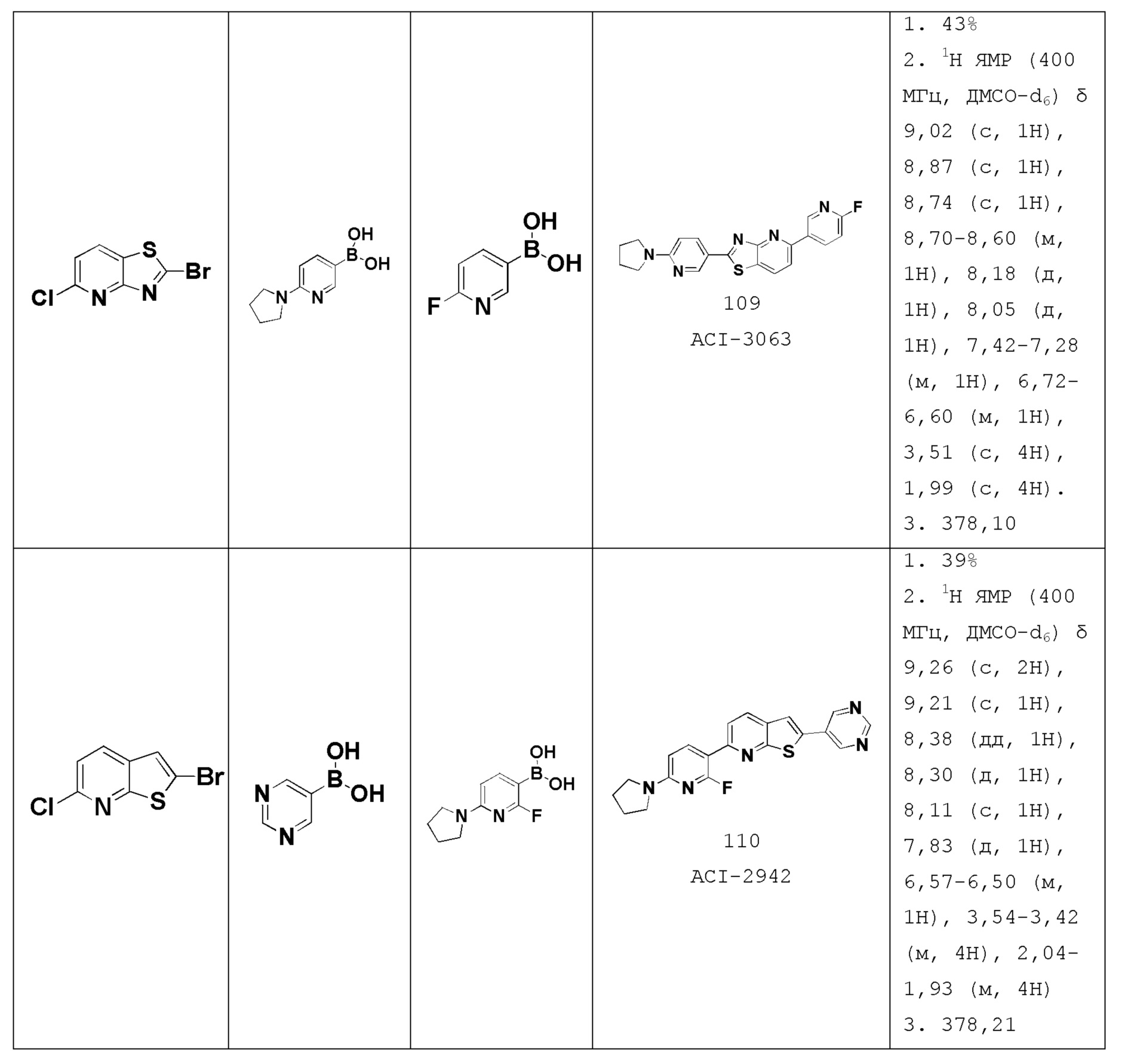
Пример 44 (ACI-2181)

Стадия A
В микроволновую пробирку добавляют указанное в заголовке соединение из Примера 26 (0,03 г, 0,0976 ммоль), (R)-3-фторпирролидин (0,061 г, 0,488 ммоль), н-бутанол (3 мл), затем N,N'-диизопропилэтиламин (0,118 мл, 0,683 ммоль). Пробирку герметично закрывают и нагревают при 200°C в течение 1 часа с применением микроволновой печи Biotage Initiator. Растворитель удаляют при пониженном давлении, и остаток помещают в дихлорметан (20 мл), промывают насыщенным раствором хлорида аммония (20 мл) и водой (20 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента метанол/дихлорметан (0/100→10/90) с получением указанного в заголовке соединения (0,013 г, 35%).
1H-ЯМР (400 МГц, Хлороформ-d) δ 9,05 (д, 1H), 8,87 (д, 1H), 8,64 (дд, 1H), 8,32 (дд, 1H), 8,17 (д, 1H), 8,03 (дт, 1H), 7,86 (с, 1H), 7,65 (д, 1H), 7,42 (дд, 1H), 6,55 (д, 1H), 5,43 (д, 1H), 3,96 (дд, 1H), 3,87-3,60 (м, 3H), 2,57-2,36 (м, 1H), 2,35-1,99 (м, 1H).
МС (ИЭР); m/z=377,48 [M+H]+
Примеры 45-55, 89-93 и 111-122
По методике, описанной в Примере 44, за исключением производных фтора и аминов, указанных в таблице ниже, получают следующие соединения.
Таблица 4




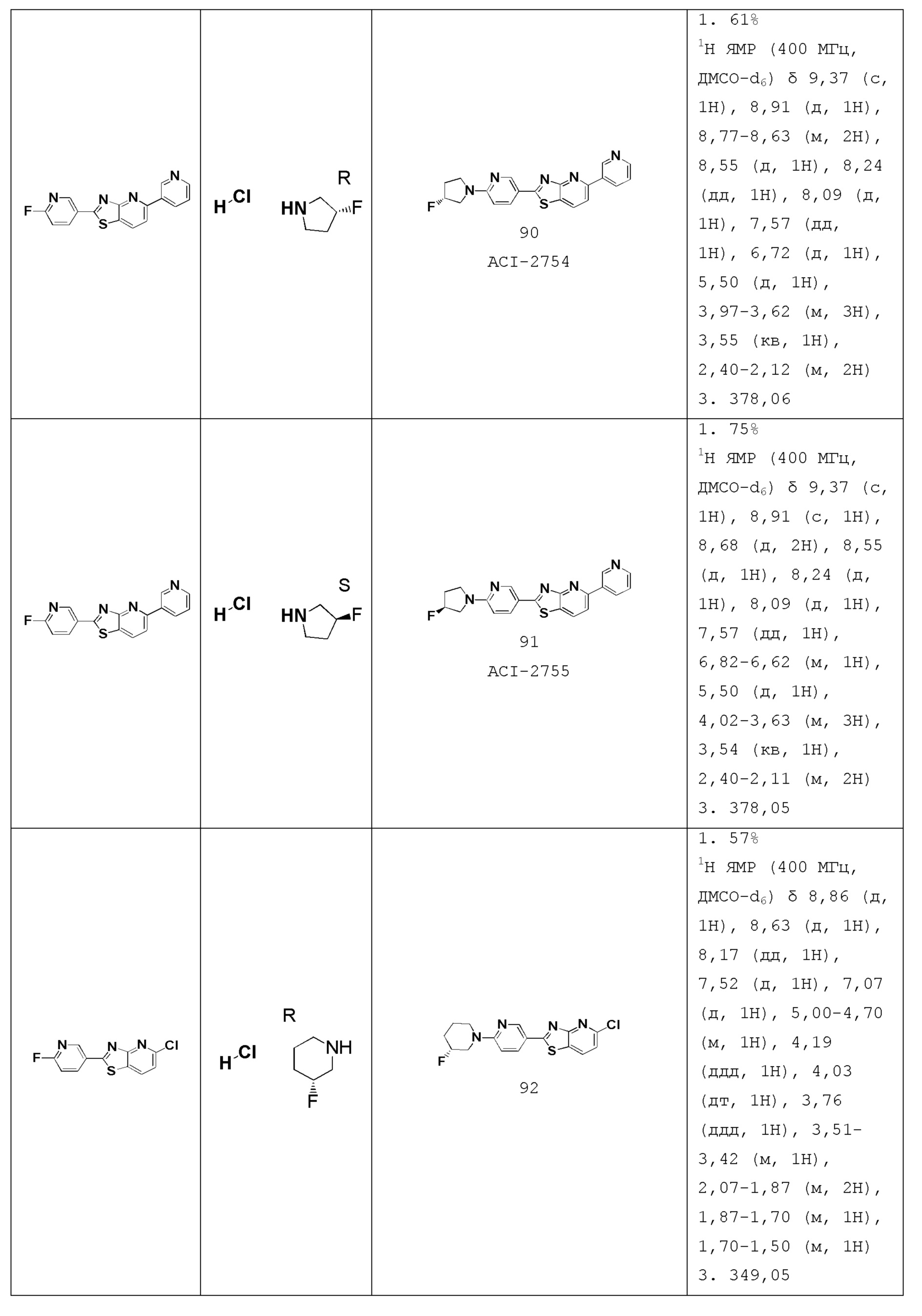

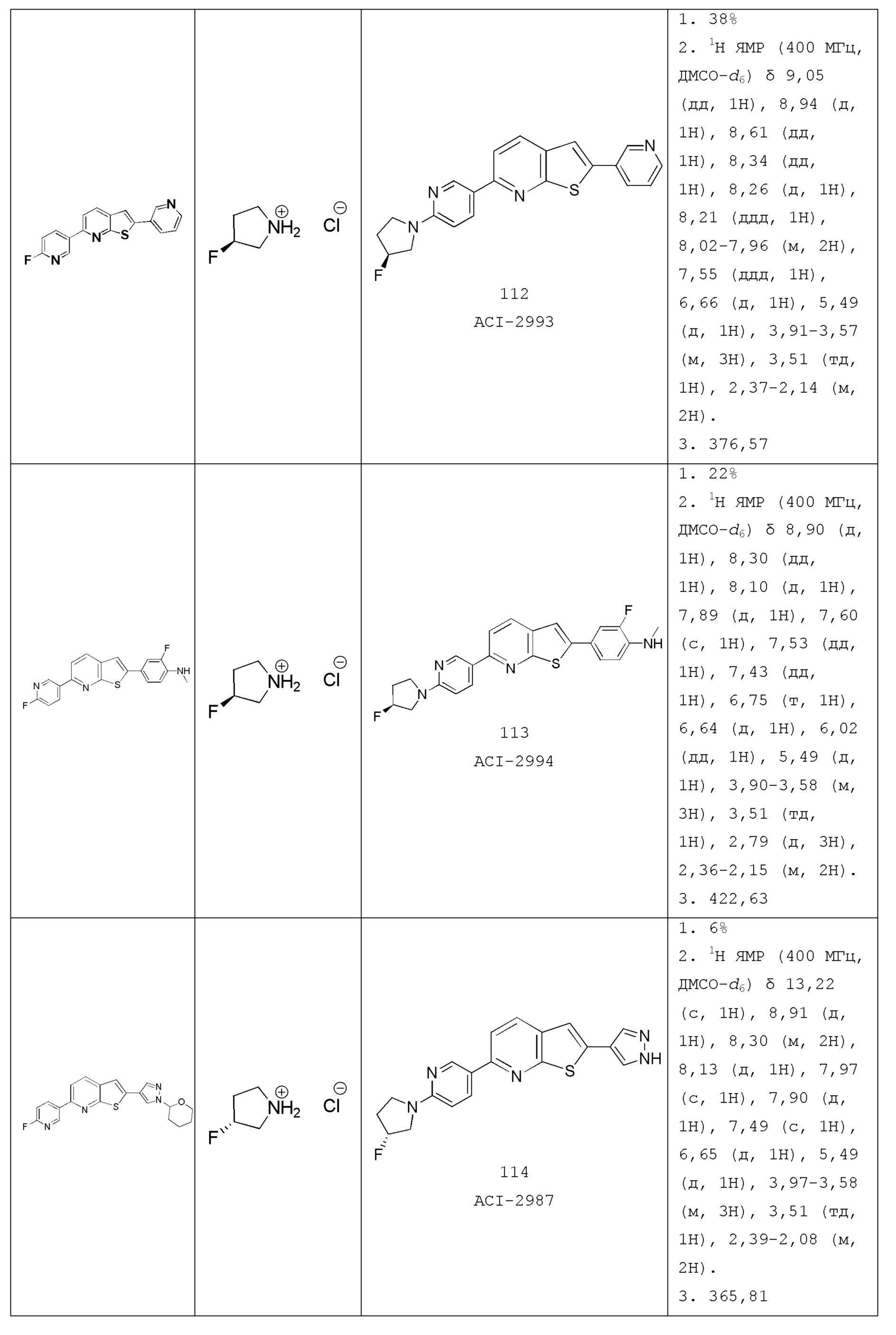


Пример 56 (ACI-2062)

Стадия A: EG 06 61-2
Смесь указанного в заголовке соединения из Примера 1 (0,070 г, 0,173 ммоль) в N,N'-диметилформамиде (4 мл) охлаждают при 0°C и добавляют гидрид натрия (0,005 г, 0,21 ммоль). Смесь перемешивают при 0°C в течение 1 ч и нагревают до комнатной температуры и перемешивают в течение еще 30 мин и добавляют 1-бром-2-фторэтан (16 мкл, 0,21 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и снова добавляют гидрид натрия (0,005 г, 0,21 ммоль) и 1-бром-2-фторэтан (0,016 мл, 0,21 ммоль). Через 2 часа добавляют воду (1 мл), и растворители удаляют при пониженном давлении. Неочищенный продукт помещают в дихлорметан (10 мл), промывают насыщенным раствором соли (10 мл) и водой (10 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента метанол/дихлорметан (0/100→10/90) с получением указанного в заголовке соединения (0,04 г, 51%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,14 (д, 1H), 9,06 (д, 1H), 8,62 (дд, 1H), 8,53 (дд, 1H), 8,35 (д, 1H), 8,21 (дт, 1H), 8,12 (д, 1H), 8,03 (с, 1H), 7,79 (д, 1H), 7,55 (дд, 1H), 4,64 (дт, 2H), 4,28 (дт, 2H), 1,49 (с, 9H).
МС (ИЭР); m/z=395,19 [M+H-tBu], 375,18 [M+H-tBu-HF]
Стадия B: EG 06 68
К соединению со стадии A выше (0,020 г, 0,044 ммоль) добавляют дихлорметан (4 мл) и трифторуксусную кислоту (400 мкл), и раствор перемешивают при комнатной температуре в течение 5 ч. Реакционную смесь was концентрируют при пониженном давлении и добавляют воду (10 мл), затем 1 M водный раствор гидроксида натрия (pH~13). Неочищенный продукт экстрагируют дихлорметаном (2×10 мл), органические фракции собирают, сушат над Na2SO4, фильтруют и растворители удаляют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента метанол/дихлорметан (0/100→20/80) с получением указанного в заголовке соединения (0,007 г, 45%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,05 (д, 1H), 8,83 (д, 1H), 8,61 (дд, 1H), 8,29-8,15 (м, 3H), 8,04-7,86 (м, 2H), 7,55 (дд, 1H), 7,24 (т, 1H), 6,68 (д, 1H), 4,59 (дт, 2H), 3,67 (дкв, 2H).
МС (ИЭР); m/z=351,20 [M+H]+
Пример 57 ACI-2097 EG 06 69
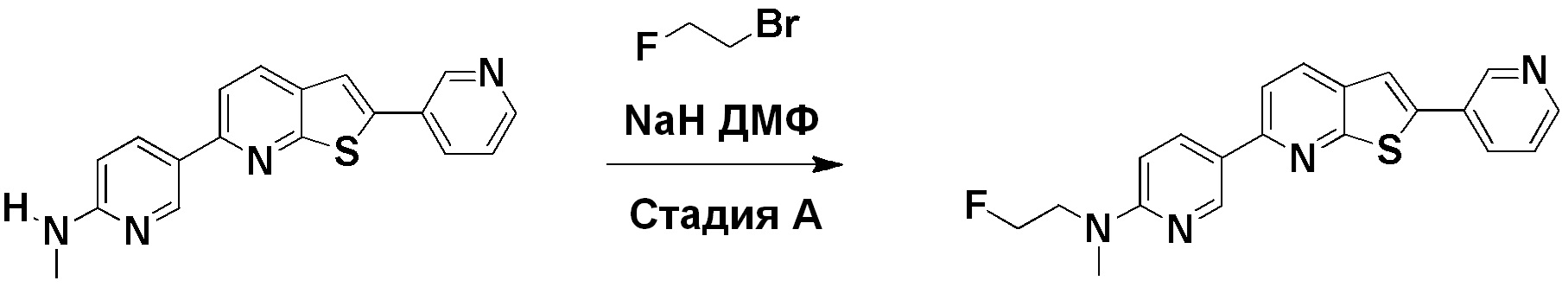
Стадия A
К указанному в заголовке соединению из Примера 47 (0,015 г, 0,036 ммоль) в N,N'-диметилформамиде (2 мл) добавляют гидрид натрия (0,0034 г, 0,14 ммоль) и смесь перемешивают при комнатной температуре в течение 1 ч, затем добавляют 1-бром-2-фторэтан (0,01 мл, 0,15 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду (2 мл), и растворители удаляют при пониженном давлении. Неочищенный продукт помещают в дихлорметан (10 мл), промывают насыщенным раствором соли (10 мл) и водой (10 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента метанол/дихлорметан (0/100→10/90) с получением указанного в заголовке соединения (0,004 г, 23%).
1H-ЯМР (400 МГц, Хлороформ-d) δ 9,02 (д, 1H), 8,85 (д, 1H), 8,61 (д, 1H), 8,31 (дд, 1H), 8,06 (д, 1H), 8,01-7,94 (м, 1H), 7,69 (д, 1H), 7,53 (с, 1H), 7,40 (дд, 1H), 6,67 (д, 1H), 4,70 (дт, 2H), 4,01 (дт, 2H), 3,21 (с, 3H).
МС (ИЭР); m/z=365,20 [M+H]+
Пример 58 (ACI-1929)

Стадия A
Высушенную в печи колбу Шленка вакуумируют и повторно заполняют газообразным аргоном. Методику повторяют 3-4 раза и колбу охлаждают до комнатной температуры. Затем добавляют XANTPHOS (16,9 мг, 0,029 ммоль) и ацетат палладия(II) (2,2 мг, 9,75 мкмоль) и дегазируют (аргон). 1,4-Диоксан (5 мл) добавляют через шприц, и смесь нагревают при 110°C в течение 2 минут с получением прозрачного желтого раствора, что указывает на образование Pd-катализатора. Затем коммерчески доступный 2,3-дигидробензо[b][1,4]диоксин-6-амин (16,2 мг, 0,107 ммоль), указанное в заголовке соединение из Препаративного примера 14(30 мг, 0,097 ммоль) и карбонат цезия (95 мг, 0,292 ммоль) добавляют в атмосфере аргона. Реакционную смесь нагревают при 110°C на песочной бане в течение 2 ч, охлаждают до комнатной температуры, и растворители удаляют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента дихлорметан/этилацетат (90/10) с получением указанного в заголовке соединения в виде белого твердого вещества (41,2 мг, 37%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,15 (с, 1H), 7,90 (д, 1H), 7,65 (д, 2H), 7,52 (с, 1H), 7,45 (д, 1H), 7,14-7,00 (м, 3H), 6,81 (д, 2H), 4,93-4,78 (м, 1H), 4,78-4,65 (м, 1H), 4,41-4,31 (м, 1H), 4,24 (дд, 5H)
МС (ИЭР); m/z=423,11 [M+H]+
Примеры 59-73 и 123-127
По методике, описанной в Примере 58, за исключением применения производных галогена и аминов/амидов, указанных в таблице ниже, получают следующие соединения.
Таблица 5




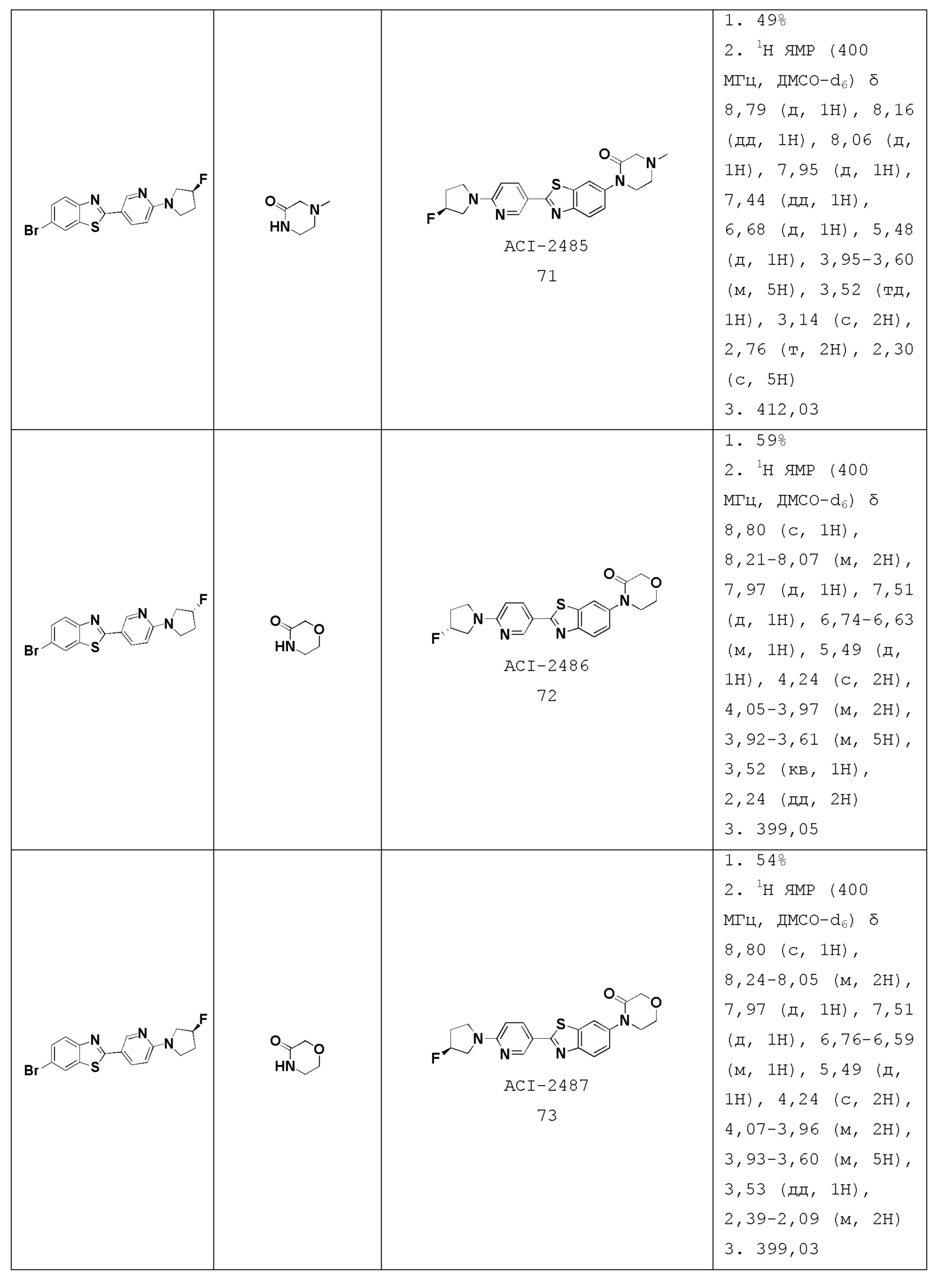


Пример 74 (ACI-1975)

Стадия A
Раствор указанного в заголовке соединения из Примера 60(0,037 г, 0,075 ммоль) в дихлорметане (2 мл) и 1,25 N HCl (2 мл) в метаноле перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь концентрируют при пониженном давлении досуха. Добавляют 1N NaOH, и водную фазу экстрагируют дихлорметаном (3×20 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (0,012 г, 41%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,09 (с, 1H), 7,82 (д, 1H), 7,62 (д, 2H), 7,43 (д, 2H), 7,29 (с, 1H), 6,94 (д, 2H), 6,77 (д, 1H), 6,59 (д, 2H), 5,98 (кв, 1H), 4,87-4,73 (м, 1H), 4,73-4,62 (м, 1H), 4,32-4,20 (м, 1H), 4,20-4,11 (м, 1H), 2,71 (д, 3H).
МС (ИЭР); m/z=394,10 [M+H]+
Примеры 75 и 76
По методике, описанной в Примере 74, за исключением Boc-защищенных производных, указанных в таблице ниже, получают следующие соединения.
Таблица 6

Пример 77 (ACI-1962)

Стадия A
Высушенную в печи колбу Шленка вакуумируют и снова заполняют газообразным аргоном. Методику повторяют 3-4 раза и колбу охлаждают до комнатной температуры. Затем, 1,4-диоксан (5 мл) добавляют через шприц и дегазируют (аргон). Указанное в заголовке соединение из Препаративного примера 6(200 мг, 0,811 ммоль), этинилтриметилсилан (0,458 мл, 3,240 ммоль), йодид меди (I) (7,72 мг, 0,041 ммоль), Pd(Ph3P)4 (94 мг, 0,081 ммоль) и триэтиламин (0,451 мл, 3,24 ммоль) добавляют в атмосфере аргона. Реакционную смесь нагревают при 100°C на песчаной бане в течение 4 ч, охлаждают до комнатной температуры и реакционную смесь разбавляют водой (50 мл). Водную фазу затем экстрагируют дихлорметаном (3×50 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента дихлорметан/этилацетат (90/10→70/30) с получением указанного в заголовке соединения (200 мг, 80%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,06 (с, 1H), 8,71-8,55 (м, 1H), 8,25 (д, 1H), 8,21 (д, 1H), 8,03 (с, 1H), 7,59 (д, 1H), 7,55 (дд, 1H), 0,28 (с, 9H)
МС (ИЭР); m/z=308,76 [M+H]+
Стадия B
Высушенную в печи колбу Шленка вакуумируют и снова заполняют газообразным аргоном. Методику повторяют 3-4 раза и колбу охлаждают до комнатной температуры. Затем, метанол (10 мл) добавляют через шприц и дегазируют (аргон). Добавляют указанное в заголовке соединение со стадии A выше(200 мг, 0,648 ммоль), затем карбонат калия (358 мг, 2,590 ммоль) в атмосфере аргона. Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрируют при пониженном давлении досуха. Добавляют воду (50 мл), и водную фазу экстрагируют дихлорметаном (3×50 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (153 мг, 74%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 9,06 (д, 1H), 8,67-8,59 (м, 1H), 8,28 (д, 1H), 8,22 (дт, 1H), 8,04 (с, 1H), 7,62 (д, 1H), 7,55 (дд, 1H), 4,50 (с, 1H).
МС (ИЭР); m/z=236,60 [M+H]+
Стадия C
Высушенную в печи колбу Шленка вакуумируют и снова заполняют газообразным аргоном. Методику повторяют 3-4 раза и колбу охлаждают до комнатной температуры. Затем, 1,4-диоксан (8 мл) добавляют через шприц и дегазируют (аргон). Добавляют указанное в заголовке соединение со стадии B выше(20 мг, 0,085 ммоль), 1-йод-4-метоксибензол (24 мг, 0,102 ммоль), йодид меди(I) (0,8 мг, 0,004 ммоль), Pd(Ph3P)4 (9,8 мг, 0,008 ммоль) и триэтиламин (23 мкл, 0,169 ммоль) в атмосфере аргона. Реакционную смесь нагревают при 100°C на песчаной бане в течение 4 ч, охлаждают до комнатной температуры и разбавляют водой (50 мл). Водную фазу затем экстрагируют дихлорметаном (3×50 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента дихлорметан/этилацетат (95/5→85/25) с получением указанного в заголовке соединения (5 мг, 15%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,30-8,20 (м, 2H), 8,07-8,00 (м, 1H), 7,75-7,56 (м, 5H), 7,52-7,46 (м, 1H), 7,03 (д, 2H), 3,82 (с, 3H)
МС (ИЭР); m/z=342,79 [M+H]+
Пример 78 (ACI-2234)

Стадия A
Высушенную в печи колбу Шленка вакуумируют и снова заполняют газообразным аргоном. Методику повторяют 3-4 раза и колбу охлаждают до комнатной температуры. Затем, ДМФ (2 мл) добавляют через шприц и дегазируют (аргон). Указанное в заголовке соединение из Препаративного примера 20(15 мг, 0,050 ммоль) добавляют в атмосфере аргона, затем добавляют гидрид натрия (1,5 мг, 0,060 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и добавляют 1-бром-2-фторэтан (9,5 мг, 0,075 ммоль). Затем реакционную смесь нагревают при 60°C в течение 18 часов. Неочищенный продукт охлаждают до комнатной температуры и добавляют EtOAC (40 мл). Органический слой промывают несколько раз насыщенным раствором соли, сушат над Na2SO4, фильтруют и сушат при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента дихлорметан/метанол (98/2→92/8) с получением указанного в заголовке соединения (5 мг, 25%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,70 (д, 1H), 8,00 (дд, 1H), 6,55 (д, 1H), 4,61 (дт, 2H), 3,83-3,66 (м, 4H), 3,55-3,40 (м, 4H), 3,06 (т, 2H), 2,07-1,88 (м, 4H)
МС (ИЭР); m/z=347,27 [M+H]+
Примеры 79 и 128
По методике, описанной в Примере 78, получают следующие соединения.
Таблица 7

Пример 80 (ACI-2253)

Стадия A
Высушенную в печи колбу Шленка вакуумируют и снова заполняют газообразным аргоном. Методику повторяют 3-4 раза и колбу охлаждают до комнатной температуры. Затем, 1,4-диоксан (2 мл) добавляют через шприц и дегазируют (аргон). Указанное в заголовке соединение из Препаративного примера 20(20 мг, 0,067 ммоль), 3-йодпиридин (16,4 мг, 0,080 ммоль), йодид меди(I) (1,2 мг, 0,007 ммоль), (1R,2R)-N1,N2-диметилциклогексан-1,2-диамин (2,8 мг, 0,020 ммоль) и фосфат калия (35,3 мг, 0,166 ммоль) добавляют в атмосфере аргона. Реакционную смесь нагревают при 100°C на песчаной бане в течение 18 ч, охлаждают до комнатной температуры и растворители удаляют при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением градиента дихлорметан/этилацетат (98/2→95/5) с получением указанного в заголовке соединения (11 мг, 43%).
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,75 (д, 1H), 8,65 (с, 1H), 8,44 (д, 1H), 8,12-7,97 (м, 1H), 7,84 (д, 1H), 7,47 (дд, 1H), 6,58 (д, 1H), 4,15 (т, 2H), 3,48 (с, 4H), 3,23 (т, 2H), 1,97 (с, 4H)
МС (ИЭР); m/z=378,46 [M+H]+
Примеры 129 и 130
По методике, описанной в Примере 80, получают следующие соединения.
Таблица 8

Пример 131 (ACI-3052)

Стадия A
Высушенную в печи колбу Шленка вакуумируют и снова заполняют газообразным аргоном. Методику повторяют 3-4 раза и колбу охлаждают до комнатной температуры. Затем, ДМА (5 мл) добавляют через шприц и дегазируют (аргон). Указанное в заголовке соединение из Препаративного примера 25(50 мг, 0,067 ммоль), дицианоцинк (52,6 мг, 0,448 ммоль), цинк (29,3 мг, 0,448 ммоль) и Pd(Ph3P)4 (8,6 мг, 7,47 мкмоль) добавляют в атмосфере аргона. Реакционную смесь нагревают при 120°C на песчаной бане в течение 18 ч. Неочищенный продукт охлаждают до комнатной температуры и добавляют дихлорметан (50 мл). Органический слой промывают несколько раз 1N NaOH, сушат над Na2SO4, фильтруют и сушат при пониженном давлении. Остаток очищают на картриджах HP-Sil SNAP с применением системы очистки Biotage Isolera One с применением элюента дихлорметан/метанол (98/2). Затем твердое вещество промывают ДХМ (20 мл) и маточную жидкость концентрируют при пониженном давлении с получением указанного в заголовке соединения (6 мг, 12%).
1H ЯМР (400 МГц, Хлороформ-d) δ 8,78-8,56 (м, 1H), 8,31 (д, 1H), 7,61 (д, 1H), 6,40 (дд, 1H), 3,80-3,34 (м, 4H), 2,07 (с, 4H)
МС (ИЭР); m/z=326,11 [M+H]+
Пример 132 (ACI-3092)

В 2 мл микроволновую пробирку добавляют (S)-5-хлор-2-(6-(3-фторпиперидин-1-ил)пиридин-3-ил)тиазоло[4,5-b]пиридин (26 мг, 0,075 ммоль) Пример 93, 2-метилпропан-2-олат калия (16,73 мг, 0,149 ммоль) и 1H-имидазол (6,09 мг, 0,089 ммоль) в ДМСО (1242 μl) с получением красно/коричневой суспензии, которую нагревают в течение 90 минут при 120°C. После реакции добавляют 10 мл ледяной воды, затем экстрагируют 15 мл ДХМ 3 раза, экстракт промывают подходящим количеством воды, сушат над безводным сульфатом натрия и концентрируют в вакууме. Остаток очищают на Biotage Isolera One (от 100:0 до 95:5 ДХМ/MeOH; 10 г HP-Sil колонка) с получением желаемого продукта (22 мг, 78%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,88 (д, 1H), 8,75 (д, 1H), 8,65 (с, 1H), 8,19 (дд, 1H), 8,08 (т, 1H), 7,88 (д, 1H), 7,18 (с, 1H), 7,07 (д, 1H), 4,84 (д, 1H), 4,27-4,10 (м, 1H), 4,02 (д, 1H), 3,75 (дд, 1H), 2,05-1,85 (м, 2H), 1,79 (с, 1H), 1,60 (с, 1H)
МС (ИЭР); m/z=381,11 [M+H]+
ОПИСАНИЕ БИОЛОГИЧЕСКОГО АНАЛИЗА
Анализ 1 (анализ флуоресценции):
Прямое окрашивание соединениями в соответствии с данным изобретением срезов мозга человека с болезнью Паркинсона
20 мкм замороженные срезы амигдалы покупают у внешнего поставщика (Tissue Solutions Ltd.). У доноров диагностирована БП, стадии по Брааку V-VI (Braak et al., Neurobiol. Aging, 2003, 24,197-211), и с подтвержденной aSyn патологией. Доноров БП, стадии по Брааку V-VI, со смешанной патологией, включающей aSyn агрегаты, а также Aβ бляшки, также применяют в этом анализе. Срезы хранят при -80°C до начала эксперимента.
Срезы мозга окружают пастообразным блокатором жидкости из ручки для снижения объема раствора для различных инкубаций. Срезы закрепляют на 15 мин при 4°C 4% параформальдегидом и промывают три раза в течение 5 минут ФРФБ (физиологическим раствором с фосфатным буфером) при комнатной температуре. Тестируемые компоненты инкубируют на срезах при 100 мкМ в 50% этаноле в воде в течение 30 мин при комнатной температуре, затем промывают три раза в течение 5 минут ФРФБ. Срезы затем насыщают и пермеабилизируют в блокирующем буфере (ФРФБ, 10% NGS, 0,25% Triton) в течение 1 часа при комнатной температуре и затем инкубируют в течение 2 часов при комнатной температуре с первичными антителами против aSyn: aSyn-211 (SantaCruz Biotechnology sc-12767) или aSyn-pS129 (Abcam AB51253) и первичными антителами против Aβ, 4G8, (Covance, SIG-39220). Все первичные антитела разводят 1/250 в ФРФБ, 5% NGS, 0,25% Triton. После трех промывок ФРФБ срезы инкубируют в течение 30 минут при комнатной температуре с вторичными анти-мышиными антителами, меченными AlexaFluor555 (Invitrogen A21422) или анти-кроличьими антителами, меченными AlexaFluor555 (Invitrogen A21428) и затем промывают три раза ФРФБ. Для снижения аутофлуоресценции ткани срезы инкубируют в растворе 0,1% Sudan Black (Sigma 199664) в 70% этанол в течение 15 мин при комнатной температуре, затем четыре раза промывают ФРФБ и помещают под покровные стекла с применением реагента ProLong Gold Antifade reagent (Invitrogen P36930).
Срезы анализируют на микроскопе Nikon Eclipse Ti для определения окрашивания и визуализируют с применением камеры Nikon DS-Fi2 и программы NIS-Element AR4.13.1. Результаты этого анализа показаны в таблице 9.
Прямое окрашивание соединениями в соответствии с данным изобретением срезов мозга человека с болезнью Альцгеймера
20 мкм замороженные срезы амигдалы покупают у внешнего поставщика (Tissue Solutions Ltd.). У доноров диагностирована БА, стадии по Брааку V-VI (Braak et al., Neurobiol. Aging, 1995, 16,271-284) и подтверждена Aβ патология. Срезы хранят при -80°C до начала эксперимента.
Срезы мозга окружают пастообразным блокатором жидкости из ручки для снижения объема раствора для различных инкубаций. Срезы закрепляют на 15 мин при 4°C 4% параформальдегидом и промывают три раза в течение 5 минут ФРФБ при комнатной температуре. Тестируемые компоненты инкубируют на срезах при 100 мкМ в 50% этаноле в воде в течение 30 мин при комнатной температуре, затем промывают три раза в течение 5 минут ФРФБ. Срезы затем насыщают и пермеабилизируют в блокирующем буфере (ФРФБ, 10% NGS, 0,25% Triton) в течение 1 часа при комнатной температуре и затем инкубируют в течение 2 часов при комнатной температуре с первичными антителами против Aβ, 4G8, (Covance, SIG-39220), разведенными 1/250 в ФРФБ, 5% NGS и 0,25% Triton. После трех промывок ФРФБ срезы инкубируют в течение 30 минут при комнатной температуре с вторичными анти-мышиными антителами, меченными AlexaFluor555 (Invitrogen A21422) и затем промывают три раза ФРФБ. Для снижения аутофлуоресценции ткани срезы инкубируют в растворе 0,1% Sudan Black (Sigma 199664) в 70% этанол в течение 15 мин при комнатной температуре, затем четыре раза промывают ФРФБ и помещают под покровные стекла с применением реагента ProLong Gold Antifade reagent (Invitrogen P36930).
Срезы анализируют на микроскопе Nikon Eclipse Ti для определения окрашивания и визуализируют с применением камеры Nikon DS-Fi2 и программы NIS-Element AR4.13.1. Результаты этого анализа показаны в таблице 9.
Таблица 9
Условные обозначения в таблице: интенсивность окрашивания альфа-синуклеиновых агрегатов и Телец Леви (срезы БП) и Aβ бляшек (срезы AD и срезы БП со смешанной патологией): - (нет); +/- (очень слабое); +++ (сильное); ++ (хорошее); + (слабое); н.о.: не определено
Анализ 2 (интерферометрия обратного рассеяния):
Получение общих гомогенатов мозга из контрольных и БП образцов мозга
Приблизительно 300 мг коры головного мозга контрольных и БП доноров (купленных у Tissue Solutions Ltd., доноры с диагностированной БП, стадии по Брааку V-VI, или здоровые доноры подходящего возраста) взвешивают и гомогенизируют на льду с применением стеклянного поттера в 9× объеме/массе гомогенизационного буфера: 25 мМ Tris-HCl pH 7,4, 150 мМ NaCl, 1 мМ ЭДТК, 1 мМ ЭГТК содержащих ингибиторов фосфатазы (30 мМ NaF, 0,2 мМ Na3VO4, 1 нМ окадаиковая кислота, 1 мМ фенилметилсульфонилфторид (ФМСФ), 5 мМ Na4P2O7) и протеазный ингибиторный коктейль (Complete™, Roche). Образцы аликвотируют и хранят при -80°C.
Определение констант диссоциаций (Kd) соединений в соответствии с данным изобретением интерферометрией обратного рассеяния
Измерения интерферометрии обратного рассеяния (ИОР) проводят в Molecular Sensing GmbH (Idstein, Germany). Примеры в соответствии с данным изобретением в количестве 10 мМ в ДМСО разводят 1:100 в ФРФБ и затем снова разводят в ФРФБ с получением мкМ концентрации соединения в ФРФБ с 0,02% ДМСО. Индекс рефракции аналитического буфера (ФРФБ pH 7,4 содержащий 0,02% ДМСО) и соединения подгоняют и затем проводят 2× серийные разведения соединения в полипропиленовых резервуарах для разведения. Оттаянную аликвоту контрольных, БА и БП гомогенатов мозга разводят 1/150 в ФРФБ, pH 7,4, и сразу же применяют.
Примеры в соответствии с данным изобретением и гомогенаты мозга смешивают 1:1 в 96-луночных ПЦР микропланшетах до конечного объема 60 мкл и запаивают пленкой. Анализы инкубируют при комнатной температуре в течение 45 минут, затем прогоняют на инструменте BSI. Лунки прокалывают индивидуально до впрыска образца и измерения сигнала BSI (каждую лунку анализируют трижды).
Для каждого анализа ссылочную кривую (контрольный гомогенат мозга) вычитают из аналитической кривой точка за точкой. Конечные данные для разностной кривой экспортируют в программу Graphpad Prism® (GraphPad Software, La Jolla California USA, www.graphpad.com) и вписывают в уравнение односайтового связывания для определения Kd для примера соединения. Примеры в соответствии с данным изобретением прогоняют для получения, по меньшей мере, двух успешных экспериментов с хорошей воспроизводимостью. Успех определяют как сигнал связывания с R2>0,7. Результаты этого анализа показаны в таблице 10.
Таблица 10
Реферат
Изобретение относится к соединению формулы (IIa), его определяемо меченым производным, стереоизомерам, рацемическим смесям и фармацевтически приемлемым солям, фармацевтической композиции на их основе для лечения, облегчения или профилактики расстройства или аномалии, связанных с альфа-синуклеиновыми агрегатами, диагностической композиции на их основе для применения для визуализации альфа-синуклеиновых агрегатов, способу сбора данных для диагностики или для определения предрасположенности к расстройству или аномалии, связанным с альфа-синуклеиновыми агрегатами, способу сбора данных для отслеживания остаточного расстройства или прогнозирования реакции пациента, страдающего расстройством или аномалией, связанными с альфа-синуклеиновыми агрегатами, и способу определения количества альфа-синуклеиновых агрегатов, где альфа-синуклеиновые агрегаты представляют собой тельца Леви и/или нейриты Леви. Технический результат заключается в разработке новых соединений формулы (IIa), которые могут быть использованы для диагностики, отслеживания развития заболевания или отслеживания активности лекарственных средств, группы расстройств или аномалий, связанных с агрегатами альфа-синуклеина таких как болезнь Паркинсона, слабоумия с тельцами Леви, болезни Альцгеймера, а также для лечения, облегчения или профилактики таких расстройств или аномалий. В общей формуле (IIa)









Формула











Документы, цитированные в отчёте о поиске
Производные тиофлавина, связывающие амилоид, способ обнаружения in vivo отложений амилоида и способраспознавания болезни альцгеймера

Комментарии