Дипиколиламинные производные и их фармацевтическое применение - RU2703454C2
Код документа: RU2703454C2
Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка утверждает преимущество Предварительной Заявки на Патент США № 62/001725, поданной 22 мая 2014 г., содержание которой во всей полноте включено в данное описание в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
Фосфатидилсерин (phosphatidylserine - PS), мембранный фосфолипид, обычно находится на внутренней поверхности мембраны здоровой клетки. При определенных обстоятельствах PS также обнаруживается на внешней поверхности. См. Leventis et al., Annu. Rev. Biophys.2010, 39, 407-27.
В частности, PS располагается на внешней поверхности раковых клеток. См. Thorpe et al., Breast Cancer Res Treat 1995, 36 (2), 237-51; Ran et al., Int. J. Radiai. Oncol. Biol. Phys. 2002, 54 (5), 1479-84; и Thorpe, Thromb. Res. 2010, 125 Suppl 2, S134-137. Далее, в недавних исследованиях установлено, что PS существует в опухолевых сосудистых сетях и микрососудах, образованных в опухолях. См. Stafford et al., Neoplasia. 2011, 13, 299-308; и Yin et al., Cancer Immunology Research 2013, 1, 1-13. Кроме того, PS в значительных количествах располагается на внешней поверхности многих патогенных частиц, таких как бактерии и вирусы. См. Huang et al., Cancer Res. 2005, 65 (10), 4408-16; и White et al., Bioconjug. Chem. 2010, 21 (7), 1297-1304. И наконец, PS был обнаружен на внешней поверхности клеток, в которых метаболические пути некроза клеток были неуправляемыми. Например, помимо рака, при таких состояниях, как нейродегенеративные расстройства, сердечно-сосудистые заболевания, аутоиммунные заболевания, а также нарушения обмена веществ, обнаруживается поверхностная локализация PS. См. Smith et al., Mol. Pharm. 2011, 8 (2), 583-90. Таким образом, PS является полезной мишенью доставки терапевтических средств для лечения состояний, упомянутых выше.
Белок аннексин V в настоящее время используется для доставки терапевтических средств посредством связывания с PS. Однако для такого связывания необходимы высокие уровни Са2+, которые могут активировать «скрамблазы» (ʺscramblasesʺ), способные вызывать перемещение PS на внешние поверхности близлежащих нормальных клеток, приводя к нежелательному превращению нормальных клеток в мишени.
Существует потребность в разработке средства доставки, которое селективно связывается с PS, свойственным заболеваниям, для достижения сайт-специфической доставки терапевтического лекарственного средства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение основано на неожиданном открытии того, что некоторые дипиколиламинные производные эффективны в доставке терапевтического средства к целевому сайту заболевания, при котором фосфатидилсерин находится на внешней поверхности клеточных мембран.
В соответствии с одним аспектом, данное изобретение относится к соединениям формулы (I), представленной ниже:

В данной формуле каждый из A1, А2, А3, А4, А5, А6 и В1 независимо представляет собой С1-С6 двухвалентный алифатический радикал, С1-С6 двухвалентный гетероалифатическая радикал, двухвалентный арильный радикал или двухвалентный гетероарильный радикал; В2 представляет собой связь, С1-С6 двухвалентный алифатический радикал, С1-С6 двухвалентный гетероалифатический радикал, двухвалентный арильный радикал, двухвалентный гетероарильный радикал, D1-NR1-С(O)-D2, D1-C(O)NR1-D2-NR1'-C(O)-D3, D1-D2-C(O)-NR1-С(O)-D3 или D1-D2-D3, каждый из D1, D2, D3 независимо представляет собой С1-С6 двухвалентный алифатический радикал, С1-С6 двухвалентный гетероалифатическая радикал, двухвалентный арильный радикал, двухвалентный гетероарильный радикал, С1-С10 двухвалентный аралкильный радикал или С1-С10 двухвалентный гетероаралкильный радикал, и каждый из R1 и R1' независимо представляет собой Н, С1-С6 двухвалентный гетероалифатический радикал, двухвалентный арильный радикал, двухвалентный гетероарильный радикал или С1-С10 двухвалентный аралкильный радикал; каждый из L1 и L2 независимо представляет собой связь, NR2, NR2C(О), NR2C(S), NR2CR3R4, NR2SО2, NR2C(О)NR3 или NR2C(S)NR3, каждый из R2, R3 и R4 независимо представляет собой Н, С1-С6 одновалентный алифатический радикал, С1-С6 одновалентный гетероалифатический радикал, одновалентный арильный радикал, одновалентный гетероарильный радикал, С1-С14 одновалентный аралкильный радикал, С1-С14 одновалентный гетероаралкильный радикал, C(S)R' или С(О)R', где R' представляет собой С1-С6 одновалентный алифатический радикал, С1-С6 одновалентный гетероалифатический радикал, одновалентный арильный радикал, одновалентный гетероарильный радикал, С1-С14одновалентный аралкильный радикал или С1-С14одновалентный гетероаралкильный радикал, при условии, что по меньшей мере один из L1 и L2 не является связью; каждый из W1, W2, W3, W4, W5, W6, W7 и W8 независимо представляет собой N или CR5, R5 представляет собой Н, галоген, циано, амино, гидроксильную группу, нитро, сульфгидрильную группу, С1-С6 алифатический радикал, С1-С6гетероалифатический радикал или галогеналифатический радикал; Х представляет собой связь, О, S или NR6, R6 представляет собой Н, С1-С6 одновалентный алифатический радикал, С1-С6 одновалентный гетероалифатический радикал, одновалентный арильный радикал, одновалентный гетероарильный радикал, С1-С14 одновалентный аралкильный радикал или С1-С14одновалентный гетероаралкильный радикал; Y представляет собой арильное кольцо или гетероарильное кольцо; и Z представляет собой терапевтический фрагмент.
Каждый алифатический радикал, гетероалифатический радикал, аралкильный радикал и гетероаралкильный радикал является незамещенным или замещен галогеном, циано, амино, гидроксильной группой, нитро, сульфгидрильной группой, С1-С6 алкокси, С1-С6 алкиламино, С1-С12 диалкиламино и С1-С6 галогеналкилом; и каждый арильный радикал и гетероарильный радикал является незамещенным или замещен галогеном, циано, амино, гидроксильной группой, нитро, сульфгидрильной группой, С1-С6 алифатическим радикалом, С1-С6 гетероалифатическим радикалом или галогеналифатическим радикалом.
Подгруппу соединений, описанных выше, составляют соединения формулы (I), в которых Y представляет собой

Другую подгруппу соединений формулы (I) составляют соединения, в которых каждый из W1, W2, W3 и W4 представляет собой N, и каждый из W5, W6, W7 и W8 представляет собой СН; или в которых каждый из W1, W2, W3 и W8 представляет собой N, и каждый из W4, W5, W6 и W7 представляет собой СН.
Еще одну подгруппу соединений формулы (I) составляют соединения, в которых каждый из A1, A2, A3, A4, A5 и A6 представляет собой метилен.
Кроме того, в соединениях формулы (I) B1 может представлять собой этилен, пропилен, бутилен или гексилен; Х может представлять собой О или NH; L2 может представлять собой C(O).
В описанных выше соединениях L1 также может представлять собой связь, NH, NHCH2, NHC(O), NHSО2, NHC(О)NH,




Кроме того, в соединениях формулы (I) В2 может представлять собой связь, этилен, фенилен,

В соединениях формулы (I) Z, терапевтический фрагмент, получен из терапевтического лекарственного средства. Он присоединен к L2 посредством связи, например амидной, сложноэфирной или тиоэфирной связи. После высвобождения из соединения формулы (I) в результате ферментативного гидролиза Z превращается в терапевтическое лекарственное средство, которое оказывает цитотоксическое действие, например анти-пролиферативное действие.
Предпочтительно, Z представляет собой противораковый терапевтический фрагмент, противовирусный терапевтический фрагмент, антибиотический терапевтический фрагмент, иммуностимулирующий терапевтический фрагмент, иммуносупрессивный терапевтический фрагмент, терапевтический фрагмент для лечения сердечно-сосудистого заболевания или цитотоксический фрагмент. Примеры Z включают, но без ограничения
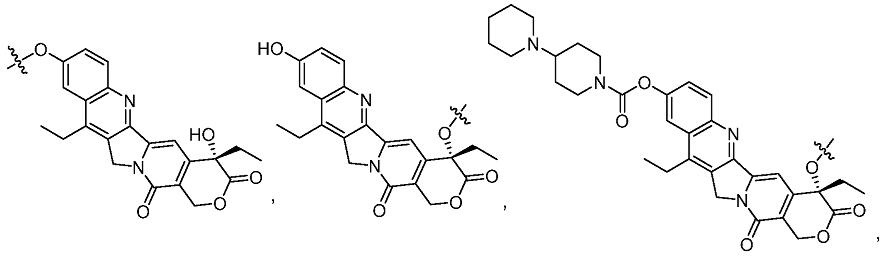


Термин «алифатический» в данном описании относится к насыщенному или ненасыщенному, линейному или разветвленному, ациклическому, циклическому или полициклическому углеводородному фрагменту. Примеры включают, но без ограничения, алкильный, алкиленовый, алкенильный, алкениленовый, алкинильный, алкиниленовый, циклоалкильный, циклоалкиленовый, циклоалкенильный, циклоалкениленовый, циклоалкинильный и циклоалкиниленовый фрагменты. Термин «гетероалифатический» в данном описании относится к алифатическому фрагменту, содержащему по меньшей мере один гетероатом, выбранный из атомов N, O, P, B, S, Si, Sb, Al, Sn, As, Se и Ge. Термин «галогеналифатический» в данном описании относится к алифатическому фрагменту, замещенному одним или несколькими атомами галогенов. Термин «алкил» в данном описании относится к прямой или разветвленной углеводородной группе, содержащий 1-20 (например, 1-10 и 1-6) атомов углерода. Примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Термин «алкилен» относится к двухвалентному алкилу. Примеры включают -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH(CH3)CH2- и -CH2CH2CH2CH2-. Термин «галогеналкил» относится к алкилу, замещенному одним или несколькими атомами галогена (хлора, фтора, брома или йода). Примеры включают трифторметил, бромметил и 4,4,4-трифторбутил. Термин «галогеналкилен» относится к двухвалентному галогеналкилу. Термин «гетероалкилен» относится к двухвалентной алкильной группе, в которой один или несколько атомов углерода замещены на гетероатом (например, атом О, N, P и S). Термин «алкокси» относится к -O-алкильной группе. Примеры включают метокси, этокси, пропокси и изопропокси. Термин «галогеналкокси» относится к алкоксигруппе, замещенной одним или несколькими атомами галогенов.
Термин «алкенил» относится к прямой или разветвленной углеводородной группе, содержащий 2-20 (например, 2-10 и 2-6) атомов углерода и одну или несколько двойных связей.
Термин «циклоалкил» относится к насыщенной или частично ненасыщенной моноциклической, бициклической, трициклической или тетрациклической углеводородной группе, содержащей от 3 до 12 атомов углерода. Примеры циклоалкильных групп включают, но без ограничения, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и циклооктил. Термин «циклоалкилен» относится к двухвалентному циклоалкилу.
Термин «гетероциклоалкил» относится к неароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, содержащей один или несколько гетероатомов (например, атомов О, N, Р и S). Примеры гетероциклоалкильных групп включают, но без ограничения, пиперазинил, имидазолидинил, азепанил, пирролидинил, дигидротиадиазолил, диоксанил, морфолинил, тетрагидропуранил и тетрагидрофуранил. Термин «гетероциклоалкилен» относится к двухвалентному гетероциклоалкилу.
Термин «арил» относится к 6-углеродной моноциклической, 10-углеродной бициклической, 14-углеродной трициклической ароматической кольцевой системе, в которой каждое кольцо может содержать от 1 до 5 заместителей. Примеры арильных групп включают фенил, нафтил и антраценил. Термин «арилен» относится к двухвалентному арилу. Термин «аралкил» относится к алкилу, замещенному арильной группой. Термин «аралкенил» относится к алкенилу, замещенному арильной группой.
Термин «гетероарил» относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, содержащей один или несколько гетероатомов (например, атомов О, N, Р, и S). Примеры включают триазолил, оксазолил, тиадиазолил, тетразолил, пиразолил, пиридил, фурил, имидазолил, бензимидазолил, пиримидинил, тиенил, хинолинил, индолил, тиазолил и бензотиазолил. Термин «гетероаралкил» относится к алкильной группе, замещенной гетероарильной группой. Термин «гетероаралкенил» относится к алкенильной группе, замещенной гетероарильной группой. Термин «гетероарилен» относится к двухвалентному гетероарилу.
Термин «галоген» относится к радикалу фтора, хлора, брома или йода. Термин «амино» относится к радикалу, полученному из амина, который является незамещенным или моно-/дизамещен алкилом, арилом, циклоалкилом, гетероциклоалкилом или гетероарилом. Термин «алкиламино» относится к группе алкил-NH-. Термин «диалкиламино» относится к группе алкил-N(алкил)-.
Термин «ацил» относится к -C(О)-алкилу, -C(О)-арилу, -C(О)-циклоалкилу, -С(O)-гетероциклоалкилу или -C(О)гетероарилу.
Термины «алкил», «циклоалкил», «гетероциклоалкил», «арил», «гетероарил», «аралкил», «гетероаралкил», «алкокси» и «арилокси», упомянутые в данном описании, включают в себя как замещенные, так и незамещенные фрагменты. Примеры заместителей включают, но без ограничения, галоген, гидроксильную группу, амино, циано, нитро, меркапто, алкоксикарбонил, амидо, карбокси, алкансульфонил, алкилкарбонил, карбамидо, карбамил, карбоксил, тиоуреидо, тиоцианато, сульфонамидо, алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклоалкил и гетероциклоалкил, где алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклоалкил и гетероциклоалкил могут быть дополнительно замещенными.
В данном описании термин «соединение» относится к соединениям, описанным выше, а также их солям, сольватам и комплексам с металлами. Соль может быть образована анионом и положительно заряженной группой (например, аминогруппой) соединения; примеры подходящего аниона включают хлорид, бромид, йодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат, ацетат, малат, тозилат, тартрат, фумарат, глутамат, глюкуронат, лактат, глутарат и малеат. Соль также может быть образована катионом и отрицательно заряженной группой; примеры подходящего катиона включают ион натрия, ион калия, ион магния, ион кальция, а также катион аммония, такой как ион тетраметиламмония. Термин «соль» включает также соли, которые содержат четвертичные атомы азота. Термин «сольват» относится к комплексу, образованному активным соединением и фармацевтически приемлемым растворителем. Примеры фармацевтически приемлемых растворителей включают воду, этанол, изопропанол, этилацетат, уксусную кислоту и этаноламин. Комплекс металла может быть образован соединением и ионом металла. Ион металла представляет собой катион, несущий два или более зарядов. Комплекс металла обычно получают посредством хелатообразования между ионом металла и соединением формулы (I). Примеры иона металла включают Zn2+, Cu2+, Ca2+, Mg2+, Mn2+, Ni2+, Co2+, Fe2+, Cd2+ и их комбинации.
Настоящее изобретение также включает применение одного из описанных выше соединений для получения лекарственного средства, предназначенного для лечения состояний, затрагивающих PS. Таким образом, данное изобретение относится также к применению такого соединения для лечения состояния, затрагивающего PS, путем введения субъекту, нуждающемуся в лечении, эффективного количества соединения по настоящему изобретению и эффективного количества одного или нескольких других активных лекарственных средств.
Настоящее изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и комплекс иона металла и одного из соединений формулы (I), описанной выше.
Фармацевтическая композиция может дополнительно содержать другое терапевтическое лекарственное средство для лечения состояний, затрагивающих PS. Активные лекарственные средства включают, но без ограничения, иммуномодулирующие агенты, такие как интерфероны α, β и γ; противовирусные средства, такие как рибавирин и амантадин; терапевтические лекарственные средства, направленного действия на любые PS-связанные состояния. Такое активное лекарственное средство и соединение по данному изобретению могут применяться субъектом в разное время или одновременно, но в двух лекарственных формах. В качестве альтернативы, они могут объединяться в композиции, как описано выше, для применения в единой лекарственной форме.
Композиция для перорального введения может представлять собой любую перорально приемлемую лекарственную форму, включая капсулы, таблетки, эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток, традиционно применяемые носители включают лактозу и кукурузный крахмал. Могут добавляться также смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул подходящие разбавители включают лактозу и высушенный кукурузный крахмал. При пероральном введении водных суспензий или эмульсий активный ингредиент может суспендироваться или растворяться в масляной фазе, объединенной с эмульгирующими или суспендирующими агентами. При желании могут добавляться определенные подсластители, вкусовые добавки или красители. Твердые лекарственные формы для перорального введения могут быть получены методами сушки распылением; экструзией горячего расплава и с применением технологий микронизации и наноизмельчения.
Аэрозоль для назального введения и композиция для ингаляции могут быть получены в соответствии с методиками, хорошо известными в области разработки фармацевтических препаратов. Например, такая композиция может быть получена в виде раствора в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, промоторов абсорбции для повышения биодоступности, фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в данной области техники. Композиция, содержащая активное соединение, может также вводиться в форме суппозиториев для ректального введения.
Носитель в фармацевтической композиции должен быть «приемлемым», то есть совместимым с активным ингредиентом композиции (предпочтительно, способным стабилизировать активный ингредиент) и безвредным для субъекта, которому предназначено лечение. В качестве фармацевтического наполнителя для доставки активного соединения может применяться один или несколько солюбилизирующих агентов. Примеры других носителей включают коллоидный оксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C Yellow#10.
Настоящее изобретение относится также к способу лечения состояния, связанного с клетками, содержащими «вывернутый наружу» фосфатидилсерин. При указанном состоянии фосфатидилсерин, обычно расположенный внутри клеток, выставлен на внешней поверхности клеток. Способ включает введение эффективного количества одного из соединений, описанных выше, субъекту, нуждающемуся в таком лечении. Соединение формулы (I) может вводиться в виде комплекса, образованного соединением и ионом металла, несущим два или более положительных зарядов (например, Zn2+). Указанное состояние имеет место при вирусной инфекции, бактериальной инфекции, воспалительном заболевании, раке, нарушении метаболизма некроза клеток в трансплантате органа, нарушении метаболизма некроза клеток при нейродегенеративном заболевании, а также нарушение метаболизма некроза клеток при сердечно-сосудистом заболевании.
Термин «лечение» относится к применению или введению соединения субъекту с целью вылечить, облегчить, смягчить, изменить болезнь, исцелить от болезни, улучшить состояние или повлиять на болезнь, симптом болезни или предрасположенность к болезни. Термин «эффективное количество» относится к количеству соединения, которое необходимо для обеспечения желаемого эффекта для субъекта. Специалистам данной области техники известно, что эффективные количества изменяются в зависимости от способа введения, применения вспомогательных веществ, а также возможности совместного применения с другими терапевтическими способами лечения, такими как применение других активных лекарственных средств.
Подробные описания одного или нескольких вариантов осуществления настоящего изобретения представлены ниже. Другие отличительные признаки, предметы и преимущества настоящего изобретения будут понятны из описания и формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ
Ниже представлены типичные соединения (51 соединение), которые были синтезированы в соответствии с методиками, описанными в примерах 1-51, и испытаны в соответствии с методиками, описанными далее.
Все соединения, представленные ниже, включают их рацематы (т.е. равные количества лево- и правовращающих энантиомеров хиральной молекулы), если иное не оговорено особо.










Соединения по настоящему изобретению могут быть получены способами синтеза, хорошо известными в данной области техники. См. R. Larock, Comprehensive Organic Transformations (2nd Ed., VCH Publishers 1999); P.G.M. Wuts and T.W. Greene, Greeneʹs Protective Groups in Organic Synthesis (4th John Wiley and Sons 2007); L. Fieser and M. Fieser, Fieser and Fieserʹs Reagents for Organic Synthesis (John Wiley and Sons 1994); L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis (2nd ed., John Wiley and Sons 2009) и их последующие издания.
Синтез соединений 1-51 и их аналитические данные представлены ниже.
Синтез дипиколиламинного промежуточного соединения (DPA, структура представлена ниже)

Дипиколиламинное (DPA) промежуточное соединение получают в соответствии со следующими стадиями:
Стадия 1

К перемешиваемому раствору 5-гидроксиизофталевой кислоты (25 г, 137 ммоль, 1 экв.) в 200 мл метанола при комнатной температуре добавляют 2,2-диметоксипропан (1,2 экв.) и п-толуолсульфоновую кислоту (TsOH, 0,2 экв.). Смесь перемешивают при 60°С, после чего метанол удаляют выпариванием. Полученную сырую смесь распределяют в смеси этилацет (EtOAc)/вода. Органический слой сушат над сульфатом магния (MgSО4) и концентрируют, получая сырой продукт, который очищают с помощью колоночной хроматографии (диоксид кремния) с получением 2,2-диметоксипропана (23 г, 79%).
1H ЯМР (300 MГц, CDCl3) δ 3,96 (с, 6H), 7,77 (с, 2H), 8,26 (с, 1H).
Стадия 2
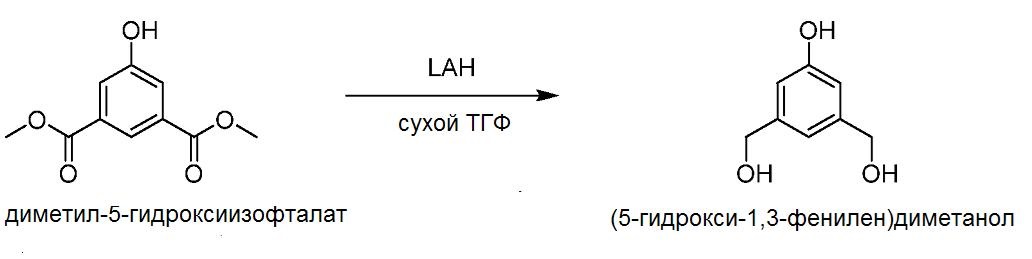
К раствору диметил-5-гидроксиизофталата (28 г, 133 ммоль, 1 экв.) в 1400 мл сухого тетрагидрофурана (ТГФ) при температуре ледяной бани с перемешиванием медленно добавляют алюмогидрид лития (LiAlH4 или LAH, 4 экв.). Полученной смеси дают возможность нагреться до 40°С, смесь перемешивают при указанной температуре в течение 16 часов, а затем гасят реакцию добавлением водного раствора хлорида аммония (NH4Cl). Смесь перемешивают в течение 1,5 часа, после этого фильтруют через целит и промывают ТГФ. Летучие органические соединения выпаривают и остаток распределяют между водой и EtOAc. Водную фазу экстрагируют этилацетатом три раза. Объединенные этилацетатные слои сушат над MgSO4 с получением (5-гидрокси-1,3-фенилен)диметанола (17 г, 82%).
1H ЯМР (400 МГц, CDCl3) δ 4,57 (с, 6H), 6,71 (с, 2H), 6,80 (с, 1H).
Стадия 3

К перемешиваемому раствору (5-гидрокси-1,3-фенилен)диметанола (7,27 г, 47 ммоль, 1 экв.) в 200 мл ацетонитрила при комнатной температуре медленно добавляют 2-(4-бромбутил)изоиндолин-1,3-дион (1,2 экв.) и карбонат калия (K2CO3, 2 экв.). Полученную смесь кипятят с обратным холодильником в течение 8 часов, после чего летучие соединения удаляют и остаток распределяют между этилацетатом и водой. Этилацетатный (EtOAc) слой промывают насыщенным раствором соли и сушат над MgSO4. Выпаривание этилацетата приводит к получению 2-(4-(3,5-бис(гидроксиметил)фенокси)бутил)изоиндолин-1,3-диона (13 г, выход 78%).
1H ЯМР (400 МГц, CDCl3) δ 1,67-1,65 (м, 2H), 1,86-1,81 (м, 2H), 3,75 (т, J=5,6 Гц, 2H), 4,00 (т, J=6,0 Гц, 2H), 4,63 (с, 2H), 4,64 (с, 2H), 6,81 (с, 2H), 6,91 (с, 1H), 7,71-7,69 (м, 2H), 7,84-7,82 (м, 2H).
Стадия 4

К перемешиваемому раствору 2-(4-(3,5-бис(гидроксиметил)фенокси)бутил)изоиндол-1,3-диона (7,44 г, 21 ммоль, 1 экв.) в 420 мл безводного дихлорметана (CH2Cl2) на ледяной бане медленно добавляют трифенилфосфин (PPh3, 2,3 экв.) и тетрабромметан (CBr4, 4,5 экв.). Полученной реакционной смеси дают возможность нагреться до комнатной температуры, затем смесь перемешивают в течение 16 часов, после чего реакцию гасят добавлением метанола (MeOH). СН2Cl2 и МеОН выпаривают, остаток распределяют между CH2Cl2 и водой. Дихлорметановый (CH2Cl2) слой сушат над MgSO4 и концентрируют, получая сырой продукт, который очищают с помощью колоночной хроматографии (силикагель) с получением продукта (5,2 г, 51).
1H ЯМР (300 МГц, CDCl3) δ 1,90-1,81 (м, 4H), 3,77 (т, J=6,6 Гц, 2H), 4,00 (т, J=5,7 Гц, 2H), 4,41 (с, 4H), 6,82 (с, 2H), 6,98 (с, 1H), 7,74-7,70 (м, 2H), 7,86-7,84 (м, 2H).
Стадия 5

К перемешиваемому раствору 2-(4-(3,5-бис(бромметил)фенокси)бутил)изоиндол-1,3-диона (3,86 г, 8,06 ммоль, 1 экв.) в 25 мл сухого диметилформамида (ДМФА) при комнатной температуре медленно добавляют бис(пиридин-2-илметил)амин (2 экв.) и K2CO3 (5 экв.). Смесь перемешивают в течение 16 часов, затем ДМФА выпаривают. Полученную сырую смесь распределяют между CH2Cl2 и водой. Дихлорметановый (CH2Cl2) слой сушат над MgSO4 и концентрируют, получая сырой продукт, который очищают с помощью колоночной хроматографии (силикагель) с получением продукта А (4,8 г, 83%).
1H ЯМР (400 МГц, CDCl3) δ 1,89-1,82 (м, 4H), 3,61 (с, 4H), 3,78-3,74 (м, 10H), 3,96 (т, J=6,0 Гц, 2H), 6,82 (с, 2H), 7,03 (с, 1H), 7,12-7,08 (м, 4H), 7,63-7,53 (м, 8Н), 7,69-7,67 (м, 2H), 7,82-7,80 (м, 2H), 8,48 (д, J=4,8 Гц, 4H).
Стадия 6

К перемешиваемому раствору соединения А (5,9 г, 8,23 ммоль, 1 экв.) в 200 мл этанола (EtOH) при комнатной температуре медленно добавляют гидразин (H2N-NH2, 10 экв.). Полученную реакционную смесь перемешивают в течение 16 часов, затем кипятят с обратным холодильником в течение 2 часов, после чего охлаждают до комнатной температуры. EtOH удаляют, получая сырую смесь, которую дважды экстрагируют CH2Cl2. Дихлорметановые (CH2Cl2) растворы объединяют, сушат над MgSO4 и концентрируют с получением DPA (4,1 г, 85%).
1H ЯМР (300 МГц, CDCl3) δ 1,65-1,55 (м, 2H), 1,84-1,75 (м, 2H), 2,75 (т, J=6,9 Гц, 2H), 3,56 (с, 4H), 3,78 (с, 8Н), 3,94 (т, J=6,6 Гц, 2H), 6,84 (с, 2H), 7,04 (с, 1H), 7,13-7,08 (м, 4H), 7,63-7,55 (м, 8H), 8,48 (д, J=4,5 Гц, 4H).
Синтез девяти DPA-мостиковых соединений, DL-1 - DL-9
DL-1

DPA (400 мг, 0,681 ммоль, 1 экв.) и триэтиламин (1 мл) растворяют в CH2Cl2 (40 мл) с последующим добавлением этил-4-хлор-4-оксобутаноата при 0°С. Полученный раствор перемешивают при 0°С в течение 2 часов, затем промывают насыщенным водным раствором хлорида аммония (3×40 мл). Дихлорметановые (CH2Cl2) слои сушат над MgSO4 и концентрируют при пониженном давлении с получением DL-1.
1H ЯМР (400 МГц, CDCl3) δ 1,27-1,19 (м, 3H), 1,70-1,67 (м, 2H), 1,84-1,78 (м, 2H), 2,44 (т, J=6,4 Гц, 2H), 2,77 (т, J=6,4 Гц, 2H), 3,43-3,29 (м, 2H), 3,64 (с, 4H), 3,79 (с, 8Н), 3,96 (т, J=6 Гц, 2H), 4,16-4,09 (м, 2H), 6,83 (с, 2H), 7,05 (с, 1H), 7,14-7,11 (м, 4H), 7,64-7,57 (м, 8H), 8,50 (д, J=4,4 Гц, 4H).
DL-2

DL-1 (487 мг, 0,68 ммоль, 1 экв.) растворяют в МеОН (4 мл) и водном растворе LiOH (4 мл, 0,5 N) и затем перемешивают при комнатной температуре в течение 15 часов. После удаления MeOH полученный остаток экстрагируют CH2Cl2 (100 мл). Дихлорметановый (CH2Cl2) раствор промывают насыщенным водным раствором хлорида аммония (2×100 мл), сушат над MgSO4 и концентрируют при пониженном давлении с получением DL-2 (380 мг).
1H ЯМР (300 МГц, CDCl3) δ 1,71-1,67 (м, 2H), 1,82-1,79 (м, 2H), 2,48 (м, 2H), 2,68 (м, 2H), 3,34 (м, 2H), 3,63 (с, 4H), 3,80 (с, 8Н), 3,96 (т, J=8 Гц, 2H), 6,83 (с, 2H), 6,90 (с, 1H), 7,15-7,11 (м, 4H), 7,66-7,54 (м, 8H), 8,51 (д, J=4,8 Гц, 4H).
DL-3

К раствору DPA (400 мг, 0,68 ммоль, 1 экв.) в CH2Cl2 (40 мл) добавляют триэтиламин (2 мл) и метил-3-(хлоркарбонил)бензоат при 0°С. Полученную реакционную смесь перемешивают при 0°С в течение 2 часов, затем разбавляют CH2Cl2 (100 мл). Дихлорметановый (CH2Cl2) раствор дважды насыщенным водным раствором NH4Cl (2×100 мл), сушат над MgSO4 и концентрируют при пониженном давлении, получая сырой продукт, который очищают с помощью колоночной хроматографии (силикагель; MeOH:CH2Cl2=1:13) с получением DL-3 (280 мг, 55%).
1H ЯМР (400 МГц, CDCl3) δ 1,91-1,84 (м, 4H), 3,58-3,54 (м, 2H), 3,63 (с, 4H), 3,78 (с, 8Н), 3,91 (с, 3H), 4,02 (т, J=5,2 Гц, 2H), 6,85 (с, 2H), 7,05 (с, 1H), 7,13-7,10 (м, 4H), 7,50-7,46 (м, 1H), 7,63-7,56 (м, 8H), 8,00 (д, J=7,6 Гц, 1H), 8,12 (д, J=8 Гц, 1H), 8,36 (с, 1H), 8,49 (д, J=4,4 Гц, 4H).
DL-4

DPA (1 г, 1,7 ммоль, 1 экв.) и метил-4-формилбензоат (840 мг, 5,12 ммоль, 3 экв.) растворяют в МеОН (20 мл) и перемешивают при 65°С в течение 15 часов. После этого раствор охлаждают до 0°С и к раствору добавляют борогидрид натрия (1 г, 26 ммоль, 15 экв.). Смесь перемешивают при 0°С в течение еще одного часа. Удаление MeOH при пониженном давлении приводит к получению остатка, который экстрагируют СН2Cl2(100 мл). Дихлорметановый (CH2Cl2) раствор промывают насыщенным водным раствором NH4Cl (2×100 мл), сушат над MgSO4 и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии (силикагель, MeOH:СН2Cl2=1:9) с получением DL-4 (700 мг, 56%).
1H ЯМР (300 МГц, CDCl3) δ 1,90-1,68 (м, 4H), 2,71 (т, J=7,2 Гц, 2H), 3,63 (с, 4H), 3,79 (с, 8Н), 3,82 (с, 2H), 3,86 (с, 3H), 3,95 (т, J=6 Гц, 2H), 6,83 (с, 2H), 7,04 (с, 1H), 7,14-7,09 (м, 4H), 7,40 (д, J=8,1 Гц, 2H), 7,63-7,55 (м, 8H), 7,98 (д, J=8,1 Гц, 2H), 8,48 (д, J=4,2 Гц, 4H).
DL-5

DL-4 (600 мг, 0,82 ммоль, 1 экв.) и ди-трет-бутилдикарбонат (360 мг, 1,65 ммоль, 2 экв.) растворяют CH2Cl2 (60 мл) и перемешивают при комнатной температуре в течение 15 часов. После удаления СН2Cl2 получают сырой остаток, который очищают с помощью колоночной хроматографии (силикагель; метанол:СН2Cl2=1:13) с получением DL-5 (550 мг, 81%).
1H ЯМР (300 МГц, CDCl3) δ 1,45-1,40 (м, 9H), 1,72 (м, 2H), 1,89 (м, 2H), 3,31-3,21 (м, 2H), 3,64 (с, 4H), 3,79 (с, 8Н), 3,89 (с, 3H), 3,92 (м, 2H), 4,47 (м, 2H), 6,82 (с, 2H), 7,07 (с, 1H), 7,14-7,09 (м, 4H), 7,27 (д, J=9 Гц, 2H), 7,63-7,56 (м, 8H), 7,98 (д, J=8,7 Гц, 2H), 8,50 (д, J=4,8 Гц, 4H).
DL-6

DL-4 (300 мг, 0,41 ммоль) растворяют в МеОН (3 мл) и водном растворе LiOH (3 мл, 0,5 N). Полученную смесь перемешивают при комнатной температуре в течение 15 часов. После удаления МеОН получают остаток, который экстрагируют СН2Cl2 (100 мл). Дихлорметановый (CH2Cl2) раствор промывают насыщенным водным раствором NH4Cl (2×100 мл), сушат над MgSO4 и концентрируют при пониженном давлении с получением DL-6 (260 мг, 88%).
DL-7

DL-5 (550 мг, 0,66 ммоль) растворяют в МеОН (6 мл) и водном растворе LiOH (6 мл, 0,5 N). Полученную смесь перемешивают при комнатной температуре в течение 15 часов. МеОН удаляют с получением остатка, который экстрагируют СН2Cl2 (100 мл). Дихлорметановый (CH2Cl2) раствор промывают насыщенным водным раствором NH4Cl (2×100 мл), сушат над MgSO4 и концентрируют при пониженном давлении с получением DL-7 (480 мг, 89%).
1H ЯМР (300 МГц, CDCl3) δ 1,50-1,26 (м, 13H), 3,29-3,23 (м, 2H), 3,65 (с, 4H), 3,81 (м, 10H), 4,53 (с, 2H), 6,77 (с, 2H), 6,93 (с, 1H), 7,15-7,11 (м, 4H), 7,38 (м, 2H), 7,63-7,53 (м, 8Н), 8,10 (д, J=7,8 Гц, 2H), 8,54 (д, J=4,2 Гц, 2H).
DL-8

Смесь DL-6 (260 мг, 0,36 ммоль, 1 экв.), К2СО3 (745 мг, 5,40 ммоль, 15 экв.), 4-хлор-7-нитробензо[с][1,2,5]оксадиазола (100 мг, 0,50 ммоль) и СН2Cl2 (30 мл) перемешивают при 40°C в течение 15 часов. Полученную реакционную смесь экстрагируют CH2Cl2 (100 мл). Дихлорметановый (CH2Cl2) раствор промывают водой (2×100 мл), сушат над MgSO4 и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии (силикагель; метанол:CH2Cl2=1:1) с получением DL-8 (200 мг, 63%)
1H ЯМР (400 МГц, ДМСО) δ 1,36 (м, 1H), 1,69-1,51 (м, 3H), 3,13 (м, 2H), 3,54 (с, 4H), 3,66 (м, 10H), 3,98 (м, 2H), 6,68 (м, 1H), 6,79 (д, J=4,4 Гц, 2H), 7,04 (д, J=5,6 Гц, 1H), 7,21-7,17 (м, 4H), 7,35-7,25 (м, 2H), 7,54-7,51 (м, 4H), 7,71-7,63 (м, 4H), 7,86 (д, J=8,4 Гц, 2H), 8,38 (м, 1H), 8,44 (д, J=5,2 Гц, 4H).
DL-9

Смесь раствора DL-3 (0,37 ммоль) в MeOH (3 мл) и водного раствора LiOH (3 мл, 0,5 N) перемешивают при комнатной температуре в течение 15 часов. МеОН удаляют при пониженном давлении с получением остатка, который экстрагируют CH2Cl2 (100 мл). Дихлорметановый (CH2Cl2) раствор промывают насыщенным водным раствором NH4Cl (2×100 мл), сушат над MgSO4 и концентрируют при пониженном давлении с получением DL-9 (240 мг, 88%).
1H ЯМР (300 МГц, CDCl3) δ 1,97-1,86 (м, 4H), 3,64 (м, 6H), 3,80 (с, 8Н), 4,14 (м, 2H), 7,08 (с, 2H), 7,20-7,12 (м, 5H), 7,62-7,51 (м, 8H), 8,21 (д, J=7,2 Гц, 2H), 8,47 (с, 1H), 8,56 (д, J=4,8 Гц, 4H).
Пример 1: Получение соединения 1
Соединение 1 по настоящему изобретению получают в соответствии с методикой, описанной ниже.
К раствору DL-2 (200 мг, 0,29 ммоль, 1 экв.) в ДМФА (20 мл) добавляют 4,11-диэтил-4,9-дигидрокси-1H-пирано[3ʹ,4ʹ:6,7]индолизино[1,2-b]хинолин-3,14(4Н,12Н)-дион (170 мг, 0,44 ммоль, 1,5 экв.), гидроксибензотриазол (117 мг, 0,87 ммоль, 3 экв.), гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (170 мг, 0,87 ммоль, 3 экв.) и N-метилморфолин (175 мг, 1,74 ммоль, 6 экв.). После перемешивания при комнатной температуре в течение 15 часов полученную реакционную смесь экстрагируют СН2Cl2 (300 мл). Затем дихлорметановый (CH2Cl2) раствор промывают насыщенным водным раствором NaHCО3 (300 мл) и водой (5×300 мл), сушат над MgSO4 и концентрируют при пониженном давлении с получением остатка. Остаток очищают с помощью колоночной хроматографии (силикагель; метанол:СН2Cl2=1:13) с получением соединения 1 (130 мг, 42%).
1H ЯМР (400 МГц, CDCl3) δ 1,01 (т, J=7,2 Гц, 3H), 1,34 (т, J=7,6 Гц, 3H), 1,74-1,67 (м, 2H), 1,94-1,77 (м, 4H), 2,62 (т, J=6,4 Гц, 2H), 3,00 (т, J=6,4 Гц, 2H), 3,11-3,06 (м, 2H), 3,39-3,34 (м, 2H), 3,61 (с, 4H ), 3,76 (с, 8Н), 3,92 (т, J=j=6,0 Гц, 2H), 5,20 (с, 2H), 5,28 (д, J=16,4 Гц, 1H), 5,71 (д, J=16,4 Гц, 1H), 6,77 (с, 2H), 7,04 (с, 1H), 7,12-7,09 (м, 4H), 7,63-7,50 (м, 10H), 7,77 (д, J=2,4 Гц, 1H), 8,14 (д, J=9,2 Гц, 1H), 8,47 (д, J=4,8 Гц, 4H). Масс-спектр: (EM +2H+)/2: найдено 532,27.
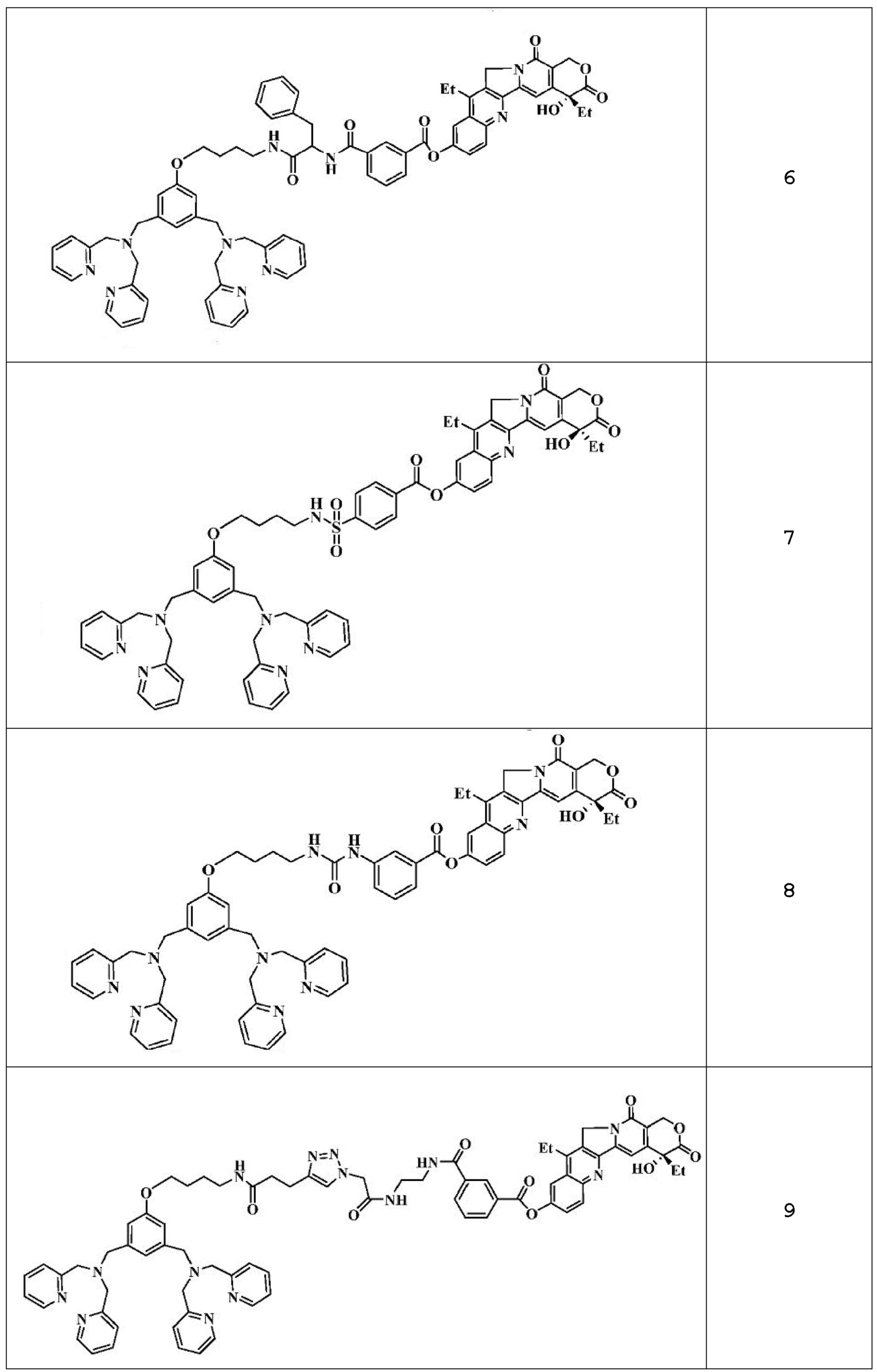
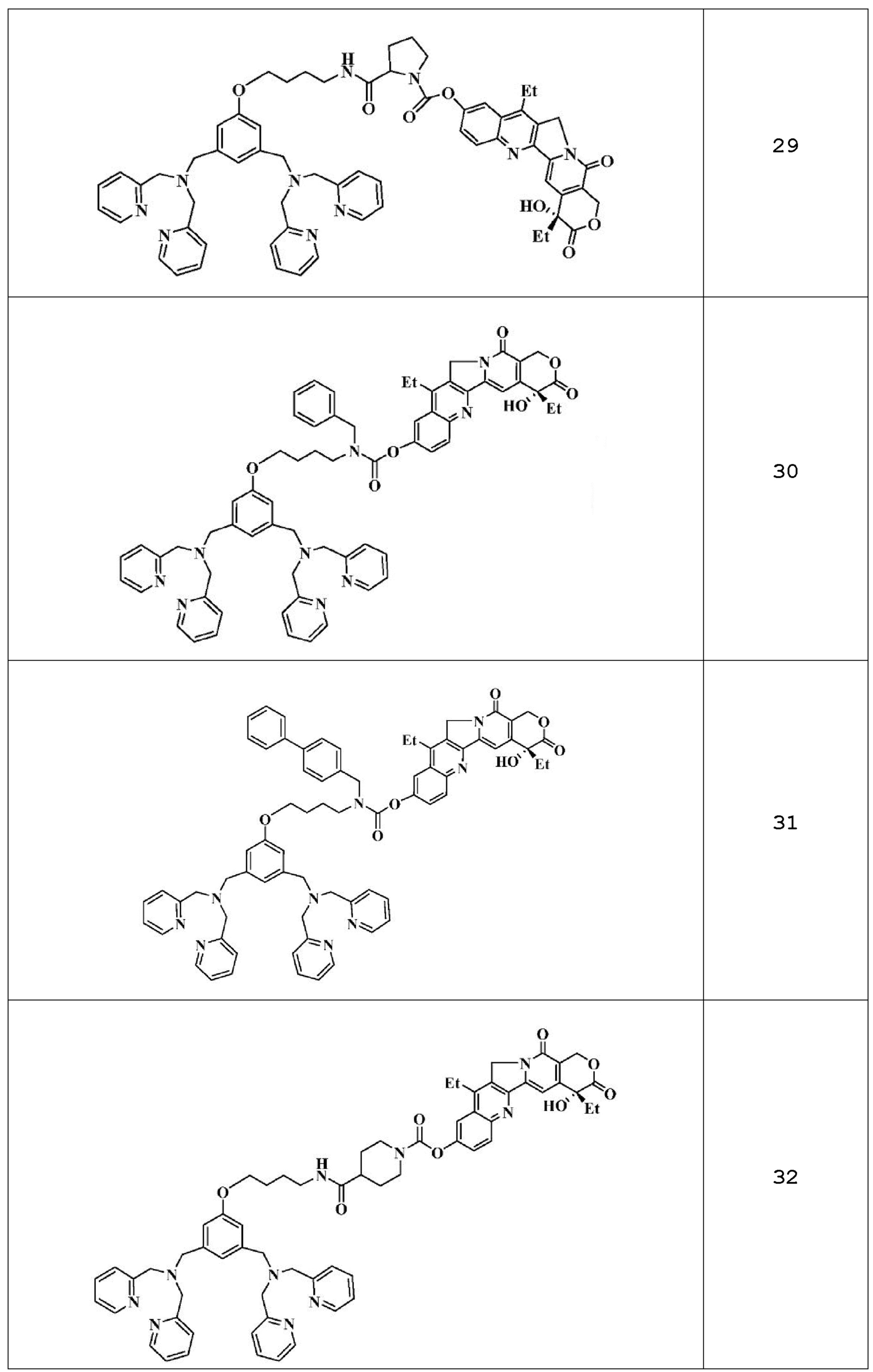
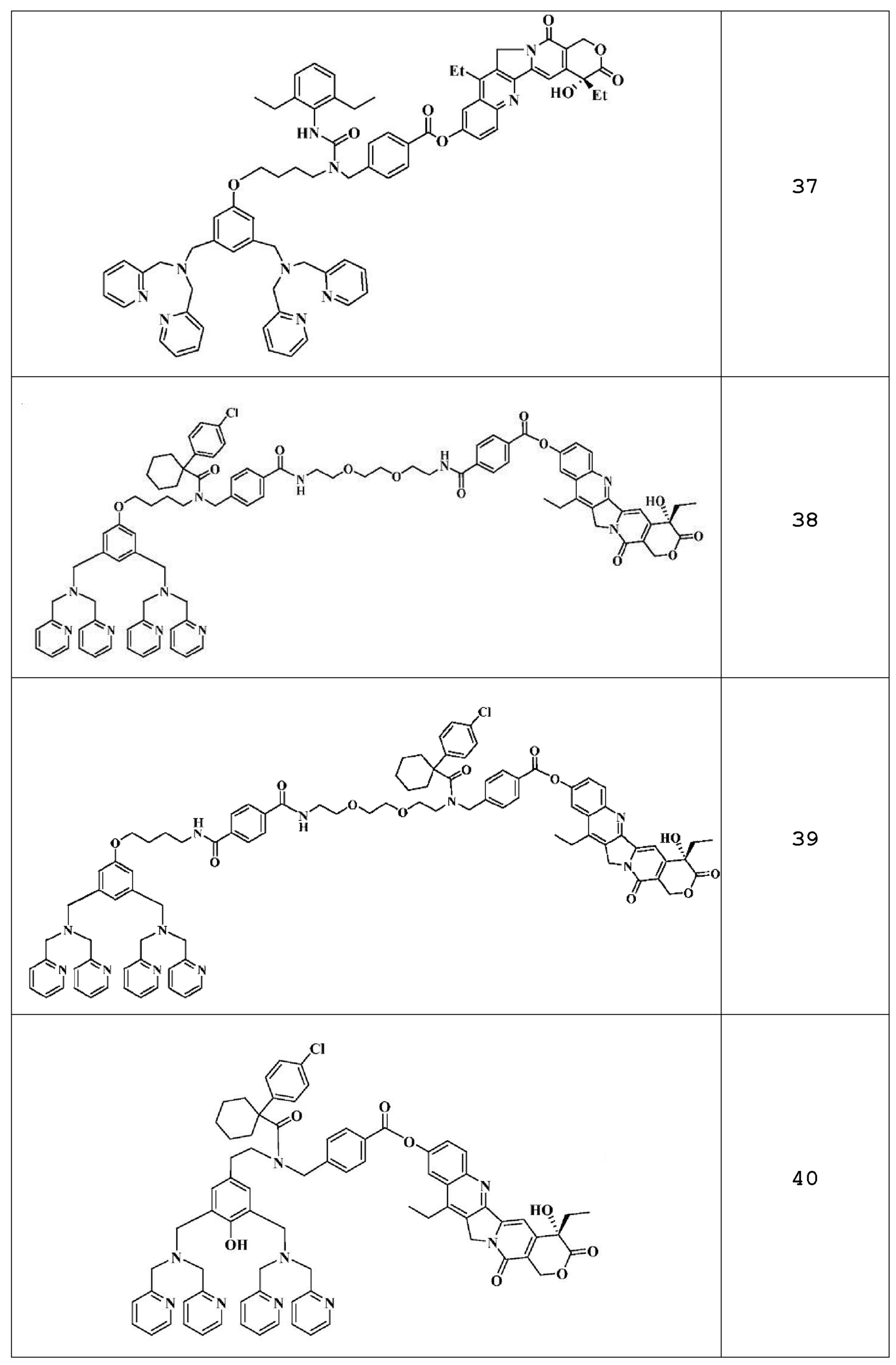
Примеры 2-51: Получение соединений 2-51
Синтез соединения 42 описан непосредственно ниже. Что касается соединений 2-41 и 43-51, их получают в соответствии с аналогичной методикой или методикой, аналогичной описанной в примере 1 выше.
На схеме 1 ниже представлена последовательность синтеза мостикового соединения, то есть 42-мостика, из коммерчески доступного соединения B через промежуточные соединения C и D.
Синтез 42-мостика, мостикового соединения для применения при получении соединения 42:

Схема 1. Синтез мостикового соединения: (а) I. Boc2O, ДХМ, 3 часа; и II. Метил-4-формилбензоат, NaBH4, MeOH, комнатная температура, 1 час; (b) гидрохлорид 1-(4-хлорфенил)циклогексанкарбонила, ДХМ, комнатная температура, 1 час; (с) 4М НСl в 1,4-диоксане, МеОН, комнатная температура, 12 часов.
Синтез соединения C: К раствору коммерчески доступного соединения B (15 г, 101,21 ммоль) в CH2Cl2 (300 мл) добавляют триэтиламин (TEA, 1 экв.) и затем ди-трет-бутилдикарбонат (Вос2О, 0,5 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, после чего растворитель удаляют в вакууме. Сырую смесь распределяют между Н2О и ДХМ. Слои разделяют, органический слой сушат над сульфатом натрия (Na2SО4) и концентрируют до прозрачного масла. К смеси прозрачного масла и 200 мл МеОН добавляют метил-4-формилбензоат (15 г, 91,35 ммоль, 0,9 экв.). Смесь перемешивают при комнатной температуре в течение 3 часов, после чего добавляют борогидрид натрия (3,7 г, 97,80 ммоль, 0,9 экв.). МеОН удаляют и остаток растворяют в 200 мл СН2Сl2. Протонированный продукт экстрагируют СН2Сl2 с 200 мл NH4Cl (водн.). Органические слои объединяют, сушат над Na2SО4, фильтруют и растворитель выпаривают. Очистка сырого остатка с помощью флэш-хроматографии (силикагель, элюирование: EtOAc/гексан (2:1)) приводит к получению 12,03 г соединения С в виде прозрачного масла (30,36 ммоль, 30%).
Синтез соединения D: К смеси соединения C (12,03 г, 30,36 ммоль) и 200 мл СН2Сl2 добавляют 1-(4-хлорфенил)циклогексанкарбонилхлорид (11,57 г, 45,54 ммоль, 1,5 экв.) и триэтиламин (10 мл, 43,08 ммоль). Реакционную смесь перемешивают в течение 2 часов при комнатной температуре. Протонированный продукт экстрагируют 200 мл CH2Cl2 с 200 мл NH4Cl (водн.). Органический слой сушат над Na2SО4, фильтруют и растворитель выпаривают. Очистка сырого остатка с помощью флэш-хроматографии (силикагель, элюирование: смесью ЕА/гексан (2:1)) приводит к получению 13,11 г соединения D в виде прозрачного масла (21,25 ммоль, 70%).
Синтез мостикового соединения 42. К соединению D (13,11 г, 21,25 ммоль) в MeOH (200 мл) добавляют 4М соляную кислоту (HCl) в диоксане (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, после чего концентрируют в вакууме. Сырую смесь распределяют между NaH4Cl (водн.) и ДХМ. Слои разделяют, органический слой сушат (Na2SО4) и концентрируют с получением мостикового соединения 42 в виде прозрачного масла (7,68 г, 14,87 ммоль, 70%).
На схеме 2 ниже представлена последовательность синтеза соединения 42 из промежуточного DPA соединения через промежуточные соединения E, F, G, H и I.
Синтез соединения 42:

Схема 2. Синтез соединения 42. (а) Метил-4-формилбензоат, NaBH4, MeOH, комнатная температура, 1 час (90%); (b) 1-(4-(хлорфенил)циклогексанкарбонилхлорид, СН2Сl2, комнатная температура, 1 час (90%); (с) 0,5M LiOH (водн.), МеОН, комнатная температура, 15 часов (90%); (d) мостиковое соединение 42, HOBt, EDCl, NMM, комнатная температура, 15 часов (40%); (е) 0,5М LiOH (водн.), MeOH, комнатная температура, 15 часов (82%); (f) HOBt, EDCl, NMM, 1,11-диэтил-4,9-дигидрокси-1H-пирано[3ʹ,4ʹ:6,7]индолизино[1,2-b]хинолин-3,14-(4H,12H)дион, комнатная температура, 15 часов (30%).
Синтез соединения Е: К упомянутому выше DPA соединению (10 г, 17,01 ммоль) в 200 мл MeOH добавляют метил-4-формилбензоат (5 г, 30,45 ммоль, 1,8 экв.). Смесь перемешивают при комнатной температуре в течение 3 часов, после чего добавляют борогидрид натрия (3,7 г, 97,80 ммоль, 5,7 экв.). МеОН удаляют и остаток растворяют в 200 мл CH2Cl2. Протонированный продукт экстрагируют CH2Cl2 с 200 мл 1М HCl (водн.). Водный слой нейтрализуют и продукт экстрагируют 200 мл CH2Cl2. Органические слои объединяют, сушат над Na2SО4, фильтруют и растворитель выпаривают с получением 11,26 г соединения Е в виде масла желтого цвета (15,30 ммоль, 90%).1H ЯМР (300 МГц, CDCl3): δ 1,70-1,78 (м, 2H), 1,80-1,86 (м, 2H), 2,71 (т, J=6,8 Гц, 2H), 3,62 (с, 4H), 3,78 (с, 8Н), 3,87 (с, 2H), 3,89 (с, 3H), 3,95 (т, J=6,4 Гц, 2H), 6,82 (с, 2H), 7,03 (с, 1H), 7,03-7,13 (м, 4H), 7,40 (д, J=8,0 Гц, 2H), 7,55-7,62 (м, 8H), 7,98 (д, J=8,0 Гц, 2H), 8,48 (д, J=8,0 Гц, 2H).
Синтез соединения F: К соединению Е (11,26 г, 15,30 ммоль) в 200 мл CH2Cl2 добавляют 1-(4-хлорфенил)циклогексанкарбонил (7,71 г, 30,00 ммоль, 2 экв.) и триметиламин (5 мл, 21,54 ммоль). Реакционную смесь перемешивают в течение 2 часов при комнатной температуре. Протонированный продукт экстрагируют 200 мл CH2Cl2 с 200 мл 1М HCl (водн.). Водный слой нейтрализуют и продукт экстрагируют 200 мл CH2Cl2. Органический слой сушат над Na2SО4, фильтруют и растворитель выпаривают с получением 13,17 г соединения F в виде масла желтого цвета (13,77 ммоль, 90%).1H ЯМР (300 МГц, CDCl3): δ 1,62 (уш.с, 12Н), 2,24 (уш.с, 2H), 2,90 (1H, уш.с), 3,23 (уш.с, 1Н), 3,63 (с, 4H), 3,78 (с, 8H), 3,88 (с, 3H), 3,92 (м, 2H), 4,02-4,14 (м, 2H), 6,78 (с, 2H), 6,95-7,39 (м, 11H), 7,55-7,63 (м, 8H), 7,93 (д, J=7,2 Гц, 2H), 8,48 (д, J=6,4 Гц, 4H).
Синтез соединения G: К соединению F (13,17 г, 13,77 ммоль) в 300 мл MeOH добавляют 50 мл 0,5М LiOH (водн.). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов. Растворитель удаляют и остаток снова растворяют в CH2Cl2. Нерастворимый остаток удаляют фильтрацией. Фильтрат промывают водой, сушат над MgSO4и растворитель удаляют в вакууме. Соединение G получают в виде порошка желтоватого цвета (11,68 г, 12,39 ммоль, 90%), которое используют в следующей стадии без дополнительной очистки.
Синтез соединения Н: Раствор, содержащий соединение G (11,68 г, 12,39 ммоль) в 40 мл ДМФА, нагревают до 40°С. К раствору добавляют EDCl (2 г, 12,8 ммоль) и HOBt (2 г, 14,8 ммоль), полученную реакционную смесь перемешивают при комнатной температуре в течение 30 минут, после чего добавляют мостиковое соединение 42, метиловый эфир 4-({{2-[2-(2-аминоэтокси)этокси]этил}-[1-(4-хлорфенил)циклогексанкарбонил]амино}метил)бензойной кислоты (9,6 г, 18,58 ммоль) с последующим добавлением N-метилморфолина (ΝΜΜ, 5 мл, 45,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов и затем разбавляют H2О. Водный раствор отделяют и экстрагируют 200 мл СН2Cl2. Объединенные экстракты промывают насыщенным раствором соли (4×100 мл), сушат над Na2SО4, фильтруют и упаривают. Очистка сырого остатка с помощью флэш-хроматографии (силикагель, рН=7, элюирование: MeOH/CH2Cl2 (1:9)) приводит к получению сложного эфира Н (7,14 г, 4,95 ммоль, 40%).
Синтез соединения I: К соединению Н (7,14 г, 4,95 ммоль) в 200 мл MeOH добавляют 30 мл 0,5М LiOH (водн.). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов. Растворитель удаляют и остаток снова растворяют в 100 мл СН2Cl2. Нерастворимый остаток удаляют фильтрацией. Фильтрат промывают водой, сушат над MgSO4и растворитель удаляют в вакууме. Соединение I получают в виде белого порошка (5,83 г, 4,08 ммоль, 82%) и используют в следующей стадии без дополнительной очистки.
Синтез соединения 42: Раствор соединения I (5,83 г, 4,08 ммоль) в 20 мл ДМФА нагревают до 40°С. К раствору добавляют 1-этил-3-(3-диметиламинопропил)карбодиимид (EDCl, 1 г, 6,4 ммоль, 1,5 экв.) и гидроксибензотриазол (HOBt, Л.Г., 7,2 ммоль, 1,7 экв.) и реакционную смесь оставляют перемешиваться в течение 30 минут. После этого добавляют 4,11-диэтил-4,9-дигидрокси-1H-пирано[3ʹ,4ʹ:6,7]индолизино[1,2-b]хинолин-3,14-(4H,12H)дион (3 г, 7,64 ммоль, 1,87 экв.) с последующим добавлением N-метилморфолина (ΝΜΜ, 5мл, 45,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов и затем разбавляют H2О. Водный раствор отделяют и экстрагируют 100 мл CH2Cl2. Объединенные экстракты промывают насыщенным раствором соли (4 × 100 мл), сушат над Na2SО4, фильтруют и упаривают. Очистка сырого остатка с помощью флэш-хроматографии (силикагель, рН=7, элюирование: MeOH/CH2Cl2 (0,5:9,5)) приводит к получению сложного эфира 42 (2,21 г, 1,22 ммоль, 30%) в виде белого порошка.
Соединение 2 получают из DL-9 с выходом 40%.1H ЯМР (400 МГц, CD3OD) δ 1,02 (т, J=7,6 Гц, 3H), 1,39 (т, J=7,6 Гц, 3H), 1,93-1,98 (м, 6H), 3,21-3,23 (м, 2H), 3,57 (м, 2H), 3,78 (с, 4H), 3,96 (д, J=16 Гц, 4H), 4,11 (м, 2H), 4,34 (д, J=16 Гц, 4H), 5,32 (с, 2H), 5,38 (д, J=16,4 Гц, 1H), 5,58 (д, J=16,4 Гц, 1H), 6,72 (с, 1H), 6,81 (с, 2H), 7,60 (д, J=7,6 Гц, 4H), 7,65 (с, 1H), 7,67-7,76 (м, 4H), 8,11-8,22 (м, 6H), 8,39 (д, J=7,2 Гц, 1H), 8,69 (д, J=4 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 555,27.
Соединение 3:1H ЯМР (400 МГц, ДМСО) δ 0,86 (т, J=6,8 Гц, 3H), 1,24 (т, J=7,6 Гц, 3H), 1,45 (м, 4H), 1,71 (м, 4H), 1,85 (м, 2H), 2,67 (м, 2H), 3,14-3,16 (м, 2H), 3,55 (с, 4H), 3,67 (с, 8Н), 3,94 (м, 2H), 5,30 (с, 2H), 5,42 (с, 2H), 6,80 (с, 2H), 7,04 (с, 1H), 7,20-7,23 (м, 4H), 7,31 (с, 1H), 7,54 (д, J=7,6 Гц, 4H), 7,61 (д, J=9,2 Гц, 1H), 7,68-7,72 (м, 4H), 7,95 (с, 1H), 8,16 (д, J=8,8 Гц, 1H), 8,45 (д, J=5,6 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 510.
Соединение 4:1H ЯМР (300 МГц, CDCl3) δ 1,05 (т, J=7,2 Гц, 3H), 1,39 (т, J=7,5 Гц, 3H), 1,97-1,83 (м, 6H), 3,13 (к, J=7,5 Гц, 2H), 3,50 (с, 4H), 3,54 (с, 8Н), 3,60-3,64 (м, 2H), 4,04 (м, 2H), 5,28 (д, J=11,7 Гц, 2H), 5,30 (д, J=16,8 Гц, 1H), 5,74 (д, J=16,2 Гц, 1H), 6,80 (с, 2H), 7,12 (с, 1H), 7,31-7,18 (м, 12H), 7,38-7,41 (м, 8H), 7,55-7,60 (м, 1H), 7,66-7,68 (м, 2H), 7,93 (д, J=2,1 Гц, 1H), 8,06 (д, J=7,8 Гц, 1H), 8,27 (д, J=9 Гц, 1H), 8,34 (д, J=7,5 Гц, 1H), 8,63 (с, 1H). Масс-спектр: (EM+2H+)/2: найдено 553,74.
Соединение 5:1H ЯМР (300 МГц, CDCl3) δ 1,05 (т, J=7,2 Гц, 3H), 1,41 (т, J=7,8 Гц, 3H), 1,83-1,97 (м, 6H), 2,78 (т, J=7,2 Гц, 2H), 3,13-3,21 (м, 2H), 3,65 (с, 4H), 3,80 (с, 8Н), 3,96-4,00 (м, 4H), 5,27 (с, 2H), 5,31 (д, J=16,2 Гц, 1H), 5,76 (д, J=16,2 Гц, 1H), 6,84 (с, 2H), 7,07 (с, 1H), 7,10-7,15 (м, 4H), 7,52-7,66 (м, 11H), 7,69 (д, J=2,1 Гц, 1H), 7,95 (д, J=1,8 Гц, 1H), 8,21 (д, J=7,8 Гц, 2H), 8,28 (д, J=9 Гц, 1H), 8,50 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 549.
Соединение 6:1H ЯМР (300 МГц, CDCl3): δ=8,61 (т, J=1,5 Гц, 1H), 8,49 (дт, J=4,8, 1,2 Гц, 4H), 8,34 (дт, J=7,8, 1,5 Гц, 1H), 8,25 (д, J=9,0 Гц, 1H), 8,07 (дт, J=8,1, 1,5 Гц, 1H), 7,92 (д, J=2,1 Гц, 1H), 7,67-7,63 (м, 3H), 7,62-7,56 (м, 9H), 7,41 (д, J=7,5 Гц, 1H), 7,30-7,27 (м, 5H), 7,25-7,18 (м, 1H), 7,14-7,10 (м, 4H), 7,07 (с, 1H), 6,80 (с, 2H), 6,15-6,11 (м, 1H), 5,73 (д, J=16,5 Гц, 1H), 5,31-5,5 (м, 3H), 4,84 (дд, J=14,0, 8,0 Гц, 1H), 3,89 (т, J=5,6 Гц, 2H), 3,79 (с, 8Н), 3,64 (с, 4H), 3,36-3,10 (м, 6H), 1,97-1,83 (м, 2H), 1,66-1,57 (м, 4H), 1,40 (т, J=7,6 Гц, 3H), 1,04 (т, J=7,4 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 629.
Соединение 7:1H ЯМР (300 МГц, CDCl3): δ=8,46 (д, J=4,5 Гц, 4H), 8,28 (д, J=8,4 Гц, 2H), 8,24 (д, J=9,3 Гц, 1H), 7,97 (д, J=8,4 Гц, 2H), 7,87 (с, 1H), 7,66-7,55 (м, 10H), 7,11-7,07 (м, 4H), 7,04 (с, 1H), 6,79 (с, 2H), 5,68 (д, J=16,5 Гц, 1H), 5,27-5,22 (м, 3H), 3,95-3,89 (м, 2H), 3,77 (с, 8Н), 3,62 (с, 4H), 3,10-3,08 (м, 4H), 1,90-1,72 (м, 6H), 1,35 (т, J=7,5 Гц, 3H), 0,98 (т, J=7,2 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 574.
Соединение 8:1H ЯМР (400 МГц, CDCl3): δ=8,48 (д, J=4,4 Гц, 4H), 8,38 (с, 1H), 8,04-8,00 (м, 2H), 7,76-7,71 (м, 3H), 7,60-7,57 (м, 4H), 7,54-7,51 (м, 5H), 7,48 (дд, J=9,2, 1,6 Гц, 1H), 7,30 (т, J=8,0 Гц, 1H), 7,11-7,08 (м, 4H), 6,96 (с, 1H), 6,83 (с, 2H), 6,06 (м, 1H), 5,68 (д, J=16,0 Гц, 1H), 5,22 (д, J=16,0 Гц, 1H), 5,19 (д, J=27,2 Гц, 1H), 5,14 (д, J=27,2 Гц, 1H), 3,99 (т, J=6,0 Гц, 2H), 3,76 (с, 8Н), 3,60 (с, 4H), 3,39-3,36 (м, 2H), 3,00 (к, J=7,2 Гц, 2H), 1,92-1,81 (м, 4H), 1,74 (к, J=6,8 Гц, 2H), 1,32 (т, J=7,6 Гц, 3H), 0,99 (т, J=7,2 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 563,25.
Соединение 9:1H ЯМР (400 МГц, CDCl3): δ 8,65 (с, 1H), 8,49 (д, J=4,4 Гц, 4H), 8,41 (с, 1H), 8,26 (д, J=8 Гц, 1H), 8,16-8,08 (м, 3H), 8,01 (д, J=8 Гц, 1H), 7,87 (д, J=2,4 Гц, 2H), 7,64-7,51 (м, 8H), 7,14 (т, J=6 Гц, 4H), 7,00 (с, 1H), 6,79 (д, J=4,4 Гц, 2H), 5,45 (дд, J=172, 16,4, 2H), 5,21 (с, 1H), 5,08 (с, 2H), 5,03 (с, 1H), 3,88-3,82 (м, 10H), 3,66 (с, 4H), 3,58-3,46 (м, 4H), 3,25-3,22 (м, 2H), 3,10-2,95 (м, 4H), 2,58-2,51 (м, 2H), 1,94-1,83 (м, 2H), 1,70-1,57 (м, 4H), 1,36 (т, J=8 Гц, 3H), 1,02 (т, J=8 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 667,29.
Соединение 11:1H ЯМР (300 МГц, CDCl3): δ=8,47 (дд, J=5,1, 0,9 Гц, 4Н), 8,22-8,19 (м, 2H), 7,85-7,82 (м, 2H), 7,64-7,52 (м, 16H), 7,43-7,30 (м, 6H), 7,11-7,04 (м, 5H), 6,85 (с, 2H), 5,71 (д, J=16,2 Гц, 1H), 5,27 (д, J=16,2 Гц, 1H), 5,22 (с, 2H), 4,68 (с, 2H), 4,05 (м, 2H), 3,76 (с, 8Н), 3,61 (4H), 3,57 (м, 2H), 3,09 (к, J=7,5 Гц, 2H), 1,93-1,83 (м, 6H), 1,35 (т, J=7,8 Гц, 3H), 1,02 (т, J=7,5 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 646,29.
Соединение 12:1H ЯМР (300 МГц, CDCl3) δ 1,03 (т, J=7,5 Гц, 3H), 1,39 (т, J=7,5 Гц, 3H), 1,85 (м, 6H), 2,58-2,51 (м, 1H), 3,24-3,03 (м, 6H), 3,38-3,29 (м, 1H), 3,52-3,48 (м, 2H), 3,67 (с, 4H), 3,82 (с, 8Н), 3,91-3,87 (м, 1H), 4,00 (т, J=4,8 Гц, 2H), 4,69 (д, J=3,0 Гц, 2H), 5,27 (д, J=12,0 Гц, 2H), 5,30 (д, J=16,5 Гц, 1H), 5,74 (д, J=16,2 Гц, 1H), 6,86 (с, 2H), 7,04 (с, 1H), 7,15-7,11 (м, 4H), 7,40-7,36 (м, 2H), 7,71-7,55 (м, 12Н), 7,83 (д, J=2,1 Гц, 1H), 8,23 (д, J=9,3 Гц, 1H), 8,49 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 641,26.
Соединение 13:1H ЯМР (300 МГц, CDCl3) δ 1,06-0,88 (м, 6Н), 1,40 (т, J=7,5 Гц, 3H), 1,83-1,65 (м, 4H), 1,97-1,85 (м, 2H), 2,26 (т, J=7,5 Гц, 1H), 2,41 (т, J=7,2 Гц, 1H), 3,16 (м, 2H), 3,35 (м, 1H), 3,49 (м, 1H), 3,65 (с, 2H), 3,67 (с, 2H), 3,80 (с, 8Н), 3,96 (м, 2H), 4,68 (с, 1H), 4,72 (с, 1H), 5,27 (с, 2H), 5,31 (д, J=14,1 Гц, 1H), 5,75 (д, J=16,2 Гц, 1H), 6,84 (с, 2H), 7,15-7,07 (м, 5H), 7,41-7,34 (м, 2H), 7,69-7,56 (м, 10Н), 7,96-7,94 (м, 1H), 8,18 (д, J=8,4 Гц, 1H), 8,31-8,24 (м, 2H), 8,50 (д, J=4,5 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 583,27.
Соединение 14:1H ЯМР (300 МГц, CDCl3) δ 1,04 (т, J=7,5 Гц, 3H), 1,40 (т, J=8,1 Гц, 3H), 1,97-1,81 (м, 6H), 3,21-3,13 (м, 2H), 3,60 (т, J=7,2 Гц, 2H), 3,67 (с, 4H), 3,82 (с, 8Н), 3,97 (м, 2H), 4,92 (с, 2H), 5,28 (д, J=3,9 Гц, 2H), 5,32 (д, J=13,2 Гц, 1H), 5,76 (д, J=16,2 Гц, 1H), 6,85 (с, 2H), 6,95-6,92 (м, 1H), 7,15-7,10 (м, 5H), 7,41 (д, J=4,8 Гц, 1H), 7,48 (д, J=7,8 Гц, 2H), 7,69-7,56 (м, 11H), 7,96 (м, 1H), 8,31-8,24 (м, 3H), 8,50 (д, J=4,5 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 603,74.
Соединение 15:1H ЯМР (300 МГц, CDCl3): δ=8,51 (д, J=4,2 Гц, 4H), 8,31-8,16 (м, 3H), 7,98-7,95 (м, 1H), 7,72-7,53 (м, 10H), 7,37 (д, J=8,1 Гц, 2H), 7,18-7,11 (м, 4H), 7,08 (с, 1H), 6,84 (с, 2H), 5,57 (дд, J=133, 16,5 Гц, 2H), 5,28 (с, 2H), 4,69 (д, J=4,8 Гц, 2H), 3,97 (д, J=5,4 Гц, 2H), 3,86-3,72 (м, 10H), 3,70-3,56 (м, 4H), 3,52-3,29 (м, 2H), 3,22-3,13 (м, 2H), 1,96-1,84 (м, 2H), 1,82-1,54 (м, 12H), 1,41 (т, J=7,2 Гц, 3H), 1,30-1,14 (м, 3H), 1,05 (т, J=7,2 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 603,78.
Соединение 16:1H ЯМР (400 МГц, CDCl3) δ 1,05 (т, J=7,2 Гц, 3H), 1,41 (т, J=7,6 Гц, 3H), 1,96-1,85 (м, 4H), 3,17 (к, J=8,0 Гц, 2H), 3,29 (с, 1H), 3,57 (с, 1H), 3,69 (с, 4H), 3,83 (с, 9H), 4,00 (с, 1H), 4,64 (с, 1H), 4,87 (с, 1H), 5,29 (д, J=5,6 Гц, 2H), 5,32 (д, J=17,2 Гц, 1H), 5,76 (д, J=16 Гц, 1H), 6,81 (с, 1H), 6,86 (с, 1H), 7,15-7,12 (м, 5H), 7,31-7,29 (м, 2H), 7,49 (м, 3H), 7,63-7,57 (м, 9H), 7,69-7,66 (м, 2H), 7,96 (д, J=2,8 Гц, 1H), 8,25 (д, J=8,4 Гц, 2H), 8,30 (д, J=9,2 Гц, 1H), 8,50 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 639,72.
Соединение 17:1H ЯМР (400 МГц, CDCl3) δ 1,00 (т, J=7,2 Гц, 3H), 1,38 (т, J=7,6 Гц, 3H), 1,63 (м, 1H), 1,81-1,94 (м, 5Н), 3,13 (к, J=7,2 Гц, 2H), 3,37 (м, 1H), 3,61 (м, 5H), 3,78 (м, 9H), 4,00 (м, 1H), 4,71 (с, 1H), 4,90 (с, 1H), 5,24 (д, J=8 Гц, 2H), 5,27 (д, J=16 Гц, 1H), 5,70 (д, J=16,4 Гц, 1H), 6,77 (с, 1H), 6,84 (с, 1H), 7,07-7,11 (м, 5H), 7,32-7,38 (м, 4H), 7,50-7,56 (м, 15H), 7,65 (д, J=9,2 Гц, 1H), 7,68 (с, 1H), 7,93 (д, J=2,4 Гц, 1H), 8,23 (д, J=8,4 Гц, 2H), 8,27 (д, J=9,2 Гц, 1H), 8,47 (д, J=4,4 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 638,83.
Соединение 18:1H ЯМР (300 МГц, CDCl3) δ 1,04 (т, J=7,5 Гц, 3H), 1,37 (т, J=7,8 Гц, 3H), 1,50-1,46 (м, 2H), 1,77 (м, 2H), 1,93-1,83 (м, 2H), 3,16 (к, J=7,5 Гц, 2H), 3,66 (с, 4H), 3,74-3,72 (м, 2H), 3,81 (с, 8Н), 4,09-3,96 (м, 4H), 4,82 (д, J=9,3 Гц, 2H), 5,28 (д, J=4,2 Гц, 2H), 5,31 (д, J=14,7 Гц, 1H), 5,75 (д, J=16,2 Гц, 1H), 6,75 (с, 1H), 6,85 (с, 1H), 7,26-7,10 (м, 15H), 7,50 (д, J=7,8 Гц, 2H), 7,68-7,55 (м, 10H), 7,95 (д, J=1,8 Гц, 1H), 8,21-8,17 (м, 2H), 8,29 (д, J=9,0 Гц, 1H), 8,49 (д, J=4,5 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 645,79.
Соединение 19:1H ЯМР (300 МГц, CDCl3) δ 1,01 (т, J=7,2 Гц, 3H), 1,38 (т, J=7,5 Гц, 3H), 1,74 (м, 2H), 1,93-1,84 (м, 6H), 3,18-3,10 (м, 2H), 3,39-3,44 (м, 2H), 3,64 (с, 4H), 3,78 (с, 8Н), 3,94 (т, J=5,7 Гц, 2H), 4,62 (с, 2H), 5,31-5,25 (м, 3H), 5,71 (д, J=16,5 Гц, 1H), 6,81 (с, 2H), 7,13-7,08 (м, 6H), 7,43 (д, J=8,7 Гц, 2H), 7,62-7,54 (м, 8H), 7,65 (д, J=2,4 Гц, 1H), 7,67 (с, 1H), 7,92 (д, J=2,4 Гц, 1H), 8,15 (д, J=2,7 Гц, 1H), 8,20 (д, J=8,1 Гц, 2H), 8,27 (д, J=9,6 Гц, 1H), 8,48 (д, J=4,8 Гц, 4H), 8,64 (д, J=2,7 Гц, 1H). Масс-спектр: (EM+2H+)/2: найдено 632.
Соединение 20:1H ЯМР (300 МГц, CDCl3) δ 1,04 (т, J=7,8 Гц, 3H), 1,40 (т, J=7,2 Гц, 3H), 1,77 (м, 2H), 1,95-1,85 (м, 4H), 3,17-3,12 (м, 2H), 3,56 (м, 2H), 3,69 (с, 4H), 3,82 (с, 8Н), 3,96 (м, 2H), 4,92 (с, 2H), 5,28 (с, 2H), 5,30 (д, J=16,5 Гц, 1H), 5,74 (д, J=16,5 Гц, 1H), 6,82 (с, 2H), 7,08 (с, 1H), 7,16-7,12 (м, 4H), 7,42 (д, J=7,8 Гц, 2H), 7,67-7,56 (м, 10H), 7,95 (с, 1H), 8,23 (д, J=7,5 Гц, 2H), 8,28 (д, J=9 Гц, 1H), 8,52 (м, 4H), 8,68 (с, 1H). Масс-спектр: (EM+2H+)/2: найдено 627.
Соединение 21:1H ЯМР (300 МГц, CDCl3) δ 1,03 (т, J=7,2 Гц, 3H), 1,39 (т, J=7,5 Гц, 3H), 1,96-1,85 (м, 4H), 2,09 (м, 2H), 3,16-3,11 (м, 2H), 3,64 (м, 2H), 3,67 (с, 4H), 3,80 (с, 8Н), 4,06 (т, J=6 Гц, 2H), 4,13 (м, 2H), 5,33-5,27 (м, 3H), 5,74 (д, J=16,8 Гц, 1H), 6,17 (д, J=8,4 Гц, 1H), 6,84 (с, 2H), 7,15-7,10 (м, 5H), 7,39 (д, J=8,1 Гц, 2H), 7,66-7,54 (м, 10H), 7,94 (с, 1H), 8,28-8,23 (м, 3H), 8,35 (д, J=9,3 Гц, 1H), 8,48 (д, J=5,1 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 630.
Соединение 22:1H ЯМР (400 МГц, CDCl3): δ=8,51 (с, 4H), 8,31-8,18 (м, 3H), 7,97-7,94 (м, 1H), 7,72-7,60 (м, 10H), 7,44-7,30 (м, 2H), 7,19-7,07 (м, 5H), 6,86 (с, 2H), 5,54 (дд, J=172, 16,4 Гц, 2H), 5,28 (с, 2H), 4,73 (д, J=16,4 Гц, 2H), 3,99 (с, 2H), 3,83-3,74 (м, 10H), 3,70-3,67 (м, 4H), 3,50 (с, 1H), 3,38 (с, 1H), 3,18 (с, 2H), 2,50-2,42 (м, 2H), 1,97-1,86 (м, 2H), 1,81 (с, 4H), 1,73-1,67 (м, 2H), 1,45-1,39 (м, 3H), 1,32-1,30 (м, 6H), 1,08-1,02 (м, 3H), 0,89-0,87 (м, 3H). Масс-спектр: (EM+2H+)/2: найдено 604,79.
Соединение 23:1H ЯМР (400 МГц, CDCl3) δ 1,04 (т, J=7,2 Гц, 3H), 1,41 (т, J=7,6 Гц, 3H), 1,59 (м, 1H), 1,76 (м, 1H), 1,96-1,83 (м, 4H), 3,20-3,14 (м, 2H), 3,30 (м, 1H), 3,59 (м, 1H), 3,67 (с, 4H), 3,81 (с, 8Н), 3,89-4,02 (м, 2H), 4,66 (с, 1H), 4,90 (с, 1H), 5,28 (д, J=5,6 Гц, 2H), 5,31 (д, J=17,2 Гц, 1H), 5,75 (д, J=16,4 Гц, 1H), 6,78 (с, 1H), 6,86 (с, 1H), 7,14-7,10 (м, 5H), 7,42-7,35 (м, 5H), 7,63-7,57 (м, 10H), 7,69-7,66 (м, 2H), 7,96 (д, J=2,8 Гц, 1H), 8,24 (д, J=8 Гц, 2H), 8,29 (д, J=9,2 Гц, 1H), 8,50 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 600,76.
Соединение 24:1H ЯМР (300 МГц, CDCl3) δ 1,04 (т, J=7,5 Гц, 3H), 1,44-1,37 (м, 4H), 1,70-1,65 (м, 1H), 1,99-1,86 (м, 4H), 3,19-3,15 (м, 2H), 3,68-3,65 (м, 6H), 3,82-3,80 (м, 10H), 4,09-3,94 (м, 2H), 5,29 (с, 2H), 5,31 (д, J=16,2 Гц, 1H), 5,75 (д, J=16,2 Гц, 1H), 6,68 (с, 1H), 6,90 (с, 1H), 7,14-7,12 (м, 5H), 7,28 (д, J=5,1 Гц, 2H), 7,64-7,39 (м, 12H), 7,72-7,67 (м, 2H), 7,99-7,80 (м, 4H), 8,17 (д, J=8,1 Гц, 1H), 8,32-8,27 (м, 2H), 8,50 (д, J=4,5 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 625,77.
Соединение 25:1H ЯМР (300 МГц, CDCl3) δ 1,00 (т, J=7,2 Гц, 3H), 1,38 (т, J=7,5 Гц, 3H), 1,60-1,49 (м, 4H), 1,93-1,81 (м, 2H), 2,46 (с, 1H), 2,54 (с, 2H), 3,03 (м, 1H), 3,17-3,10 (м, 2H), 3,44 (м, 1H), 3,64 (с, 4H), 3,78 (с, 8Н), 3,86 (м, 2H), 4,50 (с, 1H), 4,72 (с, 1H), 5,25 (д, J=4,2 Гц, 2H), 5,27 (д, J=16,8 Гц, 1H), 5,70 (д, J=16,5 Гц, 1H), 6,80-6,77 (м, 2H), 7,12-7,08 (м, 5H), 7,19-7,17 (м, 1H), 7,35-7,33 (м, 1H), 7,50-7,42 (м, 3H), 7,65-7,54 (м, 11H), 7,68 (с, 1H), 7,92 (д, J=2,4 Гц, 1H), 8,12-8,06 (м, 2H), 8,28 (д, J=9,0 Гц, 1H), 8,47 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 658,26.
Соединение 26:1H ЯМР (300 МГц, CDCl3) δ 1,04 (т, J=7,2 Гц, 3H), 1,29 (м, 2H), 1,40 (т, J=7,5 Гц, 3H), 1,68 (м, 8H), 1,95-1,86 (м, 4H), 2,28 (м, 2H), 2,95 (м, 1H), 3,16 (к, J=7,5 Гц, 2H), 3,30 (м, 1H), 3,67 (с, 4H), 3,81 (с, 8Н), 3,91 (м, 2H), 4,22 (с, 1H), 4,65 (с, 1H), 5,28 (д, J=3,6 Гц, 2H), 5,31 (д, J=15,3 Гц, 1H), 5,76 (д, J=16,5 Гц, 1H), 6,81 (с, 2H), 7,15-7,10 (м, 5H), 7,38-7,20 (м, 6H), 7,61-7,56 (м, 8H), 7,69-7,64 (м, 2H), 7,95 (д, J=1,8 Гц, 1H), 8,17 (д, J=7,8 Гц, 2H), 8,29 (д, J=9,3 Гц, 1H), 8,50 (д, J=4,2 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 658,28.
Соединение 27:1H ЯМР (300 МГц, CDCl3) δ 1,04 (т, J=7,2 Гц, 3H), 1,41 (т, J=7,5 Гц, 3H), 1,77-1,60 (м, 2H), 1,93-1,84 (м, 4H), 3,17 (к, J=7,2 Гц, 2H), 3,27 (м, 1H), 3,61 (м, 1H), 3,66 (с, 4H), 3,81 (с, 8Н), 4,01-3,94 (м, 2H), 4,61 (с, 1H), 4,90 (с, 1H), 5,28 (с, 2H), 5,31 (д, J=15,3 Гц, 1H), 5,75 (д, J=16,2 Гц, 1H), 6,79 (с, 1H), 6,85 (с, 1H), 7,14-7,10 (м, 5H), 7,69-7,55 (м, 16H), 7,96 (с, 1H), 8,25 (д, J=7,5 Гц, 2H), 8,30 (д, J=9,0 Гц, 1H), 8,50 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 634,76.
Соединение 28:1H ЯМР (300 МГц, CDCl3): δ=8,49 (дд, J=4,5, 0,9 Гц, 4H), 8,16 (д, J=9,3 Гц, 1H), 7,78 (д, J=2,1 Гц, 1H), 7,63-7,50 (м, 10H), 7,13-7,09 (м, 4H), 7,06 (с, 1H), 6,85 (с, 2H), 5,85 (т, J=6,0 Гц, 1H), 5,72 (д, J=16,2 Гц, 1H), 5,28 (д, J=16,2 Гц, 1H), 5,17 (с, 2H), 4,01 (т, J=5,4 Гц, 2H), 3,80 (с, 8Н), 3,65 (с, 4H), 3,40 (к, J=6,0 Гц, 2H), 3,07 (к, J=7,5 Гц, 2H), 1,95-1,82 (м, 6H), 1,34 (т, J=7,5 Гц, 3H), 1,01 (т, J=7,2 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 504.
Соединение 29:1H ЯМР (300 МГц, CDCl3): δ=8,48 (д, J=4,8 Гц, 4H), 8,19 (д, J=9,0 Гц, 1H), 7,85-7,55 (м, 12H), 7,12-7,08 (м, 5H), 6,79 (с, 2H), 5,71 (дд, J=16,5, 7,2 Гц, 1H), 5,29 (д, J=16,5 Гц, 1H), 5,21 (д, J=7,8 Гц, 2H), 3,92 (м, 1H), 3,78-3,74 (м, 11H), 3,63-3,59 (м, 5H), 3,36-3,34 (м, 2H), 3,11-3,08 (м, 2H), 2,40-1,72 (м, 10Н), 1,37-1,32 (м, 3H), 1,04 (т, J=7,2 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 552.
Соединение 31:1H ЯМР (400 МГц, CDCl3): δ=8,49 (д, J=4,4 Гц, 4H), 8,23 (дд, J=9,2, 5,2 Гц, 1H), 7,88-7,56 (м, 15H), 7,45-7,41 (м, 4H), 7,35 (т, J=6,4 Гц, 1H), 7,11-7,08 (м, 5H), 6,84 (с, 1H), 6,79 (с, 1H), 5,73 (д, J=16,0 Гц, 1H), 5,30 (д, J=16,0 Гц, 1H), 5,24 (с, 2H), 4,79 (с, 1H), 4,68 (с, 1H), 3,99 (т, J=5,6 Гц, 2H), 3,80-3,77 (м, 8H), 3,64-3,61 (м, 4H), 3,58-3,54 (м, 2H), 3,12-3,10 (м, 2H), 1,89-1,88 (м, 6H), 1,38-1,33 (м, 3H), 1,04-1,01 (м, 3H). Масс-спектр: (EM+2H+)/2: найдено 586,77.
Соединение 32:1H ЯМР (400 МГц, CDCl3): δ 8,48 (д, J=4,8 Гц, 4H), 8,15 (т, J=8,0 Гц, 1H), 7,77 (с, 1H), 7,62-7,54 (м, 10H), 7,11 (т, J=6,0 Гц, 4H), 7,05 (с, 1H), 6,82 (с, 2H), 6,13-6,09 (м, 1H), 5,69 (д, J=16,4 Гц, 1H), 5,26 (д, J=16,4 Гц, 1H), 5,20 (с, 2H), 4,36 (д, J=12,8 Гц, 1H), 4,25 (д, J=12,0 Гц, 1H), 3,96 (т, J=5,6 Гц, 2H), 3,78 (с, 8Н), 3,63 (с, 4H), 3,34 (к, J=6,4 Гц, 2H), 3,13-3,04 (м, 3H), 2,87 (т, J=11,2 Гц, 1H), 2,33-2,28 (м, 1H), 1,93-1,79 (м, 8H), 1,71 (к, J=7,6 Гц, 2H), 1,37 (т, J=7,6 Гц, 3H), 0,99 (т, J=7,2 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 559,26.
Соединение 33:1H ЯМР (300 МГц, CDCl3): δ=8,47 (д, J=4,8 Гц, 4H), 8,20 (д, J=9,0 Гц, 1H), 7,80-7,78 (м, 1H), 7,64-7,49 (м, 10H), 7,47-7,41 (м, 1H), 7,10 (т, J=6,0 Гц, 4H), 7,04 (с, 1H), 6,78 (с, 2H), 5,69 (д, J=16,5 Гц, 1H), 5,27 (д, J=16,5 Гц, 1H), 5,22 (с, 2H), 3,91 (м, 2H), 3,82 (м, 2H), 3,76 (с, 8Н), 3,72-3,68 (м, 4H), 3,61 (с, 6H), 3,31-3,27 (м, 2H), 3,11 (д, J=7,2 Гц, 2H), 2,47-2,44 (м, 2H), 2,35-2,33 (м, 2H), 2,05-1,95 (м, 2H), 1,92-1,83 (м, 2H), 1,81-1,76 (м, 2H), 1,66 (м, 2H), 1,36 (т, J=7,5 Гц, 3H), 1,12-1,09 (м, 6H), 0,99 (т, J=7,5 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 615,80.
Соединение 34:1H ЯМР (400 МГц, CDCl3): δ=8,38 (д, J=4,0 Гц, 4H), 7,74-7,71 (м, 4H), 7,62-7,58 (м, 7H), 7,35 (дд, J=7,2, 2,4 Гц, 1H), 7,24-7,21 (м, 4H), 6,89 (с, 1H), 6,58 (с, 2H), 5,35 (м, 1H), 4,97 (м, 1H), 4,73 (с, 2H), 4,25-4,24 (м, 1H), 4,13-4,10 (м, 1H), 3,91 (с, 3H), 3,76 (т, J=5,6 Гц, 2H), 3,68 (с, 8H), 3,61 (м, 1H), 3,49 (с, 4H), 3,20-3,17 (м, 1H), 3,08-3,03 (м, 1H), 2,94 (д, J=18,4 Гц, 1H), 2,80 (д, J=18,4 Гц, 1H), 2,49-2,30 (м, 6H), 2,10-1,93 (м, 2H), 1,71-1,53 (м, 4H), 1,25 (д, J=6,8 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 605.
Соединение 35:1H ЯМР (400 МГц, CDCl3): δ=8,49 (д, J=4 Гц, 4H), 8,18 (д, J=9,2 Гц, 1H), 7,79 (с, 1H), 7,68-7,41 (м, 11H), 7,15-7,06 (м, 6H), 5,52 (дд, J=175,6, 16,4 Гц, 2H), 5,22 (с, 2H), 4,14 (с, 2H), 3,96 (с, 4H), 3,83-3,73 (м, 8H), 3,48 (с, 2H), 3,09-3,07 (м, 2H), 1,94-1,86 (м, 2H), 1,34 (т, J=7,6 Гц, 3H), 1,019 (т, J=7,6 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 510.
Соединение 36:1H ЯМР (400 МГц, CDCl3): δ=8,68 (с, 1H), 8,49 (д, J=4,4 Гц, 4H), 8,24 (т, J=8 Гц, 2H), 8,09 (д, J=8 Гц, 1H), 7,87 (д, J=2 Гц), 7,67 (с, 1H), 7,58-7,43 (м, 10H), 7,11-7,04 (м, 6H), 5,54 (дд, J=178,6, 16Hz, 2Н), 5,27 (с, 2H), 3,83-3,76 (м, 11H), 3,49 (с, 3H), 3,15 (к, J=7,6 Гц, 2H), 2,90 (т, J=6,4 Гц, 2H), 1,95-1,84 (м, 2H), 1,38 (т, J=7,6 Гц, 3H), 1,06 (т, J=7,6 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 542.
Соединение 37:1H ЯМР (300 МГц, CDCl3): δ=8,50-8,48 (м, 4H), 8,31-8,24 (м, 3H), 7,97 (с, 1H), 7,70-7,52 (м, 12H), 7,16-7,10 (м, 6H), 7,06 (с, 1H), 7,04 (с, 1H), 6,78 (с, 2H), 6,05 (с, 1H), 5,76 (д, J=16,5 Гц, 1H), 5,34-5,28 (м, 3H), 4,74 (с, 2H), 4,04 (м, 2H), 3,77 (с, 8Н), 3,59 (с, 4H), 3,55 (м, 2H), 3,17 (к, J=7,5 Гц, 2H), 2,54 (к, J=7,5 Гц, 4H), 1,97-1,84 (м, 6H), 1,41 (т, J=7,8 Гц, 3H), 1,12 (т, J=7,5 Гц, 6H), 1,04 (т, J=7,2 Гц, 3H). Масс-спектр: (EM+2H+)/2: найдено 636.
Соединение 38:1H ЯМР (300 МГц, CDCl3) δ 1,04 (т, J=7,5 Гц, 3H), 1,32-1,25 (м, 2H), 1,40 (т, J=7,5 Гц, 3H), 1,63 (м, 6H), 1,93-1,85 (м, 6H), 2,22-2,17 (м, 2H), 2,90 (м, 1H), 3,20-3,15 (м, 3H), 3,88-3,67 (м, 26H), 4,09 (с, 1H), 4,54 (с, 1H), 5,28 (д, J=10,5 Гц, 2H), 5,31 (д, J=12,0 Гц, 1H), 5,75 (д, J=16,2 Гц, 1H), 6,77 (с, 2H), 6,97 (м, 1H), 7,26-7,11 (м, 10H), 7,72-7,55 (м, 12H), 7,99-7,96 (м, 3H), 8,29-8,26 (м, 3H), 8,49 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 798.
Соединение 39:1H ЯМР (400 МГц, CDCl3): δ=1,03 (т, J=7,2 Гц, 3H), 1,25 (м, 1H), 1,39 (т, J=7,6 Гц, 3H), 1,65-1,96 (м, 11H), 2,01 (м, 2H), 2,24 (м, 2H), 3,13-3,19 (м, 3H), 3,44-3,54 (м, 5H), 3,59-3,64 (м, 12H), 3,77 (с, 8H), 3,97 (т, J=5,6 Гц, 2H), 4,30 (с, 1H), 4,67 (с, 1H), 5,27 (д, J=12,4 Гц, 2H), 5,30 (д, J=16,0 Гц, 1H), 5,74 (д, J=16,0 Гц, 1H), 6,80 (с, 2H), 7,05 (с, 1H), 7,09-7,12 (м, 5H), 7,20-7,30 (м, 5H), 7,54-7,62 (м, 8H), 7,65-7,68 (м, 2H), 7,76 (м, 4H), 7,94 (д, J=2,4 Гц, 1H), 8,13 (д, J=6,8 Гц, 2H), 8,28 (д, J=9,2 Гц, 1H), 8,48 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 798.
Соединение 40:1H ЯМР (300 МГц, CDCl3): δ=1,04 (т, J=7,2 Гц, 3H), 1,25-1,29 (м, 1H), 1,39 (т, J=7,2 Гц, 3H), 1,66-1,97 (м, 9H), 2,17-2,26 (м, 3H), 2,75 (м, 1H), 3,12-3,20 (м, 3H), 3,39 (м, 1H), 3,74-3,86 (м, 12H), 4,10 (с, 1H), 4,72 (с, 1H), 5,27-5,34 (м, 3H), 5,75 (д, J=16,5 Гц, 1H), 6,99 (с, 2H), 7,12-7,14 (м, 4H), 7,20-7,31 (м, 6H), 7,44-7,46 (м, 4H), 7,55-7,60 (м, 4H), 7,64-7,67 (м, 3H), 7,93 (с, 1H), 8,10-8,18 (м, 2H), 8,28 (д, J=9,3 Гц, 1H), 8,51 (м, 4H). Масс-спектр: (EM+2H+)/2: найдено 645.
Соединение 41:1H ЯМР (CDCl3, 400 МГц): δ=1,12 (с, 3H), 1,21 (с, 3H), 1,68 (с, 3H), 1,91 (с, 3H), 1,63-2,33 (м, 4H), 2,26 (с, 3H), 2,41 (с, 3H), 2,38-2,58 (м, 8H), 2,72 (т, J=6,8 Гц, 2H), 3,18-3,27 (м, 2H), 3,64 (с, 4H), 3,78 (с, 8Н), 3,94 (т, J=6,0 Гц, 2H), 4,19 (д, J=8,4 Гц, 1H), 4,30 (д, J=8,4 Гц, 1H), 4,43 (дд, J=10,8, 6,8 Гц, 1H), 4,96 (д, J=9,2 Гц, 1H), 5,67 (д, J=7,2 Гц, 1H), 5,88-5,93 (м, 2H), 6,20 (т, J=9,2 Гц, 1H), 6,29 (с, 1H), 6,81 (с, 2H), 7,06 (с, 1H), 7,06-7,12 (м, 4H), 7,27-7,63 (м, 24H), 7,79 (д, J=5,6 Гц, 2H), 8,13 (д, J=5,6 Гц, 2H), 8,48 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 762.
Соединение 42:1H ЯМР (CDCl3, 400 МГц): δ=0,98 (т, J=7,2 Гц, 3H), 1,22 (м, 8H), 1,38 (т, J=7,6 Гц, 3H), 1,88 (м, 2H), 2,01 (с, 5H), 2,10-2,41 (м, 8H), 2,85 (с, 1H), 2,92 (с, 1H), 3,15 (м, 3H), 3,44 (с, 2H), 3,50-3,71 (м, 13H), 3,76 (с, 8Н), 3,86 (с, 2H), 4,10 (дд, J=7,2 Гц, 4H), 4,32 (с, 2H), 4,53 (с, 1H), 5,24 (s, 2H), 5,30 (д, J=16 Гц, 1H), 5,73 (д, J=16 Гц, 1H), 6,75 (с, 3H), 6,95 (уш., 2H), 7,1-7,25 (м, 13H), 7,29 (д, J=8,4 Гц, 2H), 7,52-7,64 (м, 8H), 7,64-7,72 (м, 3H), 7,93 (д, J=2,4 Гц, 1H), 8,14 (д, J=7,2 Гц, 2H), 8,27 (д, J=9,2 Гц, 1H), 8,47 (д, J=8,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 901,6.
Соединение 43:1H ЯМР (CDCl3, 400 МГц): δ=1,12 (с, 3H), 1,20 (с, 3H), 1,67 (с, 3H), 1,93 (с, 3H), 2,16 (с, 3H), 2,37 (с, 3H), 2,21-2,76 (м, 8Н), 2,97 (д, J=6,8 Гц, 1H), 3,36-3,41 (м, 1H), 3,54-3,62 (м, 1H), 3,71 (т, J=4,4 Гц, 4H), 3,78 (с, 4H), 3,84 (с, 8Н), 4,16-4,20 (м, 3H), 4,41-4,57 (м, 3H), 4,70 (с, 1H), 4,94 (д, J=9,2 Гц, 1H), 5,66 (дд, J=6,8, 3,6 Гц, 1H), 5,86-5,90 (м, 1H), 6,17 (к, J=9,2 Гц, 1H), 6,31 (д, J=4,4 Гц, 1H), 6,95 (с, 1H), 7,00 (с, 1H), 7,03-7,09 (м, 4H), 7,19-7,63 (м, 34H), 7,80 (дд, J=17,6, 7,2 Гц, 2H), 8,12 (м, 2H), 8,47 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 831.
Соединение 44:1H ЯМР (400 МГц, CDCl3): δ=1,05 (т, J=7,2 Гц, 3H), 1,40 (т, J=7,6 Гц, 3H), 1,85-1,96 (м, 6H), 3,14-3,54 (м, 2H), 3,52-3,57 (м, 2H), 3,65 (с, 4H), 3,80 (с, 8Н), 4,057-4,10 (м, 2H), 5,27 (с, 2H), 5,29 (д, J=16,0 Гц, 1H), 5,73 (д, J=16,0 Гц, 1H), 6,88 (с, 2H), 6,99 (д, J=8,4 Гц, 2H), 7,07-7,12 (м, 6H), 7,28-7,66 (м, 18H), 7,93 (д, J=2,8 Гц, 1H), 8,07 (д, J=8,4 Гц, 2H), 8,26 (д, J=9,2 Гц, 1H), 8,48 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 661,4.
Соединение 45: H ЯМР (CDCl3, 300 МГц): δ=1,11 (с, 3H), 1,18 (с, 3H), 1,66 (с, 3H), 1,89 (с, 3H), 2,18 (с, 3H), 2,27 (с, 3H), 2,02-2,57 (м, 7Н), 2,68 (т, J=6,6 Гц, 2H), 2,79 (т, 7=5,7 Гц, 2H), 3,25 (к, J=4,8 Гц, 2H), 3,40 (т, 7=5,1 Гц, 2H), 3,54-3,63 (м, 10H), 3,70 (т, J=4,5 Гц, 4H), 3,77 (с, 4H), 3,81 (с, 8Н), 4,18 (д, J=8,8 Гц, 1H), 4,28 (д, J=8,8 Гц, 1H), 4,39-4,47 (м, 3H), 4,94 (д, J=9,0 Гц, 1H), 5,43 (д, J=3,6 Гц, 1H), 5,66 (д, J=6,6 Гц, 1H), 5,90 (дд, J=8,4, 3,6 Гц, 1H), 6,16 (т, J=9,0 Гц, 1H), 6,28 (с, 1H), 7,06-7,09 (м, 8H), 7,22-7,61 (м, 33H), 7,79 (дд, J=7,5 Гц, 2H), 8,11 (дд, J=7,5 Гц, 2H), 8,46 (д, J=4,5 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 978.
Соединение 46:1H ЯМР (400 МГц, CDCl3): δ=1,12 (с, 3H), 1,19 (с, 3H), 1,68 (с, 3H), 1,87-1,88 (м, 1H), 1,90 (с, 3H), 2,07-2,13 (м, 1H), 2,20 (с, 3H), 2,28-2,35 (м, 1H), 2,42 (с, 3H), 2,56 (т, J=6,8 Гц, 2H), 2,66-2,67 (м, 1H), 2,80 (т, J=6,8 Гц, 2H), 3,25-3,31 (м, 2H), 3,79-3,96 (м, 18H), 4,11 (с, 2H), 4,20 (д, J=8,8 Гц, 1H), 4,22-4,28 (м, 2H), 4,31 (д, J=8 Гц, 1H), 4,40-4,45 (м, 1H), 4,95 (д, J=8,4 Гц, 1H), 5,48 (д, J=3,6 Гц, 1H), 5,68 (д, J=6,8 Гц, 1H), 5,94 (дд, J=8,4, 3,6 Гц, 1H), 6,22 (т, J=8,8 Гц, 1H), 6,27 (s, 1H), 6,89 (д, J=8,4 Гц, 2H), 7,08-7,13 (м, 4H), 7,20 (д, J=7,6 Гц, 2H), 7,27-7,66 (м, 21H), 7,77 (д, J=7,2 Гц, 2H), 8,14 (д, J=7,2 Гц, 2H), 8,41 (д, J=4,8 Гц, 2H), 8,49 (д, 7=4,8 Гц, 2H). Масс-спектр: (EM+2H+)/2: найдено 857,8.
Соединение 47:1H ЯМР (400 МГц, CDCl3): δ=1,04 (т, J=7,2 Гц, 3H), 1,30 (с, 9H), 1,44 (т, J=7,6 Гц, 3H), 1,86-1,97 (м, 4H), 2,03-2,08 (м, 2H), 3,18-3,24 (м, 2H), 3,36-3,40 (м, 2H), 3,85 (с, 4H), 3,95 (с, 6H), 4,26 (с, 2H), 5,30-5,34 (м, 3H), 5,78 (д, 1,04, J=3,6 Гц, 3H), 7,09-7,13 (м, 2H), 7,17-7,21 (м, 2H), 7,5 (д, J=8 Гц, 2H), 7,60-7,76 (м, 9H), 7,84 (д, J=8,8 Гц, 2H), 8,0 (д, J=2,4 Гц, 1H), 8,28-8,32 (м, 4H), 8,48 (д, J=7,6 Гц, 2H), 8,55 (д, J=6,8 Гц, 2H). Масс-спектр: (EM+2H+)/2: найдено 626,8.
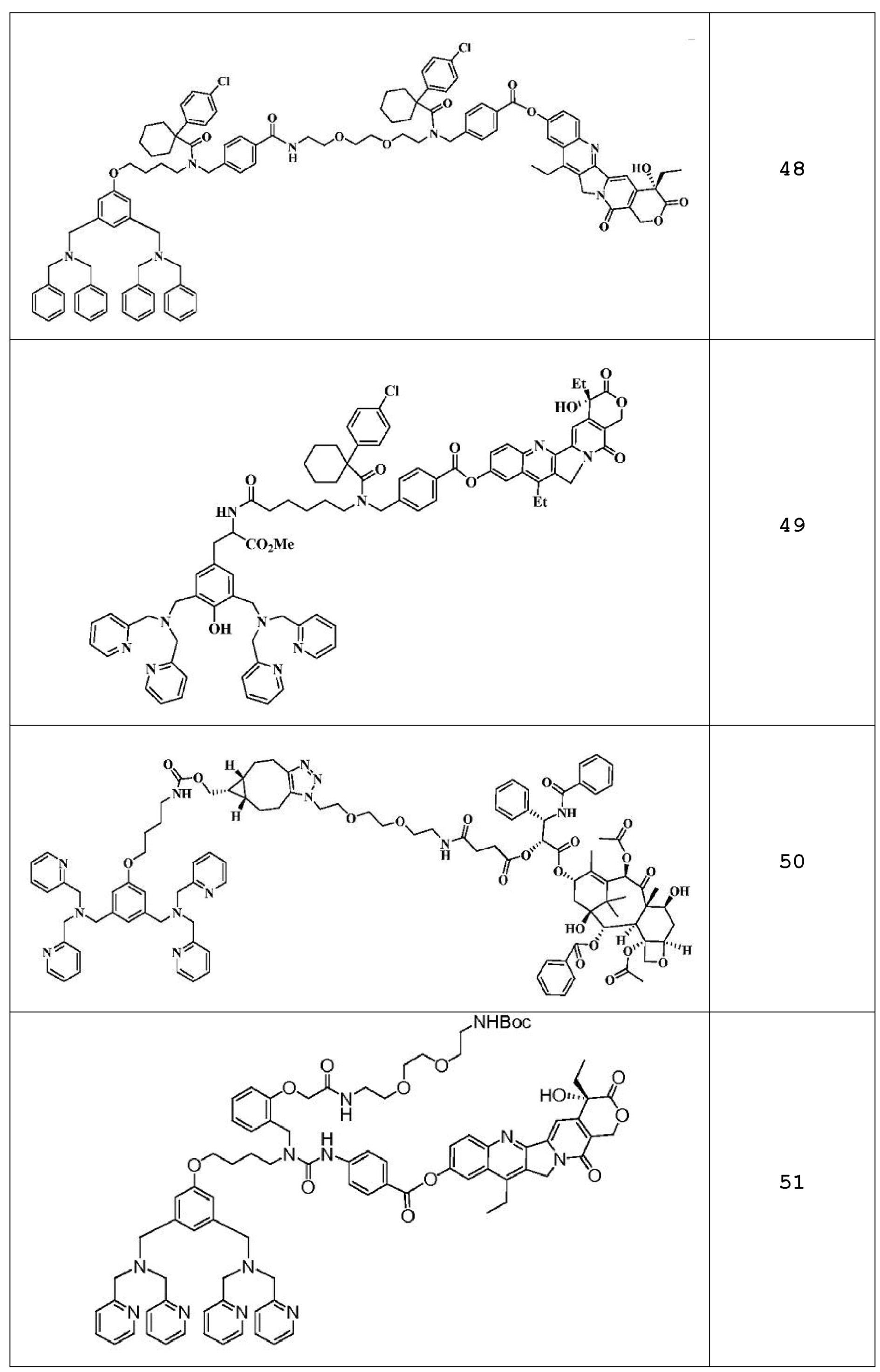
Соединение 48:1H ЯМР (CDCl3, 400 МГц): δ=0,88 (м, 6H), 1,03 (т, J=6,8 Гц, 3H), 1,39 (т, J=7,2 Гц, 3H), 1,90 (м, 2H), 2,23 (уш. 5Н), 2,93 (уш., 2H), 3,13 (м, 3H), 3,25 (с, 2H), 3,41-3,78 (м, 21H), 3,91 (м, 2H), 4,11 (с, 2H), 4,33 (с, 2H), 4,56 (с, 2H), 5,25 (с, 2H), 5,32 (д, J=18,4 Гц, 1H), 5,76 (д, J=16,4 Гц, 1H), 6,74 (с, 2H), 6,98 (с, 2H), 7,04-7,51 (м, 30H), 7,69 (м, 4H), 7,95 (с, 2H), 8,17 (д, J=6 Гц, 2H), 8,30 (д, J=8,8 Гц, 1H).
Соединение 49:1H ЯМР (300 МГц, CDCl3): δ=1,05 (т, J=7,2 Гц, 3H), 1,25 (м, 3H), 1,41 (т, J=7,5 Гц, 3H), 1,69 (м, 11H), 1,83-2,02 (м, 4H), 2,27 (м, 2H), 2,84 (м, 1H), 3,00 (д, J=5,7 Гц, 2H), 3,14-3,21 (м, 3H), 3,64 (с, 3H), 3,76 (с, 4H), 3,84 (с, 8Н), 4,15 (с, 1H), 4,57 (с, 1H), 4,74-4,80 (м, 1H), 5,29 (д, J=4,8 Гц, 2H), 5,32 (д, J=14,7 Гц, 1H), 5,76 (д, J=16,5 Гц, 1H), 6,95 (с, 2H), 7,10-7,14 (м, 4H), 7,18-7,33 (м, 6H), 7,43-7,46 (м, 4H), 7,57-7,62 (м, 4H), 7,67-7,70 (м, 2H), 7,96 (д, J=2,1 Гц, 1H), 8,17 (д, J=8,1 Гц, 2H), 8,29 (д, J=9,0 Гц, 1H), 8,52 (д, J=5,1 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 730.
Соединение 50:1H ЯМР (CDCl3, 400 МГц): δ=0,88 (м, 2H), 1,13 (с, 3H), 1,21 (с, 3H), 1,22-1,30 (м, 4H), 1,68 (с, 3H), 1,69-1,91 (м, 6H), 1,91 (с, 3H), 2,05-2,32 (м, 2H), 2,21 (с, 3H), 2,42 (с, 3H), 2,55-2,97 (м, 6H), 2,76 (т, J=6,8 Гц, 2H), 3,14-3,54 (м, 8H), 3,64 (с, 4H), 3,67 (с, 8Н), 3,86 (т, J=5,6 Гц, 2H), 3,95 (т, J=6,0 Гц, 2H), 4,10-4,12 (м, 2H), 4,09 (д, J=4,4 Гц, 1H), 4,19 (д, J=4,4 Гц, 1H), 4,29-4,45 (м, 3H), 4,95-4,97 (м, 2H), 5,45 (д, J=4,0 Гц, 1H), 5,67 (д, J=7,2 Гц, 1H), 5,92 (дд, J=8,4, 4,0 Гц, 1H), 6,19 (т, J=9,2 Гц, 1H), 6,29 (с, 1H), 6,43-6,45 (м, 1H), 6,82 (с, 2H), 6,82-7,14 (м, 5H), 7,27-7,63 (м, 26H), 7,80 (д, J=7,2 Гц, 2H), 8,13 (д, J=7,2 Гц, 2H), 8,50 (д, J=4,8 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 937.
Соединение 51:1H ЯМР (300 МГц, CDCl3): δ=1,05 (т, J=7,2 Гц, 3H), 1,25-1,40 (м, 12H), 1,83-1,91 (м, 6H), 3,16-3,23 (м, 2H), 3,47-4,05 (м, 28H), 4,55 (с, 2H), 4,77 (с, 2H), 5,28-5,34 (м, 3H), 5,76 (д, J=16,2 Гц, 1H), 6,86 (с, 2H), 7,01-7,13 (м, 5H), 7,60-7,66 (м, 16H), 7,96 (д, J=2,4 Гц, 1H), 8,08 (д, J=8,7 Гц, 2H), 8,28 (д, J=9,3 Гц, 1H), 8,48 (д, J=4,2 Гц, 4H). Масс-спектр: (EM+2H+)/2: найдено 760,4.
Zn-DPA конъюгаты каждого из соединений, описанных выше, обозначенные как Zn-DPA-(номер соединения), получают в соответствии с методикой, описанной ниже. Точнее, каждое из соединений с 1 по 51 смешивают при комнатной температуре с 2 молярными эквивалентами нитрата цинка в растворе, содержащем смесь дихлорметана и метанола (1:1), и перемешивают полученную смесь в течение часа. Удаление растворителя в вакууме приводит к получению соответствующего Zn-DPA конъюгата.
Аналитические данные нескольких Zn-DPA конъюгатов представлены ниже в качестве репрезентативных примеров:
Zn-DPA-(8):1H ЯМР (700 МГц, ДМСО-d6): δ=0,86 (т, J=7,0 Гц, 3H), 1,25 (т, J=7,7 Гц, 3H), 1,66 (квин, J=7,7 Гц, 2H), 1,79-1,89 (м, 4H), 3,16 (к, J=7,7 Гц, 2H), 3,20 (к, J=7,7 Гц, 2H), 3,75 (д, J=16,1 Гц, 4H), 3,84 (с, 4H), 4,11 (уш., 2H), 4,33 (д, J=16,1 Гц, 4H), 5,31 (с, 2H), 5,41 (с, 2H), 6,48 (уш., 1H), 6,51 (с, 1H), 6,86 (с, 1H), 6,99 (с, 2H), 7,02 (с, 1H), 7,44 (т, J=7,7 Гц, 1H), 7,54 (д, J=7,7 Гц, 4H), 7,60 (т, J=7,0 Гц, 4H), 7,65 (д, J=7,7 Гц, 1H), 7,71 (д, J=7,7 Гц, 1H), 7,65 (дд, J=9,1, 2,1 Гц, 2H), 8,05 (т, J=7,7 Гц, 4H), 8,14 (с, 1H), 8,21 (д, J=9,1 Гц, 1H), 8,37 (с, 1H), 8,63 (д, J=5,6 Гц, 3H), 8,95 (с, 1H). Масс-спектр: (EM+Zn+2H+)/2: найдено 595, (EM+2Zn+2H+)/2: найдено 627.
Zn-DPA-(11):1H ЯМР (700 МГц, ДМСО-d6): δ=0,86 (т, J=7,0 Гц, 3H), 1,25 (т, J=7,7 Гц, 3H), 1,79-1,88 (м, 6H), 3,16 (к, J=7,7 Гц, 2H), 3,48 (с, 2H), 3,73 (д, J=16,1 Гц, 4H), 3,81 (уш., 4H), 4,10 (уш., 1H), 4,32 (д, J=16,1 Гц, 4H), 4,73 (с, 2H), 5,32 (с, 2H), 5,41 (с, 2H), 6,52 (с, 1H), 6,86 (с, 1H), 6,98 (с, 2H), 7,29-7,31 (м, 1H), 7,37 (д, J=7,7 Гц, 2H), 7,40 (т, J=7,7 Гц, 4H), 7,47 (т, J=7,7 Гц, 2H), 7,52 (д, J=7,7 Гц, 4H), 7,58-7,62 (м, 6H), 7,61 (д, J=7,7 Гц, 2H), 7,76 (т, J=7,7 Гц, 2H), 7,93 (д, J=9,1 Гц, 1H), 8,03 (т, J=7,7 Гц, 4H), 8,20 (д, J=5,6 Гц, 1H), 8,42 (с, 1H), 8,63 (д, J=5,6 Гц, 4H), 8,84 (уш., 1H). Масс-спектр: (EM+Zn+2H+)/2: найдено 678, (EM+2Zn+2H+)/2: найдено 710.
Zn-DPA-(17):1H ЯМР (700 МГц, ДМСО-d6): δ=0,85 (т, J=7,0 Гц, 3H), 1,25 (т, J=7,7 Гц, 3H), 1,74-1,88 (м, 6H), 3,15 (к, J=7,7 Гц, 3H), 3,53 (с, 1H), 3,69-3,83 (м, 8H), 3,94 (уш., 1H), 4,16 (уш., 1H), 4,30-4,38 (м, 4H), 4,73 (с, 1H), 4,88 (с, 1H), 5,30 (с, 2H), 5,40 (с, 2H), 6,51 (с, 1H), 6,54-6,88 (м, 2H), 6,93 (с, 1H), 7,02 (с, 1H), 7,30-7,64 (м, 17H), 7,68 (д, J=7,7 Гц, 2H), 7,75 (д, J=9,1 Гц, 1H), 8,05 (т, J=7,7 Гц, 4H), 8,15 (с, 1H), 8,18-8,21 (м, 3H), 8,64 (д, J=5,6 Гц, 4H). Масс-спектр: (ЕМ+Zn+2H+)/2: найдено 670, (EM+2Zn+2H+)/2: найдено 702.
Zn-DPA-(31):1H ЯМР (700 МГц, ДМСО-d6): δ=0,85 (т, J=7,0 Гц, 3H), 1,19 (т, J=7,0 Гц, 2H), 1,24 (т, J=7,7 Гц, 1H), 1,82-1,84 (м, 6H), 3,07-3,15 (м, 2H), 3,50 (уш., 1H), 3,60 (уш., 1H), 3,71 (т, J=17,5 Гц, 4H), 3,81 (с, 4H), 4,12-4,14 (м, 2H), 4,31 (т, J=14,7 Гц, 4H), 4,65 (с, 1H), 4,82 (с, 1H), 5,29 (с, 2H), 5,41 (с, 2H), 6,51 (с, 1H), 6,86 (с, 1H), 6,99 (с, 2H), 7,26-7,72 (м, 20H), 7,72 (д, J=7,7 Гц, 1H), 8,03 (т, J=7,7 Гц, 3H), 8,13 (т, J=7,7 Гц, 1H), 8,63 (д, J=4,9 Гц, 4H). Масс-спектр: (ЕМ+Zn+2H+)/2: найдено 618, (EM+2Zn+2H+)/2: найдено 650.
Стабильность Zn-DPA конъюгатов в плазме
Zn-DPA конъюгаты, Zn-DPA-(8), Zn-DPA-(12), Zn-DPA-(25), Zn-DPA-(26) и Zn-DPA-(42), полученные из соединений 8, 12, 25, 26 и 42, соответственно, инкубируют в плазме крови мышей при 37°С в течение до 24 часов для оценки стабильности указанных конъюгатов.
Образец анализируют с помощью системы высокоэффективной жидкостной хроматографии для определения концентрации тестируемого конъюгата в одну из четырех временных точек (то есть, 0, 3 часа, 6 часов и 24 часа). Определяют содержание в плазме тестируемого конъюгата в процентах через 3, 6 и 24 часов после начала инкубирования. Результаты представлены в таблице 1 ниже. Более высокий процент указывает на большую стабильность. Среди пяти испытанных конъюгатов Zn-DPA-(26) и Zn-DPA-(42), полученные из соединений 26 и 42, соответственно, являются наиболее стабильными. Установлено, что после 24 часов инкубации 95% или более указанных конъюгатов сохраняется в плазме.
Таблица 1. Стабильность (сохраняющееся содержание в процентах) Zn-DPA конъюгатов: Zn-DPA-(8), Zn-DPA-(12), Zn-DPA-(25), Zn-DPA-(26) и Zn-DPA-42)
Ингибирование роста клеток рака
Культура клеток
Клетки SCM-1, MiaPaca2 и Colo205 выращивают в среде RPMI 1640 (Roswell Park Memorial Institute) (RPMI; Gibco), дополненной 10% фетальной бычьей сывороткой (FBS; Gibco). Клетки Detroit551 выращивают в среде Игла, модифицированной по способу Дульбекко (DMEM), дополненной 10% FBS 50 ед./мл пенициллина и стрептомицина и 1% заменимых аминокислот (NEAA; Gibco).
Zn-DPA конъюгаты, Zn-DPA-(8), Zn-DPA-(12), Zn-DPA-(25), Zn-DPA-(26) и Zn-DPA-(42), полученные из соединений 8, 12, 25, 26 и 42, соответственно, используют для ингибирования роста клеток рака человека (SCM-1, Colo205, MiaPaca2) и эмбриональных клеток фибробластов кожи человека Detroit551 в соответствии с методиками, описанными ниже.
Анализ жизнеспособности клеток
Жизнеспособность клеток исследуют с помощью MTS анализа (Promega, Madison, WI, USA). Точнее, клетки выращивают (2500-3000 клеток/лунка) в плоскодонном 96-луночном планшете в течение 24 часов. Среду добавляют вместе с тестируемым соединением в предопределенной концентрации. Клетки дополнительно инкубируют в течение 72 часов. В конце инкубации среду удаляют и разбавляют 100 мкл смеси 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий/феназинметосульфат. Клетки снова инкубируют в течение 1,5 часов при температуре 37°С в увлажненном инкубаторе с 5% CО2, предоставляя возможность жизнеспособным клеткам превращать соль тетразолия в формазан. Степень конверсии определяют измерением спектральной поглощательной способности при 490 нм с использованием микропланшет-ридера BioTek PowerWave-X Absorbance Microplate Reader.
Полученные данные нормализуют с помощью контроля, обработанного разбавителем (диметилсульфоксидом, ДМСО) (100% жизнеспособность), и фонового контроля (0% жизнеспособность) для проверки ингибирования роста. Значение IC50 определяют как концентрацию соединения, которая вызывает снижение жизнеспособности клеток на 50% по сравнению с контролем, обработанным разбавителем. Эти значения рассчитывают с использованием программного обеспечения GraphPad Prism version 4 (San Diego, CA, USA).
Значения IC50 для пяти Zn-DPA конъюгатов, то есть Zn-DPA-(8), Zn-DPA-(12), Zn-DPA-(25), Zn-DPA-(26) и Zn-DPA-(42), представлены в таблице 2 ниже. В данной таблице для сравнения представлены также значения IC50 двух противоопухолевых соединений, SN-38 и СРТ-11. См. ниже структуры этих двух соединений. Следует отметить, что Zn-DPA-(8), Zn-DPA-(12), Zn-DPA-(25), Zn-DPA-(26) и Zn-DPA-(42), а также СРТ-11 являются пролекарствами противоракового соединения SN-38. Zn-DPA-(26), Zn-DPA-(42) и СРТ-11 содержат примерно 24%, 18% и 58% SN-38, соответственно.


Таблица 2. Значение IC50 Zn-DPA конъюгатов, Zn-DPA-(8), Zn-DPA-(12), Zn-DPA-(25), Zn-DPA-(26), Zn-DPA-(42), и двух противораковых соединений (SN-38 и CPT-11) в отношении клеток рака человека (Colo205, SCM-1, MiaPaca2) и эмбриональных фибробластов кожи человека Detroit 551
Исследование противоопухолевой активности in vivo
Два Zn-DPA конъюгата, Zn-DPA-(26) и Zn-DPA-(42), тестируют в условиях in vivo на противоопухолевую активность в отношении опухолей Colo205 или MiaPaca2 голых мышей в соответствии с методикой, описанной ниже.
Точнее, клетки Colo205 или MiaPaca2 культивируют и содержат емкости с RPMI-1640 средой, снабженной 10% FBS. Клетки собирают и инокулируют (1×106 клеток) подкожно в левую боковую поверхность взрослому самцу голой мыши. Отбор в группу онкологических мышей проводят при среднем объеме опухоли приблизительно 200 мм3. Размеры опухолей измеряют с помощью цифрового штангенциркуля, а объем опухоли в мм3 рассчитывают по формуле: Объем=(длина х ширина^2)/2.
Мышей помещают в стерилизованные клетки, оборудованные воздушным фильтром и стерильными подстилками, в Центре лабораторных животных Национальных научно-исследовательских институтов здравоохранения. Все мыши в течение всего исследования неограниченно получают стерилизованную воду и корм при световом цикле 12 часов свет/12 часов темнота.
В данном исследовании используют несколько доз Zn-DPA-(26) и Zn-DPA-(42), то есть 40 мг/кг, 20 мг/кг и 10 мг/кг, при р <0,05 в сравнении с контролем, обработанным разбавителем, с использованием однофакторного дисперсионного анализа ANOVA и теста множественных сравнений Ньюмена-Кейса (Newman-Keuls). Оба конъюгата, Zn-DPA-(26) и Zn-DPA-(42), в смеси 10% ДМСО/20% Cremophor EL/70% декстроза вводят внутривенно один раз в день пять дней подряд при введении в дозе 20 мг/кг или 10 мг/кг или два раза в неделю в течение двух недель при введении в дозе 40 мг/кг; СРТ-11 (40 мг/кг) вводят внутривенно два раза в неделю в течение двух недель; и SN-38 (10 мг/кг) в смеси 10% ДМСО/20% Cremophor EL/10% Na2CO3/60% декстроза внутривенно вводят один раз в день пять дней подряд в течение двух недель.
Несмотря на то, что количества SN-38, содержащиеся в Zn-DPA-(26) и Zn-DPA-(42), составляют лишь 24% и 18%, соответственно (по сравнению с 58% в СРТ-11), эти два Zn-DPA конъюгата неожиданно показывают гораздо большую противоопухолевую активность по сравнению с противоопухолевой активностью SN-38 и СРТ-11, тестированных в ксенотрансплантатной модели опухоли Colo205 у мышей. В частности, Zn-DPA-(26) неожиданно показывает гораздо более высокую противоопухолевую активность в дозах 10 мг/кг и 40 мг/кг по сравнению с противоопухолевой активностью SN-38 в дозе 10 мг/кг и СРТ-11 в дозе 40 мг/кг; и Zn-DPA-(42) также неожиданно показывает зависимую от дозы противоопухолевую активность, значительно превышающую на всех трех дозах противоопухулевую активность SN-38 в дозе 10 мг/кг и противоопухолевую активность СРТ-11 в дозе 40 мг /кг.
Кроме того, в ксенотрансплантатной модели опухоли MiaPaca2 у мышей Zn-DPA-(42) неожиданно показывает зависимую от дозы противоопухолевую активность, превосходящую в дозах 40 мг/кг, 20 мг/кг и 10 мг/кг противоопухолевую активность SN-38 в дозе 10 мг/кг и противоопухолевую активность СРТ-11 в дозе 40 мг/кг.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Все отличительные признаки, раскрытые в данном описании, могут быть объединены в любой комбинации. Каждый отличительный признак, раскрытый в данном описании, может быть заменен альтернативным отличительным признаком, служащим этой же, эквивалентной или аналогичной цели. Таким образом, если не указано иное, каждый раскрытый отличительный признак является лишь примером характерных серий эквивалентных или аналогичных отличительных признаков.
Из приведенного выше описания специалист в данной области может легко определить основные характеристики настоящего изобретения и, не отступая от сущности и объема изобретения, сможет внести различные изменения и модификации в изобретение, чтобы приспособить его к различным областям применения и условиям. Например, соединения, структурно аналогичные соединениям по данному изобретению, также могут быть получены и подвергнуты скринингу на их эффективности в лечении состояния, которое связано с клетками, содержащими «вывернутый наружу» фосфатидилсерин. Таким образом, другие варианты осуществления также находятся в пределах представленной далее формулы изобретения.
Реферат
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I), где каждый из A, А, А, А, Аи Апредставляет собой метилен; Впредставляет собой этилен, бутилен или гексилен; Впредставляет собой связь, этилен, фенилен,,,,,,,или; Lпредставляет собой связь, NH, NHCH, NHC(O), NHSO, NHC(O)NH,или; Lпредставляет собой СО; каждый из W, W, W, W, W, W, Wи Wпредставляет собой CН; или каждый из W, W, W, и Wпредставляет собой N, и каждый из W, W, Wи Wпредставляет собой CH; Х представляет собой связь, О или NН; Y представляет собойили; и Z представляет собойили. Также изобретение относится к конкретным соединениям, фармацевтической композиции на основе соединения формулы (I) и Znи способу лечения. Технический результат: получено новое гетероциклическое соединение, полезное для лечения состояния, связанного с клетками, содержащими «вывернутый наружу» фосфатидилсерин. 4 н. и 8 з.п. ф-лы, 2 табл., 51 пр.
Формула











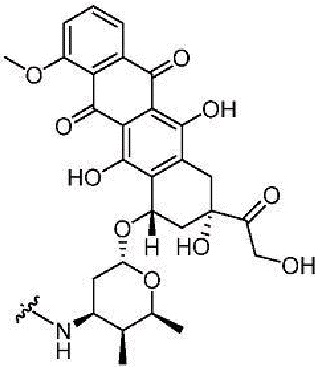
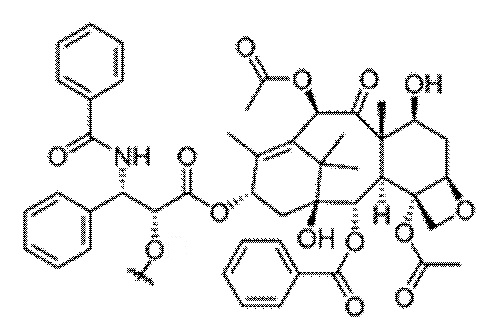







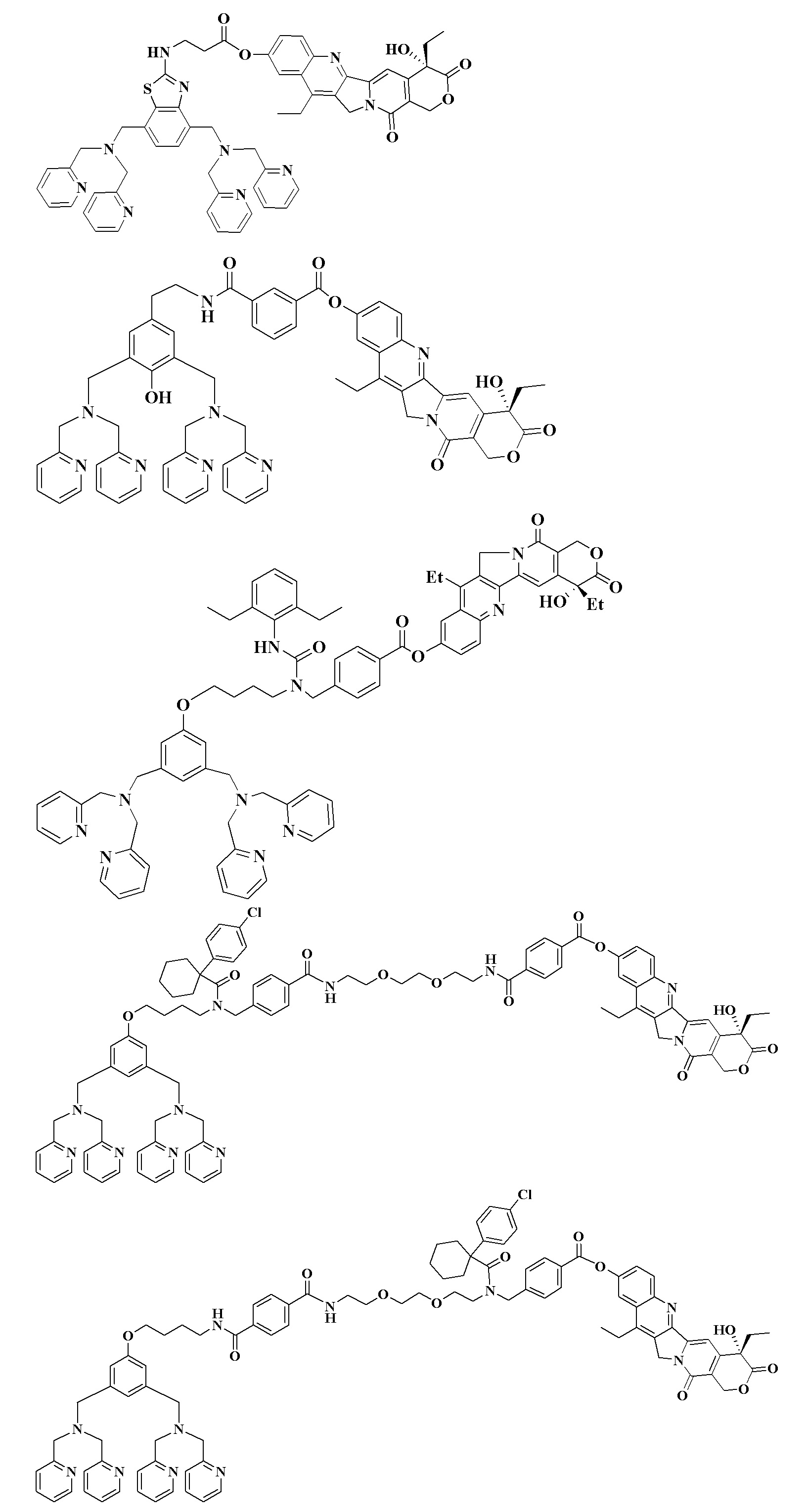
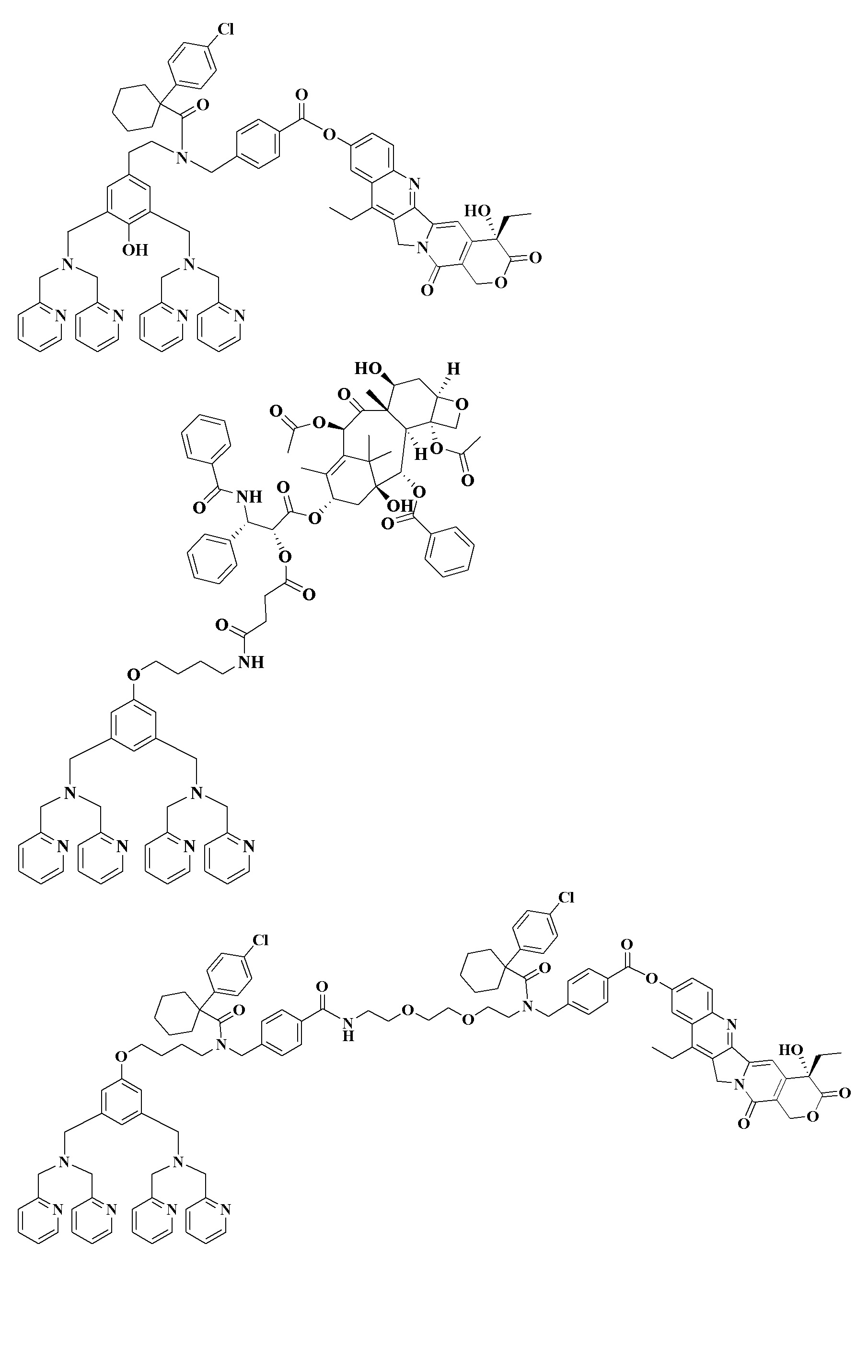







Комментарии